Производные хинолина и их применение в качестве микобактериальных ингибиторов
Номер патента: 8937
Опубликовано: 26.10.2007
Авторы: Вернье Даниэль Ф.Ж., Гийемон Жером Эмиль Жорж, Вене Марк Гастон, Ван Гестел Йозеф Франс Элизабета, Андрис Конрад Йозеф Лодевийк Марсель, Чока Имре Кристиан Франсис, Оддс Френк Кристофер, Декран Лоранс Франсуаз Бернадетт
Формула / Реферат
1. Соединение общей формулы (Iа) или общей формулы (Ib)
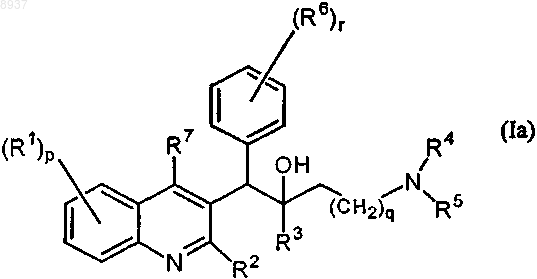
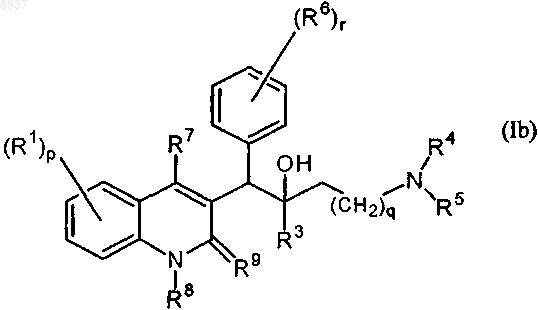
их фармацевтически приемлемые аддитивные соли с кислотами или основаниями, стереохимически изомерные формы, таутомерные формы и N-оксиды, где
R1 означает водород, галоген, галогеналкил, циано, гидрокси, Ar, Het, алкил, алкилокси, алкилтио, алкилоксиалкил, алкилтиоалкил, Ar-алкил или ди(Аr)алкил;
р означает целое число, равное 0, 1, 2, 3 или 4;
R2 означает водород, гидрокси, тио, алкилокси, алкилоксиалкилокси, алкилтио, моно- или ди(алкил)амино или радикал формулы
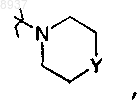
где Y означает СН2, О, S, NH или N-алкил;
R3 означает алкил, Аr, Ar-алкил, Het или Het-алкил;
q означает целое число, равное 0, 1, 2, 3 или 4;
R4 и R5 каждый независимо означают водород, алкил или бензил, или
R4 и R5 вместе с N, к которому они присоединены, могут образовывать радикал, выбранный из группы, включающей пирролидинил, 2Н-пирролил, 2-пирролинил, 3-пирролинил, пирролил, имидазолидинил, пиразолидинил, 2-имидазолинил, 2-пиразолинил, имидазолил, пиразолил, триазолил, пиперидинил, пиридинил, пиперазинил, имидазолидинил, пиридазинил, пиримидинил, пиразинил, триазинил, морфолинил и тиоморфолинил, необязательно замещенные алкилом, галогеном, галогеналкилом, гидрокси, алкилокси, амино, моно- или диалкиламино, алкилтио, алкилоксиалкилом, алкилтиоалкилом и пиримидинилом;
R6 означает водород, галоген, галогеналкил, гидрокси, Аr, алкил, алкилокси, алкилтио, алкилоксиалкил, алкилтиоалкил, Аr-алкил или ди(Аr)алкил, или
два соседних радикала R6, вместе взятые, могут образовывать бивалентный радикал формулы =С-С=С=С-;
r означает целое число, равное 0, 1, 2, 3, 4 или 5, и
R7 означает водород, алкил, Аr или Het;
R8 означает водород или алкил;
R9 означает оксо, или
R8 и R9 вместе образуют радикал =N-CH=CH-;
алкил означает прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода, где каждый атом углерода может быть необязательно замещен галогеном, гидрокси, алкилокси или оксо;
Аr означает гомоцикл, выбранный из группы, включающей фенил, нафтил, аценафтил, тетрагидронафтил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, где каждый заместитель независимо выбран из группы, включающей гидрокси, галоген, циано, нитро, амино, моно- или диалкиламино, алкил, галогеналкил, алкилокси, галогеналкилокси, карбоксил, алкилоксикарбонил, аминокарбонил, морфолинил и моно- или диалкиламинокарбонил;
Het означает моноциклический гетероцикл, выбранный из группы, включающей N-феноксипиперидинил, пирролил, пиразолил, имидазолил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридинил, пиримидинил, пиразинил и пиридазинил, или бициклический гетероцикл, выбранный из группы, включающей хинолинил, хиноксалинил, индолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил, бензотиенил, 2,3-дигидробензо[1,4]диоксинил или бензо[1,3]диоксолил, где каждый моноциклический или бициклический гетероцикл может быть необязательно замещен по атому углерода 1, 2 или 3 заместителями, выбранными из группы, включающей галоген, гидрокси, алкил или алкилокси;
галоген означает заместитель, выбранный из группы, включающей фтор, хлор, бром и йод, и
галогеналкил означает прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, где один или несколько атомов углерода замещены одним или несколькими атомами галогена.
2. Соединение по п.1, отличающееся тем, что
R1 означает водород, галоген, циано, Ar, Het, алкил и алкилокси;
р означает целое число, равное 0, 1, 2, 3 или 4;
R2 означает водород, гидрокси, алкилокси, алкилоксиалкилокси, алкилтио или радикал формулы
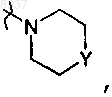
где Y означает О;
R3 означает алкил, Аr, Ar-алкил или Het;
q означает целое число, равное 0, 1, 2 или 3;
R4 и R5 каждый независимо означают водород, алкил или бензил, или
R4 и R5 вместе с N, к которому они присоединены, могут образовывать радикал, выбранный из группы, включающей пирролидинил, имидазолил, триазолил, пиперидинил, пиперазинил, пиразинил, морфолинил и тиоморфолинил, необязательно замещенные алкилом или пиримидинилом;
R6 означает водород, галоген или алкил, или
два соседних радикала R6, вместе взятые, могут образовывать бивалентный радикал формулы =С-С=С=С-;
r означает целое число, равное 1, и
R7 означает водород;
R8 означает водород или алкил;
R9 означает оксо, или
R8 и R9 вместе образуют радикал =N-CH=CH-;
алкил означает прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода, где каждый атом углерода может быть необязательно замещен галогеном или гидрокси;
Аr означает гомоцикл, выбранный из группы, включающей фенил, нафтил, аценафтил, тетрагидронафтил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, где каждый заместитель независимо выбран из группы, включающей галоген, галогеналкил, циано, алкилокси и морфолинил;
Het означает моноциклический гетероцикл, выбранный из группы, включающей N-феноксипиперидинил, фуранил, тиенил, пиридинил, пиримидинил, или бициклический гетероцикл, выбранный из группы, включающей бензотиенил, 2,3-дигидробензо[1,4]диоксинил или бензо[1,3]диоксолил, где каждый моноциклический или бициклический гетероцикл может быть необязательно замещен по атому углерода 1, 2 или 3 алкил-заместителями; и
галоген означает заместитель, выбранный из группы, включающей фтор, хлор и бром.
3. Соединение по п.1 или 2, где R6 означает водород, алкил или галоген.
4. Соединение по п.3, где R6 означает водород.
5. Соединение по любому из предшествующих пунктов, где R1 означает водород, галоген, Аr, алкил или алкилокси.
6. Соединение по п.5, где R1 означает галоген.
7. Соединение по любому из предшествующих пунктов, где р равно 1.
8. Соединение по любому из предшествующих пунктов, где R2 означает водород, алкилокси или алкилтио.
9. Соединение по п.8, где R2 означает алкилокси.
10. Соединение по любому из предшествующих пунктов, где R3 означает нафтил, фенил или тиенил, каждый из которых необязательно замещен 1 или 2 заместителями.
11. Соединение по п.10, где R3 означает нафтил или фенил.
12. Соединение по п.11, где R3 означает нафтил.
13. Соединение по любому из пп.1-9, где R3 означает Аr-алкил.
14. Соединение по любому из предшествующих пунктов, где q равно 0, 1 или 2.
15. Соединение по п.14, где q равно 1.
16. Соединение по любому из пп.1-13, где q равно 3.
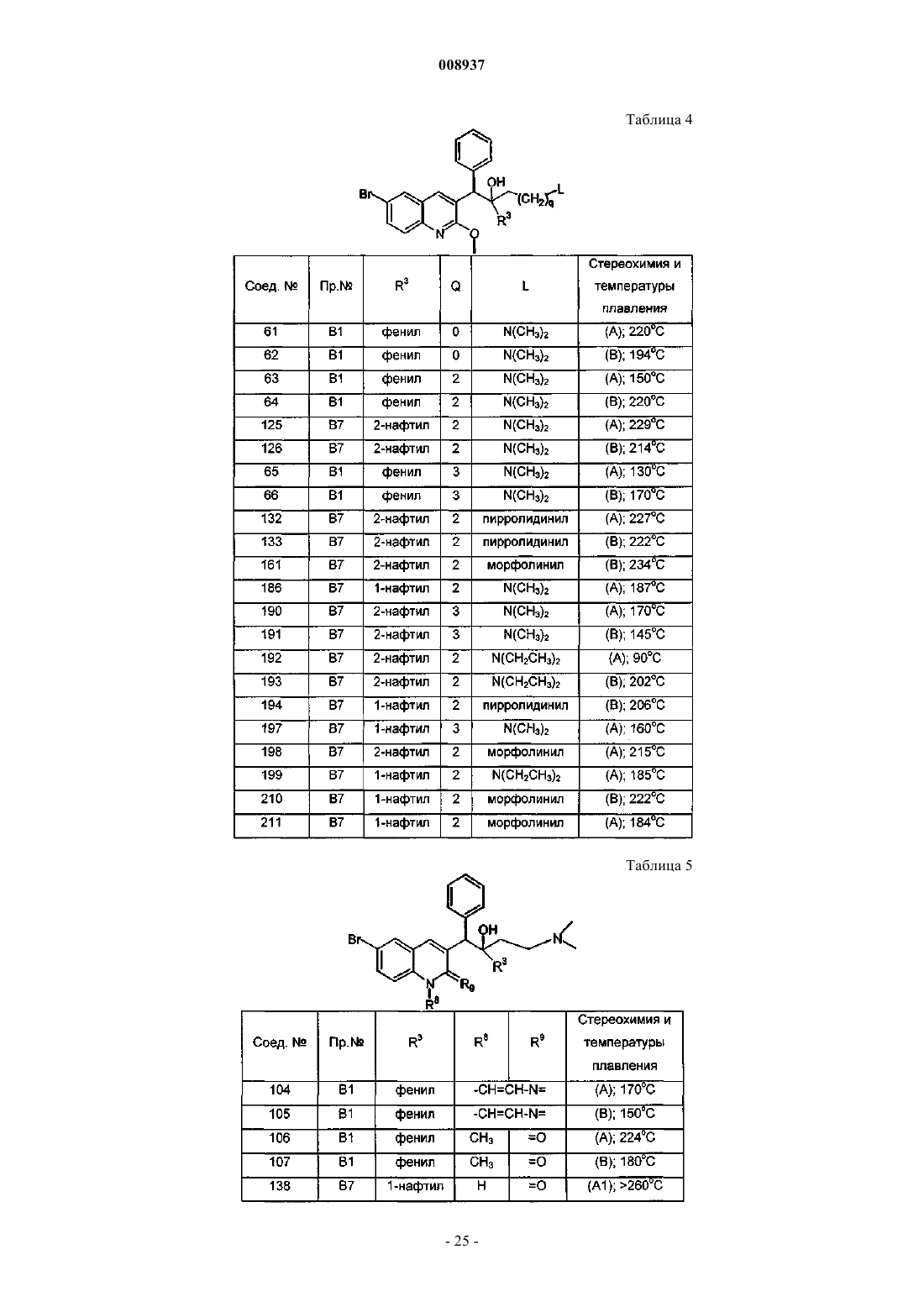
17. Соединение по любому из предшествующих пунктов, где R4 и R5 кажфыщ независимо означают водород или алкил.
18. Соединение по п.17, где R4 и R5 каждый независимо означают метил.
19. Соединение по любому из предшествующих пунктов, где R7 означает водород или метил.
20. Соединение по любому из предшествующих пунктов, где r равно 0, 1 или 2.
21. Соединение по любому из пп.1-3, отличающееся тем, что независимо друг от друга R1 означает водород, галоген, Аr, алкил или алкилокси, р=1, R2 означает водород, алкилокси или алкилтио, R3 означает нафтил, фенил или тиенил, каждый из которых необязательно замещен 1 или 2 заместителями, выбранными из группы, включающей галоген и галогеналкил, q=0, 1, 2 или 3, R4 и R5 каждый независимо означают водород или алкил, или R4 и R5 вместе с N, к которому они присоединены, образуют радикал, выбранный из группы, включающей имидазолил, триазолил, пиперидинил, пиперазинил и тиоморфолинил, R6 означает водород, алкил или галоген, r равно 0 или 1 и R7 означает водород.
22. Соединение по п.21, отличающееся тем, что независимо друг от друга R1 означает бром, R2 означает алкилокси, R3 означает нафтил или фенил, q=1, R4 и R5 каждый независимо означают водород, метил или этил, и R6 означает водород.
23. Соединение по любому из пп.1-22, где соединение представляет собой соединение формулы (Iа).
24. Соединение по п.1, отличающееся тем, что соединение представляет собой
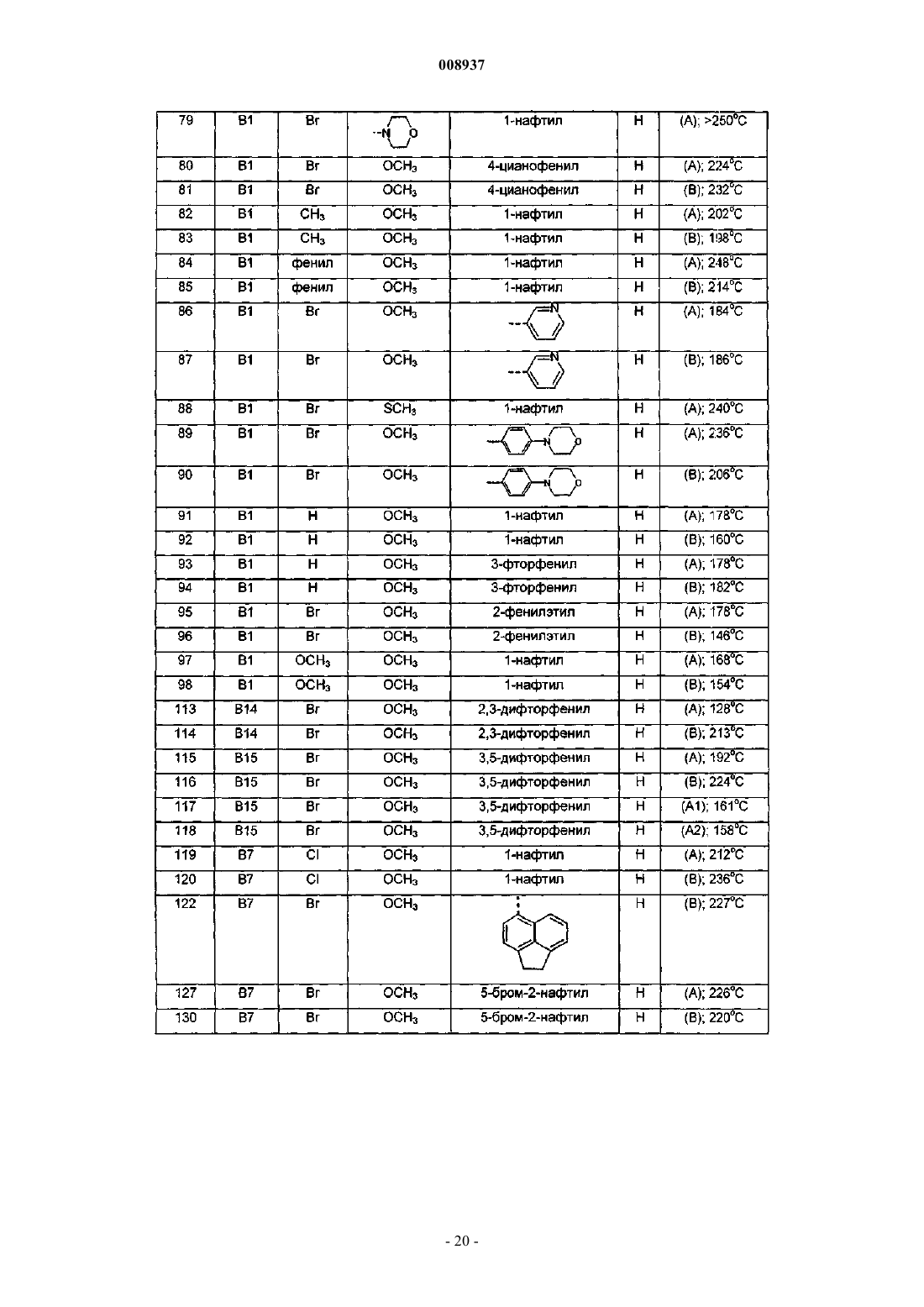
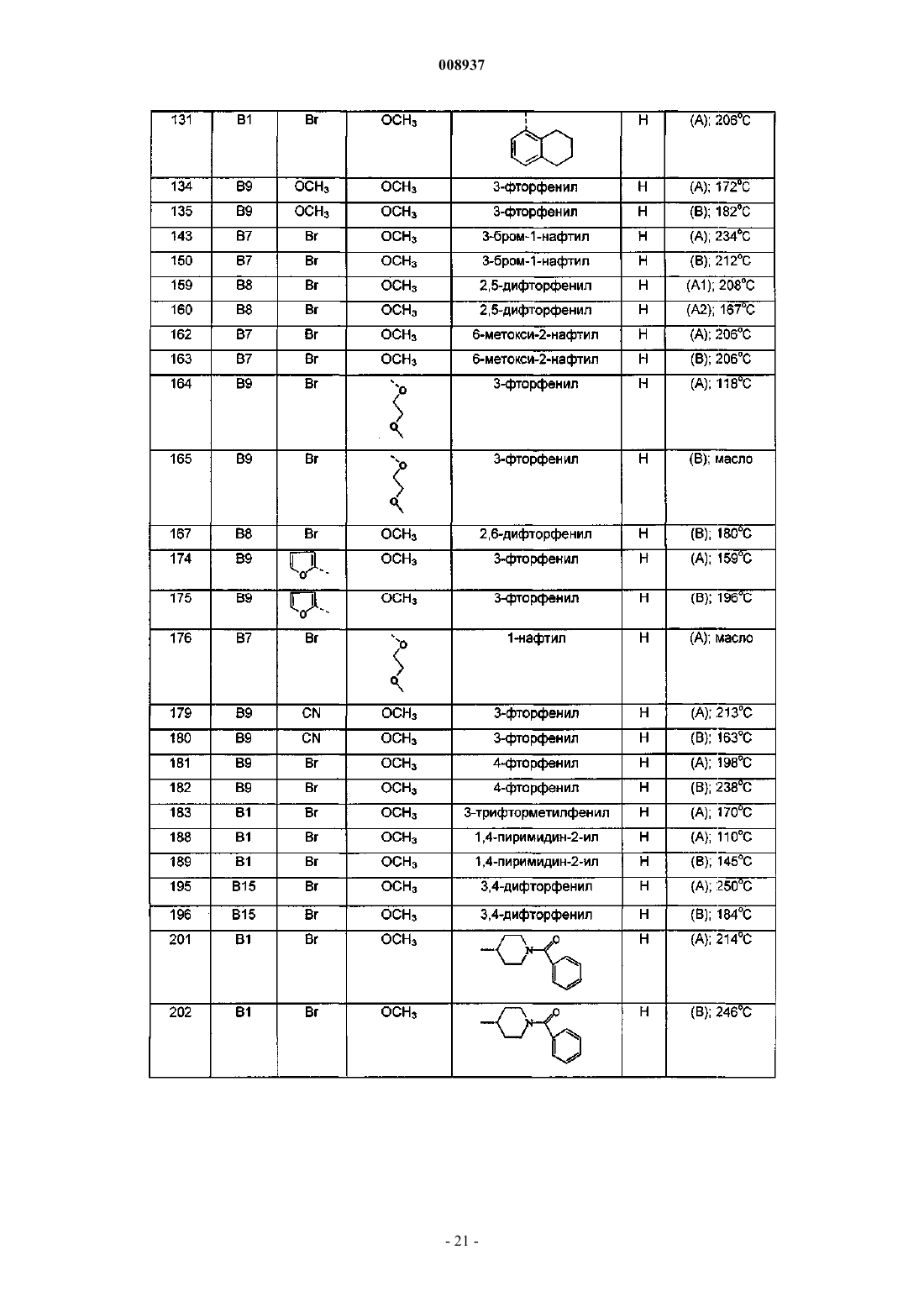
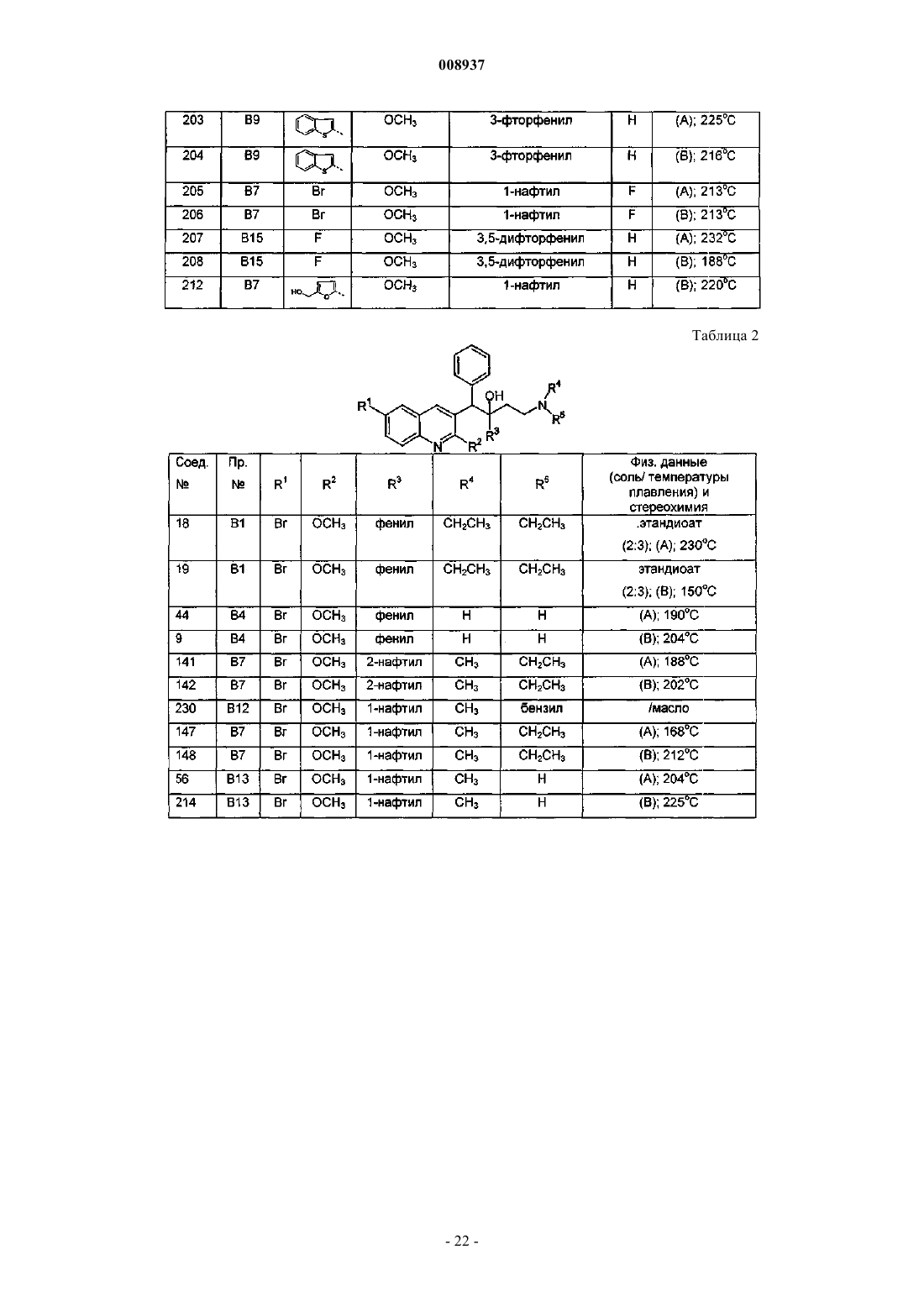
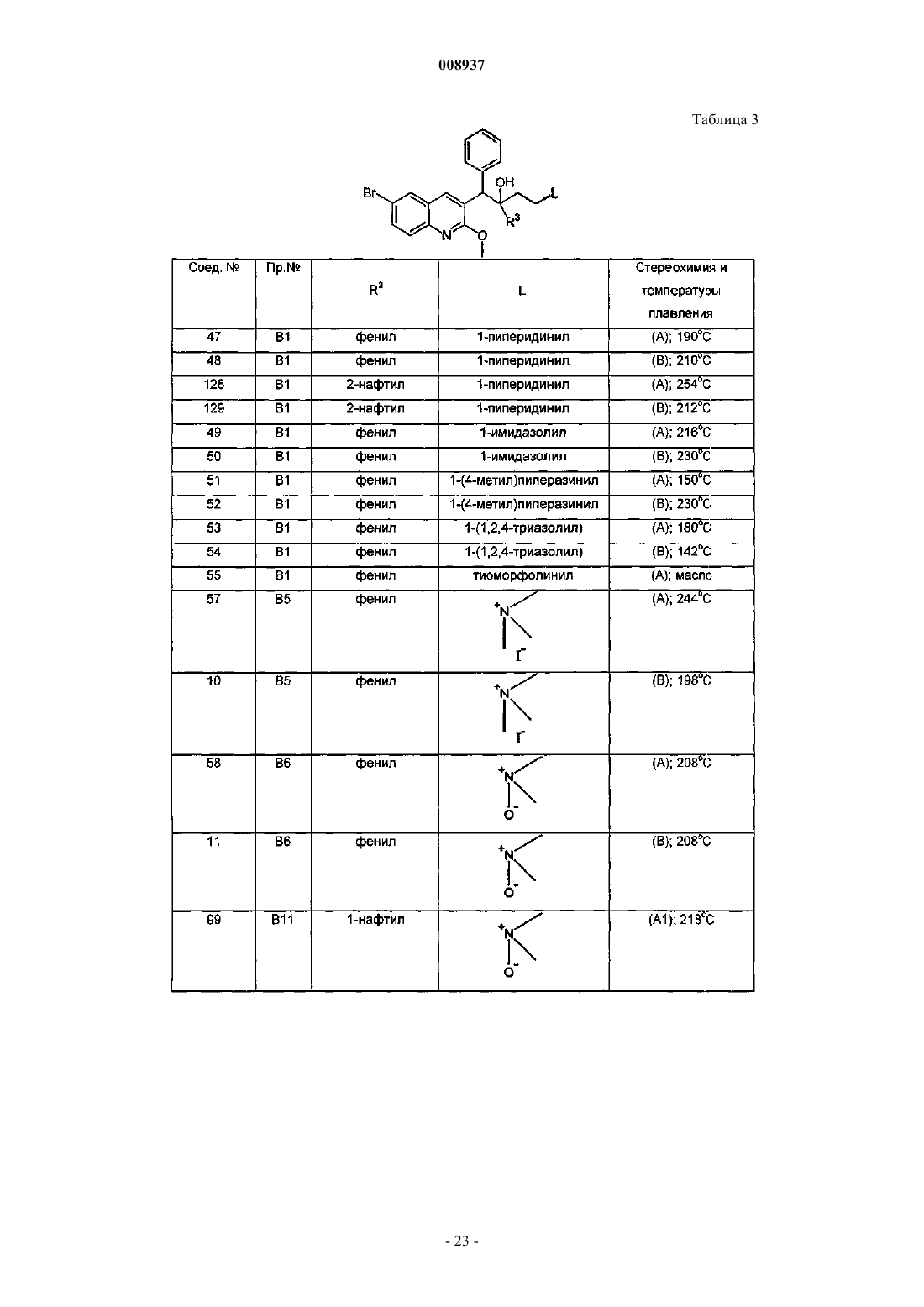
1-(6-бром-2-метоксихинолин-3-ил)-2-(3,5-дифторфенил)-4-диметиламино-1-фенилбутан-2-ол,
1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-нафталин-1-ил-1-фенилбутан-2-ол,
1-(6-бром-2-метоксихинолин-3-ил)-2-(2,5-дифторфенил)-4-диметиламино-1-фенилбутан-2-ол,
1-(6-бром-2-метоксихинолин-3-ил)-2-(2,3-дифторфенил)-4-диметиламино-1-фенилбутан-2-ол,
1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-(2-фторфенил)-1-фенилбутан-2-ол,
1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-нафталин-1-ил-1-п-толилбутан-2-ол,
1-(6-бром-2-метоксихинолин-3-ил)-4-метиламино-2-нафталин-1-ил-1-фенилбутан-2-ол и
1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-(3-фторфенил)-1-фенилбутан-2-ол,
их фармацевтически приемлемые аддитивные соли с кислотами или основаниями, стереохимически изомерные формы, таутомерные формы и N-оксиды.
25. Соединение по п.1, где соединение представляет собой соединение формулы (Iа), которое может быть представлено следующей формулой:
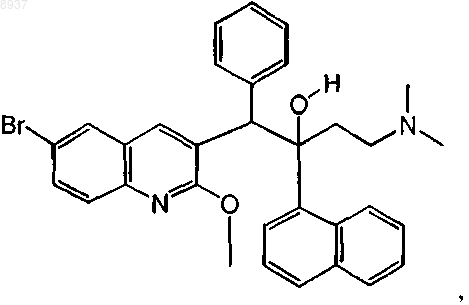
или его фармацевтически приемлемая аддитивная соль с кислотой или основанием, стереохимически изомерная форма или N-оксид.
26. Соединение по п.1, где соединение представляет собой соединение формулы (Iа), которое может быть представлено следующей формулой:
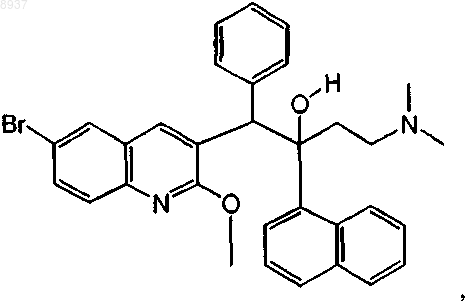
или его фармацевтически приемлемая аддитивная соль с кислотой или основанием.
27. Соединение по п.1, где соединение представляет собой соединение формулы (Iа), которое может быть представлено следующей формулой:
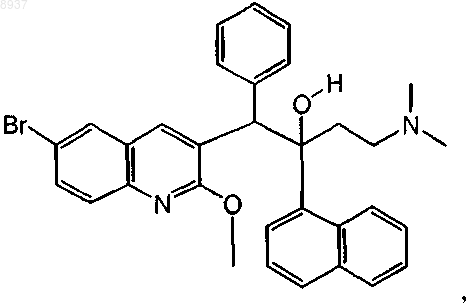
или его фармацевтически приемлемая аддитивная соль с кислотой.
28. Соединение по п.1, где соединение представляет собой соединение формулы (Iа), которое может быть представлено следующей формулой:
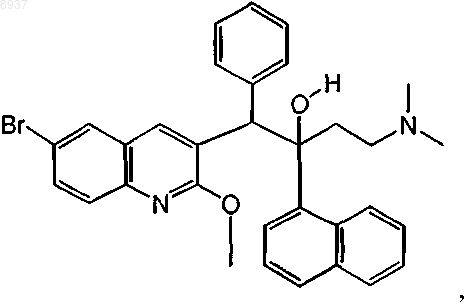
или его стереохимически изомерная форма.
29. Соединение по п.1, где соединение представляет собой соединение формулы (Iа), которое может быть представлено следующей формулой:
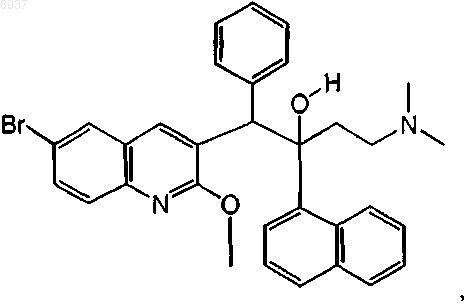
или его N-оксид.
30. Соединение по п.1, где соединение представляет собой соединение формулы (Iа), которое может быть представлено следующей формулой:
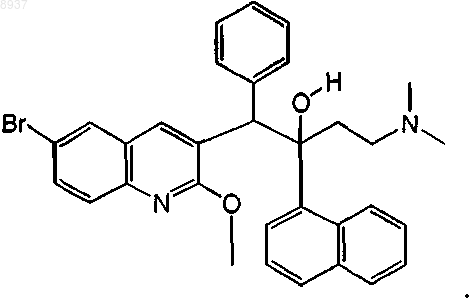
31. Соединение по п.25, где соединение представляет собой диастереомер А, имеющий точку плавления 210шС, его фармацевтически приемлемая аддитивная соль с кислотой или основанием или стереохимически изомерная форма.
32. Соединение по п.25, где соединение представляет собой диастереомер А, имеющий наивысшее значение pIC50 в анализе М. smegmatis относительно диастереомера В той же формулы, или его фармацевтически приемлемая аддитивная соль с кислотой или основанием или стереохимически изомерная форма указанного диастереомера А.
33. Соединение по п.31 или 32, где соединение представлено в энантиомерной форме, имеющей наименьшее значение MIС в анализе М. tuberculosis относительно другой энантиомерной формы той же формулы, или его фармацевтически приемлемая аддитивная соль с кислотой или основанием указанной энантиомерной формы.
34. Соединение по п.33, где соединение представлено в энантиомерной форме, имеющей наименьшее значение MIC в анализе М. tuberculosis относительно другой энантиомерной формы той же формулы.
35. Соединение по п.31 или 32, где соединение представлено в энантиомерной форме, имеющей наивысшее значение pIC50 в анализе М. smegmatis относительно другой энантиомерной формы той же формулы, или его фармацевтически приемлемая аддитивная соль с кислотой или основанием указанной энантиомерной формы.
36. Соединение по п.35, где соединение представлено в энантиомерной форме, имеющей наивысшее значение рIС50 в анализе М. smegmatis относительно другой энантиомерной формы той же формулы.
37. Применение соединения по любому из пп.1-36 в качестве лекарственного средства.
38. Композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-36.
39. Применение соединения по любому из пп.1-36 при получении лекарственного средства для лечения микобактериальных заболеваний.
40. Применение композиции по п.38 при получении лекарственного средства для лечения микобактериальных заболеваний.
41. Способ лечения пациента, страдающего от или подверженного рискумикобактериального заболевания, который включает введение пациенту терапевтически эффективного количества соединения по любому из пп.1-36.
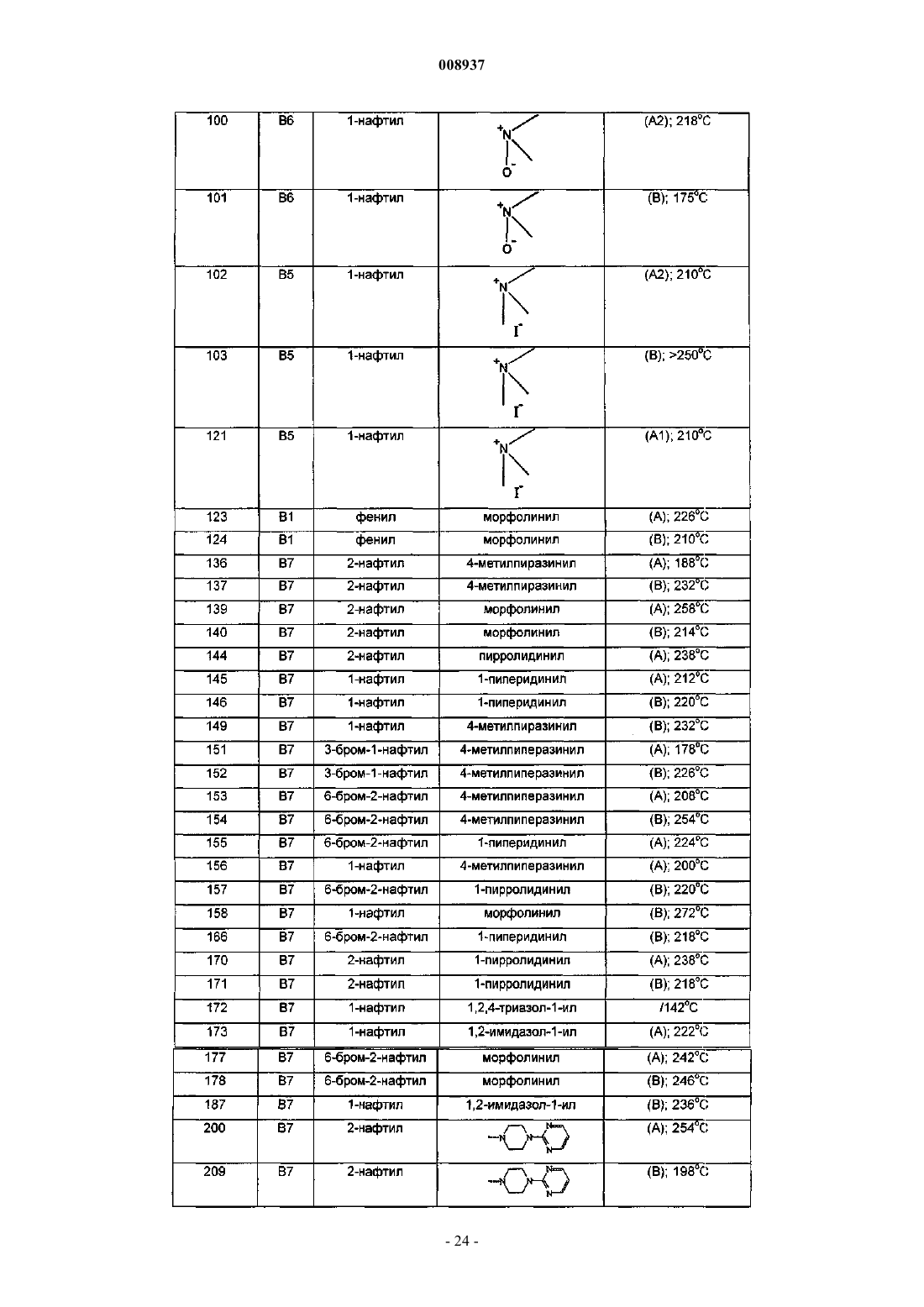
42. Способ лечения пациента, страдающего от или подверженного риску микобактериального заболевания, который включает введение пациенту терапевтически эффективного количества фармацевтической композиции по п.38.
43. Способ получения соединения по любому из пп.1-36, отличающийся тем, что соединение формулы (II) подвергают взаимодействию с соединением формулы (III) согласно следующей схеме реакции:
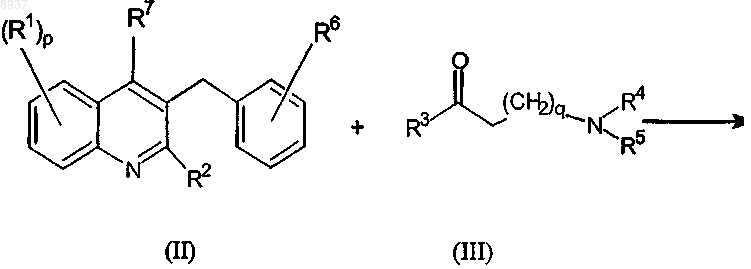
где R1, р, R2, R3, q, R4, R5, R6 и R7 имеют значения, указанные в формуле (Iа).
44. Соединение, имеющее следующую формулу:
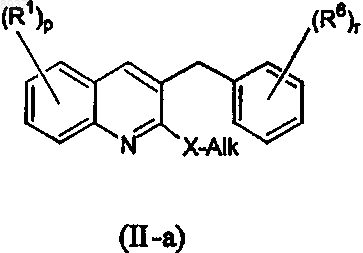
где R1, R6, р и r имеют значения, указанные в п.1, и где X=S или О и Alk представляет собой алкильную группу, как определено в п.1.
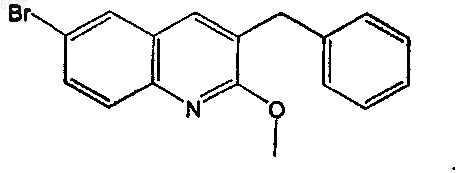
45. Соединение по п.44, где X=О.
46. Соединение по п.45, имеющее следующую формулу:
Текст
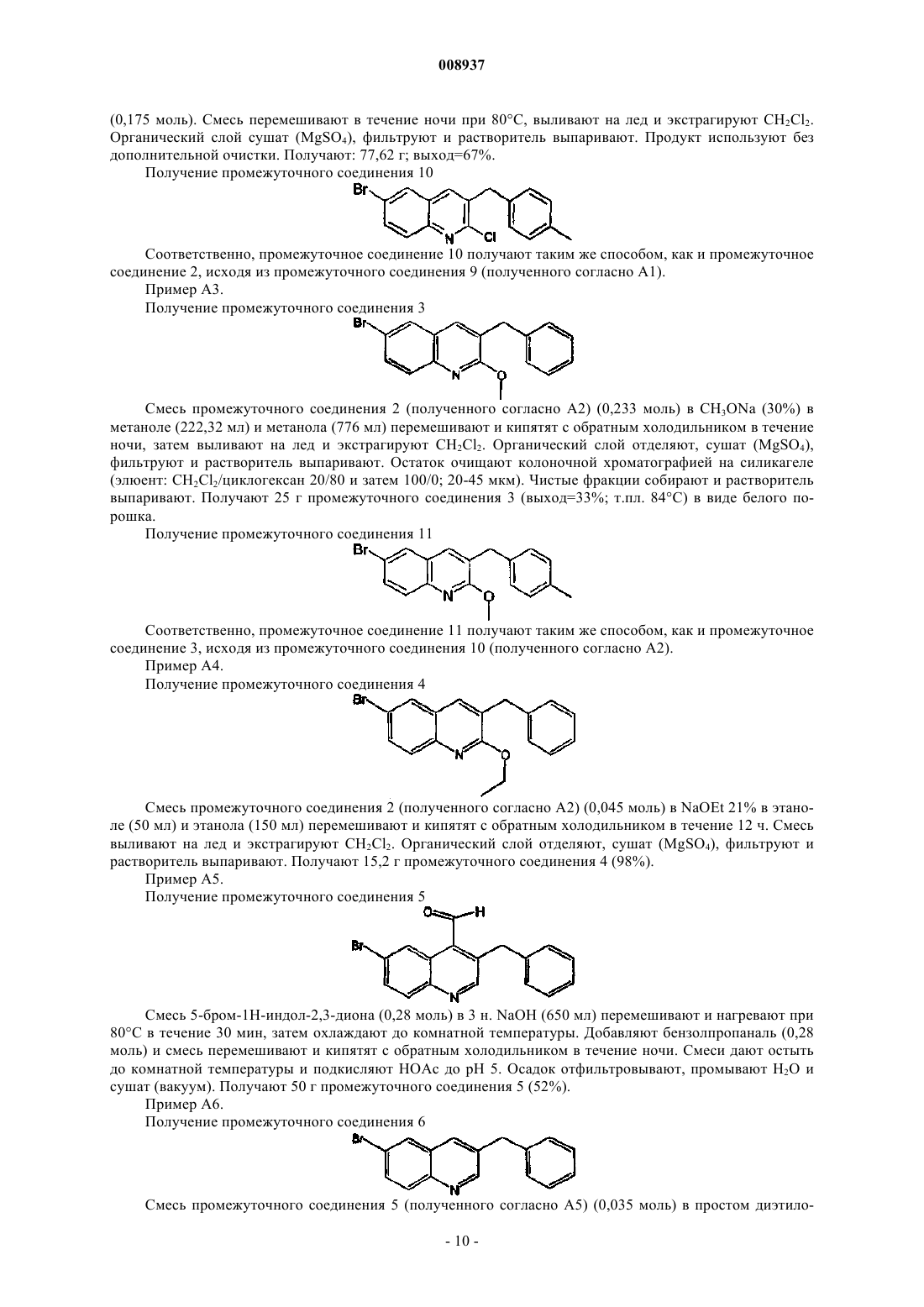
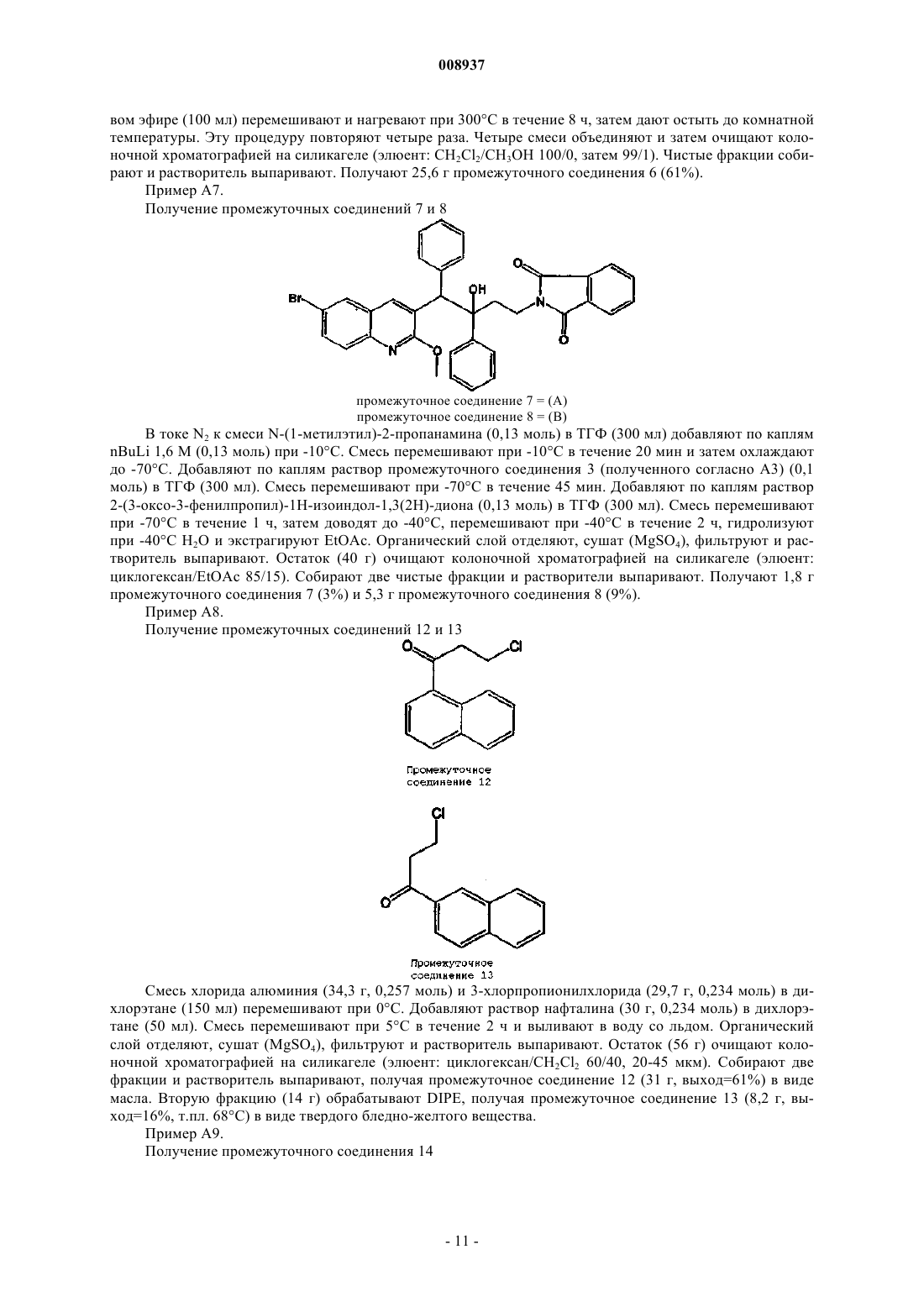
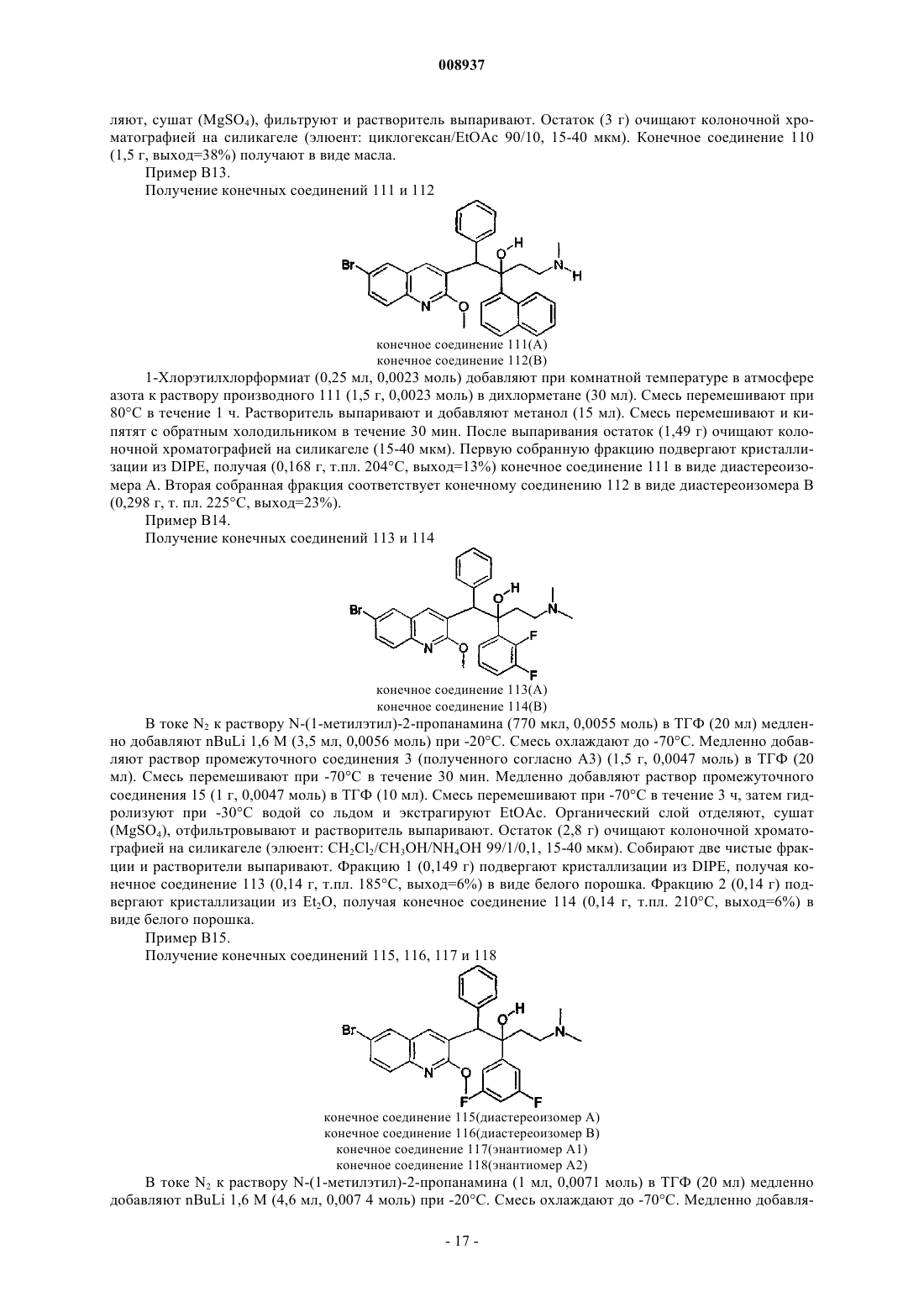
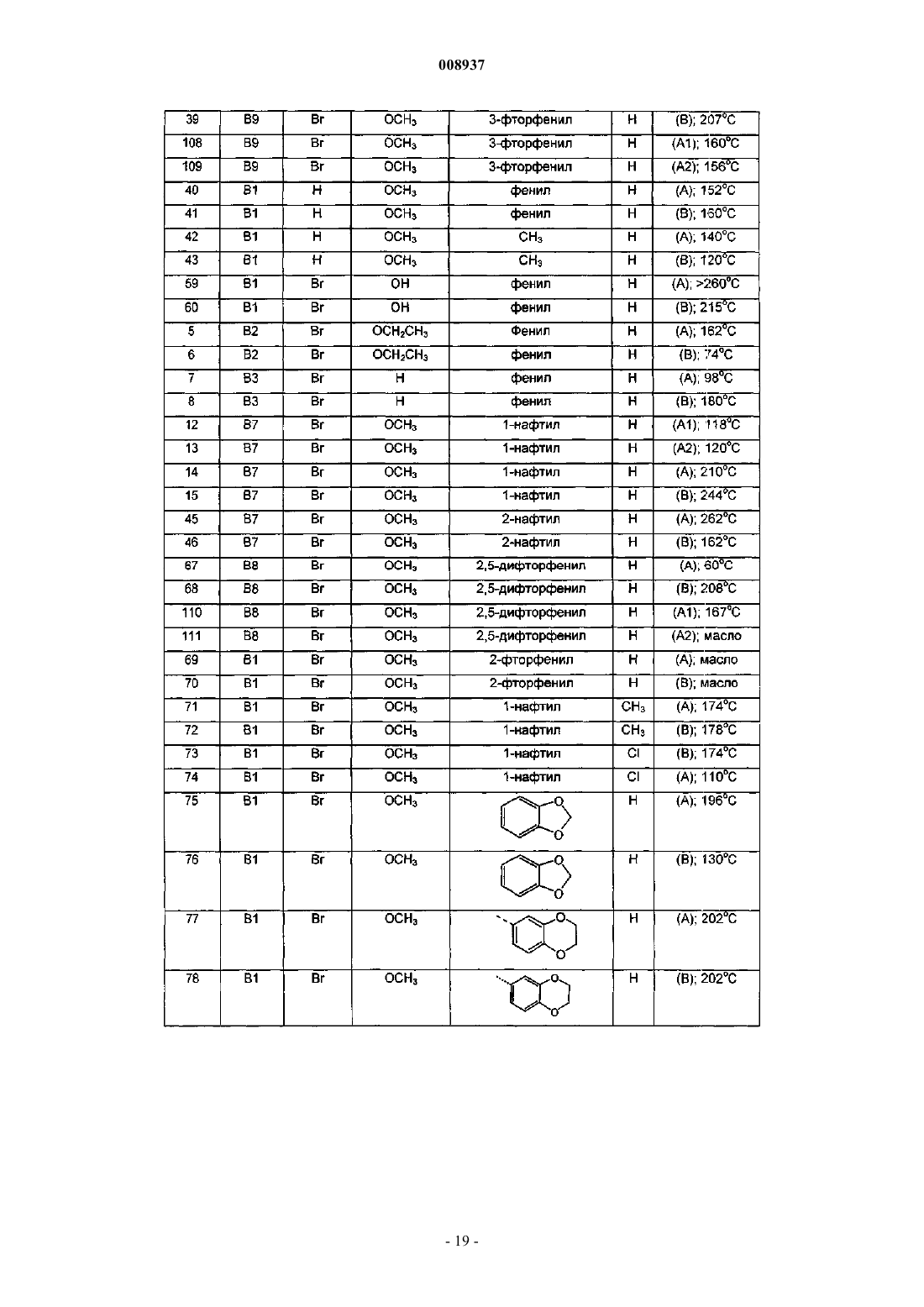
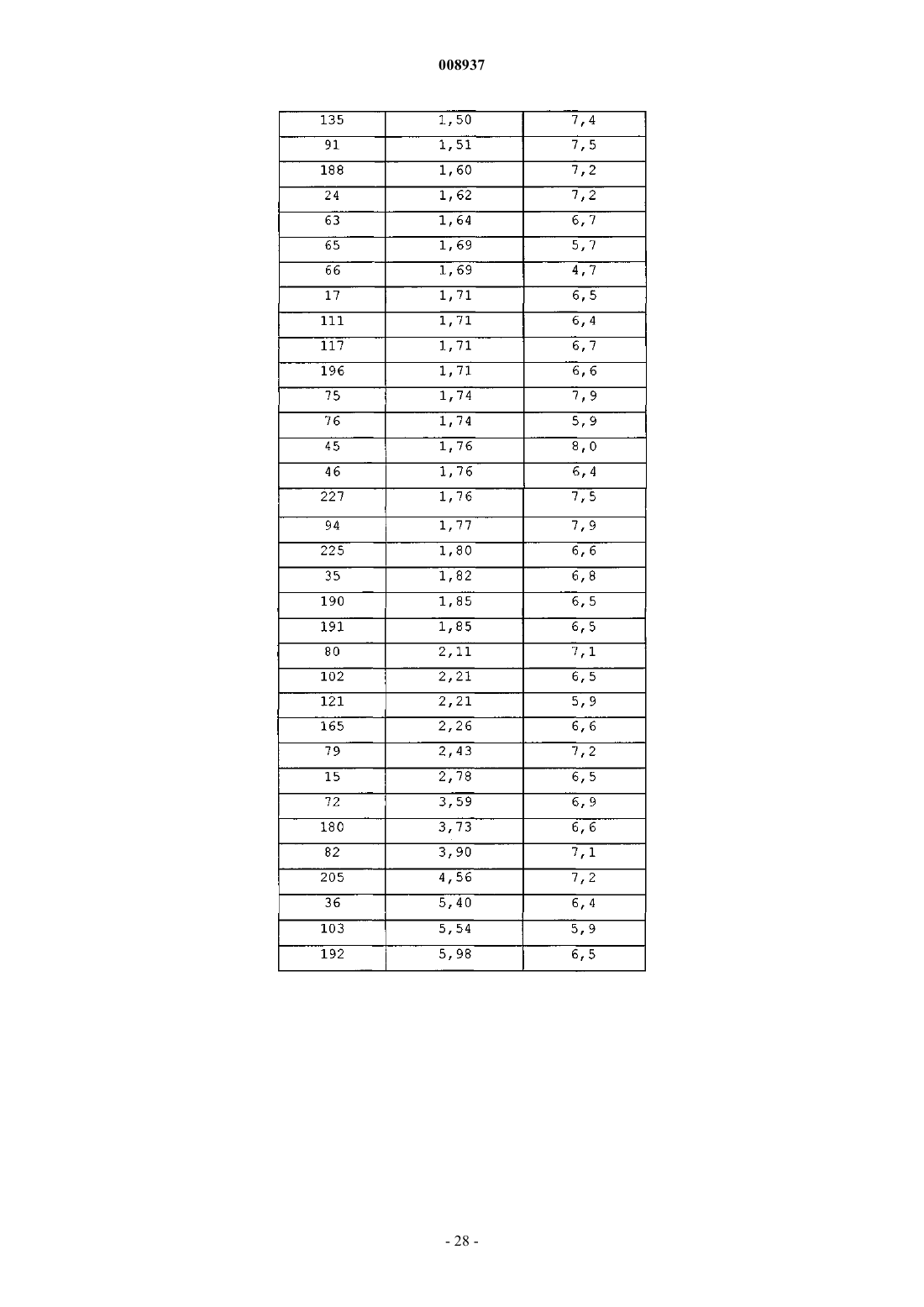
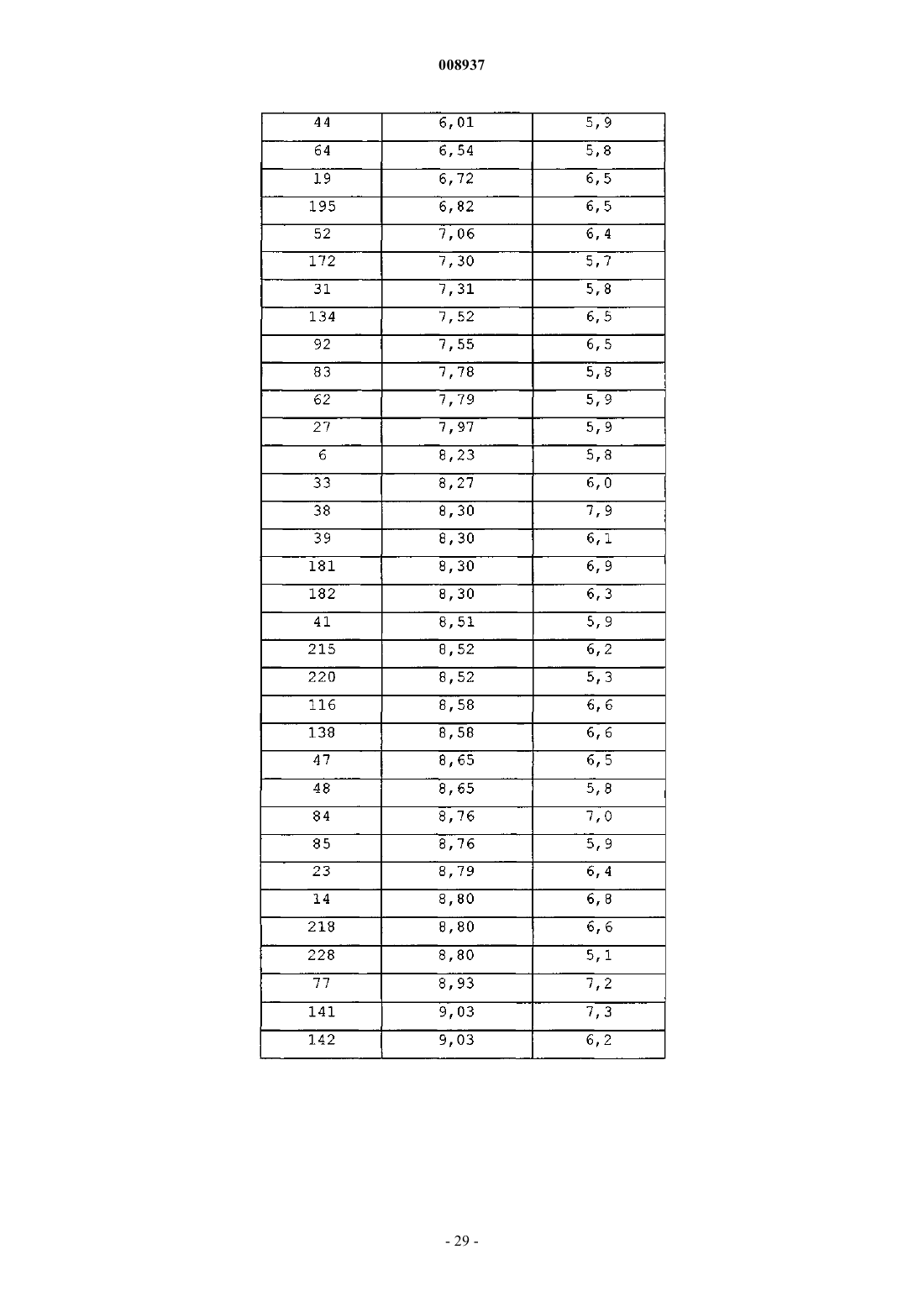
008937 Изобретение относится к новым замещенным производным хинолина, которые могут использоваться для лечения микобактериальных заболеваний, в частности таких заболеваний, которые вызваны патогенными микобактериями, такими как Mycobacterium tuberculosis, M. bovis, M. avium и М. marinum. Предпосылки к созданию изобретенияMycobacterium tuberculosis является этиологическим фактором туберкулеза (ТБ), серьезной и потенциально летальной инфекцией, широко распространенной в мире. По оценкам Всемирной организации здравоохранения более 8 млн человек заболевает ТБ каждый год и 2 млн человек умирает от туберкулеза ежегодно. За последнее десятилетие число случаев ТБ выросло на 20% в мире, где наивысший процент отмечается в наиболее бедных государствах. Если эти тенденции сохранятся, заболеваемость ТБ увеличится на 41% в следующие 20 лет. После введения 50 лет назад эффективной химиотерапии ТБ остается, после СПИД, главной инфекционной причиной смертности взрослых в мире. Осложненность эпидемии ТБ - это возрастающее появление резистентных ко многим лекарствам штаммов и летальный симбиоз с ВИЧ. ВИЧ-положительные и инфицированные ТБ люди в 30 раз более подвержены развитию активного ТБ, чем люди ВИЧ-отрицательные, и ТБ является причиной смерти одного из каждых трех людей с ВИЧ/СПИД в мире. Все существующие подходы к лечению туберкулеза предусматривают сочетание многих агентов. Например, режим, рекомендованный Службой здравоохранения США, - это комбинированное лечение изониазидом, рифампицином и пиразинамидом в течение 2 месяцев с последующим лечением только изониазидом и рифампицином в течение следующих 4 месяцев. Назначение указанных лекарств продлевают на следующие 7 месяцев пациентам, инфицированным ВИЧ. Для пациентов, инфицированных штаммами М. tuberculosis, резистентными ко многим лекарствам, к комбинированной терапии добавляют такие агенты, как этамбутол, стрептомицин, канамицин, амикацин, капреомицин, этионамид, циклосерин, ципрофоксацин и офлоксацин. Не существует ни единственного средства, которое само по себе было бы эффективно при клиническом лечении туберкулеза, ни какого-либо сочетания средств, которое предполагало бы возможность терапии длительностью менее чем 6 месяцев. Существует высокая медицинская потребность в новых лекарствах, которые усовершенствовали бы современное лечение, делая возможными режимы, которые облегчали бы согласование интересов пациента и того, кто принимает меры для его лечения. Более короткие режимы и режимы, которые требуют меньшего наблюдения, являются наилучшим путем для достижения этого. Наиболее заметный эффект лечения проявляется в первые 2 месяца во время интенсивной или бактериальной фазы, когда четыре лекарства дают вместе, бактериальная нагрузка значительно уменьшается, и пациенты становятся незаразными. 4- или 6-месячное продолжение или фаза стерилизации требуется, чтобы устранить сохранившиеся бациллы и свести к минимуму риск рецидива. Сильное стерилизующее лекарство, которое сокращало бы лечение до 2 месяцев или менее, было бы чрезвычайно полезным. Необходимы лекарства, которые облегчают согласование с условиями лечения, требуя менее интенсивного наблюдения. Очевидно,соединение, которое уменьшает и общую продолжительность лечения, и частоту введения лекарства,могло бы принести наибольшую пользу. Усложнение эпидемии ТБ объясняется возрастающей долей штаммов, резистентных ко многим лекарствам или MDR-ТБ. Вплоть до 4% всех случаев в мире рассматриваются как MDR-ТБ, т.е. как резистентные к большинству эффективных лекарств четырех-лекарственного стандарта, изониазиду и рифампицину. MDR-ТБ летален, когда его не лечат, и не поддается радикальному излечиванию стандартной терапией, так что лечение требует вплоть до 2 лет приема лекарств "второй линии". Эти лекарства часто токсичны, дорогостоящи и эффективны лишь в самой малой степени. В отсутствие эффективной терапии инфицированные пациенты с MDR-ТБ продолжают распространять болезнь, вызывая новые инфекции штаммами MDR-ТБ. Существует высокая медицинская потребность в новом лекарстве с новым механизмом действия, которое было бы способно продемонстрировать активность против штаммовMDR. Объектом данного изобретения являются новые соединения, в частности, замещенные производные хинолина, имеющие свойство ингибирования роста микобактерий и которые поэтому могут использоваться для лечения микобактериальных заболеваний, вызываемых патогенными микобактериями, такими как Mycobacterium tuberculosis, M. bovis, M. avium и М. marinum. Замещенные хинолины уже были описаны в US 5965572 (США) для лечения инфекций, резистентных к антибиотикам, и в WO 00/34265 для ингибирования роста бактериальных микроорганизмов. Ни в одной из этих публикаций не раскрыты замещенные производные хинолина по данному изобретению.-1 008937 Сущность изобретения Данное изобретение относится к новым замещенным производным хинолина, представленным формулой (Iа) или (Ib) и их аддитивным солям с кислотами или основаниями, стереохимически изомерным формам, таутомерным формам и N-оксидным формам,где R1 означает водород, галоген, галогеналкил, циано, гидрокси, Ar, Het, алкил, алкилокси, алкилтио, алкилоксиалкил, алкилтиоалкил, Ar-алкил или ди(Аr)алкил; р означает целое число, равное 0, 1, 2, 3 или 4;R4 и R5 каждый независимо означают водород, алкил или бензил, илиR6 означает водород, галоген, галогеналкил, гидрокси, Аr, алкил, алкилокси, алкилтио, алкилоксиалкил, алкилтиоалкил, Аr-алкил или ди(Аr)алкил, или два соседних радикала R6, вместе взятые, могут образовывать бивалентный радикал формулыR8 означает водород или алкил;R8 и R9 вместе образуют радикал =N-CH=CH-. Алкил означает прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода, где каждый атом углерода может быть необязательно замещен галогеном, гидрокси, алкилокси или оксо; Аr означает гомоцикл, выбранный из группы, включающей фенил, нафтил, аценафтил, тетрагидро-2 008937 нафтил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбран из группы, включающей гидрокси, галоген, циано, нитро, амино, моно- или диалкиламино, алкил, галогеналкил, алкилокси, галогеналкилокси, карбоксил, алкилоксикарбонил, аминокарбонил, морфолинил и моно- или диалкиламинокарбонил;Het означает моноциклический гетероцикл, выбранный из группы, включающей Nфеноксипиперидинил, пирролил, пиразолил, имидазолил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридинил, пиримидинил, пиразинил и пиридазинил, или бициклический гетероцикл, выбранный из группы, включающей хинолинил, хиноксалинил, индолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил, бензотиенил, 2,3 дигидробензо[1,4]диоксинил или бензо[1,3]диоксолил, где каждый моноциклический или бициклический гетероцикл может быть необязательно замещен по атому углерода 1, 2 или 3 заместителями, выбранными из группы, включающей галоген, гидрокси, алкил или алкилокси; галоген означает заместитель, выбранный из группы, включающей фтор, хлор, бром и йод, и галогеналкил означает прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, где один или несколько атомов углерода замещены одним или несколькими атомами галогена. Соединения формул (Iа) и (Ib) взаимосвязаны в том смысле, что, например, соединение формулы(Ib), где R9 означает оксо, является таутомерным эквивалентом соединения формулы (Iа), где R2 означает гидрокси (кето-енольный таутомеризм). Подробное описание В рамках данного изобретения алкил означает прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, или циклический насыщенный углеводородный радикал,имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода, где каждый атом углерода может быть необязательно замещен галогеном, гидрокси, алкилокси или оксо. Предпочтительно алкил означает метил, этил или циклогексилметил. В рамках данного изобретения Аr означает гомоцикл, выбранный из группы, включающей фенил,нафтил, аценафтил, тетрагидронафтил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, где каждый заместитель независимо выбран из группы, включающей гидрокси, галоген, циано,нитро, амино, моно- или диалкиламино, алкил, галогеналкил, алкилокси, галогеналкилокси, карбоксил,алкилоксикарбонил, аминокарбонил, морфолинил и моно- или диалкиламинокарбонил. Предпочтительно Аr означает нафтил или фенил, каждый из которых необязательно замещен 1 или 2 галогензаместителями. В рамках данного изобретения Het означает моноциклический гетероцикл, выбранный из группы,включающей N-феноксипиперидинил, пирролил, пиразолил, имидазолил, фуранил, тиенил, оксазолил,изоксазолил, тиазолил, изотиазолил, пиридинил, пиримидинил, пиразинил и пиридазинил, или бициклический гетероцикл, выбранный из группы, включающей хинолинил, хиноксалинил, индолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил, бензотиенил,2,3-дигидробензо[1,4]диоксинил или бензо[1,3]диоксолил, где каждый моноциклический или бициклический гетероцикл может быть необязательно замещен по атому углерода 1, 2 или 3 заместителями, выбранными из группы, включающей галоген, гидрокси, алкил или алкилокси. Предпочтительно Het означает тиенил. В рамках данного изобретения галоген означает заместитель, выбранный из группы, включающей фтор, хлор, бром и йод, и галогеналкил означает прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, где один или несколько атомов углерода замещены одним или несколькими атомами галогена. Предпочтительно галоген означает бром, фтор или хлор, и предпочтительно галогеналкилом является трифторметил. Предпочтительно изобретение относится к соединениям формулы (Iа) и (Ib), гдеR2 означает водород, гидрокси, алкилокси, алкилоксиалкилокси, алкилтио или радикал формулыR4 и R5 каждый независимо означают водород, алкил или бензил, илиR4 и R5 вместе с N, к которому они присоединены, могут образовывать радикал, выбранный из группы, включающей пирролидинил, имидазолил, триазолил, пиперидинил, пиперазинил, пиразинил,морфолинил и тиоморфолинил, необязательно замещенные алкилом или пиримидинилом;R6 означает водород, галоген или алкил, или два соседних радикала R6 вместе образуют бивалентный радикал формулы =С-С=С=С-;R8 означает водород или алкил;R8 и R9 вместе образуют радикал =N-CH=CH-. Алкил означает прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода, где каждый атом углерода может быть необязательно замещен галогеном или гидрокси; Аr означает гомоцикл, выбранный из группы, включающей фенил, нафтил, аценафтил, тетрагидронафтил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, где каждый заместитель независимо выбран из группы, включающей галоген, галогеналкил, циано, алкилокси и морфолинил;Het означает моноциклический гетероцикл, выбранный из группы, включающей Nфеноксипиперидинил, фуранил, тиенил, пиридинил, пиримидинил, или бициклический гетероцикл, выбранный из группы, включающей бензотиенил, 2,3-дигидробензо[1,4]диоксинил или бензо[1,3]диоксолил, где каждый моноциклический или бициклический гетероцикл может быть необязательно замещен по атому углерода 1, 2 или 3 алкил-заместителями; и галоген означает заместитель, выбранный из группы, включающей фтор, хлор и бром. Для соединений, отвечающих формуле или (Iа), или (Ib), предпочтительно, когда R1 означает водород, галоген, Аr, алкил или алкилокси. Более предпочтительно R1 означает галоген. Наиболее предпочтительно R1 означает бром. Предпочтительно р равно 1. Предпочтительно R2 означает водород, алкилокси или алкилтио. Более предпочтительно R2 означает алкилокси. Наиболее предпочтительно R2 означает метилокси. Предпочтительно R3 означает нафтил, фенил или тиенил, каждый из которых необязательно замещен 1 или 2 заместителями, предпочтительно, когда заместителем является галоген или галогеналкил,наиболее предпочтительно галоген. Более предпочтительно R3 означает нафтил или фенил. Наиболее предпочтительно R3 означает нафтил. Предпочтительно q равно 0, 1 или 2. Более предпочтительно q равно 1. Предпочтительно R4 и R5 каждый независимо означают водород или алкил, более предпочтительно водород, метил или этил, наиболее предпочтительно метил. Предпочтительно R4 и R5 вместе с N, к которому они присоединены, образуют радикал, выбранный из группы, включающей имидазолил, триазолил, пиперидинил, пиперазинил и тиоморфолинил, необязательно замещенные алкилом, галогеном, галогеналкилом, гидрокси, алкилокси, алкилтио, алкилоксиалкилом или алкилтиоалкилом, предпочтительно замещены алкилом, наиболее предпочтительно замещены метилом или этилом. Предпочтительно R6 означает водород, алкил или галоген. Наиболее предпочтительно R6 означает водород. Предпочтительно r означает 0, 1 или 2. Предпочтительно R7 означает водород или метил. Для соединений, представленных только формулой (Ib), предпочтительно R8 означает алкил, предпочтительно метил, и R9 означает кислород. Представляющую интерес группу соединений образуют соединения формулы (Iа), их фармацевтически приемлемые аддитивные соли с кислотами или основаниями, их стереохимически изомерные формы, их таутомерные формы и их N-оксидные формы, где R1 означает водород, галоген, Аr, алкил или алкилокси, р=1, R2 означает водород, алкилокси или алкилтио, R3 означает нафтил, фенил или тиенил,каждый из которых необязательно замещен 1 или 2 заместителями, выбранными из группы, включающей галоген и галогеналкил, q=0, 1, 2 или 3, R4 и R5 каждый независимо означают водород или алкил, или R4 и R5 вместе с N, к которому они присоединены, образуют радикал, выбранный из группы, включающей имидазолил, триазолил, пиперидинил, пиперазинил и тиоморфолинил, R6 означает водород, алкил или галоген, r равно 0 или 1 и R7 означает водород. Наиболее предпочтительно соединение представляет собой 1-(6-бром-2-метоксихинолин-3-ил)-2-(3,5-дифторфенил)-4-диметиламино-1-фенилбутан-2-ол,1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-нафталин-1-ил-1-фенилбутан-2-ол,1-(6-бром-2-метоксихинолин-3-ил)-2-(2,5-дифторфенил)-4-диметиламино-1-фенилбутан-2-ол,-4 008937 1-(6-бром-2-метоксихинолин-3-ил)-2-(2,3-дифторфенил)-4-диметиламино-1-фенилбутан-2-ол,1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-(2-фторфенил)-1-фенилбутан-2-ол,1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-нафталин-1-ил-1-п-толилбутан-2-ол,1-(6-бром-2-метоксихинолин-3-ил)-4-метиламино-2-нафталин-1-ил-1-фенилбутан-2-ол и 1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-(3-фторфенил)-1-фенилбутан-2-ол,их фармацевтически приемлемые аддитивные соли с кислотами или основаниями, их стереохимически изомерные формы, их таутомерные формы и их N-оксидные формы. Фармацевтически приемлемые аддитивные соли с кислотами характеризуются тем, что содержат терапевтически активные нетоксичные аддитивные солевые формы с кислотами, которые способны образовывать соединения формул либо (Iа), либо (Ib). Указанные аддитивные соли с кислотами могут быть получены обработкой соединений в виде основания, представленных формулой либо (Iа), либо (Ib), подходящими кислотами, например неорганическими кислотами, например галогенводородной кислотой, в частности хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой, азотной кислотой и фосфорной кислотой; органическими кислотами, например уксусной кислотой, гидроксиуксусной кислотой, пропионовой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, малоновой кислотой, янтарной кислотой, малеиновой кислотой, фумаровой кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, метансульфоновой кислотой, этансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой, цикламовой кислотой, салициловой кислотой, п-аминосалициловой кислотой и памовой кислотой. Соединения, представленные формулами либо (Iа), либо (Ib), содержащие кислотные протоны, могут быть также преобразованы в их терапевтически активные нетоксичные аддитивные солевые формы с основаниями обработкой подходящими органическими и неорганическими основаниями. Подходящие солевые формы с основанием включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, в частности, соли лития, натрия, калия, магния и кальция, соли с органическими основаниями,например, соли бензатина, N-метил-D-глюкамина, гидрамина, и соли с аминокислотами, например с аргинином и лизином. И наоборот, указанные аддитивные солевые формы с кислотами или основаниями могут быть преобразованы в свободные формы обработкой подходящим основанием или кислотой. Используемый в рамках данного изобретения термин "аддитивная соль" включает также сольваты,которые способны образовывать соединения формул либо (Iа), либо (Ib). Такими сольватами являются,например, гидраты и алкоголяты. Используемый здесь термин "стереохимически изомерные формы" охватывает все возможные изомерные формы, которые могут иметь соединения формул либо (Iа), либо (Ib). Если не упомянуто или не указано иначе, химическое обозначение соединений символизирует смесь всех возможных стереохимически изомерных форм и указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стерические центры могут быть R- или S-конфигурации, заместители на бивалентных циклических (частично) насыщенных радикалах могут иметь либо цис-, либо трансконфигурацию. Стереохимические изомерные формы соединений формулы или (Iа), или (Ib) очевидно должны быть охвачены сферой действия данного изобретения. Следуя правилам CAS-номенклатуры, когда имеются два стерических центра известной абсолютной конфигурации в молекуле, обозначение R или S присваивают (на основании правила последовательности Cahn-Ingold-Prelog) хиральному центру с наименьшим номером, основному центру. Конфигурацию второго стерического центра указывают, используя относительные обозначения [R,R] или[R,S], где R всегда устанавливают как основной центр, и [R,R] означает центры одной и той же хиральности, и [R,S] означает центры разной хиральности. Например, если хиральный центр с наименьшим номером в молекуле имеет S-конфигурацию, и второй центр - R, стереообозначение будет установлено как S-[R,S]. Если используют и , положение заместителя наивысшего первенства на асимметричном атоме углерода в кольцевой системе, имеющего наименьший номер в кольце, находится произвольно всегда в положении средней плоскости, определяемой кольцевой системой. Положение заместителя наивысшего первенства на другом асимметричном атоме углерода в кольцевой системе по отношению к положению заместителя наивысшего первенства на основном атоме обозначают , если он находится на той же стороне средней плоскости, определяемой кольцевой системой, или , если он находится на другой стороне средней плоскости, определяемой кольцевой системой. Соединения формулы или (Iа), или (Ib) и некоторые промежуточные соединения неизменно имеют по меньшей мере два стерических центра в их структуре, которые могут приводить по меньшей мере к 4 стереохимически различным структурам. Таутомерные формы соединений формулы или (Iа), или (Ib), как подразумевается, содержат такие соединения формулы или (Iа), или (Ib), где, например, енольная группа преобразуется в кетогруппу (кето-енольный таутомеризм). Подразумевается, что N-оксидные формы соединений, представленные формулой либо (Iа), либо(Ib), содержат такие соединения формулы или (Iа), или (Ib), где один или несколько атомов азота окисле-5 008937 ны до так называемого N-оксида, в частности таких N-оксидов, где окислен азот аминогруппы. Соединения формулы либо (Iа), либо (Ib), которые получают способами, описанными далее, могут быть синтезированы в виде рацемических смесей энантиомеров, которые могут быть отделены один от другого, следуя известным в технике методами разделения. Рацемические соединения формулы или (Iа),или (Ib) могут быть преобразованы в соответствующие диастереомерные солевые формы путем реакции с подходящей хиральной кислотой. Указанные диастереомерные солевые формы затем разделяют, например, селективной или фракционной кристаллизацией и энантиомеры выделяют с помощью щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы или (Iа), или (Ib) предусматривает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные стереохимически чистые изомерные формы могут быть также получены из соответствующих стереохимически чистых изомерных форм подходящих исходных материалов, при условии, что реакция происходит стереоспецифически. Когда желателен конкретный стереоизомер, предпочтительно указанное соединение должно быть синтезировано стереоспецифическими способами получения. В этих способах следует преимуществено использовать энантиомерно чистые исходные материалы. Изобретение также включает производные соединения (обычно называемые "пролекарства") фармакологически активных соединений по изобретению, которые разлагаются in vivo с образованием соединений по изобретению. Пролекарства имеют обычно (но не всегда) более низкую действенность при целевом рецепторе, чем соединения, до которых они разлагаются. Пролекарства особенно применимы,когда желаемое соединение имеет химические или физические свойства, которые делают его введение затруднительным или неэффективным. Например, желаемое соединение может быть только слабо растворимым, оно может плохо транспортироваться через слизистый эпителий, или оно может иметь нежелательно короткий полупериод существования в плазме. Дополнительное обсуждение пролекарств можно найти в Stella, V.J. et al., "Prodrugs", Drug Delivery Systems, 1985, pp. 112-176 и Drugs, 1985, 29, pp. 455473. Пролекарственными формами фармакологически активных соединений по изобретению обычно будут соединения, отвечающие формуле или (Iа), или (Ib), их фармацевтически приемлемые аддитивные соли с кислотой или основанием, их стереохимически изомерные формы, их таутомерные формы и их Nоксидные формы, имеющие кислотную группу, которая этерифицирована или амидирована. К таким этерифицированным кислотным группам относятся группы формулы -COORx, где Rx означает C1-6 алкил,фенил, бензил или одну из следующих групп: Амидированные группы включают группы формулы -CONRyRz, где Ry означает Н, C1-6 алкил, фенил или бензил, и R2 означает -ОН, Н, C1-6 алкил, фенил или бензил. Соединения по изобретению, имеющие аминогруппу, могут быть модифицированы с помощью кетона или альдегида, таким как формальдегид, с получением основания Манниха. Это основание будет подвергаться гидролизу с кинетикой первого порядка в водном растворе. Неожиданно было обнаружено, что соединения по изобретению могут быть использованы для лечения микобактериальных заболеваний, в частности заболеваний, вызываемых патогенными микобактериями, такими как Mycobacterium tuberculosis, M. bovis, M. avium и М. marinum. Данное изобретение,следовательно, относится также к соединениям формулы либо (Iа), либо (Ib), определение которых дано здесь выше, их фармацевтически приемлемым аддитивным солям с кислотами или основаниями, их стереохимически изомерным формам, их таутомерным формам и их N-оксидным формам для применения в качестве медицинского средства. Изобретение также относится к композиции, содержащей фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения по изобретению. Соединения по изобретению могут входить в состав различных фармацевтических форм, предназначенных для введения. Как подходящие составы могут быть названы все составы, обычно используемые для системного введения лекарств. Чтобы приготовить фармацевтические составы по данному изобретению, эффективное количество конкретного соединения, необязательно в виде аддитивной соли, в качестве активного ингредиента, объединяют в тонкоизмельченную смесь с фармацевтически приемлемым носителем, причем этот носитель может иметь широкое разнообразие форм в зависимости от желаемого вида препарата для введения. Эти фармацевтические составы желательны в виде стандартной лекарственной формы, в частности, для перорального введения или парентеральной инъекции. Например, при приготовлении составов в виде лекарственной формы для перорального введения может быть использована любая обычная фармацевтическая среда, такая как, например, вода, гликоли, масла, спирты и тому подобное, в случае жидких препаратов для перорального введения, таких как суспензии, сиропы,эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители,смазки, связующие, дезинтегрирующие агенты и тому подобное, в случае порошков, пилюль, капсул и-6 008937 таблеток. Благодаря легкости их введения, таблетки и капсулы представляют собой наиболее предпочтительные стандартные лекарственные формы для перорального введения, в случае которых явно используются твердые фармацевтические носители. Для парентеральных композиций носитель обычно будет содержать стерильную воду, по меньшей мере, в своей большей части, наряду с другими ингредиентами,например, для улучшения растворимости, которые могут быть включены в состав. Например, могут быть приготовлены растворы для инъекций, в которых носитель включает солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Могут быть также приготовлены суспензии для инъекций, в этом случае могут быть использованы подходящие жидкие носители, суспендирующие агенты и тому подобное. Сюда также относятся препараты в твердом виде, которые предназначаются для преобразования в жидкие препараты незадолго до применения. В зависимости от пути введения фармацевтическая композиция будет предпочтительно содержать от 0,05 до 99 мас.%, более предпочтительно от 0,1 до 70 мас.%, активного ингредиента и от 1 до 99,95 мас.%, более предпочтительно от 30 до 99,9 мас.%, фармацевтически приемлемого носителя, все проценты даны на основе всего состава. Фармацевтическая композиция дополнительно может содержать различные другие известные ингредиенты, например смазку, стабилизирующий агент, буферный агент, эмульгирующий агент, регулирующий вязкость агент, поверхностно-активное вещество, консервант, ароматизирующее вещество или краситель. Особенно удобно получать указанные фармацевтические композиции в виде стандартной лекарственной формы для облегчения введения и равномерности дозирования. Используемый здесь термин"стандартная лекарственная форма" относится к физически дискретным единицам, используемым в качестве унифицированных доз, каждая единица содержит заданное количество активного ингредиента, рассчитанное таким образом, чтобы создавать желательный терапевтический эффект, в сочетании с необходимым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая таблетки с насечками или с покрытием), капсулы, пилюли, пакетики с порошком, облатки, суппозитории, растворы или суспензии для инъекций и тому подобное и их раздельные кратные формы. Суточная доза соединения по изобретению будет, конечно, изменяться в зависимости от используемого соединения, пути введения, желательного лечения и определенного микобактериального заболевания. Однако, как правило, удовлетворительные результаты будут достигнуты, когда соединение по изобретению вводят в суточной дозе, не превышающей 1 г, например в пределах от 10 до 50 мг/кг массы тела. Далее данное изобретение также относится к применению соединения формулы или (Iа), или (Ib),его фармацевтически приемлемых аддитивных солей с кислотами или основаниями, его стереохимически изомерных форм, его таутомерных форм и его N-оксидных форм для производства лекарственного средства для лечения микобактериальных заболеваний. Соответственно, в другом аспекте изобретение относится к способу лечения пациента, страдающего от или подверженного риску микобактериального заболевания, который включает введение пациенту терапевтически эффективного количества соединения или фармацевтического состава по изобретению. Общее приготовление Соединения по изобретению обычно могут быть получены путем последовательных стадий, каждая из которых известна специалисту. В частности, соединения, отвечающие формуле (Iа), могут быть получены путем взаимодействия промежуточного соединения формулы (II) с промежуточным соединением формулы (III) согласно следующей схеме реакции (1): Схема 1 с использованием BuLi в смеси DIPA и ТГФ, где все переменные имеют определения, как в формуле (Iа). Перемешивание может увеличивать скорость реакции. Реакция легко может быть проведена при температуре в пределах между -20 и -70 С. Исходные соединения и промежуточные соединения формул (II) и (III) являются соединениями, которые либо коммерчески доступны, либо могут быть получены согласно обычным способам, широко известным в технике. Например, промежуточные соединения формулы (IIа) могут быть получены согласно следующей схеме реакции (2): где все переменные имеют такие значения, как в формулах (Iа) и (Ib). Схема реакции (2) включает стадию (а), в которой соответствующий замещенный анилин подвергают взаимодействию с соответствующим ацилхлоридом, таким как 3-фенилпропионилхлорид, 3-фторбензолпропионилхлорид или пхлорбензолпропионилхлорид, в присутствии подходящего основания, такого как триэтиламин, и подходящего инертного в реакции растворителя, такого как метиленхлорид или этилендихлорид. Реакция может быть легко осуществлена при температуре в пределах между комнатной температурой и температурой кипения с обратным холодильником. На следующей стадии (b) продукт присоединения, полученный на стадии (а), подвергают взаимодействию с фосфорилхлоридом (РОСl3) в присутствии N,Nдиметилформамида (формилирование по Вильсмайеру-Хааке с последующей циклизацией). Реакция может быть легко осуществлена при температуре в пределах между комнатной температурой и температурой кипения с обратным холодильником. На следующей стадии (с) конкретную группу R3, где R3 является алкилокси или алкилтиорадикалом, вводят путем взаимодействия промежуточного соединения, полученного на стадии (b), с соединением X-Alk, где X=S или О, и Alk означает алкилгруппу, определение которой дано в формулах (Iа) и (Ib). Промежуточные соединения формулы (IIb) могут быть получены согласно следующей схеме реакции (3), где на первой стадии (а) замещенный индол-2,3-дион подвергают взаимодействию с замещенным 3-фенилпропиональдегидом в присутствии подходящего основания, такого как гидроксид натрия(реакция Пфитцингера), после чего соединение карбоновой кислоты на следующей стадии (b) декарбоксилируют при высокой температуре в присутствии подходящего инертного в реакции растворителя, такого как простой дифениловый эфир. Схема 3 Очевидно, что в предшествующих и последующих реакциях продукты реакции могут быть выделены из реакционной среды и, если необходимо, дополнительно очищены в соответствии с известными в данной области способами, такими как экстракция, кристаллизация и хроматография. Кроме того, очевидно, что продукты реакции, которые существуют более чем в одной энантиомерной форме, могут быть выделены из их смеси известными способами, в частности препаративной хроматографией, такой как препаративная ЖХВР. Обычно соединения формул (Iа) и (Ib) могут быть разделены на их изомерные формы.-8 008937 Промежуточные соединения формулы (III) являются соединениями, которые либо коммерчески доступны, либо могут быть получены в соответствии с обычными процедурами реакции, общеизвестными в технике. Например, промежуточные соединения формулы (IIIа), где R3 означает Аr, замещенный заместителями R10, где каждый R10 независимо выбран из группы, включающей гидрокси, галоген, циано, нитро, амино, моно- или диалкиламино, алкил, галогеналкил, алкилокси, галогеналкилокси, карбоксил, алкилоксикарбонил, аминокарбонил, морфолинил и моно- или диалкиламинокарбонил, и s означает целое число, равное 0, 1, 2 или 3, могут быть получены согласно следующей схеме реакции (4): Схема 4 Схема реакции (4) включает стадию (а), в которой соответствующий замещенный фенил подвергают взаимодействию по реакции Фриделя-Крафта с подходящим ацилхлоридом, таким как 3 хлорпропионилхлорид или 4-хлорбутирилхлорид, в присутствии подходящей кислоты Льюиса, такой как АlСl3, FeCl3, SnCl4, TiCl4 или ZnCl2, и подходящего инертного в реакции растворителя, такого как метиленхлорид или этилендихлорид. Реакция может быть легко осуществлена при температуре в пределах между комнатной температурой и температурой кипения с обратным холодильником. На следующей стадии (b) аминогруппу (-NR4R5) вводят путем взаимодействия промежуточного соединения, полученного на стадии (а), с первичным или вторичным амином. Следующие примеры поясняют данное изобретения без его ограничения. Экспериментальная часть Для некоторых соединений абсолютная стереохимическая конфигурация стерического атома (атомов) углерода в них экспериментально не определена. В таких случаях стереохимически изомерная форма, которая была изолирована первой, обозначена как "А", и вторая как "В" безотносительно к действительной стереохимической конфигурации. Однако указанные изомерные формы "А" и "В" могут быть точно охарактеризованы специалистом с использованием известных способов, таких как, например,рентгенография. Способ выделения описан подробно ниже. Здесь далее "ДМФ" означает N,N-диметилформамид, "DIPE" означает диизопропиловый простой эфир, "ТГФ" означает тетрагидрофуран. А. Получение промежуточных соединений. Пример А 1. Получение промежуточного соединения 1 Бензолпропаноилхлорид (0,488 моль) добавляют по каплям при комнатной температуре к раствору 4-бромбензоламина (0,407 моль) в Et3N (70 мл) и CH2Cl2 (700 мл) и смесь перемешивают при комнатной температуре в течение ночи. Смесь выливают в воду и концентрированный NH4OH и экстрагируютCH2Cl2. Органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток подвергают кристаллизации из простого диэтилового эфира. Остаток (119,67 г) экстрагируют в CH2Cl2 и промывают 1 н. НСl. Органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 107,67 г промежуточного соединения 1. Получение промежуточного соединения 9 Соответственно, промежуточное соединение 9 получают таким же способом, как промежуточное соединение 1, но используя 4-метил-бензолпропаноилхлорид. Пример А 2. Получение промежуточного соединения 2 Реакцию проводят дважды. РОСl3 (1,225 моль) добавляют по каплям при 10 С к ДМФ (0,525 моль). Затем при комнатной температуре добавляют промежуточное соединение 1 (полученное согласно А 1)(0,175 моль). Смесь перемешивают в течение ночи при 80 С, выливают на лед и экстрагируют CH2Cl2. Органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Продукт используют без дополнительной очистки. Получают: 77,62 г; выход=67%. Получение промежуточного соединения 10 Соответственно, промежуточное соединение 10 получают таким же способом, как и промежуточное соединение 2, исходя из промежуточного соединения 9 (полученного согласно А 1). Пример A3. Получение промежуточного соединения 3 Смесь промежуточного соединения 2 (полученного согласно А 2) (0,233 моль) в CH3ONa (30%) в метаноле (222,32 мл) и метанола (776 мл) перемешивают и кипятят с обратным холодильником в течение ночи, затем выливают на лед и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4),фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле(элюент: СН 2 Сl2/циклогексан 20/80 и затем 100/0; 20-45 мкм). Чистые фракции собирают и растворитель выпаривают. Получают 25 г промежуточного соединения 3 (выход=33%; т.пл. 84 С) в виде белого порошка. Получение промежуточного соединения 11 Соответственно, промежуточное соединение 11 получают таким же способом, как и промежуточное соединение 3, исходя из промежуточного соединения 10 (полученного согласно А 2). Пример А 4. Получение промежуточного соединения 4 Смесь промежуточного соединения 2 (полученного согласно А 2) (0,045 моль) в NaOEt 21% в этаноле (50 мл) и этанола (150 мл) перемешивают и кипятят с обратным холодильником в течение 12 ч. Смесь выливают на лед и экстрагируют СН 2 Сl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Получают 15,2 г промежуточного соединения 4 (98%). Пример А 5. Получение промежуточного соединения 5 Смесь 5-бром-1 Н-индол-2,3-диона (0,28 моль) в 3 н. NaOH (650 мл) перемешивают и нагревают при 80 С в течение 30 мин, затем охлаждают до комнатной температуры. Добавляют бензолпропаналь (0,28 моль) и смесь перемешивают и кипятят с обратным холодильником в течение ночи. Смеси дают остыть до комнатной температуры и подкисляют НОАс до рН 5. Осадок отфильтровывают, промывают Н 2 О и сушат (вакуум). Получают 50 г промежуточного соединения 5 (52%). Пример А 6. Получение промежуточного соединения 6 Смесь промежуточного соединения 5 (полученного согласно А 5) (0,035 моль) в простом диэтило- 10008937 вом эфире (100 мл) перемешивают и нагревают при 300 С в течение 8 ч, затем дают остыть до комнатной температуры. Эту процедуру повторяют четыре раза. Четыре смеси объединяют и затем очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH 100/0, затем 99/1). Чистые фракции собирают и растворитель выпаривают. Получают 25,6 г промежуточного соединения 6 (61%). Пример А 7. Получение промежуточных соединений 7 и 8nBuLi 1,6 М (0,13 моль) при -10 С. Смесь перемешивают при -10 С в течение 20 мин и затем охлаждают до -70 С. Добавляют по каплям раствор промежуточного соединения 3 (полученного согласно A3) (0,1 моль) в ТГФ (300 мл). Смесь перемешивают при -70 С в течение 45 мин. Добавляют по каплям раствор 2-(3-оксо-3-фенилпропил)-1 Н-изоиндол-1,3(2 Н)-диона (0,13 моль) в ТГФ (300 мл). Смесь перемешивают при -70 С в течение 1 ч, затем доводят до -40 С, перемешивают при -40 С в течение 2 ч, гидролизуют при -40 С Н 2O и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (40 г) очищают колоночной хроматографией на силикагеле (элюент: циклогексан/EtOAc 85/15). Собирают две чистые фракции и растворители выпаривают. Получают 1,8 г промежуточного соединения 7 (3%) и 5,3 г промежуточного соединения 8 (9%). Пример А 8. Получение промежуточных соединений 12 и 13 Смесь хлорида алюминия (34,3 г, 0,257 моль) и 3-хлорпропионилхлорида (29,7 г, 0,234 моль) в дихлорэтане (150 мл) перемешивают при 0 С. Добавляют раствор нафталина (30 г, 0,234 моль) в дихлорэтане (50 мл). Смесь перемешивают при 5 С в течение 2 ч и выливают в воду со льдом. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (56 г) очищают колоночной хроматографией на силикагеле (элюент: циклогексан/СН 2 Сl2 60/40, 20-45 мкм). Собирают две фракции и растворитель выпаривают, получая промежуточное соединение 12 (31 г, выход=61%) в виде масла. Вторую фракцию (14 г) обрабатывают DIPE, получая промежуточное соединение 13 (8,2 г, выход=16%, т.пл. 68 С) в виде твердого бледно-желтого вещества. Пример А 9. Получение промежуточного соединения 14 Смесь промежуточного соединения 12 (полученного согласно А 8) (3 г, 0,0137 моль), Nбензилметиламина (2 мл, 0,0150 моль) в ацетонитриле (100 мл) перемешивают при 80 С в течение 2 ч. При комнатной температуре (RT) добавляют воду. Смесь экстрагируют СН 2 Сl2. Органический слой отделяют и сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (6 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/MeOH 97/3, 20-45 мкм), получая ВВ 1 (4,2 г, количественный выход) в виде масла, получая промежуточное соединение 14. Пример А 10. Получение промежуточного соединения 15 Смесь 3,5-дифторацетофенона (коммерчески доступен) (25 г, 0,16 моль), гидрохлорида диэтиламина (52 г, 0,64 моль), параформальдегида (19 г, 0,63 моль) в конц. НСl (5 мл) и этанола (300 мл) перемешивают при 80 С в течение 16 ч. Смесь выпаривают досуха и остаток обрабатывают 3 н. НСl (50 мл). Эту смесь экстрагируют Et2O (330 мл). Органический слой собирают и подщелачивают K2 СО 3 (10% водн.). Органический слой сушат над MgSO4 и выпаривают. Продукт, промежуточное соединение 15,используют без дополнительной очистки на следующей стадии (23,7 г, выход: 69%) как масло. В. Получение конечных соединений. Пример В 1. Получение конечных соединений 1, 2, 3 и 4 В токе N2 к раствору N-(1-метилэтил)-2-пропанамина (0,067 моль) в ТГФ (100 мл) медленно добавляют nBuLi 1,6 М (0,067 моль) при -20 С. Смесь охлаждают до -70 С. Медленно добавляют раствор промежуточного соединения 3 (полученного согласно A3) (0,122 моль) в ТГФ (200 мл). Смесь перемешивают при -70 С в течение 30 мин. Медленно добавляют раствор 3-(диметиламино)-1-фенил-1-пропанона(0,146 моль) в ТГФ (100 мл). Смесь перемешивают при -70 С в течение 1 ч, затем гидролизуют при -30 С водой со льдом и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (67 г) очищают колоночной хроматографией на силикагеле (элюент:CH2Cl2/CH3OH/NH4OH 99/1/0,1, 20-45 мкм). Собирают две чистые фракции и растворители выпаривают. Фракцию 1 (7,2 г) подвергают кристаллизации из DIPE. Осадок отфильтровывают и сушат. Получают 6,5 г диастереоизомера А (конечное соединение 3) (т.пл. 172 С) (10%) в виде белого твердого вещества. Фракцию 2 (13 г) подвергают кристаллизации из 2-пропанона и простого диэтилового эфира. Осадок отфильтровывают и сушат. Получают 11 г диастереоизомера В (конечное соединение 4) (т.пл. 170 С)(17%) в виде белого твердого вещества. Часть фракции конечного соединения 3 (4 г) разделяют на его энантиомеры колоночной хроматографией (элюент: гексан/2-пропанол 99,9/0,1, колонка: CHIRACELOD). Собирают две чистые фракции и растворители выпаривают. Остаток подвергают кристаллизации из пентана. Осадок отфильтровывают и сушат. Получают 0,7 г энантиомера А 1 (конечное соединение 1)(т.пл.194 С) и 0,6 г энантиомера А 2 (конечное соединение 2) (т.пл. 191 С) в виде твердого белого вещества. Пример В 2. Получение конечных соединений 5 и 6 К раствору N-(1-метилэтил)-2-пропанамина (0,04 8 моль) в ТГФ (70 мл) медленно добавляют nBuLi 1,6 М (0,04 8 моль) при -20 С. Смесь охлаждают снова до -70 С. Медленно добавляют раствор промежуточного соединения 4 (полученного согласно А 4) (0,044 моль) в ТГФ (150 мл). Смесь перемешивают при-70 С в течение 30 мин. Медленно добавляют раствор 3-(диметиламино)-1-фенил-1-пропанона (0,053 моль) в ТГФ (100 мл). Смесь перемешивают при -70 С в течение 1 ч, гидролизуют при -30 С водой со льдом и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (23,5 г) очищают колоночной хроматографией на силикагеле (элюент:CH2Cl2/CH3OH/NH4OH 99,5/0,5/0,1, 15-40 мкм). Собирают две чистые фракции и растворители выпаривают. Остаток подвергают кристаллизации из DIPE. Осадок отфильтровывают и сушат. Получают 0,7 г конечного соединения 5 (3%) (т.пл. 162 С) в виде белого твердого вещества и 1 г конечного соединения 6(5%) (т.пл. 74 С) в виде белого твердого вещества. Пример В 3. Получение конечных соединений 7 и 8 В токе N2 к раствору N-(1-метилэтил)-2-пропанамина (0,070 моль) в ТГФ (70 мл) добавляют по каплям nBuLi (1,6 М) (0,070 моль) при -30 С. Смесь перемешивают при -20 С в течение 30 мин, затем охлаждают до -70 С. Добавляют по каплям раствор промежуточного соединения 6 (полученного согласно А 6) (0,046 моль) в ТГФ (130 мл). Смесь перемешивают при -70 С в течение 45 мин. Добавляют по каплям раствор 3-(диметиламино)-1-фенил-1-пропанона (0,056 моль) в ТГФ (100 мл). Смесь перемешивают при -70 С в течение 2 ч, гидролизуют водой со льдом и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (23,6 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 99/1/0,1, 15-40 мкм). Собирают две чистые фракции и растворители выпаривают. Фракцию 1 (4 г) подвергают кристаллизации из простого диэтилового эфира. Осадок отфильтровывают и сушат. Получают 1,7 г конечного соединения 7 (т.пл. 98 С)(7,6%). Фракцию 2 (3,5 г) подвергают кристаллизации из простого диэтилового эфира/EtOAc. Осадок отфильтровывают и сушат. Получают 2,2 г конечного соединения 8 (т.пл. 180 С) (9,8%) в виде белого твердого вещества. Пример В 4. Получение конечного соединения 9- 13008937 Смесь промежуточного соединения 8 (полученного согласно А 7) (0,009 моль) и гидразина (0,01 моль) в этаноле (70 мл) перемешивают и кипятят с обратным холодильником в течение 1 ч. Растворитель выпаривают досуха. Остаток растворяют в СН 2 Сl2. Органический раствор промывают K2 СО 3 10%, сушат(MgSO4), фильтруют и растворитель выпаривают. Остаток (5 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 97/3/0,1, 15-40 мкм). Собирают чистые фракции и растворитель выпаривают. Остаток подвергают кристаллизации из простого диэтилового эфира. Осадок отфильтровывают и сушат. Получают 2,6 г конечного соединения 9 (т.пл. 204 С) (62%) в виде твердого бледножелтого вещества. Пример В 5. Получение конечного соединения 10CH3I (0,0033 моль) добавляют при комнатной температуре к раствору конечного соединения 4 (полученного согласно В 1) (0,003 моль) в 2-пропаноне (15 мл). Осадок отфильтровывают и сушат. Получают 1,2 г конечного соединения 10 (т.пл. 198 С) (62%) в виде твердого бледно-желтого вещества. Пример В 6. Получение конечного соединения 11 Раствор 3-хлорпероксибензойной кислоты (0,0069 моль) в СН 2 Сl2 (35 мл) добавляют по каплям при комнатной температуре к раствору конечного соединения 4 (полученного согласно В 1) (0,0069 моль) вCH2Cl2 (35 мл). Смесь перемешивают при комнатной температуре в течение 1 ч, промывают K2 СО 3 10%,сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток подвергают кристаллизации из простого диэтилового эфира. Осадок отфильтровывают и сушат. Получают 1,8 г конечного соединения 11 (т.пл. 208 С) в виде твердого белого вещества. Пример В 7. Получение конечных соединений 12, 13, 14 и 15 В токе N2 к раствору N-(1-метилэтил)-2-пропанамина (0,05 моль) в ТГФ (80 мл) медленно добавляют nBuLi 1,6 М (0,05 моль) при -20 С. Смесь перемешивают при 20 С в течение 15 минут, затем охлаждают до -70 С. Медленно добавляют раствор промежуточного соединения 3 (полученного согласно A3)(0,046 моль) в ТГФ (150 мл). Смесь перемешивают при -70 С в течение 30 мин. Медленно добавляют раствор 0,055 моль 3-(диметиламино)-1-(1-нафтил)-1-пропанона в ТГФ (120 мл). Смесь перемешивают при -70 С в течение 3 ч, гидролизуют при -30 С водой со льдом и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (29 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 99,5/0,5/0,1, 15-35 мкм). Собира- 14008937 ют две фракции и растворитель выпаривают. Получают 3 г фракции 1 и 4,4 г фракции 2. Фракции 1 и 2 подвергают кристаллизации отдельно из DIPE. Осадок отфильтровывают и сушат, получают 2,2 г диастереоизомера А, конечного соединения 14 (выход: 9%, т.пл. 210 С) в виде твердого белого вещества и 4 г диастереоизомера В, конечного соединения 15 (выход: 16%, т.пл. 244 С) в виде твердого белого вещества. Чтобы получить соответствующие энантиомеры, диастереоизомер А (конечное соединение 14) очищают хиральной хроматографией на силикагеле (элюент: гексан/EtOH, 99,95/0,05). Собирают две фракции и растворитель выпаривают. Получают 0,233 г энантиомера А 1 (конечное соединение 12) (т.пл. 118 С) в виде твердого белого вещества и 0,287 г энантиомера А 2 (конечное соединение 13) (т.пл. 120 С) в виде твердого белого вещества. Пример В 8. Получение конечных соединений 67, 68, 110 и 111 В токе N2 к раствору N-(1-метилэтил)-2-пропанамина (0,0104 моль) в ТГФ (50 мл) медленно добавляют nBuLi 1,6 М (0,067 моль) при -20 С. Смесь охлаждают до -70 С. Медленно добавляют раствор промежуточного соединения 3 (полученного согласно A3) (0,0087 моль) в ТГФ (50 мл). Смесь перемешивают при -70 С в течение 30 мин. Медленно добавляют раствор 3-(диметиламино)-1-(2,5-дифторфенил)-1 пропанона (0,0122 моль) в ТГФ (20 мл). Смесь перемешивают при -70 С в течение 1 ч, затем гидролизуют при -30 С водой со льдом и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), отфильтровывают и растворитель выпаривают. Остаток (6,3 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 98/2/0,2, 20-45 мкм). Собирают две чистые фракции и растворители выпаривают. Фракцию 1 (1,2 г) подвергают кристаллизации из Et2O. Осадок отфильтровывают и сушат. Получают 0,63 г диастереоизомера А (конечное соединение 67) (т.пл. 60 С, выход=13%) в виде твердого белого вещества. Фракцию 2 (1 г) подвергают кристаллизации из простого диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,64 г диастереоизомера В (конечное соединение 68) (т.пл. 208 С, выход=14%). 0,63 г диастереоизомера А очищают, используя chiracel AD (элюент: гептан/iPrOH,99,95/0,05). Собирают две фракции, соответствующие энантиомеру А 1 (конечное соединение 110, 0,13 г,т.пл. 167 С) в виде твердого белого вещества и энантиомеру А 2 (конечное соединение 111, 0,086 г) в виде масла. Пример В 9. Получение конечных соединений 38, 39, 108 и 109 В токе N2 к раствору N-(1-метилэтил)-2-пропанамина (0,04 моль) в ТГФ (50 мл) медленно добавляют nBuLi 1,6 М (0,04 моль) при -20 С. Смесь охлаждают до -70 С. Медленно добавляют раствор промежуточного соединения 3 (полученного согласно A3) (0,037 моль) в ТГФ (100 мл). Смесь перемешивают при -70 С в течение 30 мин. Медленно добавляют раствор 3-(диметиламино)-1-(3-фторфенил)-1 пропанона (0,044 моль) в ТГФ (50 мл). Смесь перемешивают при -70 С в течение 1 ч, затем гидролизуют при -30 С водой со льдом и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (20 г) очищают колоночной хроматографией на силикагеле(элюент: CH2Cl2/CH3OH/NH4OH 99,5/0,5/0,1, 15-40 мкм). Собирают три чистые фракции и растворители выпаривают. Фракцию 1 (2,8 г) подвергают кристаллизации из DIPE. Осадок отфильтровывают и сушат. Получают 1,45 г (7%) диастереоизомера А (конечное соединение 38) (т.пл. 198 С) в виде твердого белого вещества. Фракцию 2 (3,4 г) подвергают кристаллизации из DIPE. Осадок отфильтровывают и сушат. Получают 1,55 г (8%) диастереоизомера В (конечное соединение 39) (т.пл. 207 С) в виде твердого белого- 15008937 вещества. Часть фракции конечного соединения 38 (1 г) разделяют на его энантиомеры хиральной хроматографией (элюент: гексан/2-пропанол 99,9/0,1, колонка: CHIRACEL OD). Собирают две чистые фракции и растворители выпаривают. Остаток подвергают кристаллизации из пентана. Осадок отфильтровывают и сушат. Выход: 0,3 г энантиомера А 1 (конечное соединение 108) (т.пл. 160 С) в виде твердого белого вещества и 0,26 г энантиомера А 2 (конечное соединение 109) (т.пл. 156 С) в виде твердого белого вещества. Пример В 10. Получение конечных соединений 71 и 72 В токе N2 к раствору N-(1-метилэтил)-2-пропанамина (0,0042 моль) в ТГФ (20 мл) медленно добавляют nBuLi 1,6 М (0,0042 моль) при -20 С. Смесь охлаждают до -70 С. Медленно добавляют раствор промежуточного соединения 9 (полученного согласно А 1) (0,0038 моль) в ТГФ (50 мл). Смесь перемешивают при -70 С в течение 30 мин. Медленно добавляют раствор 3-(диметиламико)-1-(1-нафтил)-1 пропанона (0,0059 моль) в ТГФ (20 мл). Смесь перемешивают при -70 С в течение 1 ч, затем гидролизуют при -30 С водой со льдом и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4),фильтруют и растворитель выпаривают. Остаток (2,2 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 99/1/0,1, 15-40 мкм). Собирают две чистые фракции и растворители выпаривают. Фракцию 1 (0,17 г) подвергают кристаллизации из Et2O. Осадок отфильтровывают и сушат. Выход: 0,05 г диастереоизомера А (конечное соединение 71) (т.пл. 174 С, выход=3%) в виде твердого белого вещества. Фракцию 2 (0,27 г) подвергают кристаллизации из простого диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,053 г диастереоизомера В (конечное соединение 72)(т.пл. 178 С, выход=4%) в виде твердого белого вещества. Пример В 11. Получение конечного соединения 99 Раствор 3-хлорпероксибензойной кислоты (0,0036 моль) в СН 2 Сl2 (10 мл) добавляют по каплям при комнатной температуре к раствору конечного соединения 12 (энантиомер А 1) (полученного согласно В 7)(0,0069 моль) в CH2Cl2 (35 мл). Смесь перемешивают при комнатной температуре в течение 1 ч, промывают K2 СО 3 10%, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток подвергают кристаллизации из простого диэтилового эфира. Осадок отфильтровывают и сушат. Получают 0,16 г конечного соединения 99 (т.пл. 218 С, выход=78%) в виде твердого белого вещества. Пример В 12. Получение конечного соединения 110 В токе N2 к раствору N-(1-метилэтил)-2-пропанамина (0,007 5 моль) в ТГФ (30 мл) медленно добавляют nBuLi 1,6 М (0,0075 моль) при -20 С. Смесь охлаждают до -70 С. Медленно добавляют раствор промежуточного соединения 3 (полученного согласно A3) (0,0062 моль) в ТГФ (20 мл). Смесь перемешивают при -70 С в течение 30 мин. Медленно добавляют раствор 0,0075 моль промежуточного соединения 14 (полученного согласно примеру А 9) в ТГФ (10 мл). Смесь перемешивают при -70 С в течение 90 мин, затем гидролизуют при -30 С водой со льдом и экстрагируют EtOAc. Органический слой отде- 16008937 ляют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (3 г) очищают колоночной хроматографией на силикагеле (элюент: циклогексан/EtOAc 90/10, 15-40 мкм). Конечное соединение 110(1,5 г, выход=38%) получают в виде масла. Пример В 13. Получение конечных соединений 111 и 112 1-Хлорэтилхлорформиат (0,25 мл, 0,0023 моль) добавляют при комнатной температуре в атмосфере азота к раствору производного 111 (1,5 г, 0,0023 моль) в дихлорметане (30 мл). Смесь перемешивают при 80 С в течение 1 ч. Растворитель выпаривают и добавляют метанол (15 мл). Смесь перемешивают и кипятят с обратным холодильником в течение 30 мин. После выпаривания остаток (1,49 г) очищают колоночной хроматографией на силикагеле (15-40 мкм). Первую собранную фракцию подвергают кристаллизации из DIPE, получая (0,168 г, т.пл. 204 С, выход=13%) конечное соединение 111 в виде диастереоизомера А. Вторая собранная фракция соответствует конечному соединению 112 в виде диастереоизомера В(0,298 г, т. пл. 225 С, выход=23%). Пример В 14. Получение конечных соединений 113 и 114 В токе N2 к раствору N-(1-метилэтил)-2-пропанамина (770 мкл, 0,0055 моль) в ТГФ (20 мл) медленно добавляют nBuLi 1,6 М (3,5 мл, 0,0056 моль) при -20 С. Смесь охлаждают до -70 С. Медленно добавляют раствор промежуточного соединения 3 (полученного согласно A3) (1,5 г, 0,0047 моль) в ТГФ (20 мл). Смесь перемешивают при -70 С в течение 30 мин. Медленно добавляют раствор промежуточного соединения 15 (1 г, 0,0047 моль) в ТГФ (10 мл). Смесь перемешивают при -70 С в течение 3 ч, затем гидролизуют при -30 С водой со льдом и экстрагируют EtOAc. Органический слой отделяют, сушат(MgSO4), отфильтровывают и растворитель выпаривают. Остаток (2,8 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 99/1/0,1, 15-40 мкм). Собирают две чистые фракции и растворители выпаривают. Фракцию 1 (0,149 г) подвергают кристаллизации из DIPE, получая конечное соединение 113 (0,14 г, т.пл. 185 С, выход=6%) в виде белого порошка. Фракцию 2 (0,14 г) подвергают кристаллизации из Et2O, получая конечное соединение 114 (0,14 г, т.пл. 210 С, выход=6%) в виде белого порошка. Пример В 15. Получение конечных соединений 115, 116, 117 и 118 В токе N2 к раствору N-(1-метилэтил)-2-пропанамина (1 мл, 0,0071 моль) в ТГФ (20 мл) медленно добавляют nBuLi 1,6 М (4,6 мл, 0,007 4 моль) при -20 С. Смесь охлаждают до -70 С. Медленно добавля- 17008937 ют раствор промежуточного соединения 15 (полученного согласно А 10) (2,0 г, 0,0061 моль) в ТГФ (10 мл). Смесь перемешивают при -70 С в течение 30 мин. Медленно добавляют раствор 3-(диметиламино)1-(3,5-дифторфенил)-1-пропанона (полученного согласно А 10) (2 г, 0,0094 моль) в ТГФ (15 мл). Смесь перемешивают при -70 С в течение 2 ч, затем гидролизуют при -30 С водн. 10% NH4Cl и экстрагируютEtOAc. Органический слой отделяют, сушат (MgSO4), отфильтровывают и растворитель выпаривают. Остаток (4,5 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/iPrOH/NH4OH 99,5/0,5/0,05, 15-40 мкм). Собирают две чистые фракции и растворители выпаривают. Фракцию 1 (0,67 г,выход=20%) подвергают кристаллизации из DIPE, получая конечное соединение 115 (0,29 г, т.пл. 192 С,выход=9%) в виде белого порошка. Фракцию 2 (0,46 г) подвергают кристаллизации из Et2O, получая конечное соединение 116 (0,22 г, т.пл. 224 С, выход=7%) в виде белого порошка. Из 0,1 г конечного соединения 115 выделяют конечные соединения 116 и 117 (энантиомеры) с помощью CHIRACEL OD (элюент: гептан/iPrOH, 99,9/0,1, 15-40 мкм). Собирают две фракции и подвергают кристаллизации из Et2O, получая конечное соединение 116 (0,05 г, т.пл. 161 С, выход=100%) в виде белого порошка и конечное соединение 117 (0,043 г, т. пл. 158 С, выход=98%) в виде белого порошка. Следующие конечные соединения получают согласно способам, описанным выше. Таблица 1 С. Фармакологические примеры. С.1. Способ испытания in vitro соединений в отношении М. tuberculosis. Круглодонные стерильные 96-луночные микротитрационные планшеты заполняют 100 мкл жидкой среды Middlebrook (1). Потом исходные растворы (10 конечная испытуемая концентрация) соединений добавляют объемами по 25 мкл к рядам парных лунок в колонке 2 так, чтобы иметь возможность оценить их воздействия на бактериальный рост. Последовательные пятикратные разбавления делают непосредственно в микротирационных планшетах от колонки 2 до 11, используя специализированную автоматическую систему (Zymark Corp., Hopkinton, MA). Наконечники пипеток заменяют после каждых трех разбавлений, чтобы свести к минимуму ошибки пипетирования с высокогидрофобными соединениями. Необработанные контрольные пробы с инокулятом (колонка 1) и без него (колонка 12) включают в каждый микротитрационный планшет. Приблизительно 5000 КОЕ на лунку Mycobacterium tuberculosis(штамм H37RV) в объеме 100 мкл в жидкой среде Middlebrook (1) добавляют к рядам от А до Н, кроме колонки 12. Такой же объем жидкой среды без инокулята добавляют к колонке 12 в ряды от А до Н. Культуры инкубируют при 37 С в течение 7 дней в увлажненной атмосфере (инкубатор с открытым воздушным клапаном и непрерывной вентиляцией). За день до окончания инкубирования, через 6 дней после инокуляции, во все лунки добавляют Resazurin (1:5) в объеме 20 мкл и планшеты инкубируют еще 24 ч при 37 С. На седьмой день бактериальный рост оценивают флуорометрически. Флуоресценция считывается управляемым компьютером флуорометром (Spectramax Gemini EM, Molecular Devices) при длине волны возбуждения 530 нм и длине волны эмиссии 590 нм. Процентное ингибирование роста, достигаемое соединениями, рассчитывают согласно стандартным методам и данные MIC (представляющие величины IC90, выраженные в микрограмм/мл) рассчитывают. Результаты показаны в табл. 5.- 26008937 С.2. Способ in vitro испытания соединений на антибактериальную активность против штамма М.Smegmatis ATCC607. Круглодонные стерильные 96-луночные микротитрационные планшеты заполняют 180 мкл стерильной деионизированной воды, обогащенной 0,25% BSA. Потом исходные растворы (7,8 конечная испытуемая концентрация) соединений добавляют объемами по 45 мкл к рядам парных лунок в колонке 2 так, чтобы иметь возможность оценить их воздействия на бактериальный рост. Последовательные пятикратные разбавления (45 мкл в 180 мкл) делают непосредственно в микротитрационных планшетах от колонки 2 до 11, используя специализированную автоматическую систему (Zymark Corp., Hopkinton,MA). Наконечники пипеток заменяют после каждых трех разбавлений, чтобы свести к минимуму ошибки пипетирования с высокогидрофобными соединениями. Необработанные контрольные пробы с инокулятом (колонка 1) и без него (колонка 12) включают в каждый микротитрационный планшет. Приблизительно 250 КОЕ на лунку бактериального инокулята в объеме 100 мкл в 2,8 жидкой среде MuellerHinton добавляют к рядам от А до Н, кроме колонки 12. Такой же объем жидкой среды без инокулята добавляют к колонке 12 в ряды от А до Н. Культуры инкубируют при 37 С в течение 48 ч в увлажненной атмосфере с 5% СО 2 (инкубатор с открытым воздушным клапаном и непрерывной вентиляцией). Перед окончанием инкубирования, через 2 дня после инокуляции, бактериальный рост количественно оценивают флуорометрически. Поэтому во все лунки добавляют Alamar Blue (10) в объеме 20 мкл и планшеты инкубируют еще 2 ч при 50 С. Флуоресценция считывается управляемым компьютером флуорометром (Cytofluor, Biosearch) при длине волны возбуждения 530 нм и длине волны эмиссии 590 нм (прирост 30). Процентное ингибирование роста, достигаемое соединениями, рассчитывают согласно стандартным методам. pIC50 определяют как концентрацию 50% ингибирования бактериального роста. Результаты показаны в табл. 5. Таблица 5 Результаты скрининга in vitro соединений по данному изобретению для М. tuberculosis (MIC) и М. smegmatis (pIC50)
МПК / Метки
МПК: C07D 215/48, C07D 405/04, C07D 401/06, C07D 405/06, C07D 215/22, A61P 31/06, C07D 409/04, C07D 215/36, A61K 31/47, C07D 409/06, C07D 401/12
Метки: микобактериальных, производные, ингибиторов, качестве, применение, хинолина
Код ссылки
<a href="https://eas.patents.su/30-8937-proizvodnye-hinolina-i-ih-primenenie-v-kachestve-mikobakterialnyh-ingibitorov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хинолина и их применение в качестве микобактериальных ингибиторов</a>
Предыдущий патент: Производные фенил-гетероциклильных эфиров в качестве ингибиторов обратного захвата серотонина
Следующий патент: Применение кластерина для лечения и/или профилактики периферических неврологических заболеваний
Случайный патент: Кремнийсодержащее соединение в качестве добавки, облегчающей технологическую обработку, для полиолефиновых композиций