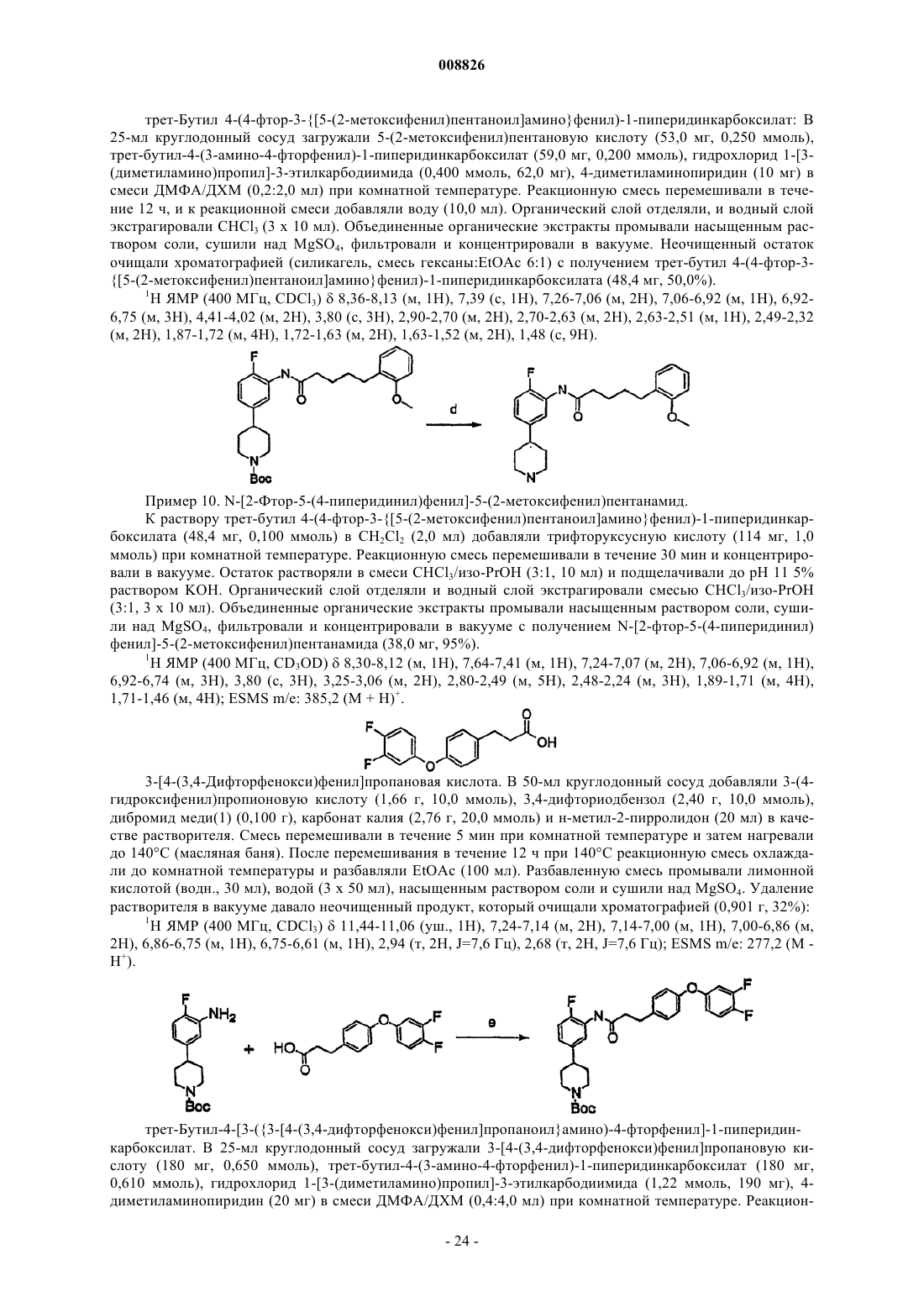
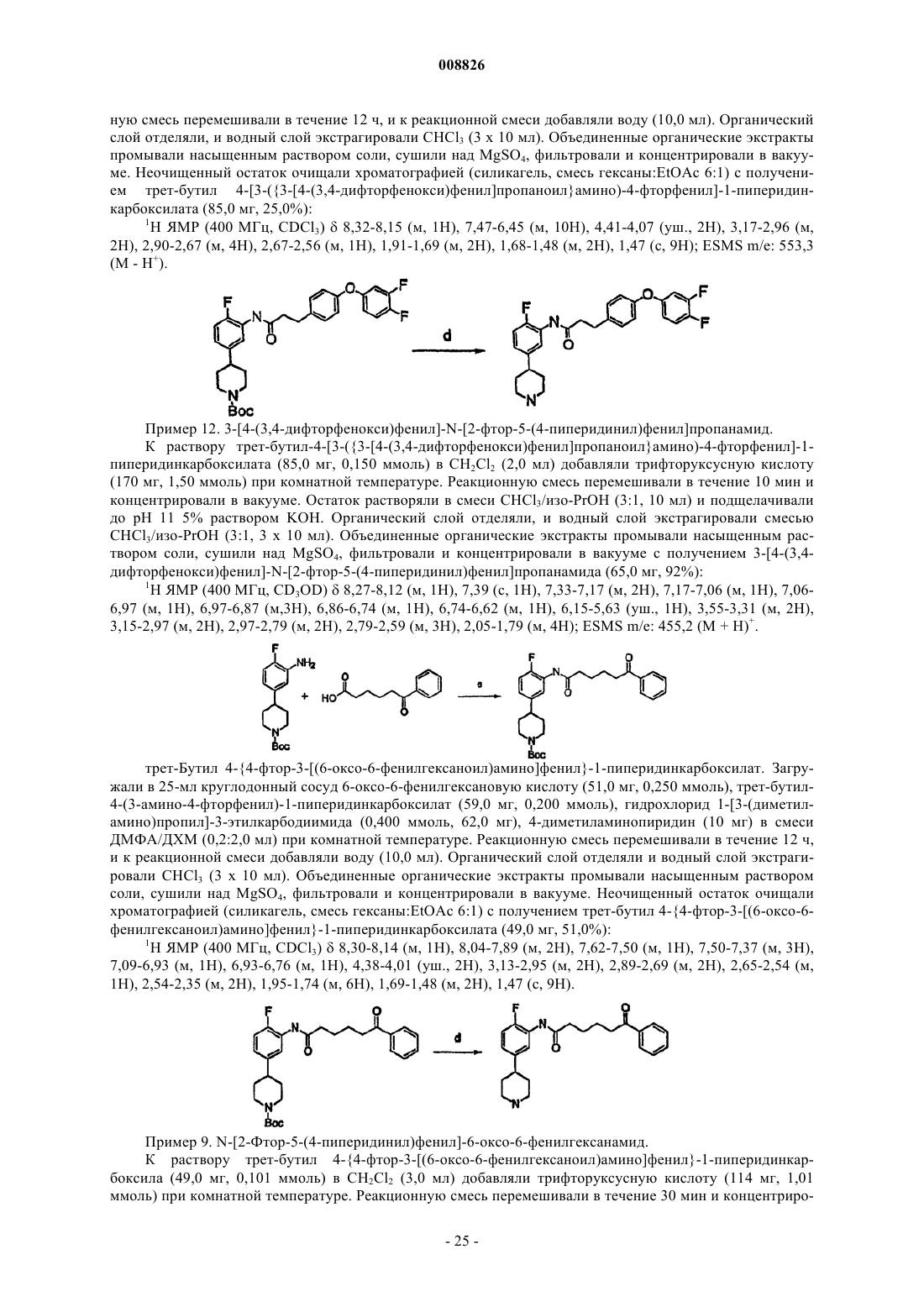
Вторичные аминоанилиновые пиперидины в качестве антагонистов мкг1 и их применение
Номер патента: 8826
Опубликовано: 31.08.2007
Авторы: Лу Каи, Делеон Джон, Марзабади Мохаммад, Дзианг Ю, Ветцель Джон, Чен Чиен-Ан
Формула / Реферат
1. Соединение, имеющее структуру
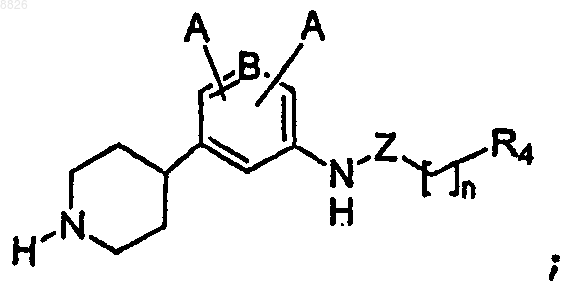
где каждый А независимо представляет собой -Н, -F, -Cl, -Br, -I, -CN, -NO2 или C1-C7 алкил с линейной или разветвленной цепью;
В представляет собой СН;
Z представляет собой СО;
R4 представляет собой -ОR3, -NHR3, -СОR3, С6 или С10 арил или С3-С10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -OR2 или C1-C7 алкилом с линейной или разветвленной цепью;
где каждый R3 независимо представляет собой -Н; C1-C7 алкил с линейной или разветвленной цепью, C1-C7 монофторалкил или C1-C7 полифторалкил; С6 или С10 арил или С3-С10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -NO2, -CN, -OR2 или -NHR2;
где каждый R2 независимо представляет собой -Н, C1-C7 алкил с линейной или разветвленной цепью, С6 или С10 арил или С3-С10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -NO2 или -CN; и
n представляет собой целое число от 0 до 6 включительно;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где соединение имеет структуру
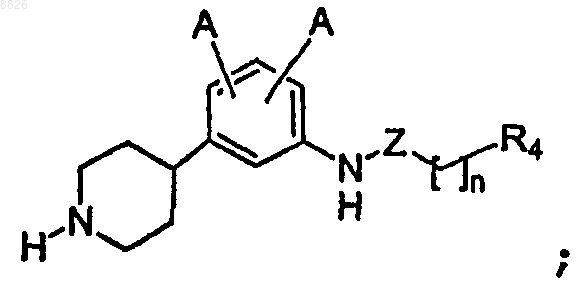
где А и Z определены в п.1;
R4 представляет собой С6 или С10 арил или С3-С10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -ОR3 или C1-C7 алкилом с линейной или разветвленной цепью;
где каждый R3 представляет собой C1-C7 алкил с линейной или разветвленной цепью, С6 или С10 арил или С3-С10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -NO2, -CN или -OR2;
где каждый R2 представляет собой -Н, C1-C7 алкил с линейной или разветвленной цепью, С6 или С10 арил или С3-С10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -NO2 или -CN; и
n определено в п.1.
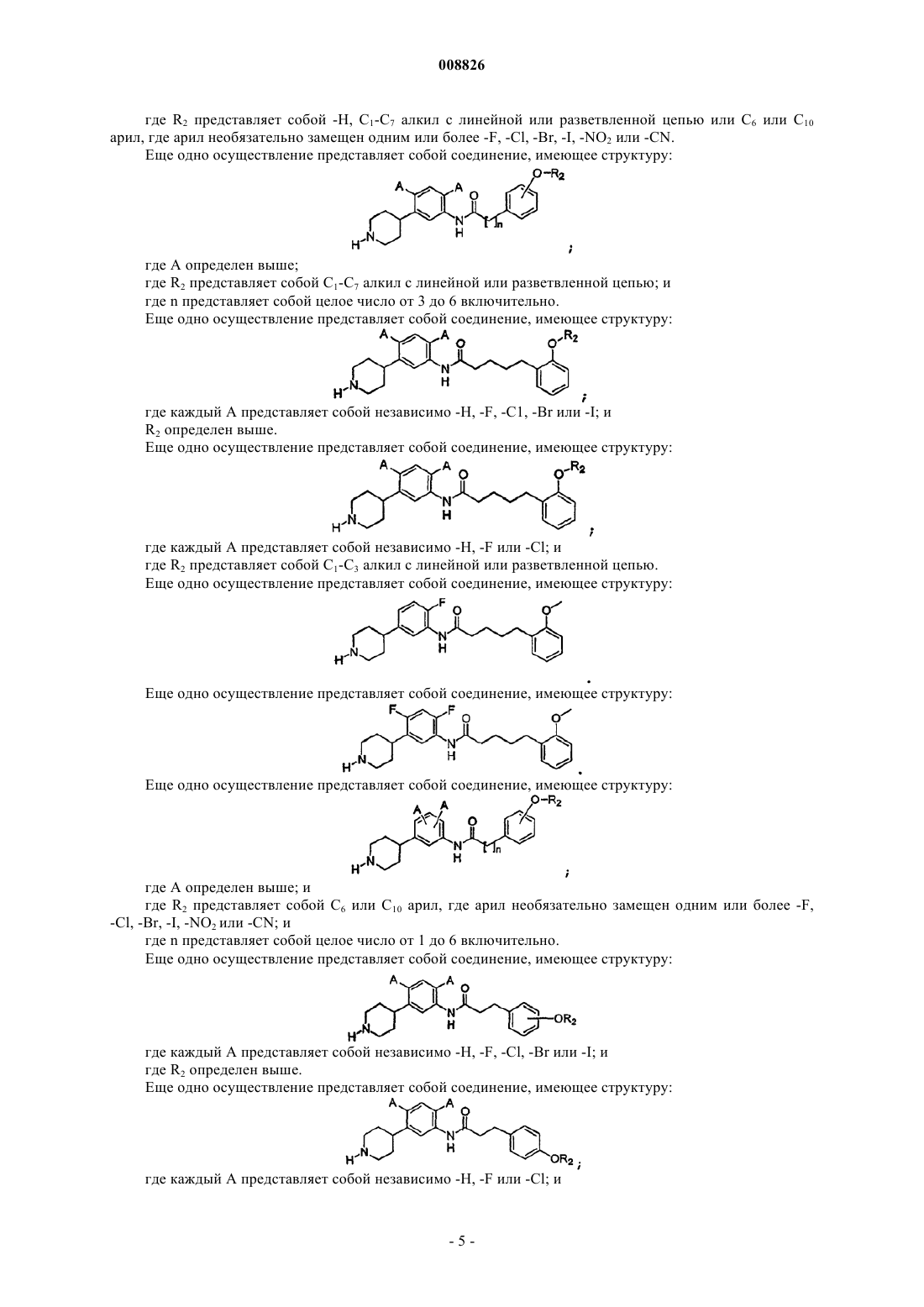
3. Соединение по п.2, где соединение имеет структуру
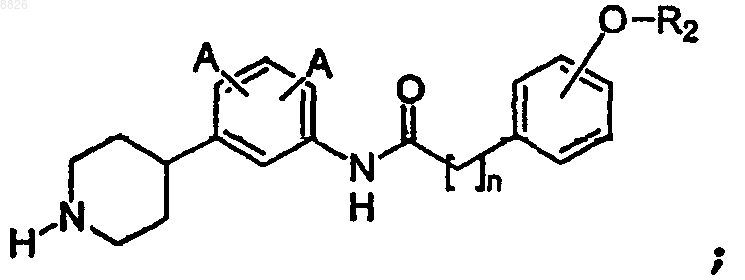
где А определен в п.1;
R2 представляет собой -Н, C1-C7 алкил с линейной или разветвленной цепью или С6 или С10 арил, где арил необязательно замещен одним или более -F, -Cl, -Br, -I, -NO2 или -CN; и
n определено в п.1.
4. Соединение по п.3, где соединение имеет структуру
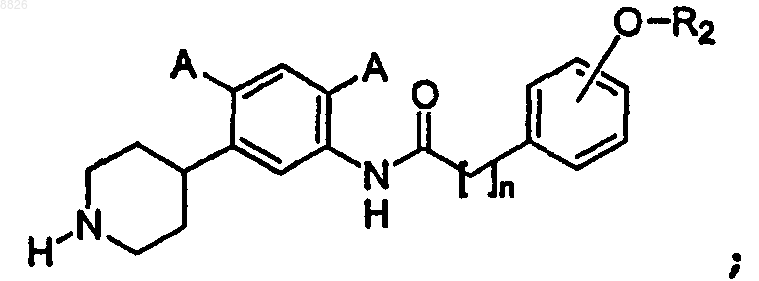
где А определен в п.1;
R2 представляет собой C1-C7 алкил с линейной или разветвленной цепью и
n представляет собой целое число от 3 до 6 включительно.
5. Соединение по п.4, где соединение имеет структуру
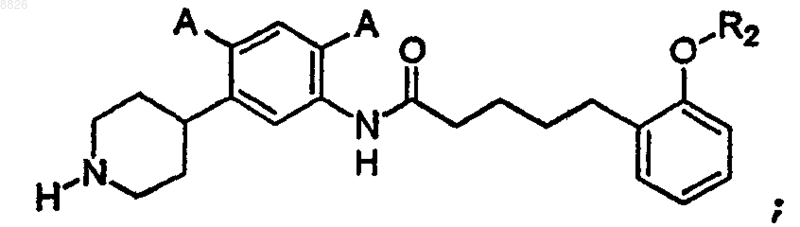
где каждый А представляет собой независимо -Н, -F, -Cl, -Br или -I и R2 определен в п.4.
6. Соединение по п.5, где соединение имеет структуру
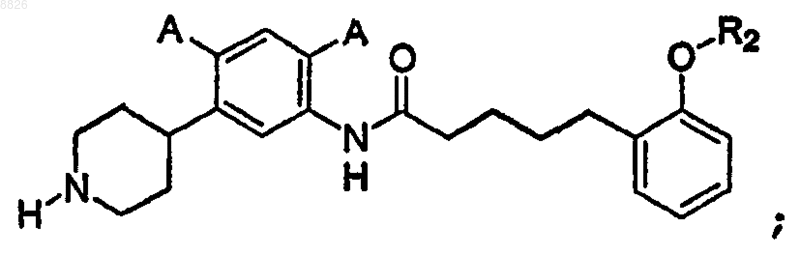
где каждый А представляет собой независимо -Н, -F или -Cl; и где R2 представляет собой C1-С3 алкил с линейной или разветвленной цепью.
7. Соединение по п.6, где соединение имеет структуру
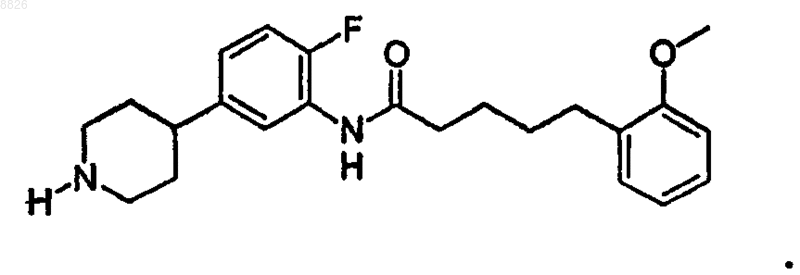
8. Соединение по п.6, где соединение имеет структуру
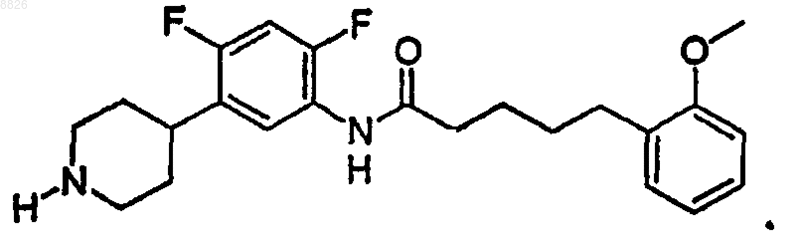
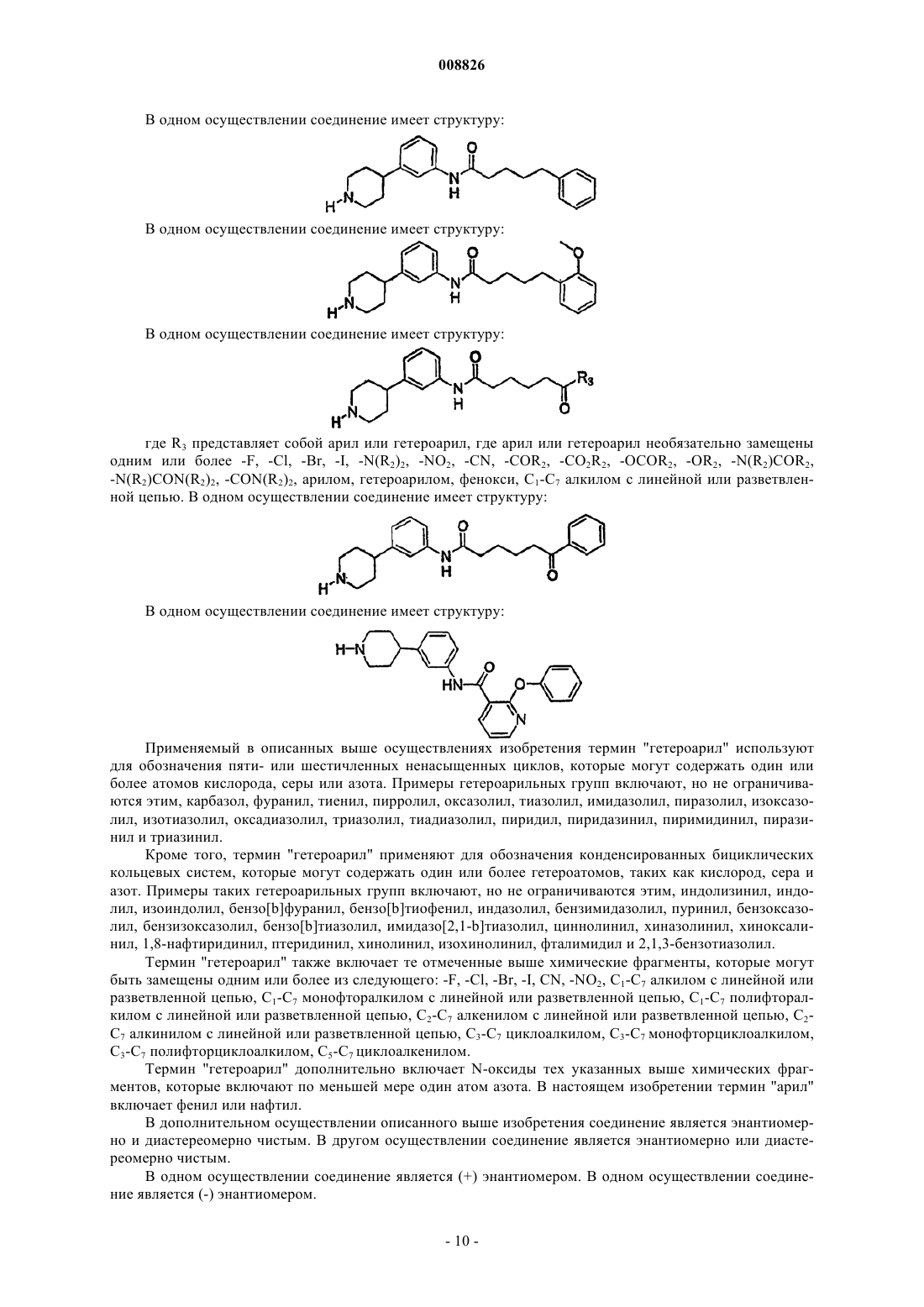
9. Соединение по п.1, где соединение имеет структуру
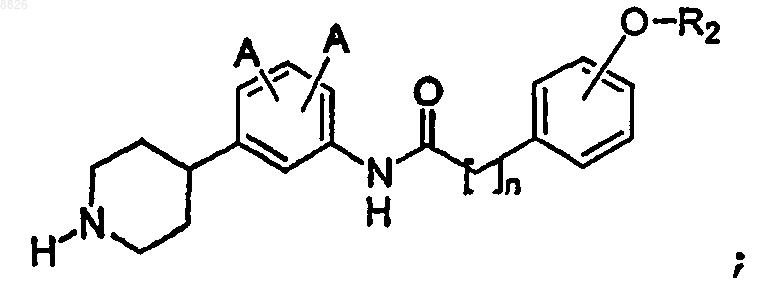
где А определен в п.1 и
R2 представляет собой С6 или С10 арил, где арил необязательно замещен одним или более -F, -Cl, -Br, -I, -NO2 или -CN; и
n представляет собой целое число от 1 до 6 включительно.
10. Соединение по п.9, где соединение имеет структуру
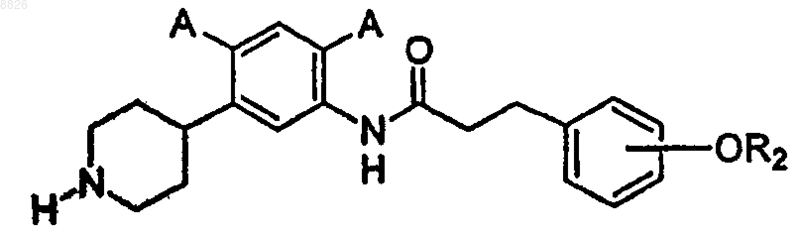
где каждый А представляет собой независимо -Н, -F, -Cl, -Br или -I и
R2 определен в п.9.
11. Соединение по п.10, где соединение имеет структуру
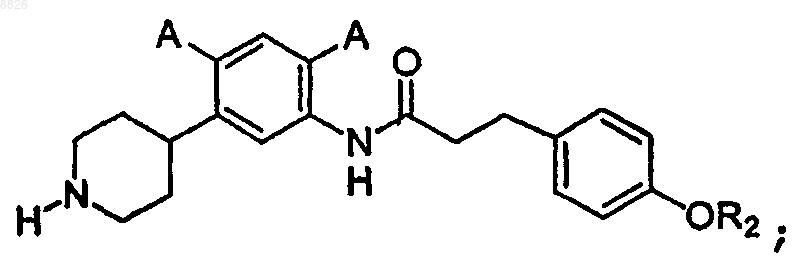
где каждый А представляет собой независимо -Н, -F или -Cl и
R2 представляет собой С6 или С10 арил, необязательно замещенный одним или более -F, -Cl или -Br.
12. Соединение по п.11, где соединение имеет структуру
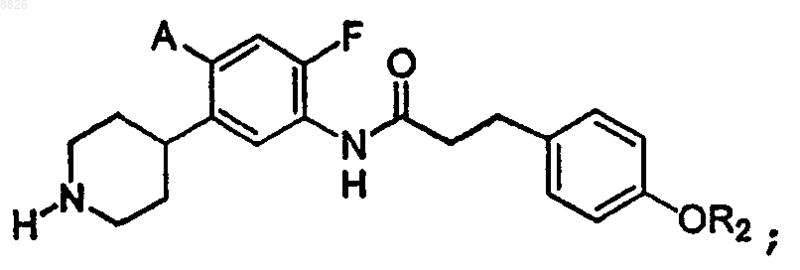
где каждый А представляет собой независимо -Н, -F или -Cl и
R2 представляет собой С6 или С10 арил, необязательно замещенный одним или более -F.
13. Соединение по п.12, где соединение имеет структуру
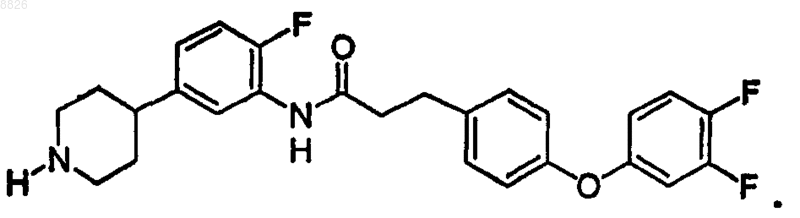
14. Соединение по п.1, где соединение имеет структуру
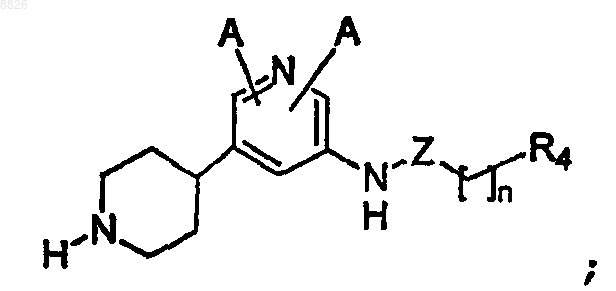
где A, Z, n и R4 определены в п.1.
15. Соединение по п.14, где соединение имеет структуру
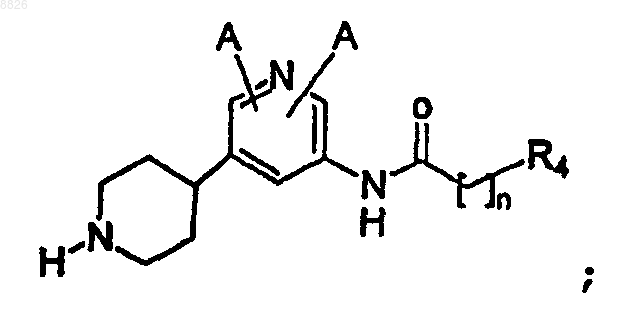
где А определен в п.1; и
R4 представляет собой С6 или С10 арил, необязательно замещенный одним или более -F, -Cl, -Br, -I,
-OR3 или C1-C7 алкилом с линейной или разветвленной цепью;
где каждый R3 представляет собой независимо C1-C7 алкил с линейной или разветвленной цепью, С6 или С10 арил или С3-С10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -NO2, -CN или -OR2;
где каждый R2 представляет собой независимо C1-C7 алкил с линейной или разветвленной цепью; и
n определено в п.1.
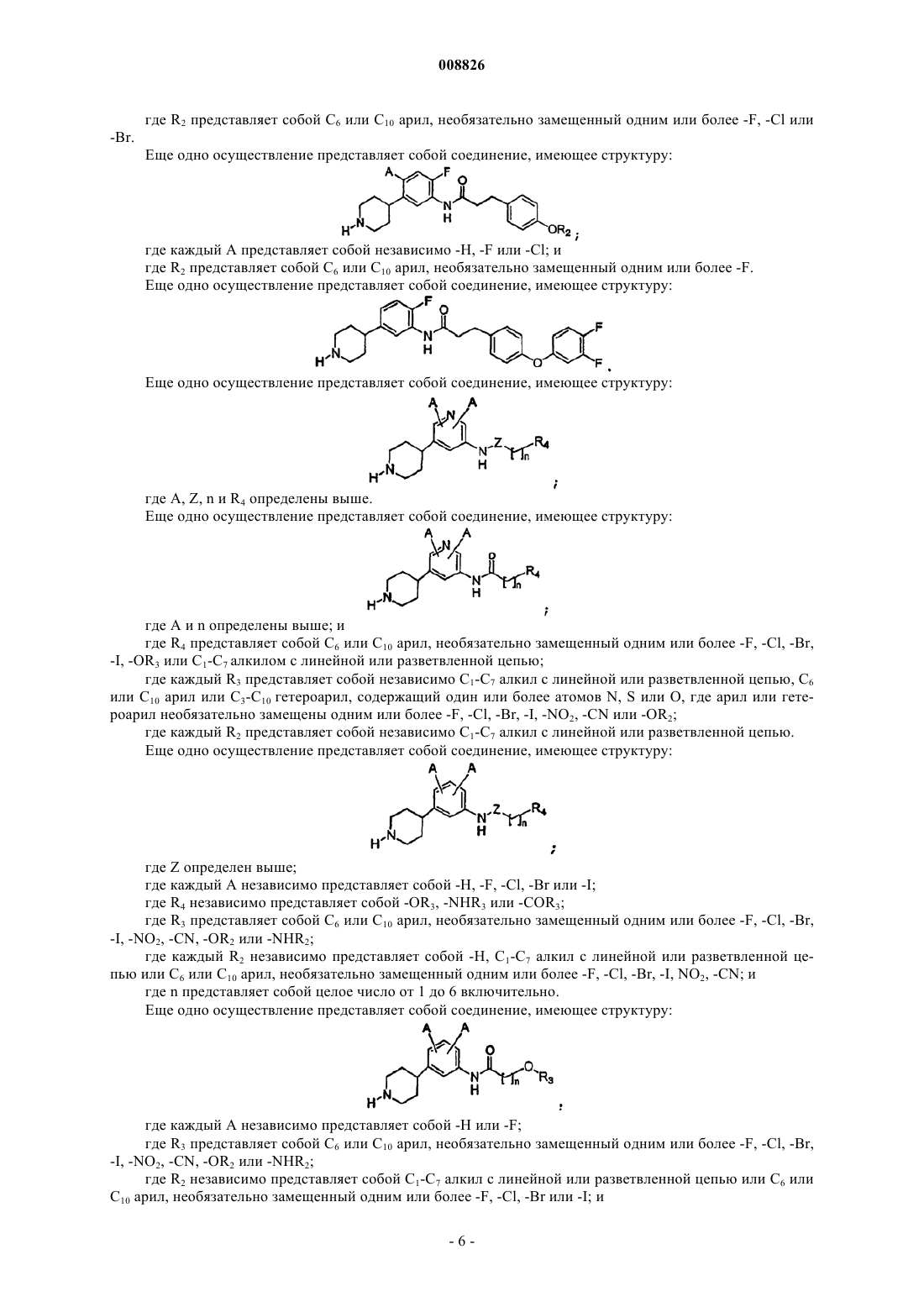
16. Соединение по п.1, где соединение имеет структуру
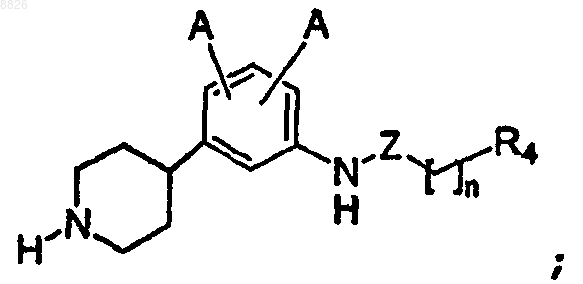
где Z определен в п.1;
каждый А независимо представляет собой -Н, -F, -Cl, -Br или -I;
R4 независимо представляет собой -ОR3, -NHR3 или -СОR3;
где R3 представляет собой С6 или С10 арил, необязательно замещенный одним или более -F, -Cl, -Br, -I, -NO2, -CN, -OR2 или -NHR2;
где каждый R2 независимо представляет собой -Н, C1-C7 алкил с линейной или разветвленной цепью или С6 или С10 арил, необязательно замещенный одним или более -F, -Cl, -Br, -I, -NO2, -CN; и
n представляет собой целое число от 1 до 6 включительно.
17. Соединение по п.16, где соединение имеет структуру
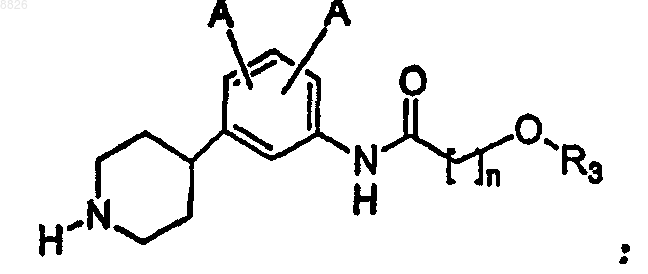
где каждый А независимо представляет собой -Н или -F;
где R3 представляет собой С6 или С10 арил, необязательно замещенный одним или более -F, -Cl, -Br, -I, -NO2, -CN, -OR2 или -NHR2;
где R2 независимо представляет собой C1-C7 алкил с линейной или разветвленной цепью или С6 или С10 арил, необязательно замещенный одним или более -F, -Cl, -Br или -I; и
n представляет собой целое число от 1 до 6 включительно.
18. Соединение по п.16, где соединение имеет структуру

где А представляет собой -Н, -F, -Cl, -Br или -I;
R3 представляет собой С6 или С10 арил, необязательно замещенный -NHR2 и
где R2 представляет собой С6 или С10 арил, необязательно замещенный одним или более -F, -Cl, -Br, -I;
19. Соединение по п.18, где соединение имеет структуру
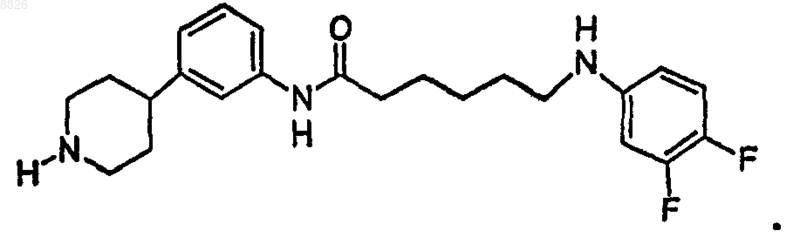
20. Соединение по п.16, где соединение имеет структуру
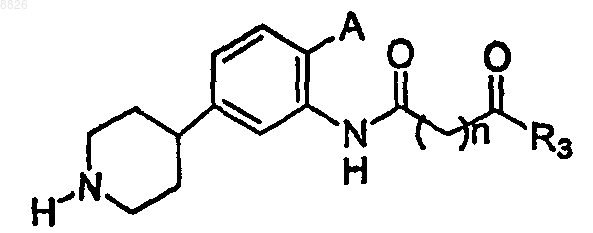
21. Соединение по п.20, где соединение имеет структуру
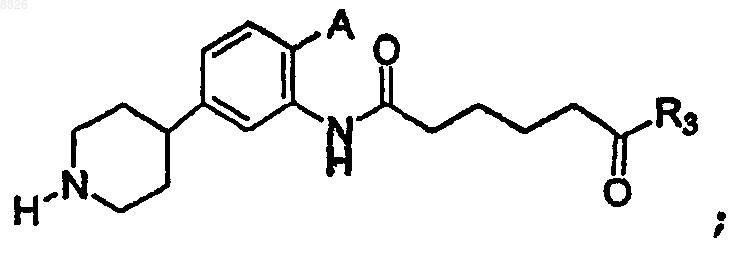
где А представляет собой -Н, -F, -Cl, -Br или -I;
R3 представляет собой С6 или C10 арил, необязательно замещенный одним или более -F, -Cl, -Br или -I.
22. Соединение по п.21, где соединение имеет структуру
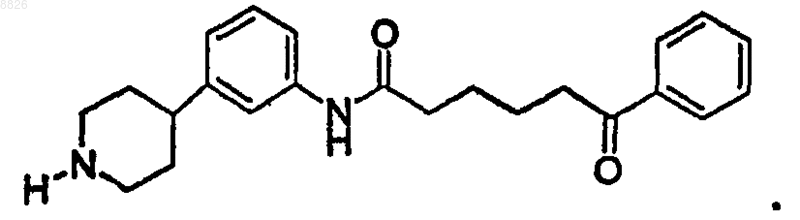
23. Соединение по п.21, где соединение имеет структуру

24. Фармацевтическая композиция, включающая соединение по п.1 и фармацевтически приемлемый носитель.
25. Способ получения фармацевтической композиции, включающий смешивание соединения по п.1 и фармацевтически приемлемого носителя.
26. Применение соединения по п.1 для приготовления лекарственного средства для лечения нарушения, опосредованного рецептором МКГ1.
27. Применение по п.26, где терапевтически эффективное количество составляет количество от приблизительно 0,03 до приблизительно 300 мг.
28. Применение по п.27, где нарушение представляет собой депрессию.
29. Применение по п.27, где нарушение представляет собой тревожность.
30. Применение по п.27, где нарушение представляет собой ожирение.
31. Применение по п.27, где нарушение представляет собой ургентное недержание мочи.
32. Применение соединения по п.1 для приготовления лекарственного средства для лечения депрессии, тревожности, недержания мочи или ожирения.
33. Применение по п.32, где терапевтически эффективное количество составляет от приблизительно 0,03 до приблизительно 300 мг.
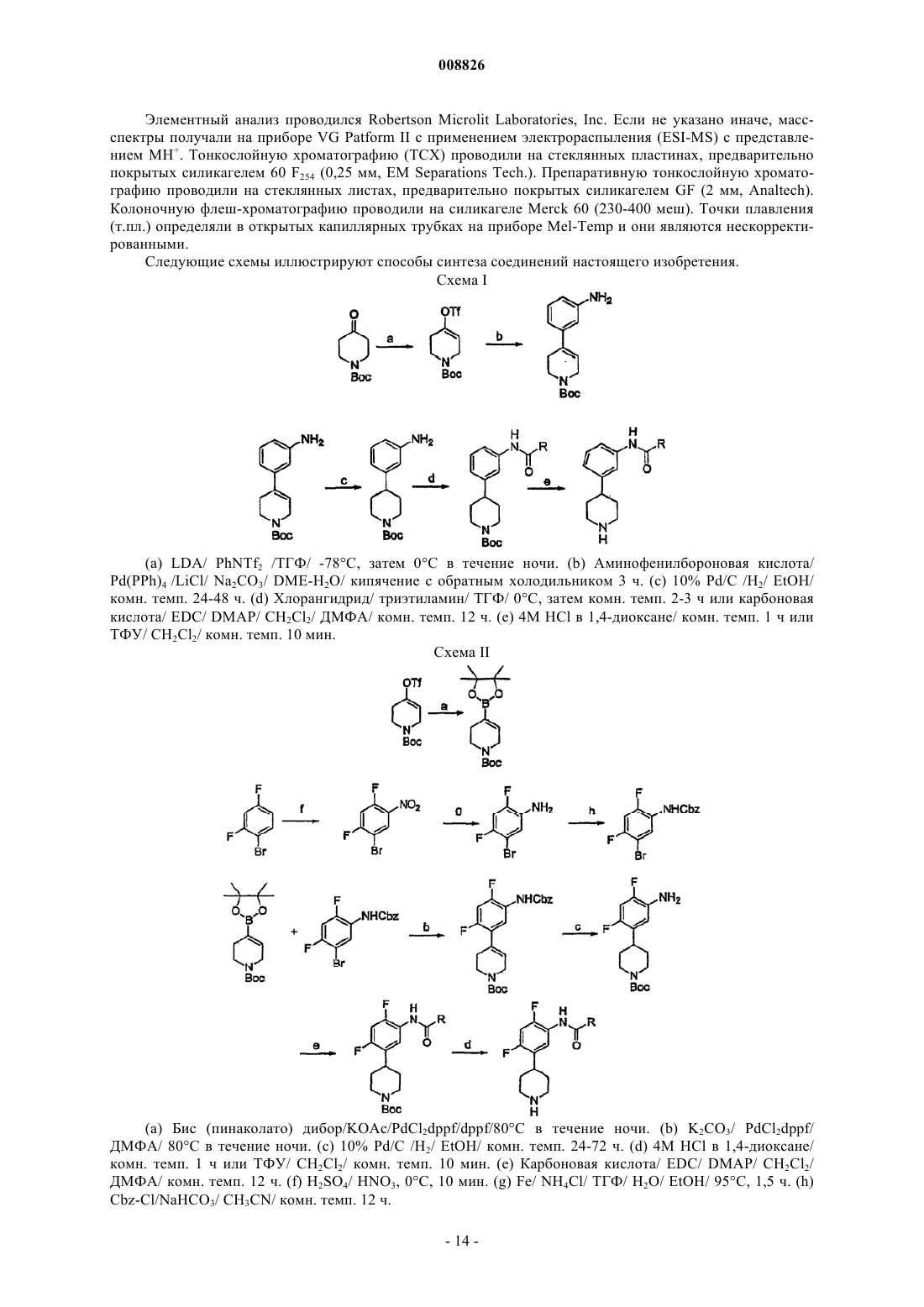
Текст
008826 По данной заявке испрашивается приоритет на основании патента США 10/189145, зарегистрированного 3 июля 2002 г., содержание которого включено в качестве ссылки. По всему описанию к данной заявке в скобках даются ссылки на различные публикации, указывающие автора и год. Полные библиографические данные ссылок можно найти в конце описания непосредственно перед формулой изобретения. Полное раскрытие данных публикаций, таким образом, включено в данную заявку в качестве ссылки для более подробного описания области техники, к которой относится изобретение. Область техники, к которой относится изобретение Меланинконцентрирующий гормон (МКГ) представляет собой циклический пептид, первоначально выделенный из гипофиза лососевых (костистые рыбы) (Kawauchi et al., 1983). У рыб пептид из 17 аминокислот вызывает агрегацию меланина в меланофорах и ингибирует секрецию АКТГ, действуя в качестве функционального антагониста -МСГ. МКГ млекопитающих (19 аминокислот) высоко консервативен у крысы, мыши и человека, проявляя 100% аминокислотную идентичность, но его физиологическая роль менее ясна. МКГ, как показано, участвует в различных процессах, включая регуляцию потребления пищи, водного баланса, энергетического метаболизма, состояния общего возбуждения/внимания, памяти и когнитивных функций, а также психиатрических нарушениях (в качестве обзоров смотри Baker, 1991;Baker, 1994; Nahon, 1994; Knigge et al., 1996). Его роль в регуляции потребления пищи или массы тела подтверждается недавней публикацией в Nature (Qu et al., 1996), в которой продемонстрировано, что наблюдается гиперэкспрессия МКГ в гипоталамусе мышей ob/ob по сравнению с мышами ob/+ и что при голодании дополнительно увеличивается мРНК МКГ как у мышей с ожирением, так и у нормальных мышей. МКГ также стимулирует потребление пищи у нормальных крыс при введении в боковые желудочки (Rossi et al., 1997). Сообщалось также, что МКГ является функциональным антагонистом поведенческих эффектов МСГ (Miller et al., 1993; Gonzalez et al., 1996; Sanchez et al., 1997); кроме того, как показано, стресс увеличивает уровень мРНК ПОМК, снижая в то же время уровень мРНК предшественника МКГ, препроМКГ (ппМКГ), (Presse et al., 1992). Таким образом, МКГ может служить в качестве интегративного нейропептида, вовлеченного в реакцию на стресс, а также в регуляцию потребления пищи и половой активности (Baker, 1991; Knigge et al., 1996). Биологические эффекты МКГ, как считается, опосредуются специфическими рецепторами. Меченный тритием лиганд ([3H]-MКГ), как сообщалось, демонстрирует специфическое связывание с мембранами мозга, но непригодное для сатурационного анализа, так, что ни сродство, ни Вmax не были определены (Drozdz and Eberle, 1995). Йодирование тирозина в тринадцатом положении радиоактивным йодом дает лиганд с существенно сниженной биологической активностью (см. Drozdz and Eberle, 1995). Напротив, йодирование радиоактивным йодом аналога МКГ, [Phe13,Tyr19]-МКГ, было успешным (Drozdz et al.,1995); лиганд сохраняет биологическую активность и демонстрирует специфическое связывание с различными клеточными линиями, включая мышиную меланому (B16-F1, G4F и G4F-7), клетки РС 12 иCOS. В клетках G4F-7 КD = 0,118 нМ и Вmax1100 сайтов/клетка. Важно, что связывание не ингибировалось -МСГ, но слабо ингибировалось ANF крысы (Ki = 116 нМ по сравнению с 12 нМ для нативного МКГ) (Drozdz et al., 1995). Позднее сообщалось о специфическом связывании МКГ в трансформированных кератиноцитах (Burgaud et al., 1997) и клетках меланомы (Drozdz et al., 1998), где исследования с поперечной фотосшивкой дают возможность предполагать, что рецептор представляет собой мембранный белок с кажущейся молекулярной массой 45-50 кДа, что сравнимо с диапазоном молекулярных масс суперсемейства рецепторов GPCR. До сих пор не сообщалось о радиоавторадиографических исследованиях локализации рецептора МКГ с применением данного лиганда. Локализация и типы биологической активности пептида МКГ предполагают, что модуляция активности рецептора МКГ может быть полезной для ряда терапевтических приложений. Роль МКГ в потреблении пищи наиболее хорошо охарактеризована в плане потенциального клинического применения. МКГ экспрессируется в латеральном гипоталамусе - области мозга, вовлеченной в регуляцию жажды и голода (Grillon et al., 1997); недавно было показано, что орексины А и В, которые являются сильными орексигенными агентами, характеризуются очень сходной с МКГ локализацией в латеральном гипоталамусе (Sakurai et al., 1998). Уровни мРНК МКГ в данной области мозга растут у крыс после лишения пищи в течение 24 ч (Herve and Fellman, 1997); после введения инсулина наблюдается существенное увеличение распространенности и интенсивности окрашивания иммунореактивного МКГ перикарионов и волокон одновременно со значительным ростом уровня мРНК МКГ (Bahjaoui-Bouhaddi et al., 1994). В соответствии со способностью МКГ стимулировать потребление пищи у крыс находятся данные о том, что уровни мРНК МКГ повышаются в гипоталамусах мышей ob/ob с ожирением (Qu et al., 1996) и снижаются в гипоталамусах крыс, получавших лептин, чье потребление пищи и прибавка в массе тела также снижались (Sahu, 1998). МКГ, очевидно, действует как функциональный антагонист меланокортиновой системы в плане своих эффектов на потребление пищи и на секрецию гормонов ГГА осью (гипоталамо-гипофизарно-адреналовая ось) (Ludwig et al., 1998). Вместе эти данные дают возможность предполагать участие эндогенного МКГ в регуляции энергетического баланса и ответа на стресс и являются-1 008826 обоснованием для разработки конкретных соединений, действующих на рецепторы МКГ для применения при лечении ожирения и ассоциированных со стрессом нарушений. У всех видов, исследованных к настоящему времени, основная часть нейронов содержащей МКГ группы клеток занимает достаточно постоянное положение в тех областях латерального гипоталамуса и субталамуса, где они расположены, и может представлять собой часть некоторых так называемых экстрапирамидальных моторных путей. Они включают важные стриатные и паллидофугальные пути, включая таламус и кору мозга, области гипоталамуса и реципрокные связи с субталамусным ядром, субстанцией нигра и центрами среднего мозга (Bittencourt et al., 1992). По своей локализации содержащая МКГ группа клеток может быть мостом или механизмом для установления связи гипоталамической висцеральной активности с подходящей и координированной моторной активностью. Клинически это может иметь определенную ценность для рассмотрения вовлечения данной системы МКГ в заболевания с нарушениями движения, такие как болезнь Паркинсона и хорея Гентингтона, в которые, как известно, вовлечены экстрапирамидальные пути. Исследования генетических сцеплений человека локализовали локусы аутентичного МКГч на 12 хромосоме (12q23-24) и вариант локусов МКГч на 5 хромосоме (5ql2-13) (Pedeutour et al., 1994). Локус 12q23-24 совпадает с локусом, в котором картирована аутосомная доминантная атаксия мозжечка типа II(SCA2) (Auburger et al., 1992; Twells et al., 1992). Данное заболевание включает нейродегенеративные нарушения, включая оливопонтомозжечковую атрофию. Кроме того, ген болезни Дарье был картирован в локусе 12q23-24 (Craddock et al., 1993). Болезнь Дарье характеризуется аномалиями в адгезии кератиноцитов I и психическими расстройствами в некоторых семьях. С точки зрения функционального и анатомического паттернов нервной системы МКГ в мозге крыс и человека ген МКГ может быть хорошим кандидатом для SCA2 и болезни Дарье. Интересно,что заболевания с высоким социальным влиянием картированы в данном локусе. Действительно, ген,ответственный за хроническую и острую формы спинальной мышечной атрофии, был приписан к хромосоме 5q12-13 с применением анализа генетического сцепления (Melki et al., 1990; Westbrook et al., 1992). Более того, независимые линии доказательств поддерживают отнесение главного локуса шизофрении к хромосоме 5q11.2-13.3 (Sherrington et al., 1988; Bassett et al., 1988; Gilliam et al., 1989). Представленные выше исследования предполагают, что МКГ может играть роль в нейродегенеративных заболеваниях и нарушениях эмоциональной сферы. На основе наблюдаемых эффектов МКГ в других биологических системах предполагаются дополнительные терапевтические приложения соединений, относящихся к МКГ. Например, МКГ может регулировать репродуктивные функции у самцов и самок крыс. Транскрипты МКГ и пептид МКГ найдены в зародышевых клетках семенников взрослых крыс, предполагая, что МКГ может участвовать в обновлении стволовых клеток и/или дифференцировке ранних сперматоцитов (Hervieu et al., 1996). МКГ, введенный прямо в медиальную преоптическую область (МРОА) или в вентромедиальное ядро (VMN), стимулировал половую активность у самок крыс (Gonzalez et al., 1996). У овариэктомированных крыс,праймированных эстрадиолом, МКГ стимулировал секрецию лютеинизирующего гормона (ЛГ), в то время как антисыворотка против МКГ ингибировала секрецию ЛГ (Gonzalez et al., 1997). Zona incerta,которая содержит большую популяцию тел клеток МКГ, идентифицирована ранее как регуляторная область предовуляторного выброса ЛГ (MacKenzie et al., 1984). Сообщалось, что МКГ влияет на секрецию гипофизарных гормонов, включая АКТГ и окситоцин. Аналоги МКГ могут также быть пригодными для лечения эпилепсии. В модели припадков PTZ введение МКГ перед индукцией припадка предотвращало конвульсивную активность, как у крыс, так и у морских свинок, предполагая, что нейроны, содержащие МКГ, могут участвовать в нервных связях, лежащих в основе индуцированного PTZ припадка (Knigge and Wagner, 1997). МКГ, как было обнаружено, влияет также на поведенческие корреляты когнитивных функций. Введение МКГ ускоряло угасание ответа пассивного избегания у крыс (McBride et al., 1994), увеличивая вероятность того, что антагонисты рецептора МКГ могут быть полезны для сохранения памяти и/или ее удержания. Возможная роль МКГ в модуляции или восприятии боли поддерживается плотной иннервацией околоводопроводного серого вещества(PAG) МКГ-позитивными волокнами. Наконец, МКГ может участвовать в регуляции потребления воды.ICV инфузия МКГ находящейся в сознании овце вызывала диуретические, натрийуретические и калийуретические изменения в ответе на увеличенный объем плазмы (Parkes, 1996). Совместно с анатомическими данными, сообщающими о присутствии МКГ в областях мозга, регулирующих водный баланс, результаты указывают на то, что МКГ может быть важным пептидом, вовлеченным в центральный контроль водного гомеостаза у млекопитающих. Недавно опубликованы данные об идентификации рецептора МКГ, ассоциированного с G-белками(Chambers et al., 1999; Saito et al., 1999). Данные группы идентифицировали МКГ как эндогенный лиганд сиротского рецептора SLC-1 человека, ассоциированного с G-белками (Lakaye et al., 1998). Крысиный гомолог данного рецептора (называемый сейчас МКГ-1), как сообщалось, локализован в областях мозга крыс, связанных с пищевым поведением (например, дорзомедиальном и вентромедиальном гипоталамусе). Связь между МКГ-1 и эффектами МКГ на потребление пищи была дополнительно подтверждена последними сообщениями о фенотипе нокаутных по МКГ-1 мышах. Две группы независимо показали(Marsh et al, 2002; Chen et al, 2002), что направленное разрушение гена рецептора МКГ-1 (нокаут МКГ-1) у мышей ведет к тому, что животные страдают гиперфагией, но являются худыми и имеют сниженную массу тела по отношению к детенышам дикого типа. Снижение массы тела обусловлено увеличением метаболизма. Каждая группа продемонстрировала, что нокаутные по МКГ-1 мыши являются устойчивыми к ожирению, индуцируемому диетой, и обычно имеют массу, сходную с детенышами, получающими обычную пищу. Наконец, в настоящее время описаны в литературе синтетические молекулы-антагонисты рецептора МКГ-1. Bednarek et al. (2002) сообщили о синтезе высокоаффинных пептидных антагонистов МКГ-1. Кроме того, низкомолекулярный антагонист МКГ-1 описан Takekawa et al. (Takekawa et al., 2002). Данное соединение, Т-226296, характеризуется высоким сродством к рецептору МКГ-1 (5-9 нМ для МКГ-1 крысы и человека) и, как показано, снижает потребление пищи, индуцируемое аппликацией МКГ в желудочек мозга. Эти данные обосновывают стратегию применения антагониста рецептора МКГ-1 для лечения ожирения. Более того, в собственных исследованиях заявителей были протестированы антагонисты МКГ-1 на нескольких животных моделях, которые хорошо известны как предсказывающие эффективность соединений у человека (Borowsky, et al., Nature Medicine 2003). Данные эксперименты показывают, что антагонисты МКГ-1 пригодны для лечения ожирения, депрессии, тревожности, а также нарушений мочеиспускания. Здесь заявители сообщают о синтезе вторичных аминоанилиновых пиперидинов, которые связываются с клонированным рецептором-1 меланинконцентрирующего гормона (МКГ-1) человека. Кроме того, данные соединения избирательно связываются с рецептором-МКГ-1 по сравнению с другим клонированным рецептором, ассоциированным с G-белком. Раскрыта способность ингибировать активацию клонированного рецептора, измеренную тестами in vitro. Более того, соединения настоящего изобретения могут также быть использованы для лечения аномальных состояний, опосредованных инактивацией рецептора МКГ-1, таких как нарушения потребления пищи (ожирение, булимия и нейрогенная булимия), половые/репродуктивные нарушения, депрессия,тревожность, депрессия и тревожность, эпилептический припадок, гипертензия, кровоизлияние в мозг,застойная сердечная недостаточность, нарушения сна или любое состояние, при котором может быть благоприятен антагонизм рецептора МКГ-1. Краткое изложение существа изобретения В данном изобретении предлагается соединение, имеющее структуру: где каждый А независимо представляет собой -Н, -F, -Cl, -Br, -I, -CN, -NO2 или C1-C7 алкил с линейной или разветвленной цепью; где В представляет собой СН; где Z представляет собой СО; где R4 представляет собой -ОR3, -NHR3, -СОR3, С 6 или С 10 арил или С 3-С 10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F,-Cl, -Br, -I, -OR2 или C1-C7 алкилом с линейной или разветвленной цепью; где каждый R3 независимо представляет собой -Н; C1-C7 алкил с линейной или разветвленной цепью, C1-C7 монофторалкил или C1-C7 полифторалкил; С 6 или С 10 арил или С 3-С 10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -NO2, -CN, -OR2 или -NHR2; где каждый R2 независимо представляет собой -Н, C1-C7 алкил с линейной или разветвленной цепью, С 6 или С 10 арил или С 3-С 10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -NO2 или -CN; и где n представляет собой целое число от 0 до 6 включительно; или его фармацевтически приемлемая соль. В дополнительном осуществлении указанного выше изобретения соединение является энантиомерно или диастереомерно чистым. В другом осуществлении соединение является энантиомерно или диастереомерно чистым. В одном осуществлении соединение представляет собой (+) энантиомер. В одном осуществлении соединение представляет собой (-) энантиомер. Иллюстрацией изобретения является фармацевтическая композиция, включающая фармацевтически приемлемый носитель и терапевтически эффективное количество любого из соединений изобретения. Иллюстрацией изобретения является фармацевтическая композиция, полученная смешиванием любого из соединений, описанных выше, и фармацевтически приемлемого носителя.-3 008826 Иллюстрацией изобретения является способ получения фармацевтической композиции, включающий смешивание любого из соединений изобретения и фармацевтически приемлемого носителя. Иллюстрацией изобретения является применение любого соединения, описанного выше, для приготовления лекарственного средства для лечения нарушения, опосредованного рецептором МКГ 1 нарушения, опосредуемого рецептором МКГ 1, у нуждающегося в этом субъекта. В одном осуществлении терапевтически эффективное количество составляет количество от приблизительно 0,03 до приблизительно 300 мг. В одном осуществлении нарушение представляет собой депрессию. В одном осуществлении нарушение представляет собой тревожность. В одном осуществлении нарушение представляет собой ожирение. В одном осуществлении нарушение представляет собой ургентное недержание мочи. Одно осуществление представляет собой применение любого соединения, описанного выше, для приготовления лекарственного средства для лечения депрессии, тревожности, недержания мочи или ожирения. В одном осуществлении терапевтически эффективное количество составляет от приблизительно 0,03 до приблизительно 300 мг. Подробное описание изобретения В данном изобретении предлагается соединение, имеющее структуру: где каждый А независимо представляет собой -Н, -F, -Cl, -Br, -I, -CN, -NO2 или C1-C7 алкил с линейной или разветвленной цепью; где В представляет собой СН; где Z представляет собой СО; где R4 представляет собой -OR3, -NHR3, -СОR3, С 6 или С 10 арил или С 3-С 10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F,-Cl, -Br, -I, -OR2 или C1-C7 алкилом с линейной или разветвленной цепью; где каждый R3 независимо представляет собой -Н; C1-C7 алкил с линейной или разветвленной цепью, C1-C7 монофторалкил или C1-C7 полифторалкил; С 6 или C10 арил или С 3-С 10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Вr, -I, -NO2, -CN, -OR2 или -NHR2; где каждый R2 независимо представляет собой -Н, C1-C7 алкил с линейной или разветвленной цепью, С 6 или С 10 арил или С 3-С 10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -NO2 или -CN; и где n представляет собой целое число от 0 до 6 включительно; или его фармацевтически приемлемая соль. Одно осуществление представляет собой соединение, имеющее структуру: где A, Z и n определены выше; где R4 представляет собой С 6 или C10 арил или С 3-С 10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -ОR3 или C1-C7 алкилом с линейной или разветвленной цепью; где каждый R3 представляет собой C1-C7 алкил с линейной или разветвленной цепью, С 6 или С 10 арил или С 3-С 10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -NO2, -CN или -OR2; где каждый R2 представляет собой -Н, C1-C7 алкил с линейной или разветвленной цепью, С 6 или С 10 арил или С 3-С 10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Вr, -I, -NO2 или -CN. Еще одно осуществление представляет собой соединение, имеющее структуру:-4 008826 где R2 представляет собой -Н, C1-C7 алкил с линейной или разветвленной цепью или С 6 или С 10 арил, где арил необязательно замещен одним или более -F, -Cl, -Br, -I, -NO2 или -CN. Еще одно осуществление представляет собой соединение, имеющее структуру: где А определен выше; где R2 представляет собой C1-C7 алкил с линейной или разветвленной цепью; и где n представляет собой целое число от 3 до 6 включительно. Еще одно осуществление представляет собой соединение, имеющее структуру: где каждый А представляет собой независимо -Н, -F, -C1, -Br или -I; иR2 определен выше. Еще одно осуществление представляет собой соединение, имеющее структуру: где каждый А представляет собой независимо -Н, -F или -Cl; и где R2 представляет собой C1-С 3 алкил с линейной или разветвленной цепью. Еще одно осуществление представляет собой соединение, имеющее структуру: Еще одно осуществление представляет собой соединение, имеющее структуру: Еще одно осуществление представляет собой соединение, имеющее структуру: где А определен выше; и где R2 представляет собой С 6 или C10 арил, где арил необязательно замещен одним или более -F,-Cl, -Br, -I, -NO2 или -CN; и где n представляет собой целое число от 1 до 6 включительно. Еще одно осуществление представляет собой соединение, имеющее структуру: где каждый А представляет собой независимо -Н, -F, -Cl, -Br или -I; и где R2 определен выше. Еще одно осуществление представляет собой соединение, имеющее структуру: где каждый А представляет собой независимо -Н, -F или -Cl; и где R2 представляет собой С 6 или С 10 арил, необязательно замещенный одним или более -F, -Cl или Еще одно осуществление представляет собой соединение, имеющее структуру: где каждый А представляет собой независимо -Н, -F или -Cl; и где R2 представляет собой С 6 или С 10 арил, необязательно замещенный одним или более -F. Еще одно осуществление представляет собой соединение, имеющее структуру: Еще одно осуществление представляет собой соединение, имеющее структуру: где A, Z, n и R4 определены выше. Еще одно осуществление представляет собой соединение, имеющее структуру: где А и n определены выше; и где R4 представляет собой С 6 или С 10 арил, необязательно замещенный одним или более -F, -Cl, -Br,-I, -OR3 или C1-C7 алкилом с линейной или разветвленной цепью; где каждый R3 представляет собой независимо C1-C7 алкил с линейной или разветвленной цепью, С 6 или С 10 арил или С 3-С 10 гетероарил, содержащий один или более атомов N, S или О, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -NO2, -CN или -OR2; где каждый R2 представляет собой независимо C1-C7 алкил с линейной или разветвленной цепью. Еще одно осуществление представляет собой соединение, имеющее структуру: где Z определен выше; где каждый А независимо представляет собой -Н, -F, -Cl, -Br или -I; где R4 независимо представляет собой -ОR3, -NHR3 или -СОR3; где R3 представляет собой С 6 или С 10 арил, необязательно замещенный одним или более -F, -Cl, -Br,-I, -NO2, -CN, -OR2 или -NHR2; где каждый R2 независимо представляет собой -Н, C1-C7 алкил с линейной или разветвленной цепью или С 6 или С 10 арил, необязательно замещенный одним или более -F, -Cl, -Br, -I, NO2, -CN; и где n представляет собой целое число от 1 до 6 включительно. Еще одно осуществление представляет собой соединение, имеющее структуру: где каждый А независимо представляет собой -Н или -F; где R3 представляет собой С 6 или С 10 арил, необязательно замещенный одним или более -F, -Cl, -Br,-I, -NO2, -CN, -OR2 или -NHR2; где R2 независимо представляет собой C1-C7 алкил с линейной или разветвленной цепью или С 6 или С 10 арил, необязательно замещенный одним или более -F, -Cl, -Br или -I; и-6 008826 где n представляет собой целое число от 1 до 6 включительно. Еще одно осуществление представляет собой соединение, имеющее структуру: где А представляет собой -Н, -F, -Cl, -Br или -I; где R3 представляет собой С 6 или С 10 арил, необязательно замещенный -NHR2; и где R2 представляет собой C6 или С 10 арил, необязательно замещенный одним или более -F, -Cl, -Br,Еще одно осуществление представляет собой соединение, имеющее структуру: Еще одно осуществление представляет собой соединение, имеющее структуру: Еще одно осуществление представляет собой соединение, имеющее структуру: где А представляет собой -Н, -F, -Cl, -Br или -I; где R3 представляет собой С 6 или С 10 арил, необязательно замещенный одним или более -F, -Cl, -Br или -I. Еще одно осуществление представляет собой соединение, имеющее структуру: Еще одно осуществление представляет собой соединение, имеющее структуру: Иллюстрацией настоящего изобретения является фармацевтическая композиция, включающая фармацевтически приемлемый носитель и фармацевтически терапевтически эффективное количество любого из соединений, описанных выше. Иллюстрацией изобретения является фармацевтическая композиция, полученная смешиванием любого из соединений, описанных выше, и фармацевтически приемлемого носителя. Иллюстрацией изобретения является способ получения фармацевтической композиции, включающий смешивание любого из соединений, описанных выше, и фармацевтически приемлемого носителя. Иллюстрацией изобретения является способ синтеза для получения любого из соединений, описанных выше. Иллюстрацией изобретения является применение любого из соединений или фармацевтических композиций, описанных выше, для приготовления лекарственного средства для лечения нарушения, опосредованного рецептором МКГ 1. В данном изобретении также предлагается соединение, имеющее структуру: где каждый Q независимо представляет собой водород; где Х представляет собой фенил или гетероцикл, содержащий азот, где фенил или гетероцикл, содержащий азот, необязательно замещены одним или более -F, -Cl, -Br, -I, -ZR3, -ZOR3, -OZR3, -ZN(R3)2,-N(R3)ZR3, -N(R3)ZN(R3)2, -CN, -NO2, -SR3, -(CH2)qOR3, -(CH2)qSR3, арилом, фенокси или гетероарилом,C1-C7 алкилом с линейной или разветвленной цепью, монофторалкилом или полифторалкилом, С 2-С 7 алкенилом или алкинилом с линейной или разветвленной цепью или С 3-С 7 циклоалкилом, монофторциклоалкилом, полифторциклоалкилом или циклоалкенилом; где каждый Z независимо представляет собой СО; CS; SO2; или отсутствует; где каждый R независимо представляет собой -Н; -F; C1-C7 алкил с линейной или разветвленной цепью, монофторалкил или полифторалкил; С 2-С 7 алкенил или алкинил с линейной или разветвленной цепью; -N(R3)2; -NO2; -CN; -СО 2R3; -ОСОR3; -ОR3; -N(R3)СОR3 или -CON(R3)2; где каждый R2 независимо представляет собой -Н, C1-C7 алкил с линейной или разветвленной цепью, арил или гетероарил, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br,-I, -NO2, -CN, C1-C7 алкилом с линейной или разветвленной цепью, монофторалкилом или полифторалкилом или С 2-С 7 алкенилом или алкинилом с линейной или разветвленной цепью; где каждый R3 независимо представляет собой -Н; C1-C7 алкил с линейной или разветвленной цепью, монофторалкил или полифторалкил; C2-C7 алкенил или алкинил с линейной или разветвленной цепью; С 3-С 7 циклоалкил, монофторциклоалкил, полифторциклоалкил или циклоалкенил; арил или гетероарил, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -N(R2)2, -NO2,-CN, -COR2, -CO2R2, -OCOR2, -OR2, -N(R2)COR2, -N(R2)CON(R2)2, -CON(R2), арилом, гетероарилом, фенокси, C1-C7 алкилом с линейной или разветвленной цепью, монофторалкилом или полифторалкилом,С 2-С 7 алкенилом или алкинилом с линейной или разветвленной цепью, С 3-С 7 циклоалкилом, монофторциклоалкилом, полифторциклоалкилом или циклоалкенилом; где каждый R4 независимо представляет собой -Н; -ZR3, -ZOR3, -OZR3, -ZN(R3)2, -N(R3)ZR3,-N(R3)ZN(R3)2, C1-C7 алкил с линейной или разветвленной цепью, монофторалкил или полифторалкил,арил, бензил или гетероарил, где арил, бензил или гетероарил необязательно замещены одним или более-F, -Cl, -Br, -I, -ZR3, -ZOR3, -OZR3, -ZN(R3)2, -N(R3)ZR3, -N(R3)ZN(R3)2, -CN, -NO2, -SR3, -(CH2)qOR3,-(CH2)qSR3, арилом, бензилом, гетероарилом, C1-C7 алкилом с линейной или разветвленной цепью, монофторалкилом или полифторалкилом, С 2-С 7 алкенилом или алкинилом с линейной или разветвленной цепью или С 3-С 7 циклоалкилом, монофторциклоалкилом, полифторциклоалкилом или циклоалкенилом; где каждый k независимо представляет собой целое число от 1 до 3 включительно; где n представляет собой целое число от 0 до 6 включительно; где q представляет собой целое число от 1 до 3 включительно; или его фармацевтически приемлемая соль. В данном изобретении предлагается соединение, имеющее структуру: где каждый Q независимо представляет собой водород; где каждый А независимо представляет собой -Н, -F, -Cl, -Br, -I, -ZR3, -ZOR3, -OZR3, -ZN(R3)2,-N(R3)ZR3, -N(R3)ZN(R3)2, -CN, -NO2, -N(R3)2, -ОR3, -SR3, -(СН 2)qОR3, -(СН 2)qSR3, C1-C7 алкил с линейной или разветвленной цепью, монофторалкил или полифторалкил, С 2-С 7 алкенил или алкинил с линейной или разветвленной цепью, С 3-С 7 циклоалкил, монофторциклоалкил, полифторциклоалкил или циклоалкенил; где каждый В независимо представляет собой N или СН; где каждый Z независимо представляет собой СО; CS; SO2 или отсутствует; где каждый R независимо представляет собой -Н, -F, C1-C7 алкил с линейной или разветвленной цепью, монофторалкил или полифторалкил, С 2-С 7 алкенил или алкинил с линейной или разветвленной цепью, -N(R3)2, -NO2, -CN, -СO2R3, -ОСОR3, -ОR3, -N(R3)СОR3 или -СОN(R3)2; где каждый R2 независимо представляет собой -Н, C1-C7 алкил с линейной или разветвленной цепью, арил или гетероарил, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br,-I, -NO2, -CN, C1-C7 алкилом с линейной или разветвленной цепью, монофторалкилом или полифторалкилом или С 2-С 7 алкенилом или алкинилом с линейной или разветвленной цепью;-8 008826 где каждый R3 независимо представляет собой -Н; C1-C7 алкил с линейной или разветвленной цепью, монофторалкил или полифторалкил; C2-C7 алкенил или алкинил с линейной или разветвленной цепью; С 3-С 7 циклоалкил, монофторциклоалкил, полифторциклоалкил или циклоалкенил; арил или гетероарил, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -N(R2)2, -NO2,-CN, -COR2, -CO2R2, -OCOR2, -OR2, -N(R2)COR2, -N(R2)CON(R2)2, -CON(R2)2, арилом, гетероарилом, фенокси, C1-C7 алкилом с линейной или разветвленной цепью, монофторалкилом или полифторалкилом,С 2-С 7 алкенилом или алкинилом с линейной или разветвленной цепью, С 3-С 7 циклоалкилом, монофторциклоалкилом, полифторциклоалкилом или циклоалкенилом; где каждый R4 независимо представляет собой -Н; -ZR3, -ZOR3, -OZR3, -ZN(R3)2, -N(R3)ZR3,-N(R3)ZN(R3)2, C1-C7 алкил с линейной или разветвленной цепью, монофторалкил или полифторалкил,арил, бензил или гетероарил, где арил, бензил или гетероарил необязательно замещены одним или более-F, -Cl, -Br, -I, -ZR3, -ZOR3, -OZR3, -ZN(R3)2, -N(R3)ZR3, -N(R3)ZN(R3)2, -CN, -NO2, -SR3, -(CH2)qOR3,-(CH2)qSR3, арилом, бензилом, гетероарилом, C1-C7 алкилом с линейной или разветвленной цепью, монофторалкилом или полифторалкилом, С 2-С 7 алкенилом или алкинилом с линейной или разветвленной цепью или С 3-С 7 циклоалкилом, монофторциклоалкилом, полифторциклоалкилом или циклоалкенилом; где каждый k независимо представляет собой целое число от 1 до 3 включительно; где n представляет собой целое число от 0 до 6 включительно; где q представляет собой целое число от 1 до 3 включительно; или его фармацевтически приемлемая соль. В одном осуществлении каждый А независимо представляет собой -Н, -F, -Cl, -Br, -I, -ZR3, -ZOR3,-OZR3, -ZN(R3)2, -N(R3)ZR3, -N(R3)ZN(R3)2, -N(R3)2, -ОR3, -SR3, -(CH2)qOR3, -(CH2)qSR3, C1-C7 алкил с линейной или разветвленной цепью, монофторалкил или полифторалкил; где каждый Z независимо представляет собой СО; CS или отсутствует; где каждый R независимо представляет собой -Н, -F или C1-C7 алкил с линейной или разветвленной цепью; где каждый R2 независимо представляет собой -Н, C1-C7 алкил с линейной или разветвленной цепью, арил или гетероарил, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br,-I, -NO2, -CN, C1-C7 алкилом с линейной или разветвленной цепью, монофторалкилом или полифторалкилом, или С 2-С 7 алкенилом или алкинилом с линейной или разветвленной цепью; где каждый R3 независимо представляет собой -Н, C1-C7 алкил с линейной или разветвленной цепью, арил или гетероарил, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br,-I, -N(R2)2, -NO2, -CN, -COR2, -CO2R2, -OCOR2, -OR2, -N(R2)COR2, -N(R2)CON(R2)2, -CON(R2)2, арилом,гетероарилом, фенокси, C1-C7 алкилом с линейной или разветвленной цепью, монофторалкилом или полифторалкилом, С 2-С 7 алкенилом или алкинилом с линейной или разветвленной цепью, С 3-С 7 циклоалкилом, монофторциклоалкилом, полифторциклоалкилом или циклоалкенилом; В одном осуществлении соединение имеет структуру: В одном осуществлении соединение имеет структуру: В одном осуществлении соединение имеет структуру: В одном осуществлении соединение имеет структуру: где R4 представляет собой арил, где арил необязательно замещен одним или более -F, -Cl, -Br, -I,C1-C7 алкилом с линейной или разветвленной цепью, монофторалкилом или полифторалкилом, С 2-С 7 алкенилом или алкинилом с линейной или разветвленной цепью или С 3-С 7 циклоалкилом, монофторциклоалкилом, полифторциклоалкилом или циклоалкенилом.-9 008826 В одном осуществлении соединение имеет структуру: В одном осуществлении соединение имеет структуру: В одном осуществлении соединение имеет структуру: где R3 представляет собой арил или гетероарил, где арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -N(R2)2, -NO2, -CN, -COR2, -CO2R2, -OCOR2, -OR2, -N(R2)COR2,-N(R2)CON(R2)2, -CON(R2)2, арилом, гетероарилом, фенокси, C1-C7 алкилом с линейной или разветвленной цепью. В одном осуществлении соединение имеет структуру: В одном осуществлении соединение имеет структуру: Применяемый в описанных выше осуществлениях изобретения термин "гетероарил" используют для обозначения пяти- или шестичленных ненасыщенных циклов, которые могут содержать один или более атомов кислорода, серы или азота. Примеры гетероарильных групп включают, но не ограничиваются этим, карбазол, фуранил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тиадиазолил, пиридил, пиридазинил, пиримидинил, пиразинил и триазинил. Кроме того, термин "гетероарил" применяют для обозначения конденсированных бициклических кольцевых систем, которые могут содержать один или более гетероатомов, таких как кислород, сера и азот. Примеры таких гетероарильных групп включают, но не ограничиваются этим, индолизинил, индолил, изоиндолил, бензо[b]фуранил, бензо[b]тиофенил, индазолил, бензимидазолил, пуринил, бензоксазолил, бензизоксазолил, бензо[b]тиазолил, имидазо[2,1-b]тиазолил, циннолинил, хиназолинил, хиноксалинил, 1,8-нафтиридинил, птеридинил, хинолинил, изохинолинил, фталимидил и 2,1,3-бензотиазолил. Термин "гетероарил" также включает те отмеченные выше химические фрагменты, которые могут быть замещены одним или более из следующего: -F, -Cl, -Br, -I, CN, -NO2, C1-C7 алкилом с линейной или разветвленной цепью, C1-C7 монофторалкилом с линейной или разветвленной цепью, C1-C7 полифторалкилом с линейной или разветвленной цепью, C2-C7 алкенилом с линейной или разветвленной цепью, С 2 С 7 алкинилом с линейной или разветвленной цепью, С 3-С 7 циклоалкилом, С 3-С 7 монофторциклоалкилом,С 3-С 7 полифторциклоалкилом, C5-C7 циклоалкенилом. Термин "гетероарил" дополнительно включает N-оксиды тех указанных выше химических фрагментов, которые включают по меньшей мере один атом азота. В настоящем изобретении термин "арил" включает фенил или нафтил. В дополнительном осуществлении описанного выше изобретения соединение является энантиомерно и диастереомерно чистым. В другом осуществлении соединение является энантиомерно или диастереомерно чистым. В одном осуществлении соединение является (+) энантиомером. В одном осуществлении соединение является (-) энантиомером.- 10008826 В изобретении предлагается для каждого из описанных выше соединений каждый из чистых стереоизомеров. Такие стереоизомеры могут включать энантиомеры, диастереомеры или Е или Z алкеновые или иминовые изомеры. В изобретении также предлагаются стереоизомерные смеси, включая рацемические смеси, диастереомерные смеси или E/Z изомерные смеси. Стереоизомеры могут быть синтезированы в чистой форме (Ngrdi, M.; Stereoselective Synthesis, (1987) VCH Editor Ebel, H. и Asymmetric Synthesis, volumes 3 В 5, (1983) Academic Press, Editor Morrison, J.) или их можно разделить с помощью различных способов, таких как кристаллизация и хроматографические методы (Jaques, J.; Collet, A.; Wilen,S.; Enantiomer, Racemates, and Resolutions, 1981, John Wiley and Sons и Asymmetric Synthesis, Vol. 2, 1983,Academic Press, Editor Morrison, J). Кроме того, соединения настоящего изобретения могут присутствовать в виде энантиомеров, диастереомеров, изомеров, или два или более соединения могут присутствовать, образуя рацемическую или диастереомерную смесь. Соединения настоящего изобретения являются предпочтительно чистыми на 80%, более предпочтительно чистыми на 90% и наиболее предпочтительно чистыми на 95%. В данное изобретение входят фармацевтически приемлемые соли и комплексы всех описанных здесь соединений. Кислоты и основания, из которых получают данные соли, включают, но не ограничиваются этим, перечисленные здесь кислоты и основания. Кислоты включают, но не ограничиваются этим, следующие неорганические кислоты: хлористо-водородную кислоту, бромисто-водородную кислоту, иодисто-водородную кислоту,серную кислоту и борную кислоту. Кислоты включают, но не ограничиваются этим, следующие органические кислоты: уксусную кислоту, яблочную кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, метансульфоновую кислоту, бензойную кислоту, гликолевую кислоту, молочную кислоту и миндальную кислоту. Основания включают, но не ограничиваются этим, аммиак, метиламин, этиламин, пропиламин, диметиламин, диэтиламин, триметиламин, триэтиламин, этилендиамин, гидроксиэтиламин, морфолин, пиперазин и гуанидин. В данном изобретении дополнительно предлагаются гидраты и полиморфы всех описанных здесь соединений. В объем настоящего изобретения включаются пролекарства соединений изобретения. В целом такие пролекарства обычно являются функциональными производными соединений изобретения, которые легко превращаются in vivo в требуемое соединение. Так, в настоящем изобретении термин "введение" должен охватывать лечение различных состояний, описанных вместе с конкретно раскрытым соединением или с соединением, которое может быть не раскрыто конкретно, но которое превращается в конкретно описанное соединение in vivo после введения больному. Традиционные процедуры выбора и получения подходящих пролекарственных производных описаны, например, в Design of Progrugs, ed. H. Bundgaard, Elsevier, 1985. Настоящее изобретение дополнительно включает метаболиты соединений настоящего изобретения. Метаболиты включают активные формы, продуцируемые после введения соединений данного изобретения в биологическую среду. Иллюстрацией изобретения является фармацевтическая композиция, включающая фармацевтически приемлемый носитель и терапевтически эффективное количество любого из соединений изобретения. Иллюстрацией изобретения является фармацевтическая композиция, полученная смешиванием любого из соединений, описанных выше, и фармацевтически приемлемого носителя. Иллюстрацией изобретения является способ получения фармацевтической композиции, включающий смешивание любого из соединений изобретения и фармацевтически приемлемого носителя. Твердый носитель может включать одно или более веществ, которые также могут действовать в качестве эндогенных носителей (например, пищевые или микропищевые носители), отдушки, смазывающие агенты, солюбилизаторы, суспендирующие агенты, наполнители, агенты, обеспечивающие скольжение, средства для прессования, связующие агенты или разрыхляющие таблетку агенты; это может быть также инкапсулирующее вещество. В порошках носитель является тонко измельченным твердым веществом, которое находится в смеси с тонко измельченным активным ингредиентом. В таблетках активный ингредиент смешан с носителем, обладающим необходимыми свойствами для прессования, в подходящих пропорциях и которым придана желаемая форма и размер. Порошки и таблетки предпочтительно содержат до 99% активного ингредиента. Подходящие твердые носители включают, например,фосфат кальция, стеарат магния, тальк, сахара, лактозу, декстрин, крахмал, желатин, целлюлозу, поливинилпирролидин, низкоплавкие воски и ионообменные смолы. Жидкие носители применяют для получения растворов, суспензий, эмульсий, сиропов, эликсиров и композиций под давлением. Активный ингредиент может быть растворен или суспендирован в фармацевтически приемлемом жидком носителе, таком как вода, органический растворитель, их смесь или фармацевтически приемлемые масла или жиры. Жидкий носитель может содержать другие подходящие фармацевтические добавки, такие как солюбилизаторы, эмульгаторы, буферы, консерванты, подсластители, отдушки, суспендирующие агенты, загущающие агенты, окрашивающие агенты, регуляторы вязкости, стабилизаторы или осморегуляторы. Подходящие примеры жидких носителей для перорального и парентерального введения включают воду (в особенности содержащую добавки, описанные выше, на- 11008826 пример, производные целлюлозы, предпочтительно раствор натриевой соли карбоксиметилцеллюлозы),спирты (включая одноатомные и многоатомные спирты, например, гликоли) и их производные, и масла(например, фракционированное кокосовое масло и арахисовое масло). Для парентерального введения носителем может быть также эфир жирных кислот, такой как этилолеат или изопропилмиристат. Стерильные жидкие носители пригодны в композициях стерильной жидкой формы для парентерального введения. Жидким носителем для композиций под давлением может быть галогенированный углеводород или другой фармацевтически приемлемый пропеллент. Жидкие фармацевтические композиции, которые являются стерильными растворами или суспензиями, могут быть применены, например, для внутримышечного, интратекального, эпидурального, внутрибрюшинного или подкожного введения. Стерильные растворы можно также вводить внутривенно. Соединения могут быть получены в виде стерильной твердой композиции, которая может быть растворена или суспендирована перед введением с применением стерильной воды, физиологического солевого раствора или другой подходящей стерильной среды для инъекций. Подразумевается, что носители включают необходимые и инертные связующие агенты, суспендирующие агенты, смазывающие агенты, отдушки, подсластители, консерванты, красители и покрывающие агенты. Соединение можно вводить перорально, в форме стерильного раствора или суспензии, содержащих другие растворы или суспендирующие агенты (например, физиологический раствор или глюкозу в количестве, достаточном для придания раствору изотоничности), соли желчных кислот, камедь, желатин, сорбитмоноолеат, полисорбат 80 (олеатные сложные эфиры сорбита и сополимеры их ангидридов с этиленоксидом) и тому подобное. Соединение можно также вводить перорально либо в жидкой, либо в твердой форме композиции. Композиции, пригодные для перорального введения, включают твердые формы, такие как пилюли, капсулы, гранулы, таблетки и порошки, и жидкие формы, такие как растворы, сиропы, эликсиры и суспензии. Формы, пригодные для парентерального введения, включают стерильные растворы, эмульсии и суспензии. Оптимальные дозы для введения могут быть определены специалистами в данной области техники и должны варьироваться в зависимости от конкретного применяемого соединения, состава препарата,способа введения и прогрессирования состояния заболевания. Дополнительные факторы, зависимые от конкретного субъекта, подлежащего лечению, включая возраст субъекта, массу, пол, диету и время введения, должны приводить к необходимости подбора доз. Иллюстрацией изобретения является способ синтеза для получения любого из соединений изобретения. Иллюстрацией изобретения является способ лечения нарушения, опосредуемого рецептором МКГ 1, у нуждающегося в этом субъекта, включающий введение субъекту терапевтически эффективного количества любого из соединений или фармацевтических композиций изобретения и фармацевтически приемлемого носителя. В одном осуществлении терапевтически эффективное количество составляет от приблизительно 0,03 до приблизительно 300 мг. В одном осуществлении нарушение представляет собой депрессию. В одном осуществлении нарушение представляет собой тревожность. В одном осуществлении нарушение представляет собой ожирение. В одном осуществлении нарушение представляет собой ургентное недержание мочи. Одно осуществление представляет собой способ лечения субъекта, страдающего нарушением, выбранным из депрессии, тревожности, ожирения или ургентного неудержания мочи у нуждающегося в этом субъекта, включающий введение субъекту терапевтически эффективного количества соединения изобретения. В одном осуществлении терапевтически эффективное количество составляет от приблизительно 0,03 до приблизительно 300 мг. В другом осуществлении нарушение представляет собой депрессию. В одном осуществлении нарушение представляет собой тревожность. В одном осуществлении нарушение представляет собой ожирение. В одном осуществлении нарушение представляет собой ургентное недержание мочи. В применении к субъекту "терапевтически эффективное количество" представляет собой любое количество соединения, которое при введении субъекту, страдающему заболеванием, против которого соединения являются эффективными, вызывает подавление, ремиссию или регрессию заболевания. В применении к субъекту, "субъект" является позвоночным, млекопитающим или человеком. В данном изобретении предлагается способ лечения субъекта, страдающего нарушением, где нарушение облегчается путем снижения активности рецептора МКГ-1, который включает введение субъекту соединения изобретения, которое является антагонистом рецептора МКГ-1, в количестве, эффективном для лечения нарушения у субъекта. В отдельных осуществлениях нарушение представляет собой нарушение регуляции стероидного или гипофизарного гормона, нарушение секреции адреналина, желудочно-кишечное нарушение, сердечно-сосудистое заболевание, нарушение электролитного баланса, гипертензию, диабет, респираторное заболевание, астму, нарушение репродуктивной функции, иммунное нарушение, эндокринное заболевание, заболевание скелетных мышц, нейро-эндокринное заболевание, нарушение когнитивных функций,- 12008826 нарушение памяти, такое как болезнь Альцгеймера, нарушение сенсорной модуляции и трансмиссии,нарушение координации движений, нарушение сенсорной интеграции, нарушении интеграции движений,нарушение дофаминэргической функции, такое как болезнь Паркинсона, нарушение сенсорной трансмиссии, нарушение обоняния, нарушение симпатической иннервации, аффективное расстройство, такое как депрессия и тревожность, связанное со стрессом нарушение, нарушение баланса жидкостей, припадочное состояние, боль, психотическое поведение, такое как шизофрения, толерантность к морфину,опиатная зависимость, мигрень или нарушение мочеиспускания, такое как недержание мочи. В предпочтительном осуществлении предметом изобретения является способ лечения по следующим показаниям: депрессия, тревожность, нарушения питания/массы тела и нарушения мочеиспускания. Примерами нарушения питания/массы тела являются ожирение, булимия или нейрогенная булимия. Примеры нарушения мочеиспускания включают, но не ограничиваются этим, недержание мочи, гиперактивный мочевой пузырь, ургентное недержание мочи, частое мочеиспускание, срочное мочеиспускание, ночное недержание мочи или энурез. Гиперактивный мочевой пузырь и срочное мочеиспускание могут быть или не быть связанными с доброкачественной гиперплазией простаты. В данном изобретении предлагается способ модификации пищевого поведения субъекта, который включает введение субъекту количества соединения изобретения, эффективного для снижения потребления пищи субъектом. В данном изобретении также предлагается способ лечения нарушения питания у субъекта, который включает введение субъекту количества соединения данного изобретения, эффективного для снижения потребления пищи субъектом. В осуществлении настоящего изобретения нарушение питания представляет собой булимию, ожирение или нейрогенную булимию. В осуществлении настоящего изобретения субъект является позвоночным, млекопитающим, человеком или собакой. В дополнительном осуществлении соединение вводят в сочетании с пищей. В настоящем изобретении дополнительно предлагается способ снижения массы тела субъекта, который включает введение субъекту количества соединения изобретения, эффективного для снижения массы тела субъекта. В настоящем изобретении также предлагается способ лечения субъекта, страдающего депрессией,который включает введение субъекту количества соединения данного изобретения, эффективного для лечения депрессии у субъекта. В настоящем изобретении дополнительно предлагается способ лечения субъекта, страдающего тревожностью, который включает введение субъекту количества соединения данного изобретения, эффективного для лечения тревожности у субъекта. В настоящем изобретении также предлагается способ лечения субъекта, страдающего депрессией и тревожностью, который включает введение субъекту количества соединения данного изобретения, эффективного для лечения депрессии и тревожности у субъекта. В настоящем изобретении также предлагается способ лечения субъекта, страдающего главным депрессивным нарушением, дистимическим нарушением, биполярными нарушениями I и II, шизоаффективным нарушением, нарушениями когнитивных способностей с состоянием депрессии, нарушениями личности, бессонницей, сонливостью, нарколепсией, нарушением циркадного ритма сна, ночными кошмарами, состоянием ужаса во сне, лунатизмом, принудительным навязчивым состоянием, паническим состоянием с или без клаустрофобии, посттравматическим стрессом, состоянием социальной тревожности, социальной фобией и состоянием генерализованной тревожности. В настоящем изобретении также предлагается способ лечения субъекта, страдающего нарушением мочеиспускания, который включает введение субъекту количества соединения данного изобретения, эффективного для лечения нарушения мочеиспускания у субъекта. В некоторых осуществлениях нарушения мочеиспускания представляют собой недержание мочи, гиперактивный мочевой пузырь, ургентное недержание мочи, частое мочеиспускание, ургентное мочеиспускание, ночное недержание мочи или энурез. Данное изобретение будет лучше понято из последующих подробных экспериментов. Однако специалист в данной области техники должен с легкостью понять, что конкретные обсуждаемые способы и результаты являются только иллюстрациями изобретения, как описано более полно в формуле изобретения, следующей после них. Экспериментальная частьI. Синтез химических соединений. Общие способы. Все реакции проводили в атмосфере аргона, и реагенты, в чистом виде или в подходящих растворителях, переносили в реакционный сосуд посредством шприца или канюли. Множественные реакции параллельного синтеза проводили в сосудах (без инертной атмосферы) с применением JKEM мешалок с нагревателем (Saint Louis, МО). Безводные растворители получали от Aldrich ChemicalCompany (Milwaukee, WI) и использовали сразу после получения. Если это не отмечено специально, 1 Н спектры записывали при 400 МГц (Brker, Model: Avance) с тетраметилсиланом в качестве внутреннего стандарта, с = синглет; д = дублет; т = триплет; кв = квартет; р = квинтет; секстет; септет; уш. = уширенный; м = мультиплет.- 13008826 Элементный анализ проводился Robertson Microlit Laboratories, Inc. Если не указано иначе, массспектры получали на приборе VG Patform II с применением электрораспыления (ESI-MS) с представлением МН+. Тонкослойную хроматографию (ТСХ) проводили на стеклянных пластинах, предварительно покрытых силикагелем 60 F254 (0,25 мм, ЕМ Separations Tech.). Препаративную тонкослойную хроматографию проводили на стеклянных листах, предварительно покрытых силикагелем GF (2 мм, Analtech). Колоночную флеш-хроматографию проводили на силикагеле Merck 60 (230-400 меш). Точки плавления(т.пл.) определяли в открытых капиллярных трубках на приборе Mel-Temp и они являются нескорректированными. Следующие схемы иллюстрируют способы синтеза соединений настоящего изобретения. Схема IMeOH/ комн. темп. 24-72 ч. (d) 4 М НCl в 1,4-диоксане/ комн. темп. 1 ч или ТФУ/ CH2Cl2/ комн. темп. 0,2 ч. (е) Карбоновая кислота/ EDC/ DMAP/ CH2Cl2/ ДМФА/ комн. темп. 12 ч. Общая методика пиперидинового синтеза (схема 1). трет-Бутил 4-[(трифторметил)сульфонил]окси-3,6-дигидро-1(2 Н)-пиридинкарбоксилат: н-Бутил лития (17,6 мл, 44,2 ммоль, 2,5 М в гексанах) добавляли к раствору диизопропиламина (96,2 мл, 44,2 ммоль) в безводном ТГФ (40,0 мл) при 0 С, и полученную смесь перемешивали в течение 20 мин. Реакционную смесь охлаждали до -78 С, и трет-бутил 4-оксо-1-пиперидинкарбоксилат (Aldrich ChemicalCompany, 7,97 г, 40,0 ммоль) в ТГФ (40,0 мл) по каплям добавляли к реакционной смеси, которую затем перемешивали в течение 30 мин. К реакционной смеси по каплям добавляли Tf2NPh (42,0 ммоль, 15,0 г) в ТГФ (40,0 мл), и реакционную смесь перемешивали при 0 С в течение ночи. Реакционную смесь концентрировали в вакууме, повторно растворяли в смеси гексаны:ЕtОАс (9:1),пропускали через слой оксида алюминия, и слой оксида алюминия промывали смесью гексаны:ЕtOАс(9:1). Объединенные экстракты концентрировали в вакууме с получением желаемого продукта (16,5 г),который был загрязнен некоторым количеством исходного вещества Tf2NPh. 1 трет-Бутил 4-(3-аминофенил)-3,6-дигидро-1(2 Н)-пиридинкарбоксилат. Дегазированную смесь 2 М водного раствора Na2CO3 (4,20 мл), трет-бутил 4-[(трифторметил) сульфонил]окси-3,6-дигидро-1(2 Н)-пиридинкарбоксилата (0,500 г, 1,51 ммоль), гемисульфата 3 аминофенилбороновой кислоты (0,393 г, 2,11 ммоль), хлорида лития (0,191 г, 4,50 ммоль) и тетракистрифенилфосфинпалладий (0,080 г, 0,075 ммоль) в диметоксиэтане (5,00 мл) кипятили с обратным холодильником в течение 3 ч в атмосфере аргона. Органический слой охлажденной реакционной смеси отделяли, и водный слой промывали этилацетатом (3 х 50 мл). Объединенные органические растворы сушили и концентрировали в вакууме. Неочищенный продукт хроматографировали (диоксид кремния, смесь гексаны:Еt:ОАс: дихлорметан 6:1:1 с 1% изопропиламином) с получением желаемого продукта (0,330 г,81%). 1- 15008826 трет-Бутил 4-[3-(амино)фенил]-1-пиперидинкарбоксилат. Смесь трет-бутил 4-(3-аминофенил)-3,6-дигидро-1(2 Н)-пиридинкарбоксилата (3,10 г, 11,3 ммоль) и 10% Pd/C (1,00 г) в этаноле (100 мл) гидрировали при комнатной температуре с применением баллонного способа в течение 2 дней. Реакционную смесь фильтровали через целит и промывали этанолом. Объединенные этанольные экстракты концентрировали в вакууме, и остаток хроматографировали на диоксиде кремния (смесь дихлорметан:метанол:изопропиламин 95:5:1) с получением желаемого продукта (2,63 г,84%). 1 трет-Бутил 4-3-[(6-бромгексаноил)амино]фенил-1-пиперидинкарбоксилат: 25-мл круглодонный сосуд, наполненный трет-бутил 4-[3-(амино)фенил]-1-пиперидинкарбоксилатом (2,00 ммоль, 0,553 г), 6 бромгексаноилхлоридом (0,427 г, 2,00 ммоль, 1,0 экв.), триэтиламином (0,404 г, 4,00 ммоль) и ТГФ (8,00 мл), перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь разбавляли хлороформом (50 мл) и промывали водой (100 мл), насыщенным раствором соли, сушили над MgSO4 и концентрировали в вакууме. Остаток очищали хроматографией (силикагель, смесь гексаны/EtOAc 10:1) с получением желаемого продукта (0,921 г, 95,8%). 1 трет-Бутил 4-(3-[6-(3,4-дифторанилино)гексаноил]аминофенил)-1-пиперидинкарбоксилат: 5-мл круглодонный сосуд, наполненный трет-бутил 4-3-[(6-бромгексаноил)амино]фенил-1-пиперидинкарбоксилатом (40,9 мг, 0,100 ммоль), 3,4-дифторанилином (0,100 ммоль, 12,9 мг), K2 СО 3 (0,100 ммоль,13,8 мг), NaI (22,5 мг, 0,150 ммоль) и ДМФА (1,00 мл), нагревали при 120 С в течение 12 ч. Смесь разбавляли водой (10 мл). Водный слой экстрагировали хлороформом (3 х 10 мл), и объединенные экстракты промывали насыщенным раствором соли, сушили над MgSO4 и концентрировали в вакууме. Остаток очищали хроматографией (смесь гексаны/EtOAc 10:1) с получением желаемого продукта в виде светложелтого масла (7,14 мг, 14,3%). 1- 16008826 Пример 6. 6-(3,4-Дифторанилино)-N-[3-(4-пиперидинил)фенил]гексанамид. В раствор трет-бутил 4(3-[6-(3,4-дифторанилино)гексаноил]аминофенил)-1-пиперидинкарбоксилата (11,2 мг, 0,0224 ммоль) в дихлорметане (0,500 мл) при 0 С медленно добавляли трифторуксусную кислоту (25,5 мг, 2,24 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и концентрировали в вакууме. Остаток растворяли в смеси изо-РrОН/СНCl3 (1:3, 10 мл) и подщелачивали до рН 11 10% раствором KОН, промывали Н 2 О и затем насыщенным раствором соли. Органический слой сушили надMgSO4 и концентрировали в вакууме с получением желаемого продукта (8,98 мг, 99%): 1H ЯМР (400 МГц, СDCl3)7,39-7,08 (м, 5 Н), 7,06-6,94 (м, 2 Н), 6,91-6,81 (м, 1 Н), 6,77-6,67 (м, 1 Н), 3,54-3,42 (м, 2 Н),3,25-3,04 (м, 3H), 2,91-2,80 (м, 1 Н), 2,45-2,32 (м, 2 Н), 2,11-1,99 (м, 2 Н), 1,98-1,83 (м, 2 Н), 1,80-1,62 (м,4 Н), 1,55-1,40 (м, 2 Н), 1,34-1,23 (м, 1 Н); ESMS m/e: 402,2 (М + Н)+. Следующие соединения получали согласно схеме I. Пример 1. 5-(2-Метоксифенил)-N-[3-(4-пиперидинил)фенил]пентанамид. трет-Бутил 4-(3-[5-(2-метоксифенил)пентаноил]аминофенил)-1-пиперидинкарбоксилат обрабатывали в соответствии со схемой I с получением продукта. 1H ЯМР (400 МГц, CDCl3)7,52-6,68 (м, 8 Н), 3,74 (с, 3H), 3,61-3,35 (м, 2 Н), 3,14-2,90 (м, 2 Н), 2,882,56 (м, 3H), 2,52-2,27 (м, 2 Н), 2,10-1,51 (м, 8 Н); ESIMS m/e: 367,2 (М + Н)+. Пример 2. 5-Фенил-N-[3-(4-пиперидинил)фенил]пентанамид. трет-Бутил 4-3-[(5-фенилпентаноил)амино]фенил-1-пиперидинкарбоксилат обрабатывали в соответствии со схемой I с получением продукта. 1H ЯМР (400 МГц, CDCl3)7,51-6,83 (м, 9 Н), 3,66-3,40 (м, 2 Н), 3,08-2,80 (м, 2 Н), 2,78-2,45 (м, 3H),2,43-2,28 (м, 2 Н), 2,08-1,06 (м, 8 Н); ESIMS m/e: 337,2 (М + Н)+. Пример 3. 6-Оксо-6-фенил-N-[3-(4-пиперидинил)фенил]гексанамид. трет-Бутил 4-3-[(6-оксо-6-фенилгексаноил)амино]фенил-1-пиперидинкарбоксилат обрабатывали в соответствии со схемой I с получением продукта. 1H ЯМР (400 МГц, CD3OD)7,98-7,83 (м, 2 Н), 7,60-7,31 (м, 4 Н), 7,28-7,12 (м, 2 Н), 6,97-6,87 (м, 1 Н),3,48-3,31 (м, 2 Н), 3,10-2,68 (м, 5 Н), 2,40-2,26 (м, 2 Н), 2,05-1,63 (м, 8 Н); ESIMS m/e: 365,2 (М + Н)+. Пример 4. 2-Фенокси-N-3-(4-пиперидинил)фенил]никотинамид. Смесь трет-бутил 4-[3-(амино)фенил]-1-пиперидинкарбоксилата (0,15 ммоль), 2-феноксиникотиноилхлорида (0,23 ммоль) и триэтиламина (0,30 ммоль) в 3 мл растворителя (смеси СН 2Cl2:ТГФ, 1:3) перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь очищали препаративной ТСХ (диоксид кремния, смесь EtOAc:гексаны 1:1) с получением желаемого продукта, трет-бутил 4-(3[(2-фенокси-3-пиридинил)карбонил]аминофенил)-1-пиперидинкарбоксилата. К очищенному продукту,растворенному в 1,0 мл СН 2Cl2, добавляли трифторуксусную кислоту (1,0 мл), и раствор перемешивали при комнатной температуре в течение 1 мин. Реакционную смесь концентрировали в вакууме с получением соли ТФУ желаемого продукта. 1H ЯМР (400 МГц, CDCl3)9,85 (с, 1 Н), 8,76-8,64 (уш., 1 Н), 8,30-8,14 (уш., 1 Н), 7,67 (с, 1 Н), 7,49 (т,2 Н, J=7,8 Гц), 7,42-7,29 (м, 3H), 7,24 (т, 3H, J=5,2 Гц), 7,03 (д, 1 Н, J=7,2 Гц), 3,59 (уш.д, 2 Н, J=11,5 Гц),3,16-3,02 (м, 2 Н), 2,9-2,79 (м, 1 Н), 2,14-2,01 (м, 4 Н); ESIMS m/e: 374,1 (М + Н)+. Пример 5. 5-(4-Метоксифенил)-N-[3-(4-пиперидинил)фенил]пентанамид. Получали в соответствии с методикой, описанной на схеме 1 Метил (2Z)-2-ацетил-3-(4-фторфенил)-2-пропеноат. Смесь 4-фторбензальдегида (25,5 г, 0,220 моль),метил 3-оксобутаноата (21,80 г, 0,220 моль) и пиперидина (1,0 мл) в безводном бензоле (250 мл) перемешивали в течение 10 мин при комнатной температуре и затем кипятили с обратным холодильником и насадкой Дина-Старка. Реакционную смесь затем охлаждали до комнатной температуры, и растворитель удаляли в вакууме с получением метил (2Z)-2-ацетил-3-(4-фторфенил)-2-пропеноата в виде черного твердого вещества (48,6 г, 99%), которое использовали на следующей стадии без очистки.- 17008826 холодильником в течение 24 ч, охлаждали до комнатной температуры и фильтровали. Твердое вещество промывали этанолом (200 мл), и объединенный фильтрат концентрировали в вакууме. Остаток очищали хроматографией (силикагель, смесь гексаны/EtOAc/Et3N 50:50:0,1) с получением смеси таутомеров (4:1,33,0 г, 53,9%). 1 5-Метил 1-(4-нитрофенил) 6-(4-фторфенил)-2-метокси-4-метил-1,5(6 Н)-пиримидиндикарбоксилат. К раствору метил 6-(4-фторфенил)-2-метокси-4-метил-1,6-дигидро-5-пиримидинкарбоксилата (1,76 г,6,34 ммоль) и 4-диметиламинопиридина (12,7 ммоль, 1,55 г) в безводном СН 2Cl2 (20,0 мл) добавляли раствор 4-нитрофенилхлорформиата (4,47 г, 22,2 ммоль) в СН 2Cl2 (20,0 мл) при 23 С. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Реакционную смесь разбавляли CH2Cl2 (50 мл),промывали водой, насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали моментальной колоночной хроматографией (смесь гексаны/этилацетат 4:1). Продукт получали в виде желтого сиропа, который после растирания с гексанами превращался в белый порошок (2,40 г, 84,3%). Неочищенный продукт использовали на следующей стадии без дополнительной очистки. Метил 1-[(4-трет-бутокси-4-оксобутил)амино]карбонил-6-(4-фторфенил)-2-метокси-4-метил-1,6 дигидро-5-пиримидинкарбоксилат. К раствору 5-метил 1-(4-нитрофенил) 6-(4-фторфенил)-2-метокси-4 метил-1,5(6 Н)-пиримидиндикарбоксилата (88,7 мг, 0,200 ммоль) и K2 СО 3 (41,5 мг, 0,300 ммоль) в смеси СН 3 ОН/СН 2Cl2 (0,1/2,0 мл) добавляли трет-бутил 4-аминобутаноат (31,8 мг, 0,200 ммоль). После перемешивания при комн. темп. в течение 1 ч смесь промывали насыщенным Na2CO3 и насыщенным раствором соли. Органический слой сушили над MgSO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (5-10% 2 М NH3/MeOH в 50% смеси EtOAc/гексаны) с получением продукта (92,2 мг, 99%). Т. пл. 135-138 С. 1 4-[(6-(4-Фторфенил)-5-(метоксикарбонил)-4-метил-2-оксо-3,6-дигидро-1(2 Н)-пиримидинил)карбонил]аминомасляная кислота. К раствору метил 1-[(4-трет-бутокси-4-оксобутил)амино]карбонил-6(4-фторфенил)-2-метокси-4-метил-1,6-дигидро-5-пиримидинкарбоксилата (77,3 мг, 0,166 ммоль) в дихлорметане (2,00 мл) при 0 С медленно добавляли трифторуксусную кислоту (189 мг, 1,66 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и концентрировали в вакууме. Остаток растворяли в смеси изо-PrОН/СНCl3 (1:3, 10 мл) и подщелачивали до рН 11 10% растворомKОН, промывали Н 2O и затем насыщенным раствором соли. Органический слой сушили над MgSO4 и концентрировали в вакууме с получением желаемого продукта (58,1 мг, 88,9%). ESMS m/e: 394,1 (М + Н)+.- 18008826 Метил 3-[(4-3-[1-(трет-бутоксикарбонил)-4-пиперидинил]анилино-4-оксобутил)амино]карбонил-4-(4-фторфенил)-6-метил-2-оксо-1,2,3,4-тетрагидро-5-пиримидинкарбоксилат. В 10-мл круглодонный сосуд загружали 4-[(6-(4-фторфенил)-5-(метоксикарбонил)-4-метил-2-оксо-3,6-дигидро-1(2 Н)пиримидинил)карбонил]аминомасляную кислоту (77,0 мг, 0,189 ммоль), трет-бутил-4-[3-(амино)фенил]-1-пиперидинкарбоксилат (52,2 мг, 0,189 ммоль), гидрохлорид 1-[3-(диметиламино)пропил]-3 этилкарбодиимида (0,567 ммоль, 87,8 мг), 4-диметиламинопиридин (11,5 мг, 0,0945 ммоль) в смеси ДМФА/ДХМ (0,2:2,0 мл) при комнатной температуре. Реакционную смесь перемешивали в течение 12 ч,и к реакционной смеси добавляли воду (10,0 мл). Органический слой отделяли, и водный слой экстрагировали СНCl3 (3 х 10 мл). Объединенные органические экстракты промывали насыщенным раствором соли, сушили над МgSO4, фильтровали и концентрировали в вакууме. Остаток хроматографировали (диоксид кремния, смесь гексаны:ЕtOАс 9:1) с получением желаемого продукта (40,9 мг, 33,2%): 1 Пример 7. Метил 4-(4-фторфенил)-6-метил-2-оксо-3-[(4-оксо-4-[3-(4-пиперидинил)анилино]бутил амино)карбонил]-1,2,3,4-тетрагидро-5-пиримидинкарбоксилат. К раствору метил 3-[(4-3-[1-(трет-бутоксикарбонил)-4-пиперидинил]анилино-4-оксобутил)амино]карбонил-4-(4-фторфенил)-6-метил-2-оксо-1,2,3,4-тетрагидро-5-пиримидинкарбоксилата (40,9 мг,0,0628 ммоль) в дихлорметане (2,00 мл) при 0 С медленно добавляли трифторуксусную кислоту (71,6 мг,0,628 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и концентрировали в вакууме. Остаток растворяли в смеси изо-РrОН/СНCl3 (1:3, 10 мл) и подщелачивали до рН 11 10% раствором KОН, промывали H2O и затем насыщенным раствором соли. Органический слой сушили над MgSO4 и концентрировали в вакууме с получением желаемого продукта (34,6 мг, 99%): 1 трет-Бутил-4-3-[(4-[(5-метоксилкарбонил-6-(3,4-дифторфенил)-4-метил-2-оксо-3,6-дигидро 1(2 Н)-пиримидинил)карбонил]аминобутаноил)амино]фенил-1-пиперидинкарбоксилат. В 50-мл сосуд загружали 4-[(5-ацетил-6-(3,4-дифторфенил)-4-метил-2-оксо-3,6-дигидро-1(2 Н)-пиримидинил)карбонил]аминомасляную кислоту (313 мг, 0,854 ммоль), трет-бутил-4-[3-(амино)фенил]-1-пиперидинкарбоксилат (235 мг, 0,857 ммоль), гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (7,71 ммоль, 265 мг), 4-диметиламинопиридин (10,4 мг, 0,0854 ммоль) в смеси ДМФА/ДХМ (0,8:8,0 мл) при комнатной температуре. Реакционную смесь перемешивали в течение 12 ч, и к реакционной смеси добавляли воду (20,0 мл). Органический слой отделяли, и водный слой экстрагировали СНCl3 (3 х 10 мл). Объединенные органические экстракты промывали насыщенным раствором соли, сушили над MgSO4,фильтровали и концентрировали в вакууме. Остаток хроматографировали (диоксид кремния, смесь гексаны:ЕtОАс 9:1) с получением желаемого продукта (378 мг, 67,8%): 1 Пример 8. 5-Метоксикарбонил-6-(3,4-дифторфенил)-4-метил-2-оксо-N-4-оксо-4-[3-(4-пиперидинил)анилино]бутил-3,6-дигидро-1(2 Н)-пиримидинкарбоксамид. К раствору трет-бутил 4-3-[(4-[(5-метоксилкарбонил-6-(3,4-дифторфенил)-4-метил-2-оксо-3,6 дигидро-1(2 Н)-пиримидинил)карбонил]аминобутаноил)амино]фенил-1-пиперидинкарбоксилата (378 мг, 0,579 ммоль) в дихлорметане (5,00 мл) при 0 С медленно добавляли трифторуксусную кислоту (659 мг, 5,79 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и концентрировали в вакууме. Остаток растворяли в смеси изо-PrОН/СНСl3 (1:3, 10 мл) и подщелачивали до рН 11 10% раствором KОН, промывали H2O и затем насыщенным раствором соли. Органический слой сушили над MgSO4 и концентрировали в вакууме. Остаток очищали флэш-хроматографией (смесь дихлорметан:метанол 5:1) с получением желаемого продукта (93,8 мг, 29,3%). 1(т.т., 1 Н, J=3,8, 11,9 Гц), 1,88-1,82 (м, 1 Н), 1,75-1,63 (м, 6 Н); ESMS m/e: 554,3 (М + Н)+. Общая методика пиперидинового синтеза (схема 2) 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,6-дигидро-1(2 Н)-пиридинкарбокси лат. В 50-мл круглодонный сосуд загружали бис(пинаколато)дибор (422 мг, 1,66 ммоль), KОАс (444 мг,4,53 ммоль), PdCl2dppf (37,0 мг, 3,00 моль%) и dppf (25 мг, 3,00 моль%), добавляли раствор трет-бутил 4[(трифторметил)сульфонил]окси-3,6-дигидро-1(2 Н)-пиридинкарбоксилата (500 мг, 1,51 ммоль) в 1,4 диоксане (10,0 мл) при комнатной температуре в атмосфере аргона. Смесь нагревали до 80 С в течение ночи. После охлаждения до комнатной температуры смесь фильтровали через целит, и целит промывалиEtOAc (3 х 20 мл). Объединенные фильтраты промывали H2O и насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали моментальной хроматографией (смесь EtOAc:гексаны 9:1) с получением трет-бутил 4-(4,4,5,5-тетраметил-1,3,2 диоксаборолан-2-ил)-3,6-дигидро-1(2 Н)-пиридинкарбоксилата (355 мг, 76%). 1 5-Бром-2,4-дифторнитробензол. К суспензии 1-бром-2,4-дифторбензола (53,0 ммоль, 6,00 мл) в концентрированной H2SO4 (38,5 мл) при 0 С по каплям добавляли концентрированную НNO3 (34,0 мл),поддерживая температуру реакционной массы ниже 20 С. Полученную смесь перемешивали в течение 10 мин при 0 С и затем выливали в смесь воды и льда при интенсивном перемешивании. Смесь экстрагировали Et2O (3 х 100 мл). Объединенные органические экстракты промывали водным раствором NaHCO3 (3 х 100 мл) и насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией (смесь EtOAc:гексаны 1:9) с получением 5-бром-2,4-дифторнитробензола в виде желтого масла (12,2 г, 97%). 1- 20008826 5-Бром-2,4-дифторанилин. В 250-мл круглодонный сосуд загружали 5-бром-2,4-дифторнитробензол(5,04 г, 21,3 ммоль), насыщенный NH4Cl (25,0 мл), порошок железа (5,00 г, 89,5 ммоль), этанол (100 мл),ТГФ (50,0 мл) и воду (25,0 мл), нагревали с обратным холодильником до 95 С в течение 1,5 ч. После охлаждения до комнатной температуры добавляли насыщенный раствор NаНСО 3 (100 мл), и смесь фильтровали через целит, и целит промывали EtOAc (3 х 50 мл). Объединенные фильтраты промывали Н 2O и насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией (смесь EtOAc:гексаны 1:9) с получением 5-бром-2,4 дифторанилина (2,61 г, 59,1%). 1 Н ЯМР (400 МГц, CDCl3)6,97 (д.д., 1 Н, J=7,2, 6,7 Гц), 6,85 (т, 1 Н, J=8,2 Гц), 3,63 (уш., 2 Н). Бензил 5-бром-2,4-дифторфенилкарбамат. В 250-мл круглодонный сосуд добавляли 5-бром-2,4 дифторанилин (5,00 г, 24,2 ммоль), хлорбензилформиат (4,10 мл, 29,0 ммоль), NaНСО 3 (6,10 г, 72,6 ммоль) и ацетонитрил (100 мл). Реакционную смесь перемешивали при 25 С в течение 12 ч, затем фильтровали через грубый фильтр из пористого стекла, воронку с тонким стеклянным фильтром, промывали EtOAc (3 х 20 мл) и концентрировали в вакууме. Фильтрат промывали Н 2 О и насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией (смесь EtOAc:гексаны 1:9) с получением бензил 5-бром-2,4 дифторфенилкарбамата (5,05 г, 61,0%). 1(1,48 ммоль, 1,21 г), добавляли раствор бензил 5-бром-2,4-дифторфенилкарбамата (5,05, 14,8 ммоль) в ДМФА (150 мл) при комнатной температуре в атмосфере аргона. Смесь нагревали до 80 С в атмосфере аргона в течение ночи. После охлаждения до комнатной температуры смесь фильтровали через целит, и целит промывали EtOAc (3 х 100 мл). Фильтраты промывали Н 2 О (3 х 200 мл), насыщенным раствором соли (100 мл), сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (смесь EtOAc:гексаны 1:9) с получением трет-бутил 4-(5[(бензилокси)карбонил]амино-2,4-дифторфенил)-3,6-дигидро-1(2 Н)-карбоксилата (1,60 г, 24,5%): 1(25,0 мл) гидрировали при комнатной температуре в течение 72 ч с применением баллона с водородом(200 фунтов/дюйм 2; 1379 кПа). Реакционную смесь фильтровали через целит и промывали смесью Этил (4 Е)-5-(2-метоксифенил)-4-пентеноат. В круглодонный сосуд на 200 мл добавляли 2-иоданизол (5,00 г, 21,4 ммоль), этил 4-пентеноат (3,30 г, 25,6 ммоль), тетракис(трифенилфосфин)палладий(0) (0,740 г, 0,600 ммоль), триэтиламин (6,00 мл, 42,7 ммоль) и смесь CH3CN (45,0 мл) и ТГФ (15,0 мл). Реакционную смесь кипятили с обратным холодильником в течение ночи и затем охлаждали до комнатной температуры. После удаления растворителей в вакууме полученный темно-коричневый остаток растворяли в 5% НCl (водн.) и экстрагировали СН 2Cl2 трижды. Объединенные экстракты промывали насыщенным раствором NаНСО 3, сушили над MgSO4,концентрировали в вакууме. Темно-коричневое масло очищали хроматографией (силикагель, смесь Этил 5-(2-метоксифенил)пентаноат. К раствору этил (4 Е)-5-(2-метоксифенил)-4-пентеноата (3,40 г,14,5 ммоль) в смеси EtOAc и МеОН (40,0/10,0 мл) добавляли небольшими порциями Pd/C (палладий на угле 10%, 0,700 г) во избежание возгорания. Реакционную смесь затем перемешивали в течение ночи при комнатной температуре и давлении водорода 300 psi (2068 кПа). После снятия давления смесь фильтровали через целит и целит промывали EtOAc (3 х 50 мл). Фильтрат концентрировали в вакууме с получением неочищенного продукта в виде светло-желтого масла (3,40 г, 100%), который использовали без дополнительной очистки. 5-(2-Метоксифенил)пентановая кислота. В 250-мл круглодонный сосуд загружали этил 5-(2 метоксифенил)пентаноат (3,40 г, 14,5 ммоль), NaOH (1,74 г, 42,8 ммоль), ТГФ (25,0 мл) и воду (25,0 мл). Реакционную смесь кипятили с обратным холодильником в течение 2 ч и охлаждали до комнатной температуры. Реакционную смесь концентрировали в вакууме, и полученный водный раствор подкисляли 6 М НCl до рН 5. Кислую смесь экстрагировали смесью хлороформ/изопропиловый спирт (3:1, 3 х 50 мл), и объединенные органические фазы промывали насыщенным раствором соли, сушили над Na2SO4 и концентрировали в вакууме с получением продукта в виде белого твердого вещества (2,68 г, 90%), который использовали без дополнительной очистки. 1 трет-Бутил 4-(2,4-дифтор-5-[5-(2-метоксифенил)пентаноил]аминофенил)-1-пиперидинкарбоксилат. В 15-мл круглодонный сосуд загружали 5-(2-метоксифенил)пентановую кислоту (69,0 мг, 0,810 ммоль), трет-бутил 4-(5-амино-2,4-дифторфенил)-1-пиперидинкарбоксилат (229 мг, 0,740 ммоль), гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (2,22 ммоль, 426 мг), 4-диметиламинопиридин(9 мг, 0,07 ммоль) в смеси ДМФА/ДХМ (0,2:5,0 мл) при комнатной температуре. Реакционную смесь перемешивали в течение 12 ч, и к реакционной смеси добавляли воду (10,0 мл). Органический слой отделяли, и водный слой экстрагировали СНCl3 (3 х 10 мл). Объединенные органические экстракты промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме с получением трет-бутил 4-(2,4-дифтор-5-[5-(2-метоксифенил)пентаноил]аминофенил)-1-пиперидинкарбоксилата (310 мг, 83,2%): Пример 11. N-[2,4-Дифтор-5-(4-пиперидинил)фенил]-5-(2-метоксифенил)пентанамид. К раствору трет-бутил 4-(2,4-дифтор-5-[5-(2-метоксифенил)пентаноил]аминофенил)-1-пиперидинкарбоксилата (310 мг, 0,620 ммоль) в дихлорметане (5,00 мл) при 0 С медленно добавляли трифторуксусную кислоту (707 мг, 6,20 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и концентрировали в вакууме. Остаток растворяли в смеси изо-РrОН/СНCl3 (1:3, 10 мл) и подщелачивали до рН 11 10% раствором KОН, промывали Н 2 О и затем насыщенным раствором соли. Органический слой отделяли, сушили над MgSO4 и концентрировали в вакууме с получением желаемого продукта (108 мг, 43,3%): 1 Н ЯМР (400 МГц, СDCl3)7,59 (т, 1 Н, J=8,2 Гц), 7,10-6,96 (м, 2 Н), 6,90-6,68 (м, 3H), 3,67 (с, 3H),3,09 (д, 2 Н, J=12,4 Гц), 2,89 (т.т., 1 Н, J=11,8 Гц), 2,69 (д.т., 2 Н, J=2,6, 12,4 Гц), 2,54 (т, 2 Н, J=7,2 Гц), 2,33(т, 2 Н, J=7,2 Гц), 1,76-1,48 (м, 8 Н); ESMS m/e: 403,3 (М + H)+. Общая методика пиперидинового синтеза (схема 3)(1,48 моль, 1,21 г), добавляли раствор 4-бром-1-хлор-2-нитробензола (3,30 г, 15,0 ммоль) в ДМФА (50,0 мл) при комнатной температуре в атмосфере аргона. Смесь нагревали до 80 С в атмосфере аргона в течение 12 ч. После охлаждения до комнатной температуры смесь фильтровали через целит, и целит промывали EtOAc (3 х 100 мл). Фильтраты промывали Н 2O (3 х 200 мл), насыщенным раствором соли (100 мл), сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (смесь EtOAc:гексаны 1:9) с получением трет-бутил 4-(4-фтор-3-нитрофенил)-3,6-дигидро-1(2 Н)-пиридинкарбоксилата (3,13 г, 65,1%). 1 трет-Бутил-4-(3-амино-4-фторфенил)-1-пиперидинкарбоксилат. Смесь трет-бутил 4-(4-фтор-3 нитрофенил)-3,6-дигидро-1(2 Н)-пиридинкарбоксилата (2,35 г, 8,85 ммоль) и 10% Pd/C (400 мг) в этилацетате (40,0 мл) и метаноле (10,0 мл) гидрировали при комнатной температуре в течение 72 ч с применением баллона с водородом (200 фунт/дюйм 2; 1379 кПа). Реакционную смесь фильтровали через целит и промывали смесью EtOAc/MeOH (1:1, 3 х 50 мл). Фильтрат концентрировали в вакууме с получением трет-бутил-4-(3-амино-4-фторфенил)-1-пиперидинкарбоксилата (2,10 г, 98,0%): 1H ЯМР (400 МГц,СDCl3)6,96-6,76 (м, 1H), 6,67-6,54 (м, 1H), 6,54-6,40 (м, 1H), 4,38-4,09 (уш., 2 Н), 4,09-3,58 (уш., 2 Н),2,87-2,62 (м, 2 Н), 2,60-2,39 (м, 1H), 1,85-1,65 (м, 2 Н), 1,64-1,40 (м, 2 Н), 1,48 (с, 9 Н).- 23008826 трет-Бутил 4-(4-фтор-3-[5-(2-метоксифенил)пентаноил]аминофенил)-1-пиперидинкарбоксилат: В 25-мл круглодонный сосуд загружали 5-(2-метоксифенил)пентановую кислоту (53,0 мг, 0,250 ммоль),трет-бутил-4-(3-амино-4-фторфенил)-1-пиперидинкарбоксилат (59,0 мг, 0,200 ммоль), гидрохлорид 1-[3(диметиламино)пропил]-3-этилкарбодиимида (0,400 ммоль, 62,0 мг), 4-диметиламинопиридин (10 мг) в смеси ДМФА/ДХМ (0,2:2,0 мл) при комнатной температуре. Реакционную смесь перемешивали в течение 12 ч, и к реакционной смеси добавляли воду (10,0 мл). Органический слой отделяли, и водный слой экстрагировали СНCl3 (3 х 10 мл). Объединенные органические экстракты промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенный остаток очищали хроматографией (силикагель, смесь гексаны:EtOAc 6:1) с получением трет-бутил 4-(4-фтор-3[5-(2-метоксифенил)пентаноил]аминофенил)-1-пиперидинкарбоксилата (48,4 мг, 50,0%). 1 Пример 10. N-[2-Фтор-5-(4-пиперидинил)фенил]-5-(2-метоксифенил)пентанамид. К раствору трет-бутил 4-(4-фтор-3-[5-(2-метоксифенил)пентаноил]аминофенил)-1-пиперидинкарбоксилата (48,4 мг, 0,100 ммоль) в CH2Cl2 (2,0 мл) добавляли трифторуксусную кислоту (114 мг, 1,0 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 30 мин и концентрировали в вакууме. Остаток растворяли в смеси СНCl3/изо-РrОН (3:1, 10 мл) и подщелачивали до рН 11 5% раствором KОН. Органический слой отделяли и водный слой экстрагировали смесью СНCl3/изо-РrОН(3:1, 3 х 10 мл). Объединенные органические экстракты промывали насыщенным раствором соли, сушили над МgSO4, фильтровали и концентрировали в вакууме с получением N-[2-фтор-5-(4-пиперидинил) фенил]-5-(2-метоксифенил)пентанамида (38,0 мг, 95%). 1 Н ЯМР (400 МГц, CD3OD)8,30-8,12 (м, 1 Н), 7,64-7,41 (м, 1 Н), 7,24-7,07 (м, 2 Н), 7,06-6,92 (м, 1 Н),6,92-6,74 (м, 3H), 3,80 (с, 3H), 3,25-3,06 (м, 2 Н), 2,80-2,49 (м, 5 Н), 2,48-2,24 (м, 3H), 1,89-1,71 (м, 4 Н),1,71-1,46 (м, 4 Н); ESMS m/e: 385,2 (М + Н)+. 3-[4-(3,4-Дифторфенокси)фенил]пропановая кислота. В 50-мл круглодонный сосуд добавляли 3-(4 гидроксифенил)пропионовую кислоту (1,66 г, 10,0 ммоль), 3,4-дифториодбензол (2,40 г, 10,0 ммоль),дибромид меди(1) (0,100 г), карбонат калия (2,76 г, 20,0 ммоль) и н-метил-2-пирролидон (20 мл) в качестве растворителя. Смесь перемешивали в течение 5 мин при комнатной температуре и затем нагревали до 140 С (масляная баня). После перемешивания в течение 12 ч при 140 С реакционную смесь охлаждали до комнатной температуры и разбавляли EtOAc (100 мл). Разбавленную смесь промывали лимонной кислотой (водн., 30 мл), водой (3 х 50 мл), насыщенным раствором соли и сушили над MgSO4. Удаление растворителя в вакууме давало неочищенный продукт, который очищали хроматографией (0,901 г, 32%): 1 трет-Бутил-4-[3-(3-[4-(3,4-дифторфенокси)фенил]пропаноиламино)-4-фторфенил]-1-пиперидинкарбоксилат. В 25-мл круглодонный сосуд загружали 3-[4-(3,4-дифторфенокси)фенил]пропановую кислоту (180 мг, 0,650 ммоль), трет-бутил-4-(3-амино-4-фторфенил)-1-пиперидинкарбоксилат (180 мг,0,610 ммоль), гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (1,22 ммоль, 190 мг), 4 диметиламинопиридин (20 мг) в смеси ДМФА/ДХМ (0,4:4,0 мл) при комнатной температуре. Реакцион- 24008826 ную смесь перемешивали в течение 12 ч, и к реакционной смеси добавляли воду (10,0 мл). Органический слой отделяли, и водный слой экстрагировали СНCl3 (3 х 10 мл). Объединенные органические экстракты промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенный остаток очищали хроматографией (силикагель, смесь гексаны:ЕtOАс 6:1) с получением трет-бутил 4-[3-(3-[4-(3,4-дифторфенокси)фенил]пропаноиламино)-4-фторфенил]-1-пиперидинкарбоксилата (85,0 мг, 25,0%): 1(170 мг, 1,50 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 10 мин и концентрировали в вакууме. Остаток растворяли в смеси СНCl3/изо-РrОН (3:1, 10 мл) и подщелачивали до рН 11 5% раствором KОН. Органический слой отделяли, и водный слой экстрагировали смесью СНCl3/изо-РrОН (3:1, 3 х 10 мл). Объединенные органические экстракты промывали насыщенным раствором соли, сушили над МgSO4, фильтровали и концентрировали в вакууме с получением 3-[4-(3,4 дифторфенокси)фенил]-N-[2-фтор-5-(4-пиперидинил)фенил]пропанамида (65,0 мг, 92%): 1 трет-Бутил 4-4-фтор-3-[(6-оксо-6-фенилгексаноил)амино]фенил-1-пиперидинкарбоксилат. Загружали в 25-мл круглодонный сосуд 6-оксо-6-фенилгексановую кислоту (51,0 мг, 0,250 ммоль), трет-бутил 4-(3-амино-4-фторфенил)-1-пиперидинкарбоксилат (59,0 мг, 0,200 ммоль), гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (0,400 ммоль, 62,0 мг), 4-диметиламинопиридин (10 мг) в смеси ДМФА/ДХМ (0,2:2,0 мл) при комнатной температуре. Реакционную смесь перемешивали в течение 12 ч,и к реакционной смеси добавляли воду (10,0 мл). Органический слой отделяли и водный слой экстрагировали СНCl3 (3 х 10 мл). Объединенные органические экстракты промывали насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенный остаток очищали хроматографией (силикагель, смесь гексаны:ЕtOАс 6:1) с получением трет-бутил 4-4-фтор-3-[(6-оксо-6 фенилгексаноил)амино]фенил-1-пиперидинкарбоксилата (49,0 мг, 51,0%): 1 Пример 9. N-[2-Фтор-5-(4-пиперидинил)фенил]-6-оксо-6-фенилгексанамид. К раствору трет-бутил 4-4-фтор-3-[(6-оксо-6-фенилгексаноил)амино]фенил-1-пиперидинкарбоксила (49,0 мг, 0,101 ммоль) в СН 2Cl2 (3,0 мл) добавляли трифторуксусную кислоту (114 мг, 1,01 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 30 мин и концентриро- 25008826 вали в вакууме. Остаток растворяли в смеси СНCl3/изо-РrОН (3:1, 10 мл) и подщелачивали до рН 11 5% раствором KОН. Органический слой отделяли, и водный слой экстрагировали смесью СНCl3/изо-РrОН(3:1,3 х 10 мл). Объединенные органические экстракты промывали насыщенным раствором соли, сушили над МgSO4, фильтровали и концентрировали в вакууме с получением N-[2-фтор-5-(4 пиперидинил)фенил]-6-оксо-6-фенилгексанамида (35,5 мг, 86,0%). Соль НCl: 1H ЯМР (400 МГц, CDCl3)8,14-8,01 (уш., 1 Н), 8,01-7,89 (м, 2 Н), 7,65-7,52 (м, 1 Н), 7,527,43 (м, 2 Н), 7,43-7,26 (уш., 1 Н), 7,13-7,00 (м, 1 Н), 7,00-6,88 (уш., 1 Н), 3,68-3,43 (м, 2 Н), 3,19-2,92 (уш.,4 Н), 2,89-2,67 (м, 1 Н), 2,61-2,36 (уш., 2 Н), 2,26-2,06 (м, 2 Н), 2,06-1,93 (м, 2 Н), 1,93-1,71 (уш., 4 Н); ESMSII. Способы синтеза общих структур. Описанные в разделе I примеры служат исключительно иллюстрацией способов, применяемых для синтеза антагонистов МКГ 1. Другие производные могут быть получены с применением обобщенных способов на основе способов синтеза, примененных для синтеза веществ примеров. Для создания дополнительных производных может быть необходимо включить в обобщенные способы синтеза стратегии введения защиты и снятия защиты для таких заместителей, как амино, амидо,карбоновая кислота и гидроксильные группы. Способы введения защиты и снятия защиты таких групп хорошо известны в данной области техники, и их можно найти, например, в Green, T.W. and Wuts, P.G.M.III. Пероральные композиции. В качестве конкретного осуществления пероральной композиции данного изобретения 100 мг одного из описанных здесь соединений объединяют с достаточно тонко измельченной лактозой с получением общего количества от 580 до 590 мг для наполнения капсулы из твердого геля размером 0.IV. Фармакологическая оценка соединений на клонированном рецепторе МКГ 1 крысы. Фармакологические свойства соединений настоящего изобретения оценивали на клонированном рецепторе МКГ 1 крысы с применением протоколов, описанных ниже. Клетки-хозяева Для исследования гетерологично экспрессируемых белков может быть использовано множество клеток-хозяев. Данные клетки включают, но не ограничиваются этим, классифицированные линии клеток млекопитающих, такие как: Cos-7, CHO, LM(tk-), HEK293, Peak rapid 293, и т.д.; линии клеток насекомых, такие как: Sf9, Sf21 и т.д.; клетки амфибий, такие как ооциты шпорцевой лягушки; и другие. Клетки COS-7 выращивают в 150-мм чашках в DMEM с добавками (модифицированной Дульбекко среде Игла с 10% околоплодной бычьей сывороткой, 4 мМ глутамином, 100 единицами/мл пенициллина/ 100 фг/мл стрептомицина) при 37 С, 5% СO2. Исходные чашки клеток COS-7 обрабатывают трипсином и рассевают в отношении 1:6 каждые 3-4 дня. Клетки 293 почек эмбриона человека выращивают в 150-мм чашках в DMEM с добавками (10% околоплодной бычьей сывороткой, 4 мМ глутамином, 100 единицами/мл пенициллина/100 фг/мл стрептомицина) при 37 С, 5% CO2. Исходные чашки клеток 293 обрабатывают трипсином и рассевают в отношении 1:6 каждые 3-4 дня. Клетки Peak rapid 293 (Peakr293) почек эмбриона человека выращивают в 150-мм чашках в DMEM с добавками (10% околоплодной бычьей сывороткой, 10% L-глутамином, 50 фг/мл гентамицина) при 37 С, 5% СO2. Исходные чашки клеток Peak rapid 293 обрабатывают трипсином и рассевают в отношении 1:12 каждые 3-4 дня. Фибробластные LM(tk-) клетки мыши выращивают в 150-мм чашках в DMEM с добавками (модифицированной Дульбекко среде Игла с 10% околоплодной бычьей сывороткой, 4 мМ глутамином, 100 единицами/мл пенициллина/100 фг/мл стрептомицина) при 37 С, 5% СO2. Исходные чашки клетокLM(tk-) обрабатывают трипсином и рассевают в отношении 1:10 каждые 3-4 дня. Клетки яичников китайского хомячка (СНО) выращивают в 150-мм чашках в среде HAM=s F-12 с добавками (10% околоплодной бычьей сывороткой, 4 мМ L-глутамином и 100 единицами/мл пенициллина/100 фг/мл стрептомицина) при 37 С, 5% СО 2. Исходные чашки клеток СНО обрабатывают трипсином и рассевают в отношении 1:8 каждые 3-4 дня. Фибробластные клетки NIH-3T3 эмбриона мыши выращивают в 150-мм чашках в модифицированной Дульбекко среде Игла (DMEM) с добавками (10% околоплодной бычьей сывороткой, 4 мМ глутамином, 100 единицами/мл пенициллина/100 фг/мл стрептомицина) при 37 С, 5% СO2. Исходные чашки клеток NIH-3T3 обрабатывают трипсином и рассевают в отношении 1:15 каждые 3-4 дня. Клетки Sf9 и Sf21 выращивают в монослое в 150-мм чашках для культуры ткани в среде TMN-FH с добавкой 10% сыворотки плодов телят, при 27 С без СО 2. Клетки насекомых High Five выращивают в монослое в 150-мм чашках для культуры ткани в среде Ex-Cell 400 с добавкой L-глутамина, также при 27 С без СО 2. В некоторых случаях линии клеток, которые растут в прикрепленных монослоях, могут быть переведены в суспензионную культуру для повышения выхода клеток и получения больших партий однородного материала тестирования для обычных проектов скрининга рецепторов.- 26008826 Временная экспрессия ДНК, кодирующая подлежащие исследованию белки, может быть временно экспрессирована во многих линиях клеток млекопитающих, насекомых, амфибий и других с помощью нескольких способов,включая, но не ограничиваясь этим, опосредуемую фосфатом кальция, опосредуемую ДЭАЭ-декстраном,опосредуемую липосомами, опосредуемую вирусами, опосредуемую электропорацией доставку и доставку микроинъекцией. Для каждого из данных способов может потребоваться оптимизация подходящих экспериментальных параметров в зависимости от ДНК, линии клеток и типа применяемого затем тестирования. Ниже описан типичный протокол для кальций-фосфатного способа в применении к клеткам Peakrapid 293. Прикрепленные клетки собирают приблизительно за двадцать четыре часа до трансфекции и повторно высевают при плотности 3,5 х 106 клеток/чашку в 150-мм чашку для культуры ткани и инкубируют в течение ночи при 37 С с 5% CO2. 250 фл смеси CaCl2 и ДНК (15 фг ДНК в 250 мМ CaCl2) вносят в 5 мл пластиковую пробирку, и при легком перемешивании медленно добавляют 500 фл 2 Х HBS (280 мМNaCl, 10 мМ KCl, 1,5 мМ Na2HPO4, 12 мМ декстроза, 50 мМ HEPES). Смесь инкубируют в течение 20 мин при комнатной температуре для образования преципитата ДНК. Смесь преципитата ДНК затем добавляют к среде культивирования в каждую чашку и инкубируют в течение 5 ч при 37 С, 5% CO2. После инкубации в каждую чашку добавляют 5 мл среды культивирования (DMEM, 10% FBS, 10% L-глут и 50 мкг/мл гентамицина). Клетки затем инкубируют в течение от 24 до 48 ч при 37 С, 5% CO2. Ниже описан типичный протокол для ДЭАЭ-декстранового способа в применении к клеткам Cos-7; Клетки, подлежащие трансфекции, рассевают за 24 ч до трансфекции для получения сосудов с 70-80% конфлуентностью ко времени трансфекции. Вкратце, 8 фг рецепторной ДНК плюс 8 фг любой дополнительной необходимой ДНК (например, экспрессионного вектора G-белка, репортерного конструкта,маркера устойчивости к антибиотику, ложного вектора и т.д.) добавляют к 9 мл полной DMEM плюс смесь ДЭАЭ-декстран (10 мг/мл в ЗФР). Клетки Cos-7, помещенные во флакон Т 225 (субконфлуентно),промывают один раз ЗФР, и в каждый флакон добавляют смесь ДНК. Клетки инкубируют в течение 30 мин при 37 С, 5% СO2. После инкубации в каждый флакон добавляют 36 мл полной DMEM с 80 фМ хлорохина и инкубируют еще в течение 3 ч. Среду затем удаляют и ровно на 2 мин добавляют 24 мл полной среды, содержащей 10% ДМСО, которую затем удаляют. Клетки затем промывают 2 раза ЗФР, и в каждый флакон добавляют 30 мл полной DMEM. Клетки затем инкубируют в течение ночи. На следующий день клетки собирают с помощью обработки трипсином и пересевают в зависимости от требований типа проводимого тестирования. Ниже описан типичный протокол для опосредуемой липосомами трансфекции клеток СНО; Клетки,подлежащие трансфекции, рассевают за 24 ч до трансфекции для получения сосудов с 70-80% конфлуентностью ко времени трансфекции. В целом 10 фг ДНК, которая может включать различные соотношения рецепторной ДНК плюс любой дополнительной необходимой ДНК (например, экспрессионного вектора G-белка, репортерного конструкта, маркера устойчивости к антибиотику, ложного вектора и т.д.),применяют для трансфекции каждого 75-см 2 флакона с клетками. Трансфекцию, опосредуемую липосомами, проводят в соответствии с рекомендациями производителя (LipofectAMINE, GibcoBRL, Bethesda,MD). Трансфецированные клетки собирают через 24 ч после трансфекции и используют либо пересевают в зависимости от требований типа проводимого тестирования. Ниже описан типичный протокол для способа электропорации в применении к клеткам Cos-7; Клетки, подлежащие трансфекции, рассевают за 24 ч до трансфекции для получения сосудов с субконфлуентностью ко времени трансфекции. Клетки, собранные с применением обработки трипсином, ресуспендируют в их среде выращивания и подсчитывают. 4 х 106 Клеток суспендируют в 300 фл DMEM и помещают в кювету для электропорации. К клеточной суспензии добавляют 8 фг рецепторной ДНК плюс 8 фг любой дополнительной необходимой ДНК (например, экспрессионного вектора G-белка, репортерного конструкта, маркера устойчивости к антибиотику, ложного вектора и т.д.), и кювету помещают вBioRad Gene Pulser и подвергают действию электрического импульса (установки Gene Pulser: напряжение 0,25 кВ, емкость 950 FF). После действия импульса в каждую кювету вносят 800 фл полной DMEM,и суспензию переносят в стерильную пробирку. В каждую пробирку вносят полную среду для доведения конечной концентрации клеток до 1 х 105 клеток/100 F1. Клетки затем размещают в зависимости от требований типа проводимого тестирования. Ниже описан типичный протокол для опосредуемой вирусом экспрессии гетерологичных белков в применении к бакуловирусной инфекции клеток Sf9 насекомого. Кодирующая область ДНК, кодирующей раскрытый здесь рецептор, может быть субклонирована в pBlueBacIII в имеющиеся сайты рестрикции или сайты, сконструированные в 5' и 3' последовательностях по отношению к области, кодирующей полипептид. Для создания бакуловируса 0,5 фг вирусной ДНК (Baculogold) и 3 фг конструкта ДНК, кодирующего полипептид, могут быть совместно трансфецированы в 2 х 106 клеток Sf9 насекомого Spodoptera frugiperda с помощью способа кальций-фосфатной копреципитации, как описано в общих чертахPharmingen (в "Baculovirus Expression Vector System: Procedures and Methods Manual"). Клетки затем ин- 27008826 кубируют в течение 5 дней при 27 С. Супернатант из чашки с совместной трансфекцией может быть собран центрифугированием, и рекомбинантная вирусная бляшка очищена. Процедуры инфекции клеток вирусом, получения исходных препаратов вируса и титрования исходных препаратов вируса соответствуют описанным в руководстве Pharmingen. Сходные принципы могут в целом быть применены в отношении экспрессии в клетках млекопитающих посредством ретровирусов, лесного вируса Simliki и вирусов с двойной цепью ДНК, таких как адено-, герпес- и вирусы коровьей оспы и тому подобное. Стабильная экспрессия Гетерологичная ДНК может быть стабильно включена в клетки-хозяева, что заставляет клетку постоянно экспрессировать чужеродный белок. Способы доставки ДНК в клетку сходны с таковыми, описанными выше для временной экспрессии, но при этом требуется совместная трансфекция вспомогательного гена для обеспечения устойчивости к лекарству целевой клетки-хозяина. Последующая устойчивость к лекарству может быть использована для отбора и поддержания клеток, которые захватили гетерологичную ДНК. Имеется целый набор генов устойчивости, включая, но не ограничиваясь этим, устойчивость к неомицину, канамицину и гигромицину. Для целей исследований рецепторов стабильную экспрессию гетерологичного рецепторного белка осуществляют в клетках млекопитающих, включая СНО, НЕК 293, LM(tk-) и т.п., но не обязательно только в них. Получение клеточной мембраны Для тестирования связывания осадки трансфецированных клеток суспендируют в охлажденном до температуры льда буфере (20 мМ трис.НСl, 5 мМ ЭДТА, рН 7,4) и гомогенизируют обработкой ультразвуком в течение 7 с. Клеточные лизаты центрифугируют при 200 х g в течение 5 мин при 4 С. Супернатанты затем центрифугируют при 40000 х g в течение 20 мин при 4 С. Полученные осадки промывают один раз в буфере гомогенизации и суспендируют в буфере для связывания (смотри способы для радиолигандного связывания). Концентрацию белка определяют способом Брэдфорда (1976) с применением бычьего сывороточного альбумина в качестве стандарта. Анализ связывания обычно проводят немедленно, но возможно получение партии мембран и ее хранение в замороженном виде в жидком азоте для последующего применения. Тестирование связывания радиолиганда Тестирование связывания радиолиганда рецептором МКГ 1 крысы проводили с применением плазмиды pcDNA3.1-rMCH1-f (с присвоеннымРТА-3505 патентного депозита в АТСС). ПлазмидаpcDNA3.1-rMCH1-f включает регуляторные элементы, необходимые для экспрессии ДНК в клетке млекопитающего, оперативно связанные с ДНК, кодирующей рецептор МКГ 1 мыши, таким образом, что это обеспечивает ее экспрессию. Плазмида pcDNA3.1-rMCH1-f была депонирована 05 июля 2001 Американской коллекцией типов клеточных культур (АТСС), 12301 Parklawn Drive, Rockville, Maryland 20852,США в соответствии с условиями Будапештского договора о Международном признании депозита микроорганизмов для целей процедуры патентования, и ей был присвоенРТА-3505 патентного депозита в АТСС. Тестирование связывания также может быть проведено, как описано здесь ниже, с применением плазмиды pEXJ.HR-TL231 (регистрационный 203197 в АТСС). Плазмида pEXJ.HR-TL231 кодирует рецептор МКГ 1 человека и была депонирована 17 сентября 1998 Американской коллекцией типов клеточных культур (АТСС), 12301 Parklawn Drive, Rockville, Maryland 20852, США в соответствии с условиями Будапештского договора о Международном признании депозита микроорганизмов для целей процедуры патентования, и ей был присвоен регистрационный 203197 АТСС. Клетки Peak rapid 293 почек эмбриона человека (клетки Peakr293) временно трансфецировали ДНК,кодирующей рецептор МКГ 1, с помощью кальций-фосфатного способа, и клеточные мембраны получали, как описано выше. Эксперименты по связыванию с мембранами из клеток Peakr293, трансфецированных рецептором МКГ 1 крысы, проводили с 0,08 нМ [3 Н] соединением А (меченым по заказу Amersham) (синтез соединения А подробно описан ниже) с применением буфера инкубации, состоящего из 50 мМ трис рН 7,4, 10 мм MgCl2, 0,16 мМ PMSF, 1 мМ 1,10 фенантролина и 0,2% БСА. Связывание проводили при 25 С в течение 90 мин. Инкубацию прекращали быстрой вакуумной фильтрацией через стеклянные волоконные фильтры GF/C, предварительно пропитанные 5% PEI, с применением 50 нМ трис рН 7,4 в качестве буфера промывки. Во всех экспериментах неспецифическое связывание определяли с помощью 10 фМ соединения А. Функциональные тесты Клетки могут быть подвергнуты скринингу на присутствие эндогенного рецептора млекопитающего с применением функциональных тестов. Клетки с отсутствующим или присутствующим на низком уровне эндогенным рецептором могут быть трансфецированы экзогенным рецептором для применения в функциональных тестах. Для скрининга активации рецептора может быть применен широкий спектр тестов. Данные тесты варьируют от, например, традиционных измерений фосфатидилинозита, цАМФ, Са и K+; до систем измерения тех же самых вторичных посредников, но которые были модифицированы или адаптированы для большей производительности, большей специфичности и большей чувствительности; до основанных на клетках платформ, сообщающих о более общих клеточных событиях, вызываемых активацией рецеп- 28008826 тора, таких как, например, метаболические изменения, дифференцировка и деление/пролиферация клеток; до тестов высокой ступени на уровне организма, которые отслеживают сложные физиологические или поведенческие изменения, которые, как полагают, инициируются в результате активации рецептора,включая, например, сердечно-сосудистые, анальгетические, орексигенные, анксиолитические и седативные эффекты. Результаты анализа связывания радиолиганда Описанные выше соединения тестировали с применением клонированного МКГ 1 крысы. Связывающее сродство соединений показано в таблице I.V. Синтез соединения А. Ниже описан синтез соединения А. Соединение А представляет собой радиоактивно меченое соединение, которое применяли в тестах радиолигандного связывания, описанных выше.N-[3-(1,2,3,6-Тетрагидро-4-пиридинил)фенил]ацетамид. Взаимодействие насыщенного водного раствора Na2CO3 (25 мл), трет-бутил 4-[(трифторметил) сульфонил]окси-1,2,3,6-тетрагидро-1-пиридинкарбоксилата (20 ммоль), 3-ацетамидофенилборной кислоты (30 ммоль) и тетракистрифенилфосфинпалладия(0) (1,15 г) в диметоксиэтане (40 мл) при температуре кипения с обратным холодильником в течение ночи давало трет-бутил 4-[3-(ацетиламино)фенил]3,6-дигидро-1(2 Н)-пиридинкарбоксилат. Снятие защиты ВОС группы с применением НCl в диоксане с последующим защелачиванием (рН 11-12) давало желаемый продукт. Трет-бутил N-(3-бромпропил)карбамат: получали из 3-бромпропиламина гидробромида и ВОС 2O в присутствии основания в дихлорметане.N-3-[1-(3-аминопропил)-1,2,3,6-тетрагидро-4-пиридинил]фенилацетамид. Взаимодействие третбутил N-(3-бромпропил)карбамата и N-[3-(1,2,3,6-тетрагидро-4-пиридинил)фенил]ацетамида при температуре кипения с обратным холодильником в диоксане с каталитическим количеством Bu4NI и основанием, как описано на схеме А, давало трет-бутил 3-(4-[3-(ацетиламино)фенил]-3,6-дигидро-1(2 Н)-пиридинил)пропилкарбамат. Снятие защиты группы ВОС с применением НCl в диоксане с последующим подщелачиванием (рН 11-12) давало желаемый продукт. Метил (4S)-3-([3-(4-[3-(ацетиламино)фенил]-3,6-дигидро-1(2 Н)-пиридинил)пропил]аминокарбонил)-4-(3,4-дифторфенил)-6-(метоксиметил)-2-оксо-1,2,3,4-тетрагидро-5-пиримидинкарбоксилат. Получали в результате взаимодействия 5-метил 1-(4-нитрофенил)-(6S)-6-(3,4-дифторфенил)-4(метоксиметил)-2-оксо-3,6-дигидро-1,5(2 Н)-пиримидиндикарбоксилата (описанного в публикации РСТWO 00/37026, опубликованной 29 июня 2000 г.) и N-3-[1-(3-аминопропил)-1,2,3,6-тетрагидро-4 пиридинил]фенилацетамида. 1(уш., 2 Н), 2,17 (с, 3H), 1,82 (р, 2 Н, J=7,2 Гц); ESMS: 612,25 (М+Н)+. Тритированный метил (4S)-3-[(3-4-[3-(ацетиламино)фенил]-1-пиперидинилпропил)амино]карбонил-4-(3,4-дифторфенил)-6-(метоксиметил)-2-оксо-1,2,3,4-тетрагидро-5-пиримидинкарбоксилат. Метил (4S)-3-([3-(4-[3-(ацетиламино)фенил]-3,6-дигидро-1(2 Н)-пиридинил)пропил]аминокарбонил)-4-(3,4-дифторфенил)-6-(метоксиметил)-2-оксо-1,2,3,4-тетрагидро-5-пиримидинкарбоксилат тритировали (Amersham) с применением описанного холодного способа (Н 2, баллонный способ, метанол, Pd/C,в течение ночи) с получением тритированного метил (4S)-3-[(3-4-[3-(ацетиламино)фенил]-1-пиперидинилпропил)амино]карбонил-4-(3,4-дифторфенил)-6-(метоксиметил)-2-оксо-1,2,3,4-тетрагидро-5 пиримидинкарбоксилата +)-изомера), который в свою очередь применяли в качестве радиолиганда в фармакологических тестах для МКГ.
МПК / Метки
МПК: C07D 211/70, A61K 31/44
Метки: антагонистов, аминоанилиновые, вторичные, применение, пиперидины, мкг1, качестве
Код ссылки
<a href="https://eas.patents.su/30-8826-vtorichnye-aminoanilinovye-piperidiny-v-kachestve-antagonistov-mkg1-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Вторичные аминоанилиновые пиперидины в качестве антагонистов мкг1 и их применение</a>
Предыдущий патент: Проппанты и способ их изготовления
Следующий патент: Очистка вариантов her-2
Случайный патент: Микробицидные воздушный фильтр и дыхательная маска