Производные 1,2,4 – триаминобензола, пригодные для лечения расстройств центральной нервной системы
Номер патента: 8589
Опубликовано: 29.06.2007
Авторы: Венсель Торнее Кристиан, Банг Нергор Мортен, Роттлёндер Марио, Ритзен Андреас, Ханжин Николай
Формула / Реферат
1. Производное 1,2,4-триаминобензола формулы I
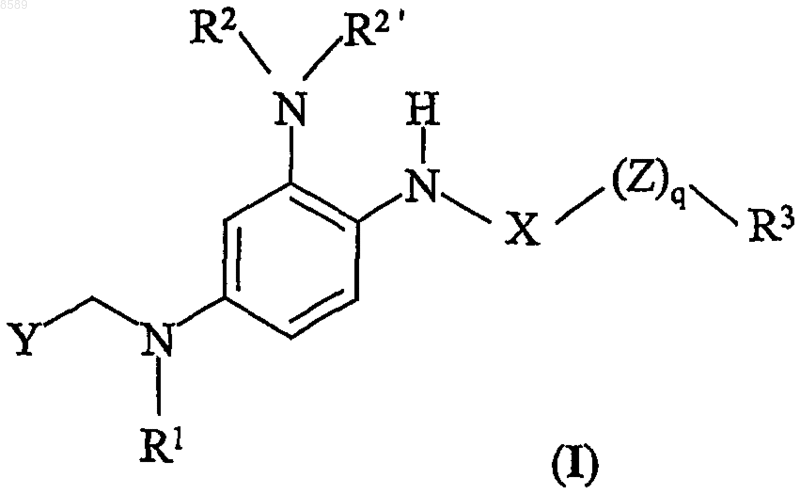
в которой
R1 выбран из группы, состоящей из водорода и C1-6алк(ен/ин)ила;
R2 и R2' независимо выбраны из группы, состоящей из водорода;
R3 выбран из группы, состоящей из C1-6алк(ен/ин)ила и арил-C1-6алк(ен/ин)ила;
X представляет СО;
Z является О;
q равно 0 или 1; и
Y представляет гетероарил формул II и III
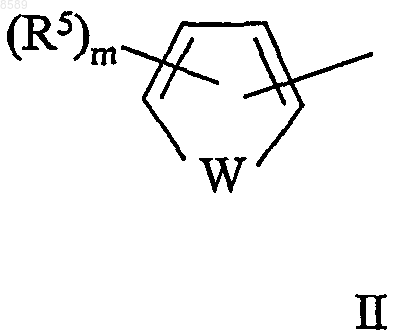
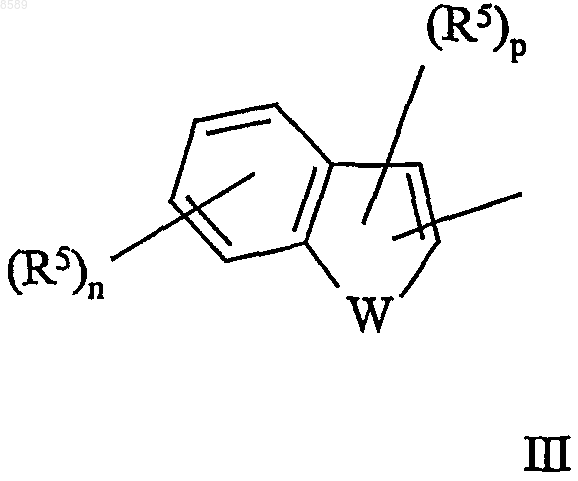
в которых
W представляет О или S;
m равно 0, 1 или 2;
n равно 0, 1, 2, 3 или 4;
р равно 0 или 1; и
каждый R5 независимо выбран из группы, состоящей из C1-6алк(ен/ин)ила, арила, галогена, C1-6алк(ен/ин)илокси, -NR7R7' и -SO2R8; где
R7 и R7' независимо выбраны из группы, состоящей из C1-6алк(ен/ин)ила; и
R8 выбран из группы, состоящей из арила;
или его фармацевтически приемлемые соли.
2. Соединение по п.1, в котором q равно 0.
3. Соединение по п.1, в котором q равно 1 и Z представляет собой кислород.
4. Соединение по одному из пп.1-3, в котором R3 представляет собой C1-6алк(ен/ин)ил.
5. Соединение по одному из пп.1-3, в котором R3 представляет собой арил-С1-6алк (ен/ин)ил.
6. Соединение по одному из пп.1-5, в котором W представляет собой кислород.
7. Соединение по одному из пп.1-5, в котором W представляет собой серу.
8. Соединение по одному из пп.1-7, в котором Y имеет формулу II.
9. Соединение по одному из пп.1-7, в котором Y имеет формулу III.
10. Соединение по одному из пп.1-9, в котором Y имеет формулы IIb или IIIb
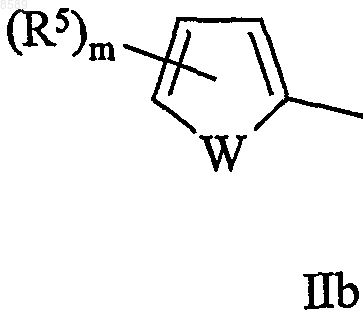
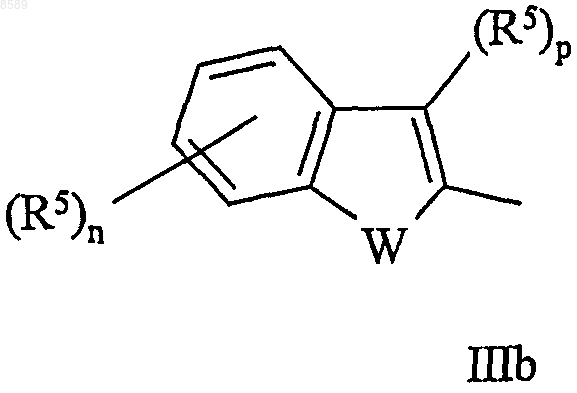
в которых W, m, n, p и R5 имеют значения, определенные выше.
11. Соединение по одному из пп.1-9, в котором Y имеет формулы IIс или IIIс
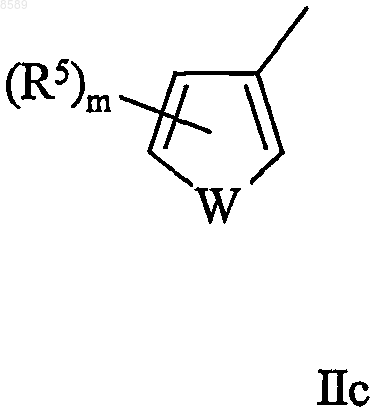
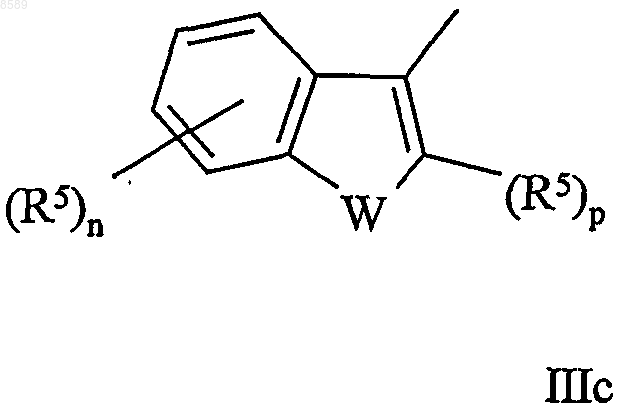
в которых W, m, n, р и R5 имеют значения, определенные выше.
12. Соединение по одному из пп.1-11, где указанное соединение выбрано из группы, состоящей из
этилового эфира {2-амино-4-[(5-хлортиофен-2-илметил)метиламино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(5-хлортиофен-2-илметил)амино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(5-метилтиофен-2-илметил)метиламино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(5-бромтиофен-2-илметил)амино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(6-хлор-3-метоксибензо[b]тиофен-2-илметил)амино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(бензо[b]тиофен-2-илметил)амино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(5-метилтиофен-2-илметил)амино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(4-бром-3-метокситиофен-2-илметил)амино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(5-фенилтиофен-2-илметил)амино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(3-хлортиофен-2-илметил)амино]фенил}карбаминовой кислоты;
этилового эфира (2-амино-4-{[4-(4-хлорбензолсульфонил)-3-метилтиофен-2-илметил]амино}фенил) карбаминовой кислоты;
этилового эфира {2-амино-4-[(3-метилтиофен-2-илметил)амино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(5-фторбензофуран-3-илметил)амино]фенилl}карбаминовой кислоты;
этилового эфира {2-амино-4-[(тиофен-2-илметил)амино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(4-бромтиофен-2-илметил)амино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(5-этилтиофен-2-илметил)амино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(тиофен-3-илметил)амино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(5-хлортиофен-2-илметил)этиламино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(бензо[b]тиофен-3-илметил)амино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(5-диметиламинобензо[b]тиофен-3-илметил)амино]фенил}карбаминовой кислоты;
этилового эфира {2-амино-4-[(5-диметиламино-3-метилбензо[b]тиофен-2-илметил)амино]фенил} карбаминовой кислоты;
этилового эфира {2-амино-4-[(5-фтортиофен-2-илметил)амино]фенил}карбаминовой кислоты;
пропилового эфира {2-амино-4-[(бензо[b]тиофен-2-илметил)амино]фенил}карбаминовой кислоты;
пропилового эфира {2-амино-4-[(бензо[b]тиофен-3-илметил)амино]фенил}карбаминовой кислоты;
N-{2-амино-4-[(5-хлортиофен-2-илметил)амино]фенил}-2- (4-фторфенил)ацетамида и
N-{2-амино-4-[(5-хлортиофен-2-илметил)амино]фенил}-3,3-диметилбутирамида;
и их фармацевтически приемлемых солей.
13. Фармацевтическая композиция для профилактики, лечения и/или подавления расстройства центральной нервной системы, содержащая соединение по одному из пп.1-12 в терапевтически эффективном количестве вместе с одним или более фармацевтически приемлемым носителем или разбавителем.
14. Применение соединения по одному из пп.1-13 для производства фармацевтического препарата для профилактики, лечения и/или подавления расстройства центральной нервной системы.
15. Применение по п.14, отличающееся тем, что расстройство центральной нервной системы выбрано из группы, состоящей из судорожных припадков, таких как судороги, эпилепсия и непрерывный эпилептический припадок.
16. Применение по п.14, отличающееся тем, что расстройство центральной нервной системы выбрано из группы, состоящей из нейропатических болей и мигрени, таких как аллодиния, гипералгическая боль, фантомная боль, нейропатическая боль, связанная с нейропатией при диабете, и нейропатическая боль, связанная с мигренью.
17. Применение по п.14, отличающееся тем, что расстройство центральной нервной системы выбрано из группы, состоящей из состояний, связанных с тревогой, таких как тревога, генерализованное тревожное расстройство, паническая тревога, обсессивно-компульсивное расстройство, социальная фобия, состояние тревоги, посттравматическое стрессовое расстройство, острая стрессовая реакция, регуляторное расстройство, ипохондрические расстройства, страх разлуки, агорафобия, специфические фобии, расстройство тревоги, возникающее за счет общего состояния, или расстройство тревоги, вызванное химическими веществами.
18. Применение по п.14, отличающееся тем, что расстройство центральной нервной системы выбрано из группы, состоящей из нейродегенеративных заболеваний, таких как болезнь Альцгеймера, хорея Гентингтона, рассеянный склероз, амиотрофический боковой склероз, индуцированные СПИДом энцефалопатии и другие, связанные с инфекциями энцефалопатии, вызванные рубеллавирусами, герпесвирусами, спирохетами и неизвестными патогенами, болезнь Крейтцфельда-Якоба, болезнь Паркинсона, вызванные травмой нейродегенерации.
19. Применение по п.14, отличающееся тем, что расстройство центральной нервной системы выбрано из группы, состоящей из состояний гипервозбуждения нейронов, таких как возникающие при отмене препаратов или вызванные интоксикацией.
Текст
008589 Область техники, к которой относится изобретение Настоящее изобретение относится к новым производным 1,2,4-триаминобензола, которые открывают калиевые каналы семейства KCNQ. Соединения пригодны для профилактики, лечения и/или подавления расстройств центральной нервной системы. Уровень техники Ионные каналы представляют собой клеточные белки, которые регулируют поток ионов, включая поток ионов калия, кальция, хлора и натрия в клетки и из них. Такие каналы имеются во всех клетках животных и человека и оказывают влияние на различные процессы, включая передачу в нейронах, сокращение мышц и клеточную секрецию. У людей имеется более 70 субъединиц калиевых каналов (Jentsch Nature Reviews Neuroscience 2000,1, 21-30) с большим разнообразием структур и функций. Калиевые каналы нейронов, которые обнаруживают в мозге, в основном ответственны за поддержание отрицательного потенциала покоя мембран, а также регуляцию реполяризации мембран после потенциала действия. Одной подгруппой генов калиевых каналов является семейство KCNQ. Было показано, что мутации в четырех из пяти генов KCNQ приводят к развитию заболеваний, включая сердечные аритмии, глухоту и эпилепсию (Jentsch Nature Reviews Neuroscience 2000, 1, 21-30). Полагают, что ген KCNQ4 кодирует молекулярный коррелат калиевых каналов, обнаруженных во внешних волосковых клетках улитки и в волосковых клетках типа I вестибулярного аппарата, мутации в котором приводят к наследственной глухоте.KCNQ1 (KvLQT1) организуется с продуктом гена KCNE1 (минимальный К(+)-белок канала) в сердце с образованием замедляющего работу сердца выпрямителеподобного К(+) тока. Мутации в данном канале могут привести к развитию врожденного синдрома длинного зубца QT типа 1 (LQT1), а также они связаны с формой глухоты (Robbins Pharmacol. Ther. 2001, 90, 1-19). Гены KCNQ2 и KCNQ3 были открыты в 1988 г., и оказалось, что они являются мутантными при наследственной форме эпилепсии, известной как доброкачественные семейные судороги новорожденных(Rogawski Trends in Neurosciences 2000, 23, 393-398). Белки, кодированные генами KCNQ2 и KCNQ3,располагаются в пирамидальных нейронах коры головного мозга и гиппокампуса человека, областях мозга, связанных с возникновением и развитием судорожных припадков (Cooper et al. Proceedings National Academy of Science USA 2000, 97, 4914-4919).KCNQ2 и KCNQ3 представляют собой две субъединицы калиевых каналов, которые образуют Мтоки при экспрессии in vitro. M-ток является неинактивирующим калиевым током, обнаруженным во многих типах нейронов. В каждом типе клеток он является доминантным в регуляции возбудимости мембран, будучи единственным постоянным током при инициации потенциала действия (Marrion AnnualReview Physiology 1997, 59, 483-504). Модуляция М-тока оказывает значительное влияние на возбудимость нейронов, например, активация тока будет приводить к снижению возбудимости нейронов. Таким образом, вещества, открывающие данные каналы KCNQ, будут снижать избыточную активность нейронов при таких состояниях, как судорожные припадки и заболевания, характеризующихся избыточной активностью нейронов, например, при эпилепсии и нейропатической боли. Ретигабин (D-23129, этиловый эфир N-(2-амино-4-(4-фторбензиламино)фенил) карбаминовой кислоты) и его аналоги раскрыты в патенте ЕР 554543. Ретигабин является противосудорожным препаратом с широким спектром действия и высокими противосудорожными свойствами как в условиях in vitro, так и in vivo. Он является активным при пероральном и внутрибрюшинном введении крысам и мышам в ряде противосудорожных тестов, включая: индуцированные электричеством судорожные припадки, судорожные припадки, индуцированные химическим воздействием пентилентетразола, пикротоксина и N-метилD-аспартата (NMDA), и тест на генетической модели, мышах DBA/2 (Rostock et al. Epilepsy Research 1996, 23, 211-223). Кроме того, ретигабин активен на модели сложных парциальных припадков с киндлингом, вызванным стимуляцией миндалины, что дополнительно указывает на то, что данное соединение обладает потенциальной возможностью для применения в противосудорожной терапии. В недавно проведенных клинических испытаниях было показано, что ретигабин проявляет эффективность в снижении частоты судорожных припадков у пациентов с эпилепсией (Bialer et al. Epilepsy Research 2002, 51,31-71). Было показано, что ретигабин активирует К(+) ток в нейронах, и фармакология данного индуцированного тока согласуется с опубликованными данными по фармакологии М-канала, свидетельствующими о корреляции с гетеромультимером KCNQ2/3 К(+) канала. На основании этого можно предположить,что активация каналов KCNQ2/3 может быть частично ответственна за противосудорожную активность данного средства (Wickenden et al. Molecular Pharmacology 2000, 58, 591-600), и что другие средства, действующие по такому же механизму, могут иметь аналогичные применения. Сообщалось, что каналы KCNQ2 и 3 стимулировались на моделях нейропатической боли(Wickenden et al. Society for Neuroscince Abstracts 2002, 454, 7), и была высказана гипотеза о том, что модуляторы калиевых каналов являются активными при нейропатической боли и эпилепсии (Schroder et al.Neuropharmacology 2001, 40, 888-898; Blackburn-Munro and Jensen European Journal of Pharmacology 2003,460, 109-116). Кроме того, сообщалось, что присутствие мРНК каналов KCNQ в мозге и других частях-1 008589 центральной нервной системы связано с болью (Goldstein et al. Society for Neuroscience Abstracts 2003, 53,8). В дополнение к роли при нейропатической боли экспрессия мРНК KCNQ 2-5 в ганглии тригеминального и дорсального корня и в тригеминальном хвостатом ядре свидетельствует о том, что данные каналы могут также воздействовать на сенсорный процессинг мигрени (Goldstein et al. Society for Neuroscience Abstracts 2003, 53, 8). В недавно опубликованных сообщениях было показано, что мРНК KCNQ 3 и 5, в дополнение к таковой KCNQ2, экспрессируется в астроцитах и глиальных клетках. Таким образом, каналы KCNQ 2, 3 и 5 могут модулировать синаптическую активность в ЦНС и вносить свой вклад в нейропротективное действие веществ, открывающих каналы KCNQ (Noda et al., Society for Neuroscience Abstracts 2003, 53. 9). Так, ретигабин и другие модуляторы KCNQ могут проявлять защитное действие в отношении нейродегенеративных эффектов при эпилепсии, поскольку было показано, что ретигабин предупреждает нейродегенерацию лимба и экспрессию маркеров апоптоза после индуцированного каиновой кислотой эпилептического статуса у крыс (Ebert et al. Epilepsia 2002, 43 Suppl. 5, 86-95). Это может иметь отношение к предупреждению прогрессирования эпилепсии у пациентов, т.е. выражается в антиэпилептогенном действии. Также было показано, что ретигабин замедляет прогрессирование киндлинга гиппокампуса у крыс, который является дополнительной моделью развития эпилепсии (Tober et al. European Journal ofPharmacology 1996, 303, 163-169). С учетом того, что противосудорожные соединения, такие как бензодиазепины и хлорметиазол,применяются в клинике для лечения синдрома отмены этанола, и что другие противосудорожные препараты, например габапентин, являются очень эффективными на моделях данного синдрома на животных(Watson et al. Neuropharmacology 1997, 36, 1369-1375), заявители предположили, что другие противосудорожные соединения, такие как вещества, открывающие KCNQ, будут также эффективными при данном состоянии. мРНК субъединиц KCNQ2 и 3 обнаружена в областях мозга, связанных с тревогой и эмоциональным поведением, таким как биполярное расстройство, например, в гиппокампусе и миндалине (Saganichet al. Journal of Neuroschience 2001, 21, 4609-4624), и сообщалось, что ретигабин является активным на некоторых моделях состояний, подобных тревоге, на животных (Hartz et al. Journal of Psychopharmacology 2003, 17 suppl. 3, A28, B16), и другие используемые в клинике противосудорожные соединения применяются для лечения биполярного расстройства. В заявке WO 200196540 раскрывается применение модуляторов М-тока, образованного экспрессией генов KCNQ2 и KCNQ3, для лечения бессоницы, в то время как в заявке WO 2001092526 раскрывается,что модуляторы KCNQ5 можно использовать для лечения нарушений сна. В заявке WO 01/022953 раскрывается применение ретигабина для профилактики и лечения нейропатической боли, такой как аллодиния, гипералгическая боль, фантомная боль, нейропатическая боль,связанная с нейропатией при диабете, и нейропатическая боль, связанная с мигренью. В заявке WO 02/049628 раскрывается применение ретигабина для профилактики, лечения, подавления и ослабления состояний, связанных с тревогой, таких как тревога, генерализованное тревожное расстройство, паническая тревога, обсессивно-компульсивное расстройство, социальная фобия, состояние тревоги, посттравматическое стрессовое расстройство, острая стрессовая реакция, регуляторное расстройство, ипохондрические расстройства, страх разлуки, агорафобия и специфические фобии. В заявке WO 97/15300 раскрывается применение ретигабина для лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера, хорея Гентингтона, рассеянный склероз, амиотрофический боковой склероз, индуцированная СПИДом энцефалопатия и другие, связанные с инфекциями энцефалопатии, вызванные рубеллавирусами, герпесвирусами, спирохетами и неизвестными патогенами, болезнь Крейтцфельда-Якоба, болезнь Паркинсона, вызванная травмой нейродегенерация и состояний гипервозбуждения нейронов, таких как возникающие при отмене препаратов или вызванные интоксикацией, нейродегенеративных заболеваний периферической нервной системы, таких как полинейропатии и полиневриты. Следовательно, имеется большая потребность в новых соединениях, которые открывают калиевые каналы семейства KCNQ. Также желательными являются новые соединения с улучшенными по сравнению с известными соединениями свойствами, которые открывают калиевые каналы семейства KCNQ, такие как ретигабин. Желательно улучшение одного или более из следующих параметров: периода полувыведения, клиренса,избирательности, взаимодействия с другими лекарственными препаратами, биодоступности, эффективности, способности к формуляции, химической стабильности, метаболической стабильности, проницаемости через мембраны, растворимости и терапевтического индекса. Улучшение данных параметров может привести к таким улучшениям, как улучшенная схема введения при уменьшении числа необходимых доз в день; простота введения пациентам при многократном применении; сниженные побочные эффекты; повышенный терапевтический индекс;-2 008589 повышенная переносимость и/или улучшенное восприятие. Краткое описание изобретения В соответствии с вышеизложенным, целью изобретения является обеспечение новых соединений,которые эффективно открывают калиевые каналы семейства KCNQ. Соединения по изобретению представляют собой производные 1,2,4-триаминобензола общей формулы I или их фармацевтически приемлемые солиR1, R2, R2', R3, X, Z, Y и q имеют значения, определенные ниже. Изобретение дополнительно относится к фармацевтической композиции, содержащей соединение формулы I, и к ее применению. Описание изобретения Настоящее изобретение относится к новым производным 1,2,4-триаминобензола формулы IR1 выбран из группы, состоящей из атома водорода, С 1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила, С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, ацила, гидрокси-С 1-6 алк(ен/ин)ила и гидрокси-С 3-8 циклоалк(ен)ила;R2 и R2' независимо выбраны из группы, состоящей из атома водорода, C1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила, арила, С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, арил-С 1-6 алк(ен/ин)ила, ацила, гидрокси-С 1-6 алк(ен/ин) ила и гидрокси-С 3-8 циклоалк(ен)ила;R3 выбран из группы, состоящей из атома водорода, C1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила, арила,С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, арил-С 1-6 алк(ен/ин)ила, гидрокси-C1-6 алк(ен/ин)ила, арил-С 3-8 циклоалк (ен)ила, NR10R10'-C1-6 алк(ен/ин)ила, NR10R10'-С 3-8 циклоалк(ен)ила и гидрокси-С 3-8 циклоалк (ен)ила; гдеR10 и R10' независимо выбраны из группы, состоящей из атома водорода, C1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила, С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, гидрокси-С 1-6 алк(ен/ин)ила, гидрокси-С 3-8 циклоалкR10 и R10' вместе с атомом азота, с которым они связаны, образуют 4-8-членное насыщенное или ненасыщенное кольцо, которое необязательно содержит 1, 2 или 3 дополнительных гетероатома;X представляет СО или SO2;R4 выбран из группы, состоящей из атома водорода,С 1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила, С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, гидрокси-С 1-6 алкR3 и R4 вместе с атомом азота, с которым они связаны, образуют 4-8-членное насыщенное или ненасыщенное кольцо, которое необязательно содержит 1, 2 или 3 дополнительных гетероатома, кольцо, образованное R3 и R4 и атомом азота, необязательно замещено одним или более заместителями, независимо выбранными из С 1-6 алк(ен/ин)ила, арила и арил-С 1-6 алк(ен/ин)ила;Y представляет гетероарил формул II и IIIn равно 0, 1, 2, 3 или 4; р равно 0 или 1; и каждый R5 независимо выбран из группы, состоящей из С 1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила,арила, С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, арил-С 1-6 алк(ен/ин)ила, ацила, атома галогена, галоген-С 1-6 алк(ен/ин)ила, С 1-6 алк(ен/ин)илокси, -CO-NR6R6', циано, нитро, -NR7R7'; -S-R8, -SО 2R8 и SО 2OR8; гдеR6 и R6' независимо выбраны из группы, состоящей из атома водорода, C1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила, С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила и арила;R7 и R7' независимо выбраны из группы, состоящей из атома водорода, С 1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила, С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, арила и ацила; иR9 и R9' независимо выбраны из группы, состоящей из атома водорода, С 1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила и С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила; или их фармацевтически приемлемым солям. Когда q равно 0, то тогда R3 соединен с X, в то время когда q равно 1, то тогда R3 соединен с Z, который соединен с X. Таким образом, X-(Z)q-R3 может представлять собой X-R3, X-O-R3 или X-NR3R4. В конкретном воплощении настоящее изобретение относится к соединению формулы I, в которойR3 выбран из группы, состоящей из атома водорода, С 1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила, арила,С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, арил-С 1-6 алк(ен/ин)ила, гидрокси-С 1-6 алк(ен/ин)ила и гидрокси-С 3-8 циклоалк(ен)ила; иZ имеет значения, определенные выше, при условии, что R4 выбран из группы, состоящей из атома водорода, C1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила, С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, гидрокси-С 1-6 алкY имеет значения, определенные выше, при условии, что каждый R5 независимо выбран из группы,состоящей из С 1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила, арила, С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, арилС 1-6 алк(ен/ин)ила, ацила, атома галогена, галоген-С 1-6 алк(ен/ин)ила, -CO-NR6R6', циано, нитро, -NR7R7',-S-R8, -SO2R8 и SO2OR8; или его фармацевтически приемлемым солям. В одном воплощении R1 выбран из группы, состоящей из ацила, гидрокси-С 1-6 алк(ен/ин)ила и гидрокси-С 3-8 циклоалк(ен)ила. В другом воплощении изобретение относится к таким соединениям, в которых R1 выбран из группы, состоящей из атома водорода, C1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила и С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила. В одном предпочтительном воплощении изобретение относится к таким соединениям, в которых R1 выбран из группы, состоящей из атома водорода и С 1-6 алк(ен/ин)ила. В конкретном воплощении изобретение относится к таким соединениям, в которых R1 представляет собой атом водорода. В другом конкретном воплощении изобретение относится к таким соединениям, в которых R1 представляет собой С 1-6 алк(ен/ин)ил. В одном воплощении по меньшей мере один из R2 и R2' выбран из группы, состоящей из арила,арил-С 1-6 алк(ен/ин)ила, ацила, гидрокси-С 1-6 алк(ен/ин)ила и гидрокси-С 3-8 циклоалк(ен)ила. В другом воплощении по меньшей мере один из R2 и R2' выбран из группы, состоящей из атома водорода, С 1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила и С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила. В еще одном воплощении изобретение относится к таким соединениям, в которых по меньшей мере один из заместителей R2 и R2' является атомом водорода. В еще одном воплощении изобретение относится к таким соединениям, в которых оба R2 и R2' являются атомами водорода. В одном воплощении R3 выбран из группы, состоящей из гидрокси-С 1-6 алк(ен/ин)ила, арил-С 3-8 циклоалк(ен)ила, NR10R10'-C1-6 алк(ен/ин)ила, NR10R10'-С 3-8 циклоалк(ен)ила и гидрокси-С 3-8 циклоалкR10 и R10' независимо выбраны из группы, состоящей из атома водорода, C1-6 алк(ен/ин) ила, С 3-8 циклоалк(ен)ила, С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, гидрокси-С 1-6 алк(ен/ин)ила, гидрокси-С 3-8 циклоалк(ен)ила, гидрокси-С 3-8 циклоалк(ен)ил-C1-6 алк(ен/ин)ила, галоген-С 1-6 алк(ен/ин)ила, галоген-С 3-8 циклоалк(ен)ила, галоген-С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, циано-С 1-6 алк(ен/ин)ила, циано-С 3-8 циклоалкR10 и R10' вместе в атомом азота, с которым они связаны, образуют 4-8-членное насыщенное или ненасыщенное кольцо, которое необязательно содержит 1, 2 или 3 дополнительных гетероатома.-4 008589 В еще одном воплощении изобретение относится к таким соединениям, в которых q равно 1, Z представляет собой NR4, и R3 является атомом водорода. В еще одном воплощении изобретение относится к таким соединениям, в которых R3 является иным, чем атом водорода. В еще одном воплощении R3 выбран из группы, состоящей из C1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен) ила, арила, С 3-8 циклоалк(ен)ил-C1-6 алк(ен/ин)ила и арил-С 1-6 алк(ен/ин)ила. В еще одном воплощении изобретение относится к таким соединениям, в которых R3 выбран из группы, состоящей из С 1-6 алк(ен/ин)ила и арил-С 1-6 алк(ен/ин)ила. В еще одном воплощении изобретение относится к таким соединениям, в которых R3 является C1-6 алк(ен/ин)илом. В еще одном воплощении R3 является С 3-8 циклоалк(ен)ил-C1-6 алк(ен/ин)илом. В еще одном воплощении изобретение относится к таким соединениям, в которых R3 представляет собой арил-С 1-6 алк(ен/ин)ил. В одном воплощении изобретение относится к таким соединениям, в которых X является SO2. В еще одном воплощении изобретение относится к таким соединениям, в которых X является СО. В одном воплощении q равно 0. В еще одном воплощении изобретение относится к таким соединениям, в которых X является СО иq равно 0. В еще одном воплощении изобретение относится к таким соединениям, в которых X представляет СО, и q равно 0, и R3 является иным чем арил. В другом воплощении q равно 1. В одном воплощении изобретение относится к таким соединениям, в которых q равно 1 и Z представляет NR4. В одном воплощении q равно 1, Z представляет NR4 и R3 и R4 вместе с атомом азота, с которым они связаны, образуют 4-8-членное насыщенное или ненасыщенное кольцо, которое необязательно содержит 1, 2 или 3 дополнительных гетероатома, кольцо, образованное R3 и R4, и атомом азота, необязательно замещено одним или более заместителями, независимо выбранными из C1-6 алк(ен/ин)ила, арила и арилС 1-6 алк(ен/ин)ила. В другом воплощении q равно 1, Z представляет NR4 и R4 выбран из группы, состоящей из атома водорода, С 1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила, С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, гидрокси-С 1-6 алк(ен/ин)ила и гидрокси-С 3-8 циклоалк(ен)ила. В еще одном воплощении q равно 1, Z представляет NR4 и R4 является атомом водорода. В одном воплощении q равно 1, Z представляет NR4 и по меньшей мере один из R3 и R4 является иным, чем атом водорода. В еще одном воплощении изобретение относится к таким соединениям, в которых q равно 1, Z является атомом кислорода. В еще одном воплощении изобретение относится к таким соединениям, в которых X является СО, q равно 1 и Z представляет атом кислорода. В еще одном воплощении изобретение относится к таким соединениям, в которых R2 и R2' являются атомами водорода, X представляет СО, q равно 1 и Z является атомом кислорода. В еще одном воплощении изобретение относится к таким соединениям, в которых W является атомом кислорода. В еще одном воплощении изобретение относится к таким соединениям, в которых W является атомом серы. В еще одном воплощении изобретение относится к таким соединениям, в которых W является атомом серы и X представляет СО. В еще одном воплощении изобретение относится к таким соединениям, в которых W является атомом серы и q равно 0. В еще одном воплощении изобретение относится к таким соединениям, в которых W является атомом серы, X представляет СО и q равно 0. В еще одном воплощении изобретение относится к таким соединениям, в которых W является атомом серы, q равно 1 и Z представляет атом кислорода. В еще одном воплощении изобретение относится к таким соединениям, в которых W является атомом серы, X представляет СО, q равно 1 и Z является атомом кислорода. В еще одном воплощении m равно 0. В еще одном воплощении m равно 1. В еще одном воплощении m равно 2. В еще одном воплощении m равно 3. В еще одном воплощении n равно 0. В еще одном воплощении n равно 1. В одном воплощении n равно 2, 3 или 4. В одном воплощении р равно 0.-5 008589 В другом воплощении р равно 1. В одном воплощении по меньшей мере один R5 выбран из группы, состоящей из ацила, -CO-NR6R6',нитро, -S-R8 и SO2OR8. В другом воплощении каждый R5 независимо выбран из группы, состоящей из C1-6 алк(ен/ин)ила,С 3-8 циклоалк(ен)ила, арила, С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила, арил-С 1-6 алк(ен/ин)ила, атома галогена, галоген-С 1-6 алк(ен/ин)ила, С 1-6 алк(ен/ин)илокси, циано, -NR7R7' и -SO2R8. В еще одном воплощении каждый R5 независимо выбран из группы, состоящей из C1-6 алк(ен/ин) ила, арила, атома галогена, С 1-6 алк(ен/ин)илокси, -NR7R7' и -SO2R8. В еще одном воплощении изобретение относится к таким соединениям, в которых каждый R5 независимо выбран из группы, состоящей из С 1-6 алк(ен/ин)ила, атома галогена и -SO2R8, где R8 является арилом. В еще одном воплощении по меньшей мере один заместитель R5 является С 1-6 алк(ен/ин)илом. В еще одном воплощении по меньшей мере один заместитель R5 является арилом. В еще одном воплощении по меньшей мере один заместитель R5 является C1-6 алк(ен/ин)илокси. В еще одном воплощении по меньшей мере один заместитель R5 является -SO2R8. В еще одном воплощении по меньшей мере один заместитель R5 является атомом галогена. В еще одном воплощении по меньшей мере один заместитель R5 является атомом галогена, который выбран из группы, состоящей из атомов хлора, брома и йода. В еще одном воплощении по меньшей мере один заместитель R5 является атомом фтора. В еще одном воплощении по меньшей мере один заместитель R5 является атомом хлора. В еще одном воплощении по меньшей мере один заместитель R5 является атомом брома. В еще одном воплощении по меньшей мере один заместитель R5 является -NR7R7' . В одном воплощении по меньшей мере один заместитель R5 является -NR7R7' и по меньшей мере один из R7 и R7' представляет арил или ацил. В одном воплощении по меньшей мере один заместитель R5 является -NR7R7' и по меньшей мере один из R7 и R7' выбран из группы, состоящей из атома водорода, С 1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила и С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ила. В другом воплощении по меньшей мере один заместитель R5 является -NR7R7' и по меньшей мере один из R7 и R7' выбран из группы, состоящей из атома водорода и С 1-6 алк(ен/ин)ила. В еще одном воплощении по меньшей мере один заместитель R5 является -NR7R7' и по меньшей мере один из R7 и R7' представляет С 1-6 алк(ен/ин)ил. В еще одном воплощении по меньшей мере один заместитель R5 является -NR7R7' и оба R7 и R7' представляют С 1-6 алк(ен/ин)ил. В одном воплощении по меньшей мере один заместитель R5 является -SO2R8 и R8 представляет 9 9'-NR R , где R9 и R9' независимо выбраны из группы, состоящей из атома водорода, С 1-6 алк(ен/ин)ила, С 3-8 циклоалк(ен)ила и С 3-8 циклоалк(ен)ил-C1-6 алк(ен/ин)ила. В одном воплощении по меньшей мере один заместитель R5 является -SO2R8 и R8 выбран из группы,состоящей из C1-6 алк(ен/ин)ила, С 3-8 циклоалк (ен)ила, С 3-8 циклоалк(ен)ил-C1-6 алк(ен/ин)ила и арила. В еще одном воплощении по меньшей мере один заместитель R5 является -SO2R8 и R8 представляет арил. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуII. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIII. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулы IIb или IIIb. в которых W, m, n, р и R5 имеют значения, определенные выше. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIb. В еще одном воплощении изобретение относится к таким соединениям, в которых m равно 0, и Y имеет формулу IIb. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIIb. В еще одном воплощении изобретение относится к таким соединениям, в которых n равно 0, и Y имеет формулу IIIb.-6 008589 В еще одном воплощении изобретение относится к таким соединениям, в которых р равно 0, и Y имеет формулу IIIb. В еще одном воплощении изобретение относится к таким соединениям, в которых n равно 0, р равно 0, и Y имеет формулу IIIb. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIIb, и n+р равно 1, и в его конкретном аспекте n равно 1, и р равно 0, и в его другом конкретном аспектеn равно 0, и р равно 1. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIIb, и n+р равно 2, в его конкретном аспекте n равно 2, и р равно 0, и в его другом конкретном аспекте n равно 1, и р равно 1. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулы IIb1, IIb2, IIb3, IIIb1, IIIb2, IIIb3 или IIIb4, представленные нижеR5' и R5" независимо имеют значения, как R5, и каждый R5 независимо имеет значения, определенные выше. В еще одном воплощении изобретение относится к таким соединениям, в которыхY имеет формулу IIIb, и n+р равно 1, в его конкретном аспекте n равно 1, и р равно 0, и в его другом конкретном аспекте n равно 0, и р равно 1; илиY имеет формулу IIIb, и n+р равно 2, в его конкретном аспекте n равно 2, и р равно 0, и в его другом конкретном аспекте n равно 1, и р равно 1; илиY имеет формулу IIb1, или IIb2, или IIb3, или IIIb1, или IIIb2, IIIb3, или IIIb4. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIb1, или IIb2, или IIb3, или в которых m равно 0, и Y имеет формулу IIb. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIb1. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIb2. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIb3. В еще одном воплощении изобретение относится к таким соединениям, в которыхY имеет формулу IIIb, и n+р равно 1, в его конкретном аспекте n равно 1, и р равно 0, и в его другом конкретном аспекте n равно 0, и р равно 1; илиY имеет формулу IIIb, и n+р равно 2, в его конкретном аспекте n равно 2, и р равно 0, и в его другом конкретном аспекте n равно 1, и р равно 1. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIIb1. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIIb2. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIIb3. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIIb4. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулы IIс или IIIс. в которых W, m, n, p и R5 имеют значения, определенные выше. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIс. В еще одном воплощении изобретение относится к таким соединениям, в которых m равно 0, и Y имеет формулу IIс. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIIс. В еще одном воплощении изобретение относится к таким соединениям, в которых n равно 0, и Y имеет формулу IIIс. В еще одном воплощении изобретение относится к таким соединениям, в которых р равно 0, и Y имеет формулу IIIс. В еще одном воплощении изобретение относится к таким соединениям, в которых n равно 0, р равно 0 и Y имеет формулу IIIс. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIIс, и n+р равно 1, и в его конкретном аспекте n равно 1, и р равно 0, и в его другом конкретном аспектеn равно 0, и р равно 1. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIIс, и n+р равно 2, и в его конкретном аспекте n равно 2, и р равно 0, и в его другом конкретном аспектеn равно 1, и р равно 1. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулы IIс 1, IIс 2, IIс 3, IIIс 1, IIIc2, IIIc3 или IIIc4, представленные ниже:R5' и R5" независимо имеют значения, как R5 и каждый R5 независимо имеет значения, определенные выше. В еще одном воплощении изобретение относится к таким соединениям, в которыхY имеет формулу IIIc, и n+р равно 1, в его конкретном аспекте n равно 1, и р равно 0 и в его другом конкретном аспекте n равно 0, и р равно 1; илиY имеет формулу IIIc, и n+р равно 2, в его конкретном аспекте n равно 2, и р равно 0 и в его другом конкретном аспекте n равно 1, и р равно 1; илиY имеет формулу IIc1, или IIc2, или IIc3, или IIIс 1, IIIc2, или IIIc3, или IIIc4. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIc1, или IIc2, или IIc3, или m равно 0, и Y имеет формулу IIc. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIc1. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIc2. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIc3. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуY имеет формулу IIIc, и n+р равно 1, в его конкретном аспекте n равно 1, и р равно 0, и в его другом конкретном аспекте n равно 0, и р равно 1; илиY имеет формулу IIIc, и n+р равно 2, в его конкретном аспекте n равно 2, и р равно 0, и в его другом конкретном аспекте n равно 1, и р равно 1. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIIc1. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIIс 2. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIIс 3. В еще одном воплощении изобретение относится к таким соединениям, в которых Y имеет формулуIIIс 4. В еще одном воплощении изобретение относится к таким соединениям, в которых r равно 0. В еще одном воплощении изобретение относится к таким соединениям, в которых r равно 1. В еще одном воплощении изобретение относится к таким соединениям, в которых r равно 2. В еще одном воплощении изобретение относится к таким соединениям, в которых s равно 0. В еще одном воплощении изобретение относится к таким соединениям, в которых s равно 1, 2 или 3. В еще одном воплощении изобретение относится к таким соединениям, в которых Y формулы II представляетIIb1, или IIb2, или IIb3, или IIс 1, или IIс 2, или IIс 3; или группу формулы IIb, в которой m равно 0; или группу формулы IIс, в которой m равно 0. В еще одном воплощении изобретение относится к таким соединениям, в которых Y формулы II представляетIIb1, или IIb2, или IIb3; или группу формулы IIb, в которой m равно 0; или группу формулы IIс, в которой m равно 0. В еще одном воплощении изобретение относится к таким соединениям, в которых Y формулы III представляетIIIb1, или IIIb2, или IIIb3, или IIIb4, или IIIс 1, или IIIс 2, или IIIс 3, или IIIс 4; или группу формулы IIIb, в которой n равно 0; или группу формулы IIIb, в которой р равно 0; или-9 008589 группу формулы IIIb, в которой n равно 0, и р равно 0; или группу формулы IIIb, в которой n+р равно 1, в его конкретном аспекте n равно 1, и р равно 0, и в его другом конкретном аспекте n равно 0, и р равно 1;Y имеет формулу IIIb, и n+p равно 2, в его конкретном аспекте n равно 2, и р равно 0, и в его другом конкретном аспекте n равно 1, и р равно 1; группу формулы IIIс, в которой n равно 0; или группу формулы IIIс, в которой р равно 0; или группу формулы IIIс, в которой n равно 0 и р равно 0; или группу формулы IIIс, в которой n+р равно 1, в его конкретном аспекте n равно 1, и р равно 0, и в его другом конкретном аспекте n равно 0, и р равно 1; илиY имеет формулу IIIс, и n+р равно 2, в его конкретном аспекте n равно 2, и р равно 0, и в его другом конкретном аспекте n равно 1, и р равно 1. В еще одном воплощении изобретение относится к таким соединениям, в которых Y формулы III представляет:IIIb2, или IIIс 3; или группу формулы IIIb, в которой n равно 0, и р равно 0; или группу формулы IIIс, в которой n равно 0, и р равно 0. В еще одном воплощении изобретение относится к таким соединениям, в которых m равно 0, и Y имеет формулу II, в его конкретных аспектах Y имеет формулы IIb или IIс. В еще одном воплощении m равно 1, и Y имеет формулу II, в его конкретных аспектах Y имеет формулу IIb, и в его более конкретных аспектах Y имеет формулы IIb1, IIb2 или IIb3. В еще одном воплощении m равно 1, и R5 выбран из группы, состоящей из С 1-6 алк(ен/ин)ила и атома галогена, и Y имеет формулу II, в его конкретном аспекте Y имеет формулу IIb, и в его более конкретных аспектах Y имеет формулы IIb1, IIb2 или IIb3. В еще одном воплощении изобретение относится к таким соединениям, в которых m равно 1, и R5 представляет C1-6 алк(ен/ин)ил, и Y имеет формулу II, в его конкретном аспекте Y имеет формулу IIb, и в его более конкретных аспектах Y имеет формулы IIb1 или IIb3. В еще одном воплощении изобретение относится к таким соединениям, в которых m равно 1, и R5 представляет атом водорода, такой как атом брома, или хлора, или фтора, и Y имеет формулу II, в его конкретном аспекте Y имеет формулу IIb, и в его более конкретных аспектах Y имеет формулы IIb1, IIb2 или IIb3. В еще одном воплощении изобретение относится к таким соединениям, в которых m равно 1, и R5 представляет атом брома или хлора, и Y имеет формулу II, в его конкретном аспекте Y имеет формулуIIb, и в его более конкретных аспектах Y имеет формулы IIb1, IIb2 или IIb3. В еще одном воплощении изобретение относится к таким соединениям, в которых m равно 1, и R3 представляет С 1-6 алк(ен/ин)ил, и Y имеет формулу II, в его конкретном аспекте Y имеет формулу IIb, и в его более конкретных аспектах Y имеет формулы IIb1, IIb2 или IIb3, и в его наиболее конкретном аспектеY имеет формулу IIb3. В еще одном воплощении изобретение относится к таким соединениям, в которых R1 представляет С 1-6 алк(ен/ин)ил, m равно 1, R5 представляет С 1-6 алк(ен/ин)ил или атом галогена, и Y имеет формулу II, в его конкретном аспекте Y имеет формулу IIb, и в его более конкретном аспекте Y имеет формулу IIb3. В еще одном воплощении изобретение относится к таким соединениям, в которых n равно 0, р равно 0, и Y имеет формулу III, в его конкретных аспектах Y имеет формулу IIIb или IIIс. В еще одном воплощении изобретение относится к таким соединениям, в которых n равно 1, и Y имеет формулу III, в его конкретных аспектах Y имеет формулы IIIb или IIIс, и в его более конкретных аспектах Y имеет формулы IIIb2, IIIb3 или IIIс 2. В еще одном воплощении изобретение относится к таким соединениям, в которых n+р равно 1 и Y имеет формулу III, в его конкретном аспекте Y имеет формулу IIIс, и в его более конкретном аспекте Y имеет формулу IIIс 2. В еще одном воплощении изобретение относится к таким соединениям, в которых n+р равно 2 и Y имеет формулу III, в его конкретном аспекте Y имеет формулу IIIb, и в его более конкретных аспектах Y имеет формулы IIIb2 или IIIb3. В еще одном воплощении Y не имеет формулу II, когда W представляет атом кислорода. В еще одном воплощении соединение формулы I содержит не более чем 3 арильных группы,имеющих значения, определенные здесь. Соединения из следующего перечня и их фармацевтически приемлемые соли являются предпочтительными: этиловый эфир 2-амино-4-[(5-хлортиофен-2-илметил)метиламино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(5-хлортиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(5-метилтиофен-2-илметил)метиламино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(5-бромтиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(6-хлор-З-метоксибензо[b]тиофен-2-илметил)амино]фенилкарбами- 10008589 новой кислоты; этиловый эфир 2-амино-4-[(бензо[b]тиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(5-метилтиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(4-бром-3-метокситиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(5-фенилтиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(З-хлортиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир (2-амино-4-[4-(4-хлорбензолсульфонил)-3-метилтиофен-2-илметил]аминофенил) карбаминовой кислоты; этиловый эфир 2-амино-4-[(3-метилтиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(5-фторбензофуран-3-илметил)амино]фенил 1 карбаминовой кислоты; этиловый эфир 2-амино-4-[(тиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(4-бромтиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(5-этилтиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(тиофен-3-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(5-хлортиофен-2-илметил)этиламино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(бензо[b]тиофен-3-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(5-диметиламинобензо[b]тиофен-3-илметил)амино]фенил карбаминовой кислоты; этиловый эфир 2-амино-4-[(5-диметиламино-3-метилбензо[b]тиофен-2-илметил)амино]фенил карбаминовой кислоты; этиловый эфир 2-амино-4-[(5-фтортиофен-2-илметил)амино]фенилкарбаминовой кислоты; пропиловый эфир 2-амино-4-[(бензо[b]тиофен-2-илметил)амино]фенилкарбаминовой кислоты; пропиловый эфир 2-амино-4-[(бензо[b]тиофен-3-илметил)амино]фенилкарбаминовой кислоты;N-2-амино-4-[(5-хлортиофен-2-илметил)амино]фенил-3,3-диметилбутирамид. В конкретном аспекте соединения из следующего перечня и их фармацевтически приемлемые аддитивные соли кислоты являются предпочтительными: этиловый эфир 2-амино-4-[(5-хлортиофен-2-илметил)метиламино]фенилкарбаминовой кислоты,этиловый эфир 2-амино-4-[(5-хлортиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(5-метилтиофен-2-илметил)метиламино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(5-бромтиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(6-хлор-3-метоксибензо[b]тиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(бензо)[b]1 тиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(5-метилтиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(4-бром-3-метокситиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(5-фенилтиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(3-хлортиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир (2-амино-4-[4-(4-хлорбензолсульфонил)-3-метилтиофен-2-илметил]аминофенил) карбаминовой кислоты; этиловый эфир 2-амино-4-[(3-метилтиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(5-фторбензофуран-3-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир (2-амино-4-[(тиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(4-бромтиофен-2-илметил)амино]фенилкарбаминовой кислоты,этиловый эфир 2-амино-4-[(5-этилтиофен-2-илметил)амино]фенилкарбаминовой кислоты; этиловый эфир 2-амино-4-[(тиофен-3-илметил) амино] фенилкарбаминовой кислоты и этиловый эфир 2-амино-4-[(5-хлортиофен-2-илметил)этиламино]фенилкарбаминовой кислоты. В одном аспекте изобретение обеспечивает фармацевтическую композицию, содержащую по меньшей мере одно соединение формулы I, определенной выше, или его фармацевтически приемлемую соль, в терапевтически эффективном количестве вместе с одним или более фармацевтически приемлемым носителем или разбавителем. В одном конкретном аспекте изобретение обеспечивает фармацевтическую композицию, содержащую по меньшей мере одно соединение формулы I, определенной выше, или его фармацевтически приемлемую аддитивную соль кислоты, в терапевтически эффективном количестве вместе с одним или более фармацевтически приемлемым носителем или разбавителем. Изобретение обеспечивает фармацевтическую композицию для перорального или парентерального введения, где указанная фармацевтическая композиция содержит по меньшей мере одно соединение формулы I или его соль в терапевтически эффективном количестве вместе с одним или более фармацевтически приемлемым носителем или разбавителем. В одном воплощении соединения по изобретению можно вводить в качестве только одного тера- 11008589 певтически эффективного соединения. В другом воплощении соединения по изобретению можно вводить в качестве части комбинированной терапии, т.е. соединения по изобретению можно вводить в комбинации с другими терапевтически эффективными соединениями, обладающими противосудорожными свойствами. Эффекты таких других соединений, обладающих противосудорожными свойствами, могут включать, но не ограничиваться активностью в отношении ионных каналов, таких как натриевый, калиевый или кальциевый каналы; возбуждающих аминокислотных систем, например, блокадой или модуляцией NMDA-рецепторов; ингибиторных систем нейромедиаторов, например, при усилении высвобождения ГАМК или блокаде поглощения ГАМК и/или стабилизации мембраны. Имеющиеся в настоящее время противосудорожные препараты включают, но не ограничиваются тиагабином, карбамазепином, вальпроатом натрия, ламотригином, габапентином, прегабалином, этосуксимидом, леветирацетамом, фенитоином, топираматом, зонисамидом, а также членами группы бензодиазепина и барбитуратов. Соединения по изобретению рассматриваются в качестве пригодных для увеличения ионного потока в вольтаж-зависимом калиевом канале. Соединения по изобретению рассматриваются в качестве пригодных для профилактики, лечения и/или подавления расстройства или состояния, реагирующего на повышенный ионный поток в калиевом канале, таком как калиевые ионные каналы семейства KCNQ. В одном аспекте было установлено, что соединения по изобретению оказывают влияние на калиевые каналы семейства KCNQ, в частности на субъединицу KCNQ2. Согласно одному аспекту соединения по изобретению рассматриваются в качестве пригодных для профилактики, лечения и/или подавления различных расстройств центральной нервной системы, таких как судорожные припадки, например судороги, эпилепсия и эпилептический статус; состояния, связанные с тревогой, такие как тревога, генерализованное тревожное расстройство, паническая тревога, обсессивно-компульсивное расстройство, социальная фобия, состояние тревоги, посттравматическое стрессовое расстройство, острая стрессовая реакция, регуляторное расстройство, ипохондрические расстройства,страх разлуки, агорафобия и специфические фобии. Следовательно, соединения по изобретению рассматриваются в качестве пригодных для профилактики, лечения и/или подавления различных расстройств центральной нервной системы, таких как судорожные припадки, такие как судороги, эпилепсия и эпилептический статус; нейропатическая боль, такая как аллодиния, гипералгическая боль, фантомная боль, нейропатическая боль, связанная с нейропатией при диабете, и нейропатическая боль, связанная с мигренью; состояния, связанные с тревогой, такие как тревога, генерализованное тревожное расстройство, паническая тревога, обсессивно-компульсивное расстройство, социальная фобия, состояние тревоги, посттравматическое стрессовое расстройство, острая стрессовая реакция, регуляторное расстройство, ипохондрические расстройства, страх разлуки, агорафобия и специфические фобии; нейродегенеративные заболевания, такие как болезнь Альцгеймера, хорея Гентингтона, рассеянный склероз, амиотрофический боковой склероз, индуцированная СПИДом энцефалопатия и другие, связанные с инфекциями энцефалопатии, вызванные рубеллавирусами, герпесвирусами, спирохетами и неизвестными патогенами, болезнь Крейтцфельда-Якоба, болезнь Паркинсона, вызванная травмой нейродегенерация; состояния гипервозбуждения нейронов, такие как возникающие при отмене препаратов или вызванные интоксикацией, нейродегенеративные заболевания периферической нервной системы, такие как полинейропатии и полиневриты. Следовательно, соединения по изобретению рассматриваются в качестве пригодных для профилактики, лечения и/или подавления расстройств или состояний, таких как судорожные припадки, нейропатические боли и мигрень, состояния тревоги и нейродегенеративные заболевания. По одному конкретному аспекту соединения по изобретению рассматриваются в качестве пригодных для профилактики, лечения и/или подавления судорожных припадков, таких как судороги, эпилепсия и эпилептический статус. По другому конкретному аспекту соединения по изобретению рассматриваются в качестве пригодных для профилактики, лечения и/или подавления нейропатических болей и мигрени, таких как аллодиния, гипералгическая боль, фантомная боль, нейропатическая боль, связанная с нейропатией при диабете, и нейропатическая боль, связанная с мигренью. Дополнительно соединения по изобретению рассматриваются в качестве пригодных для профилактики, лечения и/или подавления состояний, связанных с тревогой, таких как тревога, генерализованное тревожное расстройство, паническая тревога, обсессивно-компульсивное расстройство, социальная фобия, состояние тревоги, посттравматическое стрессовое расстройство, острая стрессовая реакция, регуляторное расстройство, ипохондрические расстройства, страх разлуки, агорафобия и расстройство тревоги,возникающее за счет общего состояния, и расстройство тревоги, вызванное химическими веществами, и- 12008589 специфические фобии. Дополнительно соединения по изобретению рассматриваются в качестве пригодных для профилактики, лечения и/или подавления нейродегенеративных заболеваний, таких как болезнь Альцгеймера, хорея Гентингтона, рассеянный склероз, амиотрофический боковой склероз, индуцированная СПИДом энцефалопатия и другие, связанные с инфекциями энцефалопатии, вызванные рубеллавирусами, герпесвирусами, спирохетами и неизвестными патогенами, болезнь Крейтцфельда-Якоба, болезнь Паркинсона,вызванная травмой нейродегенерация и состояния гипервозбуждения нейронов, такие как возникающие при отмене препаратов или вызванные интоксикацией. В другом аспекте изобретение обеспечивает соединения, показывающие эффект в одном или более из следующих тестов: относительный поток через канал KCNQ2, который является показателем активности соединения в отношении канала-мишени; максимальный электрошок, который является показателем судорожных припадков, индуцированных неспецифической стимуляцией ЦНС электричеством; индуцированные пилокарпином судорожные припадки, индуцированные пилокарпином судорожные припадки часто трудно лечить многими имеющимися противосудорожными препаратами и, таким образом, они является моделью устойчивых к препаратам судорожных припадков; тесты по установлению порога для судорог, индуцированных электричеством и тесты по установлению порога для судорог, индуцированных химическими веществами,на данных моделях определяют порог, при котором возникают судорожные припадки, таким образом, на данных моделях определяют, насколько соединения могут замедлять развитие судорожных припадков; киндлинг миндалины, который используется в качестве показателя прогрессирования заболевания, поскольку у здоровых животных судорожные припадки на данной модели становятся более тяжелыми при дополнительной стимуляции животных. Согласно одному конкретному аспекту изобретения соединения являются активными в отношенииKCNQ2 со значением EC50 менее 15000 нM по данным теста относительный поток через каналKCNQ2, который описан ниже. Согласно одному конкретному аспекту изобретения соединения являются активными в отношенииKCNQ2 со значением ЕС 50 менее 1500 нМ по данным теста относительный поток через канал KCNQ2,который описан ниже. Согласно другому конкретному аспекту изобретения соединения являются активными в отношенииKCNQ2 со значением ЕС 50 менее 150 нМ по данным теста относительный поток через канал KCNQ2,который описан ниже. Согласно другому конкретному аспекту изобретения соединения имеют значения ЕС 50 менее 15 мг/кг в тесте Максимальный электрошок, который описан ниже. Согласно еще одному конкретному аспекту изобретения соединения имеют значения EC50 менее 5 мг/кг в тесте Максимальный электрошок, который описан ниже. Согласно одному конкретному аспекту изобретения соединения имеют значения ЕС 50 менее 5 мг/кг в тестах Установление порога для судорожных припадков, индуцированных электричеством и/или Установление порога для судорожных припадков, индуцированных химическими веществами, которые описаны ниже. Некоторые соединения имеют незначительные или клинически малозначимые побочные эффекты. Таким образом, некоторые соединения тестированы на моделях нежелательного седативного, гипотермического и атаксического действия. Некоторые соединения имеют такое значение соответствующего периода полувыведения или соответствующего клиренса, что пациентам требуется принимать таблетки, например, один или два раза в день. Пациенты легко запоминают это, и, таким образом, это способствует лучшему восприятию лечения препаратом. Некоторые соединения имеют высокий терапевтический индекс противосудорожного действия и побочных эффектов, например нарушения двигательной активности или атаксического действия, что определяют постановкой теста на вращающемся стержне. Это означает, что соединения, как и следовало ожидать, будут хорошо переноситься пациентами, что позволит использовать высокие дозы до проявления побочных эффектов. При этом восприятие лечения будет хорошим, и введение высоких доз позволит сделать лечение более эффективным у пациентов с побочными эффектами от других препаратов. Определения Термин "гетероатом" относится к атомам азота, кислорода или серы."Атом галогена" означает атомы фтора, хлора, брома или йода. Выражение "С 1-6 алк(ен/ин)ил" означает С 1-6 алкил, С 1-6 алкенил или С 2-6 алкинил. Термин "С 1-6 алкил" относится к разветвленному или неразветвленному алкилу, содержащему 1-6 атомов углерода, включая, но не ограничиваясь метилом, этилом, 1-пропилом, 2-пропилом, 1-бутилом, 2 бутилом, 2-метил-2-пропилом, 2,2-диметил-1-пропилом и 2-метил-1-пропилом.- 13008589 Аналогично "С 2-6 алкенил" и "С 2-6 алкинил", соответственно, обозначает такие группы, которые содержат 2-6 атомов углерода, включающие одну двойную связь и одну тройную связь, соответственно,включая, но не ограничиваясь этенилом, пропенилом, бутенилом, этинилом, пропинилом и бутинилом. Выражение "С 3-8 циклоалк(ен)ил" означает С 3-8 циклоалкил- или циклоалкенил. Термин "С 3-8 циклоалкил" обозначает моноциклический или бициклический карбоцикл, содержащий 3-8 С-атомов, включая, но не ограничиваясь циклопропилом, циклопентилом, циклогексилом и т.д. Термин "С 3-8 циклоалкенил" означает моноциклический или бициклический карбоцикл, содержащий 3-8 С-атомов и включающий одну двойную связь. Когда два заместителя вместе с атомом азота, с которым они связаны, образуют 4-8-членное насыщенное или ненасыщенное кольцо, которое необязательно содержит 1, 2 или 3 дополнительных гетероатома, то тогда моноциклическая кольцевая система образована 4-8 атомами, выбранными из атома азота,1-7 атомами углерода и 0-3 гетероатомами, выбранными из N, S или О. Примерами таких кольцевых систем являются азетидин, бета-лактам, пирролидин, пиперидин, пиперазин, морфолин, пиррол, оксазолидин, тиазолидин, имидазолидин, тетразол и пиразол. Термин "арил" относится к ароматическим системам, таким как пиридин, тиазол, оксазол, фенил,нафтил, тиофен и фуран, которые необязательно замещены одним или более заместителями, независимо представляющими собой гидрокси, атом галогена, С 1-6 алк(ен/ин) ил, С 3-8 циклоалк(ен)ил, С 38 циклоалк(ен)ил-С 1-6 алк(ен/ин)ил, галоген-C1-6 алк(ен/ин)ил, С 1-6 алкокси, С 3-8 алкокси, ацил, нитро или циано, -CO-NH-C1-6 алк(ен/ин)ил, -CO-N(С 1-6 алк(ен/ин)ил)2, -NH-С 1-6 алк(ен/ин) ил, -N(С 1-6 алк(ен/ин)ил)2, S-C1-6 алк(ен/ин)ил,-SO2-С 1-6 алк(ен/ин)ил,-SO2O-С 1-6 алк(ен/ин)ил,-NH2,-SO2N(C1-6 алк(ен/ин)ил)2 или -SO2NН-С 1-6 алк(ен/ин)ил; или два смежных заместителя вместе с ароматической группой, с которой они связаны, могут образовать 4-8-членное кольцо, которое необязательно содержит один или два гетероатома. Когда два смежных заместителя вместе с ароматической группой, с которой они связаны, образуют 4-8-членное кольцо, которое необязательно содержит один или два гетероатома, то тогда кольцевая система образована 4-8-атомами, выбранными из 3-8 атомов углерода и 0-2 гетероатомов, выбранных из N,S или О. Такие два смежных заместителя могут вместе образовать -(СН 2)n"-СН 2-, -СН=СН-(СН 2)m"-, -СН 2 СН=СН-(СН 2)p"-, -СН=СН-СН=СН-, -(СН 2)n"-O-, -O-(CH2)m"-O-, -СН 2-О-(СН 2)p"-O-, -СН 2-O-СН 2-O-СН 2-,-(СН 2)n"-S-, -S-(CH2)m"-S-, -CH2-S-(СН 2)p"-S-, -CH2-S-CH2-S-СН 2-, -(CH2)n"-NH-, -NH- (CH2)m"-NH-, -CH2NH-(CH2)p"-NH-, -CH=CH-NH-, -O-(CH2)m"-NH-, -CH2-O-(CH2)p"-NH или -О-(CH2)p"-NH-CH2-, -S-(CH2)m"NH-, -N=CH-NH-, -N=CH-O- или -N=CH-S-, где m" равно 1, 2 или 3, n" равно 2, 3 или 4, и р" равно 1 или 2. В том смысле, в котором он здесь используется, термин "ацил" относится к формилу, С 1-6 алк(ен/ин) карбонилу, С 3-8 циклоалк(ен)илкарбонилу, арилкарбонилу, арил-С 1-6 алк(ен/ин)илкарбонилу или С 3-8 циклоалк(ен)ил-C1-6 алк(ен/ин)илкарбонилу, где С 1-6 алк(ен/ин)ил, С 3-8 циклоалк(ен)ил и арил имеют значения,определенные выше. Термин "галоген-С 1-6 алк(ен/ин)ил" обозначает C1-6 алк(ен/ин)ил, замещенный одним или более атомами галогена, включая, но не ограничиваясь трифторметипом. Аналогично галоген-С 3-8 циклоалк(ен)ил обозначает С 3-8 циклоалк(ен)ил, замещенный одним или более атомами галогена, и галоген-С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ил обозначает С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ил, замещенный одним или более атомами галогена. В термине "С 3-8 циклоалк (ен)ил-С 1-6 алк(ен/ин)ил", С 3-8 циклоалк(ен)ил и С 1-6 алк(ен/ин)ил имеют значения, определенные выше. Кроме того, термины, такие как гидрокси-С 1-6 алк(ен/ин)ил, гидрокси-С 3-8 циклоалк(ен)ил, арил-С 1-6 алк(ен/ин)ил, С 1-6 алк(ен/ин)илокси, С 3-8 циклоалк(ен)илокси, C1-6 алк(ен/ин) илкарбонил, С 3-8 циклоалк (ен) илкарбонил, арилкарбонил, арил-С 1-6 алк(ен/ин)илкарбонил, С 3-8 циклоалк(ен)ил-C1-6 алк(ен/ин)илкарбонил, арил-С 3-8 циклоалк(ен)ил, гидрокси-С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ил, гидрокси-С 1-6 алк(ен/ин)илС 3-8 циклоалк(ен)ил, циано-С 1-6 алк(ен/ин)ил, циано-С 3-8 циклоалк (ен)ил, циано-С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ил, NR10NR10'-С 1-6 алк(ен/ин)ил и NR10NR10'-С 3-8 циклоалк(ен)ил и т.д. обозначают группы, в которых C1-6 алк(ен/ин)ил, С 3-8 циклоалк(ен)ил и арил имеют значения, определенные выше. Соли по изобретению предпочтительно являются фармацевтически приемлемыми солями. Такие соли включают фармацевтически приемлемые аддитивные соли кислоты, фармацевтически приемлемые соли металлов, соли аммония и алкилированного аммония. Фармацевтически приемлемые соли по изобретению предпочтительно представляют собой аддитивные соли кислоты. Аддитивные соли кислоты включают соли неорганических кислот, а также органических кислот. Аддитивные соли кислоты по изобретению предпочтительно являются фармацевтически приемлемыми солями соединений по изобретению, образованными нетоксичными кислотами. Примерами таких солей органических кислот являются соли, полученные с малеиновой, фумаровой, бензойной, аскорбиновой, янтарной, щавелевой, бис-метиленсалициловой, метансульфоновой, этандисульфоновой, уксусной, пропионовой, винной, салициловой, лимонной, глюконовой, молочной, яблочной, миндальной, коричной, цитраконовой, аспарагиновой, стеариновой, пальмитиновой, итаконовой,- 14008589 гликолевой, п-аминобензойной, глутаминовой, бензолсульфоновой и теофиллинуксусной кислотами, а также 8-галогентеофиллины, например 8-бромтеофиллин. Примерами таких солей неорганических кислот являются соли, полученные с соляной, бромистоводородной, серной, сульфаминовой, фосфорной и азотной кислотами. Такие аддитивные соли кислоты можно получить способами, известными специалистам в данной области. Дополнительные примеры фармацевтически приемлемых аддитивных солей неорганической или органической кислоты включают фармацевтически приемлемые соли, перечисленные в J. Pharm. Sci. 1977, 66, 2, который включен здесь для сведения. Также предназначенными в качестве фармацевтически приемлемых аддитивных солей кислоты являются гидраты, которые способны образовать настоящие соединения. Кроме того, когда в молекуле имеется двойная связь или полностью, или частично насыщенная кольцевая система, то могут быть получены геометрические изомеры. Подразумевается, что любые геометрические изомеры, выделенные, чистые или частично очищенные геометрические изомеры или их смеси, включаются в объем изобретения. Аналогично молекулы, содержащие связь с ограниченным вращением, могут образовывать геометрические изомеры. Они также предназначены для включения в объем настоящего изобретения. Кроме того, некоторые соединения по настоящему изобретению могут находиться в различных таутомерных формах и подразумевается, что любые таутомерные формы, которые способны образовать соединения, включаются в объем настоящего изобретения. Кроме того, соединения по данному изобретению могут находиться в несольватированных, а также в сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобное. Как правило, сольватированные формы рассматриваются в качестве равноценных с несольватированными формами для целей изобретения. Некоторые из соединений по настоящему изобретению содержат хиральные центры, и такие соединения находятся в форме изомеров (т.е. энантиомеров). Изобретение включает все такие изомеры и их любые смеси, включая рацемические смеси. Рацемические формы можно разделить на оптические антиподы известными способами, например,разделением их диастереоизомерных солей с помощью оптически активной кислоты и выделением оптически активного амина обработкой основанием. Другой метод разделения рацематов на оптические антиподы основан на хроматографии на оптически активном матриксе. Рацемические соединения по настоящему изобретению можно также разделить на их оптические антиподы, например, дробной кристаллизацией d- или l-тартратов, манделатов или камфорсульфонатов. Соединения по настоящему изобретению можно также разделить получением диастереоизомерных производных. Можно использовать дополнительные способы разделения оптических изомеров, известные специалистам в данной области. Такие способы включают имеющиеся у J. Jaques, A. Collet and S.Wilen inEnantiomers, Racemates, and Resolutions, John Wiley and Sons, New York (1981). Оптически активные соединения можно также получить из оптически активных исходных веществ. Изобретение также включает пролекарства настоящих соединений, которые при введении претерпевают химическое превращение в результате метаболических процессов перед тем, как они превращаются в фармакологически активные соединения. В основном такими пролекарствами будут функциональные производные соединений общей формулы I, которые легко превращаются in vivo в необходимое соединение формулы I. Описаны общепринятые методы отбора и получения подходящих пролекарств,например, в Design of Prodrugs, ed. H.Bundgaard, Elsevier, 1985. Изобретение также включает активные метаболиты настоящих соединений. При их использовании по отношению к соединениям формулы I термины "эпилепсия" и "эпилепсии" включают любые эпилепсии, эпилептические синдромы и эпилептические припадки, описанные вAgainst Epilepsy. Epilepsia 1989, 30(4): 389-399. Фармацевтические композиции Соединения по данному изобретению в основном применяются в виде свободного основания или в виде его фармацевтически приемлемой соли. Типичные примеры упомянуты выше. Если желательно, то фармацевтическая композиция по изобретению может содержать соединение формулы I в комбинации с дополнительными фармакологически активными соединениями, такими как описаны ниже. Фармацевтические композиции могут быть специально составлены для введения любым подходящим путем, таким как пероральный, ректальный, интраназальный, ингаляционный, местный (включая буккальный и сублингвальный), через кожу, интрацистернальный, внутрибрюшинный, вагинальный и парентеральный (включая подкожный, внутримышечный, интратекальный, внутривенный и внутрикожный) путь, предпочтительным является пероральный путь введения. Очевидно, понятно, что предпочти- 15008589 тельный путь будет зависеть от общего состояния и возраста субъекта, который подвергается лечению,природы состояния, которое лечится, и выбранного активного ингредиента. Фармацевтические композиции по данному изобретению или таковые, которые получают по данному изобретению, можно вводить любым подходящим путем, например перорально в форме таблеток,капсул, порошков, гранул, пеллет, драже, пилюль или лепешек, растворов или суспензий в водных или неводных жидкостях или жидких эмульсиях "масло-в-воде" или "вода-в-масле" и т.д., или парентерально в форме растворов для инъекций. Другие фармацевтические композиции для парентерального введения включают дисперсии, суспензии или эмульсии, а также стерильные порошки для восстановления в стерильных инъекционных растворах или дисперсиях перед применением. Также в объем настоящего изобретения включаются инъекционные композиции-депо. Другие подходящие формы для введения включают суппозитории, спреи, мази, кремы, гели, аэрозоли, дермальные пластыри, имплантаты и т.д. Для получения таких композиций можно использовать методы, хорошо известные в данной области, и можно использовать любые фармацевтически приемлемые носители, разбавители, наполнители или другие добавки, обычно используемые в данной области. Обычно соединения по изобретению вводят в разовой лекарственной форме, содержащей указанные соединения в количестве примерно 0,01-100 мг. Как правило, общая суточная доза находится в пределах примерно 0,05-500 мг или даже 0,05-1500 мг, или 0,05-3000 мг, и наиболее предпочтительно 0,1-50 мг активного соединения по изобретению. Обычно для парентеральных путей введения, таких как внутривенный, интратекальный, внутримышечный и аналогичного введения, дозы находятся на уровне примерно половины от дозы, используемой для перорального введения. Соединения по изобретению можно вводить самостоятельно или в комбинации с фармацевтически приемлемыми носителями или наполнителями в одной или множественных дозах. Фармацевтические композиции по изобретению можно составлять с использованием фармацевтически приемлемых носителей или разбавителей, а также любых других известных адъювантов и наполнителей согласно обычным методам, например, раскрытым в Remington: The Science and Practice of Pharmacy, 19 Edition, Gennaro,Ed., Mack Publishing Co., Easton, PA, 1995. Композиции обычно могут быть представлены в разовой лекарственной форме с использованием методов, известных в области фармации. Можно использовать любые другие адъюванты или добавки, обычно применяемые для данных целей, такие как красители, ароматизаторы, консерванты и т.д., при условии, что они совместимы с активными ингредиентами. Фармацевтические композиции по изобретению можно получить с использованием общепринятых в данной области методов. Например, таблетки можно получить смешением активного ингредиента с обычными адъювантами и/или разбавителями и затем прессованием смеси с помощью обычного аппарата для таблетирования. Примеры адъювантов или разбавителей включают: кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, камеди и тому подобное. Можно использовать любые другие адъюванты или добавки, обычно используемые для данных целей, такие как красители, ароматизаторы, консерванты и т.д., при условии, что они совместимы с активными ингредиентами. В тех случаях, когда это является подходящим, то можно приготовить твердую лекарственную форму с оболочками, такими как кишечные оболочки, или их можно составить для обеспечения контролируемого высвобождения активного ингредиента, например, непрерывного или длительного высвобождения согласно методам, хорошо известным в данной области. Если используется жидкий носитель, то препарат может находиться в форме сиропа, эмульсии,мягкой желатиновой капсулы или стерильного инъекционного раствора, такого как суспензия или раствор в водной или неводной жидкости. Для парентерального введения можно использовать растворы новых соединений по изобретению в стерильном водном растворе, водном растворе пропиленгликоля, водном растворе витамина Е или кунжутном или арахисовом масле. Растворы для инъекций можно приготовить растворением активного ингредиента и возможных добавок в части растворителя для инъекций, предпочтительно стерильной воды,доведением раствора до желаемого объема, стерилизацией раствора и наполнением им подходящих ампул или флаконов. Можно внести любую подходящую добавку, обычно используемую в данной области,такую как осмотические средства, консерванты, антиоксиданты и т.д. Следовательно, такие водные растворы должны быть соответствующим образом забуферены, если это необходимо, и в начале жидкий разбавитель делают изотоническим с помощью достаточного количества соли и глюкозы. Водные растворы являются особенно пригодными для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. Используемые стерильные водные среды легко получить с использованием обычных методов, известных специалистам в данной области. Подходящие фармацевтические носители включают инертные твердые разбавители или наполнители, стерильный водный раствор и различные органические растворители. Примерами жидких носителей являются сироп, арахисовое масло, оливковое масло, фосфолипиды, жирные кислоты, амины жирных кислот, полиоксиэтилен и вода. Аналогично носитель или разбавитель может включать любое вещество для непрерывного высвобождения, известное в данной области, такое как глицерилмоностеарат или глицерилдистеарат, одно или в смеси с воском.- 16008589 Типичными примерами рецептуры композиций по изобретению являются следующие: 1) таблетки, содержащие 5,0 мг соединения по изобретению в виде свободного основания: 2) таблетки, содержащие 0,5 мг соединения по изобретению в виде свободного основания: Получение соединений по изобретению Соединения по изобретению общей формулы I, в которой R1, R2, R2', R3, X, Y, Z и q имеют значения,определенные выше, получают способами, представленными на схеме и описанными ниже: В последующем любой из R1, R2, R2', R3, R4, R5, R6, R6', R7, R7', R8, R9, R9', R10, R10', X, Y, Z, W, m, n, p и q имеют значения, определенные выше. Соединения общей формулы VII получают способами, известными химикам в данной области (v.Bebenburg et al. Chemiker Zeitung 1979, Sonderdruck 103, 3-15) и схематично описанными ниже. Соединения общей формулы IV получают взаимодействием 4-нитроанилина с подходящими электрофильными реагентами, такими как, но не ограничиваясь ими, хлорангидриды кислот, бромангидриды кислот, иодангидриды кислот, сульфонилхлориды, изоцианаты, ангидриды карбоновых кислот, активированные сложные эфиры и алкилгалогенформиаты с добавлением оснований, таких как триалкиламины,карбонат калия или алкоголяты лития, натрия или калия, или без таковых в подходящем растворителе,например, этилацетате, диоксане, тетрагидрофуране, ацетонитриле или диэтиловом эфире, при соответствующей температуре, такой как комнатная температура или температура кипения, достигаемая обычным нагреванием или микроволновым облучением, с последующим восстановлением нитрогруппы с использованием подходящего восстановителя, например, дитионита натрия, порошкообразного железа или цинка в водном растворе соляной кислоты или газообразного водорода в присутствии подходящего катализатора для гидрирования, такого как палладий на активированном угле, в подходящих растворителях, таких как метанол или этанол, при подходящей температуре. Соединения общей формулы V получают взаимодействием соединений общей формулы IV с реагентом, образующим защитную группу по анилиновой группе, например, ангидридом фталевой кислоты,в подходящем растворителе, таком как ледяная уксусная кислота, при подходящей температуре. Соединения общей формулы VI получают из соединений общей формулы V реакциями нитрования,известными специалистам в данной области, такими как реакция с дымящей азотной кислотой, в подходящем растворителе, таком как ледяная уксусная кислота, при подходящей температуре. Соединения общей формулы VII получают из соединений общей формулы IV снятием защиты с анилиновой функциональной группы гидратом гидразина в подходящем растворителе, таком как 1,2 диоксан, при подходящей температуре. Альтернативно соединения общей формулы VII можно получить из 2-нитро-1,4-диаминобензола в 3 стадии, как представлено на схеме и описано ниже. На первой стадии менее пространственно затрудненный и более реакционноспособный азот анилина защищают соответствующей защитной группой PG[Protective Groups in Organic Synthesis, 3rd Edition T.W.Greene, P.G.M.Wuts, Wiley Interscience, 1999], такой как трет-бутилоксикарбонил (Вос-группа), взаимодействием с соответствующим реагентом, образующим защитную группу, например, ди-трет-бутилдикарбонатом, в соответствующем растворителе,таком как ацетонитрил, при соответствующей температуре с получением соединений общей формулыXI. Соединения общей формулы XII получают из соединений общей формулы XI взаимодействием с подходящими электрофильными реагентами, образующими R3-(Z)q-X-гpyппy, такую как алкил-, арил или гетероарилхлорформиаты или карбамоилхлориды, хлорангидриды кислот, бромангидриды кислот,иодангидриды кислот, сульфонилхлориды, изоцианаты, ангидриды карбоновых кислот, активированные карбоновые кислоты, с активирующими реагентами, такими как карбодиимиды или другие, известные химикам в данной области, в подходящих растворителях, например ацетонитриле, тетрагидрофуране,1,2-дихлорэтане или метиленхлориде, при соответствующей температуре, такой как комнатная температура или температура кипения, достигаемая обычным нагреванием или микроволновым облучением, с добавлением оснований, таких как окись магния, карбонат калия, триалкиламины, пиридин или бикарбонат натрия или без таковых, как описано выше для соединений общей формулы IV. Защитную группу удаляют способами, известными химикам в данной области. В частности, Вос- 18008589 группу можно отщепить обработкой соответствующей кислотой, например трифторуксусной кислотой,при отсутствии или в присутствии растворителя, например метиленхлорида или толуола, при соответствующей температуре, с получением соединений общей формулы VII. Получение соединений общей формулы VIII Соединения общей формулы VII подвергают реакциям восстановительного алкилирования, известным химикам в данной области, с альдегидами общих формул IIa или IIIа, в которых R5, W, m, n и p имеют значения, определенные выше, с использованием восстановителей, таких как боргидрид натрия или цианоборгидрид натрия, в подходящем растворителе, например метаноле, этаноле, тетрагидрофуране, воде, диоксане или их смесях, с добавлением каталитических количеств кислоты, такой как уксусная кислота или без таковой, при подходящей температуре, с получением соединений общей формулы VIII, в которой R1 является атомом водорода. Альтернативно соединения общей формулы VII можно подвергнуть взаимодействию с альдегидами общих формул IIа или IIIа в подходящем растворителе, таком как метанол, этанол, тетрагидрофуран, диоксан, ксилол или их смеси, с добавлением каталитических количеств кислоты, такой как уксусная кислота, или кислой ионообменной смолы или без таковой, при соответствующей температуре с образованием иминов, которые можно выделить кристаллизацией или выпариванием растворителя. Затем имины можно восстановить с использованием восстановителей, таких как боргидрид натрия или цианоборгидрид натрия, в подходящем растворителе, например, метаноле, этаноле, тетрагидрофуране, воде, диоксане или их смесях, с получением соединений общей формулы VIII, в которой R1 является атомом водорода. Необязательно для модификации R1 полученные соединения общей формулы VIII можно подвергнуть дополнительному восстановительному алкилированию с использованием подходящих альдегидов и восстановителей, таких как боргидрид натрия или цианоборгидрид натрия, в подходящем растворителе,например метаноле, этаноле, тетрагидрофуране, воде, диоксане или их смесях, с добавлением каталитических количеств кислоты, такой как уксусная кислота или без таковой, при подходящей температуре,как описано выше. Данную реакцию также можно проводить in situ после первого восстановительного алкилирования альдегидами общих формул IIа или IIIа. Альтернативно для модификации R1 полученные соединения общей формулы VIII можно подвергнуть ацилированию с использованием подходящих электрофильных реагентов, таких как хлорангидриды кислот, бромангидриды кислот, иодангидриды кислоты, сульфонилхлориды и алкилгалогенформиаты, с добавлением оснований, таких как триалкиламины, карбонат калия или алкоголяты лития, натрия или калия, в подходящем растворителе, например этилацетате, диоксане, тетрагидрофуране или диэтиловом эфире, при соответствующей температуре, как описано выше. Соединения общей формулы IX получают восстановлением соединений общей формулы VIII с использованием подходящего восстановителя, например дитионита натрия, порошкообразного железа или цинка, в водном растворе соляной кислоты или уксусной кислоты, в отсутствие или в присутствии органических растворителей, таких как тетрагидрофуран или этанол, или газообразного водорода в присутствии подходящего катализатора для гидрирования, такого как палладий на активированном угле, в подходящих растворителях, таких как метанол или этанол, или смесь вода/тетрагидрофуран, при подходящей температуре. Полученные соединения идентичны соединениям по изобретению общей формулы I, в которой R2 и R2' являются атомом водорода, и в которой R1, R3, X, Y, Z и q имеют значения, определенные выше. Соединения общей формулы I, в которой R1 не является атомом водорода, и где R2 и необязательно 2'R не являются атомом водорода, получают взаимодействием соединений общей формулы IX, в которойR1 не является атомом водорода, с использованием следующих способов: введением R2 восстановительным алкилированием с использованием подходящих альдегидов и восстановителей, таких как боргидрид натрия или цианоборгидрид натрия, в подходящем растворителе, например, метаноле, этаноле, тетрагидрофуране, воде, диоксане или их смесях, с добавлением каталитических количеств кислоты, такой как уксусная кислота или без таковой, при подходящей температуре, как описано выше; необязательным введением R2' дополнительным восстановительным алкилированием с использованием подходящих альдегидов и восстановителей, таких как боргидрид натрия или цианоборгидрид натрия, в подходящем растворителе, например, метаноле, этаноле, тетрагидрофуране, воде, диоксане или их смесях, с добавлением каталитических количеств кислоты, такой как уксусная кислота или без таковой, при подходящей температуре, как описано выше. Альтернативно R2' или R2 вводят ацилированием с использованием подходящих электрофильных реагентов, таких как хлорангидриды кислот, бромангидриды кислот, иодангидриды кислот, сульфонилхлориды и алкилгалогенформиаты, с добавлением оснований, таких как триалкиламины, карбонат калия или алкоголяты лития, натрия или калия в подходящем растворителе, например этилацетате, диоксане,тетрагидрофуране или диэтиловом эфире, при соответствующей температуре, как описано выше. Для получения соединений общей формулы I, в которой R1 является атомом водорода и в которой 2R и необязательно R2' не являются атомом водорода, вводят защитную группу, такую как третбутилоксикарбонил, как R1, до восстановления нитрогруппы, способами, известными химикам в данной- 19008589 области. Данную защитную группу отщепляют после введения R2 и необязательно R2' известными способами. Соединения общих формул IIа и IIIа получают обычными способами, известными химикам в данной области, схематично представленными ниже: восстановлением сложного эфира карбоновой кислоты соответствующим восстановителем, таким как гидрид диизобутилалюминия с последующим окислением полученного бензилового спирта подходящим окислителем, таким как смесь перрутенат тетрапропиламмония/N-метилморфолин-N-оксид,хлорхромат пиридиния, смесь диметилсульфоксид/оксалилхлорид. Альтернативно соединения общих формул IIа и IIIа можно получить формилированием с использованием дихлорметилметилового эфира и тетрахлорида титана (Gross et al., Org. Synth. Coll, 1973, Vol. V, 365; Fanghaenel et al. , J. Prakt. Chem. 1997, 339, 277). Альтернативно соединения общих формул На и IIIа можно получить способами, известными химикам в данной области, такими как депротонирование гетероароматического соединения сильным основанием, таким как алкиллитий, и последующим взаимодействием с N,N-диметилформамидом. Альтернативно соединения общих формул IIа и IIIа можно получить способами, известными химикам в данной области, такими как обменная реакция галоген-металла галогензамещенных гетероароматических соединений, таких как бромиды или иодиды, взаимодействием с металлирующим агентом, таким как галид алкиллития или алкилмагния, или диалкилмагния. Альтернативно соединения общих формулIIа и IIIа можно получить способами, известными химикам в данной области, например взаимодействием тиофенов и бензотиофенов с фосфорилхлоридом в присутствии N-метил-N-фенилформамида (King et al.Chem. 2002, 67, 205). Примеры Данные аналитической ЖХ/МС получали на оборудовании РЕ Sciex API 150EX, снабженном источником IonSpray и системой Shimadzu LC-8A/SLC-10A. Колонка: 30x4,6 мм Waters Symmetry C18 с размером частиц 3,5 мкм; система растворителей: А=смесь вода/трифторуксусная кислота (100:0,05) и В=смесь вода/ацетонитрил/трифторуксусная кислота (5:95:0,03); метод: элюирование линейным градиентом 90% А до 100% В в течение 4 мин и с расходом 2 мл/мин. Чистоту определяли интегрированием данных УФ (254 нм) и ELSD. Время удерживания (RT или tR) выражали в минутах. Препаративную очистку ЖХ/МС проводили на том же оборудовании. Колонка: 50x20 мм YMCODS-A с размером частиц 5 мкм; метод: элюирование линейным градиентом 80% А до 100% В в течение 7 мин и с расходом 22,7 мл/мин. Сбор фракций проводили при детектировании МС с разделением потоков. 1 Н ЯМР-спектры записывали при 500,13 МГц на оборудовании Bruker Avance DRX500 или при 250,13 МГц на оборудовании Bruker АС 250. Дейтерированный хлороформ (99,8%D) или диметилсульфоксид (99,8%D) использовали в качестве растворителей. ТМС использовали в качестве внутреннего стандарта. Значения химических сдвигов выражали в м.д. Для множества ЯМР-сигналов применяли следующие сокращения: s=синглет, d=дублет, t=триплет, q=квартет, qui=квинтет, h=гептет, dd=дублет дублетов, ddd=дублет дублетов дублетов, dt=дублет триплетов, dq=дублет квартетов, tt=триплет триплетов,m=мультиплет и b=широкий синглет. В некоторых случаях представлены значения констант расщепления J. Точки плавления (т.пл.) определяли на устройстве Bchi B-540, и они представлены без поправки. Получение промежуточных соединений Этиловый эфир (4-аминофенил)карбаминовой кислоты. 4-Нитроанилин (100 г, 0,72 моль) растворяли в этилацетате (800 мл) и добавляли диизопропилэтиламин (89,6 мл, 0,936 моль). Добавляли этилхлорформиат (252 мл, 1,45 моль), растворенный в этилацетате (200 мл), и раствор перемешивали в течение 18 ч при комнатной температуре. Смесь промывали 2 М НСl (300 мл) и насыщенным раствором соли (300 мл), высушивали (MgSO4) и концентрировали в вакууме до половины первоначального объема. К полученному раствору добавляли палладий на активированном угле (10 г, 5% Pd, 50% Н 2O) и смесь гидрировали в аппарате Парра (р(Н 2)=3 бар) при комнатной температуре в течение 12 ч. Смесь фильтровали через целит и растворитель выпаривали в вакууме с получением 118 г (90%) указанного в заголовке соединения в виде кристаллического продукта. ЖХ/МС (m/z) 180,9 (МН+); время удерживания=0,60 мин. 1 Н ЯМР (CDCl3): 1,27 (т, 3 Н); 3,42 (шир.,2 Н, NH2); 4,19 (кв, 2 Н); 6,52 (шир., 1 Н NH); 6,64 (м, 2 Н); 7,14 (м, 2 Н). Аналогичным способом получали следующее соединение. Пропиловый эфир (4-аминофенил)карбаминовой кислоты. Выход: 98%. 1 Н ЯМР (CDCl3): 0,96 (т, 3 Н); 1,68 (м, 2 Н); 3,51 (шир., 2 Н); 4,09 (т, 2 Н); 6,46 (шир.,1 Н); 6,63 (д, 2 Н); 7,14 (м, 2 Н). Этиловый эфир (4-фталимидофенил)карбаминовой кислоты. Этиловый эфир (4-аминофенил)карбаминовой кислоты (118 г, 0,65 моль) растворяли в ледяной уксусной кислоте (2,0 л) в атмосфере азота и смесь нагревали до 90 С. Добавляли ангидрид фталевой кислоты (102,0 г, 0,69 моль) порциями в течение 30 мин и реакционную смесь выдерживали при 90 С в течение 2 ч. Смеси давали охладиться до комнатной температуры и выпавший осадок отфильтровывали. Осадок промывали на фильтре водой (2 л), затем диэтиловым эфиром (3 л) и затем высушивали в вакуу- 20008589 ме. Выход 127 г (62%) указанного в заголовке соединения в виде белого кристаллического вещества. ЖХ/МС (m/z) 311,3 (МН+); время удерживания=2,57 мин. 1 Н ЯМР (ДMCO-d6): 1,26 (т, 3 Н); 4,15 (кв, 2 Н); 7,34 (дд, 2 Н); 7,58 (дд, 2 Н); 7,90 (ддд, 2 Н); 7,95 (ддд, 2 Н); 9,80 (с, 1 Н, NH). Аналогичным способом получали следующее соединение. Пропиловый эфир (4-фталимидофенил)карбаминовой кислоты. Выход: 81%. Этиловый эфир (2-нитро-4-фталимидофенил)карбаминовой кислоты. Этиловый эфир (4-фталимидофенил)карбаминовой кислоты (99,0 г, 0,32 моль) суспендировали в ледяной уксусной кислоте (1,5 л) и нагревали до 90 С. Добавляли дымящую азотную кислоту (17,2 мл,0,41 моль) по каплям в течение 30 мин при 90-95 С. Затем реакционную смесь перемешивали при 100 С в течение 1 ч и охлаждали до комнатной температуры. Кристаллические твердые частицы отфильтровывали и промывали на фильтре ледяной уксусной кислотой (500 мл), водой (1 л) и диэтиловым эфиром (1 л), затем высушивали в вакууме с получением 101 г (90%) указанного в заголовке соединения в виде желтого твердого вещества. ЖХ/МС (m/z) 355,0 (МН+); время удерживания=3,34 мин. 1 Н ЯМР (ДMCO-d6): 1,25 (т, 3 Н); 4,16 (кв,2 Н); 7,81 (м, 2 Н); 7,93 (ддд, 2 Н); 7,99 (ддд, 2 Н); 6,15 (дд, 1 Н); 9,99 (с, 1 Н, NH). Аналогичным способом получали следующее соединение. Пропиловый эфир (2-нитро-4-фталимидофенил)карбаминовой кислоты. Выход: 70%. Этиловый эфир (4-амино-2-нитрофенил)карбаминовой кислоты. 1,2-Диметоксиэтан (1,0 л) добавляли к этиловому эфиру (2-нитро-2-фталимидофенил)карбаминовой кислоты (101 г, 0,28 моль) и смесь кипятили с обратным холодильником. Добавляли моногидрат гидразина (19,6 г, 0,39 моль) по каплям в течение 10 мин и смесь перемешивали при кипячении с обратным холодильником в течение 1,5 ч. После охлаждения до комнатной температуры смесь фильтровали и твердые частицы промывали на фильтре диметоксиэтаном (250 мл). Фильтрат концентрировали упариванием и кристаллический продукт красного цвета перекристаллизовывали из толуола (350 мл) , выпавший в осадок продукт отфильтровывали и высушивали в вакууме. Маточный раствор концентрировали до половины первоначального объема и выдерживали в течение 16 ч. Осажденное вещество отфильтровывали и перекристаллизовывали, как описано ранее. Перекристаллизованные твердые частицы объединяли с получением в целом 57,6 г (90%) темно-красного соединения. ЖХ/МС (m/z) 225,1 (МН+); время удерживания=2,08 мин. 1 Н ЯМР (CDC13): 1,33 (т, 3 Н); 3,77 (с, 2 Н,NH2); 4,23 (кв, 2 Н); 6,98 (дд, 1 Н); 7,45 (д, 1 Н); 8,28 (д, 1 Н); 9,39 (с, 1 Н, NH). Аналогичным способом получали следующее соединение. Выход: 91%. 1 Н ЯМР (CDCl3): 0,98 (т, 3 Н); 1,71 (м, 2 Н); 3,78 (шир., 2 Н); 4,13 (т, 2 Н); 6,98 (дд, 1 Н); 7,44 (д, 1 Н); 8,27 (д, 1 Н); 9,39 (с, 1 Н). трет-Бутиловый эфир(4-амино-3-нитрофенил)карбаминовой кислоты. К нагреваемому с обратным холодильником раствору 2-нитро-1,4-диаминобензола (10,135 г, 66,18 ммоль) в тетрагидрофуране (100 мл) добавляли Вос 2O (ди-трет-бутилдикарбонат, 32,6 г, 149 ммоль) порциями в течение 2 ч. Полученный раствор выливали в гептан (2 л), обрабатывали ультразвуком в течение 15 мин, фильтровали и высушивали в вакууме с получением 13,40 г указанного в заголовке соединения в виде красного твердого вещества. Выход 80%. ЖХ/МС (m/z) 295,4 ([M+H+MeCN]+); время удерживания=2,54 (УФ, ELSD) 96%, 100%. 1 Н ЯМР (ДMCO-d6): 1,47 (с, 9 Н); 6,96 (д, 1 Н); 7,24 (с, 2 Н, NH2), 7,41 (дд, 1 Н); 8,20 (с, 1 Н); 9,28 (с, 1 Н,NH).[4-(4-Хлорбензолсульфонил)-3-метилтиофен-2-ил]метанол. Раствор метилового эфира 4-(4-хлорбензолсульфонил)-3-метилтиофен-2-карбоновой кислоты (992 мг, 3,00 ммоль) в безводном тетрагидрофуране (20 мл) и безводном СН 2 Сl2 (10 мл) охлаждали до 0 С в атмосфере N2 и добавляли DIBAL-H (9,0 мл, 9,0 ммоль, 1 М раствор в толуоле). Через 3 ч добавляли еще порцию DIBAL-H (4,5 мл, 4,5 ммоль) и перемешивание продолжали еще в течение 2 ч. Реакционную смесь гасили добавлением насыщенного раствора сегнетовой соли (30 мл) и смесь перемешивали в течение 1 ч при комнатной температуре. Фазы разделяли, водную фазу экстрагировали EtOAc (2x50 мл), и объединенные органические слои высушивали над Na2SO4 и упаривали в вакууме. Продукт очищали хроматографией на силикагеле на системе FlashMaster с использованием элюента смеси гептан/этилацетат (элюирование линейным градиентом от 1:0 до 6:4). Объединяли фракции, содержащие продукт, и упаривали в вакууме с получением желаемого соединения (788 мг, 87%). ЖХ/МС (m/z)=285,2(д, J=8,5 Гц, 2 Н), 8,18 (с, 1 Н). Аналогично получали следующие соединения.(4-Бром-3-метокситиофен-2-ил)метанол. Суспензию метилового эфира 4-бром-3-гидрокситиофен-2-карбоновой кислоты (948 мг, 4,00 ммоль), диметилсульфата (0,57 мл, 6,0 ммоль) и K2 СO3 (1,11 г, 8,0 ммоль) в ацетоне (10 мл) кипятили с обратным холодильником в течение 4 ч. После охлаждения до комнатной температуры добавляли воду(25 мл). Смесь экстрагировали EtOAc (2x25 мл) и экстракты объединяли, высушивали над Na2SO4 и упаривали в вакууме. Остаток растворяли в безводном тетрагидрофуране (20 мл), раствор охлаждали до 0 С в атмосфере азота и добавляли DIBAL-H (12 мл, 12 ммоль, 1 М раствор в толуоле). Через 2 ч добавляли еще порцию DIBAL-H (6 мл, 6 ммоль) и перемешивание продолжали еще в течение 2 ч. Реакционную смесь гасили добавлением насыщенного раствора сегнетовой соли (30 мл) и смесь перемешивали в течение 1 ч при комнатной температуре. Фазы разделяли, водную фазу экстрагировали EtOAc (2x50 мл) и объединенные органические слои высушивали над Na2SO4 и упаривали в вакууме. Продукт очищали хроматографией на силикагеле на системе FlashMaster с использованием элюента смеси гептан/этилацетат (элюирование линейным градиентом от 1:0 до 2:1). Объединяли фракции, содержащие продукт, и упаривали в вакууме с получением желаемого соединения (482 мг, 54%). 1 Н ЯМР (CDCl3): 1,86 (шир., 1 Н), 3,90 (С, 3 Н), 4,77 (с, 2 Н), 7,15 (с, 1 Н). Аналогично получали следующее соединение.(6-Хлор-3-метоксибензо[b]тиофен-2-ил)метанол. Выход: 75%. 1 Н ЯМР (CDCl3): 1,92 (т, J=5,9 Гц, 1 Н), 3,99 (с, 3 Н), 4,90 (д, J=5,7 Гц, 2 Н), 7,33 (дд,J=l,9, 8,5 Гц, 1 Н), 7,64 (д, J=8,5 Гц, 1 Н), 7,73 (д, J=l,9 Гц, 1 Н). Получение гетероарильных альдегидов общей формулы IIа и IIIa 4-(4-Хлорбензолсульфонил)-3-метилтиофен-2-карбальдегид. К суспензии [4-(4-хлорбензолсульфонил)-3-метилтиофен-2-ил]метанола (786 мг, 2,60 ммоль), Nоксида 4-метилморфолина (0,46 г, 3,9 ммоль) и порошкообразных молекулярных сит 4 (1,3 г, активированных непродолжительным нагреванием в вакууме) в СН 2 Сl2 (7 мл) добавляли перрутенат тетрапропиламмония (46 мг, 0,13 ммоль). Полученную смесь перемешивали в течение 1 ч, после чего ее фильтровали через слой силикагеля (примерно 25 г), элюируя EtOAc. Элюат упаривали в вакууме, и продукт очищали хроматографией на силикагеле на системе FlashMaster с использованием элюента смеси гептан/этилацетат (элюирование линейным градиентом от 1:0 до 1:1). Объединяли фракции, содержащие продукт, и упаривали в вакууме с получением указанного в заголовке соединения (644 мг, 82%). 1 Н ЯМР (CDCl3): 2,60 (с, 3 Н), 7,53 (д, J=9,0 Гц, 2 Н), 7,87 (д, J=8,5 Гц, 2 Н), 8,53 (с, 1 Н), 10,01 (с, 1 Н). Аналогично получали следующие альдегиды. 3-Хлортиофен-2-карбальдегид. Выход: 94%. 1 Н ЯМР (CDCl3): 7,07 (д, J=5,2 Гц, 1 Н), 7,72 (д, J=0,5, 4,7 Гц, 1 Н), 10,07 (д, J=0,9 Гц,1 Н). 4-Бром-3-метокситиофен-2-карбальдегид. Выход: 45%. 1 Н ЯМР (CDCl3): 4,18 (с, 3 Н), 7,60 (д, J=1,4 Гц, 1 Н), 10,08 (д, J=1,4 Гц, 1 Н). 6-Хлор-3-метоксибензо[b]тиофен-2-карбальдегид. Выход: 86%. 1 Н ЯМР (CDCl3): 4,34 (с, 3 Н), 7,36 (дд, J=1,7, 8,7 Гц, 1 Н), 7,75 (д, J=1,4 Гц, 1 Н), 7,82 (д,J=8,5 Гц, 1 Н), 10,36 (с, 1 Н). 5-Диметиламинобензо[b]тиофен-3-карбальдегид. Выход: 72%. 1 Н ЯМР (CDCl3): 3,05 (с, 6 Н), 7,00 (дд, J=2,4, 9,0 Гц, 1 Н), 7,68 (д, J=9,0 Гц, 1 Н), 7,99 (д,J=2,8 Гц, 1 Н), 8,24 (с, 1 Н), 10,11 (с, 1 Н). 5-Диметиламино-3-метилбензо[b]тиофен-2-карбальдегид. Выход: 73%. 1 Н ЯМР (CDCl3): 2,74 (с, 3 Н), 3,03 (с, 6 Н), 7,00 (д, J=2,4 Гц, 1 Н), 7,12 (дд, J=2,4, 9,0 Гц,1 Н), 7,69 (д, J=9,0 Гц, 1 Н), 10,30 (с, 1 Н). 5-Фторбензофуран-3-карбальдегид. При постоянной температуре -60 С диметилсульфоксид (3,27 г, 41,8 ммоль) в дихлорметане (10 мл) добавляли к раствору оксалилхлорида (2,65 г, 20,9 ммоль) в дихлорметане (30 мл) и раствор перемешивали в течение 15 мин. 1-(5-Фторбензофуран-3-ил)метанол (3,16 г, 19,0 ммоль), растворенный в дихлорметане (60 мл), добавляли по каплям при -60 С. Смесь перемешивали в течение 20 мин с последующим добавлением триэтиламина (9,61 г, 0,095 ммоль). После перемешивания в течение 10 мин реакционной смеси давали нагреться до комнатной температуры и перемешивали еще в течение 20 мин. Органическую фракцию последовательно промывали порциями по 50 мл водой, 1 н. водным раствором НСl, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, затем высушивали(MgSO4) и концентрировали в вакууме с получением сырого указанного в заголовке соединения с коли- 22008589 чественным выходом в виде бежевого кристаллического твердого вещества. 1 Н ЯМР (CDCl3): 7,13 (дт, 1 Н); 7,50 (дд, 1 Н); 7,86 (дд, 1 Н); 8,30 (с, 1 Н); 10,15 (с, 1 Н). 5-Фтортиофен-2-карбальдегид. К раствору тиофена (4,8 мл, 60 ммоль) в безводном Et2O (200 мл) при 0 С добавляли h-BuLi (70 мл,66 ммоль, 0,95 М раствор в гексане) по каплям и раствор перемешивали в течение 1 ч при -5 С - 0 С. Затем температуру доводили до -70 С и добавляли раствор (PhSO2)2NF (28,4 г, 90 ммоль) в безводном тетрагидрофуране (200 мл), поддерживая температуру ниже -50 С. Затем полученной смеси давали медленно нагреться до комнатной температуры в течение ночи, добавляли 2 н. раствор NaOH (300 мл), смесь фильтровали и органический слой промывали 2 н. раствором NaOH (2x300 мл) и насыщенным растворомNH4Cl (300 мл), и затем высушивали над Na2SO4. Перегонка с использованием колонны Вигро длиной 40 см удаляла большую часть Et2O, и конечная совместная перегонка с гептаном (50 мл) давала 20,7 ммоль 2-фтортиофена и 4,6 ммоль тиофена (определяли 1 Н ЯМР с использованием 200 мкл DME в качестве внутреннего стандарта) примерно в 100 мл тетрагидрофурана и гептана (т.кип.60-100 С). Данный раствор охлаждали до 0 С и добавляли по каплям н-BuLi (44 мл, 41 ммоль, 0,95 М раствор в гексане). Через 1 ч добавляли по каплям раствор ДМФА (4,8 мл, 62 ммоль) в Et2O (15 мл) и перемешивание продолжали еще в течение 1 ч при 0 С. Реакционную смесь гасили насыщенным раствором NH4Cl (200 мл) и экстрагировали Et2O (2x200 мл), и экстракт высушивали над Na2SO4. Большую часть растворителя удаляли выпариванием при атмосферном давлении (колонна Вигро длиной 40 см) и затем темный остаток выпаривали в вакууме с получением смеси 5-фтортиофен-2-карбальдегида и тиофен-2-карбальдегида в соотношении примерно 10:1 (т.кип.78-79 С, 25 мм рт. ст.) в виде золотистого масла (1,32 г, 44%). Данную смесь использовали без дополнительной очистки. 1 Н ЯМР (CDCl3): 6,65 (д, J=4,2, 1 Н), 7,50 (д, J=3,8 Гц, 1 Н),9,76 (д, J=4,2 Гц, 1 Н). Получение промежуточных соединений общей формулы VII Промежуточные соединения общей формулы VII получали общим способом, как описано ниже для получения этилового эфира 4-[(5-фторбензофуран-3-илметил)амино]-2-нитрофенилкарбаминовой кислоты, или общим способом, как описано ниже для получения N-(4-амино-2-нитрофенил)-2-(4-фторфенил)ацетамида. Этиловый эфир 4-[(5-фторбензофуран-3-илметил)амино]-2-нитрофенилкарбаминовой кислоты. В трехгорлой круглодонной колбе, снабженной аппаратом Дина-Старка, смешивали 5-фторбензофуран-3-карбальдегид (3,59 г, 21,9 ммоль) и этиловый эфир (4-амино-2-нитрофенил)карбаминовой кислоты (4,48 г, 19,9 ммоль) в о-ксилоле (80 мл) и добавляли каталитическое количество кислой ионообменной смолы (Amberlite IRC-84, 100 мг). Смесь нагревали до кипения в течение 5 ч, фильтровали теплой и концентрировали в вакууме. Данный сырой продукт растворяли в смеси диоксан:метанол (4:1) (90 мл) и добавляли боргидрид натрия (1,50 г, 39,8 ммоль) порциями в течение 30 мин. Реакционную смесь перемешивали при комнатной температуре в течение ночи, затем выливали в воду (200 мл) и экстрагировали этилацетатом (3x75 мл). Объединенные органические фракции промывали насыщенным раствором соли, высушивали (MgSO4) и упаривали с получением неочищенного твердого вещества, которое очищали хроматографией на силикагеле (элюент: смесь этилацетат:гептан 1:2). Это давало 4,50 г (61%) указанного в заголовке соединения в виде красного кристаллического вещества. 1 Н ЯМР (CDCl3): 1,33 (т, 3 Н); 4,07 (т, 1 Н); 4,23 (кв, 2 Н); 4,42 (д, 2 Н); 6,99 (дд, 1 Н); 7,05 (дт, 1 Н); 7,25 (дд, 1 Н); 7,42 (т, 1 Н); 7,44 (д, 1 Н); 7,65 (с, 1 Н); 8,31 (д, 1 Н); 9,39 (с, 1 Н). Аналогично получали следующие промежуточные соединения. Этиловый эфир 4-[(5-метилтиофен-2-илметил)амино]-2-нитрофенилкарбаминовой кислоты. Выход: 73%. ЖХ/МС (m/z) 336 (МН+); время удерживания = 3,41 мин. Этиловый эфир 4-[(3-метилтиофен-2-илметил)амино]-2-нитрофенилкарбаминовой кислоты. Выход: 89%. ЖХ/МС (m/z). Этиловый эфир 4-[(тиофен-2-илметил)амино]-2-нитрофенилкарбаминовой кислоты. Выход: 71%. ЖХ/МС (m/z) 321 (МН+); время удерживания = 3,24 мин. Этиловый эфир 4-[(тиофен-3-илметил)амино]-2-нитрофенилкарбаминовой кислоты. Выход: 69%. ЖХ/МС (m/z) 320 (МН+); время удерживания = 3,08 мин. Этиловый эфир 4-[(бензо[b]тиофен-3-илметил)амино]-2-нитрофенилкарбаминовой кислоты. Выход: 87%. Т.пл. 151-152 С. ЖХ/МС (m/z) 371,0 (МН+); время удерживания=3,59 мин.N-(4-Амино-2-нитрофенил)-2-(4-фторфенил)ацетамид. К перемешиваемой суспензии трет-бутилового эфира 4-[(2-(4-фторфенил)ацетиламино]-3-нитрофенилкарбаминовой кислоты (2,40 г, 6,16 ммоль) в метиленхлориде (5 мл) добавляли трифторуксусную кислоту (5 мл). Через 15 мин метиленхлорид выпаривали и оставшийся раствор переносили в насыщенный водный раствор NaHCO3 (200 мл) при обработке ультразвуком. Осадок отфильтровывали, промывали водой и высушивали в вакууме с получением 1,70 г указанного в заголовке соединения в виде краснокоричневого твердого вещества. Выход: 96,3%. ЖХ/МС; время удерживания=2,25 (УФ, ELSD) 89%,100%. 1 Н ЯМР (ДМСО-d6): 3,59 (с, 2 Н); 5,65 (шир., 2 Н, NH2); 6,83 (дд, 1 Н); 7,08 (д, 1 Н); 7,15 (т, 2 Н), 7,21(д, 1 Н); 7,32 (дд, 2 Н); 9,91 (с, 1 Н, NH). Аналогично получали следующее соединение.N-(4-Амино-2-нитрофенил)-3,3-диметилбутирамид. Выход: 680 мг, 93%. ЖХ/МС (m/z) 293,43 ([M+H+MeCN]+); время удерживания=2,29 (УФ, ELSD) 99,5%, 99,1%. 1 Н ЯМР (ДMCO-d6): 1,00 (с, 9 Н); 2,12 (с, 2 Н); 3,45 (шир., H2O+NH2); 6,84 (дд, 1H); 7,06 (д,1 Н); 7,14 (д, 1 Н); 9,64 (с, 1 Н, NH). Получение промежуточных соединений общей формулы VIIIN-А-[(5-Хлортиофен-2-илметил)амино]-2-нитрофенил-2-(4-фторфенил)ацетамид. Раствор N-(4-амино-2-нитрофенил)-2-(4-фторфенил)ацетамида (306 мг, 1,06 ммоль) и 5-хлор-2 тиофенкарбоксальдегид (186 мг, 1,2 экв.) в безводном этаноле (40 мл) нагревали при 70 С в течение 30 мин. Полученный раствор концентрировали до небольшого объема (примерно 3 мл) и гасили гептаном(15 мл). Коричневый кристаллический продукт отделяли фильтрованием с получением 350 мг промежуточного имина N-4-[(5-хлортиофен-2-илметилен)амино]-2-нитрофенил-2-(4-фторфенил)ацетамида. Выход: 79,2%. 1 Н ЯМР (ДМСО-d6): 3,71 (с, 2 Н); 7,17 (т, 2 Н); 7,29 (д, 1 Н); 7,36 (дд, 2 Н); 7,62 (д, 1 Н); 7,63 (дд, 1 Н); 7,71 (д, 1 Н); 8,83 (с, 1 Н); 10,44 (с, 1 Н). Твердое вещество суспендировали в метаноле (5 мл), добавляли NaBH3CN (200 мг), затем уксусную кислоту (2 мл). Полученный раствор превращался в суспензию. Через 15 мин ее обрабатывали водой (50 мл) и продукт отделяли фильтрованием с получением после высушивания в вакууме 330 мг красного твердого вещества. Выход: 93,8%. ЖХ/МС (m/z) 420 ([М+Н]+); время удерживания=3,34 (УФ, ELSD) 97%, 100%. 1 Н ЯМР (ДMCO-d6): 3,60 (с, 2 Н); 4,45 (д, 2 Н) ; 6,87 (т, 1 Н, NH); 6,93 (дд, 1 Н); 6,94 (д, 1 Н); 6,97 (д, 1 Н); 7,11(д, 1 Н); 7,14 (т, 2 Н); 7,28 (д, 1 Н); 7,32 (дд, 2 Н); 9,98 (с, 1 Н). Аналогично получали из соответствующего анилина следующее соединение.N-4-[(5-Хлортиофен-2-илметил)амино]-2-нитрофенил-3,3-диметилбутирамид. Неочищенный промежуточный имин выделяли выпариванием и восстановлением, как описано выше. Затем реакционную смесь упаривали до небольшого объема, обрабатывали насыщенным водным раствором NaHCO3 и этилацетатом, и органический слой упаривали. Остаток растворяли в горячем диизопропиловом эфире, осаждали гептаном и фильтровали. Выход: 880 мг, 87,6%. ЖХ/МС (m/z) 382,48([М+Н]+); время удерживания=3,46 (УФ, ELSD) 88%, 91%. 1 Н ЯМР (ДМСО-d6): 0,99 (с, 9 Н); 2,12 (с, 2 Н); 4,45 (д, 2 Н); 6,84 (т, 1 Н, NH); 6,92 (дд, 1 Н); 6,94 (д, 1 Н); 6,97 (д, 1 Н); 7,07 (д, 1 Н); 7,19 (д, 1 Н); 9,69 (с,1 Н). Получение промежуточных соединений общей формулы XII трет-Бутиловый эфир [4-[2-(4-фторфенил)ацетиламино]-3-нитрофенилкарбаминовой кислоты. К суспензии трет-бутилового эфира (4-амино-3-нитрофенил)карбаминовой кислоты (1,992 г, 7,87 ммоль) и NaHCO3 (5,4 г) в ацетонитриле (20 мл) добавляли (4-фторфенил)ацетилхлорид (1,8 мл, 1,3 экв.). Полученную суспензию обрабатывали ультразвуком в течение 5 мин и перемешивали при комнатной температуре в течение 16 ч. Ее выливали в воду (200 мл), обрабатывали ультразвуком в течение 5 мин,фильтровали и промывали водой и гептаном. Полученный остаток растворяли в горячем этилацетате (30 мл), добавляли насыщенный водный раствор NaHCO3 (50 мл) и полученную соль гасили гептаном (200 мл). Полученную суспензию обрабатывали ультразвуком в течение 5 мин и фильтровали. Остаток промывали водой и гептаном и высушивали в вакууме с получением 2,48 г коричнево-желтого твердого вещества. Выход: 80,9%. ЖХ/МС (m/z) 412,54 ([M+Na]+), 453,58 ([M+MeCN+Na]+); время удерживания=3,33(УФ, ELSD) 97%, 100%. 1 Н ЯМР (ДМСО-d6): 1,48 (с, 9 Н); 3,66 (с, 2 Н) 7,16 (т, 2 Н), 7,34 (дд, 2 Н); 7,54 (д,1 Н); 7,64 (дд, 1 Н); 8,16 (д, 1 Н); 9,79 (с, 1 Н, NH), 10,29 (с, 1 Н, NH). Аналогично с использованием соответствующего хлорангидрида кислоты получали следующее соединение. Трет-бутиловый эфир [4-[3,3-диметилбутириламино)-3-нитрофенил]карбаминовой кислоты. Реакционную смесь перемешивали при 45 С в течение 30 мин с избытком трет-бутилацетилхлорида(3 экв.). Сырой продукт выделяли после обработки смесью этилацетат-насыщенный водный раствор NaHCO3 и очищали флэш-хроматографией на SiO2 (50 г) с использованием смеси 10-15% этилацетат-гептан в качестве элюента. Выход: 2,20 мг (78,6%), желтое твердое вещество. ЖХ/МС (m/z) 415,58 ([M+MeCN+Na]+); время удерживания=3,31 (УФ, ELSD) 99,5%, 99,9%. 1 Н ЯМР (ДMCO-d6) : 1,01 (с, 9 Н); 1,49 (с, 9 Н); 2,17 (с, 2 Н); 7,43 (д, 2 Н); 7,63 (дд, 1 Н); 8,11 (д, 1 Н); 9,77 (с, 1 Н, NH); 10,01 (с, 1 Н, NH). Соединения в соответствии с изобретением Аддитивные соли кислоты соединений в соответствии с изобретением можно легко получить способами, известными специалистам в данной области. Пример 1. 1 а. Этиловый эфир 2-амино-4-[(5-фторбензофуран-3-илметил)амино]фенилкарбаминовой кислоты. Этиловый эфир 4-[(5-фторбензофуран-3-илметил)амино]-2-нитрофенилкарбаминовой кислоты(4,50 г, 12,1 ммоль) растворяли в абсолютном этаноле (140 мл), к этому добавляли 6 н. водный раствор НСl (38 мл) и порошкообразное железо (5,70 г, 0,10 моль). Красную смесь нагревали при 60 С до исчез- 24008589 новения интенсивной окраски (20 мин). Твердые частицы отфильтровывали, и этанол удаляли из фильтрата выпариванием в вакууме. К остатку добавляли водный аммиак (насыщенный раствор), который затем экстрагировали этилацетатом (3x100 мл). Объединенные органические фракции промывали насыщенным раствором соли, высушивали (MgSO4) и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле (элюент: смесь этилацетат:гептан 1:1) с получением 2,70 г (66%) указанного в заголовке соединения в виде твердого вещества. Т.пл. 150-151 С. Вычислено для C18H18FN3O3: С 62,96; Н 5,28; N 12,24. Найдено: С 63,00; Н 5,38; N 12,13. ЖХ/МС (m/z) 344 (МН+) ; время удерживания=2,00 мин. 1 Н ЯМР (ДMCO-d6): 1,19 (т, 3 Н); 4,03 (кв,2 Н); 4,26 (д, 2 Н); 4,55 (с, 2 Н; NH2); 5,79 (т, 1 Н); 5,91 (дд, 1 Н); 6,02 (д, 1 Н, NH); 6,72 (д, 1 Н); 7,13 (дт, 1 Н); 7,56 (м, 2 Н); 7,95 (с, 1 Н); 8,16 (шир., 1 Н, NH). Аналогично получали следующие соединения и выделяли в виде их аддитивных солей кислоты,гидрохлоридов. 1b. Дигидрохлорид этилового эфира 2-амино-4-[(5-метилтиофен-2-илметил)амино]фенилкарбаминовой кислоты. Осаждение сырого продукта из этилацетата добавлением раствора соляной кислоты в диэтиловом эфире давало указанное в заголовке соединение. Т.пл. 190 С (с разложением). Вычислено для C15H19N3O2S2HCl: С 47,00; Н 5,67; N 10,97. Найдено: С 46,84; Н 5,86; N 11,10. ЖХ/МС (m/z) 306 (МН+); время удерживания = 1,77 мин. 1 Н ЯМР (ДМСО-d6): 1,22 (т, 3 Н); 2,37 (с, 3 Н); 4,08 (кв, 2 Н); 4,37 (с, 2 Н); 6,64 (м, 1 Н); 6,67 (дд, 1 Н); 6,72 (д, 1 Н); 6,86 (д, 1 Н); 7,13 (д, 1 Н); 8,93 (шир., 1 Н, NH). 1 с. Дигидрохлорид этилового эфира 2-амино-4-[(3-метилтиофен-2-илметил)амино]фенилкарбаминовой кислоты. Осаждение сырого продукта из этилацетата добавлением раствора соляной кислоты в диэтиловом эфире давало указанное в заголовке соединение. ЖХ/МС (m/z) 306 (МН+); время удерживания = 1,68 мин. 1 Н ЯМР (CDCl3) (свободного основание): 1,25 (т, 3 Н); 2,23 (с, 3 Н); 3,78 (шир., 3 Н); 4,13 (кв, 2 Н); 4,32 (с, 2 Н); 6,05-6,10 (м, 2H+NH); 6,82 (д, 1 Н); 6,93 (д, 1 Н); 7,11 (д, 1 Н). 1d. Дигидрохлорид этилового эфира 2-амино-4-[(тиофен-2-илметил)амино]фенил карбаминовой кислоты. Осаждение сырого продукта из этанола добавлением раствора соляной кислоты в диэтиловом эфире давало указанное в заголовке соединение. Т.пл. 195 С. Вычислено для C14H17N3O2S2HCl: С 46,16; Н 5,26; N 11,54. Найдено: С 46,34; Н 5,43; N 11,28. ЖХ/МС (m/z) 292 (МН+); время удерживания = 1,58 мин. 1 Н ЯМР (ДMCO-d6): 1,22 (т, 3 Н); 4,08 (кв,2 Н); 4,48 (с, 2 Н); 6,71 (дд, 1 Н); 6,79 (д, 1 Н); 6,97 (дд, 1 Н); 7,10 (д, 1 Н); 7,16 (д, 1 Н); 7,40 (д, 1 Н); 8,97(шир., 1 Н, NH). 1 е. Дигидрохлорид этилового эфира 2-амино-4-[(тиофен-3-илметил)амино]фенил карбаминовой кислоты. Осаждение сырого продукта из этилацетата добавлением раствора соляной кислоты в диэтиловом эфире давало указанное в заголовке соединение. Т.пл. 196-197 С. Вычислено для C14H17N3O2S2HCl: С 46,16; Н 5,26; N 11,54. Найдено: С 46,23; Н 5,47; N 11,30. ЖХ/МС (m/z) 292 (МН+); время удерживания=1,54 мин. 1 Н ЯМР (ДMCO-d6): 1,21 (т, 3 Н); 4,08 (кв, 2 Н); 4,29 (с, 2 Н); 6,66 (дд, 1 Н); 6,73 (д, 1 Н); 7,14 (дд, 1 Н); 7,16 (д, 1 Н); 7,45 (м, 1 Н); 7,51 (дд, 1 Н); 8,86 (шир., 1 Н, NH). 1f. Дигидрохлорид этилового эфира 2-амино-4-[(бензо[b]тиофен-3-илметил)амино]фенилкарбаминовой кислоты. Осаждение сырого продукта из этилацетата добавлением раствора соляной кислоты в диэтиловом эфире давало указанное в заголовке соединение. Т.пл. 213-214 С. Вычислено для C18H21N3Cl2O2S: С 51,68; Н 4,95; N 10,05. Найдено: С 51,88; Н 5,35;(10 мл) кипятили с обратным холодильником в течение 20 ч в атмосфере N2. После охлаждения образовавшийся имин оранжево-красного цвета отделяли фильтрованием и высушивали в вакууме с получением неочищенного продукта (312 мг, 61%), который суспендировали в смеси метанол:уксусная кислота 10:1 (10 мл). Добавляли NaBH3CN (0,19 г, 3,0 ммоль) и смесь перемешивали в течение 1 ч при комнатной температуре. Затем добавляли еще порцию NaBH3CN (0,19 г, 3,0 ммоль) и еще через 1 ч добавляли на- 25008589 сыщенный водный раствор бикарбоната натрия (20 мл). Образовавшийся амин, твердое вещество красного цвета, отделяли фильтрованием и высушивали в вакууме с получением неочищенного продукта(293 мг, 94%), который суспендировали в абсолютном этаноле (10 мл). К этому добавляли 6 н. НСl (1,1 мл, 6,6 ммоль) и порошкообразное железо (193 мг, 3,46 ммоль) и смесь красного цвета нагревали до 60 С, пока красная окраска не переходила в желтую, примерно в течение 10-20 мин. Смесь выливали в насыщенный водный раствор бикарбоната натрия (50 мл) и EtOAc (50 мл), полученную смесь фильтровали, фазы разделяли и затем водную фазу экстрагировали EtOAc (2x50 мл). Объединенные органические фазы высушивали (Na2SO4) и растворитель выпаривали в вакууме. Продукт выделяли хроматографией на силикагеле на системе FlashMaster с использованием в качестве элюента смеси гептан/этилацетат (элюирование линейным градиентом, как правило, от 8:2 до 1:1). Объединяли фракции,содержащие продукт, и упаривали в вакууме с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (213 мг, 78%). ЖХ/МС (m/z)=480,l (M+H+); вычислено для C21H23ClN3O4S2:480,0813; время удерживания = 2,35 мин; чистота по УФ=72,4%, чистота по ELS=86,5%. 1 Н ЯМР (ДMCO-d6): 1,19 (шир., 3 Н), 2,16 (с, 3 Н),4,02 (кв, J=6,9 Гц, 2 Н), 4,23 (д, J=6,l Гц, 2 Н) , 4,57 (с, 2 Н), 5,81 (дд, J=2,4, 8,5 Гц, 1 Н), 5,91-5,95 (м, 2 Н),6,72 (шир.д, J=6,6 Гц, 1 Н), 7,72 (д, J=8,5 Гц, 2 Н), 7,90 (д, J=8,5 Гц, 2 Н), 8,15 (шир., 1 Н), 8,31 (с, 1 Н). Аналогично получали следующие соединения. 2b. Этиловый эфир 2-амино-4-[(3-хлортиофен-2-илметил)амино]фенилкарбаминовой кислоты. Выход: 76%. ЖХ/МС (m/z)=326,0 (M+H+), вычислено для C14H17ClN3O2S: 326,0725; время удерживания=1,95 мин., чистота по УФ=85,8%; чистота по ELS=98,1%. 1 Н ЯМР (ДМСО-d6): 1,19 (шир., 3 Н),4,03 (кв, J=7,1 Гц, 2 Н), 4,30 (д, J=6,1 Гц, 2 Н), 4,57 (с, 2 Н), 5,83 (дд, J=2,4, 8,5 Гц, 1 Н), 5,93-5,97 (м, 2 Н),6,73 (шир.д, J=7,1 Гц, 1 Н), 6,99 (д, J=5,2 Гц, 1 Н), 7,48 (д, J=5,2 Гц, 1 Н), 8,16 (шир., 1 Н). 2 с. Этиловый эфир 2-амино-4-[(4-бром-3-метокситиофен-2-илметил)амино]фенилкарбаминовой кислоты. Выход: 66%. ЖХ/МС (m/z)=402,0 (M+H+), вычислено для C15H19BrN3O3S: 400,0325 (100%), 402,0310(шир., 1 Н). Пример 3. 3 а. Этиловый эфир 2-амино-4-[(5-метилтиофен-2-илметил)(метил)амино]фенилкарбаминовой кислоты. Смесь 5-метил-2-тиофенкарбоксальдегида (108 мкл, 1,00 ммоль), этилового эфира (4-амино-2 нитрофенил) карбаминовой кислоты (225 мг, 1,00 ммоль) и Amberlite IRC-84 (10 мг) в о-ксилоле (4 мл) кипятили с обратным холодильником в атмосфере Аr в течение 5 ч. Летучие вещества удаляли выпариванием в вакууме и остаток растворяли в ацетонитриле (5 мл). К полученному раствору добавлялиNaBH3CN (0,25 г, 4,0 ммоль), затем НОАс (5 капель). После перемешивания в течение 5 мин раствор становился темно-красным. Добавляли формальдегид (37% раствор в воде, 0,89 мл, 12 ммоль) и перемешивание продолжали в течение 30 мин при переодическом добавлении НОАс. Реакционную смесь упаривали досуха в вакууме, и остаток распределяли между насыщенным водным раствором бикарбоната натрия(50 мл) и EtOAc (50 мл). Водную фазу экстрагировали EtOAc (50 мл), и объединенные органические слои высушивали (Na2SO4), и растворители выпаривали в вакууме. Затем остаток растворяли в этаноле (10- 26008589 мл). Добавляли 6 н. водный раствор НСl (2,0 мл, 12 ммоль) и порошкообразное железо (0,34 г, 6,0 ммоль) и смесь красного цвета нагревали при 60 С, пока красная окраска не переходила в желтую, примерно в течение 15 мин. Смесь выливали в насыщенный водный раствор бикарбоната натрия (50 мл) и EtOAc (50 мл), полученную смесь фильтровали, разделяли фазы и затем водную фазу экстрагировали EtOAc (2x50 мл). Объединенные органические слои высушивали (Na2SO4) и растворители выпаривали в вакууме. Продукт очищали хроматографией на силикагеле на системе FlashMaster с использованием в качестве элюента смеси гептан/этилацетат (элюирование линейным градиентом, как правило, от 8:2 до 1:1). Объединяли фракции, содержащие продукт, и упаривали в вакууме с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (145 мг, 45% в целом). ЖХ/МС (m/z)=319,9 (M+H+),вычислено для C16H22N3O2S: 320,1427; время удерживания=1,80 мин, чистота по УФ=98,4%; чистота поELS=97,2%. 1 Н ЯМР (CDCl3): 1,29 (т, J=7,1, 3 Н), 2,41 (с, 3 Н), 2,91 (с, 3 Н), 3,76 (шир., 2 Н), 4,19 (кв, J=7,1 Гц, 2 Н), 4,52 (с, 2 Н), 6,02 (шир., 1 Н), 6,17 (д, J=2,8 Гц, 1 Н), 6,25 (дд, J=2,8, 8,5 Гц, 1 Н), 6,53-6,58 (м, 1 Н),6,66 (д, J=3,3 Гц, 1 Н), 6,98 (д, J=8,5 Гц, 1 Н). Аналогично получали следующее соединение. 3b. Этиловый эфир 2-амино-4-[(5-хлортиофен-2-илметил)(метил)амино]фенилкарбаминовой кислоты. Выход: 34%. ЖХ/МС (m/z)=340,0 (M+H+), вычислено для C15H19ClN3O2S: 340,0881; время удерживания = 2,14 мин, чистота по УФ=82,3%; чистота по ELS=90,2%. 1 Н ЯМР (CDCl3): 1,29 (т, J=6,8, 3 Н), 2,91(дд, J=2,4, 8,5 Гц, 1 Н), 6,73 (д, J=3,8 Гц, 1 Н), 6,99 (д, J=8,5 Гц, 1 Н). Аналогично получали следующее соединение, за исключением того, что вместо формальдегида использовали ацетальдегид: 3 с. Этиловый эфир 2-амино-4-[(5-хлортиофен-2-илметил)(этил)амино]фенилкарбаминовой кислоты. Выход: 12%. ЖХ/МС (m/z)=353,9 (M+H+), вычислено для C16H21ClN3O2S: 354,1038; время удерживания=2,02 мин., чистота по УФ=97,5%; чистота по ELS=99,0%. 1 Н ЯМР (CDCl3): 1,16 (т, J=7,1, 3 Н), 1,29(т, J=6,8, 3 Н), 3,36 (кв, J=7,1 Гц, 2 Н), 3,76 (шир., 2 Н), 4,19 (кв, J=7,2 Гц, 2 Н), 4,47 (с, 2 Н), 6,05 (шир., 1 Н),6,13 (д, J=2,4 Гц, 1 Н), 6,19 (дд, J=2,4, 9,0 Гц, 1 Н), 6,73 (д, J=3,8 Гц, 1 Н), 6,96 (д, J=8,0 Гц, 1 Н). Аналогично получали следующее соединение, за исключением того, что не добавляли формальдегид. 3d. Этиловый эфир 2-амино-4-[(5-фтортиофен-2-илметил)амино]фенилкарбаминовой кислоты. Выход: 65% (25% после проведения очистки препаративной ЖХ/МС для удаления нефторированных побочных продуктов). ЖХ/МС (m/z)=310,2 (M+H+), вычислено для C14H17FN3O2S: 310,1020; время удерживания=1,76 мин, чистота по УФ=96,6%; чистота по ELS=83,4%. 1 Н ЯМР (CDCl3): 1,29 (шир., 3 Н),3,82 (шир., 2 Н), 4,19 (кв, J=7,2 Гц, 2 Н), 4,31 (д, J=2,0 Гц, 2 Н), 6,05 (шир., 1 Н), 6,09 (д, J=8,0 Гц, 1 Н), 6,29(дд, J=1,5, 3,8 Гц, 1 Н), 6,58 (т, J=3,5 Гц, 1 Н), 6,94 (д, J=8,0 Гц, 1 Н). Пример 4. 4 а. Этиловый эфир 2-амино-4-[(5-хлортиофен-2-илметил)амино]фенилкарбаминовой кислоты. Раствор 5-хлортиофен-2-карбальдегида (240 мкл, 111 мкмоль, 463 мМ в 1,2-дихлорэтане) добавляли к раствору этилового эфира 4-амино-2-нитрофенилкарбаминовой кислоты (240 мкл, 111 мкмоль, 463 мМ в 1,2-дихлорэтане). Добавляли триацетоксиборгидрид натрия (118 мг, 555 мкмоль) и полученную смесь перемешивали в течение 3,5 ч при 40 С. Смеси давали охладиться до комнатной температуры и добавляли воду (100 мкл). Смесь фильтровали через силикагель (500 мг) и колонку промывали 1,2-дихлорэтаном(3 мл). Объединенные органические фазы упаривали досуха в вакууме. Полученное твердое вещество растворяли в этаноле (3 мл). К одной трети полученного раствора (1 мл) добавляли железо (19 мг) с последующим добавлением водного раствора соляной кислоты (96 мкл, 6 М раствор). Полученную смесь помещали в ультразвуковую баню на 10 мин. Затем добавляли насыщенный водный раствор бикарбоната натрия (2 мл). Смесь экстрагировали этилацетатом (3 мл). Органическую фазу промывали водой (3 мл) и насыщенным раствором соли (3 мл), высушивали над сульфатом магния, фильтровали и упаривали досуха в вакууме. Полученный продукт растворяли в 190 мкл диметилсульфоксида и подвергали очистке препаративной ЖХ-МС. Полученный раствор упаривали досуха в вакууме. Выход (6,8 мг, 56%). ЖХ/МС(m/z) ([M+H]+) 326,1; время удерживаниям, 90 (УФ, ELSD) 92%, 99%. Аналогичным способом получали следующие соединения. 4b. Этиловый эфир 2-амино-4-[(5-(бромтиофен-2-илметил)амино]фенилкарбаминовой кислоты. ЖХ/МС (m/z) (M+H+) 371,9; время удерживания=1,94 (УФ, ELSD) 89%, 98%. 4 с. Этиловый эфир 2-амино-4-[(4-(бромтиофен-2-илметил)амино]фенилкарбаминовой кислоты. ЖХ/МС (m/z) (М+Н+) 372,0; время удерживания=1,96 (УФ, ELSD) 76%, 100%. 4d. Этиловый эфир 2-амино-4-[(5-этилтиофен-2-илметил)амино]фенилкарбаминовой кислоты. ЖХ/МС (m/z) (M+H+) 320,1; время удерживания=1,90 (УФ, ELSD) 72%, 96%. 4 е. Этиловый эфир 2-амино-4-[(бензо[b]тиофен-2-илметил)амино]фенилкарбаминовой кислоты. ЖХ/МС (m/z) (М+Н+) 342,1; время удерживания=2,06 (УФ, ELSD) 75%, 100%. 4f. Этиловый эфир 2-амино-4-[(5-фенилтиофен-2-илметил)амино]фенилкарбаминовой кислоты.- 27008589 ЖХ/МС (m/z) (М+Н+) 368,2; время удерживания=2,21 (УФ, ELSD) 90%, 99%. Пример 5. 5 а. Пропиловый эфир 2-амино-4-[(бензо[b]тиофен-2-илметил)амино]фенилкарбаминовой кислоты. Бензо[b]тиофен-2-карбальдегид (1,36 г, 8,38 ммоль) добавляли к раствору пропилового эфира (4 амино-2-нитрофенил)карбаминовой кислоты (2,00 г, 8,36 ммоль) в ацетонитриле (10 мл). Смесь нагревали до 160 С в течение 2 мин в герметично закрытом реакторе для обработки в микроволновой печи. После охлаждения добавляли NaBH3CN (1,06 г, 16,7 ммоль) и АсОН (48 мкл, 0,84 ммоль) и смесь перемешивали в течение 30 мин при 25 С. Добавляли смесь вода/насыщенный раствор соли (1:1, 100 мл) и смесь экстрагировали этилацетатом (3x100 мл). Органическую фазу высушивали над сульфатом магния,фильтровали и концентрировали в вакууме. Неочищенное промежуточное соединение очищали флэшхроматографией на силикагеле (элюент: смесь этилацетат:гептан 1:9) и упаривали досуха. Затем промежуточное соединение растворяли в тетрагидрофуране (20 мл) и добавляли Na2S2O4 (3,67 г, 21 ммоль),растворенный в воде (50 мл). Полученную смесь перемешивали при 40 С в течение 5 ч в атмосфере аргона. Полученную смесь экстрагировали этилацетатом (3x100 мл), объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали в вакууме. Очистка флэшхроматографией (элюент: смесь этилацетат:гептан 1:1) давала 0,3 г (10%) указанного в заголовке соединения в виде твердого вещества. ЖХ/МС (m/z) 356 ([М+Н]+); время удерживания=2,45 мин. 1 Н ЯМР(CDCl3): 0,95 (т, 3 Н); 1,67 (м, 2 Н); 4,08 (т, 2 Н); 4,55 (с, 2 Н); 6,08 (д, 1 Н); 6,13 (дд, 1 Н); 6,93 (д, 1 Н); 7,20 (с,1 Н); 7,27 (дт, 1 Н); 7,32 (дт, 1 Н); 7,68 (д, 1 Н); 7,77 (д, 1 Н). Аналогичным образом получали следующее соединение: 5b. Пропиловый эфир 2-амино-4-[(бензо[b]тиофен-3-илметил)амино]фенилкарбаминовой кислоты. Выход: 16%. ЖХ/МС (m/z) 356 ([М+Н]+); время удерживания=2,24 мин. 1 Н ЯМР (CDCl3): 0,96 (т,3 Н); 1,68 (м, 2 Н); 4,10 (т, 2 Н); 4,51 (с, 2 Н); 6,12 (д, 1 Н); 6,14 (дд, 1 Н); 6,95 (д, 1 Н); 7,36 (с, 1 Н); 7,39 (дт,1 Н); 7,40 (дт, 1 Н); 7,79 (дд, 1 Н); 7,87 (дд, 1 Н). Пример 6. 6 а. N-2-Амино-4-[(5-хлортиофен-2-илметил)амино]фенил-2-(4-фторфенил)ацетамид. К перемешиваемому раствору N-4-[(5-хлортиофен-2-илметил)амино]-2-нитрофенил-2-(4-фторфенил)ацетамида (320 мг, 0,762 ммоль) в тетрагидрофуране (25 мл) и уксусной кислоты (8 мл) красного цвета периодически добавляли порошкообразный цинк (размер частиц 10 мкм, 10 г) порциями в течение 30 мин. Через 5 мин раствор становился бесцветным. Полученную бесцветную суспензию фильтровали через слой SiO2 (10 г) с использованием этилацетата в качестве элюента, и полученный раствор упаривали в вакууме. Полученное твердое вещество растворяли в смеси этилацетат/ацетон/трифторуксусная кислота (3 мл/3 мл/20 мл), обрабатывали насыщенным водным раствором NaHCO3 (50 мл) и гептаном (30 мл), и продукт отделяли фильтрованием с получением 280 мг бледно-серого твердого вещества. Выход: 94,2%. ЖХ/МС (m/z) 390,4 ([М+Н]+); время удерживания = 2,26 (УФ, ELSD) 99%, 100%. 1 Н ЯМР (ДMCO-d6): 3,56 (с, 2 Н); 4,28 (д, 2 Н); 4,57 (с, 2 Н, NH2); 5,87 (дд, 1 Н); 5,98 (м, 2 Н, NH и аром. Н); 6,74 (д, 1 Н); 6,86 (д, 1 Н); 6,93 (д, 1 Н); 7,13 (т, 2 Н); 7,35 (дд, 2 Н); 9,10 (s, 1 Н). Аналогично получали следующее соединение из соответствующего нитросоединения. 6b. N-2-амино-4-[(5-хлортиофен-2-илметил)амино]фенил-3,3-диметилбутирамид. После фильтрования через SiO2 и упаривания продукт осаждали из бифазного раствора в смеси этилацетат/насыщенный водный NaHCO3 (5 мл/20 мл) с гептаном (50 мл). Выход: 580 мг, 71,5%. ЖХ/МС(m/z) 352,48 ([М+Н]+); время удерживания = 2,16 (УФ, ELSD) 96%, 99%. 1 Н ЯМР (ДMCO-d6): 1,01 (с,9 Н), 2,11 (с, 2 Н); 4,29 (д, 2 Н); 4,54 (с, 2 Н, NH2); 5,88 (дд, 1 Н); 5,97 (т, 1 Н, NH); 5,99 (д, 1 Н); 6,72 (д, 1 Н); 6,87 (д, 1 Н); 6,93 (д, 1 Н); 8,82 (с, 1 Н). Тестирование in vitro и in vivo Соединения по изобретению тестировали и было показано их действие на одной или более моделей,представленных ниже. Относительный поток через канал KCNQ2 Клетки, стабильно экспрессирующие вольтаж-регулируемые каналы KCNQ2, высевали за день до постановки опыта и метили [86Rb+]. В день постановки опыта клетки отмывали HBSS-содержащим буфером. Клетки предварительно инкубировали с препаратом и включение [86Rb+] стимулировали субмаксимальной концентрацией КСl, равной 15 мМ, при сохраняющемся присутствии препарата. После соответствующего инкубационного периода супернатант удаляли и определяли радиоактивность ССРМ на сцинтилляционном счетчике (Tricarb). Клетки лизировали 2 мМ NaOH и определяли количество 86Rb+. Рассчитывали относительный поток СРМсупернатант/СРМсупернатант+СРМклетки)Cmpd/(СРМсупернатант/СРМсупернатант+СРМклетки)15mМ KCl)100-100. Значение ЕС 50 соединений по изобретению составляет менее 20000 нМ, в большинстве случаев менее 2000 нМ и во многих случаях менее 200 нМ. Следовательно, соединения по изобретению рассматриваются в качестве пригодных для лечения заболеваний, связанных с калиевыми каналами семейства- 28008589 Максимальный электрошок Тест проводили на группах мышей-самцов с использованием корнеальных электродов и воздействием прямоугольных электрических импульсов силой 26 мА в течение 0,4 с для индукции судорог, проявляющихся в тонических вытягиваниях задних конечностей (Wlaz et al. Epilepsy Research 1998, 30, 219229). Индуцированные пилокарпином судорожные припадки Индуцированные пилокарпином судорожные припадки вызывали внутрибрюшинным введением пилокарпина в дозе 250 мг/кг группам мышей-самцов, и наблюдали за развитием припадков, проявляющихся в утрате способности к принятию положения, в течение 30 мин (Starr et al. Pharmacology Biochemistry and Behavior 1993, 45, 321-325). Тест по установлению порога для индуцированных электричеством судорог Использовали метод "вверх-вниз" в модификации (Kimball et al. Radiation Research 1957, 1-12) для определения среднего порога индукции тонического вытяжения задних конечностей в ответ на корнеальный электрошок у мышей-самцов. Первая мышь из каждой группы получала электрошок силой 14 мА(0,4 сек, 50 Гц), и затем проводили наблюдение за развитием судорожного припадка. Если судороги наблюдали, то для следующей мыши ток уменьшали на 1 мА, если судороги не наблюдали, то ток увеличивали на 1 мА. Данную процедуру повторяли для всех 15 мышей в опытной группе. Тест по установлению порога для индуцированных химическими веществами судорог Определяли пороговую дозу пентилентетразола, необходимую для индукции клонических судорог при инфузии пентилентетразола с определенной скоростью (5 мг/мл со скоростью 0,5 мл/мин) в боковую хвостовую вену мышей-самцов (Nutt et al. J. Pharmacy and Pharmacology 1986, 38, 697-698). Киндлинг, вызванный электрической стимуляцией миндалины Крыс подвергали оперативному вмешательству с целью имплантации триполярных электродов в дорсолатеральную миндалину. После операции животным давали восстановиться перед введением крысам тестируемого соединения в различных дозах или носителя соединений. Животных стимулировали первоначальным порогом +25 мкА разряда ежедневно в течение 3-5 недель и в каждом случае регистрировали тяжесть судорожных припадков, продолжительность судорожных припадков и продолжительность разряда после действия (Racine. Electroencephalography and Clinical Neurophysiology 1972, 32, 281294). Побочные эффекты Побочные эффекты со стороны центральной нервной системы оценивали при определении времени нахождения мышей на вращающемся стержне (Capacio et al. Drug and Chemical Toxicology 1992, 15, 177201) или при определении их двигательной активности по числу пересеченных инфракрасных пучков в опытной клетке (Watson et al. Neuropharmacology 1997, 36, 1369-1375). Гипотермическое действие соединения на внутреннюю температуру тела у животных определяли ректальным зондом или имплантированным радиотелеметрическим датчиком, способными измерять температуру (Keeney et al. Physiologyand Behaviour 2001, 74, 177-184). Фармакокинетика Фармакокинетические параметры соединения определяли при в/в или пероральном введении крысам Spraque Dawley и отборе проб крови в течение 20 ч. Концентрацию соединений в плазме крови определяли ЖХ/МС/МС. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное 1,2,4-триаминобензола формулы IR1 выбран из группы, состоящей из водорода и C1-6 алк(ен/ин)ила;R2 и R2' независимо выбраны из группы, состоящей из водорода;Y представляет гетероарил формул II и IIIn равно 0, 1, 2, 3 или 4; р равно 0 или 1; и каждый R5 независимо выбран из группы, состоящей из C1-6 алк(ен/ин)ила, арила, галогена, C17 7' 8 6 алк(ен/ин)илокси, -NR R и -SO2R ; где 7 7'R и R независимо выбраны из группы, состоящей из C1-6 алк(ен/ин)ила; иR8 выбран из группы, состоящей из арила; или его фармацевтически приемлемые соли. 2. Соединение по п.1, в котором q равно 0. 3. Соединение по п.1, в котором q равно 1 и Z представляет собой кислород. 4. Соединение по одному из пп.1-3, в котором R3 представляет собой C1-6 алк(ен/ин)ил. 5. Соединение по одному из пп.1-3, в котором R3 представляет собой арил-С 1-6 алк (ен/ин)ил. 6. Соединение по одному из пп.1-5, в котором W представляет собой кислород. 7. Соединение по одному из пп.1-5, в котором W представляет собой серу. 8. Соединение по одному из пп.1-7, в котором Y имеет формулу II. 9. Соединение по одному из пп.1-7, в котором Y имеет формулу III. 10. Соединение по одному из пп.1-9, в котором Y имеет формулы IIb или IIIb в которых W, m, n, p и R5 имеют значения, определенные выше. 11. Соединение по одному из пп.1-9, в котором Y имеет формулы IIс или IIIс в которых W, m, n, р и R5 имеют значения, определенные выше. 12. Соединение по одному из пп.1-11, где указанное соединение выбрано из группы, состоящей из этилового эфира 2-амино-4-[(5-хлортиофен-2-илметил)метиламино]фенилкарбаминовой кислоты; этилового эфира 2-амино-4-[(5-хлортиофен-2-илметил)амино]фенилкарбаминовой кислоты; этилового эфира 2-амино-4-[(5-метилтиофен-2-илметил)метиламино]фенилкарбаминовой кислоты; этилового эфира 2-амино-4-[(5-бромтиофен-2-илметил)амино]фенилкарбаминовой кислоты; этилового эфира 2-амино-4-[(6-хлор-3-метоксибензо[b]тиофен-2-илметил)амино]фенилкарбаминовой кислоты; этилового эфира 2-амино-4-[(бензо[b]тиофен-2-илметил)амино]фенилкарбаминовой кислоты; этилового эфира 2-амино-4-[(5-метилтиофен-2-илметил)амино]фенилкарбаминовой кислоты; этилового эфира 2-амино-4-[(4-бром-3-метокситиофен-2-илметил)амино]фенилкарбаминовой кислоты; этилового эфира 2-амино-4-[(5-фенилтиофен-2-илметил)амино]фенилкарбаминовой кислоты; этилового эфира 2-амино-4-[(3-хлортиофен-2-илметил)амино]фенилкарбаминовой кислоты; этилового эфира (2-амино-4-[4-(4-хлорбензолсульфонил)-3-метилтиофен-2-илметил]аминофенил) карбаминовой кислоты; этилового эфира 2-амино-4-[(3-метилтиофен-2-илметил)амино]фенилкарбаминовой кислоты; этилового эфира 2-амино-4-[(5-фторбензофуран-3-илметил)амино]фенилlкарбаминовой кислоты; этилового эфира 2-амино-4-[(тиофен-2-илметил)амино]фенилкарбаминовой кислоты; этилового эфира 2-амино-4-[(4-бромтиофен-2-илметил)амино]фенилкарбаминовой кислоты;
МПК / Метки
МПК: C07D 307/82, A61K 31/381, A61P 25/00, A61K 31/343, C07D 333/32, C07D 333/64, C07D 333/28, C07D 333/20
Метки: 1,2,4, триаминобензола, нервной, расстройств, пригодные, системы, центральной, производные, лечения
Код ссылки
<a href="https://eas.patents.su/30-8589-proizvodnye-124-triaminobenzola-prigodnye-dlya-lecheniya-rasstrojjstv-centralnojj-nervnojj-sistemy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1,2,4 – триаминобензола, пригодные для лечения расстройств центральной нервной системы</a>
Предыдущий патент: Способ каталитической полимеризации олефинов и реакторная система
Следующий патент: Композиции и способы эластичного цементирования высокотемпературных скважин
Случайный патент: Поручень












