Замещенные производные аминоизоксазолина и их применение в качестве антидепрессантов
Номер патента: 8189
Опубликовано: 27.04.2007
Авторы: Баккер Маргарета Хенрика Мариа, Де Лукас Оливарес Ана Изабель, Андрес-Хиль Хосе Игнасио, Альказар-Вака Мануэль Хесус
Формула / Реферат
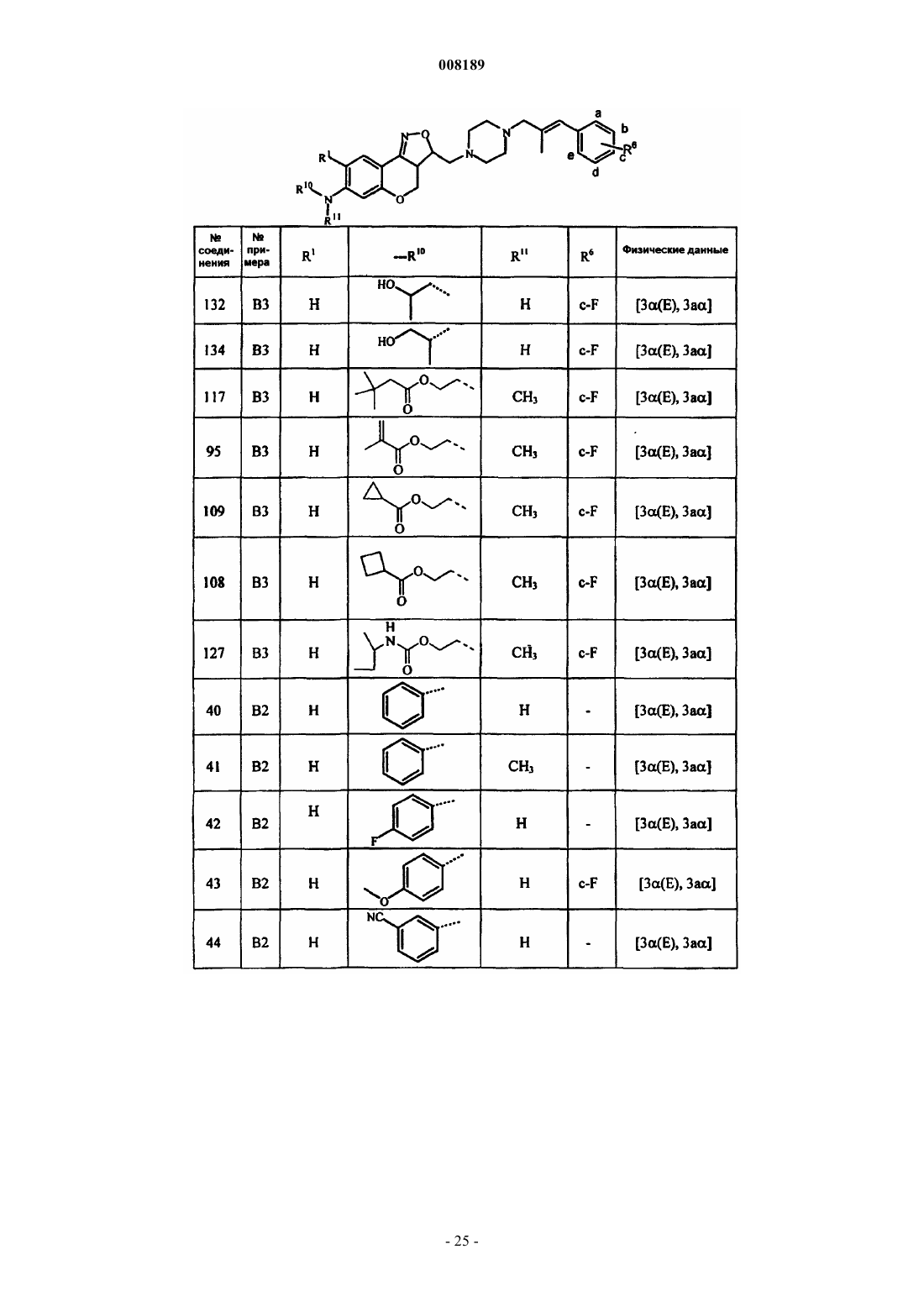
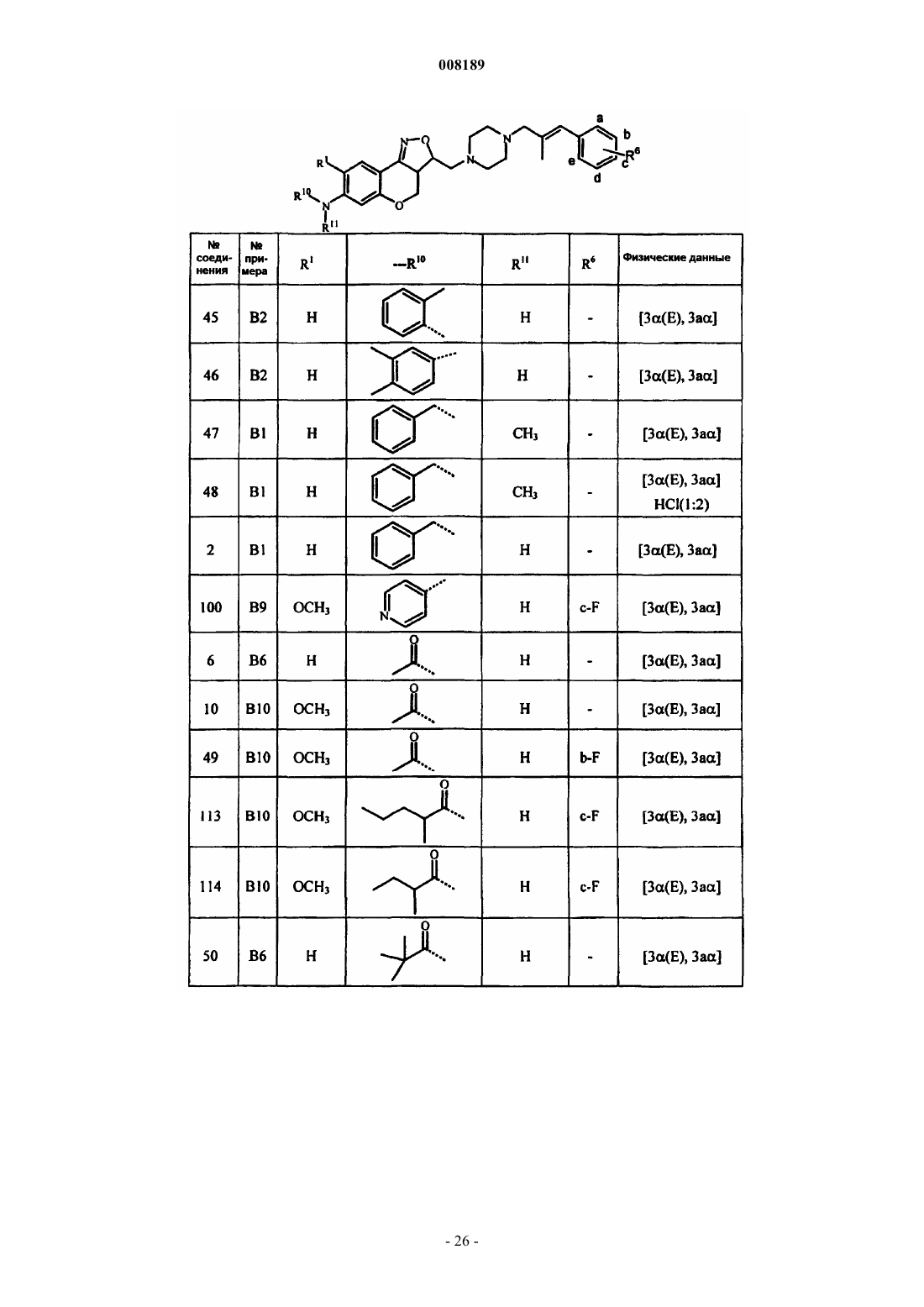
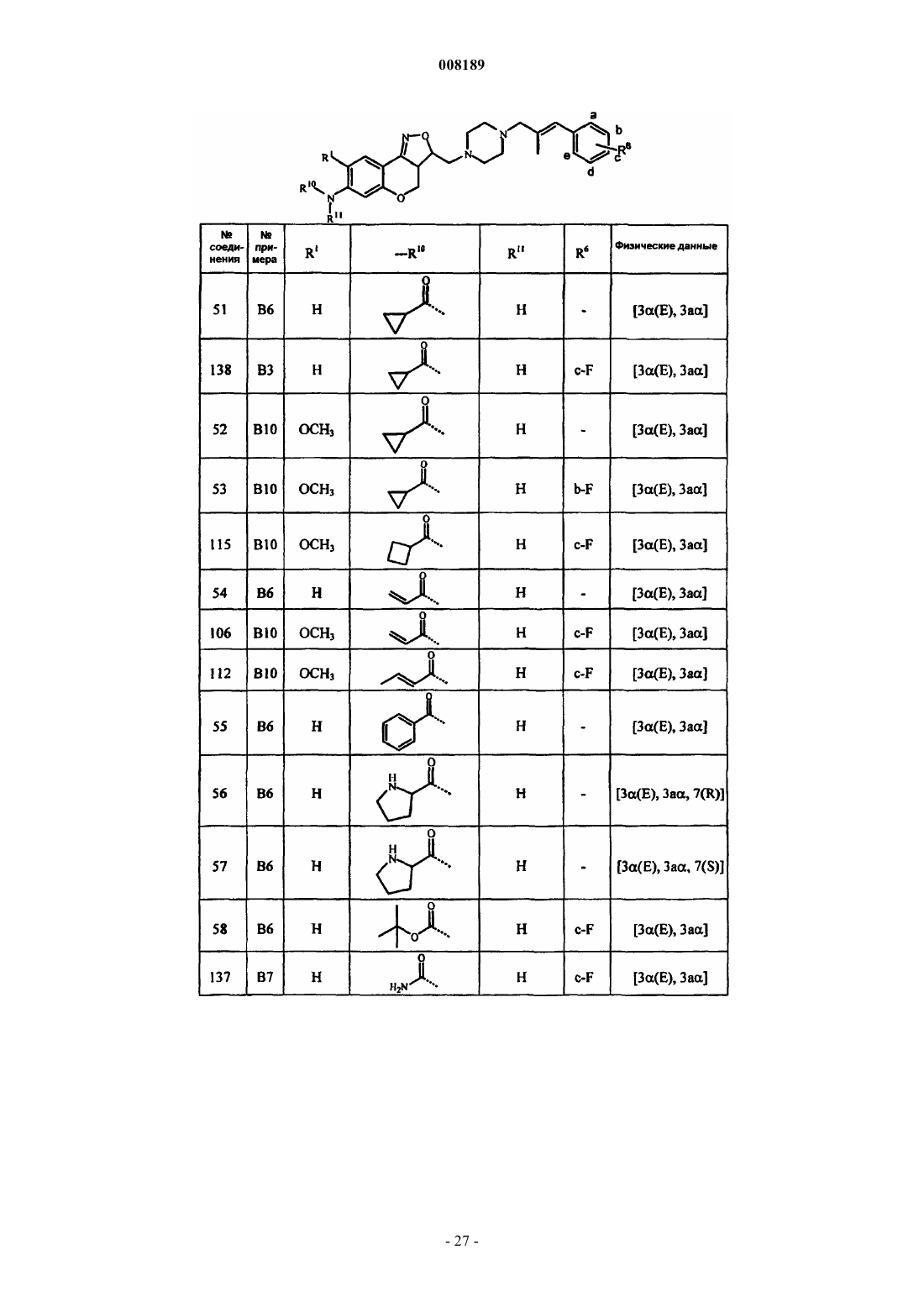
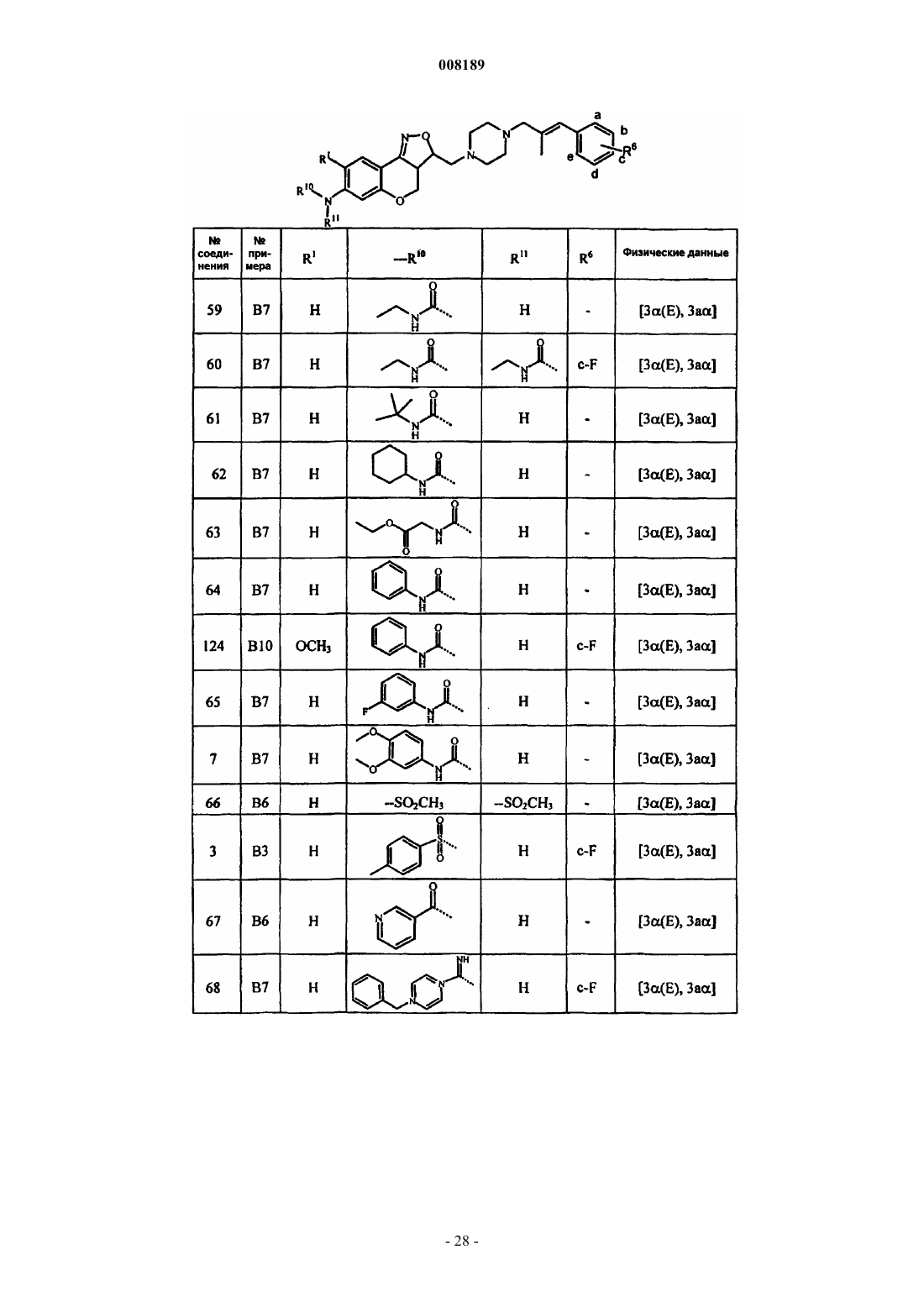
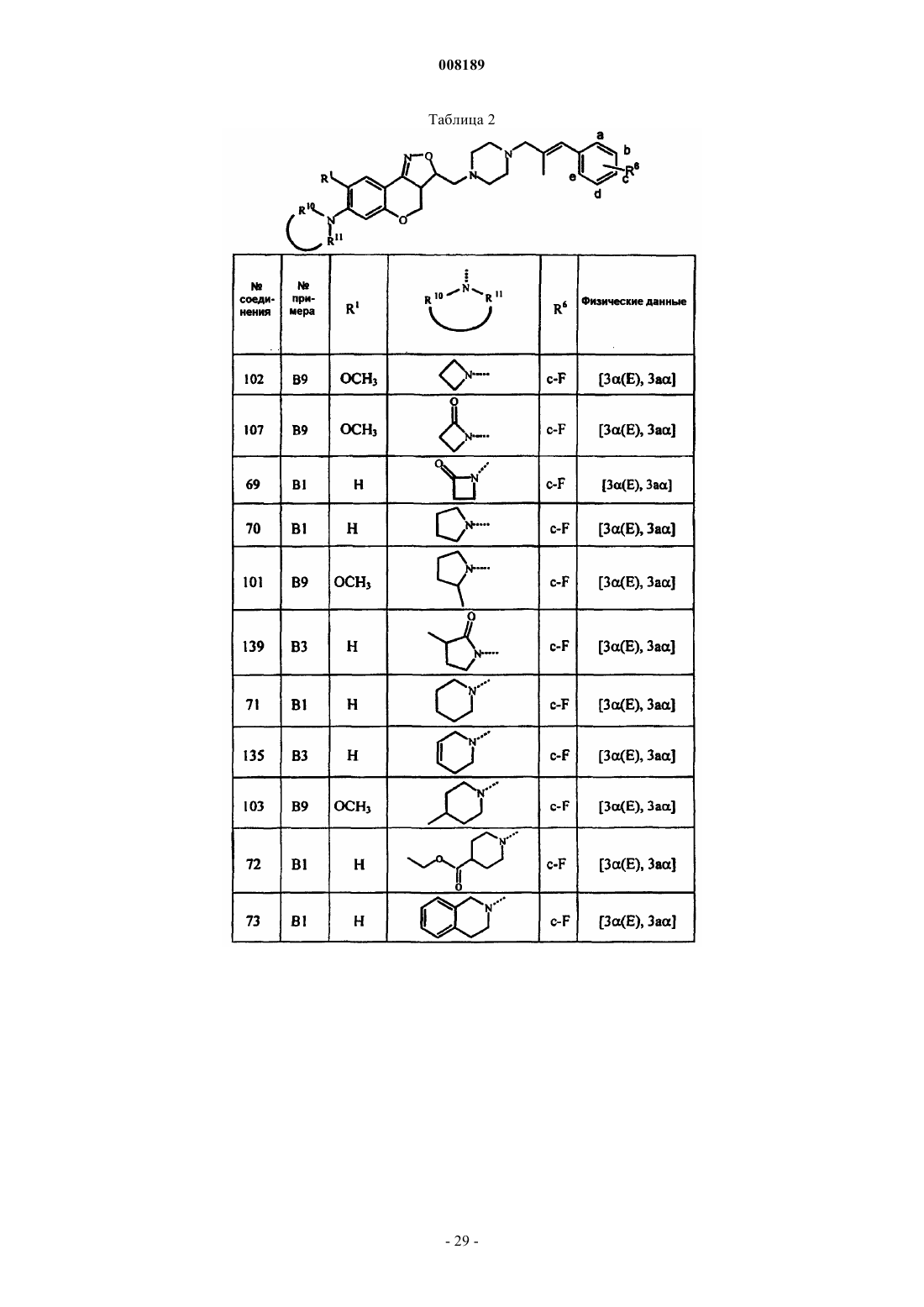
1. Соединение общей формулы (I)
его фармацевтически приемлемые аддитивные соли кислоты или основания, его стереохимически изомерные формы и его N-оксидная форма, где Х представляет собой СН2, N-R7, S или О;
R7 выбран из группы, состоящей из водорода, алкила, Аr, Аr-алкила, алкилкарбонила, алкилоксикарбонила и моно- и ди(алкил)аминокарбонила;
каждый из R1 и R2 выбран из группы, состоящей из водорода, гидрокси, циано, галогена, OSO2H, ОSO2СН3, N-R10R11, алкилокси, алкилоксиалкилокси, алкилоксиалкилоксиалкилокси, тетрагидрофуранилокси, алкилтио, алкилкарбонилокси, алкилоксиалкилкарбонилокси, пиридинилкарбонилокси, алкилкарбонилоксиалкилокси, алкилоксикарбонилокси, алкенилокси, алкенилкарбонилокси и моно- или ди(алкил)аминоалкилокси;
при условии, что по меньшей мере один из R1 и R2 является N-R10R11,
где каждый R10 и R11 независимо друг от друга выбран из группы, состоящей из водорода, алкила, Het, Аr, Аr-алкила, Het-алкила, моно- или ди(алкил)аминоалкила, моно- или ди(алкенил)аминоалкила, алкилкарбонила, алкенилкарбонила, Аr-карбонила, Het-карбонила, алкилоксикарбонила, аминокарбонила, моно- или ди(алкил)аминокарбонила, моно- или ди(Аr)аминокарбонила, моно- или ди(алкилоксикарбонилалкил)аминокарбонила, алкилкарбонилоксиалкила, алкенилкарбонилоксиалкила, моно- или ди(алкил)аминокарбонилоксиалкила, аминоиминометила, алкиламиноиминометила, N-бензилпиперазинилиминометила, алкилсульфонила и Аr-сульфонила; или
R10 и R11 могут быть взяты вместе и могут образовывать с N одновалентный радикал, выбранный из группы, состоящей из
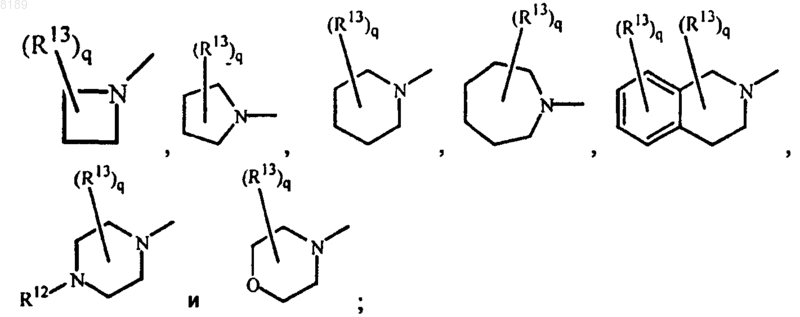
где R12 выбран из группы, состоящей из водорода, алкила, Ar, Ar-алкила, Ar-алкенила, алкилкарбонила, алкилоксикарбонила, алкилоксиалкилкарбонила и моно- или ди(алкил)аминокарбонила;
причем каждое кольцо необязательно имеет 1, 2 или 3 двойных связи и каждое кольцо необязательно замещено q радикалами R13, при этом каждый радикал R13 независимо друг от друга выбран из группы, состоящей из алкила, оксо, Ar, Ar-алкила, Ar-алкенила и алкилоксикарбонила и q представляет собой целое число в диапазоне от 0 до 6; или
R1 и R2 могут быть взяты вместе с образованием двухвалентного радикала -R1-R2-, выбранного из группы, состоящей из -O-CH2-NR14-, -NR14-CH2-O-, -NR15-CH2-NR14-, -NR14-CH2-CH2-O-, -O-CH2-CH2-NR14-, -NR15-CH2-CH2-NR14-, где каждый из R14 и R15 независимо друг от друга выбраны из группы, состоящей из водорода, алкила, Аr, Аr-алкила, алкилкарбонила, алкилоксикарбонила, алкилоксиалкилкарбонила и моно- или ди(алкил)аминокарбонила;
а и b представляют собой асимметрические центры;
(СН2)m представляет собой прямую углеводородную цепь, имеющую m атомов углерода, m является целым числом в диапазоне от 1 до 4;
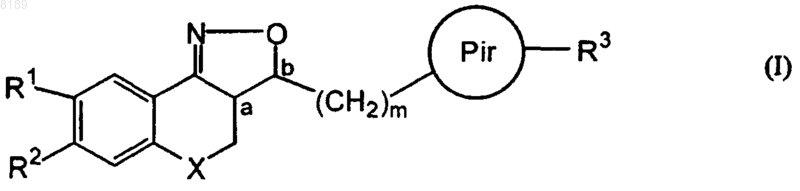
Pir представляет собой радикал, соответствующий любой из формул (IIа), (IIb) или (IIc)
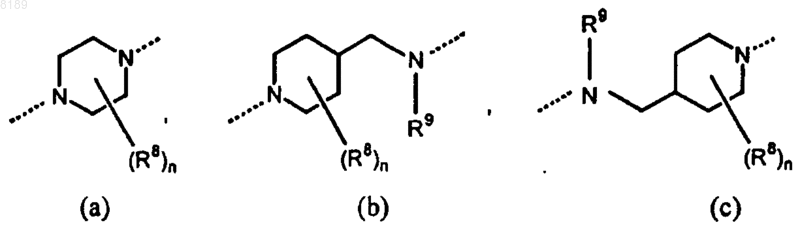
необязательно замещенный n радикалами R8, где
каждый R8 независимо друг от друга выбран из группы, состоящей из гидрокси, амино, нитро, циано, галогена и алкила;
n представляет собой целое число в диапазоне от 0 до 5;
R9 выбран из группы, состоящей из водорода, алкила и формила;
R3 представляет собой необязательно замещенную ароматическую гомоциклическую или гетероциклическую структуру вместе с необязательно замещенной и частично или полностью гидрированной углеводородной цепью, содержащей от 1 до 6 атомов, с помощью которой такая циклическая структура присоединена к Pir-радикалу, причем цепь может содержать один или более гетероатомов, выбранных из группы, состоящей из О, N и S;
алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, необязательно замещенный одним или несколькими радикалами, выбранными из метила, галогена, циано, оксо, гидрокси, алкилокси или амино;
алкенил представляет собой прямой или разветвленный ненасыщенный углеводородный радикал, имеющий одну или более двойных связей, необязательно замещенный одним или несколькими радикалами, выбранными из метила, галогена, циано, оксо, гидрокси, алкилокси или амино;
Аr представляет собой фенил или нафтил, необязательно замещенный одним или несколькими радикалами, выбранными из группы, состоящей из алкила, галогена, циано, оксо, гидрокси, алкилокси и амино; и
Het представляет собой моноциклический гетероциклический радикал, выбранный из группы, состоящей из азетидинила, пирролидинила, диоксолила, имидазолидинила, пиразолидинила, пиперидинила, гомопиперидинила, диоксила, морфолинила, дитианила, тиоморфолинила, пиперазинила, имидазолидинила, тетрагидрофуранила, 2Н-пирролила, пирролинила, имидазолинила, пирразолинила, пирролила, имидазолила, пиразолила, триазолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, тиадиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила, пиридазинила и триазинила; причем каждый радикал необязательно замещен одним или более радикалами, выбранными из группы, состоящей из алкила, Ar, Аr-алкила, галогена, циано, оксо, гидрокси, алкилокси и амино.
2. Соединение по п.1, отличающееся тем, что
Х является О;
каждый из R1 и R2 выбран из группы, состоящей из водорода, N-R10R11 и алкилокси;
при условии, что по меньшей мере один из R1 и R2 является N-R10R11,
где каждый из R10 и R11 независимо друг от друга выбран из группы, состоящей из водорода, алкила, Het, Ar, Аr-алкила, Het-алкила, моно- или ди(алкил)аминоалкила, моно- или ди(алкенил)аминоалкила, алкилкарбонила, алкенилкарбонила, Аr-карбонила, Het-карбонила, алкилоксикарбонила, аминокарбонила, моно- или ди(алкил)аминокарбонила, моно- или ди(Ar)аминокарбонила, моно- или ди(алкилоксикарбонилалкил)аминокарбонила, алкилкарбонилоксиалкила, алкенилкарбонилоксиалкила, моно- или ди(алкил)аминокарбонилоксиалкила, N-бензилпиперазинилиминометила, алкилсульфонила и Аr-сульфонила;
или
R10 и R11 могут быть взяты вместе и могут образовывать с N одновалентный радикал, выбранный из группы, состоящей из
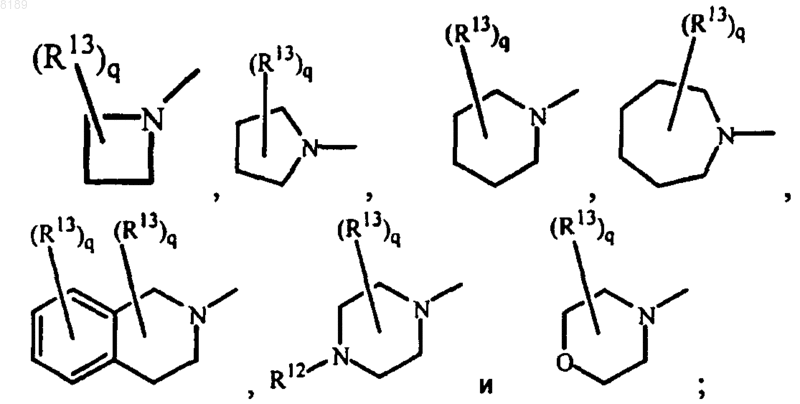
где R12 выбран из группы, состоящей из водорода, алкила, Аr, Аr-алкила и Аr-алкенила;
причем каждое кольцо необязательно имеет двойную связь и каждое кольцо необязательно замещено q радикалами R13, при этом каждый радикал R13 независимо друг от друга выбран из группы, состоящей из алкила, оксо и алкилоксикарбонила и q представляет собой целое число в диапазоне от 0 до 2; или R1 и R2 могут быть взяты вместе с образованием двухвалентного радикала -O-CH2-CH2-NR14-, где R14 выбран из группы, состоящей из водорода, алкила, алкилкарбонила, алкилоксиалкилкарбонила и моно- или ди(алкил)аминокарбонила;
а и b представляют собой асимметрические центры;
(СН2)m представляет собой прямую углеводородную цепь, имеющую m атомов углерода, m является целым числом, равным 1;
Pir представляет собой радикал, соответствующий формуле (IIа);
R3 представляет собой необязательно замещенную ароматическую гомоциклическую или гетероциклическую структуру вместх ё необязательно замещенной и частично или полностью гидрированной углеводородной цепью, содержащей от 1 до 6 атомов, с помощью которой такая циклическая структура присоединена к Pir-радикалу, причем цепь может содержать один или более гетероатомов, выбранных из группы, состоящей из О, N и S;
алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, необязательно замещенный одним или несколькими метильными или аминорадикалами;
алкенил представляет собой прямой или разветвленный ненасыщенный углеводородный радикал, имеющий одну или более двойных связей, необязательно замещенный одним или несколькими метильными радикалами;
Аr представляет собой фенил, необязательно замещенный одним или несколькими радикалами, выбранными из группы, состоящей из алкила, галогена, циано, гидрокси и алкилокси; и Het представляет собой моноциклический гетероциклический радикал, выбранный из группы, состоящей из азетидинила, пирролидинила, пиперидинила, гомопиперидинила, морфолинила, пиперазинила, N-бензилпиперазинила, тетрагидрофуранила и пиридинила.
3. Соединение по любому из пп.1 и 2, отличающееся тем, что R3 представляет собой радикал, соответствующий любой из формул (IIIa), (IIIb) или (IIIc)

где d представляет собой простую связь, когда Z представляет собой двухвалентный радикал, выбранный из группы, состоящей из -СН2-, -С(=O)-, -СН(ОН)-, -C(=N-OH)-, -СН(алкил)-, -О-, -S-, -S(=O)-, -NH- и -SH-; или Z представляет собой трехвалентный СН-фрагмент, который образует ковалентную связь с R4, представляющим собой алкил, с тем, чтобы образовался циклоалкильный фрагмент; или d представляет собой двойную связь, когда Z представляет собой или трехвалентный радикал формулы =СН- или =С(алкил)-; или Z представляет собой трехвалентный СН-фрагмент, который образует ковалентную связь с R4, представляющим собой алкил, так что образуется циклоалкенильный фрагмент;
А представляет собой 5- или 6-членное ароматическое гомоциклическое или гетероциклическое кольцо, выбранное из группы, состоящей из фенила, пиранила, пиридинила, пиразинила, пиримидинила, пиридазинила, тиенила, изотиазолила, пирролила, имидазолила, пиразолила, фуранила, оксадиазолила и изоксазолила;
р представляет собой целое число в диапазоне от 0 до 6;
каждый из R4 и R5 независимо друг от друга выбран из группы, состоящей из водорода, алкила, Аr, бифенила, галогена и циано;
или R4 и R5 могут быть взяты вместе с образованием двухвалентного радикала -R4-R5-, выбранного из группы, состоящей из -СН2-, =СН-, -СН2-СН2-, -СН=СН-, -О-, -NH-, =N-, -S-, -CH2N(-алкила)-, -N(-алкил)СН2-, -CH2NH-, -NHCH2-, -CH=N-, -N=CH-, -CH2O- и -OCH2-;
каждый R6 независимо друг от друга выбран из группы, состоящей из гидрокси, амино, нитро, циано, галогена, карбоксила, алкила, Ar, алкилокси, Ar-окси, алкилкарбонилокси, алкилоксикарбонила, алкилтио, моно- и ди(алкил)амино, алкилкарбониламино, моно- и ди(алкил)аминокарбонила, моно- и ди(алкил)аминокарбонилокси, моно- и ди(алкил)аминоалкилокси; или два соседних радикала R6 могут быть взяты вместе с образованием двухвалентного радикала -R6-R6-, выбранного из группы, состоящей из -СН2-СН2-O-,
-О-СН2-СН2-, -O-СН2-С(=O)-, -С(=O)-СН2-O-, -O-СН2-O-, -СН2-O-СН2-, -O-СН2-СН2-O-, -СН=СН-СН=СН-, -CH=CH-CH=N-, -CH=CH-N=CH-, -CH=N-CH=CH-, -N=CH-CH=CH-, -CH2-CH2-CH2-, -СН2-СН2-С(=O)-, -С(=O)-СН2-СН2-, -СН2-С(=O)-СН2- и -СН2-СН2-СН2-СН2-; и
R16 выбран из группы, состоящей из водорода, алкила, Ar и Ar-алкила.
4. Соединение по любому из пп.1-3, отличающееся тем, что R3 представляет собой радикал, соответствующий любой из формул (IIIa), (IIIb) или (IIIc), где
d представляет собой двойную связь, тогда как Z представляет собой трехвалентный радикал формулы =СН- или =С(алкил)-;
А является фенилом;
р представляет собой целое число, равное 0 или 1;
каждый из R4 и R5 независимо друг от друга выбран из группы, состоящей из водорода и алкила; и
каждый R6 является галогеном; и
R16 является водородом.
5. Соединение по любому из пп.1-4, отличающееся тем, что Х=O, один из R1 и R2 представляет собой водород, метокси или этокси; m=1; Pir представляет собой радикал, соответствующий формуле (IIа), в которой n=0; R3 представляет собой радикал, соответствующий формуле (IIIb), в которой Z является =СН-, d представляет собой двойную связь, А является фенильным кольцом, R4 является метилом и каждый из R5 и R16 является водородом.
6. Соединение по любому из пп.1-5, отличающееся тем, что R1 представляет собой водород или метокси и R2 является аминным радикалом NR10R11, X=O, m=1; Pir представляет собой радикал, соответствующий формуле (IIа), в которой n=0; R3 представляет собой радикал, соответствующий формуле (IIIb), в которой Z является =СН-, d представляет собой двойную связь, А является фенильным кольцом, R4 является метилом и каждый из R5 и R16 является водородом.
7. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения по любому из пп.1-6.
8. Способ получения фармацевтической композиции по п.7, включающий смешивание соединения по любому из пп.1-6 и фармацевтически приемлемого носителя.
9. Применение соединения по любому из пп.1-6 для получения лекарственного средства для лечения депрессии, тревоги и нарушений массы тела.
10. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-6 и одно или более других соединений, выбранных из группы, состоящей из антидепрессантов, анксиолитиков и нейролептических средств.
11. Применение фармацевтической композиции по п.10 для получения лекарственного средства, для лечения депрессии, тревоги и нарушений массы тела.
12. Применение фармацевтической композиции по п.10 для получения лекарственного средства для лечения депрессии, тревоги и нарушений массы тела, причем указанное лечение включает одновременное или последовательное введение соединения по любому из пп.1-6 и одного или более других соединений, выбранных из группы, состоящей из антидепрессантов, анксиолитиков и нейролептических средств.
13. Способ лечения депрессии, тревоги и нарушений массы тела, где указанное лечение включает одновременное или последовательное введение одного или более соединений из антидепрессантов, анксиолитиков и нейролептических средств и соединения по любому из пп.1-6.
14. Способ повышения эффективности и/или начала действия лекарственного средства при лечении депрессии, тревоги и нарушений массы тела, включающий введение фармацевтической композиции по п.10.
15. Способ получения фармацевтической композиции по п.10, включающий смешивание соединения по любому из пп.1-6 и соединения, выбранного из группы, состоящей из антидепрессантов, анксиолитиков и нейролептических средств, и фармацевтически приемлемого носителя.
16. Способ получения соединения, соответствующего формуле (I), отличающийся тем, что соединение, соответствующее формуле (IV), подвергают взаимодействию с амином формулы (V) в соответствии со следующей реакцией
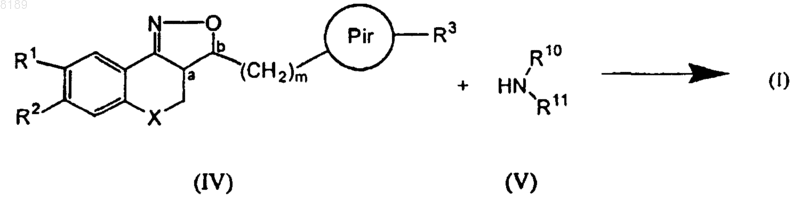
где все группы, за исключением R1 и R2, имеют такие же значения, как в формуле (I), по меньшей мере один из R1 и R2 представляет собой галоген, и не более одного из R1 и R2 выбрано из группы, состоящей из водорода, гидрокси, циано, галогена, ОSO2Н, ОSO2СН3, N-R10R11, алкилокси, алкилоксиалкилокси, алкилоксиалкилоксиалкилокси, тетрагидрофуранилокси, алкилкарбонилокси, алкилтио, алкилоксиалкилкарбонилокси, пиридинилкарбонилокси, алкилкарбонилоксиалкилокси, алкилоксикарбонилокси, алкенилокси, алкенилкарбонилокси и моно- или ди(алкил)аминоалкилокси.
Текст
008189 Данное изобретение относится к замещенным производным аминоизоксазолина, в особенности к трициклическим производным дигидробензопираноизоксазолина, дигидрохинолинизоксазолина, дигидронафталинизоксазолина и дигидробензотиопиранизоксазолина, замещенным в фенильной части трициклического фрагмента первичной, вторичной и/или третичной аминогруппами, к способам их получения, к содержащим их фармацевтическим композициям и к их применению в качестве лекарственного препарата для лечения, в частности, депрессии, тревоги, нарушений движения, психоза, шизофрении и нарушений массы тела, включая нервную анорексию и булимию. Изобретение относится также к новой комбинации указанных замещенных производных аминоизоксазолинов с антидепрессантами, анксиолитиками, нейролептиками и лекарственными средствами для лечения болезни Паркинсона. Из ЕР 361577 В 1 известны производные тетрагидронафталина и индана, обладающие антидепрессивной активностью. Указанные соединения являются типичными блокаторами повторного (обратного) захвата моноамина, обладающими дополнительно антагонистической активностью в отношении 2 адренорецептора и они проявляют антидепрессивную активность, не оказывая успокаивающего действия. В WO 97/25317 раскрыты трициклические производные 4,5-дигидронафт[1,2-с]изоксазола, обладающие антагонистической активностью в отношении серотонина 5-НТ 3, которые применяются для лечения тревоги, психиатрических расстройств, тошноты, рвоты и лекарственной зависимости. Они отличаются по химической структуре от соединений настоящего изобретения насыщением изоксазольного фрагмента и схемой его замещения. В ЕР 885883 А 1 раскрыты бициклические конденсированные гетероциклические соединения,имеющие активность в отношении допамина D4 и антагонистическую активность в отношении серотонина 5-НТ 2, которые применяются в качестве средств для лечения центральной нервной системы, в особенности в качестве нейролептического средства. Они отличаются по химической структуре от соединений настоящего изобретения природой конденсированного гетероцикла и схемой его замещения. Проблемы, связанные с соединениями предшествующего уровня данной области, состоят в том, что они вызывают значительные побочные действия, такие как тошнота, возбуждение, повышенная частота сердечных сокращений и снижение сексуальной функции. Кроме того, для начала ответной реакции необходимо длительное время, в частности 3-4 недели. Задача настоящего изобретения состоит в получении новых производных соединений, предназначенных для лечения депрессии, тревоги, нарушений движений, психоза, шизофрении и нарушений массы тела, в частности соединений, не имеющих вышеуказанных недостатков. Настоящее изобретение относится к новым замещенным производным аминоизоксазолина, соответствующим общей формуле (I) их фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам и к их N-оксидной форме, где Х представляет собой CH2, N-R7, S или О;R7 выбран из группы, состоящей из водорода, алкила, Аr, Аr-алкила, алкилкарбонила, алкилоксикарбонила и моно- и ди(алкил)аминокарбонила; каждый из R1 и R2 выбран из группы, состоящей из водорода, гидрокси, циано, галогена, OSO2H,ОSO2 СН 3, N-R10R11-, алкилокси, алкилоксиалкилокси, алкилоксиалкилоксиалкилокси, тетрагидрофуранилокси, алкилтио, алкилкарбонилокси, алкилоксиалкилкарбонилокси, пиридинилкарбонилокси, алкилкарбонилоксиалкилокси, алкилоксикарбонилокси, алкенилокси, алкенилкарбонилокси и моно- или ди(алкил)аминоалкилокси; при условии, что по меньшей мере один из R1 и R2 является N-R10R11,где каждый из R10 и R11 независимо друг от друга выбран из группы, состоящей из водорода, алкила, Het, Ar, Аr-алкила, Het-алкила, моно- или ди(алкил)аминоалкила, моно- или ди(алкенил)аминоалкила,алкилкарбонила, алкенилкарбонила, Аr-карбонила, Het-карбонила, алкилоксикарбонила, аминокарбонила, моно- или ди(алкил)аминокарбонила, моно- или ди(Ar)аминокарбонила, моно- или ди(алкилоксикарбонилалкил)аминокарбонила, алкилкарбонилоксиалкила, алкенилкарбонилоксиалкила,моно- или ди(алкил)аминокарбонилоксиалкила, аминоиминометила, алкиламиноиминометила, Nбензилпиперазинилиминометила, алкилсульфонила и Аr-сульфонила; илиR10 и R11 могут быть взяты вместе и могут образовывать с N одновалентный радикал, выбранный из группы, состоящей из где R12 выбран из группы, состоящей из водорода, алкила, Ar, Аr-алкила, Аr-алкенила, алкилкарбонила,алкилоксикарбонила, алкилоксиалкилкарбонила и моно- или ди(алкил)аминокарбонила; причем каждое кольцо необязательно имеет 1, 2 или 3 двойных связи и каждое кольцо необязательно замещено q радикалами R13, при этом каждый радикал R13 независимо друг от друга выбран из группы, состоящей из алкила, оксо, Ar, Аr-алкила, Аr-алкенила и алкилоксикарбонила и q представляет собой целое число в диапазоне от 0 до 6; илиR1 и R2 могут быть взяты вместе с образованием двухвалентного радикала -R1-R2, выбранного из группы, состоящей из -O-CH2-NR14-, -NR14-CH2-O-, -NR15-CH2-NR14-, -NR14-CH2-CH2-O-, -O-CH2-CH2NR14-, -NR15-CH2-CH2-NR14-, где каждый из R14 и R15 независимо друг от друга выбраны из группы, состоящей из водорода, алкила, Аr, Аr-алкила, алкилкарбонила, алкилоксикарбонила, алкилоксиалкилкарбонила и моно- или ди(алкил)аминокарбонила; а и b представляют собой асимметрические центры;(CH2)m представляют собой прямую углеводородную цепь, имеющую m атомов углерода, m является целым числом в диапазоне от 1 до 4;Pir представляет собой радикал, соответствующий любой из формул (IIа), (IIb) или (IIс) необязательно замещенный n радикалами R8, где каждый R8 независимо друг от друга выбран из группы, состоящей из гидрокси, амино, нитро, циано, галогена и алкила;n представляет собой целое число в диапазоне от 0 до 5;R3 представляет собой необязательно замещенную ароматическую гомоциклическую или гетероциклическую структуру вместе с необязательно замещенной и частично или полностью гидрированной углеводородной цепью, содержащей от 1 до 6 атомов, с помощью которой такая циклическая структура присоединена к Pir радикалу, причем цепь может содержать один или более гетероатомов, выбранных их группы, состоящей из О, N и S; алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал,имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, необязательно замещенный одним или несколькими радикалами, выбранными из метила, галогена, циано, оксо, гидрокси, алкилокси или амино; алкенил представляет собой прямой или разветвленный ненасыщенный углеводородный радикал,имеющий одну или более двойных связей, необязательно замещенный одним или несколькими радикалами, выбранными из метила, галогена, циано, оксо, гидрокси, алкилокси или амино; Аr представляет собой фенил или нафтил, необязательно замещенный одним или несколькими радикалами, выбранными из группы, состоящей из алкила, галогена, циано, оксо, гидрокси, алкилокси и амино; иHet представляет собой моноциклический гетероциклический радикал, выбранный из группы, состоящей из азетидинила, пирролидинила, диоксолила, имидазолидинила, пиразолидинила, пиперидинила, гомопиперидинила, диоксила, морфолинила, дитианила, тиоморфолинила, пиперазинила, имидазолидинила, тетрагидрофуранила, 2 Н-пирролила, пирролинила, имилазолинила, пирразолинила, пирролила,имидазолила, пиразолила, триазолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, тиадиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила, пиридазинила и триазинила; причем каждый радикал необязательно замещен одним или более радикалами, выбранными из группы, состоящей из алкила, Аr, Аr-алкила, галогена, циано, оксо, гидрокси, алкилокси и амино.-2 008189 Изобретение предпочтительно относится к соединениям, соответствующим формуле (I), их фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам и к их N-оксидной форме,где Х является О; каждый из R1 и R2 выбран из группы, состоящей из водорода, N-R10R11 и алкилокси; при условии, что по меньшей мере один из R1 и R2 является N-R10R11,где каждый из R10 и R11 независимо друг от друга выбран из группы, состоящей из водорода, алкила, Het, Аr, Аr-алкила, Het-алкила, моно- или ди(алкил)аминоалкила, моно- или ди(алкенил)аминоалкила,алкилкарбонила, алкенилкарбонила, Аr-карбонила, Het-карбонила, алкилоксикарбонила, аминокарбонила, моно- или ди(алкил)аминокарбонила, моно- или ди(Аr)аминокарбонила, моно- или ди(алкилоксикарбонилалкил)аминокарбонила, алкилкарбонилоксиалкила, алкенилкарбонилоксиалкила,моно- или ди(алкил)аминокарбонилоксиалкила, N-бензилпиперазинилиминометила, алкилсульфонила и Аr-сульфонила; илиR10 и R11 могут быть взяты вместе и могут образовывать с N одновалентный радикал, выбранный из группы, состоящей из где R12 выбран из группы, состоящей из водорода, алкила, Аr, Аr-алкила и Аr-алкенила; причем каждое кольцо необязательно имеет двойную связь и каждое кольцо необязательно замещено q радикалами R13, при этом каждый радикал R13 независимо друг от друга выбран из группы, состоящей из алкила, оксо и алкилоксикарбонила и q представляет собой целое число в диапазоне от 0 до 2; илиR1 и R2 могут быть взяты вместе с образованием двухвалентного радикала -O-CH2-CH2-NR14-, где 14R выбран из группы, состоящей из водорода, алкила, алкилкарбонила, алкилоксиалкилкарбонила и моно- или ди(алкил)аминокарбонила; а и b представляют собой асимметрические центры;(СН 2)m представляет собой прямую углеводородную цепь, имеющую m атомов углерода, m является целым числом, равным 1;R3 представляет собой необязательно замещенную ароматическую гомоциклическую или гетероциклическую структуру вместе с необязательно замещенной и частично или полностью гидрированной углеводородной цепью, содержащей от 1 до 6 атомов, с помощью которой такая циклическая структура присоединена к Pir-радикалу, причем цепь может содержать один или более гетероатомов, выбранных из группы, состоящей из О, N и S; алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал,имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, необязательно замещенный одним или несколькими метильными или амино радикалами; алкенил представляет собой прямой или разветвленный ненасыщенный углеводородный радикал,имеющий одну или более двойных связей, необязательно замещенный одним или несколькими метильными радикалами; Аr представляет собой фенил, необязательно замещенный одним или несколькими радикалами, выбранными из группы, состоящей из алкила, галогена, циано, гидрокси и алкилокси; иHet представляет собой моноциклический гетероциклический радикал, выбранный из группы, состоящей из азетидинила, пирролидинила, пиперидинила, гомопиперидинила, морфолинила, пиперазинила, N-бензилпиперазинила, тетрагидрофуранила и пиридинила. Настоящее изобретение, в особенности, относится к соединениям, соответствующим формуле (I),их фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам и к их N-оксидной форме, где R3 представляет собой радикал, соответствующий любой из формул (IIIa), (IIIb) или (IIIc)d представляет собой простую связь, тогда как Z представляет собой двухвалентный радикал, выбранный из группы, состоящей из -СН 2-, -С(=O)-, -СН(ОН)-, -C(=N-OH)-, -СН(алкил)-, -О-, -S-, -S(=O)-, -NH- и -SH-; или Z представляет собой трехвалентный СН-фрагмент, который образует ковалентную связь с R4, представляющим собой алкил, с тем, чтобы образовался циклоалкильный фрагмент; или d представляет собой двойную связь,тогда как Z представляет собой или трехвалентный радикал формулы =СН-, или =С(алкил)-; или Z представляет собой трехвалентный СН-фрагмент, который образует ковалентную связь с R4, представляющим собой алкил, с тем, чтобы образовался циклоалкенильный фрагмент; А представляет собой 5- или 6-членное ароматическое гомоциклическое или гетероциклическое кольцо, выбранное из группы, состоящей из фенила, пиранила, пиридинила, пиразинила, пиримидинила,пиридазинила, тиенила, изотиазолила, пирролила, имидазолила, пиразолила, фуранила, оксадиазолила и изоксазолила; р представляет собой целое число в диапазоне от 0 до 6; каждый из R4 и R5 независимо друг от друга выбран из группы, состоящей из водорода, алкила, Аr,бифенила, галогена и циано; илиR4 и R5 могут быть взяты вместе с образованием двухвалентного радикала -R4-R5, выбранного из группы, состоящей из -CH2-, =СН-, -СН 2-СН 2-, -СН=СН-, -О-, -NH-, =N-, -S-, -CH2N(-алкила)-, -N(алкил)СН 2-, -CH2NH-, -NHCH2-, -CH=N-, -N=CH-, -СН 2 О- и -ОСН 2-; каждый R6 независимо друг от друга выбран из группы, состоящей из гидрокси, амино, нитро, циано, галогена, карбоксила, алкила, Аr, алкилокси, Аr-окси, алкилкарбонилокси, алкилоксикарбонила, алкилтио, моно- и ди(алкил)амино, алкилкарбониламино, моно- и ди(алкил)аминокарбонила, моно- и ди(алкил)аминокарбонилокси, моно- и ди(алкил)аминоалкилокси; или два соседних радикала R6 могут быть взяты вместе с образованием двухвалентного радикала 6R16 выбран из группы, состоящей из водорода, алкила, Аr и Аr-алкила. Данное изобретение предпочтительно относится к таким соединениям, соответствующим формуле(I), их фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам и к их N-оксидной форме, в которых R3 представляет собой радикал, соответствующий любой из формул (IIIa), (IIIb) или (IIIc), гдеd представляет собой двойную связь, тогда как Z представляет собой трехвалентный радикал формулы =СН- или =С(алкил)-; А является фенилом; р представляет собой целое число, равное 0 или 1; каждый из R4 и R5 независимо друг от друга выбран из группы, состоящей из водорода и алкила; и каждый R6 является галогеном; иR16 является водородом. Данное изобретение более предпочтительно относится к соединениям, соответствующим формуле(I), их фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам и к их N-оксидной форме, где Х=O, один из R1 и R2 представляет собой водород,метокси или этокси; m=1; Pir представляет собой радикал, соответствующий формуле (IIа), в которойn=0; R3 представляет собой радикал, соответствующий формуле (IIIb), в которой Z является =СН-, d представляет собой двойную связь, А является фенильным кольцом, R4 является метилом и каждый из R5 и R16 является водородом. В особенности интересные соединения представляют собой такие соединения, соответствующие формуле (I), их фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы и их N-оксидную форму, где R1 представляет собой водород или метокси и R2 является аминным радикалом NR10R11, Х=O, m=1; Pir представляет собой радикал, соответствующий формуле (IIа), в которой n=0; R3 представляет собой радикал, соответствующий формуле (IIIb), в которойZ является =СН-, d представляет собой двойную связь, А является фенильным кольцом, R4 является метилом и каждый из R5 и R16 является водородом. В особенности интересными являются такие соединения, в которых А представляет собой незамещенное фенильное кольцо или фенильное кольцо, замещенное атомом галогена, в особенности атомом F,Сl или Вr. В рамках данной заявки алкил означает прямые или разветвленные насыщенные углеводородные радикалы, имеющие от 1 до 6 атомов углерода, например метил, этил, пропил, бутил, 1-метилпропил,1,1-диметилэтил, пентил, гексил; или алкил означает циклические насыщенные углеводородные радикалы, имеющие от 3 до 6 атомов углерода, например циклопропил, метилциклопропил, циклобутил, циклопентил и циклогексил. Алкильные радикалы могут быть необязательно замещены одним или несколькими радикалами, выбранными из галогена, циано, оксо, гидрокси, алкилокси или амино, например полигалогеналкилом, в особенности дифторметилом и трифторметилом. В рамках данной заявки термин галоген является родовым для фтора, хлора, брома и йода. В рамках данной заявки термин алкенил означает прямой или разветвленный ненасыщенный углеводородный радикал, имеющий одну или несколько двойных связей, например этенил, 1-пропенил, 2 пропенил и 1,3-бутандиенил. Алкенильные радикалы могут быть необязательно замещены одним или несколькими радикалами, выбранными из галогена, циано, оксо, гидрокси, алкилокси или амино, например гидроксиэтенилом. Фармацевтически приемлемые соли определены как соли, включающие терапевтически активные формы нетоксичных аддитивных солей кислоты, которые способны образовывать соединения, соответствующие формуле (I). Указанные соли могут быть получены обработкой основной формы соединений,соответствующих формуле (I), подходящими кислотами, например неорганическими кислотами, например, галогенводородной кислотой, в особенности хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой, азотной кислотой и фосфорной кислотой; органическими кислотами, например уксусной кислотой, гидроксиуксусной кислотой, пропановой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, малоновой кислотой, янтарной кислотой, малеиновой кислотой, фумаровой кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, метансульфоновой кислотой, этансульфоновой кислотой, бензолсульфоновой кислотой, пара-толуолсульфоновой кислотой,цикламовой кислотой, салициловой кислотой, пара-аминосалициловой кислотой и памовой кислотой. Соединения в соответствии с формулой (I), содержащие кислотные протоны, могут быть также превращены в их терапевтически активные формы нетоксичных аддитивных солей металла или амина обработкой соответствующими органическими и неорганическими основаниями. Подходящие формы основных солей включают, например, соли аммония, соли щелочного и щелочно-земельного металла, в особенности соли лития, натрия, калия, магния и кальция, соли с органическими основаниями, например, с бензатином, N-метил-О-глюкамином, соли гибрамина, и соли с аминокислотами, например с аргинином и лизином. И наоборот, указанные формы солей могут быть превращены в свободные формы обработкой соответствующим основанием или кислотой. Использованный в рамках данной заявки термин аддитивная соль включает также сольваты, которые способны образовывать соединения, соответствующие формуле (I), а также их соли. Такие сольваты представляют собой, например, гидраты и алкоголяты. Выражение N-оксидные формы соединений, соответствующих формуле (I), означает включение таких соединений формулы (I), в которых один или несколько атомов азота окислены до так называемогоN-оксида, в частности до таких N-оксидов, у которых N-окислены один или более атомов азота пиперазинильного радикала. Использованный в данном описании термин стереохимически изомерные формы включает все возможные изомерные формы, которыми могут обладать соединения формулы (I). Если не упомянуто или не указано иным образом, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереоизомеры и энантиомеры основной молекулярной структуры. Стереогенные центры могут в особенности иметь R- или Sконфигурацию; заместители в двухвалентных циклических (частично) насыщенных радикалах могут иметь или цис- или трансконфигурацию. Соединения, включающие двойные связи, могут иметь Е- илиZ-стереохимию указанной двойной связи. Очевидно, что стереохимически изомерные формы соединений формулы (I) предназначены для включения в объем данного изобретения. В соответствии с условиями номенклатуры CAS, в том случае, когда в молекуле присутствуют два стереогенных центра известной абсолютной конфигурации, хиральному центру с наименьшим номером,являющемуся эталонным центром, присваивается R- или S-дескриптор (на основе правила последовательности Канна-Ингольда-Прелога (Cahn-Ingold-Prelog). Конфигурация второго стереогенного центра указывается с использованием соответственных дескрипторов [R,R] или [R,S], где R всегда указывается в качестве эталонного центра и [R,R] показывает центры с одинаковой хиральностью и [R,S] показывает центры разной хиральности. Так например, если самый меньший по нумерации хиральный центр в молекуле имеет S-конфигурацию и второй центр представляет собой R, стереодескриптор будет-5 008189 указан как S-[R,S]. Если используютсяи , то положение самого старшего заместителя в асимметрическом атоме углерода в циклической структуре, имеющем самый меньший номер в цикле, всегда произвольно находится в -положении средней плоскости, определенной циклической структурой. Положение самого старшего заместителя в другом асимметрическом атоме углерода в циклической структуре (атом водорода в соединениях формулы (I относительно положения самого старшего заместителя в эталонном атоме называется , если он находится на той же стороне средней плоскости, определенной циклической структурой, или , если он находится на другой стороне средней плоскости, определенной циклической структурой. Соединения формулы (I) и некоторые из промежуточных продуктов имеют по меньшей мере два стереогенных центра в их структуре, соответственно обозначенные в формуле (I) a и b. Вследствие синтетического пути синтеза трициклической структуры конфигурация указанных двух асимметрических центров а и b является заданной с тем, чтобы соответственная конфигурация центра а былаS и центра b была R. Изобретение включает также производные соединения (обычно называемые пролекарства) фармакологически активных соединений в соответствии с изобретением, которые расщепляются in vivo с образованием соединений в соответствии с изобретением. Пролекарства обычно (но не всегда) обладают меньшим действием на целевой рецептор, чем соединения, до которых они расщепляются. Пролекарства являются в особенности применимыми, когда требуемое соединение имеет химические или физические свойства, которые делают его введение трудным или неэффективным. Так например, требуемое соединение может быть слаборастворимым, оно может плохо проникать в слизистую оболочку эпителия или может иметь нежелательно короткий период полувыведения из плазмы. Дополнительное обсуждение пролекарств может быть найдено в Stella, V. J. et al., Prodrugs, Drug Delivery Systems, 1985, pp. 112-176,и в Drugs, 1985, 29, pp. 455-473. Пролекарственные формы фармакологически активных соединений в соответствии с изобретением будут обычно представлять собой соединения в соответствии с формулой (I), их фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы и их N-оксидную форму,имеющую эстерифицированную или амидированную кислотную группу. В такие эстерифицированные кислотные группы включены группы формулы -COORx, где Rx представляет собой C1-6 алкил, фенил, бензил или одну из следующих групп: Амидированные группы включают группы формулы -CONRyRz, где Ry представляет собой Н, C1-6 алкил,фенил или бензил и Rz представляет собой -ОН, Н, C1-6 алкил, фенил или бензил. Соединения в соответствии с изобретением, имеющие аминогруппу, могут быть получены из кетона или альдегида, такого как формальдегид, с образованием основания Манниха. Такое основание будет гидролизоваться в водном растворе в соответствии с кинетическим уравнением первого порядка. Соединения формулы (I), полученные в раскрытых ниже способах, могут быть синтезированы в форме рацемических смесей энантиомеров, которые могут быть отделены друг от друга следующими известными в данной области методиками разделения. Рацемические соединения формулы (I) могут быть превращены в соответствующие диастереоизомерные солевые формы реакцией с подходящей хиральной кислотой. Указанные диастереоизомерные солевые формы разделяют затем, например, селективной или фракционной кристаллизацией и выделяют из них энантиомеры с использованием щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы могут быть также получены из соответствующих чистых стереохимически изомерных форм подходящих исходных продуктов, при условии, что реакция происходит стереоспецифически. Если желателен отдельный стереоизомер, соединение предпочтительно следует синтезировать стереоспецифическими методами получения. В таких методах удобно использовать энантиомерно чистые исходные продукты. Было показано, что соединения в соответствии с изобретением, в особенности соединения в соответствии с формулой (I), их фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы и их N-оксидная форма неожиданно имеют селективную ингибирующую активность в отношении обратного захвата серотонина (5-НТ), в комбинации с дополнительной антагонистической активностью в отношении 2-адренорецептора и проявляют сильную антидепрессивную и/или анксиолитическую активность, и/или нейролептическую активность, и/или регуляторную активность в отношении массы тела, не оказывая при этом успокаивающее действие. Кроме того, ввиду их селективной активности в отношении обратного захвата серотонина (5-НТ), а также антагонистической активности в отношении -адренорецептора, соединения в соответствии с данным изобретением являют-6 008189 ся также подходящими для лечения и/или профилактики заболеваний, при которых может найти терапевтическое применение или только одна из указанных активностей или комбинация указанных активностей. Соединения в соответствии с данным изобретением могут быть в особенности подходящими для лечения и/или профилактики следующих заболеваний: расстройств центральной нервной системы, включающих нарушения эмоционального состояния,включающие в частности обширное депрессивное расстройство, депрессию с или без психотических признаков, кататонических признаков, меланхолических признаков, атипичных признаков, возникающих после начала родов и, в случае повторяющихся эпизодов, с или без сезонной особенности, дистимию,биполярное расстройство I, биполярное расстройство II, циклотимию, повторяющуюся краткосрочную депрессию, эмоциональное расстройство, биполярное расстройство по иным неустановленным причинам, нарушение эмоционального состояния вследствие общего состояния здоровья, нарушение эмоционального состояния, вызванное приемом веществ, нарушение эмоционального состояния по иным неустановленным причинам, сезонное эмоциональное расстройство и предменструальные дисфории; тревожные расстройства, включающие приступы паники, агорафобию, паническое состояние без агорафобии,агорафобию с анамнезом панического расстройства, специфическую фобию, социальную фобию, навязчиво-компульсивное побуждение, посттравматический стресс, острое стрессовое расстройство, генерализованную тревогу, тревогу, обусловленную общим состоянием здоровья, тревогу, вызванную приемом веществ, и тревогу по иным неустановленным причинам; родственные стрессу расстройства, связанные с депрессией и/или тревогой, включающие острую стрессовую реакцию, регулируемые расстройства(краткосрочная депрессивная реакция, пролонгированная депрессивная реакция, невроз страха в комбинации с депрессивной реакцией, регулируемое расстройство с преобладающим нарушением других эмоций, регулируемое расстройство с преобладающим нарушением проводимости нерва, регулируемое расстройство с нарушением эмоций и проводимости нерва, регулируемые расстройства с другими установленными преобладающими симптомами) и другие реакции на сильный стресс; слабоумие, нарушения памяти и нарушения познавательной способности по иным неустановленным причинам, в особенности слабоумие, вызванное дегенеративными расстройствами, поражениями, травмой, инфекциями, сосудистыми расстройствами, токсинами, гипоксией, витаминной недостаточностью или эндокринными расстройствами, или нарушения памяти, вызванные алкоголем или другими причинами, обуславливающими недостаток тиамина, двустороннее повреждение височной доли вследствие простого герпетического энцефалита и другого лимбического энцефалита, вторичную нейронную потерю вследствие гипоксии/гипогликемии/сильных судорог и оперативного вмешательства, дегенеративные расстройства, сосудистые расстройства или патологию вокруг III желудочка головного мозга; расстройства познавательной способности вследствие снижения познавательной способности в результате других болезней; личностные расстройства, включающие параноидное изменение личности, шизоидное изменение личности, шизотипичное изменение личности, антисоциальное изменение личности, пограничное изменение личности, мимическое изменение личности, аутоэротическое изменение личности, изменение личности, связанное с замкнутостью, зависимое изменение личности, навязчиво-компульсивное изменение личности и изменение личности по иным неустановленным причинам; шизоэмоциональные расстройства в результате различных причин, включающие шизоэмоциональные расстройства типа мании, депрессивного типа, смешанного типа, параноидную, деструктивную, кататоническую, недифференцированную и остаточную шизофрению, шизофреническое расстройство,шизоэмоциональное расстройство, бред, краткое психотическое расстройство, частичное психотическое расстройство, психотическое расстройство, вызванное приемом веществ, и психотическое расстройство по иным неустановленным причинам; акинезию, акинезо-ригидные синдромы, дискинезию и паркинсонизм, вызванный приемом лекарственных средств, синдром Жилля де ла Туретта (Gilles de la Tourette) и его симптомы, тремор, хорею, миоклонию, тики и дистонию; дефицит внимания/повышенная активность (ADHD); болезнь Паркинсона, паркинсонизм, вызванный лекарственным средством, пост-энцефалитный паркинсонизм, прогрессирующий супрануклеарный паралич, множественную системную атрофию, кортикобазальную дегенерацию, комплекс паркинсонизма - ALS слабоумия и кальциноз базального ядра головного мозга; слабоумие по типу болезни Альцгеймера с депрессивным настроением, возникающим на ранней или поздней стадии; поведенческие расстройства и расстройства проводимости при слабоумии и замедленном умственном развитии, включающие беспокойство и тревожное возбуждение; экстрапирамидальные нарушения движений; синдром Дауна; акатизию; нарушения питания, включающие невроз анорексии, атипичный невроз анорексии, невроз булимии,атипичный невроз булимии, переедание, связанное с другими физиологическими нарушениями, рвоту,связанную с другими физиологическими нарушениями, и нарушения питания по неустановленным причинам;-7 008189 слабоумие, связанное со СПИДом (AIDS). Состояний хронической боли, включающих невропатическую боль, воспалительную боль, раковую боль и послеоперационную боль после хирургического вмешательства, включая стоматологическую операцию. Данные указания могут также включать острую боль, скелетно-мышечную боль, боль в спине ниже шейного отдела позвоночника, боль в верхних конечностях, фибромиалгию и болевые мышечнолицевые синдромы, болевой ротолицевой синдром, боли в брюшной полости, фантомную боль, боль при невралгии тройничного нерва и атипичную лицевую боль, повреждение нервного корешка и арахноменингит, гериатрическую боль, боль в центральной части позвоночника и воспалительную боль. Нейродегенеративных заболеваний, включающих болезнь Альцгеймера, хорею Гентингтона, болезнь Крейтцфельда-Якоба, болезнь Пика, заболевания, связанные с разрушением миелинового слоя нервных волокон, такие как рассеянный склероз и ALS (боковой амиотрофический склероз), другие невропатии и невралгию, рассеянный склероз, боковой амиотрофический склероз, удар и травму головы. Вредных привычек, включающих зависимость или неправильное употребление, или злоупотребление веществами с или без физиологической зависимости, в особенности, когда вещество представляет собой алкоголь, амфетамины, амфетаминоподобные вещества, кофеин, коноплю, кокаин, галлюциногены, летучие препараты, никотин, синтетические наркотические препараты, фенциклидин, фенциклидиноподобные соединения, седативногипнотические средства, бензодиазепины и/или другие вещества, в частности, применяемые для лечения синдрома отмены вышеуказанных веществ и алкогольного делирия; нарушения эмоционального состояния, в особенности вызванные алкоголем, амфетаминами, кофеином, коноплей, кокаином, галлюциногенами, летучими препаратами, никотином, синтетическими наркотическими препаратами, фенилциклидином, седативными средствами, гипнотическими средствами, анксиолитиками и другими веществами; тревожные расстройства, в особенности вызванные алкоголем, амфетаминами, кофеином, коноплей, кокаином, галлюциногенами, летучими препаратами, никотином, синтетическими наркотическими препаратами, фенциклидином, седативными средствами, гипнотическими средствами, анксиолитиками и другими веществами, и регулируемые расстройства с тревогой. Прекращения курения. Нарушений массы тела, включая ожирение. Расстройств и нарушений сна, включающих бессонницу и/или парасомнию как основные расстройства сна, расстройства сна, связанные с другим психическим расстройством, расстройства сна, обусловленные общим состоянием здоровья, и расстройства сна, вызванные веществом; нарушения циркадного ритма; для улучшения качества сна. Сексуальной дисфункции, включающей нарушения сексуального влечения, расстройства полового возбуждения, оргазменные расстройства, сексуальные болевые расстройства, сексуальную дисфункцию,обусловленную общим состоянием здоровья, сексуальную дисфункцию, вызванную веществами, и сексуальную дисфункцию по иным неустановленным причинам. Настоящее изобретение относится также к соединениям формулы (I), их фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам, их Nоксидной форме, а также к их пролекарствам, применяемым в качестве лекарственного средства, в особенности для лечения депрессии, тревоги, нарушений движений, психоза, болезни Паркинсона и нарушений массы тела. Изобретение относится также к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения в соответствии с данным изобретением, в особенности соединения, соответствующего формуле (I),его фармацевтически приемлемых аддитивных солей кислоты или основания, его стереохимически изомерных форм и его N-оксидной формы или указанного выше пролекарства. Соединения данного изобретения, в частности соединения, соответствующие формуле (I), их фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы и их N-оксидная форма и пролекарства или их любая подгруппа могут быть приготовлены в виде различных лекарственных форм, предназначенных для целей введения. В качестве подходящих композиций в данном описании могут быть цитированы все композиции, обычно используемые для системного введения лекарственных средств. Для приготовления фармацевтических композиций данного изобретения эффективное количество конкретного соединения, необязательно в форме аддитивной соли, в качестве активного ингредиента объединяют с фармацевтически приемлемым носителем, который может иметь широкое множество форм, зависящих от формы требуемого для введения препарата, с получением при этом однородной смеси. Желательно, чтобы указанные фармацевтические композиции находились в виде стандартных лекарственных форм, подходящих, в особенности, для перорального, ректального,чрескожного введения инъекций или ингаляцией. Так, например, для приготовления композиций в виде лекарственной формы для перорального введения может быть использована любая из общепринятых-8 008189 фармацевтических сред, например, такая как вода, гликоли, масла, спирты и подобные - в случае жидких препаратов для перорального введения, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, смазывающие вещества, связывающие вещества, способствующие распадаемости лекарственной формы, и подобные - в случае порошков, пилюль, капсул и таблеток. Таблетки и капсулы, вследствие простоты их введения, являются наиболее удобными стандартными лекарственными формами для перорального введения, в которых несомненно используются твердые фармацевтические носители. Для приготовления композиций, предназначенных для парентерального введения, носитель будет обычно включать, по меньшей мере, большей частью, стерильную воду, хотя, например, для способствования растворимости могут быть включены другие ингредиенты. Могут быть приготовлены, например, инъецируемые растворы, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Могут быть также приготовлены инъецируемые суспензии, в которых могут быть использованы соответствующие жидкие носители, суспендирующие средства и подобные средства. Включены также твердые лекарственные препараты, предназначенные для превращения незадолго до использования в жидкие лекарственные препараты. В композициях, подходящих для чрескожного введения, носитель необязательно включает средство, усиливающее проницаемость внутрь, и/или подходящее увлажняющее средство, необязательно объединенное с подходящими добавками любого происхождения, взятыми в небольших количествах, которые не оказывают существенное неблагоприятное действие на кожу. Такие добавки могут облегчать введение на кожу и/или могут быть полезными для приготовления требуемых композиций. Указанные композиции могут быть введены различными способами, например в виде чрескожного пластыря (наклейки), в виде аппликации, в виде мази. Для облегчения введения и однородности дозы, в особенности, выгодно приготавливать вышеуказанные фармацевтические композиции в виде стандартной лекарственной формы. Использованный в данном описании термин стандартная лекарственная форма относится к физически дискретным унифицированным формам, подходящим в качестве стандартных доз, при этом каждая унифицированная форма содержит заданное количество активного ингредиента, рассчитанное на получение желательного терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включающие таблетки с зарубками или таблетки с покрытием), капсулы, пилюли, порошки в пакетиках, облатки, суппозитории, инъецируемые растворы или суспензии и подобные формы и их отдельные разновидности. Соединения в соответствии с данным изобретением могут быть также подходящими в качестве дополнительного средства для повышения эффективности и/или начала действия лекарственного средства при лечении и/или профилактике вышеперечисленных болезней в комбинации с любой комбинацией соединений, выбранных из группы, состоящей из антидепрессантов, анксиолитиков, нейролептических средств и/или лекарственных средств для лечения болезни Паркинсона, которые являются доступными в текущей практике, или которые находятся в стадии разработки, или которые будут доступны в будущем. Действенность соединений данного изобретения оценивают на моделях грызунов, в отношении которых являются активными антидепрессанты, анксиолитики, нейролептические средства и/или лекарственные средства для лечения болезни Паркинсона. Так, например, соединения оцениваются в комбинации с антидепрессантами, анксиолитиками, нейролептическими средствами и/или лекарственными средствами для лечения болезни Паркинсона на ослабление гипертермии, вызванной стрессом. Таким образом данное изобретение относится также к фармацевтической композиции, содержащей соединения в соответствии с изобретением, в частности соединения, соответствующие формуле (I), их фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы и их N-оксидную форму и пролекарства и одно или более других соединений, выбранных из группы, состоящей из антидепрессантов, анксиолитиков, нейролептических средств и/или лекарственных средств для лечения болезни Паркинсона. Изобретение, кроме того, относится к способу получения фармацевтической композиции, включающему смешивание соединения в соответствии с данным изобретением, в особенности соединений,соответствующих формуле (I), их фармацевтически приемлемых аддитивных солей кислоты или основания, их стереохимически изомерных форм и их N-оксидной формы и пролекарств или любой их подгруппы и соединения у выбранного из группы, состоящей из антидепрессантов, анксиолитиков, нейролептических средств и лекарственных средств для лечения болезни Паркинсона, и фармацевтически приемлемого носителя. Изобретение также относится к применению соединения в соответствии с данным изобретением, в особенности соединений, соответствующих формуле (I), их фармацевтически приемлемых аддитивных солей кислоты или основания, их стереохимически изомерных форм и их N-оксидной формы и пролекарств для производства лекарственного препарата, предназначенного для лечения депрессии, тревоги,нарушения движений, психоза, шизофрении и нарушений массы тела. Для оценки соединений настоящего изобретения на антагонистическую активность в отношении 2-адренорецептора и ингибирующую активность в отношении обратного захвата серотонина (5-НТ) могут быть использованы исследования сигнальной трансдукции (передачи сигнала) и связывания in vi-9 008189tro рецептора и переносчика нейротрансмиттера. В качестве показателей проникновения в центральную нервную систему и эффективности блокирования 2-адренорецепторов и переносчиков серотонина могут быть, соответственно, использованы оккупация 2-адренорецептора и переносчика серотонина exvivo. В качестве показателей антагонизма в отношении 2-адренорецептора in vivo может быть использована инверсия потери установочного рефлекса, наблюдаемая у крыс после подкожного введения или перорального дозирования соединения перед внутривенным введением крысам медетомидина (медетомидиновый тест). В качестве показателей ингибирующей активности в отношении обратного захвата серотонина (5-НТ) может быть использовано ингибирование подергивания головы и возбуждения у крыс,наблюдаемое после подкожного введения или перорального дозирования соединения перед подкожным введением крысам пара-хлорамфетамина (рСА-тест). Соединения в соответствии с данным изобретением могут быть обычно получены последовательными стадиями, каждая из которых известна специалистам в данной области. Соединения, соответствующие формуле (I), могут быть, в частности, получены реакцией промежуточного соединения в соответствии с формулой (IV) (обычно называемой реакцией нуклеофильного замещения в ароматическом ядре) с амином формулы (V) где все группы (переменные) в формуле (IV), за исключением R1 и R2, имеют такое же значение, как и в формуле (I) по меньшей мере один из R1 и R2 представляет собой галоген и не более одного из R1 и R2 выбрано из группы, состоящей из водорода, гидрокси, циано, галогена, OSO2H, ОSО 2 СН 3, N-R10R11, алкилокси, алкилоксиалкилокси, алкилоксиалкилоксиалкилокси, тетрагидрофуранилокси, алкилкарбонилокси, алкилтио, алкилоксиалкилкарбонилокси, пиридинилкарбонилокси, алкилкарбонилоксиалкилокси,алкилоксикарбонилокси, алкенилокси, алкенилкарбонилокси и моно- или ди(алкил)аминоалкилокси. Такая реакция может быть представлена или в виде Указанная реакция может быть осуществлена в инертном реакционном растворителе, таком как пиридин, в присутствии подходящего основания, такого как KF, и при температуре от комнатной до температуры образования флегмы. Заместители R1 и R2 могут быть изменены или взаимозаменены хорошо известными в данной области методами, такими как деметилирование, ацилирование, эстерификация, аминирование и амидирование. В частности могут быть использованы некоторые из реакций, известных как применяемые для восстановления вторичных аминов, например восстановление бензиламинового радикала в соответствующий аминовый радикал с использованием, например, НВr и уксусной кислоты, или синтез вторичного аминового радикала из первичного аминового радикала реакцией с изоцианатом или ацилгалогенидом в соответствующем инертном реакционном растворителе, таком как трихлорметан, в присутствии подходящего основания, такого как триэтиламин.- 10008189 Исходные продукты и некоторые из промежуточных соединений представляют собой соединения,которые являются или коммерчески доступными, или могут быть получены в соответствии с традиционными методиками реакций, известными в данной области. Промежуточные соединения, в особенности промежуточные соединения, соответствующие формуле (IV), в частности, соответствующие формуле (IVa), (IVb) и (IVc), могут быть получены в соответствии с различными путями. В частности, соединения, соответствующие формуле (IVIIa), то есть соединения в соответствии с формулой (IV) с Pir-радикалом в соответствии с формулой (IIа), могут быть получены реакцией нуклеофильного замещения в промежуточном соединении формулы (VII) с замещенным пиперазином, соответствующим формуле (VI). Указанные реакции можно осуществлять в инертном реакционном растворителе, таком как диоксан, метилизобутилкетон или N,N'-диметилформамид, в присутствии подходящего основания, такого как карбонат калия, карбонат натрия или триэтиламин, или даже без основания, с использованием в последнем случае избытка реагента формулы (VI). Подходящий диапазон температур для реакции - от 100 С до 150 С. В промежуточном соединении формулы (VII) L представляет собой любую подходящую химически активную удаляемую группу, в частности галоген, такой как хлор, бром или йод, или сульфонилокси,такой как метилсульфонилокси или 4-метилбензолсульфонилокси. Соединения, соответствующие формуле (IVIIa), могут быть также получены двухстадийной реакционной схемой, в соответствии с которой промежуточное соединение формулы (VII) подвергают сначала взаимодействию (стадия 1) с замещенным пиперазином, соответствующим формуле (VIII), после чего в образовавшееся промежуточное соединение формулы (IX) вводят радикал R3 (стадия 2). Условия реакции подобны условиям, указанным выше для получения промежуточных соединений формулы (IVIIa). В промежуточном соединении формулы (VII) L представляет собой любую подходящую химически активную удаляемую группу, в частности галоген, такой как хлор, бром или йод, или сульфонилокси,такой как метилсульфонилокси или 4-метилбензолсульфонилокси. Одна из азотсодержащих функциональных групп замещенного пиперазина формулы (VIII) может быть также защищена, например, трет-бутоксикарбонильной группой. В соединении формулы (X) L представляет собой любую подходящую химически активную удаляемую группу, в особенности галоген, такой как хлор, бром или йод, или сульфонилокси, такой как метилсульфонилокси или 4-метилбензолсульфонилокси. Вместо соединения формулы (X) может быть также использован R3-CHO, где R3 имеет такое же значение, как и в формуле (I). Соединения, соответствующие формуле (IVIIa), могут быть также получены двухстадийной реакционной схемой, в соответствии с которой промежуточное соединение формулы (IX) подвергают взаимодействию с кислотой, соответствующей формуле (XI) (стадия 1), с последующим восстановлением карбонильной функциональной группы промежуточного соединения формулы (XII) (стадия 2). Реакции стадии 1 могут быть осуществлены в инертном реакционном растворителе, таком как хлороформ, дихлорметан, тетрагидрофуран, диметилформамид или их смесь, с применением любой из методик, известных специалистам в данной области, и с использованием конденсационных реагентов, таких как 1,1'карбонилдиимидазол, N,N'-дициклогексилкарбодиимид, или указанным выше превращением карбоновой кислоты формулы (XI) в соответствующий хлорангидрид кислоты. Реакции, показанные на стадии 2,- 11008189 могут быть осуществлены с использованием подходящего восстановителя, такого как алюмогидрид лития или гидрид алюминия, в подходящем растворителе, например, тетрагидрофуране. Указанные реакции обычно протекают при температуре в диапазоне от -20 С до комнатной температуры. В промежуточных соединениях формул (XI), (XII) и (XIII) группа А представляет собой необязательно замещенную ароматическую гомоциклическую или гетероциклическую структуру, включающую частично или полностью гидрированную углеводородную цепь, содержащую, как максимум, 5 атомов углерода, один или более из которых могут быть замещены одним или несколькими атомами, выбранными из группы, состоящей из кислорода, азота и серы, с помощью которой циклическая структура присоединена к определенному выше Pir-радикалу. Промежуточные соединения формулы (VII), в которых Х=O, могут быть получены в соответствии со следующей реакционной схемой: В промежуточном соединении формулы (XV) L представляет собой любую подходящую химически активную удаляемую группу, в особенности галоген, такой как хлор, бром или йод, или сульфонилокси,такой как метилсульфонилокси или 4-метилбензолсульфонилокси. Кроме того, Alk в промежуточном соединении формулы (XV) представляет собой любую C1-6 алкильную группу, в особенности этильную группу, и m является таким, как он определен в формуле (I). Промежуточные соединения, соответствующие формуле (VII), в которых X=NH, могут быть также получены способом, эквивалентным вышеуказанной стадии 1 а, при условии, что промежуточное соединение формулы (XIV) заменено его аминовым аналогом формулы (XVII), предпочтительно с аминогруппой, защищенной, например, СОСF3-группой. Стадию алкилирования можно осуществлять в инертном реакционном растворителе, например тетрагидрофуране или диметилформамиде, в присутствии сильного основания, такого как гидрид натрия или калия, и дополнительно краун-эфира, такого как 18-краун-6 или 15-краун-5. Подходящий диапазон температур для реакции - от комнатной температуры до 60 С. Промежуточные соединения формулы (XVIII) превращают в оксимы формулы (XIX) с применением известных в данной области методик, например, с использованием гидрохлорида гидроксиламина в присутствии NаНСО 3 или пиридина в инертном реакционном растворителе, например этаноле (стадия 2). Промежуточные соединения формулы (XIX) окисляют до их нитрилоксидов и in situ подвергают внутримолекулярному циклоприсоединению с получением промежуточных соединений формулы (XX). Окисление можно осуществлять с использованием раствора гипохлорита натрия в присутствии триэтиламина в инертном растворителе, таком как дихлорметан, при комнатной температуре. Окисление можно также осуществлять с использованием хлорамина-ТN-хлор-4 метилбензолсульфонамида) при перемешивании и нагревании в растворителе, таком как этанол при температуре флегмы. На данной стадии образуются два стереоцентра а и b формулы (IV). Получение промежуточного соединения формулы (XXI) может быть достигнуто с использованием методик, известных в данной области, например восстановлением карбонильного соединения формулы(XX) в присутствии подходящего восстановителя, например боргидрида натрия, в подходящем растворителе, таком как вода, спирт, тетрагидрофуран или их смесь, обычно при комнатной температуре. Промежуточное соединение формулы (VII) может быть получено из промежуточного соединения формулы (XXI) с использованием стандартных методик. Таким образом, взаимодействие с метансульфонилхлоридом или 4-метилбензолсульфонилхлоридом в присутствии основания, такого как триэтиламин,в инертном реакционном растворителе, например дихлорметане, при температурах реакции в диапазоне от 0 С до комнатной температуры дает соответствующее сульфонилоксипроизводное промежуточное соединение формулы (VII). Соответствующее галогенпроизводное может быть также получено, например, обработкой промежуточного соединения формулы (XXI) трифенилфосфином в присутствии тетрахлорметана в инертном реакционном растворителе, таком как тетрагидрофуран, при перемешивании и кипячении смеси с обратным холодильником. Очевидно, что в предшествующих и последующих реакциях продукты реакции могут быть выделены из реакционной среды и, в случае необходимости, затем очищены в соответствии с методиками, известными в данной области, такими как экстракция, кристаллизация и хроматография. Кроме того, очевидно, что продукты реакции, которые существуют в более чем одной энантиомерной форме, могут быть выделены из их смеси известными методиками, в особенности препаративной хроматографией, такой как препаративная ВЭЖХ. Обычно промежуточные соединения (VII) и (IV) и конечные соединения, соответствующие формуле (I), могут быть разделены на их энантиомерные формы. Соединения в соответствии с изобретением, в которых X=CH2, могут быть получены в соответствии со следующей реакционной схемой (схема 1), согласно которой промежуточное соединение, соответствующее формуле (VI), сначала N-алкилируют дигалогенпроизводным формулы (XXII) с использованием стандартных методик в присутствии или в отсутствие основания и в инертном реакционном растворителе, таком как хлороформ, дихлорметан или 1,2-дихлорэтан, и при температурах реакции в диапазоне от комнатной температуры до 80 С с получением промежуточного соединения формулы (XXIII). Альдегид формулы (XXIV) подвергают взаимодействию с трет-бутиламином (XXV) в апротонном рас- 13008189 творителе, таком как толуол, при перемешивании и нагреве при температуре образования флегмы с удалением воды с использованием стандартного устройства, такого как ловушка Дина-Старка, с получением имина формулы (XXVI). С-алкилирование промежуточного соединения формулы (XXVI) промежуточным соединением формулы (XXIII) может быть достигнуто в присутствии алкиллитиевого производного,такого как н-бутиллитий, в инертной атмосфере и в сухом инертном растворителе, таком как тетрагидрофуран, при низких температурах в диапазоне от -78 до 0 С с получением промежуточного соединения формулы (XXVII). Промежуточное соединение формулы (XXVIII) может быть получено взаимодействием промежуточного соединения формулы (XXVII) с гидроксиламином в присутствии основания, такого как бикарбонат натрия, в растворителе, таком как низший алкиловый спирт, подобный этанолу, обычно при комнатной температуре. И наконец, окисление производного оксима формулы (XXVIII) до его нитрилоксида и последующее циклоприсоединение in situ с получением промежуточного соединения формулы (XXIX) может быть достигнуто подобными стандартными методиками, такими, которые указаны выше для промежуточного соединения формулы (XIX), взаимодействующего с получением промежуточных соединений формулы (XX). Схема 1 Очевидно, что раскрытые выше реакционные стадии могут быть приспособлены к получению определенных продуктов реакции. Раскрытые реакционные стадии могут быть осуществлены любым путем, известным специалистам в данной области, включающим реакции в растворе или в твердой фазе,при этом в последнем случае продукты реакции связаны с полимерным материалом и высвобождаются из полимерного материала на конечной стадии расщепления. Примеры таких вариантов и модификаций раскрыты далее в данной заявке с целью иллюстрации примеров. Следующие примеры иллюстрируют настоящее изобретение, не ограничивая его. Экспериментальная часть Использованная в данной заявке система нумерации углеродного цикла в соединениях, соответствующих формуле (I), является следующей: У некоторых соединений абсолютная стереохимическая конфигурация стереогенного(ых) атома(ов) углерода в данном описании экспериментально не определена. В таких случаях стереохимически изомерная форма, которая выделена первой, обозначена А и вторая форма обозначена В без дополнительной ссылки на реальную стереохимическую конфигурацию. Однако, указанные изомерные формы А и В могут быть недвусмысленно охарактеризованы специалистами в данной области с использованием известных в данной области методов, например, таких как дифракция рентгеновских лучей. Стереогенные центры а и b в соединениях формулы (I) имеют соответственно номера в цикле 3 а и 3. Далее в описании DMF (ДМФ) означает N,N'-диметилформамид, DIPE означает простой диизопропиловый эфир и THF (ТГФ) означает тетрагидрофуран. А. Получение промежуточных соединений Пример А.1 а. Получение промежуточного соединения 1 Смесь (3-хлор-2-метил-1-пропенил)бензола (0,0506 моль), 1,1-диметилэтил-1-пиперазинкарбоксилата (0,076 моль) и NаНСО 3 (0,0506 моль) в СНСl3 (150 мл) перемешивали и кипятили с обратным холодильником в течение 9 ч. Реакционную смесь обрабатывали водой и экстрагировали СН 2 Сl2. Остаток очищали хроматографией на силикагеле в короткой открытой колонке (элюент: СН 2 Сl2/СН 3 ОН 99/1). Чистые фракции собирали и выпаривали растворитель. Выход: 16,7 г промежуточного соединения 1 (98%).b. Получение промежуточного соединения 2 К раствору промежуточного соединения 1 (0,0496 моль) в СН 2 Сl2 (350 мл) добавляли по каплям трифторуксусную кислоту (81 мл) и полученную реакционную смесь перемешивали в течение 4 ч при комнатной температуре. Реакционную смесь охлаждали и подщелачивали 50% NaOH. Полученную смесь экстрагировали и выпаривали органический растворитель. Выход: 9,6 г промежуточного соединения 2. Пример А.2 а. Получение промежуточного соединения 3 К раствору 4-фтор-2-гидроксибензальдегида (0,0143 моль) в ДМФ (16 мл), перемешиваемому при 0 С, добавляли К 2 СО 3 (0,0265 моль) и этил (Е)-4-бром-2-бутеноат (0,02145 моль). Реакционная смесь перемешивалась в течение 5 ч при комнатной температуре. Добавляли воду и полученную смесь экстрагировали СН 2 Сl2. Отделенный органический слой сушили (Na2SO4), фильтровали и выпаривали растворитель. Остаток очищали хроматографией на силикагеле в короткой открытой колонке (элюент СН 2 Сl2/гексан при их соотношении 1/1 и 2/1). Собирали требуемые фракции и выпаривали растворитель. Выход: 3,47 г промежуточного соединения 3.b. Получение промежуточного соединения 4 К раствору промежуточного соединения 3 (0,0138 моль) в этаноле (35 мл), перемешиваемому при 0 С, добавляли NaOAc (0,0207 моль) и гидроксиламин (0,0165 моль). Реакционную смесь перемешивали в течение 2 ч при 0 С. Затем добавляли CH2Cl2 и воду. Смесь нейтрализовали насыщенным водным раствором NaHCO3. Органический слой отделяли, сушили (Na2SO4), фильтровали и выпаривали растворитель. Выход: 4,65 г промежуточного соединения 4. с. Получение промежуточного соединения 5 К раствору промежуточного соединения 4 (0,0174 моль) в СН 2 Сl2 (70 моль) при 0 С добавляли по каплям 4% NaClO (0,0348 моль). Реакционная смесь перемешивалась в течение 2 ч при комнатной температуре. При 0 С добавляли по каплям Et2N (0,0261 моль) и образовавшаяся реакционная смесь перемешивалась в течение 24 ч при комнатной температуре. Органический слой отделяли, сушили (Na2SO4),фильтровали и выпаривали растворитель. Остаток очищали хроматографией на силикагеле в короткой открытой колонке (элюент: CH2Cl2/EtOAc 100/0, затем 90/10). Собирали фракции продукта и выпаривали растворитель. Выход: 1,2 г промежуточного соединения 5 (26%).d. Получение промежуточного соединения 6 К раствору промежуточного соединения 5 (0,0042 моль) в ТГФ (32 мл) и Н 2O (3 мл) при 0 С добавляли порциями NaBH4 (0,0105 моль). Реакционная смесь перемешивалась в течение 24 ч при комнатной температуре. Добавляли насыщенный водный раствор NH4Cl и полученную смесь экстрагировали СН 2 Сl2. Отделенный органический слой сушили (Na2SO4), фильтровали и выпаривали растворитель. Остаток очищали хроматографией на силикагеле в короткой открытой колонке (элюент: CH2Cl2/EtOAc 9/1 и СН 2 Сl2/2-пропанон 4/1). Собирали требуемые фракции и выпаривали растворитель. Выход: 0,76 г промежуточного соединения 6 (81%). е. Получение промежуточного соединения 7 К раствору промежуточного соединения 6 (0,00336 моль) и Et3N (0,00504 моль) в СН 2 Сl2 (15 мл) при 0 С добавляли метансульфонилхлорид (0,003696 моль). Реакционная смесь перемешивалась в течение 60 мин при 0 С. Добавляли СН 2 Сl2. Добавляли насыщенный водный раствор NaHCO3. Органический слой отделяли, сушили (Na2SO4), фильтровали и выпаривали растворитель. Выход: 0,890 г промежуточного соединения 7 (88%).- 16008189 Пример А.3. Получение промежуточного соединения 8 Смесь промежуточного соединения 7 (0,0029 моль), промежуточного соединения 2 (0,0035 моль) иNаНСО 3 (0,0043 моль) в 1,4-диоксане (15 мл) перемешивалась и кипятилась с обратным холодильником в течение 24 ч. Добавляли воду. Смесь экстрагировали СН 2 Сl2. Отделенный органический слой сушили(Na2SO4), фильтровали и выпаривали растворитель. Остаток очищали хроматографией на силикагеле в короткой открытой колонке (элюент: CH2Cl2/EtOAc 9/1, затем чистый EtOAc). Собирали требуемые фракции и выпаривали растворитель. Остаток промывали DIPE, затем сушили. Выход: 0,170 г промежуточного соединения 8 (14%). Пример А.4. Получение промежуточного соединения 13(0,3197 моль) и СН 2O (1,023 моль) в СН 3 СN (320 мл) перемешивалась при кипячении с обратным холодильником в течение ночи. Неочищенную реакционную смесь промывали НСl (5%) и экстрагировалиAcOEt. Органический слой сушили над Na2SO4, фильтровали и выпаривали досуха. Остаток очищали хроматографией в открытой колонке с использованием в качестве элюентов СН 2 Сl2 и смеси СН 2 Сl2:МеОН (1, 2, 4, 10%). Получали 1,13 г промежуточного соединения 13 и 14,99 г смеси, содержащей исходный продукт и ожидаемый продукт. Реакцию повторяли с полученной смесью (0,077 моль), МgСl2(0,1164 моль), Et3N (0,2909 моль) и СН 2O (0,5237 моль) в СН 3 СN (320 мл). Полученный продукт очищали хроматографией в открытой колонке с использованием в качестве элюента смеси CH2Cl2:МеОН (1, 2, 4,10%). Выход: 9,34 г промежуточного соединения 13. Общий выход: 10,47 г промежуточного соединения 13 (55%). В. Получение конечных соединений Пример В.1. Получение конечного соединения 1 К раствору промежуточного соединения 8 (полученному в соответствии с А.3) (0,0002372 моль) в пиридине (2 мл), перемешиваемому в атмосфере N2, добавляли N,N,N'-триметил-1,2-этандиамин(0,0028469 моль). Реакционная смесь перемешивалась и кипятилась с обратным холодильником в течение 24 ч в герметизированной трубке. Добавляли дополнительное количество N,N,N'-триметил-1,2 этандиамина (0,0028469 моль) и реакционная смесь перемешивалась в течение 3 дней при 120 С. Выпаривали растворитель. Остаток очищали хроматографией на силикагеле в короткой открытой колонке(элюент: СН 2 Сl2/СН 3 ОН 98/2 и 95/5). Собирали фракции продукта и выпаривали растворитель. Выход: 0,090 г (свободное основание, 76%). Остаток растворяли в 2-пропаноле и превращали в гидрохлоридную кислую соль (1:2) с использованием смеси HCl/2-пропанол. Остаток отфильтровывали и сушили. Выход: 0,045 г конечного соединения 1 (33%). Пример В.2. Получение конечного соединения 2 Смесь промежуточного соединения 8 (полученного в соответствии с А.3) (0,0024 моль), бензолметанамина (0,0288 моль) и KF (0,0024 моль) нагревалась в течение 5 дней при 150 С в герметизированной- 17008189 трубке. Добавляли дополнительное количество бензолметанамина (0,0288 моль) и реакционная смесь нагревалась при 150 С в течение 18 ч. Добавляли воду. Полученную смесь экстрагировали СН 2 Сl2. Отделенный органический слой сушили (Na2SO4),фильтровали и выпаривали растворитель. Остаток очищали хроматографией на силикагеле в короткой открытой колонке (элюент: CH2Cl2/EtOAc 2/1). Собирали фракции продукта и выпаривали растворитель. Остаток промывали DIPE, затем сушили. Выход: 0,890 г конечного соединения 2 (73%). Пример В.3 Получение конечного соединения 3 Реакцию проводили в атмосфере N2. Герметизированную трубку загружали промежуточным соединением 9(полученным в соответствии с А.3) (0,0003997 моль), 4-метилбензолсульфонамидом (0,0004796 моль),Pd(OAc)2 (0,000004 моль), Xantphos (0,000006 моль) и Сs2 СО 3 (0,0005996 моль) в 1,4-диоксане (2 мл),предварительно дезоксигенированном. Реакционная смесь нагревалась до 100 С в течение 24 ч. Добавляли дополнительное количество Pd(OAc)2 (0,000012 моль) и Xantphos (0,000018 моль) и реакционная смесь нагревалась в течение еще 24 ч при 100 С. Реакционную смесь охлаждали до комнатной температуры, разбавляли СН 2 Сl2, фильтровали через целит и фильтрат выпаривали. Остаток очищали хроматографией в колонке с силикагелем Sep-Pak (элюент: СН 2 Сl2/(СН 3 ОН/NН 3) 100/0 и 99/1). Собирали фракции продукта и выпаривали растворитель. Остаток промывали DIPE, затем сушили. Выход: 0,100 г конечного соединения 3 (42%). (Xantphos = 9,9-диметил-9 Н-ксантен-4,5-диил)би [дифенилфосфин]=CAS 161265-03-8. Пример В.4 Получение конечного соединения 4 Смесь промежуточного соединения 10(0,000008 моль), трет-BuONa (0,0004945 моль) и морфолина (0,0003296 моль) в толуоле (требуемое количество) перемешивалась в герметизированной трубке в атмосфере азота в течение 24 ч. Добавляли дополнительное количество морфолина (0,0003296 моль), и реакционная смесь перемешивалась в течение 24 ч при 100 С. Затем добавляли воду и полученную смесь экстрагировали CH2Cl2. Отделенный органический слой сушили (Na2SO4), фильтровали и выпаривали растворитель. Остаток очищали хроматографией в колонке с силикагелем Sep-Pak (элюент: СН 2 Сl2/(СН 3 ОН/NН 3) 100/0 и 99/1) и промывали DIPE. Выход: 0,040 г конечного соединения 4 (23%). Пример В.5. Получение конечного соединения 5 Смесь конечного соединения 2 (полученного в соответствии с В.2) (0,002949 моль) в НВr (25 мл) и АсОН (50 мл) нагревалась при 80 С в течение 15 дней. Реакционную смесь охлаждали и обрабатывалиNа 2 СО 3 до рН 7-8, экстрагировали СН 2 Сl2 и досуха выпаривали растворитель. Остаток очищали хромато- 18008189 графией на силикагеле в короткой открытой колонке (элюент: CH2Cl2/MeOH 99/1; 98/2). Собирали фракции продукта и выпаривали растворитель. Остаток промывали DIPE. Выход: 0,5 г конечного соединения 5 (41%). Пример В.6. Получение конечного соединения 6 К смеси конечного соединения 5 (полученного в соответствии с В.5) (0,0004301 моль) и Et3N(0,0012903 моль) в СНСl3 (7 мл), перемешиваемой при 0 С, добавляли метилкарбонилхлорид (0,0006451 моль). Реакционная смесь перемешивалась в течение 2 ч при комнатной температуре. Добавляли насыщенный водный раствор NаНСО 3. Органический слой отделяли, сушили (Na2SO4), фильтровали и выпаривали растворитель. Остаток очищали хроматографией на силикагеле в короткой открытой колонке(элюент: СН 2 Сl2/СН 3 ОН 97/3 и 96/4). Собирали требуемые фракции и выпаривали растворитель. Выход: 0,100 г конечного соединения 6 (51%). Пример В.7. Получение конечного соединения 7 К раствору конечного соединения 5 (полученного в соответствии с В.5) (0,0004779 моль) в ТГФ (3 мл) добавляли 4-изоцианато-1,2-диметоксибензол (0,0007646 моль). Реакционная смесь перемешивалась в течение 24 ч при комнатной температуре. Выпаривали растворитель. Остаток очищали хроматографией в колонке с силикагелем Sep-Pak (элюент: CH2Cl2/ (СН 3 ОН/NН 3) 99/1 и 98/2). Собирали требуемые фракции и выпаривали растворитель. Остаток промывали DIPE, затем сушили. Выход: 0,210 г конечного соединения 7 (73%). Пример В.8. Получение конечного соединения 8 К раствору промежуточного соединения 11(полученного в соответствии с А.3)(0,014981 моль) в СН 2 Сl2 (20 мл) добавляли по каплям ТФУ (TFA) (4 мл). Реакционная смесь перемешивалась при комнатной температуре в течение 5 ч. Затем смесь подщелачивали Na2CO3 (насыщенный раствор), экстрагировали СН 2 Сl2 и выпаривали досуха. Твердое вещество промывали DIPE. Выход: 500 мг конечного соединения 8 (76%). Пример В.9. Получение конечного соединения 9 Реакцию проводили в атмосфере азота. Герметизированную трубку загружали Сs2 СО 3 (0,0008196 моль), который тонко измельчали и сушили в эксикаторе. Затем трубку загружали Pd(OAc)2 (0,0391 ммоль) и R-BINAP (0,0000527 моль), предварительно смешанными в дезоксигенированном толуоле (3 мл). Затем добавляли промежуточное соединение 12(полученное в соответствии с А.3) (0,0005854 моль) и N,N'-диметил-1,2-этандиамин (0,0007025 моль) и смесь нагревалась до 100 С в течение 24 ч. Затем добавляли дополнительное количество N,N'-диметил 1,2-этандиамина (0,0007025 моль) и смесь нагревалась до 100 С в течение 24 ч. Смесь охлаждали до комнатной температуры, разбавляли СН 2 Сl2, фильтровали через рыхлый слой целлита и концентрировали. Остаток очищали хроматографией в колонке с силикагелем Sep-Pak (элюент: CH2Cl2 иCH2Cl2/(СН 3 ОН/NН 3) 1 и 2%) и промывали DIPE. Выход: 107 мг конечного соединения 9 (35%). Пример В.10. Получение конечного соединения 10 Связанный с полимером DIEA промывали СНСl3 (4 мл). После этого трубку загружали конечным соединением 8 (полученным в соответствии с В.8) (0,0002229 моль), DIEA (0,0004458 моль) в СНСl3 (4 мл) и затем при 0 С добавляли ацетилхлорид (0,0002675 моль). Смесь перемешивалась в течение 3 ч при комнатной температуре. Затем добавляли связанный с полимером трис(2-аминоэтил)амин (0,0002229 моль) и смесь перемешивалась в течение ночи при комнатной температуре. Смесь фильтровали, концентрировали и остаток промывали DIPE. Выход: 75 мг конечного соединения 10 (69%). Пример В.11. Получение конечного соединения 11 К смеси конечного соединения 9 (полученного в соответствии с В.9) (0,0002886 моль) и СН 2O(0,0008658 моль) в МеОН (4 мл) добавляли ZnBr2 (0,0001443 моль). Ее перемешивали при комнатной температуре в течение 15 мин и добавляли NаСNВН 3 (0,0004329 моль). Образовавшаяся реакционная смесь перемешивалась при кипячении с обратным холодильником в течение 24 ч. Затем добавляли дополнительные количества СН 2 О (0,0002886 моль), ZnBr2 (0,0001443 моль) и NаСNВН 3 (0,0004329 моль) и реакционная смесь перемешивалась при кипячении с обратным холодильником в течение 24 ч. Затем опять добавляли дополнительные количества СН 2 О (0,0002886 моль), ZnBr2 (0,0001443 моль) иNаСNВН 3 (0,0004329 моль) и смесь обрабатывали NH4Cl (10%), и экстрагировали СН 2 Сl2. Органический слой отделяли, сушили (Na2SO4) и выпаривали растворитель. Остаток очищали хроматографией в колонке с силикагелем Sep-Pak (элюент: СН 2 Сl2 и СН 2 Сl2/(СН 2 ОН/NН 3) 1%) и лиофилизовали. Выход: 28 мг конечного соединения 11 (18%). Пример В.12. Получение конечного соединения 12 Смесь промежуточного соединения 14(полученного в соответствии с А 2.е) (0,0099 моль), промежуточного соединения 2 (полученного в соответствии с A1.b) (0,0149 моль), KI (0,0099 моль) и К 2 СО 3 (0,0099 моль) в MIK (35 мл) перемешивалась при кипячении с обратным холодильником в течение ночи. Неочищенную реакционную смесь вы- 20008189 паривали досуха и остаток промывали водой. Ее экстрагировали AcOEt, сушили над Na2SO4, фильтровали и выпаривали досуха. Остаток очищали хроматографией в открытой колонке с использованием в качестве элюента смеси СН 2 Сl2:МеОН (4%). Выход: 3,1 г конечного соединения 12 (62%). Пример В.13. Получение конечного соединения 13 Смесь конечного соединения 12(полученного в соответствии с В.12) с исходным промежуточным соединением 13 (полученным в соответствии с А.4), вместо 4-фтор-2-гидроксибензальдегида (А 2.а) (0,0046 моль), 15% NaSMe/H2O (4,41 мл) и МеОН (42 мл) перемешивалась при кипячении с обратным холодильником в течение 2 ч и при комнатной температуре в течение ночи. Неочищенную реакционную смесь концентрировали в вакууме и остаток промывали водой и экстрагировали AcOEt. Органический слой сушили над Na2SO4, фильтровали и выпаривали досуха. Остаток очищали хроматографией в открытой колонке с использованием в качестве элюентов смеси СН 2 Сl2:МеОН (1, 2, 4%). И наконец, продукт кристаллизовали из DIPE. Выход: 0,85 конечного соединения 13 (39%). Пример В.14. Получение конечного соединения 14 К смеси конечного соединения 13 (полученного в соответствии с В.13) (0,000217 моль) и СН 2 ОZnBr2 (0,0001 моль). Ее перемешивали при комнатной температуре в течение 15 мин и добавляли МеОН(3 мл). Образовавшаяся реакционная смесь перемешивалась при кипячении с обратным холодильником в течение 2 дней. Неочищенную реакционную смесь промывали 10% раствором NH4Cl и ее экстрагировали AcOEt. Органический слой сушили над Na2SO4, фильтровали и выпаривали досуха. Остаток очищали сначала в manifold под вакуумом с использованием картриджа с силикагелем Sep-Pak (5 г) (элюенты = СН 2 Сl2 и СН 2 Сl2:МеОН (1, 2%), затем очищали ВЭЖХ с использованием в качестве элюента смесиCH2Cl2:МеОН (2%). Выход: 0,03 г конечного соединения 14 (29%). Пример В.15. Получение конечного соединения 15 К смеси конечного соединения 13 (полученного в соответствии с В.13) (0,00043 моль) и Et3N(0,00065 моль) в СНСl3 (4 мл), охлажденной с использованием бани со льдом, добавляли метоксиацетилхлорид (0,00043 моль) и образовавшаяся реакционная смесь перемешивалась при комнатной температуре в течение ночи. Неочищенную реакционную смесь промывали насыщенным раствором NаНСО 3 и ее экстрагировали СН 2 Сl2. Органический слой сушили над Na2SO4, фильтровали и выпаривали досуха. Остаток очищали в manifold под вакуумом с использованием картриджа с силикагелем Sep-Pak (5 г) (элюенты = СН 2 Сl2:ацетон (10%) и CH2Cl2:МеОН (2%). И, наконец, продукт кристаллизовали из DIPE. Выход: 0,6782 г конечного соединения 15 (34%). Пример В.16. Получение конечного соединения 16 Смесь конечного соединения 13 (полученного в соответствии с В.13) (0,00026 моль), EtNCO(0,00041 моль) и толуола (3 мл) перемешивалась при 75 С в течение ночи в герметизированной трубке. Выпаривали растворитель и остаток очищали в manifold под вакуумом с использованием картриджа с силикагелем Sep-Pak (5 г) (элюенты = CH2Cl2, CH2Cl2: ацетон 10% и СН 2 Сl2:МеОН 2%). И наконец, продукт кристаллизовали из DIPE в виде сиропа. Выход: 0,0595 г конечного соединения 16 (43%). В следующих таблицах (табл. 1-4) дан ряд соединений, которые были получены в соответствии с любым из вышепредставленных примеров. Все соединения были испытаны на их фармакологическую активность. Таблица 1
МПК / Метки
МПК: C07D 498/14, C07D 265/00, C07D 311/00, A61K 31/5383, C07D 261/00, A61K 31/424, C07D 261/20, A61P 25/00, C07D 498/04
Метки: применение, производные, замещенные, антидепрессантов, качестве, аминоизоксазолина
Код ссылки
<a href="https://eas.patents.su/30-8189-zameshhennye-proizvodnye-aminoizoksazolina-i-ih-primenenie-v-kachestve-antidepressantov.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные аминоизоксазолина и их применение в качестве антидепрессантов</a>
Предыдущий патент: Способ обработки акустического поля и акустический модуль для его реализации
Следующий патент: Композиция для защитного покрытия
Случайный патент: Сварка элементов из политетрафторэтилена