Производные изоксазолина в качестве антидепрессантов
Номер патента: 6747
Опубликовано: 28.04.2006
Авторы: Ланглуа Ксавье Жан Мишель, Стеклер Томас Хорст Вольфганг, Хейлен Годеливе Ирма Кристин Мария, Мегенс Антониус Адрианус Хендрикус Петрус, Пастор-Фернандес Хоакин, Баккер Маргарета Хенрика Мария, Сид-Нуньес Хосе Мария, Алькасар-Вака Мануэль Хесус, Фернандес-Гадеа Франсиско Хавьер, Андрес-Хиль Хосе Игнасио
Формула / Реферат
1. Соединение общей формулы (I)
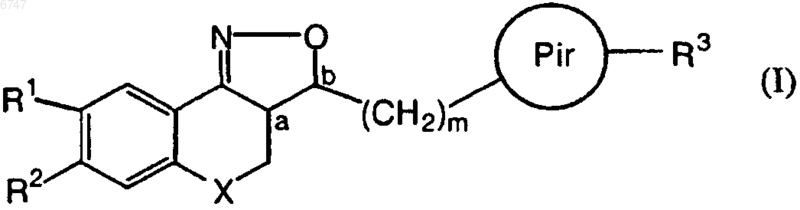
где Х представляет собой СН2, N-R7 или О;
R7 выбран из группы, включающей водород, алкил, фенил, фенилалкил, алкилкарбонил, алкилоксикарбонил и моно- и диалкиламинокарбонил, причем фенильные и алкильные группы необязательно замещены одним или несколькими атомами галогена;
R1 и R2 выбраны, каждый независимо, из группы, включающей водород, гидрокси, циано, галоген, OSO2H, ОSО2СН3, фенил, фенилалкил, алкилокси, алкилоксиалкилокси, алкилоксиалкилоксиалкилокси, тетрагидрофуранилокси, алкилкарбонилокси, алкилтио, алкилоксиалкилкарбонилокси, пиридинилкарбонилокси, алкилкарбонилоксиалкилокси, алкилоксикарбонилокси, алкенилокси, алкенилкарбонилокси и моно- и диалкиламиноалкилокси и алкильные и арильные радикалы необязательно замещены одним или несколькими гидрокси или атомами галогена или аминогруппами; или
R1 и R2 могут быть взяты вместе с образованием бивалентного радикала -R1-R2-, выбранного из группы, включающей -СН2-СН2-O-, -O-СН2-СН2-, -O-СН2-O-, -СН2-O-СН2- и -O-СН2-СН2-O-;
а и b являются асимметричными центрами;
(СН2)m представляет собой линейную углеводородную цепь из m атомов углерода, где m равно целому числу в интервале от 1 до 4;
Pir представляет собой радикал согласно любой из формул (IIа), (IIb) или (IIс)
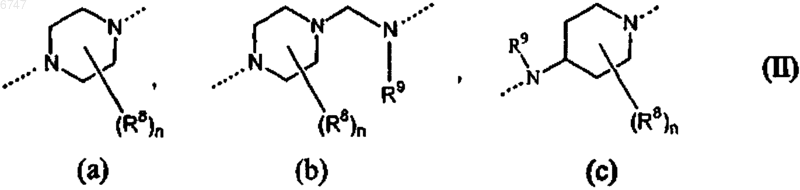
где каждый R8 выбран независимо из группы, включающей водород, гидрокси, амино, нитро, циано, галоген и алкил;
n равно целому числу в интервале от 1 до 5;
R9 выбран из группы, включающей водород, алкил и формил; и
R3 представляет собой радикал согласно любой из формул (III)

где d представляет собой простую связь, в то время как Z представляет собой бивалентный радикал, выбранный из группы, включающей -СН2-, -С(=O)-, -СН(ОН)-, -C(=N-OH)-, -CH(алкил)-, -О-, -S-, -S(=O)- и -NH-; или d представляет собой двойную связь, в то время как Z представляет собой трехвалентный радикал формулы =СН- или =С(алкил)-;
А представляет собой 5- или 6-членный ароматический гомоциклический или гетероциклический цикл, выбранный из группы, включающей фенил, пиранил, пиридинил, пиразинил, пиримидинил, пиридазинил, тиенил, изотиазолил, пирролил, имидазолил, пиразолил, фуранил, оксадиазолил и изоксазолил;
р равно целому числу в интервале от 0 до 4;
q равно целому числу в интервале от 0 до 7;
R4 выбран из группы, включающей водород, алкил, фенил, бифенил, нафтил, галоген и циано, и алкильный и арильный радикалы необязательно замещены одним или несколькими гидрокси или атомами галогена или аминогруппами;
R5 равен R4; или
R4 и R5 могут быть взяты вместе с образованием бивалентного радикала -R4-R5-, выбранного из группы, включающей -СН2-, =СН-, -СН2-СН2-, -СН=СН-, -О-, -NH-, =N-, -S-, -CH2N (алкил)-, -CH=N-,
-СН2O- и -ОСН2-;
каждый R6 независимо выбран из группы, включающей водород, гидрокси, амино, нитро, циано, галоген, карбоксил, алкил, фенил, алкилокси, фенилокси, алкилкарбонилокси, алкилоксикарбонил, алкилтио, моно- и диалкиламино, алкилкарбониламино, моно- и диалкиламинокарбонил, моно- и диалкиламинокарбонилокси, моно- и диалкиламиноалкилокси, и алкильный и арильный радикалы необязательно замещены одним или несколькими гидрокси или атомами галогена или аминогруппами; или
два соседних радикала R6 могут быть взяты вместе с образованием бивалентного радикала -R6-R6-, выбранного из группы, включающей -СН2-СН2-O-, -O-СН2-СН2-, -O-СН2-С(=O)-, -O-CH2-O-, -CH2-O-CH2-, -O-СН2-СН2-O-, -СН=СН-СН=СН-, -CH=CH-CH=N-, -CH=CH-N=CH-, -CH=N-CH=CH-, -N=CH-CH=CH-, -CH2-CH2-CH2-, -CH2-CH2-C(=O)- и -СН2-СН2-СН2-СН2-; и
R10 выбран из группы, включающей водород, алкил, фенилалкил и фенил,
алкил представляет собой линейные или разветвленные насыщенные углеводородные радикалы с 1-6 атомами углерода или циклические насыщенные углеводородные радикалы с 3-6 атомами углерода;
галоген представляет собой фтор, хлор, бром или йод;
его фармацевтически приемлемая аддитивная соль кислоты или основания, их стереохимически изомерные формы и их N-оксидные формы.
2. Соединение по п.1, отличающееся тем, что Х=О или NH; R1 и R2, оба, представляют собой алкилокси; m=1; Pir представляет собой радикал формулы (IIа), где R8 представляет собой водород, и n=4; R3 представляет собой радикал формулы (IIIb), где Z представляет собой =СН-, d представляет собой двойную связь, А представляет собой фенильный цикл, R4 представляет собой алкил, и R10 представляет собой водород.
3. Применение соединения по любому из пп.1-2 в качестве лекарственного средства для лечения депрессии, тревоги и нарушений массы тела.
4. Применение соединения по любому из пп.1-2 при получении лекарственного средства для лечения депрессии, тревоги и нарушений массы тела.
5. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения по любому из пп.1-2.
6. Способ получения фармацевтической композиции по п.5, включающий смешивание соединения по любому из пп.1-2 и фармацевтически приемлемого носителя.
7. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-2 и одно или несколько других соединений, выбранных из группы, включающей антидепрессанты, анксиолитики и антипсихотические средства.
8. Способ получения фармацевтической композиции по п.7, включающий смешивание соединения по любому из пп.1-2 и соединения, выбранного из группы, включающей антидепрессанты, анксиолитики и антипсихотические средства, и фармацевтически приемлемого носителя.
9. Применение фармацевтической композиции по п.7 при получения лекарственного средства для повышения эффективности и/или ускорения начала действия при лечении депрессии, тревоги и нарушений массы тела.
10. Применение фармацевтической композиции по п.7 для повышения эффективности и/или ускорения начала действия при лечении депрессии, тревоги и нарушений массы тела.
11. Способ лечения депрессии, тревоги и нарушений массы тела, включающий одновременное или последовательное введение соединения по любому из пп.1-2 и одного или нескольких других соединений, выбранных из группы, состоящей из антидепрессантов, анксиолитиков и антипсихотических средств.
12. Способ получения соединения по любому из пп.1-2, отличающийся тем, что соединение формулы (IV) подвергают взаимодействию с производным пиперазина формулы (V)
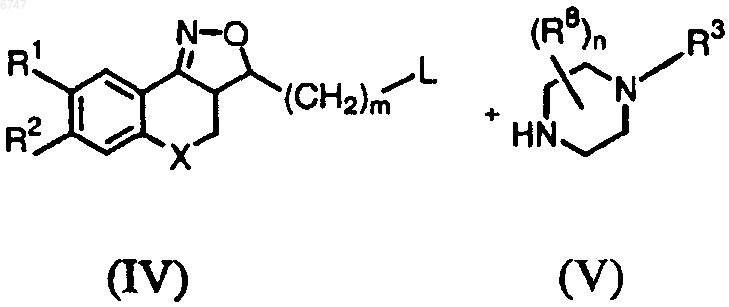
где R1, R2, R3, R8, X, m и n имеют значения, указанные в п.1, и L представляет собой любую подходящую реакционноспособную удаляемую группу.
13. Способ получения соединения по любому из пп.1-2, отличающийся тем, что соединение формулы (IV) подвергают взаимодействию с производным пиперазина формулы (VII) и далее соединением формулы (IX)
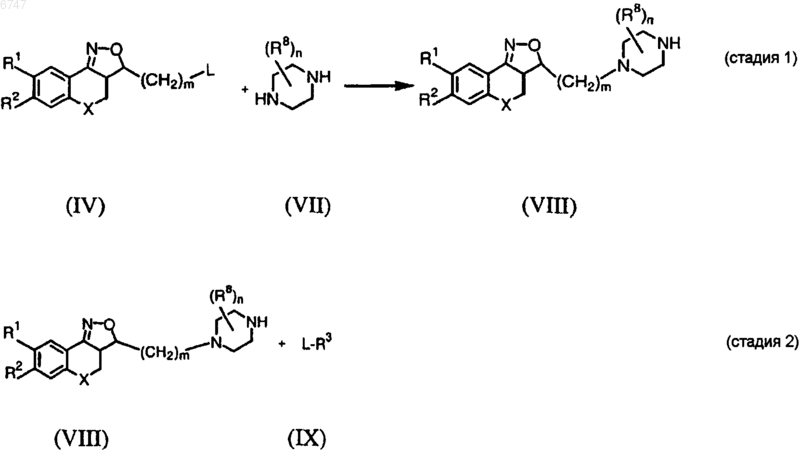
где R1, R2, R3, R8, X, m ш n имеют значения, указанные в п.1, и L представляет собой любую подходящую реакционноспособную удаляемую группу.
14. Соединение общей формулы (IV)
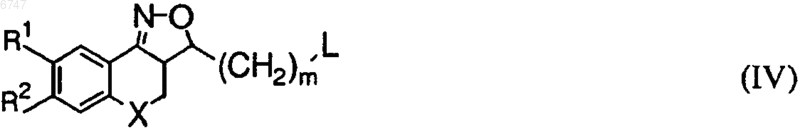
где R1, R2, X и m имеют значения, указанные при определении формулы (I), и L представляет собой удаляемую группу, за исключением 3,3а,4,5-тетрагидронафто[1,2-с]изоксазол-3-уксусной кислоты.
15. Соединение по п.14, отличающееся тем, что L выбран из группы, включающей OSO2C6H4(СН3), OSO2СН3, Сl, Вr и I.
16. Соединение общей формулы (VIII)
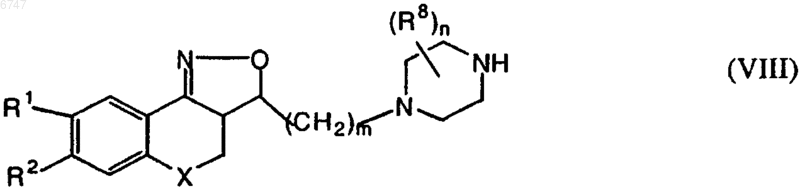
где R1, R2, X, m, R8 и n имеют значения, указанные при определении формулы (I).
Текст
006747 Изобретение относится к замещенным изоксазолинам, обладающим антидепрессивной активностью и/или анксиолитической активностью и/или активностью в отношении регулирования массы тела, способам их получения, фармацевтическим композициям, содержащим их, и к их применению в качестве лекарственных средств, в частности, для лечения депрессии, тревоги, связанных со стрессом расстройств, ассоциированных с депрессией и/или тревогой, и нарушений массы тела, включая нервнопсихическую анорексию и булимию. Изобретение также относится к новому сочетанию замещенных изоксазолинов, обладающих антидепрессивной активностью и/или анксиолитической активностью и/или активностью регулирования массы тела, с антидепрессантами, анксиолитиками или антипсихотическими средствами. Производные тетрагидронафталина и индана, демонстрирующие антидепрессивную активность, известны из ЕР 361577 В 1. Указанные соединения являются типичными блокаторами обратного поглощения моноаминов с дополнительной активностью антагонистов 2-адренорецепторов, и они демонстрируют антидепрессивную активность, не будучи седативными. Проблемы, связанные с соединениями известного уровня техники, состоят в том, что такие соединения вызывают значительные побочные эффекты, такие как тошнота, раздражение, повышенная частота сердечных сокращений и ослабление половой функции. Кроме того, до начала реакции требуется длительное время, в частности 3-4 недели. Целью настоящего изобретения являются новые соединения, обладающие антидепрессивной активностью, и/или анксиолитической активностью, и/или активностью в отношении регулирования массы тела, в частности соединения, не обладающие указанными выше недостатками. Настоящее изобретение относится к производным изоксазолина общей формулы (I)R7 выбран из группы, включающей водород, алкил, фенил, фенилалкил, алкилкарбонил, алкилоксикарбонил и моно- и диалкиламинокарбонил, причем фенильные и алкильные группы, необязательно,замещены одним или несколькими атомами галогена;R1 и R2 выбраны, каждый, независимо, из группы, включающей водород, гидрокси, циано, галоген,OSO2H, ОSО 2 СН 3, фенил, фенилакил, алкилокси, алкилоксиалкилокси, алкилоксиалкилоксиалкилокси,тетрагидрофуранилокси, алкилкарбонилокси, алкилтио, алкилоксиалкилкарбонилокси, пиридинилкарбонилокси, алкилкарбонилоксиалкилокси, алкилоксикарбонилокси, алкенилокси, алкенилкарбонилокси и моно- и диалкиламиноалкилокси, причем алкильные и арильные радикалы, необязательно, замещены одним или несколькими гидрокси или атомами галогена или аминогруппами; илиR1 и R2 могут быть взяты вместе с образованием бивалентного радикала -R1-R2-, выбранного из группы, включающей -СН 2-СН 2-O-, -O-СН 2-СН 2-, O-СН 2-O-, -СН 2-O-СН 2- и -O-СН 2-СН 2-O-; а и b являются асимметричными центрами;(СН 2)m представляет собой линейную углеводородную цепь из m атомов углерода, причем m равно целому числу в интервале от 1 до 4;Pir представляет собой радикал согласно любой из формул (IIа), (IIb) или (IIс) где каждый R8 выбран независимо из группы, включающей водород, гидрокси, амино, нитро, циано, галоген и алкил;n равно целому числу в интервале от 1 до 5;R3 представляет собой радикал согласно любой из формул (III) где d представляет собой простую связь, в то время как Z представляет собой бивалентный радикал, выбранный из группы, включающей -СН 2-, -С(=O)-, -СН(ОН)-, -C(=N-OH)-, -СН(алкил)-, -О-, -S-, -S(=O)- и-NH-; или d представляет собой двойную связь, в то время как Z представляет собой трехвалентный радикал формулы =СН- или =С(алкил)-; А представляет собой 5- или 6-членный ароматический гомоциклический или гетероциклический цикл, выбранный из группы, включающей фенил, пиранил, пиридинил, пиразинил, пиримидинил, пиридазинил, тиенил, изотиазолил, пирролил, имидазолил, пиразолил, фуранил, оксадиазолил и изоксазолил; р равно целому числу в интервале от 0 до 4;q равно целому числу в интервале от 0 до 7;R4 выбран из группы, включающей водород, алкил, фенил, бифенил, нафтил, галоген и циано, причем алкильный и арильный радикалы необязательно замещены одним или несколькими гидрокси или атомами галогена или аминогруппами;R4 и R5 могут быть взяты вместе с образованием бивалентного радикала -R4-R5-, выбранного из группы, включающей -CH2-, =CH, -CH2-CH2-, -СН=СН-, -О-, -NH-, =N, -S-, -CH2N( алкил)-, -CH=N-,-CH2O- и -ОСН 2-; каждый R6 независимо выбран из группы, включающей водород, гидрокси, амино, нитро, циано,галоген, карбоксил, алкил, фенил, алкилокски, фенилокси, алкилкарбонилокси, алкилоксикарбонил, алкилтио, моно- и диалкиламино, алкилкарбониламино, моно- и диалкиламинокарбонил, моно- и диалкиламинокарбонилокси, моно- и диалкиламиноалкилокси, причем алкильный и арильный радикалы необязательно замещены одним или несколькими гидрокси или атомами галогена или аминогруппами; или два соседних радикала R6 могут быть взяты вместе с образованием бивалентного радикала -R6-R6-,выбранного из группы, включающей -CH2-CH2-O-, -O-CH2-CH2-, -O-СН 2-С(=O)-, -O-СН 2-O-, -СН 2-OСН 2-, -O-СН 2-СН 2-O, -СН=СН-СН=СН-, -СН=СН-CH=N-, -CH=CH-N=CH-, -CH=N-CH=CH-, -N=CHCH=CH-, -CH2-CH2-CH2-, -СН 2-СН 2-С(=O)- и -СН 2-СН 2-СН 2-СН 2-; иR10 выбран из группы, включающей водород, алкил, фенилалкил и фенил. Предпочтительно изобретение относится к таким соединениям, где Х=О или NH; R1 и R2, оба, представляют собой алкилокси; m=1; Pir представляет собой радикал формулы (IIа), где R8 представляет собой водород, и n=4; R3 представляет собой радикал формулы (IIIb), где Z представляет собой =СН-, d представляет собой двойную связь, А представляет собой фенильный цикл, R4 представляет собой алкил,и R10 представляет собой водород. Более предпочтительно изобретение относится к таким соединениям, где Х=О, R1 и R2, оба, представляют собой метокси; m=1; Pir представляет собой радикал формулы (IIа), где R8 представляет собой водород, и n=4; R3 представляет собой радикал формулы (IIIb), где Z представляет собой =СН-, d представляет собой двойную связь, А представляет собой фенильный цикл, R4 представляет собой метил, иR10 представляет собой водород. В рамках данной заявки термин "алкил" обозначает линейные или разветвленные углеводородные радикалы с 1-6-атомами углерода, например, метил, этил, пропил, бутил, 1-метилпропил, 1,1 диметилэтил, пентил, гексил; или термин "алкил" обозначает циклические насыщенные углеводородные радикалы с 3-6 атомами углерода, например, циклопропил, метилциклопропил, циклобутил, циклопентил и циклогексил. "Галоген" является общим определением для фтора, хлора, брома и йода. Алкильные радикалы, необязательно замещенные одним или несколькими атомами галогена, представляют собой,наример, полигалогеналкильные радикалы, например дифторметил и трифторметил. Термин "фармацевтически примемлемые соли" относится к терапевтически активным нетоксичным формам аддитивных солей, которые способны образовывать соединения формулы (I). Указанные соли можно получить обработкой соединений формулы (I) в виде основания подходящими кислотами, например неорганическими кислотами, например, галогеноводородной кислотой, в частности, хлористоводородной кислотой или бромисто-водородной кислотой, серной кислотой, азотной кислотой и фосфорной кислотой; органическими кислотами, например уксусной кислотой, оксиуксусной кислотой,пропановой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, малоновой кислотой, янтарной кислотой, малеиновой кислотой, фумаровой кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, метансульфоновой кислотой, этансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой, цикламовой кислотой, салициловой кислотой, паминосалициловой кислотой и памовой кислотой. Соединения формулы (I), содержащие кислотные протоны, также можно преобразовать обработкой подходящими органическими и неорганическими основаниями в формы их терапевтически активных нетоксичных солей металлов или аддитивных солей аминов. Подходящими формами солей оснований являются, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, в частности литиевые, натриевые, калиевые, магниевые и кальциевые соли, соли органических оснований, например соли бензатина, N-метил-D-глюкамина, гибрамина, и соли, образованные с аминокислотами, например аргинином и лизином. И наоборот, указанные формы солей можно преобразовать в свободные формы обработкой подходящими основанием или кислотой.-2 006747 Термин "аддитивная соль", используемый в рамках данной заявки, также включает сольваты, которые способны образовывать соединения формулы (I), а также их соли. Такими сольватами являются, например, гидраты и алкоголяты. Термин "N-оксидные формы сoединений формулы (I)" включает такие соединения формулы (I), где один или несколько атомов азота окислены до так называемого N-оксида, в частности, те N-оксиды, гдеN-окислены один или несколько атомов азота пиперазинильного радикала. Термин "стереохимически изомерные формы", используемый в данном описании, относится ко всем возможным изомерным формам, которые могут быть у соединений формулы (I). Если не указано иного, химическое название соединений обозначает смесь всех стереохимически возможных изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереогенные центры могут иметь R- или S-конфигурацию; и заместители бивалентных циклических (частично) насыщенных радикалов могут иметь или цис- или трансконфигурацию. Соединения, содержащие двойные связи, могут иметь Е- или Z-стереохимию при указанной двойной связи. Очевидно, подразумевается, что стереохимически изомерные формы соединений формулы (I) входят в объем данного изобретения. Согласно соглашениям САS по номенклатуре, когда в молекуле присутствуют два стереогенных центра известной абсолютной конфигурации, пишут префиксы R или S (на основании правила последовательности Кана-Ингольда-Прелога) при хиральном центре с наименьшим номером - опорном центре. Конфигурацию второго стереогенного центра указывают с использованием родственных префиксов[R,R] или [R,S], где R всегда конкретизируют как опорный центр, и [R,R] показывает центры с одинаковой хиральностью, и [R,S] показывает центры с неодинаковой хиральностью. Например, если в молекуле хиральный центр с наименьшим номером имеет S-конфигурацию, а второй центр является R,стереопрефикс будет выглядеть S-[R,S]. Если используют и , положение самого старшего заместителя у асимметричного атома углерода в циклической системе с наименьшим числом циклов всегда в положении средней плоскости, определяемой циклической системой. Положение старшего заместителя у другого асимметричного атома углерода в циклической системе (атом водорода в соединениях формулы (I относительно положения самого старшего заместителя у опорного атома, обозначается ,если он находится с той же стороны средней плоскости, определяемой циклической системой, или ,если он находится с другой стороны средней плоскости, определяемой циклической системой. Соединения формулы (I) и некоторые промежуточные соединения имеют по меньшей мере два стереогенных центра в своей структуре, обозначенные в формуле (I) а и b соответственно. Вследствие синтетического пути, соответствующего синтезу трициклической системы, кофигурация указанных двух асимметричных центров а и b предопределена, так что относительной конфигурацией центра а являетсяS, и центра b - R. Изобретение также относится к производным (обычно называемым "пролекарства") фармакологически активных соединений по изобретению, которые разлагаются in vivo с образованием соединений по изобретению. Пролекарства, как правило (но не всегда), имеют меньшую силу в отношении рецепторамишени, чем соединения, до которых они разлагаются. Пролекарства особенно полезны, когда нужное соединение имеет химические или физические свойства, затрудняющие его введение или делающие его неэффективным. Например, нужное соединение может оказаться просто трудно растворимым, оно может плохо переноситься через эпителий слизистых оболочек, или оно может иметь нежелательно короткий полупериод существования в плазме. Дополнительное обсуждение пролекарств можно найти в Stella,V.J., et al., "Prodrugs", Drug Delivery Sustems, 1985, pp. 112-176, и в Drugs, 1985, 29, pp. 455-473. Пролекарственные формы фармакологически активных соединений по изобретению, как правило,будут представлять собой соединения формулы (I), их фармацевтически приемлемые аддитивные соли кислот или оснований, их стереохимически изомерные формы и их N-оксидные формы, содержащие кислотную группу, которую этерифицируют или амидируют. В число таких этерифицированных кислотных групп входят группы формулы -COORx, где Rx представляет собой C1-6-алкил, фенил, бензил или группу одной из формул К амидированным группам относятся группы формулы -CONRyRz, где Ry представляет собой Н,C1-6-алкил, фенил или бензил, и R2 представляет собой -ОН, Н, C1-6-алкил, фенил или бензил. Соединения по изобретению, содержащие аминогруппу, можно дериватизировать с кетоном или альдегидом, таким как формальдегид, с образованием основания Манниха. Такое основание будет гидролизоваться в водном растворе с кинетикой реакции первого порядка. Соединения формулы (I), которые получают способами, описанными ниже, можно синтезировать в виде рацемических смесей энантиомеров, которые можно отделить один от другого, следуя хорошо известным методам разделения. Рацемические соединения формулы (I) можно преобразовать в соответст-3 006747 вующие формы диастереомерных солей взаимодействием с подходящей хиральной кислотой. Затем указанные формы диастереомерных солей разделяют, например, селективной или фракционной кристаллизацией, и сами энантиомеры освобождают с помощью щелочи. Другой способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные стереохимически чистые изомерные формы также можно получить из соответствующих стереохимически чистых изомерных форм подходящих исходных веществ, при условии, что взаимодействие происходит стереоспецифически. Предпочтительно, если нужен стереоизомер,указанное соединение синтезируют стереоспецифическими способами получения. В таких способах удобно использовать энантиомерно чистые исходные вещества. Неожиданно выяснилось, что соединения по изобретению обладают селективной ингибирующей активностью обратного поглощения серотонина (5-НТ) в сочетании также с активностью антагонистов 2-адренорецепторов и демонстрируют сильную антидепрессивную и/или анксиолитическую активность и/или активность регулирования массы тела, не будучи седативными. Также с учетом их селективной ингибирующей активности обратного поглощения серотонина (5-НТ), а также активности антагонистов 2-адренорецепторов, соединения по изобретению также подходят для лечения и/или профилактики заболеваний, при которых полезными для лечения являются или одна из активностей, или сочетание указанных активностей. В частности, соединения по изобретению могут подходить для лечения и/или профилактики заболеваний, перечисленных далее. Расстройства центральной нервной системы, в том числе расстройства настроения, включая, в частности, обширное депрессивное расстройство, депрессию с или без психотических признаков, кататонических признаков, меланхолических признаков, атипичных признаков постнатальной атаки, и, в случае повторяющихся эпизодов, с или без сезонных особенностей,дистимическое расстройство, биполярное I расстройство, биполярное II расстройство, циклотимическое расстройство, повторяющееся кратковременное депрессивное расстройство, смешанное аффективное расстройство, биполярное расстройство без иных определений, расстройство настроения из-за общего состояния здоровья, расстройство настроения, вызванное какими-либо веществами, расстройство настроения без иных определений, сезонное аффективное расстройство и предменструальные дисфорические расстройства; тревожные расстройства, в том числе паническая атака, агорафобии, паническое расстройство без агорафобии, агорабофобия с историей панического расстройства, специфические фобии, социальные фобии, обсессивно-компульсивное расстройство, посттравматическое стрессовое расстройство, острое стрессовое расстройство, генерализованное тревожное расстройство, тревожное расстройство из-за общего состояния здоровья, тревожное расстройство, вызванное какими-либо веществами, и тревожное расстройство без иных определений; расстройства, связанные со стрессом, ассоциированные с депрессией и/или тревогой, в том числе острая стрессовая реакция, регулируемые расстройства (краткая депрессивная реакция, длительная депрессивная реакция, смешанная тревога и депрессивная реакция, регулируемое расстройство с доминирующим отклонением других эмоций, регулируемое расстройство с доминирующим отклонением проводимости, регулируемое расстройство со смешанным отклонением эмоций и проводимости, регулируемые расстройства без других специфических доминирующих симптомов) и другие реакции на сильный стресс; деменция, амнезийные расстройства и когнитивные расстройства без иных определений, в особенности, деменция, вызыванная дегенеративными нарушениями, повреждениями, травмами, инфекциями,сосудистыми нарушениями, токсинами, аноксией, недостатком витаминов или эндокринными нарушениями, или амнезийные расстройства, вызванные алкокголем или другими причинами дефицита тиамина, повреждение билатеральной височной доли вследствие герпетического энцефалита и другого лимибического энцефалита, нейрональная потеря, побочная при аноксии/гипогликемии/тяжелых конвульсиях и хирургической операции, дегенеративных нарушениях, сосудистых нарушениях или патологии вблизи желудочка III; когнитивные расстройства из-за когнитивного нарушения, являющегося результатом других болезней; личностные расстройства, в том числе параноидное личностное расстройство, шизоидное личностное расстройство, шизотипичное личностное расстройство, антиобщественное личностное расстройство,пограничное личностное расстройство, мимическое личностное расстройство, самолюбование, необщительность, зависимое личностное расстройство, обсессивно-компульсивное личностное расстройство и личностное расстройство без иных определений; шизоаффективные расстройства, являющиеся результатом различных причин, в том числе шизоаффективные расстройства маниакального типа, депрессивного типа, смешанного типа, параноидная, гебефреническая, кататоническая, недифференцированная и резидуальная шизофрения, расстройство в форме шизофрении, шизоаффективное расстройство, бредовое расстройство, краткое психотическое расстройство, разделенное психотическое расстройство, психотическое расстройство, вызванное какимилибо веществами, и психотическое расстройство без иных определений;-4 006747 акинезия, акинетическо-ригидные синдромы, дискинезия и паркинсонизм, вызванный лекарственной терапией, синдром Жиля де ла Туретто и его симптомы, тремор, хорея, миоклонус, тики и дистония; дефицит внимания/гиперактивность (ADHD); болезнь Паркинсона, паркинсонизм, вызванный лекарственными средствами, постэнцефалитный паркинсонизм, прогрессирующий надъядерный паралич, множественная системная атрофия, кортикобазальная дегенерация, комплекс паркинсонизма и ALS-деменции и кальцификация базальных ганглиев; деменция типа болезни Альцгеймера с ранней или поздней атакой с деперссивным настроением; поведенческие отклонения и расстройства проводимости при деменции и умственной отсталости, в том числе беспокойное состояние и возбуждение; экстрапирамидальные двигательные расстройства; синдром Дауна; акатизия; расстройства питания, в том числе, нервно-психическая анорексия, атипичная нервно-психическая анорексия, нервно-психическая булимия, атипичная нервно-психическая булимия, переедание, связанное с другими психологическими отклонениями, рвота, связанная с другими психологическими отклонениями, и неспецифические пищевые расстройства; деменция, связанная со СПИДом. Состояния хронической боли, в том числе невропатическая боль, боль при воспалении, боль при раке и послеоперационная боль после хирургической опрерации, включая стоматологическую операцию. К таким показаниям также могут относиться острая боль, боль в скелетных мышцах, боль в пояснице,боль в верхних конечностях, фибромиалгия и мышечно-лицевые болевые синдромы, оролицевая боль,абдоминальная боль, фантомная боль, боль при болезненном и атипичном тике лица, повреждение нервных корешков и арахноидит, гериатрическая боль, общая боль и боль при воспалении. Нейродегенеративные заболевания, в том числе болезнь Альцгеймера, хорея Гентингтона, болезнь Крейтфельдта-Якоба, болезь Пика, демиелинирующие расстройства, такие как рассеянный склероз иALS, другие невропатии и невралгии, рассеянный склероз, боковой амиотрофический склероз, удар и травмы головы. Аддикционные расстройства, в том числе зависимость от веществ или злоупотребление веществами с или без физиологической зависимости,в частности, когда вещества представляют собой алкоголь, амфетамины, амфетаминоподобные вещества,кофеин, коноплю, кокаин, галлюциногены, летучие вещества, никотин, опиаты, фенциклидин, фенциклидиноподобные соединения, успокоительно-снотворные средства, бензодиазепины и/или другие вещества, в частности, полезные для лечения абстиненции от перечисленных выше веществ и алкогольноабстинентного делирия; расстройства настроения, вызванные, в частности, алкоголем, амфетаминами, кофеином, коноплей,кокаином, галлюциногенами, летучими веществами, никотином, опиатами, фенциклидином, седативными средствами, снотворными средствами, анксиолитиками и другими веществами; тревожные расстройства, вызванные, в частности, алкоголем, амфетаминами, кофеином, коноплей,кокаином, галлюциногенами, летучими веществами, никотином, опиатами, фенциклидином, седативными средствами, снотворными средствами, анксиолитиками и другими веществами, и регулируемые расстройства с тревогой. Прекращение курения. Борьба с массой тела, включая ожирение. Расстройства и нарушения сна, в том числе диссомния и/или парасомния как первичные расстройства сна, расстройства сна, связанные с другой болезнью, расстройство сна из-за общего состояния здоровья и расстройство сна, вызванное какимилибо веществами; нарушения циркадного ритма; улучшение качества сна. Половая дисфункция, в том числе расстройства полового влечения, расстройства полового возбуждения, оргазменные расстройства, половые болевые расстройства, половая дисфункция из-за общего состояния здоровья и половая дисфункция без иных определений. Таким образом, настоящее изобретение относится к соединениям формулы (I), указанной выше, их фармацевтически приемлемым аддитивным солям кислот или оснований, их стереоизомерным формам,их N-оксидным формам, а также к их пролекарствам, для применения в качестве лекарственного средства. Кроме того, настоящее изобретение также относится к применению соединения формулы (I), его фармацевтически приемлемым аддитивным солям кислот или оснований, его стереоизомерным формам,его N-оксидной форме, а также к его пролекарству, для получения лекарственного средства для лечения депрессии, тревоги и нарушениям массы тела, или, в более общей форме, любого из перечисленных выше заболеваний. Соединения по изобретению также могут быть подходящими как дополнение при лечении и/или профилактике перечисленных выше заболеваний в сочетании с антидепрессантами, анксиолитическими-5 006747 средствами и/или антипсихотическими средствами, которые в настоящее время доступны или разрабатываются или станут доступными в будущем, с целью улучшения эффективности и/или ускорения начала действия. Оценка производится на животных моделях грызунов, для которых, как показано, антидепрессанты, анксиолитики и/или антипсихотические средства являются активными. Например, соединения оценивают в сочетании с антидепрессантами, анксиолитическими средствами и/или антипсихотическими средствами для ослабления гипертермии, вызванной стрессом. Следовательно, изобретение также относится к фармацевтической композиции, содержащей соединения по изобретению и одно или несколько соединений, выбранных из группы, состоящей из антидепрессантов, анксиолитиков и антипсихотических средств, а также к применению такой композиции для получения лекарственного средства для повышения эффективности и/или ускорения начала действия при лечении депрессии и/или тревоги. Связывание нейротрансмиттерного переносчика и рецептора in vitro и исследования сигнальной трансдукции можно использовать для оценки активности 2-адренорецепторного антагонизма и активности ингибирования обратного поглощения серотонина (5-НТ) соединений по настоящему изобретению. В качестве показателей общей пенетрации и возможности блокирования 2-адренорецепторов и переносчиков серотонина, соответственно, можно использовать захват 2-адренорецепторов и переносчиков серотонина ex vivo. В качестве показателей 2-адренорецепторного антагонизма in vivo можно использовать реверсирование потери установочного рефлекса, наблюдаемого у крыс после подкожной инъекции или перорального дозирования соединения перед внутривенным введением крысам медетомидина (медетомидиновый тест). В качестве показателей активности ингибирования обратного поглощения серотонина (5-НТ) можно использовать подавление подергиваний головы и возбуждения у крыс, наблюдаемое после подкожной инъекции или перорального дозирования соединения перед подкожным введением крысам п-хлорамфетамина (тест с рСА). Изобретение также относится к композиции, содержащей фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по изобретению. Соединения изобретения или их любую подгруппу можно вводить в состав различных фармацевтических форм для целей введения. В качестве подходящих кoмпозиций можно назвать все композиции,обычно используемые для системного введения лекарственных средств. Для того чтобы получить фармацевтические композиции данного изобретения, эффективное количество определенного соединения как активного ингредиента, необязательно, в форме аддитивной соли соединяют при тщательном перемешивании с фармацевтически приемлемым носителем, который может принимать самые разные формы в зависимости от формы препарата, нужной для введения. Такие фармацевтические композиции желательны в стандартной лекарственной форме, подходящей, в частности, для введения пероральным путем,ректально, чрескожно, путем парентеральной инъекции или путем ингаляции. Например, при получении композиций в виде пероральной лекарственной формы можно использовать любые обычные фармацевтические среды, такие как, например, воду, гликоли, масла, спирты и т.п., в случае жидких пероральных препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, наполнители, смазывающие вещества, связующие вещества, разрыхлители, и т.п., в случае порошков, пилюль, капсул и таблеток. По причине легкости введения таблетки и капсулы представляют собой наиболее удобные пероральные стандартные лекарственные формы, в которых, очевидно, используют твердые фармацевтические носители. Носитель для парентеральных композиций, как правило, будет содержать стерильную воду, по меньшей мере в большей части, хотя могут быть включены другие ингредиенты, например, способствующие растворению. Например, можно получить растворы для инъекций, в которых носитель состоит из физиологического раствора, раствора глюкозы или смеси физиологического раствора и раствора глюкозы. Также можно получить суспензии для инъекций, и в таком случае можно использовать соответствующие жидкие носители, суспендирующие вещества и т.п. В число подходящих препаратов также входят твердые препаративные формы, предназначенные для преобразования в жидкие препаративные формы непосредственно перед применением. В композициях, подходящих для чрескожного введения, носитель содержит, необязательно, вещество, усиливающее пенетрацию, и/или подходящее смачивающее вещество, необязательно, в сочетании с подходящими добавками любой природы в небольших количествах, которые не оказывают существенного вредного действия на кожу. Указанные добавки могут облегчить введение в кожу и/или могут способствовать получению нужных композиций. Такие композиции можно вводить различными способами, например, в виде трансдермального пэтча, композиции для точечного нанесения, в виде мази. Особенно удобно получать вышеописанные фармацевтические композиции в стандартной лекарственной форме для облегчения введения и равномерности дозировки. Термин "стандартная лекарственная форма", используемый в данном описании, относится к физически дискретным единицам, подходящим для однократных дозировок, причем каждая единица содержит предварительно установленное количество активного ингредиента, рассчитанное на получение нужного лечебного действия, в сочетании с требуемым количеством фармацевтического носителя. Примерами таких стандартных лекарственных форм являются таблетки (в том числе, таблетки с насечкой и с покрытием), капсулы, пилюли, пакетики с по-6 006747 рошком, облатки, суппозитории, растворы или суспензии для инъекций и т.п. и их отдельные составляющие. Соединения по изобретению можно получить путем осуществления последовательности стадий,каждая из которых известна специалистам. В частности, соединения формулы (I) с радикалом Pir формулы (IIа) можно получить путем нуклеофильного замещения промежуточного соединения формулы (IV) с замещенным пиперазином формулы (V). Такие реакции можно осуществить в растворителе, инертном по отношению к реакции, таком как диоксан, метилизобутилкетон или N,N'-диметилформамид, в присутствии подходящего основания, такого как карбонат калия, карбонат натрия или триэтиламин, или даже в отсутствие основания, с использованием в таком последнем случае избытка реагента формулы (V). Обычные температуры реакции находятся в интервале от 100 до 150 С. В соединении (IV) L представляет собой любую подходящую реакционноспособную удаляемую группу, в частности, галоген, такой как хлор, бром или йод, или сульфонилокси, такой как метилсульфонилокси или 4-метилбензолсульфонилокси. Соединения формулы (I) с радикалом Pir формулы (IIа) также можно получить по 2-стадийной реакционной схеме, когда промежуточное соединение формулы (IV) сначала подвергают взаимодействию с замещенным пиперазином формулы (VII), после чего в молекулу вводят радикал R3. Условия взаимодействия подобны условиям, описанным выше для получения соединений формулы (VI). В соединении (IV) L представляет собой любую подходящую реакционноспособную удаляемую группу, в частности, галоген, такой как хлор, бром или йод, или сульфонилокси, такой как метилсульфонилокси или 4-метилбензолсульфонилокси. В промежуточном соединении (VII) также можно защитить один из функциональных азотов, например, с помощью трет-бутилоксикарбонильной группы. В соединении (IX) L представляет собой любую подходящую реакционноспособную удаляемую группу, в частности галоген, такой как хлор, бром или йод, или сульфонилокси, такой как метилсульфонилокси или 4-метилбензолсульфонилокси. Также в качестве соединения (IX) можно использовать R3-CHO. Соединения формулы (I) с радикалом Pir формулы (IIа) также можно получить по 2-стадийной реакционной схеме, когда промежуточное соединение формулы (VIII) подвергают взаимодействию с кислотой формулы (X), после чего осуществляют следующее взаимодействие по карбонильной функциональной группе промежуточного соединения (XI). Взаимодействие на стадии 1 можно осуществить в растворителе, инертном по отношению к реакции, таком как хлороформ, дихлорметан, тетрагидрофуран,диметилформамид или их смесь, с использованием любых способов, известных специалистам в данной области техники, с использованием реагентов конденсации, таких как 1,1'-карбонилдиимидазол, N,N'дициклогексилкарбодиимид или предварительного превращения карбоновой кислоты формулы (X) в соответствующий хлорангидрид. Реакции, показанные на стадии 2, можно осуществить с использованием подходящего восстановителя, такого как алюмогидрид лития или гидрид алюминия, в подходящем растворителе, например тетрагидрофуране. Как правило, такие реакции проходят при температуре в интервале от -20 С до комнатной температуры. В промежуточных соединениях (XI) и (XII) группа А представляет собой необязательно замещенную ароматическую гомоциклическую или гетероциклическую систему, включающую частично или полностью гидрированную углеводородную цепь длиной максимум в 5 атомов углерода, из которых один или несколько атомов углерода могут быть заменены одним или несколькими атомами, выбранными из группы, включающей атомы кислорода, азота и серы, с помощью которой циклическая система присоединяется к радикалу Pir, значения которого указаны выше. Заместители R1 и R2 можно заменить или взаимно преобразовать один в другой способами, хорошо известными в данной области, такими как деметилирование, ацилирование, этерификация, аминирование и амидирование. Исходные вещества и некоторые промежуточные соединения представляют собой соединения, которые либо коммерчески доступны, либо могут быть получены обычными реакционными методами, как правило, известными в данной области. Например, промежуточные соединения формулы (IV), в которых Х=О, можно получить согласно реакционной схеме, приведенной далее (схема 1). Схема 1 В промежуточном соединении (XIV) L представляет собой любую подходящую реакционноспособную удаляемую группу, в частности галоген, такой как хлор, бром или йод, или сульфонилокси, такой как метилсульфонилокси или 4-метилбензолсульфонилокси. Кроме того, Alk в промежуточном соединении (XIV) представляет собой любую C1-6-алкильную группу, в частности этильную группу, и m имеет значения, указанные в определении формулы (I). Промежуточные соединения формулы (IV), в которых Х=NH, также можно получить равноценным способом согласно приведенной выше стадии 1, при условии, что промежуточное соединение (XIII) заменяют на его аминный аналог (XVI), предпочтительно с аминогруппой, защищенной, например, группой СОСF3-. Стадию алкилирования можно осуществить в растворителе, инертном по отношению к реакции, например тетрагидрофуране или диметилформамиде, в присутствии сильного основания, такого как гидрид натрия или калия, и добавлением краун-эфира, такого как 18-краун-6 или 15-краун-5. Подходящие температуры реакций находятся в интервале от комнатной температурой до 60 С. Промежуточные соединения формулы (XVII) преобразуют в оксимы формулы (XVIII) с использованием методов, известных в данной области, например с использованием гидрохлорида гидроксиламина в присутствии NaHCO3 или пиридина, в растворителе, инертном по отношению к реакции, например этаноле. Промежуточное соединение (XVIII) окисляют до нитрилоксида и осуществляют внутримолекулярное циклоприсоединение in situ, и получают соединение формулы (XIX). Такое окисление можно осуществить с использованием раствора гипохлорита натрия в присутствии триэтиламина в растворителе, инертном по отношению к реакции, таком как дихлорметан, при комнатной температуре. Окисление также можно осуществить с использованием хлорамина-Т (натриевая соль N-хлор-4 метилбензолсульфонамида) при перемешивании и нагревании в растворителе, таком как кипящий этанол. На данной стадии образуются два стероцентра соединения формулы (I) а и b. Получение соединения формулы (XX) может быть достигнуто способами, известными в данной области, например, восстановлением карбонилсодержащего соединения формулы (XIX) в присутствии подходящего восстановителя, например боргидрида натрия, в подходящем растворителе, таком как вода,спирт, тетрагидрофуран или их смесь, как правило, при комнатной температуре. Промежуточные соединения формулы (IV) можно получить из промежуточных соединений формулы (XX) обычными способами. Так, взаимодействие с метансульфонилхлоридом или 4 метилбензолсульфонилхлоридом в присутствии основания, такого как триэтиламин, в растворителе,инертном по отношению к реакции, например, дихлорметане, при температуре реакции в интервале от 0 С до комнатной температуры дает соответствующее промежуточное сульфонилоксипроизводное (IV). Также можно получить соответствующее галогенсодержащее производное, например, обрабатывая промежуточное соединение формулы (XX) трифенилфосфином в присутствии тетрахлорметана в растворителе, инертном по отношению к реакции, таком как тетрагидрофуран, при перемешивании и кипячении смеси с обратным холодильником. Понятно, что в реакциях, описанных выше и далее, продукты реакций могут быть выделены из реакционной среды и, при необходимости, затем очищены согласно методам, как правило, известным в данной области, таким как экстракция, кристаллизация и хроматография. Кроме того, очевидно, что продукты реакций, которые существуют в нескольких энантиомерных формах, можно выделить из их смесей известными методами, в частности, путем препаративной хроматографии, такой как препаративная-9 006747 ВЭЖХ. Обычно промежуточные соединения (IV) и конечные соединения формулы (I) можно разделить на их энантиомерные формы. Соединения по изобретению, в которых Х=СН 2, можно получить по приведенной далее реакционной схеме (схема 2), где промежуточное соединение формулы (V) сначала N-алкилируют с помощью дигалогенпроизводного формулы (XX) обычными методами в присутствии или в отсутствие основания и в инертном по отношению к реакции растворителе, таком как хлороформ, дихлорметан или 1,2 дихлорэтан, при температурах реакции в интервале от комнатной температуры до 80 С, причем получают промежуточное соединение формулы (XXI). Альдегид формулы (XXII) подвергают взаимодействию с трет-бутиламином в апротонном растворителе, таком как толуол, при перемешивании и нагревании при температуре образования флегмы с удалением воды с использованием стандартного устройства, такого как водный сепаратор Дина-Старка, и получают имин формулы (XXIV). С-алкилирование промежуточного соединения формулы (XXIV) промежуточным соединением формулы (XXI) можно проводить в присутствии производного алкиллития, такого как н-бутиллитий, в инертной атмосфере и в сухом инертном растворителе, таком как тетрагидрофуран, при низких температурах в интервале от -78 до 0 С с получением промежуточного соединения формулы (XXV). Промежуточное соединение формулы (XXVI) можно получить взаимодействием промежуточного соединения формулы (XXV) с гидроксиламином в присутствии основания, такого как бикарбонат натрия, в растворителе, таком как низший алкиловый спирт, например этанол, как правило, при комнатной температуре. Наконец, окисление оксима формулы(XXVI) до его нитрилоксида и последующего циклоприсоединения in situ с образованием соединения формулы (XXVII) проводят обычным способом, таким как способы, описанные выше для промежуточного соединения формулы (XVIII), с получением соединения формулы (XIX). Схема 2-10 006747 Понятно, что реакционные стадии, описанные выше, можно адаптировать для конкретных продуктов реакций. Описанные реакционные стадии можно осуществлять любым способом, известным специалисту, в том числе в растворе или твердофазными реакциями, в процессе которых, в последнем случае,продукты реакции связываются со смолой и, на конечной стадии отщепления, отсоединяются от смолы. Примеры таких вариантов и способов разделений описаны в данной заявке далее в примерах. Соединение 3,3 а,4,5-тетрагидронафто[1,2-с]изоксазол-3-уксусная кислота (формула (IV), где каждый из R1 и R2 представляет собой Н, m=0, Х=СН 2, и L=СООН, описано в Synthetic Communications,27(16), 2733-2742 (1997) как промежуточное соединение для синтеза противовоспалительных, аналгезирующих и антипсихотических соединений и исключено из объема притязаний. Приведенные далее примеры иллюстрируют настоящее изобретение, не ограничивая его. Экспериментальная часть Система нумерации углеродов для соединений формулы (I), используемая в данной заявке, следующая: Абсолютная стереохимическая конфигурация стереогенных атомов углерода в некоторых соединениях экспериментально не определялась. В некоторых случаях стереохимически изомерную форму, которую выделили первой, называют "А", а вторую - "В", без дальнейшего обращения к фактической стереохимической конфигурации. Однако указанные изомерные формы "А" и "В" специалист в данной области техники может однозначно охарактеризовать с использованием способов, известных в данной области, таких как, например, рентгенография. Стереогенные центры а и b в формуле (I) имеют номера в цикле 3 а и 3 соответственно. Далее в описании "ДМФА" обозначает N,N-диметилформамид, "DIPE" обозначает диизопропиловый эфир, и "ТГФ" обозначает тетрагидрофуран. А. Получение промежуточных соединений. Пример А 1.а. Получение промежуточного соединения 1. Раствор метилового эфира 4-бром-2-бутеновой кислоты (0,1647 моль) в ДМФА (50 мл) добавляют по каплям к смеси 2-гидрокси-4,5-диметоксибензальдегида (0,0823 моль) и K2 СО 3 (0,1647 моль) в ДМФА(200 мл). Реакционную смесь перемешивают в течение 2 ч при комнатной температуре, фильтруют и фильтрат упаривают досуха. Остаток промывают 10% водным раствором NaOH и затем экстрагируют СН 2 Сl2. Органический слой отделяют, сушат (Na2SO4), фильтруют и растворитель выпаривают. Остаток промывают диэтиловым эфиром и затем сушат. Получают 20 г промежуточного соединения 1 (87%). Пример А 1.b. Получение промежуточного соединения 2. К раствору промежуточного соединения 1 (0,041 моль) в этаноле (150 мл) добавляют гидроксиламин (0,045 моль). Добавляют пиридин (57 мл). Реакционную смесь перемешивают в течение 2 ч при комнатной температуре, затем выливают в воду и подкисляют концентрированной НСl. Полученную смесь экстрагируют СН 2 Сl2. Органический слой отделяют, сушат (Na2SO4), фильтруют, и растворитель выпаривают. Получают 11,7 г (96%, выход сырого продукта реакции). Образец (2 г) очищают высокоэффективной жидкостной хроматографией на силикагеле (элюент СН 2 Сl2/СН 3 ОН 95/5). Чистые фракции собирают и растворитель выпаривают. Остаток промывают диэтиловым эфиром и затем сушат. Получают 0,9 г промежуточного соединения 2. Пример А 1.с. Получение промежуточного соединения 3.-11 006747 К смеси промежуточного соединения 2 (0,037 моль) и Et3N (1 мл) в СН 2 Сl2 (220 мл) добавляют по каплям 5% NaOCl (130 мл). Реакционную смесь перемешивают в течение 4 ч при комнатной температуре, затем промывают водой, сушат (Na2SO4), фильтруют и фильтрат упаривают. Остаток очищают хроматографией на открытой короткой колонке с силикагелем (элюент СН 2 Сl2/2-пропанон 100/0 и 95/5). Нужные фракции собирают и растворитель выпаривают. Выход 5,8 г (54%, используют на следующей стадии без дополнительной очистки). Образец (2 г) перекристаллизовывают из EtOAc. Выпавшее в осадок вещество отфильтровывают и сушат. Получают 1,7 г промежуточного соединения 3. Пример А 1.d. Получение промежуточного соединения 4. К раствору промежуточного соединения 3 (0,017 моль) в ТГФ (50 мл) и Н 2O (5 мл) при перемешивании и охлаждении на ледяной бане добавляют по частям NaBH4 (0,043 моль). Полученную смесь перемешивают в течение 2 ч при комнатной температуре. Добавляют 2-пропанон, перемешивая смесь еще в течение 30 мин. Реакционную смесь промывают водой и экстрагируют СН 2 Сl2. Органический слой отделяют, промывают насыщенным солевым раствором, сушат (Na2SO4), фильтруют и растворитель выпаривают. Остаток очищают хроматографией на открытой короткой колонке с силикагелем (элюент СН 2 Сl2/СН 3 ОН 95/5) и высокоэффективной жидкостной хроматографией на силикагеле (элюент СН 2 Сl2/СН 3 ОН 98/2). Чистые фракции собирают и растворитель выпаривают. Образец (1,8 г) обрабатывают диэтиловым эфиром и затем сушат. Получают 1,2 г промежуточного соединения 4 (59%). Пример А 1.е. Получение промежуточного соединения 5. К раствору промежуточного соединения 4 (полученного согласно A3, 0,0109 моль) в СН 2 Сl2 (60 мл) добавляют Et3N (0,016 моль). Смесь охлаждают на ледяной бане. Добавляют метансульфонилхлорид(0,012 моль), и полученную реакционную смесь перемешивают в течение 30 мин. Затем смесь промывают водой, сушат (Na2SO4) и растворитель выпаривают. Получают 3,5 г промежуточного соединения 5(82%, используют на следующей реакционной стадии без дополнительной очистки). Пример А 1.f. Получение промежуточного соединения 6. Реакцию осуществляют в атмосфере N2. К раствору промежуточного соединения 5 (полученного согласно А 1.е, 0,00873 моль) в СН 2 Сl2 (100 мл), охлажденному до -78 С, при перемешивании добавляют по каплям ВВr3 (0,04368 моль). Реакционную смесь нагревают до -40 С и продолжают перемешивание в течение 2 ч при -40 С. Органический слой отделяют, сушат (Na2SO4), фильтруют, и растворитель выпаривают. Остаток очищают колоночной флэш-хроматографией на силикагеле (элюент СН 2 Сl2/СН 3 ОН 97/3) и затем ВЭЖХ (элюент СН 2 Сl2/СН 3 ОН от 99,5/0,5 до 90/10). Собирают две группы фракций продукта реакции и из них выпаривают растворитель. Получают 0,750 г промежуточного соединения 6(26%). Пример А 1.g. Получение промежуточного соединения 7. Смесь промежуточного соединения 5 (полученного согласно А 1.е, 0,0422 моль) и пиперазина(0,1267 моль) в 1,4-диоксане (15 мл) перемешивают в течение 2 ч при 100 С. Растворитель выпаривают. Остаток промывают водой и экстрагируют CH2Cl2. Органический слой отделяют, сушат (Na2SO4), фильтруют и растворитель выпаривают. Получают 13 г промежуточного соединения 7 (ЯМР, 85%). Пример А 1.h. Получение промежуточного соединения 8. Промежуточное соединение 5 (полученное согласно А 1.е) (200 г, 0,58 моль) разделяют на его энантиомеры хиральной колоночной хроматографией на колонке LC110-2 с неподвижной фазой CHIRALPACK-AD (2000 г, давление набивки 45 бар, зона детектора 2,56, длина волны 240 нм, температура 30 С; впрыскиваемый раствор: 200 г в 8,4 л CH3CN; затем 19,6 л метанола (+2% этанола), затем фильтрация;-12 006747 объем впрыскивания 700 мл; элюент CH3OH/CH3CN 70/30, об./об.). Собирают две группы фракций продукта и из них выпаривают растворитель. Получают 95 г промежуточного соединения 8. Пример А 1.i. Получение промежуточного соединения 9. Смесь промежуточного соединения 8 (полученного согласно A1.h, 0,0728 моль) и 1-(третбутилоксикарбонил)пиперазина (0,087 моль) в диоксане (500 мл) перемешивают и кипятят с обратным холодильником в течение 48 ч. Растворитель выпаривают, и добавляют СН 2 Сl2. Также добавляют Н 2O иNaOH (50%), и смесь экстрагируют СН 2 Сl2. Органический слой отделяют, сушат (МgSO4), и выпаривают растворитель в вакууме. Получают промежуточное соединение 9. Пример А 1.j. Получение промежуточного соединения 10. Смесь промежуточного соединения 9 (0,00318 моль) и 2,2,2-трифторуксусной кислоты (189 мл) в СН 2 Сl2 (500 мл) перемешивают в течение 1 ч при комнатной температуре. Растворитель выпаривают и остаток растворяют в CH2Cl2. Добавляют NaOH (50%) и смесь экстрагируют. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель в вакууме. Остаток очищают хроматографией на короткой колонке с силикагелем (элюент СН 2 Сl2/(МеОН/NН 3) 100/0; 95/5). Чистые фракции собирают, и выпаривают растворитель. Получают 14,32 г промежуточного соединения 10 (59%). Пример А 1.k. Получение промежуточного соединения 11. Смесь промежуточного соединения 10 (0,00599 моль), 1-хлор-2-пропанона (0,00599 моль) и K2 СО 3(0,01199 моль) в ДМФА (200 мл) перемешивают в течение 24 ч при комнатной температуре. Растворитель выпаривают. Остаток растворяют в СН 2 Сl2. Органический раствор промывают водой, сушат(MgSO4), фильтруют и выпаривают растворитель в вакууме. Получают промежуточное соединение 11(выход количественный). Пример А 1.l. Получение промежуточного соединения 12. Реакцию осуществляют в атмосфере N2. Смесь 3,4-дигидро-2-нафталинкарбоновой кислоты (0,0043 моль) и 1,1'-карбонилбис[1H-имидазола] (0,0047 моль) в сухом CH2Cl2 перемешивают в течение 1 ч при комнатной температуре. Добавляют раствор промежуточного соединения 7 (полученного согласно A1.g,0,0043 моль) в сухом СН 2 Сl2, и полученный реакционный раствор перемешивают в течение 24 ч при комнатной температуре. Раствор промывают водой и затем экстрагируют СН 2 Сl2. Отделенный органический слой сушат (Na2SO4), фильтруют и растворитель выпаривают. Остаток очищают хроматографией на короткой колонке с силикагелем (элюент СН 2 Сl2/СН 3 ОН 97/3). Чистые фракции собирают и выпаривают растворитель. Получают 0,4 г промежуточного соединения 12 (22%). Пример А 1.m. Получение промежуточного соединения 13. К раствору промежуточного соединения 7 (полученного согласно A1.g, 0,003 моль) в СН 2 Сl2 (20 мл) добавляют бромид этенилтрифенилфосфония (0,0025 моль). Реакционную смесь перемешивают в течение 4 ч при комнатной температуре. Растворитель выпаривают при пониженном давлении. Получают 2,2 г промежуточного соединения 13, которое используют на следующей реакционной стадии без дополнительной очистки. Пример А 1.n. Получение промежуточного соединения 14. К раствору (Е)-3-йод-2-метилпропеновой кислоты (0,009 моль) в сухом CH2Cl2 (100 мл) при комнатной температуре в токе N2 добавляют 1,1'-карбонилбис[1H-имидазол] (0,0099 моль). Смесь перемешивают в течение 1 ч и затем добавляют промежуточное соединение 7 (полученное согласно A1.g, 0,009 моль). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч, промывают Н 2O и насыщенным солевым раствором, сушат (Na2SO4), и выпаривают растворитель при пониженном давлении. Остаток (белое пенистое вещество) очищают хроматографией на короткой колонке с силикагелем(элюент CH2Cl2/MeOH 99/1). Чистые фракции собирают и выпаривают растворитель. Получают 3,82 г промежуточного соединения 14 (белое твердое вещество, 81%). Пример А 1.о. Получение промежуточного соединения 15. Раствор LiAlH4, 1,0 М/ТГФ (0,00848 моль) в ТГФ (100 мл) перемешивают в токе N2 при -20 С. Добавляют АlСl3 (0,0093 моль) в один прием и полученную смесь перемешивают при -20 С в течение 10 мин. Добавляют по каплям раствор промежуточного соединения 14 (полученного согласно A1.n, 0,0077 моль) в ТГФ (100 мл) и полученную смесь перемешивают при -20 С в течение 1 ч. При -10 С добавляют по каплям насыщенный (20%) раствор NH4Cl, и реакционную смесь оставляют нагреваться до комнатной температуры. К суспензии добавляют Н 2O и экстрагируют ее CH2Cl2. Органический слой отделяют, сушат (Na2SO4) и выпаривают растворитель при пониженном давлении. Остаток обрабатывают Et2O и сушат. Получают 3,73 г промежуточного соединения 15 (белое твердое вещество, 94%). Пример А 1.р. Получение промежуточного соединения 16. Смесь промежуточного соединения 7 (полученного согласно A1.g, 0,015 моль), 1-хлор-2-пропанона(0,015 моль) и K2 СО 3 (0,030 моль) в CH3CN (60 мл) перемешивают в течение 24 ч при комнатной температуре. Растворитель выпаривают. Остаток обрабатывают водой и СН 2 Сl2. Органический слой отделяют,сушат (Na2SO4) и выпаривают растворитель. Остаток очищают хроматографией на короткой колонке с силикагелем (элюент СН 2 Сl2/СН 3 ОН 95/5). Чистые фракции собирают, и выпаривают растворитель. Получают 4,79 г промежуточного соединения 16 (82%). Пример А 1.q. Получение промежуточного соединения 17. К раствору промежуточного соединения 16 (полученного согласно A1.p, 0,0051 моль) и Н 2O (3,2 мл) в ТГФ (40,5 мл) при 0 С добавляют по частям NaBH4 (0,0128 моль). Реакционную смесь перемешивают в течение ночи при комантной температуре и затем обрабатывают 10% водным раствором NH4Cl. Смесь экстрагируют СН 2 Сl2. Органический слой отделяют, сушат и выпаривают растворитель. Остаток очищают хроматографией на короткой колонке с силикагелем (элюент СН 2 Сl2/СН 3 ОН 97/3). Нужные фракции собирают и выпаривают растворитель. Получают 1,6 г промежуточного соединения 17 (80%). Пример А 1.r. Получение промежуточного соединения 18. Промежуточное соединение 7 (полученное согласно A1.g, 0,03 моль) растворяют в CH3CN (200 мл),и добавляют K2 СО 3 (0,27 моль). Добавляют оксиранметанол (0,27 моль) и реакционную смесь перемешивают в течение уикенда при 60 С. Растворитель выпаривают. Остаток обрабатывают водой и СН 2 Сl2. Органический слой отделяют, сушат (Na2SO4), фильтруют и выпаривают растворитель при пониженном-14 006747 давлении. Остаток очищают препаративной ВЭЖХ (элюент (1) CH2Cl2/(СН 3 ОН/NН 3) 95/5, затем элюент(2) СН 2 Сl2/СН 3 ОН 90/10). Фракции продукта собирают и выпаривают растворитель. Получают 7,5 г(61%) чистого промежуточного соединения 18 и 3,5 г смеси исходного вещества и нужного соединения(1/1). Пример А 1.s. Получение промежуточного соединения 19. Промежуточное соединение 18 (полученное согласно A1.r, 0,0012 моль) растворяют в СН 2 Сl2 (20 мл). Добавляют раствор натриевой соли перйодной кислоты (0,0024 моль) в NaHCO3/H2O (q.s.) и полученную реакционную смесь энергично перемешивают в течение 2 ч. Смесь обрабатывают водой и СН 2 Сl2. Органический слой отделяют, промывают насыщенным солевым раствором, сушат (Na2SO4),фильтруют и выпаривают растворитель в вакууме. Получают 0,430 г промежуточного соединения 19(выход количественный; используют на следующей реакционной стадии без дополнительной очистки). Пример А 2.а. Получение промежуточного соединения 20. Реакцию проводят в атмосфере N2. Раствор 2,2,2-трифтор-N-(2-формилфенил)ацетамида (0,1869 моль) в ДМФА (375 мл) добавляют по каплям к NaH (0,2055 моль) в ДМФА (375 мл). Смесь перемешивают в течение 30 мин при комнатной температуре. Добавляют по каплям раствор метилового эфира 4 бром-3-бутеновой кислоты (0,2803 моль) в ДМФА (200 мл). Затем добавляют 18-краун-6 (каталитическое количество). Полученную реакционную смесь перемешивают в течение 2 ч при 60 С и затем в течение ночи при комнатной температуре. Растворитель выпаривают. Остаток промывают водой и экстрагируютCH2Cl2. Отделенный органический слой сушат (Nа 2SO4), фильтруют и выпаривают растворитель. Остаток очищают хроматографией на открытой колонке с силикагелем (элюент СН 2 Сl2/гексан 90/10, 100/0 и СН 2 Сl2/2-пропанон 96/4, 90/10 и 80/20). Чистые фракции собирают и выпаривают растворитель. Получают 44,37 г промежуточного соединения 20 (75%, используют на следующей реакционной стадии без дополнительной очистки). Пример А 2.b. Получение промежуточного соединения 21. К раствору промежуточного соединения 20 (полученного согласно А 2.а, 0,1407 моль) в этаноле(450 мл) добавляют гидроксиламин (0,169 моль) и пиридин (0,211 моль), и полученную реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Смесь промывают 10% раствором лимонной кислоты и затем экстрагируют СН 2 Сl2. Органический слой отделяют, сушат (Na2SO4), фильтруют и выпаривают растворитель. Получают 45,76 г промежуточного соединения 21 (98%, используют на следующей реакционной стадии без дополнительной очистки). Пример А 2.с. Получение промежуточного соединения 22. Смесь промежуточного соединения 21 (полученного согласно А 2.b, 0,0658 моль) и натриевой солиN-хлор-4-метилбензолсульфонамида (0,0658 моль) в этаноле (500 мл) перемешивают и кипятят с обратным холодильником в течение 2 ч. Смесь концентрируют в вакууме, фильтруют через дикалит, фильтрат промывают водой и насыщенным солевым раствором и затем экстрагируют СН 2 Сl2. Органический слой отделяют, сушат (Na2SO4), фильтруют и выпаривают растворитель. Остаток очищают хроматографией на открытой колонке с силикагелем (элюент СН 2 Сl2/2-пропанон 100/0, 96/4, 90/10 и 80/20). Нужные фрак-15 006747 ции собирают и выпаривают растворитель. Остаток (сироп) кристаллизуют из гексана, затем промываютDIPE и сушат. Получают 12,32 г промежуточного соединения 22 (57%). Пример А 2.d. Получение промежуточного соединения 23. К смеси промежуточного соединения 22 (полученного согласно А 2.с, 0,0116 моль) в ТГФ (81 мл) и Н 2O (6,8 мл) при перемешивании и охлаждении льдом добавляют по частям NaBH4 (0,0289 моль). Полученную реакционную смесь перемешивают в течение ночи при комнатной температуре. Смесь обрабатывают насыщенным водным раствором NH4Cl и затем экстрагируют EtOAc. Органический слой отделяют, сушат (Na2SO4), фильтруют и выпаривают растворитель. Остаток промывают СН 2 Сl2 и затем перекристаллизовывают из EtOAc. Выпавшее в осадок вещество отфильтровывают и сушат. Получают 0,9 г промежуточного соединения 23 (38%). Пример А 2.е. Получение промежуточного соединения 24. Смесь промежуточного соединения 23 (полученного согласно A2.d, 0,001468 моль) и трифенилфосфина (0,001909 моль) в тетрахлорметане (30 мл) и ТГФ (20 мл) перемешивают и кипятят с обратным холодильником в течение 3 ч. Растворитель выпаривают досуха. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюент СН 2 Сl2/гексан 90/10, затем 100/0). Нужные фракции собирают и выпаривают растворитель. Остаток кристаллизуют из метанола. Выпавшее в осадок вещество отфильтровывают и сушат. Получают 2,6 г промежуточного соединения 24 (79%). Пример A3.а. Получение промежуточного соединения 25. К раствору 1,4-дихлор-2-бутена (0,025 моль) в СН 2 Сl2 (60 мл) добавляют по частям 1,1 диметилэтил-1-пиперазинкарбоксилат (0,02 моль). Реакционную смесь перемешивают в течение 24 ч при комнатной температуре и затем перемешивают и кипятят с обратным холодильником в течение 24 ч. Реакцию гасят насыщенным водным раствором NaHCO3, смесь сушат (Na2SO4), фильтруют и выпаривают растворитель. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюент СН 2 Сl2/EtOAc). Чистые фракции собирают и выпаривают растворитель. Получают 2,2 г промежуточного соединения 25 (40%). Пример A3.b. Получение промежуточного соединения 26. Реакцию осуществляют в токе N2. Смесь NaH (60%, 0,0579 моль) и 18-краун-6 (кат. количество) в ТГФ (25 мл) охлаждают. Добавляют по частям смесь 2-амино-4,5-диметоксибензальдегида (0,0579 моль) и ТГФ (50 мл). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин. Добавляют по частям смесь промежуточного соединения 25 (полученного согласно A3.а, 0,0386 моль) и ТГФ(50 мл). Смесь перемешивают при комнатной температуре в течение 3 суток и затем обрабатывают раствором NH4Cl (10%). Смесь экстрагируют СН 2 Сl2. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель досуха. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюент СН 2 Сl2/СН 3 ОН 99/1 и 98/2). Чистые фракции собирают и выпаривают растворитель. Получают 5,5 г промежуточного соединения 26 (23%). Пример A3.с. Получение промежуточного соединения 27. Реакцию осуществляют в токе N2. Смесь промежуточного соединения 26 (полученного согласно А 3.b, 0,02 моль) в ТГФ (80 мл) и 18-краун-6 (кат. количество) добавляют по частям к смеси NaH (60%,0,03 моль) и ТГФ (20 мл). Смесь перемешивают при комнатной температуре в течение 3 ч, обрабатывают-16 006747 раствором NH4Cl (20%), затем экстрагируют СН 2 Сl2 и выпаривают растворитель досуха. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюент СН 2 Сl2/СН 3 ОН 99/1 и 98/2). Чистые фракции собирают и выпаривают растворитель. Получают 5,3 г промежуточного соединения 27(58%). Пример A3.d. Получение промежуточного соединения 28. Смесь промежуточного соединения 27 (полученного согласно A3.с, 0,0115 моль), гидроксиламина(0,0126 моль) и NaHCO3 (0,023 моль) в абс. этаноле (60 мл) перемешивают при комнатной температуре в течение 24 ч, фильтруют, и выпаривают растворитель досуха. Получают 5,8 г промежуточного соединения 28 (95%). Пример A3.е. Получение промежуточного соединения 29. К раствору промежуточного соединения 28 (полученного согласно A3.d, 0,0109 моль) в CH2Cl2 (100 мл) добавляют по частям 1-хлор-2,5-пирролидиндион (0,0272 моль). Смесь перемешивают при комнатной температуре в течение 2 ч. Добавляют по каплям Et3N (0,0272 моль). Смесь перемешивают при комнатной температуре в течение ночи, гасят реакцию 10% раствором K2 СО 3, затем экстрагируют и выпаривают растворитель досуха. Получают промежуточное соединение 29. Пример A3.f. Получение промежуточного соединения 30. Смесь промежуточного соединения 29 (полученного согласно А 3.е, 0,0109 моль) и LiOH (0,0119 моль) в Н 2 О (17,5 мл) и 1,4-диоксане (70 мл) перемешивают при комнатной температуре в течение 3 ч. Смесь обрабатывают раствором NaOH (2 н.) и затем экстрагируют CH2Cl2. Растворитель выпаривают досуха. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюентCH2Cl2/CH3OH 98/2). Чистые фракции собирают и выпаривают растворитель. Получают 2,07 г промежуточного соединения 30 (45%). Пример A3.g. Получение промежуточного соединения 31. К раствору промежуточного соединения 30 (0,0047 моль) в CH2Cl2 (33 мл) добавляют по каплям трифторуксусную кислоту (7,9 мл). Смесь перемешивают при комнатной температуре в течение 3 ч, охлаждают и подщелачивают 50% раствором NaOH. Смесь экстрагируют и растворитель выпаривают досуха. Получают 1,6 г промежуточного соединения 31 (100%). Пример А 4.а. Получение промежуточного соединения 32. К смеси 1-(2-нафтилметил)пиперазина (0,025 моль) и NaHCO3 (0,025 ммоль) в CH2Cl2 (75 мл) добавляют 1,4-дихлор-2-бутен (0,03 моль). Реакционную смесь перемешивают в течение 24 ч при комнатной температуре. Твердое вещество отфильтровывают, промывают CH2Cl2 и органический раствор промывают 10% раствором Na2CO3, сушат (Na2SO4), фильтруют и выпаривают растворитель. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюент CH2Cl2/EtOAc/2-пропанон).-17 006747 Чистые фракции собирают и выпаривают растворитель. Получают 3,4 г промежуточного соединения 32(43%). Пример А 4.b. Получение промежуточного соединения 33. Раствор NS (0,0546 моль) и трет-бутиламина (0,0983 моль) в толуоле (75 мл) перемешивают и кипятят с обратным холодильником в течение 24 ч с использованием водоотделителя Дина-Старка. Растворитель выпаривают. Остаток очищают перегонкой (т.кип. при 5 мм рт.ст. 75 С). Получают 8,1 г промежуточного соединения 33 (72%). Пример А 4.с. Получение промежуточного соединения 34. Реакцию осуществляют в атмосфере N2. К раствору промежуточного соединения 33 (полученного согласно А 4.а, 0,0125 моль) и 2,2,6,6-тетраметилпиперидина (0,0012 моль) в сухом ТГФ (25 мл) при перемешивании при -78 С добавляют по каплям н-BuLi (0,014 моль). Смесь перемешивают в течение 3 ч при -10 С. При -10 С добавляют по частям раствор промежуточного соединения 32 (полученного согласно А 4.b, 0,0083 моль) в сухом ТГФ (25 мл). Реакционную смесь перемешивают в течение 24 ч при комнатной температуре, затем реакцию гасят раствором NH4Cl (10%), и органический слой отделяют. Водный слой экстрагируют СН 2 Сl2. Объединенные органические слои сушат (Na2SO4), фильтруют и выпаривают растворитель. Получают 5,6 г промежуточного соединения 34 (100%). Пример А 4.d. Получение промежуточного соединения 35. К раствору промежуточного соединения 34 (полученного согласно А 4.с, 0,0083 моль) в абс. этаноле(50 мл) добавляют NаНСО 3 (0,015 моль) и гидроксиламин (0,0125 моль). Реакционную смесь перемешивают в течение 24 ч при комнатной температуре. Добавляют СН 2 Сl2 и твердое вещество отфильтровывают и промывают CH2Cl2. Растворитель выпаривают. Остаток растворяют в CH2Cl2 и раствор промывают 10% раствором Na2CO3 и насыщенным солевым раствором. Органический слой отделяют, сушат(Na2SO4), фильтруют и выпаривают растворитель. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюент CH2Cl2/EtOAc/2-пропанон). Чистые фракции собирают и выпаривают растворитель. Получают 0,9 г промежуточного соединения 35 (24%). Пример А 5.а. Получение соединения 36. Смесь А (0,029 моль) и промежуточного соединения 5 (полученного согласно А 1.е, 0,0058 моль) в 1,4-диоксане перемешивают в течение 6 ч при 100 С. Растворитель выпаривают. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюент CH2Cl2/CH3OH 98/2-97/3). Фракции продукта реакции собирают и выпаривают растворитель. Получают 3,3 г промежуточного соединения 36. Пример А 5.b. Получение соединения 37. К раствору промежуточного соединения 36 (полученного согласно A5.f, 0,0071 моль) в СНСl3 (50 мл) добавляют по каплям трифторуксусную кислоту (11,7 мл) и полученную реакционную смесь перемешивают в течение 3 ч при 10 С. Реакционную смесь охлаждают и затем подщелачивают 50% раствором NaOH. Полученную смесь экстрагируют и из экстракта выпаривают растворитель. Получают 2,5 г промежуточного соединения 37 (выход количественный, используют на следующей реакционной стадии без дополнительной очистки). В. Получение конечных соединений. Пример B1.a. Получение соединения 1.-18 006747 Смесь промежуточного соединения 5 (полученного согласно А 1.е, 0,0291 моль) и 1-(3-фенил-2 пропенил)пиперазина (0,0582 моль) нагревают в течение 2 ч при 100 С. Сырую реакционную смесь промывают водой и экстрагируют CH2Cl2. Органический слой отделяют, сушат (Na2SO4), фильтруют и выпаривают растворитель. Остаток очищают хроматографией на короткой открытой колонке с силикагелем(элюент CH2Cl2/СН 3 ОН 95/5) и ВЭЖХ на силикагеле (элюент CH2Cl2/СН 3 ОН 80/20). Чистые фракции собирают и выпаривают растворитель. Полученную фракцию разделяют на ее оптические энантиомеры хиральной колоночной хроматографией на Chiralpak AD (элюент C2H5OH/CH3CN 90/10). Собирают фракции (В)-энантиомера и выпаривают растворитель. Остаток растворяют в метаноле и преобразуют в гидрохлорид (1:2). Выпавшее в осадок вещество отфильтровывают и сушат. Получают 2,47 г соединения 1. Пример В 1.b. Получение соединения 2. Смесь промежуточного соединения 5 (полученного согласно А 1.е, 0,0044 моль) и (3-фенил-2 пропенил)пиперазина (0,0087 моль) перемешивают в течение 2 ч при 100 С. Реакционную смесь очищают хроматографией на короткой открытой колонке с силикагелем (элюент CH2Cl2/СН 3 ОН 95/5) и затем высокоэффективной жидкостной хроматографией на силикагеле (элюент CH2Cl2/СН 3 ОН 96/4). Чистые фракции собирают и выпаривают растворитель. Остаток (1,4 г) обрабатывают диэтиловым эфиром и затем сушат. Получают 1,2 г соединения 2 (60%). Пример В 1.с. Получение соединения 3. Смесь промежуточного соединения 6 (0,00227 моль), (Е)-1-(2-метил-3-фенил-2-пропенил) пиперазина (0,00273 моль) и NaHCO3 (0,00455 моль) в диоксане (30 мл) перемешивают и кипятят с обратным холодильником в течение 48 ч. Растворитель выпаривают. Остаток растворяют в CH2Cl2. Органический раствор промывают водой, сушат (МgSO4), фильтруют и выпаривают растворитель. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюент CH2Cl2/(СН 3 ОН/NН 3) 99/1) и затем ВЭЖХ (элюент CH2Cl2/СН 3 ОН от 99,5/0,5 до 98/2). Нужные фракции собирают и выпаривают растворитель. Получают 0,17 г соединения 3. Пример В 1.d. Получение соединения 4. Смесь промежуточного соединения 8 (полученного согласно A1.h, 0,0058 моль) и(0,0116 моль) в диоксане (10 мл) перемешивают и кипятят с обратным холодильником в течение 8 ч, затем перемешивают в течение ночи при комнатной температуре и затем перемешивают и кипятят с обратным холодильником в течение 18 ч. Смесь обрабатывают Н 2 О и экстрагируют CH2Cl2. Органический слой отделяют и выпаривают растворитель. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюент CH2Cl2/MeOH 97/3). Нужные фракции собирают и выпаривают растворитель. Остаток обрабатывают диэтиловым эфиром и затем сушат. Получают 0,9 г соединения 4 (33%). Пример В 1.е. Получение соединения 5. Смесь промежуточного соединения 10 (полученного согласно A1.i, 0,0029 моль),(0,0058 моль), АсОН (0,48 г) и (AcO)3BHNa (0,4 г) в 1,2-дихлорэтане (20 мл) перемешивают и кипятят с обратным холодильником в течение ночи. Смесь обрабатывают Н 2O и экстрагируют. Органический слой отделяют и выпаривают растворитель. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюент CH2Cl2/MeOH 97/3). Нужные фракции собирают и выпаривают растворитель. Остаток обрабатывают диэтиловым эфиром и затем сушат. Получают 1,07 г соединения 5 (82%). Пример В 1.f. Получение соединения 6.Et3N (0,00061 моль) в хлороформе (10 мл) перемешивают при комнатной температуре в течение 2 ч. Добавляют воду и полученную смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4),фильтруют, и выпаривают растворитель в вакууме. Остаток очищают СС-ТСХ на хроматотроне (элюентCH2Cl2/СН 3 ОН 97/3; затем 99/1). Нужные фракции собирают и выпаривают растворитель. Получают 0,022 г соединения 6. Пример В 1.g. Получение соединения 7. Соединение 2 (полученное согласно B1.b, 0,0022 моль) разделяют на чистые оптические энантиомеры хиральной колоночной хроматографией на Chiralpak AD (элюент C2H5OH/CH3CN 90/10). Собирают две группы фракций и выпаривают из них растворитель. Получают 1,5 г фракции 1 (чистота по LCI 99,5%) и 1,5 г фракции 2 (чистота по LCI 99,5%). Фракцию 1 кристаллизуют, обрабатывая гексаном при перемешивании в течение ночи. Выпавшее в осадок вещество отфильтровывают и сушат. Получают 1,08 г соединения 7 (маслянистое твердое вещество). Фракцию 2 кристаллизуют, обрабатывая EtOAc при перемешивании в течение ночи. Выпавшее в осадок вещество отфильтровывают и сушат. Получают 0,54 г соединения 8 (маслянистое твердое вещество). Пример В 2.а. Получение соединения 9. Смесь промежуточного соединения 24 (полученного согласно А 2.е, 0,0022 моль), 1-(2 нафталинметил)пиперазина (0,0044 моль и KI (каталитическое количество) в 1,4-диоксане (2,5 мл) перемешивают и кипятят с обратным холодильником в течение ночи. Реакционную смесь промывают водой и экстрагируют CH2Cl2. Остаток очищают хроматографией на короткой открытой колонке с силикагелем(элюент CH2Cl2/СН 3 ОН 98/2) и затем ВЭЖХ (элюент CH2Cl2/(СН 3 ОН/NН 3) 96/4). Чистые фракции собирают и выпаривают растворитель. Остаток обрабатывают DIPE, отфильтровывают и сушат. Получают 0,3 г соединения 9 (30%). Пример В 2.b. Получение соединения 10.NaH (60%, 0,0018 моль) в сухом ТГФ (2 мл). Реакционную смесь перемешивают в течение 30 мин при комнатной температуре, добавляют по каплям ацетонитрил (0,0013 моль) и реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Реакционную смесь промывают водным растворомNH4Cl и экстрагируют CH2Cl2. Органический слой после отделения сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюентCH2Cl2/СН 3 ОН 98/2) и затем ВЭЖХ (элюент CH2Cl2/(СН 3 ОН/NН 3) 98/2). Чистые фракции собирают и выпаривают растворитель. Получают 0,26 г соединения 10 (52%). Пример В 3.а. Получение соединения 11. Смесь промежуточного соединения 31 (полученного согласно А 3.g, 0,0045 моль), (Е)-(3-хлор-2 метил-1-пропенил)бензола (0,0037 моль) и K2 СО 3 (0,0037 моль) в ДМФА (15 мл) перемешивают при 70 С в течение 2 ч. Смесь промывают водой и затем экстрагируют CH2Cl2. Органический слой отделяют,сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюент CH2Cl2/СН 3 ОН 98/2). Нужные фракции собирают, и выпаривают растворитель. Остаток очищают снова ВЭЖХ (элюент CH2Cl2/(СН 3 ОН/NН 3) 98/2). Чистые фракции собирают и выпаривают растворитель. Остаток обрабатывают DIPE. Выпавшее в осадок вещество отфильтровывают и сушат. Получают 0,34 г соединения 11 (20%). Пример В 3.b. Получение соединения 12. Соединение 11 (полученное согласно В 3.а, 0,00605 моль) очищают высокоэффективной жидкостной хроматографией на Chiracel OJ (элюент гексан/MeOH/EtOH 20/24/56). Нужные фракции собирают и выпаривают растворитель. Получают фракции А и В. Фракцию А очищают высокоэффективной жидкостной хроматографией на RP BDS C18 (элюент (0,5% NH4OAс в Н 2O/СН 3 СN (90/10/МеОН 70/30). Чистые фракции собирают и выпаривают растворитель. Водный слой экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток перемешивают в гексане и выпавшее в осадок вещество отфильтровывают. Получают 0,69 г соединения 12. Фракцию В очищают высокоэффективной жидкостной хроматографией на RP BDS C18 (элюент (0,5% NH4OAc в Н 2O/СН 3 СN (90/10/МеОН 70/30). Чистые фракции собирают и выпаривают растворитель. Водный слой экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток перемешивают в гексане и выпавшее в осадок вещество отфильтровывают. Получают 0,67 г соединения 13. Пример 4. Получение соединения 14. Реакцию осуществляют в твердой фазе с использованием синтезатора Quest 210 (Argonaut Technologies,(0,0006 моль) вацетонитриле (4 мл) добавляют N,NСан-Карлос, США). К суспензии диизопропилэтиламин (0,0036 моль). Добавляют 1-(2-хлорфенилметил)пиперазин (0,0012 моль) и полученную реакционную смесь премешивают в течение 20 ч при 80 С. Затем содержимое каждого реактора фильтруют и фильтрат упаривают. Остаток очищают ВЭЖХ. Чистые фракции собирают и выпаривают растворитель. Получают 0,102 г соединения 14. Пример В 5.а. Получение соединения 15. Смесь промежуточного соединения 7 (полученного согласно A1.g, 0,0036 моль), 2-(бромметил) нафталина (0,0055 моль) и K2 СО 3 (0,0055 моль) в MIK (15 мл) перемешивают в течение 24 ч при 100 С. Сырую реакционную смесь промывают водой и затем экстрагируют CH2Cl2. Органический слой отделяют, сушат (Na2SO4), фильтруют и выпаривают растворитель. Остаток очищают высокоэффективной жидкостной хроматографией на силикагеле (2 х) I) элюент CH2Cl2/СН 3 ОН 95/5; (II) элюентCH2Cl2/(СН 3 ОН/NН 3) 98/2). Чистые фракции собирают и выпаривают растворитель. Получают 0,2 г соединения 15 (11%). Пример B5.b. Получение соединения 16. Соединение 15 (полученное согласно В 5.а, 0,0106 моль) разделяют на его энантиомеры колоночной хроматографией (элюент гексан/С 2 Н 5OН, градиент от 30/70 до 0/100; колонка CHIRALPAK AD, 1000 А,20 мкм, DIACEL). Собирают две чистые фракции и из них выпаривают растворитель. Остаток растворяют в СН 3 ОН и превращают в соль гидрохлорид (1:2). Выпавшее в осадок вещество отфильтровывают и сушат. Получают 2,08 г соединения 16 (36%) и 2,19 г соединения 17 (38%). Пример В 6. Получение соединения 18. Смесь промежуточного соединения 7 (полученного согласно A1.g, 0,0045 моль), 2-метил-3-(3 тиенил)-2-пропеналя (0,00675 моль), NаВН(ОАс)3 (0,00675 моль) и НОАс (2 капли) в 1,2-дихлорэтане (30 мл) перемешивают в течение ночи при комнатной температуре. Добавляют насыщенный водный растворNH3Cl и полученную смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают колоночной флэш-хроматографией на силикагеле(элюент CH2Cl2/(CH3OH/NH3) 97/3) и затем ВЭЖХ (элюент CH2Cl2/(СН 3 ОН/NН 3) от 99/1 до 98/2). Фракции продукта собирают и выпаривают растворитель. Получают 0,965 г соединения 18 (46%; также содержит 3% (Z)-изомера). Пример В 7. Получение соединения 19. Смесь промежуточного соединения 10 (полученного согласно A1.j, 0,003 моль), 4-хлорбензальдегида (0,0045 моль) и (AcO)3BHNa (0,0045 моль) в 1,2-дихлорэтане (30 мл) перемешивают и кипятят с обратным холодильником в течение 2 ч при комнатной температуре. Добавляют насыщенный водный раствор NH4Cl и полученную смесь экстрагируют CH2Cl2. Отделенный органический слой сушат(MgSO4), фильтруют и выпаривают растворитель в вакууме. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюент CH2Cl2/(МеОН/NН 3) 97/3). Нужные фракции собирают и выпаривают растворитель. Остаток переосаждают из DIPE. Получают 1,180 г соединения 19 (57%). Пример В 8. Получение соединения 20.NаОСН 3 в СН 3 ОН (0,00108 моль) в сухом СН 3 ОН (8 мл) перемешивают в течение 16 ч при 65 С (реакцию осуществляют в твердой фазе с использованием синтезатора Quest 210 (Argonaut Technologies, СанКарлос, США). Смеси фильтруют и фильтрат очищают ВЭЖХ (элюент CH2Cl2/(СН 3 ОН/NН 3) 98/2). Нужные фракции собирают и выпаривают растворитель. Получают 0,032 г соединения 20.-20 С. Добавляют в один прием АlСl3 (0,0009 моль). Полученный раствор перемешивают в течение 10 мин при -20 С. Добавляют по каплям раствор промежуточного соединения 12 (полученного согласно А 1.l,0,0008 моль) в ТГФ (5 мл) и полученную реакционную смесь перемешивают в течение 1 ч при -20 С. Затем осторожно добавляют насыщенный водный раствор NH4Cl. Реакционную смесь промывают водой и затем экстрагируют СН 2 Сl2. Органический слой отделяют, сушат (Na2SO4), фильтруют и выпаривают растворитель. Остаток обрабатывают эфиром. Остаток (0,13 г) очищают СС-ТСХ на хроматотроне (элюент CH2Cl2/СН 3 ОН 97/3). Чистые фракции собирают и выпаривают растворитель. Получают 0,09 г соединения 21 (30%). Пример В 10. Получение соединения 22. Реакцию осуществляют в токе N2. Смесь промежуточного соединения 13 (полученного согласноA1.m, 0,001 моль) и сухого СН 3 ОН (20 мл) перемешивают при комнатной температуре. Добавляют 30% раствор NаОСН 3 в СН 3 ОН (0,002 моль). Добавляют 5-инданкарбоксальдегид (0,002 моль) и полученную реакционную смесь перемешивают и кипятят с обратным холодильником в течение 16 ч. Реакционную смесь оставляют охлаждаться до комнатной температуры. Добавляют 20% раствор NH4Cl и полученную смесь экстрагируют CH2Cl2. Органический слой отделяют, промывают водой и насыщенным солевым раствором, сушат (Na2SO4), фильтруют и выпаривают растворитель при пониженном давлении. Остаток очищают хроматографией на короткой открытой колонке и СС-ТСХ (элюент CH2Cl2/СН 3 ОН 98/2). Фракции продукта реакции собирают и выпаривают растворитель. Получают 0,035 г соединения 22 (7,2%,светло-коричневое твердое вещество). Пример В 11. Получение соединения 23. Смесь промежуточного соединения 15 (полученного согласно A1.o, 0,00136 моль), 2-(триметилстаннил)пиридина (0,0027 моль) и Рd(РРh3)4 (0,00013 моль) в толуоле (20 мл) нагревают до 100 С. Смесь перемешивают в течение 16 ч и охлаждают до комнатной температуры. Добавляют Н 2O и смесь экстрагируют CH2Cl2. Отделенный органический слой собирают, промывают Н 2O и насыщенным солевым раствором, сушат (Na2SO4) и выпаривают растворитель при пониженном давлении. Остаток очищают хроматографией на короткой открытой колонке (элюент CH2Cl2/MeOH 98/2). Чистые фракции собирают и выпаривают растворитель. Полученный остаток очищают СС-ТСХ на хроматотроне (элюентCH2Cl2/MeOH 98/2). Чистые фракции собирают и выпаривают растворитель. Получают 0,044 г соединения 23 (светло-коричневое твердое вещество, 7%). Пример В 12. Получение соединения 24.(0,0062 моль) в ТГФ (20 мл) при перемешивании добавляют по каплям 2,5 М раствор н-BuLi (0,0062 моль) в гексане. Смесь перемешивают в течение 15 мин. Добавляют по каплям раствор промежуточного соединения 11 (полученного согласно A1.k, 0,00514 моль) в ТГФ (20 мл). Реакционную смесь перемешивают в течение 16 ч при 50 С. Добавляют воду и полученную смесь экстрагируют Et2O. Органический слой отделяют, сушат (МgSO4), фильтруют и выпаривают растворитель в вакууме. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюент CH2Cl2/СН 3 ОН 97/3) и затем ВЭЖХ (элюент CH2Cl2/(СН 3 ОН/NН 3) 99/1) для разделения изомеров (E)/(Z). Две группы фракций продукта реакции собирают и из них выпаривают растворитель. Получают 0,651 г соединения 24 (26%, (Е. Пример В 13. Получение соединения 25.(0,0015 моль) и смесь перемешивают в течение 15 мин. Смесь фильтруют и остаток на фильтре (смолу) промывают безводным ТГФ (3 х). Смолу суспендируют в ТГФ. Добавляют промежуточное соединение 19(полученное согласно A1.s, 0,0004 моль) и реакционную смесь перемешивают в течение ночи при 100 С. Смесь охлаждают, фильтруют и фильтрат упаривают в вакууме. Остаток очищают препаративной ВЭЖХ(элюент CH2Cl2/(СН 3 ОН/NН 3) 97/3). Фракции продукта реакции собирают и выпаривают растворитель. Получают 0,168 г соединения 25. Пример В 14. Получение соединения 26. Смесь промежуточного соединения 16 (полученного согласно A1.p, 0,0025 моль), бензоламина(0,0028 моль) и NaBH4 (0,0028 моль) в НОАс (50 мл) перемешивают в течение 2 ч при комнатной температуре. Добавляют водный раствор NH4Cl. Полученную смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель в вакууме. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюент CH2Cl2/(СН 3 ОН/NН 3) 99/1) и затем колоночной флэш-хроматографией на силикагеле (элюент CH2Cl2/(СН 3 ОН/NН 3) 98/2). Фракции продукта реакции собирают и выпаривают растворитель. Получают 0,181 г соединения 26 (15%). Пример В 15. Получение соединения 27. К раствору промежуточного соединения 17 (полученного согласно A1.q, 0,0012 моль), 3-фторфенола (0,0018 моль) и РРh3, пол. (0,0024 моль), в сухом ТГФ (10 мл) в атмосфере N2 добавляют по кап(0,0018 моль). Реакционную смесь перемешивают в течение ночи при комнатной темлям пературе. Смесь фильтруют, промывают CH2Cl2 и СН 3 ОН, и выпаривают растворитель. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюент CH2Cl2/EtOAc 2/1 иCH2Cl2/СН 3 ОН 96/4) и затем колоночной флэш-хроматографией на силикагеле (элюент CH2Cl2/СН 3 ОН 97/3). Фракции продукта реакции собирают и выпаривают растворитель. Получают 0,29 г соединения 27 К раствору промежуточного соединения 35 (полученного согласно A4.d, 0,002 моль) в CH2Cl2 (10 мл) добавляют NaClO (4%, 0,005 моль). Реакционную смесь перемешивают в течение 4 ч при комнатной температуре. Добавляют Et3N (0,004 моль) и реакционную смесь перемешивают в течение 24 ч при комнатной температуре. Органический слой отделяют, промывают раствором Na2SO3 (10%), сушат (Na2SO4),фильтруют и выпаривают растворитель. Остаток очищают хроматографией на короткой открытой колонке (элюент EtOAc и CH2Cl2/СН 3 ОН 95/5). Нужные фракции собирают и выпаривают растворитель. Остаток растворяют в диэтиловом эфире, затем раствор фильтруют через дикалит и фильтрат упаривают. Остаток растворяют в диэтиловом эфире и преобразуют в гидрохлорид (1:2). Выпавшее в осадок вещество отфильтровывают, промывают 2-пропаноном и диэтиловым эфиром и сушат. Получают 0,15 г соединения 28 (15%). Пример В 17. Получение соединения 29.-24 006747 Смесь промежуточного соединения 37 (полученного согласно А 5.g, 0,006 моль) и 2(бромметил)нафталина (0,003 моль) в диоксане (40 мл) перемешивают при 100 С в течение 6 ч и затем в течение ночи при комнатной температуре. Реакционную смесь обрабатывают 10% водным растворомK2 СО 3 и затем экстрагируют CH2Cl2. Органический слой отделяют и упаривают. Остаток очищают хроматографией на короткой открытой колонке с силикагелем (элюент CH2Cl2/СН 3 ОН 95/5 и 90/10 иCH2Cl2/(СН 3 ОН/NН 3) 95/5). Фракции продукта реакции собирают, и выпаривают растворитель. Остаток(1,49 г) обрабатывают диэтиловым эфиром и затем сушат. Получают 0,8 г соединения 29 (53%). В приведенных далее таблицах (табл. 1-5) перечислен ряд соединений, которые получают согласно какому-либо из примеров, приведенных выше. Все соединения также проверяют на их фармакологическую активность. Таблица 1
МПК / Метки
МПК: A61P 25/00, C07D 261/20, A61K 31/495, C07D 498/04
Метки: производные, изоксазолина, качестве, антидепрессантов
Код ссылки
<a href="https://eas.patents.su/30-6747-proizvodnye-izoksazolina-v-kachestve-antidepressantov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные изоксазолина в качестве антидепрессантов</a>
Предыдущий патент: Способы лечения глазных неоваскулярных заболеваний
Следующий патент: Сигаретный фильтр с волокнами активированного угля
Случайный патент: Штамм молочно-кислых бактерий streptococcus thermophilus, обеспечивающий улучшенную текстуру ферментированных молочных продуктов, и его применение












