Производные тропана в качестве модуляторов ссr5
Номер патента: 7590
Опубликовано: 29.12.2006
Авторы: Тэйлор Стефан Колин Джон, Басфорд Патрисиа Энн, Вуд Энтони, Стефенсон Питер Томас
Формула / Реферат
1. Соединение формулы (I)
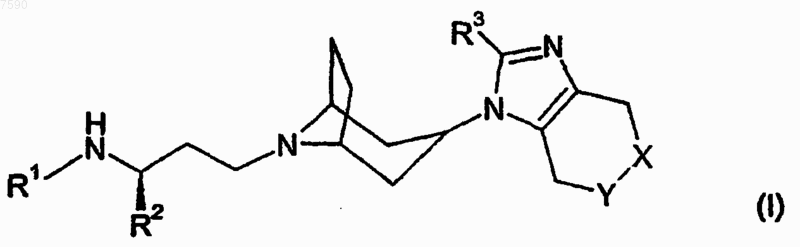
или его фармацевтически приемлемые соль, сольват или его производные, где
X и Y выбирают из СН2 и NR4 так, что один из X или Y представляет собой СН2, а другой представляет собой NR4;
R1 и R4 независимо представляют собой R5; COR5; CO2R5; CONR6R7; SO2R5 или (С1-6-алкилен)фенил, где фенил замещен 0-3 атомами или группами, выбранными из С1-6-алкила, С1-6-алкилкарбонила, С1-6-алкокси, С1-6-алкоксикарбонила, галогена, CF3, ОН, CN, NR6R7, COR7, CO2R7 или CONR6R7;
R2 представляет собой фенил, замещенный 0-3 атомами или группами, выбранными из С1-6-алкила, С1-6-алкилкарбонила, С1-6-алкокси, C1-6-алкоксикарбонила, галогена, CF3, ОН, CN, NR6R7, CO2R7 или CONR6R7;
R3 представляет собой C1-4-алкил, замещенный 0-3 атомами фтора;
R5 представляет собой С1-6-алкил, С2-6-алкенил, С2-6-алкинил, С3-7-циклоалкил; 5- или 6-членный ароматический гетероцикл или 4-7-членный насыщенный гетероцикл; где указанные алкил, алкенил, алкинил и циклоалкил замещены 0-3 атомами или группами, выбранными из оксо, галогена, CF3, OR7, CN, NR6R7, COR7, CO2R7 или CONR6R7; где указанные гетероциклы содержат от одного до трех гетероатомов, выбранных из N, О или S; и где указанные гетероциклы замещены 0-3 атомами или группами, выбранными из С1-6-алкила, С1-6-алкилкарбонила, С1-6-алкокси, С1-6-алкоксикарбонила, галогена, CF3, ОН, CN, NR6R7, COR7, CO2R7 или CONR6R7;
R6 представляет собой Н; С1-6-алкил, С2-6-алкенил, С2-6-алкинил, С3-7-циклоалкил; 5- или 6-членный ароматический гетероцикл или 4-7-членный насыщенный гетероцикл; где указанные алкил, алкенил, алкинил и циклоалкил замещены 0-3 атомами или группами, выбранными из оксо, галогена, CF3, OR7, CN, COR7 или CO2R7; где указанные гетероциклы содержат от одного до трех гетероатомов, выбранных из N, О или S; и где указанные гетероциклы замещены 0-3 атомами или группами, выбранными из С1-6-алкила, С1-6-алкилкарбонила, С1-6-алкокси, C1-6-алкоксикарбонила, галогена, CF3, ОН, CN, COR7 или CO2R7;
R7 представляет собой Н или С1-б-алкил;
или, когда R6 и R7 оба присоединены к одному и тому же атому N, NR6R7 может также представлять собой 5-7-членный, насыщенный, частично ненасыщенный или ароматический гетероцикл, содержащий от 0 до 2 дополнительных гетероатомов, выбранных из О, N или S.
2. Соединение по п.1, где X представляет собой СН2, NC1-4-алкил, NCH2-фенил, NCOC1-4-алкил, замещенный 0-3 атомами фтора, NCO2C1-4-алкил или NSO2C1-2-алкил.
3. Соединение по п.1, где X представляет собой СН2, NCOC1-2-алкил, замещенный 0-3 атомами фтора, или NCO2C1-4-алкил.
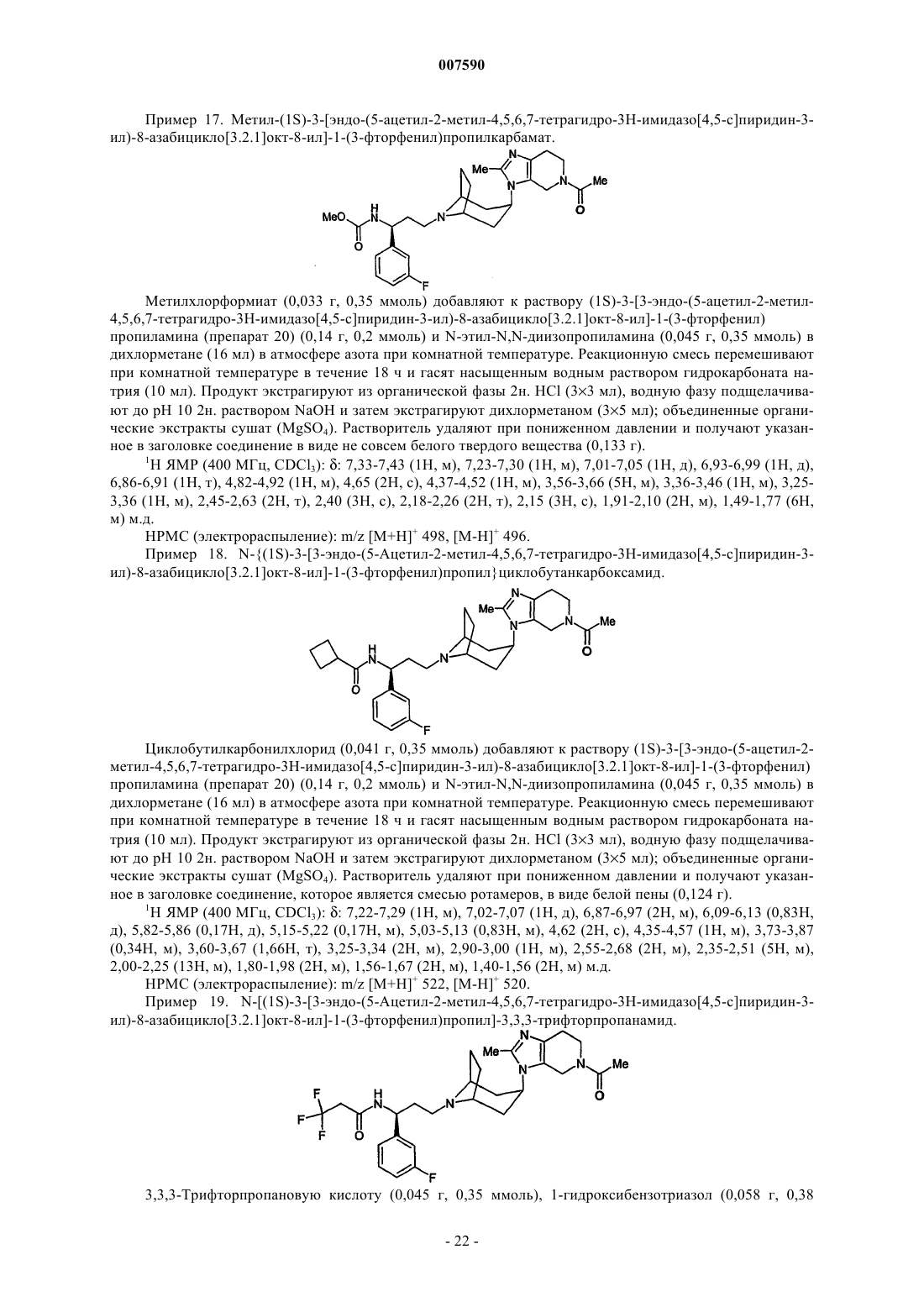
4. Соединение по любому из предшествующих пунктов, где X представляет собой СН2, NCOC1-2-алкил или NCO2C1-2-алкил.
5. Соединение по п.1, где Y представляет собой СН2, NC1-6-алкил, N(С1-6-алкилен)фенил, NCOC1-6-алкил, замещенный 0-3 атомами фтора, NCO2С1-6-алкил или NSO2C1-6-алкил.
6. Соединение по п.1, где Y представляет собой СН2, NC1-4-алкил, N(C1-4-алкилен)фенил, NCOC1-4-алкил, замещенный 0-3 атомами фтора, NCO2С1-4-алкил или NSO2C1-4-алкил.
7. Соединение по п.1, где Y представляет собой СН2, NC1-4-алкил, NCH2-фенил, NCOC1-4-алкил, замещенный 0-3 атомами фтора, NCO2C1-4-алкил или NSO2C1-2-алкил.
8. Соединение по п.1, где Y представляет собой СН2, NCOC1-2-алкил или NCO2С1-2-алкил.
9. Соединение по любому из предшествующих пунктов, где R1 представляет собой COR5 или CO2R5 и R5 означает С1-6-алкил, замещенный 0-3 атомами фтора, С3-7-циклоалкил, замещенный 0-3 атомами фтора, C1-6-алкокси, замещенный 0-3 атомами фтора, или 4-7-членный насыщенный гетероцикл, содержащий 1-3 гетероатома, выбранных из N, О или S.
10. Соединение по любому из предшествующих пунктов, где R1 представляет собой COR5 или CO2R5, где R5 означает C1-4-алкил, замещенный 0-3 атомами фтора, С3-5-циклоалкил, замещенный 0-3 атомами фтора, или 5- или 6-членный N, О или S-содержащий насыщенный гетероцикл.
11. Соединение по любому из предшествующих пунктов, где R1 представляет собой COR5 или CO2R5, и R5 означает C1-3-алкил, замещенный 0-3 атомами фтора, С3-4-циклоалкил или 5- или 6-членный О-содержащий насыщенный гетероцикл.
12. Соединение по любому из предшествующих пунктов, где R1 представляет собой COC1-2-алкил или СO2С1-2-алкил.
13. Соединение по любому из предшествующих пунктов, где R2 представляет собой фенил, замещенный 0-3 атомами фтора.
14. Соединение по любому из предшествующих пунктов, где R2 представляет собой фенил, замещенный 0 или 1 атомом фтора.
15. Соединение по любому из предшествующих пунктов, где R2 представляет собой монофторзамещенный фенил.
16. Соединение по любому из предшествующих пунктов, где R3 представляет собой C1-4-алкил.
17. Соединение по любому из предшествующих пунктов, где R3 представляет собой метил.
18. Соединение по п.1, которое представляет собой метил-1-эндо-{8-[(3S)-3-(ацетиламино)-3-(3-фторфенил)пропил]-8-азабицикло[3.2.1]окт-3-ил}-2-метил-4,5,6,7-тетрагидро-1H-имидазо[4,5-с]пиридин-5-карбоксилат или его фармацевтически приемлемые соль, сольват или производное.
19. Соединение по п.1, которое представляет собой метил-1-{эндо-8-[(3S)-3-ацетамидо-3-(3-фторфенил)пропил]-8-азабицикло[3.2.1]окт-3-ил}-2-метил-4,5,6,7-тетрагидро-1H-имидазо[4,5-с]пиридин-5-карбоксилат (R,R)-тартрат.
20. Фармацевтическая композиция, включающая соединение формулы (I) или его фармацевтически приемлемые соль, сольват или производное по любому из предшествующих пунктов, вместе с одним или несколькими фармацевтически приемлемым(и) наполнителем(ями), разбавителем(ями) или носителем(ями).
21. Фармацевтическая композиция по п.20, включающая одно или несколько дополнительных терапевтических средств.
22. Фармацевтическая композиция по п.21, где дополнительное терапевтическое средство или дополнительные терапевтические средства включают один или несколько ингибиторов ВИЧ-протеазы и/или ингибиторов ВИЧ-обратной транскриптазы.
23. Фармацевтическая композиция по п.22, где один или несколько ингибиторов ВИЧ-обратной транскриптазы выбирают из класса ненуклеозидных ингибиторов обратной транскриптазы и из нуклеозид/нуклеотидных ингибиторов обратной транскриптазы.
24. Применение соединения формуыы (I) или его фармацевтически приемлемых соли, сольвата или производного по любому из пп.1-19 в качестве лекарственного средства.
25. Применение соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или производного по любому из пп.1-19 для лечения заболеваний, в которые вовлечена модуляция рецепторов CCR5.
26. Применение по п.25, где заболеванием является ВИЧ-инфекция, генетически родственная ВИЧ ретровирусная инфекция, СПИД или воспалительное заболевание.
27. Применение соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или производного по любому из пп.1-19 для изготовления лекарственного средства для лечения заболеваний, в которые вовлечена модуляция рецепторов CCR5.
28. Применение по п.27, где заболеванием является ВИЧ-инфекция, генетически родственная ВИЧ ретровирусная инфекция, СПИД или воспалительное заболевание.
29. Применение по п.27, где заболеванием является респираторное заболевание, выбранное из респираторного дистресс-синдрома у взрослых (ARDS), бронхита, хронического бронхита, хронического обструктивного легочного заболевания, муковисцидоза, астмы, эмфиземы, ринита или хронического синусита.
30. Применение по п.27, где заболевание выбрано из воспалительных кишечных заболеваний, рассеянного склероза, ревматоидного артрита, отторжения трансплантата, эндометриоза, диабета I типа, заболеваний почек, фиброза, хронического панкреатита, воспалительных состояний легких, энцефалита, хронической сердечной недостаточности, псориаза, инсульта, ожирения, заболеваний ЦНС, анемии, атеросклеротических бляшек, атопического дерматита, рака и боли.
31. Способ лечения млекопитающих, страдающих заболеваниями, в которые вовлечена модуляция рецепторов CCR5, который включает лечение указанных млекопитающих эффективным количеством соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или производного по любому из пп.1-19.
32. Способ лечения по п.31, где заболеванием является ВИЧ-инфекция, генетически родственная ВИЧ ретровирусная инфекция, СПИД или воспалительное заболевание.
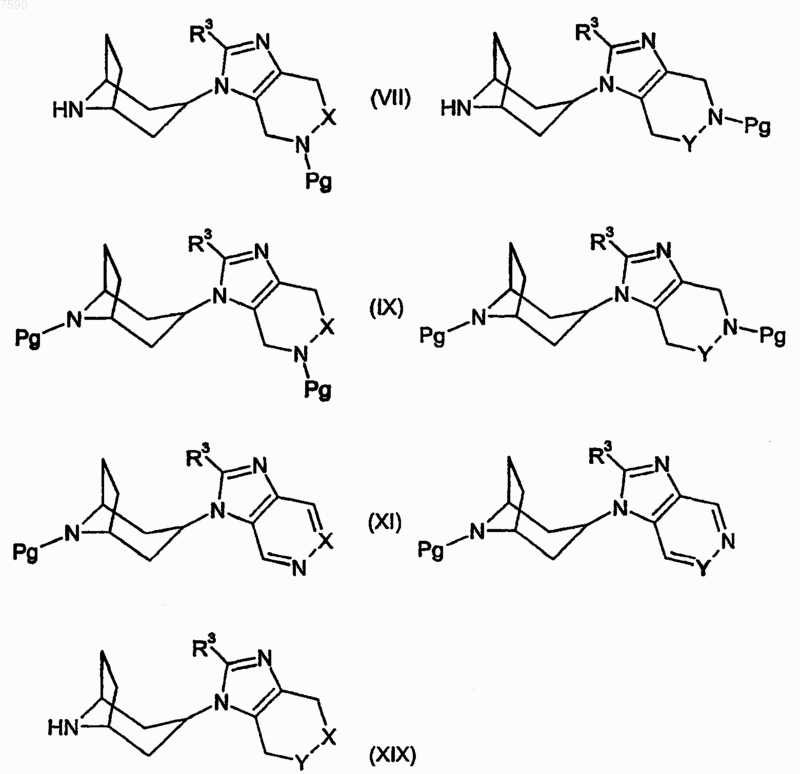
33. Соединение формулы (VII), (IX), (XI) или (XIX), где X, Y и R3 определены, как указано в п.1 для соединения формулы (I), a Pg представляет собой аминозащитную группу
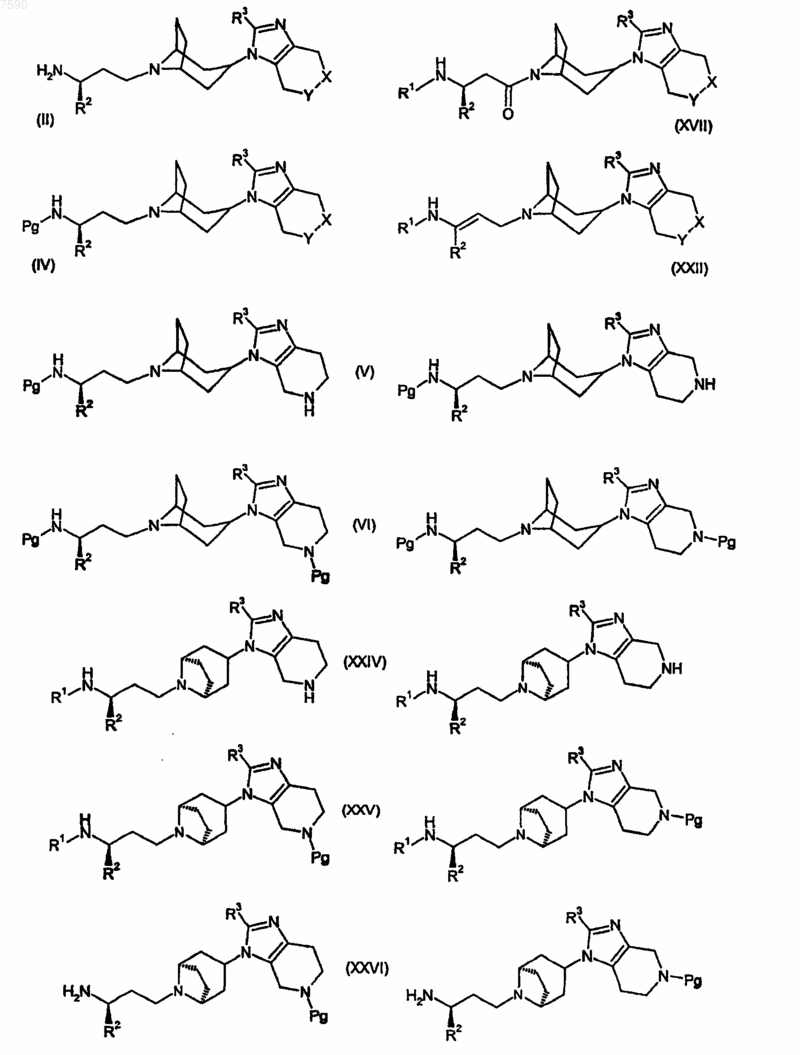
34. Соединение формулы (II), (IV), (V), (VI), (XVII), (XXII), (XXIV), (XXV) или (XXVI), где X, Y, R1, R2 и R3 определены, как указано в п.1 для соединения формулы (I), a Pg представляет собой аминозащитную группу
Текст
007590 Данное изобретение относится к производным тропана, способам их получения, к композициям,содержащим данные производные, и к их применению. Более конкретно, данное изобретение относится к применению производных 8-азабицикло[3.2.1]октана для лечения множества заболеваний, включая заболевания, в которые вовлечена модуляция рецепторов хемокина CCR5. Соответственно, соединения по данному изобретению применимы в лечении ВИЧ-инфекции, например ВИЧ-1, и генетически родственных ретровирусных инфекций (и возникающего в результате синдрома приобретенного иммунодефицита, СПИД), и воспалительных заболеваний. Название хемокин представляет собой сокращение слов хемотактические цитокины. Хемокины включают большое семейство белков, которые обладают общими важными особенностями структуры и способны притягивать лейкоциты. В качестве хемотактических факторов лейкоцитов хемокины играют необходимую роль в притяжении лейкоцитов к различным тканям тела, т.е. в процессе, который является существенным как в воспалении, так и в ответе организма на инфекцию. Так как хемокины и их рецепторы являются главными в патофизиологии воспалительных и инфекционных заболеваний, агенты, которые активны в модуляции, предпочтительно модуляции в качестве антагонистов, активности хемокинов и их рецепторов, применимы в терапевтическом лечении таких воспалительных и инфекционных заболеваний. Рецептор хемокинов CCR5 имеет особое значение для лечения воспалительных и инфекционных заболеваний. CCR5 представляет собой рецептор для хемокинов, особенно для макрофагальных белков воспаления (MIP), обозначаемых MIP-1 и MIP-1, и для белка, который регулируется при активации и экспрессируется и выделяется нормальными Т-клетками (RANTES). Согласно первому аспекту данного изобретения предлагается соединение формулы (I) или его фармацевтически приемлемые соль, сольват или производное,где X и Y выбирают из СН 2 и NR4 так, что один из X или Y представляет собой СН 2, а другой представляет собой NR4;R1 и R4 независимо представляют собой R5; COR5; CO2R5; CONR6R7; SO2R5; или (С 1-6-алкилен) фенил, где фенил замещен 0-3 атомами или группами, выбранными из C1-6-алкила, С 1-6-алкилкарбонила,С 1-6-алкокси, С 1-6-алкоксикарбонила, галогена, CF3, ОН, CN, NR6R7, COR7, CO2R7 или CONR6R7;R5 представляет собой С 1-6-алкил, С 2-6-алкенил, С 2-б-алкинил, С 3-7-циклоалкил; 5- или 6-членный ароматический гетероцикл; или 4-7-членный насыщенный гетероцикл, где указанные алкил, алкенил,алкинил и циклоалкил замещены 0-3 атомами или группами, выбранными из оксо, галогена, CF3, OR7,CN, NR6R7, COR7, CO2R7 или CONR6R7; где указанные гетероциклы содержат один или три гетероатома,выбранные из N, О или S; и где указанные гетероциклы замещены 0-3 атомами или группами, выбранными из С 1-6-алкила, С 1-6-алкилкарбонила, С 1-6-алкокси, C1-6-алкоксикарбонила, галогена, CF3, ОН, CN,NR6R7, COR7, CO2R7 или CONR6R7;R7 представляет собой Н или С 1-6-алкил; или, когда R6 и R7, оба, присоединены к одному и тому же атому N, NR6R7 может также представлять собой 5-7-членный, насыщенный, частично ненасыщенный или ароматический гетероцикл, содержащий от 0 до 2 дополнительных гетероатомов, выбранных из О, N или S. В одном аспекте данного изобретения X представляет собой СН 2, NH, NC1-4-алкил, NCH2-фенил,NCOC1-4-алкил, замещенный 0-3 атомами фтора, NCO2 С 1-4-алкил или NSO2 С 1-2-алкил. В другом аспекте данного изобретения X представляет собой СН 2, NCOC1-2-алкил, замещенный 0-3 атомами фтора, или NCO2C1-4-алкил. В еще одном аспекте данного изобретения X представляет собой СН 2, NCOC1-2-алкил или NСO2 С 1-2 алкил. В еще одном аспекте данного изобретения Y представляет собой СН 2, NH, NС 1-6-алкил, N (С 1-6 алкилен) фенил, NCOC1-6-алкил, замещенный 0-3 атомами фтора, NCO2 С 1-6-алкил или NSO2 С 1-6-алкил. В еще одном аспекте данного изобретения Y представляет собой СН 2, NH, NC1-4-алкил, N(C1-4 алкилен)фенил, NCOC1-4-алкил, замещенный 0-3 атомами фтора, NCO2 С 1-4-алкил или NSO2 С 1-4-алкил. В еще одном аспекте данного изобретения Y представляет собой СН 2, NH, NC1-4-алкил, NСН 2 фенил, NCOC1-4-алкил, замещенный 0-3 атомами фтора, NCO2 С 1-4-алкил или NSO2 С 1-2-алкил.-1 007590 В еще одном аспекте данного изобретения Y представляет собой СН 2, NCOC1-2-алкил или NCO2 С 1-2 алкил. В еще одном аспекте данного изобретения R1 представляет собой COR5 или CO2R5 и R5 означаетC1-6-алкил, замещенный 0-3 атомами фтора, С 3-7-циклоалкил, замещенный 0-3 атомами фтора, С 1-6 алкокси, замещенный 0-3 атомами фтора, или 4-7-членный насыщенный гетероцикл, содержащий 1-3 гетероатома, выбранных из N, О или S. В другом аспекте данного изобретения R1 представляет собой COR5 или CO2R5, где R5 означает С 1-4-алкил, замещенный 0-3 атомами фтора, С 3-5-циклоалкил, замещенный 0-3 атомами фтора, или 5- или 6-членный N, О или S-содержащий насыщенный гетероцикл. В еще одном аспекте данного изобретения R1 представляет собой COR5 или CO2R5, и R5 означает С 1-3-алкил, замещенный 0-3 атомами фтора, С 3-4-циклоалкил или 5- или 6-членный О-содержащий насыщенный гетероцикл. В еще одном аспекте данного изобретения R1 представляет собой COC1-2-алкил или СO2 С 1-2-алкил. В еще одном аспекте данного изобретения R2 представляет собой фенил, замещенный 0-3 атомами фтора. В еще одном аспекте данного изобретения R2 представляет собой фенил, замещенный 0 или 1 атомом фтора. В еще одном аспекте данного изобретения R2 представляет собой незамещенный фенил. В еще одном аспекте данного изобретения R2 представляет собой монофторзамещенный фенил (например, метазамещенный). В еще одном аспекте данного изобретения R3 представляет собой C1-4-алкил. В еще одном аспекте данного изобретения R3 представляет собой метил. Термин алкил в качестве группы или части группы включает группы с линейной и разветвленной цепью. Примеры алкилов включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Термин С 3-7-циклоалкил означает циклопропил, циклобутил, циклопентил, циклогексил или циклогептил. Термин галоген означает фтор, хлор, бром или иод. Следует понимать, что изобретение охватывает все комбинации конкретных аспектов изобретения,как описано выше, согласующиеся с определением соединений формулы (I). Соединения формулы (I) содержат по меньшей мере два основных центра, и приемлемые кислотноаддитивные соли получают из кислот, которые образуют нетоксичные соли. Примеры включают соли: гидрохлорид, гидробромид, гидроиодид, хлорид, бромид, иодид, сульфат, бисульфат, нитрат, фосфат,гидрофосфат, ацетат, фумарат, памоат, аспартат, безилат (бензолсульфонат), карбонат, бикарбонат, камзилат (камфорсульфонат), D- и L-лактат, D- и L-тартрат, эзилат (этансульфонат), мезилат, малонат, оротат, глюцептат (глюкогентонат), метилсульфат, стеарат, глюкуронат, 2-нафтилат, тозилат, хибензат (О(4-гидроксибензоил)бензоат), никотинат, изетионат, малат, малеат, цитрат, глюконат, сукцинат, сахарат,бензоат, эзилат и памоат. Для просмотра приемлемых солей см. Berge et al., J. Pharm. Sci., 66, 1-19, 1977. Фармацевтически приемлемые сольваты соединений формулы (I) или их соли, или производные включают их гидраты. Соединения формулы (I) могут быть модифицированы так, чтобы получить фармацевтически приемлемые производные по любым из функциональных групп данных соединений. Специалистам в данной области понятно, что некоторые защищенные производные соединений формулы (I), которые могут быть получены перед последней стадией снятия защиты, могут не обладать фармакологической активностью,как таковые, но могут в некоторых случаях трансформироваться после введения в организм, например, в результате метаболизма, с образованием соединений формулы (I), которые являются фармакологически активными. Такие соединения обозначают термином пролекарство. Специалистам в данной области,кроме того, понятно, что некоторые остатки, известные специалистам как "проостатки" ("pro-moieties"),например, как описано в ["Design of Prodrugs" by H Bundgaard (Elsevier) 1985], можно поместить на соответствующие функциональные группы в соединениях формулы (I) и также получить пролекарство. Кроме того, некоторые соединения формулы (I) могут действовать как пролекарства других соединений формулы (I). Под фармацевтически приемлемыми производными соединений формулы (I) подразумеваются все защищенные производные и пролекарства соединений формулы (I). В объем соединений формулы (I) по данному изобретению также включены их полиморфы. Квалифицированному специалисту будет понятно, что соединения формулы (I) могут содержать дополнительный хиральный центр и, следовательно, могут существовать в двух или более стереоизомерных формах. Кроме того, среднему специалисту будет понятно, что замещение имидазолом тропанового цикла может давать продукты либо в эндо-, либо в экзо-конфигурации и данное изобретение защищает обе конфигурации. Данное изобретение включает все индивидуальные стереоизомеры (например, энантиомеры) соединений формулы (I) и, где это применимо, их индивидуальные таутомерные формы вместес их смесями (например, рацемическими смесями). Предпочтительным является замещение имидазолом тропанового цикла, приводящее к продуктам эндо-конфигурации. Разделение диастереоизомеров можно успешно осуществить обычными методами, например, фрак-2 007590 ционной кристаллизацией, хроматографией или ВЭЖХ стереоизомерной смеси соединения формулы (I) или его подходящей соли, или подходящего производного. Индивидуальный энантиомер соединения формулы (I) можно также получить из соответствующего оптически чистого промежуточного соединения или разделением соответствующего рацемата, например, методом ВЭЖХ с помощью подходящего хирального носителя, или фракционной кристаллизацией диастереоизомерных солей, полученных взаимодействием соответствующего рацемата или с подходящей оптически активной кислотой, или оптически активным основанием в зависимости от ситуации. Альтернативно, индивидуальный энантиомер соединения формулы (I) можно получить, используя хиральные реагенты, например хиральные катализаторы. Данное изобретение также включает меченные изотопами соединения формулы (I). Изотопные варианты соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или производного определяются как соединения, в которых по меньшей мере один атом замещен атомом с таким же атомным номером, но другой атомной массой, которая отличается от атомной массы, обычно встречающейся в природе. Примеры изотопов, которые можно ввести в соединения формулы (I) и его фармацевтически приемлемые соли, сольваты или производные, включают изотопы водорода, углерода, азота, кислорода,фосфора, серы, фтора и хлора, например 2 Н, 3 Н, 13 С, 14 С, 15N, 17O, 18O, 31P, 32P, 35S, 18F и 36 Сl соответственно. Некоторые изотопные варианты соединений формулы (I) и их фармацевтически приемлемых солей,сольватов или производных, например, такие, в которые введен радиоактивный изотоп, например 3 Н или 14 С, применимы для изучения распределения лекарств и/или субстратов в тканях. Изотопы трития (3 Н) и углерода-14 (т.е. 14 С) особенно предпочтительны из-за легкости получения и определения. Кроме того,замещение изотопами, например дейтерием, т.е. 2 Н, может привести к некоторым терапевтическим преимуществам в результате более высокой устойчивости к метаболизму, например к увеличенному периоду полувыведения in vivo или пониженным требованиям к дозировке, и, следовательно, может быть предпочтительным в некоторых обстоятельствах. Изотопные варианты соединений формулы (I) и их фармацевтически приемлемых солей, сольватов и производных по данному изобретению могут быть получены соответствующей адаптацией обычных способов, обсуждаемых ниже, и способов, которые иллюстрируются нижеследующими препаратами и примерами. Предпочтительные соединения формулы (I) включают соединения примеров 7, 13, 17, 27, 29, 33, 34,35, 36, 37, 39, 41, 44, 45, 46, 49 и их фармацевтически приемлемые соли, сольваты и производные. Соединения формулы (I) и их фармацевтически приемлемые соли, сольваты и производные и промежуточные соединения для них можно получить любым способом, известным в данной области техники для получения соединений аналогичной структуры, например способами, описанными в WO 00/38680 и WO 01/90106 (обе публикации включены в данную заявку в качестве ссылки). В частности, условия реакции, описанные в WO 01/90106 для получения соединений формулы (I) из соединений формул(XIV), (XIX) и (XXIV), подходят для применения, соответственно, в способах (G), (K) и (L), описанных ниже. В общих способах и схемах, описанных ниже, R1-R7, X и Y определены, как указано ранее, если только не указано другое; R8 и R8a в формуле (III.2), (способ (В, являются такими, что группа определяет нужный заместитель R5, где стрелка указывает место присоединения к соединению формулы(II); Z представляет собой Н или группу, активирующую карбоновые кислоты, например хлор или 1-Нимидазол-1-ил; EsGp представляет собой группу, образующую сложный эфир, например С 1-6-алкил; Pg представляет собой аминозащитную группу, такую как, например, boc; ArLg представляет собой уходящую группу, подходящую для ароматического нуклеофильного замещения, такую как группы, описанные в книге [Jerry March, Advanced Organic Chemistry (4th edition), Wiley Interscience, 1992, page 652]THF (ТГФ) означает тетрагидрофуран; Lg означает уходящую группу, подходящую для алифатического нуклеофильного замещения, такую как группы, описанные в книге [Jerry March, ibid, page 352] (включенной в данную заявку в качестве ссылки), включающие Сl, Br, I и сложные эфиры сульфокислот (например, тозилат, мезилат и трифлат); WSCDI означает гидрохлорид 1-(3-диметиламинопропил)-3 этилкарбодиимида; DCC означает N,N'-дициклогексилкарбодиимид; НОАТ означает 1-гидрокси-7 азабензотриазол; HOBt означает гидрат 1-гидроксибензотриазола; РуВОР означает гексафторфосфат бензотриазол-1-илокси-трис(пирролидино)фосфония; РуВrОР означает гексафторфосфат бром-триспирролидинофосфония; и реагент Mukaiyama представляет собой иодид 2-хлор-1-метилпиридиния. Соединения формулы (I) можно получить следующими общими способами. По первому способу (А) соединения формулы (I), где R1 представляет собой R5, могут быть получены алкилированием соединения формулы (II) соединением формулы (III.1) в условиях, обычных для алкилирования. Удобно проводить алкилирование в условиях, описанных ниже в данной заявке в связи со схемой 1, стадия (i). По второму способу (В) соединения формулы (I), где R1 представляет собой R5, могут быть получены взаимодействием соединения формулы (II) с соединением формулы (III.2) в условиях, обычных для восстановительного аминирования. Удобно проводить восстановительное аминирование в условиях, описанных ниже в данной заявке в связи со схемой 1, стадия (g). По третьему способу (С) соединения формулы (I), где R1 представляет собой COR5, могут быть получены взаимодействием соединения формулы (II) с соединением формулы (III.3) в условиях, обычных для проведения реакции сочетания карбоновой кислоты с амином. Удобно проводить сочетание в условиях, описанных ниже в данной заявке в связи со схемой 1, стадия (k). По четвертому способу (D) соединения формулы (I), где R1 представляет собой CO2R5, могут быть получены взаимодействием соединения формулы (II) с галогенформиатом формулы (III.4) в условиях, обычных для реакции сочетания. Удобно проводить реакцию сочетания в условиях, описанных ниже в данной заявке в связи со схемой 1 для получения соединений формулы (IV), где R4 представляет собой CO2R5. По пятому способу (Е) соединения формулы (I), где R1 представляет собой CONR6R7, могут быть получены взаимодействием амина формулы (II) с ацилимидазолидом формулы (III.5) в обычных условиях. Удобно проводить данную реакцию в условиях, описанных ниже в данной заявке в связи со схемой 1 для получения соединений формулы (IV), где R4 представляет собой CONR6R7. По шестому способу (F) соединения формулы (I), где R1 представляет собой SO2R5, могут быть получены взаимодействием соединения формулы (II) с сульфонилгалогенидом формулы (III.6) в обычных условиях. Удобно проводить указанное взаимодействие в условиях, описанных ниже в данной заявке в связи со схемой 1 для получения соединений формулы (IV), где R4 представляет собойSO2R6. Согласно еще одному способу (G), соединения формулы (I) могут быть получены восстановлением соединения формулы (XVII) в обычных условиях восстановления. Согласно еще одному способу (Н), соединения формулы (I) могут быть получены восстановительным аминированием альдегида формулы (XVIII) в обычных условиях. Удобно проводить восстановительное аминирование в условиях, описанных ниже в данной заявке в связи со схемой 1, стадия (g). По другому способу (I) соединения формулы (I) могут быть получены восстановительным аминированием нитрила формулы (XX) с амином формулы (XIX) в обычных условиях. Удобно проводить восстановительное аминирование в условиях, описанных ниже в данной заявке в связи со схемой 1, стадия (g). Еще по одному способу (J) соединения формулы (I) могут быть получены алкилированием амина формулы (XIX) или его соли соединением формулы (XXI) в обычных условиях. Удобно проводить алкилирование в условиях, описанных ниже в данной заявке в связи со схемой 1, стадия (i). Еще по одному способу (K) соединения формулы (I) могут быть получены асимметрическим восстановлением соединения формулы (XXII) в условиях, обычно используемых для восстановления. Еще по одному способу (L) соединения формулы (I), где R1 представляет собой COR5, могут быть получены из амина формулы (II) или его соли с металлом (т.е депротонированной формы) взаимодействием со сложным эфиром формулы (XXIII) в обычных условиях. Еще по одному способу (М) соединения формулы (I) могут быть получены превращением другого соединения формулы (I). Подходящие превращения включают получение соединений формулы (I), где X или Y представляет собой NR5, из соответствующих соединений формулы (I), где X или соответственноY представляет собойNH. Квалифицированный специалист в данной области понимает, что такое превращение можно легко осуществить способами, полностью аналогичными описанным выше для процессов (A)-(F) и (L). Еще по одному способу (N) соединения формулы (I) могут быть получены из защищенного производного соединения формулы (I) в результате снятия защиты. Схемы, которыми дополнительно иллюстрируются способы получения соединений формулы (I) и промежуточных соединений для них, приводятся ниже. Специалисты в данной области поймут, что некоторые из методик, описанных в схемах для получения соединений формулы (I) или промежуточных соединений для их получения, могут быть не применимы для некоторых из возможных заместителей. Кроме того, специалисты в данной области поймут, что может быть необходимо или желательно проводить трансформации, описанные в схемах, в другой последовательности, отличающейся от описанной, или изменить одну или более трансформаций, чтобы получить нужное соединение формулы (I). Специалистам в данной области, кроме того, понятно, что, как показано на нижеследующих схемах,может быть необходимо или желательно на любой стадии в синтезе соединений формулы (I) защитить одну или несколько чувствительных групп в молекуле для того, чтобы предотвратить нежелательные-5 007590 побочные реакции. Конкретно, может быть необходимо или желательно защитить аминогруппы. Защитные группы, используемые при получении соединений формулы (I), можно использовать обычным образом. См., например, защитные группы, которые описаны в монографии "Protective Groups in Organic Synthesis" by Theodora W. Green and Peter G. M. Wuts, third edition, (John Wiley and Sons, 1999), in particularchapter 7, pages 494-653 ("Protection for the Амино Group"), включенной в данную заявку в качестве ссылки, в которой также описаны способы удаления таких групп. Аминозащитные группы boc, бензилоксикарбонильная, бензильная и ацетильная особенно часто используют в синтезах соединений формулы (I) и их промежуточных соединений. Схема 1 Что касается конкретно схемы 1, трансформации, изображенные на ней, могут быть осуществлены следующим образом:(а). Замещение уходящей группы в нитропиридине формулы (XV) амином формулы (XIV) удобно проводить в присутствии основания, такого как амин (например, триэтиламин или N-этил-N,Nдиизопропиламин) или карбонат щелочного металла (например, карбонат натрия или карбонат калия); в растворителе, таком как спирт (например, метанол или этанол), нитрил (например, ацетонитрил) или амид (например, ДМФА); и при температурах от температуры окружающей среды до повышенной (например, примерно до 120 С).(b) Имидазопиридин формулы (XI) может быть получен восстановлением и циклизацией in situ аминонитропиридина формулы (XII). Восстановление удобно проводить в присутствии восстановителя,например порошка железа; растворителя, такого как карбоновая кислота (например, уксусная кислота); и при температурах от температуры окружающей среды до примерно 120 С. Циклизацию промежуточного амино-аминопиридина удобно проводить присоединением ангидрида формулы (XIII) при повышенной температуре (например, около 140 С).(c) Восстановление имидазопиридина формулы (XI) в имидазопиперидин формулы (X) удобно осуществлять каталитическим гидрированием в присутствии подходящего катализатора, такого как катализатор на основе переходных металлов, например, платинового (например, оксида платины) или палладиевого (например, гидроксида палладия или палладия на угле) катализатора; в растворителе, таком как спирт (например, метанол или этанол) или карбоновая кислота (например, уксусная кислота); при температурах от температуры окружающей среды до повышенной (например, до 80 С); и при повышенном-6 007590 давлении водорода от 150 до 500 кПа (например, 400 кПа водорода).(d). Имидазопиперидин формулы (X) может быть защищен взаимодействием с бензилгалогенидом,например, бензилбромидом или бензилхлоридом. Реакцию удобно проводить в растворителе, таком как спирт (например, этанол) или галогензамещенном алкане (ДХМ) и при комнатной температуре.(e). На стадии (е), альтернативной стадиям (с) и (d), имидазопиридин формулы (XI) обрабатывают,например, бензилгалогенидом, таким как бензилбромид, получая четвертичное промежуточное соединение, которое восстанавливают в обычных условиях. Удобно добавлять бензилбромид к имидазопиридину формулы (XI) в присутствии растворителя, такого как спирт (например, этанол) или галогеналкан (например, ДХМ) при температуре окружающей среды, получая четвертичное промежуточное соединение,которое затем восстанавливают добавлением гидрида щелочного металла, например боргидрида натрия,при пониженной температуре (например, около -70 С).(f). Когда защитная группа представляет собой ацетильную или аналогичную ей группу, ее удаление удобно проводить обработкой основанием, таким как гидроксид щелочного металла (например, гидроксид натрия или калия) или кислотой, такой как неорганическая кислота (например, соляная кислота),и при повышенной температуре, например при 60-100 С.(g). Соединения формулы (VI) получают восстановительным аминированием альдегида формулы(VIII) амином формулы (VII). Указанную реакцию удобно проводить в присутствии кислоты, такой как органическая кислота (например, уксусная кислота), в растворителе, таком как простой эфир (например,ТГФ) или галогеналкан (например, ДХМ), используя гидрид щелочного металла в качестве восстановителя, например триацетоксиборгидрид натрия, цианоборгидрид натрия или боргидрид натрия, и при температуре окружающей среды.(h). Если защиту на стадии (d) осуществляют бензильной группой, ее удаление удобно проводить гидрированием с переносом, используя подходящий источник водорода, такой как формиат аммония,над катализатором на основе переходного металла, таким как палладиевый катализатор (например, палладий на угле или гидроксид палладия на угле), в растворителе, таком как спирт (например, этанол), и при повышенной температуре, например около 60 С.(i). Когда R4 представляет собой R5, соединения формулы (IV) получают из аминов формулы (V) алкилированием соединения формулы (III.1). Удобно проводить алкилирование в подходящем растворителе, таком как галогеналкан (например, ДХМ), спирт (например, этанол) или простой эфир (например,ТГФ), необязательно в присутствии основания, такого как триэтиламин или N-этил-N,Nдиизопропиламин, и при температурах от температуры окружающей среды до повышенной (например,при кипячении с обратным холодильником).(j). Когда защитной группой является защитная группа bос, ее удаление удобно проводить в присутствии кислоты, например неорганической кислоты (например, безводной НСl) или трифторуксусной кислоты; в подходящем растворителе, таком как сложный эфир (например, этилацетат), галогеналкан(например, ДХМ) или простой эфир (например, ТГФ), и при температуре от 0 С до температуры окружающей среды.(k). Соединения формулы (I) могут быть получены из соединения формулы (II) по способам (A)-(F) и (L), описанным выше. Что касается способа (С), реакцию сочетания кислота/амин удобно проводить, используя хлорангидрид кислоты формулы (III.3), избыток акцептора кислоты, такого как триэтиламин или N-этил-N,Nдиизопропиламин, растворитель, такой как галогеналкан (например, ДХМ) или простой эфир (например,ТГФ), и при повышенной температуре. Альтернативно, реакцию сочетания кислота/амин проводят, используя кислоту формулы (III.3), активированную такими реагентами, как WSCDI или DDC и HOBt или HOAt, избыток акцептора кислоты,такого как триэтиламин или N-этил-N,N-диизопропиламин, растворитель, такой как галогеналкан (например, ДХМ) или простой эфир (например, ТГФ), и при температуре окружающей среды. В еще одном альтернативном способе реакцию сочетания кислота/амин проводят, используя кислоту формулы (III.3), или РуВОР, РуВrОР, или реагент Mukaiyama, избыток акцептора кислоты, такого как триэтиламин или N-этил-N,N-диизопропиламин, растворитель, такой как галогеналкан (например, ДХМ) или простой эфир (например, ТГФ), и при температуре окружающей среды. Специалисты в данной области понимают, что одно или несколько превращений из описанных на схеме 1 можно проводить в другой последовательности, отличающейся от показанной на схеме, или можно изменить, чтобы получить целевое соединение формулы (I). В одном из вариантов схемы 1 стадию (i) можно проводить в условиях восстановительного аминирования, например, таких, которые описаны выше для стадии (g), используя соединение формулы (III.2). В другом варианте схемы 1 соединения формулы (IV), где R4 представляет собой COR5, могут быть получены взаимодействием соединения формулы (V) с соединением формулы (III.3) в обычных условиях сочетания карбоновая кислота/амин, таких как описанные выше для стадии (k). В еще одном варианте схемы 1 соединения формулы (IV), где R4 представляет собой CO2R5, получают взаимодействием соединения формулы (V) с галогенформиатом формулы (III.4) (например, хлорформиатом), необязательно в присутствии акцептора кислоты, такого как триэтиламин или N-этил-N,N-7 007590 диизопропиламин; в растворителе, таком как галогеналкан (например, ДХМ) или простой эфир (например, ТГФ), и при температурах от 0 С до температуры окружающей среды. В еще одном варианте схемы 1 соединения формулы (IV), где R4 представляет собой CONR6R7, могут быть получены взаимодействием соединения формулы (V) с ацилимидазолидом формулы (III.5), необязательно в присутствии акцептора кислоты, такого как триэтиламин или N-этил-N,Nдиизопропиламин, в растворителе, таком как галогеналкан (например, ДХМ) или простой эфир (например, ТГФ), и при температурах от 0 С до температуры окружающей среды. В еще одном варианте схемы 1 соединения формулы (IV), где R4 представляет собой SO2R5, могут быть получены взаимодействием соединения формулы (V) с сульфонилгалогенидом формулы (III.6) (например, сульфонилхлоридом), необязательно в присутствии акцептора кислоты, такого как триэтиламин или N-этил-N,N-диизопропиламин, в растворителе, таком как галогеналкан (например, ДХМ), и при температурах от 0 С до температуры окружающей среды. В еще одном варианте схемы 1 соединения формулы (I), где X представляет собой NR4 и Y представляет собой СН 2, могут быть получены заменой на стадии (а) нитропиридина формулы (XV) нитропиридином формулы (XVI) Специалист в данной области, следовательно, поймет, что формулы на схеме 1, производные от формулы (XV), в том числе формулы (I), (II), (IV), (V), (VI), (VII), (IX), (X), (XI) и (XII), охватывают соответствующие соединения, производные от соединений формулы (XVI). В еще одном варианте схемы 1 соединения формулы (I) могут быть получены проведением стадий(h)-(k) в другой последовательности, как показано ниже на схеме 1 а. Схема 1 а Специалисту в данной области будет понятно, что варианты, только что обсуждавшиеся выше дляR4 и стадии (i) схемы 1, точно так же применимы к R1 и стадии (k) схемы 1 а. Аналогично, ссылаясь на вариант схемы 1, только что обсуждавшийся выше для производных соединений формулы (XVI), специалист в данной области поймет, что те формулы в схеме 1 а, которые являются производными формул(XV), в том числе формулы (I), (VI), (XXIV), (XXV) и (XXVI), охватывают соответствующие соединения,производные соединений формулы (XVI). Кроме того, специалист поймет, что способы (А)-(F) и (L) имеют прямые аналоги при получении соединений формулы (I) из соединений формулы (XXIV), где, соответственно, R1 представляет собой R5,COR5, CO2R5, CONR6R7 и SO2R5. Соединения формул (XVII), (XIX) и (XXII) имеют структуру, аналогичную структуре соединений формулы (I) или промежуточных соединений для них, и их можно получить аналогичными способами.-8 007590 Соединения формул (III.1)-(III.6), (VIII), (XIII)-(XVI), (XVIII), (XX) и (XXI) или представляют собой известные соединения, или могут быть получены традиционными химическими способами; см., например, WO 01/90106. Фармацевтически приемлемая соль соединения формулы (I) может быть легко получена смешиванием раствора соединения формулы (I) и раствора нужной кислоты. Соль может выпадать в осадок из раствора, и ее можно отфильтровать или извлечь после выпаривания растворителя. Соединения формулы (I) и их фармацевтически приемлемые соли, сольваты и производные применимы, так как они обладают фармакологической активностью в отношении животных, включая человека. Более конкретно, они применимы для лечения заболеваний, которые связаны с модуляцией рецепторовCCR5. Болезненные состояния, которые представляют особый интерес, включают ВИЧ, ретровирусные инфекции, генетически родственные ВИЧ, СПИД и воспалительные заболевания. Соединения по данному изобретению можно применять для лечения респираторных заболеваний,включая респираторный дистресс-синдром у взрослых (ARDS), бронхит, хронический бронхит, хроническое обструктивное легочное заболевание, муковисцидоз, астму, эмфизему, ринит и хронический синусит. Другие состояния, которые можно лечить, представляют собой состояния, которые инициируются направленной миграцией Т-клеток в различных органах, на которые влияет такая миграция, или которые каким-либо другим образом коррелируют с упомянутой миграцией. Предполагается, что соединения по данному изобретению могут быть применимы для лечения таких состояний, и особенно для указанных ниже (но не ограниченных ими), для которых установлена корреляция с CCR5 или хемокинами CCR5: воспалительные кишечные заболевания, в том числе болезнь Крона и язвенный колит, рассеянный склероз, ревматоидный артрит, отторжение трансплантата, в частности, трансплантатов цельных органов (но не только их), таких как сердце, легкие, печень, почки и поджелудочная железа (например, аллотрансплантаты почек и легких), эндометриоз, диабет I типа, заболевания почек, например гломерулярная болезнь, фиброз, например фиброз печени, легких и почек, хронический панкреатит, воспалительные состояния легких, энцефалит, например ВИЧ-энцефалит, хроническая сердечная недостаточность, псориаз,инсульт, ожирение, заболевания ЦНС, такие как связанные со СПИД деменция и болезнь Альцгеймера,анемия, атеросклеротические бляшки, атопический дерматит, хронический панкреатит, рак, например неходжкинская лимфома, саркома Капоши, меланома и рак молочной железы, и боль, например ноцицептивная боль и невропатическая боль (например, периферическая невропатическая боль). Инфекционные заболевания, связанные с модуляцией рецепторов CCR5, включают острую и хроническую инфекцию вируса гепатита В (HBV) и С (HCV), бубонную, первично-септическую и легочную чуму, инфекцию вирусами группы оспы, как, например, натуральная оспа, инфекцию токсоплазмоза,инфекцию микобактериями, трипаносомальные инфекции, например болезнь Шагаса, пневмонию и цитоспоридиоз. Недавний обзор возможных приложений хемокинов и блокаторов хемокиновых рецепторов см. вtherapeutic intervention", Curr. Opin. Chem. Biol., 4(4), 420-7 (August 2000). Использование соединений формулы (I) и их фармацевтически приемлемых солей, сольватов и производных в качестве ингибиторов ВИЧ-инфекции можно показать с помощью одной или нескольких методик, известных в данной области, например, с помощью микроанализов ВИЧ-культуры, описанных в статье [Dimitrov et al., J. Clin. Microbiol., 28, 734-737 (1990)], и анализа псевдотитрования ВИЧрепортера, описанного в статье [Connor et al., Virology, 206 (2) 935-44 (1995)]. Способность соединений формулы (I) и их фармацевтически приемлемых солей, сольватов и производных модулировать активность рецепторов хемокинов выявляют, используя известные в данной области методики, такие как, например, методики анализа CCR5, описанные в Combadiere et al., J. Leukoc.Biol., 60, 147-52 (1996); анализы внутриклеточной мобилизации кальция, как описано теми же авторами; и по их способности ингибировать связывание оболочечного ВИЧ-белка (gp120) с рецепторами CCR5 по методике, описанной в примере 1 европейского патента ЕР 1118858 А 2 (стр. 85-88). Клеточные линии,экспрессирующие нужные рецепторы, включают линии, нативно экспрессирующие рецептор, такие как РМ-1 или IL-2, стимулируемые периферическими лимфоцитами крови (PBL), или клетки, сконструированные для экспрессирования рекомбинантного рецептора, например, СНО, 300.19, L1.2 или НЕK-293. Соединения формулы (I) можно вводить сами по себе, но обычно их надо вводить в смеси с подходящим фармацевтическим наполнителем, разбавителем или носителем, выбранным в соответствии с намеченным путем введения и обычной фармацевтической практикой. Например, соединения формулы (I) можно вводить перорально, трансбуккально или сублингвально в виде таблеток, капсул, лекарственных форм, состоящих из множества частиц; гелей, пленок, овул (каплевидных лекарственных форм), эликсиров, растворов или суспензий (которые могут содержать вещества, придающие вкус и цвет) для немедленного, задержанного, модифицированного, замедленного, прерывистого или контролируемого высвобождения. Соединения формулы (I) можно также вводить в виде быстро распадающихся или быстро растворяющихся лекарственных форм, или в виде высокоэнергетической дисперсии, или в виде частиц с покрытием. Подходящие композиции соединений формулы (I) мо-9 007590 гут быть в виде лекарственных форм с покрытием или без покрытия в зависимости от требований. Такие твердые фармацевтические композиции, например таблетки, могут содержать наполнители,такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция, двухосновный фосфат кальция, глицин и крахмал (предпочтительно крахмал из кукурузы, картофеля и маниоки), разрыхлители, например, такие как натрий-крахмалгликолят, натрий-кроскармелоза и некоторые комплексные силикаты, и связующие для грануляции, такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (ГПМЦ), гидроксипропилцеллюлоза (ГПЦ), сахароза, желатин и аравийская камедь. Кроме того, могут быть включены смазывающие агенты, например, такие как стеарат магния, стеариновая кислота, глицерилбегенат и тальк. Типичный пример. Рецептура таблетки может обычно содержать от 0,01 до 500 мг активного соединения, тогда как масса таблетки составляет от 50 до 1000 мг. Примеры рецептур для таблеток, содержащих 5 и 10 мг активного вещества показаны ниже: 0,5% мас./мас. добавляют перед прессованием и после измельченияили его фармацевтически приемлемые соль, сольват или производное - количество регулируют соответственно, а также в зависимости от активности лекарства. Таблетки изготавливают стандартным способом, например, прямым прессованием или способом влажной или сухой грануляции. На сердцевину таблетки может быть нанесено соответствующее покрытие, например, такое как Opadry White/Opadry Clear, и таблетки должным образом упаковывают (например, во флаконы или блистеры). Твердые композиции аналогичного типа могут также использоваться в качестве содержимого капсул из желатина и ГПМЦ. Наполнители, предпочтительные в этом отношении, включают лактозу, крахмал, целлюлозу, молочный сахар или полиэтиленгликоли с большой молекулярной массой. Для водных суспензий и/или эликсиров соединения формулы (I) могут быть объединены с различными подсластителями или веществами, придающими вкус, красящими веществами и красителями, эмульгирующими и/или суспендирующими агентами и разбавителями, такими, например, как вода, этанол, пропиленгликоль и глицерин; и их комбинациями. Соединения формулы (I) можно также вводить парентерально, например, внутривенно, внутриартериально, внутрибрюшинно, интратекально, интравентрикулярно, интрауретрально, интрастернально,интракраниально, внутримышечно или подкожно или их также можно вводить инфузией или с помощью безыгольных методов инъекций. Для такого парентерального введения соединения формулы (I) лучше применять в виде стерильного водного раствора, который может содержать и другие вещества, например, достаточное количество солей или глюкозу, чтобы сделать раствор изотоническим крови. Если необходимо, водные растворы следует обработать подходящим буфером (предпочтительно до рН от 3 до 9). Получение приемлемых композиций для парентерального введения в стерильных условиях легко осуществить по стандартным фармацевтическим методикам, хорошо известным специалистам в данной области. Для перорального или парентерального введения больным людям дневные дозировки соединений формулы (I) и их фармацевтически приемлемых солей, сольватов и производных составляют от 0,01 до 30 мг/кг (однократно или делят на несколько доз) и предпочтительно от 0,01 до 15 мг/кг. Таким образом,таблетки содержат от 1 мг до 0,5 г соединения для введения однократно или за два или более раз соответственно. Лечащий врач в любом случае определяет реальную дозировку, которая должна быть наиболее подходящей для отдельного больного и должна меняться в зависимости от возраста, массы тела и реакции конкретного больного. Вышеуказанные дозировки являются примерными для среднего случая.- 10007590 Разумеется, могут быть отдельные примеры, когда полезны более высокие или более низкие диапазоны дозировок и такие дозировки включены в объем данного изобретения. Пероральное введение является предпочтительным. Предпочтительно, если введение имеет место незадолго до того, как требуется эффект. Соединения формулы (I) можно также вводить интраназально или ингаляцией, и их удобно доставлять в виде ингалятора - сухого порошка или в виде подачи аэрозоля из контейнера под давлением, помпой, распылителем или аэрозольным аппаратом с применением или без него, подходящего газавытеснителя, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан (HFA 134A [торговая марка]) или 1,1,1,2,3,3,3-гептафторпропан(HFA 227EA [торговая марка]), диоксида углерода или других подходящих газов. В случае аэрозоля под давлением единичная дозировка может быть задана обеспечением наличия клапана для подачи нужного количества. Контейнер под давлением, помпа, спрей, распылитель или аэрозольный аппарат могут содержать раствор или суспензию активного соединения, например, используя смесь этанола и газавытеснителя в качестве растворителя, который может, кроме того, содержать смазывающее вещество,например триолеат сорбита. Капсулы и картриджи (изготовленные, например, из желатина) для применения в ингаляторах и аппаратах для вдувания, могут содержать порошок смеси соединения формулы (I) и подходящей порошкообразной основы, например, лактозы или крахмала. Аэрозольные или сухие порошковые комбинации обычно изготавливают таким образом, чтобы каждая отмеренная доза или "прыск" содержали от 1 мкг до 10 мг соединения формулы (I) для доставки больному. Полная дневная доза при введении аэрозоля составляет от 1 мкг до 20 мг, и ее можно вводить однократно или, что более обычно, частичными дозами в течение дня. Альтернативно, соединения формулы (I) можно вводить в виде суппозиториев или пессариев, или их можно накладывать местно в виде геля, гидрогеля, бальзама, раствора, крема, мази или опудривающего средства. Соединения формулы (I) можно также вводить дермально и трансдермально, например,применяя кожный пластырь. Их также можно вводить легочным или ректальным путями. Их также можно вводить в глаза (окулярным путем), особенно для лечения воспалительных состояний или заболеваний глаз. Для применения в офтальмологии данные соединения могут быть приготовлены в виде тонких суспензий в изотоническом стерильном физиологическом растворе с заданным рН или предпочтительно в виде растворов в изотоническом стерильном физиологическом растворе с заданным рН, необязательно в комбинации с консервантом, как, например, хлорид бензилалкония. Альтернативно, композиции данных соединений могут быть приготовлены в виде мази, такой как вазелин. Для нанесения местно на кожу соединения формулы (I) могут быть приготовлены в виде подходящей мази, содержащей активное соединение, суспендированное или растворенное, например, в смеси с одним или несколькими следующими компонентами: минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, соединение полиоксиэтиленполиоксипропилена, эмульгирующий воск и вода. Альтернативно, они могут быть приготовлены в виде подходящего бальзама или крема, суспендированных или растворенных, например, в смеси с одним или несколькими следующими компонентами: минеральное масло, сорбитанмоностеарат, полиэтиленгликоль, жидкий парафин, полисорбат 60, сложные цетиловые эфиры, воск, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и вода. Соединения формулы (I) можно также применять в сочетании с циклодекстрином. Известно, что циклодекстрины образуют комплексы включения и невключения с молекулами лекарств. Образование комплексов лекарство-циклодекстрин может изменить растворимость, скорость растворения, биодоступность и/или стабильность молекулы лекарства. Комплексы лекарство-циклодекстрин обычно применимы для большинства лекарственных форм и путей введения. В качестве альтернативы непосредственному образованию комплексов с лекарством, циклодекстрин можно использовать как дополнительную добавку, например, в качестве носителя, разбавителя или солюбилизатора. Альфа-, бета- и гамма-декстрины используют чаще всего, и подходящие примеры описаны в WO-A-91/11172, WO-A-94/02518 и WO-А 98/55148. Соединения формулы (I) и их фармацевтически приемлемые соли, сольваты и производные имеют следующие преимущества: они более селективны, быстрее начинают действовать, обладают более сильным действием, лучше всасываются, более стабильны, более устойчивы к метаболизму, обладают пониженной зависимостью в отношении приема пищи, обладают повышенной безопасностью или имеют другие желательные свойства (например, в отношении растворимости и гигроскопичности), по сравнению с соединениями предшествующего уровня техники. Соединения формулы (I) и их фармацевтически приемлемые соли, сольваты и производные можно вводить отдельно или как часть комбинированной терапии. Таким образом, в объем данного изобретения входят варианты его осуществления, включающие совместное введение и композиции, которые содержат, наряду с соединением по данному изобретению в качестве активного ингредиента, дополнительные терапевтические средства и дополнительные активные ингредиенты. Такие сложные схемы введения лекарственных средств, которые часто относят к комбинированной терапии, могут быть использованы для лечения или профилактики любых заболеваний или состояний, опосредованных или связанных с- 11007590 модуляцией хемокиновых рецепторов CCR5, особенно инфекции вирусом иммунодефицита человека ВИЧ. Применение таких комбинаций терапевтических средств является особенно уместным в отношении лечения или профилактики инфицирования и распространения вируса иммунодефицита человека(ВИЧ) и родственных патогенных ретровирусов среди пациентов, нуждающихся в лечении, и тех, кто рискует стать таким пациентом. Хорошо известна из литературы способность таких ретровирусных патогенов развиваться за относительно короткий период времени в штаммы, устойчивые к любой монотерапии, которую назначают указанным пациентам. Кроме требований терапевтической эффективности, которые могут сделать необходимым применение активных веществ в дополнение к соединениям формулы (I) и их фармацевтически приемлемым солям, сольватам и производным, модулирующим хемокиновые рецепторы CCR5, могут быть дополнительные причины, при которых необходимо или весьма рекомендуется применение комбинаций лекарств, содержащих активные ингредиенты, которые представляют собой дополнительную терапию, т.е. дополняют и усиливают функцию соединений по данному изобретению, осуществляющих модуляцию хемокиновых рецепторов CCR5. Такие дополнительные лекарственные средства, используемые для вспомогательного лечения, включают лекарства, которые вместо непосредственного лечения или профилактики заболеваний или состояний, опосредованных модуляцией хемокиновых рецепторов CCR5 или связанных с указанной модуляцией, лечат заболевания или состояния, которые являются непосредственным результатом или сопровождают косвенным образом основные или первичные заболевания или состояния, модулируемые хемокиновыми рецепторами CCR5. Например, когда основным или первичным заболеванием или состоянием, модулируемым хемокиновыми рецепторами CCR5, является ВИЧинфекция и ее развитие, может быть необходимо или, по меньшей мере, желательно лечить условнопатогенные инфекции, неоплазмы и другие состояния, которые имеют место в результате состояния нарушенного иммунитета у больного, получающего лечение. Другие активные агенты можно применять с соединениями формулы (I) и их фармацевтически приемлемыми солями, сольватами и производными,например, для того, чтобы обеспечить иммунную стимуляцию или для лечения боли и воспаления, которые сопровождают первоначальную и основную ВИЧ-инфекцию. Таким образом, в способах лечения и фармацевтических композициях по данному изобретению можно использовать соединения формулы (I) и их фармацевтически приемлемые соли, сольваты и производные в форме монотерапии, но указанные способы и композиции можно также использовать в форме множественной (комбинированной) терапии, где одно или несколько соединений формулы (I) или их фармацевтически приемлемых солей, сольватов и производных вводят совместно в сочетании с одним или несколькими известными терапевтическими средствами, такими как средства, подробно описанные далее. Предпочтительные комбинации по данному изобретению включают сочетание одновременного или последовательного лечения соединением формулы (I) или его фармацевтически приемлемыми солью,сольватом или производным и одним или несколькими ингибиторами ВИЧ-протеазы и/или ингибитором ВИЧ-обратной транскриптазы, предпочтительно выбранными из класса ненуклеозидных ингибиторов обратной транскриптазы (NNRTI), включающих невирапин, делавирдин и ифавиренц, но не ограниченных ими; из нуклеозид/нуклеотидных ингибиторов, включающих зидовудин, диданозин, залцитабин,ставудин, ламивудин, абакавир, адефовир и дипивоксил, но не ограниченных ими; и из ингибиторов протеазы, включающих индинавир, ритонавир, саквинавир, нелфинавир, лопинавир и ампренавир, но не ограниченных ими. Другие средства, применимые в вышеописанных предпочтительных вариантах осуществления комбинаций по данному изобретению, включают исследуемые и открываемые в настоящее время лекарства из любых вышеуказанных классов ингибиторов, включая (но без ограничения ими) FTC, РМРА, фозивудин, тидоксил, талвиралин, S-1153, МKС-442, MSC-204, MSH-372, DMP450, PNU-140690, ABT-378, KNI764, TMC120 и ТМС 125. В объем предпочтительных вариантов осуществления настоящего изобретения также включены комбинации соединения формулы (I) или его фармацевтически приемлемых соли, сольвата и производного с дополнительным терапевтическим средством, используемые для дополнительного лечения, где указанное дополнительное терапевтическое средство включает один или несколько компонентов, независимо выбранных из группы, состоящей из ингибиторов пролиферации, например, гидроксимочевины; иммуномодуляторов, например, сарграмостима и различных форм интерферона и производных интерферона; ингибиторов слияния, например AMD3100, Т-20, Т-1249, PRO-140, PRO-542, AD-349, ВВ-10010 и других агонистов/антагонистов хемокиновых рецепторов; модуляторов тахикининовых рецепторов, например антагонистов NK1, ингибиторов интегразы, например AR177; ингибиторов RNaseH; ингибиторов вирусной транскрипции и репликации РНК и других агентов, которые ингибируют вирусную инфекцию или улучшают состояние или результат лечения ВИЧ-инфицированных индивидов, действуя по различным механизмам. Предпочтительные способы лечения по данному изобретению для профилактики ВИЧ-инфекции,или лечения авиремических и асимптоматических субъектов, потенциально или действительно ВИЧинфицированных, включают (но не ограничиваются этим) введение средства, независимо выбранного из(v) соединения, выбранного из класса ингибиторов протеаз, используемого вместо NRTI в комбинациях по пп. (iii) и (iv), но не ограничиваются этим. Предпочтительные способы по данному изобретению для терапии ВИЧ-инфицированных индивидуумов с определяемым заражением вирусом или аномально низким CD4 дополнительно включают варианты лечения, выбираемые из следующего:(vi) лечение по п. (i), указанное выше в дополнение к стандартной первоначально рекомендуемой схеме лечения установленных ВИЧ-инфекций, например, см. http://hivatis.org/trtgdlns.html. Такие стандартные схемы включают (но не ограничиваются ими) агент из класса ингибиторов протеаз в сочетании с двумя NRTI; и(vii) стандартные рекомендуемые первоначальные схемы для лечения установленных ВИЧинфекций, например, см. http://hivatis.org/trtgdlns.html, где либо компонент-ингибитор протеазы, либо один или оба NRTI замещен/замещены соединением формулы (I), как указано в данной заявке. Предпочтительные способы терапии ВИЧ-инфицированных индивидуумов, для которых антивирусная терапия была неудачной, дополнительно включают варианты лечения, выбираемые из (viii) лечения по вышеприведенному п. (i), в дополнение к стандартной рекомендуемой схеме лечения таких пациентов,для которых антиретровирусная терапия была неудачной,например,см.(ix) стандартной рекомендуемой схемы лечения таких пациентов, для которых антиретровирусная терапия была неудачной, например, см. http://hivatis.org/trtgdlns.html, где либо один из компонентовингибиторов протеаз, либо один или оба NRTI замещен/замещены соединением формулы (I), как описано в данной заявке. Дополнительные комбинации для применения по данному изобретению включают комбинацию соединения формулы (I) или его фармацевтически приемлемых соли, сольвата и производного с еще одним антагонистом CCR5, таким как N-(1S)-3-[3-(3-изопропил-5-метил-4 Н-1,2,4-триазол-4-ил)экзо-8 азабицикло[3.2.1]окт-8-ил]-1-фенилпропил-4,4-дифторциклогексанкарбоксамидом; антагонистом CCR1,таким как ВХ-471; агонистом бета-адренорецепторов, таким как салметерол; агонистом кортикостероидов, таким как пропионат флутиказона; антагонистом LTD4, таким как монтелукаст, мускариновым антагонистом, таким как бромид тиотропия; ингибитором PDE4, таким как циломиласт или рофлумиласт; ингибитором СОХ-2, таким как целекоксиб, валдекоксиб или рофекоксиб; альфа-2-дельта-лигандом, таким как габапентин или прегабалин; бета-интерфероном, таким как REBIF; модулятором рецепторовTNF, таким как ингибитор TNF-альфа (например, адалимумаб), ингибитор редуктазы HMG СоА, такой как статин (например, аторвастатин); или с иммунодепрессантом, таким как циклоспорин или макролид,например такролимус. В вышеописанных предпочтительных вариантах осуществления комбинаций по данному изобретению соединение формулы (I) или его фармацевтически приемлемые соль, сольват или производное и другие терапевтически активные средства можно вводить в лекарственных формах либо отдельно, либо в сочетании друг с другом и по времени одновременно или периодически. Таким образом, введение одного компонента средства может происходить перед введением другого компонента, одновременно с ним или после введения другого компонента средства (средств). Понятно, что все ссылки на лечение в данной заявке включают излечивающее, паллиативное и профилактическое лечение. Таким образом, данное изобретение относится к соединению формулы (I) или его фармацевтически приемлемым соли, сольвату или производному; способам получения соединений формулы (I) или его фармацевтически приемлемых соли, сольвата или производного; фармацевтической композиции, включающей соединение формулы (I) или его фармацевтически приемлемые соль, сольват или производное вместе с фармацевтически приемлемым наполнителем, разбавителем или носителем; соединению формулы (I) или его фармацевтически приемлемым соли, сольвату или производному для применения в качестве лекарства; соединению формулы (I) или его фармацевтически приемлемым соли, сольвату или производному для лечения заболеваний, связанных с модуляцией рецепторов CCR5; соединению формулы (I) или его фармацевтически приемлемым соли, сольвату или производному для лечения ВИЧ, генетически родственной ВИЧ ретровирусной инфекции, СПИД или воспалительных заболеваний; соединению формулы (I) или его фармацевтически приемлемым соли, сольвату или производному для лечения респираторных заболеваний, включая респираторный дистресс-синдром у взрослых (ARDS),- 13007590 бронхит, хронический бронхит, хроническое обструктивное легочное заболевание, муковисцидоз, астму,эмфизему, ринит и хронический синусит; соединению формулы (I) или его фармацевтически приемлемым соли, сольвату или производному для лечения воспалительных кишечных заболеваний, в том числе болезни Крона и язвенного колита,рассеянного склероза, ревматоидного артрита, отторжения трансплантата, включая аллотрансплантаты почки или легкого, эндометриоза, диабета I типа, заболеваний почек, хронического панкреатита, воспалительных состояний легких или хронической сердечной недостаточности; применению соединений формулы (I) или его фармацевтически приемлемых соли, сольвата или производного для изготовления лекарственного средства для лечения заболеваний, связанных с модуляцией рецепторов CCR5; применению соединений формулы (I) или его фармацевтически приемлемых соли, сольвата или производного для изготовления лекарственного средства для лечения ВИЧ, генетически родственной ВИЧ ретровирусной инфекции, СПИД или воспалительных заболеваний; применению соединений формулы (I) или его фармацевтически приемлемых соли, сольвата или производного для изготовления лекарственного средства для лечения респираторных заболеваний,включая респираторный дистресс-синдром у взрослых (ARDS), бронхит, хронический бронхит, хроническое обструктивное легочное заболевание, муковисцидоз, астму, эмфизему, ринит или хронический синусит; применению соединений формулы (I) или его фармацевтически приемлемых соли, сольвата или производного для изготовления лекарственного средства для лечения воспалительных кишечных заболеваний, в том числе болезни Крона и язвенного колита, рассеянного склероза, ревматоидного артрита,отторжения трансплантата, включая аллотрансплантаты почки или легкого, эндометриоза, диабета I типа, заболеваний почек, хронического панкреатита, воспалительных состояний легких или хронической сердечной недостаточности; способу лечения заболеваний, связанных с модуляцией рецепторов CCR5 у млекопитающих, который включает лечение указанных млекопитающих эффективным количеством соединения формулы (I) или его фармакологически приемлемых соли, сольвата или производного; способу лечения ВИЧ, генетически родственной ВИЧ ретровирусной инфекции, СПИД или воспалительных заболеваний, который включает лечение указанных млекопитающих эффективным количеством соединения формулы (I) или его фармакологически приемлемых соли, сольвата или производного; способу лечения респираторных заболеваний, включая респираторный дистресс-синдром у взрослых (ARDS), бронхит, хронический бронхит, хроническое обструктивное легочное заболевание, муковисцидоз, астму, эмфизему, ринит и хронический синусит, который включает лечение указанных млекопитающих эффективным количеством соединения формулы (I) или его фармакологически приемлемых соли, сольвата или производного; способу лечения воспалительных кишечных заболеваний, в том числе болезни Крона и язвенного колита, рассеянного склероза, ревматоидного артрита, отторжения трансплантата, включая аллотрансплантаты почки или легкого, эндометриоза, диабета I типа, заболеваний почек, хронического панкреатита, воспалительных состояний легких или хронической сердечной недостаточности, который включает лечение указанных млекопитающих эффективным количеством соединения формулы (I) или его фармакологически приемлемых соли, сольвата или производного; промежуточным соединениям формул (II), (IV), (V), (VI), (VII), (IX), (X), (XI), (XVII), (XIX), (XXII),(XXIV), (XXV) и (XXVI); соответствующим промежуточным соединениям, получаемым замещением на стадии (а) нитропиридина формулы (XV) нитропиридином формулы (XVI); и их соответствующим производным, с которых снята защита. Изобретение иллюстрируется нижеследующими примерами и препаратами, в которых могут использоваться следующие сокращения: 0,88 ammonia (0,88 аммиак) означает концентрированный раствор гидроксида аммония, 0,88 SG,ч означает час,мин означает минуту,МС означает масс-спектр,ЯМР означает ядерный магнитный резонанс Ацетилхлорид (0,3 мл, 4,20 ммоль) добавляют к раствору (1S)-3-[3-эндо-(5-бензил-2-метил-4,5,6,7 тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропиламина (препарат 13) (1,8 г, 3,84 ммоль) в дихлорметане (30 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч и растворитель удаляют при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле, с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (от 94:6:0,6, по объему, до 92:8:0,8 и затем 90:10:1). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде белой пены (1,76 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,20-7,38 (10 Н, м), 6,42-6,48 (1 Н, д), 5,05-5,14 (1 Н, м), 4,23-4,37 (1 Н,м), 3,68 (2 Н, с), 3,44 (2 Н, с), 3,19-3,28 (2 Н, м), 2,81-2,89 (2 Н, м), 2,63-2,69 (2 Н, м), 2,31-2,45 (5 Н, м), 2,132,22 (2 Н, м), 1,82-2,02 (7 Н, м), 1,26-1,42 (2 Н, кв), 1,14-1,41 (2 Н, м) м.д. НРМС (электрораспыление): m/z [M+Na]+ 534, [М+Н]+ 512, [М-Н]+ 510. Найдено: С, 72,92; Н, 8,06; N, 13,45. Вычислено для C32H41N500,75 моль Н 2O: С, 73,18; Н, 8,16; N,13,33%. Пример 2. N-(1S)-3-[3-эндо-(2-Метил-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропилацетамид. К раствору N-(1S)-3-[3-эндо-(5-бензил-2-метил-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-3 ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропилацетамида (пример 1) (0,80 г, 1,56 ммоль) в этаноле (20 мл) в атмосфере азота добавляют 20% палладий на угле (0,16 г) при комнатной температуре. Затем добавляют формиат аммония (0,40 г, 6,34 ммоль) и реакционную смесь осторожно кипятят с обратным холодильником в течение 30 мин. Затем добавляют дополнительную аликвоту формиата алюминия (0,20 г,3,17 ммоль) и раствор осторожно кипятят с обратным холодильником в течение 45 мин. Реакционную смесь охлаждают до комнатной температуры и фильтруют через Arbocel, хорошо промывая этанолом. Фильтрат упаривают при пониженном давлении и остаток очищают колоночной флэш-хроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол: концентрированный водный аммиак (от 92:8:0,8, по объему, до 90:10:1). Фракции, содержащие продукт,упаривают и получают указанное в заголовке соединение в виде белой пены (0,61 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,20-7,38 (5 Н, м), 6,26-6,36 (1 Н, д), 5,12-5,19 (1 Н, м), 4,36-4,46 (1 Н, м),3,89 (2 Н, с), 3,27-3,37 (2 Н, м), 3,03-3,09 (2 Н, м), 2,52-2,63 (2 Н, м), 2,31-2,53 (5 Н, м), 2,17-2,29 (2 Н, м),1,89-2,17 (7 Н, м), 1,40-1,59 (4 Н, м) м.д. НРМС (электрораспыление): m/z [M+Na]+ 444, [М+Н]+ 422, [М-Н]+ 420. Найдено: С, 67,14; Н, 8,29; N, 15,62. Вычислено для C25H35N5O1,5 моль Н 2O: С, 66,93; Н, 8,54; N,15,61%. Пример 3. N-(1S)-3-[эндо-(5-Ацетил-2-метил-4,5,6,7-тетрагидро-3 Н-имидазо[4,5-с]пиридин-3-ил)8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропилацетамид.(пример 2) (0,066 г, 0,157 ммоль) в дихлорметане (4 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и промывают насыщенным водным раствором гидрокарбоната натрия (5 мл). Органическую фазу сушат (MgSO4), а растворитель удаляют при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле, с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (от 94:6:0,6, по объему, до 92:8:0,8). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде белой пены (0,069 г), которое представляет собой смесь ротамеров. 1 Н ЯМР (400 МГц, CDCl3): : 7,23-7,40 (5 Н, м), 6,26-6,31 (0,83 Н, д), 6,03-6,07 (0,17 Н, д), 5,18-5,24 Уксусную кислоту (0,06 мл, 1,04 ммоль) добавляют к перемешиваемому раствору N-(1S)-3-[3 эндо-(2-метил-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропилацетамида (пример 2) (0,09 г, 0,21 ммоль) и ацетона (0,03 мл, 0,41 ммоль) в дихлорметане (5 мл) в атмосфере азота при комнатной температуре. Затем добавляют триацетоксиборгидрид натрия (0,09 г,0,42 ммоль) и реакционную смесь выдерживают при комнатной температуре в течение 18 ч. Добавляют дополнительные аликвоты ацетона (0,03 мл, 0,41 ммоль) и триацетоксиборгидрид натрия (0,09 г, 0,42 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Реакционную смесь распределяют между насыщенным водным раствором гидрокарбоната натрия (10 мл) и дихлорметаном (10 мл). Органическую фазу удаляют, а водную фазу промывают дихлорметаном (10 мл). Объединенные органические фазы промывают Н 2O (10 мл), сушат (MgSO4) и удаляют растворитель при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (от 94:6:0,6, по объему до 92:8:0,8). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде белой пены (0,066 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,24-7,39 (5 Н, м), 6,26-6,45 (1 Н, д), 5,12-5,18 (1 Н, кв), 4,31-4,43 (1 Н,м), 3,62 (2 Н, с), 3,29-3,38 (2 Н, м), 2,88-2,97 (1 Н, м), 2,75-2,81 (2 Н, м), 2,58-2,65 (2 Н, м), 2,41-2,51 (2 Н, м),2,37 (3H, с), 2,20-2,25 (2 Н, м), 2,03-2,12 (2 Н, м), 2,01 (3H, с), 1,91-2,00 (2 Н, м), 1,47-1,60 (4 Н, м), 1,11-1,18 Триацетоксиборгидрид натрия (0,50 г, 2,35 ммоль) добавляют к перемешиваемому раствору N(1S)-3-[3-эндо-(2-метил-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил)-8-азабицикло[3.2.1]окт-8 ил]-1-фенилпропилацетамида (пример 2) (0,45 г, 1,06 ммоль) и параформальдегида (0,064 г, 2,13 ммоль) в дихлорметане (4 мл) в атмосфере азота при комнатной температуре и реакционную смесь перемеши- 16007590 вают при комнатной температуре в течение 18 ч. Добавляют дополнительные аликвоты параформальдегида (0,064 г, 2,13 ммоль) и триацетоксиборгидрида натрия (0,5 г, 2,35 ммоль) и перемешивание продолжают еще в течение 24 ч. Реакционную смесь распределяют между насыщенным водным раствором гидрокарбоната натрия (10 мл) и дихлорметаном (10 мл). Органическую фазу удаляют, а водную фазу промывают дихлорметаном (10 мл). Объединенные органические фазы промывают Н 2 О (10 мл), сушат(MgSO4) и удаляют растворитель при пониженном давлении. Остаток очищают колоночной флэшхроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (от 92:8:0,8, по объему, до 90:10:0,5, затем 90:10:0,6). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде белой пены (0,10 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,23-7,38 (5 Н, м), 6,34-6,39 (1 Н, д), 5,10-5,18 (1 Н, кв), 4,35-4,44 (1 Н,м), 3,50 (2 Н, с), 3,31-3,38 (2 Н, м), 2,63-2,73 (4 Н, м), 2,37-2,51 (8 Н, м), 2,19-2,25 (2 Н, т), 1,90-2,16 (9 Н, м),1,43-1,60 (2 Н, м) м.д. НРМС (электрораспыление): m/z [М+Н]+ 436, [М-Н]+ 434. Найдено: С, 69,17; Н, 8,62; N, 15,43. Вычислено для C26H37N5O0,9 моль Н 2O: С, 69,12; Н, 8,66; N,15,50%. Пример 6. N-1S)-3-3-эндо-[2-Метил-5-(метилсульфонил)-4,5,6,7-тетрагидро-3H-имидазо[4,5-с] пиридин-3-ил]-8-азабицикло[3.2.1]окт-8-ил-1-фенилпропил)ацетамид. Метансульфонилхлорид (0,02 мл, 0,25 ммоль) добавляют к раствору N-(1S)-3-[3-эндо-(2-метил 4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропилацетамида (пример 2) (0,08 г, 0,19 ммоль) и триэтиламина (0,04 мл, 0,29 ммоль) в дихлорметане (3 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и растворитель удаляют при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле, с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (от 94:6:0,6, по объему, до 92:8:0,8). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде пены розового цвета(пример 2) (0,08 г, 0,19 ммоль) и триэтиламина (0,04 мл, 0,29 ммоль) в дихлорметане (3 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и растворитель удаляют при пониженном давлении. Остаток очищают колоночной флэшхроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (от 94:6:0,6, по объему, до 92:8:0,8). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде не совсем белой пены(пример 2) (0,08 г, 0,19 ммоль) и триэтиламина (0,04 мл, 0,29 ммоль) в дихлорметане (3 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и растворитель удаляют при пониженном давлении. Остаток очищают колоночной флэшхроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (от 94:6:0,6, по объему, до 92:8:0,8). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде белой пены (0,078 г),которое представляет собой смесь ротамеров. 1 Н ЯМР (400 МГц, CDCl3): : 7,22-7,38 (5 Н, м), 6,28-6,36 (0,8 Н, д), 6,03-6,08 (0,2 Н, д), 5,10-5,18 (1 Н,кв), 4,66 (2 Н, с), 4,37-4,43 (1 Н, м), 3,82-3,86 (0,4 Н, м), 3,64-3,73 (1,6 Н, т), 3,28-3,39 (2 Н, м), 2,58-2,72 (2 Н,м), 2,32-2,52 (7 Н, м), 2,18-2,28 (2 Н, т), 2,02-2,16 (2 Н, м), 1,92-2,01 (5 Н, м), 1,47-1,64 (4 Н, м), 1,15-1,20 (3H,т) м.д. НРМС (электрораспыление): m/z [M+Na]+ 500, [М+Н]+ 478, [М-Н]+ 476. Найдено: С, 68,72; Н, 8,30; N, 14,29. Вычислено для C28H39N5O20,75 моль Н 2O: С, 68,47; Н, 8,31; N,14,26%. Пример 9. N-(1S)-3-[3-эндо-(5-Изобутирил-2-метил-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин 3-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропилацетамид.(пример 2) (0,08 г, 0,19 ммоль) и триэтиламина (0,04 мл, 0,29 ммоль) в дихлорметане (3 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и растворитель удаляют при пониженном давлении. Остаток очищают колоночной флэшхроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (94:6:0,6, по объему, до 92:8:0,8). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение, которое представляет собой смесь ротамеров, в виде белой пены (0,078 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,22-7,38 (5 Н, м), 6,28-6,34 (0,9 Н, д), 6,03-6,09 (0,1 Н, м), 5,18-5,25 Циклобутилкарбонилхлорид (0,03 мл, 0,26 ммоль) добавляют к раствору (1S)-3-[3-эндо-(2,5 диметил-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропиламина (препарат 14) (0,085 г, 0,22 ммоль) и триэтиламина (0,04 мл, 0,29 ммоль) в дихлорметане (3 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч и растворитель удаляют при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (94:6:0,6, по объему, до 92:8:0,8 и затем до 90:10:1). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде белой пены (0,089 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,21-7,37 (5 Н, м), 6,01-6,07 (1 Н, д), 5,08-5,15 (1 Н, кв), 4,32-4,43 (1 Н,м), 3,52 (2 Н, с), 3,25-3,37 (2 Н, м), 2,92-3,02 (1 Н, м), 2,62-2,73 (4 Н, м), 2,36-2,50 (8 Н, м), 2,00-2,34 (8 Н, м),1,82-1,99 (4 Н, м), 1,42-1,58 (4 Н, м) м.д. НРМС (электрораспыление): m/z [М+Н]+ 476, [М-Н]+ 474. Найдено: С, 71,94; Н, 8,79; N, 14,46. Вычислено для C29H41N5O0,5 моль Н 2O: С, 71,87; Н, 8,73; N,14,45%. Пример 11. N-(1S)-3-[3-эндо-(2,5-Диметил-4,5,б,7-тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил)-8 азабицикло[3.2.1]окт-8-ил]-1-фенилпропилтетрагидропиран-4-карбоксамид. 1-(3-Диметиламинопропил)-3-этилкарбодиимидгидрохлорид (0,05 г, 0,26 ммоль) добавляют к раствору тетрагидропиран-4-карбоновой кислоты, (0,03 г, 0,23 ммоль), (1S)-3-[3-эндо-(2,5-диметил-4,5,6,7 тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропиламина (препарат 14) (0,08 г, 0,20 ммоль), триэтиламина (0,04 мл, 0,29 ммоль) и 1-гидроксибензотриазола (0,04 г, 0,26 ммоль) в дихлорметане (3 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч, затем реакционную смесь распределяют между дихлорметаном (10 мл) и насыщенным водным раствором гидрокарбоната натрия (10 мл). Органическую фазу сушат (MgSO4), а растворитель удаляют при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (от 94:6:0,6, по объему, до 92:8:0,8, затем 90:10:1). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде белой пены (0,098 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,33-7,39 (2 Н, м), 7,23-7,32 (3H, м), 5,88-5,96 (1 Н, д), 5,08-5,17 (1 Н,кв), 4,35-4,43 (1 Н, м), 3,97-4,03 (2 Н, м), 3,48 (2 Н, с), 3,26-3,44 (4 Н, м), 2,68-2,73 (2 Н, м), 2,62-2,68 (2 Н, м),2,47 (3H, с), 2,27-2,44 (6 Н, м), 2,17-2,22 (2 Н, т), 2,01-2,07 (2 Н, м), 1,93-2,00 (2 Н, м), 1,68-1,82 (2 Н, м), 1,431,56 (4 Н, м) м.д. НРМС (электрораспыление): m/z [M+H]+ 506. Найдено: С, 69,41; Н, 8,64; N, 13,50. Вычислено для C30H43N5O20,75 моль Н 2O: С, 69,40; Н, 8,64; N,13,49%. Пример 12. N-1S)-3-3-эндо-[2-Метил-5-(3,3,3-трифторпропаноил)-4,5,6,7-тетрагидро-3H-имидазо(пример 2) (0,08 г, 0,19 ммоль), триэтиламина (0,04 мл, 0,29 ммоль) и 1-гидроксибензотриазола (0,04 г,0,26 ммоль) в дихлорметане (3 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч, затем реакционную смесь распределяют между дихлорметаном (10 мл) и насыщенным водным раствором гидрокарбоната натрия (10 мл). Органическую фазу сушат (MgSO4), и удаляют растворитель при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол (92:8, по объему, до 90:10, 85:15, затем до 80:200). Фракции, содержащие продукт,упаривают и получают указанное в заголовке соединение в виде белой пены (0,089 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,21-7,39 (5 Н, м), 6,17-6,31 (1 Н, м), 5,10-5,18 (1 Н, кв), 4,71 (2 Н, с),4,46-4,83 (1 Н, м), 3,65-3,75 (2 Н, м), 3,26-3,48 (4 Н, м), 2,70-2,76 (1,5 Н, м), 2,63-2,69 (0,5 Н, м), 2,44-2,48 Ацетилхлорид (0,026 г, 0,34 ммоль) добавляют к раствору метил-3-эндо-8-[(3S)-3-амино-3-(3 фторфенил)пропил]-8-азабицикло[3.2.1]окт-3-ил-2-метил-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин 5-карбоксилата (препарат 21) (0,14 г, 0,31 ммоль) и N-этил-N,N-диизопропиламин (0,043 г, 0,34 ммоль) в дихлорметане (16 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и гасят насыщенным водным раствором гидрокарбоната натрия (20 мл). Продукт экстрагируют из органической фазы 2 н. НСl (33 мл) и водную фазу подщелачивают до рН 10 с помощью 2 н. NaOH и затем экстрагируют дихлорметаном (35 мл) и объединенные органические экстракты сушат (MgSO4). Растворитель удаляют при пониженном давлении и получают указанное в заголовке соединение в виде не совсем белого твердого вещества (0,132 г). 1[4,5-с]пиридин-5-карбоксилата (препарат 21) (0,14 г, 0,31 ммоль) и N-этил-N,N-диизопропиламина (0,043 г, 0,34 ммоль) в дихлорметане (16 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и гасят насыщенным водным раствором гидрокарбоната натрия (20 мл). Продукт экстрагируют из органической фазы 2 н. раствором НСl (33 мл), водную фазу подщелачивают до рН 10, используя 2 н. раствор NaOH и затем экстрагируют дихлорметаном (35 мл); объединенные органические экстракты сушат (MgSO4). Растворитель удаляют при пониженном давлении и получают указанное в заголовке соединение в виде не совсем белого твердого вещества (0,132 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,22-7,32 (1 Н, м), 7,00-7,05 (1 Н, м), 6,87-6,99 (2 Н, м), 6,04-6,16 (1 Н, м),5,03-5,15 (1 Н, м), 4,45-4,56 (2 Н, м), 4,32-4,44 (1 Н, м), 3,57-3,75 (5 Н, м), 3,24-3,35 (2 Н, м), 2,92-3,02 (1 Н,м), 2,56-2,64 (2 Н, м), 2,34-2,52 (5 Н, м), 1,98-2,32 (6 Н, м), 1,79-1,96 (4 Н, м), 1,40-1,67 (6 Н, м) м.д. НРМС (электрораспыление): m/z [М+Н]+ 538, [М-Н]+ 536. Пример 15. Метил-3-эндо-(8-(3S)-3-(3-фторфенил)-3-[(3,3,3-трифторпропаноил)амино]пропил-8 азабицикло[3.2.1]окт-3-ил)-2-метил-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-5-карбоксилат. 3,3,3-Трифторпропановую кислоту (0,043 г, 0,34 ммоль), 1-гидроксибензотриазол (0,056 г, 0,37 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (0,076 г, 0,4 ммоль) и метил-3-эндо 8-[(3S)-3-амино-3-(3-фторфенил)пропил]-8-азабицикло[3.2.1]окт-3-ил-2-метил-4,5,6,7-тетрагидро-3Hимидазо[4,5-с]пиридин-5-карбоксилат (препарат 21) (0,14 г, 0,31 ммоль) растворяют в дихлорметане (16 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и гасят насыщенным водным раствором гидрокарбоната натрия (20 мл). Органическую фазу удаляют и сушат (MgSO4). Растворитель удаляют при пониженном давлении и получают указанное в заголовке соединение в виде не совсем белого твердого вещества (0,136 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,23-7,32 (1 Н, м), 7,02-7,07 (1 Н, д), 6,92-6,97 (2 Н, м), 6,57-6,69 (1 Н, м),5,14-5,22 (1 Н, м), 4,45-4,56 (2 Н, м), 4,12-4,23 (1 Н, м), 3,60-3,72 (5 Н, м), 3,26-3,36 (2 Н, м), 2,99-3,14 (2 Н,кв), 2,56-2,62 (2 Н, м), 2,38-2,50 (2 Н, м), 2,37 (3H, с), 2,18-2,28 (2 Н, м), 2,01-2,13 (2 Н, м), 1,82-1,99 (2 Н, м),1,41-1,65 (4 Н, м) м.д. НРМС (электрораспыление): m/z [M+H]+ 566, [М-Н]+ 564. Пример 16. Метил-3-эндо-(8-(3S)-3-(3-фторфенил)-3-[(метоксикарбонил)амино]пропил-8-азабицикло[3.2.1]окт-3-ил)-2-метил-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-5-карбоксилат. Метилхлорформиат (0,032 г, 0,34 ммоль) добавляют к раствору метил-3-эндо-8-[(3S)-3-амино-3-(3 фторфенил)пропил]-8-азабицикло[3.2.1]окт-3-ил-2-метил-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин 5-карбоксилата (препарат 21) (0,14 г, 0,31 ммоль) и N-этил-N,N-диизопропиламина (0,043 г, 0,34 ммоль) в дихлорметане (16 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и гасят насыщенным водным раствором гидрокарбоната натрия (20 мл). Органическую фазу удаляют и сушат (MgSO4). Растворитель удаляют при пониженном давлении и получают указанное в заголовке соединение в виде не совсем белого твердого вещества Метилхлорформиат (0,033 г, 0,35 ммоль) добавляют к раствору (1S)-3-[3-эндо-(5-ацетил-2-метил 4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-(3-фторфенил) пропиламина (препарат 20) (0,14 г, 0,2 ммоль) и N-этил-N,N-диизопропиламина (0,045 г, 0,35 ммоль) в дихлорметане (16 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и гасят насыщенным водным раствором гидрокарбоната натрия (10 мл). Продукт экстрагируют из органической фазы 2 н. НСl (33 мл), водную фазу подщелачивают до рН 10 2 н. раствором NaOH и затем экстрагируют дихлорметаном (35 мл); объединенные органические экстракты сушат (MgSO4). Растворитель удаляют при пониженном давлении и получают указанное в заголовке соединение в виде не совсем белого твердого вещества (0,133 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,33-7,43 (1 Н, м), 7,23-7,30 (1 Н, м), 7,01-7,05 (1 Н, д), 6,93-6,99 (1 Н, д),6,86-6,91 (1 Н, т), 4,82-4,92 (1 Н, м), 4,65 (2 Н, с), 4,37-4,52 (1 Н, м), 3,56-3,66 (5 Н, м), 3,36-3,46 (1 Н, м), 3,253,36 (1 Н, м), 2,45-2,63 (2 Н, т), 2,40 (3H, с), 2,18-2,26 (2 Н, т), 2,15 (3H, с), 1,91-2,10 (2 Н, м), 1,49-1,77 (6 Н,м) м.д. НРМС (электрораспыление): m/z [М+Н]+ 498, [М-Н]+ 496. Пример 18. N-(1S)-3-[3-эндо-(5-Ацетил-2-метил-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-3 ил)-8-азабицикло[3.2.1]окт-8-ил]-1-(3-фторфенил)пропилциклобутанкарбоксамид. Циклобутилкарбонилхлорид (0,041 г, 0,35 ммоль) добавляют к раствору (1S)-3-[3-эндо-(5-ацетил-2 метил-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-(3-фторфенил) пропиламина (препарат 20) (0,14 г, 0,2 ммоль) и N-этил-N,N-диизопропиламина (0,045 г, 0,35 ммоль) в дихлорметане (16 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и гасят насыщенным водным раствором гидрокарбоната натрия (10 мл). Продукт экстрагируют из органической фазы 2 н. НСl (33 мл), водную фазу подщелачивают до рН 10 2 н. раствором NaOH и затем экстрагируют дихлорметаном (35 мл); объединенные органические экстракты сушат (MgSO4). Растворитель удаляют при пониженном давлении и получают указанное в заголовке соединение, которое является смесью ротамеров, в виде белой пены (0,124 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,22-7,29 (1 Н, м), 7,02-7,07 (1 Н, д), 6,87-6,97 (2H, м), 6,09-6,13 (0,83 Н,д), 5,82-5,86 (0,17 Н, д), 5,15-5,22 (0,17 Н, м), 5,03-5,13 (0,83 Н, м), 4,62 (2 Н, с), 4,35-4,57 (1 Н, м), 3,73-3,87- 22007590 ммоль), гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,079 г, 0,41 ммоль) и (1S)-3-[3 эндо-(5-ацетил-2-метил-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил)-8-азабицикло[3.2.1]окт-8 ил]-1-(3-фторфенил)пропиламин (препарат 20) (0,140 г, 0,31 ммоль) растворяют в дихлорметане (16 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и гасят насыщенным водным раствором гидрокарбоната натрия (20 мл). Органическую фазу удаляют и сушат (MgSO4). Растворитель удаляют при пониженном давлении и получают указанное в заголовке соединение, которое является смесью ротамеров, в виде не совсем белого твердого вещества (0,136 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,22-7,33 (1 Н, м), 7,02-7,07 (1 Н, д), 6,92-6,98 (2 Н, м), 6,66-6,72 (0,85 Н,д), 6,36-6,42 (0,15 Н, д), 5,27-5,34 (0,15 Н, м), 5,13-5,19 (0,85 Н, м), 4,61 (2 Н, с), 4,35-4,53 (1 Н, м), 3,68-3,88 Тетрагидропиран-4-карбоновую кислоту (0,046 г, 0,35 ммоль), 1-гидроксибензотриазол (0,058 г,0,38 ммоль), гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,079 г, 0,41 ммоль) и (1S)-3[3-эндо-(5-ацетил-2-метил-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил)-8-азабицикло[3.2.1]окт-8 ил]-1-(3-фторфенил)пропиламин (препарат 20) (0,140 г, 0,31 ммоль) растворяют в дихлорметане (16 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и гасят насыщенным водным раствором гидрокарбоната натрия (20 мл). Органическую фазу удаляют и сушат (MgSO4). Растворитель удаляют при пониженном давлении и получают указанное в заголовке соединение, которое является смесью ротамеров, в виде не совсем белого твердого вещества (0,145 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,22-7,35 (1 Н, м), 7,02-7,08 (1 Н, м), 6,88-7,01 (2 Н, м), 5,93-6,04 (0,85 Н,д), 5,75-5,82 (0,15 Н, д), 5,16-5,25 (0,15 Н, м), 5,04-5,15 (0,85 Н, кв), 4,62 (2 Н, с), 4,33-4,57 (1 Н, м), 3,92-4,02 Гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,035 г, 0,18 ммоль) добавляют к раствору тетрагидропиран-4-карбоновой кислоты (0,022 г, 0,17 ммоль), (1S)-3-3-эндо-[2-метил-5-(3,3,3 трифторпропаноил)-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил]-8-азабицикло[3.2.1]окт-8-ил-1 фенилпропиламина (препарат 24) (0,075 г, 0,15 ммоль), триэтиламина (0,03 мл, 0,22 ммоль) и 1 гидроксибензотриазола (0,027 г, 0,18 ммоль) в дихлорметане (3 мл) в атмосфере азота при комнатной температуре и перемешивают в течение 18 ч. Растворитель удаляют при пониженном давлении и остаток очищают колоночной флэш-хроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (95:5:0,5, по объему, до 92:8:0,5). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение, которое представляет собой смесь ротамеров, в виде белой пены (0,075 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,32-7,38 (2 Н, м), 7,23-7,32 (3H, м), 5,82-5,89 (0,85 Н, д), 5,66-5,72 Гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,035 г, 0,18 ммоль) добавляют к раствору 3,3,3-трифторпропановой кислоты (0,022 г, 0,17 ммоль), (1S)-3-3-эндо-[2-метил-5-(3,3,3 трифторпропаноил)-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил]-8-азабицикло[3,2,1]окт-8-ил-1 фенилпропиламина (препарата 24) (0,075 г, 0,15 ммоль), триэтиламина (0,03 мл, 0,22 ммоль) и 1 гидроксибензотриазола (0,027 г, 0,18 ммоль) в дихлорметане (3 мл) в атмосфере азота при комнатной температуре и перемешивают в течение 18 ч. Растворитель удаляют при пониженном давлении и остаток очищают колоночной флэш-хроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (от 95:5:0,5 по объему до 92:8:0,5). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение, которое представляет собой смесь ротамеров, в виде белой пены (0,075 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,32-7,38 (2 Н, м), 7,22-7,31 (3H, м), 6,39-6,47 (0,8 Н, д), 6,08-6,18 (0,2 Н,д), 5,51-5,59 (0,2 Н, кв), 5,18-5,25 (0,8 Н, кв), 4,70 (1,6 Н, с), 4,66 (0,4 Н, с), 4,40-4,55 (1 Н, м), 4,06-4,16 (0,2 Н,м), 3,63-3,71 (1,8 Н, т), 3,25-3,36 (4 Н, м), 3,00-3,14 (2 Н, м), 2,58-2,72 (2 Н, м), 2,36-2,50 (5 Н, м), 2,18-2,35 Циклобутилкарбонилхлорид (0,02 мл, 0,17 ммоль) добавляют к раствору (1S)-3-3-эндо-[2-метил-5(3,3,3-трифторпропаноил)-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил]-8-азабицикло[3.2.1]окт-8 ил-1-фенилпропиламина (препарат 24) (0,075 г, 0,15 ммоль) и триэтиламина (0,03 мл, 0,22 ммоль) в дихлорметане (3 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 1,5 ч и удаляют растворитель при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (от 95:5:0,5 по объему до 92:8:0,5). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение, которое является смесью ротамеров, в виде белой пены (0,068 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,32-7,39 (2 Н, м), 7,22-7,31 (3H, м), 5,86-5,93 (0,87 Н, д), 5,60-5,64 Метилхлорформиат (0,015 мл, 0,19 ммоль) добавляют к раствору (1S)-3-3-эндо-[2-метил-5-(3,3,3 трифторпропаноил)-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил]-8-азабицикло[3.2.1]окт-8-ил-1 фенилпропиламина (препарат 24) (0,075 г, 0,15 ммоль) и триэтиламина (0,03 мл, 0,22 ммоль) в дихлорметане (3 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 1,5 ч и растворитель отгоняют при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (от 95:5:0,5, по объему, до 92:8:0,5). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде белой пены (0,062 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,33-7,40 (2 Н, м), 7,21-7,33 (3H, м), 7,04-7,18 (1 Н, м), 4,82-4,96 (1 Н, м),4,73 (2 Н, с), 4,43-4,60 (1 Н, м), 3,64-3,73 (1 Н, т), 3,46-3,64 (4 Н, м), 3,39-3,47 (1 Н, м), 3,26-3,38 (3H, м), 2,622,77 (2 Н, м), 2,49-2,59 (2 Н, м), 2,43 (3H, с), 2,19-2,30 (2 Н, м), 1,92-2,08 (4 Н, м), 1,48-1,68 (4 Н, м) м.д. НРМС (электрораспыление): m/z [М+Н]+ 548, [М-Н]+ 546. Найдено: С, 60,47; Н, 6,68; N, 12,45. Вычислено для C28H36F3N5O30,5 моль Н 2O: С, 60,42; Н, 6,70; N,12,58%. Пример 25. Метил-3-эндо-(8-(3S)-3-[(метоксикарбонил)амино]-3-фенилпропил-8-азабицикло Метилхлорформиат (0,015 мл, 0,19 ммоль) добавляют к раствору метил-3-эндо-8-[(3S)-3-амино-3 фенилпропил]-8-азабицикло[3.2.1]окт-3-ил-2-метил-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-5 карбоксилата (препарат 26) (0,06 г, 0,14 ммоль) и триэтиламина (0,03 мл, 0,22 ммоль) в дихлорметане (3 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и удаляют растворитель при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (от 94:6:0,6 по объему, до 92:8:0,8). Фракции,содержащие продукт, упаривают и получают указанное в заголовке соединение в виде белой пены (0,058 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,22-7,38 (6 Н, м), 4,87-4,94 (1 Н, м), 4,42-4,63 (3H, м), 3,65-3,75 (5 Н, м),3,62 (3H, с), 3,41-3,47 (1 Н, т), 3,28-3,37 (1 Н, м), 2,60-2,66 (2 Н, м), 2,49-2,60 (2 Н, м), 2,43 (3H, с), 2,20-2,27 Гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,04 г, 0,21 ммоль) добавляют к раствору 3,3,3-трифторпропановой кислоты (0,015 мл, 0,16 ммоль), метил-3-эндо-8-[(3S)-3-амино-3- 25007590 фенилпропил]-8-азабицикло[3.2.1]окт-3-ил-2-метил-4,5,6,7-тетрагидро-3H-имидазо[4,5-с]пиридин-5 карбоксилата (препарат 26) (0,06 г, 0,14 ммоль), триэтиламина (0,03 мл, 0,22 ммоль) и 1 гидроксибензотриазола (0,03 г, 0,20 ммоль) в дихлорметане (3 мл) в атмосфере азота при комнатной температуре. Реакцию проводят при комнатной температуре в течение 18 ч. Растворитель удаляют при пониженном давлении и остаток очищают колоночной флэш-хроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (от 94:6:0,6, по объему, до 92:8:0,6). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде белой пены (0,071 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,28-7,36 (2 Н, м), 7,22-7,27 (3H, м), 6,37-6,50 (1 Н, д), 5,14-5,23 (1 Н, м),4,51 (2 Н, с), 4,34-4,46 (1 Н, м), 3,60-3,68 (2 Н, м), 3,70 (3H, с), 3,27-3,33 (2 Н, м), 2,98-3,10 (2 Н, м), 2,57-2,64(препарат 28) (0,125 г, 0,30 ммоль) и триэтиламина (0,06 мл, 0,43 ммоль) в дихлорметане (5 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 1,5 ч и растворитель удаляют при пониженном давлении. Остаток очищают колоночной флэшхроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан: метанол: концентрированный водный аммиак (от 94:6:0,6, по объему, до 92:8:0,6). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде белой пены (0,125 г). 1 Гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,077 г, 0,4 ммоль) добавляют к раствору 3,3,3-трифторпропановой кислоты (0,03 мл, 0,34 ммоль), (1S)-3-[3-эндо-(5-ацетил-2-метил-4,5,6,7 тетрагидро-3H-имидазо[4,5-с]пиридин-3-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропиламина (препарат 28) (0,125 г, 0,3 ммоль), триэтиламина (0,07 мл, 0,5 ммоль) и 1-гидроксибензотриазола (0,061 г, 0,40 ммоль) в дихлорметане (5 мл) в атмосфере азота при комнатной температуре. Реакционную смесь выдерживают при комнатной температуре в течение 3 ч. Растворитель удаляют при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (94:6:0,6, по объему, до 92:8:0,6, затем до 90:10:0,6). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение, которое является смесью ротамеров, в виде белой пены (0,14 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,32-7,40 (2 Н, м), 7,27-7,31 (3H, м), 6,50-6,58 (0,85 Н, д), 6,27-6,32 Ацетилхлорид (0,02 г, 0,25 ммоль) добавляют к раствору тригидрохлорида метил-1-эндо-8-[(3S)-3 амино-3-фенилпропил]-8-азабицикло[3.2.1]окт-3-ил-2-метил-4,5,6,7-тетрагидро-1H-имидазо[4,5-с]пиридин-5-карбоксилата (препарат 36) (0,125 г, 0,23 ммоль) и N-этил-N,N-диизопропиламина (0,103 г, 0,8 ммоль) в дихлорметане (4 мл) в атмосфере азота при комнатной температуре и реакционную смесь перемешивают в течение 18 ч. Добавляют дихлорметан (5 мл) и раствор промывают насыщенным водным раствором гидрокарбоната натрия (10 мл) и насыщенным раствором соли (10 мл). Органическую фазу сушат (MgSO4) и удаляют растворитель при пониженном давлении. Остаток очищают колоночной флэшхроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (от 98:2:0,2, по объему, до 97:3:0,3). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде белой пены (0,09 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,40-7,25 (5 Н, м), 6,30-6,20 (1 Н, д), 5,20-5,10 (1 Н, кв), 4,50-4,35 (3 Н,м), 3,80-3,60 (5 Н, м), 3,35 (2 Н, м), 2,80-2,60 (2 Н, м), 2,50-2,40 (5 Н, м), 2,30-1,90 (7 Н, м), 1,70-1,45 (6 Н, м) м.д. НРМС (электрораспыление): m/z [М+Н]+ 480, [М-Н]+ 478. Пример 30. Метил-1-эндо-(8-(3S)-3-[(метоксикарбонил)амино]-3-фенилпропил-8-азабицикло Метилхлорформиат (0,024 г, 0,25 ммоль) добавляют к раствору тригидрохлорида метил-1-эндо-8[(3S)-3-амино-3-фенилпропил]-8-азабицикло[3.2.1]окт-3-ил-2-метил-4,5,6,7-тетрагидро-1H-имидазо[4,5 с] пиридин-5-карбоксилата (препарат 36) (0,125 г, 0,23 ммоль) и N-этил-N,N-диизопропиламина (0,118 г,0,91 ммоль) в дихлорметане (4 мл) в атмосфере азота при комнатной температуре и реакционную смесь перемешивают в течение 18 ч. Добавляют дихлорметан (5 мл) и раствор промывают насыщенным водным раствором гидрокарбоната натрия (10 мл) и насыщенным раствором соли (10 мл). Органическую фазу сушат (MgSO4) и удаляют растворитель при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:сконцентрированный водный аммиак (от 99:1:0,1 по объему, до 98:2:0,2). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде белой пены (0,07 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,40-7,10 (6 Н, м), 5,00-4,80 (1 Н, м), 4,60-4,40 (3 Н, м), 3,80-3,60 (8 Н, м),3,50-3,30 (2 Н, м), 2,80-2,65 (2 Н, м), 2,60-2,40 (5 Н, м), 2,30-1,95 (6 Н, м), 1,85-1,50 (4 Н, м) м.д. НРМС (электрораспыление): m/z [M+H]+ 496. Пример 31. Метил-1-эндо-(8-(3S)-3-[(циклобутилкарбонил)амино]-3-фенилпропил-8-азабицикло Циклобутилкарбонилхлорид (0,03 г, 0,25 ммоль) добавляют к раствору тригидрохлорида метил-1 эндо-8-[(3S)-3-амино-3-фенилпропил]-8-азабицикло[3.2.1]окт-3-ил-2-метил-4,5,6,7-тетрагидро-1Hимидазо[4,5-с]пиридин-5-карбоксилата (препарата 36) (0,125 г, 0,23 ммоль) и N-этил-N,Nдиизопропиламина (0,118 г, 0,91 ммоль) в дихлорметане (4 мл) в атмосфере азота при комнатной температуре и реакционную смесь перемешивают в течение 18 ч. Добавляют дихлорметан (5 мл) и раствор промывают насыщенным водным раствором гидрокарбоната натрия (10 мл) и насыщенным раствором соли (10 мл). Органическую фазу сушат (MgSO4) и удаляют растворитель при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле, элюируя с градиентом растворителей дихлорметан:метанол:концентрированный водный аммиак (от 99:1:0,1, по объему, до 98:2:0,2). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде белой пены (0,08 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,40-7,20 (5 Н, м), 6,10-6,00 (1 Н, д), 5,20-5,10 (1 Н, кв), 4,50-4,35 (3 Н,м), 3,80-3,60 (5 Н, м), 3,40-3,30 (2 Н, м), 3,00 (1 Н, кв), 2,80-2,65 (2 Н, м), 2,50-1,50 (21 Н, м) м.д. НРМС (электрораспыление): m/z [M+H]+ 520. Пример 32. Метил-2-метил-1-эндо-(8-(3S)-3-фенил-3-[(3,3,3-трифторпропаноил)амино]пропил-8 азабицикло[3.2.1]окт-3-ил)-4,5,6,7-тетрагидро-1 Н-имидазо[4,5-с]пиридин-5-карбоксилат. Гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,056 г, 0,3 ммоль) добавляют к раствору 3,3,3-трифторпропановой кислоты (0,022 мл, 0,25 ммоль), тригидрохлорида метил-1-эндо-8-[(3S)3-амино-3-фенилпропил]-8-азабицикло[3.2.1]окт-3-ил-2-метил-4,5,6,7-тетрагидро-1H-имидазо[4,5-с] пиридин-5-карбоксилата (препарат 36) (0,125 г, 0,23 ммоль), N-этил-N,N-диизопропиламина (0,16 мл,0,91 ммоль) и 1-гидроксибензотриазола (0,042 г, 0,27 ммоль) в дихлорметане (4 мл) в атмосфере азота при комнатной температуре. Реакционную смесь выдерживают при комнатной температуре в течение 2 ч. Добавляют дихлорметан (5 мл) и раствор промывают насыщенным водным раствором гидрокарбоната натрия (10 мл) и насыщенным раствором соли (10 мл). Органическую фазу сушат (MgSO4) и удаляют растворитель при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (от 99:1:0,1 по объему, до 98:2:0,2). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде белой пены (0,077 г). 1 Н ЯMР (400 МГц, CDCl3): : 7,40-7,25 (5 Н, м), 6,60 (1 Н, д), 5,20 (1 Н, кв), 4,50-4,35 (3 Н, м), 3,80-3,70[4,5-с]пиридин-5-карбоксилата (препарат 40) (0,409 г, 0,72 ммоль) и триэтиламина (0,33 г, 3,25 ммоль) в дихлорметане (10 мл) в атмосфере азота при комнатной температуре и реакционную смесь перемешивают в течение 2 ч. Затем раствор промывают водой (10 мл), 1 н. водным раствором гидроксида натрия (10 мл) и насыщенным раствором соли (10 мл). Органическую фазу отделяют, сушат (MgSO4) и удаляют растворитель при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле с градиентным элюированием смесью растворителей дихлорметан:метанол:концентрированный водный аммиак (от 99:1:0,1, по объему, до 97:3:0,3). Фракции, содержащие продукт, упаривают и получают указанное в заголовке соединение в виде белой пены (0,24 г). 1 Н ЯМР (400 МГц, CDCl3): : 7,30-7,25 (1 Н, м), 7,10-6,90 (3 Н, м), 6,80-6,50 (1 Н, м), 5,20-5,10 (1 Н,кв), 4,65-4,38 (3 Н, м), 3,80-3,60 (5 Н, м), 3,50-3,30 (2 Н, м), 2,80-1,90 (16 Н, м), 1,70-1,40 (4 Н, м) м.д. НРМС (электрораспыление): m/z [M+H]+ 498. Примеры 34-43 получают способами, аналогичными описанным выше. НРМС записывают в режиме ионизации электрораспылением.
МПК / Метки
МПК: A61K 31/46, C07D 451/04, A61P 29/00
Метки: качестве, модуляторов, производные, тропана, ссr5
Код ссылки
<a href="https://eas.patents.su/30-7590-proizvodnye-tropana-v-kachestve-modulyatorov-ssr5.html" rel="bookmark" title="База патентов Евразийского Союза">Производные тропана в качестве модуляторов ссr5</a>
Предыдущий патент: Пирролидины, которые ингибируют цамф-специфичную pde
Следующий патент: Способ отделения сложного полиэфира от других материалов
Случайный патент: Способ восстановления и нормализации менструального цикла