Производные замещенного 2-пиридинил-6, 7, 8, 9-тетрагидропиримидо[1, 2-а]пиримидин-4-она и 7-пиридинил-2,3-дигидроимидазо[1, 2-а]пиримидин-5(1н)она
Номер патента: 6859
Опубликовано: 28.04.2006
Авторы: Маргери Северен, Неделек Ален, Словински Франк, Ларденуа Патрик, Саади Мурад, Локхид Алистер, Галле Тьерри, Йеш Филипп
Формула / Реферат
1. Производное пиримидона, представленное формулой (I), или его соль, либо его сольват или его гидрат,
где
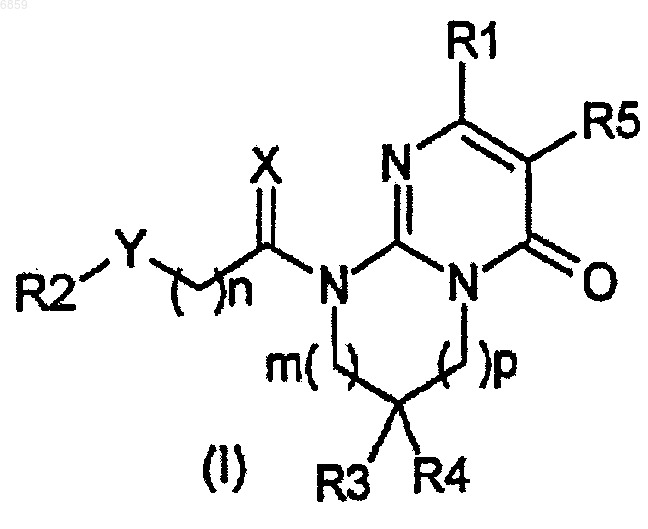
X представляет собой два атома водорода, атом серы, атом кислорода или C1-2алкильную группу и атом водорода;
Y представляет собой связь, этениленовую группу, этиниленовую группу, атом кислорода, атом серы, сульфонильную группу, сульфоксидную группу, карбонильную группу, гидроксииминометиленовую группу, диоксолановую группу, атом азота, возможно замещенный C1-6алкильной группой, фенильной группой или бензильной группой; или метиленовую группу, возможно замещенную одной или двумя группами, выбранными из C1-6алкильной группы, бензильной группы, гидроксильной группы, C1-4алкоксигруппы, C1-2пергалогенированной алкильной группы, аминогруппы, ацетиламиногруппы или фенильной группы;
R1 представляет собой 2-, 3- или 4-пиридиновое кольцо, возможно замещенное C3-6циклоалкильной группой, C1-4алкильной группой, C1-4алкоксигруппой, бензильной группой или атомом галогена;
когда Y представляет собой связь, возможно замещенную метиленовую группу, гидроксииминометиленовую группу, диоксолановую группу или карбонильную группу, тогда R2 представляет собой C1-6алкильную группу, возможно замещенную гидроксигруппой, C6,10арилокси или C6,10ариламиногруппой; C3-6циклоалкильную группу, C1-4алкилтиогруппу, C1-4алкоксигруппу, C1-2пергалогенированную алкильную группу, C1-3галогенированную алкильную группу, фенилтиогруппу, бензильную группу, бензольное кольцо, индановое кольцо, 5,6,7,8-тетрагидронафталиновое кольцо, нафталиновое кольцо, пиридиновое кольцо, пиррольное кольцо, тиофеновое кольцо, фурановое кольцо или имидазольное кольцо; бензильную группу или кольца, возможно замещенные 1-4 заместителями, выбранными из C1-6алкильной группы, метилендиоксигруппы, атома галогена, C1-2пергалогенированной алкильной группы, C1-3галогенированной алкильной группы, гидроксильной группы, C1-4алкоксигруппы, нитро, циано, амино, C1-5моноалкиламиногруппы, C2-10диалкиламиногруппы, C1-6алкилкарбониламиногруппы, C6,10арилкарбониламиногруппы, C1-4алкилсульфонильной группы, C1-4алкилсульфонилоксигруппы или фенильной группы;
когда Y представляет собой этениленовую группу, этиниленовую группу, атом кислорода, атом серы, сульфонильную группу, сульфоксидную группу или возможно замещенный атом азота, тогда R2 представляет собой C1-6алкильную группу, возможно замещенную гидроксигруппой, C6,10арилокси или C6,10ариламиногруппой; C3-6циклоалкильную группу, C1-2пергалогенированную алкильную группу, C1-3галогенированную алкильную группу, бензильную группу, бензольное кольцо, индановое кольцо, 5,6,7,8-тетрагидронафталиновое кольцо, нафталиновое кольцо, C6,10ариламино, пиридиновое кольцо, пиррольное кольцо, тиофеновое кольцо, фурановое кольцо или имидазольное кольцо; бензильную группу или кольца, возможно замещенные 1-4 заместителями, выбранными из C1-6алкильной группы, метилендиоксигруппы, атома галогена, C1-2пергалогенированной алкильной группы, C1-3галогенированной алкильной группы, гидроксильной группы, C1-4алкоксигруппы, нитро, циано, амино, C1-5моноалкиламиногруппы, C2-10диалкиламиногруппы, C1-6алкилкарбониламиногруппы, C6,10арилкарбониламиногруппы, C1-4алкилсульфонильной группы, C1-4алкилсульфонилоксигруппы или фенильной группы;
R3 представляет собой атом водорода, C1-6алкильную группу, гидроксигруппу, C1-4алкоксигруппу или атом галогена;
R4 представляет собой атом водорода, C1-6алкильную группу, гидроксигруппу, C1-4алкоксигруппу или атом галогена;
R5 представляет собой атом водорода, C1-6алкильную группу или атом галогена; при условии, что когда R3 и R4 представляют собой, каждый, атом водорода, тогда R5 не является атомом водорода;
когда m равно 0, р равно 1, 2 или 3,
когда m равно 1, р равно 0, 1 или 2,
когда m равно 2, р равно 0 или 1, и
n представляет собой 0-3.
2. Производное пиримидона или его соль, либо его сольват, или его гидрат по п.1, где R1 представляет собой незамещенное пиридиновое кольцо.
3. Производное пиримидона, которое выбрано из группы, состоящей из
9-[3-(2-фторфенил)пропил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2-оксо-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2-гидрокси-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2-оксо-2-фенилэтил)-7,7-дифтор-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2(S)-гидрокси-2-фенилэтил)-7,7-дифтор-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2-оксо-2-фенилэтил)-3-фтор-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-[2-оксо-2-(3-хлорфенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-(2(S)-гидрокси-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-[2-оксо-2-(3-фторфенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-[2-гидрокси-2-(3-хлорфенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-[2-гидрокси-2-(3-фторфенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-(2(S)-гидрокси-2-фенилэтил)-3-фтор-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-[2-оксо-2-(4-фторфенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-[2-оксо-2-(5,5,8,8-тетраметил-5,6,7,8-тетрагидронафт-2-ил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-[2-оксо-2-(3-метоксифенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-[2-оксо-2-(4-фенилфенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-[2-(1-метил-2-оксо-2-(3,4-метилендиокси-5-метоксифенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-[2-оксо-2-(4-хлорфенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-[2-оксо-2-(нафт-2-ил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-[2-оксо-2-(4-метилфенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2-оксо-2-фенилэтил)-7,7-диметил-3-бром-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-(2(S)-метокси-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-(3-фенилпропаноил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-(2-гидрокси-2-метил-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-a]пиримидин-4-она;
9-(2-метокси-2-фенил-2-трифторметилэтаноил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2-гидрокси-2,2-дифенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-(2-гидроксиимино-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2-гидрокси-2-метил-2-фенилэтил)-7,7-диметил-3-фтор-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
7,7-диметил-9-(2-фениы[1,3]диоксолан-2-илметил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2,3-дигидроксипропил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
(2(R)-метокси-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2-гидрокси-3-фениламинопропил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2-ацетиламино-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-(2-амино-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2-гидрокси-3-феноксипропил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2-оксо-2-фенилэтил)-3-фтор-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-[2-оксо-2-(3-фторфенил)этил]-3-фтор-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-(2-оксо-2-фенилэтил)-3-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2-оксо-2-фенилэтил)-3-хлор-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2-оксо-2-фенилэтил)-3-бром-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
2-(7-метил-6-оксо-8-пиридинил-3,4-дигидро-2H,6Н-пиримидо[1,2-а]пиримидин-1-ил)-N-фенилацетамида;
9-(2(S)-гидрокси-2-фенилэтил)-3-хлор-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2(S)-гидрокси-2-фенилэтил)-3-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-(2(S)-гидрокси-2-фенилэтил)-3-фтор-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2(S)-метокси-2-фенилэтил)-3-фтор-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2(R)-метокси-2-фенилэтил)-3-фтор-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-[3-(2-фторфенил)пропил]-7-гидрокси-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-[3-(2-фторфенил)пропил]-7-метокси-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
9-(2-оксо-2-фенилэтил)-7-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2-гидрокси-2-фенилэтил)-7-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2-гидрокси-2-метил-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2-гидрокси-2-метил-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-(2(R)-метокси-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-она;
3-фтор-9-[2-(4-фтор-2-метоксифенил)этил]-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-индан-2-илметил-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
3-фтор-9-[2-(4-фтор-2-метоксифенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
9-[2-(4-фтор-2-метоксифенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она;
или его соли, либо его сольвата, или его гидрата.
4. Производное пиримидона, которое выбрано из группы, состоящей из
[3-(2-фторфенил)пропил]-2,2-диметил-7-(пиридин-4-ил)-2,3-дигидро-1Н-имидазо[1,2-а]пиримидин-5-она;
[2-оксо-2-фенилэтил]-2,2-диметил-7-(пиридин-4-ил)-2,3-дигидро-1Н-имидазо[1,2-а]пиримидин-5-она;
[2-гидрокси-2-фенилэтил]-2,2-диметил-7-(пиридин-4-ил)-2,3-дигидро-1Н-имидазо[1,2-а]пиримидин-5-она;
[2-оксо-2-(4-хлорфенил)этил]-2,2-диметил-7-(пиридин-4-ил)-2,3-дигидро-1Н-имидазо[1,2-а]пиримидин-5-она;
[2-оксо-2-(4-метилфенил)этил]-2,2-диметил-7-(пиридин-4-ил)-2,3-дигидро-1Н-имидазо[1,2-а]пиримидин-5-она;
[2-оксо-4-фенилфенил]-2,2-диметил-7-(пиридин-4-ил)-2,3-дигидро-1Н-имидазо[1,2-а]пиримидин-5-она;
[1-метил-2-оксо-2-(3,4-метилендиокси-5-метоксифенил)этил]-2,2-диметил-7-(пиридин-4-ил)-2,3-дигидро-1Н-имидазо[1,2-а]пиримидин-5-она;
[2-оксо-2-(нафт-2-ил)этил]-2,2-диметил-7-(пиридин-4-ил)-2,3-дигидро-1Н-имидазо[1,2-а]пиримидин-5-она;
[2-оксо-2-(4-фторфенил)этил]-2,2-диметил-7-(пиридин-4-ил)-2,3-дигидро-1Н-имидазо[1,2-а]пиримидин-5-она;
[2-оксо-2-(3-метоксифенил)-этил]-2,2-диметил-7-(пиридин-4-ил)-2,3-дигидро-1Н-имидазо[1,2-а]пиримидин-5-она;
[2-оксо-2-(5,5,8,8-тетраметил-5,6,7,8-тетрагидронафт-2-ил)этил]-2,2-диметил-7-(пиридин-4-ил)-2,3-дигидро-1Н-имидазо[1,2-а]пиримидин-5-она;
или его соли, либо его сольвата, или его гидрата.
5. Производное пиримидона, которое выбрано из группы, состоящей из
9-[2-(4-фтор-2-метоксифенил)этил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(4-фтор-2-метоксифенил)этил]-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(4-фторфенил)этил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
8-метил-9-(2-оксо-2-фенилэтил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(2,5-диметоксифенил)этил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(2-метоксифенил)этил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2(S)-гидрокси-2-фенилэтил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2(S)-гидрокси-2-фенилэтил]-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
8-метил-9-[нафталин-1-илметил]-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
8,8-диметил-9-[2-оксо-2-фенилэтил]-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
8-метил-9-[нафталин-2-илметил]-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(3-метоксифенил)-2-оксоэтил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(3-хлорфенил)-2-оксоэтил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
8,8-диметил-9-[2(S)-фенилпропил]-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
8,8-диметил-9-[2(R)-фенилпропил]-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
8-этил-9-[2-оксо-2-фенилэтил]-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
8-этил-9-[2(S)-гидрокси-2-фенилэтил]-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
3-фтор-8-метил-9-(2-оксо-2-фенилэтил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
8,8-диметил-9-[нафталин-1-илметил]-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(4-фторфенил)-2(S)-гидроксиэтил]-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(3-фторфенил)-2-гидроксиэтил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(3,5-дихлорфенил)-2-гидроксиэтил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-бензо[1,3]диоксол-5-ил-2-оксоэтил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(3-бромфенил)-2(S)-гидроксиэтил]-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(2,3-дигидробензо[1,4]диоксин-6-ил)-2-оксоэтил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
3-фтор-9-(2-(S)-гидрокси-2-фенилэтил)-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-(2-бифенил-4-ил-2(S)-гидроксиэтил)-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(3-фторфенил)-2(S)-гидроксиэтил]-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-(2(S)-гидрокси-2-нафталин-2-илэтил)-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-юэр;
9-[2-(4-хлорфенил)-2(S)-гидроксиэтил]-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(3,4-дихлорфенил)-2(S)-гидроксиэтил]-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-(2(S)-гидрокси-2-паратолилэтил)-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
3-бром-8-метил-9-(2-оксо-2-фенилэтил)-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2(S)-гидрокси-2-(3-метоксифенил)этил]-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(2,4-дихлорфенил)-2(S)-гидроксиэтил]-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
3-фтор-9-(2(S)-гидрокси-2-фенилэтил)-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(3-метоксифенил)-2-оксоэтил]-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2(S)-гидрокси-2-фенилэтил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она (диастереоизомер I);
9-[2(S)-гидрокси-2-фенилэтил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она (диастереоизомер II);
8,8-диметил-9-(2-оксо-2-паратолилэтил)этил)-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(3-бромфенил)-2-оксоэтил]-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
4-[2-(2,2-диметил-6-оксо-8-пиридин-4-ил-3,4-дигидро-2Н,6Н-пиримидо[1,2-а]пиримидин-1-ил)-1-гидроксиэтил]бензонитрила;
9-[2-(3-фторфенил)-2-оксоэтил]-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(3,4-дихлорфенил)-2-гидроксиэтил]-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(4-хлopфенил)-2-гидроксиэтил]-8-этил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(3-бромфенил)-2-оксоэтил]-8-этил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
9-[2-(4-хлорфенил)-2-оксоэтил]-8-этил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она;
8-этил-9-(2-гидрокси-2-паратолилэтил)-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
или его соли, либо его сольвата, или его гидрата.
6. Лекарство, содержащее в качестве активного ингредиента вещество, выбранное из группы, состоящей из производного пиримидона, представленного формулой (I), или его солей, либо его сольвата, или его гидрата по пп.1-5.
7. Ингибитор GSK3b или GSK3b и cdk5/p25 активности, выбранный из группы производного пиримидона, представленного формулой (I), или его солей, либо его сольвата, или его гидрата по пп.1-5.
8. Применение соединения по пп.1-5 для изготовления лекарства для профилактического и/или терапевтического лечения заболевания, вызванного ненормальной GSK3b или GSK3b и cdk5/p25 активностью.
9. Применение соединения по пп.1-5 для изготовления лекарства для профилактического и/или терапевтического лечения нейродегенеративного заболевания.
10. Применение соединения по п.9, где нейродегенеративное заболевание выбрано из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, таупатий, сосудистых деменций; острого инсульта, травматических повреждений; цереброваскулярных травм, травмы головного мозга, травмы спинного мозга; периферических невропатий; бокового амиотрофического склероза; ретинопатии или глаукомы.
11. Применение соединения по пп.1-5 для изготовления лекарства для профилактического и/или терапевтического лечения инсулиннезависимого диабета; ожирения; маниакально-депрессивного расстройства; шизофрении; алопеции; прекращения курения; эпилепсии или видов рака.
12. Применение по п.11, где рак представляет собой рак молочной железы, немелкоклеточный рак легких, рак щитовидной железы, Т- или В-клеточную лейкемию или опухоль, индуцированную вирусом.
Текст
006859 Область изобретения Настоящее изобретение относится к соединениям, которые пригодны в качестве активного ингредиента лекарства для профилактического и/или терапевтического лечения нейродегенеративных заболеваний, вызываемых ненормальными активностями GSK3 самой по себе или объединенными действиями GSK3 и cdk5/p25. Предшествующий уровень техникиGSK3 (киназа-3 гликогенсинтазы) представляет собой пролин-направленную серин-треонин киназу, которая играет важную роль в регуляции метаболизма, дифференцировки и выживания. Первоначально она была определена как фермент, способный фосфорилировать и, следовательно, ингибировать гликогенсинтазу. Позже открыли, что GSK3 идентична тау-протеинкиназе 1 (ТРK1), ферменту, который фосфорилирует тау-протеин в эпитопах, которые, как обнаружено, также являются гиперфосфорилированными при болезни Альцгеймера и при некоторых таупатиях. Интересно, что фосфорилирование GSK3 при помощи протеинкиназы В (АКТ) приводит к потере ее киназной активности, и было высказано предположение, что это ингибирование может являться промежуточным звеном некоторых действий нейротропных факторов. Кроме того, фосфорилирование при помощи GSK3 -катенина, белка, вовлеченного в выживание клеток, ведет к его расщеплению зависимым от убиквитинилирования протеасомным путем. Таким образом, оказывается, что ингибирование GSK3 активности может привести к нейротропному действию. Действительно, существует доказательство того, что литий, неконкурентный ингибиторGSK3, усиливает нейритогенез в некоторых моделях и также увеличивает выживание нейронов через индукцию факторов выживания, таких как Bcl-2, и ингибирование экспрессии проапоптозных факторов,таких как Р 53 и Вах. В недавних исследованиях было показано, что -амилоид увеличивает активность GSK3 и фосфорилирование тау-протеина. Кроме того, это гиперфосфорилирование, а также нейротоксические действия-амилоида блокируются хлоридом лития и антисмысловой mRNA (матричной рибонуклеиновой кислотой) GSK3. Эти наблюдения позволяют уверенно предположить, что GSK3 может являться связью между двумя основными патологическими процессами болезни Альцгеймера: ненормальным процессингом АРР (предшественника амилоидного белка) и гиперфосфорилированием тау-протеина. Хотя тау-гиперфосфорилирование приводит к дестабилизации цитоскелета нейронов, патологические следствия ненормальной GSK3 активности имеют место, вероятнее всего, не только благодаря патологическому фосфорилированию тау-протеина, так как, как указано выше, излишняя активность этой киназы может влиять на выживание через модуляцию экспрессии апоптозных и антиапоптозных факторов. Кроме того, было показано, что -амилоид-индуцированное увеличение GSK3 активности ведет к фосфорилированию и, следовательно, ингибированию пируватдегидрогеназы, основного фермента в производстве энергии и синтезе ацетилхолина.cdk5(циклин-зависимая киназа)/р 25, также известная как тау-протеинкиназа 2 (ТРK2) представляет собой пролин-направленную Ser/Thr киназу, необходимую для развития центральной нервной системы и,в частности, для нейрональной миграции и роста нейритов. Cdk5 представляет собой гомолог циклинзависимых киназ и экспрессируется повсеместно. Ее активатор р 35 (305 аа белок) или усеченная форма р 25 (208 аа с отсутствием N-концевого богатого пролином домена, не требующегося для активности) селективно экспрессируются в нейронах, ограничивая cdk5 киназную активность по существу CNS (центральной нервной системой). Cdk5 полностью инактивирована в отсутствии р 35 или р 25. Терминcdk5/p25 используют в описании для активного фермента, так как есть доказательство, которое позволяет предположить, что р 25 и в меньшей степени р 35 могут быть вовлечены в патологические процессы. Физиологические субстраты cdk5/p25 включают в себя DARPP-32 (дофамин- и цАМФрегулируемый фосфопротеин 32), Munc-18, PAK1 (р 21-активируемую киназу), синапсин 1 и возможно некоторые другие. Кроме того, теперь установлено, что cdk5/p25 фосфорилирует тау-протеиновые эпитопы, которые гиперфосфорилированы при болезни Альцгеймера. Совсем недавно в мозге пациентов с болезнью Альцгеймера была обнаружена увеличенная активность cdk5/p25, неправильная локализацияcdk5 и увеличение р 25 активатора. Интересно, что предварительное фосфорилирование тау-протеина при помощи cdk5/p25 значительно усиливает тау-фосфорилирование при помощи GSK3 на других эпитопах, где также обнаружено гиперфосфорилирование при болезни Альцгеймера. Кроме того, нейрофибриллярные клубки, признак болезни Альцгеймера, помечены антисывороткой к GSK3 и cdk5, а не кGSK3 и MAP (митогенактивируемая протеинкиназа) киназе, также GSK3 и cdk5 связаны с микротрубочками и обе, больше чем РКА (протеинкиназа А) и СK (креатинкиназа), вносят вклад в AD(болезнь Альцгеймера)-подобное фосфорилирование тау-протеина. Эти результаты, взятые вместе, позволяют предположить, что смешанные ингибиторы GSK3 и cdk5 должны быть эффективными для защиты таупротеина от гиперфосфорилирования. Следовательно, они должны быть полезными при лечении любого патологического нарушения, связанного с ненормальным фосфорилированием тау-протеина, в частности болезни Альцгеймера, а также других таупатий (например лобно-височно-теменной деменции, кортикобазальной дегенерации, болезни Пика, прогрессирующего супрануклеарного паралича).Cdk5/p25 связана с апоптозом и нейродегенерацией в более широком понимании. Ее сверхэкспрессия вызывает апоптоз в культивируемых нейронах, в ткани мозга апоптические клетки проявляют сильную иммунореактивность к cdk5. Нейротоксические агенты, включая А(1-42), повреждение нейронов,ишемия или удаление факторов роста ведут к активации и неправильной локализации cdk5/p25, ненормальному фосфорилированию cdk5 субстратов, разрушению цитоскелета и клеточной смерти. Кроме того, фосфорилирование при помощи cdk5/p25 превращает DARPP-32 в ингибитор протеинкиназы А,уменьшая передачу сигнала в стриатум с очевидными осложнениями болезни Паркинсона. Также предполагается, что роль cdk5 в ALS (боковой амиотрофический склероз) основана на ее способности фосфорилировать нейрофиламенты. Совсем недавно в мышиной модели бокового амиотрофического склероза было обнаружено прекращение регулирования cdk5. Все вместе, эти экспериментальные наблюдения указывают на то, что GSK3 ингибиторы могут найти применение при лечении нейропатологических последствий и дефицита внимания и познавательных способностей, связанных с болезнью Альцгеймера, а также других острых и хронических нейродегенеративных заболеваний. Они включают в себя, без ограничения, болезнь Паркинсона, таупатии (например, лобно-височно-теменную деменцию, кортикобазальную дегенерацию, болезнь Пика, прогрессирующий супрануклеарный паралич) и другие виды деменции, включая мультиинфарктную деменцию; острый инсульт и другие травматические повреждения; цереброваскулярные повреждения (например,возрастную дистрофию желтого пятна); травмы головного и спинного мозга; периферические невропатии; ретинопатии и глаукому. Кроме того, ингибирование GSK3 может найти применение при лечении других заболеваний, таких как инсулиннезависимый диабет (например, диабет II типа) и ожирение; маниакально-депрессивное расстройство; шизофрения; алопеция; виды рака, такие как рак молочной железы, немелкоклеточный рак легких, рак щитовидной железы, Т- или В-клеточная лейкемия и некоторые вызванные вирусом опухоли. Так как представляется, что обе GSK3 и cdk5/p25 играют главную роль в индукции апоптоза в нейрональных клетках, совместное ингибирование этих двух ферментов может найти применение при лечении не только болезни Альцгеймера и других указанных выше таупатии, но также ряда других нейродегенеративных заболеваний, в частности болезни Паркинсона и бокового амиотрофического склероза; других деменций, включая мультиинфарктную деменцию, острый инсульт и другие травматические повреждения; цереброваскулярные повреждения (например, возрастную дистрофию желтого пятна); травмы головного и спинного мозга; периферические невропатии; ретинопатии и глаукому. Кроме того,смешанные ТРK1/ТРK2 ингибиторы могут найти применение при лечении других заболеваний, таких как: прекращение курения и другие синдромы отмены, эпилепсия. Описание сущности изобретения Цель данного изобретения состоит в том, чтобы предложить соединения, пригодные в качестве активного ингредиента лекарства для профилактического и/или терапевтического лечения заболевания,вызванного ненормальной активностью GSK3 или GSK3 и cdk5/p25, более конкретно нейродегенеративных заболеваний. Более конкретно, целью является предложить новые соединения, пригодные в качестве активного ингредиента лекарства, которое дает возможность профилактики и/или лечения нейродегенеративного заболевания, такого как болезнь Альцгеймера. Таким образом, авторы данного изобретения обнаружили соединения, обладающие ингибирующей активностью в отношении GSK3. В результате они обнаружили, что соединения, представленные следующей формулой (I), обладали требуемой активностью и были пригодны в качестве активного ингредиента лекарства для профилактического и/или терапевтического лечения указанных выше заболеваний. Таким образом, в настоящем изобретении предложены производные пиримидона, представленные формулой (I), или его соли, его сольваты или его гидраты,гдеX представляет собой два атома водорода, атом серы, атом кислорода или C1-2 алкильную группу и атом водорода;Y представляет собой связь, этениленовую группу, этиниленовую группу, атом кислорода, атом серы, сульфонильную группу, сульфоксидную группу, карбонильную группу, гидроксииминометиленовую группу, диоксолановую группу, атом азота, возможно замещенный C1-6 алкильной группой, фенильной группой или бензильной группой; или метиленовую группу, возможно замещенную одной или двумя группами, выбранными из C1-6 алкильной группы, бензильной группы, гидроксильной группы, С 1-4-2 006859 алкоксигруппы, C1-2 пергалогенированной алкильной группы, аминогруппы, ацетиламиногруппы или фенильной группы;R1 представляет собой 2-, 3- или 4-пиридиновое кольцо, возможно замещенное C3-6 циклоалкильной группой, C1-4 алкильной группой, C1-4 алкоксигруппой, бензильной группой или атомом галогена; когда Y представляет собой связь, возможно замещенную метиленовую группу, гидроксииминометиленовую группу, диоксолановую группу или карбонильную группу, тогда R2 представляет собой C1-6 алкильную группу, возможно замещенную гидроксигруппой, С 6,10 арилокси или С 6-10 ариламиногруппой;C3-6 циклоалкильную группу, C1-4 алкилтиогруппу, C1-4 алкоксигруппу, C1-2 пергалогенированную алкильную группу, C1-3 галогенированную алкильную группу, фенилтиогруппу, бензильную группу, бензольное кольцо, индановое кольцо, 5,6,7,8-тетрагидронафталиновое кольцо, нафталиновое кольцо, пиридиновое кольцо, пиррольное кольцо, тиофеновое кольцо, фурановое кольцо или имидазольное кольцо; бензильную группу или кольца, возможно замещенные 1-4 заместителями, выбранными из C1-6 алкильной группы, метилендиоксигруппы, атома галогена, С 1-2 гипергалогенированной алкильной группы, C1-3 галогенированной алкильной группы, гидроксильной группы, C1-4 алкоксигруппы, нитро, циано, амино,C1-5 моноалкиламиногруппы, C2-10 диалкиламиногруппы, C1-6 алкилкарбониламиногруппы, C6,10 арилкарбониламиногруппы, C1-4 алкилсульфонильной группы, C1-4 алкилсульфонилоксигруппы или фенильной группы; когда Y представляет собой этениленовую группу, этиниленовую группу, атом кислорода, атом серы, сульфонильную группу, сульфоксидную группу или возможно замещенный атом азота, тогда R2 представляет собой C1-6 алкильную группу, возможно замещенную гидроксигруппой, C6,10 арилокси илиC6,10 ариламиногруппой; C3-6 циклоалкильную группу, C1-2 пергалогенированную алкильную группу, C1-3 галогенированную алкильную группу, бензильную группу, бензольное кольцо, индановое кольцо,5,6,7,8-тетрагидронафталиновое кольцо, нафталиновое кольцо, C6,10 ариламино, пиридиновое кольцо,пиррольное кольцо, тиофеновое кольцо, фурановое кольцо или имидазольное кольцо; бензильную группу или кольца, возможно замещенные 1-4 заместителями, выбранными из C1-6 алкильной группы, метилендиоксигруппы, атома галогена, C1-2 пергалогенированной алкильной группы, C1-3 галогенированной алкильной группы, гидроксильной группы, C1-4 алкоксигруппы, нитро, циано, амино, C1-5 моноалкиламиногруппы, C2-10 диалкиламиногруппы, C1-6 алкилкарбониламиногруппы, C6,10 арилкарбониламиногруппы, C1-4 алкилсульфонильной группы, C1-4 алкилсульфонилоксигруппы или фенильной группы;R3 представляет собой атом водорода, C1-6 алкильную группу, гидроксигруппу, C1-4 алкоксигруппу или атом галогена;R4 представляет собой атом водорода, C1-6 алкильную группу, гидроксигруппу, C1-4 алкоксигруппу или атом галогена;R5 представляет собой атом водорода, C1-6 алкильную группу или атом галогена; при условии, что когда R3 и R4 каждый представляют собой атом водорода, тогда R5 не является атомом водорода; когда m равно 0, р равно 1, 2 или 3,когда m равно 1, р равно 0, 1 или 2,когда m равно 2, р равно 0 или 1, иn представляет собой 0-3. В соответствии с еще одним аспектом настоящего изобретения предложено лекарство, содержащее в качестве активного ингредиента вещество, выбранное из группы, состоящей из производных пиримидона, представленных формулой (I), и его физиологически приемлемых солей, и его сольватов и гидратов. В качестве предпочтительных воплощений лекарства предложено указанное выше лекарство, которое применяют для профилактического и/или терапевтического лечения заболеваний, вызванных ненормальной активностью GSK3 или GSK3 и cdk5/p25, и указанное выше лекарство, которое применяют для профилактического и/или терапевтического лечения нейродегенеративных заболеваний и, кроме того, других заболеваний, таких как инсулиннезависимый диабет (например диабет II типа) и ожирение; маниакально-депрессивное расстройство; шизофрения; алопеция; прекращение курения и другие синдромы отмены, эпилепсия; виды рака, такие как рак молочной железы, немелкоклеточный рак легких,рак щитовидной железы, Т- или В-клеточная лейкемия и некоторые вызванные вирусом опухоли. В качестве других предпочтительных воплощений настоящего изобретения предложено указанное выше лекарство, где заболевания представляют собой нейродегенеративные заболевания и выбраны из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, бокового амиотрофического склероза,таупатий (например лобно-височно-теменной деменции, кортикобазальной дегенерации, болезни Пика,прогрессирующего супрануклеарного паралича) и других видов деменции, включая мультиинфарктную деменцию; острый инсульт и другие травматические повреждения; цереброваскулярных повреждений(например возрастной дистрофия желтого пятна); травмы головного и спинного мозга; периферических невропатий; ретинопатии и глаукомы; и указанное выше лекарство в форме фармацевтической композиции, содержащей указанное выше вещество в качестве активного ингредиента вместе с одной или более чем одной фармацевтической добавкой.-3 006859 В настоящем изобретении, кроме того, предложен ингибитор GSK3 или GSK3 и cdk5/p25 активности, содержащий в качестве активного ингредиента вещество, выбранное из группы, состоящей из производных пиримидона формулы (I) и их солей, и их сольватов и их гидратов. В соответствии с другими аспектами данного изобретения предложен способ для профилактического и/или терапевтического лечения нейродегенеративных заболеваний, вызванных ненормальной активностью GSK3 или GSK3 и cdk5/p25, который включает в себя стадию, на которой пациенту вводят профилактически и/или терапевтически эффективное количество вещества, выбранного из группы, состоящей из производных пиримидона формулы (I) и его физиологически приемлемых солей, и их сольватов и гидратов; и применение вещества, выбранного из группы, состоящей из производных пиримидона формулы (I) и их физиологически приемлемых солей, и их сольватов и гидратов для изготовления указанного выше лекарства. При использовании здесь, C1-6 алкильная группа представляет собой прямую или разветвленную алкильную группу, имеющую от 1 до 6 атомов углерода, например метильную группу, этильную группу, нпропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, вторбутильную группу, трет-бутильную группу, н-пентильную группу, изопентильную группу, неопентильную группу, 1,1-диметилпропильную группу, н-гексильную группу, изогексильную группу и подобные;C1-4 алкоксигруппа представляет собой алкилоксигруппу, имеющую от 1 до 4 атомов углерода, например метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу и подобные; атом галогена представляет собой атом фтора, хлора, брома или йода;C1-2 пергалогенированная алкильная группа представляет собой алкильную группу, где все водороды замещены галогеном, например CF3 или C2F5;C1-6 галогенированная алкильная группа представляет собой алкильную группу, где по меньшей мере один водород не был замещен атомом галогена;C1-5 моноалкиламиногруппа представляет собой аминогруппу, замещенную одной C1-5 алкильной группой, например метиламиногруппу, этиламиногруппу, пропиламиногруппу, изопропиламиногруппу,бутиламиногруппу, изобутиламиногруппу, трет-бутиламиногруппу, пентиламиногруппу и изопентиламиногруппу;C2-10 диалкиламиногруппа представляет собой аминогруппу, замещенную двумя C1-5 алкильными группами, например диметиламиногруппу, этилметиламиногруппу, диэтиламиногруппу, метилпропиламиногруппу и дииизопропиламиногруппу;C6,10 ариламино представляет собой аминогруппу, замещенную фенильной группой или нафтильной группой;C6,10 арилоксигруппа представляет собой фенилоксигруппу и нафтилоксигруппу. Диоксолановая группа представляет собой следующую группу: Гидроксииминометиленовая группа представляет собой следующую группу: Этениленовая группа представляет собой двухвалентную группу формулы Этиниленовая группа представляет собой двухвалентную группу формулы Уходящая группа представляет собой группу, которую можно легко расщепить и заместить, такой группой может быть, например, тозил, мезил, бромид и подобные. Соединения, представленные указанной выше формулой (I), могут образовывать соль. Примеры такой соли включают в себя, когда имеется кислотная группа, соли щелочных металлов и щелочноземельных металлов, таких как литий, натрий, калий, магний и кальций; соли аммония и амины, такие как метиламин, диметиламин, триметиламин, дициклогексиламин, трис(гидроксиметил)аминометан,N,N-бис(гидроксиэтил)пиперазин, 2-амино-2-метил-1-пропанол, этаноламин, N-метилглюкамин и Lглюкамин; или соли с основными аминокислотами, такими как лизин, -гидроксилизин и аргинин. Соли-4 006859 присоединения оснований кислых соединений получают стандартными способами, хорошо известными в данной области техники. Когда присутствует основная группа, примеры включают в себя соли с минеральными кислотами,такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота; соли с органическими кислотами, такими как метансульфоновая кислота, бензолсульфоновая кислота, паратолуолсульфоновая кислота, уксусная кислота, пропионовая кислота, винная кислота, фумаровая кислота, малеиновая кислота, яблочная кислота, щавелевая кислота, янтарная кислота, лимонная кислота, бензойная кислота, миндальная кислота, коричная кислота, молочная кислота, гликолевая кислота, глюкуроновая кислота, аскорбиновая кислота, никотиновая кислота и салициловая кислота; или соли с кислыми аминокислотами, такими как аспарагиновая кислота и глутаминовая кислота. Соли присоединения солей основных соединений получают стандартными способами, хорошо известными в данной области техники, которые включают в себя, но не ограничены ими, растворение свободного основания в водном растворе спирта, содержащем подходящую кислоту, и выделение соли путем упаривания раствора, или путем взаимодействия свободного основания и кислоты в органическом растворителе, в этом случае соль отделяют непосредственно или осаждают вторым органическим растворителем, или ее можно получить путем концентрирования раствора. Кислоты, которые можно использовать для получения солей присоединения кислот, предпочтительно включают в себя такие кислоты, которые образуют при объединении со свободным основанием фармацевтически приемлемые соли,т.е. соли, анионы которых относительно безопасны для организма животного в фармацевтических дозах этих солей, таким образом, что полезные свойства, имеющиеся в свободном основании, не подвержены побочным действиям, относимым за счет анионов. Хотя предпочтительными являются медицински приемлемые соли основных соединений, все соли присоединения кислот входят в объем настоящего изобретения. Кроме производных пиримидона, представленных указанной выше формулой (I), и их солей, их сольваты и гидраты также входят в объем настоящего изобретения. Производные пиримидона, представленные указанной выше формулой (I), могут иметь один или более чем один асимметрический атом углерода. Что касается стереохимии таких асимметрических атомов углерода, они могут независимо находиться как в (R), так и в (S) конфигурации, и производное пиримидона может существовать в виде стереоизомеров, таких как оптические изомеры или диастереоизомеры. Любые стереоизомеры в чистой форме, любые смеси стереоизомеров, рацематы и подобное входят в область настоящего изобретения. Примеры предпочтительных соединений по настоящему изобретению представлены в табл. 1 и 2 ниже. Однако объем настоящего изобретения не ограничен этими соединениями. Предпочтительные соединения по настоящему изобретению, представленные формулой (I), включают в себя также(1) соединения, где R1 представляет собой 3- или 4-пиридиновое кольцо и более предпочтительно 4-пиридиновое кольцо, которое может быть замещено C1-2 алкильной группой, C1-2 алкоксигруппой или атомом галогена; и/или(2) X представляет собой два атома водорода, атом кислорода или C1-2 алкильную группу и атом водорода;(3) Y представляет собой связь, карбонильную группу, гидроксииминометильную группу, диоксолановую группу; или метиленовую группу, возможно замещенную одной или двумя группами, выбранными из C1-6 алкильной группы, бензильной группы, гидроксильной группы, C1-4 алкоксигруппы, C1-2 пергалогенированной алкильной группы, аминогруппы, ацетиламиногруппы или фенильной группы. Более предпочтительные соединения по настоящему изобретению, представленные формулой (I),включают в себя также(1) соединения, где R1 представляет собой незамещенное 4-пиридиновое кольцо. Особенно предпочтительные соединения по настоящему изобретению, представленные формулой[1,2-а]пиримидин-4-он; 38. 9-[2(S)-Гидрокси-2-фенилэтил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-он (диастереоизомер I); 39. 9-[2(S)-Гидрокси-2-фенилэтил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-он (диастереоизомер II); 40. 8,8-Диметил-9-(2-оксо-2-паратолилэтил)этил)-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2 а]пиримидин-4-он; 41. 9-[2-(3-Бромфенил)-2-оксоэтил]-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2 а]пиримидин-4-он; 42. 4-[2-(2,2-Диметил-6-оксо-8-пиридин-4-ил-3,4-дигидро-2 Н,6 Н-пиримидо[1,2-а]пиримидин-1-ил)1-гидроксиэтил]бензонитрил; 43. 9-[2-(3-Фторфенил)-2-оксоэтил]-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2 а]пиримидин-4-он; 44. 9-[2-(3,4-Дихлорфенил)-2-гидроксиэтил]-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он; 45. 9-[2-(4-Хлорфенил)-2-гидроксиэтил]-8-этил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-он; 46. 9-[2-(3-Бромфенил)-2-оксоэтил]-8-этил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он; 47. 9-[2-(4-Хлорфенил)-2-оксоэтил]-8-этил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он; 48. 8-Этил-9-(2-гидрокси-2-паратолилэтил)-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-он. В качестве дополнительного объекта настоящее изобретение касается также способов получения соединений, представленных указанной выше формулой (I). Эти соединения можно получить, например, способами, описанными ниже. Способ получения Пиримидоновые соединения, представленные указанной выше формулой (I), можно получить в соответствии со схемой 1. Схема 1(В указанной выше схеме определения R1, R2, R3, R4, R5, X, р, m и n такие, как описано ранее для соединения формулы (I. Проводят взаимодействие пиримидонового производного, представленного формулой (III) выше,где R1 такой, как определено для соединения формулы (I), с основанием, таким как гидрид натрия, карбонат натрия или карбонат калия в растворителе, таком как N,N-диметилформамид, N-метилпирролидон,N,N-диметилацетамид или хлороформ при подходящей температуре в интервале от 0 до 130 С в атмосфере обычного воздуха, затем добавляют соединение формулы (II), где R2, X, Y и n такие, как определено для соединения формулы (I), и L представляет собой уходящую группу, предпочтительно бромид или мезильную группу, с получением соединения указанной выше формулы (I). Соединения формулы (II) имеются в продаже или их можно синтезировать способами, хорошо известными специалистам в данной области техники. Соединения формулы (III) можно получить способом, описанным в схеме 2.(В указанной выше схеме определения R1, R3, R4, R5, р и m такие, как описано ранее). В соответствии с этим методом, проводят взаимодействие 3-кетоэфира формулы (IV) с соединением формулы (V). Эту реакцию можно осуществлять в присутствии карбоната калия в спиртовом растворителе, таком как метанол, этанол и подобные, или без него, при подходящей температуре в интервале от 25-140 С в атмосфере обычного воздуха. Альтернативно, соединения формулы (III), где R5 представляет собой атом водорода, можно галогенировать для того, чтобы получить соединения формулы (III), где R5 представляет собой атом галогена, такой как атом брома или атом хлора. Эту реакцию можно осуществить в кислой среде, такой как уксусная кислота или пропионовая кислота, в присутствии бромсукцинимида, или хлорсукцинимида, или брома. Кроме того, соединения формулы (III), где R5 представляет собой атом фтора, можно получить по аналогии со способом, описанным в Tetrahedron Letters, Vol. 30,45, pp. 613-616, 1989. Соединения формулы (V) или (IV) имеются в продаже или их можно синтезировать способами, хорошо известными специалистам в данной области техники. Например, соединения формулы (IV), где R1 представляет собой пиридиновое кольцо, возможно замещенное C1-4 алкильной группой, C1-4 алкоксигруппой или атомом галогена, можно получить путем взаимодействия никотиновой кислоты, возможно замещенной C1-4 алкильной группой, C1-4 алкоксигруппой или галогеном, с моноэфиром малоновой кислоты. Реакцию можно осуществлять способами, хорошо известными специалистам в данной области техники, например в присутствии связывающего агента, такого как 1,1'-карбонилбис-1 Н-имидазол, в растворителе, таком как тетрагидрофуран, при температуре в интервале от 20 до 70 С. Соединения формулы (I) также можно получить, начиная с другого соединения формулы (I), используя способы, хорошо известные специалистам в данной области техники. В указанной выше реакции, может быть иногда необходима защита и удаление защиты функциональной группы. Подходящую защитную группу Pg можно выбрать в зависимости от типа функциональной группы и можно использовать способ, описанный в литературе. Примеры защитной группы, способов защиты и удаления защиты приведены, например, в Protective groups in Organic Synthesis, Greene etal., 2nd Ed. (John WileySons, Inc., New York). Соединения по настоящему изобретению обладают ингибирующей активностью в отношенииGSK3. Соответственно, соединения по настоящему изобретению полезны в качестве активного ингредиента для изготовления лекарства, которое делает возможным профилактическое и/или терапевтическое лечение заболевания, вызываемого ненормальной активностью GSK3 или GSK3 и cdk5/p25, и в более частном случае нейродегенеративных заболеваний, таких как болезнь Альцгеймера. Кроме того, соединения по настоящему изобретению также пригодны в качестве активного ингредиента для изготовления лекарства для профилактического и/или терапевтического лечения нейродегенеративных заболеваний,таких как болезнь Паркинсона, боковой амиотрофический склероз, таупатий (например лобно-височнотеменной деменции, кортикобазальной дегенерации, болезни Пика, прогрессирующего супрануклеарного паралича), и других деменции, включая мультиинфарктную деменцию; острый инсульт и другие травматические повреждения; цереброваскулярные повреждения (например, возрастная дистрофия желтого пятна); травмы головного и спинного мозга; периферические невропатии; ретинопатии и глаукома,и другие заболевания, такие как инсулинонезависимый диабет (например диабет II типа) и ожирение; маниакально-депрессивные расстройства; шизофрения; алопеция; прекращение курения и другие синдромы отмены, эпилепсия; виды рака, такие как рак молочной железы, немелкоклеточный рак легких,рак щитовидной железы, Т- или В-клеточная лейкемия и некоторые вызванные вирусом опухоли. Настоящее изобретение, кроме того, относится к способу лечения нейродегенеративных заболеваний, вызванных ненормальной активностью GSK3 или GSK3 и cdk5/p25, и указанных выше заболеваний, при котором в организм млекопитающего, нуждающегося в этом, вводят эффективное количество соединения формулы (I). В качестве активного ингредиента лекарства по настоящему изобретению можно использовать вещество, которое выбрано из группы, состоящей из соединения, представленного приведенной выше формулой (I), и его фармакологически приемлемых солей, и его сольватов, и его гидратов. Это вещество,само по себе, можно вводить в качестве лекарства по настоящему изобретению, однако, желательно вводить это лекарство в форме фармацевтической композиции, которая содержит указанное выше вещество в качестве активного ингредиента и одно или более чем одно вспомогательное вещество. В качестве ак- 10006859 тивного ингредиента лекарства по настоящему изобретению, можно использовать в комбинации два или более чем два указанные выше соединения. Указанная выше фармацевтическая композиция может быть дополнена активным ингредиентом другого лекарства для лечения указанных выше заболеваний. Тип фармацевтической композиции не является строго ограниченным, и эта композиция может быть представлена в виде любого препарата для перорального или парентерального введения. Например, фармацевтическую композицию можно приготовить, например, в форме фармацевтических композиций для перорального введения, таких как гранулы, мелкие гранулы, порошки, твердые капсулы, мягкие капсулы, сиропы, эмульсии, суспензии, растворы и подобное, или в форме фармацевтических композиций для парентеральных введений, таких как инъекции для внутривенного, внутримышечного или подкожного введения, капельные вливания, чрескожные препараты, средства для введения через слизистую, капли в нос, средства для ингаляции, суппозитории и подобные. Инъекции или капельные вливания можно приготовить в виде порошковых препаратов, например в форме лиофильно высушенных препаратов, и их можно использовать путем растворения перед применением в подходящей водной среде, такой как физиологический солевой раствор. Препараты с замедленным высвобождением, например покрытые полимерной оболочкой, можно вводить непосредственно в мозг. Типы фармацевтических вспомогательных веществ, используемых в изготовлении фармацевтической композиции, соотношения содержания фармацевтических вспомогательных веществ относительно активного ингредиента, и способы получения фармацевтической композиции может правильно выбрать специалист в данной области техники. Неорганические или органические вещества, или твердые или жидкие вещества, можно использовать в качестве фармацевтических вспомогательных веществ. В общем случае, фармацевтические вспомогательные вещества можно вводить в соотношение от 1% по массе до 90% по массе, исходя из массы активного ингредиента. Примеры эксципиентов, используемых для получения твердых фармацевтических композиций включают в себя, например, лактозу, сахарозу, крахмал, тальк, целлюлозу, декстрин, каолин, карбонат кальция и тому подобное. Для получения жидких композиций для перорального введения можно использовать подходящий инертный разбавитель, такой как вода или растительное масло. Жидкая композиция может содержать, кроме инертного разбавителя, вспомогательные вещества, такие как увлажняющие агенты, суспендирующие средства, подсластители, ароматизирующие вещества, красители и консерванты. Жидкую композицию можно поместить в капсулы, изготовленные из рассасывающегося вещества,такого как желатин. Примеры растворителей или суспензионных сред, используемых для получения композиций для парентерального введения, например инъекций, суппозиториев, включают в себя воду,пропиленгликоль, полиэтиленгликоль, бензиловый спирт, этилолеат, лецитин и подобные. Примеры веществ для основы, используемых для суппозиториев, включают в себя, например какао-масло, эмульгированное какао-масло, лауриновый липид, витепсол. Доза и частота введения лекарства по настоящему изобретению не являются строго ограниченными, и их можно выбирать в зависимости от состояния, например задачи профилактического и/или терапевтического лечения, типа заболевания, массы тела или возраста пациента, тяжести заболевания и тому подобного. В общем случае, суточная доза для перорального введения взрослому может составлять от 0,01 до 1000 мг (масса активного ингредиента), и эту дозу можно вводить один раз в сутки или несколько раз в сутки в виде разделенных доз, или один раз в несколько дней. Когда это лекарство используют в качестве инъекции, введения можно предпочтительно осуществлять длительно или импульсно в суточной дозе от 0,001 до 100 мг (масса активного ингредиента) для взрослого. Химические примеры Настоящее изобретение далее объяснено более конкретно со ссылкой на следующие основные примеры, однако, объем настоящего изобретения не ограничивается этими примерами. Пример 1. (Соединение 8 табл. 1). 9-(2(S)-Гидрокси-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2 а]пиримидин-4-она гидрохлорида (1:1). 1.1. 7,7-Диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-он. Смесь 5,9 г (30,55 ммоль) этил-3-(пиридин-4-ил)-3-оксипропионата, 5,0 г (30,55 ммоль) 5,5 диметил-1,4,5,6-тетрагидро-2-пиримидинамина моногидрохлорида (полученного по аналогии со способом, описанным в патенте США 4262122) и 6,33 г (45,82 ммоль) карбоната калия в 60 мл этанола нагревали при температуре дефлегмации в течение 12 ч. Охлажденную суспензию фильтровали и растворитель удаляли выпариванием. Полученный остаток растворяли в дихлорметане и промывали водой. Органическую фазу сушили и упаривали с получением 6,30 г (80%) продукта в виде бежевого твердого вещества. Точка плавления: 152-154 С. 1.2. 9-(2(S)-Гидрокси-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она гидрохлорид (1:1). Суспензию 0,8 г (3,12 ммоль) 7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2 а]пиримидин-4-она в 8 мл безводного диметилформамида обрабатывали 274 мг (6,86 ммоль) гидрида натрия (60%-ная суспензия в минеральном масле), и полученную в результате смесь нагревали при 50 С- 11006859 в течение 30 мин. Добавляли 0,494 мл (3,74 ммоль) (S)-2-хлop-1-фенилэтанола и реакционную смесь нагревали при 50 С в течение 4 ч. Охлажденный раствор обрабатывали водой и экстрагировали этилацетатом. Органическую фазу сушили и упаривали с получением неочищенного продукта, который очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол в соотношениях от 98/2 до 90/10. 0,486 г чистого продукта, полученного в форме свободного основания, растворяли в горячем этаноле и обрабатывали 1 экв. хлористого водорода в изопропаноле. Охлажденный раствор фильтровали с получением 0,192 г (15%) белого твердого вещества. Точка плавления 234-236 С. []D = -22,9 (c=1, СН 3 ОН). Пример 2. (Соединение 49 табл. 1). 9-(2-Оксо-2-фенилэтил)-7-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-он. 2.1. 5-Метил-1,4,5,6-тетрагидро-2-пиримидинамина гидрохлорид. К раствору, содержащему 6,7 г (41,6 моль) 2-метил-1,3-пропандиамина гидрохлорида (Tetrahedron(1994) 50(29), 8617-8632) в 50 мл метанола, добавляли 83 мл раствора метилата натрия в метаноле (1 ммоль/мл) и полученную в результате смесь обрабатывали 3,97 г (41,6 ммоль) гуанидина гидрохлорида. Реакционную смесь нагревали при 140 С в течение 3 ч. Раствор фильтровали, растворитель выпаривали и полученный остаток использовали непосредственно на следующей стадии. 2.2. 7-Метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-он. Продукт получали по аналогии со стадией 1.1, используя промежуточное соединение со стадии 2.1. 2.3. 9-(2-Оксо-2-фенилэтил)-7-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-он. Суспензию 0,32 г (1,34 ммоль) 7-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а] пиримидин-4-она в 10 мл безводного диметилформамида обрабатывали 64 мг (1,34 ммоль) гидрида натрия (50%-ная суспензия в минеральном масле) и полученную в результате смесь перемешивали в течение 40 мин. Добавляли 0,267 г (1,34 ммоль) фенацилбромида и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Раствор обрабатывали водой и экстрагировали этилацетатом. Органическую фазу сушили и выпаривали с получением неочищенного продукта, который очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол в соотношениях от 100/0 до 90/10 с получением 0,235 г чистого продукта, полученного в форме свободного основания. Точка плавления 202-203 С. Пример 3. (Соединение 47 табл. 1). 9-[3-(2-фторфенил)пропил]-7-гидрокси-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а] пиримидин-4-он. 3.1. 7-Гидрокси-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-он. Продукт получали по аналогии со стадией 1.1, используя 2-амино-1,4,5,6-тетрагидро-5 пиримидинол (Arch. Int. Pharmacodyn. Ther. (1968), 175(1), 193-211). Точка плавления: 305-307 С. 3.2. 9-[3-(2-Фторфенил)пропил]-7-гидрокси-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2 а]пиримидин-4-он. Суспензию 1,0 г (4,09 ммоль) 7-гидрокси-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2 а]пиримидин-4-она и 0,95 г (4,09 ммоль) 1-[3-(метилсульфонилокси)пропил]-2-фторбензола в 100 мл безводного ацетонитрила обрабатывали 4,1 г (1,42 ммоль) фторида калия, осажденного на оксиде алюминия(Fluka), и полученную в результате смесь нагревали при 80 С в течение 24 ч. Охлажденный раствор фильтровали и растворитель выпаривали с получением остатка, который очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол/аммиак в соотношениях от 98/2/0,2 до 96/4/0,4. Получали 0,96 г (61%) чистого продукта в форме свободного основания. Точка плавления 205-207 С. Пример 4. (Соединение 48 табл. 1). 9-[3-(2-Фторфенил)пропил]-7-метокси-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а] пиримидин-4-она оксалат (1:1). 4.1. 9-[3-(2-Фторфенил)пропил]-7-метокси-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2 а]пиримидин-4-она оксалат (1:1). К суспензии, содержащей 0,12 г (0,31 ммоль) 9-[3-(2-фторфенил)пропил]-7-гидрокси-2-(пиридин-4 ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-она в 3 мл диметилформамида, добавляли 14 мг(0,34 ммоль) суспензии гидрида натрия в минеральном масле (60%) и полученную в результате смесь перемешивали при комнатной температуре в течение 15 мин. Смесь охлаждали до -20 С и обрабатывали 19,6 мкл (0,31 ммоль) йодметана. Перемешивание продолжали в течение 1 ч. Добавляли воду и органическую фазу отделяли. Растворитель выпаривали с получением остатка, который очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол/аммиак в соотношении 98/2/0,2. Получали 0,1 г (85%) чистого продукта и его превращали в монооксалатную соль путем обработки одним эквивалентом щавелевой кислоты 0,085 (65%). Точка плавления 164-166 С.- 12006859 Пример 5. (Соединение 4 табл. 1). 9-(2-Оксо-2-фенилэтил)-7,7-дифтор-2-(пиримидин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а] пиримидин-4-он. 5.1. 5,5-Дифтор-1,4,5,6-тетрагидро-2-пиримидинамин. Продукт получали по аналогии со способом, описанным на стадии 2.1, и используя 2,2-дифтор-1,3 пропандиамин (Tetrahedron (1994) 50(29), 8617-8632), и его использовали как таковой на следующей стадии. 5.2. 7,7-Дифтор-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-он. Продукт получали по аналогии со стадией 1.1 и используя промежуточное соединение со стадии 5.2. Точка плавления: 239-240 С. 5.3. 9-(2-Оксо-2-фенилэтил)-7,7-дифтор-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а] пиримидин-4-он. По аналогии со способом, описанным на стадии 2.3, получали это соединение в виде свободного основания. Точка плавления: 217-219 С. Пример 6. (Соединение 6 табл. 1). 9-(2-Оксо-2-фенилэтил)-3-фтор-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2 а]пиримидин-4-она гидрохлорид (1:1). 6.1. Этил-2-фтор-3-оксо-3-пиридин-4-ил-пропаноата гидрохлорид (Tetrahedron Letters, Vol. 30,45, pp. 6113-6116, 1989). К раствору 134,88 мл (0,54 моль) три-н-бутилфосфина в 500 мл безводного тетрагидрофурана в атмосфере аргона добавляли 63,8 мл (0,54 моль) этилбромфторацетата и полученную в результате смесь перемешивали при комнатной температуре в течение 40 ч. Реакционную смесь охлаждали до -78 С и по каплям добавляли 237,58 мл (0,594 моль) нбутиллития (2,5 М в гексане) и оставляли перемешиваться в течение 1 ч. Добавляли 76,44 г (0,54 моль) изоникотиноилхлорида (Heterocyclic Chemistry, 18, 519, 1981) и смесь оставляли перемешиваться в течение 1 ч. Температуру оставляли подниматься до комнатной температуры в течение ночи и при 0 С добавляли 700 мл 5%-ного водного раствора бикарбоната натрия и полученную в результате смесь оставляли перемешиваться в течение ночи. Тетрагидрофуран выпаривали при пониженном давлении и полученную в результате водную фазу экстрагировали дихлорметаном, промывали рассолом и сушили над безводным сульфатом натрия, и выпаривали с получением темно-коричневого остатка. После флэш-хроматографии на силикагеле (элюент смесь циклогексан/этилацетат от 90/10 до 50/50). Продукт обрабатывали раствором соляной кислоты в изопропаноле (6 н.) с получением 20 г (17%) продукта. Точка плавления 142144 С. 6.2. 7,7-Диметил-3-фтор-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-он. Смесь 5,0 г (20,19 ммоль) этилпиридин-4-ил-3-оксо-2-фторпропаноата гидрохлорида, 3,30 г (20,19 ммоль) 5,5-диметил-1,4,5,6-тетрагидро-2-пиримидинамина гидрохлорида (полученного по аналогии со способом, описанным в патенте США 4262122) и 8,37 г (60,57 ммоль) карбоната калия в 30 мл этанола нагревали при температуре дефлегмации в течение 18 ч. Охлажденную суспензию фильтровали и растворитель удаляли выпариванием. Полученный остаток обрабатывали дихлорметаном и промывали водой. Органическую фазу сушили и упаривали с получением 1,9 г (34%) продукта в виде бежевого твердого вещества. Точка плавления: 190-192 С. 6.3. 9-(2-Оксо-2-фенилэтил)-3-фтор-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она гидрохлорид (1:1). Суспензию 0,30 г (1,09 ммоль) 7,7-диметил-3-фтор-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Hпиримидо[1,2-а]пиримидин-4-она в 6 мл безводного диметилформамида обрабатывали 53 мг(1,31 ммоль) гидрида натрия (60%-ная суспензия в минеральном масле) и полученную в результате смесь перемешивали в течение 10 мин. Добавляли 0,261 г (1,31 ммоль) фенацилбромида и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Раствор обрабатывали водой и экстрагировали этилацетатом. Органическую фазу сушили и упаривали с получением неочищенного продукта, который очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол в соотношениях от 98/2 до 90/10 с получением 0,10 г чистого продукта,полученного в форме свободного основания, которое превращали в гидрохлоридную соль. Точка плавления 236-238 С. Пример 7. (Соединение 21 в табл. 1). 9-(2-Оксо-2-фенилэтил)-7,7-диметил-3-бром-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2 а]пиримидин-4-он. 7.1. 3-Бром-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она гидробромид (1:1). К раствору 3,0 г (11,7 ммоль) 7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2 а]пиримидин-4-она в 75 мл уксусной кислоты по каплям добавляли 0,6 мл (11,7 ммоль) брома. Смесь оставляли перемешиваться при комнатной температуре в течение 2 ч.- 13006859 Осажденное твердое вещество выделяли фильтрацией, промывали эфиром и сушили с получением 4,53 г (935) продукта в виде желтого твердого вещества. Точка плавления 270-272 С. 9-(2-Оксо-2-фенилэтил)-7,7-диметил-3-бром-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2 а]пиримидин-4-он. Раствор, содержащий 4,15 г (10,43 моль) 3-бром-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро 4 Н-пиримидо[1,2-а]пиримидин-4-она гидробромида в воде, обрабатывали избытком водного раствора гидроксида натрия. Свободное основание экстрагировали дихлорметаном и органические вещества сушили и выпаривали. Остаток растворяли в 25 мл безводного диметилформамида и 0,542 г (13,56 ммоль) гидрида натрия (60%-ная суспензия в минеральном масле) и полученную в результате смесь перемешивали в течение 40 мин. Добавляли 2,43 г (12,49 ммоль) фенацилбромида и реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Раствор обрабатывали водой при 0 С и осадок, который образовывался, выделяли фильтрацией и сушили, 3,5 г (74%). Точка плавления: 223-225 С. Пример 8. (Соединение 38 в табл. 1). 9-(2-Оксо-2-фенилэтил)-3-метил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-он. 8.1. 3-Метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-он. Смесь 14,0 г (67,56 ммоль) этил-2-метил-3-(пиридин-4-ил)-3-оксопропионата (полученного по аналогии со способом, описанным в патенте Франции FR 2529786), 9,16 г (67,66 ммоль) 1,4,5,6-тетрагидро 2-пиримидинамина моногидрохлорида (полученного в соответствии с J. Org. Chem., 1955, 20, 829) и 9,33 г (67,66 ммоль) карбоната калия в 300 мл этанола нагревали при температуре дефлегмации в течение 12 ч. Охлажденную суспензию фильтровали и растворитель удаляли выпариванием. Полученный остаток обрабатывали водой и осадок фильтровали и сушили. Таким образом получали осадок в виде коричневого твердого вещества. 10,5 г (64%). Точка плавления: 242-243 С. 8.2. 9-(2-Оксо-2-фенилэтил)-3-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-он. Суспензию 0,25 г (1,03 ммоль) 3-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2 а]пиримидин-4-она в 4 мл безводного диметилформамида обрабатывали 45 мг (1,03 ммоль) гидрида натрия (50%-ная суспензия в минеральном масле) и полученную в результате смесь перемешивали в течение 1 ч. Добавляли 0,205 г (1,03 ммоль) фенацилбромида и реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Раствор обрабатывали водой и экстрагировали этилацетатом. Органическую фазу сушили и выпаривали с получением неочищенного продукта, который очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол/аммиак в соотношениях от 98/2/0,2 с получением 0,10 г (27%) чистого продукта, полученного в форме свободного основания. Точка плавления 190-192 С. Пример 9. (Соединение 2 в табл. 1). 9-(2-Оксо-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а] пиримидин-4-она гидрохлорид (1:1). Продукт получали, используя способ, описанный на стадии 2.3, используя 7,7-диметил-2-(пиридин 4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-он. Точка плавления: 283-285 С. Пример 10. (Соединение 3 в табл. 1). 9-(2-Гидрокси-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а] пиримидин-4-он. К раствору 2,0 г (5,34 ммоль) 9-(2-оксо-2-фенилэтил)7,7-диметил-2-пиридин-4-ил-6,7,8,9 тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она, полученного на стадии 9, в 100 мл метанола при 0 С добавляли 0,24 г (6,41 ммоль) боргидрида натрия. Перемешивание поддерживали в течение 30 мин и растворитель удаляли выпариванием. Добавляли воду и полученную в результате смесь экстрагировали дихлорметаном. Органические экстракты сушили и выпаривали и остаток растирали с этилацетатом с получением 1,66 г (83%) продукта. Охарактеризовывали 2-бут-2-эндиоатную соль продукта. Точка плавления 195-197 С. Пример 11. (Соединение 34 в табл. 1). 9-(2-Амино-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а] пиримидин-4-она гидрохлорид (1:1). 11.1. 2-[2-(3,3-Диметил-6-оксо-8-(пиридин-4-ил)-3,4-дигидро-2 Н,6 Н-пиримидо[1,2-а]пиримидин-1 ил)-1-фенилэтил]изоиндол-1,3-дион. К раствору 0,2 г (0,531 ммоль) 9-(2-гидрокси-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9 тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она, 0,080 г (0,584 моль) фталимида и 0,195 г (0,742 ммоль) в 30 мл безводного тетрагидрофурана при 0 С добавляли 0,142 мл (0,903 ммоль) диэтилизодикарбоксилата и реакционную смесь перемешивали в течение 18 ч. Растворитель выпаривали и остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол/диэтиламин в соотношениях 98/2/0,2 с получением 0,06 г (22%) продукта.- 14006859 11.2. 9-(2-Амино-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2 а]пиримидин-4-она гидрохлорид (1:1). Раствор 0,470 г (0,929 ммоль) 2-[2-(3,3-диметил-6-оксо-8-(пиридин-4-ил)-3,4-дигидро-2 Н,6 Нпиримидо[1,2-а]пиримидин-1-ил)-1-фенилэтил]изоиндол-1,3-диона в 50 мл этанола, содержащего 0,452 мл (9,29 ммоль) гидразина гидрата нагревали при температуре дефлегмации в течение 18 ч. Охлажденный раствор фильтровали и растворитель удаляли выпариванием. Остаток очищали хроматографией на силикагеле, элюируя смесью этилацетат/метанол/диэтиламин в соотношениях от 95/5/0,5 до 94/6/0,6. Выделенное свободное основание превращали в солянокислую соль с получением 0,283 г[3-(2-Фторфенил)пропил]-2,2-диметил-7-(пиридин-4-ил)-2,3-дигидро-1 Н-имидазо[1,2-а]пиримидин 5-она гидрохлорид (1:2). 12.1. 5,5-Диметил-4,5-дигидро-1 Н-имидазол-2-иламина гидробромид (1:1). К раствору 15 г (0,17 моль) 1,2-диамино-2-метилпропана в 150 мл воды при 0 С по частям добавляли 18 г (0,17 г моль) цианбромида и температуре позволяли нагреться до комнатной в течение 4 ч. Воду удаляли выпариванием и этанол добавляли и выпаривали. После растирания в смеси диэтилового эфира и этанола получали 29,5 г (89%) продукта в виде аморфного гигроскопического твердого вещества. 12.2. 2,2-Диметил-7-(пиридин-4-ил)-2,3-дигидро-1 Н-имидазо[1,2-а]пиримидин-5-он. Суспензию 4,5 г (23,2 ммоль) 5,5-диметил-4,5-дигидро-1 Н-имидазол-2-иламина гидробромида, 2,99 г (15,46 ммоль) этил-3-(пиридин-4-ил)-3-оксопропионата и 4,27 г (30,89 ммоль) карбоната калия в 100 мл этанола нагревали при температуре дефлегмации в течение 18 ч. Охлажденную суспензию фильтровали и растворители выпаривали. Полученный остаток растворяли в дихлорметане и промывали водой. Растворитель выпаривали с получением 2,5 г (67%) чистого продукта. Точка плавления 226-228 С. 12.3. [3-(2-Фторфенил)пропил]-2,2-диметил-7-(пиридин-4-ил)-2,3-дигидро-1 Н-имидазо[1,2-а]пиримидин-5-она гидрохлорид (1:2). Суспензию 0,3 г (1,23 ммоль) 2,2-диметил-7-(пиридин-4-ил)-дигидро-1 Н-имидазо[1,2-а]пиримидин 5-она в 6 мл безводного диметилформамида обрабатывали 64 мг (1,6 ммоль) гидрида натрия (60%-ная суспензия в минеральном масле). Смесь нагревали при 60 С в течение 10 мин и затем добавляли 0,322 г(1,48 ммоль) 3-(2-фторфенил)пропилбромида и смесь нагревали при 120 С в течение 1 ч. Охлажденную суспензию обрабатывали водой и экстрагировали этилацетатом. Растворитель выпаривали с получением остатка, который очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол в соотношениях от 98/2 до 95/5 с получением 0,248 г (55%) чистого продукта в форме свободного основания, которое превращали в гидрохлоридную соль. Точка плавления 140-142 С. Пример 13. (Соединение 1 в табл. 3). 9-[2-(4-Фтор-2-метоксифенил)этил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-он. 13.1. 8-Метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Смесь 6 г (31,0 ммоль) этил-3-(пиридин-4-ил)-3-оксопропионата, 4,6 г (31,0 ммоль) 6-метил-1,4,5,6 тетрагидропиримидин-2-иламина гидрохлорида (полученного в соотвествии с J. Org, Chem., 20, 1955,829-838) и 6,44 г (46,0 ммоль) карбоната калия в 50 мл этанола нагревали при температуре дефлегмации в течение 18 ч. Реакционную смесь охлаждали и растворитель удаляли выпариванием. Полученный остаток обрабатывали водой и осадок отделяли фильтрацией с получением 3,85 г (51%) продукта. Точка плавления 245-247 С. 13.2. (4-Фтор-2-метоксифенил)уксусной кислоты метиловый эфир. К суспензии 14,34 г (32,47 ммоль) ацетата свинца (IV) в 100 мл безводного толуола добавляли смесь 5,2 г (30,92 ммоль) 1-(4-фтор-2-метоксифенил)этанола и 15,02 мл (123,13 ммоль) эфирата трифторида бора в 9 мл метанола. Реакционную смесь затем перемешивали при комнатной температуре в течение 16 ч. К охлажденной смеси добавляли воду и полученный в результате раствор экстрагировали толуолом. Экстрагировали промывали насыщенным раствором гидрокарбоната натрия, насыщенным раствором хлорида натрия и сушили сульфатом натрия. Растворитель выпаривали до сухости с получением 6 г продукта в виде масла, которое использовали на следующей стадии без дальнейшей очистки. 13.3. (4-Фтор-2-метоксифенил)этанол. К суспензии 1,72 г (45,41 ммоль) литийалюминийгидрида в 120 мл тетрагидрофурана при 0 С по каплям добавляли 6 г (30,27 ммоль) растворенного в 120 мл (4-фтор-2-метоксифенил)уксусной кислоты метилового эфира и полученную в результате смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь разбавляли 100 мл диэтилового эфира при 0 С и обрабатывали избытком насыщенного водного раствора сульфата натрия. Добавляли дополнительно твердый сульфат натрия и органическую фазу фильтровали для удаления солей. Растворитель выпаривали досуха с получением 5,1 г- 15006859 13.4. Метансульфоновой кислоты 2-(4-фтор-2-метоксифенил)этиловый эфир. К раствору 5,1 г (29,97 ммоль) 2-(4-фтор-2-метоксифенил)этанола в 30 мл безводного дихлорметана добавляли при 0 С 6,26 мл (44,95 ммоль) триэтиламина и 3,5 мл (44,95 ммоль) метансульфонилхлорида. Полученную в результате смесь перемешивали при 0 С в течение 1 ч. Смесь затем разбавляли водой и дихлорметаном и экстрагировали дихлорметаном. Органический слой сушили и упаривали с получением 7 г (100%) метансульфоновой кислоты 2-(4-фтор-2-метоксифенил)этилового эфира. 13.5. 9-[2-(4-Фтор-2-метоксифенил)этил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она гидрохлорид (1:1). К раствору 0,25 г (1,03 ммоль) 8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-она в 4 мл безводного диметилформамида добавляли 0,046 мг (1,14 ммоль) гидрида натрия(60%-ная суспензия в минеральном масле) и смесь оставляли перемешиваться при 50 С в течение 20 мин. Добавляли 0,282 г (1,14 ммоль) метансульфоновой кислоты 2-(4-фтор-2-метоксифенил)этилового эфира и перемешивание продолжали в течение 18 ч. Добавляли воду и смесь экстрагировали дихлорметаном. Экстракты промывали насыщенным водным раствором хлорида натрия, сушили и упаривали с получением неочищенного продукта. После очистки хроматографией на силикагеле, элюируя смесью дихлорметан/метанол в соотношениях от 100/0 до 96/4, получали соединение в форме свободного основания, которое превращали в солянокислую соль с получением 0,192 г (43%) чистого продукта. Точка плавления: 206-208 С. Пример 14. (Соединение 2 в табл. 3). 9-[2-(4-Фтор-2-метоксифенил)этил]-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2 а]пиримидин-4-он. 14.1. 8,8-Диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Смесь 7,68 г (39,8 ммоль) этил-3-(пиридин-4-ил)-3-оксопропионата, 7,9 г (37,9 ммоль) 6,6-диметил 1,4,5,6-тетрагидропиримидин-2-иламина гидробромида (полученного в соответствии с Bull. Soc. Chim.Belg., 1950, 59, 573-587) и 11 г (79,5 ммоль) карбоната калия в 80 мл этанола нагревали при температуре дефлегмации в течение 18 ч. Реакционную смесь охлаждали и растворитель удаляли выпариванием. Полученный остаток обрабатывали водой и осадок выделяли фильтрацией с получением 3,21 г (33%) продукта. Точка плавления 345-347 С. 14.2. 9-[2-(4-Фтор-2-метоксифенил)этил]-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. К раствору 0,222 г (0,87 ммоль) 8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-она в 5 мл безводного диметилформамида добавляли 0,039 г (0,95 ммоль) гидрида натрия(60%-ная суспензия в минеральном масле) и смесь оставляли перемешиваться при 50 С в течение 20 мин. Добавляли 0,236 г (0,95 ммоль) метансульфоновой кислоты 2-(4-фтор-2-метоксифенил)этилового эфира и перемешивание продолжали в течение 18 ч. Добавляли воду и смесь экстрагировали дихлорметаном. Экстракты промывали насыщенным водным раствором хлорида натрия, сушили и выпаривали с получением неочищенного продукта. После очистки хроматографией на силикагеле, элюируя смесью дихлорметан/метанол в соотношениях от 100/0 до 96/4, получали 0,18 г (50%) неочищенного продукта. Точка плавления: 217-219 С. Пример 15. (Соединение 8 в табл. 3). 9-(2(S)-Гидрокси-2-фенилэтил)-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-она гидрохлорид (1:1). К раствору 1 г (3,90 ммоль) 8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-она в 12 мл безводного диметилформамида добавляли 0,343 г (8,58 ммоль) гидрида натрия(60%-ная суспензия в минеральном масле) и смесь оставляли перемешиваться при 50 С в течение 1 ч. Добавляли 0,794 г (5,07 ммоль) (1-S)-2-хлор-1-фенилэтанола и смесь оставляли перемешиваться при 120 С в течение 12 ч. Добавляли воду и смесь экстрагировали этилацетатом. Экстракты промывали насыщенным водным раствором хлорида натрия, сушили и выпаривали с получением неочищенного продукта. После очистки хроматографией на силикагеле, элюируя смесью этилацетат/этанол в соотношениях от 100/0 до 96/4, соединение получали в форме свободного основания, которое превращали в солянокислую соль с получением 0,87 г (59%) чистого продукта. Точка плавления 204-209 С, []D = -20,7 (с = 0,855, СН 3 ОН). Пример 16. (Соединение 10 в табл. 3). 8,8-Диметил-9-(2-оксо-2-фенилэтил)-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин 4-она гидрохлорид (1:1). К раствору 0,12 мл (1,65 ммоль) диметилсульфоксида в 3 мл безводного дихлорметана при -78 С добавляли 0,21 мл (1,46 ммоль) трифторуксусного ангидрида в 1 мл безводного дихлорметана и смесь оставляли перемешиваться при -78 С в течение 20 мин. Добавляли 0,1 г (0,27 ммоль) 9-(2(S)-гидрокси-2 фенилэтил)-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она в 2 мл безводного дихлорметана при -78 С и перемешивание продолжали в течение 30 мин.- 16006859 Добавляли 0,31 мл (2,23 ммоль) триэтиламина и смесь оставляли перемешиваться при комнатной температуре в течение 12 ч. Добавляли воду и смесь экстрагировали этилацетатом, экстракты промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором хлорида натрия, сушили и упаривали с получением неочищенного продукта. После очистки хроматографией на силикагеле,элюируя смесью дихлорметан/метанол/гидроксид аммония в соотношениях 95/5/0,5. Соединение получали в форме свободного основания, которое превращали в солянокислую соль с получением 0,026 г(24%) чистого продукта. Точка плавления: 247-249 С. Пример 17. (Соединение 16 в табл. 3). 8-Этил-9-(2-оксо-2-фенилэтил)-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин 4-она гидрохлорид (1:1). 17.1. 8-Этил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Смесь 5 г (25,88 ммоль) этил-3-(4-пиридинил)-3-оксопропионата, 3,85 г (23,53 ммоль) 6-этил 1,4,5,6-тетрагидро-2-пиримидин-2-иламина гидрохлорида (полученного в соответствии с J. Org. Chem.,20, 1955, 829-838) и 6,83 г (49,41 ммоль) карбоната калия в 51 мл этанола нагревали при температуре дефлегмации в течение 18 ч. Реакционную смесь охлаждали и растворитель удаляли выпариванием. Полученный остаток обрабатывали водой и остаток выделяли фильтрацией с получением 4,1 г (68%) продукта. Точка плавления 244-246 С. 17.2. 8-Этил-9-(2-оксо-2-фенилэтил)-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин 4-она гидрохлорид (1:1). К раствору 0,3 г (1,17 ммоль) 8-этил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин 4-она в 6 мл безводного диметилформамида добавляли 0,343 г (8,58 ммоль) гидрида натрия (60%-ная суспензия в минеральном масле) и смесь оставляли перемешиваться при 50 С в течение 15 мин. При 0 С добавляли 0,303 г (1,52 ммоль) фенацилбромида, смесь оставляли перемешиваться при 0 С в течение 3 ч и температуре позволяли повышаться до комнатной температуры в течение 12 ч. Добавляли воду и смесь экстрагировали этилацетатом. Экстракты промывали насыщенным раствором хлорида натрия, сушили и выпаривали с получением неочищенного продукта. После очистки хроматографией на силикагеле, элюируя смесью дихлорметан/метанол в соотношениях от 100/0 до 96/4. Соединение получали в форме свободного основания, которое превращали в солянокислую соль с получением 0,134 г (28%) чистого продукта. Точка плавления 189-191 С. Пример 18. (Соединение 18 в табл. 3). 3-Фтор-8-метил-9-(2-оксо-2-фенилэтил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 18.1. 3-Фтор-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Продукт получали по аналогии со стадией 13.1, используя промежуточное соединение со стадии 6.1. Точка плавления 274-276 С. 18.2. 3-Фтор-8-метил-9-(2-оксо-2-фенилэтил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-он. Продукт получали по аналогии со стадией 17.2. Точка плавления 201-202 С. Перечень химических структур и физических данных для соединений указанной выше формулы (I),иллюстрирующих настоящее изобретение, приведен в табл. 1, 2 и 3. Соединения получали в соответствии со способами из примера. В этих таблицах R1 представляет собой незамещенное 4-пиридиновое кольцо (4-ру), Ph представляет собой фенильную группу, Et представляет собой этильную группу, Me представляет собой метильную группу; в колонке "X", когда X представляет собой два атома водорода, указан только "Н", (S), (R) или(S) означает абсолютную S конфигурацию. В табл. 1 для соединений формулы (I) "m" и "р" равно 1; в табл. 2 для соединений формулы (I) "m" равно 0 и "р" равно 1 и в табл. 3 для соединений формулы (I) "m" равно 0 и "р" равно 2. Пример испытания. Ингибирующая активность лекарства по настоящему изобретению в отношенииGSK3: Можно использовать два разные протокола. По первому протоколу: 7,5 мкМ предварительно фосфорилированного GS1 (гликогенсинтазы 1) пептида и 10 мкМ АТР (аденозинтрифосфата) (содержащего 300000 импульсов в минуту 33 Р-АТР) инкубировали в 25 мМ Tris-HCl (трис(гидроксиметил)аминометан), рН 7,5, 0,6 мМ DTT (дитиотреитола), 6 мМ MgCl2, 0,6 мМ EGTA (этиленбис(оксиэтиленнитрило)тетрауксусная кислота), 0,05 мг/мл BSA (бы- 24006859 чий сывороточный альбумин) буфера в течение 1 ч при комнатной температуре в присутствии GSK3(общий объем реакционной смеси: 100 мкл). По второму протоколу: 4,1 мкМ предварительно фосфорилированного GS1 пептида и 42 мкМ АТР(содержащего 260000 импульсов в минуту 33 Р-АТР) инкубировали в 80 мМ Mes (2-(N-морфолино) этансульфоновая кислота)-NаОН, рН 6,5, 1 мМ ацетата Mg, 0,5 мМ EGTA, 5 мМ 2-меркаптоэтанола,0,02% Твин-20, 10%-ного глицеринового буфера в течение 2 ч при комнатной температуре в присутствииGSK3. Ингибиторы растворяли в DMSO (диметилсульфоксиде) (конечная концентрация растворителя в реакционной среде 1%). Реакцию останавливали 100 мкл раствора, приготовленного из 25 г полифосфорной кислоты (85% Р 2O5), 126 мл 85%-ной Н 3 РO4, Н 2O до 500 мл и затем перед применением разбавленного до 1:100. Аликвоту реакционной смеси затем переносили на Whatman P81 катионообменные фильтры и промывали раствором, описанным выше. Внедренную 33 Р радиоактивность определяли при помощи жидкостной сцинтилляционной спектрометрии. Фосфорилированный GS-1 пептид имел следующую последовательность:GSK3 ингибирующую активность соединений по настоящему изобретению выражали в IC50 (концентрации, вызывающей 50%-ное ингибирование), и, в качестве иллюстрации, интервал IC50 значений соединений табл. 1 находится между концентрациями 4 нмоль и 2 мкмоль, соединений табл. 2 находится между концентрациями 30 нмоль и 2 мкмоль и соединений табл. 3 находится между концентрациями 1 нмоль и 2 мкмоль. Пример испытания 2. Ингибирующая активность лекарства по настоящему изобретению в отношении cdk5/p25. Можно использовать следующий протокол: 0,4 мг/мл гистона Н 1 и 10 мкМ АТР (содержащего 300000 импульсов в минуту 33 Р-АТР) инкубировали в 50 мМ HEPES, рН 7,2, 1 мМ DTT, 1 мМ MgCl2, 1 мМ EGTA, 0,02% Твин-20 буфера в течение 1 ч при комнатной температуре в присутствии cdk5/p25 (общий объем реакционной смеси: 100 мкл). Ингибиторы растворяли в DMSO (конечная концентрация в реакционной смеси 1%). Реакцию останавливали 100 мкл раствора из 25 г полифосфорной кислоты (85% Р 2 О 5), 126 мл 85%ной Н 3 РО 4, Н 2O до 500 мл (разбавленного до 1:100 перед применением). Аликвоту реакционной смеси затем переносили на Whatman P81 катионообменные фильтры и промывали раствором, описанным выше. Внедренную 33 Р радиоактивность определяли путем жидкостной сцинтилляционной спектрометрии.Cdk5/p25 ингибирующую активность соединений по настоящему изобретению выражали в виде значений IC50. Обычно использовали 3-кратные серийные разведения ингибитора для по меньшей мере 1000-кратного интервала концентраций. В качестве иллюстрации интервал IC50 соединений табл. 1 находится между концентрациями 200 нмоль и 5 мкмоль. В качестве иллюстрации значения IC50 некоторых соединений приведенной выше формулы (I), иллюстрирующие настоящее изобретение, приведены в табл. 4. Таблица 4(1). Таблетки. Указанные ниже ингредиенты смешивают обычным способом и прессуют, используя традиционные приспособления. Соединение примера 1 30 мг Кристаллическая целлюлоза 60 мг Кукурузный крахмал 100 мг Лактоза 200 мг Стеарат магния 4 мг(2). Мягкие капсулы. Указанные ниже ингредиенты смешивают обычным способом и заполняют мягкие капсулы. Соединение примера 1 30 мг Оливковое масло 300 мг Лецитин 20 мг(3). Парентеральные препараты. Указанные ниже ингредиенты смешивают обычным способом для приготовления инъекций, содержащихся в 1 мл ампуле. Соединение примера 1 3 мг Хлорид натрия 4 мг Дистиллированная вода для инъекций 1 мл Промышленная применимость Соединения по настоящему изобретению обладают GSK3 или GSK3 и cdk5/p25 ингибирующей активностью и пригодны в качестве активного ингредиента лекарства для профилактического и/или терапевтического лечения заболеваний, вызываемых ненормальной активностью GSK3 или GSK3 иcdk5/p25, и, в более частном случае, нейродегенеративных заболеваний. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное пиримидона, представленное формулой (I), или его соль, либо его сольват или его гидрат,гдеX представляет собой два атома водорода, атом серы, атом кислорода или C1-2 алкильную группу и атом водорода;Y представляет собой связь, этениленовую группу, этиниленовую группу, атом кислорода, атом серы, сульфонильную группу, сульфоксидную группу, карбонильную группу, гидроксииминометиленовую группу, диоксолановую группу, атом азота, возможно замещенный C1-6 алкильной группой, фенильной группой или бензильной группой; или метиленовую группу, возможно замещенную одной или двумя группами, выбранными из C1-6 алкильной группы, бензильной группы, гидроксильной группы, C1-4 алкоксигруппы, C1-2 пергалогенированной алкильной группы, аминогруппы, ацетиламиногруппы или фенильной группы;R1 представляет собой 2-, 3- или 4-пиридиновое кольцо, возможно замещенное C3-6 циклоалкильной группой, C1-4 алкильной группой, C1-4 алкоксигруппой, бензильной группой или атомом галогена; когда Y представляет собой связь, возможно замещенную метиленовую группу, гидроксииминометиленовую группу, диоксолановую группу или карбонильную группу, тогда R2 представляет собой C1-6 алкильную группу, возможно замещенную гидроксигруппой, C6,10 арилокси или C6,10 ариламиногруппой;C3-6 циклоалкильную группу, C1-4 алкилтиогруппу, C1-4 алкоксигруппу, C1-2 пергалогенированную алкильную группу, C1-3 галогенированную алкильную группу, фенилтиогруппу, бензильную группу, бензольное кольцо, индановое кольцо, 5,6,7,8-тетрагидронафталиновое кольцо, нафталиновое кольцо, пиридиновое кольцо, пиррольное кольцо, тиофеновое кольцо, фурановое кольцо или имидазольное кольцо; бензильную группу или кольца, возможно замещенные 1-4 заместителями, выбранными из C1-6 алкильной группы, метилендиоксигруппы, атома галогена, C1-2 пергалогенированной алкильной группы, C1-3 галогенированной алкильной группы, гидроксильной группы, C1-4 алкоксигруппы, нитро, циано, амино,C1-5 моноалкиламиногруппы, C2-10 диалкиламиногруппы, C1-6 алкилкарбониламиногруппы, C6,10 арилкарбониламиногруппы, C1-4 алкилсульфонильной группы, C1-4 алкилсульфонилоксигруппы или фенильной группы; когда Y представляет собой этениленовую группу, этиниленовую группу, атом кислорода, атом серы, сульфонильную группу, сульфоксидную группу или возможно замещенный атом азота, тогда R2 представляет собой C1-6 алкильную группу, возможно замещенную гидроксигруппой, C6,10 арилокси илиC6,10 ариламиногруппой; C3-6 циклоалкильную группу, C1-2 пергалогенированную алкильную группу, C1-3 галогенированную алкильную группу, бензильную группу, бензольное кольцо, индановое кольцо,5,6,7,8-тетрагидронафталиновое кольцо, нафталиновое кольцо, C6,10 ариламино, пиридиновое кольцо,пиррольное кольцо, тиофеновое кольцо, фурановое кольцо или имидазольное кольцо; бензильную группу или кольца, возможно замещенные 1-4 заместителями, выбранными из C1-6 алкильной группы, метилендиоксигруппы, атома галогена, C1-2 пергалогенированной алкильной группы, C1-3 галогенированной- 26006859 алкильной группы, гидроксильной группы, C1-4 алкоксигруппы, нитро, циано, амино, C1-5 моноалкиламиногруппы, C2-10 диалкиламиногруппы, C1-6 алкилкарбониламиногруппы, C6,10 арилкарбониламиногруппы, C1-4 алкилсульфонильной группы, C1-4 алкилсульфонилоксигруппы или фенильной группы;R3 представляет собой атом водорода, C1-6 алкильную группу, гидроксигруппу, C1-4 алкоксигруппу или атом галогена;R4 представляет собой атом водорода, C1-6 алкильную группу, гидроксигруппу, C1-4 алкоксигруппу или атом галогена;R5 представляет собой атом водорода, C1-6 алкильную группу или атом галогена; при условии, что когда R3 и R4 представляют собой, каждый, атом водорода, тогда R5 не является атомом водорода; когда m равно 0, р равно 1, 2 или 3,когда m равно 1, р равно 0, 1 или 2,когда m равно 2, р равно 0 или 1, иn представляет собой 0-3. 2. Производное пиримидона или его соль, либо его сольват, или его гидрат по п.1, где R1 представляет собой незамещенное пиридиновое кольцо. 3. Производное пиримидона, которое выбрано из группы, состоящей из 9-[3-(2-фторфенил)пропил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а] пиримидин-4-она; 9-(2-оксо-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она; 9-(2-гидрокси-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а] пиримидин-4-она; 9-(2-оксо-2-фенилэтил)-7,7-дифтор-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а] пиримидин-4-она; 9-(2(S)-гидрокси-2-фенилэтил)-7,7-дифтор-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2 а]пиримидин-4-она; 9-(2-оксо-2-фенилэтил)-3-фтор-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2 а]пиримидин-4-она; 9-[2-оксо-2-(3-хлорфенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2 а]пиримидин-4-она; 9-(2(S)-гидрокси-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2 а]пиримидин-4-она; 9-[2-оксо-2-(3-фторфенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2 а]пиримидин-4-она; 9-[2-гидрокси-2-(3-хлорфенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-она; 9-[2-гидрокси-2-(3-фторфенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-она; 9-(2(S)-гидрокси-2-фенилэтил)-3-фтор-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-она; 9-[2-оксо-2-(4-фторфенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2 а]пиримидин-4-она; 9-[2-оксо-2-(5,5,8,8-тетраметил-5,6,7,8-тетрагидронафт-2-ил)этил]-7,7-диметил-2-(пиридин-4-ил)6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-она; 9-[2-оксо-2-(3-метоксифенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-она; 9-[2-оксо-2-(4-фенилфенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она; 9-[2-(1-метил-2-оксо-2-(3,4-метилендиокси-5-метоксифенил)этил]-7,7-диметил-2-(пиридин-4-ил)6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-она; 9-[2-оксо-2-(4-хлорфенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2 а]пиримидин-4-она; 9-[2-оксо-2-(нафт-2-ил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2 а]пиримидин-4-она; 9-[2-оксо-2-(4-метилфенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она; 9-(2-оксо-2-фенилэтил)-7,7-диметил-3-бром-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2 а]пиримидин-4-она; 9-(2(S)-метокси-2-фенилэтил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2 а]пиримидин-4-она; 9-(3-фенилпропаноил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-она;- 28006859 9-индан-2-илметил-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она; 3-фтор-9-[2-(4-фтор-2-метоксифенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4Hпиримидо[1,2-а]пиримидин-4-она; 9-[2-(4-фтор-2-метоксифенил)этил]-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-она; или его соли, либо его сольвата, или его гидрата. 4. Производное пиримидона, которое выбрано из группы, состоящей из[2-оксо-2-(5,5,8,8-тетраметил-5,6,7,8-тетрагидронафт-2-ил)этил]-2,2-диметил-7-(пиридин-4-ил)-2,3 дигидро-1 Н-имидазо[1,2-а]пиримидин-5-она; или его соли, либо его сольвата, или его гидрата. 5. Производное пиримидона, которое выбрано из группы, состоящей из 9-[2-(4-фтор-2-метоксифенил)этил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2 а]пиримидин-4-она; 9-[2-(4-фтор-2-метоксифенил)этил]-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2 а]пиримидин-4-она; 9-[2-(4-фторфенил)этил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4 она; 8-метил-9-(2-оксо-2-фенилэтил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4 она; 9-[2-(2,5-диметоксифенил)этил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-она; 9-[2-(2-метоксифенил)этил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она; 9-[2(S)-гидрокси-2-фенилэтил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она; 9-[2(S)-гидрокси-2-фенилэтил]-8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-она; 8-метил-9-[нафталин-1-илметил]-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4 она; 8,8-диметил-9-[2-оксо-2-фенилэтил]-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она; 8-метил-9-[нафталин-2-илметил]-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4 она; 9-[2-(3-метоксифенил)-2-оксоэтил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-она; 9-[2-(3-хлорфенил)-2-оксоэтил]-8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она; 8,8-диметил-9-[2(S)-фенилпропил]-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин 4-она; 8,8-диметил-9-[2(R)-фенилпропил]-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин 4-она;
МПК / Метки
МПК: A61K 31/519, A61P 3/10, C07D 487/04, A61P 25/28
Метки: замещенного, 7-пиридинил-2,3-дигидроимидазо[1, производные, 2-a]пиримидин-5(1н)она, 2-пиридинил-6, 2-а]пиримидин-4-она, 9-тетрагидропиримидо[1
Код ссылки
<a href="https://eas.patents.su/30-6859-proizvodnye-zameshhennogo-2-piridinil-6-7-8-9-tetragidropirimido1-2-apirimidin-4-ona-i-7-piridinil-23-digidroimidazo1-2-apirimidin-51nona.html" rel="bookmark" title="База патентов Евразийского Союза">Производные замещенного 2-пиридинил-6, 7, 8, 9-тетрагидропиримидо[1, 2-а]пиримидин-4-она и 7-пиридинил-2,3-дигидроимидазо[1, 2-а]пиримидин-5(1н)она</a>
Следующий патент: Композиции и способы модулирования гемиканалов коннексина
Случайный патент: Исполнительный механизм газового клапана












