Оксадиазольные и тиадиазольные производные пирролидина
Номер патента: 6212
Опубликовано: 27.10.2005
Авторы: Шварц Маттиас, Помель Венсан, Паж Патрик, Кваттропани Анна, Томас Расселл Дж.
Формула / Реферат
1. Оксадиазольное производное пирролидина согласно формуле I
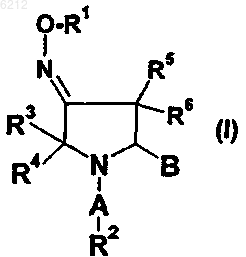
а также его геометрические изомеры, его оптически активные формы в виде энантиомеров, диастереомеров и его рацемические формы, а также его фармацевтически приемлемые соли,
где A выбирают из группы, состоящей из -(C=O)-, -(C=O)-O-, -SO2-, -SO2NH-, -CH2-;
B является оксадиазольным или тиадиазольным кольцом;
R1 выбирают из группы, включающей или состоящей из C1-C6-алкила, C2-C6-алкенила, C2-C6-алкинила, арила, гетероарила, C1-C6-алкиларила, C1-C6-алкилгетероарила, R1 может образовывать с атомом O, с которым он связан, 3-8-членное насыщенное или ненасыщенное гетероциклическое кольцо, которое может содержать 1-2 дополнительных гетероатома, выбранных из N, S и O, и которое необязательно конденсировано с арилом, гетероарилом или 3-8-членным насыщенным или ненасыщенным циклоалкильным кольцом;
R2 выбирают из группы, включающей или состоящей из C1-C6-алкила, C2-C6-алкенила, C2-C6-алкинила, арила, гетероарила, гетероарилалкила, 3-8-членного циклоалкила, ацила, C1-C6-алкиларила, C1-C6-алкилгетероарила, при этом указанные циклоалкильные или арильные или гетероарильные группы могут быть конденсированы с 1-2 дополнительными циклоалкильными или арильными или гетероарильными группами;
R3, R4, R5 и R6 независимо друг от друга выбирают из группы, состоящей из водорода, галогена, C1-C6-алкила или C1-C6-алкоксигруппы.
2. Оксадиазольное производное пирролидина по п.1, где R1 выбирают из группы, состоящей из H или C1-C6-алкильной группы, в частности -CH3.
3. Оксадиазольное производное пирролидина по п.1 или 2, где A является -(C=O)-.
4. Оксадиазольное производное пирролидина по любому из предшествующих пунктов, где R2 является арильной или гетероарильной группой.
5. Оксадиазольное производное пирролидина по п.4, где R является фенильной группой.
6. Оксадиазольное производное пирролидина по п.5, где указанная фенильная группа замещена фенильной группой.
7. Оксадиазольное производное пирролидина по любому из предшествующих пунктов, где B является оксадиазолом формулы IIa или IIb
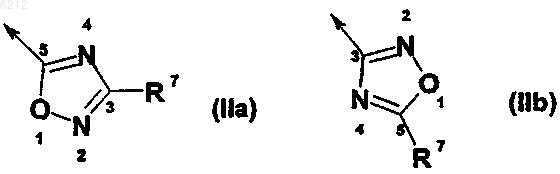
где R7 выбирают из группы, включающей или состоящей из водорода, сульфонила, аминогруппы, C1-C6-алкила, C2-C6-алкенила, C2-C6-алкинила, где указанные цепи алкила, алкенила, алкинила могут прерываться гетероатомом, выбранным из N, O или S, арила, гетероарила, насыщенного или ненасыщенного 3-8-членного циклоалкила, гетероциклоалкила, где указанные группы циклоалкила, гетероциклоалкила, арила или гетероарила могут быть конденсированы с 1-2 дополнительными группами циклоалкила, гетероциклоалкила, арила или гетероарила, ацильного фрагмента, C1-C6-алкиларила, C1-C6-алкилгетероарила, C2-C6-алкениларила, C2-C6-алкенилгетероарила, C2-C6-алкиниларила, C2-C6-алкинилгетероарила, C1-C6-алкилциклоалкила, C1-C6-алкилгетероциклоалкила, C2-C6-алкенилциклоалкила, C2-C6-алкенилгетероциклоалкила, C2-C6-алкинилциклоалкила, C2-C6-алкинилгетероциклоалкила, алкоксикарбонила, аминокарбонила, C1-C6-алкилкарбоксильной группы, C1-C6-алкилацила, арилацила, гетероарилацила, C3-C8-(гетеро)циклоалкилацила, C1-C6-алкилацилоксигруппы, C1-C6-алкилалкоксигруппы, C1-C6-алкилалкоксикарбонила, C1-C6-алкиламинокарбонила, C1-C6-алкилациламиногруппы, ациламиногруппы, C1-C6-алкилуреидогруппы, C1-C6-алкилкарбамата, C1-C6-алкиламиногруппы, C1-C6-алкиламмония, C1-C6-алкилсульфонилоксигруппы, C1-C6-алкилсульфонила, C1-C6-алкилсульфинила, C1-C6-алкилсульфанила, C1-C6-алкилсульфониламиногруппы, C1-C6-алкиламиносульфонила, гидроксильной группы или галогена.
8. Оксадиазольное производное пирролидина по п.7, где R7 выбирают из группы, состоящей из сульфонильного или аминофрагмента, или группы C1-C6-алкила, C2-C6-алкенила, C2-C6-алкинила, арила, гетероарила, 3-8-членного циклоалкила, необязательно содержащего по меньшей мере один гетероатом, выбранный из N, O, S, C1-C6-алкиларила, C1-C6-алкилгетероарила, C2-C6-алкениларила, C2-C6-алкенилгетероарила, алкоксикарбонила, амида карбоновой кислоты, C1-C6-алкилкарбонила, арилкарбонила или гетероарилкарбонила, C3-C8-циклоалкилкарбонила, при этом указанные группы замещены по меньшей мере одним сульфонильным или аминофрагментом.
9. Оксадиазольное производное пирролидина по п.8, где R7 выбирают из группы, состоящей из C1-C6-алкиламиногруппы, гетероциклоалкила, C1-C6-алкилгетероциклоалкила, аминокарбонила, C1-C6-алкиламинокарбонила, C1-C6-алкилациламиногруппы, C1-C6-алкилсульфонила или C1-C6-алкила.
10. Оксадиазольное производное пирролидина по п.9, где R7 выбирают из группы, состоящей из диметиламинометила, 2-(диметиламино)этила, 1-метил-3-пиперидинила или 4-(ацетил-1-пиперазинил)метила.
11. Оксадиазольное производное пирролидина по любому из пп.1-10, где B является изоксадиазолом формулы III или IV
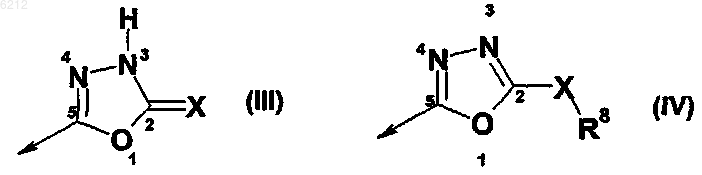
где X означает O или S;
R8 является водородом, C1-C6-алкилом, C2-C6-алкенилом, C2-C6-алкинилом, арилом, гетероарилом, насыщенным или ненасыщенным 3-8-членным циклоалкилом, необязательно содержащим 1-3 гетероатома, выбранных из N, O, S, ацильным фрагментом, C1-C6-алкиларилом, C1-C6-алкилгетероарилом, C2-C6-алкениларилом, C2-C6-алкенилгетероарилом, алкоксикарбонилом, амидом карбоновой кислоты, C1-C6-алкоксигруппой, арилоксигруппой, гетероарилоксигруппой, галогеном, цианогруппой, C1-C6-алкилкарбонилом, арилкарбонилом или гетероарилкарбонилом, насыщенным или ненасыщенным C4-C8-циклоалкилкарбонилом, где указанные группы циклоалкила или арила или гетероарила могут быть конденсированы с 1-2 дополнительными циклоалкильными или арильными или гетероарильными группами и указанная цепь алкила, алкенила, алкинила может быть прервана гетероатомом, выбранным из N, O или S.
12. Оксадиазольное производное пирролидина по любому из предшествующих пунктов, где каждый из R3, R4, R5 и R6 является H.
13. Оксадиазольное производное пирролидина по любому из предшествующих пунктов, где A означает -(C=O)-, R1 является метильной группой, R2 является группой бифенила, каждый из R3, R4, R5 и R6 является H и B является оксадиазольным кольцом формул IIa, IIb, III или IV.
14. Оксадиазольное производное пирролидина по п.13, где B является оксадиазольным кольцом формул IIa или IIb.
15. Оксадиазольное производное пирролидина по любому из предшествующих пунктов, выбранное из следующей группы:
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона
O-метилоксим (3EZ,5S)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1' -бифенил]-4-илкарбонил)-5-(1,3,4-оксадиазол-2-ил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-(5-тиоксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-5-(3-бензил-1,2,4-оксадиазол-5-ил)-1-([1,1'-бифенил]-4-илкарбонил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-(3-{[(2-фурилметил)сульфанил]метил}-1,2,4-оксадиазол-5-ил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{3-[2-оксо-2-(1-пирролидинил)этил]-1,2,4-оксадиазол-5-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{3-[(2-пиридинилсульфанил)метил]-1,2,4-оксадиазол-5-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(4-фторфенил)-1,2,4-оксадиазол-5-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{3-[(2-тиенилсульфанил)метил]-1,2,4-оксадиазол-5-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{3-[2-(3,5-диметил-1H-пиразол-1-ил)этил]-1,2,4-оксадиазол-5-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{3-[(метилсульфонил)метил]-1,2,4-оксадиазол-5-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(5-метил-3-изоксазолил)-1,2,4-оксадиазол-5-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(2-тиенилметил)-1,2,4-оксадиазол-5-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-(3-фенил-1,2,4-оксадиазол-5-ил)-3-пирролидинона,
O-метилоксим (3EZ, 5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-(3-{[(2-фурилметил)сульфонил]метил}-1,2,4-оксадиазол-5-ил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-5-[3-(аминометил)-1,2,4-оксадиазол-5-ил]-1-([1,1'-бифенил]-4-илкарбонил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{3-[(RS)-гидрокси(фенил)метил]-1,2,4-оксадиазол-5-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{3-[(1RS)-1-гидроксипропил]-1,2,4-оксадиазол-5-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(гидроксиметил)-1,2,4-оксадиазол-5-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{3-[(1S,2R)-2-гидроксициклогексил]-1,2,4-оксадиазол-5-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(4-пиперидинил)-1,2,4-оксадиазол-5-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{3-[(3RS)-пиперидинил]-1,2,4-оксадиазол-5-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{3-[(2RS)-пиперидинил]-1,2,4-оксадиазол-5-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-[(2'-хлор-[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-5-(3-метил-1,2,4-оксадиазол-5-ил)-1-{[2'-(трифторметил)[1,1'-бифенил]-4-ил]карбонил}-3-пирролидинона,
O-метилоксим (3Z,5S)-1-[(2'-фтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-[(4'-фтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-(1,2,4-оксадиазол-3-ил)-3-пирролидинона,
O-метилоксим (3E,5S)-1-[(2'-фтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона,
O-метилоксим (3E,5S)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона,
O-метилоксим (3Z,5S)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[5-(феноксиметил)-1,2,4-оксадиазол-3-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-(5-фенил-1,2,4-оксадиазол-3-ил)-3-пирролидинона,
N-({3-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-5-ил}метил)ацетамид,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[4-(гидроксиметил)фенил]-1,2,4-оксадиазол~3-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[5-(2-(гидроксиэтил)-1,2,4-оксадиазол-3-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[(2S)-2-гидрокси-2-фенилэтил]-1,2,4-оксадиазол-3-ил}-3-пирролидинона,
{3-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-5-ил}метилформамид,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[5-(метоксиметил)-1,2,4-оксадиазол-3-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[5-(2-феноксиэтил)-1,2,4-оксадиазол-3-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[5-(2-метоксиэтил)-1,2,4-оксадиазол-3-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-5-[5-(1-ацетил-4-пиперидинил)-1,2,4-оксадиазол-3-ил]-1-([1,1'-бифенил]-4-илкарбонил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[5-(2-пиридинил)-1,2,4-оксадиазол-3-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[5-(3-тиенил)-1,2,4-оксадиазол-3-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-(5-этил-1,2,4-оксадиазол-3-ил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-(5-циклопентил-1,2,4-оксадиазол-3-ил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-(5-метил-1,2,4-оксадиазол-3-ил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[(RS)-гидрокси(фенил)метил]-1,2,4-оксадиазол-3-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[(1RS)-1-гидрокси-2-фенилэтил]-1,2,4-оксадиазол-3-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[(1R)-1-(диметиламино)-2-фенилэтил]-1,2,4-оксадиазол-3-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[5-(3-пиридинил)-1,2,4-оксадиазол-3-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[5-(4-пиридинил)-1,2,4-оксадиазол-3-ил]-3-пирролидинона,
O-метилоксим (3Z,5S)-5-{5-[(4-ацетил-1-пиперазинил)метил]-1,2,4-оксадиазол-3-ил}-1-([1,1'-бифенил]-4-илкарбонил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-5-[3-(1-ацетил-4-пиперидинил)-1,2,4-оксадиазол-5-ил]-1-([1,1'-бифенил]-4-илкарбонил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-5-{5-[(4-ацетил-1-пиперазинил)метил]-1,2,4-оксадиазол-3-ил}-1-([1,1'-бифенил]-4-илкарбонил)-3-пирролидинона,
N-({3-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-5-ил}метил)-3-(1-пиперидинил)пропанамид,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[(3S)-1-метилпиперидинил]-1,2,4-оксадиазол-3-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[(3R)-1-метилпиперидинил]-1,2,4-оксадиазол-3-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[5-(6-гидрокси-3-пиридинил)-1,2,4-оксадиазол-3-ил]-3-пирролидинона,
O-метилоксим (3Z,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-5-{5-[(1S,2R)-1-амино-2-гидроксипропил]-1,2,4-оксадиазол-3-ил}-1-([1,1'-бифенил]-4-илкарбонил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[(3S)-пиперидинил]-1,2,4-оксадиазол-3-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[(3R)-пиперидинил]-1,2,4-оксадиазол-3-ил}-3-пирролидинона,
O-метилоксим (3EZ,5RS)-1-([1,1'-бифенил]-4-илкарбонил)-5-[5-(1-метил-3-пиперидинил)-1,2,4-оксадиазол-3-ил]-3-пирролидинона,
трет-бутил (3R)-3-{3-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-5-ил}-1-пиперидинкарбоксилат,
4-({3-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-5-ил}метил)-2,6-пиперазиндион,
O-метилоксим (3Z,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3-пирролидинона,
O-метилоксим (3Z,5S)-1-[(2'-хлор-4'-фтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[5-(1-метил-4-пиперидинил)-1,2,4-оксадиазол-3-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил}-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(1-метил-4-пиперидинил)-1,2,4-оксадиазол-5-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-5-{5-[(1S)-1-амино-2-гидроксиэтил]-1,2,4-оксадиазол-3-ил}-1-([1,1'-бифенил]-4-илкарбонил)-3-пирролидинона,
5-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-N-[3-(диметиламино)пропил]-1,2,4-оксадиазол-3-карбоксамид,
O-метилоксим (3E,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил}-3-пирролидинона,
трет-бутил (3S)-3-{3-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-5-ил}-1-пиперидинкарбоксилат,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[(4-метил-1-пиперазинил)метил]-1,2,4-оксадиазол-3-ил}-3-пирролидинона,
O-метилоксим (3Z,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[(4-метил-1-пиперазинил)метил]-1,2,4-оксадиазол-3-ил}-3-пирролидинона,
этил 5-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-3-карбоксилат,
O-метилоксим (3E,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3-пирролидинона,
O-метилоксим (3Z,5RS)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3-пирролидинона,
N-({3-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-5-ил}метил)-3-(диметиламино)пропанамид,
трет-бутил 4-(2-{3-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-5-ил}этил)-1-пиперазинкарбоксилат,
O-метилоксим (3EZ,5S)-1-[(2'-хлор-4'-фтор[1,1'-бифенил]-4-ил)карбонил]-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-[(4'-фтор-2'-метил[1,1'-бифенил]4-ил)карбонил]-5-[3-метил-1,2,4-оксадиазол-5-ил]-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[2-(диметиламино)этил]-1,2,4-оксадиазол-3-ил}-3-пирролидинона,
2-{5-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-3-ил}этил[(трет-бутоксикарбонил)амино]ацетат,
N-({3-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-5-ил}метил)-2-(диметиламино)ацетамид,
O-метилоксим (3EZ,5S)-1-[(2'-хлор-4'-фтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-5-{5-[(1S)-1-амино-2-трет-бутоксиэтил]-1,2,4-оксадиазол-3-ил}-1-([1,1'-бифенил]-4-илкарбонил)-3-пирролидинона,
трет-бутил 4-{5-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-3-ил}-1-пиперидинкарбоксилат,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[5-(1-пиперазинилметил)-1,2,4-оксадиазол-3-ил]-3-пирролидинона,
трет-бутил (4S)-4-{3-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-5-ил}-4-[(трет-бутоксикарбонил)амино]бутаноат,
4-{[(2S,4EZ)-2-(5-{[(трет-бутоксикарбонил)амино]метил}-1,2,4-оксадиазол-3-ил)-4-(метоксиимино)пирролидинил]карбонил}-1,1'-бифенил,
трет-бутил 2-{3-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-5-ил}этилкарбамат,
2-{5-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-3-ил}этиламиноацетат,
O-метилоксим (3E,5S)-1-[(2',4'-дифтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона,
O-метилоксим (3EZ,5S)-1-[(2',4'-дифтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона,
4-{[(2S,4EZ)-2-(5-{(1S)-2-трет-бутокси-1-[(трет-бутоксикарбонил)амино]этил}-1,2,4-оксадиазол-3-ил)-4-(метоксиимино)пирролидинил]карбонил}-1,1'-бифенил,
O-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-(5-винил-1,2,4-оксадиазол-3-ил)-3-пирролидинона,
4-{[(2S,4EZ)-2-(5-{(1S,2R)-2-трет-бутокси-1-[(трет-бутоксикарбонил)амино]пропил}-1,2,4-оксадиазол-3-ил)-4-(метоксиимино)пирролидинил]карбонил}-1,1'-бифенил,
O-метилоксим (3Z,5S)-1-[(2',4'-дифтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона,
трет-бутил 4-({3-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-5-ил}метил)-1-пиперазинкарбоксилат.
16. Применение оксадиазольного производного пирролидина по любому из пп.1-15 в качестве лекарственного средства.
17. Применение оксадиазольного производного пирролидина по любому из пп.1-15 для приготовления фармацевтической композиции для лечения и/или профилактики преждевременной родовой деятельности, преждевременных родов и дисменореи.
18. Применение оксадиазольного производного пирролидина по любому из пп.1-15 для приготовления фармацевтической композиции для модулирования рецептора окситоцина.
19. Применение по п.18, где указанное модулирование заключается в блокировании рецептора окситоцина или в антагонизации связывания окситоцина с его рецептором.
20. Применение по п.19 для лечения или профилактики расстройств, опосредованных рецептором окситоцина.
21. Применение оксадиазольного производного пирролидина по любому из пп.1-15 для приготовления фармацевтической композиции для перорального введения.
22. Фармацевтическая композиция, содержащая по меньшей мере одно оксадиазольное производное пирролидина по любому из пп.1-15 и его фармацевтически приемлемый носитель, разбавитель или эксципиент.
23. Способ получения оксадиазольного производного пирролидина формулы (I), где B является группой 1,2,4-оксадиазола формулы (IIb), включающий следующую стадию:
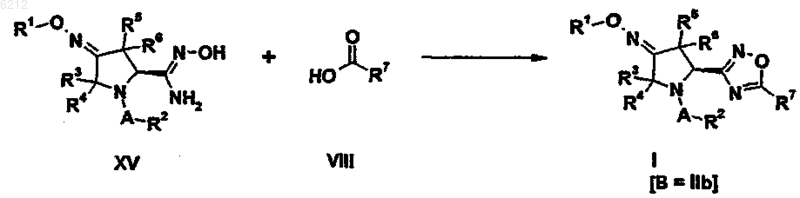
24. Способ получения оксадиазольного производного пирролидина формулы (I), где B является группой 1,2,4-оксадиазола формулы (IIa), включающий следующую стадию:
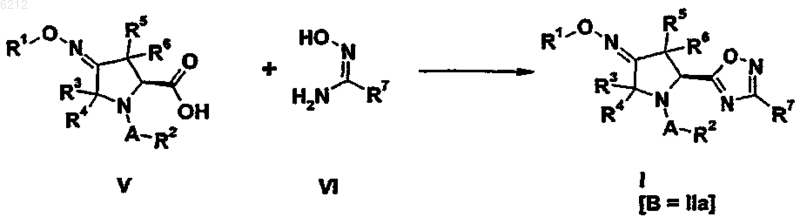
25. Способ получения оксадиазольного производного пирролидина формулы (I), где B является группой 1,3,4-оксадиазола формулы (III) или (IV), включающий любую из следующих стадий:
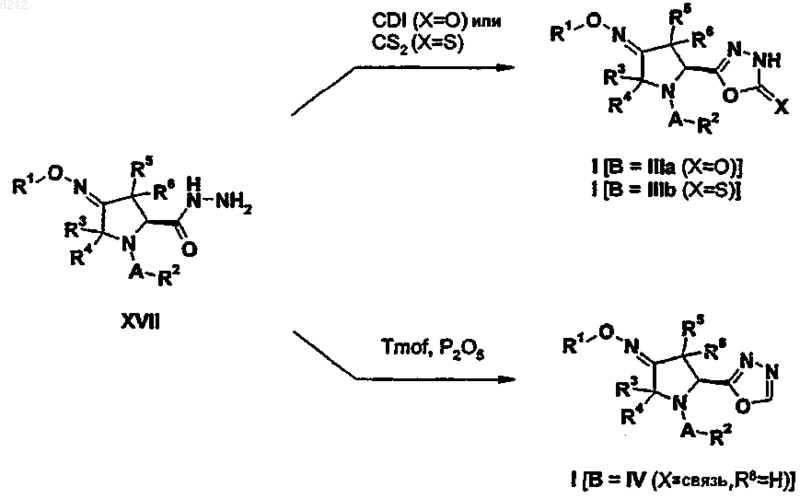
Текст
006212 Область изобретения Данное изобретение относится к новым оксадиазольным производным пирролидина и тиадиазольным производным пирролидина, в частности, для применения в качестве лекарственных средств, а также к фармацевтическим композициям, содержащим такие производные пирролидина. Указанные производные пирролидина полезны при лечении и/или профилактике преждевременной родовой деятельности,преждевременных родов и дисменореи. Предпочтительно производные пирролидина проявляют модулирующую, особенно антагонистическую активность по отношению к рецептору окситоцина. Более предпочтительно, указанные соединения полезны при лечении и/или профилактике патологических состояний, опосредованных окситоцином, включая преждевременную родовую деятельность, преждевременные роды и дисменоррею. Предпосылки изобретения Одной из наиболее важных проблем в области акушерства является терапия преждевременной родовой деятельности и преждевременных родов, так как они являются главной причиной перинатальной заболеваемости и смертности. Для лечения преждевременной родовой деятельности предлагалось использование сульфата магния и этанола. Однако концентрации сульфата магния в плазме выше терапевтических пределов 4-8 мг/дл могут вызывать ингибирование сердечной проводимости и нейромышечной передачи, угнетение дыхания и остановку сердца, таким образом, делая указанное средство неподходящим особенно в том случае,когда нарушено функционирование почек. Этанол является эффективным при предотвращении преждевременной родовой деятельности, но он не обеспечивает соответствующего уменьшения респираторного дистресс-синдрома плода. Также предполагается, что этанол негативно действует на плод. Два следующих терапевтических средства относятся к одной из групп:b) антагонисты окситоцина. 2-адренергический рецептор, как правило, вызывает ингибирующее действие в клетках, в которых он экспрессируется (мышцы, сердце, матка и т.д.). 2-адренергические агонисты используют для активации указанного ингибирующего действия рецептора. Следовательно, 2-адренергические агонисты являются симпатомиметиками, которые, наряду с другими факторами, ингибируют сократимость матки. Известными 2-адренергическими агонистами для лечения преждевременной родовой деятельности являются ритодрин, тербуталин и альбутерол. Ритодрин (т.е. (R,S)-4-гидрокси-альфа-[1-2-(4-гидроксифенил)этил]амино]этил]бензолметанол; см. патент США 3410944, N. V. Philips) является главным 2-адренергическим агонистом, но вызывает ряд сердечно-сосудистых и метаболических побочных эффектов у матери, включая тахикардию, повышенную секрецию ренина, гипергликемию (и реактивную гипогликемию у младенцев). Тербуталин (т.е. 5-[2-[(1,1-диметилэтил)амино]-1-гидроксиэтил]-1,3-бензолдиол, патент США 3937838, Draco) и альбутерол '-(1,1-диметилэтил)амино]метил]-4-гидрокси-1,3-бензолдиметанол; патент США 3644353, Allen and Hanburys) являются дополнительными 2-адренергическими агонистами и вызывают побочные эффекты, подобные эффектам ритодрина. Более современный способ лечения преждевременной родовой деятельности заключается в применение антагонистов окситоцина. Окситоцин (ОТ) является пептидным гормоном и вызывает сокращение матки млекопитающих во время родов. Соответствующий рецептор окситоцина сходен с рецепторами вазопрессина V1a и V2 и действует посредством связанного с G белком рецептора, сопряженного с активацией фосфолипазы С, и увеличивает количество IР 3, которые высвобождают Са 2+ из внутриклеточных мест хранения. Возникающее в результате увеличение внутриклеточного кальция приводит к повышенному сокращению гладкой мускулатуры посредством активации киназы легкой цепи миозина. Количество рецепторов окситоцина (ОТ) в значительной степени возрастает в ходе беременности. Показано, что концентрация рецепторов ОТ коррелирует со спонтанной активностью матки (М. Maggi et al. J. Clin. Endocrinol. Metabol.; 70; 1142, 1990). В последние несколько лет накоплены доказательства, строго свидетельствующие о том, что гормон окситоцин может быть физиологическим инициатором родовой деятельности у нескольких видов млекопитающих, включая человека. Более того, предполагают, что окситоцин оказывает свое действие с двух сторон: посредством непосредственного сокращения миометрия матки и посредством усиления синтеза и высвобождения сократительных простагландинов из эндометрия/децидуальной оболочки матки. Кроме того, указанные простагландины могут иметь важное значение для процесса созревания шейки матки. Посредством указанных механизмов процесс родовой деятельности (своевременной и преждевременной) инициируется за счет повышенной чувствительности матки к окситоцину, частично возникающей в результате увеличения количества рецепторов окситоцина в данной ткани. Посредством блокирования окситоцина можно добиться прямого (сократительного) и непрямого(повышенного синтеза простагландина) действий окситоцина на матку. Поэтому предполагается, что блокатор или антагонист окситоцина является более эффективным для лечения преждевременной родовой деятельности, чем современные схемы лечения. Атосибан (т.е. окситоцин, 1-(3-меркаптопропановая кислота)-2-(О-этил-D-тирозин)-4-L-треонин-8L-орнитин) представляет собой циклический пентапептид, который является наиболее известным антагонистом ОТ (WO 9501368, Ferring AB; J. Reprod. Fertil., 101 (2), 345-52 (English) 1994; Am. J. Obstet. Gynecol., 170 (2), 474-8 (English) 1994). Главным препятствием для применения пептидных антагонистов,подобных атосибану, является проблема низкой пероральной биодоступности в результате деградации в кишечнике. Поэтому их необходимо вводить парентерально. Также в WO 96/22775 и патенте США 5756497 (Merck) в качестве антагонистов рецепторов ОТ раскрываются бензоксазинилпиперидины или бензоксазиноны. Инданилпиперидины и толилпиперазины описаны Evans et al. в J. Med. Chem., 35, 3919 (1992) в качестве антагонистов ОТ, которые можно доставлять перорально. В настоящее время обнаружено, что соединения согласно данному изобретению являются антагонистами окситоцина и связываются с рецептором окситоцина. В том случае, когда рецептор окситоцина связывается соединениями согласно данному изобретению, окситоцин оказывается антагонизированным посредством того, что блокировано его взаимодействие с рецептором и таким образом он оказывается неспособным проявлять свои биологические и фармакологические действия. Таким образом, соединения согласно данному изобретению полезны при лечении и профилактике преждевременной родовой деятельности и преждевременных родов. Соединения также полезны для остановки родовой деятельности для родоразрешения посредством кесарева сечения. В частности, соединения согласно данному изобретению применимы при лечении и профилактике окситоцин-связанных нарушений у животных, предпочтительно у млекопитающих и особенно у человека. Другой целью данного изобретения является обеспечение способа антагонизации функций окситоцина при патологическом состоянии у млекопитающих. Целью данного изобретения также является разработка способа профилактики или лечения окситоцинсвязанных расстройств в виде преждевременной родовой деятельности посредством антагонизации связывания окситоцина с его рецептором. Соединения согласно данному изобретению также применимы при лечении дисменореи, которую можно определить как цикличную боль, связанную с менструацией во время циклов овуляции. Считается, что боль является результатом сокращений матки и ишемии, вероятно опосредованных влиянием простагландинов, продуцируемых в секретирующем эндометрии. За счет блокирования обоих, прямого и непрямого, действий окситоцина на матку антагонист окситоцина является более эффективным для лечения дисменореи, чем современные схемы лечения. Описание изобретения В следующих параграфах даны определения различных химических фрагментов, которые составляют соединения согласно изобретению, и эти определения предназначены для применения единообразно по всему описанию и в формуле изобретения, если особое четко указанное определение не дает более широкого определения.C1-С 6-Алкил относится к моновалентным алкильным группам, имеющим от 1 до 6 атомов углерода. Примерами указанного термина являются группы, такие как метил, этил, н-пропил, изопропил, нбутил, изобутил, трет-бутил, н-гексил и тому подобные. Арил относится к ненасыщенной ароматической карбоциклической группе из 6-14 атомов углерода, имеющей одно кольцо (например, фенил) или множество конденсированных колец (например,нафтил). Предпочтительный арил включает фенил, нафтил, фенантренил и тому подобное.C1-С 6-Алкиларил относится к C1-С 6-алкильным группам, имеющим арильный заместитель, включая бензил, фенэтил и тому подобное. Гетероарил относится к моноциклической гетероароматической или бициклической или трициклической гетероароматической группе с конденсированными кольцами. Конкретные примеры гетероароматических групп включают необязательно замещенный пиридил, пирролил, фурил, тиенил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,3 оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,3,4-триазинил, 1,2,3 триазинил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил, бензотиенил, бензотриазолил, изобензотиенил, индолил, изоиндолил, 3 Н-индолил, бензимидазолил, имидазо[1,2-а]пиридил, бензотиазолил,бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил, нафтиридинил, пиридо[3,4-b]пиридил, пиридо[3,2-b]пиридил, пиридо[4,3-b]пиридил, хинолил, изохинолил, тетразолил,5,6,7,8-тетрагидрохинолил, 5,6,7,8-тетрагидроизохинолил, пуринил, птеридинил, карбазолил, ксантенил или бензохинолил.C1-С 6-Алкилгетероарил относится к C1-С 6-алкильным группам, имеющим гетероарильный заместитель, включая 2-фурилметил, 2-тиенилметил, 2-(1 Н-индол-3-ил)этил и тому подобное. С 1-С 6-Алкенил относится к алкенильным группам, предпочтительно имеющим от 2 до 6 атомов углерода и имеющим по меньшей мере 1 или 2 центра алкенильной ненасыщенности. Предпочтительные алкенильные группы включают этенил (-СН=СН 2) , н-2-пропенил (аллил, -СН 2 СН=СН 2) и тому подоб-2 006212 ное. С 1-С 6-Алкениларил относится к С 2-С 6-алкенильным группам, имеющим арильный заместитель,включая 2-фенилвинил и тому подобное. С 1-С 6-Алкенилгетероарил относится к С 2-С 6-алкенильным группам, имеющим гетероарильный заместитель, включая 2-(3-пиридинил)винил и тому подобное. С 2-С 6-Алкинил относится к алкинильным группам, предпочтительно имеющим от 2 до 6 атомов углерода и имеющим по меньшей мере 1-2 центра алкинильной ненасыщенности, предпочтительные алкинильные группы включают этинил (-ССН) , пропаргил (-СН 2 ССН) и тому подобное. С 2-С 6-Алкиниларил относится к С 2-С 6-алкинильным группам, имеющим арильный заместитель,включая фенилэтинил и тому подобное. С 2-С 6-Алкинилгетероарил относится к С 2-С 6-алкинильным группам, имеющим гетероарильный заместитель, включая 2-тиенилэтинил и тому подобное. С 3-С 6-Циклоалкил относится к насыщенной карбоциклической группе из 3-8 атомов углерода,имеющей одно кольцо (например, циклогексил) или множество конденсированных колец (например,норборнил). Предпочтительные циклоалкильные группы включают циклопентил, циклогексил, норборнил и тому подобное.C1-С 6-Алкилциклоалкил относится к C1-С 6-алкильным группам, имеющим циклоалкильный заместитель, включая циклогексилметил, циклопентилпропил, и тому подобное. Гетероциклоалкил относится к С 3-С 8-циклоалкильной группе согласно приведенному выше определению, в которой до 3 атомов углерода заменены гетероатомами, выбранными из группы, состоящей из О, S, NR, при этом R означает водород или метил. Предпочтительные гетероциклоалкильные группы включают пирролидин, пиперидин, пиперазин, 1-метилпиперазин, морфолин и тому подобное. С 1-С 6-Алкилгетероциклоалкил относится к C1-С 6-алкильным группам, имеющим гетероциклоалкильный заместитель, включая 2-(1-пирролидинил)этил, 4-морфолинилметил, (1-метил-4-пиперидинил) метил и тому подобное. Карбоксильная группа относится к группе -С(О)ОН. С 1-С 6-Алкилкарбоксильная группа относится к C1-С 6-алкильным группам, имеющим карбоксильный заместитель, включая 2-карбоксиэтил и тому подобное. Ацил относится к группе -C(O)R, где R включает Н, С 1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6 алкинил, С 3-С 8-циклоалкил, гетероциклоалкилгетероциклоалкил, арил, гетероарил, C1-С 6 алкиларил или C1-С 6-алкилгетероарил, С 2-С 6-алкениларил, С 2-С 6-алкенилгетероарил, С 2-С 6 алкиниларил, С 2-С 6-алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-С 6-алкилгетероциклоалкил.C1-С 6-Алкилацил относится к C1-С 6-алкильным группам, имеющим ацильный заместитель, включая 2-ацетилэтил и тому подобное. Арилацил относится к арильным группам, имеющим ацильный заместитель, включая 2 ацетилфенил и тому подобное. Гетероарилацил относится к гетероарильным группам, имеющим ацильный заместитель, включая 2-ацетилпиридил и тому подобное. С 3-С 8-(гетеро)циклоалкилацил относится к 3-8-членным циклоалкильным или гетероциклоалкильным группам, имеющим ацильный заместитель. Ацилоксигруппа относится к группе -OC(O)R, где R включает Н, C1-С 6-алкил, С 2-С 6 алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкилгетероциклоалкил, арил, гетероарил, C1-С 6-алкиларил или С 1-С 6-алкилгетероарил, С 2-С 6-алкениларил, С 2-С 6-алкенилгетероарил, С 2-С 6-алкиниларил, С 2-С 6-алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-С 6-алкилгетероциклоалкил.C1-С 6-Алкилациламиногруппа относится к C1-С 6-алкильным группам, имеющим ациламинозаместитель, включая 2-(пропиониламино)этил и тому подобное. Уреидогруппа относится к группе -NRC(О)NR'R", где каждый R, R', R" независимо означает водород, C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил,арил, гетероарил, C1-С 6-алкиларил или C1-С 6-алкилгетероарил, С 2-С 6-алкениларил, С 2-С 6 алкенилгетероарил, С 2-С 6-алкиниларил, С 2-С 6-алкинилгетероарил, C1-С 6-алкилциклоалкил, C1 С 6-алкилгетероциклоалкил и где R' и R" вместе с атомом азота, с которым они связаны, необязательно могут образовывать 3-8-членное кольцо гетероциклоалкила.C1-С 6-алкилуреидогруппа относится к C1-С 6-алкильным группам, имеющим уреидозаместитель,включая 2-(N'-метилуреидо)этил и тому подобное. Карбамат относится к группе -NRC(O)OR', где каждый R, R' независимо означает водород, С 1 С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил, C1-С 6-алкиларил или C1-С 6-алкилгетероарил, С 2-С 6-алкениларил, С 2-С 6-алкенилгетероарил, С 2-С 6-алкиниларил, С 2-С 6 алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-С 6-алкилгетероциклоалкил. Аминогруппа относится к группе -NRR', где каждый R, R' независимо означает водород, C1-С 6 алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил, C1-С 6-алкиларил или C1-С 6-алкилгетероарил, С 2-С 6-алкениларил, С 2-С 6-алкенилгетероарил, С 2-С 6-алкиниларил, С 2-С 6-алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-С 6-алкилгетероциклоалкил и где R и R' вместе с атомом азота, с которым они связаны, необязательно могут образовывать 3-8-членное кольцо гетероциклоалкила.C1-С 6-Алкиламиногруппа относится к C1-С 6-алкильным группам, имеющим аминозаместитель,включая 2-(1-пирролидинил)этил и тому подобное. Аммоний относится к положительно заряженной группе -N+RR'R", где каждый R, R', R" независимо означает С 1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил, C1-С 6-алкиларил или C1-С 6-алкилгетероарил, С 2-С 6-алкениларил, С 2-С 6-алкенилгетероарил, С 2-С 6-алкиниларил, С 2-С 6-алкинилгетероарил, C1-С 6-алкилциклоалкил, С 1-С 6-алкилгетероциклоалкил, и где R и R' вместе с атомом азота, с которым они связаны, необязательно могут образовывать 3-8-членное кольцо гетероциклоалкила.C1-С 6-Алкиламмоний относится к С 1-С 6-алкильным группам, имеющим аммониевый заместитель,включая 2-(1-пирролидинил)этил и тому подобное. Ионизируемый фрагмент относится к фрагменту, который можно превратить в соль, например, с помощью протонирования. Амино- или сульфонильные фрагменты являются примерами ионизируемых/протонируемых фрагментов. Галоген относится к атомам фтора, хлора, брома и йода. Сульфонилоксигруппа относится к группе -OSO2-R, где R выбран из Н, C1-С 6-алкила, C1-С 6 алкила, замещенного галогенами, например, группа -OSO2-CF3, С 2-С 6-алкенила, С 2-С 6-алкинила,С 3-С 8-циклоалкила, гетероциклоалкила, арила, гетероарила, C1-С 6-алкиларила или C1-С 6 алкилгетероарила, С 2-С 6-алкениларила, С 2-С 6-алкенилгетероарила, С 2-С 6-алкиниларила, С 2-С 6 алкинилгетероарила, С 1-С 6-алкилциклоалкила, C1-С 6-алкилгетероциклоалкила.C1-С 6-Алкилсульфинил относится к C1-С 6-алкильным группам, имеющим сульфинильный заместитель, включая 2-(метилсульфинил)этил и тому подобное. Сульфанил относится к группам -S-R, где R включает Н, C1-С 6-алкил, C1-С 6-алкил, замещенный галогенами, например, группа -SO-CF3, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил,гетероциклоалкил, арил, гетероарил, C1-С 6-алкиларил или C1-С 6-алкилгетероарил, С 2-С 6 алкениларил, С 2-С 6-алкенилгетероарил, С 2-С 6-алкиниларил, С 2-С 6-алкинилгетероарил, C1-С 6 алкилциклоалкил, C1-С 6-алкилгетероциклоалкил. Предпочтительные сульфанильные группы включают метилсульфанил, этилсульфанил и тому подобное.C1-С 6-Алкиламиносульфонил относится к C1-С 6-алкильным группам, имеющим аминосульфонильный заместитель, включая 2-(циклогексиламиносульфонил)этил и тому подобное. Замещенный или незамещенный: если особо не ограничено определением отдельного заместителя, указанные выше группы, подобные алкильной, алкенильной, алкинильной, арильной и гетероарильной и т.д. группам, необязательно могут быть замещены 1-5 заместителями, выбранными из группы, состоящей из C1-С 6-алкила, С 2-С 6-алкенила, С 2-С 6-алкинила, циклоалкила, гетероциклоалкила, C1-С 6-алкиларила, C1-С 6-алкилгетероарила, С 1-С 6-алкилциклоалкила, C1-С 6 алкилгетероциклоалкила, аминогруппы, аммония, ацила, ацилоксигруппы, ациламиногруппы, аминокарбонила, алкоксикарбонила, уреидогруппы, карбамата, арила, гетероарила,сульфинила, сульфонила, алкоксигруппы, сульфанила, галогена, карбоксильной группы,тригалогенметила, цианогруппы, гидроксильной группы, меркаптогруппы, нитрогруппы и тому подобного. Альтернативно, указанное замещение также может включать случаи, когда соседние заместители были подвергнуты реакции замыкания кольца, особенно в тех случаях, когда вовлечены смежные функциональные заместители, таким образом образуя, например, лактамы, лактоны, циклические ангидриды,а также ацетали, тиоацетали, аминали, образованные при замыкании кольца, например, при попытке получить защитную группу. Фармацевтически приемлемые соли или комплексы относится к солям или комплексам идентифицированных ниже соединений формулы, которые сохраняют требуемую биологическую активность. Примеры таких солей включают, но не ограничены указанным, кислотно-аддитивные соли, образованные с неорганическими кислотами (например, хлористоводородной кислотой, бромисто-водородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и тому подобной), и соли, образованные с органическими кислотами, такими как уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, фумаровая кислота, малеиновая кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, памовая кислота, альгиновая кислота, полиглутаминовая кислота,нафталинсульфоновая кислота, нафталиндисульфоновая кислота, метансульфоновая кислота и полигалактуроновая кислота. Указанные соединения также можно вводить в виде фармацевтически приемлемых четвертичных солей, известных специалисту в данной области, которые, в частности, включают четвертичную соль аммония формулы -NR, R', R"+Z-, где R, R' , R" независимо означают водород, алкил или бензил, C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, C1-С 6-алкиларил, C1-С 6-алкилгетероарил, циклоалкил, гетероциклоалкил, и Z означает противоион, включая хлорид, бромид, йодид, -О-алкил, толуолсульфонат, метилсульфонат, сульфонат, фосфат или карбоксилат (такой как бензоат, сукцинат, ацетат,гликолат, малеат, малат, фумарат, цитрат, тартрат, аскорбат, циннамат, манделат и дифенилацетат). Фармацевтически активное производное относится к любому соединению, которое при введении реципиенту способно прямо или косвенно обеспечивать раскрытую в данном описании активность. Энантиомерный избыток (ее) относится к продуктам, которые получают посредством асимметричного синтеза, т.е. синтеза с использованием нерацемических исходных веществ и/или реагентов или синтеза, включающего в себя по меньшей мере одну энантиоселективную стадию, получая при этом из-5 006212 быток одного энантиомера, по меньшей мере, порядка примерно 52% ее. В отсутствие асимметричного синтеза обычно получают рацемические продукты, которые, однако, также обладают заявленной в изобретении активностью в качестве антагонистов OT-R. Общая формула (I) согласно данному изобретению также включает ее таутомеры, ее геометрические изомеры, ее оптически активные формы в виде энантиомеров, диастереомеров и ее рацемические формы, а также ее фармацевтически приемлемые соли. Предпочтительными фармацевтически приемлемыми солями соединения формулы (I) являются кислотно-аддитивные соли, образованные с фармацевтически приемлемыми кислотами, подобные следующим солям: гидрохлориду, гидробромиду, сульфату или бисульфату, фосфату или гидрофосфату, ацетату, бензоату, сукцинату, фумарату, малеату, лактату,цитрату, тартрату, глюконату, метансульфонату, бензолсульфонату и паратолуолсульфонату. Один аспект данного изобретения включает оксадиазольные производные пирролидина и тиадиазольные производные пирролидина формулы (I). Оксадиазольные и тиадиазольные производные пирролидина согласно формуле I подходят для того, чтобы модулировать, в частности, ингибировать функцию OT-R и, более конкретно, для того, чтобы антагонизировать рецептор окситоцина. В том случае, когда рецептор окситоцина связывается соединениями согласно формуле I, окситоцин оказывается антагонизированным посредством того, что блокировано его взаимодействие с рецептором и таким образом он оказывается неспособным проявлять свои биологические или фармакологические действия. Таким образом, соединения согласно данному изобретению, в частности, полезны при лечении и/или профилактике окситоцин-связанных расстройств у млекопитающих и, в частности, у человека. Соединениями согласно данному изобретению являются соединения формулы I Указанная формула также включает ее геометрические изомеры, ее оптически активные формы в виде энантиомеров, диастереомеров и ее рацемические формы, а также ее фармацевтически приемлемые соли. Предпочтительными фармацевтически приемлемыми солями соединения (I) являются кислотноаддитивные соли, образованные с фармацевтически приемлемыми кислотами, подобные следующим солям: гидрохлориду, гидробромиду, сульфату или бисульфату, фосфату или гидрофосфату, ацетату,бензоату, сукцинату, фумарату, малеату, лактату, цитрату, тартрату, глюконату, метансульфонату (мезилату), бензолсульфонату и паратолуолсульфонату. В указанной формуле (I), А выбирают из группы, состоящей из -(С=O)-, -(С=O)-O-, -SO2-, -SO2NH-,-C(=NH)-, -(C=O)-NH-, -(C=S)-NH, -CH2-. Более предпочтительно, А является карбонильной группой. В является незамещенным или замещенным оксадиазольным или тиадиазольным кольцом.R1 выбирают из группы, включающей или состоящей из незамещенного или замещенного C1-С 6 алкила, незамещенного или замещенного С 2-С 6-алкенила, незамещенного или замещенного С 2-С 6 алкинила, незамещенного или замещенного арила, незамещенного или замещенного гетероарила, незамещенного или замещенного C1-С 6-алкиларила, незамещенного или замещенного C1-С 6-алкилгетероарила, R1 может образовывать с атомом O, с которым он связан, 3-8-членное замещенное или незамещенное, насыщенное или ненасыщенное гетероциклическое кольцо, которое может содержать 1-2 дополнительных гетероатома, выбранных из N, S и O, и которое необязательно конденсировано с арилом,гетероарилом или 3-8-членным насыщенным или ненасыщенным циклоалкильным кольцом. Предпочтительно, R1 является Н или C1-С 3-алкилом, наиболее предпочтительно метильной группой.R2 выбирают из группы, включающей или состоящей из незамещенного или замещенного C1-С 6 алкила, незамещенного или замещенного С 2-С 6-алкенила, незамещенного или замещенного С 2-С 6 алкинила, незамещенного или замещенного арила, незамещенного или замещенного гетероарила, незамещенного или замещенного, насыщенного или ненасыщенного 3-8-членного циклоалкила, ацила, незамещенного или замещенного C1-С 6-алкиларила, незамещенного или замещенного C1-С 6-алкилгетероарила, при этом указанные циклоалкильные или арильные или гетероарильные группы могут быть конденсированы с 1-2 дополнительными циклоалкильными или арильными или гетероарильными группами. Более предпочтительной является арильная, в частности, фенильная группа, которая необязательно замещена, например, дополнительной фенильной группой (таким образом, давая бифенильный фрагмент).R3, R4, R5 и R6 независимо друг от друга выбирают из группы, состоящей из водорода, галогена, C1 С 6-алкила, C1-С 6-алкоксигруппы. Предпочтительно каждый из них является Н. Предпочтительными производными пирролидина являются соединения согласно формуле I, где R1 выбирают из группы, состоящей из Н или -C1-С 6-алкила, в частности, -СН 3, А является -(С=O)-, R2 является замещенным или незамещенным арилом, замещенной или незамещенной гетероарильной группой, в частности, группой бифенила.-6 006212 Согласно предпочтительному варианту заместитель В является 1,2,4-оксадиазольным заместителем,который может быть присоединен к кольцу пирролидина следующими способами (IIа) или (IIb) : В указанных формулах (На) и (IIb), R7 выбирают из группы, включающей или состоящей из водорода, сульфонила, аминогруппы, незамещенного или замещенного C1-С 6-алкила, незамещенного или замещенного С 2-С 6-алкенила, незамещенного или замещенного С 2-С 6-алкинила, где указанные цепи алкила, алкенила, алкинила могут прерываться гетероатомом, выбранным из N, О или S, незамещенного или замещенного арила, незамещенного или замещенного гетероарила, незамещенного или замещенного насыщенного или ненасыщенного 3-8-членного циклоалкила, незамещенного или замещенного гетероциклоалкила, где указанные группы циклоалкила, гетероциклоалкила, арила или гетероарила могут быть конденсированы с 1-2 дополнительными группами циклоалкила, гетероциклоалкила, арила или гетероарила, ацильного фрагмента, незамещенного или замещенного С 1-С 6-алкиларила, незамещенного или замещенного C1-С 6-алкилгетероарила, незамещенного или замещенного С 2-С 6-алкениларила, незамещенного или замещенного С 2-С 6-алкенилгетероарила, незамещенного или замещенного С 2-С 6-алкиниларила,незамещенного или замещенного С 2-С 6-алкинилгетероарила, незамещенного или замещенного C1-С 6 алкилциклоалкила, незамещенного или замещенного C1-С 6-алкилгетероциклоалкила, незамещенного или замещенного С 2-С 6-алкенилциклоалкила, незамещенного или замещенного С 2-С 6-алкенилгетероциклоалкила, незамещенного или замещенного С 2-С 6-алкинилциклоалкила, незамещенного или замещенного С 2-С 6-алкинилгетероциклоалкила, замещенного или незамещенного алкоксикарбонила, замещенного или незамещенного аминокарбонила, замещенной или незамещенной C1-С 6-алкилкарбоксильной группы, замещенного или незамещенного C1-С 6-алкилацила, замещенного или незамещенного арилацила, замещенного или незамещенного гетероарилацила, замещенного или незамещенного С 3-С 8(гетеро)циклоалкилацила, незамещенной или замещенной C1-С 6-алкилацилоксигруппы, незамещенной или замещенной C1-С 6-алкилалкоксигруппы, незамещенного или замещенного C1-С 6-алкилалкоксикарбонила, незамещенного или замещенного C1-С 6-алкиламинокарбонила, незамещенной или замещенной C1-С 6-алкилациламиногруппы, ациламиногруппы, незамещенной или замещенной C1-С 6-алкилуреидогруппы, замещенного или незамещенного C1-С 6-алкилкарбамата, незамещенной или замещенной C1 С 6-алкиламиногруппы, незамещенного или замещенного C1-С 6-алкиламмония, незамещенной или замещенной C1-С 6-алкилсульфонилоксигруппы, незамещенного или замещенного C1-С 6-алкилсульфонила,незамещенного или замещенного C1-С 6-алкилсульфинила, незамещенного или замещенного C1-С 6 алкилсульфанила, незамещенной или замещенной C1-С 6-алкилсульфониламиногруппы, незамещенного или замещенного С 1-С 6-алкиламиносульфонила, гидроксильной группы, галогена, цианогруппы. Согласно предпочтительному варианту, R7 является заместителем, содержащим ионизируемый(особенно протонируемый) фрагмент. В частности, R7 может быть выбран из группы, состоящей из карбокси- или аминофрагмента. Альтернативно, R7 может быть выбран из группы, состоящей из любых из указанных выше заместителей, которые несут, по меньшей мере, один карбокси- или аминофрагмент. Предпочтительным ионизируемым (протонируемым) фрагментом является циклический третичный амин (являясь при этом гетероциклоалкилом). Более предпочтительными являются С 1-С 6-алкиламиногруппа, гетероциклоалкил, подобный пиперазинам или пиперидинам, C1-С 6-алкилгетероциклоалкил, аминокарбонил, С 1-С 6-алкиламинокарбонил,C1-С 6-алкилациламиногруппа, С 1-С 6-алкилсульфонил, С 1-С 6-алкилкарбоксильная группа. Наиболее предпочтительными являются диметиламинометил, 2-(диметиламино)этил, 1-метил-3-пиперидинил, (4 ацетил-1-пиперазинил)метил. Согласно другому варианту заместитель В является 1,3,4-оксадиазолом формулы (IV) или его таутомером формулы (III):X в указанных формулах (III) и (IV) означает О или S, где в случае формулы IV X также может означать связь. В том случае, когда X является О или S и R8 является водородом, соединения формулы IV представляют собой соответствующие таутомеры формулы III.R8 в формуле (IV) выбирают из группы, включающей или состоящей из водорода, незамещенного или замещенного C1-С 6-алкила, незамещенного или замещенного С 2-С 6-алкенила, незамещенного или замещенного С 2-С 6-алкинила, незамещенного или замещенного арила, незамещенного или замещенного-7 006212 гетероарила, незамещенного или замещенного насыщенного или ненасыщенного 3-8-членного циклоалкила, необязательно содержащего, по меньшей мере, один гетероатом (например, от 1 до 3), выбранный из N, О, S, ацильного фрагмента, незамещенного или замещенного C1-С 6-алкиларила, незамещенного или замещенного C1-С 6-алкилгетероарила, незамещенного или замещенного С 2-С 6-алкениларила, незамещенного или замещенного С 2-С 6-алкенилгетероарила, замещенного или незамещенного алкоксикарбонила,амида карбоновой кислоты, замещенной или незамещенной C1-С 6-алкоксигруппы, замещенной или незамещенной арилоксигруппы, замещенной или незамещенной гетероарилоксигруппы, галогена, цианогруппы, замещенного или незамещенного C1-С 6-алкилкарбонила, замещенного или незамещенного арилкарбонила или гетероарилкарбонила, замещенного или незамещенного насыщенного или ненасыщенногоC4-С 8-циклоалкилкарбонила, где указанные группы циклоалкила или арила или гетероарила могут быть конденсированы с 1-2 дополнительными циклоалкильными или арильными или гетероарильными группами и где указанная цепь алкила, алкенила, алкинила может быть прервана гетероатомом, выбранным из N, О или S. В частности, более предпочтительными производными пирролидина являются такие соединения согласно формуле I, в которых А является -(С=O), R1 означает C1-С 6-алкильную группу, R2 означает либо арильную группу, либо гетероарил, каждый из R3, R4, R5 и R6 является Н и В является оксадиазолом согласно формулам IIа, IIb, III или IV. Наиболее предпочтительными производными пирролидина являются такие соединения согласно формуле I, в которых А является -(С=O), R1 является метильной группой, R означает либо (не)замещенную арильную группу, либо (не)замещенный гетероарил, каждый из R3, R4, R5 и R6 является Н и В является оксадиазолом согласно формулам IIа, IIb, III и IV, в частности, 1,2,4-оксадиазолом формул IIа илиIIb. Наиболее предпочтительными производными пирролидина являются такие соединения, согласно формуле I, в которых А является -(С=O), R1 означает метильную группу, R2 означает бифенильную группу, каждый из R3, R4, R5 и R6 является Н и В является оксадиазолом согласно формуле IIа, IIb, III и IV, в частности, 1,2,4-оксадиазолом формул IIа или IIb. Соединения формулы I могут содержать один или несколько асимметричных центров и поэтому могут существовать в виде энантиомеров или диастереомеров. Следует понимать, что изобретение включает как смеси, так и отдельные индивидуальные изомеры или энантиомеры соединений формулы I. В особенно предпочтительном варианте производные пирролидина согласно формуле I получают в энантиомерном избытке, составляющем, по меньшей мере, 52% ее, предпочтительно, по меньшей мере, 9298% ее. Конкретные примеры соединений формулы I включают следующие соединения: О-метилоксим(3EZ,5S)-5-5-[(1S)-1-амино-2-трет-бутоксиэтил]-1,2,4-оксадиазол-3-ил-1-([1,1'бифенил]-4-илкарбонил)-3-пирролидинона; трет-бутил 4-5-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4 оксадиазол-3-ил-1-пиперидинкарбоксилат; О-метилоксим (3EZ, 5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[5-(1-пиперазинилметил)-1,2,4-оксадиазол-3-ил)-3-пирролидинона; трет-бутил (4S)-4-3-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]1,2,4-оксадиазол-5-ил-4-[(трет-бутоксикарбонил)амино]бутаноат; 4-[(2S,4EZ)-2-(5-[(трет-бутоксикарбонил)амино]метил-1,2,4-оксадиазол-3-ил)-4-(метоксиимино) пирролидинил]карбонил-1,1'-бифенил; трет-бутил 2-3-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4 оксадиазол-5-илэтилкарбамат; 2-5-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол 3-илэтиламиноацетат; О-метилоксим (3 Е,5S)-1-[(2',4'-дифтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5 ил)-3-пирролидинона; О-метилоксим (3EZ,5S)-1-[(2',4'-дифтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол 5-ил)-3-пирролидинона; 4-[(2S,4EZ)-2-(5-(1S)-2-трет-бутокси-1-[(трет-бутоксикарбонил)амино]этил-1,2,4-оксадиазол-3 ил)-4-(метоксиимино)пирролидинил]карбонил-1,1'-бифенил; О-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-(5-винил-1,2,4-оксадиазол-3-ил)-3-пирролидинона; 4-[(2S,4EZ)-2-(5-(1S,2R)-2-трет-бутокси-1-[(трет-бутоксикарбонил)амино]пропил-1,2,4-оксадиазол-3-ил)-4-(метоксиимино)пирролидинил]карбонил-1,1'-бифенил; О-метилоксим (3Z,5S)-1-[(2',4'-дифтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5 ил)-3-пирролидинона; трет-бутил 4-(3-[(2S,4EZ)-l-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4 оксадиазол-5-илметил)-1-пиперазинкарбоксилат. Следующий аспект данного изобретения относится к применению оксадиазольных или тиадиазольных производных пирролидина согласно формуле I в качестве лекарственного средства, в частности, для лечения и/или профилактики преждевременной родовой деятельности, преждевременных родов, для остановки родовой деятельности перед родоразрешением посредством кесарева сечения и дисменореи. Предпочтительно, соединения согласно формуле I подходят для модулирования функции ОТ и таким образом специфично осуществляют лечение и/или профилактику расстройств, которые опосредованы- 11006212 рецептором окситоцина. Указанное лечение включает модулирование - особенно понижающая регуляция или антагонизация - рецептора окситоцина. Более конкретно, соединения согласно данному изобретению полезны для лечения преждевременной родовой деятельности, дисменореи и для остановки родовой деятельности перед родоразрешением посредством кесарева сечения. Следующим объектом данного изобретения является способ получения производных пирролидина согласно формуле I. Производные пирролидина, приведенные в качестве примеров в данном изобретении, можно получить из легко доступных исходных веществ, используя следующие общие способы и процедуры. Будет понятно, что в тех случаях, когда приведены типичные или предпочтительные экспериментальные условия (т.е. температуры реакции, время, моли реагентов, растворители и т.д.), также можно использовать другие экспериментальные условия, если не оговорено особо. Оптимальные условия реакции могут варьировать в зависимости от конкретных используемых реагентов или растворителей, но такие условия может определить специалист в данной области с помощью рутинных процедур оптимизации. В общем, производные пирролидина согласно общей формуле I можно получить несколькими способами, используя методики как для раствора, так и для твердой фазы. Согласно одному способу производные пирролидина согласно общей формуле I, где заместителем В является 1,2,4-оксадиазол формулы (IIа), получают из соответствующих соединений карбоновых кислот V и амидоксимов VI, где заместители R1-R7 и А имеют значения, определенные выше, с использованием хорошо известных методик для растворов, таких как описанные в примерах и показанные на схеме 1 ниже. Схема 1 Амидоксимные компоненты VI либо получают из коммерческих источников, либо получают из соответствующих нитрилов VII обработкой последних гидроксиламином при стандартных условиях, хорошо известных специалисту в данной области, таких как условия, описанные в примерах и показанные на схеме 2 ниже. Схема 2 Нитрильные компоненты VII либо получают из коммерческих источников, либо получают, например, из соответствующих карбоновых кислот VIII, как показано на схеме 3, любым из способов взаимопревращения функциональных групп, хорошо известных специалисту в данной области, используемых для превращения карбоновой кислоты в соответствующий нитрил. Примеры включают (i) восстановление карбоновой кислоты VIII в соответствующий карбальдегид с последующим превращением в соответствующий оксим и дегидратацией последнего до соответствующего нитрила VII с использованием,например, N,N'-карбонилдиимидазола или подобных реагентов, или (ii) превращение карбоновой кислоты VIII в соответствующий первичный карбоксамид с последующей дегидратацией до соответствующего нитрила VII с использованием стандартных условий, хорошо известных специалисту в данной области,таких как условия, описанные далее в примерах. Схема 3 Пирролидин-2-карбоновые кислоты V (см. схему 1), где заместители R1-R7 и А имеют значения, определенные выше, можно получить из соединений общей формулы IX в результате реакции с замещенными гидроксиламинами X, используя стандартные методики синтеза, которые описаны далее в примерах и показаны на схеме 4. Схема 4 Соединения формулы X либо получают из коммерческих источников, либо получают из N-Bocгидроксиламина XI и алкилирующих агентов XII (Х=Сl, Вr, I) стандартными способами синтеза, как по- 12006212 казано на схеме 5 и описано далее в примерах. Схема 5 Кето-соединения общей формулы IX, где заместители R1-R7 и А имеют значения, определенные выше, можно получить окислением коммерчески доступного соответствующим образом N-защищенного 4-гидроксипролина XIII, используя стандартные методики синтеза, которые описаны далее в примерах и показаны на схеме 6. Альтернативно, сами соединения общей формулы IX можно получить из соединений формулы V посредством превращения эфира оксима в кетонный фрагмент, например, в условиях мягкого гидролиза, как описано далее в примерах. Если, согласно данному процессу, кето-соединения IX затем снова подвергают воздействию другого гидроксиламинного компонента X, так как показано на схеме 6, то общее превращение VIXV будет соответствовать взаимному обмену R1 во фрагменте эфира оксима соединений общей формулы V. Аналогичное взаимопревращение эфира оксима возможно на уровне конечных соединений общей формулы I (IXIVI) , как показано на схеме 6. Схема 6 Согласно другому способу производные пирролидина согласно общей формуле I, где заместителем В является 1,2,4-оксадиазол формулы (IIb), получают из соответствующих амидоксимных кислотных соединений XV, где заместители R1-R7 и А имеют значения, определенные выше, и карбоновых кислотVIII с использованием хорошо известных методик для растворов, таких как методики, описанные в примерах и показанные на схеме 7 ниже. Схема 7 Амидоксимные компоненты XV получают из соответствующих нитрилов XVI, где заместители R1R и А имеют значения, определенные выше, обработкой последних гидроксиламином при стандартных условиях, хорошо известных специалисту в данной области, таких как условия, описанные в примерах и показанные на схеме 8 ниже. Сами нитрильные компоненты XVI получают, например, из соответствующих карбоновых кислот V, где заместители R1-R7 и А имеют значения, определенные выше, любым из способов взаимопревращения функциональных групп, хорошо известных специалисту в данной области,используемых для превращения карбоновой кислоты в соответствующий нитрил. Примеры включают (i) восстановление карбоновой кислоты V в соответствующий карбальдегид с последующим превращением в соответствующий оксим и дегидратацией последнего до соответствующего нитрила XVI с использованием, например, N,N'-карбонилдиимидазола или подобных реагентов, или (ii) превращение карбоновой кислоты V в соответствующий первичный карбоксамид с последующей дегидратацией до соответствующего нитрила XVI с использованием стандартных условий, хорошо известных специалисту в данной области, таких как условия, описанные далее в примерах. 7 Производные пирролидина согласно общей формуле I, где заместителем В является 1,3,4 оксадиазол формулы III и/или IV, можно получить из соответствующих соединений гидразида XVII, где заместители R1 -R7 и А имеют значения, определенные выше, используя методики для растворов, хорошо известные специалисту в данной области, такие как методики, описанные в примерах и показанные на схеме 9 ниже. Например, соединения формулы I, где заместителем В является 1,3,4-оксадиазол формулыIII, можно получить обработкой соединения XVII с помощью CDI или СS2 в основных условиях, чтобы получить соответствующие продукты, где X означает О или S, соответственно. Альтернативно, гидразидное промежуточное соединение XVII можно обработать TMOF, а затем Р 2 О 5 при кипячении с толуолом, чтобы получить соединения формулы I, где В является IV. Схема 9 Соединения гидразида XVII получают, например, из соответствующих карбоновых кислот V, где заместители R1 -R7 и А имеют значения, определенные выше, через соответствующие сложные метиловые эфиры XVIII и с помощью последующей обработки последних гидразином в стандартных условиях,хорошо известных специалисту в данной области, таких как условия, описанные в примерах и показанные на схеме 10 ниже. Схема 10 Таким образом, соединения общей формулы I, где заместители R1-R8 и А имеют значения, определенные выше, доступны для получения из предшественников общей формулы V/XVIII (см. схемы 1, 7-10 выше). Как правило, указанные предшественники формул V/XVIII исходно будут нести защитную группу для атома азота пирролидинового кольца, такую как Воc, Fmoc или другие, следовательно будут представлять собой V' и/или XVIII' (-A-R2 = защитная группа, PG) , как показано на схеме 11. Для синтеза конечных соединений I, N-защитные группы V' и/или XVIII' обычно удаляют и заменяют подходящимN-заместителем, таким как, например, ацильная группа, группа -C(O)-R2 или -SO2-R2, например, обработкой ацилирующим агентом или сульфонирующим агентом XX. Дополнительными соединениями формулы (XX) являются карбоксилирующие агенты, сульфонирующие агенты, сульфонамидирующие агенты, имидирующие агенты, амидирующие агенты, тиоамидирующие агенты или алкилирующие агенты. Связывание требуемого фрагмента (-A-R2) с атомом азота пирролидина можно осуществить либо после, либо до образования оксадиазольного или тиадиазольного кольца, как показано на схеме 11 (А или В, соответственно) и описано далее в примерах. Наиболее подходящий выбор протокола последовательности синтеза будет зависеть от природы заместителей R1-R8 (в частности, R7). Предпочтительными ацилирующими агентами XX являются хлорангидриды кислот (ХХа), обычно используемые вместе с подходящим основанием - третичным амином, или карбоновая кислота (ХХb), используемая вместе с агентом связывания пептидов, например, DIC или EDC. Соединения формулы I, где А означает -(С=O)-O-, -SO2-, -SO2NH-, -C(=NH)-, -(C=O)-NH,-(C=S)-NH, -CH2-, можно получить, используя соответствующим образом подходящие карбоксилирующие агенты, сульфонирующие агенты, сульфонамидирующие агенты, имидирующие агенты, амидирую- 14006212 щие агенты, тиоамидирующие агенты или алкилирующие агенты, например, сульфонилхлориды, изоцианаты, изотиоцианаты, хлорформиаты, замещенные галоидалкилы или другие, получая, соответственно сульфонамид, мочевину, тиомочеввину, карбамат, замещенные алкил-производные и другие. Схема 11 Согласно следующему общему способу, соединения формулы I можно превратить в альтернативные соединения формулы I' используя подходящие методики защиты/снятия защиты/взаимопревращения функциональных групп, хорошо известные специалисту в данной области, как показано на схеме 12 и описано далее в примерах. Схема 12- 15006212 Согласно еще одному способу производные пирролидина согласно общей формуле I получают, используя новую методику (протокол) твердофазного синтеза, который изображен на схеме 13 и описан далее в примерах. Например, в случае твердофазного синтеза соединений общей структуры I, где В=IIа,N-Boc-защищенное производное пирролидина V подвергают взаимодействию со смолой, несущей линкер, подверженный расщеплению нуклеофильными соединениями, например, со смолой на основеKaiseroxime (оксима Kaiser), используя стандартные условия связывания, опосредованного карбодиимидом, хорошо известные специалисту в данной области. Снятие Вос-защиты с помощью разбавленной ТФУ в DCM, или с помощью BF3OEt2 в разбавленной НОАс в DCM, дает соединения формулы XXIV. Последнее соединение можно обработать ацилирующими агентами общей формулы XX, где заместители А и R2 имеют значения, определенные выше, и LG может быть соответствующей уходящей группой. Предпочтительными ацилирующими агентами XX являются хлорангидриды кислот (ХХа), используемые вместе с основанием - третичным амином, или карбоновые кислоты (ХХb), используемые вместе с агентом связывания пептидов, например, таким как DIC, EDC, TBTU, DECP или другие, чтобы получить продукты общей формулы XXIII. Соединения формулы I, где А отличается от карбонильной функциональной группы, получают заменой соединений формулы XX соединениями, содержащими подходящие функциональные группы, например, сульфонилхлоридами, изоцианатами, изотиоцианатами, хлорформиатами, замещенными галоидалкилами или другими, чтобы получить сульфонамид, мочевину, тиомочевину, карбамат, замещенные алкильные производные или другие, соответственно. Для того, чтобы получить конечные соединения общей формулы I, связь со смолой расщепляют длительной обработкой амидоксимами VI с последующим нагреванием, например, с пиридином. Кружки на схеме 13 означают шарики смолы, с которыми соответствующие соединения связывают во время твердофазного синтеза. Другие производные формулы I получают, используя известные модификации или вариации последовательности реакций, приведенной на схеме 13. Кроме смолы на основе вышеуказанного оксима Kaiser для твердофазного синтеза соединений общей формулы I можно использовать другие подходящие реагенты,особенно смолы, известные специалисту в данной области. Схема 13 Последовательности реакций, изображенные на приведенных выше схемах, дают энантиомерно чистые соединения формулы I в случае использования энантиомерно чистых исходных веществ.(S)-формы коммерчески доступных соединений формул V-VIII, X и/или XX использовали в качестве исходных веществ. Однако последовательности реакций, изображенные на приведенных выше схемах, обычно дают смеси (Е) - и (Z)-изомеров по отношению к заместителям по экзоциклической двойной связи пирролидинового кольца. Во всех исследованных случаях указанные (Е)/(Z)-изомеры можно разделить стандартными хроматографическими способами, хорошо известными специалисту в данной области, такими как- 16006212 высокоэффективная жидкостная хроматография с обращенной фазой (ВЭЖХ) или флэш-хроматография на силикагеле (ФХ). Альтернативно, любой из (Е)/(Z)-изомеров может быть последовательно обогащен избирательной кристаллизацией в соответствующих растворителях или смесях растворителей. Определение абсолютной конфигурации экзоциклической двойной связи осуществляли с использованием ЯМРметодик, хорошо описанных в литературе, которые будут известны специалисту в данной области (для определения конфигурации, например, функциональностей оксима, см., например, E.Breitmaier, W.Voelter Carbon-13 NMR Spectroscopy, 3rd Ed, VCH, 1987, p. 240). Для того, чтобы увеличить общие выходы предпочтительного изомера (обычно (Z)-изомера), менее предпочтительный изомер (обычно (Е)изомер) можно рециркулировать путем намеренной повторной изомеризации в органических растворителях, содержащих следовые количества кислоты, такой как НСl, опять с последующим (Е)/(Z)разделением посредством хроматографии и/или кристаллизации, как показано на схеме 14. Схема 14 В том случае, если указанные выше общие способы синтеза не подходят для получения соединений согласно формуле I и/или необходимых промежуточных соединений для синтеза соединений формулы I,следует использовать подходящие способы получения, известные специалисту в данной области. В общем, пути синтеза любого отдельного соединения формулы I будут зависеть от конкретных заместителей в каждой молекуле и от того, насколько легко доступны необходимые промежуточные соединения; и опять-таки такие факторы оценивают специалисты в данной области. В отношении всех способов защиты, снятия защиты, см. Philip J. Kocienski, в Protecting Groups, Georg Thieme Verlag Stuttgart, New York,1994, и, Theodora W. Greene and Peter G.M. Wuts в Protective Groups in Organic Synthesis, WileyInterscience, 1991. Соединения согласно данному изобретению могут быть выделены в ассоциации с молекулами растворителей путем кристаллизации после выпаривания соответствующего растворителя. Фармацевтически приемлемые кислотно-аддитивные соли соединений формулы I, которые содержат основной центр,можно получить обычным способом. Например, раствор свободного основания можно обработать подходящей кислотой, либо в чистом виде, либо в подходящем растворе, и полученную в результате соль выделить либо фильтрованием, либо выпариванием в вакууме реакционного растворителя. Фармацевтически приемлемые основно-аддитивные соли можно получить аналогичным образом путем обработки раствора соединения формулы I подходящим основанием. Оба типа соли могут быть образованы или подвергнуты взаимопревращению с использованием способов на основе ионообменных смол. Последний аспект данного изобретения относится к применению соединений согласно формуле I для лечения преждевременной родовой деятельности, преждевременных родов, дисменореи, при этом предпочтительно соединения формулы (I) подходят для модулирования рецептора окситоцина, к применению указанных соединений для получения фармацевтических композиций для модулирования рецептора окситоцина, а также композиций, содержащих активные соединения согласно формуле I. Предполагается, что указанное модулирование рецептора окситоцина является подходящим способом лечения преждевременной родовой деятельности, преждевременных родов и дисменореи. Следовательно, фармацевтические композиции, содержащие соединение формулы I и фармацевтически приемлемый носитель,разбавитель или эксципиент, таким образом, также входят в объем данного изобретения. Специалисту в данной области известно все множество таких соединений носителей, разбавителей или эксципиентов,подходящих для приготовления фармацевтической композиции. Данное изобретение также относится к соединениям для применения в качестве лекарственного средства. Соединения согласно изобретению вместе с обычно используемым адъювантом, носителем, разбавителем или эксципиентом можно готовить в форме фармацевтических композиций и их единичных доз,и такую форму можно использовать в виде твердых веществ, таких как таблетки или наполненные капсулы, или жидкостей, таких как растворы, суспензии, эмульсии, эликсиры или наполненные ими капсулы, которые все используются для перорального применения, или в форме стерильных инъецируемых растворов для парентерального (включая подкожное применение). Такие фармацевтические композиции и их единичные дозированные формы могут содержать ингредиенты в обычных пропорциях с или без дополнительных активных соединений или элементов, и такие единичные дозированные формы могут содержать любое подходящее эффективное количество активного ингредиента, соизмеримое с предполагаемым диапазоном суточной дозы, которую необходимо применять. При использовании в качестве фармацевтических средств, производные пирролидина согласно данному изобретению обычно вводят в форме фармацевтической композиции. Такие композиции можно- 17006212 получить способом, хорошо известным в фармацевтической области, и они содержат по меньшей мере одно активное соединение. Обычно соединения согласно данному изобретению вводят в фармацевтически эффективном количестве. Количество реально вводимого соединения обычно будет определять специалист, учитывая имеющие значение обстоятельства, включая состояние, которое необходимо лечить,выбранный путь введения, фактически вводимое соединение, возраст, массу и индивидуальный ответ пациента, тяжесть симптомов у пациента и тому подобное. Фармацевтические композиции согласно данному изобретению можно вводить множеством способов, включая пероральный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный и интраназальный. Композиции для перорального введения могут принимать форму нефасованных жидких растворов или суспензий или нефасованных порошков. Однако в большинстве случаев композиции предоставляются в единичных дозированных формах, чтобы облегчить точное дозирование. Термин единичные дозированные формы относится к физически дискретным единицам, подходящим в качестве единичных доз для человека и других млекопитающих, при этом каждая единица содержит предварительно определенное количество активного вещества, рассчитанное для получения требуемого терапевтического действия, в ассоциации с подходящим фармацевтическим эксципиентом. Обычные единичные дозированные формы включают предварительно заполненные, предварительно измеренные ампулы или шприцы с жидкими композициями или пилюли, таблетки, капсулы или тому подобное в случае твердых композиций. В таких композициях, оксадиазольное производное пирролидина обычно является минорным компонентом (от примерно 0,1 до примерно 50 мас.% или предпочтительно от примерно 1 до примерно 40 мас.%), при этом остальная часть представлена различными наполнителями или носителями и технологическими добавками, помогающими готовить требуемую дозированную форму. Жидкие формы, подходящие для перорального введения, могут содержать подходящие водные или неводные наполнители с буферами, суспендирующими и диспергирующими агентами, красителями,ароматизаторами и тому подобным. Твердые формы могут содержать, например, любой из следующих ингредиентов или соединений сходной природы: связующее вещество, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза, дезинтегрирующий агент, такой как альгиновая кислота, примогель или кукурузный крахмал; лубрикант, такой как стеарат магния; глидант, такой как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматизирующий агент, такой как мята, метилсалицилат или апельсиновый ароматизатор. Инъецируемые композиции обычно основаны на инъецируемом стерильном физиологическом растворе или фосфатно-солевом буфере или других инъецируемых носителях, известных в данной области. Как указано выше, производные пирролидина формулы I в таких композициях обычно являются минорным компонентом, часто в пределах от 0,05 до 10 мас.%, при этом остальная часть представлена инъецируемым носителем и тому подобным. Описанные выше соединения для перорально вводимых или инъецируемых композиций являются только типичными примерами. Другие вещества, а также способы обработки и тому подобное указаны в части 8 Remington's Pharmaceutical Sciences, 17th Edition, 1985, Marck Publishing Company, Easton, Pennsylvania, который включен в данное описание в виде ссылки. Соединения согласно данному изобретению также можно вводить в формах замедленного высвобождения или из систем доставки лекарственного средства с замедленным высвобождением. Описание типичных веществ замедленного высвобождения также можно найти в материалах, включенных вRemington's Pharmaceutical Sciences. Далее данное изобретение будет проиллюстрировано с помощью некоторых примеров, которые не следует рассматривать как ограничивающие объем изобретения. Данные ВЭЖХ, ЯМР и МС, представленные в описанных ниже примерах, получали, как описано ниже. В сопровождающих примерах далее использованы следующие сокращения: мин (минута), ч (час), г (грамм), ммоль (миллимоль), т.пл. (точка плавления), экв. (эквиваленты), мл (миллилитр), мкл (микролитры), мл (миллилитры), ACN (ацетонитрил), Воc (бутоксикарбонил), CDCl3 (дейтерированный хлороформ), CDI (карбонилдиимидазол), сНех(циклогексаны), ДХМ (DCM) (дихлорметан), DECP (диэтилцианофосфонат), DIC (диизопропилкарбодиимид), DMAP (4-диметиламинопиридин), ДМФА (DMF) (диметилформамид), ДМСО (DMSO) (диметилсульфоксид), ДМСО-d6 (дейтерированный диметилсульфоксид), EDC (1-(3-диметиламинопропил)-3-этилкарбодиимид), EtOAc (этилацетат), Et2O (диэтиловый эфир), Fmoc (9-флуоренилметоксикарбонил), HOBt (1-гидроксибензотриазол), смола на основе оксима Kaiser (смола на основе 4 нитробензофеноноксима); K2 СО 3 (карбонат калия), NaH (гидрид натрия), NаНСО 3 (бикарбонат натрия),nBuLi (н-бутиллитий), TBTU (тетрафторборат О-бензотриазолил-N,N,N',N'-тетраметилурония), TEA(триэтиламин), ТФУ (TFA) (трифторуксусная кислота), ТГФ (THF) (тетрагидрофуран), TMOF (триметилортоформиат), MgSO4 (сульфат магния), пет-эфир (петролейный эфир), КТ (комнатная температура). Примеры Промежуточное соединение 1. (2S)-1-(трет-Бутоксикарбонил)-4-оксо-2-пирролидинкарбоновая кислота (ср. схема 6, соединение XIII).(30 г; 0,13 моль) растворяли в ацетоне (1500 мл). В колбу помещали механическую мешалку и раствор энергично перемешивали. Свежеприготовленный раствор 8N хромовой кислоты готовили растворением триоксида хрома (66,7 г; 0,667 моль) в воде (40 мл), добавлением концентрированной серной кислоты(53,3 мл) и добавлением достаточного количества воды, чтобы довести объем раствора до 115 мл. Затем добавляли 8N раствор хромовой кислоты (115 мл) по каплям в течение периода времени, равного 30 мин,при непрерывном энергичном перемешивании, при этом экзотермическую реакцию поддерживали при оптимальной температуре 25 С, используя баню со льдом. После того, как хромовую кислоту добавляли полностью, реакционную смесь перемешивали еще в течение 15 мин, поддерживая оптимальную температуру 25 С. Затем реакционную смесь гасили добавлением метанола (20 мл). Экзотермический эффект контролировали, используя баню со льдом и при необходимости прямое добавление небольшого количества колотого льда прямо в реакционную смесь. Реакционную смесь фильтровали через слой целита и затем концентрировали в вакууме. Затем полученный в результате кислотный раствор экстрагировали этилацетатом (3300 мл) и объединенные органические слои промывали насыщенным раствором соли(2100 мл) . Затем органические слои сушили с помощью сульфата магния и концентрировали в вакууме. Неочищенный продукт перекристаллизовывали из этилацетата, получая белый кристаллический продукт, (2S)-1-(трет-бутоксикарбонил)-4-оксо-2-пирролидинкарбоновую кислоту (22,55 г; 76%). Противоположное промежуточное соединение, (2R)-1-(трет-бутоксикарбонил)-4-оксо-2-пирролидинкарбоновую кислоту, получали, следуя такому же протоколу, исходя из коммерческой (2R,4S)-1-(третбутоксикарбонил) -4-гидрокси-2-пирролидинкарбоновой кислоты. 1 Н ЯМР (360 МГц, CDCl3); 1,4 (м, 9 Н), 2,5-3,0 (м, 2 Н), 3,7-3,9 (м, 2 Н), 4,75 (дд, 1 Н). Промежуточное соединение 2. (2S,4EZ)-1-(трет-бутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновая кислота (ср. схема 4, соединение V). Получали раствор, содержащий (2S)-1-(трет-бутоксикарбонил)-4-оксо-2-пирролидинкарбоновую кислоту (промежуточное соединение 1; 5,0 г; 21 ммоль) и гидрохлорид О-метилгидроксиламина (2,7 г; 32,8 ммоль) в хлороформе (100 мл), содержащем триэтиламин (5,5 г; 55 ммоль). Затем реакционную смесь перемешивали при температуре окружающей среды в течение ночи перед удалением растворителя. Полученную в результате неочищенную реакционную смесь растворяли в этилацетате (150 мл) и быстро промывали 1N HCl (40 мл). Затем кислый слой экстрагировали этилацетатом (320 мл) и объединенные органические слои промывали насыщенным раствором соли, затем сушили над сульфатом магния,фильтровали и растворитель удаляли в вакууме. Требуемый продукт (5,3 г; 94%) выделяли в виде бледно-желтого масла. 1 Н ЯМР (400 МГц, CDCl3); 1.45 (м, 9 Н), 2.8-3.2 (м, 2 Н), 3.9 (с, 3 Н), 4.2 (м, 2 Н), 4.5-4.7 (м, 1 Н). Промежуточное соединение 3. (2S,4EZ)-1-(трет-бутоксикарбонил)-4-(этоксиимино)-2-пирролидинкарбоновая кислота (ср. схема 4, соединение V). Получали раствор, содержащий (2S)-1-(трет-бутоксикарбонил)-4-оксо-2-пирролидинкарбоновую кислоту (промежуточное соединение 1; 5,0 г; 22 ммоль) и гидрохлорид 0-этилгидроксиламина (6,4 г; 65,5 ммоль) в смеси 1:1 пиридина и этанола (100 мл). Реакционную смесь кипятили с обратным холодильником в течение 2,5 ч, затем охлаждали и удаляли растворитель. Остаток растворяли в этилацетате и быстро промывали 1,3N НСl (40 мл). Затем кислый слой экстрагировали этилацетатом (320 мл) и объединенные органические слои промывали насыщенным раствором соли, затем сушили над сульфатом магния,фильтровали и растворитель удаляли в вакууме. Требуемый продукт (5,5 г; 93%) выделяли в виде бледно-желтого масла. 1 Н ЯМР (400 МГц, ДМСО); 1.3 (т, 3 Н), 1.55 (м, 9 Н), 2.9-2.7 (м, 1 Н), 3.4-3.1 (м, 1 Н), 4.1-4.3 (м,4 Н), 4.6 Получали раствор, содержащий (2S)-1-(трет-бутоксикарбонил)-4-оксо-2-пирролидинкарбоновую кислоту (промежуточное соединение 1; 5,0 г; 22 ммоль) и моногидрат гидрохлорида Оаллилгидроксиламина (7,2 г; 65,5 ммоль) в смеси 1:1 пиридина и этанола (100 мл). Реакционную смесь кипятили с обратным холодильником в течение 2,5 ч, затем охлаждали и удаляли растворитель. Остаток растворяли в этилацетате и быстро промывали 1,3N НСl (40 мл). Затем кислый слой экстрагировали этилацетатом (320 мл) и объединенные органические слои промывали насыщенным раствором соли,затем сушили над сульфатом магния, фильтровали и растворитель удаляли в вакууме. Требуемый продукт (5,9 г; 94%) выделяли в виде бледно-желтого масла. 1 Н ЯМР (400 МГц, CDCl3); 1.5 (м, 9 Н), 2.8-3.2 (м, 2 Н), 4.2 (м, 2 Н), 4.5-4.7 (м, 3 Н), 5.25 (м, 2 Н), 5.9 Такой же способ, который использовали при получении промежуточного соединения 2, но исходя из (2S)-1-(трет-бутоксикарбонил)-4-оксо-2-пирролидинкарбоновой кислоты (промежуточное соединение 1) и 1-[(аминоокси)метил]-4-метоксибензола (промежуточное соединение 6), давал указанное в заголовке соединение в виде камеди с выходом 85%. 1 Н ЯМР (400 МГц, ДМСО); 1.5 (м, 9 Н), 2.7-2.9 (м, 1 Н), 3.9 (с, 3 Н), 4.2 (м, 3 Н), 4.6 (м, 1 Н), 5.15 (с,2 Н), 7.1 (д, 2 Н), 7.45 (д, 2 Н). Промежуточное соединение 6. 1-[(Аминоокси)метил]-4-метоксибензол (ср. схема 5, соединение X). Получали раствор N-Boc-гидроксиламина (2,0 г; 17,1 ммоль) в безводном ТГФ (60 мл). Затем добавляли гидрид натрия (1,1 г 60% суспензии в парафиновом масле; 25,7 ммоль) и суспензию перемешивали. Затем к реакционной смеси добавляли каталитическое количество KI, затем осторожно добавляли 4-метоксибензилхлорид (3,2 г; 20,2 ммоль). Затем реакционной смеси давали возможность перемешиваться в течение ночи с последующим удалением растворителя в вакууме. Остаток собирали диэтиловым эфиром (100 мл) и газообразный НСl барботировали в течение 20 мин, вызывая начало осаждения продукта. Колбу закупоривали и оставляли стоять в течение ночи. Затем отфильтровывали продукт в виде не совсем белого воска (выход 39-52% в зависимости от партий). 1 Н ЯМР (400 МГц, D2O); 3.8 (с, 3 Н), 5 (с, 2 Н), 7.0 (д, 2 Н), 7.4 (д, 2 Н). Промежуточное соединение 7. Некоммерческие амидоксимы. Способ A. Например, N'-гидроксиэтанимидамид (ацетамидоксим) (ср. схема 2, соединение VI). 4 5 мл высокоочищенного ацетонитрила добавляли к 90 мл смеси 50% гидроксиламина/50% воды(мас./мас.) и перемешивали магнитной мешалкой при 25 С. В большинстве случаев отделялся кристаллический N'-гидроксиэтанимидамид. Смесь перемешивали в течение 24 ч при комнатной температуре до полного образования кристаллов и на следующий день фильтровали. В тех случаях, когда в начале не происходило отделение твердого вещества, отбирали небольшое количество раствора, выпаривали и образованные кристаллы использовали для затравки основного раствора. Продукт очищали следующим образом: кристаллы отфильтровывали и затем растворяли в неполярном растворителе (перфторгексан) при нагревании и охлаждали в течение ночи при температуре окружающей среды для перекристаллизации. Затем кристаллическое вещество отфильтровывали и промывали перфторгексаном. Требуемый продукт, N'-гидроксиэтанимидамид, имел точку плавления 136-138 С и выход примерно 56%. Способ В. Например, трет-бутил-2-амино-2-(гидроксиимино)этилкарбамат (схема 2, соединение Триэтиламин (535 мкл; 3,84 ммоль) добавляли к раствору трет-бутилцианометилкарбамата (500 мг; 3,20 ммоль) и гидрохлорида гидроксиламина (227 мг; 3,84 ммоль) в этаноле (10 мл). Затем реакционную смесь нагревали в течение ночи при 80 С. Полученный в результате раствор затем выпаривали в вакууме. К остатку добавляли этилацетат (10 мл) и гидрохлорид триэтиламина удаляли фильтрованием. Затем раствор выпаривали в вакууме, получая неочищенный продукт. 1H ЯМР (360 МГц, ДМСО); 1.53 (с, 9 Н), 3.62-3.63 (д, 2 Н), 5.33-5.44 (с, 2 Н), 7.10 (т, 1 Н), 8.94 (с, 1 Н). Подобным образом, используя способ В и исходя из соответствующих коммерческих карбонитрилов и гидрохлорида гидроксиламина, получали следующие родственные промежуточные соединения амидоксимов: (2RS)-N',2-дигидроксибутанимидамид, (1S,2R)-N',2-дигидроксициклогексанкарбоксимидамид, N',3-дигидроксипропанимидамид, N',2-дигидроксиэтанимидамид, (2RS)-N',2-дигидрокси-2 фенилэтанимидамид, трет-бутил 4-[амино(гидроксиимино)метил]-1-пиперидинкарбоксилат, трет-бутил(3RS)-3-[амино(гидроксиимино)метил]-1-пиперидинкарбоксилат, трет-бутил-(2RS)-2-амино(гидроксиимино)метил]-1-пиперидинкарбоксилат, этиламино(гидроксиимино)этаноат. Промежуточное соединение 8. (2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N'-гидрокси-4-(метоксиимино)-2-пирролидинкарбоксимидамид (схема 8, соединение XV). 1-(трет-Бутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновую кислоту (промежуточное соединение 2; 95,9 г; 0,371 моль) загружали в колбу объемом 3 л с фланцем, снабженную навесной мешалкой, отверстиями для входа/выхода азота и датчиком температуры. Затем в колбу добавляли безводный ТГФ (1,15 л), и раствор охлаждали до -20 С, с последующим добавлением триэтиламина (52 мл,0,371 моль). Затем раствор перемешивали в течение 10 мин. К раствору в течение 10 мин добавляли этилхлорформиат (35 мл; 0,371 моль), поддерживая температуру около -20 С. Затем реакционную смесь перемешивали еще в течение 30 мин при данной температуре. Насыщенный аммиаком раствор ТГФ готовили барботированием аммиака через 250 мл безводного ТГФ в течение 15 мин при -78 С. Раствор аммиака добавляли в реакционную колбу через канюлю в течение 10 мин, поддерживая температуру реакции ниже -25 С, контролируя экзотермический эффект. Раствору давали возможность достичь комнатной температуры в течение 2 ч и затем перемешивали в течение следующего часа. Растворитель удаляли из реакционной смеси в вакууме и остаток распределяли между дихлорметаном (500 мл) и водой (500 мл). После разделения органический слой промывали водой 3250 мл, объединенные водные слои затем промывали ДХМ 2250 мл и полученный ДХМ снова промывали 100 мл воды. Затем объединенные органические слои сушили над сульфатом натрия, фильтровали и растворитель удаляли в вакууме. Требуемый продукт, трет-бутил (2S,4EZ)-2-(аминокарбонил)-4-(метоксиимино)-1-пирролидинкарбоксилат, получали в виде белого аморфного твердого вещества (85,8 г; 90%). 1 Н ЯМР (400 МГц, ДМСО); 1.5 (с, 9 Н), 2.65 (м, 1 Н), 3.15 (м, 1 Н), 3.9 (с, 3 Н), 4.2 (м, 2 Н), 4.5 (м, 1 Н),7.2 (м, 1 Н), 7.65 (м, 1 Н). Трет-бутил (2S,4EZ)-2-(аминокарбонил)-4-(метоксиимино)-1-пирролидинкарбоксилат (20 г; 77,7 ммоль) загружали в круглодонную колбу объемом 1 л в инертной атмосфере. Затем в колбу добавляли безводный дихлорметан (140 мл) с последующим добавлением ТФУ (60 мл). Реакционную смесь перемешивали при комнатной температуре в течение 90 мин, контролируя исчезновение исходного вещества с помощью ТСХ (10% МеОН в ДХМ). Затем к реакционной смеси добавляли толуол (200 мл) и растворители удаляли в вакууме. Остаток повторно растворяли в ДХМ (200 мл) , охлаждали до -5 С и добавляли триэтиламин (43 мл, 311 ммоль) (экзотермическая реакция). К реакционной смеси добавляли[1,1'-бифенил]-4-карбонилхлорид (16,8 г; 77,7 ммоль) и перемешивали при комнатной температуре в течение 1,5 ч. В этот момент дополнительно добавляли ДХМ (500 мл) и 1 М НСl (250 мл). Смесь энергично перемешивали и осадок отфильтровывали. Слои фильтрата разделяли, при этом органический слой промывали 1 М НСl (250 мл) и насыщенным бикарбонатом (250 мл). Основной водный слой снова промывали ДХМ (250 мл) и объединенные органические слои сушили над сульфатом магния, фильтровали и фильтрат концентрировали примерно до 200 мл. Полученную в результате суспензию фильтровали. Получали требуемый продукт, (2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбоксамид, в виде не совсем белого твердого вещества (7,3 г; 28%). Дополнительное количество менее чистого вещества (7,9 г; 30%) можно получить при добавлении к фильтрату гексана (125 мл). 1(4,21 г; 22,1 ммоль). Полученную в результате суспензию нагревали до 80 С в течение 4 ч. Растворитель удаляли в вакууме и остаток растворяли в ДХМ (400 мл), раствор промывали 1 М НСl (275 мл) и насыщенным бикарбонатом (70 мл), затем сушили над сульфатом натрия, фильтровали и растворитель удаляли в вакууме. Очистка молекулярной хроматографией на силикагеле при начальном элюировании дихлорметаном, чтобы удалить менее полярные вещества, и затем 1% МеОН в ДХМ, давала требуемое соединение, (2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбонитрил, в виде не совсем белого твердого вещества (4,2 г; 60%). 1 Н ЯМР (400 МГц, ДМСО); 3.0 (м, 1 Н), 3.2 (м, 1 Н), 3.7 (м, 3 Н), 4.2 (м, 1 Н), 4.5 (м, 1 Н), 5.4 (м, 1 Н),7.4-7.8 (м, 9 Н). Следуя общему способу, описанному выше для синтеза промежуточных соединений 8, триэтиламин(1,94 мл; 13,94 ммоль) медленно при перемешивании добавляли к суспензии (2S,4EZ)-1-([1,1'-бифенил]4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбонитрила (3,71 г; 11,62 ммоль) и гидрохлорида гидроксиламина (0,97 г; 13,94 ммоль) в этаноле (150 мл). Реакционную смесь оставляли перемешиваться при 80 С в течение 16 ч и затем охлаждали до температуры окружающей среды. Растворитель удаляли выпариванием и твердое вещество суспендировали в воде (100 мл) и фильтровали. Твердое вещество промывали диэтиловым эфиром (2100 мл), при этом происходило уплотнение, и затем сушили в вакууме при 40 С, получая требуемый продукт, (2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N'-гидрокси-4-(метоксиимино)-2-пирролидинкарбоксимидамид (3,35 г; 82%). 1 Получали раствор, содержащий, например, (4EZ)-1-(трет-бутоксикарбонил)-4-(метоксиимино)-2 пирролидинкарбоновую кислоту (промежуточное соединение 2; 17,81 ммоль; 4,6 г) в смеси 1:1 метанола и толуола (250 мл). Затем к перемешиваемому раствору по каплям при комнатной температуре в атмосфере азота добавляли триметилсилилдиазометан (32,5 мл 2 М раствора в гексанах, 59 ммоль). После прекращения выделения газа азота полученный в результате желтый раствор выпаривали в вакууме и остаток повторно растворяли в ДХМ и промывали насыщенным NH4Cl и 10% NaHCO3 и насыщенным раствором соли, сушили над Na2SO4 и выпаривали в вакууме, получая требуемое соединение 1-трет-бутил 2 метил(2S,4EZ)-4-(метоксиимино)-1,2-пирролидиндикарбоксилат в виде желтого масла (4,0 г; 83%). 1-трет-Бутил 2-метил(2S,4EZ)-4-(метоксиимино)-1,2-пирролидиндикарбоксилат (1,95 ммоль; 530 мг) растворяли в 4 мл МеОН и добавляли раствор 4 мл МеОН и 1,5 мл (d=l,03; 30,86 ммоль) 80% гидрата гидразина (конечная c(NH2NH2) =13%). Реакционную смесь перемешивали в течение 2 дней. Растворители выпаривали в вакууме, и остаток повторно растворяли в МеОН и выпаривали (3 х). Требуемое соединение трет-бутил (2S,4EZ)-2-(гидразинкарбонил)-4-(метоксиимино)-1-пирролидиндикарбоксилат выделяли в виде желтого масла (500 мг; 94%). 1 Н ЯМР (CDCl3): 1.47 (с, 9 Н, СН 3), 2.8-3.2 (м, 2 Н, СН 2), 3.87 (с, 3 Н, СН 3-О), 3.95-4.3 (м, 2 Н, СН 2),4.52 (м, 1 Н, CH-N) МС(АРСl+): 273.0, 545.4 (2 М+1). Промежуточное соединение 10. 2'-Метил[1,1'-бифенил]-4-карбоновая кислота. К смеси 4-бромбензойной кислоты (30 г; 0,15 моль), 2-метилфенилбороновой кислоты (24 г; 0,15 моль), карбоната натрия (250 г) в толуоле (500 мл) и воды (500 мл) в атмосфере азота добавляли тетракис-трифенилфосфинпалладия(0) (9 г; 0,0074 моль). Реакционную смесь кипятили с обратным холодильником в течение 10 ч. После указанного времени к реакционной смеси добавляли 100 мл 10% NaOH,водный слой отделяли и промывали толуолом (2200 мл). Подкисление водного слоя 3N раствором НСl давало твердый продукт, который отфильтровывали, промывали водой и сушили. Затем неочищенный продукт кристаллизовали из толуола, получая 2'-метил[1,1'-бифенил]-4-карбоновую кислоту (20 г; 62,5%). Напротив, продукт также можно получить из 1-бром-2-метилбензола и 4-карбоксибензолбороновой кислоты, используя аналогичные условия. 1 Н ЯМР (300 МГц, ДМСО); 2.2 (с, 3 Н), 7.2-7.4 (м, 4 Н), 7.43 (д, J=9 Гц, 2 Н), 7.99 (д, J=9 Гц, 2 Н), 13(ушир., 1 Н). Подобным образом, используя соответствующие коммерческие бороновые кислоты и арилбромиды, получали следующие родственные промежуточные соединения производные 1,1'-бифенила (12): 4'метил[1,1'-бифенил]-4-карбоновая кислота; 2',3-диметил[1,1'-бифенил]-4-карбоновая кислота; 2',6'диметил[1,1'-бифенил]-4-карбоновая кислота; 2-метил[1,1'-бифенил]-4-карбоновая кислота; 3-метил[1,1'бифенил]-4-карбоновая кислота; 2,2'-диметил[1,1'-бифенил]-4-карбоновая кислота; 2'-метокси[1,1'бифенил]-4-карбоновая кислота; 3'-метокси[1,1'-бифенил]-4-карбоновая кислота; 4'-метокси[1,1'бифенил]-4-карбоновая кислота; 2'-хлор[1,1'-бифенил]-4-карбоновая кислота; 3'-хлор[1,1'-бифенил]-4 карбоновая кислота; 4'-хлор[1,1'-бифенил]-4-карбоновая кислота; 3',4'-дихлор[1,1'-бифенил]-4 карбоновая кислота; 2'-(трифторметил)[1,1'-бифенил]-4-карбоновая кислота; 3'-(трифторметил)[1,1'бифенил]-4-карбоновая кислота; 2'-циано[1,1'-бифенил]-4-карбоновая кислота; 2',4'-дифтор[1,1'бифенил]-4-карбоновая кислота; 4-(2-пиридинил)бензойная кислота; 4-(3-пиридинил)бензойная кислота; 4-(4-пиридинил)бензойная кислота; 4-(5-пиридинил)бензойная кислота; и другие. Промежуточное соединение 11. 4-(3-Метил-2-пиридинил)бензойная кислота. Смесь 2-бром-3-метилпиридина (22,5 г; 0,1312 моль), 4-(гидроксиметил)фенилбороновой кислоты(25 г; 0,164 моль), Pd(PPh3)4 (9,5 г; 0,0082 моль) и карбоната натрия (200 г в 500 мл воды) в толуоле (750 мл) кипятили с обратным холодильником в атмосфере азота в течение 15 ч. Отделяли толуоловый слой и перегоняли при пониженном давлении, получая остаток. Затем остаток очищали хроматографией на колонке, получая [4-(3-метил-2-пиридинил)фенил]метанол (12 г; 47%). К раствору [4-(3-метил-2-пиридинил)фенил]метанола (12 г; 0,06 моль) в безводном ДМФА (150 мл) добавляли дихромат пиридиния (91 г; 0,24 моль) и перемешивали при КТ в течение 3 дней. Реакционную смесь вливали в воду и экстрагировали этилацетатом (250 мл). Органический слой промывали водой,насыщенным раствором соли, сушили и концентрировали. Неочищенный продукт очищали хроматографией на колонке с силикагелем, получая 4-(3-метил-2-пиридинил)бензойную кислоту (3 г; 25%) в виде белого твердого вещества. 1 Н ЯМР (300 МГц, ДМСО); 2.3 (с, 3 Н) , 7.33 (дд, J =1.5 Гц, 5 Гц, 1 Н), 7.67 (д, J=8 Гц, 2 Н), 7.75 (д, J(200 г) в толуоле (500 мл) и воде (500 мл) добавляли Pd(PPh3)4 (16 г; 0,014 моль) и кипятили с обратным холодильником в течение 16 ч. Реакционную смесь охлаждали и отделившийся органический слой промывали водой и насыщенным раствором соли и сушили. Растворитель удаляли, получая 4-(3 пиридил)толуол (42 г; 90%). К смеси 4-(3-пиридил)толуола (35 г; 0,207 моль) в пиридине (400 мл) и воде (400 мл) порциями добавляли KMnCO4 (163 г; 1,03 моль) и кипятили с обратным холодильником в течение 12 ч. Реакционную смесь фильтровали через целит и подкисляли концентрированной НСl. Продукт промывали водой и сушили, получая 4-(3-пиридил)бензойную кислоту (32 г; 76%) в виде белого твердого вещества. К смеси 4(3-пиридил)бензойной кислоты (22 г; 0,11 моль) в ТГФ (2,5 л) добавляли mСРВА (152 г; 0,44 моль; 50%) и перемешивали при КТ в течение 12 ч. Твердое вещество отфильтровывали и промывали ТГФ, получая 4-(1-оксидо-3-пиридинил)бензойную кислоту (20 г; 86%). 1 Н ЯМР (300 МГц, ДМСО); 7.5-7.8 (м, 5 Н), 7.9 (д, J =8 Гц, 2 Н), 8.33 (д, J= 5 Гц, 2 Н). Подобным образом, исходя из 4-толилбороновой кислоты (45 г; 0,33 моль) и 2-бромпиридина (52 г; 0,33 моль) получали родственное промежуточное соединение 4-(1-оксидо-2-пиридинил)бензойную кислоту. Пример 1. Общий способ синтеза в растворе оксадиазольных производных пирролидина общей формулы I при В=IIа (схемы 1, 11): О-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-(3-метил 1,2,4-оксадиазол-5-ил)-3-пирролидинона; О-метилоксим (3E,5S)-l-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона и О-метилоксим (3Z,5S)-1-[(2'-метил[1,1'бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона.a) Протокол образования оксадиазольного кольца. Диизопропилкарбодиимид (3,16 г; 25,17 ммоль) добавляли к раствору (2S,4EZ)-1-(трет-бутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновой кислоты (промежуточное соединение 2; 6,50 г; 25,17 ммоль) и ацетамидоксима (промежуточное соединение 7; 1,86 г; 25,17 ммоль) в ДХМ (55 мл) и перемешивали в течение ночи при комнатной температуре(нерастворимые в ДХМ амидоксимы предварительно растворяли в ТГФ, к которому добавляли растворDIC и промежуточное соединение 2 в ДХМ). После фильтрования с помощью насоса и выпаривания в вакууме остаток растворяли в пиридине (60 мл) и перегоняли с обратным холодильником в течение одного часа, затем охлаждали и оставляли на ночь, затем выпаривали в вакууме. Затем неочищенный продукт растворяли в ДХМ (50 мл) и промывали насыщенным NаНСО 3 (водный) (2 х 50 мл) и затем 1 М НСl(водный) (2 х 50 мл) сушили над сульфатом магния и выпаривали в вакууме (выход неочищенного продукта 70%). Хроматография на силикагеле при элюировании 15% этилацетатом в гексанах давала требуемое соединение,трет-бутилb) Протокол стадии снятия N-защиты. Готовили раствор, содержащий трет-бутил(2S,4EZ)-4-(метоксиимино)-2-(3-метил-1,2,4-оксадиазол 5-ил)-1-пирролидинкарбоксилат (1,26 г; 4,25 ммоль) в безводном ДХМ (120 мл). При 0 С газообразный НСl, предварительно высушенный с помощью ловушки с концентрированной H2SO4, медленно барботировали через реакционную смесь, и снятие защиты контролировали с помощью ТСХ, используя смесь циклогексан/этилацетат (1/1) и окраску раствором Pancaldi. Примерно через 45 мин ТСХ показывала, что исходного вещества не оставалось, и затем ДХМ выпаривали в вакууме без нагревания, чтобы избежать разложения соли пирролидина. Затем добавляли дополнительное количество ДХМ (20 мл) и снова выпаривали в вакууме, чтобы удалить возможно оставшийся НСl (2-3 раза). Требуемый продукт, хлористоводородную соль О-метилоксима (3EZ,5S)-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона, выделяли в виде белого твердого вещества и использовали без дальнейшей очистки и характеристики. с) Протоколы стадии N-защиты. Способ А. К раствору хлористоводородной соли О-метилоксима (3EZ,5S)-5-(3-метил-1,2,4 оксадиазол-5-ил)-3-пирролидинона (200 мг; 0,8 6 ммоль) в ДХМ (5 мл) добавляли [1,1'-бифенил]-4 карбонилхлорид (205 мг; 0,95 ммоль), затем диизопропилэтиламин (314 мкл; 1,81 ммоль) и перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли аминометилполистироловую смолу (250 мг) и перемешивали в течение одного часа перед фильтрованием с помощью насоса. Раствор промывали лимонной кислотой (водный) (25 мл) и затем сушили над MgSO4 и выпаривали в вакууме. Продукт, О-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-(3-метил-1,2,4 оксадиазол-5-ил)-3-пирролидинона, очищали хроматографией на силикагеле, элюируя 20% этилацетатом в гексанах (60 мг; выход 19%). Способ В. Готовили раствор, содержащий хлористоводородную соль О-метилоксима (3EZ,5S)-5-(3 метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона, 2'-метил[1,1'-бифенил]-4-карбоновую кислоту (0,857 г; 4,04 ммоль; 0,95 экв.) и необязательно DMAP (1,03 г; 8,50 ммоль; 2,0 экв.) в безводном ДХМ (120 мл). Реакционную смесь перемешивали при КТ в течение 10 мин, затем охлаждали до 0 С. При 0 С медленно порциями в течение 30 мин добавляли EDC, HCl (815 мг; 4,25 ммоль). Реакционную смесь перемешивали при 0 С в течение 2 ч и осторожно нагревали до КТ в течение ночи. После завершения реакции органическую фазу дважды промывали лимонной кислотой (10%) и карбонатом натрия (10%). Органическую фазу сушили и выпаривали. Неочищенный продукт очищали и разделяли на (Е)- и (Z)-изомеры хроматографией на колонке (система Biotage, колонка 40 М, 90 г SiO2), используя смесь циклогексан/этилацетат(1/1) в качестве элюента, получая О-метилоксим (3 Е,5S)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-5-(3 метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона (770 мг; 34%, бесцветное масло, чистота по данным ВЭЖХ 97,5%) и О-метилоксим (3Z,5S)-1-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4 оксадиазол-5-ил)-3-пирролидинона (740 мг; 33%, бесцветное масло, чистота по данным ВЭЖХ 98,3%). О-метилоксим (3E,5S)-l-[(2'-метил[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)3-пирролидинона: масло; 1H ЯМР (300 МГц, CDCl3); 2.28 (с, 3 Н, АrСН 3), 2.42 (с, 3 Н, СН 3), 3.03-3.32 (м,2 Н), 3.88 (с, 3 Н, NOCH3), 4.38-4.59 (м, 2 Н), 6.03 (м, 1 Н) , 7.22-7.29 (м, 5 Н, Н аром.), 7.40-7.44 (м, 2 Н, Н аром.), 7.55 (9 м, 1 Н); МС (АРСI+): 391.5; МС(АРСI-): 389.2. О-метилоксим Следуя общим способам, которые описаны в примере 1 (способ В), исходя из (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновой кислоты (промежуточное соединение 2),N'-гидроксиэтанимидамида (промежуточное соединение 7) и 2'-хлор[1,1'-бифенил]-4-карбоновой кислоты (промежуточное соединение 10), после флэш-хроматографии выделяли указанное в заголовке соединение в виде смеси E-/Z-изомеров в виде масла с выходом 31% (чистота по данным ВЭЖХ 98,5%). Масло; 1 Н ЯМР (300 МГц, CDCl3); 2.41 (с, 3 Н, СН 3), 2.96-3.31 (м, 2 Н, СН 2), 3.87 (с, 3 Н, NОСH3),4.31-4.59 (м, 2 Н, СН 2), 6.03 (м, 1 Н), 7.30 (с, 3 Н, Н аром.), 7.50-7.64 (м, 5 Н, Н аром.); MC(ESI+): 411.2; Следуя общим способам, которые описаны в примере 1 (способ В), исходя из (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновой кислоты (промежуточное соединение 2),N'-гидроксиэтанимидамида (промежуточное соединение 7) и 2'-(трифторметил)[1,1'-бифенил]-4 карбоновой кислоты (промежуточное соединение 10), после флэш-хроматографии выделяли указанное в заголовке соединение в виде смеси E-/Z-изомеров в виде масла с выходом 44% (чистота по данным ВЭЖХ 88,2%). Масло; 1 Н ЯМР (300 МГц, CDCl3); 2.40 (с, 3 Н, СН 3), 2.88-3.31 (м, 2 Н, СН 2), 3.87 (с, 3 Н, NOCH3),4.27-4.53 (м, 2 Н, СН 2), 6.03 (м, 1 Н), 7.27-7.70 (м, 7 Н, Н аром.), 7.77 (м, 1 Н, Н аром.); MC(ESI+): 445.4; Следуя общим способам, которые описаны в примере 1 (способ В), исходя из (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновой кислоты (промежуточное соединение 2),N'-гидроксизтанимидамида (промежуточное соединение 7) и 2' -фтор[1,1' -бифенил]-4-карбоновой кислоты (промежуточное соединение 10), получали указанные в заголовке соединения в виде смеси Е-/Zизомеров и затем разделяли флэш-хроматографией, получая О-метилоксим (3 Е,5S)-1-[(2'-фтор[1,1'бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона с выходом 11% (чистота по данным ВЭЖХ 95,0%) и O-метилоксим (3Z,5S)-1-[(2'-фтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил 1,2,4-оксадиазол-5-ил)-3-пирролидинона с выходом 11% (чистота по данным ВЭЖХ 98,2%). О-метилоксим (3 Е,5S)-1-[(2'-фтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)3-пирролидинона: масло; 1 Н ЯМР (300 МГц, CDCl3); 2.42 (с, 3 Н, СН 3), 3.07-3.25 (м, 2 Н, СН 2), 3.87 (с, 3 Н,NOCH3), 4.42-4.52 (м, 2 Н, СН 2) , 6.04 (м, 1 Н), 7.15-7.29 (м, 2H, Н аром.), 7.30-7.44 (м, 2 Н, Н аром.), 7.70 Следуя общим способам, которые описаны в примере 1 (способ В), исходя из (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновой кислоты (промежуточное соединение 2),N'-гидроксиэтанимидамида (промежуточное соединение 7) и 4'-фтор[1,1'-бифенил]-4-карбоновой кислоты (промежуточное соединение 10), после флэш-хроматографии выделяли указанное в заголовке соединение в виде смеси E-/Z-изомеров в виде масла с выходом 32% (чистота по данным ВЭЖХ 94,1%). Масло; 1 Н ЯМР (300 МГц, CDCl3); 2.42 (с, 3 Н, СН 3), 2.95-3.30 (м, 2 Н, СН 2), 3.87 (с, 3 Н, NOCH3),4.27-4.55 (м, 2 Н, СН 2), 6.02 (м, 1 Н), 7.12 (м, 2 Н, Н аром.), 7.27-7.61 (м, 6 Н, Н аром.), MC(ESI+): 395.5; Следуя общим способам, которые описаны в примере 1 (способ В), исходя из (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновой кислоты (промежуточное соединение 2),N'-гидроксиэтанимидамида (промежуточное соединение 7) и 2'-хлор-4'-фтор[1,1'-бифенил]-4-карбоновой кислоты (промежуточное соединение 10), после флэш-хроматографии выделяли указанное в заголовке соединение в виде смеси E-/Z-изомеров в виде масла с общим выходом 60% (чистота по данным ВЭЖХ 95,20%). Последующая флэш-хроматография давала О-метилоксим (3Z,5S)-1-[(2'-хлор-4'-фтор[1,1'бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона с выходом 30% (чистота по данным ВЭЖХ 97,5%). О-метилоксим (3EZ,5S)-1-[(2'-хлор-4'-фтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона: масло; 1 Н ЯМР (300 МГц, CDCl3): 2.31 (с, 3 Н, СН 3), 2.78-3.24 (м, 2 Н, СН 2),3.77 (с, 3 Н, NOCH3), 4.30-4.52 (м, 2 Н, СН 2), 5.93 (м, 1 Н), 6.88-7.60 (м, 7 Н, Н аром.), MC(ESI+): 429.20. О-метилоксим (3Z,5S)-l-[(2'-хлор-4'-фтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона: масло; 1 Н ЯМР (300 МГц, CDC13): 2.31 (с, 3 Н, СН 3), 2.78-3.24 (м, 2 Н, СН 2),3.77 (с, 3 Н, NOCH3), 4.30-4.52 (м, 2 Н, СН 2), 5.93 (м, 1 Н), 6.88-7.60 (м, 7 Н, Н аром.); MC(ESI+): 429.20. Пример 7. О-Метилоксим (3EZ,5S)-1-[(2',4'-дифтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4 оксадиазол-5-ил)-3-пирролидинона; О-метилоксим (3Z,5S)-l-[(2',4'-дифтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона; О-метилоксим (3E,5S)-l-[(2',4'-дифтор [1,1'бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона. Следуя общим способам, которые описаны в примере 1 (способ В), исходя из (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновой кислоты (промежуточное соединение 2),N'-гидроксиэтанимидамида (промежуточное соединение 7) и 2',4'-дифтор[1,1'-бифенил]-4-карбоновой кислоты (промежуточное соединение 10), после флэш-хроматографии выделяли указанное в заголовке соединение в виде смеси E-/Z-изомеров в виде масла с общим выходом 37% (чистота по данным ВЭЖХ 98,6%). Последующее разделение Е- и Z-изомеров флэш-хроматографией давало О-метилоксим (3Z,5S)1-[(2',4'-дифтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона с выходом 15% (чистота по данным ВЭЖХ 98,5%) и О-метилоксим (3 Е,5S)-1-[ (2',4'-дифтор[1,1'-бифенил]-4 ил)карбонил]-5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пирролидинона с выходом 13% (чистота по данным ВЭЖХ 97,5%). О-метилоксим (3EZ,5S)-1-[(2',4'-дифтор[1,1'-бифенил]-4-ил)карбонил]-5-(3-метил-1,2,4-оксадиазол- 26006212 5-ил)-3-пирролидинона: масло; 1 Н ЯМР (300 МГц, CDCl3); 2.34 (с, 3 Н, СН 3), 2.86-3.25 (м, 2 Н, СН 2), 3.79 Следуя общим способам, которые описаны в примере 1 (способ В), исходя из (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновой кислоты (промежуточное соединение 2),N'-гидроксиэтанимидамида (промежуточное соединение 7) и 4'-фтор-2'-метил[1,1'-бифенил]-4-карбоновой кислоты (промежуточное соединение 10), после флэш-хроматографии выделяли указанное в заголовке соединение в виде смеси E-/Z-изомеров в виде масла с выходом 14% (чистота по данным ВЭЖХ 95,2%). Масло; 1 Н ЯМР (300 МГц, CDC13); 2.17 (с, 3 Н, СН 3), 2.34 (с,3 Н, СН 3) 2.86-3.26 (м, 2 Н, СН 2), 3.80 (с,3 Н, NOCH3), 4.33-4.45 (м, 2 Н, СН 2), 5.97 (м, 1 Н), 6.82-6.95 (м, 2 Н, Н аром.), 7.10-7.66 (м, 5 Н, Н аром.),MC(ESI+): 409.33; MC(ESI-): 407.11. Пример 9. О-Метилоксим (3 Е,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(2-гидроксиэтил)-1,2,4 оксадиазол-5-ил]-3-пирролидинона; О-метилоксим (3Z, 5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(2 гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3-пирролидинона. Следуя общим способам, которые описаны в примере 1 (способ В), исходя из (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновой кислоты (промежуточное соединение 2),N',3-дигидроксипропанимидамида (промежуточное соединение 7) и [1,1'-бифенил]-4-карбоновой кислоты (промежуточное соединение 10), после флэш-хроматографии выделяли указанное в заголовке соединение в виде смеси E-/Z-изомеров в виде масла с общим выходом 64% (чистота по данным ВЭЖХ 90%). На этой стадии проводили очистку для удаления примесей с использованием пол-трисамина в ДХМ(Novabiochem), чтобы удалить избыток кислых побочных продуктов, которые трудно удалить флэшхроматографией на колонке. Е- и Z-изомеры окончательно разделяли флэш-хроматографией на колонке(система Biotage, колонка 40 М, 90 г SiO2) , используя в качестве элюента смесь циклогексан/этилацетат(2/8), получая О-метилоксим (3E,5S)-l-([l,l'-бифенил]-4-илкарбонил)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3-пирролидинона с выходом 25% (чистота по данным ВЭЖХ 98,0%) и О-метилоксим (3Z,5S)1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3-пирролидинона с выходом 25% (чистота по данным ВЭЖХ 99,5%). О-метилоксим (3 Е,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5 ил]-3-пирролидинона: белое твердое вещество, т.пл. 140,5 С; 1 Н ЯМР (300 МГц, CDCl3): 2.98-3.05 (м, 3 Н,СН 2), 3.33 (м, 1 Н, СН 2), 3.86 (с, 3 Н, ОСН 3), 4.35-4.57 (м, 2 Н, СН 2), 6.04 (м, 1 Н, СН), 7.38-7.51 (м, 3 Н, Н-AR.) 7.51-7.61 (м, 6 Н, Н-Аг.), M+(ESI+): 407.31; M(ESI-): 405.13. О-метилоксим (3Z,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5 ил]-3-пирролидинона: белое твердое вещество, т.пл. 141 С; 1H ЯМР (300 МГц, CDCl3) : 2.98-3.05 (м, 3 Н,СН 2), 3.33 (м, 1 Н, СН 2), 3.86 (с, 3 Н, ОСН 3) , 4.35-4.57 (м, 2 Н, СН 2), 6.04 (м, 1 Н, СН), 7.38-7.51 (м, 3 Н,Н-Аr.), 7.51-7.61 (м, 6 Н, Н-Аr.), M+(ESI+): 407.31; M(ESI-): 405.13. Пример 10. 2-5-[(2S,4EZ)-1-([1,1'-Бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4 оксадиазол-3-илэтил[(трет-бутоксикарбонил)амино]ацетат; 2-5-[(2S,4EZ)-l-([1,1'-бифенил]-4-илкарбо- 27006212 нил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-3-илэтиламиноацетат.EDC (290 мг; 1,51 ммоль) порциями (в течение 15 минут) добавляли к перемешиваемому раствору О-метилоксима (3Z,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3 пирролидинона (1,59 ммоль; пример 9), диметиламинопиридина (185 мг; 1,51 ммоль) и [(третбутоксикарбонил)амино]уксусной кислоты (264 мг; 1,51 ммоль) в ДХМ (50 мл) при 0 С. После перемешивания в течение 1 ч при 0 С реакционной смеси давали возможность нагреться до комнатной температуры. Реакцию контролировали с помощью ТСХ и ЖХ/МС. После перемешивания еще в течение часа при КТ реакционную смесь гидролизовали водой, промывали лимонной кислотой 10% (210 мл), затемNa2CO3 (водный) (210 мл) , сушили над MgSO4 и выпаривали в вакууме, получая неочищенный продукт. Хроматография на силикагеле при элюировании 40% EtOAc в циклогексане давала требуемое соединение, 2-5-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол 3-илэтил[(трет-бутоксикарбонил)амино]ацетат; в виде смеси Е- и Z-изомеров с выходом 90% (чистота по данным ВЭЖХ: 93,6%). M+(ESI + ): 564.61; M(ESI-): 562.60(2-5-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол 3-илэтил[(трет-бутоксикарбонил) амино]ацетат) (100 мг; 0,178 ммоль) обрабатывали раствором 25% ТФУ/ДХМ при 0 С в течение 1 часа. Затем реакционную смесь медленно делали основной при 0 С с помощью раствора карбоната натрия (10%) и экстрагировали ДХМ. Органические фазы объединяли и сушили над сульфатом магния и растворитель удаляли, получая требуемое соединение 2-5-[(2S,4EZ)-1([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-3-ил этиламиноацетат в виде масла с выходом 70% (чистота по данным ВЭЖХ 94,6%). Следуя общим способам, которые описаны в примере 1 (способ В), исходя из (2S,4EZ)-1-(третбутоксикарбонил)-4-(метоксиимино)-2-пирролидинкарбоновой кислоты (промежуточное соединение 2),N',3-дигидроксипропанимидамида (промежуточное соединение 7) и 2'-хлор-4'-фтор[1,1'-бифенил]-4 карбоновой кислоты (промежуточное соединение 10), после флэш-хроматографии выделяли указанное в заголовке соединение в виде смеси E-/Z-изомеров в виде масла с общим выходом 8% (чистота по данным ВЭЖХ 7 8,7%). Масло; 1 Н ЯМР (300 МГц, CDCl3):2.93 (м, 2 Н, СН 2), 3.10-3.25 (м, 2 Н, СН 2), 3.80 (с, 3 Н, NOCH3) ,4.34-4.45 (м, 2 Н, СН 2), 5.98 (м, 1 Н), 6.90-7.05 (м, 2 Н, Н аром.), 7.20-7.66 (м, 5 Н, Н аром.); MC(ESI+): 459.12; MC(ESI-): 457.07. Пример 12. трет-Бутил-4-5-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4-оксадиазол-3-ил-1-пиперидинкарбоксилат; О-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4 илкарбонил)-5-[3-(4-пиперидинил)-1,2,4-оксадиазол-5-ил)-3-пирролидинона.[1,1'-бифенил]-4-карбонилхлорида, после флэш-хроматографии (циклогексан/этилацетат, 6/4) выделяли требуемое соединение трет-бутил 45[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино) пирролидинил]-1,2,4-оксадиазол-3-ил-1-пиперидинкарбоксилат в виде смеси Е-/Z-изомеров с выходом 60% (чистота по данным ВЭЖХ 97,9%). Масло; 1 Н ЯМР (300 МГц, CDCl3); 1.47 (с, 9 Н, СН 3), 1.60-2.10 (м, 4 Н, СН 2), 2.90-3.02 (м, 2 Н, СН 2),3.30-3.40 (м, 1 Н, СН), 3.86 (с, 3 Н, NOCH3), 4.01-4.55 (м, 6 Н, CH2N), 6.03 (м, 1 Н), 7.48-7.64 (м, 9 Н, Н аром.); MC(ESI+): 546.4; MC(ESI-): 544.2. трет-Бутил 4-5-[(2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)пирролидинил]-1,2,4 оксадиазол-3-ил-1-пиперидинкарбоксилат (100 мг; 1,80 ммоль) обрабатывали раствором 25% ТФУ/ДХМ при 0 С в течение 1 ч. Затем реакционную смесь делали основной с помощью раствора карбоната натрия (10%) и экстрагировали ДХМ. Органические фазы объединяли и сушили над сульфатом магния, и растворитель удаляли, получая остаток, который очищали флэш-хроматографией, используя в качестве элюента смесь циклогексан/этилацетат (2/8), получая О-метилоксим (3Z,5S)-1-([1,1'-бифенил]-4 илкарбонил)-5-[3- (4-пиперидинил)-1,2,4-оксадиазол-5-ил)-3-пирролидинона в виде смеси Е-/Z-изомеров с выходом 80% (чистота по данным ВЭЖХ 96,1%). Масло; 1 Н ЯМР (300 МГц, CDCl3); 1.80-2.20 (м, 4 Н, СН 2), 2.90-3.50 (м, 8 Н, СН 2), 3.87 (с, 3 Н,NОСН 3), 4.30-4.60 (м, 2 Н, СН 2), 6.04 (м, 1 Н, СН), 7.48-7.64 (м, 9 Н, Н аром.); MC(ESI+): 446.4. Пример 13. О-Метилоксим (3EZ, 5S)-5-[3-(1-ацетил-4-пиперидинил)-1,2,4-оксадиазол-5-ил]-1-([1,1'бифенил]-4-илкарбонил)-3-пирролидинона. О-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(4-пиперидинил)-1,2,4-оксадиазол-5 ил]-3-пирролидинона (пример 12) растворяли в безводном ДХМ при 0 С в присутствии 1,5 эквивалента триэтиламина и обрабатывали 1 эквивалентом ацетилхлорида. Реакционную смесь перемешивали при указанной температуре в течение 30 мин и затем гидролизовали с помощью льда. Затем реакционную смесь делали основной, используя раствор карбоната натрия (10%) и экстрагировали ДХМ. Затем сушили над сульфатом магния, и растворитель удаляли, получая остаток, который очищали флэшхроматографией, используя в качестве элюента смесь циклогексан/этилацетат (1/1), получая Ометилоксим (3EZ,5S)-5-[3-(1-ацетил-4-пиперидинил)-1,2,4-оксадиазол-5-ил]-1-([1,1'-бифенил]-4-илкарбонил)-3-пирролидинона в виде смеси E-/Z-изомеров с выходом 95% (чистота по данным ВЭЖХ 100%). Масло; 1 Н ЯМР (300 МГц, CDCl3); 1.70-2.20 (м, 8 Н, СН 3 СО, СН 2), 2.89-3.40 (м, 6 Н, СН 2), 3.88 (с, 3 Н,NOCH3), 4.40-4.60 (м, 2 Н, СН 2), 6.04 (м, 1 Н, СН), 7.48-7.64 (м, 9 Н, Н аром.): MC(ESI+): 488.37; MC(ESI-): 486.17. Пример 14. О-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(1-метил-4-пиперидинил)1,2,4-оксадиазол-5-ил]-3-пирролидинона. О-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(4-пиперидинил)-1,2,4-оксадиазол-5 ил)-3-пирролидинона (пример 12) растворяли в безводном ДХМ при 0 С в присутствии 1,5 эквивалента триэтиламина и обрабатывали 1 эквивалентом метилиодида. Реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь гидролизовали и затем делали основной, используя раствор карбоната натрия (10%) и экстрагировали ДХМ. Затем сушили над сульфатом магния и растворитель удаляли, получая остаток, который очищали флэш-хроматографией, используя в качестве элюента смесь дихлорметан/метанол (98/2), получая О-метилоксим (3EZ,5S)-1-([1,1'-бифенил]-4 илкарбонил)-5-[3-(1-метил-4-пиперидинил)-1,2,4-оксадиазол-5-ил]-3-пирролидинона в виде смеси E-/Zизомеров с выходом 50% (чистота по данным ВЭЖХ 96,8%).- 29006212 Масло; 1 Н ЯМР (300 МГц, CDCl3); 1.19 (м, 2 Н, СН 2), 2.14-2.70 (м, 8 Н, СН 3, СН 2), 2.89-3.25 (м, 4 Н,СН 2), 3.80 (с, 3 Н, NOCH3), 4.20-4.55 (м, 2 Н, СН 2), 5.94 (м, 1 Н, СН), 7.33-7.58 (м, 9 Н, Н аром.); MC(ESI+): 460.43; MC(ESI-): 458.24. Пример 15. Общий способ синтеза в растворе оксадиазольных производных пирролидина общей формулы I, где В является заместителем формулы IIb (см. схемы 7, 11): О-метилоксим (3EZ,5S)-1-([1,1'бифенил]-4-илкарбонил)-5-[5-(феноксиметил)-1,2,4-оксадиазол-3-ил]-3-пирролидинона. К суспензии (2S,4EZ)-1-([1,1'-бифенил]-4-илкарбонил)-N'-гидрокси-4-(метоксиимино)-2-пирролидинкарбоксимидамида (промежуточное соединение 8; 100 мг; 0,28 ммоль), DMAP (71 мг; 0,34 ммоль) и феноксиуксусной кислоты (48 мг; 0,31 ммоль) в ДХМ и ДМФА (1:1, 10 мл) добавляли EDC (59 мг; 0,31 ммоль). После перемешивания в течение ночи при температуре окружающей среды растворитель выпаривали в вакууме. Остаток растворяли в ДХМ (10 мл) и промывали лимонной кислотой (водной) (210 мл), с последующим промыванием бикарбонатом натрия (водным) (210 мл). После выпаривания в вакууме добавляли пиридин (15 мл) и раствор кипятили с обратным холодильником в течение ночи. Пиридин удаляли в вакууме, и остаток растворяли в ДХМ (10 мл), промывали лимонной кислотой (водной)(210 мл), сушили над сульфатом магния и выпаривали, получая указанное в заголовке соединение с чистотой 80% по данным ВЭЖХ. MC(ESI+): m/z=469,2. Пример 16. 3-[(2S,4EZ)-l-([1,1'-Бифенил]-4-илкарбонил)-4-(метоксиимино)-пирролидинил]-1,2,4 оксадиазол-5-илметилформамид.
МПК / Метки
МПК: C07D 413/04, A61K 31/4025, A61P 15/00
Метки: пирролидина, оксадиазольные, тиадиазольные, производные
Код ссылки
<a href="https://eas.patents.su/30-6212-oksadiazolnye-i-tiadiazolnye-proizvodnye-pirrolidina.html" rel="bookmark" title="База патентов Евразийского Союза">Оксадиазольные и тиадиазольные производные пирролидина</a>
Предыдущий патент: Вакцины, включающие в качестве адъюванта интерферон типа i, и связанные с этим способы
Следующий патент: Кристаллическая композиция, содержащая эсциталопрам
Случайный патент: Моющие составы и способ их получения












