2-,3-,4- или 5-замещенные n-(1- (арил-, гетероарил-или арилалкил)сульфонил) индолы и их применение в терапии
Номер патента: 6132
Опубликовано: 27.10.2005
Авторы: Йоханссон Гари, Кальдирола Патриция, Нильссон Бьерн М.
Формула / Реферат
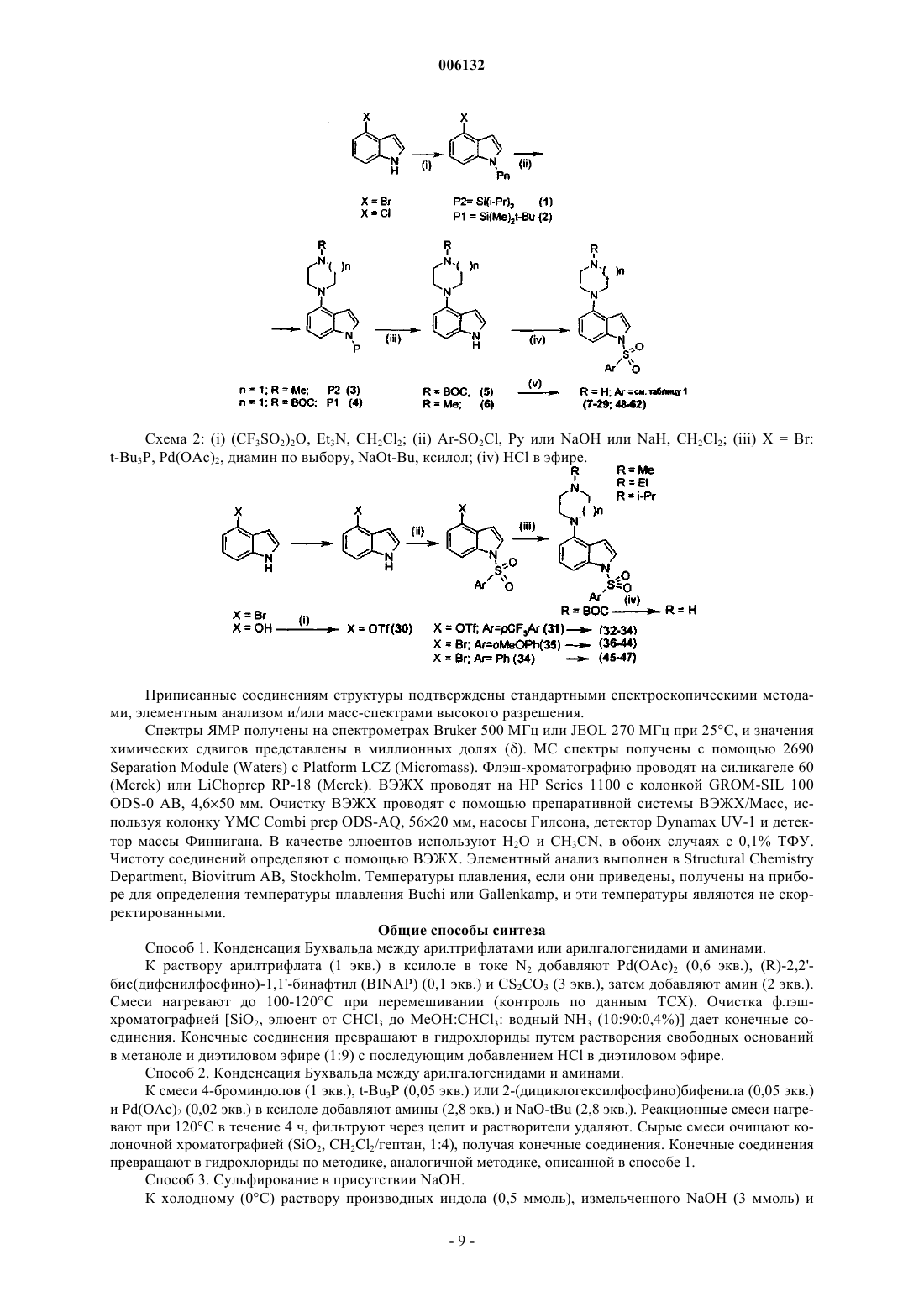
1. Соединение общей формулы (I)

где Ar представляет собой
(1) фенил,
(2) нафтил,
(3) 5-10-членное моноциклическое или бициклическое гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из группы, включающей кислород, серу или азот, или
(4) -R9-фенил;
где каждый фенил, нафтил и гетероциклическое кольцо независимо друг от друга необязательно замещены галогеном, C1-6алкилом, CF3, гидроксилом, C1-6алкоксилом, OCF3, COCF3, CN, NO2, фенилоксигруппой, фенилом, C1-6алкилсульфонилом, C2-6алкенилом, -NR7R8, C1-6алкилкарбоксилом, формилом, -C1-6алкил-NH-CO-фенилом, -C1-6алкил-CO-NH-фенилом, -NH-CO-C1-6алкилом, -CO-NR7R8 или SR7; где каждый из заместителей R7 и R8 независимо друг от друга представляет собой H или C1-6алкил; и R9 представляет собой C1-6алкил или C2-6алкенил; причем каждый из них необязательно замещен фенилом или фенилоксигруппой;
R2 представляет собой H, фенил, I или C1-6алкил;
R3 представляет собой H или 3-(1-азабицикло[2.2.2]окт-2-ен)ил;
R4 представляет собой H или гетероциклическое кольцо, выбранное из группы, включающей

где R6 представляет собой H, C1-6алкил или бензил; и
R5 представляет собой H, гидроксигруппу, C1-3алкоксигруппу, F, NO2, CF3, OCF3 или гетероциклическое кольцо, выбранное из группы, включающей

или его фармацевтически приемлемая соль, гидрат или стереоизомер.
2. Соединение по п.1, где Ar представляет собой
(1) фенил,
(2) 1-нафтил или 2-нафтил,
(3) 5-10-членное моноциклическое или бициклическое гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из группы, включающей кислород, серу или азот, или
(4) -R9-фенил;
где каждый фенил, нафтил и гетероциклическое кольцо независимо друг от друга необязательно замещены F, Cl, Br, C1-6алкилом, CF3, гидроксилом, C1-6алкоксилом, OCF3, фенилом, C2-6алкенилом, -NR7R8, -NH-CO-C1-6алкилом или SR7; где каждый из заместителей R7 и R8 независимо друг от друга представляет собой H или C1-6алкил; и R9 представляет собой C1-2алкил;
R2 представляет собой H, фенил, I или C1-6алкил;
R4 выбран из группы, включающей
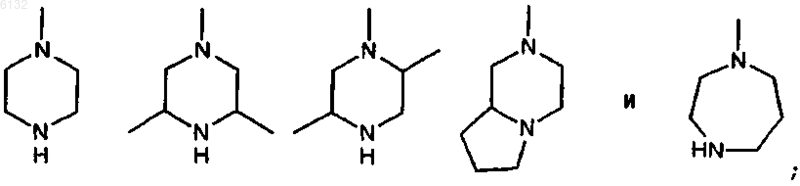 и
и
R5 представляет собой C1-3алкоксигруппу или гетероциклическое кольцо, выбранное из группы, включающей

3. Соединение по п.1, где Ar представляет собой фенил, необязательно замещенный F, Cl, Br, метилом, CF3, C1-4алкоксилом, OCF3, CN, NO2, фенилоксигруппой, фенилом, метилсульфонилом или -NR7R8, где каждый из заместителей R7 и R8 независимо друг от друга представляет собой H или метил.
4. Соединение по п.1, где Ar представляет собой 1-нафтил или 2-нафтил, причем каждый из них необязательно замещен F, Cl, Br, метилом, CF3, C1-4алкоксилом, OCF3, CN, NO2, фенилоксигруппой, фенилом, метилсульфонилом или -NR7R8, где каждый из заместителей R7 и R8 независимо друг от друга представляет собой H или метил.
5. Соединение по п.1, где Ar представляет собой гетероциклическое кольцо, выбранное из группы, включающей фурил, пирролил, триазолил, диазолил, оксазолил, тиазолил, оксадиазолил, изотиазолил, изоксазолил, тиадиазолил, пиридил, пиримидил, пиразинил, тиенил, имидазолил, пиразолил, индолил, хинолинил, изохинолинил, бензофурил, бензотиенил и бензоксадиазолил, причем каждый из них необязательно замещен атомом галогена, C1-6алкилом, CF3, гидроксилом, C1-6алкоксилом, OCF3, CN, NO2, фенилоксигруппой, фенилом, C1-6алкилсульфонилом, C2-6алкенилом, -NR7R8, C1-6алкилкарбоксилом, формилом, -NH-CO-C1-6алкилом, -CO-NR7R8 или SR7; где каждый из заместителей R7 и R8 независимо друг от друга представляет собой H или C1-6алкил.
6. Соединение по п.5, где Ar представляет собой гетероциклическое кольцо, выбранное из группы, включающей пиридил, тиенил, имидазолил, пиразолил, бензотиенил и бензоксадиазолил, причем каждый из них необязательно замещен атомами галогена или C1-6алкилом.
7. Соединение по п.6, где Ar представляет собой 2-пиридил, 3-пиридил или 4-пиридил.
8. Соединение по п.1, где Ar представляет собой 5-7-членное ароматическое, частично насыщенное или полностью насыщенное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из группы, включающей O, S или NR10, где R10 представляет собой H, C1-6алкил, -CO-CF3, или отсутствует.
9. Соединение по п.1, где Ar представляет собой -R9-фенил, где R9 представляет собой C1-3алкил или C2-3алкенил, причем каждый из них необязательно замещен фенилом, и где фенил необязательно замещен F, Cl, Br, метилом, CF3, C1-4алкоксилом, OCF3, CN, NO2, фенилоксигруппой, фенилом, метилсульфонилом или -NR7R8; причем каждый из заместителей R7 и R8 независимо друг от друга представляет собой H или C1-6алкил.
10. Соединение по любому из пп.1-9, где каждый из заместителей R2 и R3 представляет собой H.
11. Соединение по любому из пп.1-10, где каждый из заместителей R4 и R5 независимо друг от друга представляет собой гетероциклическое кольцо, выбранное из группы, включающей
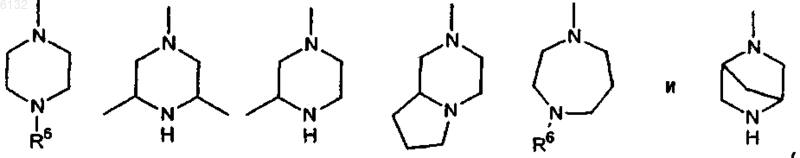
где R6 представляет собой H, C1-3алкил или бензил.
12. Соединение по п.1, где Ar представляет собой фенил, необязательно замещенный F, Cl, Br, метилом, CF3, C1-4алкоксилом, OCF3, CN, NO2, фенилоксигруппой, фенилом, метилсульфонилом или -NR7R8, где каждый из заместителей R7 и R8 независимо друг от друга представляет собой H или метил; каждый из заместителей R2 и R3 представляет собой H и каждый из заместителей R4 и R5 независимо друг от друга представляет собой гетероциклическое кольцо, выбранное из группы, включающей

где R6 представляет собой H, C1-3алкил или бензил.
13. Соединение по п.1, где Ar представляет собой 1-нафтил или 2-нафтил, причем каждый из них необязательно замещен F, Cl, Br, метилом, CF3, C1-4алкоксилом, OCF3, CN, NO2, фенилоксигруппой, фенилом, метилсульфонилом или -NR7R8, где каждый из заместителей R7 и R8 независимо друг от друга представляет собой H или метил; каждый из заместителей R2 и R3 представляет собой H и каждый из заместителей R4 и R5 независимо друг от друга представляет собой гетероциклическое кольцо, выбранное из группы, включающей

где R6 представляет собой H, C1-3алкил или бензил.
14. Соединение по п.1, где Ar представляет собой гетероциклическое кольцо, выбранное из группы, включающей пиридил, тиенил, имидазолил, пиразолил, бензотиенил и бензоксадиазолил, причем каждый из них необязательно замещен атомами галогена или C1-6алкилом; каждый из заместителей R2 и R3 представляет собой H и каждый из заместителей R4 и R5 независимо друг от друга представляет собой гетероциклическое кольцо, выбранное из группы, включающей
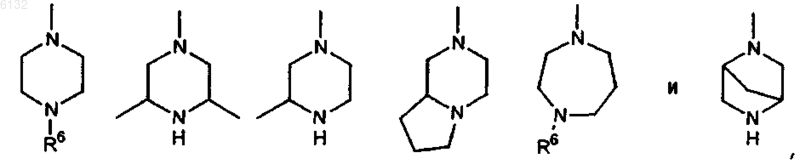
где R6 представляет собой H, C1-3алкил или бензил.
15. Соединение по п.14, где Ar представляет собой 2-пиридил, 3-пиридил или 4-пиридил; каждый из заместителей R2 и R3 представляет собой H и каждый из заместителей R4 и R5 независимо друг от друга представляет собой гетероциклическое кольцо, выбранное из группы, включающей
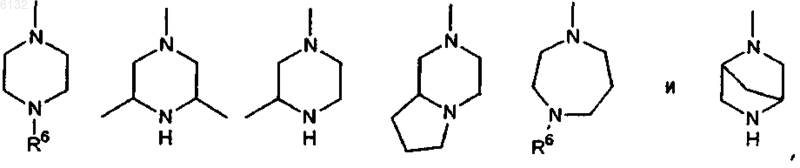
где R6 представляет собой H, C1-3алкил или бензил.
16. Соединение по п.1, где Ar представляет собой -R9-фенил; каждый из заместителей R2 и R3 представляет собой H и каждый из заместителей R4 и R5 независимо друг от друга представляет собой гетероциклическое кольцо, выбранное из группы, включающей
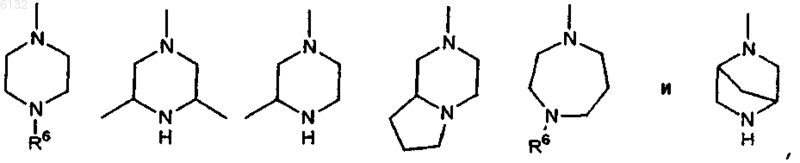
где R6 представляет собой H, C1-3алкил или бензил; R9 представляет собой C1-3алкил или C2-3алкенил, причем каждый из них необязательно замещен фенилом и фенил необязательно замещен F, Cl, Br, метилом, CF3, C1-4алкоксилом, OCF3, CN, NO2, фенилоксигруппой, фенилом, метилсульфонилом или -NR7R8; причем каждый из заместителей R7 и R8 независимо друг от друга представляет собой H или C1-6алкил.
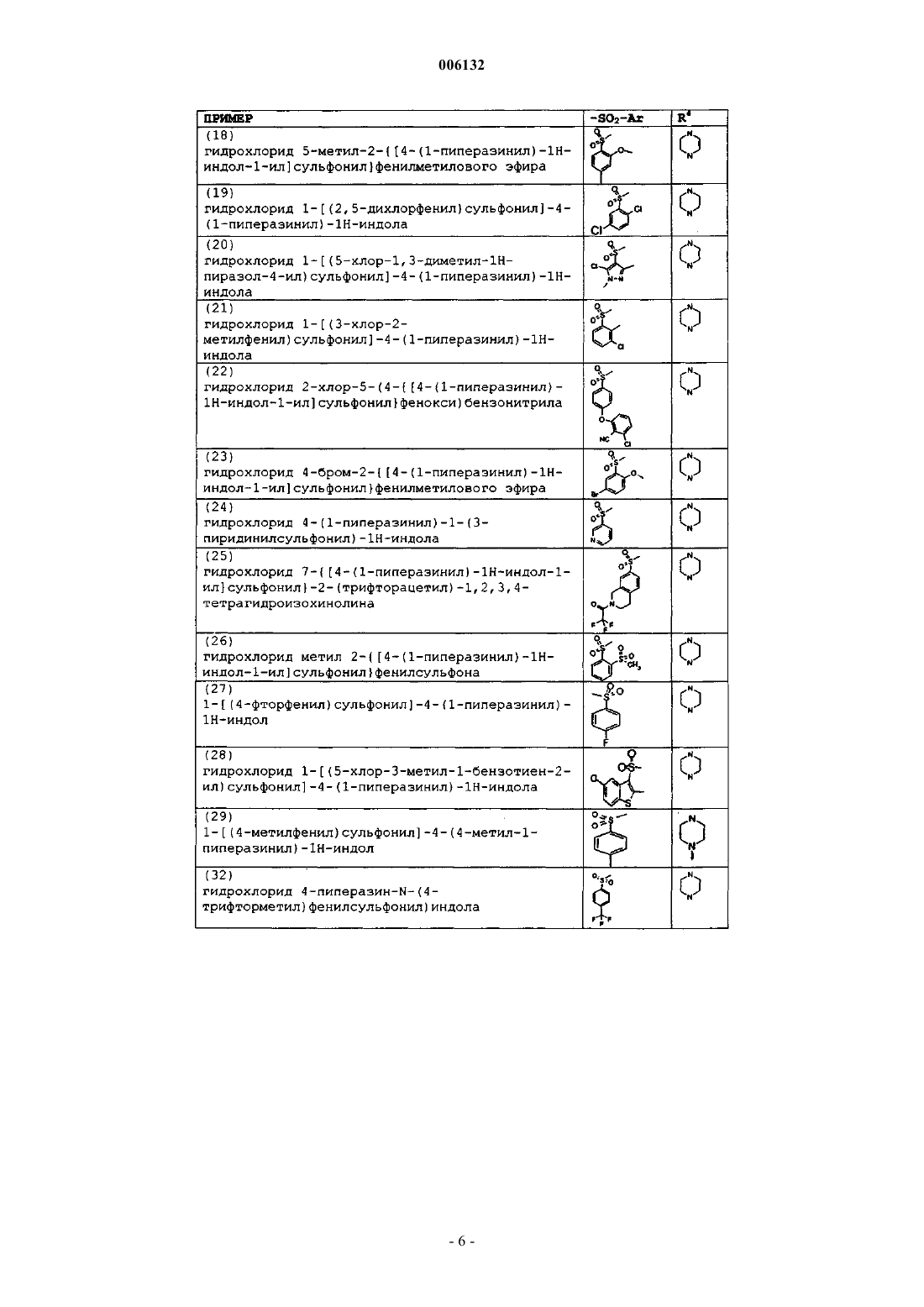
17. Соединение по п.1, причем указанное соединение представляет собой
гидрохлорид 1-фенилсульфонил-4-пиперазинилиндола,
гидрохлорид 1-[(2,5-диметоксифенил)сульфонил]-4-(1-пиперазинил)-1H-индола,
гидрохлорид 1-(мезитилсульфонил)-4-(1-пиперазинил)-1H-индола,
гидрохлорид 1-(1-нафтилсульфонил)-4-(1-пиперазинил)-1H-индола,
гидрохлорид N,N-диметил-5-{[4-(1-пиперазинил)-1H-индол-1-ил]сульфонил}-1-нафтиламина,
гидрохлорид 1-[(4-пропоксифенил)сульфонил]-4-(1-пиперазинил)-1H-индола,
гидрохлорид 1-[(2,5-дихлор-3-тиенил)сульфонил]-4-(1-пиперазинил)-1H-индола,
гидрохлорид 1-[(4-метоксифенил)сульфонил]-4-(1-пиперазинил)-1H-индола,
гидрохлорид 1-[(2,4-дифторфенил)сульфонил]-4-(1-пиперазинил)-1H-индола,
гидрохлорид 1-[(1,1'-бифенил)-4-илсульфонил]-4-(1-пиперазинил)-1H-индола,
гидрохлорид 1-[(3,4-диметоксифенил)сульфонил]-4-(1-пиперазинил)-1H-индола,
гидрохлорид 5-метил-2-{[4-(1-пиперазинил)-1H-индол-1-ил]сульфонил}фенилметилового эфира,
гидрохлорид 1-[(2,5-дихлорфенил)сульфонил]-4-(1-пиперазинил)-1H-индола,
гидрохлорид 1-[(5-хлор-1,3-диметил-1H-пиразол-4-ил)сульфонил]-4-(1-пиперазинил)-1H-индола,
гидрохлорид 1-[(3-хлор-2-метилфенил)сульфонил]-4-(1-пиперазинил)-1H-индола,
гидрохлорид 2-хлор-5-(4-{[4-(1-пиперазинил)-1H-индол-1-ил]сульфонил}фенокси)бензонитрила,
гидрохлорид 4-бром-2-{[4-(1-пиперазинил)-1H-индол-1-ил]сульфонил}фенилметилового эфира,
гидрохлорид 4-(1-пиперазинил)-1-(3-пиридилсульфонил)-1H-индола,
гидрохлорид 7-{[4-(1-пиперазинил)-1H-индол-1-ил]сульфонил}-2-(трифторацетил)-1,2,3,4-тетрагидроизохинолина,
гидрохлорид метил 2-{[4-(1-пиперазинил)-1H-индол-1-ил]сульфонил}фенилсульфона,
гидрохлорид 1-[(4-фторфенил)сульфонил]-4-(1-пиперазинил)-1H-индола,
гидрохлорид 1-[(5-хлор-3-метил-1-бензотиен-2-ил)сульфонил]-4-(1-пиперазинил)-1H-индола,
гидрохлорид 4-(4-метил-1-пиперазинил)-1-(4-метилбензолсульфонил)-1H-индола,
гидрохлорид 4-пиперазино-N-(4-трифторметил)фенилсульфонилиндола,
гидрохлорид 4-(3-метилпиперазин)-{N-(4-трифторметил)фенилсульфонил}-1H-индола,
гидрохлорид 4-(4-метил-1-пиперазинил)-1-(2-метилбензолсульфонил)-1H-индола,
гидрохлорид 4-(4-этил-1-пиперазинил)-1-(2-метилбензолсульфонил)-1H-индола,
гидрохлорид 4-(1-пиперазинил)-1-(2-метилбензолсульфонил)-1H-индола,
гидрохлорид 4-(5-азаиндолизидинил)-1-(2-метилбензолсульфонил)-1H-индола,
гидрохлорид 4-(4-метил-1-гомопиперазинил)-1-(2-метилбензолсульфонил)-1H-индола,
гидрохлорид 4-(3-метил-1-пиперазинил)-1-(2-метилбензолсульфонил)-1H-индола,
гидрохлорид 4-(цис-3,5-диметил-1-пиперазинил)-1-(2-метилбензолсульфонил)-1H-индола,
гидрохлорид 4-(4-изопропил-1-пиперазинил)-1-(2-метилбензолсульфонил)-1H-индола,
гидрохлорид 4-(1S,4S)-2-метил-2,5-диазабицикло[2.2.1]гептил-1-(2-метилбензолсульфонил)-1H-индола,
гидрохлорид 4-(4-метил-1-гомопиперазинил)-1-(бензолсульфонил)-1H-индола,
гидрохлорид 4-(цис-3,5-диметил-1-пиперазинил)-1-(бензолсульфонил)-1H-индола,
гидрохлорид 4-(4-этил-1-пиперазинил)-1-(бензолсульфонил)-1H-индола,
гидрохлорид 4-пиперазинил-1-(4-нитробензолсульфонил)-1H-индола,
гидрохлорид 4-пиперазинил-1-(4-бромбензолсульфонил)-1H-индола,
гидрохлорид 4-пиперазинил-1-(4-хлорбензолсульфонил)-1H-индола,
гидрохлорид 4-пиперазинил-1-(E-2-фенилэтенсульфонил)-1H-индола,
гидрохлорид 4-пиперазинил-1-(3-трифторметилбензолсульфонил)-1H-индола,
гидрохлорид 4-пиперазинил-1-(4-цианобензолсульфонил)-1H-индола,
гидрохлорид 4-пиперазинил-1-(4-хлор-7-хлор-2,1,3-бензоксадиазолсульфонил)-1H-индола,
гидрохлорид 4-пиперазинил-1-(3-цианобензолсульфонил)-1H-индола,
гидрохлорид 4-пиперазинил-1-(4-феноксибензолсульфонил)-1H-индола,
гидрохлорид 4-пиперазинил-1-(4-хлорфенилметансульфонил)-1H-индола,
гидрохлорид 4-пиперазинил-1-(4-метилфенилметансульфонил)-1H-индола,
гидрохлорид 4-пиперазинил-1-(1,1-дифенилэтансульфонил)-1H-индола,
гидрохлорид 4-пиперазинил-1-(4-трифторметоксибензолсульфонил)-1H-индола,
гидрохлорид 4-пиперазинил-1-(5-[(бензоиламино)метил]тиофен-2-сульфонил)-1H-индола,
гидрохлорид 1-[(N-метил-1H-имидазолил-4-ил)сульфонил]-4-(1-пиперазинил)-1H-индола,
N-бензолсульфонил-5-(4-метилпиперазин-1-ил)индол,
N-(4-метилбензолсульфонил)-5-(4-метилпиперазин-1-ил)индол,
N-бензолсульфонил-5-(4-изопропилпиперазин-1-ил)индол,
N-(4-метилбензолсульфонил)-5-(4-изопропилпиперазин-1-ил)индол,
гидрохлорид N-(3,4-диметоксибензолсульфонил)-5-(4-пропилпиперазин-1-ил)индола,
гидрохлорид N-(3-фторбензолсульфонил)-5-(4-пропилпиперазин-1-ил)индола,
гидрохлорид N-(4-пропилбензолсульфонил)-5-(4-метилпиперазин-1-ил)индола,
гидрохлорид N-(1-нафталинсульфонил)-5-(4-метилпиперазин-1-ил)индола,
гидрохлорид N-(бифенил-4-сульфонил)-5-(4-метилпиперазин-1-ил)индола,
гидрохлорид N-(4-метоксибензолсульфонил)-5-(4-метилпиперазин-1-ил)индола,
гидрохлорид N-(3,4-диметоксибензолсульфонил)-5-(4-метилпиперазин-1-ил)индола,
гидрохлорид N-(2,4-дифторбензолсульфонил)-5-(4-метилпиперазин-1-ил)индола,
гидрохлорид N-(4-метоксибензолсульфонил)-5-(4-бензилпиперазин-1-ил)индола,
гидрохлорид N-(2,4-дифторбензолсульфонил)-5-(4-бензилпиперазин-1-ил)индола,
гидрохлорид N-(4-бутоксибензолсульфонил)-5-(4-бензилпиперазин-1-ил)индола,
гидрохлорид N-(3,4-диметоксибензолсульфонил)-5-(4-бензилпиперазин-1-ил)индола,
гидрохлорид N-(бифенил-4-сульфонил)-5-(4-бензилпиперазин-1-ил)индола,
гидрохлорид N-(нафталин-2-сульфонил)-5-(4-бензилпиперазин-1-ил)индола,
гидрохлорид N-(4-пропилбензолсульфонил)-5-(4-бензилпиперазин-1-ил)индола,
гидрохлорид N-(3-фторбензолсульфонил)-5-(4-бензилпиперазин-1-ил)индола,
гидрохлорид N-(4-метоксибензолсульфонил)-5-(пиперазин-1-ил)индола,
гидрохлорид N-(2,4-дифторбензолсульфонил)-5-(пиперазин-1-ил)индола,
гидрохлорид N-(4-бутоксибензолсульфонил)-5-(пиперазин-1-ил)индола,
дигидрохлорид N-(3,4-диметоксибензолсульфонил)-5-(пиперазин-1-ил)индола,
дигидрохлорид N-(бифенил-4-сульфонил)-5-(пиперазин-1-ил)индола,
дигидрохлорид N-(нафталин-2-сульфонил)-5-(пиперазин-1-ил)индола,
дигидрохлорид N-(4-пропилбензолсульфонил)-5-(пиперазин-1-ил)индола,
дигидрохлорид N-(3-фторбензолсульфонил)-5-(пиперазин-1-ил)индола,
дигидрохлорид N-(бензолсульфонил)-5-(пиперазин-1-ил)индола,
3-(1-азабицикло[2.2.2]окт-2-ен-3-ил)-1-[(4-фторфенил)сульфонил]-1H-индол,
гидрохлорид 2-иод-1-(фенилсульфонил)-4-(1-пиперазинил)-1H-индола,
гидрохлорид 2-фенил-1-(фенилсульфонил)-4-(1-пиперазинил)-1H-индола,
трифторацетат 4-пиперазинил-2-метил-1-бензосульфонилиндола или
гидрохлорид 1-фенилсульфонил-4-(гомопиперазинил)индола.
18. Соединение по п.1, причем указанное соединение представляет собой 1-(фенилсульфонил)-4-(1-пиперазинил)-1H-индол.
19. Соединение по п.1, причем указанное соединение представляет собой 1-[(2,5-диметоксифенил)сульфонил]-4-(1-пиперазинил)-1H-индол.
20. Соединение по п.1, причем указанное соединение представляет собой гидрохлорид 4-(1-пиперазинил)-1-(3-пиридилсульфонил)-1H-индола.
21. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
22. Применение соединения по любому из пп.1-20 при производстве лекарственного средства для лечения или предупреждения заболевания, связанного с относящимся к серотонину 5-HT6 рецептором.
23. Применение по п.22, где заболевание представляет собой ожирение.
24. Применение по п.22, где заболевание представляет собой расстройство ЦНС.
Текст
006132 Область техники Настоящее изобретение относится к новым 2-, 3-, 4- или 5-замещенным N-(1-(арил-, гетероарилили арилалкил)сульфонил)индольным соединениям, к фармацевтическим композициям, содержащим эти соединения, и к применению этих соединений при получении лекарственного средства для лечения ожирения и заболеваний ЦНС, а также к способу лечения этих заболеваний. Уровень техники Ожирение представляет собой состояние, характеризующееся повышенным содержанием жиров в теле, приводящее к избытку массы тела сверх допустимых норм. В западном мире ожирение является наиболее важным заболеванием, связанным с питанием, и составляет главную проблему со здоровьем во всех промышленных странах. Это заболевание приводит к повышенной смертности из-за возрастания случаев таких заболеваний, как сердечно-сосудистые заболевания, желудочно-кишечные заболевания,респираторные заболевания, рак и NIDDM (диабет II типа). Поиск соединений, которые снижают массу тела, ведется в течение многих десятилетий. Одно из направлений исследований заключается в активации серотонергических систем, или путем прямой активации подтипов серотониновых рецепторов, или путем ингибирования обратного захвата серотонина. Однако точный требуемый профиль рецепторного подтипа не известен. Серотонин (5-гидрокситриптамин или 5-НТ), ключевой медиатор периферической и центральной нервной системы, модулирует широкий спектр физиологических и патологических функций, в том числе беспокойство, нормализацию сна, агрессию, потребление пищи и депрессию. Идентифицировано и клонировано множество подтипов рецепторов серотонина. Один из них, рецептор 5-НТ 6, был клонирован несколькими группами в 1993 г. (М. Ruat, E. Traiffort, J-M. Arrang, J. Tardivel-Lacombe, J. Diaz, R. Leurs,J-C. Shwartz. Biochem. Biophys. Res. Commun. 1993, 193(1), 268-276; M. Sebben, H. Ansanay, J. Bockaert,A. Dumuis, NeuroReport, 5, 2553-2557 (1994. Этот рецептор, по-видимому, сопрягается с аденилилциклазой и проявляет сродство к антипсихотическим средствам, таким как клозапин. Недавно было сообщено об уменьшении поглощения пищи крысами под влиянием антагониста 5-НТ 6 и 5-НТ 6-антисмысловых олигонуклеотидов; (J.C. Bentley, С.А. Mardsen, A.J. Sleight, K.С. Fone. Effect of 5-HT6 antagonist Ro 04-6790 on food consumption in rats trained to a fixed feeding regime. Br. J. Pharmacol. 1999, Suppl., 126, P66;J.C. Bentley, A.J. Sleight, C.A. Mardsen, KCF Fone. 5-HT6 antisense oligonucleotide ICV affects rat performance in water maze and feeding. J. Psychopharmacol Suppl. A64, 1997, 255). Идентифицированы соединения с повышенным сродством и селективностью к рецептору 5-НТ 6,например, в публикациях WO 00/34242 и М. Isaac, A. Slassi, T. Xin, N. MacLean, J. Wilson, K. McCallum,H. Wang, L. Demchyshyn: 6-Bicyclopiperazinyl-1-arylsulfonylindoles and 6-Bicyclopiperidinyl-1arylsulfonylindoles derivatives as novel, potent and selective 5-HT6 receptor antagonists; Bioorganic and Medicinal Chemistry-Letters 2000, 10, 1719-1721. Подробное описание изобретения В настоящем изобретении установлено, что соединения формулы (I) проявляют сродство к рецептору 5-НТ 6 в качестве антагонистов в низком наномолярном интервале концентраций. Соединения настоящего изобретения, являющиеся 5-НТ 6-антагонистами, являются полезными для лечения или профилактики ожирения и для лечения или профилактики расстройств памяти и заболеваний ЦНС (шизофрении, болезни Паркинсона и депрессии), дефицита внимания, сопряженного с гиперактивностью (Attention Deficit Hyperactive Disorders, ADHD), злоупотребления лекарственными средствами. В соответствии с настоящим изобретением предложено соединение общей формулы (I)(1) фенил,(2) нафтил,(3) 5-10-членное моноциклическое или бициклическое гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из группы, включающей кислород, серу или азот, или(4) -R9-фенил; где каждый фенил, нафтил и гетероциклическое кольцо независимо друг от друга необязательно замещены галогеном, C1-6 алкилом, CF3, гидроксилом, C1-6 алкоксилом, OCF3, COCF3, CN, NO2, фенилоксигруппой, фенилом, C1-6 алкилсульфонилом, С 2-6 алкенилом, -NR7R8, C1-6 алкилкарбоксилом, формилом, -С 1-6 алкил-NН-СO-фенилом, -С 1-6 алкил-СО-NН-фенилом, -NH-CO-C1-6 алкилом, -CO-NR7R8 или SR7; где каждый из заместителей R7 и R8 независимо друг от друга представляет собой Н или C1-6 алкил и R9 представляет собой C1-6 алкил или С 2-6 алкенил; причем каждый из них необязательно замещен фенилом или или его фармацевтически приемлемая соль, гидрат или стереоизомер, при условии, что когда заместитель R2 представляет собой алкил, R4 не является Н. Определение C1-6 алкил означает линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода. Примерами указанных низших алкилов являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, а также пентил и гексил с линейными и разветвленными цепочками. Определение C1-6 алкоксигруппа означает линейную или разветвленную алкоксигруппу, содержащую от 1 до 6 атомов углерода. Примерами указанных низших алкоксигрупп являются метокси-, этокси-, н-пропокси-, изопропокси-, н-бутокси-, изобутокси-, втор-бутокси-, трет-бутоксигруппа, а также пентокси- и гексоксигруппы с линейными и разветвленными цепочками. Определение галоген означает фтор, хлор, бром или иод. Определение гетероциклическое кольцо включает ненасыщенные, а также насыщенные или частично насыщенные гетероциклические кольца. Предпочтительные соединения изобретения представляют собой соединения общей формулы (I),где Аr представляет собой(1) фенил,(2) 1-нафтил или 2-нафтил,(3) 5-10-членное моноциклическое или бициклическое гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из группы, включающей кислород, серу или азот, или(4) -R9-фенил; где каждый фенил, нафтил и гетероциклическое кольцо независимо друг от друга необязательно замещены F, Cl, Вr, C1-6 алкилом, CF3, гидроксилом, C1-6 алкоксилом, OCF3, фенилом, С 2-6 алкенилом, -NR7R8,-NH-CO-C1-6 алкилом или SR7; где каждый из заместителей R7 и R8 независимо друг от друга представляет собой Н или C1-6 алкил и R9 представляет собой C1-2 алкил;R5 представляет собой C1-3 алкоксигруппу или гетероциклическое кольцо, выбранное из группы,включающей Другими предпочтительными соединениями настоящего изобретения являются соединения, где(a) Аr представляет собой фенил, необязательно замещенный F, Сl, Вr, метилом, CF3, C1-4 алкоксилом, OCF3, CN, NО 2, фенилоксигруппой, фенилом, метилсульфонилом или -NR7R8, где каждый из заместителей R7 и R8 независимо друг от друга представляет собой Н или метил.(b) Аr представляет собой 1-нафтил или 2-нафтил, причем каждый из них необязательно замещен F,Сl, Вr, метилом, CF3, C1-4 алкоксилом, OCF3, CN, NO2, фенилоксигруппой, фенилом, метилсульфонилом или -NR7R8, где каждый из заместителей R7 и R8 независимо друг от друга представляет собой Н или метил.(c) Аr представляет собой гетероциклическое кольцо, выбранное из группы, включающей фурил,пирролил, триазолил, диазолил, оксазолил, тиазолил, оксадиазолил, изотиазолил, изоксазолил, тиадиазолил, пиридил, пиримидил, пиразинил, тиенил, имидазолил, пиразолил, индолил, хинолинил, изохинолинил, бензофурил, бензотиенил и бензоксадиазолил, причем каждый из них необязательно замещен атомом галогена, C1-6 алкилом, CF3, гидроксилом, C1-6 алкоксилом, OCF3, CN, NO2, фенилоксигруппой, фенилом, C1-6 алкилсульфонилом, С 2-6 алкенилом, -NR7R8, С 1-6-алкилкарбоксилом, формилом, -NH-CO-C1-6 алкилом, -CO-NR7R8 или SR7; где каждый из заместителей R7 и R8 независимо друг от друга представляет собой Н или C1-6 алкил.(d) Ar представляет собой гетероциклическое кольцо, выбранное из группы, включающей пиридил,тиенил, имидазолил, пиразолил, бензотиенил и бензоксадиазолил, причем каждый из них необязательно замещен атомами галогена или C1-6 алкилом.(f) Ar представляет собой 5-7-членное ароматическое, частично насыщенное или полностью насыщенное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из группы, включающей О, S или NR10, где R10 представляет собой Н, C1-6 алкил, -CO-CF3, или отсутствует.(g) Ar представляет собой R9-фенил, где R9 представляет собой C1-3 алкил или С 2-3 алкенил, причем каждый из них необязательно замещен фенилом, и где фенил необязательно замещен F, Cl, Вr, метилом,CF3, C1-4 алкоксилом, OCF3, CN, NO2, фенилоксигруппой, фенилом, метилсульфонилом или -NR7R8; причем каждый из заместителей R7 и R8 независимо друг от друга представляет собой Н или C1-6 алкил. Другие предпочтительные соединения настоящего изобретения представляют собой соединения общей формулы (I), где каждый из заместителей R4 и R5 независимо друг от друга представляет собой гетероциклическое кольцо, выбранное из группы, включающей где R6 представляет собой Н, C1-3 алкил или бензил. Следующие соединения являются особенно предпочтительными вариантами осуществления изобретения: 1-(фенилсульфонил)-4-(1-пиперазинил)-1 Н-индол,1-[(4-фторфенил)сульфонил]-4-(1-пиперазинил)-1 Н-индол,1-[(5-хлор-3-метил-1-бензотиен-2-ил)сульфонил]-4-(1-пиперазинил)-1 Н-индол,3-(1-азабицикло[2.2.2]окт-2-ен-3-ил)-1-(фенилсульфонил)-1 Н-индол,5-метокси-(1-фенилсульфонил)-4-(1-пиперазинил)-1 Н-индол,4-(4-этил-1-пиперазинил)-1-(фенилсульфонил)-1 Н-индол,1-[(4-метилфенил)сульфонил]-4-(4-метил-1-пиперазинил)-1 Н-индол,1-(фенилсульфонил)-5-(1-пиперазинил)-1 Н-индол,4-(2,5-диметил-1-пиперазинил)-1-(фенилсульфонил)-1H-индол,4-(2,6-диметил-1-пиперазинил)-1-(фенилсульфонил)-1 Н-индол,4-(1,4-диазепан-1-ил)-1-(фенилсульфонил)-1 Н-индол,2-[1-(фенилсульфонил)-1 Н-индол-4-ил]октагидропирроло[1,2-а]пиразин-1-(2-нафтилсульфонил)-4(1-пиперазинил)-1 Н-индол,1-(1-нафтилсульфонил)-4-(1-пиперазинил)-1 Н-индол,1-[(4-метилфенил)сульфонил]-4-(1-пиперазинил)-1 Н-индол,N-(1-азабицикло[2.2.2]окт-3-ил)-N-1-[(4-метилфенил)сульфонил]-1 Н-индол-4-иламин,-3 006132 2-этил-4-(4-этил-1-пиперазинил)-1-[(фенил)сульфонил]-1 Н-индол,2-этил-1-(4-метилфенилсульфонил)-4-(1-пиперазинил)-1 Н-индол,4-(2,5-диметил-1-пиперазинил)-2-этил-1-(фенилсульфонил)-1 Н-индол,4-(4-этил-1-пиперазинил)-5-фтор-1-[(4-метилфенил)сульфонил]-1H-индол,5-фтор-4-(1-пиперазинил)-1-[4-(трифторметил)фенил]сульфонил-1 Н-индол,5-хлор-1-(фенилсульфонил)-4-(1-пиперазинил)-1 Н-индол,1-[(5-хлор-3-метил-1-бензотиен-2-ил)сульфонил]-5-метокси-4-(1-пиперазинил)-1 Н-индол,1-[(5-хлор-3-метил-1-бензотиен-2-ил)сульфонил]-5-(1-пиперазинил)-lH-индол,1-[(4-метилфенил)сульфонил]-4-(3-метил-1-пиперазинил)-1 Н-индол,1-[(4-метилфенил)сульфонил]-4-(4-пиперидинилокси)-1 Н-индол. Наиболее предпочтительные варианты изобретения составляют соединения гидрохлорид 1-(фенилсульфонил)-4-(1-пиперазинил)-lH-индола,гидрохлорид 1-[(2,5-диметоксифенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола,гидрохлорид 4-(1-пиперазинил)-1-(3-пиридинилсульфонил)-1 Н-индола. Некоторые соединения формулы (I) способны существовать в стереоизомерных формах, включающих диастереомеры и энантиомеры, и изобретение охватывает каждую из этих стереоизомерных форм и их смеси, в том числе рацематы. Различные стереоизомерные формы могут быть отделены друг от друга с помощью обычных способов. Любая данная изомерная форма может быть получена с помощью стереоспецифического или асимметрического синтеза. Изобретение также охватывает любые таутомерные формы и их смеси. Соединения формулы (I) могут образовывать кислотно-аддитивные соли с кислотами, такими как обычные фармацевтически приемлемые кислоты, например малеиновая, соляная, бромисто-водородная,фосфорная, уксусная, фумаровая, салициловая, лимонная, молочная, миндальная, винная и метансульфоновая кислота. Соединения формулы (I) также могут образовывать сольваты, такие как гидраты, и изобретение также охватывает эти формы. В данном случае следует понимать, что определение соединение формулы (I) также включает эти формы. Соединения формулы (I) могут быть удобным образом введены в виде фармацевтической композиции, содержащей соединение в сочетании с фармакологически и фармацевтически приемлемыми носителями. Такие фармацевтические композиции могут быть приготовлены с помощью способов и с использованием носителей или наполнителей, которые хорошо известны в данной области. В целом, общепринятые прописи таких способов и ингредиенты приведены в публикации Remington's Pharmaceutical Sciences by E.W. Martin (Mark Publ. Co., 15th Ed., 1975). Соединения и композиции могут быть введены перорально, парентерально (например, с помощью внутривенных, внутрибрюшинных или внутримышечных инъекций), трансдермально или ректально. В случае перорального терапевтического введения активное соединение может быть смешано с одним или несколькими наполнителями и использовано в форме таблеток для глотания, таблеток под язык,лепешек, капсул, эликсиров, суспензий, сиропов, облаток и т.д. Такие композиции и препараты должны содержать по меньшей мере 0,1% активного соединения. Процентное содержание в композициях и препаратах, конечно, может меняться и обычно составляет приблизительно от 2 до 60 мас.% из расчета на данную дозированную лекарственную форму. Количество активного соединения в указанных терапевтически полезных композициях должно быть таким, чтобы достигался эффективный уровень доз. Таблетки, лепешки, пилюли, капсулы и т.д. также могут содержать следующие компоненты: связующие вещества, такие как трагакант, аравийская камедь, кукурузный крахмал или желатин; наполнители, такие как двухосновный фосфат кальция; диспергирующий агент, такой как кукурузный крахмал,картофельный крахмал, альгиновая кислота и т.д.; смазывающее вещество, такое как стеарат магния; и также может быть добавлен подсластитель, такой как сахароза, фруктоза, лактоза или аспартам, или корригирующий вкус и запах агент, такой как перечная мята, масло грушанки или грушевая отдушка. Когда дозированная лекарственная форма представляет собой капсулу, то она может содержать помимо названных выше материалов жидкий носитель, такой как растительное масло или полиэтиленгликоль. Различные другие материалы могут присутствовать в качестве покрытий или для того, чтобы другим образом модифицировать физическую форму твердой дозированной лекарственной формы. Например, таблетки, пилюли или капсулы могут быть покрыты желатином, воском, шеллаком или сахаром и т.д. Сиропы или эликсиры могут содержать активное соединение, сахарозу или фруктозу в качестве подсластителя, метил- и пропилпарабены в качестве консервантов, краситель и корригирующие агенты, такие как вишневая или апельсиновая вкусовая добавка. Конечно, любой материал, используемый при получении любой дозированной лекарственной формы, должен быть фармацевтически приемлем и практически не токсичен в используемых количествах. Кроме того, активное соединение может быть введено в препараты и устройства с постепенным высвобождением активного компонента. Соединения или композиции также могут быть введены внутривенно или внутрибрюшинно путем вливания или с помощью инъекций. Растворы активного соединения или его солей могут быть приготовлены в воде, необязательно в смеси с нетоксичным поверхностно-активным веществом. Дисперсии также-4 006132 могут быть получены в глицерине, жидких полиэтиленгликолях, триацетине и в их смесях и в маслах. Полезные дозы соединений формулы I могут быть определены при сравнении их активности in vitro и in vivo на животных моделях. Методы экстраполяции эффективных доз для мышей и других животных на человека известны в данной области; см., например, патент США 4938949. Соединение может быть введено в дозированной лекарственной форме, содержащей, например,приблизительно от 0,05 до 500 мг, обычно приблизительно от 0,1 до 250 мг, наиболее предпочтительно приблизительно от 1 до 150 мг активного ингредиента на дозированную лекарственную форму. Необходимая доза может присутствовать в виде одноразовой (единичной) дозы или в виде поделенных доз, вводимых через соответствующие интервалы. Композиции могут быть введены перорально, подъязычно, трансдермально или парентерально при уровнях доз приблизительно от 0,01 до 150 мг/кг, предпочтительно приблизительно от 0,1 до 50 мг/кг и наиболее предпочтительно приблизительно от 0,1 до 30 мг/кг веса тела млекопитающего. Таблица I Соединения получены в соответствии со схемами синтеза 1 или 2. Все соединения в табл. I представляют собой гидрохлориды. Общие схемы синтеза Схема 1. (i) NaH, ТГФ, TBDMSCl или TIPSCl в СН 2 Сl2; (ii) X = Вr: t-Вu3 Р, Pd(OAc)2, диамин по выбору, NaOt-Bu, ксилол; (iii) Bu4NF 1M, ТГФ или NaF, этилацетат; (iv) Ar-SO2Cl, Py или NaOH или NaH,CH2Cl2; (v) HCl в эфире. Приписанные соединениям структуры подтверждены стандартными спектроскопическими методами, элементным анализом и/или масс-спектрами высокого разрешения. Спектры ЯМР получены на спектрометрах Bruker 500 МГц или JEOL 270 МГц при 25 С, и значения химических сдвигов представлены в миллионных долях . МС спектры получены с помощью 2690Separation Module (Waters) с Platform LCZ (Micromass). Флэш-хроматографию проводят на силикагеле 60(Merck) или LiChoprep RP-18 (Merck). ВЭЖХ проводят на HP Series 1100 с колонкой GROM-SIL 100ODS-0 АВ, 4,650 мм. Очистку ВЭЖХ проводят с помощью препаративной системы ВЭЖХ/Масс, используя колонку YMC Combi prep ODS-AQ, 5620 мм, насосы Гилсона, детектор Dynamax UV-1 и детектор массы Финнигана. В качестве элюентов используют Н 2 О и СН 3 СN, в обоих случаях с 0,1% ТФУ. Чистоту соединений определяют с помощью ВЭЖХ. Элементный анализ выполнен в Structural ChemistryDepartment, Biovitrum AB, Stockholm. Температуры плавления, если они приведены, получены на приборе для определения температуры плавления Buchi или Gallenkamp, и эти температуры являются не скорректированными. Общие способы синтеза Способ 1. Конденсация Бухвальда между арилтрифлатами или арилгалогенидами и аминами. К раствору арилтрифлата (1 экв.) в ксилоле в токе N2 добавляют Pd(OAc)2 (0,6 экв.), (R)-2,2'бис(дифенилфосфино)-1,1'-бинафтил (BINAP) (0,1 экв.) и CS2CO3 (3 экв.), затем добавляют амин (2 экв.). Смеси нагревают до 100-120 С при перемешивании (контроль по данным ТСХ). Очистка флэшхроматографией [SiO2, элюент от СНСl3 до МеОН:СНСl3: водный NH3 (10:90:0,4%)] дает конечные соединения. Конечные соединения превращают в гидрохлориды путем растворения свободных оснований в метаноле и диэтиловом эфире (1:9) с последующим добавлением НСl в диэтиловом эфире. Способ 2. Конденсация Бухвальда между арилгалогенидами и аминами. К смеси 4-броминдолов (1 экв.), t-Вu3 Р (0,05 экв.) ИЛИ 2-(дициклогексилфосфино)бифенила (0,05 экв.) и Pd(OAc)2 (0,02 экв.) в ксилоле добавляют амины (2,8 экв.) и NaO-tBu (2,8 экв.). Реакционные смеси нагревают при 120 С в течение 4 ч, фильтруют через целит и растворители удаляют. Сырые смеси очищают колоночной хроматографией (SiO2, СН 2 Сl2/гептан, 1:4), получая конечные соединения. Конечные соединения превращают в гидрохлориды по методике, аналогичной методике, описанной в способе 1. Способ 3. Сульфирование в присутствии NaOH. К холодному (0 С) раствору производных индола (0,5 ммоль), измельченного NaOH (3 ммоль) и-9 006132 гидросульфата тетрабутиламмония (0,05 ммоль) в CH2Cl2 (3 мл) добавляют арилсульфонилхлориды (0,75 ммоль). Смеси встряхивают 30 мин при 0 С и 30 мин при комнатной температуре. Каждую смесь затем фильтруют через слой гидроматрикса (Varian, 3 см) и силикагеля (0,5 см). Систему промывают CH2Cl2 (23 мл) и растворитель выпаривают в вакууме. Полученные остатки (конечные продукты в виде свободных оснований) растворяют в CH2Cl2 (3 мл) и добавляют НСl в эфире (2 мл), затем встряхивают в течение 2 ч при комнатной температуре. Полученные осадки отфильтровывают, получая названные соединения в виде гидрохлоридов. Чистоту соединений анализируют методом ЖХ и, возможно, очищают с помощью ЖХ/МС, если это необходимо. Способ 4. Сульфирование в присутствии NaH. К производным индола (1 экв.) и 60%-ной дисперсии NaH в масле (2 экв.) в CH2Cl2, содержащем ДМФ (1%), добавляют сульфонилхлориды (1,5 экв.). Через 1 ч при комнатной температуре реакционные смеси гасят водой, фильтруют и растворитель удаляют. После очистки колоночной хроматографией(SiO2, СН 2 Сl2:МеОН, 9:1:0,4% NH3) получают конечные соединения. Конечные соединения превращают в гидрохлориды по методике, аналогичной методике, описанной в способе 1. Способ 5. Сульфирование натриевой соли 4-(4-трет-бутилоксикарбонил)пиперазинилиндола (исходный раствор А). К раствору 4-(4-трет-бутилоксикарбонил)пиперазинилиндола (1,50 г, 6,50 ммоль) в ТГФ (45 мл) добавляют NaH (163 мг, 6,5 ммоль). Реакционную смесь перемешивают при комнатной температуре 0,5 ч. Суспензию разбавляют до 60 мл с помощью ТГФ и разделяют на 30 реакционных пузырьков (исходный раствор А). К исходному раствору А (2 мл) добавляют различные сульфонилхлориды (0,25 ммоль) в ТГФ(2 мл). Реакционные смеси встряхивают 3 ч, после чего добавляют МеОН (100 мкл). К смесям добавляют полистирол-трисамин (ПС-трисамин) и реакционные смеси перемешивают при комнатной температуре в течение ночи. Смеси фильтруют через короткую колонку с силикагелем и летучие вещества удаляют. Сырые продукты растворяют в МеОН (2 мл), затем добавляют 2 М раствор НСl/эфир (4 мл). Через 0,5 ч образцы центрифугируют и маточный раствор декантируют через 0,5 ч. Оставшееся твердое вещество промывают эфиром и сушат в вакууме, получая гидрохлорид. Пример 1 (промежуточное соединение). 4-Бром-1-(триизопропилсилил)-1H-индол (схема 1). К раствору 4-броминдола (3,07 г, 15,6 ммоль) и триизопропилсилилхлорида (3,62 г, 18,8 ммоль) вCH2Cl2 (50 мл) и ДМФ (2 мл) добавляют NaH в виде 60%-ной дисперсии в масле (0,94 г, 23,4 ммоль). Реакционную смесь перемешивают при комнатной температуре 1 ч и гасят водой. Нерастворимый продукт отфильтровывают и растворитель удаляют. После очистки колоночной хроматографией (SiO2,СН 2 Сl2/гептан, 1:4) получают 3,44 г (63%) названного соединения. 1 Н ЯМР (CDCl3)7,42-6,63 (м, 5 Н), 1,66 (септ, J = 8 Гц, 3 Н), 1,10 (д, J = 8 Гц, 18 Н); МС (ESI) 354,4 (М+Н)+; чистота (по ВЭЖХ) 95%. Пример 2 (промежуточное соединение). N-трeт-Бутилтриметилсилил-4-хлориндол (схема 1). В безводном ТГФ (0,5 л) растворяют 4-хлориндол (131,1 г, 0,871 моль). Раствор охлаждают до 0 С(ледяная баня, перемешивание), одной порцией добавляют t-BuOK (97,6 г, 0,871 моль) и перемешивание продолжают еще в течение 5 мин. При хорошем перемешивании порциями в течение 10 мин добавляют трет-бутилдиметилхлорсилан (131,13 г, 0,871 моль). Реакция экзотермична (выделяется тепло). Через 30 мин реакционную смесь гасят водой (20 мл), доводят рН до 8-9 и экстрагируют этилацетатом (350 мл). Органические фазы сушат (MgSO4), фильтруют и летучие вещества удаляют в вакууме. Остаток растирают и кристаллизуют из гептана, получая 181 г (78%) названного соединения. 1 Н ЯМР (CDCl3)7,45 (дд, J = 7,9 Гц, J = 0,8 Гц, 1 Н), 7,25 (д, J = 3,0 Гц, 1 Н), 7,18-7,07 (м, 2 Н), 6,77(д, 1 Н), 0,96 (с, 9 Н), 0,62 (с, 6 Н); 13 С ЯМР (CDCl3) 141,8; 131,7; 130,3; 125,9; 122,0; 119,7; 112,5; 103,5; 26,3; 19,5; -3,9; МС (ESI) 266,1 (М+Н). Пример 3 (промежуточное соединение). 4-(4-Метил-1-пиперазинил)-1-(триизопропилсилил)-1 Ниндол (схема 1). Соединение получают по способу 2 из 4-бром-1-(триизопропилсилил)индола (0,090 г, 0,255 ммоль),t-Вu3 Р (3,6 мг, 0,014 ммоль) и Pd(OAc)2 (1 мг, 0,0036 ммоль) в ксилоле (3 мл) и 4-метил-1-пиперазина(0,135 г, 0,73 ммоль) и NaOt-Bu (69 мг, 0,72 ммоль). Сырой продукт очищают колоночной хроматографией (SiO2, СН 2 Сl2/гептан, 1:4), получая 90 мг (84%) чистого вещества. 1 Н ЯМР (CD3OD)7,19-6,56 (м, 5 Н), 3,31-3,25 (м, 4 Н), 2,71-2,63 (м, 4 Н), 2,36 (с, 3 Н), 1,76 (септ, J = 8 Гц, 3 Н), 1,11 (д, J = 8 Гц, 18 Н);(схема 1). Соединение получают по способу 2 из N-трет-бутилдиметилсилил-4-хлориндола (100 г, 376 ммоль,1 экв.), трет-бутил-1-пиперазинкарбоксилата (84 г, 451 ммоль), ацетата палладия(II) (1,26 г, 5,62 ммоль,2%), 2-(дициклогексилфосфино)бифенила (3,95 г, 11,28 ммоль, 4 мол.%) и t-BuONa (50 г, 520 ммоль, 1,4 экв.) в толуоле. Раствор охлаждают до комнатной температуры и добавляют KН 2 РО 4 (150 мл, 13% вод- 10006132 ный раствор), доводят рН до 8-9, затем экстрагируют толуолом (2100 мл), сушат (MgSO4) и упаривают. Остаток перекристаллизовывают из гептана, получая 124,4 г (79,9%). 1 Н ЯМР (CDCl3)7,20 (д, J = 8,4 Гц, 1 Н), 7,13 (д, J = 3,2 Гц, 1 Н), 7,06 (т, 1 Н), 6,60-6,57 (м, 2 Н), 3,65(т, 4 Н), 3,16 (т, 4 Н), 1,48 (с, 9 Н), 0,91 (с, 9 Н), 0,58 (с, 6 Н); 13 С ЯМР (CDCl3)155,0; 145,5; 142,2; 129,9; 124,9; 122,0; 109,3; 107,2; 102,9; 79,8; 77,3; 51,5; 28,5; 26,4; 19,5; -3,8; МС (ESI) 416,4 (М+Н). Пример 5 (промежуточное соединение). 4-(4-Вос-пиперазинил)индол (схема 1). Смесь N-трет-бутилдиметилсилил-4-(4-трет-бутилоксикарбонатпиперазинил)индола (4) (116,9 г,281 ммоль), NaF (30 г, 714 ммоль), AcOEt (440 г), воды (200 мл) и Bu4NSO4 (2 г, 6 ммоль) нагревают при интенсивном перемешивании до 50-60 С в атмосфере азота в течение 2 ч. Органическую фазу отделяют и водную фазу экстрагируют еще раз AcOEt (100 мл). Органические фазы сушат (MgSO4), упаривают и упаривают одновременно с этанолом. Остаток перекристаллизовывают из смеси эфир:гексан (1:3), получая 81,0 г (95,6%) названного соединения. 1 Н ЯМР (CDCl3)8,59 (шир.с, 1 Н); 7,12-7,02 (м, 3 Н), 6,58 (д, J = 6,9 Гц, 1 Н), 7,53 (т, 1 Н), 3,69 (т,4 Н), 3,19 (т, 4 Н), 1,53 (с, 9 Н); 13 С ЯМР (CDCl3)155,1; 145,5; 137,1; 123,2; 122,6; 121,4; 106,9; 106,5; 100,8; 80,0; 77,4; 51,4; 28,6; МС (ESI) 302,2 (М+Н). Пример 6 (промежуточное соединение). 4-(4-Метил-1-пиперазинил)-1H-индол (схема 1). Смесь 4-(1-метил-1-пиперазинил)-1-(триизопропилсилил)-1 Н-индола (110 мг, 0,296 ммоль) и 1 М раствор Bu4NF в ТГФ (1 мл) перемешивают при комнатной температуре 1 ч. Добавляют смесь СН 2 Сl2/гептан, 1:1 (10 мл) и затем фильтруют через силикагель. Продукт очищают колоночной хроматографией (SiO2, CH2Cl2/MeOH, 9:1:0,4% NH3), получая 60 мг (94%) названного вещества. 1 Н ЯМР (CD3OD)7,11-6,41 (м, 5 Н), 3,30-3,23 (м, 4 Н), 2,71-2,66 (м, 4 Н), 2,37 (с, 3 Н); МС (ESI) 216,4 (М+Н)+; чистота (по ВЭЖХ) 95%. Пример 7. Дигидрохлорид 1-фенилсульфонил-4-пиперазинилиндола. Названное соединение получают из 4-bос-пиперазинилиндола и фенилсульфонилхлорида по способу 3. 1 Н ЯМР (ДМСО-d6)9,64 (шир.с, 2 Н), 7,98-7,94 (м, 4 Н), 7,80-7,77 (м, 1 Н), 7,70-7,65 (м, 1 Н), 7,637,55 (м, 3 Н), 7,27-7,22 (м, 1 Н), 6,95 (д, J = 3,76 Гц, 1 Н), 6,81-6,77 (м, 1 Н), 3,31-3,20 (м, 4 Н); 13 С ЯМР (ДMCO-d6)144,79, 137,02, 135,22, 134,62, 129,82, 126,65, 125,63, 125,54, 123,49, 111,15,107,87, 107,76, 47,81, 42,86. Анал. (C18H19N3O2S2 HCl0,5 H2O) С, Н, N. Пример 8. Гидрохлорид 1-[(2,5-диметоксифенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 2,5-(диметоксифенил) сульфонилхлорида по способу 3. 1 Н ЯМР (500 МГц, ДМСО-d6)8,95 (шир., 1 Н), 7,71 (д, J= 5 Гц, 1 Н), 7,52 (д, J = 5 Гц, 1 Н), 7,38 (д, J= 8 Гц, 1 Н), 7,27 (д, J = 8 Гц, 1 Н), 7,14 (т, J = 8 Гц, 1 Н), 7,13 (д, J = 8 Гц, 1 Н), 6,86 (д, J = 5 Гц, 1 Н), 6,77 (д,J = 8 Гц, 1 Н), 3,81 (с, 3 Н), 3,64 (с, 3 Н), 3,40-3,20 (м, 8 Н); МС (ESI+) для m/z 402 (М+Н)+. Пример 9. Гидрохлорид 1-(мезитилсульфонил)-4-(1-пиперазинил)-1 Н-индола (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и мезитилсульфонилхлорида по способу 3. 1 Н ЯМР (270 МГц, ДМСО-d6)9,10 (шир., 1 Н), 7,71 (д, J = 5 Гц, 1 Н), 7,40-7,20 (м, 3 Н), 7,00-6,80 (м,2 Н), 6,51 (д, J = 8 Гц, 1 Н), 3,30-3,20 (м, 8 Н), 2,41 (с, 6 Н), 2,27 (с, 3 Н); МС (ESI+) для m/z 384 (М+Н)+. Пример 10. Гидрохлорид 1-(1-нафтилсульфонил)-4-(1-пиперазинил)-1 Н-индола (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и нафтилсульфонилхлорида по способу 3. 1 Н ЯМР (270 МГц, ДМСО-d6)9,03 (шир., 1 Н), 8,63 (д, J = 8 Гц, 1 Н), 8,43 (д, J = 8 Гц, 1 Н), 8,34 (д, J= 8 Гц, 1 Н), 8,15-8,05 (м, 2 Н), 7,80-7,65 (м, 3 Н), 7,41 (д, J = 8 Гц, 1 Н), 7,18 (т, J = 8 Гц, 1 Н), 6,93 (д, J = 5 Гц, 1 Н), 6,74 (д, J = 8 Гц, 1 Н), 3,30-3,20 (м, 8 Н); МС (ESI+) для m/z 392 (М+Н)+. Пример 11. Гидрохлорид N,N-диметил-5-[4-(1-пиперазинил)-1 Н-индол-1-ил]сульфонил-1 нафталинамина (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 5-N,N-диметилнафталинамин-1 сульфонилхлорида по способу 3. 1 Н ЯМР (270 МГц, ДМСО-d6)9,25 (шир., 1 Н), 8,63 (д, J = 8 Гц, 1 Н), 8,41 (д, J = 8 Гц, 1 Н), 8,29 (д,J = 8 Гц, 1 Н), 8,12 (м, 2 Н), 7,80-7,65 (м, 3 Н), 7,41 (д, J = 8 Гц, 1 Н), 7,18 (т, J = 8 Гц, 1 Н), 6,93 (д, J = 5 Гц,- 11006132 1 Н), 6,74 (д, J = 8 Гц, 1 Н), 3,30-3,20 (м, 8H), 2,82 (м, 6 Н); МС (ESI+) для m/z 435 (М+Н)+. Пример 12. Гидрохлорид 1-[(4-пропоксифенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 4-пропоксифенилсульфонилхлорида по способу 3. 1 Н ЯМР (270 МГц, ДМСО-d6)9,03 (шир., 1 Н), 7,89 (д, J = 8 Гц, 2 Н), 7,78 (д, J = 5 Гц, 1 Н), 7,61 (д, J= 8 Гц, 1 Н), 7,25 (т, J = 8 Гц, 1 Н), 7,07 (д, J = 8 Гц, 2 Н), 6,93 (д, J = 5 Гц, 1 Н), 6,67 (д, J = 8 Гц, 1 Н), 4,01 (т,J = 7 Гц, 2 Н), 3,28 (м, 8 Н), 1,66 (м, 2 Н), 1,38 (м, 2 Н), 0,88 (т, J = 7 Гц, 2 Н),МС (ESI+) для m/z 414 (М+Н)+. Пример 13. Гидрохлорид 1-[(2,5-дихлор-3-тиенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 2,5-дихлор-3-тиенилсульфонилхлорида по способу 3. 1 Н ЯМР (270 МГц, ДМСО-d6)9,24 (шир., 1 Н), 7,78 (д, J = 5 Гц, 1 Н), 7,72 (с, 1 Н), 7,57 (д, J = 8 Гц,1 Н), 7,29 (т, J = 8 Гц, 1 Н), 7,01 (д, J = 5 Гц, 1 Н), 6,86 (д, J = 8 Гц, 1 Н), 3,31 (м, 8 Н). МС (ESI+) для m/z 416 (М+Н)+. Пример 14. Гидрохлорид 1-[(4-метоксифенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 4-метоксифенилсульфонилхлорида по способу 3. 1 Н ЯМР (270 МГц, ДМСО-d6)9,07 (шир., 1 Н), 7,90 (д, J = 8 Гц, 2 Н), 7,78 (д, J = 5 Гц, 1 Н), 7,61 (д, J= 8 Гц, 1 Н), 7,25 (т, J = 8 Гц, 1 Н), 7,09 (д, J = 8 Гц, 2 Н), 6,92 (д, J = 5 Гц, 1 Н), 6,68 (д, J = 8 Гц, 1 Н), 3,79 (с,3 Н), 3,24 (м, 8 Н); МС (ESI+) для m/z 371 (М+Н)+. Пример 15. Гидрохлорид 1-[(2,4-дифторфенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 2,4-дифторфенилсульфонилхлорида по способу 3. 1 Н ЯМР (270 МГц, ДМСO-d6)9,41 (шир., 1 Н), 8,24 (м, 1 Н), 7,75 (м, 1 Н), 7,58 (м, 1 Н), 7,47-7,33 (м,2 Н), 7,23 (т, J= 8 Гц, 1 Н), 6,99 (д, J = 5 Гц, 1 Н), 6,70 (д, J = 8 Гц, 1 Н), 3,25 (м, 8 Н),МС (ESI+) для m/z 378 (М+Н)+. Пример 16. Гидрохлорид 1-([1,1'-бифенил]-4-илсульфонил)-4-(1-пиперазинил)-1 Н-индола (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 1,1'-бифенил-4-илсульфонилхлорида по способу 3. 1 Н ЯМР (270 МГц, ДМСО-d6)9,26 (шир., 1 Н), 8,04 (м, 2 Н), 7,88 (м, 3 Н), 7,67 (м, 3 Н), 7,46 (м, 3 Н),7,27 (т, J = 8 Гц, 1 Н), 6,96 (д, J = 5 Гц, 1 Н), 6,80 (д, J = 8 Гц, 1 Н), 3,25 (м, 8 Н); МС (ESI+) для m/z 418 (М+Н)+. Пример 17. Гидрохлорид 1-([3,4-диметоксифенил]сульфонил)-4-(1-пиперазинил)-1 Н-индола (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 3,4-диметоксифенилсульфонилхлорида по способу 3. 1 Н ЯМР (270 МГц, ДМСО-d6)9,00 (шир., 1 Н), 7,82 (д, J = 5 Гц, 1 Н), 7,66 (д, J = 8 Гц, 1 Н), 7,57 (м,1 Н), 7,40 (д, J = 3 Гц, 1 Н), 7,24 (т, J = 8 Гц, 1 Н), 7,10 (д, J = 8 Гц, 1 Н), 6,90 (д, J = 5 Гц, 1 Н), 6,78 (д, J = 8 Гц, 1 Н), 3,78 (с, 6 Н), 3,24 (м, 8 Н); МС (ESI+) для m/z 402 (М+Н)+. Пример 18. Гидрохлорид 5-метил-2-[4-(1-пиперазинил)-1 Н-индол-1-ил]сульфонилфенилметилового эфира (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 5-метил-2-метоксифенилсульфонилхлорида по способу 3. 1 Н ЯМР (270 МГц, ДМСО-d6)9,45 (шир., 1 Н), 7,92 (д, J = 8 Гц, 1 Н), 7,70 (д, J = 5 Гц, 1 Н), 7,30 (д, J= 8 Гц, 1 Н), 7,13 (т, J = 8 Гц, 1 Н), 7,01-6,92 (м, 2 Н), 6,83 (д, J = 5 Гц, 1 Н), 6,73 (д, J = 8 Гц, 1 Н), 3,70 (с,3 Н), 3,26 (м, 8 Н), 3,32 (с, 3 Н); МС (ESI+) для m/z 386 (М+Н)+. Пример 19. Гидрохлорид 1-[(2,5-дихлорфенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 2,5-дихлорфенилсульфонилхлорида по способу 3. 1 Н ЯМР (270 МГц, ДМСО-d6)9,09 (шир., 1 Н), 8,25 (д, J = 3 Гц, 1 Н), 7,91-7,81 (м, 2 Н), 7,72 (д, J = 8 Гц, 1 Н), 7,36 (д, J = 8 Гц, 1 Н), 7,23 (т, J = 8 Гц, 1 Н), 6,98 (д, J = 3 Гц, 1 Н), 6,82 (д, J = 8 Гц, 1 Н), 3,26 (м,8 Н). Пример 20. Гидрохлорид 1-[(5-хлор-1,3-диметил-1 Н-пиразол-4-ил)сульфонил]-4-(1-пиперазинил)1 Н-индола (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 5-хлор-1,3-диметил-1 Н- 12006132 пиразол-4-илсульфонилхлорида по способу 3. 1 Н ЯМР (270 МГц, ДМСО-d6)9,17 (шир., 1 Н), 7,78 (д, J = 3 Гц, 1 Н), 7,49 (д, J = 8 Гц, 1 Н), 7,28 (т, J= 8 Гц, 1 Н), 6,93 (д, J = 3 Гц, 1 Н), 6,87 (д, J = 8 Гц, 1 Н), 3,72 (с, 3 Н), 3,28 (м, 8 Н), 2,34 (с, 3 Н); МС (ESI+) для m/z 394 (М+Н)+. Пример 21. Гидрохлорид 1-[(3-хлор-2-метилфенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 3-хлор-2-метоксифенилсульфонилхлорида по способу 3. 1 Н ЯМР (270 МГц, ДМСО-d6)9,21 (шир., 1 Н), 7,89 (д, J = 3 Гц, 1 Н), 7,82 (т, J = 8 Гц, 1 Н), 7,51 (т, J= 8 Гц, 1 Н), 7,19 (д, J = 8 Гц, 1 Н), 7,10 (т, J = 8 Гц, 1 Н), 7,01 (д, J = 3 Гц, 1 Н), 6,81 (д, J = 8 Гц, 1 Н), 3,29 (м,8 Н), 2,54 (с, 3 Н); МС (ESI+) для m/z 390 (М+Н)+. Пример 22. Гидрохлорид 2-хлор-5-(4-[4-(1-пиперазинил)-1 Н-индол-1-ил]сульфонилфенокси) бензонитрила (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 2-хлор-5-[4-(пиперазинил)-1 Ниндол-1-ил]сульфонилхлорида по способу 3. 1 Н ЯМР (270 МГц, ДМСО-d6)9,20 (шир., 1 Н), 8,06 (д, J = 8 Гц, 2 Н), 7,81 (д, J = 3 Гц, 1 Н), 7,75-7,55(м, 3 Н), 7,30-7,15 (м, 4 Н), 6,97 (д, J = 3 Гц, 1 Н), 6,82 (д, J = 8 Гц, 1 Н), 3,27 (м, 8 Н); МС (ESI+) для m/z 493 (М)+, 495. Пример 23. Гидрохлорид 4-бром-2-[4-(1-пиперазинил)-1 Н-индол-1-ил]сульфонилфенилметилового эфира (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и сульфонилхлорида 4-бром-2 фенилметилового эфира по способу 3. 1 Н ЯМР (270 МГц, ДМСО-d6)9,40 (шир., 1 Н), 8,12 (д, J = 3 Гц, 1 Н), 7,88 (д, J = 8 Гц, 1 Н), 7,72 (д, J= 5 Гц, 1 Н), 7,37 (д, J = 8 Гц, 1 Н), 7,25-7,10 (м, 2 Н), 6,89 (д, J = 3 Гц, 1 Н), 6,78 (д, J = 8 Гц, 1 Н), 3,71 (с,3 Н), 3,29 (м, 8 Н); МС (ESI+) для m/z 450 (М)+, 452. Пример 24. Гидрохлорид 4-(1-пиперазинил)-1-(3-пиридинилсульфонил)-1 Н-индола (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 3-пиридинилсульфонилхлорида по способу 3. 1 Н ЯМР (270 МГц, ДМСО-d6)9,37 (шир., 1 Н), 9,18 (д, J = 3 Гц, 1 Н), 8,86 (д, J = 5 Гц, 1 Н), 8,39 (д, J= 8 Гц, 1 Н), 7,85 (д, J = 3 Гц, 1 Н), 7,70-7,60 (м, 2 Н), 7,27 (т, J = 8 Гц, 1 Н), 7,00 (д, J = 3 Гц, 1 Н), 6,82 (д, J = 8 Гц, 1 Н), 3,24 (м, 8 Н); МС (ESI+) для m/z 343 (М+Н)+. Пример 25. Гидрохлорид 7-[4-(1-пиперазинил)-1 Н-индол-1-ил]сульфонил-2-(трифторацетил)1,2,3,4-тетрагидроизохинолина (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 2-(трифторацетил)-1,2,3,4 тетрагидроизохинолинсульфонилхлорида по способу 3. 1 Н ЯМР (500 МГц, ДМСО-d6). Измерения проведены при 100 С 9,25 (шир., 1 Н), 7,94 (шир., 1 Н),7,75 (д, J = 8 Гц, 1 Н), 7,71 (д, J = 3 Гц, 1 Н), 7,63 (д, J = 8 Гц, 1 Н), 7,41 (д, J = 8 Гц, 1 Н), 7,26 (т, J = 8 Гц,1 Н), 6,90 (д, J = 3 Гц, 1 Н), 6,81 (д, J = 8 Гц, 1 Н), 4,80 (с, 2 Н), 3,79 (м, 2 Н), 3,35-3,25 (м, 8 Н), 2,97 (м, 2 Н); МС (ESI+) для m/z 493 (М+Н)+. Пример 26. Гидрохлорид метил 2-[4-(1-пиперазинил)-1 Н-индол-1-ил]сульфонилфенилсульфона(схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 2-метилсульфонилфенилсульфонилхлорида по способу 3. 1 Н ЯМР (270 МГц, ДМСО-d6)9,22 (шир., 1 Н), 8,29 (д, J = 8 Гц, 1 Н), 7,99 (т, J = 8 Гц, 1 Н), 7,90-7,80(м, 2 Н), 7,43 (д, J = 8 Гц, 1 Н), 7,30-7,15 (м, 2 Н), 7,04 (д, J = 3 Гц, 1 Н), 6,85 (д, J = 8 Гц, 1 Н), 3,56 (с, 3 Н),3,29 (м, 8 Н); МС (ESI+) для m/z 420 (М+Н)+. Пример 27. Гидрохлорид 1-[(4-фторфенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 2-метилсульфонилфенилсульфонилхлорида по способу 4, получая гидрохлорид (выход 70%), чистота по ВЭЖХ 95%. 1 Н ЯМР (ДMCO-d6)3,26 (шир.с, 8 Н), 6,80 (шир.с, 1 Н), 6,95 (шир.с, 1 Н), 7,26 (шир.с, 1 Н), 7,61(вер.т, 2 Н), 7,80 (шир.с, 1 Н), 8,06 (шир.с, 1 Н), 9,30 (шир.с, 1 Н); 13 С ЯМР (ДМСО-d6)165,20, 144,94, 135,14, 133,31, 130,06 (2 С), 125,62 (2 С), 123,50, 117,25, 117,06,111,15, 107,92, 107,71, 47,82 (2 С), 42,98 (2 С); МС (posES-FIA) m/z 360 (М+Н). Пример 28. Гидрохлорид 1-[(5-хлор-3-метил-1-бензотиен-2-ил)сульфонил]-4-(1-пиперазинил)-1 Н- 13006132 индола (схема 1). Названное соединение получают из 4-(4-bос-пиперазинил)индола и 1-(5-хлор-3-метил-1-бензотиен 2-ил)сульфонилхлорида по способу 4, получая гидрохлорид (выход 45%), чистота по ВЭЖХ 95%. 1 Н ЯМР (ДМСО-d6)2,65 (с, 3 Н), 3,26 (шир.с, 8 Н), 6,82 (вер.д, 1 Н), 7,00 (вер.д, 1 Н), 7,28 (вер.т, 1 Н),7,60 (вер.дд, 2 Н), 7,87 (вер.д, 1 Н), 8,08-8,12 (м, 2 Н); 13 С ЯМР (ДМCO-d6)145,05, 139,82, 139,35, 137,46, 135,14, 133,31, 130,96, 128,70 (2 С), 125,62,124,89, 124,12, 123,52, 111,42, 107,91, 107,71, 47,87 (2 С), 43,03 (2 С), 12,27; МС (posES-FIA) m/z 446 (М+Н). Пример 29. Гидрохлорид 4-(4-метил-1-пиперазинил)-1-(4-метилбензолсульфонил)-1 Н-индола (схема 1). Названное соединение получают из 4-(4-метил-1-пиперазинил)-1 Н-индола и п-метилбензолсульфонилхлорида по способу 4 (выход 45%). 1 Н ЯМР (CD3OD)7,81-6,77 (м, 9 Н), 3,62-3,02 (м, 8 Н), 2,98 (с, 3 Н), 2,34 (с, 3 Н); МС (ESI) 370,5 (М+Н)+; чистота по ВЭЖХ 95%. Пример 30 (промежуточное соединение). Синтез (4-трифторметилсульфонилокси)индола (схема 2). К раствору 4-гидроксииндола (1,0 г, 7,5 ммоль) в CH2Cl2 (20 мл) добавляют Et3N (1,6 мл, 11,3 ммоль). Реакционную смесь охлаждают (ледяная баня), затем осторожно добавляют раствор N-фенилбис(трифторметансульфонамида) (2,6 г, 7,5 ммоль) в CH2Cl2. Реакционную смесь через 10 мин промывают водным раствором K2 СО 3, сушат (K2 СО 3) и фильтруют. Летучие вещества удаляют в вакууме, получая 2,9 г светло-коричневого масла, которое очищают флэш-хроматографией (Si2O, CHCl3). Получают 2,47 г (62%) названного соединения в виде светло-оранжевого масла. Чистота по данным ГХ составляет 92%. 1 Н ЯМР (MeOH-d3):7,45 (д, 1 Н), 7,35 (д, 1 Н), 7,15 (т, 1 Н), 7,00 (д, 1 Н), 6,50 (д, 1 Н). Пример 31 (промежуточное соединение). Синтез (4-трифтормeтилсульфонилокси)-(N-(4-трифторметил)фенилсульфонил)индола (cхема 2). Раствор 4-(трифторметилсульфонилокси)индола (2,28 г, 8,6 ммоль) в CH2Cl2 добавляют по каплям в атмосфере N2 в течение 10 мин к смеси NaH (619 мг, 25,8 ммоль, предварительно промыт гептаном) вCH2Cl2 (20 мл) и ДМФ (0,5 мл). Медленно при температуре 0 С добавляют раствор 4(трифторметил)бензолсульфонилхлорида (2,31 г, 9,5 ммоль) в CH2Cl2 (1 мл). Смесь оставляют при комнатной температуре при перемешивании на 1 ч. Затем реакционную смесь осторожно гасят водой, органическую фазу отделяют, сушат, фильтруют через силикагель и концентрируют, получая 3,3 г сырого продукта в виде красного масла. Продукт очищают флэш-хроматографией (SiO2, элюент от гептана до гептан/EtOAc, 10:1), получая 2,43 г (59%) названного соединения в виде бесцветного масла. Чистота по данным ВЭЖХ 100%. МС m/z=496 (M+Na+). 1 Н ЯМР (МеОН-d3):8,20 (д, 2 Н), 8,1 (д, 1 Н), 7,85 (м, 3 Н), 7,45 (т, 1 Н), 7,30 (д, 1 Н), 6,85 (д, 1 Н). Пример 32. Гидрохлорид 4-пиперазино-(N-(4-трифторметил)фенилсульфонил)индола (cхема 2). Названное соединение получают из (4-трифторметилсульфонилокси)(N-(4-трифторметил) фенилсульфонил)индола (200 мг, 0,42 ммоль) и пиперазина (72 мг, 0,84 ммоль) по способу 1. После очистки флэш-хроматографией (SiO2, элюент от СНСl3 до МеОН/СНСl3, 10:90:0,4% водного NH3) получают 10 мг желтого масла. Масло растворяют в этаноле и добавляют HCl/эфир, затем перемешивают в течение нескольких часов. Твердое вещество отфильтровывают, получая 10 мг конечного продукта в виде бежевого твердого вещества, которое далее очищают препаративной ВЭЖХ, после образования гидрохлорида получают конечный продукт (38 мг, 51%). Чистота по данным ВЭЖХ 97%. МС (posEI) m/z=410 (М+Н). 1 Н ЯМР (CD3OD)8,12 (д, 2 Н, J = 8,3 Гц), 7,84 (д, 2 Н, J = 8,3 Гц), 7,76-7,68 (м, 2 Н), 7,33-7,27 (м,1 Н), 6,88-6,85 (м, 2 Н), 3,44-3,30 (м, 8 Н, частично скрыт). Пример 33. Дигидрохлорид 4-(3-метилпиперазин)-(N-(4-трифторметил)фенилсульфонил)индола(cхема 2). Названное соединение получают из (4-трифторметилсульфонилокси)(N-(4-трифторметил) фенилсульфонил)индола и рацемата 2-метилпиперазина по способу 1. После фильтрования через диоксид кремния с использованием в качестве элюента градиента от СНСl3 до МеОН/СНСl3 (10:90:0,4% водного NH3) получают 48 мг конечного продукта в виде бежевого твердого вещества. Т.пл. 145 С (разл.). 1 Н ЯМР (MeOH-d3):8,10 (д, 2 Н), 7,85 (д, 2 Н), 7,75 (д, 1 Н), 7,65 (д, 1 Н), 7,30 (т, 1 Н), 6,85 (м, 2 Н),3,50 (м, 5 Н), 3,00 (т, 1 Н), 2,85 (т, 1 Н), 1,35 (д, 3 Н); МС (posEI) m/z=424 (М+Н). Анал. (C20H20F3N3O2S2HCl) C, H, N, S, N вычисл. 8,47, найдено 9,32. Чистота по данным ВЭЖХ 94%. Пример 34 (промежуточное соединение). 4-Бром-1-(бензолсульфонил)-1 Н-индол (схема 2). 4-Бром-1-(бензолсульфонил)-1H-индол получают из 4-броминдола и фенилсульфонилхлорида по способу 4, получая 3,1 г (91%) светло-фиолетового твердого вещества. Н ЯМР (CDCl3)7,94 (д, J = 8 Гц, 1 Н), 7,89-7,84 (м, 2 Н), 7,62 (д, 4 Гц, 1 Н), 7,57-7,51 (м, 1 Н), 7,467,37 (м, 3 Н), 7,19-7,13 (м, 1 Н), 6,72 (дд, J = 1,4 Гц, 1 Н); МС (ESI) 419,9+421,9 (М+Н)+;чистота по данным ВЭЖХ 95%. Пример 35 (промежуточное соединение). 4-Бром-1-(2-метилбензолсульфонил)-1 Н-индол (схема 2). Названное соединение получают из 4-броминдола (1,02 г, 5,25 ммоль) и о-метилбензолсульфонилхлорида (смесь 9:1 орто- и параметилизомеров) (1,29 г, 6,78 ммоль) по способу 4. После очистки колоночной хроматографией (SiO2, CH2Cl2:гептан) получают 1,6 г (87%) названного соединения,содержащего приблизительно 10% п-метилизомера в виде вязкого светло-фиолетового масла. 1 Н ЯМР (CD3OD)7,94-6,68 (м, 9 Н), 2,52 (с, 3 Н); МС (ESI) 352,3 (М+Н)+; чистота по данным ВЭЖХ 95%. Пример 36. 4-(4-Метил-1-пиперазинил)-1-(2-метилбензолсульфонил)-1 Н-индол (схема 2). Названное соединение получают из 4-бром-1-(2-метилбензолсульфонил)-1 Н-индола (0,135 мг, 0,385 ммоль) и 4-метил-1-пиперазина (0,143 мг, 0,77 ммоль) по способу 2. Продукт очищают колоночной флэш-хроматографией (SiO2, СН 2 Сl2:МеОН, 9:1:0,4% NH3) и превращают в HCl-соль, выделяя 15 мг(10%). 1 Н ЯМР (CD3OD)7,97-6,79 (м, 9 Н), 3,72-3,07 (м, 8 Н), 3,01 (с, 3 Н), 2,48 (с, 3 Н); МС (ESI) 370,0 (М+Н)+; чистота по данным ВЭЖХ 95%. Пример 37. 4-(4-Этил-1-пиперазинил)-1-(2-метилбензолсульфонил)-1 Н-индол (схема 1). Названное соединение получают из 4-бром-1-(2-метилбензолсульфонил)-1 Н-индола и 4-этил-1 пиперазина по способу 1. Продукт выделяют колоночной хроматографией(SiO2,СН 2 Сl2:МеОН/гептан:0,4% NH3), превращают в гидрохлорид путем добавления HCl/эфир, получая 85 мг(40%) белого твердого вещества. 1 Н ЯМР (CD3OD)7,95-6,61 (м, 9 Н), 3,41-3,26 (м, 8 Н), 3,20-3,07 (м, 2 Н), 2,47 (с, 3 Н), 1,42 (т, J = 7 Гц, 3 Н); МС (ESI) 384,0 (М+Н)+; чистота по данным ВЭЖХ 95%. Пример 38. 4-(1-Пиперазинил)-1-(2-метилбензолсульфонил)-1 Н-индол (схема 1). Названное соединение получают из 4-бром-1-(2-метилбензолсульфонил)-1 Н-индола и пиперазина по способу 1, выделяя 25 мг (12%) белого твердого вещества. 1 Н ЯМР (CD3OD)7,91-6,79 (м, 9 Н), 3,49-3,30 (м, 8 Н), 2,48 (с, 3 Н); МС (ESI) 356,1 (М+Н)+; чистота по данным ВЭЖХ 95%. Пример 39. 4-(5-Азаиндолизидинил)-1-(2-метилбензолсульфонил)-1 Н-индол (схема 1). Названное соединение получают из 4-бром-1-(2-метилбензолсульфонил)-1 Н-индола и 5-азаиндолизидинила по способу 1, выделяя 30 мг (13%) белого твердого вещества. 1 Н ЯМР свободного основания (CDCl3)7,85-7,66 (м, 9 Н), 3,63-3,47 (м, 1 Н), 3,16-2,93 (м, 3 Н), 2,672,45 (м, 5 Н), 2,51 (с, 3 Н), 2,33-2,19 (м, 2 Н), 1,92-1,74 (м, 4 Н), 1,52-1,44 (м, 1 Н); МС (ESI) 396,0 (М+Н)+; чистота по данным ВЭЖХ 95%. Пример 40. 4-(4-Метил-1-гомопиперазинил)-1-(2-метилбензолсульфонил)-1 Н-индол (схема 1). Названное соединение получают из 4-бром-1-(2-метилбензолсульфонил)-1 Н-индола и 4-метил-1 гомопиперазина по способу 1, выделяя 20 мг (13%) белого твердого вещества. 1 Н ЯМР (CD3OD)7,91-6,73 (м, 9 Н), 3,74-3,45 (м, 8 Н), 3,00 (с, 3 Н), 2,47 (с, 3 Н), 2,34-2,26 (м, 2 Н); МС (ESI) 384,0 (М+Н)+; чистота по данным ВЭЖХ 95%. Пример 41. 4-(3-Метил-1-пиперазинил)-1-(2-метилбензолсульфонил)-1 Н-индол (схема 1). Названное соединение получают из 4-бром-1-(2-метилбензолсульфонил)-1 Н-индола и 3-метилпиперазина по способу 1, выделяя 110 мг (38%) белого твердого вещества. 1 Н ЯМР (CD3OD)7,92-6,82 (м, 9 Н), 3,64-3,39 (м, 5 Н), 3,12-3,03 (м, 1 Н), 2,92-2,83 (м, 1 Н), 2,47 (с,3 Н), 1,40 (д, J = 7 Гц, 3 Н); МС (ESI) 370,0 (М+Н)+; чистота по данным ВЭЖХ 94%. Пример 42. 4-(цис-3,5-Диметил-1-пиперазинил)-1-(2-метилбензолсульфонил)-1 Н-индол (схема 1). Названное соединение получают из 4-бром-1-(2-метилбензолсульфонил)-1H-индола- и цис-3,5 диметил-1-пиперазина по способу 1, выделяя 10 мг (4%) белого твердого вещества. 1 Н ЯМР (CD3OD)7,90-6,82 (м, 9 Н), 3,69-3,58 (м, 4 Н), 2,83-2,74 (м, 2 Н), 2,45 (с, 3 Н), 1,41 (д, J = 7 Гц, 6 Н); МС (ESI) 492,1 (М+Н)+; чистота по данным ВЭЖХ 95%. Пример 43. 4-(4-Изопропил-1-пиперазинил)-1-(2-метилбензолсульфонил)-1 Н-индол (схема 1). Названное соединение получают из 4-бром-1-(2-метилбензолсульфонил)-1 Н-индола и 4-изопропил 1-пиперазина по способу 1, выделяя 7 5 мг (56%) белого твердого вещества. 1 Н ЯМР (CD3OD)7,92-6,81 (м, 9 Н), 3,75-3,56 (м, 5 Н), 3,48-3,40 (м, 2 Н), 3,19-3,09 (м, 2 Н), 2,47 (с,3 Н), 1,44 (д, J= 7 Гц, 6 Н); МС (ESI) 398,1 (М+Н)+; чистота по данным ВЭЖХ 95%.- 15006132 Пример 44. 4-1S,4S)-2-Метил-2,5-диазабицикло[2.2.1]гептил)-1-(2-метилбензолсульфонил)-1 Ниндол (схема 1). Названное соединение получают из 4-бром-1-(2-метилбензолсульфонил)-1 Н-индола и (1S,4S)-2 метил-2,5-диазабицикло[2.2.1]гептана по способу 1, получая 25 мг (19%) белого твердого вещества. 1 Н ЯМР (CD3OD)7,91-6,44 (м, 9 Н), 4,67-4,63 (м, 1 Н), 4,35-4,33 (м, 1 Н), 4,09-4,07 (м, 1 Н), 3,99-3,95(м, 1 Н), 3,72-3,70 (м, 1 Н), 3,21-3,17 (м, 1 Н), 2,95 (с, 3 Н), 2,33-2,31 (м, 2 Н); МС (ESI) 382,1 (М+Н)+; чистота по данным ВЭЖХ 95%. Пример 45. 4-(4-Метил-1-гомопиперазинил)-1-(бензолсульфонил)-1 Н-индол (схема 1). Названное соединение получают из 4-бром-1-(бензолсульфонил)-1 Н-индола и 4-метил-1 гомопиперазина по способу 1, выделяя 4 мг (2%) белого твердого вещества. 1 Н ЯМР для свободного основания (CDCl3)7,86-7,11 (м, 8 Н), 6,71 (д, J = 4 Гц, 1 Н), 6,54 (д, J = 8 Гц, 1 Н), 3,60-3,57 (м, 2 Н), 3,52-3,48 (м, 2 Н), 2,81-2,78 (м, 2 Н), 2,68-2,64 (м, 2 Н), 2,39 (с, 3 Н), 2,04-2,00 (м,2 Н); МС (ESI) 370,1 (М+Н)+; чистота по данным ВЭЖХ 95%. Пример 46. 4-(цис-3,5-Диметил-1-пиперазинил)-1-(бензолсульфонил)-1 Н-индол (схема 1). Названное соединение получают из 4-бром-1-(бензолсульфонил)-1 Н-индола и цис-3,5-диметил-1 пиперазина по способу 1, выделяя 138 мг (52%) белого твердого вещества. 1 Н ЯМР (CD3OD)7,93-6,82 (м, 10 Н), 3,64-3,59 (м, 4 Н), 2,77-2,68 (м, 2 Н), 1,36 (д, J = 6 Гц, 6 Н); МС (ESI) 370,0 (М+Н)+; чистота по данным ВЭЖХ 95%. Пример 47. 4-(4-Этил-1-пиперазинил)-1-(бензолсульфонил)-1 Н-индол (схема 1). Названное соединение получают из 4-бром-1-(бензолсульфонил)-1 Н-индола и 4-этилпиперазина по способу 1, выделяя 129 мг (48%) белого твердого вещества. 1 Н ЯМР (CD3OD)7,94-6,81 (м, 10 Н), 3,69-3,62 (м, 4 Н), 2,34-3,26 (частично скрыт) (м, 4 Н), 3,143,04 (м, 2 Н), 1,40 (т, J = 7 Гц, 3 Н); МС (ESI) 370,1 (М+Н)+; чистота по данным ВЭЖХ 95%. Пример 48. 4-Пиперазинил-1-(4-нитробензолсульфонил)-1 Н-индол (схема 1). Названное соединение получают по способу 5 из 4-нитробензолсульфонилхлорида и натриевой соли 4-(4-трет-бутилоксикарбонил)пиперазинилиндола (исходный раствор А), выделяя 60,3 мг (86%) в виде HCl-соли. 1 Н ЯМР (CD3OD)8,34 (д, 2 Н, J = 9,0 Гц), 8,18 (д, 2 Н, J = 9,0 Гц), 7,76-7,69 (м, 2 Н), 7,33-7,27 (м,1 Н), 6,90-6,85 (м, 2 Н) 3,44-3,30 (м, 8 Н, частично скрыт); МС (ESI) 386,9 (М+Н)+; чистота по данным ВЭЖХ 95%. Пример 49. 4-Пиперазинил-1-(4-бромбензолсульфонил)-1 Н-индол (схема 1). Названное соединение получают по способу 5 из 4-бромбензолсульфонилхлорида и натриевой соли 4-(4-трет-бутилоксикарбонил)пиперазинилиндола (исходный раствор А), выделяя 40,3 мг (53%) в видеHCl-соли. 1 Н ЯМР (CD3OD)7,81-7,61 (м, 6 Н), 7,30-7,24 (м, 1 Н), 6,86-6,83 (м, 2 Н) 3,44-3,30 (м, 8 Н); МС (ESI) 419,9, 421,9 (М+Н)+; чистота по данным ВЭЖХ 98%. Пример 50. 4-Пиперазинил-1-(4-хлорбензолсульфонил)-1H-индол (схема 1). Названное соединение получают по способу 5 из 4-хлорбензолсульфонилхлорида и натриевой соли 4-(4-трет-бутилоксикарбонил)пиперазинилиндола (исходный раствор А), выделяя 42 мг (61%) в видеHCl-соли. 1 Н ЯМР (CD3OD)7,88 (д, 2 Н, J = 8,7 Гц), 7,72-7,63 (м, 2 Н), 7,50 (д, 2 Н, J = 8,7 Гц), 7,30-7,24 (м,1 Н), 6,86-6,84 (м, 2 Н) 3,44-3,31 (м, 8 Н); МС (ESI) 375,9, 377,9 (М+Н)+; чистота по данным ВЭЖХ 95%. Пример 51. 4-Пиперазинил-1-(Е-2-фенилэтенсульфонил)-1H-индол (схема 1). Названное соединение получают по способу 5 из 1-(Е-2-фенилэтен)сульфонилхлорида и натриевой соли 4-(4-трет-бутилоксикарбонил)пиперазинилиндола (исходный раствор А), выделяя 8 мг (11%) в видеHCl-соли. 1 Н ЯМР (CD3OD)7,78 (д, 1 Н, J = 15,4 Гц) 7,68-7,25 (м, 9 Н), 7,16 (д, 1 Н, J = 15,4), 6,88-6,84 (м, 2 Н) 3,46-3,34 (м, 8 Н); МС (ESI) 368,0 (М+Н)+; чистота по данным ВЭЖХ 97%. Пример 52. 4-Пиперазинил-1-(3-трифторметилбензолсульфонил)-1 Н-индол (схема 1). Названное соединение получают по способу 5 из 3-трифторметилбензолсульфонилхлорида и натриевой соли 4-(4-трет-бутилоксикарбонил)пиперазинилиндола (исходный раствор А), выделяя 42 мг(м, 8 Н); МС (ESI) 410,0 (М+Н)+; чистота по данным ВЭЖХ 95%.- 16006132 Пример 53. 4-Пиперазинил-1-(4-цианбензолсульфонил)-1 Н-индол (схема 1). Названное соединение получают по способу 5 из 4-цианбензолсульфонилхлорида и натриевой соли 4-(4-трет-бутилоксикарбонил)пиперазинилиндола (исходный раствор А), получая 28 мг (42%) белого твердого вещества. МС (ESI): 367,0 (М+Н)+, чистота по данным ВЭЖХ 95%. Пример 54. 4-Пиперазинил-1-(4-хлор-7-хлор-2,1,3-бензоксадиазолсульфонил)-1H-индол (схема 1). Названное соединение получают по способу 5 из 4-хлор-7-хлорсульфонил-2,1,3 бензоксадиазолсульфонилхлорида и натриевой соли 4-(4-трет-бутилоксикарбонил)пиперазинилиндола(исходный раствор А), выделяя 12 мг (16%) белого твердого вещества. 1 Н ЯМР (CD3OD)8,42 (д, 2 Н, J = 7,1 Гц), 7,84-7,63 (м, 3 Н), 7,27-7,21 (м, 1 Н), 6,85-6,81 (м, 2 Н),3,43-3,27 (м, 8 Н, частично скрыт); МС (ESI) 418,0 (М+Н)+; чистота по данным ВЭЖХ 91%. Пример 55. 4-Пиперазинил-1-(3-цианбензолсульфонил)-1H-индол (схема 1). Названное соединение получают по способу 5 из 4-трифторметилбензолсульфонилхлорида и натриевой соли 4-(4-трет-бутилоксикарбонил)пиперазинилиндола (исходный раствор А), выделяя 68 мг(50%) белого твердого вещества. МС (ESI): 367,1 (М+Н)+, чистота по данным 93%. Пример 56. 4-Пиперазинил-1-(4-феноксибензолсульфонил)-1 Н-индол (схема 1). Названное соединение получают по способу 5 из 4-феноксибензолсульфонилхлорида и натриевой соли 4-(4-трет-бутилоксикарбонил)пиперазинилиндола (исходный раствор А), выделяя 68 мг (87%) белого твердого вещества. 1 Н ЯМР (CD3OD)7,82-7,59 (м, 4 Н), 7,76-7,34 (м, 4 Н), 6,88-6,78 (м, 6 Н), 3,45-3,30 (м, 8 Н); МС (ESI) 434,1 (М+Н)+; чистота по данным ВЭЖХ 95%. Пример 57. 4-Пиперазинил-1-(4-хлорфенилметансульфонил)-1 Н-индол (схема 1). Названное соединение получают по способу 5 из 4-хлорфенилметансульфонилхлорида и натриевой соли 4-(4-трет-бутилоксикарбонил)пиперазинилиндола (исходный раствор А), выделяя 3 мг (4%) белого твердого вещества. 1 Н ЯМР (CD3OD)7,44 (д, 1 Н, J = 8,2 Гц), 7,24-7,18 (м, 4 Н), 6,87-6,84 (м, 3 Н), 6,69-6,67 (м, 1 Н), 4,72(с, 2 Н), 3,43-3,31 (м, 8 Н, частично скрыт); МС (ESI) 390,0, 392,1 (М+Н)+; чистота по данным ВЭЖХ 91%. Пример 58. 4-Пиперазинил-1- (4-метилфенилметансульфонил) -1 Н-индол (схема 1). Названное соединение получают по способу 5 из 4-метилфенилметансульфонилхлорида и натриевой соли 4-(4-трет-бутилоксикарбонил)пиперазинилиндола (исходный раствор А), выделяя 9 мг (13%) белого твердого вещества. 1 Н ЯМР (CD3OD)7,46 (д, 1 Н, J = 8,4 Гц), 7,24-7,18 (м, 1 Н), 7,06 (д, 1 Н, J = 4,0 Гц), 6,95-6,85 (м,3 Н), 6,76-6,64 (м, 3 Н), 4,65 (с, 2 Н), 3,47-3,35 (м, 8 Н), 2,24 (с, 3 Н); МС (ESI) 370,1 (М+Н)+; чистота по данным ВЭЖХ 95%. Пример 59. 4-Пиперазинил-1-(1,1-дифенилэтансульфонил)-1 Н-индол (схема 1). Названное соединение получают по способу 5 из 1,1-дифенилэтансульфонилхлорида и натриевой соли 4-(4-трет-бутилоксикарбонил)пиперазинилиндола (исходный раствор А), выделяя 57 мг (71%) белого твердого вещества. 1 Н ЯМР (CD3OD)7,59 (д, 1 Н, J= 8,4 Гц), 7,31-7,25 (м, 1 Н), 7,12-7,05 (м, 10 Н), 6,86-6,83 (м, 1 Н),6,50-6,48 (м, 1 Н), 6,42 (т, 1 Н, J = 6,6 Гц), 4,28 (д, 2 Н, J = 6,6 Гц), 3,47-3,32 (м, 8 Н); МС (ESI) 446,1 (М+Н)+; чистота по данным ВЭЖХ 92%. Пример 60. 4-Пиперазинил-1-(4-трифторметоксибензолсульфонил)-1 Н-индол (схема 1). Названное соединение получают по способу 5 из 4-трифторметоксибензолсульфонилхлорида и натриевой соли 4-(4-трет-бутилоксикарбонил)пиперазинилиндола (исходный раствор А), получая 46 мг(м, 1 Н), 6,87-6,85 (м, 2 Н), 3,44-3,31 (м, 8 Н, частично скрыт); МС (ESI) 426,1 (М+Н)+; чистота по данным ВЭЖХ 93%. Пример 61. 4-Пиперазинил-1-(5-[(бензоиламино)метил]тиофен-2-сульфонил)-1 Н-индол (схема 1). Названное соединение получают по способу 5 из 5-[(бензоиламино)метил]тиофен-1-сульфонилхлорида и натриевой соли 4-(4-трет-бутилоксикарбонил)пиперазинилиндола (исходный раствор А), получая 5 мг (6%) белого твердого вещества. 1 Н ЯМР (CD3OD)7,79-7,42 (м, 8 Н), 7,30-7,24 (м, 1 Н), 7,00-6,98 (м, 1 Н), 6,85-6,81 (м, 2 Н), 3,39-3,28(м, 8 Н, частично скрыт); МС (ESI) 481,1 (М+Н)+; чистота по данным ВЭЖХ 91%. Пример 62. Гидрохлорид 1-[(N-метил-1 Н-имидазол-4-ил)сульфонил]-4-(1-пиперазинил)-1 Н-индола. Названное соединение получают из 4-(4-bос-пиперазинил)индола и 1-метил-1 Н-имидазол-4-илсуль- 17006132 фонилхлорида по способу 3. Выход 74%. 1 Н ЯМР (270 МГц, ДМСО-d6)9,23 (шир., 1 Н), 8,25 (с, 1 Н), 7,75 (с, 1 Н), 7,61 (д, J = 3 Гц, 1 Н), 7,53 (д, J = 8 Гц, 1 Н), 7,22 (т, J = 8 Гц, 1 Н), 6,86 (д, J = 3 Гц, 1 Н), 6,79 (д, J = 8 Гц, 1 Н), 3,65 (с, 3 Н), 3,27 (м, 8 Н); МС (ESI+) для m/z 346 (М+Н)+. Схема 3. (i) (iPr)3Si, NaH, диметилформамид/дихлорметан; R5 (когда он отличен от Н) (tBu)3P; Таблица II Соединения получены в соответствии со схемой синтеза 3.- 19006132 Пример 63 (промежуточное соединение). 4-Бром-1-триизопропилсилилиндол. Растворяют в дихлорметане (100 мл) и ДМФ (1 мл) 5-броминдол (3,92 г, 20 ммоль). К охлажденному раствору добавляют NaH (0,88 г, 22 ммоль, 60% в масле). После перемешивания в течение 15 мин к реакционной смеси по каплям добавляют триизопропилсилилхлорид (3,86 г, 20 ммоль). Через 3 ч добавляют воду (1 мл), затем MgSO4. Смесь фильтруют и концентрируют, остаток пропускают через колонку с диоксидом кремния, элюируя гексаном. Получают продукт в виде бледно-желтого масла (5,96 г, 17 ммоль, выход 85%). 1 Н ЯМР (CDCl3)1,13 (18 Н, д, J = 8), 1,67 (3 Н, м), 6,55 (1 Н, д, J = 3), 7,21 (1 Н, дд, J = 9,2), 7,24 (1 Н,д, J = 3), 7,36 (1 Н, д, J = 9) и 7,74 (1 Н, д, J = 2). Пример 64 (промежуточное соединение). 5-(4-Метилпиперазин-1-ил)индол. 5-Бром-1-триизопропилсилилиндол (5,8 г, 16,4 ммоль), N-метилпиперазин (1,8 г, 18 ммоль), NaOtBu (2,2 г, 23 ммоль), Pd(OAc)2 (37 мг, 0,16 ммоль), t-Вu3 Р (66 мг, 0,33 ммоль) и ксилол (30 мл) перемешивают и нагревают при 130 С при перемешивании в течение 5 ч. Сырой продукт хроматографируют на колонке с диоксидом кремния с использованием смеси дихлорметан/МеОН, 95/5, в качестве элюента. После концентрирования основных фракций получают 5,6 г масла, которое растворяют в MeCN (10 мл),добавляют 20 мл 1 М раствора фторида тетрабутиламмония в ТГФ и смесь оставляют на ночь. Реакционную смесь переносят на колонку с диоксидом кремния и элюируют смесью дихлорметан/МеОН, 95/5,получая продукт в виде масла (2 г, 9,3 ммоль; выход 57%). 1H ЯМР (CDCl3)2,37 (3 Н, с), 2,64 (4 Н, т, J=5), 3,19 (4 Н, т, J=5), 6,44-6,48 (1 Н, м), 6,95-7,00 (1 Н, м),7,16 (1 Н, д, J=3), 7,18 (1 Н, д, J=2), 7,29 (1 Н, д, J=9) и 8,12 (1 Н, шир.с). Промежуточные соединения 65-67 получают с использованием той же методики, что и при получении промежуточного соединения 64. Пример 65 (промежуточное соединение). 5-(4-Изопропилпиперазин-1-ил)индол.(4 Н, м), 6,45-6,48 (1 Н, м), 6,96-7,00 (1 Н, дм), 7,14-7,19 (2 Н, м), 7,30 (1 Н, д, J=9) и 8,13 (1 Н, шир.с). Пример 68. N-Бензолсульфонил-5-(4-метилпиперазин-1-ил)индол. В дихлорметане (10 мл) растворяют 5-(4-метилпиперазин-1-ил)индол (215 мг, 1 ммоль), бензолсульфонилхлорид (265 мг, 1,5 ммоль) и Aliquat 336 (10 мг). Добавляют водный раствор NaOH (20%, 2 мл) и смесь интенсивно перемешивают 6 ч. Органический слой отделяют, сушат и концентрируют, получая сырой продукт в виде масла, которое очищают на колонке с диоксидом кремния с использованием дихлорметана и МеОН в качестве элюента. Чистые фракции концентрируют, получая масло (260 мг, 0,66 ммоль). 1 Н ЯМР (CDCl3)2,35 (3 Н, с), 2,59 (4 Н, т, J=5), 3,18 (4 Н, т, J=5),6,57 (1 Н, д, J=4), 6,98-7,03 (2 Н, м),7,38-7,54 (4 Н, м), 7,82-7,90 (3 Н, м); МС (posES-FIA) 355,1345 М+; чистота (ВЭЖХ, chromsil C18) 98%. Соединения примеров 69-87 получают с использованием методики примера 1. Соединения примеров 72-87 представлены в виде гидрохлоридов. Пример 69. N-(4-Метилбензолсульфонил)-5-(4-метилпиперазин-1-ил)индол.(2 Н, м), 7,73-7,78 (2 Н, м), 7,80-7,86 (2 Н, м) и 11,79 (1 Н, шир.с); МС (posES-FIA) 449,1595 М+; чистота (ВЭЖХ, chromsil C18) 98%. Пример 88. Гидрохлорид N-(4-метоксибензолсульфонил)-5-(4-пиперазин-1-ил)индола. В дихлорметане (4 мл) растворяют N-(4-метоксибензолсульфонил)-5-(4-бензилпиперазин-1-ил) индол (0,25 г, 0,54 ммоль), добавляют -хлорэтилхлорформиат (0,150 г, 1,05 ммоль) и смесь оставляют при комнатной температуре на 2 ч, после чего ее концентрируют. К смеси добавляют МеОН (10 мл) и смесь кипятят с обратным холодильником 2 ч, затем концентрируют, получая продукт (0,22 г, количественный выход). 1 Н ЯМР (МеОН-d6)3,39-3,47 (8 Н, м), 3,77 (3 Н, с), 6,64 (1 Н, д, J=3), 6,94 (2 Н, д, J=9), 7,15 (1 Н, дд,J=9, 2), 7,26 (1 Н, д, J=2), 7,59 (1 Н, д, J=4), 7,80 (2 Н, д, J=9) и 7,90 (1 Н, д, J=9); МС (posES-FIA) 371,1304 М+; чистота (ВЭЖХ, chromsil C18) 98%. Соединения примеров 89-95 получают с использованием методики примера 88. Пример 89. Гидрохлорид N-(2,4-дифторбензолсульфонил)-5-(пиперазин-1-ил)индола.(20 мг, 0,85 ммоль) в ДМФ (1 мл) и перемешивают 15 мин. Затем добавляют 4-фторфенилсульфонилхлорид (174 мг, 0,90 ммоль) и полученный раствор перемешивают 30 мин при 0 С и 3 ч при комнатной температуре. ДМФ выпаривают и полученное твердое вещество хроматографируют (элюент СH2Cl2/МеОН, 90/10), получая 100 мг (32%) требуемого соединения. 1 Н ЯМР (270 МГц, ДМСО-d6)8,25-8,10 (м, 3 Н), 7,99 (д, J = 8 Гц, 1 Н), 7,83 (д, J = 8 Гц, 1 Н), 7,657,30 (м, 3 Н), 7,20-7,05 (м, 2 Н), 3,18 (шир., 2 Н), 2,75 (шир., 2 Н), 1,78 (шир., 2 Н), 1,50 (шир., 2 Н); МС (ESI+) для m/z 383 (М+Н)+. Пример 99 (промежуточное соединение). трет-Бутил 4-[2-иод-1-(фенилсульфонил)-1 Н-индол-4-ил]1-пиперазинкарбоксилат. Смесь бутилмагнийхлорида (1 мл, 1 ммоль, 2,0 М в эфире) и диизопропиламина (0,279 мл, 2 ммоль) в безводном ТГФ (5 мл) перемешивают 4 ч в инертной атмосфере при комнатной температуре. Медленно добавляют раствор трет-бутил-4-[1-(фенилсульфонил)-1 Н-индол-4-ил]-1-пиперазинкарбоксилата (220 мг,0,5 ммоль) в ТГФ (2 мл) и полученную смесь перемешивают 2 ч при комнатной температуре. По каплям добавляют раствор иода (380 мг, 2,2 ммоль) в ТГФ (2 мл) и смесь перемешивают в течение ночи. После выпаривания растворителя в вакууме остаток обрабатывают водным раствором NH4Cl (10 мл). Смесь экстрагируют CH2Cl2 (310 мл), объединенные органические слои сушат (MgSO4) и концентрируют в вакууме. Остаток очищают колоночной хроматографией (SiO2) с использованием CH2Cl2 в качестве элюента, получая 100 мг (35%). 1 Н ЯМР (500 МГц, CDCl3)8,05-7,80 (м, 3 Н), 7,60-7,35 (м, 3 Н), 7,19 (т, J = 8 Гц, 1 Н), 6,98 (с, 1 Н),6,72 (д, J = 8 Гц, 1 Н), 3,62 (м, 4 Н), 3,05 (м, 4 Н), 1,47 (м, 9 Н); МС (ESI+) для m/z 568 (М+Н)+. Пример 100. Гидрохлорид 2-иод-1-(фенилсульфонил)-4-(1-пиперазинил)-1 Н-индола. В CH2Cl2 (1 мл) добавляют трет-бутил 4-[2-иод-1-(фенилсульфонил)-1 Н-индол-4-ил]-1-пиперазинкарбоксилат (25 мг, 0,044 ммоль) и НСl в эфире (1 мл) и встряхивают при комнатной температуре 2 ч. Образующийся осадок отфильтровывают и промывают эфиром, получая 20 мг требуемого соединения. 1 Н ЯМР (270 МГц, ДМСО-d6)9,02 (шир., 1 Н), 7,90-7,80 (м, 3 Н), 7,75-7,55 (м, 3 Н), 7,32 (с, 1 Н), 7,22K2 СО 3 (0,075 мл) перемешивают 3 дня при 80 С в диметоксиэтане (2 мл). После выпаривания растворителя сырой продукт очищают колоночной хроматографией (SiO2) и получают 30 мг требуемого соединения (80%). 1 Н ЯМР (270 МГц, ДМСО-d6)8,02 (д, J= 8 Гц, 1 Н), 7,55-7,20 (м, 11 Н), 6,78 (т, J = 8 Гц, 1 Н), 7,57 (с,1 Н), 3,58 (м, 4 Н), 3,02 (м, 4 Н), 1,48 (м, 9 Н). МС (ESI+) для m/z 518 (М+Н)+. Пример 102. Гидрохлорид 2-фенил-1-(фенилсульфонил)-4-(1-пиперазинил)-1 Н-индола. В СН 2 Сl2 (1 мл) растворяют трет-бутил 4-[2-фенил-1-(фенилсульфонил)-1 Н-индол-4-ил]-1 пиперазинкарбоксилат (30 мг, 0,058 ммоль), затем добавляют НСl в эфире (1 мл). Реакционную смесь встряхивают при комнатной температуре 2 ч. Образующийся осадок отфильтровывают и промывают эфиром, получая 20 мг требуемого соединения (80%). 1 Н ЯМР (270 МГц, ДМСО-d6)9,02 (шир., 1 Н), 7,90-7,80 (м, 3 Н), 7,75-7,55 (м, 3 Н), 7,32 (с, 1 Н), 7,22- 24006132 МС (ESI+) для m/z 418 (М+Н)+. Пример 103 (промежуточное соединение). 4-Трифторметансульфонилокси-2-метил-1-тетрабутилдиметилсилилиндол. В 30 мл дихлорметана растворяют 4-гидрокси-2-метилиндол (3,0 г, 20 ммоль), затем добавляют триэтиламин (4,2 мл). Раствор охлаждают (ледяная баня) и медленно добавляют раствор ангидрида трифторметансульфоновой кислоты (6,3 г, 22 ммоль) в дихлорметане (6 мл). Через 10 мин раствор промывают водным раствором K2 СО 3, сушат (K2 СО 3) и растворитель выпаривают. Соединение растворяют в ТГФ (10 мл) и добавляют NaH (0,8 г 80%-ной суспензии в масле). Добавляют раствор тетрабутилдиметилсилилхлорида (TBDMSCl) (3,3 г, 22 ммоль) в ТГФ (5 мл). Раствор разбавляют 20 мл дихлорметана,промывают водным раствором NH4Cl. Органическую фазу сушат и упаривают. Вещество очищают хроматографией (SiO2, гексан-эфир). Выход 5,7 г (75%). 1 Н ЯМР (CDCl3)7,48 (д, J = 7,9 Гц, 1 Н), 7,10-6,96 (м, 2 Н), 6,44 (с, 1 Н), 2,50 (с, 3 Н), 0,96 (с, 9 Н),0,64 (с, 6 Н); МС (ESI) 381,1 (М+Н). Пример 104 (промежуточное соединение). 4-(N-Boc-пиперазинил)-2-метил-1-тетрабутилдиметилсилилиндол. 4-Трифторметансульфонилокси-2-метил-1-тетрабутилдиметилсилилиндол (1,0 г, 2,6 ммоль) и bоспиперазин (0,73 г, 3,9 ммоль) вводят в реакцию в соответствии со способом 1, получая 0,75 г (67%) твердого вещества. 1 Н ЯМР (CDCl3)7,20 (д, J = 8,2 Гц, 1 Н), 6,96 (т, 1 Н), 6,55 (д, J = 7,4 Гц, 1 Н), 6,31 (с, 1 Н), 3,63 (пт,4 Н), 3,11 (пт, 4 Н), 2,47 (с, 3 Н), 1,48 (с, 9 Н), 0,94 (с, 9 Н), 0,64 (с, 6 Н); МС (ESI) 417,4 (М+Н). Пример 105. Трифторацетат 4-пиперазинил-2-метил-1-бензосульфонилиндола. В этилацетате (5 мл) растворяют 4-(N-boc-пиперазинил)-2-метил-1-тетрабутилдиметилсилилиндол(0,2 г, 0,48 ммоль), затем добавляют раствор фторида натрия (0,1 г) в воде (1 мл). Смесь интенсивно перемешивают (50 С) в течение 2 ч. Органическую фазу отделяют, сушат и упаривают. Сырой продукт растворяют в дихлорметане (10 мл), затем добавляют бензосульфонилхлорид (0,1 г, 0,58 ммоль) и водный NaOH (0,5 мл, 50% водный раствор). Смесь интенсивно перемешивают 1 ч. Добавляют воду (5 мл),органическую фазу отделяют, сушат и упаривают. Сырой продукт растворяют в дихлорметане (10 мл) и добавляют трифторуксусную кислоту (1 мл). Через 3 ч растворитель выпаривают и соединение кристаллизуют из этанола. Получают 60 мг (54%). 1 Н ЯМР (CDCl3)7,83-7,77 (м, 3 Н), 7,59-7,56 (м, 1 Н), 7,50-7,46 (м, 2 Н), 7,19 (т, 1 Н), 6,81 (д, J = 7,8 Гц, 1 Н), 6,52 (с, 1 Н), 3,41 (пт, 4 Н), 3,30 (пт, 4 Н), 2,61 (с, 3 Н); 13 С-ЯМР (CDCl3)143,7, 138,8, 138,0, 136,6, 133,9, 129,2, 126,1, 124,3, 123,5, 111,5, 110,0, 107,3,48,5, 43,8, 14,6; МС (ESI) 356,4 (М+Н). Пример 106 (промежуточное соединение). N-трет-бутилдиметилсилил-4-(4-bос-гомопиперазинил) индол. Названное соединение получают по методике примера 4. 1 Н ЯМР (D2O)9,37 (шир.с, 2 Н) NH; 7,95 (м, 2 Н); 7,73-7,56 (м, 4 Н); 7,44 (д, J = 8,2, 1 Н) ; 7,18 (т, J = 8,2, 1 Н); 6,84 (м, 1 Н); 6,65 (д, J = 7,9, 1 Н); 3,65 (м, 2 Н); 3,46 (м, 2 Н); 3,31 (м, 2 Н); 3,19 (м, 2 Н); 2,13 (м,2 Н). 13 С ЯМР (D2O): 145,7, 137,5, 136,3, 135,2, 130,4, 127,3, 126,2, 125,1, 121,3, 109,3, 105,4, 100,0, 50,8,48,7, 46,6, 45,1, 25,6. МС (ESI) 356 (М+Н). Пример 107 (промежуточное соединение). 1-Фенилсульфонил-N-трет-бутилдиметилсилил-4-(4-bосгомопиперазинил)индол. 1 Н ЯМР (CDCl3)7,86 (м, 2 Н); 7,54-7,38 (м, 6 Н); 7,4 (т, J=8,2, 1 Н); 6,65-6,62 (м, 1 Н); 3,63-3,41 (м,8 Н); 1,97 (м, 2 Н); 1,43 (с, 9 Н); МС (ESI) 456 (М+Н). Фармакологические испытания Способность соединения настоящего изобретения связываться с рецептором 5 НТ 6 может быть определена с использованием методов оценки in vivo и in vitro, известных в данной области. Биологическая активность соединений, полученных в примерах, проверена с помощью различных испытаний. Оценка внутренней 5-НТ 6-активности Антагонисты рецепторов 5 НТ 6 характеризуют путем измерения ингибирования индуцированного 5 НТ повышения цАМФ (сАМР) в клетках НЕК 293, экспрессирующих человеческий рецептор 5-НТ 6 (см.Boess et al. , (1997), Neuropharmacology 36, 713-720). Вкратце говоря, клетки НЕК 293/5-НТ 6 высевают в 96-луночные планшеты, покрытые полилизином, при плотности 25000 клеток на лунку и выращивают в среде DMEM (модифицированная по способу Дульбекко среда Игла) (без фенолового красного), содержащей 5% диализированной фетальной телячьей сыворотки рогатого скота, в течение 48 ч при 37 С в термостате с 5% СО 2. Среду затем отсасывают и заменяют на 0,1 мл среды для анализа (сбалансированный солевой раствор Хенкса, содержащий 20 мМ HEPES, 1,5 мМ изобутилметилксантина и 1 мг/мл альбумина бычьей сыворотки). После добавления испытуемых веществ, 50 мкл, растворенных в среде для анализа, клетки выдерживают в течение 10 мин при 37 С в термостате с 5% СО 2. Затем среду снова отсасывают и определяют содержание цАМФ с использованием набора радиоактивного цАМФ (AmershamPharmacia Biotech, BIOTRAK RPA559). Эффективность антагонистов количественно характеризуют путем определения концентрации, которая дает 50%-ное ингибирование вызванного 5 НТ (при [5-НТ] = 8 хЕС 50) повышения цАМФ, с использованием формулы Ki=IC50/(1+[5 НТ]/ЕС 50). Обычно величина сродства к рецептору 5-НТ 6 (Ki) находится в интервале от 0,1 нМ до 2 мкМ. Метод оценки уменьшения потребления пищи in vivo Животные. Для проведения скрининга в качестве основной животной модели выбирают тучную (ob/ob) мышь,так как такая мутантная мышь потребляет большое количество пищи, что дает высокое значение отношения сигнал-шум. Для дополнительного подтверждения и сравнения данных по эффективности влияние соединений на потребление пищи также изучают на диких видах мышей (C57BL/6J). Фиксируют количество пищи, потребляемой в течение 15 ч вливания соединений. Во всех тестах используют самцов мышей (тучные C57BL/6JBom-Lepob и худые дикиеC57BL/6JBom; Bomholtsgaard, Denmark) возрастом 8-9 недель со средним весом тела 50 г (тучные) и 25 г(худые). Животных содержат поодиночке в клетках при 231 С и влажности 40-60% и обеспечивают свободный доступ к воде и стандартной лабораторной пище. Устанавливают цикл 12/12 ч свет/темнота,выключая свет в 5 ч вечера. До начала испытаний животных выдерживают при таких условиях по меньшей мере одну неделю. Соединения. Испытуемые соединения растворяют в растворителе, подходящем для каждого конкретного соединения, например, в таком как циклодекстрин, циклодекстрин/метансульфоновая кислота, полиэтиленгликоль/метансульфоновая кислота, физиологический раствор. Для каждого исследования готовят свежие растворы. Используют дозы 30, 50 и 100 мг/кг/день. Чистота испытуемых соединений соответствует аналитической чистоте. Имплантация мининасоса. Животных взвешивают в начале исследования и распределяют случайным образом по весу тела. Используют осмотические мининасосы Alzet (Модель 2001D; скорость вливания 8 мкл/ч) и заправляют их по существу так, как рекомендовано в техническом руководстве Alzet (Alza Scientific Products, 1997,Teeuwes and Yam, 1976). Используют непрерывные подкожные вливания продолжительностью 24 ч. Мининасосы либо заполняют испытуемыми соединениями в различных концентрациях, растворенными в несущем растворителе, либо только несущим растворителем и хранят в растворителе, предварительно нагретом до 37 С (приблизительно 1 ч). Мининасосы имплантируют в заднюю область шеи при кратко- 26006132 временной анестезии (метофан/энфлуран). Такая хирургическая процедура длится приблизительно 5 мин. Требуется приблизительно 3 ч для установления стационарной подачи соединения. Измерения потребления пищи. Вес пищевых гранул измеряют в 5 ч вечера и в 8 ч вечера в течение двух дней до (базовый уровень) и одного дня после имплантации осмотических мининасосов. Взвешивание проводят с помощью снабженных компьютером весов Mettler Toledo PR 5002. Производят коррекцию на случайные потери. В конце исследования животных умерщвляют путем свертывания шеи и отбирают образец крови из главной артерии для последующего определения концентрации лекарства в плазме. Определение концентрации лекарства в плазме. Образцы белков в плазме осаждают метанолом, центрифугируют, надосадочную жидкость переносят в сосуды для ВЭЖХ и впрыскивают в систему (жидкостной хроматограф)/масс-спектрометр. Массспектрометр устанавливают на модель электровпрыска положительных ионов и используют Multiple Reaction Monitoring. Для расчета концентраций неизвестных образцов используют линейный регрессионный анализ стандартов, проводимый через точку отсчета. Статистическая оценка. Потребление пищи за 15 ч измеряют в течение трех последовательных дней и выводят процент от значений базовой линии для каждого животного для дня до лечения и дня после лечения. Значения выражают в виде среднего значенияст. ошибка исреднеквадратичная ошибка для восьми животных на группу данной дозы. Статистическую оценку проводят с помощью анализа Kruskal-Wallis one-wayANOVA с использованием процента от базовых значений. Если статистическая значимость достигает уровня р 0,05, проводят оценку в соответствии с U-тестом по Mann-Whitney для статистического сравнения между контрольной и обработанными группами. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I)(1) фенил,(2) нафтил,(3) 5-10-членное моноциклическое или бициклическое гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из группы, включающей кислород, серу или азот, или(4) -R9-фенил; где каждый фенил, нафтил и гетероциклическое кольцо независимо друг от друга необязательно замещены галогеном, C1-6 алкилом, CF3, гидроксилом, C1-6 алкоксилом, OCF3, COCF3, CN, NO2, фенилоксигруппой, фенилом, C1-6 алкилсульфонилом, С 2-6 алкенилом, -NR7R8, C1-6 алкилкарбоксилом, формилом, -С 1-6 алкил-NН-СO-фенилом, -С 1-6 алкил-СО-NН-фенилом, -NH-CO-C1-6 алкилом, -CO-NR7R8 или SR7; где каждый из заместителей R7 и R8 независимо друг от друга представляет собой Н или C1-6 алкил; и R9 представляет собой C1-6 алкил или С 2-6 алкенил; причем каждый из них необязательно замещен фенилом или фенилоксигруппой; или его фармацевтически приемлемая соль, гидрат или стереоизомер. 2. Соединение по п.1, где Аr представляет собой(1) фенил,(2) 1-нафтил или 2-нафтил,(3) 5-10-членное моноциклическое или бициклическое гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из группы, включающей кислород, серу или азот, или(4) -R9-фенил; где каждый фенил, нафтил и гетероциклическое кольцо независимо друг от друга необязательно замещены F, Cl, Вr, C1-6 алкилом, CF3, гидроксилом, C1-6 алкоксилом, OCF3, фенилом, С 2-6 алкенилом, -NR7R8,-NH-CO-C1-6 алкилом или SR7; где каждый из заместителей R7 и R8 независимо друг от друга представляет собой Н или C1-6 алкил; и R9 представляет собой C1-2 алкил;R5 представляет собой C1-3 алкоксигруппу или гетероциклическое кольцо, выбранное из группы,включающей 3. Соединение по п.1, где Аr представляет собой фенил, необязательно замещенный F, Cl, Вr, метилом, СF3, C1-4 алкоксилом, OCF3, CN, NО 2, фенилоксигруппой, фенилом, метилсульфонилом или -NR7R8,где каждый из заместителей R7 и R8 независимо друг от друга представляет собой Н или метил. 4. Соединение по п.1, где Аr представляет собой 1-нафтил или 2-нафтил, причем каждый из них необязательно замещен F, Cl, Вr, метилом, CF3, C1-4 алкоксилом, OCF3, CN, NO2, фенилоксигруппой, фенилом, метилсульфонилом или -NR7R8, где каждый из заместителей R7 и R8 независимо друг от друга представляет собой Н или метил. 5. Соединение по п.1, где Аr представляет собой гетероциклическое кольцо, выбранное из группы,включающей фурил, пирролил, триазолил, диазолил, оксазолил, тиазолил, оксадиазолил, изотиазолил,изоксазолил, тиадиазолил, пиридил, пиримидил, пиразинил, тиенил, имидазолил, пиразолил, индолил,хинолинил, изохинолинил, бензофурил, бензотиенил и бензоксадиазолил, причем каждый из них необязательно замещен атомом галогена, C1-6 алкилом, CF3, гидроксилом, C1-6 алкоксилом, OCF3, CN, NO2, фенилоксигруппой, фенилом, C1-6 алкилсульфонилом, С 2-6 алкенилом, -NR7R8, C1-6 алкилкарбоксилом, формилом, -NH-CO-C1-6 алкилом, -CO-NR7R8 или SR7; где каждый из заместителей R7 и R8 независимо друг от друга представляет собой Н или C1-6 алкил. 6. Соединение по п.5, где Аr представляет собой гетероциклическое кольцо, выбранное из группы,включающей пиридил, тиенил, имидазолил, пиразолил, бензотиенил и бензоксадиазолил, причем каждый из них необязательно замещен атомами галогена или C1-6 алкилом. 7. Соединение по п.6, где Аr представляет собой 2-пиридил, 3-пиридил или 4-пиридил. 8. Соединение по п.1, где Аr представляет собой 5-7-членное ароматическое, частично насыщенное или полностью насыщенное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из группы, включающей О, S или NR10, где R10 представляет собой Н, C1-6 алкил, -СО-СF3 или отсутствует. 9. Соединение по п.1, где Аr представляет собой -R9-фенил, где R9 представляет собой C1-3 алкил- 28006132 или С 2-3 алкенил, причем каждый из них необязательно замещен фенилом, и где фенил необязательно замещен F, Cl, Вr, метилом, CF3, C1-4 алкоксилом, OCF3, CN, NО 2, фенилоксигруппой, фенилом, метилсульфонилом или -NR7R8; причем каждый из заместителей R7 и R8 независимо друг от друга представляет собой Н или C1-6 алкил. 10. Соединение по любому из пп.1-9, где каждый из заместителей R2 и R3 представляет собой Н. 11. Соединение по любому из пп.1-10, где каждый из заместителей R4 и R5 независимо друг от друга представляет собой гетероциклическое кольцо, выбранное из группы, включающей-NR7R8, где каждый из заместителей R7 и R8 независимо друг от друга представляет собой Н или метил; каждый из заместителей R2 и R3 представляет собой Н и каждый из заместителей R4 и R5 независимо друг от друга представляет собой гетероциклическое кольцо, выбранное из группы, включающей где R6 представляет собой Н, C1-3 алкил или бензил. 13. Соединение по п.1, где Аr представляет собой 1-нафтил или 2-нафтил, причем каждый из них необязательно замещен F, Cl, Вr, метилом, CF3, C1-4 алкоксилом, OCF3, CN, NO2, фенилоксигруппой, фенилом, метилсульфонилом или -NR7R8, где каждый из заместителей R7 и R8 независимо друг от друга представляет собой Н или метил; каждый из заместителей R2 и R3 представляет собой Н и каждый из заместителей R4 и R5 независимо друг от друга представляет собой гетероциклическое кольцо, выбранное из группы, включающей где R6 представляет собой Н, C1-3 алкил или бензил. 14. Соединение по п.1, где Аr представляет собой гетероциклическое кольцо, выбранное из группы,включающей пиридил, тиенил, имидазолил, пиразолил, бензотиенил и бензоксадиазолил, причем каждый из них необязательно замещен атомами галогена или C1-6 алкилом; каждый из заместителей R2 и R3 представляет собой Н и каждый из заместителей R4 и R5 независимо друг от друга представляет собой гетероциклическое кольцо, выбранное из группы, включающей где R6 представляет собой Н, C1-3 алкил или бензил. 15. Соединение по п.14, где Аr представляет собой 2-пиридил, 3-пиридил или 4-пиридил; каждый из заместителей R2 и R3 представляет собой Н и каждый из заместителей R4 и R5 независимо друг от друга представляет собой гетероциклическое кольцо, выбранное из группы, включающей где R6 представляет собой Н, C1-3 алкил или бензил. 16. Соединение по п.1, где Аr представляет собой -R9-фенил; каждый из заместителей R2 и R3 представляет собой Н и каждый из заместителей R4 и R5 независимо друг от друга представляет собой гетероциклическое кольцо, выбранное из группы, включающей где R6 представляет собой Н, C1-3 алкил или бензил; R9 представляет собой C1-3 алкил или С 2-3 алкенил,причем каждый из них необязательно замещен фенилом и фенил необязательно замещен F, Cl, Вr, метилом, CF3, C1-4 алкоксилом, OCF3, CN, NO2, фенилоксигруппой, фенилом, метилсульфонилом или -NR7R8; причем каждый из заместителей R7 и R8 независимо друг от друга представляет собой Н или C1-6 алкил. 17. Соединение по п.1, причем указанное соединение представляет собой гидрохлорид 1-фенилсульфонил-4-пиперазинилиндола,гидрохлорид 1-[(2,5-диметоксифенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола,гидрохлорид 1-(мезитилсульфонил)-4-(1-пиперазинил)-1 Н-индола,гидрохлорид 1-(1-нафтилсульфонил)-4-(1-пиперазинил)-1 Н-индола,гидрохлорид N,N-диметил-5-[4-(1-пиперазинил)-1 Н-индол-1-ил]сульфонил-1-нафтиламина,гидрохлорид 1-[(4-пропоксифенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола,гидрохлорид 1-[(2,5-дихлор-3-тиенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола,гидрохлорид 1-[(4-метоксифенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола,гидрохлорид 1-[(2,4-дифторфенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола,гидрохлорид 1-[(1,1'-бифенил)-4-илсульфонил]-4-(1-пиперазинил)-1 Н-индола,гидрохлорид 1-[(3,4-диметоксифенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола,гидрохлорид 5-метил-2-[4-(1-пиперазинил)-1 Н-индол-1-ил]сульфонилфенилметилового эфира,гидрохлорид 1-[(2,5-дихлорфенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола,гидрохлорид 1-[(5-хлор-1,3-диметил-1 Н-пиразол-4-ил)сульфонил]-4-(1-пиперазинил)-1 Н-индола,гидрохлорид 1-[(3-хлор-2-метилфенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола,гидрохлорид 2-хлор-5-(4-[4-(1-пиперазинил)-1 Н-индол-1-ил]сульфонилфенокси)бензонитрила,гидрохлорид 4-бром-2-[4-(1-пиперазинил)-1 Н-индол-1-ил]сульфонилфенилметилового эфира,гидрохлорид 4-(1-пиперазинил)-1-(3-пиридилсульфонил)-1 Н-индола,гидрохлорид 7-[4-(1-пиперазинил)-1 Н-индол-1-ил]сульфонил-2-(трифторацетил)-1,2,3,4-тетрагидроизохинолина,гидрохлорид метил 2-[4-(1-пиперазинил)-1 Н-индол-1-ил]сульфонилфенилсульфона,гидрохлорид 1-[(4-фторфенил)сульфонил]-4-(1-пиперазинил)-1 Н-индола,гидрохлорид 1-[(5-хлор-3-метил-1-бензотиен-2-ил)сульфонил]-4-(1-пиперазинил)-1 Н-индола,гидрохлорид 4-(4-метил-1-пиперазинил)-1-(4-метилбензолсульфонил)-1 Н-индола,гидрохлорид 4-пиперазино-N-(4-трифторметил)фенилсульфонилиндола,гидрохлорид 4-(3-метилпиперазин)-N-(4-трифторметил)фенилсульфонил-1 Н-индола,гидрохлорид 4-(4-метил-1-пиперазинил)-1-(2-метилбензолсульфонил)-1 Н-индола,гидрохлорид 4-(4-этил-1-пиперазинил)-1-(2-метилбензолсульфонил)-1 Н-индола,гидрохлорид 4-(1-пиперазинил)-1-(2-метилбензолсульфонил)-1 Н-индола,гидрохлорид 4-(5-азаиндолизидинил)-1-(2-метилбензолсульфонил)-1 Н-индола,гидрохлорид 4-(4-метил-1-гомопиперазинил)-1-(2-метилбензолсульфонил)-1 Н-индола,гидрохлорид 4-(3-метил-1-пиперазинил)-1-(2-метилбензолсульфонил)-1 Н-индола,гидрохлорид 4-(цис-3,5-диметил-1-пиперазинил)-1-(2-метилбензолсульфонил)-1 Н-индола,гидрохлорид 4-(4-изопропил-1-пиперазинил)-1-(2-метилбензолсульфонил)-1 Н-индола,гидрохлорид 4-(1S,4S)-2-метил-2,5-диазабицикло[2.2.1]гептил-1-(2-метилбензолсульфонил)-1 Ниндола,гидрохлорид 4-(4-метил-1-гомопиперазинил)-1-(бензолсульфонил)-1 Н-индола,гидрохлорид 4-(цис-3,5-диметил-1-пиперазинил)-1-(бензолсульфонил)-1 Н-индола,гидрохлорид 4-(4-этил-1-пиперазинил)-1-(бензолсульфонил)-1 Н-индола,гидрохлорид 4-пиперазинил-1-(4-нитробензолсульфонил)-1 Н-индола,гидрохлорид 4-пиперазинил-1-(4-бромбензолсульфонил)-1 Н-индола,гидрохлорид 4-пиперазинил-1-(4-хлорбензолсульфонил)-1 Н-индола,гидрохлорид 4-пиперазинил-1-(Е-2-фенилэтенсульфонил)-1 Н-индола,гидрохлорид 4-пиперазинил-1-(3-трифторметилбензолсульфонил)-1 Н-индола,гидрохлорид 4-пиперазинил-1-(4-цианобензолсульфонил)-1 Н-индола,гидрохлорид 4-пиперазинил-1-(4-хлор-7-хлор-2,1,3-бензоксадиазолсульфонил)-1 Н-индола,гидрохлорид 4-пиперазинил-1-(3-цианобензолсульфонил)-1 Н-индола,гидрохлорид 4-пиперазинил-1-(4-феноксибензолсульфонил)-1 Н-индола,гидрохлорид 4-пиперазинил-1-(4-хлорфенилметансульфонил)-1 Н-индола,гидрохлорид 4-пиперазинил-1-(4-метилфенилметансульфонил)-1 Н-индола,гидрохлорид 4-пиперазинил-1-(1,1-дифенилэтансульфонил)-1 Н-индола,гидрохлорид 4-пиперазинил-1-(4-трифторметоксибензолсульфонил)-1 Н-индола,- 30
МПК / Метки
МПК: A61P 25/00, A61K 31/404, C07D 209/08
Метки: арилалкил)сульфонил, применение, n-(1, арил, гетероарил-или, 5-замещенные, 2-,3-,4, терапии, индолы
Код ссылки
<a href="https://eas.patents.su/30-6132-2-3-4-ili-5-zameshhennye-n-1-aril-geteroaril-ili-arilalkilsulfonil-indoly-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">2-,3-,4- или 5-замещенные n-(1- (арил-, гетероарил-или арилалкил)сульфонил) индолы и их применение в терапии</a>
Предыдущий патент: Патрон для взрывания
Следующий патент: 7 – аминотриазолопиримидины, способ и промежуточные продукты для их получения, содержащие их средства, а также их применение для борьбы с фитопатогенными грибами
Случайный патент: Катализаторы на основе хрома