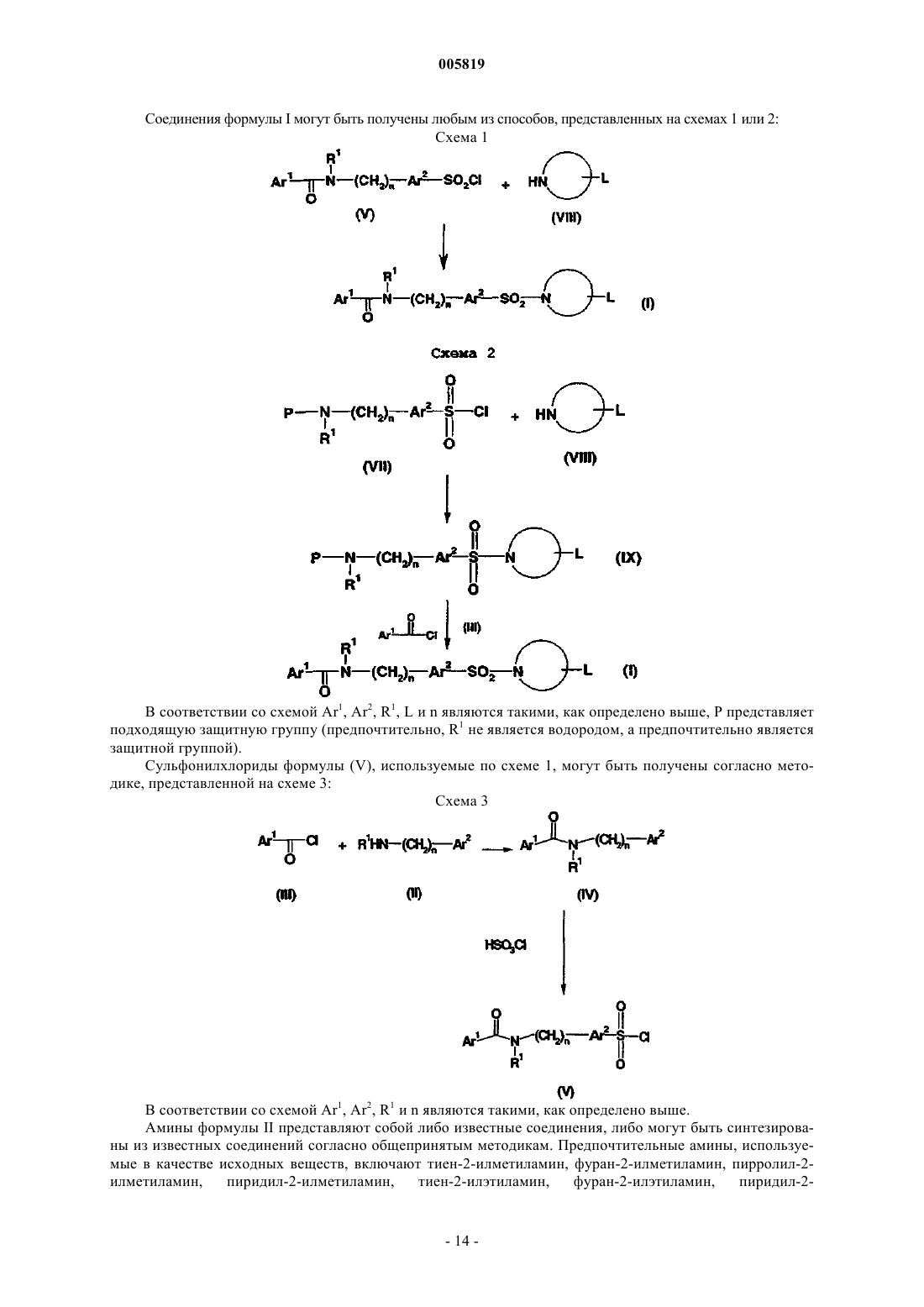
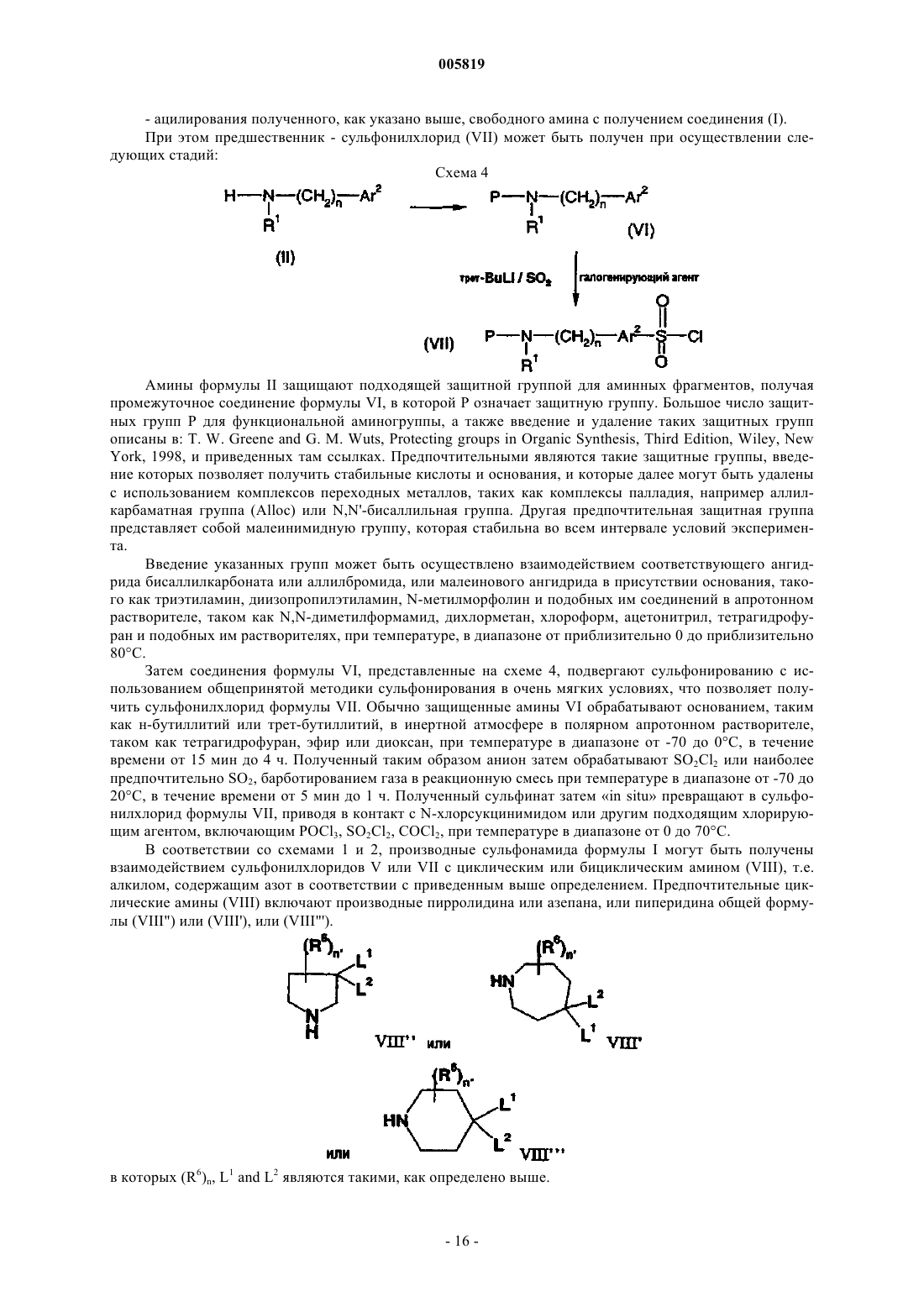
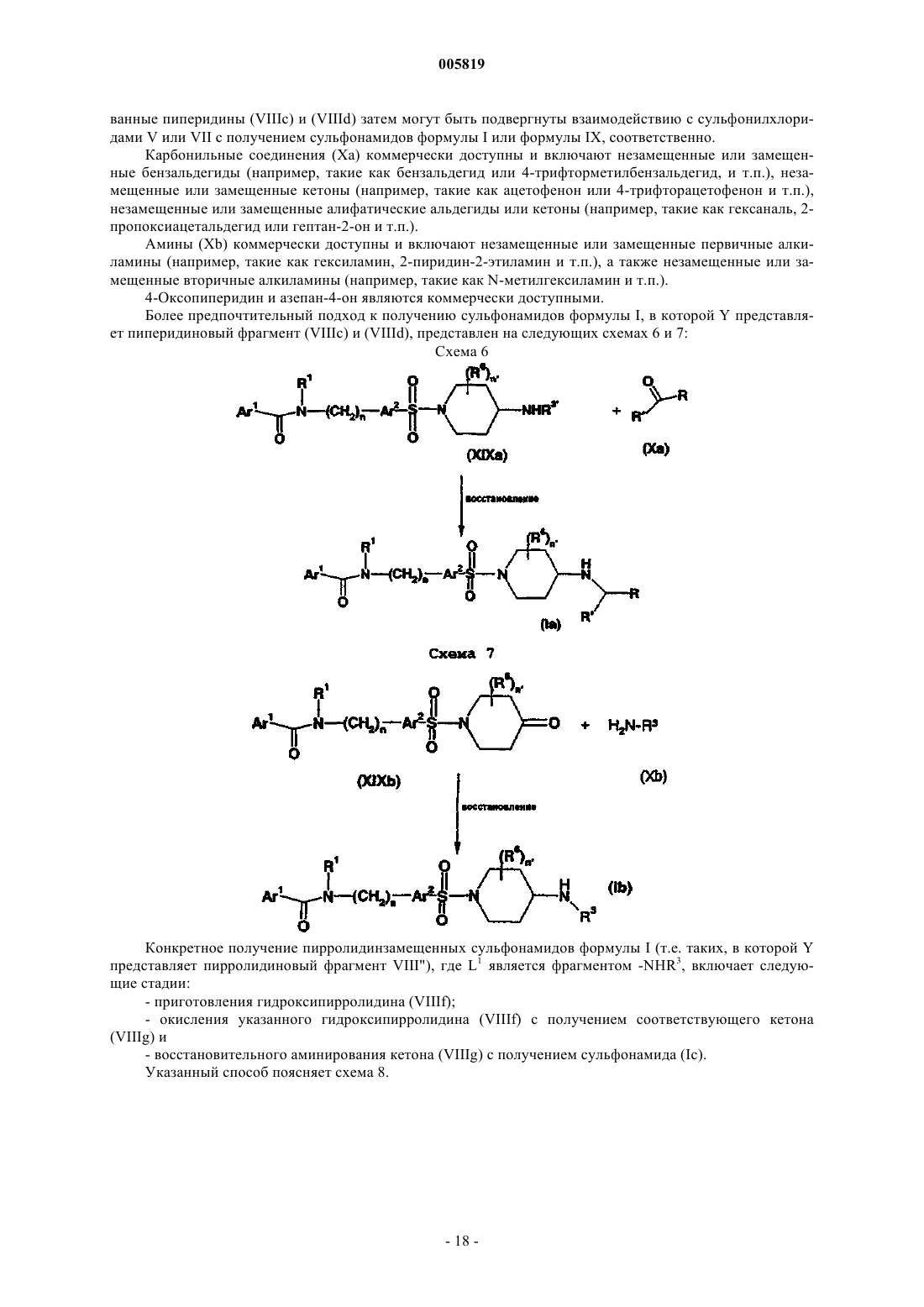
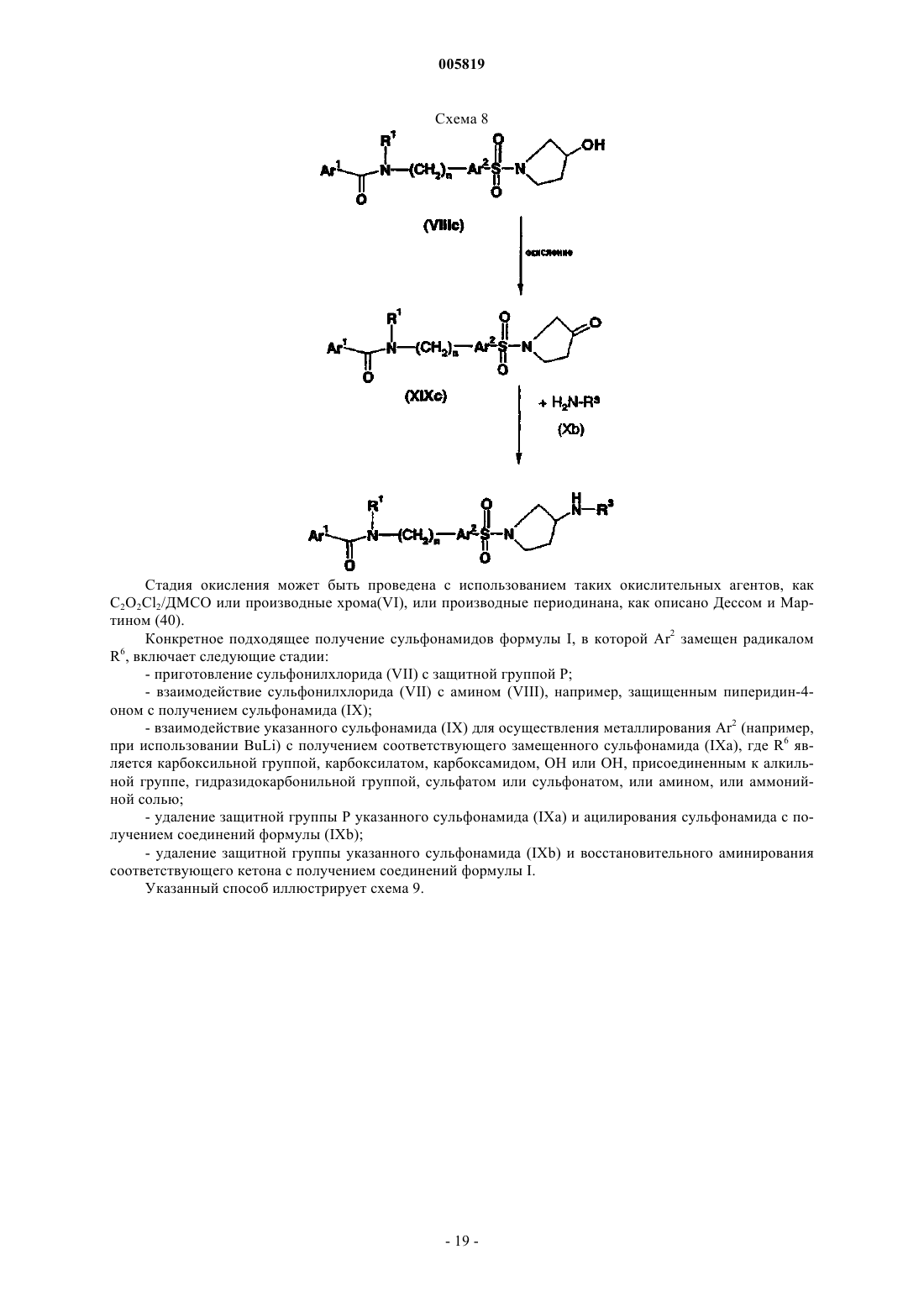
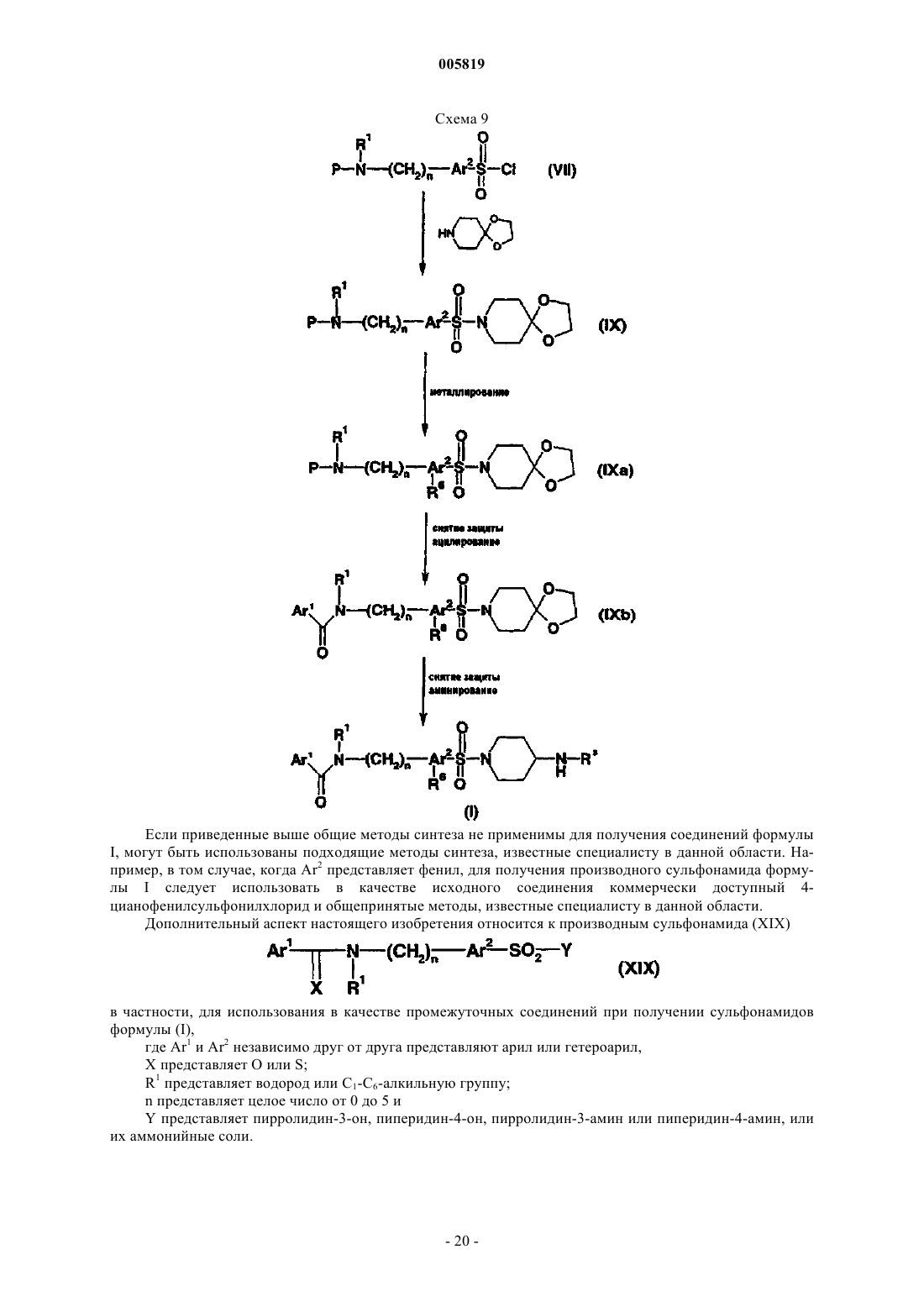
Фармацевтически активные производные сульфонамида, содержащие как липофильные, так и ионизируемые фрагменты, в качестве ингибиторов jun-протеинкиназ
Номер патента: 5819
Опубликовано: 30.06.2005
Авторы: Рюкле Томас, Готтелан Жан-Пьер, Аркинстолл Стефен, Кампс Монсеррат, Алази Серж, Черч Деннис, Бьямонте Марко
Формула / Реферат
1. Производные сульфонамида формулы I
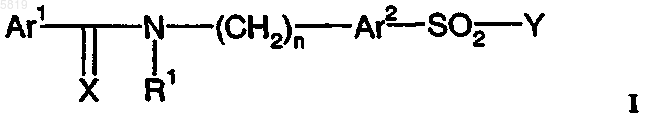
включая его геометрические изомеры, в оптически активной форме, такой как энантиомеры, диастереомеры, а также в форме рацематов, и также их фармацевтически приемлемые соли,
где Ar1 представляет арил или гетероарил,
Ar2 представляет тиенил или фуранил
X представляет O или S;
R1 представляет водород или C1-C6-алкильную группу или R1 с Ar1 образует 5-6-членное насыщенное или ненасыщенное кольцо;
n представляет целое число от 0 до 5;
Y представляет 4-12-членный насыщенный циклический или бициклический алкил, содержащий азот, который образует связь с сульфонильной группой в формуле I, причем указанный 4-12-членный насыщенный циклический или бициклический алкил замещен по меньшей мере одним фрагментом -NR3'R3, где по меньшей мере один из R3' и R3 не представляет водород, а является заместителем, выбранным из группы, состоящей из линейного или разветвленного C4-C18-алкила, арил-C1-C18-алкила, гетероарил-C2-C18-алкила, C1-C14-алкила, замещенного C3-C12-циклоалкилом или -бицикло или -трициклоалкилом, и где указанная алкильная цепь может содержать 1-3 атома O или S.
2. Производное сульфонамида по п.1, в котором Ar1 выбран из группы, состоящей из фенила, тиенила, фурила, пиррола, пиридила, необязательно замещенного C1-C6-алкилом, C1-C6-алкокси, C1-C6-алкенилом, C2-C6-алкинилом, амино, ациламино, аминокарбонилом, C1-C6-алкоксикарбонилом, арилом, карбоксилом, циано, галогеном, гидрокси, нитро, сульфонилом, C1-C6-тиоалкокси.
3. Производное сульфонамида по п.2, в котором Ar1 представляет фенил.
4. Производное сульфонамида согласно любому из предшествующих пунктов, где Ar1 выбран из галогенфенила, нитрофенила, гидроксифенила, алкоксифенила, пиридила, 3,4-дигидроксифенила, тиоксодигидропиридина или его таутомера, пиразола и X представляет O, R1 представляет водород, n означает 1.
5. Производное сульфонамида по п.4, в котором Y представляет пирролидиновый, азепановый или пиперидиновый фрагмент приведенных ниже формул
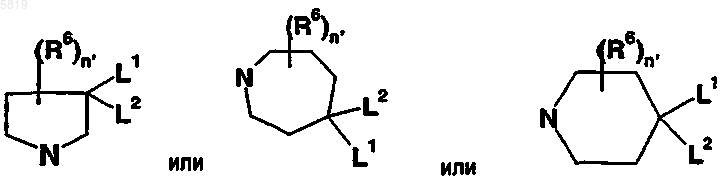
в которых R6 выбран из группы, состоящей из водорода, C1-C6-алкила, C1-C6-алкокси, OH, галогена, нитро, циано, сульфонила, оксо (=O), сульфокси, ацилокси, тиоалкокси и, когда R6 не представляет водород, n' означает целое число от 0 до 4 и по меньшей мере один из L1 и/или L2 представляет фрагмент -NR3'R3, где по меньшей мере один из R3' и R3 не представляет водород, а является заместителем, выбранным из группы, состоящей из линейного или разветвленного C4-C18-алкила, арил-C1-C18-алкила, гетероарил-C2-C18-алкила, C1-C14-алкила, замещенного C3-C12-циклоалкилом или -бицикло или -трициклоалкилом, и где указанная алкильная цепь может содержать 1-3 атома O или S.
6. Производное сульфонамида по п.5, в котором n' означает 1 или 2.
7. Производное сульфонамида по п.5 или 6, в котором R6 представляет H, L2 представляет H, L1 представляет -NR3'R3; где по меньшей мере один из R3' и R3 не представляет водород, а является заместителем, выбранным из группы, состоящей из линейного или разветвленного C4-C18-алкила, арил-C1-C18-алкила, гетероарил-C2-C18-алкила, C1-C14-алкила, замещенного C3-C12-циклоалкилом или -бицикло или -трициклоалкилом, и где указанная алкильная цепь может содержать 1-3 атома O или S.
8. Производное сульфонамида по п.7, в котором L1 означает -NHR3; где R3 представляет линейный или разветвленный C4-C12-алкил или бензильную группу.
9. Производное сульфонамида по п.8, в котором L1 означает -NHR3; где R3 представляет линейный или разветвленный C6-C12-алкил.
10. Производное сульфонамида по п.8 или 9, в котором R3 представляет линейный или разветвленный C6-C12-алкил, замещенный циклогексильной группой.
11. Производное сульфонамида по любому из пп.8-10, в котором Y представляет пиперидиновую группу
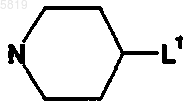
L1 означает -NHR3, где R3 представляет линейный или разветвленный C6-C12-алкил или бензильную группу.
12. Производное сульфонамида по п.11, в котором R3 представляет C8-C12-алкил.
13. Производное сульфонамида согласно любому из предшествующих пунктов, выбранное из группы, включающей следующие соединения:
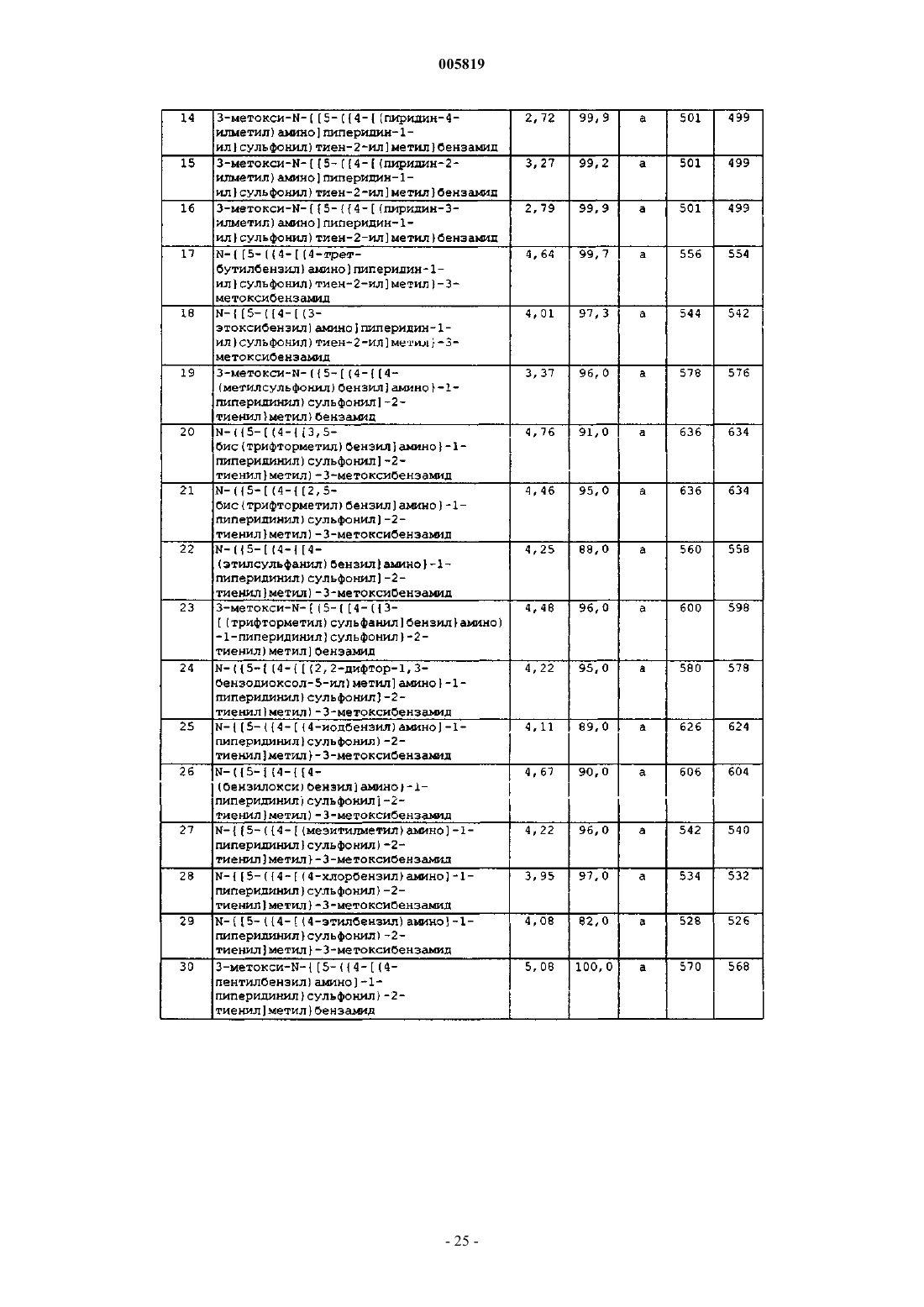
4-хлор-N-[(5-{[4-(гексиламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
3-метокси-N-{[5-({4-[(4-трифторметилбензил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
4-хлор-N-[(5-{[4-(1,3-тиазол-2-иламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
4-хлор-N-[(5-{[4-(гептиламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
4-хлор-N-[(5-{[4-(пентиламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
4-хлор-N-[(5-{[4-(бутиламино)пиперидин-1-ил]сульфонил}тиен-2-ил) метил]бензамид,
4-хлор-N-[(5-{[4-(додециламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
4-хлор-N-{[5-({4-[(2-циклогексилэтил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
4-хлор-N-{[5-({4-[(циклогексилметил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
4-хлор-N-({5-[(4-{[(1R)-1-циклогексилэтил]амино}пиперидин-1-ил)сульфонил]тиен-2-ил}метил)бензамид,
N-{[5-({4-[(lR,2R,4S)-бицикло[2.2.1]гепт-2-иламино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-4-хлорбензамид,
4-хлор-N-{[5-({4-[(2-пропоксиэтил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({4-[(1-адамантилметил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-4-хлорбензамид,
4-хлор-N-{[5-({4-[(2-пиридин-2-илэтил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
4-хлор-N-{[5-({4-[(2-пиперидин-1-илэтил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
4-хлор-N-{[5-({4-[(2-этилгексил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
4-хлор-N-({5-[(4-{[3-(1H-имидазол-1-ил)пропил]амино}пиперидин-1-ил)сульфонил]тиен-2-ил}метил)бензамид,
4-хлор-N-[(5-{[4-(октиламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
N-[(5-{[4-(гептиламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]-3-метоксибензамид,
3-метокси-N-[(5-{[4-(октиламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
3-метокси-N-[(5-{[4-(пентиламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
N-[(5-{[4-(бутиламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]-3-метоксибензамид,
N-[(5-{[4-(додециламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]-3-метоксибензамид,
N-{[5-({4-[(2-циклогексилэтил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
N-({5-[(4-{[(1R)-1-циклогексилэтил]амино}пиперидин-1-ил)сульфонил]тиен-2-ил}метил)-3-метоксибензамид,
N-{[5-({4-[(1R,2R,4S)бицикло[2.2.1]гепт-2-иламино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
3-метокси-N-{[5-({4-[(2-пропоксиэтил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({4-[(1-адамантилметил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
N-{[5-({4-[(3,3-диэтоксипропил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
3-метокси-N-{[5-({4-[(3-морфолин-4-илпропил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
3-метокси-N-{[5-({4-[(2-пиридин-2-илэтил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
3-метокси-N-{[5-({4-[(2-пиперидин-1-илэтил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({4-[(2-этилгексил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
N-({5-[(4-{[3-(1H-имидазол-1-ил)пропил]амино}пиперидин-1-ил)сульфонил]тиен-2-ил}метил)-3-метоксибензамид,
N-[(5-{[4-(гексиламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]-3-метоксибензамид,
N-[(5-{[4-(гептиламино)азепан-1-ил]сульфонил}тиен-2-ил)метил]-3-метоксибензамид,
3-метокси-N-[(5-{[4-(октиламино)азепан-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
3-метокси-N-[(5-{[4-(пентиламино)азепан-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
N-[(5-{[4-(бутиламино)азепан-1-ил]сульфонил}тиен-2-ил)метил]-3-метоксибензамид,
N-[(5-{[4-(додециламино)азепан-1-ил]сульфонил}тиен-2-ил)метил]-3-метоксибензамид,
N-{[5-({4-[(2-циклогексилэтил)амино]азепан-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
N-({5-[(4-{[(1R)-1-циклогексилэтил]амино}азепан-1-ил)сульфонил]тиен-2-ил}метил)-3-метоксибензамид,
N-{[5-({4-[(1R,2R,4S)-бицикло[2.2.1]гепт-2-иламино]азепан-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
3-метокси-N-{[5-({4-[(2-пропоксиэтил)амино]азепан-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({4-[(циклогексилметил)амино]азепан-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
N-{[5-({4-[(1-адамантилметил)амино]азепан-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид
3-метокси-N-{[5-({4-[(3-морфолин-4-илпропил)амино]азепан-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
3-метокси-N-{[5-({4-[(2-пиридин-2-илэтил)амино]азепан-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
3-метокси-N-{[5-({4-[(2-пиперидин-1-илэтил)амино]азепан-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({4-[(2-этилгексил)амино]азепан-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
N-({5-[(4-{[3-(1H-имидазол-1-ил)пропил]амино}азепан-1-ил)сульфонил]тиен-2-ил}метил)-3-метоксибензамид,
4-хлор-N-[(5-{[4-(гептиламино)азепан-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
4-хлор-N-[(5-{[4-(октиламино)азепан-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
4-хлор-N-[(5-{[4-(пентиламино)азепан-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
N-[(5-{[4-(бутиламино)азепан-1-ил]сульфонил}тиен-2-ил)метил]-4-хлорбензамид,
4-хлор-N-[(5-{[4-(додециламино)азепан-1-ил]сульфонил}тиен-2-ил) метил]бензамид,
4-хлор-N-{[5-({4-[(2-циклогексилэтил)амино]азепан-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({4-[(1R,2R,4S)-бицикло[2.2.1]гепт-2-иламино]азепан-1-ил}сульфонил)тиен-2-ил]метил}-4-хлорбензамид,
4-хлор-N-{[5-({4-[(2-пропоксиэтил)амино]азепан-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
4-хлор-N-{[5-({4-[(2-этилгексил)амино]азепан-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
4-хлор-N-[(5-{[4-(гексиламино)азепан-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
N-[(5-{[4-(гексиламино)азепан-1-ил]сульфонил}тиен-2-ил)метил]-3-метоксибензамид,
3-метокси-N-[(5-{[4-({2-[3-(трифторметил)фенил]этил}амино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
3-метокси-N-({5-[(4-{[2-(4-метилфенил)этил]амино}пиперидин-1-ил)сульфонил]тиен-2-ил}метил)бензамид,
3-метокси-N-({5-[(4-{[(1S,2R)-2-фенилциклопропил]амино}пиперидин-1-ил)сульфонил]тиен-2-ил}метил)бензамид,
3-метокси-N-{[5-({4-[(1-нафтилметил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
3-метокси-N-{[5-({4-[(2-фенилпропил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-({5-[(4-{[2-(4-гидроксифенил)этил]амино}пиперидин-1-ил)сульфонил]тиен-2-ил}метил)-3-метоксибензамид,
3-метокси-N-{[5-({4-[(3-фенилпропил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({4-[(2,3-дигидроксипропил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
N-{[5-({4-[(2-гидроксиэтил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
3-метокси-N-[(5-{[4-(нониламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
3-метокси-N-[(5-{[4-(дециламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
3-метокси-N-[(5-{[4-(этиламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
N-{[5-({4-[(2-[1,1'-бифенил]-4-илэтил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
N-{[5-({4-[([1,1'-бифенил]-3-илметил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
3-метокси-N-{[5-({4-[(2-тиен-2-илэтил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
3-метокси-N-[(5-{[4-({4-[(трифторметил)сульфонил]бензил}амино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
3-метокси-N-{[5-({4-[(хинолин-4-илметил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({4-[([1,1'-бифенил]-4-илметил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}-3-метоксибензамид,
4-хлор-N-{[5-({4-[(2-{[(трифторметил)сульфонил]амино}этил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}бензамид,
4-хлор-N-[(5-{[4-(пропиламино)-1-пиперидинил]сульфонил}-2-тиенил)метил]бензамид,
4-хлор-N-[(5-{[4-({4-[(трифторметил)сульфонил]бензил}амино)-1-пиперидинил]сульфонил}-2-тиенил)метил]бензамид,
4-хлор-N-{[5-({4-[(3,4-дигидроксибензил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}бензамид,
метил [{1-[(5-{[(4-хлорбензоил)амино]метил}-2-тиенил)сульфонил]-4-пиперидинил}(гексил)амино]ацетат,
трет-бутил [{1-[(5-{[(4-хлорбензоил)амино]метил}-2-тиенил)сульфонил]-4-пиперидинил}(гексил)амино]ацетат,
[{1-[(5-[(4-хлорбензоил)амино]метил-2-тиенил)сульфонил]-4-пиперидинил}(гексил)амино]уксусная кислота,
N-[(5-{[3-(гептиламино)пирролидин-1-ил]сульфонил}тиен-2-ил)метил]-3-метоксибензамид,
3-метокси-N-[(5-{[3-(октиламино)пирролидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
3-метокси-N-[(5-{[3-(пентиламино)пирролидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
N-[(5-{[3-(бутиламино)пирролидин-1-ил]сульфонил}тиен-2-ил)метил]-3-метоксибензамид,
N-[(5-{[3-(додециламино)пирролидин-1-ил]сульфонил}тиен-2-ил)метил]-3-метоксибензамид,
N-{[5-({3-[(2-циклогексилэтил)амино]пирролидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
N-({5-[(3-{[(1R)-1-циклогексилэтил]амино}пирролидин-1-ил)сульфонил]тиен-2-ил}метил)-3-метоксибензамид,
N-{[5-({3-[(1R,2R,4S)-бицикло[2.2.1]гепт-2-иламино]пирролидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
3-метокси-N-{[5-({3-[(2-пропоксиэтил)амино]пирролидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({3-[(циклогексилметил)амино]пирролидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
N-{[5-({3-[(1-адамантилметил)амино]пирролидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
3-метокси-N-{[5-({3-[(3-морфолин-4-илпропил)амино]пирролидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
3-метокси-N-{[5-({3-[(2-пиридин-2-илэтил)амино]пирролидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
3-метокси-N-{[5-({3-[(2-пиперидин-1-илэтил)амино]пирролидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({3-[(2-этилгексил)амино]пирролидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
N-[(5-{[3-(гексиламино)пирролидин-1-ил]сульфонил}тиен-2-ил)метил]-3-метоксибензамид,
4-хлор-N-[(5-{[3-(гептиламино)пирролидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
4-хлор-N-[(5-{[3-(гексиламино)пирролидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
4-хлор-N-[(5-{[3-(пентиламино)пирролидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
N-[(5-{[3-(бутиламино)пирролидин-1-ил]сульфонил}тиен-2-ил)метил]-4-хлорбензамид,
4-хлор-N-{[5-({3-[(2-циклогексилэтил)амино]пирролидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({3-[(1R,2R,4S)-бицикло[2.2.1]гепт-2-иламино]пирролидин-1-ил}сульфонил)тиен-2-ил]метил}-4-хлорбензамид,
4-хлор-N-({5-[(3-{[(1-гидроксициклогексил)метил]амино}пирролидин-1-ил)сульфонил]тиен-2-ил}метил) бензамид,
N-{[5-({3-[(1-адамантилметил)амино]пирролидин-1-ил}сульфонил)тиен-2-ил]метил}-4-хлорбензамид,
4-хлор-N-{[5-({3-[(3-морфолин-4-илпропил)амино]пирролидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
4-хлор-N-{[5-({3-[(2-пиридин-2-илэтил)амино]пирролидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
4-хлор-N-{[5-({3-[(2-пиперидин-1-илэтил)амино]пирролидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
4-хлор-N-{[5-({3-[(2-этилгексил)амино]пирролидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
4-хлор-N-[(5-{[3-(октиламино)пирролидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
метил (2S)-1-[(5-{[(4-хлорбензоил)амино]метил}-2-тиенил)сульфонил]-4-(гексиламино)-2-пирролидинкарбоксилат,
3-метокси-N-{[5-({4-[(пентиламино)метил]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({4-[2-(бутиламино)этил]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
N-{[5-({4-[(4-бутиланилино)метил]-1-пиперидинил}сульфонил)-2-тиенил]метил}-3-метоксибензамид,
4-хлор-N-{[5-({4-[гексил(метил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
4-хлор-N-{[5-({4-[(циклогексилметил)(гексил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({4-[бензил(гексил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-4-хлорбензамид,
4-хлор-N-{[5-({4-[гексил(пиридин-3-илметил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
4-хлор-N-{[5-({4-[гексил(пиридин-4-илметил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
4-хлор-N-{[5-({4-[гексил(пиридин-2-илметил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({4-[бутил(гексил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-4-хлорбензамид,
4-хлор-N-{[5-({4-[гексил(3-фенилпропил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
4-хлор-N-{[5-({4-[гексил(2-фенилэтил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({4-[[(5-бром-2-фурил)метил](гексил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-4-хлорбензамид,
3-метокси-N-({5-[(4-{метил[4-(трифторметил)бензил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)бензамид,
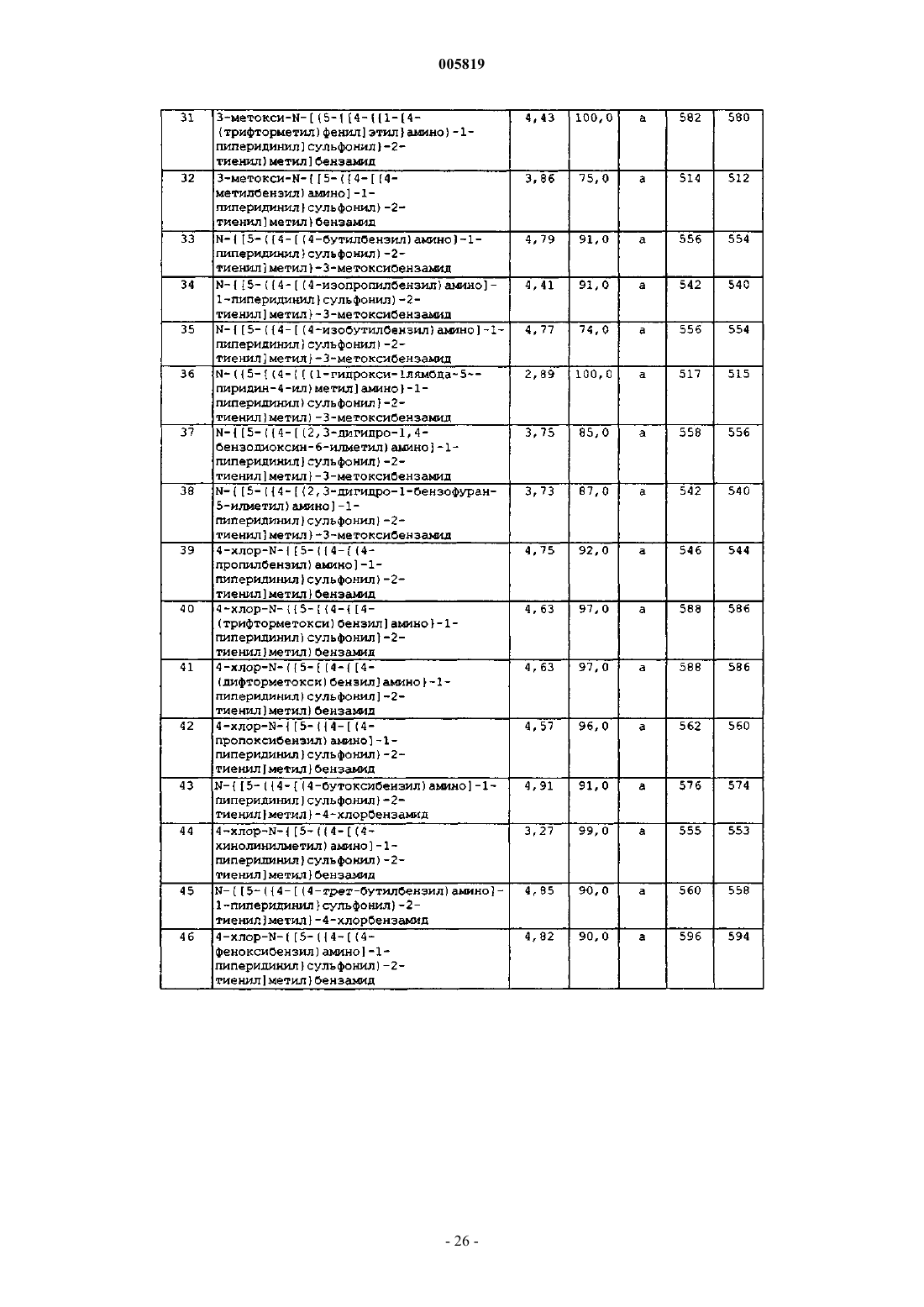
4-хлор-N-{[5-({4-[(3-хлорбензил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
3-метокси-N-({5-[(4-{[4-(трифторметил)бензил]амино}пиперидин-1-ил)сульфонил]тиен-2-ил}метил)бензамид,
3-метокси-N-{[5-({4-[(3-метилбензил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
3-метокси-N-{[5-({4-[(4-пропилбензил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
3-метокси-N-({5-[(4-{[3-(трифторметил)бензил]амино}пиперидин-1-ил)сульфонил]тиен-2-ил}метил)бензамид,
3-метокси-N-({5-[(4-{[4-(трифторметокси)бензил]амино}пиперидин-1-ил)сульфонил]тиен-2-ил}метил)бензамид,
N-({5-[(4-{[4-(дифторметокси)бензил]амино}пиперидин-1-ил)сульфонил]тиен-2-ил}метил)-3-метоксибензамид,
3-метокси-N-{[5-({4-[(2,3,4,5,6-пентаметилбензил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
3-метокси-N-{[5-({4-[(4-пропоксибензил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({4-[(4-бутоксибензил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
3-метокси-N-{[5-({4-[(4-метоксибензил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
3-метокси-N-{[5-({4-[(пиридин-4-илметил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
3-метокси-N-{[5-({4-[(пиридин-2-илметил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
3-метокси-N-{[5-({4-[(пиридин-3-илметил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
N-{[5-({4-[(4-трет-бутилбензил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
N-{[5-({4-[(3-этоксибензил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}-3-метоксибензамид,
3-метокси-N-{[5-({4-[(4-феноксибензил)амино]пиперидин-1-ил}сульфонил)тиен-2-ил]метил}бензамид,
3-метокси-N-[(5-{[4-({4-[(трифторметил)сульфанил]бензил}амино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид,
3-метокси-N-({5-[(4-{[4-(метилсульфонил)бензил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)бензамид,
N-({5-[(4-{[3,5-бис(трифторметил)бензил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)-3-метоксибензамид,
N-({5-[(4-{[2,5-бис(трифторметил)бензил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)-3-метоксибензамид,
N-({5-[(4-{[4-(этилсульфанил)бензил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)-3-метоксибензамид,
3-метокси-N-[(5-{[4-({3-[(трифторметил)сульфанил]бензил}амино)-1-пиперидинил]сульфонил}-2-тиенил)метил]бензамид,
N-({5-[(4-{[(2,2-дифтор-1,3-бензодиоксол-5-ил)метил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)-3-метоксибензамид,
N-{[5-({4-[(4-иодбензил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}-3-метоксибензамид,
N-({5-[(4-{[4-(бензилокси)бензил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)-3-метоксибензамид,
N-{[5-({4-[(мезитилметил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}-3-метоксибензамид,
N-{[5-({4-[(4-хлорбензил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}-3-метоксибензамид,
N-{[5-({4-[(4-этилбензил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}-3-метоксибензамид,
3-метокси-N-{[5-({4-[(4-пентилбензил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}бензамид,
3-метокси-N-[(5-{[4-({1-[4-(трифторметил)фенил]этил}амино)-1-пиперидинил]сульфонил}-2-тиенил)метил]бензамид,
3-метокси-N-{[5-({4-[(4-метилбензил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}бензамид,
N-{[5-({4-[(4-бутилбензил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}-3-метоксибензамид,
N-{[5-({4-[(4-изопропилбензил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}-3-метоксибензамид,
N-{[5-({4-[(4-изобутилбензил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}-3-метоксибензамид,
N-({5-[(4-{[(1-гидрокси-1l ~5~-пиридин-4-ил)метил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)-3-метоксибензамид,
N-{[5-({4-[(2,3-дигидро-1,4-бензодиоксин-6-илметил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}-3-метоксибензамид,
N-{[5-({4-[(2,3-дигидро-1-бензофуран-5-илметил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}-3-метоксибензамид,
4-хлор-N-{[5-({4-[(4-пропилбензил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}бензамид,
4-хлор-N-({5-[(4-{[4-(трифторметокси)бензил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)бензамид,
4-хлор-N-({5-[(4-{[4-(дифторметокси)бензил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)бензамид,
4-хлор-N-{[5-({4-[(4-пропоксибензил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}бензамид,
N-{[5-({4-[(4-бутоксибензил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}-4-хлорбензамид,
4-хлор-N-{[5-({4-[(4-хинолинилметил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}бензамид,
N-{[5-({4-[(4-трет-бутилбензил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}-4-хлорбензамид,
4-хлор-N-{[5-({4-[(4-феноксибензил)амино]-1-пиперидинил}сульфонил)-2-тиенил]метил}бензамид,
4-хлор-N-[(5-{[4-({4-[(трифторметил)сульфанил]бензил}амино)-1-пиперидинил]сульфонил}-2-тиенил)метил]бензамид,
4-хлор-N-({5-[(4-{[4-(трифторметил)бензил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)бензамид,
3-метокси-N-({5-[(4-{[2-(трифторметил)бензил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)бензамид,
3-метокси-N-[(5-{[4-({[6-(трифторметил)-3-пиридинил]метил}амино)-1-пиперидинил]сульфонил}-2-тиенил)метил]бензамид,
N-[(5-{[4-(бензиламино)-1-пиперидинил]сульфонил}-2-тиенил)метил]-3-метоксибензамид,
3-метокси-N-[(5-{[4-({1-[4-(трифторметил)фенил]пропил}амино)-1-пиперидинил]сульфонил}-2-тиенил)метил]бензамид,
3-метокси-N-[(5-{[4-({1-метил-1-[4-(трифторметил)фенил]этил}амино)-1-пиперидинил]сульфонил}-2-тиенил)метил]бензамид,
4-хлор-N-[(5-{[4-({1-[4-(трифторметил)фенил]этил}амино)-1-пиперидинил]сульфонил}-2-тиенил)метил]бензамид,
4-хлор-N-[(5-{[4-({1-метил-1-[4-(трифторметил)фенил]этил}амино)-1-пиперидинил]сульфонил}-2-тиенил)метил]бензамид,
4-хлор-N-[(5-{[2-({[4-(трифторметил)бензил]амино}метил)-1-пирролидинил]сульфонил}-2-тиенил)метил]бензамид,
4-хлор-N-[(5-{[(3R)-3-({[4-(трифторметил)бензил]амино}метил)пирролидинил]сульфонил}-2-тиенил)метил]бензамид,
4-хлор-N-({5-[(3-{[4-(трифторметил)бензил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)бензамид,
4-хлор-N-{[5-({3-[(гексиламино)метил]-1-пиперидинил}сульфонил)-2-тиенил]метил}бензамид,
4-хлор-N-({5-[(3-{[4-(трифторметил)бензил]амино}-1-пирролидинил)сульфонил]-2-тиенил}метил)бензамид,
4-хлор-N-{[5-({(3R)-3-[(гексиламино)метил]пирролидинил}сульфонил)-2-тиенил]метил}бензамид,
4-хлор-N-[(5-{[3-({[4-(трифторметил)бензил]амино}метил)-1-пиперидинил]сульфонил}-2-тиенил)метил]бензамид,
2-оксо-N-({5-[(4-{[4-(трифторметил)бензил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)-1,2-дигидро-3-пиридинкарбоксамид,
N-[(5-{[4-(гексиламино)-1-пиперидинил]сульфонил}-2-тиенил)метил]-2-оксо-1,2-дигидро-3-пиридинкарбоксамид,
N-[(5-{[4-(гексиламино)-1-пиперидинил]сульфонил}-2-тиенил)метил]-2-гидроксибензамид,
2-гидрокси-N-({5-[(4-{[4-(трифторметил)бензил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)бензамид,
N-[(5-{[4-(гексиламино)-1-пиперидинил]сульфонил}-2-тиенил)метил]-2-тиоксо-1,2-дигидро-3-пиридинкарбоксамид,
2-тиоксо-N-({5-[(4-{[4-(трифторметил)бензил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)-1,2-дигидро-3-пиридинкарбоксамид,
N-[(5-{[4-(бутиламино)-1-пиперидинил]сульфонил}-2-тиенил)метил]-2-оксо-1,2-дигидро-3-пиридинкарбоксамид,
N-({5-[(4-{этил[4-(трифторметил)бензил]амино}-1-пиперидинил)сульфонил]-2-тиенил}метил)-3-метоксибензамид,
4-хлор-N-[(5-{[4-({имино[4-(трифторметил)фенил]метил}амино)-1-пиперидинил]сульфонил}-2-тиенил)метил]бензамид,
1-[(5-{[(4-хлорбензоил)амино]метил}-2-тиенил)сульфонил]-4-(гексиламино)пролин,
этил 2-{[4-(гексиламино)пиперидин-1-ил]сульфонил}-5-{[(3-метоксибензоил)амино]метил}тиофен-3-карбоксилат,
N-{[5-{[4-(гексиламино)пиперидин-1-ил]сульфонил}-4-(триметилсилил)тиен-2-ил]метил}-3-метоксибензамид,
N-({5-{[4-(гексиламино)пиперидин-1-ил]сульфонил}-4-[гидрокси(фенил)метил]тиен-2-ил}метил)-3-метоксибензамид,
этиловый эфир 5-[(3-метоксибензоиламино)метил]-2-[4-(4-трифторметилбензиламино)пиперидин-1-сульфонил]тиофен-3-карбоновой кислоты,
N-[(4-хлор-5-{[4-(гексиламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]-3-метоксибензамид.
14. Производное сульфонамида по любому из предшествующих пунктов для применения в качестве лекарственного средства.
15. Применение производного сульфонамида по любому из пп.1-13 для получения лекарственного средства для лечения нейронных нарушений, выбранных из эпилепсии, болезни Альцгеймера, заболевания Хантингтона, болезни Паркинсона, заболеваний сетчатки, повреждений спинного мозга, множественного склероза, травмы головы и ишемии, аутоиммунного заболевания, выбранного из воспалительного заболевания кишечника (IBD), ревматоидного артрита, астмы, септического шока, отторжения трансплантата, рака, выбранного из рака молочной железы, колоректального рака, рака поджелудочной железы, рака яичников, рака простаты, тестикулярного рака, рака печени, рака почки, рака легкого, кардиоваскулярного заболевания, включая удар, артериосклероз, инфаркт миокарда, нарушение кровоснабжения миокарда и ишемическое состояние, включая нарушение кровоснабжения сердца, почки и мозга, почечную недостаточность.
16. Применение производного сульфонамида по п.15 для модулирования каскада реакций, связанного с участием JNK.
17. Применение по п.16 для лечения или профилактики нарушений, связанных с отклоняющимися от нормы экспрессией или активностью JNK.
18. Применение по п.17 для лечения или профилактики нарушений, связанных с отклоняющимися от нормы экспрессией или активностью JNK2 и/или JNK3.
19. Фармацевтическая композиция, содержащая по меньшей мере одно производное сульфонамида согласно любому из пп.1-13 и его фармацевтически приемлемый носитель, разбавитель или эксципиент.
20. Способ получения производного сульфонамида по любому из пп. 1-13, согласно которому сульфонамид формулы (XIX)
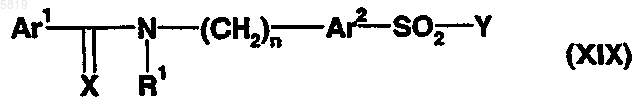
в которой Ar1, Ar2, X, R1, R2 и n являются такими, как определено выше, и Y представляет пирролидин-3-он или пиперидин-4-он, подвергают восстановительному аминированию с использованием амина формулы H2N-R3, в которой R3 является таким, как определено выше.
21. Способ получения производного сульфонамида по любому из пп.1-13, согласно которому сульфонамид формулы (XIX)

в которой Ar1, Ar2, X, R1, R2 и n являются такими, как определено выше, и Y представляет пирролидин-3-амин или пиперидин-4-амин, подвергают взаимодействию с альдегидом R3-CHO формулы (Xa), в которой R3 является таким, как определено выше.
22. Производное сульфонамида формулы (XIX)
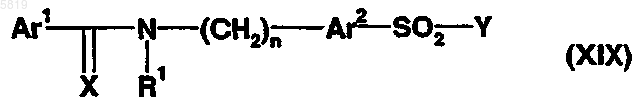
в которой Ar1 представляет арил или гетероарил,
Ar2 представляет тиенил или фуранил;
X представляет O или S;
R1 представляет водород или C1-C6-алкильную группу,
n означает целое число от 0 до 5 и
Y представляет пирролидин-3-он, пиперидин-4-он, пирролидин-3-амин или пиперидин-4-амин.
Текст
005819 Область техники Настоящее изобретение относится к производным сульфонамида, содержащим липофильные фрагменты, указанные производные являются в значительной степени растворимыми. Такие производные сульфонамида преимущественно используют в качестве фармацевтически активных соединений. Настоящее изобретение также относится к фармацевтическим композициям, содержащим указанные производные сульфонамида. В частности, настоящее изобретение относится к производным сульфонамида,которые могут быть использованы для лечения и/или профилактики нарушений и расстройств иммунной системы и системы нейронов. А именно, производные сульфонамида согласно настоящему изобретению проявляют значительную модулирующую, преимущественно ингибирующую активность в отношении функционирования JNK (Jun-киназы) или каскадов реакций с участием JNK. Предшествующий уровень техники Апоптозом называют комплекс изменений, происходящих в мембране и органеллах клетки, наблюдаемых в том случае, когда клетка претерпевает процесс запрограммированной гибели. При протекании этого процесса клетка активирует заложенную в ней программу гибели клетки и систематическим образом сама себя разрушает. При этом наблюдается следующий ряд событий. На поверхности клетки появляются пузырьки, и поверхность клетки начинает экспрессировать профагоцитные сигналы. Затем вся клетка претерпевает фрагментацию в связанные с мембраной везикулы,которые быстро и четко ликвидируются посредством фагоцитоза, так что окружающим тканям наносятся минимальные повреждения. Затем клетка отделяется от своих соседей. В ядре тоже проходит ряд характерных морфологических изменений, по мере того, как оно заканчивает свое существование генетическим самоуничтожением, хроматин уплотняется и особым образом расщепляется на фрагменты ДНК. Гибель нейронов играет важную роль в обеспечении нормального функционирования нервной системы. По-видимому, гибель развивающихся нейронов зависит от размера мишени, которую они иннервируют: клетки с меньшими синаптическими системами с большей вероятностью подвержены гибели,чем клетки, у которых сформированы синапсы со сложной структурой. Это может отражать процесс,который приводит к относительному равновесию пре- и постсинаптических нейронов в функционирующей нервной системе. Хотя высказывались предположения, что гибель нейронов осуществляется путем апоптоза, но только недавно было убедительно показано, что нейроны в развивающемся мозге грызунов претерпевают апоптоз, об этом свидетельствует морфология и фрагментация ДНК. Поскольку ясно, что гибель клеток в процессе их развития не является патологическим процессом, разумно предположить, что клетка действительно прекращает свое существование. Гибель нейронов происходит либо в результате апоптоза, либо вследствие некротических процессов после травмы нерва или при нейродегенеративном заболевании. Многочисленные компоненты играют ключевую роль в запуске запрограммированной гибели нейронов. К числу компонентов, приводящих к апоптозу нейронов, относятся члены семейства SAPK/JNK, входящие в подсемейство МАР-киназ(МАРК). Клетки млекопитающих реагируют на некоторые внеклеточные раздражители посредством активации сигнальных каскадов, медиаторами которых являются различные активированные митогенами протеинкиназы (МАРК). Несмотря на различия реакций на предшествующие стимулы, каскады, в которых участвуют МАР-киназы, организованы аналогичным образом, и в них принимают участие киназы киназ МАР-киназ (МАРККК или МЕКК), киназы МАР-киназ (МАРКК или МКК) и МАР-киназы (МАРК). МАР-киназы представляют собой довольно большое семейство киназ, которые включают c-Jun Nтерминальные киназы (JNK), также называемые стресс-активированными протеинкиназами (SAPK), а также включают киназы, регулируемые посредством внеклеточного сигнала (ERK) и р 38 МАР-киназы. Каждый из этих трех типов подсемейств МАР-киназ участвует по крайней мере в трех различных, но осуществляемых параллельно, каскадах реакций передачи информации, запуск которых осуществляется под воздействием внешних стимулов. Каскад реакций передачи сигнала с участием JNK активируется в результате воздействия на клетки стрессовых факторов окружающей среды, таких как химические токсины, радиация, гипоксия и осмотический шок (скачок осмотического давления), а также при воздействии на клетки факторов роста или противовоспалительных цитокинов, таких как фактор некроза опухолей альфа (TNF-) или интерлейкин-1 бета (IL-1). Две разновидности киназ МАР-киназ (также называемых МКК или МАРКК), т.е. МКК 4 (также называемая JNKK1) и МКК 7 (также называемая JNKK2), активируют JNK посредством двойного фосфорилирования определенных треониновых и тирозиновых остатков, расположенных в Thr-Pro-Tyr мотиве активационной петли фермента, в ответ на воздействие цитокинов и стрессовые сигналы. Даже располагаясь в сигнальном каскаде вверх по потоку, МКК 4, как известно, сама активируется под воздействием киназы киназ МАР-киназ (МЕКК 1) посредством фосфорилирования определенных сериновых и треониновых остатков.-1 005819 После активации JNK связывается с N-терминальным участком фактора транскрипции мишени и фосфорилирует транскрипционные активационные домены, чтр приводит к позитивной регуляции экспрессии различных генных продуктов, что может вызвать апоптоз, воспалительную реакцию или онкогенные процессы (1-5). МАРК (митоген-активированные протеинкиназы) представляют собой серин/треонинкиназы, активируемые посредством двойного фосфорилирования определенных треониновых и тирозиновых остатков. Клеткам млекопитающих присущи, по крайней мере, три различных, но параллельных каскада реакций, которые передают информацию, генерируемую внеклеточными стимулами, к МАРК. Указанные каскады реакций состоят из каскадов реакций киназ, приводящих к активации ERK (внеклеточных регуляторных киназ), JNK (c-Jun N-терминальных киназ) и p38/CSBP киназ. В том случае, когда в ретрансляцию особого молекулярного сигнала стрессового типа включены каскады как с участием JNK, так и каскады с участием р 38, каскад с участием ERK в основном отвечает за трансдукцию в клеточные ядра митогенных сигналов/сигналов к дифференцировке.SAPK-каскады представляют подсемейство семейства митоген-активирующих протеинкиназ, которые активируются под воздействием различных внешних стимулов, включая разрушение ДНК под воздействием УФ-излучения, воздействие TNF-, IL-1, керамида, воздействие клеточных стрессов и воздействие реакционноспособных соединений кислорода, и имеют определенную субстратную специфичность. Трансдукция сигнала посредством MKK4/JNK или МКК 3/р 38 приводит к фосфорилированию индуцибельных факторов транскрипции, c-Jun и ATF2, которые затем оказывают воздействие либо как гомодимеры, либо как гетеродимеры, инициируя транскрипцию действующих в прямом направлении (даунстрим) эффекторов.c-Jun представляет собой белок, который образует гомодимеры и гетеродимеры (например, с c-Fos) для продуцирования трансактивирующего комплекса АР, который необходим для активации множества генов (например, матричных металлопротеиназ), участвующих в воспалительной реакции. Киназы JNK были открыты, когда было найдено, что несколько различных стимулов, таких как УФ-облучение и фактор некроза опухолей TNF, стимулируют фосфорилирование c-Jun на специфических сериновых остатках на N-конце белка. Были идентифицированы три индивидуальных JNK-фермента как продукты генов JNK1, JNK2 иJNK3, и были идентифицированы десять различных изоформ JNK (3,6,7). JNK1 и JNK2 экспрессируются повсеместно в различных тканях человека, в то время как JNK3 экспрессируется селективно в мозге,сердце и яичках (7, 8, 9, 10). Каждая изоформа связывается с субстратом с различной аффинностью,предполагая, in vivo, специфическое субстратное регулирование сигнальных каскадов реакций посредством различных изоформ JNK. В недавней публикации: Xie X et al, (Structure 1998, 6 (8); 983-991) высказано предположение, что активируемые под воздействием стресса сигнальные каскады трансдукции необходимы для апоптоза нейронов, индуцированного посредством потери NGF линией клеток крыс РС-12, симпатическими нейронами из верхнего шейного ганглия (SCG). Ингибирование специфических киназ, а именно киназыMAP киназы 3 (МКК 3) и киназы MAP киназы 4 (МКК 4), или c-Jun (части МКК-4 каскада) может быть достаточным для того, чтобы блокировать апоптоз (см. также Kumagae Y et al, Brain Res Mol Brain Res,1999, 61(1), 10-17; Yang DD et al, Nature, 1997, 389 (6653); 865-870). В течение нескольких часов убывания NGF в SCG нейронах c-Jun становится в значительной степени фосфорилированной и содержание белков повышается. Аналогичным образом, в линиях клеток крыс РС-12, лишенных NGF, JNK и р 38 претерпевают устойчивую активацию, в то время как ERK ингибируются. Совместимые с этой JNK3 мыши линии КО резистентны к токсичным стимулам, индуцирующим апоптоз в гиппокампе, и что еще более важно, у них значительно понижается эпилепсия типа припадка при реагировании на токсичные стимулы, по сравнению с животными в норме (Nature 1997, 389, 865-870). Недавно сообщалось о том,что сигнальный каскад реакций, связанный с участием JNK, причастен к пролиферации клеток и играет важную роль в случае аутоиммунных заболеваний (Immunity, 1998, 9, 575-585; Current Biology, 1999, 3,116-125), посредническую роль в которых играют активация и пролиферация Т-клеток. Не подверженные какому-либо воздействию (предшествующие) CD4+ хелперные Т (Th) клетки распознают специфические комплексы МНС-пептида на антигенпрезентирующих клетках (АРС) посредством комплекса рецепторов Т-клеток (TCR). В дополнение к ТСТ-медиаторному сигналу, дополнительный стимулирующий сигнал обеспечивается, по меньшей мере, частично посредством лигированияCD28, экспрессируемого на Т-клетках, с В 7 белками на АРС. Комбинация этих двух сигналов индуцирует клональную экспрессию Т-клеток. Через 4-5 дней пролиферации клетки предшественника СD4+Т дифференцируются в содержащие спейсер эффекторные Th клетки, которые опосредуют функции иммунной системы. Во время этого процесса дифференцировки происходит существенное перепрограммирование экспрессии гена. В соответствии с присущими им профилями секреции цитокинов и иммуномодулирующим действием определены две субпопуляции эффекторных Тh клеток: субпопуляция клеток Thl продуцируетIFN и LT (TNF-), которые необходимы для осуществления противовоспалительных реакций, медиато-2 005819 рами которых являются клетки; субпопуляция клеток Тh2 секретирует интерлейкины IL-4, IL-5, IL-6, IL10 и IL-13, которые являются медиаторами активации и дифференцировки В-клеток. Эти клетки играют центральную роль в иммунном ответе. При стимуляции антигеном каскад реакций с участием JNK MAP киназы индуцируется в эффекторных клетках Тh1, но не в клетках Тh2. Кроме того, дифференцировка предшественников - Т-клеток CD4+ в клетки эффекторы Тh1, но не Тh2, снижена у мышей с дефицитомJNK-2. Следовательно, в последнее время было установлено, что сигнальный каскад реакций с участиемJNK играет важную роль в установлении баланса между Тh1 и Тh2 в иммунной реакции, осуществляемой посредством JNK2. Некоторые факторы транскрипции, известные как JNK субстраты, представляют собой Jun белки (cjun, JunB и Jun D), родственные факторы транскрипции ATF2 и ATFa, факторы транскрипции Ets, такие как Elk-1 и Sap-1, опухолевые гены-супрессоры р 53 и доменные белки гибели клеток (DENN). Активация каскада реакций с участием JNK документально подтверждена для течения ряда заболеваний, обеспечивая, таким образом, логическое обоснование для выбора мишеней при отыскании лекарственного средства. В дополнение, молекулярно-генетический подход обосновывает роль этого каскада реакций в случае некоторых заболеваний. Например, аутоиммунные и воспалительные заболевания являются следствием неподходящей активации иммунной системы. Активированные иммунные клетки экспрессируют множество генов, кодирующих молекулы зоны воспаления, включая цитокины, факторы роста, рецепторы клеточной поверхности, молекулы клеточной адгезии и ферменты расщепления. Множество таких генов, как известно, подвергаются регуляции посредством каскада реакций с участием JNK, посредством активации факторов транскрипции c-Jun и ATF2. Ингибирование активации JNK в бактериальных полисахарид-стимулированных макрофагах эффективно модулирует продуцирование ключевого противовоспалительного цитокина - фактора некроза опухоли TNF (11). Ингибирование активации JNK снижает активацию фактора транскрипции, ответственного за индуцибельную экспрессию матричных металлопротеиназ (ММР) (12), которые, как известно, ответственны за эрозию хряща и кости при ревматоидном артрите и общую деструкцию тканей в случае других аутоиммунных заболеваний. Каскад реакций с участием JNK также активируется в Т-клетках посредством стимуляции антигеном и дополнительной стимуляции рецептора действием CD28 (13) и регулирует продуцирование IL-2 промотора (14). Неподходящая активация Т-лимфоцитов инициирует и сохраняет навсегда множество аутоиммунных заболеваний, включая астму, синдром раздраженной толстой кишки и множественный склероз. В нейронах, поврежденных в результате болезни Альцгеймера, и в СА 1 нейронах пациентов с острой гипоксией (15) содержание белка JNK3 было значительно повышено. Ген JNK3, как было обнаружено, также экспрессируется в поврежденных участках мозга пациентов при болезни Альцгеймера (16). В дополнение, было обнаружено, что нейроны мышей линии JNK3 КО становятся резистентными к действию каиновой кислоты, индуцирующей апоптоз нейронов, по сравнению с мышами вида, обитающего на воле (8). Основываясь на этих данных, полагают, что каскад сигнальных реакций с участием JNK, и в особенности, с участием JNK2 и JNK3, тесно связан с управляемыми апоптозом заболеваниями, такими как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия и припадки, болезнь Хантингтона, травматические повреждения мозга, а также ишемические и геморрагические удары. Кардиоваскулярные заболевания, такие как атеросклероз и рестеноз, являются следствием нарушенного регулирования разрастания стенок кровеносного сосуда. Каскад реакций с участием JNK активируется атерогенными стимулами и регулирует локальное продуцирование цитокина и фактора роста в васкулярных клетках (17, 18), индуцируя проатеросклеротические гены (19). Ишемия сама по себе или в совокупности с реперфузией в сердце, печени, почке или мозге приводит к гибели клеток и образованию рубца, которые в конце концов приводят к застойной сердечной недостаточности, заболеваниям печени, почечной недостаточности или церебральной дисфункции. Каскад реакций, связанных с участием JNK, активируется посредством ишемии и реперфузии в сердце (20), приводя к активации JNK-зависимых генов и повреждению тканей, медиатором которого являются лейкоциты. Активация JNK также наблюдается в почке (21) или печени (22), с последующей ишемией и реперфузией. Как было доказано, понижающая регуляция JNK улучшает функционирование почки и приводит к длительному результату при нефритической и ишемической почечной недостаточности (23). Рак характеризуется неконтролируемыми ростом, пролиферацией и миграцией клеток. На ранних стадиях рака легкого экспрессия с-jun претерпевает изменения и может служить медиатором фактора роста, передающего сигнал в небольших раковых клетках легкого (24). В дополнение к регулированию продуцирования c-jun, активация JNK может регулировать фосфорилирование р 53, и таким образом, может модулировать течение клеточного цикла (25). Кроме того, роль активации JNK в NTVL-1 (Т-клетки человека с вирусомлейкемии типа 1) является медиатором образования опухоли (26), приводя к предположению о потенциальном применении ингибиторов JNK для лечения рака (27). Селективное ингибиро-3 005819 вание активации JNK посредством имеющегося в природе ингибирующего JNK пептида, называемогоJNK-интерактивным белком-1 (JIP 1), блокирует трансформацию клеток (28). Таким образом, ингибиторы JNK могут блокировать трансформацию и рост опухолевых клеток. Для целенаправленного ингибирования каскада реакций с участием JNK в заявке WO/9849188 предлагается использовать полипептид человека, т.е. JNK-взаимодействующий белок-1 (JIP-1), который представляет собой биологический продукт и который также был изучен в отношении противодействия заболеваниям, связанным с апоптозом. Хотя было подтверждено, что такие полипептиды человека оказывают ингибирующее воздействие на каскад реакций, связанных с участием JNK, использованию таких полипептидов присущ целый ряд недостатков.- Активные биопептиды или биопротеины получают только посредством довольно сложного и дорогого биосинтеза, который в результате часто приводит к получению продуктов с довольно высокой стоимостью.- Пептиды, как известно, обладают очень плохой проницаемостью через мембрану и могут не перейти через мембрану, разделяющую кровь и мозг.- Принципиальным недостатком использования пептидных ингибиторов или антагонистов является проблема низкой пероральной биодоступности, возникающая вследствие расщепления в кишечнике. Следовательно, они должны вводиться парентерально, и, наконец,пептидные ингибиторы или антагонисты часто воспринимаются организмом-хозяином как вторгшееся вещество, которое необходимо удалить, таким образом, вызывается аутоиммунный ответ. Существенная релевантность каскада реакций с участием JNK в случае некоторых широко распространенных заболеваний придает большое значение получению ингибиторов JNK, предпочтительно селективных. Следовательно, целью настоящего изобретения является предоставление молекул, которые пригодны для лечения различных заболеваний, в частности, системы нейронов или аутоиммунной системы,включающих нарушения, расстройства, рак, ишемические состояния и кардиоваскулярные заболевания. Кроме того, целью настоящего изобретения является получение химических соединений, которые способны к модулированию, предпочтительно к понижающей регуляции или к ингибированию каскада реакций с участием JNK (Jun киназы) таким образом, чтобы такие соединения были пригодными для лечения заболеваний, которые связаны с каскадом реакций с участием JNK. Кроме того, целью настоящего изобретения является разработка способов получения указанных химических соединений. Дополнительно целью настоящего изобретения является создание нового вида фармацевтических композиций, предназначенных для лечения заболеваний, в частности таких, медиатором которых является функционирование JNK. Наконец, целью настоящего изобретения является разработка способа лечения и/или профилактики заболеваний, которые вызваны расстройством аутоиммунной системы и/или системы нейронов. Сущность изобретения Вышеуказанные цели могут быть достигнуты в соответствии с независимыми пунктами формулы изобретения. Предпочтительные случаи осуществления изобретения отражают прилагаемые зависимые пункты формулы изобретения. В приведенных ниже абзацах представлены определения различных химических фрагментов, из которых построены соединения согласно настоящему изобретению, и предполагается, что эти определения одинаковым образом используются во всем описании и в формуле изобретения, если только специально не приводится иная формулировка, приводящая к более широкому толкованию.C1-С 6-алкил относится к моновалентным алкильным группам, содержащим 1-6 атомов углерода. Этот термин иллюстрируют такие группы, как метил, этил, н-пропил, изопропил, н-бутил, изобутил,трет-бутил, н-гексил и подобные им группы. Арил относится к ненасыщенной ароматической карбоциклической группе, содержащей от 6 до 14 атомов углерода и имеющей одно кольцо (например, фенил) или несколько конденсированных колец(например, нафтил). Предпочтительный арил включает фенил, нафтил, фенантренил и подобные им группы.C1-С 6-алкиларил относится к C1-С 6-алкильным группам, у которых имеется арильный заместитель, включая бензил, фенетил и подобные им группы. Гетероарил относится к моноциклической гетероароматической или бициклической, или трициклической конденсированной гетероароматической группе. Конкретные примеры гетероароматических групп включают необязательно замещенный пиридил, пирролил, фурил, тиенил, имидазолил, оксазолил,изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,3-оксадиазолил,1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,3,4-триазинил, 1,2,3-триазинил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил, бензотиенил, бензотриазолил, изобензотиенил, индолил,изоиндолил, 3 Н-индолил, бензимидазолил, имидазо[1,2-а]пиридил, бензотиазолил, бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил, нафтиридинил, пиридо[3,4-b]пиридил,пиридо[3,2-b]пиридил,пиридо[4,3-b]пиридил,хинолил,изохинолил,тетразолил,5,6,7,8-4 005819 тетрагидрохинолил, 5,6,7,8-тетрагидроизохинолил, пуринил, птеридинил, карбазолил, ксантенил или бензохинолил.C1-С 6-алкилгетероарил относится к C1-С 6-алкильной группе, имеющей гетероарильный заместитель, включая 2-фурилметил, 2-тиенилметил, 2-(1 Н-индол-3-ил)этил и подобные им группы. Алкенил относится к алкенильным группам, предпочтительно содержащим от 2 до 6 атомов углерода и имеющим по меньшей мере 1 или 2 алкенильно ненасыщенных участка. Предпочтительно алкенильные группы включают этенил (-СН=СН 2), н-2-пропенил (аллил, -СН 2 СН=СН 2) и подобные им группы. Алкинил относится к алкинильным группам, предпочтительно содержащим от 2 до 6 атомов углерода и имеющим по меньшей мере 1-2 алкинильно ненасыщенных участка, предпочтительные алкинильные группы включают этинил (-ССН), пропаргил (-СН 2 СОСН) и подобные им группы. Ацил относится к группе -C(O)R, в которой R включает C1-С 6-алкил, арил, гетероарил,C1-С 6-алкиларил или C1-С 6-алкилгетероарил. Ацилокси относится к группе -OC(O)R, в которой R включает C1-С 6-алкил, арил, гетероарил, C1-С 6-алкиларил или C1-С 6-алкилгетероарил. Алкокси относится к группе -O-R, в которой R включает C1-С 6-алкил или арил, или гетероарил, или C1-С 6-алкиларил, или C1-С 6-алкилгетероарил. Предпочтительные алкоксигруппы включают, например, метокси, этокси, фенокси и подобные им группы. Алкоксикарбонил относится к группе -С(О)OR, в которой R включает C1-С 6-алкил или арил,или гетероарил, или C1-С 6-алкиларил, или C1-С 6-алкилгетероарил. Аминокарбонил относится к группе -C(O)NRR', в которой каждый R, R' независимо включает водород или C1-С 6-алкил, или арил, или гетероарил, или C1-С 6-алкиларил, или C1-С 6-алкилгетероарил. Ациламино относится к группе -NR(CO)R', в которой каждый R, R' независимо представляет водород или C1-С 6-алкил, или арил, или гетероарил, или C1-С 6-алкиларил, или C1-С 6 алкилгетероарил. Галоген относится к атомам фтора, хлора, брома и иода. Сульфонил относится к группе -SO2-R, в которой R выбран из Н, группы арил, гетероарил,C1-С 6-алкил, C1-С 6-алкил, замещенной галогеном, например, группы -SO2-CF3, C1-С 6-алкиларил или C1-С 6-алкилгетероарил. Сульфокси относится к группе -S(O)-R, в которой R выбран из Н, группы C1-С 6-алкил, C1-С 6 алкил, замещенной галогеном, например, группы -SO-CF3, арил, гетероарил, C1-С 6-алкил или C1-С 6 алкилгетероарил. Тиоалкокси относится к группе -S-R, в которой R включает C1-С 6-алкил или арил, или гетероарил, или C1-С 6-алкиларил, или C1-С 6-алкилгетероарил. Предпочтительные группы тиоалкокси включают тиометокси, тиоэтокси и подобные им группы. Замещенный или незамещенный: если при определении конкретного заместителя не указано иное, вышеуказанные группы, такие как алкил, алкенил, алкинил, арил и гетероарил, и подобные им группы могут быть необязательно замещены от 1 до 5 заместителями, выбранными из группы, состоящей из таких заместителей, как C2-С 6-алкил, C2-С 6-алкиларил, C2-С 6-алкилгетероарил,C2-С 6-алкенил, С 2-С 6-алкинил, первичная, вторичная или третичная аминогруппы или четвертичный аммониевый фрагмент, ацил, ацилокси, ациламино, аминокарбонил, алкоксикарбонил,арил, гетероарил, карбоксил, циано, галоген, гидрокси, меркапто, нитро, сульфокси, сульфонил, алкокси, тиоалкокси, тригалогенметил и подобных им заместителей. Альтернативно, указанное замещение может включать такую ситуацию, когда соседние заместители претерпевают замыкание кольца, в особенности, когда в этом участвуют соседние функциональные заместители, образуя, таким образом, например, лактамы, лактоны, циклические ангидриды, а также ацетали, тиоацетали, аминали, образующиеся посредством замыкания кольца, например, при замыкании кольца в целях получения защитной группы. Термин фармацевтически приемлемые соли или комплексы относится к солям или комплексам указанных ниже соединений формулы I, которые сохраняют необходимую биологическую активность. Примеры таких солей включают, не ограничиваясь этим, соли - продукты присоединения кислоты, образованные с неорганическими кислотами (например, такими как хлористо-водородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, азотная кислота и подобные им кислоты), и соли, образованные с органическими кислотами, такими как уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, фумаровая кислота, малеиновая кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, памовая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновая кислота, нафталиндисульфоновая кислота и полигалактуроновая кислота. Указанные соединения также могут быть введены в виде фармацевтически приемлемых четвертичных солей, известных специалисту в данной области, которые, в частности, включают четверичную аммониевую соль формулы -NR,R',R"+Z-, в которой R, R' , R" независимо представляют водород, алкил или бензил, a Z представляет противоион, включающий хлорид, бромид, иодид, -O-алкил, толуолсульфонат, ме-5 005819 тилсульфонат, сульфонат, фосфат или карбоксилат (такой как бензоат, сукцинат, ацетат, гликолят, малеинат, малат, фумарат, цитрат, тартрат, аскорбат, циннамоат, манделат и дифенилацетат). Термин фармацевтически активное производное относится к любому соединению, которое при введении реципиенту способно обеспечить прямо или косвенно раскрытую в настоящем описании активность. Термин ионизируемый фрагмент относится к функциональным группам, характеристическое электронное распределение которых может быть изменено с образованием при этом ионной или ионизируемой группы, или иными словами, с получением соли. Предпочтительные ионизируемые фрагменты представляют собой основные группы, такие как амины, которые протонируются с получением соли. Термин в значительной степени растворимые означает, что соединения настоящего изобретения проявляют хорошую растворимость в водных растворителях. Предпочтительный порог составляет приблизительно 50 мкг/мл растворителя, более предпочтительно по меньшей мере 100 мкг/мл растворителя. Термин липофильная цепь относится к группам, которые проявляют заметное притяжение к гидрофобным группам, заместителям или соединениям, в особенности, к липидам или соединениям или фрагментам жирного ряда. Такие группы в особенности включают необязательно замещенные С 4-С 18 алкильные группы или замещенные или незамещенные алкиларильные группы. Термин гидрофильная группа относится к функциональным группам, которые проявляют заметное притяжение к гидрофильным или полярным группам, заместителям или соединениям, или соединениям или фрагментам жирного ряда. Такие группы в особенности включают карбоксилаты, гидроксиды,сульфаты или сульфонаты, или амины, или аммонийные соли. Термин энантиомерный избыток (ее) относится к продуктам, которые получают в основном энантиомерным синтезом или синтезом, включающим энантиоселективную стадию, при котором образуется избыток одного из энантиомеров, по меньшей мере, достигается выход приблизительно 52% ее. В отсутствие энантиомерного синтеза обычно получают рацемический продукт, что, однако, также входит в объем изобретения при установлении активности продукта как ингибитора активности JunK2 и/илиJunK3. Один из аспектов настоящего изобретения относится к производным сульфонамида формулы I в которой Аr1 и Аr2 независимо друг от друга представляют арильную или гетероарильную группы.R1 представляет водород или C1-С 6-алкильную группу, предпочтительно Н, или R1 с Аr1 образует 56-членное насыщенное или ненасыщенное кольцо.n представляет целое число от 0 до 5, предпочтительно 1-3 и наиболее предпочтительно 1.Y в приведенной выше формуле I представляет 4-12-членный насыщенный циклический или бициклический алкил, содержащий азот, который образует связь с сульфонильной группой формулы I. Указанный 4-12-членный насыщенный циклический или бициклический алкил замещен по меньшей мере одним ионизируемым фрагментом, к которому присоединена липофильная цепь. Вышеуказанный ионизируемый фрагмент, находящийся в L1, обеспечивает улучшенную растворимость молекул формулы I по сравнению с соединениями, которые не содержат такой фрагмент. Особенно эффективны в отношении ингибирования JNK, в частности JNK2 и/или JNK3, такие соединения, в которых L1 также включает липофильный фрагмент. Как полагают, такие липофильные группы входят в полости фермента, активность которого необходимо ингибировать. Настоящее изобретение также включает геометрические изомеры, оптически активные формы,энантиомеры, диастереомеры соединений формулы I, а также их рацематы и их фармацевтически приемлемые соли, так же как и их фармацевтически активные производные производных сульфонамида формулы I. В формуле I предпочтительные Аr1 и Аr2 представляют такие фрагменты, которые независимо выбраны из группы, включающей или состоящей из фенила, тиенила, фуранила, пиррола, пиридила, необязательно замещенного замещенным или незамещенным C1-С 6-алкилом, таким как тригалогенметил, замещенным или незамещенным C1-С 6-алкокси, замещенным или незамещенным C2-С 6-алкенилом, замещенным или незамещенным C2-С 6-алкинилом, амино, ациламино, аминокарбонилом, C1-С 6 алкоксикарбонилом, арилом, карбоксилом, циано, галогеном, гидрокси, нитро, сульфонилом, C1-С 6 тиоалкокси. Наиболее предпочтительный Аr1 представляет замещенный фенил, включающий галогенфенил (например, 4-хлорфенил), нитрофенил, гидроксифенил, алкоксифенил, пиридил, 3,4 дигидроксифенил, тиоксодигидропиридин или его таутомер, пиразол, в то время как наиболее предпочтительный Аr2 представляет незамещенную или замещенную тиенильную или фуранильную группу. Предпочтительно такие заместители, которые присоединены к указанной тиенильной или фуранильной группе, представляют гидрофильные группы, которые являются группами, обеспечивающими лучшую растворимость соединения формулы I. Они включают, в особенности, карбоксильные группы,-6 005819 карбоксилаты, карбоксамиды, ОН или несущие ОН алкильные группы, гидразидокарбонильные группы,сульфаты или сульфонаты, или амины, или аммонийные соли. Гидрофильные заместители у Аr2 представляют особый интерес для того, чтобы дополнительно повысить растворимость соединения формулыI. В том случае, когда Аr1 представляет 4-хлорфенил, нитрофенил, гидроксифенил, алкоксифенил, пиридил, 3,4-дигидроксифенил, тиоксодигидропиридин или его таутомер, пиразольную группу, X представляет предпочтительно О, R1 представляет водород, n означает 1, и Аr2 представляет тиенил или фуранил. В частности, предпочтительное воплощение настоящего изобретения относится к производным сульфонамида, в которых Y представляет пирролидиновый, азепановый или пиперидиновый фрагмент приведенных ниже формул. В указанных формулах R6 выбран из группы, включающей или состоящей из водорода, замещенного или незамещенного C1-С 6-алкила, замещенного или незамещенного C1-С 6-алкокси, ОН, галогена, нитро, циано, сульфонила, оксо (=O), сульфокси, ацилокси, тиоалкокси, и если R6 не представляет водород,п' представляет целое число от 0 до 4, предпочтительно 1 или 2, в соответствии с чем по меньшей мере один из L1 и/или L2 представляет ионизируемый фрагмент, к которому присоединена липофильная группа. Согласно более предпочтительному воплощению сульфонамидного производного формулы I, Y представляет пирролидиновый, азепановый или пиперидиновый фрагмент, как описано выше, в котором R6 представляет Н, L2 представляет Н, L1 представляет -NR3'R3; где по меньшей мере один из R3' и R3 не является водородом, а выбран из группы, состоящей из линейного или разветвленного С 4-С 18-алкила, арил-С 1-С 18-алкила, гетероарилС 2-C18-алкила, С 1-С 14-алкила, замещенного С 3-С 12-циклоалкилом или -бицикло или -трициклоалкилом, в соответствии с чем указанная алкильная цепь может содержать 1-3 атома О или S. Более предпочтительно L1 представляет -NHR3; где R3 представляет линейный или разветвленный С 4-С 12-алкил, предпочтительно С 6-С 12-алкил, необязательно замещенный циклогексильной группой, илиR3 представляет бензильный фрагмент. Наиболее предпочтительно производные сульфонамида согласно настоящему изобретению представляют такие соединения, в которых Y представляет пиперидиновую группу и L1 представляет -NHR3; где R3 представляет линейный или разветвленный С 6-С 12-алкил, предпочтительно С 3-С 12-алкил, или R3 представляет бензильный фрагмент. Конкретные примеры соединений формулы I включают следующие соединения: 4-хлор-N-[(5-[4-(гексиламино)пиперидин-1-ил] сульфонилтиен-2-ил)метил]бензамид,3-метокси-N-[5-(4-[(4-трифторметилбензил)амино]пиперидин-1-илсульфонил)тиен-2 ил]метилбензамид,4-хлор-N-[(5-[4-(1,3-тиазол-2-иламино)пиперидин-1-ил]сульфонилтиен-2-ил)метил]бензамид,4-хлор-N-[(5-[4-(гептиламино)пиперидин-1-ил]сульфонилтиен-2-ил)метил]бензамид,4-хлор-N-[(5-[4-(пентиламино)пиперидин-1-ил]сульфонилтиен-2-ил)метил] бензамид,4-хлор-N-[(5-[4-(бутиламино)пиперидин-1-ил]сульфонилтиен-2-ил )метил]бензамид,4-хлор-N-[(5-[4-(додециламино)пиперидин-1-ил]сульфонилтиен-2-ил)метил]бензамид,4-хлор-N-[5-(4-[(2-циклогексилэтил)амино]пиперидин-1-илсульфонил)тиен-2-ил]метилбензамид,4-хлор-N-[5-(4-[(циклогексилметил)амино]пиперидин-1-илсульфонил)тиен-2-ил]метилбензамид,4-хлор-N-(5-[(4-[(1R)-1-циклогексилэтил]аминопиперидин-1-ил)сульфонил]тиен-2-илметил)бензамид,N-[5-(4-[(1R,2R,4S)-бицикло[2.2.1]гепт-2-иламино]пиперидин-1-илсульфонил)тиен-2-ил]метил 4-хлорбензамид,4-хлор-N-([5-(4-[(2-пропоксиэтил)амино]пиперидин-1-илсульфонил)тиен-2-ил]метилбензамид,N-[5-(4-[(1-адамантилметил)амино]пиперидин-1-илсульфонил)тиен-2-ил]метил-4-хлорбензамид,N-[5-(4-[(4-изопропилбензил)амино]-1-пиперидинилсульфонил)-2-тиенил]метил-3-метоксибензамид,N-[5-(4-[(4-изобутилбензил)амино]-1-пиперидинилсульфонил)-2-тиенил]метил-3-метоксибензамид,N-(5-[(4-[(1-гидрокси-1 лямбда-5-пиридин-4-ил)метил]амино-1-пиперидинил)сульфонил]-2 тиенилметил)-3-метоксибензамид,N-[5-(4-[(2,3-дигидро-1,4-бензодиоксин-6-илметил)амино]-1-пиперидинилсульфонил)-2 тиенил]метил-3-метоксибензамид,N-[5-(4-[(2,3-дигидро-1-бензофуран-5-илметил)амино]-1-пиперидинилсульфонил)-2-тиенил]метил-3-метоксибензамид,4-хлор-N-[5-(4-[(4-пропилбензил)амино]-1-пиперидинилсульфонил)-2-тиенил]метилбензамид,4-хлор-N-(5-[(4-[4-(трифторметокси)бензил]амино-1-пиперидинил)сульфонил]-2-тиенилметил)бензамид,4-хлор-N-(5-[(4-[4-(дифторметокси)бензил]амино-1-пиперидинил)сульфонил]-2-тиенилметил)бензамид,4-хлор-N-[5-(4-[(4-пропоксибензил)амино]-1-пиперидинилсульфонил)-2-тиенил]метилбензамид,N-[5-(4-[(4-бутоксибензил)амино]-1-пиперидинилсульфонил)-2-тиенил]метил-4-хлорбензамид,4-хлор-N-[5-(4-[(4-хинолинилметил)амино]-1-пиперидинилсульфонил)-2-тиенил]метил)бензамид,N-[5-(4-[(4-трет-бутилбензил)амино]-1-пиперидинилсульфонил)-2-тиенил]метил-4-хлорбензамид,4-хлор-N-[5-(4-[(4-феноксибензил)амино]-1-пиперидинилсульфонил)-2-тиенил]метилбензамид,4-хлор-N-[(5-[4-(4-[(трифторметил)сульфанил]бензиламино)-1-пиперидинил]сульфонил-2 тиенил)метил]бензамид,4-хлор-N-(5-[(4-[4-(трифторметил)бензил]амино-1-пиперидинил)сульфонил]-2-тиенилметил)бензамид,3-метокси-N-(5-[(4-[2-(трифторметил)бензил]амино-1-пиперидинил)сульфонил]-2-тиенилметил)бензамид,3-метокси-N-[(5-[4-([6-(трифторметил)-3-пиридинил]метиламино)-1-пиперидинил]сульфонил 2-тиенил)метил]бензамид,N-[(5-[4-(бензиламино)-1-пиперидинил]сульфонил-2-тиенил)метил]-3-метоксибензамид,3-метокси-N-[(5-[4-(1-[4-(трифторметил)фенил]пропиламино)-1-пиперидинил]сульфонил-2 тиенил)метил]бензамид,3-метокси-N-[(5-[4-(1-метил-1-[4-(трифторметил)фенил]этиламино)-1-пиперидинил]сульфонил-2-тиенил)метил]бензамид,4-хлор-N-[(5-[4-(1-[4-(трифторметил)фенил]этиламино)-1-пиперидинил]сульфонил-2 тиенил)метил]бензамид,4-хлор-N-[(5-[4-(1-метил-1-[4-(трифторметил)фенил]этиламино)-1-пиперидинил]сульфонил-2 тиенил)метил]бензамид,4-хлор-N-[(5-[2-([4-(трифторметил)бензил]аминометил)-1-пирролидинил]сульфонил-2-тиенил)метил]бензамид,4-хлор-N-[(5-[(3R)-3-([4-(трифторметил)бензил]аминометил)пирролидинил]сульфонил-2 тиенил)метил]бензамид,4-хлор-N-(5-[(3-[4-(трифторметил)бензил]амино-1-пиперидинил)сульфонил]-2-тиенилметил)бензамид,4-хлор-N-[5-(3-[(гексиламино)метил]-1-пиперидинилсульфонил)-2-тиенил]метилбензамид,4-хлор-N-(5-[(3-[4-(трифторметил)бензил]амино-1-пирролидинил)сульфонил]-2-тиенилметил)бензамид,4-хлор-N-[5-3R)-3-[(гексиламино)метил]пирролидинилсульфонил)-2-тиенил]метил)бензамид,4-хлор-N-[(5-[3-([4-(трифторметил)бензил]аминометил)-1-пиперидинил]сульфонил-2 тиенил)метил]бензамид,2-оксо-N-(5-[(4-[4-(трифторметил)бензил]амино-1-пиперидинил)сульфонил]-2-тиенилметил)1,2-дигидро-3-пиридинкарбоксамид,N-[(5-[4-(гексиламино)-1-пиперидинил]сульфонил-2-тиенил)метил]-2-оксо-1,2-дигидро-3 пиридинкарбоксамид,N-[(5-[4-(гексиламино)-1-пиперидинил]сульфонил-2-тиенил)метил]-2-гидроксибензамид,2-гидрокси-N-(5-[(4-[4-(трифторметил)бензил]амино-1-пиперидинил)сульфонил]-2-тиенилметил)бензамид,N-[(5-[4-(гексиламино)-1-пиперидинил]сульфонил-2-тиенил)метил]-2-тиоксо-1,2-дигидро-3 пиридинкарбоксамид,- 12005819 2-тиоксо-N-(5-[(4-[4-(трифторметил)бензил]амино-1-пиперидинил)сульфонил]-2-тиенилметил)1,2-дигидро-3-пиридинкарбоксамид,N-[(5-[4-(бутиламино)-1-пиперидинил]сульфонил-2-тиенил)метил]-2-оксо-1,2-дигидро-3-пиридинкарбоксамид,N-5-[(4-этил[4-(трифторметил)бензил]амино-1-пиперидинил)сульфонил]-2-тиенилметил)-3 метоксибензамид,4-хлор-N-[(5-[4-(имино[4-(трифторметил)фенил]метиламино)-1-пиперидинил]сульфонил-2 тиенил)метил]бензамид,1-[(5-[(4-хлорбензоил)амино]метил-2-тиенил)сульфонил]-4-(гексиламино)пролин,этил 2-[4-(гексиламино)пиперидин-1-ил]сульфонил-5-[(3-метоксибензоил)амино]метилтиофен 3-карбоксилат,N-[5-[4-(гексиламино)пиперидин-1-ил]сульфонил-4-(триметилсилил)тиен-2-ил]метил-3-метоксибензамид,N-(5-[4-(гексиламино)пиперидин-1-ил]сульфонил-4-[гидрокси(фенил)метил]тиен-2-илметил)-3 метоксибензамид,этиловый эфир 5-[(3-метоксибензоиламино)метил]-2-[4-(4-трифторметилбензиламино)пиперидин 1-сульфонил]тиофен-3-карбоновой кислоты,N-[(4-хлор-5-[4-(гексиламино)пиперидин-1-ил] сульфонилтиен-2-ил)метил]-3-метоксибензамид. Соединения формулы I подходят для использования при лечении расстройств иммунной системы и системы нейронов млекопитающих, в особенности, человека. Такие расстройства системы нейронов включают, например, нейродегенеративные заболевания, например такие как болезнь Альцгеймера, болезнь Хантингтона, болезнь Паркинсона, заболевания сетчатки, повреждения спинного мозга, множественный склероз, травма головы, эпилепсия и припадки, ишемический и геморрагический мозговой удар. Нарушения и расстройства иммунной системы включают, например, астму, отторжение трансплантата,воспалительные процессы, такие как воспалительное заболевания кишечника (IBD), эрозию хряща и кости, ревматоидный артрит, септический шок. Соединения формулы I также могут быть использованы для лечения рака, такого как рак молочной железы, колоректальный рак, рак поджелудочной железы, рак простаты, тестикулярный рак, рак яичников, рак легкого, рак печени, рак почки. В соответствии с другим воплощением, соединения формулы I могут быть использованы для лечения кардиоваскулярных заболеваний, включая атеросклероз, рестеноз, удар, ишемию, например, церебральную ишемию, инфаркт миокарда. В соответствии с другим воплощением, соединения формулы I могут быть использованы для лечения различных ишемических состояний, включая сердечную и почечную недостаточность, гепатические расстройства и нарушение кровоснабжения мозга. Предпочтительно соединения формулы I, непосредственно или в форме фармацевтической композиции могут применяться для модулирования каскада реакций, связанных с участием JNK, более конкретно, для лечения или профилактики нарушений и расстройств, связанных с экспрессией или активностью JNK, в особенности, JNK2 и JNK3. Такое модулирующее воздействие обычно предпочтительно включает ингибирование каскадов реакций, связанных с участием JNK, в особенности, JNK2 и/илиJNK3. Такие отклоняющиеся от нормы экспрессия или активность JNK могут вызываться различными стимулами (например, такими как стресс, септический шок, стресс, вызванный воздействием окислителя,цитокинез) и могут вызывать каскад процессов, приводящих, например, к неконтролируемому апоптозу,воспалительной реакции или онкогенным процессам. Эти явления часто связаны с различными нарушениями и расстройствами, включая перечисленные выше расстройства и болезненные состояния. Следовательно, соединения настоящего изобретения могут применяться для лечения нарушений и расстройств посредством модулирующего воздействия на функционирование JNK или сигнальные каскады реакций. Модулирующее воздействие на функционирование JNK или сигнальные каскады реакций, связанные с участием JNK, может включать ее активацию, но предпочтительно включает понижающую регуляцию,приводящую к ингибированию каскадов реакций, связанных с участием JNK, в особенности, JNK2 и/илиJNK3. Соединения настоящего изобретения могут быть использованы в отдельности или в комбинации с другими фармацевтическими средствами, например, с другими JNK-модуляторами. Еще одной целью настоящего изобретения является способ получения новых производных сульфонамида, соответствующих формуле I, которые были описаны выше. Производные сульфонамида, являющиеся предметом настоящего изобретения, могут быть получены из легко доступных исходных веществ с использованием приведенных ниже способов и методик. Необходимо принимать во внимание, что приведены типичные или предпочтительные условия эксперимента (т.е. температура реакции, время, количество молей реагента, растворители и т.п.), однако могут быть использованы и другие условия эксперимента, если не указано иное. Оптимальные условия реакции могут варьироваться в зависимости от типа используемого реагента, однако такие условия могут быть определены специалистом в данной области в соответствии с общепринятой практикой проведения процедур оптимизации.- 13005819 Соединения формулы I могут быть получены любым из способов, представленных на схемах 1 или 2: Схема 1 В соответствии со схемой Ar1, Ar2, R1, L и n являются такими, как определено выше, Р представляет подходящую защитную группу (предпочтительно, R1 не является водородом, а предпочтительно является защитной группой). Сульфонилхлориды формулы (V), используемые по схеме 1, могут быть получены согласно методике, представленной на схеме 3: Схема 3 В соответствии со схемой Ar1, Ar2, R1 и n являются такими, как определено выше. Амины формулы II представляют собой либо известные соединения, либо могут быть синтезированы из известных соединений согласно общепринятым методикам. Предпочтительные амины, используемые в качестве исходных веществ, включают тиен-2-илметиламин, фуран-2-илметиламин, пирролил-2 илметиламин,пиридил-2-илметиламин,тиен-2-илэтиламин,фуран-2-илэтиламин,пиридил-2- 14005819 илэтиламин, тиен-2-илпропиламин, фуран-2-илпропиламин, пиридил-2-илпропиламин и подобные им амины. Ацилхлориды формулы III также либо коммерчески доступны, либо представляют собой ранее описанные соединения. Предпочтительные ацилхлориды включают галогенбензоилхлориды, например, 4 хлорбензоилхлорид, 4-фторбензоилхлорид или трифторметилбензоилхлорид, алкоксибензоилхлорид,пиридилкарбонилхлорид и подобные им соединения. Ацилгалогениды (III) также могут быть получены взаимодействием соответствующей карбоновой кислоты с неорганическим галогенидом кислоты, таким как тионилхлорид, трихлорид фосфора или оксалилхлорид, в обычных условиях. Как правило, такую реакцию проводят при использовании приблизительно 1-5 молярных эквивалентов ацилгалогенида или оксалилхлорида, либо в виде чистой формы, либо в инертном растворителе, таком как тетрахлорид углерода, при температуре в интервале от приблизительно 0 до приблизительно 80 С в течение от приблизительно 1 до приблизительно 48 ч. При проведении данной реакции также может быть использован катализатор, такой как N,N-диметилформамид. В том случае, когда в реакции конденсации, приведенной на схеме III, используют ацилгалогенид(III), он обычно реагирует с амином (II) в присутствии подходящего основания, которое является акцептором кислоты, выделяющейся во время реакции. Подходящие основания включают, например, триэтиламин, диизопропилэтиламин, N-метилморфолин и подобные им соединения. Альтернативно, может быть использован избыток амина II для связывания кислоты, образующейся во время реакции. Альтернативно, в реакции конденсации может быть использована карбоновая кислота, соответствующая соединению (III). Карбоновые кислоты и производные соединения (III) представляют собой коммерчески доступные реагенты или могут быть получены согласно общепринятым методикам. Реакцию конденсации карбоновой кислоты формулы III (например, ацилхлорида) с амином (II) обычно проводят, используя какой-либо общепринятый конденсирующий агент, который включает, например, карбодиимиды, такие как дициклогексилкарбодиимид, N-(3-диметиламинопропил)-N'этилкарбодиимид и другие промотирующие агенты, например, такие как N,N-карбонилдиимидазол или РуВОР. Данная реакция может быть проведена с использованием или без использования хорошо известных добавок, таких как N-гидроксисукцинимид, 1-гидроксибензотриазол и т.д., которые, как известно,способствуют конденсации карбоновых кислот и аминов. Реакцию конденсации с использованием либо ацилгалогенида (III), либо соответствующей ему карбоновой кислоты, предпочтительно проводят при температуре от приблизительно 0 до приблизительно 6 С в течение приблизительно от 1 до приблизительно 24 ч. Обычно реакцию проводят в инертном апротонном полярном растворителе, таком как N,N-диметилформамид, дихлорметан, хлороформ, ацетонитрил, тетрагидрофуран и в подобных им растворителях, используя приблизительно от 1 до приблизительно 5 молярных эквивалентов амина, в расчете на карбоновую кислоту или соответствующий ей хлорангидрид. После завершения реакции карбоксамид (IV) выделяют, используя общепринятые методы,включая осаждение, хроматографию, фильтрацию, перегонку и подобные им методы. Сульфонилхлориды формулы V, необходимые для получения конечного продукта формулы I, в особенности, такие как сульфонилпиперидины или -пирролидины или -азепаны, получают с использованием общепринятых методов сульфонирования, применяемых для карбоксамидов (IV) Предпочтительный сульфонирующий реагент, используемый в данной реакции (как показано на схеме 3), представляет собой хлорсульфоновую кислоту (HSO3-Cl). Обычно реакцию сульфонирования проводят путем обработки карбоксамида формулы (IV) с использованием приблизительно от 5 до приблизительно 10 молярных эквивалентов сульфонирующего реагента в инертном растворителе, таком как дихлорметан, при температуре, в диапазоне от приблизительно -70 до приблизительно 50 С. Предпочтительно добавление хлорсульфоновой кислоты осуществляют при -70 С, что приводит к образованию промежуточной сульфоновой кислоты. Повышение температуры до 20 С делает возможным образование сульфонилхлорида формулы V. Соединения формулы I, в которой X = S, можно получить из соответствующих ариламидов (в которых X = О), например бензамидов, обычными методами взаимопревращения функциональных групп, хорошо известными специалисту в данной области, например, путем обработки реагентом Лавессона (Lawesson) или другими реагентами (Pedersen, В. S. et al.; Bull. Soc. Chim. Belg. 1978, 87, 223). Альтернативный подход к получению соединений формулы I представлен выше на схеме 2 и включает следующие стадии:- защиты функциональной аминогруппы соединения формулы II;- хлорсульфонилирования ароматической группы (Аr2 в соединении VI), с получением соединения формулы VII;- образования сульфонамидной функциональной группы (с получением соединения IX);- удаления защитной группы Р (снятие защиты), присутствовавшей в соединении IX;- ацилирования полученного, как указано выше, свободного амина с получением соединения (I). При этом предшественник - сульфонилхлорид (VII) может быть получен при осуществлении следующих стадий: Схема 4 Амины формулы II защищают подходящей защитной группой для аминных фрагментов, получая промежуточное соединение формулы VI, в которой Р означает защитную группу. Большое число защитных групп Р для функциональной аминогруппы, а также введение и удаление таких защитных групп описаны в: Т. W. Greene and G. M. Wuts, Protecting groups in Organic Synthesis, Third Edition, Wiley, NewYork, 1998, и приведенных там ссылках. Предпочтительными являются такие защитные группы, введение которых позволяет получить стабильные кислоты и основания, и которые далее могут быть удалены с использованием комплексов переходных металлов, таких как комплексы палладия, например аллилкарбаматная группа (Alloc) или N,N'-бисаллильная группа. Другая предпочтительная защитная группа представляет собой малеинимидную группу, которая стабильна во всем интервале условий эксперимента. Введение указанных групп может быть осуществлено взаимодействием соответствующего ангидрида бисаллилкарбоната или аллилбромида, или малеинового ангидрида в присутствии основания, такого как триэтиламин, диизопропилэтиламин, N-метилморфолин и подобных им соединений в апротонном растворителе, таком как N,N-диметилформамид, дихлорметан, хлороформ, ацетонитрил, тетрагидрофуран и подобных им растворителях, при температуре, в диапазоне от приблизительно 0 до приблизительно 80 С. Затем соединения формулы VI, представленные на схеме 4, подвергают сульфонированию с использованием общепринятой методики сульфонирования в очень мягких условиях, что позволяет получить сульфонилхлорид формулы VII. Обычно защищенные амины VI обрабатывают основанием, таким как н-бутиллитий или трет-бутиллитий, в инертной атмосфере в полярном апротонном растворителе,таком как тетрагидрофуран, эфир или диоксан, при температуре в диапазоне от -70 до 0 С, в течение времени от 15 мин до 4 ч. Полученный таким образом анион затем обрабатывают SO2Cl2 или наиболее предпочтительно SO2, барботированием газа в реакционную смесь при температуре в диапазоне от -70 до 20 С, в течение времени от 5 мин до 1 ч. Полученный сульфинат затем in situ превращают в сульфонилхлорид формулы VII, приводя в контакт с N-хлорсукцинимидом или другим подходящим хлорирующим агентом, включающим РОСl3, SO2Cl2, COCl2, при температуре в диапазоне от 0 до 70 С. В соответствии со схемами 1 и 2, производные сульфонамида формулы I могут быть получены взаимодействием сульфонилхлоридов V или VII с циклическим или бициклическим амином (VIII), т.е. алкилом, содержащим азот в соответствии с приведенным выше определением. Предпочтительные циклические амины (VIII) включают производные пирролидина или азепана, или пиперидина общей формулы (VIII") или (VIII'), или (VIII"').- 16005819 Амины формулы (VIII'") или (VIII"), или (VIII') представляют собой либо коммерчески доступные соединения, либо соединения, которые могут быть получены согласно известным методикам. Реакцию сочетания сульфонилхлоридов (V) и (VII) с аминами VIII с получением сульфонамидов формулы I осуществляют, приводя в контакт сульфонилхлориды с аминами формулы VIII, в присутствии подходящего основания, являющегося акцептором кислоты, образующейся во время реакции. Подходящие основания включают, например, триэтиламин, диизопропилэтиламин, N-метилморфолин и подобные им соединения. Реакцию предпочтительно проводят в среде растворителя, такого как N,Nдиметилформамид, диметилсульфоксид, N-метилпирролидон, этанол, ацетонитрил, обычно при температуре от приблизительно 0 до приблизительно 100 С. В соответствии с предпочтительным воплощением настоящего изобретения производные сульфонамида формулы I получают взаимодействием сульфонилхлорида V или VII с пиперидином формулыVIII . Пиперидины формулы VIII представляют собой либо коммерчески доступные соединения, либо могут быть получены по известным методикам. Такие общепринятые методы, известные специалисту в данной области, описаны, например, в J. Pharm. Sci. 1972, 61, 1316; J. Heterocyclic. Chem., 1986, 23, 73;Tetrahedron Lett., 1996, 37, 1297, патенте США US 5106983, заявках WO/9113872 и WO/9606609. Пиперидиносульфонамиды формулы I могут быть получены путем приведения в контакт сульфонилхлоридов (V) и/или (VII) с пиперидином формулы VIII в присутствии подходящего основания, являющегося акцептором кислоты, образующейся в процессе реакции. Подходящие основания включают,например, триэтиламин, диизопропилэтиламин, N-метилморфолин и подобные им основания. Реакцию предпочтительно проводят в среде растворителя, такого как N,N-диметилформамид, диметилсульфоксид,N-метилпирролидон, этанол, ацетонитрил, при температуре от приблизительно 0 до приблизительно 100 С. Конкретные сульфонамиды формулы XIV, в которой R1 представляет водород, легко получить из защищенных сульфонилхлоридов VII, путем приведения в контакт указанных сульфонилхлоридов VII с амином формулы VIII в присутствии подходящего основания, являющегося акцептором кислоты, образующейся в процессе реакции. Подходящие основания включают, например, триэтиламин, диизопропилэтиламин, N-метилморфолин и подобные им основания. Реакцию предпочтительно проводят в среде растворителя, такого как N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, этанол, ацетонитрил, при температуре от приблизительно 0 до приблизительно 100 С. Использование сульфонилхлоридов типа VII приводит к получению аминов, которые необходимо подвергать удалению защиты с использованием способов, хорошо известных специалисту в данной области, с получением амина общей формулы XIV в которой R1, Ar2, Y и n являются такими, как определено выше. Производные типа XIV затем ацилируют согласно методике, описанной выше для получения амидов конденсацией аминов с ацилхлоридами или карбоновыми кислотами, в предпочтительных условиях,описанных выше, что приводит к получению соединений общей формулы I. Конкретное получение пиперидиносульфонамидов формулы I (Y представляет пиперидин VIII),где L1 представляет фрагмент -NHR3, включает или:- реакцию пиперидин-4-она (VIIIb) с амином(Хb); и представлено на схеме 5 Схема 5R3, R3', R6 являются такими, как определено выше, R' представляет Н или алкильную группу, R представляет арил, предпочтительно фенильную группу, и Р представляет защитную группу. Аминиро- 17005819 ванные пиперидины (VIIIс) и (VIIId) затем могут быть подвергнуты взаимодействию с сульфонилхлоридами V или VII с получением сульфонамидов формулы I или формулы IX, соответственно. Карбонильные соединения (Ха) коммерчески доступны и включают незамещенные или замещенные бензальдегиды (например, такие как бензальдегид или 4-трифторметилбензальдегид, и т.п.), незамещенные или замещенные кетоны (например, такие как ацетофенон или 4-трифторацетофенон и т.п.),незамещенные или замещенные алифатические альдегиды или кетоны (например, такие как гексаналь, 2 пропоксиацетальдегид или гептан-2-он и т.п.). Амины (Хb) коммерчески доступны и включают незамещенные или замещенные первичные алкиламины (например, такие как гексиламин, 2-пиридин-2-этиламин и т.п.), а также незамещенные или замещенные вторичные алкиламины (например, такие как N-метилгексиламин и т.п.). 4-Оксопиперидин и азепан-4-он являются коммерчески доступными. Более предпочтительный подход к получению сульфонамидов формулы I, в которой Y представляет пиперидиновый фрагмент (VIIIс) и (VIIId), представлен на следующих схемах 6 и 7: Схема 6 Конкретное получение пирролидинзамещенных сульфонамидов формулы I (т.е. таких, в которой Y представляет пирролидиновый фрагмент VIII"), где L1 является фрагментом -NHR3, включает следующие стадии:- окисления указанного гидроксипирролидина (VIIIf) с получением соответствующего кетона- восстановительного аминирования кетона (VIIIg) с получением сульфонамида (Iс). Указанный способ поясняет схема 8. Стадия окисления может быть проведена с использованием таких окислительных агентов, как С 2 О 2 Сl2/ДМСО или производные хрома(VI), или производные периодинана, как описано Дессом и Мартином (40). Конкретное подходящее получение сульфонамидов формулы I, в которой Аr2 замещен радикалом 6- взаимодействие указанного сульфонамида (IX) для осуществления металлирования Аr2 (например,при использовании BuLi) с получением соответствующего замещенного сульфонамида (IХа), где R6 является карбоксильной группой, карбоксилатом, карбоксамидом, ОН или ОН, присоединенным к алкильной группе, гидразидокарбонильной группой, сульфатом или сульфонатом, или амином, или аммонийной солью;- удаление защитной группы Р указанного сульфонамида (IХа) и ацилирования сульфонамида с получением соединений формулы (IХb);- удаление защитной группы указанного сульфонамида (IXb) и восстановительного аминирования соответствующего кетона с получением соединений формулы I. Указанный способ иллюстрирует схема 9. Если приведенные выше общие методы синтеза не применимы для получения соединений формулыI, могут быть использованы подходящие методы синтеза, известные специалисту в данной области. Например, в том случае, когда Аr2 представляет фенил, для получения производного сульфонамида формулы I следует использовать в качестве исходного соединения коммерчески доступный 4 цианофенилсульфонилхлорид и общепринятые методы, известные специалисту в данной области. Дополнительный аспект настоящего изобретения относится к производным сульфонамида (XIX) в частности, для использования в качестве промежуточных соединений при получении сульфонамидов формулы (I),где Аr1 и Аr2 независимо друг от друга представляют арил или гетероарил,X представляет О или S;R1 представляет водород или C1-С 6-алкильную группу;n представляет целое число от 0 до 5 иY представляет пирролидин-3-он, пиперидин-4-он, пирролидин-3-амин или пиперидин-4-амин, или их аммонийные соли. Заключительный аспект настоящего изобретения относится к применению соединений формулы I для модулирования функционирования JHK или сигнальных каскадов реакций, применению указанных соединений для получения фармацевтических композиций, предназначенных для модулирования каскада реакций, связанных с участием JNK, а также композиций, содержащих активные соединения формулы I. Указанное модулирование каскада реакций, связанных с участием JNK, рассматривают как способ, который подходит для лечения различных заболеваний. В том случае, когда производные сульфонамида настоящего изобретения используют в качестве фармацевтических средств, указанные соединения обычно вводят в форме фармацевтических композиций. Следовательно, фармацевтические композиции, включающие соединения формулы I и фармацевтически приемлемый носитель, разбавитель или эксципиент,также входят в объем настоящего изобретения. Специалисту в данной области известен целый ряд таких носителей, разбавителей или эксципиентов, подходящих для включения в рецептуру фармацевтических композиций. Также настоящее изобретение предлагает соединения для применения в качестве лекарственных средств. В частности, в соответствии с настоящим изобретением предлагаются соединения формулы I для применения в качестве ингибиторов JNK, в особенности JNK2 и/или JNK3, для лечения нарушений иммунитета, а также системы нейронов млекопитающих, в особенности человека, как непосредственно указанными соединениями, так и указанными соединениями в сочетании с другими лекарственными средствами. Соединения настоящего изобретения вместе с обычно используемыми адъювантом, носителем, разбавителем или эксципиентом могут быть включены в состав фармацевтических композиций или их единичных дозированных форм, и такие формы могут быть использованы в виде твердого продукта, такого как таблетки или наполненные капсулы, или в виде жидкости, такой как растворы, суспензии, эмульсии,эликсиры, или в виде капсул, наполненных такими жидкостями, все из которых предназначены для перорального введения, или в форме стерильных растворов для инъекций для парентерального (включая чрескожное) введения. Такие фармацевтические композиции и их единичные дозированные формы могут включать ингредиенты в общепринятых пропорциях, с добавлением или без добавления других активных соединений или активных начал, и такие единичные дозированные формы могут содержать любое подходящее количество активного ингредиента, соответствующее намеченному интервалу дневных доз, предполагаемых для применения. В том случае, когда производные сульфонамида настоящего изобретения используют в качестве фармацевтических средств, их обычно вводят в виде фармацевтических композиций. Такие композиции могут быть приготовлены способом, хорошо известным в области фармацевтики, и включают по меньшей мере одно активное соединение. Как правило, соединения настоящего изобретения вводят в фармацевтически эффективном количестве. Количество фактически вводимого соединения обычно определяется лечащим врачом, с учетом существенных обстоятельств, включая состояние пациента, подлежащее лечению, выбор способа введения, конкретное вводимое соединение, возраст, массу и реакцию конкретного пациента, степень выраженности симптомов и подобные указанным обстоятельства. Фармацевтические композиции настоящего изобретения могут быть введены различными способами, включая пероральный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный и интраназальный. В зависимости от предполагаемого способа доставки соединения предпочтительно- 21005819 используют, в соответствии с рецептурой, в виде либо композиций для инъекций, либо композиций для перорального введения. Композиции для перорального введения могут иметь вид жидких растворов или суспензий большого объема или порошков большой массы. Однако в большинстве случаев композиции представлены в виде единичных дозированных форм, что облегчает точное дозирование. Термин единичная дозированная форма относится к физически дискретным единицам, пригодным в качестве разовой дозы для человека и других млекопитающих, каждая единичная форма содержит предварительно определенное количество активного вещества, рассчитанное таким образом, чтобы достичь необходимого терапевтического эффекта, в сочетании с подходящим фармацевтическим эксципиентом. Типичные единичные дозированные формы включают предварительно наполненные, предварительно определенной величины ампулы или шприцы с жидкой композицией, или в случае твердой композиции - пилюли, таблетки, капсулы или подобные им формы. В таких композициях производное сульфонамида обычно содержится в небольшом количестве (от приблизительно 0,1 до приблизительно 50% по массе или предпочтительно от приблизительно 1 до приблизительно 40% по массе), а остальное количество представляет собой растворители или носители и добавки, облегчающие изготовление, необходимые для получения нужной дозированной формы. Жидкие формы, пригодные для перорального введения, могут включать подходящий водный или неводный разбавитель, с добавлением буферов, суспендирующих и диспергирующих агентов, подкрашивающих веществ, веществ, улучшающих вкус и запах, и подобных им веществ. Твердые формы могут включать, например, какой-либо из следующих ингредиентов, или соединения аналогичной им природы: связующее, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент,такой как крахмал или лактоза, дезинтегрирующее средство, такое как альгиновая кислота, Примогель или кукурузный крахмал; смазывающее вещество, такое как стеарат магния, вещество, улучшающее скольжение, такое как коллоидный диоксид кремния; подслащивающее вещество, такое как сахароза или сахарин; или вещество, улучшающее вкус и запах, такое как мятное масло, метилсалицилат или апельсиновый ароматизатор. Композиции для инъекций обычно основаны на пригодном для инъекций стерильном физиологическом растворе или физиологическом растворе, забуференном фосфатом, или других пригодных для инъекций носителях, известных из предшествующего уровня техники. Как указывалось выше, производное сульфонамида формулы I в таких композициях обычно содержится в небольшом количестве, зачастую варьируя от 0,05 до 10% по массе, а остальное составляет пригодный для инъекций носитель и подобные вещества. Описанные выше компоненты для перорального введения или композиции для инъекций являются наиболее характерными. Другие вещества, а также методики изготовления и подобное этому описаны в:Remington's Pharmaceutical Sciences, 17th Edition, Part 8, 1985, Marck Publishing Company, Easton, Pennsylvania, включенном в настоящее описание посредством ссылки. Соединения настоящего изобретения также могут быть введены в виде форм замедленного высвобождения или систем доставки с замедленным высвобождением. Описание наиболее типичных веществ, используемых для замедленного высвобождения, также можно найти в материалах, включенных в: Remington's Pharmaceutical Sciences. Далее настоящее изобретение будет проиллюстрировано некоторыми примерами, которые не следует рассматривать как ограничивающие объем настоящего изобретения. Данные ВЭЖХ (высокоэффективная жидкостная хроматография), ЯМР (ядерный магнитный резонанс) и МС (масс-спектроскопия),приведенные в представленных ниже примерах, получены таким образом, как указано ниже. В дальнейшем в приведенных примерах используются следующие сокращения: мин (минута), ч (часы), г (грамм),ммоль (миллимоль), т.пл. (температура плавления), экв. (эквивалент), мл (миллилитр), мкл (микролитр),ACN (ацетонитрил), Воc (бутоксикарбонил), CDCl3 (дейтерированный хлороформ), сНех (циклогексан),ДХМ (дихлорметан), DECP (диэтилцианофосфонат), DIEA (диизопропилэтиламин), DIC (диизопропилкарбодиимид), DMAP (4-диметиламинопиридин), ДМФ (диметилформамид), ДМСО (диметилсульфоксид), ДМСО-d6 (дейтерированный диметилсульфоксид), EDC (1-(3-диметиламинопропил)-3 этилкарбодиимид), EtOAc (этилацетат), Et2O (диэтиловый эфир), Fmoc (9-флуоренилметоксикарбонил),HOBt (1-гидроксибензотриазол), K2 СО 3 (карбонат калия), NaH (гидрид натрия), NаНСО 3 (бикарбонат натрия), н-BuLi (н-бутиллитий), TBTU (О-бензотриазолил-N,N,N',N' -тетраметилуронийтетрафторборат),TEA (триэтиламин), TFA (трифторуксусная кислота), ТГФ (тетрагидрофуран), TMOF (триметилортоформиат) , MgSO4 (сульфат магния), PetEther (петролейный эфир), кт (комнатная температура). Примеры Пример 1 (Методика Е; см. схемы 1, 3 и 6) Получение 3-метокси-N-[5-(4-[(4-трифторметилбензил)амино]пиперидин-1-илсульфонил)тиен 2-ил]метилбензамида (1)[(3-Метоксибензоил)амино]метилтиофен-2-сульфонилхлорид (1 а) К раствору 2-аминометилтиофена (10,6 мл, 103 ммоль) и пиридина (9,1 мл, 104 ммоль) в 100 мл хлороформа добавляют при 0 С раствор 3-метоксибензоилхлорида (19,2 г, 103 ммоль) в CH2Cl2. Реакционной смеси дают нагреться до комнатной температуры в течение 1 ч и перемешивают дополнительно 3 ч. Добавляют воду, и в осадок выпадает 3-метокси-N-(тиен-2-илметил)бензамид, соединение (1b) (10,1 г).- 22005819 Твердое вещество отфильтровывают и промывают водой. Оставшийся органический слой промывают насыщенным раствором соли, сушат над MgSO4 и упаривают досуха, получая дополнительное количество соединения (1b) (15,2 г). Суммарный выход составляет 25,3 г (99,9%). Соединение (1b) используют на следующей стадии без дополнительной очистки. Хлорсульфоновую кислоту (5,62 мл, 84 ммоль) растворяют в 20 мл СН 2 Сl2 и добавляют при энергичном перемешивании к раствору соединения (1b) (11,0 г, 42 ммоль) в 100 мл СН 2 Сl2. Образуется резиноподобное твердое вещество, и реакционную смесь перемешивают в течение 3 часов. Реакцию гасят льдом и добавляют охлажденный льдом раствор NaHCO3, доводя рН до 8,5. Водный слой дважды промывают СН 2 Сl2. К водному слою добавляют тетрабутиламмонийгидроксид (40% в воде) (32 мл, 50 ммоль), при этом образуется твердое вещество. Полученный осадок экстрагируют в CH2Cl2 и водный слой промывают 3 раза CH2Cl2. Объединенные органические слои сушат над MgSO4 и упаривают досуха,получая слабо окрашенную пену, 5-[(3-метоксибензоил)амино]метилтиофен-2-сульфонат тетрабутиламмония (1 с) (24 г, 97%). ЯМР-спектры свидетельствует о получении чистого соединения, которое используют на следующей стадии хлорирования. К раствору соединения (1 с) (2,0 г, 3,4 ммоль) в 50 мл СН 2 Сl2 добавляют трифосген (800 мг, 2,7 ммоль, 2,3 экв.), растворенный в 10 мл СН 2 Сl2. К реакционной смеси добавляют по каплям в течение 10 мин ДМФ (0,1 мл, 1,4 ммоль), при этом может наблюдаться выделение газа. Газы улавливаются на выходе из реакционной колбы 2N раствором NaOH. Реакционную смесь перемешивают в течение 3 ч и неочищенный продукт непосредственно фильтруют через силикагель, используя смесь EtOAc/гексан (1:2) в качестве элюента. Оранжевое твердое вещество выделяют перекристаллизацией из смеси циклогексан/СН 2 Сl2. Соединение (1 а) (730 мг, 60%) получают в виде бесцветных игл. 1 Н ЯМР (CDCl3)8,83 (т, J= 3,8 Гц, 1 Н). 1-[(5-[(3-Метоксибензоил)амино]метилтиен-2-ил)сульфонил]пиперидин-4-аммонийтрифторацетат (1d) К раствору 5-([1-(3-метоксибензоил]аминометил)тиофен-2-сульфонилхлорида (1 а) (8 г, 23 ммоль) и DIEA (8,7 мл, 50,9 ммоль) в 100 мл CH2Cl2 добавляют раствор 4-Вос-аминопиперидина (5,5 г, 27,7 ммоль) в 50 мл CH2Cl2. Реакционную смесь перемешивают в течение 4 ч. Избыток аминов удаляют экстракцией НСl (IN). Высушенный органический слой упаривают досуха. После перекристаллизации получают 8,3 г (71%) чистого трет-бутил 1-[(5-[(3-метоксибензоил)амино]метилтиен-2-ил)сульфонил]пиперидин-4-илкарбамата, (1 е). Данные 1 Н ЯМР свидетельствует о получении чистого продукта,который подвергают снятию защиты согласно обычной методике, используя TFA. Продукт после удаления защиты осаждают диэтиловым эфиром, получая 8,43 г (82%) соединения (1d): 1 Н ЯМР (ДMCO-d6)9,29 (т, J = 5,8 Гц, 1 Н), 7,88 (м, 3 Н), 7,48-7,36 (м, 4 Н) , 7,17 (д, J = 3,7 Гц, 1 Н), 7,11 (д, J = 6,8 Гц, 1 Н), 4,66(д, J = 5,6 Гц, 2 Н) , 3,79 (с, 3 Н), 3,61 (д, J = 11,7 Гц, 2 Н), 3,09 (м, 1 Н), 2,43 (т, J = 11,1 Гц, 2 Н), 1,96 (д, J = 11,1 Гц, 2 Н), 1,54 (дд, J = 11,9, 3,7 Гц, 2 Н). M/Z APCI: 410,1 (М+1), 408,2 (М-1). 3-Метокси-N-[5-(4-[(4-трифторметилбензил)амино]пиперидин-1-илсульфонил)тиен-2-ил]метилбензамид (1) Соединение (1d) (50 мг, 0,1 ммоль) растворяют в 2 мл ДХМ и нейтрализуют DIEA (18 мкл, 0,1 ммоль) до рН 7. К раствору добавляют 4-трифторметилбензальдегид (18 мг, 0,11 ммоль) и реакционную смесь перемешивают в течение 30 мин, с последующим добавлением уксусной кислоты (6 мкл, 0,1 ммоль) и триацетоксиборгидрида натрия (28 мг, 0,14 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 4 ч, разбавляют этиловым эфиром и гасят NaOH (1N), доводя значение рН до 9. Органический слой промывают насыщенным раствором соли, сушат над MgSO4 и упаривают досуха. Неочищенный продукт очищают флэш-хроматографией, получая 51 мг чистого соединения (1)(91%) в виде бесцветного твердого вещества: т.пл. HCl-соли: 235-236 С, 1H ЯМР (ДМСО-d6)9,29 (т, J = 5,8 Гц, 1 Н), 7,66 (д, J = 8,3 Гц, 2 Н), 7,65-7,40 (м, 6 Н), 7,19 (д, J = 3,8 Гц, 1 Н), 7,15 (дд, J = 7,9, 1,5 Гц, 1 Н),4,70 (д, J = 5,6 Гц, 2 Н) , 3,83 (с, 3 Н), 3,77 (д, шир., 2 Н), 3,41 (д, шир., 2 Н), 2,61-2,40 (м, 3 Н) , 1,93 (м, 2 Н),1,42 (м, 2 Н). M/Z APCI: 568,6 (М+1), 566,6 (М-1). Альтернативно, соединение 1 может быть синтезировано методом параллельного синтеза в растворе: Соединение (1d) (50 мг, 0,1 ммоль) суспендируют в 2 мл DCE, используя устройство для параллельного синтеза Quest210. Суспензию нейтрализуют DIEA (18 мкл, 0,1 ммоль), доводя значение рН до 7, при этом соединение (1 с) растворяется. К раствору добавляют 4-трифторметилбензальдегид в 100 мкл ДМФ (18 мг, 0,11 ммоль) и реакционную смесь перемешивают в течение 30 мин в атмосфере аргона,с последующим добавлением уксусной кислоты (6 мкл, 0,1 ммоль) и триацетоксиборгидрида натрия (28 мг, 0,14 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, разбавляют DCE и гасят насыщенным раствором NаНСО 3, доводя значение рН до 9. Органический слой промывают насыщенным раствором соли, сушат над MgSO4 и фильтруют в сцинтилляционные флаконы. Добавляют 50 мг связанного с полимером бензальдегида и 20 мг аминометилированного полимера Меррифилда и встряхивают в течение ночи. Раствор фильтруют, полимер дважды промывают растворителем- 23005819 и объединенные органические слои упаривают досуха при умеренной температуре в течение 1 ч, используя вакуумную центрифугу Savant Speed Vac Plus. Методика параллельного синтеза позволяет получить чистое соединение (1), в виде бесцветного порошка, который затем обрабатывают НСl в диэтиловом эфире, переводя его в соль НСl. Перечисленные ниже соединения (обозначены как пример ) получают аналогичным образом, в соответствии с приведенной выше методикой и используя соответствующие исходные соединения (условия ВЭЖХ: С 8 симметрия, а - MeCN, 0,09% TFA, от 0 до 100% (10 мин); b - MeCN, 0,09% TFA, от 0 до 100% (8 мин); масс-спектроскопия APCI). Пример 63 (Методика А; см схемы 1, 3 и 7): Получение 4-хлор-N-[(5-[4-(гексиламино)пиперидин-1-ил]сульфонилтиен-2-ил)метил]бензамида 4-Хлор-N-тиофен-2-илметилбензамид (63 а) Раствор 4-хлорбензоилхлорида (0,114 моль) в 50 мл сухого CH2Cl2 добавляют в течение 30 мин к перемешиваемому раствору 2-аминометилтиофена (0,137 моль) и iPr2NEt (0,25 моль) в СН 2 Сl2 (200 мл) при 0 С. Образуется белое твердое вещество, и реакционной смеси дают нагреться до комнатной температуры в течение 1 ч. Смесь разбавляют 200 мл CH2Cl2, промывают дважды водным раствором НСl(0,lN) и сушат над MgSO4. После выпаривания растворителя получают 28 г (98%) указанного в заголовке бензамида в виде белого твердого вещества: т.пл. 153-154 С. 1 Н ЯМР (CDCl3)7,9 (д, J = 8,67 Гц, 2 Н),7,58 (д, J = 8,67 Гц, 2 Н) , 7,44 (дд, J = 3,77, 1,13 Гц, 1 Н), 7,22 (д, J = 5,27 Гц, 1 Н), 7,16 (дд, J = 3,39, 5,27 Гц,1 Н), 6,62 (шир.д, 1 Н), 4,98 (д, J = 5,65 Гц, 2 Н). 5-([1-(4-Хлорфенил)метаноил]аминометил)тиофен-2-сульфонилхлорид (63b) Хлорсульфоновую кислоту (20,1 мл, 198 ммоль) в СН 2 С 12 (80 мл) добавляют по каплям к раствору соединения (63 а) (10 г, 40 ммоль) в СН 2 Сl2 (500 мл) при -80 С. Смеси дают нагреться до комнатной тем- 27005819 пературы в течение 5 ч. Реакционную смесь выливают на лед и быстро экстрагируют CH2Cl2. Органический слой сушат над MgSO4 и растворитель выпаривают досуха, получая 8,8 г (63%) необходимого сульфонилхлорида (63b); т.пл. 133-135 С. 1 Н ЯМР (ДМСО-d6)9,21 (т, J = 6,4 Гц, 1 Н), 7,87 (д, J = 8,67 Гц, 2 Н), 7,53 (д, J = 8,67 Гц, 2 Н), 6,91 (д, J = 3,39 Гц, 1 Н) , 6,77 (д, J = 3,39 Гц, 1 Н), 4,53 (д, J =3,77 Гц, 2 Н). 4-Хлор-N-(5-[(4-оксопиперидин-1-ил) сульфонил] тиен-2-илметил)бензамид (63 с) Раствор 5-([1-(4-хлорфенил)метаноил]аминометил)тиофен-2-сульфонилхлорида (1b) (5,0 г, 14 ммоль) в 100 мл хлороформа и раствор моногидрата гидрохлорида 4-пиперидинона (4,3 г, 28 ммоль) в 21 мл NaOH (2N) энергично перемешивают в течение 15 ч. Реакцию гасят НСl (2N) и органический слой дважды экстрагируют НСl (2N) и дважды насыщенным раствором соли. После высушивания и выпаривания хлороформа из органической фазы получают 5,8 г (99,5%) соединения (63 с) в виде бесцветного твердого вещества. 1 Н ЯМР (CDCl3)7,67 (д, J = 8,7 Гц, 2 Н) , 7,42-7,38 (м, ЗН), 6,99 (д, J = 3,8 Гц, 1 Н) ,6,53 (т, J = 5,3 Гц, 1 Н), 4,74 (д, J = 6,0 Гц, 2 Н), 3,37 (д, J = 6,2 Гц, 4 Н) , 2,50 (д, J = 6,2 Гц, 4 Н). 4-Хлор-N-[(5-[4-(гексиламино)пиперидин-1-ил]сульфонилтиен-2-ил)метил]бензамид (63) Смесь N-сульфонилпиперидона (63 с) (3,01 г, 7,28 ммоль), н-гексиламина (1,06 мл, 8,01 ммоль), свежеизмельченного NаВН(ОАс)3 (3,1 г, 14,6 ммоль), безводного 1,2-дихлорэтана (150 мл) и ТГФ (100 мл) перемешивают в течение 80 мин при 23 С. Смесь концентрируют на роторном испарителе (Тбани=57 С), растворяют в EtOAc(500 мл), промывают (смесь насыщенный раствор соли:насыщенный раствор K2 СО 3, 4:1; 250 мл) и упаривают,получая 4,1 г неочищенного вещества. Остаток растворяют в 50 мл горячего ацетона, очищают на силикагеле,упаривают, загружают на колонку для хроматографии (силикагель, диаметр = 5,5 см) и элюируют (МеОН:СН 2 Сl2, 7:150). Хроматографическую очистку повторяют, получая 2,95 г (81%) указанного в заголовке вторичного амина в виде белого твердого вещества. 1 Н ЯМР (ДМСО-d6)9,37 (т, J = 5,8 Гц, 1 Н), 7,90 (дт, J = 8,7, 2,2 Гц, 2 Н), 7,51 (дт, J = 8,5, 2,2 Гц, 2 Н), 7,16 (д, J = 3,8 Гц, 1 Н), 4,65 (д, J = 5,8 Гц, 2 Н), 3,39 (дм, J = 11,9 Гц,2 Н), 3,60-3,00 (шир.с, 1 Н), 2,49 (ддд, J = 11,5, 9,8, 1,7 Гц, 2 Н), 2,43 (т, J = 6,9 Гц, 2 Н), 2,44-2,38 (утопленный м, 1 Н), 1,82 (дм, J = 10,0 Гц, 2 Н) , 1,38-1,14 (м, 10 Н), 0,83 (т, J = 6,7 Гц), 13 С ЯМР (ДМСО-d6) 165,33(хлорбензамид, С 4), 129,22 (хлорбензамид, С 2 и С 6), 128,52 (хлорбензамид, С 3 и С 5), 126,27 (тиофен,С 4), 52,53 (пиперидин, С 4), 46,07 (гексил), 44,41 (пиперидин, С 2 и С 6), 38,09 (тиенил-СН 2) , 31,21 (пиперидин, С 3 и С 5), 30,66 (гексил), 29,49 (гексил), 26,48 (гексил), 22,06 (гексил), 13,91 (гексил). M/Z APCI: 498 (М+1), 496 (М-1). Анализ методом ВЭЖХ: время удерживания R.t = 5,00 мин (градиент а). Вычислено для C23H32ClN3O3S2: С: 55,46%. Н: 6,48%. N: 8,44%. Найдено: С: 54,19%, Н: 6,52%, N: 8,22%. Альтернативно, соединение (63) может быть синтезировано методом параллельного синтеза в растворе: соединение (63 с) (20 мг, 0,05 ммоль) растворяют в 2 мл ТГФ, используя устройство для параллельного синтеза Quest210. К раствору добавляют N-гексиламин в DCE (5,6 мг, 0,06 ммоль) и реакционную смесь перемешивают в течение 30 мин в атмосфере аргона, с последующим добавлением уксусной кислоты (6 мкл, 0,1 ммоль) и триацетоксиборгидрида натрия (28 мг, 0,14 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 4 ч, разбавляют DCE и гасят насыщенным раствором NаНСО 3, доводя рН до 8,5. Органический слой промывают насыщенным раствором соли, сушат над MgSO4 и фильтруют в сцинтилляционные флаконы. В каждый флакон добавляют MP-TsOH (3 экв.) и встряхивают в течение ночи. Раствор фильтруют и полимер основательно промывают DCE. К полученному полимеру затем добавляют 3 раза по 1 мл NH3 в EtOH и каждый раз встряхивают в течение 10 мин. Полимер промывают и объединенный этанольный раствор упаривают досуха при умеренной температуре в течение 1 ч, используя вакуумную центрифугу Savant Speed Vac Plus. Данная методика позволяет при использовании параллельного синтеза получить чистое соединение (63) в виде белого бесцветного порошка, который затем обрабатывают НСl в диэтиловом эфире и переводят соединение в форму его HCl-соли. Ниже перечислены соединения (обозначены как пример ), полученные аналогичным образом в соответствии с приведенной выше методикой и с использованием соответствующих исходных соединений:
МПК / Метки
МПК: A61P 25/00, C07D 409/12, A61K 31/4535
Метки: содержащие, jun-протеинкиназ, производные, ингибиторов, активные, ионизируемые, фармацевтически, сульфонамида, качестве, липофильные, фрагменты
Код ссылки
<a href="https://eas.patents.su/30-5819-farmacevticheski-aktivnye-proizvodnye-sulfonamida-soderzhashhie-kak-lipofilnye-tak-i-ioniziruemye-fragmenty-v-kachestve-ingibitorov-jun-proteinkinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтически активные производные сульфонамида, содержащие как липофильные, так и ионизируемые фрагменты, в качестве ингибиторов jun-протеинкиназ</a>
Предыдущий патент: Сложные эфиры фениламинобензгидроксамовых кислот
Следующий патент: Агонисты и антагонисты рецепторов 5-ht2c
Случайный патент: Индикаторная пломба