Производные сульфонамида, способ их получения и их использование в качестве лекарственных средств.
Номер патента: 2351
Опубликовано: 25.04.2002
Авторы: Ваймэн Пол Эдриан, Кинг Фрэнсис Дэвид, Бромидж Стивен Марк
Формула / Реферат
1. Соединение формулы (I) или его соль
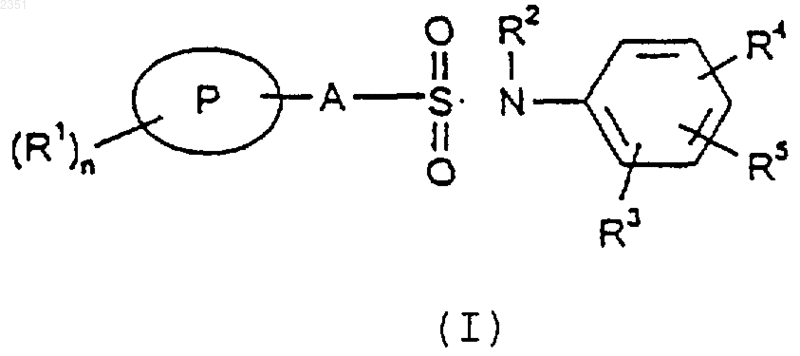
где Р означает фенил, нафтил, тиофенил, бензотиазолил, бензотиадиазолил, бензотиофенил, хинолинил, изоксазолил, бензофуранил или индолил;
А является простой связью, C1-6 алкиленом или C1-6 алкениленом;
R1 означает галоген, C1-6 алкил, необязательно замещенный одним или более атомами галогена, С3-6 циклоалкил, COC1-6 алкил, C1-6 алкокси, ОСF3, гидрокси, гидрокси C1-6 алкил, гидрокси C1-6 алкокси, C1-6 алкокси C1-6 алкокси, нитро, амино, алкиламино или диалкиламино, циано или R1 представляет фенил, нафтил или пиридил;
n равно 0, 1, 2, 3, 4, 5 или 6,
R2 означает водород, C1-6 алкил или apил-C1-6 алкил;
R3 представляет группу R5 или вместе с R5 образует группу (СН2)2О или (СН2)3О или R3 связан с R2 с образованием группы (СН2)2 или (СН2)3;
R4 представляет N-пиперазиновое кольцо, необязательно замещенное C1-6 алкилом,
R5 означает водород, галоген, C1-6 алкил, С3-6 циклоалкил, COC1-6 алкил, C1-6 алкокси, гидрокси, гидрокси C1-6 алкил, гидрокси C1-6 алкокси, C1-6 алкокси C1-6 алкокси, нитро, трифторметил, циано или арил.
2. Соединение по п.1, где Р является фенилом, тиофеном, бензотиофеном или нафтилом.
3. Соединение по п.1 или 2, где R1 является галогеном или C1-6 алкилом, необязательно замещенным одним или более атомами галогена.
4. Соединение по любому из пп.1-3, где R2 является водородом.
5. Соединение по любому из пп.1-4, где R4 является незамещенным пиперазиновым кольцом.
6. Соединение по любому из пп.1-5, где R5 является C1-6 алкокси.
7. Соединение по любому из пп.1-6, где R5 находится в пара-положении относительно сульфонамидной связи.
8. Соединение по любому из пп.1-7, где Р-А является 5-хлор-3-метилбензо[b]тиофен-2-илом.
9. Соединение по п.1, представляющее собой
4-бром-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,
N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-2-тиофенсульфонамид,
N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-5-(пиридин-2-ил)-2-тиофенсульфонамид,
2,5-дихлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-3-тиофенсульфонамид,
4-бром-5-хлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-2-тиофенсульфонамид,
N-[4-метокси-3-(4-метилпиперазин-1-ил) фенил]бензолсульфонамид,
3-бром-5-хлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-2-тиофенсульфонамид,
N-[4-метокси-3-(4-метилпиперазин-1-ил) фенил]бензилсульфонамид,
2-бром-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,
3-бром-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,
3-хлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-4-метилбензолсульфонамид,
N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]транс-стиролсульфонамид,
3,4-дихлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,
3,5-дихлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,
N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил[2,1,3]бензотиадиазол-4-сульфонамид,
5-хлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-3-метил-2-бензотиофенсульфонамид,
N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-2-метил-5-нитробензолсульфонамид,
N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-2-трифторметилбензолсульфонамид,
N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-3-трифторметилбензолсульфонамид,
2,3-дихлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,
5-йод-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-2-метилбензолсульфонамид,
3-йод-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,
3-йод-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-4-метилбензолсульфонамид,
[4-метокси-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлорнафталин-2-сульфокислоты,
[4-метокси-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлорнафталин-1-сульфокислоты,
[4-метокси-3-(4-метилпиперазин-1-ил)фенил]амид 4-хлорнафталин-1-сульфокислоты,
[4-метокси-3-(4-метилпиперазин-1-ил)фенил]амид 7-хлорнафталин-1-сульфокислоты,
[4-метокси-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-2-метилбензо[b]тиофен-3-сульфокислоты,
[4-метокси-3-(4-метилпиперазин-1-ил)фенил]амид бензофуран-2-сульфокислоты,
[4-метокси-3-(4-метилпиперазин-1-ил)фенил]амид 1-метил-1Н-индол-2-сульфокислоты,
(4-метокси-3-пиперазин-1-илфенил)амид 5-пиридин-2-илтиофен-2-сульфокислоты,
N-(4-метокси-3-пиперазин-1-илфенил)-3-трифторметилбензолсульфонамид,
3-йод-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид,
(4-метокси-3-пиперазин-1-илфенил)амид 3,5-диметилизоксозол-4-сульфокислоты,
3,5-дихлор-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид,
2,5-дибром-3,6-дифтор-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид,
(4-метокси-3-пиперазин-1-илфенил)амид нафталин-1-сульфокислоты,
(4-метокси-3-пиперазин-1-илфенил)амид 2-бром-5-хлортиофен-2-сульфокислоты,
2-хлор-4-фтор-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид,
3-бром-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид,
3-хлор-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид,
(4-метокси-3-пиперазин-1-илфенил)амид 5-хлорнафталин-2-сульфокислоты,
(4-метокси-3-пиперазин-1-илфенил)амид 4-бром-5-хлортиофен-2-сульфокислоты,
(4-метокси-3-пиперазин-1-илфенил)амид 2,5-дихлортиофен-3-сульфокислоты,
4-бpoм-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид,
(4-метокси-3-пиперазин-1-илфенил)амид 5-хлор-3-метил-бензо[b]тиофен-2-сульфокислоты,
(4-метокси-3-пиперазин-1-илфенил)амид 5-хлор-2-метил-бензо[b]тиофен-3-сульфокислоты,
(4-метокси-3-пиперазин-1-илфенил)амид 1-метил-1H-индол-2-сульфокислоты,
(4-метокси-3-пиперазин-1-илфенил)амид бензофуран-2-сульфокислоты,
(4-метокси-3-пиперазин-1-илфенил)амид нафталин-2-сульфокислоты,
(4-метокси-3-пиперазин-1-илфенил)амид 5-хлорнафталин-1-сульфокислоты,
4-хлор-2,5-диметил-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид,
3,4-дихлор-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид,
3-хлор-N-(4-метокси-3-пиперазин-1-илфенил)-4-метилбензолсульфонамид,
2-трифторметил-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид,
4-йод-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид,
4-трет-бутил-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид,
[7-(4-метилпиперазин-1-ил)-2,3-дигидробензофуран-5-ил]амид нафталин-1-сульфокислоты,
[7-(4-метилпиперазин-1-ил)-2,3-дигидробензофуран-5-ил]амид тиофен-2-сульфокислоты,
[7-(4-метилпиперазин-1-ил)-2,3-дигидробензофуран-5-ил]амид 5-хлортиофен-2-сульфокислоты,
[7-(4-метилпиперазин-1-ил)-2,3-дигидробензофуран-5-ил]амид 5-пиридин-2-илтиофен-2-сульфокислоты,
[7-(4-метилпиперазин-1-ил)-2,3-дигидробензофуран-5-ил]амид 2,5-дихлортиофен-3-сульфокислоты,
[7-(4-метилпиперазин-1-ил)-2,3-дигидробензофуран-5-ил]амид 4-бром-5-хлортиофен-2-сульфокислоты,
[7-(4-метилпиперазин-1-ил)-2,3-дигидробензофуран-5-ил]амид 3-бром-5-хлортиофен-2-сульфокислоты,
4-хлор-2,5-диметил-N-[7-(4-метилпиперазин-1-ил)-2,3-дигидробензофуран-5-ил]бензолсульфонамид,
[7-(4-метилпиперазин-1-ил)-2,3-дигидробензофуран-5-ил]амид 5-хлор-3-метилбензо[b] тиофен-2-сульфокислоты,
[7-(4-метилпиперазин-1-ил)-2,3-дигидробензофуран-5-ил]амид нафталин-2-сульфокислоты,
3-бром-N-[7-(4-метилпиперазин-1-ил)-2,3-дигидробензофуран-5-ил]бензолсульфонамид,
3,5-дихлор-N-[7-(4-метилпиперазин-1-ил)-2,3-дигидробензофуран-5-ил]бензолсульфонамид,
4-трет-бутил-N-[7-(4-метилпиперазин-1-ил)-2,3-дигидробензофуран-5-ил]бензолсульфонамид,
2,5-дибром-3,6-дифтор-N-[7-(4-метилпиперазин-1-ил)-2,3-дигидробензофуран-5-ил]бензолсульфонамид,
2,5-дибром-3,6-дифтор-N-(7-пиперазин-1-ил-2,3-дигидробензофуран-5-ил)бензолсульфонамид,
4-хлор-2,3-диметил-N-(7-пиперазин-1-ил-2,3-дигидробензофуран-5-ил)бензолсульфонамид,
[3-(4-циклопропилметилпиперазин-1-ил)-4-метоксифенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты,
[3-(4-бензилпиперазин-1-ил)-4-метоксифенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты,
[4-гидрокси-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты,
[4-бензилокси-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты,
[4-этокси-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты,
[4-изопропокси-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты,
[2-бром-5-(4-метилпиперазин-1-ил)фенил]амид нафталин-2-сульфокислоты,
[4-хлор-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты,
[4-бром-3-(4-метилпиперазин-1-ил)фенил]амид нафталин-2-сульфокислоты,
1-(5-хлор-3-метилбензо[b]тиофен-2-сульфонил)-6-(4-метилпиперазин-1-ил)-2,3-дигидро-1H-индол,
1-(5-хлор-3-метилбензо[b]тиофен-2-сульфонил)-5-метокси-6-(4-метилпиперазин-1-ил)-2,3-дигидро-1Н-индол,
[4-метокси-2-метил-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты,
[2-(2-гидроксиэтил)-4-метокси-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты,
1-(5-хлор-3-метилбензо[b]тиофен-2-сульфонил)-5-метокси-4-(4-метилпиперазин-1-ил)-2,3-дигидро-1Н-индол гидрохлорид,
[3-метокси-4-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты,
[4-метокси-3-(1-метилпиперидин-4-ил)фенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты,
[3-(4-метилпиперазин-1-ил)фенил]амид нафталин-2-сульфокислоты
2,3,4-трихлор-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид,
2,3-дихлор-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид,
3-хлор-2-метил-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид,
4-хлор-N-(4-метокси-3-пиперазин-1-ил-фенил)бензолсульфонамид,
(4-метокси-3-пиперазин-1-илфенил)амид 5-бромтиофен-2-сульфокислоты,
2,3-дихлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,
1-(5-хлор-3-метилбензо[b]тиофен-2-сульфонил)-5-фенил-6-пиперазин-1-ил-2,3-дигидро-1Н-индол,
5-хлор-1-(5-хлор-3-метилбензо[b]тиофен-2-сульфонил)-6-пиперазин-1-ил-2,3-дигидро-1H-индол,
1-(5-хлор-3-метилбензо[b]тиофен-2-сульфонил)-7-пиперазин-1-ил-1,2,3,4-тетрагидрохинолин,
[4-метил-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты,
и их фармацевтически приемлемые соли.
10. Соединение по любому из пп. 1-8, представляющее собой гидрохлорид (4-метокси-3-пиперазин-1-илфенил)амида 5-хлор-3-метил-
бензо[b]тиофен-2-сульфокислоты.
11. Применение соединения по любому из пп.1-10 в терапевтических целях в качестве антагониста в отношении 5-HT6 рецепторов.
12. Применение соединения по любому из пп.1-10 при лечении шизофрении, болезни Альцгеймера и/или депрессии.
13. Фармацевтическая композиция, содержащая соединение по любому из пп.1-10 и фармацевтически приемлемый носитель или наполнитель.
14. Способ получения соединения формулы (I) или его соли
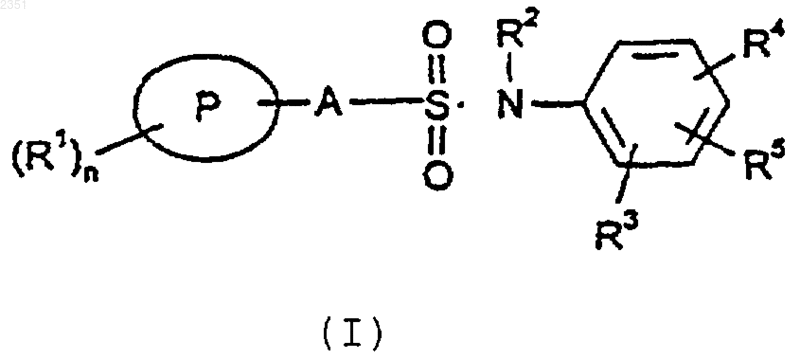
где
Р означает фенил, нафтил, тиофенил, бензотиазолил, бензотиадиазолил, бензотиофенил, хинолинил, изоксазолил, бензофуранил или индолил;
А является простой связью, C1-6 алкиленом или С1-6 алкениленом;
R1 означает галоген, C1-6 алкил, необязательно замещенный одним или более атомами галогена, С3-6 циклоалкил, COC1-6 алкил, C1-6 алкокси, ОСF3, гидрокси, гидрокси C1-6 алкил, гидрокси C1-6 алкокси, C1-6 алкокси C1-6 алкокси, нитро, амино, алкиламино или диалкиламино, циано или R1 представляет фенил, нафтил или пиридил;
n равно 0, 1, 2, 3, 4, 5 или 6,
R2 означает водород, C1-6 алкил или арил-С1-6 алкил;
R3 представляет группу R5 или вместе с R5 образует группу (СН2)2O или (СН2)3О или R3 связан с R2 с образованием группы (СН2)2 или (CH2)3;
R4 представляет группу N-пиперазиновое кольцо, необязательно замещенное C1-6 алкилом; и
R5 означает водород, галоген, C1-6 алкил, С3-6 циклоалкил, COC1-6 алкил, C1-6 алкокси, гидрокси, гидрокси C1-6 алкил, гидрокси C1-6 алкокси, C1-6 алкокси C1-6 алкокси, нитро, трифторметил, циано или арил;
где указанный способ включает взаимодействие соединения формулы (II)
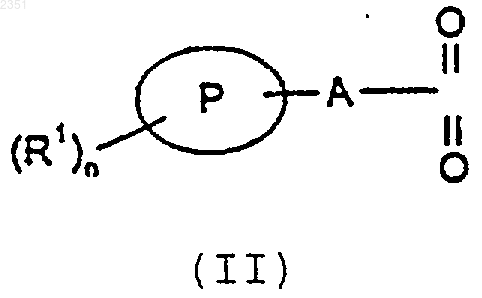
в которой R1, n, Р и А такие, как определено для формулы (I), и L является удаляемой группой, или его защищенных производных с соединением формулы (III)
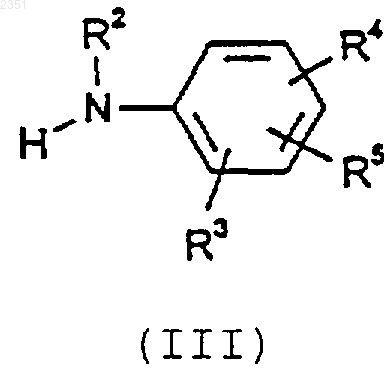
в которой R2, R3, R4 и R5 такие, как определено для формулы (I), или его защищенными производными,
и в случае необходимости далее
- удаление любых защитных групп,
- образование фармацевтически приемлемой соли.
Текст
1 Данное изобретение относится к соединениям, имеющим фармакологическую активность, способам их получения, композициям,содержащим их, и их использованию при лечении расстройств ЦНС (центральной нервной системы). В ЕРА 0 021 580 и ЕРА 0 076 072 описаны производные сульфонамида, которые представлены, как имеющие антиаритмическое действие. В настоящее время открыт структурно определенный класс соединений, который, как было обнаружено, имеет антагонистическое действие в отношении 5HT6 рецептора. Полагают, что антагонисты 5HT6 рецептора могут быть полезны при лечении определенных расстройств ЦНС, таких как тревога, депрессия, эпилепсия,навязчивые компульсивные расстройства, мигрень, приобретенное усиление когнитивной(подсознательной) памяти, например, для лечения болезни Альцгеймера, нарушений сна, расстройств питания, таких как анорексия и булимия, приступов паники, синдрома отмены при злоупотреблении наркотиков, таких как кокаин,этанол, никотин и бензодиазепины, для лечения шизофрении, а также расстройств, связанных с травмами позвоночника и/или повреждениями головы, таких как гидроцефалия. Соединения данного изобретения также предположительно могут быть использованы при лечении определенных ЖК (желудочно-кишечных) расстройств, таких как синдром раздраженной толстой кишки (IBS). Данное изобретение, в первом аспекте,представляет соединение формулы (I) или его соль: где Р означает фенил, нафтил, бициклическое гетероциклическое кольцо или является 5-7 членным гетероциклическим кольцом, содержащим от 1 до 4 гетероатомов, выбранных из кислорода, азота или серы; А является простой связью, C1-6 алкиленом или C1-6 алкениленом;R1 означает галоген, С 1-6 алкил, необязательно замещенный одним или более атомами галогена, С 3-6 циклоалкил, COC1-6 алкил, C1-6 алкокси, ОСF3, гидрокси, гидрокси C1-6 алкил,гидрокси C1-6 алкокси, C1-6 алкокси C1-6 алкокси,C1-6 алканоил, нитро, амино, C1-6 алкиламино или ди-С 1-6 алкиламино, циано, илиR1 означает фенил, нафтил, бициклическое гетероциклическое кольцо или является 5-7 членным гетероциклическим кольцом, содержащим от 1 до 4 гетероатомов, выбранных из кислорода, азота или серы;R4 представляет группу -X(CH2)p-R6, где Х простая связь, СН 2, О, NH или N-C1-6 алкил, и р принимает значение от 0 до 6, и R6 является необязательно замещенным 5-7 членным гетероциклическим кольцом, содержащим от 1 до 3 гетероатомов, выбранных из азота, серы или кислорода, или R6 представляет NR7R8, где R7 иR8 независимо водород, C1-6 алкил или арил C1-6 алкил; иC1-6 алкил, самостоятельно или как часть другой группы, может быть прямой или разветвленной цепью. Предпочтительными алкильными группами обычно являются метил и этил. В данном случае термин арил включает необязательно замещенный фенил и нафтил. Если Р является бициклическим гетероциклическим кольцом, то примером его могут быть бензотиофен, хинолин или изохинолин. Если Р является 5-7 членным гетероциклическим кольцом, то примером его могут быть тиенил, фурил, пирролил, триазолил, диазолил,имидазолил, оксозолил, тиазолил, оксадиазолил,изотиазолил, изоксозолил, тиадиазолил, пиридил, пиримидил, пирролидинил и пиразинил. Гетероциклические кольца могут быть присоединены к остатку молекулы через любой подходящий атом углерода или, если присутствует,атом азота. Подходящие заместители для этих колец включают R5 группы, такие как определено выше. Предпочтительно, Р является фенилом,тиофеном, бензотиофеном или нафтилом. Предпочтительно А простая связь, этиленовая группа или группа -СН=СН-. Наиболее предпочтительно А простая связь. Если R1 является гетероциклической группой, то примером его являются перечисленные выше. Предпочтительно R1 представляет галоген или C1-6 алкил, необязательно замещенный одним или более атомами галогена, например,метил или трифторметил. Предпочтительно n равно 0, 1, 2 или 3,особенно 1 или 2. Преимущественно R2 является водородом или C1-6 алкилом. Предпочтительно R2 является водородом. Должно быть понятно, что если R3/R5 группы связаны вместе, две группы должны быть присоединены к соседним атомам углерода фенильного кольца.R , в частности, водород. Предпочтительно R4 находится в метаположении по отношению к сульфонамидной группе. Предпочтительно Х представляет связь,р равно 0 и R6 необязательно замещенное 5-7 членное гетероциклическое кольцо. Гетероциклические кольца могут быть присоединены к остатку молекулы через атом углерода или, если присутствует, атом азота. Необязательные заместители для этих колец, которые могут быть у атома углерода и/или азота, включают C1-6 алкил, в частности, метил. Более предпочтительно,R4 является N-пиперазином, необязательно замещенным C1-6 алкилом, особенно незамещенным пиперазином. Предпочтительно R5 является C1-6 алкокси,наиболее предпочтительно метокси. Предпочтительно R5 находится в пара-положении по отношению к сульфонамидной группе. Предпочтительным значением для Р-А является бензо[b]тиофен-2-ил или бензо[b]тиофен 3-ил, необязательно замещенный одной или двумя R1 группами, особенно 5-хлор-3 метилбензо[b]тиофен-2-ил. Определенные соединения данного изобретения включают 4-бpoм-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,N-[4-метокси-3-(4-метилпиперазин-1 ил)фенил]-2-тиофенсульфонамид,N-[4-метокси-3-(4-метилпиперазин-1 ил)фенил]-5-(пиридин-2-ил)-2-тиофенсульфонамид,2,5-дихлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-3-тиофенсульфонамид,4-бром-5-хлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-2-тиофенсульфонамид,N-[4-метокси-3-(4-метилпиперазин-1-ил) фенил]бензолсульфонамид,3-бром-5-хлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-2-тиофенсульфонамид,N-[4-метокси-3-(4-метилпиперазин-1 ил)фенил]бензилсульфонамид,2-бром-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,3-бром-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,3-хлор-N-[4-метокси-3-(4-метилпиперазин 1-ил)фенил]-4-метилбензолсульфонамид,N-[4-метокси-3-(4-метилпиперазин-1 ил)фенил]транс-стиролсульфонамид,3,4-дихлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,3,5-дихлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,N-[4-метокси-3-(4-метилпиперазин-1 ил)фенил]-[2,1,3]бензотиадиазол-4-сульфонамид,5-хлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-3-метил-2-бензотиофенсульфонамид,5[b]тиофен-2-сульфокислоты,[4-метокси-3-(1-метилпиперидин-4-ил) фенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты,[3-(4-метилпиперазин-1-ил)фенил]амид нафталин-2-сульфокислоты и их фармацевтически приемлемые соли. Соединения формулы (I) могут образовывать кислотно-аддитивные соли с кислотами,такими как обычные фармацевтически приемлемые кислоты, например, малеиновая, соляная,бромисто-водородная, фосфорная, уксусная,фумаровая, салициловая, лимонная, молочная,миндальная, винная и метансульфокислота. Соединения формулы (I) могут также образовывать сольваты, такие как гидраты, и данное изобретение, кроме того, распространяется и на такие формы. В данном случае понятно,что выражение соединение формулы (I) также включает его сольваты и гидраты. Определенные соединения формулы (I) способны существовать в стереоизомерных формах, включая диастереомеры и энантиомеры, причем данное изобретение распространяется на каждую из этих форм и их смеси, включая рацематы. Различные стереоизомерные формы могут быть отделены одна от другой по обычным методикам, или любой данный изомер может быть получен стереоспецифическим или асимметрическим синтезом. Изобретение также распространяется на любые таутомерные формы и их смеси. Данное изобретение также представляет способ получения соединения формулы (I) или его фармацевтически приемлемой соли, кото 9 рый включает взаимодействие соединения формулы (II) в которой R1, n, P и А такие, как определено для формулы (I), и L является удаляемой группой,или его защищенных производных с соединением формулы (III) в которой R2, R3, R4 и R5 такие, как определено для формулы (I), или его защищенными производными, и с последующим необязательным удалением любых защитных групп; образованием фармацевтически приемлемой соли. Подходящие удаляемые группы включают галоген, в частности хлор. Взаимодействие соединений формул (II) и (III) осуществляют путем смешивания двух реагентов вместе, необязательно в инертном растворителе, таком как ацетон. Такая реакция может быть проведена в присутствии основания. Специалисту в данной области будет понятно, что может быть необходима защита определенных групп. Подходящие защитные группы и методики их присоединения и удаления являются обычными в области органической химии, такими как описаны в Green T.W.Protective groups in organic synthesis. New York,Wiley (1981). Например, подходящие защитные группы для группы пиперазина включают ВОС,СОССl3, СОСF3 и метил, последняя из которых может быть удалена обработкой 1 хлорэтилхлорформиатом по стандартной методике.N-замещенные пиперазины могут быть получены ацилированием или алкилированием соответствующего соединения NH-пиперазина по стандартной методике. Соединения формул (II) и (III) являются коммерчески доступными или могут быть получены в соответствии с известными методиками или аналогично известным методикам. Фармацевтически приемлемые соли могут быть получены общепринятым взаимодействием с соответствующей кислотой или ее производным. Соединения формулы (I) и их фармацевтически приемлемые соли обладают антагонистическим действием по отношению к 5HT6 рецептору и предположительно используются при лечении определенных расстройств ЦНС, таких как тревога, депрессия, эпилепсия, навязчивые компульсивные расстройства, мигрень, болезнь Альцгеймера (приобретенное усиление когнитивной памяти), нарушения сна (включая нарушение циркадного ритма), расстройств питания, 002351 10 таких как анорексия и булимия, приступов паники, синдрома отмены при злоупотреблении наркотиков, таких как кокаин, этанол, никотин и бензолдиазепины, шизофрении, а также расстройств, связанных с травмами позвоночника и/или повреждениями головы, таких как гидроцефалия. Соединения данного изобретения также предположительно могут быть использованы при лечении определенных ЖК расстройств,таких как (IBS) синдром раздраженной кишки. Таким образом, данное изобретение также представляет соединение формулы (I) или его фармацевтически приемлемую соль для использования в качестве терапевтического средства, в частности для лечения или профилактики перечисленных выше расстройств. Данное изобретение далее представляет способ лечения или профилактики перечисленных выше расстройств у млекопитающих,включая человека, который предусматривает введение пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Согласно другому аспекту, данное изобретение представляет использование соединений формулы (I) или их фармацевтически приемлемых солей для производства лекарственных средств для лечения или профилактики перечисленных выше расстройств. Данное изобретение также представляет фармацевтическую композицию, которая включает соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Фармацевтическая композиция данного изобретения, которая может быть приготовлена смешиванием, преимущественно при температуре окружающей среды и атмосферном давлении, обычно адаптирована для перорального,парентерального или ректального введения и,как таковая, может быть в виде таблеток, капсул, жидких препаративных форм для перорального введения, порошков, гранул, лепешек,восстанавливаемых порошков, растворов для инъекций, или вливаний, или суспензий, или суппозиториев. Обычно предпочтительны композиции для перорального введения. Таблетки и капсулы для перорального введения могут быть в единичной дозированной форме и могут содержать обычные наполнители, такие как связывающие агенты, наполнители, смазывающие агенты для таблеток, дезинтеграторы и приемлемые увлажняющие агенты. Таблетки могут быть покрыты оболочкой по методикам, хорошо известным в обычной фармацевтической практике. Жидкие препаративные формы для перорального введения могут быть в виде, например,водных или масляных суспензий, растворов,эмульсий, сиропов или эликсиров, или могут быть в виде сухого продукта, который воссоздается водой или другими подходящими связую 11 щими агентами перед использованием. Такие жидкие препаративные формы могут содержать обычные добавки, такие как суспендирующие агенты, эмульгаторы, не водные связующие агенты (которые могут включать пищевые масла), консерванты и, при желании, обычные вкусовые агенты или красители. Для парентерального введения жидкие единичные дозированные формы получают,используя соединение данного изобретения или его фармацевтически приемлемую соль и стерильный носитель. Соединение в зависимости от используемого носителя и концентрации, может быть либо суспендировано, либо растворено в носителе. При приготовлении растворов соединение может быть растворено для инъекций, стерильно отфильтровано перед вливанием в подходящие флаконы или ампулы и запаено. Предпочтительно, в носителе растворяют адъюванты, такие как местные анестетики, консерванты и буферные агенты. Для повышения стабильности,композицию можно заморозить после вливания во флакон, а воду удалить в вакууме. Парентеральные суспензии получают практически тем же способом, за исключением того, что композицию суспендируют в носителе вместо растворения, и стерилизация не обязательно сопровождается фильтрацией. Соединение может быть стерилизовано под действием этиленоксида до суспендирования в стерильном носителе. Преимущественно в композицию включают поверхностно-активное вещество или увлажняющий агент, способствующий равномерному распределению соединения. Композиция может содержать от 0,1 до 99 мас.%, предпочтительно от 10 до 60 мас.% активного ингредиента в зависимости от способа введения. Доза соединения, применяемая для лечения перечисленных выше расстройств, изменяется обычно в зависимости от серьезности расстройства, веса пациента и других подобных факторов. Однако в общем случае, подходящая единичная доза может составлять от 0,05 до 1000 мг, более подходяще от 0,05 до 20,0 мг,например, от 0,2 до 5 мг; и такая единичная дозированная форма может быть введена более чем один раз в день, например, два или три раза в день, таким образом, чтобы общая дневная доза составляла от 0,5 до 100 мг; и такое лечение может длиться в течение нескольких недель или месяцев. При введении согласно методике данного изобретения, никаких неприемлемых токсикологических эффектов от применения соединения данного изобретения не ожидается. Представленные ниже описания и примеры иллюстрируют получение соединений данного изобретения. Описание 1. 1-(2-Метокси-5-нитрофенил) пиперазин (D1). 12 Раствор 5 М серной кислоты (114 мл) добавляют в течение более 0,3 ч к 1-(2-метоксифенил)пиперазину (110 г) при температуре 0 С при перемешивании. К охлажденной на ледяной бане перемешиваемой суспензии затем добавляют в течение более 1,75 ч концентрированную серную кислоту (560 мл), и температуру поддерживают в течение еще 1,5 ч. Затем порциями добавляют нитрат калия (71,5 г) в течение свыше 1,5 ч к перемешиваемой холодной вязкой смеси, которую затем выстаивают в течение 18 ч. Раствор вливают в лед (2 кг) и полученную охлажденную смесь доводят до рН 12 добавлением 40% раствора гидроксида натрия. Маслянистую смесь экстрагируют этилацетатом (2 х 2 л) и объединенные органические экстракты промывают водой (3 л), сушат (Nа 2SO4), концентрируют до остатка, который затем перемешивают с диэтиловым эфиром (700 мл) с получением соединения (D1) в виде желтого твердого вещества, т. пл. 84-87 С (95 г, 70%). MH+ 238. Описание 2. 4-трет-Бутоксикарбонил-1-(2 метокси-5-нитрофенил)пиперазин (D2). К перемешиваемому гетерогенному раствору 1-(2-метокси-5-нитрофенил)пиперазина(1,1 л) добавляют раствор ди-трет-бутилдикарбоната (91,3 г) в тетрагидрофуране (300 мл) в течение более 0,5 ч. Затем порциями добавляют карбонат калия (60,7 г) в течение более 0,5 ч и смесь перемешивают при температуре окружающей среды в течение 18 ч. Смесь концентрируют для удаления органического растворителя и полученную смесь экстрагируют дихлорметаном (2 х 1 л). Объединенные органические фазы промывают водой (1 л), сушат (Na2SO4) и концентрируют до остатка, который перемешивают с диэтиловым эфиром (500 мл) и гексаном(D2) в виде желтого твердого вещества, т. пл. 136-7 С (125 г, 89%). МН+ 338. Описание 3. 4-трет-Бутоксикарбонил-1-(5 амино-2-метоксифенил)пиперазин (D3). Суспензию 10% палладий на угле (10 г) в растворе 4-трет-бутоксикарбонил-1-(2-метокси 5-нитрофенил)пиперазина (D2) (124,5 г) в этаноле (3,5 л) и воде (50 мл) перемешивают с водородом при температуре окружающей среды и атмосферном давлении в течение 18 ч. Реакционную смесь фильтруют и фильтрат концентрируют с получением целевого соединения (D3) в виде смолы (112 г, 99%). МН+ 308. Описание 4-14. Общая методика получения N-[4-метокси-3-(4-трет-бутоксикарбонил-1 пиперазинил)фенил]арилсульфонамидов(15,6 ммоль), диизопропилэтиламина (15,6 ммоль) и соответствующего арилсульфонилхлорида (15,6 ммоль) в дихлорметане (100 мл) перемешивают при комнатной температуре в течение 18 ч. 13 Смесь концентрируют и остаток подвергают хроматографии на колонке с силикагелем,элюируя градиентом дихлорметан/метанол с получением следующих очищенных целевых продуктов. Промежуточное соединение используют неочищенным без выделения(D10). Пиридин (60 мл) добавляют к перемешиваемому раствору 4-трет-бутоксикарбонил-1-(5 амино-2-метоксифенил)пиперазина (D3) (112 г) в дихлорметане (1 л) при температуре окружающей среды в атмосфере аргона. К этому раствору добавляют в течение более 0,75 ч. раствор 5-хлор-3-метилбензо[b]тиофен-2-сульфонилхлорида (102,5 г) в дихлорметане (2,1 л) и фиолетовый раствор перемешивают в течение 18 ч. Смесь затем промывают 1 М раствором соляной кислоты (3 л), водой (3 л), сушат(Na2SO4) и концентрируют с получением пены,которую перемешивают с ацетоном (800 мл) и водой (800 мл) с получением целевого соединения (D10) в виде бордового твердого вещества,т. пл. 100-103 С (194,9 г, 97%). MH+ 552/554. Описание 15. 1-(2-Метокси-5-нитрофенил)-4-трихлорацетилпиперазин (D15). Раствор 5-нитро-1-(2-метоксифенил) пиперазина (D1) (44 г) в дихлорметане (300 мл) добавляют к перемешиваемому раствору трихлорацетилхлорида (32 мл) в дихлорметане (200 мл) в течение более 0,25 ч. Через 3 ч реакционную смесь концентрируют и остаток перекристаллизовывают из хлороформа с получением целевого соединения (D15) в виде желтого твердого вещества (43 г, 61%). Найдено MH+ 382/384. 14 Описание 16. 1-(5-Амино-2-метоксифенил)-4-трихлорацетилпиперазин (D16). Раствор дигидрата дихлорида олова (27 г) в концентрированной НСl (60 мл) медленно добавляют к перемешиваемой суспензии 1-(2 метокси-5-нитрофенил)-4-трихлорацетилпиперазина (D15) (15 г) в смеси концентрированнаяHCl/этанол (1:2, 120 мл). Через 24 ч смесь фильтруют, разбавляют дихлорметаном (600 мл) и подщелачивают раствором Nа 2 СО 3. Слои разделяют, органическую фазу сушат, концентрируют до 1/3 объема и подкисляют 1 М эфирным раствором НСl с получением целевого соединения (D16) в виде зеленого твердого вещества(50 мл) при температуре 0 С в атмосфере аргона добавляют триэтиламин (0,59 мл, 4,2 ммоль) и циклопропан карбонилхлорид (2,1 ммоль). Перемешивание продолжают в течение 12 ч. Реакционную смесь концентрируют в вакууме и распределяют между насыщенным воднымNаНСО 3 и дихлорметаном. Органический слой сушат над сульфатом натрия и концентрируют в вакууме с получением целевого соединения(D17) с 90% выходом. Найдено МН+ 306. Описание 18. [4-(2-Метокси-5-нитрофенил)пиперазин-1-ил]фенил метанон (D18). Целевое соединение получают с 85% выходом по методике, описанной для D17, используя бензоилхлорид. Найдено МН+ 342. Описание 19. [4-(5-Амино-2-метоксифенил)пиперазин-1-ил]циклопропил метанон(1,8 ммоль) в этаноле гидрируют над катализатором, 10% палладий на угле, в течение 2 ч при комнатной температуре с получением целевого соединения с 91% выходом. Найдено МН+ 276. Описание 20. [4-(5-Амино-2-метоксифенил)пиперазин-1-ил]фенилметанон (D20). Целевое соединение получают с 95% выходом, используя методику, описанную для(1,6 ммоль) сухом ТГФ (10 мл) в атмосфере аргона добавляют LiAlH4 (240 мг, 6,4 ммоль). Полученную смесь нагревают с обратным холодильником в течение 12 ч и охлаждают перед гашением водой (0,25 мл), 10% водным NaOH(0,25 мл) и окончательно водой (0,75 мл). Фильтрация через целит и концентрирование в вакууме дают целевое соединение (D21) с 75% выходом. Найдено МН+ 262. 15 Описание 22. 3-(4-Бензилпиперазин-1-ил)4-метоксифениламин (D22). Целевое соединение получают с 76% выходом по методике, описанной для D21. Найдено МН+ 298. Описание 23. 1-Метилпирролидин-3 иловый эфир метансульфокислоты (D23). К раствору 1-метилпирролидин-3-ола (2,0 г, 20 ммоль) и триэтиламина (3 мл, 22 ммоль) в дихлорметане (25 мл) при температуре 0 С в атмосфере аргона добавляют метансульфонилхлорид (2,4 г, 21 ммоль). Перемешивание продолжают при температуре от 0 С до комнатной в течение 1 ч перед распределением между насыщенным водным бикарбонатом натрия и дихлорметаном. Органическую фазу сушат над сульфатом натрия и концентрируют в вакууме с получением неочищенного мезилата (3,6 г), который используют непосредственно на следующей стадии. Описание 24. 3-(2-Метокси-5-нитрофенокси)-1-метилпирролидин (D24). Раствор 2-метокси-5-нитрофенола (5,1 г,30 ммоль) в ДМФ (10 мл) добавляют к гидриду натрия (1,6 г, 66 ммоль) в атмосфере аргона. Через 1 ч добавляют раствор неочищенного мезилата (D23, 3,6 г, 20 ммоль) в ДМФ (10 мл) и реакционную смесь нагревают до температуры 50 С в течение 48 ч. Реакционную смесь охлаждают, гасят водой и концентрируют в вакууме перед распределением между насыщенным водным бикарбонатом натрия и дихлорметаном. Органическую фазу сушат над сульфатом натрия и концентрируют в вакууме. Остаток очищают хроматографией на колонке с силикагелем с получением целевого соединения (D24). Найдено МН+ 253. Описание 25. 4-Метокси-3-(1-метилпирролидин-3-илокси)фениламин (D25). Раствор 3-(2-метокси-5-нитрофенокси)-1 метилпирролидина (3,0 г, 0,12 ммоль) в этаноле(50 мл) гидрируют над катализатором, 10% палладий на угле, в течение 2 ч с получением целевого соединения (D25). Найдено МН+ 223. Описание 26. 1-(4-Бром-3-нитрофенил)-4 метилпиперазин (D26). Раствор 1-метил-4-(3-нитрофенил) пиперазина (ЕР 0533267 А) (1,0 г, 4,5 ммоль) в ледяной уксусной кислоте (25 мл) обрабатывают бромом(0,23 мл, 1 эквивалент). Реакционную смесь перемешивают при температуре 75 С в течение ночи, затем охлаждают, фильтруют и желтое липкое твердое вещество распределяют между карбонатом калия (водным) и 2% метанолом в дихлорметане. Органическую фазу сушат(Na2SO4) и упаривают при пониженном давлении с получением целевого соединения (D26) в виде вязкого оранжевого масла (928 мг, 68%) МН+ 300/302. Описание 27. 2-Бром-5-(4-метилпиперазин-1-ил)фениламин (D27). 16 Суспензию порошка железа (1,77 г, 31,6 ммоль) в насыщенном водном растворе хлорида аммония (140 мл) при температуре 100 С обрабатывают по каплям раствором 1-(4-бром-3 нитрофенил)-4-метилпиперазина (D26) (3,54 г,11,8 ммоль) в метаноле (70 мл). Смесь кипятят с обратным холодильником в течение 1 ч, затем охлаждают и распределяют между водой и 3% метанолом в дихлорметане. Органическую фазу сушат (Na2SO4) и упаривают при пониженном давлении с получением неочищенного продукта. Продукт очищают хроматографией на колонке с силикагелем, элюируя метанолом и дихлорметаном, с получением целевого соединения (D27) в виде белого твердого вещества (2,18 г, 68%) МН+ 270/272. Описание 28. 2-Метокси-6-метилфениламин (D28). Раствор 1-метокси-3-метил-2-нитробензола(4 г), при атмосферном давлении при комнатной температуре в течение 18 ч. Катализатор удаляют фильтрацией и фильтрат упаривают при пониженном давлении с получением целевого соединения (D28) в виде янтарного масла, которое кристаллизуется при выстаивании (11,18 г,91%). 1(3,62 г, 26,4 ммоль), мета-хлорэтамина гидрохлорида (12,7 г, 66 ммоль) и карбоната калия (15 г) в хлорбензоле (90 мл) кипятят с обратным холодильником в атмосфере аргона в течение 20 ч. Смесь охлаждают и фильтруют и фильтрат упаривают при пониженном давлении с получением целевого соединения (D29) в виде красного масла, которое медленно кристаллизуется при выстаивании (5,4 г, 93%) МН+ 221. Описание 30. 1-(6-Метокси-2-метил-3 нитрофенил)-4-метилпиперазин (D30). Раствор 1-(2-метокси-6-метилфенил)-4 метилпиперазина (D29) (6,2 г, 28 ммоль) в концентрированной серной кислоте (50 мл) обрабатывают порциями нитратом калия (3,3 г, 33 ммоль) более 5 мин, поддерживая температуру 25-30 С. Смесь перемешивают в течение ночи при комнатной температуре, затем добавляют в лед и подщелачивают 40% раствором гидроксида натрия. Смесь экстрагируют дихлорметаном и органическую фазу сушат (Na2SO4) и упаривают при пониженном давлении с получением неочищенного соединения. Очистка хроматографией на колонке с силикагелем, элюируя метанолом и дихлорметаном, дает целевое соединение (D30) (4,56 г, 61%) МН+=266. Описание 31. 2-[3-Метокси-2-(4-метилпиперазин-1-ил)-6-нитрофенил]этанол (D31). 17 Смесь 1-(6-метокси-2-метил-3-нитрофенил)-4-метилпиперазина (D30) (360 мг, 1,36 ммоль), сухого диметилсульфоксида (3 мл), параформальдегида (82 мг, 2,72 ммоль) и третбутоксида калия (52 мг, 0,46 ммоль) нагревают до температуры 70-75 С в течение 30 ч. После охлаждения смесь распределяют между водой и этилацетатом. Органическую фазу сушат(Na2SO4), упаривают при пониженном давлении и очищают хроматографией на колонке с силикагелем, элюируя метанолом и дихлорметаном,с получением целевого соединения (D31) в виде желтого твердого вещества (152 мг, 38%)MH+=296. Описание 32. 2-[6-Амино-3-метокси-2-(4 метилпиперазин-1-ил)фенил]этанол (D32). Целевое соединение (D32) получают из 2[3-метокси-2-(4-метилпиперазин-1-ил)-6-нитрофенил]этанола (D31) (142 мг, 0,48 ммоль), используя методику описания 28, в виде чистого масла, кристаллизующегося при выстаивании(94 мг, 74%) МН+=266. Описание 33. 4-Метокси-2-метил-3-(4 метилпиперазин-1-ил)фениламин (D33). Целевое соединение (D33) получают из 1(6-метокси-2-метил-3-нитрофенил)-4-метилпиперазина (D30) (150 мг, 0,56 ммоль), используя методику описания 28, в виде рыжеватокоричневого порошка (78 мг, 59%) МН+=236. Описание 34. 1-(2-Метокси-4-нитрофенил)-4-метилпиперазин (D34). Смесь N-метилпиперазина (216 мг, 2,15 ммоль) 2-бром-5-нитроанизола (1 г, 4,3 ммоль),карбоната калия (447 мг, 3,23 ммоль), бромида меди (I) (86,6 мг, 0,30 ммоль) в пиридине (0,5 мл) и толуоле (2 мл) нагревают до температуры 100 С в течение ночи. После охлаждения смесь распределяет между водой и эфиром и водную фазу далее экстрагируют этилацетатом. Объединенные органические фазы сушат (Na2SO4) упаривают при пониженном давлении с получением неочищенного продукта. Продукт очищают хроматографией на колонке с силикагелем,элюируя метанолом и дихлорметаном, с получением целевого соединения (D34) в виде желтого/коричневого масла (80 мг, 15%) MH+=252. Описание 35. 3-Метокси-4-(4-метилпиперазин-1-ил)фениламин (D35). Целевое соединение (D35) получают из 1(2-метокси-4-нитрофенил)-4-метилпиперазина(D34) (80 мг, 0,319 ммоль), используя методику описания 28 (50 мг, 71%) MH+=222. Описание 36. 4-(2-Метокси-5-нитрофенил) пиридин (D36). Перемешанную смесь 2-бром-4 нитроанизола (7,6 г, 32,7 ммоль), 4 пиридинбороновой кислоты (4,07 г, 33 ммоль) и порошкообразного карбоната натрия (13,8 г, 5 эквивалентов) в смеси 1:1 1,2-диметоксиэтан : вода (1,360 мл) дегазируют в течение 0,5 ч пропусканием потока аргона. Добавляют тетракистрифенилфосфин палладий (0) (1,35 г) и смесь 18 охлаждают, растворители выпаривают при пониженном давлении до приблизительно половины объема и водный остаток подкисляют 5N соляной кислотой и промывают этилацетатом. Кислую фазу затем подщелачивают твердым карбонатом калия и экстрагируют этилацетатом,органическую фазу сушат (Na2SO4) и упаривают при пониженном давлении с получением целевого соединения (D36) в виде желтого твердого вещества (3,4 г, 45%). 1H ЯМР (250 МГц, CDCl3)(м.д.): 8.7(д,2 Н) , 8.32 (д, 1 Н), 8.29-8.25(м, 1 Н), 7.47(д, 2 Н),7.09(д, 1 Н) , 3.96(с, 3 Н). Описание 37. 4-(2-Метокси-5-нитрофенил)-1-метил-1,2,3,6-тетрагидропиридин (D37). Раствор 4-(2-метокси-5-нитрофенил) пиридина (D36) (3,4 г, 14,8 ммоль) в ацетоне (150 мл) обрабатывают избытком йодметана (5 мл) и смесь перемешивают при комнатной температуре в течение ночи. Осевшую четвертичную соль отфильтровывают, промывают ацетоном и сушат с получением 5,02 г продукта, который растворяют в смеси 1:1 этанол : вода (230 мл) и обрабатывают порциями при комнатной температуре в атмосфере аргона боргидридом натрия(1,23 г, 32,4 ммоль). Смесь перемешивают в течение 1 ч при комнатной температуре, затем добавляют карбонат калия (10 г) и органический слой отделяют от водной фазы, которую повторно экстрагируют этилацетатом. Органические фазы объединяют и сушат (Na2SO4) и упаривают при пониженном давлении с получением целевого соединения (D37) в виде оранжевого масла, которое медленно кристаллизуетсяH ЯМР (250 МГц, CDCl3)(м.д.): 8.15(д,1 Н) , 8.05(с, 1 Н), 6.9(д, 1 Н), 5.9-5.84(м, 1 Н),3.9(с, 1 Н), 3.15-3.05(м, 2 Н), 2.7-2.61(м, 2 Н), 2.62.5(м, 2 Н), 2.4(с, 3 Н). Описание 38. 4-Метокси-3-(1-метилпиперидин-1-ил)фениламин (D38). Раствор 4-(2-метокси-5-нитрофенил)-1 метил-1,2,3,6-тетрагидропиридина (D37) (1,0 г,4 ммоль) в этаноле (50 мл) и ледяной уксусной кислоте (5 мл) гидрируют над 10% палладием на угле при температуре 50 С и давлении 3,515 кг/см 2 (50 пси) в течение 4 дней. Катализатор удаляют фильтрацией, фильтрат упаривают при пониженном давлении и остаток распределяют между карбонатом калия (водным) и дихлорметаном. Органическую фазу сушат (Na2SO4) и упаривают при пониженном давлении с получением целевого соединения (D38) в виде коричневого масла, которое быстро кристаллизуется в светлый рыжевато-коричневый порошок (760 мг, 86%). MH+=221. Описание 39. 4-Метокси-3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)фениламин гидрохлорид(D39). Раствор 4-(2-метокси-5-нитрофенил)-1 метил-1,2,3,6-тетрагидропиридина (D37) (570 19 мг, 2 ммоль) в этаноле (35 мл) нагревают до температуры 60 С и обрабатывают по каплям раствором дихлорида олова (2 г) в концентрированной соляной кислоте (4 мл). Смесь нагревают в течение 2 ч после добавления и оставляют охлаждаться. Осадок отфильтровывают и промывают этанолом с получением целевого соединения (D39) в виде бледно-желтого порошка (580 мг, 99%). МН+=219. Общая методика получения гидрохлоридов арил-N-(4-метокси-3-пиперазин-1-ил)бензолсульфонамида твердофазным методом. Описание 40. Получение 1-(2-метокси-5 нитрофенил)пиперазин-4-ила, связанное со смолой Меррифилда. Раствор 1-(2-метокси-5-нитрофенил) пиперазина (9,7 г) в N-метилпирролидин-2-оне(NMП) (150 мл) нагревают с хлорметилполистиролдивинилбензольной смолой (Меррифилд,150-300 меш) при температуре 60 С в течение 24 ч в атмосфере аргона. Смолу затем фильтруют, промывают (NМП; дихлорметан/метанол градиент) и сушат с получением целевого соединения (6,9 г), которое используют непосредственно в описании 41. Описание 41. Получение 1-(5-амино-2 метоксифенил)пиперазин-4-ила, связанное со смолой Меррифилда. Раствор дигидрата дихлорида олова (9 г) вN,N-диметилформамиде (ДМФ) (120 мл) перемешивают в течение 72 ч при комнатной температуре в атмосфере аргона со смолой из описания 40 (6,9 г). Смолу фильтруют, промывают(ДМФ; дихлорметан/метанол градиент) и сушат с получением целевого соединения (6,6 г), которое используют непосредственно в описании 42. Описание 42. Общая методика получения арил-N-[4-метокси-3-(4-полимерилпиперазин-1 ил)]бензолсульфонамида, связанная со смолой Меррифилда. Раствор арил сульфонилхлорида (0,4 ммоль) и диизопропилэтиламина (1 ммоль) в дихлорметане (3 мл) перемешивают в течение 24 ч при комнатной температуре со смолой (0,1 ммоль) из описания 41. Смолу фильтруют, промывают (дихлорметан; дихлорметан/метанол градиент; метанол) с получением целевого соединения, которое используют непосредственно в примерах 133-137. Описание 43. (S)-1-Метил-2-(2-метокси-5 нитрофенокси)пирролидин (D43). Раствор 2-метокси-3-нитрофенола (5,58 г,0,033 моль),(S)-1-метил-2-гидроксиметилпирролидина (3,45 г, 0,03 моль) и трифенилфосфина (8.65 г, 0,033 моль) в сухом ТГФ (80 мл) охлаждают до температуры 5 С и обрабатывают ДЭАД (5,2 мл, 0,033 моль) в течение более 15 мин. Реакционную смесь выдерживают при комнатной температуре в течение 16 ч, затем упаривают в вакууме и распределяют между 5%NaOH (вод.)/Еt2 О. Органическую фазу отделяют и экстрагируют 10% НСl (водной). Водный экс 002351NaOH (водным) и экстрагируют Et2O. Органические экстракты промывают H2O, сушат надNa2SO4 и упаривают в вакууме с получением целевого соединения (D43) (6,79 г, 85%) МН+=267. Описание 44. (S)-1-Метил-2-(2-метокси-5 аминофенокси)пирролидин (D44). Раствор (S)-1-метил-2-(2-метокси-5-нитрофенокси)пирролидина (D43) (6,79 г, 0,0255 моль) в этаноле (200 мл) гидрируют в присутствии 5% Pd/C (0,5 г добавляют в водную суспензию) при атмосферном давлении и комнатной температуре в течение 16 ч. Катализатор удаляют фильтрацией через кизельгур и фильтрат упаривают в вакууме с получением целевого соединения (D44) (5,64 г, 93%) MH+=237. Пример 1. N-[4-Метокси-3-(4-метил-1 пиперазинил)фенил]тиофен-2-илсульфонамид. Раствор тиофен-2-сульфонилхлорида (82 мг, 0,45 ммоль) в ацетоне (2 мл) добавляют к раствору 4-метокси-3-(4-метилпиперазин-1 ил)анилина (100 мг, 0,45 ммоль) в ацетоне (2 мл) и смесь выдерживают в течение ночи при комнатной температуре. Полученное кристаллическое твердое вещество отфильтровывают и промывают ацетоном, затем диэтиловым эфиром с получением целевого соединения в виде гидрохлорида. (153 мг, 84%). МС: m/z=368. По той же методике получают следующие соединения. Получение арил-N-(4-метокси-3-пиперазин-1-илфенил) бензолсульфонамидов. Эти соединения получают по трем общим методикам, представленным ниже. Общая методика 1. В примерах 68-75 соединения получают по следующей общей методике из соответствующих аналогов N-метил пиперазина. Раствор 1-хлорэтилхлорформиата (1,7 ммоль) и соответствующего N-[4-метокси-3-(4 метил-1-пиперазинил)фенил] арилсульфонамида (0,34 ммоль) в 1,2-дихлорметане (4 мл) кипятят с обратным холодильником в течение 0,75 ч,охлаждают, разбавляют диизопропилэтиламином (1,7 ммоль) и кипятят с обратным холодильником в течение еще 2,5 ч. Раствор концентрируют до остатка, который повторно растворяют в метаноле, кипятят с обратным холодильником в течение 1 ч и затем перемешивают при комнатной температуре в течение 24 ч. Смесь концентрируют и остаток распределяют между этилацетатом и водным раствором бикарбоната натрия. Органический слой сушат, концентрируют до остатка и очищают хроматографией на колонке с силикагелем, используя градиент растворителей метанол/дихлорметан. Хлористоводородную соль продукта получают растворением чистого материала после хроматографии в смеси ацетон/дихлорметан и подкислением эфирной НСl. Общая методика 2. В примерах 76-86 соединения получают по следующей общей методике из соответствующих N-Boc производных (D4-D14). Перемешиваемый раствор соответствующего N-Boc производного (D4-D14) (10,3 ммоль) в метаноле (100 мл) и 1 М эфирной НСl(51,6 мл) нагревают при температуре 60 С в течение 1,5 ч. Смесь затем концентрируют и остаток перемешивают с ацетоном с получением следующих целевых соединений в виде хлористо-водородных солей. 24 перекристаллизовывают (этанол/вода 1:1) с получением целевого соединения (Е 83) в виде белого твердого вещества, т. пл. 276-280 С (разл.)(142 г, 83%), н (250 МГц, D6-ДМСО) 2.29(3 Н,с), 2.90(4 Н, шс), 3.01(4 Н, шс), 3.55(3 Н, с), 6.546.71(3 Н, м), 7,42(1 Н, д, J 8.8 Гц), 7.85(1 Н, с),7.93(1 Н, д, J 8.8 Гц), 9.03(2 Н, шс). 10.3(1 Н, шс),МН+ 452. Общая методика 3. В примерах 87-94 соединения получают по следующей общей методике. Раствор соответствующего арилсульфонилхлорида (0,47 ммоль) и анилина из D16 (0,47 ммоль) в дихлорметане (4 мл) и пиридине (2,4 ммоль) перемешивают в течение 18 ч при комнатной температуре. Смесь промывают 1 М водной НСl, затем водой. Слои разделяют и к органическому слою добавляют 4,4 М водного КОН(1,4 ммоль) при энергичном перемешивании в течение 18 ч. Затем к гетерогенной смеси добавляют равный объем 10% фосфатного буфера. Слои снова разделяют и органическую фазу сушат и разбавляют 1 М эфирной НСl с получением хлористо-водородных солей следующих соединений в виде осадка. Пример 83. Гидрохлорид (4-метокси-3 пиперазин-1-илфенил)амида 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты (Е 83). Перемешиваемую суспензию 4-метокси-3(4-трет-бутоксикарбонилпиперазин-1-ил)фениламида 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты (D10) (193 г) в тетрагидрофуране (820 мл) и концентрированной соляной кислоте (180 мл) нагревают с обратным холодильником в течение 1,75 ч после чего получают раствор. Раствор концентрируют и остаток растворяют в горячем этаноле (600 мл). При охлаждении осаждается твердое вещество, которое фильтруют и получают по методике, описанной ранее в WO 95/11243 (Glaxo) и подвергают взаимодействию с соответствующими арилсульфонилхлоридами по методике, описанной в примере 1 с получением следующих соединений: Примеры 109-110. Следующие соединения получают из соответствующих N-метил аналогов по общей методике, описанной для примеров 68-75(5 мл) добавляют 5-хлор-3-метилбензотиофен-2 сульфонилхлорид (1 ммоль). Перемешивание продолжают при комнатной температуре в течение 14 ч. Гидрохлоридную соль сульфонамида собирают фильтрацией, растирают с диэтиловым эфиром и сушат в вакууме с 42% выходом. Найдено МН+ 506/508. Пример 112. [3-(4-Бензилпиперазин-1-ил)4-метоксифенил]амид 5-хлор-3-метилбензо[b] тиофен-2-сульфокислоты (Е 112). Целевое соединение получают с 32% выходом по методике, описанной для Е 111. Найдено МН+ 542/544. Пример 113. [4-Гидрокси-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты (Е 113). К суспензии комплекса диметилсульфида трибромида бора (620 мг, 2 ммоль) в 1,2 дихлорэтане (30 мл) в атмосфере аргона добавляют 26 фенил]амид 5-хлор-3-метилбензо[b]тиофен-2 сульфокислоты (Е 17) (0,2 ммоль). Реакционную смесь нагревают с обратным холодильником в течение 12 ч, охлаждают, гасят добавлением воды (20 мл) и распределяют между насыщенным водным раствором бикарбоната натрия и дихлорметаном. Органическую фазу сушат над сульфатом натрия и концентрируют в вакууме. Остаток очищают хроматографией на колонке с силикагелем с получением целевого соединения(0,5 мл) добавляют к гидриду калия (35% дисперсия в минеральном масле, 50 мг, 0,44 моль) при комнатной температуре в атмосфере аргона. Через 10 мин добавляют раствор алкилирующего агента (0,22 ммоль) в ДМФ (0,3 мл) и перемешивание продолжают в течение 12 ч. Реакционную смесь гасят водой и затем концентрируют в вакууме перед распределением между насыщенным водным бикарбонатом натрия и дихлорметаном. Органическую фазу сушат над сульфатом натрия и концентрируют в вакууме. Остаток очищают хроматографией на колонке с силикагелем с получением следующих алкилированных конечных соединений. Пример 114. [4-Бензилокси-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты (Е 114). Получают с 22% выходом, используя бензилбромид. Найдено МН+ 542/544. Пример 115. [4-Этокси-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-3-метилбензо[b] тиофен-2-сульфокислоты (Е 115). Получают с 28% выходом, используя методику, описанную выше с использованием этилйодида. Найдено МН+ 480/482. Пример 116. [4-Изопропокси-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты (Е 116). Получают с 20% выходом по методике,описанной выше, с использованием 2 йодпропана. Найдено МН+ 494/496. Пример 117. [4-Метокси-3-(1-метилпирролидин-3-илокси)фенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты (Е 117). Целевое соединение получают с 48% выходом из D25 и 5-хлор-3-метилбензотиофен-2 сульфонилхлорида, как описано для Е 111. Найдено MH+ 467/469. Пример 118. [2-бром-5-(4-метилпиперазин 1-ил)фенил]амид нафталин-2-сульфокислоты(Е 118). Целевое соединение (Е 118) получают из нафталин-2-сульфонилхлорида (100 мг, 0,44 ммоль) и 2-бром-5-(4-метилпиперазин-1-ил) фениламина (D27) (120 мг, 0,44 ммоль), исполь 27 зуя методику примера 1 (85 мг, 35%) МН+ = 460/462. Пример 119. [4-Хлор-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-3-метилбензо[b] тиофен-2-сульфокислоты (Е 119). Целевое соединение (Е 119) получают из 4 хлор-3-(4-метилпиперазин-1-ил)бензоламина[b]тиофен-2-сульфонилхлорида (62 мг, 0,22 ммоль) по методике примера 1 (49 мг, 44%)(600 мг, 2,23 ммоль) и нафталин-2 сульфонилхлорида (504 мг, 2,23 ммоль) по методике примера 1 (939 мг, 92%) MH+ = 460/462. Пример 121. [3-(2-Диметиламиноэтокси)4-йодфенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты (Е 121). Целевое соединение получают из 3-(2 диметиламиноэтокси)-4-йоданилина(WO 95/15954, описание 50) (109 мг, 0,36 ммоль) и 5 хлор-3-метилбензо[b]тиофен-2-сульфонилхлорида (100 мг, 0,36 ммоль) по методике примера 1 (70 мг, 36%) MH+ = 551/553. Пример 122. [1-(2-Диметиламиноэтил)-2,3 дигидро-1 Н-индол-6-ил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты (E122). Целевое соединение (E122) получают из 1(2-диметиламиноэтил)-2,3-дигидро-1 Н-индол-6 иламина (WO 95/32967, описание 4) (100 мг,0,49 ммоль) и 5-хлор-3-метилбензо[b]тиофен-2 сульфонилхлорида (137 мг, 0,49 ммоль) по методике примера 1 (40 мг, 18%) MH+=450/452. Пример 123. 1-(5-Хлор-3-метилбензо[b] тиофен-2-сульфонил)-6-(4-метилпиперазин-1 ил)-2,3-дигидро-1 Н-индол (Е 123). Целевое соединение (Е 123) получают из 6(4-метилпиперазин-1-ил)-2,3-дигидро-1 Н-индола (получен из 3-нитроанилина по методике,описанной в WO 95/06637, промежуточное соединение 3) (39 мг, 0,18 ммоль) и 5-хлор-3 метилбензо[b]тиофен-2-сульфонилхлорида (50 мг, 0,18 ммоль) по методике примера 1 (75 мг,84%) MH+=462/464. Пример 124. 1-(5-Хлор-3-метилбензо[b] тиофен-2-сульфонил)-5-метокси-6-(4-метилпиперазин-1-ил)-2,3-дигидро-1 Н-индол (Е 124). Целевое соединение (Е 124) получают из 5 метокси-6-(4-метилпиперазин-1-ил)-2,3-дигидро-1 Н-индола (WO 95/06637, промежуточное соединение 3) (99 мг, 0,4 ммоль) и 5-хлор-3 метилбензо[b]тиофен-2-сульфонилхлорида (113 мг, 0,4 ммоль) по методике примера 1 (194 мг,92%) MH+=492/494. 28 Пример 125. [4-Метокси-2-метил-3-(4 метилпиперазин-1-ил)фенил]амид 5-хлор-3 метилбензо[b]тиофен-2-сульфокислоты (Е 125). Целевое соединение (Е 125) получают из 4 метокси-2-метил-3-(4-метилпиперазин-1-ил)фениламина (D33) (58 мг, 0,247 ммоль) и 5-хлор-3 метилбензо[b]тиофен-2-сульфонилхлорида (70 мг, 0,247 ммоль) по методике примера 1 (103 мг,81%) МН+=480/482. Пример 126. [2-(2-Гидроксиэтил)-4-метокси-3-(4-метилпиперазин-1-ил)фенил]амид 5 хлор-3-метилбензо[b]тиофен-2-сульфокислоты(Е 126). Целевое соединение (Е 126) получают из 2[6-амино-3-метокси-2-(4-метилпиперазин-1-ил) фенил]этанола (D32) 74 мг, 0,28 ммоль) и 5 хлор-3-метилбензо[b]тиофен-2-сульфонилхлорида (78 мг, 0,28 ммоль) по методике примера 1(218 мг, 0,25 ммоль) и триэтилфосфина (183 мг,0,375 ммоль) в сухом ТГФ (5 мл) в атмосфере аргона обрабатывают раствором диэтилазодикарбоксилата (110 мг, 0,375 ммоль) в сухом ТГФ (5 мл). Смесь перемешивают в течение ночи при комнатной температуре. Растворитель выпаривают при пониженном давлении и остаток распределяют между разбавленной соляной кислотой и этилацетатом. Кислый слой подщелачивают 40% гидроксидом натрия и повторно экстрагируют этилацетатом. Органическую фазу сушат (Na2SO4) и выпаривают при пониженном давлении с получением неочищенного продукта, который очищают хроматографией на колонке с силикагелем, элюируя метанолом и дихлорметаном с получением гидрохлорида (52 мг, 23%) МН+ = 492/494. Пример 128. [3-Метокси-4-(4-метилпиперазин-1-мл)фенил]амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты (Е 128). Раствор 3-метокси-4-(4-метилпиперазин-1 ил)фениламина (D35) (50 мг, 0,23 ммоль) и 5 хлор-3-метилбензо[b]тиофен-2-сульфонилхлорида (64 мг, 0,23 ммоль) в дихлорметане (2 мл) выдерживают при комнатной температуре в течение ночи. Реакционную смесь разбавляют дихлорметаном и промывают карбонатом калия(водным), полученную смесь повторно экстрагируют дополнительным дихлорметаном. Объединенные органические фазы сушат (Na2SO4) и упаривают при пониженном давлении с получением неочищенного продукта, который очищают хроматографией на колонке с силикагелем,элюируя метанолом и дихлорметаном. Таким образом получают целевое соединение (Е 128) в 29 виде бесцветного твердого вещества (36 мг,34%) МН+=466. Пример 129. 4-Бpoм-N-[4-метокси-3-(1 метил-1,2,3,6-тетрагидропиридин-4-ил)фенил] бензолсульфонамид (Е 129). Целевое соединение (Е 129) получают из 4 метокси-3-(1-метил-1,2,3,6-тетрагидропиридин 4-ил)фениламина (свободное основание D39)(107 мг, 0,49 ммоль) и 4-бромбензолсульфонилхлорида (125 мг, 0,9 ммоль) по методике примера 1 (179 мг, 77%) МН+= 437/439. Пример 130. [4-Метокси-3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)фенил]амид 5-хлор 3-метилбензо[b]тиофен-2-сульфокислоты (Е 130). Целевое соединение (Е 130) получают из 4 метокси-3-(1-метил-1,2,3,6-тетрагидропиридин 4-ил)фениламина (свободное основание D39)(100 мг, 0,46 ммоль) и 5-хлор-3-метилбензо[b] тиофен-2-сульфонилхлорида (129 мг, 0,46 ммоль) по методике примера 1 (177 мг, 77%).(D38) (150 мг, 0,68 ммоль) и 5-хлор-3 метилбензо[b]тиофен-2-сульфонилхлорида (192 мг, 0,68 ммоль) по методике примера 1 (108 мг,32%). МН+=465/467. Пример 132. [3-(4-Метилпиперазин-1 ил)фенил]амид нафталин-2-сульфокислоты(Е 132). Целевое соединение (Е 132) получают из 3(4-метилпиперазин-1-ил)бензоламина и нафталин-2-сульфонилхлорида по методике примера 1. МН+=382. Примеры 133-137. Получение гидрохлоридов арил-N-(4-метокси-3-пиперазин-1-ил)бензолсульфонамида твердофазным методом. Смолу из описания 42 перемешивают в течение 24 ч при комнатной температуре с раствором 1-хлорэтилхлорформиата (1,1 ммоль) в дихлорметане (2 мл), затем фильтруют и промывают дихлорметаном. Фильтрат концентрируют и остаток повторно растворяют в метаноле(3 мл) и раствор кипятят с обратным холодильником в течение 5 ч. Затем раствор концентрируют с получением целевого соединения. По этой методике получают следующие соединения: 30 намид (Е 138) MC(MH+) 430/432 получают по общей методике примера 1. Примеры 139-141. Следующие соединения получают аналогично методике примеров 68-75: Пример 142. [4-Метил-3-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-3-метилбензо[b] тиофен-2-сульфокислоты (Е 142). Целевое соединение (Е 142) получают из 5 хлор-3-метилбензо[b]тиофен-2-сульфонилхлорида и 4-метил-3-(4-метилпиперазин-1-ил) бензоламина по методике примера 1. МН+= 448/450. Пример 143. (S)-[4-Метокси-3-(1-метилпирролидин-2-илметокси)фенил]амид 5-хлор-3 метилбензо[b]тиофен-2-сульфокислоты (Е 143). Раствор (S)-1-метил-2-(2-метокси-5-аминофенокси)пирролидина (D44) (0,22 г, 9,3 х 10-4 моль) в ДХМ (10 мл), содержащий DIPEA (0,162 мл 9,3 х 10-4 моль) обрабатывают 5-хлор-3 метилбензол-2-сульфонилхлоридом (0,262 г,9,3x10-4 моль) порциями. Перемешивают при комнатной температуре в течение 18 ч, затем упаривают в вакууме и остаток очищают хроматографией на колонке с силикагелем Sep-Pak с 2% МеОН/ДХМ в качестве элюента с получением целевого соединения в виде чистой бесцветной смолы (0,14 г, 31%). Эту смолу превращают в гидрохлорид обработкой НСl в Et2O (0,31 мл 1,0 М раствор) при растирании с получением соли целевого соединения (Е 143) в виде белого кристаллического твердого вещества. МН+=481/483. Методика исследования антагонистического действия в отношении 5-НТ 6. Тестируемое соединение растворяют в смеси полиэтиленгликоль : диметилсульфоксид(1:1) при 1 или 10 мМ и разбавляют до 0,1 мМ,используя 5 мМ трио буфер (рН 7,725 С). Растворение сопровождают добавлением 0,02 мл 5 М НСl, нагреванием до 40 С и обработкой ультразвуком в течение 10 мин. Последовательное растворение препаратов в том же буфере проводят с использованием либо TECAN 5052,либо Biomek 2000 Workstation. Образцы разбавленных тестируемых соединений (0,05 мл) смешивают с 0.05 мл радиолиганда [3H]-LSD, приготовленного в инкубационном буфере и 0,4 мл суспензии препарата промытых мембран НеLа 5 НТ 6 клеток (полученных из Dr. D. Sibley, NIH,Bethesda, см. ссылку 1) (см. таблицу 1), также в инкубационном буфере. Параметры инкубации для каждого исследования представлены в таблице 2. Инкубационный буфер представляет собой 50 мМ Trizma (Sigma, UK) рН 7.725 С,4 мМ MgCl2. 31 После инкубации при температуре 37 С смеси фильтруют, используя Packard Filtermate в формате Packard TopCount. Фильтры промывают 4 х 1 мл аликвот ледяным инкубационным буфером. Фильтры сушат и пропитывают 0,04 мл Microscint 20 (Packars). Значения IC50 определяют исходя из значений в минуту, используя логистическую кривую с четырьмя параметрами, построенную в программе EXCEL (2). Значения Ki рассчитывают по методике Cheng andlog10 молярных IC50 и Кi соответственно. Таблица 1. Параметры методик, используемых для получения мембран с целью исследования связывания Таблица 2. Условия исследования на связывание рецептораPharmacol., 92, 881-894. Все соединения примеров 11, 15, 17, 61, 65,70, 72, 77, 78, 79, 83, 84, 87 и 90 показали особенно хорошее селективное антагонистическое действие в отношении рецептора 5-НТ 6, имея значения рКi выше 8.0 для клонированных 5 НТ 6 рецепторов человека. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его сольR1 означает галоген, C1-6 алкил, необязательно замещенный одним или более атомамиR4 представляет N-пиперазиновое кольцо,необязательно замещенное C1-6 алкилом,R5 означает водород, галоген, C1-6 алкил,С 3-6 циклоалкил, COC1-6 алкил, C1-6 алкокси,гидрокси, гидрокси C1-6 алкил, гидрокси C1-6 алкокси, C1-6 алкокси C1-6 алкокси, нитро, трифторметил, циано или арил. 2. Соединение по п.1, где Р является фенилом, тиофеном, бензотиофеном или нафтилом. 3. Соединение по п.1 или 2, где R1 является галогеном или C1-6 алкилом, необязательно замещенным одним или более атомами галогена. 4. Соединение по любому из пп.1-3, где R2 является водородом. 5. Соединение по любому из пп.1-4, где R4 является незамещенным пиперазиновым кольцом. 6. Соединение по любому из пп.1-5, где R5 является C1-6 алкокси. 7. Соединение по любому из пп.1-6, где R5 находится в пара-положении относительно сульфонамидной связи. 8. Соединение по любому из пп.1-7, где РА является 5-хлор-3-метилбензо[b]тиофен-2 илом. 9. Соединение по п.1, представляющее собой 4-бром-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,N-[4-метокси-3-(4-метилпиперазин-1 ил)фенил]-2-тиофенсульфонамид,N-[4-метокси-3-(4-метилпиперазин-1 ил)фенил]-5-(пиридин-2-ил)-2-тиофенсульфонамид,2,5-дихлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-3-тиофенсульфонамид,4-бром-5-хлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-2-тиофенсульфонамид,N-[4-метокси-3-(4-метилпиперазин-1-ил) фенил]бензолсульфонамид,3-бром-5-хлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-2-тиофенсульфонамид,N-[4-метокси-3-(4-метилпиперазин-1-ил) фенил]бензилсульфонамид,2-бром-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,3-бром-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид, 33 3-хлор-N-[4-метокси-3-(4-метилпиперазин 1-ил)фенил]-4-метилбензолсульфонамид,N-[4-метокси-3-(4-метилпиперазин-1 ил)фенил]транс-стиролсульфонамид,3,4-дихлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,3,5-дихлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,N-[4-метокси-3-(4-метилпиперазин-1-ил) фенил-[2,1,3]бензотиадиазол-4-сульфонамид,5-хлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]-3-метил-2-бензотиофенсульфонамид,N-[4-метокси-3-(4-метилпиперазин-1-ил) фенил]-2-метил-5-нитробензолсульфонамид,N-[4-метокси-3-(4-метилпиперазин-1-ил) фенил]-2-трифторметилбензолсульфонамид,N-[4-метокси-3-(4-метилпиперазин-1-ил) фенил]-3-трифторметилбензолсульфонамид,2,3-дихлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,5-йод-N-[4-метокси-3-(4-метилпиперазин 1-ил)фенил]-2-метилбензолсульфонамид,3-йод-N-[4-метокси-3-(4-метилпиперазин 1-ил)фенил]бензолсульфонамид,3-йод-N-[4-метокси-3-(4-метилпиперазин 1-ил)фенил]-4-метилбензолсульфонамид,[4-метокси-3-(4-метилпиперазин-1-ил) фенил]амид 5-хлорнафталин-2-сульфокислоты,[4-метокси-3-(4-метилпиперазин-1-ил) фенил]амид 5-хлорнафталин-1-сульфокислоты,[4-метокси-3-(4-метилпиперазин-1-ил) фенил]амид 4-хлорнафталин-1-сульфокислоты,[4-метокси-3-(4-метилпиперазин-1-ил) фенил]амид 7-хлорнафталин-1-сульфокислоты,[4-метокси-3-(4-метилпиперазин-1-ил) фенил]амид 5-хлор-2-метилбензо[b]тиофен-3 сульфокислоты,[4-метокси-3-(4-метилпиперазин-1-ил) фенил]амид бензофуран-2-сульфокислоты,[4-метокси-3-(4-метилпиперазин-1-ил) фенил]амид 1-метил-1 Н-индол-2-сульфокислоты,(4-метокси-3-пиперазин-1-илфенил)амид 5-пиридин-2-илтиофен-2-сульфокислоты,N-(4-метокси-3-пиперазин-1-илфенил)-3 трифторметилбензолсульфонамид,3-йод-N-(4-метокси-3-пиперазин-1 илфенил)-бензолсульфонамид,(4-метокси-3-пиперазин-1-илфенил)амид 3,5-диметилизоксозол-4-сульфокислоты,3,5-дихлор-N-(4-метокси-3-пиперазин-1 илфенил)бензолсульфонамид,2,5-дибром-3,6-дифтор-N-(4-метокси-3 пиперазин-1-илфенил)бензолсульфонамид,(4-метокси-3-пиперазин-1-илфенил)амид нафталин-1-сульфокислоты,(4-метокси-3-пиперазин-1-илфенил)амид 2-бром-5-хлортиофен-2-сульфокислоты,2-хлор-4-фтор-N-(4-метокси-3-пиперазин 1-илфенил)бензолсульфонамид,3-бром-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид, 002351 1-(5-хлор-3-метилбензо[b]тиофен-2-сульфонил)-5-метокси-4-(4-метилпиперазин-1-ил)2,3-дигидро-1 Н-индол гидрохлорид,[3-метокси-4-(4-метилпиперазин-1-ил)фенил]амид 5-хлор-3-метилбензо[b]тиофен-2 сульфокислоты,[4-метокси-3-(1-метилпиперидин-4-ил) фенил]амид 5-хлор-3-метилбензо[b]тиофен-2 сульфокислоты,[3-(4-метилпиперазин-1-ил)фенил]амид нафталин-2-сульфокислоты 2,3,4-трихлор-N-(4-метокси-3-пиперазин-1 илфенил)бензолсульфонамид,2,3-дихлор-N-(4-метокси-3-пиперазин-1 илфенил)бензолсульфонамид,3-хлор-2-метил-N-(4-метокси-3-пиперазин 1-илфенил)бензолсульфонамид,4-Хлор-N-(4-метокси-3-пиперазин-1-илфенил)бензолсульфонамид,(4-метокси-3-пиперазин-1-илфенил)амид 5-бромтиофен-2-сульфокислоты,2,3-дихлор-N-[4-метокси-3-(4-метилпиперазин-1-ил)фенил]бензолсульфонамид,1-(5-хлор-3-метилбензо[b]тиофен-2 сульфонил)-5-фенил-6-пиперазин-1-ил-2,3 дигидро-1 Н-индол,5-хлор-1-(5-хлор-3-метилбензо[b]тиофен 2-сульфонил)-6-пиперазин-1-ил-2,3-дигидро 1H-индол,1-(5-хлор-3-метилбензо[b]тиофен-2 сульфонил)-7-пиперазин-1-ил-1,2,3,4 тетрагидрохинолин,[4-метил-3-(4-метилпиперазин-1-ил)фенил] амид 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты,и их фармацевтически приемлемые соли. 10. Соединение по любому из пп. 1-8,представляющее собой гидрохлорид (4-метокси 3-пиперазин-1-илфенил)амида 5-хлор-3-метилбензо[b]тиофен-2-сульфокислоты. 11. Применение соединения по любому из пп.1-10 в терапевтических целях в качестве антагониста в отношении 5-HT6 рецепторов. 12. Применение соединения по любому из пп.1-10 при лечении шизофрении, болезни Альцгеймера и/или депрессии. 13. Фармацевтическая композиция, содержащая соединение по любому из пп.1-10 и фармацевтически приемлемый носитель или наполнитель. 14. Способ получения соединения формулы (I) или его солиR1 означает галоген, C1-6 алкил, необязательно замещенный одним или более атомами галогена, С 3-6 циклоалкил, COC1-6 алкил, C1-6 алкокси, ОСF3, гидрокси, гидрокси C1-6 алкил,гидрокси C1-6 алкокси, C1-6 алкокси C1-6 алкокси,нитро, амино, алкиламино или диалкиламино,циано или R1 представляет фенил, нафтил или пиридил;n равно 0, 1, 2, 3, 4, 5 или 6,R2 означает водород, C1-6 алкил или арилС 1-6 алкил; 38 алкокси, C1-6 алкокси C1-6 алкокси, нитро, трифторметил, циано или арил; где указанный способ включает взаимодействие соединения формулы (II) в которой R1, n, Р и А такие, как определено для формулы (I), и L является удаляемой группой,или его защищенных производных с соединением формулы (III) в которой R2, R3, R4 и R5 такие, как определено для формулы (I), или его защищенными производными,и в случае необходимости далее- удаление любых защитных групп,- образование фармацевтически приемлемой соли.
МПК / Метки
МПК: C07D 333/34
Метки: способ, использование, средств, получения, качестве, лекарственных, сульфонамида, производные
Код ссылки
<a href="https://eas.patents.su/20-2351-proizvodnye-sulfonamida-sposob-ih-polucheniya-i-ih-ispolzovanie-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Производные сульфонамида, способ их получения и их использование в качестве лекарственных средств.</a>
Предыдущий патент: Замещенные пиразол-3-илбензазолы
Следующий патент: Производные индазоламида в качестве серотонинергических агентов
Случайный патент: Регулирование роста растений












