Пиримидинкарбоксамиды, используемые в качестве ингибиторов изозимов pde4
Номер патента: 5028
Опубликовано: 28.10.2004
Авторы: Маджи Томас Виктор, Марфэт Энтони, Чэмберз Роберт Джеймс
Формула / Реферат
1. Соединение формулы (1.0.0)
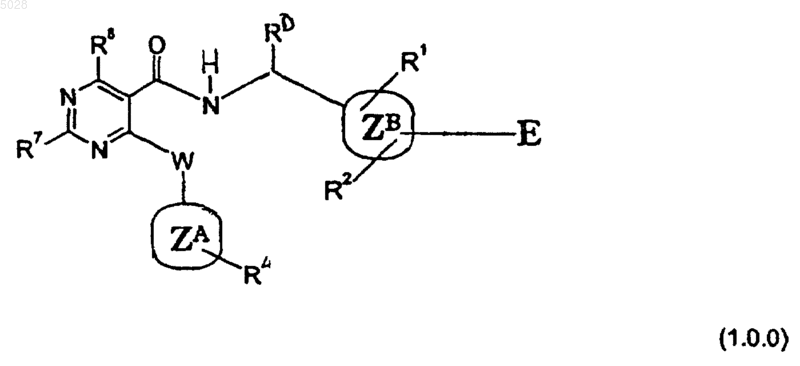
или его фармацевтически приемлемая соль,
где R1 обозначает -H, -F или -Cl,
R2 обозначает -H, -F, -Cl или -CH3,
R3 обозначает -H или -CH3,
ZB обозначает фенил, циклопентил, циклогексил, фуранил, тиенил, тиазолил, оксазолил, индолин-2-онил, пиридил или пиразинил,
E обозначает -H, -F, -OCH3, -OH, -CH(OH)CH3, -CH (OH) (CH3)2, -OC(=O)R12, -NHS (=O)2CH3, -S(=O)2NH2, -NH2 или -N(CH3)2,
ZA обозначает фенил или пиридил, где R4 представлен дважды и обозначает -F или -Cl или же R4 является единственным заместителем, представляющим собой -F, -Cl, -CN, -NO2, -NH2, -N(CH3)2, -CF3, -SCH3, -OCH3, -OCH2CH3, -C(=O)CH3, -C(=O)OCH3, -CONH2, -NHS(=O)2CH3,
или ZA обозначает фенил, где два R4, взятые вместе с атомами углерода, к которым они присоединены, и фенильным циклом, частью которого они являются, образуют индолил, хинолинил, 1,3-бензодиоксолил, бензоксазолил, 1,3-бензодитиолил, бензотиазолил, бензимидазолил или 1,4-бензодиоксанил,
R7 и R8, каждый независимо, выбраны из группы, включающей -H, -F, -Cl, -OR12, (C1-C4)алкил, гидрокси (C1-C4)алкил, -CF3, -C(=O)OR12, -NR12R13, гидрокси (C1-C4)алкиламино, фенил, бензил или гетероциклильный радикал, выбранный из группы, включающей пирролил, оксазолил, тиазолил, оксадиазолил, тиадиазолил, имидазолил, пиридинил, тетразолил, индолил и бензимидазолил, где каждый из указанных фенильного, бензильного или гетероциклильного радикалов независимо замещен 0-2 заместителями R10,
R10 обозначает радикал, выбранный из группы, включающей -F, -Cl, -CF3, -CN, -OR12, (C1-C2) алкил, гидрокси (C1-C2)алкил, -O-C(=O)R13, -O-C(=O)NR12R13, -NR12R13, -NR12C(=O) R13, -NR12C(=O)OR13, -NR12S (=O)2R13 и -S (=O)2NR12R13, и
R12 и R13 каждый обозначает радикал, независимо выбранный из группы, включающей -H, -(C1-C4)алкил, фенил или бензил, где указанные алкил, фенил или бензил замещены 0-3 заместителями, выбранными из группы, состоящей из F и Cl.
2. Соединение по п.1, где R1 обозначает -H, ZB обозначает фенил, фуранил или тиенил, Е обозначает -OCH3, -OH, -CH(OH)CH3 или -CH(OH)(CH3)2, ZA обозначает фенил или пиридил, где R4 присутствует дважды и обозначает -F или -Cl, или же R4 является единственным заместителем, представляющим собой -F, -Cl, -CN, -OCH3 или -NO2, или ZA обозначает фенил, где два R4, взятые вместе с атомами углерода, к которым они присоединены, и фенильным циклом, частью которого они являются, образуют 1,3-бензодиоксолил, и R7 и R8, каждый независимо, выбраны из группы, включающей -H, -CH3, -OCH3, -CF3 или -NH2.
3. Соединение по п.1, выбранное из группы, включающей
2-фтор-4-(1-гидрокси-1-метилэтил)бензиламид 4-(бензо-[1,3]диоксол-5-илокси)пиримидин-5-карбоновой кислоты формулы (6.0.1),
4-(1-гидрокси-1-метилэтил)бензиламид 4-(бензо[1,3]-диоксол-5-илокси)пиримидин-5-карбоновой кислоты формулы (6.0.2),
2-N-(2-хлорбензил)-1-[6-(2,4-дифторфенокси)пиримидин-5-ил]карбоксамид формулы (6.0.3),
1-[6-(4-фторфенокси)пиримидин-5-ил]-2-N-[4-(метокси)бензил]карбоксамид формулы (6.0.4),
1-[6-(4-фторфенокси)пиримидин-5-ил]-2-N-[(тиофен-2-ил)метил]карбоксамид формулы (6.0.5),
(тиофен-2-илметил)амид 4-(бензо[1,3]диоксол-5-илокси)пиримидин-5-карбоновой кислоты формулы (6.0.6),
1-[6-(4-фторфенокси)пиримидин-5-ил]-2-N-[(фуран-2-ил)метил]карбоксамид формулы (6.0.7),
2-N-(2-хлорбензил)-1-[6-(2,4-дифторфенокси)пиримидин-5-ил]карбоксамид формулы (6.0.8),
1-[6-(4-фторфенокси)пиримидин-5-ил]-2-N-[1-метил-1-(4-метокси)бензил]карбоксамид формулы (6.0.9),
1-[6-(4-фторфенокси)пиримидин-5-ил]-2-N-[1-метил-1-(тиофен-2-ил)метил]карбоксамид формулы (6.0.10),
2-N-[1-метил-1-(тиофен-2-ил)метил]-1-[6-(пиридин-3ил)оксипиримидин-5-ил]карбоксамид формулы (6.0.11),
(1-тиофен-2-илэтил)амид 4-(бензо[1,3]диоксол-5-илокси)пиримидин-5-карбоновой кислоты формулы (6.0.12),
1-[6-(5-хлорпиридин-3-ил)оксипиримидин-5-ил]-2-N-[((3-метил)тиофен-2-ил)метил]карбоксамид формулы (6.0.13),
2-N-[(4-метоксифенил)метил]-1-[6-(пиридин-3-ил)оксипиримидин-5-ил]карбоксамид формулы (6.0.14),
2-N-[(4-хлортиофен-2-ил)метил]-1-[6-(4-фторфенокси)пиримидин-5-ил]карбоксамид формулы (6.0.15),
(4-хлортиофен-2-илметил)амид 4-(бензо[1,3]диоксол-5-илокси)пиримидин-5-карбоновой кислоты формулы (6.0.16),
2-N-[(5-хлорфуран-2-ил)метил]-1-[6-(4-фторфенокси)пиримидин-5-ил]карбоксамид формулы (6.0.17),
1-[6-(5-хлорпиридин-3-ил)оксипиримидин-5-ил]-2-N-[(тиазол-2-ил)метил]карбоксамид формулы (6.0.18),
1-[6-(4-фторфенокси)пиримидин-5-ил]-2-N-[4-(1-гидроксиизопропил)бензил]карбоксамид формулы (6.0.19),
4-(1-гидроксиэтил)бензиламид 4-(бензо[1,3]диоксол-5-илокси)пиримидин-5-карбоновой кислоты формулы (6.0.20),
2-N-(2,3-дифторбензил)-1-[6-(4-фторфенокси)пиримидин-5-ил]карбоксамид формулы (6.0.21),
1-[6-(4-фторфенокси)пиримидин-5-ил]-2-N-(4-гидроксибензил)карбоксамид формулы (6.0.22),
2-N-(2-хлорбензил)-1-{6-[3-(N,N-диметиламино)фенокси]пиримидин-5-ил}карбоксамид формулы (6.0.23),
2-N-(2-хлорбензил)-1-[6-(4-цианофенокси)пиримидинбил]карбоксамид формулы (6.0.24),
2-хлорбензиламид 4-(бензо[1,3]диоксол-5-илокси)пиримидин-5-карбоновой кислоты формулы (6.0.25),
1-[6-(4-фторфенокси)пиримидин-5-ил]-2-N-(4-метилсульфоаминобензил)карбоксамид формулы (6.0.26),
1-[6-(4-фторфенокси)пиримидин-5-ил]-2-N-[1-метил-1-(5-хлор-2-тиофен-2-ил)метил]карбоксамид формулы (6.0.27),
[1-(5-хлортиофен-2-ил)этил]амид 4-(бензо[1,3]диоксол-5-илокси)пиримидин-5-карбоновой кислоты формулы (6.0.28),
2-N-[4-(1-гидроксиизопропил)бензил]-1-[6-(3-нитрофенокси)пиримидин-5-ил]карбоксамид формулы (6.0.29),
1-[6-(3-цианофенокси)пиримидин-5-ил]-2-N-[4-(1-гидроксиизопропил)бензил]карбоксамид формулы (6.0.30),
1-[6-(4-фторфенокси)пиримидин-5-ил]-2-N-[4-(1-гидроксиизопропил)бензил]карбоксамид формулы (6.0.31),
2-N-[4-(1-гидроксиизопропил)бензил]-1-[6-(3-трифторметилфенокси)пиримидин-5-ил]карбоксамид формулы (6.0.32),
1-[6-(3-хлорфенокси)пиримидин-5-ил]-2-N-[4-(1-гидроксиизопропил)бензил]карбоксамид формулы (6.0.33),
2-N-(2-фторбензил)-1-[6-(пиридин-3-ил)оксипиримидин-5-ил]карбоксамид формулы (6.0.34),
1-[6-(4-фторфенокси)пиримидин-5-ил]-2-N-(4-иминобензил)карбоксамид формулы (6.0.35),
4-аминобензиламид 4-(бензо[1,3]диоксол-5-илокси)пиримидин-5-карбоновой кислоты формулы (6.0.36),
2-N-[5-(1-гидроксиэтил)тиофен-2-ил]-1-[6-(пиридин-3-ил)оксипиримидин-5-ил]карбоксамид формулы (6.0.37),
[5-(1-гидроксиэтил)тиофен-2-илметил]амид 4-(бензо-[1,3]диоксол-5-илокси)пиримидин-5-карбоновой кислоты формулы (6.0.38),
2-N-[5-(1-гидроксиизопропил)тиофен-2-ил]-1-[6-(пиридин-3-ил)оксипиримидин-5-ил]карбоксамид формулы (6.0.39),
[5-(1-гидрокси-1-метилэтил)тиофен-2-илметил]амид 4-(бензо[1,3]диоксол-5-илокси)пиримидин-5-карбоновой кислоты формулы (6.0.40),
2-N-[4-(1-гидроксиизопропил)бензил]-1-[6-(3-метилтиофенокси)пиримидин-5-ил]карбоксамид формуыы (6.0.41),
1-[6-(4-фторфенокси)пиримидин-5-ил]-2-N-{4-[(1-гидроксиизопропил)циклогексил]метил}карбоксамид формулы (6.0.42),
1-[6-(4-фторфенокси)пиримидин-5-ил]-2-N-[(5-метилпиразин-2-ил)метил]карбоксамид формулы (6.0.43),
(5-метилпиразин-2-илметил)амид 4-(бензо[1,3]диоксол-5-илокси)пиримидин-5-карбоновой кислоты формулы (6.0.44),
2-N-(4-N,N-диметилбензил)-1-[6-(4-фторфенокси)пиримидин-5-ил]карбоксамид формулы (6.0.45),
4-диметиламинобензиламид 4-(бензо[1,3]диоксол-5-илокси)пиримидин-5-карбоновой кислоты формулы (6.0.46),
2-N-[(4-аминосульфонил)бензил]-1-[6-(4-фторфенокси)пиримидин-5-ил]карбоксамид формулы (6.0.47),
4-сульфамоилбензиламид 4-(бензо[1,3]диоксол-5-илокси)пиримидин-5-карбоновой кислоты формулы (6.0.48),
2-N-[4-(1-гидроксиизопропил)бензил]-1-[6-(3-метилкарбонилфенокси)пиримидин-5-ил]карбоксамид формулы (6.0.49),
1-[6-(3-цианофенокси)пиримидин-5-ил]-2-N-{4-[(1-гидроксиизопропил)циклогексил]метил}карбоксамид формулы (6.0.50),
2-N-[4-(1-гидроксиизопропил)бензил]-1-[6-(3-метоксикарбонилфенокси)пиримидин-5-ил]карбоксамид формулы (6.0.51),
2-N-(2-хлорбензил)-1-[6-(3-метилкарбонилфенокси)пиримидин-5-ил]карбоксамид формулы (6.0.52).
4. Фармацевтическая композиция для применения при лечении субъекта, страдающего от заболевания, нарушения или состояния, опосредованного изозимом PDE4, участвующим в регуляции активации и дегрануляции эозинофилов, содержащая терапевтически эффективное количество соединения формулы (1.0.0) по п.1 и фармацевтически приемлемый носитель.
5. Применение терапевтически эффективного количества соединения формулы (1.0.0) по п.1 для изготовления лекарственного средства для лечения субъекта, страдающего от заболевания, нарушения или состояния, опосредованного изозимом PDE4, участвующим в регуляции активации и дегрануляции эозинофилов.
6. Применение по п.5, где указанное заболевание, нарушение или состояние включает одно или несколько заболеваний, выбранных из группы, включающей
астму любого типа, этиологии или патогенеза, астму, которая является заболеванием, выбранным из группы, включающей атопическую астму, не атопическую астму, аллергическую астму, атопическую, бронхиальную, IgE-опосредованную астму, бронхиальную астму, идиопатическую астму, подлинную астму, врожденную астму, вызванную патофизиологическими нарушениями, приобретенную астму, вызванную факторами окружающей среды, эссенциальную астму неизвестного или неочевидного происхождения, неатопическую астму, бронхитическую астму, эмфизематозную астму, астму, вызванную упражнениями, профессиональную астму, инфекционную астму, вызванную бактериальной, грибковой, протозойной или вирусной инфекцией, неаллергическую астму, начальную стадию астмы, синдром стридора у детей,
хроническое или острое сужение просвета бронхов, хронический бронхит, обструкцию малых дыхательных путей и эмфизему,
обструктивные или воспалительные заболевания дыхательных путей любого типа, этиологии или патогенеза или обструктивное или воспалительное заболевание дыхательных путей, которое представляет собой заболевание, выбранное из группы, включающей астму, пневмокониоз, хроническую эозинофильную пневмонию, хроническое обструктивное легочное заболевание (COPD), COPD, которое включает хронический бронхит, легочную эмфизему или связанную с ней одышку, COPD, которое характеризуется необратимой прогрессирующей обструкцией дыхательных путей, респираторный дистресс-синдром взрослых (ARDS) и обострение гиперреактивности дыхательных путей вследствие другой лекарственной терапии,
пневмокониоз любого типа, этиологии или патогенеза или пневмокониоз, который представляет собой заболевание, выбранное из группы, включающей алюминоз, заболевание, встречающееся у рабочих, контактирующих с алюминиевой рудой, антракоз или астму шахтеров, асбестоз или астму слесарей-паропроводчиков, халикоз или заболевание резчиков по камню, птилоз, вызванный вдыханием пыли от перьев страусов, сидероз, вызываемый вдыханием частиц железа, силикоз или заболевание шлифовальщиков, биссиноз или хлопково-пылевую астму и тальковый пневмокониоз,
бронхит любого типа, этиологии или патогенеза, или бронхит, который представляет собой заболевание, выбранное из группы, включающей острый бронхит, острый ларинго-трахеальный бронхит, арахидный бронхит, катаральный бронхит, крупозный бронхит, сухой бронхит, инфекционный астматический бронхит, продуктивный бронхит, стафиллококковый или стрептококковый бронхит и везикулярный бронхит,
бронхоэктаз любого типа, этиологии или патогенеза или бронхоэктаз, который представляет собой заболевание, выбранное из группы, включающей цилиндрический бронхоэктаз, мешкообразный бронхоэктаз, веретенообразный бронхоэктаз, капиллярный бронхоэктаз, кистозный бронхоэктаз, сухой бронхоэктаз и фолликулярный бронхоэктаз,
сезонный аллергический ринит, или постоянный аллергический ринит, или синусит любого типа, этиологии или патогенеза, или синусит, который представляет собой заболевание, выбранное из группы, включающей гнойный или негнойный синусит, острый или хронический синусит и синусит решетчатой, лобной, верхнечелюстной или клиновидной пазух,
ревматоидный артрит любого типа, этиологии или патогенеза или ревматоидный артрит, который представляет собой заболевание, выбранное из группы, включающей острый артрит, острый подагрический артрит, хронический воспалительный артрит, дегенеративный артрит, инфекционный артрит, артрит Лайма, пролиферативный артрит, псориатический артрит и позвонковый артрит,
подагру, а также лихорадку и боль, связанные с воспалением,
связанное с эозинофилами нарушение любого типа, этиологии или патогенеза или связанное с эозинофилами нарушение, которое представляет собой заболевание, выбранное из группы, включающей эозинофилию, легочную инфильтрационную эозинофилию, синдрома Лоффлера, хроническую эозинофильную пневмонию, тропическую легочную эозинофилию,
бронхопневмонический аспергиллез, аспергиллому, гранулему, содержащую эозинофилы, аллергический гранулематозный ангиит или синдром Чург-Штраусса, нодозный полиартрит (PAN) и системный некротизирующий васкулит,
атопический дерматит, или аллергический дерматит, или аллергическую или атопическую экзему,
крапивницу любого типа, этиологии или патогенеза или крапивницу, которая представляет собой заболевание, выбранное из группы, включающей иммунно-опосредованную крапивницу, комплемент-опосредованную крапивницу, крапивницу, вызванную уртикариогенным веществом, крапивницу, вызванную физическим агентом, стресс-индуцированную крапивницу, идиопатическую крапивницу, острую крапивницу, хроническую крапивницу, ангиоэдему, холинэргическую крапивницу, холодную крапивницу в аутосомной доминантной форме или в приобретенной форме, контактную крапивницу, гигантскую крапивницу и папулезную крапивницу,
конъюнктивит любого типа, этиологии или патогенеза или конъюнктивит, который представляет собой заболевание, выбранное из группы, включающей актинический конъюнктивит, острый катаральный конъюнктивит, острый контагиозный конъюнктивит, аллергический конъюнктивит, атопический конъюнктивит, хронический катаральный конъюнктивит, гнойный конъюнктивит и хронический двусторонний конъюнктивит,
увеит любого типа, этиологии или патогенеза или увеит, который представляет собой заболевание, выбранное из группы, включающей воспаление всего или части увеального тракта, переднего увеита, ирита, циклита, иридоциклита, грануломатозного увеита, негрануломатозного увеита, факоантигенного увеита, заднего увеита, хороидита и хориоретинита,
псориаз,
рассеянный склероз любого типа, этиологии или патогенеза или рассеянный склероз, который представляет собой заболевание, выбранное из группы, включающей первичный прогрессирующий рассеянный склероз и рецидивирующий ремиттирующий рассеянный склероз,
аутоиммунные/воспалительные заболевания любого типа, этиологии или патогенеза или аутоиммунное/воспалительное заболевание, которое представляет собой заболевание, выбранное из группы, включающей аутоиммунные гематологические нарушения, гемолитическую анемию, апластичесъую анемию, чистую анемию красных кровяных клеток, идиопатическую тромбоцитопеническую пурпуру, системную красную волчанку, полихондрит, склеродерму, гранулематоз Вегнера, дерматомиозит, хронический активный гепатит, тяжелую миастению, синдром Стивенса-Джонсона, идиопатическое спру, аутоиммунные воспалительные заболевания кишечника, язвенный колит, болезнь Крона, эндокринную офтальмопатию, болезнь Грейвса, саркоидоз, альвеолит, хронический гиперчувствительный пневмонит, первичный биллиарный цирроз, ювенильный диабет или сахарный диабет I типа, передний увеит, грануломатозный или задний увеит, высушивающий кератоконъюнктивит, эпидемический кератоконъюнктивит, диффузный интерстициальный легочный фиброз или интерстициальный фиброз легких, идиопатический легочный фиброз, кистозный фиброз, псориатический артрит, гломерулонефрит с нефротическим синдромом или без него, острый гломерулонефрит, идиопатический нефротический синдром, нефропатию с минимальными изменениями, воспалительные/гиперпролиферативные кожные заболевания, псориаз, атопический дерматит, контактный дерматит, аллергический контактный дерматит, доброкачественная семейная пузырчатка, эритематозная пузырчатка, листовидная пузырчатка и обыкновенная пузырчатка,
профилактику отторжения аллогенного трансплантанта после трансплантации органа,
воспалительное заболевание кишечника (IBD) любого типа, этиологии или патогенеза или воспалительное заболевание кишечника, которое представляет собой заболевание, выбранное из группы, включающей язвенный колит (UC), коллагеновый колит, полипозный колит, трансмуральный колит и болезнь Крона (CD),
септический шок любого типа, этиологии или патогенеза или септический шок, который представляет собой заболевание, выбранное из группы, включающей почечную недостаточность, острую почечную недостаточность, кахексию, малярийную кахексию, гипофизарную кахексию, уремическую кахексию, кардиальную кахексию, супраренальную кахексию или болезнь Аддисона, связанную с раком кахексию и кахексию как следствие инфицирования вирусом иммунодефицита человека (ВИЧ),
повреждение печени,
легочную гипертонию и вызванную гипоксией легочную гипертонию,
заболевания, связанные с костной недостаточностью, первичный остеопороз и вторичный остеопороз,
нарушения центральной нервной системы любого типа, этиологии или патогенеза или нарушение центральной нервной системы, которое представляет собой заболевание, выбранное из группы, включающей депрессию, болезнь Паркинсона, ухудшение способности к обучению и памяти, позднюю дискинезию, наркотическую зависимость, атеросклеротическое слабоумие и слабоумие, сопровождающее хорею Хантингтона, болезнь Вилсона, паралич и таламические атрофии,
инфицирование, особенно инфицирование вирусами, при котором вирусы увеличивают продукцию TNF-a в организме хозяина или при котором вирусы являются чувствительными к повышающей регуляции TNF-a в организме хозяина, так что на их репликацию или другие жизненно важные функции оказывается неблагоприятное влияние, включающими вирус, который представляет собой вирус, выбранный из группы, включающей HIV-1, HIV-2 и HIV-3, цитомегаловирус, CMV, вирус гриппа, аденовирусы и вирусы герпеса, включающие Herpes zoster и Herpes simplex,
инфицирование дрожжами и грибками, где указанные дрожжи и грибки являются чувствительными к повышающей регуляции TNF-a или стимулируют продукцию TNF-a в организме хозяина при введении вместе с другими лекарственными средствами, выбранными для лечения системных дрожжевых и грибковых инфекций, включающими, не ограничиваясь ими, полимиксины, например, полимицин B, имидазолы, клотримазол, эконазол, миконазол и кетоконазол, триазолы, флюконазол и итраназол, и амфотерицины, например амфотерицин В и липосомальный амфотерицин B, и
ишемическое реперфузионное повреждение, аутоиммунные диабеты, ретинальный аутоиммунитет, хроническую лимфоцитарную лейкемию, ВИЧ инфекции, эритематозную волчанку, заболевание почек и мочеточника, мочеполовые и желудочно-кишечные нарушения и заболевания простаты.
7. Применение по п.6, где указанное заболевание, нарушение или состояние представляет собой заболевание, выбранное из группы, включающей (1) воспалительные заболевания и состояния, включающие воспаление суставов, ревматоидный артрит, ревматоидный спондилит, остеоартрит, воспалительное заболевание кишечника, язвенный колит, хронический гломерулонефрит, дерматит и болезнь Крона, (2) респираторные заболевания и состояния, включающие астму, острый респираторный дистресс-синдром, хроническое легочное воспалительное заболевание, бронхит, хроническое обструктивное заболевание дыхательных путей и силикоз, (3) инфекционные заболевания и состояния, включающие сепсис, септический шок, эндотоксический шок, грамотрицательный сепсис, токсический шоковый синдром, лихорадку и миалгию как следствие бактериальной, вирусной или грибковой инфекции, и грипп, (4) иммунные заболевания и состояния, включающие аутоиммунные диабеты, системную эритематозную волчанку, реакцию "трансплантант против хозяина", отторжение аллотрансплантанта, рассеянный склероз, псориаз и аллергический ринит, и (5) другие заболевания и состояния, включающие костно-резорбционные заболевания, реперфузионное повреждение, вторичную кахексию по отношению к инфекции или злокачественности, вторичную кахексию по отношению к синдрому приобретенного иммунодефицита человека (СПИД), инфекции вируса иммунодефицита человека (ВИЧ) или связанному со СПИДом комплексу (ARC), образование келоида, образование рубцовой ткани, сахарный диабет типа I и лейкемию.
8. Сочетание соединения формулы (1.0.0) по п.1 с одним или несколькими соединениями, выбранными из группы, включающей следующие соединения:
(a) ингибиторы биосинтеза лейкотриенов, ингибиторы 5-липоксигеназы (5-10) и антагонисты белка, активирующего 5-липоксигеназу (F1AP), выбранные из группы, включающей зилейтон, ABT-761, фенлейтон, тепоксалин, Abbott-79175, Abbott-85761, N-(5-замещенные)тиофен-2-алкилсульфонамиды формулы (5.2.8), 2,6-ди-трет-бутилфенолгидразоны формулы (5.2.10), Zeneca ZD-2138 формулы (5.2.11), SB-210661 формулы (5.2.12), пиридинилзамещенные 2-цианонафталиновые производные 1-739010, 2-цианохинолиновые производные 1-746530, индольные и хинолиновые соединения MK-591, MK-88 6 и BAYx1005,
(b) антагонисты рецепторов лейкотриенов 1TB4, 1TC4, 1TD4 и 1TE4, выбранные из группы, включающей фенотиазин-3-оновое производное 1-651392, амидиновое производное CGS-25019c, бензоксазоламиновое производное онтазоласта, бензолкарбоксимидамидное производное BII1-284/260, соединения зафирлукаст, аблукаст, монтелукаст, пранлукаст, верлукаст (MK-679), RG-12525, Ro-245913, иралукаст (CGP 45715A) и BAYx7195,
(c) ингибиторы PDE4,
(d) ингибиторы 5-липоксигеназы (5-10) и антагонисты белка, активирующего 5-липоксигеназу (F1AP),
(e) соединения, обладающие двойной активностью ингибиторов 5-липоксигеназы (5-10) и антагонистов фактора активации тромбоцитов (PAF),
(f) антагонисты лейкотриенов (1TRAs) 1TB4, 1TC4, 1TD4 и 1TE4,
(g) антигистаминные антагонисты рецептора H1 цетиризина, лоратадина, дезлоратадина, фексофенадина, астемизола, азеластина и хлорфенирамина,
(h) гастропротективные антагонисты рецептора H2,
(i) сосудосуживающие симпатомиметические средства, агонисты a 1- и a 2-адренорецепторов, вводимые перорально или местно для противоотечного применения, выбранные из группы, включающей пропилгекседрин, фенилэфрин, фенилпропаноламин, псевдоэфедрин, нафазолина гидрохлорид, оксиметазолина гидрохлорид, тетрагидрозолина гидрохлорид, ксилометазолина гидрохлорид и этилнорэпинефрина гидрохлорид,
(j) один или несколько агонистов a 1- и a 2-адренорецепторов, перечисленные выше в подпункте (i), в сочетании с одним шыш несколькими ингибиторами 5-липоксигеназы (5-10), перечисленными выше в подпункте (a),
(k) антихолинэргические средства - ипратропиум бромид, тиотропиум бромид, окситропиум бромид, пирензепин и телензепин,
(l) агонисты от b 1- до b 4-адренорецепторов, выбранные из группы, включающей метапротеренол, изопротеренол, изопреналин, альбутерол, салбутамол, формотерол, салметерол, тербуталин, орципреналин, битолтерол и пирбутерол,
(m) теофиллин и аминофиллин,
(n) кромогликат натрия,
(o) антагонисты мускариновых рецепторов (M1, M2 и M3),
(p) ингибиторы COX-1 (NSAID) и NSAID на основе оксида азота,
(q) селективный ингибитор COX-2 рофекоксиба,
(r) инсулиноподобные миметики фактора роста типа I (IGF-1),
(s) циклезонид,
(t) вводимые путем ингаляции глюкокортикоиды с уменьшенными системными побочными эффектами, выбранные из группы, включающей преднизон, преднизолон, флюнизолид, триамцинолона ацетонид, беклометазона дипропионат, будесонид, флютиказона пропионат и мометазона фуроат,
(u) ингибиторы триптазы,
(v) антагонисты фактора активации тромбоцитов (PAF),
(w) моноклональные антитела, активные против эндогенных компонентов, участвующих в процессе воспаления,
(x) IP1 576,
(y) агенты, направленные против фактора некроза опухоли (TNFa ), выбранные из группы, включающей этанерсепт, инфликсимаб и D2E7,
(z) DMARD, выбранные из группы, включающей лефлюномид,
(aa) пептиды TCR,
(bb) ингибиторы интерлейкин-конвертирующего фермента (ICE),
(cc) ингибиторы IMPDH,
(dd) ингибиторы молекул адгезии, включающие антагонисты V1A-4,
(ee) катепсины,
(ff) ингибиторы MAP киназы,
(gg) ингибиторы глюкозо-6-фосфатдегидрогеназы,
(hh) антагонисты кинин-B1- и B2-рецепторов,
(ii) золото в виде ауротиогруппы в сочетании с гидрофильными группами,
(jj) иммунносупрессорные агенты, выбранные из группы, включающей циклоспорин, азатиоприн и метотрексат,
(kk) противоподагрические агенты, выбранные из группы, включающей колхицин,
(ll) ингибиторы ксантиноксидазы, выбранные из группы, включающей аллопуринол,
(mm) уриколитические агенты, выбранные из группы, включающей пробенецид, сульфинпиразон и бензбромарон,
(nn) антинеопластические агенты, которые представляют собой антимитотические лекарственные средства, выбранные из группы, включающей винбластин и винкристин,
(oo) стимуляторы секреции гормонов роста,
(pp) ингибиторы металлопротеаз матрикса (MMPs), выбранные из группы, включающей стромелизины, коллагеназы, желатиназы, аггреканазы, коллагеназы-1 (MMP-1), коллагеназы-2 (MMP-8), коллагеназы-3 (MMP-13), стромелизин-1 (MMP-3), стромелизин-2 (MMP-10) и стромелизин-3 (MMP-11),
(qq) трансформирующий фактор роста (TGFb ),
(rr) тромбоцитарный фактор роста (PDGF),
(ss) фибробластный фактор роста, выбранный из группы, включающей основной фибробластный фактор роста (bFGF),
(tt) гранулоцитарный макрофаговый колониестимулирующий фактор (GM-CSF),
(uu) капсаицин,
(vv) антагонисты тахикининовых рецепторов NK1 и NK3, выбранные из группы, включающей NKP-608C, SB-233412 (талнетант) и D-4418,
(ww) ингибиторы эластазы, выбранные из группы, включающей UT-77 и ZD-08 92, и
(xx) агонисты рецептора аденозина A2a.
Текст
1 1.0 Ссылка на параллельно рассматриваемые заявки Приводится ссылка на параллельно рассматриваемую международную заявку и заявку США на ее основе, серийный номерPCT/IB98/00315, обе указанные заявки поданы 10 марта 1998 (юридический документРС 9726 А) и опубликованы как WO 98/45268 15 октября 1998; испрашивается приоритет на базе заявки с серийным номером 60/043403, поданной 4 апреля 1997 (юридический документPC9762), в настоящее время отозванной, в которой описаны никотинамидные производные, обладающие биологической активностью как ингибиторы изозима PDE4, и которые, следовательно, могут применяться при лечении воспалительных, респираторных и аллергических заболеваний и состояний. Ничто из материала, раскрытого в вышеуказанных заявках, не говорит рядовому специалисту в области, к которой относятся указанные заявки, о новых соединениях настоящего изобретения или о неожиданно высоком уровне ингибиторной активности данных соединений по отношению к изозиму PDE4. Также приводится ссылка на параллельно рассматриваемую заявку с серийным номером 09/345185, поданную 30 июня 1999 (юридический документРС 10096 А); испрашивается приоритет на базе заявки с серийным номером 60/105120, поданной 21 октября 1998 (юридический документРС 10096), в которой описаныN-замещенные никотинамидные производные и способы их получения. Однако описанные соединения и способы не являются идентичными соединениям и способам по настоящему изобретению. Далее, приводится ссылка на параллельно рассматриваемые заявки, поданные одновременно с настоящей заявкой, юридические документыРС 10523; РС 10546; РС 10657; РС 10690; и РС 10691, которые включают другие классы никотинамидных производных, которые могут применяться в качестве селективных ингибиторов изозима PDE4. 2.0 Предпосылки создания изобретения 3',5'-Циклонуклеотидфосфодиэстеразы(PDE) представляют собой большой класс ферментов, подразделяющихся по меньшей мере на одиннадцать различных семейств, которые структурно, биохимически и фармакологически отличаются одно от другого. Ферменты в пределах каждого семейства обычно относят к изоэнзимам или изозимам. Всего данный класс включает более пятнадцати генных продуктов, а дальнейшее разнообразие происходит в результате различных сплайсинга и пост трансляционного процессинга данных генных продуктов. Настоящее изобретение в основном относится к четырем генным продуктам четвертого семейства PDE, т.е., PDE4A, PDE4B, PDE4C иPDE4D. Данные ферменты вместе являются 2 изоформами или подтипами семейства изозимовPDE4. Ниже приводится более детальное обсуждение геномной организации, молекулярной структуры и ферментативной активности, характерного сплайсинга, регуляции транскрипции и фосфорилирования, распределения и экспрессии, а также селективного ингибирования подтипов изозима PDE4.PDE4 характеризуются способностью к селективному, высокоаффинному гидролитическому расщеплению вторичного мессенджера циклического нуклеотида, 3',5'-циклического аденозинмонофосфата (сАМР) и чувствительностью к ингибированию ролипрамом. В последние годы был открыт ряд селективных ингибиторов PDE4, и на ряде моделей болезней были продемонстрированы благотворные фармакологические эффекты, полученные в результате ингибирования. См., например, Torphy et al.,Environ. Health Perspect. 102 Suppl. 10, 79-84,1994; Duplantier et al., J. Med. Chem. 39 120-125,1996; Schneider et al., Pharmacol. Biochem. Behav. 50 211-217, 1995; Banner and Page, Br. J.biological activities of a series of 1pyridylnaphthalene derivatives", J. Med. Chem. 42 1088-1099, 1999. Соответственно, в данной области сохраняется повышенный интерес в отношении открытия дополнительных селективных ингибиторов PDE4. Настоящее изобретение также касается применения селективных ингибиторов PDE4 для улучшенного терапевтического лечения ряда воспалительных, респираторных и аллергических заболеваний и состояний, но особенно для лечения астмы; хронического обструктивного легочного заболевания (COPD), включая хронический бронхит, эмфизему и бронхоэктаз; хронического ринита и хронического синусита. В предыдущем уровне техники, однако, первым курсом терапии при лечении астмы и других обструктивных заболеваний дыхательных путей являлся неселективный ингибитор PDE теофиллин, а также пентоксифиллин и IBMX, которые могут быть представлены формулами (0.0.1),(0.0.2) и (0.0.3), соответственно Теофиллин, одной из биохимических мишеней которого являются PDE, в дополнение к его хорошо охарактеризованной бронходиляторной активности, оказывает влияние на сосудистую сеть пациентов с повышенным легочным артериальным давлением, подавляет воспалительный клеточный ответ и вызывает апоптоз эозинофилов. Неблагоприятные эффекты теофиллина, из которых наиболее распространенными являются сердечная аритмия и тошнота,также опосредуются ингибированием PDE, что обуславливает необходимость поиска более селективных ингибиторов PDE, способных подавлять как функции иммунных клеток in vitro, так и аллергическое легочное воспаление in vivo, и в то же время обладающих улучшенными профилями побочных эффектов. В пределах дыхательных путей пациентов, страдающих от астмы и других обструктивных заболеваний дыхательных путей, для поиска лекарственного средстваPDE4 является наиболее важным из изозимовPDE благодаря его распределению в гладкой мускулатуре дыхательных путей и в клетках,участвующих в процессе воспаления. Некоторые ингибиторы PDE4, введенные в применение в данной области, до сих пор конструировали так, чтобы они имели улучшенный терапевтический индекс относительно побочных эффектов вышеуказанных неселективных ксантинов, затрагивающих сердечно-сосудистую, желудочнокишечную и центральную нервную систему. Блокада воздушного потока и воспаление дыхательных путей являются признаками астмы, а также COPD. В то время, как бронхиальная астма преимущественно характеризуется эозинофильным воспалением, нейтрофилы, очевидно, играют главную роль в патогенезеCOPD. Таким образом, PDE, которые участвуют в релаксации гладкой мускулатуры и которые также обнаружены в эозинофилах и нейтрофилах, возможно являются необходимым звеном в развитии обоих заболеваний. Участвующие в данных процессах PDE включают PDE3 и PDE4,и были открыты ингибиторы, обладающие бронходиляторными свойствами, которые представляют собой селективные ингибиторы PDE3s и двойные селективные ингибиторы PDE3/4. Примерами данных ингибиторов являются милринон, селективный ингибитор PDE3, а также зардаверин и бенафентрин, оба являющиеся двойными селективными ингибиторами PDE3/4,которые могут быть представлены формулами Однако бенафентрин приводит к расширению просвета бронхов только при введении путем ингаляции, а зардаверин вызывает только умеренную и кратковременную бронходиляцию. Милринон, кардиотонический агент, вызывает кратковременную бронходиляцию и небольшую степень защиты от индуцированного сужения просвета бронхов, но обладает значительными неблагоприятными эффектами, например вызывает тахикардию и гипотонию. Неудовлетворительные результаты были также получены с низкоселективным ингибитором PDE4, тибенеластом, и селективным ингибитором PDE5, запринастом, которые могут быть представлены формулами (0.0.7) и (0.0.8) Более успешные результаты были получены в данной области после открытия и разработки селективных ингибиторов PDE4.In vivo ингибиторы PDE4 уменьшают приток эозинофилов в легкие стимулированных аллергеном животных, в то же время они также уменьшают сужение бронхов и повышенную бронхиальную реактивность, встречающуюся после стимуляции антигеном. ИнгибиторыPDE4 также подавляют активность иммунных клеток, включающих CD4+ Т-лимфоциты, моноциты, тучные клетки и базофилы; уменьшают отек легких; ингибируют возбудительную нонадренергическую нонхоленергическую передачу нервного сигнала (eNANC); стимулируют тормозящую нонадренергическую нонхоленергическую передачу нервного сигнала (iNANC); уменьшают митогенез гладкой мускулатуры дыхательных путей и вызывают расширение просвета бронхов. Ингибиторы PDE4 также подавляют связанную с патофизиологией COPD активность ряда участвующих в процессе воспаления клеток,включающих моноциты/макрофаги, CD8+ Т-лимфоциты и нейтрофилы. Ингибиторы PDE4 также уменьшают митогенез гладкой мускулатуры сосудов и потенциально препятствуют способности эпителиальных клеток дыхательных путей генерировать медиаторы воспаления. Посредством высвобождения из гранул нейтральных протеаз и кислых гидролаз, а также генерирования реакционноспособных разновидностей кислорода, нейтрофилы вносят вклад в разрушение тканей, 5 связанное с хроническим воспалением, и, кроме того, они участвуют в патологии таких состояний, как эмфизема. Селективные ингибиторы PDE4, которые были открыты до настоящего времени, обеспечивающие благоприятные терапевтические эффекты, включают SB-207499, идентифицированный как ARIFLO, который может быть представлен формулой (0.1.9)SB-207499, введенный перорально в дозах 5, 10 и 15 мг b.i.d., продуцирует значительное увеличение подошвы FEV1 (объема форсированного выдоха за 1 с) по сравнению с плацебо на 2 неделю исследования, включающего большое число пациентов. Другой мощный, селективный ингибитор PDE4, CDP840, показывал подавление поздних реакций на вдыхаемый аллерген через 9,5 дней перорального введения в дозах 15 и 30 мг в группе пациентов с бронхиальной астмой. CDP840 может быть представлен формулой (0.0.9)PDE также исследовали в качестве потенциальной терапии для обструктивного заболевания легких, включающего COPD. В большом исследовании SB-2074 99 на пациентах с COPD группа пациентов, получающих 15 мг b.i.d., испытывала прогрессивное улучшение в значениях подошвы FEV1 при достижении максимального среднего различия по сравнению с плацебо 160 мл на 6 неделю, что представляет собой 11% улучшение. См. Compton et al., "The efficacy of Ariflo (SB-207499), a second generation,oral PDE4 inhibitor, in patients with COPD," Am.J. Respir. Crit. Care Med. 159, 1999. Было обнаружено, что пациенты с тяжелой формой COPD имеют легочную гипертонию, а уменьшение среднего легочного артериального давления при клинических состояниях достигается путем перорального введения селективных ингибиторовPDE3 милринона и эноксимона. Было показано,что эноксимон уменьшает сопротивляемость дыхательных путей у пациентов, госпитализированных с декомпенсированной COPD. См.Leeman et al., Chest 91 662-6, 1987. Применение селективного ингибирования PDE3 мотапизоном и селективного ингибирования PDE5 запринастом показало, что совместное ингибирование PDE 3 и 5 вызывает релаксацию колец легочной артерии, которые непосредственно связаны с образцом изозимов PDE, обнаружен 005028 6 ном в гладкой мускулатуре легочной артерии. См. Rabe et al., Am. J. Physiol. 266 (LCMP 10):L536-L543, 1994. Структуры милринона и запринаста представлены выше формулами (0.0.4) и (0.0.8), соответственно. Структуры эноксимона и мотапизона могут быть представлены формулами (0.0.10) и (0.0.11), соответственно Эффекты ингибиторов PDE4, оказываемые на различные воспалительные клеточные ответы, могут использоваться в качестве базы для профилирования и выбора ингибиторов для дальнейшего исследования. Данные эффекты включают повышение уровня сАМР и ингибирование продукции супероксида, дегрануляцию,хемотаксис и высвобождение фактора некроза опухолей альфа (TNFa) в эозинофилах, нейтрофилах и моноцитах. Ингибиторы PDE4 могут вызывать тошноту и рвоту, что, как полагают,является неблагоприятным эффектом. Неблагоприятный рвотный эффект стал очевидным при первом исследовании ингибиторов PDE4 для показаний ЦНС, таких как депрессия, при применении в клинических испытаниях ролипрама и денбуфиллина. Ролипрам и денбуфиллин могут быть представлены формулами (0.0.12) и Механизм(ы), посредством которого ингибиторы PDE4 потенциально могут вызывать рвоту, является неопределенным, но исследование ингибитора PDE4 RO-20-1724 позволяет предположить, что тошнота и рвота, по меньшей мере частично, опосредуются рвотными центрами в мозге. Неблагоприятное воздействие на желудочно-кишечный тракт может быть вызвано локальными эффектами, например ролипрам является очень мощным стимулятором секреции кислоты из париетальных клеток желудка, и получившийся в результате избыток кислоты посредством местного раздражения может вызывать обострение желудочно-кишечных нарушений. RO-20-1724 может быть представлен формулой (0.0.14) Усилия, предпринятые для минимизации или устранения вышеуказанных неблагоприятных эффектов, иногда связанных с ингибиторами PDE4, включали создание ингибиторов, которые не проникают в центральную нервную систему, и введение ингибиторов PDE4 скорее посредством ингаляции, чем перорально. 7 В отношении подтипов PDE4 А, В, С и D,было обнаружено, что PDE4C обычно является менее чувствительным ко всем ингибиторам; тогда как в отношении подтипов А, В и D еще не существует четких данных по специфичности ингибиторов, которая определяется как 10 кратное различие в значениях IС 50. Хотя большинство ингибиторов, особенно RS-25344, являются более активными против PDE4D, это не считается селективностью. RS-25344 может быть представлен формулой (0.0.15) С другой стороны, существует стереоселективный эффект, состоящий в повышении уровня сАМР в ряде типов клеток, который был продемонстрирован результатами исследования(0.0.9), и его менее активного энантиомера СТ 1731, который представлен формулой (0.0.16) Ранее было известно, что ролипрам имеет способность взаимодействовать с высокоаффинным связывающим сайтом, расположенным на мембранах мозга, а позднее в данной области было установлено, что указанный сайт, связывающий ролипрам высоким сродством к (Sr),который отличается от каталитического сайтаPDE4B. Позднее Sr был идентифицирован для всех четырех подтипов PDE4. См. Hughes et al.,Drug Discovery Today 2(3) 89-101, 1997. Присутствие Sr имеет большое значение для реализации способности некоторых ингибиторов, таких как ролипрам и RS-25344, ингибировать каталитическую активность изозимов PDE4. Влияние остатков на связывание ингибитора также является существенным. Было показано, что одиночная аминокислотная заменаPDE4B является критической для ингибирования ролипрамом, что является общим эффектом,так как родственные ингибиторы RP-73401 иRo-20-1724 также утрачивают активность по отношению к мутантному фементу. Однако роль связывания ингибиторов с Sc или Sr в повышении уровня сАМР и ингибирования клеточных ответов в настоящее время полностью не ясна. В исследованиях, проводимых на морских свинках, было обнаружено, что RP-73401 явля 005028Pulm. Pharmacol. 8 37-42, 1995; (2) антигениндуцированной бронхоальвеолярной оросительной (BAL) эозинофилии, Raeburn et al.,"Anti-inflammatory and bronchodilator propertiesof RP73401, a novel and selective phosphodiesterase Type IV inhibitor," Br. J. Pharmacol. 113 14231431, 1994; (3) антиген-индуцированной эозинофилии дыхательных путей, а также гиперреактивности дыхательных путей (AHR), индуцированной фактором активации тромбоцитовRP-73401, пикламиласта, была прекращена. Пикламиласт может быть представлен формулой (0.0.17) Родственные серии соединений представлены RPR-132294 и RPR-132703, которые, как было показано в исследованиях на крысах, обладают активностью в отношении ингибирования антиген-индуцированного бронхоспазма;inhibitors," XVth EFMC Int. Symp. Med. Chem.,1998. Структура RPR-132294 может быть представлена формулой (0.0.18) Другим соединением, разработка которого была прекращена, является WAY-PDA-641, филаминаст, который, как было показано в экспериментах, проведенных на собаках, является активным в отношении ингибирования серотонининдуцированного сужения просвета бронхов. Филаминаст может быть представлен формулой (0.0.19) Как полагают в данной области, ингибиторы PDE4, которые имеют высокое сродство к Sr,могут коррелировать с рвотой и повышенной секрецией желудочной кислоты. RS-23544, RP73401 и СР-80633 вызывают рвоту и имеют высокое сродство к Sr. CDP840 и SB-207499 обладают сравнительно низким сродством к Sr, но сродство CDP840 к Sc значительно выше, чем уCDP840 обеспечивает существенное ингибирование позднего ответа при лечении астмы без каких-либо нежелательных эффектов в виде рвоты или головной боли. Другим ингибиторомPDE4, который, как было показано, имеет неблагоприятные эффекты в виде тошноты и рвоты, является BRL-61063, также именуемый ципамфиллин, который дополнительно описан ниже. Разработка CDP840 была прекращена,тогда как СР-80633, атизорам, продолжают разрабатывать. СР-80633 и BRL-61063 могут быть представлены формулами (0.0.20) и (0.1.12),соответственно Другим разрабатываемым соединением является LAS-31025, арофиллин, который, как было обнаружено в экспериментах, проводимых на морских свинках, является активным в отношении ингибирования антиген-индуцированного сужения просвета бронхов; Beleta, В. J.,"Characterization of LAS31025: a new selectiveFrom Genes to Therapies, Glasgow, UK, 1996,Abstract 73. LAS-31025, арофиллин, может быть представлен формулой (0.0.21) Проводится успешная разработка ряда ингибиторов PDE4. Например, влияние V-11294A на LPS-стимулированное высвобождение TNFex vivo и РНА-индуцированную пролиферацию лимфоцитов определяли в рандомизированном,дважды слепом, плацебо-контролируемом исследовании, где было обнаружено, что пероральная доза, составляющая 300 мг, является эффективной для уменьшения уровней TNF иA611, 1999. Соединение D4418 вводили здоровым добровольцам в рандомизированном плацебоконтролируемом исследовании фазы I с однократной повышающейся дозой; Montana et al.,"Activity of D4418, a novel phosphodiesterase 4Respir. Crit. Care Med. 159 A108, 1999. D4418 является умеренно активным ингибиторомPDE4 с IC50, равным 200 нМ. Он хорошо абсорбируется при пероральном применении; доза 200 мг обеспечивает Сmах в плазме 1,4 мкг/мл. Разработка D4418 была прекращена из-за его умеренной активности и он был заменен на проходящее предклиническую разработку тестируемое соединение D4396.V-11294A и D4418 могут быть представлены формулами (0.0.22) и (0.0.23), соответственно Другое соединение, CI-1018, испытывали на 54 субъектах, и неблагоприятные эффекты не были обнаружены при применении доз до 400 мг; Pruniaux et al., "The novel phosphodiesteraseeosinophilia in sensitized brown-norway rats comparision with rolipram," Inflammation S-04-6,1999. Было продемонстрировано, что CI-1018 обладает хорошей биодоступностью при пероральном применении (57% у крыс) и хорошей активностью при пероральном применении сED50, равным 5 мг/кг, у тех же видов. CI-1018 является относительно слабым ингибиторомU937. CI-1018 был идентифицирован как имеющий структуру или ассоциированный со структурой, близко родственной PD-168787,который, как было показано в исследованиях,проводимых на крысах, обладает активностью в отношении ингибирования антиген-индуцированной эозинофилии; Pascal et al., "Synthesis Вышеуказанные соединения также исследовали на животных моделях, в результате чего была продемонстирована их PDE4-ингибирующая активность. Например, в экспериментах, проводимых на морских свинках, было обнаружено, что V-11294A является активным в отношении ингибирования антиген-индуцированного сужения просвета бронхов; CavallaMed, 155 A660, 1997. В экспериментах, проводимых на морских свинках, было обнаружено,что В 4418 является активным в отношении ингибирования ранней и поздней фазы антигениндуцированного сужения просвета бронхов иthe novel phosphodiesterase Type 4 inhibitor, CI1018," 215th ACS Nat. Meeting, MEDI 008, 1998. Другие успешно разрабатываемые соединения включают CDC-3052, D-22888, YM-58997 и рофлумиласт, которые могут быть представлены формулами (0.0.27), (0.0.28), (0.0.29) и Разработка CDC-3052 была прекращена, но был достигнут успех в разработке очень активных ингибиторов PDE4, таких как соединение,представленное формулой (0.0.31), и противовоспалительного соединения CDC-801, представленного формулой (0.0.32), соответственно Было опубликовано, что соединение формулы (0.0.32) имеет значения IC50, составляющие 42 пМ и 130 нМ для ингибирования PDE4 и продукции TNF, соответственно; Muller et al.,"N-Phthaloyl beta-aryl-beta-amino derivatived:CDC-801 принадлежит к ряду соединений,в основе которых лежит талидомид, оно разрабатывалось в основном для улучшения TNF-ингибирующей активности талидомида для лечения аутоиммунных заболеваний. Талидомид может быть представлен формулой (0.0.33) Исследовали также пригодность CDC-801 для лечения болезни Крона, хронического грануломатозного воспалительного заболевания неизвестной этиологии, обычно включающего концевой участок подвздошной кишки, с рубцеванием и утолщением стенки кишечника, которые часто приводят к закупорке кишечника и образованию фистулы и абсцесса. Болезнь Крона имеет высокую частоту рецидива после лечения.American Chemical Society, Las Vegas, USA,MEDI 245, 1997. YM-58997 имеет структуру 1,8 нафтиридин-2-он, как и YM-976. Исследовали возможность применения рофлумиласта для лечения как COPD, так и астмы, значение ICso для него составляет 3,5 нМ,как определно на стандартных in vitro моделях астмы у морских свинок. Также было описано применение рофлумиласта и поверхностноактивного вещества для лечения респираторного дистресс-синдрома взрослых (ARDS). Было показано, что AWD-12281, который теперь называют лотепреднол, является активным на крысиной модели аллергического ринита, как дополнительно описано ниже в разделе,касающемся аллергического ринита и применения ингибиторов PDE4 для его лечения. AWD12281 может быть представлен формулойCDP840, приведенному также выше в виде формулы (0.0.9), включают L-82 6141, который,как было опубликовано, обладает активностью на крысиной модели бронхита; Gordon et al.,"Anti-inflammatory effects of a PDE4 inhibitor in aCrit. Care Med. 159 A33, 1999. Другое такое соединение является родственным по структуре соединениям, опубликованным в Perrier et al.,"Substituted furans as inhibitors of PDE4 enzyme,"(Ach)-индуцированного AHR; PAF-индуцированных BAL эозинофилии и нейтрофилии, а также AHR; антиген-индуцированного бронхоспазма; и анафилактического сужения просвета бронхов; Fujimura et al., "Bronchoprotective effects of KF-19514 cilostazol in guinea-pigs inbronchodilator. KF17625," Jpn. J. Pharmacol. 58(Suppl. 1) 238P, 1992. KF19514 и KF17625 могут быть представлены формулами (0.0.41) и Другими соединениями, которые, как было обнаружено, являются очень мощными ингибиторами PDE4, являются соединения, представленные формулами (0.0.36), (0.0.37) и (0.0.38) Были созданы соединения, которые объединяют ингибиторную активность по отношению к PDE4 и металлопротеиназе матрикса в одной молекуле; Groneberg et al., "Dual inhibitionof phosphodiesterase 4 and matrix metalloproteinases by an (arylsulfonyl)hydroxamic acid template," J. Med. Chem. 42(4) 541-544, 1999. Два примера таких соединений представлены формулами (0.0.39) и (0.0.40) Соответственные значения IC50 для соединений формул (0.1.36) и (0.1.37), полученные при использовании анализа PDE4 макрофагов морских свинок, составляли 1 нМ и 30 нМ. С помощью экспериментов, проводимых на морских свинках, было показано, что соединения, идентифицированные как KF19514 иKF17625, обладают активностью в отношении ингибирования следующих событий: гистамининдуцированного и антиген-индуцированного сужения просвета бронхов; PAF-индуцированной эозинофилии легких и антиген-индуцированной BAL эозинофилии; ацетилхолин Приведенная активность ряда индандионов и отсутствие рвоты при их применении позволяет предположить, что гипотеза, которая связывает побочные эффекты, такие как рвота, с отношением сродства к ферменту PDE4 к сродству к высокоаффинному сайту связывания ролипрама (HARBS) является ошибочным. Такие индандионы могут быть представлены формулами (0.0.43) и (0.0.44) Созданные прежде ингибиторы PDE4 по своим химическим структурам относятся к большому числу разных классов. Такие классы отличаются так, как отличаются фенантридины и нафтиридины. Одним классом ингибиторовPDE4 являются лигнаны, такие как Т-440, который, как было показано, обладает активностью в отношении ингибирования следующих событий: ранней фазы сужения просвета бронхов,вызванного антигеном, гистамином, LTD4, U46619, Ach, нейрокинином А и эндотелином-1; аллерген-индуцированной ранней фазы и поздней фазы сужения просвета бронхов и BAL эозинофилии; и озон-индуцированных AHR и повреждения эпителия дыхательных путей. Оптимизация РDЕ 4-ингибирующей активности таких соединений привела к открытию Т-2585, одного из наиболее активных ингибиторов PDE4, опи 15 санных до настоящего времени, имеющего значение IC50 0,13 нМ для ингибирования PDE4 из легких морских свинок. Т-440 и Т-2585 могут быть представлены формулами (0.0.45) и Другой класс ингибиторов PDE4 состоит из бензофуранов и бензотиофенов. В частности,фурановый и хромановый циклы использовались в качестве заменителей циклопентилового эфира ролипрамового фармакофора. Примером такого соединения является соединение, родственное по структуре BAY 19-8004, и которое может быть представлено формулой (0.0.47) Было опубликовано другое соединение бензофуранового типа, которое имеет значениеIC50 2,5 нМ и может быть представлено формулой (0.0.48) Соединение с родственной структурой, которое, однако, не является бензофураном, характеризуется конденсированным диоксициновым циклом и, как было опубликовано, обеспечивает почти полное ингибирование PDE4 из трахеи собаки при 100 нМ. Данное соединение может быть представлено формулой (0.0.4 9) Хинолины и хинолоны являются другим классом структур, относящихся к ингибиторамPDE4, они служат заменителями катехолового фрагмента ролипрама. Данное соединение и два соединения с подобной структурой могут быть представлены формулами (0.0.50), (0.0.51) и Диазепиноиндолы представляют другой структурный класс соединений, к которому принадлежат некоторые ингибиторы PDE4,описанные в данной области. Ингибиторы PDE4CI-1018 и PD-168787, описанные также выше,принадлежат к данному классу соединений. Другой пример диазепиноиндола, который, как было опубликовано, имеет IC50, составляющий 3 нМ для ингибирования PDE4 из клеток U937,может быть представлен формулой (0.0.53) Пурины, ксантины и птеридины представляют следующие классы химических соединений, к которым принадлежат ингибиторы PDE4,описанные ранее в данной области. СоединениеV-11294A, описанное также выше и представленное формулой (0.0.22), является пурином. В данной области был описан ингибитор PDE4,который относится к ксантиновым соединениям, классу, к которому принадлежит теофиллин;analogues," Bioorg. Med. Chem. Letts. 8 29252930, 1998. Ксантиновое соединение может быть представлено формулой (0.0.54)PDE4, принадлежащий к классу птеридиновых соединений, имеет IC50, составляющий 16 нМ для ингибирования PDE4, полученного из опухолевых клеток, и ингибирует рост опухолевых клеток в микромолярных концентрациях; Merzmalignant tumor cell growth," J. Med. Chem. 41(24) 4733-4743, 1998. Птеридиновый ингибитор PDE4 может быть представлен формулой Триазины представляют очередной класс химических соединений, к которому принадлежат ингибиторы PDE4, описанные ранее в данной области. Были описаны два таких триазина,которые проявляют бронходиляторную активность и являются мощными релаксирующими агентами на трахейной модели морских свинок. Данные соединения, которые могут быть представлены приведенными ниже формулами(0.0.56) и (0.0.57), также являются умеренно актвными ингибиторами PDE4 со значениями Триазином, имеющим структуру, которую принимают как близко родственную структуре соединений формул (0.0.56) и (0.0.57), являетсяUCB-29936, который, как было показано, обладает активностью на мышиной модели септического шока; Danhaive et al., "UCB29936, a selective phosphodiesterase Type IV inhibitor: therapeutic potential in endotoxic shock," Am. J. Respir.Crit. Care. Med. 159 A611, 1999. В данной области были предприняты усилия для улучшения селективности ингибиторовPDE4 в отношении подтипов от А до D, также описанных ниже. В настоящее время известны четыре изоформы (подтипа) изозима PDE4, охватывающие семь вариантов, образующихся после сплайсинга, также описанные выше. мРНК изоформы PDE4D экспрессируется в воспалительных клетках, таких как нейтрофилы и эозинофилы, и в данной области полагают, чтоD-селективные ингибиторы PDE4 будут обеспечивать хорошую клиническую эффективность при уменьшенных побочных эффектах. Было описано никотинамидное производное, обладающее селективностью по отношению к ингибированию изоформы PDE4D; WO 98/45268; а также нафтиридиновое производное, являющееся селективным ингибитором PDE4D; WO 98/18796. Данные соединения могут быть представлены формулами (0.0.58) и (0.0.59), соответственно 18 В данной области было описано другое никотинамидное соединение, которое может применяться для лечения CNS заболеваний, таких как рассеянный склероз; GB-2327675; также в данной области было описано ролипрамовое производное, являющееся ингибитором PDE4,который связывается с одинаковым сродством как с каталитическим сайтом, так и с сайтомHARB, на человеческом PDE4B2B; Tian et al.,"Dual inhibition of human Type 4 phosphodiesterase isostates by (R, R)-(+/-)-methyl-3-acetyl-4-[3(cyclopentyloxy)-4-methoxyphenyl]-3-methyl-1pirrolidine carboxylate," Biochemistry 37(19) 6894-6904, 1998. Никотинамидное производное и ролипрамовое производное могут быть представлены формулами (0.0.60) и (0.0.61), соответственно Дополнительная информация по предпосылкам создания изобретения, касающаяся селективных изозимов PDE4, может быть обнаружена в публикациях, доступных в данной области, например, Norman, "PDE4 inhibitors 1999,"WO 98/45268 (Marfat et al.), опубликованная 15 октября 1998, раскрывает никотинамидные производные, обладающие активностью как селективные ингибиторы изозима PDE4D. Данные селективные ингибиторы представлены формулой (0.1.1)US 4861891 (Saccomano et al.), опубликованный 29 августа 1989, раскрывает никотинамидные соединения формулы (0.1.2), функционирующие как ингибиторы кальцийнезависимой с-АМР фосфодиэстеразы, которые могут применяться в качестве антидепрессантов Никотинамидное ядро типичного соединения, раскрытого в данном патенте, непосредственно связано с группой R1, которая определяется как 1-пиперидил, 1-(3-индолил)этил, С 1-С 4 алкил, фенил, 1-(1-фенилэтил) или бензил, необязательно монозамещенный метилом, меток 19(0.1.4) где n равно 0-3; R1 может быть выбран из многочисленной группы, но обычно он обозначает Н, 6-СН 3 или 5-Сl; R2 обозначает алкил, алкенил, алкинил, циклоалкил, арил или аралкил; R1 и R2 обзначают галоген, CN, NO2, алкил, галогеналкил, алкокси, галогеналкокси, алкилтио, галогеналкилтио, алкилсульфонил, галогеналкилсульфонил, арил, арилокси или арилтио; и R4 обозначает алкил. ЕР 500989 (Mollner et al.) раскрывает ингибиторы АСЕ формулы (0.1.5)N(R4)2, где R4 обозначает низший алкил, необязательно замещенный арил или ацил; R1 обозначает ОН, низший алкокси, необязательно замещенный арил низший алкокси, арилокси или дизамещенную аминогруппу; R2 обозначает низший алкил или амино-низший алкил; и R1 иR2 обзначают галоген, NO2, низший алкил, галоген-низший алкил, арил-низший алкил или арил. Конкретные раскрытые воплощения включают такие соединения, как имеющие формулу (0.1.6) где R обозначает 1 или 2 заместителя, выбранных из низшего алкила, тригалогенметила, алкокси и галогена; R1 обозначает Н или алкил иR" обозначает водород или алкил.JP 07304775 (Otsuka et al.) раскрывает нафтиридиновые и пиридопиразиновые производные, которые обладают противовоспалительным, иммуномодулирующим, анальгетическим,антипиретическим, антиаллергическим и антидепрессивным действием. Также раскрываются промежуточные соединения формулы (0.1.8) где X может обозначать СН, a R и R' каждый обозначают низший алкил. В отношении раскрытий указанных выше патентов и опубликованных патентных заявок,можно оценить, что только раскрытие WO 98/45268 (Marfat et al.) касается ингибирования изозима PDE4. Существующий уровень техники также содержит информацию, касающуюся соединений, полностью отличных по химической структуре от соединений формулы (1.0.0) настоящего изобретения, но которые, с другой стороны, обладают биологической активностью,подобной активности соединений формулыUS 5552438; US 5602157 и US 5614540 (автором которых является Christensen), имеющие одинаковую дату приоритета, 2 апреля 1992,относятся к терапевтическому агенту, определенному как ARIFLO, который является соединением формулы (0.1.9) и называется, как указано ниже Соединение формулы (0.1.9) входит в объем US 5552438, который раскрывает класс соединений формулы (0.1.10)R14=Н. Описания US 5602157 и US 5614540 отличаются от описания US 5552438 и друг от друга по определению группы R3, которая в случае соединения ARIFLO обозначает CN. Предпочтительная солевая форма соединенияUS 5863926 (Christensen et al.) раскрывает аналоги соединения ARIFLO, например,имеющие формулу (0.1.11)WO 99/18793 (Webb et al.) раскрывает способ получения ARIFLO и родственных соединений. WO 95/00139 (Barnette et al.) заявляет соединение, которое имеет соотношение IC50,составляющее 0,1 или выше, что касается IC50 для каталитической формы PDE IV, связывающей ролипрам с высоким сродством, деленному на IC50 для формы, связывающей ролипрам с низким сродством; но в независимом пункте формулы изобретения ограничивает его объем соединением, которое не было известно как ингибитор PDE4 до 21 июня 1993.WO 99/20625 (Eggleston) раскрывает кристаллические полиморфные формы ципамфиллина, предназначенные для лечения PDE4- иWO 99/20280 (Griswold et al.) раскрывает способ лечения зуда путем введения эффективного количества ингибитора PDE4, например,соединения формулы (0.1.13)US 5922557 (Роn) раскрывает клеточную линию СНО-K1, которая стабильно экспрессирует высокие уровни полноразмерного сАМРспецифического фермента с низкой Km, который, в свою очередь, используют для исследования активных ингибиторов фермента PDE4, и сравнивает порядок величин их активностей в отношении увеличения уровня сАМР в препаратах целых клеток с их способностью ингибировать фосфодиэстеразную активность в препаратах разрушенных клеток. Также упоминается о том, что обнаружено, что анализ ингибирования растворимого фермента, описанный в предыдущем уровне техники, не отражает характера действия ингибиторов in vivo. Затем раскрывается улучшенный анализ растворимого фермента на целых клетках, который, как утверждается,отражает характер действия ингибиторов invivo. Далее раскрывается, что существует по меньшей мере четыре различных изоформы или подтипа PDE4 и что каждый подтип, как показано, приводит к получению после сплайсинга ряда вариантов, которые, в свою очередь, могут иметь различную клеточную локализацию и различное сродство к ингибиторам. В отношении раскрытий вышеуказанных патентов и опубликованных патентных заявок,можно оценить, что включенные в них соединения обладают такой же биологической активностью в отношении ингибирования PDE4, как и соединения формулы (1.0.0). В то же время, однако, специалист в данной области увидит, что химические структуры указанных соединений,раскрытые в предыдущем уровне техники, не только отличаются друг от друга, но также отличаются от новых соединений настоящего изобретения. Существующий уровень техники включает также и другую информацию, касающуюся соединений, отличающихся по химической структуре от соединений формулы (1.0.0),и которые кроме того не обладают РDЕ 4 ингибирующей активностью, подобной активности соединений формулы (1.0.0). Такие соединения, раскрытые в предыдущем уровне техники, тем не менее, часто имеют терапевтическое применение, подобное тому, которое имеют соединения формулы (1.0.0), т.е., при лечении воспалительных, респираторных и аллергических заболеваний и состояний. В особенности, это применимо к некоторым ингибиторам ферментов и антагонистам рецепторов,участвующим в так называемом лейкотриеновом пути. Особенно, в случае, касающемся лейкотриенов LTB4 и LTD4. Соответственно, типичные патенты и опубликованные патентные заявки, раскрывающие дополнительную информацию данного типа, описаны ниже. 23 Метаболизм арахидоновой кислоты происходит под действием циклооксигеназы-1 и 5 липоксигеназы. 5-Липоксигеназный путь приводит к продукции лейкотриенов (LT), которые принимают участие в реализации воспалительного ответа посредством эффекта, который они оказывают на аггрегацию нейтрофилов, дегрануляцию и хемотаксис; проницаемость сосудов; сокращение гладкой мускулатуры; а также на лимфоциты. Цистеинильные лейкотриены,LTC4, LTD4 и LTE4, играют важную роль в патогенезе астмы. Компоненты лейкотриенового пути, которые являются мишенями для терапевтического вмешательства, показаны на следующей диаграмме: Другим типом вышеуказанных терапевтических мишеней является рецептор LTB4, а примером антагониста указанного рецептора является BIIL-260, терапевтический агент, который может быть представлен формулой (0.1.17) Другим примером терапевтического агента, являющегося антагонистом рецептора LTB4,является CGS-25019c, который может быть представлен формулой (0.1.18) Соответственно, агенты, которые способны вмешиваться в какую-либо стадию 5-липоксигеназного пути, могут применяться для терапевтического лечения. Примером одного из таких агентов является ингибитор 5-липоксигеназы, зилейтон, терапевтический агент, идентифицированный как ZYFLO, который может быть представлен формулой (0.1.14) В вышеописанном уровне техники отсутствуют материалы, раскрывающие или предлагающие специалисту новые соединения настоящего изобретения или их РDЕ 4-ингибирующую активность, а также полученное в результате существенное улучшение терапевтического применения и терапевтического индекса при лечении воспалительных, респираторных и аллергических заболеваний и состояний. 4.0 Краткое содержание изобретения Настоящее изобретение относится к соединению формулы (1.0.0) Другим таким агентом является антагонист рецептора LTD4, зафирлукаст, терапевтический агент, идентифицированный как ACCOLATE,который может быть представлен формулой или его фармацевтически приемлемой соли, Другим таким антагонистом рецептораLTD4 является монтелукаст, терапевтический агент, идентифицированный как SINGULAIR,который может быть представлен формулой где R1 обозначает -Н, -F или -Сl,R2 обозначает -Н, -F, -Сl или -СН 3,RD обозначает -Н или -СН 3,ZB обозначает фенил, циклопентил, циклогексил, фуранил, тиенил, тиазолил, оксазолил,индолин-2-онил, пиридил или пиразинил,Е обозначает -Н, -F, -ОСН 3, -ОН,-СН(ОН)СН 3,-СН(ОН)(СН 3)2,-OC(=O)R12,-NHS (=O)2CH3, -S(=O)2NH2, -NH2 или -N(CH3)2,ZA обозначает фенил или пиридил, где R4 представлен дважды и обозначает -F или -Сl,или же R4 является единственным заместителем,представляющим собой -F, -Сl, -CN, -NO2, -NH2,-N(CH3)2, -CF3, -SCH3, -OCH3, -OCH2CH3, 25-C(=O)CH3, -C(=O)OCH3, -CONH2, -NHS(=O)2CH3,или ZA обозначает фенил, где два R4, взятые вместе с атомами углерода, к которым они присоединены, и фенильным циклом, частью которого они являются, образуют индолил, хинолинил, 1,3-бензодиоксолил, бензоксазолил,1,3-бензодитиолил, бензотиазолил, бензимидазолил или 1,4-бензодиоксанил,R7 и R8, каждый независимо, выбраны из группы, включающей -Н, -F, -Сl, -OR12, (С 1-С 4) алкил, гидрокси(С 1-С 4)алкил, -CF3, -C(=O)OR12,-NR12R13, гидрокси (С 1-С 4)алкиламино, фенил,бензил или гетероциклильный радикал, выбранный из группы, включающей пирролил, оксазолил, тиазолил, оксадиазолил, тиадиазолил, имидазолил, пиридинил, тетразолил, индолил и бензимидазолил, где каждый из указанных фенильного, бензильного или гетероциклильного радикалов независимо замещен 0-2 заместителямиR12 и R13 каждый обозначают радикал, независимо выбранный из группы, включающей-Н, -(С 1-С 4)алкил, фенил или бензил, где указанные алкил, фенил или бензил замещены 0-3 заместителями, выбранными из группы, состоящей из F и Сl. Настоящее изобретение далее касается фармацевтической композиции, предназначенной для применения при лечении субъекта,страдающего от заболевания, нарушения или состояния, опосредованного изозимом PDE4,участвующим в регуляции активации и дегрануляции эозинофилов, содержащей терапевтически эффективное количество соединения формулы (1.0.0) и фармацевтически приемлемый носитель. Настоящее изобретение относится к применению терапевтически эффективного количества соединения формулы (1.0.0) для изготовления лекарственного средства для лечения субъекта, страдающего от заболевания, нарушения или состояния, опосредованного изозимомPDE4, участвующим в регуляции активации и дегрануляции эозинофилов. Указанное заболевание, нарушение или состояние включает одно или несколько заболеваний, выбранных из группы, включающей астму любого типа, этиологии или патогенеза, астму, которая является заболеванием,выбранным из группы, включающейм атопическую астму, неатопическую астму, аллергическую астму, атопическую, бронхиальную, IgEопосредованную астму, бронхиальную астму,идиопатическую астму, подлинную астму, врожденную астму, вызванную патофизиологическими нарушениями, приобретенную астму,вызванную факторами окржающей среды, эс 005028 26 сенциальную астму неизвестного или неочевидного происхождения, неатопическую астму,бронхитическую астму, эмфизематозную астму,астму, вызванную упражнениями, профессиональную астму, инфекционную астму, вызванную бактериальной, грибковой, протозойной или вирусной инфекцией, неаллергическую астму, начальную стадию астмы, синдром стридора у детей,хроническое или острое сужение просвета бронхов, хронический бронхит, обструкцию малых дыхательных путей и эмфизему,обструктивные или воспалительные заболевания дыхательных путей любого типа, этиологии или патогенеза, или обструктивное или воспалительное заболевание дыхательных путей, которое представляет собой заболевание,выбранное из группы, включающей астму,пневмокониоз, хроническую эозинофильную пневмонию, хроническое обструктивное легочное заболевание (COPD), COPD, которое включает хронический бронхит, легочную эмфизему или связанную с ней одышку, COPD, которое характеризуется необратимой прогрессирующей обструкцией дыхательных путей, респираторный дистресс-синдром взрослых (ARDS) и обострение гиперреактивности дыхательных путей вследствие другой лекарственной терапии,пневмокониоз любого типа, этиологии или патогенеза или пневмокониоз, который представляет собой заболевание, выбранное из группы, включающей алюминоз, заболевание,встречающееся у рабочих, контактирующих с алюминиевой рудой, антракоз или астму шахтеров, асбестоз или астму слесарей-паропроводчиков, халикоз или заболевание резчиков по камню, птилоз, вызванный вдыханием пыли от перьев страусов, сидероз, вызываемый вдыханием частиц железа, силикоз или заболевание шлифовальщиков, биссиноз или хлопковопылевую астму и тальковый пневмокониоз,бронхит любого типа, этиологии или патогенеза или бронхит, который представляет собой заболевание, выбранное из группы, включающей острый бронхит, острый ларинготрахеальный бронхит, арахидный бронхит, катаральный бронхит, крупозный бронхит, сухой бронхит, инфекционный астматический бронхит, продуктивный бронхит, стафиллококковый или стрептококковый бронхит и везикулярный бронхит,бронхоэктаз любого типа, этиологии или патогенеза или бронхоэктаз, который представляет собой заболевание, выбранное из группы,включающей цилиндрический бронхоэктаза,мешкообразный бронхоэктаз, веретенообразный бронхоэктаз, капиллярный бронхоэктаз, кистозный бронхоэктаз, сухой бронхоэктаз и фолликулярный бронхоэктаз,сезонный аллергический ринит, или постоянный аллергический ринит, или синусит любого типа, этиологии или патогенеза, или синусит, 27 который представляет собой заболевание, выбранное из группы, включающей гнойный или негнойный синусит, острый или хронический синусит и синусит решетчатой, лобной, верхнечелюстной или клиновидной пазух,ревматоидный артрит любого типа, этиологии или патогенеза, или ревматоидный артрит, который представляет собой заболевание,выбранное из группы, включающей острый артрит, острый подагрический артрит, хронический воспалительный артрит, дегенеративный артрит,инфекционный артрит, артрит Лайма, пролиферативный артрит, псориатический артрит и позвонковый артрит,подагру, а также лихорадку и боль, связанные с воспалением,связанное с эозинофилами нарушение любого типа, этиологии или патогенеза или связанное с эозинофилами нарушение, которое представляет собой заболевание, выбранное из группы, включающей эозинофилию, легочную инфильтрационную эозинофилию, синдрома Лоффлера, хроническую эозинофильную пневмонию, тропическую легочную эозинофилию,бронхопневмонический аспергиллез, аспергиллому, гранулему, содержащую эозинофилы,аллергический гранулематозный ангиит или синдром Чург-Штраусса, нодозный полиартерит(PAN) и системный некротизирующий васкулит,атопический дерматит, или аллергический дерматит, или аллергическую или атопическую экзему,крапивницу любого типа, этиологии или патогенеза, или крапивницу, которая представляет собой заболевание, выбранное из группы,включающей иммунно-опосредованную крапивницу, комплемент-опосредованную крапивницу, крапивницу, вызванную уртикариогенным веществом, крапивницу, вызванную физическим агентом, стресс-индуцированную крапивницу,идиопатическую крапивницу, острую крапивницу, хроническую крапивницу, ангиоэдему,холинэргическую крапивницу, холодную крапивницу в аутосомной доминантной форме или в приобретенной форме, контактную крапивницу, гигантскую крапивницу и папулезную крапивницу,конъюнктивит любого типа, этиологии или патогенеза или конъюнктивит, который представляет собой заболевание, выбранное из группы, включающей актинический конъюнктивит,острый катаральный конъюнктивит, острый контагиозный конъюнктивит, аллергический конъюнктивит, атопический конъюнктивит,хронический катаральный конъюнктивит, гнойный конъюнктивит и хронический двусторонний конъюнктивит,увеит любого типа, этиологии или патогенеза, или увеит, который представляет собой заболевание, выбранное из группы, включающей воспаление всего или части увеального 28 тракта, переднего увеита, ирита, циклита, иридоциклита, грануломатозного увеита, негрануломатозного увеита, факоантигенного увеита,заднего увеита, хороидита и хориоретинита,псориаз,рассеянный склероз любого типа, этиологии или патогенеза, или рассеянный склероз,который представляет собой заболевание, выбранное из группы, включающей первичный прогрессирующий рассеянный склероз и рецидивирующий ремиттирующий рассеянный склероз,аутоиммунные/воспалительные заболевания любого типа, этиологии или патогенеза или аутоиммунное/воспалительное заболевание,которое представляет собой заболевание, выбранное из группы, включающей аутоиммунные гематологические нарушения, гемолитическую анемию, апластическую анемию, чистую анемию красных кровяных клеток, идиопатическую тромбоцитопеническую пурпуру, системную красную волчанку, полихондрит, склеродерму,гранулематоз Вегнера, дерматомиозит, хронический активный гепатит, тяжелую миастению,синдром Стивенса-Джонсона, идиопатическое спру, аутоиммунные воспалительные заболевания кишечника, язвенный колит, болезнь Крона,эндокринную офтальмопатию, болезнь Грейвса,саркоидоз, альвеолит, хронический гиперчувствительный пневмонит, первичный биллиарный цирроз, ювенильный диабет или сахарный диабет I типа, передний увеит, грануломатозный или задний увеит, высушивающий кератоконъюнктивит, эпидемический кератоконъюнктивит,диффузный интерстициальный легочный фиброз или интерстициальный фиброз легких,идиопатический легочный фиброз, кистозный фиброз, псориатический артрит, гломерулонефрит с нефротическим синдромом или без него,острый гломерулонефрит, идиопатический нефротический синдром, нефропатию с минимальными изменениями, воспалительные/гиперпролиферативные кожные заболевания, псориаз,атопический дерматит, контактный дерматит,аллергический контактный дерматит, доброкачественная семейная пузырчатка, эритематозная пузырчатка, листовидная пузырчатка и обыкновенная пузырчатка,профилактику отторжения аллогенного трансплантанта после трансплантации органа,воспалительное заболевание кишечника(IBD) любого типа, этиологии или патогенеза или воспалительное заболевание кишечника,которое представляет собой заболевание, выбранное из группы, включающей язвенный колит (UC), коллагеновый колит, полипозный колит, трансмуральный колит и болезнь Крона(CD),септический шок любого типа, этиологии или патогенеза или септический шок, который представляет собой заболевание, выбранное из группы, включающей почечную недостаточ 29 ность, острую почечную недостаточность, кахексию, малярийную кахексию, гипофизарную кахексию, уремическую кахексию, кардиальную кахексию, супраренальную кахексию или болезнь Аддисона, связанную с раком кахексию и кахексию, как следствие инфицирования вирусом иммунодефицита человека (ВИЧ),повреждение печени,легочную гипертонию и вызванную гипоксией легочную гипертонию,заболевания, связанные с костной недостаточностью, первичный остеопороз и вторичный остеопороз,нарушения центральной нервной системы любого типа, этиологии или патогенеза или нарушение центральной нервной системы, которое представляет собой заболевание, выбранное из группы, включающей депрессию, болезнь Паркинсона, ухудшение способности к обучению и памяти, позднюю дискинезию, наркотическую зависимость, атеросклеротическое слабоумие и слабоумие, сопровождающее хорею Хантингтона, болезнь Вилсона, паралич и таламические атрофии,инфицирование, особенно инфицирование вирусами, при котором вирусы увеличивают продукцию TNF- в организме хозяина, или при котором вирусы являются чувствительными к повышающей регуляции TNF- в организме хозяина, так, что на их репликацию или другие жизненно важные функции оказывается неблагоприятное влияние, включающими вирус, который представляет собой вирус, выбранный из группы, включающей HIV-1, HIV-2 и HIV-3,цитомегаловирус, CMV, вирус гриппа, аденовирусы и вирусы герпеса, включающие Herpeszoster и Herpes simplex,инфицирование дрожжами и грибками, где указанные дрожжи и грибки являются чувствительными к повышающей регуляции TNF- или стимулируют продукцию TNF- в организме хозяина при введении вместе с другими лекарственными средствами, выбранными для лечения системных дрожжевых и грибковых инфекций, включающими, не ограничиваясь ими, полимиксины, например полимицин В, имидазолы, клотримазол, эконазол, миконазол и кетоконазол, триазолы, флюконазол и итраназол и амфотерицины, например амфотерицин В и липосомальный амфотерицин В, и ишемическое реперфузионное повреждение, аутоиммунные диабеты, ретинальный аутоиммунитет, хроническую лимфоцитарную лейкемию, ВИЧ инфекции, эритематозную волчанку, заболевание почек и мочеточника, мочеполовые и желудочно-кишечные нарушения и заболевания простаты. В особенности, соединения формулы(1.0.0) могут применяться для лечения (1) воспалительных заболеваний и состояний, включающих воспаление суставов, ревматоидный 30 артрит, ревматоидный спондилит, остеоартрит,воспалительное заболевание кишечника, язвенный колит, хронический гломерулонефрит, дерматит и болезнь Крона, (2) респираторных заболеваний и состояний, включающих астму, острый респираторный дистресс-синдром, хроническое легочное воспалительное заболевание,бронхит, хроническое обструктивное заболевание дыхательных путей и силикоз, (3) инфекционных заболеваний и состояний, включающих сепсис, септический шок, эндотоксический шок,грамотрицательный сепсис, токсический шоковый синдром, лихорадку и миалгию как следствие бактериальной, вирусной или грибковой инфекции, и грипп, (4) иммунных заболеваний и состояний, включающих аутоиммунные диабеты, системную эритематозную волчанку, реакцию трансплантант против хозяина, отторжение аллотрансплантанта, рассеянный склероз,псориаз и аллергический ринит, и (5) других заболеваний и состояний, включающих костнорезорбционные заболевания, реперфузионное повреждение, вторичную кахексию по отношению к инфекции или злокачественности, вторичную кахексию по отношению к синдрому приобретенного иммунодефицита человека(СПИД), инфекции вируса иммунодефицита человека (ВИЧ) или связанному со СПИДом комплексу (ARC), образование келоида, образование рубцовой ткани, сахарный диабет типа I,и лейкемию. Подробное описание изобретения 5.0 Соединения Настоящее изобретение касается группы новых соединений, которые являются биологически активными в качестве ингибиторов PDE4,и, следовательно, в особенности могут применяться при лечении проникающих и ослабляющих заболеваний, астмы и хронического обструктивного легочного заболевания. Указанная новая группа соединений представлена формулой (1.0.0) или их фармацевтически приемлемыми солями,где R1 обозначает -Н, -F или -Сl,R2 обозначает -Н, -F, -Сl или -СН 3,RD обозначает -Н или -СН 3,ZB обозначает фенил, циклопентил, циклогексил, фуранил, тиенил, тиазолил, оксазолил,индолин-2-онил, пиридил или пиразинил,Е обозначает -Н, -F, -ОСН 3, -ОН,-СН(ОН)СН 3,-СН(ОН)(СН 3)2,-OC(=O)R12,-NHS (=O)2CH3, -S(=O)2NH2, -NH2 или -N(CH3)2, 31ZA обозначает фенил или пиридил, где R4 представлен дважды и обозначает -F или -Сl,или же R4 является единственным заместителем,представляющим собой -F, -Сl, -CN, -NO2, -NH2,-N(CH3)2, -CF3, -SCH3, -OCH3, -OCH2CH3,-C(=O)CH3, -С(=О)ОСН 3, -CONH2, -NHS (=O)2CH3,или ZA обозначает фенил, где два R4, взятые вместе с атомами углерода, к которым они присоединены, и фенильным циклом, частью которого они являются, образуют индолил, хинолинил, 1,3-бензодиоксолил, бензоксазолил,1,3-бензодитиолил, бензотиазолил, бензимидазолил или 1,4-бензодиоксанил,R7 и R8, каждый независимо, выбраны из группы, включающей -Н, -F, -Сl, -OR12, (C1-C4) алкил, гидрокси (C1-C4)алкил, -CF3, -C(=O)OR12,-NR12R13, гидрокси (C1-C4)алкиламино, фенил,бензил или гетероциклильный радикал, выбранный из группы, включающей пирролил, оксазолил, тиазолил, оксадиазолил, тиадиазолил, имидазолил, пиридинил, тетразолил, индолил и бензимидазолил, где каждый из указанных фенильного, бензильного или гетероциклильного радикалов независимо замещен 0-2 заместителямиR12 и R13 каждый обозначают радикал, независимо выбранный из группы, включающей-Н, -(C1-C4)алкил, фенил или бензил, где указанные алкил, фенил или бензил замещены 0-3 заместителями, выбранными из группы, состоящей из F и Сl. Предпочтительными являются соединения,где R1 обозначает -Н, ZB обозначает фенил, фуранил или тиенил, Е обозначает -ОСН 3, -ОН,-СН(ОН)СН 3 или -СН (ОН)(СН 3)2, ZA обозначает фенил или пиридил, где R4 присутствует дважды и обозначает -F или -Сl, или же R4 является единственным заместителем, представляющим собой -F, -Сl, -CN, -ОСН 3 или -NO2,или ZA обозначает фенил, где два R4, взятые вместе с атомами углерода, к которым они присоединены, и фенильным циклом, частью которого они являются, образуют 1,3-бензодиоксолил, и R7 и R8, каждый, независимо, выбраны из группы, включающей -Н, -СН 3, -ОСН 3, -CF3 или -NH2. В нижеследующей табл. 1 приведены конкретные воплощения соединений формулы(1.0.0), перечисленные по названию, иллюстрированные структурной формулой и определенные как формулы от (6.0.1) до (6.0.52) Подробное описание изобретениz 6.0 Способы получения соединений формулы(1.0.0) Способы, подходящие для получения левостороннего фрагмента соединения формулы(1.0.0), иллюстрируются на приведенной ниже схеме синтеза (10.1.0), где R7, R8 и ZA имеют 37 такие же значения, как определено выше. Конечный продукт показан в виде формулы (2.0.5). Схема синтеза (10.1.0)(2.0.0) преобразовывают в соответствующий этиловый эфир пиримидинового соединения формулы (2.0.1) путем взаимодействия (2.0.0) с этанолом в присутствии тионилхлорида. Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение периода времени, составляющего приблизительно от 1 до 3 ч, предпочтительно приблизительно 1,5 ч. В реакции 2 схемы (10.1.0) этиловый эфир 6-хлорпиримидинового соединения формулы(2.0.1) преобразовывают в соответствующий этиловый эфир соединения формулы (2.0.2) путем взаимодействия (2.0.1) с соединением формулы ZA-OH, в присутствии гидрида натрия или карбоната цезия и полярного апротонного растворителя, такого как диметилформамид(ДМФ). Реакцию проводят при температуре,составляющей приблизительно от 60 до 150 С,предпочтительно приблизительно от 80 до 100 С, в течение периода времени, составляющего приблизительно от 10 до 24 ч, предпочтительно приблизительно 18 ч. В реакции 3 схемы (10.1.0) этиловый эфир пиримидинового соединения формулы (2.0.1) преобразовывают в соответствующее 5-карбоксипиримидиновое соединение формулы (2.0.3) путем взаимодействия (2.0.2) с гидроксидом натрия в этанольном растворителе. Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение периода времени,составляющего приблизительно от 3 до 5 ч, предпочтительно приблизительно 4 ч. В реакции 4 схемы (10.1.0) 5-карбоксипиримидиновое соединение формулы (2.0.3),полученное на предыдущей стадии синтеза, которое образует левосторонний фрагмент соединения формулы (1.0.0), взаимодействует с амином формулы (2.0.4), который образует правосторонний фрагмент соединения формулы(1.0.0). Данное соединение находится в виде амина и в результате получают амидную связь,которая соединяет две половины соединения формулы (1.0.0). Реакцию проводят, используя 38 смесь конденсрующих реагентов гидрохлорида 1-[3-(диметиламино)пропил]-3-этилкарбодиимида и гидрата 1-гидроксибензотриазола. Также могут использоваться другие конденсирующие реагенты, например дициклогексилкарбодиимид(DCCI), N,N'-карбонилдиимидазол и бензотриазол-1-ил диэтилфосфат. Реакцию конденсации проводят в апротонном, полярном растворителе, например N,Nдиметилформамиде (ДМФ); дихлорметане; тетрагидрофуране (ТГФ); ацетонитриле или Nметилпирролидоне (NMP). Предпочтитлеьным является безводный N,N-диметилформамид. Реакцию проводят при температуре от комнатной до слегка превышающей комнатную, в течение периода времени, составляющего от 8 до 30 ч, обычно от 10 до 24 ч, чаще 18 ч. В приведенной ниже схеме синтеза (10.2.0) процедуры синтеза, описанные в общих выражениях выше, в описании схемы синтеза(10.1.0), проводят с учетом конкретных исходных веществ, промежуточных соединений и конкретного конечного продукта, 4-(бензо[1,3] диоксол-5-илокси)пиридин-5-карбоновой кислоты 2-фтор-4-(1-гидрокси-1-метилэтил)бензиламида. Схема синтеза (10.2.0)(3.0.1) в присутствии карбоната цезия, или гидрида натрия, с образованием метилендиоксифеноксипиримидина формулы (3.0.2). Реакционную смесь, включающую (3.0.0) и (3.0.1), нагревают до температуры, составляющей от 80 до 100 С, предпочтительно 90 С, в течение периода времени, составляющего от 1 до 24 ч, предпочтительно 18 ч. В реакции 2 схемы (10.2.0) 5-карбоэтокси 4-метилендиоксифеноксипиримидин формулы(3.0.2) преобразовывают в соответствующий 5 карбокси-4-метилендиоксифеноксипиримидин формулы (3.0.3) путем обработки гидроксидом лития в тетрагидрофуране и воде в течение от 1 до 48 ч при температуре окружающей среды,предпочтительно в течение 18 ч. Затем реакционную смесь подкисляют до рН, составляющего 39 от 1,5 до 2,5, предпочтительно 2,0, с помощью 3 н соляной кислоты. В реакции 3 схемы (10.2.0) 5-карбоксипиримидин формулы (3.0.3) в безводном дихлорметане или в N,N-диметилформамиде смешивают при комнатной температуре с амидными конденсирующими агентами гидрохлоридом 1-[3-(диметиламино)пропил]-3-этилкарбодиимида; гидратом 1-гидроксибензотриазола и N,Nдиизопропилэтиламином или триэтиламином; в течение от 15 до 45 мин; после чего он взаимодействует при температуре окружающей среды с 4-аминометилгидроксипропилбензолом формулы (3.0.4) в течение от 12 до 24 ч, предпочтительно в течение 18 ч. Полученный в результате продукт представляет собой соединение формулы (3.0.5), которое является соединением настоящего изобретения. Подробное оисание изобретения 7.0 Фармацевтические соли и другие формы Вышеописанные соединения настоящего изобретения могут применяться в их конечной,не солевой, форме. С другой стороны, применение данных соединений в виде фармацевтически приемлемых солей, полученных с различными органическими и неорганическими кислотами и основаниями в соответствии с методиками, хорошо известными в данной области, также входит в объем настоящего изобретения. Фармацевтически приемлемые солевые формы соединений формулы (1.0.0) получают в основном с помощью традиционных способов. Если соединение формулы (1.0.0) содержит карбоксильную группу, его подходящая соль может быть получена путем взаимодействия соединения с соответствующим основанием с обеспечением соответствующей основно-аддитивной соли. Примерами таких оснований являются гидроксиды щелочных металлов, включая гидроксид калия, гидроксид натрия и гидроксид лития; гидроксиды щелочно-земельных металлов, такие как гидроксид бария и гидроксид кальция; алкоксиды щелочных металлов, например этанолат калия и пропанолат натрия; и различные органические основания, такие как пиперидин, диэтаноламин и N-метилглутамин. Также включены соли алюминия соединений формулы (1.0.0). Для некоторых соединений формулы(1.0.0) кислотно-аддитивные соли могут быть получены путем обработки указанных соединений фармацевтически приемлемыми органическими и неорганическими кислотами, например гидрогалогенидами, такими как гидрохлорид,гидробромид, гидроиодид; другими минеральными кислотами и их соответствующими солями, такими как сульфат, нитрат, фосфат и т.д.; алкил- и моноарилсульфонатами, такими как этансульфонат, толуолсульфонат и бензолсульфонат; и другими органическими кислотами и их соответствующими солями, такими как аце 005028 40 тат, тартрат, малеат, сукцинат, цитрат, бензоат,салицилат, аскорбат и т.д Соответственно, фармацевтически приемлемые кислотно-аддитивные соли соединения формулы (1.0.0) включают, не ограничиваясь ими: ацетат, адипат, альгинат, аргинат, аспартат,бензоат, бензолсульфонат (безилат), бисульфат,бисульфит, бромид, бутират, камфорат, камфорсульфонат, каприлат, хлорид, хлорбензоат, цитрат, циклопентанпропионат, диглюконат, дигидрофосфат, динитробензоат, додецилсульфат,этансульфонат, фумарат, галактерат (из муциновой кислоты), галактуронат, глюкогептаноат,глюконат, глутамат, глицерофосфат, гемисукцинат, гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид, гидробромид, гидроиодид,2-гидроксиэтансульфонат, иодид, изетионат,изобутират, лактат, лактобионат, малат, малеат,малонат, манделат, метафосфат, метансульфонат, метилбензоат, моногидрофосфат, 2 нафталинсульфонат, никотинат, нитрат, оксалат,олеат, памоат, пектинат, персульфат, фенилацетат, 3-фенилпропионат, фосфат, фосфонат, фталат. Далее, основные соли соединений настоящего изобретения включают, не ограничиваясь ими, соли алюминия, аммония, кальция, меди,железа (II), железа (III), лития, магния, марганца(II), марганца (IV), калия, натрия и цинка. Предпочтительными в ряду вышеперечисленных солей являются соли аммония; соли щелочных металлов натрия и калия и соли щелочноземельных металлов кальция и магния. Соли соединений формулы (1.0.0), полученные из фармацевтически приемлемых нетоксичных органических оснований включают, не ограничиваясь ими, соли первичных, вторичных и третичных аминов, замещенные амины, включая природные замещенные амины, циклические амины и основные ионообменные смолы, например аргинин, бетаин, кофеин, хлорпрокаин,холин, N,N'-дибензилэтилен-диамин (бензатин),дициклогексиламин, диэтаноламин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидробамин, изопропиламин,лидокаин, лизин, меглюмин, N-метил-Dглюкамин, морфолин, пиперазин, пиперидин,полиаминовые смолы, прокаин, пурины, теобромин, триэтаноламин, триэтиламин, триметиламин, трипропиламин и трис-(гидроксиметил)метиламин (трометамин). Соединения настоящего изобретения, которые включают основные азотсодержащие группы, могут быть кватернизированы такими агентами, как (C1-C4)алкилгалогениды, например метил, этил, изопропил и трет-бутил хлориды, бромиды и иодиды; ди-(C1-C4)алкилсульфат, например диметил, диэтил и диамилсульфаты; (C10-C18)алкилгалогениды, например децил, додецил, лаурил, меристил и стеарилхло 41 риды, бромиды и иодиды; и арил-(C1C4)алкилгалогениды, например бензилхлорид и фенетилбромид. Такие соли позволяют получить как водорастворимые, так и растворимые в масле соединения настоящего изобретения. В ряду перечисленных выше фармацевтических солей предпочтительные соли включают,не ограничиваясь ими, ацетат, безилат, цитрат,фумарат, глюконат, гемисукцинат, гипурат,гидрохлорид, гидробромид, изетионат, манделат, меглюмин, нитрат, олеат, фосфонат, пивалат, фосфат натрия, стеарат, сульфат, сульфосалицилат, тартрат, тиомалат, тозилат и трометамин. Кислотно-аддитивные соли основных соединений формулы (1.0.0) получают при взаимодействии свободной основной формы с достаточным количеством требуемой кислоты с получением соли обычным способом. Свободное основание можно регенерировать при взаимодействии солевой формы с основанием и выделяя свободное основание обычным способом. Свободные основные формы отличаются от их соответствующих солевых форм до известной степени по некоторым физическим свойствам,таким как растворимость в полярных растворителях, но в других отношениях для целей настоящего изобретения соли являются эквивалентными их соответствующим свободным основным формам. Как указано, фармацевтически приемлемые основно-аддитивные соли соединений формулы (1.0.0) получают при взаимодействии с металлами или аминами, такими как щелочные металлы и щелочно-земельные металлы или органические амины. Предпочтительными металлами являются натрий, калий, магний и кальций. Предпочтительными органическими аминами являютсяN,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, N-метил-Dглюкамин и прокаин. Основно-аддитивные соли кислотных соединений настоящего изобретения получают при взаимодействии свободной кислой формы с достаточным количеством требуемого основания с получением соли обычным способом. Свободная кислая форма может быть регенерирована при взаимодействии солевой формы с кислотой и выделении свободной кислой формы обычным способом. Свободные кислые формы до некоторой степени отличаются от их соответствующих солевых форм по физическим свойствам, таким как растворимость в полярных растворителях, но в других отношениях соли являются эквивалентными их соответствующим свободным кислотным формам для целей настоящего изобретения. Множественные солевые формы включены в объем настоящего изобретения, когда соединения настоящего изобретения содержат более,чем одну группу, способную к образованию 42 таких фармацевтически приемлемых солей. Примеры типичных множественных солевых форм включают, не ограничиваясь ими, битартрат, диацетат, дифумарат, димеглюмин, дифосфат, динатрий и тригидрохлорид. В свете вышесказанного можно видеть, что выражение"фармацевтически приемлемая соль", используемое в настоящем описании,обозначает активный ингредиент, включающий соединение формулы (1.0.0), используемое в форме его соли, особенно, когда указанная солевая форма придает упомянутому активному ингредиенту улучшенные фармакокинетические свойства по сравнению со свободной формой указанного активного ингредиента, или некой другой солевой формой упомянутого активного ингредиента, использованной ранее. Фармацевтически приемлемая солевая форма указанного активного ингредиента может также изначально придавать требуемое фармакокинетическое свойство упомянутому активному ингредиенту,которым он прежде не обладал, и даже может положительно влиять на фармакодинамику упомянутого активного ингредиента по отношению к его терапевтической активности в организме. Фармакокинетические свойства упомянутого активного ингредиента, которые можно изменить благоприятным образом, включают,например, способ, которым упомянутый активный ингредиент транспортируется через клеточные мембраны и который в свою очередь может непосредственно и положительно влиять на абсорбцию, распределение, биотрансформацию и экскрецию упомянутого активного ингредиента. В то время, как путь введения фармацевтической композиции является важным, а различные анатомические, физиологические и патологические факторы могут значительно влиять на биодоступность, растворимость упомянутого активного ингредиента обычно зависит от характеристик его конкретной солевой формы, в которой он применяется. Далее, как будет понятно специалисту в данной области,водный раствор упомянутого активного ингредиента будет обеспечивать наиболее быструю абсорбцию упомянутого активного ингредиента в организме пациента, подлежащего лечению, в то время, как липидные растворы и суспензии,также, как твердые дозированные формы, будут приводить к наименее быстрой абсорбции упомянутого активного ингредиента. Пероральный прием активного ингредиента формулы (1.0.0) является наиболее предпочтительным путем введения по причинам безопасности, удобства и экономии, но на абсорбцию такой пероральной дозированной формы может неблагоприятно влиять такая физическая характеристика, как полярность; тошнота, вызываемая раздражением слизистой оболочки желудочно-кишечного тракта, разрушением пищеварительными ферментами и низким рН, 43 нерегулярная абсорбция или быстрое прохождение в присутствии пищи или других лекарств и метаболизм под действием ферментов слизистой оболочки, кишечной флоры или печени. Получение готовых форм упомянутого активного ингредиента в виде различных формацевтически приемлемых солевых форм может быть эффективным при преодолении или облегчении одной или нескольких вышеперечисленных проблем, связанных с абсорбцией пероральных дозированных форм. Соединение формулы (1.0.0), полученное в соответствии со способами, описанными в данном документе, может быть выделено из реакционной смеси, в которой его в конечном счете получают, путем любых обычных средств, известных химику, имеющему квалификацию в области получения органических соединений. После выделения указанного соединения оно может быть очищено известными способами. Различные споссобы и методы могут быть использованы для выделения и очистки и включают, например, перегонку; перекристаллизацию; колоночную хроматографию; ионнообменную хроматографию; гель-хроматографию; аффинную хроматографию; препаративную тонкослойную хроматографию и экстракцию растворителем. 7.1 Стереоизомеры Соединение, охватываемое формулой(1.0.0), может быть таким, что составляющие его атомы способны располагаться в пространстве двумя или более различными путями, несмотря на то, что они имеют идентичные связи. Как следствие, указанное соединение существует в виде стереоизомеров. Цис-транс изомерия является только одним типом стереоизомерии. Когда стереоизомеры являются несовместимыми зеркальными отображениями друг друга, они представляют собой энантиомеры, которые имеют хиральность вследствие присутствия одного или нескольких асимметрических углеродных атомов в их составляющей структуре. Энантиомеры являются оптически активными и поэтому различимыми, поскольку они вращают плоскость поляризованного света равными количествами, но в противоположных направлениях. Когда два или более асимметричных атомов углерода присутствуют в соединениях формулы (1.0.0), существует две возможных конфигурации при каждом упомянутом атоме углерода. Когда присутствуют два асимметрических атома углерода, существует четыре возможных стереоизомера. Далее, эти четыре возможных стереоизомера могут группироваться в шесть возможных пар стереоизомеров, отличных друг от друга. Чтобы пара молекул с более, чем одним асимметрическим атомом углерода представляла собой энантиомерную смесь, они должны иметь различные конфигурации при каждом асимметричном атоме углерода. Те па 005028 44 ры, которые не относятся к энантиомерам, имеют различное стереохимическое родство, относящееся к диастереомерному родству. Стереоизомеры, не являющиеся энантиомерами, называют диастереоизомерами или, чаще, диастереомеры. Все из данных хорошо известных аспектов стереохимии соединений формулы (1.0.0) рассматриваются как часть настоящего изобретения. Таким образом, объем настоящего изобретения включает соединения формулы (1.0.0),являющиеся стереоизомерами и когда они являются энантиомерами,индивидуальными энантиомерами, рацемическими смесями указанных энантиомеров и искусственными, т.е.,специально полученными смесями, содержащими пропорции указанных энантиомеров, которые отличаются от пропорций указанных энантиомеров в рацемической смеси. Когда соединение формулы (1.0.0) включает стереоизомеры,которые являются диастереомерами, оно также включается в объем упомянутого соединения в виде индивидуальных диастереомеров, также,как смесь любых двух или более указанных диастереомеров в любых пропорциях. Для иллюстрации, в случае, когда в соединении формулы (1.0.0) присутствует единственный асимметричный атом углерода, приводящий к появлению его (-)(R) и (+)(S) энантиомеров, указанное соединение охватывает все его фармацевтически приемлемые солевые формы,пролекарства и метаболиты, которые являются терапевтически активными и могут применяться при лечении и профилактике заболеваний и состояний, описанных далее в настоящем документе. Когда соединение формулы (1.0.0) существует в виде (-)(R) и (+)(S) энантиомеров,(+)(S) энантиомер или (-)(R) энантиомер, по отдельности, также охватывается упомянутым соединением, в случае, когда вся, по существу вся, или преобладающая часть терапевтической активности, относится только к одному из указанных энантиомеров и/или нежелательные побочные эффекты относятся только к одному из указанных энантиомеров. В случае, когда по существу нет различия между биологическими активностями обоих энантиомеров, объем притязаний по упомянутому соединению (1.0.0) схватывает (+)(S) энантиомер и (-)(R) энантиомер, представленные вместе как рацемическая смесь, или как нерацемическая смесь при любом соотношении их пропорциональных количеств. Например, конкретные биологические активности и/или физические и химические свойства пары или набора энантиомеров соединения формулы (1.0.0), где таковые существуют, могут предполагать применение указанных энантиомеров в определенных соотношениях для обеспечения вклада в конечный терапевтический продукт. Для иллюстрации, в случае, когда существует пара энантиомеров, они могут быть использованы в таких соотношениях, как 90%(S) и 10%(R) - 90% (S). После оценки свойств различных энантиомеров соединения формулы(1.0.0), где таковые существуют, пропорциональное количество одного или нескольких указанных энантисмеров с определенными желательными свойствами, которое вносит вклад в конечный терапевтический продукт, можно определить на основании прямопропорциональной зависимости. 7.2 Изотопы Далее подразумевается, что в объем изобретения включены изотопо-меченные формы соединения формулы(1.0.0). Изотопномеченная форма соединения формулы (1.0.0) является идентичной упомянутому соединению,кроме того, что один или несколько атомов упомянутого соединения заменены на атом или атомы, имеющие атомную массу или массовое число, отличное от атомной массы или массового числа упомянтого атома, который обычно распространен в природе. Примеры изотопов,которые являются коммерчески легко доступными и которые могут быть введены в соединения формулы (1.0.0) в соответствии с хорошо отработанными процедурами, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, например, 2 Н, 3 Н, 13 С, 14 С,15N, 18O, 17O, 31P, 32P, 35S, 18F, и 36 Сl, соответственно. Соединение формулы (1.0.0), его пролекарство или фармацевтически приемлемая соль,которые содержат один или несколько вышеуказанных изотопов и/или другие изотопы других атомов, рассматриваются в пределах объема настоящего изобретения. Изотопно-меченное соединение формулы(1.0.0) может быть выгодно использовано различными способами. Например, изотопномеченное соединение формулы (1.0.0), в которое введен радиоактивный изотоп, такой как 3 Н или 14 С, может применяться в анализе распределения лекарства и/или субстрата в тканях. Данные радиоактивные изотопы, т.е., тритий, 3 Н, и углерод-14, 14 С, являются особенно предпочтительными вследствие легкости получения и простой детектируемости. Введение более тяжелых изотопов, например дейтерия, 2 Н, в соединение формулы (1.0.0) обеспечивает терапевтические преимущества, основанные на большей метаболической стабильности упомянутого изотопно-меченного соединения. Большая метаболическая стабильность непосредственно связана с увеличенным периодом полужизни in vivo или сниженными требованиями дозировки, что при большинстве обстоятельств составляет предпочтительное воплощение настоящего изобретения. Изотопно-меченное соединение формулы (1.0.0) обычно может быть получено с помошью процедур, раскрытых в схемах синтеза и их описании, в примерах и 46 способах получения данного документа, при замещении легко доступным изотопномеченным реагентом его соответствующего не изотопно-меченного аналога. Дейтерий, 2 Н, также может быть введен в соединения формулы (1.0.0) с целью манипулирования окислительным метаболизмом с помощью первичного кинетического изотопного эффекта. Первичный кинетический изотопный эффект представляет изменение скорости химической реакции, которая следует из замещения изотопного ядра, что в свою очередь вызывает изменения энергий начального состояния, требуемых для образования ковалентной связи вследствие указанного изотопного замещения. Замещение более тяжелым изотопом обычно приводит к снижению энергии начального состояния для химической связи, таким образом вызывая уменьшение скорости, лимитирующей скорость стадии разрыва связи. Если событие разрыва связи происходит на участке седельной точки или рядом с ним, наряду с координатой реакции с множеством продуктов отношения распределения продуктов могут существенно меняться. Для иллюстрации, когда дейтерий связан с атомом углерода при необмениваемом участке, различие скоростей km/kd, равное 2-7,является типичным. Данное различие в скорости, успешно примененное к лабильному при окислении соединению формулы (1.0.0), может значительно влиять на профиль упомянутого соединения in vivo и приводить к улучшенным фармако-кинетическим свойствам. При открытии и разработке терапевтических средств квалифицированный специалист в данной области ищет способы оптимизации фармако-кинетических параметров при сохранении желательных свойств in vitro. Будет разумным допустить, что многие соединения с бедными фармако-кинетическими профилями являются лабильными по отошению к окислительному метаболизму. Доступные в настоящее время анализы in vitro на микросомах печени обеспечивают ценную информацию о протекании данного окислительного метаболизма, которое, в свою очередь, позволяет предложить рациональный дизайн дейтерированных соединений формулы (1.0.0) с улучшенной стабильностью вследствие устойчивости к такому окислительному метаболизму. Таким образом, получают значительные улучшения фармакокинетических профилей соединений формулы (1.0.0) и это может быть выражено количественно в терминах увеличений периода полужизни in vivo(t/2), концентрации при максимальном терапевтическом эффекте (Стах), площади под кривой доза-ответ (AUC) и F и в терминах уменьшений в выведении, дозе и стоимости. Для иллюстрации вышесказанного соединения формулы (1.0.0), которые имеют множественные потенциальные сайты для окислительного метаболизма, например бензильные 47 атомы водорода и атомы водорода в альфаположении по отношению к атому азота, получают в виде ряда аналогов, в которых различные сочетания атомов водорода замещены атомами дейтерия, таким образом, что некоторые, большинство или все из указанных атомов водорода,замещены атомами дейтерия. Определения периода полужизни обеспечивают разумное и точное определение степени улучшения сопротивления окислительному метаболизму. Таким способом определяют, что период полужизни исходного соединения может быть увеличен на 100% в результате такого замещения дейтерием водорода. Замещение водорода дейтерием в соединении формулы (1.0.С) можно также использовать для достижения благоприятного изменения профиля метаболитов исходного соединения путем уменьшения или устранения нежелательных токсичных метаболитов. Например, когда токсичный метаболит появляется в результате окислительного разрыва связи С-Н, разумно ожидать, что дейтерированный аналог в значительной степени будет уменьшать или полностью исключать получение нежелательного метаболита, даже в случае, когда конкретное окисление не является стадией, определяющей скорость. Дальнейшая информация относительно существующего уровня техники, относящегося к замещению водорода дейтерием, может быть получена, например, у Hanzlik et al., J. Org.Chem. 52 3326-3334, 1987; Foster, Adv. Drug Res. 14 1-40, 1985, Gillette et al., Biochemistry 33(10) 2927-2937, 1994; and Jarman et al., Carcinogenesis 16(4) 683-688, 1993. Подробное описание изобретения 8.0 Терапевтические применения и клинические конечные результаты Нижеприведенное описание рассматривает терапевтические применения, к которым можно приложить соединения формулы (1.0.0), и, в случае применимости, объяснение клинических конечных результатов, связанных с такими терапевтическими применениями. Также представлено раскрытие различных анализов in vitro и экспериментов на животных моделях, которые предоставляют данные, достаточные для определения и демонстрации терапевтической применимости соединений формулы (1.0.0). Терапевтическая применимость соединений формулы (1.0.0) относится к пациенту или субъекту, страдающему от заболевания или состояния, как представлено в настоящем документе, и поэтому нуждающемуся в таком лечении. Благоприятные результаты считаются терапевтическими, если получены при введении животным или человеку. Термины "животное" и"животные", применяющиеся в настоящем описании, используют просто с целью указания на то, что люди противопоставлены другим членам 48 царства животных. Соединения формулы (1.0.0) обладают терапевтической применимостью при лечении животных и, в особенности, людей. Все основные подразделения класса млекопитающих (Mammalia) включены в объем настоящего изобретения в той связи, в которой они являются реципиентами терапевтического лечения, как описано в настоящем описании. Млекопитающие имеют ценность в качестве домашних животных у людей и поэтому, вероятно, могут являться субъектами лечения. Это в особенности относится к собачьим и кошачьим группам млекопитающих. Другие млекопитающие представляют ценность как одомашненные животные, и их лечение в соответствии с настоящим изобретением является возможным с точки зрения негативного экономического эффекта при отсутствии лечения заболеваний и состояний, описанных в данном документе. В особенности это относится к лошадям, коровам, свиньям и овцам. Соединения формулы (1.0.0) ингибируют изозим PDE4 и поэтому имеют широкий диапазон терапевтических применений, как описано ниже, вследствие существенной роли, которую семейство изозимов PDE4 играет в физиологии всех млекопитающих. Ферментативная роль,выполняемая изозимами PDE4, состоит во внутриклеточном гидролизе аденозин 3',5'монофосфата (сАМР) в провоспалительных лейкоцитах. сАМР, в свою очередь отвечает за опосредование эффектов многочисленных гормонов в организме, и, как следствие, ингибирование PDE4 играет существенную роль в различных физиологических процессах. В данной области существует обширная литература, описывающая эффекты ингибиторов PDE на ответные реакции различных воспалительных клеток,которые в дополнение к увеличению уровня сАМР включают ингибирование продукции супероксида, дегрануляции, хемотатксиса и высвобождения фактора некроза опухоли (TNF) эозинофилами, нейтрофилами и моноцитами.PDE4 впервые был обнаружен в 1985 г.,Nemoz et al. Biochem. Pharmacol. 34 2997-3000,1985, и ингибиторы PDE4 ролипрам и денбуфиллин были исследованы в клинике на предмет лечения таких состояний ЦНС, как депрессия. Затем было установлено, что PDE4 является основной фосфодиэстеразой воспалительных лейкоцитов. Четыре подтипа PDE4, т.е. PDE4A,PDE4B, PDE4C и PDE4D, широко распространены в тканях человека, что определяется по присутствию их мРНК. PDE4D экспрессируется в почках, тимусе, тонком кишечнике и тканях толстой кишки и существенно экспрессируется в мозге, легких, скелетных мышцах, простате и лейкоцитарных тканях периферической крови(PBL). Он слабо экспрессируется в сердце, плаценте, печени, поджелудочной железе, селезенке, семенных пузырьках и тканях яичника.PDE4A и PDE4B также значительно экспресси 49 руются в мозге и тканях скелетной мускулатуры и слабо экспрессируются в плаценте, печени и тканях яичника. PDE4C значительно экспрессируется в тканях скелетной мускулатуры и слабо экспрессируется в тканях яичника. PDE4C обычно не определяется в большинстве перечисленных тканей. Семейство изозимов PDE4 является преобладающей формой фосфодиэстеразы, найденной в типах клеток, вовлеченных в хронические воспалительные заболевания, и в ряду типов клеток, продуцируемых костным мозгом, только тромбоциты не продуцируют PDE4. PDE4 является основным сАМР-метаболизирующим ферментом в иммунных и воспалительных клетках и является одним из двух основных сАМРметаболизирующих ферментов в гладкой мускулатуре дыхательных путей. PDE4 эксклюзивно представлен в нейтрофилах, эозинофилах,базофилах и моноцитах, в то время как в макрофагах также была продемонстрирована активность PDE3 и PDE1, а у Т-лимфоцитов активность PDE7. Благоприятные противовоспалительные эффекты ингибиторов PDE были продемонстрированы ранее в экспериментах in vitro, в которых было установлено, что такие соединения ингибируют генерацию супероксида в человеческих моноцитах, эозинофилах и нейтрофилах; высвобождение медиатора в базофилах, макрофагах и нейтрофилах; и высвобождение TNF- моноцитами и макрофагами; ингибиторы PDE также ингибируют высвобождение медиатора воспалительными клетками, такими как моноциты и происходящие от моноцитов макрофаги, тучные клетки легких,Тлимфоциты, В-лимфоциты, альвеолярные макрофаги и эозинофилы. Благоприятные противовоспалительные эффекты, включающие ингибирование микрососудистых истечений в легких сенсибилизированных морских свинок и уменьшение бронхиальной гиперреактивности, а также эозинофилии у обезьян после нескольких стимуляций антигеном также ранее наблюдали в экспериментах in vivo. Также ранее было продемонстрировано, что ингибиторы PDE4 значительно подавляют высвобождение TNF- из мононуклеарных фагоцитов. 8.1 Астма Одним из наиболее важных респираторных заболеваний, которое можно лечить ингибиторами PDE4 типа соединений формулы(1.0.0), является астма - хроническое, участившееся заболевание, зарегистрированное по всему миру и характеризующееся перемежающейся возвратной обструкцией дыхательных путей,гиперреактивностью дыхательных путей и воспалением. Причина астмы еще подлежит выяснению, но наиболее общим патологическим проявлением астмы является воспаление дыхательных путей, которое может быть значитель 005028 50 ным даже в дыхательных путях пациентов со слабой астмой. На основании результатов исследований бронхиальной биопсии и лаважа было ясно показано, что астма включает инфильтрацию тучных клеток, эозинофилов и Тлимфоцитов в дыхательных путях пациентов. Бронхоальвеолярный лаваж (BAL) у атопических астматиков показал активацию интерлейкина IL-3, IL-4, IL-5 и фактора, стимулирующего колонии гранулоцитов/макрофагов (GMCSF), что предполагает присутствие популяции Т-хелпера 2 (Th2)-подобных Т-клеток. Соединения формулы (1.0.0) ингибируютPDE4 в эозинофилах человека и поэтому могут применяться для лечения атопической и не атопической астмы. Термин "атопия" относится к генетической предрасположенности по отношению к развитию гиперсенсибилизирующих реакций типа I (немедленного типа) против обычных антигенов окружающей среды. Наиболее частым клиническим проявлением является аллергический ринит, в то время, как бронхиальная астма, атопический дерматит и пищевая аллергия встречаются реже. Соответственно,под выражением "атопическая астма", как оно используется в настоящем описании, подразумевают синонимичность с термином "аллергическая астма", то есть, бронхиальная астма, которая имеет аллергическое проявление у сенсибилизированного человека. Под термином "не атопическая астма", как он используется в настоящем описании, подразумевают, что он относится ко всем другим типам астмы, особенно,по существу к "истинной" астме, которая провоцируется рядом факторов, включающих интенсивные упражнения, раздражающие частицы, психологические стрессы и т.д. Применение соединений формулы (1.0.0) для лечения атопической астмы или не атопической астмы установлено и продемонстрировано на моделях, ингибирования PDE, ингибирования активации эозинофилов и бронходиляторных моделях, описанных ниже. Ингибирование изозима PDE. Способность соединений формулы (1.0.0) селективно ингибировать PDE4 продемонстрирована анализом ингибирования человеческого PDE. В данном анализе все изоферментные препараты получают из человеческих источников. ПрепаратыPDE3 и PDE4 получают, используя преимущество преобладания изозимов PDE3 в тромбоцитах и изозимов PDE4 в нейтрофилах. Используют следующие методы. Кровь человека собирают с помощью цитратного буфера и выделяют нейтрофилы путем седиментации в декстране,центрифугирования в градиенте плотности и гипотонического лизиса эритроцитов. Тромбоциты человека из того же источника промывают 51 мМ Tris-HCl, рН 7,4), содержащего следующие растворы ингибиторов протеаз: 5 мкл/мл фенилметилсульфонилфторида (7 мг/мл в 2 пропаноле), 1 мкл/мл лейпептина и пепстатина А (1 мг/мл каждого в этаноле). После ультразвуковой обработки в течение 15 с при 4 С гомогенаты центрифугируют (2200g). Осадок ресуспендируют в 10 мл буфера и ультразвуковую обработку повторяют. Объединенные супернатанты хранят при -20 С. Другие изоферменты частично очищают,используя хроматографические методы, как описано в данной области, причем PDE1 и PDE5 получают из легкого человека, a PDE2 получают из тромбоцитов человека. Активность PDE определяют в присутствии и отсутствии тестируемого вещества формулы (1.0.0) при изменяющихся концентрациях, используя метод с ионнообменной колонкой, описанный Thompson et al.,Nucleotide Res. 10 69-92, 1979; с 1 мкМ [3 Н]сАМР в качестве субстрата (PDE3 и PDE4), или 0,5 мкМ кальция, 0,125 мкМ кальмодулина и 1,0 мкМ [3 Н]-сАМР (PDE1), или 100 мкМ [3 Н]сАМР (PDE2), или 1,0 мкМ [3H]-cGMP (PDE5). В данном тестовом методе, соединение формулы (1.0.0) в основном ингибируют изозимы PDE4, имея относительно малый ингибирующий эффект на PDE1, PDE2, PDE3 и PDE5. Селективная ингибиторная активность соединений формулы (1.0.0) по отношению кPDE4 также может быть определена с использованием набора из пяти различных изозимов PDE в соответствии с процедурами, известными в данной области. Ткани, используемые как источники различных изозимов, могут включать следующие: PDE1B - аорта свиньи; PDE1C сердце морской свинки; PDE3 - сердце морской свинки; PDE4 - моноциты человека; и PDE5 трахея собаки. PDE1B, 1 С, 3 и 5 частично очищали, применяя общепринятые хроматографические методы; Torphy and Cieslinski, Mol.Pharmacol. 37 206-214, 1990. PDE4 очищают до кинетической гомогенности путем последовательного применения анионного обмена и хроматографии на гепарин-сефарозе; Torphy et al.,J. Biol. Chem. 267 1798-1804, 1992. Активностьand Cieslinski, описанную в цитируемой выше статье. Также можно оценить ингибирующуюPDE4 способность соединений формулы (1.0.0) по увеличению аккумуляции сАМР в не поврежденных тканях, используя клетки U-937, клеточную линию моноцитов человека, которая,как было показано, содержит большое количество PDE4. Для оценки уровня РDЕ 4 ингибирующей активности в не поврежденных клетках недифференцированные клетки U-937 52 ние дополнительных 4 мин. Клетки лизируют через 5 мин после инициации реакции при добавлении 17,5% перхлорной кислоты, рН приводят к нейтральному значению добавлением 1 М K2 СО 3 и содержание сАМР оценивают с помощью РИА. Общая методика данного анализа описана у Brooker et al., "Radioimmunoassay ofcyclic AMP and cyclic GMP" Adv. Cyclic Nucleotide Res. 10 1-33, 1979. Бронходиляторная активность. Было показано, что различные изозим-селективные ингибиторы PDE вызывают эффективную релаксацию гладкой мускулатуры дыхательных путей человека, в то время как в данных тканях и клетках было идентифицировано наличие ферментативной активности PDE1, 2, 3, 4 и 5. Было показано, что селективные ингибиторыPDE3 и PDE4 вызывают релаксацию бронхиальных колец при различных условиях. Далее,сАМР вовлечен не только в релаксацию гладкой мускулатуры, но также оказывает общее ингибиторное влияние на пролиферацию гладкой мускулатуры дыхательных путей. Гипертрофия и гиперплазия гладкой мускулатуры дыхательных путей могут модулироваться сАМР, и данные состояния являются общими морфологическими признаками хронической астмы. Было показано, что сочетание ингибиторов PDE3 иPDE4 имеет выраженный ингибиторный эффект на пролиферацию. Несколько семейств изозимов PDE, включая PDE4, были обнаружены в легочных артериях человека и было показано,что селективные ингибиторы PDE вызывают релаксацию колец легочной артерии. Релаксация бронхов человека. Образцы легких человека, извлекаемых при онкологической хирургии, получают в течение трех дней после удаления. Извлекают маленькие бронхи(внутренний диаметр приблизительно 2-5 мм),разрезают на сегменты и помещают на хранение в жидком азоте в ампулы объемом 2 мл, заполненные телячьей фетальной сывороткой (FCS),содержащей 1,8 М диметилсульфоксида (DMSO) и 0,1 М сахарозы в качестве криопротектора. Ампулы помещают в коробку из полистирола(11x11x22 см) и медленно замораживают при средней скорости охлаждения примерно 0,6 С/мин в морозильнике, установленном на-70 С. После 3-15 ч ампулы переносят в жидкий азот (-196 С), где они хранятся до использования. Перед использованием ткани выдерживают в течение 30-60 мин до -70 С, перед вскрытием ампулы выдерживают 2,5 мин, помещая их в водяную баню с температурой 37 С. Затем бронхиальные сегменты промывают, помещая их в чашку, содержащую раствор KrebsHenseleit (мкМ: NaCl 118, KСl 4,7, MgSO4 1,2,СаСl2 1,2, KH2PO4 1,2, NaHCO3 25, глюкоза 11,EDTA 0,03) при 37 С, разрезают на кольца и суспендируют в 10 мл бане для органов для регистрации изометрического напряжения при предварительной нагрузке 1 г. Кривую концен 53 трация - ответ получают с помощью кумулятивных добавлений, причем каждую концентрацию добавляют при получении максимального эффекта от предыдущей концентрации. Папаверин(300 мкМ) добавляют в конце кривой концентрация - ответ для индуцирования полной релаксации бронхиальных колец. Данный эффект принимается за 100% релаксацию. В вышеприведенных тестовых моделях соединения формулы (1.0.0) продуцируют концентрационно-зависимую релаксацию препаратов колец бронхов человека при концентрациях в диапазоне от 0,001 до 1,0 мкМ, причем предпочтительные воплощения являются активными при концентрациях в диапазоне от 5,0 до 50 нМ. Подавление сужения просвета бронхов,индуцированного бомбезином. Самцов морских свинок линии DunkinHartley (4 00-800 г), имеющих свободный доступ к воде и пище перед экспериментом анестезируют фенобарбиталом натрия (100 мг/кг и. п.) и пентобарбиталом натрия (30 мг/кг и.п.), затем парализуют галламином (10 мг/кг в.м.). Животных, фиксируемых при 37 С на нагреваемой подложке, контролируют ректальным термометром, вентилируют через трахеальную канюлю (примерно 8 мл/кг, 1 Гц) смесью воздуха и кислорода (45:55 об./об.). Вентиляцию регистрируют с помощью пневмотахографа, соединенного с дифференциальным преобразователем давления, в линии с респираторным насосом. Изменения давления в пределах торекса регистрируют непосредственно через интраторальную канюлю, используя дифференциальный преобразователь давления, таким образом,что разница давления между трахеей и торексом может быть измерена и выведена на дисплей. По результатам измерений воздушного потока и транслегочного давления как сопротивление воздушному потоку (R1 см Н 2 О/л/с), так и податливость (Cddyn) рассчитывают с помощью цифрового электронного респираторного анализатора для каждого дыхательного цикла. Кровяное давление и частоту сердцебиения регистрируют из каротидной артерии с использованием преобразователя давления. Когда значение базального сопротивления и податливости являются стабильными, отсроченное сужение просвета бронхов индуцируют непрерывной внутривенной инфузией бомбезина (100 нг/кг/мин). Бомбезин растворяют в 100% этаноле и разбавляют физиологическим раствором с фосфатным буфером. Тестируемые соединения формулы (1.0.0) вводят, когда ответ на бомбезин является максимальным и стабильным, что, как рассчитано, происходит через 2 мин после начала вливания бомбезина. Прекращение сужения бронхов оценивают через 1 ч после либо интратрахеальной, либо интрадуоденальной инстилляции или внутривенной инъекции болюса. 54 Бронхоспазмолитическую активность выражают как % ингибирования начальной, максимальной сопротивляемости (RD) после инфузии бомбезина. Значения ED50 соответствуют дозе, которая вызывает 50% сокращение увеличения сопротивляемости, вызванной бомбезином. Продолжительность действия опрделяется как время в минутах, при котором сужение просвета бронхов уменьшается на 50% или больше. Влияние на кровяное давление (ВР) и частоту сердечных сокращений (HR) характеризуется значениями ED20; т.е. дозами, которые снижают ВР или HR, измеряемые через 5 мин после введения, на 20%. Тестируемые соединения формулы (1.0.0) вводят либо в виде растворов, либо, в случае интратрахеальной или интрадуоденальной инстилляции, также в виде водных суспензий, содержащих 0,5% трагаканта, если тестируемое соединение не является достаточно растворимым. Перед введением суспенизии в течение 5 мин обрабатывают ультразвуком для получения частиц малого размера. Каждое лекарственное средство тестируют в 2-4 дозах (n=3-4 на дозу). Используют необходимое количество контролей(5-6). В приведенной выше модели тестирования соединения формулы (1.0.0) проявляют бронходилляторную активность в дозах, находящихся в интервале от 0,001 до 0,1 мг/кг в. в. или от 0,1 до 5,0 мг/кг и.д. Анализ на крысиной модели астмы. В тесте для оценки терапевтического влияния соединения формулы (1.0.0) на симптом одышки, т.е. тяжелого или затрудненного дыхания, используют крыс, полученных от инбредной линии астматических крыс. Используют как самок (190-250 г), так и самцов (260-400 г) крыс. Яичный альбумин (ЕА), степень очисткиV, кристаллизованный и лиофилизированный,гидроксид алюминия и метисергид бималеат,используемые в данном тесте, являются коммерчески доступными. Стимуляцию и последующее считывание респираторных показаний проводят в чистом пластиковом ящике с внутренними размерами 10x6x4 дюймов. Крышка ящика является съемной. При применении крышку плотно закрывают с помощью четырех зажимов и герметичность обеспечивают с помощью мягкого резинового уплотнения. Через центр каждого торца камеры вставляют распылитель с использованием герметичного уплотнения, и каждый торец ящика также имеет выходное отверстие. Пневмотахограф вставляют в один торец ящика и соединяют его с объемным преобразователем давления, который затем соединяют с динографом через соответствующие соединительные устройства. При аэрозолизации антигена выходные отверстия открывают, а пневмотахограф изолируют от камеры. Затем выходные отвер 55 стия закрывают и пневмотахограф соединяют с камерой на время регистрации респираторных данных. Для стимуляции 2 мл 3% раствора антигена в физиологическом растворе помещают в каждый распылитель и получают воздушный аэрозоль с помощью небольшого диафрагменного насоса, работающего при 10 psi (фунт/кв. дюйм) и объемной скорости потока 8 л/мин. Крыс сенсибилизируют путем подкожного введения 1 мл суспензии, содержащей 1 мг ЕА и 200 мг гидроксида алюминия в физиологическом растворе. Их используют в период между 12 и 24 днем после сенсибилизации. Для того,чтобы избежать серотониновой компоненты ответа за 5 мин до аэрозольной стимуляции крыс предварительно обрабатывают внутривенно метисергидом при концентрации 3,0 мг/кг. Затем крыс подвергают воздействию аэрозоля,содержащего 3% ЕА в физиологическом растворе в течение ровно 1 мин, затем в течение последующих 30 мин регистрируют респираторные профили. Продолжительность непрерывной одышки определяют по регистрации респираторных характеристик. Тестируемые соединения формулы (1.0.0) обычно вводят либо перорально за 1-4 ч до стимуляции, либо внутривенно за 2 мин до стимуляции. Соединения растворяют либо в физрастворе или 1% метоцеле, либо суспендируют в 1% метоцеле. Объем вводимого тестируемого соединения составляет 1 мл/кг (внутривенно) или 10 мл/кг (перорально). Перед пероральной обработкой крыс не кормят в течение ночи. Эффект, оказываемый на крыс, определяют, исходя из их способности к уменьшению продолжительности симптомов одышки, в сравнении с контрольной группой, обработанной средой. Тестируемые соединения формулы (1.0.0) анализируют для ряда доз и рассчитывают ED50,который определяют как доза (мг/кг), которая ингибирует продолжительность симптомов на 50%. Механика легких у подготовленных,сознающих беличьих обезьян. С помощью данного метода у тестируемых беличьих обезьян определяют способность соединений формулы (1.0.0) ингибировать антигенAscaris-индуцированные изменения респираторных параметров, например сопротивляемость воздушных путей. Процедура теста включает помещение подготовленных беличьих обезьян в сиденья в камерах для введения аэрозоля. С целью контроля измерения легочной механики респираторных параметров регистрируют в течение периода, составляющего приблизительно 30 мин для установления нормальных контрольных значений для каждой обезьяны в данный день. Для перорального введения соединения формулы (1.0.0) растворяют или суспендируют в 1% растворе метоцеля (метилцеллюлоза, 65HG, 400 cps) и вводят в объеме 1 мл/кг массы тела. Для аэрозольного введения 56 соединения формулы (1.0.0) применяют ультразвуковой распылитель. Периоды перед обработкой варьируют от 5 мин до 5 ч до стимуляции обезьян аэрозольными дозами антигена Ascaris. После стимуляции каждую порцию данных рассчитывают как процентное изменение от контрольных значений для каждого респираторного параметра, включающего сопротивляемость воздушных путей (RL) и динамическую податливость (Cdyn). Затем результаты, полученные для каждого тестируемого соединения в течение периода, составляющего минимально 60 мин после стимуляции, сравнивают с предварительно полученной исторической базовой линией контрольных значений для каждой конкретной обезьяны. Далее все значения, полученные для каждой обезьяны в течение 60 мин после стимуляции, т.е. значения исторической базовой линии и тестовые значения, по отдельности усредняют и используют для расчета суммарного процента ингибирования ответа на антиген Ascaris, вызванного тестируемым соединением. Для статистического анализа результатов применяют двусторонний t-тест. Профилактика индуцированного сужения просвета бронхов у аллергизированной овцы. Процедура тестирования терапевтической активности соединений формулы (1.0.0) в отношении профилактики сужения просвета бронхов описана ниже. Она основана на обнаружении определенной породы аллергизированной овцы с известной чувствительностью к конкретному антигену, Ascaris suum, которая отвечает на стимуляцию ингалляцией острым, а также поздним бронхиальными ответами. Время развития как острого, так и позднего бронхиальных ответов приблизительно равно времени,наблюдающемуся у людей, страдающих астмой; кроме того, фармакологическая модификация как острого, так и познего ответов подобна обнаруженной у человека. Ответы данных овец на стимуляцию антигеном наблюдаются по большей части в их больших дыхательных путях,что делает возможным мониторинг эффектов как изменений в сопротивляемости легких, т. е. специфической сопротивляемости легких. Используют взрослых овец со средней массой 35 кг (в диапазоне 18-50 кг). Все используемые животные удовлетворяют двум критериям: 1) они имеют природную кожную реакцию до 1:1000 или 1:10000 разбавлений экстрактаAscaris suum и 2) они ранее отвечали на стимуляцию ингаляцией Ascaris suum как острым сужением просвета бронхов, так и поздней бронхиальной обструкцией. См. Abraham et al., Am.He получающих седативного средства овец удерживают в повозке в лежащем положении с фиксированными головами. После местной анестезии 2% раствором лидокаина, вводимого назальными пассажами, баллоновый катетер вво 57 дят через одну ноздрю в нижний отдел пищевода. Затем животных интубируют внутритрахейной трубкой, вводимой вручную через другую ноздрю с использованием гибкого фиброоптического бронхоскопа в качестве направителя. Легочное давление оценивают с помощью баллонового катетера пищевода (наполненного 1 мл воздуха), который располагают так, что вдыхание продуцирует отрицательное отклонение давления с ясно различимыми кардиогенными осциллициями. Латеральное давление в трахее измеряют с помощью катетера с боковыми отверстиями (внутренние размеры: 2,5 мм), введенного через назотрахеальную трубку и расположенного на расстоянии от ее кончика. Транслегочное давление, т.е. разность между трахеальным давлением и легочным давлением, измеряют с помощью дифференциального преобразователя давления. Тестирование катетерной системы преобразователя давления не обнаруживает сдвига фазы между давлением и потоком до частоты 9 Гц. Для измерения легочной сопротивляемости (RL) наибольший конец назотрахеальной трубки соединяют с пневмотахографом. Сигналы потока и легочного давления регистрируют на осциллографе, который связан с компьютером для on-line вычисления RL из легочного давления, дыхательного объема, полученного путем интеграции, и потока. Для определения RL используют анализ 10-15 вдохов. Для получения легочной сопротивляемости(SRL=RLxVtq) объем торакального газа (Vtg) измеряют в плетизмографе. Аэрозоли, содержащие экстракт Ascarissuum (1:20), получают с помощью доступного медицинского распылителя, который продуцирует аэрозоль со среднемассовым аэродинамическим диаметром 6,2 мкм (стандартное геометрическое отклонение 2,1), что определяют с помощью анализатора электрического арзмера. Выход из распылителя направлен в Т-образный отвод, один конец которого присоединен к назотрахеальной трубке, а другой конец которого связан с инспираторной частью обычного респиратора. Аэрозоль доставляется в общем объеме 500 мл со скоростью 20 мл в минуту. Таким образом, каждая овца получает равные дозы антигена в испытаниях с применением как плацебо, так и лекарственного средства. Перед стимуляцией антигеном проводят базовые измерения SRL, за час до стимуляции начинают инфузию тестируемого соединения,измерения SRL повторяют и затем овцу подвергают стимуляции ингаляцией антигена Ascarissuum. Измерения SRL проводят сразу после стимуляции антигеном и через 1, 2, 3, 4, 5, 6, 6,5, 7,7,5 и 8 ч после стимуляции антигеном. Плацебо и тестируемые лекарственные средства разделяют по меньшей мере 14 дней. Далее в исследовании овце дают болюсную дозу тестируемого соединения с последующей инфузией тестируемого соединения в течение 0,5-1 ч до стиму 005028ANOVA Kruskal-Wallis используют для сравнения острого немедленного ответа на антиген и пика позднего ответа в контрольных и обработанных лекарственным средством животных. Другим анализом, который может быть применен, основанным на применении приматов, является анализ, описанный в Turner et al.,"Characterization of a primate model of asthmausing anti-allergy/anti-asthma agents," Inflammation Research 45 239-245, 1996. Противовоспалительная активность. Противовоспалительную активность соединений формулы (1.0.0) демонстрируют по ингибированию активации эозинофилов. В данном анализе образцы крови (50 мл) собирают у неатопических добровольцев с числом эозинофилов, варьирующим от 0,06 до 0,47 х 109 л-1. Венозную кровь собирают в центрифужные пробирки, содержащие 5 мл тринатрий цитрата(3,8%, рН 7,4). Кровь, содержащую антикоагулянт, разбавляют (1:1, об.:об.) физиологическим раствором с фосфатным буфером (PBS, не содержащий ни кальция, ни магния) и наслаивают на 15 мл изотонического Percoll (плотность 1,082 1,085 г/мл, рН 7,4) в центрифужной пробирке объемом 50 мл. После центрифугирования (30 мин, 1000g, 20C) мононуклеарные клетки на поверхности раздела плазма/Percoll осторожно отсасывают и отбрасывают. Нейтрофил/эозинофил/эритроцитарный осадок (объемом примерно 5 мл) осторожно ресуспендируют в 35 мл изотонического раствора хлорида аммония (NH4Cl, 155 мМ;KНСО 3, 10 мМ; EDTA, 0,1 мМ; 0-4 С) . Через 15 мин клетки дважды промывают (10 мин, 400 g,4 С) в PBS, содержащем фетальную телячью сыворотку (2%, FCS). Для разделения эозинофилов и нейтрофилов используют магнитную систему для разделения клеток. С помощью данной системы можно разделять клетки в суспензии в соответствии с поверхностными маркерами, указанная система включает постоянный магнит, в который помещена колонка, которая включает поддающуюся намагничиванию стальную матрицу. Перед применением колонку уравновешиваютPBS/FCS в течение 1 ч и затем промывают охлажденным на льду PBS/FCS в обратном направлении с помощью шприца объемом 20 мл. Иглу 21G для подкожных инъекций присоединяют к основанию колонки и спускают через иглу 1-2 мл охлажденного на льду буфера. После центрифугирования гранулоцитов супернатант отсасывают и клетки осторожно ресуспендируют со 100 мкл магнитных частицCD-16, инкубируют на льду 40 мин и затем разбавляют до 5 мл охлажденным на льдуPBS/FCS. Клеточную суспензию медленно вводят в верхнюю часть колонки и открывают кран,чтобы клетки медленно продвигались в стальной матрице. Затем колонку промываютPBS/FCS (35 мл), который осторожно добавляют в верхнюю часть колонки, чтобы не нарушить равновесие магнитно-меченных нейтрофилов, уже задержанных на стальной матрице. Немеченные эозинофилы собирают в центрифужную пробирку объемом 50 мл и промывают(10 мин, 400g, 4 С). Полученный осадок ресуспендируют в 5 мл сбалансированного солевого раствора Хэнкса (HBSS) так, чтобы перед применением оценить количество клеток и чистоту. Разделительную колонку удаляют из магнита и элюируют фракцию нейтрофилов. Затем колонку промывают PBS (50 мл) и этанолом(абсолютным) и хранят при 4 С. Общее количество клеток считают с помощью микросчетчика клеток. К образцу добавляют одну каплю лизогенного раствора и через 30 с в образце снова считают клетки, чтобы оценить загрязнение эритроцитами. Цитоспиновые мазки получают на центрифуге ShandonCytospin 2 (образцы объемом 100 мкл, 3 мин,500 об/мин). Полученные препараты окрашивают и дифференциальный счет клеток осуществляют с помощью светого микроскопа, определяющего по меньшей мере 500 клеток. Жизнеспособность клеток оценивают путем исключения окрашенных трипановым синим. Эозинофилы разбавляют HBSS и с помощью пипетки вносят в 96-луночные титрационные микропланшеты (МТР) в количестве 110103 клеток/лунку. Каждая лунка содержит 200 мкл образца, включающего: 100 мкл суспензии эозинофилов; 50 мкл HBSS; 10 мкл люцигенина; 20 мкл активационного стимула; и 20 мкл тестируемого соединения. Образцы инкубируют с тестируемым соединением или средой в течение 10 мин, затем добавляют активационный стимул fMLP (10 мкл), растворенный в диметилсульфоксиде и после этого разбавленный буфером, так что при использовании самая высокая концентрация растворителя составляет 1% (при концентрации тестируемого соединения 100 мкМ). МТР встряхивают для облегчения перемешивания клеток и среды и помещают в люминометр. Общую хемилюминесценцию и временной профиль для каждой лунки измеряют одновременно в течение 20 мин и результаты выражают в виде произвольных единиц или в виде процента от хемилюминесценции, индуцированной fMLP в отсутствии тестируемого соединения. Результаты подгоняют для уравнения Hill и автоматически рассчитывают значения IC50. Соединения формулы (1.0.0) являются активными в описан 005028 60 ном выше методе тестирования в концентрациях, находящихся в интервале от 0,0001 до 0,5 мкМ, в препочтительных воплощениях они являются активными в концентрациях, находящихся в интервале от 0,5 до 20 нМ. На основании вышеописанного можно сделать вывод, что соединения формулы (1.0.0) могут применяться для лечения воспалительных или обструктивных заболеваний дыхательных путей, или других состояний, включающих обструкцию дыхательных путей. В частности, они могут применяться для лечения бронхиальной астмы. С точки зрения их противовоспалительной активности, их влияния на гиперреактивность дыхательных путей и их профиля в отношении ингибирования изофермента PDE, в особенности, как селективных ингибиторов PDE4, соединения формулы (1.0.0) могут применяться для лечения, в частности, для профилактического лечения, обструктивных или воспалительных заболеваний дыхательных путей. Таким образом, путем продолжительного и регулярного введения в течение длительных периодов времени соединения формулы (1.0.0) могут применяться для обеспечения повышения защиты от рецидива сужения просвета бронхов или другого симптоматического приступа, сопровождающего обструктивные или воспалительные заболевания дыхательных путей. Соединения формулы (1.0.0) могут также применяться для подавления, улучшения или реверсирования базального статуса таких заболеваний. Благодаря наличию бронходиляторной активности соединения формулы (1.0.0) могут применяться в качестве бронходиляторов, например, для лечении хронического или острого сужения бронхов, а также для симптоматического лечения обструктивных или воспалительных заболеваний дыхательных путей. Термин "лечение", использующийся на протяжении настоящего описания и формулы изобретения в отношении обструктивных или воспалительных заболеваний дыхательных путей, следует понимать, соответственно, как охватывающий как профилактическую, так и симптоматическую формы терапии. В свете приведенного выше описания можно видеть, что настоящее изобретение также относится к способу лечения гиперреактивности дыхательных путей у млекопитающих; к способу расширения просвета бронхов у млекопитающих и, в осбенности, к способу лечения обструктивных или воспалительных заболеваний дыхательных путей, особенно астмы, у млекопитающего, нуждающегося в таком лечении,данный способ включает введение упомянутому млекопитающему эффективного количества соединения формулы (1.0.0). Обструктивные или воспалительные заболевания дыхательных путей, на которые направлено настоящее изобретение, включают
МПК / Метки
МПК: C07D 405/12, C07D 409/12, A61K 31/505, C07D 409/14
Метки: ингибиторов, используемые, пиримидинкарбоксамиды, изозимов, качестве
Код ссылки
<a href="https://eas.patents.su/30-5028-pirimidinkarboksamidy-ispolzuemye-v-kachestve-ingibitorov-izozimov-pde4.html" rel="bookmark" title="База патентов Евразийского Союза">Пиримидинкарбоксамиды, используемые в качестве ингибиторов изозимов pde4</a>
Предыдущий патент: Ингибиторы репликации респираторно-синцитиального вируса
Следующий патент: Высокоселективные ингибиторы обратного захвата норэпинефрина и способы их применения
Случайный патент: Способ и устройство для записи меток в информационный слой оптического диска


































