Производные резорцина
Номер патента: 4476
Опубликовано: 29.04.2004
Авторы: Браунинг Эндрю Фрэнсис, Проктер Мартин Джеймс, Гиден Джоанна Виктория, Коллингтон Эрик Уильям
Формула / Реферат
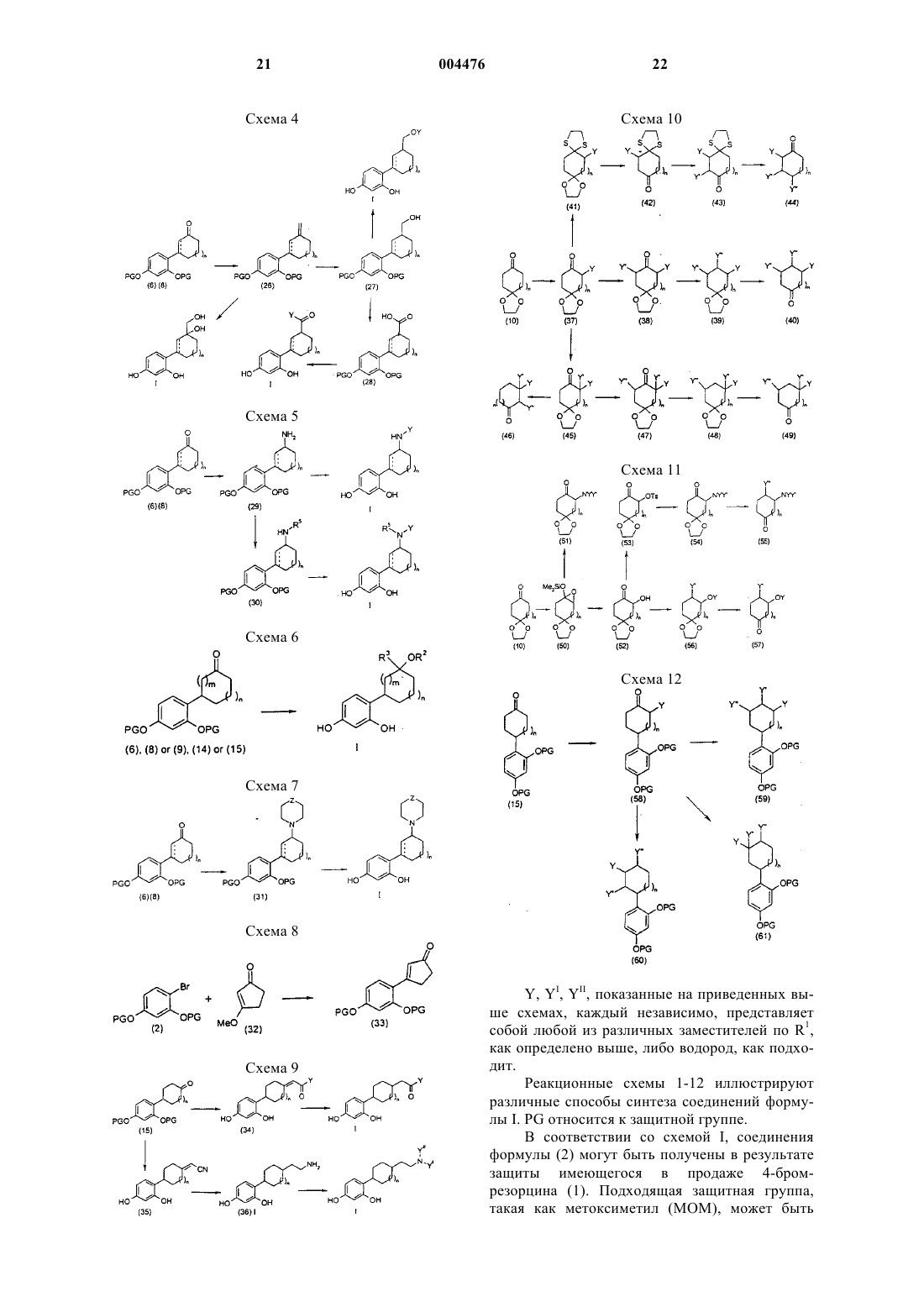
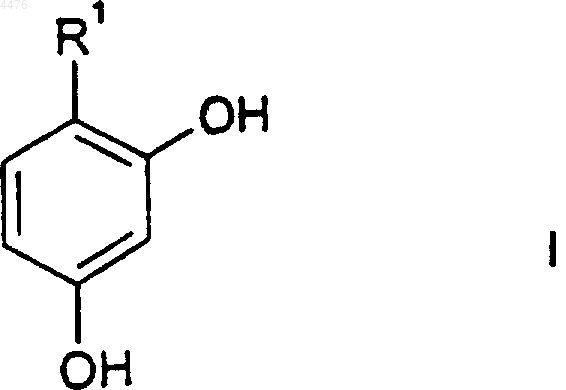
1. Соединение формулы I
или его фармацевтически приемлемая соль, где
R1 представляет собой (C3-C8)циклоалкильное кольцо или (C5-C8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо, либо циклоалкенильное кольцо замещено 1-3 заместителями, независимо выбранными из группы, состоящей из циано; галогено; (C1-C6)алкила; арила; (C2-C9)гетероциклоалкила; (C2-C9)гетероарила; арил(C1-C6)алкила-; =O; =CHO(C1-C6)алкила; амино; гидрокси; (C1-C6)алкокси; арил(C1-C6)алкокси-; (C1-C6)ацила; (C1-C6)алкиламино-; арил(C1-C6)алкиламино-; амино(C1-C6)алкила-; (C1-C6)алкокси-CO-NH-; (C1-C6)алкиламино-CO-; (C2-C6)алкенила; (C2-C6)алкинила; гидрокси(C1-C6)алкила-; (C1-C6)алкокси(C1-C6)алкила-; (C1-C6)ацилокси(C1-C6)алкила-; нитро; циано(C1-C6)алкила-; галогено(C1-C6)алкила-; нитро(C1-C6)алкила-; трифторметила; трифторметил(C1-C6)алкила-; (C1-C6)ациламино-; (C1-C6)ациламино(C1-C6)алкила-; (C1-C6)алкокси(C1-C6)ациламино-; амино(C1-C6)ацила-; амино(C1-C6)ацил(C1-C6)алкила-; (C1-C6)алкиламино(C1-C6)ацила-; ((C1-C6)алкил)2амино(C1-C6)ацила-; -CO2R2; -(C1-C6)алкил-CO2R2; -C(O)N(R2)2; -(C1-C6)алкил-C(O)N(R2)2; R2ON=; R2ON=(C1-C6)алкила-; R2ON=CR2(C1-C6)алкила-; -NR2(OR2); -(C1-C6)алкил-NR2(OR2); -C(O)(NR2OR2); -(C1-C6)алкил-C(O)(NR2OR2); -S(O)mR2; где каждый R2 независимо выбран из водорода, (C1-C6)алкила, арила или арил(C1-C6)алкила-; R3C(O)O-, где R3 представляет собой (C1-C6)алкил, арил или арил(C1-C6)алкил-; R3C(O)O-(C1-C6)алкила-; R4R5N-C(O)-O-; R4R5NS(O)2-; R4R5NS(O)2(C1-C6)алкила-; R4S(O)2R5N-; R4S(O)2R5N(C1-C6)алкила-; причем m представляет собой 0, 1 или 2, a R4 и R5, каждый независимо, выбраны из водорода или (C1-C6)алкила; -C(=NR6)(N(R4)2); либо -(C1-C6)алкил-C(=NR6)(N(R4)2); где R6 представляет собой OR2 или R2, где R2 является таким, как определено выше;
при условии, что циклоалкенильное кольцо не является ароматическим;
при условии, что R1 должен быть замещен по меньшей мере одним из R3C(O)O-(C1-C6)алкила-; R2ON=; R2ON=(C1-C6)алкила-; R2ON=CR2(C1-C6)алкила-; -NR2(OR2); R4R5NS(O)2-; R4R5NS(O)2(C1-C6)алкила-; R4S(O)2R5N- или R4S(O)2R5N(C1-C6)алкила-;
при условии, что когда R1 замещен только одним R2ON=, то R2 не может представлять собой водород.
2. Соединение по п.1, где R1 представляет собой циклогексильное или циклогексенильное кольцо, замещенное по положению 3 или 4, либо циклопентильное или циклопентенильное кольцо, замещенное по положению 3.
3. Соединение по п.1, где R1 является монозамещенным.
4. Соединение по п.1, где R1 является дизамещенным.
5. Соединение по п.1, где R1 замещен, по меньшей мере, R3C(O)O-(C1-C6)алкилом-.
6. Соединение по п.1, где R1 замещен по меньшей мере одним из R2ON=, R2ON=(C1-C6)алкила- или R2ON=CR2(C1-C6)алкила-.
7. Соединение по п.1, где R1 замещен по меньшей мере одним -NR2(OR2).
8. Соединение по п.1, где R1 замещен по меньшей мере одним из R4R5NS(O)2-, R4R5NS(O)2(C1-C6)алкила-, R4S(O)2R5N- или R4S(O)2R5N(C1-C6)алкила-.
9. Соединение по п.1, где R1 замещен по меньшей мере одним из R4S(O)2R5N- или R4S(O)2R5N(C1-C6)алкила-.
10. Соединение по п.1, где R1 представляет собой (C3-C8)циклоалкильное кольцо или (C5-C8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо, либо циклоалкенильное кольцо замещено одним из R3C(O)O-(C1-C6)алкила-, R2ON=, R2ON=(C1-C6)алкила-, R2ON=CR2(C1-C6)алкила-, -NR2(OR2), R4R5NS(O)2-, R4R5NS(O)2(C1-C6)алкила-, R4S(O)2R5N- или R4S(O)2R5N(C1-C6)алкила-.
11. Соединение по п.10, где R1 представляет собой (C3-C8)циклоалкильное кольцо или (C5-C8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо, либо циклоалкенильное кольцо замещено одним из R3C(O)O-(C1-C6)алкила-, R2ON= или R4S(O)2R5N-.
12. Соединение по п.10, где R1 замещен R3C(O)O-(C1-C6)алкилом-.
13. Соединение по п.10, где R1 замещен R2ON=, R2ON=(C1-C6)алкилом- или R2ON=CR2(C1-C6)алкилом-.
14. Соединение по п.10, где R1 замещен R2ON=.
15. Соединение по п.10, где R1 замещен -NR2(OR2).
16. Соединение по п.10, где R1 замещен R4R5NS(O)2-, R4R5NS(O)2(C1-C6)алкилом-, R4S(O)2R5N- или R4S(O)2R5N(C1-C6)алкилом-.
17. Соединение по п.1, где R1 замещен R4S(O)2R5N- или R4S(O)2R5N(C1-C6)алкилом-.
18. Соединение по п.1, где (C2-C9)гетероциклоалкильный заместитель представляет собой группу формулы

где m представляет собой 0, 1 или 2, а
Z представляет сосющ CH2, NR2, O, S, SO или SO2.
19. Соединение по п.1, выбранное из группы, состоящей из
O-бензил-4-(2,4-дигидроксифенил)циклогексаноноксима;
(+)-N-[3-(2,4-дигидроксифенил)циклогексил]метансульфонамида;
(+)-O-метил-3-(2,4-дигидроксифенил)циклогексаноноксима;
(+)-O-бензил-3-(2,4-дигидроксифенил)циклогексаноноксима
и их фармацевтически приемлемой соли.
20. Соединение по п.1, выбранное из группы, состоящей из
O-метил-4-(2,4-дигидроксифенил)циклогексаноноксима;
(+)-4-[3-(гидроксиамино)циклогексил]-1,3-бензолдиола;
цис-N-[4-(2,4-дигидроксифенил)циклогексил]-1-бутансульфонамида;
транс-N-[4-(2,4-дигидроксифенил)циклогексил]метансульфонамида;
цис-N-[4-(2,4-дигидроксифенил)циклогексил]метансульфонамида;
[4-(2,4-дигидроксифенил)циклогексил]метилпропионата;
цис/транс-4-[4-(гидроксиамино)циклогексил]-1,3-бензолдиола;
транс-4-[4-(метоксиамино)циклогексил]-1,3-бензолдиола
и их фармацевтически приемлемой соли.
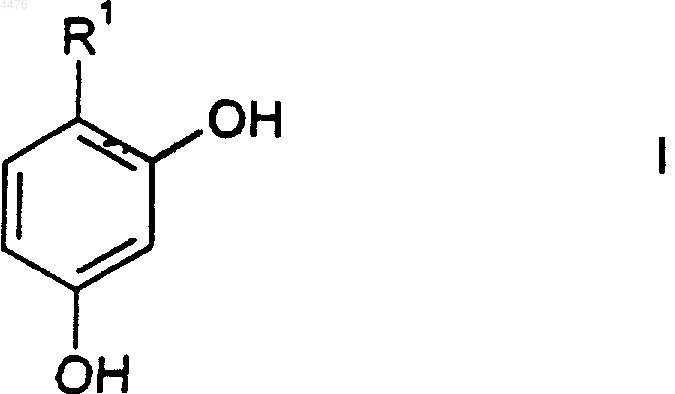
21. Фармацевтическая композиция для местного применения для отбеливания кожи или уменьшения пигментации кожи у человека, содержащая фармацевтически приемлемый носитель и отбеливающее кожу или уменьшающее пигментацию количество соединения формулы I
или его фармацевтически приемлемой соли, где
R1 представляет собой (C3-C8)циклоалкильное кольцо или (C5-C8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо, либо циклоалкенильное кольцо замещено 1-3 заместителями, независимо выбранными из группы, состоящей из циано; галогено; (C1-C6)алкила; арила; (C2-C9)гетероциклоалкила; (C2-C9)гетероарила; арил(C1-C6)алкила-; =O; =CHO(C1-C6)алкила; амино; гидрокси; (C1-C6)алкокси; арил(C1-C6)алкокси-; (C1-C6)ацила; (C1-C6)алкиламино-; арил(C1-C6)алкиламино-; амино(C1-C6)алкила-; (C1-C6)алкокси-CO-NH-; (C1-C6)алкиламино-CO-; (C2-C6)алкенила; (C2-C6)алкинила; гидрокси(C1-C6)алкила-; (C1-C6)алкокси(C1-C6)алкила-; (C1-C6)ацилокси(C1-C6)алкила-; нитро; циано(C1-C6)алкила-; галогено(C1-C6)алкила-; нитро(C1-C6)алкила-; трифторметила; трифторметил(C1-C6)алкила-; (C1-C6)ациламино-; (C1-C6)ациламино(C1-C6)алкила-; (C1-C6)алкокси(C1-C6)ациламино-; амино(C1-C6)ацила-; амино(C1-C6)ацил(C1-C6)алкила-; (C1-C6)алкиламино(C1-C6)ацила-; ((C1-C6)алкил)2амино(C1-C6)ацила-; -CO2R2; -(C1-C6)алкил-CO2R2; -C(O)N(R2)2; -(C1-C6)алкил-C(O)N(R2)2; R2ON=; R2ON=(C1-C6)алкила-; R2ON=CR2(C1-C6)алкила-; -NR2(OR2); -(C1-C6)алкила-NR2(OR2); -C(O)(NR2OR2); -(C1-C6)алкил-C(O)(NR2OR2); -S(O)mR2; где каждый R2 независимо выбран из водорода, (C1-C6)алкила, арила или арил(C1-C6)алкила-; R3C(O)O-, где R3 представляет собой (C1-C6)алкил, арил или арил(C1-C6)алкил-; R3C(O)O-(C1-C6)алкила-; R4R5N-C(O)-O-; R4R5NS(O)2-; R4R5NS(O)2(C1-C6)алкила-; R4S(O)2R5N-; R4S(O)2R5N(C1-C6)алкила-; причем m представляет собой 0, 1 или 2, a R4 и R5, каждый независимо, выбраны из водорода или (C1-C6)алкила; -C(=NR6)(N(R4)2); либо -(C1-C6)алкил-C(=NR6)(N(P4)2); где R6 представляет собой OR2 или R2, где R2 является таким, как определено выше;
при условии, что циклоалкенильное кольцо не является ароматическим;
при условии, что R1 должен быть замещен по меньшей мере одним из R3C(O)O-(C1-C6)алкила-; R2ON=; R2ON=(C1-C6)алкила-; R2ON=CR2(C1-C6)алкила-; -NR2(OR2); R4R5NS(O)2-; R4R5NS(O)2(C1-C6)алкила-; R4S(O)2R5N- или R4S(O)2R5N(C1-C6)алкила-.
22. Композиция по п.21, где R1 указанного соединения представляет собой циклогексильное или циклогексенильное кольцо, замещенное по положению 3 или 4, либо циклопентильное или циклопентенильное кольцо, замещенное по положению 3.
23. Композиция по п.21, где R1 указанного соединения является монозамещенным.
24. Композиция по п.21, где R1 указанного соединения является дизамещенным.
25. Композиция по п.21, где R1 указанного соединения замещен по меньшей мере R3C(O)O-(C1-C6)алкилом-.
26. Композиция по п.21, где R1 указанного соединения замещен по меньшей мере одним из R2ON=, R2ON=(C1-C6)алкила- или R2ON=CR2(C1-C6)алкила-.
27. Композиция по п.21, где R1 указанного соединения замещен по меньшей мере одним -NR2(OR2).
28. Композиция по п.21, где R1 указанного соединения замещен по меньшей мере одним из R4R5NS(O)2-, R4R5NS(O)2(C1-C6)алкила-, R4S(O)2R5N-или R4S(O)2R5N(C1-C6)алкила-.
29. Композиция по п.21, где R1 указанного соединения замещен по меньшей мере одним из R4S(O)2R5N- или R4S(O)2R5N(C1-C6)алкила-.
30. Композиция по п.21, где R1 указанного соединения представляет собой (C3-C8)циклоалкильное кольцо или (C5-C8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо, либо циклоалкенильное кольцо замещено одним из R3C(O)O-(C1-C6)алкила-, R2ON=, R2ON=(C1-C6)алкила-, R2ON=CR2(C1-C6)алкила-, -NR2(OR2), R4R5NS(O)2-, R4R5NS(O)2(C1-C6)алкила-, R4S(O)2R5N- или R4S(O)2R5N(C1-C6)алкила-.
31. Композиция по п.30, где R1 указанного соединения представляет собой (C3-C8)циклоалкильное кольцо или (C5-C8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо, либо циклоалкенильное кольцо замещено одним шч R3C(O)O-(C1-C6)алкила-, R2ON= или R4S(O)2R5N-.
32. Композиция по п.30, где R1 указанного соединения замещен R3C(O)O-(C1-C6)алкилом-.
33. Композиция по п.30, где R1 указанного соединения замещен R2ON=, R2ON=(C1-C6)алкилом- или R2ON=CR2(C1-C6)алкилом-.
34. Композиция по п.30, где R1 указанного соединения замещен R2ON=.
35. Композиция по п.30, где R1 указанного соединения замещен -NR2(OR2).
36. Композиция по п.30, где R1 указанного соединения замещен R4R5NS(O)2-, R4R5NS(O)2(C1-C6)алкилом-, R4S(O)2R5N- или R4S(O)2R5N(C1-C6)алкилом-.
37. Композиция по п.30, где R1 указанного соединения замещен R4S(O)2R5N- или R4S(O)2R5N(C1-C6)алкилом-.
38. Композиция по п.21, где (C2-C9)гетероциклоалкильный заместитель представляет собой группу формулы

где m представляет собой 0, 1 или 2, а
Z представляет собой CH2, NR2, O, S, SO или SO2.
39. Композиция по п.21, содержащая соединение, выбранное из группы, состоящей из
4-(2,4-дигидроксифенил)циклогексаноноксима;
O-метил-4-(2,4-дигидроксифенил)циклогексаноноксима;
O-бензил-4-(2,4-дигидроксифенил)циклогексаноноксима;
3-(2,4-дигидроксифенил)-2-циклогексен-1-оноксима;
(+)-3-(2,4-дигидроксифенил)циклогексаноноксима;
(+)-N-[3-(2,4-дигидроксифенил)циклогексил]метансульфонамида;
(+)-4-[3-(гидроксиамино)циклогексил]-1,3-бензолдиола;
(+)-O-метил-3-(2,4-дигидроксифенил)циклогексаноноксима;
(+)-O-бензил-3-(2,4-дигидроксифенил)циклогексаноноксима;
3-(2,4-дигидроксифенил)-2-циклопентеноноксима;
(+)-3-(2,4-дигидроксифенил)циклопентаноноксима
и их фармацевтически приемлемой соли.
40. Композиция по п.21, содержащая соединение, выбранное из группы, состоящей из
цис-N-[4-(2,4-дигидроксифенил)циклогексил]-1-бутансульфонамида;
транс-N-[4-(2,4-дигидроксифенил)циклогексил]метансульфонамида;
цис-N-[4-(2,4-дигидроксифенил)циклогексил]метансульфонамида;
[4-(2,4-дигидроксифенил)циклогексил]метилпропионата;
цис/транс-4-[4-(гидроксиамино)циклогексил]-1,3-бензолдиола;
транс-4-[4-(метоксиамино)циклогексил]-1,3-бензолдиола
и их фармацевтически приемлемой соли.
41. Композиция по п.21, где отбеливающее кожу или уменьшающее пигментацию эффективное количество соединения формулы I является ингибирующим тирозиназу эффективным количеством указанного соединения.
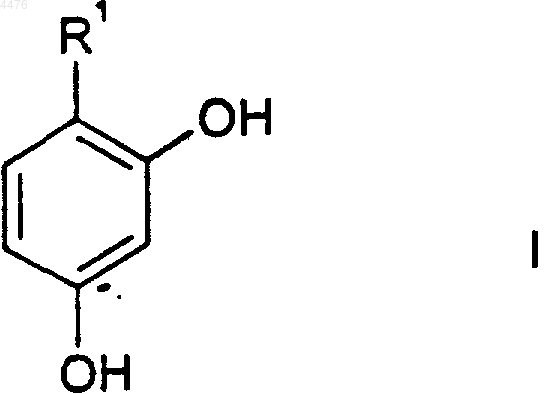
42. Способ отбеливания кожи или уменьшения пигментации кожи у человека, при котором указанному человеку вводят отбеливающее кожу или уменьшающее пигментацию эффективное количество соединения формулы I
или его фармацевтически приемлемой соли, где
R1 представляет собой (C3-C8)циклоалкильное кольцо или (C5-C8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо, либо циклоалкенильное кольцо замещено 1-3 заместителями, независимо выбранными из группы, состоящей из циано; галогено; (C1-C6)алкила; арила; (C2-C9)гетероциклоалкила; (C2-C9)гетероарила; арил(C1-C6)алкила-; =O; =CHO(C1-C6)алкила; амино; гидрокси; (C1-C6)алкокси; арил(C1-C6)алкокси-; (C1-C6)ацила; (C1-C6)алкиламино-; арил(C1-C6)алкиламино-; амино(C1-C6)алкила-; (C1-C6)алкокси-CO-NH-; (C1-C6)алкиламино-CO-; (C2-C6)алкенила; (C2-C6)алкинила; гидрокси(C1-C6)алкила-; (C1-C6)алкокси(C1-C6)алкила-; (C1-C6)ацилокси(C1-C6)алкила-; нитро; циано(C1-C6)алкила-; галогено(C1-C6)алкила-; нитро(C1-C6)алкила-; трифторметила; трифторметил(C1-C6)алкила-; (C1-C6)ациламино-; (C1-C6)ациламино(C1-C6)алкила-; (C1-C6)алкокси(C1-C6)ациламино-; амино(C1-C6)ацила-; амино(C1-C6)ацил(C1-C6)алкила-; (C1-C6)алкиламино(C1-C6)ацила-; ((C1-C6)алкил)2амино(C1-C6)ацила-; -CO2R2; -(C1-C6)алкил-CO2R2; -C(O)N(R2)2; -(C1-C6)алкил-C(O)N(R2)2; R2ON=; R2ON=(C1-C6)алкила-; R2ON=CR2(C1-C6)алкила-; -NR2(OR2); -(C1-C6)алкил-NP2(OR2); -C(O)(NR2OR2); -(C1-C6)алкил-C(O)(NR2OR2); -S(O)mR2; где каждый R2 независимо выбран из водорода, (C1-C6)алкила, арила или арил(C1-C6)алкила-; R3C(O)O-(C1-C6)алкила-, где R3 представляет собой (C1-C6)алкил, арил или арил(C1-C6)алкил-; R4R5N-C(O)-O-; R4R5NS(O)2-; R4R5NS(O)2(C1-C6)алкила-; R4S(O)2R5N-; R4S(O)2R5N(C1-C6)алкила-; причем m представляет собой 0, 1 или 2, a R4 и R5, каждый независимо, выбраны из водорода или (C1-C6)алкила; -C(=NR6)(N(R4)2); либо -(C1-C6)алкил-C(=NR6)(N(R4)2); где R6 представляет собой OR2 или R2, где R2 является таким, как определено выше;
при условии, что циклоалкенильное кольцо не является ароматическим;
при условии, что, когда R1 представляет собой (C5-C8)циклоалкильное кольцо, или когда R1 представляет собой (C5-C8)циклоалкенильное кольцо, имеющее следующую структуру

где n представляет собой 0, 1, 2 или 3, где такое (C5-C8)циклоалкильное кольцо или (C5-C8)циклоалкенильное кольцо замещено гидрокси, (C1-C6)алкокси-, арил(C1-C6)алкокси-, -OC(O)(C1-C6)алкил, -OC(O)арил(C1-C6)алкил, -OC(O)фенил, галогено, (C1-C6)алкилом-, арил(C1-C6)алкилом-, -SH, -S(C1-C6)алкил, арил(C1-C6)алкил-S-, -NH2, -NH(C1-C6)алкил или арил(C1-C6)алкил-HN-; то данное (C5-C8)циклоалкильное кольцо или (C5-C8)циклоалкенильное кольцо должно быть ди- или тризамещенным.
43. Способ по п.42, где R1 указанного соединения представляет собой циклогексильное шыш циклогексенильное кольцо, замещенное по положению 3 или 4, либо циклопентильное или циклопентенильное кольцо, замещенное по положению 3.
44. Способ по п.42, где R1 указанного соединения является монозамещенным.
45. Способ по п.42, где R1 указанного соединения является дизамещенным.
46. Способ по п.42, где R1 указанного соединения замещен по меньшей мере одним из R3C(O)O-(C1-C6)алкила-.
47. Способ по п.42, где R1 указанного соединения замещен по меньшей мере одним из R2ON=, R2ON=(C1-C6)алкила- или R2ON=CR2(C1-C6)алкила-.
48. Способ по п.42, где R1 указанного соединения замещен по меньшей мере одним -NR2(OR2).
49. Способ по п.42, где R1 указанного соединения замещен по меньшей мере одним из R4R5NS(O)2-, R4R5NS(O)2(C1-C6)алкила-, R4S(O)2R5N- или R4S(O)2R5N(C1-C6)алкила-.
50. Способ по п.42, где R1 указанного соединения замещен по меньшей мере одним из R4S(O)2R5N- или R4S(O)2R5N(C1-C6)алкила-.
51. Способ по п.42, где R1 указанного соединения представляет собой (C3-C8)циклоалкильное кольцо или (C5-C8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо, либо циклоалкенильное кольцо замещено одним из R3C(O)O-(C1-C6)алкила-, R2ON=, R2ON=(C1-C6)алкила-, R2ON=CR2(C1-C6)алкила-, -NR2(OR2), R4R5NS(O)2-, R4R5NS(O)2(C1-C6)алкила-, R4S(O)2R5N- или R4S(O)2R5N(C1-C6)алкила-.
52. Способ по п.51, где R1 указанного соединения представляет собой (C3-C8)циклоалкильное кольцо или (C5-C8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо, либо циклоалкенильное кольцо замещено одним из R3C(O)O-(C1-C6)алкила-, R2ON= или R4S(O)2R5N-.
53. Способ по п.51, где R1 указанного соединения замещен R3C(O)O-(C1-C6)алкилом-.
54. Способ по п.51, где R1 указанного соединения замещен R2ON=, R2ON=(C1-C6)алкилом- или R2ON=CR2(C1-C6)алкилом-.
55. Способ по п.51, где R1 указанного соединения замещен R2ON=.
56. Способ по п.51, где R1 указанного соединения замещен -NR2(OR2).
57. Способ по п.51, где R1 указанного соединения замещен R4R5NS(O)2-, R4R5NS(O)2(C1-C6)алкилом-, R4S(O)2R5N- или R4S(O)2R5N(C1-C6)алкилом-.
58. Способ по п.51, где R1 указанного соединения замещен R4S(O)2R5N- или R4S(O)2R5N(C1-C6)алкилом-.
59. Способ по п.42, где (C2-C9)гетероциклоалкильный заместитель представляет собой группу формулы
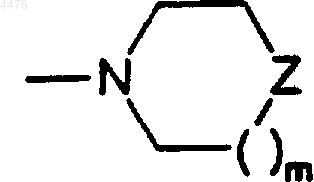
где m представляет собой 0, 1 или 2, а
Z представляет собой CH2, NR2, O, S, SO или SO2.
60. Способ по п.46, где R1 представляет собой группу формулы

которая замещена согласно п.1,
где n представляет собой 0, 1 или 2 и
где пунктирная линия указывает на возможную двойную связь в данном положении.
61. Способ по п.60, где R1 указанного соединения замещен -O, =NOH, CH2OH,
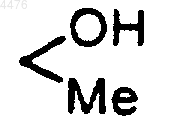
либо их комбинацией.
62. Способ по п.42, где указанное соединение выбрано из группы, состоящей из
4-(2,4-дигидроксифенил)циклогексанона;
4-(2,4-дигидроксифенил)циклогексаноноксима;
O-метил-4-(2,4-дигидроксифенил)циклогексаноноксима;
O-бензил-4-(2,4-дигидроксифенил)циклогексаноноксима;
3-(2,4-дигидроксифенил)-2-циклогексен-1-она;
(+)-3-(2,4-дигидроксифенил)циклогексанона;
3-(2,4-дигидроксифенил)-2-циклогексен-1-оноксима;
(+)-3-(2,4-дигидроксифенил)циклогексаноноксима;
(+)-4-[3-(1-пиперазинил)циклогексил]-1,3-бензолдиола;
(+)-N-[3-(2,4-дигидроксифенил)циклогексил]метансульфонамида;
(+)-4-[3-(гидроксиметил)циклогексил]-1,3-бензолдиола;
(+)-4-[3-(гидроксиамино)циклогексил]-1,3-бензолдиола;
цис/транс-4-[4-(гидроксиметил)циклогексил]-1,3-бензолдиола;
цис/транс-4-(4-гидрокси-4-метилциклогексил)-1)3-бензолдиола;
(+)-O-метил-3-(2,4-дигидроксифенил)циклогексаноноксима;
(+)-3-(2,4-дигидроксифенил)-1-метилциклогексанола;
(+)-O-бензил-3-(2,4-дигидроксифенил)циклогексаноноксима;
3-(2,4-дигидроксифенил)-2-циклопентеноноксима;
(+)-3-(2,4-дигидроксифенил)циклопентанона;
(+)-3-(2,4-дигидроксифенил)циклопентаноноксима
и их фармацевтически приемлемой соли.
63. Способ по п.42, где указанное соединение выбрано из группы, состоящей из
4-(2,4-дигидроксифенил)-3-циклогексен-1-она;
цис/транс-N-[4-(2,4-дигидроксифенил)циклогексил]ацетамида;
цис-N-[4-(2,4-дигидроксифенил)циклогексил]-1-бутансульфонамида;
транс-N-[4-(2,4-дигидроксифенил)циклогексил]метансульфонамида;
цис-N-[4-(2,4-дигидроксифенил)циклогексил]метансульфонамида;
4-[4-(4-гидроксифенил)циклогексил]-1,3-бензолдиола;
цис/транс-метил-[4-(2,4-дигидроксифенил)циклогексил]ацетата;
транс-метил-[4-(2,4-дигидроксифенил)циклогексил]ацетата;
цис-метил-[4-(2,4-дигидроксифенил)циклогексил]ацетата;
транс-[4-(2,4-дигидроксифенил)циклогексил]уксусной кислоты;
цис-[4-(2,4-дигидроксифенил)циклогексил]уксусной кислоты;
цис/транс-[4-(2,4-дигидроксифенил)циклогексил]уксусной кислоты;
цис/транс-[4-(2,4-дигидроксифенил)циклогексил]ацетонитрила;
цис/транс-4-[4-(2-аминоэтил)циклогексил]-1,3-бензолдиола;
(+)-4-(3,3-дифторциклогексил)-1,3-бензолдиола;
(+)-3-(2,4-дигидроксифенил)циклогексанкарбоксамида;
(+)-3-(2,4-дигидроксифенил)-N-гидроксициклогексанкарбоксамида;
(+)-3-(2,4-дигидроксифенил)-N-этилциклогексанкарбоксамида;
(+)-4-[3-гидрокси-3-(гидроксиметил)циклогексил]-1,3-бензолдиола;
(+)-N-[3-(2,4-дигидроксифенил)циклогексил]ацетамида;
цис/транс-4-(2,4-дигидроксифенил)циклогексанкарбоновой кислоты;
транс-4-(2,4-дигидроксифенил)циклогексилэтилкарбамата;
транс-4-(2,4-дигидроксифенил)циклогексилциклогексилкарбамата;
транс-4-[4-(фенилсульфанил)циклогексил]-1,3-бензолдиола;
транс-4-[4-(фенилсульфонил)циклогексил]-1,3-бензолдиола;
[4-(2,4-дигидроксифенил)циклогексил]метилпропионата;
этил-4-(2,4-дигидроксифенил)-1-гидроксициклогексанкарбоксилата;
цис/транс-4-[4-(гидроксиамино)циклогексил]-1,3-бензолдиола;
транс-4-[4-(метоксиамино)циклогексил]-1,3-бензолдиола
и их фармацевтически приемлемой соли.
64. Способ по п.42, где отбеливающее кожу или уменьшающее пигментацию эффективное количество соединения формулы I является ингибирующим тирозиназу эффективным количеством указанного соединения.
Текст
1 Область изобретения Настоящее изобретение относится к применению некоторых производных резорцина в качестве отбеливающих кожу агентов. Предпосылки изобретения Термины отбеливающий агент и депигментирующий агент в этом документе используются в качестве взаимозаменяемых. Цвет кожи у людей является результатом сложной серии клеточных процессов, осуществляющихся в единственной в своем роде популяции клеток, называемых меланоцитами. Меланоциты локализованы в нижней части эпидермиса, и их функция заключается в синтезе пигмента меланина, который защищает организм от повреждающих воздействий ультрафиолетового излучения. Когда кожа подвергается воздействию ультрафиолетового излучения, такого как излучения, содержащегося в солнечном свете, меланоциты усиливают синтез меланина. Меланин откладывается в меланосомах, которые представляют собой пузырьки, находящиеся внутри клетки. Меланосомы выталкиваются из клетки и переносятся к поверхности кожи кератиноцитами, которые поглощают меланинсодержащие меланосомы. Конечный результат заключается в том, что видимые слои кожи проявляют коричневый цвет, обычно известный как загар. Темнота этого оттенка, наблюдаемого на коже,пропорциональна количеству меланина, синтезированного меланоцитами и перенесенного к кератиноцитам. Механизм, путем которого происходит образование пигментации кожи, меланогенез, является особенно сложным и схематически включает в себя следующие основные стадии: тирозинL-дофа (диоксифенил-L-аланин)дофахинондофахроммеланины. Первые две реакции в этой серии катализируются ферментом тирозиназой. Активность тирозиназы промотируется действием -меланоцитстимулирующего гормона или ультрафиолетовым излучением, что в конечном итоге приводит к образованию меланина как нарушению пигментации кожи. Точно установлено, что вещество обладает депигментирующим эффектом, если оно воздействует непосредственно на жизнеспособность эпидермальных меланоцитов при нормальном меланогенезе и/или если оно препятствует одной из стадий биосинтеза меланина. Активные соединения, применяемые в различных способах и композициях по данному изобретению, ингибируют тирозиназу и вследствие этого ингибируют или снижают биосинтез меланина. Существует строгое требование к агентам,способным достигать мест отложения, таких как пятна и веснушки, чтобы восстановить нормальный цвет кожи. С этой целью разработаны и выпущены в продажу различные агенты и способы. Примерами таких способов являются(а) способ, при котором витамин С (Lаскорбиновую кислоту), обладающий хорошей восстанавливающей способностью, вводят перорально в больших количествах; (б) способ,при котором парентерально вводят глутатион;(в) способ, при котором вводят перекись, такую как перекись водорода, перекись цинка, перекись натрия и тому подобное, которые, как считают, обладают обесцвечивающим воздействием на меланин; и (г) способ, при котором местно вводят витамин С или цистеин в виде мази, крема, лосьона или тому подобное. Применение витамина С связано с проблемой в отношении стабильности, и он становится настолько нестабильным в содержащих воду системах, что это приводит к изменению их запаха и цвета. Тиоловые соединения, такие как глутатион и цистеин, не проявляют достаточного депигментирующего эффекта ввиду того, что данный эффект развивается очень медленно. Вещества, в настоящее время наиболее широко используемые в качестве депигментирующих, представляют собой, в частности, гидрохинон и его производные, особенно его простые эфиры, такие как монометиловый эфир гидрохинона. Известно, что эти соединения,несмотря на их эффективность, вызывают побочные эффекты, которые могут быть опасными. Гидрохинон, применение которого ограничено концентрацией 2%, является как раздражающим, так и цитотоксическим в отношении меланоцитов. Патент США 4526179 относится к некоторым сложным эфирам жирных кислот и гидрохинона, которые обладают хорошей активностью и являются менее раздражающими и более стабильными, чем гидрохинон. Японская заявка на патент 27909/86 относится к другим производным гидрохинона,которые не имеют недостатков гидрохинона, но обладают относительно низкой эффективностью. Патент США 5449518 относится к производным 2,5-дигидроксифенилкарбоновой кислоты в качестве депигментирующих кожу агентов. Европейская заявка на патент ЕР 341664 А 1 относится к некоторым производным резорцина в качестве ингибиторов тирозиназы и депигментирующих кожу агентов. Международная публикация РСТ WO 99/15148 относится к некоторым производным резорцина в качестве ингибиторов тирозиназы и депигментирующих кожу агентов. Депигментирующие агенты для местного применения, которые обладают хорошей эффективностью и являются безвредными, особенно желательны для лечения следующих состояний: региональной гиперпигментации, вызванной гиперактивностью меланоцитов, такой как идиопатическая меланодермия, имеющая место 3 либо во время беременности (маска беременных, или хлоазма), либо как побочный эффект эстроген-прогестероновой контрацепции; локальной гиперпигментации, вызванной доброкачественной гиперактивностью меланоцитов и пролиферацией, такой как старческое лентиго,или печеночные пятна (liver spots); гиперпигментации, вызванной травмой, такой как фотосенсибилизация после повреждения и рубцевание; и некоторых форм лейкодермы, таких как витилиго, при которой, если поврежденная кожа не может быть репигментирована, остаточные зоны нормальной кожи являются депигментированными, придавая всей коже гомогенный белый цвет. Краткое изложение сущности изобретения Производные резорцина формулы I, которые определены ниже и используются в различных способах и композициях по данному изобретению, полезны при лечении упомянутых выше дерматологических состояний, а также других дерматологических состояний, некоторые из которых упомянуты далее в этом документе, при которых подвергаемому лечению субъекту желательно снизить или уменьшить пигментацию кожи, пораженной этим состоянием, с медицинской или косметической целью. Кроме того, производные резорцина формулы I полезны для лечения воспалительных расстройств, таких как псориаз, дерматит и угри, и для лечения перхоти. Таким образом, в данном изобретении предложено соединение формулы I или его фармацевтически приемлемая соль,где R1 представляет собой (С 3-С 8)циклоалкильное кольцо или (С 5-С 8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо, либо циклоалкенильное кольцо замещено 1-3 заместителями, независимо выбранными из группы,состоящей из циано; галогено; (С 1-С 6)алкила; арила; (С 2-С 9)гетероциклоалкила; (С 2-С 9)гетероарила; арил(С 1-С 6)алкила-; =О; =СНО(С 1-С 6) алкила; амино; гидрокси; (С 1-С 6)алкокси; арил(С 1-С 6)алкокси-;-S(O)mR ; где каждый R2 независимо выбран из водорода, (С 1-С 6)алкила, арила или арил(С 1 С 6)алкила-; R3C(O)O-, где R3 представляет собой (С 1-С 6)алкил, арил или арил(С 1-С 6)алкил-;m представляет собой 0, 1 или 2, a R4 и R5, каждый независимо, выбраны из водорода или (С 1 С 6)алкила; -C(=NR6)(N(R4)2); либо -(С 1-С 6) алкил-C(=NR6)(N(R4)2); где R6 представляет собой OR2 или R2, где R2 является таким, как определено выше; при условии, что циклоалкенильное кольцо не является ароматическим; при условии, что R1 должен быть замещен по меньшей мере одним из R3C(O)O-(C1C6)алкила;R4S(O)2R5N-; или R4S(O)2R5N(С 1-С 6)алкила-; при условии, что когда R1 замещен только одним R2ON=, то R2 не может представлять собой водород. Когда R1 представляет собой циклогексильное или циклогексенильное кольцо, данное кольцо предпочтительно замещено по положению 3 или 4 и более предпочтительно по положению 4. Когда R1 представляет собой циклопентильное или циклопентенильное кольцо, данное кольцо предпочтительно замещено по положению 3. В предпочтительном воплощении R1 является монозамещенным. В еще одном предпочтительном воплощении R1 является дизамещенным. В еще одном предпочтительном воплощении R1 замещен R3C(O)O-(С 1-С 6)алкилом-. В еще одном предпочтительном воплощении R1 замещен по меньшей мере одним из(C1-C6)aлкилa-; при условии, что, когда R1 замещен только одним R2ON=, то R2 не может представлять собой водород. В еще одном предпочтительном воплощении R1 замещен по меньшей мере одним R2ON=,при условии, что, когда R1 замещен только одним R2ON=, то R2 не может представлять собой водород. В еще одном предпочтительном воплощении R1 замещен по меньшей мере одним-NR2(OR2). В еще одном предпочтительном воплощении R1 замещен по меньшей мере одним из 5 В еще одном предпочтительном воплощении R1 замещен по меньшей мере однимR4S(O)2R5N-. В еще одном предпочтительном воплощении R1 замещен по меньшей мере однимR4S(O)2R5N(С 1-С 6)aлкилoм-. В еще одном предпочтительном воплощении R1 представляет собой (С 3-С 8)циклоалкильное кольцо или (С 5-С 8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо,либо циклоалкенильное кольцо замещено одним из R3 С(О)О-(С 1-С 6)алкила-, R2ON=, R2ON=(С 1 С 6)aлкилa-,R2ON=CR2(C1-С 6)алкила-,2 2 4 5C6)aлкилa-, R S(O)2R N- или R4S(O)2R5N(C1C6)aлкилa-; где R2, R3, R4 и R5 являются такими,как определено выше; при условии, что циклоалкенильное кольцо не является ароматическим; и при условии, что когда R1 замещен 2R ON=, то R2 не может представлять собой водород. В еще одном предпочтительном воплощении R1 представляет собой (С 3-С 8)циклоалкильное кольцо или (С 5-С 8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо,либо циклоалкенильное кольцо замещено одним изR S(O)2R N-; где R , R , R и R являются такими, как определено выше; при условии, что циклоалкенильное кольцо не является ароматическим; и при условии, что когда R1 замещен 2R ON=, то R2 не может представлять собой водород. В еще одном предпочтительном воплощении R1 замещен R3C(O)O-(C1-С 6)алкилом-. В еще одном предпочтительном воплощении R1 замещен R2ON=, R2ON=(С 1-С 6)алкиломили R2ON=CR2(С 1-С 6)aлкилoм-,при условии, что когда R1 замещен R2ON=,2 то R не может представлять собой водород. В еще одном предпочтительном воплощении R1 замещен R2ON=, когда R2 не может представлять собой водород. В еще одном предпочтительном воплощении R1 замещен -NR2(OR2). В еще одном предпочтительном воплощении R1 замещен R4R5NS(O)2-, R4R5NS(O)2(С 1 С 6)алкилом-, R4S(O)2R5N- или R4S(O)2R5N(С 1 С 6)aлкилoм-. В еще одном предпочтительном воплощении R1 замещен R4S(O)2R5N-. В еще одном предпочтительном воплощении R1 замещен R4S(O)2R5N(C1-C6)aлкилом-.(С 2-С 9)гетероциклоалкильный заместитель,когда он присутствует на R1, предпочтительно представляет собой группу формулыZ представляет собой CH2, NR2, О, S, SO или SO2. Для любого из вышеупомянутых соединений по настоящему изобретению R1 предпочтительно представляет собой группу формулы которая замещена, как описано выше для R1; где n представляет собой 0, 1 или 2; где пунктирная линия указывает на возможную двойную связь в данном положении. В предпочтительном воплощении n представляет собой 0 или 1. В еще одном предпочтительном воплощении n представляет собой 0; а пунктирная линия представляет собой двойную связь в данном положении. В еще одном предпочтительном воплощении n представляет собой 1. В еще одном предпочтительном воплощении R1 замещен =О, =NОН, СН 2 ОН,или их комбинацией. В еще одном предпочтительном воплощении n представляет собой 0; R1 замещен =NОН; а пунктирная линия представляет собой двойную связь в данном положении. В еще одном предпочтительном воплощении n представляет собой 1; и R1 замещен =О,=NOH, CH2OH либо или их комбинацией. В данном изобретении также предложено соединение, выбранное из группы, состоящей из О-бензил-4-(2,4-дигидроксифенил)циклогексаноноксима;-О-бензил-3-(2,4-дигидроксифенил) циклогексаноноксима и их фармацевтически приемлемой соли. Кроме того, в данном изобретении предложено соединение, выбранное из группы, состоящей из О-метил-4-(2,4-дигидроксифенил)циклогексаноноксима;[4-(2,4-дигидроксифенил)циклогексил] метилпропионата; цис/транс-4-[4-(гидроксиамино)циклогексил]-1,3-бензолдиола; транс-4-[4-(метоксиамино)циклогексил]1,3-бензолдиола и их фармацевтически приемлемой соли. В настоящем изобретении также предложена фармацевтическая композиция для местного применения для отбеливания кожи или уменьшения пигментации кожи у человека, содержащая фармацевтически приемлемый носитель и отбеливающее кожу или уменьшающее пигментацию количество соединения формулы I или его фармацевтически приемлемой соли,где R1 представляет собой (С 3-С 8)циклоалкильное кольцо или (С 5-С 8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо,либо циклоалкенильное кольцо замещено 1-3 заместителями, независимо выбранными из группы, состоящей из циано; галогено; (С 1 С 6)алкила; арила; (С 2-С 9)гетероциклоалкила;-S(O)mR ; где каждый R2 независимо выбран из водорода, (С 1-С 6)алкила, арила или арил(С 1 С 6)алкила-; R3C(O)O-, где R3 представляет собой (С 1-С 6)алкил, арил или арил(С 1-С 6)алкил-;R4 и R5, каждый независимо, выбран из водорода или (С 1-С 6)алкила; -C(=NR6)(N(R4)2); либо -(С 1-С 6)алкил-C(=NR6)(N(R4)2); где R6 представляет собой OR2 или R2, где R2 является таким, как определено выше; при условии, что циклоалкенильное кольцо не является ароматическим; 8 при условии, что R1 должен быть замещен по меньшей мере одним из R3C(O)O-(С 1 С 6)алкилa-;R4S(O)2R5N- или R4S(O)2R5N(С 1-С 6)aлкилa-. Когда R1 представляет собой циклогексильное или циклогексенильное кольцо, данное кольцо предпочтительно замещено по положению 3 или 4 и более предпочтительно по положению 4. Когда R1 представляет собой циклопентильное или циклопентенильное кольцо, данное кольцо предпочтительно замещено по положению 3. В предпочтительном воплощении R1 является монозамещенным. В еще одном предпочтительном воплощении R1 является дизамещенным. В еще одном предпочтительном воплощении R1 замещен по меньшей мере однимR3C(O)O-(С 1-С 6)алкилом-. В еще одном предпочтительном воплощении R1 замещен по меньшей мере одним изR2 ОN=СR2(С 1-С 6)алкила-. В еще одном предпочтительном воплощении R1 замещен по меньшей мере одним R2ON=. В еще одном предпочтительном воплощении R1 замещен по меньшей мере одним-NR2(OR2). В еще одном предпочтительном воплощении R1 замещен по меньшей мере одним изR S(O)2R N- или R S(O)2R5N(C1-C6)алкилa-. В еще одном предпочтительном воплощении R1 замещен по меньшей мере однимR4S(O)2R5N-. В еще одном предпочтительном воплощении R1 замещен по меньшей мере однимR4S(O)2R5N(C1-C6)алкилом-. В еще одном предпочтительном воплощении(С 3-С 8) циклоалкильное кольцо или (С 5-С 8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо, либо циклоалкенильное кольцо замещеноR ON=(C1-C6)aлкилoм-, R ON=CR (C1-С 6)алкилом-, -NR2(OR2), R4R5NS(O)2-, R4R5NS(O)2(C1C6)aлкилoм-, R4S(O)2R5N- или R4S(O)2R5N(C1C6)aлкилoм-; где R2, R3, R4 и R5 являются такими, как определено выше; при условии, что циклоалкенильное кольцо не является ароматическим. В еще одном предпочтительном воплощении R1 представляет собой (С 3-С 8)циклоалкильное кольцо или (С 5-С 8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо,либо циклоалкенильное кольцо замещено одним из 9 при условии, что циклоалкенильное кольцо не является ароматическим. В еще одном предпочтительном воплощении R1 замещен R3C(O)O-(C1-С 6)алкилом-. В еще одном предпочтительном воплощении R1 замещен R2ON=, R2ON=(C1-C6)алкиломили R2ON=CR2(C1-C6)алкилом-. В еще одном предпочтительном воплощении R1 замещен R2ON=. В еще одном предпочтительном воплощении R1 замещен -NR2(OR2). В еще одном предпочтительном воплощении R1 замещен R4R5NS(O)2-, R4R5NS(O)2(C1C6)алкилом-, R4S(O)2R5N- или R4S(О)2R5N(С 1 С 6)алкилом-. В еще одном предпочтительном воплощении R1 замещен R4S(O)2R5N-. В еще одном предпочтительном воплощении R1 замещен R4S(O)2R5N(C1-C6)алкилом-.(С 2-С 9)гетероциклоалкильный заместитель,когда он присутствует на R1 соединения формулы I, предпочтительно представляет собой группу формулыZ представляет собой CH2, NR2, О, S, SO или SO2. Для любой из вышеупомянутых композиций по настоящему изобретению R1 соединения формулы I предпочтительно представляет собой группу формулы которая замещена, как описано выше для R1; где n представляет собой 0, 1 или 2; где пунктирная линия указывает на возможную двойную связь в данном положении. В еще одном предпочтительном воплощении п представляет собой 0 или 1. В еще одном предпочтительном воплощении n представляет собой 0; а пунктирная линия представляет собой двойную связь в данном положении. В еще одном предпочтительном воплощении n представляет собой 1. В еще одном предпочтительном воплощении R1 замещен =О, =NOH, СН 2 ОН или либо их комбинацией. В еще одном предпочтительном воплощении n представляет собой 0; R1 замещен =NОН; а пунктирная линия представляет собой двойную связь в данном положении. 10 В еще одном предпочтительном воплощении n представляет собой 1; а R1 замещен =О,=NОН, СН 2 ОН или либо их комбинацией. В настоящем изобретении также предложена фармацевтическая композиция для местного применения для отбеливания кожи или уменьшения пигментации кожи у человека, содержащая фармацевтически приемлемый носитель и отбеливающее кожу или уменьшающее пигментацию эффективное количество соединения, выбранного из группы, состоящей из 4-(2,4-дигидроксифенил)циклогексаноноксима; О-метил-4-(2,4-дигидроксифенил)циклогексаноноксима; О-бензил-4-(2,4-дигидроксифенил)циклогексаноноксима; 3-(2,4-дигидроксифенил)-2-циклогексен-1 оноксима;-3-(2,4-дигидроксифенил)циклопентаноноксима и их фармацевтически приемлемой соли. В настоящем изобретении также предложена фармацевтическая композиция для местного применения для отбеливания кожи или уменьшения пигментации кожи у человека, содержащая фармацевтически приемлемый носитель и отбеливающее кожу или уменьшающее пигментацию эффективное количество соединения, выбранного из группы, состоящей из цис-N-[4-(2,4-дигидроксифенил)циклогексил]-1-бутансульфонамида; транс-N-[4-(2,4-дигидроксифенил)циклогексил]метансульфонамида; цис-N-[4-(2,4-дигидроксифенил)циклогексил]метансульфонамида;[4-(2,4-дигидроксифенил)циклогексил] метилпропионата; цис/транс-4-[4-(гидроксиамино)циклогексил]-1,3-бензолдиола; транс-4-[4-(метоксиамино)циклогексил]1,3-бензолдиола и их фармацевтически приемлемой соли. В еще одном предпочтительном воплощении отбеливающее кожу или уменьшающее пигментацию эффективное количество соедине 11 ния формулы I фармацевтической композиции по настоящему изобретению представляет собой ингибирующее тирозиназу эффективное количество указанного соединения. В настоящем изобретении также предложена фармацевтическая композиция для местного применения для ингибирования тирозиназы у человека, содержащая фармацевтически приемлемый носитель и ингибирующее тирозиназу эффективное количество соединения, выбранного среди соединений любых вышеупомянутых фармацевтических композиций по настоящему изобретению. В настоящем изобретении также предложен способ отбеливания кожи или уменьшения пигментации кожи у человека, при котором указанному человеку вводят отбеливающее кожу или уменьшающее пигментацию эффективное количество соединения формулы I или его фармацевтически приемлемой соли,где R1 представляет собой (С 3-С 8)циклоалкильное кольцо или (С 5-С 8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо,либо циклоалкенильное кольцо замещено 1-3 заместителями, независимо выбранными из группы, состоящей из циано; галогено; (С 1 С 6)алкила; арила; (С 2-С 9)гетероциклоалкила;-S(O)mR ; где каждый R2 независимо выбран из водорода, (C1-C6)алкила, арила или арил(С 1 С 6)алкила-; R3C(O)O-(C1-C6)алкила-, где R3 представляет собой (C1-C6)алкил, арил или арил(С 1-С 6)алкил-; R4R5N-C(O)-O-; R4R5NS(O)2-;R4 и R5, каждый независимо, выбраны из водорода или (С 1-С 6)алкила; -C(=NR6)(N(R4)2); либо -(C1-C6)алкил-C(=NR6)(N(R4)2); где R6 представляет собой OR2 или R2, где R2 является таким, как определено выше; при условии, что циклоалкенильное кольцо не является ароматическим; при условии, что, когда R1 представляет собой (С 5-С 8)циклоалкильное кольцо или когда(С 5-С 8)циклоалкенильное кольцо замещено гидрокси, (С 1-С 6)алкокси-, арил(С 1-С 6)алкокси-,-ОС(О)(С 1-С 6)алкил, -ОС(O)арил(С 1-С 6)алкил,-ОС(О)фенил,галогено,(С 1-С 6)алкилом-,арил(С 1-С 6)алкилом-, -SH, -S(C1-C6)алкилом,арил(C1-C6)алкил-S-, -NH2, -NH(C1-С 6)алкил или арил(C1-C6)алкил-НN-; то указанное (С 5 С 8)циклоалкильное кольцо или (С 5-С 8)циклоалкенильное кольцо должно быть ди- или тризамещенным. Когда R1 представляет собой циклогексильное или циклогексенильное кольцо, данное кольцо предпочтительно замещено по положению 3 или 4 и более предпочтительно по положению 4. Когда R1 представляет собой циклопентильное или циклопентенильное кольцо, данное кольцо предпочтительно замещено по положению 3. В предпочтительном воплощении R1 является монозамещенным. В еще одном предпочтительном воплощении R1 является дизамещенным. В предпочтительном воплощении R1 соединения по данному способу замещен по меньшей мере одним из R3C(O)O-(C1-C6)алкила-, R2ON=, R2ON=(C1-C6)алкила-, R2OH=CR2R4S(O)2R5N(C1-C6)aлкилa-. В еще одном предпочтительном воплощении R1 соединения по данному способу замещен по меньшей мере одним R3 С(О)О-(C1C6)алкилом-. В еще одном предпочтительном воплощении R соединения по данному способу замещен по меньшей мере одним из R2ON=, R2 ОN=(С 1 С 6)алкила- или R2 ОN=СR2(С 1-С 6)алкила-. В еще одном предпочтительном воплощении R1 соединения по данному способу замещен по меньшей мере одним R2ON=. 13 В еще одном предпочтительном воплощении R1 соединения по данному способу замещен по меньшей мере одним -NR2(OR2). В еще одном предпочтительном воплощении R1 соединения по данному способу замещен по меньшей мере одним из R4R5NS(O)2-,R4R5NS(O)2(C1-С 6)алкила-, R4S(O)2R5N- илиR4S(O)2R5N(C1-C6)алкилa-. В еще одном предпочтительном воплощении R1 соединения по данному способу замещен по меньшей мере одним R4S(O)2R5N-. В еще одном предпочтительном воплощении R1 соединения по данному способу замещен по меньшей мере одним R4S(O)2R5N(C1C6)алкилом-. В еще одном предпочтительном воплощении R1 соединения по данному способу замещен по меньшей мере одним гидрокси(C1C6)алкилом-. В еще одном предпочтительном воплощении(С 5 С 8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо, либо циклоалкенильное кольцо замещено одним из R3C(O)O-(C1C6)алкилa-,R2ON=,R2ON=(C1-C6)алкила-,2 2R2, R3, R4 и R5 являются такими, как определено выше. В еще одном предпочтительном воплощении R1 представляет собой (С 3-С 8)циклоалкильное кольцо или (С 5-С 8)циклоалкенильное кольцо, причем либо циклоалкильное кольцо,либо циклоалкенильное кольцо замещено одним изR S(O)2R N-; где R , R , R и R являются такими, как определено выше. В еще одном предпочтительном воплощенииR3 С(О)О-(C1C6)алкилом-. В еще одном предпочтительном воплощении R1 замещен одним из R2ON=, R2 ОN=(C1C6)алкила- или R2ON=CR2(C1-C6)алкила-. В еще одном предпочтительном воплощении R1 замещен одним R2ON=. В еще одном предпочтительном воплощении R1 замещен одним -NR2(OR2). В еще одном предпочтительном воплощении R1 замещен одним из R4R5NS(O)2-,R4R5NS(O)2(C1-C6)алкила-, R4S(O)2R5N- илиR4S(O)2R5N(C1-С 6)алкила-. В еще одном предпочтительном воплощении R1 замещен одним R4S(O)2R5N-. В еще одном предпочтительном воплощении R1 замещен одним R4S(O)2R5N(C1C6)алкилом-. В еще одном предпочтительном воплощении R1 соединения по данному способу замещен одним гидрокси(С 1-С 6)алкилом-.(С 2-С 9)гетероциклоалкильный заместитель,когда он присутствует на R1 соединения формулы I, предпочтительно представляет собой группу формулыZ представляет собой CH2, NR2, О, S, SO или SO2. Для любого из вышеупомянутых способов по настоящему изобретению R1 соединения формулы I предпочтительно представляет собой группу формулы которая замещена, как описано выше для R1; где n представляет собой 0, 1 или 2; где пунктирная линия указывает на возможную двойную связь в данном положении. В еще одном предпочтительном воплощении n представляет собой 0 или 1. В еще одном предпочтительном воплощении n представляет собой 0; а пунктирная линия представляет собой двойную связь в данном положении. В еще одном предпочтительном воплощении n представляет собой 1. В еще одном предпочтительном воплощении R1 замещен =О, =NОН, СН 2 ОН или либо их комбинацией. В еще одном предпочтительном воплощении n представляет собой 0; R1 замещен =NОН; а пунктирная линия представляет собой двойную связь в данном положении. В еще одном предпочтительном воплощении n представляет собой 1; и R1 замещен =О,=NOH, CH2OH, или либо их комбинацией. В предпочтительном воплощении способа по настоящему изобретению человеку вводят отбеливающее кожу или уменьшающее пигментацию эффективное количество соединения,выбранного из группы, состоящей из 4-(2,4-дигидроксифенил)циклогексанона; 4-(2,4-дигидроксифенил)циклогексаноноксима; О-метил-4-(2,4-дигидроксифенил)циклогексаноноксима; О-бензил-4-(2,4-дигидроксифенил)циклогексаноноксима; 3-(2,4-дигидроксифенил)-2-циклогексен-1 она;-3-(2,4-дигидроксифенил)циклопентаноноксима и их фармацевтически приемлемой соли. В еще одном предпочтительном воплощении способа по настоящему изобретению человеку вводят отбеливающее кожу или уменьшающее пигментацию эффективное количество соединения, выбранного из группы, состоящей из 4-(2,4-дигидроксифенил)-3-циклогексен-1 она; цис/транс-N-[4-(2,4-дигидроксифенил) циклогексил]ацетамида; цис-N-[4-(2,4-дигидроксифенил)циклогексил]-1-бутансульфонамида; транс-N-[4-(2,4-дигидроксифенил)циклогексил]метансульфонамида; цис-N-[4-(2,4-дигидроксифенил)циклогексил]метансульфонамида; 4-[4-(4-гидроксифенил)циклогексил]-1,3 бензолдиола; цис/транс-метил [4-(2,4-дигидроксифенил) циклогексил]ацетата; транс-метил[4-(2,4-дигидроксифенил)циклогексил] метилпропионата; этил 4-(2,4-дигидроксифенил)-1-гидроксициклогексанкарбоксилата; цис/транс-4-[4-(гидроксиамино)циклогексил]-1,3-бензолдиола; транс-4-[4-(метоксиамино)циклогексил]1,3-бензолдиола и их фармацевтически приемлемой соли. В предпочтительном воплощении отбеливающее кожу или уменьшающее пигментацию эффективное количество соединения по способу настоящего изобретения является ингибирующим тирозиназу эффективным количеством указанного соединения. В настоящем изобретении также предложен способ ингибирования тирозиназы у человека, нуждающегося в таком лечении, при котором указанному человеку вводят ингибирующее тирозиназу эффективное количество соединения, выбранного среди соединений, используемых в любых вышеупомянутых способах по настоящему изобретению. В настоящем изобретении также предложена фармацевтическая композиция для местного или трансдермального применения для лечения воспалительного расстройства, такого как псориаз, дерматит или угри, либо для лечения перхоти у человека, содержащая фармацевтически приемлемый носитель и количество соединения формулы I или его фармацевтически приемлемой соли, используемых в любых вышеупомянутых фармацевтических композициях по настоящему изобретению, при этом указанное количество является эффективным при лечении такого расстройства или состояния. 17 В настоящем изобретении также предложен способ лечения воспалительных расстройств, таких как псориаз, дерматит или угри,либо способ лечения перхоти у человека, при котором указанному человеку вводят количество соединения формулы I или его фармацевтически приемлемой соли, используемых в любых вышеупомянутых способах по настоящему изобретению, при этом указанное количество является эффективным при лечении такого расстройства или состояния. В настоящем изобретении также предложено применение любых соединений, используемых в любых вышеупомянутых способах по настоящему изобретению, или любых соединений, используемых в любых вышеупомянутых фармацевтических композициях по настоящему изобретению, с получением лекарственного средства, полезного для отбеливания кожи или уменьшения пигментации кожи у человека. Термин алкил, как он использован здесь,если не оговорено особо, включает в себя насыщенные одновалентные углеводородные радикалы, имеющие прямые, разветвленные или циклические группировки либо их комбинации. Любые заместители или функциональные группы на алкильной группе, как указано здесь, могут быть замещены где угодно на данной алкильной группе. Термин арил, как он использован здесь,относится к фенилу или нафтилу, возможно замещенному одним или более чем одним заместителем, предпочтительно от нуля до двух заместителей, независимо выбранных из галогена,ОН, (С 1-С 6)алкила, (C1-C6)алкокси, амино, (C1C6)алкиламино, ди-C1-C6)алкил)амино, нитро,циано и трифторметила. Любые заместители или функциональные группы на арильной группе, как указано здесь, могут быть замещены где угодно на данной арильной группе. Термин один или более чем один заместитель, как он использован здесь, относится к количеству заместителей, равному от одного заместителя до максимально возможного количества заместителей, исходя из числа доступных мест связывания. Галогено, как он использован здесь, относится к галогену и, если не оговорено особо,включает в себя хлоро, фторо, бромо и иодо. Термин ацил, как он использован здесь,если не оговорено особо, включает в себя радикал общей формулы RCO, где R представляет собой алкил, алкокси, арил, арилалкил или арилалкилокси, а термины алкил или арил являются такими, как определено выше. Термин ацилокси, как он использован здесь, включает в себя О-ацильные группы, в которых ацил является таким, как определено выше.(С 2-С 9)гетероциклоалкил, как он использован здесь, относится к пирролидинилу, тетрагидрофуранилу, дигидрофуранилу, тетрагидро 004476 18 пиранилу, пиранилу, тиопиранилу, азиридинилу, оксиранилу, метилендиоксилу, хроменилу,изоксазолидинилу, 1,3-оксазолидин-3-илу, изотиазолидинилу,1,3-тиазолидин-3-илу,1,2 пиразолидин-2-илу, 1,3-пиразолидин-1-илу, пиперидинилу, тиоморфолинилу, 1,2-тетрагидротиазин-2-илу, 1,3-тетрагидротиазин-3-илу, тетрагидротиадиазинилу,морфолинилу,1,2 тетрагидродиазин-2-илу, 1,3-тетрагидродиазин 1-илу, тетрагидроазепинилу, пиперазинилу,хроманилу и так далее. Специалисту в данной области техники ясно, что связывание указанного (С 2-С 9)гетероциклоалкильного кольца может осуществляться через атом углерода или через гетероатом азота, где это возможно.(С 2-С 9)гетероарил, как он использован здесь, относится к фурилу, тиенилу, тиазолилу,пиразолилу, изотиазолилу, оксазолилу, изоксазолилу, пирролилу, триазолилу, тетразолилу,имидазолилу, 1,3,5-оксадиазолилу, 1,2,4-оксадиазолилу, 1,2,3-оксадиазолилу, 1,3,5-тиадиазолилу, 1,2,3-тиадиазолилу, 1,2,4-тиадиазолилу,пиридилу, пиримидилу, пиразинилу, пиридазинилу, 1,2,4-триазинилу, 1,2,3-триазинилу, 1,3,5 триазинилу, пиразоло[3,4-b]пиридинилу, циннолинилу, птеридинилу, пуринилу, 6,7-дигидро 5 Н-[1]пиридинилу, бензо[b]тиофенилу, 5,6,7,8 тетрагидрохинолин-3-илу, бензоксазолилу, бензотиазолилу, бензизотиазолилу, бензизоксазолилу, бензимидазолилу, тианафтенилу, изотианафтенилу, бензофуранилу, изобензофуранилу,изоиндолилу, индолилу, индолизинилу, индазолилу, изохинолилу, хинолилу, фталазинилу,хиноксалинилу, хиназолинилу, бензоксазинилу и так далее. Специалисту в данной области техники ясно, что связывание указанных (С 2 С 9)гетероарильных колец может осуществляться через атом углерода или через гетероатом азота,где это возможно. Соединения формулы I могут содержать хиральные центры и, следовательно, могут существовать в различных энантиомерных и диастереомерных формах. Это изобретение относится ко всем оптическим изомерам, стереоизомерам и таутомерам соединений формулы I и к их смесям, и ко всем фармацевтическим композициям и способам лечения, определенным выше, в которых они содержатся или используются, соответственно. Формула I, как она определена выше, также включает в себя соединения, идентичные описанным соединениям, но при том обстоятельстве, что один или более чем один атом водорода, углерода или других атомов заменены их изотопами. Такие соединения могут быть полезны в качестве исследовательских и диагностических инструментов в фармакокинетических исследованиях метаболизма и в анализах связывания. Настоящее изобретение также относится к фармацевтически приемлемым солям присоединения кислот и оснований любых вышеупомя 19 нутых соединений формулы I. Кислоты, которые используются для получения фармацевтически приемлемых солей присоединения кислот вышеупомянутых основных соединений по данному изобретению, представляют собой такие кислоты, которые образуют нетоксичные соли присоединения кислот, т.е. соли, содержащие фармакологически приемлемые анионы, такие как соли гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, ацетат, лактат, цитрат, кислый цитрат, тартрат, битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, птолуолсульфонат и памоат (т.е. 1,1-метиленбис-(2-гидрокси-3-нафтоат. Подробное описание изобретения Соединения формулы I могут быть получены, как описано в приведенных далее реакционных схемах и обсуждении. Если не оговорено особо, n, m, R2, R3, R4, R5, Z и структурная формула I в следующих реакционных схемах и обсуждении являются такими, как определено выше. Схема 1Y, YI, YII, показанные на приведенных выше схемах, каждый независимо, представляет собой любой из различных заместителей по R1,как определено выше, либо водород, как подходит. Реакционные схемы 1-12 иллюстрируют различные способы синтеза соединений формулы I. PG относится к защитной группе. В соответствии со схемой I, соединения формулы (2) могут быть получены в результате защиты имеющегося в продаже 4-бромрезорцина (1). Подходящая защитная группа,такая как метоксиметил (MOM), может быть 23 введена традиционными способами, которые хорошо известны специалистам в данной области техники. Например, алкилирование 4 бромрезорцина может быть осуществлено двумя эквивалентами метоксиметилхлорида в присутствии диизопропиламина в галогенированном растворителе при температуре приблизительно от 0 С до комнатной. Соединения общей формулы (3) могут быть получены с использованием традиционных способов. Например, взаимодействие соединений формулы (2) с н-бутиллитием в присутствии N,N,N,N-тетраметилэтилендиамина в подходящем растворителе, таком как тетрагидрофуран, с последующей остановкой реакции триизопропилборатом и гидролизом водной кислотой может давать соединения формулы(3). Соединения общей формулы (5) могут быть получены с использованием традиционных способов. Например, обработка соединений формулы (4) трифенилфосфином и бромом в хлорированном растворителе будет давать соединения формулы (5). Соединение (4), в котором п=1, имеется в продаже (Aldrich, Milwaukee,WI, USA). Соединения формулы (6) могут быть получены путем взаимодействия соединений формулы (3) с соединениями формулы (5) в условиях реакции сочетания Сузуки (Suzuki). Например,реакция Сузуки может быть осуществлена, используя палладий,тетракис(трифенилфосфин)палладий (пять мольных процентов), карбонат натрия (два эквивалента) и нагревая в подходящей системе растворителей (например,диметоксиэтан/вода) приблизительно при 80 С. Превращение соединений формулы (6) в соединения формулы (8) может быть осуществлено в стандартных условиях восстановления, таких как, например, газообразный водород и металлический катализатор, такой как родий на оксиде алюминия, при температуре, приблизительно равной комнатной, и атмосферном давлении. Снятие защиты с соединений формулы (6) или(8) в подходящих условиях, например, когда защитной группой является MOM, в условиях нагревания при 50 С в метаноле с Дауэксом(Dowex) в кислотной форме, дает соединения формулы I, в которых R1 замещен =О, (7), (9). Соединения формулы (7) или (9) затем могут быть в дальнейшем преобразованы в стандартных условиях с получением резорцинов формулы I, в которых R1 замещен =NOR2. Например,нагревание соединений формулы (7) в подходящем растворителе (например этаноле) при приблизительно 80 С с требуемой солью гидроксиламина гидрохлорида и триэтиламином дает аналоги соединений формулы I. Соединения формулы I, в которых R1 замещен NHOR2, могут быть получены из соединений формулы I, в которых R1 замещен =NOR2, путем восстановления в стандартных реакционных условиях, на 004476 24 пример, с помощью цианоборгидрида натрия в уксусной кислоте при температуре, равной или приблизительно равной комнатной. Соединения формулы (8) далее могут быть преобразованы в стандартных условиях с получением резорцинов формулы I, в которых R1 дизамещен фторо. Например, обработка соединений формулы (8) трифторидом диэтиламиносеры в подходящем растворителе, например диметоксиэтане, после подходящего способа снятия защиты будет давать аналоги соединений формулы I. Согласно схеме 2, соединения общей формулы (10) хорошо известны и могут быть получены с использованием традиционных способов(11) могут быть получены в результате взаимодействия соединений формулы (2) с нбутиллитием в присутствииN,N,N'N'тетраметилэтилендиамина в эфирном растворителе с последующим добавлением соединения формулы (10). Дегидрирование соединений формулы (11) в стандартных условиях, например при нагревании соединений формулы (11) приблизительно при 110 С в аппарате ДинаСтарка в присутствии камфорсульфоновой кислоты в подходящем растворителе (например толуоле), дает соединения формулы (12). Гидрирование в стандартных условиях, например с использованием газообразного водорода и палладия на угле в этаноле, дает соединения общей формулы (13). Снятие защиты в подходящих условиях дает резорцины формулы I, в которыхR1 замещен =О (14). Соединения формулы (14) далее могут быть преобразованы в стандартных условиях с получением резорцинов формулы I,в которых R1 замещен =NOR2. Например, нагревание соединений формулы (14) в подходящем растворителе (например этаноле) при приблизительно 80 С с требуемой солью гидроксиламина гидрохлорида и триэтиламином дает аналоги формулы I. Последующее восстановление в стандартных условиях будет давать соединения формулы I, в которых R1 замещен NHOR2. Соединения формулы (14) кроме этого могут быть повторно защищены подходящей защитной группой, такой как трет-бутилдиметилсилил, в стандартных реакционных условиях с получением соединений формулы (15). Соединения формулы (15) могут быть преобразованы далее с использованием стандартных реакционных условий. Например, метиленирование с использованием соответствующей реакции Виттига (Witting) будет давать соединения формулы (16), например, обработка бромидом метилтрифенилфосфония трет-бутилатом калия в подходящем растворителе (например, тетрагидрофуране) при температуре между-78 и 0 С с последующим добавлением соединения формулы (15) будет давать соединения формулы (16). Последующее превращение со 25 единений формулы (16) в стандартных условиях, например гидроборирование, дает соединения формулы (17), а последующее окисление с использованием подходящих условий, таких как дихромат пиридиния в диметилформамиде при комнатной температуре, дает соединения формулы (18). Соединения формулы (17) могут быть обработаны алкилбромидом в подходящем растворителе (например, ацетоне) в присутствии карбоната калия с получением соединений формулы I, в которых R1 замещен эфирной группой,после того, как осуществлено соответствующее снятие защиты, например, когда защитной группой является трет-бутилдиметилсилил, может быть использован фторид тетрабутиламмония в тетрагидрофуране. Альтернативно, соединения формулы (17) также могут быть этерифицированы в стандартных условиях, например обработкой кислым хлоридом в присутствии триэтиламина в хлорированном растворителе при температуре, приблизительно равной комнатной. Соединения формулы (18) могут быть преобразованы с образованием аналогов, таких как сложные эфиры и амиды, в условиях, хорошо известных специалистам в данной области техники. Например, условия образования амидов могут включать в себя обработку соединений формулы (18) изобутилхлорформиатом и триэтиламином в хлорированном растворителе при приблизительно 0 С с последующим добавлением подходящего амина. Снятие защиты в подходящих условиях будет давать соединения формулы I, в которых R1 замещен амидом. Кроме этого, снятие защиты с соединений формулы(16), (17) и (18) в стандартных условиях дает соединения формулы I, в которых R1 замещен метиленом, гидроксилметилом или карбоновой кислотой, соответственно. Согласно схеме 3 соединения формулы(20) могут быть получены, используя в качестве исходного соединение (19), которое имеется в продаже. Превращение в соединения формулы(20) может происходить в стандартных условиях, таких как, например, когда защитной группой является бензил, конденсацию соединения(19) и бензилового спирта с удалением воды при помощи аппарата Дина-Старка можно осуществить в соответствии с хорошо известной методологией. Конденсацию соединений формулы(20) с соединениями формулы (10) можно осуществить с использованием стандартных методик, например обработка соединений формулы(20) основанием, таким как диизопропиламид лития, в эфирном растворителе с последующим добавлением соединения формулы (10) будет давать соединения формулы (21). Обработка соединений формулы (21) подходящим реагентом, таким как N-бромсукцинимид в хлорированном растворителе при температуре, приблизительно равной комнатной, может давать соединения формулы (22). Из соединений форму 004476 26 лы (22) в подходящих условиях далее могут быть образованы соединения формулы (23). Такие условия могут включать в себя обработку соединений формулы (22) основанием, таким как 1,8-диазобицикло[5.4.0]ундец-7-ен, в подходящем растворителе,таком какN,Nдиметилформамид, при температуре приблизительно 140 С. Обработка соединений формулы(23) в стандартных условиях гидрирования, например газообразным водородом и палладием на угле в этаноле, дает соединения общей формулы (24), когда защитной группой является бензил. Соединения формулы (14) далее могут быть получены путем обработки соединений формулы (24) в кислотных условиях. Превращение соединений формулы (14) в соединения формулы I может включать в себя необходимость использования защитных групп,что очевидно специалистам в данной области техники. Некоторые примеры таких соединений формулы I проиллюстрированы на схеме 3. Превращение соединений формулы (15) в соединения формулы I может включать в себя восстановление кетоновой группировки в стандартных условиях, например, боргидридом натрия в этаноле. Последующее преобразование можно осуществить, например с использованием химических реакций, описанных в другом месте этого документа, с получением соединений формулы I, в которых YI может являться алкилом, ацилом или карбониламино. В тех примерах, где используются защитные группы,для получения соединений формулы I требуется применение подходящего метода снятия защиты. Альтернативно, на соединения формулы(15) можно воздействовать, получая соединения формулы I, в которых R1 замещен амидом или сульфонамидом. Обработка соединений формулы (15) бензиламином в условиях восстановительного аминирования, например, одним эквивалентом триацетоксиборгидрида натрия в подходящем растворителе (дихлорэтане), с последующим гидрогенолизом в стандартных условиях, например, палладий на угле, газообразный водород, этанол, дает соединения формулы (25). Синтез соединений формулы I может быть осуществлен с использованием традиционных способов. Например, соединения формулы (25) могут взаимодействовать с сульфонилхлоридами и кислыми хлоридами в хлорированном растворителе в присутствии основания (например, триэтиламина) при температуре, приблизительно равной комнатной. Снятие защиты с использованием подходящих условий реакции дает соединения формулы I, в которых Y является сульфонамидной или амидной группой. Согласно схеме 4, соединения формулы(26) могут быть синтезированы с использованием стандартных способов. Например соединения формулы (6) или (8) могут быть гомологизированы с использованием реакции Виттига и 27 подвергнуты дальнейшим воздействиям, как описано выше, с получением соединений формулы I. Соединения формулы (26) или (16) из схемы 2 также могут быть подвергнуты дигидроксилированию в стандартных условиях, например, в присутствии каталитического тетроксида осмия и N-метилморфолина в эфирном растворителе, и после применения подходящего метода снятия защиты дают соединения формулы I, в которых R1 замещен -(ОН)(СН 2 ОН). Согласно схеме 5, соединения формулы(29) могут быть получены путем взаимодействия соединений (6) или (8), как описано выше на схеме 3. Кроме этого, соединения формул (29) и(25) могут быть преобразованы в результате обработки алкилирующим агентом, например алкилиодидом, в хлорированном растворителе в присутствии триэтиламина при температуре,приблизительно равной комнатной, с получением соединения (30) перед сульфонированием или образованием амидной связи и снятием защиты, в результате чего получаются соединения формулы I, в которых Y представляет собой(6), (8) или (9), (14) или (15) могут быть обработаны подходящим органометаллическим реагентом, таким как реактив Гриньяра, в эфирном растворителе при температуре от -78 до 0 С с последующим снятием защиты и получением соединений формулы I, в которых R1 замещен(31) могут быть образованы в условиях, хорошо известных специалистам в данной области техники. Обработка соединений (6) или (8) амином,таким как пиперидин, в подходящем растворителе (например дихлорэтане) и восстанавливающим агентом, таким как триацетоксиборгидрид натрия, с последующим снятием защиты будет давать соединения формулы I, в которыхR1 замещен азотсодержащим гетероциклом. Согласно схеме 8, соединения общей формулы (33) могут быть получены с использованием традиционных способов. Например, взаимодействие соединений формулы (2) с нбутиллитием в присутствииN,N,N',N'тетраметилэтилендиамина в подходящем растворителе, таком как тетрагидрофуран, с последующей остановкой реакции кетоном (32) (продается Aldrich) и гидролизом с помощью водной кислоты, может давать соединения формулы(33). Манипулирование функциональными группами, как представлено на схемах 1-7 и схеме 8, позволяет затем синтезировать соединения формулы I. Согласно схеме 9, соединения формулы(15), (6) или (8) далее могут быть преобразованы с получением соединений формулы (34) с использованием стандартных химических способов Виттига и Wadworths-Emmons, с после 004476 28 дующим подходящим методом снятия защиты. Соединения формулы (34) могут быть восстановлены с использованием стандартного гидрирования, как описано выше, с получением соединений, в которых Y представляет собой ОН,О-алкил или аминоалкил. Стандартный химический способ Wadworths-Emmons также может давать соединения формулы (35). Восстановление в подходящих условиях будет давать соединения формулы (36), которые могут быть далее преобразованы с использованием стандартных химических способов, описанных выше в этом документе, с получением соединений, в которых(10) могут быть превращены в соединения формулы (37) с использованием стандартной методики алкилирования. Например, соединение формулы (10) может быть обработано подходящим основанием, таким как диизопропиламид лития, в подходящем растворителе, таком как тетрагидрофуран, при температуре от -78 до 0 С с последующим добавлением алкилирующего агента. Такие алкилирующие агенты хорошо известны специалистам в данной области техники и могут включать в себя хлоро, бромо или иодоалкильные соединения; эпоксиды; альдегиды, азиридины; ,-ненасыщенные эфиры, кетоны или амиды; хлорангидриды; электрофильные источники кислорода,такие как Мо(СО)5.пиридин (Crimmons, M.Т. et al., 1992, J.Am. Chem. Soc., 114:5445); или электрофильные источники азота, такие как 2,4,6-триизопропилбензолсульфонилазид (Evans, P.A. et аl.,1992, Tetrahedron Lett. 33:6959). Такие алкилирующие агенты имеются в продаже или могут быть получены с помощью стандартных методик, хорошо известных специалистам в данной области техники. На соединения формулы (37) далее можно воздействовать, используя методику, подобную описанной выше. Например, алкилирование соединений формулы (37) в условиях кинетического депротонирования (см., например, Kopka,I. and Rathke, M.W., 1981, J. Оrg. Chem. 46:3771) с последующим алкилированием, как описано выше, будет давать соединения формулы (38). Альтернативно, алкилирование соединений формулы (37) в условиях термодинамического депротонирования (Kopka and Rathke, 1981, выше) с последующим алкилированием, как описано ранее, будет давать соединения формулы(45). Последующее алкилирование или манипулирование функциональной группой, известное специалистам в данной области техники, как описано в другом месте в этом документе, с последующим удалением защитной карбонильной группы в стандартных условиях, например водная соляная кислота приблизительно при 050 С, будет давать соединения формул (40), (46) и (49). 29 Кроме этого, соединения формулы (37) могут быть защищены подходящей защитной группой, например этилендитиокеталя, и удаление защитной кетальной группы в стандартных реакционных условиях, например водная соляная кислота приблизительно при 0-50 С, позволит осуществить последующее функциональное изменение циклоалкильного кольца с использованием описанной выше методики и получением соединений формулы (44). Согласно cхеме 11, соединения формулы(50) могут быть образованы из соединений формулы (10) с использованием известной методики (см., например, Adam, W. et al., 1989,Tetrahedron Lett. 30:6497) (Ts = тозил). Стандартное манипулирование функциональными группами дает соединения формулы (55) и (57). Расщепление оксиранового кольца амином дает соединения формулы (51). Альтернативно, кислотный гидролиз дает соединения формулы(52). Превращение соответствующего спирта в уходящую группу, такую как п-толуолсульфонил, позволит осуществить нуклеофильное замещение с помощью ряда нуклеофилов в стандартных, хорошо известных условиях. Такие нуклеофилы могут включать в себя амины,тиолаты, алкоголяты и нуклеофилы на основе углерода, такие как цианид, которые имеются в продаже или получаются с применением стандартных, хорошо известных специалистам методик. Соединения формулы (40), (44) и (49) могут быть получены с использованием описанных выше способов или других известных специалистам в данной области техники способов,так что заместители на R1 являются такими, как определено выше. Согласно cхемам 10 и 11, на кетоны формул (37), (38), (40), (42), (43), (44), (45), (46),(47), (49), (51), (54), (55) и (57) далее можно воздействовать так, как описано выше на cхемах 19, и превращать их в соединения формулы I, как описано на cхемах 2 и 3. Согласно cхеме 12, соединения формулы I могут быть также получены с использованием описанной выше методики. Соединения формулы (58) могут быть превращены в соединения формулы I с использованием химических реакций так, как описано выше на cхемах 1-11. Специалистам в данной области техники следует принимать во внимание, что в описанных выше процессах функциональные группы промежуточных соединений могут нуждаться в защите с помощью защитных групп. Применение защитных групп хорошо известно в данной области техники и полностью описано среди других источников в Protecting Groups in Organic Chemistry. J.W.F. McOmie, (ed.), 1973, Plenum Press; и в Protecting Groups in Organic Synthesis. 2nd edition, T.W. GreeneP.G.M. Wutz,1991, Wiley-Interscience. 30 Соединения формулы I, которые являются основными по своей природе, способны к образованию широкого ряда различных солей с разными неорганическими и органическими кислотами. Несмотря на то, что такие соли должны быть фармацевтически приемлемыми для введения животным, на практике часто желательно первоначально выделить соединение формулы I из реакционной смеси в виде фармацевтически неприемлемой соли и далее просто превратить последнюю обратно в свободное основание путем обработки щелочным реагентом, а после этого превратить это последнее свободное основание в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислот активных основных соединений по этому изобретению легко получить путем обработки основного соединения по существу эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. После осторожного выпаривания растворителя можно легко получить желаемую твердую соль. Те соединения формулы I, которые являются кислотными по своей природе, способны к образованию основных солей с различными фармацевтически приемлемыми катионами. Примеры таких солей включают в себя соли щелочных и щелочно-земельных металлов и,особенно, соли натрия и калия. Эти соли могут быть получены с помощью традиционных методик. Химические основания, которые используются в качестве реагентов для получения фармацевтически приемлемых основных солей по данному изобретению, представляют собой такие основания, которые образуют нетоксичные основные соли с кислотными соединениями формулы I. Такие нетоксичные основные соли включают в себя соли, производные от таких фармацевтически приемлемых катионов, как катионы натрия, калия, кальция и магния и так далее. Эти соли могут быть легко получены путем обработки соответствующих кислотных соединений водными растворами, содержащими желаемые фармацевтически приемлемые катионы, и далее выпариванием полученного раствора до сухого состояния предпочтительно при пониженном давлении. Альтернативно, они также могут быть получены путем смешивания растворов кислотных соединений в низших спиртах и желаемого алкоголята щелочного металла и упаривания затем полученного раствора до сухого состояния, как описано выше. В обоих случаях для обеспечения полноты прохождения реакции и максимальных выходов желаемых конечных продуктов предпочтительно использовать стехиометрические соотношения реагентов. Соединения формулы I и их фармацевтически приемлемые соли (далее здесь активные соединения по данному изобретению) полезны 31 при лечении нарушений пигментации у человека, включая солнечное и простое лентиго (в том числе возрастные/печеночные пятна), меланодермию/хлоазму и поствоспалительную гиперпигментацию. Такие соединения снижают уровни меланина кожи путем ингибирования продукции меланина независимо от того, продуцируется ли последний постоянно или в ответ на УФ-излучение (такое как воздействие солнца). Таким образом, активные соединения по данному изобретению могут применяться для снижения содержания меланина кожи в непатологических состояниях, приводя таким образом, по желанию пользователя, к осветлению тона кожи, либо предупреждая накопление меланина в коже, которая находится под воздействием УФизлучения. Кроме этого, они могут быть использованы в комбинации с отшелушивающими кожу агентами (включая гликолевую кислоту или трихлоруксусную кислоту для отшелушивания клеток кожи лица) для осветления тона кожи и предупреждения репигментации. Соответствующая схема приема лекарства, количество каждой введенной дозы и конкретные интервалы между дозами активного соединения будут зависеть от конкретного используемого активного соединения, состояния пациента, которого лечат, а также от природы и тяжести расстройства или состояния, которое лечат. Предпочтительно активное соединение вводят в таком количестве и через такие интервалы времени, которые приводят к желаемому лечению или улучшению расстройства или состояния, которое лечат. Активное соединение по данному изобретению также может применяться в комбинации с солнечными фильтрами (UVA- или UVBблокаторами) для предупреждения репигментации, для защиты от индуцированного солнцем или УФ-лучами потемнения кожи либо для усиления их способности к уменьшению уровня меланина в коже и их отбеливающего кожу воздействия. Активное соединение по данному изобретению также может применяться в комбинации с ретиноевой кислотой или ее производными либо с любыми соединениями, которые взаимодействуют с рецепторами ретиноевой кислоты и ускоряют или усиливают способность соединений по изобретению к уменьшению уровня меланина кожи и отбеливающее воздействие на кожу либо усиливают способность соединений по изобретению к предупреждению накапливания меланина в коже. Активное соединение по данному изобретению также может применяться в комбинации с 4 гидроксианизолом. Кроме того, активные соединения по данному изобретению могут применяться в комбинации с аскорбиновой кислотой, ее производными и продуктами на основе аскорбиновой кислоты (такими как аскорбат магния) либо другими продуктами с антиоксидантным меха 004476 32 низмом (такими как ресвератрол), которые ускоряют или усиливают их способность к уменьшению уровня меланина в коже и отбеливающее воздействие их на кожу. Данное изобретение относится как к способам отбеливания или уменьшения пигментации кожи, при которых соединение формулы I или его фармацевтически приемлемую соль и один или более чем один другой активный ингредиент, упомянутый выше, вводят совместно,как часть одной и той же фармацевтической композиции, а также к способам, при которых их вводят раздельно, как часть соответствующей схемы приема лекарства, разработанной для получения преимуществ комбинационной терапии. Соответствующая схема приема лекарства, количество каждой вводимой дозы и конкретные интервалы между дозами каждого активного агента будут зависеть от конкретной комбинации применяемых активных агентов,состояния пациента, которого лечат, а также от природы и тяжести расстройства или состояния,которое лечат. Такие дополнительные активные ингредиенты обычно будут вводиться в количествах, меньших либо равных тем, в которых они эффективны в качестве отдельных терапевтических агентов местного применения. ОдобренныеFDA дозы таких активных агентов, получивших одобрение FDA для введения людям, опубликованы в литературе. Активные соединения по настоящему изобретению обычно вводят в форме фармацевтических композиций, содержащих по меньшей мере одно из соединений формулы (I) вместе с фармацевтически приемлемым носителем или разбавителем. Такие композиции обычно изготавливают общепринятым способом, применяя твердые или жидкие носители либо разбавители, которые пригодны для местного введения, в форме растворов, гелей, кремов, желе, паст,лосьонов, мазей, целебных мазей, аэрозолей и тому подобное. Примеры носителей для применения активных соединений по данному изобретению включают в себя водные или водно-спиртовые растворы, эмульсию типа масло-в-воде или вода-в-масле, эмульгированный гель либо двухфазную систему. Предпочтительными композициями по данному изобретению являются композиции в форме лосьонов, кремов, молочка,гелей, масок, микросфер или наносфер либо везикулярных дисперсий. В случае везикулярных дисперсий липиды, из которых сделаны везикулы, могут быть ионного или неионного типа либо их смесью. Используемое здесь выражение отбеливающее кожу или уменьшающее пигментацию количество соединения формулы I и тому подобное означает количество или концентрацию этого соединения, способное к обнаружимому отбеливанию кожи или уменьшению пигментации у человека, что определяется любым стан 33 дартным анализом. Активное соединение типично вводят в фармацевтической композиции и по стандартному курсу лечения, что обеспечивает желаемый результат депигментации кожи. Используемое здесь выражение ингибирующее тирозиназу эффективное количество соединения формулы I и тому подобное означает количество или концентрацию соединения,способное к обнаружимому ингибированию активности тирозиназы человека, что определяется любым стандартным анализом. Используемое здесь выражение количество соединения формулы I, эффективное при лечении воспалительного расстройства, такого как псориаз, дерматит или угри, либо при лечении перхоти и тому подобное означает количество или концентрацию соединения, способное вызывать обнаружимое улучшение, уменьшение,устранение, замедление или предупреждение прогрессирования любого симптома или состояния, вызванного таким расстройством либо состоянием или связанного с ним, у человека,что определяется любым стандартным анализом. В депигментирующих композициях по настоящему изобретению концентрация активного соединения по данному изобретению обычно находится в пределах от 0,01 до 10%, предпочтительно от 0,1 до 10%, по отношению к общей массе композиции. Композиции по данному изобретению могут также дополнительно содержать увлажнитель, поверхностно-активное вещество, кератолитическое вещество, противовоспалительный агент, комплексообразующий агент, антиоксидант, консервант, ароматизатор или солнцезащитный агент. Способность соединений формулы I ингибировать тирозиназу может быть определена с использованием любой из следующих методик. 1. Анализ на тирозиназу (DOPA-оксидазу) с использованием клеточного лизата. В анализе и скрининге с использованием клеточного лизата применяют линию клеток меланомы человека SKMEL 188 (имеющую лицензию от Memorial Sloan-Kettering). В этом анализе соединения и L-дигидроксифенилаланин (L-DOPA) (100 мкг/мл) инкубируют с клеточными лизатами, содержащими тирозиназу человека, в течение 8 ч перед тем, как чашки прочитывают при 405 нм. Эффективность соединений в анализе на DOPA-оксидазу очень хорошо коррелирует с таковой в анализе на тирозингидроксилазу, в котором используется 3 Нтирозин в качестве субстрата. Большинство соединений формулы I, которые были протестированы в этом анализе, показали значение IC50 ниже 10 мкМ. Например, соединение примера 23, т.е -3-(2,4-дигидроксифенил)циклопентаноноксим, имеет значение IC50 в этом анализе приблизительно 2 мкМ. 34 2. Анализ на меланин в первичных меланоцитах человека. Соединения инкубируют с первичными меланоцитами человека в присутствии меланоцитстимулирующего гормона (-MSH) в течение 2-3 дней. Далее клетки лизируют гидроксидом натрия и додецилсульфатом натрия(SDS) и считывают меланиновые сигналы при 405 нм. Альтернативно, к клеткам добавляют 14C-DOPA в комбинации с ингибиторами тирозиназы, и нерастворимый в кислоте 14 С-меланин количественно определяют с помощью сцинтилляционного счетчика. Значения IC50 отражают ингибирующую активность соединений в синтезе нового меланина, который был стимулирован -MSH. 3. Анализ на тирозинкиназу (ТК). ТК-анализы могут быть проведены с использованием очищенных тирозинкиназных доменов c-met, erb-B2 или IGF-r. В этом анализе применяется специфическое антитело к фосфорилированному остатку тирозина. Колориметрические сигналы генерируются пероксидазой хрена, конъюгированной с этим антителом. 4. Эквивалентная модель кожи человека. Смесь меланоцитов и кератиноцитов человека выращивают в воздушно-жидкостной интерфазе. Эта культура тканей образует трехмерную структуру, гистологически и микроскопически напоминающую эпидермис кожи человека. Тестируемые соединения добавляют к верхней части клеток, имитируя местное нанесение лекарства. После инкубации с соединениями (10 мкМ) в течение 3 дней клетки энергично промывают и лизируют для проведения анализа наDOPA-оксидазу. 5. Анализ на IL-1 (анализ на интерлейкин-1). Для оценки влияния соединений на секрецию IL-1 в эквивалентной модели кожи человека может быть использован ELISA-анализIL-1 (RD system). IL-1 является провоспалительным цитокином и играет роль в УФиндуцированном воспалении кожи. 6. Исследование in vivo. В этом исследовании могут быть использованы черные или темно-коричневые морские свинки с гомогенной окраской кожи. Раствор тестируемого соединения формулы I (5%-ный в смеси этанол:пропиленгликоль, 70:30) и носитель в качестве контроля наносят на животных дважды в день, 5 дней в неделю в течение 4-8 недель. Используя этот анализ, депигментацию можно определить путем вычитания отражения света от необработанной кожи из отражения света от обработанной кожи. Настоящее изобретение проиллюстрировано следующими далее примерами. Следует понимать, однако, что данное изобретение не ограничено конкретными деталями этих примеров. Точки плавления не скорректированы. 35 Спектры протонного ядерного магнитного резонанса (400 МГц 1 Н ЯМР) измерены для растворов в d6-DMSO, CDCl3 или d4-МеОН, а положения пиков выражены в миллионных долях(млн-1) по нисходящей от тетраметилсилана(TMS). Ширина пиков указана следующим образом: s, синглет; d, дублет; t, триплет; q; квартет, m, мультиплет; b, широкий. Следующие далее примеры являются только иллюстративными и не предназначены для ограничения объема настоящего изобретения. Примеры Промежуточное соединение 1. 1-Бром-2,4 бис(метоксиметокси)бензол. В высушенную в сушильном шкафу круглодонную колбу вместимостью 250 мл, снабженную магнитной мешалкой, в атмосфере аргона загружают 4-бромрезорцин (9,45 г; 50 ммоль) и CH2Cl2 (50 мл). Перемешиваемую суспензию охлаждают до 0 С и с помощью шприца добавляют диизопропиламин (19,1 мл; 110 ммоль) в виде одной порции. Перемешивание раствора красного цвета продолжают в течение следующих 10 мин, после чего по каплям с помощью шприца добавляют метилхлорметиловый эфир (10,7 мл; 120 ммоль), следя за тем,чтобы внутренняя температура не превышала 10 С. Полученный раствор желтого цвета оставляют нагреваться до комнатной температуры в течение ночи. В реакционный сосуд вливают раствор гидроксида аммония (50 мл; 50%) и перемешивание продолжают в течение 1 ч. Далее смесь выливают в делительную воронку и производят разделение фаз. Водную фазу затем экстрагируют CH2Cl2 (330 мл), и объединенные органические экстракты промывают солевым раствором (20 мл), высушивают над безводным сульфатом магния, фильтруют и концентрируютin vacuo, получая масло оранжевого цвета. Очистку выполняют путем колоночной флэшхроматографии (SiO2; этилацетат/петролейный эфир, 1:1, об./об.), получая указанный в заголовке продукт (10,7 г; 77%) в виде масла бледно-желтой окраски. Н (CDCl3) 7.42 (1 Н, d), 6.88[4.5]декан-8-ол. В круглодонную колбу, снабженную магнитной мешалкой, в атмосфере аргона загружают 1-бром-2,4-бис(метоксиметокси)бензол (2,00 г; 7,2 ммоль) и тетрагидрофуран (ТГФ) (50 мл). С помощью шприца добавляют N,N,N',N'тетраметилендиамин (2,3 мл; 15,2 ммоль) в виде одной порции и перемешиваемый раствор охлаждают до -78 С. С помощью шприца по каплям добавляют н-бутиллитий (9,5 мл; 15,2 ммоль; 1,6 М в гексане). Полученный раствор желтого цвета перемешивают в течение 1 ч при-78 С и медленно, с помощью шприца добавля 004476 36 ют 1,4-циклогександионмоноэтиленкеталь (1,35 г; 8,7 ммоль) в виде раствора в ТГФ (25 мл). Полученный раствор перемешивают при -78 С в течение 1 ч и далее оставляют нагреваться до комнатной температуры в течение ночи. Добавляют соляную кислоту (20 мл; 2 М) и реакционную смесь энергично перемешивают в течение 15 мин. Добавляют этилацетат (100 мл) и смесь выливают в делительную воронку. Фазы разделяют и водную фазу экстрагируют этилацетатом(320 мл). Объединенные органические экстракты промывают соляным раствором (20 мл),высушивают над безводным сульфатом магния,фильтруют и концентрируют, получая масло оранжевого цвета, которое очищают путем колоночной флэш-хроматографии (SiO2; этилацетат/петролейный эфир, 45:55, об./об.). Указанный в заголовке продукт (1,42 г; 56%) выделяют в виде бесцветного масла.[4.5]дец-7-ен. 8-[2,4-Бис(метоксиметокси)фенил]-1,4 диоксаспиро[4.5]декан-8-ол (1,40 г; 3,95 ммоль) помещают в круглодонную колбу вместимостью 50 мл, снабженную магнитной мешалкой и аппаратом Дина-Старка. Добавляют толуол (30 мл), затем камфорсульфоновую кислоту (10 мг). Перемешиваемый раствор далее нагревают с обратным холодильником в течение 1 ч, охлаждают и добавляют насыщенный водный раствор бикарбоната натрия (10 мл). Смесь выливают в делительную воронку и производят разделение фаз. Водную фазу экстрагируют этилацетатом(215 мл) и объединенные органические экстракты промывают соляным раствором (15 мл),высушивают над безводным сульфатом магния,фильтруют и концентрируют in vacuo, получая масло оранжевого цвета, которое очищают путем колоночной флэш-хроматографии (SiO2; этилацетат/петролейный эфир, 45:55, об./об.),получая указанный в заголовке продукт (0,94 г) в виде бесцветного масла. Н (СDСl3) 1.84 (2 Н,t), 2.41-2.43 (2 Н, m), 2.56-2.62 (2 Н, m), 3.47 (6 Н,s), 3.98-4.02 (4 Н, m), 5.13 (4 Н, s), 5.58-5.63 (1 Н,m), 6.64 (1 Н, dd), 6.78 (1 Н, d), 7.08 (1 Н, d). Промежуточное соединение 4. 8-[2.4 Бис(метоксиметокси)фенил]-1,4-диоксаспиро[4.5]декан. 8-[2,4-Бис(метоксиметокси)фенил]-1,4 диоксаспиро[4.5]дец-7-ен (0,950 г; 2,83 ммоль) и палладий (200 мг; 10%-ный на угле) перемешивают в атмосфере водорода в течение 15 ч. Далее смесь фильтруют через набивку целита,промывая этилацетатом. Затем фильтрат упаривают до сухого состояния, получая желаемый продукт (0,955 г; 100%) в виде бесцветного мас 37 ла. Н (CDCl3) 1.67-1.87 (8 Н, m), 2.90-2.99 (1 Н,m), 3.46 (3H, s), 3.48 (3H, s), 3.97 (4 Н, s), 5.12[4.5]декан (3,20 г; 9,47 ммоль) и метанол (50 мл). Через 20 мин к перемешиваемому раствору при комнатной температуре добавляют водную соляную кислоту (50 мл; 1,00 М) и реакционную смесь перемешивают в течение 1,5 ч. Твердый бикарбонат натрия добавляют до нейтрализации реакционной смеси и раствор помещают в условия пониженного давления. Остаток распределяют между этилацетатом (30 мл) и водой (10 мл) и водный слой экстрагируют этилацетатом(320 мл). Объединенные органические слои промывают соляным раствором (10 мл), высушивают над сульфатом магния, фильтруют и концентрируют in vacuo. Неочищенный продукт очищают путем колоночной флэшхроматографии (SiO2; этилацетат/петролейный эфир, 1:4, об./об.), получая указанное в заголовке соединение (2,20 г; 60%) в виде белого порошка. Н (CDCl3) 1.85-1.96 (2 Н, m), 2.14-2.22(1 Н, m), 6.85 (1 Н, m), 7.08 (1 Н, d). Промежуточное соединение 6. 3-[2,4 Бис(метоксиметокси)фенил]-2-циклогексен-1 он. Водный карбонат натрия (2 мл 6 М раствора) и 2,4-бис(метоксиметокси)фенилбороновую кислоту (120 мг) в этаноле (2 мл) добавляют к раствору тетракис(трифенилфосфин)палладия(57 мг) и 3-бром-2-циклогексен-1-она (87 мг) в диметоксиэтане (3 мл) и смесь нагревают с обратным холодильником. Через 6 ч смесь распределяют между водой (50 мл) и этилацетатом(100 мл). Органический слой высушивают над сульфатом магния и упаривают in vacuo, получая масло, которое очищают путем колоночной флэш-хроматографии(1 Н, dd), 6.85 (1 Н, d), 7.16 (1 Н, d). Промежуточное соединение 7. -3-[2,4 Бис(метоксиметокси)фенил]-2-циклогексанон. Суспензию 3-[2,4-бис(метоксиметокси) фенил]-2-циклогексен-1-она (300 мг) и палладиевого катализатора (50 мг; 10%-ный палладий на угле) в этаноле перемешивают при температуре окружающей среды под давлением водорода 98 кПа. Через 16 ч смесь фильтруют через целит и фильтрат упаривают in vacuo. Продукт 38 растворяют в дихлорметане (15 мл). Добавляют целит и хлорхромат пиридиния (430 мг) и смесь перемешивают при комнатной температуре. Через 3 ч смесь фильтруют через набивку кремнезема и элюируют смесью петролейный эфир/этилацетат (10:3, об./об.), затем очищают путем колоночной флэш-хроматографии (SiO2; петролейный эфир/этилацетат, 4:1, об./об.), получая указанное в заголовке соединение в виде масла (200 мг; 70 %). Н (CDCl3) 1.7-1.9 (2 Н,перекрывающиеся m), 2.05 (1 Н, m), 2.15 (1 Н, m),2.35-2.60 (4 Н, перекрывающиеся m), 3.37 (1 Н,m), 3.490 (3H, s), 3.492 (3H, s), 5.15 (2 Н, s), 5.20(10 мл). Через 3 ч охлажденную реакционную смесь распределяют между водой и этилацетатом. Органический слой высушивают над сульфатом магния и упаривают in vacuo, получая указанное в заголовке соединение в виде масла-3-[2,4-Бис(метоксиметокси)фенил] циклогексанон (80 мг) и пиперазин (24 мг) растворяют в дихлорэтане (5 мл) и перемешивают при температуре окружающей среды в течение 1 ч в атмосфере аргона. Добавляют триацетоксиборгидрид тетраметиламмония (79 мг) и продолжают перемешивать в атмосфере аргона. Через 16 ч добавляют дополнительные порции пиперазина (24 мг) и триацетоксиборгидрида тетраметиламмония (79 мг) и продолжают перемешивание. По истечении следующих 6 ч по каплям добавляют ледяную уксусную кислоту до получения раствора и продолжают перемешивание при температуре окружающей среды. По истечении следующих 16 ч реакционную смесь распределяют между гидрокарбонатом натрия (20 мл насыщенного раствора) и этилацетатом. Водный слой экстрагируют этилацетатом (320 мл), а объединенные органические экстракты высушивают над сульфатом магния и упаривают in vacuo. Неочищенный остаток очищают путем колоночной флэшхроматографии (SiO2; дихлорметан/метанол,9:1, об./об.), получая указанное в заголовке соединение в виде твердого вещества беловатой окраски (52 мг; 53%) и смеси диастереоизомеров; 39 Хлорид никеля гексагидрат (77 мг) и боргидрид натрия (24 мг) добавляют к перемешиваемому раствору -3-[2,4-бис(метоксиметокси)фенил] циклогексанон оксима (50 мг) в метаноле (2 мл). Через 0,5 ч добавляют воду до тех пор, пока не прекратится вспенивание, реакционную смесь фильтруют и остаток тщательно промывают метанолом. Объединенные фильтрат и промывки упаривают in vacuo и неочищенный остаток очищают путем колоночной флэш-хроматографииm/z (ES+) 295 (М+H)+. Промежуточное соединение 11. -N-3[2,4-Бис(метоксиметокси)фенил]циклогексил метансульфонамид. Триэтиламин (0,014 мл) и метансульфонилхлорид (8 мкл) добавляют к раствору -3[2,4-бис(метоксиметокси)фенил]циклогексиламина (27 мг) в дихлорметане (1 мл) и смесь перемешивают в атмосфере аргона при температуре окружающей среды. Через 1 ч смесь распределяют между этилацетатом (20 мл) и гидрокарбонатом натрия (20 мл насыщенного водного раствора). Водный слой экстрагируют этилацетатом (220 мл), а объединенные органические экстракты высушивают над сульфатом магния и упаривают in vacuo, получая указанное в заголовке соединение в виде масла и смеси диастереоизомеров;m/z (ES+) 374 (М+Н)+. Промежуточное соединение 12. -2.4 Бис(метоксиметокси)-1-(3-метиленциклогексил) бензол. трет-Бутилат калия (50 мг) добавляют к суспензии бромида метилтрифенилфосфония в тетрагидрофуране (4 мл) при 0 С. Через 0,5 ч добавляют раствор -3-[2,4-бис(метоксиметокси)фенил]циклогексанона (100 мг) в тетрагидрофуране (1 мл) и смесь оставляют нагреваться до температуры окружающей среды. Через 16 ч реакционную смесь распределяют между хлоридом аммония (30 мл насыщенного водного раствора) и этилацетатом. Водный слой экстрагируют дополнительными количествами этилацетата (230 мл) и объединенные органические экстракты промывают соляным раствором (30 мл), высушивают над сульфатом магния и упаривают in vacuo. Неочищенный остаток очищают путем колоночной флэш-хроматографии 40 Промежуточное соединение 13. -3-[2.4 Бис(метоксиметокси)фенил]циклогексилметанол. 9-Борабициклононан (2,7 мл 0,5 М раствора в тетрагидрофуране) добавляют к перемешиваемому раствору -2,4-бис(метоксиметокси)1-(3-метиленциклогексил)бензола (80 мг) в тетрагидрофуране (2 мл) при 0 С в атмосфере аргона. Через 1 ч при 0 С реакционную смесь оставляют нагреваться до температуры окружающей среды и продолжают перемешивание. Через 2 ч реакционную смесь охлаждают до 0 С и добавляют воду (0,1 мл). Когда выделение пузырьков прекращается, добавляют перекись водорода (1 мл 30%-ного раствора, мас./об.) и гидроксид натрия (1 мл 2 М раствора) и смесь оставляют нагреваться до температуры окружающей среды. По прошествии следующих 16 ч реакционную смесь охлаждают до 0 С. Насыщенный водный метабисульфит натрия добавляют до тех пор, пока с помощью крахмальноиодидной бумаги не будет фиксироваться отсутствие хоть каких-либо количеств оксиданта,и реакционную смесь экстрагируют этилацетатом (330 мл). Объединенные органические экстракты промывают водой (20 мл), высушивают над сульфатом магния и упаривают in vacuo. Неочищенный остаток очищают путем колоночной флэш-хроматографии (SiO2; этилацетат/бензин, 1:1, об./об.), получая указанное в заголовке соединение в виде масла бледнокоричневой окраски (46 мг; 54%);in vacuo и остаток распределяют между этилацетатом (100 мл) и водой (100 мл). Водный слой экстрагируют этилацетатом (2100 мл), а объединенные органические экстракты высушивают над сульфатом магния и упаривают invacuo. Неочищенный остаток очищают путем колоночной флэш-хроматографии (SiO2; этилацетат/бензин, 1:1, об./об.), получая указанное в заголовке соединение в виде масла бледножелтой окраски (197 мг; 94%);-3-[2,4-бис(метоксиметокси)фенил] циклогексаноноксима (85 мг) в тетрагидрофуране (2 мл) при 0 С в атмосфере аргона. Через 2 ч добавляют уксусную кислоту (1 мл) и смесь 41 оставляют нагреваться до температуры окружающей среды. Через 16 ч добавляют гидрокарбонат натрия (20 мл насыщенного водного раствора), смесь экстрагируют этилацетатом (320 мл) и объединенные органические экстракты высушивают над сульфатом магния и упаривают in vacuo. Неочищенный остаток очищают путем колоночной флэш-хроматографии (SiO2; дихлорметан/метанол, 9:1, об./об.), получая два соединения в виде прозрачной смолы, которые идентифицируют как диастереоизомеры указанного в заголовке соединения; транс-изомер (12 мг; 14%);(400 мг) растворяют в диметилформамиде (3 мл) при перемешивании. Последовательно добавляют трет-бутилдиметилсилилхлорид (704 мг),имидазол (660 мг) и 4-диметиламинопиридин (3 мг). Через 4 ч растворитель удаляют in vacuo и остаток распределяют между этилацетатом (20 мл) и водой (5 мл). Водную фазу экстрагируют этилацетатом (210 мл) и объединенные органические фазы промывают соляным раствором(10 мл), высушивают над безводным сульфатом магния и концентрируют при пониженном давлении, получая коричневое масло. Очистка путем колоночной флэш-хроматографии (SiO2; элюирование смесью этилацетат/петролейный эфир, 1:9, об./об.) дает указанное в заголовке соединение в виде хлопьев белого цвета (750 мг; 89 %). Н (СDСl3): 0.18 (6 Н, s), 0.20 (6 Н, s), 0.97m/z (ES+) 435 (M+1)+. Промежуточное соединение 17. третБутил-[3-[трет-бутил(диметил)силил]окси-4(4-метиленциклогексил)фенокси]диметилсилан. К перемешиваемой суспензии бромида метилтрифенилфосфония (329 мг) в безводном ТГФ (10 мл) при 0 С добавляют трет-бутилат калия (103 мг) в виде одной порции. После перемешивания в течение 30 мин добавляют раствор 4-(2,4-бис[трет-бутил(диметил)силил] оксифенил)циклогексанона (200 мг) в ТГФ (5 мл). Реакционную смесь перемешивают в течение следующих 30 мин при 0 С и добавляют насыщенный водный раствор хлорида аммония(20 мл). Слои разделяют и водный слой экстрагируют этилацетатом (320 мл). Объединенные органические фазы промывают соляным раствором (20 мл), высушивают над безводным сульфатом магния и концентрируют in vacuo. Очистка путем колоночной флэшхроматографии (SiO2; элюирование смесью диэтиловый эфир/петролейный эфир, 1:4, об./об.) 42 дает указанное в заголовке соединение в виде бесцветного масла (135 мг; 68%). Н (СDСl3): 0.19 (6 Н, s), 0.24 (6 Н, s), 0.97 (9 Н, s), 1.03 (9 Н, s),1.41 (2 Н, dq), 1.84-1.93 (2 Н, m), 2.16 (2 Н, dt),2.33-2.42 (2H, m), 3.01 (1H, tt), 4.66 (2H, s), 6.29(1H, dd), 6.40 (1H, dd), 6.94 (1H, d). Промежуточное соединение 18. транс/цис[4-(2.4-Бис[трет-бутил(диметил)силил]окси фенил)циклогексил]метанол. трет-Бутил-[3-[трет-бутил(диметил) силил]окси-4-(4-метиленциклогексил)фенокси] диметилсилан (135 мг) растворяют при перемешивании в безводном ТГФ (5 мл) и охлаждают до -78 С. К перемешиваемому раствору добавляют 9-борабицикло[3.3.1]нонан (3,13 мл; 0,5 М в ТГФ) и полученную реакционную смесь оставляют нагреваться до комнатной температуры в течение 3 ч, а затем перемешивают в течение 3 дней. После охлаждения до 0 С добавляют перекись водорода (1 мл; 30%-ный водный раствор) и гидроксид натрия (1 мл; 2 М водный раствор). Реакционную смесь оставляют при перемешивании на 1 ч нагреваться до комнатной температуры, охлаждают до 0 С и добавляют насыщенный водный раствор метабисульфата натрия (30 мл). Слои разделяют и водный слой экстрагируют этилацетатом (320 мл). Объединенные органические фазы промывают соляным раствором (20 мл), высушивают над безводным сульфатом магния и концентрируют in vacuo. Очистка путем колоночной флэшхроматографии (SiO2; элюирование смесью петролейный эфир/диэтиловый эфир, 3:17, об./об.) дает желаемый продукт в виде желтого масла(1 Н, m). Промежуточное соединение 19. транс/цис 4-(2.4-Бис[трет-бутил(диметил)силил]окси фенил)-1-метилциклогексанол. 4-(2,4-Бис(трет-бутилдиметилсилилокси фенилциклогексанон (50 мг) растворяют в безводном ТГФ (10 мл) и охлаждают до 0 С. По каплям добавляют хлорид метилмагния (59 мл; 22%-ный, мас./об., в ТГФ) и реакционную смесь оставляют нагреваться до комнатной температуры при перемешивании в течение 2 дней. Реакционную смесь распределяют между воднымHCl (10 мл; 0,5 М) и этилацетатом (10 мл). Водную фазу экстрагируют этилацетатом (210 мл) и объединенные органические фазы промывают насыщенным водным раствором бикарбоната натрия (10 мл), соляным раствором (10 мл) и затем высушивают над безводным сульфатом магния. Удаление растворителя при пониженном давлении позволяет получить масло, которое очищают путем колоночной флэшхроматографии (SiO2; элюирование смесью 43 этилацетат/петролейный эфир, 1:4, об./об.), получая указанное в заголовке соединение в виде твердого вещества белого цвета и смеси диастереоизомеров (29 мг; 56%). Н (CDCl3): 0.19 (6 Н,s), 0.23 (6 Н, s), 0.97 (9 Н, s), 1.02 (9 Н, s), 1.26(1.5 Н, s), 1.32 (1.5 Н, s), 1.36-1.82 (8 Н, m), 2.732.91 (1 Н, m), 6.29-6.31 (1 Н, m, 6.39-6.42 (1 Н, m),6.80 (0.5 Н, d), 7.20 (0.5 Н, d). Промежуточное соединение 20. транс/цис 4-(2,4-Бис[трет-бутил(диметил)силил]окси фенил)циклогексиламин. 4-[2,4-Бис(трет-бутилдиметилсилилокси) фенил]циклогексаноноксим (120 мг) растворяют при перемешивании в безводном метаноле (10 мл). Раствор охлаждают до -40 С и добавляют хлорида никеля гексагидрат (133 мг). Перемешивание продолжают в течение 10 мин перед тем, как в виде одной порции добавить боргидрид натрия (42 мг). Реакционную смесь перемешивают при -40 С в течение 20 мин и добавляют воду (0,5 мл). Реакционную смесь оставляют нагреваться при перемешивании до комнатной температуры. Добавляют силикагель и растворитель удаляют in vacuo. Очистка путем колоночной флэш-хроматографии (SiO2; элюирование смесью CH2Cl2:MeOH:NH4OH, 44:50:6,об./об.) позволяет получить желаемый продукт в виде масла бледно-коричневой окраски (83 мг; 71%) и смеси диастереоизомеров. H (CD3OD): 0.22 (6 Н, s), 0.27 (6 Н, s), 1.02 (9 Н, s), 1.08 (9 Н, s),1.24-1.40 (1 Н, m), 1.42-1.57 (1 Н, m), 1.57-1.68m/z (ES+) 436 (M+1)+. Промежуточное соединение 21. транс/цисN-[4-(2,4-Бис[трет-бутил(диметил)силил]окси фенил)циклогексил]ацетамид. транс/цис-4-(2,4-Бис[трет-бутил(диметил) силил]оксифенил)циклогексиламин (27 мг) растворяют в пиридине (0,5 мл). Последовательно добавляют ацетилхлорид (6 мкл) и 4 диметиламинопиридин (2 мг) и реакционную смесь перемешивают в течение 24 ч. Растворитель удаляют in vacuo и остаток распределяют между этилацетатом (10 мл) и водой (2 мл). Водную фазу экстрагируют этилацетатом (25 мл) и объединенные органические фазы промывают соляным раствором (10 мл), высушивают над безводным сульфатом магния и концентрируют, получая коричневое масло. Очистка путем колоночной флэш-хроматографии (SiO2; элюирование смесью этилацетат/петролейный эфир, 7:3, об./об.) позволяет получить указанный в заголовке продукт в виде твердого белого вещества (15 мг; 50%) и смеси диастереоизомеров. Н (CDCl3): 0.17 (3H, s), 0.19 (3H, s), 0.21N,N,N',N'-тетраметилэтилендиамин с последующим добавлением по каплям н-бутиллития-78 С в течение 1 ч медленно добавляют раствор 3-метокси-2-циклопентен-1-она (605 мг) в ТГФ (5 мл). Реакционную смесь перемешивают при -78 С в течение 1 ч перед тем, как нагреть до 0 С. Добавляют 1 М HCl (20 мл) и через 10 мин смесь экстрагируют этилацетатом (250 мл). Объединенные органические фазы промывают соляным раствором (30 мл), высушивают над сульфатом магния и концентрируют invacuo. Неочищенный остаток очищают путем колоночной флэш-хроматографии (SiO2; этилацетат/бензин, 1:1, об./об.), получая указанное в заголовке соединение в виде желтого масла (128 мг; 13%);m/z (ES+) 279 (М+1)+. Промежуточное соединение 23. -3-[2,4 Бис(метоксиметокси)фенил]циклопентанон. 3-[2,4-Бис(метоксиметокси)фенил]-2 циклопентен-1-он (50 мг) и палладий (10 мг; 10%-ный на угле) перемешивают в атмосфере водорода в течение 15 ч. Далее смесь фильтруют через набивку с целитом, промывая этилацетатом, и фильтрат концентрируют in vacuo. Остаток очищают путем колоночной флэшхроматографии (SiO2; этилацетат/бензин, 1:1,об./об.), получая указанное в заголовке соединение в виде бесцветного масла (8 мг; 16%);m/z (ES+) 583 (2M+Na)+. Промежуточное соединение 24. 3(Бензилокси)-2-циклогексен-1-он. В круглодонную колбу, снабженную магнитной мешалкой и аппаратом Дина-Старка,добавляют 1,3-циклогександион (60,0 г; 535 ммоль), толуол (450 мл), п-толуолсульфоновой кислоты моногидрат (1,35 г; 5,20 ммоль) и бензиловый спирт (52,6 г; 487 ммоль). Полученный раствор нагревают с обратным холодильником в течение 12 ч. Реакционную смесь охлаждают до комнатной температуры и затем промывают насыщенным водным раствором карбоната натрия (2100 мл). Далее органический слой промывают соляным раствором (100 мл), высушивают над сульфатом магния, фильтруют и концентрируют in vacuo, с получением коричневого масла (94,9 г), которое кристаллизуется при стоянии в течение 17 ч. Неочищенный кристаллический материал суспендируют в изопропи 45 ловом эфире (20 мл). Смесь фильтруют и кристаллический материал промывают охлажденным во льду изопропиловым эфиром (330 мл),затем холодным петролейным эфиром (220 мл). Полученное твердое кристаллическое вещество желто-оранжевой окраски высушивают в течение ночи при пониженном давлении, получая желаемый продукт (74,4 г; 76%);[4.5]дец-8-ил)-2-циклогексен-1-он. В круглодонную колбу, снабженную магнитной мешалкой, добавляют безводный тетрагидрофуран (600 мл) и диизопропиламин (38,1 мл; 272 ммоль). Перемешиваемый раствор охлаждают до -78 С и по каплям с помощью шприца порциями по 20 мл добавляют нбутиллитий (113,4 мл; 272 ммоль; 2,4 М в циклогексанах). Полученный раствор желтого цвета перемешивают в течение 35 мин при -78 С, затем добавляют 3-(бензилокси)-2-циклогексен-1 он (50,0 г; 248 ммоль) в виде раствора в безводном тетрагидрофуране (100 мл). Раствор перемешивают в течение 1 ч перед добавлением циклогексан-1,4-дионмоноэтиленкеталя (38,7 г; 248 ммоль) в виде раствора в безводном тетрагидрофуране (100 мл). Раствор перемешивают в течение 2 ч при -78 С, затем оставляют медленно нагреваться до комнатной температуры в течение 1 ч. Добавляют насыщенный водный хлорид аммония (80 мл), затем дихлорметан(700 мл) и смесь перемешивают до тех пор, пока не останется твердых частиц. Слои разделяют и водную фазу экстрагируют дихлорметаном(2100 мл). Объединенные органические слои промывают соляным раствором (50 мл), высушивают над сульфатом магния, затем концентрируют in vacuo. Растирание полученных твердых частиц с метанолом дает указанное в заголовке соединение (78,4 г; 88%);m/z (ES+) 359 (M+H+). Промежуточное соединение 26. -1(Бензилокси)-6-бром-3-(1,4-диоксаспиро[4.5] дец-8-ил)-2-оксабицикло[2.2.2]октан-5-он. В круглодонную колбу, снабженную магнитной мешалкой, помещают -3-(бензилокси)-6-(8-гидрокси-1,4-диоксаспиро[4.5]дец-8 ил)-2-циклогексен-1-он (78,4 г; 219 ммоль) и дихлорметан (600 мл). К перемешиваемому раствору в виде одной порции добавляют Nбромсукцинимид (40,9 г; 230 ммоль) с последующим добавлением, когда больше не остается твердых частиц, водной бромисто-водородной кислоты (3 капли; 48%-ный раствор). Полученный раствор перемешивают при комнатной температуре в течение 2 ч, затем выливают в делительную воронку, содержащую водный раствор метабисульфита натрия (150 мл) и дихлорметан (200 мл), после чего воронку энергично встряхивают. Слои разделяют и органи 004476 46 ческий слой промывают соляным раствором(200 мл), высушивают над сульфатом магния,фильтруют, затем концентрируют in vacuo, получая твердое вещество. Растирание с метанолом (500 мл) дает желаемое соединение (82,8 г; 86%) в виде твердого белого вещества;m/z (ES+) 437 и 439 [(1:1), М+Н+]. Промежуточное соединение 27. 5(Бензилокси)-2-(1,4-диоксаспиро[4.5]дец-7-ен-8 ил)фенол. В круглодонную колбу помещают -1(бензилокси)-6-бром-3-(1,4-диоксаспиро[4.5] дец-8-ил)-2-оксабицикло[2.2.2]октан-5-он (13,8 г; 31,6 ммоль) и безводный N,N-диметилформамид (140 мл). К перемешиваемому раствору в виде одной порции добавляют 1,8 диазабицикло[5.4.0]ундец-7-ен (9,92 мл; 66,3 ммоль). Раствор немедленно становится темнокоричневым, и его далее нагревают до 140 С в течение 12 ч при энергичном перемешивании. Реакционную смесь оставляют охлаждаться до комнатной температуры и большую часть растворителя удаляют при пониженном давлении. Оставшееся масло распределяют между этилацетатом (200 мл) и водой (100 мл), затем слои разделяют и водную фазу экстрагируют этилацетатом (350 мл). Объединенные органические слои еще раз экстрагируют водой (330 мл) для удаления оставшегося N,N-диметилформамида. Органическую фазу промывают соляным раствором (20 мл), высушивают над сульфатом магния, фильтруют, затем концентрируют in vacuo, получая маслянистое твердое вещество коричневого цвета, которое адсорбируют на силикагеле. Очистка путем колоночной флэш-хроматографии (SiO2; этилацетат/петролейный эфир, 1:1, об./об.) дает желаемый продукт (7,1 г; 66%) в виде твердого белого вещества;m/z (ES+) 339 (М+Н+). Промежуточное соединение 28. 4-(1,4 Диоксаспиро[4.5]дец-8-ил)-1,3-бензолдиол. В круглодонную колбу, снабженную магнитной мешалкой, помещают 5-(бензилокси)-2(1,4-диоксаспиро[4.5]дец-7-ен-8-ил)фенол (6,90 г; 20,4 ммоль), этанол (300 мл) и палладий (2,00 г; 10%-ный на активированном угле). Затем из реакционного сосуда откачивают воздух и помещают в атмосферу водорода. Этот процесс повторяют 15 раз, перед тем как начать энергичное перемешивание в течение 64 ч в атмосфере водорода. Далее реакционную смесь фильтруют через набивку целита, промывая этилацетатом. Фильтрат концентрируют in 47 В круглодонную колбу, снабженную магнитной мешалкой, помещают 4-(2,4-бис[третбутил(диметил)силил]оксифенил)циклогексанон (3,20 г; 7,36 ммоль). Добавляют безводный 1,2-дихлорэтан (85 мл) и к перемешиваемому раствору добавляют бензиламин (0,97 мл; 8,83 ммоль) в виде раствора в 1,2-дихлорэтане (20 мл). Добавляют измельченное в порошок активированное молекулярное сито 4 (5,80 г) и реакционную смесь энергично перемешивают в течение 2,5 ч. Добавляют в виде одной порции тетраметиламмоний-триацетоксиборгидрид(2,90 г; 11,0 ммоль) и реакционную смесь перемешивают в течение 64 ч при комнатной температуре. Добавляют водный раствор гидроксида натрия (30 мл; 0,4 М) и энергичное перемешивание продолжают в течение 0,5 ч. Далее реакционную смесь фильтруют через целит, промывая дихлорметаном (100 мл). Слои разделяют и водный слой экстрагируют дихлорметаном(250 мл). Объединенные органические фазы промывают соляным раствором (100 мл), высушивают над сульфатом магния, фильтруют и концентрируют in vacuo, получая неочищенный продукт. Очистка путем колоночной флэшхроматографии (SiO2; этилацетат/петролейный эфир, градиентное элюирование с применением отношения 1:9, 1:4, затем 3:7, об./об.) дает указанный в заголовке продукт (2,69 г; 70%) в виде масла бледно-желтой окраски. н (CDCl3) 0.01(1 Н, br), 1.39 (4 Н, m), 1.52 (2 Н, m), 1.70 (2 Н, m),2.69 (1 Н, m), 2.75 (1 Н, m), 6.10 (1 Н, d), 6.23 (1 Н,dd), 6.84 (1 Н, d), 7.15 (5 Н, m). Промежуточное соединение 30. N-БензилN-[4-(2,4-бис[трет-бутил(диметил)силил]окси фенил)циклогексилиден]амин. В круглодонную колбу, снабженную магнитной мешалкой, добавляют 4-(2,4-бис[третбутил(диметил)силил]оксифенил)циклогексанон (817 мг; 1,88 ммоль). Добавляют безводный дихлорметан (50 мл) с последующим добавлением бензиламина (0,82 мл; 7,52 ммоль) и активированного молекулярного сита 4 (10,0 г). Реакционную смесь энергично перемешивают в течение 15 ч, затем добавляют дихлорметан (50 мл), реакционную смесь фильтруют через целит,промывая дихлорметаном (50 мл). Фильтрат концентрируют in vacuo, получая желаемый продукт (1,00 г; 86%) в виде желтого масла. Н 48 фенил)циклогексилиден]амин (4,00 г; 7,63 ммоль) и безводный тетрагидрофуран (480 мл) с последующим добавлением безводного метанола (120 мл). К этому раствору добавляют боргидрид натрия (1,16 г; 30,5 ммоль) и реакционную смесь перемешивают в течение 17 ч. Далее реакционную смесь разбавляют диэтиловым эфиром (600 мл) и добавляют водный гидроксид натрия (400 мл; 0,4 М). После перемешивания в течение 10 мин слои разделяют и водный слой экстрагируют дихлорметаном (3100 мл). Объединенные органические фазы промывают соляным раствором (50 мл), высушивают над сульфатом магния и концентрируют in vacuo, получая желтое масло. Очистка путем колоночной флэш-хроматографии (SiO2; этилацетат/петролейный эфир, градиентное элюирование с применением отношения 1:9, 1:4, затем 3:7, об./об.) дает желаемый продукт в виде твердого вещества кремовой окраски (2,09 г; 54%). Н (CDCl3) 0.01 (6 Н, s), 0.05 (6 Н, s), 0.80 (9 Н, s), 0.85 (9 Н, s),1.18 (4 Н, m), 1.66 (2 Н, m), 1.87 (2 Н, m), 2.19 (1 Н,m), 2.68 (1 Н, m), 6.12 (1 Н, d), 6.23 (1 Н, dd), 6.77(1 Н, d), 7.17 (5 Н, m). Промежуточное соединение 32. транс-4(2,4-бис[трет-Бутил(диметил)силил]окси фенил)циклогексиламин. В круглодонную колбу добавляют трансN-бензил-N-[4-(2,4-бис[трет-бутил(диметил) силил]оксифенил)циклогексил]амин (500 мг; 0,95 ммоль) и этанол (20 мл). К перемешиваемому раствору добавляют палладий (10%-ный,мас./мас., на активированном угле; 200 мг; 0,19 ммоль) в виде суспензии в этаноле (5 мл). Из реакционного сосуда откачивают воздух и помещают в атмосферу водорода (10 циклов). Реакционную смесь энергично перемешивают в атмосфере водорода в течение 18 ч, затем фильтруют через набивку целита, промывая метанолом (100 мл). Растворитель удаляют invacuo, получая желаемый продукт (402 мг; 97%) в виде бесцветного масла. Н (CDCl3) 0.01 (6 Н,s), 0.05 (6 Н, s), 0.78 (9 Н, s), 0.82 (9 Н, s), 1.08 (2 Н,m), 1.21 (2 Н, m), 1.62 (2 Н, m), 1.78 (2 Н, m), 2.59(2 Н, m), 6.11 (1 Н, d), 6.22 (1 Н, dd), 6.78 (1 Н, d). Промежуточное соединение 33. цис-4-(2,4 Бис[трет-бутил(диметил)силил]оксифенил) циклогексиламин. В круглодонную колбу, снабженную магнитной мешалкой, добавляют цис-N-бензил-N[4-(2,4-бис[трет-бутил(диметил)силил]окси фенил)циклогексил]амин (700 мг; 1,33 ммоль) и этанол (30 мл). К перемешиваемому раствору добавляют палладий (10%-ный, в/в, на активированном угле; 283 мг; 0,27 ммоль) в виде суспензии в этаноле (5 мл). Из реакционного сосуда откачивают воздух и помещают в атмосферу водорода (10 циклов). Реакционную смесь энергично перемешивают в атмосфере водорода в течение 18 ч, затем фильтруют через набивку целита, промывая метанолом (100 мл). Раство 49 ритель удаляют in vacuo, получая желаемый продукт (561 мг; 97%) в виде бесцветного масла. Н (CDCl3) 0.01 (6 Н, s), 0.04 (6 Н, s), 0.78 (9 Н,s), 0.83 (9 Н, s), 1.21-1.55 (10 Н, m), 2.64 (1 Н, m),3.05 (1 Н, m), 6.11 (1 Н, d), 6.22 (1 Н, dd), 6.84 (1 Н,d). Промежуточное соединение 34. цис-N-[4(2,4-Бис[трет-бутил(диметил)силил]окси фенил)циклогексил]метансульфонамид. В круглодонную колбу, снабженную магнитной мешалкой, помещают цис-4-(2,4 бис[трет-бутил(диметил)силил]оксифенил) циклогексиламин (47 мг; 0,108 ммоль) и 1,2 дихлорэтан (4 мл). К перемешиваемому раствору добавляют метансульфонилхлорид (10 мкл; 0,12 ммоль), триэтиламин (30 мкл; 0,22 ммоль) и 4-диметиламинопиридин (каталитическое количество). Раствор перемешивают в течение 17 ч,затем распределяют между водным гидроксидом натрия (5 мл; 0,2 М) и дихлорметаном (5 мл). Водную фазу экстрагируют дихлорметаном(25 мл) и объединенные органические слои промывают соляным раствором (8 мл), высушивают над сульфатом магния и концентрируют invacuo. Неочищенный продукт адсорбируют на силикагеле и очищают путем колоночной флэшхроматографии (SiO2; этилацетат/петролейный эфир, градиентное элюирование с применением отношения 1:9, 1:4, затем 1:3, об./об.), получая указанное в заголовке соединение (39 мг; 70%),которое затвердевает при стоянии. Н (СDСl3) 0.17 (6 Н, s), 0.23 (6 Н, s), 0.97 (9 Н, s), 1.00 (9 Н, s),1.53 (2 Н, m), 1.71 (4 Н, m), 1.94 (2 Н, m), 2.85 (1 Н,m), 2.99 (3H, s), 3.78 (1H, m), 4.83 (1H, d), 6.28(1H, d), 6.42 (1H, dd), 6.97 (1H,d). Промежуточное соединение 35. транс-N[4-(2,4-Бис[трет-бутил(диметил)силил]окси фенил)циклогексил]метансульфонамид. В круглодонную колбу, снабженную магнитной мешалкой, добавляют транс-4-(2,4 бис[трет-бутил(диметил)силил]оксифенил) циклогексиламин (248 мг; 0,57 ммоль) и 1,2 дихлорэтан (25 мл). К перемешиваемому раствору добавляют триэтиламин (191 мкл; 1,37 ммоль) с последующим добавлением метансульфонилхлорида (53 мкл; 0,68 ммоль) и трех кристаллов 4-диметиламинопиридина. Полученный раствор перемешивают при комнатной температуре в течение 18 ч и затем выливают в делительную воронку, содержащую дихлорметан (100 мл) и воду (20 мл). Слои разделяют и водную фазу экстрагируют дихлорметаном(150 мл). Объединенные органические фазы промывают соляным раствором (50 мл), высушивают над сульфатом магния, фильтруют и концентрируют in vacuo, получая указанное в заголовке соединение в виде масла бледножелтой окраски (320 мг; 100%). H (CDCl3) 0.02 50 2.81 (3H, s), 3.19 (1 Н, m), 3.92 (1 Н, d), 6.13 (1 Н,d), 6.22 (1 Н, dd), 6.66 (1 Н, d). Промежуточное соединение 36. 4-(4[трет-Бутил(диметил)силил]оксифенил) циклогексанон. В круглодонную колбу, снабженную магнитной мешалкой, добавляют 4-(4-гидрокси) фенилциклогексанон (1,00 г; 5,26 ммоль) (имеется в продаже от Aldrich) и безводный N,Nдиметилформамид (5 мл). К перемешиваемому раствору добавляют имидазол (0,90 г; 13,20 ммоль), трет-бутил(диметил)силилхлорид (1,19 г; 7,89 ммоль) и 4-диметиламинопиридин (каталитическое количество). Реакционную смесь перемешивают в течение 17 ч при комнатной температуре и затем N,N-диметилформамид удаляют in vacuo. Остаток распределяют между этилацетатом (100 мл) и водой (5 мл). Слои разделяют и водную фазу экстрагируют этилацетатом (320 мл). Объединенные органические слои промывают соляным раствором, высушивают над сульфатом магния, фильтруют и концентрируют in vacuo. Очистка путем колоночной флэш-хроматографии (SiO2; этилацетат/петролейный эфир, 2:3, об./об.) позволяет получить указанное в заголовке соединение(1,39 г; 87%), в виде твердого вещества бледножелтой окраски. Н (CDCl3) 0.19 (6 Н, s), 0.98(9 Н, s), 1.87 (2 Н, m), 2.20 (2 Н, m), 2.46 (4 Н, т),2.99 (1 Н, m), 6.77 (2 Н, d), 7.07 (2 Н, d). Промежуточное соединение 37. 4-(4[трет-Бутил(диметил)силил]оксифенил)-1[2,4-бис(метоксиметокси)фенил]циклогексанол. В круглодонную колбу, снабженную магнитной мешалкой, помещают 1-бром-2,4 бис(метоксиметокси)бензол (277 мг; 1,00 ммоль) и безводный тетрагидрофуран (5 мл). Перемешиваемый раствор охлаждают до -78 С,добавляют N,N,N',N'-тетраметилэтилендиамин(0,32 мл; 2,10 ммоль) с последующим добавлением по каплям н-бутиллития (0,88 мл; 2,10 ммоль; 2,40 М раствор в циклогексанах). Полученный раствор перемешивают в течение 40 мин при -78 С, затем с помощью шприца добавляют 4-(4-[трет-бутил(диметил)силил]окси фенил)циклогексанон (304 мг; 1,00 ммоль) в виде раствора в безводном тетрагидрофуране (2 мл) и реакционную смесь перемешивают в течение 30 мин при -78 С, затем оставляют нагреваться до комнатной температуры в течение 3 ч. Реакцию останавливают водной соляной кислотой (5 мл; 0,10 М), затем реакционную смесь выливают в делительную воронку, содержащую этилацетат (50 мл) и воду (10 мл). Слои разделяют и водную фазу экстрагируют этилацетатом(35 мл). Объединенные органические слои промывают соляным раствором (10 мл), высушивают над сульфатом магния, фильтруют и концентрируют in vacuo. Полученное масло очищают путем колоночной флэш-хроматографии (SiO2; этилацетат/петролейный эфир, 51 3:7, об./об.), получая указанное в заголовке соединение в виде твердого белого вещества (127 мг; 25%) и смеси диастереоизомеров. Н (CDCl3) 0.19 (6 Н, s), 0.98 (6 Н, s), 1.63 (2 Н, m), 1.84 (2 Н,m), 1.96 (2 Н, m), 2.56 (2 Н, m), 2.70 (1 Н, m), 3.48(2 Н, s), 6.68 (1 Н, dd), 6.73 (2 Н, d), 6.85 (1 Н, d),7.05 (2 Н, d), 7.33 (1H, d). Промежуточное соединение 38. третБутил-(4-(4-[2,4-бис(метоксиметокси)фенил]-3 циклогексен-1-илфенокси)диметилсилан. В круглодонную колбу, снабженную магнитной мешалкой, помещают 4-(4-[третбутил(диметил)силил]оксифенил)-1-[2,4 бис(метоксиметокси)фенил]циклогексанол (125 мг; 0,25 ммоль), толуол (10 мл) и птолуолсульфокислоты моногидрат (3 кристалла). Реакционную смесь нагревают с обратным холодильником в течение 30 мин, затем охлаждают до комнатной температуры перед добавлением насыщенного водного бикарбоната натрия(5 мл). Слои разделяют и водный слой экстрагируют этилацетатом (310 мл). Объединенные органические слои промывают соляным раствором (10 мл), высушивают над сульфатом магния, фильтруют и концентрируют in vacuo. Указанное в заголовке соединение выделяют без дальнейшей очистки в виде масла (118 мг; 98%) и смеси диастереоизомеров. Н (CDCl3) 0.19 (6 Н,s), 0.98 (9 Н, s), 1.84 (1 Н, m), 2.00 (1 Н, m), 2.27(1 Н, dd), 6.77 (2 Н, d), 6.78 (1H,d), 7.07 (2H.d),7.11 (1 Н, d). Промежуточное соединение 39. третБутил-(4-4-[2.4-бис(метоксиметокси)фенил] циклогексилфенокси)диметилсилан. В круглодонную колбу, снабженную магнитной мешалкой, добавляют трет-бутил-(4-4[2,4-бис(метоксиметокси)фенил]-3-циклогексен 1-илфенокси)диметилсилан (118 мг; 0,24 ммоль) и этанол (15 мл). К перемешиваемому раствору добавляют в виде одной порции палладий (каталитическое количество; 10%-ный на активированном угле). Затем из реакционного сосуда откачивают воздух, и сосуд помещают в атмосферу водорода. Этот процесс повторяют 10 раз, перед тем как оставить сосуд в атмосфере водорода. Реакционную смесь энергично перемешивают в течение 17 ч, затем фильтруют через целит, промывая этилацетатом. Фильтрат концентрируют in vacuo, получая указанное в заголовке соединение в виде бесцветного масла(0,20 г; 5,10 ммоль; 60%-ная дисперсия в минеральном масле), который промывают петролейным эфиром (420 мл). Избыток петролейного эфира удаляют при пониженном давлении. Добавляют безводный тетрагидрофуран (120 мл) и перемешиваемый раствор охлаждают до 0 С. С помощью шприца добавляют по каплям триметилфосфоноацетат (756 мкл; 5,10 ммоль) и перемешиваемую смесь оставляют нагреваться до комнатной температуры в течение 1 ч. Смесь охлаждают до 0 С перед добавлением 4-[2,4 бис(метоксиметокси)фенил]циклогексанона(1,00 г; 3,40 ммоль) в виде раствора в тетрагидрофуране (30 мл). Смесь бледно-желтой окраски нагревают с обратным холодильником в течение 0,75 ч, затем охлаждают до комнатной температуры и распределяют между этилацетатом (100 мл) и насыщенным водным раствором хлорида аммония (30 мл). Слои разделяют, и водный слой экстрагируют этилацетатом (330 мл). Объединенные органические слои промывают соляным раствором (30 мл), высушивают над сульфатом магния, фильтруют и концентрируютin vacuo, получая желтое масло. Очистка путем колоночной флэш-хроматографии (SiO2; этилацетат/петролейный эфир, 1:2, об./об.) дает указанное в заголовке соединение в виде желтого масла (1,13 г; 95%). H (CD3OD) 1.53-1.70 (2 Н,m), 2.00-2.13 (4 Н, m), 2.45 (2 Н, m), 3.26 (1 Н, m),3.48 (3H, s), 3.53 (3H, s), 3.71 (3H, s), 5.17 (2 Н, s),5.24 (2 Н, s), 5.73 (1 Н, s), 6.67 и 6.68 (1 Н, d), 6.83(1 Н, d), 7.08 (1 Н, d). Промежуточное соединение 41. цис/трансМетил-4-[2,4-бис(метоксиметокси)фенил] циклогексилацетат. В круглодонную колбу, снабженную магнитной мешалкой, добавляют -метил-4-[2,4 бис(метоксиметокси)фенил]циклогексилиден ацетат (1,13 г; 3,23 ммоль) и этанол (50 мл). К перемешиваемому раствору в виде одной порции добавляют палладий (каталитическое количество; 10%-ный на активированном угле). Из реакционного сосуда откачивают воздух, и сосуд помещают в атмосферу водорода. Этот процесс повторяют 10 раз, перед тем как оставить сосуд в атмосфере водорода, и затем энергично перемешивают в течение 17 ч. Реакционную смесь фильтруют через целит, промывая этанолом, и фильтрат упаривают до сухого состояния, получая указанное в заголовке соединение(1,13 г; 99%) в виде бесцветного масла и смеси диастереоизомеров. Н (CD3OD) 1.53 (2 Н, m),1.62-1.78 (2 Н, m), 1.87 (4 Н, m), 2.93 (1 Н, m), 3.47 53 Промежуточное соединение 42. -4-[2,4 Бис(метоксиметокси)фенил]циклогексилиден уксусная кислота. В круглодонную колбу, снабженную магнитной мешалкой, добавляют триметилсилилдиэтилфосфоноацетат (1,08 мл; 3,83 ммоль) и безводный тетрагидрофуран (25 мл). Перемешиваемый раствор охлаждают до 0 С и с помощью шприца в течение 5 мин по каплям добавляют н-бутиллитий (1,80 мл; 3,83 ммоль; 2,2 М в циклогексанах). Реакционную смесь оставляют медленно нагреваться до комнатной температуры и перемешивают в течение 17 ч. С помощью шприца добавляют 4-[(2,4-бис(метоксиметокси) фенил)]циклогексанон (750 мг; 2,55 ммоль) в виде раствора в тетрагидрофуране (25 мл). Через 2 ч перемешивания при комнатной температуре реакционную смесь выливают в делительную воронку, содержащую водный раствор гидроксида натрия (10 мл; 10%, мас./об.). После однократного экстрагирования диэтиловым эфиром (10 мл) водный слой подкисляют, добавляя концентрированную соляную кислоту(10 мл), затем экстрагируют диэтиловым эфиром (320 мл). Объединенные органические слои промывают водой (10 мл), высушивают над сульфатом магния, фильтруют и концентрируют in vacuo, получая указанное в заголовке соединение (422 мг; 52%) в виде масла. н(2 Н, s), 5.21 (2 Н, s), 5.71 (1 Н, s), 6.67 (1 Н, dd),6.81 (1 Н, d), 7.05 (1 Н, d). Промежуточное соединение 43. -4-[2,4 Дигидроксифенил]циклогексилиденуксусная кислота. В круглодонную колбу, снабженную магнитной мешалкой, помещают -4-[2,4 бис(метоксиметокси)фенил]циклогексилиден уксусную кислоту (25 мг; 74 мкмоль), смолу Дауэкс (dowex) в кислотной форме (75 мг) и метанол (15 мл), затем перемешивают при 60 С в течение 3 ч. Реакционную смесь фильтруют через набивку целита, промывая метанолом. Растворитель удаляют при пониженном давлении, получая желтое масло (15 мг), которое очищают препаративной тонкослойной хроматографией (ТСХ) (этилацетат/петролейный эфир, 3:1, об./об.), получая указанное в заголовке соединение (6,5 мг; 35%) в виде масла,m/z (ES+) 339 (М+Н+). Промежуточное соединение 44. -4-[2,4 Бис(метоксиметокси)фенил]циклогексилиден ацетонитрил. В круглодонную колбу, снабженную магнитной мешалкой, добавляют гидрид натрия (40 мг; 0,95 ммоль; 60%-ная дисперсия в минеральном масле). После промывания гидрида натрия петролейным эфиром (220 мл) избыток растворителя удаляют при пониженном давлении. Добавляют 1,2-диметоксиэтан (10 мл) и пере 004476 54 мешиваемую суспензию охлаждают до 0 С. По каплям добавляют диэтилцианометилфосфонат(102 мкл; 0,95 ммоль). Реакционную смесь оставляют медленно нагреваться до комнатной температуры в течение 2 ч. Затем добавляют 4[(2,4-бис(метоксиметокси)фенил)]циклогексанон (200 мг; 0,68 ммоль) в виде раствора в 1,2 диметоксиэтане (10 мл) и реакционную смесь перемешивают в течение 17 ч при комнатной температуре. Реакционную смесь выливают в делительную воронку, содержащую воду (50 мл) и диэтиловый эфир (50 мл). Слои разделяют и водную фазу экстрагируют диэтиловым эфиром (220 мл). Объединенные органические слои промывают соляным раствором (20 мл),высушивают над сульфатом магния, фильтруют и концентрируют in vacuo, получая масло. Очистка путем колоночной флэш-хроматографии(141 мг; 66%) в виде масла бледно-желтой окраски. Н (СD3 ОD) 1.57-1.70 (2 Н, m), 2.02-2.25 (2 Н,m), 2.34-2.49 (2 Н, m), 2.60 (1 Н, m), 3.03 (1 Н, m),3.24 (1 Н, m), 3.47 (3H, s), 3.52 (3H, s), 5.17 (2H,s), 5.23 (2H, s), 5.33 (1H, s), 6.66 и 6.69 (1H, d),6.83 (1H, d), 7.09 (1H, d). Промежуточное соединение 45. -[4-(2,4 Дигидроксифенил)циклогексилиден]ацетонитрил. В круглодонную колбу, снабженную магнитной мешалкой, добавляют -4-[2,4 бис(метоксиметокси)фенил]циклогексилиден ацетонитрил (141 мг; 0,45 ммоль) и метанол (5 мл). Реакционную смесь перемешивают, раствор нагревают с обратным холодильником и медленно добавляют водную соляную кислоту(5 мл; 1,0 М). Нагревание продолжают в течение 1 ч и реакционную смесь оставляют охлаждаться до комнатной температуры, перед тем как добавить насыщенный водный раствор бикарбоната натрия (12 мл). Затем реакционную смесь распределяют между этилацетатом (30 мл) и водой (10 мл). Водный слой экстрагируют этилацетатом (315 мл) и объединенные органические слои промывают соляным раствором(20 мл), высушивают над сульфатом магния,фильтруют и концентрируют in vacuo. Остаток очищают путем колоночной флэш-хроматографии (SiO2; этилацетат/петролейный эфир,1:1, об./об.), получая указанное в заголовке соединение в виде твердого белого вещества (90 мг; 88%). 55 мг) в безводном 1,2-диметоксиэтане добавляют трифторид диэтиламиносеры (34 мкл) при комнатной температуре в атмосфере аргона. Через 1 ч добавляют еще трифторид диэтиламиносеры(170 мкл). Через 48 ч реакционную смесь распределяют между водой (20 мл) и этилацетатом(20 мл). Водный слой экстрагируют этилацетатом (220 мл) и объединенные органические экстракты высушивают над сульфатом магния и упаривают in vacuo. Неочищенный остаток очищают путем колоночной флэшхроматографии (SiO2; этилацетат/бензин, 1:1,об./об.), получая указанное в заголовке соединение в виде смолы (31 мг);(1 мл) при 0 С в течение 3 ч добавляют к перемешиваемому раствору оксида xpoмa(VI) (64 мг) в 2 М серной кислоте (0,64 мл). Через 3 ч при 0 С и затем 16 ч при комнатной температуре реакционную смесь распределяют между водой(10 мл) и этилацетатом (20 мл). Слои разделяют и водный слой экстрагируют этилацетатом(220 мл). Объединенные органические экстракты промывают водой (20 мл), высушивают над сульфатом магния и упаривают in vacuo. Остаток очищают путем колоночной флэшхроматографии (SiO2; этилацетат/бензин, 4:1,об./об.), получая указанное в заголовке соединение в виде бесцветного масла (15 мг; 29%);Rf (этилацетат/бензин, 4:1, об./об.) 0,5. Промежуточное соединение 48. -3-[2,4 Бис(метоксиметокси)фенил]циклогексанкарбоксамид. Триэтиламин (16 мкл) и изобутилхлорформиат (14 мкл) добавляют при 0 С в атмосфере аргона к перемешиваемому раствору 3-[2,4-бис(метоксиметокси)фенил]циклогексанкарбоновой кислоты в безводном тетрагидрофуране (2 мл). Через 30 мин добавляют водный раствор аммиака (0,5 мл; 28%). Реакционную смесь распределяют между водой (20 мл) и этилацетатом (50 мл). Водный слой экстрагируют этилацетатом (220 мл) и объединенные органические экстракты высушивают над сульфатом магния и упаривают in vacuo, получая указанное в заголовке соединение (26 мг; 87%) в виде смеси диастереоизомеров; 56 карбоновой кислоты в безводном тетрагидрофуране (2 мл). Через 30 мин добавляют водный раствор гидроксиламина (0,5 мл; 50 мас.%). Реакционную смесь распределяют между водой(20 мл) и этилацетатом (50 мл). Водный слой экстрагируют этилацетатом (220 мл) и объединенные органические экстракты высушивают над сульфатом магния и упаривают in vacuo,получая указанное в заголовке соединение в виде твердого вещества (26 мг; колич.) и смеси диастереоизомеров;(0,5 мл; 2 М раствор в тетрагидрофуране). Реакционную смесь распределяют между водой (20 мл) и этилацетатом (50 мл). Водный слой экстрагируют этилацетатом (220 мл) и объединенные органические экстракты высушивают над сульфатом магния и упаривают in vacuo, получая указанное в заголовке соединение в виде твердого вещества (24 мг; колич.) и смеси диастереоизомеров;N-оксид N-метилморфолина (120 мг) и тетроксид осмия (100 мкл; 2,5 мас.% в третбутаноле) добавляют при комнатной температуре к раствору -2,4-бис(метоксиметокси)-1-(3 метиленциклогексил)бензола (30 мг) в тетрагидрофуране (0,7 мл) и воде (0,3 мл). Через 16 ч к реакционной смеси добавляют целит с последующим добавлением воды (5 мл) и персульфита натрия (20 мг). Реакционную смесь фильтруют, значение рН фильтрата доводят до рН 4 с помощью 2 М раствора соляной кислоты и объем водной фазы доводят до 20 мл. Водный слой экстрагируют этилацетатом (320 мл), объединенные органические экстракты промывают соляным раствором (20 мл), высушивают над сульфатом магния и упаривают in vacuo. Остаток очищают путем колоночной флэшхроматографии (SiO2; этилацетат), получая указанное в заголовке соединение в виде твердого вещества (30 мг; 89%) и смеси диастереоизомеров;m/z (ES+) 327 (М+Н)+. Промежуточное соединение 52. -N-3[2,4-Бис(метоксиметокси)фенил]циклогексил ацетамид. Триэтиламин (15 мкл) и уксусный ангидририд (10 мл) добавляют при комнатной темпе 57 ратуре к перемешиваемому раствору -3-[2,4 бис(метоксиметокси)фенил]циклогексиламина(29 мг) в безводном 1,2-дихлорэтане (2 мл). Через 0,5 ч реакционную смесь распределяют между водой (20 мл) и этилацетатом (50 мл) и водный слой экстрагируют этилацетатом (320 мл). Объединенные органические экстракты высушивают над сульфатом магния и упаривают in vacuo, получая указанное в заголовке соединение в виде твердого вещества (22 мг; 66%) и смеси диастереоизомеров;(1,57 г) в этаноле (50 мл) при 0 С. По прошествии 2 ч при 0 С и затем 18 ч при комнатной температуре реакционную смесь распределяют между 2 М HCl (20 мл), водой (40 мл) и этилацетатом (50 мл) и водный слой повторно экстрагируют этилацетатом (250 мл). Объединенные органические экстракты промывают соляным раствором (40 мл), высушивают над сульфатом магния и упаривают in vacuo. Остаток очищают,используя колоночную флэш-хроматографию(SiO2; этилацетат/бензин, 3:17, об./об.), получая транс-изомер указанного в заголовке соединения в виде твердого белого вещества (546 мг; 35%) и цис-изомер указанного в заголовке соединения в виде твердого белого вещества (83 мг; 5%). транс - H (CDCl3) 0.18 (6 Н, s), 0.22 (6 Н, s),0.98 (9 Н, s), 1.02 (9 Н, s), 1.18-1.22 (4 Н, m), 1.801.84 (3H, m), 2.00-2.05 (2 Н, m), 2.78-2.86 (1 Н,m), 3.60-3.70 (1 Н, m), 6.28 (1 Н, d), 6.39 (1 Н, dd),6.94 (1 Н, d). цис-н (CDCl3) 0.18 (6 Н, s), 0.22 (6 Н, s),0.98 (9 Н, s), 1.02 (9 Н, s), 1.58-1.78 (6 Н, m), 1.841.92 (2 Н, m), 2.70-2.80 (1 Н, m), 4.12 (1 Н, bs),6.28 (1 Н, d), 6.40 (1H,dd), 7.02 (1H,d). Промежуточное соединение 55. транс-4(2,4-Бис[трет-бутил(диметил)силил]окси фенил)циклогексил-4-(диметиламино)бензоат. Триэтиламин (20 мкл), 4-диметиламинопиридин (каталитическое количество) и 4 диметиламинобензоилхлорид (26 мг) добавляют к перемешиваемому раствору транс-4-(2,4 бис[трет-бутил(диметил)силил]оксифенил) циклогексанола (30 мг) в безводном дихлорметане (2 мл) при комнатной температуре в атмосфере аргона. Через 24 ч растворитель удаляют при пониженном давлении и остаток распределяют между водой (10 мл) и этилацетатом (20 мл). Водный слой экстрагируют этилацетатом(220 мл) и объединенные органические экс 004476 58 тракты промывают соляным раствором (10 мл),высушивают над сульфатом магния и упаривают in vacuo. Остаток очищают путем колоночной флэш-хроматографии (SiO2; этилацетат/бензин, 1:24, об./об.), получая указанное в заголовке соединение в виде твердого белого вещества (18 мг; 45%);m/z (ES+) 585 (M+H)+. Промежуточное соединение 56. цис/транс 4-(2,4-Бис[трет-бутил(диметил)силил]окси фенил)циклогексанкарбоновая кислота. Дихромат пиридиния (146 мг) добавляют к перемешиваемому раствору цис/транс-[4-(2,4 бис[трет-бутил(диметил)силил]оксифенил) циклогексил]метанола (50 мг) и N,Nдиметилформамида (1 мл) при комнатной температуре в атмосфере аргона Через 24 ч реакционную смесь распределяют между водой (20 мл) и диэтиловым эфиром (30 мл). Слои разделяют,и водный слой экстрагируют диэтиловым эфиром (230 мл). Объединенные органические экстракты высушивают над сульфатом магния и упаривают in vacuo. Остаток очищают путем колоночной флэш-хроматографии (SiO2; этилацетат/бензин, 1:9, об./об.), получая указанное в заголовке соединение в виде твердого вещества кремовой окраски (23 мг; 44%);(диметил)силил]оксифенил)циклогексанола (50 мг) в безводном дихлорэтане (1 мл) при комнатной температуре в атмосфере аргона. Реакционную смесь нагревают до 40 С в течение 120 ч и распределяют между водой (50 мл) и этилацетатом (50 мл). Слои разделяют и водный слой экстрагируют этилацетатом (250 мл). Объединенные органические экстракты высушивают над сульфатом магния и упаривают in vacuo. Остаток очищают путем колоночной флэшхроматографии (SiO2; этилацетат/бензин, 1:2,об./об.), получая указанное в заголовке соединение в виде твердого вещества (55 мг; 95%);(50 мг) в безводном дихлорэтане (1 мл) при комнатной температуре в атмосфере аргона. Реакционную смесь нагревают до 40 С в течение 120 ч и распределяют между водой (50 мл) и этилацетатом (50 мл). Слои разделяют и водный слой экстрагируют этилацетатом (250 мл). Объединенные органические экстракты высушивают над сульфатом магния и упаривают invacuo. Остаток очищают путем колоночной флэш-хроматографии (SiO2; этилацетат/бензин,1:2, об./об.), получая указанное в заголовке соединение в виде твердого вещества бледножелтой окраски (30 мг; 47%); Н (CDCl3) 0.12(18 мг) помещают в круглодонную колбу, снабженную магнитной мешалкой. Добавляют этанол (5 мл), а затем боргидрид натрия (3,3 мг) и реакционную смесь перемешивают в течение 16 ч. Добавляют водный раствор HCl (20 мл; 1 М),затем этилацетат (20 мл), органическую фазу удаляют и промывают соляным раствором (15 мл), высушивают над безводным сульфатом магния, фильтруют и далее концентрируют invacuo. Остаток очищают путем колоночной флэш-хроматографии (SiO2; этилацетат/петролейный эфир, 60:40, об./об.), получая указанное в заголовке соединение (14 мг; 78%) в виде твердого белого вещества; H (CD3OD) 1.38-1.56(4 Н, m), 1.85-1.88 (2 Н, m), 2.04-2.07 (2 Н, m),2.80 (1 Н, tt), 3.58-3.65 (1 Н, m), 6.24-6.29 (2 Н, m),6.90 (1 Н, d); m/z (ES-) 267 М+АсОН)-1). Промежуточное соединение 60. цис-4-(2,4 Бис[трет-бутил(диметил)силил]оксифенил) циклогексилметансульфонат. В круглодонную колбу, содержащую цис 4-(2,4-бис[трет-бутил(диметил)силил]окси фенил)циклогексанол (200 мг; 0,46 ммоль), добавляют дихлорметан (10 мл), а затем триэтиламин (96 мкл; 0,69 ммоль) и диметиламинопиридин (каталитическое количество). Колбу продувают аргоном и добавляют метансульфонилхлорид (53 мкл; 0,69 ммоль) при перемешивании. Перемешивание продолжают в течение следующих 24 ч и реакционную смесь выливают в воду и экстрагируют дихлорметаном (420 мл). Объединенные органические экстракты промывают соляным раствором, высушивают над сульфатом магния и концентрируют in vacuo. Очистка путем колоночной флэшхроматографии (SiO2; этилацетат/бензин, 1:9) позволяет получить указанное в заголовке соединение в виде масла (194 мг; 82%); Н (CDCl3) 0.19 (6 Н, s), 0.22 (6 Н, s), 0.97 (9 Н, s), 1.01 (9 Н, s),1.20-1.35 (2 Н, m), 1.65-1.78 (4 Н, m), 2.15-2.22(диметил)силил]оксифенил)циклогексил] метанола в безводном дихлорметане (3 мл) при комнатной температуре в атмосфере аргона. Через 16 ч реакционную смесь распределяют между водой (10 мл) и этилацетатом (20 мл). Слои разделяют и водный слой экстрагируют этилацетатом (220 мл). Объединенные органические экстракты высушивают над сульфатом магния и упаривают in vacuo. Остаток очищают путем колоночной флэш-хроматографии (SiO2; этилацетат/бензин, 1:19, об./об.), получая указанное в заголовке соединение в виде желтого масла и смеси диастереоизомеров (114 мг; 92%); Н (CDCl3) -0.04 (6 Н, s), 0.02 (6 Н, s), 0.96 (9 Н, s),1.00 (9 Н, s), 1.08-1.18 (3H, m), 1.20-2.10 (9 Н, m),2.24-2.40 (2 Н, m), 2.76-2.92 (1 Н, m), 3.94 (0.6 Н,d), 4.18 (0.4 Н, d), 6.26 (1 Н, m), 6.40 (1 Н, dd),6.94-6.98 (1 Н, m). Промежуточные соединения 62 и 63. Диастереоизомеры этил-4-(2,4-бис[трет-бутил(диметил)силил]оксифенил)-1-гидроксициклогексанкарбоксилата. В круглодонную колбу, снабженную вращающимся стержнем, помещают тетрагидрофуран (6 мл), этилвиниловый эфир (0,28 мл; 2,92 ммоль) и охлаждают до -78 С. По каплям добавляют раствор трет-бутиллития (1 мл; 1,7 М,1,7 ммоль) и колбу оставляют нагреваться до 0 С. Колбу оставляют при этой температуре до тех пор, пока ярко-желтая окраска не исчезнет,перед тем как опять охладить до -78 С. По каплям добавляют раствор 4-(4-[трет-бутил(250 мг; 0,58 ммоль) в ТГФ (4 мл). Через 30 мин реакцию останавливают увлажненным ТГФ (0,5 мл воды в 5 мл ТГФ), реакционную смесь выливают в воду (10 мл) и экстрагируют диэтиловым эфиром (310 мл). Объединенные органические экстракты промывают соляным раствором, высушивают над сульфатом магния и концентрируют in vacuo. Этот остаток растворяют в метаноле (40 мл), охлаждают до -78 С и в течение 10 мин через данный раствор пропускают озонированный кислород. По прошествии этого промежутка времени избыток озона удаляют, пропуская через раствор кислород. Реакционную смесь оставляют нагреваться до комнатной температуры и концентрируют in vacuo. Очистка путем колоночной флэш-хроматографии (SiO2; этилацетат/бензин, 1:6), позволяет получить указанные в заголовке соединения. Элюирующийся первым диастереоизомер (31 мг; 11%); Н
МПК / Метки
МПК: A61K 7/48, C07C 251/44
Метки: производные, резорцина
Код ссылки
<a href="https://eas.patents.su/30-4476-proizvodnye-rezorcina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные резорцина</a>
Предыдущий патент: Металлический катализатор на подложке, способ его получения и способ прямого получения пероксида водорода
Следующий патент: Липосомный препарат 6,9-бис[(2-аминоэтил)-амино]бензо[g]изохинолин-5,10-диона дималеата
Случайный патент: Содержащая флавонол сухая композиция растительного происхождения и способы ее использования