Липосомный препарат 6,9-бис[(2-аминоэтил)-амино]бензо[g]изохинолин-5,10-диона дималеата
Формула / Реферат
1. Липосомный препарат соединения 6,9-бис-[(2-аминоэтил)амино]бензо[g]изохинолин-5,10-диона дималеат (BBR 2778) формулы
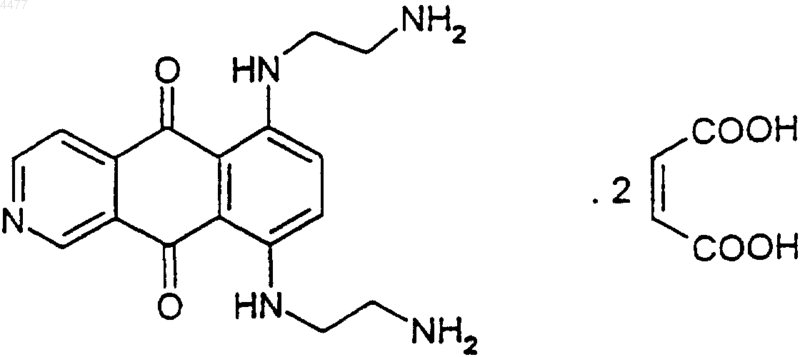
отличающийся тем, что указанные липосомы включают в себя фосфатидилхолин, холестерин и соединение BBR 2778 при массовом соотношении холестерин/фосфолипид от 1:2 до 1:7 и массовом соотношении BBR 2778/фосфолипид от 1:4 до 1:25.
2. Липосомный препарат по п.1, где указанный фосфатидилхолин содержит остатки жирных кислот, выбранных из пальмитиновой, олеиновой, линолевой, гамма-линолевой, линоленовой и стеариновой кислот.
3. Липосомный препарат по п.1, где указанный фосфатидилхолин представляет собой смесь гидрогенизированных и негидрогенизированных форм в массовом соотношении от 1:2 до 2:1.
4. Липосомный препарат по п.3, где указанная гидрогенизированная форма имеет точку плавления 120шC и точку кристаллизации 90шC, а указанная негидрогенизированная форма имеет термограмму по существу такую, как представлено на фиг. 5.
5. Липосомный препарат по любому из пп.1-4, где липосомы дополнительно содержат стеариламин и/или дицетилфосфат.
6. Применение липосомного препарата по пп.1-5 для приготовления противоопухолевого лекарственного средства.
Текст
1 Настоящее изобретение относится к фармацевтическому липосомному препарату соединения 6,9-бис-[(2-аминоэтил)амино]бензо[g] изохинолин-5,10-диона дималеата (BBR 2778). Липосомы представляют собой водные дисперсии природных и/или синтетических фосфолипидов (биосовместимых и биоразлагаемых), организованных в один или более чем один бислой. Когда фосфолипиды гидратируются в водной среде, они спонтанно образуют коллоидные микрочастицы или переносчики,диаметром обычно 0,05-5,0 мкм. Размер липосомной частицы, которая может представлять собой структуру с одним или множеством бислоев, варьирует от 0,025 до 2,5 мкм, в зависимости от ее структуры. Размер везикулы - это важный параметр для определения периода полувыведения липосом, и он влияет на объем инкапсулируемого лекарства. Липосомы могут быть классифицированы в соответствии с их составом на природные и/или синтетические фосфолипиды (фосфосфинголипиды) и, кроме того, их бислой может содержать другие компоненты, такие как холестерин и сконъюгированные с липидами гидрофильные полимеры. В зависимости от их размера и числа бислоев, липосомы могут также быть подразделены на следующие категории:(SUV),(г) мультивезикулярные везикулы (MVV),(д) олиголамеллярные везикулы (OLV). Физико-химические свойства фосфолипидов, образующих липосомы, такие как мембранная текучесть, плотность распределения заряда, пространственное затруднение и проницаемость, влияют на взаимодействие между липосомами и компонентами крови, тканями и клетками. Липосомы признаны как потенциально ценные переносчики лекарств. Способность липосом вмещать, переносить и высвобождать лекарства находит различные применения в клинической практике. Простейшим применением липосом в области фармацевтики является их использование в качестве нетоксичных переносчиков нерастворимых лекарственных средств. Более сложное применение включает использование липосом как резервуаров для пролонгированного высвобождения лекарственных средств или для локализации лекарственного средства с тем, чтобы либо избегать, либо достигать определенной ткани. Использование лекарственных средств в липосомальной форме дало положительные результаты в лечении и профилактике ряда заболеваний, например в антимикробной терапии, противораковой терапии, при применении в качестве адьювантов в вакцинах, в гормональной и ферментативной 2 терапиях, в диагностических процедурах и в лечении заболеваний кожи и глаз. Лекарственные средства, используемые в лечении таких заболеваний, как рак, обычно имеют ограниченный терапевтический индекс и могут быть высокотоксичными для нормальных тканей. Липосомный препарат может улучшить терапевтический индекс, корректируя биораспределение лекарственного средства. Серия экспериментов с инкапсулированными в липосомах антрациклинами с увеличенным периодом полувыведения из плазмы крови показала снижение кардиотоксичности и лучшую выживаемость животных по сравнению с контролями, которым давали свободное лекарственное средство. В случае доксорубицина, антрахинонового противоопухолевого лекарственного средства, использование его липосомных препаратов оказалось эффективным в уменьшении токсичности. Наиболее опасный побочный эффект доксорубицина - это прогрессирующее необратимое поражение сердца. Доксорубицин, инкапсулированный в липосомах, показывал снижение токсичности при сохранении его терапевтической эффективности. В US 4 797 285, US 4 898 735 и US 5 043 166 описаны липосомные препараты доксорубицина и их использование в лечении рака. Соединение BBR 2778 представляет собой антрахиноновое противоопухолевое лекарственное средство с пртивоопухолевой активностью и сниженной кардиотоксичностью, имеющее следующую формулу: Полное описание соединения BBR 2778 представлено в US 5 587 382, US 5 717 099, US 5 506 232, US 5 616 709 и в J. Med. Chem., 1994,Vol. 37, 828-837. После внутривенного болюсного введения доз от 40 до 60 мг/кг BBR 2778 мышам линииCD1 имела место гибель некоторого количества животных либо в ходе обработки, либо сразу же после нее. Такие внезапные смертельные исходы предположительно обусловлены одним из следующих факторов, связанных с использованиемBBR 2778: тромбообразующая активность; изменение гемокоагуляционных параметров с последующим развитием диссеминированного внутрисосудистого свертывания; индукция анафилактического шока; прямое токсическое воздействие на центральную нервную систему; аритмогенная активность; электролитический дисбаланс. Проявление этого зависимого от дозы феномена уменьшается при уменьшении скорости введения (0,1 мл/мин, 7-8 мин на инъ 3 екцию) и также при внутрибрюшинном введении. Задача настоящего изобретения, следовательно, заключалась в поиске подходящего препарата соединения BBR 2778, позволившего бы преодолеть отмеченные выше недостатки, в особенности внезапные случаи гибели, наблюдавшиеся после болюсного введения активного ингредиента. Неожиданно было обнаружено,что липосомный препарат BBR 2778, характеризующийся определенным составом, успешно решает указанную задачу. Таким образом, в изобретении предложен липосомный препарат соединения BBR 2778, состоящий из липосом, содержащих фосфатидилхолин,холестерин и BBR 2778, при массовом соотношении холестерин/фосфолипид от 1:2 до 1:7 и при массовом соотношении BBR 2778/фосфолипид от 1:4 до 1:25. Фосфатидилхолин предпочтительно включает остатки жирных кислот, выбранных из пальмитиновой, олеиновой, линолевой, гаммалинолевой, линоленовой и стеариновой кислот, а липосомы образованы смесью гидрогенизированных и негидрогенизированных фосфатидилхолинов, имеющих указанный жирнокислотный состав,при соотношении от 1:2 до 2:1, более предпочтительно указанная смесь состоит из гидрогенизированного фосфотидилхолина, имеющего точку плавления 120 С и точку кристаллизации 90 С, и негидрогенизированного фосфатидилхолина, имеющего термограмму, представленую на фиг. 5. Гидрогенизированный и негидрогенизированный фосфатидилхолины, имеющие вышеуказанный состав,имеются в продаже под наименованиями PHOSPHOLIPON 90 Н и PHOSPHOLIPON 90 соответственно. Предпочтительно композиция по изобретению содержит, в дополнение к вышеупомянутым компонентам, заряженные соединения, такие как стеариламин и дицетилфосфат. Добавление указанных компонентов придает липосомам поверхностный заряд, который вызывает их взаимное отталкивание, таким образом предотвращая схлопывание липосом. Смесь фосфолипидов может также содержать додецилсульфат натрия, кремофор RH60, альфа-токоферола фосфат и ацетат кальция. Кроме того, небольшие фракции (15-19 мол.%) соединений с гидрофильными группами, такие как моносиалоганглиозиды, гидрогенизированный фосфатидилинозит и сконъюгированные с липидами полиэтиленгликоли (PEG-DSPE), могут быть включены в мембранный бислой для уменьшения взаимодействия между липосомами и клетками и компонентами крови. Липосомные препараты по изобретению были протестированы in vivo на противоопухолевую активность и токсичность. В качестве опухолевой модели была использована мышиная лейкемия Р 388. В частности, активность по предотвращению внезапной гибели была оценена в сравнении с контрольной группой, которой 4 вводили препарат свободного лекарственного средства. Детали описаны в примерах. Результаты тестов доказали, что липосомные препараты по изобретению вызывают ощутимое увеличение среднего времени жизни и заметное уменьшение токсичности. Кроме того, случаи внезапной гибели животных более не наблюдались. В заключение, следовательно, можно утверждать, что препараты по изобретению сохраняют противоопухолевую активность и не вызывают внезапной гибели, наблюдаемой в случае использования свободного лекарственного средства или других традиционных препаратов этого активного ингредиента. Следующие примеры иллюстрируют изобретение более подробно. Пример 1. Очистка лецитина до фосфатидилхолина. Основным источником лецитина являются растительные масла из соевых бобов, семян хлопчатника, подсолнечника, рапса или животные ткани (яйца). Соевый и яичный лецитины наиболее существенны в силу производимых количеств. Соевые бобы подвергают экстракции гексаном с получением сырого лецитина полутвердой констистенции, который содержит 52% фосфолипидов, 35% масел и жиров, 10% гликолипидов и сахаров, 2% неомыляемых веществ и 1% воды. Жирные кислоты экстрагируют из сырого лецитина с получением тонкого или гранулированного порошка лецитина, который дополнительно экстрагируют этанолом и фракционируют с получением более чистых лецитинов с более высоким содержанием фосфатидилхолина. Сырой лецитин был также очищен с использованием простого способа для промышленнго производства фосфатидилхолина путем экстракции ацетоном, какописано в US 5 442 276. Очистка сырого лецитинаPHOSPHOLIPON 90H (PHO 90H) получали гидрогенизацией PHOSPHOLIPON 90 (PHO 90). Эти два коммерческих фосфолипидаPHOSPHOLIPON 90: Пероксидное число: макс. 5 Кислотное число: макс. 0,5 Этанол: макс. 0,5% Вода, макс. 1,5% Форма: желтое пастообразное вещество Примесь d,1-токоферола, мин. 0,1% PHOSPHOLIPON 90H Иодное число: макс. 1 Вода: макс. 2,0% Температура фазового перехода 20%-ной дисперсии в Н 2 О приблизительно 54 С. Форма: белое твердое кристаллическое вещество Положения 1 и 2 глицерина в молекуле фосфатидилхолина этерифицированы жирными кислотами, такими как: пальмитиновая, олеиновая,линолевая, линоленовая и стеариновая кислоты. Пример 2. Хроматографический анализ фосфолипидов. Количественный и качественный анализ образцов фосфатидилхолина для определения жирнокислотного состава был осуществлен посредством GLC анализа (газожидкостная хроматография). Жирные кислоты в образцах фосфолипидов были обнаружены и дозированы с использованием чистых метиловых эфиров жирных кислот (Carlo Erba) и стандартного оливковового масла. Омыление образца: 50 мг вещества помещали в пробирку и добавляли 3 мл 1 н гидроксида натрия (Baker). Пробирку плотно закрывали и помещали в специальный термостат при температуре 110 С на 1 ч. После охлаждения до комнатной температуры образец подкисляли 2 н соляной кислотой (Baker) и экстрагировали 10 мл смеси н-гексан/этилацетат 90/10 (Merck). Органический растворитель удаляли в умеренном потоке азота. Этерификация образцов: из пробирки удаляли органическую фазу, добавляли 1 мл ВF3 в метаноле, пробирку плотно закрывали и выдерживали 1 ч при температуре 100 С. После охлаждения до комнатной температуры к образцу добавляли 5 мл дистиллированной воды и дважды экстрагировали 5 мл смеси нгексан/этилацетат 90/10. 1 мкл органической фазы высушивали над Na2SO4 и затем впрыскивали в газовой хроматограф. Режим эксплуатации Газовый хроматограф: Меgа 5300 Carlo Erba Колонка: Megawax, длина 30 м, внутренний диаметр 0,32 мм, толщина пленки (f.t.) 0,25 мкм Носитель: гелий, скорость 45 см/с Инжектор: с делением потока 1/100 при 250 С Детектор: F.I.D. (пламенный ионизационный детектор) при 280 С Термостат: 120 С на 1 мин Конечная температура: 250 С, скорость увеличения температуры 5 С/мин 6 На фиг. 1-3 показаны газовые хроматограммы стандарта, РНО 90 и РНО 90 Н соответственно. В табл. 1 показано процентное содержание кислот в анализируемых липидах. Таблица 1 Жирные кислоты PHOSPHOLIPON 90 PHOSPHOLIPON 90H Стеариновая 4,13 85 Пальмитиновая 14,21 14 Олеиновая 9,84 Линолевая 64,44 Гамма-линолевая 1,50 Линоленовая 5,88 Пример 3. Термический анализ фосфолипидов. Коммерческие фосфолипиды РНО 90 и РНО 90 Н, как по отдельности, так и в смеси,анализировали методом дифференциальной сканирующей калориметрии (DSC). Образцы готовили следующим образом: 500 мг РНО 90 растворяли в 10 мл дихлорметана + 1 мл МеОН (Si); 500 мг РНО 90 Н растворяли в 10 мл дихлорметана + 1 мл МеОН (S2). Образец 1: 2 мл S1 Образец 2: 2 мл S2 Образец 3: 0,5 мл S1+1,5 мл S2 Образец 4: 1 мл S1+1 мл S2 Образец 5: 1,5 мл S1+0,5 мл S2 Образцы высушивали в потоке азота при слабом нагревании, затем анализировали методом DSC (дифференциальная сканирующая калориметрия). Анализы выполняли с использованием системы Mettler DSC 20, нагревали до 200 С с градиентом 3 С/мин, затем образец оставляли охлаждаться. На фиг. 4-5 представлены термограммы двух фосфолипидов. Как можно видеть на фиг. 4, РНО 90 Н имеет заметную, хорошо определимую точку плавления при 120 С и точку кристаллизации при 90 С. Что касается РНО 90, то фиг. 5 показывает,что это не кристаллический порошок, а пастообразная масса и, следовательно, как и в случае со всеми жирами, это вещество не имеет отчетливо выраженной точки плавления, но есть точка размягчения, которая является температурой,при которой жиры начинают течь, и точка просветления, которая является температурой, при которой жир становится совершенно прозрачным. Это подтверждается термограммой РНО 90, где вместо определенного пика, как в случае с термограммой РНО 90 Н, наблюдается широкая полоса, соответствующая точке размягчения. Что же касается термограммы смесей, то точка кристаллизации наблюдается при более низких температурах, и она далее уменьшается от смеси РНО 90 Н:РНО 90 2:1 до смеси 1:1 и,наконец, полностью исчезает в смеси РНО 90 Н:РНО 90 1:2, где преобладают характерные свойства РНО 90. 7 Пример 4. Приготовление липосомного препарата. 3,6 г РНО 90, 1,8 г PHO 90H (соотношение 2:1) и 0,52 г холестерина помещали в круглодонную колбу объемом 500 мл и добавляли 50 мл дихлорметана. Смесь обрабатывали ультразвуком в течение примерно 10 мин для улучшения растворения. Полученный раствор выпаривали досуха в роторном пленочном испарителе(Rotavapour) при 40 С под вакуумом и с незначительным вращением до получения гомогенной фосфолипидной пленки. Полученную фосфолипидную пленку охлаждали, затем добавляли раствор BBR 2778,полученный растворением 300 мг BBR 2778 в 60 мл смеси вода/пропиленгликоль 60/40 и фильтрованием через фильтр 0,22 мкм, и 10 мл стеклянных шариков со средним диаметром 2 мм. Круглодонную колбу, соединенную с роторным испарителем, оставляли на ночь при медленном вращении (15 ч, 300 вращений/мин) при комнатной температуре и давлении до полной регидратации. Табл. 2 представляет результаты анализа полученного препарата BBR 2778. Таблица 2 Препарат BBR 2778% липосом с размером 0,22 мкм Пример 5. Оценка противоопухолевой активности BBR 2778 липосом. Животные: мыши были предоставленыCharles River Breeding Laboratories, (Calco,Como, Италия); это были самцы в возрасте 6-8 недель, содержавшиеся в стандартных условиях. Препараты: в качестве эталона использовали BBR 2778, растворенный и разведенный в стерильной воде сразу перед введением мышам в дозе 10 мг/кг. Использовали липосомный препарат из примера 4. Опухолевая модель: Р 388 мышиная лейкемия, предоставленная NCд Frederick Cancer Facility (США), поддерживается серией внутрибрюшинных трансплантаций мышам линииDBA2. Мышам трансплантировали 106 клеток Р 388 лейкемии/мышь, а липосомное соединение и эталонный стандарт вводили внутривенно в дни 1, 4, 7 после трансплантации опухоли. Противоопухолевую активность определяли как процентное увеличение времени жизни мышей, выраженное соотношением О/К % среднего времени жизни (СВЖ) обработанной группы (О) к среднему времени жизни контрольной группы (К): Табл. 3 представляет результаты определения противоопухолевой активности BBR 2778 в протестированных препаратах. Случаи внезапной гибели 2/53 2/32 число смертей от интоксикации/общее количество мышейсреднее значение множества тестов Сравнение между препаратом из примера 4 и раствором BBR 2778 ясно свидетельствует об исчезновении случаев внезапной гибели у мышей,которым вводили липосомный препарат. Анализы каждой отдельной введенной дозы показывают различия как в отношении величины О/К %, так и токсичности, между липосомным препаратом и препаратом в виде раствора; при дозах 18 и 27 мг/кг не наблюдали значительной разницы в величинах О/К %, в то время как проявление токсичности наблюдали только после обработки неинкапсулированным BBR 2778. Препарат по изобретению в сравнении сBBR 2778 в растворе в дозе 40 мг/кг вызывает значительное улучшение величины среднего времени жизни: 287, 250 и 159, соответственно,и заметное уменьшение токсичности (12 и 60,4% соответственно). Доза 60 мг/кг токсична для обоих препаратов. Следовательно, можно утверждать, что введение липосомного препарата BBR 2778 по изобретению не вызывает внезапной гибели и в то же время характеризуется уменьшением токсичности. Что касается противоопухолевой активности, то результаты тестов BBR 2778 в растворе подтверждаются, при этом наблюдается даже заметное увеличение величины О/К % при некоторых дозировках. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Липосомный препарат соединения 6,9 бис-[(2-аминоэтил)амино]бензо[g]изохинолин 5,10-диона дималеат (BBR 2778) формулы отличающийся тем, что указанные липосомы включают в себя фосфатидилхолин, холестерин и соединение BBR 2778 при массовом соотношении холестерин/фосфолипид от 1:2 до 1:7 и массовом соотношении BBR 2778/фосфолипид от 1:4 до 1:25. 2. Липосомный препарат по п.1, где указанный фосфатидилхолин содержит остатки жирных кислот, выбранных из пальмитиновой,олеиновой, линолевой, гамма-линолевой, линоленовой и стеариновой кислот. 3. Липосомный препарат по п.1, где указанный фосфатидилхолин представляет собой смесь гидрогенизированных и негидрогенизированных форм в массовом соотношении от 1:2 до 2:1. 4. Липосомный препарат по п.3, где указанная гидрогенизированная форма имеет точку 10 плавления 120 С и точку кристаллизации 90 С,а указанная негидрогенизированная форма имеет термограмму по существу такую, как представлено на фиг. 5. 5. Липосомный препарат по любому из пп.1-4, где липосомы дополнительно содержат стеариламин и/или дицетилфосфат. 6. Применение липосомного препарата по пп.1-5 для приготовления противоопухолевого лекарственного средства.
МПК / Метки
МПК: A61P 35/00, A61K 9/127
Метки: препарат, 6,9-бис[(2-аминоэтил)-амино]бензо[g]изохинолин-5,10-диона, дималеата, липосомный
Код ссылки
<a href="https://eas.patents.su/6-4477-liposomnyjj-preparat-69-bis2-aminoetil-aminobenzogizohinolin-510-diona-dimaleata.html" rel="bookmark" title="База патентов Евразийского Союза">Липосомный препарат 6,9-бис[(2-аминоэтил)-амино]бензо[g]изохинолин-5,10-диона дималеата</a>
Предыдущий патент: Производные резорцина
Следующий патент: Герметичная ёмкость
Случайный патент: Разъединительная установка и связанный с ней способ отделения










