Мостиковые производные пиперидина
Номер патента: 25035
Опубликовано: 30.11.2016
Авторы: Бауманн Карлхайнц, Луэбберс Томас, Томас Эндрю, Грин Люк, Лимберг Анья
Формула / Реферат
1. Соединение формулы I
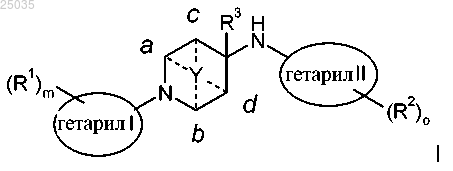
где гетарил I представляет собой пяти- или шестичленную гетероарильную группу, содержащую 1-3 гетероатома, выбранных из S или N;
гетарил II представляет собой шестичленную гетероарильную группу, содержащую 1-3 гетероатома, выбранных из S или N, или представляет собой двухкольцевую систему, содержащую 1-4 гетероатома, выбранных из S или N, где по меньшей мере одно кольцо является ароматическим;
R1 представляет собой галоген, С1-4алкокси или С1-4алкил, возможно замещенный по меньшей мере одним галогеном;
R2 представляет собой галоген, С1-4алкокси, С1-4алкил, возможно замещенный по меньшей мере одним галогеном, циклогексил, замещенный 1-2 заместителями, выбранными из С1-4алкила, возможно замещенного по меньшей мере одним галогеном, или представляет собой С1-4алкил, замещенный гидрокси, фурил, О-бензил или -(СН2)р-фенил, возможно замещенный одним, двумя или тремя галогенами, С1-4алкокси, циано или С1-4алкилом, возможно замещенным по меньшей мере одним галогеном;
R3 представляет собой водород или С1-4алкил;
Y представляет собой -(СН2)n-, -СН2ОСН2-, -СН2О-, CH2S-, -CH2SCH2- и присоединен к двум кольцевым атомам углерода, связь осуществляется через каждый кольцевой атом углерода а и b или через каждый кольцевой атом c и d;
р представляет собой 0 или 1;
m представляет собой 0, 1 или 2; если m представляет собой 2, тогда R1 могут быть одинаковыми или различными;
n представляет собой 2 или 3;
о представляет собой 0, 1 или 2, если о представляет собой 2, тогда R2 могут быть одинаковыми или различными;
или его фармацевтически приемлемая кислотно-аддитивная соль.
2. Соединение формулы I по п.1
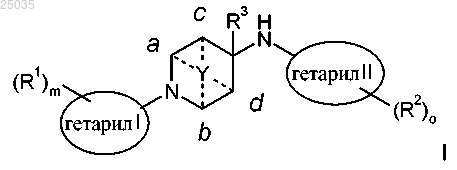
где гетарил I представляет собой пиридинил, 1,2,4-тиадиазолил, пиразинил или пиримидинил;
гетарил II представляет собой [1,2,4]триазоло[1,5-а]пиридинил, [1,2,4]триазоло[1,5-а]пиразинил, 5,6,7,8-тетрагидро[1,2,4]триазоло[1,5-а]пиридинил, [1,2,4]триазоло[1,5-с]пиримидинил, 4,5,6,7-тетрагидробензотиазолил или пиримидинил;
R1 представляет собой метил, хлор или CF3;
R2 представляет собой метил, н-пропил, фтор, хлор, трифторметил, метокси, -С(СН3)2ОН, О-бензил, циклогексил, замещенный двумя метилами или трифторметилом, фурил или -(СН2)р-фенил, возможно замещенный одним, двумя или тремя атомами F и/или Cl, циано или метокси;
R3 представляет собой водород или метил;
Y представляет собой -(СН2)n-, -СН2ОСН2-, -ОСН2-, -CH2SCH2-, -SCH2 и присоединен к двум кольцевым атомам углерода, связь осуществляется через каждый кольцевой атом углерода а и b или через каждый кольцевой атом с и d;
р представляет собой 0 или 1;
m представляет собой 0, 1 или 2;
n представляет собой 2 или 3;
о представляет собой 1 или 2, если о представляет собой 2, тогда R2 могут быть одинаковыми или различными;
или его фармацевтически приемлемая кислотно-аддитивная соль.
3. Соединение формулы I по п.1, где
Y представляет собой -(СН2)2-,
гетарил I представляет собой
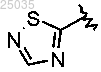
и гетарил II представляет собой двухкольцевую систему, содержащую 1-4 гетероатома.
4. Соединение формулы I по любому из пп.1-3, где соединение представляет собой
[(рац)-3-экзо-8-(3-метил[1,2,4]тиадиазол-5-ил)-8-азабицикло[3.2.1]окт-3-ил]-(4-фенил-4,5,6,7-тетрагидробензотиазол-2-ил)амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-(2-хлор-4-фторфенил)-6-метил[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-(2-хлор-4-фторфенил)-6-фтор-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-(4-хлор-2-метоксифенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-(3-циано-4-фторфенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-(3,4-дифторфенил)-6-трифторметил[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-метокси[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-хлор-6-трифторметил[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[5,6-диметил[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-бензилокси[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[5-пропил[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-(5-фенил-[1,2,4]триазоло[1,5-а]пиразин-2-ил)амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[5-трифторметил[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[6-хлор-8-(3,4-дифторфенил)[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[7-метил-5-пропил[1,2,4]триазоло[1,5-с]пиримидин-2-ил]амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-(4,4-диметилциклогексил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-(7-фуран-2-ил-[1,2,4]триазоло[1,5-а]пиримидин-2-ил)амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[7-трифторметил[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-(4-трифторметилциклогексил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-(4-фторфенил)-5,6,7,8-тетрагидро[1,2,4]триазоло[1,5-а]пиридин-2-ил]-[(рац)-8-экзо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]амин или
[(рац)-8-(3,4-дифторфенил)-5,6,7,8-тетрагидро[1,2,4]триазоло[1,5-а]пиридин-2-ил]-[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]амин.
5. Соединение формулы I по п.1, где
Y представляет собой -(СН2)2-,
гетарил I представляет собой
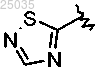
и гетарил II представляет собой шестичленную гетероарильную группу, содержащую 1-3 гетероатома, выбранных из S или N.
6. Соединение формулы I по любому из пп.1, 2 или 5, где соединение представляет собой 2-{6-(4-хлорбензил)-2-[(рац)-3-эндо-8-(3-метил[1,2,4]тиадиазол-5-ил)-8-азабицикло[3.2.1]окт-3-иламино]пиримидин-4-ил}пропан-2-ол.
7. Соединение формулы I по п.1, где
Y представляет собой -(СН2)n-,
гетарил I представляет собой
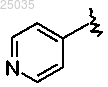
и гетарил II представляет собой двухкольцевую систему, содержащую 1-4 гетероатома.
8. Соединение формулы I по любому из пп.1, 2 или 7, где соединение представляет собой
[(рац)-3-экзо-8-(2-хлорпиридин-4-ил)-8-азабицикло[3.2.1]окт-3-ил]-[8-(3,4-дифторфенил)-6-метил[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин или
[8-(3,4-дифторфенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]-[(рац)-8-эндо-3-(2-трифторметилпиридин-4-ил)-3-азабицикло[3.2.1]окт-8-ил]амин.
9. Соединение формулы I по п.1, где
гетарил I представляет собой
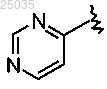
и гетарил II представляет собой двухкольцевую систему, содержащую 1-4 гетероатома и другие радикалы такие, как определено в п.1.
10. Соединение формулы I по любому из пп.1, 2 или 9, где соединение представляет собой
[(рац)-8-эндо-3-(6-метилпиримидин-4-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-(2,3,4-трифторфенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-эндо-3-(6-метилпиримидин-4-ил)-6-окса-3-азабицикло[3.2.1]окт-8-ил]-[8-(2,3,4-трифторфенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-9-экзо-7-(6-метилпиримидин-4-ил)-3-тиа-7-азабицикло[3.3.1]нон-9-ил]-[8-(2,3,4-трифторфенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-9-эндо-3-(6-метилпиримидин-4-ил)-3-азабицикло[3.3.1]нон-9-ил]-[8-(2,3,4-трифторфенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-9-экзо-7-(6-метилпиримидин-4-ил)-3-окса-7-азабицикло[3.3.1]нон-9-ил]-[8-(2,3,4-трифторфенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин;
[(рац)-8-экзометил-3-(6-метилпиримидин-4-ил)-3-азабицикло[3.2.1]окт-8-эндо-ил]-[8-(2,3,4-трифторфенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин или
[8-(3,4-дифторфенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]-[(рац)-8-эндо-3-(2-метилпиримидин-4-ил)-3-азабицикло[3.2.1]окт-8-ил]амин.
11. Лекарственное средство для лечения или профилактики заболевания, связанного с отложением бета-амилоида, содержащее одно или более соединений по любому из пп.1-10 и фармацевтически приемлемые эксципиенты.
12. Лекарственное средство по п.11 для лечения болезни Альцгеймера, церебральной амилоидной ангиопатии, наследственной церебральной геморрагии с амилоидозом голландского типа (HCHWA-D), мультиинфарктной деменции, деменции боксеров и синдрома Дауна.
13. Применение соединения по любому из пп.1-10 при производстве лекарственного средства для лечения болезни Альцгеймера, церебральной амилоидной ангиопатии, наследственной церебральной геморрагии с амилоидозом голландского типа (HCHWA-D), мультиинфарктной деменции, деменции боксеров и синдрома Дауна.
14. Применение соединения по любому из пп.1-10 в качестве модулятора бета-амилоида.
15. Применение соединения по любому из пп.1-10 для лечения болезни Альцгеймера, церебральной амилоидной ангиопатии, наследственной церебральной геморрагии с амилоидозом голландского типа (HCHWA-D), мультиинфарктной деменции, деменции боксеров и синдрома Дауна.
16. Способ лечения болезни Альцгеймера, церебральной амилоидной ангиопатии, наследственной церебральной геморрагии с амилоидозом голландского типа (HCHWA-D), мультиинфарктной деменции, деменции боксеров и синдрома Дауна, включающий введение эффективного количества соединения по любому из пп.1-10.
Текст
Настоящее изобретение относится к соединениям формулы где гетарил I, гетарил II, R1, R2, R3, Y, p, m, n, о являются такими, как определено в формуле изобретения; или их фармацевтически активным кислотно-аддитивным солям. Настоящие соединения формулы I являются модуляторами амилоида бета и, таким образом, они могут быть полезны для лечения или профилактики заболеваний, ассоциированных с отложением -амилоида в головном мозге, в частности болезни Альцгеймера и других заболеваний, таких как церебральная амилоидная ангиопатия, наследственная церебральная геморрагия с амилоидозом голландского типа (HCHWA-D), мультиинфарктная деменция, деменция боксеров и синдром Дауна. Настоящее изобретение относится к соединениям формулы где гетарил I представляет собой пяти- или шестичленную гетероарильную группу, содержащую 13 гетероатома, выбранных из S или N; гетарил II представляет собой шестичленную гетероарильную группу, содержащую 1-3 гетероатома, выбранных из S или N, или представляет собой двухкольцевую систему, содержащую 1-4 гетероатома, выбранных из S или N, где по меньшей мере одно кольцо является ароматическим;R1 представляет собой низший алкил, низший алкокси, низший алкил, замещенный галогеном или галоген;R2 представляет собой низший алкил, низший алкил, замещенный галогеном, водород, низший алкокси, циклоалкил, замещенный низшим алкилом, или низший алкил, замещенный галогеном, или представляет собой низший алкил, замещенный гидрокси, фурил, О-бензил или -(СН 2)р-фенил, возможно замещенный галогеном, низший алкокси, низший алкил, замещенный галогеном, низшим алкилом или циано;R3 представляет собой водород или низший алкил;Y представляет собой -(CH2)n-, -CH2OCH2-, -CH2O-, CH2S-, -CH2SCH2- и присоединен к двум кольцевым атомам углерода, связь осуществляется через каждый кольцевой атом углерода а и b или через каждый кольцевой атом c и d; р представляет собой 0 или 1;m представляет собой 0, 1 или 2; если m представляет собой 2, тогда R1 могут быть одинаковыми или различными;n представляет собой 2 или 3; о представляет собой 0, 1 или 2, если о представляет собой 2, тогда R2 могут быть одинаковыми или различными; или их фармацевтически активным кислотно-аддитивным солям. Было установлено, что соединения по настоящему изобретению формулы I являются модуляторами для бета-амилоида и, таким образом, они могут быть полезными для лечения или профилактики заболевания, связанного с отложением -амилоида в мозге, в частности болезни Альцгеймера, а также других заболеваний, таких как церебральная амилоидная ангиопатия, наследственная церебральная геморрагия с амилоидозом голландского типа (HCHWA-D), мультиинфарктной деменции, деменции боксеров и синдрома Дауна. Болезнь Альцгеймера (БА) является наиболее частой причиной слабоумия в пожилом возрасте. Патологически, БА характеризуется отложением амилоида во внеклеточных и внутриклеточных бляшках и нейрофибриллярных клубках в головном мозге. Амилоидные бляшки в основном состоят из амилоидных пептидов (А пептиды), которые происходят из белка-предшественника -амилоида (АРР) в результате нескольких стадий протеолитического расщепления. Некоторые формы АРР были идентифицированы,из них наиболее распространенными являются белки длиной 695, 751 и 770 аминокислот. Все они происходят из одного гена посредством дифференцированного сплайсинга. А пептиды происходят из одного домена АРР. А пептиды продуцируются из АРР в результате последовательного действия двух протеолитических ферментов, называемых - и -секретазами. -секретаза первой расщепляет внеклеточный домен АРР недалеко от трансмембранного домена (ТМ) с получением С-концевого фрагмента АРР, содержащего ТМ- и цитоплазматический домены (CTF ). CTFявляется субстратом для -секретазы, которая расщепляет [АРР] в нескольких соседних позициях ТМ домена с получениемпептидов и цитоплазматического фрагмента. Различные протеолитические расщепления, опосредованные -секретазой, дают в результате А пептиды с разной длиной цепи, например А 38, А 40 и А 42. Последний рассматривается в качестве наиболее патогенного пептида амилоида из-за его сильной тенденцией к образованию нейротоксических агрегатов.-секретаза является типичной аспартил-протеазой. -секретаза является протеолитическим ферментом, состоящим из нескольких белков, е точный состав до конца не ясен. Тем не менее, пресенилины являются важными компонентами е активности и могут представлять собой новую группу атипичных аспартилпротеаз, которые расщепляют ТМ домен их субстратов, и которые сами по себе являются политопными мембранными белками. Другими важными компонентами -секретазы могут быть никастрин и продукты генов aph1 и pen-2. Установленными субстратами для -секретазы являются АРР и белки семейства рецепторов Notch, однако, -секретаза обладает свободной субстратной специфичностью и может расщеплять другие мембранные белки, не связанные с АРР и Notch. Активность -секретазы является абсолютно необходимой для образования А пептидов. Это было показано как генетическими средствами, т.е. удалением гена пресенилина, так и ингибирующими соединениями с низким молекулярным весом. Поскольку в соответствии с амилоидной гипотезой БА образование и осаждение А является конечной причиной заболевания, считается, что селективные и сильные ингибиторы -секретазы будут полезны для профилактики и лечения болезни Альцгеймера. Альтернативным способом лечения является модуляция активности -секретазы, которая приводит к селективному уменьшению образования А 42. Это приведет к увеличению более коротких А изоформ, например А 38, А 37 или других, которые обладают уменьшенной способностью к агрегации и образованию бляшек, а также являются менее нейротоксическими. Соединения, которые показывают этот эффект на модуляцию -секретазы, включают некоторые нестероидные противовоспалительные средства (НПВС) и родственные аналоги (Weggen и соавт. Nature, 414 (2001), 212-16). Таким образом, соединения по настоящему изобретению могут быть полезны для лечения или профилактики заболевания, связанного с отложением -амилоида в мозге, в частности болезни Альцгеймера и других заболеваний, таких как церебральная амилоидная ангиопатия, наследственная церебральная геморрагия с амилоидозом голландского типа (HCHWA-D), мультиинфарктная деменция, деменция боксеров и синдром Дауна. Многочисленными документами, описывающими современный уровень знаний по модуляции секретазы, являются, например, следующие публикации:Narlawar и соавт., J. Med. Chem. 49 (2006), 7588-91. Используются следующие определения для соединений формулы I. Как используется здесь, термин"низший алкил" означает насыщенную линейную или с разветвленной цепью группу, содержащую от 1 до 7 атомов углерода, например, метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и т.п. Предпочтительными алкильными группами являются группы с 1-4 атомами углерода. Как используется здесь, термин "низший алкил, замещенный галогеном", означает алкильную группу, как определено выше, где по крайней мере один атом водорода замещен атомом галогена, напримерCF3, CHF2, CH2F, CH2CF3, CH2CH2CF3, CF2CHF2, CH2CF2CF3 и т.п. Как используется здесь, термин "низший алкил, замещенный гидрокси" означает алкильную группу, как определено выше, где по крайней мере один атом водорода замещен гидрокси, СН 2 ОН,СНСН 3 ОН или С(СН 3)2 ОН. Как используется здесь, термин "низший алкокси" означает алкильную группу, как определено выше, которая присоединена посредством атома О. Термин "галоген" означает хлор, йод, фтор и бром. Термин "пятичленная гетероарильная группа, содержащая от 1 до 3 гетероатомов, выбранных из S или N" выбран из группы, состоящей из Предпочтительной пятичленной гетероарильной группой является Термин "шестичленная гетероарильная группа, содержащая от 1 до 3 гетероатомов, выбранных из S или N" выбран из группы, состоящей из Предпочтительными шестичленными гетероарильными группами являются Термин "двухкольцевая система, содержащая 1-4 гетероатома, выбранных из S или N, где по меньшей мере одно кольцо является ароматическим" выбран из группы, состоящей из Термин "фармацевтически приемлемые кислотно-аддитивные соли" охватывает соли с неорганическими и органическими кислотами, такими как соляная, азотная, серная, фосфорная, лимонная, муравьиная, фумаровая, малеиновая, уксусная, янтарная, винная, метансульфоновая, п-толуолсульфоновая кислоты и т.п. Объектами настоящего изобретения являются соединения формулы I, применение таких соединений при получении лекарственных средств для лечения болезни Альцгеймера, церебральной амилоидной ангиопатии, наследственной церебральной геморрагии с амилоидозом голландского типа (HCHWA-D),мультиинфарктной деменции, деменции боксеров и синдрома Дауна, их получение и лекарственные средства на основе соединений формулы I в соответствии с настоящим изобретением. Также, объектами настоящего изобретения являются все формы оптически чистых энантиомеров,рацематы или диастереомерные смеси соединений формулы I. Одним из объектов настоящего изобретения являются соединения формулы где гетарил I представляет собой пяти- или шестичленную гетероарильную группу, содержащую 13 гетероатома, выбранных из S или N; гетарил II представляет собой шестичленную гетероарильную группу, содержащую 1-3 гетероатома, выбранных из S или N, или представляет собой двухкольцевую систему, содержащую 1-4 гетероатома, выбранных из S или N, где по меньшей мере одно кольцо является ароматическим;R1 представляет собой низший алкил, низший алкокси, низший алкил, замещенный галогеном, или галоген;R2 представляет собой низший алкил, низший алкил, замещенный гидрокси или представляет собойR3 представляет собой водород или низший алкил;Y представляет собой -(CH2)n-, -CH2OCH2-, -CH2O-, CH2S-, -CH2SCH2- и присоединен к двум кольцевым атомам углерода, связь осуществляется через каждый кольцевой атом углерода а и b или через каждый кольцевой атом c и d; р представляет собой 0 или 1;m представляет собой 0, 1 или 2; если m представляет собой 2, тогда R1 могут быть одинаковыми или различными;n представляет собой 2 или 3; о представляет собой 0, 1 или 2, если о представляет собой 2, тогда R2 могут быть одинаковыми или различными; или их фармацевтически активные кислотно-аддитивные соли. Одним из воплощений настоящего изобретения также являются соединения формулы IR2 представляет собой метил, н-пропил, фторо, хлоро, трифторметил, метокси или представляет собой -С(СН 3)2 ОН, или представляет собой О-бензил, или представляет собой циклогексил, замещенный метилом или трифторметилом, или представляет собой фурил, или представляет собой -(СН 2)р-фенил,возможно замещенный одним, двумя или тремя атомами галогена, выбранными из F, или Cl, или циано,или метокси;R3 представляет собой водород или метил;Y представляет собой -(СН 2)n-, или представляет собой -СН 2 ОСН 2-, или представляет собой -ОСН 2-,или представляет собой -CH2SCH2-, или представляет собой -SCH2 и присоединен к двум кольцевым атомам углерода, связь осуществляется через каждый кольцевой атом углерода а и b или через каждый кольцевой атом c и d; р представляет собой 0 или 1;n представляет собой 2 или 3; о представляет собой 1 или 2, если о представляет собой 2, тогда R2 могут быть одинаковыми или различными; или их фармацевтически активные кислотно-аддитивные соли. Одним из воплощений настоящего изобретения являются также соединения формулы I, где Y представляет собой -(СН 2)2-, гетарил I представляет собой и гетарил II представляет собой двухкольцевую систему, содержащую 1-4 гетероатома, например, следующие соединения:[(рац)-8-(3,4-дифторфенил)-5,6,7,8-тетрагидро[1,2,4]триазоло[1,5-а]пиридин-2-ил]-[(рац)-8-эндо-3(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]амин. Дополнительным воплощением настоящего изобретения являются соединения формулы I, где Y представляет собой -(СН 2)2-, гетарил I представляет собой и гетарил II представляет собой шестичленную гетероарильную группу, содержащую 1-3 гетероатома, выбранных из S или N, например,следующее соединение: 2-6-(4-хлорбензил)-2-[(рац)-3-эндо-8-(3-метил[1,2,4]тиадиазол-5-ил)-8-азабицикло[3.2.1]окт-3 иламино]пиримидин-4-илпропан-2-ол. Дополнительным воплощением настоящего изобретения являются соединения формулы I, где Y представляет собой -(СН 2)n-, гетарил I представляет собой и гетарил II представляет собой двухкольцевую систему, содержащую 1-4 гетероатома, например, следующие соединения:[8-(3,4-дифторфенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]-[(рац)-8-эндо-3-(2 трифторметилпиридин-4-ил)-3-азабицикло[3.2.1]окт-8-ил]амин. Дополнительным воплощением настоящего изобретения являются соединения формулы I, где гетаи гетарил II представляет собой двухкольцевую систему, содержащую рил I представляет собой 1-4 гетероатома, например, следующие соединения:[8-(3,4-дифторфенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]-[(рац)-8-эндо-3-(2-метилпиримидин-4 ил)-3-азабицикло[3.2.1]окт-8-ил]амин. Данные соединения формулы I и их фармацевтически приемлемые соли могут быть получены способами, известными в данной области, например способами, описанными ниже, которые включают: а) взаимодействие соединения формулы где X представляет собой галоген и остальные группы обладают значениями, как описано выше, и,при необходимости, конвертирование полученных соединений в фармацевтически кислотноаддитивные соли; или где X представляет собой галоген и остальные группы обладают значениями, как описано выше,или с) взаимодействие соединения формулы где группы обладают значениями, как описано выше, и R3 представляет собой водород, и,при необходимости, конвертирование полученных соединений в фармацевтически кислотноаддитивные соли. Получение соединений формулы I по настоящему изобретению может осуществляться последовательным (линейным) или конвергентным синтезом. Синтез соединений по изобретению показан на следующих схемах. Навыки, необходимые для проведения реакции и очистки полученных продуктов известны специалистам в данной области. Заместители и индексы, используемые в следующем описании процессов имеют значения, данные здесь ранее, если не указано обратное. Более конкретно, соединения формулы I могут быть получены способами, приведенными ниже,способами, приведенными в примерах, или аналогичными способами. Подходящие условия реакций для отдельных реакционных стадий известны специалистам в данной области. Последовательность реакций не ограничивается таковой, изображенной в схемах, однако, в зависимости от исходных материалов и их соответствующей реакционной способности последовательность реакционных стадий может быть свободно изменена. Исходные вещества являются либо коммерчески доступными, либо могут быть получены способами, аналогичными способам, приведенным ниже, способами, описанными в примерах, или способами, известными в данной области техники. Схема 1 Соединения формулы I по настоящему изобретению и их фармацевтически приемлемые соли могут быть получены связыванием аминов общей формулы 2 и галидов общей формулы 3 (см. схему 1). Эта реакция может быть проведена с использованием общеизвестных методик, например, реакцией замещения в каталитических условиях (например, катализ с использованием палладия(0) или меди(II или при температурных условиях или в основных условиях. Альтернативно, галиды 3 могут взаимодействовать в условиях, описанных выше, с аминами общей формулы 4, которые несут защитную группу PG, например Boc, на азоте пиперидина (см. схему 2). После депротекции, например, трифторуксусной кислотой пиперидины 6 могут быть связаны с галидами гетарила I формулы 7 с получением соединений формулы I. Схема 3R3 представляет собой водород. Альтернативно, анилины общей формулы 9 могут вступать в реакцию восстановительного аминирования с кетонами общей формулы 8 или 10 (см. схему 3) с получением соединений I как напрямую, так и после отщепления защитной группы PG соединений 5, с последующим связыванием с галидом гетероарила I 7, как показано на схеме 2. Восстановительное аминирование может проводиться способами,известными специалистам в области органического синтеза, например, нагреванием амина и кетона в подходящем растворителе (например, толуоле, дихлорэтане, ТГФ) возможно в присутствии кислоты (например, уксусной кислоты, тетраизопропилортотитаната) и восстановлением промежуточного имина подходящим восстановительным агентом (например, триацетоксиборогидрида натрия, цианоборогидрида натрия, борогидрида натрия, водорода в присутствии палладия на угле). Связывание анилинов общей формулы 9 с кетонами общей формулы 8 или 10 может альтернативно быть проведено при помощи протокола аза-Виттинг/восстановления (см. схему 4). Анилины общей формулы 9 сначала могут быть конвертированы в их соответствующие триалкилфосфазены 11 посредством реакции с триалкилфосфораном (например, дихлортриметилфосфораном, полученным в результате реакции триметилфосфина с гексахлорэтаном в NUA или дихлорметане) и органическим основным амином(например, триэтиламином, диизопропилэтиламином) в подходящем растворителе (например, ТГФ, дихлорметан). Кетоны общей формулы 8 или 10 затем добавляют к реакционной смеси, содержащей полученные in situ фосфазены 11 и смесь нагревают. Полученные имин/енамины (енамины могут образовываться для соединений с мостиком Y между атомами а и b) 12 или 13 затем обрабатывают подходящим восстанавливающим агентом (например, триацетоксиборогидридом натрия, цианоборогидридом натрия,борогидридом натрия, декабораном, комплексом боран-ТГФ, водородом в присутствии палладия на угле) в подходящем растворителе (ТГФ, ДХМ, МеОН и их смеси) с или без кислотного катализатора (например, уксусной кислоты) при комнатной или повышенной температуре с получением соединений общей формулы 5 или I (для R3 - водорода). Схема 5 А представляет собой Триазолопиридины общей формулы 5 а могут альтернативно быть получены превращением аминов общей формулы 14 в их соответствующие изотиоцианаты 15 (например, реакцией с трифосгеном или 1,1'-тиокарбонилдиимидазолом в дихлорметане в присутствии органического или водного неорганического основания) и взаимодействием с аминами общей формулы 4 (см. схему 5). Получившиеся тиомочевины 16 могут быть активированы алкилированием йодометаном и впоследствии циклизованы в триа-8 025035 золопиридины 5 а сильным нагреванием (130 С) в присутствии подходяще функционализированного производного гидроксиламина, например О-(триметилсилил)гидроксиламина в полярном растворителе,например диметилацетамиде. Схема 6D представляет собой карбоциклическое кольцо, предпочтительно Триазолопиридины общей формулы 5b могут быть получены первоначальным конденсированием циклических гидразидов 18 и изотиоцианатов 19 (полученные способами, известными квалифицированным в уровне техники специалистам) с образованием тиомочевины 20 (см. схему 6). Активация серы посредством алкилирования (например, йодометаном в ДМФ при повышенных температурах) позволяет заменить е азидом (например, азидом натрия в ДМФ при повышенных температурах) с получением азидогуанидина 22. Восстановление Штаудингера с триметилфосфином дат промежуточный фосфазен 23,который циклизуется при нагревании с получением триазолопиридина 5b. Анилины общей формулы 9, которые могут быть использованы в качестве исходных веществ для получения соединений формулы I, могут быть получены, как описано в следующих схемах. Схема 7 А представляет собой и X представляет собой Cl или Br. Анилины 9 а, в которых гетероарил II представляет собой аннелированный триазоловый остаток(см. схему 7), могут быть получены из соответствующих аминопроизводных 14, которые являются как коммерчески доступными, так и могут быть получены из соответствующих галидов 24 посредством катализируемого палладием сочетания Сузуки с бороновыми кислотами или бороновыми эфирами (например, пинаколиновым эфиром). Амины 14 могут взаимодействовать с этоксикарбонилизотиоцианатом с получением производных тиомочевины 25, которые циклизуют с помощью обработки гидроксиламином в присутствии основания с выделением диоксида углерода с получением аннелированных тиазолов 9 а А представляет собой и X представляет собой Cl или Br. Альтернативно, порядок стадий на схеме 7 может быть изменен (см. схему 8). Галиды 24 (которые являются как коммерчески доступными, так и могут быть получены способами, известными из уровня техники) могут взаимодействовать с этоксикарбонилизотиоцианатом с последующей обработкой гидроксиламином с получением аннелированных триазолов 27. Эти галиды могут быть подвергнуты, например, катализируемой палладием реакции сочетания Сузуки с бороновыми кислотами или катализируемому медью(I) связыванию с фенолами (например, в соответствии с D. Maiti и соавт. JOC 2010, 75, 17911794) с получением замещенных аминотриазолов 9 а. Схема 9 А представляет собой В представляет собой Соединения 9 а могут быть гидрогенизированы с палладием на угле в качестве катализатора с получением соответствующих частично насыщенных соединений 9b (см. схему 9). В зависимости от природы кольца А проведение данной реакции может потребовать повышенной температуры или давления водорода или присутствие кислоты (например, HCl). Альтернативно, соединения 9 а могут быть восстановлены с металлами, например, магнием в спиртовом растворе (таком как этанол) с или без активации металла (например, активация с каталитическим количеством йода). Схема 10 С представляет собой карбоциклическое кольцо, предпочтительно Анилины 9 с, в которых гетероарил II представляет собой аннелированный тиазол (см. схему 10),могут быть получены конденсацией -бромкетонов 28 с тиомочевиной (например, нагреванием в подходящем растворителе, например этаноле), -бромкетоны являются как коммерчески доступными, так и могут быть с легкостью получены способами, известными квалифицированным в области органического синтеза специалистом, например, взаимодействием подходящего кетона с бромом в хлороформе. Галиды общей формулы 3, которые могут быть использованы в качестве исходных веществ для получения соединений формулы I, могут быть получены, как описано на следующих схемах. Схема 11 Галотриазол 3 может быть получен из анилина 9 (см. схему 11) через образование соответствующей соли диазония и последующий распад в присутствии источника галида, такого как галид меди (I) или галоводород (X = хлор или бром).R2', R2 и R2 представляет собой низший алкил, низший алкил, замещенный гидрокси или -(СН 2)рфенил, возможно замещенный галогеном. Галиды 3 а, в которых гетероарил II представляет собой пиримидин (см. схему 12), может быть получен как, например, описано у K. Baumann и соавт., WO 2009103652 восстановлением трихлорпиримидинов 29 с получением дихлорпроизводного 30, например, обработкой цинком в водном растворе аммиака при 0 С. Затем, 4-хлор заместитель соединения 30 может быть замещен в реакции нуклеофильного замещения (такой как реакция с реагентом Гриньяра R2'MgX, например, бензилмагния хлорида в тетерагидрофуране при от -80 до +20 С) или, посредством реакции замещения, катализируемой катализаторомметаллом (например, используя ацетат палладия, 2-дициклогексилфосфино-бифенил, тетрагидрофуран,микроволновая печь, 30 мин, 200 С). Альтернативно, один из активных атомов хлора соединения 29 сначала замещается группой R2, с последующим замещением второго хлор-заместителя в промежуточном соединении 31 группой R2"', с получением 3 а. Схема 13R2 представляет собой -(СН 2)р-фенил, возможно замещенный галогеном. Галиды 3b, в которых гетероарил II представляет собой пиримидин (см. схему 13), могут быть получены из 2,6-дихлорпиримидин-4-карбоновой кислоты метилового эфира взаимодействием с, например,метилмагния хлоридом в ТГФ при -78 до 0 С, что дает 2-(2,6-дихлорпиримидин-4-ил)пропан-2-ол. Хлорид в позиции 4 2-(2,6-дихлорпиримидин-4-ил)пропан-2-ола может быть заменен на заместитель R2, например, в реакции сочетания Сузуки с арил/гетероарил бороновой кислотой/эфиром R2-B(OH/OR')2 в присутствии палладиевого катализатора и основания (например, карбоната натрия) в например, диметоксиэтане в качестве растворителя с получением хлорида 3b. Альтернативно, 4-хлор заместитель может взаимодействовать с органическим хлоридом цинка R2ZnCl, например, хлоридом бензилцинка в присутствии палладиевого катализатора с получением хлорида 3b. Для проведения данной модификации может потребоваться защита спиртовой группы 2-(2,6-дихлорпиримидин-4-ил)пропан-2-ола перед второй стадией, например, защитой с помощью триметилсилильной группы, которая может вводиться, например, с бис (триметилсилил)ацетамидом и может быть отщеплена после указанной модификации с помощью,например, p-TsOH в ТГФ/воде. Кетоны общей формулы 8, которые могут быть использованы в качестве исходных веществ для получения соединений формулы I, могут быть получены, как описано на следующих схемах. Схема 14 Реакция Манниха кетона на схеме 14 с формальдегидом и подходящим амином PG-NH2 приводит к кетону 10 а. Защитная группа 10 а может быть изменена, как необходимо (например, с бензила на boc- 11025035PG-NH2 приводит к кетону 10b. Депротекция соединений 10b или 10 а и связывание с подходящим галидом гетарила I в основных условиях, температурных условиях или в присутствии металла-катализатора приводит к кетону 8. Амины общей формулы 2, которые могут быть использованы в качестве исходных веществ для получения соединений формулы I, могут быть получены, как описано на следующих схемах. Схема 15 Кетоны 8 могут быть легко конвертированы в амины 2 а (R3 = Н) посредством восстановительного аминирования с аммиаком или гидроксиламином или другим подходящим предшественником амина (см. схему 15). Получение амина 2b (R3 = Me) начинается с добавления метил-реагента Гриньяра к кетону 10 а. Получившийся третичный спирт используют в реакции Риттера с ацетонитрилом при сильнокислых условиях. Омыление амида и замена защитной группы на группу гетарила I, как описано ранее на схеме 14, приводит к амину 2b. Схема 16 Амины 2 с, в которых гетероарил I представляет собой 3-метил[1,2,4]тиадиазол (см. схему 15), могут, например, быть получены катализируемым палладием связыванием 5-хлор-3-метил[1,2,4]тиадиазола с пиперидин-4-ил-карбаминовой кислоты трет-бутилового эфира и последующим отщеплением защитной Вос-группы в присутствии кислоты. Альтернативно, амины 2 с могут быть получены из Восзащищенных аминопиперидинов реакцией с источником изотиоцианата, таким как бензоилизотиоцианат,изотиоцианат металла, тиофосген или активированное производное тиомочевины с получением соответствующих производных тиомочевины. Конденсация (1,1-диметоксиэтил)диметиламином и последующая циклизация с гидроксиламин-О-сульфоновой кислотой в присутствии основания, такого как пиридин,приводит после депротекции к аминам 2 с. Схема 17 Соединения общей формулы Ia, где R1 представляет собой галоген, такой как Cl, могут быть конвертированы в соединения общей формулы Ib, где R1 представляет собой алкокси, такой как ОМе, OEt обработкой подходящей солью натрия (NaOMe или NaOEt) в подходящем спиртовом растворителе, таком как метанол или этанол соответственно (см. схему 17). Соединения тестировались в соответствии с экспериментом, данным здесь. Описание анализа -секретазы. Анализ клеточной -секретазы. Клетки Н 4 нейроглиомы человека, сверхэкспрессирующие АРР человека, поместили в количестве 30,000 клеток/лунка/200 мкл на 96-луночные планшеты в среде IMDM, содержащей 10% ФТС, 0.2 мг/л гигромицина В и инкубировали в течение 2 ч при 37 С, 5% СО 2 перед добавлением тестируемых соединений. Соединения для тестирования растворили в 100% Me2SO с получением 10 мМ стокового раствора. Обычно 12 мкл этого раствора затем разводили в 1000 мкл среды IMDM (без ФТС). Последовательные разведения 1:1 дали 10-точечную кривую доза-ответ. 100 мкл каждого разведения добавляли к клеткам в 96-луночные планшеты. В качестве подходящих контролей в данном тестировании использовали только носитель и референсное соединение. Конечная концентрация Me2SO составляла 0.4%. После инкубирования в течение 22 ч при 37 С, 5% СО 2, 50 мкл супернатанта переместили в круглодонные 96-луночные полипропиленовые планшеты для детекции АР 42. 50 мкл буфера для анализа (50 мМ Трис/Cl, рН 7.4, 60 мМ NaCl, 0.5% БСА, 1% TWEEN 20) добавили к лункам с последующим добавлением 100 мкл антитела для детекции (рутенилированное ВАР 15 0.0625 мкг/мл в буфере для анализа). 50 мкл предварительно смешанного антитела захвата (биотинилированное антитело 6 Е 10, 1 мкг/мл) и покрытых стрептавидином магнитных шариков (Dynal M-280, 0.125 мг/мл) инкубировали в течение 1 ч при комнатной температуре перед добавлением на планшеты для анализа. Планшеты для анализа инкубировали на шейкере в течение 3 ч при комнатной температуре и считывали на Bioveris M8 Analyser в соответствии с инструкцией производителя (Bioveris). Токсичность соединений анализировали с помощью теста клеточной жизнеспособности для клеток,обработанных соединениями, посредством калориметрического анализа (CellTiter 96TM AQ анализ,Promega) в соответствии с инструкцией производителя. Вкратце, после удаления 50 мкл супернатанта клеточной культуры для детекции А 42, 20 мкл 1 раствора MTS/PES добавили к клеткам и инкубировали в течение 30 мин при 37 С, 5% СО 2. Затем записывали оптическую плотность при 490 нм. Значения IC50 для ингибирования секреции А 42 подсчитывали с помощью нелинейного регрессионного анализа с оптимизацией, используя программное обеспечение XLfit 4.0 (IDBS). В нижеприведенном списке показаны данные ингибирования секреции А 42 для всех соединений Соединения формулы I и фармацевтически приемлемые соли соединений формулы I могут применяться в качестве лекарственных средств, например, в виде фармацевтических препаратов. Фармацевтические препараты могут быть введены перорально, например, в виде таблеток, таблеток с покрытием,драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Введение может, однако, также быть осуществлено ректально, например, в форме суппозиториев, парентерально, например,в форме растворов для инъекций. Соединения формулы I могут приготавливаться вместе с фармацевтически инертными, неорганическими или органическими носителями для получения фармацевтических препаратов. Лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и т.п. могут быть использованы, например, в качестве таких носителей для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п. В зависимости от природы активного вещества, однако, носители, как правило, не требуются в случае мягких желатиновых капсул. Подходя- 13025035 щими носителями для получения растворов и сиропов являются, например, вода, полиолы, глицерин,растительное масло и т.п. Подходящими носителями для суппозиториев являются, например, природные или гидрогенизированные масла, воски, жиры, полужидкие или жидкие полиолы и т.п. Фармацевтические препараты могут, кроме того, содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать другие терапевтически ценные вещества. Лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также являются объектом настоящего изобретения, также как и способ их получения, который включает приведение одного или более соединений формулы I и/или их фармацевтически приемлемых кислотно-аддитивных солей и, при необходимости, одного или более других терапевтически ценных веществ в галенову форму вместе с одним или более терапевтически инертным носителем. В соответствии с настоящим изобретением соединения формулы I, а также их фармацевтически приемлемые соли являются полезными для лечения или профилактики заболеваний, на основании ингибирования секреции А 42, таких как болезнь Альцгеймера. Дозировка может варьироваться в широких пределах и, конечно, должна быть адаптирована к индивидуальным требованиям в каждом конкретном случае. В случае перорального введения дозировка для взрослых может варьировать от около 0,01 мг до около 1000 мг в день соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Суточную дозу можно вводить в виде однократной дозы или в виде разделенных доз и, кроме того, верхний предел может быть также превышен, когда это необходимо. Приготовление таблеток (влажная грануляция) Способ приготовления. 1. Смешивают ингредиенты 1, 2, 3 и 4 и гранулируют с помощью очищенной воды. 2. Высушивают гранулы при 50 С. 3. Пропускают гранулы через подходящее размольное устройство. 4. Добавляют ингредиент 5 и смешивают в течение 3 мин, прессуют на подходящем прессе. Приготовление капсул. Способ приготовления. 1. Смешивают ингредиенты 1, 2 и 3 в подходящем миксере в течение 30 мин. 2. Добавляют ингредиенты 4 и 5 и перемешивают в течение 3 мин. 3. Наполняют смесью подходящие капсулы.a) 3-(3,4-Дифторфенил)-5-метилпиридин-2-амин. 3-Бромо-5-метилпиридин-2-амин (0.5 г, 2.7 ммоль), 3,4-дифторфенилбороновую кислоту (0.5 г, 3.2 ммоль) и [1,1'-бис-(дифенилфосфино)ферроцен]дихлорпалладий(II)-дихлорметановый комплекс (0.1 г,0.1 ммоль) растворили в смеси диоксана (10 мл) и 1 М водного раствора карбоната натрия (8 мл) в атмосфере аргона и смесь нагревали при 100 С в течение 1 ч. Реакционную смесь разбавили этилацетатом,разделили и органический слой промыли солевым раствором, высушили над сульфатом натрия, отфильтровали и растворитель выпарили при пониженном давлении. Остаток очистили колоночной хроматографией на силикагеле с использованием н-гептана/этилацетата (об./об. 1:1) в качестве элюента. Соединение, указанное в заголовке, получили в виде светло-коричневого кристаллического осадка (0.6 г,количеств.).b) 3-(3,4-Дифторфенил)-2-изотиоцианато-5-метилпиридин. К раствору 3-(3,4-дифторфенил)-5-метилпиридин-2-амина (0.6 г, 2.7 ммоль) в дихлорметане (15 мл) добавили раствор бикарбоната натрия (2.3 г, 26.7 ммоль) в воде (25 мл) с последующим добавлением раствора тиофосгена (0.25 мл, 3.2 ммоль) в дихлорметане (1 мл) и смесь перемешивали в течение 15 мин. Фазы разделили и органическую фазу высушили над сульфатом натрия и растворитель выпарили под вакуумом с получением соединения, указанного в заголовке, в виде кристаллического желтого осадкаc) 1-рац)-3-Экзо-8-бензил-8-азабицикло[3.2.1]октан-3-ил)-3-(3-(3,4-дифторфенил)-5 метилпиридин-2-ил)тиомочевина. К раствору 3-(3,4-дифторфенил)-2-изотиоцианато-5-метилпиридина (0.3 г, 1.1 ммоль) в диметилацетамиде (0.2 мл) добавили (рац)-3-экзо-8-бензил-8-азабицикло[3.2.1]октан-3-амин (0.3 г, 1.1 ммоль) и смесь нагревали при 50 С в течение 15 мин. Реакционную смесь разбавили этилацетатом, промыли водой, солевым раствором, высушили над сульфатом натрия и растворитель частично выпарили при пониженном давлении, что привело к кристаллизации продукта. Соединение, указанное в заголовке, получили в виде серо-белого кристаллического осадка (0.4 г, 75%).(0.06 мл, 1.0 ммоль) и смесь нагревали при 80 С в течение 2 ч. Реакционную смесь выпарили досуха, остаток перерастворили в этилацетате, промыли насыщенным гидрокарбонатом натрия, солевым раствором, высушили над сульфатом натрия, отфильтровали и растворитель выпарили при пониженном давлении. Соединение, указанное в заголовке, получили в виде светло-желтой смолы (0.3 г, 94%).N'-рац)-3-экзо-8-бензил-8-азабицикло[3.2.1]октан-3-ил)-N-(3-(3,4 дифторфенил)-5-метилпиридин-2-ил)карбамимидотиоата (0.05 г, 0.1 ммоль) в ДМФ (0.5 мл) добавили О(триметилсилил)гидроксиламин (0.03 мл, 0.2 ммоль) и смесь нагревали до 150 С в течение 1 ч с последующим нагреванием в течение 1 ч при 200 С в микроволновой печи. Реакционную смесь разбавили этилацетатом, промыли водой, солевым раствором, высушили над сульфатом натрия, отфильтровали и растворитель выпарили при пониженном давлении. Остаток очистили колоночной хроматографией на силикагеле с использованием н-гептана/этилацетата (об./об. 1:1 до 0:1) в качестве элюента. Соединение,- 15025035f) рац)-3-Экзо-8-(2-хлорпиридин-4-ил)-8-азабицикло[3.2.1]октан-3-ил)-8-(3,4-дифторфенил)-6 метил[1,2,4]триазоло[1,5-а]пиридин-2-амин. К раствору рац)-3-экзо-8-бензил-8-азабицикло[3.2.1]октан-3-ил)-8-(3,4-дифторфенил)-6 метил[1,2,4]триазоло[1,5-а]пиридин-2-амина (0.02 г, 0.03 ммоль) в метаноле (1 мл) добавили на конце мерной ложки 10% палладия на угле, и затем каплю 25% водного раствора гидрохлорида и смесь перемешивали в атмосфере водорода (баллон) в течение 3 ч. Реакционную смесь отфильтровали через Hyflo и сконцентрировали досуха. Остаток перерастворили в диметилацетамиде (1 мл), смесь подщелачили добавлением триэтиламина и добавили 2-хлор-4-фторпиридин (0.02 г, 0.15 ммоль). Смесь нагревали при 120 С в течение 3 ч, после чего смесь разбавили этилацетатом, промыли водой, солевым раствором, высушили над сульфатом натрия, отфильтровали и растворитель выпарили при пониженном давлении. Остаток очистили колоночной хроматографией на силикагеле с использованием н-гептана/этилацетатаa) 3-(4-Фенил-4,5,6,7-тетрагидробензотиазол-2-иламино)-(рац)-3-экзо-8-азабицикло[3.2.1]октан-8 карбоновой кислоты трет-бутиловый эфир. К раствору 4-фенил-4,5,6,7-тетрагидробензотиазол-2-иламина (46 мг, 0.2 ммоль) в дихлорэтане (0.6 мл) добавили при комнатной температуре с перемешиванием ВОС-нортропинон (64 мг, 0.28 ммоль) и тетраизопропилортотитанат (178 мкл, 0.6 ммоль). Реакционную смесь перемешивали в течение ночи при 90 С в закрытой пробирке под азотом. При комнатной температуре добавили этанол (0.6 мл) и борогидрид натрия (15 мг, 0.4 ммоль) и реакционную смесь перемешивали при 85 С в течение 4 ч и 30 мин. Добавили воду, реакционную смесь перемешивали в течение 30 мин и преципитат отфильтровали и промыли этанолом. Фильтрат сконцентрировали при пониженном давлении. Добавили воду и реакционную смесь экстрагировали дважды этилацетатом. Объединенные органические слои промыли концентрированным водным раствором хлорида натрия, высушили над сульфатом натрия, отфильтровали и сконцентрировали при пониженном давлении. Остаток очистили колоночной хроматографией на силикагеле с использованием градиента от CH2Cl2 до CH2Cl2/MeOH 19:1 (об./об.) в качестве элюента с получением соединения, указанного в заголовке, в виде светло-коричневого осадка (73 мг, 83%).b) рац)-3-Экзо-8-азабицикло[3.2.1]окт-3-ил)-(4-фенил-4,5,6,7-тетрагидробензотиазол-2-ил)амина гидрохлорид. К раствору 3-(4-фенил-4,5,6,7-тетрагидробензотиазол-2-иламино)-(рац)-3-экзо-8 азабицикло[3.2.1]октан-8-карбоновой кислоты трет-бутилового эфира (93 мг, 0.21 ммоль) в метиленхлориде (5 мл) добавили 2 М раствор гидрохлорида в диэтиловом эфире (1.1 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удалили при пониженном давлении,остаток обработали диэтиловым эфиром и выпарили. Соединение, указанное в заголовке, получили в виде светло-коричневого осадка (76 мг, 96%).[(рац)-3-Экзо-8-(3-метил[1,2,4]тиадиазол-5-ил)-8-азабицикло[3.2.1]окт-3-ил]-(4-фенил-4,5,6,7 тетрагидробензотиазол-2-ил)амин. Ацетат палладия (II) (3.3 мг, 0.015 ммоль) и 2-(дициклогексилфосфино)бифенил (11 мг, 0.03 ммоль) перемешивали под азотом при комнатной температуре в диоксане (1.7 мл) в течение 10 мин. Третбутилат натрия (27 мг, 0.28 ммоль), рац)-3-экзо-8-азабицикло[3.2.1]окт-3-ил)-(4-фенил-4,5,6,7 тетрагидробензотиазол-2-ил)амина гидрохлорид (70 мг, 0.19 ммоль), N,N-диизопропилэтиламин (63 мкл,0.37 ммоль) и 5-хлор-3-метил[1,2,4]тиадиазол (28 мг; 0.21 ммоль) добавили и реакционную смесь нагре- 16025035 вали при 200 С в течение 30 мин в микроволновой печи. Реакционную смесь разбавили водой и экстрагировали дважды этилацетатом. Объединенные органические слои промыли водой, высушили над сульфатом натрия, отфильтровали и сконцентрировали при пониженном давлении. Остаток очистили колоночной хроматографией на силикагеле с использованием градиента от CH2Cl2 до CH2Cl2/MeOH 19:1 а) (рац)-3-[(Z)-Гидроксиимино]-8-азабицикло[3.2.1]октан-8-карбоновой кислоты трет-бутиловый эфир. К раствору Вос-нортропинона (1.13 г, 5 ммоль) в этаноле (5 мл) добавили с перемешиванием гидроксиламина гидрохлорид (0.695 г, 10 ммоль) в воде (5 мл). Бикарбонат натрия (0.84 г, 10 ммоль) добавили по порциям и реакционную смесь кипятили с обратным холодильником в течение 45 мин под азотом и перемешивали при комнатной температуре в течение ночи. Растворитель выпарили при пониженном давлении. Добавили воду и реакционную смесь экстрагировали дважды этилацетатом. Объединенные органические слои высушили над сульфатом натрия, отфильтровали и растворитель выпарили при пониженном давлении с получением соединения, указанного в заголовке, в виде коричневого масла (1.28 г,100%).(рац)-3-[(Z)-гидроксиимино]-8-азабицикло[3.2.1]октан-8-карбоновой кислоты третбутилового эфира (635 мг, 2.64 ммоль) в этаноле (4 мл) и уксусной кислоте (1 мл) гидрогенизировали в атмосфере водорода в течение ночи при комнатной температуре в присутствии PtO2 (42 мг, 6.6 мае.%). Другую порцию PtO2 (42 мг) добавили и реакционную смесь дополнительно гидрогенизировали в течение ночи. Катализатор отфильтровали, промыли этанолом. Фильтрат сконцентрировали при пониженном давлении и остаток очистили колоночной хроматографией на силикагеле с использованиемCH2Cl2/MeOH/NH3 19:1:0.1 (об./об./об.) в качестве элюента с получением соединения, указанного в заголовке, в виде желтого осадка (622 мг, 100%).(рац)-(3-эндо)-3-[4-(4-Хлорбензил)-6-(1-гидрокси-1-метилэтил)пиримидин-2-иламино]-8 азабицикло[3.2.1]октан-8-карбоновой кислоты трет-бутиловый эфир. Раствор (рац)-3-эндо-3-амино-8-азабицикло[3.2.1]октан-8-карбоновой кислоты трет-бутилового эфира (189 мг, 0.837 ммоль), 2-[2-хлор-6-(4-хлорбензил)пиримидин-4-ил]пропан-2-ол (342 мг, 0.92 ммоль) и N,N-диизопропилэтиламин (214 мкл, 1.26 ммоль) в диоксане (2 мл) нагревали при 150 С в микроволновой печи в течение 1 ч. Реакционную смесь разбавили водой и экстрагировали дважды этилацетатом. Объединенные органические слои промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия, отфильтровали и сконцентрировали при пониженном давлении. Остаток очистили колоночной хроматографией на силикагеле с использованием градиента от CH2Cl2 доCH2Cl2:MeOH 19:1 (об./об.) в качестве элюента. Соединение, указанное в заголовке, получили в виде желтого масла (86 мг, 21%).d) 2-[2-[(рац)-(3-Эндо)-(8-азабицикло[3.2.1]окт-3-ил)амино]-6-(4-хлорбензил)пиримидин-4-пропан 2-ола гидрохлорид. К раствору (рац)-3-эндо-3-[4-(4-хлорбензил)-6-(1-гидрокси-1-метилэтил)пиримидин-2-иламино]-8 азабицикло[3.2.1]октан-8-карбоновой кислоты трет-бутилового эфира (86 мг, 0.177 ммоль) в метиленхлориде (2 мл) добавили при комнатной температуре с перемешиванием 2 М раствор гидрохлорида в диэтиловом эфире (0.9 мл) и перемешивали при комнатной температуре в течение ночи. Растворитель удалили при пониженном давлении и добавили трифторуксусную кислоту (2 мл). Растворитель удалили при пониженном давлении с получением соединения, указанного в заголовке, в виде коричневой смолы иламино]пиримидин-4-ил)пропан-2-ол. Ацетат палладия(II) (3.8 мг, 0.017 ммоль) и 2-(дициклогексилфосфино)бифенил (12 мг, 0.034 ммоль) перемешивали под азотом при комнатной температуре в диоксане (1 мл) в течение 10 мин. третБутилат натрия (32 мг, 0.32 ммоль), 2-[2-[(рац)-3-эндо-(8-азабицикло[3.2.1]окт-3-ил)амино]-6-(4 хлорбензил)пиримидин-4-ил]пропан-2-ола гидрохлорид (90 мг, 0.213 ммоль), N,N-диизопропилэтиламин(72.3 мкл, 0.425 ммоль) в диоксане (2 мл) и 5-хлор-3-метил[1,2,4]-тиадиазол (32 мг; 0.234 ммоль) добавили и реакционную смесь нагревали при 150 С в течение 1 ч в микроволновой печи. Реакционную смесь разбавили водой и экстрагировали дважды этилацетатом. Объединенные органические слои were промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия, отфильтровали и сконцентрировали при пониженном давлении. Остаток очистили колоночной хроматографией на силикагеле с использованием градиента от CH2Cl2 до CH2Cl2:MeOH 19:1 (об./об.) в качестве элюента. Соединение, указанное в заголовке, получили в виде светло-коричневой смолы (55 мг, 48%).(рац)-3-Бензил-3-азабицикло[3.2.1]октан-8-она оксим (1.2 г, 5.1 ммоль, WO 2005/21536 А 2) растворили в метаноле (20 мл), добавили большую ложку никеля Ренея и смесь перемешивали в атмосфере водорода в течение 1 ч, после чего е отфильтровали через Hyflo и сконцентрировали. Остаток очистили колоночной хроматографией на силикагеле с использованием градиента CH2Cl2:MeOH (об./об. 9:1-7:3) в качестве элюента. Соединение, указанное в заголовке, получили в виде воскообразного осадка (0.3 г,26%), также как и вышедший раньше экзоизомер (0.4 г, 36%).b) N-(3-Бромо-пиридин-2-ил)-N'-этоксикарбонил-тиомочевина. 3-Бромпиридин-2-амин (30 г, 168 ммоль) и этоксикарбонилизотиоцианат (24.8 г, 21.3 мл, 185 ммоль) растворили в диоксане (300 мл) и перемешивали при комнатной температуре. Через 4 ч добавили дополнительное количество этоксикарбонилизотиоцианата (1 мл, 8.4 ммоль) добавили. Через 1 час растворитель выпарили и остаток высушили под глубоким вакуумом в течение 12 ч. Соединение, указанное в заголовке, получили в виде светло-желтого осадка (51.2 г, 100%) и использовали неочищенным на следующей стадии.c) 8-Бромо-[1,2,4]триазоло[1,5-а]пиридин-2-амин. Гидроксиламин (58.5 г, 842 ммоль) и N,N-диизопропилэтиламин (65.3 г, 86.3 мл, 505 ммоль) растворили в метаноле (200 мл) и этаноле (200 мл). N-(3-бромопиридин-2-ил)-N'-этоксикарбонилтиомочевину (51.2 г, 168 ммоль) добавили и реакционную смесь перемешивали при комнатной температуре в течение 1 ч и затем при 60 С в течение 3 ч. Белый преципитат отфильтровали и тритурировали водой в течение 25 мин, отфильтровали и тритурировали два раза диэтиловым эфиром. Осадок высушили совместной эвапорацией с толуолом и высушили под вакуумом. Соединение, указанное в заголовке,получили в виде белого осадка (27.9 г, 78%).(5.33 г,25 ммоль),3,4 дифторфенилбороновую кислоту (5.92 г, 37.5 ммоль) и 2 М водный раствор карбоната натрия (62.5 мл,125 ммоль) в 1,4-диоксане (250 мл) обработали 1,1'-бис-(дифенилфосфино)ферроцен-палладий(II)дихлорид дихлорметановым комплексом (1.02 г, 1.25 ммоль) при комнатной температуре и затем перемешивали в течение 18 ч при 110 С. Реакционную смесь охладили до комнатной температуры и разделили между водой (312 мл) и этилацетатом (500 мл). Водный слой экстрагировали дополнительным ко- 18025035 личеством этилацетата (500 мл). Органические слои промыли насыщенным водным раствором хлорида натрия (300 мл), объединили, высушили над сульфатом натрия, отфильтровали и выпарили. Коричневый осадок тритурировали диэтиловым эфиром (130 мл) и дихлорметаном (25 мл) с получением соединения,указанного в заголовке, в виде светло-коричневого осадка (6.33 г, 97%).e) 2-Бромо-8-(3,4-дифторфенил)-[1,2,4]триазоло[1,5-а]пиридин. К раствору бромида меди (II) (5.86 г, 26.3 ммоль) и трет-бутилнитрит (3.01 г, 3.48 мл, 26.3 ммоль) в ацетонитриле (93 мл) добавили 8-(3,4-дифторфенил)-[1,2,4]триазоло[1,5-а]пиридин-2-амин (4.30 г, 17.5 ммоль) по порциям при 60 С. Реакционную смесь перемешивали в течение 2 ч при 75 С, охладили до комнатной температуры и погасили 1 М водным раствором гидрохлорида (186 мл). Смесь экстрагировали дихлорметаном (186 мл) три раза. Органические слои объединили, высушили над сульфатом натрия,отфильтровали и выпарили. Флэш-хроматография на силикагеле (120 г) с дихлорметаном дала соединение, указанное в заголовке, в виде светло-желтого осадка (4.30 г, 79%).N-рац)-8-Эндо-3-бензил-3-азабицикло[3.2.1]октан-8-ил)-8-(3,4-дифторфенил)[1,2,4]триазоло[1,5-а]пиридин-2-амин. Раствор 2-бромо-8-(3,4-дифторфенил)-[1,2,4]триазоло[1,5-а]пиридина (85 мг, 0.27 ммоль), (рац)-8 эндо-3-бензил-3-азабицикло[3.2.1]октан-8-амина (50 мг, 0.23 ммоль) и феноксида натрия (40 мг, 0.35 ммоль) в безводном 1,4-диоксане (1 мл) в закрытой пробирке продули аргоном в течение 10 мин.Pd2(dba)3CHCl3 (19 мг, 0.02 ммоль) и ксантфос (21 мг, 0.04 ммоль) добавили к раствору и дегазирование продолжили в течение дополнительных 5 мин перед тем как реакционную смесь нагревали при 130 С в течение 0,5 ч. Реакционную смесь разбавили дихлорметаном, промыли 1 М водным раствором карбоната натрия, органическую фазу высушили над сульфатом натрия, растворитель выпарили, остаток очистили колоночной хроматографией на силикагеле с использованием н-гептана/этилацетата (об./об. 8:2 до 1:1) в качестве элюента. Соединение, указанное в заголовке, получили в виде светло-желтого осадка (88 мг,85%).N-рац)-8-эндо-3-бензил-3-азабицикло[3.2.1]октан-8-ил)-8-(3,4-дифторфенил)[1,2,4]триазоло[1,5-а]пиридин-2-амину (0.09 г, 0.2 ммоль) в метаноле (5 мл) добавили большую ложку 10% палладия на угле, с последующим добавлением нескольких капель 25% водной соляной кислоты и смесь перемешивали в атмосфере водорода в течение 2 дней. Затем реакционную смесь отфильтровали через Hyflo и сконцентрировали досуха. Остаток перерастворили в диметилацетамиде (1 мл), добавили триэтиламин, доведя рН до основного, с последующим добавлением 4-йодо-2-(трифторметил)пиридина(0.05 г, 0.2 ммоль) и смесь нагревали при 135 С в течение 16 ч. Реакционную смесь затем разбавили этилацетатом, промыли повторно водой, затем солевым раствором, высушили над сульфатом натрия и сконцентрировали. Остаток очистили колоночной хроматографией на силикагеле с использованием нгептана/этилацетата (об./об. 1:1) в качестве элюента. Соединение, указанное в заголовке, получили в виде светло-желтого осадка (8.4 мг, 9%).a) 2-Бромо-8-(2,3,4-трифторфенил)-[1,2,4]триазоло[1,5-а]пиридин. Соединение, указанное в заголовке, белый осадок, получили по аналогии с примером 4 стадии от d до е из 8-бромо[1,2,4]триазоло[1,5-а]пиридин-2-амин и 2,3,4-трифторфенилбороновой кислоты.N-рац)-8-Эндо-3-бензил-3-азабицикло[3.2.1]октан-8-ил)-8-(2,3,4-трифторфенил)[1,2,4]триазоло[1,5-а]пиридин-2-амин. Соединение, указанное в заголовке, светло-коричневая пена, получили по аналогии с примером 4f изc) [(рац)-8-Эндо-3-(6-метилпиримидин-4-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-(2,3,4-трифторфенил)[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин. Соединение, указанное в заголовке, светло-коричневая пена, получили по аналогии с примером 4g из N-рац)-8-эндо-3-бензил-3-азабицикло[3.2.1]октан-8-ил)-8-(2,3,4-трифторфенил)-[1,2,4]триазоло[1,5 а]пиридин-2-амина и 4-хлор-6-метил пиримидина.a) [(рац)-8-Эндобензил-3-азабицикло[3.2.1]окт-8-ил]карбаминовой кислоты трет-бутиловый эфир. К раствору (рац)-8-эндо-3-бензил-3-азабицикло[3.2.1]октан-8-амина (3.9 г, 17.9 ммоль) в дихлорметане (40 мл) добавили Вос-ангидрид (6.19 мл, 26.9 ммоль), и реакционную смесь перемешивали при 25 С в течение 2 ч. Удаление растворителя при пониженном давлении с последующей очисткой получившегося сырого материала колоночной хроматографией через нормальный силикагель (0-10% EtOAc/гексан) дало соединение, указанное в заголовке, в виде белого осадка (4.5 г, 79%). 1 Н NMR (DMSO-d6, 400 MHz):(ppm) = 7.33-7.27 (m, 4 Н), 7.23-7.21 (m, 1H), 6.60 (br s, 1H, NH),3.44 (s, 2H), 3.25 (m, 1H), 2.58 (dm, 2H), 2.07 (br d, 2H), 2.03 (br s, 1H), 1.70 (br m, 2H), 1.55 (br m, 2H), 1.37b) [(рац)-8-Эндо-3-азабицикло[3.2.1]окт-8-ил]карбаминовой кислоты трет-бутиловый эфир. К раствору [(рац)-8-эндобензил-3-азабицикло[3.2.1]окт-8-ил]карбаминовой кислоты третбутилового эфира (4.5 г, 14.2 ммоль) в метаноле (60 мл) добавили Pd/C (10%; 750 мг), и реакционную смесь перемешивали в атмосфере водорода при 25 С в течение 3 ч. Реакционную смесь отфильтровали через слой целита, и фильтрат выпарили под вакуумом с получением соединения, указанного в заголовке, в виде белого осадка (3.1 г, 96%).c) [(рац)-8-Эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]карбаминовой кислоты трет-бутиловый эфир. К раствору [(рац)-8-эндо-3-азабицикло[3.2.1]окт-8-ил]карбаминовой кислоты трет-бутилового эфира (3.5 г, 15.4 ммоль) в этаноле (40 мл) в закрытой пробирке добавили 5-хлор-3-метил[1,2,4]тиадиазол(1.73 мл, 18.5 ммоль) и триэтиламин (3.26 мл, 23.2 ммоль). Реакционную смесь перемешивали при 100 С в течение 12 ч. Растворитель удалили под вакуумом. Получившийся неочищенный материал очистили колоночной хроматографией через нормальный силикагель (0-15% EtOAc/гексан) с получением соединения, указанного в заголовке, в виде белого осадка (3.9 г, 91%).[(рац)-8-эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8 ил]карбаминовой кислоты трет-бутилового эфира (700 мг, 2.16 ммоль) в дихлорметане (15 мл) добавили трифторуксусную кислоту (2.5 мл) и реакционную смесь перемешивали при 25 С в течение 2 ч. Летучие компоненты удалили под вакуумом. Получившийся остаток нейтрализовали насыщенным раствором водного бикарбоната натрия и экстрагировали дихлорметаном (230 мл). Объединенный органический слой высушили над безводным сульфатом натрия, отфильтровали, и растворитель выпарили под вакуумом с получением соединения, указанного в заголовке, в виде белого осадка (480 мг, 96%).(15.3 мг, 0.132 ммоль). Смесь продули аргоном в течение 10 мин. К этой смеси затем добавилиPd2(dba)3CHCl3 (7.3 мг, 0.007 ммоль) и ксантфос (8.16 мг,0.014 ммоль). Реакционную смесь продули ещ раз аргоном в течение 10 мин. Реакционную смесь нагревали при 130 С в течение 0,5 ч в микроволновой печи. Е разбавили EtOAc (10 мл) и промыли водой (5 мл). Органический слой высушили над безводным сульфатом натрия, отфильтровали, и растворитель выпарили под вакуумом. Получившийся неочищенный материал очистили с помощью препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде серо-белого осадка (8.8 мг, 21%).a) 2-Бромо-8-(2-хлор-4-фторфенил)-6-фтор-[1,2,4]триазоло[1,5-а]пиридин. К раствору бромида меди (II) (60 мг, 0.268 ммоль) и трет-бутилнитрита (27.8 мг, 0.268 ммоль) в ацетонитриле (2 мл) при 60 С добавили 8-(2-хлор-4-фторфенил)-6-фтор-[1,2,4]триазоло[1,5-а]пиридин-2-иламин (CAS 1319068-45-5; WO 2011092272) (50 мг, 0.179 ммоль) одной порцией, и реакционную смесь перемешивали в течение 2 ч при 75 С. Реакционную смесь охладили до 25 С, и погасили водным раствором HCl (1 M, 5 мл). Реакционную смесь разбавили водой (5 мл), и экстрагировали EtOAc (210 мл). Объединенный органический слой высушили над безводным сульфатом натрия, отфильтровали, и выпарили при пониженном давлении с получением соединения, указанного в заголовке, (55 мг, неочищенное) в виде коричневого осадка который использовали на следующей стадии без какой-либо дополнительной очистки.[(рац)-8-Эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-(2-хлор-4 фторфенил)-6-фтор-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин. Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (48.8 мг, 0.021 ммоль) и 2-бромо-8-(2 хлор-4-фторфенил)-6-фтор-[1,2,4]триазоло[1,5-а]пиридина (CAS 1319068-45-5; WO 2011092272) (50 мг,0.14 ммоль) в виде белого осадка (11.3 мг, 16%).a) 2-Бромо-8-(4-фтор-2-метоксифенил)-[1,2,4]триазоло[1,5-а]пиридин. Соединение, указанное в заголовке, белый осадок, получили по аналогии с примером 4 стадии от d до е из 8-бромо[1,2,4]триазоло[1,5-а]пиридин-2-амина и 4-фтор-2-метоксифенилбороновой кислоты.[(рац)-8-Эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-(4-хлор-2 метокси-фенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин. Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (52.1 мг, 0.23 ммоль) и 2-бромо-8-(4 фтор-2-метокси-фенил)-[1,2,4]триазоло[1,5-а]пиридина (50 мг, 0.14 ммоль) в виде серо-белого осадкаa) 5-(2-Бромо-[1,2,4]триазоло[1,5-а]пиридин-8-ил)-2-фторбензонитрил. Соединение, указанное в заголовке, белый осадок, получили по аналогии с примером 4 стадии от d до е из 8-бромо[1,2,4]триазоло[1,5-а]пиридин-2-амина и 4-фтор-3-цианофенилбороновой кислоты.[(рац)-8-Эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-(3-ииано-4 фторфенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин. Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (39.2 мг, 0.17 ммоль) и 5-(2 бромо[1,2,4]триазоло[1,5-а]пиридин-8-ил)-2-фтор-бензонитрила(37 мг, 0.11 ммоль) в виде серо-белого осадка (14.6 мг, 27%).a) 2-Бромо-8-(3,4-дифторфенил)-6-трифторметил[1,2,4]триазоло[1,5-а]пиридин. Соединение, указанное в заголовке, коричневый осадок, (57 мг, неочищенное), получили по аналогии с примером 7 а из 8-(3,4-дифторфенил)-6-трифторметил[1,2,4]триазоло[1,5-а]пиридин-2-иламина[(рац)-8-Эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-(3,4 дифторфенил)-6-трифторметил[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин. Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (44.4 мг, 0.19 ммоль) и 2-бромо-8-(3,4 дифторфенил)-6-трифторо[1,2,4]триазоло[1,5-а]пиридина (CAS 1319068-34-2, WO 2011092272) (50 мг,0.13 ммоль) в виде серо-белого осадка (22.0 мг, 14%). Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (51.5 мг, 0.23 ммоль) и 2-бромо-8 метоксил-[1,2,4]триазоло[1,5-а]пиридина (CAS 1319067-40-7; WO 2011092272) (35 мг, 0.15 ммоль) в виде белого осадка (15.3 мг, 27%).a) 2-Бромо-8-хлор-6-трифторметил[1,2,4]триазоло[1,5-а]пиридин. Соединение, указанное в заголовке, коричневый осадок, (60 мг, неочищенное), получили по аналогии с примером 7 а из 8-хлор-6-трифторметил[1,2,4]триазоло[1,5-а]пиридин-2-ил-амина (CAS 120664061-0; WO 2011092272) (50 мг, 0.212 ммоль).[(рац)-8-Эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-хлор-6 трифторметил[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин. Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (56.0 мг, 0.25 ммоль) и 2-бромо-8-хлор-6 трифторметил[1,2,4]триазоло[1,5-а]пиридина (CAS 1206640-61-0; WO 2011092272) (50 мг, 0.167 ммоль) в виде серо-белого осадка (8.7 мг, 12%).a) 2-Бромо-5,6-диметил[1,2,4]триазоло[1,5-а]пиридин. Соединение, указанное в заголовке, коричневый осадок, (50 мг, неочищенное), получили по аналогии с примером 7 а из 5,6-диметил[1,2,4]триазоло[1,5-а]пиридин-2-ил-амина (CAS 1319067-94-1; WO 2011092272) (40 мг, 0.24 ммоль).[(рац)-8-Эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[5,6 диметил[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин. Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (74.3 мг, 0.33 ммоль) и 2-бромо-5,6 диметил[1,2,4]триазоло[1,5-а]пиридина (CAS 1319067-94-1; WO 2011092272) (50 мг, 0.22 ммоль) в виде белого осадка (11.9 мг, 15%).a) 8-Бензилокси-2-бромо[1,2,4]триазоло[1,5-а]пиридин. Соединение, указанное в заголовке, коричневый осадок (50 мг, неочищенное), получили по аналогии с примером 7 а из 8-бензилокси[1,2,4]триазоло[1,5-а]пиридин-2-ил-амина (CAS 1319067-83-8; WO 2011092272) (40 мг, 0.167 ммоль).[(рац)-8-Эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8 бензилокси[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин. Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (55.2 мг, 0.24 ммоль) и 8-бензилокси-2 бромо[1,2,4]триазоло[1,5-а]пиридина (CAS 1319067-83-8; WO 2011092272) (50 мг, 0.16 ммоль) в виде белого осадка (15.9 мг, 22%).a) 2-Бромо-5-пропил[1,2,4]триазоло[1,5-а]пиридин. Соединение, указанное в заголовке, белый осадок (53 мг, неочищенное), получили по аналогии с примером 7 а из 5-пропил[1,2,4]триазоло[1,5-а]пиридин-2-ил-амина (CAS 1319067-63-4; WO 2011092272)[(рац)-8-Эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[5 пропил[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин. Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (70 мг, 0.31 ммоль) и 2-бромо-5 пропил[1,2,4]триазоло[1,5-а]пиридина (CAS 1319067-63-4; WO 2011092272) (50 мг, 0.20 ммоль) в виде серо-белого осадка (11.2 мг, 14%).a) 2-Амино-5-фенил-[1,2,4]триазоло[1,5-а]пиразин. К раствору 6-(4-фторфенил)пиразин-2-амина (1.484 г, 7.84 ммоль), растворенному в безводном диоксане (60 мл) добавили этоксикарбонил изотиоцианат (1.02 мл, 8.63 ммоль) с получением желтой суспензии. Реакционную смесь перемешивали при комнатной температуре в течение 2 дней, при этом цвет изменялся от желтого до красного и в итоге получилась светло-коричневая суспензия. Реакционную смесь выпарили досуха при пониженном давлении. Неочищенный продукт сразу использовали на следующей стадии (2.92 г, неочищенное).MS ISP (m/e): 321.1 (100) [(М+Н)+]. Неочищенный продукт добавили к суспензии гидроксиламина гидрохлорида (2.72 г, 39.2 ммоль) иN,N-диизопропилэтламина (4.03 мл, 23.5 ммоль), суспендированного в метаноле (20 мл) и этаноле (20 мл). После перемешивания в течение 1 ч при комнатной температуре, реакционную смесь перемешивали при 60 С в течение 3 ч. Реакционную смесь выпарили досуха при пониженном давлении и остаток разделили между насыщенным водным гидрокарбонатом натрия и метиленхлоридом. Органический слой высушили над сульфатом натрия, отфильтровали и растворители выпарили при пониженном давлении. Неочищенный материал очистили дважды флэш-хроматографией (силикагель, 100 г, от 0 до 15% МеОН/NH4OH в дихлорметане) с получением соединения, указанного в заголовке, в виде серо-белого осадка (985 мг, 55%).b) 2-Бромо-5-фенил-(1,2,4)триазоло(1,5-а)пиразин. Соединение, указанное в заголовке, получили по аналогии с примером 7 а из 2-амино-5-фенил[1,2,4]триазоло[1,5-а]пиразина (145.9 мг, 0.69 ммоль) в виде светло-желтого кристаллического осадка[(рац)-8-Эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-(5-фенил[1,2,4]триазоло[1,5-а]пиразин-2-ил)амин. Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (42.6 мг, 0.19 ммоль) и 2-бром-5-фенил(1,2,4)триазоло(1,5-а)пиразина (35 мг, 0.08 ммоль) в виде белого осадка (10.9 мг, 20%).a) 2-Бромо-5-трифторметил[1,2,4]триазоло[1,5-а]пиридин. Соединение, указанное в заголовке, коричневый осадок, (60 мг, неочищенное), получили по аналогии с примером 7 а из 5-трифторметил[1,2,4]триазоло[1,5-а]пиридин-2-ил-амина (CAS 1319067-64-5;[(рац)-8-Эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[5 трифторметил[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин. Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (63 мг, 0.28 ммоль) и 2-бромо-(5 трифторметил[1,2,4]триазоло[1,5-а]пиридин-2-ил)амина (CAS 1319067-64-5; WO 2011092272) (50 мг,0.188 ммоль) в виде серо-белого осадка (13.2 мг, 17%). Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (48.8 мг, 0.218 ммоль) и 2-бромо-6-хлор 8-(3,4-дифторфенил)-[1,2,4]триазоло[1,5-а]пиридина (CAS 1329673-51-9; US 20110201605) (50 мг, 0.145 ммоль) в виде серо-белого осадка (10.2 мг, 14%). Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (65.8 мг, 0.29 ммоль) и 2-бромо-7-метил- 25025035-78 С под азотом и перемешивании раствор 1.6 М н-бутиллития в гексане (7.88 мл, 12.6 ммоль). Реакция является экзотермичной и она стала светло-желтой. Реакционную смесь перемешивали в течение 15 мин при -78 С и затем в течение 2 ч при 0 С. Реакционную смесь охладили до -78 С и по каплям добавили 4,4-диметилциклогексанон (937 мг, 7.2 ммоль), растворенный в тетрагидрофуране (5 мл). Реакционную смесь нагрели до комнатной температуры в течение ночи. Реакционную смесь погасили насыщенным водным раствором хлорида аммония и экстрагировали дважды этилацетатом. Объединенные органические слои промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия,отфильтровали и растворитель выпарили при пониженном давлении. Остаток очистили колоночной хроматографией на силикагеле с использованием этилацетата в качестве элюента с получением соединения,указанного в заголовке, в виде белого порошка (1.034 г, 57%).b) 3-(4,4-Диметилциклогекс-1-енил)пиридин-2-иламин. К раствору N-(3-(1-гидрокси-4,4-диметилциклогексил)пиридин-2-ил)пиваламида (1.034 г, 3.34 ммоль) в этаноле (51 мл) добавили 2 М водный раствор гидроксида натрия (16.98 ммоль, 8.5 мл). Реакционную смесь нагревали в течение ночи при 100 С. Растворитель выпарили при пониженном давлении и остаток разделили между этилацетатом и водой. Водный слой экстрагировали дважды этилацетатом и органические слои объединили, высушили над сульфатом натрия, отфильтровали и растворитель удалили при пониженном давлении с получением соединения, указанного в заголовке, в виде белого осадкаc) N-[3-(4,4-Диметилциклогекс-1-енил)пиридин-2-ил]-N'-карбоэтокситиомочевина. К раствору 3-(4,4-диметилциклогекс-1-енил)пиридин-2-иламина (704 мг, 3.48 ммоль) в диоксане (21 мл) добавили при комнатной температуре этоксикарбонилизотиоцианат (433 мл, 3.48 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и растворитель удалили, получив неочищенный продукт в виде желтого масла (1.42 г, количеств).d) 8-(4,4-Диметилциклогекс-1-енил)-[1,2,4]триазоло[1,5-а]пиридин-2-иламин. К раствору N-[3-(4,4-диметилциклогекс-1-енил)пиридин-2-ил]-N'-карбоэтокситиомочевины (1.42 г,3.48 ммоль) в этаноле (4.3 мл) добавили при комнатной температуре гидроксиламина гидрохлорид (1.50 г, 21.4 ммоль) и метанол (4.3 мл). Желтую суспензию нагревали при 70 С в течение ночи. Растворитель выпарили при пониженном давлении и остаток разделили между этилацетатом и водой. Водный слой экстрагировали дважды этилацетатом и органические слои объединили, промыли насыщенным водным раствором хлорида натрия, высушили над сульфатом натрия, отфильтровали и растворитель удалили при пониженном давлении. Неочищенный материал очистили колоночной хроматографией на силикагеле сначала этилацетатом в качестве элюента и затем ещ раз смесью гептан/этилацетат (1:1 об./об.) в качестве элюента с получением соединения, указанного в заголовке, в виде желтого осадка (526 мг, 51%).e) 8-(4,4-Диметилциклогексил)-[1,2,4]триазоло[1,5-а]пиридин-2-иламин. К раствору 8-(4,4-диметилциклогекс-1-енил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил-амина (30 мг,0.124 ммоль) в метаноле (4 мл) добавили 10% Pd/C (30 мг), и реакционную смесь оставили перемешиваться в атмосфере водорода при 25 С в течение 2 ч. Реакционную смесь отфильтровали через слой целита и фильтрат выпарили под вакуумом с получением соединения, указанного в заголовке, (30 мг, 99%) в виде белого осадка, который использовали на следующей стадии без дополнительной очистки.f) 2-Бромо-8-(4,4-диметилциклогексил)-[1,2,4]триазоло[1,5-c]пиридин. Соединение, указанное в заголовке, белый осадок, (43 мг, неочищенное), получили по аналогии с примером 7 а из 8-(4,4-диметилциклогексил)-[1,2,4]триазоло[1,5-а]пиридин-2-иламина (36 мг, 0.14 ммоль). MS ISP (m/e): 308.2/310.2 (98/100) [(М+Н)+].[(рац)-8-Эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-(4,4 диметилциклогексил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин. Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (46.9 мг, 0.209 ммоль) и 2-бромо-8-(4,4 диметилциклогексил)-(1,2,4)триазоло(1,5-а)пиридина (43 мг, 0.14 ммоль) в виде белого осадка (12.3 мг,19%).a) 2-Бромо-7-фуран-2-ил[1,2,4]триазоло[1,5-а]пиримидин. Соединение, указанное в заголовке, коричневый осадок, (50 мг, неочищенное), получили по аналогии с примером 7 а из 7-фуран-2-ил-[1,2,4]триазоло[1,5-а]пиримидин-2-ил-амина (CAS 338793-16-1;[(рац)-8-Эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-(7-фуран-2-ил[1,2,4]триазоло[1,5-а]пиримидин-2-ил)амин. Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (46.9 мг, 0.209 ммоль) и 2-бромо-7-фуран 2-ил-[1,2,4]триазоло[1,5-а]пиримидина в виде белого осадка (15.6 мг, 27%).a) 2-Бромо-7-трифторметил[1,2,4]триазоло[1,5-а]пиридин. Соединение, указанное в заголовке, коричневый осадок, (39 мг, неочищенное), получили по аналогии с примером 7 а из 7-трифторметил[1,2,4]триазоло[1,5-а]пиридин-2-ил-амина (CAS 1260811-97-9; WO 2011092272) (30 мг, 0.14 ммоль).[(рац)-8-Эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[7 трифторметил[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин. Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (49.2 мг, 0.22 ммоль) и 2-бромо-7 трифторметил[1,2,4]триазоло[1,5-а]пиридина (полученный амин CAS 1260811-97-9; WO 2011092272) (39 мг, 0.147 ммоль) в виде серо-белого осадка (25.1 мг, 42%).b) 8-(4-Трифторметилциклогексил[1,2,4]триазоло[1,5-а]пиридин-2-ил-амин. К раствору 8-(4-трифторметилциклогексенил)-[1,2,4]триазоло[1,5-а]пиридин-2-иламина (CAS 1329673-42-8, US 20110201605) (30 мг, 0.106 ммоль) в метаноле (5 мл) добавили 10% Pd/C (30 мг), и реакционную смесь оставили перемешиваться при 25 С в течение 2 ч в атмосфере водорода. Реакционную смесь отфильтровали через слой целита и фильтрат выпарили под вакуумом, получив соединение, указанное в заголовке, в виде белого осадка (30 мг, 99%) который использовали на следующей стадии без дополнительной очистки.b) 2-Бромо-8-(4-трифторметил)циклогексил[1,2,4]триазоло[1,5-а]пиридин. Соединение, указанное в заголовке, белый осадок (37 мг, неочищенное) получили по аналогии с примером 7 а из 8-(4-трифторметилциклогексил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил-амина (30 мг, 0.10 ммоль). MS ISP (m/e): 348.0/350.0 (100/85) [(М+Н)+].[(рац)-8-Эндо-3-(3-метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]окт-8-ил]-[8-(4 трифторметилциклогексил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин. Соединение, указанное в заголовке, получили по аналогии с примером 6 е из (рац)-8-эндо-3-(3 метил[1,2,4]тиадиазол-5-ил)-3-азабицикло[3.2.1]октан-8-амина (34.2 мг, 0.15 ммоль) и 2-бромо-8-(4 трифторметилциклогексил)-[1,2,4]триазоло(1,5-а)пиридина (37 мг, 0.10 ммоль) в виде светлокоричневого осадка (4 мг, 8%). а) (рац)-3-Бензил-6-окса-3-азабицикло[3.2.1]октан-8-он. Раствор бензиламина (1.26 мл, 11.6 ммоль) в метаноле (2 мл) добавили по каплям к кипящему с обратным холодильником раствору дигидро-фуран-3-она (1 г, 11.6 ммоль), параформальдегида (1.04 г,34.84 ммоль), и ледяной уксусной кислоты (0.67 мл, 11.61 ммоль) в метаноле (8 мл) в течение 3 ч под азотом. Кипение с обратным холодильником продолжили в течение 1 ч, после чего коричневую реакционную смесь перемешивали при 23 С в течение 16 ч. Реакционную смесь сконцентрировали под вакуумом. Получившееся масло разбавили водой и защелачили 6 н. водным раствором NaOH. Водный раствор экстрагировали этилацетатом, промыли водой, солевым раствором, высушили над сульфатом натрия,отфильтровали и сконцентрировали при пониженном давлении. Неочищенный продукт очистили колоночной флэш-хроматографией на силикагеле с 25-30% этилацетат в гексане в качестве элюента. Соединение, указанное в заголовке, получили в виде бесцветной вязкой жидкости (500 мг, 20%).b) (рац)-3-Бензил-6-окса-3-азабицикло[3.2.1]октан-8-она оксим. Смесь (рац)-3-бензил-6-окса-3-азабицикло[3.2.1]октан-8-она (500 мг, 2.30 ммоль), гидроксиламина гидрохлорида (224 мг, 3.22 ммоль) и пиридина (0.32 мл) в этаноле (5 мл) нагревали при 100 С в течение 2 ч. Реакционную смесь сконцентрировали при пониженном давлении. Добавили к остатку 2.5 н. водный раствор гидроксида натрия (10 мл). Получившийся раствор экстрагировали этилацетатом (50 мл), промыли водой и солевым раствором, высушили над безводным сульфатом натрия, отфильтровали и сконцентрировали при пониженном давлении. Неочищенный продукт очистили колоночной хроматографией на силикагеле смесью 5-10% этилацетат/гексан в качестве элюента, получив соединение, указанное в заголовке, в виде коричневой вязкой жидкости (220 мг, 43%).c) (рац)-8-Эндо-3-бензил-6-окса-3-азабицикло[3.2.1]окт-8-иламин. К деоксигенированному раствору (рац)-3-бензил-6-окса-3-азабицикло[3.2.1]октан-8-она оксима (6.6 г, 28.4 ммоль) в метаноле (140 мл) добавили никель Ренея (1.36 г) в атмосфере аргона. Его гидрогенизировали с использованием баллона водорода при 23 С в течение 1 ч. Реакционную смесь отфильтровали через слой целита и фильтрат сконцентрировали досуха. Неочищенный остаток очистили колоночной флэш-хроматографией на силикагеле (0.5 до 1.5% метанол в дихлорметане в качестве элюента). Получили смесь экзо- и эндоизомеров. Колоночную хроматографию повторили дважды с получением эндоизомера в виде бесцветного масла (260 мг, 42%).d) рац)-8-Эндо-3-бензил-6-окса-3-азабицикло[3.2.1]окт-8-ил)-[8-(2,3,4-трифторфенил)[1,2,4]триазоло [1,5-а] пиридин-2-ил]амин. Раствор 2-бромо-8-(2,3,4-трифторфенил)-[1,2,4]триазоло[1,5-а]пиридина (100 мг, 0.30 ммоль), (рац)8-эндо-3-бензил-6-окса-3-азабицикло[3.2.1]окт-8-иламина (66 мг, 0.305 ммоль) и феноксида натрия (45 мг, 0.39 ммоль) в безводном 1,4-диоксане (4 мл) в пробирке для микроволновой печи продули аргоном в течение 10 мин. Pd2(dba)3CHCl3 (11 мг, 0.011 ммоль) и ксантфос (13 мг, 0.022 ммоль) добавили к раствору и дегазирование продолжили в течение дополнительных 5 мин перед нагреванием реакционной смеси при 130 С в течение 30 мин в микроволновой печи. Реакционную смесь разбавили дихлорметаном (20 мл), промыли 1 М водным раствором карбоната натрия (130 мл). Органическую фазу высушили над сульфатом натрия, отфильтровали и растворитель выпарили при пониженном давлении. Остаток очистили колоночной флэш-хроматографией на силикагеле с использованием МеОН/дихлорметан (3%) в качестве элюента, получив соединение, указанное в заголовке, в виде светло-коричневого осадка (85 мг,59%).(рац)-8-Эндо-6-окса-3-азабицикло[3.2.1]окт-8-ил-[8-(2,3,4-трифторфенил)-[1,2,4]триазоло[1,5 а]пиридин-2-ил]амин. К деоксигенированному раствору рац)-8-эндо-3-бензил-6-окса-3-азабицикло[3.2.1]окт-8-ил)-[8(2,3,4-трифторфенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амина (85 мг, 0.18 ммоль) в метаноле (15 мл) добавили 10% палладия на угле (19 мг) и несколько капель 25% водного раствора соляной кислоты. Реакционную массу перемешивали в атмосфере водорода при атмосферном давлении и при 23 С в течение 2 дней. Реакционную массу отфильтровали через слой целита и фильтрат выпарили досуха при пониженном давлении, получив соединение, указанное в заголовке, в виде коричневого вязкого осадка (68 мг,99%).(рац)-8-эндо-6-окса-3-азабицикло[3.2.1]окт-8-ил-[8-(2,3,4-трифторфенил)[1,2,4]триазоло[1,5-а]пиридин-2-ил]амина (68 мг, 0.181 ммоль) в NMP (1 мл) добавили триэтиламин до тех пор, пока рН получившегося раствора не стал основным. К этой реакции добавили 4-хлор-6 метилпиримидин (70 мг, 0.544 ммоль) и смесь нагревали при 135 С в течение 2 ч. Реакционную массу охладили и разделили между этилацетатом (50 мл) и водой (10 мл). Органическую фазу высушили над безводным сульфатом натрия и сконцентрировали досуха при пониженном давлении. Получившийся неочищенный остаток очистили с помощью препаративной ВЭЖХ, используя в качестве растворителя ацетонитрил и водный буфер ацетата аммония и колонку Xbridge, получив соединение, указанное в заголовке, в виде светло-коричневого осадка (24.0 мг, 28%).a) (рац)-7-Бензил-3-тиа-7-азабицикло[3.3.1]нонан-9-он. Соединение, указанное в заголовке, получили по аналогии с примером 24 а из тетрагидротиопиран 4-она (10 г, 86.0 ммоль) в виде светло-желтого осадка (4 г, 17%).b) (рац)-7-Бензил-3-тиа-7-азабицикло[3.3.1]нонан-9-она оксим. Соединение, указанное в заголовке, получили по аналогии с примером 24b из (рац)-7-бензил-3-тиа 7-азабицикло[3.3.1]нонан-9-она в виде осадка (2.4 г, 90%).c) (рац)-9-Экзо-7-бензил-3-тиа-7-азабицикло[3.3.1]нон-9-иламин. Соединение, указанное в заголовке, получили по аналогии с примером 24 с из (рац)-7-бензил-3-окса 7-азабицикло[3.3.1]нонан-9-она оксима (1.5 г, 5.7 ммоль) в виде осадка (150 мг, 10%).d) рац)-9-Экзо-7-бензил-3-тиа-7-азабицикло[3.3.1]нон-9-ил)-[8-(2,3,4-трифторфенил)[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин. Соединение, указанное в заголовке, получили по аналогии с примером 24d из 2-бромо-8-(2,3,4 трифторфенил)-[1,2,4]триазоло[1,5-а]пиридина (150 мг, 0.457 ммоль) и (рац)-9-экзо-7-бензил-3-тиа-7 азабицикло[3.3.1]нон-9-иламина (124.7 мг, 0.503 ммоль) в виде светло-коричневого осадка (90.0 мг,39%).e) рац)-9-Экзо-3-тиа-7-азабицикло[3.3.1]нон-9-ил)-[8-(2,3,4-трифторфенил)-[1,2,4]триазоло[1,5 а]пиридин-2-ил]амин. Соединение, указанное в заголовке, получили по аналогии с примером 24 е из рац)-9-экзо-7 бензил-3-тиа-7-азабицикло[3.3.1]нон-9-ил)-[8-(2,3,4-трифторфенил)-[1,2,4]триазоло[1,5-а]пиридин-2 ил]амина (90 мг, 0.182 ммоль) в виде светло-желтого осадка (70.0 мг, 95%).[(рац)-9-Экзо-7-(6-метилпиримидин-4-ил)-3-тиа-7-азабицикло[3.3.1]нон-9-ил]-[8-(2,3,4 трифторфенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амин. Соединение, указанное в заголовке, получили по аналогии с примером 24f из рац)-9-экзо-3-тиа-7- 29
МПК / Метки
МПК: A61K 31/4196, A61P 25/00, C07D 471/04, C07D 519/00
Метки: производные, пиперидина, мостиковые
Код ссылки
<a href="https://eas.patents.su/30-25035-mostikovye-proizvodnye-piperidina.html" rel="bookmark" title="База патентов Евразийского Союза">Мостиковые производные пиперидина</a>
Предыдущий патент: Заместитель клинкера на основе обожженной глины
Следующий патент: Сшиваемая силаном полимерная композиция, изделие и способ получения кабеля
Случайный патент: Энантиоселективное получение s-энантиомера омепразола или смеси s- и r-энантиомеров омепразола, обогащенной s-энантиомером омепразола












