Энантиоселективное получение s-энантиомера омепразола или смеси s- и r-энантиомеров омепразола, обогащенной s-энантиомером омепразола
Номер патента: 14818
Опубликовано: 28.02.2011
Авторы: Дон Цзяцзя, Ван Ванцзунь, Чжао Сяолон, Цзян Бяо
Формула / Реферат
1. Способ получения S-энантиомера омепразола или смеси S- и R-энантиомеров омепразола, обогащенной S-энантиомером омепразола формулы (I)
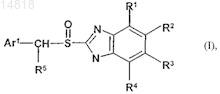
в которой остатки R1, R3и R4 представляют собой атом водорода, R2 представляет собой ОСН3, R5 представляет собой атом водорода, а Ar1 представляет собой остаток формулы
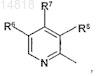
в которой остатки R6 и R8представляют собой СН3, a R7представляет собой ОСН3,
заключающийся в том, что прохиральный сульфид формулы (II)
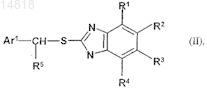
в которой остатки R1, R2, R3, R4, R5 и Ar1имеют указанные выше значения,
окисляют в органическом растворителе соответствующим окислителем в присутствии катализатора, отличающийся тем, что катализатором служит комплекс титана(IV), получаемый взаимодействием соединения титана(IV) с хиральным бидентатным (R,R)- или (S,S)-1,2-бис-арилэтан-1,2-диолом, при температуре в интервале от 20 до 25°С в течение от 10 до 20 мин, и где каталитическое окисление проводят без добавления какого-либо основания.
2. Способ по п.1, предусматривающий выполнение дополнительной стадии, на которой S-энантиомер омепразола взаимодействием с источником цинка переводят в цинковую соль этого S-энантиомера омепразола.
3. Способ по одному из пп.1 или 2, при осуществлении которого в качестве хирального бидентатного (R,R)- или (S',S)-1,2-бис-арилэтан-1,2-диола используют соединение общей формулы (III) или (III')
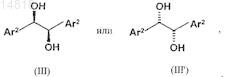
в которой остаток Ar2 выбран из группы, включающей
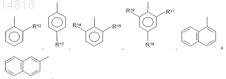
где остатки R12-R18 независимо друг от друга выбраны из группы, включающей водород, алкил, алкоксигруппу, карбоксилатный остаток, галоген, фенил, трифторметил и NO2.
4. Способ по п.3, где остатки R14 и R15 независимо друг от друга выбраны из группы, включающей водород, алкил, алкоксигруппу и галоген, а остатки R16, R17 и R18 независимо друг от друга выбраны из группы, включающей водород и алкил.
5. Способ по п.4, где остатки R14 и R15 являются идентичными, а остатки R16, R17 и R18 также имеют идентичные значения.
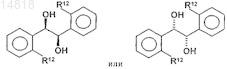
6. Способ по п.5, где остаток R12 представляет собой атом брома.
7. Способ по п.6, при осуществлении которого в качестве (R,R)- или (S,S)-1,2-бис-арил-1,2-диола используют соединение формулы
8. Способ по одному из пп.1-7, при осуществлении которого в качестве соединения титана(IV) используют алкоксид титана(IV).
9. Способ по п.8, при осуществлении которого в качестве титанового соединения используют изопропоксид титана(IV).
10. Способ по одному из предыдущих пунктов, при осуществлении которого хиральный бидентатный лиганд и прохиральный сульфид формулы (II) используют в соотношении между ними, равном 0,1:1.
11. Способ по одному из предыдущих пунктов, при осуществлении которого алкоксид титана(IV) и прохиральный сульфид формулы (II) используют в молярном соотношении между ними, равном 0,05:1.
12. Способ по одному из предыдущих пунктов, при осуществлении которого реакцию проводят в присутствии воды.
13. Способ по одному из предыдущих пунктов, при осуществлении которого в качестве окислителя используют пероксид водорода, гидропероксид алкила или гидропероксид арилалкила.
14. Способ по одному из предыдущих пунктов, при осуществлении которого сначала приготавливают катализатор взаимодействием хирального лиганда с алкоксидом титана(IV) в органическом растворителе, а затем к реакционной смеси добавляют прохиральный сульфид формулы (II).
15. Способ по одному из предыдущих пунктов, при осуществлении которого окисление проводят при температуре порядка -20°С в течение 12-18 ч.
16. Способ по одному из предыдущих пунктов, заключающийся в том, что:
а) в реактор загружают смесь хирального бидентатного (R,R)- или (S,S)-1,2-бис-арилэтан-1,2-диола и алкоксида титана(IV) в присутствии органического растворителя,
б) к реакционной смеси, полученной на стадии а), добавляют воду,
в) к образовавшейся на стадии б) реакционной смеси добавляют прохиральный сульфид формулы (II),
г) к реакционной смеси, полученной на стадии в), добавляют окислитель,
д) к реакционной смеси, полученной на стадии г), добавляют водный раствор аммиака,
е) к водной смеси, полученной на стадии д), добавляют кислоту,
ж) водную смесь экстрагируют органическим растворителем,
з) органический раствор охлаждают и отфильтровывают выпавший в осадок энантиомер соединения формулы (I) и
и) при необходимости требуемый изомер соединения формулы (I) переводят в цинковую соль.
Текст
ЭНАНТИОСЕЛЕКТИВНОЕ ПОЛУЧЕНИЕ S-ЭНАНТИОМЕРА ОМЕПРАЗОЛА ИЛИ СМЕСИ S- И R-ЭНАНТИОМЕРОВ ОМЕПРАЗОЛА, ОБОГАЩЕННОЙ В изобретении описан новый способ получения S-энантиомера омепразола или смеси S- и Rэнантиомеров омепразола, обогащенной S-энантиомером омепразола. При осуществлении этого нового способа прохиральный сульфид окисляют в органическом растворителе соответствующим окислителем в присутствии комплекса титана(IV), получаемого взаимодействием соединения титана(IV) с хиральным бидентатным (R,R)- или (S,S)-1,2-бис-арилэтан-1,2-диолом, при температуре в интервале от 20 до 25 С в течение от 10 до 20 мин, и где каталитическое окисление проводят без добавления какого-либо основания 014818 Настоящее изобретение относится к новому способу получения S-энантиомера омепразола или смеси S- и R-энантиомеров омепразола, обогащенной S-энантиомером омепразола. Понятия "S-энантиомер омепразола" и "эзомепразол" используются в настоящем описании в качестве синонимов. Омепразол относится к известным ингибиторам секреции кислоты желудочного сока, и применяется в качестве лекарственных средств для лечения заболеваний желудочно-кишечного тракта, прежде всего язвы желудка. В качестве примера известных действующих веществ наряду с омепразолом можно назвать, пантопразол, лансопразол и рабепразол. Эти действующие вещества благодаря наличию у них сульфоксидной группы являются хиральными, и поэтому интерес представляет получение подобных соединений в форме чистых энантиомеров. В настоящее время на рынке широко предлагается прежде всего S-энантиомер омепразола, т.е. эзомепразол, в виде его магниевой соли. Разделение замещенных 2-(2-пиридинилметилсульфинил)-1 Н-бензимидазолов на отдельные энантиомеры описано, например, в DE 4035455, WO 94/27988 и WO 2004/002982. Данные публикации относятся, в частности, также к разделению омепразола на оба его энантиомера. При разделении энантиомеров описанными в этих публикациях способами исходят из рацемата указанных соединений, который взаимодействием с соответствующим оптически активным соединением переводят в пару диастереомеров, которые затем можно разделять известным путем. Выделение одного энантиомера из обогащенной им смеси двух энантиомеров хиральных бензимидазольных соединений описано также в WO 97/02261. Подобным способам разделения рацемической смеси присущ целый ряд недостатков, заключающихся в том, что, во-первых, ненужный энантиомер приходится обычно направлять в отходы, а во-вторых, разделение рацемической смеси связано с проведением сложных и снижающих выход целевого продукта операций. В соответствии с этим в данной области имеется целый ряд предложений, направленных на получение индивидуальных энантиомеров производных бензимидазола с хиральной сульфоксидной группой путем хирального синтеза. В этом отношении можно сослаться, например, на публикацию WO 96/17076, в которой описано окисление соответствующих прохиральных сульфидов под действием микроорганизмов до индивидуальных энантиомеров требуемых сульфидных соединений, или на публикацию WO 96/17077, в которой описано восстановление рацемических сульфонов под действием микроорганизмов до требуемых стереоизомеров сульфоксидов. В обеих указанных публикациях речь идет, однако, о способах, предусматривающих использование микроорганизмов, тогда как соответствующие индивидуальные энантиомеры производных бензимидазола с хиральной сульфоксидной группой представляется более целесообразным получать химическим способом асимметрического синтеза. Подобный способ описан в публикации WO 96/002535 и заключается в том, что прохиральный сульфид подвергают взаимодействию с окислителем в присутствии катализатора. Такой катализатор представляет собой титановый комплекс с диэтилтартратом в качестве бидентатного лиганда. Этому способу, однако, присущ существенный недостаток, состоящий в необходимости проведения реакции в очень специфических условиях. Так, в частности, реакцию обычно необходимо проводить в присутствии основания и в строго определенной последовательности. Для превращения титанового комплекса, например, обязательно присутствие прохирального сульфида, а реакция должна протекать при повышенной температуре и/или при повышенной продолжительности. Кроме того, при осуществлении описанного в указанной публикации способа используют крайне специфический окислитель, а именно гидропероксид кумола. Более новый способ асимметрического синтеза производных бензимидазола с хиральной сульфоксидной группой описан в публикации WO 03/089408. Согласно этой публикации реакцию проводят в присутствии основания и титанового либо ванадиевого катализатора с хиральным монодентатным лигандом. В принципе из уровня техники известно множество способов асимметрического окисления сульфидов до оптически активных сульфоксидов, и в этом отношении можно сослаться, например, на публикацию в Journal of Organic Chemistry 63, 1998, сс. 9392-9395. Однако заранее нельзя предсказать, пригоден ли какой-либо из многих описанных в общих чертах способов асимметрического окисления сульфидов до оптически активных сульфоксидов и для получения требуемых замещенных бензимидазолов с хиральной сульфоксидной группой и будет ли он обладать преимуществами перед известными способами. Сказанное относится прежде всего к асимметрическому синтезу индивидуальных энантиомеров омепразола, прежде всего эзомепразола. Исходя из вышеизложенного, в данной области сохраняется потребность в разработке других способов получения S-энантиомера омепразола или смеси S- и R-энантиомеров омепразола, обогащенной Sэнантиомером омепразола без недостатков, присущих известным из уровня техники способам. В настоящем изобретении предлагается способ получения S-энантиомера омепразола или смеси Sи R-энантиомеров омепразола, обогащенной S-энантиомером омепразола формулы (I) в которой остатки R1, R3 и R4 представляют собой атом водорода, R2 представляет собой ОСН 3, R5 представляет собой атом водорода, а Ar1 представляет собой остаток формулы в которой остатки R6 и R8 представляют собой СН 3, a R7 представляет собой ОСН 3, заключающийся в том, что прохиральный сульфид формулы (II) в которой остатки R1, R2 R3, R4, R5 и Ar1 имеют указанные выше значения, окисляют в органическом растворителе соответствующим окислителем в присутствии катализатора, отличающийся тем, что катализатором служит комплекс титана(IV), получаемый взаимодействием соединения титана(IV) с хиральным бидентатным (R,R)- или (S,S)-1,2-бис-арилэтан-1,2-диолом, при температуре в интервале от 20 до 25 С в течение от 10 до 20 мин, и где каталитическое окисление проводят без добавления какого-либо основания. Хиральный бидентатный (R,R)- или (S,S)-1,2-бис-арилэтан-1,2-диол предпочтительно представляет собой соединение общей формулы (III) или (III') где остатки R12-R18 независимо друг от друга выбраны из группы, включающей водород, алкил, алкоксигруппу, карбоксилатный остаток, галоген, фенил, трифторметил и NO2. Согласно настоящему изобретению под алкилом предпочтительно подразумевается С 1 С 20 алкильный остаток, более предпочтительно С 1-С 10 алкильный остаток, особенно предпочтительно C1 С 6 алкильный остаток, такой как метильная, этильная, изопропильная, н-пропильная, н-бутильная, изобутильная и трет-бутильная группа. Согласно настоящему изобретению под алкоксигруппой предпочтительно подразумевается алкоксильный остаток с 1-20, более предпочтительно с 1-10, прежде всего с 1-6, атомами углерода, такой как метокси-, этокси-, изопропокси-, н-пропокси-, н-бутокси-, изобутокси- и трет-бутоксигруппа. Согласно настоящему изобретению под галогеном подразумевается атом галогена, прежде всего атом фтора, хлора, брома или иода, особенно предпочтительны из которых атомы фтора. Согласно настоящему изобретению под галогеналкоксигруппой предпочтительно подразумевается имеющая указанные выше значения алкоксигруппа, замещенная одним либо несколькими, прежде всего 1-5, более предпочтительно 1-3, особенно предпочтительно 1, 2 или 3, указанными выше атомами галогена. Атомы галогена могут быть идентичными или разными и располагаться у одного либо у нескольких атомов углерода. Предпочтительны идентичные атомы галогена, которые (если это возможно с химической точки зрения) связаны с одним и тем же атомом углерода, как это имеет место, например, в случае CF3-группы. Согласно настоящему изобретению под галогеналкилом предпочтительно подразумевается имею-2 014818 щий указанные выше значения алкил, замещенный одним либо несколькими, прежде всего 1-5, более предпочтительно 1-3, особенно предпочтительно 1, 2 или 3, указанными выше атомами галогена. Атомы галогена могут быть идентичными или разными и располагаться у одного либо у нескольких атомов углерода. Предпочтительны идентичные атомы галогена, которые (если это возможно с химической точки зрения) связаны с одним и тем же атомом углерода, как это имеет место, например, в случае CF3-группы. Согласно настоящему изобретению под алкилкарбонильным остатком предпочтительно подразумевается имеющий указанные выше значения алкил, содержащий функциональную карбонильную группу С=О. Согласно настоящему изобретению под алкоксикарбонилом подразумевается имеющая указанные выше значения алкоксигруппа, содержащая карбонильную группу С=О. Согласно настоящему изобретению под арилом предпочтительно подразумевается фенильная или 1- либо 2-нафтильная группа. Арил необязательно может быть замещен одним-тремя заместителями,прежде всего указанными выше атомами галогена, нитрогруппой, алкилом и указанной выше алкоксигруппой. Согласно настоящему изобретению под алкилтиогруппой предпочтительно подразумевается имеющий указанные выше значения алкил, содержащий тиогруппу. Согласно настоящему изобретению под алкоксиалкоксигруппой предпочтительно подразумевается имеющая указанные выше значения алкоксигруппа, замещенная указанной выше алкоксигруппой. Согласно настоящему изобретению под диалкиламиногруппой подразумевается аминогруппа, замещенная двумя указанными выше алкильными группами. Согласно настоящему изобретению под фенилалкилом, соответственно фенилалкоксигруппой подразумеваются имеющие указанные выше значения алкил, соответственно алкоксигруппа, замещенные фенильной группой. Согласно настоящему изобретению под карбоксилатным остатком предпочтительно подразумевается остаток карбоновой кислоты с 1-10, более предпочтительно с 1-6, особенно предпочтительно с 1-4,атомами углерода. Согласно настоящему изобретению под арилалкилом предпочтительно подразумевается имеющий указанные выше значения алкил, замещенный указанным выше арилом. Поскольку согласно настоящему изобретению остатки могут образовывать циклические структуры или конденсированные циклические системы, такие остатки предпочтительно замыкают углеродный цикл с 5-10, более предпочтительно с 5, 6 или 7, атомами углерода, который необязательно может быть замещен. Поскольку согласно изобретению соответствующая структурная единица может быть замещена, в качестве ее заместителя предпочтителен, если не указано иное, указанный выше атом галогена C1 С 6 алкильной группы или С 1-С 6 алкоксигруппы. В последующем изобретение более подробно рассмотрено на примере омепразола. В остатках Ar2 остаток R12 особенно предпочтительно представляет собой имеющий указанные выше значения алкил или имеющий указанные выше значения галоген, прежде всего атом брома. Остаток R13 представляет собой прежде всего имеющий указанные выше значения алкил, имеющий указанные выше значения галоген, прежде всего атом брома, или имеющую указанные выше значения алкоксигруппу, особенно предпочтительно алкильный остаток с 1-4 атомами углерода или атом брома. Остатки R14 и R15 предпочтительно идентичны и выбраны из группы, включающей атом водорода и имеющие указанные выше значения галоген, алкил и алкоксигруппу. Остатки R16, R17 и R18 также предпочтительно идентичны и более предпочтительно представляют собой атом водорода или имеющий указанные выше значения алкил. Особенно предпочтителен (R,R)- или (S,S)-1,2-бис-арилэтил-1,2-диол, т.е. соединение формулы(R,R)- или (S,S)-1,2-бис-арилэтил-1,2-диол, используемый согласно изобретению в качестве хирального лиганда титанового соединения, можно получать известным путем, соответственно это соединение имеется в продаже. Указанные соединения можно получать прежде всего асимметрическим дигидроксилированием (Е)-стильбена либо соответствующих производных стильбена методом, описанным,например, в Chem. Rev. 94, 1994, с. 2483, или в Chirality 13, 2001, cc. 258-265. Обе эти публикации в части, касающейся получения диолов, включены в настоящее описание в качестве ссылки. Согласно изобретению катализатор приготавливают in situ взаимодействием соответствующего титанового соединения, прежде всего алкоксида титана(IV), предпочтительно изопропоксида титана(IV)(Ti(i-PrO)4), с соответствующим хиральным диолом формулы (III), соответственно (III'). Взаимодействие соединения титана(IV) с диолом проводят в органическом растворителе, предпочтительно в присутствии-3 014818 воды, а более предпочтительно использовать для приготовления катализатора тот же растворитель, который позднее используют для окисления. При этом речь идет прежде всего о галогензамещенных или незамещенных алкил- и арилуглеводородах, таких как метиленхлорид, хлороформ, четыреххлористый углерод, гексан и толуол. Наиболее предпочтителен в качестве органического растворителя толуол. Катализатор предпочтительно приготавливать при температуре в интервале от 20 до 50 С, прежде всего от 20 до 25 С. Длительность процесса получения катализатора составляет от 1 до 60 мин, предпочтительно от 10 до 20 мин. Согласно изобретению предпочтительно сначала приготавливать in situ катализатор, а затем добавлять к содержащей катализатор реакционной смеси прохиральный сульфид формулы (II), прежде всего соединение формулы и в завершение добавлять окислитель. В другом предпочтительном варианте катализатор приготавливают в присутствии прохирального сульфида формулы (II), т.е., например, сначала в реактор загружают титановое соединение, затем добавляют прохиральный сульфид формулы (II) и в завершение добавляют хиральный диол. В этом варианте окислитель также предпочтительно добавлять в последнюю очередь. Последующее окисление предпочтительно проводить в той же смеси растворителей, которую использовали для приготовления катализатора, т.е. также в присутствии воды в органическом растворителе, предпочтительно выбранном из группы галогензамещенных или незамещенных алкил- и арилуглеводородов, таких как метиленхлорид, хлороформ, четыреххлористый углерод, гексан и толуол, предпочтителен из которых толуол. Энантиоселективную каталитическую реакцию предпочтительно проводить при температуре в интервале от -78 до 25 С, более предпочтительно в интервале от порядка -20 до 0 С, прежде всего при температуре порядка -20 С. Продолжительность энантиоселективного каталитического окисления составляет, как правило, от 2 до 24 ч, предпочтительно от 12 до 18 ч. Согласно изобретению можно применять любой пригодный для этой цели окислитель, однако особенно предпочтительно использовать в качестве окислителя пероксид водорода, гидропероксид алкила или арилалкила, наиболее предпочтительно гидропероксид трет-бутила. Предпочтительно же в любом случае не использовать в качестве окислителя гидропероксид кумола. При осуществлении предлагаемого в изобретении способа количества катализатора и прохирального сульфида формулы (II) предпочтительно выбирать с таким расчетом, чтобы молярное соотношение между хиральным бидентатным лигандом и прохиральным сульфидом формулы (II) составляло от 0,02:1 до 0,4:1, более предпочтительно порядка 0,1:1. Молярное же соотношение между титановым соединением и сульфидом формулы (II) согласно изобретению предпочтительно должно составлять от 0,01:1 до 0,2:1, более предпочтительно порядка 0,05:1. Согласно изобретению предпочтительно приготавливать катализатор, равно как и проводить последующее энантиоселективное каталитическое окисление в присутствии воды при молярном соотношении между водой и прохиральным сульфидом формулы (II) предпочтительно от 0,01:1 до 2:1, более предпочтительно порядка 1:1. Количество используемого окислителя не играет существенной роли, однако предпочтительно использовать окислитель в количестве, при котором соотношение между ним и прохиральным сульфидом формулы (II) составляет от 0,5:1 до 3:1, более предпочтительно порядка 2:1. По завершении процесса энантиоселективного окисления прохирального сульфида формулы (II) до хирального сульфоксида формулы (I) реакционную смесь в принципе можно подвергать любой приемлемой переработке, однако при создании изобретения было установлено, что при переработке реакционной смеси особым способом сульфоксид формулы (I), прежде всего эзомепразол, образуется в виде основания, которое затем можно особо простым путем переводить в его соли. По завершении процесса энантиоселективного каталитического окисления соединения формулы (II) до соединения формулы (I) реакционную смесь предпочтительно согласно изобретению обрабатывать водным основным раствором. В качестве такого водного основного раствора предпочтительно использовать водный раствор аммиака. После добавления раствора аммиака добавляют кислоту, в качестве которой можно использовать неорганическую кислоту в виде водного раствора или органическую кислоту,предпочтительно органическую кислоту, особенно предпочтительно уксусную кислоту. Величину рН водного раствора предпочтительно при этом устанавливать на значение в пределах от 5 до 8, особенно предпочтительно от 6 до 7,5. Полученный таким путем водный раствор экстрагируют органическим растворителем, в качестве которого предпочтительно использовать галогензамещеннные или незамещенные алкил- либо арилуглеводороды и кетоны, такие как метиленхлорид, хлороформ, четыреххлористый угле-4 014818 род, гексан, толуол, ацетон, бутанон и метилизобутилкетон. Возможно использование и иных обычных органических экстрагентов. Предпочтительным растворителем для экстрагирования является метилизобутилкетон. При создании изобретения неожиданно было установлено, что (S)-омепразол (эзомепразол), при охлаждении органического экстрагента выпадает в осадок в чистом виде. Предпочтительно при этом охлаждать экстрагирующий раствор до температуры в интервале от -78 до 25 С, более предпочтительно в интервале от -20 до 0 С, например, до температуры порядка -10 С, в результате чего требуемый энантиомер соединения формулы (I) выпадает при этом в виде твердого вещества в форме свободного основания. Таким в принципе простым путем удается получать прежде всего S-энантиомер омепразола с очень хорошим выходом и высокой оптической чистотой. При наличии в полученном указанным путем продукте остатков нежелательного энантиомера соединения формулы (I) их для повышения степени оптической чистоты продукта можно отделять обычным способом. Обычно требуемый энантиомер, получении эзомепразола, образуется в виде твердого вещества,представляющего собой смесь аморфного и кристаллического продуктов. Поскольку предлагаемый в изобретении способ с предусмотренной при его осуществлении предпочтительной процедурой переработки реакционной смеси позволяет получать требуемый изомер соединения формулы (I) в форме свободного основания в виде твердого вещества, такое основание может оказаться наиболее предпочтительным переводить в его соль. В этом состоит особое преимущество предлагаемого в изобретении способа перед известными из уровня техники способами, которыми получение определенной соли эзомепразола, описанное, например, в WO 98/28294, возможно лишь при условии высоких затрат и, в частности, заключается в растворении образованной с щелочным металлом соли эзомепразола в воде, экстракции нейтрального эзомепразола органическим растворителем путем снижения значения рН добавлением водорастворимой кислоты, выпариванием растворителя до поучения высококонцентрированного раствора и добавлении вещества, не являющегося растворителем, с получением в результате эзомепразола в форме основания в виде твердого вещества. Предлагаемый же в изобретении способ позволяет простым путем непосредственно получать в результате соответствующей переработки реакционной смеси по завершении энантиоселективного каталитического окисления соответствующего сульфида до сульфоксида свободное основание в виде твердого вещества. Затем такое свободное основание можно обычным путем переводить в одну из требуемых солей, на конкретный тип которых в принципе не накладывается никаких особых ограничений. При этом можно прежде всего назвать натриевую,магниевую, литиевую, калиевую, кальциевую и четвертичную аммониевую соли, а также пиперидиновую соль и прежде всего цинковую соль. Цинковую соль эзомепразола согласно изобретению особенно предпочтительно получать путем обработки эзомепразола соответствующим источником цинка. К таким предпочтительным источникам цинка относятся ацетат цинка, бромид цинка, гидроксид карбоната цинка, хлорид цинка, трифторметансульфонат цинка, нитрат цинка, диэтилцинк и сульфат цинка, из которых наиболее предпочтительны диэтилцинк и хлорид цинка, прежде всего диэтилцинк. В соответствии с этим в наиболее предпочтительном варианте осуществления изобретения в нем предлагается способ получения эзомепразола или соли эзомепразола, прежде всего цинковой соли эзомепразола, заключающийся в том, что: а) в реактор загружают (R,R)-1,2-бис-арилэтил-1,2-диол, прежде всего (R,R)-1,2-бис-(2 бромфенил)этан-1,2-диол, вместе с алкоксидом титана(IV), прежде всего с тетраизопропоксидом титана,в органическом растворителе,б) к этой реакционной смеси добавляют воду,в) к полученной на стадии б) реакционной смеси добавляют соответствующий сульфид общей формулы (II), прежде всего соединение формулы г) к этой смеси добавляют окислитель, прежде всего гидропероксид алкила или арилалкила, наиболее предпочтительно гидропероксид дибутила,д) добавляют водный основный раствор, прежде всего водный раствор аммиака,е) к этой смеси добавляют кислоту, прежде всего органическую кислоту, такую как уксусная кислота, предпочтительно до достижения значения рН в пределах от 5 до 8, особенно предпочтительно от 6 до 7,5,ж) водную смесь экстрагируют соответствующим органическим растворителем,з) органический раствор охлаждают и отфильтровывают выпавший в осадок энантиомер соединения формулы (I), прежде всего эзомепразол, и и) при необходимости указанный энантиомер переводят в соль, прежде всего цинковую соль.-5 014818 Ниже изобретение более подробно поясняется на примерах. Пример 1. Получение S-омепразола К раствору (R,R)- 1,2-бис-(2-бромфенил)этан-1,2-диола (12 мг, 0,032 ммоля) в толуоле (2 мл) при 25 С добавляли тетраизопропоксид титана (4,5 мг, 0,016 ммоля). Раствор перемешивали в течение 10 мин, добавляли воду (5,7 мг, 0,32 ммоля) и перемешивание продолжали еще в течение 10 мин. Затем к раствору добавляли 5-метокси-2-(4-метокси-3,5-диметил-2-пиридинил)метил]тио]-1H-бензимидазол(105 мг, 0,32 моля) и температуру устанавливали на уровне -20 С. Далее медленно добавляли гидропероксид трет-бутила (70%-ный, 96 мкл, 0,064 ммоля). После выдержки в течение 12 ч при -20 С раствор трижды экстрагировали водным гидроксидом аммония (12,5%-ный NH3, 35 мл). Затем к объединенным водным экстрактам добавляли метилизобутилкетон (5 мл). После этого рН водной фазы устанавливали на требуемое значение добавлением уксусной кислоты, водную фазу отделяли и экстрагировали ее дополнительным количеством метилизобутилкетона (5 мл). Органический раствор оставляли стоять на ночь в охлажденном до -10 С состоянии, осаждая таким путем указанную в заголовке нейтральную форму S-омепразола в твердом виде (99 мг, выход 90%). Энантиомерный избыток S-омепразола составил 94%. После очистки метилизобутилкетоном получили S-омепразол с энантиомерным избытком более 99%. Пример 2. Получение R-омепразола К раствору (S,S)-1,2-бис-(2-бромфенил)этан-1,2-диола (12 мг, 0,032 ммоля) в толуоле (2 мл) при 25 С добавляли тетраизопропоксид титана (4,5 мг, 0,016 ммоля). Раствор перемешивали в течение 10 мин, добавляли воду (5,7 мг, 0,32 ммоля) и перемешивание продолжали еще в течение 10 мин. Затем к раствору добавляли 5-метокси-2-(4-метокси-3,5-диметил-2-пиридинил)метил]тио]-1 Н-бензимидазол(105 мг, 0,32 моля) и температуру устанавливали на уровне -20 С. Далее медленно добавляли гидропероксид трет-бутила (70%-ный, 96 мкл, 0,064 ммоля). После выдержки в течение 12 ч при -20 С раствор трижды экстрагировали водным гидроксидом аммония (12,5%-ный NH3, 35 мл). Затем к объединенным водным экстрактам добавляли метилизобутилкетон (5 мл). После этого рН водной фазы устанавливали на требуемое значение добавлением уксусной кислоты, водную фазу отделяли и экстрагировали ее дополнительным количеством метилизобутилкетона (5 мл). Органический раствор оставляли стоять на ночь в охлажденном до -10 С состоянии, осаждая таким путем указанную в заголовке нейтральную форму R-омепразола в твердом виде. Энантиомерный избыток R-омепразола составил 93%. Пример 3. Получение цинковой соли эзомепразола В 10 мл тетрагидрофурана при 5-часовом перемешивании растворяли эзомепразол (1 г, 2,9 ммоля) и медленно добавляли 2,9 мл диэтилцинка (1-молярный раствор в гексане). Полученную смесь оставляли перемешиваться на ночь при температуре окружающей среды. Затем добавляли 10 мл дистиллированной воды, выпавший осадок отфильтровывали и промывали дистиллированной водой. Таким путем получили 1 г (91%) указанного в заголовке соединения. Пример 4. (Получение лигандов катализатора) (Е)-2,2-дибромстильбен 4,4 мл (7,4 г, 40 ммолей) желтой суспензии хлорида титана(IV) в 150 мл тетрагидрофурана перемешивали магнитной мешалкой в ледяной бане в атмосфере азота. Затем осторожно добавляли 5 г (77 ммолей) пылевидного цинка. После этого добавляли 7 г (38 ммолей) альдегида 1 в 50 мл тетрагидрофурана и смесь в течение 8 ч нагревали с обратным холодильником. Охлажденную реакционную смесь сливали в 1-молярную разбавленную водную соляную кислоту и продукт экстрагировали гексаном. Объединенные экстракты промывали водой и раствором (поваренной) соли, сушили над сульфатом натрия, фильтровали и фильтрат упаривали на ротационном испарителе с получением в результате 6,2 г (97%) соединения 2. После перекристаллизации из смеси, содержавшей 5% толуола и 95% этанола, получили соединение 2 в виде игольчатых кристаллов белого цвета. В 1-литровую трехгорлую колбу сначала помещали воду (180 мл) и 2-метилпропан-2-ол (180 мл), а затем добавляли метансульфонамид (3,39 г, 0,0419 моля) и смесь катализаторов асимметрического дигидроксилирования AD-mix- (50,2 г). Образовавшуюся смесь перемешивали механической мешалкой до полного растворения всех твердых веществ. Затем колбу охлаждали до 0 С и добавляли к ее содержимому дибромстильбен 2 (12,0 г, 32,3 ммоля). Далее реакционную смесь в течение 72 ч интенсивно перемешивали с выдержкой при температуре в интервале от 0 до 3 С. Затем добавляли сульфид натрия (54 г,0,439 моля) и смесь оставляли перемешиваться на ночь. После этого добавляли дихлорметан (350 мл) и фазы разделяли. Водный слой экстрагировали дихлорметаном (3175 мл), объединенные органические слои промывали 2-молярным раствором КОН (30 мл), сушили (MgSO4) и летучие вещества выпаривали при пониженном давлении. Остаток очищали экспресс-хроматографией путем элюирования смесью диэтиловый эфир/гексан и затем перекристаллизовывали (из смеси гексан/дихлорметан в соотношении 1,1:1, 92 мл) с получением в результате диола 3 (12,5 г, 94%) в виде игольчатых кристаллов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения S-энантиомера омепразола или смеси S- и R-энантиомеров омепразола, обогащенной S-энантиомером омепразола формулы (I) в которой остатки R1, R3 и R4 представляют собой атом водорода, R2 представляет собой ОСН 3, R5 представляет собой атом водорода, а Ar1 представляет собой остаток формулы в которой остатки R6 и R8 представляют собой СН 3, a R7 представляет собой ОСН 3,заключающийся в том, что прохиральный сульфид формулы (II) в которой остатки R1, R2, R3, R4, R5 и Ar1 имеют указанные выше значения,окисляют в органическом растворителе соответствующим окислителем в присутствии катализатора,отличающийся тем, что катализатором служит комплекс титана(IV), получаемый взаимодействием соединения титана(IV) с хиральным бидентатным (R,R)- или (S,S)-1,2-бис-арилэтан-1,2-диолом при температуре в интервале от 20 до 25 С в течение от 10 до 20 мин, и где каталитическое окисление проводят без добавления какого-либо основания. 2. Способ по п.1, предусматривающий выполнение дополнительной стадии, на которой Sэнантиомер омепразола взаимодействием с источником цинка переводят в цинковую соль этого Sэнантиомера омепразола. 3. Способ по одному из пп.1 или 2, при осуществлении которого в качестве хирального бидентатного (R,R)- или (S',S)-1,2-бис-арилэтан-1,2-диола используют соединение общей формулы (III) или (III') где остатки R12-R18 независимо друг от друга выбраны из группы, включающей водород, алкил, алкоксигруппу, карбоксилатный остаток, галоген, фенил, трифторметил и NO2. 4. Способ по п.3, где остатки R14 и R15 независимо друг от друга выбраны из группы, включающей водород, алкил, алкоксигруппу и галоген, а остатки R16, R17 и R18 независимо друг от друга выбраны из группы, включающей водород и алкил. 5. Способ по п.4, где остатки R14 и R15 являются идентичными, а остатки R16, R17 и R18 также имеют идентичные значения. 6. Способ по п.5, где остаток R12 представляет собой атом брома. 7. Способ по п.6, при осуществлении которого в качестве (R,R)- или (S,S)-1,2-бис-арил-1,2-диола используют соединение формулы 8. Способ по одному из пп.1-7, при осуществлении которого в качестве соединения титана(IV) используют алкоксид титана(IV). 9. Способ по п.8, при осуществлении которого в качестве титанового соединения используют изопропоксид титана(IV). 10. Способ по одному из предыдущих пунктов, при осуществлении которого хиральный бидентатный лиганд и прохиральный сульфид формулы (II) используют в соотношении между ними, равном 0,1:1. 11. Способ по одному из предыдущих пунктов, при осуществлении которого алкоксид титана(IV) и прохиральный сульфид формулы (II) используют в молярном соотношении между ними, равном 0,05:1. 12. Способ по одному из предыдущих пунктов, при осуществлении которого реакцию проводят в присутствии воды. 13. Способ по одному из предыдущих пунктов, при осуществлении которого в качестве окислителя используют пероксид водорода, гидропероксид алкила или гидропероксид арилалкила. 14. Способ по одному из предыдущих пунктов, при осуществлении которого сначала приготавливают катализатор взаимодействием хирального лиганда с алкоксидом титана(IV) в органическом растворителе, а затем к реакционной смеси добавляют прохиральный сульфид формулы (II). 15. Способ по одному из предыдущих пунктов, при осуществлении которого окисление проводят при температуре порядка -20 С в течение 12-18 ч. 16. Способ по одному из предыдущих пунктов, заключающийся в том, что: а) в реактор загружают смесь хирального бидентатного (R,R)- или (S,S)-1,2-бис-арилэтан-1,2-диола и алкоксида титана(IV) в присутствии органического растворителя,б) к реакционной смеси, полученной на стадии а), добавляют воду,в) к образовавшейся на стадии б) реакционной смеси добавляют прохиральный сульфид формулы (II),г) к реакционной смеси, полученной на стадии в), добавляют окислитель,д) к реакционной смеси, полученной на стадии г), добавляют водный раствор аммиака,е) к водной смеси, полученной на стадии д), добавляют кислоту,ж) водную смесь экстрагируют органическим растворителем,з) органический раствор охлаждают и отфильтровывают выпавший в осадок энантиомер соединения формулы (I) и и) при необходимости требуемый изомер соединения формулы (I) переводят в цинковую соль.
МПК / Метки
МПК: C07D 235/28, C07D 401/12
Метки: смеси, получение, обогащенной, s-энантиомера, омепразола, s-энантиомером, r-энантиомеров, энантиоселективное
Код ссылки
<a href="https://eas.patents.su/9-14818-enantioselektivnoe-poluchenie-s-enantiomera-omeprazola-ili-smesi-s-i-r-enantiomerov-omeprazola-obogashhennojj-s-enantiomerom-omeprazola.html" rel="bookmark" title="База патентов Евразийского Союза">Энантиоселективное получение s-энантиомера омепразола или смеси s- и r-энантиомеров омепразола, обогащенной s-энантиомером омепразола</a>
Предыдущий патент: Применение флавоноидых соединений
Следующий патент: Карбаматные соединения в качестве агонистов рецептора 5-нт4
Случайный патент: Газовыделяющие композиции, уменьшающие вязкость нефти, для возбуждения продуктивного пласта нефтяного коллектора












