Пурины, полезные в качестве ингибиторов mtor киназы, их использование и их фармацевтические композиции
Формула / Реферат
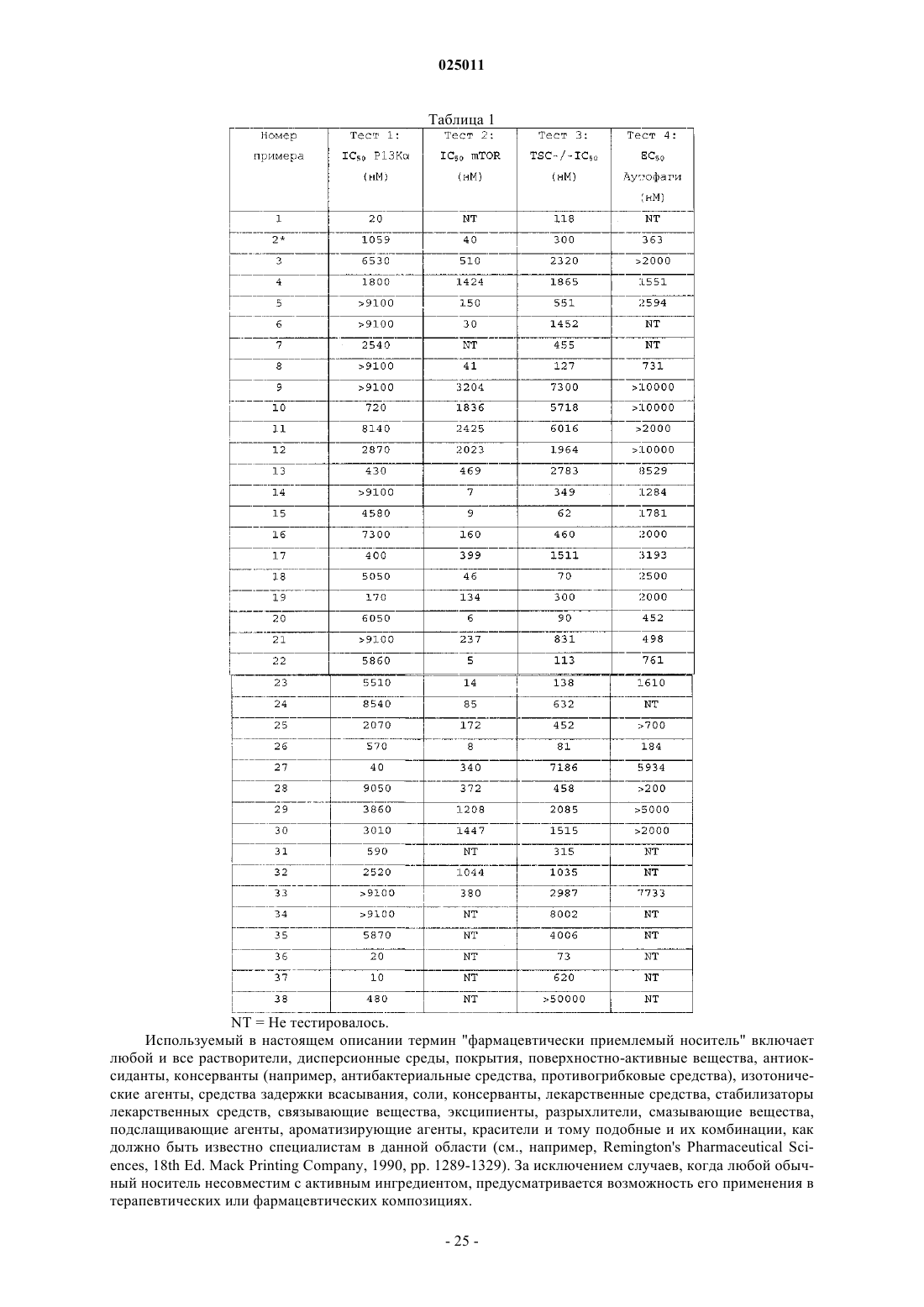
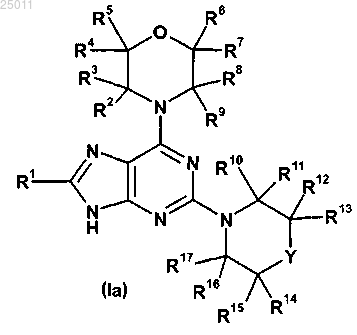
1. Соединение формулы (Ia) или его фармацевтически приемлемая соль
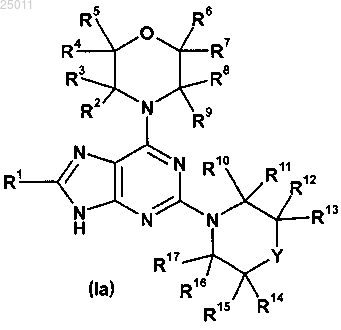
где R1 представляет

где R18 и R22 независимо представляют водород, галоген, гидрокси или гидрокси-C1-3алкил-;
R19 и R21 независимо представляют водород, амино, гидрокси, карбокси, C1-3алкокси, амино-C1-3алкил-,
C1-3алкил-C(=O)-NH-, С1-3алкил-S(=O)m-NH- или гидрокси-C1-3алкил-;
m представляет 0, 1 или 2;
R20 представляет водород, галоген или C1-3алкокси; или
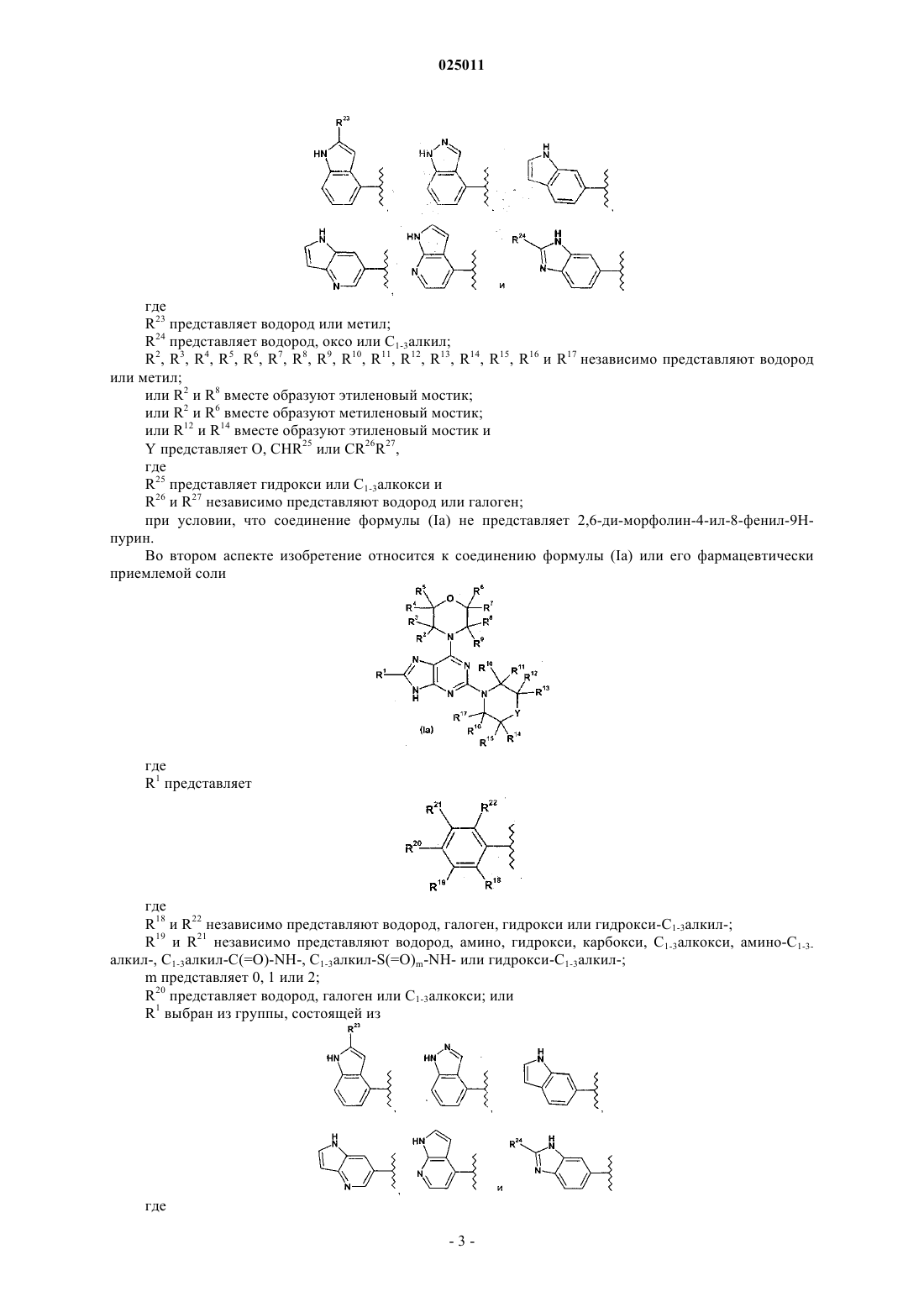
R1 выбран из группы, состоящей из
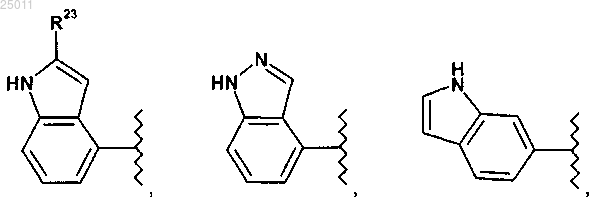
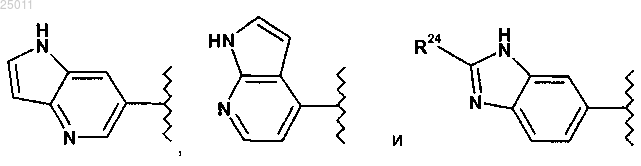
где R23 представляет водород или метил;
R24 представляет водород, оксо или C1-3алкил;
R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16 и R17 независимо представляют водород или метил; или
R2 и R8 вместе образуют этиленовый мостик; или
R2 и R6 вместе образуют метиленовый мостик; или
R12 и R14 вместе образуют этиленовый мостик и
Y представляет О, CHR25 или CR26R27,
где R25 представляет гидрокси или C1-3алкокси и
R26 и R27 независимо представляют водород или галоген;
при условии, что соединение формулы (Ia) не представляет 2,6-диморфолин-4-ил-8-фенил-9Н-пурин.
2. Соединение формулы (Ia) или его фармацевтически приемлемая соль
где R1 представляет
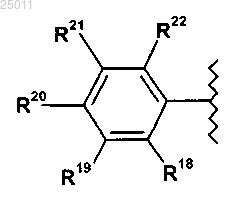
где R18 и R22 независимо представляют водород, галоген, гидрокси или гидрокси-C1-3алкил-;
R19 и R21 независимо представляют водород, амино, гидрокси, карбокси, C1-3алкокси, амино-C1-3алкил-, C1-3алкил-C(=O)-NH-, C1-3алкил-S(=O)m-NH- или гидрокси-C1-3алкил-;
m представляет 0, 1 или 2;
R20 представляет водород, галоген или C1-3алкокси; или
R1 выбран из группы, состоящей из
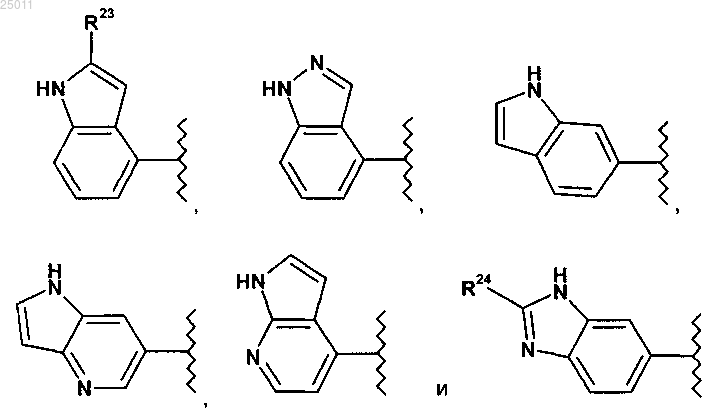
где R23 представляет водород или метил;
R24 представляет водород, оксо или C1-3алкил;
R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16 и R17 независимо представляют водород или метил; или
R5 и R6 вместе образуют этиленовый мостик и
Y представляет О, CHR25 или CR26R27,
где R25 представляет гидрокси или C1-3алкокси и
R26 и R27 независимо представляют водород или галоген;
при условии, что соединение формулы (Ia) не представляет 2,6-диморфолин-4-ил-8-фенил-9Н-пурин.
3. Соединение по п.1 или его фармацевтически приемлемая соль, где R1 представляет
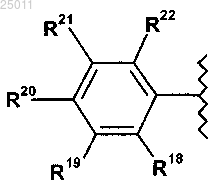
где R18 и R22 независимо представляют водород, галоген, гидрокси или гидрокси-C1-3алкил-;
R19 и R21 независимо представляют водород, амино, гидрокси, карбокси, C1-3алкокси, амино-C1-3алкил-, C1-3алкил-C(=O)-NH-, C1-3алкил-S(=O)m-NH- или гидрокси-C1-3алкил-;
m представляет 0, 1 или 2 и
R20 представляет водород, галоген или C1-3алкокси.
4. Соединение по п.3 или его фармацевтически приемлемая соль, где по меньшей мере один из R18, R19, R20, R21 и R22 не представляет водород.
5. Соединение по п.1 или его фармацевтически приемлемая соль, где R1 выбран из группы, состоящей из
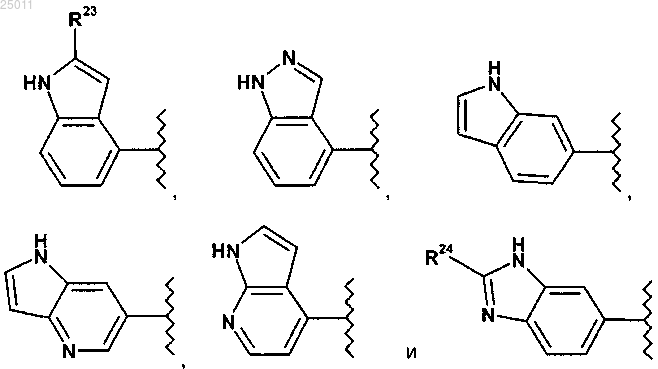
где R23 представляет водород или метил и
R24 представляет водород, оксо или C1-3алкил.
6. Соединение по любому из пп.1-5 или его фармацевтически приемлемая соль, где Y представляет О.
7. Соединение по любому из пп.1-5 или его фармацевтически приемлемая соль, где Y представляет CHR26 или CR27R28.
8. Соединение по п.1 или 2, которое выбрано из
3-[2-((2S,6R)-2,6-диметилморфолин-4-ил)-6-морфолин-4-ил-9H-пурин-8-ил]фенола;
2,6-бис-((S)-3-метилморфолин-4-ил)-8-(1H-пирроло[2,3-b]пиридин-4-ил)-9H-пурина;
{2-фтор-5-[6-((S)-3-метилморфолин-4-ил)-2-морфолин-4-ил-9H-пурин-8-ил]фенил}метанола;
2-(4,4-дифторпиперидин-1-ил)-8-(1H-индол-4-ил)-6-((S)-3-метилморфолин-4-ил)-9H-пурина;
5-[2,6-бис-((S)-3-метилморфолин-4-ил)-9H-пурин-8-ил]-1,3-дигидробензоимидазол-2-она;
{5-[2,6-бис-((S)-3-метилморфолин-4-ил)-9H-пурин-8-ил]-2-метоксифенил}метанола;
8-(1H-индол-4-ил)-2-морфолин-4-ил-6-(8-окса-3-азабицикло[3.2.1]окт-3-ил)-9H-пурина;
2-метокси-5-[6-((S)-3-метилморфолин-4-ил)-2-морфолин-4-ил-9H-пурин-8-ил]бензойной кислоты;
{4-хлор-3-[6-((S)-3-метилморфолин-4-ил)-2-морфолин-4-ил-9H-пурин-8-ил]фенил}метанола;
3-(2,6-диморфолин-4-ил-9H-пурин-8-ил)бензиламина;
1-{3-[6-((S)-3-метилморфолин-4-ил)-2-морфолин-4-ил-9H-пурин-8-ил]фенил}этанола;
2,6-диморфолин-4-ил-8-(1H-пирроло[3,2-b]пиридин-6-ил)-9H-пурина;
8-(1H-индол-6-ил)-2,6-бис-((S)-3-метилморфолин-4-ил)-9H-пурина;
8-(1H-индол-4-ил)-2,6-бис-((R)-3-метилморфолин-4-ил)-9H-пурина;
1-[8-(1H-индол-4-ил)-6-((S)-3-метилморфолин-4-ил)-9H-пурин-2-ил]пиперидин-4-ола;
{3-[2,6-бис-((S)-3-метилморфолин-4-ил)-9H-пурин-8-ил]-5-метоксифенил}метанола;
8-(3H-индол-4-ил)-2-((R)-3-метилморфолин-4-ил)-6-((S)-3-метилморфолин-4-ил)-9H-пурина;
{3-[2,6-бис-((R)-3-метилморфолин-4-ил)-9H-пурин-8-ил]-4-фторфенил}метанола;
8-(1H-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-2-морфолин-4-ил-9H-пурина;
8-(1H-индол-6-ил)-6-((R)-3-метилморфолин-4-ил)-2-морфолин-4-ил-9H-пурина;
8-(1H-индол-4-ил)-2,6-бис-((S)-3-метилморфолин-4-ил)-9H-пурина;
8-(1H-индол-4-ил)-6-((S)-3-метилморфолин-4-ил)-2-морфолин-4-ил-9H-пурина;
8-(1H-индол-6-ил)-6-((S)-3-метилморфолин-4-ил)-2-морфолин-4-ил-9H-пурина;
8-(1H-индол-4-ил)-2-(4-метоксипиперидин-1-ил)-6-морфолин-4-ил-9H-пурина;
8-(1H-индол-4-ил)-2,6-диморфолин-4-ил-9H-пурина;
8-(1H-индазол-4-ил)-2,6-диморфолин-4-ил-9H-пурина;
8-(1H-индол-6-ил)-2,6-диморфолин-4-ил-9H-пурина;
3-(2,6-диморфолин-4-ил-9H-пурин-8-ил)фениламина;
N-[3-(2,6-диморфолин-4-ил-9H-пурин-8-ил)фенил]ацетамида;
8-(2-метил-1H-индол-4-ил)-2,6-диморфолин-4-ил-9H-пурина;
3-[2-((2S,6R)-2,6-диметилморфолин-4-ил)-6-морфолин-4-ил-9H-пурин-8-ил]фениламина;
N-[3-(2,6-диморфолин-4-ил-9H-пурин-8-ил)фенил]метансульфонамида;
{2-[2-((2S,6R)-2,6-диметилморфолин-4-ил)-6-морфолин-4-ил-9H-пурин-8-ил]фенил}метанола;
[2-(2,6-диморфолин-4-ил-9H-пурин-8-ил)фенил]метанола;
3-(2,6-диморфолин-4-ил-9H-пурин-8-ил)фенола;
[3-(2,6-диморфолин-4-ил-9H-пурин-8-ил)фенил]метанола;
2-(2,6-диморфолин-4-ил-9H-пурин-8-ил)фенола;
6-(3,3-диметилморфолин-4-ил)-8-(1H-индол-6-ил)-2-морфолин-4-ил-9H-пурина;
6-(3,3-диметилморфолин-4-ил)-8-(1H-индол-4-ил)-2-мсрфолин-4-ил-9H-пурина;
8-(1H-индол-4-ил)-2-((S)-3-метилморфолин-4-ил)-6-((R)-3-метилморфолин-4-ил)-9H-пурина;
8-(1H-индол-6-ил)-2-((S)-3-метилморфолин-4-ил)-6-((R)-3-метилморфолин-4-ил)-9H-пурина;
8-(1H-индол-6-ил)-2,6-бис-((R)-3-метилморфолин-4-ил)-9H-пурина;
8-(1H-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-2-(8-окса-3-азабицикло[3.2.1]окт-3-ил)-9H-пурина;
8-(1H-индол-4-ил)-2-((R)-3-метилморфолин-4-ил)-6-морфолин-4-ил-9H-пурина;
8-(1H-индол-6-ил)-2-морфолин-4-ил-6-(1S,4S)-2-окса-5-азабицикло[2.2.1]гепт-5-ил-9H-пурина;
8-(1H-индол-4-ил)-2-((S)-3-метилморфолин-4-ил)-6-морфолин-4-ил-9H-пурина;
8-(1H-индол-4-ил)-2-морфолин-4-ил-6-(1S,4S)-2-окса-5-азабицикло[2.2.1]гепт-5-ил-9H-пурина;
8-(1H-индол-6-ил)-6-((S)-3-метилморфолин-4-ил)-2-(8-окса-3-азабицикло[3.2.1]окт-3-ил)-9H-пурина;
8-(1H-индол-4-ил)-6-((S)-3-метилморфолин-4-ил)-2-(8-окса-3-азабицикло[3.2.1]окт-3-ил)-9H-пурина;
8-(1H-индол-6-ил)-2-морфолин-4-ил-6-(3-окса-8-азабицикло[3.2.1]окт-8-ил)-9H-пурина;
8-(1H-индол-4-ил)-2-морфолин-4-ил-6-(3-окса-8-азабицикло[3.2.1]окт-8-ил)-9H-пурина;
и их фармацевтически приемлемых солей.
9. Соединение по п.1, представляющее собой 8-(1H-индол-4-ил)-2,6-бис-((R)-3-метилморфолин-4-ил)-9H-пурин, имеющий следующую формулу:
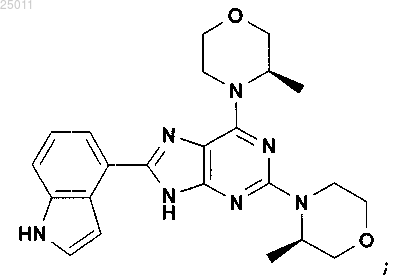
или его фармацевтически приемлемая соль.
10. Соединение по п.1, представляющее собой 8-(2,3-дигидро-1H-индол-4-ил)-2-((S)-3-метилморфолин-4-ил)-6-((R)-3-метилморфолин-4-ил)-9H-пурин, имеющий следующую формулу:
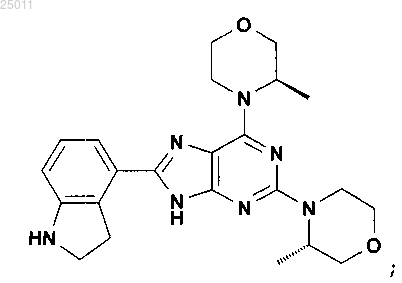
или его фармацевтически приемлемая соль.
11. Соединение по п.1, представляющее собой 8-(1H-индол-4-ил)-2-((S)-3-метилморфолин-4-ил)-6-((R)-3-метилморфолин-4-ил)-9H-пурин, имеющий следующую формулу:
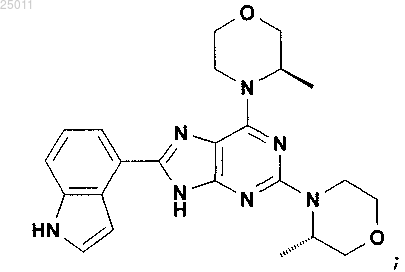
или его фармацевтически приемлемая соль.
12. Соединение по п.1, представляющее собой 8-(1H-индол-4-ил)-6-((R)-3-метилморфолин-4-ил)-2-(8-окса-3-азабицикло[3.2.1]окт-3-ил)-9H-пурин, имеющий следующую формулу:
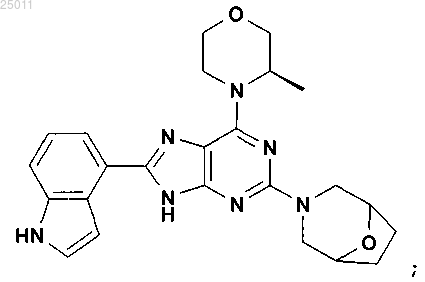
или его фармацевтически приемлемая соль.
13. Применение соединения по любому из пп.1-12 или его фармацевтически приемлемой соли в качестве лекарственного средства для лечения или предотвращения рака или нейродегенеративного расстройства.
14. Применение соединения по любому из пп.1-12 или его фармацевтически приемлемой соли при лечении или предотвращении рака или нейродегенеративного расстройства.
15. Фармацевтическая композиция для лечения или предотвращения рака или нейродегенеративного расстройства, содержащая соединение по любому из пп.1-12 или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент, разбавитель или носитель.
16. Применение соединения по любому из пп.1-12 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения или предотвращения рака или нейродегенеративного расстройства.
Текст
Изобретение относится к новым гетероциклическим соединениям формулы (Iа) в которой все параметры определены в описании, к их получению, к их медицинскому применению,в частности к их применению при лечении рака и нейродегенеративных расстройств, и к лекарственным средствам, содержащим их. 025011 Область, к которой относится изобретение Изобретение относится к пуриновым производным и их фармацевтически приемлемым солям, к способам их получения, к их применению при лечении заболеваний, к их применению или отдельно, или в комбинации по меньшей мере с одним дополнительным терапевтическим средством и, необязательно,в комбинации с фармацевтически приемлемым носителем, для получения фармацевтических препаратов,к применению препаратов для лечения заболеваний и к способу лечения указанных заболеваний, включающему введение пуриновых производных теплокровному животному, в частности человеку. Уровень техники Суперсемейство фосфатидилинозитол-3-киназ (PI3K) включает 4 различных связанных с PI3K липид- или протеинкиназы. I, II и III класс представляют собой липидкиназы, которые отличаются своими субстратными специфичностями, в то время как PI3K IV класса (также называемые PIKK) представляют собой протеинкиназы. Фосфатидилинозитол-3-киназы I класса включают семейство липидкиназ, которые катализируют перенос фосфата в положение D-3' липидов инозитола для получения фосфоинозитол 3-фосфата (PIP), фосфоинозитол-3,4-дифосфата (PIP2) и фосфоинозитол-3,4,5-трифосфата (PIP3), которые, в свою очередь, действуют в качестве вторых мессенжеров в каскадах передачи сигналов стыкующими белками, содержащими гомологию плекстрина, FYVE, Phox и другие связывающие фосфолипиды домены, в разнообразные комплексы передачи сигналов, часто на плазматической мембране Vanhaesebroeck et al., Annu. Rev. Biochem 70:535 (2001); Katso et al., Annu. Rev. Cell Dev. Biol. 17:615 (2001. Из двух PI3K I класса PI3K IA класса представляют собой гетеродимеры, составленные из каталитической субъединицы p110 (изоформы , , ), конститутивно связанные с регуляторной субъединицей, которая может представлять собой p85:, p55, p50, p85 или p55. Подкласс IB класса имеет один член семейства, гетеродимер, составленный из каталитической субъединицы p110, связанной с одной из двух регуляторных субъединиц, p101 или p84 (Fruman et al., Аппи Rev. Biochem. 67:481 (1998); Suire et al., Curr.Biol. 15:566 (2005. Модулярные домены субъединиц p85/55/50 включают домены гомологии Src (SH2),которые связывают остатки фосфотирозина в контексте определенной последовательности на активированном рецепторе и цитоплазматических тирозинкиназах, приводя к активации и определению локализации PI3K IA класса. PI3K IB класса активируется непосредственно связанными G белком рецепторами,которые связывают разнообразный репертуар пептидных и не пептидных лигандов (Stephens et al., Call 89:105 (1997; Katso et al., Annu. Rev. Cell Dev. Biol. 17615-675 (2001. Следовательно, полученные в результате фосфолипидные продукты PI3K I класса связывают обратный каскад реакций с участием рецепторов с прямым каскадом различной клеточной активности, включая пролиферацию, выживание, хемотаксис, клеточную транспортировку, подвижность, метаболизм, воспалительные и аллергические реакции, транскрипцию и трансляцию (Cantley et al., Cell 64:281 (1991); Escobedo и Williams, Nature 335:85(1988); Fantl et al., Cell 69:413 (1992. Во многих случаях PIP2 и PIP3 вовлекают Akt, продукт человеческого гомолога вирусного онкогенаv-Akt, в плазматическую мембрану, где он действует в качестве узловой точки для многих внутриклеточных путей передачи сигналов, важных для роста и выживания (Fantl et al., Cell 69:413-423 (1992); Bader et al., Nature Rev. Cancer 5:921 (2005); Vivanco и Sawyer, Nature Rev. Cancer 2:489 (2002. Аберрантная регуляция PI3K, которая часто увеличивает выживание посредством активации Akt, является одним из наиболее распространенных явлений при раке у людей, и было показано, что она возникает на множественных уровнях. Опухолевый суппрессорный ген PTEN, который дефосфорилирует фосфоинозитиды в положении 3' инозитольного кольца, и, благодаря этому, является антагонистом активности PI3K, функционально делетируется при разнообразных опухолях. При других опухолях гены изоформы p110,PIK3CA и Akt амплифицируются, и увеличенная экспрессия белка их генных продуктов была продемонстрирована при нескольких видах рака у людей. Кроме того, мутации и транслокации p85, которые служат для стимуляции комплекса p85-p110, были описаны при различных формах рака у людей. Также при широком разнообразии форм рака у людей были описаны соматические бессмысленные мутации вPIK3CA, которые активируют пути прямого каскада передачи сигналов (Karg et al., Proc. Natl. Acad. Sci.USA 102:802 (2005); Samuels et al., Science 304:554 (2004); Samuels et al., Cancer Cell 7:561-573 (2005. Эти наблюдения показывают, что нарушение регуляции фосфоинозитол-3-киназы и находящихся выше и ниже по ходу транскрипции компонентов этого пути передачи сигналов представляет собой один из наиболее распространенных видов нарушения регуляции, связанных с различными формами рака и пролиферативными заболеваниями у людей (Parsons et al., Nature 436:792 (2005); Hennessey et al., Nature Rev.Drug Disc. 4:988-1004 (2005. Мишенью рапамицина у млекопитающих (mTOR) является член PI3K IV класса. mTOR собирает сеть передачи сигналов, которая передает сигналы о содержании питательных веществ и различные другие стимулы для регуляции широкого диапазона клеточных функций, включая рост, пролиферацию, выживание, аутофагию, различные типы дифференциации и метаболизма клеток. Обнаруживается, что в клетках млекопитающих белок mTOR образует комплексы в двух различных сущностях, называемыхmTORC1 и mTORC2. Комплекс mTORC1, то есть mTOR, связанный с раптором, был предметом многочисленных исследований. Именно mTORC1 интегрирует входные сигналы о содержании питательных-1 025011 веществ и факторов роста и является, в свою очередь, ответственным за регуляцию клеточного роста,главным, образом, через регуляторы синтеза белка, такие как 4 ЕВР 1 или RPS6. Регуляция mTORC1 требует для активации активацию PI3K и Akt, и это значит, что mTORC1 представляет собой эффектор путиAkt фосфорилированием S473 (нумерация Akt 1) (Sarbasscv et al., Science 307:7098 (2005. Следовательно, в данном случае mTORC2 считается активатором обратного каскада реакций Akt. Представляет интерес, что mTOR может поэтому считаться важным и выше, и ниже по ходу транскрипции от Akt. Поэтому каталитическое ингибирование mTOR может представлять уникальный путь воздействия на очень сильный блок в пути PI3K-Akt путем воздействия на эффекторы обратного и прямого каскада реакций. Была также продемонстрирована связь между ингибированием mTCR и аутофагией (Ravikumar etal., Wat Genet. 36(6): 585-95 (2004. Аутофагия существенна для нейронного гомеостаза, и ее дисфункция связывалась с нейродегенерацией. Утрата аутофагии у нейронов вызывает нейродегенеративные заболевания у мышей (Komatsu et al., Nature 441:880-4 (2006); Hara et al., Nature 441:385-9 (2006, свидетельствуя о решающей роли аутофагии для поддержания белкового гомеостаза в нейронах. Нейродегенеративные заболевания характеризуются включениями неправильно упакованных белков как одного из характерных признаков. Индукция аутсфагии усиливает выведение неправильно упакованных белков и, таким образом, предложена в качестве лечения по поводу нейродегенеративных протеинопатий. Болезнь Хантингтона (HD) представляет собой аутосомальное доминантное нейродегенеративнэе расстройство, при котором мутация гена IT15, кодирующего белок Хантингтона (Htt), ведет к распространению полиглутамина в Exon1 Htt. Внутриклеточная агрегация этого мутантного белка Htt и атрофия мозга (в частности, коры и полосатого тела) являются основными характерными признаками HD. Она клинически ведет к нарушению двигательной функции и когнитивной функции, кроме психиатрических расстройств и потери массы тела. Ингибирование mTOR вызывает аутофагию и уменьшает агрегацию мутантного Htt и опосредованную мутантным Ht гибель клеток на моделях HD in vitro и in vivo (Ravikumar et al., Nat: Genet. 36(6):58595 (2004. Поэтому ингибирование mTOR предоставляет возможность фармацевтического вмешательства и модуляции прерванных клеточных процессов, характерных для HD. В связи с указанным выше считают, что ингибиторы PI3K I класса и mTOR представляют ценность при лечении пролиферативных заболеваний и других расстройств, в частности, HD. Настоящее изобретение относится к новым пуриновым производным, обладающим ингибиторной активностью в отношении PI3K I класса и/или mTOR, их получению, медицинскому применению и лекарственным средствам, содержащим их. Краткое описание сущности изобретения В первом аспекте изобретение относится к соединению (Ia) или его фармацевтически приемлемой соли, гдеR23 представляет водород или метил;R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16 и R17 независимо представляют водород или метил; или R2 и R8 вместе образуют этиленовый мостик; или R2 и R6 вместе образуют метиленовый мостик; или R12 и R14 вместе образуют этиленовый мостик иR25 представляет гидрокси или C1-3 алкокси иR26 и R27 независимо представляют водород или галоген; при условии, что соединение формулы (Ia) не представляет 2,6-ди-морфолин-4-ил-8-фенил-9Hпурин. Во втором аспекте изобретение относится к соединению формулы (Ia) или его фармацевтически приемлемой солиR23 представляет водород или метил;R2, R3, R4, R5, R6, R7, R8, R9, Rl0, R11, R12, R13, R14, R15, R16 и R17 независимо представляют водород или метил или R5 и R6 вместе образуют этиленовый мостик; иR25 представляет гидрокси или C1-3 алкокси иR26 и R27 независимо представляют водород или галоген; при условии, что соединение формулы (Ia) не представляет 2,6-ди-морфолин-4-ил-8-фенил-9Hпурин. Определения Используемый в настоящем описании термин "галоген" или "галоид" относится к фтору, хлору,брому и йоду. Используемый в настоящем описании термин "C1-3 алкил" относится к полностью насыщенной разветвленной или неразветвленной углеводородной составляющей части, имеющей до 3 атомов углерода. Репрезентативные примеры C1-3 алкила включают метил, этил, н-пропил и изопропил. Используемый в настоящем описании термин "C1-3 алкокси" относится к C1-3 алкил-О-, где C1-3 алкил представляет, как определено выше в настоящем описании. Репрезентативные примеры C1-3 алкокси включают метокси, этокси, пропокси и 2-пропокси. Используемый в настоящем описании термин "гидрокси-C1-3 алкил" относится к C1-3 алкильной группе, как определено выше в настоящем описании, где один из атомов водорода C1-3 алкильной группы заменен OH. Репрезентативные примеры гидрокси-C1-3 алкила включают, без ограничения, гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил и 3-гидроксипропил. Используемый в настоящем описании термин "амино-C1-3 алкил" относится к C1-3 алкильной группе,как определено выше в настоящем описании, где один из атомов водорода C1-3 алкильной группы заменен первичной аминогруппой. Репрезентативные примеры гидрокси-C1-3 алкила включают, без ограничения,аминометил, 2-аминоэтил, 2-аминопропил и 3-аминопропил. Подробное описание изобретения Настоящее изобретение относится к соединениям и их фармацевтическим препаративным формам,которые могут применяться при лечении или профилактике заболеваний, состояний и/или расстройств,модулируемых ингибированием PI3K I класса и/или mTOR. Вариант осуществления 1: соединение формулы (Ia) или его фармацевтически приемлемая соль, как описано выше в настоящей заявке. Вариант осуществления 2: соединение формулы (Ia) или его фармацевтически приемлемая соль, как описано выше в настоящей заявке. Вариант осуществления 3: соединение в соответствии с любым вариантом осуществления 1-2 или его фармацевтически приемлемая соль, где R1 представляетR20 представляет водород, галоген или C1-3 алкокси. Вариант осуществления 4: соединение в соответствии с вариантом осуществления 3 или его фармацевтически приемлемая соль, где по меньшей мере один из R18, R19, R20, R21 и R22 не представляет водород. Вариант осуществления 5: соединение в соответствии с любым вариантом осуществления 1-3 или его фармацевтически приемлемая соль, где R1 выбран из группы, состоящей изR23 представляет водород или метил иR24 представляет водород, оксо или C1-3 алкил. Вариант осуществления 6: соединение в соответствии с любым вариантом осуществления 1-5 или его фармацевтически приемлемая соль, где Y представляет O. Вариант осуществления 7: соединение в соответствии с любым вариантом осуществления 1-3 или его фармацевтически приемлемая соль, где Y представляет CHR26 или CR27R28. Вариант осуществления 8: соединение в соответствии с вариантом осуществления 1 или вариантом осуществления 2, которое выбрано из и их фармацевтически приемлемых солей. Вариант осуществления 9: соединение в соответствии с вариантом осуществления 1 или вариантом осуществления 2, которое выбрано из и их фармацевтически приемлемых солей. За счет одного или более чем одного асимметричного атома углерода, который может присутствовать в соединении формулы (Ia), соответствующее соединение формулы (Ia) может существовать в чистой оптически активной форме или в форме смеси оптических изомеров, например в форме рацемиче- 13025011 ской смеси. Все из таких чистых оптических изомеров и все из их смесей, включая рацемические смеси,являются частью настоящего изобретения. Используемый в настоящем описании термин "изомеры" относится к различным соединениям, которые имеют одинаковую молекулярную формулу, но отличаются расположением и конфигурацией атомов. Также используемый в настоящем описании термин "оптический изомер" или "стереоизомер" относится к любой из различных стереоизомерных конфигураций, которые могут существовать для данного соединения по настоящему изобретению, и включает геометрические изомеры. Понятно, что заместитель может быть присоединен в хиральном центре атома углерода. Термин "хиральный" относится к молекулам, которые имеют свойство невозможности наложения на представляющего их зеркальное изображение партнера, хотя термин "ахиральный" относится к молекулам, которые могут накладываться на представляющего их зеркальное изображение партнера. Поэтому изобретение включает энантиомеры, диастереомеры или рацематы соединения. "Энантиомеры" представляют собой пару стереоизомеров, которые представляет собой не накладываемые зеркальные изображения друг друга. Смесь 1:1 пары энантиомеров представляет собой "рацемическую" смесь. Этот термин при целесообразности используется для обозначения рацемической смеси. "Диастереоизомеры" представляют собой стереоизомеры, которые имеют по меньшей мере два асимметричных атома, но которые не являются зеркальными изображениями друг друга. Абсолютная стереохимия определяется; в соответствии с системой R-S Кана-ИнголдаПрелога. Когда соединение представляет собой чистый энантимомер, то стереохимия при каждом из хиральных атомов углерода может быть определена или как R, или как S. Разделенные соединения, абсолютная конфигурация которых неизвестна, могут быть обозначены (+) или (-) в зависимости от направления (право- или левовращающие), в котором они вращают плоскость поляризованного света при длине волны D-линии натрия. Определенные соединения, описанные в настоящей заявке, содержат один или более асимметричных центров или осей, и, таким образом, могут вызвать появление энантиомеров, диастереомеров и других стереоизомерных форм, которые могут быть определены с точки зрения абсолютной стереохимии как (R) - или (S)-. В зависимости от выбора исходных материалов и процедур соединения могут присутствовать в форме одного из возможных изомеров или в виде их смесей, например, в виде чистых оптических изомеров, или в виде смесей изомеров, таких как рацематы и смеси диастереоизомеров, в зависимости от числа асимметрических атомов углерода. Подразумевается, что настоящее изобретение включает все такие возможные изомеры, включая рацемические смеси, диастереомерные смеси и оптически чистые формы. Оптически активные (R)- и (S)-изомеры могут быть получены с использованием хиральных синтонов или хиральных реагентов, или разделены с использованием обычных технологий. Если соединение содержит двойную связь, то заместитель может быть конфигурации E или Z. Если соединение содержит дизамещенный циклоалкил, то заместитель циклоалкила может иметь цис- или транс-конфигурацию. Возможно также существование промежуточных соединений и соединений по настоящему изобретению в различных таутомерных формах, и все такие формы входят в объем изобретения. Термин "таутомер" или "таутомерная форма" относится к структурным изомерам с различной энергией, которые являются взаимопревращаемыми через низкоэнергетический барьер. Например, протонные таутомеры(также известные как прототропные таутомеры) включают интерконверсии посредством миграции протона, такие как кето-енольные и имин-енаминные изомеризации. Конкретным примером протонного таутомера является имидазольная часть, где протон может мигрировать между двумя кольцевыми атомами азота. Валентные таутомеры включают интерконверсии реорганизациями некоторых из связывающих электронов. Любые полученные в результате смеси изомеров могут быть разделены на основе физикохимических различий компонентов на чистые или, по существу, чистые геометрические или оптические изомеры, диастереомеры, рацематы, например, хроматографией и/или фракционной кристаллизацией. Любые полученные в результате рацематы конечных продуктов промежуточных соединений могут быть разделены на оптические антиподы известными способами, например, разделением их диастереомерных солей, полученных с оптически активной кислотой или основанием, и освобождением оптически активного кислотного или основного соединения. В частности, основная часть может, таким образом,использоваться для разделения соединений по настоящему изобретению на их оптические антиподы,например, фракционной кристаллизацией соли, образованной с оптически активной кислотой, например,винной кислотой, дибензоилвинной кислотой, диацетилвинной кислотой, ди-O,O'-п-толуолвинной кислотой, миндальной кислотой, яблочной кислотой или камфор-10-сульфоновой кислотой. Рацемические продукты могут быть также разделены хиральной хроматографией, например, высокоэффективной жидкостной хроматографией (ВЭЖХ) с использованием хирального адсорбента. Используемый в настоящем описании термин "соль" или "соли" относится к кислотно-аддитивной или основно-аддитивной соли соединения по изобретению. "Соли" включают, в частности, "фармацевтически приемлемые соли". Термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют биологическую эффективность и свойства соединений по настоящему-изобретению и которые обычно не являются биологически или иным образом нежелательными. Во многих случаях соединения по настоящему изобретению способны образовывать кислые и/или основные соли за счет присутствия- 14025011 амино и/или карбоксильной групп или групп, подобных им. В одном варианте осуществления изобретение относится к соединению формулы (Ia), как определено в настоящем описании, в свободной форме. В другом варианте осуществления изобретение относится к соединению формулы (Ia), как определено Е настоящем описании, в форме соли. В другом варианте осуществления изобретение относится к соединению формулы (Ia), как определено в настоящем описании, в форме кислотно-аддитивной соли. В еще одном варианте осуществления изобретение относится к соединению формулы (Ia), как определено в настоящем описании, в форме фармацевтически приемлемой соли. В еще одном варианте осуществления изобретение относится к любому соединению примеров в свободной форме. В еще одном варианте осуществления изобретение относится к любому соединению примеров в форме соли. В еще одном варианте осуществления изобретение относится к любому соединению примеров в форме кислотно-аддитивной соли. В еще одном варианте осуществления изобретение относится к любому соединению примеров в фармацевтически приемлемой соли. Фармацевтически приемлемые кислотно-аддитивные соли могут быть образованы с неорганическими кислотами и органическими кислотами, например, ацетат, аспартат, бензоат, бесилат, бромид/гидробрмид, бикарбонат/карбонат, бисульфат/сульфат, камфорсульфонат, хлорид/гидрохлорид,хлортеофиллонат, цитрат, этандисульфонат, фумарат, глюцептат, глюконат, глюкуронат, гиппурат, гидройодид/йодид, изетионат, лактат, лактобионат, лаурилсульфат, малат, малеат, малонат, манделат, месилат, метилсульфат, нафтоат, напсилат, никотинат, нитрат, октадеканоат, олеат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, полигалактуронат, пропионат, стеарат, сукцинат, сульфосалицилат, тартрат, тосилат и трифторацетат. Неорганические кислоты, из которых могут быть получены соли, включают, например, хлористоводородную кислоту, бромисто-водородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и тому подобные. Органические кислоты, из которых могут быть получены соли, включают, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, толуолсульфоновую кислоту, сульфосалициловую кислоту и тому подобные. Фармацевтически приемлемые основноаддлтивные соли могут быть образованы с неорганическими и органическими основаниями. Неорганические основания, из которых могут быть получены соли, включают, например, соли аммония и металлов из колонок с I по XII периодической таблицы. В определенных вариантах осуществления соли получены из натрия, калия, аммония, кальция, магния, железа, серебра, цинка и меди, особенно подходящие соли включают соли аммония, калия, натрия, кальция и магния. Органические основания, из которых могут быть получены соли включают, например, первичные,вторичные и третичные амины, замещенные амины, включая естественно встречающиеся замещенные амины, циклические амины, основные ионообменные смолы и тому подобные. Определенные органические амины включают изопропиламин, бензатин, холинат, диэтаноламин, диэтиламин, лизин, меглумин,пиперазин и трометамин. Фармацевтически приемлемые соли по настоящему изобретению могут быть синтезированы из основной или кислотной части обычными химическими способами. В целом, такие соли могут быть получены взаимодействием форм свободной кислоты этих соединений со стехиометрическим количеством соответствующего основания (такого как гидроксид, карбонат, бикарбонат Na, Ca, Mg или K или тому подобные), или взаимодействием форм свободного основания этих соединений со стехиометрическим количеством соответствующей кислоты. Такие реакции обычно проводятся в воде или в органическом растворителе, или в смеси этих двух сред. В целом, если это осуществимо, желательно использование неводных сред, таких как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил. Перечисления дополнительных подходящих солей могут быть найдены, например, в "Remington's PharmaceuticalProperties, Selection, and Use", Stahl и Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Кроме того, соединения по настоящему изобретению, включая их соли, могут быть также получены в форме их гидратов или включают другие растворители, используемые для их кристаллизации. Соединения по настоящему изобретению могут ввиду присущих им свойств или приданной конструкции образовывать сольваты с фармацевтически приемлемыми растворителями (включая воду); поэтому предполагается, что изобретение включает и сольватированные, и несольватированные формы. Термин "сольват" относится к молекулярному комплексу соединения по настоящему изобретению (включая их фармацевтически приемлемые соли) с одной или более молекулами растворителя. Такие молекулы растворителя представляют собой те, которые обычно используются в фармацевтической области, которые, как известно, безвредны для реципиента, например, воду, этанол и тому подобные. Термин "гидрат" относится к комплексу, где молекула растворителя представляет собой воду. Соединения по изобретению, т.е. соединения формулы (Ia), которые содержат группы, способные действовать в качестве доноров и/или акцепторов водорода, могут быть способны образовывать соединения, образующие сокристаллы. Эти сокристаллы могут быть получены из соединений формулы (Ia)- 15025011 известными формирующими сокристаллы процедурами. Такие процедуры включают помол, нагревание,совместную сублимацию, совместное расплавление или обеспечение контакта в растворе соединений формулы (Ia) с соединением, образующим сокристаллы, в условиях кристаллизации и выделение образованных посредством этого сокристаллов. Подходящие соединения, образующие сокристаллы, включают те, которые описаны в документе WO 2004/078163. Следовательно, изобретение, кроме того, относится к сокристаллам, включающим соединение формулы (Ia). Соединения по настоящему изобретению, включая их соли, гидраты и сольваты, могут взиду присущих им свойств или приданной конструкции образовывать полиморфы. Любая формула, приведенная в настоящем описании, также предназначена для представления немеченых форм соединений, а также: изотопически меченных форм соединений. Изотопически меченные соединения имеют структуры, изображенные формулами, приведенными в настоящем описании, за исключением того, что один или более атомов заменены атомом, имеющим выбранную атомную массу или массовое число. Примеры изотопов, которые могут быть включены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2 Н, 3 Н, 11C, 13C,14C, 15N, 18F, 31 Р, 32P, 35S, 3SCl, 125I, соответственно. Изобретение включает различные изотопически меченные соединения, как определено в настоящем описании, например, те, в которых присутствуют радиоактивные изотопы, такие как 3 Н и 14 С, или те, в которых присутствуют нерадиоактивные изотопы,такие как 2 Н и 13 С. Такие изотопически меченные соединения могут использоваться в метаболических исследованиях (с 14 С), реакционных кинетических исследованиях (например, с 2 Н или 3 Н), методиках выявления и получения изображения, таких как позитронно-эмиссионная томография (PET) или одиночнофотонная эмиссионная компьютерная томография (SPECT), включая анализы тканевого распределения лекарственных веществ или субстратов, или при радиоактивном лечении пациентов. В частности, 18F или меченое соединение может быть особенно желательно для исследований PET или SPECT. Изотопически меченные соединения формулы (Ia) могут быть в целом получены обычными технологиями, известными специалистам в данной области, или способами, аналогичными способам, описанным в сопровождающих Примерах и Способах получения, с использованием соответствующих изотопически меченных реагентов вместо ранее используемого немеченого реагента. Кроме того, замещение более тяжелыми изотопами, в частности дейтерием. (т.е. 2 Н или D), может обеспечить определенные терапевтические преимущества в результате большей метаболической устойчивости, например, увеличенного периода полувыведения in vivo или сниженных требований дозировки или улучшения терапевтического индекса. Понятно, что в этом контексте дейтерий рассматривается как заместитель соединения формулы (Ia). Концентрация такого более тяжелого изотопа, в частности дейтерия, может быть определен фактором изотопного обогащения. Используемый в настоящем описании термин "фактор изотопного обогащения" означает соотношение между изотопным избытком и натуральным обилием определенного изотопа. Если заместитель в соединении по настоящему изобретению обозначен как дейтерий, то такое соединение имеет фактор изотопного обогащения для каждого обозначенного атома дейтерия по меньшей мере 3500 (включение дейтерия 52,5% у каждого обозначенного атома дейтерия), по меньшей мере 4000 (включение дейтерия 60%), по меньшей мере 4500 (включение дейтерия 67,5%), по меньшей мере 5000 (включение дейтерия 75%), по меньшей мере 5500 (включение дейтерия 82,5%), по меньшей мере 6000 (включение дейтерия 90%), по меньшей мере 6333,3 (включение дейтерия 95%), по меньшей мере 6466,7 (включение дейтерия 97%), по меньшей мере 6600 (включение дейтерия 99%) или по меньшей мере 6633,3 (включение дейтерия 99,5%). Фармацевтически приемлемые сольваты в соответствии с изобретением включают те, в которых растворитель кристаллизации может быть изотопно замещен, например, D2O, d6-ацетон, d6-DMSO (диметилсульфоксид). Соединения по настоящему изобретению могут быть синтезированы синтетическими путями, которые включают способы, аналогичные тем, которые хорошо известны в химических областях, в частности, в свете описания, содержащегося в настоящей заявке. Исходные материалы в целом доступны из коммерческих источников, таких как компания Aldrich Chemicals (Milwaukee, Wis.), или они могут быть легко получены с использованием способов, хорошо известных специалистам в данной области (например, получены способами, в целом описанных способами, в целом описанными в Louis F. Fieser and Maryder organischen Chemie, 4, Aufl. ed. Springer-Verlag, Berlin, включая дополнения (также доступные через базу данных Beilstein online. В целях иллюстрации, изображенные ниже схемы реакций представляют возможные пути синтеза соединений по настоящему изобретению, также ключевых промежуточных соединений. Более подробное описание отдельных стадий реакций содержится в представленном ниже разделе Примеры. Специалистам в данной области понятно, что для синтеза соединений по изобретению могут использоваться другие пути синтеза. Хотя определенные исходные материалы и реагенты изображены в схемах и обсуждаются ниже, легко может быть произведено замещение другими исходными материалами и реагентами для обеспечения разнообразных производных и/или условий реакции. К тому же, многие из соединений,полученных способами, описанными ниже, могут быть дополнительно модифицированы в свете настоя- 16025011 щего описания с использованием обычных химических приемов, хорошо известных специалистам в данной области. В еще одном аспекте изобретение относится к способу получения соединения формулы (Ia), в свободной форме или в виде фармацевтически приемлемой соли, включающему реакцию соединения формулы (IIa) в которой R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16 и R17 представляют, как определено для формулы (I), с соединением формулы (III) или (IV) в которых R1 представляет, как определено для формулы (Ia), и затемi) необязательное восстановление, окисление или другая функционализация полученного соединения,ii) отщепление любой присутствующей защитной группы (групп),iii) извлечение получаемого соединения формулы (Ia) в свободной форме или в форме фармацевтически приемлемой соли и/илиiv) необязательное разделение смесей оптически активных изомеров на их отдельные оптически активные изомерные формы. Реакции могут осуществляться в соответствии с обычными способами. Например, реакция, описанная выше на стадии (a), может проводиться в присутствии подходящего металлического катализатора,например, тетракис(трифенилфосфин)палладия, подходящего основания, например, фторида цезия, подходящего растворителя, например, ацетонитрила/воды и при подходящей температуре, например от 50 до 150C, более подходяще от 90 до 130C. Реакция, описанная выше на стадии (b), может проводиться в присутствии подходящего катализатора, например, ацетата палладия(II), подходящего окислителя, например, ацетата меди(II), подходящего растворителя, например, уксусной кислоты, и при подходящей температуре, например, от 0 до 50C, или более подходяще, при комнатной температуре. Пока контекст не указывает иного, в пределах объема настоящего текста защитной группой обозначается только легко удаляемая группа, которая не является ингредиентом конкретного желательного конечного продукта соединения по настоящему изобретению. Защита функциональных групп такими защитными группами, сами функциональные группы и реакции их отщепления описаны, например, в стандартно цитируемых работах, таких как J.F.W. McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London и New York 1973, в Т. W. Greene and P G. M. Wuts, "Protective Groups in Organic Synthesis", Third edition, Wiley, New York 1999, in "The Peptides"; vol. 3 (editors: E. Gross and J. Meienhofer),Academic Press, London and New York 1981 в "Methoden der organischen Chemie" (Methods of OrganicChemistry), Houben Weyl, 4th edition, Volume 15/I, Georg Thieme Verlag, Stuttgart 1974, в H.-D. Jakubke и Н. Jeschkeit, "Aminosuren, Peptide, Proteine" (Amino acids, Peptides, Proteins), Verlag Chemie, Weinheim,Deerfield Beach, и Basel 1982, и в Jochen Lehmann, "Chemie der Kohlenhydrate: Monosaccharide und Derivate" (Chemistry of Carbohydrates: Monosaccharides and Derivatives), Georg Thieme Verlag, Stuttgart 1974. Свойством защитных групп является тс, что они могут быть легко удалены (т.е. без возникновения нежелательных вторичных реакций) например, сольволизом, восстановлением, фотолизом или, альтернативно, в физиологических условиях (например, ферментным расщеплением). Соли соединений по настоящему изобретению, имеющие по меньшей мере одну образующую соль группу, могут быть получены способом, известным специалистам в данной области. Например, соли соединений по настоящему изобретению, имеющие кислотные группы, могут быть образованы, например,обработкой соединений соединениями металлов, такими как соли щелочных металлов подходящих органических карбоновых кислот, например, натриевой солью 2-этилгексаноевой кислоты, органическими соединениями щелочных металлов или щелочно-земельных металлов, такими как соответствующие гид- 17025011 роксиды, карбонаты или гидрокарбонаты, такие как гидроксид натрия или калия, карбонаты или гидрокарбонаты, соответствующими соединениями кальция или аммиаком или подходящим органическим амином, причем предпочтительно используются стехиометрические количества или лишь небольшой избыток образующего соль агента. Кислотно-аддитивные соли соединений по настоящему изобретению получают общепринятым образом, например, обработкой соединений кислотой или подходящим аниснообменным реагентом. Внутренние соли соединений по настоящему изобретению, содержащие группы,образующие кислотные и основные соли, например, свободную карбоксигруппу и свободную аминогруппу, могут быть образованы, например, нейтрализацией солей, таких как кислотно-аддитивные соли,до изоэлектрической точки, например, слабыми основаниями, или обработкой ионообменкиками. Соли могут быть превращены в свободные соединения в соответствии со способами, известными специалистам в данной области. Соли металлов и аммония могут быть превращены, например, обработкой подходящими кислотами и кислотно-аддитивными солями, например, обработкой подходящим основным агентом. Для тех соединений, которые содержат асимметричный атом, соединения существуют в отдельных оптически активных изомерных формах или в виде их смесей, например, в виде рацемических или диастереомерных смесей. Настоящее изобретение включает и отдельные оптически активные R- и Sизомеры, а также смеси, например, их рацемические или диастереомерные смеси. Кроме того, настоящее изобретение включает все геометрические и позиционные изомеры. Например, если соединение по настоящему изобретению включает двойную связь или конденсированное кольцо, то и цис-, и трансформы, а также смеси входят в объем изобретения. Диастереомерные смеси могут быть разделены на их отдельные диастереоизомеры на основании их физико-химических различий способами, хорошо известными специалистам з данной области, такими как хроматография и/или фракционная кристаллизация. Энантиомеры могут разделяться превращением энантиомерных смесей в диастереомерную смесь взаимодействием с соответствующим оптически активным соединением (например, хиральным вспомогательным соединением, таким как хиральный спирт или хлорид кислоты Мошера), разделением диастереизомеров и превращением (например, гидролизом) отдельных диастереизомеров в соответствующие чистые энантиомеры. Также, некоторые из соединений по настоящему изобретению могут представлять собой атропизомеры (например, замещенные биарилы) и считаются частью настоящего изобретения. Энантиомеры могут также разделяться использованием имеющейся в продаже хиральной колонки ВЭЖХ. Изобретение, кроме того, включает любой вариант настоящих способов, в которых промежуточный продукт, получаемый на любой его стадии, используется в качестве исходного материала, и проводятся остающиеся стадии, или в которых исходные материалы образуются in situ в условиях реакции, или в которых компоненты реакции используются в форме их солей или оптически чистого материала. Соединения по изобретению и промежуточные продукты могут быть также превращены друг в друга в соответствии со способами, в целом известными специалистам в данной области. В целях иллюстрации, в изображенных ниже схемах реакции представлены потенциальные пути синтеза соединений по настоящему изобретению, а также промежуточных соединений. Более подробное описание отдельных стадий реакции представлено ниже в разделе Примеры. Специалистам в данной области понятно, что для синтеза соединений по изобретению могут использоваться другие пути синтеза. Хотя определенные исходные материалы и реагенты изображены на схемах и обсуждаются ниже, они могут легко замещаться другими исходными материалами и реагентами для получения разнообразных производных и/или условий реакций. Кроме того, многие из соединений, полученных способами, описанными ниже, могут дополнительно модифицироваться в свете настоящего описания: с использованием обычных химических процедур, хорошо известных специалистам в данной области.- 18025011 Схема 1. Общая процедура 1 для синтеза пуриновых соединений В целом, соединения формулы Ia могут быть получены в соответствии со схемой 1 в четыре стадии,начиная с имеющегося в продаже промежуточного соединения V. Что касается отдельных стадий на показанной выше схеме, то первая стадия включает получение промежуточного соединения VII замещением хлора нуклеофилом, таким как функционализированное морфолино промежуточное соединение VI. Промежуточное соединение IX может быть получено взаимодействием промежуточного соединения VII с промежуточным соединением VIII в присутствии адекватного основания, такого как диизопропилэтиламиновый растворитель, такой как диметилацетамид, и нагревание. Третья стадии включает бромирование промежуточного соединения IX в промежуточное соединение IIa, которое может осуществляться с использованием брома в соответствующем растворителе, таком как дихлорметан. Целевые соединения структуры Ia могут быть получены соединением промежуточного соединения II с разнообразными имеющимися в продаже или синтезированными борными кислотами или сложными эфирами структуры III или IV с использованием металлического катализатора, наиболее часто иллюстрируемыми имеющимися в продаже палладиевыми комплексами. Схема 2. Общая процедура для синтеза сложных эфиров борной кислоты. Сложные эфиры борной кислоты формулы IV могут быть получены в соответствии со схемой 2 в одну стадию, где R1 представляет, как описано в формуле (Ia). Стадия включает взаимодействие замещенного арилбромида или гетероарилбромида формулы XIII с бис(пинаколато)дибором в присутствии имеющегося в продаже палладиевого катализатора, растворителя, такого как диоксан, при температуре в диапазоне от 80 до 120C. Соединения формулы (Ia), в свободной форме или в форме фармацевтически приемлемой соли, далее в настоящем описании часто именуемые "агентами по изобретению", проявляют ценные фармакологические свойства при тестировании in vitro и поэтому могут применяться в лекарственных средствах при лечении или для использования в качестве химических соединений для исследований, например в качестве соединений-инструментов. Агенты по изобретению представляют собой ингибиторы PI3K I класса и mTOR. Ингибиторные свойства соединения по изобретению в отношении PI3K I класса и mTOR можно оценить в тестах, описанных ниже в настоящей заявке.- 19025011 Биологические анализы Тест 1: Анализ PI3 киназы Анализ PI3K-киназы методом KinaseGlo: 50 нл разведений соединения подавали на черные 384 луночные низкообъемные не связывающие стирол (NBS) планшеты ( по каталогу Costar NBS3676). La-фосфатидилинозит (PI), представленный в виде раствора 10 мг/мл в метаноле, переносили в стеклянную пробирку и сушили в потоке азота. Затем его суспендировали в 3% октилглюкозиде (OG) перемешиванием вихревой мешалкой и хранили при 4C. Люминесцентный анализ киназы методом KinaseGlo(Prornega, Madison/WI, USA) представляет собой гомогенный высокоэффективный способ (HTS) измерения активности киназы количественным определением АТФ, остающегося в растворе после реакции киназы. Добавляли 5 мкл смеси PI/OG с подтипом PI3K (табл. 1). Реакции киназы начинали добавлением 5 мкл АТФ-смеси, содержащей в конечном объеме 10 мкл 10 мМ TRI3-HCl рН 7,5, 3 мМ MgCl2, 50 мМNaCl, 0,05% CHAPS, 1 мМ DTT и 1 мкМ АТФ, при комнатной температуре. Реакции останавливали 10 мкл KinaseGlo и планшеты считывали через 10 мин на планшетном ридере Synergy2 с использованием времени интеграции 0,1 с на лунку. В аналитические планшеты добавляли 2,5 мкМ ингибитора киназыPI3 pan-class 1 (стандарт) для обеспечения 100% ингибирования реакции киназы, и ингибирование 0% давал растворитель-носитель (90% DMSO в воде). Этот стандарт использовали в качестве эталонного соединения и включали во все аналитические планшеты в форме 16 точек разведения в двух повторениях. Клонирование PI3K Конструкт PI3K представляет собой слияние домена p85 iSH2 и соответствующей изоформыp110. Фрагмент p85 и ген изоформы p110 получали PCR (полимеразной цепной реакцией, ПЦР) из кЦНК первой нити, полученной RT-PCR, из продаваемой РНК из плаценты, семенников и головного мозга, как описано ниже. Конструкты и белки PI3KBV1075: Конструкт бакуловируса BV-1075 создавали лигирсвакием трех частей, состоящих из фрагмента p85 и фрагмента p110, клонированных в вектор pBlueBac4.5. Фрагмент p85 происходил из плазмиды р 1661-2, переваренной Nhe/Spe. Фрагмент p110, происходящий из его клона, верифицировали секвенированием и использовали в LR410 в виде фрагмента SpeI/HindIII. Для создания экспрессионного вектора бакуловируса LR410 использовали реакцию ферментативной смеси Gateway LR для переноса вставки в адаптированный вектор Gateway pBlueBac4.5 (Invitrogen). Вектор клонированияpBlueBac4.5 (Invitrogen) переваривали с Nhe/HindIII. Это приводило к получению конструкта PED 153.8. Компонент p85 (iSH2) создавали ПЦР, используя ORF 318 в качестве матрицы и одного прямого праймера KAC1028 (5'-gctagcatgcgagaatatgatagat-tatatgaag-aatatacc) (SEQ ID NO: 1) и двух обратных праймеров,KAC1029 (5'-gcctccaccac-ctccgcctg-gtttaatgctgttcatacgtttgtc) (SEQ ID NO: 2) и KAC1039 (5'-tactagtccgcctccac-cacctccgcctccaccacctccgcc) (SEQ ID NO: 3). Эти два обратных праймера перекрываются и включают линкер 12 х Gly и N-концевую последовательность гена p110 в сайт SpeI. Фрагмент ПЦР клонировали в pCR2.1 ТОРО (Invitrogen). Секвенированием было определено, что из полученных клонов правильной является р 1661-2. Эту плазмиду переваривали с Nhe и SpeI, и полученный фрагмент выделяли гелем и очищали для субклонирования. Фрагмент клонирования p110 получали ферментным перевариванием клона LR410 (см. выше) сSpeI и HindIII. Сайт SpeI находится в кодирующей области гена p110. Полученный фрагмент выделяли гелем и очищали для субклонирования. Вектор клонирования, pBlueBac4.5 (Invitrogen), получали ферментным перевариванием Nhe и HindIII. Вырезанный вектор очищали колонкой Qiagen и затем дефосфорилировали щелочной фосфатазой телячьего кишечника (CIP) (BioLabs). После завершения реакции CIP вырезанный вектор снова очищали колонкой для получения конечного вектора. Цитирование трех частей выполняли, используя лигазу Roche Rapid и спецификации поставщика. Конечную плазмиду верифицировали секвенированием.PI3K очищали в две хроматографические стадии: аффинной хроматографии на иммобилизованном металле (IMAC) на Ni сефарозной смоле (GE Healthcare) и гель-фильтрации с использованием колонки Superdex 200 26/60 (GE Healthcare). Все буферы охлаждали до 4C и лизис выполняли при охлаждении на льду. Колоночное фракционирование выполняли при комнатной температуре. Обычно замороженные клетки из 10-л культуры клеток Tn5 ресуспендировали в "Литическом буфере" (20 мМ Tris-Cl, pH 7.5, 500 мМ NaCl, 5% глицерин, 5 мМ имидазола, 1 мМ NaF, 0,1 мкг/мл окадаевой кислоты (ОАА), 5 мМ BME (бета-меркаптоэтанола), 1 смесь полного ингибитора протеазы - безEDTA (20 таблеток/1 л буфера, Roche Applied Sciences), бензоназа (25 ЕД/мл буфера, EMD Biosciences) в отношении 1:6 об./об. клеточного осадка после центрифугирования к литическому буферу, и механически лизировали гомогенизацией гомогенизатором Даунса в течение 20 ударов с использованием плотно пригнанного пестика. Лизат центрифугировали при 45000 g в течение 30 мин и супернатант загружали на предварительно уравновешенную колонку IMAC (3 мл смолы/100 мл лизата). Колонку промывали 3-5 колоночными объемами литического буфера с последующим вторым промыванием 3-5 колоночными объемами 20 мМ Tris-Cl, pH 7,5, 500 мМ NaCl, 5% глицерина, 45 мМ имидазола, 1 мМ NaF, 0,1 мкг/мл ОАА, 5 мМ ВМЕ, 1 смесь полного ингибитора протеазы - без EDTA. Белек элюировали 20 мМ Tris-Cl,pH 7,5, 0,5 М NaCl, 5% глицерином:, 250 мМ имидазола, 1 мМ NaF, 0,1 мкг/мл ОАА, 5 мМ ВМЕ, 1 смесь полного ингибитора протеазы - без EDTA. Подходящие фракции анализировали SDS-PAGE и, соответственно, объединяли. Белок дополнительно очищали гель-фильтрацией на колонке Superdex 200 26/60, уравновешенной в 20 мМ Tris-Cl, pH 7,5, 0,5 М NaCl, 5% глицерине, 1 мМ NaF, 5 мМ DTT, 1 смесь полного ингибитора протеазы - без EDTA. Подходящие фракции анализировали SDS-PAGE и, соответственно, объединяли. Равный объем диализного буфера (20 мМ Tris-Cl, pH 7,5, 500 мМ NaCl, 50% глицерин, 5 мМ NaF, 5 мМ DTT) добавляли в пул и затем диализировали против диализного буфера с двумя заменами (одной заменой в течение ночи). Белок хранили при -20C. Тест 2: биохимический анализ mTORIC50 для соединений, взаимодействующих с mTOR, оценивали с использованием анализа индикатора FRAP1/mTOR TR-FRET (Invitrogen by Life Technologies). FRAP1/mTOR (PV4753) и антитело LanthaScreen Eu-Anti-GST (PV5594) (общий объем 14 мкл) добавляли в каждую лунку 384-луночного планшетаProxiPlate-384 Plus (Perkin-Elmer). Соединения серийно разбавляли в DMSO (12 точек, фактор разведения 4) и затем 1 мкл разбавленного соединения добавляли в каждую лунку и смешивали пипетированием с применением устройства Biomek FX (Beckman Coulter). В каждую лунку добавляли 5 мкл индикатораmTOR киназы 314 (PV6087), смешивали и планшеты инкубировали при комнатной температуре в течение 1 ч. Конечные концентрации компонентов составляли 6 нМ FRAP1/3 нМ антитела LanthaScreen EuAnti-G3T/50 нМ индикатора mTOR киназы 314/немеченые соединения, 4,810-6-20 мкМ. Конечная композиция аналитического буфера составляет 50 мМ HEPES (pH 7,5), 50 мМ NaCl, 5 мМ MgCl2, 1 мМEGTA. 0,01% Pluronic F-127. Планшеты измеряли в планшетном ридере (Perkin Elmer, EnVision), используя возбуждение при 340 нм и эмиссию при двух длинах волн, Эмиссию-1 665 нм и Эмиссию-2 515 нм.- 21025011 Отношение TR-FRET для каждой лунки (Эмиссия-1 665/Эмиссия-2 615) наносили на график как функцию концентрации соединения, используя программное обеспечение GraphPad Prism, и IC50 определяли,используя нелинейную регрессию с устранением выброса данных. Тест 3: Анализ TSC Далее следует описание анализа получения высокоинформативного изображения, используя мышиные эмбриональные клетки-фибробласты TSC1-/-(MEF), для тестирования соединений для ингибирования конститутивно активного mTOR. Анализ основан на окрашивании фосфо-S6 (240/244), используя имеющееся в продаже антитело, и выявление флуоресцентно меченным вторичным антителом. Этот анализ обеспечивает получение величин IC50 для соединений, которые ингибируют mTOR. В настоящей заявке описывается последовательность получения изображения и алгоритм распознавания изображений для получения изображения и измерения изменений уровней pS6 240/244. Количественное определение окрашивания pS6 с использованием получения и анализа высокоинформативного изображения 1. 0-й день: Высевание клеток. Субконфлюентные клетки TSC1-/- MEF собирают трипсинизацией,ресуспендируют в ростовой среде и подсчитывают. Получают клеточную суспензию 166666 клеток/мл и 30 мкл добавляют в лунки 384-луночного планшета, используя электронную многоканальную пипетку. Это приводит к высеванию 5000 клеток/лунка. Планшеты кратковременно центрифугируют для осаждения клеток и держат при 37C и 5% CO2. 2. 1-й день: Клеточные планшеты промывают раствором PBS с обедненным составом компонентов(содержит глюкозу, бикарбонат натрия, HEPES и фенольный красный), используя моющее устройство для 384-луночных планшетов. Последовательность операций промывания предусматривает аспирацию объема до 30 мкл/лунка перед подачей 60 мкл/лунка раствора PBS с обедненным составом компонентов. Стадии аспирации и подачи повторяют 8 раз и оставляют конечный объем 30 мкл/лунка. Клеточные планшеты помещают при 37C и 5% CO2 на 2 ч. Обработка соединением. Реакции на дозы соединения получают в DMSO. Затем дозы, вызывающие реакции, разбавляют 1:50 в среде. 10 мкл разбавленного соединения добавляют к 30 мкл клеток, получая конечное разведение 1:200 первоначального соединения и конечную концентрацию 0,5% DMSO. Обработки соединением выполняют в трех повторениях. Планшеты помещают при 37C и 5% CO2 на 2 ч. Затем клетки фиксируют добавлением 10 мкл/лунка 5 концентрированного фиксатора Мирски. Это приводит к общему объему 50 мкл на лунку и концентрации 1 фиксатора Мирски. Клетки в клеточных планшетах осаждают кратковременным центрифугированием и планшеты инкубируют в течение 1 ч при комнатной температуре. Затем клетки промывают, используя устройство для промывания 384-луночных планшетов, используя последовательность операций, предусматривающую аспирацию объема до 30 мкл/лунка перед подачей 60 мкл/лунка 1X TBS. Стадии аспирации и подачи повторяют 8 раз и затем дополнительная стадия аспирации оставляет конечный объем 10 мкл/лунка. Затем добавляют блокирующий буфер (1X TBS + 0,1%Triton X-100 + 0,1% BSA) в количестве 25 мкл/лунка и планшеты инкубируют при комнатной температуре в течение 30 мин. Затем клеточные планшеты аспирируют до 10 мкл/лунка. Первичное антитело(фосфо-S6 рибосомальный белок (Ser240/244) (61H9) кроличье mAb клеточной передачи сигналов 4838) разводят 1:150 в блокирующий буфер и затем добавляют в количестве 10 мкл/лунка в клеточные планшеты. Планшеты инкубируют в течение ночи при 4C. 3. 2-й день: Клеточные планшеты промывают, используя способ 1X TBS, подробно описанный выше, и затем добавляют раствор вторичного антитела в количестве 10 мкл/лунка (раствор вторичного антитела: блокирующий буфер + краситель Hoechst 10 мкг/мл + козий анти-кроличий Cy5 вторичное антитело (в разведении 1:150 (козий анти-кроличий IgG Cy5: Chemicon International AP187/Hoechst 33342:Invitrogen H3570). Планшеты инкубируют з течение 1 ч при комнатной температуре и затем промывают 1X TBS, используя последовательность операций, подробно описанную выше, без стадии конечной аспирации, что приводит к конечному объему 90 мкл TBS/лунка. Получение изображения. Дно планшета очищают 70% этанолом и затем визуализируют, используя автоматизированный эпифлуоресцентный микроскоп InCell 1000. Используют увеличение 10 и визуализируют 1 область (поле) на лунку, это обычно захватывает всего около 400 клеток на лунку. Изображения Hoechst33342 получают, используя возбуждение при 360 нм (фильтр D360 40X), эмиссию 460 нМ (фильтр HQ46040 М) и время экспозиции 200 мс. Изображения Cy5 получают, используя возбуждение при 620 нм (фильтрChroma 62060X), эмиссию 700 нМ (фильтр Chroma HQ70075 М) и время экспозиции 200 мс. Зеркало двухполосного прохождения используют для всех изображений. 4. Анализ изображения: Программное обеспечение InCell Analysis используют для анализа изображений, используя алгоритм двойного объекта. Сначала выявляют ядра на изображении Hoechst33342,используя сегментацию "top-hat" и минимальную ядерную площадь 10 мкм 2. Во-вторых, клетки определяют, используя воротничок 0,7 мкм вокруг ядер. Измеряют интенсивность флуоресценции Cy5 внутри воротничка (клеточную интенсивность) и результаты представляют на основании "Средняя величина на- 22025011 клетку". 5. Расчет IC50: Величины IC50 рассчитывают нанесением на график величин клеточной интенсивности на ось y при нанесении величин зависимости реакции от дозы на ось x. Величины IC50 представляют силу действия соединения против mTOR. Тест 4: Анализ аутофагии Аутофагия представляет собой катаболический путь, который разрушает основной объем цитозоля в лизосомальных компартментах, обеспечивая возможность рециклирования аминокислот и жирных кислот. Одним из ключевых регуляторов аутофагии является мишень рапамицина у млекопитающих(mTOR), консервативная серин/треонинкиназа, которая подавляет инициацию аутофагического процесса,когда доступны питательные вещества, ротовые факторы и энергия. Для количественного определения индукции аутофагии ингибиторами mTOR, заявители используют репортер mCherry-GFP-LC3, который пригоден для доставки ретоовируса в клетки млекопитающих, устойчивой экспрессии и анализа флуоресцентной микроскопией. Репортер mCherry-GFP-LC3. Аминокислотная последовательность конструкта mCherry-GFP-LC3 показана ниже (SEQ ID NO: 5). Подчеркнута последовательность mCherry, последовательность GFP представлена жирным шрифтом и последовательность LC3A заключена в рамки. Ниже описана последовательность операций получения изображения и алгоритм распознавания изображения для визуализации и измерения изменений аутофагического пути Количественное определение аутофагии с использованием получения и анализа высокоинформативного изображения. 1. 0-й день: Высевание клеток. Субконфлюентные клетки H4 mCherry-GFP-LC3 собирают трипсинизацией, ресуспендируют в ростовой, среде и подсчитывают (клетки H4: линия клеток нейроглиомы человека (АТСС). Получают клеточную суспензию 66000 клеток/мл и 30 мкл добавляют в лунки 384-луночного планшета, используя электронную многоканальную пипетку. Это приводит к высеванию 2000 клеток/лунка. Клеточные планшеты кратковременно центрифугируют для осаждения клеток и помещают при 37C и 5% CO2. 2. 1-й день: Обработка соединением. Реакции в зависимости от дозы соединения получают в DMSO. Затем дозы, вызывающие реакции,разбавляют 1:50 в среде. 10 мкл разбавленного соединения добавляют к 30 мкл клеток, получая конечное разведение 1:200 первоначального соединения и конечную концентрацию 0,5% DMSO. Обработки соединением выполняют в трех повторениях. 384-луночные планшеты помещают при 37C и 5% CO2. Обработку соединением выполняют в течение 16-18 ч (см. примечание 1). 3. 2-й день: Фиксация клеток. Клетки фиксируют добавлением 10 мкл/лунка 5 концентрированного фиксатора Мирски с добавлением 25 мкг/мл красителя Hoechst33342. Это приводит к общему объему 50 мкл на лунку и концентрации 1 фиксатора Мирски и 5 мкг/мл Hoechst33342. Клетки в 384-луночных клеточных планшетах кратковременно осаждают центрифугированием и планшты инкубируют в течение 1 ч при комнатной температуре. Затем клетки промывают, используя устройство для промывания 384-луночных планшетов, используя последовательность операций, предусматривающую аспирацию объема до 10 мкл/лунка перед- 23025011 подачей 100 мкл/лунка 1X TES. Стадии аспирации и подачи повторяют 4 раза и оставляют конечный объем 100 мкл/лунка. Планшет герметично укупоривают, используя адгезивную фольгу ПЦР. 4. Получение изображения. Дно планшета очищают 70% этанолом и затем визуализируют, используя автоматизированный эпифлуоресцентный микроскоп InCell 1000. Используют увеличение 20 м визуализируют 4 различных области (поля) на лунку, это обычно захватывает всего около 400 клеток на лунку. ИзображенияHoechst33342 получают, используя возбуждение при 360 нм (фильтр D36040x), эмиссию при 460 нМ(фильтр HQ460 40 М) и время экспозиции 150 мс. Изображения GFP получают, используя возбуждение при 475 нм (фильтр) S475 20x), эмиссию при 535 нМ (фильтр HQ5 3550M) и время экспозиции 1 с. Изображения mCherry получают, используя возбуждение при 535 нм (фильтр HQ53550x), эмиссию при 620 нМ (фильтр HQ620 60M) и время экспозиции 1 с. Для всех изображений используют зеркало четырехдиапазонного пропускания. 5. Анализ изображения. Программное обеспечение InCell Analysis используют для анализа изображений, используя алгоритм двойного объекта. Сначала выявляют ядра на изображении Hoechst33342, используя сегментациюtop-hat и минимальную ядерную площадь 50 мкм 2. Клетки определяют, используя воротничок 10 мкм вокруг ядер. Во-вторых, на изображении mCherry идентифицируют точки (органеллы) внутри клеток,используя множественную сегментацию top-hat. В-третьих, маску по точкам mCherry переносят на изображение GFP. В-четвертых, измеряют интенсивность флуоресценции GFP внутри маски по точкамmCherry (эталонная интенсивность). 6. Параметр "органеллы" отражает положительные по точкам mCherry репортера mCherry-GFP-LC3 и используется для расчета 'точек LC3/клетка'. С этой целью рассчитывают число органелл на клетку и усредняют по всем клеткам в данной лунке (среднее на клеточную основу). Числа mCherryположительных точек LC3 (ось y) наносят на график как функцию величин реакции в зависимости от дозы соединения (ось x) и величины EC50 рассчитывают для каждого соединения. Величины EC50 представляют силу действия соединения с точки зрения активации аутофагии (например, увеличение количества mCherry-голожительных точек LC3). Примечания. 1. Модулирование аутофагии и перераспределение mCherry-GFP-LC3 можно было наблюдать уже после времени обработки соединением 3-4 ч. Однако более выраженные эффекты наблюдаются при времени обработки 16-18 ч. Соединения примеров проявили величины, представленные ниже в табл. 1, при тестировании в описанных выше анализах. Примеры, помеченные , являются ссылочными и не входят в объем настоящего изобретения.NT = He тестировалось. Используемый в настоящем описании термин "фармацевтически приемлемый носитель" включает любой и все растворители, дисперсионные среды, покрытия, поверхностно-активные вещества, антиоксиданты, консерванты (например, антибактериальные средства, противогрибковые средства), изотонические агенты, средства задержки всасывания, соли, консерванты, лекарственные средства, стабилизаторы лекарственных средств, связывающие вещества, эксципиенты, разрыхлители, смазывающие вещества,подслащивающие агенты, ароматизирующие агенты, красители и тому подобные и их комбинации, как должно быть известно специалистам в данной области (см., например, Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, pp. 1289-1329). За исключением случаев, когда любой обычный носитель несовместим с активным ингредиентом, предусматривается возможность его применения в терапевтических или фармацевтических композициях.- 25025011 Термин "терапевтически эффективное количество" соединения по настоящему изобретению относится к соединению по настоящему изобретению, которое вызывает биологическую или медицинскую реакцию у индивида, например снижение или ингибирование активности фермента или белка, или облегчение симптомов, облегчение течения состояний, замедление или задержка прогрессирования заболевания или предотвращение заболевания и т.д. В одном неограничивающем варианте осуществления термин "терапевтически эффективное количество" относится к количеству соединения по настоящему изобретению, которое при введении индивиду эффективно для (1), по меньшей мере, частичного облегчения, ингибирования, предотвращения и/или смягчения течения состояния или расстройства или заболевания (i) опосредованных PI3K I класса и/или mTOR, или (ii) связанных с активностью PI3K I класса и/или mTOR, или (iii) характеризуемых активностью (нормальной или патологической) PI3K I класса и/или mTOR; или (2) снижения или ингибирования активности PI3K I класса и/или mTOR. В другом неограничивающем варианте осуществления термин "терапевтически эффективное количество" относится к количеству соединения по настоящему изобретению, которое при введении в клетку, или в ткань, или в неклеточный биологический материал, или среду, эффективно по меньшей мере для снижения или ингибирования активности PI3K I класса и/или mTOR. Значение термина "терапевтически эффективное количество", как иллюстрируется в указанных выше вариантах осуществления для PI3K I класса и/или mTOR,также относится в том же значении к любым другим релевантным белкам/пептидам/ферментам, таким как PI3K II или III класса. Используемый в настоящем описании термин "субъект" относится к животному. Обычно животное представляет собой млекопитающее. Субъект также относится, например, к приматам (например, людям,мужчинам или женщинам), коровам, овцам, козам, лошадям, собакам, кошкам, кроликам, крысам, мышам, рыбам, птицам и тому подобным. В определенных вариантах осуществления субъект представляет собой примата. В еще одном варианте осуществления субъект представляет собой человека. Используемый в настоящем описании термин "ингибировать", "ингибирование" или "ингибирующий" относится к уменьшению или подавлению данного состояния, симптома или расстройства, или заболевания, или к значительному уменьшению исходной активности биологической активности или процесса. Используемый в настоящем описании термин "лечить", "лечебный эффект" или "лечение" любого заболевания или расстройства относится к одному варианту осуществления для облечения течения заболевания или расстройства (т.е. замедления, или остановки, или уменьшения развития заболевания или по меньшей мере одного из его клинических симптомов). В другом варианте осуществления "лечить", "лечебный эффект" или "лечение" относится к облегчению или смягчению по меньшей мере одного физического параметра, включая те, которые могут не ощущаться пациентом. В еще одном варианте осуществления "лечить", "лечебный эффект" или "лечение" относится к модулированию заболевания или расстройства или физически (например, стабилизации ощущаемого симптома), физиологически (например,стабилизации физического параметра) или обоими путями. Используемый в настоящем описании термин "предотвращение" любого конкретного заболевания или расстройства относится к введению субъекту соединения по изобретению перед тем, как станут очевидными любые симптомы этого заболевания или расстройства. Используемый в настоящем описании термин "субъект, нуждающийся в лечении" относится к субъекту, у которого также лечение окажет благоприятный биологический, медицинский эффект или воздействие на качество жизни. Пока в настоящем описании нет иных указаний или ясного противоречия контексту, то используемый термин с неопределенными и определенным артиклями единственного числа и подобные термины,используемые в контексте настоящего изобретения (в частности, в контексте формулы изобретения),следует рассматривать как охватывающие и единственное, и множественное число. Использование любого и всех примеров или примерной формулировки (например, "такой как") в настоящем описании предназначено просто для лучшего освещения изобретения и не ставит ограничения заявленного объема изобретения. Термин "соединения по настоящему изобретению" (пока нет иной специальной идентификации) относится к соединениям формулы (Ia), соединениям из раздела Примеры, фармацевтически приемлемым солям таких соединений и/или гидратам или сольватам таких соединений, а также всем стереоизомерам (включая диастереоизомеры и энантиомеры), таутомерам и изотопно меченным соединениям(включая дейтерий). Соединения по настоящему изобретению могут применяться для лечения заболеваний, состояний и расстройств, модулируемых ингибированием PI3K I класса и фермента mTOR; следовательно, соединения по настоящему изобретению (включая композиции и способы, используемые в нем) могут быть использованы при получении лекарственного средства для терапевтических видов применения, описанных в настоящей заявке. Следовательно, другим вариантом осуществления настоящего изобретения является фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по настоящему изобретению, или его фармацевтически приемлемой соли, и фармацевтически приемлемый эксципиент, разбавитель или носитель. В другом варианте осуществления настоящее изобретение отно- 26025011 сится к фармацевтической композиции, содержащей соединение по настоящему изобретению, его фармацевтически приемлемую соль, и фармацевтически приемлемый эксципиент, разбавитель или носитель. Типичную препаративную форму получают смешиванием соединения по настоящему изобретению и носителя, разбавителя или эксципиента. Подходящие носители, разбавители и эксципиенты хорошо известны специалистам в данной области и включают материалы, такие как углеводороды, воски, растворимые в воде и/или набухающие полимеры, гидрофильные или гидрофобные материалы, желатин,масла, растворители, воду и тому подобные. Конкретный используемый носитель, разбавитель или эксципиент зависит от средства и цели, с которой применяется соединение по настоящему изобретению. Растворители в целом выбирают на основании растворителей, считаемых специалистами в данной области как безопасные (GRAS), которые предстоит ввести млекопитающему. В целом, безопасные растворители представляют собой нетоксичные водные растворители, такие как вода, и другие нетоксичные растворители, которые растворимы и смешиваемы в воде. Подходящие водные растворители включают воду, этанол, пропиленгликоль, полиэтиленгликоли (например, PEG400, PEG300), и т.д. и их смеси. Препаративные формы могут также включать один или более буферов, стабилизирующих агентов, поверхностно-активных веществ, смачивающих агентов, смазывающих веществ, эмульгаторов, суспендирующих агентов, консервантов, антиоксидантов, придающих непрозрачность агентов, глянцевателей, содействующих переработке агентов, красящих агентов, подсластителей, пахучих агентов, отдушек и других известных добавок для обеспечения представления привлекательного лекарственного средства (т.е соединения по настоящему изобретению или его фармацевтической композиции) или помощи при получении фармацевтического продукта (т.е. лекарственного средства). Препаративные формы могут быть получены с использованием обычного растворения и процедур смешивания. Например, основной объем лекарственной субстанции, т.е. соединения по изобретению или стабилизированной формы соединения (например, комплекса с производным циклодекстрина или другим известным агентом комплексообразования), растворяют в подходящем растворителе в присутствии одного или более эксципиентов. Соединение по изобретению обычно включают в состав фармацевтических лекарственных форм для обеспечения легко контролируемой дозировки лекарственного средства и для предоставления пациенту привлекательного и обеспечивающего легкое манипулирование продукта. Фармацевтическая композиция (или препаративная форма) для применения может быть упакована разнообразными путями, в зависимости от способа, используемого для введения лекарственного средства. В целом, изделие для распространения включает контейнер, имеющий заключенную в нем фармацевтическую препаративную форму в соответствующей форме. Подходящие контейнеры хорошо известны специалистам в данной области и включают материалы, такие как флаконы (пластиковые и стеклянные),саше, ампулы, пластиковые мешочки, металлические цилиндры и тому подобные. Контейнер может также быть обеспечен защищенной от неумелого обращения сборкой для предотвращения несанкционированного доступа к содержимому упаковки. Кроме того, контейнер имеет расположенную на нем этикетку, в которой описано содержимое контейнера. Этикетка может также включать соответствующие предупреждения. В одном варианте осуществления изобретение относится к лечению клеточных пролиферативных заболеваний, таких как рост опухоли и/или рост раковых клеток, опосредуемый PI3K и/или mTOR. Заболевания могут включать те, которые проявляют сверхэкспрессию или амплификацию PI3K альфа, Rheb,соматическую мутацию PIK3CA или мутации зародышевой линии или соматическую мутацию PTEN,TSC1, TSC2, или мутации и транслокацию p85, которые служат для стимуляции комплекса p85-p110. В частности, соединения могут применяться при лечении видов рака у людей или животных (например,мышей), включая, например, саркому; рак легких; бронхов; предстательной железы; молочных желез(включая спорадические раковые опухоли молочных желез и индивидов с болезнью Коудена); поджелудочной железы; рак желудочно-кишечного тракта; ободочной кишки; толстой кишки; карциному толстой кишки; колоректальную аденому; рак щитовидной железы; печени; внутрипеченочных желчных протоков; гепатоцеллюлярный рак; рак надпочечников; рак разных отделов желудка; глиому; глиобластому; рак эндометрия; меланому; рак почек; рак почечной лоханки; рак мочевого пузыря; рак тела матки; рак шейки матки; рак влагалища; рак яичников; множественную меланому; рак пищевода; лейкоз; острый миелолейкоз; хронический миелолейкоз; лимфоцитарный лейкоз; миелоидный лейкоз; рак мозга; карциному мозга; рак ротовой полости и глотки; рак гортани; рак тонкого кишечника; неходжкинскую лимфому; меланому; ворсинчатую аденому ободочной кишки; неоплазию; неоплазию эпителиального характера; лимфомы; карциному молочных желез; базальноклеточную карциному; плоскоклеточную карциному; актиновый кератоз; опухолевые заболевания, включая солидные опухоли; опухоль головы и шеи; истинную полицитемию; эссенциальную тромбоцитемию; миелофиброз с миелоидной метаплазией; и болезнь Вальдестрема. В других вариантах осуществления состояние или расстройство (например опосредованное PI3K) выбрано из группы, состоящей из истинной полицитемии, эссенциальной тромбоцитемии, миелофиброза с миелоидной метаплазией, астмы, COPD, ARDS, синдрома Лоффлера, эозинофильной пневмонии, паразитарной (в частности, инвазии многоклеточными организмами) инвазии (включая тропическую эозинофилию), бронхолегочного аспергиллеза, узелкового полиартериита (включая синдром Чарга-Страусса),- 27025011 эозинофильной гранулемы, связанных с эозинофилами расстройств, поражающих дыхательные пути,вызванных реакцией на лекарственные средства, псориаза, контактного дерматита, атонического дерматита, гнездного облысения, мультиформной эритемы, герпетиформного дерматита, склеродермии, витилиго, связанного с гиперчувствительностью ангиита, сыпи, буллезной псевдопузырчатки, красной волчанки пузырчатки, приобретенного буллезного эпидермолиза, аутоиммунных гематологических расстройств (например, гемолитической анемии, апластической анемии, анемии вследствие чистой эритроцитарной аплазии и идиопатической тромбоцитопении), системной красной волчанки, полихондрита,склеродермии, грануломатоза Вегенера, дерматомиозита, хронического активного гепатита, генерализованной миастении, синдрома Стивена-Джонсона, идиолатического спру, аутоиммунного воспалительного кишечного заболевания (например, язвенного колита. и болезни Крона), эндокринной офтальмопатии,болезни Грейвса, саркоидоза, альвеолита, хронического вызванного гиперчувствительностью пневмонита, рассеянного склероза, первичного билиарного цирроза, увеита (переднего и заднего), интерстициального легочного фиброза, псориатического артрита, гломерулонефрита, сердечно-сосудистых заболеваний, атеросклероза, гипертензии, тромбоза глубоких вен, инсульта, инфаркта миокарда, нестабильной стенокардии, тромбоэмболии, эмболии легочной артерии, тромболитических заболеваний, острой артериальной ишемии, тромботических окклюзии периферических артерий и ишемической болезни сердца,реперфузионных повреждений, ретинопатии, такой как диабетическая ретинопатия, или гипербарической вызванной кислородом ретинопатии и состояний, характеризуемых повышенным внутриглазным давлением, или секрецией глазной водянистой влаги, таких как глаукома. Дополнительные синдромы с установленной или потенциальной молекулярной связью с нарушением регуляции активности mTOR-киназы, например, описаны в "K. Inoki et al.; Disregulation of the TSCmTOR pathway in human disease, Nature Genetics, vol 37, 19-24"; "D.M. Sabatini; mTOR and cancer: insightsPI3K/Akt pathway for cancer drug discovery, Nature Reviews, vol. 4, 988-1004", и представляют собой следующие: Отторжение трансплантата органа или ткани, например, для лечения реципиентов, например трансплантатов сердца, легких, сердечно-легочного комплекса, печени, почек, поджелудочной железы, кожи или роговицы; болезни трансплантат-против-хозяина, такой как после трансплантации костного мозга; Рестеноз Бугорковый склероз Лимфоангиолейомиоматоз Пигментный ретинит и другие дегенеративные расстройства сетчатки Аутоиммунные заболевания, включая энцефаломиелит, инсулинозависимый сахарный диабет, волчанка, дерматомиозит, артрит и ревматические заболевания Устойчивый к стероидам острый лимфобластный лейкоз Фибротические заболевания, включая склеродермию, легочный фиброз, почечный фиброз, кистозный фиброз Легочная гипертензия Иммуномодуляция Рассеянный склероз Синдром VHL Комплекс Карнея Семейный аденоматозный полипоз Синдром ювенильного полипоза Синдром Бирта-Хогга-Дьюка Семейная гипертрофическая кардиомиопатия Синдром Вольфа-Паркинсона-Уайта Кейродегенеративные расстройства, такие как болезнь Паркинсона, болезнь Хантингтона,. болезнь Альцгеймера и деменции, вызванные мутациями тау, спиномозжечковая атаксия 3-го типа, заболевание двигательных нейронов, вызванное мутациями SOD1, нейронные цероидные липофуцинозы/болезнь Баттена (педиатрическая нейродегенерация) Влажная и сухая дегенерация желтого пятна Мышечная дистрофия (атрофия, кахексия) и миопатии, такие как болезнь Дэнона. Бактериальные и вирусные инфекции, включая инфекцию М. tuberculosis, стрептококком группы A,HSV I типа, ВИЧ инфекцию Нейрофиброматоз, включая нейрофиброматоз 1 типа, и Синдром Пейтца-Джегерса, болезнь Коудена. Соединения с ингибиторной активностью в отношении mTORC1 проявили благоприятный эффект при иммуномодуляции и при лечении прслиферативных заболеваний, таких как поздние стадии почечноклеточной карциномы или расстройств, связанных с мутацией зародышевой линии при туберосклерозе(TSC). Каталитическое ингибирование активности mTOR Ser/Thr-киназы или активности PI3 киназ I клас- 28025011 са и, в частности, двойное ингибирование PI3-киназы(киназ) I класса и mTOR-киназы, может применяться для лечения заболеваний, зависимых от пути PI3K/Akt/mTOR. Недавно была описана эффективность двойного ингибитора PI3-киназы/mTOR при злокачественной глиоме (Cancer Cell 9, 341-349). Для указанных выше видов применения требуемая дозировка, конечно, варьируется в зависимости от типа введения, конкретного состояния, подлежащего лечению, и желаемого эффекта. В целом, указывается, что удовлетворительные результаты получают при системном введении в суточных дозировках от примерно 0,03 до примерно 100,0 мг/кг массы тела, например от примерно 0,03 до примерно 10,0 мг/кг массы тела. Показанная суточная дозировка у более крупных млекопитающих, например людей,находится в диапазоне от примерно 0,5 мг до примерно 3 г, например от примерно 5 мг до примерно 1,5 г, для удобства вводимая, например, дробными дозами до четырех раз в день или в форме замедленного высвобождения. Подходящие стандартные лекарственные формы для перорального введения содержат от приблизительно 0,1 до примерно 500 мг, например от примерно 1,0 до примерно 500 мг активного ингредиента. В целом, соединения по настоящему изобретению вводятся в виде фармацевтических композиций одним из следующих путей введения: пероральное, системное (например, трансдермальное, интраназальное или посредством суппозитории), или парентеральное (например, внутримышечное, внутривенное или подкожное) введение. Предпочтительным способом введения является применение удобной схемы ежедневного введения, которая может быть подобрана в соответствии со степенью поражения. Композиции могут принимать форму таблеток, пилюль, капсул, полутвердых препаратов, порошков,препаративных форм длительного высвобождения, растворов, суспензий, эликсиров, аэрозолей или любых других соответствующих композиций. Другим предпочтительным способом введения соединений по настоящему изобретению является ингаляция. Это эффективный способ доставки терапевтического средства непосредственно в дыхательные пути. Соединения по настоящему изобретению могут вводиться в свободной форме или в форме фармацевтически приемлемой соли, например, как указано выше. Такие соли могут быть получены обычным образом и проявляют такой же порядок активности, как свободные соединения. Следовательно, изобретение также относится к способу предотвращения или лечения состояний,расстройств или заболеваний, опосредованных активацией PI3K (например, PI3-киназы альфа) и/или ферментов mTOR, например, таких как указано выше, у субъекта, нуждающегося в таком лечении, причем способ включает введение указанному субъекту эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли. В одном варианте осуществления изобретение относится к способу предотвращения или лечения рака или нейродегенеративного расстройства у нуждающегося в таком лечении субъекта, причем способ включает введение указанному субъекту эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли. В другом варианте осуществления нейродегенеративное расстройство представляет собой болезнь Паркинсона, Хантингтона или Альцгеймера. В еще одном варианте осуществления нейродегенеративное расстройство представляет собой болезнь Хантингтона; соединению по настоящему изобретению или его фармацевтически приемлемой соли для применения в качестве лекарственного средства, например, в любом из способов, как указано в настоящем описании; соединению по настоящему изобретению или его фармацевтически приемлемой соли для применения в качестве фармацевтического средства, например, в любом из способов, как указано в настоящем описании, в частности, для применения при одном или более заболеваниях, опосредованных фосфатидилинозит 3-киназами. В одном варианте осуществления изобретение относится к соединению по настоящему изобретению или к его фармацевтически приемлемой соли для применения при лечении или предотвращении рака или нейредегенеративного расстройства. В другом варианте осуществления нейродегенеративное расстройство представляет собой болезнь Паркинсона, Хантингтона или Альцгеймера. В еще одном варианте осуществления нейродегенеративное расстройство представляет собой болезнь Хантингтона; применению соединения по настоящему изобретению или его фармацевтически приемлемой соли в любом из способов, как указано в настоящем описании, в частности, для лечения или предотвращения одного или более заболеваний, опосредованных фосфатидилинозит 3-киназами. В одном варианте осуществления изобретение относится к применению соединения по настоящему изобретению или к его фармацевтически приемлемой соли для лечения или предотвращения рака или нейродегенеративного расстройства. В другом варианте осуществления нейродегенеративное расстройство представляет собой болезнь Паркинсона, Хантингтона или Альцгеймера. В еще одном варианте осуществления нейродегенеративное расстройство представляет собой болезнь Хантингтона; применению соединения по настоящему изобретению или его фармацевтически приемлемой соли для получения лекарственного средства для лечения или предотвращения одного или более заболеваний,опосредованных фосфатидилинозит 3-киназами. В одном варианте осуществления изобретение относится к применению соединения по настоящему изобретению или к его фармацевтически приемлемой соли для получения лекарственного средства для лечения или предотвращения рака или нейродегенеративно- 29
МПК / Метки
МПК: A61P 35/00, C07D 487/04, A61K 31/519
Метки: композиции, качестве, полезные, пурины, фармацевтические, ингибиторов, использование, киназы
Код ссылки
<a href="https://eas.patents.su/30-25011-puriny-poleznye-v-kachestve-ingibitorov-mtor-kinazy-ih-ispolzovanie-i-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Пурины, полезные в качестве ингибиторов mtor киназы, их использование и их фармацевтические композиции</a>
Предыдущий патент: Фильтры табачного дыма для курительных устройств с пористыми массами, имеющими наполнение частицами углерода и перепад давления в капсуле
Следующий патент: Сополимер пропилена для литья изделий с раздувом
Случайный патент: Материал на основе штукатурки, включающий вещество, способное связывать формальдегид