Замещенные 1,2,3,4,5,6-гексагидро-2,6-метано-3-бензазоцины и их применение в качестве лекарственных средств
Номер патента: 5681
Опубликовано: 28.04.2005
Авторы: Грауэрт Маттиас, Энзингер Хельмут, Картер Адриан, Мирау Йоахим, Вайзер Томас, Гаида Вольфрам
Формула / Реферат
1. Соединения общей формулы 1
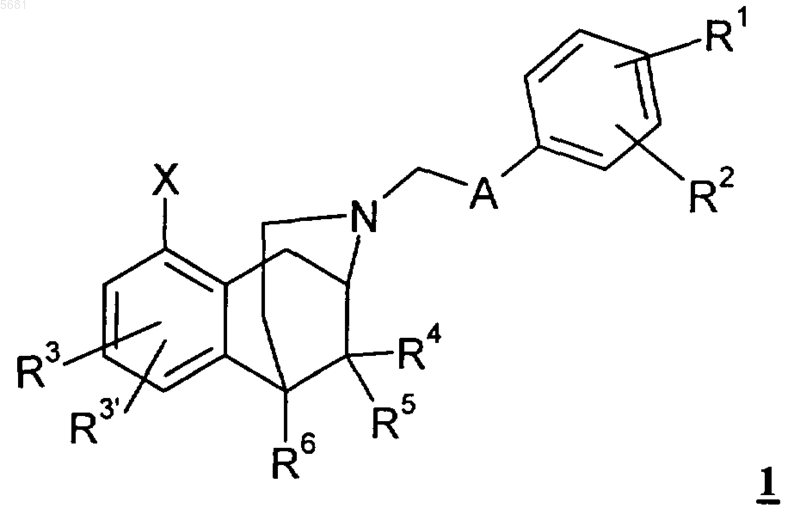
в которой
R1 и R2 имеют идентичные или разные значения и могут обозначать водород, C1-C6алкил, C1-C6алкилоксигруппу, OH, F, Cl или Br,
R3 и R3' имеют идентичные или разные значения и могут обозначать водород, F, Cl, Br, метил, этил, OH, CF3, метоксигруппу или фенил, который необязательно может быть замещен заместителем, выбранным из группы, включающей F, Cl, Br, метил, этил, OH, CF3 и метоксигруппу,
R4, R5 и R6 имеют идентичные или разные значения и могут обозначать водород, метил или этил,
X может обозначать NH2, NH-(C1-C6алкил), N(C1-C6алкил)2, при этом обе C1-C6алкильные группы могут быть идентичными или разными, NH-COH, NH-CO(C1-C6алкил) или F,
A может обозначать -(CH2)3-, -CH2-CH2-O-, -CH2-O-CH2-, -(CH2)4-, -CH(C1-C6алкил)-O-CH2, -(CH2)2-O-CH2-, -(CH2)3-O-, -(CH2)5-, -CH2-O-(CH2)3-, -(CH2)2-O-(CH2)2-, -(CH2)3-O-CH2-, -(CH2)4-O-, -CH2-O-CH2-CH2-O-,
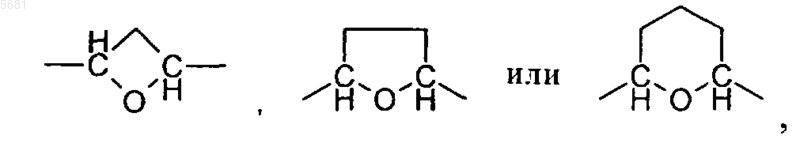
необязательно в виде их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей.
2. Соединения общей формулы 1 по п.1, в которой
R1 и R2 имеют идентичные или разные значения и могут обозначать водород, метил, этил, метилоксигруппу, этилоксигруппу, OH, F, Cl или Br,
R3 и R3' имеют идентичные или разные значения и могут обозначать водород, F, Cl, Br, метил, этил, OH, CF3, метоксигруппу или фенил, замещенный заместителем, выбранным из группы, включающей F, Cl, Br и предпочтительно метил,
R4, R5 и R6 имеют идентичные или разные значения и могут обозначать водород или метил,
X может обозначать NH2, NH-(метил), N(метил)2, NH-(этил), N(этил)2, NH-COH, NH-COMe или F,
A может обозначать -CH2-CH2-O-, -CH2-O-CH2-, -CH(метил)-O-CH2-, -CH(этил)-O-CH2-, -CH(изопропил)-O-CH2-, -(CH2)2-O-CH2-, -(CH2)3-O-, -CH2-O-(CH2)3-, -(CH2)2-O-(CH2)2-, -(CH2)3-O-CH2-, -(CH2)4-O-, -CH2-O-CH2-CH2-O,
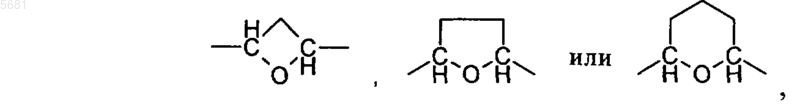
необязательно в виде их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей.
3. Соединения общей формулы 1 по п.1 или 2, в которой R1 и R2 имеют идентичные или разные значения и могут обозначать водород или F, R3 и R3' имеют идентичные или разные значения и могут обозначать водород, F,
Cl, Br, CF3 или метил,
R4, R5 и R6 имеют идентичные или разные значения и могут обозначать водород или метил,
X может обозначать NH2, NH-(метил), N(метил)2, NH-COH, NH-COMe или F,
A может обозначать -CH(метил)-O-CH2-, -CH2-O-CH2- или 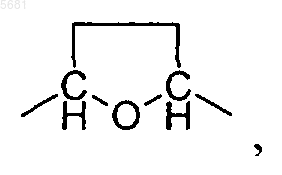
необязательно в виде их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей.
4. Соединения общей формулы 1 по п.1, 2 или 3, в которой
R1 и R2 имеют идентичные или разные значения и могут обозначать водород или F,
R3 и R3' имеют идентичные или разные значения и могут обозначать водород, F, Cl, Br, CF3 или метил,
R4, R5 и R6 имеют идентичные или разные значения и могут обозначать водород или метил,
X может обозначать NH2, NH-(метил) или NH-COH,
A может обозначать -CH(метил)-O-CH2-, -CH2-O-CH2- или 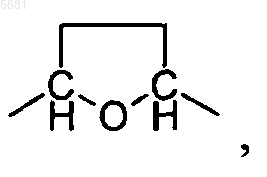
необязательно в виде их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей.
5. Соединения общей формулы 1 по п.1, 2 или 3, в которой
R1 и R2 имеют идентичные или разные значения и могут обозначать водород или F,
R3 и R3' могут обозначать водород,
R4, R5 и R6 имеют идентичные или разные значения и могут обозначать водород или метил,
X может обозначать F,
A может обозначать -CH(метил)-O-CH2-,
необязательно в виде их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей.
6. Фармацевтическая композиция, отличающаяся тем, что она содержит в своем составе соединение формулы 1 по любому из пп.1-5 наряду с обычными вспомогательными веществами и носителями.
7. Применение соединений формулы 1 по любому из пп.1-5 в качестве лекарственных средств.
8. Применение соединений формулы 1 по любому из пп.1-5 для получения соответствующего лекарственного средства, предназначенного для предупреждения или лечения заболеваний или нарушений, при которых благодаря блокаде потенциал-зависимого натриевого канала удается достичь требуемый терапевтический эффект.
9. Применение соединений формулы 1 по любому из пп.1-5 для получения соответствующего лекарственного средства, предназначенного для предупреждения или лечения различных видов аритмии, спазмов, сердечной и мозговой ишемии, болей, а также нейродегенеративных заболеваний.
10. Применение соединений формулы 1 по любому из пп.1-5 для получения соответствующего лекарственного средства, предназначенного для предупреждения или лечения эпилепсии, гипогликемии, гипоксии, аноксии, травм головного мозга, отеков головного мозга, апоплексии, перинатальной асфиксии, перерождений мозжечка, амиотрофического бокового склероза, болезни Хантингтона, болезни Альцгеймера, болезни Паркинсона, маниакально-депрессивного психоза, гипотонии, инфаркта миокарда, нарушений сердечного ритма, стенокардии, хронической боли, невропатической боли или для местного обезболивания.
11. Способ получения соединений общей формулы 1
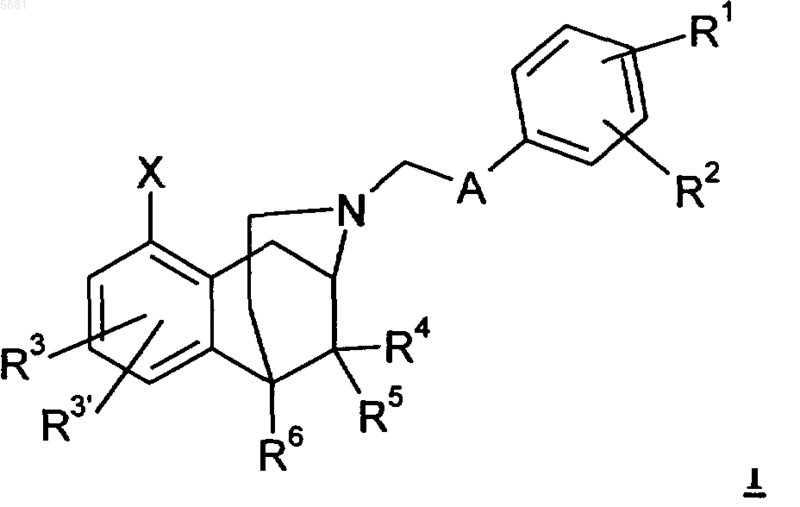
в которой радикалы R1, R2, R3, R3', R4, R5, R6, X и A имеют указанные в пп.1-5 значения, отличающийся тем, что соединения общей формулы 3
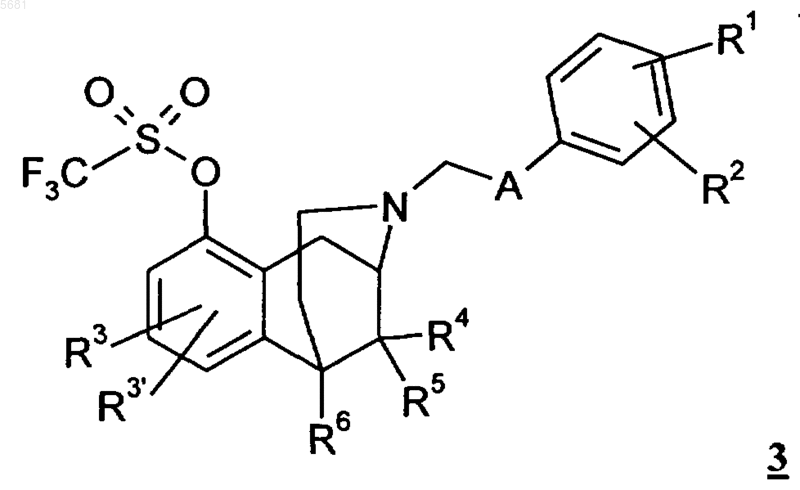
в которой радикалы R1, R2, R3, R3', R4, R5, R6 и A имеют указанные в пп.1-5 значения, подвергают в ароматическом растворителе при палладиевом катализе взаимодействию с кетимином, предпочтительно с бензофенонимином, с получением соединений общей формулы 1, где X представляет собой NH2, а остальные радикалы имеют вышеуказанные значения, с необязательным последующим алкилированием или ацилированием полученэых соединений или их превращением в соединения формулы 1, в которых X представляет собой F.
12. Промежуточные соединения общей формулы 3
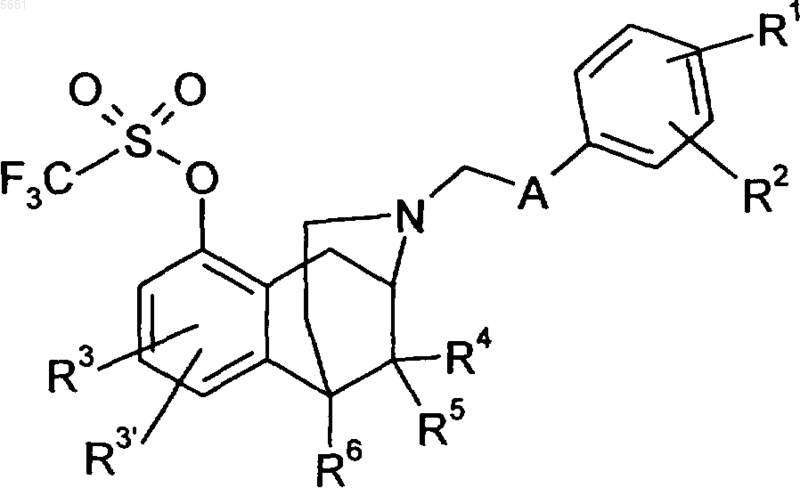
в которой радикалы R1, R2, R3, R3', R4, R5, R6 и A могут иметь указанные в пп.1-5 значения.
Текст
005681 Настоящее изобретение относится к замещенным 1,2,3,4,5,6-гексагидро-2,6-метано-3-бензазоцинам общей формулы 1 в которой R1 и R2 имеют идентичные или разные значения и могут обозначать водород, С 1-С 6 алкил, С 1 С 6 алкилоксигруппу, ОН, F, Cl или Вr;R3 и R3' имеют идентичные или разные значения и могут обозначать водород, F, Сl, Вr, метил, этил,ОН, CF3, метоксигруппу или фенил, который необязательно может быть замещен заместителем, выбранным из группы, включающей F, Cl, Вr, метил, этил, ОН, CF3 и метоксигруппу;R4, R5 и R6 имеют идентичные или разные значения и могут обозначать водород, метил или этил;X может обозначать NH2, NН-(С 1-С 6 алкил), N(С 1-С 6 алкил)2, при этом обе С 1-С 6 алкильные группы могут быть идентичными или разными, NH-COH, NН-СО(С 1-С 6 алкил) или F; А может обозначать -(СН 2)3-, -СН 2-СН 2-О-, -СН 2-О-СН 2-, -(СН 2)4-, -СН(С 1-С 6 алкил)-О-СН 2-, -(СН 2)2-ОСН 2-, -(СН 2)3-О-, -(СН 2)5-, -СН 2-О-(СН 2)3-, -(СН 2)2-О-(СН 2)2-, -(СН 2)3-О-СН 2-, -(СН 2)4-О-, -СН 2-О-СН 2-СН 2-О-, необязательно в виде их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. Предпочтительными являются соединения общей формулы 1, в которой R1 и R2 имеют идентичные или разные значения и могут обозначать водород, метил, этил, метилоксигруппу, этилоксигруппу, ОН, F,Cl или Вr, R3 и R3' имеют идентичные или разные значения и могут обозначать водород, F, Сl, Вr, метил,этил, ОН, CF3, метоксигруппу или фенил, замещенный заместителем, выбранным из группы, включающей F, Cl, Вr и предпочтительно метил;R4 , R5 и R6 имеют идентичные или разные значения и могут обозначать водород или метил;X может обозначать NH2, NH-(метил), N(метил)2, NН-(этил), N(этил)2. NH-COH, NH-COMe или F; А может обозначать -СН 2-СН 2-О-, -СН 2-О-СН 2-, -СН(метил)-О-СН 2-, -СН(этил)-О-СН 2-, -СН(изопропил)О-СН 2-, -(СН 2)2-О-СН 2-, -(СН 2)3-О-, -СН 2-О-(СН 2)3-, -(СН 2)2-О-(СН 2)2-, -(СН 2)3-О-СН 2-, -(СН 2)4-О-, -СН 2-О-СН 2 СН 2-О-, необязательно в виде их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. К особенно предпочтительным относятся соединения общей формулы 1, в которойR1 и R2 имеют идентичные или разные значения и могут обозначать водород или F;R3 и R3' имеют идентичные или разные значения и могут обозначать водород, F, Cl, Br, CF3 или метил;R4, R5 и R6 имеют идентичные или разные значения и могут обозначать водород или метил;X может обозначать NH2, NН-(метил), N(метил)2, NH-COH, NH-COMe или F; А может обозначать -СН(метил)-О-СН 2-, -СН 2-О-СН 2- или необязательно в виде их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. Особое значение согласно изобретению имеют соединения общей формулы 1, в которой R1 и R2 имеют идентичные либо разные значения и могут обозначать водород или F;R3 и R3' имеют идентичные либо разные значения и могут обозначать водород, F, Сl, Br, CF3 или метил;R4, R5 и R6 имеют идентичные либо разные значения и могут обозначать водород или метил;-1 005681 необязательно в виде их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно их фармакологически приемлемых кислотно-аддитивных солей. Такое же особое значение, что и представленные выше, имеют согласно изобретению соединения общей формулы 1, в которой R1 и R2 имеют идентичные либо разные значения и могут обозначать водород или F;R4, R5 и R6 имеют идентичные либо разные значения и могут обозначать водород или метил;X может обозначать F; А может обозначать -СН(метил)-О-СН 2-,необязательно в виде их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно их фармакологически приемлемых кислотно-аддитивных солей. В представленных выше соединениях общей формулы 1 R1, если он не обозначает водород, находится предпочтительно в орто- или пара-положении, особенно предпочтительно в орто-положении по отношению к мостику А. В тех же представленных выше соединениях общей формулы 1 R2, если он не обозначает водород, предпочтительно находится в орто-положении по отношению к мостику А. В представленных выше соединениях общей формулы 1 R3, если он не обозначает водород, предпочтительно находится в положении 7, т.е. в пара-положении по отношению к группе X. В тех же представленных выше соединениях общей формулы 1 R3' , если он не обозначает водород, находится предпочтительно в положении 9, т.е. в орто-положении по отношению к группе X. Особенно предпочтительны согласно изобретению соединения формулы 1, в которых R3' обозначает водород. Особый интерес представляют соединения общей формулы 1, выбранные из группы, включающей:C1-C6 алкил представляет собой неразветвленный или разветвленный углеводородный радикал с 1-6 атомами углерода, которые необязательно могут содержать также циклические системы. Алкильные заместители могут быть идентичными или разными и необязательно замещены одним либо несколькими атомами галогена, предпочтительно фтором. В качестве примеров можно назвать метил, этил, пропил,изопропил, бутил, изобутил, пентил, изопентил, неопентил, гексил, циклопропилметил, циклобутил,циклопентил и циклогексил. В некоторых случаях для вышеназванных алкильных групп используются также общепринятые сокращения, например Me для метила, Et для этила, Prop для пропила и т.п.C1-С 6 алкилоксигруппа представляет собой неразветвленный или разветвленный углеводородный радикал с 1-6 атомами углерода, присоединенный через атом кислорода. Алкилоксизаместители могут быть идентичными или разными. В качестве примеров можно назвать такие группы, как метилокси, этилокси, пропилокси, изопропилокси, бутилокси, изобутилокси, пентилокси, изопентилокси, неопентилокси, гексилокси, циклопропилметилокси, циклобутилокси, циклопентилокси и циклогексилокси. В некоторых случаях для вышеназванных алкилоксигрупп используется также краткое обозначение алкокси. В соответствии с этим вместо метилокси-, этилокси-, пропилокси- и других подобных групп могут использоваться также краткие обозначения метокси, этокси, пропокси и т.п. В некоторых случаях вышеназванные алкилоксигруппы могут быть представлены общепринятыми сокращениями, такими как МеО для метилокси, EtO для этилокси, РrорО для пропилокси и т.п. Группы с двумя связями, представляющие группу А, могут быть присоединены согласно изобретению в обоих возможных направлениях к смежным с ними остаткам. При необходимости соединения общей формулы 1 можно переводить в их соли, прежде всего для применения в фармацевтике, в их фармакологически приемлемые кислотно-аддитивные соли с соответствующей неорганической либо органической кислотой. В качестве кислот для этих целей могут применяться среди прочих янтарная кислота, бромисто-водородная кислота, уксусная кислота, фумаровая кислота, малеиновая кислота, метансульфоновая кислота, молочная кислота, фосфорная кислота, соляная кислота, серная кислота, винная кислота или лимонная кислота. Кроме того, возможно применение и смесей указанных кислот. Предлагаемые в изобретении соединения являются блокаторами потенциал-зависимого натриевого канала. При этом имеются в виду соединения, которые конкурентно или не конкурентно вытесняют батрахотоксин (ВТХ) с высокой степенью сродства (Кi1000 нМ) из места связывания с натриевым каналом. Такие вещества проявляют "зависимость, обусловленную особенностями их применения", при блокаде натриевых каналов, иными словами, для связывания соединений с натриевым каналом необходимо сначала активировать натриевые каналы. Максимальную блокаду натриевых каналов удается достичь лишь после их неоднократной стимуляции. Вследствие этого соединения предпочтительно связываются с натриевыми каналами, которые подвергаются многоразовой активации. Благодаря этому соединения способны проявлять свою эффективность в тех частях тела, патология которых обусловлена соответствующей сверхстимуляцией. Под это понятие подпадают такие заболевания, как различные виды аритмии, спазмы, сердечная и мозговая ишемия, боли, а также нейродегенеративные заболевания различного происхождения. В качестве примеров можно назвать эпилепсию, гипогликемию, гипоксию, аноксию, травмы головного мозга, отек головного мозга, кровоизлияние в мозг, перинатальную асфиксию, перерождение мозжечка, амиотрофический боковой склероз, болезнь Хантингтона, болезнь Альцгеймера, болезнь Паркинсона, маниакально-депрессивный психоз, гипотонию, инфаркт миокарда, нарушения ритма сердца, стенокардию, хроническую боль, невропатическую боль, а также местное обезболивание (потеря чувствительности части тела). Еще одним объектом изобретения в соответствии с этим является применение соединений общей формулы 1 в качестве лекарственных средств, прежде всего таких лекарственных средств, с помощью которых в результате блокады потенциал-зависимого натриевого канала можно достичь требуемый терапевтический эффект. Предпочтительно применять предлагаемые соединения общей формулы 1 для получения лекарственных средств, предназначенных для предупреждения или лечения аритмии, спазмов, сердечной и мозговой ишемии, болей, а также нейродегенеративных заболеваний. Наиболее предпочтительным является указанное применение соединений общей формулы 1 по изобретению для получения соответствующего лекарственного средства, предназначенного для предупреждения или лечения эпилепсии, гипогликемии, гипоксии, аноксии, травм головного мозга, отека головного мозга, апоплексии, перинатальной асфиксии, перерождения мозжечка, амиотрофического бокового склероза, болезни Хантингтона, болезни Альцгеймера, болезни Паркинсона, маниакально-депрессивного психоза, гипотонии, инфаркта миокарда, нарушений ритма сердца, стенокардии, хронической боли, невропатической боли, а также местного обезболивания (потеря чувствительности части тела).-3 005681 В тест-системе для подтверждения блокирующего натриевый канал действия исследуют связывание ВТХ с натриевым каналом [S.W. Postma и W.A. Catterall, Mol. Pharmacol. 25, с. 219-227 (1984)], а также проводят пэтч-кламп-эксперименты (с парной электрической стимуляцией), с помощью которых удается показать, что соединения по изобретению блокируют подвергнутый электрической стимуляции натриевый канал зависимым от специфики применения образом [W.A. Catterall, Trends Pharmacol. Sci. 8, стр. 57-65 (1987)]. За счет выбора соответствующей клеточной системы (например, нейрональных,кардиальных, DRG-клеток) можно исследовать действие соединений на различные подтипы натриевого канала). Способность предлагаемых в изобретении соединений блокировать натриевый канал может быть подтверждена таким фактором, как блокада индуцированного вератридином высвобождения глутамата[S. Villauneva, P. Frenz, Y. Dragnic, F. Orrego, Brain Res. 461, с 377-380 (1988)]. Вератридин представляет собой токсин, который постоянно открывает натриевый канал. В результате создается возможность повышенного притока ионов натрия в клетку. Через описанный выше каскад этот приток натрия в нейрональную ткань способствует усиленному высвобождению глутамата. Благодаря соединениям по изобретению этому высвобождению глутамата удается противодействовать. Противосудорожные свойства предлагаемых субстанций были подтверждены в исследованиях их защитного действия против судорог, инициированных у мышей максимальным электрошоком [М.А. Rogawski и R.J. Porter, Pharmacol. Rev. 42, с. 223-286 (1990)]. Нейрозащитные свойства предлагаемых соединений были подтверждены в исследованиях их защитного действия на крысах с использованием МСАО-модели [U. Pschom и A.J. Carter, Journ. StrokeBeal, Annals of Neurology 38, с. 357-366 (1995), и J.B. Schulz, R.T. Matthews, D.R. Henshaw и M.F. Beal,Neuroscience 71, с 1043-1048 (1996)], а также на индуцированной МФТП (1-метил-4-фенил-1.2,3,6 тетрагидропиридин) модели перерождения (J.P. Steiner и др., Proc. Natl. Acad. Sci. 94, с. 2019-2024(1997)]. Анальгетическое действие было подтверждено на индуцированной формалином модели боли [D.Dubuisson и S.G. Dennis, Pain 4, стр. 161-174 (1977)], а также на модели лигатуры [G.J. Bennett и Y.-K.Xie, Pain 33, с. 87-107 (1988)]. В некоторых публикациях [например, J.R. Calabrese, С. Bowden, M.J. Woyshville в Psychopharmacology: The Fourth Generation of Progress (под ред. D.E. Bloom и D.J. Kupfer), стр. 1099-1111, Нью-Йорк, издво Raven Press Ltd.] описывалась, кроме того, возможность применения блокаторов натриевого канала для терапии циклофрении (маниакально-депрессивного заболевания). Предлагаемые в изобретении соединения общей формулы 1 можно получать аналогично в принципе известным методам синтеза. Один из таких возможных вариантов синтеза представлен на схеме 1. Схема 1 Ключевой стадией является перевод фенола формулы 2 в соединение формулы 1, в которой X обозначает NH2, каковую реакцию осуществляют согласно Бухвальду [J.P. Wolfe, J. Ahman, J.P. Sadighi, R.A. Singer,S.L. Buchwald, THL 1997, с. 6367-6370]. Требуемые для указанной реакции трифлаты формулы 3 можно получать, исходя из соединений 2 взаимодействием с ангидридом трифторметансульфоновой кислоты в присутствии вспомогательного основания. В качестве таких вспомогательных оснований могут рассматриваться согласно изобретению органические амины, такие, например, как диметиламинопиридин, пиридин, а также трет-амины, такие, например, как триметиламин, триэтиламин, диизопропилэтиламин или ДБУ (диазабициклоундецен). Предпочтительно из вышеназванных аминов применять в качестве вспомогательного основа-4 005681 ния трет-амины, особенно предпочтительно триэтиламин. Реакцию проводят в апротонных органических растворителях, предпочтительно в растворителях, выбранных из группы, включающей диметилформамид, диметилацетамид, метиленхлорид, толуол, а также тетрагидрофуран. К наиболее предпочтительным из них следует отнести метиленхлорид. Реакции с получением трифлатов формулы 3 предпочтительно проводить при температурах ниже комнатной температуры, особенно предпочтительно в интервале от -50 до 0 С, наиболее предпочтительно в интервале от -30 до -5 С. По истечении 0,5-4 ч реакцию проводят далее при комнатной температуре до достижения полного превращения (примерно 1-12 ч). После переработки полученные таким путем сырые продукты 3 без последующей очистки подвергают в ароматическом органическом растворителе, предпочтительно выбранном из группы, включающей толуол, бензол и ксилол, особенно предпочтительно толуол, при палладиевом катализе, предпочтительно в присутствии фосфинового лиганда, взаимодействию с источником азота, предпочтительно с кетиминами, особенно предпочтительно с бензофенонимином. В качестве палладиевых катализаторов приемлемы согласно изобретению трис(дибензилиденацетон)дипалладий, ацетат палладия(И) или, например, тетракистрифенилфосфинпалладий. В качестве фосфиновых лигандов могут использоваться, например, лиганды, выбранные из группы, включающей ДФФФ (1,1'-бис(дифенилфосфино)ферроцен),БИНАФ (2,2'-(дифенилфосфино)-1,1'-бинафтил), n-толБИНАФ (2,2'-бис(ди-n-толилфосфино)-1,1'-бинафтил),PPh2-CHMe-P(трет-Bu)2, фосфинзамещенные ферроцены, а также трифенилфосфин. Предпочтительно в качестве каталитической системы применять трис(дибензилиденацетон)дипалладий/БИНАФ. Реакцию предпочтительно проводить в условиях без доступа влаги и кислорода при предпочтительно повышенной температуре. Реакцию предпочтительно осуществляют при нагревании используемого растворителя с обратным холодильником. Получаемый в качестве промежуточного продукта иминовый аддукт путем кислотного гидролиза,предпочтительно с использованием разбавленных минеральных кислот, особенно предпочтительно разбавленной соляной кислоты, можно переводить в соединения формулы 1 по изобретению (где X обозначает NH2). Очистку продуктов осуществляют с помощью хроматографии на силикагеле либо путем кристаллизации, предпочтительно путем кристаллизации фармакологически приемлемых кислотноаддитивных солей, например гидрохлоридов. Из вышеизложенного очевидно, что трифлаты общей формулы 3 играют главную роль при синтезе предлагаемых в изобретении соединений общей формулы 1. В соответствии с этим еще одним объектом настоящего изобретения являются промежуточные соединения общей формулы 3 в которой R1, R2, R3, R3, R4, R5, R6 и А могут иметь указанные выше значения. При синтезе соединений общей формулы 1 по изобретению, где X не обозначает NH2, можно работать следующим образом. Соединения формулы 1, в которых X обозначает NН-(С 1-С 6 алкил) или М(С 1-С 6 алкил)2, могут быть получены по известным способам путем алкилирования соединений 1, в которых X обозначает NH2, путем восстановительного аминирования или путем ацилирования, необязательно в присутствии органических оснований, с последующим восстановлением. Алкилирование можноосуществлять следующим образом. Соединение общей формулы 1, где X обозначает NH2, растворяют в полярном органическом растворителе, таком как диметилформамид, диметилацетамид, метиленхлорид или тетрагидрофуран, предпочтительно в диметилформамиде или метиленхлориде. Полученный таким путем раствор смешивают затем с основанием и соответствующим алкилирующим агентом. В качестве основания пригодны гидриды щелочных и щелочно-земельных металлов, предпочтительно гидрид натрия. В качестве алкилирующего агента могут использоваться алкилгалогениды, такие как алкилхлорид, алкилбромид и прежде всего алкилиодид, а также алкилтозилаты, -мезилаты, -трифлаты и диалкилсульфаты. После обычной переработки алкилированные соединения общей формулы 1 можно очищать с помощью хроматографии на силикагеле или путем кристаллизации, необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей, предпочтительно в виде гидрохлоридов. Для получения соединений общей формулы 1 путем восстановительного аминирования при прочих обычных условиях, при охлаждении, предпочтительно в интервале от -50 С до комнатной температуры,особенно предпочтительно от -30 до 0 С, амины формулы 1, где X обозначает NH2, в присутствии кислот, таких как разбавленная соляная кислота, разбавленная уксусная кислота или разбавленная серная кислота, смешивают с альдегидами либо кетонами, после чего образующиеся таким путем в качестве промежуточных продуктов шиффовы основания или иминиевые соли восстанавливают. Восстановление осуществляют с использованием гидридов металлов, таких, например, как борогидрид натрия, LiAlH4,-5 005681Li-алкоксигидриды, NaBH4, NaBHCN3, NaBH(OAc)3, предпочтительно использовать борогидрид натрия. После обычной переработки алкилированные соединения общей формулы 1 можно очищать с помощью хроматографии на силикагеле или путем кристаллизации, необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей, предпочтительно в виде гидрохлоридов. Соединения формулы 1, где X обозначает NНСО(С 1-С 6 алкил), можно получать по известным способам путем ацилирования соединений 1, где X обозначает NH2, предпочтительно с помощью хлорангидридов кислот или ангидридов. С этой целью аминосоединение формулы 1, где X обозначает NH2,суспендируют в органическом растворителе, смешивают с органическим основанием и добавляют требуемый хлорангидрид кислоты или ангидрид. Затем смесь в течение 40-60 мин, предпочтительно в течение 25-45 мин, выдерживают при комнатной температуре. Пригодными для использования в указанных целях органическими растворителями являются диметилформамид, диметилацетамид, метиленхлорид,толуол или тетрагидрофуран, предпочтителен из которых метиленхлорид. Пригодными органическими основаниями являются диметиламинопиридин, пиридин, трет-амины, например триметиламин, триэтиламин, диизопропилэтиламин, ДБУ (диазабициклоундецен). После переработки продукты очищают с помощью хроматографии на силикагеле или путем кристаллизации, предпочтительно путем кристаллизации фармакологически приемлемых кислотно-аддитивных солей, например гидрохлоридов. Исходя из получаемых по описанной выше технологии соединений формулы 1, где X обозначаетNHC(С 1-С 6 алкил), путем восстановления с использованием гидридов металлов, таких, например, как LiAlH4, Li-алкоксигидриды, NаВН 4, NаВНСN3, NaBH(OAc)3, предпочтительно борогидрида натрия, можно также получать соединения формулы 1, где, например, X обозначает NH(С 1-С 6 алкил). Эти реакции предпочтительно проводить в эфирных органических растворителях, предпочтительно в тетрагидрофуране или диоксане, в присутствии кислот Льюиса, предпочтительно трифторидэфирата бора, при повышенной температуре, предпочтительно выше 50 С, особенно предпочтительно при нагревании используемого растворителя с обратным холодильником. После переработки продукты очищают с помощью хроматографии на силикагеле или путем кристаллизации, предпочтительно путем кристаллизации фармакологически приемлемых кислотно-аддитивных солей, например гидрохлоридов. Формилированные соединения формулы 1 (X обозначает NHCOH) можно получать, например,взаимодействием соединений формулы 1, где X обозначает NH2, с муравьиной кислотой при повышенной температуре, предпочтительно при нагревании с обратным холодильником. После переработки продукты очищают с помощью хроматографии на силикагеле или путем кристаллизации, предпочтительно путем кристаллизации фармакологически приемлемых кислотно-аддитивных солей, например гидрохлоридов. Фторзамещенные соединения формулы 1 (X обозначает F) можно получать по известным способам путем диазотирования соединений 1, где X обозначает NH2, и последующей вываркой с BF4-. Реакцию предпочтительно проводить с использованием NOBF4 в качестве диазотирующего и фторирующего реагента в эфирных растворителях, предпочтительно в тетрагидрофуране или диоксане, при повышенной температуре, предпочтительно выше 50 С, особенно предпочтительно при нагревании используемого растворителя с обратным холодильником. После переработки продукты очищают с помощью хроматографии на силикагеле или путем кристаллизации, предпочтительно путем кристаллизации фармакологически приемлемых кислотно-аддитивных солей, например гидрохлоридов. Представленные на схеме 1 в качестве исходных соединений 1,2,3,4,5,6-гексагидро-2,6-метано-3 бензазоцин-10-олы (2) можно получать по известным из уровня техники методам синтеза. В этом отношении можно сослаться на заявки ЕР 521422, WO 97/06146 и WO 99/14199. При получении соединений общей формулы 2, в которых R представляет собой водород, исходят из соединений общей формулы 4, используя при этом метод синтеза, аналогичный описанному в заявке WO 99/14199. Для получения же соединений общей формулы 2, в которых R3 не является водородом, требуется сначала модифицировать соединения общей формулы 4. Эту модификацию осуществляют с использованием в принципе известных рекомендаций по синтезу, представленному на нижеприведенных схемах. Замещение метилом в пара-положении (R3 обозначает метил) можно осуществлять, например, согласно тому, как указано на схеме 2. Для получения бромированного соединения формулы 5 соединения формулы 4 растворяют в соответствующем растворителе, предпочтительно в уксусной кислоте либо трифторуксусной кислоте, особенно предпочтительно в смеси этих обеих кислот, и при температуре в интервале от 0 до 23 С, предпочтительно при 10 С, порциями смешивают с N-БС (N-бромсукцинимидом). По истечении примерно 1-5 ч реакция завершается. Далее проводят обычную переработку. Очистку продуктов в зависимости от склонности соединений 5 к кристаллизации осуществляют либо путем кристаллизации, либо посредством хроматографии. Бензилирование соединений формулы 5 с получением соединений формулы 6 предпочтительно осуществлять в органическом растворителе, предпочтительно в растворителе, выбранном из группы,включающей дихлорметан, диметилформамид и диметилацетамид, особенно предпочтительно в диметилацетамиде. С этой целью соединения 5 растворяют в одном из указанных растворителей и в присутствии соответствующего основания при температуре в интервале от 0 до 50 С, особенно предпочтительно при комнатной температуре (приблизительно 23 С), смешивают с бензилхлоридом. В качестве оснований приемлемы органические и неорганические основания. В качестве неорганического основания могут использоваться карбонаты щелочных или щелочно-земельных металлов: лития, натрия, калия,кальция, такие как карбонат натрия, карбонат лития, карбонат калия, карбонат кальция, предпочтителен из них карбонат калия. В качестве органического основания предпочтительно использовать органические амины, особенно предпочтительно диизопропилэтиламин, триэтиламин, циклические амины, такие как ДБУ, или пиридин. По завершении процесса добавления бензилхлорида продолжают перемешивать еще в течение 1-6 ч, предпочтительно 2-4 ч, при повышенной температуре, предпочтительно в интервале от приблизительно 50 до 120 С, особенно предпочтительно при температуре порядка 100 С, максимально,однако, при температуре кипения используемого растворителя. Далее проводят обычную переработку. Очистку продуктов в зависимости от склонности соединений 6 к кристаллизации осуществляют либо путем кристаллизации, либо посредством хроматографии. Соединения формулы 7 можно получать из соединений формулы 6 взаимодействием с соответствующими формилирующими реагентами. С этой целью соединения 6 растворяют в соответствующем органическом растворителе, предпочтительно в безводном органическом растворителе, предпочтительно в эфирном растворителе, выбранном из группы, включающей диэтиловый эфир, тетрагидрофуран и диоксан, предпочтительно в диэтиловом эфире, и при пониженной температуре, предпочтительно ниже -20 С и особенно предпочтительно при температуре в интервале от -50 до -78 С, смешивают с бутиллитием, предпочтительно растворенном в н-гексане. После примерно 0,5-2-часового перемешивания в указанном интервале температур добавляют формилирующий реагент, предпочтительно диметилформамид, и продолжают перемешивание еще в течение 0,5-2 ч, необязательно при слегка повышенной температуре, предпочтительно в интервале от -30 до 0 С, особенно предпочтительно при приблизительно -10 С. Далее проводят обычную переработку. Очистку продуктов в зависимости от склонности соединений 7 к кристаллизации осуществляют либо путем кристаллизации, либо посредством хроматографии. Восстановление соединений формулы 7 приводит к получению метильных соединений формулы 8. С этой целью соединения 7 растворяют в соответствующем органическом растворителе, предпочтительно в безводном органическом растворителе, предпочтительно в эфирном растворителе, выбранном из группы, включающей диэтиловый эфир, тетрагидрофуран и диоксан, предпочтительно в тетрагидрофуране, и затем смешивают с соответствующим восстановителем, предпочтительно с гидридом соли металла, особенно предпочтительно с NaBH4 или NaCNBH3, предпочтительно с последним из них. Далее предусматривается добавление трифторида бора, предпочтительно ВF3-эфирата. После добавления восстановителя перемешивают еще в течение 1-6 ч, предпочтительно в течение 2-4 ч, при постоянной температуре, предпочтительно при комнатной температуре. После добавления протонного растворителя, особенно предпочтительно низшего спирта, выбранного из группы, включающей метанол, этанол и изопропанол, особенно предпочтительно метанола, и гидролиза, осуществляемого с помощью водной кислоты,предпочтительно водной соляной кислоты, продолжают перемешивание в течение 0,5-4 ч, необязательно при повышенной температуре, предпочтительно при температуре выше 50 С, особенно предпочтительно-7 005681 при нагревании используемого растворителя с обратным холодильником. Последующую переработку проводят обычным образом. Очистку продуктов в зависимости от склонности соединений 8 к кристаллизации осуществляют либо путем кристаллизации, либо посредством хроматографии. За счет отщепления присутствующей в соединении формулы 8 метоксигруппы получают гидроксисоединения формулы 9, каковую операцию осуществляют под действием сильных кислот, таких как HI и НВr, особенно предпочтительно концентрированной НВr, при повышенной температуре, предпочтительно при температуре выше 50 С, особенно предпочтительно при нагревании с обратным холодильником. Необходимость в применении растворителя при использовании, например, НВr отпадает. По истечении приблизительно 1-6 ч, предпочтительно 2-4 ч, реакция завершается. Последующую переработку проводят обычным образом. Очистку продуктов в зависимости от склонности соединений 9 к кристаллизации осуществляют либо путем кристаллизации, либо посредством хроматографии. Согласно другому варианту отщепление присутствующей в соединениях 8 метоксигруппы с получением гидроксисоединений 9 можно осуществлять с помощью ВВr3 аналогично тому, как это описано ниже для превращения соединений формулы 17 в гидроксисоединения формулы 18. Отщеплением бензильной группы путем гидрогенолиза из соединений формулы 9 можно получать соединения формулы 10. Эту реакцию восстановления осуществляют предпочтительно путем каталитического гидрирования, предпочтительно с использованием палладиевых катализаторов или никеля Ренея,особенно предпочтительно палладиевых катализаторов в спиртовых растворителях, предпочтительно в метаноле, при комнатной температуре. Последующую переработку проводят обычным образом. Очистку продуктов в зависимости от их склонности к кристаллизации осуществляют либо путем кристаллизации,либо посредством хроматографии. Соединения общей формулы 2 можно получать исходя из соединений общей формулы 10 аналогично путям синтеза, описанным в заявке WO 99/14199. Замещение фтором в пара-положении осуществляют представленным на схеме 3 путем. С этой целью соединение формулы 6 растворяют в соответствующем органическом растворителе, предпочтительно в безводном органическом растворителе, предпочтительно в эфирном растворителе, выбранном из группы, включающей диэтиловый эфир, тетрагидрофуран и диоксан, предпочтительно в диэтиловом эфире, и при пониженной температуре, предпочтительно ниже -20 С, особенно предпочтительно при температуре в интервале от -50 до -78 С, смешивают с бутиллитием, предпочтительно растворенном в нгексане. После примерно 0,5-2-часового перемешивания в указанном интервале температур медленно добавляют соответствующий фторирующий агент, предпочтительно N-фторбензолсульфонимид, растворенный в одном из вышеназванных растворителей, и в течение последующих 0,5-2 ч продолжают перемешивание при постоянной температуре. Дальнейшую обработку проводят обычным образом. Очистку продуктов в зависимости от их склонности к кристаллизации осуществляют либо путем кристаллизации,либо с помощью хроматографических методов. Схема 3 Перевод соединений формулы 11 в гидроксисоединения формулы 12 осуществляют аналогично описанному выше превращению соединений 8 в соединения 9. Перевод соединений формулы 12 в дебензилированные соединения формулы 13 осуществляют аналогично описанному превращению соединений 9 в соединения 10. Соединения общей формулы 2 можно получать исходя из соединений общей формулы 13 аналогично путям синтеза, описанным в заявке WO 99/14199. Замещение группой CF3 в пара-положении осуществляют путем синтеза, представленным на схеме 4. С этой целью на первой стадии соединение формулы 4 переводят в иодид формулы 14. Эту реакцию осуществляют аналогично вышеописанному превращению соединений 4 в соединения 5 с использованием N-ИС (N-иодсукцинимида). Из соединений формулы 14 можно получать N-защищенные соединения формулы 15, в которых PG представляет собой аминозащитную группу. В качестве защитной группы могут рассматриваться груп-8 005681 пы, обычно используемые для защиты аминофункции. В качестве примеров можно назвать бензильную группу, бензилоксикарбонильную группу и трет-бутилоксикарбонильную группу, предпочтительна из которых последняя из них. Для введения трет-бутилоксикарбонильной группы работают следующим образом. Реакцию проводят предпочтительно в органическом растворителе, предпочтительно в растворителе, выбранном из группы, включающей дихлорметан, диметилформамид и диметилацетамид, особенно предпочтительно в дихлорметане. С этой целью соединения 14 растворяют в растворителе в присутствии соответствующего основания при температуре в интервале от -50 до 10 С, предпочтительно от -20 до 0 С, и смешивают с неорганическим основанием. В качестве неорганического основания могут использоваться гидроксиды щелочных или щелочноземельных металлов: лития, натрия, калия, кальция, такие как гидроксид натрия, гидроксид лития, гидроксид калия, гидроксид кальция, предпочтительно гидроксид калия, необязательно в водном растворе. Затем добавляют ди-трет-бутилдикарбонат, необязательно растворенный в одном из вышеназванных растворителей. По завершении добавления продолжают перемешивание еще в течение 0,5-6 ч, предпочтительно в течение 1-3 ч, необязательно при повышенной температуре, предпочтительно при комнатной температуре. Последующую обработку проводят обычным образом. Очистку продуктов в зависимости от склонности соединений 15 к кристаллизации осуществляют либо путем кристаллизации, либо посредством хроматографии. Схема 4 Исходя из соединений формулы 15, можно получать трифторметильные соединения формулы 16. С этой целью соединение 15 растворяют в соответствующем органическом растворителе, предпочтительно в полярном органическом растворителе, выбранном из группы, включающей диметилацетамид, диметилсульфоксид и диметилформамид, особенно предпочтительно в диметилформамиде, и смешивают с метиловым эфиром фторсульфонилдифторуксусной кислоты и CuI, предпочтительно с безводным CuI. Затем реакционную смесь нагревают до температуры в интервале от 50 до 90 С, особенно предпочтительно до 70 С. При постоянной температуре перемешивают в промежутке времени между 1-м и 4-м днями, предпочтительно в течение 2 дней. В зависимости от того, как протекает реакция, может оказаться необходимым дополнительно добавлять метиловый эфир фторсульфонилдифторуксусной кислоты иCuI. Последующую обработку проводят обычным образом. Очистку продуктов в зависимости от склонности соединений 16 к кристаллизации осуществляют либо путем кристаллизации, либо посредством хроматографии. За счет отщепления аминозащитной группы, исходя из соединений формулы 16, получают соединения формулы 17. Методы отщепления используемых защитных групп известны из уровня техники. В качестве примера достаточно назвать лишь один из возможных вариантов отщепления защитной третбутилоксикарбонильной группы. Эту операцию осуществляют взаимодействием соединений 16 с трифторуксусной кислотой в соответствующем органическом растворителе, предпочтительно в дихлорметане, при комнатной температуре в течение 1-3 ч. Последующую обработку проводят обычным образом. Очистку продуктов в зависимости от склонности соединений 17 к кристаллизации осуществляют либо путем кристаллизации, либо посредством хроматографии. За счет отщепления метоксигруппы, исходя из соединений формулы 17, получают соединения формулы 18, каковую реакцию осуществляют взаимодействием с раствором ВBr3 в присутствии трифторуксусной кислоты в соответствующем органическом растворителе, предпочтительно в дихлорметане, при пониженной температуре, предпочтительно ниже -50 С, особенно предпочтительно в интервале от -75 до-60 С. После добавления реагентов при вышеуказанной температуре реакцию перемешиванием при температуре в интервале от -20 до 20 С, предпочтительно при приблизительно 0 С, в течение 4-12 ч доводят до полного завершения. Последующую переработку проводят обычным образом. Очистку продуктов в зависимости от склонности соединений 18 к кристаллизации осуществляют либо путем кристаллизации,либо посредством хроматографии. Согласно другому варианту отщепление содержащейся в соединениях 17 метоксигруппы с получением гидроксисоединений 18 можно осуществлять также с использованием сильных кислот. В этом отношении можно сослаться на соответствующие пояснения, касающиеся превращения соединений 8 в гидроксисоединения 9.-9 005681 Соединения общей формулы 2 можно получать, исходя из соединений общей формулы 18 аналогично путям синтеза, описанным в заявке WO 99/14199. Замещение фенилом в пара-положении осуществляют представленным на схеме 5 путем. Схема 5 Исходя из соединений формулы 6 взаимодействием с соответствующим образом замещенными боранатами и последующим трансметаллированием с помощью соединений палладия(0) получают соединения формулы 19. В качестве боранатов используют замещенные остатком R фенилбороновые кислоты. Для превращения соединения 6 последнее растворяют в соответствующем органическом растворителе,предпочтительно в безводном и не содержащем кислород органическом растворителе, предпочтительно в эфирном растворителе, выбранном из группы, включающей диэтиловый эфир, тетрагидрофуран и диоксан, предпочтительно в диоксане, и последовательно примешивают вышеназванное производное бороновой кислоты, фосфат калия и соответствующий палладиевый(0) катализатор. В качестве такого Pd(0)катализатора приемлемы согласно изобретению трис(дибензилиденацетон)дипалладий, ацетат палладия(II) или, например, тетракистрифенилфосфинпалладий, предпочтительно трис(дибензилиденацетон)палладий(0). Кроме того, предусматривается обязательное добавление фосфинов или фосфитов. В качестве фосфиновых лигандов могут использоваться среди прочих лиганды, выбранные из группы, включающей ДФФФ (1,1'-бис(дифенилфосфино)ферроцен), БИНАФ (2,2'-(дифенилфосфино)-1,1 бинафтил), n-толБИНАФ (2,2'-бис(ди-n-толилфосфино)-1,1'-бинафтил), PPh2-CHMe-P(трет-Bu)2, фосфинзамещенные ферроцены, трифенилфосфин и триметилфосфит, предпочтительно триметилфосфит. После добавления всех компонентов реакции перемешивают в течение 0,5-2 ч при повышенной температуре,предпочтительно при температуре выше 50 С, особенно предпочтительно при нагревании растворителя с обратным холодильником. Последующую переработку проводят обычным образом. Очистку продуктов в зависимости от склонности соединений 19 к кристаллизации осуществляют либо путем кристаллизации,либо посредством хроматографии. Перевод соединений формулы 19 в гидроксисоединения формулы 20 осуществляют аналогично тому, как описано выше, для превращения соединений 8 в соединения 10 (через соединения 9). Соединения общей формулы 2 можно получать исходя из соединений общей формулы 20 аналогично путям синтеза, описанным в заявке WO 99/14199. Галогензамещенные производные могут быть получены, например, взаимодействием соединений общей формулы 1 по изобретению, в которых X представляет собой NH2, a R3 представляет собой водород, с N-ИС, N-БС или N-ХС (схема 6). При этом, как правило, получают смеси пара-, орто- и пара-/ортодвузамещенных соединений, разделять которые можно с помощью хроматографии. Соединения общей формулы 2, в которых R представляет собой водород, можно получать, исходя из соединений общей формулы 4 аналогично путям синтеза, описанным в заявке WO 99/14199. Для получения соединений 2, в которых R обозначает водород, исходят из соединений формулы 21 (схема 7),получать которые можно из соединений 4. Соединения формулы 21 представлены в заявке WO 99/14199. Схема 7 Ниже изобретение более подробно поясняется на примерах, при этом представленные в примерах соединения и способ их получения никоим образом не ограничивают его объем.I. Синтез промежуточных продуктов 4-20 Соединения формул(2R,6S)-7-бром-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцин, гидрохлорид 5 а 24,7 г (0,1 моля) (2R,6S)-10-метокси-l,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3 бензазоцина (4 а) растворяют в 220 мл уксусной кислоты и 22 мл трифторуксусной кислоты, охлаждают до 10 С и порциями смешивают с 19,6 г N-БС (N-бромсукцинимида). Далее перемешивают в течение 3 ч при 10 С, растворитель удаляют в вакууме и остаток смешивают с охлажденным льдом раствором аммиака. Затем дважды экстрагируют порциями по 200 мл уксусного эфира, объединенную органическую фазу сушат и растворитель удаляют в вакууме. Остаток растворяют в ацетоне и с помощью эфирной НСl осаждают гидрохлорид. Выход: 32,6 г (91%), tпл 203 С. Соединения формулы 6(2R,6S)-3-бензил-7-бром-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3 бензазоцин 6 а 32,6 г (91 ммоль) (2R,6S)-7-бром-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3 бензазоцина гидрохлорида 5 а растворяют в 160 мл диметилацетамида, смешивают с 28 г К 2 СО 3 и 18,9 г бензилхлорида и в течение 3 ч перемешивают при 100 С. Затем растворитель удаляют в вакууме, остаток смешивают с водой и дважды экстрагируют порциями по 200 мл уксусного эфира. Объединенную органическую фазу сушат, растворитель удаляют под вакуумом и остаток хроматографируют на силикагеле. Соответствующие фракции концентрируют под вакуумом. Выход: 24,5 г (73%), масло.(2R,6S)-3-бензил-7-формил-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3 бензазоцин 7 а 24,5 г (59 ммолей) (2R,6S)-3-бензил-7-бром-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6 метано-3-бензазоцина 6 а растворяют в 250 мл простого абсолютного эфира, охлаждают до -70 С и к раствору по каплям добавляют 40,7 мл BuLi (1,6M в гексане). Затем в течение 1 ч перемешивают при -60 С, по каплям добавляют 10 мл ДМФ и в течение последующего часа смеси дают медленно нагреться до -10 С. Далее смесь сливают в 500 мл воды и дважды экстрагируют порциями по 300 мл простого эфира. Объединенную органическую фазу сушат, растворитель удаляют под вакуумом и остаток хроматографируют на силикагеле. Соответствующие фракции концентрируют под вакуумом. Выход: 18,3 г (85%), масло. Соединения формулы 8(2R,6S)-3-бензил-7-метил-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3 бензазоцин 8 а 8 г (22 ммоля) (2R,6S)-3-бензил-7-формил-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6 метано-3-бензазоцина 7 а растворяют в 80 мл ТГФ, смешивают с 4 г NaCNBH3 и 20 мл ВF3-эфирата и в течение 3 ч перемешивают при комнатной температуре. Затем осторожно добавляют по каплям 100 мл метанола, после чего добавляют 100 мл 2 н. НСl и в течение 1 ч кипятят с обратным холодильником. Растворитель удаляют в вакууме, остаток смешивают с аммиаком и дважды экстрагируют порциями по 100 мл уксусного эфира. Объединенную органическую фазу сушат, растворитель удаляют в вакууме и остаток хроматографируют на силикагеле. Соответствующие фракции концентрируют под вакуумом. Выход: 5,5 г (72%), масло. Соединения формулы 9(2R,6S)-3-бензил-7-метил-10-гидрокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3 бензазоцин 9 а 5,3 г (15 ммолей) (2R,6S)-3-бензил-7-метил-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6 метано-3-бензазоцина 8 а растворяют в 54 мл концентрированной НВr и в течение 2 ч кипятят с обратным холодильником. Затем смесь концентрируют под вакуумом, остаток смешивают со льдом и концентрированным аммиаком и дважды экстрагируют порциями по 50 мл уксусного эфира. Объединенную органическую фазу сушат и растворитель удаляют в вакууме. Остаток растворяют в ацетоне и с помощью эфирной НСl осаждают гидрохлорид. Выход: 3,7 г (66%). Соединения формулы 10(2R,6S)-7-метил-10-гидрокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцин 10 а 3,6 г (10 ммолей) (2R,6S)-3-бензил-7-метил-10-гидрокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил 2,6-метано-3-бензазоцина 9 а гидрируют в присутствии 0,4 г PdC в 60 мл метаноле при давлении 5 бар в течение 4 ч. Затем фильтруют и удаляют растворитель в вакууме. Выход: 2,6 г (92%), масло. Соединения формулы 11(2R,6S)-3-бензил-7-фтор-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3 бензазоцин 11 а 8 г (20 ммолей) (2R,6S)-3-бензил-7-бром-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6 метано-3-бензазоцина 6 а растворяют в 100 мл простого эфира, охлаждают до -65 С и в атмосфере азота добавляют по каплям 15 мл BuLi (1,6 М в гексане). По истечении 1 ч по каплям добавляют 8 г Nфторбензолсульфонимида в 100 мл ТГФ и в течение 1 ч перемешивают при -60 С. Затем нагревают до комнатной температуры, нерастворимые компоненты отфильтровывают с помощью вакуум-фильтра и удаляют растворитель в вакууме. Остаток растворяют в 100 мл воды, смешивают с 10 мл концентрированного аммиака и дважды экстрагируют порциями по 150 мл простого эфира. Объединенную органическую фазу сушат, растворитель удаляют в вакууме и остаток хроматографируют на силикагеле. Соответствующие фракции концентрируют под вакуумом. Выход: 3,4 г (48%), масло. Соединения формулы 12(2R,6S)-3-бензил-7-фтор-10-гидрокси-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3 бензазоцин 12 а Указанное соединение получают в виде масла аналогично соединению 9, исходя из соединения 11. Соединения формулы 13(2R,6S)-7-фтор-10-гидрокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцин 13 а Указанное соединение получают в виде масла аналогично соединению 10 исходя из соединения 12. Соединения формулы 14- 12005681 32,5 г (0,13 моля) (2R,6S)-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3 бензазоцина 4 а растворяют в 330 мл уксусной кислоты и 110 мл трифторуксусной кислоты, охлаждают до 5 С и порциями смешивают с 32,9 г N-ИС. Далее перемешивают в течение 3 ч при 10 С, растворитель удаляют в вакууме и остаток смешивают с охлажденным льдом раствором аммиака. Затем дважды экстрагируют порциями по 200 мл уксусного эфира, объединенную органическую фазу сушат и растворитель удаляют в вакууме. Остаток растворяют в уксусном эфире и с помощью эфирной НСl осаждают гидрохлорид. Выход: 31,7 г (59%), tnл 231C. Соединения формулы 15(2R,6S)-3-трет-бутилоксикарбонил-7-иод-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6 метано-3-бензазоцин 15 а 31,6 г (78 ммолей) (2R,6S)-7-иод-10 метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3 бензазоцина гидрохлорида 14 а суспендируют в 350 мл дихлорметана, охлаждают до -5 С, смешивают с 9 г КОН в 18 мл воды и по каплям добавляют 17,7 г ди-трет-бутилдикарбоната в 50 мл дихлорметана. Затем смеси дают медленно нагреться до комнатной температуры, в течение 2 ч перемешивают при КТ и смешивают с 200 мл воды. Органическую фазу отделяют, сушат и растворитель удаляют в вакууме. Выход: 36,7 г (100%), вязкое масло. Соединения формулы 16(2R,6S)-3-трет-бутилоксикарбонил-7-трифторметил-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцин 16 а 15,8 г (34 ммоля) (2R,6S)-3-трет-бутилоксикарбонил-7-иод-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцина 15 а растворяют в 120 мл ДМФ, затем добавляют 10 г метилового эфира фторсульфонилдифторуксусной кислоты и 2,3 г CuI и нагревают до 70 С. По истечении 24 ч добавляют еще 3 г метилового эфира фторсульфонилдифторуксусной кислоты и 0,7 г CuI и повторно перемешивают в течение 18 ч при 70 С. Далее смесь охлаждают, смешивают с 500 мл простого эфира и с помощью вакуум-фильтра отфильтровывают нерастворимые компоненты. Фильтрат дважды промывают разбавленным раствором аммиака и водой. Органическую фазу сушат и растворитель удаляют в вакууме. Выход: 13,6 г (98%), смола оранжевого цвета. Соединения формулы 17(2R,6S)-7-трифторметил-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3 бензазоцин 17 а 13,6 г (33 ммоля) (2R,6S)-3-трет-бутилоксикарбонил-7-трифторметил-10-метокси-1,2,3,4,5,6 гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцина 16 а растворяют в 250 мл дихлорметана, затем по каплям добавляют 25 мл трифторуксусной кислоты и в течение 2 ч перемешивают при комнатной температуре. После этого смесь сливают в ледяную воду и раствор аммиака, органическую фазу отделяют,сушат и в вакууме удаляют растворитель. Выход: 10,7 г (100%), смола оранжевого цвета. Соединения формулы 18(2R,6S)-7-трифторметил-10-гидрокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3 бензазоцин 18 а 1,0 г (3,2 ммоля) (2R,6S)-7-трифторметил-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6 метано-3-бензазоцина 17 а растворяют в 10 мл дихлорметана, охлаждают до -65 С и по каплям добавляют 7 мл раствора ВВr3 (1M в дихлорметане). Затем раствору дают нагреться до 0 С и при этой температуре перемешивают в течение 8 ч. Далее при охлаждении льдом примешивают 10 мл МеОН и растворитель удаляют в вакууме. Выход: 1,2 г (100%), смола коричневого цвета. Соединения формулы 19(2R,6S)-3-бензил-7-(4-метил)фенил- 10-метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано 3-бензазоцин 19 а 4,1 г (10 ммолей) (2R,6S)-3-бензил-7-бром-10-метокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6 метано-3-бензазоцина 6 а растворяют в 100 мл дегазованного диоксана в атмосфере N2, смешивают с 12,6 г К 2 РО 4, 2,9 г 4-метилфенилбороновой кислоты, 0,92 г трис(дибензилиденацетон)палладия(0) и 0,25 г триметилфосфита и в течение 1 ч кипятят с обратным холодильником. Затем дают остыть, отфильтровывают с помощью вакуум-фильтра соли и удаляют в вакууме растворитель. Остаток хроматографируют на силикагеле и соответствующие фракции концентрируют под вакуумом. Выход: 3,8 г (89%), масло. Соединения формулы 20(2R,6S)-10-гидрокси-7-(4-метил)фенил-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3 бензазоцин, гидробромид 20 а Указанное соединение получают, исходя из соединения 19 а аналогично соединению 10 а, tnл 250 С.(2R,6S)-10-гидрокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцин, гидробромид 21 а Указанное соединение получают, исходя из соединения 4 а аналогично соединению 9 а.(2R,6S,11R)-10-гидрокси-1,2,3,4,5,6-гексагидро-6,11-диметил-2,6-метано-3-бензазоцин, гидробромид 21b Указанное соединение получают, исходя из соединения 4b аналогично соединению 9 а.(2R,6S,11S)-10-гидрокси-1,2,3,4,5,6-гексагидро-6,11-диметил-2,6-метано-3-бензазоцин, гидробромид 21 с Указанное соединение получают, исходя из соединения 4 с аналогично соединению 9 а.(2R,6S)-10-гидрокси-1,2,3,4,5,6-гексагидро-6-метил-2,6-метано-3-бензазоцин, гидрохлорид 21d Указанное соединение получают, исходя из соединения 4d аналогично соединению 9 с.II. Синтез соединений формулы 2(2R,6S,2"S)-10-гидрокси-3-[2-(бензилокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6 метано-3-бензазоцин, дигидрохлорид 2 а 1,6 г (6,9 ммоля) (2R,6S)-10-гидрокси-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3 бензазоцина гидробромида 21 а суспендируют в 30 мл дихлорметана и смешивают с 6 мл Nметилморфолина. По истечении 30 мин смесь охлаждают до -5 С и по каплям медленно добавляют к ней раствор из 2,3 г (11,6 ммоля) хлорангидрида (-)-S-2-бензилоксипропионовой кислоты в 20 мл дихлорметана. Затем перемешивают еще в течение 30 мин при -5 С, смешивают с 40 мл 2 н. соляной кислоты и отделяют органическую фазу. Далее органическую фазу сушат над MgSO4, растворитель удаляют в вакууме и остаток растворяют в 80 мл ТГФ. К этому раствору добавляют 1,0 г (26 ммолей) LiAl4, температура при этом повышается до 35 С. Затем выдерживают в течение 30 мин для реакции между компонентами, примешивают 0,8 мл воды и 0,4 мл 5 н. едкого натра и отделяют от неорганического осадка. Этот осадок промывают 100 мл ТГФ и объединенные органические фазы концентрируют в вакууме. Остаток растворяют в 200 мл простого эфира, сушат над MgSO4 и с помощью эфирной соляной кислоты осаждают гидрохлорид. Кристаллы отделяют и промывают ацетоном. Выход: 2,1 г (73%), tпл 254C, []D25 = (-)20,7 (с=1 в метаноле). С использованием соответствующих карбоновых кислот были получены, кроме того, следующие соединения формулы 2:(2R,6S,2S')-10-гидрокси-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцин, дигидрохлорид 2b: данное соединение получают, исходя из соединения 21 а аналогично получению соединения 2 а;(2R,6S,11R,2S')-10-гидрокси-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6-гексагидро-6,11 диметил-2,6-метано-3-бензазоцин, дигидрохлорид 2 с: данное соединение получают, исходя из соединения 21b аналогично получению соединения 2 а;(2R,6S,11S,2S')-10-гидрокси-3-[2-(бензилокси)пропил]-1,2,3,4,5,6-гексагидро-6,11-диметил-2,6 метано-3-бензазоцин, дигидрохлорид 2d: данное соединение получают, исходя из соединения 21 с аналогично получению соединения 2 а;(2R,6S,2S')-10-гидрокси-3-[2-(бензилокси)пропил]-1,2,3,4,5,6-гексагидро-6-метил-2,6-метано-3 бензазоцин, дигидрохлорид 2 е: данное соединение получают, исходя из соединения 21d аналогично получению соединения 2 а;(2R,6S)-10-гидрокси-3-[2-(2,6-дифторфенилметокси)этил]-1,2,3,4,5,6-гексагидро-6,11,11-триметил 2,6-метано-3-бензазоцин, дигидрохлорид 2f: данное соединение получают, исходя из соединения 21 а аналогично получению соединения 2 а;(2R,6S,2S)-10-гидрокси-3-[2-(2,6-дифторфенилметокси)изопентил]-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцин, дигидрохлорид данное соединение получают, исходя из соединения 21 а аналогично получению соединения 2 а;(2R,6S)-10-гидрокси-3-[2-(бензилокси)этил]-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3 бензазоцин, дигидрохлорид 2h: данное соединение получают, исходя из соединения 21 а аналогично получению соединения 2 а;(2R,6S)-10-гидрокси-3-[2-(2-фторфенилметокси)этил]-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6 метано-3-бензазоцин, дигидрохлорид 2i: данное соединение получают, исходя из соединения 21 а аналогично получению соединения 2 а;(2R,6S)-10-гидрокси-3-[2-(2,4-дифторфенилметокси)этил ]-1,2,3,4,5,6-гексагидро-6,11,11-триметил 2.6-метано-3-бензазоцин, дигидрохлорид 2j: данное соединение получают, исходя из соединения 21 а аналогично получению соединения 2 а;(2R,6S)-10-гидрокси-3-[2-('2,6-диметилфенилметокси)этил]-1,2,3,4,5,6-гексагидро-6,11,11-триметил 2,6-метано-3-бензазоцин, дигидрохлорид 2k: данное соединение получают, исходя из соединения 21 а аналогично получению соединения 2 а;- 14005681 данное соединение получают, исходя из соединения 21 а аналогично получению соединения 2 а;(2R,6S,2S')-10-гидрокси-3-[2-(2,6-дифторфенилметокси)бутил]-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцин, дигидрохлорид 2m: данное соединение получают, исходя из соединения 21 а аналогично получению соединения 2 а;(2R,6S,2S')-10-гидрокси-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6-гексагидро-6-метил-2,6 метано-3-бензазоцин, дигидрохлорид 2n: данное соединение получают, исходя из соединения 21d аналогично получению соединения 2 а;(2R,6S,2"R,5"S)-10-гидрокси-3-[5"-фенилтетрагидрофуран-2"-ил)метил]-1,2,3,4,5,6-гексагидро 6,11,11-триметил-2,6-метано-3-бензазоцин, дигидрохлорид 2 о: данное соединение получают, исходя из соединения 21 а аналогично получению соединения 2 а;(2R,6S,2"S,5"S)-10-гидpoкcи-3-[5"-фeнилтeтpaгидpoфypaн-2"-ил)мeтил]-1,2,3,4,5,6-гексагидро 6,11,11-триметил-2,6-метано-3-бензазоцин, дигидрохлорид 2p. данное соединение получают, исходя из соединения 21 а аналогично получению соединения 2 а;(2R,6S)-10-гидpoкcи-3-[2-(2,6-дифтopфeнилoкcи)пpoпил]-1,2,3,4,5,6-гексагидро-6,11,11-триметил 2,6-метано-3-бензазоцин, дигидрохлорид 2q: данное соединение получают, исходя из соединения 21 а аналогично получению соединения 2 а;(2R,6S)-10-гидрокси-3-[4-(2,6-дифторфенил)бутил]-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6 метано-3-бензазоцин, дигидрохлорид 2r: данное соединение получают, исходя из соединения 21 а аналогично получению соединения 2 а;(2R,6S,2S')-10-гидрокси-7-метил-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6-гексагидро 6,11,11-триметил-2,6-метано-3-бензазоцин, дигидрохлорид 2s: данное соединение получают, исходя из соединения 10 а аналогично получению соединения 2 а;(2R,6S,2S')-10-гидрокси-7-метил-3-[2-(бензилокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11-триметил 2,6-метано-3-бензазоцин, дигидрохлорид 2t: данное соединение получают, исходя из соединения 10 а аналогично получению соединения 2 а;(2R,6S,2"S,5"S)-10-гидрокси-7-метил-3-[5"-фенилтетрагидрофуран-2"-ил)метил]-1,2,3,4,5,6 гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцин, дигидрохлорид 2u: данное соединение получают, исходя из соединения 10 а аналогично получению соединения 2 а;(2R,6S,2S')-10-гидрокси-7-фтор-3-[2-(бензилокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11-триметил 2,6-метано-3-бензазоцин, дигидрохлорид 2v: данное соединение получают, исходя из соединения 13 а аналогично получению соединения 2 а;(2R,6S,2S')-10-гидрокси-7-трифторметил-3-[2-(бензилокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцин, дигидрохлорид 2w: данное соединение получают, исходя из соединения 18 а аналогично получению соединения 2 а;(2R,6S,2S')-10-гидрокси-7-(4-метилфенил)-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6 гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцин, дигидрохлорид 2 х: данное соединение получают, исходя из соединения 20 а аналогично получению соединения 2 а;(2R,6S)-10-гидрокси-7-метил-3-[2-(2,6-дифторфенилметокси)этил]-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцин, дигидрохлорид 2v данное соединение получают, исходя из соединения 10 а аналогично получению соединения 2 а.III. Синтез соединений формулы 1 по изобретению Пример 1. (2R,6S,2S')-10-амино-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6-гексагидро 6,11,11-триметил-2,6-метано-3-бензазоцин, дигидрохлорид: 13,5 г (0,03 моля) (2R,6S,2"S)-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцин-10-ола 2d растворяют в 135 мл дихлорметана, смешивают с 30 мл триэтиламина и добавляемым на кончике шпателя 4-диметиламинопиридина и охлаждают до -10 С. Затем по каплям добавляют 6,8 мл ангидрида трифторметансульфоновой кислоты, в течение 1 ч перемешивают при -10 С, а в течение последующих 2 ч при комнатной температуре. После этого реакционную смесь сливают на лед, смешивают с 50 мл аммиака, органическую фазу отделяют и один раз промывают 50 мл воды. Органическую фазу сушат, растворитель удаляют в вакууме, остаток растворяют в 350 мл толуола и смешивают с 21,6 г CsCO3 и 10,8 г бензофенонимина. Затем в течение 30 мин через суспензию пропускают поток азота, смешивают с 1,2 г БИНАФ и 0,6 г трис(дибензилиденацетон)дипалладия и в течение 6 ч нагревают с обратным холодильником. После охлаждения промывают 200 мл воды, органическую фазу сушат и растворитель удаляют в вакууме. Остаток растворяют в этаноле и с помощью эфирной НСl осаждают гидрохлорид. Данное соединение получают, исходя из соединения 2 а аналогично примеру 1; tnл 257C, []D20 = (-)29,3 Данное соединение получают, исходя из соединения 2 с аналогично примеру 1; tпл 232 С, []D20 = (-)4,1 Данное соединение получают, исходя из соединения 2d аналогично примеру 1; tпл 267C, []D20 = (-)2,4 Данное соединение получают, исходя из соединения 2n аналогично примеру 1; tпл 187C,[]D20=19,7 (c=1 в МеОН). Пример 6: Данное соединение получают, исходя из соединения 2m аналогично примеру 1; tnл 200 С. Пример 7: (2R,6S,2S')-10-амино-3-[2-(2,6-дифторфенилметокси)изопентил]-1,2,3,4,5,6-гексагидро 6,11,11-триметил-2,6-метано-3-бензазоцин. дигидрохлорид: Данное соединение получают, исходя из соединения 2g аналогично примеру 1; tnл 274C, []D20 = (-)21,8 Данное соединение получают, исходя из соединения 2f аналогично примеру 1; tпл 270 С, []D20 = (-)77,4 Данное соединение получают, исходя из соединения 21 аналогично примеру 1; tпл 190C (разложе Пример 10: (2R,6S)-10-амино-3-[2-(бензилокси)этил]-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6 метано-3-бензазоцин, дигидрохлорид: Данное соединение получают, исходя из соединения 2h аналогично примеру Пример 11: Данное соединение получают, исходя из соединения 2i аналогично примеру 1; tпл 220 С. Пример 12: (2R,6S)-10-амино-3-[2-(2,6-дифторфенилокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцин, дигидрохлорид: Данное соединение получают, исходя из соединения 2q аналогично примеру 1; tпл 250 оС. Данное соединение получают, исходя из соединения 2r аналогично примеру l; tпл 250C. Пример 14: (2R,6S)-10-амино-3-[2-(2,4-дифторфенилметокси)этил]-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцин, дигидрохлорид: Данное соединение получают, исходя из соединения 2i аналогично примеру 1; tпл 220 С. Пример 15: (2R,6S)-10-амино-3-[2-(2,6-диметилфенилметокси)этил]-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцин, дигидрохлорид: Данное соединение получают, исходя из соединения 2k аналогично примеру l; tпл 245C. Пример 16: Данное соединение получают, исходя из соединения 2 р аналогично примеру 1; tпл 253C, []D20 = (-)135,4 Данное соединение получают, исходя из соединения 2 о аналогично примеру 1; tпл 255 С. Пример 18: (2R,6S,2"S)-10-ацетамино-3-[2-(2,6-бензилокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцин, гидрохлорид: К 1,1 г (2,4 ммоля) (2R,6S,2"S)-10-амино-3-[2-(бензилокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцина дигидрохлорида (пример 2) и 5 мл триэтиламина в 50 мл дихлорметана добавляют 2 мл ацетангидрида и в течение 0,5 ч перемешивают при комнатной температуре. Затем смесь концентрируют в вакууме, смешивают со 100 мл простого эфира и дважды промывают порциями Данное соединение получают, исходя из соединения из примера 1 аналогично примеру 18; 0,5 г (1,2 ммоля) (2R,6S,2"S)-10-амино-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6 гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцина (пример 1) смешивают с 10 мл 97%-ной муравьиной кислоты и в течение 1 ч кипятят с обратным холодильником. Затем смесь концентрируют в вакууме,остаток смешивают со льдом и 50 мл аммиака и дважды экстрагируют порциями по 50 мл уксусного эфира. Объединенную органическую фазу промывают 30 мл воды, сушат и растворитель удаляют в вакууме. Остаток растворяют в простом эфире и с помощью эфирной НСl осаждают гидрохлорид. Выход: 0,3 г (52%), tпл аморфный []D20 = (-)41,6 (с=1 в МеОН). Пример 21: (2R,6S,2"S)-10-метиламино-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцин, дигидрохлорид: 1,0 г (2,4 ммоля) (2R,6S,2"S)-10-амино-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6 гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцина (пример 1) растворяют в 10 мл уксусного эфира и смешивают с 1 мл триэтиламина и 1 мл ангидрида трифторуксусной кислоты. По истечении 10 мин дважды промывают порциями по 10 мл воды, органическую фазу сушат и растворитель удаляют в вакууме. Остаток растворяют в 10 мл диметилацетамида и смешивают с 0,5 г NaH. По истечении 15 мин добавляют 1 мл метилиодида и в течение 1 ч перемешивают при 50 С. Затем растворитель удаляют в вакууме,остаток смешивают с 20 мл метанола и 2 мл 20%-ной NaOH и в течение 30 мин перемешивают при 60 С. После этого раствор повторно концентрируют под вакуумом, остаток смешивают с 50 мл воды и дважды экстрагируют порциями по 100 мл простого эфира. Объединенную органическую фазу сушат, растворитель удаляют в вакууме и остаток хроматографируют на силикагеле. Соответствующие фракции объединяют и с помощью эфирной НС 1 осаждают гидрохлорид. Выход: 0,4 г (35%), tпл 243C, []D2 = (-)20,5 (с=1 в МеОН). Пример 22: К охлажденному до -10 С раствору из 0,6 мл 37%-ного формалина и 1,2 мл 3 н. H2SO4 порциями добавляют суспензию из 0,4 г (1 ммоль) (2R,6S,2"S)-10-амино-3-[2-(2,6-дифторфенилметокси)пропил]1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцина (пример 1) и 0,3 г NaBH4 в 7 мл ТГФ.- 19005681 После добавления выдерживают в течение 10 мин для реакции компонентов, затем смешивают с аммиаком и дважды экстрагируют порциями по 20 мл уксусного эфира. Органическую фазу сушат и растворитель удаляют в вакууме. Остаток растворяют в простом эфире и с помощью эфирной НСl осаждают гидрохлорид. Выход: 0,5 г (97%), tпл 125C, []D20 = (-)20,0 (с=1 в МеОН). Пример 23: (2R,6S,2"S)-10-этиламино-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцин, дигидрохлорид: 1,1 г (2,4 ммоля) (2R,6S,2"S)-10-ацетамино-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6 гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцина (пример 1) растворяют в 30 мл ТГФ, смешивают с 0,5 г NaBH4 и 1,5 мл ВF3-эфирата и в течение 6 ч нагревают с обратным холодильником. Далее смеси дают охладиться, добавляют к ней 30 мл МеОН и 60 мл 2 н. НСl и в течение последующих 30 мин нагревают с обратным холодильником. Затем растворитель удаляют в вакууме, остаток смешивают с концентрированным аммиаком и дважды экстрагируют порциями по 30 мл уксусного эфира. Объединенную органическую фазу один раз промывают 20 мл воды, сушат и растворитель удаляют в вакууме. Остаток растворяют в ацетоне и с помощью эфирной НСl осаждают гидрохлорид. Выход: 0,95 г (89%), tnл 242C, []D20 = (-)24,8 (с=1 в МеОН). Пример 24: (2R,6S,2"S)-10-фтор-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6-гексагидро 6,11,11-триметил-2,6-метано-3-бензазоцин, гидрохлорид: 1,5 г (3,6 ммоля) (2R,6S,2"S)-10-амино-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6 гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцина (пример 1) предварительно помещают в 30 мл диоксана, смешивают с 3 г NOBF4 в 30 мл диоксана и в течение 1 ч перемешивают при 90 С. Затем растворитель удаляют в вакууме, остаток смешивают с 50 мл уксусного эфира и по одному разу промывают 30 мл разбавленного аммиака и 30 мл воды соответственно. Объединенную органическую фазу сушат,растворитель удаляют в вакууме и остаток хроматографируют на силикагеле. Требуемые фракции объединяют и с помощью эфирной НСl осаждают гидрохлорид. Выход: 0,5 г (33%), tпл 190C, []D20 = (-)27,3 (с=1 в МеОН). Пример 25: Данное соединение получают, исходя из соединения 2s аналогично примеру l; tпл 236C. Пример 26: (2R,6S,2"S)-10-амино-7-метил-3-[2-(бензилокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцин, дигидрохлорид: Данное соединение получают, исходя из соединения 2t аналогично примеру 1; tnл 227C, []D20 = (-)31,8 Данное соединение получают, исходя из соединения в примере 26 аналогично примеру 20; tnл 141 С. Пример 28: (2R,6S,2"S)-10-формиламино-7-метил-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6 гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцин, дигидрохлорид: Данное соединение получают, исходя из соединения в примере 25 аналогично примеру 20; tпл 105 С Данное соединение получают, исходя из соединения в примере 26 аналогично примеру 21; tnл 100C Данное соединение получают, исходя из соединения в примере 25 аналогично примеру 21; tnл 221 С Данное соединение получают аналогично примеру 1; tпл 250 С. Пример 32: (2R,6S,2"S)-10-амино-7-хлор-3-[2-(бензилокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцин, дигидрохлорид: 4,5 г (10 ммолей) (2R,6S,2"S)-10-амино-3-[2-(бензилокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцина дигидрохлорида (пример 2) растворяют в 90 мл МеОН и 90 мл ледяной уксусной кислоты, смешивают с 1,45 г N-XC (N-хлорсукцинимида) и в течение 4 ч перемешивают при комнатной температуре. Затем растворитель удаляют в вакууме, остаток растворяют в 100 мл водного раствора аммиака и дважды экстрагируют порциями по 50 мл уксусного эфира. Объединенную органическую фазу сушат, растворитель удаляют в вакууме и остаток хроматографируют на силикагеле. Соответствующие фракции концентрируют под вакуумом и с помощью эфирной НСl осаждают гидрохлорид. Выход: 1,3 г (27%), tnл 222C, []D20 = (-)17,4 (с=1 в МеОН). Пример 33: Данное соединение получают аналогично примеру 32 и после хроматографического разделения получают продукт с выходом 0,6 г (12%) и tпл 197 С, []D20=11,0 (с=1 в МеОН). Пример 34: (2R,6S,2"S)-10-aмино-7-xлop-3-[2-(2,6-дифторфенилметокси)пропил 1-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцин, дигидрохлорид: Данное соединение получают, исходя из соединения из примера 1 аналогично примеру 32; tпл 247C. Пример 35: (2R,6S,2"S)-10-амино-7-бром-3-[2-(бензилокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцин, дигидрохлорид: Данное соединение получают исходя из соединения из примера 2 аналогично примеру 32 с использованием N-БС; tпл 215 С, []D20 = (-)17,3 (с=1 в МеОН). Пример 36: (2R,6S,2"S)-10-амино-7,9-дибром-3-[2-(бензилокси)пропил]-1,2,3,4,5,6-гексагидро 6,11,11-триметил-2,6-метано-3-бензазоцин, дигидрохлорид: Данное соединение получают аналогично соединению из примера 35 по аналогии с примером 33; tпл 177C, []D20=11,5 (с=1 в МеОН). Пример 37:(2R,6S,2"S)-10-амино-7-бром-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3-6 ензазоцин, дигидрохлорид: Данное соединение получают, исходя из соединения из примера 1 аналогично примеру 32 с использованием N-БС; tпл 233 С, []D20 = (-)20,5 (с=1 в МеОН). Пример 38: (2R,6S,2"S)-10-амино-7,9-дибром-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6 гексагидро-6,11,11 -триметил-2,6-метано-3-бензазоцин, дигидрохлорид: Данное соединение получают аналогично соединению из примера 37 по аналогии с примером 36; tпл 236C, []D20 =5,9 (с=1 в МеОН). Пример 39: (2R,6S,2"S)-10-амино-9-бром-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцин, дигидрохлорид: Данное соединение получают аналогично соединению из примера 37 по аналогии с примером 32; tnл 252C, []D20 = (-)14,6 (с=1 в МеОН). Пример 40: (2R,6S,2"S)-10-амино-7-фтор-3-[2-(бензилокси)пропил]-1,2,3,4,5,6-гексагидро-6,11,11 триметил-2,6-метано-3-бензазоцин, дигидрохлорид: Данное соединение получают, исходя из соединения 2v аналогично примеру 1; tпл 150 С. Пример 41: (2R,6S,2"S,5"S)-10-aмино-7-метил-3-[5"-фенилтетрагидрофуран-2"-ил)метил]-1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцин, дигидрохлорид: Данное соединение получают, исходя из соединения 2u аналогично примеру 1; tпл 250 С. Пример 42: (2R,6S,2"S,5"S)-10-метиламино-7-метил-3-[5"-фенилтетрагидрофуран-2"-ил)метил]1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцин, дигидрохлорид:,Данное соединение получают, исходя из соединения из примера 41 аналогично примеру 21; tnл 250 С. Пример 43: (2R,6S,2"S,5"S)-10-формиламино-7-метил-3-[5"-фенилтетрагидрофуран-2"-ил)метил]1,2,3,4,5,6-гексагидро-6,11,11-триметил-2,6-метано-3-бензазоцин, дигидрохлорид:- 23005681 Данное соединение получают, исходя из соединения из примера 41 аналогично примеру 20; tпл 250 С. Пример 44: (2R,6S,2"S)-10-амино-7-трифторметил-3-[2-(бензилокси)пропил]-1,2,3,4,5,6-гексагидро 6-метил-2,6-метано-3-бензазоцин, дигидрохлорид: Данное соединение получают, исходя из соединения 2w аналогично примеру 1; tпл 165 С. Пример 45: (2R,6S,2"S)-10-амино-7-(4-метилфенил)-3-[2-(2,6-дифторфенилметокси)пропил]-1,2,3,4,5,6 гексагидро-6-метил-2,6-метано-3-бензазоцин, дигидрохлорид: Данное соединение получают, исходя из соединения 2 х аналогично примеру 1; tпл 219C, []D20 = (-)19,5(с=1 в МеОН). Предлагаемые в изобретении соединения могут назначаться для перорального, трансдермального,назального, ингаляционного или парентерального введения. При этом соединения по изобретению представлены в качестве активных ингредиентов в обычных лекарственных формах, например в композициях, состоящих в основном из инертного фармацевтического носителя и эффективной дозы действующего вещества и выпускаемых в виде таблеток, драже, капсул, облаток, порошков, растворов, суспензий,эмульсий, сиропов, суппозиториев, ТТС (трансдермальные терапевтические системы) и т.д. При пероральном применении эффективная доза соединений по изобретению составляет от 1 до 1000, предпочтительно от 1 до 500, особенно предпочтительно от 5 до 300 мг/доза; при внутривенном, подкожном или внутримышечном применении указанная доза составляет от 0,001 до 50, предпочтительно от 0,1 до 10 мг/доза. Для ингаляции пригодны согласно изобретению растворы, содержащие от 0,01 до 1,0, предпочтительно от 0,1 до 0,5% активного вещества. Для введения путем ингаляции предпочтительно использовать порошки. Вместе с тем предлагаемые соединения можно применять и в виде растворов для инфузий, предпочтительно в виде физиологического раствора или раствора питательной соли. Предлагаемые соединения могут применяться индивидуально или в сочетании с другими активными веществами по изобретению, необязательно в сочетании с иными фармакологически активными веществами. Пригодны в этих целях такие, например, лекарственные формы, как таблетки, капсулы, свечи,растворы, микстуры, эмульсии или диспергируемые порошки. Соответствующие таблетки можно изготавливать, например, смешением активного или нескольких активных веществ с известными вспомогательными веществами, например с инертными разбавителями, такими как карбонат кальция, фосфат кальция или лактоза, с разрыхлителями, такими как кукурузный крахмал или альгиновая кислота, связующими, такими как крахмал или желатин, антиадгезивами, такими как стеарат магния или тальк, и/или со средствами, обеспечивающими эффект депо, т.е. продленное действие, такими как карбоксиметилцеллюлоза, ацетофталат целлюлозы или поливинилацетат. Таблетки могут состоять из нескольких слоев. Аналогичным образом, как это практикуется при изготовлении таблеток, можно изготавливать драже с нанесением на их сердцевину с помощью обычно используемых в этих целях средств, например коллидона или шеллака, гуммиарабика, талька, диоксида титана или сахара, покрытия (оболочки). Для достижения эффекта депо или во избежание несовместимости сердцевина также может состоять из нескольких слоев. Равным образом и оболочку драже для обеспечения продленного действия можно выполнять многослойной, используя в этих целях вспомогательные вещества, указанные выше для таблеток. Микстуры на основе предлагаемых в изобретении активных веществ, соответственно комбинаций активных веществ дополнительно могут содержать в своем составе и подслащивающее вещество, такое как сахарин, цикламат, глицерин или сахар, а также корригент вкуса, например, из группы ароматизаторов, таких как ванилин или апельсиновый экстракт. Кроме того, в состав микстур могут входить способствующие суспендированию вспомогательные вещества или загустители, такие как натрийкарбоксиме- 24005681 тилцеллюлоза, смачиватели, например продукты конденсации жирных спиртов и этиленоксида, или защитные вещества, такие как n-гидроксибензоаты. Растворы для инъекций приготавливают обычным образом, например добавлением консервантов, таких как n-гидроксибензоаты, или стабилизаторов, таких как щелочнометаллические соли этилендиаминтетрауксусной кислоты, и расфасовывают во флакончики или ампулы. Капсулы, содержащие одно или несколько активных веществ, соответственно комбинации активных веществ, изготавливают, например, следующим образом: сначала активные вещества смешивают с инертными носителями, такими как лактоза или сорбит, и затем инкапсулируют в желатиновые капсулы. Соответствующие свечи можно изготавливать, например, смешением с предусмотренными для таких целей носителями, такими как нейтральные жиры или полиэтиленгликоль, соответственно его производные. Терапевтически эффективная суточная доза для взрослого пациента составляет от 1 до 1000 мг, предпочтительно от 10 до 500 мг. Ниже изобретение поясняется на примерах, которые никоим образом не ограничивают его объем. Примеры фармацевтических композиций А) Таблетки Состав одной таблетки: Активное вещество 300 мг Лактоза 240 мг Кукурузный крахмал 340 мг Поливинилпирролидон 45 мг Стеарат магния 15 мг 940 мг Тонкоизмельченное активное вещество, лактозу и часть кукурузного крахмала смешивают друг с другом. Смесь просеивают, после чего ее увлажняют раствором поливинилпирролидона в воде, разминают, подвергают влажной грануляции и сушат. Полученные гранулы, остальную часть кукурузного крахмала и стеарат магния просеивают и смешивают. В завершение смесь таблетируют с получением в результате таблеток соответствующей формы и соответствующего размера. Б) Таблетки Состав одной таблетки: Активное вещество 80 мг Кукурузный крахмал 190 мг Лактоза 55 мг Микрокристаллическая целлюлоза 35 мг Поливинилпирролидон 15 мг Натрийкарбоксиметилкрахмал 23 мг Стеарат магния 2 мг 400 мг Тонкоизмельченное активное вещество, часть кукурузного крахмала, лактозу, микрокристаллическую целлюлозу и поливинилпирролидон смешивают друг с другом, смесь просеивают и вместе с остальной частью кукурузного крахмала и водой перерабатывают с получением в результате гранул, которые сушат и просеивают. Затем к этим гранулам добавляют натрийкарбоксиметилкрахмал и стеарат магния, смешивают и из смеси прессуют таблетки требуемого размера. В) Драже Состав одного драже: Активное вещество 5 мг Кукурузный крахмал 41,5 мг Лактоза 30 мг Поливинилпирролидон 3 мг Стеарат магния 0,5 мг 80 мг Активное вещество, кукурузный крахмал, лактозу и поливинилпирролидон тщательно перемешивают и увлажняют водой. Влажную массу продавливают через сито с размером ячеек 1 мм, сушат при температуре порядка 45C и затем гранулы пропускают через то же сито. После примешивания стеарата магния с помощью таблетировочной машины прессуют выпуклую сердцевину драже диаметром 6 мм. На полученные таким путем сердцевины драже по известной технологии наносят оболочку, состоящую в основном из сахара и талька. Готовые драже полируют воском. Г) Капсулы Состав одной капсулы: Активное вещество 150 мг Кукурузный крахмал 268,5 мг Стеарат магния 1,5 мг 420 мг- 25005681 Активное вещество и кукурузный крахмал смешивают и увлажняют водой. Влажную массу пропускают через сито и сушат. Сухие гранулы просеивают и смешивают со стеаратом магния. Полученную смесь расфасовывают в твердожелатиновые капсулы размера 1. Д) Раствор для ампул: Состав: Активное вещество 50 мг Хлорид натрия 50 мг Вода для разовой инъекции 5 мл Активное вещество растворяют при собственном значении рН или необязательно при рН 5,5-6,5 в воде, смешивают с хлоридом натрия для получения изотонического раствора. Полученный раствор фильтруют, исключая пирогенность, и фильтрат в асептических условиях ампулируют и ампулы затем стерилизуют и запаивают. В ампулах содержится 5, 25 и 50 мг активного вещества. Е) Суппозитории Состав: Активное вещество 50 мг Отвержденный жир (Adeps solidus) 1650 мг 1700 мг Отвержденный жир расплавляют. При 40 С измельченное активное вещество диспергируют до достижения гомогенности, после чего охлаждают до 38 С и заливают в слегка охлажденные предварительно формы, получая в результате требуемые суппозитории. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы 1 в которой R1 и R2 имеют идентичные или разные значения и могут обозначать водород, С 1-С 6 алкил,С 1-С 6 алкилоксигруппу, ОН, F, Cl или Вr;R3 и R3' имеют идентичные или разные значения и могут обозначать водород, F, Сl, Вr, метил, этил,ОН, CF3, метоксигруппу или фенил, который необязательно может быть замещен заместителем, выбранным из группы, включающей F, Cl, Вr, метил, этил, ОН, CF3 и метоксигруппу;R4, R5 и R6 имеют идентичные или разные значения и могут обозначать водород, метил или этил;X может обозначать NH2, NН-(С 1-С 6 алкил), N(С 1-С 6 алкил)2, при этом обе C1-С 6 алкильные группы могут быть идентичными или разными, NH-COH, NН-СО(С 1-С 6 алкил) или F; А может обозначать -(СН 2)3-, -СН 2-СН 2-О-, -СН 2-О-СН 2-, -(СН 2)4-, -СH(C1-С 6 алкил)-О-СН 2, -(СН 2)2-ОСН 2-, -(СН 2)3-О-, -(СН 2)5-, -СН 2-О-(СН 2)3-, -(СН 2)2-О-(СН 2)2-, -(СН 2)3-О-СН 2-, -(СН 2)4-О-, -СН 2-О-СН 2-СН 2-О-, необязательно в виде их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. 2. Соединения общей формулы 1 по п.1, в которойR1 и R2 имеют идентичные или разные значения и могут обозначать водород, метил, этил, метилоксигруппу, этилоксигруппу, ОН, F, Cl или Вr;R3 и R3' имеют идентичные или разные значения и могут обозначать водород, F, Сl, Вr, метил, этил,ОН, CF3, метоксигруппу или фенил, замещенный заместителем, выбранным из группы, включающей F,Cl, Вr и предпочтительно метил;R4, R5 и R6 имеют идентичные или разные значения и могут обозначать водород или метил; необязательно в виде их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей.- 26005681 3. Соединения общей формулы 1 по п.1 или 2, в которой R1 и R2 имеют идентичные или разные значения и могут обозначать водород или F, R3 и R3' имеют идентичные или разные значения и могут обозначать водород, F, Cl, Br, CF3 или метил;R4 , R5 и R6 имеют идентичные или разные значения и могут обозначать водород или метил;X может обозначать NH2, NН-(метил), N(метил)2, NH-COH, NH-COMe или F; А может обозначать -СН(метил)-О-СН 2-, -СН 2-О-СН 2- или необязательно в виде их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. 4. Соединения общей формулы 1 по пп.1,2 или 3, в которойR1 и R2 имеют идентичные или разные значения и могут обозначать водород или F;R3 и R3' имеют идентичные или разные значения и могут обозначать водород, F, Cl, Br, CF3 или метил;R4 , R5 и R6 имеют идентичные или разные значения и могут обозначать водород или метил;X может обозначать NH2, NН-(метил) или NH-COH; А может обозначать -СН(метил)-О-СН 2-, -СН 2-О-СН 2- или необязательно в виде их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. 5. Соединения общей формулы 1 по п.1,2 или 3, в которойR1 и R2 имеют идентичные или разные значения и могут обозначать водород или F;R4 , R5 и R6 имеют идентичные или разные значения и могут обозначать водород или метил;X может обозначать F; А может обозначать -СН(метил)-О-СН 2-,необязательно в виде их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. 6. Фармацевтическая композиция, отличающаяся тем, что она содержит в своем составе соединение формулы 1 по любому из пп.1-5 наряду с обычными вспомогательными веществами и носителями. 7. Применение соединений формулы 1 по любому из пп.1-5 в качестве лекарственных средств. 8. Применение соединений формулы 1 по любому из пп.1-5 для получения соответствующего лекарственного средства, предназначенного для предупреждения или лечения заболеваний или нарушений,при которых благодаря блокаде потенциал-зависимого натриевого канала удается достичь требуемый терапевтический эффект. 9. Применение соединений формулы 1 по любому из пп.1-5 для получения соответствующего лекарственного средства, предназначенного для предупреждения или лечения различных видов аритмии,спазмов, сердечной и мозговой ишемии, болей, а также нейродегенеративных заболеваний. 10. Применение соединений формулы 1 по любому из пп.1-5 для получения соответствующего лекарственного средства, предназначенного для предупреждения или лечения эпилепсии, гипогликемии,гипоксии, аноксии, травм головного мозга, отеков головного мозга, апоплексии, перинатальной асфиксии, перерождений мозжечка, амиотрофического бокового склероза, болезни Хантингтона, болезни Альцгеймера, болезни Паркинсона, маниакально-депрессивного психоза, гипотонии, инфаркта миокарда,нарушений сердечного ритма, стенокардии, хронической боли, невропатической боли или для местного обезболивания. 11. Способ получения соединений общей формулы 1 в которой радикалы R1, R2, R3, R3' , R4, R5, R6, X и A имеют указанные в пп.1-5 значения, отличающийся тем, что соединения общей формулы 3 в которой радикалы R1, R2, R3, R3', R4, R5, R6 и А имеют указанные в пп.1-5 значения, подвергают в ароматическом растворителе при палладиевом катализе взаимодействию с кетимином, предпочтительно с бензофенонимином, с получением соединений общей формулы 1, где X представляет собой NH2, а остальные радикалы имеют вышеуказанные значения, с необязательным последующим алкилированием или ацилированием полученных соединений, или их превращением в соединения формулы 1, в которыхX представляет собой F. 12. Промежуточные соединения общей формулы 3 в которой радикалы R1, R2, R3, R3', R4, R5, R6 и А могут иметь указанные в пп.1-5 значения.
МПК / Метки
МПК: C07D 407/06, C07D 221/26, A61K 31/445
Метки: качестве, 1,2,3,4,5,6-гексагидро-2,6-метано-3-бензазоцины, замещенные, лекарственных, применение, средств
Код ссылки
<a href="https://eas.patents.su/29-5681-zameshhennye-123456-geksagidro-26-metano-3-benzazociny-i-ih-primenenie-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные 1,2,3,4,5,6-гексагидро-2,6-метано-3-бензазоцины и их применение в качестве лекарственных средств</a>
Предыдущий патент: Ингибиторы гиразы и их применение для лечения бактериальной инфекции
Следующий патент: Трансформированные грибы, в частности рода chrysosporium, способные к синтезу гетерологичных полипептидов
Случайный патент: Способ приготовления суспензий лекарственных частиц для доставки путем ингаляции












