Производные бензамида для ингибирования активности abl1, abl2 и bcr-abl1
Номер патента: 24391
Опубликовано: 30.09.2016
Авторы: Фюре Паскаль, Шепфер Йозеф, Марцинцик Андреас, Гротцфельд Роберт Мартин, Янке Вольфганг, Салем Баха, Додд Стефани Кей, Пелле Ксавье Франсуа Андре, Джоунс Дэррил Бринли, Манли Пол
Формула / Реферат
1. Соединение формулы (I)
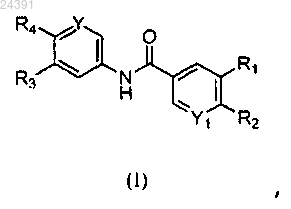
где R1 представляет собой пиразолил; где указанный пиразолил является незамещенным или замещен 1 группой R6;
R2 представляет собой пирролидинил; где указанный пирролидинил замещен одной группой R7;
R3 выбирают из водорода и галогена;
R4 выбирают из -SF5 и -Y2-CF2-Y3;
R6 в каждом случае независимо выбирают из водорода, метила, трифторметила, галогена;
R7 выбирают из гидрокси, метила, гидроксиметила, (2-амино-3-метилбутаноил)окси, карбокси, метоксикарбонила и фосфоноокси;
Y представляет собой СН;
Y1 выбирают из СН и N;
Y2 выбирают из CF2, О и S(O)0 и
Y3 выбирают из хлора, фтора и трифторметила;
или его фармацевтически приемлемые соли.
2. Соединение по п.1 формулы (Ib)
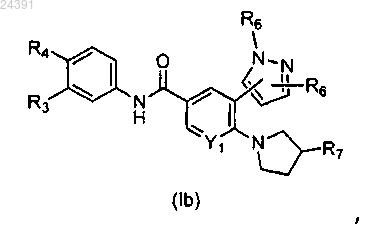
где R3 выбирают из водорода и галогена;
R4 выбирают из -SF5 и -Y2-CF2-Y3;
R6, когда связан с азотом пиразолильного кольца, выбирают из водорода, метила и R6, когда связан с атомом углерода пиразолильного кольца, выбирают из водорода, метила, трифторметила и галогена;
R7 выбирают из гидрокси, метила, гидроксиметила, (2-амино-3-метилбутаноил)окси, карбокси, метоксикарбонила и фосфоноокси;
Y1 выбирают из СН и N;
Y2 выбирают из CF2, О и S(O)0;
Y3 выбирают из фтора и трифторметила;
или его фармацевтически приемлемые соли.
3. Соединение по п.2 формулы (Ic)
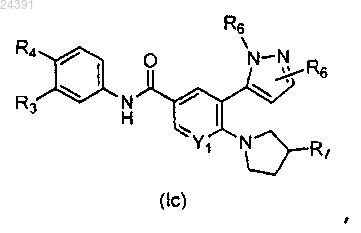
где R3 выбирают из водорода и галогена;
R4 выбирают из -SF5 и -Y2-CF2-Y3;
R6, когда связан с азотом пиразолильного кольца, выбирают из водорода, метила и R6, когда связан с атомом углерода пиразолильного кольца, выбирают из водорода, метила, трифторметила и галогена;
R7 выбирают из гидрокси, метила, гидроксиметила, (2-амино-3-метилбутаноил)окси, карбокси, метоксикарбонила и фосфоноокси;
Y1 выбирают из СН и N;
Y2 выбирают из CF2, О и S(O)0;
Y3 выбирают из фтора, хлора и трифторметила;
или его фармацевтически приемлемые соли.
4. Соединение по п.3 или его фармацевтически приемлемая соль, выбранное из
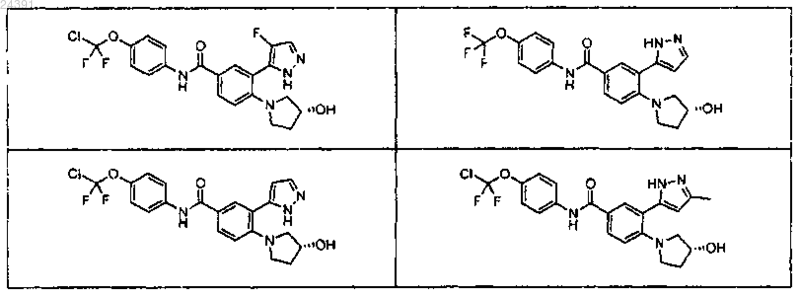
5. Соединение по п.3 или его фармацевтически приемлемая соль, выбранное из
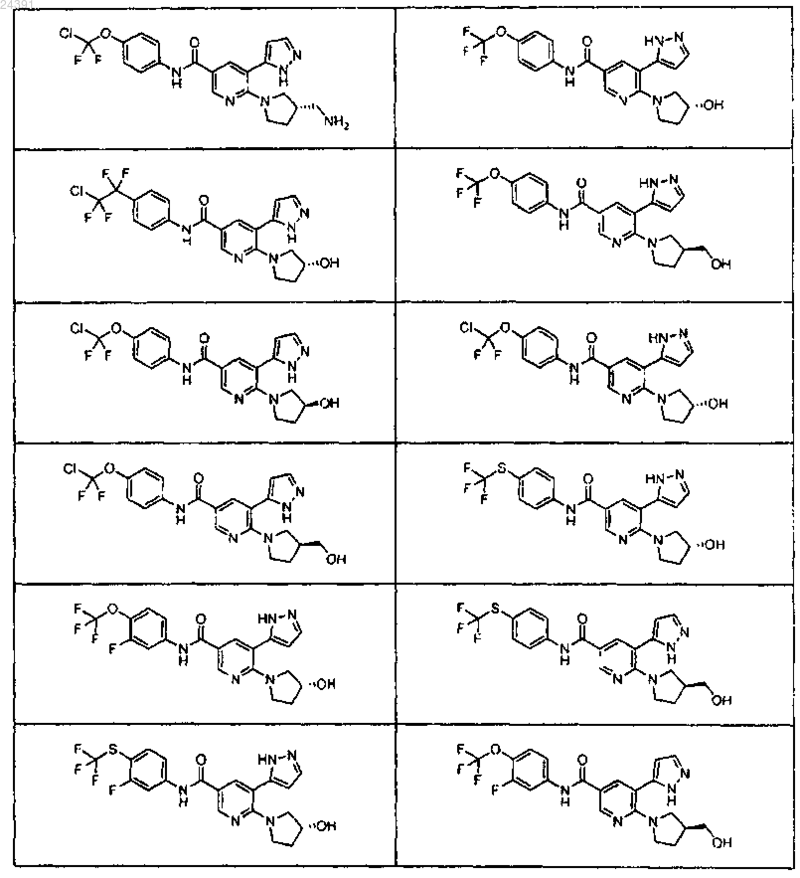
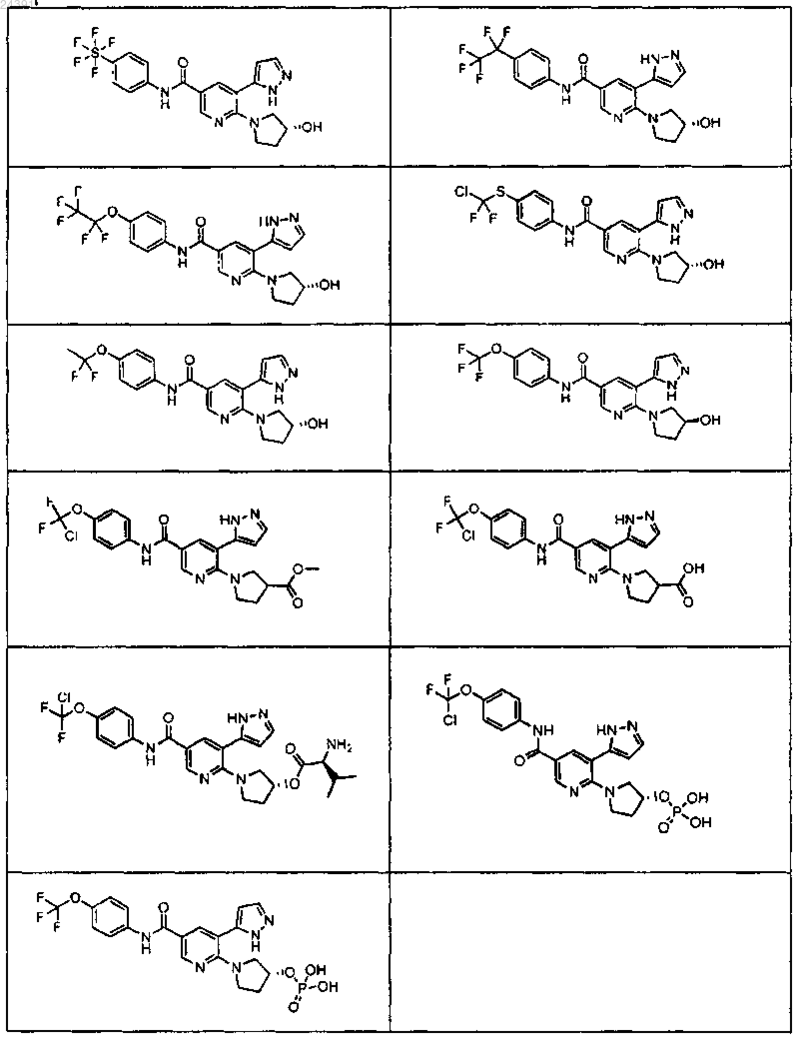
6. Соединение по п.3 или его фармацевтически приемлемая соль, выбранное из

7. Соединение по п.1 или его фармацевтически приемлемая соль, которое представляет собой

8. Соединение, выбранное из
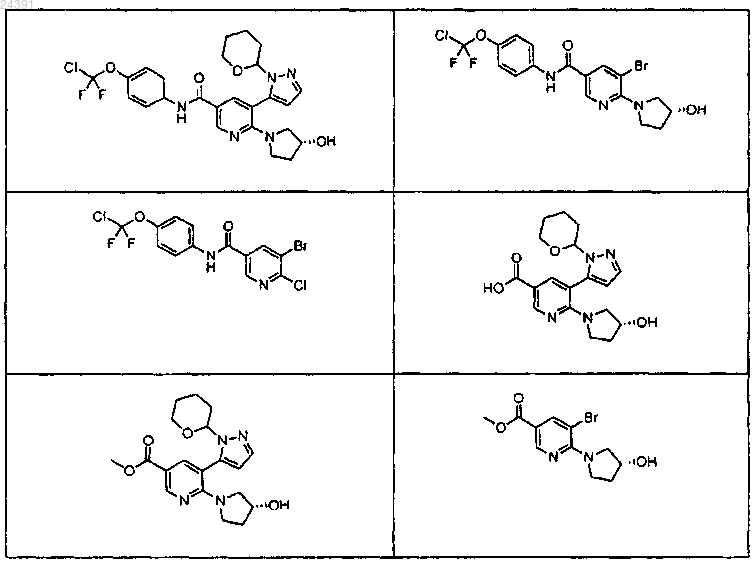
9. Соединение по п.1, которое представляет собой (R)-N-(4-(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1Н-пиразол-5-ил)никотинамид или его фармацевтически приемлемую соль.
10. Фармацевтическая композиция, содержащая аморфную дисперсию (R)-N-(4-(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1Н-пиразол-5-ил)никотинамида и 1-2 эксципиента, выбранных из PVP VA64 и Pharmacoat 603.
11. Композиция по п.10, где процентное содержание Pharmacoat 603 находится в диапазоне от 30 до 45%, процентное содержание PVP VA64 находится в диапазоне от 30 до 45% и процентное содержание (R)-N-(4-(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1Н-пиразол-5-ил)никотинамида находится в диапазоне от 20 до 30%.
12. Композиция по п.11, где процентное содержание Pharmacoat 603 составляет 37,5%, процентное содержание PVP VA64 составляет 37,5% и процентное содержание (R)-N-(4-(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1Н-пиразол-5-ил)никотинамида составляет 25%.
13. Способ лечения пациента, имеющего лейкоз, выбранный из хронического миелоидного лейкоза (CML) и острого лимфобластного лейкоза (ALL), включающий введение указанному пациенту терапевтически эффективного количества (R)-N-(4-(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1Н-пиразол-5-ил)никотинамида или его фармацевтически приемлемой соли и необязательно последовательное или одновременное введение терапевтически эффективного количества соединения, выбранного из иматиниба, нилотиниба, дазатиниба, босутиниба, понатиниба и бафетиниба.
14. Способ по п.13, включающий введение указанному пациенту терапевтически эффективного количества (R)-N-(4-(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1Н-пиразол-5-ил)никотинамида или его фармацевтически приемлемой соли.
15. Способ по п.13, включающий последовательное введение терапевтически эффективного количества соединения (R)-N-(4-(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1Н-пиразол-5-ил)никотинамида или его фармацевтически приемлемой соли и последовательное введение терапевтически эффективного количества соединения, выбранного из иматиниба, нилотиниба, дазатиниба, босутиниба, понатиниба и бафетиниба.
16. Способ по п.13, включающий введение указанному пациенту терапевтически эффективного количества (R)-N-(4-(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1Н-пиразол-5-ил)никотинамида или его фармацевтически приемлемой соли и одновременное введение терапевтически эффективного количества соединения, выбранного из иматиниба, нилотиниба, дазатиниба, босутиниба, понатиниба и бафетиниба.
17. Способ по п.16, где (R)-N-(4-(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1Н-пиразол-5-ил)никотинамид вводят при дозе в пределах 90-130 мг/кг.
18. Способ по п.17, где нилотиниб вводят при дозе 10-50 мг/кг.
19. Способ по п.18, где иматиниб вводят при дозе 50-200 мг/кг.
20. Применение соединения формулы (I) или его фармацевтически приемлемой соли по любому одному из пп.1-7 и 9 для лечения рака.
21. Применение по п.20, где рак представляет собой лейкоз, выбранный из хронического миелоидного лейкоза и острого лимфобластного лейкоза.
22. Применение по п.20 или 21 вместе с дополнительным соединением, выбранным из иматиниба, нилотиниба, дазатиниба, босутиниба, понатиниба и бафетиниба.
23. Применение по п.22 для последовательного или одновременного введения с указанным дополнительным соединением, где указанное дополнительное соединение представляет собой нилотиниб.
24. Применение по любому одному из пп.20-23, где соединение представляет собой (R)-N-(4-(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1Н-пиразол-5-ил)никотинамид или его фармацевтически приемлемую соль.
25. Применение соединения формулы (I) или его фармацевтически приемлемой соли по п.1 в получении лекарственного средства для лечения рака.
26. Применение по п.25, где рак представляет собой лейкоз, выбранный из хронического миелоидного лейкоза и острого лимфобластного лейкоза.
Текст
ПРОИЗВОДНЫЕ БЕНЗАМИДА ДЛЯ ИНГИБИРОВАНИЯ АКТИВНОСТИ ABL1, ABL2 И BCR-ABL1 Додд Стефани Кей (US), Фюре Паскаль, Гротцфельд Роберт Мартин,Янке Вольфганг, Джоунс Дэррил Бринли, Манли Пол, Марцинцик Андреас, Пелле Ксавье Франсуа Андре, Салем Баха, Шепфер Йозеф где Y, Y1, R1, R2, R3 и R4 определены в "Кратком описании изобретения"; способным к ингибированию активности BCR-ABL1 и его мутантов. Изобретение также обеспечивает способ получения соединений по изобретению, фармацевтические композиции, содержащие такие соединения, и способы применения таких соединений при лечении рака. Перекрестные ссылки на родственные заявки Настоящая заявка испрашивает приоритет к предварительной заявке США 61/647174, поданной 15 мая 2012 г., и предварительной заявке США 61/790967, поданной 15 марта 2013 г., каждая из которых включена в настоящую заявку в качестве ссылки в полном объеме. Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, способным к ингибированию тирозинкиназной ферментативной активности белка Абельсона (ABL1), Абельсон-родственного белка (ABL2) и родственных химерных белков, в частности BCR-ABL1. Изобретение также обеспечивает способ получения соединений по настоящему изобретению, фармацевтических препаратов, содержащих такие соединения, и способы применения таких соединений при лечении рака. Предпосылки создания изобретения Тирозинкиназная активность ABL1 белка обычно жестко регулируется N-концевой кэппирующей областью SH3 домена, играющей важную роль. Один регуляторный механизм включает миристоилирование глицин-2 остатка на N-концевом кэп-сайте и затем взаимодействие с миристатсвязывающим сайтом в SH1 каталитическом домене. Отличительным признаком хронического миелогенного лейкоза(CML) является хромосома Philadelphia (Ph), образованная в результате t(9,22) реципрокальной хромосомной транслокации в гемтатопоэтической стволовой клетке. Эта хромосома несет BCR-ABL1 онкоген,который кодирует химерный BCR-ABL1 белок, который не содержит N-концевой кэп и содержит конститутивно активный тирозинкиназный домен. Хотя лекарственные средства, которые ингибируют тирозинкиназную активность BCR-ABL1 через АТР-конкуретный механизм, такие как Gleevec/Glivec (иматиниб), Tasigna (нилотиниб) и Sprycel(дасатиниб), являются эффективными для лечения CML, у некоторых пациентов возникает рецидив из-за возникновения лекарственно-резистентных клонов, в которых мутации в SH1 домене мешают связыванию с ингибитором. Хотя Tasigna и Sprycel сохраняют эффективность в отношении многих Gleevecрезистентных мутантных форм BCR-ABL1, мутация, в которой треонин-315 остаток заменен изолейцином (T315I), остается нечувствительной ко всем трем лекарственным средствам и может привести к развитию резистентности к терапии у CML пациентов. Поэтому ингибование BCR-ABL1 мутаций, таких какT315I, остается неудовлетворенной медицинской потребностью. Помимо CML, BCR-ABL1 гибридные белки являются причиной, вызывающей определенный процент острых лимфоцитарных лейкозов, и лекарственные средства, прицельно действующие на ABL киназную активность, также являются полезными для этого показания. Средства, прицельно действующие на миристоилсвязывающий сайт (так называемые аллостерические ингибиторы), обладают потенциалом для лечения BCR-ABL1 расстройств (J. Zhang, F.J. Adrian, W.Okram, Y. Choi, A. Wojciechowski, X. Deng, G. Liu, G. Fendrich, A. Strauss, N. Vajpai, S. Grzesiek, T. Tuntland, Y. Liu, B. Bursulaya, M. Azam, P.W. Manley, J.R. Engen, G.Q. Daley, M. Warmuth., N.S. Gray. Targeting BCR-ABL by combining allosteric with ATP-binding-site inhibitors. Nature 2010/ 463:501-6). Для предотвращения возникновения лекарственной резистентности в результате использования АТР ингибитора и/или аллостерического ингибитора может быть разработано комбинированное лечение с использованием обоих типов ингибитора для лечения BCR-ABL1-связанных расстройств. В частности, существует потребность в малых молекулах или их комбинациях, которые ингибируют активность BCR-ABL1 иBCR-ABLl-мутации через АТР связывающий сайт, миристоилсвязывающий сайт или комбинацию обоих сайтов. Кроме того, соединения по настоящему изобретению в качестве ингибиторов ABL1 киназной активности имеют потенциал для использования в качестве терапевтических средств для лечения метастатических инвазивных карцином и вирусных инфекций, таких как покс-вирус и вирус Эбола. Соединения по настоящему изобретению также обладают потенциалом для лечения или профилактики заболеваний или расстройств, ассоциированных с аномально активированной киназной активностью ABL1 дикого типа, включая незлокачественные заболевания или расстройства, такие как заболевания ЦНС, в частности нейродегенеративные заболевания (например, болезнь Альцгеймера, болезнь Паркинсона), заболевания двигательных нейронов (амиотрофический боковой склероз), мышечные дистрофии, аутоиммунные и воспалительные заболевания (диабет и фиброз легких), вирусные инфекции, прионовые заболевания. Краткое описание изобретения В одном аспекте настоящее изобретение обеспечивает соединения формулы (I) где R1 представляет собой пиразолил; где указанный пиразолил является незамещенным или замещен 1-2 группами R6;R2 представляет собой пирролидинил; где указанный пирролидинил замещен одной группой R7;R3 выбирают из водорода и галогена;R6 в каждом случае независимо выбирают из водорода, гидрокси, метила, метокси, циано, трифторметила, гидроксиметила, галогена, амино, фторэтила, этила и циклопропила;Y выбирают из СН и N;Y1 выбирают из СН и N;Y3 выбирают из водорода, хлора, фтора, метила, дифторметила и трифторметила. Во втором аспекте настоящее изобретение обеспечивает фармацевтическую композицию, которая содержит соединение формулы (I) или его N-оксидное производное, индивидуальные изомеры и смесь изомеров, или его фармацевтически приемлемую соль в смеси с одним или несколькими подходящими эксципиентами. В третьем аспекте настоящее изобретение обеспечивает способ лечения заболевания у животного,где модуляция BCR-ABL1 активности может предотвращать, ингибировать или облегчать патологию и/или симптоматологию заболеваний, при этом способ включает введение животному терапевтически эффективного количества соединения формулы (I) или его N-оксидного производного, индивидуальных изомеров и смеси изомеров или его фармацевтически приемлемой соли. В четвертом аспекте настоящее изобретение обеспечивает применение соединения формулы (I) для получения лекарственного средства для лечения заболевания у животного, в котором BCR-ABL1 активность способствует патологии и/или симптоматологии заболевания. В пятом аспекте настоящее изобретение обеспечивает соединение формулы (I) для применения в терапии для животного, в котором BCR-ABL1 активность способствует патологии и/или симптоматологии заболевания. В шестом аспекте настоящее изобретение обеспечивает способ получения соединений формулы (I) и их N-оксидных производных, пролекарственных производных, защищенных производных, индивидуальных изомеров и смеси изомеров и их фармацевтически приемлемых солей. Краткое описание чертежей Фиг. 1 - порошковая рентгеновская дифрактограмма (с использованием медного источника (лямбда=1,54 А) для измерения) для аморфной твердодисперсной композиции примера 9 (см. пример 41), с 25% нагрузкой соединения примера 9 с PVP VA64 (37,5%) и Pharmacoat 603 (37,5%). Фиг. 2 - животные с подкожными KCL-22 ксенотрансплантатами, которые получали ежедневное лечение соединением примера 9. Продемонстрирована дозозависимая противоопухолевая активность. Фиг. 3 - KCL-22 клетки выращивали в качестве подкожных ксенотрансплантатов, и четыре животных получали дозу 75 мг/кг Нилотиниба BID (два раза в день). Когда у опухолей развивалась резистентность к лечению Нилотинибом, дозировку изменяли до 30 мг/кг соединения примера 9 два раза в день. Лечение нилотинибрезистентных опухолей соединением примера 9 привело к регрессии опухолей. Каждая линия представляет отдельное животное. Фиг. 4 - животным с подкожными KCL-22 ксенотрансплантатами вводили дозу в комбинации 30 мг/кг соединения примера 9 два раза в день и 75 мг/кг Нилотиниба два раза в день. Каждая линия представляет отдельное животное. Полную регрессию опухоли наблюдали у всех животных и поддерживали до конца исследования. Определения. Общие термины, используемые выше и ниже в настоящей заявке, предпочтительно имеют в контексте настоящего раскрытия следующие значения, если не указано иное, при этом более общие термины, где бы они ни использовались, независимо друг от друга, могут быть заменены более конкретными определениями или сохраняться, таким образом определяя более подробные варианты воплощения на-2 024391"Алкил" относится к разветвленным или неразветвленным углеводородным группам, содержащим от 1 до 7 атомов углерода (С 1-7 алкил) или от 1 до 4 атомов углерода (С 1-4 алкил). Репрезентативные примеры алкила включают, но не ограничиваются этим, метил, этил, н-пропил, изо-пропил, н-бутил, вторбутил, изо-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, 3-метилгексил, 2,2 диметилпентил, 2,3-диметилпентил, н-гептил, н-октил, н-нонил, н-децил и подобные. Замещенный алкил представляет собой алкильную группу, содержащую один или несколько, например один, два или три,заместителей, выбранных из галогена, гидрокси или алкоксигрупп. Галогензамещенный алкил и галогензамещенный алкокси может быть либо линейным, либо разветвленным и включает метокси, этокси, дифторметил, трифторметил, пентафторэтил, дифторметокси, трифторметокси и подобные."Арил" означает моноциклическую или конденсированную бициклическую ароматическую кольцевую структуру, содержащую от шести до десяти кольцевых атомов углерода. Например, арил может представлять собой фенил или нафтил, предпочтительно фенил. "Арилен" означает двухвалентный радикал, образованный из арильной группы."BCR-ABL1" относится к гибридному белку, образованному из N-концевых экзонов гена, включающего область с кластером точечных разрывов (BCR), и основной С-концевой части (экзоны 2-11)Abelson(ABL1) гена. Наиболее распространенные гибридные транскрипты кодируют 210-кДа белок(p210BCR-ABL1), хотя более редкие транскрипты кодируют 190-кДа белок (p190BCR-ABL1) и 230-кДа белок (p230BCR-ABL1). ABL1 последовательности этих белков содержат ABL1 тирозинкиназный домен,который является жестко регулируемым в белке дикого типа, но конститутивно активированным в BCRABL1 гибридных белках. Эта тирозинкиназа с нарушенной регуляцией взаимодействует с несколькими клеточными сигнальными путями, приводя к трансформации и нарушенной регуляции пролиферации клеток."BCR-ABL1 мутанты" относятся к многочисленным моносайтовым мутациям в BCR-ABL1, включающим Glu255 лизин, Glu255 валин, Thr315 изолейцин, Met244Val, Phe317Leu, Leu24 8Val,Met343Thr, Gly250Ala, Met351Thr, Gly250Glu, Glu355Gly, Gln252His, Phe358Ala,Gln252Arg, Phe359Val, Tyr253His, Val379Ile, Tyr253Phe, Phe382Leu, Glu255Lys,Leu387Met, Glu255Val, His396-Pro, Phe311-Ile, His396Arg, Phe311Leu, Ser417Tyr,Thr315Ile, Glu459Lys и Phe486Ser. Соединения по настоящему изобретению являются чувствительными к замещению на R3/R4 замещенном кольце в положении, которое представляет собой орто относительно точки присоединенияNHC(O) группы. Для сравнения предоставлены, например, следующие соединения формулы (I). Значение ИК 50 примера 2 составляет 1 нМ в сравнении с хлор- или метилзамещением, где значение ИК 50 составляет 1,6 и 1,8 мкМ соответственно:"Гетероарил" имеет значение, определенное для арила выше, где один или несколько из кольцевых членов представляет собой гетероатом. Например, 5-8-членный гетероарил содержит минимум 5 членов кольца, выбранных из углерода, азота, кислорода и серы. Следовательно, 5-8-членный гетероарил включает пиридил, индолил, индазолил, хиноксалинил, хинолинил, бензофуранил, бензопиранил, бензотиопиранил, бензо[1,3]диоксол, имидазолил, бензоимидазолил, пиримидинил, фуранил, оксазолил, изоксазолил, триазолил, тетразолил, пиразолил, тиенил и т.д."Циклоалкил" означает насыщенную, моноциклическую, бициклическую или связанную мостиковой связью полициклическую кольцевую структуру, содержащую указанное количество кольцевых атомов. Например, С 3-10 циклоалкил включает циклопропил, циклобутил, циклопентил, циклогексил и т.д. Частично ненасыщенный циклоалкил означает циклоалкил, как определено выше, по меньшей мере с одной двойной связью."Гетероциклоалкил" означает циклоалкил, как он определен в настоящей заявке, при условии, что один или несколько из указанных кольцевых атомов углерода замещены группой, выбранной из -O-, -N=,-NR-, -С (О)-, -S-, -S(O)- или -S(O)2-, где R представляет собой водород, С 1-4 алкил или азот-защитную группу (например, карбобензилокси, пара-метоксибензилкарбонил, трет-бутилоксикарбонил, ацетил,бензоил, бензил, пара-метокси-бензил, пара-метокси-фенил, 3,4-диметоксибензил и подобные). Например, 3-8-членный гетероциклоалкил включает морфолино, пирролидинил, пирролидинил-2-он, пиперазинил, пиперидинил, пиперидинилон, 1,4-диокса-8-аза-спиро[4,5]дец-8-ил, тиоморфолино, сульфаноморфолино, сульфономорфолино и т.д."Галоген" (или гало) предпочтительно представляет собой хлор или фтор, но также может быть бромом или йодом.GLEEVEC (иматиниб мезилаты) показан для лечения пациентов с KIT (CD117)-положительными неоперабельными и/или метастатическими злокачественными гастроинтестинальными стромальными опухолями (GIST). Он также показан для лечения взрослых пациентов после полной макроскопической резекции KIT (CD117)-положительных GIST. Он также показан для лечения впервые диагносцированных взрослых пациентов и пациентов детского возраста с филадельфийская хромосома-положительным хроническим миелоцитарным лейкозом с (Ph+ CML) в хронической фазе и пациентов с Ph+ CML в бластном кризе (ВС), фазе акселерации (АР) или в хронической фазе (СР) после неудачи применения интерферональфа терапии. Он может также быть использован в качестве прицельно действующего лекарственного средства для лечения следующих редких заболеваний с ограниченными возможностями лечения: рецидивного или резистентного филадельфийская хромосома-положительного острого лимфобластного лейкоза (Ph+ ALL); миелодиспластических/миелопролиферативных заболеваний (MDS/MPD), связанных с перегруппировкой генов рецепторов тромбоцитарного фактора роста (PDGFR); агрессивного системного мастоцитоза (ASM) без D816V с-KIT мутации или с неизвестным мутационным статусом с-KIT; гиперэозинофильного синдрома/хронического эозинофильного лейкоза (HES/CEL) с FIP1L1-PDGFR гибридной киназой (мутационный анализ или FISH демонстрация делеции CHIC2 аллеля) и для пациентов с HES и/или CEL, которые являются FIP1L1-PDGFR гибридная киназа-отрицательными или это неизвестно; и неоперабельных, рецидивирующих и/или метастатических выбухающих дерматофибросарком (DFSP).TASIGNA (нилотиниб) показан для лечения взрослых пациентов с впервые диагностированным филадельфийская хромосома-положительным хроническим миелоцитарным лейкозом (Ph+CML) в хронической фазе. Он может быть использован для лечения взрослых пациентов, которые больше не полу-4 024391 чают положительного результата или не переносят другие терапии, включая иматиниб (GLEEVEC), или получали другие терапии, включая иматиниб (GLEEVEC), но не могут переносить их.SPRYCEL (дазатиниб) представляет собой рецептурное лекарственное средство для лечения взрослых пациентов с впервые диагностированным филадельфийская хромосома-положительным (Ph+) хроническим миелоцитарным лейкозом (CML) в хронической фазе и для лечения взрослых пациентов,которые больше не получают положительного результата или не переносят другие терапии, а также для пациентов с ALL.BOSULIF (босутиниб) представляет собой рецептурное лекарственное средство для лечения взрослых пациентов с впервые диагностированным филадельфийская хромосома-положительным (Ph+) хроническим миелоцитарным лейкозом (CML) в хронической фазе и для лечения взрослых пациентов,которые больше не получают положительного результата или не переносят другие терапии, а также для пациентов с ALL. Соединения формулы (I) могут иметь различные изомерные формы. Например, любой асимметричный атом углерода может присутствовать в (R)-, (S)- или (R,S)-конфигурации, предпочтительно в (R)или (S)-конфигурации. Заместители на двойной связи или особенно на кольце могут присутствовать в цис-(-Z-) или транс-(=Е-) форме. Соединения, таким образом, могут присутствовать в виде смесей изомеров или предпочтительно в виде чистых изомеров, предпочтительно в виде чистых диастереомеров или чистых энантиомеров. Следующие соединения формулы (I) могут существовать в таутомерной форме Для иллюстрации таутомерии со следующими конкретными примерами (R)-N-(4(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1 Н-пиразол-5-ил)никотинамид (правая структура,ниже) представляет собой таутомер Когда используется форма множественного числа (например, соединения, соли), она включает и единственное число (например, одно соединение, одна соль). "Соединение" не исключает, что присутствует (например, в фармацевтической композиции) более чем одно соединение формулы (I) (или его соль), артикль "а" просто представляет неопределенный артикль. "А", таким образом, предпочтительно следует понимать как "один или несколько", менее предпочтительно, альтернативно, как "один". Термин "и/или его N-оксид, его таутомер и/или его (предпочтительно фармацевтически приемлемая) соль", главным образом, означает, что соединение формулы (I) может присутствовать как таковое или в смеси с его N-оксидом, в виде таутомера (например, в результате кето-енольной, лактамлактимной, амид-имидокислотной или енамин-иминовой таутомерии), или в виде (например, вызванной эквивалентной реакцией) смеси с его таутомером, или в виде соли соединения формулы (I) и/или любой из этих форм или смесей двух или более таких форм. Любые формулы, представленные в настоящей заявке, предназначены также для представления немеченых форм, а также изотопно меченых форм соединений. Изотопно меченые соединения имеют структуры, отображенные формулами, приведенными в настоящей заявке, за исключением того, что один или несколько атомов заменены атомом, имеющим выбранную атомную массу или массовое число. Примеры изотопов, которые могут быть включены в соединения по настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2 Н, 3 Н, 11C, 13C, 14C, 15N,18F, 31P, 32P, 35S, 36Cl, 123I, 124I, 125I соответственно. Изобретение включает различные изотопно меченные соединения, как определено в настоящей заявке, например, те, в которых радиоактивные изотопы, такие как 3 Н и 14 С, или те, в которых нерадиоактивные изотопы, такие как 2 Н и 13 С присутствуют. Такие изотопномеченые соединения полезны в метаболических исследованиях (с 14 С), в исследованиях кинетики реакций (с, например, 2 Н или 3 Н), методах детекции или визуализации, таких как позитронно-5 024391 эмиссионная томография (PET) или однофотонная эмиссионная компьютерная томография (SPECT),включая анализы распределения лекарственных средств или тканей субстрата или в радиоактивной терапии пациентов. В частности, 18F или меченое соединение могут быть особенно желательными для PET или SPECT исследований. Изотопно меченые соединения по настоящему изобретению, как правило, могут быть получены обычными способами, известными специалистам в данной области техники, или способами, аналогичными тем, которые описаны в прилагаемых Примерах, с использованием подходящих изотопно меченых реагентов. Кроме того, замещение более тяжелыми изотопами, особенно дейтерием (т.е. 2 Н или D), может давать определенные терапевтические преимущества в результате более высокой метаболической стабильности, например больший период полужизни in vivo или снижение уровня необходимых доз или улучшение терапевтического индекса. Понятно, что дейтерий в этом контексте рассматривается в качестве заместителя соединения по настоящему изобретению. Концентрация такого тяжелого изотопа, особенно дейтерия, может быть определена при помощи изотопного коэффициента обогащения. Термин "изотопный коэффициент обогащения", используемый в настоящей заявке, означает соотношение между распространенностью изотопа и природной распространенностью конкретного изотопа. Если заместитель в соединении по данному изобретению обозначен как дейтерий, такое соединение имеет изотопный коэффициент обогащения для каждого указанного атома дейтерия по меньшей мере 3500 (52,5% включения дейтерия в каждом определенном атоме дейтерия), по меньшей мере 4000 (60% включения дейтерия), по меньшей мере 4500 (67,5% включения дейтерия), по меньшей мере 5000 (75% включения дейтерия), по меньшей мере 5500 (82,5% включения дейтерия), по меньшей мере 6000 (90% включения дейтерия), по меньшей мере 6333,3 (95% включения дейтерия), по меньшей мере 6466,7 (97% включения дейтерия), по меньшей мере 6600 (99% включения дейтерия) или по меньшей мере 6633,3 (99,5% включения дейтерия). Например, соединение формулы (Ib), представленное в настоящей заявке, где R3 представляет собой водород и Y представляет собой СН, может включать дейтерий на пирролидинильном кольце, как показано: Эта дейтерированная форма менее склонна к метаболической трансформации (слева выше) по сравнению с недейтерированной формой (справа выше). Описание предпочтительных вариантов воплощения Настоящее изобретение относится к соединениям, способным к ингибированию активности BCRABL1 или мутантов BCR-ABL1 через аллостерический миристоилсвязывающий сайт. В одном варианте воплощения, относящемся к соединениям по настоящему изобретению, представлены соединения формулы (Ib) где R3 выбирают из водорода и галогена; R4 выбирают из -SF5 и -Y2-CF2-Y3; R6, когда связан с азотом пиразолильного кольца, выбирают из водорода, метила, гидроксиэтила, фторэтила, этила и циклопропила и R6, когда связан с атомом углерода пиразолильного кольца, выбирают из водорода, гидрокси,метила, метокси, циано, трифторметила, гидроксиметила, галогена, амино, фторэтила, этила и циклопропила; R7 выбирают из гидрокси, метила, галогена, метокси, гидроксиметила, амино, метиламино, аминометила, трифторметила, 2-гидроксипропан-2-ила, метилкарбониламино, диметиламино, 2-амино-3 метилбутаноил)окси, карбокси, метоксикарбонила, фосфоноокси, циано и аминокарбонила; Y1 выбирают из СН и N; Y2 выбирают из CF2, О и S(O)0-2; Y3 выбирают из водорода, фтора, хлора, метила, дифторметила и трифторметила; или их фармацевтически приемлемые соли. В следующем варианте воплощения представлены соединения формулы (Ic) где R3 выбирают из водорода и галогена; R4 выбирают из -SF5 и -Y2-CF2-Y3; R6, когда связан с азотом пиразолильного кольца, выбирают из водорода, метила, гидроксиэтила, фторэтила, этила и циклопропила и R6, когда связан с атомом углерода пиразолильного кольца, выбирают из водорода, гидрокси,метила, метокси, циано, трифторметила, гидроксиметила, галогена, амино, фторэтила, этила и циклопропила; R7 выбирают из гидрокси, метила, галогена, метокси, гидроксиметила, амино, метиламино, аминометила, трифторметила, 2-гидроксипропан-2-ила, метилкарбониламино, диметиламино, 2-амино-3 метилбутаноил)окси, карбокси, метоксикарбонила, фосфоноокси, циано и аминокарбонила; Y1 выбирают из СН и N; Y2 выбирают из CF2, О и S(O)0-2; Y3 выбирают из водорода, фтора, хлора, метила, дифторметила и трифторметила; или их фармацевтически приемлемые соли. В другом варианте воплощения представлены соединения формулы (I) или их фармацевтически приемлемые соли, где R1 представляет собой пиразолил; где указанный пиразолил является незамещенным или замещен от 1 до 2 групп R6. В следующем варианте воплощения R1 представляет собой незамещенный пиразолил. В следующем варианте воплощения R1 представляет собой пиразолил, замещенный одной группойR6. В следующем варианте воплощения R1 представляет собой пиразолил, замещенный двумя группами R6. В другом варианте воплощения R2 представляет собой пирролидин-1-ил, замещенный одной группой R7. В другом варианте воплощения Y выбирают из СН и N. В следующем варианте воплощения Y представляет собой N. В следующем варианте воплощения Y представляет собой СН. В другом варианте воплощения Y1 выбирают из СН и N. В следующем варианте воплощения Y1 представляет собой N. В следующем варианте воплощения Y1 представляет собой СН. Следующие дополнительные варианты относятся к соединениям любой одной из формул (I), (Ib) или (Ic) или их фармацевтически приемлемым солям. В другом варианте воплощения R3 выбирают из водорода и галогена. В другом варианте воплощения R4 выбирают из -SF5 и -Y2-CF2-Y3. В следующем варианте воплощения R4 представляет собой хлордифторметокси. В следующем варианте воплощения R4 представляет собой трифторметокси. В другом варианте воплощения R6 в каждом случае независимо выбирают из водорода, гидрокси,метила, метокси, циано, трифторметила, гидроксиметила, галогена, амино, фторэтила, этила и циклопропила. В следующем варианте воплощения R6, когда связан с азотом пиразолильного кольца, выбирают из водорода, метила, гидроксиэтила, фторэтила, этила и циклопропила. В следующем варианте воплощения R6, когда связан с атомом углерода пиразолильного кольца,выбирают из водорода, гидрокси, метила, метокси, циано, трифторметила, гидроксиметила, галогена,амино, фторэтила, этила и циклопропила. В другом варианте воплощения R7 выбирают из гидрокси, метила, галогена, метокси, гидроксиметила, амино, метиламино, амино-метила, трифторметила, 2-гидроксипропан-2-ила, метилкарбониламино,диметиламино, 2-амино-3-метилбутаноил)окси, карбокси, метоксикарбонила, фосфоноокси, циано и аминокарбонила. В другом варианте воплощения Y2 выбирают из CF2, О и S(O)0-2. В следующем варианте воплощения Y2 представляет собой О. В следующем варианте воплощения Y2 представляет собой CF2. В следующем варианте воплощения Y2 представляет собой S(O)0-2. В другом варианте воплощения Y3 выбирают из водорода, хлора, фтора, метила, дифторметила и трифторметила. В следующем варианте воплощения Y3 представляет собой хлор. В следующем варианте воплощения Y3 представляет собой фтор. В следующем варианте воплощения представлены соединения или их фармацевтически приемлемые соли, выбранные из В другом варианте воплощения представлены соединения или их фармацевтически приемлемые соли, выбранные из В другом варианте воплощения представлены соединения или их фармацевтически приемлемые соли, выбранные из В другом варианте воплощения представлено соединение или его фармацевтически приемлемая соль, которое представляет собой В другом варианте воплощения представлены соединения, выбранные из Фармакология и полезность. На основании исследований ингибирования, описанных в разделе "Анализ" ниже, соединение формулы (I) в соответствии с настоящим изобретением демонстрирует терапевтическую эффективность,особенно против расстройств, зависимых от BCR-ABL1 активности. В частности, соединения по настоящему изобретению ингибируют аллостерический или миристоилсвязывающий сайт BCR-ABL1 (включаяBCR-ABL1 дикого типа и/или его мутации). Объединение АТР-конкурентного ингибитора BCR-ABL1 с аллостерическим ингибитором BCRABL1 замедляет приобретенную резистентность в BCR-ABL1+KCL-22 клетках in vitro. К удивлению,BCR-ABL1+KCL-22 клетки, которые обрабатывали через каждые 3-4 дня соединением по настоящему изобретению, показали приобретенную резистентность после приблизительно 28 дней, тогда как те же самые клетки, которые обрабатывали через каждые 3-4 дня нилотинибом или дасатинибом, показали приобретенную резистентность уже через 18-21 день. Еще более удивительно, когда BCR-ABL1+KCL-22 клетки обрабатывали через каждые 3-4 дня комбинацией соединения по настоящему изобретению с либо нилотинибом, либо дасатинибом, не наблюдали никакую приобретенную резистентность, по меньшей мере, в течение первых 60 дней. Поэтому соединения по настоящему изобретению, связывающиеся с миристоилсвязывающим сайтом, в комбинаци с ингибиторами BCR-ABL1, которые связываются с сайтом связывания АТР, имеют особенно важное значение для лечения пролиферативных заболеваний, в которых имеет место положительная регуляция ABL1 киназной активности, как в случае с BCR-ABL1 гибридными белками в CML и подвидах других гематологических злокачественных заболеваний, таких как ALL и AML. Клетки карциномы используют invapodia для разрушения внеклеточного матрикса в процессе инвазии и метастазирования опухоли. ABL киназная активность необходима для SRC-индуцированного образования invapodia, регуляции отдельных стадий сборки и функции invapodia. Поэтому соединения по настоящему изобретению, в качестве ингибиторов ABL, имеют потенциал для использования в качестве терапевтических средств для лечения метастатических инвазивных карцином. Аллостерический ингибитор ABL1 киназы можно использовать для лечения рака головного мозга: включая глиобластому, которая является наиболее распространенной и наиболее агрессивной злокачественной первичной опухолью головного мозга, в которой экспрессия ABL1 иммуногистохимически определяется в субпопуляции пациентов (Haberler С., Gelpi E., Marosi С., Rossler K., Birner P., Budka H., Hainfellner J.A. Immunohistochemical analysis of platelet-derived growth factor receptor-alpha, beta, c-KIT, ABL1 иABL2 proteins in glioblastoma: possible implications for patient selection for imatinib mesylate therapy. J. Neurooncol. 2006 Jan; 76 (2):105-9). Однако клинические испытания с использованием Gleevec не были успешными у пациентов с глиобластомой (Reardon D.A., Dresemann G., Taillibert S., Campone M., van denOct 1; 15(19):6258-66; Dresemann G. Imatinib and hydroxyurea in pretreated progressive glioblastoma multiforme: a patient series. Ann Oncol. 2005 Oct; 16(10): 1702-8), возможно по причине плохого внутриопухолевого воздействия лекарственного средства в головном мозге и в отсутствие нарушенного гематоэнцефалического барьера (Holdhoff et al., J. Neurooncol. 2010; 97(2):241-5). Действительно, в предклинических исследованиях было показано, что транспорт Gleevec через гемато-энцефалический барьер ограничивается активным транспортом вытекающих веществ, таких как Р-гликопротеин. Это также относится и к дазатинибу (Chen Y., Agarwal S., Shaik N.M., Chen C., Yang Z., Elmquist W.F. P-glycoprotein and(3): 956-63). Известно, что облучение усиливает открытие гемато-энцефалического барьера. В мышиных моделях, ответ мультиформной глиобластомы на Gleevec соотносился с увеличением задержки опухолевого роста и повышением выживания, когда Gleevec вводили в сочетании с ежедневным облучениемgrowth delay and survival in irradiated mouse models of glioblastoma. Int J. Radiat Oncol Biol Phys. 2006 Jan 1; 64(1):263-71). Поэтому новый ингибитор ABL1 с высокой экспозицией в головном мозге представляет собой серьезный терапевтический подход для лечения глиобластомы и других опухолей головного мозга. ЦНС-CML: сообщалось о ЦНС бласткризисе и неблагоприятном исходе у некоторых CML пациентов, которых лечили препаратом Gleevec, и это можно объяснить низкой экспозицией Gleevec в головном мозге. (Kim H.J., Jung C.W., Kim K., Ann J.S., Kim W.S., Park K., Ko Y.H., Kang W.K., Park K. Isolatedreport of two cases. Indian J. Hematol. Blood Transfus. 2011 Mar; 27(1):51-4). Действительно, у CML пациентов концентрация Gleevec на самом деле намного ниже (в 100 раз) в ЦНС, чем в плазме (Leis J.F.,Stepan D.E., Curtin P.T., Ford J.M., Peng B., Schubach S., Druker B.J., Maziarz R.T. Central nervous systemfailure in patients with chronic myelogenous leukemia lymphoid blast crisis and Philadelphia chromosome positive acute lymphoblastic leukemia treated with imatinib (STI-571). Leuk Lymphoma. 2004 Apr; 45(4):695-8). Поэтому ингибиторы ABL1 по настоящему изобретению, которые демонстрируют высокую экспозицию в головном мозге, представляют собой эффективный подход для разработки терапевтических средств против CML, включая ЦНС-CML. Соединения по настоящему изобретению могут быть полезными в лечении вирусных инфекций. Например, вирусные инфекции могут быть опосредованы ABL1 киназной активностью, как в случае покс-вирусов и вируса Эбола. Было показано, что Gleevec и Tasigna останавливают высвобождение частиц вируса Эбола из инфицированных клеток, in vitro (Kalman, Daniel; Bornmann, William Gerard,Methods of use of non-ATP competitive tyrosine kinase inhibitors to treat pathogenic infection, PCT Int. Appl. 2007, WO 2007002441; Garcia Mayra; Cooper Arik; Shi Wei; Bornmann William; Carrion Ricardo; KalmanDaniel; Nabel Gary J. Productive Replication of Ebola Virus Is Regulated by the ABL1 Tyrosine Kinase. Science translational medicine 2012; 4:123ra24). Поэтому можно ожидать, что соединения по настоящему изобретению, которые ингибируют ABL1 киназу, будут снижать способность патогена к репликации. Соединения по настоящему изобретению также могут быть полезными в лечении нервной дегенерации. Хотя нативная ABL1 тирозиновая киназа остается в относительном состоянии покоя в головном мозге здорового взрослого человека, она может активироваться в головном мозге пациентов с ЦНС заболеваниями, включая нейродегенеративные заболевания, такие как болезнь Альцгеймера (AD), болезнь Паркинсона (AD), фронтотемпоральная деменция (FTD), болезнь Пика, болезнь Ниманна-Пика С типа(NPC) и другие дегенеративные, воспалительные и аутоиммунные заболевания и старение. Болезнь Паркинсона является вторым наиболее распространенным хроническим нейродегенеративным заболеванием, при этом наиболее распространенная наследственная аутосомально-рецессивная форма вызвана мутациями в Е 3 убихитинлигазе, parkin. Последние исследования показали, что активированный ABL1/ABL2 был обнаружен в полосатом теле у пациентов с спорадической болезнью Паркинсона. Одновременно с этим, parkin был тирозин-фосфорилированным, вызывая потерю его убихитинлигазы и цитозащитных действий, на что указывала аккумуляция parkin субстратов (Ko H.S., Lee Y., ShinT.M. Phosphorylation by the c-Abl protein tyrosine kinase inhibits parkin's ubiquitination and protective function. Proc Natl Acad Sci USA. 2010 Sep 21; 107(38):16691-6; Imam S.Z., Zhou Q., Yamamoto A., Valente A.J.,Ali S.F., Bains M., Roberts J.L., Kahle P.J., Clark R.A., Li S. Novel regulation of parkin function through c-Ablmediated tyrosine phosphorylation: implications for Parkinson's disease. J. Neurosci. 2011 Jan 5; 31(1):157-63). Эти два исследования также показали, что в клетке или животных моделях болезни Паркинсона фармакологическое ингибирование ABL1 киназы или генетический ABL1 "нокдаун" препятствовали фосфорилированию тирозина белка parkin и восстанавливали активность его Е 3 лигазы и цитозащитную функцию как in vitro, так и in vivo. Эти результаты показывают, что ABL1-зависимое фосфорилирование тирозина белка parkin представляет собой основную посттрансляционную модификацию, которая приводит к потере функции parkin и прогрессированию заболевания в спорадической PD. Поэтому способность соединений по настоящему изобретению ингибировать миристатсвязывающий сайт ABL1, как можно ожидать, откроет новые терапевтические возможности для блокирования развития болезни Паркинсона. Болезнь Альцгеймера характеризуется двумя основными особенностями: внеклеточные отложения нейротоксичного амилоида-, что приводит к развитию амилоидных бляшек и внутриклеточной аккумуляции гиперфосфорилированного tau, что способствует развитию нейрофибриллярных сплетений (NFT). Уровень амилоида- снижается после интратекального введения Gleevec в головном мозге морских свинок дикого типа и в клеточных моделях (Netzer W.J., Dou F., Cai D., Veach D., Jean S., Li Y.,Bornmann W.G., Clarkson B., Xu H., Greengard P. Gleevec inhibits beta-amyloid production but not Notchcleavage. Proc Natl Acad Sci USA. 2003 Oct 14; 100 (21): 12444-9). Этой же группой было сделано предположение, что Gleevec достигает амилоидснижающего эффекта через новый механизм, препятствующий GSAP взаимодействию с гамма-секретазным субстратом, APP-CTF (He G., Luo W., Li P., Remitters С., Netzer W.J., Hendrick J., Bettayeb K., Flajolet M., Gorelick F., Wennogle L.P., Greengard P. Gammasecretase activating protein is a therapeutic target for Alzheimer's disease. Nature. 2010 Sep 2; 467(7311):95-8). В этом исследовании эффект Gleevec, такой как ингибирование GSAP/APP-CTF, наблюдали только при микромолярных концентрациях. Другая группа показала, что фосфорилирование тирозина внутриклеточного домена АРР (т.е. Tyr682) регулирует процессинг амилоидогенного АРР, ускоряя образование амилоида-Р in vivo (Barbagallo А.Р., Weldon R., Tamayev R., Zhou D., Giliberto L., Foreman O., D'Adamio L.Nov 16; 5 (11):e15503). Другие исследования показали, что АРР является тирозин-фосфорилированным в клетках, экспрессирующих конститутивно активную форму ABL1 онкогена (Zambrano N., Bruni P., Minopoli G., Mosca R., Molino D., Russo C., Schettini G., Sudol M., Russo T. The beta-amyloid precursor proteinChem. 2001 Jun 8; 276(23):19787-92). Эти данные, взятые вместе, предполагают ABL1-зависимый процессинг амилоидогенного АРР для образования токсичного амилоид- пептида и последующих амилоидных бляшек. Поэтому можно ожидать, что ингибитор ABL1 будет снижать образование амилоидных бляшек у пациентов с болезнью Альцгеймера. Было показано, что Tau фосфорилируется ABL1 киназой по тирозинам 18, 197, 310 и 394 в клеточных моделях, и было показано, что tau pY394 присутствует в поражениях NFT в головном мозге AD пациентов.ABL1 активирован в головном мозге пациентов с спорадической болезнью Альцгеймера, как показано по его фосфорилированию либо по Y412, индикатору активации, который ко-локализует грануловаскулярную дегенерацию, либо по Т 735, который ко-локализован с типичными поражениями, амилоидными бляшками, нейрофибриллярными сплетениями (NFT), в дополнение к GVD. Амилоид- и окислительный стресс активируют ABL1 киназу в культурах нервных клеток, и интрацеребральная инъекция фибриллярного амилоидного пептида приводит к повышенной экспрессии ABL1 и далее на этом пути эффектора р 73. Трансгенные мыши (APP/Swe мышиная модель AD) показали повышенные уровни ABL1 в головном мозге, и, когда этих мышей обрабатывали ингибитором ABL1 Gleevec, tau фосфорилирование снижалось в головном мозге животных. Трансгенная мышиная модель, экспрессирующая конститутивно активный ABL1 в нейронах переднего мозга, демонстрировала потерю нейронов, тяжелое нейровоспаление и тирозин-фосфорилированный tau в головном мозге (см. обзор в Schlatterer S.D., Acker C.M.,Davies P. c-Abl in neurodegenerative disease. J. Mol. Neurosci. 2011 Nov; 45(3):445-52). На основании всех этих результатов существует доказательство роли ABL1 киназы в патогенезе болезни Альцгеймера для развития обоих поражений - амилоидных бляшек и нейрофибриллярных сплетений. Кроме того, активированный ABL1 также присутствует в других таупатиях, помимо спорадической болезни Альцгеймера, в том числе в головном мозге пациентов с фронтотемпоральной деменцией сN279K и P301L мутациями, болезнью Пика и Гуам Паркинсон-деменцией (Schlatterer S.D., Acker C.M.,Davies P. c-Abl in neurodegenerative disease. J. Mol. Neurosci. 2011 Nov; 45(3):445-52). Поэтому соединения по настоящему изобретению, ингибирующие ABL1 в ЦНС, представляют собой эффективный подход для разработки терапевтических средств против болезни Альцгеймера, а также других -амилоидозов, таких как сосудистая деменция и другие таупатии, такие как фронтотемпоральная деменция и болезнь Пика. Болезнь Ниманна-Пика С типа (NPC) представляет собой фатальное аутосомальное рецессивное расстройство, характеризующееся аккумуляцией свободного холестерина и гликосфинголипидов в эндосомальной-лизосомальной системе и прогрессирующей гибелью нейронов, особенно мозжечковых нервных клеток Пуркинье. В мышиной модели NPC проапоптический ABL1, находящаяся далее по ходу транскрипции мишень, а также р 73 гены-мишени экспрессируются в мозжечке. Ингибирование ABL1 при помощи Gleevec предотвращало потерю нервных клеток Пуркинье, улучшало неврологические симптомы и повышало выживаемость. Этот эффект провыживания Gleevec соотносился с пониженными уровнями мРНК р 73 проапоптических генов-мишеней (Alvarez A.R., Klein A., Castro J., Cancino G.I.,Amigo J., Mosqueira M., Vargas L.M., Yevenes L.F., Bronfman F.C., Zanlungo S. Imatinib therapy blocks cerebellar apoptosis and improves neurological symptoms in a mouse model of Niemann-Pick type С disease.FASEB J. 2008 Oct; 22(10):3617-27). Поэтому соединения по настоящему изобретению, ингибирующиеABL1 киназу, представляют собой эффективный подход для разработки терапевтических средств против заболеваний, вызванных проапоптическим путем ABL1/р 73, таких как NPC. В моделях прионовых заболеваний Gleevec показал благоприятные эффекты: он замедлял прионовую нейроинвазию путем ингибирования распространения приона с периферии в ЦНС (Yun S.W., Ertmerimatinib mesylate delays prion neuroinvasion by inhibiting prion propagation in the periphery. J. Neurovirol. 2007 Aug; 13 (4):328-37). Gleevec и дефицит ABL1 индуцировали клеточный клиренс PrPSc в прионинфицированных клетках (Ertmer A., Gilch S., Yun S.W., Flechsig E., Klebl B., Stein-Gerlach M., Kleincells. J. Biol. Chem. 2004 Oct 1; 279 (40):41918-27). Поэтому, новые ингибиторы ABL1 по настоящему изобретению также представляют собой эффективный терапевтический подход для лечения прионовых заболеваний, таких как болезнь Крейцфельда-Якоба. Причиной Х-связанной рецессивной мышечной дистрофии Эмери-Дрейфуса являются мутации эмерина, ядерно-мембранного белка, играющего роль в ядерной архитектуре, генной регуляции и передаче сигналов. Недавно проведенное исследование показало, что эмерин тирозин-фосфорилируется непосредственно при помощи ABL1 в клеточных моделях и что статус фосфорилирования эмерина изменяет связывание эмерина с другими белками, такими как BAF. Это, в свою очередь, может объяснить мислокализацию мутантного эмерина из ядерного в цитозольные компартменты и соответствующие изменения в расположенном далее на этом пути эффекторе и сигнальном интеграторе для сигнального пути(путей) на ядерной оболочке (Tifft K.E., Bradbury K.A., Wilson K.L. Tyrosine phosphorylation of nuclearmembrane protein emerin by SRC, ABL1 and other kinases. J. Cell Sci. 2009 Oct 15; 122 (Pt 20):3780-90). Изменения в эмерин-ламин взаимодействиях как в фазе митоза, так и в интерфазе являются важными для патологии мышечной дистрофии. Кроме того, результаты другого исследования показывают, чтоGleevec ослабляет скелетно-мышечную дистрофию у mdx мышей (Huang P., Zhao X.S., Fields M., Ransohoff R.M., Zhou L. Imatinib attenuates skeletal muscle dystrophy in mdx mice. FASEB J. 2009 Aug; 23(8):2539-48). Поэтому новые ингибиторы ABL1 по настоящему изобретению также представляют собой терапевтические подходы для лечения скелетных и мышечных дистрофий. Кроме того, ABL1 киназа играет роль в воспалении и окислительном стрессе, двух механизмах, которые вовлечены в различные заболевания человека, от острых заболеваний ЦНС, таких как удар и травматические поражения головного мозга или спинного мозга, хронических заболеваний ЦНС, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона и заболевания двигательных нейронов,до не связанных с ЦНС воспалительных и аутоиммунных заболеваний, таких как диабет, фиброз легких. Например, Gleevec предотвращает фиброз в различных предклинических моделях системного склероза и индуцирует регрессию установившегося фиброза (Akhmetshina A., Venalis P., Dees С., BuschN., Zwerina J., Schett G., Distler O., Distler J.H. Treatment with imatinib prevents fibrosis in different preclinical models of systemic sclerosis and induces regression of established fibrosis. Arthritis Rheum. 2009 Jan; 60(1):219-24), и он демонстрирует антифибротические эффекты в блеомицин-индуцированном фиброзе легких у мышей (Aono Y., Nishioka Y., Inayama M., Ugai M., Kishi J., Uehara H, Izumi K., Sone S. Imatinibas a novel antifibrotic agent in bleomycin-induced pulmonary fibrosis in mice. Am J. Respir. Crit Care Med. 2005 Jun 1; 171 (11):1279-85). Другое исследование показало, что как иматиниб, так и нилотиниб уменьшали блеомицин-индуцированное острое легочное поражение и фиброз легких у мышей (Rhee C.K., Leeon bleomycin-induced acute lung injury and pulmonary fibrosis in mice. Respiration. 2011; 82(3):273-87). Хотя в этих исследованиях авторы были сфокусированы на участии механизма, связанного с PDGFR, который представлял интерес, в исследовании Rhee et al. (Respiration. 2011; 82(3):273-87) нилотиниб, который является значительно более сильным ингибитором c-ABL, чем иматиниб, показал более высокие терапевтические антифибротические эффекты, таким образом подтверждая терапевтическую применимость ингибиторов с-ABL для лечения заболеваний человека с легочным воспалением. В другом исследовании гипероксия, вызываемая у мышей, повышала активацию ABL1, которая необходима для фосфорилирования динамина 2 и продукции реактивных видов кислорода и легочного просачивания (Singleton P.A.,Pendyala S., Gorshkova I.A., Mambetsariev N., Moitra J., Garcia J.G, Natarajan V. Dynamin 2 and c-Abl arecaveolin-enriched microdomains of the endothelium. J. Biol. Chem. 2009 Dec 11; 284 (50):34964-75). Поэтому эти данные показывают, что новые ингибиторы c-ABL по настоящему изобретению имеют терапевтическую применимость для лечения заболеваний человека с легочным воспалением. Активация ABL1 инсулином, через модификацию FAK ответа, может играть важную роль в направлении митогенного против метаболического сигнала инсулинового рецептора (Genua M., Pandini G.,Cassarino M.F., Messina R.L., Frasca F. c-Abl and insulin receptor signalling. Vitam Horm. 2009; 80:77-105). Было показано, что ингибиторы c-Abl, такие как Gleevec, обеспечивают регрессию диабета 1 типа у не страдающих ожирением диабетических мышей (Louvet С., Szot G.L., Lang J., Lee M.R., Martinier N., Bollag G., Zhu S., Weiss A., Bluestone J.A. Tyrosine kinase inhibitors reverse type 1 diabetes in nonobese diabeticmice. Proc Natl Acad Sci USA. 2008 Dec 2; 105 (48):18895-900). Облегчение тяжести диабета при помощиactivation and anti-apoptotic preconditioning. FASEB J. 2007 Feb; 21 (2):618-28). Поэтому новые ингибиторы ABL1 по настоящему изобретению имеют терапевтическую применимость для лечения диабета у человека. Ингибитор ABL1 по настоящему изобретению можно использовать в комбинации с одним или несколькими из существующих лечений указанных выше заболеваний, например ингибитор ABL1 по на- 13024391 стоящему изобретению можно использовать в комбинации с Levodopa или другими L-DOPAсодержащими лекарственными средствами или допаминовым агонистом для лечения болезни Паркинсона, или в комбинации с ингибитором холинэстеразы, таким как Exelon капсула или чрескожный пластырь, для лечения болезни Альцгеймера. В хроническом миелогенном лейкозе (CML), реципрокная сбалансированная хромосомная транслокация в гематопоэтических стволовых клетках (HSC) образует BCR-ABL1 гибридный ген. Этот ген кодирует онкогенный BCR-ABL1 гибридный белок. Тогда как ABL1 кодирует жестко регулируемую тирозиновую протеинкиназу, которая играет фундаментальную роль в регуляции клеточной пролиферации,адгезии и апоптоза, BCR-ABL1 гибридный ген кодирует как конститутивно активированная киназа. Эта активированная киназа трансформирует HSC с образованием фенотипа, демонстрирующего нарушенную регуляцию клональной пролиферации, пониженную способность к адгезии к строме костного мозга и пониженный апоптический ответ на мутагенные стимулы, приводя к прогрессивно более злокачественным трансформациям. Полученные в результате гранулоциты не могут развиваться в зрелые лимфоциты и высвобождаются в кровоток, приводя к дефициту зрелых клеток и повышенной восприимчивости к инфекции. Было показано, что АТР-конкурентные ингибиторы BCR-ABL1 препятствуют киназной активации митогенного и антиапоптического путей (например, PI-3 киназа и STAT5), приводя к гибели клеток с BCR-ABL1 фенотипом и, таким образом, обеспечивая эффективную терапию против CML. KCL-22 клеточная линия (полученная от DSMZ, Ltibniz Institute, Germany) выделена из плевральной эффузии 32 летней женщины при помощи аппарата хромосомно-позитивного CML Philadelphia в бластном кризе в 1981 г. и описана для содержания t(9; 22), приводящего к гибридному гену BCR-ABL1 и мутации р 53.KCL-22 клеточная линия может быть использована в модели Xenograft для демонстрации in vivo эффективности соединений изобретения (см. Assay section, infra). Соединения по настоящему изобретению, в качестве ингибиторов BCR-ABL1, включая его мутанты, являются, таким образом, особенно подходящими для лечения заболеваний, связанных с его чрезмерной экспрессией, таких как ALL или CML лейкозы. Также было показано, что соединения по настоящему изобретению обладают противоопухолевой активностью in vitro: in vitro противоопухолевую активность испытывают, например, с использованием лейкозных клеточных линий, таких как Ba/F3-BCR-ABL1, KCL-22, K-562, MEG-01, KYO-1, LAMA-84,KU812, EM-2, CML-T1, BV-173 или ALL-SIL. Настоящее изобретение включает способ лечения рака, включающий введение субъекту, наждующемуся в таком лечении, эффективного количества соединения по настоящему изобретению или фармацевтической композиции. Следующий вариант воплощения включает введение субъекту дополнительного терапевтического средства. В следующем варианте воплощения дополнительное терапевтическое средство представляет собой другой ингибитор BCR-ABL1, выбранный из иматиниба, нилотиниба, дасатиниба, досутиниба, радотиниба, понатиниба и бафетиниба. В другом варианте воплощения представлен способ лечения состояния, опосредованного BCRABL1, включающий введение субъекту, нуждающемуся в этом, эффективного количества соединения по настоящему изобретению или фармацевтической композиции.BCR-ABL1 содержит одну или несколько мутаций. Примеры таких мутаций включают V299L,T315I, F317I, F317L, Y253F, Y253H, Е 255K, E255V, F359C и F359V (UJane F. Apperley. Part 1: Mechanismof resistance to imatinib in chronic myeloid leukaemia. Lancet Oncology 2007; 8:1018). В следующем варианте воплощения представлен способ лечения состояния, опосредованного BCRABL1, где BCR-ABL1 содержит одну или несколько мутаций, выбранных из V299L, T315I, F317I, F317L,Y253F, Y253H, Е 255K, E255V, F359C и F359V. В некоторых вариантах воплощения настоящее изобретение относится к указанному выше способу,где указанное соединение вводят парентерально. В некоторых вариантах воплощения настоящее изобретение относится к указанному выше способу,где указанное соединение вводят внутримышечно, внутривенно, подкожно, перорально, внутрилегочно,интратекально, местно или интраназально. В некоторых вариантах воплощения настоящее изобретение относится к указанному выше способу,где указанное соединение вводят системно. В некоторых вариантах воплощения настоящее изобретение относится к указанному выше способу,где указанный пациент представляет собой млекопитающее. В некоторых вариантах воплощения настоящее изобретение относится к указанному выше способу,где указанный пациент представляет собой примата. В некоторых вариантах воплощения настоящее изобретение относится к указанному выше способу,где указанный пациент представляет собой человека. В другом аспекте настоящее изобретение относится к способу лечения ABL1/BCR-ABL1 опосредованного расстройства, включающему следующую стадию: введение пациенту, нуждающемуся в этом, терапевтически эффективного количества химиотерапевтического средства в комбинации с тера- 14024391 певтически эффективным количеством соединения формулы (I). В другом аспекте представлено соединение формулы (I) или любые конкретные варианты его воплощения, описанные выше, для использования при лечении рака. В еще одном аспекте рак представляет собой лейкоз, выбранный из хронического миелолейкоза(CML) и острого лимфобластного лейкоза (ALL). В другом аспекте представлено соединение формулы (I) или любые конкретные варианты его воплощения для использования при лечении рака в комбинации с дополнительным соединением, выбранным из иматиниба, нилотиниба, дазатиниба, босутиниба, понатиниба и бафетиниба. В еще одном аспекте соединение формулы (I) представляет собой (R)-N-(4-(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1 Н-пиразол-5-ил)никотинамид. В еще одном аспекте соединение формулы (I) представляет собой фармацевтически приемлемую соль (R)-N-(4-(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1 Н-пиразол-5-ил)никотинамида. В еще одном аспекте дополнительное соединение вводят последовательно. В еще одном аспекте дополнительное соединение вводят одновременно. В еще одном аспекте дополнительное соединение представляет собой нилотиниб. В еще одном аспекте дополнительное соединение представляет собой иматиниб. В еще одном аспекте дополнительное соединение представляет собой дазатиниб. В еще одном аспекте дополнительное соединение представляет собой босутиниб. В еще одном аспекте дополнительное соединение представляет собой понатиниб. В еще одном аспекте дополнительное соединение представляет собой бафетиниб. В другом аспекте настоящее изобретение относится к способу лечения ABL1/BCR-ABL1 опосредованного расстройства, включающему следующую стадию: введение пациенту, нуждающемуся в этом, терапевтически эффективного количества химиотерапевтического средства в комбинации с терапевтически эффективным количеством соединения формулы (I). Фармацевтические композиции. В другом аспекте настоящее изобретение обеспечивает фармацевтически приемлемые композиции,которые включают терапевтически эффективное количество одного или нескольких соединений, описанных выше, сформулированных вместе с одним или несколькими фармацевтически приемлемыми носителями (добавками) и/или разбавителями. Как описано подробно ниже, фармацевтические композиции по настоящему изобретению могут быть специально сформулированы для введения в твердой или жидкой форме, включая композиции, предназначенные для следующего: (1) перорального введения, например смачивающие препараты (водные или неводные растворы или суспензии), таблетки, например,предназначенные для буккального, сублингвального введения и системной абсорбции, болюсы, порошки, гранулы, пасты для нанесения на язык; (2) парентерального введения, например, при помощи подкожной, внутримышечной, внутривенной или эпидуральной инъекции, например, в виде стерильного раствора или суспензии или композиции замедленного высвобождения; (3) местного нанесения, например, в виде крема, мази или пластыря с контролируемым высвобождением или спрея, наносимого на кожу; (4) интравагинального или интраректального введения, например, в виде пессария, крема или пены;(9) внутрилегочного введения или (10) интратекального введения. Фраза "терапевтически эффективное количество", как это используется в настоящей заявке, означает такое количество соединения, вещества или композиции, включающей соединение по настоящему изобретению, которое является эффективным для получения некоторого желаемого терапевтического эффекта в, по меньшей мере, субпопуляции клеток у животного при разумном соотношении польза/риск в применении к любому медицинскому лечению. Фраза "фармацевтически приемлемый", как это используется в настоящей заявке, относится к тем соединениям, веществам, композициям и/или лекарственным формам, которые, согласно взвешенной медицинской оценке, являются подходящими для использования в контакте с тканями человека и животных, без чрезмерной токсичности, раздражения, аллергических реакций или других проблем или осложнений, соответствуя разумному соотношению польза/риск. Фраза "фармацевтически приемлемый носитель", как это используется в настоящей заявке, означает фармацевтически приемлемое вещество, композицию или носитель, такой как жидкий или твердый наполнитель, разбавитель, эксципиент, технологическая добавка (например, смазывающее вещество, тальк,стеарат магния, кальция или цинка или стеариновая кислота) или растворяемое инкапсулирующее вещество, участвующее в переносе или транспортировании соединения по настоящему изобретению из одного органа или части тела к другому органу или части тела. Каждый носитель должен быть "приемлемым", в том смысле, что он должен быть совместимым с другими ингредиентами композиции и не быть вредным для пациента. Некоторые примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы,такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) тальк; (8) эксципиенты, такие как масло какао и воски для суппозиториев; (9) масло, такое как арахисовое масло, масло семян хлопчатника, сафлоровое масло, кунжутное масло,оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные вещества, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) рН буферные растворы; (21) сложные полиэфиры, поликарбонаты и/или полиангидриды и (22) другие нетоксичные совместимые вещества, используемые в фармацевтических композициях. Как описано выше, некоторые варианты воплощения соединений по настоящему изобретению могут содержать щелочную функциональную группу, такую как амино или алкиламино, и, таким образом,могут образовывать фармацевтически приемлемые соли с фармацевтически приемлемыми кислотами. Термин "фармацевтически приемлемые соли", в этом отношении, относится к относительно нетоксичным неорганическим и органическим кислотно-аддитивным солям соединений по настоящему изобретению. Эти соли можно получить in situ в процессе получения носителя для введения или лекарственной формы, или путем отдельного взаимодействия очищенного соединения по настоящему изобретению в форме свободного основания с подходящей органической или неорганической кислотой и выделения образованной таким образом соли в процессе последующей очистки. Репрезентативные соли включают гидробромид, гидрохлорид, сульфат, бисульфат, фосфат, нитрат, ацетат, валерат, олеат, пальмитат, стеарат, лаурат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, наптилат, мезилат, глюкогептаноат, лактобионат и лаурилсульфонат и подобные (см., например, Berge et al. (1977)"Pharmaceutical Salts", J. Pharm. Sci. 66:1-19). Фармацевтически приемлемые соли соединений по настоящему изобретению включают традиционные нетоксичные соли или четвертичные аммониевые соли соединений, например, образованные из нетоксичных органических или неорганических кислот. Например, такие традиционные нетоксичные соли включают соли, образованные из неорганических кислот, таких как хлористо-водородная, бромисто-водородная, серная, сульфаминовая, фосфорная, азотная и подобные; и соли, образованные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, пальмитиновая, малеиновая, гидроксималеиновая, фенилуксусная,глутаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изотионовая и подобные. В других случаях соединения по настоящему изобретению могут содержать одну или несколько кислотных функциональных групп и, таким образом, могут образовывать фармацевтически приемлемые соли с фармацевтически приемлемыми основаниями. Термин "фармацевтически приемлемые соли" в этих случаях относится к относительно нетоксичным неорганическим и органическим основноаддитивным солям соединений по настоящему изобретению. Эти соли также можно получить in situ в процессе получения носителя для введения или лекарственной формы или путем отдельного взаимодействия очищенного соединения по настоящему изобретению в форме свободной кислоты с подходящим основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого металлического катиона, с аммиаком или с фармацевтически приемлемым органическим первичным, вторичным или третичным амином. Репрезентативные соли щелочных или щелочно-земельных металлов включают соли лития, натрия, калия, кальция, магния и алюминия и подобные. Репрезентативные органические амины, полезные для образования основно-аддитивных солей, включают этиламин, диэтиламин, этилендиамин, этаноламин, диэтаноламин, пиперазин и подобные (см., например, Berge et al., supra). Смачивающие вещества, эмульгаторы и смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красители, агенты высвобождения, вещества покрытий, подсластители, отдушки и ароматизаторы, консерванты и антиоксиданты также могут присутствовать в композициях. Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, цистеин гидрохлорид, бисульфат натрия, метабисульфит натрия, сульфит натрия и подобные; (2) маслорастворимые антиоксиданты, такие как аскорбилпальмитат,бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), лецитин, пропилгаллат, альфа-токоферол и подобные; и (3) металло-хелатные вещества, такие как лимонная кислота, этилендиаминтетрауксусная кислота (EDTA), сорбит, винная кислота, фосфорная кислота и подобные. Фармацевтические композиции по настоящему изобретению включают композиции, подходящие для перорального, назального введения, местного (включая буккальное и сублингвальное), ректального,вагинального и/или парентерального введения. Композиции удобным образом могут быть представлены в стандартной лекарственной форме и могут быть получены любыми способами, хорошо известными в фармацевтике. Количество активного ингредиента, которое может быть объединено с веществомносителем для получения одной лекарственной дозы, варьируется в зависимости от хозяина, который принимает лечение, конкретного способа введения. Количество активного ингредиента, которое может быть объединено с веществом-носителем для получения одной лекарственной дозы, как правило, составляет такое количество соединения, которое обеспечивает терапевтический эффект. Как правило, исходя из 100%, это количество будет находиться в пределах от около 0,1 до около 99% активного ингредиента,предпочтительно от около 5 до около 70%, наиболее предпочтительно от около 10 до около 30%. В некоторых вариантах воплощения композиция по настоящему изобретению включает эксципиент, выбранный из группы, включающей циклодекстрины, целлюлозы, липосомы, мицеллообразующие вещества, например желчные кислоты, и полимерные носители, например сложные полиэфиры и полиангидриды; и соединение по настоящему изобретению. В некоторых вариантах воплощения указанная выше композиция делает соединение по настоящему изобретению перорально биодоступным. Способы получения этих составов или композиций включают стадию приведения соединения по настоящему изобретению в ассоциацию с носителем и, необязательно, одним или несколькими вспомогательными ингредиентами. Как правило, композиции получают путем однородного и гомогенного смешивания для приведения в ассоциацию соединения по настоящему изобретению с жидкими носителями или тонкоизмельченными твердыми носителями, или и теми и другими, и затем, если это необходимо,формования продукта. Фармацевтические композиции по настоящему изобретению, подходящие для перорального введения, могут быть в форме капсул, саше, пилюль, таблеток, лепешек (с использованием содержащей отдушки основы, обычно такой как сахароза и аравийская камедь или трагакант), порошков, гранул или в виде раствора, суспензии или твердой дисперсии в водной или неводной жидкости, или в виде жидкой эмульсии масло-в-воде или вода-в-масле, или в виде эликсира или сиропа, или в виде пастилок (с использованием инертной основы, такой как желатин и глицерин или сахароза и аравийская камедь), и/или в виде полосканий для рта и т.п., при этом каждая такая форма содержит предварительно определенное количество соединения по настоящему изобретению в качестве активного ингредиента. Соединение по настоящему изобретению также можно вводить в виде болюса, электуария или пасты. Фармацевтическая композиция в виде твердой дисперсии по настоящему изобретению включает,например, аморфную дисперсию соединения по настоящему изобретению, эксципиент (сополимеры, такие как поливинилпирролидинон (PVP) VA64 (Kollidon VA64 или Copovidone) и подобные). Твердая дисперсия может быть дополнительно усилена при помощи гидроксилпропилметилцеллюлоз (НРМС) с низкой вязкостью (таких как Pharmacoat 603, Methocel Е 3 или подобные); см. пример 41 ниже для получения более детальной информации для получения фармацевтической композиции в виде твердой дисперсии по настоящему изобретению. В одном варианте воплощения настоящего изобретения представлена фармацевтическая композиция, включающая аморфную дисперсию (R)-N-(4-(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1 Н-пиразол-5-ил)никотинамида (пример 9) и от 1 до 2 эксципиентов; где эксципиент выбирают из НРМС AS, Pharmacoat 603, Eudragit L100, PVP K30, PVP VA64 и Eudragit EPO. В следующем варианте воплощения эксципиенты представляют собой PVP VA64 и Pharmacoat 603. В следующем варианте воплощения процентное содержание Pharmacoat 603 находится в диапазоне от 30 до 45%, процентное содержание PVP VA64 находится в диапазоне от 30 до 45%, и процентное содержание(R)-N-(4-(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1 Н-пиразол-5 ил)никотинамида (пример 9) находится в диапазоне от 20 до 30%. В следующем варианте воплощения процентное содержание Pharmacoat 603 составляет 37,5%, процентное содержание PVP VA64 составляет 37,5%, и процентное содержание (R)-N-(4(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1 Н-пиразол-5-ил)никотинамида (пример 9) составляет 25%. В твердых лекарственных формах по настоящему изобретению для перорального введения (капсулы, таблетки, пилюли, драже, порошки, гранулы, лепешки и подобное) активный ингредиент смешан с одним или несколькими фармацевтически приемлемыми носителями, такими как цитрат натрия или дикальций фосфат, и/или любым из следующих: (1) наполнители или создающие объем вещества, такие как крахмалы, лактоза, сахароза, глюкоза, маннит и/или кремневая кислота; (2) связующие, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или аравийская камедь; (3) увлажнители, такие как глицерин; (4) разрыхлители, такие как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия; (5) замедляющие растворение вещества, такие как парафин; (6) ускорители абсорбциии, такие как четвертичные аммониевые соединения, и поверхностно-активные вещества, такие как полоксамер и лаурилсульфат натрия; (7) смачивающие вещества, такие как, например, цетиловый спирт, глицеринмоностеарат и неионные поверхностно-активные вещества; (8) абсорбенты, такие как каолин и бентонитовая глина; (9) смазывающие вещества, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, стеарат цинка, стеарат натрия, стеариновая кислота и их смеси; (10) красители; и (11) контролирующие высвобождение вещества, такие как кросповидон или этилцеллюлоза. В случае капсул, таблеток и пилюль, фармацевтические композиции также могут включать буферные вещества. Твердые композиции подобного типа также можно использовать в качестве наполнителей в мягких и твердых желатиновых капсулах с использованием таких эксципиентов, как лактоза или молочные сахара, а также высокомолекулярных полиэтиленгликолей и подобных. Таблетку можно получить путем прессования или формования, необязательно с использованием одного или нескольких вспомогательных ингредиентов. Прессованные таблетки можно получить с использованием связующего (например, желатин или гидроксипропилметилцеллюлоза), смазывающего вещества, инертного разбавителя, консерванта, разрыхлителя (например, натрий крахмалгликолят или сшитая натрий карбоксиметилцеллюлоза), поверхностно-активного или диспергирующего вещества. Формованные таблетки можно получить путем формования в подходящей машине смеси порошкообразного соединения, смоченного инертным жидким разбавителем. Таблетки и другие твердые лекарственные формы фармацевтических композиций по настоящему изобретению, такие как драже, капсулы, пилюли и гранулы, необязательно могут иметь насечку или могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области фармацевтического формулирования. Они также могут быть сформулированы таким образом, чтобы обеспечивать медленное или контролируемое высвобождение активного ингредиента, содержащегося в них, с использованием, например, гидроксипропилметилцеллюлозы в разных пропорциях для обеспечения желаемого профиля высвобождения, других полимерных матриц,липосом и/или микросфер. Они могут быть сформулированы для быстрого высвобождения, например, с использованием сушки замораживанием. Они могут быть стерилизованы, например, путем фильтрования через удерживающий бактерии фильтр или путем включения стерилизующих средств в форме стерильных твердых композиций, которые можно растворить в стерильной воде или какой-либо другой стерильной среде для инъекций непосредственно перед использованием. Эти композиции также могут, но необязательно, содержать вещества, делающие композицию непрозрачной, и могут иметь такую композицию,которая обеспечивает высвобождение активного ингредиента (ингредиентов) только или преимущественно в определенной части желудочно-кишечного тракта, необязательно замедленным образом. Примеры композиций, предназначенных для включения в них лекарственного средства, которые можно использовать, включают полимерные вещества и воски. Активный ингредиент также может быть в микроинкапсулированной форме, если это является подходящим, с одним или несколькими описанными выше эксципиентами. Жидкие лекарственные формы для перорального введения соединений по настоящему изобретению включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активного ингредиента жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие вещества и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3 бутиленгликоль, масла (в частности, масло семян хлопчатника, масло земляного ореха, кукурузное масло, масло из проростков семян, оливковое, касторовое и кунжутное масло), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана и их смеси. Помимо инертных разбавителей пероральные композиции также могут включать адъюванты, такие как смачивающие вещества, эмульгаторы и суспендирующие вещества, подсластители, отдушки, красители, ароматизаторы и консерванты. Суспензии, помимо активных соединений, могут содержать суспендирующие вещества, например этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагакант и их смеси. Фармацевтические композиции по настоящему изобретению для ректального или вагинального введения могут быть представлены в виде суппозитория, который можно получить путем смешивания одного или нескольких соединений по настоящему изобретению с одним или несколькими подходящими нераздражающими эксципиентами или носителями, включая, например, масло какао, полиэтиленгликоль, воск для суппозиториев или салицилат, и который является твердым при комнатной температуре,но жидким при температуре тела и поэтому будет плавиться в прямой кишке или вагинальной полости и высвобождать активное соединение. Фармацевтические композиции по настоящему изобретению, которые являются подходящими для вагинального введения, также включают пессарии, тампоны, кремы, гели, пасты, пены или композиции спреев, содержащие такие носители, которые известны из уровня техники как подходящие. Лекарственные формы для местного или чрескожного введения соединения по настоящему изобретению включают порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и препараты для ингаляций. Активное соединение может быть смешано в стерильных условиях с фармацевтически приемлемым носителем и с любыми консервантами, буферами или пропеллентами, которые могут потребоваться. Мази, пасты, кремы и гели могут содержать, помимо активного соединения по настоящему изобретению, эксципиенты, такие как животные и растительные жиры, масла, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремневая кислота, тальк и оксид цинка или их смеси. Порошки и спреи могут содержать, помимо соединения по настоящему изобретению, эксципиенты,такие как лактоза, тальк, кремневая кислота, гидроксид алюминия, силикаты кальция и полиамидный порошок или смеси таких веществ. Спреи дополнительно могут содержать традиционные пропелленты,- 18024391 такие как хлорфторуглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан. Чрескожные пластыри имеют дополнительное преимущество, обеспечивая контролируемую доставку соединения по настоящему изобретению в организм. Такие лекарственные формы можно получить путем растворения или диспергирования соединения в подходящей среде. Усилители абсорбции также можно использовать для увеличения потока соединения через кожу. Скорость такого потока можно контролировать либо путем обеспечения контролирующей скорость мембраны, либо путем диспергирования соединения в полимерной матрице или геле. Офтальмические композиции, глазные мази, порошки, растворы и т.п. также предусматриваются как охватываемые объемом настоящего изобретения. Фармацевтические композиции по настоящему изобретению, подходящие для парентерального введения, включают одно или несколько соединений по настоящему изобретению в объединении с одним или несколькими фармацевтически приемлемыми стерильными изотоническими водными или неводными растворами, дисперсиями, суспензиями или эмульсиями или стерильными порошками, которые могут быть реструктурированы с получением стерильных растворов или дисперсий для инъекций непосредственно перед использованием, которые могут содержать сахара, спирты, антиоксиданты, буферы,бактериостатические вещества, растворенные вещества, которые делают композицию изотонической с кровью предполагаемого реципиента, или суспендирующие вещества или загустители. Примеры подходящих водных и неводных носителей, которые можно использовать в фармацевтических композициях по настоящему изобретению, включают воду, этанол, полиолы (такие как глицерин,пропиленгликоль, полиэтиленгликоль и подобные) и подходящие смеси таких веществ, растительные масла, такие как оливковое масло, и органические сложные эфиры для инъекций, такие как этилолеат. Подходящую текучесть можно поддерживать, например, с использованием веществ для покрытия, таких как лецитин, путем поддержания требуемого размера частиц в случае дисперсий и путем использования поверхностно-активных веществ. Эти композиции также могут содержать адъюванты, такие как консерванты, смачивающие вещества, эмульгаторы и диспергирующие вещества. Предотвращение действия микроорганизмов на соединения по настоящему изобретению можно обеспечить путем включения различных антибактериальных и противогрибковых средств, например парабена, хлорбутанола, фенолсорбиновой кислоты и подобных. Также может быть желательным включение в композиции изотонических веществ, таких как сахара,хлорид натрия и подобные. Кроме того, пролонгированную абсорбцию фармацевтической формы для инъекций можно получить путем включения веществ, которые замедляют абсорбцию, таких как моностеарат алюминия и желатин. В некоторых случаях для пролонгирования действия лекарственного средства желательно замедлить абсорбцию лекарственного средства из подкожной или внутримышечной инъекции. Это можно осуществить с использованием жидкой суспензии кристаллического или аморфного вещества, имеющего плохую водорастворимость. Скорость абсорбции лекарственного средства в этом случае зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, замедленную абсорбцию парентерально вводимой лекарственной формы получают путем растворения или суспендирования лекарственного средства в масляном носителе. Депо формы для инъекций получают путем формирования матрицы для микроинкапсулирования соединений по настоящему изобретению в биоразлагаемых полимерах, таких как полилактидполигликолид. В зависимости от отношения лекарственного средства к полимеру и природы конкретного используемого полимера скорость высвобождения лекарственного средства можно контролировать. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Депо формы для инъекций также получают путем заключения лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканью организма. Когда соединения по настоящему изобретению вводят в виде фармацевтических средств человеку и животным, их можно вводить per se или в виде фармацевтической композиции, содержащей, например,от 0,1 до 99% (более предпочтительно от 10 до 30%) активного ингредиента в комбинации с фармацевтически приемлемым носителем. Препараты по настоящему изобретению можно вводить перорально, парентерально, местно или ректально. Их, безусловно, вводят в формах, подходящих для каждого пути введения. Например, их вводят в форме таблеток или капсул, путем инъекции, ингаляции, в виде глазного лосьона, мази, суппозитория и т.п., введение осуществляют путем инъекции, инфузии или ингаляции; местным путем с использованием лосьона или мази; и ректальным путем с использованием суппозиториев. Пероральные введения являются предпочтительными. Фразы "парентеральное введение" и "вводимый парентерально", как это используется в настоящей заявке, означают способы введения, отличные от энтерального и местного введения, обычно путем инъекции, и включают, без ограничения, внутривенную, внутримышечную, интраартериальную, интратекальную, интракапсулярную, интраорбитальную, интракардиальную, внутрикожную, интраперитонеальную, транстрахеальную, подкожную, субкутикулярную, интраартикулярную, субкапсулярную, субарахноидальную, интраспинальную и интрастернальную инъекцию и инфузию. Фразы "системное введение", "вводимый системно", "периферийное введение" и "вводимый периферийно", как это используется в настоящей заявке, означают введение соединения, лекарственного средства или другого вещества, отличное от введения непосредственно в центральную нервную систему,так, чтобы оно поступало в систему пациента и таким образом подвергалось метаболизму и другим подобным процессам, например подкожное введение. Эти соединения можно вводить человеку и другим животным для лечения любым подходящим путем введения, в том числе перорально, назально, например в виде спрея, ректально, интравагинально,парентерально, интрацистернально и местно, например в форме порошков, мазей или капель, включая буккальное и сублингвальное введение. Независимо от выбранного пути введения, соединения по настоящему изобретению, которые можно использовать в подходящей гидратированной форме, и/или фармацевтические композиции по настоящему изобретению формулируют в фармацевтически приемлемые лекарственные формы традиционными способами, известными специалистам в данной области. Фактические уровни доз активных ингредиентов в фармацевтических композициях по настоящему изобретению могут варьироваться таким образом, чтобы обеспечивать количество активного ингредиента, которое является эффективным для достижения желаемого терапевтического ответа для конкретного пациента, композиции и пути введения, не являясь при этом токсичными для пациента. Выбранный уровень доз будет зависеть от различных факторов, включая активность конкретного используемого соединения по настоящему изобретению или его сложного эфира, соли или амида, путь введения, время введения, скорость экскреции или метаболизма конкретного используемого соединения,скорость и степень абсорбции, продолжительность лечения, другие лекарственные средства, соединения и/или вещества, используемые в комбинации с конкретным используемым соединением, возраст, пол,массу тела, состояние, общее состояние здоровья и предыдущую медицинскую историю пациента, которого лечат, и подобные факторы, хорошо известные в медицине. Лечащий врач или ветеринар со средней квалификацией легко сможет определить и прописать эффективное количество фармацевтической композиции, которая требуется. Например, лечащий врач или ветеринар может начать с доз соединений по настоящему изобретению, используемых в фармацевтической композиции, на уровнях ниже тех, которые необходимы для достижения желаемого терапевтического эффекта, и постепенно увеличивать дозу вплоть до достижения желаемого эффекта. Как правило, подходящая суточная доза соединения по настоящему изобретению будет представлять собой такое количество соединения, которое представляет собой самую низкую дозу, эффективную для обеспечения терапевтического эффекта. Такая эффективная доза, как правило, зависит от факторов,описанных выше. Как правило, пероральные, внутривенные, интрацеребровентрикулярные и подкожные дозы соединений по настоящему изобретению для пациента, когда их используют для показанных анальгетических эффектов, находятся в пределах от около 0,0001 до около 100 мг на 1 кг массы тела в день. Если желательно, эффективную суточную дозу активного соединения можно вводить в виде двух,трех, четырех, пяти, шести или более дробных доз, вводимых раздельно с подходящими интервалами времени в течение дня, необязательно, в стандартных лекарственных формах. РК параметры in vivo могут быть использованы для оценки PK параметров человека. С применением различных способов, известных в данной области для прогнозирования PK человека, можно оценить прогнозируемый клиренс человека. Например,(R)-N-(4-(хлордифторметокси)фенил)-6-(3 гидроксипирролидин-1-ил)-5-(1 Н-пиразол-5-ил)никотинамид (пример 9) по оценкам составляет 3 мл/мин/кг, и объем распределения оценивается как 1 л/кг. Прогнозируемая эффективная суточная доза для человека для соединения примера 9, поэтому, была определена как находящаяся в пределах от 90 до 130 мг/день. Хотя соединение по настоящему изобретению можно вводить отдельно, предпочтительным является введение соединения в виде фармацевтического препарата (композиции). Соединения в соответствии с настоящим изобретением могут быть сформулированы для введения любым удобным путем для применения в лечении человека или в ветеринарии, аналогично другим фармацевтическим средствам. В другом аспекте настоящее изобретение обеспечивает фармацевтически приемлемые композиции,которые включают терапевтически эффективное количество одного или нескольких соединений по настоящему изобретению, описанных выше, сформулированных вместе с одним или несколькими фармацевтически приемлемыми носителями (добавками) и/или разбавителями. Как подробно описано ниже,фармацевтические композиции по настоящему изобретению могут быть специально сформулированы для введения в твердой или жидкой форме, включая предназначенные для следующего: (1) перорального введения, например смачивающие препараты (водные или неводные растворы или суспензии), таблетки,болюсы, порошки, гранулы, пасты для нанесения на язык; (2) парентерального введения, например, при помощи подкожной, внутримышечной или внутривенной инъекции, например, в виде стерильного раствора или суспензии; (3) местного нанесения, например, в виде крема, мази или спрея для нанесения на кожу, легкие или слизистые оболочки; (4) интравагинального или интраректального введения, например,в виде пессария, крема или пены; (5) сублингвального или буккального введения; (6) глазного введения;(7) чрескожного введения; (8) назального введения. Термин "лечение" предназначен для охвата также профилактики, терапии и лечения. Пациент, принимающий такое лечение, представляет собой любое животное, нуждающееся в этом,включая приматов, в частности человека, и других млекопитающих, таких как лошади, крапный рогатый скот, свиньи и овцы; а также домашнюю птицу и домашних животных в целом. Технология микроэмульгирования может улучшить биодоступность некоторых липофильных (не растворимых в воде) фармацевтических средств. Примеры включают Триметрин (Dordunoo, S.K., et al.,Drug Development and Industrial Pharmacy, 17(12), 1685-1713, 1991) и REV 5901 (Sheen, P.C., et al., J.Pharm. Sci 80(7), 712-714, 1991). Помимо прочего, микроэмульгирование обеспечивает повышенную биодоступность путем преимущественного направления абсорбции на лимфатическую систему вместо системы кровотока, которая, таким образом, обходит печень и предотвращает разложение соединений в гепатобилиарном кровообращении. Хотя предусматриваются все подходящие амфифильные носители, в настоящем изобретении предпочтительными носителями в основном являются такие, которые имеют официальную маркировку "Признан безвредным" (Generally-Recognized-as-Safe (GRAS и которые могут как растворять соединение по настоящему изобретению, так и микроэмульгировать его на более поздней стадии, когда раствор приходит в контакт с комплексной водной фазой (такой как в желудочно-кишечном тракте человека). Обычно амфифильные ингредиенты, которые удовлетворяют этим требованиям, имеют HLB (гидрофильнолипофильный баланс) значения 2-20, и их структуры содержат алифатические радикалы с линейной цепью в пределах от С-6 до С-20. Примерами являются полиэтилен-гликолизированные глицериды жирных кислот и полиэтиленгликоли. Особенно предусматриваются коммерчески доступные амфифильные носители, включая ряд Гелуцировых носителей, Лабрафил, Лабразол или Лаурогликоль (изготовитель и поставщик всех вышеперечисленных Gattefosse Corporation, Saint Priest, France), PEG-моно-олеат, PEG-ди-олеат, PEG-моно-лаурат и ди-лаурат, Лецитин, Полисорбат 80 и т.п. (производятся и поставляются рядом компаний в США и по всему миру). Гидрофильные полимеры, подходящие для использования в настоящем изобретении, представляют собой такие, которые являются легко водорастворимыми, могут быть ковалентно связаны с везикулообразующим липидом и которые являются переносимыми in vivo без токсических эффектов (т.е. являются биосовместимыми). Подходящие полимеры включают полиэтиленгликоль (PEG), полимолочную кислоту (также называемую полилактидом), полигликолевую кислоту (также называемую полигликолидом),сополимер полимолочной-полигликолевой кислоты и поливиниловый спирт. Предпочтительные полимеры представляют собой такие, которые имеют молекулярную массу от около 100 или 120 Да до около 5000 или 10000 Да и более предпочтительно от около 300 до около 5000 Да. В особенно предпочтительном варианте воплощения полимер представляет собой полиэтиленгликоль, имеющий молекулярную массу от около 100 до около 5000 Да и более предпочтительно имеющий молекулярную массу от около 300 до около 5000 Да. В особенно предпочтительном варианте воплощения полимер представляет собой полиэтиленгликоль с молекулярной массой 750 Да (PEG(750. Полимеры также могут определяться по количеству мономеров в них; в предпочтительном варианте воплощения настоящего изобретения используют полимеры, состоящие по меньшей мере из около трех мономеров, такие PEG полимеры, состоящие из трех мономеров (приблизительно 150 Да). Другие гидрофильные полимеры, которые могут быть подходящими для использования в настоящем изобретении, включают поливинилпирролидон, полиметоксазолин, полиэтилоксазолин, полигидроксипропил метакриламид, полиметакриламид, полидиметилакриламид и производные целлюлозы, такие как гидроксиметилцеллюлоза или гидроксиэтилцеллюлоза. В некоторых вариантах воплощения композиция по настоящему изобретению включает биосовместимый полимер, выбранный из группы, включающей полиамиды, поликарбонаты, полиалкилены, полимеры сложных эфиров акриловой и метакриловой кислот, поливиниловые полимеры, полигликолиды,полисилоксаны, полиуретаны и их сополимеры, целлюлозы, полипропилен, полиэтилены, полистирол,полимеры молочной кислоты и гликолевой кислоты, полиангидриды, поли(орто)эфиры, поли(масляную кислоту), поли(валериановую кислоту), поли(лактид-со-капролактон), полисахариды, белки, полигиалуроновые кислоты, полицианоакрилаты и их композиции, смеси или сополимеры. Циклодекстрины представляют собой циклические олигосахариды, состоящие из 6, 7 или 8 глюкозных звеньев, которые обозначаются греческими буквами альфа, бета или гамма соответственно. Неизвестно о существовании циклодекстринов, содержащих меньше шести глюкозных звеньев. Глюкозные звенья связаны альфа-1,4-глюкозидными связями. Как следствие конформации кресла сахарных звеньев,все вторичные гидроксильные группы (по С-2, С-3) расположены на одной стороне кольца, тогда как все первичные гидроксильные группы по С-6 расположены на другой стороне. Как результат, внешние стороны являются гидрофильными, делая циклодекстрины водорастворимыми. В отличие от этого, полости циклодекстринов являются гидрофобными, поскольку они выстланы водородом атомов С-3 и С-5 и эфир-подобными кислородами. Эти матрицы делают возможным комплексообразование с различными относительно гидрофобными соединениями, включая, например, стероидные соединения, такие как 17- 21024391 бета-эстрадиол (см., например, van Uden et al. Plant Cell Tiss. Org. Cult. 38:1-3-113 (1994. Комплексообразование происходит посредством ван-дер-ваальсовых взаимодействий и путем образования водородных связей. Общий обзор химии циклодекстринов см. в Wenz, Agnew. Chem. Int. Ed. Engl., 33:803-822(1994). Физико-химические свойства циклодекстриновых производных сильно зависят от типа и степени замещения. Например, их растворимость в воде находится в диапазоне от нерастворимых (например,триацетил-бета-циклодекстрин) до растворимости 147% (мас./об.) (G-2-бета-циклодекстрин). Кроме того,они растворимы во многих органических растворителях. Свойства циклодекстринов позволяют контролировать растворимость различных компонентов композиции путем увеличения или уменьшения их растворимости. Были описаны различные циклодекстрины и способы их получения. Например, Parmeter (I), et al.(патент США 3453259) и Gramera, et al. (патент США 3459731) описывают электронейтральные циклодекстрины. Другие производные включают циклодекстрины с катионнными свойствами [Parmeter(II), патент США 3453257], нерастворимые сшитые циклодекстрины (Solms, патент США 3420788) и циклодекстрины с анионными свойствами [Parmeter (III), патент США 3426011]. Из циклодекстриновых производных с анионными свойствами можно указать такие, где карбоновые кислоты, фосфористые кислоты, фосфиновые кислоты, фосфоновые кислоты, фосфорные кислоты, тиофосфоновые кислоты, тиосульфиновые кислоты и сульфоновые кислоты присоединены к родительскому циклодекстрину[см. Parmeter (III), supra]. Кроме того, сульфоалкилэфирные производные циклодекстринов описаны Stella, et al. (патент США 5134127). Липосомы состоят по меньшей мере из одной липидной бислойной оболочки, заключающей в себе водный внутренний компартмент. Липосомы могут быть охарактеризованы по типу и по размеру оболочки. Небольшие однослойные везикулы (SUV) имеют одну оболочку и типичный диаметр в пределах от 0,02 до 0,05 мкм; крупные однослойные везикулы (LUVS) типично больше, чем 0,05 мкм. Олиголамеллярные крупные везикулы и мультиламеллярные везикулы имеют несколько, обычно концентрических, слоев оболочки, и они типично больше чем 0,1 мкм. Липосомы с несколькими неконцентрическими оболочками, т.е. несколькими более мелкими везикулами, содержащимися в более крупной везикуле,называют мультивезикулярными везикулами. Один аспект настоящего изобретения относится к композициям, включающим липосомы, содержащие соединение по настоящему изобретению, где оболочка липосомы сформулирована для обеспечения липосомы с повышенной несущей способностью. Альтернативно или в дополнение к этому, соединение по настоящему изобретению может содержаться в, или быть адсорбированным на липосомном бислое липосомы. Соединение по настоящему изобретению может быть агрегировано с липидным поверхностно-активным веществом и может транспортироваться, находясь во внутреннем пространстве липосомы; в этих случаях липосомная оболочка сформулирована так, чтобы быть стойкой к разрушительным эффектам агрегата активное средство-поверхностно-активное вещество. В соответствии с одним вариантом воплощения настоящего изобретения липидный бислой липосомы содержит липиды, дериватизованные полиэтиленгликолем (PEG) так, чтобы PEG цепи простирались от внутренней поверхности липидного бислоя во внутреннее пространство, инкапсулированное липосомой, и простирались от внешней поверхности липидного бислоя в окружующую среду. Активные вещества, содержащиеся в липосомах по настоящему изобретению, находятся в солюбилизированной форме. Агрегаты, состоящие из поверхностно-активного вещества и активного вещества(такие как эмульсии или мицеллы, содержащие представляющее интерес активное вещество), могут быть заключены во внутреннем пространстве липосом в соответствии с настоящим изобретением. Поверхностно-активное вещество действует как агент, диспергирующий и солюбилизирующий активное вещество, и может быть выбрано из любого подходящего алифатического, циклоалифатического или ароматического поверхностно-активного вещества, включая, но не ограничиваясь этим, биосовместимые лизофосфатидилхолины (LPC) с разной длиной цепей (например, от около C14 до около С 20). Полимердериватизированные липиды, такие как PEG-липиды, также можно использовать для мицеллообразования, поскольку их действие направлено на ингибирование слияния мицелла/оболочка, и поскольку присоединение полимера к молекулам поверхностно-активного вещества снижает CMC поверхностноактивного вещества и способствует мицеллообразованию. Предпочтительными являются поверхностноактивные вещества с CMC в микромолярном диапазоне; поверхностно-активные вещества с более высоким CMC можно использовать для получения мицелл, заключенных в липосомы по настоящему изобретению, однако мицеллярные поверхностно-активные мономеры могут влиять на стабильность липосомного бислоя и могут быть движущей силой в разработке липосом желаемой стабильности. Липосомы в соответствии с настоящим изобретением можно получить любым из различных способов, которые известны из уровня техники; см., например, патент США 4235871; опубликованные заявки РСТ WO 96/14057; New RRC, Liposomes: A practical approach, IRL Press, Oxford (1990), pages 33-104;Lasic D.D., Liposomes from physics to applications, Elsevier Science Publishers BV, Amsterdam, 1993. Например, липосомы по настоящему изобретению можно получить путем диффундирования липида, дериватизированного гидрофильным полимером, в предварительно сформированные липосомы, на- 22024391 пример, подвергая предварительно сформированные липосомы контактированию с мицеллами, образованными из липидпривитых полимеров, при концентрациях липидов, соответствующих конечному мольному проценту дериватизированного липида, который является желательным, в липосоме. Липосомы, содержащие гидрофильный полимер, также могут быть образованы путем гомогенизации, гидратирования липидной области или методами экструзии, как это известно из уровня техники. В одном аспекте настоящего изобретения липосомы получают так, чтобы они имели, по существу,гомогенные размеры в выбранном размерном диапазоне. Один эффективный способ классификации по размеру включает экструдирование водной суспензии липосом через ряд поликарбонатных мембран,имеющих выбранный одинаковый размер пор; размер пор мембраны должен примерно соответствовать самым большим размерам липосом, которые получают путем экструзии через такую мембрану; см., например, патент США 4737323 (12 апреля 1988 г.). Характеристики высвобождения препарата по настоящему изобретению зависят от инкапсулирующего вещества, концентрации инкапсулированного лекарственного средства и присутствия модификаторов высвобождения. Например, высвобождением можно манипулировать, поскольку оно является рН зависимым, например, с использованием рН-чувствительного покрытия, которое высвобождает только при низком рН, как, например, в желудке, или при более высоком рН, как, например, в кишечнике. Энтеросолюбильное покрытие можно использовать для предотвращения высвобождения до тех пор, пока препарат не пройдет через желудок. Можно использовать несколько покрытий или смеси цианамида,инкапсулированного в различных веществах, для получения начального высвобождения в желудке с последующим более поздним высвобождением в кишечнике. Высвобождением также можно манипулировать путем включения солей или порообразующих веществ, которые могут повышать водопоглощение или высвобождать лекарственное средство посредством диффузии из капсулы. Эксципиенты, которые модифицируют растворимость лекарственного средства, также можно использовать для контролирования скорости высвобождения. Вещества, которые усиливают разрушение матрицы или высвобождают из матрицы, также могут быть включены. Они могут быть добавлены к лекарственному средству, добавлены в виде отдельной фазы (т.е. в виде мелких частиц) или могут быть совместно растворены в полимерной фазе, в зависимости от соединения. Во всех случаях количество должно находиться в пределах от 0,1 до 30% (мас./мас.) полимера. Типы веществ, которые усиливают разрушение, включают неорганические соли, такие как сульфат аммония и хлорид аммония, органические кислоты, такие как лимонная кислота,бензойная кислота и аскорбиновая кислота, неорганические основания, такие как карбонат натрия, карбонат калия, карбонат кальция, карбонат цинка и гидроксид цинка, и органические основания, такие как протаминсульфат, спермин, холин, этаноламин, диэтаноламин и триэтаноламин, и поверхностноактивные вещества, такие как Tween и Pluronic. Порообразующие вещества, которые добавляют микроструктуру матрицам (т.е. водорастворимые соединения, такие как неорганические соли и сахара), добавляют в виде твердых частиц. Диапазон должен составлять от 1 до 30% (мас./мас.) полимера. Поглощением также можно манипулировать путем изменения времени нахождения частиц в кишечнике. Это достигается, например, путем покрытия частиц мукозально-адгезивным полимером или выбора его в качестве инкапсулирующего вещества. Примеры включают большинство полимеров со свободными карбоксильными группами, такие как хитозан, целлюлозы и особенно полиакрилаты (как используется в настоящей заявке, полиакрилаты относятся к полимерам, включающим акрилатные группы и модифицированные акрилатные группы, таким как цианоакрилаты и метакрилаты). Фармацевтические комбинации. Изобретение, главным образом, относится к применению соединения формулы (I) (или фармацевтической композиции, включающей соединение формулы (I в лечении одного или нескольких заболеваний, указанных в настоящей заявке; где ответ на лечение является благоприятным, как показано, например, путем частичного или полного устранения одного или нескольких симптомов заболевания,вплоть до полного излечения или ремиссии. Филадельфийская хромосома-положительный (Ph+) ALL составляет 15-30% от ALL взрослых и до 5% от педиатрических ALL (Faderl S., Garcia-MAnero G., Thomas D., et al. Philadelphia Chromosome Positive Acute Lymphoblastic Leukemia- Current Concepts and Future Perspectives. Rev Clin Exp Hematol 2002; 6:142-160). Педиатрический Ph+ ALL характеризуется более старшим возрастом (в среднем 9-10 лет против приблизительно 4 лет для всех ALL пациентов) и более высоким числом WBC при постановке диагноза. Как у взрослых, так и у детей Ph+ ALL характеризуется реципрокальной транслокацией между хромосомами 9 и 22 (t(9; 22) (q34; q11, приводящей к слиянию BCR гена на хромосоме 22 с ABL генными последовательностями, транслоцированными из хромосомы 9, приводя к экспрессии BCR-ABL1 белка. Существуют 2 основных варианта BCR-ABL1, p190BCR-ABL1, определяемый у приблизительно 85% Ph+ ALL пациентов, и р 210 BCR-ABL1, типичный для CML, идентифицированный у приблизительно 15% Ph+ ALL пациентов (Dombret H., Galbert J., Boiron J., et al. Outcome of Treatment in Adults with Лечение ALL основано на классификации риска для каждого пациента, с повышением интенсивности лечения для пациентов, которые имеют больший риск рецидива; эта стратегия максимизирует скорости ремиссии, при этом ограничивая ненужные токсичности. Прогресс постепенно увеличивался от введения комбинированной химиотерапии и лечения предсимптоматического лейкоза центральной нервной системы до более новых интенсивных схем лечения для пациентов, которые имеют больший риск рецидива (С.Н. Pui and W. E. Evans. Acute Lymphoblastic Leukemia New Engl J. Med 1998; 339:605-615). До разработки иматиниба Ph+ ALL пациентов лечили при помощи интенсивной химиотерапии с последующей трансплантацией гематопоэтических стволовых клеток (HSCT), идеально с подходящим родственным донором, поскольку было показано, что это приводит к улучшенному EFS против любого HSCT с другими донорами или химиотерапии, используемой отдельно. В целом, и в отличие от большинства педиатрических пациентов с ALL, пациенты с Ph+ ALL имели плохие прогнозы с низким процентом выживания без неблагоприятных событий (EFS) (Arico M., Valsecchi M.G., Camitta В., Schrappe M., ChessellsJ., Baruchel A., Gaynon P., Silverman L., Janka-Schaub G., Kamps W, et al. New Engl J. Med 2000; 342:9981006). Существующие терапии (такие как GLEEVEC, TASIGNA, SPRYCEL, BOSULIF, ICLUSIG и подобные) связываются с АТР-связывающим сайтом киназного домена. В отличие от этого, соединения по настоящему изобретению являются мощными ингибиторами BCR-ABL1, ABL1 и ABL2, которые связываются с сайтом на киназном домене, который отличается от АТР-связывающего сайта. Поэтому соединения по настоящему изобретению с их новым, аллостерическим механизмом действия могут быть использованы в качестве самостоятельной терапии или могут быть использованы последовательно или в комбинации с существующими терапиям, выбранными из GLEEVEC, TASIGNA,SPRYCEL, BOSULIF и ICLUSIG. В качестве самостоятельной терапии соединения по настоящему изобретению могут быть использованы для лечения BCR-ABL1, ABL1 и ABL2-родственных заболеваний и расстройств. BCR-ABL1 может быть дикого типа или мутантным BCR-ABL1, выбранным из V299L, T315I, F317I/L, Y253F/H,E255K/V и F359C/V. Соединения по настоящему изобретению могут быть использованы для лечения пациентов, которые не реагируют на существующие методы лечения в результате мутаций, возникающих в АТР-связывающем сайте. В качестве комбинированной терапии соединения по настоящему изобретению представляют собой уникальную возможность для лечения пациентов с Ph+ лейкозом с использованием комбинации двух мощных, механистически различных ингибиторов BCR-ABL. Комбинированный подход в клинике может обеспечить пациентов с более глубоким и более устойчивым сокращением опухолевой нагрузки со снижением риска рецидива. В другом варианте воплощения настоящего изобретения представлен способ лечения теплокровного животного, имеющего лейкоз, выбранный из хронического миелолейкоза (CML) и острого лимфобластного лейкоза (ALL), включающий введение указанному животному терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли. В следующем варианте воплощения теплокровное животное представляет собой человека (пациента). В следующем варианте воплощения соединение по настоящему изобретению представляет собой(пример 9) или его фармацевтически приемлемую соль. В другом варианте воплощения настоящего изобретения представлен способ лечения теплокровного животного, имеющего лейкоз, выбранный из хронического миелолейкоза (CML) и острого лимфобластного лейкоза (ALL), включающий последовательное введение указанному животному терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли и терапевтически эффективного количества соединения, выбранного из иматиниба, нилотиниба, дазатиниба, босутиниба, понатиниба и бафетиниба. В следующем варианте воплощения теплокровное животное представляет собой человека (пациента). В следующем варианте воплощения соединение по настоящему изобретению представляет собой(пример 9) или его фармацевтически приемлемую соль. В следующем варианте воплощения доза(R)-N-(4-(хлордифторметокси)фенил)-6-(3 гидроксипирролидин-1-ил)-5-(1 Н-пиразол-5-ил)никотинамида (пример 9) составляет 90-130 мг. В следующем варианте воплощения доза нилотиниба составляет 10-50 мг/кг, иматиниба составляет 50-200 мг/кг, дазатиниба составляет 5-20 мг/кг или понатиниба составляет 2-10 мг/кг. В следующем варианте воплощения доза босутиниба составляет 500 мг. В другом варианте воплощения настоящего изобретения представлен способ лечения теплокровного животного, имеющего лейкоз, выбранный из хронического миелолейкоза (CML) и острого лимфобластного лейкоза (ALL), включающий одновременное введение указанному животному терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемле- 24024391 мой соли и терапевтически эффективного количества соединения, выбранного из иматиниба, нилотиниба, дазатиниба, босутиниба, понатиниба и бафетиниба. В следующем варианте воплощения теплокровное животное представляет собой человека (пациента). В следующем варианте воплощения соединение по настоящему изобретению представляет собой(пример 9) или его фармацевтически приемлемую соль. В следующем варианте воплощения доза(R)-N-(4-(хлордифторметокси)фенил)-6-(3 гидроксипирролидин-1-ил)-5-(1 Н-пиразол-5-ил)никотинамида (пример 9) составляет 90-130 мг. В следующем варианте воплощения доза нилотиниба составляет 10-50 мг/кг, иматиниба составляет 50-200 мг/кг, дазатиниба составляет 5-20 мг/кг или понатиниба составляет 2-10 мг/кг. В следующем варианте воплощения доза босутиниба составляет 500 мг. В другом варианте воплощения настоящего изобретения представлен способ лечения теплокровного животного, имеющего лейкоз, выбранный из хронического миелолейкоза (CML) и острого лимфобластного лейкоза (ALL), включающий одновременное введение указанному животному терапевтически эффективного количества (R)-N-(4-(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1 Нпиразол-5-ил)никотинамида (пример 9) или его фармацевтически приемлемой соли и терапевтически эффективного количества нилотиниба. В другом варианте воплощения настоящего изобретения представлен способ лечения теплокровного животного, имеющего лейкоз, выбранный из хронического миелолейкоза (CML) и острого лимфобластного лейкоза (ALL), включающий одновременное введение указанному животному терапевтически эффективного количества (R)-N-(4-(хлордифторметокси)фенил)-6-(3-гидроксипирролидин-1-ил)-5-(1 Нпиразол-5-ил)никотинамида (пример 9) или его фармацевтически приемлемой соли и терапевтически эффективного количества нилотиниба. Соединение формулы (I) также можно использовать в комбинации с другими противоопухолевыми соединениями. Такие соединения включают, но не ограничиваются этим, ингибиторы рибонуклеотидредуктазы, ингибиторы топоизомеразы I; JAK ингибиторы, такие как руксолитиниб; ингибиторы smoothened, такие как LDE225; интерферон; ингибиторы топоизомеразы II; действующие на микротрубочки активные соединения; алкилирующие соединения; ингибиторы гистон деацетилазы; ингибиторы mTOR,такие как RAD001; противоопухолевые антиметаболиты; соединения платины; соединения, прицельно действующие на/снижающие протеин- или липидкиназную активность, ингибиторы метионинаминопептидазы; модификаторы биологического ответа; ингибиторы Ras онкогенных изоформ; ингибиторы теломеразы; ингибиторы протеасомы; соединения, используемые в лечении гематологических злокачественных заболеваний, такие как флударабин; соединения, которые прицельно действуют на, снижают или ингибируют активность PKC, такие как мидостаурин; ингибиторы HSP90, такие как 17-AAG (17 аллиламиногелданамицин,NSC330507),17-DMAG(17-диметиламиноэтиламино-17-деметоксигелданамицин, NSC707545), IPI-504, CNF1010, CNF2024, CNF1010 от компании Conforma Therapeutics,HSP990 и AUY922; темозоломид (TEMODAL); ингибиторы кинезинового веретенного белка, такие какPfizer, лейковорин, EDG связующие, антилейкемические соединения, ингибиторы S-аденозилметионин декарбоксилазы, антипролиферативные антитела или другие химиотерапевтические соединения. Кроме того, альтернативно или в дополнение к этому, их можно использовать в комбинации с ионизирующим облучением. Кроме того, в качестве альтернативы или в дополнение, они могут быть использованы в комбинации с JAK ингибиторами, такими как руксолитиниб. Кроме того, в качестве альтернативы или в дополнение, они могут быть использованы в комбинации с ингибиторами smoothened, такими как LDE225. Кроме того, в качестве альтернативы или в дополнение они могут быть использованы в комбинации с интерфероном. Термин "ингибиторы рибонуклеотидредуктазы" относится к пиримидиновым или пуриновым нуклеозидным аналогам, включая, но не ограничиваясь этим, флударабин и/или цитозин арабинозид (ara-С),6-тиогуанин, 5-фторурацил, кладрибин, 6-меркаптопурин (особенно в комбинации с ara-С против ALL),клофарабин, неларабин (пролекарство 9 арабинофуранозилгуанин, ara-G), пентостатин, гидроксимочевину или 2-гидрокси-1 Н-изоиндол-1,3-дионовые производные (Nandy et al., Acta Oncologica 1994; 33:953961). Термин "ингибитор топоизомеразы I", как это используется в настоящей заявке, включает, но не ограничивается этим, топотекан, гиматекан, иринотекан, камптотециан и его аналоги, 9-нитрокамптотецин и макромолекулярный камптотециновый конъюгат PNU-166148 (соединение А 1 в WO99/17804). Иринотекан можно вводить, например, в форме, как он поставляется на рынок, например, под торговой маркойCAMPTOSAR. Топотекан можно вводить, например, в форме, как он поставляется на рынок, например,- 25024391 под торговой маркой HYCAMTIN. Термин "ингибитор топоизомеразы II", как это используется в настоящей заявке, включает, но не ограничивается этим, антрациклины, такие как доксорубицин (включая липосомный препарат, например,CAELYX), даунорубицин, эпирубицин, идарубицин и неморубицин, антрахиноны митоксантрон и лосоксантрон и подофиллотоксины этопозид и тенипозид. Этопозид можно вводить, например, в форме,как он поставляется на рынок, например, под торговой маркой ETOPOPHOS. Тенипозид можно вводить,например, в форме, как он поставляется на рынок, например, под торговой маркой VM 26-BRISTOL. Доксорубицин можно вводить, например, в форме, как он поставляется на рынок, например, под торговой маркой ADRIBLASTIN или ADRIAMYCIN. Эпирубицин можно вводить, например, в форме, как он поставляется на рынок, под торговой маркой FARMORUBICIN. Идарубицин можно вводить, например, в форме, как он поставляется на рынок, например, под торговой маркой ZAVEDOS. Митоксантрон можно вводить, например, в форме, как он поставляется на рынок, например, под торговой маркой NOVANTRON. Термин "действующее на микротрубочки активное соединение" относится к стабилизирующим микротрубочки, дестабилизирующим микротрубочки соединениям и ингибиторам полимеризации микротубулина, включающим, но не ограничиваясь этим, таксаны, например паклитаксел и доцетаксел, алкалоиды барвинка, например винбластин, особенно винбластин сульфат, винкристин, особенно винкристин сульфат, и винорелбин, дискодермолиды, кохицин и эпотилоны и их производные, например эпотилон В или D или их производные. Паклитаксел можно вводить, например, в форме, как он поставляется на рынок, например TAXOL. Доцетаксел можно вводить, например, в форме, как он поставляется на рынок, например, под торговой маркой TAXOTERE. Винбластин сульфат можно вводить, например, в форме, как он поставляется на рынок, например, под торговой маркой VINBLASTIN R.P. Винкристин сульфат можно вводить, например, в форме, как он поставляется на рынок, например, под торговой маркой FARMISTIN. Дискодермолид можно получить, например, как раскрыто в патенте США 5010099. Также включены производные эпотилона, которые раскрыты в WO 98/10121, US 6194181, WO 98/25929,WO 98/08849, WO 99/43653, WO 98/22461 и WO 00/31247. Особенно предпочтительными являются Эпотилон А и/или В. Термин "алкилирующее соединение", как это используется в настоящей заявке, включает, но не ограничивается этим, циклофосфамид, ифосфамид, мелфалан или нитрозомочевину (BCNU или Gliadel). Циклофосфамид можно вводить, например, в форме, как он поставляется на рынок, например, под торговой маркой CYCLOSTIN. Ифосфамид можно вводить, например, в форме, как он поставляется на рынок, например, под торговой маркой HOLOXAN. Термин "ингибиторы гистон деацетилазы" или "ингибиторы HDAC" относится к соединениям, которые ингибируют гистон деацетилазу и которые обладают антипролиферативной активностью. Он включает соединения, такие как LDH589, раскрытый в WO 02/22577, особенно N-гидрокси-3-[4-(2 гидроксиэтил)[2-(1 Н-индол-3-ил)этил]-амино]метил]фенил]-2 Е-2-пропенамид, N-гидрокси-3-[4-2-(2 метил-1 Н-индол-3-ил)-этил]-амино]метил]фенил]-2 Е-2-пропенамид и его фармацевтически приемлемые соли. Кроме того, этот термин особым образом включает субероиланилид гидроксамовую кислоту (SAHA). Термин "противоопухолевый антиметаболит" включает, но не ограничивается этим, 5-фторурацил или 5-FU, капецитабин, гемицитабин, ДНК деметилирующие соединения, такие как 5-азацитидин и децитабин, метотрексат и эдатрексат, и антагонисты фолиевой кислоты, такие как преметрексед. Капецитабин можно вводить, например, в форме, как он поставляется на рынок, например, под торговой маркойXELODA. Гемицитабин можно вводить, например, в форме, как он поставляется на рынок, под торговой маркой GEMZAR. Термин "соединение платины", как это используется в настоящей заявке, включает, но не ограничивается этим, карбоплатин, цис-платин, цисплатину и оксалиплатин. Карбоплатин можно вводить, например, в форме, как он поставляется на рынок, например, под торговой маркой CARBOPLAT. Оксалиплатин можно вводить, например, в форме, как он поставляется на рынок, например, под торговой маркойELOXATIN. Термин "соединения, прицельно действующие на/снижающие протеин- или липидкиназную активность"; или "протеин- или липидфосфатазную активность", как это используется в настоящей заявке,включает, но не ограничивается этим, ингибиторы тирозиновой, и/или сериновой, и/или треониновой протеинкиназы или ингибиторы липидкиназы, например: а) соединения, прицельно действующие на, снижающие или ингибирующие активность членовABL1 семейства, продукты слияния их генов (например, BCR-ABL1 киназа) и мутанты, такие как соединения, которые прицельно действуют на, снижают или ингибируют активность членов ABL1 семейства и продукты слияния их генов, например иматиниб, нилотиниб, дасатиниб, босутиниб, понатиниб, бафетиниб, PD180970, AG957, NSC 680410 и PD173955;b) соединения, прицельно действующие на, снижающие или ингибирующие активность членов протеинкиназы С (PKC) и Raf семейства сериновых/треониновых киназ, членов MEK, SRC, JAK, FAK,PDK1, PKB/Akt и Ras/MAPK семейства и/или членов семейства циклинзависимых киназ (CDK), и осо- 26024391 бенно те стауроспориновые производные, которые раскрыты в патенте США 5093330, например мидостаурин; примеры других соединений включают, например UCN-01, сафингол, BAY 43-9006, Бриостатин 1, Перифосин; Илмофосин; RO 318220 и RO 320432; GO 697 6; Изис 3521; LY333531/LY379196; изохинолиновые соединения, такие как соединения, раскрытые в WO 00/09495; FTIs; BEZ235 (ингибитор Р 13 К) или АТ 7 519 (ингибитор CDK). Термин "ингибиторы mTOR" относится к соединениям, которые ингибируют мишень рапамицина у млекопитающих (mTOR) и которые обладают антипролиферативной активностью, такие как сиролимус(Rapamune), эверолимус (Certican), CCI-779 и АВТ 578. Термин "модификатор биологического ответа", как это используется в настоящей заявке, относится к лимфокину или интерферонам, например интерферону . Термин "ингибитор онкогенных изоформ Ras", например Н-Ras, K-Ras или N-Ras, как это используется в настоящей заявке, относится к соединениям, которые прицельно действуют на, снижают или ингибируют онкогенную активность Ras, например "ингибитор фарнезилтрансферазы", например L744832, DK8G557 или R115777 (Zarnestra). Термин "ингибитор теломеразы", как это используется в настоящей заявке, относится к соединениям, которые прицельно действуют на, снижают или ингибируют активность теломеразы. Соединения,которые прицельно действуют на, снижают или ингибируют активность теломеразы, главным образом,представляют собой соединения, которые ингибируют рецептор теломеразы, например теломестатин. Термин "ингибитор метионинаминопептидазы", как это используется в настоящей заявке, относится к соединениям, которые прицельно действуют на, снижают или ингибируют активность метионинаминопептидазы. Соединения, которые прицельно действуют на, снижают или ингибируют активность метионинаминопептидазы, представляют собой, например, бенгамид или его производное. Термин "ингибитор протеасомы", как это используется в настоящей заявке, относится к соединениям, которые прицельно действуют на, снижают или ингибируют активность протеасомы. Соединения,которые прицельно действуют на, снижают или ингибируют активность протеасомы, включают, например, Бортезомид (Velcade) и MLN 341. Термин "ингибиторы HSP90", как это используется в настоящей заявке, включает, но не ограничивается этим, соединения, которые прицельно действуют на, снижают или ингибируют собственную АТРазную активность HSP90; разрушают, прицельно действуют на, снижают или ингибируют HSP90 зависимые белки через убихитинпротеасомный путь. Соединения, которые прицельно действуют на,снижают или ингибируют собственную АТРазную активность HSP90, главным образом, представляют собой соединения, белки или антитела, которые ингибируют АТРазную активность HSP90, например 17 аллиламино,17-деметоксигелданамицин (17AAG), гелданамициновое производное; другие гелданамицин-родственные соединения; радицикол и ингибиторы HDAC. Примеры ингибиторов HSP90 включаютHSP990 и AUY922. Для лечения острого миелогенного лейкоза (AML) соединения формулы (I) можно использовать в комбинации со стандартными терапиями лейкоза, особенно в комбинации с терапиями, используемыми для лечения AML. В частности, соединения формулы (I) можно вводить в комбинации с, например, ингибиторами фарнезилтрансферазы и/или другими лекарственными средствами, полезными для леченияAML, такими как Даунорубицин, Адриамицин, Ara-C, VP-16, Тенипозид, Митоксантрон, Идарубицин,Карбоплатинум и PKC412. Соединения, которые прицельно действуют на, снижают или ингибируют активность гистондеацетилазы (HDAC), такие как бутират натрия и субероиланилид гидроксамовая кислота (SAHA), ингибируют активность ферментов, известных как гистондеацетилазы. Конкретные ингибиторы HDAC включаютMS275, SAHA, FK228 (прежнее название FR901228), Трихостатин А и соединения, раскрытые в патенте США 6552065, в частности N-гидрокси-3-[4-2-(2-метил-1 Н-индол-3-ил)этил]амино]метил]фенил]2 Е-2-пропенамид или его фармацевтически приемлемую соль и N-гидрокси-3-[4-[(2-гидроксиэтил)2(1 Н-индол-3-ил)этил]амино]метил]фенил]-2 Е-2-пропенамид или его фармацевтически приемлемую соль,особенно лактатную соль. Подходы повреждения опухолевых клеток относятся к подходам, таким как ионизирующее излучение. Термин "ионизирующее излучение", используемый выше и далее, означает ионизирующее излучение, которое возникает в виде либо электромагнитных лучей (таких как Х-лучи и гамма-лучи), либо частиц (таких как альфа и бета частицы). Ионизирующее излучение обеспечивается в, но не ограничиваясь этим, лучевой терапии и известно из уровня техники; см. Hellman, Principles of Radiation Therapy, Cancer,in Principles and Practice of Oncology, Devita et al., Eds., 4th Edition, Vol. 1, p. 248-275 (1993). Термин "ингибиторы S-аденозилметиониндекарбоксилазы", как это используется в настоящей заявке, включает, но не ограничивается этим, соединения, раскрытые в патенте США 5461076."Другие химиотерапевтические соединения" включают, но не ограничиваются этим, растительные алкалоиды, гормональные соединения и антагонисты; модификаторы биологического ответа, предпочтительно лимфокины или интерфероны; антисмысловые олигонуклеотиды или олигонуклеотидные производные; sh-РНК или si-РНК; или различные другие соединения или соединения с другим или неизвест- 27024391 ным механизмом действия. Структура активных соединений, определяемых кодовыми номерами, родовыми или торговыми названиями, может быть взята из действующей редакции стандартного справочника "The Merck Index" или из баз данных, например Patents International (например, IMS World Publications). Никакое цитирование ссылочных документов, которое можно найти в настоящем раскрытии, не должно рассматриваться как допущение, что эти цитируемые ссылочные документы являются известным уровнем техники, который мог бы негативно повлиять на патентоспособность настоящего изобретения. Способы получения соединений по настоящему изобретению. Настоящее изобретение также включает способы получения соединений по настоящему изобретению. В описанных реакциях может быть необходимо защитить реакционноспособные функциональные группы, например гидрокси, амино, имино, тио или карбоксигруппы, где эти группы являются желательными в конечном продукте, для избежания их нежелательного участия в реакциях. Обычные защитные группы можно использовать в соответствии со стандартной практикой, например, см. T.W. Greene иP.G.M. Wuts in "Protective Groups in Organic Chemistry", John Wiley и Sons, 1991. К значениям температур, указанным ранее или далее в заявке, должно быть добавлено "около" как незначительные отклонения от приведенных числовых значений, например отклонения 10% являются допустимыми. Все реакции могут осуществляться в присутствии одного или нескольких разбавителей и/или растворителей. Исходные материалы можно использовать в эквимолярных количествах; с другой стороны, соединение можно использовать в избытке, например, для функционирования в качестве растворителя или для смещения равновесия в целом или, в большинстве слечаев, для ускорения скорости реакции. Реакционные реагенты, такие как кислоты, щелочи или катализаторы, можно добавлять в подходящих количествах, как известно в данной области, требуемых для реакции, и в соответствии с общеизвестными процедурами. Соединения формулы (I) можно получить аналогично представленному в следующей схеме реакций I. Схема реакций I в которой Y, Y1, R1, R2, R3 и R4 являются такими, как определено для формулы (I) в "Кратком описании изобретения", и X1 и Х 2 представляют собой атомы галогена, X1 может быть выбран из хлора, брома или йода, и Х 2 может быть выбран из хлора или фтора. Стадия а. Соединение формулы (4) можно получить путем взаимодействия хлорангидрида кислоты соединения формулы (2) с соединением формулы (3) в присутствии подходящего растворителя (например, тетрагидрофурана или подобного) и органического основания (например, диизопропилэтиламина или подобного). Реакция протекает при температуре от около 0 С до примерно комнатной температуры и может протекать примерно до 2 ч до полного завершения. Хлорангидрид кислоты соединения формулы (2) можно получить с использованием хлорирующего агента (например, тионилхлорида или оксалилхлорида или подобного) в присутствии катализатора (например, диметилформамида или подобного) и подходящего растворителя (например, толуола или подобного). Реакция протекает при температуре от комнатной или при нагревании до около 85 С и может протекать примерно до 2 ч до полного завершения. Стадия b. Соединение формулы (5) можно получить путем взаимодействия соединения формулы (4) с R2-H, где R2 такой, как определено в "Кратком описании изобретения", в присутствии подходящего растворителя (например, 2-пропанола или диметилсульфоксида или подобного) и подходящего органического основания (например, диизопропилэтиламина или триэтиламина или подобного). Реакция протекает при температуре от около 90 до около 140 С и может занять от около 30 мин до около 72 ч до завершения. Стадия с. Соединение формулы (6) можно получить путем взаимодействия соединения формулы(4), где X1 предпочтительно представляет собой бром или йод, с R1-Z1, где R1 такой, как определено в настоящей заявке, Z1 предпочтительно представляет собой бороновую кислоту или сложный эфир (реакция Сузуки), в присутствии подходящего растворителя (например, диметоксиэтана или смеси диметоксиэтана и воды или подобного), подходящего неорганического основания (например, карбоната натрия или подобного) и палладиевого катализатора (например, бис-(трифенилфосфин)палладий(II) дихлорида или комплекса 1,1'-бис-(дифенилфосфино)ферроцен-палладий(II)дихлорида с дихлорметаном или тетракис(трифенилфосфин)палладий(0) или подобного) и, необязательно, сорастворителя (например, этанола или подобного). Реакция протекает при температуре от примерно 80 до около 130 С и может занять от 20 мин до около 18 ч до завершения. В качестве альтернативы стадию с можно осуществить путем взаимодействия соединения формулы(4), где X1 предпочтительно представляет собой бром или йод, с R1-Z2, где R1 такой, как определено в настоящей заявке, Z2 предпочтительно представляет собой реагент на основе триалкилолова (реакция Стилла), в присутствии подходящего растворителя (например, диметилсульфоксида или подобного) и палладиевого катализатора (например, тетракис(трифенилфосфин)палладий(0. Реакция протекает при температуре от около 140 С и может занять в целом до около 18 ч. Стадия d. Соединение формулы (I) можно получить путем взаимодействия соединения формулы(5), где X1 предпочтительно представляет собой бром или йод, с R1-Z1, где R1 такой, как определено в настоящей заявке, Z1 предпочтительно представляет собой бороновую кислоту или сложный эфир (реакция Сузуки), в присутствии подходящего растворителя (например, диметоксиэтана или смеси диметоксиэтана и воды или подобного), неорганического основания (например, карбоната натрия или подобного) и палладиевого катализатора (например, бис-(трифенилфосфин)палладий(II) дихлорида или комплекса 1,1'-бис-(дифенилфосфино)ферроцен-палладий(II)дихлорида с дихлорметаном или тетракис(трифенилфосфин)палладий(0) или подобного) и, необязательно, сорастворителя (например, этанола или подобного). Реакция протекает при температуре от около 80-130 С и может занять от около 20 мин до 2 ч до завершения. Стадия е. Соединение формулы (I) можно получить путем взаимодействия соединения формулы (6) с R2-H, где R2 такой, как определено в настоящей заявке, в присутствии подходящего растворителя (например, 2-пропанола или диметилсульфоксида или подобного), органического основания (например,диизопропилэтиламина или триэтиламина или подобного). Реакция протекает при температуре от около 90-140 С и может занять от около 30 мин до 72 ч до завершения. Соединения формулы (I) можно получить аналогично тому, как описано в следующей схеме реакций II. Схема реакций II в которой Y, Y1, R1, R2, R3 и R4 являются такими, как определено для формулы (I) в "Кратком описании изобретения", и X1 и Х 2 представляют собой атомы галогена, X1, в частности хлор, бром или йод,Х 2, в частности хлор или фтор, и Alk представляет собой цепь низшего алкила, в частности метил. Стадия f. Соединение формулы (8) можно получить путем взаимодействия соединения формулы (7) с R2-H, где R2 такой, как определено в настоящей заявке, по аналогии со стадией b. Стадия g. Соединение формулы (9) можно получить путем взаимодействия соединения формулы(8), где X1 предпочтительно представляет собой бром или йод, с R1-Z1, где R1 такой, как определено в настоящей заявке, Z1 предпочтительно представляет собой бороновую кислоту или сложный эфир (реакция Сузуки), по аналогии со стадией d. Стадия h. Соединение формулы (10) можно получить путем гидролиза сложного эфира соединения формулы (9) в присутствии подходящего растворителя (например, воды или подобного), неорганического основания (например, гидроксида натрия или подобного). Реакция протекает при комнатной температуре и может занять в целом до около 2 ч. Стадия i. Соединение формулы (I) можно получить путем взаимодействия соединения формулы(10) с соединением формулы (3) в присутствии связующего реагента (такого как 1-этил-3-(3 диметиламинопропил)карбодиимидгидрохлорид и гидроксибензотриазол или подобного), подходящего основания (такого как N-метилморфолин, диизопропилэтиламин или подобного) и подходящего растворителя (такого как дихлорметан, диметилформамид или подобного). Реакция протекает при комнатной температуре и может занять приблизительно 12 ч до завершения.
МПК / Метки
МПК: A61K 31/4439, C07D 401/04, C07D 401/14, C07D 403/10, A61P 35/00, C07D 213/82
Метки: активности, производные, bcr-abl1, бензамида, ингибирования, abl1
Код ссылки
<a href="https://eas.patents.su/30-24391-proizvodnye-benzamida-dlya-ingibirovaniya-aktivnosti-abl1-abl2-i-bcr-abl1.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензамида для ингибирования активности abl1, abl2 и bcr-abl1</a>
Предыдущий патент: Система для маркировки биологического объекта, не являющегося человеком, и взятия образца биологического объекта
Следующий патент: Феноксиэтилпиперидиновые соединения
Случайный патент: N-адамантилбензамиды в качестве ингибиторов 11-β-гидроксистероиддегидрогеназы












