Замещенные производные бензамида
Номер патента: 22376
Опубликовано: 30.12.2015
Авторы: Галлей Гуидо, Пфлигер Филипп, Норкросс Роджер, Труссарди Рене
Формула / Реферат
1. Соединение формулы
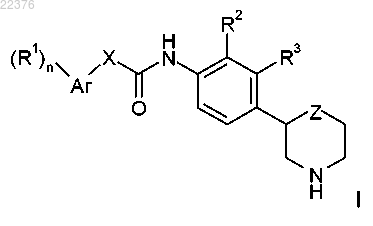
где R1 представляет собой водород, галоген, цианогруппу, С1-7-алкил, С1-7-алкил, замещенный галогеном, С1-7-алкоксигруппу, С1-7-алкоксигруппу, замещенную галогеном или C(O)NH2, или представляет собой фенил, возможно, содержащий в качестве заместителя галоген, цианогруппу или С1-7-алкоксигруппу, замещенную галогеном, или представляет собой 2,2-дифторбензо[d][1,3]диоксол-5-ил, или представляет собой 6-(трифторметил)пиразин-2-ил или 5-(трифторметил)пиразин-2-ил, или представляет собой 6-(трифторметил)пиримидин-4-ил, или представляет собой 6-(трифторметил)пиридин-3-ил, или представляет собой 5-цианопиразин-2-ил, или представляет собой 2-(трифторметил)пиримидин-4-ил;
n равно 1 или 2;
R2 представляет собой галоген, С1-7-алкил или цианогруппу и R3 представляет собой водород или же R2 представляет собой водород и R3 представляет собой галоген, С1-7-алкил или цианогруппу;
X представляет собой связь, -NR'-, -CH2NH- или -CHR'-;
R' представляет собой водород или С1-7-алкил;
Z представляет собой связь, -СН2- или -О-;
Ar представляет собой фенил или представляет собой гетероарил, выбранный из группы, включающей 1Н-индазол-3-ил, пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, пиримидин-5-ил, 1Н-пиразол-3-ил, 1Н-пиразол-4-ил или 1Н-пиразол-5-ил,
или их фармацевтически приемлемые кислотно-аддитивные соли.
2. Соединение формулы IA, охватываемое формулой I по п.1
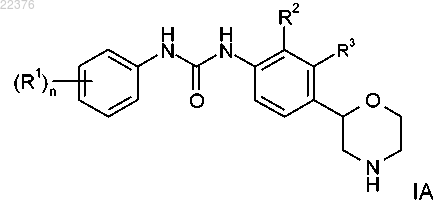
где R1 представляет собой водород, галоген, цианогруппу, С1-7-алкил, С1-7-алкил, замещенный галогеном, С1-7-алкоксигруппу, С1-7-алкоксигруппу, замещенную галогеном или C(O)NH2, или представляет собой фенил, возможно, содержащий в качестве заместителя галоген, цианогруппу или С1-7-алкоксигруппу, замещенную галогеном, или представляет собой 2,2-дифторбензо[d][1,3]диоксол-5-ил, или представляет собой 6-(трифторметил)пиразин-2-ил или 5-(трифторметил)пиразин-2-ил, или представляет собой 6-(трифторметил)пиримидин-4-ил, или представляет собой 6-(трифторметил)пиридин-3-ил, или представляет собой 5-цианопиразин-2-ил, или представляет собой 2-(трифторметил)пиримидин-4-ил;
n равно 1 или 2;
R2 представляет собой галоген, С1-7-алкил или цианогруппу и R3 представляет собой водород или же R2 представляет собой водород и R3 представляет собой галоген, С1-7-алкил или цианогруппу,
или его фармацевтически приемлемые кислотно-аддитивные соли.
3. Соединение по любому из пп.1 или 2, причем указанными соединениями являются
1-(3-цианофенил)-3-((R)-2-фтор-4-морфолин-2-илфенил)мочевина;
1-(3-цианофенил)-3-((S)-2-фтор-4-морфолин-2-илфенил)мочевина;
(RS)-1-(2-хлор-4-(морфолин-2-ил)фенил)-3-(3-цианофенил)мочевина;
(S)-1-(2-хлор-4-(морфолин-2-ил)фенил)-3-(3-цианофенил)мочевина;
(R)-1-(2-хлор-4-(морфолин-2-ил)фенил)-3-(3-цианофенил)мочевина;
1-(3-циано-5-фторфенил)-3-((S)-2-фтор-4-морфолин-2-илфенил)мочевина;
1-(3-циано-4-фторфенил)-3-((S)-2-фтор-4-морфолин-2-илфенил)мочевина;
(S)-1-(5-циано-2-метоксифенил)-3-(2-фтор-4-(морфолин-2-ил)фенил)мочевина;
(R)-1-(5-циано-2-метоксифенил)-3-(2-фтор-4-(морфолин-2-ил)фенил)мочевина;
(R)-1-(2-хлор-4-(морфолин-2-ил)фенил)-3-(5-циано-2-метоксифенил)мочевина;
(S)-1-(2-хлор-4-(морфолин-2-ил)фенил)-3-(5-циано-2-метоксифенил)мочевина;
(R)-1-(2-хлор-4-(морфолин-2-ил)фенил)-3-(5-циано-2-(дифторметокси)фенил)мочевина;
(S)-1-(2-хлор-4-(морфолин-2-ил)фенил)-3-(5-циано-2-(дифторметокси)фенил)мочевина;
1-(5-циано-2-фторфенил)-3-((R)-2-фтор-4-морфолин-2-илфенил)мочевина;
1-((R)-2-бром-4-морфолин-2-илфенил)-3-(5-циано-2-метоксифенил)мочевина;
1-((S)-2-бром-4-морфолин-2-илфенил)-3-(5-циано-2-метоксифенил)мочевина;
1-(3-циано-5-фторфенил)-3-((R)-2-фтор-4-морфолин-2-илфенил)мочевина;
1-((R)-2-бром-4-морфолин-2-илфенил)-3-(5-циано-2-дифторметоксифенил)мочевина;
1-((S)-2-бром-4-морфолин-2-илфенил)-3-(5-циано-2-дифторметоксифенил)мочевина;
(R)-1-(3-циано-2-фторфенил)-3-(2-фтор-4-(морфолин-2-ил)фенил)мочевина;
(R)-1-(3-циано-4-фторфенил)-3-(2-фтор-4-(морфолин-2-ил)фенил)мочевина;
1-(5-циано-2-дифторметоксифенил)-3-((S)-2-фтор-4-морфолин-2-илфенил)мочевина;
1-(5-циано-2-дифторметоксифенил)-3-((R)-2-фтор-4-морфолин-2-илфенил)мочевина;
(S)-1-(5-циано-2-этоксифенил)-3-(2-фтор-4-(морфолин-2-ил)фенил)мочевина или
(R)-1-(5-циано-2-этоксифенил)-3-(2-фтор-4-(морфолин-2-ил)фенил)мочевина.
4. Соединение формулы IB, охватываемое формулой I по п.1
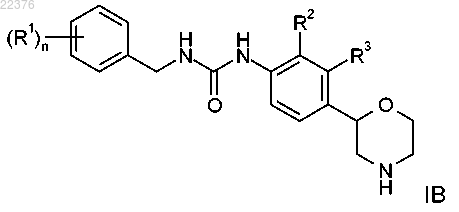
где R1 представляет собой водород, галоген, цианогруппу, С1-7-алкил, С1-7-алкил, замещенный галогеном, С1-7-алкоксигруппу, С1-7-алкоксигруппу, замещенную галогеном или C(O)NH2, или представляет собой фенил, возможно, содержащий в качестве заместителя галоген, цианогруппу или С1-7-алкоксигруппу, замещенную галогеном, или представляет собой 2,2-дифторбензо[d][1,3]диоксол-5-ил, или представляет собой 6-(трифторметил)пиразин-2-ил или 5-(трифторметил)пиразин-2-ил, или представляет собой 6-(трифторметил)пиримидин-4-ил, или представляет собой 6-(трифторметил)пиридин-3-ил, или представляет собой 5-цианопиразин-2-ил, или представляет собой 2-(трифторметил)пиримидин-4-ил;
n равно 1 или 2;
R2 представляет собой галоген, С1-7-алкил или цианогруппу и R3 представляет собой водород или же R2 представляет собой водород и R3 представляет собой галоген, С1-7-алкил или цианогруппу,
или его фармацевтически приемлемые кислотно-аддитивные соли.
5. Соединение формулы IB по любому из пп.1 или 4, причем указанными соединениями являются
1-(3-цианобензил)-3-((R)-2-фтор-4-морфолин-2-илфенил)мочевина;
1-(3-цианобензил)-3-((S)-2-фтор-4-морфолин-2-илфенил)мочевина;
(R)-1-(3-(дифторметокси)бензил)-3-(2-фтор-4-(морфолин-2-ил)фенил)мочевина или
(S)-1-(3-(дифторметокси)бензил)-3-(2-фтор-4-(морфолин-2-ил)фенил)мочевина.
6. Соединение формулы IC, охватываемое формулой I по п.1
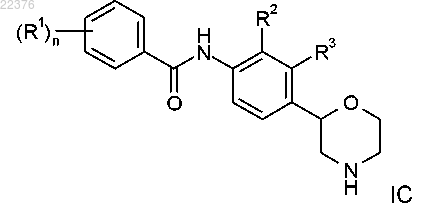
где R1 представляет собой водород, галоген, цианогруппу, С1-7-алкил, С1-7-алкил, замещенный галогеном, С1-7-алкоксигруппу, С1-7-алкоксигруппу, замещенную галогеном или C(O)NH2, или представляет собой фенил, возможно, содержащий в качестве заместителя галоген, цианогруппу или С1-7-алкоксигруппу, замещенную галогеном, или представляет собой 2,2-дифторбензо[d][1,3]диоксол-5-ил, или представляет собой 6-(трифторметил)пиразин-2-ил или 5-(трифторметил)пиразин-2-ил, или представляет собой 6-(трифторметил)пиримидин-4-ил, или представляет собой 6-(трифторметил)пиридин-3-ил, или представляет собой 5-цианопиразин-2-ил, или представляет собой 2-(трифторметил)пиримидин-4-ил;
n равно 1 или 2;
R2 представляет сбоой галоген, С1-7-алкил или цианогруппу и R3 представляет собой водород или же R2 представляет собой водород и R3 представляет собой галоген, С1-7-алкил или цианогруппу,
или его фармацевтически приемлемые кислотно-аддитивные соли.
7. Соединение формулы IC по любому из пп.1 или 6, где указанным соединением является (S)-4-хлор-N-(2-хлор-4-(морфолин-2-ил)фенил)бензамид.
8. Соединение формулы ID, охватываемое формулой I по п.1
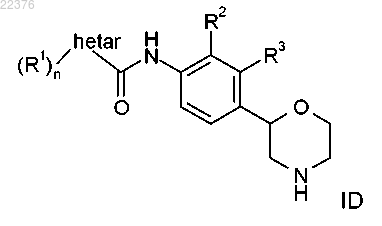
где R1 представляет собой водород, галоген, цианогруппу, С1-7-алкил, С1-7-алкил, замещенный галогеном, С1-7-алкоксигруппу, С1-7-алкоксигруппу, замещенную галогеном или C(O)NH2, или представляет собой фенил, возможно, содержащий в качестве заместителя галоген, цианогруппу или С1-7-алкоксигруппу, замещенную галогеном, или представляет собой 2,2-дифторбензо[d][1,3]диоксол-5-ил, или представляет собой 6-(трифторметил)пиразин-2-ил или 5-(трифторметил)пиразин-2-ил, или представляет собой 6-(трифторметил)пиримидин-4-ил, или представляет собой 6-(трифторметил)пиридин-3-ил, или представляет собой 5-цианопиразин-2-ил, или представляет собой 2-(трифторметил)пиримидин-4-ил;
n равно 1 или 2;
R2 представляет собой галоген, С1-7-алкил или цианогруппу и R3 представляет собой водород или же R2 представляет собой водород и R3 представляет собой галоген, С1-7-алкил или цианогруппу;
Hetar выбирают из группы, включающей 1Н-индазол-3-ил, пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, пиримидин-5-ил, 1Н-пиразол-3-ил, 1Н-пиразол-4-ил или 1Н-пиразол-5-ил,
или его фармацевтически приемлемые кислотно-аддитивные соли.
9. Соединение формулы ID по любому из пп.1 и 8, причем указанными соединениями являются
((R)-2-фтор-4-морфолин-2-илфенил)амид 6-фтор-1Н-индазол-3-карбоновая кислота;
((S)-2-фтор-4-морфолин-2-илфенил)амид 6-фтор-1Н-индазол-3-карбоновая кислота;
((R)-2-фтор-4-морфолин-2-илфенил)амид 1-(4-фторфенил)-1Н-пиразол-3-карбоновая кислота;
((S)-2-фтор-4-морфолин-2-илфенил)амид 1-(4-фторфенил)-1Н-пиразол-3-карбоновая кислота;
((S)-2-фтор-4-морфолин-2-илфенил)амид 2-метил-5-фенил-2Н-пиразол-3-карбоновая кислота;
(RS)-N-(2-хлор-4-(морфолин-2-ил)фенил)-1-(4-фторфенил)-1Н-пиразол-4-карбоксамид;
(R)-N-(2-фтор-4-(морфолин-2-ил)фенил)-1-(4-фторфенил)-1Н-пиразол-4-карбоксамид;
(S)-N-(2-фтор-4-(морфолин-2-ил)фенил)-1-(4-фторфенил)-1Н-пиразол-4-карбоксамид;
((R)-2-фтор-4-морфолин-2-илфенил)амид 2-метил-5-фенил-2Н-пиразол-3-карбоновая кислота;
2-хлор-N-((R)-2-фтор-4-морфолин-2-илфенил)-6-метоксиизоникотинамид;
2-хлор-N-((S)-2-фтор-4-морфолин-2-илфенил)-6-метоксиизоникотинамид;
(RS)-N-(2-циано-4-(морфолин-2-ил)фенил)-1-(4-фторфенил)-1Н-пиразол-3-карбоксамид;
(S)-N-(2-хлор-4-(морфолин-2-ил)фенил)-1-(4-фторфенил)-1Н-пиразол-3-карбоксамид;
(R)-N-(2-хлор-4-(морфолин-2-ил)фенил)-1-(4-фторфенил)-1Н-пиразол-3-карбоксамид;
(S)-N-(2-хлор-4-(морфолин-2-ил)фенил)-1-(4-фторфенил)-1Н-пиразол-4-карбоксамид;
(R)-N-(2-хлор-4-(морфолин-2-ил)фенил)-1-(4-фторфенил)-1Н-пиразол-4-карбоксамид;
(R)-6-хлор-N-(2-хлор-4-(морфолин-2-ил)фенил)никотинамид;
(S)-6-хлор-N-(2-хлор-4-(морфолин-2-ил)фенил)никотинамид;
6-хлор-N-((R)-2-метил-4-морфолин-2-илфенил)никотинамид;
(S)-1-(3-(дифторметокси)фенил)-N-(2-фтор-4-(морфолин-2-ил)фенил)-1Н-пиразол-4-карбоксамид;
(S)-1-(4-(дифторметокси)фенил)-N-(2-фтор-4-(морфолин-2-ил)фенил)-1Н-пиразол-4-карбоксамид;
(S)-4-циано-N-(2-фтор-4-(морфолин-2-ил)фенил)пиколинамид;
(R)-4-циано-N-(2-фтор-4-(морфолин-2-ил)фенил)пиколинамид;
(S)-6-циано-N-(2-фтор-4-(морфолин-2-ил)фенил)пиколинамид;
(S)-1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)-N-(2-фтор-4-(морфолин-2-ил)фенил)-1Н-пиразол-4-карбоксамид;
(R)-N-(3-фтор-4-(морфолин-2-ил)фенил)-2-(трифторметил)изоникотинамид;
(R)-2-этокси-N-(3-фтор-4-(морфолин-2-ил)фенил)изоникотинамид;
(R)-6-этокси-N-(3-фтор-4-(морфолин-2-ил)фенил)никотинамид;
(R)-1-(4-(дифторметокси)фенил)-N-(3-фтор-4-(морфолин-2-ил)фенил)-1Н-пиразол-4-карбоксамид;
(S)-N-(3-фтор-4-(морфолин-2-ил)фенил)-2-(трифторметил)изоникотинамид;
(S)-2-этокси-N-(3-фтор-4-(морфолин-2-ил)фенил)изоникотинамид;
(S)-6-этокси-N-(3-фтор-4-(морфолин-2-ил)фенил)никотинамид;
(S)-1-(4-(дифторметокси)фенил)-N-(3-фтор-4-(морфолин-2-ил)фенил)-1Н-пиразол-4-карбоксамид;
(R)-N-(3-хлор-4-(морфолин-2-ил)фенил)-2-этоксиизоникотинамид;
(R)-N-(3-хлор-4-(морфолин-2-ил)фенил)-6-этоксиникотинамид;
(R)-N-(3-хлор-4-(морфолин-2-ил)фенил)-1-(4-(дифторметокси)фенил)-1Н-пиразол-4-карбоксамид;
(S)-N-(3-хлор-4-(морфолин-2-ил)фенил)-2-этоксиизоникотинамид;
(S)-N-(3-хлор-4-(морфолин-2-ил)фенил)-6-этоксиникотинамид;
(S)-N-(3-хлор-4-(морфолин-2-ил)фенил)-1-(4-(дифторметокси)фенил)-1Н-пиразол-4-карбоксамид;
(R)-N-(2-хлор-4-(морфолин-2-ил)фенил)-6-цианопиколинамид;
(S)-N-(2-хлор-4-(морфолин-2-ил)фенил)-6-цианопиколинамид;
(S)-N-(2-хлор-4-(морфолин-2-ил)фенил)-5-цианопиколинамид;
(R)-N-(2-хлор-4-(морфолин-2-ил)фенил)-5-цианопиколинамид;
(S)-N-(2-хлор-4-(морфолин-2-ил)фенил)-6-цианоникотинамид;
(R)-N-(2-хлор-4-(морфолин-2-ил)фенил)-6-цианоникотинамид;
(S)-N-(2-хлор-4-(морфолин-2-ил)фенил)-1-(4-цианофенил)-1Н-пиразол-4-карбоксамид;
(S)-1-(4-(дифторметокси)фенил)-N-(2-фтор-4-(морфолин-2-ил)фенил)-1Н-1,2,3-триазол-4-карбоксамид;
(S)-N-(3-хлор-4-(морфолин-2-ил)фенил)-1-(4-цианофенил)-1Н-пиразол-4-карбоксамид;
(S)-4-хлор-6-циано-N-(2-фтор-4-(морфолин-2-ил)фенил)пиколинамид;
(S)-2-циано-N-(3-фтор-4-(морфолин-2-ил)фенил)-6-метоксиизоникотинамид;
(S)-1-(4-циано-2-фторфенил)-N-(3-фтор-4-(морфолин-2-ил)фенил)-1Н-пиразол-4-карбоксамид;
(S)-N-(3-хлор-4-(морфолин-2-ил)фенил)-1-(4-циано-2-фторфенил)-1Н-пиразол-4-карбоксамид;
(S)-1-(4-циано-2-фторфенил)-N-(2-фтор-4-(морфолин-2-ил)фенил)-1Н-пиразол-4-карбоксамид;
(S)-1-(4-цианофенил)-N-(2-фтор-4-(морфолин-2-ил)фенил)-1Н-пиразол-4-карбоксамид;
(S)-N-(3-хлор-4-(морфолин-2-ил)фенил)-2-циано-6-метилизоникотинамид;
(S)-2-циано-N-(2-фтор-4-(морфолин-2-ил)фенил)-6-метилизоникотинамид;
(S)-N4-(3-фтор-4-(морфолин-2-ил)фенил)-6-метилпиридин-2,4-дикарбоксамид;
(S)-2-циано-N-(3-фтор-4-(морфолин-2-ил)фенил)-6-метилизоникотинамид;
(S)-6-хлор-N4-(3-фтор-4-(морфолин-2-ил)фенил)пиридин-2,4-дикарбоксамид;
(S)-6-этил-N4-(3-фтор-4-(морфолин-2-ил)фенил)пиридин-2,4-дикарбоксамид;
(S)-N4-(3-хлор-4-(морфолин-2-ил)фенил)-6-метилпиридин-2,4-дикарбоксамид;
(S)-N4-(2-фтор-4-(морфолин-2-ил)фенил)-6-метилпиридин-2,4-дикарбоксамид;
(S)-N4-(2-фтор-4-(морфолин-2-ил)фенил)-6-метоксипиридин-2,4-дикарбоксамид;
(S)-2-циано-N-(2-фтор-4-(морфолин-2-ил)фенил)-6-метоксиизоникотинамид;
(S)-N4-(2-хлор-4-(морфолин-2-ил)фенил)-6-метилпиридин-2,4-дикарбоксамид;
(S)-N-(2-хлор-4-(морфолин-2-ил)фенил)-2-циано-6-метилизоникотинамид;
(S)-N-(2-хлор-4-(морфолин-2-ил)фенил)-2-циано-6-метоксиизоникотинамид;
(S)-N-(2-фтор-4-(морфолин-2-ил)фенил)-1-(6-(трифторметил)пиразин-2-ил)-1Н-пиразол-4-карбоксамид;
(S)-N-(2-хлор-4-(морфолин-2-ил)фенил)-1-(6-(трифторметил)пиразин-2-ил)-1Н-пиразол-4-карбоксамид;
(S)-N-(3-фтор-4-(морфолин-2-ил)фенил)-1-(6-(трифторметил)пиразин-2-ил)-1Н-пиразол-4-карбоксамид;
(S)-N-(3-хлор-4-(морфолин-2-ил)фенил)-1-(6-(трифторметил)пиразин-2-ил)-1Н-пиразол-4-карбоксамид;
(S)-N-(3-фтор-4-(морфолин-2-ил)фенил)-1-(6-(трифторметил)пиримидин-4-ил)-1Н-пиразол-4-карбоксамид;
(S)-N-(3-фтор-4-(морфолин-2-ил)фенил)-1-(6-(трифторметил)пиридин-3-ил)-1Н-пиразол-4-карбоксамид;
(S)-1-(5-цианопиразин-2-ил)-N-(3-фтор-4-(морфолин-2-ил)фенил)-1Н-пиразол-4-карбоксамид
(S)-N-(3-фтор-4-(морфолин-2-ил)фенил)-1-(2-(трифторметил)пиримидин-4-ил)-1Н-пиразол-4-карбоксамид;
(S)-4-хлор-6-циано-N-(3-фтор-4-(морфолин-2-ил)фенил)пиколинамид;
(S)-N-(3-фтор-4-(морфолин-2-ил)фенил)-1-(5-(трифторметил)пиразин-2-ил)-1Н-пиразол-4-карбоксамид;
(S)-5-циано-N-(2-фтор-4-(морфолин-2-ил)фенил)-6-метилпиколинамид;
(S)-5-циано-N-(3-фтор-4-(морфолин-2-ил)фенил)-6-метилпиколинамид или
(S)-6-этокси-N-(2-фтор-4-(морфолин-2-ил)фенил)никотинамид.
10. Соединение формулы IE, охватываемое формулой I по п.1
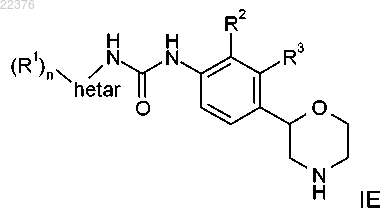
где R1 представляет собой водород, галоген, цианогруппу, С1-7-алкил, С1-7-алкил, замещенный галогеном, С1-7-алкоксигруппу, С1-7-алкоксигруппу, замещенную галогеном или C(O)NH2, или представляет собой фенил, возможно, содержащий в качестве заместителя галоген, цианогруппу или С1-7-алкоксигруппу, замещенную галогеном, или представляет собой 2,2-дифторбензо[d][1,3]диоксол-5-ил, или представляет собой 6-(трифторметил)пиразин-2-ил или 5-(трифторметил)пиразин-2-ил, или представляет собой 6-(трифторметил)пиримидин-4-ил, или представляет собой 6-(трифторметил)пиридин-3-ил, или представляет собой 5-цианопиразин-2-ил, или представляет собой 2-(трифторметил)пиримидин-4-ил;
n равно 1 или 2;
R2 представляет собой галоген, С1-7-алкил или цианогруппу и R3 представляет собой водород или же R2 представляет собой водород и R3 представляет собой галоген, С1-7-алкил или цианогруппу;
Hetar выбирают из группы, включающей 1Н-индазол-3-ил, пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, пиримидин-5-ил, 1Н-пиразол-3-ил, 1Н-пиразол-4-ил или 1Н-пиразол-5-ил,
или его фармацевтически приемлемые кислотно-аддитивные соли.
11. Соединение формулы IE по любому из пп.1 или 10, причем указанными соединениями являются
1-(6-хлорпиридин-3-ил)-3-((R)-2-фтор-4-морфолин-2-илфенил)мочевина;
1-(6-хлорпиридин-3-ил)-3-((S)-2-фтор-4-морфолин-2-илфенил)мочевина;
1-((R)-2-фтор-4-морфолин-2-илфенил)-3-(6-трифторметилпиридин-3-ил)мочевина;
1-((S)-2-фтор-4-морфолин-2-илфенил)-3-(6-трифторметилпиридин-3-ил)мочевина;
(RS)-1-(2-хлор-4-морфолин-2-илфенил)-3-(6-хлорпиридин-3-ил)мочевина;
(S)-1-(2-хлор-4-морфолин-2-илфенил)-3-(6-хлорпиридин-3-ил)мочевина;
(R)-1-(2-хлор-4-морфолин-2-илфенил)-3-(6-хлорпиридин-3-ил)мочевина;
(RS)-1-(2-бром-4-(морфолин-2-ил)фенил)-3-(6-хлорпиридин-3-ил)мочевина;
(RS)-1-(6-хлорпиридин-3-ил)-3-(2-хлор-4-пирролидин-3-илфенил)мочевина;
(R)-1-(6-хлорпиридин-3-ил)-3-(2-метил-4-(морфолин-2-ил)фенил)мочевина;
(R)-1-(2-хлор-4-(морфолин-2-ил)фенил)-3-(6-(трифторметил)пиридин-3-ил)мочевина;
(S)-1-(2-хлор-4-(морфолин-2-ил)фенил)-3-(6-(трифторметил)пиридин-3-ил)мочевина;
1-((S)-2-хлор-4-морфолин-2-илфенил)-3-(2-трифторметилпиримидин-5-ил)мочевина;
1-((R)-2-хлор-4-морфолин-2-илфенил)-3-(2-трифторметилпиримидин-5-ил)мочевина;
(S)-1-(2-хлор-4-(морфолин-2-ил)фенил)-3-(5-(трифторметил)пиридин-2-ил)мочевина;
(R)-1-(2-хлор-4-(морфолин-2-ил)фенил)-3-(5-(трифторметил)пиридин-2-ил)мочевина;
(R)-1-(2-хлор-4-(морфолин-2-ил)фенил)-3-(5-хлорпиридин-2-ил)мочевина;
(S)-1-(2-хлор-4-(морфолин-2-ил)фенил)-3-(5-хлорпиридин-2-ил)мочевина;
(R)-1-(2-бром-4-(морфолин-2-ил)фенил)-3-(6-цианопиридин-3-ил)мочевина;
(S)-1-(2-бром-4-(морфолин-2-ил)фенил)-3-(6-цианопиридин-3-ил)мочевина;
1-((R)-2-бром-4-морфолин-2-илфенил)-3-(6-хлорпиридин-3-ил)мочевина;
1-((S)-2-бром-4-морфолин-2-илфенил)-3-(6-хлорпиридин-3-ил)мочевина;
1-((S)-2-бром-4-морфолин-2-илфенил)-3-(2-трифторметилпиримидин-5-ил)мочевина или
1-((R)-2-бром-4-морфолин-2-илфенил)-3-(2-трифторметилпиримидин-5-ил)мочевина.
12. Соединение формулы I по п.1, где Z представляет собой связь или -СН2-.
13. Соединение по любому из пп.1 или 12, причем указанными соединениями являются
(RS)-1-(6-хлорпиридин-3-ил)-3-(2-хлор-4-пирролидин-3-илфенил)мочевина;
(RS)-1-(2-хлор-4-(пиперидин-3-ил)фенил)-3-(6-хлорпиридин-3-ил)мочевина или
(RS)-6-хлор-N-(2-хлор-4-пиперидин-3-илфенил)никотинамид.
14. Соединение (S)-N-(3-фтор-4-(морфолин-2-ил)фенил)-5-(трифторметил)пиразин-2-карбоксамид.
15. Способ получения соединения формулы I, раскрытого в любом из пп.1-13, включающий:
а) отщепление N-протекторной группы от соединения формулы
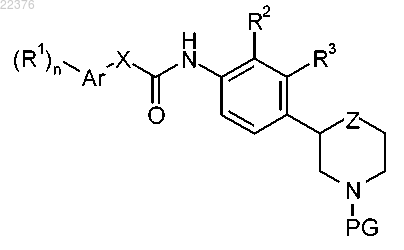
с получением соединения формулы
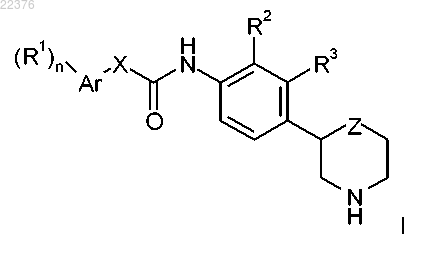
где PG представляет собой N-протекторную группу,
и, при необходимости, превращение полученного соединения в фармацевтически приемлемые кислотно-аддитивные соли.
16. Фармацевтическая композиция для селективного связывания с TAAR1, включающая соединение по любому из пп.1-14 и фармацевтически приемлемый носитель и/или вспомогательное вещество.
17. Фармацевтическая композиция, включающая соединение по любому из пп.1-14 и фармацевтически приемлемый носитель и/или вспомогательное вещество для применения в лечении депрессии, тревожного невроза, биполярного расстройства, синдрома дефицита внимания с гиперактивностью (СДВГ), расстройств, связанных со стрессом, психических расстройств, шизофрении, неврологических заболеваний, болезни Паркинсона, нейродегенеративных расстройств, болезни Альцгеймера, эпилепсии, мигрени, гипертонии, наркотической зависимости и токсикомании, а также метаболических расстройств, расстройств приема пищи, диабета, диабетических осложнений, тучности, дислипидемии, расстройств потребления и усвоения энергии, расстройств и нарушения функции гомеостаза температуры тела, расстройств сна и суточного биоритма и сердечно-сосудистых заболеваний.
18. Применение соединения по любому из пп.1-14 в качестве лиганда для TAAR1.
19. Применение соединения по любому из пп.1-14 в качестве терапевтически активного вещества в лечении депрессии, тревожного невроза, биполярного расстройства, синдрома дефицита внимания с гиперактивностью (СДВГ), расстройств, связанных со стрессом, психических расстройств, шизофрении, неврологических заболеваний, болезни Паркинсона, нейродегенеративных расстройств, болезни Альцгеймера, эпилепсии, мигрени, гипертонии, наркотической зависимости и токсикомании, а также метаболических расстройств, расстройств приема пищи, диабета, диабетических осложнений, тучности, дислипидемии, расстройств потребления и усвоения энергии, расстройств и нарушения функции гомеостаза температуры тела, расстройств сна и суточного биоритма и сердечно-сосудистых заболеваний.
20. Применение соединения по любому из пп.1-14 для изготовления лекарственных средств для терапевтического и/или профилактического лечения депрессии, тревожного невроза, биполярного расстройства, синдрома дефицита внимания с гиперактивностью (СДВГ), расстройств, связанных со стрессом, психических расстройств, шизофрении, неврологических заболеваний, болезни Паркинсона, нейродегенеративных расстройств, болезни Альцгеймера, эпилепсии, мигрени, гипертонии, наркотической зависимости и токсикомании, а также метаболических расстройств, расстройств приема пищи, диабета, диабетических осложнений, тучности, дислипидемии, расстройств потребления и усвоения энергии, расстройств и нарушения функции гомеостаза температуры тела, расстройств сна и суточного биоритма и сердечно-сосудистых заболеваний.
Текст
где R1 представляет собой водород, галоген, цианогруппу, низший алкил, низший алкил, замещенный галогеном, низшую алкоксигруппу, низшую алкоксигруппу, замещенную галогеном или C(O)NH2, или представляет собой фенил, возможно, содержащий в качестве заместителя галоген, цианогруппу или низшую алкоксигруппу, замещенную галогеном, или представляет собой 2,2-дифторбензо[d][1,3]диоксол-5-ил, или представляет собой 6-(трифторметил)пиразин-2-ил или 5-(трифторметил)пиразин-2-ил, или представляет собой 6-(трифторметил)пиримидин-4-ил, или представляет собой 6-(трифторметил)пиридин-3-ил, или представляет собой 5-цианопиразин-2-ил, или представляет собой 2-(трифторметил)пиримидин-4-ил; n равно 1 или 2; R2 представляет собой галоген, низший алкил или цианогруппу и R3 представляет собой водород или же R2 представляет собой водород и R3 представляет собой галоген, низший алкил или цианогруппу;X представляет собой связь, -NR'-, -CH2NH- или -CHR'-; R' представляет собой водород или низший алкил; Z представляет собой связь, -СН 2- или -О-; Аr представляет собой фенил или представляет собой гетероарил, выбранный из группы, включающей 1 Н-индазол-3-ил, пиридин-2-ил, пиридин-3-ил, пиридин-4 ил, пиримидин-5-ил, 1 Н-пиразол-3-ил, 1 Н-пиразол-4-ил или 1 Н-пиразол-5-ил; или к их фармацевтически приемлемым кислотно-аддитивным солям, которые можно применять для лечения депрессии, тревожного невроза, биполярного расстройства, синдрома дефицита внимания с гиперактивностью (СДВГ), расстройств,связанных со стрессом, психических расстройств, шизофрении, неврологических заболеваний, болезни Паркинсона, нейродегенеративных расстройств, болезни Альцгеймера, эпилепсии, мигрени, гипертонии,наркотической зависимости и токсикомании, а также метаболических расстройств, расстройств приема пищи,диабета, диабетических осложнений, тучности, дислипидемии, расстройств потребления и усвоения энергии,расстройств и нарушения функции гомеостаза температуры тела, расстройств сна и суточного биоритма и сердечно-сосудистых заболеваний. Настоящее изобретение относится к соединениям формулы где R1 представляет собой водород, галоген, цианогруппу, низший алкил, низший алкил, замещенный галогеном, низшую алкоксигруппу, низшую алкоксигруппу, замещенную галогеном, или C(O)NH2,или представляет собой фенил, возможно, содержащий в качестве заместителя галоген, цианогруппу или низшую алкоксигруппу,замещенную галогеном,или представляет собой 2,2 дифторбензо[d][1,3]диоксол-5-ил, или представляет собой 6-(трифторметил)пиразин-2-ил или 5(трифторметил)пиразин-2-ил, или представляет собой 6-(трифторметил)пиримидин-4-ил, или представляет собой 6-(трифторметил)пиридин-3-ил, или представляет собой 5-цианопиразин-2-ил, или представляет собой 2-(трифторметил)пиримидин-4-ил;R2 представляет собой галоген, низший алкил или цианогруппу и R3 представляет собой водород или же R2 представляет собой водород и R3 представляет собой галоген, низший алкил или цианогруппу;R' представляет собой водород или низший алкил;Ar представляет собой фенил или представляет собой гетероарил, выбранный из группы, включающей 1 Н-индазол-3-ил, пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, пиримидин-5-ил, 1 Н-пиразол-3 ил, 1 Н-пиразол-4-ил или 1 Н-пиразол-5-ил,или к их фармацевтически приемлемым кислотно-аддитивным солям. Настоящее изобретение включает все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры. Кроме того, все таутомерные формы соединений формулы I также охвачены настоящим изобретением. К настоящему времени было обнаружено, что соединения формулы I обладают сильным сродством к рецепторам следовых аминов (TAARs), в частности TAAR1. Предложенные соединения можно применять для лечения депрессии, тревожного невроза, биполярного расстройства, синдрома дефицита внимания с гиперактивностью (СДВГ), расстройств, связанных со стрессом, психических расстройств, таких как шизофрения, неврологических заболеваний, таких как болезнь Паркинсона, нейродегенеративных расстройств, таких как болезнь Альцгеймера, эпилепсии,мигрени, гипертонии, наркотической зависимости и токсикомании, а также метаболических расстройств,таких как расстройства приема пищи, диабета, диабетических осложнений, тучности, дислипидемии,расстройств потребления и усвоения энергии, расстройств и нарушения функции гомеостаза температуры тела, расстройств сна и суточного биоритма и сердечно-сосудистых заболеваний. Некоторые физиологические эффекты (т.е. сердечно-сосудистые эффекты, гипотензия, индукция седативного эффекта), о которых сообщалось в отношении соединений, способных связываться с адренергическими рецепторами (WO02/076950, WO97/12874 или ЕР 0717037), могут быть расценены как нежелательные побочные эффекты для лекарственных средств, предназначенных для лечения заболеваний центральной нервной системы, описанных выше. Таким образом, желательно получить лекарственные средства, селективные к TAAR1 рецепторам, но не к адренергическим рецепторам. Объекты по настоящему изобретению демонстрируют селективность к TAAR1 рецепторам над адренергическими рецепторами, в частности хорошую селективность над человеческими и крысиными адренергическими рецепторами альфа 1 и альфа 2. Классические биогенные амины (серотонин, норадреналин, адреналин, дофамин, гистамин) играют важную роль как нейротрансмиттеры в центральной и периферической нервной системе [1]. Их синтез и хранение, а также их деградация и обратный захват после высвобождения жестко регулируются. Известно, что дисбаланс уровня биогенных аминов является причиной измененной функции мозга при многих патологических состояниях [2-5]. Другой класс эндогенных аминосоединений, так называемые следовые амины (TAs), в значительной мере пересекается с классическими биогенными аминами в отношении структуры, метаболизма и внутриклеточной локализации. TAs включают паратирамин, фенилэтиламин, триптамин и октопамин, и они присутствуют в нервной системе млекопитающих, в целом, при более низких концентрациях по сравнению с классическими биогенными аминами [6]. Их дисрегуляцию связывают с различными психическими заболеваниями, такими как шизофрения и депрессия [7], а также с другими состояниями, такими как синдром дефицита внимания с гиперактивностью, головная боль, болезнь Паркинсона, наркотическая зависимость и токсикомания, а также расстройства приема пищи [8, 9]. На протяжении долгого времени существование ТА-специфичных рецепторов лишь гипотетически предполагалось на основании анатомически дискретных высокоаффинных ТА-связывающих сайтов в ЦНС человека и других млекопитающих [10, 11]. Таким образом, считалось, что фармакологические эффекты TAs опосредованы хорошо известным механизмом классических биогенных аминов, как за счет запуска их высвобождения или ингибирования их обратного захвата, так и за счет перекрестной реакции с их рецепторными системами [9, 12, 13]. Эта точка зрения существенно изменилась в связи с недавним открытием нескольких членов нового семейства GPCRs, рецепторов следовых аминов (TAARs) [7, 14]. У человека присутствует 9 генов TAAR (включая 3 псевдогена), у мышей - 16 генов (включая 1 псевдоген). Гены TAAR не содержат интронов (с одним исключением: TAAR2 содержит 1 интрон) и расположены друг за другом в одном и том же сегменте хромосомы. Такое филогенетическое родство рецепторных генов в согласии с тщательным сравнением сходства GPCR-фармакофоров и фармакологическими данными, указывает на то, что эти рецепторы образуют три различных подсемейства [7, 14]. TAAR1 представляет собой первый подкласс, состоящий из четырех генов (TAAR1-4), высоко консервативных у человека и грызунов. TAs активируют TAAR1 через Gas. Было показано, что дисрегуляция TAs вносит свой вклад в этиологию многих заболеваний, таких как депрессия, психоз, синдром дефицита внимания с гиперактивностью, наркотическая зависимость и токсикомания, болезнь Паркинсона, головная боль, расстройства приема пищи, метаболические расстройства, и поэтому лиганды TAAR1 обладают большим потенциалом для лечения подобных заболеваний. Таким образом, имеется повышенный интерес к расширению знаний о рецепторах следовых аминов. Используемые ссылки. 1. Deutch, A.Y. and Roth, R.H. (1999) Neurotransmitters. Напечатано в Fundamental Neuroscience (2ndsubfamilies of novel G protein-coupled receptors, Genomics, 85, 372-385. Объектами настоящего изобретения являются новые соединения формулы I, а также их фармацевтически приемлемые соли, их применение для изготовления лекарственных средств для лечения заболеваний, связанных с биологической функцией рецепторов следовых аминов, их получение, а также лекарственные средства на основе соединения по настоящему изобретению для контроля или профилактики заболеваний, таких как депрессия, тревожный невроз, биполярное расстройство, синдром дефицита внимания с гиперактивностью, расстройства, обусловленные стрессом, психические расстройства, такие как шизофрения, неврологические расстройства, такие как болезнь Паркинсона, нейродегенеративные расстройства, такие как болезнь Альцгеймера, эпилепсия, мигрень, наркотическая зависимость и токсикомания, а также метаболические расстройства, такие как расстройства приема пищи, диабет, диабетические осложнения, тучность, дислипидемия, расстройства потребления и усвоения энергии, расстройства и нарушение функции гомеостаза температуры тела, расстройства сна и суточного биоритма, а также сердечно-сосудистые расстройства. Предпочтительными показаниями к применению соединений по настоящему изобретению являются депрессия, психоз, болезнь Паркинсона, тревожность и синдром дефицита внимания с гиперактивностью (СДВГ), а также диабет. В данном тексте термин "низший алкил" обозначает насыщенную группу с линейной или разветвленной цепью, содержащую от 1 до 7 атомов углерода, такую как метил, этил, пропил, изопропил, нбутил, изобутил, 2-бутил, третбутил и т.п. Предпочтительными алкильными группами являются группы,содержащие 1-4 атома углерода. В данном тексте термин "низшая алкоксигруппа" обозначает группу, в которой алкильный остаток таков, как раскрыто выше, и присоединен через атом кислорода. Термин "галоген" обозначает хлор, иод, фтор и бром. В данном тексте термин "низший алкил, замещенный галогеном" обозначает насыщенную группу с линейной или разветвленной цепью, содержащую от 1 до 7 атомов углерода, как раскрыто для термина"низший алкил", в которой по меньшей мере один атом водорода замещен атомом галогена. Предпочтительным атомом галогена является фтор. Примерами таких групп являются CF3, CHF2, CH2F, CH2CF3 илиCH2CHF2. В данном тексте термин "низшая алкоксигруппа, замещенная галогеном" обозначает алкоксигруппу, раскрытую выше, где один или более атомов водорода замещены галогеном, например ОСН 3, OCHF2,OCH2F, OCH2CF3 или OCH2CHF2. Термин "фармацевтические приемлемые кислотно-аддитивные соли" охватывает соли неорганических и органических кислот, таких как хлороводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.п. Одним из осуществлений настоящего изобретения являются соединения формулы IA где R1 представляет собой водород, галоген, цианогруппу, низший алкил, низший алкил, замещенный галогеном, низшую алкоксигруппу, низшую алкоксигруппу, замещенную галогеном или C(O)NH2,или представляет собой фенил, возможно, содержащий в качестве заместителя галоген, цианогруппу или низшую алкоксигруппу,замещенную галогеном,или представляет собой 2,2 дифторбензо[d][1,3]диоксол-5-ил, или представляет собой 6-(трифторметил)пиразин-2-ил или 5(трифторметил)пиразин-2-ил, или представляет собой 6-(трифторметил)пиримидин-4-ил, или представляет собой 6-(трифторметил)пиридин-3-ил, или представляет собой 5-цианопиразин-2-ил, или представляет собой 2-(трифторметил)пиримидин-4-ил;R2 представляет собой галоген, низший алкил или цианогруппу и R3 представляет собой водород или же R2 представляет собой водород и R3 представляет собой галоген, низший алкил или цианогруппу,или их фармацевтически приемлемые кислотно-аддитивные соли, например следующие соединения: Еще одним осуществлением настоящего изобретения являются соединения формулы IB где R1 представляет собой водород, галоген, цианогруппу, низший алкил, низший алкил, замещенный галогеном, низшую алкоксигруппу, низшую алкоксигруппу, замещенную галогеном или C(O)NH2,или представляет собой фенил, возможно, содержащий в качестве заместителя галоген, цианогруппу или низшую алкоксигруппу,замещенную галогеном,или представляет собой 2,2 дифторбензо[d][1,3]диоксол-5-ил, или представляет собой 6-(трифторметил)пиразин-2-ил или 5(трифторметил)пиразин-2-ил, или представляет собой 6-(трифторметил)пиримидин-4-ил, или представляет собой 6-(трифторметил)пиридин-3-ил, или представляет собой 5-цианопиразин-2-ил, или представляет собой 2-(трифторметил)пиримидин-4-ил;R2 представляет собой галоген, низший алкил или цианогруппу и R3 представляет собой водород или же R2 представляет собой водород и R3 представляет собой галоген, низший алкил или цианогруппу,или их фармацевтически приемлемые кислотно-аддитивные соли, например следующие соединения: Еще одним осуществлением настоящего изобретения являются соединения формулы IC где R1 представляет собой водород, галоген, цианогруппу, низший алкил, низший алкил, замещенный галогеном, низшую алкоксигруппу, низшую алкоксигруппу, замещенную галогеном или C(O)NH2,или представляет собой фенил, возможно, содержащий в качестве заместителя галоген, цианогруппу или низшую алкоксигруппу,замещенную галогеном,или представляет собой 2,2 дифторбензо[d][1,3]диоксол-5-ил, или представляет собой 6-(трифторметил)пиразин-2-ил или 5(трифторметил)пиразин-2-ил, или представляет собой 6-(трифторметил)пиримидин-4-ил, или представляет собой 6-(трифторметил)пиридин-3-ил, или представляет собой 5-цианопиразин-2-ил, или представляет собой 2-(трифторметил)пиримидин-4-ил;R2 представляет собой галоген, низший алкил или цианогруппу и R3 представляет собой водород или R2 представляет собой водород и R3 представляет собой галоген, низший алкил или цианогруппу,или их фармацевтически приемлемые кислотно-аддитивные соли, например следующее соединение: (S)-4-хлор-N-(2-хлор-4-(морфолин-2-ил)фенил)бензамид. Еще одним осуществлением настоящего изобретения являются соединения формулы ID где R1 представляет собой водород, галоген, цианогруппу, низший алкил, низший алкил, замещенный галогеном, низшую алкоксигруппу, низшую алкоксигруппу, замещенную галогеном или C(O)NH2,или представляет собой фенил, возможно, содержащий в качестве заместителя галоген, цианогруппу или низшую алкоксигруппу,замещенную галогеном,или представляет собой 2,2 дифторбензо[d][1,3]диоксол-5-ил, или представляет собой 6-(трифторметил)пиразин-2-ил или 5(трифторметил)пиразин-2-ил, или представляет собой 6-(трифторметил)пиримидин-4-ил, или представляет собой 6-(трифторметил)пиридин-3-ил, или представляет собой 5-цианопиразин-2-ил, или представляет собой 2-(трифторметил)пиримидин-4-ил;R2 представляет собой галоген, низший алкил или цианогруппу и R3 представляет собой водород или же R2 представляет собой водород и R3 представляет собой галоген, низший алкил или цианогруппу;"Hetar" выбирают из группы, включающей 1 Н-индазол-3-ил, пиридин-2-ил, пиридин-3-ил, пиридин 4-ил, пиримидин-5-ил, 1 Н-пиразол-3-ил, 1 Н-пиразол-4-ил или 1 Н-пиразол-5-ил,или их фармацевтически приемлемые кислотно-аддитивные соли, например следующие соединения: Еще одним осуществлением настоящего изобретения являются соединения формулы IE где R1 представляет собой водород, галоген, цианогруппу, низший алкил, низший алкил, замещенный галогеном, низшую алкоксигруппу, низшую алкоксигруппу, замещенную галогеном или C(O)NH2,или представляет собой фенил, возможно, содержащий в качестве заместителя галоген, цианогруппу или низшую алкоксигруппу,замещенную галогеном,или представляет собой 2,2 дифторбензо[d][1,3]диоксол-5-ил, или представляет собой 6-(трифторметил)пиразин-2-ил или 5(трифторметил)пиразин-2-ил, или представляет собой 6-(трифторметил)пиримидин-4-ил, или представляет собой 6-(трифторметил)пиридин-3-ил, или представляет собой 5-цианопиразин-2-ил, или представляет собой 2-(трифторметил)пиримидин-4-ил;R2 представляет собой галоген, низший алкил или цианогруппу и R3 представляет собой водород или же R2 представляет собой водород и R3 представляет собой галоген, низший алкил или цианогруппу; или их фармацевтически приемлемые кислотно-аддитивные соли, например следующие соединения: Еще одним объектом настоящего изобретения является соединение формулы I, где Z представляет собой связь или -СН 2-, например следующие соединения: Еще одним осуществлением настоящего изобретения являются соединения формулы где R1 представляет собой водород, галоген, цианогруппу, низший алкил, низший алкил, замещенный галогеном, низшую алкоксигруппу или представляет собой фенил, возможно, замещенный галогеном;R2 представляет собой галоген, низший алкил или цианогруппу;R' представляет собой водород или низший алкил;Ar представляет собой фенил или гетероарил, выбранный из группы, включающей 1 Н-индазол-3-9 022376 ил, пиридин-3-ил, пиридин-4-ил, 1 Н-пиразол-3-ил, 1 Н-пиразол-4-ил или 1 Н-пиразол-5-ил,или их фармацевтически приемлемые кислотно-аддитивные соли. Предложенные соединения формулы I и их фармацевтически приемлемые соли можно получить способами, известными в данной области техники, например способами, описанными ниже, включающими: а) отщепление N-протекторной группы от соединений формулы где PG представляет собой N-протекторную группу, выбранную из -С(О)О-трет-бутила и других сущностей, описанных выше, и, по желанию, превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли. Получение соединений формулы I по настоящему изобретению можно проводить последовательными или сходящимися путям синтеза. Синтез соединений по настоящему изобретению приведен на следующих схемах 1-7 и в описании 138 конкретных примеров. Навыки, необходимые для проведения реакции и очистки полученных продуктов, доступны специалистам в данной области техники. Заместители и индексы, используемые в следующем далее описании способов, имеют значение, раскрытое ранее,если не указано противоположное. Более подробно, соединения формулы I можно получить представленными ниже способами, способами, приведенными в примерах или аналогичными способами. Подходящие условия реакций для индивидуальных реакционных стадий известны специалисту в данной области техники. Последовательность стадий не ограничивается представленной на схемах 1-7; напротив, в зависимости от исходных веществ и их относительной реакционной способности последовательность стадий реакции можно свободно изменять. Исходные вещества либо имеются в продаже, либо могут быть получены способами, аналогичными приведенным ниже, способами, описанными в источниках, ссылки на которые даны в описании или в примерах, или же способами, известными в данной области техники. Общий способ Схема 1 Заместители таковы, как описано выше, R2 представляет собой F или Cl и R3 представляет собой водород или же R2 представляет собой водород и R3 представляет собой F или Cl. Стадия А. Альфахлоркетон 2 можно получить реакцией гомологизации ацилхлорида 1, включающей последовательно сначала обработку (триметилсилил)диазометаном, а затем обработку концентрированной хлороводородной кислотой. Реакцию проводят в смеси ацетонитрила, THF и диэтилового эфира в качестве растворителя при температуре между 0 С и комнатной. Предпочтительными условиями является смешивание реагентов при 0-5 С с последующим проведением реакции в течение 30 мин при комнатной температуре на первой стадии и смешивание реагентов 0-5 С с последующим проведением реакции в течение 30 мин при комнатной температуре на второй стадии. Стадия В. Образование эпоксида можно осуществить в несколько стадий, включающих восстановление альфа-хлоркетона 2 обработкой восстанавливающим агентом, таким как NaBH4 или LiBH4, в растворителе, таком как МеОН, EtOH, THF, диоксан, с последующей циклизацией получаемого альфахлорспирта обработкой основанием, таким как метоксид натрия, этоксид натрия, трет-бутоксид калия или карбонат цезия в том же растворителе. Предпочтительными условями являются NaBH4 в этаноле при температуре 5 С до комнатной в течение 1 ч с последующей обработкой метоксидом натрия при комнатной температуре в течение 16 ч и затем при 40 С, в течение 1 ч. Стадия С. Нуклеофильное раскрытие кольца можно осуществить обработкой эпоксида 3 с помощью 2-аминоэтанола, возможно, в присутствии органического основания, такого как триэтиламин, N,Nдиизопропилэтиламин или N-метилморфолин в апротонном полярном органическом растворителе, таком как эфир, THF, диоксан или ТВМЕ. Предпочтительными условями являются избыток 2-аминоэтанола в качестве основания в THF при комнатной температуре, в течение 16 ч. Стадия D. Селективную защиту аминогруппы в аминоспирте 4 можно осуществить обработкой дитрет-бутилкарбонатом, возможно, в присутствии органического основания, такого как триэтиламин, N,Nдиизопропилэтиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ. Предпочтительными условями являются дихлорметан в отстутствие основания, при комнатной температуре, в течение 16 ч. Стадия Е. Циклизацию можно осуществить в несколько стадий, включающих получение эфира сульфонновой кислоты путем обработки диола 5 одним эквивалентом метансульфонилхлорида в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или Nметилморфолин, в эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ, с последующей циклизацией путем обработки с помощью не-нуклеофильного основания, такого как третбутоксид калия или 2-метил-2-бутоксид калия, в эфирных растворителях, таких как диэтиловый эфир,диоксан, THF или ТВМЕ. Предпочтительными условиями для первой стадии являются триэтиламин в THF, смешивание реагентов при 0-5 С и затем проведение реакции в течение 30 мин при комнатной температуре, после этого удаление побочного продукта триэтиламина гидрохлорида путем фильтрации. Предпочтительными условиями для второй стадии являются 2-метил-2-бутоксид калия в THF, смешивание реагентов при 0-5 С и затем проведение реакции в течение 1 ч при комнатной температуре. Стадия F. Образование связи C-N можно осуществить обработкой вещества 6 имином бензофенона в присутствии палладиевого или медного катализатора, лиганда и основания, в растворителях, таких как диоксан, DME, THF, толуол, DMF и DMSO, при повышенной температуре, например, с помощью катализируемой палладием реакции Бухвальда-Хартвига. Предпочтительными условями являются катализатор трис-(дибензилиденацетон)дипалладий(0), катализатор (R)-(+)-2,2'-бис-(дифенилфосфино)-1,1'-бинафтил и трет-бутоксид натрия в диоксане при 100 С в течение 1 ч. Стадия G. Снятие N-протекторной группы в соединении 7 можно осуществить гидрированием с помощью водорода при нормальном или повышенном давлении или гидрированием с переносом водорода, с помощью формиата аммония или циклогексадиена в качестве источника водорода, в присутствии катализатора, такого как PtO2, Pd-C или никель Ренея, в растворителях, таких как МеОН, EtOH, H2O, диоксан, THF, HOAc, EtOAc CH2Cl2, CHCl3, DMF или их смеси. Предпочтительными условями являются формиат аммония в присутствии палладия на активированном угле в МеОН, при 60 С, в течение 1 ч. По желанию, рацемическую смесь хирального амина 8 можно разделить на составляющие его энантиомеры с помощью хиральной ВЭЖХ. Стадия Н. Образование амидной связи можно осуществить реакцией конденсации между амином 8 и карбоновой кислотой 9 в присутствии сшивающего агента, такого как DCC, EDC, TBTU или HATU, в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или Nметилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или в эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ. Предпочтительными условиями являются TBTU с N-метилморфолином в THF при 50-60 С, в течение 18-48 ч. Как вариант, образование амидной связи можно осуществить реакцией конденсации между амином 8 и ацилхлоридом 9' в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, в присутствии органического основания, такого как триэтиламин или N,N-диизопропилэтиламин. Предпочтительными условями являются триэтиламин в THF при комнатной температуре в течение 18 ч. По желанию, ацилхлорид 9' можно получить in situ из соответствующей карбоновой кислоты 9, путем обработки оксалилхлоридом в галогенированных растворителях, таких как дихлорметан или 1,2 дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, в присутствии катализатора, такого как DMF. Предпочтительными условями являются дихлорэтан при комнатной температуре в течение 1 ч. Стадия I. Снятие N-протекторной ВОС-группы можно осуществить с) помощью минеральных кислот, таких как HCl, H2SO4 или Н 3 РО 4, или органических кислот, таких как CF3COOH, CHCl2COOH,НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или Н 2 О, при 0-80 С. Предпочтительными условями являются CF3COOH в водном ацетонитриле при 80 С в течение 5 ч или 4 н. HCl в диоксане и THF при 60 С в течение 16 ч. По желанию, рацемическую смесь морфолинов IC-1 или ID-1 можно разделить на составляющие ее энантиомеры с помощью хиральной ВЭЖХ. Заместители таковы, как описано выше, и R2 представляет собой F или Cl, a R3 представляет собой водород, или же R2 представляет собой водород и R3 представляет собой F или Cl, a Y представляет собой связь или -СН 2-. Стадия А. Получение мочевины можно осуществить в одном и том же реакционном сосуде в две стадии, включающих сначале превращение амина 8-1 в соответствующий изоцианат 12, с последующим введением этого изоцианата в реакцию in situ с амином 11. Получение изоцианата можно осуществить обработкой амина 8-1 трифосгеном, дифосгеном или фосгеном в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, в присутствии органического основания, такого как триэтиламин или N,N-диизопропилэтиламин, или неорганического основания, такого как карбонат натрия или карбонат калия. Предпочтительными условиями для получение изоцианата 12 являются трифосген и карбонат натрия в смеси дихлорметана и воды при комнатной температуре в течение 2-3 ч, с последующей обработкой амином 11 в той же смеси растворителей при комнатной температуре в течение 2 ч. Стадия В. Снятие N-протекторной ВОС-группы можно осуществить с помощью минеральных кислот, таких как HCl, H2SO4 или Н 3 РО 4, или органических кислот, таких как CF3COOH, CHCl2COOH,НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или Н 2 О, при 0-80 С. Предпочтительными условями являются CF3COOH в водном ацетонитриле при 80 С в течение 3 ч или 4 н. HCl в диоксане и THF при 60 С в течение 16 ч. По желанию, рацемическую смесь морфолинов IA-1, IE-1 или IB-1 можно разделить на составляющие ее энантиомеры с помощью хиральной ВЭЖХ. Схема 3 Заместители таковы, как описано выше, R2 представляет собой Cl, Br или I, и Z представляет собой связь, -СН 2- или О. Стадия А. Анилины 14 можно региоселективно галогенировать реакцией с одним эквивалентом галогенирующих агентов, таких как N-хлорсукцинимид, N-бромсукцинимид или N-иодсукцинимид. Примеры подходящих анилинов 14 включают производные пирролидина, в которых Z представляет собой связь [CAS 908334-28-1], производные пиперидина, в которых Z представляет собой -СН 2-[CAS 87579879-1], и производные морфолина, в которых Z представляет собой О [CAS 1002726-96-6]. Реакцию проводят в апротонных полярных органических растворителях, таких как DMF или NMP. Предпочтительными условями являются NBS в DMF при комнатной температуре, в течение 15 мин или NCS в DMF при 70 С, в течение 1 ч. Стадия В. Образование амидной связи можно осуществить реакцией конденсации между амином 15 и карбоновой кислотой 9 в присутствии сшивающего агента, такого как DCC, EDC, TBTU или HATU, в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или Nметилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ. Предпочтительными условями являются TBTU с N-метилморфолином в THF при 50-60 С в течение 18-48 ч. Как вариант, образование амидной связи можно осуществить реакцией конденсации между амином 15 и ацилхлоридом 9' в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан,или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, в присутствии органического основания, такого как триэтиламин или N,N-диизопропилэтиламин. Предпочтительными условями являются триэтиламин в THF при комнатной температуре в течение 18 ч. По желанию, ацилхлорид 9' можно получить in situ из соответствующй карбоновой кислоты 9 обработкой оксалилхлоридом в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан,или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, в присутствии катализатора, такого как DMF. Предпочтительными условями являются дихлорэтан при комнатной температуре в течение 1 ч. Стадия С: Снятие N-протекторной ВОС-группы можно осуществить с помощью минеральных кислот, таких как HCl, H2SO4 или Н 3 РО 4, или органических кислот, таких как CF3COOH, CHCl2COOH,НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или Н 2 О, при 0-80 С. Предпочтительными условями являются CF3COOH в водном ацетонитриле при 80 С в течение 5 ч или 4 н. HCl в диоксане и THF при 60 С в течение 16 ч. По желанию, рацемическую смесь морфолинов IC-2 или ID-2 можно разделить на составляющие ее энантиомеры с помощью хиральной ВЭЖХ. Схема 4 Заместители таковы, как описано выше, R2 представляет собой CN и Z представляет собой связь, СН 2- или О. Стадия А. Ароматические нитрильные соединения 17 можно получить реакцией ароматических бром-соединений 15-1 с цианидными солями металлов, таким как цианид калия, цианид натрия или цианид меди(1), возможно, в присутствии палладиевого катализатора. Реакцию проводят в апротонных полярных органических растворителях, таких как DMF или NMP,при повышенной температуре. Предпочтительными условями являются CuCN в NMP при 160 С в течение 5 ч. Стадия В. Образование амидной связи можно осуществить реакцией конденсации между амином 17 и карбоновой кислотой 9 в присутствии сшивающего агента, такого как DCC, EDC, TBTU или HATU,вприсутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин илиN-метилморфолин, в галогенированных растворителях, таких как дихпорметан или 1,2-дихлорэтан,или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ. Предпочтительными условями являются TBTU с N-метилморфолином в THF при 50-60 С в течение 18-48 ч. Как вариант, образование амидной связи можно осуществить реакцией конденсации между амином 17 и ацилхлоридом 9' в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан,или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, в присутствии органического основания, такого как триэтиламин или N,N-диизопропилэтиламин. Предпочтительными условями являются триэтиламин в THF при комнатной температуре в течение 2 ч. По желанию, ацилхлорид 9' можно получить in situ из соответствующей карбоновой кислоты 9 обработкой оксалилхлоридом в галогенированных растворителях, таких как дихпорметан или 1,2 дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, в присутствии катализатора, такого как DMF. Предпочтительными условями являются дихлорэтан при комнатной температуре в течение 1 ч. Стадия С. Снятие N-протекторной ВОС-группы можно осуществить с помощью минеральных кислот, таких как HCl, H2SO4 или Н 3 РО 4, или органических кислот, таких как CF3COOH, CHCl2COOH,НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или Н 2 О, при 0-80 С. Предпочтительными условями являются CF3COOH в водном ацетонитриле при 80 С в течение 5 ч или 4 н. HCl в диоксане и THF при 60 С в течение 16 ч. По желанию, рацемическую смесь морфолинов IC-3 и ID-3 можно разделить на составляющие ее энантиомеры с помощью хиральной ВЭЖХ. Схема 5 Заместители таковы, как описано выше, Z представляет собой связь, -СН 2-или О. Стадия А. Получение мочевины можно осуществить в одном реакционном сосуде в две стадии,включающих сначала превращение амина 17 в соответствующий изоцианат 19 с последующим введением этого изоцианата в реакцию in situ с амином 11. Получение изоцианата можно осуществить обработкой амина 17 трифосгеном, дифосгеном или фосгеном в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, в присутствии органического основания, такого как триэтиламин или N,N-диизопропилэтиламин, или неорганического основания, такого как карбонат натрия или карбонат калия. Предпочтительными условиями для получения изоцианата 19 являются трифосген и карбонат натрия в смеси дихлорметана и воды при комнатной температуре в течение 3 ч, с последующей обработкой амином 11 в той же смеси растворителей при комнатной температуре в течение 24-48 ч. Стадия В: Снятие N-протекторной ВОС-группы можно осуществить с помощью минеральных кислот, таких как HCl, H2SO4 или Н 3 РО 4, или органических кислот, таких как CF3COOH, CHClOOH, НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или Н 2 О при 0-80 С. Предпочтительными условями являются CF3COOH в водном ацетонитриле при 80 С в течение 4 ч или 4 н. HCl в диоксане и THF при 60 С в течение 16 ч. По желанию, рацемическую смесь морфолинов IA-2 и IE-2 можно разделить на составляющие ее энантиомеры с помощью хиральной ВЭЖХ. Заместители таковы, как описано выше. Стадия А. Альфа-галогенкетоны 22 можно получить реакцией гомологизации ацилгалида 21 [например, hal = хлор и алкил = метил, CAS 35675-46-8], включающей последовательную обработку сначала(триметилсилил)диазометаном, а затем обработку концентрированной бромоводородной кислотой или хлороводородной кислотой. Эту реакцию проводят с помощью смеси ацетонитрила, THF и гексана в качестве растворителя при температуре между 0 С и комнатной. Предпочтительными условиями являются смешивание реагентов при 0-5 С с последующим проведением реакции в течение 1 ч при комнатной температуре на первой стадии, и смешивание реагентов при 0-5 С с последующим проведением реакции в течение 30 минут при комнатной температуре на второй стадии. Стадия В. Получение эпоксида можно осуществить в несколько стадий, включающих восстановление альфа-галогенкетонов 22 обработкой восстанавливающим агентом, таким как NaBH4 или LiBH4, в растворителе, таком как МеОН, EtOH, THF, диоксан, с последующей циклизацией получаемого альфагалогенспирта обработкой основанием, таким как метоксид натрия, этоксид натрия, трет-бутоксид калия или карбонат цезия, в том же растворителе. Предпочтительными условиями являются NaBH4 в этаноле при температуре от 5 С до комнатной, в течение 1 ч, с последующей обработкой метоксидом натрия при комнатной температуре в течение 16 ч. Стадия С. Нуклеофильное раскрытие кольца можно осуществить обработкой эпоксида 23 2 аминоэтанолом, возможно, в присутствии органического основания, такого как триэтиламин, N,Nдиизопропилэтиламин или N-метилморфолин, в апротонном полярном органическом растворителе, таком как эфир, THF, диоксан или ТВМЕ. Предпочтительными условями являются использование избытка 2-аминоэтанола в качестве основания в THF при комнатной температуре в течение 16 ч. Стадия D. Селективную защиту аминогруппы в аминоспирте 24 можно осуществить обработкой дитрет-бутилкарбонатом, возможно, в присутствии органического основания, такого как триэтиламин, N,Nдиизопропилэтиламин или N-метилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ. Предпочтительными условями являются THF в отстутствие основания, при комнатной температуре в течение 16 ч. Стадия Е. Циклизацию можно осуществить в несколько стадий, включающих получение сульфонатного эфира путем обработки диола 25 одним эквивалентом метансульфонилхлорида в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ, с последующей циклизацией путем обработки не-нуклеофильным основанием, таким как трет-бутоксид калия или 2-метил-2 бутоксид калия, в эфирных растворителях, таких как диэтиловый эфир, диоксан, THF или ТВМЕ. Предпочтительными условиями для первой стадии являются триэтиламин в THF, смешивание реагентов при 0-5 С и затем проведение реакции в течение 1 ч при комнатной температуре, затем удаление побочного триэтиламина гидрохлорида фильтрацией. Предпочтительными условиями для второй стадии являются 2-метил-2-бутоксид калия в THF, смешивание реагентов при 0-5 С и затем проведение реакции в течение 30 минут при комнатной температуре. Стадия F. Восстановление нитрогруппы в соединении 26 можно осуществить гидрогенированием с помощью водорода при нормальном или повышенном давлении или гидрированием с переносом водорода с помощью формиата аммония или циклогексадиена в качестве источника водорода, с катализатором, таким как PtO2, Pd-C или никель Ренея, в растворителях, таких как МеОН, EtOH, Н 2 О, диоксан,THF, HOAc, EtOAc CH2Cl2, CHCl3, DMF или их смесь. Предпочтительными условями являются формиат аммония в присутствии палладия на активированном угле в МеОН при 60 С в течение 1 ч. Стадия G. Образование амидной связи можно осуществить реакцией конденсации между амином 27 и карбоновой кислоты 9 в присутствии сшивающего агента, такого как DCC, EDC, TBTU или HATU, в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или Nметилморфолин, в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ. Предпочтительными условями являются TBTU с N-метилморфолином в THF при 50-60 С в течение 18-48 ч. Как вариант, образование амидной связи можно осуществить реакцией конденсации между амином 27 и ацилхлоридом 9' в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан,или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, в присутствии органического основания, такого как триэтиламин или N,N-диизопропилэтиламин. Предпочтительными условями являются триэтиламин в THF при комнатной температуре в течение 2 ч. По желанию, ацилхлорид 9 можно получить in situ из соответствующей карбоновой кислоты 9 обработкой оксалилхлоридом в галогенированных растворителях, таких как дихлорметан или 1,2 дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан, THF, DME или ТВМЕ, в присутствии катализатора, такого как DMF. Предпочтительными условями являются дихлорэтан при комнатной температуре в течение 1 ч. Стадия Н. Снятие N-протекторной ВОС-группы можно осуществить с помощью минеральных кислот, таких как HCl, H2SO4 или Н 3 РО 4, или органических кислот, таких как CF3COOH, CHCl2COOH,НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или Н 2 О, при 0-80 С. Предпочтительными условями являются CF3COOH в водном ацетонитриле при 80 С в течение 4 ч или 4 н. HCl в диоксане и THF при 60 С в течение 16 ч. По желанию, рацемическую смесь морфолинов IC-4 и ID-4 можно разделить на составляющие ее энантиомеры с помощью хиральной ВЭЖХ. Схема 7 Заместители таковы, как описано выше, и X представляет собой NH, R2 представляет собой алкил и Стадия А. Получение мочевины можно осуществить в одном реакционном сосуде в две стадии,включающие сначала превращение амина 27 в соответствующий изоцианат 29 с последующей введением этого изоцианата in situ в реакцию с амином 11. Получение изоцианата можно осуществить обработкой амина 27 трифосгеном, дифосгеном или фосгеном в галогенированных растворителях, таких как дихлорметан или 1,2-дихлорэтан, в присутствии органического основания, такого как триэтиламин или N,N-диизопропилэтиламин, или неорганического основания, такого как карбонат натрия или карбонат калия. Предпочтительными условиями для получения изоцианата 29 являются трифосген и карбонат натрия в смеси дихлорметана и воды, при комнатной температуре, в течение 2-3 ч, с последующей обработкой амином 11 в той же смеси растворителей при комнатной температуре в течение 2 ч. Стадия В. Снятие N-протекторной ВОС-группы можно осуществить с помощью минеральных кислот, таких как HCl, H2SO4 или Н 3 РО 4, или органических кислот, таких как CF3COOH, CHCl2COOH,НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, THF, МеОН, EtOH или Н 2 О, при 0-80 С. Предпочтительными условями являются CF3COOH в водном ацетонитриле при 80 С в течение 3 ч или 4 н. HCl в диоксане и THF при 60 С в течение 16 ч. По желанию, рацемическую смесь морфолинов IA-3 и IE-3 можно разделить на составляющие ее энантиомеры с помощью хиральной ВЭЖХ. Выделение и очистка соединений. Выделение и очистку соединений и промежуточных продуктов, описанных в данном тексте, можно осуществить, по желанию, любым удобным способом выделения или очистки, таким как, например,фильтрация, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, толстослойная хроматография, препаративная жидкостная хроматография низкого или высокого давления или комбинация этих способов. Конкретные примеры подходящих способов разделения и выделения можно привести посредством ссылки на способы получения и примеры, данные ниже. При этом, разумеется, также можно применять другие эквивалентные способы разделения или выделения. Рацемические смеси хиральных соединений формулы I можно разделять с помощью хиральной ВЭЖХ. Рацемические смеси хиральных синтетических промежуточных продуктов можно также разделять с помощью хиральной ВЭЖХ. Соли соединений формулы I. Соединения формулы I являются основными, и их можно перевести в соответствующие кислотноаддитивные соли. Такое превращение можно осуществить обработкой с помощью, по меньшей мере,стехиометрического количества подходящей кислоты, такой как хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., а также органической кислоты, такой как уксусная кислота, пропионовая кислота, ликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и т.п. Как правило, свободное основание растворяют в инертном органическом растворителе,таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и т.п., и добавляют кислоту в таком же растворителе. Температуру поддерживают в интервале между 0 и 50 С. Получаемая соль осаждается самопроизвольно или ее можно извлечь из раствора с помощью менее полярного растворителя. Пример 1. R)-2-Фтор-4-морфолин-2-илфенил)амид 6-фтор-1 Н-индазол-3-карбоновой кислоты(30 мл) при 0-5 С при перемешивании добавляли по каплям (триметилсилил)диазометан (13.7 мл, 2 М раствор в диэтиловом эфире). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Анализ с помощью ТСХ показал, что реакция была завершена. Затем по каплям добавляли хлороводородную кислоту (3.81 мл, 37% водн.) при 0-5 С в течение 10 мин и реакционную смесь затем перемешивали при комнатной температуре еще в течение 20 мин. Реакционную смесь вливали в EtOAc и экстрагировали последовательно водным раствором Na2CO3, водой и насыщенным солевым раствором. Органический слой затем высушивали над Na2SO4 и концентрировали в вакууме с получением 2-хлор-1(4-бром-3-фторфенил)этанона (5.67 г) в виде желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. MS (EI): 203 ([81BrM-CH2Cl]+), 201 ([79BrM-CH2Cl]+),175 ([81BrM-CH2ClCO]+), 173 ([79BrM-CH2Cl-CO]+).b) (RS)-2-(4-Бром-3-фторфенил)оксиран. К раствору 2-хлор-1-(4-бром-3-фторфенил)этанона (6.16 г) в этаноле (100 мл) при 5 С добавляли при перемешивании порциями в течение 5 мин NaBH4 (788 мг). Реакционную смесь затем перемешивали при комнатной температуре в течение 1 ч с получением светло-желтого раствора. Анализ с помощью ТСХ показал, что реакция была завершена. Затем добавляли метоксид натрия (562 мг) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Анализ с помощью ТСХ показал, что осталось небольшое количество исходного вещества и поэтому реакционную смесь перемешивали при 40 С в течение 1 ч. Реакционную смесь затем вливали в воду и экстрагировали дважды с помощьюEtOAc. Объединенные органические слои промывали насыщенным солевым раствором, затем высушивали над Na2SO4 и концентрировали в вакууме с получением (RS)-2-(4-бром-3-фторфенил)оксирана (4.69 г) в виде желтого масла, которое использовали на следующей стадии без дополнительной очистки.c) (RS)-1-(4-Бром-3-фторфенил)-2-(2-гидроксиэтиламино)этанол. К раствору (RS)-2-(4-бром-3-фторфенил)оксирана (4.69 г) в THF (11 мл) добавляли при перемешивании 2-аминоэтанол (13.2 мл) и эту смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем вливали в солевой раствор и экстрагировали дважды с помощью EtOAc. Объединенные органические слои высушивали над Na2SO4 и концентрировали в вакууме с получением (RS)1-(4-бром-3-фторфенил)-2-(2-гидроксиэтиламино)этанола (5.37 г) в виде желтого вязкого масла, которое использовали на следующей стадии без дополнительной очистки. MS (ISP): 280.2 ([81BrM+H]+), 278.1(60 мл) добавляли при перемешивании Boc2O (4.00 г) и эту смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем вливали в воду и экстрагировали дихлорметаном. Органический слой промывали последовательно с помощью 1 М водного раствора HCl, насыщенного водного раствора NaHCO3 и насыщенного солевого раствора, затем высушивали над Na2SO4 и концентрировали в вакууме. Остаток очищали флэш-хроматографией на колонке (силикигель; градиент: 0-10% МеОН в дихлорметане) с получением трет-бутилового эфира (RS)-[2-(4-бром-3-фторфенил)-2-гидроксиэтил]-(2 гидроксиэтил)карбаминовой кислоты (3.89 г, 45% за 4 стадии) в виде светло-желтого вязкого масла. MS(RS)-[2-(4-бром-3-фторфенил)-2-гидроксиэтил]-(2 гидроксиэтил)карбаминовой кислоты (3.88 г) и триэтиламина (1.71 мл) в THF (40 мл) при 0-5 С добавляли при перемешивании по каплям метансульфонилхлорид (873 мкл). Реакционную смесь затем перемешивали при комнатной температуре в течение 30 мин с получением белой суспензии. Реакционную смесь затем фильтровали для удаления триэтиламина гидрохлорида, промывали фильтр с помощью THF(6 мл). Фильтрат охлаждали до 0-5 С и добавляли 2-метил-2-бутоксид калия (9.05 мл, 1.7 М раствор в толуоле). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем вливали в воду и экстрагировали дважды с помощью EtOAc. Объединенные органические слои высушивали надNa2SO4 и концентрировали в вакууме. Остаток очищали флэш-хроматографией на колонке (силикигель; градиент: 0-30% EtOAc в гексане) с получением трет-бутилового эфира (RS)-2-(4-бром-3 фторфенил)морфолин-4-карбоновой кислоты (1.73 г, 47%) в виде оранжевого вязкого масла. MS (ISP): 306.1 ([81BrM+H-C4H8]+), 304.1 ([79BrM+H-C4H8]+), 262.0 ([81BrM+H-C4H8-CO2]+), 260.1(1.57 г) и имина бензофенона (1.15 мл) в толуоле (40 мл) добавляли при перемешивании трет-бутоксид натрия (691 мг). Через реакционную смесь продували аргон в течение 10 мин. Добавляли (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил (280 мг) и трис-(дибензилиден-ацетон)дипалладий(0) (120 мг), реакционную смесь нагревали до 100 С и перемешивали в течение 1 ч. Реакционную смесь вливали в воду и экстрагировали дважды с помощью EtOAc. Органические слои высушивали над Na2SO4 и концентрировали в вакууме. Остаток очищали флэш-хроматографией на колонке (силикигель; градиент: 0-30% EtOAc в гексане) с получением трет-бутилового эфира(RS)-2-[4-(бензгидрилиденамино)-3 фторфенил]морфолин-4-карбоновой кислоты (2.215 г, количеств.) в виде желтого вязкого масла. MSg) трет-Бутиловый эфир (RS)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты. К раствору трет-бутилового эфира (RS)-2-[4-(бензгидрилиденамино)-3-фторфенил]морфолин-4 карбоновой кислоты (2.21 г) в метаноле (40 мл) добавляли при перемешивании формиат аммония (4.54 г). Реакционную смесь дегазировали барботированием аргона через эту смесь в течение нескольких минут. Затем добавляли 10% палладий на активированном угле (255 мг) и реакционную смесь перемешива- 19022376 ли при 60 С в течение 1 ч. Реакционную смесь затем фильтровали через целит, фильтрат вливали в 1 М водный NaOH и экстрагировали дважды с помощью EtOAc. Объединенные органические слои высушивали над Na2SO4 и концентрировали в вакууме. Остаток очищали флэш-хроматографией на колонке (силикигель; градиент: 0-30% EtOAc в гексане) с получением трет-бутилового эфира (RS)-2-(4-амино-3 фторфенил)морфолин-4-карбоновой кислоты (1.42 г, 74%) в виде белого твердого вещества. MS (ISP): 319.2 ([M+Na]+), 297.3 ([М+Н]+), 241.2 ([М+Н-С 4 Н 8]+), 197.2 ([М+Н-С 4 Н 8-СО 2]+).h) трет-Бутиловый эфир (+)-(R)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты и третбутиловый эфир (-)-(S)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты. Энантиомеры трет-бутилового эфира (RS)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты разделяли с помощью хиральной ВЭЖХ (колонка: Chyralpak AD, 550 см; элюент: 10% изопропанол/гептан; давление: 18 бар; скорость потока: 35 мл/мин) с получением трет-бутилового эфира (+)-(R)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты (146 мг,светло-желтое твердое вещество), время удерживания = 62 мин; трет-бутилового эфира (-)-(S)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты (153 мг,грязно-белое твердое вещество), время удерживания = 74 мин.i) трет-Бутиловый эфир (R)-2-(3-фтор-4-[(6-фтор-1 Н-индазол-3-карбонил)амино]фенил)морфолин 4-карбоновой кислоты. К суспензии трет-бутилового эфира (+)-(R)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты (40 мг) в THF (6 мл) и DMF (2 мл) при перемешивании добавляли последовательно Nметилморфолин (0.12 мл), TBTU (128 мг) и 6-фтор-1 Н-индазол-3-карбоновую кислоту (47 мг, CAS 129295-30-3), эту смесь нагревали при 50 С в течение 24 ч и затем при 60 С в течение 18 ч. Эту смесь затем концентрировали в вакууме и остаток очищали хроматографией на колонке (SiO2; градиент: гептан/EtOAc) с получением трет-бутилового эфира(R)-2-3-фтор-4-[(6-фтор-1 Н-индазол-3 карбонил)амино]фенилморфолин-4-карбоновой кислоты (15 мг, 24%) в виде белого твердого вещества.j) R)-2-Фтор-4-морфолин-2-илфенил)амид 6-фтор-1 Н-индазол-3-карбоновой кислоты. К раствору трифторуксусной кислоты (38 мкл) в воде (1.5 мл) добавляли при перемешивании раствор трет-бутилового эфира (R)-2-3-фтор-4-[(6-фтор-1 Н-индазол-3-карбонил)амино]фенилморфолин-4 карбоновой кислоты (15 мг) в ацетонитриле (0.5 мл). Сосуд с реакционной смесью затем укупоривали и эту смесь встрхивали при 80 С в течение 5 ч. Реакционную смесь затем охлаждали до комнатной температуре и вливали в 1 М водный NaOH, полученную смесь экстрагировали дважды с помощью EtOAc. Органические слои высушивали над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией на колонке (Isolute Flash-NH2 производства Separtis; градиент:MeOH/EtOAc/гептан) с получением R)-2-фтор-4-морфолин-2-илфенил)амида 6-фтор-1 Н-индазол-3 карбоновой кислоты (9 мг, 77%) в виде белого твердого вещества. MS (ISP): 359.1 ([М+Н]+). Пример 2. S)-2-Фтор-4-морфолин-2-илфенил)амид 6-фтор-1 Н-индазол-3-карбоновой кислоты Указанное в заголовке соединение получали по аналогии с примером 1 с помощью трет-бутилового эфира (-)-(S)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты вместо трет-бутилового эфира(+)-(R)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты на стадии i). Белое твердое вещество. а) трет-Бутиловый эфир (R)-2-4-[3-(3-цианофенил)уреидо]-3-фторфенилморфолин-4-карбоновой кислоты. К раствору трет-бутилового эфира (+)-(R)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты (60 мг, пример 1h) в дихлорметане (2 мл) добавляли при перемешивании трифосген (22 мг). Затем добавляли раствор карбоната натрия (43 мг) в воде (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2.5 ч. Анализ с помощью ТСХ показал, что исходное вещество прореагировало. Затем добавляли 3-аминобензонитрил (48 мг, CAS 2237-30-1) и реакционную смесь перемешивали при комнатной температуре еще в течение 2 ч. Анализ с помощью ТСХ показал, что реакция была завершена. Реакционную смесь вливали в дихлорметан и экстрагировали водой. Органический слой отделяли, высушивали над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке (SiO2; градиент: 0-80% EtOAc в гексане) с получением трет-бутилового эфира (R)-2-4- 20022376[3-(3-цианофенил)уреидо]-3-фторфенилморфолин-4-карбоновой кислоты (95 мг, количеств.) в виде белого твердого вещества. MS (ISP): 439.2 ([М-Н]-).b) 1-(3-Цианофенил)-3-R)-2-фтор-4-морфолин-2-илфенил)мочевина. К раствору трифторуксусной кислоты (216 мкл) в воде (4.5 мл) при перемешивании добавляли раствор трет-бутилового эфира (R)-2-4-[3-(3-цианофенил)уреидо]-3-фторфенилморфолин-4-карбоновой кислоты (85 мг) в ацетонитриле (2 мл). Сосуд с реакционной смесью затем укупоривали и эту смесь встрхивали при 80 С в течение 3 ч. Реакционную смесь затем охлаждали до комнатной температуры,вливали в 1 М водный NaOH и полученную смесь экстрагировали дважды с помощью EtOAc. Органические слои высушивали над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией на колонке (Isolute Flash-NH2 производства Separtis); градиент: гептан/EtOAc/МеОН) с получением 1-(3-цианофенил)-3-R)-2-фтор-4-морфолин-2-илфенил)мочевины (45 мг, 61%) в виде белого твердого вещества. MS (ISP): 341.1 ([М+Н]+). Пример 4. 1-(3-Цианофенил)-3-S)-2-фтор-4-морфолин-2-илфенил)мочевина Указанное в заголовке соединение получали по аналогии с примером 3 с помощью трет-бутилового эфира (-)-(S)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты вместо трет-бутилового эфира(+)-(R)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты на стадии а). Белое твердое вещество. а) 1-(4-Бром-3-хлорфенил)-2-хлорэтанон. К раствору 4-бром-3-хлорбензоилхлорида (11 г, CAS 21900-32-3) в ацетонитриле (50 мл) и THF (50 мл) при 0-5 С при перемешивании добавляли по каплям (триметилсилил)диазометан (26.0 мл, 2 М раствор в диэтиловом эфире). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Анализ с помощью ТСХ показал, что реакция была завершена. Затем добавляли по каплям хлороводородную кислоту(7.22 мл, 37% водн.) при 0-5 С в течение 10 мин и реакционную смесь затем перемешивали при комнатной температуре еще в течение 20 мин. Реакционную смесь вливали в EtOAc и экстрагировали последовательно водным раствором Na2CO3, водой и насыщенным солевым раствором. Органический слой затем высушивали над Na2SO4 и концентрировали в вакууме с получением 1-(4-бром-3-хлорфенил)-2 хлорэтанона (11.0 г, 95%) в виде светло-коричневого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. MS (EI): 221 ([81Br37ClM-CH2Cl]+), 219b) (RS)-2-(4-Бром-3-хлорфенил)оксиран. К раствору 1-(4-бром-3-хлорфенил)-2-хлорэтанона (18.4 г) в этаноле (200 мл) при 5 С добавляли порциями при перемешивании в течение 5 мин NaBH4 (2.23 г). Реакционную смесь затем перемешивали при комнатной температуре в течение 90 мин с получением светло-желтого раствора. Анализ с помощью ТСХ показал, что реакция была завершена. Затем добавляли метоксид натрия (1.59 г) и реакционную смесь перемешивали при 50 С в течение 4 ч. Анализ с помощью ТСХ показал, что реакция была завершена. Реакционную смесь затем вливали в ТВМЕ и экстрагировали насыщенным солевым раствором. Органический слой высушивали над Na2SO4 и концентрировали в вакууме с получением (RS)-2-(4-бром 3-хлорфенил)оксирана (15.2 г) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки.c) (RS)-1-(4-Бром-3-хлорфенил)-2-(2-гидроксиэтиламино)этанол. К раствору (RS)-2-(4-бром-3-хлорфенил)оксирана (15.2 г) в THF (40 мл) добавляли при перемешивании 2-аминоэтанол (35.1 мл) и эту смесь перемешивали при комнатной температуре в течение 7 ч. Реакционную смесь затем вливали в солевой раствор и экстрагировали дважды с помощью EtOAc. Объединенные органические слои высушивали над Na2SO4 и концентрировали в вакууме с получением (RS)-1(4-бром-3-хлорфенил)-2-(2-гидроксиэтиламино)этанола (19.0 г) в виде желтого масла, которое использовали на следующей стадии без дополнительной очистки. MS (ISP): 298.1 ([81Br37ClM+H]+), 296.0d) трет-Бутил-(RS)-2-(4-бром-3-хлорфенил)-2-гидроксиэтил(2-гидроксиэтил)карбамат. К раствору (RS)-1-(4-бром-3-хлорфенил)-2-(2-гидроксиэтиламино)этанола (19.0 г) в THF (200 мл) при 0 С добавляли при перемешивании Boc2O (14.1 г) и эту смесь затем перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем вливали в этилацетат и экстрагировали последовательно 1 М водным NaOH и насыщенным солевым раствором. Органический слой высушивали над(12.7 г) и триэтиламина (6.72 мл) в THF (150 мл) при 0-5 С добавляли при перемешивании по каплям метансульфонилхлорид (2.76 мл). Реакционную смесь затем перемешивали при комнатной температуре в течение 1 ч с получением белой суспензии. Реакционную смесь затем фильтровали для удаления триэтиламина гидрохлорида, фильтр промывали с помощью THF (20 мл). Фильтрат охлаждали до 0-5 С и добавляли 2-метил-2-бутоксид калия (28.4 мл, 1.7 М раствор в толуоле). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, затем вливали в EtOAc и экстрагировали последовательно разбавленной водной HCl, водой и насыщенным солевым раствором. Органический слой высушивали над Na2SO4 и концентрировали в вакууме. Остаток очищали флэш-хроматографией на колонке (силикигель; градиент: 0-50% EtOAc в гексане) с получением трет-бутил-(RS)-2-(4-бром-3 хлорфенил)морфолин-4-карбоксилата (9.32 г, 77%) в виде желтого масла. MS (ISP): 324.0f) трет-Бутил-(RS)-2-(3-хлор-4-(дифенилметиленамино)фенил)морфолин-4-карбоксилат. К раствору трет-бутил-(RS)-2-(4-бром-3-хлорфенил)морфолин-4-карбоксилата (0.50 г) и имина бензофенона (253 мг) в толуоле (5 мл) добавляли при перемешивании трет-бутоксид натрия (204 мг). Через реакционную смесь продували аргон в течение 10 мин. Добавляли (R)-(+)-2,2'-бис-(дифенилфосфино)1,1'-бинафтил (82.7 мг) и трис-(дибензилиденацетон)дипалладий(0) (36.5 мг) и реакционную смесь нагревали при 90 С в течение ночи. Реакционную смесь вливали в EtOAc и экстрагировали последовательно разбавленной водной HCl, водой и насыщенным солевым раствором. Органический слой высушивали над Na2SO4 и концентрировали в вакууме. Остаток очищали флэш-хроматографией на колонке (силикигель; градиент: 0-50% EtOAc в гексане) с получением трет-бутил-(RS)-2-(3-хлор-4(дифенилметиленамино)фенил)морфолин-4-карбоксилата (639 мг, количеств.) в виде желтого масла. MS(0.63 г) в метаноле (8 мл) добавляли при перемешивании ацетат натрия (325 мг) и гидроксиламин гидрохлорид (202 мг). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч и затем при 60 С в течение 5 ч. Реакционную смесь затем концентрировали в вакууме и остаток очищали флэшхроматографией на колонке (силикигель; градиент: 0-70% EtOAc в гексане) с получением трет-бутил(RS)-2-(4-амино-3-хлорфенил)морфолин-4-карбоксилата (345 мг, 84%) в виде белого твердого вещества.h) трет-Бутил-(RS)-2-(3-хлор-4-(3-(3-цианофенил)уреидо)фенил)морфолин-4-карбоксилат. К раствору трет-бутил-(RS)-2-(4-амино-3-хлорфенил)морфолин-4-карбоксилата (70 мг) в дихлорметане (2 мл) добавляли при перемешивании трифосген (25 мг). Затем добавляли раствор карбоната натрия(47 мг) в воде (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2.5 ч. Анализ с помощью ТСХ показал, что исходное вещество прореагировало. Затем добавляли 3 аминобензонитрил (53 мг, CAS 2237-30-1) и реакционную смесь перемешивали при комнатной температуре еще в течение 2 ч. Анализ с помощью ТСХ показал, что реакция была завершена. Реакционную смесь вливали в дихлорметан и экстрагировали водой. Органический слой отделяли, высушивали над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке (SiO2; градиент: 0-30%EtOAc в гексане) с получением трет-бутил-(RS)-2-(3-хлор-4-(3-(3 цианофенил)уреидо)фенил)морфолин-4-карбоксилата (114 мг, количеств.) в виде аморфного белого твердого вещества. MS (ISP): 457.2 ([37ClM-Н]-), 455.2 ([35ClM-H]).i) (RS)-1-(2-Хлор-4-(морфолин-2-ил)фенил)-3-(3-цианофенил)мочевина. К раствору трифторуксусной кислоты (225 мкл) в воде (4.5 мл) добавляли при перемешивании раствор трет-бутил-(RS)-2-(3-хлор-4-(3-(3-цианофенил)уреидо)фенил)морфолин-4-карбоксилата (114 мг) в ацетонитриле (2 мл). Сосуд с реакционной смесью затем укупоривали и эту смесь встрхивали при 80 С в течение 3 ч. Реакционную смесь затем охлаждали до комнатной температуре и вливали в 1 М водныйNaOH, полученную смесь экстрагировали дважды с помощью EtOAc. Органические слои высушивали над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией на колонке (Isolute Flash-NH2 производства Separtis); градиент: гептан/EtOAc/МеОН) с получением (RS)1-(2-хлор-4-(морфолин-2-ил)фенил)-3-(3-цианофенил)мочевины (58 мг, 72%) в виде белого твердого вещества. MS (ISP): 359.1 ([37ClM+H]+), 357.1 ([35ClM+H]+). Примеры 6 и 7. (S)-1-(2-Хлор-4-(морфолин-2-ил)фенил)-3-(3-цианофенил)мочевина и (R)-1-(2-хлор 4-(морфолин-2-ил)фенил)-3-(3-цианофенил)мочевина Энантиомеры (RS)-1-(2-хлор-4-(морфолин-2-ил)фенил)-3-(3-цианофенил)мочевины (49 мг, пример 5) разделяли с помощью хиральной ВЭЖХ (колонка: Chyralpak AD, 550 см; элюент: 40% этанол/гептан; давление: 18 бар; скорость потока: 35 мл/мин) с получением Указанное в заголовке соединение получали по аналогии с примером 3 с помощью 6-хлорпиридин 3-амина (CAS 5350-93-6) вместо 3-аминобензонитрила на стадии а). Белое твердое вещество. MS (ISP): 353.1 ([37ClM+H]+), 351.1 ([35ClM+H]+). Пример 9. 1-(6-Хлорпиридин-3-ил)-3-S)-2-фтор-4-морфолин-2-илфенил)мочевина Указанное в заголовке соединение получали по аналогии с примером 3 с помощью трет-бутилового эфира (-)-(S)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты вместо трет-бутилового эфира Указанное в заголовке соединение получали по аналогии с примером 3 с помощью 6(трифторметил)пиридин-3-амина (CAS 106877-33-2) вместо 3-аминобензонитрила на стадии а). Белое твердое вещество. MS (ISP): 385.1 ([М+Н]+). Пример 11. 1-S)-2-Фтор-4-морфолин-2-илфенил)-3-(6-трифторметилпиридин-3-ил)мочевина Указанное в заголовке соединение получали по аналогии с примером 3 с помощью трет-бутилового эфира (-)-(S)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты вместо трет-бутилового эфира Указанное в заголовке соединение получали по аналогии с примером 1 с помощью 1-(4 фторфенил)-1 Н-пиразол-3-карбоновой кислоты (CAS 1152535-34-6) вместо 6-фтор-1 Н-индазол-3 карбоновой кислоты на стадии i). Белое твердое вещество. MS (ISP): 385.1 ([М+Н]+). Пример 13. S)-2-Фтор-4-морфолин-2-илфенил)амид 1-(4-фторфенил)-1 Н-пиразол-3-карбоновой кислоты Указанное в заголовке соединение получали по аналогии с примером 1 с помощью трет-бутилового эфира (-)-(S)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты вместо трет-бутилового эфира(+)-(R)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты и 1-(4-фторфенил)-1 Н-пиразол-3 карбоновой кислоты (CAS 1152535-34-6) вместо 6-фтор-1 Н-индазол-3-карбоновой кислоты на стадии i). Белое твердое вещество. MS (ISP): 385.1 ([М+Н]+). Пример 14. (RS)-1-(2-Хлор-4-морфолин-2-илфенил)-3-(6-хлорпиридин-3-ил)мочевина Указанное в заголовке соединение получали по аналогии с примером 5 с помощью 6-хлорпиридин 3-амина (CAS 5350-93-6) вместо 3-аминобензонитрила на стадии h). Грязно-белое твердое вещество. MS Указанное в заголовке соединение получали по аналогии с примером 3 с помощью 3(аминометил)бензонитрила (CAS 10406-24-3) вместо 3-аминобензонитрила на стадии а). Грязно-белое аморфное твердое вещество. MS (ISP): 355.2 ([М+Н]+). Пример 16. 1-(3-Цианобензил)-3-S)-2-фтор-4-морфолин-2-илфенил)мочевина Указанное в заголовке соединение получали по аналогии с примером 3 с помощью трет-бутилового эфира (-)-(S)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты вместо трет-бутилового эфира Указанное в заголовке соединение получали по аналогии с примером 1 с помощью трет-бутилового эфира (-)-(S)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты вместо трет-бутилового эфира карбоновой кислоты (CAS 10250-64-3) вместо 6-фтор-1 Н-индазол-3-карбоновой кислоты на стадии i). Белое твердое вещество. MS (ISP): 381.3 ([М+Н]+). Пример 18. (RS)-N-(2-Хлор-4-(морфолин-2-ил)фенил)-1-(4-фторфенил)-1 Н-пиразол-4-карбоксамид а) трет-Бутил-(RS)-2-(3-хлор-4-(1-(4-фторфенил)-1 Н-пиразол-4-карбоксамидо)фенил)морфолин-4 карбоксилат. К суспензии 1-(4-фторфенил)-1 Н-пиразол-4-карбоновой кислоты (69 мг, CAS 138907-81-0) в дихлорэтане (2 мл) добавляли при перемешивании оксалилхлорид (67 мкл) и DMF (2 капли). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и затем концентрировали в вакууме. Остаток растворяли в THF (1 мл) и полученный раствор добавляли по каплям при перемешивании к раствору трет-бутил-(RS)-2-(4-амино-3-хлорфенил)морфолин-4-карбоксилата (80 мг, пример 5 д и триэтиламина (178 мкл) в THF (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Неочищенную реакционную смесь затем концентрировали в вакууме и остаток очищали хроматографией на колонке (SiO2; градиент: 0-50% EtOAc в гептане) с получением трет-бутил-(RS)-2-(3-хлор-4-(1(4-фторфенил)-1 Н-пиразол-4-карбоксамидо)фенил)морфолин-4-карбоксилата (102 мг, 80%) в виде белого твердого вещества. MS (ISP): 520.3 ([37ClM+NH4]+), 518.2 ([35ClM+NH4]+), 503.1 ([37ClM+H]+),501.1 ([35ClM+H]+), 447.1 ([37ClM+H-C4H8]+), 445.1 ([35ClM+H-C4H8]+).b) (RS)-N-(2-Хлор-4-(морфолин-2-ил)фенил)-1-(4-фторфенил)-1 Н-пиразол-4-карбоксамид. К раствору трифторуксусной кислоты (200 мкл) в воде (4.5 мл) добавляли при перемешивании раствор трет-бутил-(RS)-2-(3-хлор-4-(1-(4-фторфенил)-1 Н-пиразол-4-карбоксамидо)фенил)морфолин-4 карбоксилата (100 мг) в ацетонитриле (3 мл). Сосуд с реакционной смесью затем укупоривали и эту смесь встрхивали при 80 С в течение 5 ч. Реакционную смесь затем охлаждали до комнатной температуры, вливали в 1 М водный NaOH и полученную смесь экстрагировали дважды с помощью EtOAc. Органические слои высушивали над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией на колонке (Isolute Flash-NH2 производства Separtis); градиент:MeOH/EtOAc/гептан) с получением (RS)-N-(2-хлор-4-(морфолин-2-ил)фенил)-1-(4-фторфенил)-1 Нпиразол-4-карбоксамида (77 мг, 96%) в виде белого твердого вещества. MS (ISP): 403.1 ([37ClM+H]+),401.0 ([35ClM+H]+). Примеры 19 и 20. (S)-1-(2-Хлор-4-морфолин-2-илфенил)-3-(6-хлорпиридин-3-ил)мочевина и (R)-1(2-хлор-4-морфолин-2-илфенил)-3-(6-хлорпиридин-3-ил)мочевина Энантиомеры (RS)-1-(2-хлор-4-морфолин-2-илфенил)-3-(6-хлорпиридин-3-ил)мочевины (42 мг,пример 14) разделяли с помощью хиральной ВЭЖХ (колонка: Chyralpak AD, 550 см; элюент: 40% этанол/гептан; давление: 18 бар; скорость потока: 35 мл/мин) с получением Указанное в заголовке соединение получали по аналогии с примером 1 с помощью 1-(4 фторфенил)-1 Н-пиразол-4-карбоновой кислоты (CAS 138907-81-0) вместо 6-фтор-1 Н-индазол-3 карбоновой кислоты на стадии i). Белое твердое вещество. MS (ISP): 385.1 ([М+Н]+). Указанное в заголовке соединение получали по аналогии с примером 1 с помощью трет-бутилового эфира (-)-(S)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты вместо трет-бутилового эфира(+)-(R)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты и 1-(4-фторфенил)-1 Н-пиразол-4 карбоновой кислоты (CAS 138907-81-0) вместо 6-фтор-1 Н-индазол-3-карбоновой кислоты на стадии i). Белое твердое вещество. MS (ISP): 385.1 ([М+Н]+). Пример 23. R)-2-Фтор-4-морфолин-2-илфенил)амид 2-метил-5-фенил-2 Н-пиразол-3-карбоновой кислоты(R)-2-(3-фтор-4-[(2-метил-5-фенил-2 Н-пиразол-3-карбонил)амино]фенил)морфолин-4-карбоновой кислоты. К суспензии 1-метил-3-фенил-1 Н-пиразол-5-карбоновой кислоты (46 мг, CAS 10250-64-3) в дихлорэтане (2 мл) добавляли при перемешивании оксалилхлорид (44 мкл) и DMF (2 капли). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и затем концентрировали в вакууме. Остаток растворяли в THF (1 мл) и полученный раствор добавляли по каплям при перемешивани к раствору трет-бутилового эфира (+)-(R)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты (50 мг, пример 1h) и триэтиламина (118 мкл) в THF (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Неочищенную реакционную смесь затем концентрировали в вакууме и остаток очищали хроматографией на колонке (SiO2; градиент: 0-50% EtOAc в гептане) с получением третбутилового эфира (R)-2-3-фтор-4-[(2-метил-5-фенил-2 Н-пиразол-3-карбонил)амино]фенилморфолин-4 карбоновой кислоты (81 мг, количеств.) в виде белого твердого вещества. MS (ISP): 503.1 ([M+Na]+),481.3 ([М+Н]+), 425.2 ([М+Н-С 4 Н 8]+).b) R)-2-Фтор-4-морфолин-2-илфенил)амид 2-метил-5-фенил-2 Н-пиразол-3-карбоновой кислоты. К раствору трифторуксусной кислоты (124 мкл) в воде (4 мл) добавляли при перемешивании раствор трет-бутилового эфира(R)-2-3-фтор-4-[(2-метил-5-фенил-2 Н-пиразол-3-карбонил)амино]фенилморфолин-4-карбоновой кислоты (78 мг) в ацетонитриле (2 мл). Сосуд с реакционной смесью затем укупоривали и эту смесь встрхивали при 80 С в течение 4 ч. Реакционную смесь затем охлаждали до комнатной температуры, вливали в 1 М водный NaOH и полученную смесь экстрагировали дважды с помощью EtOAc. Органические слои высушивали над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией на колонке (Isolute Flash-NH2 производства Separtis); градиент: EtOAc/гептан) с получением R)-2-фтор-4-морфолин-2-илфенил)амида 2-метил-5-фенил-2 Нпиразол-3-карбоновой кислоты (49 мг, 79%) в виде белого твердого вещества. MS (ISP): 381.3 ([М+Н]+). Пример 24. 2-Хлор-N-R)-2-фтор-4-морфолин-2-илфенил)-6-метоксиизоникотинамид Указанное в заголовке соединение получали по аналогии с примером 23 с помощью 2-хлор-6 метоксиизоникотиновой кислоты (CAS 15855-06-8) вместо 1-метил-3-фенил-1 Н-пиразол-5-карбоновой кислоты на стадии а). Белое твердое вещество. MS (ISP): 368.1 ([37ClM+H]+), 366.2 ([35ClM+H]+). Пример 25. 2-Хлор-N-S)-2-фтор-4-морфолин-2-илфенил)-6-метоксиизоникотинамид Указанное в заголовке соединение получали по аналогии с примером 23 с помощью третбутилового эфира (-)-(S)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты вместо трет- 26022376 бутилового эфира (+)-(R)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты и 2-хлор-6 метоксиизоникотиновой кислоты (CAS 15855-06-8) вместо 1-метил-3-фенил-1 Н-пиразол-5-карбоновой кислоты на стадии а). Белое твердое вещество. MS (ISP): 368.1 ([37ClM+H]+), 366.1 ([35ClM+H]+). Пример 26. 1-(3-Циано-5-фторфенил)-3-S)-2-фтор-4-морфолин-2-илфенил)мочевина Указанное в заголовке соединение получали по аналогии с примером 3 с помощью трет-бутилового эфира (-)-(S)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты вместо трет-бутилового эфира Указанное в заголовке соединение получали по аналогии с примером 3 с помощью трет-бутилового эфира (-)-(S)-2-(4-амино-3-фторфенил)морфолин-4-карбоновой кислоты вместо трет-бутилового эфираa) трет-Бутил-(RS)-2-(4-амино-3-бромфенил)морфолин-4-карбоксилат. К раствору трет-бутил-(RS)-2-(4-аминофенил)морфолин-4-карбоксилата (3.07 г, CAS-1002726-96-6) в DMF (30 мл) добавляли при перемешивании NBS (1.96 г) и эту смесь перемешивали при комнатной температуре в течение 15 мин. Реакционную смесь затем вливали в EtOAc и экстрагировали последовательно водой и насыщенным солевым раствором. Органический слой высушивали над Na2SO4 и затем концентрировали в вакууме с получением трет-бутил-(RS)-2-(4-амино-3-бромфенил)морфолин-4 карбоксилата (4.0 г, количеств.) в виде светло-коричневого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. MS (ISP): 359.0 ([81BrM+H]+), 357.0 ([79BrM+H]+),303.0 ([81BrM+H-C4H8]+), 301.0 ([79BrM+H-C4H8]+).b) трет-Бутил-(RS)-2-(4-амино-3-цианофенил)морфолин-4-карбоксилат. К раствору трет-бутил-(RS)-2-(4-амино-3-бромфенил)морфолин-4-карбоксилата (3.76 г) в NMP (30 мл) добавляли при перемешивании CuCN (1.77 г) и реакционную смесь затем перемешивали при 160 С в течение 5 ч. Эту смесь затем охлаждали до комнатной температуры и вливали в EtOAc. Полученную суспензию фильтровали через спеченное стекло и фильтрат экстрагировали последовательно водой и насыщенным солевым раствором. Органический слой высушивали над Na2SO4 и концентрировали в вакууме. Остаток очищали флэш-хроматографией на колонке (силикигель; градиент: 0-60% EtOAc в гептане) с получением трет-бутил-(RS)-2-(4-амино-3-цианофенил)морфолин-4-карбоксилата (659 мг, 21%) в виде желтого твердого вещества. MS (ISP): 321.2 ([M+NH4]+), 304.2 ([М+Н]+).c) трет-Бутил-(RS)-2-(3-циано-4-(1-(4-фторфенил)-1 Н-пиразол-3-карбоксамидо)фенил)морфолин-4 карбоксилат. К суспензии 1-(4-фторфенил)-1 Н-пиразол-3-карбоновой кислоты (52 мг, CAS 1152535-34-6) в дихлорэтане (2 мл) добавляли при перемешивании оксалилхлорид (61 мкл) и DMF (2 капли). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и затем концентрировали в вакууме. Остаток растворяли в THF (1 мл) и полученный раствор добавляли по каплям при перемешивании к раствору трет-бутил-(RS)-2-(4-амино-3-цианофенил)морфолин-4-карбоксилата (70 мг) и триэтиламина (161 мкл) в THF (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Неочищенную реакционную смесь затем концентрировали в вакууме и остаток очищали хроматографией на колонке (SiO2; градиент: 0-50% EtOAc в гептане) с получением трет-бутил-(RS)-2-(3-циано-4-(1-(4 фторфенил)-1 Н-пиразол-3-карбоксамидо)фенил)морфолин-4-карбоксилата (49 мг, 43%) в виде белогоd) (RS)-N-(2-Циано-4-(морфолин-2-ил)фенил)-1-(4-фторфенил)-1 Н-пиразол-3-карбоксамид. К раствору трифторуксусной кислоты (84 мкл) в воде (4.5 мл) добавляли при перемешивании раствор трет-бутил-(RS)-2-(3-циано-4-(1-(4-фторфенил)-1 Н-пиразол-3-карбоксамидо)фенил)морфолин-4 карбоксилата (41 мг) в ацетонитриле (2 мл). Сосуд с реакционной смесью затем укупоривали и эту смесь встрхивали при 80 С в течение 5 ч. Реакционную смесь затем охлаждали до комнатной температуры,вливали в 1 М водный NaOH и полученную смесь экстрагировали дважды с помощью EtOAc. Органические слои высушивали над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией на колонке (SiO2; градиент: 0-10% метанол в дихлорметане) с получением (RS)-N(2-циано-4-(морфолин-2-ил)фенил)-1-(4-фторфенил)-1 Н-пиразол-3-карбоксамида (20 мг, 61%) в виде белого твердого вещества. MS (ISP): 392.2 ([М+Н]+). Пример 29. (S)-N-(2-Хлор-4-(морфолин-2-илa) (+)-трет-Бутил (R)-2-(4-амино-3-хлорфенил)морфолин-4-карбоксилат и (-)-трет-бутил (S)-2-(4 амино-3-хлорфенил)морфолин-4-карбоксилат. Энантиомеры трет-бутил-(RS)-2-(4-амино-3-хлорфенил)морфолин-4-карбоксилата (2.00 г, пример 5 д) разделяли с помощью хиральной ВЭЖХ (колонка: Chyralpak AD, 550 см; элюент: 10% изопропанол/гептан; давление: 18 бар; скорость потока: 35 мл/мин) с получениемb) (S)-N-(2-Хлор-4-(морфолин-2-ил)фенил)-1-(4-фторфенил)-1 Н-пиразол-3-карбоксамид. Указанное в заголовке соединение получали по аналогии с примером 18 с помощью (-)-трет-бутил(S)-2-(4-амино-3-хлорфенил)морфолин-4-карбоксилата вместо трет-бутил-(RS)-2-(4-амино-3 хлорфенил)морфолин-4-карбоксилата и 1-(4-фторфенил)-1 Н-пиразол-3-карбоновой кислоты (CAS 1152535-34-6) вместо 1-(4-фторфенил)-1 Н-пиразол-4-карбоновой кислоты на стадии а). Белое твердое вещество. MS (ISP): 403.1 ([37ClM+H]+), 401.1 ([35ClM+H]+). Пример 30. (R)-N-(2-Хлор-4-(морфолин-2-ил)фенил)-1-(4-фторфенил)-1 Н-пиразол-3-карбоксамид Указанное в заголовке соединение получали по аналогии с примером 18 с помощью (+)-трет-бутил(R)-2-(4-амино-3-хлорфенил)морфолин-4-карбоксилата (пример 29 а) вместо трет-бутил-(RS)-2-(4-амино 3-хлорфенил)морфолин-4-карбоксилата и 1-(4-фторфенил)-1 Н-пиразол-3-карбоновой кислоты (CAS 1152535-34-6) вместо 1-(4-фторфенил)-1 Н-пиразол-4-карбоновой кислоты на стадии а). Белое твердое вещество. MS (ISP): 403.1 ([37ClM+H]+), 401.1 ([35ClM+H]+). Пример 31. (S)-N-(2-Хлор-4-(морфолин-2-ил)фенил)-1-(4-фторфенил)-1 Н-пиразол-4-карбоксамид Указанное в заголовке соединение получали по аналогии с примером 18 с помощью (-)-трет-бутил(S)-2-(4-амино-3-хлорфенил)морфолин-4-карбоксилата (пример 29 а) вместо трет-бутил-(RS)-2-(4-амино 3-хлорфенил)морфолин-4-карбоксилата на стадии а). Белое твердое вещество. MS (ISP): 403.1 Указанное в заголовке соединение получали по аналогии с примером 18 с помощью (+)-трет-бутил(R)-2-(4-амино-3-хлорфенил)морфолин-4-карбоксилата (пример 29 а) вместо трет-бутил-(RS)-2-(4-амино 3-хлорфенил)морфолин-4-карбоксилата на стадии а). Белое твердое вещество. MS (ISP): 403.1(RS)-2-(3-циано-4-[3-(3-цианофенил)уреидо]фенил)морфолин-4 карбоновой кислоты. К раствору трет-бутил-(RS)-2-(4-амино-3-цианофенил)морфолин-4-карбоксилата (70 мг, пример 28b) в дихлорметане (2 мл) добавляли при перемешивании трифосген (25 мг). Затем добавляли раствор карбоната натрия (49 мг) в воде (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Анализ с помощью ТСХ показал, что исходное вещество прореагировало. После этого добавляли 3-аминобензонитрил (28 мг, CAS 2237-30-1) и реакционную смесь перемешивали при комнатной температуре еще в течение 40 ч. Анализ с помощью ТСХ показал, что реакция была завершена. Реакционную смесь вливали в дихлорметан и экстрагировали водой. Органический слой отделяли, высушивали над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке(SiO2; градиент: 0-100% EtOAc в гексане) с получением трет-бутилового эфира (RS)-2-3-циано-4-[3-(3 цианофенил)уреидо]фенилморфолин-4-карбоновой кислоты (16 мг, 16%) в виде белого твердого вещества. MS (ISP): 392.2 ([М+Н-С 4 Н 8]+) 348.2 ([М+Н-С 4 Н 8-СО 2]+).b) (RS)-1-(2-Циано-4-морфолин-2-илфенил)-3-(3-цианофенил)мочевина. К раствору трифторуксусной кислоты (22 мкл) в воде (3 мл) добавляли при перемешивании раствор трет-бутилового эфира (RS)-2-3-циано-4-[3-(3-цианофенил)уреидо]фенилморфолин-4-карбоновой кислоты (13 мг) в ацетонитриле (1.5 мл). Сосуд с реакционной смесью затем укупоривали и эту смесь встрхивали при 80 С в течение 4 ч. Реакционную смесь затем охлаждали до комнатной температуры,вливали в 1 М водный NaOH и полученную смесь экстрагировали дважды с помощью EtOAc. Органические слои высушивали над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией на колонке (Isolute Flash-NH2 производства Separtis); градиент: гептан/EtOAc/МеОН) с получением (RS)-1-(2-циано-4-морфолин-2-илфенил)-3-(3-цианофенил)мочевины (6 мг, 52%) в виде светло-коричневого твердого вещества. MS (ISP): 348.1 ([М+Н]+). Пример 34. (S)-4-Хлор-N-(2-хлор-4-(морфолин-2-ил)фенил)бензамид Указанное в заголовке соединение получали по аналогии с примером 18 с помощью 4 хлорбензоной кислоты (CAS 74-11-3) вместо 1-(4-фторфенил)-1 Н-пиразол-4-карбоновой кислоты на стадии а). Белое твердое вещество. MS (ISP): 355.2 ([37ClM+H]+), 353.1 ([37Cl35ClM+H]+), 351.2 Указанное в заголовке соединение получали по аналогии с примером 18 с помощью (+)-трет-бутил(R)-2-(4-амино-3-хлорфенил)морфолин-4-карбоксилата (пример 29 а) вместо трет-бутил-(RS)-2-(4-амино 3-хлорфенил)морфолин-4-карбоксилата и 6-хлорникотиновой кислоты (CAS 5326-23-8) вместо 1-(4 фторфенил)-1 Н-пиразол-4-карбоновой кислоты на стадии а). Белое твердое вещество. MS (ISP): 356.2
МПК / Метки
МПК: C07D 401/12, C07D 413/14, C07D 413/12, A61K 31/4245, C07D 265/30, A61P 25/00
Метки: замещенные, производные, бензамида
Код ссылки
<a href="https://eas.patents.su/30-22376-zameshhennye-proizvodnye-benzamida.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные бензамида</a>












