Пуриновые производные и их применение в качестве модуляторов толл-подобного рецептора 7
Формула / Реферат
1. Соединение, представленное формулой IIa
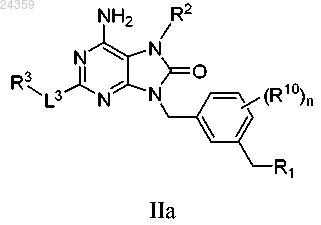
или фармацевтически приемлемая соль указанного соединения, где
R1 представляет собой -NR4R5;
R2 представляет собой C1-C6-алкил, C2-C6-алкенил, C3-C7-карбоциклил-C1-C6-алкил или фенил-C1-C6-алкил, возможно содержащий в качестве заместителя в фенильном кольце C1-C6-алкокси;
-L3-R3 представляет собой -O-C1-C6-алкил или -O-C1-C6-алкилен-O-C1-C6-алкил;
каждый из R4 и R5 независимо представляет собой Н или C3-C7-карбоциклил-C1-C6-алкил; или
R4 и R5 совместно с азотом, к которому они оба присоединены, образуют незамещенный гетероцикл, причем указанный гетероцикл представляет собой 4-6-членное моноциклическое полностью насыщенное кольцо, содержащее гетероатом, выбранный из N;
n равно 0.
2. Соединение по п.1, отличающееся тем, что R2 представляет собой метил, этил, н-пропил, изопропил, н-бутил, аллил, циклопропил, метилциклопропил, циклопропилметилен, бензил или метоксибензил.
3. Соединение по п.1, отличающееся тем, что -L3-R3 представляет собой -OCH2CH2OCH3 или -OCH2CH2CH2CH3.
4. Соединение по п.1, выбранное из группы, состоящей из
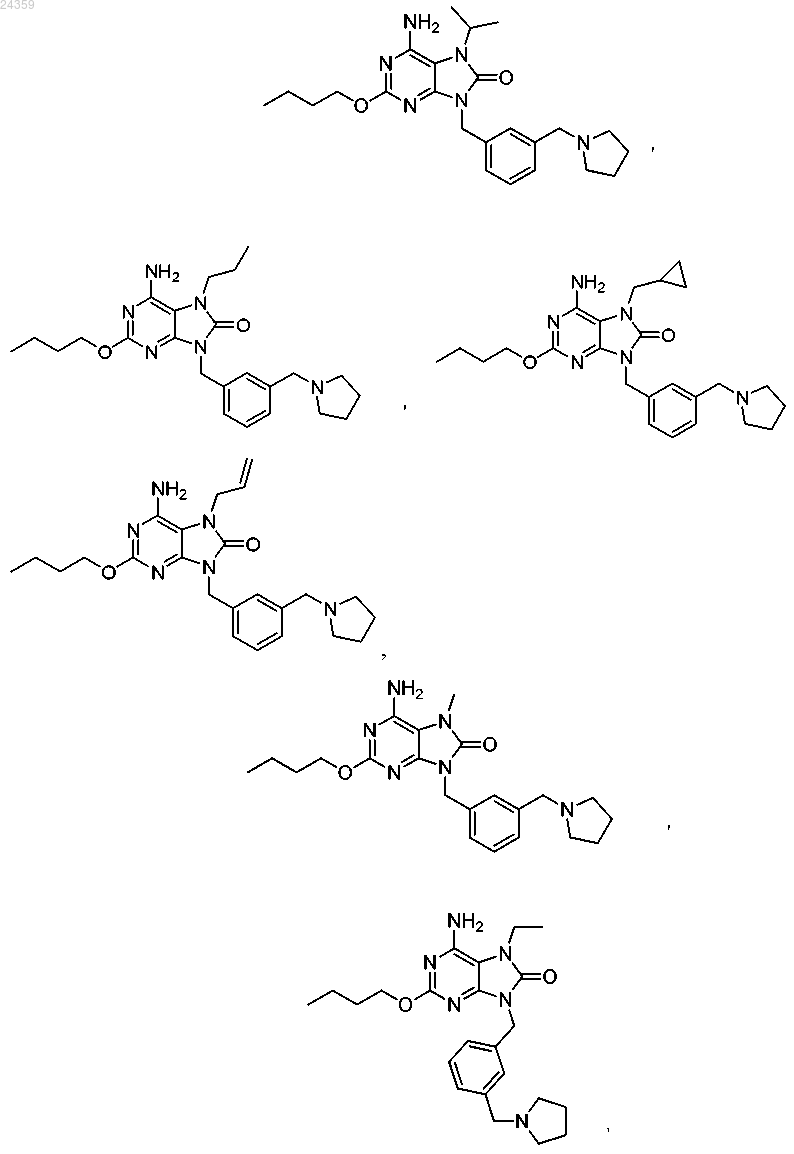
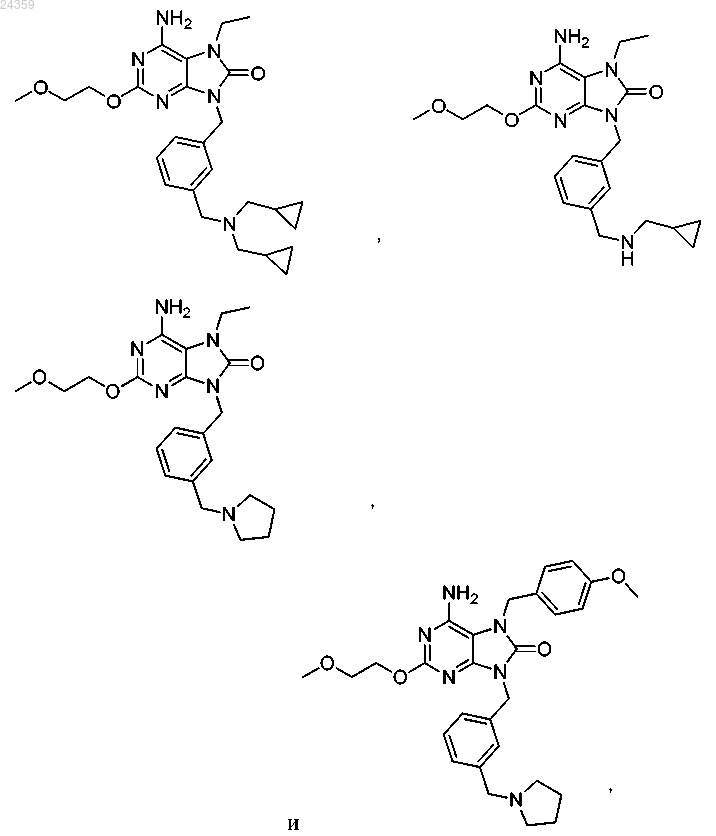
или фармацевтически приемлемые соли указанного соединения.
5. Соединение по п.1, отличающееся тем, что -L3-R3 представляет собой -OCH2CH2CH2CH3.
6. Соединение по п.1, отличающееся тем, что R4 и R5 совместно с азотом, к которому они оба присоединены, образуют гетероцикл, имеющий следующую структуру:
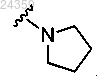
7. Фармацевтическая композиция, содержащая по меньшей мере одно соединение по любому из пп.1-6 или фармацевтически приемлемую соль указанного соединения; фармацевтически приемлемый носитель или наполнитель.
8. Фармацевтическая композиция по п.7, дополнительно содержащая по меньшей мере один дополнительный активный агент, выбранный из группы, состоящей из следующего: интерфероны, рибавирин, ингибиторы протеазы NS3 вируса гепатита С (HCV), ингибиторы альфа-глюкозидазы-1, гепатопротекторы, нуклеозидные или нуклеотидные ингибиторы полимеразы NS5B HCV, ненуклеозидные ингибиторы полимеразы NS5B HCV, ингибиторы NS5A HCV, агонисты TLR-7, ингибиторы циклофиллина, ингибиторы IRES HCV, усилители фармакокинетики и другие лекарственные средства для лечения вируса гепатита С или их смеси.
9. Фармацевтическая композиция по п.8, отличающаяся тем, что указанный по меньшей мере один дополнительный активный агент выбран из группы, состоящей из следующего:
(1) интерфероны, выбранные из группы, включающей пэгилированный rIFN-альфа 2b (ПЭГ-Интрон), пэгилированный rIFN-альфа 2а (Пегасис), rIFN-альфа 2b (Интрон А), rIFN-альфа 2а (Роферон-А), интерферон альфа (MOR-22, ОРС-18, Альфаферон, Альфанатив, Мультиферон, субалин), интерферон альфакон-1 (Инферген), интерферон альфа-n1 (Веллферон), интерферон альфа-n3 (Альферон), интерферон-бета (Авонекс, DL-8234), интерферон-омега (омега DUROS, Биомед 510), альбинтерферон альфа-2b (Альбуферон), IFN альфа-2b XL, BLX-883 (Локтерон), DA-3021, гликозилированный интерферон альфа-2b (AVI-005), ПЭГ-Инферген, пэгилированный интерферон лямбда-1 (пэгилированный IL-29), белерофон и их смеси;
(2) рибавирин (Ребетол, Копегус), тарибавирин (Вирамидин) и их смесь;
(3) ингибиторы протеазы NS3 HCV, выбранные из группы, включающей боцепревир (SCH-503034, SCH-7), телапревир (VX-950), TMC435350, BI-1335, BI-1230, МК-7009, VBY-376, VX-500, BMS-790052, BMS-605339, PHX-1766, AS-101, YH-5258, YH5530, YH5531, ITMN-191 и их смеси;
(4) ингибиторы альфа-глюкозидазы-1, выбранные из группы, включающей целгозивир (МХ-3253), Миглитол, UT-231B и их смеси;
(5) гепатопротекторы, выбранные из группы, включающей IDN-6556, ME 3738, LB-84451, силибилин, MitoQ и их смеси;
(6) нуклеозидные или нуклеотидные ингибиторы полимеразы NS5B HCV, выбранные из группы, включающей R1626, R7128 (R4048), IDX184, IDX-102, ВСХ-4678, валопицитабин (NM-283), MK-0608 и их смеси;
(7) ненуклеозидные ингибиторы полимеразы NS5B HCV, выбранные из группы, включающей PF-868554, VCH-759, VCH-916, JTK-652, MK-3281, VBY-708, VCH-222, А848837, ANA-598, GL60667, GL59728, А-63890, А-48773, А-48547, ВС-2329, VCH-796 (несбувир), GSK625433, BILN-1941, XTL-2125, GS-9190 и их смеси;
(8) ингибиторы NS5A HCV, выбранные из группы, включающей AZD-2836 (А-831), А-689 и их смеси;
(9) агонисты TLR-7, выбранные из группы, включающей ANA-975, SM-360320 и их смеси;
(10) ингибиторы циклофиллина, выбранные из группы, включающей DEBIO-025, SCY-635, NIM811 и их смеси;
(11) ингибиторы IRES HCV, выбранные из группы, включающей MCI-067;
(12) усилители фармакокинетических характеристик, выбранные из группы, включающей BAS-100, SPI-452, PF-4194477, ТМС-41629, рокситромицин и их смеси;
(13) другие лекарственные средства для лечения вируса гепатита С, выбранные из группы, включающей тимозин альфа 1 (Задаксин), нитазоксанид (Алинея, NTZ), BIVN-401 (виростат), PYN-17 (альтирекс), KPE02003002, актилон (CPG-10101), KRN-7000, цивацир (civacir), GI-5005, XTL-6865, BIT225, РТХ-111, ITX2865, TT-033i, ANA 971, NOV-205, тарвацин, ЕНС-18, VGX-410C, EMZ-702, AVI 4065, BMS-650032, BMS-791325, Бавитуксимаб, MDX-1106 (ONO-4538), Оглуфанид, VX-497 (меримеподиб) и их смеси.
10. Способ обеспечения агонистического воздействия на Толл-подобный рецептор 7, включающий приведение клетки, несущей Толл-подобный рецептор 7, в контакт с эффективным количеством соединения по любому из пп.1-6 или фармацевтически приемлемой соли указанного соединения.
11. Комбинированный фармацевтический агент, содержащий:
а) первую фармацевтическую композицию, содержащую соединение по любому из пп.1-6 или фармацевтически приемлемую соль указанного соединения;
б) вторую фармацевтическую композицию, содержащую по меньшей мере один дополнительный активный агент, выбранный из группы, состоящей из следующего: интерфероны, рибавирин, ингибиторы протеазы NS3 HCV, ингибиторы альфа-глюкозидазы-1, гепатопротекторы, нуклеозидные или нуклеотидные ингибиторы полимеразы NS5B HCV, ненуклеозидные ингибиторы полимеразы NS5B HCV, ингибиторы NS5A HCV, агонисты TLR-7, ингибиторы циклофиллина, ингибиторы IRES HCV, усилители фармакокинетических характеристик и другие лекарственные средства для лечения вируса гепатита С или их смеси.
12. Применение соединения по любому из пп.1-6 в качестве терапевтического вещества.
13. Применение соединения по любому из пп.1-6 для получения лекарственного средства для лечения вирусной инфекции у пациента.
14. Применение по п.13, при котором указанное лекарственное средство содержит дополнительно по меньшей мере один дополнительный активный агент, выбранный из группы, состоящей из интерферонов, рибавирина, ингибиторов протеазы NS3 вируса гепатита С (HCV), ингибиторов альфа-глюкозидазы 1, гепатопротекторов, нуклеозидных или нуклеотидных ингибиторов полимеразы NS5B HCV, ненуклеозидных ингибиторов полимеразы NS5B HCV, ингибиторов NS5A HCV, агонистов TLR-7, ингибиторов циклофиллина, ингибиторов IRES HCV, усилителей фармакокинетических характеристик и других лекарственных средств для лечения вируса гепатита С или их смесей.
15. Применение по п.14, отличающееся тем, что указанный по меньшей мере один дополнительный активный агент выбран из группы, состоящей из следующего:
(1) интерфероны, выбранные из группы, включающей пегилированный rIFN-альфа 2b (ПЭГ-Интрон), пегилированный rIFN-альфа 2а (Пегасис), rIFN-альфа 2b (Интрон A), rIFN-альфа 2а (Роферон-А), интерферон альфа (MOR-22, ОРС-18, Альфаферон, Альфанатив, Мультиферон, субалин), интерферон альфакон-1 (Инферген), интерферон альфа-n1 (Веллферон), интерферон альфа-n3 (Альферон), интерферон-бета (Авонекс, DL-8234), интерферон-омега (омега DUROS, Биомед 510), альбинтерферон альфа-2b (Альбуферон), IFN альфа-2b XL, BLX-883 (Локтерон), DA-3021, гликозилированный интерферон альфа-2b (AVI-005), ПЭГ-Инферген, ПЭГилированный интерферон лямбда-1 (ПЭГилированный IL-29), белерофон и их смеси;
(2) рибавирин (Ребетол, Копегус), тарибавирин (Вирамидин) и их смеси;
(3) ингибиторы протеазы NS3 HCV, выбранные из группы, включающей боцепревир (SCH-503034, SCH-7), телапревир (VX-950), TMC435350, BI-1335, BI-1230, MK-7009, VBY-376, VX-500, BMS-790052, BMS-605339, PHX-1766, AS-101, YH-5258, YH5530, YH5531, ITMN-191 и их смеси;
(4) ингибиторы альфа-глюкозидазы-1, выбранные из группы, включающей целгозивир (МХ-3253), Миглитол, UT-231B и их смеси;
(5) гепатопротекторы, выбранные из группы, включающей IDN-6556, ME 3738, LB-84451, силибилин, MitoQ и их смеси;
(6) нуклеозидные или нуклеотидные ингибиторы полимеразы NS5B HCV, выбранные из группы, включающей R1626, R7128 (R4048), IDX184, IDX-102, ВСХ-4678, валопицитабин (NM-283), MK-0608 и их смеси;
(7) ненуклеозидные ингибиторы полимеразы NS5B HCV, выбранные из группы, включающей PF-868554, VCH-759, VCH-916, JTK-652, MK-3281, VBY-708, VCH-222, А848837, ANA-598, GL60667, GL59728, А-63890, А-48773, А-48547, ВС-2329, VCH-796 (несбувир), GSK625433, BILN-1941, XTL-2125, GS-9190 и их смеси;
(8) ингибиторы NS5A HCV, выбранные из группы, включающей AZD-2836 (А-831), А-689 и их смеси;
(9) агонисты TLR-7, выбранные из группы, включающей ANA-975, SM-360320 и их смеси;
(10) ингибиторы циклофиллина, выбранные из группы, включающей DEBIO-025, SCY-635, NIM811 и их смеси;
(11) ингибиторы IRES HCV, выбранные из группы, включающей MCI-067;
(12) усилители фармакокинетических характеристик, выбранные из группы, включающей BAS-100, SPI-452, PF-4194477, ТМС-41629, рокситромицин и их смеси;
(13) другие лекарственные средства для лечения вируса гепатита С, выбранные из группы, включающей тимозин альфа 1 (Задаксин), нитазоксанид (Алинея, NTZ), BIVN-401 (виростат), PYN-17 (альтирекс), KPE02003002, актилон (CPG-10101), KRN-7000, цивацир, GI-5005, XTL-6865, BIT225, РТХ-111, ITX2865, TT-033i, ANA 971, NOV-205, тарвацин, ЕНС-18, VGX-410C, EMZ-702, AVI 4065, BMS-650032, BMS-791325, Бавитуксимаб, MDX-1106 (ONO-4538), Оглуфанид, VX-497 (меримеподиб) и их смеси.
Текст
Изобретение относится в целом к соединениям и фармацевтическим композициям, селективно активирующим Толл-подобный рецептор 7 (TLR7), и способам их получения и применения. Предложено соединение формулы IIa где R1 представляет собой -NR4R5; R2 представляет собой С 1-С 6-алкил, С 2-С 6-алкенил, С 3-C7 карбоциклил-С 1-С 6-алкил или фенил-С 1-С 6-алкил, возможно содержащий в качестве заместителя в фенильном кольце С 1-С 6-алкокси; -L3-R3 представляет собой -O-С 1-С 6-алкил или -O-С 1-С 6-алкиленO-С 1-С 6-алкил; каждый из R4 и R5 независимо представляет собой Н или С 3-С 7-карбоциклил-С 1-С 6 алкил; или R4 и R5 совместно с азотом, к которому они оба присоединены, образуют незамещенный гетероцикл, причем указанный гетероцикл представляет собой 4-6-членное моноциклическое полностью насыщенное кольцо, содержащее гетероатом, выбранный из N; и n равно 0, и фармацевтически приемлемые соли указанного соединения, композиции, содержащие указанное соединение или его соль, способы обеспечения агонистического воздействия на Толл-подобный рецептор 7, которые включают применение таких соединений, а также применение указанного соединения в качестве терапевтического вещества. Область техники Заявка на данный патент относится в целом к соединениям и фармацевтическим композициям, селективно активирующим Толл-подобный рецептор 7 (TLR7), и способам их получения и применения. Уровень техники Система врожденного иммунитета обеспечивает организм средствами "первой линии обороны" против вторжения патогенов. При врожденной иммунной реакции рецептор, кодируемый в зародышевой линии, распознает внедряющийся патоген, при этом активация указанного рецептора инициирует сигнальный каскад, что приводит к индукции экспрессии цитокинов. Рецепторы системы врожденного иммунитета обладают широкой специфичностью и способны распознавать молекулярные структуры, которые высококонсервативны у разных патогенов. Одно из семейств таких рецепторов включает Толлподобные рецепторы (TLR), названные так вследствие их гомологичности с Толл-рецепторами, впервые идентифицированными у дрозофилы. Толл-подобные рецепторы присутствуют в таких клетках, как макрофаги, дендритные клетки и клетки эпителия. У млекопитающих существует по меньшей мере десять разных TLR. Для некоторых из этих рецепторов идентифицированы лиганды и соответствующие сигнальные каскады. Например, TLR2 активируется липопротеином бактерий (например, Е.coli), TLR3 активируется двухцепочечной РНК, TLR4 активируется липополисахаридом (т.е. ЛПС или эндотоксином) граммотрицательных бактерий (например,Salmonella и Е.coli. O157:H7), TLR5 активируется флагеллином подвижных бактерий (например,Listeria), TLR7 распознает и реагирует на имиквимод, a TLR9 активируется неметилированными последовательностями CpG ДНК патогена. Стимуляция каждого из этих рецепторов приводит к активации фактора транскрипции NF-В и других сигнальных молекул, которые участвуют в регуляции экспрессии генов цитокинов, включая гены, кодирующие фактор-альфа некроза опухолей (ФНО-), интерлейкин-1(ИЛ-1) и некоторые хемокины. Краткое описание изобретения Настоящее изобретение основано, в частности, на обнаружении авторами настоящего изобретения того факта, что некоторые небольшие молекулы способны вызывать изменения в опосредуемой TLRрецепторами передаче иммуностимулирующего сигнала. Соответственно, настоящее изобретение относится к соединениям, фармацевтическим композициям и способам их применения при профилактике или лечении заболеваний или патологических состояний, связанных с активностью Толл-подобных рецепторов 7 (TLR7) у пациентов. Изобретение включает соединение формулы IIa или фармацевтически приемлемую соль указанного соединения, где-L3-R3 представляет собой -O-C1-C6-алкил или -O-C1-C6-алкилен-О-C1-C6-алкил; каждый из R4 и R5 независимо представляет собой Н или C3-C7-карбоциклил-C1-C6-алкил; илиR4 и R5 совместно с азотом, к которому они оба присоединены, образуют незамещенный гетероцикл, причем указанный гетероцикл представляет собой 4-6-членное моноциклическое полностью насыщенное кольцо, содержащее гетероатом, выбранный из N;n равно 0. Согласно другому варианту реализации в настоящем изобретении предложена фармацевтическая композиция, содержащая по меньшей мере одно соединение формулы IIa или фармацевтически приемлемую соль указанного соединения, и фармацевтически приемлемый носитель или наполнитель. Согласно другому варианту реализации в настоящем изобретении предложена фармацевтическая композиция, содержащая по меньшей мере одно соединение формулы IIa или фармацевтически приемлемую соль указанного соединения, по меньшей мере один дополнительный активный агент и фармацевтически приемлемый носитель или наполнитель. Согласно другому варианту реализации в настоящем изобретении предложен способ лечения или профилактики вирусной инфекции, включающий введение пациенту, который в этом нуждается, терапевтически эффективного количества по меньшей мере одного соединения формулы IIa или фармацевтически приемлемой соли, сольвата и/или эфира указанного соединения. Согласно другому варианту реализации в настоящем изобретении предложен комбинированныйa) первую фармацевтическую композицию, содержащую соединение формулы IIa или фармацевтически приемлемую соль указанного соединения;b) вторую фармацевтическую композицию, содержащую по меньшей мере один дополнительный активный агент, выбранный из группы, включающей интерфероны, рибавирин или его аналоги, ингибиторы протеазы NS3 вируса гепатита С (HCV), ингибиторы альфа-глюкозидазы 1, гепатопротекторы, нуклеозидные или нуклеотидные ингибиторы полимеразы NS5B HCV, ненуклеозидные ингибиторы полимеразы NS5B HCV, ингибиторы NS5A HCV, агонисты TLR-7, ингибиторы циклофиллина, ингибиторыIRES HCV, усилители фармакокинетических характеристик и другие лекарственные препараты для лечения вируса гепатита С или их смеси. Подробное описание изобретения Далее приведено подробное описание некоторых аспектов настоящего изобретения, примеры которых проиллюстрированы с помощью соответствующих структур и формул. Несмотря на то что в описании настоящего изобретения приведены ссылки на пронумерованные пункты формулы изобретения,следует понимать, что настоящее изобретение не ограничено лишь указанными пунктами формулы. Напротив, подразумевается, что настоящее изобретение включает все альтернативы, модификации и эквиваленты, которые можно включить в настоящее изобретение, охарактеризованное в пунктах формулы изобретения. Содержание каждого из документов, на которые приведены ссылки в настоящем описании, включено в настоящее описание посредством ссылки во всей полноте для любых целей. Определения. Если не указано иное, следующие термины имеют следующие значения. При указании в настоящем описании торгового наименования, подразумевается, что такое указание относится независимо как к продукту с таким торговым наименованием, так и активному фармацевтическому ингредиенту (ингредиентам) указанного продукта. Термин "соединение согласно настоящему изобретению" или "соединение, отвечающее формулеIIa" означает в настоящем описании соединение, отвечающее формуле IIa или фармацевтически приемлемые соль или физиологически функциональное производное указанного соединения. Соединения согласно изобретению также включают соответствующие таутомерные формы, например, таутомерные"енолы", указанные в настоящем описании. Аналогично, что касается выделенных промежуточных продуктов, таких, например, как соединения, отвечающие формуле (2), термин "соединение, отвечающее формуле (номер)", обозначает соединение, отвечающее этой формуле и фармацевтически приемлемые соли, сольваты и физиологически функциональные производные указанного соединения."Алкил" обозначает углеводород, содержащий нормальные, вторичные, третичные или циклические атомы углерода. Например, алкильная группа может содержать от 1 до 20 атомов углерода (т.е. алкил C1C20), от 1 до 10 атомов углерода (т.е. алкил C1-C10) или от 1 до 6 атомов углерода (т.е. алкил C1-C6). Примеры подходящих алкильных групп включают метил (Me, -СН 3), этил (Et, -СН 2 СН 3), 1-пропил (н-Pr, нпропил, -СН 2 СН 2 СН 3), 2-пропил (изо-Pr, изопропил, -СН(СН 3)2), 1-бутил (н-Bu, н-бутил,-СН 2 СН 2 СН 2 СН 3), 2-метил-1-пропил (изо-Bu, изобутил, -СН 2 СН(СН 3)2), 2-бутил (s-Bu, втор-бутил,-СН(СН 3)СН 2 СН 3),2-метил-2-пропил(-СН(СН 2 СН 3)СН(СН 3)2),(-СН(СН 3)С(СН 3)3 и октил (-(СН 2)7 СН 3), но не ограничиваются ими. Термин "алкокси" обозначает группу, отвечающую формуле -О-алкил, в которой алкильная группа,определенная выше, присоединена к исходной молекуле через атом кислорода. Алкильная часть алкоксигруппы может содержать от 1 до 20 атомов углерода (т.е. алкокси C1-C20), от 1 до 12 атомов углерода(т.е. алкокси C1-C10) или от 1 до 6 атомов углерода (т.е. алкокси C1-C6). Примеры подходящих алкильных групп включают метокси (-О-СН 3 или -ОМе), этокси (-ОСН 2 СН 3 или -OEt), трет-бутоксигруппу (-ОС(СН 3)3 или -OtBu) и подобные, но не ограничиваются ими."Алкенил" обозначает углеводород, содержащий нормальные, вторичные, третичные или циклические атомы углерода по меньшей мере с одним участком ненасыщения, т.е. углерод-углеродной sp2 двойной связью. Например, алкенильная группа может содержать от 2 до 20 атомов углерода (т.е. алкенил C2-C20), от 2 до 12 атомов углерода (т.е. алкенил C2-C12) или от 2 до 6 атомов углерода (т.е. алкенилC2-C6). Примеры подходящих алкенильных групп включают этилен, винил (-СН=СН 2), аллил(-СН 2 СН=СН 2), циклопентил (-С 5 Н 7) и 5-гексинил (-СН 2 СН 2 СН 2 СН 2 СН=СН 2), но не ограничиваются ими."Алкинил" обозначает углеводород, содержащий нормальные, вторичные, третичные или цикличе-2 024359 ские атомы углерода по меньшей мере с одним участком ненасыщения, т.е. углерод-углеродной sp тройной связью. Например, алкинильная группа может содержать от 2 до 20 атомов углерода (т.е. алкинилC2-C20), от 1 до 12 атомов углерода (т.е. алкинил C2-C12) или от 1 до 6 атомов углерода (т.е. алкинил C2C6). Примеры подходящих алкинильных групп включают ацетиленовую (-С=СН), пропаргиловую(-СН 2 С=СН) и подобные, но не ограничиваются ими."Алкилен" обозначает насыщенный углеводородный радикал с разветвленной или прямой цепью или циклический, содержащий два одновалентных радикальных центра, образованных при удалении двух атомов водорода от одного и того же или двух разных атомов углерода исходного алкана. Например, алкиленовая группа может содержать от 1 до 20 атомов углерода, от 1 до 10 атомов углерода или от 1 до 6 атомов углерода. Типичные алкиленовые радикалы включают метилен (-СН 2-), 1,1-этил(-CH2CH2CH2-), 1,4-бутил (-СН 2 СН 2 СН 2 СН 2-) и подобные, но не ограничиваются ими. Термин "замещенный", употребляемый по отношению к алкилу, алкилену, арилу, арилалкилу, гетероциклилу и др., например "замещенный алкил", "замещенный алкилен", "замещенный арил", "замещенный арилалкил", "замещенный гетероциклил" и "замещенный карбоциклил", обозначает алкил, алкилен,арил, арилалкил, гетероциклил, карбоциклил, соответственно, в котором один или более атомов водорода независимо замещен заместителем, отличным от водорода. Типичные заместители включают -X, -R,-О-, =O, -OR, -SR, -S-, -NR2, -N+R3, =NR, -CX3, -CN, -OCN, -SCN, -N=C=O, -NCS, -NO, -NO2, =N2, -N3,-NHC(=O)R, -C(=O)NRR -S(=O)2O-, -S(=O)2OH, -S(=O)2R, -OS(=O)2OR, -S(=O)2NR, -S (=O)R,-OP(=O)(OR)2,-P(=O)(OR)2, -P(=O)(O-)2, -P(=O)(OH)2, -P(O)(OR)(O-), -C(=O)R, -C(S)R, -C(O)OR, -C(O)O",-C(S)OR, -C(O)SR, -C(S)SR, -C(O)NRR, -C(S)NRR, -C(=NR)NRR, где X является независимо галогеном:F, Cl, Br или I; а каждый независимо является Н, алкилом, арилом, арилалкилом, гетероциклом или защитной группой или фрагментом пролекарства. Алкиленовая, алкениленовая и алкиниленовая группы также могут быть замещены аналогичным образом. Специалисты в данной области техники должны понимать, что, когда такие фрагменты, как "алкил", "арил", "гетероциклил" и др., замещены одним или несколькими заместителями, указанные фрагменты могут быть по-другому обозначены как "алкиленовый", "ариленовый", "гетероцикленовый" и др. фрагменты (т.е. указывая на то, что по меньшей мере один из атомов водорода в исходном "алкиле","ариле", "гетероцикле" и др. был замещен указанным заместителем(ями. Когда такие фрагменты, как"алкил", "арил", "гетероциклил" и др., обозначают в настоящем описании как "замещенные" или схематически изображают как замещенные (или необязательно замещенные, например, когда число заместителей находится в пределах от нуля до целого положительного числа), то термины "алкил", "арил", "гетероциклил" и др. являются взаимозаменяемыми с терминами "алкилен", "арилен", "гетероциклилен" и др. Термин "пролекарство" применяют в настоящем описании для обозначения соединения, которое при введении в биологическую систему образует лекарственное вещество, т.е. активный ингредиент,вследствие спонтанной химической реакции (реакций), ферментативно катализируемой химической реакции (реакций), фотолиза и/или метаболической химической реакции (реакций). Таким образом, пролекарство представляет собой ковалентно модифицированный аналог или латентную форму терапевтически активного соединения. Специалист в данной области техники должен понимать, что заместители и другие фрагменты соединений, отвечающих формуле IIa, должны быть выбраны таким образом, чтобы получить соединение,которое будет достаточно стабильным для обеспечения фармацевтически подходящего соединения, которое можно вводить в состав приемлемо стабильной фармацевтической композиции. Соединения, отвечающие формуле IIa, которые имеют такую стабильность, находятся в рамках настоящего изобретения."Гетероалкил" обозначает алкильную группу, в которой один или более атомов углерода были замещены на гетероатом, такой как О, N или S. Например, если атом углерода алкильной группы, присоединенный к исходной молекуле, замещен гетероатомом (например, О, N или S), образующиеся гетероалкильные группы, соответственно, представляют собой алкоксигруппу (например, -ОСН 3 и др.), аминогруппу (например, -NHCH3, -N(СН 3)2 и др.) или тиоалкильную группу (например, -SCH3). Если нетерминальный атом углерода алкильной группы, который не присоединен к исходной молекуле, замещен гетероатомом (например, О, N или S), образующиеся гетероалкильные группы представляют собой, соответственно, алкилэфир (например, -СН 2 СН 2-О-СН 3 и др.) алкиламин (например, -CH2NHCH3, -CH2N(CH3)2 и др.) или тиоалкилэфир (например, -CH2-S-CH3). Если терминальный атом углерода замещен гетероатомом (например, О, N или S), образующиеся гетероалкильные группы представляют собой, соответственно, гидроксиалкильную группу (например, -СН 2 СН 2-ОН), аминоалкильную группу (например, -CH2NH2) или алкилтиогруппу (например, -CH2CH2-SH). Гетероалкильная группа может содержать, например, от 1 до 20 атомов углерода, от 1 до 10 атомов углерода, от 1 до 6 атомов углерода. "Гетероалкильная группаC1-C6" обозначает гетероалкильную группу, содержащую от 1 до 6 атомов углерода. Термин "карбоцикл" или "карбоциклил" обозначает насыщенное, частично ненасыщенное или ароматическое кольцо, содержащее от 3 до 7 атомов углерода в составе моноцикла, от 7 до 12 атомов углерода в составе бицикла и примерно до 20 атомов углерода в составе полицикла. Моноциклические кар-3 024359 боциклы содержат от 3 до 6 атомов в кольце, однако более типично от 5 до 6 атомов в кольце. Бициклические карбоциклы содержат от 7 до 12 атомов в кольце, например, образующих бициклическую (4,5),(5,5), (5,6) или (6,6) систему, или 9 или 10 атомов в кольце, образующих бициклическую (5,6) или (6,6) систему. Примеры моноциклических карбоциклов включают циклопропил, циклобутил, циклопентил, 1 циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1 циклогекс-2-енил, 1-циклогекс-3-енил, фенил и др. Термин "возможно замещенный" применительно к конкретному фрагменту соединения, отвечающего формуле I (например, возможно замещенная арильная группа), обозначает фрагмент, содержащий 0, 1, 2 или более заместителей. Термин "хиральный" обозначает молекулы, которые при наложении не совпадают со своим зеркальным отражением, а термин "ахиральный" обозначает молекулы, которые при наложении совпадают со своим зеркальным отражением. Термин "стереоизомеры" обозначает соединения, которые обладают идентичным химическим строением, но различаются по расположению атомов или групп в пространстве. Термин "диастереомер" обозначает стереоизомер с двумя или более центрами хиральности, молекулы которого не являются зеркальным отражением друг друга. Диастереомеры обладают разными физическими свойствами, например, температурой плавления, температурой кипения, спектральными свойствами и реакционной способностью. Смеси диастереомеров можно разделять при помощи аналитических методов с высоким разрешением, таких как электрофорез и хроматография. Термин "энантиомеры" обозначает два стереоизомера соединения, изображения которых при наложении не совпадают друг с другом. Стереохимические определения и правила, применяемые в настоящем описании, в общем случае соответствуют S.P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984), McGraw-Hill Book Company, New York; and Eliel, E. и Wilen, S., Stereochemistry of Organic Compounds (1994), John WileySons,Inc., New York. Многие органические соединения существуют в оптически активной форме, т.е. они обладают способностью вращать плоскость плоскополяризованнного света. При описании оптически активного соединения применяют приставку D или L, либо R или S для обозначения абсолютной конфигурации молекулы относительно ее хирального центра (центров). Приставку d или I, либо (+) или (-) применяют для обозначения знака вращения плоскополяризованного света данным соединением, причем (-) или 1 означает, что соединение является левовращающим. Соединение с приставкой (+) или d является правовращающим. Для заданной химической структуры такие стереоизомеры идентичны за исключением того, что они являются зеркальным отображением друг друга. Конкретный стереоизомер могут также называть энантиомером, а смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров 50:50 называют рацемической смесью или рацематом, которая может существовать в случае,когда в ходе химической реакции или процесса отсутствует стереоселективность или стереоспецифичность. Термины "рацемическая смесь" и "рацемат" обозначают эквимолярную смесь двух видов энантиомеров, не обладающую оптической активностью. Защитные группы. В контексте настоящего изобретения защитные группы включают фрагменты пролекарства и химические защитные группы. Защитные группы доступны, хорошо известны и широко применяются и их можно применять для предупреждения побочных реакций с участием защищаемой группой во время синтеза, т.е. путей или способов получения соединений, предложенных в настоящем изобретении. По большей части решение о том, какую группу защищать, когда это нужно делать и какова должна быть природа химической защитной группы "3 Г" будет зависеть от химизма реакции, для предотвращения протекания которой осуществляют защиту (например, кислотные, основные, окислительные, восстановительные или другие условия) и от предполагаемого направления синтеза. Группы 3 Г не должны быть и обычно не являются одинаковыми, если соединение замещают многими 3 Г. В целом 3 Г должны применять для защиты таких функциональных групп, как карбоксильная, гидроксильная, тио- или аминогруппы, и так, чтобы предупредить побочные реакции или другим образом способствовать эффективности синтеза. Порядок удаления защитных групп с получением свободных незащищенных групп зависит от планируемого направления синтеза и от условий проведения реакции и может проводиться в любом порядке, определенном специалистом в данной области техники. Можно защищать разные функциональные группы в составе соединений, предложенных в изобретении. Например, защитные группы для групп -ОН (либо гидроксил, карбоновая кислота, фосфорная кислота или другие функциональные группы) включают "группы, образующие эфир или сложный эфир". Группы, образующие эфир или сложный эфир, могут выступать в качестве химических защитных групп в схемах синтеза, приведенных в настоящем описании. Однако некоторые гидроксил- и тиозащитные группы не являются группами, образующими эфир или сложный эфир, как должны понимать специалисты в данной области техники, и относятся к амидам, обсуждаемым ниже. Очень большое число гидроксильных защитных групп и амидобразующих групп, а также соответствующие реакции химического расщепления описаны в Protective Groups in Organic Synthesis, TheodoraW. Green and Peter G.M. Wuts (John WileySons, Inc., New York, 1999, ISBN 0-471-16019-9) ("Green"). Также см. работу Kocienski, Philip J.; Protecting Groups (Georg Thieme Verlag Stuttgart, New York, 1994),содержание которой полностью включено в настоящее описание посредством ссылки. В частности, Глава 1, Protecting Groups: An Overview, с. 1-20, Глава 2, Hydroxyl Protecting Groups, с. 21-94, Глава 3, DiolGroups, с. 155-184. Для ознакомления с защитными группами для карбоновых кислот, фосфорной кислоты, фосфоната, сульфоновой кислоты и других защитных групп для кислот см. работу Green, как указано ниже. Такие группы включают в качестве примера, но без ограничений, сложные эфиры, амиды, гидразиды и подобное. Согласно настоящему изобретению соединение представлено формулой IIa или фармацевтически приемлемой солью указанного соединения, гдеR3 представляет собой алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, гетероалкил, замещенный гетероалкил, карбоциклил, замещенный карбоциклил, карбоциклилалкил, замещенный карбоциклилалкил, гетероциклил, замещенный гетероциклил, гетероциклилалкил или замещенный гетероциклилалкил;R4 и R5 вместе с азотом, к которому они оба присоединены, образуют замещенный или незамещенный гетероцикл;R6 представляет собой алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, гетероалкил, замещенный гетероалкил, карбоциклил, замещенный карбоциклил, карбоциклилалкил, замещенный карбоциклилалкил, гетероциклил, замещенный гетероциклил, гетероциклилалкил или замещенный гетероциклилалкил;R7 и R8, каждый независимо, представляют собой Н, алкил, замещенный алкил, карбоциклил, замещенный карбоциклил, карбоциклилалкил, замещенный карбоциклилалкил, гетероциклил, замещенный гетероциклил, гетероциклилалкил или замещенный гетероциклилалкил; илиR7 и R8 вместе с азотом, к которому они оба присоединены, образуют замещенный или незамещенный гетероцикл;R9 представляет собой Н, алкил, замещенный алкил, карбоциклил, замещенный карбоциклил, карбоциклилалкил, замещенный карбоциклилалкил, гетероциклил, замещенный гетероциклил, гетероциклилалкил или замещенный гетероциклилалкил, защитную группу или фрагмент пролекарства;n равно 0, 1, 2 или 3. Согласно одному варианту реализации формулы IIa R1 представляет собой NR4R5; a R4 и R5 вместе с азотом, к которому они оба присоединены, образуют замещенный или незамещенный гетероцикл. Согласно другому варианту реализации формулы IIa R1 представляет собой NR4R5; a R4 и R5 вместе с азотом, к которому они оба присоединены, образуют замещенный или незамещенный гетероцикл, где гетероцикл представляет собой 4-6-членное моноциклическое полностью насыщенное или частично ненасыщенное кольцо, содержащее по меньшей мере один гетероатом, выбранный из N, О и S, или 10-12 членное конденсированное бициклическое полностью насыщенное или частично ненасыщенное кольцо,содержащее по меньшей мере один гетероатом, выбранный из N, О и S. Согласно другому варианту реализации формулы IIa гетероцикл выбирают из группы, включающей: Согласно другому варианту реализации формулы IIa R1 представляет собой NR4R5; R4 представляет собой Н, алкил, замещенный алкил, карбоциклилалкил, замещенный карбоциклилалкил; a R5 представляет собой карбоциклил, замещенный карбоциклил, карбоциклилалкил, замещенный карбоциклилалкил,арил, замещенный арил, гетероарил, замещенный гетероарил, гетероциклилалкил, замещенный гетероциклилалкил, -С(О)Н, -C(O)R3, -C(O)OR3 или -C(O)NR7R8. Согласно другому варианту реализации формулы IIa R2 представляет собой-C(O)R6, -C(O)OR6,-C(O)NR7R8, -S(O)OR7, -S(O)NR7R8, -S(O)2OR7 или -S(O)2NR7R8. Согласно другому варианту реализации формулы IIa R4 представляет собой Н, метил, этил, нпропил, изопропил, н-бутил, циклопропил или циклопропилметиленил; R5 представляет собой фенил,пиридинил, -С(О)СН 3, -С(О)ОСН 3, -С(О)СН 2 СН 3 или -С(О)ОСН 2 СН 3. Согласно другому варианту реализации формулы IIa R2 представляет собой алкил, замещенный алкил, алкенил, замещенный алкенил, карбоциклил, замещенный карбоциклил, карбоциклилалкил, замещенный карбоциклилалкил, арил, замещенный арил, арилалкил, замещенный арилалкил, гетероциклилалкил или замещенный гетероциклилалкил. Согласно другому варианту реализации формулы IIa R2 представляет собой метил, этил, н-пропил,изопропил, н-бутил, аллил, циклопропил, метилциклопропил, циклопропилметилен, бензил или метоксибензил. Согласно другому варианту реализации формулы IIa L3 представляет собой -О-. Согласно другому варианту реализации формулы IIa -L3-R3 представляет собой -О-алкил или -Оалкилен-О-алкил. Согласно другому варианту реализации формулы IIa -L3-R3 представляет собой -ОСН 2 СН 2 ОСН 3 или-ОСН 2 СН 2 СН 2 СН 3. Согласно другому варианту реализации формулы IIa R1 представляет собой -NR4R5; R2 представляет собой алкил, замещенный алкил, алкенил, замещенный алкенил, циклилалкил, замещенный циклилалкил, циклилалкилалкил, замещенный циклилалкилалкил, арил, замещенный арил, арилалкил, замещенный арилалкил, гетероциклилалкил или замещенный гетероциклилалкил; L3 представляет собой -О-; R3 представляет собой алкил, замещенный алкил, гетероалкил, замещенный гетероалкил; а R4 и R5 вместе с азотом, к которому они оба присоединены, образуют замещенный или незамещенный гетероцикл. Фармацевтические составы. Соединения, предложенные в настоящем изобретении, вводят в составы лекарственных форм с применением традиционных носителей и наполнителей, которые выбирают в соответствии с общепринятой практикой. Таблетки содержат вспомогательные вещества, вещества, способствующие скольжению,наполнители, связующие вещества и др. Водные составы готовят в стерильной форме и, когда планируют их доставку путем, отличным от перорального, обычно получают их изотоническими. Все составы могут содержать наполнители, такие как описаны в Handbook of Pharmaceutical Excipients (1986), содержание которой включено в настоящее описание посредством ссылки во всей полноте. Наполнители включают аскорбиновую кислоту и другие антиоксиданты, хелатирующие агенты, такие как ЭДТА, углеводы, такие как декстрин, гидроксиалкилцеллюлозу, гидроксиалкилметилцеллюлозу, стеариновую кислоту и др. рН указанных составов находится в диапазоне от 3 до 11, но обычно составляет примерно от 7 до 10. Хотя возможно введение активных ингредиентов в отдельности, может быть предпочтительно представить их в виде фармацевтических составов. Составы, предложенные в настоящем изобретении,как для ветеринарного применения, так и для применения у человека, содержат по меньшей мере активный ингредиент наряду с одним или более приемлемыми носителями и, возможно, другими терапевтическими ингредиентами. Носитель(и) должен быть "приемлемым" в том смысле, что он должен быть совместим с другими ингредиентами состава и физиологически безопасны для реципиента. Составы согласно изобретению включают составы, подходящие для вышеуказанных путей введения. Составы могут быть традиционно представлены в виде дозированной лекарственной формы и могут быть получены при помощи любого из способов, хорошо известных в области фармации. Методы получения и составы в общем случае можно найти в работе Remington's Pharmaceutical Sciences (Mack Publishing Co., Easton, Pa.), содержание которой включено в настоящее описание посредством ссылки во всей полноте. Такие способы включают этап объединения активного ингредиента с носителем, который содержит один или более вспомогательных ингредиентов. В целом, составы готовят путем равномерного и тщательного объединения активного ингредиента с жидкими носителями или тонко измельченными твердыми носителями или и тем, и другими, и затем, при необходимости, формовки продукта.-6 024359 Составы, предложенные в настоящем изобретении, подходящие для перорального введения, могут быть представлены в форме дискретных единиц, таких как капсулы, саше или таблетки, каждая из которых содержит заранее определенное количество активного ингредиента; в виде порошков или гранул; в виде раствора или суспензии в водной или неводной жидкости; или в виде жидкой эмульсии типа "масло-в-воде" или "вода-в-масле". Активный ингредиент также можно вводить в виде болюсов, электуария или пасты. Таблетку получают путем прессования или формовки, возможно с одним или более вспомогательными ингредиентами. Спрессованные таблетки можно готовить путем прессования в соответствующем аппарате активного ингредиента в свободнотекучей форме, такой как порошок или гранулы, возможно в смеси со связующим веществом, смазывающим веществом, инертным разбавителем, консервантом, поверхностно-активным веществом или диспергирующим агентом. Формованные таблетки можно получать путем формовки в соответствующем аппарате смеси порошкообразного активного ингредиента,увлажненного инертным жидким разбавителем. Таблетки можно покрывать оболочкой или наносить на них насечки, при этом состав указанных таблеток может быть таким, чтобы обеспечивать замедленное или контролируемое высвобождение активного ингредиента. Для введения в глаз или в другие наружные ткани, например, в полость рта или на кожу, указанные составы предпочтительно наносят в виде местных мази или крема, содержащих активные ингредиент(ы) в количестве, например, 0,075-20% м/м (включая активный ингредиент(ы) в диапазоне от 0,1 до 20% с шагом 0,1% м/м, такие как 0,6% м/м, 0,7% м/м и др.), предпочтительно от 0,2 до 15% м/м, а еще более предпочтительно от 0,5 до 10% м/м. При получении состава в виде мази активные ингредиенты можно применять либо в сочетании с парафиновой, либо с водорастворимой основой мазей. В качестве альтернативы, активные ингредиенты можно включать в состав крема, применяя кремовую основу типа "маслов-воде". Если желательно, водная фаза кремовой основы может включать, например, по меньшей мере 30% м/м многоатомного спирта, т.е. спирта, содержащего две или более гидроксильных групп, такого как пропиленгликоль, бутан-1,3-диол, маннитол, сорбитол, глицерин и полиэтиленгликоль (включая ПЭГ 400) и их смеси. Составы для местного применения могут желательно включать соединение, которое усиливает всасывание или проникновение активного ингредиента через кожу или другие пораженные участки. Примеры таких усилителей проникновения через кожу включают диметилсульфоксид и родственные аналоги. Масляная фаза эмульсий, предложенных в настоящем изобретении, может быть получена из известных ингредиентов известным образом. Хотя указанная фаза может включать только эмульсификатор(по-другому называемый эмульгатором), желательно, чтобы она содержала смесь по меньшей мере одного эмульгатора с жиром или маслом, или и с жиром, и с маслом. Предпочтительно, гидрофильный эмульгатор вводят в состав наряду с липофильным эмульгатором, выступающим в качестве стабилизатора. Вместе эмульгатор(ы) со стабилизатором(ами) образуют так называемый эмульгирующий воск, а указанный воск вместе с маслом и жиром образует так называемую эмульгирующую мазевую основу, которая образует масляную дисперсную фазу состава в виде крема. Эмульгаторы и стабилизаторы эмульсии, подходящие для применения в составе, предложенном в изобретении, включают Tween 60, Span 80, цетостеариловый спирт, бензиловый спирт, миристиловый спирт, глицерилмоностеарат и лаурилсульфат натрия. Выбор подходящих масел или жиров для состава основан на достижении желаемых косметических свойств. Крем предпочтительно должен представлять собой нежирный, не красящийся и смываемый препарат с подходящей консистенцией, чтобы избежать вытекания из тюбиков или других емкостей. Можно применять сложные одно или двухосновные эфиры алкилов с прямой или разветвленной цепью,такие как диизоадипат, изоацетилстеарат, сложный диэфир пропиленгликоля и жирных кислот кокосового масла, изопропилмиристат, децилолеат, изопропилпальметат, бутилстеарат, 2-этилгексилпальмитат или сложные эфиры со смешанными или разветвленными цепями, такие как Crodamol CAP, причем предпочтительны последние три эфира. Указанные вещества могут применяться в отдельности или в сочетании в зависимости от требуемых свойств. В качестве альтернативы можно применять липиды с высокой температурой плавления, такие как белый мягкий парафин и/или жидкий парафин или другие минеральные масла. Фармацевтические составы согласно настоящему изобретению содержат одно или более соединений, предложенных в настоящем изобретении, и один или более фармацевтически приемлемых носителей или наполнителей и, возможно, другие терапевтические агенты. Фармацевтические составы, содержащие активный ингредиент, могут быть в любой форме, подходящей для планируемого способа введения. Когда состав применяют для перорального введения, можно получить, например, таблетки, лепешки, пастилки, водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсии, твердые или мягкие капсулы, сиропы или эликсиры. Композиции, предназначенные для перорального введения, можно получить в соответствии с любым способом, известным в данной области техники для производства фармацевтических композиций, при этом такие композиции могут содержать один или более агентов, включая подсластители, ароматизаторы, красители и консерванты, для получения приятного на-7 024359 вкус препарата. Также подходят таблетки, содержащие активные ингредиенты в смеси с нетоксичным фармацевтически приемлемым наполнителем, который подходит для получения таблеток. Такие вспомогательные вещества могут, например, представлять собой инертные разбавители, такие как карбонат кальция или натрия, лактоза, моногидрат лактозы, натриевая соль кроскармеллозы, повидон, фосфат кальция или натрия; гранулирующие и дезинтегрирующие агенты, такие как кукурузный крахмал или альгиновая кислота; связующие вещества, такие как целлюлоза, микрокристаллическая целлюлоза, крахмал, желатин или камедь; и смазывающие вещества, такие как стеарат магния, стеариновая кислота или тальк. Таблетки могут быть без оболочки или с покрытием, нанесенным при помощи известных способов, включая микроинкапсулирование, чтобы замедлить распад и всасывание в желудочно-кишечном тракте и, тем самым, обеспечить длительное действие в течение более продолжительного периода. Например, можно применять вещество, замедляющее доставку, такое как глицерилдистеарат, в отдельности или в сочетании с воском. Составы для перорального применения также можно получить в виде твердых желатиновых капсул,в которых активные ингредиенты смешаны с твердым разбавителем, например, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активные ингредиенты смешаны с водной или масляной основой, такой как кокосовое масло, жидкий парафин или оливковое масло. Водные суспензии, предложенные в изобретении, содержат активные вещества в смеси с наполнителями, подходящими для получения водных эмульсий. Такие наполнители включают суспендирующий агент, такой как натриевая соль карбоксиметилцеллюлозы, метилцеллюлоза, гидроксипропилметилцеллюлоза, трагакантовая камедь и гуаровая камедь, а также диспергирующие или смачивающие агенты,такие как фосфатиды природного происхождения (например, лецитин), продукт конденсации оксида алкилена и жирной кислоты (например, полиоксиэтиленстеарат), продукт конденсации оксида этилена и длинноцепочечного алифатического спирта (например, гептадекаэтиленоксикетанол), продукт конденсации оксида этилена и частичного сложного эфира, полученного из жирной кислоты и ангидрида гекситола (например, полиоксиэтиленсорбитана моноолеат). Водная суспензия также может содержать один или более консервантов, таких как этил- или н-пропил-п-гидроксибензоат, один или более красителей, один или более ароматизаторов и один или более подсластителей, таких как сахароза или сахарин. Масляные суспензии можно приготовить путем суспендирования активных ингредиентов в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло,или в минеральном масле, таком как жидкий парафин. Суспензии для перорального введения могут содержать загустители, такие как воск, твердый парафин или цетиловый спирт. Можно добавлять подсластители, такие как подсластители, указанные в настоящем описании, и ароматизаторы, чтобы сделать препарат приятным на вкус. Такие композиции можно сохранять путем добавления антиоксиданта, такого как аскорбиновая кислота. Диспергируемые порошки и гранулы, предложенные в изобретении, подходящие для приготовления водных суспензий путем добавления воды, обеспечивают активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и с одним или более консервантами. Примеры подходящих диспергирующих или смачивающих агентов приведены выше. Также могут присутствовать дополнительные вспомогательные вещества, например подсластители, ароматизаторы и красители. Фармацевтические композиции, предложенные в изобретении, также могут быть в форме эмульсий типа "масло-в-воде". Масляной фазой может быть растительное масло, такое как оливковое масло или арахисовое масло, минеральное масло, такое как жидкий парафин, или их смесь. Подходящие эмульгирующие агенты включают природные камеди, такие как гуаровая камедь и трагакантовая камедь, природные фосфатиды, такие как соевый лецитин, сложные эфиры или частичные эфиры, полученные из жирных кислот и ангидридов гекситола, таких как сорбитана моноолеат, и продуктов конденсации таких частичных эфиров с оксидом этилена, таких как полиоксиэтиленсорбитана моноолеат. Эмульсия также может содержать подсластители и ароматизаторы. Сиропы и эликсиры можно получать с применением подсластителей, таких как глицерин, сорбитол и сахароза. Такие составы также могут содержать средство, уменьшающее раздражение, консервант, ароматизатор или краситель. Фармацевтические композиции, предложенные в изобретении, могут быть в форме стерильных инъекционных препаратов, таких как стерильные водные или масляные инъекционные суспензии. Эти суспензии можно приготовить в соответствии с известными способами с применением таких подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые указаны в настоящем описании. Стерильный инъекционный препарат также может быть стерильным инъецируемым раствором или суспензией в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, таком как раствор 1,3-бутандиола, или его готовят в виде лиофилизированного порошка. Среди приемлемых носителей и растворителей, которые можно применять, - вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла можно традиционно применять в качестве растворителя или суспендирующей среды. Для данной цели можно применять любое мягкое нелетучее масло, включая синтетические моно- и диглицериды. Кроме того, жирные кислоты,такие как олеиновая кислота, можно применять подобным образом при приготовлении инъекционных-8 024359 форм. Количество активного ингредиента, которое можно сочетать с веществом носителя для получения формы для однократного введения, может варьироваться в зависимости от хозяина, которого лечат, и конкретного способа введения. Например, состав с контролируемым высвобождением предназначенный для перорального введения человеку, может содержать примерно от 1 до 1000 мг активного вещества,смешанного с соответствующим и удобным количеством вещества носителя, которое может варьироваться примерно от 5 до примерно 95% от массы всей композиции (масса:масса). Фармацевтическую композицию можно приготовить так, чтобы обеспечить легко отмеряемые для введения количества композиции. Например, водный раствор, предназначенный для внутривенного вливания, может содержать от 3 до 500 мкг активного ингредиента на миллилитр раствора таким образом, чтобы производить инфузию подходящего объема при скорости примерно 30 мл/ч. Составы, подходящие для введения в глаз, включают глазные капли, в которых активный ингредиент растворен или суспендирован в подходящем носителе, особенно в водном растворителе для активного ингредиента. Активный ингредиент предпочтительно присутствует в таких составах в концентрации 0,5-20%, преимущественно 0,5-10%, в частности примерно 1,5% м/м. Составы, подходящие для местного введения в ротовую полость, включают лепешки, содержащие активный ингредиент в ароматизированном носителе, обычно сахарозе или гуаровой или трагакантовой камеди; пастилки, содержащие активный ингредиент в инертном носителе, таком как желатин или глицерин или сахароза и гуаровая камедь; и полоскания, содержащие активный ингредиент в подходящем жидком носителе. Составы для ректального введения могут быть представлены в виде суппозиториев с подходящей основой, содержащей, например, масло какао или салицилат. Составы, подходящие для внутрилегочного или назального введения, имеют размер частиц, например, в диапазоне от 0,1 до 500 мкм (включая размер частиц в диапазоне от 0,1 до 5000 мкм с таким шагом, как 0,5 мкм, 1 мкм, 30 мкм, 35 мкм и т.д.), которые вводят путем быстрой ингаляции через носовой проход или путем ингаляции через рот так, чтобы они достигали альвеолярных мешочков. Подходящие составы включают водные или масляные растворы активного ингредиента. Составы, подходящие для введения в виде аэрозоля или сухого порошка, можно приготовить в соответствии с традиционными способами и можно доставлять совместно с другими терапевтическими агентами, такими как соединения,применяемые ранее для лечения или профилактики инфекций, как указано в настоящем описании. Составы, подходящие для вагинального введения, могут быть представлены в форме маточных колец, тампонов, кремов, гелей, паст, пен или спрея, содержащих наряду с активным ингредиентом такие носители, которые известны в данной области техники в качестве подходящих. Составы, подходящие для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостаты и растворенные вещества, которые придают составу изотоничность по отношению к крови предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Составы представлены в виде контейнеров, содержащих одну дозу или множество доз, например,запечатанные ампулы и флаконы, при этом указанные составы можно хранить в сублимированном (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например,воды для инъекций, непосредственно перед применением. Приготовляемые для немедленного введения инъекционные растворы и суспензии готовят из стерильных порошков, гранул и таблеток, таких как описано ранее. Предпочтительные дозированные составы представляют собой составы, содержащие суточную дозу или единичную суточную субдозу, как указано в настоящем описании ранее, или соответствующую долю указанной дозы или субдозы активного ингредиента. Следует понимать, что помимо ингредиентов, конкретно указанных выше, составы, предложенные в этом изобретении, могут включать другие агенты, традиционно применяемые в данной области техники, учитывая тип рассматриваемого состава; например, составы, подходящие для перорального введения,могут включать ароматизаторы. Согласно изобретению также предложены ветеринарные композиции, содержащие по меньшей мере один активный ингредиент, определенный выше, совместно с ветеринарным носителем. Ветеринарные носители представляют собой вещества, подходящие для введения указанной композиции, и они могут быть твердыми, жидкими или газообразными веществами, которые в других отношениях инертны или приемлемы в области ветеринарии и совместимы с активным ингредиентом. Эти ветеринарные композиции можно вводить перорально, парентерально или любым другим желаемым путем. Соединения, предложенные в изобретении, также можно включать в состав, обеспечивающий контролируемое высвобождение активного ингредиента, что дает возможность менее частого дозирования или улучшает фармакокинетический или токсический профиль активного ингредиента. Соответственно,согласно изобретению также предложены композиции, содержащие одно или более соединений, предложенных в изобретении, где состав указанных композиций обеспечивает длительное или контролируемое высвобождение.-9 024359 Эффективная доза активного ингредиента зависит, по меньшей мере, от природы патологического состояния, подвергаемого лечению, токсичности, от того, применяют ли соединение для профилактики(более низкие дозы) или для лечения активного заболевания или патологического состояния, от способа доставки и конкретного фармацевтического состава, при этом указанную дозу должен определять врач с помощью традиционных исследований с повышением дозы. Можно ожидать, что эффективная доза будет находиться в диапазоне от примерно 0,0001 до 10 мг/кг массы тела в день, типично от примерно 0,001 до примерно 1 мг/кг массы тела в день, более типично от примерно 0,01 до примерно 1 мг/кг массы тела в день, еще более типично от примерно 0,05 до примерно 0,5 мг/кг массы тела в день. Например, возможная суточная доза для взрослого человека с массой тела примерно 70 кг будет находиться в диапазоне от примерно 0,05 мг до примерно 100 мг, или от примерно 0,1 мг до примерно 25 мг, или от примерно 0,4 мг до примерно 4 мг, и может принимать форму однократных или многократных доз. Согласно еще одному варианту реализации в настоящем изобретении предложены фармацевтические композиции, содержащие соединение, отвечающее формуле IIa, или фармацевтически приемлемую соль указанного соединения, и фармацевтически приемлемый носитель или наполнитель. Согласно еще одному варианту реализации в настоящем изобретении предложены фармацевтические композиции, содержащие соединение, отвечающее формуле IIa, или фармацевтически приемлемую соль указанного соединения в сочетании по меньшей мере с одним дополнительным активным агентом и фармацевтически приемлемый носитель или наполнитель. Согласно еще одному варианту реализации в настоящем изобретении предложены фармацевтические композиции, содержащие соединение, отвечающее формуле IIa, или фармацевтически приемлемую соль указанного соединения в сочетании по меньшей мере с одним дополнительным активным агентом и фармацевтически приемлемый носитель или наполнитель. Примеры дополнительного активного агента также включают интерфероны, рибавирин или его аналоги, ингибиторы протеазы NS3 HCV, ингибиторы альфа-глюкозидазы-1, гепатопротекторы, нуклеозидные или нуклеотидные ингибиторы полимеразыNS5B HCV, ненуклеозидные ингибиторы полимеразы NS5B HCV, ингибиторы NS5A HCV, агонистыTLR-7, ингибиторы циклофиллина, ингибиторы IRES HCV, усилители фармакокинетических характеристик и другие лекарственные препараты для лечения вируса гепатита С (HCV) или их смеси. Более конкретно, одно или более соединений, предложенных в настоящем изобретении, можно сочетать с одним или более соединениями, выбранными из группы, включающей:(Альбуферон), IFN альфа-2b XL, BLX-883 (Локтерон), DA-3021, гликозилированный интерферон альфа 2b (AVI-005), ПЭГ-Инферген, Пегилированный интерферон лямбда-1 (Пегилированный IL-29), белерофон и их смеси;(6) нуклеозидные или нуклеотидные ингибиторы полимеразы NS5B HCV, выбранные из группы,включающей R1626, R7128 (R4048), IDX184, IDX-102, ВСХ-4678, валопицитабин (NM-283), MK-0608 и их смеси;(7) ненуклеозидные ингибиторы полимеразы NS5B HCV, выбранные из группы, включающей PF868554, VCH-759, VCH-916, JTK-652, MK-3281, VBY-708, VCH-222, А 848837, ANA-598, GL60667,GL59728, А-63890, А-48773, А-48547, ВС-2329, VCH-796 (несбувир), GSK625433, BILN-1941, XTL-2125,GS-9190 и их смеси;(13) другие лекарственные препараты для лечения вируса гепатита С, выбранные из группы, включающей тимозин альфа 1 (Задаксин), нитазоксанид (Алинея, NTZ), BIVN-401 (виростат), PYN-17 (альтирекс), KPE02003002, актилон (CPG-10101), KRN-7000, цивацир, GI-5005, XTL-6865, BIT225, PTX-111,ITX2865, TT-033i, ANA 971, NOV-205, тарвацин, EHC-18, VGX-410C, EMZ-702, AVI 4065, BMS-650032,BMS-791325, Бавитуксимаб, MDX-1106 (ONO-4538), Оглуфанид, VX-497 (меримеподиб) и их смеси. Согласно еще одному варианту реализации в настоящем изобретении предложены фармацевтические композиции, содержащие комбинированный фармацевтический агент, содержащий: а) первую фармацевтическую композицию, содержащую соединение, отвечающее формуле IIa, или фармацевтически приемлемую соль указанного соединения; и б) вторую фармацевтическую композицию, содержащую по меньшей мере один дополнительный активный агент, выбранный из группы, включающей интерфероны, рибавирин или его аналоги, ингибиторы протеазы NS3 HCV, ингибиторы альфа-глюкозидазы-1, гепатопротекторы, нуклеозидные или нуклеотидные ингибиторы полимеразы NS5B HCV, ненуклеозидные ингибиторы полимеразы NS5B HCV,ингибиторы NS5A HCV, агонисты TLR-7, ингибиторы циклофиллина, ингибиторы IRES HCV, усилители фармакокинетических характеристик и другие препараты для лечения вируса гепатита С или их смеси. Способы введения. Одно или более соединений, предложенных в изобретении (обозначаемых в настоящем описании как активные ингредиенты), вводят любым путем, приемлемым для патологического состояния, подвергаемого лечению. Подходящие пути введения включают пероральный, ректальный, назальный, местный(включая буккальный и сублингвальный), вагинальный и парентеральный (включая подкожный и внутримышечный, внутривенный, внутрикожный, интратекальный и эпидуральный) и подобные. Следует принимать во внимание, что предпочтительный путь введения может варьироваться, например, в зависимости от конкретного патологического состояния у реципиента. Преимущество соединений, предложенных в данном изобретении, состоит в том, что указанный соединения биодоступны при пероральном введении и их можно вводить перорально. Комбинированная терапия. Согласно одному варианту реализации соединения, предложенные в настоящем изобретении, применяют в комбинации с другими активными терапевтическими ингредиентами или агентами. Комбинации соединений, отвечающих формуле IIa, и дополнительных активных агентов можно выбирать для лечения пациентов с вирусной инфекцией, например вирусным гепатитом В, вирусным гепатитом С или ВИЧ-инфекцией. Предпочтительно, чтобы другими активными терапевтическими ингредиентами были интерфероны, рибавирин или его аналоги, ингибиторы протеазы NS3 HCV, ингибиторы альфа-глюкозидазы-1, гепатопротекторы, нуклеозидные или нуклеотидные ингибиторы полимеразы NS5B HCV, ненуклеозидные ингибиторы полимеразы NS5B HCV, ингибиторы NS5A HCV, агонисты TLR-7, ингибиторы циклофиллина, ингибиторы IRES HCV, усилители фармакокинетических характеристик и другие препараты для лечения вируса гепатита С или их смеси. Комбинации соединений, отвечающих формуле IIa, обычно выбирают на основании патологического состояния, которое нужно лечить, перекрестного взаимодействия ингредиентов и фармакологических свойств комбинации. Например, когда лечат инфекцию (например, вирус гепатита С), композиции, предложенные в изобретении, комбинируют с активными агентами (такими как указано в настоящем описании). Подходящие активные агенты или ингредиенты, которые можно комбинировать с соединениями,отвечающими формуле IIa, могут включать одно или более соединений, выбранных из группы, включающей:(Альбуферон), IFN альфа-2b XL, BLX-883 (Локтерон), DA-3021, гликозилированный интерферон альфа 2b (AVI-005), ПЭГ-Инферген, Пегилированный интерферон лямбда-1 (Пегилированный IL-29), белерофон и их смеси;(6) нуклеозидные или нуклеотидные ингибиторы полимеразы NS5B HCV, выбранные из группы,включающей R1626, R7128 (R4048), IDX184, IDX-102, ВСХ-4678, валопицитабин (NM-283), MK-0608 и их смеси;(7) ненуклеозидные ингибиторы полимеразы NS5B HCV, выбранные из группы, включающей PF868554, VCH-759, VCH-916, JTK-652, MK-3281, VBY-708, VCH-222, А 848837, ANA-598, GL60667,GL59728, А-63890, А-48773, А-48547, ВС-2329, VCH-796 (несбувир), GSK625433, BILN-1941, XTL-2125,GS-9190 и их смеси;(13) другие лекарственные препараты для лечения вируса гепатита С, выбранные из группы, включающей тимозин альфа 1 (Задаксин), нитазоксанид (Алинея, NTZ), BIVN-401 (виростат), PYN-17 (альтирекс), KPE02003002, актилон (CPG-10101), KRN-7000, цивацир, GI-5005, XTL-6865, BIT225, РТХ-111,ITX2865, TT-033i, ANA 971, NOV-205, тарвацин, ЕНС-18, VGX-410C, EMZ-702, AVI 4065, BMS-650032,BMS-791325, Бавитуксимаб, MDX-1106 (ONO-4538), Оглуфанид, VX-497 (меримеподиб) и их смеси. Согласно другому варианту реализации в настоящем изобретении предложены фармацевтические композиции, содержащие соединение, предложенное в настоящем изобретении, или его фармацевтически приемлемую соль, в комбинации по меньшей мере с одним дополнительным активным агентом и фармацевтически приемлемый носитель или наполнитель. Согласно настоящему изобретению активный агент, применяемый в комбинации с соединением,предложенным в настоящем изобретении, может быть любым агентом, имеющим терапевтический эффект, когда его применяют в комбинации с соединением, предложенном в настоящем изобретении. Например, активным агентом, применяемым в комбинации с соединением, предложенным в настоящем изобретении, могут быть интерфероны, рибавирин или его аналоги, ингибиторы протеазы NS3 HCV, ингибиторы альфа-глюкозидазы-1, гепатопротекторы, нуклеозидные или нуклеотидные ингибиторы полимеразы NS5B HCV, ненуклеозидные ингибиторы полимеразы NS5B HCV, ингибиторы NS5A HCV, агонисты TLR-7, ингибиторы циклофиллина, ингибиторы IRES HCV, усилители фармакокинетических характеристик и другие препараты для лечения вируса гепатита С или их смеси. Согласно другому варианту реализации в настоящем изобретении предложены фармацевтические композиции, содержащие соединение, предложенное в настоящем изобретении, или его фармацевтически приемлемую соль в комбинации по меньшей мере с одним дополнительным активным агентом, выбранным из группы, включающей:(Альбуферон), IFN альфа-2b XL, BLX-883 (Локтерон), DA-3021, гликозилированный интерферон альфа 2b (AVI-005), ПЭГ-Инферген, Пегилированный интерферон лямбда-1 (Пегилированный IL-29), белерофон и их смеси;(19) нуклеозидные или нуклеотидные ингибиторы полимеразы NS5B HCV, выбранные из группы,включающей R1626, R7128 (R4048), IDX184, IDX-102, ВСХ-4678, валопицитабин (NM-283), MK-0608 и их смеси;(20) ненуклеозидные ингибиторы полимеразы NS5B HCV, выбранные из группы, включающей PF868554, VCH-759, VCH-916, JTK-652, MK-3281, VBY-708, VCH-222, А 848837, ANA-598, GL60667,GL59728, А-63890, А-48773, А-48547, ВС-2329, VCH-796 (несбувир), GSK625433, BILN-1941, XTL-2125,GS-9190 и их смеси;(26) другие лекарственные препараты для лечения вируса гепатита С, выбранные из группы, включающей тимозин альфа 1 (Задаксин), нитазоксанид (Алинея, NTZ), BIVN-401 (виростат), PYN-17 (альтирекс), KPE02003002, актилон (CPG-10101), KRN-7000, цивацир, GI-5005, XTL-6865, BIT225, РТХ-111,ITX2865, TT-033i, ANA 971, NOV-205, тарвацин, ЕНС-18, VGX-410C, EMZ-702, AVI 4065, BMS-650032,BMS-791325, Бавитуксимаб, MDX-1106 (ONO-4538), Оглуфанид, VX-497 (меримеподиб) и их смеси. Согласно еще одному варианту реализации в настоящем изобретении предложен комбинированный фармацевтический агент, содержащий: а) первую фармацевтическую композицию, содержащую соединение, предложенное в настоящем изобретении, или его фармацевтически приемлемую соль; б) вторую фармацевтическую композицию, содержащую по меньшей мере один дополнительный активный агент, выбранный из группы, включающей интерфероны, рибавирин или его аналоги, ингибиторы протеазы NS3 HCV, ингибиторы альфа-глюкозидазы-1, гепатопротекторы, нуклеозидные или нуклеотидные ингибиторы полимеразы NS5B HCV, ненуклеозидные ингибиторы полимеразы NS5B HCV,ингибиторы NS5A HCV, агонисты TLR-7, ингибиторы циклофиллина, ингибиторы IRES HCV, усилители фармакокинетических характеристик и другие препараты для лечения вируса гепатита С или их смеси. Также можно сочетать любое соединение, предложенное в изобретении, с одним или более активными агентами в дозируемой лекарственной форме для одновременного или последовательного введения пациенту. Комбинированную терапию можно проводить в одновременном или последовательном режиме. При последовательном введении комбинацию можно вводить в виде двух или более введений. Совместным введением соединения, предложенного в изобретении, с одним или более другими активными агентами обычно называют одновременное или последовательное введение соединения, предложенного в изобретении, и одного или более других активных агентов таким образом, чтобы обеспечить терапевтически эффективные количества и соединения, предложенного в изобретении, и одного или более других активных агентов в организме человека. Совместное введение включает введение дозированных лекарственных форм соединений, предложенных в изобретении, перед введением дозированной лекарственной формы одного или более других активных агентов или после их введения, например, введение соединений, предложенных в изобретении в течение нескольких секунд, минут или часов до или после введения одного или более других активных агентов. Например, одну дозу соединения, предложенного в изобретении, можно вводить сначала, а после нее вводить одну дозу одного или более других активных агентов в течение нескольких секунд или минут. В качестве альтернативы, одну дозу одного или более других активных агентов можно вводить сначала, а после нее вводить одну дозу соединения, предложенного в изобретении, в течение нескольких секунд или минут. В некоторых случаях может быть желательно вводить одну дозу соединения, предложенного в изобретении, сначала, а после нее вводить одну дозу одного или более других активных агентов через несколько часов (например, 1-12 ч). В других случаях, может быть желательно вводить одну дозу одного или более других активных агентов, а после нее вводить одну дозу соединения, предложенного в изобретении, через несколько часов (например, 1-12 ч). Комбинированная терапия может обеспечивать "синергию" или "синергический эффект", т.е. эффект, достигаемый, когда активные ингредиенты применяют вместе, превышает сумму эффектов, которые возникают вследствие применения соединений по отдельности. Синергического эффекта можно достичь, когда активные ингредиенты: (1) совместно готовят в виде одного состава и вводят или обеспечивают их доставку одновременно в комбинированном составе; (2) доставляют поочередно или параллельно в виде отдельных составов; или (3) в каком-то другом режиме. Если доставку осуществляют в ходе поочередной терапии, синергического эффекта можно достигнуть, когда соединения вводят или обеспечивают их доставку последовательно, например, в разных таблетках или капсулах, или при введении разных инъекций при помощи разных шприцов. Обычно во время поочередной терапии эффективную дозу каждого активного ингредиента вводят последовательно, т.е. серийно, а при комбинированной терапии эффективные дозы двух или более активных ингредиентов вводят вместе. Согласно еще одному варианту реализации в настоящем изобретении предложены способы лечения вирусной инфекции у пациента, включающие: введение пациенту терапевтически эффективного количества соединения, отвечающего формулеIIa или его фармацевтически приемлемой соли. Согласно еще одному варианту реализации в настоящем изобретении предложены способы лечения вирусной инфекции у пациента, включающие: введение пациенту терапевтически эффективного количества соединения, отвечающего формуле IIa или его фармацевтически приемлемой соли и по меньшей мере одного дополнительного активного агента.- 13024359 Согласно еще одному варианту реализации в настоящем изобретении предложены способы лечения вирусного гепатита С у пациента, включающие: введение пациенту терапевтически эффективного количества соединения, отвечающего формуле IIa или фармацевтически приемлемой соли указанного соединения. Согласно еще одному варианту реализации в настоящем изобретении предложены способы лечения вирусного гепатита С у пациента, включающие введение пациенту терапевтически эффективного количества соединения, отвечающего формуле IIa или фармацевтически приемлемой соли указанного соединения и по меньшей мере одного дополнительного активного агента. Согласно еще одному варианту реализации в настоящем изобретении предложены способы лечения вирусного гепатита С у пациента, включающие введение пациенту терапевтически эффективного количества соединения, отвечающего формуле IIa или фармацевтически приемлемой соли указанного соединения и по меньшей мере одного дополнительного активного агента, выбранного из группы, включающей интерфероны, рибавирин или его аналоги, ингибиторы протеазы NS3 HCV, ингибиторы альфаглюкозидазы-1, гепатопротекторы, нуклеозидные или нуклеотидные ингибиторы полимеразы NS5BHCV, ненуклеозидные ингибиторы полимеразы NS5B HCV, ингибиторы NS5A HCV, агонисты TLR-7,ингибиторы циклофиллина, ингибиторы IRES HCV, усилители фармакокинетических характеристик и другие лекарственные препараты для лечения вируса гепатита С или их смеси. Согласно еще одному варианту реализации в настоящем изобретении предложено применение соединения или его фармацевтически приемлемой соли для получения препарата для лечения вирусной инфекции, например инфекции вируса гепатита В/вируса гепатита С. Согласно еще одному варианту реализации в настоящем изобретении предложен способ лечения или профилактики вирусной инфекции, включающий совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества по меньшей мере одного соединения, отвечающего формуле IIa и по меньшей мере одного дополнительного активного агента, выбранного из группы, включающей:(Альбуферон), IFN альфа-2b XL, BLX-883 (Локтерон), DA-3021, гликозилированный интерферон альфа 2b (AVI-005), ПЭГ-Инферген, Пегилированный интерферон лямбда-1 (Пегилированный IL-29), белерофон и их смеси;(6) нуклеозидные или нуклеотидные ингибиторы полимеразы NS5B HCV, выбранные из группы,включающей R1626, R7128 (R4048), IDX184, IDX-102, ВСХ-4678, валопицитабин (NM-283), MK-0608 и их смеси;(7) ненуклеозидные ингибиторы полимеразы NS5B HCV, выбранные из группы, включающей PF868554, VCH-759, VCH-916, JTK-652, MK-3281, VBY-708, VCH-222, А 848837, ANA-598, GL60667,GL59728, А-63890, А-48773, А-48547, ВС-2329, VCH-796 (несбувир), GSK625433, BILN-1941, XTL-2125,GS-9190 и их смеси;(13) другие препараты для лечения вируса гепатита С, выбранные из группы, включающей тимозин альфа 1 (Задаксин), нитазоксанид (Алинея, NTZ), BIVN-401 (виростат), PYN-17 (альтирекс),KPE02003002, актилон (CPG-10101), KRN-7000, цивацир, GI-5005, XTL-6865, BIT225, РТХ-111,ITX2865, TT-033i, ANA 971, NOV-205, тарвацин, ЕНС-18, VGX-410C, EMZ-702, AVI 4065, BMS-650032,BMS-791325, Бавитуксимаб, MDX-1106 (ONO-4538), Оглуфанид, VX-497 (меримеподиб) и их смеси.- 14024359 Согласно еще одному варианту реализации в настоящем изобретении предложен способ модуляции Толл-подобного рецептора 7, включающий приведение клетки, несущей Толл-подобный рецептор 7, в контакт с эффективным количеством соединения, отвечающего формуле IIa или его фармацевтически приемлемой соли. Термин "модулирование" обозначает приведение Толл-подобного рецептора 7 в контакт с соединением, отвечающим формуле IIa, которое, например, является агонистом или частичным агонистом Толл-подобного рецептора 7. Согласно еще одному варианту реализации в настоящем изобретении предложен способ индуцирования выработки интерферона (или IFN-a) у пациента, нуждающегося в этом, включающий введение указанному пациенту терапевтически эффективного количества по меньшей мере одного соединения,отвечающего формуле IIa, или фармацевтически приемлемой соли указанного соединения. Примеры Синтез примера А. Схема 1 Соединение 2. 2-(2-Метоксиэтокси)-9 Н-пурин-6-иламин (1 г, 4,78 ммоль) (1), ,'-дибромо-м-ксилен (2,52 г, 9,56 ммоль) и безводный карбонат калия (1,32 г, 9,56 ммоль) соединяли в ДМФ (10 мл) и перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь разбавляли этилацетатом (120 мл), промывали водой (2), солевым раствором, сушили над Na2SO4 и выпаривали в вакууме. Неочищенный продукт очищали при помощи хроматографии на силикагеле с 0-10% метанола в этилацетате в качестве элюента. Выпаривание соответствующих фракций давало 9-(3-бромометилбензил)-2-(2-метоксиэтокси)-9 Н-пурин 6-иламин (2) (1,1 г, 2,80 ммоль, 59%). МС: 392/394 (МН+). Соединение 3. 9-(3-Бромометилбензил)-2-(2-метоксиэтокси)-9 Н-пурин-6-иламин (2) (1 г, 2,54 ммоль) растворяли в ацетонитриле (10 мл). N-бромосукцинимид (1,5 г, 8,4 ммоль) добавляли частями в течение 5 мин. Смесь перемешивали при комнатной температуре в течение 1 ч, затем разбавляли этилацетатом (100 мл), промывали 10% водным раствором Na2S2O3 и солевым раствором, сушили над Na2SO4 и выпаривали в вакууме. Неочищенный 8-бромо-9-(3-бромометилбензил)-2-(2-метоксиэтокси)-9 Н-пурин-6-иламин (3) (1 г) применяли для следующего этапа без очистки. Пример А. Неочищенный 8-бромо-9-(3-бромометилбензил)-2-(2-метоксиэтокси)-9 Н-пурин-6-иламин (3) (1 г) растворяли в дихлорэтане (10 мл) и добавляли пирролидон (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи и затем выпаривали в вакууме. Остаток (4) растворяли в метаноле (20 мл) и добавляли 50% водный KOH (2 мл). Смесь нагревали при кипячении с обратным холодильником, пока анализ при помощи ВЭЖХ не указывал на полное исчезновение исходного вещества(3 ч). Затем смесь охлаждали до температуры окружающей среды и добавляли концентрированную водную HCl (5 мл). Нагревание при кипячении с обратным холодильником продолжали в течение 1 ч,после которого реакционную смесь выпаривали до образования сухого вещества в вакууме. Твердый остаток экстрагировали 3 при помощи метанола в целях отделения от солей. Раствор метанола выпаривали в вакууме и неочищенный продукт очищали при помощи обращенно-фазной ВЭЖХ (5-45% ацетонитрил/40 мМ водная HCl), получая 6-амино-2-(2-метоксиэтокси)-9-(3-пирролидин-1-илметилбензил)9 Н-пурин-8-ол (пример А) (450 мг 1,13 ммоль) в виде желтого твердого вещества в форме соли HCl. Н ЯМР (ДМСО) : 10,09 (s, 1H), 9,78 (br, 1H), 7,47-7,33 (m, 4H), 6,54 (br, 2H), 4,87 (s, 2H), 4,32 (d,J=5,1 Гц 2 Н), 4,23 (t, J=4,5 Гц, 2 Н), 3,56 (t, J=4,5 Гц, 2H), 3,25 (s, 3 Н), 3,38-3,00 (m, 4H), 2,05-1,75 (m, 4H); МС: 399 (МН+). Примеры В, С, D, E, F, G, H, I, J, K, L, М, и N готовили при помощи процедур, аналогичных тем,которые применяли для приготовления примера А, за исключением того, что пирролидин заменяли соответствующим амином в каждом из этих примеров. Пример В. Соединение 5. Неочищенный 8-бромо-9-(3-бромометилбензил)-2-(2-метоксиэтокси)-9 Н-пурин-6-иламин (70 мг) растворяли в ДМФ (2 мл). Добавляли 2-гидроксипиридин (100 мг) и безводный карбонат калия (100 мг),и реакционную смесь перемешивали в течение ночи. После разбавления этилацетатом (100 мл), раствор промывали водой и солевым раствором, высушивали на Na2SO4 и выпаривали в вакууме. Неочищенный продукт(5) превращали в 1-3-6-амино-8-гидрокси-2-(2-метоксиэтокси)-9 Н-пурин-9- 18024359 ил)метил)фенил)метил)пиридин-2(1 Н)-он (пример О, 41 мг) при помощи процедур, аналогичных тем,которые применяли для превращения соединение 4 в пример А. 1 Н ЯМР (ДМСО) : 10,54 (s, 1 Н), 7,72 (d, J=7 Гц, 1 Н), 7,40 (t, J=7 Гц, 1 Н), 7,29 (t, J=7,2 Гц, 1 Н), 7,227,11 (m, 3 Н), 6,38 (d, J=9 Гц, 1 Н), 6,20 (t, J=6,6 Гц, 1 Н), 5,06 (s, 2H), 4,84 (s, 2H), 4,31 (t, J=4,5 Гц, 2 Н), 3,60 Пример Р. 6-амино-2-(2-метоксиэтокси)-9-(3-пирролидин-1-илметилбензил)-9 Н-пурин-8-ол (пример А) (31 мг 0,078 ммоль) растворяли в ДМФ (2 мл). Безводный карбонат калия (50 мг) добавляли, после чего добавляли п-метоксибензил хлорид (13,7 мкл, 0,101 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли дихлорметаном, промывали водой и солевым раствором,высушивали на Na2SO4 и выпаривали в вакууме. Очищение при помощи препаративной ВЭЖХ (5-60% ацетонитрил/40 мМ водная HCl) давало 6-амино-7-(4-метокси-бензил)-2-(2-метоксиэтокси)-9-(3 пирролидин-1-илметилбензил)-7,9-дигидро-пурин-8-он (пример Р) (6 мг) в виде соли HCl. 1 Н ЯМР (CDCl3) : 12,54 (br, 1H), 7,85-6,88 (m, 10 Н), 5,24 (s, 2H), 5,14 (s, 2H), 4,66 (s, 2H), 4,20 (br,2H), 3,81 (s, 3 Н), 3,72 (br, 2H), 3,58 (br, 2H), 3,36 (s, 3 Н), 2,85 (br, 2H), 2,25-2,00 (m, 4 Н); МС: 519 (МН+). Синтез пример Q. Схема 4 6-Амино-2-(2-метоксиэтокси)-9-(3-пирролидин-1-илметилбензил)-9 Н-пурин-8-ол (пример А) (60 мг,0,15 ммоль) растворяли в дихлорэтане (2 мл). Добавляли N,N-диизопропилэтиламин (0,1 мл) и смесь охлаждали до 0 С. Добавляли этилхлорформат (0,04 мл, 0,42 ммоль). После перемешивания в течение 30 мин реакцию останавливали водой и концентрировали в вакууме. Очищение при помощи препараттивной обращено фазной ВЭЖХ (5-45% ацетонитрил/40 мМ водная HCl) давало 9-(3-(пирролидин-1 илметил)бензил)-6-амино-2-(2-метоксиэтокси)-9 Н-пурин-8-ил-этил карбонат (пример Q) (24 мг) в виде белого стекловидного твердого вещества, соли HCl. 1 Н ЯМР (ДМСО) : 9,99 (br, 1H), 7,45-7,32 (m, 4H), 7,08 (br, 2H), 4,89 (s, 2H), 4,37 (q, J=6,9 Гц, 2 Н),4,29 (t, J=4,5 Гц, 2 Н), 4,20 (br, 2 Н), 3,58 (t, J=4,5 Гц, 2 Н), 3,26 (s, 3H), 3,15-2,85 (m, 4 Н), 1,92-1,78 (m, 4 Н),1,31 (t, J=6,9 Гц, 3 Н); МС: 471 (МН+). Примеры R, S, T, U и V готовили при помощи процедур, аналогичных тем, которые применяли для приготовления пример Q, за исключением того, что этилхлорформат заменяли на изопропилхлорформат,и соответствующее исходное вещество применяли для каждого из этих примеров. Пример R.- 19024359 9-(3-(Пирролидин-1-илметил)бензил)-6-амино-2-(2-метоксиэтокси)-9 Н-пурин-8-ил-изопропил карбонат, приготовленный из примера А. 1 Н ЯМР (ДМСО) : 10,65 (br, 1 Н), 7,55-7,37 (m, 4 Н), 7,10 (br, 2 Н), 5,11 (sept, J=6,3 Гц, 1 Н), 4,89 (s,2 Н), 4,33-4,25 (m, 4 Н), 3,58 (t, J=4,5 Гц, 2 Н), 3,36-3,26 (m, 2 Н), 3,26 (s, 3H), 3,08-2,95 (m, 2 Н), 2,05-1,80 (m,4 Н), 1,33 (d, J=6,3 Гц, 6H); МС: 485 (МН+). Пример S. 9-(3-4-Фторопиперидин-1-ил)метил)бензил)-6-амино-2-(2-метоксиэтокси)-9 Н-пурин-8-илизопропил карбонат, приготовленный из примера K. 1 Н ЯМР (ДМСО) : 10,95 (br, 1 Н), 7,59-7,38 (m, 4 Н), 7,10 (br, 2 Н), 5,10 (sept, J=6,3 Гц, 1 Н), 4,89 (s,2 Н), 4,33-4,23 (m, 4 Н), 3,58 (t, J=4,5 Гц, 2 Н), 3,36-2,87 (m, 5 Н), 3,26 (s, 3H), 2,25-1,95 (m, 4 Н), 1,33 (d, J=6,3 Гц, 6 Н); МС: 517 (МН+). Пример Т. 9-(3-(Пиперидин-1-илметил)бензил)-6-амино-2-(2-метоксиэтокси)-9 Н-пурин-8-ил-изопропил карбонат, приготовленный из примера J. 1 Н ЯМР (CD3OD) : 1,43 (d, 6H, J=6 Гц), 1,72-1,97 (m, 6H), 2,95 (t, 4H, J=9,3 Гц), 3,38 (s, 3 Н), 3,75 (t,2H, J=4,5, 9 Гц), 4,28 (s, 2H), 4,62 (t, 2H, J=4,5, 9 Гц), 5,11 (s, 2H), 5,21-5,31 (m, 1 Н), 7,48 (d, 2 Н, J=4,2 Гц),7,56 (d, 1 Н, J=3,6 Гц), 7,66 (s, 1 Н); ЖХ-МС: m/z для C25H34N6O5+ + Н наблюдаемое 499,2 через 2,31 мин 3,5-минутного цикла, градиент 5-95% CH3CN в Н 2 О. Пример U. 9-(3-4-Метилпиперазин-1-ил)метил)бензил)-6-амино-2-(2-метоксиэтокси)-9 Н-пурин-8-илизопропил карбонат, приготовленный из примера С. 1 Н ЯМР (CO3CD) : 1,43 (d, 6H, J=6 Гц), 3,0 (s, 4H), 3,39 (s, 3 Н), 3,64 (s, 2H), 3,77 (t, 2H, J=4,5 Гц),4,49 (s, 2H), 4,63 (t, 2H, J=4,5 Гц), 5,11 (s, 2H), 5,23-5,31 (m, 1H), 7,46-7,62 (m, 3 Н), 7,72 (s, 1H); ЖХ-МС: m/z для C25H35N7O5 + + Н наблюдаемое 514, через 2,09 мин 3,5-минутного цикла, градиент 5-95% CH3CN в Н 2 О. Пример V. 9-(3-(Пирролидин-1-илметил)бензил)-6-амино-2-бутокси-9 Н-пурин-8-ил-изопропил карбонат, при- 20024359 готовленный из примера W. 1 Н ЯМР (ДМСО) : 0,89 (t, 3 Н, J=7,2 Гц), 3,17 (d, 6H), 1,29-42 (m, 2H), 1,62 (q, 2H, J=7,5 Гц), 1,792,02 (m, 4 Н), 2,91-3,08 (m, 2 Н), 3,21-3,36 (m, 2 Н), 4,17 (t, 2H, J=6,6 Гц), 4,29 (d, 2H, J=6 Гц), 4,89 (s, 2 Н),5,06-5,15 (m, 1 Н), 7,38-7,57 (m, 4 Н), 10,95 (s, 1H). ЖХ-МС: m/z для C25H34N6O4 + + Н наблюдаемое 483,2 через 2,64 мин 3,5-минутного цикла, градиент 5-95% CH3CN в Н 2 О. Синтез примера W. Схема 5 Соединение 6. 2-Хлораденин (1,53 г, 9,03 ммоль) разделяли и разливали в три флакона для микроволновой печи(10-20 мл), каждый из которых содержал 1-бутанол (10 мл) и t-BuOK (5 мл, 1 М в ТХФ). Каждый флакон нагревали до 170 С в течение 40 мин. Три реакционные смеси соединяли, растворитель удаляли при помощи роторного испарителя, а продукт очищали на колонки для отгонки легких фракций, элюируя 10% метанолом в этилацетате. Выпаривание раствора давало 1,33 г (70%) 2-бутокси-9 Н-пурин-6-амина (6) в виде грязно-белого твердого вещества. 1 Н ЯМР (ДМСО) : 0,919 (t, 3H), 1,39 (m, 2H), 1,62 (m, 2 Н), 4,09 (t, 2H), 6,00 (s, 2H), 7,44 (s, 1H). ЖХ-МС: m/z для C9H13N5O+ + Н наблюдаемое 208,1 через 1,34 мин 3,5-минутного цикла, градиент 5-95%CH3CN в Н 2 О. Пример W готовили из соединения 6 при помощи процедур, аналогичных тем, которые применяли для приготовления примера А. 1 Н ЯМР (ДМСО) : 0,89 (t, 3 Н, J=7,2 Гц), 1,29-1,42 (m, 2H), 1,60 (q, 2H, J=7,2 Гц), 1,77-2,04 (m, 4 Н),2,97-3,10 (m, 2 Н), 3,26-3,37 (m, 2 Н), 4,12 (t, 2H, J=7 Гц), 4,30 (d, 2H, J=6 Гц), 4,89 (s, 2H), 7,30-7,50 (m,4 Н), 10,26 (s, 1H), LCMC: m/z для C21H28N6O2 + + H наблюдаемое 397,2 через 2,50 мин 3,5-минутного цикла, градиент 5-95% CH3CN в Н 2 О. Синтез примера X. Схема 6 Пример X. Пример D (40 мг 0,100 ммоль) растворяли в дихлорэтане (2 мл) и охлаждали до 0 С. Последовательно добавляли диизопропилэтиламин (0,1 мл), а затем метансульфонил хлорид (0,012 мл, 0,154 ммоль). После перемешивания в течение 1 ч при 0 С реакционную смесь гасили водой (1 мл) и выпаривали до образования сухого вещества. Очищение при помощи обращенно-фазной ВЭЖХ (5-60% ацетонитрил/40 мМ водная HCl) давало пример X (23 мг). 1 Н ЯМР (ДМСО) : 9,96 (s, 1H), 7,34-7,18 (m, 4H), 6,45 (br, 2H), 4,85 (s, 2H), 4,37 (s, 2H), 4,24 (t,J=4,5 Гц, 2 Н), 3,57 (t, J=4,5 Гц, 2 Н), 3,26 (s, 3 Н), 2,94 (s, 3 Н), 2,91 (d, J=6,9 Гц, 2H), 0,88-0,78 (m, 1 Н), 0,350,29 (m, 2 Н), 0,04-0,00 (m, 2 Н); МС: 477 (МН+).(0,1 мл), а затем этил изоцианат (0,05 мл). После перемешивания при комнатной температуре в течение ночи реакционную смесь выпаривали до образования сухого вещества в вакууме. Очищение при помощи обращенно-фазной ВЭЖХ (5-60% ацетонитрил/40 мМ водная HCl) давало пример Y (23 мг) в виде белого твердого вещества в форме соли HCl. 1 Н ЯМР (ДМСО) : 10,96 (br, 1 Н), 8,87 (t, J=5,7 Гц, 1 Н), 7,57-7,36 (m, 4H), 4,95 (s, 2H), 4,32-4,25 (m,4 Н), 3,58 (t, J=4,5 Гц, 2 Н), 3,25 (s, 3 Н), 3,36-3,25 (m, 4 Н), 3,05-2,92 (m, 2 Н), 2,02-1,80 (m, 4 Н), 1,13 (t, J=7,2 Гц, 3 Н); МС: 470 (МН+). Синтез примера Z. Схема 8 Пример Z. Пример D (40 мг, 0,10 ммоль) растворяли в дихлорэтане (2 мл). Добавляли N,Nдиизопропилэтиламин (0,1 мл), и смесь охлаждали до 0 С. Добавляли этилхлорформат (0,021 мл, 0,22 ммоль). После перемешивания в течение 30 мин реакцию гасили водой и концентрировали под вакуумом. Очищение при помощи препаративной обращенно-фазной ВЭЖХ (5-60% ацетонитрил/40 мМ водная HCl) давало пример Z (17 мг) в виде белого твердого вещества. 1 Н ЯМР (ДМСО) : 7,32-7,11 (m, 4H), 7,06 (br, 2H), 4,85 (s, 2H), 4,45 (s, 2H), 4,36 (q, J=7,5 Гц, 2 Н),4,28 (t, J=4,5 Гц, 2 Н), 4,02 (br, 2 Н), 3,58 (t, J=4,5 Гц, 2 Н), 3,26 (s, 3 Н), 3,06-2,97 (m, 2 Н), 1,30 (t, J=6,9 Гц,3 Н), 1,22-1,02 (m, 3 Н), 0,93-0,81 (m, 1 Н), 0,38-0,29 (m, 2 Н), 0,12-0,05 (m, 2 Н); МС: 543 (МН+). Синтез примера АА и примера АВ. Схема 9 Примеры АА и АВ. Пример D (40 мг, 0,10 ммоль) растворяли в дихлорэтане (2 мл). Добавляли N,Nдиизопропилэтиламин (0,1 мл), а затем этилизоцианат (0,05 мл). После перемешивания при комнатной температуре в течение 30 мин, реакционную смесь выпаривали до образования сухого вещества в вакууме. Очищение при помощи обращенно-фазной ВЭЖХ (5-60% ацетонитрил/40 мМ водная HCl) давало пример АА (4 мг) и пример АВ (6,5 мг) в виде белых твердых веществ. Пример АА: 1 Н ЯМР (ДМСО) : 9,93 (s, 1 Н), 7,30-7,09 (m, 4 Н), 6,44 (br, 2 Н), 6,30 (m, 1 Н), 4,82 (s, 2 Н), 4,46 (s,2 Н), 4,24 (t, J=4,5 Гц, 2 Н), 3,57 (t, J=4,5 Гц, 2 Н), 3,26 (s, 3 Н), 3,10-2,94 (m, 4 Н), 0,96 (t, J=6,9 Гц, 3 Н), 0,93- 22024359 0,81 (m, 1 Н), 0,34-0,25 (m, 2 Н), 0,08-0,01 (m, 2 Н); МС: 470 (МН+). Пример АВ: 1 Н ЯМР (ДМСО) : 8,88 (m, 1 Н), 7,30-7,05 (m, 4 Н), 6,29 (m, 1 Н), 4,90 (s, 2H), 4,46 (s, 2 Н), 4,29 (t,J=4,5 Гц, 2 Н), 3,59 (t, J=4,5 Гц, 2 Н), 3,30 (m, 2 Н), 3,26 (s, 3 Н), 3,08-2,94 (m, 4 Н), 1,13 (t, J=6,9 Гц, 3 Н), 0,95 Соединение 7. 2-(2-Метоксиэтокси)-9 Н-пурин-6-амин (1) (1,28 г, 6,12 ммоль), -бромо-м-толунитрил (1,37 г, 7,0 ммоль) и карбонат калия (0,97 г, 7,0 ммоль) соединяли в ДМФ (10 мл) и перемешивали при комнатной температуре в течение 4 ч. Смесь разбавляли этилацетатом (200 мл), промывали водой и солевым раствором, высушивали на Na2SO4 и выпаривали в вакууме. Остаток выкристаллизовывали из этилацетата,получая 3-6-амино-2-(2-метоксиэтокси)-9 Н-пурин-9-ил)метил)бензонитрил (7) (1,0 г) в виде белого твердого вещества. Соединение 9. 3-6-амино-2-(2-метоксиэтокси)-9 Н-пурин-9-ил)метил)бензонитрил (7) (1,0 г) суспендировали в ацетонитриле. N-бромосукцинимид (1,0 г) добавляли маленькими порциями в течение 10 мин. После перемешивания в течение 1 ч смесь разбавляли этилацетатом, промывали 10% водным растворомNa2S2O3, насыщенным водным раствором NaHCO3 и солевым раствором, высушивали на Na2SO4 и выпаривали до образования сухого вещества в вакууме. Неочищенный 3-6-амино-8-бромо-2-(2 метоксиэтокси)-9 Н-пурин-9-ил)метил)бензонитрил (8) растворяли в метаноле (50 мл), и добавляли 50% водный раствор KOH (1 мл). Смесь нагревали при кипячении с обратным холодильником в течение 3 ч и затем концентрировали в вакууме. Продукт экстрагировали при помощи этилацетата, объединенные органические слои промывали водой и солевым раствором, высушивали на Na2SO4 и выпаривали в вакууме. Очищение при помощи флэш-хроматографии на силикагеле (элюент: 0-10% МеОН в этилацетате) давало 3-6-амино-8-метокси-2-(2-метоксиэтокси)-9 Н-пурин-9-ил)метил)бензонитрил (9) (0,45 г) в виде розоватого твердого вещества.- 23024359 Соединение 10. 3-6-Амино-8-метокси-2-(2-метоксиэтокси)-9 Н-пурин-9-ил)метил)бензонитрил (9) (50 мг) растворяли в ацетонитриле (2 мл). Добавляли 6 н. водный раствор HCl (2 мл), и смесь перемешивали при комнатной температуре в течение ночи. После выпаривания до образования сухого вещества, остаток растворяли в ДМФ (1 мл). Добавляли карбонат калия (100 мг) и этил йодид (0,02 мл), и смесь перемешивали при комнатной температуре в течение 5 ч. После разбавления водой (20 мл) продукт экстрагировали при помощи дихлорметана. Объединенные органические слои промывали водой и солевым раствором, высушивали на Na2SO4 и выпаривали в вакууме. Очищение при помощи флэш-хроматографии на силикагеле (элюент: 0-10% МеОН в этилацетате) давало 3-6-амино-7-этил-2-(2-метоксиэтокси)-8-оксо-7,8 дигидропурин-9-ил)метил)бензонитрил (10) (35 мг) в виде бесцветного стекловидного вещества. Пример АС. 3-6-Амино-7-этил-2-(2-метоксиэтокси)-8-оксо-7,8-дигидропурин-9-ил)метил)бензонитрил (35 мг) растворяли в дихлорэтане (2 мл) и охлаждали 0 С. Добавляли 1 М раствор DIBAL (диизобутилалюминийгидрида) в толуоле (0,5 мл). После перемешивания в течение 1 ч, реакцию гасили водой и добавляли насыщенный раствор виннокислого калий-натрия. После интенсивного перемешивания в течение 30 мин,смесь экстрагировали при помощи дихлорметана. Объединенные органические слои промывали водой и солевым раствором, высушивали на Na2SO4 и выпаривали в вакууме. Неочищенный продукт (11) растворяли в метаноле (1 мл) и уксусной кислоте (0,5 мл). Добавляли пирролидин (0,1 мл), а затем добавляли триацетоксиборогидрид натрия (100 мг). Смесь перемешивали в течение 1 ч при комнатной температуре и затем выпаривали до образования сухого вещества. Остаток растворяли в водной HCl/ацетонитриле и очищали при помощи препаративной обращенно-фазной ВЭЖХ (5-60% ацетонитрил/40 мМ водная HCl), которая давала пример АС (9 мг) в форме соли HCl в виде бесцветного стекловидного вещества. 1 Н ЯМР (ДМСО) : 10,66 (br, 1H), 7,54-7,29 (m, 4H), 6,74 (br, 2H), 4,92 (s, 2H), 4,31-4,25 (m, 4 Н), 3,97 Соединение 12. К суспензии 2-хлораденина (1,7 г, 10,18 ммоль) в ДМФ (10 мл) добавляли K2CO3 (1,4 г, 10,18 ммоль), 2-бромометилбензонитрил (2 г, 10,18 ммоль). Реакция протекала при 80 С. После завершения реакции реакционную смесь разбавляли водой, а затем отбирали осадок. Твердое вещество промывали водой, затем эфиром алкоксикислоты. Продукт (12) высушивали под высоким вакуумом. МС: 285 (МН+). Соединение 13. В сосуд с n-BuOH (10 мл), добавляли NaH (60%, 840 мг, 21 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 12 (2,4 г, 8,4 ммоль). Смеси давали прореагировать при 120 С примерно в течение получаса. Затем реакционную смесь охлаждали, промывали насыщенным раствором NH4Cl и экстрагировали при помощи ДХМ. Органические слои высушивали на Na2SO4 и фильтровали. Фильтрат концентрировали и остаток (13) очищали на колонке с силикагелем, применяя в качестве растворителя ДХМ/МеОН. 1 Н ЯМР (d6-ДМСО) : 0,90 (t, 3 Н), 1,33-1,41 (m, 2 Н), 1,58-1,67 (m, 2 Н), 4,19 (t, 2H), 5,32 (s, 2H), 7,22(s, 2 Н), 7,52-7,84 (m, 4 Н), 8,06 (s, 1H); МС: 323 (МН+). Пример AD готовили из соединения 13 при помощи процедур, аналогичных тем, которые применяли для приготовления примера АС за исключением того, что соединение 10 заменяли соединением 13. 1 Н ЯМР (CD3OD) : 0,99 (t, 3 Н), 1,46-1,54 (m, 2H), 1,76-1,1,83 (m, 2H), 2,01-2,11 (m, 2H), 2,15-2,17(m, 4H); МС: 411 (МН+). Примеры АЕ, AF, AG и АН готовили при помощи процедур, аналогичных тем, которые применяли для приготовления пример AD за исключением того, что во время этапа 7-N-алкилирования при получении соответствующих соединений применяли соответствующий йодид. Пример АЕ. Соединение 14 готовили при помощи процедур, аналогичных тем, которые применяли для приготовления соединения 13 за исключением того, что вместо n-BuOH применяли циклобутанол. 1 Н ЯМР (CDCl3) : 1,61-1,95 (m, 2H), 2,14-2,44 (m, 4H), 5,13-5,18 (m, 1H), 5,30 (s, 2H), 5,94 (s, 2H),7,44-7,64 (m, 5H); МС: 321 (МН+). Пример AI готовили при помощи процедур, показанных на схеме 12, и аналогичных тем, которые применяли для приготовления примера АС. Данные спектрального анализа промежуточных продуктов и пример АС показаны ниже. Соединение 15. 1 Н ЯМР (CDCl3) : 1,62-1,88 (m, 2H), 2,11-2,45 (m, 4H), 5,14-5,16 (m, 1H), 5,30 (s, 2H), 6,23 (s, 2 Н),7,44-7,65 (m, 4H); МС: 399 (МН+). Соединеннее 16. 1 Н ЯМР (CDCl3) : 1,52-1,77 (m, 2H), 1,96-2,17 (m, 2H), 2,29-2,38 (m, 2H), 4,02 (s, 3H), 5,01-5,08 (m,3 Н), 5,91 (s, 2H), 7,32-7,56 (m, 4H); МС: 351 (МН+). Соединение 17. 1 Н ЯМР (CDCl3) : 1,68-1,88 (m, 2H), 3,20-3,37 (m, 4H), 5,00-5,02 (m, 2H), 5,19-5,20 (m, 1H), 7,457,68 (m, 4H); МС: 337 (МН+). Пример AI. 1 Н ЯМР (CD3OD) : 1,73-2,28 (m, 8H), 2,44-2,48 (m, 2H), 3,15-3,20 (m, 2H), 4,44-4,48 (m, 2H), 4,37 (s,2 Н), 5,10 (s, 2 Н), 5,25-5,34 (m, 1 Н), 7,49-7,59 (m, 4 Н); МС: 395 (МН+). Пример AJ готовили при помощи процедур, показанных на схеме 13, и аналогичных тем, которые применяли для приготовления примера АС. Данные спектрального анализа промежуточных продуктов и пример AJ показаны ниже. Соединение 18. 1 Н ЯМР (ДМСО) : 1,47-1,56 (m, 2 Н), 1,64-1,74 (m, 2 Н), 3,33-3,43 (m, 2 Н), 4,16 (t, 2H), 7,05 (s, 2 Н),7,87 (s, 1H), 12,55 (bs, 1H); МС: 224 (МН+). Соединение 19. 1 Н ЯМР (CDCl3) : 1,65-1,74 (m, 2 Н), 1,81-1,87 (m, 2 Н), 3,69 (t, 2H), 5,27 (s, 2H), 6,52 (s, 2H), 7,397,68 (m, 5 Н); МС: 339 (МН+). Соединение 20. 1 Н ЯМР (CDCl3) : 1,70-1,76 (m, 2 Н), 1,82-1,87 (m, 2 Н), 3,69 (t, 2H), 4,32 (t, 2H), 5,28 (s, 2H), 6,57 (s,2 Н), 7,39-7,63 (m, 4 Н); МС: 419 (МН+). Соединение 21. 1 Н ЯМР (CDCl3) : 1,70-1,74 (m, 2 Н), 1,81-1,87 (m, 2 Н), 3,69 (t, 2H), 4,07 (s, 3H), 4,29 (t, 2H), 5,08 (s,2 Н), 5,81 (s, 2 Н), 7,37-7,61 (m, 4 Н); МС: 369 (МН+). Соединение 22. 1 Н ЯМР (CD3OD) : 1,69-1,70 (m, 2 Н), 1,87-1,91 (m, 2 Н), 3,63 (t, 2H), 4,56 (t, 2H), 5,11 (s, 2H), 7,567,82 (4 Н); МС: 355 (МН+). Пример AJ. 1 Н ЯМР (CD3OD) : 1,66-1,72 (m, 2 Н), 1,87-1,93 (m, 2 Н), 2,01-2,04 (m, 2 Н), 2,15-2,18 (m, 2 Н), 3,153,19 (m, 2 Н), 3,45-3,49 (m, 2 Н), 3,62 (t, 2H), 4,38 (t, 2H), 4,58 (t, 2H), 5,12 (s, 2H), 7,47-7,61 (m, 4 Н); МС: 413 (МН+). Пример AK и пример AL готовили при помощи процедур, показанных на схеме 14, и аналогичных тем, которые применяли для приготовления пример АС. Бромид (23), применяемый на первом этапе, получали путем обработки соответствующего бензенметила соединения N-бромсукцинимида в ацетонитриле при комнатной температуре или при 40 С. Данные спектрального анализа промежуточных продуктов, а также примера AK и примера AL перечислены ниже. Соединение 23. 1 Н ЯМР (CDCl3) : 3,43 (s, 3 Н), 3,75 (t, 2H), 4,47 (s, 2H), 5,28 (s, 2H), 5,85 (s, 2H), 7,47-7,65 (m, 4H); МС: 359 (МН+). Соединение 24. 1 Н ЯМР (CD3OD) : 3,40 (s, 3 Н), 3,73 (s, 2H), 4,47 (s, 2H), 5,38 (s, 2H), 7,58-7,62 (m, 2H), 7,84 (s, 1H); МС: 437 (МН+). Соединение 25. 1 Н ЯМР (CDCl3) : 3,41 (s, 3 Н), 3,74 (t, 2H), 4,09 (s, 3 Н), 4,44 (t, 2H), 5,06 (s, 2H), 5,48 (s, 2H), 7,427,61 (m, 3 Н); МС: 389 (МН+). Соединение 26. 1 Н ЯМР (CDCl3) : 3,41 (s, 3 Н), 3,72-3,76 (m, 2H), 3,89 (s, 3 Н), 4,09 (s, 3 Н), 3,42-3,47 (m, 2H), 5,00 (s,2 Н), 5,48 (s, 2 Н), 7,45-7,62 (m, 3 Н); МС: 385 (МН+). Пример AK. 1 Н ЯМР (CD3OD) : 2,02-2,06 (m, 2 Н), 2,20-2,23 (m, 2 Н), 3,10-3,16 (m, 2 Н), 3,40 (s, 3 Н), 3,54-3,58 (m,2 Н), 3,76 (t, 2 Н), 4,63 (t, 2 Н), 5,10 (s, 2 Н), 7,52-7,59 (m, 2 Н), 7,74 (s, 1H); МС: 433 (МН+). Пример AL. 1 Н ЯМР (CD3OD) : 2,01-2,03 (m, 2 Н), 2,15-2,19 (m, 2 Н), 3,18-3,23 (m, 2 Н), 3,41 (s, 3 Н), 4,44-3,49 (m,2 Н), 3,77 (t, 2H), 3,93 (s, 3 Н), 4,36 (s, 2H), 4,66 (t, 2H), 5,03 (s, 2H), 7,11 (d, 1H), 7,52-7,58 (m, 2 Н); МС: 429 (МН+). Пример AM готовили при помощи процедур, показанных на схеме 15, и аналогичных тем, которые применяли для приготовления примера АС. Данные спектрального анализа промежуточных продуктов и примера AM перечислены ниже. Соединение 27. 1 Н ЯМР (CD3OD) : 3,39 (s, 3 Н), 3,73 (t, 2H), 4,45 (t, 2H), 5,44 (s, 2H), 7,36 (t, 1H), 7,78-7,87 (m, 2H),8,01 (s, 1H); МС: 343 (МН+). Соединение 28. 1 Н ЯМР (CD3OD) : 3,39 (s, 3 Н), 3,72 (t, 2H), 4,44 (t, 2H), 5,44 (s, 2H), 7,37 (t, 1H), 7,67-7,79 (m, 2H); МС: 421 (МН+). Соединение 29. 1 Н ЯМР (CDCl3) : 3,40 (s, 3 Н), 3,73 (t, 2H), 3,92 (s, 3 Н), 4,11 (s, 3 Н), 4,46 (t, 2H), 5,12 (s, 2H), 6,94 (d,1H), 7,14 (s, 1H), 7,60 (dd, 1H); МС: 385 (МН+). Пример AM. 1 Н ЯМР (CD3OD) : 1,97-1,99 (m, 2H), 2,13-2,16 (m, 2H), 3,12-3,17 (m, 2H), 3,37 (s, 3H), 3,38-3,44 (m,2H), 3,72 (t, 2H), 3,89 (s, 3 Н), 4,27 (s, 2H), 4,56 (t, 2H), 5,08 (s, 2H), 7,09 (d, 1H), 7,33 (s, 1 Н), 7,45 (dd, 1 Н); МС: 429 (МН+). Синтез примера AN. Пример AN готовили при помощи процедур, показанных на схеме 16, и аналогичных тем, которые применяли для приготовления примера АС. Данные спектрального анализа промежуточных продуктов и примера AN перечислены ниже.
МПК / Метки
МПК: C07D 473/18, A61P 31/12, A61K 31/52, A61K 31/522
Метки: модуляторов, качестве, производные, рецептора, толл-подобного, пуриновые, применение
Код ссылки
<a href="https://eas.patents.su/30-24359-purinovye-proizvodnye-i-ih-primenenie-v-kachestve-modulyatorov-toll-podobnogo-receptora-7.html" rel="bookmark" title="База патентов Евразийского Союза">Пуриновые производные и их применение в качестве модуляторов толл-подобного рецептора 7</a>
Предыдущий патент: Способ получения карбида кремния
Следующий патент: Устройство для корректирования вросших ногтей пальцев ног и способ косметической коррекции вросших ногтей пальцев ног
Случайный патент: Способ и устройство для подачи и размещения гибкого намагниченного элемента












