Производные дифенилпиразолопиридинов, их получение и применение в качестве модуляторов нуклеарного рецептора not
Формула / Реферат
1. Соединения формулы (I)
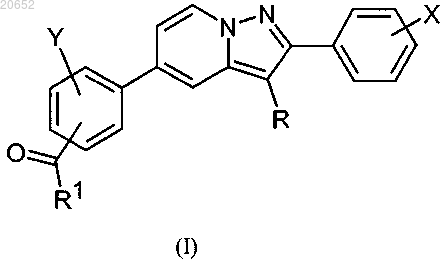
где R представляет собой атом водорода или галогена или (С1-С6)алкил;
X представляет собой один или несколько заместителей, выбранных из атомов водорода или галогена, (C1-C6)алкилов, галоген(C1-C6)алкилов, (C1-C6)алкоксигрупп, галоген(С1-С6)алкоксигрупп, циано-, гидроксигруппы или гидрокси(С1-С6)алкилов;
Y представляет собой атом водорода, галогена или (С1-С6)алкил;
R1 представляет собой NR2R3 или OR4;
R2 и R3 независимо друг от друга представляют собой атомы водорода, (C1-C6)алкилы, гидрокси(C1-C6)алкилы или оксо(С1-С6)алкилы или R2 и R3 с атомом азота, с которым они связаны, образуют гетероцикл, необязательно замещенный (C1-C6)алкилом, гидрокси- или оксогруппой;
R4 представляет собой (C1-C6)алкил, гидрокси(C1-C6)алкил или оксо(C1-C6)алкил;
в виде основания или кислотно-аддитивной соли с фармацевтически приемлемой кислотой,
указанный гетероцикл представляет собой насыщенный цикл, содержащий от 5 до 9 атомов углерода и по меньшей мере один атом азота.
2. Соединения формулы (I) по п.1, отличающиеся тем, что
R представляет собой атом водорода или хлора;
X представляет собой один или несколько заместителей, выбранных из атомов галогенов, (С1-С6)алкилов, галоген(С1-C6)алкилов, (С1-С6)алкоксигрупп, галоген(С1-С6)алкоксигрупп или цианогруппы;
Y представляет собой атом водорода, атом галогена или (С1-С6)алкил;
R1 представляет собой OR4;
R4 представляет собой метил;
в виде основания или кислотно-аддитивной соли с фармацевтически приемлемой кислотой.
3. Соединения формулы (I) по п.1, отличающиеся тем, что
R представляет собой атом водорода или хлора;
X представляет собой один или несколько заместителей, выбранных из атома хлора или фтора, метила, трифторметила, метокси-, трифторметокси- или цианогруппы;
Y представляет собой атом водорода, хлора, фтора или метил;
R1 представляет собой OR4;
R4 представляет собой метил;
в виде основания или кислотно-аддитивной соли с фармацевтически приемлемой кислотой.
4. Соединения формулы (I) по п.1, отличающиеся тем, что
R представляет собой атом водорода или хлора;
X представляет собой один или несколько заместителей, выбранных из атомов галогенов, (С1-С6)алкилов, галоген(С1-С6)алкилов, (С1-С6)алкоксигрупп, галоген(С1-С6)алкоксигрупп или цианогруппы;
Y представляет собой атом водорода, атом галогена или (С1-С6)алкил;
R1 представляет собой NR2R3;
R2 и R3 независимо друг от друга представляют собой атомы водорода, метильные, этильные, изопропильные, циклопропильные группы или R2 и R3 с атомом азота, с которым они связаны, образуют морфолинил или пирролидинил, необязательно замещенный гидроксигруппой;
в виде основания или кислотно-аддитивной соли с фармацевтически приемлемой кислотой.
5. Соединения формулы (I) по п.1, отличающиеся тем, что
R представляет собой атом водорода или хлора;
X представляет собой один или несколько заместителей, выбранных из атома хлора или фтора, метила, трифторметила, метокси-, трифторметокси- или цианогруппы;
Y представляет собой атом водорода или хлора или метил;
R1 представляет собой NR2R3;
R2 и R3 независимо друг от друга представляют собой атомы водорода, метильные, этильные, изопропильные, циклопропильные группы или R2 и R3 с атомом азота, с которым они связаны, образуют морфолинил или пирролидинил, необязательно замещенный гидроксигруппой;
в виде основания или кислотно-аддитивной соли с фармацевтически приемлемой кислотой.
6. Соединение, выбранное из следующего:
метил-3-[2-(4-хлорфенил)пиразоло[1,5-а]пиридин-5-ил]бензоат;
3-[2-(4-хлорфенил)пиразоло[1,5-а]пиридин-5-ил]бензамид;
3-[2-(4-хлорфенил)пиразоло[1,5-а]пиридин-5-ил]-N,N-диметилбензамид;
3-[2-(4-хлорфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;
метил-3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]бензоат;
3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;
3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-изопропилбензамид;
3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N,N-диметилбензамид;
{3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]фенил}морфолин-4-илметанон;
3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-2,N-диметилбензамид;
2-хлор-5-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;
4-хлор-3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;
3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-4,N-диметилбензамид;
2-фтор-4-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;
N-циклопропил-3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]бензамид;
{3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]фенил}пирролидин-1-илметанон;
3-[2-(2,6-дифторфенил)пиразоло[1,5-а]пиридин-5-ил]метилбензамид;
3-[2-(2-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;
N-метил-3-[2-(4-трифторметилфенил)пиразоло[1,5-а]пиридин-5-ил]бензамид;
4-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;
2-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;
{3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]фенил}-(3-гидроксипирролидин-1-ил)метанон;
3-[2-(2,4-дифторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;
N-метил-3-[2-(4-трифторметоксифенил)пиразоло[1,5-а]пиридин-5-ил]бензамид;
3-[2-(3,4-дифторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;
3-[2-(3,5-дифторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;
3-[2-(3-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;
N-метил-3-(2-р-толилпиразоло[1,5-а]пиридин-5-ил)бензамид;
3-[2-(4-метоксифенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;
3-[2-(3,4-диметилфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;
3-[2-(4-цианофенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;
3-[2-(2,3-дифторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;
N-метил-3-(2-о-толилпиразоло[1,5-а]пиридин-5-ил)бензамид;
3-[3-хлор-2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид.
7. Лекарственное средство, обладающее модулирующим действием в отношении нуклеарных рецепторов NOT, отличающееся тем, что содержит соединение формулы (I) по любому из пп.1-6 или аддитивную соль этого соединения с фармацевтически приемлемой кислотой.
8. Фармацевтическая композиция, обладающая модулирующим действием в отношении рецепторов NOT, отличающаяся тем, что содержит соединение формулы (I) по любому из пп.1-6 или фармацевтически приемлемую соль этого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент.
9. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственного средства, предназначенного для лечения и профилактики нейродегенеративных заболеваний.
10. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственного средства, предназначенного для лечения и профилактики травм головного мозга и эпилепсии.
11. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственного средства, предназначенного для лечения и профилактики психических заболеваний.
12. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственного средства, предназначенного для лечения и профилактики воспалительных заболеваний.
13. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственного средства, предназначенного для лечения и профилактики остеопороза и раковых заболеваний.
14. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственного средства, предназначенного для лечения и профилактики болезни Паркинсона, болезни Альцгеймера, таупатий и рассеянного склероза.
15. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственного средства, предназначенного для лечения и профилактики шизофрении, депрессии, лекарственной зависимости, синдрома дефицита внимания и гиперактивности.
16. Промежуточное соединение формулы (VI-1)
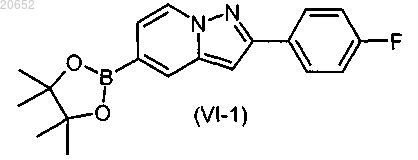
17. Применение соединения по п.16 для получения соединений общей формулы (I) по п.1.
Текст
ПРОИЗВОДНЫЕ ДИФЕНИЛПИРАЗОЛОПИРИДИНОВ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ НУКЛЕАРНОГО РЕЦЕПТОРА NOT в которой R представляет собой атом водорода или галогена или (С 1-С 6)алкил; X представляет собой один или несколько заместителей, выбранных из атомов водорода или галогена, (С 1-С 6)алкилов,галоген(С 1-С 6)алкилов, (С 1-С 6)алкоксигрупп, галоген(С 1-С 6)алкоксигрупп, циано-, гидроксигруппы или гидрокси(С 1-С 6)алкилов; Y представляет собой атом водорода, галогена или (С 1-С 6)алкил;R1 представляет собой NR2R3 или OR4; R2 и R3 независимо друг от друга представляют собой атомы водорода, (С 1-С 6)алкилы, гидрокси(С 1-С 6)алкилы или оксо(С 1-С 6)алкилы или R2 и R3 с атомом азота, с которым они связаны, образуют гетероцикл, необязательно замещенный (С 1 С 6)алкилом, гидрокси- или оксогруппой; R4 представляет собой (С 1-С 6)алкил, гидрокси(С 1-С 6)алкил или оксо(С 1-С 6)алкил; в виде основания или кислотно-аддитивной соли. Применение в терапии при лечении или профилактике заболеваний, затрагивающих нуклеарные рецепторы Nurr-1,называемые также NR4A2, NOT, TINUR, RNR-1 и HZF3. Изобретение относится к производным дифенилпиразолопиридинов, их получению и применению в терапии при лечении или профилактике заболеваний, затрагивающих нуклеарные рецепторы Nurr-1,называемые также NR4A2, NOT, TINUR, RNR-1 и HZF3. Настоящее изобретение относится к соединениям формулы (I) где R представляет собой атом водорода или галогена или (С 1-С 6)алкил;X представляет собой один или несколько заместителей, выбранных из атомов водорода или галогена, (C1-C6)алкилов, галоген(C1-C6)алкилов, (C1-C6)алкоксигрупп, галоген(C1-С 6)алкоксигрупп, циано-,гидроксигруппы или гидрокси(С 1-С 6)алкилов;Y представляет собой атом водорода, галогена или (C1-С 6)алкил;R2 и R3 независимо друг от друга представляют собой атомы водорода, (С 1-С 6)алкилы, гидрокси(С 1 С 6)алкилы или оксо(С 1-С 6)алкилы или R2 и R3 с атомом азота, с которым они связаны, образуют гетероцикл, необязательно замещенный (C1-C6)алкилом, гидрокси- или оксогруппой;R4 представляет собой (C1-C6)алкил, гидрокси(C1-C6)алкил или оксо(C1-C6)алкил; в виде основания или кислотно-аддитивной соли. Соединения формулы (I) могут содержать один или несколько асимметрических атомов углерода. Таким образом, они могут существовать в форме энантиомеров или диастереоизомеров. Такие энантиомеры, диастереоизомеры, а также их смеси, включая рацемические смеси, составляют часть настоящего изобретения. Соединения формулы (I) могут существовать в виде оснований или кислотно-аддитивных солей. Такие аддитивные соли составляют часть настоящего изобретения. Соли могут быть получены с фармацевтически приемлемыми кислотами, при этом соли других кислот, являющиеся полезными, например, для очистки или выделения соединений формулы (I), также составляют часть настоящего изобретения. Соединения формулы (I) могут существовать также в виде гидратов или сольватов, а именно в виде ассоциатов или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты и сольваты также составляют часть настоящего изобретения. В рамках настоящего изобретения принято, что группа (Cx-Ct) означает группу, содержащую от х до t атомов углерода; атом галогена означает атом фтора, хлора, брома или йода; алкил означает линейную, разветвленную или циклическую насыщенную алифатическую группу,необязательно замещенную линейным, разветвленным или циклическим насыщенным алкилом. В качестве примеров можно упомянуть метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, циклопропил, циклобутил, циклопентил, циклогексил, метилциклопропил, циклопропилметил и т.д.; алкоксигруппа означает -О-алкил, в котором алкил имеет определенные ранее значения; галогеналкил означает алкил, замещенный одним или несколькими одинаковыми или разными атомами галогенов, в качестве примеров можно упомянуть CF3, CH2CF3, CHF2, CCl3; гидроксиалкил означает алкил, замещенный гидроксигруппой, в качестве примеров можно упомянуть СН 2 ОН, СН 2 СН 2 ОН и т.д.; оксоалкил означает алкил, замещенный оксогруппой (С=O), в качестве примеров можно упомянуть СН 3 СО, СН 2 СОСН 2 и т.д.; галогеналкоксигруппа означает -О-алкил, в котором алкил имеет определенные ранее значения и замещен одним или несколькими одинаковыми или разными атомами галогенов, в качестве примеров можно упомянуть OCF3, OCHF2, OCCl3; арил означает ароматический моно- или бицикл, содержащий от 6 до 10 атомов углерода, в качестве примеров арилов можно упомянуть фенил и нафтил; гетероцикл означает азотсодержащий насыщенный цикл, необязательно имеющий мостиковую структуру и содержащий от 5 до 9 атомов углерода, по меньшей мере один атом азота и необязательно от 1 до 3 дополнительных гетероатомов, таких как атомы кислорода, азота или серы. Предпочтительно можно упомянуть пиперидил, пиперазинил, пирролидинил, морфолинил и т.д. Среди соединений формулы (I), являющихся объектами настоящего изобретения, первую группу соединений составляют соединения, в которыхR представляет собой атом водорода или хлора;X представляет собой один или несколько заместителей, выбранных из атомов галогенов, (C1-1 020652Y представляет собой атом водорода, атом галогена или (С 1-С 6)алкил;R4 представляет собой метил; в виде основания или кислотно-аддитивной соли. Среди соединений формулы (I), являющихся объектами настоящего изобретения, вторую группу соединений составляют соединения, в которыхR представляет собой атом водорода или хлора;X представляет собой один или несколько заместителей, выбранных из атома хлора или фтора, метила, трифторметила, метокси-, трифторметокси- или цианогруппы;Y представляет собой атом водорода, хлора, фтора или метил;R4 представляет собой метил; в виде основания или кислотно-аддитивной соли. Среди соединений формулы (I), являющихся объектами настоящего изобретения, третью группу соединений составляют соединения, в которыхR представляет собой атом водорода или хлора;X представляет собой один или несколько заместителей, выбранных из атомов галогенов, (C1C6)алкилов, галоген(С 1-С 6)алкилов, (C1-C6)алкоксигрупп, галоген(C1-C6)алкоксигрупп или цианогруппы;Y представляет собой атом водорода, атом галогена или (С 1-С 6)алкил;R2 и R3 независимо друг от друга представляют собой атомы водорода, метильные, этильные, изопропильные, циклопропильные группы или R2 и R3 с атомом азота, с которым они связаны, образуют морфолинил или пирролидинил, необязательно замещенный гидроксигруппой; в виде основания или кислотно-аддитивной соли. Среди соединений формулы (I), являющихся объектами настоящего изобретения, четвертую группу соединений составляют соединения, в которыхR представляет собой атом водорода или хлора;X представляет собой один или несколько заместителей, выбранных из атома хлора или фтора, метила, трифторметила, метокси-, трифторметокси- или цианогруппы;Y представляет собой атом водорода или хлора или метил;R2 и R3 независимо друг от друга представляют собой атомы водорода, метильные, этильные, изопропильные, циклопропильные группы или R2 и R3 с атомом азота, с которым они связаны, образуют морфолинил или пирролидинил, необязательно замещенный гидроксигруппой; в виде основания или кислотно-аддитивной соли. Комбинации из определенных ранее групп с первой по четвертую также составляют часть настоящего изобретения. Среди соединений формулы (I), являющихся объектами настоящего изобретения, предпочтительно можно упомянуть следующие соединения: метил-3-[2-(4-хлорфенил)пиразоло[1,5-а]пиридин-5-ил]бензоат; 3-[2-(4-хлорфенил)пиразоло[1,5-а]пиридин-5-ил]бензамид; 3-[2-(4-хлорфенил)пиразоло[1,5-а]пиридин-5-ил]-N,N-диметилбензамид; 3-[2-(4-хлорфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид; метил-3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]бензоат; 3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид; 3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-изопропилбензамид; 3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N,N-диметилбензамид; 3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]фенилморфолин-4-илметанон; 3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-2,N-диметилбензамид; 2-хлор-5-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид; 4-хлор-3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид; 3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-4,N-диметилбензамид; 2-фтор-4-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;N-метил-3-(2-о-толилпиразоло[1,5-а]пиридин-5-ил)бензамид; 3-[3-хлор-2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид. Соответственно настоящему изобретению соединения общей формулы (I) можно получать способом, описанным на схеме 1. Схема 1 Соответственно схеме 1 можно получать соединения общей формулы (Ia), в которой R1 представляет собой OR4; R4 представляет собой алкил ALK; R представляет собой атом водорода; X и Y имеют определенные ранее значения, реакцией сочетания, катализируемой металлом, таким как палладий, между соединением общей формулы (II), в которой R представляет собой атом водорода; X имеет определенные ранее значения, a Hal представляет собой атом галогена, и производным общей формулы (III), в которойY и ALK имеют определенные ранее значения, a Z представляет собой производное бора. Соответственно схеме 1 можно получать соединения общей формулы (Ib), в которой R1 представляет собой OR4; R представляет собой атом водорода; X и Y имеют определенные ранее значения, a R4 представляет собой атом водорода, реакцией гидролиза соединений общей формулы (Ia) основанием,таким как гидроксид натрия, в водно-спиртовой среде. Соответственно схеме 1, путь А, можно получать соединения общей формулы (Ic), в которой R1 представляет собой NR2R3; R представляет собой атом водорода, а X, Y, R2 и R3 имеют определенные ранее значения, реакцией сочетания, катализируемой металлом, таким как палладий, между соединением общей формулы (II), в которой R представляет собой атом водорода; X имеет определенные ранее значения, a Hal представляет собой атом галогена, и производным общей формулы (IV), в которой Y, R2 и R3 имеют определенные ранее значения, a Z представляет собой производное бора. Соответственно схеме 1, путь В, можно получать соединения общей формулы (Ic), в которой R1 представляет собой NR2R3; R представляет собой атом водорода, а X, Y, R2 и R3 имеют определенные ранее значения, реакцией между соединением общей формулы (Ia), в которой R1 представляет собойOR4; R4 представляет собой алкил ALK; R представляет собой атом водорода; X и Y имеют определенные ранее значения, и амином общей формулы (V), в которой R2 и R3 имеют определенные ранее значения, в присутствии триметилалюминия в растворе или в комплексе с третичным амином, таким как 5688. Соответственно схеме 1, путь С, можно получать соединения общей формулы (Ic), в которой R1 представляет собой NR2R3; R представляет собой атом водорода, а X, Y, R2 и R3 имеют определенные ранее значения, реакцией между соединением общей формулы (Ib), в которой R1 представляет собойOR4; R представляет собой атом водорода; X и Y имеют определенные ранее значения, a R4 представляет собой атом водорода, и амином общей формулы (V), в которой R2 и R3 имеют определенные ранее значения, в присутствии активатора кислоты, такого как изобутилхлорформиат. Соответственно схеме 1, путь D, можно получать соединения общей формулы (Ic), в которой R1 представляет собой NR2R3; R представляет собой атом водорода, а X, Y, R2 и R3 имеют определенные ранее значения, реакцией сочетания, катализируемой металлом, таким как палладий, между соединением общей формулы (VI), в которой R представляет собой атом водорода; X имеет определенные ранее значения, a Z представляет собой производное бора, и производным общей формулы (VII), в которой Y, R2 иR3 имеют определенные ранее значения, a Hal представляет собой атом галогена. Также можно получать соединения общей формулы (Ic), в которой R2 и R3 представляют собой атомы водорода, способом, описанным на схеме 2. Схема 2 Соответственно схеме 2 соединения общей формулы (Ic), в которой R1 представляет собой NH2; R представляет собой атом водорода, а X и Y имеют определенные ранее значения, могут быть получены гидролизом нитрилов общей формулы (IX), например, посредством пероксида водорода в присутствии основания. Соединения общей формулы (IX) могут быть получены реакцией сочетания, катализируемой металлом, таким как палладий, между соединением общей формулы (II), в которой R представляет собой атом водорода; X имеет определенные ранее значения, a Hal представляет собой атом галогена, и производным общей формулы (VIII), в которой Y имеет определенные ранее значения; CN представляет собой цианогруппу, a Z представляет собой производное бора. Соответственно настоящему изобретению соединения общей формулы (I) можно получать способом, описанным на схеме 3. Схема 3 Соответственно схеме 3 можно получать соединения общей формулы (Id), в которой X, Y и R1 имеют определенные ранее значения, a R представляет собой атом галогена Hal, электрофильным галогенированием соединений (Ia) или (Ic), например хлорированием посредством агента, такого как Nхлорсукцинимид. Соответственно настоящему изобретению соединения общих формул (II) и (VI) можно получать способом, описанным на схеме 4. Схема 4 Соответственно схеме 4, путь А, соединения общей формулы (II), в которой X имеет определенные ранее значения; R представляет собой атом водорода, a Hal представляет собой атом галогена, могут быть получены действием О-(мезитиленсульфонил)гидроксиламина (MSH) на соединение общей формулы (XIII), в которой X и Hal имеют определенные ранее значения, например, по методике, описанной Y.Tamura, J.-H. Kim, Y. Miki, H. Hayashi, M. Ikeda в J. Het. Chem., 1975, 12, 481. Соответственно схеме 4, путь В, также можно получать соединения общей формулы (II), в которойX имеет определенные ранее значения; R представляет собой атом водорода, a Hal представляет собой атом галогена, превращением соединений общей формулы (XIII) в соединения общей формулы (XIV), в которой X и Hal имеют определенные ранее значения, действием ангидрида кислоты, такого как трифторуксусный ангидрид, в присутствии основания, такого как триэтиламин, с последующей циклизацией в соединения общей формулы (II) в присутствии катализатора, такого как хлорид двухвалентного железа,например, по методике, описанной K.S. Gudmundsson в Bioorg. Med. Chem., 2005, 13, 5346. Соединения (XIII) могут быть получены исходя из соединений (XII) действием гидроксиламина. Соединения (XII) могут быть получены исходя из пиколинов общей формулы (X) и сложных эфиров общей формулы (XI), в которой X имеет определенные ранее значения, a ALK представляет собой алкил, в присутствии сильного основания, например, по методике, описанной K.S. Gudmundsson в Bioorg. Med.Chem., 2005, 13, 5346. Наконец, соединения (VI), в которых Z представляет собой производное бора, можно получать соответственно схеме 3 реакцией сочетания, например, бис-(пинаколато)дибора с соединениями (II) при катализе металлом, таким как палладий, по методике, описанной E.F. DiMauro, R. Vitullo, J. Org. Chem.,2006, 71(10), 3959. Указанные на схемах 1-4 исходные соединения и реагенты, способы получения которых не описаны, имеются в продаже, или описаны в литературе, или могут быть получены способами, описанными или известными специалистам в данной области техники. Настоящее изобретение согласно другому из своих аспектов относится также к соединению формулы (VI-1). Данное соединение является полезным в качестве промежуточного соединения в синтезе соединений формулы (I). В приведенных далее примерах описано получение некоторых соединений по настоящему изобретению. Данные примеры не являются ограничительными и приведены только для пояснения настоящего изобретения. Номера приведенных в примерах соединений соответствуют номерам в таблице, приведенной далее для пояснения химической структуры и физических свойств некоторых соединений по настоящему изобретению. Пример 1. Метил-3-[2-(4-хлорфенил)пиразоло[1,5-а]пиридин-5-ил]бензоат (соединение 1 в таблице). 1.1. 2-(4-Бромпиридин-2-ил)-1-(4-хлорфенил)этанон. В токе азота 5 г (29,07 ммоль) 4-бром-2-метилпиридина и 11,27 г (61,04 ммоль) этил-4-хлорбензоата помещают в колбу и растворяют в 50 мл безводного тетрагидрофурана. Смесь охлаждают до 5 С и по каплям прибавляют 70 мл (70 ммоль) раствора гексаметилдисилазана лития (1 М раствор в тетрагидрофуране). После прибавления смесь перемешивают при комнатной температуре в течение 2 ч, охлаждают до 5 С и затем медленно прибавляют 100 мл воды. Далее смесь разбавляют 250 мл этилацетата и 100 мл воды. Органический слой отделяют, а из водного слоя осуществляют экстракцию этилацетатом два раза по 100 мл. Затем органические фракции объединяют, сушат над сульфатом натрия и фильтруют. Далее к фильтрату прибавляют 15 г диоксида кремния и сгущают при пониженном давлении. Полученный порошок используют в качестве твердой насадки для хроматографирования на силикагеле, элюируя смесью циклогексана и этилацетата (9/1). Получают 8,4 г (93%) соединения в виде порошка желтого цвета. ЖХ-МС: М+Н=310. 1H ЯМР (ДМСО)(м.д.): 4,6 (с, 2 Н); 6,4 (с, 1 Н); 7,4 (с, 1H); 7,5-7,6 (м, 6 Н); 7,7 (с, 1H); 7,9 (д, 2 Н); 8,1 (д, 2 Н); 8,3 (д, 1 Н); 8,4 (д, 1 Н); 15,0 (с, 1 Н) (смесь "кетон/енол": 40/60). 1.2. Оксим 2-(4-бромпиридин-2-ил)-1-(4-хлорфенил)этанона. В колбу вносят 8,4 г (27,05 ммоль) 2-(4-бромпиридин-2-ил)-1-(4-хлорфенил)этанона в 150 мл этанола. Прибавляют 22 мл (272,56 ммоль) пиридина и 7,5 г (107,93 ммоль) моногидрохлорида гидроксиламина. Затем смесь перемешивают в течение 5 ч при комнатной температуре и далее реакционную смесь сгущают при пониженном давлении до получения плотного пастообразного вещества желтого цвета,которое растворяют в 400 мл этилацетата и 400 мл воды. Органический слой отделяют, а из водного слоя осуществляют экстракцию этилацетатом три раза по 200 мл. Затем органические фракции объединяют,сушат над сульфатом натрия и фильтруют. Фильтрат сгущают при пониженном давлении и получают 8,1 г (91,9%) соединения в виде порошка синего цвета. ЖХ-МС: М+Н=325.H ЯМР (ДМСО)(м.д.): 4,3 (с, 2 Н); 7,45 (м, 2 Н); 7,50 (д, 1 Н); 7,55 (с, 1 Н); 7,75 (м, 2 Н); 8,35 (д, 1 Н); 11,65 (с, 1 Н). 1.3. 5-Бром-2-(4-хлорфенил)пиразоло[1,5-а]пиридин. В колбу вносят 12,9 г (45,21 ммоль) этил-O-(2-мезитиленсульфонил)ацетогидроксамата в 30 мл 1,4 диоксана. Смесь охлаждают до 0 С и прибавляют 13,5 мл (156,60 ммоль) хлорной кислоты (70%-й водный раствор). Затем прибавляют 10 мл 1,4-диоксана и далее смесь интенсивно перемешивают в течение 2 ч 30 мин при 0 С. Затем смесь выливают в 350 мл ледяной воды. Смесь оставляют стоять при 0 С в течение 10 мин и затем фильтрованием через пористый стеклянный фильтр отделяют образовавшееся твердое вещество белого цвета (не сушить досуха: вещество является потенциально взрывчатым в сухом состоянии). Полученное плотное пастообразное вещество белого цвета промывают 350 мл ледяной воды и далее обрабатывают 250 мл 1,2-дихлорэтана и 150 мл насыщенного раствора хлорида натрия, охлажденного до 5 С. Собранную органическую фракцию фильтруют через гидрофобный патрон. Полученный фильтрат по каплям прибавляют к охлажденному до 0 С раствору 8,1 г (24,88 ммоль) оксима 2-(4 бромпиридин-2-ил)-1-(4-хлорфенил)этанона (соединение, полученное на стадии 1.2) в 150 мл 1,2 дихлорэтана. После прибавления смеси дают нагреться до комнатной температуры и перемешивают в течение 3 ч. Затем к смеси последовательно прибавляют 250 мл дихлорметана, 200 мл воды и 100 мл 1 н. водного раствора NaOH. Смесь перемешивают и оставляют расслаиваться. Органический слой отделяют, а из водного слоя осуществляют экстракцию дихлорметаном 2 раза по 200 мл. Затем органические фракции объединяют, фильтруют через гидрофобный патрон (колонка для экстракции "жидкость/жидкость", 70 мл, Radleys) и далее смешивают с 15 г диоксида кремния. Затем фильтрат сгущают при пониженном давлении и получают порошок коричневого цвета, который используют в качестве твердой насадки для хроматографирования на силикагеле, элюируя смесью циклогексана и дихлорметана (1/1). Получают 5,8 г (75%) соединения в виде пушистого вещества слегка желтого цвета. ЖХ-МС: М+Н=307. 1H ЯМР (ДМСО)(м.д.): 7,0 (д, 1 Н); 7,1 (с, 1 Н); 7,6 (д, 2 Н); 8,0 (с, 1 Н); 8,1 (д, 2 Н); 8,7 (д, 1 Н). 1.4. Метил-3-[2-(4-хлорфенил)пиразоло[1,5-а]пиридин-5-ил]бензоат. В колбу вносят 0,235 г (0,76 ммоль) 5-бром-2-(4-хлорфенил)пиразоло[1,5-a]пиридина, полученного на стадии 1.3, 0,165 г (0,92 ммоль) 3-метоксикарбонилфенилбороновой кислоты, 0,750 г (2,30 ммоль) карбоната цезия и 0,065 г (0,08 ммоль) [1,1'-бис-(дифенилфосфино)ферроцен]палладийдихлорида(II) в присутствии 5 мл смеси "ТГФ-вода" (9/1). Затем смесь выдерживают при 70 С в течение 1 ч 30 мин и далее смесь снова доводят до комнатной температуры и разбавляют 30 мл дихлорметана и 30 мл воды. Двухфазную смесь фильтруют через гидрофобный патрон (колонка для экстракции "жидкость/жидкость", 70 мл, Radleys), затем фильтрат сгущают при пониженном давлении. Полученный остаток хроматографируют на силикагеле, элюируя смесью циклогексана и этилацетата (8/2). Получают 0,200 г (72%) требуемого соединения в виде порошка бежевого цвета. Температура плавления (С): 180-182. ЖХ-МС: М+Н=363. 1 Н ЯМР (ДМСО)(м.д.): 3,95 (с, 3 Н); 7,20 (с, 1 Н); 7,35 (д, 1 Н); 7,60 (д, 2 Н); 7,70 (т, 1H); 8,00-8,20(м, 5 Н); 8,35 (с, 1 Н); 8,85 (д, 1 Н). Пример 2. 3-[2-(4-Хлорфенил)пиразоло[1,5-а]пиридин-5-ил]бензамид (соединение 2 в таблице). 2.1. 3-[2-(4-Хлорфенил)пиразоло[1,5-а]пиридин-5-ил]бензонитрил. 0,850 г (2,76 ммоль) 5-бром-2-(4-хлорфенил)пиразоло[1,5-а]пиридина, полученного по методике стадии 1.3, вносят в колбу, содержащую 0,490 г (3,33 ммоль) 3-цианофенилбороновой кислоты, 2,70 г(8,29 ммоль) карбоната цезия и 0,225 г (0,26 ммоль) [1,1'-бис-(дифенилфосфино)ферроцен]палладийдихлорида(II) в присутствии 20 мл смеси "ТГФ-вода" (9/1). Затем смесь выдерживают при 75 С в течение 3 ч, прибавляют 0,245 г (1,66 ммоль) 3-цианофенилбороновой кислоты, 1,35 г (4,14 ммоль) карбоната цезия и 0,115 г (0,14 ммоль) [1,1'-бис-(дифенилфосфино)ферроцен]палладийдихлорида(II) и далее смесь перемешивают при 75 С в течение 1 ч 30 мин. Затем смесь разбавляют 100 мл этилацетата и 100 мл воды. Далее органический слой отделяют, а из водного слоя осуществляют экстракцию этилацетатом два раза по 100 мл. Затем органические фракции объединяют, сушат над сульфатом натрия и фильтруют. Далее фильтрат сгущают при пониженном давлении, затем полученный остаток растворяют в тетрагидрофуране и сгущают при пониженном давлении после прибавления 10 г диоксида кремния. Остаток хроматографируют на силикагеле, элюируя смесью циклогексана и этилацетата (8/2). Получают 0,185 г(20,2%) требуемого соединения в виде порошка белого цвета. ЖХ-МС: М+Н=330. 1H ЯМР (ДМСО)(м.д.): 7,19 (с, 1 Н); 7,37 (дд, 1 Н); 7,56 (м, 2 Н); 7,74 (т, 1 Н); 7,90 (м, 1 Н); 8,06 (м,2 Н); 8,15-8,24 (м, 2 Н); 8,35 (м, 1 Н); 8,82 (д, 1 Н). 2.2. 3-[2-(4-Хлорфенил)пиразоло[1,5-а]пиридин-5-ил]бензамид. 0,150 г (0,45 ммоль) [2-(4-хлорфенил)пиразоло[1,5-а]пиридин-5-ил]бензонитрила, полученного на стадии 2.1, вносят в колбу, содержащую 5 мл безводного диметилсульфоксида. Затем смесь охлаждают до 10 С и прибавляют 0,100 мл (1,17 ммоль) раствора пероксида водорода (35%-й водный раствор) и 0,035 г (0,25 ммоль) карбоната калия. Смесь снова медленно доводят до комнатной температуры и перемешивают в течение 1 ч. Затем смесь охлаждают до 5 С и прибавляют 0,500 мл (5,85 ммоль) пероксида водорода и 0,250 г (1,78 ммоль) карбоната калия. Далее смесь перемешивают в течение 1 ч 30 мин при комнатной температуре и разбавляют 50 мл воды. Смесь фильтруют через пористый стеклянный фильтр и отделяют порошок, который хроматографируют (внося твердое вещество) на силикагеле, элюируя смесью дихлорметана и метанола (9/1). Получают 0,090 г (56,8%) требуемого соединения в виде порошка белого цвета. Температура плавления (С): 283-285. ЖХ-МС: М+Н=348. 1H ЯМР (ДМСО)(м.д.): 7,17 (с, 1 Н); 7,36 (дд, 1 Н); 7,47 (с, 1 Н); 7,56 (м, 2 Н); 7,61 (т, 1 Н); 7,94 (м,1 Н); 8,00 (м, 1 Н); 8,07 (м, 2 Н); 8,11 (м, 1 Н); 8,15 (с, 1 Н); 8,32 (м, 1 Н); 8,82 (д, 1 Н). Пример 3. 3-[2-(4-Хлорфенил)пиразоло[1,5-а]пиридин-5-ил]-N,N-диметилбензамид (соединение 3 в таблице). В токе азота в колбу помещают 0,900 мл (1,80 ммоль) раствора диметиламина (2 М раствор в тетрагидрофуране) и 8 мл толуола. Затем смесь охлаждают до 0 С и далее по каплям прибавляют 0,900 мл(1,80 ммоль) раствора триметилалюминия (2 М раствор в толуоле). После прибавления смесь перемешивают при 0 С в течение 25 мин и прибавляют 0,200 г (0,55 ммоль) метил-3-[2-(4-хлорфенил)пиразоло[1,5 а]пиридин-5-ил]бензоата, полученного на стадии 2.1. Затем смесь выдерживают при 90 С в течение 3 ч и охлаждают до 0 С. Далее смесь гидролизуют прибавлением по каплям 10 мл 1 н. раствора соляной кислоты. После прибавления смесь снова доводят до комнатной температуры и затем разбавляют 60 мл дихлорметана и 60 мл воды. Значение рН водного слоя доводят до 11 посредством 1 н. раствора гидроксида натрия и затем полученную двухфазную смесь фильтруют через пористый стеклянный фильтр со слоем целита. Полученный фильтрат пропускают через гидрофобный патрон (колонка для экстракции "жидкость/жидкость", 70 мл, Radleys). Фильтрат собирают и сгущают при пониженном давлении после прибавления 1,2 г диоксида кремния. Полученный остаток хроматографируют на силикагеле, элюируя смесью циклогексана и этилацетата (3/7). Получают 0,121 г (58,4%) требуемого соединения в виде порошка белого цвета. Температура плавления (С): 175-177. ЖХ-МС: М+Н=376. 1(м, 1 Н); 7,91 (м, 1 Н); 8,00-8,15 (м, 3 Н); 8,80 (д, 1 Н). Пример 4. 3-[2-(4-Хлорфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид (соединение 4 в таблице). Синтез осуществляют согласно методике, описанной в примере 3, исходя из 0,200 г (0,55 ммоль) метил-3-[2-(4-хлорфенил)пиразоло[1,5-а]пиридин-5-ил]бензоата, полученного на стадии 3.1, 0,900 мл(1,80 ммоль) раствора метиламина (2 М раствор в тетрагидрофуране) и 0,900 мл (1,80 ммоль) раствора триметилалюминия (2 М раствор в толуоле) в 8 мл толуола. После хроматографирования на силикагеле при элюировании смесью циклогексана и этилацетата (1/1) получают 0,151 г (75,6%) требуемого соединения в виде порошка белого цвета. Температура плавления (С): 234-236. ЖХ-МС: М+Н=362. 1(м, 1 Н); 8,02-8,12 (м, 3 Н); 8,28 (м, 1 Н); 8,62 (м, 1 Н); 8,82 (д, 1 Н). Пример 5. Метил-3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]бензоат (соединение 5 в таблице). 5.1. 2-(4-Бромпиридин-2-ил)-1-(4-фторфенил)этанон. В токе азота 5,0 г (29,07 ммоль) 4-бром-2-пиколина и 10,2 г (60,95 ммоль) этил-4-фторбензоата помещают в колбу и растворяют в 50 мл безводного тетрагидрофурана. Смесь охлаждают до 0 С и по каплям прибавляют 70 мл (70 ммоль) раствора гексаметилдисилазана лития (1 М раствор в тетрагидрофуране). После прибавления смесь перемешивают при комнатной температуре в течение 2 ч, охлаждают до 5 С и затем медленно прибавляют 100 мл воды. Далее смесь разбавляют 250 мл этилацетата и 100 мл воды. Органический слой отделяют, а из водного слоя осуществляют экстракцию этилацетатом два раза по 100 мл. Затем органические фракции объединяют, сушат над сульфатом натрия и фильтруют. Далее к фильтрату прибавляют 15 г диоксида кремния, перемешивают и затем сгущают при пониженном давлении. Полученный порошок используют в качестве твердой насадки для хроматографирования на силикагеле, элюируя смесью циклогексана и этилацетата (9/1). Получают 7,5 г (88%) соединения в виде порошка желтого цвета. ЖХ-МС: М+Н=294 (соотношение "кетон/енол": 43/57). 1 5.2. Оксим 2-(4-бромпиридин-2-ил)-1-(4-фторфенил)этанона. 7,5 г (24,26 ммоль) 2-(4-бромпиридин-2-ил)-1-(4-фторфенил)этанона помещают в колбу, содержащую 100 мл абсолютного этанола. Прибавляют 20 мл (247,78 ммоль) пиридина и 7,08 г (101,88 ммоль) моногидрохлорида гидроксиламина и смесь перемешивают в течение 3 ч при комнатной температуре. Затем этанол выпаривают в вакууме и полученный остаток обрабатывают 250 мл воды и 250 мл этилацетата. Органический слой отделяют, а из водного слоя осуществляют экстракцию этилацетатом 5 раз по 150 мл. Затем органические фракции объединяют, сушат над сульфатом натрия и сгущают в вакууме. Получают 7,82 г соединения. ЖХ-МС: М+Н=309. 1H ЯМР (ДМСО-d6, , м.д.): 4,26 (с, 2 Н); 7,19 (т, 2 Н); 7,50 (м, 2 Н); 7,75 (м, 2 Н); 8,33 (д, 1 Н); 11,50 (с,1 Н) (получение оксима (Е. 5.3. 5-Бром-2-(4-фторофенил)пиразоло[1,5-а]пиридин. 7,82 г (25,50 ммоль) оксима 2-(4-бромпиридин-2-ил)-1-(4-фторфенил)этанона помещают в колбу и растворяют в 400 мл 1,2-дихлорэтана. Раствор О-(мезитиленсульфонил)гидроксиламина (0,27 М раствор в 1,2-дихлорэтане (соединение, полученное по методике, описанной на стадии 1.3 по каплям прибавляют к смеси, охлажденной до 0 С. После прибавления смесь перемешивают при комнатной температуре в течение 1 ч 30 мин. Затем смесь разбавляют 200 мл воды и 200 мл 1 н. раствора гидроксида натрия. Двухфазную смесь перемешивают и оставляют расслаиваться. Органический слой отделяют, а из водного слоя осуществляют экстракцию дихлорметаном 4 раза по 200 мл. Затем органические фракции объединяют, сушат над сульфатом натрия и фильтруют. Далее к фильтрату прибавляют 15 г диоксида кремния и затем сгущают при пониженном давлении. Полученный порошок используют в качестве твердой насадки для хроматографирования на силикагеле, элюируя смесью циклогексана и дихлорметана (1/1). Получают 5,06 г (68 %) соединения в виде пушистого порошка белого цвета. ЖХ-МС: М+Н=291. 1H ЯМР (ДМСО-d6, , м.д.): от 7,00 до 7,10 (м, 2 Н); 7,45 (м, 2 Н); 8,05 (м, 3 Н); 8,70 (д, 1 Н). 5.4. Метил-3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]бензоат. В токе азота вносят 0,400 г (1,37 ммоль) 5-бром-2-(4-фторфенил)пиразоло[1,5-а]пиридина, полученного на стадии 5.3, 0,300 г (1,67 ммоль) 3-метоксикарбонилфенилбороновой кислоты, 1,330 г (4,08 ммоль) карбоната цезия в 5 мл смеси тетрагидрофурана и воды, 9/1. Прибавляют 0,11 г (0,13 ммоль) [1,1'бис-(дифенилфосфино)ферроцен]палладийдихлорида(II) и смесь нагревают при 70 С в течение 4 ч. Затем смесь снова доводят до комнатной температуры и далее разбавляют 40 мл дихлорметана и 40 мл воды. Затем смесь фильтруют через гидрофобный патрон (колонка для экстракции "жидкость/жидкость",70 мл, Radleys), органический слой отделяют и сгущают при пониженном давлении после прибавления 2 г диоксида кремния. Остаток хроматографируют на силикагеле, элюируя смесью циклогексана и этилацетата (9/1). Получают 0,340 г (71%) требуемого соединения в виде порошка белого цвета. Температура плавления (С): 162-164. ЖХ-МС: М+Н=347. 1H ЯМР (ДМСО)(м.д.): 3,95 (с, 3 Н); 7,15 (с, 1 Н); 7,30-7,38 (м, 3 Н); 7,70 (т, 1 Н); 8,00-8,15 (м, 5 Н); 8,35 (м, 1 Н); 8,80 (д, 1 Н). Пример 6. 3-[2-(4-Фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид (соединение 6 в таблице). Синтез осуществляют согласно методике, описанной в примере 3, исходя из 0,200 г (0,58 ммоль) метил-3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]бензоата, полученного на стадии 7.4, 1,00 мл(2,00 ммоль) раствора метиламина (2 М раствор в тетрагидрофуране) и 1,00 мл (2,00 ммоль) раствора триметилалюминия (2 М раствор в толуоле) в 8 мл толуола. После хроматографирования на силикагеле при элюировании смесью циклогексана и этилацетата (1/1) получают 0,235 г (67,7%) требуемого соединения в виде порошка белого цвета. Температура плавления (С): 214-216. ЖХ-МС: М+Н=346. 1(м, 1 Н); 8,05-8,21 (м, 3 Н); 8,29 (м, 1 Н); 8,60 (м, 1 Н); 8,82 (д, 1 Н). Пример 7. 3-[2-(4-Фторфенил)пиразоло[1,5-а]пиридин-5-ил]-2,N-диметилбензамид (соединение 10 в таблице). 7.1. 2-(4-Фторфенил)-5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)пиразоло[1,5-а]пиридин (соединение VI-1). 1,00 г (3,43 ммоль) 5-бром-2-(4-фторфенил)пиразоло[1,5-а]пиридина, полученного аналогично стадии 7.3, помещают в присутствии 1,05 г (4,13 ммоль) бис-(пинаколато)дибора, 1,00 г (10,19 ммоль) ацетата калия и 0,280 г (0,34 ммоль) [1,1'-бис-(дифенилфосфино)ферроцен]палладийдихлорида(II) в 14 мл диоксана. Полученную смесь нагревают микроволновым излучением при 140 С в течение 20 мин и разбавляют 100 мл дихлорметана и 100 мл воды. Затем двухфазную смесь фильтруют через гидрофобный патрон("колонка для экстракции "жидкость/жидкость", 70 мл, Radleys). Органический слой отделяют и сгущают при пониженном давлении после прибавления 4 г диоксида кремния. Полученный остаток хроматографируют на силикагеле, элюируя смесью циклогексана и этилацетата (9/1). Получают 0,992 г (85,4%) требуемого соединения в виде порошка розоватого цвета. ЖХ-МС: М+Н=338 (разложение в колонке до бороновой кислоты М+Н=257). 1(10,83 ммоль) триэтиламина, 0,408 г (3,02 ммоль) моногидрата N-гидроксибензотриазола, 0,579 г (3,02 ммоль) моногидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида и 5 мл дихлорметана. Смесь перемешивают при комнатной температуре в течение 1 ч и затем прибавляют 1,51 мл (3,02 ммоль) раствора метиламина (2 М раствор в тетрагидрофуране). Смесь перемешивают в течение ночи при комнатной температуре, затем прибавляют 0,5 мл (1 ммоль) раствора метиламина и перемешивают в течение ночи. Затем смесь сгущают при пониженном давлении и далее к смеси прибавляют 5 мл дихлорметана и 0,390 мл (2,99 ммоль) изобутилхлорформиата. Смесь снова перемешивают в течение ночи и разбавляют 7 мл дихлорметана и 7 мл воды. Затем смесь фильтруют через гидрофобный патрон (колонка для экстракции "жидкость/жидкость", 70 мл, Radleys). Органический слой отделяют и сгущают при пониженном давлении. Получают 0,298 г (56,2%) требуемого соединения в виде порошка белого цвета. ЖХ-МС: М+Н=228. 1H ЯМР (ДМСО)(м.д.): 2,31 (с, 3 Н); 2,80 (д, 3 Н); 7,05-7,35 (м, 2 Н); 7,68 (м, 1 Н); 8,32 (уш.с, 1 Н). 7.3. 3-[2-(4-Фторфенил)пиразоло[1,5-а]пиридин-5-ил]-4,N-диметилбензамид. Вносят 0,150 г (0,44 ммоль) 2-(4-фторфенил)-5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2 ил)пиразоло[1,5-а]пиридина, полученного на стадии 7.1, 0,144 г (0,63 ммоль) 3-бром-2,Nдиметилбензамида, полученного на стадии 10.2, 0,434 г (1,33 ммоль) карбоната цезия и 0,036 г (0,044 ммоль) [1,1'-бис-(дифенилфосфино)ферроцен]палладийдихлорида(II) в 5 мл смеси тетрагидрофурана и воды, 9/1. Смесь перемешивают при 60 С в течение ночи. Далее смесь разбавляют 50 мл дихлорметана и 50 мл воды. Затем двухфазную смесь фильтруют через гидрофобный патрон (колонка для экстракции"жидкость/жидкость", 70 мл, Radleys). Органический слой отделяют и сгущают при пониженном давлении после прибавления 1,5 г диоксида кремния. Полученный остаток хроматографируют на силикагеле, элюируя смесью циклогексана и этилацетата (1/1). Получают 0,103 г (65%) требуемого соединения в виде порошка белого цвета. Температура плавления (С): 240-242. ЖХ-МС: М+Н=360. 1(с, 1 Н); 8,10 (м, 2 Н); 8,28 (с, 1 Н); 8,76 (д, 1 Н). Пример 8. N-Циклопропил-3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]бензамид (соединение 15 в таблице). 0,0382 г (0,67 ммоль) циклопропиламина разбавляют 10 мл безводного тетрагидрофурана. Затем медленно прибавляют 0,0859 г (0,33 ммоль) DABAL (двойной аддукт триметилалюминия и 1,4 диазабицикло[2.2.2]октана) и смесь перемешивают в течение 1 ч. Далее прибавляют 0,145 г (0,42 ммоль) метил-3-[2-(4-фторфенил)пиразоло[1,5-a]пиридин-5-ил]бензоата, полученного по методике 5.4, и реакционную смесь нагревают в микроволновой печи в 2 приема по 30 мин при 130 С. Затем смесь гидролизуют при 5 С посредством 5 мл воды и 5 мл 1 н. водного раствора соляной кислоты. После гидролиза смесь разбавляют 50 мл воды и 50 мл дихлорметана и затем фильтруют через гидрофобный патрон (колонка для экстракции "жидкость/жидкость" 70 мл, Radleys). Органический слой отделяют и сгущают при пониженном давлении после прибавления 1,5 г диоксида кремния. Полученный остаток хроматографируют на силикагеле, элюируя смесью циклогексана и этилацетата (6/4). Получают 0,112 г (72,3%) требуемого соединения в виде порошка белого цвета. Температура плавления (С): 179-181. ЖХ-МС: М+Н=372. 1H ЯМР (ДМСО)(м.д.): от 0,60 до 0,80 (м, 4H); 3,92 (м, 1 Н); 7,15 (с, 1H); 7,30-7,39 (м, 3 Н); 7,61 (т,1 Н); 7,88 (д, 1 Н); 7,98 (д, 1H); 8,10 (м, 3 Н); 8,22 (с, 1 Н); 8,57 (м, 1 Н); 8,81 (д, 1 Н). Пример 9. 3-[2-(4-Фторфенил)пиразоло[1,5-а]пиридин-5-ил]фенил-(3-гидроксипирролидин-1 ил)метанон (соединение 22 в таблице). 0,100 г (0,30 ммоль) 3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]бензойной кислоты, полученной аналогично примеру 8, помещают в колбу в присутствии 0,170 мл (1,20 ммоль) триэтиламина и 20 мл дихлорметана. Затем прибавляют 0,051 мкл (0,39 ммоль) изобутилхлорформиата и смесь перемешивают при комнатной температуре в течение 2 ч. К смеси прибавляют 0,0341 г (0,39 ммоль) 3 гидроксипирролидина и продолжают перемешивать при комнатной температуре в течение 2 ч. Далее смесь разбавляют 50 мл воды и 50 мл дихлорметана. Затем двухфазную смесь фильтруют через гидрофобный патрон (колонка для экстракции "жидкость/жидкость", 70 мл, Radleys). Органический слой отделяют и сгущают при пониженном давлении после прибавления 1 г диоксида кремния. Полученный остаток хроматографируют на силикагеле, элюируя смесью циклогексана и этилацетата (6/4). Получают 0,063 г (50%) требуемого соединения в виде воскоподобного вещества бледно-желтого цвета. Температура плавления (С): 173-175. ЖХ-МС: М+Н=402. 1H ЯМР (ДМСО)(м.д.): от 1,65 до 2,05 (м, 2 Н); 3,40-3,70 (м, 4 Н); 4,32 (д, 1 Н); 5,00 (д, 1 Н); 7,11 (с,1 Н); 7,32 (м, 3 Н); 7,60 (м, 2 Н); 7,93 (д, 2 Н); 8,08 (м, 3 Н); 8,77 (д, 1 Н). Пример 10. N-Метил-3-(2-р-толилпиразоло[1,5-а]пиридин-5-ил)бензамид (соединение 28 в таблице). 10.1. 2-(4-Бромпиридин-2-ил)-1-р-толилэтанон. В токе азота 1 г (5,81 ммоль) 4-бром-2-метилпиридина и 1,75 г (11,60 ммоль) метил-4 метилбензоата помещают в колбу и растворяют в 30 мл безводного тетрагидрофурана. Смесь охлаждают до 5 С и по каплям прибавляют 14 мл (14 ммоль) раствора гексаметилдисилазана лития (1 М раствор в тетрагидрофуране). После прибавления смесь перемешивают при комнатной температуре в течение 2 ч 30 мин, далее охлаждают до 5 С и медленно прибавляют 20 мл воды. Затем смесь разбавляют 200 мл этилацетата и 200 мл воды. Органический слой отделяют, сушат над сульфатом натрия и фильтруют. Далее к фильтрату прибавляют 5 г диоксида кремния и сгущают при пониженном давлении. Полученный порошок используют в качестве твердой насадки для хроматографирования на силикагеле, элюируя смесью циклогексана и этилацетата (95/5), и получают 1,03 г (61%) соединения в виде порошка желтого цвета. ЖХ-МС: М+Н=290. 10.2. 4-Бром-2-(3-р-толил-2 Н-азирин-2-ил)пиридин. 1,03 г 2-(4-бромпиридин-2-ил)-1-р-толилэтанона, полученного на стадии 13.1, вносят в колбу, содержащую 0,99 г (14,2 ммоль) моногидрохлорида гидроксиламина, 3 мл (37 ммоль) пиридина и 100 мл этанола. Реакционную смесь перемешивают в течение ночи и затем сгущают при пониженном давлении. Далее полученный остаток обрабатывают 200 мл этилацетата и 200 мл воды. Органический слой отделяют, сушат над сульфатом натрия и затем сгущают при пониженном давлении. 1,10 г полученного соединения растворяют в колбе, содержащей 0,660 мл (4,74 ммоль) триэтиламина и 30 мл дихлорметана. Далее реакционную смесь охлаждают до 5 С и затем по каплям прибавляют 0,200 мл (1,42 ммоль) ангидрида трифторуксусной кислоты. Далее смесь перемешивают при комнатной температуре в течение 3 ч и гидролизуют 100 мл воды. Затем смесь перемешивают в течение 10 мин и фильтруют через гидрофобный патрон (колонка для экстракции "жидкость/жидкость", 70 мл, Radleys). Далее к фильтрату прибавляют 1,2 г диоксида кремния и сгущают при пониженном давлении. Полученный порошок используют в качестве твердой насадки для хроматографирования на силикагеле, элюируя смесью циклогексана и этилацетата (95/5). Получают 0,746 г (77%) требуемого соединения в виде порошка белого цвета. 1H ЯМР (ДМСО)(м.д.): 2,42 (д, 3 Н); 3,45 (с, 1 Н); 7,42-7,58 (м, 4H); 7,78 (м, 2 Н); 8,30 (д, 1 Н). 10.3. 5-Бром-2-р-толилпиразоло[1,5-а]пиридин. 0,746 г 4-бром-2-(3-р-толил-2 Н-азирин-2-ил)пиридина, полученного на стадии 13.2, растворяют в присутствии 6,6 мг (0,052 ммоль) хлорида железа(II) в 30 мл 1,2-диметоксиэтана. Затем смесь нагревают с обратным холодильником в течение 6 ч. Далее прибавляют 10 мг (0,078 ммоль) хлорида железа(II) и перемешивают при нагревании с обратным холодильником в течение 3 ч. Затем смесь разбавляют 50 мл этилацетата и 50 мл воды. Далее органический слой отделяют, сушат над сульфатом натрия и фильтруют. Затем к фильтрату прибавляют 2 г диоксида кремния и сгущают при пониженном давлении. Полученный порошок используют в качестве твердой насадки для хроматографирования на силикагеле, элюируя смесью циклогексана и этилацетата (85/15). Получают 0,534 г (71%) требуемого соединения в виде порошка желтого цвета. ЖХ-МС: М+Н=287. 1 Н ЯМР (ДМСО)(м.д.): 2,48 (м, 3 Н); 7,00 (м, 2 Н); 7,32 (м, 2 Н); 7,88 (м, 2 Н); 8,00 (м, 1 Н); 8,68 (д,1 Н). 10.4. N-Метил-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензамид. 2,50 г (11,68 ммоль) 3-бром-N-метилбензамида, 3,56 г (14,01 ммоль) бис-(пинаколато)дибора, 3,43 г[1,1'-бис(дифенилфосфино)ферроцен]палладийдихлорида(II) вносят в 20 мл диоксана и нагревают микроволновым излучением при 130 С в течение 45 мин. Затем смесь разбавляют 150 мл этилацетата и 100 мл воды. Органический слой отделяют, а из водного слоя осуществляют экстракцию этилацетатом два раза по 100 мл. Далее органические фракции объединяют, сушат над сульфатом натрия и затем сгущают при пониженном давлении после прибавления 10 г диоксида кремния. Полученный остаток хроматографируют на силикагеле, элюируя смесью циклогексана и этилацетата (8/2). Получают 1,39 г требуемого соединения в виде порошка розоватого цвета (присутствие пинакола). Н ЯМР (ДМСО)(м.д.): 1,30 (с, 12 Н); 2,78 (д, 3 Н); 7,48 (т, 1H); 7,80 (м, 1 Н); 7,95 (м, 1 Н); 8,12 (м,1 Н); 8,50 (м, 1H). 10.5. N-Метил-3-(2-р-толилпиразоло[1,5-а]пиридин-6-ил)бензамид. Вносят 0,150 г (0,52 ммоль) 5-бром-2-р-толилпиразоло[1,5-а]пиридина, полученного на стадии 13.3,0,136 г (0,52 ммоль) N-метил-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензамида, полученного на стадии 13.4, 0,510 г (1,57 ммоль) карбоната цезия и 0,043 г (0,05 ммоль) [1,1'-бис(дифенилфосфино)ферроцен]палладийдихлорида(II) в 5 мл смеси тетрагидрофурана и воды, 9/1. Смесь перемешивают при 65 С в течение 4 ч. Далее смесь разбавляют 50 мл дихлорметана и 50 мл воды. Затем двухфазную смесь фильтруют через гидрофобный патрон (колонка для экстракции "жидкость/жидкость",70 мл, Radleys). Органический слой отделяют и сгущают при пониженном давлении после прибавления 1,5 г диоксида кремния. Полученный остаток хроматографируют на силикагеле, элюируя смесью циклогексана и этилацетата (1/1). Получают 0,138 г (77,7%) требуемого соединения в виде порошка бежевого цвета. Температура плавления (С): 204-206. ЖХ-МС: М+Н=342. 1H ЯМР (ДМСО)(м.д.): 2,38 (с, 3 Н); 2,85 (д, 3 Н); 7,10 (с, 1 Н); 7,31 (м, 3 Н); 7,62 (т, 1 Н); 7,90 (м,3 Н); 7,98 (д, 1 Н); 8,08 (с, 1 Н); 8,29 (с, 1 Н); 8,61 (д, 1 Н); 8,81 (д, 1 Н). Пример 11. 3-[3-Хлор-2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид (пример 34 в таблице). 0,100 г (0,29 ммоль) 3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамида, полученного по методике 6, помещают в колбу в присутствии 3 мл дихлорметана. Прибавляют 0,060 г (0,45 ммоль) N-хлорсукцинимида и смесь перемешивают при комнатной температуре в течение ночи. Далее реакционную смесь разбавляют 50 мл дихлорметана и 50 мл воды. Затем двухфазную смесь фильтруют через гидрофобный патрон (колонка для экстракции "жидкость/жидкость", 70 мл, Radleys). Органический слой отделяют и сгущают при пониженном давлении после прибавления 1,2 г диоксида кремния. Полученный остаток хроматографируют на силикагеле, элюируя смесью циклогексана и этилацетата(6/4). Получают 0,0592 г (53,8%) требуемого соединения в виде порошка белого цвета. Температура плавления (С): 221-223. ЖХ-МС: М+Н=380. 1H ЯМР (ДМСО)(м.д.): 2,88 (д, 3 Н); 7,42 (м, 2 Н); 7,47 (дд, 1 Н); 7,64 (т, 1 Н); 7,93 (м, 1 Н); 8,01 (м,1 Н); 8,05 (м, 1 Н); 8,10 (м, 2 Н); 8,31 (м, 1 Н); 8,63 (м, 1 Н); 8,88 (д, 1 Н). Приведенные далее таблицы даны для пояснения химической структуры общей формулы (I) (табл. 1) и физико-химических характеристик (табл. 2) некоторых примеров соединений по настоящему изобретению. В этих таблицах: в столбце "Тпл" приведены температуры плавления соединений в С;Me и Et означают метильные и этильные группы соответственно; знак указывает на один или несколько связывающих атомов. 1 Соединения по настоящему изобретению были объектами фармакологических испытаний, позволивших определить их модулирующее действие в отношении рецепторов NOT. Оценка активности in vitro на клетках N2A. Активность соединений по настоящему изобретению оценивали на линии клеток (N2A), эндогенно экспрессирующих рецептор мыши Nurr-1 и стабильно трансфицированных респонсивным элементом,связывающим NOT (NBRE), присоединенный к гену-репортеру люциферазы. Испытания осуществляли соответственно описанной далее методике. Клеточная линия Neuro-2A происходит из коммерческого стандартного препарата (АТСС). КлонNeuro-2A был получен из спонтанной опухоли, происходящей из штамма мыши A albino, полученногоR.J. Klebe и соавт. Затем данную линию Neuro-2A стабильно трансфицировали 8NBRE-люциферазой. Клетки N2A-8NBRE культивировали до конфлюэнтности в культуральных флаконах площадью 75 см 2,содержавших среду DMEM, дополненную 10% эмбриональной телячьей сыворотки, 4,5 г/л глюкозы и 0,4 мг/мл генетицина. После культивирования в течение недели клетки обрабатывали 0,25%-м трипсином в течение 30 с, затем снова суспендировали в DMEM без красного фенолового, содержавшем 4,5 г/л глюкозы, 10% делипидированной сыворотки Hyclone, и помещали в 96-луночные планшеты белого цвета с прозрачным дном. Клетки вносили из расчета 60000 единиц на лунку в объеме 75 мкл за 24 ч до прибавления соединений. Соединения вносили в объеме 25 мкл и инкубировали дополнительно в течение 24 ч. В день измерения в каждую лунку прибавляли одинаковый объем (100 мкл) среды Steadylite, затем выжидали в течение 30 мин до достижения полного лизиса клеток и получения максимального сигнала. Затем после запечатывания адгезивной пленкой в планшетах осуществляли измерения с использованием микропланшетного люминометра. Из испытуемых соединений готовили исходные растворы с концентрацией 10-2 М и затем разбавляли 100%-м ДМСО. Растворы испытуемых соединений с каждой концентрацией предварительно разбавляли культуральной средой перед инкубацией с клетками, что давало,таким образом, конечную концентрацию ДМСО 0,625%. Лучшие соединения обладают СЕ 50 в интервале от 0,1 нМ до 10 мкМ. Например, соединения 2, 4, 10, 14, 16 и 26 показали СЕ 50 45, 2, 6,6, 125, 326 и 1,3 нМ соответственно. Таким образом, следует, что соединения по настоящему изобретению обладают модулирующим действием в отношении рецепторов NOT. Следовательно, соединения по настоящему изобретению могут быть использованы для получения лекарственных средств с целью применения их в терапии при лечении или профилактике заболеваний,затрагивающих рецепторы NOT. Таким образом, согласно другому из своих аспектов настоящее изобретение относится к лекарственным средствам, содержащим соединение формулы (I) или аддитивную соль этого соединения с фармацевтически приемлемой кислотой. Такие лекарственные средства находят применение в терапии, в частности, при лечении и профилактике нейродегенеративных заболеваний, таких как, например, болезнь Паркинсона, болезнь Альцгеймера, таупатии (например, прогрессирующий супрануклеарный паралич, лобно-височная деменция, кортикобазальная дегенерация, болезнь Пика); повреждения головного мозга, такие как ишемия, черепно- 18020652 мозговые травмы и эпилепсия; психические заболевания, такие как шизофрения, депрессия, лекарственная зависимость, синдром дефицита внимания и гиперактивности; воспалительные заболевания центральной нервной системы, такие как рассеянный склероз, энцефалит, миелит, энцефаломиелит и другие воспалительные заболевания, такие как сосудистые патологии, атеросклероз, воспаление суставов, артроз, ревматоидный артрит; остеоартрит, болезнь Крона, язвенный колит; аллергические воспалительные заболевания, такие как астма, аутоиммунные заболевания, такие как диабет I типа, волчанка, склеродермии, синдром Гийена-Барре, болезнь Аддисона и другие иммуноопосредованные заболевания; остеопороз; раковые заболевания. Такие соединения могут быть использованы также при лечении, связанном с пересадками и/или трансплантациями клеток-штаммов. Согласно другому из своих аспектов настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве действующего начала соединение по настоящему изобретению. Такие фармацевтические композиции содержат эффективную дозу по меньшей мере одного соединения по настоящему изобретению или одной фармацевтически приемлемой соли этого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. Эксципиенты выбирают из традиционных эксципиентов, известных специалистам в данной области техники, в соответствии с требуемыми фармацевтической формой и способом введения. В фармацевтических композициях по настоящему изобретению, предназначенных для перорального, сублингвального, подкожного, внутримышечного, внутривенного, топического, местного, интратрахеального, интраназального, чрескожного или ректального введения, указанное выше действующее начало формулы (I) или его соль может вводиться в стандартной лекарственной форме в смеси с традиционными фармацевтическими эксципиентами животному и человеку для профилактики или лечения указанных выше нарушений или заболеваний. Соответствующие стандартные лекарственные формы включают в себя формы для перорального введения, такие как таблетки, капсулы с мягкой или твердой желатиновой оболочкой, порошки, гранулы и растворы или суспензии для перорального введения, формы для сублингвального, трансбуккального,интратрахеального, интраокулярного, интраназального и ингаляционного введения, формы для топического, чрескожного, подкожного, внутримышечного или внутривенного введения, формы для ректального введения и имплантаты. Для топического применения соединения по настоящему изобретению можно использовать в кремах, гелях, мазях или лосьонах. В качестве примера стандартная лекарственная форма соединения по настоящему изобретению в форме таблетки может содержать следующие компоненты: Могут иметь место особые случаи, в которых дозы устанавливают увеличенными или уменьшенными; такие дозы также охватывает данное изобретение. По принятой практике соответствующие дозы для каждого пациента определяет врач в зависимости от способа введения, массы тела и реакции пациента. Настоящее изобретение в одном из своих аспектов относится также к способу лечения указанных выше патологий, включающему в себя введение пациенту эффективной дозы соединения по настоящему изобретению или одной из его фармацевтически приемлемых солей. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I) где R представляет собой атом водорода или галогена или (С 1-С 6)алкил;X представляет собой один или несколько заместителей, выбранных из атомов водорода или галогена, (C1-C6)алкилов, галоген(C1-C6)алкилов, (C1-C6)алкоксигрупп, галоген(С 1-С 6)алкоксигрупп, циано-,гидроксигруппы или гидрокси(С 1-С 6)алкилов;Y представляет собой атом водорода, галогена или (С 1-С 6)алкил;R2 и R3 независимо друг от друга представляют собой атомы водорода, (C1-C6)алкилы, гидрокси(C1C6)алкилы или оксо(С 1-С 6)алкилы или R2 и R3 с атомом азота, с которым они связаны, образуют гетероцикл, необязательно замещенный (C1-C6)алкилом, гидрокси- или оксогруппой;R4 представляет собой (C1-C6)алкил, гидрокси(C1-C6)алкил или оксо(C1-C6)алкил; в виде основания или кислотно-аддитивной соли с фармацевтически приемлемой кислотой,указанный гетероцикл представляет собой насыщенный цикл, содержащий от 5 до 9 атомов углерода и по меньшей мере один атом азота. 2. Соединения формулы (I) по п.1, отличающиеся тем, чтоR представляет собой атом водорода или хлора;X представляет собой один или несколько заместителей, выбранных из атомов галогенов, (С 1 С 6)алкилов, галоген(С 1-C6)алкилов, (С 1-С 6)алкоксигрупп, галоген(С 1-С 6)алкоксигрупп или цианогруппы;Y представляет собой атом водорода, атом галогена или (С 1-С 6)алкил;R4 представляет собой метил; в виде основания или кислотно-аддитивной соли с фармацевтически приемлемой кислотой. 3. Соединения формулы (I) по п.1, отличающиеся тем, чтоR представляет собой атом водорода или хлора;X представляет собой один или несколько заместителей, выбранных из атома хлора или фтора, метила, трифторметила, метокси-, трифторметокси- или цианогруппы;Y представляет собой атом водорода, хлора, фтора или метил;R4 представляет собой метил; в виде основания или кислотно-аддитивной соли с фармацевтически приемлемой кислотой. 4. Соединения формулы (I) по п.1, отличающиеся тем, чтоR представляет собой атом водорода или хлора;X представляет собой один или несколько заместителей, выбранных из атомов галогенов, (С 1 С 6)алкилов, галоген(С 1-С 6)алкилов, (С 1-С 6)алкоксигрупп, галоген(С 1-С 6)алкоксигрупп или цианогруппы;Y представляет собой атом водорода, атом галогена или (С 1-С 6)алкил;R2 и R3 независимо друг от друга представляют собой атомы водорода, метильные, этильные, изопропильные, циклопропильные группы или R2 и R3 с атомом азота, с которым они связаны, образуют морфолинил или пирролидинил, необязательно замещенный гидроксигруппой; в виде основания или кислотно-аддитивной соли с фармацевтически приемлемой кислотой. 5. Соединения формулы (I) по п.1, отличающиеся тем, чтоR представляет собой атом водорода или хлора;X представляет собой один или несколько заместителей, выбранных из атома хлора или фтора, метила, трифторметила, метокси-, трифторметокси- или цианогруппы;Y представляет собой атом водорода или хлора или метил;R2 и R3 независимо друг от друга представляют собой атомы водорода, метильные, этильные, изопропильные, циклопропильные группы или R2 и R3 с атомом азота, с которым они связаны, образуют морфолинил или пирролидинил, необязательно замещенный гидроксигруппой; в виде основания или кислотно-аддитивной соли с фармацевтически приемлемой кислотой. 6. Соединение, выбранное из следующего: метил-3-[2-(4-хлорфенил)пиразоло[1,5-а]пиридин-5-ил]бензоат; 3-[2-(4-хлорфенил)пиразоло[1,5-а]пиридин-5-ил]бензамид; 3-[2-(4-хлорфенил)пиразоло[1,5-а]пиридин-5-ил]-N,N-диметилбензамид; 3-[2-(4-хлорфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид; метил-3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]бензоат; 3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид; 3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-изопропилбензамид; 3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N,N-диметилбензамид; 3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]фенилморфолин-4-илметанон; 3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-2,N-диметилбензамид; 2-хлор-5-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид; 4-хлор-3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид; 3-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-4,N-диметилбензамид; 2-фтор-4-[2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид;N-метил-3-(2-о-толилпиразоло[1,5-а]пиридин-5-ил)бензамид; 3-[3-хлор-2-(4-фторфенил)пиразоло[1,5-а]пиридин-5-ил]-N-метилбензамид. 7. Лекарственное средство, обладающее модулирующим действием в отношении нуклеарных рецепторов NOT, отличающееся тем, что содержит соединение формулы (I) по любому из пп.1-6 или аддитивную соль этого соединения с фармацевтически приемлемой кислотой. 8. Фармацевтическая композиция, обладающая модулирующим действием в отношении рецепторовNOT, отличающаяся тем, что содержит соединение формулы (I) по любому из пп.1-6 или фармацевтически приемлемую соль этого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. 9. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственного средства, предназначенного для лечения и профилактики нейродегенеративных заболеваний. 10. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственного средства, предназначенного для лечения и профилактики травм головного мозга и эпилепсии. 11. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственного средства, предназначенного для лечения и профилактики психических заболеваний. 12. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственного средства, предназначенного для лечения и профилактики воспалительных заболеваний. 13. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственного средства, предназначенного для лечения и профилактики остеопороза и раковых заболеваний. 14. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственного средства, предназначенного для лечения и профилактики болезни Паркинсона, болезни Альцгеймера, таупатий и рассеянного склероза. 15. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственного средства, предназначенного для лечения и профилактики шизофрении, депрессии, лекарственной зависимости, синдрома дефицита внимания и гиперактивности. 16. Промежуточное соединение формулы (VI-1) 17. Применение соединения по п.16 для получения соединений общей формулы (I) по п.1.
МПК / Метки
МПК: A61P 25/08, A61P 25/18, C07D 471/04, A61P 19/10, A61P 25/28, A61K 31/437
Метки: получение, дифенилпиразолопиридинов, рецептора, производные, модуляторов, нуклеарного, применение, качестве
Код ссылки
<a href="https://eas.patents.su/22-20652-proizvodnye-difenilpirazolopiridinov-ih-poluchenie-i-primenenie-v-kachestve-modulyatorov-nuklearnogo-receptora-not.html" rel="bookmark" title="База патентов Евразийского Союза">Производные дифенилпиразолопиридинов, их получение и применение в качестве модуляторов нуклеарного рецептора not</a>
Предыдущий патент: Катод для электролитических процессов
Следующий патент: Органоминеральное удобрение и способ его получения
Случайный патент: Защитное укрытие












