Производные хинолина в качестве ингибиторов киназы
Номер патента: 24162
Опубликовано: 31.08.2016
Авторы: Квинси Джоанна Рейчел, Лангхем Барри Джон, Франклин Ричард Джереми, Ньюсс Джуди Шарлотт, Брукингз Даниел Кристофер, Браун Джулиен Алистэр, Партон Эндрью Харри, Али Мезхер Хуссейн, Форд Даниел Джеймс
Формула / Реферат
1. Соединение формулы (I) или его N-оксид или его фармацевтически приемлемая соль:

в которой
U обозначает -CF3;
Q обозначает N-R4;
Z обозначает пиридопиримидинил-4-ил;
М обозначает фенил, пиридинил или пиразинил, каждая из этих групп необязательно может содержать один или большее количество заместителей, независимо выбранных из группы, включающей хлор, метил и метоксигруппу;
W обозначает C-R5;
R1, R2 и R3 независимо обозначают водород, галоген, C1-C6-алкил, трифторметил или C1-С6-алкилсульфонил;
R4 обозначает водород или C1-С6-алкил; и
R5 обозначает водород.
2. N-Оксидное производное соединения формулы (I) по п.1 или его фармацевтически приемлемая соль.
3. Соединение по п.1, в котором атом углерода, к которому непосредственно присоединены фрагменты -Q-Z и -CF3, обладает (R)-конфигурацией.
4. Соединение по п.1, в котором R4 обозначает водород или метил.
5. Соединение по п.1, в котором Z обозначает пиридо[3,2-d]пиримидин-4-ил.
6. Соединение по п.1, в котором М обозначает пиридинил.
7. Соединение по п.1, в котором М обозначает метилпиримидинил.
8. Соединение по любому из предыдущих пунктов, в котором R3 обозначает водород.
9. Соединение по п.1, описывающееся формулой (IIA), или его фармацевтически приемлемая соль:

в которой R1 и R2 являются такими, как определено в п.1;
X обозначает N;
R16 обозначает водород;
R17 обозначает водород;
R18 обозначает водород или метил; и
R19 обозначает водород.
10. Соединение по п.9, описывающееся формулой (IIB), или его фармацевтически приемлемая соль:
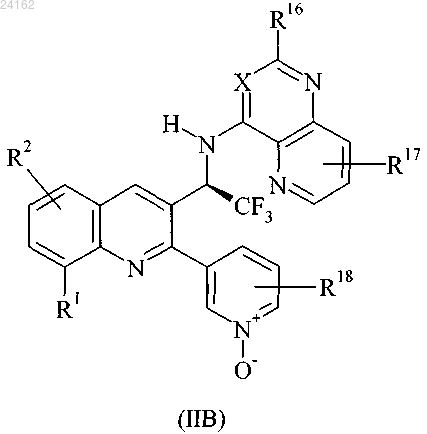
в которой R1 и R2 являются такими, как определено в п.1; и
X, R16, R17 и R18 являются такими, как определено в п.9.
11. Соединение по пп.9, 10, в котором R18 обозначает водород.
12. Соединение по пп.9, 10, в котором R18 обозначает метил.
13. Соединение по п.1, в котором R1 обозначает хлор.
14. Соединение по п.1, в котором R1 обозначает трифторметил.
15. Соединение по любому из предыдущих пунктов, в котором R2 обозначает водород, галоген или C1-С6-алкил.
16. Соединение по п.15, в котором R2 обозначает водород.
17. Соединение, выбранное из группы, включающей
N-{(R)-1-[8-хлор-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламин,
N-{(R)-1-[8-хлор-2-(1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламин,
N-[(R)-1-(8-хлор-2-фенилхинолин-3-ил)-2,2,2-трифторэтил]пиридо[3,2-d]пиримидин-4-иламин,
N-{(R)-1-[8-хлор-2-(4-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламин,
N-{(R)-1-[8-хлор-2-(4-метил-1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламин,
N-{(R)-1-[8-хлор-2-(2-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламин,
N-{(R)-1-[8-хлор-2-(2-метил-1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламин,
N-{(R)-1-[8-хлор-2-(5-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламин,
N-{(R)-1-[8-хлор-2-(5-метил-1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламин,
N-{(R)-1-[8-хлор-2-(пиразин-2-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламин,
N-{(R)-1-[8-хлор-2-(6-метоксипиразин-2-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламин,
N-{(R)-1-[8-хлор-2-(6-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-{(R)-1-[8-хлор-2-(6-метил-1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-{(R)-1-[8-метил-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-{(R)-1-[8-метил-2-(1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-{(R)-l-[7-фтор-8-метил-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-{(R)-1-[7-фтор-8-метил-2-(1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-{(R)-1-[7-фтор-8-метил-2-(2-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-{(R)-1-[7-фтор-8-метил-2-(2-метил-1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-{(R)-1-[7-фтор-8-метил-2-(5-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-{(R)-1-[7-фтор-8-метил-2-(5-метил-1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-{(R)-1-[2-(пиридин-3-ил)-8-(трифторметил)хинолин-3-ил]-2,2,2-грифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-{(R)-1-[2-(1-оксипиридин-3-ил)-8-(трифторметил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-{(R)-1-[2-(6-метилпиридин-3-ил)-5,6,8-трифторхинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-((R)-1-[2-(6-метил-1-оксипиридин-3-ил)-5,6,8-трифторхинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-((R)-1-[8-хлор-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}-N-метилпиридо[3,2-d]пиримидин-4-иламин,
N-{(R)-1-[8-хлор-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}-N-(1-оксипиридо[3,2-d]пиримидин-4-ил)амин,
N-{(R)-1-[8-хлор-2-(1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}-N-(1-оксипиридо[3,2-d]пиримидин-4-ил)амин,
N-{(S)-l-[8-хлор-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламин,
N-{(S)-1-[8-хлор-2-(1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламин,
N-{(R)-1-[2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-{(R)-1-[2-(1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-{(R)-1-[8-хлор-2-(6-хлорпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламин,
N-{(R)-1-[2-(2-метил-1-оксипиридин-3-ил)-8-(трифторметил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-{(R)-1-[8-(метансульфонил)-2-(2-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин,
N-{(R)-1-[8-(метансульфонил)-2-(2-метил-1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин и
N-{(R)-1-[8-(метансульфонил)-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-амин.
18. Фармацевтическая композиция для лечения и/или предупреждения воспалительного, аутоиммунного, сердечно-сосудистого, нейродегенеративного, метаболического, онкологического, ноцицептивного патологического состояния или патологического состояния глаз, включающая соединение формулы (I) по п.1 или его N-оксид или его фармацевтически приемлемую соль совместно с фармацевтически приемлемым носителем.
19. Применение соединения формулы (I) по п.1 или его N-оксида или его фармацевтически приемлемой соли для приготовления лекарственного средства, предназначенного для лечения и/или предупреждения воспалительного, аутоиммунного, сердечно-сосудистого, нейродегенеративного, метаболического, онкологического, ноцицептивного патологического состояния или патологического состояния глаз.
20. Применение соединения формулы (I) по п.1 или его N-оксида или его фармацевтически приемлемой соли для лечения и/или предупреждения воспалительного, аутоиммунного, сердечно-сосудистого, нейродегенеративного, метаболического, онкологического, ноцицептивного патологического состояния или патологического состояния глаз.
21. Способ лечения и/или предупреждения воспалительного, аутоиммунного, сердечно-сосудистого, нейродегенеративного, метаболического, онкологического, ноцицептивного патологического состояния или патологического состояния глаз, который включает введение пациенту, нуждающемуся в таком лечении, соединения формулы (I) по п.1 или его N-оксида или его фармацевтически приемлемой соли в эффективном количестве.
22. N-{(R)-1-[8-[хлор-2-(1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламин.
23. Фармацевтическая композиция для лечения и/или предупреждения воспалительного, аутоиммунного, сердечно-сосудистого, нейродегенеративного, метаболического, онкологического, ноцицептивного патологического состояния или патологического состояния глаз, включающая N-{(R)-1-[8-хлор-2-(1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламин совместно с фармацевтически приемлемым носителем.
24. Применение N-{(R)-1-[8-хлор-2-(1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламина для приготовления лекарственного средства, предназначенного для лечения и/или предупреждения воспалительного, аутоиммунного, сердечно-сосудистого, нейродегенеративного, метаболического, онкологического, ноцицептивного патологического состояния или патологического состояния глаз.
25. Применение N-{(R)-1-[8-хлор-2-(1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламина для лечения и/или предупреждения воспалительного, аутоиммунного, сердечно-сосудистого, нейродегенеративного, метаболического, онкологического, ноцицептивного патологического состояния или патологического состояния глаз.
26. Способ лечения и/или предупреждения воспалительного, аутоиммунного, сердечно-сосудистого, нейродегенеративного, метаболического, онкологического, ноцицептивного патологического состояния или патологического состояния глаз, который включает введение пациенту, нуждающемуся в таком лечении, N-{(R)-1-[8-хлор-2-(1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтил}пиридо[3,2-d]пиримидин-4-иламина в эффективном количестве.
Текст
В заявке описана группа производных хинолина и хиноксалина формулы (I), Партон Эндрью Харри, Али Мезхер Хуссейн, Брукингз Даниел Кристофер,Браун Джулиен Алистэр, Форд Даниел Джеймс, Франклин Ричард Джереми, Лангхем Барри Джон,Ньюсс Джуди Шарлотт, Квинси Джоанна Рейчел (GB) Веселицкая И.А., Кузенкова Н.В.,Веселицкий М.Б., Каксис Р.А.,Белоусов Ю.В., Куликов А.В.,Кузнецова Е.В. (RU) содержащих фторированную этильную боковую цепь, которые являются селективными ингибиторами ферментов киназы PI3 и поэтому полезны для применения в медицине, например,для лечения воспалительных, аутоиммунных, сердечно-сосудистых, нейродегенеративных,метаболических, онкологических, ноцицептивных патологических состояний или патологических состояний глаз. Настоящее изобретение относится к классу производных хинолина и хиноксалина и к их применению в терапии. Точнее, настоящее изобретение относится к производным хинолина и хиноксалина, содержащим фторированную этильную боковую цепь. Эти соединения являются селективными ингибиторами ферментов фосфатидилинозит-3-киназы (PI3K) и поэтому полезны для применения в качестве фармацевтических средств, в особенности для лечения неблагоприятных воспалительных, аутоиммунных,сердечно-сосудистых, нейродегенеративных, метаболических, онкологических, ноцицептивных патологических состояний и патологических состояний глаз. Путь PI3K участвует в различных физиологических и патологических функциях, которые предположительно проявляются при целом ряде заболеваний людей. Так, PI3K обеспечивают сигнал, критически важный для пролиферации клеток, жизнеспособности клеток, переноса через мембраны, переноса глюкозы, разрастания нейритов, активных перемещений в мембране клетки, продуцирования супероксида, перераспределения актина и хемотаксиса (см. S. Ward et al., ChemistryBiology, 2003, 10, 207-213; иS.G. WardP. Finan, Current Opinion in Pharmacology, 2003, 3, 426-434); и известно, что они участвуют в патологии рака, а также в метаболических, воспалительных и сердечно-сосудистых заболеваниях (см. М.Р. Wymann et al., Trends in Pharmacol. Sci., 2003, 24, 366-376). Аберрантная повышенная регуляция пути PI3K участвует в самых различных типах рака человека (см. S. BraderS.A. Eccles, Tumori, 2004,90, 2-8). Поэтому соединения, предлагаемые в настоящем изобретении, являющиеся активными и селективными ингибиторами PI3K, полезны для лечения и/или предупреждения различных заболеваний человека. Они включают аутоиммунные и воспалительные нарушения, такие как ревматоидный артрит, рассеянный склероз, астму, воспалительную болезнь кишечника, псориаз и отторжение трансплантата; сердечно-сосудистые нарушения, включая тромбоз, гипертрофию сердца, гипертензию и нерегулярные сердечные сокращения (например, при сердечной недостаточности); нейродегенеративные нарушения, такие как болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, удар, боковой амиотрофический склероз, повреждение спинного мозга, травма головы и судороги; метаболические нарушения, такие как ожирение и диабет типа 2; онкологические патологические состояния, включая лейкоз, глиобластому,лимфому, меланому и раковые заболевания печени, костей, кожи, головного мозга, поджелудочной железы, легких, молочной железы, желудка, ободочной кишки, прямой кишки, предстательной железы,яичников и шейки матки человека; боли и ноцицептивные нарушения; и нарушения глаз, включая возрастную дегенерацию желтого пятна (ВДЖП). Кроме того, соединения, предлагаемые в настоящем изобретении, могут быть полезны для использования в качестве фармакологических стандартов при разработке новых биологических тестов и при поиске новых фармакологических средств. Так, соединения, предлагаемые в настоящем изобретении,можно использовать в качестве радиолигандов при анализах, предназначенных для обнаружения соединений, способных связываться с ферментами PI3K человека. В WO 2008/118454, WO 2008/118455 и WO 2008/118468 описаны различные серии производных хинолина и хиноксалина, структуры которых являются сходными, и утверждается, что они применимы для ингибирования биологической активности PI3K человека и применимы для лечения патологических состояний и заболеваний, опосредуемых с помощью PI3K. В WO 2009/081105, WO 2010/046639 и находящейся одновременно на рассмотрении WO 2011/058108 (по которой испрашивается приоритет по заявкам на патент Великобритании 0919829.2 и 1012102.8), опубликованной 19 мая 2011 г., описаны отдельные классы производных конденсированных бициклических гетероарилов в качестве селективных ингибиторов ферментов PI3K, которые полезны для лечения неблагоприятных воспалительных, аутоиммунных, сердечно-сосудистых, нейродегенеративных, метаболических, онкологических, ноцицептивных патологических состояний и патологических состояний глаз. Однако до сих пор ни в одной публикации предшествующего уровня техники не раскрыт или предложен класс обладающих определенной структурой производных хинолина и хиноксалина, содержащих фторированную этильную боковую цепь, предлагаемых в настоящем изобретении. Соединения, предлагаемые в настоящем изобретении, являются активными и селективными ингибиторами PI3K, обладающими сродством связывания (IC50) с изоформой PI3K, и/или PI3K, и/илиPI3K, и/или PI3K человека, равным 50 мкМ или менее, в общем случае 20 мкМ или менее, обычно 5 мкМ или менее, в типичном случае 1 мкМ или менее, предпочтительно 500 нМ или менее, в идеальном случае 100 нМ или менее и более предпочтительно 20 нМ или менее (специалист в данной области техники должен понимать, что меньшее значение IC50 означает более активное соединение). Соединения,предлагаемые в настоящем изобретении, могут обладать по меньшей мере 10-кратным селективным сродством, обычно по меньшей мере 20-кратным селективным сродством, предпочтительно по меньшей мере 50-кратным селективным сродством и в идеальном случае по меньшей мере 100-кратным селективным сродством к изоформе PI3K, и/или PI3K, и/или PI3K, и/или PI3K человека по сравнению с другими киназами человека. Соединения, предлагаемые в настоящем изобретении, обладают значительными преимуществами,-1 024162 проявляющимися в их высокой активности и селективности, явной эффективности и ценных фармакокинетических характеристиках (включая клиренс и биологическую доступность). Настоящее изобретение относится к соединению формулы (I) или его N-оксиду или его фармацевтически приемлемой солиZ обозначает пиридопиримидинил-4-ил; М обозначает фенил, пиридинил или пиразинил, каждая из этих групп необязательно может содержать один или большее количество заместителей, независимо выбранных из группы, включающей хлор,метил и метоксигруппу;R4 обозначает водород или C1-С 6-алкил; иR5 обозначает водород. Если для любой группы, содержащейся в соединениях формулы (I), приведенной выше, указано,что она является необязательно замещенной, эта группа может являться незамещенной или содержать один или большее количество заместителей. Обычно такие группы являются незамещенными или содержат 1 или 2 заместителя. Для применения в медицине соли соединений формулы (I) должны быть фармацевтически приемлемыми солями. Однако для получения соединений, предлагаемых в настоящем изобретении, или их фармацевтически приемлемых солей можно использовать другие соли. Подходящие фармацевтически приемлемые соли соединений, предлагаемых в настоящем изобретении, включают соли присоединения с кислотами, которые, например, можно приготовить путем смешивания раствора соединения, предлагаемого в настоящем изобретении, с раствором фармацевтически приемлемой кислоты, такой как хлористоводородная кислота, серная кислота, метансульфоновая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, бензойная кислота, лимонная кислота, винная кислота или фосфорная кислота. Кроме того, если соединения, предлагаемые в настоящем изобретении, содержит кислотный фрагмент, например, карбоксигруппу, то их подходящие фармацевтически приемлемые соли могут включать соли щелочных металлов, например, соли натрия или калия, соли щелочноземельных металлов, например, соли кальция или магния, и соли, образованные с подходящими органическими лигандами, например, четвертичные аммониевые соли. Сольваты соединений формулы (I) можно получить с обычными органическими растворителями,например, углеводородными растворителями, такими как бензол или толуол; хлорированными растворителями, такими как хлороформ или дихлорметан; спиртовыми растворителями, такими как метанол, этанол или изопропанол; простыми эфирными растворителями, такими как диэтиловый эфир или тетрагидрофуран; или сложноэфирными растворителями, такими как этилацетат. Альтернативно, сольваты соединений формулы (I) можно получить с водой и в этом случае они будут являться гидратами. Подходящие алкильные группы, которые могут содержаться в соединениях, предлагаемых в настоящем изобретении, включают обладающие линейной и разветвленной цепью C1-С 6-алкильные группы, например С 1-С 4-алкильные группы. Типичные примеры включают метильную и этильную группы и обладающие линейной или разветвленной цепью пропильную, бутильную и пентильную группы. Предпочтительные алкильные группы включают метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, 2,2-диметилпропил и 3-метилбутил. Являющиеся производными выражения, такие как"С 1 С 6 алкиламиногруппа", образуются соответствующим образом. Термин "галоген" при использовании в настоящем изобретении включает атомы фтора, хлора, брома и йода, обычно фтора, хлора или брома. Если соединения формулы (I) содержат один или большее количество асимметрических центров, то они могут существовать в виде соответствующих энантиомеров. Если соединения, предлагаемые в настоящем изобретении, содержат два или большее количество асимметрических центров, то они также могут существовать в виде диастереоизомеров. Следует понимать, что настоящее изобретение включает все такие энантиомеры и диастереоизомеры и их смеси в любом соотношении, включая рацематы. Фор-2 024162 мула (I) и формулы, приведенные ниже в настоящем изобретении, включают все отдельные стереоизомеры и все их возможные смеси, если не указано или не представлено иное. Кроме того, соединения формулы (I) могут существовать в виде таутомеров, например таутомеров кетон (СН 2 С=О)енол(СН=СНОН) или таутомеров амид (МНС=О)гидроксиимин (N=COH). Формула (I) и формулы, приведенные ниже в настоящем изобретении, включают все отдельные таутомеры и все их возможные смеси,если не указано или не представлено иное. Предпочтительно, если абсолютная стереохимическая конфигурация соединений формулы (I), приведенной выше, является такой, как представлено в формуле (I-1) в которой U, Q, Z, M, W, R1, R2 и R3 являются такими, как определено выше. В выбранном варианте осуществления, в котором U обозначает -CF3, предпочтительные соединения формулы (I), определенной выше, включают такие, в которых атом углерода, к которому непосредственно присоединены фрагменты -Q-Z и -CF3, обладает (R)-конфигурацией. Следует понимать, что каждый отдельный атом, содержащийся в формуле (I) или в формулах,представленных ниже в настоящем изобретении, в действительности может содержаться в форме любого из его изотопов, встречающихся в природе, причем наиболее часто встречающийся изотоп (изотопы) является предпочтительным. Так, например, каждый отдельный атом водорода, содержащийся в формуле (I) или в формулах, представленных ниже в настоящем изобретении, может содержаться в виде атома 1 Н, 2 Н (дейтерий) или 3 Н (тритий), предпочтительно в виде 1 Н. Аналогичным образом, например, каждый отдельный атом углерода, содержащийся в формуле (I) или в формулах, представленных ниже в настоящем изобретении, может содержаться в виде атома 12 С, 13 С или 14 С, предпочтительно в виде 12 С. Конкретные подклассы соединений, предлагаемых в настоящем изобретении, представлены соединениями формулы (IA) в которой U, Q, Z, M, R1, R2, R3 и R5 являются такими, как определено выше. Предпочтительно, если абсолютная стереохимическая конфигурация соединений формулы (IA),приведенной выше, является такой, как представлено в формуле (IA-1) в которой U, Q, Z, M, R1, R2, R3 и R5 являются такими, как определено выше. В выбранном варианте осуществления, в котором U обозначает -CF3, предпочтительные соединения формул (IA) и (IB), определенных выше, включают такие, в которых атом углерода, к которому непосредственно присоединены фрагменты -Q-Z и -CF3, обладает (R)-конфигурацией. В предпочтительном варианте осуществления М обозначает пиридинил. В предпочтительном воплощении этого варианта осуществления М обозначает пиридин-3-ил. В другом варианте осуществления М обозначает метилпиридинил. В предпочтительном воплощении этого варианта осуществления М обозначает 2-метилпиридин-3-ил. Предпочтительно, если R1, R2 и R3 независимо обозначают водород, фтор, хлор, бром, метил, этил,трифторметил, метилсульфонил. Предпочтительно, если R1 обозначает водород, галоген, C1-С 6-алкил, трифторметил или C1-С 6-алкилсульфонил. В одном варианте осуществления R1 обозначает водород. В другом варианте осуществления R1 обозначает галоген, предпочтительно фтор или хлор. В одном воплощении этого варианта осуществления R1 обозначает фтор. В другом воплощении этого варианта осуществления R1 обозначает хлор. В другом варианте осуществления R1 обозначает С 1-С 6-алкил, предпочтительно метил или этил. В одном воплоще-3 024162 нии этого варианта осуществления R1 обозначает метил. В другом воплощении этого варианта осуществления R1 обозначает этил. В другом варианте осуществления R1 обозначает трифторметил. В другом варианте осуществления R1 обозначает С 1-С 6-алкилсульфонил. В одном воплощении этого варианта осуществления R1 обозначает метилсульфонил. Предпочтительно, если R2 обозначает водород, галоген или C1-С 6-алкил. Обычно R2 обозначает водород или галоген. В одном варианте осуществления R2 обозначает водород. В другом варианте осуществления R2 обозначает галоген, предпочтительно фтор или хлор. В одном воплощении этого варианта осуществления R2 обозначает фтор. В другом воплощении этого варианта осуществления R2 обозначает хлор. В другом варианте осуществления R2 обозначает C1-С 6-алкил. В одном воплощении этого варианта осуществленияR2 обозначает метил. Предпочтительно, если R3 обозначает водород или галоген. Обычно R3 обозначает водород. В одном варианте осуществления R3 обозначает водород. В другом варианте осуществления R3 обозначает галоген. В одном воплощении этого варианта осуществления R3 обозначает фтор. В предпочтительном варианте осуществления R2 и R3 оба обозначают водород. В одном варианте осуществления R4 обозначает водород. В другом варианте осуществления R4 обозначает С 1-С 6-алкил, предпочтительно метил. Предпочтительные значения группы R4 включают водород и метил. В выбранном варианте осуществления настоящее изобретение относится к N-оксидному производному соединения формулы (I), определенной выше, или к его фармацевтически приемлемой соли. Один подкласс соединений, предлагаемых в настоящем изобретении, представлен соединениями формулы (IIA) и их фармацевтически приемлемыми солямиR18 обозначает водород или метил; иR19 обозначает водород. Предпочтительная подгруппа соединений формулы (IIA), приведенной выше, представлена соединениями формулы (IIB) и их фармацевтически приемлемыми солями в которой R1, R2, X, R16, R17 и R18 являются такими, как определено выше. Предпочтительные новые соединения, предлагаемые в настоящем изобретении, включают все соединения, получение которых описано в прилагающихся примерах, и их фармацевтически приемлемые соли. Настоящее изобретение также относится фармацевтической композиции, которая включает соединение, предлагаемое в настоящем изобретении, определенное выше, или его фармацевтически приемлемую соль, совместно с одним или большим количеством фармацевтически приемлемых носителей. Фармацевтические композиции, предлагаемые в настоящем изобретении, могут находиться в форме, пригодной для перорального, трансбуккального, парентерального, назального, местного, глазного или ректального введения, или в форме, пригодной для введения путем ингаляции или вдувания. Фармацевтические композиции, предназначенные для перорального введения, могут находиться,например, в форме таблеток, лепешек или капсул, приготовленных по обычным методикам с использованием фармацевтически приемлемых инертных наполнителей, таких как связующие (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); разрыхлители(например, картофельный крахмал или натриевая соль гликолята крахмала); или смачивающие агенты(например, лаурилсульфат натрия). На таблетки можно нанести покрытия по методикам, хорошо известным в данной области техники. Жидкие препараты, предназначенные для перорального введения, могут находиться, например, в форме растворов, сиропов или суспензий или они могут представлять собой сухой препарат, предназначенный для проводимого перед использованием восстановления водой или другим подходящим разбавителем. Такие жидкие препараты можно приготовить по обычным методикам с использованием фармацевтически приемлемых добавок, таких как суспендирующие агенты, эмульгирующие агенты, неводные растворители или консерванты. Эти препараты также могут содержать соли,оказывающее буферное воздействие, вкусовые добавки, красители или подсластители, если это является целесообразным. Препараты, предназначенные для перорального введения, можно готовить в таком виде, чтобы обеспечить регулируемое высвобождение активного соединения. Композиции, предназначенные для трансбуккального введения, могут находиться, например, в форме таблеток или лепешек, приготовленных обычным образом. Соединения формулы (I) можно приготовить для парентерального введения путем инъекции, например инъекции ударной дозы вещества или путем вливания. Препараты для инъекции могут поставляться в разовой дозированной форме, например, в стеклянных ампулах или содержащих множество доз контейнерах, например, в стеклянных флаконах. Композиции для инъекции могут находиться в таких формах, как суспензии, растворы или эмульсии в масле или водных разбавителях и могут содержать применяющиеся для приготовления препаратов средства, такие как суспендирующие, стабилизирующие,консервирующие и/или диспергирующие средства. Альтернативно, активный ингредиент может находиться в порошкообразной форме для проводимого перед применением восстановления с помощью подходящего разбавителя, например, стерильной апирогенной воды. В дополнение к препаратам, описанным выше, соединения формулы (I) также можно приготовить в виде препаратов-депо. Такие препараты пролонгированного действия можно вводить путем имплантации или внутримышечной инъекции. В случае назального введения или введения путем ингаляции соединения, предлагаемые в настоящем изобретении, обычным образом можно приготовить в виде материалов для распыления с использованием в упаковках под давлением или устройствах типа небулайзер с применением подходящего пропеллента, например дихлордифторметана, фтортрихлорметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа или смеси газов. При необходимости композиции можно использовать в упаковке или дозирующем устройстве, которое может включать одну или большее количество разовых дозированных форм, содержащих активный ингредиент. К упаковке или дозирующему устройству могут прилагаться инструкции по введению. В случае местного введения соединения, предназначенные для использования настоящем изобретении, обычным образом можно приготовить в виде подходящей мази, содержащей активный компонент,суспендированный или растворенный в одном или большем количестве фармацевтически приемлемых носителей. Предпочтительные носители включают, например, минеральное масло, жидкие нефтепродукты, пропиленгликоль, полиоксиэтилен, полиоксипропилен, эмульгирующийся воск и воду. Альтернативно, соединения, предназначенные для использования настоящем изобретении, можно приготовить в виде подходящего лосьона, содержащего активный компонент, суспендированный или растворенный в одном или большем количестве фармацевтически приемлемых носителей. Предпочтительные носители включают, например, минеральное масло, сорбитанмоностеарат, полисорбат 60, воск на основе цетиловых эфиров, цетеариловый спирт, бензиловый спирт, 2-октилдодеканол и воду. В случае введения в глаза соединения, предназначенные для использования настоящем изобретении, обычным образом можно приготовить в виде тонкоизмельченных суспензий в изотоническом, обладающем необходимым значением рН стерильном физиологическом растворе, без добавления или с добавлением консерванта, такого как бактерицидное или фунгицидное средство, например, фенилмеркурнитрат, бензилалконийхлорид или хлоргексидинацетат. Альтернативно, в случае введения в глаза соединения можно приготовить в виде мази, такой как на основе вазелинового масла. В случае ректального введения соединения, предназначенные для использования настоящем изобретении, обычным образом можно приготовить в виде суппозиториев. Их можно приготовить путем смешивания активного компонента с подходящим, не оказывающим раздражающего воздействия инертным наполнителем, который является твердым при комнатной температуре, но жидким при ректальной температуре и поэтому плавится в прямой кишке с высвобождением активного компонента. Такие веще-5 024162 ства включают, например, масло какао, пчелиный воск и полиэтиленгликоли. Количество соединения, предназначенного для использования настоящем изобретении, необходимое для профилактики или лечения конкретного патологического состояния, будет меняться в зависимости от выбранного соединения и состояния подвергающегося лечению пациента. Однако обычно суточные дозы могут составлять примерно от 10 нг/кг до 1000 мг/кг, обычно от 100 нг/кг до 100 мг/кг, например, примерно от 0,01 до 40 мг/(кг массы тела) при пероральном или трансбуккальном введении, от примерно 10 нг/кг до 50 мг/(кг массы тела) при парентеральном введении и от примерно 0,05 мг до примерно 1000 мг, например, от примерно 0,5 до примерно 1000 мг, при назальном введении или введении путем ингаляции или вдувания. Соединения формулы (I), приведенной выше, в которой Q обозначает N-R4, можно получить по методике, которая включает реакцию соединения формулы L1-Z с соединением формулы (III) в которой Q1 обозначает N-R4, L1 обозначает подходящую отщепляющуюся группу и U, Z, M, W,R , R , R3 и R4 являются такими, как определено выше. Отщепляющаяся группа L1 обычно обозначает атом галогена, например хлор. Альтернативно, отщепляющейся группой L1 может являться 2,5-диоксопирролидин-1-илоксигруппа. Реакцию обычно проводят при повышенной температуре в подходящем растворителе, например в хлорированном растворителе, таком как дихлорметан или хлороформ, или растворителе - нитриле, таком как ацетонитрил. Реакцию можно проводить необязательно в присутствии ускорителя реакции, такого как 4-(диметиламино)пиридин или п-толуолсульфоновая кислота. Альтернативно, реакцию можно проводить при повышенной температуре в подходящем растворителе, например тетрагидрофуран, н-бутанол, 1-метил-2-пирролидинон (NMP) или 1,4-диоксан, обычно в присутствии подходящего основания, например органического основания, такого как N,N-диизопропилэтиламин. Промежуточные продукты формулы (III), в которой Q1 обозначает NH и U обозначает -CF3, можно получить по трехстадийной методике, которая включает (i) обработку подходящего соединения формулы в которой М, W, R1, R2 и R3 являются такими, как определено выше; 2-метил-2-пропансульфинамидом в присутствии изопропоксида титана(IV) или фосфата калия; (ii) реакцию полученного соединения с (трифторметил)триметилсиланом в присутствии дифтортрифенилсиликата тетрабутиламмония или ацетата тетрабутиламмония; и (iii) обработку полученного соединения неорганической кислотой, например, хлористо-водородной кислотой. Промежуточные продукты формулы (IV) можно получить по реакции соединения формулы М-Т 1 с соединением формулы (V) в которой L2 обозначает подходящую отщепляющуюся группу, Т 1 обозначает фрагмент бороновой кислоты -В(ОН)2 или ее циклического эфира, образованного с органическим диолом, например, пинаконом, 1,3-пропандиолом или неопентилгликолем, или Т 1 обозначает -Sn(Alk1)3, где Alk1 обозначает С 1-С 6 алкильную группу, обычно н-бутил, или Т 1 обозначает -В(Alk2)2, где Alk2 обозначает C1-С 6-алкильную группу, обычно этил, и М, W, R1, R2 и R3 являются такими, как определено выше; в присутствии катализатора на основе переходного металла. Отщепляющаяся группа L2 обычно обозначает атом галогена, например хлор. Катализатором на основе переходного металла предпочтительно является тетракис(трифенилфосфин)палладий(0), в этом случае реакцию обычно проводят при повышенной температуре в подходящем растворителе, например в эфирном растворителе, таком как диметиловый эфир этиленгликоля или 1,4 диоксан, обычно в присутствии карбоната натрия или бикарбоната натрия. Альтернативно, промежуточные продукты формулы (IV) можно получить путем обработки соединения формулы (VI) в котором Ra обозначает C1-С 6-алкил, например этил, и М, W, R1, R2 и R3 являются такими, как определено выше; восстановительным реагентом, например диизобутилалюминийгидридом (DIBAL-H); с последующей обработкой полученного таким образом соединения окислительным реагентом, таким как диоксид марганца. Промежуточные продукты формулы (VI), в которой W обозначает СН, можно получить по реакции соединения формулы (VII) с соединением формулы (VIII) в которой М, R1, R2, R3 и Ra являются такими, как определено выше, и Hal обозначает галоген, например бром или йод; в присутствии катализатора на основе переходного металла, например ацетата палладия(II); с последующей обработкой полученного таким образом соединения окислительным реагентом, таким как диоксид марганца. Промежуточные продукты формулы (VIII) можно получить по реакции соединения формулы МСНО с соединением формулы (IX) в которой М и Ra являются такими, как определено выше. Реакцию обычно проводят в присутствии основания, в идеальном случае органического основания,такого как 1,4-диазабицикло[2.2.2]октан (ДАБЦО). По другой методике промежуточные продукты формулы (IV), в которой W обозначает СН, можно получить по реакции соединения формулы М-СН=СН-СНО с соединением формулы (X) в которой М, R1, R2 и R3 являются такими, как определено выше; в присутствии основания, например 2,5-диметилпирролидина; с последующей обработкой полученного таким образом соединения окислительным реагентом, таким как диоксид марганца. В одной модификации этого подхода промежуточные продукты формулы (III), в которой Q1 обозначает NH и U обозначает -CF3, можно получить по четырехстадийной методике, которая включает: (i) обработку подходящего соединения формулы (V), определенной выше, 2-метил-2-пропансульфинамидом в присутствии изопропоксида титан(IV) или фосфата калия; (ii) реакцию полученного соединения с соединением формулы М-Т 1, при условиях, аналогичных описанным выше для реакции соединения МТ 1 и соединения (V); (iii) реакцию полученного соединения с (трифторметил)триметилсиланом в присутствии дифтортрифенилсиликата тетрабутиламмония или ацетата тетрабутиламмония и (iv) обработку полученного соединения неорганической кислотой, например хлористо-водородной кислотой. Если они не имеются в продаже, исходные вещества формулы (V), (VII), (IX) и (IX) можно получить по методикам, аналогичным описанным в прилагающихся примерах или по стандартным методикам, хорошо известным в данной области техники. Следует понимать, что любое соединение формулы (I), первоначально полученное по любой из приведенных выше методик, затем можно, если это является целесообразным, превратить в другое соединение формулы (I) по методикам, известным в данной области техники. В качестве примера, соединение формулы (I), в которой М обозначает пиридинил, можно превратить в соответствующее соединение, в котором М обозначает пиридин-N-оксидный фрагмент, путем обработки подходящим окислительным реагентом, например 3-хлорпероксибензойной кислотой. Аналогичным образом, соединение формулы (I), в котором Z обозначает пиридопиримидинил, можно превратить в соответствующее соединение, в котором Z обозначает пиридопиримидин-N-оксидный фрагмент, путем обработки подходящим окислительным реагентом, например 3-хлорпероксибензойной кислотой. Соединение формулы (I), в которой R4 обозначает водород, можно превратить в соответствующее соединение, в котором R4 обозначает C1-С 6-алкил, например метил, путем обработки подходящим алкилирующим реагентом, например метилирующим реагентом, таким как йодметан, обычно в присутствии основания, такого как гидрид натрия. Если при использовании любой из описанных выше методик получения соединений, предлагаемых в настоящем изобретении, образуется смесь продуктов, то искомый продукт можно из нее выделить на подходящей стадии с помощью обычных методик, таких как препаративная ВЭЖХ (высокоэффективная жидкостная хроматография) или колоночная хроматография с использованием, например, диоксида кремния и/или оксида алюминия вместе с подходящей системой растворителей. Если при использовании описанных выше методик получения соединений, предлагаемых в настоящем изобретении, образуется смесь стереоизомеров, то эти изомеры можно разделить по обычным методикам. В частности, когда необходимо получить конкретный энантиомер соединения формулы (I), то его можно получить из соответствующей смеси энантиомеров по любой обычной методике разделения энантиомеров. Так, например, диастереоизомерные производные, например, соли можно получить по реакции смеси энантиомеров формулы (I), например, рацемата с соответствующим хиральным соединением,например, хиральным основанием. Затем диастереоизомеры можно разделить по любым обычным методикам, например, путем кристаллизации и выделить необходимый энантиомер, например, путем обработки кислотой, если диастереоизомер является солью. В другой методике разделения рацемат формулы(I) можно разделить с помощью хиральной ВЭЖХ. Кроме того, при необходимости конкретный энантиомер можно получить путем использования подходящего хирального промежуточного продукта в одной из методик, описанных выше. Альтернативно, конкретный энантиомер можно получить путем проведения энантиомерно специфического биологического превращения, например, гидролиза сложного эфира с использованием эстеразы с последующей очисткой только энантиомерно чистой образовавшейся вследствие гидролиза кислоты от непрореагировавшего антипода - сложного эфира. Если необходимо получить конкретный геометрический изомер, предлагаемый в настоящем изобретении, то для промежуточных продуктов или конечных продуктов можно использовать хроматографию, перекристаллизацию и другие обычные методики разделения. В ходе проведения любой из указанных выше последовательностей синтеза может оказаться необходимой и/или желательной защита чувствительных или реакционноспособных групп в любой из участвующих в реакциях молекул. Это можно выполнить с помощью обычных защитных групп, таких как описанные в публикациях Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Press, 1973; и T.W. GreeneP.G.M. Wuts, Protective Groups in Organic Synthesis, John WileySons, 3rd edition, 1999. Защитные группы можно удалить на любой подходящей последующей стадии по методикам, известным в данной области техники. Приведенные ниже примеры иллюстрируют получение соединений, предлагаемых в настоящем изобретении. Соединения, предлагаемые в настоящем изобретении, эффективно ингибируют активность PI3K,и/или PI3K, и/или PI3K, и/или PI3K человека. Исследования ингибирования ферментов Исследование способности соединений ингибировать активность липидкиназы четырех изоформ киназы PI3 (, ,и ) класса 1 проводили с использованием имеющегося в продаже набора для анализа на основе однородной флуоресценции с разрешением по времени, как описано в публикации Gray et al.,Anal. Biochem., 2003, 313, 234-245, в соответствии с инструкциями изготовителя (Upstate). Все исследования проводили при концентрации АТФ (аденозинтрифосфат), равной 2 мкМ, и концентрации очищенной киназы PI3 класса 1, соответствующей достаточной для образования продукта в линейном диапазоне анализа. Разведения ингибитора в ДМСО добавляли к исследуемой смеси и сравнивали с исследуемыми смесями в присутствии 2% (об./об.) только ДМСО (100% активность). IC50 означала концентрацию ингибитора, необходимую для ингибирования активности фермента на 50%. При исследовании по описанной выше методике установлено, что все соединения, приведенные в прилагающихся примерах, обладают значениями IC50 для ингибирования активности PI3K, и/или Промежуточный продукт 1 8-Хлор-2-(пиридин-3-ил)хинолин-3-карбальдегид Смесь 2,8-дихлорхинолин-3-карбальдегида (5,0 г, 22,2 ммоль), Na2CO3 (3,51 г, 33,2 ммоль) и 3 пиридилбороновой кислоты (2,72 г, 22,2 ммоль) в ДМЭ (60 мл) и воде (30 мл) дегазировали путем пропускания через смесь N2 в течение 5 мин. Добавляли Pd(PPh3)4 (1,28 г, 1,11 ммоль) и смесь нагревали при 90 С в течение 7 ч. Смеси давали охладиться до комнатной температуры. Полученный осадок отфильтровывали и промывали водой (550 мл) и диэтиловым эфиром (550 мл) и получали искомое соединение(5,4 г, 91%) в виде желтовато-коричневого твердого вещества. H (ДМСО-d6) 10,15 (s, 1H), 9,15 (s, 1H),8,94 (dd, J 2,3, 0,8 Гц, 1H), 8,77 (dd, J 4,9, 1,7 Гц, 1 Н), 8,31(dd, J 8,3, 1,3 Гц, 1 Н), 8,20-8,19 (m, 1 Н), 8,188,16 (m, 1 Н), 7,75 (dd, J 7,9, 7,5 Гц, 1 Н), 7,62 (ddd, J 7,7, 4,9, 0,8 Гц, 1 Н). ЖХМС (ЭР+) 269 (М+Н)+, ВУ 1,82 мин. Альтернативная методика К раствору никотинового альдегида (10,0 г, 93,4 ммоль) в этилакрилате (20 мл, 200 ммоль) при комнатной температуре добавляли ДАБЦО (0,5 г, 4,5 ммоль) и смесь перемешивали в течение ночи. Избыток этилакрилата удаляли в вакууме и получали неочищенное твердое вещество. Это вещество промывали гексаном и получали этиловый эфир 2-[(гидрокси)(пиридин-3-ил)метил]акриловой кислоты (18,5 г, 95%) в виде почти белого твердого вещества. H (CDCl3) 8,62 (d, J 1,7 Гц, 1 Н), 8,53 (dd, J 4,8, 1,3 Гц,1H), 7,81 (d, J 7,9 Гц, 1H), 7,28 (s, 1H), 6,42 (s, 1H), 5,93 (s, 1H), 5,63 (s, 1H), 4,18 (m, 2H), 3,20 (br, 1H),1,27 (t, J 7,1 Гц, 3 Н). ЖХМС (ЭР+) 208,2 (M+H)+. Дегазированную смесь этилового эфира 2-[(гидрокси)(пиридин-3-ил)метил]акриловой кислоты (8,2 г, 39,6 ммоль), 6-хлор-2-йоданилина (10,0 г, 39,5 ммоль), триэтиламина (9 мл, 122 ммоль) и ацетата палладия(II) (300 мг) в ацетонитриле (80 мл) нагревали при 70 С в течение ночи. Смесь охлаждали до комнатной температуры и подвергали распределению между этилацетатом (200 мл) и водой (100 мл). Водный слой отделяли и органический слой промывали рассолом (50 мл), фильтровали, сушили (с помощью устройства для разделения фаз) и концентрировали в вакууме и получали неочищенное твердое вещество. Это вещество промывали минимальным количеством охлажденного льдом диэтилового эфира и получали этиловый эфир 8-хлор-2-(пиридин-3-ил)-1,4-дигидрохинолин-3-карбоновой кислоты (10,8 г, 87%) в виде белого твердого вещества. H (CDCl3) 8,73 (m, 2 Н), 8,04 (m, 1H), 7,66 (dd, J 7,9, 5,5 Гц, 1H), 7,18(M+H)+. Суспензию этилового эфира 8-хлор-2-(пиридин-3-ил)-1,4-дигидрохинолин-3-карбоновой кислоты(10,7 г, 34 ммоль) в хлорбензоле (60 мл) обрабатывали с помощью MnO2 (10 г) и смесь нагревали при 60 С в течение 3 ч. Смесь фильтровали через слой целита и концентрировали в вакууме. Остаток промывали диэтиловым эфиром и получали этиловый эфир 8-хлор-2-(пиридин-3-ил)хинолин-3-карбоновой кислоты (8,4 г, 79%) в виде белого твердого вещества. H (CDCl3) 8,96 (d, J 1,7 Гц, 1 Н), 8,83 (s, 1H), 8,75 (dd,J 5,0, 1,1 Гц, 1 Н), 8,27 (dt, J 7,9, 1,7 Гц, 1 Н), 8,00 (dd, J 7,5, 1,0 Гц, 1 Н), 7,92 (dd, J 8,2, 1,0 Гц, 1 Н), 7,60 (m,2H), 4,32 (q, J 7,1 Гц, 2H), 1,24 (t, J 7,1 Гц, 3 Н). ЖХМС (ЭР+) 313,2 (M+H)+. К суспензии этилового эфира 8-хлор-2-(пиридин-3-ил)хинолин-3-карбоновой кислоты (1,0 г, 3,2 ммоль) в толуоле при -78 С в течение 10 мин по каплям добавляли раствор DIBAL-H (10 мл, 1 М раствор в ДХМ). Смесь перемешивали при этой температуре в течение 2 ч, затем реакцию останавливали путем добавления насыщенного водного раствора соли Рошеле (5 мл). После нагревания до комнатной темпе-9 024162 ратуры добавляли дополнительное количество раствора соли Рошеле (5 мл). Полученное твердое вещество отфильтровывали, промывали на фильтре из пористого стекла водным раствором NaOH (2 н.) и водой, и сушили и получали [8-хлор-2-(пиридин-3-ил)хинолин-3-ил]метанол (860 мг, количественный выход) в виде бежевого твердого вещества. H (ДМСО-d6) 8,92 (d, J 1,7 Гц, 1 Н), 8,73 (dd, J 4,8, 1,6 Гц, 1H),8,61 (s, 1H), 8,17 (dt, J 7,9, 1,9 Гц, 1 Н), 8,09 (dd, J 8,2, 1,1 Гц, 1 Н), 7,97 (dd, J 7,5, 1,2 Гц, 1 Н), 7,63 (m, 1H),7,58 (ddd, J 7,8, 4,8, 0,6 Гц, 1H), 5,76 (s, 1H), 5,62 (t, J 5,2 Гц, 1 Н), 4,68 (d, J 4,9 Гц, 2H). ЖХМС (ЭР+) 271,0(M+H)+. Смесь [8-хлор-2-(пиридин-3-ил)хинолин-3-ил]метанола (0,6 г, 2,2 ммоль) и MnO2 (1,0 г) в хлорбензоле (30 мл) нагревали при 70 С в течение ночи, фильтровали через слой целита, концентрировали в вакууме и промывали с помощью ДХМ и получали искомое соединение (510 мг, 86%) в виде белого твердого вещества. Промежуточный продукт 2N-[8-Хлор-2-(пиридин-3-ил)хинолин-3-ил]мет-(Е)-илиденамид 2-метилпропан-2(S)-сульфиновой кислоты Изопропоксид титана(IV) (3,17 г, 11,2 ммоль) добавляли к суспензии промежуточного продукта 1(1,5 г, 5,58 ммоль) в безводном ТГФ (30 мл). Смесь перемешивали при КТ в течение 10 мин. Добавляли(S)-2-метил-2-пропансульфинамид (0,74 г, 6,14 ммоль) и смесь перемешивали при 50 С в течение 3 ч. Реакционной смеси давали охладиться до КТ, затем ее выливали в рассол (50 мл) и фильтровали через целит, промывая с помощью EtOAc. Фильтрат промывали рассолом, сушили (Na2SO4) и концентрировали в вакууме. Очистка с помощью колоночной хроматографии (SiO2, 40-100% EtOAc в гексане) давала искомое соединение (1,88 г, 91%) в виде желтовато-коричневого твердого вещества. H (ДМСО-d6) 9,20(R)-1-[8-Хлор-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламид 2-метилпропан-2(S)-сульфиновой кислоты Смесь промежуточного продукта 2 (2,24 г, 6,03 ммоль) и дифтортрифенилсиликата тетрабутиламмония (3,58 г, 6,64 ммоль) в безводном ТГФ (40 мл) охлаждали до -40 С. Добавляли (трифторметил)триметилсилан (1,03 г, 7,24 ммоль) и смесь перемешивали при -40 С в течение 1 ч. Добавляли насыщенный водный раствор хлорида аммония (5 мл) и реакционной смеси давали нагреться до КТ. Растворитель удаляли в вакууме и остаток подвергали распределению между EtOAc и водой. Водную фазу экстрагировали дополнительным количеством EtOAc и объединенные органические фракции промывали рассолом, затем сушили (Na2SO4) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 40-100% EtOAc в гексане) и получали искомое соединение (1,78 г, 67%) в виде желтого смолообразного вещества. H (ДМСО-d6) 9,02 (s, 1 Н), 8,80 (dd, J 4,9, 1,7 Гц, 1 Н), 8,78 (dd, J 2,3,0,6 Гц, 1 Н), 8,15-8,09 (m, 2 Н), 8,04-7,99 (m, 1 Н), 7,77-7,71 (m, 1 Н), 7,67 (ddd, J 7,9, 4,9, 0,8 Гц, 1H), 6,65 (d,J 8,5 Гц, 1 Н), 5,12-5,00 (m, 1 Н), 1,15 (s, 9 Н). ЖХМС (ЭР+) 442 (М+Н)+, ВУ 2,39 мин. Промежуточный продукт 4(R)-1-[8-Хлор-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламин К раствору промежуточного продукта 3 (1,78 г, 4,04 ммоль) в метаноле (20 мл) добавляли 4 н. раствор HCl в 1,4-диоксане (4 мл, 16,0 ммоль). Смесь перемешивали при КТ в течение 1 ч. Растворитель удаляли в вакууме и остаток растирали с диэтиловым эфиром (2). Затем остаток подвергали распределению между ДХМ и насыщенным водным раствором NaHCO3. Водную фазу экстрагировали дополнительным количеством ДХМ и объединенные органические фракции промывали рассолом, затем сушили(Na2SO4) и выпаривали в вакууме и получали искомое соединение (1,28 г, 94%) в виде желтого смолообразного вещества. H (ДМСО-d6) 8,92 (s, 1H), 8,82 (d, J 2,1 Гц, 1 Н), 8,76 (dd, J 4,9, 1,5 Гц, 1H), 8,13-8,09(М+Н)+, ВУ 2,01 мин. Промежуточный продукт 5 8-Хлор-2-фенилхинолин-3-карбальдегид Смесь 2,8-дихлорхинолин-З-карбальдегида (2,0 г, 8,85 ммоль), 2 М водного раствора Na2CO3 (8 мл),фенилбороновой кислоты (1,5 г, 12,3 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,25 г, 0,216 ммоль) в ДМЭ (30 мл) дегазировали и смесь нагревали при 110 С в течение 4 ч. Смеси давали охладиться до комнатной температуры, ее разбавляли с помощью EtOAc и промывали рассолом. Органический слой сушили (MgSO4) и растворитель удаляли при пониженном давлении. Полученное твердое вещество растирали с эфиром, отфильтровывали, промывали небольшим количеством эфира, затем петролейным эфиром и сушили и получали искомое соединение (2,3 г, 97%) в виде почти белого твердого вещества. HN-(8-Хлор-2-фенилхинолин-3-ил)мет-(Е)-илиденамид 2-метилпропан-2(S)-сульфиновой кислоты При перемешивании изопропоксид титана(IV) (5,1 мл, 17,24 ммоль) добавляли к раствору промежуточного продукта 5 (2,3 г, 8,6 ммоль) в безводном ТГФ (35 мл). Смесь перемешивали при КТ в течение 10 мин, затем добавляли (S)-2-метил-2-пропансульфинамид (1,15 г, 9,5 ммоль) и смесь перемешивали при 50 С в течение 5,5 ч. Нагревание прекращали и реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду со льдом и смесь перемешивали в течение 10 мин, разбавляли с помощью EtOAc и фильтровали через целит, промывая с помощью EtOAc. Затем фильтрат промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Неочищенное твердое вещество растирали с эфиром, затем отфильтровывали, промывали эфиром и сушили и получали искомое соединение(2,45 г, 77%) в виде белого твердого вещества. H (ДМСО-d6) 9,14 (s, 1H), 8,61 (s, 1H), 8,27 (dd, J 4,9, 1,7 Гц, 1 Н), 8,10 (dd, J 8,3, 1,1 Гц, 1H), 7,59-7,69 (m, 6H), 1,24 (s, 9H). ЖХМС (ЭР+) 371 (М+Н)+, ВУ 2,1 мин. Промежуточный продукт 7[(R)-1-(8-Хлор-2-фенилхинолин-3-ил)-2,2,2-трифторэтил]амид 2-метилпропан-2(S)-сульфиновой кислоты Смесь промежуточного продукта 6 (2,45 г, 6,61 ммоль) и дифтортрифенилсиликата тетрабутиламмония (3,93 г, 7,28 ммоль) в безводном ТГФ (30 мл) охлаждали до -70 С. По каплям добавляли (трифторметил)триметилсилан (1,2 мл, 8,13 ммоль) и смесь перемешивали в течение 2 ч, давая температуре медленно повыситься. ЖХМС показывала, что небольшое количество исходного вещества не вступило в реакцию, поэтому смесь повторно охлаждали до -70 С и добавляли еще (трифторметил)триметилсилан(0,5 мл, 3,39 ммоль). Смесь перемешивали в течение еще 2 ч, давая температуре медленно повыситься до 0 С. Добавляли насыщенный водный раствор хлорида аммония (0,5 мл) и реакционной смеси давали нагреваться до комнатной температуры. Реакционную смесь дважды экстрагировали с помощью EtOAc,затем сушили (MgSO4) и растворитель выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 10-60% EtOAc в гексане) и получали искомое соединение (1,7 г, 58%) в виде бледно-желтого смолообразного вещества. H (ДМСО-d6) 8,98 (s, 1H), 8,04-8,11 (m, 2 Н), 7,56-7,73 (m, 6 Н),6,59 (d, J 8,63 Гц, 1 Н), 5,09-5,75 (m, 1 Н), 1,16 (s, 9 Н). ЖХМС (ЭР+) 441 (М+Н)+, ВУ 2,06 мин. Промежуточный продукт 8(R)-1-(8-Хлор-2-фенилхинолин-3-ил)-2,2,2-трифторэтиламин К раствору промежуточного продукта 7 (0,75 г, 1,7 ммоль) в ДХМ (2 мл) добавляли 4 н. растворHCl в 1,4-диоксане (10 мл). Смесь перемешивали при КТ в течение 20 мин. Растворитель удаляли в вакууме и затем остаток подвергали распределению между ДХМ и насыщенным водным раствором NaHCO3. Водную фазу экстрагировали дополнительным количеством ДХМ и объединенные органические фракции сушили (MgSO4) и выпаривали в вакууме и получали искомое соединение (0,55 г, 96%) в виде желтого вспененного вещества, которое использовали без дополнительной очистки. ЖХМС (ЭР+) 337N-(2,8-Дихлорхинолин-3-ил)мет-(Е)-илиденамид 2-метилпропан-2(S)-сульфиновой кислоты Фосфат калия (16 г, 75,47 ммоль) растворяли в воде (50 мл) и добавляли (S)-2-метил-2-пропансульфинамид (10,5 г, 86,78 ммоль). Смесь перемешивали в течение 10 мин, затем добавляли раствор 2,8 дихлорхинолин-3-карбальдегида (17,0 г, 75,22 ммоль) в 2-пропаноле (50 мл) и реакционную смесь перемешивали в течение 2 дней. Твердое вещество отфильтровывали, промывали водой и сушили в вакууме. Полученное твердое вещество растворяли в ДХМ, промывали рассолом и сушили (MgSO4) и растворитель удаляли при пониженном давлении. Полученное твердое вещество растирали с эфиром, отфильтровывали, промывали эфиром и сушили и получали искомое соединение (23,6 г, 95%) в виде ярко-желтого твердого вещества. H (CDCl3) 9,12 (s, 1H), 8,83 (s, 1H), 7,90 (d, J 1,9 Гц, 1 Н), 7,87 (d, J 8,2 Гц, 1H), 7,55 (t,J 7,9 Гц, 1 Н), 1,33 (s, 9H). ЖХМС (ЭР+) 330 (М+Н)+, ВУ 1,94 мин. Промежуточный продукт 10N-[8-Хлор-2-(4-метилпиридин-3-ил)хинолин-3-ил]-мет-(Е)-илиденамид 2-метилпропан-2(S)-сульфиновой кислоты Смесь промежуточного продукта 9 (5,0 г, 15,2 ммоль), 4-метилпиридин-3-илбороновой кислоты(3,15 г, 21,43 ммоль), тетракис(трифенилфосфин)палладия(0) (0,17 г, 0,147 ммоль) и 2 М водного раствора бикарбоната натрия (20 мл) в 1,4-диоксане (80 мл) дегазировали и кипятили с обратным холодильником в атмосфере азота в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры, затем подвергали распределению между EtOAc и рассолом и водный слой еще раз экстрагировали с помощьюEtOAc. Объединенные органические экстракты сушили (MgSO4) и растворитель удаляли при пониженном давлении. К раствору полученного вещества в 2-пропаноле (10 мл) добавляли раствор, полученный путем перемешивания фосфата калия (2,8 г, 13,21 ммоль) и (S)-2-метил-2-пропансульфинамида (1,85 г,15,3 ммоль) в воде (10 мл) в течение 15 мин. Реакционную смесь перемешивали в течение выходных дней. Добавляли воду со льдом и полученное твердое вещество собирали фильтрованием, тщательно промывали водой и сушили на воздухе и получали искомое соединение (5,84 г, 99%) в виде коричневого(R)-1-[8-Хлор-2-(4-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламид 2-метилпропан 2(S)-сульфиновой кислоты Раствор промежуточного продукта 10 (5 г, 12,96 ммоль) и дифтортрифенилсиликата тетрабутиламмония (7,7 г, 14,26 ммоль) в безводном ТГФ (100 мл) охлаждали до -70 С. По каплям добавляли (трифторметил)триметилсилан (2,3 мл, 15,58 ммоль) и смесь перемешивали в течение 2 ч, давая температуре медленно повыситься. ЖХМС показывала, что небольшое количество исходного вещества не вступило в реакцию, поэтому смесь повторно охлаждали до -70 С и добавляли еще (трифторметил)триметилсилан(2,3 мл, 15,58 ммоль). Смесь перемешивали в течение еще 2,5 ч, давая температуре медленно повыситься до 0 С. Добавляли насыщенный водный раствор хлорида аммония (0,5 мл) и реакционной смеси давали нагреваться до комнатной температуры. Полученное вещество дважды экстрагировали с помощьюEtOAc, затем сушили (MgSO4) и растворитель выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 60% EtOAc в гексане). Фракции, содержащие чистый необходимый изомер, объединяли и растворитель удаляли при пониженном давлении и получали искомое соединение(R)-1-[8-Хлор-2-(4-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламин К раствору промежуточного продукта 11 (1,8 г, 3,95 ммоль) в 1,4-диоксане (2,5 мл) добавляли 4 н. раствор HCl в 1,4-диоксане (15 мл). Смесь перемешивали при КТ в течение 20 мин. Растворитель удаляли в вакууме и затем остаток подвергали распределению между ДХМ и насыщенным водным растворомNaHCO3. Водную фазу экстрагировали дополнительным количеством ДХМ и объединенные органические фракции сушили (MgSO4), выпаривали в вакууме и очищали с помощью колоночной хроматографии (SiO2, 60% EtOAc в гексане) и получали искомое соединение (1,25 г, 90%) в виде бледно-желтого вспененного вещества. H (CDCl3) 8,42-8,65 (m, 3 Н), 7,95 (d, J 7,1 Гц, 1 Н), 7,86 (d, J 8,2 Гц, 1H), 7,55 (t, J 7,8 Гц, 1H), 7,24-7,40 (m, 2H), 2,15-2,32 (br s, 2H), 1,50-1,80 (br s, 3 Н). ЖХМС (ЭР+) 352 (M+H)+, ВУ 1,81 мин. Промежуточный продукт 13N-[8-Хлор-2-(2-метилпиридин-3-ил)хинолин-3-ил]-мет-(Е)-илиденамид 2-метилпропан-2(S)-сульфиновой кислоты Смесь промежуточного продукта 9 (5,0 г, 15,2 ммоль), пинаколинового эфира 2-метилпиридин-3 илбороновой кислоты (5 г, 22,43 ммоль), тетракис(трифенилфосфин)палладия(0) (0,2 г, 0,17 ммоль) и 2 М водного раствора бикарбоната натрия (20 мл) в 1,4-диоксане (80 мл) дегазировали и кипятили с обратным холодильником в атмосфере азота в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры, подвергали распределению между EtOAc и рассолом и водный слой еще раз экстрагировали с помощью EtOAc. Объединенные органические экстракты сушили (MgSO4) и растворитель удаляли при пониженном давлении. К раствору полученного вещества в 2-пропаноле (10 мл) добавляли раствор, полученный путем перемешивания фосфата калия (2,8 г, 13,21 ммоль) и (S)-2-метил-2-пропансульфинамида (1,85 г, 15,3 ммоль) в воде (10 мл) в течение 15 мин. Реакционную смесь перемешивали в течение 1 ч. Добавляли воду со льдом и полученное вещество экстрагировали с помощью ДХМ. Органический экстракт сушили (MgSO4) и растворитель удаляли в вакууме. Колоночная хроматография (SiO2, 5060% EtOAc в гексане) давала искомое соединение (4,3 г, 73%) в виде бледно-желтого вспененного вещества. H (CDCl3) 8,91 (s, 1H), 8,66 (dd, J 5,0, 1,7 Гц, 1H), 8,55 (s, 1H), 7,97 (m, 2 Н), 7,67 (dd, J 7,7, 1,6 Гц,1 Н), 7,60 (m, 1 Н), 7,33 (dd, J 7,6, 5,0 Гц, 1 Н), 2,30 (s, 3H), 1,24 (s, 9H). ЖХМС (ЭР+) 386 (М+Н)+, ВУ 1,49 мин. Промежуточный продукт 14(R)-1-[8-Хлор-2-(2-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламид 2-метилпропан 2(S)-сульфиновой кислоты Раствор промежуточного продукта 13 (4,3 г, 11,17 ммоль) и дифтортрифенилсиликата тетрабутиламмония (7,5 г, 13,9 ммоль) в безводном ТГФ (60 мл) охлаждали в атмосфере азота до -50 С и по каплям добавляли (трифторметил)триметилсилан (4,5 мл, 30,5 ммоль). Смесь перемешивали в течение 2 ч,давая температуре медленно повыситься до комнатной температуры. Смесь повторно охлаждали до 20 С, добавляли насыщенный водный раствор хлорида аммония и реакционной смеси давали нагреваться до комнатной температуры. Реакционную смесь дважды экстрагировали с помощью ДХМ, затем органические экстракты сушили (MgSO4) и фильтровали, и растворитель выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 60% EtOAc в гексане). Фракции, содержащие чистый необходимый изомер, объединяли и растворитель удаляли при пониженном давлении и получали(R)-1-[8-Хлор-2-(2-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламин К раствору промежуточного продукта 14 (3,5 г, 7,03 ммоль) в 1,4-диоксане (8 мл) добавляли 4 н. раствор HCl в 1,4-диоксане (15 мл). Смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель удаляли в вакууме и затем остаток подвергали распределению между ДХМ и насыщенным водным раствором NaHCO3. Органический экстракт сушили (MgSO4). Растворитель удаляли при пониженном давлении и получали искомое соединение в виде бледно-желтого смолообразного вещества. ЖХМС (ЭР+) 352 (М+Н)+, ВУ 1,36 мин. Промежуточный продукт 16N-[8-Хлор-2-(5-метилпиридин-3-ил)хинолин-3-ил]-мет-(Е)-илиденамид 2-иетилпропан-2(S)-сульфиновой кислоты Смесь промежуточного продукта 9 (2,0 г, 6,08 ммоль), пинаколинового эфира 5-метилпиридин-3 илбороновой кислоты (1,6 г, 7,31 ммоль), тетракис(трифенилфосфин)палладия(0) (0,35 г, 0,31 ммоль) и 2 М водного раствора бикарбоната натрия (5 мл) в 1,4-диоксане (25 мл) дегазировали и кипятили с обратным холодильником в атмосфере азота в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры, подвергали распределению между ДХМ и рассолом и водный слой еще раз экстрагировали с помощью EtOAc. Объединенные органические экстракты сушили (MgSO4) и растворитель удаляли при пониженном давлении. К раствору полученного вещества в 2-пропаноле (10 мл) добавляли раствор, полученный путем перемешивания фосфата калия (1,2 г, 5,66 ммоль) и (S)-2-метил-2-пропансульфинамида(0,75 г, 6,2 ммоль) в воде (10 мл) в течение 15 мин. Реакционную смесь перемешивали в течение ночи,затем выдерживали при 60 С в течение еще 24 ч. Добавляли ДХМ и смесь промывали рассолом, органический экстракт сушили (MgSO4) и растворитель удаляли в вакууме. Колоночная хроматография (SiO2,50-60% EtOAc в гексане) давала искомое соединение (2,28 г, 97%) в виде бледно-желтого вспененного вещества. H (CDCl3) 8,93 (s, 1H), 8,81 (s, 1 Н), 8,63 (m, 1 Н), 7,98 (m, 2 Н), 7,69 (m, 1 Н), 7,61 (m, 1H), 7,50(R)-1-[8-Хлор-2-(5-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламид 2-метилпропан 2(S)-сульфиновой кислоты Раствор промежуточного продукта 16 (2,28 г, 5,91 ммоль) и дифтортрифенилсиликата тетрабутиламмония (3,83 г, 7,09 ммоль) в безводном ТГФ (60 мл) охлаждали в атмосфере азота до -50 С и по каплям добавляли (трифторметил)триметилсилан (2,1 мл, 14,23 ммоль). Смесь перемешивали в течение 2 ч,давая температуре медленно повыситься до 0 С. Реакционную смесь повторно охлаждали до -10 С, добавляли насыщенный водный раствор хлорида аммония и реакционной смеси давали нагреваться до комнатной температуры. Реакционную смесь дважды экстрагировали с помощью ДХМ, затем органические экстракты сушили (MgSO4) и растворитель выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 50-60% EtOAc в гексане). Кристаллизация из смеси эфир/гексан давала искомое соединение (1,2 г, 44%) в виде белого кристаллического твердого вещества. H (ДМСО-d6) 9,00 (s, 1 Н), 8,65 (d, J 1,5 Гц, 1H), 8,59 (d, J 2,0 Гц, 1 Н), 8,12 (m, 2 Н), 7,84 (m, 1H), 7,73 (m, 1 Н), 6,66 (d, J 8,3 Гц, 1 Н), 5,04 (m, 1 Н), 2,45 (s, 3H), 1,16 (s, 9H). ЖХМС (ЭР+) 456 (М+Н)+, ВУ 1,55 мин. Промежуточный продукт 18(R)-1-[8-Хлор-2-(5-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламин К раствору промежуточного продукта 17 (1,2 г, 2,63 ммоль) в ДХМ (3 мл) добавляли 4 н. растворHCl в 1,4-диоксане (10 мл). Смесь перемешивали при комнатной температуре в течение 20 мин. Растворитель удаляли в вакууме и затем остаток подвергали распределению между ДХМ и насыщенным водным раствором NaHCO3. Водную фазу еще раз экстрагировали с помощью ДХМ и объединенные органические экстракты сушили (MgSO4) и выпаривали в вакууме и получали искомое соединение (0,9 г,97%) в виде бледно-желтого смолообразного вещества. ЖХМС (ЭР+) 352 (М+Н)+, ВУ 1,41 мин. Промежуточный продукт 19 8-Хлор-2-(пиразин-2-ил)хинолин-3-карбальдегид Смесь 2,8-дихлорхинолин-3-карбальдегида (2,3 г, 10,18 ммоль), 2-(трибутилстаннанил)пиразина(4,5 г, 12,2 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,4 г, 0,35 ммоль) в 1,4-диоксане (25 мл) дегазировали и смесь нагревали в атмосфере азота при 110 С в течение 5 ч. Смеси в течение ночи давали охладиться до комнатной температуры и затвердевший продукт собирали фильтрованием и несколько раз промывали эфиром. Фильтрат концентрировали и помещали в холодильник на 2 ч и получали вторую порцию, которую фильтровали, промывали эфиром и объединяли с основной массой вещества и получали искомое соединение (2,74 г, 99%) в виде желтого кристаллического твердого вещества. ЖХМС (ЭР+) 270 (М+Н)+, ВУ 1,41 мин.N-[8-Хлор-2-(пиразин-2-ил)хинолин-3-ил]мет-(Е)-илиденамид 2-метилпропан-2(S)-сульфиновой кислоты При перемешивании изопропоксид титана(IV) (6,1 мл, 20,62 ммоль) добавляли к суспензии промежуточного продукта 19 (2,74 г, 10,2 ммоль) в безводном ТГФ (30 мл). Смесь перемешивали при комнатной температуре в течение 10 мин, затем добавляли (S)-2-метил-2-пропансульфинамид (1,35 г, 11,16 ммоль) и смесь перемешивали при 50 С в течение 2 ч. Добавляли воду со льдом и смесь перемешивали в течение 10 мин. Полученное твердое вещество отфильтровывали, промывали водой и сушили на воздухе. Твердое вещество помещали в воронку с фильтром из пористого стекла и трижды экстрагировали горячим ДХМ. Экстракты, содержащие ДХМ, концентрировали при пониженном давлении и получали искомое соединение (1,1 г, 29%) в виде коричневого смолообразного вещества. H (ДМСО-d6) 9,18 (s, 1 Н),8,91 (m, 1 Н), 8,28 (m, 2 Н), 8,13 (m, 2 Н), 7,74 (m, 2 Н), 1,26 (s, 9H). ЖХМС (ЭР+) 373 (М+Н)+, ВУ 1,58 мин. Промежуточный продукт 21(R)-1-[8-Хлор-2-(пиразин-2-ил)хинолин-3-ил]-2,2,2-трифторэтиламид 2-метилпропан-2(S)-сульфиновой кислоты Смесь промежуточного продукта 20 (1,1 г, 2,95 ммоль) и дифтортрифенилсиликата тетрабутиламмония (1,9 г, 3,52 ммоль) в безводном ТГФ (25 мл) перемешивали при -50 С. По каплям добавляли (трифторметил)триметилсилан (1,1 мл, 7,45 ммоль) и смесь перемешивали в течение 2 ч, давая температуре медленно повыситься. Реакционную смесь повторно охлаждали до -20 С, добавляли рассол и реакционной смеси в течение 30 мин давали нагреться. Реакционную смесь дважды экстрагировали с помощью ДХМ, затем органические экстракты сушили (MgSO4) и растворитель выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 50-60% EtOAc в гексане) и получали искомое соединение (0,36 г, 28%) в виде коричневого смолообразного вещества. H (ДМСО-d6) 9,39 (s, 1H), 8,95(R)-1-[8-Хлор-2-(пиразин-2-ил)хинолин-3-ил]-2,2,2-трифторэтиламин К раствору промежуточного продукта 21 (0,36 г, 0,8 ммоль) в ДХМ (2 мл) добавляли 4 н. растворHCl в 1,4-диоксане (5 мл). Смесь перемешивали при комнатной температуре в течение 20 мин. Растворитель удаляли в вакууме и затем остаток подвергали распределению между ДХМ и насыщенным водным раствором NaHCO3. Водную фазу экстрагировали дополнительным количеством ДХМ и объединенные органические фракции сушили (MgSO4) и выпаривали. Остаток очищали с помощью колоночной хроматографии (SiO2, 50% EtOAc в гексане) и получали искомое соединение (0,15 г, 28%) в виде коричневого смолообразного вещества. H (ДМСО-d6) 9,36 (d, J 1,4 Гц, 1 Н), 9,00 (s, 1H), 8,82 (m, 2 Н), 8,10 (m, 2 Н), 7,73(m, 1H), 5,96 (q, J 7,8 Гц, 1 Н), 2,86 (br s, 2H). ЖХМС (ЭР+) 339 (М+Н)+, ВУ 1,41 мин. Промежуточный продукт 23 8-Хлор-2-(6-метоксипиразин-2-ил)хинолин-3-карбальдегид Смесь 2,8-дихлорхинолин-3-карбальдегида (0,5 г, 2,21 ммоль), 2-метокси-6-(трибутилстаннанил)пиразина (1,0 г, 2,51 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,2 г, 0,173 ммоль) в 1,4 диоксане (10 мл) дегазировали и нагревали при 110 С в течение ночи. Смеси давали охладиться до комнатной температуры и ее разбавляли с помощью EtOAc. Полученное твердое вещество собирали фильтрованием, промывали с помощью EtOAc, затем эфиром и сушили и получали искомое соединение (0,42 г, 63%) в виде желтого твердого вещества. H (ДМСО-d6) 10,58 (s, 1H), 9,24 (s, 1H), 8,93 (s, 1 Н), 8,53 (s,1H), 8,27 (dd, J 8,3, 1,2 Гц, 1 Н), 8,17 (dd, J 7,5, 1,2 Гц, 1 Н), 7,75 (m, 1 Н), 3,96 (s, 3 Н). ЖХМС (ЭР+) 300N-[8-Хлор-2-(6-метоксипиразин-2-ил)хинолин-3-ил]-мет-(Е)-илиденамид 2-метилпропан-2(S)-сульфиновой кислоты При перемешивании изопропоксид титана(IV) (0,85 мл, 2,87 ммоль) добавляли к суспензии промежуточного продукта 23 (0,42 г, 1,4 ммоль) в безводном ТГФ (10 мл). Смесь перемешивали при комнатной температуре в течение 10 мин, затем добавляли (S)-2-метил-2-пропансульфинамид (0,2 г, 1,65 ммоль) и смесь перемешивали при 50 С в течение 8 ч. Добавляли воду со льдом и смесь перемешивали в течение 10 мин, затем фильтровали через целит. Полученное твердое вещество несколько раз промывали с помощью EtOAc. Фильтрат промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Неочищенное вещество очищали с помощью колоночной хроматографии (SiO2, 25% EtOAc в гексане) и получали искомое соединение (0,5 г, 49%) в виде почти белого твердого вещества. H (ДМСО-d6) 9,35 (s,1 Н), 9,17 (d, J 0,3 Гц, 1H), 9,13 (s, 1 Н), 8,50 (m, 1 Н), 8,29 (dd, J 8,3, 1,2 Гц, 1 Н), 8,13 (dd, J 7,5, 1,2 Гц, 1 Н),7,73 (m, 1H), 4,00 (s, 3H), 1,26 (s, 9H). ЖХМС (ЭР+) 403 (М+Н)+, ВУ 1,69 мин. Промежуточный продукт 25 Раствор промежуточного продукта 24 (0,5 г, 1,24 ммоль) и ацетата тетрабутиламмония (0,45 г, 1,5 ммоль) в безводном ТГФ (15 мл) перемешивали в атмосфере азота при -50 С и по каплям добавляли(трифторметил)триметилсилан (0,4 мл, 2,71 ммоль). Смесь перемешивали в течение 2 ч, давая температуре медленно повыситься до комнатной температуры. Реакционную смесь повторно охлаждали до -10 С и реакцию останавливали рассолом. Реакционной смеси давали нагреваться до комнатной температуры и ее дважды экстрагировали с помощью EtOAc. Объединенные органические экстракты сушили (MgSO4) и растворитель выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 3050% EtOAc в гексане) и получали искомое соединение (120 мг, 20%) в виде бледно-желтого вспененного вещества. H (ДМСО-d6) 9,07 (d, J 0,2 Гц, 1 Н), 9,01 (s, 1H), 8,53 (s, 1 Н), 8,11 (ш, 2 Н), 7,75 (dd, J 8,1, 7,6 Гц, 1 Н), 7,07 (m, 1 Н), 6,80 (d, J 9,3 Гц, 1 Н), 4,06 (s, 3H), 1,08 (s, 9H). ЖХМС (ЭР+) 473 (М+Н)+, ВУ 1,62 мин. Промежуточный продукт 26N-[8-Хлор-2-(6-метилпиридин-3-ил)хинолин-3-ил]-мет-(Е)-илиденамид 2-метилпропан-2(S)-сульфиновой кислоты Смесь промежуточного продукта 9 (3,0 г, 9,1 ммоль), 2-метилпиридин-5-илбороновой кислоты (1,24 г, 9,1 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,10 г, 0,1 ммоль) в ДМЭ (60 мл) обрабатывали 2 М водным раствором Na2CO3 (11 мл). Реакционную смесь дегазировали и трижды продували азотом,затем нагревали при 90 С в течение 20 ч. Смеси давали охладиться до комнатной температуры и ее разбавляли с помощью EtOAc (50 мл). Органический раствор промывали водой (50 мл) и рассолом (50 мл),затем сушили (MgSO4) и выпаривали в вакууме. Затем полученное неочищенное вещество обрабатывали смесью изопропоксида титана(IV) (5,4 мл, 18,0 ммоль) и (S)-2-метил-2-пропансульфинамида (1,21 г, 10,0 ммоль) в безводном ТГФ (50 мл) в соответствии с методикой, описанной для получения промежуточного продукта 2. Искомое соединение (1,46 г, 41%) получали в виде желтого смолообразного вещества. H(R)-1-[8-Хлор-2-(6-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламид 2-метилпропан 2(S)-сульфиновой кислоты Получали в соответствии с методикой, описанной для получения промежуточного продукта 3, с использованием промежуточного продукта 26 (1,46 г, 3,79 ммоль), дифтортрифенилсиликата тетрабутиламмония (2,25 г, 4,17 ммоль), (трифторметил)триметилсилана (1,4 мл, 9,47 ммоль) и безводного ТГФ(40 мл). Искомое соединение (0,94 г, 55%) получали в виде желтого смолообразного вещества. H(R)-1-[8-Хлор-2-(6-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламин Получали в соответствии с методикой, описанной для получения промежуточного продукта 4, с использованием промежуточного продукта 27 (0,94 г, 2,07 ммоль), 4 н. раствора HCl в 1,4-диоксане (3 мл,12,0 ммоль) и метанола (18 мл). Искомое соединение (1,28 г, 84%) получали в виде бесцветного смолообразного вещества. H (ДМСО-d6) 8,89 (s, 1H), 8,68 (d, J 1,9 Гц, 1H), 8,10 (dd, J 8,3, 1,3 Гц, 1 Н), 8,04 (dd, J 7,5, 1,3 Гц, 1 Н), 7,93 (dd, J 7,9, 2,4 Гц, 1 Н), 7,67 (dd, J 8,1, 8,1 Гц, 1 Н), 7,47 (d, J 7,9 Гц, 1H), 4,70 (tq, J 7,2,7,2 Гц, 1 Н), 2,84 (d, J 7,0 Гц, 2 Н), 2,60 (s, 3H). ЖХМС (ЭР+) 352 (М+Н)+, ВУ 1,51 мин. Промежуточный продукт 29 4-(Бензотриазол-1-илокси)пиридо[3,2-d]пиримидин В реакторе в атмосфере азота этиленгликоль (2,7 л) нагревали до 45 С. Добавляли 3-аминопиридин 2-карбоновую кислоту (1,37 кг) и формамидинацетат (1,37 кг). Для облегчения перемешивания смесь нагревали при 50 С. Смесь постепенно нагревали до 125 С (в течение примерно 1 ч) и нагревание продолжали до завершения реакции (в течение 2-3 ч). После охлаждения смеси до 50 С медленно добавляли воду (7 л). Суспензию охлаждали до 20 С и перемешивали в течение ночи, затем охлаждали до -5 С и перемешивали в течение 1 ч. Полученное твердое вещество выделяли фильтрованием. Осадок на фильтре промывали холодной водой (1,5 л) и ацетоном (1,5 л) и сушили при 55 С в вакууме и получали твердое вещество (985 г, 67,5%; чистота по данным ВЭЖХ: 99,25%). Смесь этого вещества (10 г, 68,0 ммоль) и РуВОР (38,9 г, 74,8 ммоль) в ацетонитриле (250 мл) обрабатывали с помощью ДБУ (12,2 мл, 81,6 ммоль) и перемешивали в течение 2,5 ч. Реакционную смесь фильтровали и осадок промывали диэтиловым эфиром (350 мл) и сушили в вакууме. Искомое соединение (13,51 г, 75%) получали в виде кремового твердого вещества. H (ДМСО-d6) 9,28 (dd, J 4,2, 1,6 Гц, 1 Н), 8,82 (s, 1 Н), 8,59 (dd, J 8,6, 1,5 Гц, 1 Н),8,24-8,18 (m, 2 Н), 7,88-7,85 (m, 1H), 7,69-7,64 (m, 1 Н), 7,60-7,54 (m, 1 Н). ЖХМС (ЭР+) 265 (М+Н)+, ВУ 1,23 мин. Промежуточный продукт 30 1-(Пиридо[3,2-d]пиримидин-4-илокси)пирролидин-2,5-дион Смесь промежуточного продукта 29 (13,51 г, 51,0 ммоль) и N-гидроксисукцинимида (8,83 г, 77 ммоль) в дихлорметане (350 мл) перемешивали в течение 20 ч. Реакционную смесь фильтровали и фильтрат промывали водой, затем рассолом, сушили (MgSO4) и выпаривали в вакууме. Остаток растирали с диэтиловым эфиром и осадок сушили в вакууме. Искомое соединение (10,9 г, 87%) получали в виде бледно-желтого твердого вещества. H (ДМСО-d6) 9,18 (dd, J 4,1, 1,5 Гц, 1H), 8,94 (s, 1H), 8,52 (dd, J 8,7,1,7 Гц, 1 Н), 8,13 (dd, J 8,7, 4,3 Гц, 1 Н), 2,97 (s, 4H). ЖХМС (ЭР+) 245 (М+Н)+, ВУ 0,51 мин. Промежуточный продукт 31N-(о-Толил)ацетамид При перемешивании при 0 С уксусный ангидрид (33,0 мл, 350 ммоль) добавляли к раствору отолуидина (30,0 г, 280 ммоль) в дихлорметане (500 мл). Реакционной смеси давали нагреваться до комнатной температуры и ее перемешивали в течение 20 ч. Реакционную смесь подвергали распределению между ДХМ и водой. Органическую фазу промывали рассолом, затем сушили (MgSO4) и выпаривали в вакууме. Остаток перемешивали в изогексане при 0 С в течение 2 ч, затем фильтровали. Осадок промывали изогексаном и сушили в вакууме. Искомое соединение (39,87 г, 95%) получали в виде бледнорозового твердого вещества. H (CDCl3) 7,80-7,78 (m, 1H), 7,26-7,20 (m, 2H), 7,13-7,08 (m, 1H), 6,92 (br s,1H), 2,29 (s, 3H), 2,23 (s, 3 Н). ЖХМС (ЭР+) 150 (M+H)+, ВУ 0,85 мин. Промежуточный продукт 32 2-Хлор-8-метилхинолин-3-карбальдегид При перемешивании при 0 С N,N-диметилформамид (51,8 мл, 668 ммоль) в течение 15 мин порциями добавляли к оксихлориду фосфора (175 мл, 1,87 моль). Реакционной смеси давали нагреться до комнатной температуры и ее обрабатывали промежуточным продуктом 31 (39,8 г, 267 ммоль), затем нагревали при 80 С и перемешивали в течение 72 ч. Реакционную смесь охлаждали до комнатной температуры, затем при энергичном перемешивании порциями осторожно выливали в смесь воды со льдом. Реакционной смеси в воде со льдом в течение 30 мин давали нагреваться до комнатной температуры, затем ее фильтровали. Осадок промывали водой и сушили в вакууме. Искомое соединение (37,3 г, 68%) получали в виде кремового твердого вещества. H (CDCl3) 10,50 (s, 1H), 8,73 (s, 1H), 7,83 (d, J 8,1 Гц, 1H), 7,767,72 (m, 1H), 7,55 (dd, J 7,9, 7,3 Гц, 1 Н), 2,81 (s, 3 Н). ЖХМС (ЭР+) 206 (M+H)+, ВУ 1,54 мин. Промежуточный продукт 33 8-Метил-2-(пиридин-3-ил)хинолин-3-карбальдегид Получали в соответствии с методикой, описанной для получения промежуточного продукта 1, с использованием промежуточного продукта 32 (10 г, 48,7 ммоль), NaCO3 (7,74 г, 73 ммоль), 3-пиридилбороновой кислоты (5,98 г, 48,7 ммоль) и тетракис(трифенилфосфин)палладия(0) (2,81 г, 2,43 ммоль) в ДМЭ (150 мл) и воде (40 мл). Искомое соединение (11,36 г, 94%) получали в виде коричневого твердого вещества. H (CDCl3) 10,20 (s, 1H), 9,02 (dd, J 2,3, 0,8 Гц, 1H), 8,86 (s, 1H), 8,80 (dd, J 4,9, 1,7 Гц, 1 Н), 8,10N-[8-Метил-2-(пиридин-3-ил)хинолин-3-ил]мет-(Е)-илиденамид 2-метилпропан-2(S)-сульфиновой кислоты Получали в соответствии с методикой, описанной для получения промежуточного продукта 2, с использованием промежуточного продукта 33 (5 г, 20,2 ммоль), изопропоксида титана(IV) (11,9 мл, 40,3 ммоль), (S)-2-метил-2-пропансульфинамида (2,69 г, 22,0 ммоль) и безводного ТГФ (60 мл). Искомое соединение (7,8 г, 99%) получали в виде коричневого смолообразного вещества. H (ДМСО-d6) 9,08 (s,1 Н), 8,85 (dd, J 2,3, 0,8 Гц, 1H), 8,75 (dd, J 4,9, 1,7 Гц, 1 Н), 8,62 (s, 1 Н), 8,11-8,07 (m, 2 Н), 7,82-7,78 (m,1 Н), 7,65-7,59 (m, 2 Н), 2,76 (s, 3H), 1,20 (s, 9H). ЖХМС (ЭР+) 352 (М+Н)+, ВУ 1,58 мин. Промежуточный продукт 35 2-Метилпропан-2(S)-сульфиновой кислоты (R)-1-[8-метил-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2 трифторэтил]амид Получали в соответствии с методикой, описанной для получения промежуточного продукта 3, с использованием промежуточного продукта 34 (7,8 г, 22,2 ммоль), дифтортрифенилсиликата тетрабутиламмония (13,2 г, 24,4 ммоль), (трифторметил)триметилсилана (3,9 мл, 26,7 ммоль) и безводного ТГФ (150 мл). Искомое соединение (5,34 г, 57%) получали в виде желтого смолообразного вещества. H (ДМСО-d6) 8,89 (s, 1H), 8,80-8,77 (m, 2H), 8,03 (ddd, J 7,7, 1,9, 1,9 Гц, 1H), 7,94 (d, J 7,7 Гц, 1H), 7,78-7,75 (m, 1H),7,68-7,61 (m, 2H), 6,62 (d, J 8,5 Гц, 1H), 5,05 (dq, J 7,9, 7,9 Гц, 1H), 3,17 (s, 3H), 1,15 (s, 9H). ЖХМС (ЭР+) 422 (M+H)+, ВУ 1,56 мин. Промежуточный продукт 36(R)-1-[8-Метил-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламин Получали в соответствии с методикой, описанной для получения промежуточного продукта 4, с использованием промежуточного продукта 35 (1,0 г, 2,4 ммоль), 4 н. раствора HCl в 1,4-диоксане (3,5 мл,- 16024162 14,0 ммоль) и метанола (18 мл). Искомое соединение (611 г, 81%) получали в виде желтого смолообразного вещества. H (ДМСО-d6) 8,83-8,82 (m, 1H), 8,77 (s, 1H), 8,73 (dd, J 4,7, 1,5 Гц, 1 Н), 8,04 (ddd, J 7,7,2,1, 2,1 Гц, 1 Н), 7,92 (d, J 7,9 Гц, 1 Н), 7,12-7,69 (m, 1H), 7,62-7,56 (m, 2H), 4,74-4,61 (m, 1H), 2,82 (d, J 7,0 Гц, 2H), 2,70 (s, 3H). ЖХМС (ЭР+) 318 (M+H)+, ВУ 1,41 мин. Промежуточный продукт 37 7-Фтор-8-метил-2-(пиридин-3-ил)хинолин-3-карбальдегид Получали в соответствии с методикой, описанной для получения промежуточного продукта 1, с использованием 2-хлор-7-фтор-8-метилхинолин-3-карбальдегида (5,0 г, 22,36 ммоль), 3-пиридилбороновой кислоты (3,02 г, 24,6 ммоль), тетракис(трифенилфосфин)палладия(0) (127 мг, 0,11 ммоль) и Na2CO3 (3,55 г, 33,54 ммоль) в воде (30 мл) и ДМЭ (60 мл). Искомое соединение (5,52 г, 93%) получали в виде бежевого твердого вещества. H (ДМСО-d6) 10,13 (s, 1H), 9,08 (s, 1H), 8,95 (dd, J 2,3, 0,8 Гц, 1 Н), 8,75 (dd, J 4,9,1,7 Гц, 1H), 8,24 (dd, J 9,0, 6,4 Гц, 1 Н), 8,16-8,21 (m, 1H), 7,68 (t, J 9,2 Гц, 1 Н), 7,61 (ddd, J 7,9, 4,0, 0,8 Гц,1 Н), 2,66 (d, J 2,4 Гц, 3 Н). ЖХМС (ЭР+) 267 (М+Н)+, ВУ 2,16 мин. Промежуточный продукт 38N-[7-Фтор-8-метил-2-(пиридин-3-ил)хинолин-3-ил]-мет-(Е)-илиденамид 2-метилпропан-2(S)-сульфиновой кислоты Получали в соответствии с методикой, описанной для получения промежуточного продукта 2, с использованием промежуточного продукта 37 (4,52 г, 16,99 ммоль), изопропоксида титана(IV) (9,66 г, 33,98 ммоль), (S)-2-метил-2-пропансульфинамида (2,27 г, 18,69 ммоль) и безводного ТГФ (90 мл). Неочищенное вещество растирали с диэтиловым эфиром (20 мл) и твердое вещество отфильтровывали и сушили в вакууме и получали искомое соединение (4,37 г, 70%) в виде бежевого твердого вещества. H (ДМСО-d6) 9,14 (s, 1H), 8,85 (d, J 1,7 Гц, 1 Н), 8,76 (dd, J 4,9, 1,5 Гц, 1 Н), 8,60 (s, 1H), 8,23 (dd, J 9,4, 7,0 Гц, 1 Н), 8,10(R)-1-[7-Фтор-8-метил-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламид 2-метилпропан 2(S)-сульфиновой кислоты Смесь промежуточного продукта 38 (4,37 г, 11,83 ммоль) и дифтортрифенилсиликататетрабутиламмония (7,02 г, 13,01 ммоль) в безводном ТГФ (100 мл) охлаждали до -50 С. Добавляли (трифторметил)триметилсилан (2,02 г, 14,2 ммоль) и смесь перемешивали при -50 С в течение 2,5 ч. Добавляли насыщенный водный раствор хлорида аммония (15 мл) и реакционной смеси давали нагреться до КТ. Растворитель удаляли в вакууме и остаток подвергали распределению между ДХМ (100 мл) и водой (100 мл). Органическую фазу промывали рассолом (100 мл), сушили (с помощью устройства для разделения фаз) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 35-100%EtOAc в гексане) и получали искомое соединение (3,14 г, 60%) в виде белого вспененного вещества. H(R)-1-[7-Фтор-8-метил-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламин Получали в соответствии с методикой, описанной для получения промежуточного продукта 4, с использованием промежуточного продукта 39 (3,14 г, 7,15 ммоль), 4 н. раствора HCl в 1,4-диоксане (6 мл,24,0 ммоль) и метанола (30 мл). Искомое соединение (2,40 г, количественный выход) получали в виде желтого масла. H (ДМСО-d6) 8,82-8,85 (m, 2H), 8,74 (dd, J 4,9, 1,7 Гц, 1 Н), 8,00-8,08 (m, 2 Н), 7,57-7,64 (m,2 Н), 4,69 (q, J 7,7 Гц, 1 Н), 2,79-2,97 (m, 2 Н), 2,60 (d, J 2,4 Гц, 3 Н). ЖХМС (ЭР+) 336 (М+Н)+, ВУ 2,20 мин. Промежуточный продукт 41 7-Фтор-8-метил-2-(2-метилпиридин-3-ил)хинолин-3-карбальдегид Смесь 2-хлор-7-фтор-8-метилхинолин-3-карбальдегида (8,0 г, 35,77 ммоль), пинаколинового эфира 2-метилпиридин-3-илбороновой кислоты (9,58 г, 39,35 ммоль), тетракис-(трифенилфосфин)палладия(0)(207 мг, 18 ммоль) и Na2CO3 (5,69 г, 53,66 ммоль) в воде (50 мл) и ДМЭ (100 мл) дегазировали и трижды продували азотом, затем нагревали при 90 С в течение 24 ч. Смеси давали охладиться до комнатной температуры. Реакционную смесь разбавляли с помощью ДХМ (150 мл) и промывали водой (150 мл). Водную фазу экстрагировали с помощью ДХМ (2100 мл) и объединенные органические фракции промывали рассолом (150 мл), затем сушили (с помощью устройства для разделения фаз) и выпаривали в вакууме. Неочищенное вещество растирали с гексаном (50 мл), затем твердое вещество отфильтровывали и сушили в вакууме и получали искомое соединение (9,07 г, 90%) в виде бледно-желтого твердого вещества. H (ДМСО-d6) 9,94 (s, 1 Н), 9,09 (1 Н, s), 8,61 (dd, J 4,9, 1,7 Гц, 1H), 8,26 (dd, J 8,9, 6,4 Гц, 1 Н), 7,78 (dd, J 7,7, 1,7 Гц, 1 Н), 7,69 (t, J 9,2 Гц, 1 Н), 7,40 (dd, J 7,7, 4,9 Гц, 1 Н), 2,61 (d, J 2,4 Гц, 3 Н), 2,34 (s, 3 Н). ЖХМС Получали в соответствии с методикой, описанной для получения промежуточного продукта 2, с использованием промежуточного продукта 41 (5,0 г, 17,84 ммоль), изопропоксида титана(IV) (10,14 г, 35,68 ммоль), (S)-2-метил-2-пропансульфинамида (2,38 г, 19,63 ммоль) и безводного ТГФ (100 мл). Неочищенное вещество растирали с диэтиловым эфиром (20 мл) и твердое вещество отфильтровывали и сушили в вакууме и получали искомое соединение (5,14 г, 75%) в виде бледно-желтого твердого вещества. H(R)-1-[7-Фтор-8-метил-2-(2-метилпиридин-3-ил)-хинолин-3-ил]-2,2,2-трифторэтиламид 2-метилпропан-2(S)-сульфиновой кислоты Получали в соответствии с методикой, описанной для получения промежуточного продукта 39, с использованием промежуточного продукта 42 (5,13 г, 13,38 ммоль), дифтортрифенилсиликата тетрабутиламмония (7,95 г, 14,72 ммоль), (трифторметил)триметилсилана (4,56 г, 32,12 ммоль) и безводного ТГФ (100 мл). Искомое соединение (2,64 г, 43%) получали в виде почти белого вспененного вещества. H(R)-1-[7-Фтор-8-метил-2-(2-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламин К раствору промежуточного продукта 43 (2,64 г, 5,82 ммоль) в метаноле (25 мл) добавляли 4 н. раствор HCl в 1,4-диоксане (5,0 мл, 20,0 ммоль). Смесь перемешивали при КТ в течение ночи. Растворитель удаляли в вакууме и остаток растворяли в воде (10 мл) и промывали с помощью ДХМ (310 мл). Затем водную фазу подщелачивали 10% водным раствором NaOH (10 мл) и экстрагировали с помощью ДХМ(425 мл). Затем объединенные органические фракции сушили (с помощью устройства для разделения фаз) и выпаривали в вакууме и получали искомое соединение (1,76 г, 87%) в виде бледно-желтого твердого вещества. H (ДМСО-d6, 400 МГц, 110 С) 8,75 (s, 1H), 8,60 (dd, J 4,8, 1,8 Гц, 1H), 7,99 (dd, J 8,8, 6,1 Гц, 1 Н), 7,67-7,71 (m, 1 Н), 7,53 (t, J 9,3 Гц, 1 Н), 7,34-7,39 (m, 1 Н), 4,34-4,46 (m, 1 Н), 2,60 (d, J 2,5 Гц, 3 Н),2,31 (s, 3 Н). ЖХМС (ЭР+) 350 (М+Н)+, ВУ 2,22 мин. Промежуточный продукт 45 7-Фтор-8-метил-2-(5-метилпиридин-3-ил)хинолин-3-карбальдегид Получали в соответствии с методикой, описанной для получения промежуточного продукта 41, с использованием 2-хлор-7-фтор-8-метилхинолин-3-карбальдегида (5,0 г, 22,36 ммоль), 5-метилпиридин-3 илбороновой кислоты (6,95 г, 50,75 ммоль), тетракис(трифенилфосфин)палладия(0) (258 мг, 0,22 ммоль) и Na2CO3 (3,55 г, 33,54 ммоль) в воде (30 мл) и ДМЭ (60 мл). Неочищенное вещество растирали с диэтиловым эфиром (75 мл) и твердое вещество отфильтровывали и сушили в вакууме и получали искомое соединение (5,0 г, 80%) в виде коричневого твердого вещества. H (ДМСО-d6) 10,12 (s, 1H), 9,06 (s, 1H),8,72 (d, J 1,9 Гц, 1 Н), 8,60 (d, J 1,5 Гц, 1 Н), 8,24 (dd, J 9,0, 6,4 Гц, 1 Н), 7,99 (d, J 0,6 Гц, 1 Н), 7,68 (t, J 9,2 Гц, 1 Н), 2,66 (d, J 2,4 Гц, 3 Н), 2,44 (s, 3 Н). ЖХМС (ЭР+) 281 (М+Н)+, ВУ 1,66 мин. Промежуточный продукт 46N-[7-Фтор-8-метил-2-(5-метилпиридин-3-ил)-хинолин-3-ил]мет-(Е)-илиденамид 2-метилпропан 2(S)-сульфиновой кислоты Получали в соответствии с методикой, описанной для получения промежуточного продукта 2, с использованием промежуточного продукта 45 (4,99 г, 17,80 ммоль), изопропоксида титана(IV) (10,12 г,35,60 ммоль), (S)-2-метил-2-пропансульфинамида (2,38 г, 19,6 ммоль) и безводного ТГФ (100 мл). Искомое соединение (5,63 г, 82%) получали в виде темно-коричневого твердого вещества. H (ДМСО-d6) 9,13(R)-1-[7-Фтор-8-метил-2-(5-метилпиридин-3-ил)-хинолин-3-ил]-2,2,2-трифторэтиламид 2-метилпропан-2(S)-сульфиновой кислоты Получали в соответствии с методикой, описанной для получения промежуточного продукта 39, с использованием промежуточного продукта 46 (5,63 г, 14,68 ммоль), дифтортрифенилсиликата тетрабутиламмония (8,72 г, 16,15 ммоль), (трифторметил)триметилсилана (10,04 г, 70,60 ммоль) и безводного ТГФ (100 мл). Искомое соединение (3,48 г, 52%) получали в виде бежевого твердого вещества. H(R)-1-[7-Фтор-8-метил-2-(5-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламин Получали в соответствии с методикой, описанной для получения промежуточного продукта 44, с использованием промежуточного продукта 47 (3,42 г, 7,54 ммоль), 4 н. раствора HCl в 1,4-диоксане (5,0 мл, 20,0 ммоль) и метанола (25 мл). Искомое соединение (2,41 г, 92%) получали в виде бледно-желтого твердого вещества. H (ДМСО-d6) 8,82 (s, 1H), 8,60 (d, J 1,9 Гц, 1 Н), 8,57 (dd, J 2,1, 0,6 Гц, 1 Н), 8,02 (dd, J 8,9, 6,2 Гц, 1 Н), 7,85 (td, J 2,1, 0,6 Гц, 1 Н), 7,59 (t, J 9,2 Гц, 1H), 4,60-4,75 (m, 1H), 2,80 (d, J 7,0 Гц, 2 Н),2,59 (d, J 2,4 Гц, 3 Н), 2,43 (s, 3 Н). ЖХМС (ЭР+) 350 (M+H)+, ВУ 2,39 мин. Промежуточный продукт 49 2-Амино-3-(трифторметил)бензальдегид Диоксид марганца (27 г, 0,32 моль) добавляли к раствору [2-амино-3-(трифторметил)фенил]метанола (12,0 г, 0,063 моль) в ДХМ (150 мл) и смесь перемешивали при комнатной температуре в течение 18 ч. Затем добавляли дополнительное количество диоксида марганца (27 г, 0,32 моль) и реакционную смесь выдерживали в течение еще 18 ч. Реакционную смесь фильтровали через целит, затем растворитель удаляли в вакууме и получали искомое соединение (9,5 г, 80%) в виде оранжевого масла. H(ДМСО-d6) 9,93 (s, 1H), 7,68 (m, 2H), 6,82 (m, 3 Н). Промежуточный продукт 50 2-(Пиридин-3-ил)-8-(трифторметил)-1,2-дигидрохинолин-3-карбальдегид 2,5-Диметилпирролидингидрохлорид (100 мг) добавляли к раствору промежуточного продукта 49(4,1 г, 0,022 моль) и 3-(пиридин-3-ил)акролеина (2,9 г, 0,022 моль) в хлороформе (100 мл). Реакционную смесь при перемешивании кипятили с обратным холодильником в течение 7 дней. Реакционную смесь концентрировали в вакууме, затем очищали с помощью колоночной хроматографии (SiO2, 10-100%EtOAc/ДХМ) и получали искомое соединение (3,4 г, 51%) в виде бледно-коричневого масла. ЖХМС(ЭР+) 301,2 (М+Н)+, ВУ 1,29 мин. Промежуточный продукт 51 2-(Пиридин-3-ил)-8-(трифторметил)хинолин-3-карбальдегид Диоксид марганца (4,8 г, 0,056 моль) добавляли к раствору промежуточного продукта 50 (3,4 г,0,011 моль) в хлороформе (100 мл) и реакционную смесь перемешивали в течение 18 ч. Добавляли дополнительное количество диоксида марганца (2,0 г) и смесь перемешивали в течение еще 2 ч. Затем реакционную смесь фильтровали через целит, промывая с помощью ТГФ. Фильтрат сушили (Na2SO4) и концентрировали в вакууме и затем очищали с помощью колоночной хроматографии (SiO2, диэтиловый эфир) и получали искомое соединение (505 мг, 15%) в виде оранжевого твердого вещества. ЖХМС (ЭР+) 303,2 (М+Н)+, ВУ 1,29 мин. Промежуточный продукт 52N-[2-(Пиридин-3-ил)-8-(трифторметил)хинолин-3-ил]-мет-(Е)-илиденамид 2-метилпропан-2(S)сульфиновой кислоты Изопропоксид титана(IV) (909 мг, 3,2 ммоль) добавляли к раствору промежуточного продукта 51(485 мг, 1,60 ммоль) в безводном ТГФ (30 мл). Смесь перемешивали при КТ в течение 10 мин. Добавляли(S)-2-метил-2-пропансульфинамид (213 мг, 1,76 ммоль) и смесь перемешивали при КТ в течение 18 ч. Затем реакционную смесь выливали в рассол (50 мл) и фильтровали через целит, промывая с помощьюEtOAc. Фильтрат промывали рассолом, сушили (Na2SO4) и концентрировали в вакууме. Очистка с помощью колоночной хроматографии (SiO2, 40-100% EtOAc в гексане) давала искомое соединение (395 мг,61%). ЖХМС (ЭР+) 406 (М+Н)+, ВУ 1,64 мин. Промежуточный продукт 53(R)-1-[2-(Пиридин-3-ил)-8-(трифторметил)хинолин-3-ил]-2,2,2-трифторэтиламид 2-метилпропан 2(S)-сульфиновой кислоты Смесь промежуточного продукта 52 (320 мг, 0,79 ммоль) и дифтортрифенилсиликата тетрабутиламмония (405 мг, 0,75 ммоль) в безводном ТГФ (20 мл) охлаждали до -78 С. Добавляли (трифторметил)триметилсилан (123 мг, 0,87 ммоль) и смеси давали нагреться до -35 С и ее перемешивали при этой температуре в течение 30 мин. Добавляли дополнительное количество (трифторметил)триметилсилана(123 мг, 0,87 ммоль) и смесь перемешивали в течение еще 2 ч, поддерживая температуру ниже -35 С. Затем добавляли насыщенный водный раствор хлорида аммония (5 мл) и реакционной смеси давали нагреться до КТ. Растворитель удаляли в вакууме и остаток подвергали распределению между EtOAc и водой. Водную фазу экстрагировали дополнительным количеством EtOAc и объединенные органические фракции промывали рассолом, сушили (Na2SO4) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 10-100% EtOAc в ДХМ) и получали искомое соединение (270 мг, 72%) в виде желтого смолообразного вещества. ЖХМС (ЭР+) 476 (М+Н)+, ВУ 1,70 мин. Промежуточный продукт 54(R)-1-[2-(Пиридин-3-ил)-8-(трифторметил)хинолин-3-ил]-2,2,2-трифторэтиламин К раствору промежуточного продукта 53 (243 мг, 0,51 ммоль) в метаноле (20 мл) добавляли 4 н. раствор HCl в 1,4-диоксане (4 мл, 16,0 ммоль). Смесь перемешивали при КТ в течение 1 ч. Растворитель удаляли в вакууме и затем остаток подвергали распределению между ДХМ и насыщенным водным раствором NaHCO3 и выпаривали в вакууме и получали искомое соединение (180 мг, 95%) в виде бледножелтого смолообразного вещества. ЖХМС (ЭР+) 372,2 (М+Н)+, ВУ 1,56 мин. Промежуточный продукт 55 Этиловый эфир 2-[(гидрокси)(6-метилпиридин-3-ил)метил]акриловой кислоты К раствору 6-метилпиридин-3-карбальдегида (5,0 г, 41 ммоль) в этилакрилате (10 мл) при комнатной температуре добавляли ДАБЦО (1,0 г, 9 ммоль) и смесь перемешивали в течение ночи. Реакционную смесь концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии (SiO2, от гексана до 40% этилацетата) и получали искомое соединение (5,6 г, 62%) в виде желтого масла. ЖХМС(ЭР+) 222,2 (М+Н)+, ВУ 0,98 мин. Промежуточный продукт 56 Этиловый эфир 2-(6-метилпиридин-3-ил)-5,6,8-трифтор-1,4-дигидрохинолин-3-карбоновой кислоты К раствору промежуточного продукта 55 (4,2 г, 19,09 ммоль), 2,4,5-трифтор-6-броманилина (4,3 г,19,09 ммоль) и три(о-толил)фосфина (590 мг, 10 мол.%) в пропионитриле (50 мл) добавляли триэтиламин(9,6 мл, 60 ммоль). Реакционную смесь дегазировали и продували азотом, затем добавляли ацетат палладия(II) (215 мг, 5 мол.%). Реакционную смесь нагревали при 100 С в течение ночи. Реакционную смесь разбавляли этилацетатом и органическую фазу дважды промывали водой. Органическую фазу пропускали через устройство для разделения фаз и концентрировали. Полученное коричневое смолообразное вещество очищали с помощью колоночной хроматографии (SiO2, EtOAc/гексан, градиентный режим: 4080% EtOAc) и получали искомое соединение (3 г, 45%) в виде оранжевого масла. ЖХМС рН 10 (ЭР+) 349 (М+Н)+, ВУ 1,40 мин. Промежуточный продукт 57 Этиловый эфир 2-(6-метилпиридин-3-ил)-5,6,8-трифторхинолин-3-карбоновой кислоты К раствору промежуточного продукта 56 (2,8 г, 8,02 ммоль) в ДХМ добавляли диоксид марганца(2,8 г, 28,73 ммоль). Реакционную смесь перемешивали при КТ в течение ночи. Реакционную смесь фильтровали через слой целита и фильтрат концентрировали и получали искомое соединение (2,8 г,100%) в виде желтого твердого вещества. ЖХМС рН 10 (ЭР+) 347 (М+Н)+, ВУ 1,38 мин. Промежуточный продукт 58[2-(6-Метилпиридин-3-ил)-5,6,8-трифторхинолин-3-ил]метанол К раствору промежуточного продукта 57 (2,8 г, 8,1 ммоль) в толуоле при -78 С в течение 20 мин добавляли DIBAL-H. Полученный раствор перемешивали при -78 С в течение 60 мин. Реакцию останавливали 2 М раствором NaOH и полученное твердое вещество удаляли фильтрованием. Фильтрат подвергали распределению между EtOAc и водой и водную фазу экстрагировали с помощью EtOAc. Объединенные органические фазы сушили, фильтровали и выпаривали и получали искомое соединение (2,5 г,97%) в виде почти белого твердого вещества. ЖХМС (ЭР+) 305 (М+Н)+. Промежуточный продукт 59 2-(6-Метилпиридин-3-ил)-5,6,8-трифторхинолин-3-карбальдегид Смесь промежуточного продукта 58 (2,5 г, 8,2 ммоль) и диоксида марганца (3,5 г, 41 ммоль) в дихлорметане перемешивали при комнатной температуре в течение 20 ч. Реакционную смесь фильтровали через целит и полученный желтый раствор концентрировали и получали искомое соединение (1,1 г, 44%) в виде желтого твердого вещества. ЖХМС (ЭР+) 303 (М+Н)+. Промежуточный продукт 60N-[2-(6-Метилпиридин-3-ил)-5,6,8-трифторхинолин-3-ил]мет-(Е)-илиденамид 2-метилпропан-2(S)сульфиновой кислоты Изопропоксид титана(IV) (2,1 г, 7,2 ммоль) добавляли к суспензии промежуточного продукта 59(1,1 г, 3,6 ммоль) в безводном ТГФ (30 мл). Смесь перемешивали при КТ в течение 10 мин. Добавляли(S)-2-метил-2-пропансульфинамид (480 мг, 3,9 ммоль) и смесь перемешивали при 60 С в течение 1 ч. Реакционную смесь концентрировали и остаток очищали с помощью колоночной хроматографии (SiO2,40-80% EtOAc в гексане) и получали искомое соединение (1,1 г) в виде желтовато-коричневого твердого вещества. ЖХМС (ЭР+) 406 (М+Н)+, ВУ 1,526 мин. Промежуточный продукт 61(R)-1-[2-(6-Метилпиридин-3-ил)-5,6,8-трифторхинолин-3-ил]-2,2,2-трифторэтиламид 2-метилпропан-2(S)-сульфиновой кислоты Смесь промежуточного продукта 60 (2,24 г, 6,03 ммоль) и дифтортрифенилсиликата тетрабутиламмония (3,58 г, 6,64 ммоль) в безводном ТГФ (40 мл) охлаждали до -40 С. Добавляли (трифторметил)триметилсилан (1,03 г, 7,24 ммоль) и смесь перемешивали при -40 С в течение 1 ч. Добавляли насыщенный водный раствор хлорида аммония (5 мл) и реакционной смеси давали нагреться до КТ. Растворитель удаляли в вакууме и остаток подвергали распределению между EtOAc и водой. Водную фазу экстрагировали дополнительным количеством EtOAc и объединенные органические фракции промывали рассолом,затем сушили (Na2SO4) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 40-100% EtOAc в гексане) и получали искомое соединение (1,78 г, 67%) в виде желтого смолообразного вещества. ЖХМС (ЭР+) 476 (М+Н)+, ВУ 1,509 мин. Промежуточный продукт 62 К раствору промежуточного продукта 61 (400 мг, 0,84 ммоль) в метаноле (10 мл) добавляли 4 н. раствор HCl в 1,4-диоксане (10 мл). Смесь перемешивали при КТ в течение 1 ч. Растворитель удаляли в вакууме и затем остаток подвергали распределению между ДХМ и насыщенным водным раствором NaHCO3. Водную фазу экстрагировали с помощью ДХМ, затем сушили (Na2SO4) и выпаривали в вакууме и получали искомое соединение (160 мг) в виде желтого твердого вещества. ЖХМС (ЭР+) 372 (М+Н)+, ВУ 1,394 мин. Промежуточный продукт 63N-[8-Хлор-2-(пиридин-3-ил)хинолин-3-ил]мет-(Е)-илиденамид 2-метилпропан-2(R)-сульфиновой кислоты Изопропоксид титана(IV) (3,6 г, 12,6 ммоль) добавляли к суспензии промежуточного продукта 1(1,7 г, 6,33 ммоль) в безводном ТГФ (20 мл). Смесь перемешивали при КТ в течение 10 мин. Добавляли(R)-2-метил-2-пропансульфинамид (0,84 г, 6,96 ммоль) и смесь перемешивали при 50 С в течение 3 ч. Реакционной смеси давали охладиться до КТ, затем ее выливали в рассол (50 мл) и фильтровали через целит, промывая с помощью EtOAc. Фильтрат промывали рассолом, сушили (Na2SO4) и концентрировали в вакууме. Очистка с помощью колоночной хроматографии (SiO2, 30-100% EtOAc в гексане) давала искомое соединение (1,88 г, 91%) в виде желтовато-коричневого твердого вещества. H (ДМСО-d6) 9,20(S)-1-[8-Хлор-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламид 2-метилпропан-2(R)-сульфиновой кислоты Смесь промежуточного продукта 63 (0,69 г, 1,86 ммоль) и дифтортрифенилсиликата тетрабутиламмония (1,1 г, 2,04 ммоль) в безводном ТГФ (20 мл) охлаждали до -78 С. Добавляли (трифторметил)триметилсилан (0,32 г, 2,23 ммоль) и смесь перемешивали при температуре, равной от -78 С до КТ, в течение 4 ч. Добавляли насыщенный водный раствор хлорида аммония (5 мл). Смесь подвергали распределению между EtOAc и водой. Водную фазу экстрагировали дополнительным количеством EtOAc и объединенные органические фракции промывали рассолом, затем сушили (Na2SO4) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 65-90% EtOAc в гексане) и затем с использованием второй колонки (SiO2, 20-80% EtOAc в гексане) и получали искомое соединение (0,42 г,51%) в виде бледно-коричневого смолообразного вещества. H (ДМСО-d6) 9,02 (s, 1H), 8,80 (dd, J 4,9, 1,7 Гц, 1 Н), 8,78 (dd, J 2,3, 0,6 Гц, 1 Н), 8,15-8,09 (m, 2H), 8,04-7,99 (m, 1H), 7,77-7,71 (m, 1 Н), 7,67 (ddd, J 7,9,4,9, 0,8 Гц, 1 Н), 6,65 (d, J 8,5 Гц, 1 Н), 5,12-5,00 (m, 1 Н), 1,15 (s, 9H). ЖХМС (ЭР+) 442 (М+Н)+, ВУ 2,37 мин. Промежуточный продукт 65(S)-1-[8-Хлор-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламин К раствору промежуточного продукта 64 (0,42 г, 0,952 ммоль) в метаноле (10 мл) добавляли 4 н. раствор HCl в 1,4-диоксане (1 мл, 4,0 ммоль). Смесь перемешивали при КТ в течение 1 ч. Растворитель удаляли в вакууме и остаток растирали с диэтиловым эфиром (2). Затем остаток подвергали распределению между ДХМ и насыщенным водным раствором NaHCO3. Водную фазу экстрагировали дополнительным количеством ДХМ и объединенные органические фракции промывали рассолом, затем сушили(Na2SO4) и выпаривали в вакууме и получали искомое соединение (0,184 г, 57%) в виде желтого смолообразного вещества. ЖХМС (ЭР+) 338 (М+Н), ВУ 1,52 мин. Промежуточный продукт 66N-(S)-1-[8-Хлор-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтилацетамид Раствор промежуточного продукта 65 (0,50 г, 1,48 ммоль) в уксусной кислоте (10 мл) нагревали при 60 С в течение 16 ч. Растворитель удаляли в вакууме и остаток подвергали распределению между ДХМ и насыщенным водным раствором NaHCO3. Водную фазу экстрагировали дополнительным количеством ДХМ и объединенные органические фракции промывали рассолом, затем сушили (Na2SO4) и выпаривали в вакууме и получали искомое соединение (0,55 г, 98%) в виде желтого смолообразного вещества. ЖХМС (ЭР+) 380,2 (М+Н)+, ВУ 1,27 мин. Промежуточный продукт 67N-(S)-1-[8-Хлор-2-(1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтилацетамид При перемешивании раствор промежуточного продукта 66 (550 мг, 1,45 ммоль) в ДХМ (30 мл) охлаждали до 0 С. Добавляли МХПБК (м-хлорпероксибензойная кислота) (650 мг, 2,90 ммоль) и смеси в течение 3 ч давали медленно нагреться до КТ. Реакционную смесь подвергали распределению между ДХМ и насыщенным водным раствором NaHCO3. Водную фазу экстрагировали дополнительным количеством ДХМ и объединенные органические фракции промывали рассолом, сушили (Na2SO4) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 0-15% МеОН в EtOAc) и получали искомое соединение (506 мг, 88%) в виде бесцветного смолообразного вещества. ЖХМС (ЭР+) 396 (М+Н)+, ВУ 1,75 мин.(S)-1-[8-Хлор-2-(1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламин Смесь промежуточного продукта 67 (0,506 г, 1,28 ммоль) и концентрированной HCl (5 мл) в воде (5 мл) и этаноле (10 мл) нагревали при 70 С в течение 40 ч. Растворитель удаляли в вакууме и остаток подвергали распределению между ДХМ и насыщенным водным раствором NaHCO3. Водную фазу экстрагировали дополнительным количеством ДХМ и объединенные органические фракции промывали рассолом, затем сушили (Na2SO4) и выпаривали в вакууме и получали искомое соединение (0,344 г, 76%) в виде желтовато-коричневого твердого вещества. ЖХМС (ЭР+) 354,0 (М+Н)+, ВУ 1,41 мин. Промежуточный продукт 69 2-(Пиридин-3-ил)хинолин-3-карбальдегид Смесь 2-хлорхинолин-3-карбальдегида (5,0 г, 26,1 ммоль), Na2CO3 (4,15 г, 39,1 ммоль) и диэтил(3 пиридил)борана (4,22 г, 28,7 ммоль) в ДМЭ (100 мл) и воде (30 мл) дегазировали путем пропускания через смесь азота в течение 5 мин. Добавляли тетракис(трифенилфосфин)палладий(0) (0,30 г, 0,261 ммоль) и смесь нагревали при 90 С в течение 5 ч. Смеси давали охладиться до комнатной температуры. Полученный осадок отфильтровывали и промывали водой (550 мл) и диэтиловым эфиром (550 мл) и получали искомое соединение (4,3 г, 70%) в виде бледно-зеленого твердого вещества. ЖХМС (ЭР+) 235N-[2-(Пиридин-3-ил)хинолин-3-ил]мет-(Е)-илиденамид 2-метилпропан-2(S)-сульфиновой кислоты Изопропоксид титана(IV) (6,07 г, 21,4 ммоль) добавляли к суспензии промежуточного продукта 69(2,5 г, 10,7 ммоль) в безводном ТГФ (80 мл). Смесь перемешивали при КТ в течение 10 мин. Добавляли(S)-2-метил-2-пропансульфинамид (1,42 г, 11,7 ммоль) и смесь перемешивали при 50 С в течение 3 ч. Реакционной смеси давали охладиться до КТ, затем ее выливали в рассол (50 мл) и фильтровали через целит, промывая с помощью EtOAc. Фильтрат промывали рассолом, сушили (Na2SO4) и концентрировали в вакууме и получали искомое соединение (3,6 г, 99%) в виде желтовато-коричневого твердого вещества. ЖХМС (ЭР+) 338 (М+Н)+, ВУ 2,01 мин. Промежуточный продукт 71(R)-1-[2-(Пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламид 2-метилпропан-2(S)-сульфиновой кислоты Смесь промежуточного продукта 70 (3,6 г, 10,7 ммоль) и дифтортрифенилсиликата тетрабутиламмония (6,35 г, 11,8 ммоль) в безводном ТГФ (60 мл) охлаждали до -40 С. Добавляли (трифторметил)триметилсилан (2,28 г, 16,1 ммоль) и смесь перемешивали при -40 С в течение 1 ч. Добавляли насыщенный водный раствор хлорида аммония (5 мл) и реакционной смеси давали нагреться до КТ. Растворитель удаляли в вакууме и остаток подвергали распределению между EtOAc и водой. Водную фазу экстрагировали дополнительным количеством EtOAc и объединенные органические фракции промывали рассолом,затем сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 60-100% EtOAc в гексане) и получали искомое соединение (1,9 г, 44%) в виде желтого смолообразного вещества. ЖХМС (ЭР+) 408 (М+Н)+, ВУ 1,80 мин. Промежуточный продукт 72(R)-1-[2-(Пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламин К раствору промежуточного продукта 71 (0,90 г, 2,21 ммоль) в метаноле (10 мл) добавляли 4 н. раствор HCl в 1,4-диоксане (2 мл, 8,0 ммоль). Смесь перемешивали при КТ в течение 2 ч. Растворитель удаляли в вакууме и остаток растирали с диэтиловым эфиром (2). Затем остаток подвергали распределению между ДХМ и насыщенным водным раствором NaHCO3. Водную фазу экстрагировали дополнительным количеством ДХМ и объединенные органические фракции промывали рассолом, затем сушили (Na2SO4) и выпаривали в вакууме и получали искомое соединение (0,86 г, количественный выход) в виде желтого смолообразного вещества. ЖХМС (ЭР+) 304 (М+Н)+, ВУ 1,57 мин. Промежуточный продукт 73 8-Хлор-2-(6-хлорпиридин-3-ил)хинолин-3-карбальдегид Смесь 2,8-дихлорхинолин-3-карбальдегида (2,6 г, 11,5 ммоль), Na2CO3 (1,83 г, 17,3 ммоль) и 2 хлорпиридин-5-илбороновой кислоты (1,81 г, 11,5 ммоль) в 1,4-диоксане (40 мл) и воде (20 мл) дегазировали путем пропускания через смесь азота в течение 5 мин. Добавляли тетракис(трифенилфосфин)палладий(0) (0,13 г, 0,115 ммоль) и смесь нагревали при 90 С в течение 16 ч. Смеси давали охладиться до комнатной температуры. Полученный осадок отфильтровывали и промывали водой (550 мл) и диэтиловым эфиром (550 мл) и получали искомое соединение (4,3 г, 70%) в виде желтовато-коричневого твердого вещества. ЖХМС (ЭР+) 305 (М+Н)+, ВУ 1,54 мин. Промежуточный продукт 74N-[8-Хлор-2-(6-хлорпиридин-3-ил)хинолин-3-ил]мет-(Е)-илиденамид 2-метилпропан-2(S)-сульфиновой кислоты Изопропоксид титана(IV) (5,04 г, 17,8 ммоль) добавляли к суспензии промежуточного продукта 73(2,69 г, 8,88 ммоль) в безводном ТГФ (80 мл). Смесь перемешивали при КТ в течение 10 мин. Добавляли(S)-2-метил-2-пропансульфинамид (1,18 г, 9,77 ммоль) и смесь перемешивали при 50 С в течение 3 ч. Реакционной смеси давали охладиться до КТ, затем ее выливали в рассол (50 мл) и фильтровали через целит, промывая с помощью EtOAc. Фильтрат промывали рассолом, сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 25-80% EtOAc в гексане) и получали искомое соединение (1,98 г, 55%) в виде бледно-желтого твердого вещества. ЖХМС (ЭР+) 406,2 (М+Н)+, ВУ 1,68 мин. Промежуточный продукт 75(R)-1-[8-Хлор-2-(6-хлорпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламид 2-метилпропан-2(S)сульфиновой кислоты Смесь промежуточного продукта 74 (1,97 г, 4,85 ммоль) и ацетата тетрабутиламмония (1,61 г, 5,34 ммоль) в безводном ТГФ (50 мл) охлаждали до -40 С. Добавляли (трифторметил)триметилсилан (1,38 г,9,70 ммоль) и смесь перемешивали при -40 С в течение 2 ч. Добавляли насыщенный водный раствор хлорида аммония (5 мл) и реакционной смеси давали нагреться до КТ. Растворитель удаляли в вакууме и остаток подвергали распределению между EtOAc и водой. Водную фазу экстрагировали дополнительным количеством EtOAc и объединенные органические фракции промывали рассолом, затем сушили(Na2SO4) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 1565% EtOAc в гексане) и получали искомое соединение (0,50 г, 22%) в виде желтого смолообразного вещества. ЖХМС (ЭР+) 476 (М+Н)+, ВУ 2,67 мин. Промежуточный продукт 76(R)-1-[8-Хлор-2-(6-хлорпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламин К раствору промежуточного продукта 75 (0,50 г, 1,05 ммоль) в метаноле (20 мл) добавляли 4 н. раствор HCl в 1,4-диоксане (5 мл, 20,0 ммоль). Смесь перемешивали при КТ в течение 2 ч. Растворитель удаляли в вакууме и остаток подвергали распределению между ДХМ и насыщенным водным растворомNaHCO3. Водную фазу экстрагировали дополнительным количеством ДХМ и объединенные органические фракции промывали рассолом, затем сушили (Na2SO4) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 30-70% EtOAc в гексане) и получали искомое соединение(0,37 г, 95%) в виде желтого смолообразного вещества. ЖХМС (ЭР+) 372,2 (М+Н)+, ВУ 1,56 мин. Промежуточный продукт 77 Этиловый эфир 2-[(гидрокси)(2-метилпиридин-3-ил)метил]акриловой кислоты К 2-метилпиридин-3-карбальдегиду (5 г, 0,04 моль) в этилакрилате (10 мл) добавляли ДАБЦО (1 г,0,01 моль) и метанол (1 мл). Реакционную смесь перемешивали при 45 С в течение 3 дней. Затем реакционную смесь концентрировали и очищали с помощью колоночной хроматографии (SiO2, 60-100%EtOAc/ДХМ) и получали искомое соединение (62%) в виде бесцветного масла. H (ДМСО-d6) 8,32 (dd, J 4,8, 1,7 Гц, 1 Н), 7,51 (dd, J 7,7, 1,7 Гц, 1H), 7,17 (dd, J 7,7, 4,8 Гц, 1 Н), 6,28 (t, J 1,3 Гц, 1 Н), 5,91 (t, J 1,6 Гц,1 Н), 5,78 (d, J 5,0 Гц, 1 Н), 5,62 (d, J 5,0 Гц, 1H), 4,10-4,00 (m, 2 Н), 3,29 (s, 3 Н), 1,10 (t, J 7,0 Гц, 3 Н). ЖХМС (ЭР+) 222 (М+Н)+, ВУ 1,11 мин. Промежуточный продукт 78 Этиловый эфир 2-(2-метилпиридин-3-ил)-8-(трифторметил)хинолин-3-карбоновой кислоты К дегазированной смеси 2-амино-3-бромбензотрифторида (3,2 г, 17 ммоль), промежуточного продукта 77 (3,3 г, 15 ммоль), три(о-толил)фосфина (256 мг) и триэтиламина (4 мл) в пропионитриле (40 мл) при комнатной температуре добавляли ацетат палладия(II) (120 мг, 5 мол.%). Смесь повторно дегазировали и нагревали при 110 С в течение 2 ч, затем разбавляли водой (20 мл) и с помощью EtOAc (100 мл). Водный слой отделяли и экстрагировали с помощью EtOAc (100 мл). Объединенные органические фракции промывали рассолом (10 мл), сушили (Na2SO4), фильтровали и концентрировали в вакууме и получали желтое масло. Полученное неочищенное вещество растворяли в хлорбензоле (30 мл), обрабатывали с помощью MnO2 (6 г) и нагревали при 60 С в течение 2 ч, затем при 100 С в течение 4 ч. Смесь фильтровали через слой целита (при 70 С), промывали с помощью ДХМ и концентрировали в вакууме. Полученное темное масло очищали с помощью колоночной хроматографии (SiO2, от гексана до 40% EtOAc) и получали искомое соединение (3,3 г, 66%) в виде коричневого масла. H (ДМСО-d6) 8,87 (s, 1 Н), 8,59 (dd,J 4,9, 1,7 Гц, 1 Н), 8,18 (m, 2H), 7,70 (t, J 7,7 Гц, 1 Н), 7,59 (dd, J 7,7, 1,7 Гц, 1 Н), 7,23 (dd, J 7,6, 4,9 Гц, 1H),4,18 (q, J 7,1 Гц, 2H), 2,48 (s, 3H), 1,06 (t, J 7,1 Гц, 3 Н). ЖХМС (ЭР+) 361,2 (M+H)+. Промежуточный продукт 79 2-(2-Метилпиридин-3-ил)-8-(трифторметил)хинолин-3-карбальдегид К холодному (-50 С) раствору промежуточного продукта 79 (3,3 мл, 9,3 ммоль) в толуоле (50 мл) по каплям добавляли DIBAL-H (27,6 мл 1 М раствора в ДХМ). Смеси в течение 2 ч давали нагреваться до комнатной температуры, ее перемешивали при этой температуре в течение еще 30 мин, затем охлаждали до -78 С, затем по каплям добавляли 1 М водный раствор NaOH (45 мл), позволяя температуре повыситься до температуры окружающей среды. Органическую фазу отделяли и водную фазу экстрагировали с помощью EtOAc (30 мл). Объединенные органические фракции промывали 2 М водным раствором NaOH(1,7 г), нагревали при 70 С в течение 4 ч, фильтровали через слой целита, промывали с помощью ДХМ и концентрировали в вакууме. Полученное неочищенное твердое вещество промывали диэтиловым эфиром и получали искомое соединение (2,3 г, 78%) в виде белого порошкообразного вещества. H (ДМСОd6) 9,97 (s, 1H), 9,23 (s, 1H), 8,63 (m, 2 Н), 8,41 (d, J 7,0 Гц, 1 Н), 7,92 (t, J 7,8 Гц, 1 Н), 7,82 (dd, J 7,7, 1,7 Гц,1 Н), 7,41 (dd, J 7,5, 5,0 Гц, 1 Н), 2,39 (s, 3 Н). ЖХМС (ЭР+) 317,2 (М+Н)+. Промежуточный продукт 80N-[2-(2-Метилпиридин-3-ил)-8-(трифторметил)-хинолин-3-ил]мет-(Е)-илиденамид 2-метилпропан 2(S)-сульфиновой кислоты К раствору промежуточного продукта 79 (2,0 г, 6,3 ммоль) в ТГФ (15 мл) при комнатной температуре добавляли изопропоксид титана(IV) (3,5 мл). Смесь перемешивали в течение 15 мин, затем добавляли (S)-2-метил-2-пропансульфинамид (0,91 г, 7,5 ммоль) и затем нагревали при 50 С в течение 2 ч. После охлаждения до комнатной температуры добавляли воду (10 мл) и полученный осадок отфильтровывали через слой целита. Фильтрат концентрировали в вакууме и получали искомое соединение (2,2 г, 83%) в виде бледно-желтого масла. H (CDCl3) 8,96 (s, 1H), 8,66 (dd, J 4,9, 1,7 Гц, 1 Н), 8,58 (s, 1H), 8,22 (d, J 7,9 Гц, 2 Н), 7,73 (t, J 7,8 Гц, 1 Н), 7,59 (dd, J 7,7, 1,6 Гц, 1 Н), 7,30 (m, 1H), 2,06 (s, 3H), 1,26 (s, 9H). ЖХМС(R)-1-[2-(2-Метилпиридин-3-ил)-8-(трифторметил)хинолин-3-ил]-2,2,2-трифторэтиламид 2-метилпропан-2-(S)-сульфиновой кислоты К раствору промежуточного продукта 80 (2,2 г, 5,2 ммоль) в ТГФ (25 мл) добавляли ацетат тетрабутиламмония (1,9 г) и смесь охлаждали до -30 С, затем по каплям добавляли (трифторметил)триметилсилан (1,7 мл). После перемешивания в течение 1,5 ч добавляли рассол (25 мл), смеси давали нагреваться до комнатной температуры и перемешивание продолжали в течение еще 15 мин. ДобавлялиEtOAc (50 мл), затем органическую фракцию отделяли, промывали рассолом (20 мл), водой (20 мл) и рассолом (20 мл), сушили (Na2SO4), фильтровали и концентрировали в вакууме. Полученное бледножелтое твердое вещество обрабатывали с помощью колоночной хроматография (SiO2, от гексана до 40%EtOAc) и получали искомое соединение (0,90 г, 35%) в виде бледно-желтого масла. H (CDCl3) 8,52 (dd, J 4,9, 1,6 Гц, 1 Н), 8,35 (s, 1H), 8,01 (m, 1H), 7,96 (d, J 8,3 Гц, 1 Н), 7,77 (dd, J 7,6, 1,4 Гц, 1 Н), 7,54 (t, J 7,6 Гц,1 Н), 7,23 (dd, J 7,6, 5,0 Гц, 1 Н), 4,85 (t, J 7,4 Гц, 1 Н), 3,83 (d, J 7,7 Гц, 1 Н), 2,28 (s, 3H), 1,13 (s, 9H). ЖХМС(R)-1-[2-(2-Метилпиридин-3-ил)-8-(трифторметил)хинолин-3-ил]-2,2,2-трифторэтиламин К раствору промежуточного продукта 81 (0,86 г, 1,8 ммоль) в ДХМ (10 мл) добавляли HCl (1,25 мл 4 М раствора в 1,4-диоксане). К полученной твердой суспензии добавляли МеОН (10 мл) и перемешивание продолжали в течение 10 мин. Смесь подвергали распределению между ДХМ (20 мл) и насыщенным водным раствором NaHCO3 (20 мл). Органическую фазу отделяли и водную фазу экстрагировали с помощью ДХМ (10 мл). Объединенные органические фазы сушили (Na2SO4), фильтровали и концентрировали в вакууме и получали искомое соединение (664 мг, 95%) в виде бледно-желтого масла. H (CDCl3) 8,68 (d, J 4,7 Гц, 1H), 8,62 (s, 1H), 8,16 (m, 2H), 7,71 (t, J 7,9 Гц, 2H), 7,34 (m, 1H), 4,50 (m, 1H), 3,82 (s,2H), 2,45 (d, J 26,8 Гц, 3 Н). ЖХМС (ЭР+) 386,2 (M+H)+. Промежуточный продукт 83N-(R)-1-[2-(2-Метилпиридин-3-ил)-8-(трифторметил)хинолин-3-ил]-2,2,2-трифторэтилацетамид Промежуточный продукт 82 (660 мг, 1,7 ммоль) растворяли в АсОН (8 мл) и нагревали при 60 С в течение ночи и затем при 70 С в течение 2 ч. Смесь концентрировали в вакууме и остаток очищали с помощью колоночной хроматографии (SiO2, от гексана до 100% EtOAc) и получали искомое соединение(550 мг, 76%) в виде белого вспененного вещества. H (CDCl3) 8,69 (m, 1 Н), 8,49 (m, 1 Н), 8,19 (m, 2 Н),8,14 (m, 1 Н), 7,73 (t, J 7,7 Гц, 1 Н), 7,47 (m, 1 Н), 6,65 (m, 1H), 5,85 (m, 1 Н), 2,53 (s, 3 Н), 2,17 (s, 3 Н). ЖХМС(R)-1-[2-(2-Метил-1-оксипиридин-3-ил)-8-(трифторметил)хинолин-3-ил]-2,2,2-трифторэтиламин К раствору промежуточного продукта 83 (0,50 г, 1,2 ммоль) в ДХМ (10 мл) при комнатной температуре одной порцией добавляли МХПБК (0,46 г). Через 1,5 ч смесь подвергали распределению между ДХМ (50 мл) и 1 н. водным раствором NaOH (30 мл). Водный слой подкисляли лимонной кислотой (10% водный раствор) и экстрагировали с помощью ДХМ (220 мл), сушили (с помощью устройства для разделения фаз) и концентрировали в вакууме. Полученное белое порошкообразное вещество обрабатывали с помощью EtOH (5 мл) и концентрированной HCl (5 мл) и нагревали при 55 С в течение ночи. Смесь охлаждали и концентрировали в вакууме и остаток подвергали распределению между водой (10 мл) и ДХМ (10 мл). Добавляли насыщенный водный раствор NaHCO3 до установления значение рН водного слоя, равного 5, и смесь экстрагировали с помощью ДХМ (410 мл). Объединенные органические слои сушили (с помощью устройства для разделения фаз) и концентрировали в вакууме. Полученное желтое масло очищали с помощью колоночной хроматографии (SiO2, 23:2 EtOAc:MeOH) и получали искомое(M+H)+. Промежуточный продукт 85 2-Бром-6-(метансульфонил)фениламин 2-Бром-6-(метилсульфанил)фениламин (2 г, 10,7 ммоль) в ДХМ (100 мл) при КТ обрабатывали с помощью МХПБК (4 г, 23,2 ммоль) и перемешивали в течение 30 мин. Реакционную смесь промывали насыщенным водным раствором гидрокарбоната натрия, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме и получали искомое соединение. H (ДМСО-d6) 7,77 (dd, J 7,8, 1,4 Гц, 1 Н),7,63 (dd, J 8,0, 1,4 Гц, 1H), 6,73 (t, J 7,9 Гц, 1 Н), 6,03 (s, 2 Н), 3,18 (s, 3 Н). ЖХМС (ЭР+) 250 (М+Н)+, ВУ 1,175 мин. Промежуточный продукт 86 Этиловый эфир 8-(метансульфонил)-2-(2-метилпиридин-3-ил)-1,4-дигидрохинолин-3-карбоновой кислоты Промежуточный продукт 85 (1,2 г, 4,9 ммоль), промежуточный продукт 77 (1,2 г, 5,4 ммоль), ацетат палладия(II) (54,0 мг, 0,05 ммоль), три(о-толил)фосфин (149,0 мг, 0,1 ммоль) и триэтиламин (1,33 мл, 2,0 ммоль) в ацетонитриле (10 мл) дегазировали и нагревали при 100 С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме и очищали с помощью колоночной хроматографии (SiO2, 60% этилацетата/гексаны) и получали искомое соединение (57%) в виде палевого твердого вещества. H (ДМСОd6) 8,50 (dd, J 4,9, 1,7 Гц, 1 Н), 8,19 (s, 1H), 7,67-7,60 (dt, J 7,6, 1,7 Гц, 2 Н), 7,53 (d, J 7,6 Гц, 1 Н), 7,29 (dd, J 7,6, 4,9 Гц, 1H), 7,16 (t, J 7,7 Гц, 1H), 3,89 (s, 2H), 3,85-3,77 (m, 2H), 3,24 (s, 3H), 2,42 (s, 3H), 0,81 (t, J 7,1 Гц, 3 Н). ЖХМС (ЭР+) 373 (M+H)+, ВУ 1,49 мин. Промежуточный продукт 87 Этиловый эфир 8-(метансульфонил)-2-(2-метилпиридин-3-ил)хинолин-3-карбоновой кислоты Промежуточный продукт 86 (880 мг, 2,46 ммоль) в ДХМ (40 мл) обрабатывали порциями диоксида марганца (1,0 г) и перемешивали при 45 С в течение 4 ч. Реакционную смесь фильтровали и концентрировали в вакууме и получали искомое соединение (79%) в виде палевого твердого вещества. H (ДМСОd6) 9,24 (s, 1 Н), 8,63 (dd, J 8,3, 1,4 Гц, 1H), 8,58-8,54 (m, 2H), 7,96 (dd, J 8,1, 7,5 Гц, 1H), 7,68 (dd, J 7,7, 1,7 Гц, 1H), 7,36 (dd, J 7,6, 4,9 Гц, 1H), 4,18-4,11 (q, J 7,1 Гц, 2H), 3,51 (s, 3H), 2,33 (s, 3H), 1,02 (t, J 7,1 Гц,3 Н). ЖХМС (ЭР+) 371 (M+H)+, ВУ 1,35 мин. Промежуточный продукт 88[8-(Метансульфонил)-2-(2-метилпиридин-3-ил)хинолин-3-ил]метанол Промежуточный продукт 87 (1,9 г, 5,3 ммоль) в толуоле (20 мл) охлаждали до -78 С и обрабатывали с помощью DIBAL-H (1M раствор в ДХМ, 16 мл, 16 ммоль). После перемешивания в течение 1 ч реакцию останавливали 1 М водным раствором NaOH, смесь экстрагировали этилацетатом, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное вещество очищали с помощью колоночной хроматографии (SiO2, 2% метанола/EtOAc) и получали искомое соединение (59%) в виде палевого твердого вещества. H (ДМСО-d6) 8,71 (s, 1H), 8,59 (dd, J 4,9, 1,7 Гц, 1H), 8,49 (dd, J 8,1, 1,3 Гц, 1 Н), 8,40(dd, J 7,4, 1,4 Гц, 1 Н), 7,85 (dd, J 8,1, 7,4 Гц, 1 Н), 7,77 (dd, J 7,7, 1,7 Гц, 1 Н), 7,38 (m, 1H), 5,53 (t, J 5,1 Гц,1H), 4,52-4,43 (br s, 1H), 4,36 (d, J 4,4 Гц, 1 Н), 3,49 (s, 3H), 2,26 (s, 3 Н). ЖХМС (ЭР+) 329 (M+H)+, ВУ 1,10 мин. Промежуточный продукт 89 8-(Метансульфонил)-2-(2-метилпиридин-3-ил)хинолин-3-карбальдегид Промежуточный продукт 88 (1,8 г, 5,3 ммоль) в ДХМ (80 мл) обрабатывали порциями диоксида марганца (2,0 г) и перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь фильтровали, концентрировали в вакууме и очищали с помощью колоночной хроматографии (SiO2, EtOAc) и получали искомое соединение (83%) в виде палевого твердого вещества. H (ДМСО-d6) 9,98 (s, 1 Н), 9,27N-[8-(Метансульфонил)-2-(2-метилпиридин-3-ил)-хинолин-3-ил]мет-(Е)-илиденамид 2-метилпропан-2(S)-сульфиновой кислоты Промежуточный продукт 89 (1,1 г, 3,3 ммоль) и (S)-2-метил-2-пропансульфинамид (436 мг, 6,6 ммоль) смешивали и перемешивали в безводном ТГФ в течение 10 мин. Добавляли изопропоксид титана(IV) (1,95 мл, 6,6 ммоль) и реакционную смесь нагревали при 45 С в течение 12 ч. Реакционную смесь выливали в воду, экстрагировали этилацетатом, сушили над сульфатом натрия и концентрировали и получали искомое соединение (94%) в виде палевого твердого вещества. ЖХМС (ЭР+) 430,0 (М+Н)+, ВУ 1,33 мин. Промежуточный продукт 91 Промежуточный продукт 90 (1,4 г, 3,3 ммоль) в безводном ТГФ охлаждали до -40 С. Добавляли ацетат тетрабутиламмония (1,0 г, 3,6 ммоль) и реакционную смесь перемешивали в течение 10 мин. Затем добавляли (трифторметил)триметилсилан (0,94 г, 6,6 ммоль) и реакционную смесь перемешивали в течение 1 ч. Добавляли насыщенный водный раствор хлорида аммония (15 мл) и реакционной смеси давали нагреться до КТ. Растворитель удаляли в вакууме и остаток подвергали распределению между ДХМ и водой. Органическую фазу промывали рассолом (30 мл), сушили (с помощью устройства для разделения фаз) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 60100% EtOAc в гексане) и получали искомое соединение (53%) в виде белого вспененного вещества. H(ДМСО-d6; смесь поворотных изомеров состава 1:1) 9,08 (m, 1H), 8,58 (m, 1H), 8,45 (m, 2 Н), 7,85 (m, 1 Н),7,87 (т, 0,5 Н), 7,57 (m, 0,5 Н), 7,34 (m, 1 Н), 6,53 (m, 1H), 4,64 (m, 1H), 3,40 (s, 3 Н), 2,29 (s, 1,5H), 2,20 (s,1,5H), 1,10 (s, 4,5H), 1,04 (s, 4,5 Н). Промежуточный продукт 92(R)-1-[8-(Метансульфонил)-2-(2-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламин Промежуточный продукт 91 (1,2 г, 2,5 ммоль) в ДХМ (5 мл) обрабатывали 4 М раствором HCl в 1,4 диоксане (20 мл) и перемешивали при КТ в течение 30 мин. Добавляли метанол (5 мл) и реакционную смесь перемешивали в течение еще 30 мин. Реакционную смесь концентрировали и подвергали распределению между ДХМ и насыщенным водным раствором гидрокарбоната натрия. Органическую фазу сушили и концентрировали и получали искомое соединение (96%) в виде палевого твердого вещества. ЖХМС (ЭР+) 396,0 (М+Н)+, ВУ 1,25 мин. Промежуточный продукт 93 Этиловый эфир 2-[(гидрокси)(пиридин-3-ил)метил]акриловой кислоты К раствору никотинового альдегида (10,0 г, 93,4 ммоль) в этилакрилате (20 мл, 200 ммоль) при комнатной температуре добавляли ДАБЦО (0,5 г, 4,5 ммоль) и смесь перемешивали в течение ночи. Избыток этилакрилата удаляли в вакууме. Полученное неочищенное вещество твердое вещество промывали гексаном и получали искомое соединение (18,5 г, 95%) в виде почти белого твердого вещества. H(CDCl3) 8,62 (d, J 1,7 Гц, 1 Н), 8,53 (dd, J 4,8, 1,3 Гц, 1 Н), 7,81 (d, J 7,9 Гц, 1H), 7,28 (s, 1H), 6,42 (s, 1H),5,93 (s, 1H), 5,63 (s, 1H), 4,18 (m, 2H), 3,20 (br s, 1H), 1,27 (t, J 7,1 Гц, 3 Н). ЖХМС (ЭР+) 208,2 (M+H)+. Промежуточный продукт 94 Этиловый эфир 8-(метансульфонил)-2-(пиридин-3-ил)-1,4-дигидрохинолин-3-карбоновой кислоты Промежуточный продукт 85 (500 мг, 2,0 ммоль), промежуточный продукт 93 (455 мг, 2,2 ммоль),ацетат палладия(II) (22,5 мг, 0,01 ммоль), три(о-толил)фосфин (60 мг, 0,02 ммоль) и триэтиламин (0,56 мл, 4,0 ммоль) в ацетонитриле (5 мл) дегазировали и нагревали при 120 С в течение 3 ч. Реакционную смесь концентрировали в вакууме и хроматографировали (SiO2, 0-100% ДХМ-этилацетат) и получали искомое соединение (440 мг). H (ДМСО-d6) 9,18 (s, 1H), 8,88 (d, J 1,9 Гц, 1 Н), 8,73 (dd, J 4,8, 1,6 Гц, 1 Н),8,61 (dd, J 8,2, 1,3 Гц, 1H), 8,55 (dd, J 7,4, 1,4 Гц, 1H), 8,10 (m, 1 Н), 7,95 (m, 1 Н), 7,60 (ddd, J 7,8, 4,8, 0,5 Гц, 1 Н), 4,27 (q, J 7,1 Гц, 2 Н), 3,60 (s, 3 Н), 1,15 (t, J 7,1 Гц, 3 Н). ЖХМС (ЭР+) 359 (М+Н)+, ВУ 1,331 мин. Промежуточный продукт 95 Этиловый эфир 8-(метансульфонил)-2-(пиридин-3-ил)хинолин-3-карбоновой кислоты Промежуточный продукт 94 (440 мг, 1,23 ммоль) в ДХМ (20 мл) обрабатывали порциями диоксида марганца (500 мг) и перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь фильтровали и концентрировали в вакууме и получали искомое соединение (355 мг, 80%). H (ДМСО-d6) 9,18(s, 1H), 8,88 (d, J 1,9 Гц, 1 Н), 8,73 (dd, J 4,8, 1,6 Гц, 1 Н), 8,61 (dd, J 8,2, 1,3 Гц, 1H), 8,55 (dd, J 7,4, 1,4 Гц,1H), 8,10 (m, 1H), 7,95 (m, 1H), 7,60 (m, 1H), 4,27 (q, J 7,1 Гц, 2H), 3,60 (s, 3H), 1,15 (t, J 7,1 Гц, 3 Н). ЖХМС (ЭР+) 357 (M+H)+, ВУ 1,237 мин. Промежуточный продукт 96 8-(Метансульфонил)-2-(пиридин-3-ил)хинолин-3-карбальдегид Промежуточный продукт 95 (1,9 г, 5,3 ммоль) в толуоле (20 мл) охлаждали до -78 С и обрабатывали с помощью 1 М раствора DIBAL-H (16 мл, 16 ммоль) в ДХМ. После перемешивания в течение 1 ч реакцию останавливали солью Рошеле, смесь экстрагировали этилацетатом, сушили над сульфатом натрия и концентрировали в вакууме. Полученное вещество (1,67 г, 5,3 ммоль) суспендировали в ДХМ и обрабатывали диоксидом марганца (2 г). После перемешивания при КТ в течение 90 мин реакционную смесь фильтровали и оставшееся твердое вещество промывали смесью метанол-ДХМ состава 1:1. Фильтрат концентрировали в вакууме, затем очищали с помощью колоночной хроматографии (SiO2, ДХМэтилацетат) и получали искомое соединение (1,0 г). H (ДМСО-d6) 10,19 (s, 1H), 9,25 (s, 1H), 9,01 (dd, J 2,2, 0,6 Гц, 1H), 8,79 (dd, J 4,8, 1,7 Гц, 1 Н), 8,68 (dd, J 8,2, 1,3 Гц, 1 Н), 8,59 (dd, J 7,4, 1,4 Гц, 1 Н), 8,25 (m,1 Н), 7,97 (dd, J 8,1, 7,5 Гц, 1H), 7,66 (ddd, J 7,9, 4,8, 0,7 Гц, 1H), 3,62 (s, 3 Н). ЖХМС (ЭР+) 313 (М+Н)+, ВУ 1,084 мин. Промежуточный продукт 97N-[8-(Метансульфонил)-2-(пиридин-3-ил)хинолин-3-ил]мет-(Е)-илиденамид 2-метилпропан-2(S)сульфиновой кислоты Промежуточный продукт 96 (1 г, 3,3 ммоль) и (S)-2-метил-2-пропансульфинамид (436 мг, 6,6 ммоль) смешивали и перемешивали в ТГФ в течение 10 мин. Добавляли изопропоксид титана(IV) (1,95 мл, 6,6 ммоль) и реакционную смесь нагревали при 50 С в течение 3 ч. Реакционную смесь выливали в воду, экстрагировали этилацетатом, сушили над сульфатом натрия, концентрировали и хроматографировали (SiO2, гексан-ДХМ) и получали искомое соединение (1,4 г). H (ДМСО-d6) 9,32 (s, 1 Н), 8,92 (d, J 2,0 Гц, 1 Н), 8,80 (dd, J 4,8, 1,5 Гц, 1 Н), 8,67 (m, 2 Н), 8,55 (dd, J 7,3, 1,2 Гц, 1 Н), 8,16 (dt, J 7,9, 1,9 Гц, 1 Н), 7,95(R)-1-[8-(Метансульфонил)-2-(пиридин-3-ил)-хинолин-3-ил]-2,2,2-трифторэтиламид 2-метилпропан-2(S)-сульфиновой кислоты Промежуточный продукт 97 (1,37 г, 3,3 ммоль) в ТГФ охлаждали до -40 С. Добавляли дифтортрифенилсиликат тетрабутиламмония (1,96 г, 3,63 ммоль) и реакционную смесь перемешивали в течение 10 мин. Добавляли (трифторметил)триметилсилан (0,94 г, 6,6 ммоль) и реакционную смесь перемешивали в течение 1 ч. Реакционную смесь выливали в насыщенный водный раствор соли Рошеле, затем экстрагировали с помощью ДХМ, сушили над сульфатом натрия и концентрировали в вакууме. Хроматография(60% воды; 40% метанол) с обращенной фазой диоксида кремния давала искомое соединение (1,2 г). H(R)-1-[8-(Метансульфонил)-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламин Промежуточный продукт 98 (1,2 г, 2,47 ммоль) в ДХМ (5 мл) обрабатывали 4 М раствором HCl в 1,4-диоксане (20 мл) и перемешивали при КТ в течение 30 мин. Добавляли метанол (5 мл) и реакционную смесь перемешивали в течение еще 30 мин. Реакционную смесь концентрировали и подвергали распределению между ДХМ и насыщенным водным раствором гидрокарбоната натрия, сушили и концентрировали и получали искомое соединение (870 мг). H (ДМСО-d6) 9,05 (s, 1 Н), 8,89 (d, J 1,8 Гц, 1 Н), 8,78N-(R)-1-[8-Хлор-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтилацетамид Уксусный ангидрид (4,44 мл, 46,9 ммоль) добавляли к раствору промежуточного продукта 4 (15,08 г, 44,7 ммоль) в ТГФ (150 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч и затем концентрировали до объема, равного примерно 50 мл. Смесь разбавляли с помощью EtOAc(200 мл) и органический раствор промывали насыщенным водным раствором NaHCO3 (3200 мл) и рассолом (200 мл), затем сушили (MgSO4) и выпаривали в вакууме и получали искомое соединение (17,0 г,99%) в виде желто-оранжевого вспененного смолообразного вещества. H (ДМСО-d6) 9,40 (d, J 8,9 Гц,1 Н), 8,85 (s, 1H), 8,79 (dd, J 2,3, 0,6 Гц, 1 Н), 8,77 (dd, J 4,9, 1,7 Гц, 1 Н), 8,12 (dd, J 4,5, 1,1 Гц, 1 Н), 8,09 (dd,J 3,9, 1,1 Гц, 1 Н), 8,03 (ddd, J 7,8, 1,9, 1,9 Гц, 1 Н), 7,73 (dd, J 7,9, 7,9 Гц, 1H), 7,62 (ddd, J 7,8, 4,8, 0,7 Гц,1H), 6,01 (dq, J 8,1, 8,1 Гц, 1H), 1,95 (s, 3 Н). ЖХМС (рН 3) (ЭР+) 380 (М+Н)+, ВУ 1,58 мин. Промежуточный продукт 101N-(R)-1-[8-Хлор-2-(1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтилацетамид 3-Хлорпероксибензойную кислоту (13,5 г, 60,4 ммоль) при 0 С добавляли к раствору промежуточного продукта 100 (17,0 г, 44,7 ммоль) в ДХМ (250 мл). Реакционной смеси в течение 20 ч давали медленно нагреться до комнатной температуры. Смесь обрабатывали насыщенным водным растворомNaHCO3 (200 мл) и перемешивали в течение 3 ч. Затем смесь подкисляли 10% водным раствором HCl до рН 8 и органический слой отделяли. Водный слой экстрагировали с помощью ДХМ (2100 мл) и объединенные органические фазы промывали насыщенным водным раствором NaHCO3 (200 мл) и рассолом(100 мл), затем сушили (MgSO4) и выпаривали в вакууме и получали искомое соединение (17,7 г, 99%) в виде оранжевого вспененного смолообразного вещества. H (ДМСО-d6) 9,36 (d, J 8,7 Гц, 1 Н), 8,82 (s,1H), 8,44-8,43 (s, 1H), 8,40 (ddd, J 6,4, 1,7, 0,9 Гц, 1H), 8,15-8,09 (m, 2 Н), 7,75 (dd, J 7,9, 7,9 Гц, 1H), 7,647,59 (m, 1H), 7,54-7,50 (m, 1H), 5,97 (qd, J 8,3, 8,3 Гц, 1 Н), 1,93 (s, 3 Н). ЖХМС (ЭР+) 396 (M+H)+, ВУ 1,12 мин. Промежуточный продукт 102(R)-1-[8-Хлор-2-(1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтиламин Смесь концентрированной HCl (100 мл) и воды (65 мл) добавляли к раствору промежуточного продукта 101 (17,7 г, 44,7 ммоль) в этаноле (165 мл). Реакционную смесь нагревали при 80 С и перемешивали в течение 3 дней. Смесь охлаждали до комнатной температуры и концентрировали в вакууме до объема, равного примерно 100 мл, и подщелачивали до рН 8 насыщенным водным раствором NaHCO3. Водный раствор экстрагировали смесью 10% метанола/ДХМ (5100 мл) и объединенные органические слои пропускали через картридж для разделения фаз, затем выпаривали. Остаток очищали с помощью колоночной хроматографии [SiO2, 2-20% (9:1 метанол:28% раствор NH4OH) в ДХМ], затем с использованием второй колонки (аминопропил-SiO2, EtOAc), и получали искомое соединение (13,2 г, 83%) в виде вспененного смолообразного вещества. H (ДМСО-d6) 8,93 (s, 1 Н), 8,48-8,47 (m, 1H), 8,41-8,38 (m, 1H), 8,13N-(R)-1-[8-Хлор-2-(пиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтилпиридо[3,2-d]пиримидин-4 иламин Смесь промежуточного продукта 4 (0,62 г, 1,85 ммоль), 4-хлорпиридо[3,2-d]пиримидина (0,37 г,2,22 ммоль) и ДМАП (0,32 г, 2,59 ммоль) в ДХМ (15 мл) нагревали микроволновым излучением при 140 С в течение 1 ч. Реакционную смесь подвергали распределению между ДХМ и водой. Водную фазу экстрагировали дополнительным количеством ДХМ и объединенные органические фракции промывали рассолом, затем сушили (Na2SO4) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 0-20% МеОН в EtOAc) и получали искомое соединение (232 мг, 27%) в виде коричневого смолообразного вещества. H (ДМСО-d6) 9,50 (br s, 1H), 9,35 (s, 1H), 8,92 (dd, J 4,3, 1,5 Гц, 1 Н),8,77 (d, J 1,8 Гц, 1 Н), 8,68 (dd, J 4,8, 1,5 Гц, 1H), 8,48 (s, 1H), 8,21 (dd, J 8,3, 1,5 Гц, 1 Н), 8,13 (dd, J 8,3, 1,0 Гц, 1 Н), 8,08 (dd, J 7,6, 1,3 Гц, 1H), 8,07-8,04 (m, 1H), 7,92 (dd, J 8,3, 4,0 Гц, 1H), 7,74-7,70 (m, 1H), 7,52N-(R)-1-[8-Хлор-2-(1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтилпиридо[3,2-d]пиримидин-4-иламин При перемешивании раствор соединения примера 1 (144 мг, 0,308 ммоль) в ДХМ (10 мл) охлаждали до -10 С. Добавляли МХПБК (56 мг, 0,325 ммоль) и смеси в течение 3 ч давали медленно нагреться до КТ. Реакционную смесь подвергали распределению между ДХМ и насыщенным водным раствором NaHCO3. Водную фазу экстрагировали дополнительным количеством ДХМ и объединенные органические фракции промывали рассолом, сушили (Na2SO4) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 5-35% МеОН в EtOAc) и получали искомое соединение (54 мг, 36%) в виде желтого твердого вещества. H (ДМСО-d6) 9,55 (d, J 9,0 Гц, 1 Н), 9,27 (s, 1 Н), 8,90 (dd, J 4,1, 1,5 Гц,1 Н), 8,54 (s, 1 Н), 8,49 (t, J 1,5 Гц, 1H), 8,26 (ddd, J 6,4, 1,5, 0,9 Гц, 1H), 8,21 (dd, J 8,5, 1,5 Гц, 1 Н), 8,17-8,07(m, 2H), 7,91 (dd, J 8,5, 4,1 Гц, 1 Н), 7,76-7,70 (m, 1H), 7,47-7,51 (m, 1 Н), 7,37-7,43 (m, 1 Н), 6,73-6,87 (m,1 Н). ЖХМС (ЭР+) 483 (М+Н)+, ВУ 2,08 мин. Альтернативная методика Смесь промежуточного продукта 102 (13,1 г, 37 ммоль), промежуточного продукта 30 (10,8 г, 44 ммоль) и моногидрата п-толуолсульфоновой кислоты (0,70 г, 3,7 ммоль) в хлороформе (200 мл) нагревали в атмосфере азота при 70 С в течение 20 ч. Раствор охлаждали до комнатной температуры, разбавляли с помощью ДХМ (200 мл), промывали насыщенным водным раствором NaHCO3 (3200 мл) и рассолом(200 мл), затем сушили (MgSO4) и выпаривали в вакууме. Остаток растворяли в ДХМ (30 мл) и фильтровали для удаления нерастворимого твердого вещества. Фильтрат очищали с помощью колоночной хроматографии (SiO2, 2-20% МеОН в EtOAc), затем с использованием второй колонки (аминопропил-SiO2,EtOAc), и получали искомое соединение (13,45 г, 62%) в виде кремового порошкообразного вещества. Пример 3N-[(R)-1-(8-Хлор-2-фенилхинолин-3-ил)-2,2,2-трифторэтил]пиридо[3,2-d]пиримидин-4-иламин Смесь промежуточного продукта 8 (0,55 г, 1,63 ммоль) и 4-хлорпиридо[3,2-d]пиримидина (0,31 г,1,87 ммоль) в ацетонитриле (5 мл) перемешивали при 80 С в течение 2,5 ч. Реакционную смесь подвергали распределению между ДХМ и рассолом. Водную фазу экстрагировали дополнительным количеством ДХМ и объединенные органические фракции промывали рассолом, затем сушили (MgSO4) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 30% EtOAc в гексане) и продукт сушили вымораживанием и получали искомое соединение (35 мг, 2,3%) в виде белого лиофилизированного твердого вещества. H (ДМСО-d6) 9,44 (d, J 9,3 Гц, 1 Н), 9,37 (s, 1 Н), 8,93 (dd, J 4,2, 1,5 Гц,1 Н), 8,51 (s, 1 Н), 8,21 (dd, J 8,5, 1,5 Гц, 1 Н), 8,04-8,11 (m, 2 Н), 7,92 (dd, J 8,5, 4,2 Гц, 1 Н), 7,69 (t, J 8,9 Гц,1 Н), 7,47-7,61 (m, 5 Н), 6,88 (m, 1 Н). ЖХМС (ЭР+) 466 (М+Н)+, ВУ 2,78 мин. Пример 4N-(R)-1-[8-Хлор-2-(4-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтилпиридо[3,2-d]пиримидин-4-иламин Смесь промежуточного продукта 12 (216 мг, 0,615 ммоль) и промежуточного продукта 30 (180 мг,0,738 ммоль) в ДХМ (15 мл) нагревали микроволновым излучением при 140 С в течение 1 ч. Реакционную смесь разбавляли с помощью ДХМ и промывали рассолом, затем сушили (MgSO4) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 0-6% МеОН в EtOAc) и получали искомое соединение (90 мг, 30%) в виде коричневого смолообразного вещества. H (ДМСО-d6) 9,54N-(R)-1-[8-Хлор-2-(4-метил-1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтилпиридо[3,2d]пиримидин-4-иламин Раствор соединения примера 4 (90 мг, 0,187 ммоль) в ДХМ (5 мл) в атмосфере азота перемешивали в бане со льдом, добавляли МХПБК (42 мг, 0,187 ммоль) и смеси давали нагреться медленно до комнатной температуры в течение 3 ч. Реакционную смесь разбавляли с помощью ДХМ, затем промывали насыщенным водным раствором NaHCO3, сушили (MgSO4) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 6-20% МеОН в EtOAc), затем сушили вымораживанием и получали искомое соединение (33 мг, 35%) в виде белого лиофилизированного твердого вещества. HN-(R)-1-[8-Хлор-2-(2-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтилпиридо[3,2-d]пиримидин-4-иламин Смесь промежуточного продукта 15 (1,38 г, 3,93 ммоль) и промежуточного продукта 30 (1,1 г, 4,51 ммоль) в ДХМ (15 мл) нагревали микроволновым излучением при 140 С в течение 1 ч. Реакционную смесь разбавляли с помощью ДХМ и промывали рассолом, затем сушили (MgSO4) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 0-5% МеОН в EtOAc) и получали искомое соединение (1,1 г, 58%) в виде коричневого сиропообразного вещества. H (ДМСО-d6) 9,51 (m,1 Н), 9,29 (m, 1 Н), 8,91 (m, 1 Н), 8,51 (m, 1,5 Н), 8,20 (m, 2,5 Н), 8,09 (m, 1 Н), 7,88 (m, 1,5 Н), 7,72 (m, 1 Н),7,61 (m, 0,5 Н), 7,42 (m, 0,5 Н), 7,10 (m, 0,5 Н), 6,57 (m, 1 Н), 2,22 (s, 1H), 1,99 (s, 2H). ЖХМС (ЭР+) 481N-(R)-1-[8-Хлор-2-(2-метил-1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтилпиридо[3,2-d] пиримидин-4-иламин Раствор соединения примера 6 (0,55 г, 1,145 ммоль) в ДХМ (8 мл) в атмосфере азота перемешивали в бане со льдом и добавляли 77% раствор МХПБК (0,256 г, 1,143 ммоль) и перемешивали в течение ночи. Реакционную смесь разбавляли с помощью ДХМ, затем промывали насыщенным водным раствором NaHCO3, сушили (MgSO4) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 6-14% МеОН в EtOAc) и получали искомое соединение (300 мг, 53%) в виде белого вспененного вещества. H (ДМСО-d6) 9,56 (m, 0,5 Н), 9,54 (m, 0,5 Н), 9,28 (m, 0,5 Н), 9,21 (m, 0,5 Н), 8,89 (m, 0,5 Н),8,86 (m, 0,5 Н), 8,29-8,35 (m, 2 Н), 8,17-8,23 (m, 2 Н), 8,10 (m, 1 Н), 7,90 (m, 1 Н), 7,76 (m, 1H), 7,47 (m, 1 Н),7,15 (m, 0,5 Н), 7,08 (m, 0,5 Н), 6,63 (m, 0,5 Н), 6,56 (m, 0,5 Н), 2,19 (s, 1H), 1,59 (s, 2H). ЖХМС (ЭР+) 497N-(R)-1-[8-Хлор-2-(5-метилпиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтилпиридо[3,2-d]пиримидин-4-иламин Смесь промежуточного продукта 18 (0,9 г, 2,56 ммоль) и промежуточного продукта 30 (0,75 г, 3,07 ммоль) в ДХМ (15 мл) нагревали микроволновым излучением при 140 С в течение 1 ч. Реакционную смесь разбавляли с помощью ДХМ и промывали рассолом, затем сушили (MgSO4) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 0-5% МеОН в EtOAc) и получали искомое соединение (0,48 г, 39%) в виде желтого сиропообразного вещества. H (ДМСО-d6) 9,53 (d, J 9,2 Гц, 1 Н), 9,30 (s, 1H), 8,79-8,94 (m, 1 Н), 8,42-8,56 (m, 2 Н), 8,23 (d, J 1,5 Гц, 1 Н), 8,21 (d, J 1,5 Гц, 1 Н), 8,068,16 (m, 2 Н), 7,90-7,94 (m, 1 Н), 7,70-7,83 (m, 2 Н), 6,74-6,79 (m, 1 Н), 2,22 (s, 3 Н). ЖХМС (ЭР+) 481N-(R)-1-[8-Хлор-2-(5-метил-1-оксипиридин-3-ил)хинолин-3-ил]-2,2,2-трифторэтилпиридо[3,2-d] пиримидин-4-иламин Раствор соединения примера 8 (0,48 г, 1 ммоль) в ДХМ (8 мл) в атмосфере азота перемешивали в бане со льдом и добавляли 77% раствор МХПБК (0,22 г, 0,98 ммоль) и перемешивали в течение ночи. Реакционную смесь разбавляли с помощью ДХМ, затем промывали насыщенным водным растворомNaHCO3, сушили (MgSO4) и выпаривали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2, 6-10% МеОН в EtOAc), затем кристаллизовали из 2-пропанола и получали искомое соединение (155 мг, 31%) в виде белого кристаллического твердого вещества. H (ДМСО-d6) 9,53 (d, J 9,0 Гц,1 Н), 9,19 (s, 1 Н), 8,90 (dd, J 4,2, 1,4 Гц, 1 Н), 8,55 (s, 1H), 8,33 (s, 1H), 8,22 (dd, J 8,5, 1,5 Гц, 1 Н), 8,17 (dd, J 8,2, 0,9 Гц, 1 Н), 8,08 (m, 2H), 7,91 (dd, J 8,5, 4,2 Гц, 1 Н), 7,73 (m, 1 Н), 7,20 (s, 1 Н), 6,79 (m, 1H), 2,00 (s,3 Н). ЖХМС (ЭР+) 497 (М+Н)+, ВУ 1,34 мин. Пример 10
МПК / Метки
МПК: A61K 31/519, A61P 29/00, A61P 25/28, A61P 9/00, C07D 471/04
Метки: хинолина, ингибиторов, производные, киназы, качестве
Код ссылки
<a href="https://eas.patents.su/30-24162-proizvodnye-hinolina-v-kachestve-ingibitorov-kinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хинолина в качестве ингибиторов киназы</a>












