Производные хинолина в качестве ингибиторов pi3 киназы
Номер патента: 19540
Опубликовано: 30.04.2014
Авторы: Берджесс Жоэлль Лоррейн, Донателли Карла А., Адамс Николас Д., Найт Стивен Дэвид, Шмидт Стэнли Дж., Ньюландер Кеннет Аллен, Риджерс Ланс, Сарпонг Марта, Дарси Майкл Джерард
Формула / Реферат
1. Соединение, представляющее собой 2,4-дифтор-N-{2-(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинил}бензолсульфонамид, следующей структуры:
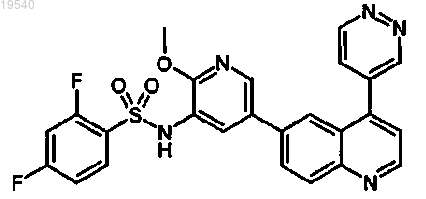
или его фармацевтически приемлемая соль.
2. Соединение по п.1, которое представляет собой 2,4-дифтор-N-{2-(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинил}бензолсульфонамид.
3. Применение соединения по п.1 или 2 или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения рака у человека, нуждающегося в этом.
4. Применение по п.3, где рак выбран из группы, состоящей из глиом головного мозга, глиобластом, лейкемий, синдрома Баннайана-Зонана, болезни Коудена, болезни Лермитта-Дюкло, рака груди, воспалительного рака груди, опухоли Вильмса, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, рака ободочной кишки, рака головы и шеи, рака почек, рака легких, рака печени, меланомы, рака яичников, рака поджелудочной железы, рака простаты, саркомы, остеосаркомы, крупноклеточной опухоли костей и щитовидной железы.
5. Применение по п.3, где рак выбран из группы, состоящей из рака яичников, рака поджелудочной железы, рака груди, рака простаты и лейкемии.
6. Фармацевтическая композиция, содержащая соединение по п.1 или 2 и фармацевтически приемлемый носитель.
Текст
или его фармацевтически приемлемой соли, фармацевтической композиции на их основе,и применению указанного соединения в производстве лекарственного средства для лечения различных видов рака, например рака яичников, рака поджелудочной железы, рака груди, рака простаты и лейкемии.(71)(73) Заявитель и патентовладелец: СМИТКЛАЙН БИЧАМ КОРПОРЕЙШН (US) Область изобретения Данное изобретение относится к применению производных хинолина для модуляции, особенно ингибирования активности или функции семейства фосфоинозитид 3' ОН киназы (называемых далее PI3 киназами), соответственно PI3K, PI3K, PI3K и/или PI3K, в частности PI3K. Соответственно, настоящее изобретение относится к новому производному хинолина, представляющему собой 2,4-дифторN-2-(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинилбензолсульфонамид, или его фармацевтически приемлемой соли, и их применению для лечения различных видов рака. Предпосылки изобретения Клеточные мембраны представляют собой огромное хранилище вторичных посредников, которые могут вовлекаться во множество путей сигнальной трансдукции. Что касается функции и регуляции эффекторных ферментов в сигнальных путях фосфолипидов, данные ферменты генерируют вторичные посредники из фосфолипидных пулов мембран (класс I PI3 киназ (например, PI3K альфа) являются киназными ферментами двойной специфичности, что означает, что они показывают как активность липидкиназы (фосфорилирование фосфоинозитидов), так и протеинкиназы, что свидетельствует об их способности фосфорилировать белок в качестве субстрата, включая аутофосфорилирование, как внутримолекулярный регуляторный механизм. Данные сигнальные ферменты фосфолипидов активируются в ответ на множество внеклеточных сигналов, таких как факторы роста, митогены, интегрины (взаимодействия клетка-клетка), гормоны, цитокины, вирусы и нейротрансмиттеры, такие как описано в данном описании ниже на схеме I, а также с помощью внутриклеточной регуляции другими сигнальными молекулами(взаимные помехи, когда первоначальный сигнал может активировать некоторые параллельные пути,которые на еще одной стадии передают сигналы PI3K-ам внутриклеточными сигнальными событиями),такими как, например, малые GTP-азы, киназы или фосфатазы. Внутриклеточная регуляция может также происходить в результате аберрантной экспрессии или недостатка экспрессии клеточных онкогенов или супрессоров опухоли. Инозитфосфолипидные (фосфоинозитиды) внутриклеточные сигнальные пути начинают с активации сигнальных молекул (внеклеточные лиганды, стимулы, рецепторная димеризация, трансактивирование ксеногенным рецептором (например, рецепторной тирозинкиназой) и рекрутмента и активации PI3K,включая вовлечение G-белок-связанного трансмембранного рецептора, интегрированного в мембрану плазмы.PI3K превращает мембранный фосфолипид PI(4,5)P2 в PI(3,4,5)P3, который функционирует как вторичный посредник. PI и PI(4)P являются также субстратами PI3K и могут фосфорилироваться и превращаться в PI3P и PI(3,4)P2, соответственно. В дополнение, данные фосфоинозитиды могут превращаться в другие фосфоинозитиды с помощью 5'-специфичной и 3'-специфичной фосфатаз, таким образом, PI3K ферментная активность прямо или косвенно приводит в результате к генерированию двух 3'фосфоинозитидных подтипов, которые функционируют как 2 ые посредники во внутриклеточных путях сигнальной трансдукции (Trends Biochem. Sci 22(7) стр. 267-72 (1997); Vanhaesebroeck et al.; Chem. Rev. 101(8) стр. 2365-80 (2001); Leslie et al. (2001); Annu. Rev. Cell, Dev, Biol. 17p, 615-75 (2001); Katso et al. иCell. Mol. Life Sci. 59(5) стр. 761-79 (2002), Toker et al.). Множественные Р 13K изоформы, категоризируемые по их каталитическим субъединицам, их регуляции соответствующими регуляторными субъединицами, экспрессионным структурам и сигнал-специфичным функциям (p110, ,и ), выполняют данную ферментную реакцию (Exp. Cell. Res. 25(1) стр. 239-54 (1999), Vanhaesebroeck and Katso et al., 2001,выше). Близко родственные изоформы p110 иадекватно экспрессируются, тогда какиболее специфично экспрессируются в гематопоэтической клеточной системе, клетках гладких мышц, миоцитах и эндотелиальных клетках (Trends Biochera. Sci. 22(7) стр. 267-72 (1997), Vanhaesebroeck et al.). Их экспрессия могла бы также регулироваться индуцируемым образом в зависимости от клеточного, тканевого типа и стимулов, а также контекста заболевания. Индуцируемость белковой экспрессии включает синтез белка, а также стабилизацию белка, которые частично регулируются ассоциацией с регуляторными субъединицами. На настоящее время идентифицировано восемь PI3K млекопитающих, разделенных на три главных класса (I, II и III) на основании гомологии последовательности, структуры, партнеров связывания, способа активации и предпочтения субстрата. Класс I PI3K in vitro может фосфорилировать фосфатидилинозит(PI), фосфатидилинозит-4-фосфат (PI4P) и фосфатидилинозит-4,5-бифосфат (PI(4,5)Р 2), давая фосфатидилинозит-3-фосфат (PI3P), фосфатидилинозит-3,4-бифосфат (PI(3,4)P2) и фосфатидилинозит-3,4,5 трифосфат (PI(3,4,5)Р 3), соответственно. Класс II PI3K фосфорилирует PI и фосфатидилинозит-4-фосфат. Класс III PI3K может фосфорилировать только PI (Vanhaesebroeck et al., 1997, выше; Vanhaesebroeck et Как проиллюстрировано на схеме А выше, фосфоинозитид 3-киназы (PI3K) фосфорилируют гидроксил третьего атома углерода инозитного кольца. Фосфорилирование фосфоинозитидов, которые генерируют PtdIns в 3,4,5-трифосфат (PtdIns(3,4,5)Р 3), PtdIns(3,4)Р 2 и PtdIns(3)Р, дает вторичные посредники для множества путей сигнальной трансдукции, включая пути, существенные для клеточной пролиферации, клеточной дифференциации, роста клеток, размера и выживания клеток, апоптоза, адгезии, подвижности клеток, миграции клеток, хемотаксиса, инвазии, цитоскелетной перегруппировки, изменений формы клеток, транспортировки везикул и метаболического пути (Katso et al., 2001, выше, и Mol. Med. Today 6(9), стр. 347-57 (2000) Stein). Связанные с G-белком рецепторы опосредуют активацию фосфоинозитид 3'ОН-киназы через небольшие GTP-азы, такие как G и Ras, и впоследствии передача сигнала PI3K играет центральную роль в установлении и координации полярности клеток и динамической организации цитоскелета, что вместе обеспечивает силу, приводящую клетки в движение. Хемотаксис непосредственное движение клеток к градиенту концентрации химических аттрактантов, называемых также хемокинами, вовлечен во многие важные заболевания, такие как воспаление/аутоиммунность,нейродегенерация, ангиогенез, инвазия/метастаз и заживление ран (Immunol. Today 21(6), стр. 260-4(2001) Hirsch et al. и Nat. Immunol. 2(2), стр. 108-15 (2001) Gerard et al.). Прогресс, достигнутый использованием генетических подходов и фармакологических средств,обеспечил понимание сигнальных и молекулярных путей, которые опосредуют хемотаксис в ответ на активируемые хемоаттрактантом связанные с G-белком рецепторы. PI3-Киназа, ответственная за генерирование данных фосфорилированных сигнальных продуктов, первоначально идентифицировалась как активность, ассоциируемая с вирусными онкобелками и тирозинкиназами рецептора фактора роста, который фосфорилирует фосфатидилинозит (PI) и его фосфорилированные производные при 3'-гидроксиле инозитного кольца (Panayotou et al., Trends Cell Biol. 2, стр. 358-60 (1992. Однако недавние биохимические исследования показали, что PI3 киназы класса I (т.е. изоформы PI3K класса IB) являются двойными специфичными киназными ферментами, что означает, что они показывают активность как липидкиназы, так и протеинкиназы, показывая, что они способны к фосфорилированию других белков как субстратов, а также к аутофосфорилированию как внутримолекулярному регуляторному механизму. Считается, что активация PI3-киназы вовлечена в ряд клеточных ответных реакций, включая рост клеток, дифференциацию и апоптоз (Parker et al., Current Biology, 5 стр. 577-99 (1995); Yao et al., Science,267 стр. 2003-05 (1995. PI3-киназа, по-видимому, вовлечена в ряд аспектов активации лейкоцитов. Показано, что активность р 85-ассоциированной PI3-киназы физически ассоциирована с цитопластичным доменом CD28, который является важной костимуляторной молекулой для активации Т-клеток в ответ на антиген (Pages et al., Nature, 369 стр. 327-29 (1994); Rudd. Immunity 4, стр. 527-34 (1996. Активация Т-клеток через CD28 снижает порог для активации антигеном и повышает величину и продолжительность пролиферативного ответа. Данные эффекты связаны с увеличениями транскрипции ряда генов,включая интерлейкин-2 (IL2), важный фактор роста Т-клеток (Fraser et al., Science 251, стр. 313-16(1991. Мутация CD28 такая, что он не может долго взаимодействовать с PI3-киназой, ведет к неудаче инициирования продуцирования IL2, предполагая критическую роль PI3-киназы в активации Т-клеток.PI3K идентифицирован как посредник G бета-гамма-зависимой регуляции JNK активности, и G бета-2 019540 гамма являются субъединицами гетеротримерных G белков (Lopez-Ilasaca et al., J. Biol. Chem. 273(5), стр. 2505-8 (1998. Клеточные процессы, в которых PI3K играют существенную роль, включают подавление апоптоза, реорганизацию скелета актина, рост сердечных миоцитов, стимуляцию гликогенсинтазы инсулином, активизацию TNF-опосредуемых нейтрофилов и генерирование супероксидов, и миграцию и адгезию лейкоцитов к эндотелиальным клеткам. Недавно, (Laffargue et al., Immunity 16(3), стр. 441-51 (2002 было описано, что PI3K передает воспалительные сигналы через разнообразные G(i)-связанные рецепторы и его центральный сигнал к функции тучных клеток, стимулов или раздражителей в контексте лейкоцитов, иммунология включает, например, цитокины, хемокины, аденозины, антитела, интегрины, факторы агрегации факторы роста, вирусы или гормоны (J. Cell. Sci. 114 (Pt 16), стр. 2903-10 (2001) Lawlor et al.; Laffargue et al., 2002, выше, иCurr. Opinion Cell Biol. 14(2), стр. 203-13 (2002) Stephens et al.). Специфичные ингибиторы в отношении индивидуальных представителей семейства ферментов обеспечивают неоценимые средства для расшифровки функций каждого фермента. Два соединения,LY294002 и уортманнин (см. здесь и далее), широко использовались и используются в качестве ингибиторов PI3-киназы. Данные соединения являются неспецифичными PI3K ингибиторами, так как они не различают четыре представителя PI3-киназ класса I. Например, величины IC50 уортманнина в отношении каждой из различных класса I PI3-киназ находятся в интервале 1-10 нМ. Аналогичным образом, величины IC50 для LY294002 в отношении каждой из данных PI3-киназ составляют около 15-20 мкМ (Fruman etal., Ann. Rev. Biochem., 67, стр. 481-507 (1998, также 5-10 мкМ для СK2 протеинкиназы и некоторую ингибирующую активность в отношении фосфолипаз. Уортманнин является грибковым метаболитом,который необратимо ингибирует PI3K активность путем ковалентного связывания с каталитическим доменом данного фермента. Ингибирование активности PI3K уортманнином устраняет последующую клеточную ответную реакцию на внеклеточный фактор. Например, нейтрофилы отвечают на хемокин fMetLeu-Phe (fMLP) стимулированием PI3K и синтезированием PtdIns(3,4,5)Р 3. Данный синтез коррелирует с активацией вспышки респираторов, вовлекаемой в нейтрофильное разрушение инвазирующих микроорганизмов. Обработка нейтрофилов уортманнином предотвращает ответную реакцию fMLPиндуцируемой респираторной вспышки (Thelen et al., Proc. Natl. Acad. Sci. USA, 91, стр. 4960-64 (1994. Действительно, данные эксперименты с уортманнином, также как и другие экспериментальные свидетельства показывают, что PI3K активность в клетках гематопоэтического происхождения, особенно нейтрофилах, моноцитах и других типах лейкоцитов вовлечена во многие иммунные реакции клеток, не являющихся клетками памяти, ассоциируемых с острым и хроническим воспалением. На основе исследований с использованием уортманнина имеется свидетельство того, что функцияPI3-киназы требуется также для некоторых аспектов передачи сигналов лейкоцитов через связанные с Gбелком рецепторы (Thelen et al., 1994, выше). Более того, было показано, что уортманнин и LY294002 блокируют миграцию нейтрофилов и высвобождение супероксида. Ингибирующие циклооксигеназу производные бензофурана описаны авторами John М. Janusz et al., в работе J. Med. Chem. 1998; Vol 41,No 18. Теперь вполне понятно, что дерегуляция онкогенов и опухоль-суппрессорных генов способствует образованию злокачественных опухолей, например, путем увеличения роста клеток и пролиферации или увеличенной выживаемости клеток. В настоящее время известно также, что сигнальные пути, опосредуемые семейством PI3K, играют центральную роль в ряде клеточных процессов, включая пролиферацию и выживаемость, и дерегуляция данных путей является причинным фактором широкого спектра опухолей человека и других заболеваний (Katso et al., Annual Rev. Cell Dev. Biol., 2001, 17: 615-617 и Foster et al., J. Cell Science, 2003, 116: 3037-3040).PI3K класса I является гетеродимером, состоящим из p110 каталитической субъединицы и регуляторной субъединицы, и данное семейство дополнительно подразделяется на ферменты класса Ia и классаIb на основании регуляторных структур и механизма регуляции. Ферменты класса Ia состоят из трех отдельных каталитических субъединиц (p110, p110 и р 110), которые димеризуют с пятью регуляторными субъединицами (р 85, р 55, р 50, р 85 и р 55), причем каталитические субъединицы способны взаимодействовать со всеми регуляторными субъединицами с образованием множества гетеродимеров.PI3K класса Ia обычно активируются в ответ на фактор роста-стимуляцию рецепторных тирозинкиназ,через взаимодействие регуляторных доменов субъединицы SH2 со специфическими фосфотирозиновыми остатками активированного рецептора или адапторных белков, таких как IRS-1. Малые GTP-азы (в качестве примера ras) также вовлекаются в активацию PI3K в сочетании с активацией рецептора тирозинки-3 019540 назы. Как p110, так и p110 конститутивно экспрессируются во всех типах клеток, тогда как экспрессия р 110 более ограничивается лейкоцитными популяциями и некоторыми эпителиальными клетками. В противоположность этому, единственный фермент класса Ib состоит из p110 каталитической субъединицы, которая взаимодействует с p101 регуляторной субъединицей. Кроме того, фермент класса Ib активируется в ответ на связанные с G-белком рецепторные (GPCR) системы, и его экспрессия, по-видимому,ограничивается лейкоцитами. Теперь существует важное свидетельство, указывающее на то, что PI3K ферменты класса Ia способствуют опухолегенезу в широком разнообразии видов рака человека или прямо, или косвенно (Vivancoand Sawyers, Nature Reviews Cancer, 2002, 2, 489-501). Например, p110 субъединица амплифицируется в некоторых опухолях, таких как опухоли яичников (Shayesteh, et al., Nature Genetics, 1999, 21: 99-102) и шейки матки (Ma et al., Oncogene, 2000, 19: 2739-2744). Совсем недавно активирующие мутации в p110(PIK3CA гене) ассоциировали с различными другими опухолями, такими как опухоли ободочной кишки и груди и легких (Samuels, et al., Science, 2004, 304, 554). Опухоль-родственные мутации в р 85 также идентифицированы в раковых заболеваниях, таких как рак яичников и ободочной кишки (Philp et al.,Cancer Research, 2001, 61, 7426-7429). В дополнение к непосредственным эффектам считается, что активация PI3K класса Ia способствует опухолегенным событиям, которые происходят в верхнюю сторону в сигнальных путях, например, с помощью лиганд-зависимой или лиганд-независимой активации рецепторных тирозинкиназ, GCPR систем или интегринов (Vara et al., Cancer Treatment Reviews, 2004, 30, 193204). Примеры таких верхних сигнальных путей включают сверхэкспрессию рецепторной тирозинкиназы Erb2 во множестве опухолей, ведущую к активации PI3K-опосредуемых путей (Harari et al., Oncogene,2000, 19, 6102-6114) и сверхэкспрессии онкогена Ras (Kauffmann-Zeh et al., Nature, 1997, 385, 544-548). В дополнение, PI3K-азы класса Ia могут способствовать непосредственно опухолегенезу, вызываемому различными сигнальными событиями вниз по потоку. Например, потеря функции PTEN опухольсуппрессорной фосфатазы, которая катализирует превращение PI(3,4,5)P3 обратно в PI(4,5)P2, ассоциируется с очень широким рядом опухолей через дерегуляцию PI3K-опосредуемого продуцированияPI(3,4,5)P3 (Simpson and Parsons, Exp. Cell Res., 2001, 264, 29-41). Кроме того, считается, что увеличение эффектов других PI3K-опосредуемых сигнальных событий способствует множеству опухолей, например,путем активации АКТ (Nicholson and Andeson, Cellular Signalling, 2002, 14, 381-395). В дополнение к роли в опосредовании пролиферативного сигнала и сигнала выживаемости в опухолевых клетках имеется также надежное свидетельство, что PI3K ферменты класса Ia также способствуют опухолегенезу через его функцию в опухоль-ассоциируемых стромальных клетках. Например, известно, что PI3K передача сигналов играет важную роль в опосредовании ангиогенных событий в эндотелиальных клетках в ответ на проангиогенные факторы, такие как VEGF (Abid et al., Arterioscler.Thromb. Vasc. Biol., 2004, 24, 294-300). Так как PI3K ферменты класса I также вовлекаются в подвижность и миграцию (Sawyer, Expert Opinion investing. Drugs, 2004, 13, 1-19), предполагается, что PI3K ингибиторы принесут терапевтическую пользу через ингибирование инвазии и метастаза опухолевых клеток. Краткое описание изобретения Данное изобретение относится к новому производному хинолина, представляющему собой 2,4 дифтор-N-2-(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинилбензолсульфонамид следующей структуры (1): или его фармацевтически приемлемой соли. Конкретно, изобретение относится к 2,4-дифтор-N-2-(метилокси)-5-[4-(4-пиридазинил)-6 хинолинил]-3-пиридинилбензолсульфонамиду. Соответственно, данное изобретение относится к применению соединения (1) или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения рака у человека, нуждающегося в этом. Предпочтительно рак выбран из группы, состоящей из: глиом головного мозга, глиобластом, лейкемий, синдрома Баннайана-Зонана, болезни Коудена, болезни Лермитта-Дюкло, рака груди, воспалительного рака груди, опухоли Вильмса, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, рака ободочной кишки, рака головы и шеи, рака почек, рака легких, рака печени, меланомы, рака яичников, рака поджелудочной железы, рака простаты, саркомы, остеосаркомы, крупноклеточной опухоли костей и щитовидной железы. Наиболее предпочтительно рак выбран из группы, состоящей из рака яичников, рака поджелудочной железы, рака груди, рака простаты и лейкемии. Изобретение также относится к фармацевтической композиции, содержащей 2,4-дифтор-N-2-4 019540(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинилбензолсульфонамид и фармацевтически приемлемый носитель. В настоящее описание включены способы совместного введения настоящего ингибирующего PI3 киназу соединения с дополнительными активными ингредиентами. Подробное описание изобретения Настоящее соединение формулы (1) ингибирует одну или более PI3 киназ. Соответственно, соединение формулы (1) предпочтительно ингибирует PI3K. Соответственно, данное изобретение относится к новому соединению формулы (1): или его фармацевтически приемлемой соли. Данное изобретение относится также к применению соединения (1) или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения рака у человека, нуждающегося в этом. Предпочтительно рак выбран из группы, состоящей из: глиом головного мозга, глиобластом, лейкемий, синдрома Баннайана-Зонана, болезни Коудена, болезни Лермитта-Дюкло, рака груди, воспалительного рака груди, опухоли Вильмса, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, рака ободочной кишки, рака головы и шеи, рака почек, рака легких, рака печени, меланомы, рака яичников, рака поджелудочной железы, рака простаты, саркомы, остеосаркомы, крупноклеточной опухоли костей и щитовидной железы. Наиболее предпочтительно рак выбран из группы, состоящей из: рака яичников, рака поджелудочной железы, рака груди, рака простаты и лейкемии. Изобретение также относится к фармацевтической композиции, содержащей 2,4-дифтор-N-2(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинилбензолсульфонамид и фармацевтически приемлемый носитель. В данном описании раскрывается также способ лечения рака, который включает совместное введение субъекту, нуждающемуся в этом, эффективного количества соединения формулы (1) и/или его фармацевтически приемлемой соли и по меньшей мере одного антинеопластического агента, такого как по меньшей мере один агент, выбранный из группы, состоящей из агентов против микротрубочек, координационных комплексов платины, алкилирующих агентов, антибиотических агентов, ингибиторов топоизомеразы II, антиметаболитов, ингибиторов топоизомеразы I, гормонов и гормональных аналогов, ингибиторов пути сигнальной трансдукции, ингибиторов ангиогенеза нерецепторной тирозинкиназы, иммунотерапевтических агентов, проапоптотических агентов и ингибиторов передачи сигналов клеточного цикла. Данное описание раскрывает также способ лечения рака, который включает совместное введение субъекту, нуждающемуся в этом, эффективного количества соединения формулы (1) и/или его фармацевтически приемлемой соли и по меньшей мере одного ингибитора пути сигнальной трансдукции, такого как агент, выбранный из группы, состоящей из ингибитора рецепторной тирозинкиназы, ингибитора нерецепторной тирозинкиназы, блокатора SH2/SH3 домена, ингибитора серин/треонинкиназы, ингибитора фосфотидилинозит-3-киназы, ингибитора передачи сигналов миоинозита и ингибитора Ras онкогена. Используемый в данном описании термин "эффективное количество" означает количество лекарственного средства или фармацевтического агента, которое будет вызывать биологическую или медицинскую ответную реакцию ткани, системы, животного или человека, которые имеет в виду, например, исследователь или врач. Кроме того, термин "терапевтически эффективное количество" означает любое количество, которое по сравнению с соответствующим субъектом, который не получает такое количество, приводит к улучшенному лечению, исцелению, предупреждению или облегчению заболевания, расстройства или побочного эффекта, или снижению скорости развития заболевания или расстройства. Данный термин охватывает также количества, эффективные для усиления нормальной физиологической функции. Соединение формулы (1) включается в фармацевтические композиции изобретения. Определения Термин "лечение" и его производные, используемый в данном описании, означает профилактическую и лечебную терапию. Профилактическая терапия означает принятие мер для защиты субъекта (пациента) от болезни, к которой он или она предрасположен или может быть предрасположен. Она называется также превентивным или профилактическим лечением. Термином "совместное введение" и его производными, используемыми в данном описании, обозначается или одновременное введение, или любым образом раздельное последовательное введение ингибирующего PI3 киназу соединения, описанного в данном описании, и дополнительного активного ингре-5 019540 диента или ингредиентов. Термин дополнительный активный ингредиент или ингредиенты, используемый в данном описании, охватывает любое соединение или терапевтический агент, о котором известно или которое(ый) демонстрирует благоприятные свойства, когда вводится пациенту, нуждающемуся в лечении. Соответственно, если введение не является одновременным, соединения вводятся близко по времени друг за другом. Кроме того, не имеет значения, вводятся ли соединения в одной и той же дозированной форме, например, одно соединение может вводиться местно, а другое соединение может вводиться орально. Термин "соединение", используемый в данном описании, охватывает все изомеры соединения. Примеры таких изомеров включают энантиомеры, таутомеры, ротамеры. Соединение формулы (1) включается в фармацевтические композиции изобретения. В настоящее время обнаружено, что соединение настоящего изобретения является ингибитором фосфатоиноизитид 3 киназ PI3K, особенно PI3K. Когда фермент фосфатоинозитид 3-киназа (PI3K) ингибируется соединением настоящего изобретения, PI3K не способен проявлять его ферментативные, биологические и/или фармакологические эффекты или действия. Соединение настоящего изобретения поэтому полезно при лечении рака. Соединение, соответствующее формуле (1), является подходящим для модуляции, особенно ингибирования активности фосфатоинозитид 3-киназы (PI3K), особенно фосфатоинозитид 3-киназы (PI3K). Поэтому соединение настоящего изобретения также полезно для лечения расстройств, которые опосредуются PI3K. Указанное лечение включает модуляцию, а именно ингибирование или понижающее регулирование, фосфатоинозитид 3-киназ. Соответственно, соединение настоящего изобретения используется для получения лекарственного средства для лечения рака. Поскольку фармацевтически активное соединение настоящего изобретения является активным в качестве ингибитора PI3 киназы, особенно PI3K, или селективно, или в конъюгации с одной или болееPI3K, PI3K и/или PI3K, оно проявляет терапевтическую полезность при лечении рака. Соответственно, в данном описании раскрывается способ лечения рака у млекопитающих, включая человека, где рак выбран из: глиом головного мозга, глиобластом, лейкемий, синдрома БаннайанаЗонана, болезни Коудена, болезни Лермитта-Дюккло, рака груди, воспалительного рака груди, опухоли Вильма, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, рака ободочной кишки,рака головы и шеи, рака почек, рака легких, рака печени, меланомы, рака яичников, рака поджелудочной железы, рака простаты, саркомы, остеосаркомы, крупноклеточной опухоли костей и рака щитовидной железы. В данном описании раскрывается способ лечения рака у млекопитающих, включая человека, где рак выбран из: лейкемии лимфобластных Т-клеток, хронической миелогенной лейкемии, хронической лимфоцитарной лейкемии, лейкемии волосяных клеток, острой лимфобластомной лейкемии, острой миелогенной лейкемии, хронической нейтрофильной лейкемии, острой лейкемии лимфобластомных Тклеток, плазмацитомы, лейкемии иммунобластомных крупных клеток, лейкемии клеток мантии, множественной миеломной мегакариобластомной лейкемии, рассеянной миеломы, острой мегакариоцитной лейкемии, промиелоцитарной лейкемии и эритролейкемии. Соответственно, в описании раскрывается способ лечения рака у млекопитающих, включая человека, где рак выбран из: злокачественной лимфомы, лимфомы Ходжкина, неходжкинской лимфомы, лимфомы лимфобластомных Т-клеток, лимформы Буркиттса и фолликулярной лимфомы. Соответственно, раскрывается способ лечения рака у млекопитающих, включая человека, где рак выбран из нейробластомы, рака мочевого пузыря, уротелиального рака, рака легких, рака вульвы, цервикального рака, рака эндометрия, ренального рака, мезотелиомы, эзофагеального рака, рака слюнных желез, гепатоклеточного рака, рака желудка, носоглоточного рака, щечного рака, рака ротовой полости,GIST (стромальной опухоли желудка) и тестикулярного рака. Когда соединение формулы (1) вводится для лечения рака, термин "совместное введение" и его производные, используемый в данном описании, означает или одновременное введение, или любым образом раздельное последовательное введение PI3 киназу ингибирующего соединения, описанного выше,и дополнительного активного ингредиента или ингредиентов, о которых известно, что они полезны при лечении рака, включая химиотерапию и лечение облучением. Термин дополнительный активный ингредиент или ингредиенты, используемый в данном описании, охватывает любое соединение или терапевтический агент, о котором известно, что оно(он) демонстрирует или которое(ый) демонстрирует благоприятные свойства, когда вводится пациенту, нуждающемуся в лечении рака. Предпочтительно, если введение не является одновременным, соединения вводят близко по времени друг за другом. Кроме того,не имеет значения, вводят ли соединения в одной и той же дозированной форме, например, одно соединение может вводиться местно, а другое соединение может вводиться орально. В конкретном случае любой антинеопластический агент, который обладает активностью против восприимчивой опухоли, подвергаемой лечению, может вводиться совместно при лечении рака в настоящем изобретении. Примеры таких агентов можно найти в публикации Cancer Principles and Practiceof Oncology V.T. Devita and S. Hellman (editors), 6th edition (15 февраля 2001 г.), Lippincott WilliamsWilkins Publishers. Специалист в данной области сможет различить, какие комбинации агентов будут полезны, на основании конкретных характеристик лекарственных средств и опухолей, о которых идет речь. Конкретные антинеопластические агенты, полезные в настоящем изобретении, включают, но не ограничиваются ими, агенты против микротрубочек, такие как дитерпеноиды и алкалоиды барвинка; координационные комплексы платины; алкилирующие агенты, такие как азотистый иприт, оксазофосфорины, алкилсульфонаты, нитрозомочевины и триазены; антибиотики, такие как антрациклины, актиномицины и блеомицины; ингибиторы топоизомеразы II, такие как эпиподофиллотоксины; антиметаболиты, такие как пурин и аналоги пиримидина, и антифолатные соединения; ингибиторы топоизомеразы I, такие как камптотецины; гормоны и гормональные аналоги; ингибиторы путей сигнальной трансдукции; ингибиторы нерецепторного тирозинкиназного ангиогенеза; иммунотерапевтические агенты; проапоптические агенты и ингибиторы передачи сигнала клеточного цикла. Примерами дополнительного активного ингредиента или ингредиентов (антинеопластический агент) для применения в комбинации или вводимых совместно с АКТ ингибирующими соединениями настоящего изобретения являются химиотерапевтические агенты. Агентами против микротрубочек или антимитотическими агентами являются фазоспецифические агенты, активные против микротрубочек опухолевых клеток во время фазы М или митоза клеточного цикла. Примеры агентов против микротрубочек включают, но не ограничиваются ими, дитерпеноиды и алкалоиды барвинка. Дитерпеноиды, которые производят из природных источников, являются фазоспецифическими противораковыми агентами, которые работают в G2/M фазах клеточного цикла. Считается, что дитерпеноиды стабилизируют -тубулиновые субъединицы микротрубочек путем связывания с данным белком. Разборка белка, по-видимому, затем ингибируется задерживающимся митозом и последующей гибелью клеток. Примеры дитерпеноидов включают, но не ограничиваются ими, паклитаксел и его аналог доцетаксел. Паклитаксел, 13-сложный эфир 5,20-эпокси-1,2,4,7,10,13-гекса-гидрокситакс-11-ен-9-он 4,10-диацетат-2-бензоата с (2R,3S)-N-бензоил-3-фенилизосерином, является природным дитерпеноидным продуктом, выделенным из дерева коротколистного или американского тисса Taxus brevifolia, и является коммерчески доступным в виде инъецируемого раствора ТАКСОЛ. Он является членом таксанового семейства терпенов. Впервые он был выделен в 1971 году авторами Wani et al., J. Am. Chem. Soc,93:2325. (1971), которые охарактеризовали его структуру с помощью химического и рентгенокристаллографического методов. Один из механизмов его активности относится к способности паклитаксела связывать тубулин, ингибируя, тем самым, рост раковых клеток. Schiff et al., Proc. Natl, Acad. Sci. USA,77:1561-1565 (1980); Schiff et al., Nature, 277:665-667 (1979); Kumar, J. Biol. Chem., 256: 10435-10441(1981). Что касается обзора синтеза и противораковой активности некоторых производных паклитаксела,см.: D.G.I. Kingston et al., Studies in Organic Chemistry vol. 26, под названием "New trends in Natural Products Chemistry 1986", Attaur-Rahman, P.W. Le Quesne, Eds, (Elsevier, Амстердам, 1986) стр. 219-235. Паклитаксел был одобрен для клинического применения при лечении рефракторного рака яичников в Соединенных Штатах (Markman et al., Yale Journal of Biology and Medicine. 64-583, 1991; McGuire et al.,Ann. Intem. Med., 111:273, 1989) и для лечения рака груди (Holmes et al., J. Nat.Cancer Inst., 83:1797,1991). Он является потенциальным кандидатом для лечения новообразований на коже (Einzig et al., Proc.Am. Soc.Clin. Oncol. 20:46) и карцином головы и шеи (Forastire et al., Sem. Oncol. 20:56, 1990). Соединение обнаруживает также потенциал для лечения поликистоза почек (Woo et al., Nature, 368:750, 1994),рака легких и малярии. Лечение пациентов паклитакселом приводит в результате к подавлению костного мозга (множественные клеточные линии, Ignoff, R.J. et al., Cancer Chemotherapy Pocket Quide, 1998), связанному с длительностью введения доз выше пороговой концентрации (50 нМ) (Kearns, C.M. et al., Seminars in Oncology, 3(6) стр. 16-23, 1995). Доцетаксел, 13-эфир N-трет-бутилового эфира (2R,3S)-N-карбокси-3-фенилизосерина с тригидратом 5-20-эпокси-1,2,4,7,10,13-гексагидрокситакс-11-ен-9-он-4-ацетат-2-бензоата, коммерчески доступен в виде инъецируемого раствора как TAXOTERE. Доцетаксел показан для лечения рака груди. Доцетаксел является полусинтетическим производным паклитаксела, q.v., получаемым с использованием природного предшественника, 10-деацетилбаккатина III, экстрагируемого из иголок ягодного или европейского тиса. Дозой, лимитирующей токсичность доцетаксела, является нейтропения. Алкалоиды барвинка являются фазоспецифическими антинеопластическими агентами, происходящими из растения барвинок. Алкалоиды барвинка действуют в M фазе (митоза) клеточного цикла путем связывания специфически с тубулином. Впоследствии, связанная молекула тубулина не способна полимеризоваться в микротрубочки. Считается, что митоз задерживается в метафазе с последующей гибелью клеток. Примеры алкалоидов барвинка включают, но не ограничиваются ими, винбластин, винкристин и винорелбин. Винбластин, сульфат винкалейкобластина, коммерчески доступен как VELBAN в виде инъецируемого раствора. Хотя он, возможно, имеет показания в качестве еще одной линии терапии разнообраз-7 019540 ных солидных опухолей, в первую очередь он показан при лечении тестикулярного рака и различных лимфом, включая болезнь Ходжкина, и лимфоцитарной и гистиоцитарной лимфом. Миелосуппрессия является показателем дозы, лимитирующей побочное действие винбластина. Винкристин, винкалейкобластин, 22-оксосульфат, является коммерчески доступным как ONCOVIN в виде инъецируемого раствора. Винкристин показан для лечения острых лейкемий и найдено также, что он полезен в лечебных режимах при злокачественных лимфомах Ходжкина и неходжкинских лимфомах. Алопеция и неврологические эффекты являются наиболее обычным побочным действием винкристина, и в меньшей степени имеет место эффект миелосупрессии и воспаления слизистой желудочно-кишечного тракта. Винорелбин, 3',4'-дидегидро-4'-деокси-C'-норвинкалейкобластин [R-(R,R)-2,3-дигидроксибутандиоат (1:2) (соль], коммерчески доступный как инъецируемый раствор винорелбинтартрата (NAVELBINE), является полусинтетическим алкалоидом барвинка. Винорелбин показан как единственный агент или в комбинации с другими химиотерапевтическими агентами, такими как цисплатин, при лечении различных солидных опухолей, в частности, немелкоклеточного рака легких, прогрессирующего рака груди и гормональнорефракторного рака простаты. Миелосупрессия является наиболее обычным показателем дозы, лимитирующей побочное действие винорелбина. Координационные комплексы платины являются нефазоспецифическими противораковыми агентами, которые взаимодействуют с ДНК. Платиновые комплексы входят в опухолевые клетки, подвергаются гидратации и образуют внутри- и межнитевые поперечные связи с ДНК, вызывая пагубные для опухоли биологические действия. Примеры координационных комплексов платины включают, но не ограничиваются ими, цисплатин и карбоплатин. Цисплатин, цис-диаминдихлорплатина, коммерчески доступен в виде инъецируемого раствора какPLATINOL. Цисплатин прежде всего показан при лечении метастатического тестикулярного рака и рака яичников и прогрессирующего рака мочевого пузыря. Побочными действиями цисплатина, ограничивающими исходную дозу, являются нефротоксичность, которая может регулироваться гидратацией и диурезом, и ототоксичность. Карбоплатин, диамин [1,1-циклобутандикарбоксилат(2-)-О,O']платины, коммерчески доступен какPARAPLATIN в виде инъецируемого раствора. Карбоплатин показан прежде всего при лечении на первой и второй стадии прогрессирующей карциномы яичников. Подавление костного мозга является определяющим фактором дозы, ограничивающей токсичность карбоплатина. Алкилирующие агенты являются нефазовыми антираковыми специфическими агентами и сильными электрофилами. Обычно алкилирующие агенты образуют ковалентные связи путем алкилирования ДНК через нуклеофильные фрагменты молекулы ДНК, такие как фосфатная, амино, сульфгидрильная,гидроксильная, карбоксильная и имидазольная группы. Такое алкилирование прерывает функцию нуклеиновой кислоты, ведущую к гибели клеток. Примеры алкилирующих агентов включают, но не ограничиваются ими, азотистый иприт, такие как циклофосфамид, мелфалан и хлорамбуцил; алкилсульфонаты,такие как бусульфан; нитрозомочевины, такие как кармустин; и триазены, такие как дакарбазин. Циклофосфамид, моногидрат 2-оксида 2-бис[2-хлорэтил)амино]тетрагидро-2 Н-1,3,2-оксазафосфорина, коммерчески доступен в виде инъецируемого раствора или таблеток как CYTOXAN. Циклофосфамид показан в качестве единственного агента или в комбинации с другими химиотерапевтическими агентами при лечении злокачественных лимфом, рассеянной миеломы и лейкемий. Алопеция, тошнота,рвота и лейкопения являются наиболее обычными показателями дозы, ограничивающей побочные действия циклофосфамида. Мелфалан, 4-[бис(2-хлорэтил)амино]-L-фенилаланин, коммерчески доступен в виде инъецируемого раствора или таблеток как ALKERAN. Мелфалан показан для паллиативного лечения рассеянной миеломы и неоперабельной эпителиальной карциномы яичников. Подавление костного мозга является наиболее обычным показателем дозы, ограничивающей побочное действие мелфалана. Хлорамбуцил, 4-[бис(2-хлорэтил)амино]бензолбутановая кислота, коммерчески доступен в виде таблеток LEUKERAN. Хлорамбуцил показан для паллиативного лечения хронической лимфатической лейкемии и злокачественных лимфом, таких как лимфосаркома, гигантская фолликулярная лимфома и болезнь Ходжкина. Подавление костного мозга является наиболее обычным показателем дозы, ограничивающей побочное действие хлорамбуцила. Бусульфан, диметансульфонат 1,4-бутандиола, коммерчески доступен в виде таблетокMYLERAN. Бусульфан показан для паллиативного лечения хронической миелогенной лейкемии. Подавление костного мозга является наиболее обычным показателем дозы, ограничивающей побочное действие бусульфана. Кармустин, 1,3-[бис(2-хлорэтил)-1-нитрозомочевина, коммерчески доступен в виде отдельных ампул лиофилизованного материала как BiCNU. Кармустин показан для паллиативного лечения в виде единственного агента или в комбинации с другими агентами опухолей головного мозга, рассеянной миеломы, болезни Ходжкина и неходжинских лимфом. Задерживающаяся миелосупрессия является наиболее обычным показателем дозы, ограничивающей побочные действия кармустина. Дакарбазин, 5-(3,3-диметил-1-триазено)имидазол-4-карбоксамид, коммерчески доступен в виде отдельных ампул материала как DTIC-Dome. Дакарбазин показан для лечения метастатической злокачественной меланомы и в комбинации с другими агентами для второй линии лечения болезни Ходжкина. Тошнота, рвота и анорексия являются наиболее обычными показателями дозы, ограничивающей побочное действие дакарбазина. Антибиотические антинеопластические агенты являются нефазовыми специфическими агентами,которые связываются или интеркалируются с ДНК. Обычно, такое действие приводит в результате к стабильным комплексам с ДНК или разрыву нитей, что прерывает обычную функцию нуклеиновых кислот,приводя к гибели клеток. Примеры антибиотических антинеопластических агентов включают, но не ограничиваются ими, актиномицины, такие как дактиномицин, антроциклины, такие как даунорубицин и доксорубицин; и блеомицины. Дактиномицин, известный также как актиномицин D, коммерчески доступен в инъецируемой форме как COSMEGEN. Дактиномицин показан для лечения опухоли Вильма и рабдомиосаркомы. Тошнота, рвота и анорексия являются наиболее обычными показателями дозы, ограничивающими побочные действия дактиномицина. Даунорубицин, гидрохлорид (8S-цис-)-8-ацетил-10-[(3-амино-2,3,6-тридеоксиL-ликсогексопиранозил)окси]-7,8,9,10-тетрагидро-6,8,11-тригирокси-1-метокси-5,12-нафтацендиона, является коммерчески доступным в виде липосомной инъецируемой формы как DAUNOXOME или в виде инъецируемого средства как CERUBIDINE. Даунорубицин показан для индукции ремиссии при лечении острой нелимфоцитарной лейкемии и прогрессирующей ВИЧ ассоциированной саркомы Капоши. Миелосупрессия является наиболее обычным показателем дозы, ограничивающей побочное действие даунорубицина. Доксорубицин, гидрохлорид (8S,10S)-10-[(3-амино-2,3,6-тридеоксиL-ликсогексопиранозил) окси]-8-гликолоил-7,8,9,10-тетрагидро-6,8,11-тригидрокси-1-метокси-5,12-нафтацендиона,коммерчески доступен в виде инъецируемой формы как RUBEX или ADRIAMYCIN RDF. Доксорубицин прежде всего показан для лечения острой лимфоблатомной лейкемии и острой миелобластомной лейкемии, а также как полезный компонент при лечении некоторых солидных опухолей и лимфом. Миелосупрессия является наиболее обычным показателем дозы, ограничивающей побочное действие доксорубицина. Блеомицин, смесь цитотоксичных гликопептидных антибиотиков, выделенных из штамма Streptomyces verticillus, коммерчески доступна как BLENOXANE. Блеомицин показан в качестве паллиативного лечения, в виде единственного агента или в комбинации с другими агентами, карциномы сквамозных клеток, лимфом и тестикулярных карцином. Легочная и кожная токсичность является наиболее обычными побочными действиями блеомицина, ограничивающими дозу. Ингибиторы топоизомеразы II включают, но не ограничиваются ими, эпиподофиллотоксины. Эпиподофиллотоксины являются фазоспецифическими антинеопластическими агентами, производимыми из растения мандрагоры. Эпиподофиллотоксины обычно воздействуют на клетки в S и G2 фазах клеточного цикла путем образования тройных или трехкомплонентных комплексов с топоизомеразой II и ДНК, вызывая разрывы ДНК нитей. Разрывы нитей накапливаются, и следует гибель клеток. Примеры эпиподофиллотоксинов включают, но не ограничиваются ими, этопозид и тенипозид. Этопозид, 4'-деметилэпиподофиллотоксин 9-[4,6-0-(R)-этилиденD-глюкопиранозида] коммерчески доступен в виде инъецируемого раствора или капсул как VePESID и обычно известен как VP-16. Этопозид показан в качестве единственного агента или в комбинации с другими химиотерапевтическими агентами при лечении тестикулярного и немелкоклеточного рака легких. Миелосуппрессия является наиболее обычным побочным эффектом этопозида. Случаи лейкопении имеют тенденцию быть более тяжелыми, чем тромбоцитопении. Тенипозид, 4'-деметилэпиподофиллотоксин 9-[4,6-0-(R)-тенилиденD-глюкопиранозида], коммерчески доступен в виде инъецируемого раствора как VUMON и обычно известен как VM-26. Тенипозид показан в качестве одиночного агента или в комбинации с другими агентами химиотерапии при лечении острой лейкемии у детей. Миелосуппрессия является наиболее обычным побочным эффектом тенипозида, ограничивающим дозу. Тенипозид может вызывать и лейкопению и тромбоцитопению. Антиметаболические неопластические агенты являются фазоспецифическими антинеопластическими агентами, которые могут действовать в S фазе (синтез ДНК) клеточного цикла путем ингибирования синтеза ДНК или путем ингибирования синтеза пуринового или пиримидинового основания, тем самым, ограничивая синтез ДНК. Следовательно, S фаза не развивается или не продолжается, и следует гибель клеток. Примеры антиметаболических антинеопластических агентов включают, но не ограничиваются ими, фторурацил, метотрексат, цитарабин, мекаптопурин, тиогуанин и гемцитабин. 5-Фторурацил-5-фтор-2,4-(1 Н,3 Н)-пиримидиндион коммерчески доступен как фторурацил. Введение 5-фторурацила ведет к ингибированию синтеза тимидилата, а также объединяется как с РНК, так и с ДНК. Результатом обычно является гибель клеток. 5-Фторурацил показан в виде одиночного агента или в комбинации с другими химиотерапевтическими агентами при лечении карцином груди, ободочной кишки, прямой кишки, желудка и поджелудочной железы. Побочными эффектами 5-фторурацила, ограничивающими дозу, являются миелосуппрессия и мукозит. Другие фторпиримидиновые аналоги включают 5-9 019540 фтордезоксиуридин (флоксуридин) и монофосфат 5-фтордезоксиуридина. Цитарабин, 4-амино-1D-арабинофуранозил-2(1 Н)-пиримидинон, коммерчески доступен как CYTOSAR-U и обычно известен как Ara-С. Считается, что цитарабин проявляет фазоспецифичность клеток в S-фазе путем ингибирования удлинения цепей ДНК и конечным объединением цитарабина с растущей ДНК цепью. Цитарабин показан в виде одиночного агента или в комбинации с другими агентами химиотерапии при лечении острой лейкемии. Другие аналоги цитидина включают 5-азацитидин и 2',2'дифтордезоксицитидин (гемцитабин). Цитарабин вызывает лейкопению, тромбоцитопению и мукозит. Меркаптопурин, моногидрат 1,7-дигидро-6 Н-пурин-6-тиона, коммерчески доступен как PURINETHOL. Меркаптопурин проявляет фазоспецифичность клеток в S-фазе ингибированием синтеза ДНК по еще неопределенному механизму. Меркаптопурин показан в виде одиночного агента или в комбинации с другими химиотерапевтическими агентами при лечении острой лейкемии. Миелосуппрессия и мукозит желудочно-кишечного тракта являются ожидаемыми побочными эффектами меркаптопурина в высоких дозах. Полезным аналогом меркаптопурина является азатиоприн. Тиогуанин, 2-амино-1,7-дигидро-6 Н-пурин-6-тион, коммерчески доступен как TABLOID. Тиогуанин проявляет фазоспецифичность клеток в S-фазе ингибированием синтеза ДНК по еще неопределенному механизму. Тиогуанин показан в виде одиночного агента или в комбинации с другими химиотерапевтическими агентами при лечении острой лейкемии. Миелосуппрессия, включая лейкопению, тромбоцитопению и анемию, является наиболее обычным побочным эффектом, ограничивающим дозу тиогуанина при его введении. Однако случаются побочные эффекты в желудочно-кишечном тракте и могут быть показателями ограничения дозы. Другие аналоги пурина включают пентостатин, эритрогидроксинониладенин, фосфат флударабина и кладрибин. Гемцитабин, моногидрохлорид 2'-дезокси-2',2'-дифторцитидина (-изомер), коммерчески доступен как GEMZAR. Гемцитабин проявляет фазоспецифичность клеток в S-фазе путем блокирования продвижения клеток через GI/S границу. Гемцитабин показан в комбинации с цисплатином при лечении локально развивающегося немелкоклеточного рака легких и в виде одиночного средства - при лечении локально развивающегося рака поджелудочной железы. Миелосуппрессия, включая лейкопению, тромбоцитопению и анемию, является наиболее обычным побочным эффектом, ограничивающим дозу гемцитабина при его введении. Метотрексат, N-[4-(2,4-диамино-6-птеридинил)метил]метиламино]бензоил]-L-глутаминовая кислота, коммерчески доступен как метотрексат натрия. Метотрексат проявляет специфично фазоклеточные эффекты, особенно в S-фазе путем ингибирования синтеза ДНК, репарации и/или репликации через ингибирование редуктазы дигидрофолевой кислоты, которое требуется для синтеза пуриннуклеотидов и тимидилата. Метотрексат показан как одиночный агент или в комбинации с другими агентами химиотерапии при лечении хориокарциномы, менингеальной лейкемии, неходжинской лимфомы и карцином груди, головы, шеи, яичников и мочевого пузыря. Миелосуппрессия (лейкопения, тромбоцитопения и анемия) и мукозит являются ожидаемыми побочными эффектами при введении метотрексата. Камптотецины, включающие камптотецин и производные камптотецина, доступны или разрабатываются как ингибиторы топоизомеразы I. Считается, что цитотоксичная активность камптотецинов связана с его топоизомеразf I ингибирующей активностью. Примеры камптотецинов включают, но не ограничиваются ими, иринотекан, топотекан и разнообразные оптические формы 7-(4-метилпиперазинометилен)-10,11-этилендиокси-20-камптотецина, описанного ниже. Иринотекан HCl, гидрохлорид (4S)-4,11-диэтил-4-гидрокси-9-[(4-пиперидинопиперидино)карбонилокси]-1 Н-пирано[3',4',6,7]индолизино[1,2-b]хинолин-3,14-(4 Н,12 Н)-диона, коммерчески доступен в виде инъецируемого раствора CAMPTOSAR. Иринотекан является производным камптотецина, которое связывается наряду с его активным метаболитом SN-38 в топоизомераза I-ДНК комплекс. Считается, что имеют место случаи цитотоксичности в результате невосстанавливаемых разрывов двойных нитей, вызываемых взаимодействием комплекса топоизомераза I:ДНК:иринотекан или SN-38 с репликационными ферментами. Иринотекан показан для лечения метастатического рака ободочной кишки или прямой кишки. Побочными эффектами, ограничивающими дозу иринотекана HCl, являются миелосуппрессия, включая нейтропению, и GI эффекты,включая диарею. Топотекан HCl, моногидрохлорид (S)-10-[(диметиламино)метил]-4-этил-4,9-дигидрокси-1 Н-пирано[3',4',6,7]индолизино[1,2-b]хинолин-3,14-(4 Н,12 Н)-диона, коммерчески доступен в виде инъецируемого раствора HYCAMTIN. Топотекан является производным камптотецина, которое связывается в топоизомераза I-ДНК комплекс и предотвращает религирование разрывов одиночных нитей, вызванное топоизомеразой I в ответ на деформацию кручения молекулы ДНК. Топотекан показан для второй линии лечения метастатической карциномы яичников и мелкоклеточного рака легких. Показателем дозы, ограничивающей побочные эффекты топотекана HCl, является миелосуппрессия, прежде всего, нейтропения. Представляет интерес также производное камптотецина формулы А, следующей ниже, которое в настоящее время разрабатывается, включая форму рацемической смеси (R,S), а также R и S энантиомеры: известное под химическим названием "7-(4-метилпиперазинометилен)-10,11-этилендиокси-20(R,S)камптотецин" (рацемическая смесь) или "7-(4-метилпиперазинометилен)-10,11-этилендиокси-20(R)камптотецин""7-(4-метилпиперазинометилен)-10,11-этилендиокси-20(S)камптотецин" (S энантиомер). Такое соединение, также как и родственные соединения, описаны, включая способы получения, в патентах США 6063923; 5342947; 5559235; 5491237 и находящейся на рассмотрении заявке США 08/977217, поданной 24 ноября 1997 г. Гормоны и гормональные аналоги являются полезными соединениями для лечения раковых заболеваний, в которых имеется взаимосвязь между гормоном(гормонами) и ростом и/или недостатком роста рака. Примеры гормонов и гормональных аналогов, полезных для лечения рака, включают, но не ограничиваются ими, адренокортикостероиды, такие как преднизон и преднизолон, которые полезны при лечении злокачественной лимфомы и острой лейкемии у детей; аминоглютетимид и другие ингибиторы ароматазы, такие как анастрозол, летразол, воразол и эксеместан, полезные при лечении адренокортикальной карциномы и гормон-зависимой карциномы груди, содержащей эстрогеновые рецепторы; прогестрины, такие как мегестролацетат, полезные при лечении гормон-зависимого рака груди и эндометриальной карциномы; эстрогены, андрогены и антиандрогены, такие как флютамид, нилютамид, бикалютамид,ацетат ципротерона и 5-редуктазы, такие как финастерид и дутастерид, полезные при лечении карциномы простаты и доброкачественной гипертрофии простаты; и антиэстрогены, такие как тамоксифен,торемифен, ралоксифен, дролоксифен, йодоксифен, а также селективные эстроген-рецепторные модуляторы (SERMS), описанные в патентах США 5681835, 5877219 и 6207716, полезные при лечении гормонзависимой карциномы груди и других чувствительных раковых заболеваний; и гонадотропинвысвобождающий гормон (GnRH) и его аналоги, которые стимулируют высвобождение люитинизирующего гормона (LH) и/или фолликул-стимулирующего гормона (FSH), для лечения карциномы простаты,например, агонисты и антагонисты LHRH, такие как гозерелинацетат и лупролид. Ингибиторы пути сигнальной трансдукции являются теми ингибиторами, которые блокируют или ингибируют химический процесс, который вызывает внутриклеточные изменения. В используемом в данном описании смысле данным изменением является пролиферация или дифференциация клеток. Ингибиторы сигнальной трансдукции, полезные в настоящем изобретении, включают ингибиторы рецепторных тирозинкиназ, нерецепторные тирозинкиназы, блокаторы SH2/SH домена, серин/треонинкиназы,фосфотидилинозит-3 киназы, миоинозит сигнализатор и Ras онкогены. Некоторые протеинтирозинкиназы катализируют фосфорилирование специфических тирозильных остатков в разнообразных белках, вовлекаемых в регулирование роста клеток. Такие протеинтирозинкиназы могут широко классифицироваться как рецепторные и нерецепторные киназы. Рецепторные тирозинкиназы являются трансмембранными белками, имеющими внеклеточный лиганд-связывающий домен, трансмембранный домен и домен тирозинкиназы. Рецепторные тирозинкиназы вовлекаются в регуляцию клеточного роста и обычно называются рецепторами фактора роста. Показано, что несоответствующая или неконтролируемая активация многих из данных киназ, т.е. аберрантная активность рецептора киназного фактора роста, например, путем сверхэкспрессии или мутации, приводит в результате к неконтролируемому росту клеток. Соответственно, аберрантная активность таких киназ была связана с злокачественным ростом ткани. Соответственно, ингибиторы таких киназ могли бы предоставить методы лечения рака. Рецепторы фактора роста включают, например, рецептор эпидермального фактора роста (EGFr), рецептор тромбоцитарного фактора роста (PDGFr), erbB2, erbB4, рецептор сосудисто-эндотелиального фактора роста (VEGFr), тирозинкиназу с доменами иммуноглобулинподобной гомологией и эпидермального фактора роста (TIE-2), рецептор инсулинового фактора роста-I(IGFI), фактор стимуляции колонии макрофага (cfms), BTK, ckit, cmet, рецепторы фактора роста фибробластов (FGF), Trk рецепторы (TrkA, TrkB и TrkC), рецепторы эфрина (eph) и RET протоонкоген. Некоторые ингибиторы рецепторов роста находятся на стадии разработки и включают лиганд-антагонисты, антитела, ингибиторы тирозинкиназы и антисмысловые олигонуклеотиды. Рецепторы фактора роста и агенты, которые ингибируют рецепторную функцию фактора роста, описаны, например, в публикацииWorkman, Paul and Kerr, David, CRC press 1994, London. Тирозинкиназы, которые не являются рецепторными киназами фактора роста, называются нерецепторными тирозинкиназами. Нерецепторные тирозинкиназы для использования в настоящем изобретении,которые являются мишенями или целями противораковых лекарственных средств, включают cSrc, Lck,- 11019540Fyn, Yes, Jak, cAbl, FAK (фокальная адгезионная киназа), Brutons тирозинкиназа и Bcr-Abl. Такие нерецепторные киназы и агенты, которые ингибируют нерецепторную функцию тирозинкиназы, описаны в рубликации Sinh, S. and Corey, S.J., (1999) Journal of Hematotherapy and Stem Cell Research 8 (5): 465-80; иBolen, J,B., Brugge, J.S., (1997) Annual review of Immunology, 15:371-404. Блокаторы SH2/SH3 домена являются агентами, которые разрывают связь SH2 или SH3 домена в широком множестве ферментов или адапторных белков, включая, PI3-K р 85 субъединицы, киназы Src семейства, адапторные молекулы, (Shc, Crk, Nek, Grb2) и Ras-GAP. SH2/SH3 домены в качестве мишени для противораковых лекарственных средств описаны Smithgall, Т.Е. (1995), Journal of Pharmacological andToxicological Methods 34(3) 125-32. Ингибиторы серин/треонинкиназ, включая блокаторы каскада MAP киназы, которые включают блокаторы Raf киназ (rafk), митоген или внеклеточную регуляторную киназу (MEK-азы) и внеклеточные регуляторные киназы (ERK-азы); и блокаторы членов семейства протеинкиназы С, включающие блокаторы РКС (альфа, бета, гамма, эпсилон, мю, лямбда, йота, зета), семейство IkB (IKKa, IKKb), РКВ семейство киназ, члены семейства act киназы и TGF бета рецепторные киназы. Такие серин/треонинкиназы и их ингибиторы описаны в публикациях Yamamoto, Т., Taya, S., Kaibuchi, K., (1999), Journal of Biochemistry, 126 (5) 799-803; Brodt, P, Samani, A., and Navab, R, (2000), Biochemical Pharmacology, 60, 1101-1107;Treatment and Research. 78: 3-27, Lackey, K. et al. Bioorganic and Medicinal Chemistry Letters, (10), 2000,223-226; патенте США 6268391; и Martinez-Iacaci, L., et al., Int. J. Cancer (2000), 88(1), 44-52. Ингибиторы членов семейства фосфотидилинозит-3 киназы, включающие блокаторы PI3-киназы,ATM, ДНК-РК и Ku также могут быть полезными в настоящем изобретении. Такие киназы описаны(7):935-8; и Zhong, H. et al., Cancer res, (2000) 60(6), 1541-1545. Представляющими интерес в настоящем изобретении являются также Myo-инозит сигнальные ингибиторы, такие как блокаторы фосфолипазы С и аналоги миоинозита. Такие сигнальные ингибиторы описаны Powis, G., and Kozzikowski A., (1994) New Molecular Targets for Cancer Chemotherapy ed., PaulWorkman and David Kerr, CRC press 1994, London. Еще одной группой ингибиторов пути сигнальной трансдукции являются ингибиторы Ras онкогена. Такие ингибиторы включают ингибиторы фарнезилтрансферазы, геранилгеранил трансферазы и СААХ протеазы, а также антисмысловые олигонуклеотиды, рибозимы и иммунотерапию. Показано, что такие ингибиторы блокируют ras активацию в клетках, содержащих мутантные ras дикого типа, действуя, тем самым, как агенты антипролиферации. Ингибирование Ras онкогена обсуждается в публикациях Scharovsky, O.G., Rozados, V.R., Gervasoni, S.I. Matar, P. (2000), Journal of Biomedical Science. 7(4) 292-8; Ashby, M.N. (1998), Current Opinion in Lipidology 9(2) 99-102; и BioChim. Biophys. Acta, (1999) 1423 (3): 1930. Как указано выше, антагонисты антител в отношении связи лиганда рецепторной киназы также могут служить в качестве ингибиторов сигнальной трансдукции. Данная группа ингибиторов пути сигнальной трансдукции включает использование гуманизированных антител к внеклеточному лиганду, связывающему домен рецепторных тирозинкиназ. Например, имклон С 225 EGFR специфические антитела (см.growth in mice, Cancer Res. (2000) 60, 5117-5124). Ингибиторы ангиогенеза нерецепторной киназы могут быть также полезными в настоящем изобретении. Ингибиторы связанных с ангиогенезом VEGFR и TIE2 обсуждены выше в отношении ингибиторов трансдукции (оба рецептора являются рецепторными тирозинкиназами). Ангиогенез обычно связан сerbB2/EGFR пути сигналов, поскольку было показано, что ингибиторы еrbB2 и EGFR ингибируют ангиогенез, прежде всего VEGF экспрессию. Соответственно, ингибиторы нерецепторной тирозинкиназы могут использоваться в комбинации с соединениями настоящего изобретения. Например, анти-VEGF антитела, которые не распознают VEGFR (рецепторная тирозинкиназа), но связываются с лигандом; низкомолекулярные ингибиторы интегрина (альфа v бета 3), которые ингибируют ангиогенез; эндостатин и ангиостатин (не-RTK) также могут оказаться полезными в комбинации с описываемыми соединениями (см.Bruns CJ et al (2000), Cancer Res., 60: 2926-2935; Schreiber AB, Winkler ME, and Derynck R. (1986), Science, 232: 1250-1253; Yen L. et al. (2000), Oncogene 19:3460-3469). Агенты, используемые в иммунотерапевтических режимах, также могут быть полезными в комбинации с соединением формулы (1). Имеется ряд иммунологических стратегий генерирования иммунного ответа. Данные стратегии находятся обычно в области опухолевой вакцинации. Эффективность иммунологических подходов может в значительной мере усиливаться через объединенное ингибирование сигнальных путей с использованием низкомолекулярных ингибиторов. Обсуждение подхода иммунологическая/опухолевая вакцина против erbB2/EGFR дается в публикациях Reilly RT et al. (2000), Cancer Res. 60: 3569-3576; и Chen Y, Hu D, Eling D.J., Robbins J., and Kipps T.J. (1998), Cancer Res. 58: 1965-1971. Агенты, используемые в проапоптотических режимах (например, bcl-2 антисмысловые олигонуклеотиды), могут быть также полезны в комбинациях согласно настоящему изобретению. Члены Bcl-2 семейства белков блокируют апоптоз. Повышающее регулирование bcl-2, следовательно, связывают с химиостойкостью. Исследования показали, что эпидермальный фактор роста (EGF) стимулирует антиапоптотические представители bcl-2 семейства (т.е. mcl-1). Следовательно, стратегии, предназначенные для понижающего регулирования экспрессии Bcl-2 в опухолях, продемонстрировали клиническую пользу и в настоящее время находятся в фазе II/III испытаний, а именно Genta's G3139 bcl-2 антисмысловой олигонуклеотид. Такие проапоптотические стратегии, использующие для bcl-2 стратегию антисмыслового олигонуклеотида, обсуждаются в публикации Waters J.S. et al. (2000), J. Clin. Oncol. 18: 1812-1823; и Kitada S et al. (1994), Antisense Res. Dev, 4; 71-79. Ингибиторы передачи сигнала клеточного цикла ингибируют молекулы, вовлекаемые в контроль клеточного цикла. Семейство протеинкиназ, называемое циклинзависимыми киназами (CDK-азы), и их взаимодействие с семейством белков, называемых циклинами, контролирующими прогрессирование через эукариотный клеточный цикл. Координация активации и инактивации различных циклин/CDK комплексов необходима для нормального прогрессирования через клеточный цикл. Разрабатывается несколько ингибиторов передачи сигнала клеточного цикла. Например, примеры циклинзависимых киназ,включающие CDK2, CDK4 и CDK6, и данные ингибиторы описаны, например, в публикации Rosania etal., Exp. Opin. Ther. Patents (2000) 10 (2): 215-230. В одном из вариантов осуществления способ лечения рака, согласно заявленному изобретению,предусматривает совместное введение соединения формулы 1 и/или его фармацевтически приемлемой соли и по меньшей мере одного антинеопластического агента, такого как агент, выбранный из группы,состоящей из агентов против микротрубочек, координационных комплексов платины, алкилирующих агентов, антибиотических агентов, ингибиторов топоизомеразы II, антиметаболитов, ингибиторов топоизомеразы I, гормонов и гормональных аналогов, ингибиторов пути сигнальной трансдукции, ингибиторов ангиогенеза нерецепторной тирозинкиназы, иммунотерапевтических агентов, проапоптотических агентов и ингибиторов передачи сигнала клеточного цикла. Биологические анализыPI3K альфа Leadseeker SPA анализ Соединение настоящего изобретения испытывали в соответствии со следующими анализами, и выявлено в качестве ингибитора PI3 киназ, особенно PI3K. Принцип анализаSPA визуализирующими гранулами являются микросферы, содержащие сцинтиллятор, который испускает свет в красной области видимого спектра. В результате данные гранулы идеально подходят для использования с CCD красителем Viewlux. Гранулы Leadseeker, использованные в данной системе, представляют собой полистирольные гранулы, которые сочетаются с полиэтиленимином. При добавлении к аналитической смеси гранулы абсорбируют как субстрат (PIP2), так и продукт (PIP3). Абсорбированный Р 33-PIP3 вызывает увеличение сигнала, измеряемое в виде показателей ADU (аналог цифровых единиц). Данный протокол детализирует использование PEI-PS Leadseeker гранул для анализа с использованиемHis-p110/ph85 PI3K альфа. Протокол анализа Твердые соединения обычно помещают в планшеты с 0,1 мкл 100% ДМСО во все лунки (за исключением колонки 6 и 18) 384-луночного, плоскодонного планшета малого объема (Greiner 784075). Соединения подвергают серийному разведению (3-кратно в 100% ДМСО) по всему планшету от колонки 1 до колонки 12 и от колонки 13 до колонки 24, оставляя колонки 6 и 18, содержащие только ДМСО, чтобы получить 11 концентраций для каждого испытуемого соединения. Буфер для анализа содержит MOPS (pH 6,5), CHAPS и DTT. PI3K альфа и PIP2 (L-альфа-Dмиофосфатидилинозит 4,5-бифосфат [PI(4,5)P2]3-O-фосфосвязанный D(+)-sn-1,2-ди-О-октаноилглицерил, CellSignals901) смешивают и инкубируют на планшете с соединением в течение 30 минут перед тем, как начинается реакция с добавлением Р 33-АТР и MgCl2 (реагенты добавляются с использованиемZoom). Для определения нижнего контроля лунки (колонка 18) обычно освобождают от фермента. Добавляют PEI-PS Leadseeker гранулы в PBS/EDTA/CHAPS (с помощью Multidrop) для гашения реакции, и планшеты оставляют для инкубации в течение по меньшей мере одного часа (обычно на протяжении ночи) перед центрифугированием. Сигнал определяют с использованием Viewlux детектора и затем вводят в программное обеспечение для нанесения кривой (Activity Base) для построения кривых ответной реакции в соответствии с концентрацией. Процент ингибировния активности вычисляют относительно высших контролей (С 1, 0,1 мкл ДМСО в колонке 6, ряды А-Р) и нижних контролей (С 2, 5 мкл 40 мкМ PIP2 в буфере в колонке 18, ряды А-Р), с использованием 100(1-(U1-C2)/(С 1-С 2. Концентрацию испытуемого соединения, дающую 50% ингибирование, определяют с использованием уравнения y=Vmaxx)/ Клеточные анализы День 1. Высевают клетки в планшеты до полудня. 10K клеток/лунка в плоскодонных 96-луночных планшетах с прозрачным дном (f.v. 105 мкл). В последние четыре лунки в последней колонке добавляют только среду. Помещают в 37 С инкубатор на всю ночь. Планшет с соединением. Приготавливают в полипропиленовых круглодонных 96-луночных планшетах; 8 соединений на планшет, 11-pt титрований каждого (3 серийное разведение), ДМСО в последней колонке (0,15% f.c на клетки). 15 мкл в первой лунке, 10 мкл ДМСО в остальных; берут 5 мкл из первой лунки и смешивают в следующей, продолжают по всему планшету (за исключением последней колонки); запечатывают крышкой из фольги и помещают при 4 С. День 2. Отбирают ингибиторы с буфером для лизиса (4 С/-20 С) и планшеты с соединением (4 С), размораживают наверху на лабораторном столе; готовят 1 Трис промывочный буфер (WB) для заполнения резервуара на планшет для промывки и завершают подачу на лабораторном столе (используя MiliQ),вращают на центрифуге, давая возможность охладиться. Блокировка MSD планшетов. Готовят 20 мл 3% блокировочного раствора/планшет (600 мг блокатора А в 20 мл WB), добавляют 150 мкл/лунка и инкубируют при комнатной температуре в течение по меньшей мере 1 ч. Добавление соединения (во время блокировки). Добавляют 300 мкл ростовой среды (RPMI w/Q, 10% FBS) на лунку (682 разбавление соединения) в каждый планшет с соединением. Добавляют 5 мкл разбавленного соединения в каждую лунку (f.v. 110 мкл) на дубликатных планшетах. Помещают в 37 С инкубатор на 30 мин. Получение лизатов. Готовят MSD буфер для лизиса; на 10 мл добавляют 200 мкл раствора ингибитора протеазы и 100 мкл каждого из ингибиторов фосфатазы I и II (до использования хранят на льду). Удаляют планшеты после инкубации, асперируют среду на промывателе планшетов, промывают 1 холодным PBS и добавляют 80 мкл MSD буфера для лизиса на лунку; инкубируют на шейкере при 4 С в течение 30 мин. Центрифугируют холодным при 2500 об/мин в течение 10 мин; оставляют планшеты при 4 С до использования в центрифуге. АКТ двойной анализ. Промывают планшеты (4 200 мкл/лунку WB в промывателе планшетов); промокают планшеты на бумажном полотенце для блоттирования. Добавляют 60 мкл лизатов/лунка, инкубируют на шейкере при комнатной температуре в течение 1 ч. Во время инкубирования готовят детекцию Ab (3 мл/планшет; 2 мл WB и 1 мл блокировочного раствора w/Ab при 10 нМ); повторяют стадию промывки, как описано выше. Добавляют 25 мкл Ab/лунка, инкубируют на шейкере при комнатной температуре в течение 1 ч; повторяют стадию промывки, как описано выше. Добавляют 150 мкл/лунка 1 буфера для считывания (разбавляют 4 исходного в ddH2O, 20 мл/планшет), немедленно производят считывание. Анализ. Отмечают все показатели данных при каждой концентрации соединения. Показатель данных при наивысшей концентрации соединения должен быть равен или выше чем 7 0% ДМСО контроля. IC50 для дубликатных прогонов должен находиться в пределах 2-кратного друг от друга (не помечен в итоговой матрице).Y min должен быть выше нуля; если оба min помечены красным (35), тогда соединение внесено в список как неактивное (IC50=наивысшей дозы). Если только один min помечен красным, но все еще 50,тогда называют IC50, как внесено в список. Любые показатели данных, равные или большие, чем 30% кривой, не принимаются во внимание. Анализ на рост клеток/гибель ВТ 474, НСС 1954 и T-47D (грудь человека) культивировали в RPMI-1640, содержащей 10% фетальной телячьей сыворотки при, 37 С в 5% CO2 в инкубаторе. За два-три дня до анализа клетки помещали в Т 75 колбу (Falcon 353136) при плотности, которая давала приблизительно 70-80% слияние во время сбора для анализа. Клетки собирали с использованием 0,25% трипсин-EDTA (Sigma 4049). Подсчет клеток производили в суспензии клеток на основе исключения трипанового синего, которым клетки были окрашены. Клетки затем помещали в лунки черного плоскодонного 384-луночного планшета из полистирола (Greiner 781086) в 48 мкл культуральной среды на лунку при 1000 клеток/лунка. Все планшеты помещали в атмосферу 5% СО 2, при 37 С на ночь и на следующий день добавляли испытуемые соединения. Один планшет обрабатывали CellTiter-Glo (Promega7573) для измерения в день 0 (t=0) и считыва- 14019540 ния, как описано выше. Испытуемые соединения готовили в полипропиленовых 384-луночных планшетах с прозрачным дном (Greiner 781280) с последовательными двукратными разведениями. 4 мкл данных разведений добавляли к 105 мкл культуральной среды, после смешения раствора, 2 мкл данных разведений добавляли в каждую лунку планшетов с клетками. Конечная концентрация ДМСО во всех лунках составляла 0,15%. Клетки инкубировали при 37 С, 5% СО 2, в течение 72 ч. После 72-часового инкубирования с соединениями каждый планшет проявляли и производили считывание. В планшеты для анализа добавляли реагент CellTiter-Glo с использованием объема, эквивалентного объему культуры клеток в лунках. Планшеты встряхивали в течение приблизительно двух минут, инкубировали при комнатной температуре в течение приблизительно 30 минут и считывали хемилюминесцентный сигнал с помощью аппарата для считывания Analyst GT (Molecular Devices). Результаты выражали в виде процента от величины t=0 и строили график зависимости от концентрации соединения. Ингибирование роста клеток определяли для каждого соединения путем установления дозо-зависимого ответа, используя систему 4 или 6 параметрических кривых с использованием программного обеспечения XLfit и определения концентрации, которая ингибировала рост клеток на 50% (gIC50) с Y min как t=0 и Y max как ДМСО контроля. Значение от лунок без клеток вычитали из всех образцов для корректировки фона. Дополнительные ссылки Соединение настоящего изобретения может быть также испытано для определения его ингибирующей активности в отношении PI3K, PI3K, PI3K и PI3K в соответствии с анализами, описанными в следующих ссылочных материалах. Для всех PI3K изоформ: 1. Cloning, expression, purification, and characterization of the human Class la phosphoinositide 3-kinaseChem. High Throughput.Screen., 2003, 6(4), 321. Для PI3K: WO 2005/011686 A1. Фармацевтически активное соединение данного изобретения полезно в качестве ингибитора PI3 киназы для млекопитающих, особенно людей, нуждающихся в этом. Фармацевтически активное соединение настоящего изобретения включается в удобные дозированные формы, такие как капсулы, таблетки или инъецируемые препараты. Используются твердые или жидкие фармацевтические носители. Твердые носители включают крахмал, лактозу, дигидрат сульфата кальция, белую глину, сахарозу, тальк, желатин, агар-агар, пектин, акацию, стеарат магния и стеариновую кислоту. Жидкие носители включают сироп, арахисовое масло, оливковое масло, физиологический раствор и воду. Аналогичным образом, носитель или разбавитель может включать материал пролонгированного высвобождения, такой как глицерилмоностеарат или глицерилдистеарат, один или с воском. Количество твердого носителя широко варьирует, но предпочтительно составляет приблизительно от 25 мг до приблизительно 1 г на единичную дозу. Когда используется жидкий носитель, препарат будет в форме сиропа, эликсира, эмульсии, мягкой желатиновой капсулы, стерильной инъецируемой жидкости,такой как в ампуле, или в форме водной или неводной жидкой суспензии. Фармацевтические препараты изготавливаются в соответствии с общепринятыми технологиями фармацевтической химии, включающими смешение, гранулирование и прессование, когда необходимо для форм таблеток, или смешение, наполнение и растворение ингредиентов, как это соответствует для получения желаемых оральных или парентеральных продуктов. Дозы соответствующих настоящему изобретению фармацевтически активных соединений в фармацевтической дозированной единице, описанной выше, составляют эффективное, нетоксичное количество, предпочтительно выбранное из интервала 0,001-100 мг/кг активного соединения, предпочтительно 0,001-50 мг/кг. При лечении человека, нуждающегося в PI3K ингибиторе, выбранная доза вводится предпочтительно от 1-6 раз в день, орально или парентерально. Предпочтительные формы парентерального введения включают локальное или местное введение, ректальное, трансдермальное, введение с помощью инъекции и непрерывное путем вливания. Оральная дозированная единица для введения человеку предпочтительно содержит от 0,05 до 3500 мг активного соединения. Предпочтительно оральное введение,которое использует более низкие дозы. Парентеральное введение, при более высоких дозах, однако также может использоваться, когда это безопасно и удобно для пациента. Оптимальные дозы, предполагаемые для введения, могут быть легко определены специалистами в данной области и варьируют в зависимости от силы препарата, способа введения и степени развития болезненного состояния. Дополнительные факторы, в зависимости от конкретного подвергаемого лечению пациента, приводят в результате к необходимости регулирования доз и включают возраст пациента, массу, диету и время введения. Изобретение предоставляет также применение соединения формулы (1) в производстве лекарственного средства для использования в лечении рака. Изобретение предоставляет также фармацевтическую композицию для применения в лечении рака,которая содержит соединение формулы (1) и фармацевтически приемлемый носитель. В дополнение, фармацевтически активное соединение настоящего изобретения может вводиться совместно с дополнительными активными ингредиентами, включающими соединения, известные как имеющие полезность при применении в комбинации с ингибитором PI3 киназы. Считается, что специалист в данной области может с использованием предыдущего описания использовать настоящее изобретение в его полной степени без дополнительного экспериментирования. Поэтому следующие примеры следует рассматривать лишь как иллюстративные, и никоим образом не для ограничения объема настоящего изобретения. Экспериментальные подробности Соединение настоящего изобретения может быть получено в соответствии со следующей схемой. Схема Условия: а) арил(R1)станнан,палладиевый катализатор, диоксан,нагревание; b) бис(пинаколато)дибор, ацетат калия, палладиевый катализатор, диоксан, нагревание; затем гетероарил(R2)бромид, палладиевый катализатор, насыщенный водный раствор Na2CO3, диоксан, нагревание. Пример. 2,4-Дифтор-N-2-(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинилбензолсульфонамид(2,132 г, 2,61 ммоль) растворяли в 1,4-диоксане (200 мл) и нагревали до 105 С. Через 3 ч добавляли еще палладиевого катализатора и нагревали в течение 6 ч. Концентрировали и растворяли в смеси метиленхлорид/метанол. Очищали колоночной хроматографией (комбифлэш) с 2% MeOH/EtOAc, получая неочищенное целевое соединение. Его растирали с EtOAc, получая 6-бром-4-(4-пиридазинил)хинолин (5,8 г, 20,27 ммол, 38,8% выход). MC(ES)+ m/e 285,9, 287,9[М+Н]+.b) 2,4-Дифтор-N-2-(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинилбензолсульфонамид. Суспензию 6-бром-4-(4-пиридазинил)хинолина (4,8 г, 16,78 ммоль), бис(пинаколато)дибора (4,69 г,18,45 ммоль), PdCl2(dppf)-CH2Cl2 (530 мг, 0,649 ммоль) и ацетата калия (3,29 г, 33,6 ммоль) в безводном 1,4-диоксане (120 мл) и нагревали при 100 С в течение 3 ч. По данным ЖХМС наблюдалось полное исчезновение исходного бромида. Реакционную смесь затем обрабатывали N-[5-бром-2-(метилокси)-3 пиридинил]-2,4-дифторбензолсульфонамидом (6,68 г, 17,61 ммоль) и еще одной порцией PdCl2(dppf)CH2Cl2 (550 мг, 0,673 ммоль), затем нагревали при 110 С в течение 16 ч. Реакционной смеси давали возможность остыть до комнатной температуры, фильтровали и концентрировали. Очистка остатка хроматографией (Analogix; 5% MeOH/5% CH2Cl2/90% EtOAc) давала 6,5 г (76%) желаемого продукта.MC(ES)+ m/e 505,9[M+H]+. Пример композиции в виде капсул Оральную дозированную форму для введения в соответствии с настоящим изобретением получали путем заполнения стандартных твердых желатиновых капсул из двух частей ингредиентами в пропорциях, показанных ниже в табл. 1. Таблица I Пример композиции в виде инъецируемого парентерального препарата Инъецируемую форму для введения, согласно настоящему изобретению, получали путем перемешивания 1,5% по массе соединения изобретения в 10% по объему пропиленгликоля в воде. Пример композиции в виде таблеток Сахарозу, дигидрат сульфата кальция и ингибитор PI3K, как показано в табл. II ниже, смешивали и гранулировали в показанных пропорциях с 10% раствором желатина. Влажные гранулы просеивали, сушили, смешивали с крахмалом, тальком и стеариновой кислотой, просеивали и прессовали в таблетки. или его фармацевтически приемлемая соль. 2. Соединение по п.1, которое представляет собой 2,4-дифтор-N-2-(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинилбензолсульфонамид. 3. Применение соединения по п.1 или 2 или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения рака у человека, нуждающегося в этом. 4. Применение по п.3, где рак выбран из группы, состоящей из глиом головного мозга, глиобластом,лейкемий, синдрома Баннайана-Зонана, болезни Коудена, болезни Лермитта-Дюкло, рака груди, воспалительного рака груди, опухоли Вильмса, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, рака ободочной кишки, рака головы и шеи, рака почек, рака легких, рака печени, меланомы, рака яичников, рака поджелудочной железы, рака простаты, саркомы, остеосаркомы, крупноклеточной опухоли костей и щитовидной железы. 5. Применение по п.3, где рак выбран из группы, состоящей из рака яичников, рака поджелудочной железы, рака груди, рака простаты и лейкемии. 6. Фармацевтическая композиция, содержащая соединение по п.1 или 2 и фармацевтически приемлемый носитель.
МПК / Метки
МПК: A61K 31/47
Метки: качестве, производные, хинолина, киназы, ингибиторов
Код ссылки
<a href="https://eas.patents.su/18-19540-proizvodnye-hinolina-v-kachestve-ingibitorov-pi3-kinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хинолина в качестве ингибиторов pi3 киназы</a>
Предыдущий патент: Применение хитозанов для лечения воспалительных заболеваний ногтей
Следующий патент: Маховик-вентилятор для подачи сжатого воздуха для очистки узловязательного стола
Случайный патент: Способ дистилляции (мет) акриловых кислот












