Дейтерированные производные ксантина и их применение
Номер патента: 23809
Опубликовано: 29.07.2016
Авторы: Харбесон Скотт Л., Тунг Роджер Д., Лю Джули Ф.
Формула / Реферат
1. Соединение структурной формулы
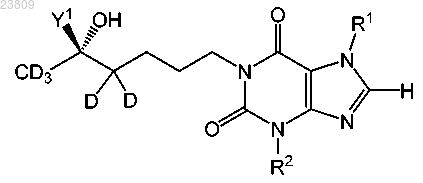
или его фармацевтически приемлемая соль, где R1 выбран из -СН3 и -CD3;
R2 выбран из -СН3 и -CD3;
Y1 представляет собой дейтерий или водород.
2. Соединение по п.1, в котором R1 представляет собой -СН3.
3. Соединение по п.1, в котором R1 представляет собой -CD3.
4. Соединение по пп.1, 2 или 3, в котором R2 представляет собой -СН3.
5. Соединение по пп.1, 2 или 3, в котором R2 представляет собой -CD3.
6. Соединение по п.1, в котором R1 представляет собой -СН3 и R2 представляет собой -СН3.
7. Соединение по п.1, в котором Y1 представляет собой дейтерий.
8. Соединение по п.1, где Y1 представляет собой водород.
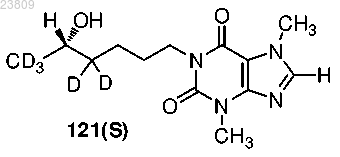
9. Соединение по п.1, выбранное из
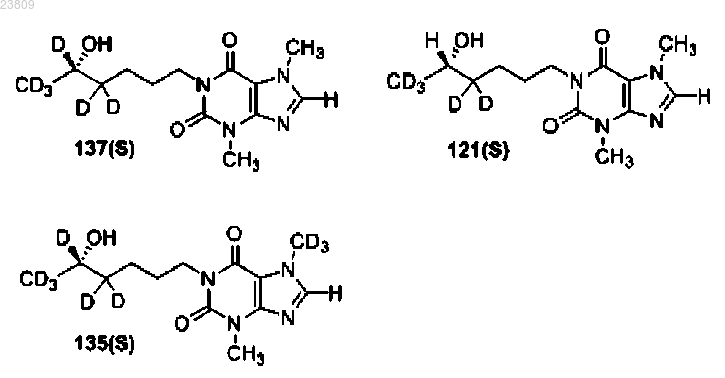
или фармацевтически приемлемая соль.
10. Соединение, структурной формулы

или его фармацевтически приемлемая соль,
где R1 выбран из -СН3 и -CD3; R2 выбран из -СН3 и -CD3;
Y1 представляет собой дейтерий или водород;
при условии, что:
(i) если Y1 представляет собой дейтерий, то R2 представляет собой CD3; и
(ii) если Y1 представляет собой водород, то R1 представляет собой СН3.
11. Соединение по п.10, в котором R1 представляет собой -СН3.
12. Соединение по п.10, в котором R1 представляет собой -CD3.
13. Соединение по любому из пп.10-12, в котором R2 представляет собой -СН3.
14. Соединение по любому из пп.10-12, в котором R2 представляет собой -CD3.
15. Соединение по п.10, в котором R1 представляет собой -СН3 и R2 представляет собой -СН3.
16. Соединение по п.10, в котором Y1 представляет собой дейтерий.
17. Соединение по п.10, в котором Y1 представляет собой водород.
18. Соединение по п.14, выбранное из
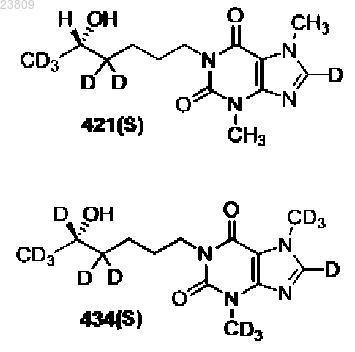
или фармацевтически приемлемая соль.
19. Соединение структурной формулы
или его фармацевтически приемлемая соль.
20. Соединение по любому из пп.1, 10 и 19, в котором фактор изотопного обогащения для каждого обозначенного атома дейтерия составляет по меньшей мере 5000.
21. Соединение по любому из пп.1, 10 и 19, в котором фактор изотопного обогащения для каждого обозначенного атома дейтерия составляет по меньшей мере 6000.
22. Соединение по любому из пп.1, 10 и 19, в котором фактор изотопного обогащения для каждого обозначенного атома дейтерия составляет по меньшей мере 6600.
23. Соединение по любому из пп.1, 10 и 19, в котором соединение содержит менее 10% другого стереоизомера.
24. Соединение по любому из пп.1, 10 и 19, в котором соединение содержит менее 5% другого стереоизомера.
25. Фармацевтическая композиция, содержащая соединение, выбранное из одного из следующих соединений:

или его фармацевтически приемлемую соли, и фармацевтически приемлемый носитель.
26. Способ лечения заболевания или состояния у пациента, нуждающегося в этом, предусматривающий введение пациенту эффективного количества композиции по п.25, при этом заболевание выбрано из диабетической нефропатии, гипертензивной нефропатии или перемежающейся хромоты на почве хронического облитерирующего заболевания артерий нижних конечностей.
27. Способ лечения хронического заболевания почек у пациента, нуждающегося в этом, предусматривающий введение пациенту эффективного количества композиции по п.25.
28. Способ по п.27, в котором хроническим заболеванием почек является гломерулонефрит, фокально-сегментарный гломерулосклероз, нефротический синдром, рефлюкс-уропатия или поликистоз почек.
29. Способ лечения хронического заболевания печени у пациента, нуждающегося в этом, предусматривающий введение пациенту эффективного количества композиции по п.25.
30. Способ по п.29, в котором хроническим заболеванием печени является печеночная недостаточность, неалкогольный стеатогепатит, жировая дистрофия печени или алкогольный гепатит или другие вызванные диетой с высоким содержанием жиров или алкоголем клеточно-дегенеративные заболевания.
31. Способ по п.30, в котором хроническим заболеванием печени является цирроз, жировая дистрофия печени или алкогольный гепатит.
32. Способ лечения связанных с диабетом заболеваний или состояний у пациента, нуждающегося в этом, предусматривающий введение пациенту эффективного количества композиции по п.25, при этом заболевание или состояние выбрано из резистентности к инсулину, ретинопатии, диабетической язвы, ассоциированного с облучением некроза, острой почечной недостаточности или индуцированной лекарственными препаратами нефротоксичности.
33. Способ лечения перемежающейся хромоты у пациента, нуждающегося в этом, предусматривающий введение пациенту эффективного количества композиции по п.25.
34. Способ лечения хронического заболевания почек у пациента, нуждающегося в этом, предусматривающий введение пациенту эффективного количества композиции по п.25.
35. Способ лечения хронического заболевания или состояния у пациента, нуждающегося в этом, при этом заболевание или состояние выбрано из сахарного инсулинозависимого диабета; инсулиннезависимого сахарного диабета; метаболического синдрома; ожирения; резистентности к инсулину; дислипидемии; патологической толерантности глюкозы; гипертензии; гиперлипидемии; гиперурикемии; подагры и гиперкоагуляции, предусматривающий введение пациенту эффективного количества композиции по п.25.
36. Способ лечения хронического заболевания или состояния у пациента, нуждающегося в этом, при этом заболевание или состояние выбрано из анемии, болезни Грейвса, окклюзии вены сетчатки, люпус-нефрита, макулярной дегенерации, миелодисплазии, прурита ВИЧ-происхождения, легочной гипертензии, окклюзии артерии сетчатки, воспаления кишечника, ишемической оптической нейропатии, острого панкреатита, серповидно-клеточной анемии, бета-талассемии, предусматривающий введение пациенту эффективного количества композиции по п.25.
Текст
ДЕЙТЕРИРОВАННЫЕ ПРОИЗВОДНЫЕ КСАНТИНА И ИХ ПРИМЕНЕНИЕ Изобретение относится к новым соединениям, которые являются дейтерированными производными ксантина и их фармацевтически приемлемыми солями. Более конкретно, данное изобретение относится к новым замещенным производным ксантина, которые являются производными пентоксифиллина. Кроме того, в данном изобретении предложены композиции,содержащие одно или несколько соединений данного изобретения и носитель, а также применение описанных соединений и композиций в способах лечения заболеваний и состояний, для которых пентоксифиллин и родственные соединения являются полезными. Данное изобретение испрашивает приоритет заявки США 12/873991, поданной 1 сентября 2010 г., и предварительной заявки на патент США 61/239342, поданной 2 сентября 2009 г., полное содержание которых включено здесь посредством отсылки. Сведения о предшествующем уровне техники Большое число современных лекарственных средств обладают слабыми свойствами всасывания,распределения, метаболизма и/или выведения (ADME), которые препятствуют их широкому применению. Слабые свойства ADME являются также главной причиной неудач кандидатных лекарственных средств во время клинических испытаний. Не смотря на то что технологии формулирования и стратегии пролекарств можно применять в некоторых случаях для улучшения некоторых свойств ADME, эти подходы не решают внутренние проблемы ADME, которые существуют для многих лекарственных средств,а также кандидатных лекарственных средств. Одной внутренней проблемой является быстрый метаболизм, который вызывает слишком быстрое выведение из организма ряда лекарственных препаратов, которые в противном случае были бы высокоэффективными для лечения заболевания. Возможным решением проблемы быстрого выведения лекарственного средства является частое дозирование или введение высоких доз для достижения достаточно высоких уровней лекарственного средства в плазме. Однако, это вносит в лечение ряд потенциальных проблем, таких как плохое соблюдение режима дозирования пациентом, побочные эффекты, которые становятся более сильными при более высоких дозах, а также увеличение стоимости лечения. В некоторых исключительных случаях главное лекарственное средство, которое быстро выводится,вводится в сочетании с ингибитором метаболизма. Например, с классом лекарственных средств, ингибиторов протеазы, которые применяются для лечения ВИЧ-инфекции. Эти лекарственные средства, как правило, вводятся совместно с ритонавиром, ингибитором фермента CYP3A4 цитохрома Р 450, ответственного за их метаболизм. Ритонавир сам по себе обладает побочными действиями и его добавляют к таблеткам, предназначенным для ВИЧ-пациентов, которые уже принимали комбинацию различных лекарственных препаратов. Аналогично, декстрометорфан, который подвергается быстрому метаболизму под действием фермента CYP2D6, был протестирован в комбинации с гуинидином, ингибиторомCYP2D6, на лечение псевдобульбарного синдрома. В большинстве случаев, комбинирование лекарственных средств с ингибиторами цитохрома Р 450 не является удовлетворительной стратегией уменьшения выведения лекарственных веществ из организма. Ингибирование активности CYP-ферментов может нарушать метаболизм и выведение других лекарственных средств, метаболизированных этим же самым ферментом. Это может вызвать накопление в организме других лекарственных средств до токсических уровней. Возможной перспективной стратегией, в случае, если она работает, для улучшения метаболических свойств лекарственных средств является модификация дейтерием. В этом подходе предприняты попытки замедлить CYP-опосредованный метаболизм лекарственного средства путем замены одного или нескольких атомов водорода атомами дейтерия. Дейтерий является безопасным, стабильным, нерадиоактивным изотопом водорода. Дейтерий образует более прочные связи с углеродом, чем водород. В исключительных случаях повышенная прочность связи, привнесенная дейтерием, может оказывать положительное влияние на свойства ADME лекарственного средства, создавая потенциал для улучшения эффективности лекарственного средства, безопасности и переносимости. В то же время, так как размер и форма дейтерия в основном идентичны водороду, то замена водорода дейтерием не будет влиять на биохимическую активность и селективность лекарственного средства по сравнению с исходной структурной химической единицей, которая содержит только водород. За последние 35 лет эффекты замещения дейтерием на скорость метаболизма были описаны для очень небольшого процента утвержденных лекарственных средств (см., например, Blake M.I. et al., JPhysiol Pharmacol 1999, 79-88; Fisher M.B. et al., Curr Opin Drug Discov Devel, 2006, 9:101-09 ("Fisher". Результаты были изменчивыми и непредсказуемыми. Для некоторых соединений дейтерирование вызывало уменьшенный метаболический клиренс in vivo. Для других изменения в метаболизме не было. Еще другие демонстрировали уменьшенный метаболический клиренс. Изменчивость в эффектах дейтерия также привела экспертов к сомнению или отказу от модификации дейтерием как жизнеспособной стратегии дизайна лекарственного средства для ингибирования неблагоприятного метаболизма (см. Foster на с. 35 и Fisher на с. 101). Эффекты модификации дейтерием на метаболические свойства лекарственного средства являются непредсказуемыми даже в том случае, когда атомы дейтерия внедрены в известные участки метаболизма. Только путем фактического приготовления и тестирования дейтерированного лекарственного средства можно определить, отличается ли и каким образом отличается скорость метаболизма от его недейтерированного аналога. Много лекарственных средств имеют множество участков возможного метаболизма. Участок(ки), где требуется замещение дейтерием и степень дейтерирования, необходимая для того чтобы видеть действие на метаболизм, если таковой имеется, будут различными для каждого лекарственного средства. Сущность изобретения Данное изобретение относится к новым соединениям, которые являются замещенными производными ксантина, и их фармацевтически приемлемым солям. Например, данное изобретение относится к новым замещенным производным ксантина, которые являются структурно родственными пентоксифиллину. Данное изобретение также предлагает композиции, содержащие одно или несколько соединений данного изобретения и носитель, и применение описанных соединений и композиций в способах лечения заболеваний и состояний, для которых пентоксифиллин и родственные соединения являются полезными. Краткое описание фигур На фиг. 1 А и 1 В показаны уровни в сыворотке соединения данного изобретения, пентоксифиллина и некоторых их соответствующих метаболитов у четырех отдельных собак после перорального введения комбинации пентоксифиллина и соединения изобретения. На фиг. 2 показан период выработки конкретных метаболитов, измеренных в фиг. 3, после инкубирования различных соединений данного изобретения, пентоксифиллина, (S)-M1 и (R)-M1 с цельной кровью крыс. На фиг. 3 показано относительное количество конкретных метаболитов, выработанных после инкубирования различных соединений данного изобретения, пентоксифиллина, (S)-Ml и (R)-M1 с цельной кровью крыс. На фиг. 4 показан период выработки конкретных метаболитов, измеренных в фиг. 5, после инкубирования различных соединений данного изобретения, пентоксифиллина, (S)-M1 и (R)-M1 с микросомами печени человека. На фиг. 5 показано относительное количество конкретных метаболитов, выработанных после инкубирования различных соединений данного изобретения, пентоксифиллина, (S)-M1 и (R)-M1 с микросомами печени человека. Сведения, подтверждающие возможность осуществления изобретения Термин "улучшение" и "лечение" используются взаимозаменяемо и предусматривают как терапевтическое, так и профилактическое лечение. Оба термина означают уменьшение, суппрессию, смягчение,ослабление, купирование или стабилизацию развития или прогрессирования заболевания (например, заболевания или нарушения, указанного здесь), уменьшение тяжести заболевания или улучшение симптомов, ассоциированных с заболеванием."Заболевание" означает любое состояние или нарушение, которое нарушает или препятствует нормальному функционированию клетки, ткани или органа. Будет понятно, что некоторое изменение природного изотопного состава возникает в синтезированном соединении в зависимости от происхождения химических материалов, используемых при синтезе. Так, например, состав пентоксифиллина по своей природе содержит небольшие количества дейтерированных изотопологов. Концентрация природных стабильных изотопов водорода и углерода несмотря на эту изменчивость является незначительной и несущественной по сравнению со степенью замещения соединений данного изобретения стабильными изотопами (см., например, Wada E. et al., Seikagaku, 1994,66: 15; Gannes L.Z. et al., СоТ.пл. Biochem Physiol Mol Integr Physiol, 1998, 119: 725). В соединении данного изобретения, когда конкретное положение обозначено как содержащее дейтерий, следует понимать,что распространенность дейтерия в этом положении значительно больше, чем природная распространенность дейтерия, которая составляет 0.015%. Как правило, положение, обозначенное как содержащее дейтерий, имеет минимальный фактор изотопного обогащения по меньшей мере 3340 (50.1% внедрения дейтерия) в каждом атоме, обозначенном как дейтерий в указанном соединении. Используемый здесь термин "фактор изотопного обогащения" означает соотношение между изотопной распространенностью и природной изотопной распространенностью конкретного изотопа. В других вариантах соединение данного изобретения имеет фактор изотопного обогащения для каждого обозначенного атома дейтерия по меньшей мере 3500 (52.5% внедрения дейтерия в каждый обозначенный дейтерием атом), по меньшей мере 4000 (60% внедрения дейтерия), по меньшей мере 4500(67.5% внедрения дейтерия), по меньшей мере 5000 (75% внедрения дейтерия), по меньшей мере 5500(82.5% внедрения дейтерия), по меньшей мере 6000 (90% внедрения дейтерия), по меньшей мере 6333.3(95% внедрения дейтерия), по меньшей мере 6466.7 (97% внедрения дейтерия), по меньшей мере 6600(99% внедрения дейтерия) или по меньшей мере 6633.3 (99.5% внедрения дейтерия). В соединениях данного изобретения любой атом, специально не обозначенный как конкретный изотоп, означает присутствие любого стабильного изотопа этого атома. Если не указано иное, в случае, когда положение обозначено специально как "Н" или "водород", положение следует понимать как содержащее водород в его природном изотопном составе. Также, если не указано иное, в случае, когда положение обозначено специально как "D" или "дейтерий", положение следует понимать как содержащее дейтерий с распространенностью, которая по меньшей мере в 3340 раз больше, чем природная распространенность дейтерия, которая составляет 0.015% (т.е. по меньшей мере 50.1% внедрения дейтерия). Термин "изотопологи" относится к веществам, молекулы которых отличаются от конкретного соединения данного изобретения только по их изотопному составу. Термин "соединение" в отношении соединения данного изобретения относится к совокупности мо-2 023809 лекул, имеющих идентичную химическую структуру, за исключением того, что могут существовать изотопные колебания между составляющими молекулу атомами. Таким образом, опытным специалистам в данной области будет понятно, что соединение, представленное конкретной химической структурой,содержащей обозначенные атомы дейтерия, будет также содержать меньшие количества изотопологов,содержащих атомы водорода в одном или нескольких обозначенных дейтерием положениях в этой структуре. Относительное количество таких изотопологов в соединении данного изобретения будет зависеть от ряда факторов, включая изотопную чистоту дейтерированных реагентов, используемых для приготовления соединения, и эффективности внедрения дейтерия на разных стадиях синтеза, используемых для приготовления соединения. Однако, как указано выше, относительное количество таких изотопологов in toto будет меньше чем 49.9% соединения. В изобретении также предложены соли соединений изобретения. Соль соединения данного изобретения образована между кислотой и основной группой соединения, такой как функциональная аминогруппа, или основанием и кислотной группой соединения, такой как карбоксильная функциональная группа. Согласно другому варианту соединение представляет собой фармацевтически приемлемую соль присоединения кислоты. Используемый здесь термин "фармацевтически приемлемый" относится к компоненту, который в общепринятом в медицине понимании является подходящим для применения в контакте с тканями человека и других млекопитающих без вызывания неспецифической токсичности, раздражения, аллергической реакции и подобных, и соответствует приемлемому соотношению польза/риск. "Фармацевтически приемлемая соль" означает любую нетоксическую соль, которая при введении реципиенту может обеспечить, непосредственно или опосредованно, соединение данного изобретения. "Фармацевтически приемлемый противоион" представляет собой ионную часть соли, которая является нетоксичной при высвобождении из соли при введении реципиенту. Кислоты, широко используемые для образования фармацевтически приемлемых солей, включают неорганические кислоты, такие как сероводород, хлористо-водородная кислота, бромисто-водородная кислота, йодисто-водородная кислота, серная кислота и фосфорная кислота, а также органические кислоты, такие как паратолуолсульфоновая кислота, салициловая кислота, винная кислота, бивинная кислота,аскорбиновая кислота, малеиновая кислота, бензолсульфоновая кислота, фумаровая кислота, глюконовая кислота, глюкуроновая кислота, муравьиная кислота, глутаминовая кислота, метансульфоновая кислота,этансульфоновая кислота, бензолсульфоновая кислота, молочная кислота, щавелевая кислота, парабромфенилсульфоновая кислота, угольная кислота, янтарная кислота, лимонная кислота, бензойная кислота и уксусная кислота, а также родственные неорганические и органические соли. Таким образом,такие фармацевтически приемлемые соли включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, иодид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутират, капрат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат, себацинат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат,хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, терефталат,сульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, гидроксибутират, глуколят, малеат, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат,нафталин-2-сульфонат, манделат и подобные соли. В одном варианте фармацевтически приемлемые соли присоединения кислот включают соли, образованные с минеральными кислотами, такими как хлористоводородная кислота и бромисто-водородная кислота, и соли, образованные с органическими кислотами,такими как малеиновая кислота. Изобретение также включает сольваты и гидраты соединения изобретения. Использующийся здесь термин "гидрат" означает соединение, которое, кроме того, содержит стехиометрическое или нестехиометрическое количество воды, связанной нековалентными межмолекулярными силами. Используемый здесь термин "сольват" означает соединение, которое, кроме того, включает стехиометрическое или нестехиометрическое количество растворителя, такого как вода, ацетон, этанол, метанол, дихлорметан, 2 пропанол или подобного, связанного нековалентными межмолекулярными силами. Должно быть понятно, что атом углерода, который несет заместители Y1 и Y2 в формулах А, А 1, I и В, может быть хиральным в некоторых случаях (когда Y1, Y2 И R3 отличаются друг от друга), и в других случаях может быть ахиральным (когда по меньшей мере два из Y1, Y2 и R3 являются одинаковыми). Этот атом углерода (т.е. атом углерода, несущий Y1 и Y2) обозначен как в формулах А, А 1, I и В. Так,например, хиральные соединения данного изобретения могут существовать в виде индивидуальных энантиомеров или же в виде рацемических или скалемических смесей энантиомеров. Таким образом,соединение настоящего изобретения будет включать рацемические и скалемические энантиомерные смеси, а также индивидуальные соответствующие стереоизомеры, которые главным образом свободны от другого возможного стереоизомера. Используемый здесь термин "по существу свободный от других стереоизомеров" означает присутствие меньше чем 25% других стереоизомеров, предпочтительно меньше чем 10% других стереоизомеров, более предпочтительно меньше чем 5% других стереоизомеров и более всего предпочтительно меньше чем 2% других стереоизомеров или меньше чем "Х"% других стереоизомеров (где X представляет собой число от 0 до 100 включительно). Способы получения или синтеза ин-3 023809 дивидуальных энантиомеров для данного соединения хорошо известны в данной области и могут применяться на практике для конечных соединений, или исходных материалов, или промежуточных соединений. Если не указано иное, то в случае, когда описанное соединение названо или отражено структурой без указания стереохимии и имеет один или более хиральных центров, следует понимать, что оно представляет все возможные стереоизомеры соединения. Используемый здесь термин "стабильные соединения" относится к соединениям, которые проявляют стабильность, достаточную для их получения, и которые сохраняют целостность соединения в течение достаточного периода времени, для того чтобы быть эффективными для целей, подробно описанных здесь (например, формулирование в продукты лечебного назначения, промежуточные соединения для использования в приготовлении терапевтических соединений, изолируемые или хранящиеся промежуточные соединения, лечение заболевания или состояния, восприимчивого к терапевтическим агентам)."Трет", "t" и "t", каждый, относится к третичному. "US" относится к Соединенным Штатам Америки. Термин "необязательно замещенный дейтерием" означает, что один или более атомов водорода в указанной группе или соединении может быть заменен на соответствующее количество атомов дейтерия. По всему описанию переменная может относиться к общему параметру (например, "каждый R") или к конкретному параметру (например, R1, R2, R3 и др.). Если не указано иное, в случае, когда переменная относится к общему параметру, это означает включение всех определенных вариантов этой конкретной переменной. Терапевтические соединения Соединения, обозначенные как "(R)" или "(S)", относятся к стереохимии углерода, несущего заместитель. Предполагается, что соединения, не имеющие такого обозначения, представляют рацемическую смесь энантиомеров. Эти соединения включают дейтерированные аналоги пропентофиллина. Пропентофиллин исследовали на лечение болезни Альцгеймера, нейропатической боли, травматического повреждения мозга, дизурии, повреждения сетчатки или головки зрительного нерва и пептической язвы. Также проводили исследование на контроль внутриглазного давления, стабилизацию ауторегулирования церебрального кровотока и ингибирование эффектов реакции на аллотрансплантат. Настоящее изобретение предлагает соединение формулы С или его фармацевтически приемлемую соль, где R1 выбран из -СН 3 и -CD3; R2 выбран из -СН 3 и -CD3; Y2 представляет собой -ОН; и Y1 представляет собой дейтерий или водород. В одном варианте предложено соединение формулы С, где R1 представляет собой-СН 3. В одном варианте предложено соединение формулы С, где R1 представляет собой -CD3. В одном варианте предложено соединение формулы С, где R2 представляет собой -СН 3. В одном варианте предложено соединение формулы С, где R2 представляет собой -CD3. Эти соединения являются дейтерированными аналогами пентоксифиллина. В одном варианте предложено соединение формулы С или его фармацевтически приемлемая соль,при этом соединение имеет структуру В одном аспекте этого варианта Y1 представляет собой дейтерий. В другом аспекте Y1 представляет собой водород. Примеры соединений формулы С включают следующие соединения и их фармацевтически приемлемые соли: В настоящем изобретении также предложено соединение формулы D или его фармацевтически приемлемая соль, где R1 выбран из -СН 3 и -CD3; R2 выбран из -СН 3 и -CD3; Y2 представляет собой -ОН; и Y1 представляет собой дейтерий или водород. В одном варианте предложено соединение формулы D, где R1 представляет собой-СН 3. В одном варианте предложено соединение формулы D, где R1 представляет собой-CD3. В одном варианте предложено соединение формулы D, где R2 представляет собой-СН 3. В одном варианте предложено соединение формулы D, где R2 представляет собой-CD3. Эти соединения являются дейтерированными аналогами пентоксифиллина. В одном варианте предложено соединение формулы D или его фармацевтически приемлемая соль,при этом соединение имеет структуру В одном аспекте этого варианта Y1 представляет собой дейтерий. В другом аспекте Y представляет собой водород. Примеры соединений формулы D включают следующие соединения и их фармацевтически приемлемые соли: В другом наборе вариантов любой атом, не обозначенный как дейтерий в любом из вариантов,представленных выше, присутствует в его природном изотопном составе. Синтез соединений этого изобретения может быть осуществлен специалистами среднего уровня в области химического синтеза. Соответствующие методики и промежуточные соединения раскрыты, например, в Sidzhakova D. et al., Farmatsiya (София, Болгария) 1988, 38(4): 1-5; Davis P.J. et al., Xenobiotica,1985, 15(12): 1001-10; Akgun H. et al., J Pharm Sci, 2001, 26(2): 67-71; немецкая заявка на патент DD 274334; чешский патент CS 237719, CS 201558; публикация патента РСТ WO 9531450 и в японской заявке на патент JP 58150594, JP 58134092, JP 58038284, JP 57200391, JP 57098284, JP 57085387, JP 57062278,JP 57080385, JP 57056481, JP 57024385, JP 57011981, JP 57024386, JP 57024382, JP 56077279, JP 56032477,JP 56007785, JP 56010188, JP 56010187, JP 55122779 и JP 55076876. Такие способы могут быть выполнены с использованием соответствующих дейтерированных и необязательно других содержащих изотопы реагентов и/или промежуточных соединений для синтеза соединений, представленных здесь, или стандартных протоколов синтеза, известных в данной области для введения изотопных атомов в химическую структуру. Примеры синтеза Способы синтеза соединений формулы I показаны на следующих схемах. Схема 1 А.Синтез соединений формулы I Как показано на схеме 1 А, дейтерированное соединение 10 алкилировано дейтерированным промежуточным соединением 11 (где X представляет собой хлорид, бромид или иодид) в присутствии карбоната калия для получения соединений формулы I. Или же для получения соединений формулы I можно использовать гидроксид натрия в водном метаноле согласно способам американского патента 4289776. Схема 1 В. Приготовление соединений, в которых Y1=OH, из соединений формулы II Как показано на схеме 1 В, соединения формулы II можно использовать для приготовления соединений, в которых Y1 представляет собой ОН. Так, например, соединения формулы II восстанавливали борогидридом натрия или бородейтеридом натрия (коммерчески доступный при 99 ат.% D) согласно общей методике Европейского патента 0330031 для получения соединений, в которых Y представляет собой ОН и Y2 представляет собой водород или дейтерий. Энантиомерные спиртовые продукты могут быть разделены, например, способом, описанным Nicklasson M. et al., Chirality, 2002, 14(8): 643-652. В альтернативном способе энзиматическое восстановление позволяет получить энантиомерно-обогащенный спиртовой продукт с помощью способов, описанных в Pekala E. et al., Acta Poloniae Pharmaceutica, 2007,64(2): 109-113 или в Pekala E. et al., Biotech J, 2007, 2(4): 492-496. Стереоселективное приготовление соединений, в которых C(Y1)(Y2) представляет собой С(Н)ОН или С(D)ОН, из соответствующих соединений, в которых C(Y1)(Y2) представляет собой С=О, можно осуществить в присутствии кеторедуктазы или карбонилредуктазы. Соединения изобретения, в которыхC(Y1)(Y2) представляет собой С(Н)ОН или C(D)OH, могут быть приготовлены стереоселективно из соответствующих соединений, в которых C(Y1)(Y2) представляет собой С=О, путем обработки источником гидрида или источником дейтерида в присутствии кеторедуктазы или карбонилредуктазы при соответствующем рН с энантиомерным избытком по меньшей мере 80%. Кеторедуктаза или карбонилредуктаза,которая способствует образованию соединения, в котором стереохимией по С(Н)ОН или C(D)OH группе является (S), может быть, например, любой из ALMAC карбонилредуктаз CRED A131, CRED A801,CRED A901, CRED A251 или CRED A271 (каждая коммерчески доступна от компании ALMAC GroupLtd., Craigavon, England), любой из CODEXIS кеторедуктаз KRED-119, KRED-137, KRED-148, KRED169, KRED-174, KRED-NADH 101, KRED-NADH 102, KRED-NADH112 или KRED- NADH 126 (каждая коммерчески доступна от компании Codexis Inc., Redwood City, CA) или SYNCORE кеторедуктаз ESKRED-121, ES-KRED-128, ES-ICRED-130, ES- KRED-142, ES-ICRED-175, ES-ICRED-169 или ES-ICRED171 (каждая коммерчески доступна от компании Syncore Labs, Шанхай, Китай). В одном аспекте фермент выбран из CRED А 131, CRED A251, KRED-NADH 101, KRED-NADH 102, KRED-NADH 112,KRED-NADH 126, ES-KRED-121, ES-KRED-128, ES-KRED-130, ES-KRED-142, ES-KRED-169 или ESKRED-171. В более конкретном аспекте фермент выбран из CRED A131, CRED А 251 и KRED-NADH 101. Кеторедуктаза или карбонилредуктаза, которая способствует образованию соединения, в котором стереохимия по С(Н)ОН или C(D)OH группе представляет собой (R), может быть, например, любой изKRED-NADP-118, CRED A601-NADP, CRED A291-NADP, CRED A311-NADP. KRED-NAD-110, ESKRED-120, ES-KRED-131, CRED A101-NADP. Количество кеторедуктазы или карбонилредуктазы, которое использовали в реакции, изменялось от 0.05 до 10 мас.% как процент массы субстрата, например от 0.5 до 5 мас.%. В одном варианте количество фермента составляет от 1.0 до 2.0 мас.%. В более конкретном аспекте количество фермента составляет примерно 1.0 мас.%. Источником гидрида является соединение или смесь, которая способна обеспечить гидридный анион или синтон гидридного аниона. Источником дейтерида является соединение или смесь,которая способна обеспечить дейтеридный анион или синтон дейтеридного аниона. Источник гидрида или дейтерида содержит каталитический кофактор и необязательно регенерирующую кофактор систему. Каталитический кофактор, который использовали с кетонредуктазой или карбонилредуктазой в способе данного изобретения, выбран из NAD, NADP, NADH, NADPH, NAD2H и NADP2H. Выбор кофактора может быть сделан на основании (а) присутствия или отсутствия регенерирующей кофактор системы; (b) требования для гидрида в отношении источника дейтерида; и (с) соответствующего значения рН для выполнения способа настоящего изобретения, то есть параметров буфера, при которых поддерживается рН от 6.0 до 7.5 во время реакции. В одном варианте рН реакции поддерживали между 6.5 и 7.3. В другом варианте рН реакции поддерживали от 6.0 до 7.0. Как правило, прикапывание KOH применяется для поддержания требуемого рН, так как во время энзиматической реакции образуется кислота. В одном аспекте рН реакции поддерживается между 6.9 и 7.05. Способ может быть выполнен при температуре при-6 023809 мерно от 20 до 37 С. В одном аспекте этого варианта температура составляет примерно от 29 до 32 С. Способ может быть выполнен в течение периода примерно от 12 до 24 ч. В одном варианте период времени составляет примерно от 24 до 40 ч. В одном варианте период времени составляет примерно от 40 до 72 ч. В одном варианте период времени является периодом, достаточным для присутствия менее чем примерно 5% начального количества соединения, в котором C(Y1)CY2) представляет собой С=О. Синтез соединения 10. При обращении к схеме 1 А соединения, которые могут быть использованы в качестве соединения 10 для приготовления соединений формулы I, являются известными и включают, но без ограничения,следующие: теобромин (где R1 и R2 представляют собой СН 3), который является коммерчески доступным. Изотопологи 10, где (a) R1 представляет собой -CD3 и R2 представляет собой -СН 3; (b) R1 представляет собой - СН 3 и R2 представляет собой -CD3; и (с) R1 и R2 представляют собой -CD3, являются хорошо известными (см. Benchekroun Y. et al., J Chromatogr В., 1977, 688: 245; Ribon В. et al., Coll INSERM, 1988,164: 268; и Horning M.G. et al., Proc Int Conf Stable Isot 2nd, 1976, 41-54. 3-Метил-7-пропилксантин, где R1 представляет собой n-пропил и R2 представляет собой -СН 3, является коммерчески доступным. Соединение 10, где R1 представляет собой СН 2 ОСН 3 и R2 представляет собой СН 3, является также известным (см. немецкую патентную заявку DE 3942872A1). Схема 2. Синтез соединения 10 Синтез соединения 10 показан на схеме 2, начиная с коммерчески доступного N-нитрозо-Nметилмочевины. Обработка дейтерированым соответствующим образом амином 12 в воде позволила получить N-алкилмочевину 13 согласно способам Boivin J.L. et al., Canadian Journal of Chemistry, 1951,29: 478-81. Мочевина 13 может быть обработана 2-цианоуксусной кислотой и уксусным ангидридом для получения производного цианоацетамида 14, которое обрабатывали сначала водным раствором NaOH и затем водным раствором HCl для получения циклизированного пиримидиндиона 15 согласно способам,описанным Dubey P.K. et al., Indian Journal of Heterocyclic Chemistry, 2005, 14(4): 301-306. Или же, цианоацетамид 14 можно обработать триметилсилилхлоридом и гексаметилдисилазаном для получения циклизированного продукта 15 способом, описанным Fulle, F et al., Heterocycles, 2000, 53(2): 347-352. Согласно способам, описанным Merlos M. et al., European Journal of Medicinal Chemistry, 1990, 25(8): 653-8, обработка пиримидиндиона 15 нитритом натрия в уксусной кислоте и затем гидроксидом аммония и дитионитом натрия позволила получить соединение 16, которое обрабатывали муравьиной кислотой для получения производного пурина 17. Согласно способам, описанным Rybar A. et al., в чешской патентной заявке CS 263595B1, алкилирование 17 соответствующим образом дейтерированным электрофилом 18 (X представляет собой хлоро, бромо или иодо) в присутствии карбоната калия и необязательно в присутствии добавок, таких как NaBr, KBr, NaI, KI или иод, позволило получить соединение 10. При обращении к схеме 2 эффективные дейтерированные аминовые реагенты 12 включают, но без ограничения, коммерчески доступные соединения, такие как n-пропил-d7-амин или известныесоединения, такие как 1-пропан- 1,1-d2-амин (Moritz F. et al., Organic Mass Spectrometry, 1993, 28(3): 207-15). Эффективные дейтерированные мочевинные реагенты 13 могут включать, но без ограничения, коммерчески доступные соединения, такие как N-метил-d3-мочевина или метилмочевина-d6 Эффективные дейтерированные электрофилы 18 могут включать, но без ограничения, коммерчески доступные соединения, такие как иодметан-d3, или бромметан-d3, или 1-бромпропан-d7, или 1 бромпропан-1,1-d2, или известные соединения, такие как (хлорметокси-d2)-этан (Williams A.G., WO 2002059070A1) или бромметоксиметан-d2 (Van der Veken B.J. et al., Journal of Raman Spectroscopy, 1992,23(4): 205-23, или (бромметокси-d2)-метан-d3 (Van der Veken B.J. et al., Journal of Raman Spectroscopy,1992, 23(4): 205-23). Коммерчески доступные дейтерированные промежуточные соединения 12, 13 и 18,указанные выше, являются доступными с изотопной чистотой по меньшей мере 98 ат.% D. Синтез промежуточного соединения 11 а-d3 (см. схему 1 А). Схема 3. Синтез промежуточного соединения 11 а-d3 Подход к приготовлению соединения 11 а-d3 (см. схему 1 А) (где R3 представляет собой CD3; R4 представляет собой -CD2(CH2)3-, и Y1 и Y2 взяты вместе для образования =O) показан на схеме 3. Так,например, метиллития добавляли в коммерчески доступный дельта-валеролактон 19 согласно способуZhang Q. et al., Tetrahedron, 2006, 62(50): 11627-11634 для получения кетона 20. Обработка 20 с помощьюTFA-d1 (99 ат.% D) в D2O (99 ат.% D) в микроволновых условиях позволила получить дейтерированный кетон 21 согласно общей методике, описанной Fodor-Csorba К, Tet Lett, 2002, 43: 3789-3792. Спиртовая группа в 21 превращалась в хлорид при обработке трифенилфосфином и тетрахлоридом углерода с получением хлорида 11 а-d5 согласно общим методикам, описанным Clement, J-L, Org Biomol Chem, 2003, 1: 1591-1597. Схема 4. Синтез промежуточных соединений 11a-d9 и 11 а-d11 На схеме 4 показан синтез соединения 11 а-d9 и соединения 11a-d11. Так, например, коммерчески доступная 4-фенилмасляная кислота 22 может быть нагрета в D2O (99 ат.% D) в присутствии Pd/C и газообразного водорода для получения дейтерированной кислоты 23 согласно общим методикам, описаннымEsaki, et al., Chem Eur J, 2007, 13: 4052-4063. Добавление дейтерированного метиллития в присутствии триметилсилилхлорида позволило получить кетон 24 согласно общей методике, описанной Porta A. et al.,J Org Chem, 2005, 70(12): 4876-4878. Кетон 24 конвертировали в ацеталь 25 обработкой D2SO4 (99 ат.%D) и коммерчески доступным этиленгликолем-d2 (99 ат.% D). Обработка 25 при помощи NaIO4 и RuCl3 согласно общей методике, описанной Gamier J.-M. et al., Tetrahedron: Asymmetry, 2007, 18(12): 1434-1442,позвоила получить карбоновую кислоту 26. Восстановление с помощью либо простого эфира LiAlH4,либо LiAlD4 (98 ат.% D) позволило получить спирты (не показано), которые затем хлорировали с использованием либо оксихлорида фосфора, либо трифенилфосфина и N-хлорсукцинимида (Naidu S.V. et al.,Tet Lett, 2007, 48(13): 2279-2282) с последующим расщеплением ацеталей с помощью D2SO4 (Heathcock,CH et al., J Org Chem, 1995, 60(S): 1120-30) с образованием хлоридов 11a-d9 и 11a-d11 соответственно. Схема 4 а. Синтез промежуточных соединений 11b-(R) На схемах 4 а и 4b показан синтез конкретных энантиомеров хлоридов 11b-(R) (где Y1 представляет собой фтор; Y2 выбран из водорода и дейтерия; и соединение находится в (R)-конфигурации) и 11b-(S)(где Y1 представляет собой фтор; Y2 выбран из водорода и дейтерия; и соединение находится в (S)конфигурации). На схеме 4 а снимали защиту спирта 27, такого как известный (5R)-5 фторгексил]окси]метил]-бензол (заявка РСТ WO2000031003), защищенного дейтерированным (или недейтерированным) бензилом, путем гидрирования в присутствии Pd/C для получения спирта 28. Спирт хлорировали тионилхлоридом согласно общей методике, описанной Lacan G. et al., J Label СоТ.пл.d Radiopharm, 2005, 48(9): 635-643 для получения хлорида 11b-(R). На схеме 4b дейтерированный (или недейтерированный) спирт 29, такой как известный (S)-(+)-5 фторгексанол (Riswoko A. et al., Enantiomer, 2002, 7(1): 33-39), хлорировали для получения хлорида 11b(S). Схема 5. Синтез промежуточных соединений 11 с и 11 е На схеме 5 показан синтез других промежуточных соединений 11 с и 11 е. Так, например, согласно способам, описанным Kutner Andrzej et al., Journal of Organic Chemistry, 1988, 53(15): 3450-7 или Larsen,SD et al., Journal of Medicinal Chemistry, 1994, 37(15): 2343-51 соединения 30 или 31 (где X представляет собой галогенид) могут быть обработаны дейтерированным реактивом Гриньяра 32 для получения промежуточного соединения 11 с, в котором R3 и Y2 одинаковые, Y1 представляет собой ОН, и X представляет собой галогенид. Обработка диэтиламиносернистым трифторидом (DAST) в дихлорметане или толуоле позволила получить промежуточное соединение 11e, в котором R3 и Y2 одинаковые, Y1 представляет собой F, и X представляет собой галогенид, согласно общей методике, описанной Karst N.A. et al., Organic Letters, 2003, 5(25): 4839-4842 или Kiso M. et al., Carbohydrate Research, 1988, 177: 51-67. Коммерчески доступные галогениды могут быть использованы для приготовления соединений 11,как описано на схеме 5. Например, коммерчески доступный 5-хлорвалерилхлорид, или коммерчески доступный 5-бромвалерилхлорид, или коммерчески доступный этил 5-бромвалерат могут быть эффективными как реагенты 30 или 31. При повторном обращении к схеме 5 применение коммерчески доступного метил-d3-магния иодида в качестве реактива Гриньяра 32 позволило получить электрофил 11, где R3 и Y2 одновременно представляют собой CD3. Схема 6. Синтез промежуточного соединения 11 е (Х=Br) На схеме 6 показан альтернативный синтез промежуточного соединения 11 е, где R3 и Y2 одинаковые и Х=Br. Так, например, согласно методике, описанной Hester J.B. et al., Journal of MedicinalChemistry, 2001, 44(7): 1099-1115, коммерчески доступный 4-хлор-1-бутанол защищали путем обработки 3,4-дигидро-2 Н-пираном (DHP) и камфорсульфоновой кислотой (CSA) для получения хлорида 33. Взаимодействие соответствующего реагента Гриньяра с магнием с последующим добавлением ацетона(R3=Y2=СН 3) или ацетона-d6 (Y2=R3=CD3) позволило получить спирт 34. Фторирование трифторидом диэтиламиносерной кислоты (DAST) в CH2Cl2 позволило получить фторид 35. Снятие защиты с помощью CSA в МеОН обеспечило получение спирта 36, и обработка N-бромсукцинимидом и трифенилфосфином позволила получить промежуточное соединение 11 е. Схема 7. Альтернативный синтез промежуточного соединения 11 е (Х=Br) На схеме 7 показан синтез промежуточного соединения 11 е, где R3 и Y2 одинаковые и Х=Br. Так,например, коммерчески доступный этиловый эфир 4-гидроксимасляной кислоты 37 обрабатывали DHP иCSA или DHP, TsOH и пиридином для получения сложного эфира 38. Восстановление с помощьюLiAID4 позволило получить дейтерированный спирт 39, который обрабатывали либо трифенилфосфином в CCl4 (Sabitha G. et al., Tetrahedron Letters, 2006, (volume date 2007), 48(2): 313-315), либо метансульфонилхлоридом, хлоридом лития и 2,6-литидином в DMF (Blaszykowski С. et al., Organic Letters, 2004,6(21): 3771-3774) для получения хлорида 40. Согласно таким же способам, которые показаны на схеме 6,хлорид 40 может быть конвертирован в 11 е. Схема 8. Синтез промежуточного соединения 11e-d8 (X=Br) На схеме 8 показан синтез промежуточного соединения 11e-d8, где R3 и Y2 одинаковые и Х=Br. Так,например, коммерчески доступный THF-d8 41 может быть обработан DCl и ZnCl2 согласно общей мето-9 023809 дике, описанной Yang A. et al., Huagong Shikan, 2002, 16(3): 37-39, для получения известного хлорида 42(Alken, Rudolf-Giesbert, WO 2003080598A1). Согласно такому же способу, который показан на схеме 6,хлорид 42 может быть конвертирован в 11e-d8. Схема 9. Синтез промежуточного соединения 11c-d8 (X=Br) На схеме 9 показан синтез промежуточного соединения 11c-d8, в котором R3 и Y2 одинаковые и Х=Br. Так, например, известную карбоновую кислоту 43 (LoT.пл.а-Krzymien, L et al, Proc. Int. Conf. Stable Isot. 2nd, 1976, Meeting Date 1975, 574-8) обрабатывали диазометаном (согласно общей методике Garrido, NM et al., Molecules, 2006, 11(6): 435-443) или триметилсилилхлоридом и метанолом-d1 (согласно общей методике Doussineau T. et al., Synlett, 2004, (10): 1735-1738) для получения сложного метилового эфира 44. Как на схеме 5, обработка сложного эфира дейтерированным реактивом Гриньяра 45 позволила получить промежуточное соединение 11c-d8. Например, применение коммерчески доступного метил-d3 иодида магния в качестве реактива Гриньяра 45 позволило получить 11c-d8, где R3 и Y2 являются одновременно CD3. Схема 10. Синтез промежуточного соединения 11c-d2 На схеме 10 показано приготовление 11c-d2, где R3 и Y2 являются одинаковыми. Так, например, известный дейтерированный сложный эфир 46 (Feldman K.S. et al., Journal of Organic Chemistry, 2000,65(25): 8659-8668) обрабатывали тетрабромидом углерода и трифенилфосфином (Brueckner A.M. et al.,European Journal of Organic Chemistry, 2003, (18): 3555-3561) для получения сложного эфира 47, где X представляет собой бромид, или обрабатывали метансульфонилхлоридом и триэтиламином с последующим хлоридом лития и DMF (Sagi K. et al., BioorganicMedicinal Chemistry, 2005, 13(S): 1487-1496) для получения сложного эфира 47, где X представляет собой хлорид. Так же, как на схеме 5, обработка сложного эфира 47 дейтерированным реактивом Гриньяра 48 позволила получить 11c-d2. Например,применение коммерчески доступного метил-d3-иодида магния в качестве реактива Гриньяра 48 позволило получить 11 с-d2, где R3 и Y2 являются одновременно CD3. Дополнительные известные хлориды, которые могут быть использованы в качестве реагента 11 в схеме 1 А, включают 1-хлор-5,5-дифлор-гексан (Rybczynski P.J. et al., J Med Chemistry, 2004, 47(1): 196209); 1-хлор-5-фторгексан (Chambers R.D. et al., Tetrahedron, 2006, 62(30): 7162-7167); 6-хлор-2-гексанол(European Patent publication 0412596); (S)-6-хлор-2-гексанол (Keinan E. et al., J Am Chem Soc, 1986,108(12): 3474-3480); коммерчески доступный (R)-6-хлор-2-гексанол; коммерчески доступный 6-хлор-2 гексанон; известный 6-хлор-2-метилгексан-2-ол (Kutner A. et al., Journal of Organic Chemistry, 1988,53(15): 3450-7); известный 6-бром-2-метилгексан-2-ол (Kutaer A. et al., Journal of Organic Chemistry, 1988,53(15): 3450-7); известный 1-бром-5-фтор-5-метилгексан (Hester J.B. et al., Journal of Medicinal Chemistry,2001, 44(7): 1099-1115). Схема 11. Синтез соединений формулы Al На схеме 11 показан синтез соединения формулы А 1. Так, например, соединение формулы I обрабатывали карбонатом калия в D2O для достижения реакции обмена водорода на дейтерий, которая позволила получить соединение формулы А 1. Опытному специалисту следует учесть, что дополнительные реакции обмена водорода на дейтерий могут также возникать в других участках в молекуле. Схема 12. Альтернативный синтез соединений формулы А 1 Альтернативный синтез соединения формулы А 1 показан на схеме 12. Так, например, промежуточное соединение 10 (см. схему 1 А) обрабатывали карбонатом калия в D2O для достижения реакции обмена водорода на дейтерий, что позволило получить соединение 50 в виде N-D или N-H звеньев. Алкилирование промежуточным соединением 11 в присутствии карбоната калия позволило получить соединения формулы А 1. Схема 12b. Альтернативный синтез соединений формулы I Альтернативный синтез соединений формулы I показан на схеме 12b. Так, например, соединения формулы А 1 обрабатывали карбонатом калия в воде для достижения обмена дейтерия на водород, что позволило получить другие соединения формулы I. Предпочтительно, чтобы в способе схемы 12b либо(а) каждый Y1 и Y2 представлял собой фтор; либо (b) Y1 был выбран из фтора и ОН; и Y2 был выбран из водорода, дейтерия, -СН 3, -CH2D, -CHD2 и -CD3. Ряд новых промежуточных соединений может быть использовано для приготовления соединений формулы А. Таким образом, изобретение предлагает соединения, которые выбраны из следующих: Соединения a-d выше могут быть приготовлены, в целом, как описано в Org. Lett., 2005, 7: 14271429, с использованием соответствующим образом дейтерированных исходных материалов. Соединения е-о могут быть приготовлены из соответствующих бромидов, перечисленных выше, при обращении к схеме 15, показанной ниже. Некоторые промежуточные соединения ксантина, эффективные для данного изобретения, также являются новыми. Таким образом, изобретение предлагает дейтерированное промежуточное соединение ксантина IIIIII где W представляет собой водород или дейтерий и каждый из R1 и R2 независимо выбран из водорода, дейтерия, C1-3 алкила, необязательно замещенного дейтерием, и C1-3 алкоксиалкила, необязательно замещенного дейтерием. Примеры R1 и R2 С 1-3 алкила включают -СН 3, -CD3, -CH2CH2CH3 и -CD2CD2CD3. Примеры C1-3 алкоксиалкила включают -СН 2 ОСН 2 СН 3, -CD2OCH2CH3, -CD2OCD2CH3 и -CD2OCD2CD3. Конкретные примеры формулы III включают следующие: В каждом из указанных выше примеров формулы III W представляет собой водород. В наборе соответствующих примеров W представляет собой дейтерий. Соли соединений формулы III также являются эффективными, включая соли, о которых известно, что они являются эффективными в отношении известных ксантинов. Примеры эффективных солей включают, но без ограничения, соль лития, соль натрия, соль калия и соль цезия. Примером особенно эффективной соли является соль калия. Конкретные подходы и соединения, показанные выше, не являются ограничением. Химические структуры в указанных здесь схемах показывают переменные, которые определены в соответствии с определениями химической группы (группы, атомы и т.д.) соответствующего положения в формуле соединения, независимо от того, обозначены они одинаковой переменной (т.е. R1, R2, R3 и т.д.) или нет. Пригодность химической группы в структуре соединения для применения в синтезе другого соединения находится в компетенции специалиста среднего уровня в данной области. Дополнительные способы синтеза соединений данного изобретения и их синтетических предшественников, включая такие, которые находятся в пределах режимов, прямо не показанных в схемах здесь, находятся в компетенции химиков среднего уровня в данной области. Синтетические химические трансформации и методы защитных группL. et al., Fieser and Fieser's Reagents for Organic Synthesis, John Wiley and Sons (1994); and Paquette L., ed.,Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) и их последующие издания. Комбинации заместителей и переменных, рассматриваемые в данном изобретении, представляют собой только такие комбинации, которые приводят к образованию стабильных соединений. Композиции. Изобретение также предлагает свободные от пирогена композиции, содержащие эффективное количество соединения данного изобретения или его фармацевтически приемлемые соли и приемлемый носитель. Предпочтительно, чтобы композиция данного изобретения была составлена для фармацевтического применения ("фармацевтическая композиция"), в которой носитель является фармацевтически приемлемым носителем. Носители являются "приемлемыми" в том смысле, что они являются совместимыми с другими ингредиентами состава и в случае фармацевтически приемлемого носителя не являются вредными для реципиента в количестве, применяемом в лекарственном средстве. Фармацевтически приемлемые носители, вспомогательные вещества и наполнители, которые могут применяться в фармацевтических композициях данного изобретения, включают, но без ограничения,ионообменники, окись алюминия, стеарат алюминия, лецитин, сывороточные протеины, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота,сорбат калия, частичные глицеридные смеси насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протаминсульфат, динатрийгидрофосфат, дикалийфосфат, хлорид натрия, соли цинка, коллоидную двуокись кремния, магния трисиликат, поливинилпирролидон, микрокристаллическую целлюлозу, вещества на основе целлюлозы, полиэтиленгликоль, натрийкарбоксиметилцеллюлозу,полиакрилаты, воски, блок-сополимеры полиэтилена и полиоксипропилена, полиэтиленгликоль и ланолин. При необходимости растворимость и биодоступность соединений настоящего изобретения в фармацевтических композициях может быть усилена способами, хорошо известными в данной области. Один способ включает использование липидных наполнителей в составе (см. "Oral Lipid-Based Formulations: Enhancing the Bioavailability of Poorly Water-Soluble Drugs (Drugs and the Pharmaceutical Sciences),"Drug Delivery: Basic Principles and Biological ExaT.пл.les," Kishor M. Wasan, ed. Wiley-Interscience, 2006). Другим известным способом усиления биодоступности является использование аморфной формы(см. американский патент 7014866 и американские патенты 20060094744 и 20060079502. Фармацевтические композиции изобретения включают такие, которые подходят для перорального,ректального, назального, местного (включая буккальное и сублингвальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное и внутрикожное) введение. В некоторых вариантах соединение указанной здесь формулы вводится трансдермально (например, с использованием трансдермального пластыря или ионтофоретических методов). Другие составы могут для удобства быть представлены в стандартной лекарственной форме, например таблетках, капсулах с замедленным высвобождением и липосомах, и могут быть приготовлены любыми способами, хорошо известными в области фармацевтики (см., например, Remington's Pharmaceutical Sciences, Mack Publishing СоТ.пл.any, Philadelphia, PA (17th ed. 1985). Такие препаративные способы предусматривают стадию связывания с подлежащей введению молекулой ингредиентов, таких как носитель, который представляет собой один или несколько вспомогательных ингредиентов. Как правило, композиции приготовлены путем равномерного и непосредственного приведения в контакт активных ингредиентов с липидными носителями, липосомами или тонкодисперсными твердыми носителями или обоими и затем при необходимости придание продукту формы. В некоторых вариантах соединение вводится перорально. Композиции настоящего изобретения,пригодные для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы, сашеты или таблетки, каждый из которых содержит предварительно установленное количество активного ингредиента; порошка или гранул; раствора или суспензии в водной жидкости или неводной жидкости; эмульсии масла в воде; эмульсии воды в масле; упакованной в липосомах; или в виде болюса и т.д. Мягкие желатиновые капсулы могут быть эффективными для содержания таких суспензий, которые могут существенно увеличивать скорость абсорбции соединения. В случае таблеток для перорального применения обычно используемые носители включают лактозу и кукурузный крахмал. Также, обычно добавляют лубриканты, такие как стеарат магния, Для перорального введения в форме капсулы полезные разбавители включают лактозу и сухой кукурузный крахмал. Когда для перорального применения требуются водные суспензии, активный ингредиент комбинируют с эмульгирующими и суспендирующими веществами. По желанию, могут также быть добавлены некоторые подсластители, и/или ароматизаторы, и/или красители. Композиции, пригодные для перорального введения, включают пастилки, содержащие ингредиенты в ароматизированной основе, обычно сахарозе и камеди или траганте; и пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин, или сахароза и камедь. Композиции, пригодные для парентерального введения, представляют собой водные и неводные стерильные растворы для инъекции, которые могут содержать антиоксиданты, буферы, бактериостаты и растворенные вещества, делающие состав изотоническим с кровью предполагаемого реципиента, а также водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты и загустители. Составы могут быть представлены в контейнерах со стандартной дозой или многократной дозой,например герметичных ампулах и флаконах, и могут храниться в замороженном состоянии (лиофилизированном), требующем только добавления стерильного жидкого носителя, например воды для инъекций,непосредственно перед применением. Приготовленные для немедленного приема растворы для инъецирования и суспензии могут быть приготовлены из стерильных порошков, гранул и таблеток. Такие растворы для инъекции могут быть в форме, например, стерильной инъецируемой водной или маслянистой суспензии. Эта суспензия может быть приготовлена известными из уровня техники способами с применением подходящих диспергирующих или увлажняющих средств (таких как, например, Твин 80) и суспендирующих средств. Стерильные препараты для инъекции могут также быть в виде предназначенных для инъекции стерильных растворов или суспензии в нетоксичном разбавителе или растворителе, пригодном для парентерального введения, например в виде раствора в 1,3-бутандиоле. Приемлемыми носителями и растворителями, пригодными для применения, являются маннитол, вода,раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные, нелетучие масла обычно используют в качестве растворителя или суспендирующей среды. С этой целью может быть использовано любое безвкусное нелетучее масло, включая синтетически моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота, и соответствующие глицеридные производные полезны для получения препаратов для инъекций, как, например натуральные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, в особенности в полиоксиэтилированной форме. Такие масляные растворы или суспензии могут также содержать длинноцепочечный спиртовой разбавитель или диспергирующие вещества. Фармацевтические композиции данного изобретения могут быть введены в форме суппозиториев для ректального введения. Эти композиции могут быть получены смешиванием соединения данного изобретения с подходящим нераздражающим вспомогательным веществом, которое является твердым при комнатной температуре, но жидким при ректальной температуре, и поэтому хорошо плавится в прямой кишке, высвобождая лекарственное средство. Такие вещества включают, но без ограничения, масло какао, пчелиный воск и полиэтиленгликоли. Фармацевтические композиции данного изобретения могут быть введены посредством аэрозоля для носа или ингаляцией. Такие композиции получают хорошо известными из уровня техники способами фармацевтического формулирования, и указанные композиции могут быть получены в виде растворов в физиологическом растворе с использованием бензилового спирта или других подходящих консервантов,усилителей всасывания для повышения биодоступности, фторуглеродов и/или иных общепринятых солюбилизирующих или диспергирущих агентов (см., например, Rabinowitz J.D. and Zaffaroni A.C., US Patent 6803031, assigned to Alexza Molecular Delivery Corporation). Местное введение фармацевтических композиций данного изобретения является особенно эффективным, когда объект обработки включает поверхности или органы, легкодоступные для местного применения. Для местного применения на кожу фармацевтические композиции должны быть формулированы с подходящей мазью, содержащей активные компоненты, суспендированные или растворенные в носителе. Носителями для местного введения соединений данного изобретения являются, но без ограничения, минеральное масло, вазелиновое масло, белый вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропиленовое соединение, эмульгирующий воск и вода. Или же, фармацевтическая композиция может быть формулирована с подходящим лосьоном или кремом, содержащим активное соединение, суспендированное или растворенное в носителе. Подходящие носители включают, но без ограничения, минеральное масло, сорбитанмоностеарат, полисорбат 60, воск на основе сложного цетилового эфира, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду. Фармацевтические композиции данного изобретения могут также местно наноситься на нижнюю область кишечника в виде состава для ректального суппозитория или в виде подходящего состава для клизмы. Местные трансдермальные пластыри и ионтофоретическое введение также включено в данное изобретение. Применение терапевтических средств может быть местным в требуемом участке. Разные методики могут использоваться для обеспечения композиций в требуемый участок, например инъекция, катетер,трокары, бомбардирующие частицы, стенты, полимеры с замедленным высвобождением лекарственных средств или другие устройства, которые обеспечивают внутренний доступ. Таким образом, согласно еще другому варианту соединения данного изобретения могут быть включены в композиции для покрытия имплантируемых медицинских устройств, таких как протезы, искусственные клапаны, сосудистые трансплантаты, стенты или катетеры. Пригодные покрытия и общее приготовление покрытых имплантируемых устройств известно в данной области и приведено в американских патентах 6099562; 5886026; и 5304121. Покрытия обычно представляют собой биологически совместимые полимерные материалы, такие как гидрогелевые полимеры, полиметилдисилоксан, поликарполактон, полиэтиленгликоль, полимолочная кислота, этиленвинилацетат и их смеси. Покрытия могут в случае необходимости быть далее покрыты подходящим поверхностным покрытием из фторсиликона, полисахаридов, полиэтиленгликоля, фосфолипидов или их комбинаций, чтобы придать композиции характеристики контролируемого высвобождения. Покрытия для инвазивных устройств должны быть включенными в определение фармацевтически приемлемого носителя, вспомогательного вещества или носителя,аналогично терминам, используемым здесь. Согласно другому варианту изобретение обеспечивает способ покрытия имплантируемого медицинского устройства, предусматривающий стадию контактирования указанного устройства с композицией покрытия, описанной выше. Опытным специалистам в данной области будет очевидно, что покрытие устройства будет производиться перед имплантированием млекопитающему. Согласно другому варианту изобретение обеспечивает способ импрегнирования имплантируемого высвобождающего лекарственное средство устройства, предусматривающий стадию контактирования указанного высвобождающего лекарственное средство устройства с соединением или композицией данного изобретения. Имплантируемые высвобождающие лекарственное средство устройства включают, но без ограничения, биоразлагаемые полимерные капсулы или гранулы, неразлагаемые, способные к диффузии полимерные капсулы и биоразлагаемые полимерные пластины. Согласно другому варианту изобретение предлагает имплантируемое медицинское устройство, покрытое соединением или композицией, содержащей соединение данного изобретения, таким образом,что указанное соединение является терапевтически активным. Согласно другому варианту изобретение обеспечивает имплантируемое высвобождающее лекарственное средство устройство, импрегнированное или содержащее соединение или композицию, содержащую соединение данного изобретения, таким образом, что указанное соединение высвобождается из указанного устройства и является терапевтически активным. Когда орган или ткань доступны из-за удаления у пациента, такой орган или ткань могут быть погружены в среду, содержащую композицию данного изобретения, при этом композиция данного изобретения может быть нанесена на орган или композиция данного изобретения может быть нанесена любым другим удобным способом. В другом варианте соединение изобретения содержит от 28 до 68% мас./мас. композиции. В данном изобретении стеарат магния и микрокристаллическая целлюлоза содержит примерно 2% мас./мас. композиции. В другом варианте композиция изобретения, кроме того, содержит второй терапевтический агент. Второй терапевтический агент может быть выбран из любого соединения или терапевтического агента, о котором известно, что он имеет или демонстрирует полезные свойства при введении с соединением,имеющим такой же механизм действия, как пентоксифиллин. Такие агенты включают такие, которые указаны как являющиеся эффективными в комбинации с пентоксифиллином, включая, но без ограничения, описанные в WO 1997019686, ЕР 0640342, WO 2003013568, WO 2001032156, WO 2006035418, и WO 1996005838. Предпочтительно, чтобы второй терапевтический агент представлял собой агент, эффективный для лечения или предупреждения заболевания или состояния, выбранного из обструктивного периферического заболевания сосудов; гломерулонефрита; нефротического синдрома; неалкогольного стеатогепатита; лейшманиоза; цирроза печени; печеночной недостаточности; псевдогипертрофической миопатии Дюшенна; позднего лучевого повреждения; индуцированной облучением лимфедемы; ассоциированного с облучением некроза; алкогольного гепатита; ассоциированного с облучением фиброза; некротического энтероколита у недоношенных новорожденных; диабетической нефропатии, почечной недостаточности,вызванной гипертензией, и другой хронической почечной недостаточности; фокально-сегментарного гломерулосклероза; легочного саркоидоза; рецидивирующего афтозного стоматита; хронической боли в груди у пациентов с раком молочной железы; опухолей мозга и центральной нервной системы; синдрома недостаточного питания, воспалений, кахексии; опосредованного интерлейкином-1 заболевания; реакции трансплантат против хозяина и других реакций на аллотрансплантат; индуцированного диетой стеатоза печени, атероматозных поражений, жировой дистрофии печени и других вызванных диетой с высоким содержанием жиров или алкоголем клеточно-дегенеративных заболеваний; вируса иммунодефицита человека типа 1 (ВИЧ-1) и других человеческих ретровирусных инфекций; множественного склероза; рака; фибропролиферативных заболеваний; бактериальной инфекции; нефротоксичности, индуцированной лекарственным средством; коллагенного колита и других заболеваний и/или состояний, характеризующихся повышенными уровнями фактора роста тромбоцитов (PDGF) или других воспалительных цитокинов; эндометриоза; нейропатий зрительного нерва и нарушений центральной нервной системы (CNS),ассоциированных с синдромом приобретенного иммунодефицита (AIDS), заболеваний иммунной системы или множественного склероза; аутоиммунных заболеваний; вирусной инфекции верхних дыхательных путей; депрессии; недержания мочи; синдрома раздраженного кишечника; септического шока; деменции Альцгеймера; нейропатической боли; дизурии; повреждения сетчатки или зрительного нерва; пептической язвы; сахарного инсулинозависимого диабета; сахарного диабета 2 типа; диабетической нефропатии, метаболического синдрома; ожирения; резистентности к инсулину; дислипидемии; патологической толерантности к глюкозе; гипертензии; гиперлипидемии; гиперурикемии; подагры; гиперкоагуляции; и воспаления или повреждения, ассоциированного с хемотаксисом нейтрофилов и/или дегранулированием. Соединения данного изобретения также могут применяться для контроля внутриглазного давления или для стабилизации ауторегулирования церебрального кровотока у субъектов, которым требуется такой контроль согласно медицинским обследованиям. В одном варианте второй терапевтический агент выбран из -токоферола и гидроксимочевины. В другом варианте второй терапевтический агент является эффективным в лечении диабета или ассоциированных нарушений и выбран из инсулина или аналогов инсулина, агонистов рецепторов глюкагон-подобного пептида 1 (GLP-1), сульфонилмочевинных агентов, бигуанидных агентов, ингибиторов альфа-глюкозидазы, агонистов PPAR, меглитинидных агентов, ингибиторов дипептидил-пептидазы 4(DPP), других ингибиторов фосфодиэстеразы (PDE1, PDE5, PDE9, PDE10 или PDE1), агонистов амилина,ингибиторов коэнзима А и средств против ожирения. Конкретные примеры инсулина включают, но без ограничения, Humulin (человеческий инсулин на основе рекомбинантной ДНК), Novolin (человеческий инсулин на основе рекомбинантной ДНК),Velosulin BR (забуференная форма простого человеческого инсулина на основе рекомбинантной ДНК),Exubera (человеческий инсулин, ингаляционный) и другие формы ингаляционного инсулина, например поставляемые компанией Mannkind's "Technosphere Insulin System". Конкретными примерами аналогов инсулина являются, но без ограничения, новарапид, инсулин детемир, инсулин лизпро, инсулин гларгин, инсулин-цинк-суспензия и инсулин лиспро. Конкретные примеры агонистов рецептора глюкагонподобного пептида 1 включают, но без ограничения, BIM-51077 (CAS-номер 275371-94-3), EXENATIDE (CAS-номер 141758-74-9), CJC-1131 (CASномер 532951 -64-7), LIRAGLUTIDE (CAS-номер 20656-20-2) и ZP-10 (CAS-номер 320367-13-3). Конкретные примеры сульфонилмочевинных препаратов включают, но без ограничения, толбутамид (CAS-номер 000064-77-7), толазамид (CAS-номер 001156-19-0), глипизид (CAS-номер 029094-61-9),карбутамид (CAS-номер 000339-43-5), глисоксепид (CAS-номер 025046-79-1), глисентид (CAS-номер 032797-92-5), глиборнурид (CAS-номер 026944-48-9), глибенкламид (CAS-номер 010238-21 -8), глихидон(CAS-номер 033342-05-1), глимепирид (CAS-номер 093479-97-1) и гликлазид (CAS-номер 021187-98-4). Конкретным примером бигуанидного средства является, но без ограничения, метформин (CASномер 000657-24-9). Конкретные примеры ингибиторов альфа-глюкозидазы включают, но без ограничения, акарбозу(CAS-номер 056180-94-0), миглитол (CAS-номер 072432-03-2) и воглибозу (CAS-номер 083480-29-9). Конкретные примеры агонистов PPAR включают, но без ограничения, мураглитазар (CAS-номер 331741-94-7), розиглитазон (CAS-номер 122320-73-4), пиоглитазон (CAS-номер 111025-46-8), рагаглитазар (CAS-номер 222834-30-2), фарглитазар (CAS-номер 196808-45-4), тезаглитазар (CAS-номер 25156585-2), навеглитазар (CAS-номер 476436-68-7), нетоглитазон (CAS-номер 161600-01-7), ривоглитазонPPAR являются росглитазон и пиоглитазон. Конкретные примеры препаратов класса меглитинидов включают, но без ограничения, репаглинид(CAS-номер 135062-02-1), натеглинид (CAS-номер 105816-04-4) и митиглинид (CAS-номер 145375-43-5). Конкретные примеры ингибиторов DPP-IV включают, но без ограничения, ситаглиптин (CASномер 486460-32-6), саксаглиптин (CAS-номер 361442-04-8), вилдаглиптин (CAS-номер 274901-16-5),денаглиптин (CAS-номер 483369-58-0), Р 32/98 (CAS-номер 251572-70-0) и NVP-DPP-728 (CAS-номер 247016-69-9). Конкретные примеры ингибиторов PDE5 включают, но без ограничения, силденафил (CAS-номер 139755-83-2), варденафил (CAS-номер 224785-90-4) и тадалафил (CAS-номер 171596-29-5). Примеры ингибиторов PDE1, PDE9, PDE10 или PDE11, которые могут эффективно применяться согласно настоящему изобретению, можно найти, например, в US 20020160939, WO 2003037432, US 2004220186, WO 2005/003129, WO 2005012485, WO 2005120514 и WO 03077949. Конкретным примером агониста амилина является, но без ограничения, прамлинитид (CAS-номер 151126-32-8). Конкретным примером ингибитора коэнзима А является, но без ограничения, этомоксир (CASномер 082258-36-4). Конкретными примерами лекарственных средств против ожирения являются, но без ограничения,HMR-1426 (CAS-номер 262376-75-0), цетилистат (CAS-номер 282526-98-1) и сибутрамин (CAS-номер 106650-56-0). В другом варианте изобретение обеспечивает раздельные лекарственные формы соединения данного изобретения и один или несколько из любых описанных выше вторых терапевтических агентов, при этом соединение и второй терапевтический агент связаны друг с другом. Используемый здесь термин"связаны друг с другом" означает, что раздельные лекарственные формы упакованы вместе или иначе связаны друг с другом так, что очевидно, что раздельные лекарственные формы предназначены для совместной продажи и введения (в течение менее 24 ч, последовательно или совместно). В фармацевтических композициях изобретения соединение настоящего изобретения присутствует в эффективном количестве. Использующийся здесь термин "эффективное количество" относится к количеству, которое при введении в соответствующем режиме дозирования является эффективным для лечения(терапевтически или профилактически) целевого нарушения. Например, эффективное количество является достаточным для снижения или ослабления тяжести, продолжительности или прогрессирования нарушения, подлежащего лечению, предупреждения прогрессирования нарушения, подлежащего лечению,вызывания регрессии нарушения, подлежащего лечению, или усиления или улучшения профилактического(их) или терапевтического(их) эффекта(ов) другой терапии. Взаимосвязь доз для животных и человека (на основе миллиграмм на квадратный метр поверхности тела) описана в Freireich et al., Cancer Chemother. Rep, 1966, 50: 219. Площадь поверхности тела может быть определена приблизительно из роста и веса пациента (см., например, Scientific Tables, Geigy Pharmaceuticals, Ardsley N.Y., 1970, 537. В одном варианте эффективное количество соединения данного изобретения находится в диапазоне от 20 до 2000 мг на лечение. В более конкретных вариантах количество находится в диапазоне от 40 до 1000 мг, или в диапазоне от 100 до 800 мг, или более конкретно в диапазоне от 200 до 400 мг на лечение. Лечение обычно производится от одного до трех раз ежедневно. Эффективные дозы будут также изменяться, что понятно опытным в данной области специалистам,в зависимости от заболевания, тяжести заболевания, способа введения, пола, возраста и общего состояния здоровья пациента, использования вспомогательного вещества, возможности совместного применения с другими терапевтическими обработками, такими как использование других агентов, и заключения лечащего врача. Например, руководством для выбора эффективной дозы может служить указание по применению пентоксифиллина. Для фармацевтических композиций, которые содержат второй терапевтический агент, эффективное количество второго терапевтического агента составляет примерно от 20 до 100% дозы, как правило, используемой в монотерапии с использованием только этого агента. Предпочтительно, чтобы эффективное количество составляло от 70 до 100% обычной монотерапевтической дозы. Обычные терапевтические дозы этих вторых терапевтических агентов хорошо известны в данной области (см., например, Wells et(2000, каждый из которых включен здесь полностью в виде ссылки. Предполагается, что некоторые из вторых терапевтических агентов, указанных выше, будут действовать синергически с соединениями данного изобретения. В этом случае можно уменьшить требуемую в монотерапии эффективную дозу второго терапевтического агента и/или соединения данного изобретения. Это является полезным для уменьшения токсических побочных эффектов второго терапевтического агента соединения данного изобретения, синергетических улучшений в эффективности, простоты введения или применения и/или снижения общей стоимости приготовления соединения или состава. Способы лечения В одном варианте изобретение предлагает способ ингибирования активности фосфодиэстеразы(PDE) в клетке, предусматривающий контактирование клетки с одним или более соединениями формулы С или D. Дополнительно к его ингибирующей PDE активности, известно, что пентоксифиллин подавляет выработку ряда других биологических агентов, таких как интерлейкин-1 (IL-1), IL-6, IL-12, TNF-альфа,фибриногена и разных факторов роста. Соответственно в другом варианте в изобретении предложен способ подавления выработки интерлейкина-1 (IL-1), IL-6, IL-12, TNF-альфа, фибриногена и разных факторов роста в клетке, предусматривающий контактирование клетки с одним или более соединениями формулы С или D. Согласно другому варианту в изобретении предложен способ лечения заболевания у пациента, нуждающегося в этом, который предпочтительно проходил лечение пентоксифиллином, при этом способ предусматривает стадию введения указанному пациенту эффективного количества соединения формулы С или D или фармацевтической композиции, содержащей соединение формулы С или D, и фармацевтически приемлемого носителя. Такие заболевания хорошо известны в данной области и описаны, но без ограничения, в следующих патентах и патентных заявках: WO 1988004928, ЕР 0493682, US 5112827, ЕР 0484785, WO 1997019686,WO 2003013568, WO 2001032156, WO 1992007566, WO 1998055110, WO 2005023193, US 4975432, WO 1993018770, ЕР 0490181 и WO 1996005836. Такие заболевания включают, но без ограничения, обструктивное периферическое заболевание сосудов; гломерулонефрит; нефротический синдром; неалкогольный стеатогепатит; лейшманиоз; цирроз печени; печеночную недостаточность; псевдогипертрофическую миопатию Дюшенна; позднее лучевое повреждение; индуцированную облучением лимфедему; ассоциированный с облучением некроз; алкогольный гепатит; ассоциированный с облучением фиброз; некротический энтероколит у недоношенных новорожденных; диабетическую нефропатию, почечную недостаточность, вызванную гипертензией, и другую хроническую почечную недостаточность; фокальносегментарный гломерулосклероз; легочный саркоидоз; рецидивирующий афтозный стоматит; хроническую боль в груди у пациентов с раком молочной железы; опухоли мозга и центральной нервной системы; синдром недостаточного питания, воспаления, кахексии; опосредованное интерлейкином-1 заболевание; реакцию трансплантат против хозяина и другие реакции аллотрансплантата; индуцированный диетой стеатоз печени, атероматозные поражения, жировую дистрофию печени и другие вызванные диетой с высоким содержанием жиров или алкоголем клеточно-дегенеративные заболевания; вирус иммунодефицита человека типа 1 (ВИЧ-1) и другие человеческие ретровирусные инфекции; множественный склероз; рак; фибропролиферативные заболевания; бактериальную инфекцию; нефротоксичность, индуцированную лекарственным средством; коллагенный колит и другие заболевания и/или состояния, характеризующиеся повышенными уровнями фактора роста тромбоцитов (PDGF) или других воспалительных цитокинов; эндометриоз; нейропатию зрительного нерва и нарушения центральной нервной системы(CNS), ассоциированные с синдромом приобретенного иммунодефицита (AIDS), заболевания иммунной системы или множественный склероз; аутоиммунное заболевание; вирусную инфекцию верхних дыхательных путей; депрессию; недержание мочи; синдром раздраженного кишечника; септический шок; деменцию Альцгеймера; нейропатическую боль; дизурию; повреждение сетчатки или зрительного нерва; пептическую язву; сахарный инсулинозависимый диабет; сахарный диабет 2 типа; диабетическую нефропатию, метаболический синдром; ожирение; резистентность к инсулину; дислипидемию; патологическую толерантность к глюкозе; гипертензию; гиперлипидемию; гиперурикемию; подагру; гиперкоагуляцию и воспаление или повреждение, ассоциированное с хемотаксисом нейтрофилов и/или дегранулированием. Кроме того, соединения формулы С или D могут применяться для контроля внутриглазного давления или для стабилизации ауторегулирования церебрального кровотока у субъектов, которые нуждаются в таком контроле по результатам медицинского обследования. В одном конкретном варианте способ данного изобретения применяется для лечения заболевания или состояния у пациента, нуждающегося в этом, выбранного из перемежающейся хромоты на основе хронического облитерирующего заболевания артерий нижних конечностей и других периферических обструктивных сосудистых заболеваний; гломерулонефрита; фокально-сегментарного гломерулосклероза; нефротического синдрома; неалкогольного стеатогепатита; лейшманиоза; цирроза печени; печеночной недостаточности; псевдогипертрофической миопатии Дюшенна; позднего лучевого повреждения; индуцированной облучением лимфедемы; алкогольного гепатита; ассоциированного с облучением фиб- 17023809 роза; некротического энтероколита у недоношенных новорожденных; диабетической нефропатии, почечной недостаточности, вызванной гипертензией, и другой хронической почечной недостаточности; легочного саркоидоза; рецидивирующего афтозного стоматита; хронической боли в груди у пациентов с раком молочной железы; опухолей мозга и центральной нервной системы; ожирения; острого алкогольного гепатита; нарушения обоняния; эндометриозу с сопутствующим бесплодием; синдрома недостаточного питания, воспаления, кахексии и открытого артериального протока. В одном варианте способ данного изобретения применяется для лечения диабетической нефропатии, гипертензивной нефропатии или перемежающейся хромоты на основе хронического облитерирующего заболевания артерий нижних конечностей. В одном аспекте этого варианта способ данного изобретения применяется для лечения диабетической нефропатии. В другом конкретном варианте способ данного изобретения применяется для лечения заболевания или состояния у пациента, нуждающегося в этом, выбранного из перемежающейся хромоты на основе хронического облитерирующего заболевания артерий нижних конечностей. В одном варианте способ данного изобретения применяется для лечения хронической почечной недостаточности. Хроническая почечная недостаточность может быть выбрана из гломерулонефрита, фокально-сегментарного гломерулосклероза, нефротического синдрома, рефлюкс-уропатии или поликистозной болезни почек. В одном варианте способ данного изобретения применяется для лечения хронического заболевания печени. Хроническое заболевание печени может быть выбрано из неалкогольного стеатогепатита, жировой дистрофии печени и других вызванных диетой с высоким содержанием жиров или алкогольиндуцированных клеточно-дегенеративных заболеваний, цирроза печени, печеночной недостаточности или алкогольного гепатита. В одном варианте способ данного изобретения применяется для лечения заболевания или состояния, связанного с диабетом. Это заболевание может быть выбрано из резистентности к инсулину, ретинопатии, диабетических язв, некроза, ассоциированного с облучением, острой почечной недостаточности или нефротоксичности, вызванной лекарственными средствами. В одном варианте способ данного изобретения применяется для лечения пациента, страдающего муковисцидозом, включая тех пациентов, которые страдают хроническим бронхитом, вызванным Pseudomonas. В одном варианте способ данного изобретения применяется для способствования заживлению ран. Примеры типичных ран, которые могут быть обработаны, включают трофические язвы, диабетические язвы и пролежневые язвы. В другом конкретном варианте способ данного изобретения применяется для лечения заболевания или состояния у пациента, нуждающегося в этом, выбранного из инсулинозависимого диабета, инсулинонезависимого диабета; метаболического синдрома; ожирения; резистентности к инсулину; дислипидемии; патологической толерантности к глюкозе, гипертензии, гиперлипидемии; гиперурицемии; подагры; и повышенной свертываемости крови. В одном варианте способ данного изобретения применяется для лечения заболевания или состояния у пациента, нуждающегося в этом, при этом заболевание или состояние выбрано из анемии, болезни Грейвса, окклюзии вены сетчатки, люпус-нефрита, макулярной дегенерации, миелодисплазии, прурита ВИЧ происхождения, легочной гипертензии, окклюзии артерии сетчатки, флегмоны кишечника, ишемической оптической нейропатии, острого панкреатита, серповидно-клеточной анемии и бета-талассемии. Способы, описанные здесь, также включают такие, в которых пациент идентифицирован как нуждающийся в конкретном установленном лечении. Идентификация пациента, нуждающегося в таком лечении, находится на усмотрении пациента или лечащего врача, и может быть субъективной (например,мнение) или объективной (например, измеряемое тестом или диагностическим методом). В другом варианте любой из вышеуказанных способов лечения предусматривает дальнейшую стадию совместного введения пациенту одного или нескольких вторых терапевических агентов. Выбор второго терапевтического агента может быть сделан из любого второго терапевтического агента, известного как эффективный для совместного введения с пентоксифиллином. Выбор второго терапевтического агента также зависит от конкретного заболевания или состояния, подлежащего лечению. Примеры вторых терапевтических агентов, которые могут использоваться в способах изобретения, представлены выше для применения в комбинаторных композициях, содержащих соединение данного изобретения и второй терапевтический агент. В частности, комбинаторные терапии данного изобретения предусматривают совместное введение соединения формулы С или D и второго терапевтического агента для лечения следующих состояний (с конкретным вторым терапевтическим агентом, указанным в скобках после показания): поздние лучевые повреждения (-токоферол), вызванный облучением фиброз (-токоферол), вызванная облучением лимфедема (-токоферол), хроническая боль в груди при раке молочной железы (-токоферол), диабетическая нефропатия 2 типа (каптоприл), синдром недостаточного питания, воспаления, кахексии (пероральная пищевая добавка, такая как Nepro; и пероральный противовоспалительный модуль, такой как Охера); и опухоли мозга и центральной нервной системы (лучевая терапии и гидроксимочевина). Комбинаторные терапии данного изобретения также предусматривают совместное введение соединения формулы С или D и второго терапевтического агента для лечения сахарного инсулинзависимого диабета; инсулинонезависимого диабета; метаболического синдрома; ожирения; резистентности к инсулину; дислипидемии; патологической толерантности к глюкозе; гипертензии; гиперлипидемии; гиперурикемии; подагры и гиперкоагуляции. Используемый здесь термин "совместное введение" означает, что второй терапевтический агент может вводиться вместе с соединением данного изобретения как часть однократной лекарственной формы (например, композиция данного изобретения, содержащая соединение изобретения и второй терапевтический агент, как описано выше) или в виде раздельных, множественных лекарственных форм. Или же, дополнительный агент может вводиться до, параллельно или после введения соединения данного изобретения. В такой комбинаторной терапии соединения данного изобретения и второй терапевтический агента(ы) вводят обычными способами. Введение пациенту композиции изобретения, содержащей соединение изобретения и второй терапевтический агент, не исключают раздельного введения этого терапевтического агента, любого другого второго терапевтического агента или любого соединения данного изобретения указанному пациенту в другое время в течение курса лечения. Эффективные количества этих вторых терапевтических агентов хорошо известны опытным в данной области специалистам и руководство по дозированию можно найти в патентах и опубликованных патентных заявках, указанных здесь, а также в Wells et al., eds., Pharmacotherapy Handbook, 2nd Edition,Appleton and Lange, Stamford, Conn. (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, Deluxe Edition, Tarascon Publishing, Loma Linda, Calif. (2000) и другой медицинской литературе. Однако, в компетенции лечащего врача находится определение оптимального диапазона эффективного количества второго терапевтического агента. В одном варианте изобретения, в котором второй терапевтический агент вводится субъекту, эффективное количество соединения данного изобретения меньше, чем его эффективное количество в случае,когда второй терапевтический агент не вводится. В другом варианте эффективное количество второго терапевтического агента меньше, чем его эффективное количество в случае, когда соединение данного изобретения не вводится. В этом способе нежелательные побочные эффекты, связанные с высокими дозами каждого агента, могут быть сведены к минимуму. Другие возможные преимущества (включая без ограничения улучшенные режимы дозирования и/или уменьшенную стоимость лекарственного средства) будут очевидны опытным в данной области специалистам. В еще другом аспекте изобретение предлагает использование соединения формулы С или D, по отдельности или вместе с одним или несколькими описанными выше вторыми терапевтическими агентами,в производстве лекарственных средств в виде одной композиции или в виде раздельных лекарственных форм для лечения или предупреждения у пациента заболевания, нарушения или симптома, указанного выше. Другим аспектом изобретения является применение соединения формулы С или D для лечения или предупреждения у пациента заболевания, нарушения или его симптома, указанного здесь. Примеры синтеза. Примеры синтеза, представленные ниже, описывают подробную методику приготовления некоторых соединений данного изобретения. Опытному специалисту в данной области будет очевидно, что могут быть приготовлены другие соединения данного изобретения с использованием других реагентов или промежуточных соединений с помощью данных методик и описанных выше схем. Приготовленные соединения анализировали методом ЯМР, масс-спектрометрии и/или элементным анализом. Анализы 1 НЯМР проводили на 300 МГц оборудовании, которое было эффективным для определения внедрения дейтерия. Если не указано иное, отсутствие ЯМР сигнала, как отмечено в примерах ниже, показывает уровень внедрения дейтерия, который составляет по меньшей мере 90%. Пример 1. Синтез 3-метил-7-(метил-d3)-1-(5-оксогексил)-1H-пурин-2,6(3H,7H)диона (соединение 100) Схема 13. Приготовление соединений 100 и 409 Стадия 1. 3-Метил-7-(метил-d3)-1H-пурин-2,6(3H,7H-дион (51). Суспензию 3-метилксантина 50 (5.0 г, 30.1 ммоль, 1 экв) и порошковый K2CO3 (5.0 г, 36.0 ммоль,1.2 экв) в DMF (95 мл) нагревали до 60 С и добавляли иодметан-d3 (Cambridge Isotopes, 99.5 ат.% D, 2.2 мл, 36.0 ммоль, 1.2 экв) через шприц. Полученную смесь нагревали при 80 С в течение 5 ч. Реакционную смесь охлаждали до комнатной температуры (КТ) и DMF выпаривали при пониженном давлении. Сырой остаток растворяли в 5%-ном водном растворе NaOH (50 мл) с образованием бледно-желтого раствора. Водный раствор промывали три раза CH2Cl2 (всего 500 мл). Водный слой подкисляли до рН 5 уксусной кислотой (6 мл) с образованием желтовато-коричневого осадка. Смесь охлаждали в ванне с ледяной водой, твердую фазу фильтровали и отмывали холодной водой. Твердую фазу высушивали в вакуумной печи с образованием 2.9 г 51 в виде желтовато-коричневого твердого вещества. Фильтрат концентрировали примерно до 25 мл и вторую партию (0.70 г) 51 собирали фильтрацией. Общий выход 51 составил 3.6 г. Сырой материал использовали без дальнейшей очистки. Стадия 2. 3-Метил-7-(метил-d3)-1-(5-оксогексил)-1H-пурин-2,6(3H,7H)дион (соединение 100). Сырой 51 (1.50 г, 8.2 ммоль, 1 экв) и порошковый K2CO3 (2.28 г, 16.4 ммоль, 2 экв) суспендировали в DMF (30 мл) и нагревали до 50 С. В полученную желтовато-коричневую суспензию добавляли 6-хлор 2-гексанон (52, 1.2 мл, 9.0 ммоль, 1.1 экв) и температуру реакции повышали до 130 С. Нагревание продолжали при 130 С в течение 2 ч, во время которого суспензия становилась более тонкодисперсной и более темной по цвету. Реакционную смесь охлаждали до КТ и DMF выпаривали при пониженном давлении. Остаточную желтовато-коричневую пасту суспендировали в EtOAc (250 мл) и фильтровали для удаления нерастворимого материала. Фильтрат концентрировали при пониженном давлении с образованием желтого масла. Сырой продукт очищали с использованием хроматографической системы Analogix,элюируя 100% EtOAc (10 мин) с последующим градиентом 0-25% МеОН/EtOAc в течение 50 мин. Фракции продукта концентрировали при пониженном давлении для получения светло-желтого масла, которое отверждалось после выстаивания в течение нескольких мин. Твердую фазу растирали с гептанами (100 мл) и фильтровали для получения 2.00 г 100 в виде грязно-белого твердого вещества, Т.пл. 101.8-103.0 С. 1 Н-ЯМР (300 МГц, CDCl3):1.64-1.68 (m, 4 Н), 2.15 (s, 3 Н), 2.51 (t, J=7.0, 2 Н), 3.57 (s, 3 Н), 4.01 (t,J=7.0, 2H), 7.52 (s, 1H). 13 С-ЯМР (75 МГц, CDCl3):20.95, 27.41, 29.69, 29.98, 40.80, 43.18, 107.63, 141.41, 148.75, 151.45,155.26, 208.80. ВЭЖХ (метод: 20 мм колонка C18-RP; градиентное элюирование 2-95% ACN+0.1% муравьиная кислота за 3.3 мин с выдержкой в течение 1.7 мин при 95% ACN; длина волны 254 нм): время удерживания 2.54 мин; чистота 98.5%. MS (M+H): 282.0. Элементный анализ (C13H15D3N4O3): вычислено: С=55.50, Н=6.45, N=19.92; обнаружено: С=55.58, Н=6.48, N=19.76. Из-за наличия триплета при 4.01 м.д. в указанном выше Н-ЯМР спектре определение наличия или отсутствия синглетного пика примерно при 3.99 м.д., соответствующего наличию или отсутствию атомов водорода на N-метильной группе в 7-положении (R1) пуринового кольца, было невозможным. Пример 2. Синтез 8-d1-3-метил-7-(метил-d3)-1-(6-d3-4-d2-5-оксогексил)-1H-пурин-2,6(3H,7H)диона(соединение 409). 8-d1-3-Метил-7-(метил-d3)-1-(6-d3-4-d2-5-оксогексил)-1H-пурин-2,6(3H,7H)дион (соединение 409). Суспензию 100 (1.80 г, 6.4 ммоль, 1 экв) и порошковый K2CO3 (0.23 г, 1.7 ммоль, 0.25 экв) в D2O (Cambridge Isotope Labs, 99 ат.% D) (45 мл) перемешивали при нагревании с обратным холодильником в течение 24 ч, во время которого суспензия превращалась в светло-желтый раствор. Реакционную смесь охлаждали до КТ, насыщали хлоридом натрия и экстрагировали четыре раза дихлорметаном (400 мл всего). Объединенный органический раствор сушили над Na2SO4, фильтровали и выпаривали при пониженном давлении для получения 1.7 г светло-желтого масла, которое отверждалось при выстаивании. Сырой материал повторно подвергали реакции обмена водорода на дейтерий в условиях, описанных выше, с использованием свежеприготовленных K2CO3 и D2O. После аналогичной обработки грязно-белое твердое вещество растирали с гексанами (100 мл) и фильтровали для получения 1.61 г 409 в виде грязно-белого твердого вещества, Т.пл. 99.6-99.8 С. 1 Н-ЯМР (300 МГц, CDCl3):1.64-1.69 (m, 4H), 3.57 (s, 3 Н), 4.01 (t, J=7.0, 2 Н). 13 С-ЯМР (75 МГц, CDCl3):21.05, 27.61, 29.90, 41.02, 107.83, 148.99, 151.69, 155.50,209.28. ВЭЖХACN+0.1% муравьиная кислота за 14 мин (1.0 мл/мин) с 4 мин выдержкой при 95% ACN; длина волны 254 нм): время удерживания 3.26 мин; чистота 98%. MS (M+H): 288.3. Элементный анализ(C13H9D9N4O3): вычислено: С=54.35, Н=6.31, N=19.50; обнаружено: С=54.36, Н=6.32, N=19.10. Примечательно, что в 1 Н-ЯМР спектре выше отсутствовали следующие пики: синглет примерно при 2.15 м.д., что указывало на отсутствие атомов водорода метилкетона; триплет примерно при 2.51 м.д., что указывало на отсутствие атомов водорода метиленкетона; и синглет примерно при 7.52 м.д., что указывало на отсутствие водорода в положении 8 пуринового кольца. Из-за наличия триплета при 4.01 м.д. в указанном выше спектре 1H-ЯМР определение наличия или отсутствия синглетного пика примерно при 3.99 м.д., соответствующего наличию или отсутствию атомов водорода на N-метильной группе в положении 7 (R1) пуринового кольца, было невозможным. Реакция обмена водорода на дейтерий (В/Д) для превращения функциональной группы СН 3 С(О)СН 2 в 100 в функциональную группу CD3C(O)CD2 в 409 может в целом применяться в аналогичных условиях для превращения соединений, содержащих один или несколько водородов в альфа положении к карбонильной группе, в соединения, содержащие один или несколько атомов дейтерия вместо соответствующего одного или нескольких атомов водорода. В одном варианте успешные реакции обмена В/Д могут проводиться при необходимости для дальнейшего увеличения внедрения дейтерия. В одном аспекте этого варианта любой избыток D2O в конце второй реакции обмена В/Д в заданной обрабатываемой партии может быть использован в первой реакции обмена В/Д в последующей обрабатываемой партии; и любой избыток D2O в конце третьей реакции обмена В/Д в заданной обрабатываемой партии может быть использован во второй реакции обмена В/Д в последующей обрабатываемой партии. Таблица ниже показывает примеры дейтерирования на трех отдельных партиях соединения, содержащего функциональную группу СН 3 С(О)СН 2, и указывает агент дейтерирования (99% D2O или водная фаза, полученная из последнего цикла дейтерирования другой партии), который может быть использован согласно данному изобретению. в структуру, показанную ниже, может быть осуществлено в последовательных партиях. Следующие таблицы показывают процент внедрения дейтерия в метил(СО), (СО)метилен и метановый углерод имидазольного кольца для последовательных обрабатываемых партий, содержащих 50 кг пентоксифиллина в каждой партииR1-2 получен из партии 1, обмен 2,R1-3 получен из партии 1, обмен 3,R2-2 получен из партии 2, обмен 2R2-3: получен из партии 2, обмен 3. В одном варианте обмен 4 является необязательным. В партии 3 обработка показана в таблице, обмен 4 выполняли в половинном объеме для обеспечения высокого внедрения дейтерия в партии 3. Пример 6. Синтез единение 419). Соединение 409 (0.50 г, 1.7 ммоль, 1.0 экв, см. пример 2) растворяли в EtOD (13 мл, Aldrich 99.5 ат.% D) и добавляли NaBH4 (0.07 г, 1.9 ммоль, 1.1 экв). Наблюдали повышение температуры от 24 до 28 С. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре, затем реакцию останавливали добавлением D2O (30 мл, Cambridge Isotope Labs, 99 ат.% D). Образовавшуюся белую суспензию экстрагировали МТВЕ (4 Х, всего 200 мл). Объединенные органические экстракты сушили надNa2SO4, фильтровали и концентрировали при пониженном давлении до прозрачного бесцветного масла(0.45 г). Сырой продукт очищали хроматографией на силикагеле, элюируя сначала 1% МеОН/CH2Cl2 с последующим градиентом 1-5% МеОН/CH2Cl2. Фракции, содержащие продукт, концентрировали при пониженном давлении для получения соединения 419 (0.41 г, 83%) в виде прозрачного бесцветного масла, которое отверждалось при выстаивании. Пример 7. Хиральное разделение (R)-8-d1-1-(4,4,6,6,6-d5-5-гидроксигексил)-3-метил-7-(метил-d3)1H-пурин-2,6(3H,7H)диона (соединение 419(R и (S)-8-d1-1-(4,4,6,6,6-d5-5-гидроксигексил)-3-метил-7(метил-d3)-1H-пурин-2,6(3H,7H)-1H-диона (соединение 419(S. Разделение энантиомеров соединения 419. Соединение 419, полученное в примере 6 выше (0.38 г), растворяли в минимальном количествеiPrOH (6 мл, степень чистоты ВЭЖХ, требуется нагревание) и разбавляли гексаном (4 мл, степень чистоты ВЭЖХ). Энантиомерное разделение достигалось с использованием ВЭЖХ системы Waters, оснащенной препаративной колонкой Daicel Chiralpak AD (20250 мм). На первой минуте в качестве подвижной фазы использовали смесь 80% гексан/20% iPrOH с 0.1% диэтиламином. После первой минуты использовали градиент до 75% гексана и 25% iPrOH вместе с 0.1% диэтиламином в течение 15 мин с последующим выдерживанием при данном соотношении в течение 17 мин при скорости потока 18 мл/мин. Этот способ вызвал базовое разделение, элюируя первым 419(R) (21.0 мин) с последующим 419(S) (24.1 мин). Фракции, содержащие каждый энантиомер, концентрировали при пониженном давлении для получения 0.16 г каждого из 419(R) (Т.пл. 107.8-108.8 С) и 419(S) (Т.пл. 108.3-108.4 С) в виде грязно-белого твердого вещества. А) (R)-8-d1-1-(4,4,6,6,6-d5-5-гидроксигексил)-3-метил-7-(метил-d3)-1H-пурин-2,6(3H,7H)дион (соединение 419(R. 1 Н-ЯМР (300 МГц, CDCl3):1.36-1.50 (m, 2 Н), 1.60-1.74 (m, 3 Н), 3.58 (s, 3 Н), 3.80 (s, 1H), 4.02 (t,J=7.3, 2 Н). 13 С-ЯМР (75 МГц, CDCl3):22.70, 27.86, 29.71, 41.14, 67.66, 107.66, 148.78, 151.54, 155.40. ВЭЖХ(метод: колонка Waters Atlantis Т 3, 2.150 мм, 3 мкм, C18-RP; градиентный режим 5-95% ACN+0.1% муравьиная кислота за 14 мин (1.0 мл/мин) с 4 мин выдержкой при 95% ACN+0.1% муравьиная кислота; длина волны 254 нм): время удерживания 3.26 мин; чистота 99.9%. Хиральная ВЭЖХ (метод: колонкаChiralpak AD 25 см; изократический режим 78% гексан/22% изопропанол/0.01% диэтиламин в течение 40 мин при 1.00 мл/мин; длина волны 254 нм): время удерживания 27.51 мин (главный энантиомер); 31.19 мин (ожидаемое для отрицательного энантиомера): чистота ее 99.9%. MS (M+H): 290.1, (M+Na): 312.3. Элементный анализ (C13H11D9N4O3): вычислено: С=53.97, Н=6.97, N=19.36; обнаружено: С=54.39,Н=7.11, N=18.98. Примечательно, что в 1 Н-ЯМР спектре выше отсутствовали следующие пики: пик примерно при 1.19 м.д., что указывало на отсутствие атомов водорода метила в альфа-положении к гидроксильной группе; и синглет примерно при 7.51 м.д., что указывало на отсутствие водорода в положении 8 пуринового кольца. Из-за наличия мультиплета при 1.36-1.50 м.д. и триплета при 4.01 м.д. в указанном выше 1 НЯМР спектре определение наличия или отсутствия пика при 1.51 м.д., соответствующего наличию или отсутствию атомов водорода в альфа положении к гидроксильной группе, и синглетного пика примерно при 3.99 м.д., соответствующего наличию или отсутствию атомов водорода на N-метильной группе в положении 7 (R1) пуринового кольца, было невозможным. В) (S)-8-d1-1-(4,4,6,6,6-d5-5-гидроксигексил)-3-метил-7-(метил-d3)-1H-пурин-2,6(3H,7H)дион (соединение 419(S. 1 Н-ЯМР (300 МГц, CDCl3):1.41-1.48 (m, 2H), 1.64-1.72 (m, 3 Н), 3.58 (s, 3 Н), 3.79 (s, 1H), 4.02 (t,J=7.4, 2 Н). 13 С-ЯМР (75 МГц, CDCl3):22.70, 27.86, 29.71, 41.15, 67.66, 107.67, 148.78, 151.54, 155.41. ВЭЖХ(метод: колонка Waters Atlantis Т 3, 2.150 мм, 3 мкм, C18-RP; градиентный режим 5-95% ACN+0.1% муравьиная кислота за 14 мин (1.0 мл/мин) с 4 мин выдержки при 95% ACN+0.1% муравьиная кислота; длина волны 254 нм): время удерживания 3.26 мин; чистота 99.9%. Хиральная ВЭЖХ (метод: колонка- 22023809 Примечательно, что в 1H-ЯМР спектре отсутствовали следующие пики: пик примерно при 1.19 м.д.,что указывало на отсутствие атомов водорода метила в альфа положении к гидроксильной группе; и синглет примерно при 7.51 м.д., что указывало на отсутствие водорода в положении 8 пуринового кольца. Из-за наличия мультиплета при 1.36-1.50 м.д. и триплета при 4.01 м.д. в указанном выше 1 Н-ЯМР спектре, определение наличия или отсутствия пика при 1.51 м.д., соответствующего наличию или отсутствию атомов водорода метилена в альфа положении к гидроксильной группе, и синглетного пика примерно при 3.99 м.д., соответствующего наличию или отсутствию атомов водорода на N-метильной группе в положении 7 (R1) пуринового кольца, было невозможным. Пример 8. Синтез 8-d1-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3-метил-7-(метил-d3)-1H-пурин 2,6(3H,7H)диона (соединение 435) Схема 17. Приготовление соединений 435, 435(R) и 435(S)NaBD4 (0.08 г, 1.9 ммоль, 1.1 экв, Cambridge Isotope Labs, 99 ат.% D). Наблюдали повышение температуры с 24 до 27 С. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре, затем гасили добавлением D2O (30 мл) (Cambridge Isotope, 99 ат.% D). Образованную белую суспензию экстрагировали МТВЕ (4 Х, всего 200 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении до прозрачного бесцветного масла (0.45 г). Сырой продукт очищали хроматографией на силикагеле, элюируя сначала 1% МеОН/CH2Cl2 с последующим градиентом 1-5% МеОН/ CH2Cl2. Фракции, содержащие продукт, концентрировали при пониженном давлении для получения 0.40 г (81%) соединения 435 в виде прозрачного бесцветного масла, которое отверждалось при выстаивании. Пример 9. Хиральное разделение (R)-8-d1-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3-метил-7-(метил-d3)1H-пурин-2,6(3H,7H)диона (соединение 435(R и (S)-8-d1-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3-метил-7(метил-d3)-1H-пурин-2,6(3H,7H)диона (соединение 435(S. Разделение энантиомеров соединения 435. Соединение 435, полученное в примере 8 выше (0.32 г), растворяли в минимальном количествеiPrOH (5 мл, ВЭЖХ степень очистки, требовалось нагревание) и разбавляли гексаном (4 мл, ВЭЖХ степень очистки). Энантиомерное разделение достигалось с использованием ВЭЖХ-системы Waters, оснащенной колонкой Daicel Chiralpak AD (20250 мм). Для первой минуты обработки подвижной фазой был 80% гексан и 20% iPrOH вместе с 0.1% диэтиламином. Через одну минуту использовали градиент до 75% гексана и 25% iPrOH вместе с 0.1% диэтиламином в течение 15 мин с последующим выдерживанием в этом соотношении растворителей в течение 17 мин при скорости потока 18 мл/мин. Этот способ привел к базовому разделению, элюируя первым соединение 435(R) (21.9 мин) с последующим соединением 435(S) (25.2 мин). Фракции, содержащие каждый энантиомер, концентрировали при пониженном давлении для получения 0.12 г каждого, 435(R) (Т.пл. 108.0-108.1 С) и 435(S) (Т.пл. 107.6-107.7 С), в виде грязно-белого твердого вещества.H-ЯМР (300 МГц, CDCl3):1.40-1.48 (m, 3 Н), 1.66-1.70 (m, 2 Н), 3.58 (s, 3 Н), 4.02 (t, J=7.5, 2 Н). 13 С-ЯМР (75 МГц, CDCl3):22.66, 27.86, 29.71, 41.15, 107.67, 148.80, 151.54, 155.41. ВЭЖХ (метод: колонка Waters Atlantis Т 3, 2.150 мм, 3 мкм, C18-RP; градиентный режим 5-95% ACN+0.1% муравьиная кислота за 14 мин (1.0 мл/мин) с 4 мин выдержкой при 95% ACN+0.1% муравьиной кислотой; длина волны 254 нм): время удерживания 3.25 мин; чистота 99.8%. Хиральная ВЭЖХ (метод: колонка ChiralpakAD 25 см; изократический режим 78% гексан/22% изопропанол/0.01% диэтиламин в течение 40 мин при 1.00 мл/мин; длина волны 254 нм): время удерживания 27.24 мин (главный энантиомер); 31.11 мин (ожидаемое для отрицательного энантиомера): чистота 99.9% ее. MS (M+H): 291.3, (M+Na): 313.2. Элементный анализ (C13H10D10N4O3): вычислено: С=53.78, Н=6.94, N=19.30; найдено: С=54.01, Н=7.07, N=18.90. Примечательно, что в 1 Н-ЯМР спектре выше отсутствовали следующие пики: пик примерно при 1.19 м.д., что указывало на отсутствие атомов водорода метила в альфа положении к гидроксильной группе; пик примерно при 3.80 м.д., что указывало на отсутствие водорода в метинилгидроксильном положении, и синглет примерно при 7.51 м.д., что указывало на отсутствие водорода в положении 8 пури- 23023809 нового кольца. Из-за наличия мультиплета при 1.36-1.50 м.д. и триплета при 4.01 м.д. в указанном выше Н-ЯМР спектре определение наличия или отсутствия пика при 1.51 м.д., соответствующего наличию или отсутствию атомов водорода метилена в альфа положении к гидроксильной группе, и синглетного пика примерно при 3.99 м.д., соответствующего наличию или отсутствию водорода на N-метильной группе в положении 7 (R1) пуринового кольца, было невозможным. В) (S)-8-d1-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3-метил-7-(метил-d3)-1H-пурин-2,6(3H,7H)дион (соединение 435(S. 1 Н-ЯМР (300 МГц, CDCl3):1.41-1.48 (m, 3 Н), 1.62-1.72 (m, 2 Н), 3.58 (s, 3 Н), 4.03 (t, J=7.4, 2 Н). 13 С-ЯМР (75 МГц, CDCl3):22.69, 27.90, 29.70, 41.17, 107.69, 148.82, 151.58, 155.43. ВЭЖХ (метод: колонка Waters Atlantis Т 3, 2.150 мм, 3 мкм, C18-RP; градиентный режим 5-95% ACN+0.1% муравьиная кислота за 14 мин (1.0 мл/мин) с 4 мин выдержкой при 95% ACN+0.1% муравьиная кислота; длина волны 254 нм): время удерживания 3.25 мин; чистота 99.5%. Хиральная ВЭЖХ (метод: колонка Chiralpak AD 25 см - изократический режим 78% гексан/22% изопропанол/0.01% диэтиламин в течение 40 мин при 1.00 мл/мин; длина волны 254 нм): время удерживания 31.11 мин (главный энантиомер); 27.24 мин (ожидаемое для отрицательного энантиомера): ее чистота 99.9%. MS (М+Н): 291.3, (M+Na): 313.2. Элементный анализ (C13H10D10N4O3): вычислено: С=53.78,Н=6.94, N=19.30; найдено: С=54.01, Н=7.11, N=18.78. Примечательно, что в 1 Н-ЯМР спектре выше отсутствовали следующие пики: пик примерно при 1.19 м.д., что указывало на отсутствие атомов водорода метила в альфа положении к гидроксильной группе; пик примерно при 3.80 м.д., что указывало на отсутствие водорода в метинилгидроксильном положении, и синглет примерно при 7.51 м.д., что указывало на отсутствие водорода в положении 8 пуринового кольца. Из-за наличия мультиплета при 1.36-1.50 м.д. и триплета при 4.01 м.д. в указанном выше 1 Н-ЯМР спектре определение наличия или отсутствия пика при 1.51 м.д., соответствующего наличию или отсутствию атомов водорода метилена в альфа положении к гидроксильной группе, и синглетного пика примерно при 3.99 м.д., соответствующего наличию или отсутствию водорода на N-метильной группе в положении 7 (R1) пуринового кольца, было невозможным. Пример 10. Синтез 8-d1-3,7-диметил-1-(4,4,6,6,6-d5-5-оксогексил)-1H-пурин-2,6(3H,7H)диона (соединение 407). Схема 18. Приготовление соединений 407. 437. 437(R) и 437(S) 1 8-d1-3,7-Диметил-1-(4,4,6,6,6-d5-5-оксогексил)-1H-пурин-2,6(3H,7H)дион (соединение 407). Смесь коммерчески доступного 58 (7.95 г, 28.6 ммоль) и карбоната калия (990 мг, 7.2 ммоль) в D2O(195 мл, Cambridge Isotopes, 99.9 ат.% D) нагревали с обратным холодильником в течение 24 ч. Суспендированное твердое вещество постепенно растворяли с образованием желтого раствора. Раствор охлаждали примерно до 40 С и концентрировали при пониженном давлении до желтовато-коричневого твердого вещества. Твердое вещество растворяли в D2O (195 мл) и раствор нагревали с обратным холодильником еще в течение 24 ч. Раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении до желтовато-коричневого твердого вещества. Добавляли этилацетат (200 мл), и смесь перемешивали в течение 0.5 ч примерно при 40 С. Нерастворимые материалы фильтровали и фильтрат концентрировали при пониженном давлении до бледно-желтого твердого вещества, которое растирали с МТВЕ (40 мл) для получения 7.5 г (93%) соединения 407 в виде грязно-белого твердого вещества. 1ACN+0.1% муравьиная кислота за 14 мин (1.0 мл/мин) с 4 мин выдержкой при 95% ACN+0.1% муравьиная кислота; длина волны 305 нм): время удерживания 3.24 мин; чистота 99.9%. MS (M+H): 285.3,(M+Na): 307.2. Элементный анализ (C13H12D6N4O3): вычислено: С=54.92, Н=6.38, N=19.71; найдено: С=54.89, Н=6.38, N=19.70. Примечательно, что в 1 Н-ЯМР спектре выше отсутствовали следующие пики: синглет примерно при 2.15 м.д., что указывало на отсутствие атомов водорода метилкетона; триплет при примерно 2.51 м.д., что указывало на отсутствие атомов водорода метиленкетона; и синглет примерно при 7.52 м.д., что указывало на отсутствие водорода в положении 8 пуринового кольца.(6.5 г, 22.9 ммоль) в этаноле-d1 (65 мл, Aldrich, 99.5 ат.% D) при 0 С. Смесь нагревали до комнатной температуры и перемешивали до образования прозрачного раствора (примерно 1 ч). Реакцию осаждали насыщенным раствором аммония хлорида-d4 (Cambridge Isotopes, 98 ат.% D) в D2O (8 мл, Cambridge Isotope, 99.9 ат.% D), этанол-d1 выпаривали при пониженном давлении и остаток экстрагировали EtOAc(160 мл). Органическую фазу промывали D2O (20 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении для получения 4.8 г (73%) соединения 437 в виде бледножелтого твердого вещества. Пример 12. Хиральное разделение (R)-8-d1-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3,7-диметил-1Hпурин-2,6(3 Н,7 Н)-диона (соединение 437(R и (S)-8-d1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3,7-диметил-1Hпурин-2,6(3 Н,7 Н)-диона (соединение 437(S. Разделение энантиомеров соединения 437. Соединение 437, полученное в примере 11 выше (1.60 г), растворяли в iPrOH (20 мл, степень чистоты ВЭЖХ, требуется нагревание). Энантиомерное разделение осуществляли с использованием ВЭЖХсистемы Waters, оснащенной препаративной колонкой Chiralpak AD (20250 мм Daicel, 10 мкм) с препаративной защитной колонкой Chiralpak AD (2050 мм Daicel, 10 мкм). Для первой минуты обработки образец элюировали 20% iPrOH/гексаны (с 0.1% диэтиламином в качестве сорастворителя) при увеличении скорости потока от 15 до 18 мл/мин. В течение следующих 15 мин образец элюировали при скорости потока 18 мл/мин градиентом 20-25% iPrOH/гексаны. Для следующих 19 мин образец элюировали при скорости потока 18 мл/мин 25% iPrOH/гексаны. В течение следующих 0.5 мин образец элюировали при скорости 18 мл/мин градиентом 25-20% iPrOH/гексаны. Для следующих 4.5 мин образец элюировали при скорости потока 18 мл/мин 20% iPrOH/гексаны. Этот способ элюирования привел к базовому разделению, элюируя первым (время удерживания приблизительно 29 мин) соединение 437(R), и элюируя вторым (время удерживания примерно 33 мин) соединение 437(S). Фракции, содержащие каждый энантиомер, собирали и концентрировали при пониженном давлении для получения 340 мг 437(R) (Т.пл. 112.0114.5 С) и 375 мг 437(S) (Т.пл. 111.9-112.3 С) в виде грязно-белых твердых веществ [примечание: только 1.0 г 437 извлекали из раствора, приготовленного выше]. А) (R)-8-d1-1-(4,4,5,6,6,6-(4-5-гидроксигексил)-3,7-диметил-1H-пурин-2,6(3 Н,7 Н)-дион (соединение 437(R. 1 Н-ЯМР (300 МГц, CDCl3):1.36-1.50 (m, 2H), 1.54 (s, 1H), 1.64-1.74 (m, 2H), 3.58 (s, 3H), 3.99 (s,3H), 4.00-4.05 (m, 2H). 13 С-ЯМР (75 МГц, CDCl3):22.66, 27.86, 29.70, 33.59, 41.14, 107.65, 148.76, 151.52, 155.40. ВЭЖХ(метод: колонка Waters Atlantis Т 3, 2.150 мм, 3 мкм, C18-RP; градиентный режим 5-95% ACN+0.1% муравьиная кислота на 14 мин (1.0 мл/мин) с 4 мин выдержки при 95% ACN+0.1% муравьиная кислота; длина волны 305 нм): время удерживания 3.28 мин; чистота 99.9%. Хиральная ВЭЖХ (метод: колонкаChiralpak AD 25 см; изократический режим 78% гексан/22% изопропанол/0.01% диэтиламин в течение 40 мин при 1.00 мл/мин; длина волны 254 нм): время удерживания 25.20 мин (главный энантиомер); 28.39 мин (ожидаемое для отрицательного энантиомера): ее чистота 99.9%. MS (M+H): 288.3, (M+Na): 310.2. Элементный анализ (C13H13D7N4O3): вычислено: С=54.34, Н=7.02, N=19.50; найдено: С=54.32, Н=7.23,N=19.35. Примечательно, что в 1 Н-ЯМР спектре выше отсутствовали следующие пики: пик примерно при 1.19 м.д., что указывало на отсутствие атомов водорода метила в альфа положении к гидроксильной группе; пик примерно при 3.80 м.д., что указывало на отсутствии водорода в метинилгидроксильном положении; и синглетный пик примерно при 7.51 м.д., что указывало на отсутствие водорода в положении 8 пуринового кольца. Из-за наличия мультиплета при 1.36-1.50 м.д. в указанном выше 1 Н-ЯМР спектре определение наличия или отсутствия пика при 1.51 м.д., соответствующего наличию или отсутствию атомов водорода метилена в альфа положении к гидроксильной группе, не было возможным. В) (S)-8-d1-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3,7-диметил-1H-пурин-2,6(3 Н,7 Н)дион (соединение 437(S. 1 Н-ЯМР (300 МГц, CDCl3):1.38-1.48 (m, 2 Н), 1.55 (s, 1H), 1.64-1.72 (m, 2H), 3.58 (s, 3H), 3.99 (s,3H), 4.00-4.05 (m, 2H). 13 С-ЯМР (75 МГц, CDCl3):22.65, 27.84, 29.71, 33.59, 41.13, 107.64, 148.75, 151.52, 155.39. ВЭЖХ(метод: колонка Waters Atlantis Т 3, 2.150 мм, 3 мкм, C18-RP; градиентный режим 5-95% ACN+0.1% муравьиная кислота за 14 мин (1.0 мл/мин) с 4 мин выдержки при 95% ACN+0.1% муравьиная кислота; длина волны 305 нм): время удерживания 3.27 мин; чистота 99.9%. Хиральная ВЭЖХ (метод: колонкаChiralpak AD 25 см; изократический режим 78% гексан/22% изопропанол/0.01% диэтиламин в течение 40 мин при 1.00 мл/мин; длина волны 254 нм): время удерживания 28.39 мин (главный энантиомер); 25.20 мин (ожидаемое для отрицательного энантиомера): чистота 99.9% ее. MS (M+H): 288.3, (M+Na): 310.2. Элементный анализ (C13H13D7N4O3): вычислено: С=54.34,Н=7.02, N=19.50; найдено: С=54.33, Н=7.30,N=19.36. Примечательно, что в 1 Н-ЯМР спектре выше отсутствовали следующие пики: пик примерно при 1.19 м.д., что указывало на отсутствие атомов водорода метила в альфа положении к гидроксильной группе; пик примерно при 3.80 м.д., что указывало на отсутствии водорода в метинилгидроксильном положении; и синглетный пик примерно при 7.51 м.д., что указывало на отсутствие водорода в положении 8 пуринового кольца. Из-за наличия мультиплета при 1.36-1.50 м.д. в указанном выше 1 Н-ЯМР спектре определение наличия или отсутствия пика при 1.51 м.д., соответствующего наличию или отсутствию атомов водорода метилена в альфа положении к гидроксильной группе, не было возможным. Пример 13. Альтернативный синтез (S)-8-d1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3,7-диметил-1Hпурин-2,6(3 Н,7 Н)диона (соединение 437(S. Схема 19. Приготовление соединения 437(S)D-Глюконолактон 59 (5 г, 28.09 ммоль) добавляли одной частью в ледяную воду (35 мл, 0-3 С) и перемешивали в течение 10 мин. Свежеприготовленный ледяной раствор NaBD4 (0.294 г, 7.02 ммоль,99%D) в 10 мл воды медленно добавляли в течение 10 мин. Реакция является слегка экзотермической (от 2 до 10 С) и рН реакции равно 7.42. Перемешивание продолжали в течение 30 мин при поддерживании температуры при 0-3 С путем охлаждения. Добавляли уксусную кислоту (0.32 мл, 5.61 ммоль) и перемешивание продолжали еще в течение 30 мин. Реакционную смесь разбавляли 18 мл воды, и раствор нагревали до 25-30 С. В смесь добавлялиKH2PO4 (0.85 г) и рН устанавливали до 7 с помощью 4 М раствора KOH. В полученную смесь добавляли(2.5 г, 8.8 ммоль) соединения 407. Добавляли раствор NAD (15 мг), GDH (2.5 мг), KRED 101 (25 мг) в 12.5 мл 0.1 KH2PO4 буфера. Полученный раствор перемешивали при 25-30 С. РН реакционной смеси поддерживали между 6 и 7 путем добавления по каплям раствора 4 М KOH по мере необходимости. ВЭЖХ контроль реакции показал завершение реакции через 12 ч с превращением 99.97 А%. Добавляли хлорид натрия (12.5 г) и перемешивали в течение 30 мин. Смесь экстрагировали этилацетатом (325 мл). Органический слой разделяли, фильтровали через целит и концентрировали до небольшого объема (5 об.). При концентрировании происходило осаждение твердой фазы продукта. Суспензию нагревали при 40-60 С и добавляли гептаны (20 мл) в течение 10 мин. Суспензию перемешивали в течение ночи при 2025 С и фильтровали. Сырой кек высушивали при 50 С в течение 12 ч для получения соединения 437(S) в виде белого твердого вещества (2.12 г, выход 85%). Чистоту продукта определяли как 99.5 А% с помощью ВЭЖХ анализа. Один энантиомер наблюдали с помощью хиральной ВЭЖХ. Внедрение дейтерия в положении 5 метина составило 95% D. ВЭЖХ (метод: колонка Waters Symmetry 4.650 мм, 3.5 мкм,С 18- градиентный режим: 15% МеОН+85% 0.1% муравьиная кислота в воде в течение 5 мин (1.25 мл/мин), наращивание до 80% МеОН+20% 0.1% муравьиная кислота в воде в течение 5 мин, наращивание до 15% МеОН+85% 0.1% муравьиная кислота в воде в течение 6 с с последующим выдерживанием в течение 3.9 мин при 15% МеОН+85% 0.1% муравьиная кислота в воде; длина волны: 274 нм): чистота 99.5%. Хиральная ВЭЖХ (метод: колонка Chiralpak AD-H 25 см; изократический режим 75% нгептан/25% изопропанол в течение 25 мин при 1.25 мл/мин; длина волны 274 нм): время удерживания 17.56 мин (главный энантиомер); 15.5 мин (ожидаемое для отрицательного энантиомера): ее чистота 99.95%. Пример 14. Альтернативный синтез (R)-8-d1-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3,7-диметил-1Hпурин-2,6(3 Н,7H)диона (соединение 437(R.D-Глюконолактон 59 (5 г, 28.09 ммоль) добавляли одной частью в ледяную воду (35 мл, 0-3 С) и перемешивали в течение 10 мин. Свежеприготовленный ледяной раствор NaBD4 (0.294 г, 7.02 ммоль,99%D) в 10 мл воды добавляли медленно в течение 10 мин. Реакция является слегка экзотермической (от 2 до 10 С) и рН равно 7.42. Перемешивание продолжали в течение 30 мин при поддержании температуры при 0-3 С путем охлаждения. Добавляли уксусную кислоту (0.32 мл, 5.61 ммоль) и перемешивание продолжали еще в течение 30 мин. Реакционную смесь разбавляли 18 мл воды, и раствор нагревали до 25-30 С. В смесь добавлялиKH2PO4 (0.85 г) и рН устанавливали до 7 с помощью 4 М раствора KOH. В этот раствор добавляли 2.5 гKH2PO4 буфера. Полученный раствор перемешивали при 25-30 С. РН реакционной смеси поддерживали между 6 и 7 путем добавления по каплям раствора 4 М KOH. Реакцию контролировали с помощью ВЭЖХ и завершали через 12 ч с превращением 99.97% по данным ВЭЖХ. Добавляли хлорид натрия(12.5 г) и перемешивали в течение 30 мин. Смесь эстрагировали этилацетатом (325 мл). Органический слой разделяли, фильтровали через целит и концентрировали до небольшого объема (5 об.), при этом происходило осаждение твердой фазы продукта. В суспензию (при 40-60 С) добавляли гептаны (20 мл) в течение 10 мин. Суспензию перемешивали в течение ночи при 20-25 С и фильтровали. Сырой кек высушивали при 50 С в течение 12 ч для получения 437(R) в виде белого твердого вещества. (2.12 г, выход 85%). Продукт был выделен с чистотой 99.95% по данным ВЭЖХ и являлся единственным энантиомером по данным хиральной ВЭЖХ. Пример 17. Синтез 1-(4,4,6,6,6-d5-5-гидроксигексил)-3,7-диметил-8-d-1H-пурин-2,6(3H,7H)диона (соединение 421). Схема 21. Приготовление соединений 421, 421(R) и 421(S) Синтез 1-(4,4,6,6,6-d5-5-гидроксигексил)-3,7-диметил-8-d-1H-пурин-2,6(3H,7H)диона (соединение 421). Согласно такой же общей методике, как для синтеза соединения 437 в примере 11 выше, соединение 407 (см. пример 10) обрабатывали NaBH4 в EtOD и экстрагировали CH2Cl2 для получения соединения 421. Пример 18. Хиральное разделение (R)-1-(4,4,6,6,6-d5-5-гидроксигексил)-3,7-диметил-8-d-1H-пурин 2,6(3H,7H)диона (соединение 421(R и (S)-1-(4,4,6,6,6-d5-5-гидроксигексил)-3,7-диметил-8-d-1H-пурин 2,6(3H,7H)диона (соединение 421(S. Разделение энантиомеров 421(R) и 421(S) из соединения 421. Часть рацемического соединения 421, полученного как описано выше, разделяли таким же способом, как рацемическое соединение 437(см. пример 12) для получения разделенных энантиомеров, соединения 421(R) (560 мг) и соединения 421(S) (520 мг). А) (R)-1-(4,4,6,6,6-d5-5-гидроксигексил)-3,7-диметил-8-d-1H-пурин-2,6(3H,7H)дион (соединение 421(R. 1ACN+0.1% муравьиная кислота за 14 мин (1.0 мл/мин) с 4 мин выдержки при 95% ACN; длина волны 254 нм): время удерживания 3.33 мин; чистота 99.9%. Хиральная ВЭЖХ (метод: колонка Chiralpak AD 25 см; изократический режим 78% гексан/22% изопропанол/0.1 % диэтиламин в течение 40 мин при 1.00 мл/мин; длина волны 254 нм): время удерживания 24.77 мин (R энантиомер), 28.16 мин (ожидаемое для S энантиомера); ее чистота 99.9%. MS (M+H-H2O): 269.1; (М+Н): 287.1; (M+Na): 309.3. Элементный анализ (C13H14D6N4O3): расчетное: С=54.53, Н=7.04, N=19.57; обнаружено: С=54.44, Н=7.18, N=19.32. В) (S)-1-(4,4,6,6,6-d5-5-гидроксигексил)-3,7-диметил-8-d-1H-пурин-2,6(3H,7H)-дион (соединение 421(S.ACN+0.1% муравьиная кислота за 14 мин (1.0 мл/мин) с 4 мин выдержкой 95% ACN; длина волны 254 нм): время удерживания 3.34 мин; чистота 99.9%. Хиральная ВЭЖХ (метод: колонка Chiralpak AD 25 см; изократический режим: 78% гексан/22% изопропанол/0.1% диэтиламин в течение 40 мин при 1.00 мл/мин; длина волны 254 нм): время удерживания 28.16 мин (S энантиомер), 24.77 мин (ожидаемое для R энантиомера); ее чистота 99.9%. MS (М+Н-Н 2 О): 269.1; (М+Н): 287.1; (M+Na): 309.3. Элементный анализ (C13H14D6N4O3): расчетное: С=54.53, Н=7.04, N=19.57; обнаружено: С=54.54, Н=7.18, N=19.31. Примечательно, что в 1H-ЯМР-спектре обоих 421(R) и 421(S) отсутствовал пик примерно при 7.51 м.д., что указывало на отсутствии водорода в положении 2 на имидазольной кольцевой системе. Альтернативное приготовление 421 (R)KH2PO4 буфере и поддерживали температуру реакции 25-30 С. Добавляли 1 мл метил-/-бутиловый эфир(МТВЕ). РН реакционной смеси поддерживали между 6 и 7, добавляя по каплям 4 М раствор KOH. Реакцию контролировали с использованием ВЭЖХ и завершали реакцию с превращением 99.87 А% через 29 ч по данным ВЭЖХ. Добавляли хлорид натрия (2.5 г, 5 wt) и перемешивали в течение 20 мин. Реакционную смесь экстрагировали этилацетатом (315 мл). Органический слой разделяли, фильтровали через слой целита и концентрировали до небольшого объема (5 об.) и твердый продукт осаждали. В суспензию добавляли гептаны (5 мл) (при 40-60 С) в течение 5 мин. Суспензию перемешивали при 20-25 С и фильтровали. Сырой кек высушивали при 50 С в течение 12 ч для получения 421(R) в виде белого твердого вещества (0.422 г, 84% выход). Выделенный продукт имел чистоту 99.5% по данным ВЭЖХ, и содержал один энантиомер по данным хиральной ВЭЖХ. Пример 19. Синтез -1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3,7-диметил-1H-пурин-2,6(3H,7H)диона Синтез -1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3,7-диметил-1H-пурин-2,6(3 Н,7 Н)диона (соединение 137). Соединение 437 (560 мг, приблизительно 2 ммоль, см. пример 11) перемешивали с K2CO3 (270 мг, 2 ммоль) в воде (10 мл). Смесь нагревали при 120-130 С для получения прозрачного раствора в течение ночи. Раствор экстрагировали CH2Cl2 (150 мл, 220 мл), и раствор CH2Cl2 сушили (Na2SO4) и фильтровали. После удаления растворителя твердое вещество перемешивали с K2CO3 (140 мг, 1 ммоль) в воде (10 мл) и нагревали в течение ночи, как указано выше, для обеспечения полного обмена дейтерия на водород. После экстрагирования CH2Cl2 (150 мл, 220 мл) раствор CH2Cl2 сушили (Na2SO4), фильтровали и концентрировали. Сырой продукт очищали хроматографией на силикагеле, элюируя 2-3% МеОН/CH2Cl2 для получения 480 мг (86%) 137. ВЭЖХ (метод: колонка Zorbax, 4.650 мм, SB-Aq, 3.5 мкм; градиентный режим: 2-98% ACN+0.1% муравьиная кислота за 6.0 мин в MSD в ESI положительном режиме; 0.63 мл/мин; длина волны 254 нм): время удерживания 2.51 мин; чистота 98.7%. MS(M+H): 287.1; (M+Na): 309.0. В целом, любое соединение изобретения, имеющее группу может быть затем конвертировано в соединение изобретения, имеющее такую же структуру, за исключением имеющего группу путем обработки подходящим основанием и источником протонов, таким как вода. Пример 20. Синтез (R)-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3,7-диметил-1H-пурин-2,6(3H,7H)диона Синтез (R)-1-(4,4,5,6,6,6-d6-5-Гидроксигексил)-3,7-диметил-1H-пурин-2,6(3 Н,7 Н)диона (соединение 137(R. Раствор 437(R) (650 мг, 2.26 ммоль, см. пример 12) и K2CO3 (320 мг, 2.3 ммоль) в воде (40 мл) нагревали при 110 С (температура ванны) в течение 26 ч. Раствор концентрировали до сухого состояния,повторно растворяли в воде (30 мл) и нагревали до 100 С еще в течение 6 ч. После охлаждения до комнатной температуры раствор экстрагировали CH2Cl2 (450 мл). Органический раствор сушили (Na2SO4),фильтровали, концентрировали, затем высушивали в вакууме для получения 565 мг 137(R) в виде грязнобелого твердого вещества. 1 Н-ЯМР (300 МГц, CDCl3):1.38-1.48 (m, 2 Н), 1.64-1.72 (m, 3 Н), 3.58 (s, 3H), 3.99 (d, J=0.5, 3 Н),4.02 (t, J=7.4, 2 Н), 7.51 (d, J=0.6, 1H). 13 С-ЯМР (75 МГц, CDCl3):22.65, 27.84, 29.71, 33.61, 41.13, 107.67,141.43, 148.73, 151.50, 155.37. ВЭЖХ (метод: колонка Waters Atlantis Т 3, 2.150 мм, 3 мкм, C18-RP; градиентный режим 5-95% ACN+0.1% муравьиная кислота за 14 мин (1.0 мл/мин) с 4 мин выдержкой при 95% ACN; длина волны 305 нм): время удерживания 3.30 мин; выход 99.9%. MS (M+H-Н 2 О): 269.4;(М+Н): 287.1; (M+Na): 309.3. Элементный анализ (C13H14D6NO3): расчетное: С=54.53, Н=7.04, N=19.57; обнаружено: С=54.43, Н=6.93, N=19.44. Альтернативный синтез (R)-1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3,7-диметил-1H-пурин-2,6(3 Н,7 Н)диона (соединение 137(R. В 3- горлую RB колбу емкостью 3 л загружали соединение 437(R) (100 г) с последующей водой (1.0 л) и K2CO3 (0.25 экв). Реакционную смесь нагревали до 805 С и контролировали методом 1 Н ЯМР. Реакцию завершали через 24 ч и обрабатывали через 65 ч. Полученный продукт экстрагировали три разаEtOAc и твердые продукты из трех экстракций объединяли и повторно растворяли в 5 объемах EtOAc при 60-65 С. Добавляли н-гептан (5.5 об.) при 60-65 С в течение 15 мин и охлаждали до 20 С в течение ночи (16 ч). Суспензию фильтровали, и сырой кек отмывали н-гептаном (21 об.) для получения соединения 137(R) после высушивания при 40-50 С. Всего было выделено 92.4 г соединения 137 (R). Чистота по данным ВЭЖХ составила 99.92% (AUC) и хиральная селективность составила 100% в отношении "S" энантиомера. 1 Н ЯМР анализ показал 99.2% "Н" в положении 8 в 3,4,5,7-тетрагидро-1H-пурин-2,6 дионовом кольце и 99.4% "D" в метильном положении. Пример 21. Синтез (S)- 1-(4,4,5,6,6,6-d6-5-гидроксигексил)-3,7-диметил-1H-пурин-2,6(3H,7H)диона Согласно такой же общей методике, как для синтеза соединения 137(R) в примере 20 выше, часть соединения 437(S) (см. пример 12) конвертировали в 310 мг соединения 137(S). 1 Н-ЯМР (300 МГц, CDCl3):1.36-1.45 (m, 2H), 1.62 (s, 1H), 1.64-1.74 (m, 2H), 3.58 (s, 3 Н), 3.99 (s,3 Н), 4.02 (t, J=7.3, 2H), 7.50 (s, 1H). 13 С-ЯМР (75 МГц, CDCl3):23.05, 28.24, 30.07, 33.95, 41.49, 107.92, 141.57, 148.93, 151.68, 155.53. ВЭЖХ (метод: колонка Waters Atlantis Т 3, 2.150 мм, 3 мкм, C18-RP; градиентный режим: 5-95%ACN+0.1% муравьиная кислота за 14 мин (1.0 мл/мин) с 4 мин выдержкой при 95% ACN; длина волны 305 нм): время удерживания 3.34 мин; чистота 99.6%. MS (М+Н-Н 2 О): 269.1; (М+Н): 287.1; (M+Na): 309.3. Элементный анализ (C13H14D6N4O3): расчетное: С=54.53, Н=7.04, N=19.57; обнаружено: С=54.71,Н=7.28, N=19.53. Примечательно, что в 1 Н-ЯМР спектре 137(S) отсутствовал пик примерно при 3.80 м.д., что указывало на отсутствие водорода в метинилгидроксильном положении. Пример 22. Синтез -1-(4,4,6,6,6-d5-5-гидроксигексил)-3,7-диметил-1H-пурин-2,6(3H,7H)диона
МПК / Метки
МПК: A01N 43/90, A61K 31/522
Метки: применение, дейтерированные, ксантина, производные
Код ссылки
<a href="https://eas.patents.su/30-23809-dejjterirovannye-proizvodnye-ksantina-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Дейтерированные производные ксантина и их применение</a>
Предыдущий патент: Строительная плита
Следующий патент: Предмет одежды
Случайный патент: Устройство и способ загрузки твердых частиц в камеру












