Дейтерированные производные 1,3-бензодиоксола
Формула / Реферат
1. Выделенное соединение формулы (I)
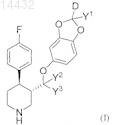
или его соль; или пролекарство или соль его пролекарства; или его гидрат, сольват или полиморф; в котором
D-является дейтерием;
каждый Y независимо выбран из дейтерия или водорода;
каждый водород независимо необязательно замещен дейтерием и
каждый углерод независимо необязательно замещен 13С.
2. Соединение или его пролекарство по п.1, в котором Y1является дейтерием.
3. Соединение по п.2, в котором до 4 атомов водорода замещены дейтерием.
4. Соединение по п.1 или 2, в котором по крайней мере один из Y2и Y3 независимо является дейтерием.
5. Соединение по п.1 или 2, в котором как Y2, так и Y3 независимо являются дейтерием.
6. Соединение, выбранное из любого одного
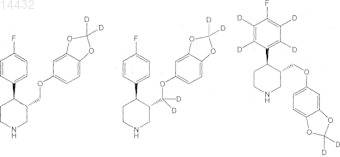
или его соли; или его пролекарства или соли его пролекарства; или его гидрата, сольвата или полиморфа; в котором все атомы водорода и все атомы углерода представлены в их природном изотопном составе.
7. Соединение или пролекарство по любому одному из пп.1-6, в котором соль соединения или его пролекарства является фармацевтически приемлемой солью.
8. Композиция, включающая эффективное количество соединения формулы (I) или фармацевтически приемлемой его соли; или его пролекарства или фармацевтически приемлемой соли его пролекарства; или его гидрата, сольвата или полиморфа и приемлемый носитель.
9. Использование соединения формулы (I) в производстве лекарственного препарата для лечения депрессии, обсессивно-компульсивного расстройства, генерализованной тревожности, посттравматического стресса, глубокой депрессии, панического расстройства, социофобии, предменструального синдрома, сердечных расстройств, несердечной грудной боли, курения, чтобы вызвать прекращение или предотвратить рецидив; состояния снижения активации тромбоцитов, алкоголизма и алкогольной зависимости; психиатрических синдромов, включая гнев, потерю восприимчивости, и отсутствие ментальной и физической энергии; дисфорического расстройства поздней лютеиновой фазы, преждевременной эякуляции, старческого слабоумия, ожирения, болезни Паркинсона, аффективной агрессии собак, роста раковых клеток, остеопороза, кожных заболеваний или расстройств, таких как гиперпролиферативные или воспалительные кожные болезни, или преждевременного женского оргазма.
10. Диагностический набор, включающий соединение формулы (I) или его соль в запаянной емкости и инструкции по использованию названного соединения для определения концентрации соединения 1 в биологическом образце.
11. Диагностический набор, включающий соединение 1 и источник фермента, превращающегося в процессе обмена веществ, в отдельных емкостях.
12. Соединение формулы (II)
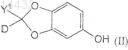
где D является дейтерием;
Y1 независимо выбран из водорода или дейтерия;
каждый углеродный атом независимо необязательно замещен 13С и
каждый водородный атом независимо необязательно замещен дейтерием.
13. Соединение по п.12, где Y1 является дейтерием.
14. Соединение по п.12, где Y1 является дейтерием и каждый водород, непосредственно связанный с ароматическим кольцом, является дейтерием.
15. Соединение по п.12, в котором все водородные атомы и все углеродные атомы присутствуют в их природном изотопном составе.
16. Соединение формулы (III)
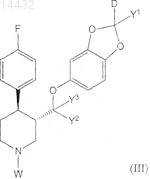
где D является дейтерием;
каждый из Y1-3 независимо выбран из водорода или дейтерия;
W является удаляемой N-защитной группой;
каждый углеродный атом независимо необязательно замещен 13С и
каждый водородный атом независимо необязательно замещен дейтерием.
17. Соединение по п.16, где Y1 является дейтерием.
18. Соединение по п.16, где по крайней мере один по крайней мере из одного из Y1и Y2 независимо является дейтерием.
19. Соединение по п.16, где как Y1, так и Y2независимо являются дейтерием.
20. Соединение по п.16, где каждый из Y1, Y2и Y3 независимо является дейтерием.
21. Соединение по п.16, где до 4 атомов водорода замещены дейтерием.
22. Соединение по любому одному из пп.16-21, в котором W выбирается из следующего: метил, бензил, метилкарбамат, этилкарбамат, винилкарбамат, фенилкарбамат, бензилкарбамат и трет-бутилкарбамат.
Текст
Настоящее изобретение относится к изотопологу соединения 1, замещенного дейтерием на метиленовом атоме углерода бензодиоксольного кольца. Изотопологи данного изобретения являются селективными ингибиторами обратного захвата серотонина (SSRIs) и обладают уникальными биофармацевтическими и метаболическими свойствами по сравнению с соединением 1. Они также могут быть использованы для точного определения концентрации соединения 1 в биологических жидкостях и для определения метаболических типов соединения 1 и его изотопологов. Изобретение также относится к композициям, включающим эти дейтерированные изотопологи и способы лечения заболеваний и состояний, которые обусловлены повышенной неврональной трансмиссией серотонина, как сами по себе, так и в комбинации с дополнительными агентами. 014432 Техническая область изобретения Настоящее изобретение связано с новыми изотопологами соединения 1, его приемлемыми кислотно-аддитивными солями, сольватами, гидратами и их полиморфами, с замещенным на дейтерий атомом водорода на метиленовом атоме углерода, находящимся между атомами кислорода в бензодиоксольном кольце, и выборочно замещенными добавочными атомами дейтерия и 13 С в положении обычных атомов водорода и 12 С соответственно. Соединения данного изобретения являются селективными ингибиторами обратного захвата серотонина (SSRIs), являются обедненными субстратами метаболизма при участии цитохрома 2D6 и обладают уникальными фармакокинетическими и биофармацевтическими свойствами по сравнению с соответствующими неизотопозамещенными соединениями. Изобретение также относится к композициям, включающим соединение настоящего изобретения, и использованию таких композиций в методах лечения заболеваний и состояний, успешно излечиваемых SSRIs, в особенности связанных с общим депрессивным нарушением, обсессивно-компульсивным нарушением, паническим расстройством, социальным тревожным расстройством, генерализированным тревожным расстройством, посттравматическим стрессом и предменструальным дисфорическим расстройством. Изобретение, кроме того, относится к методам использования соединения данного изобретения для определения концентраций соединения 1, особенно в биологических жидкостях, и определения особенностей метаболизма соединения 1. Уровень техники Соединение 1 описываемое химически разными наименованиями, такими как (-)-транс-4R-(4'-фторфенил)-3S-[(3',4'метилендиоксифенокси)метил]пиперидин;(3S,4R)-3-бензо[d][1,3]диоксол-5-илокси)метил)-4-(4 фторфенил)пиперидин; транс-(-)-3-[(1,3-бензодиоксол-5-илокси)метил]-4-(4-фторфенил)пиперидин, и его фармацевтически приемлемые дополнительные соли, сольваты, гидраты и их полиморфы, которые известны как пригодные избирательные ингибиторы обратного захвата серотонина (SSRIs). Это соединение и фармацевтические композиции, содержащие его, являются полезными при лечении депрессии, обсессивно-компульсивного нарушения, генерализированного тревожного расстройства, посттравматического стресса, большой депрессии, панического расстройства, социофобии, предменструального синдрома, кардиологических расстройств, некардиологической боли в груди, курения (как вызывающее прекращение, так и предотвращающее рецидив), состояний снижения активации тромбоцитов, алкоголизма и алкогольной зависимости, психиатрических синдромов (включающих гнев, потерю чувствительности,недостаток умственной и физической энергии), дисфорического расстройства поздней лютеиновой фазы,преждевременной эякуляции, старческого слабоумия, ожирения, болезни Паркинсона и собачьего бешенства. См. US Food and Drag Administration product label for New Drug Application (NDA)020031,020710 и 020936; Christensen J.A. and Squires R.F., патент США US 4007196, to Ferrosan; Lassen J.B., патент США US 4745122 to Ferrosan; Johnson A.M., патент США US 5371092 to Beecham Group; CrenshawSmithKline Beecham. Кроме того, найдено, что использование соединения 1 включает способы подавления роста раковых клеток, стимуляцию остеогенеза путем стимуляции остеобластов, лечение дерматологических заболеваний или нарушений, таких как гиперпролиферативные или воспалительные кожные заболевания, и лечение преждевременного женского оргазма: см. заявки на патент США 20040127573 (Telerman A. et al.); 20040127573 (Stashenko P. и Battaglino R.); 20050013853 и 20040029860 (Gil-Ad I. и Weizman А.) и 20050054688 (May K.E. и Quinn P.). Определения и характеристики этих заболеваний известны квалифицированным практикующим специалистам и дополнительно описываются, например, в вышеуказанных патентах, заявках на патенты и ссылках, содержащихся в них. См. также Harrison's Principles of Internal Medicine 16th Edition, Rasperal. Eds., 2004, W.B. Saunders. Комбинация соединения 1 с дополнительными агентами продлевает или усиливает их пользу в лечении или предотвращении депрессии, гипертензии, генерализированного тревожного расстройства, фобий, синдрома посттравматического стресса, нарушения межличностного общения, сексуальной дисфункции, расстройства пищевого поведения (включающие булимию, нервно-психическую анорексию и компульсивное переедание), ожирения, химических зависимостей, гистаминовой головной боли, мигрени, боли (включая невропатическую боль, диабетическую нефропатию, послеоперационную боль, психогенные болевые нарушения и хронический болевой синдром), болезни Альцгеймера, навязчивого синдрома, панического расстройства с или без агорафобии, нарушения памяти, болезни Паркинсона, эндокринных нарушений, спазмов сосудов, мозжечковой атаксии, расстройств желудочно-кишечного тракта,негативных симптомов шизофрении, предменструального синдрома, синдрома при фибромиалгии, недержания мочи (включая стрессовое недержание), синдрома Туретта, трихотилломании, клептомании,импотенции, рака, хронической судорожной гемикрании и головной боли у млекопитающих, расстройств дыхания во время сна, возрастных когнитивных расстройств, инсульта, травмы головы, нейродегенеративных заболеваний, шизофрении, страха, агрессии, стресса, нарушений терморегуляции, респираторных заболеваний, биполярного расстройства, психозов, нарушений сна, мании (включая острые состояния), расстройства мочевого пузыря, мочеполового расстройства, кашля, рвоты, тошноты, психических расстройств, таких как паранойя и маниакально-депрессивный психоз, тика, кардиомиопатии при диабете, диабетической ринопатии, катаракты, инфаркта миокарда, длительного утомления, хронической усталости, синдрома хронической усталости, преждевременной эякуляции, дисфории, послеродовой депрессии, социофобии, агрессивного поведения, при нарушениях мотивации, пограничного личностного расстройства, синдрома нарушения внимания без гиперактивности, синдрома Шая-Дрейджера, ишемии головного мозга, травмы спинного мозга, хореи Гентингтона, бокового амиотрофического склероза, слабоумия, вызванного СПИДом, мышечных спазмов, конвульсий, перинатальной гипоксии, гипоксии, остановки сердца, гипогликемического нейронного поражения, поражения зрения и ретинопатии, отека мозга, поздней дискинезии, черепно-мозговой недостаточности, являющейся результатом кардиотонического средства и пересадки, аффективных расстройств, расстройств настроения, агорафобии без панического расстройства и острых стрессов. Эти дополнительные агенты также применимы для уменьшения побочных эффектов соединения 1, улучшения или усиления его действия, или увеличения продолжительности его фармакологического действия. Патенты США 5776969 (James S.P.) to Eli Lilly; 5877171(Wrobleski M.L.) to Schering Corporation; и 6894053 (Childers W.E. et al.) to Wyeth. Кроме того, описаны дополнительные комбинации соединения 1 с другими компонентами, продлевающими или усиливающими их пользу при лечении или предупреждении аутизма, дискинезии, заболевания вилочковой железы, генетического или вызванного внешними условиями ожирения, поликистоза яичников, краниофарингиомы, синдрома Прадера-Вилли, синдрома Фрелиха, диабета II типа, дефицита гормона роста, синдрома Тернера, провоспалительной секреции или образования цитокина, десинхроноза, бессонницы, повышенной сонливости, ночного энуреза, синдрома беспокойных ног, вазоокклюзивных осложнений, гипергликемии, гиперинсулинемии, гиперлипидемии, гипертриглицеридемии, диабета, резистентности к инсулину, нарушенного метаболизма глюкозы, заболеваний, связанных с нарушением толерантности к глюкозе (IGT), заболеваний, связанных с нарушением уровня глюкозы натощак, гломерулосклероза, синдрома X, ишемической болезни сердца, стенокардии, васкулярного рестеноза, эндотелиальной дисфункции, ухудшения эластичности сосудов, острой сердечной недостаточности или для усиления воздействия соединения 1. Заявки на патент США US 20020032197, 20020002137,20020086865, 20020077323, 20020103249, 20020094960, 20030109544, 20030092770, 20030144270,-2 014432 20030158173, 20030139395, 20030055070, 20030139429, 20040044005, 20010014678, 20040044005,20030235631, 20030027817, 20030229001, 20030212060, 20040132797, 20040204469, 20040204401,20040171664, 20040229940, 20040229941, 20040229942, 200402299115, 20040224943, 20040229866,20040224942, 20040220153, 20040229849, 20050069596, 20050059654, 20050014848, 20050026915,20050026946, 20050143350, 20020035105, 20050143314, 20050137208, 20040010035, 20040013741,20050136127, 20050119248, 20050119160, 20050085477, 20050085475, 20010003749, 20050009815,20040248956, 20050014786, 20050009870, 20050054659, 20050143381, 20050080087, 20050070577 и 20050080084. Соединение 1 охарактеризовано in vitro исследованиями связывания с корковыми мембранами у крыс, где меченное радиоактивным изотопом соединение 1, как было обнаружено, связывается с единственным насыщаемым сайтом с высокой аффинностью. См., например, Habert E. et al., Eur. J. Pharmacol. 1985, 118: 107. Соединение 1 также было охарактеризовано целым рядом модельных систем на животных. Например, в моделях депрессии, ожирения и страха, лечение соединением 1 в точности приводило к результатам, которые коррелировали с клиническими эффектами в человеческом организме. См., например, Akegawa Y. et al. Methods Find Exp Clin Pharmacol, 1999, 21: 599; Lassen J.B., патент США US 4745122 toFerrosan; и Hascoet M. et al., Pharmacol. Biochem. Behav. 2000, 65: 339. В клинических исследованиях на человеке соединение 1 проявило хорошую переносимость и статистическую эффективность у пациентов, страдающих глубокой депрессией, легкой депрессией и дистимией, навязчивым неврозом, паническим расстройством, социальным тревожным расстройством, генерализированным тревожным расстройством и посттравматическим стрессовым расстройством. Соединение 1 является высокоэффективным, например, показывая лучшие результаты как антидепрессант по сравнению с другими соединениями с аналогичным механизмом действия в ряде исследований с помощью прямого сравнения. См., например, патенты США US Food and Drug Administration product label forNew Drug Application (NDA)020031, 020710 и 020936; Wagstaff A.J. et al., Drugs, 2002, 62: 655; Katona С. and Livingston G., J. Affect. Disord. 2002, 69: 47. После перорального приема человеком соединение 1 хорошо абсорбируется, после чего оно подвергается долгому окислительному метаболизму II фазы. Его основной путь метаболизма протекает по окислительному расщеплению бензодиоксольного кольца с образованием пирокатехинового метаболита. Последующий метаболизм II фазы включает в основном метилирование, глюкуронидацию и сульфатирование. См. схему I. Измерения in vitro показали, что эти метаболиты обладают 2% активности соединения 1 и вследствие этого не способствуют фармакодинамически его действию. В течение десятидневного периода после перорального введения здоровым добровольцам 30 мг дозы раствора, меченного радиоактивным изотопом соединения 1, приблизительно 64% соединения 1, как было обнаружено, было выведено с мочой, включая 2% в виде исходного соединения и 62% в виде метаболитов. Около 36% было выведено с фекалиями, главным образом, в виде метаболитов и менее чем 1% в виде исходного соединения в течение этого периода. Управление по продовольствию и лекарствам США одобрил марку NDA020031 от 01.12.2005. Расщепление бензодиоксольного кольца осуществляется в значительной мере цитохромом 2D6(CYP2D6), который действует как окислитель с высоким сродством, но с относительно низкой функциональной активностью. Соединение 1 также является сильнодействующим инактиватором CYP2D6, действующим по механизму, возможно через образование карбенового интермедиата на стадии метаболического окисления или через образование орто-хинона и последующей реакции с активным центром нуклеофилов. Bertelsen K.M. et al., Drug Metab. Dispos. 2003, 31: 289; Murray M., Curr. Drug Metab. 2000 1: 67;Montellano P.R. ed), pp. 305-366, 1995, Plenum Press, New York; Wu et al., Biochem. Pharmacol. 1997, 53: 1605; Bolton J.L. et al., 1994, Chem. Res. Toxicol. 7: 443. Клинически, эта инактивация, основанная на механизме действия, проявляется несколькими способами. Например, соединение 1 в значительной степени показывает нелинейную фармакокинетику, при этом состояние равновесия в несколько раз превосходит уровни, ожидаемые от однократной дозы, что является результатом автоингибирования его метаболизма. Соединение 1 также вызывает дозозависимое,очень значительное уменьшение активности CYP2D6. CYP2D6 охватывает основной путь метаболизма ряда других клинически значимых лекарственных средств, включая, например, противораковые агенты,другие антидепрессанты и антипсихотические средства; также как и наркотики, такие как широко известный наркотик "Экстази". Дозирование соединения 1 одновременно с этими агентами создает клинически значительное повышение их уровня в крови, приводя к возможности повышения токсичности.Jeppesen U. et al., Eur. J. Clin. Pharmacol. 1996, 51: 73; US FDA approved label for NDA020935, approved 01/12/2005; Laugesen S. et al., Clin Pharmacol Ther. 2005, 77: 312; Jin Y. et al., J. Natl. Cancer Inst. 2005, 97: 30; Joos AAB et al., Pharmacopsychiat. 1997, 30, 266; Segura M. et al., Clin Pharmacokinet. 2005, 44: 649. Соединение 1 является объектом для существенного варьирования среди пациентов. Пациенты, обладающие относительно низкими и относительно высокими уровнями активности CYP2D6, как было показано, имеют существенно различные скорости метаболизма соединения 1, ведущие к приблизитель-3 014432 но трехкратному увеличению продолжительности периода полувыведения у представителей Европейского контингента с недостаточным метаболизмом (НМ) с низкой CYP2D6-опосредованной окислительной эффективностью по сравнению с представителями контингента с протяженным метаболизмом (РМ) с более высокой активностью CYP2D6; Sindrup S.H. et al., Clin. Pharmacol. 1992, 51: 278. Даже при измерении в равновесном состоянии, при котором колебания времени существенно ниже, чем при первичном приеме лекарства, наблюдалась высокая вариабельность соединения 1 у исследуемой популяции (около 30-70% коэффициентов вариации между максимальной и минимальной концентрациями в плазме (Cmax и Cmin) и общим воздействием, измеренным как площадь под кривой концентрация в плазме-времяCYP2D6 является источником существенной вариабельности фармакокинетики ряда лекарственных препаратов благодаря хорошо известным полиморфизмам, приводящим к низкой активности CYP2D6 у значительной части популяции, включая около 2% азиатов и 7-8% кавказцев (Wolf C.R. and Smith G.,IARC Sci. Publ. 1999, 148: 209 (chapter 18); Mura С. et al., Br. J. Clin. Pharmacol. 1993, 35: 161; Shimizu T. etal., Drag Metab. Pharmacokinet. 2003, 18: 48). В частности, различные полиморфизмы CYP2D6 существуют у различных видов рас, и возможно, может существовать даже большая вариабельность у других групп пациентов с различным фармакогеномным фоном. Shimada T. et al., Pharmacogenetics 2001 11: 143. Схема I Поэтому, желательным является создание соединения, обладающего благоприятными активностями соединения 1, но с пониженной метаболической подверженностью CYP2D6, для последующего увеличения его фармакологически эффективной жизни у субъектов с протяженным метаболизмом, уменьшения популяционной фармакокинетической вариабельности и/или уменьшения возможности опасных взаимодействий лекарство-лекарство.-4 014432 Сущность изобретения Настоящее изобретение решает вышеупомянутые задачи путем предоставления выделенного соединения формулы (I) Соединение формулы (I) или его соль; или пролекарство или соль его пролекарства; или гидрат,сольват или его полиморф, гдеD представляет собой дейтерий; каждый Y независимо выбран из дейтерия или водорода; каждый атом водорода независимо выборочно заменен на дейтерий и каждый атом углерода независимо выборочно заменен на 13 С. Соединение формулы (I) понижает эффективность расщепления бензодиоксольного кольца с помощью CY2D6 и благоприятно уменьшает скорость ингибирования основанного на механизме CYP2D6 относительно соединения 1. Это благоприятно уменьшает скорости выведения по сравнению с соединением 1 и создает соответствующее увеличение фармакокинетического периода полувыведения. Пониженное CYP2D6 ингибирование является важным для снижения фармакокинетических взаимодействий между соединением 1 и другими лекарственными препаратами, метаболизируемыми с помощью этого фермента. Это обеспечивает повышенную безопасность по сравнению с соединением 1. В частности, это создавало бы преимущества при лечении сопутствующих заболеваний и использовании комбинаций лекарственных средств, которые являются обычными для пациентов, страдающих от депрессии, тревоги и других психических расстройств. Более того, оно было бы полезным для пациентов, принимающих соединение 1, при лечении различными медицинскими работниками без раскрытия всех своих лекарственных средств каждому из них. Оно было бы также полезным для пациентов, которые принимают лекарства, допускающие злоупотребление, с одновременным приемом соединения 1 без ведома своего врача. Пониженная субстратная эффективность CYP2D6 в метилендиокси-части бензодиоксольного кольца, показанная соединениями данного изобретения, будет в дальнейшем обеспечивать уменьшение фармакокинетической вариабельности среди пациентов, наблюдаемой для соединения 1. Соединения настоящего изобретения, включающие дополнительный дейтерий для замещения водорода на метилендиокси-атоме углерода, показывают дополнительную пользу пониженного метаболизма с помощью других ферментов цитохрома Р 450. Это важно для субъектов с недостаточным метаболизмом соединения 1, где основной метаболический путь соединения 1 протекает, главным образом, путем разрыва бензодиоксольного кольца, вероятно, обусловленного окислительным действием другого цитохромного фермента. Также относительно небольшое число разрывов кольца (завершенное расщепление бензодиоксольного кольца с образованием 4-(4-фторфенил)-3-гидроксиметилпиперидина) наблюдается у субъектов с нормальным метаболизмом, которое может появляться в результате окисления метиленового атома углерода, присоединенного к пиперидиновому кольцу, и может становиться доминирующим, если бензодиоксольное кольцо является метаболически стабилизированным. Поэтому соединения данного изобретения, которые дейтерированы по данному атому углерода, будут также благоприятно воздействовать на скорость расщепления соединения. Соединения данного изобретения и композиции, включающие их, используются для лечения или снижения тяжести расстройств, характеризуемых пониженной серотонин-зависимой неврологической активностью. Предпочтительные применения соединений формулы (I) включают способы использования при лечении депрессии, тревоги, стресса, фобий, паники, дисфории и других психических расстройств и боли. Соединения и композиции данного изобретения также используются в качестве аналитических реагентов для определения концентрации соединения 1 в растворе. "Соединение 1", как используется здесь,относится к соединению, где все атомы водорода и углерода присутствуют в тех изотопных соотношениях, в которых они распространены в природе. Установлено, что встречается некоторое изменение природной изотопной распространенности, зависящей от происхождения химических веществ. Концентрация распространенных в природе стабильных изотопов водорода и углерода, несмотря на это изменение,очень мала и несущественна по отношению к степени стабильного изотопного замещения соединений данного изобретения. См., например, Wada E. and Hanba Y., Seikagaku, 1994, 66: 15; Ganes L.Z. et al.,Comp. Biochem. Physiol. A Mol. Integr. Physiol. 1998, 119: 725.-5 014432 Включение дейтерия вместо водорода, как определено на некоторых примерах, имеет значительный эффект на физиологическую и фармакологическую активность замещенного соединения. Например, Nнитрозамины, замещенные дейтерием, могут проявлять повышенное, пониженное или неизмененное канцерогенное действие, в зависимости от того, где в соединении атом водорода замещен на дейтерий и от идентичности соединений, в которых произведены замещения (Lijinsky W et al., Food Cosmet. Toxicol. 1982, 20: 393; Lijinsky W. et al., JCNI, 1982, 69: 1127). Аналогично, известно как повышение, так и уменьшение бактериальной мутагенности замещенных дейтерием азааминокислот, в зависимости от идентичности аминокислотного производного и места замещения (Mangold J.B. et al., Mutation Res. 1994, 308: 33). Известна пониженная гепатотоксичность определенных дейтерийзамещенных соединений (GordonW.P. et al., Drug Metab. Dispos. 1987, 15: 589; Thompson D.C. et al., Chem. Biol. Interact. 1996, 101: 1). Замещение на дейтерий может влиять на запах соединения (Turin L., Chem. Senses, 1996, 21: 773) и связывание с белками плазмы (Echmann M.L. et al., J. Pharm. Sci. 1962, 51: 66; Cherrah Y. et al., Biomed. Environm. Mass Spectrom. 1987, 14: 653; Cherrah Y. et al., Biochem. Pharmacol. 1988, 37: 1311). Изменения в биораспределении и выведении определенных дейтерийзамещенных соединений предполагает изменения в их распознавании путем активных транспортных механизмов (Zello G.A. et al., Metabolism, 1994,43: 487; Gately S.J. et al., J. Nucl. Med. 1986, 27: 388; Wade D., Chem. Biol. Interact. 1999, 117: 191). Замещение водорода на дейтерий в местах, подверженных окислительному метаболизму, например,с помощью гемсодержащих белков, таких как цитохром Р 450 и пероксидазных ферментов, как известно,в некоторых, но не во всех случаях, создает значительное уменьшение скорости метаболизма благодаря первичному изотопному эффекту разрыва связи С-1 Н по сравнению с С-2 Н связью (см., например,Guengerich F.P. et al., J. Biol. Chem. 2002, 277: 33711; Rraus, J.A. and Guengerich, F.P., J. Biol. Chem. 2005,280: 19496; Mitchell K.H. et al., Proc. Natl. Acad. Sci. USA, 2003, 109: 3784; Nelson S.D. and Trager W.F.,Drag Metab. Dispos. 2003, 31: 1481; Hall L.R. and Hanzlik R.P., J. Biol. Chem. 1990, 265: 12349; Okazaki О.and Guengerich F.P., J. Biol. Chem. 268, 1546; Iwamura S. et al., J. Pharmacobio-Dyn. 1987, 10: 229). Если стадия разрыва связи С-Н ограничена по скорости, можно наблюдать существенный изотопный эффект. Если другие стадии определяют общую скорость реакции, то изотопный эффект может быть несущественным. В случаях, когда лимитирующая по скорости стадия реакции включает регибридизацию присоединяемого атома углерода с sp2 в sp3, замещение на дейтерий часто создает негативный изотопный эффект, повышающий скорость реакции. Введение дейтерия в соединение в месте, подверженном ферментативному окислению, как можно было ожидать, не производит значительных фармакокинетических изменений. См., например, Mamada K. et al., Drug Metab. Dispos. 1986, 14: 509; Streeter A.J. et al., Arch.Toxicol. 1990, 64: 109; Morgan D.S. et al., Int. Arch. Occup. Environ. Health, 1993, 65 (1 Suppl): S139. Хотя введение дейтерия в специфические органические соединения может изменить их фармакологические свойства, общее воздействие и введение дейтерия является безопасным в пределах уровней,потенциально достигаемых путем использования соединений данного изобретения в качестве лекарственных препаратов. Например, весовой процент водорода в организме млекопитающего (приблизительно 9-10%) и распространенность в природе дейтерия (приблизительно 0,015%) показывает, что средний взрослый мужчина в США обычно содержит приблизительно 1,2 г дейтерия (см., например, Harper V.W.CDC Adv. Data 2004 347: 1; www.cdc.gov/nchs/data/ad/ad347.pdf). Более того, было произведено замещение до 15% стандартного водорода на дейтерий, и оно поддерживалось в течение от нескольких дней до нескольких недель у млекопитающих, включая грызунов и собак, с минимальным наблюдаемым отрицательным действием (Czajka D.M. and Finkel A.J., Ann. N.Y.Physiol. 1961, 201: 357). Более высокие концентрации дейтерия, обычно превышающие 20%, могут быть токсичны для животных. Однако, резкая замена такого количества, как 15-23%, водорода на дейтерий в жидкости человека, как было обнаружено, не вызывает токсичности (Blagojevic N. et al. in "DosimetryTreatment Planning for Neutron Capture Therapy", Zamenhof R., Solares G. and Harling О. Eds. 1994. Advanced Medical Publishing, Madison WI, pp. 125-134). Эти авторы составили клинический протокол своей практики, включающей пероральное введение до 1 л в день дейтерированной воды (D2O) в течение периода до 5 дней, за которым следовало внутривенное введение 4 л дейтерированной воды перед радиационными исследованиями; эта дейтерированная вода легко включается по всему телу за пределами жидкостного пространства, в том числе в глюкозу и гликоген, жиры и холестерин, и, таким образом, в клеточные стенки (например, см. Diabetes Metab. 1997, 23: 251). В человеке весом 70 кг 15% замещенного на дейтерий водорода в жидком пространстве соответствуют включению приблизительно 1 кг дейтерия или эквивалентно приблизительно 5 кг дейтерированной воды. Эти количества составляют порядки величины за пределами представляемого уровня введения любых дейтерийсодержащих соединений данного изобретения. Следы дейтерия, включая в качестве дейтерий-меченых лекарственных веществ и доз, в некоторых случаях многократных, от тысяч до десятков тысяч миллиграммов дейтерированной воды, также используются здоровыми людьми любого возраста, включая новорожденных и беременных женщин, без подтвержденных инцидентов (например, Pons G. and Rey E., Pediatrics, 1999, 104: 633; Coward W.A. et al.,-6 014432MacLennan A.H. et al., Am. J. Obstet. Gynecol. 1981, 139: 948). Таким образом, очевидно, что любой выделенный дейтерий, например, в процессе метаболизма соединений данного изобретения, не представляет никакого риска для здоровья. Соединения данного изобретения являются менее эффективными субстратами для CYP2D6, чем соединение 1, и поэтому показывают пониженную скорость окислительного метаболизма и пониженный механизм действия инактивации CYP2D. Это понижает степень нежелательных метаболических взаимодействий лекарство-лекарство, наблюдаемых у соединения 1, понижая необходимость регулирования дозы других лекарственных препаратов, принимаемых пациентами, которые лечатся этими средствами. Измененные свойства соединений данного изобретения не лишают их способности связываться со своей белковой целью. Это происходит из-за того, что такое связывание в первую очередь зависит от нековалентного связывания между белком и ингибитором, на который изотопное замещение может действовать как позитивно, так и негативно, в зависимости от специфического замещения, которое имеет место, и любые негативные воздействия, которые может иметь тяжелый атом данного изобретения, на в высокой степени оптимизированное нековалентное связывание между соединениями формулы (I) и белками захвата серотонина, будут относительно небольшими. Основные факторы, участвующие в нековалентном распознавании небольших молекул белками, и сила связывания между ними включают силы Ван-дер-Ваальса, водородные связи, ионные связи, молекулярную реорганизацию, энергию десольватации небольшой молекулы, гидрофобные взаимодействия и, в конкретных примерах, энергию замещения предсуществующих лигандов связывания. См., например, GoodmanGilman's The Pharmacological Basisof Therapeutics, Tenth Edition, Hardman J.G. and Limbird L.E., eds. McGraw-Hill, 2001 и The Organic Chemistry of Drug Design and Drug Action, Silverman RB, 2004, Academic Press. Соединения данного изобретения обладают молекулярной топологией, которая очень схожа с соединением 1, так как обмен дейтерия на водород не изменяет молекулярную форму, и обмен 13 С на 12 С не влияет на конформацию (Holtzer M.E. et al., Biophys. J. 2001 80: 939). Замещение дейтерия вызывает небольшое уменьшение Ван-дер-Ваальсового радиуса (Wade D., Chem. Biol. Interact. 1999, 117: 191); но заявитель полагает, что такое уменьшение не понизит в значительной степени сродство к связыванию между молекулой и ее рецептором. Более того, немного меньший размер дейтерированных соединений данного изобретения предотвращает возможность их участия в возникающих стерических столкновениях с белком связывания, по отношению к соединению 1. Ни дейтерий, ни атомы 13 С в соединениях данного изобретения не оказывают в значительной степени содействия водородному связыванию или ионным взаимодействиям с белковыми рецепторами. Это происходит потому, что основная водородная связь и ионные взаимодействия, образуемые соединением 1 с белками захвата серотонина, осуществляются посредством атомов кислорода, азота и аминсвязывающего водорода в составе соединения 1. Любые атомы дейтерия, присоединенные к азоту в амине, будут быстро обмениваться на протоны растворителя при физиологических условиях. Белковая реорганизация или движение боковой цепи будут идентичными у соединения данного изобретения и соединения 1. Энергия десольватации соединения данного изобретения будет эквивалентна или меньше, чем энергия десольватации соединения 1, приводя к нейтральному или увеличенному сродству к связыванию с рецептором; Turowski M. et al., J. Am. Chem. Soc. 2003 125: 13836. Замещение l3C на месте 12 С в соединениях данного изобретения практически не производит никакого изменения при десольватации. Таким образом, соединение данного изобретения преимущественно сохраняет прочное связывание с белками захвата серотонина и является активным ингибитором захвата серотонина. Подробное описание изобретения Настоящее изобретение относится к выделенному соединению формулы (I) или к его соли; или пролекарству или к соли его пролекарства; или гидрату, сольвату или его полиморфу; гдеD представляет собой дейтерий; каждый Y (например, Y1, Y2, Y3) независимо выбран из дейтерия или водорода; каждый водород необязательно замещен на дейтерий и каждый атом углерода необязательно замещен на 13 С. Согласно предпочтительному варианту осуществления изобретения Y1 представляет собой дейте-7 014432 рий. Согласно другому предпочтительному варианту осуществления изобретения по крайней мере один из Y2 и Y3 независимо представляет собой дейтерий. Более предпочтительно как Y2, так и Y3 представляют собой дейтерий. Согласно другому предпочтительному варианту осуществления изобретения каждый из Y1, Y2 и Y3 представляют собой дейтерий. Согласно еще одному предпочтительному варианту осуществления изобретения каждый атом водорода в фторфенильном кольце замещен на дейтерий. Понятие "соединение", используемое здесь, включает соли, пролекарства и соли пролекарства соединения формулы (I). Это понятие также включает любые сольваты, гидраты и полиморфы любого из вышеупомянутых соединений. Конкретное перечисление "пролекарство", "соль пролекарства", "сольват", "гидрат" или "полиморф" в определенных аспектах изобретения, описанное в данном патенте, не должно интерпретироваться как намеренное исключение этих форм в других аспектах изобретения, где понятие "соединение" используется без перечисления этих форм. Соль соединения данного изобретения образуется между кислотой и основной группой соединения,такой как амино-функциональная группа, или основанием и кислотной группой соединения, такой как карбоксифункциональная группа. Согласно другому предпочтительному варианту осуществления изобретения соединение представляет собой фармацевтически приемлемую соль присоединения кислоты. Используемое здесь и в других случаях, пока не будет указано другого, понятие "пролекарство" означает производное соединения, которое может гидролизовать, окислять или иначе реагировать при биологических условиях (in vitro или in vivo) для получения соединения данного изобретения. Пролекарства могут становиться активными только в такой реакции при биологических условиях, или они могут обладать активностью в нереакционноспособных формах. Примеры пролекарств, рассматриваемые в данном изобретении, включают, но не ограничиваются, аналоги или производные соединений любой из формул,приведенных здесь, которые включают биогидролизуемые вещества, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты,биогидролизуемые уреиды и биогидролизуемые фосфатные аналоги. Другие примеры пролекарств включают производные соединений любой из формул, приведенных здесь, которые включают фрагменты -NO, -NO2, -ONO или -ONO2. Пролекарства могут в основном быть получены с использованием хорошо известных способов, таких как способы, описанные в Burger's Medicinal Chemistry and Drug Discovery (1995) 172-178, 949-982 (Manfred E., Wolff ed., 5th ed); см. также Goodman and Gilman's, The Pharmacological basis of Therapeutics, 8th ed., McGraw-Hill, Int. Ed. 1992, "Biotransformation of Drugs". Используемые здесь, если не указано иначе, понятия "биогидролизуемый амид", "биогидролизуемый сложный эфир", "биогидролизуемый карбамат", "биогидролизуемый карбонат", "биогидролизуемый уреид" и "биогидролизуемый фосфатный аналог" означают амид, сложный эфир, карбамат, карбонат,уреид или фосфатный аналог, соответственно, который либо: 1) не лишает соединение биологической активности и придает этому соединению полезные свойства in vivo, такие как захват, продолжительность действия, или введение в действие; или 2) является сам по себе биологически неактивным, но превращается in vivo в биологически активное соединение. Примеры биогидролизуемых амидов включают, но не ограничиваются, низшие алкиламиды, амиды -аминокислот, алкоксиациламиды и алкиламиноалкилкарбониламиды. Примеры биогидролизуемых сложных эфиров включают, но не ограничиваются, низшие алкилэфиры, алкоксиацилоксиэфиры, алкилациламиноалкилэфиры и сложные эфиры холина. Примеры биогидролизуемых карбаматов включают, но не ограничиваются, низшие алкиламины, замещенные этилендиамины, аминокислоты, гидроксиалкиламины, гетероциклические и гетероароматические амины и полиэфирамины. Соль пролекарства представляет собой соединение, образованное между кислотой и основной группой пролекарства, такой как аминофункциональная группа, или основанием и кислотной группой пролекарства, такой как карбоксифункциональная группа. В предпочтительном варианте осуществления изобретения соль пролекарства представляет собой фармацевтически приемлемую соль. Согласно другому предпочтительному варианту осуществления изобретения противоион к сольобразующему пролекарству соединения формулы (I) является фармацевтически приемлемым. Фармацевтически приемлемые противоионы включают, например, те кислоты и основания, приведенные здесь, которые подходят для образования фармацевтически приемлемых солей. Особенно предпочтительными являются пролекарства и соли пролекарства, которые увеличивают биодоступность соединений данного изобретения при введении таких соединений млекопитающему (например, предоставляя перорально введенному соединению легко абсорбироваться в крови) или которые повышают доставку исходного соединения в биологический отдел (например, мозг или центральную нервную систему) по отношению к исходным препаратам. Предпочтительные пролекарства включают производные, где группа, которая повышает растворимость в воде или активирует транспорт через кишечную мембрану, присоединяется к структуре формулы, описанной здесь. См., например, Alexander, J. et al. Journal of Medicinal Chemistry, 1988, 31, 318-322;of Medicinal Chemistry 1987, 30, 451-454; Bundgaard, H. A Textbook of Drug Design and Development; Harwood Academic Publ.: Switzerland, 1991; pp. 113-191; Digenis, G.A. et al. Handbook of Experimental Pharmacology 1975, 28, 86-112; Friis, G.J.; Bundgaard, H. A Textbook of Drug Design and Development; 2 ed.; Overseas Publ.: Amsterdam, 1996; pp. 351-385; Pitman, I.H. Medicinal Research Reviews, 1981, 1, 189-214. Понятие "фармацевтически приемлемый", используемое здесь, относится к компоненту, который в рамках здравого смысла в области медицины является подходящим для использования при контакте с тканями человека и других млекопитающих без чрезмерной токсичности, раздражения, аллергической реакции и т.п., и сопоставим с допустимым соотношением польза/риск. "Фармацевтически приемлемая соль" означает любую нетоксичную соль, которая при введении реципиенту способна образовывать как напрямую, так и косвенно, соединение или пролекарство соединения данного изобретения. "Фармацевтически приемлемый противоион" представляет собой ионную долю соли, которая является нетоксичной при выделении из соли при введении реципиенту. Кислоты, обычно используемые для образования фармацевтически приемлемых солей, включают неорганические кислоты, такие как сернистая, соляная, бромисто-водородная, иодисто-водородная, серная и фосфорная кислота, также как и органические кислоты, такие как п-толуолсульфокислота, салициловая, винная, дивинная, аскорбиновая, малеиновая, бензолсульфокислота, фумаровая, глюконовая, глюкуроновая, муравьиная, глутаминовая, метансульфоновая, этансульфоновая, бензолсульфоновая, молочная, щавелевая, п-бромфенилсульфоновая, угольная, янтарная, лимонная, бензойная и уксусная кислота,и родственные неорганические и органические кислоты. Такие фармацевтически приемлемые соли включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат,метафосфат, пирофосфат, хлорид, бромид, иодид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутират, соль каприновой кислоты, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат,себацат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, терефталат, сульфонат, ксиленсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, -гидроксибутират, гликолят, малеат, тартрат,метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и похожие соли. Предпочтительные фармацевтически приемлемые соли присоединения кислоты включают соли,образованные минеральными кислотами, такими как соляная и бромоводородная кислота, и особенно соли, образованные органическими кислотами, такими как малеиновая кислота. Подходящие основания для образования фармацевтически приемлемых солей с кислотными функциональными группами пролекарств включают, но не ограничиваются, гидроксиды щелочных металлов,таких как натрий, калий и литий; гидроксиды щелочно-земельных металлов, таких как кальций и магний,гидроксиды других металлов, таких как алюминий и цинк; аммиак и органические амины, такие как незамещенные или гидроксизамещенные моно-, ди- или триалкиламины; дициклогексиламин; трибутиламин; пиридин; N-метил,N-этиламин; диэтиламин; триэтиламин; моно-, бис- или трис-(2-гидроксинизший алкил амины), такие как моно-, бис- или трис-(2-гидроксиэтил)амин, 2-гидрокси-трет-бутиламин или трис-(гидроксиметил)метиламин, N,N-динизший алкил-N-(гидрокси низший алкил)амины, такие какN,N-диметил-N-(2-гидроксиэтил)амин или три(2-гидроксиэтил)амин; N-метил-D-глюкамин и аминокислоты, такие как аргинин, лизин и т.п. Используемое здесь понятие "гидрат" означает соединение, которое далее включает стехиометрическое или нестехиометрическое количество воды, связанной нековалентными внутримолекулярными связями. Используемое здесь понятие "сольват" означает соединение, которое далее включает стехиометрическое или нестехиометрическое количество растворителя, такого как вода, ацетон, этанол, метанол, дихлорметан, 2-пропанол или т.п., связанного нековалентными внутримолекулярными связями. Используемое здесь понятие "полиморф" означает твердые кристаллические формы соединения или комплекса, которые могут быть охарактеризованы физическими средствами, такими как, например, порошковая рентгенограмма или инфракрасная спектроскопия. Различные полиморфы одного и того же соединения могут проявлять различные физические, химические и/или спектроскопические свойства. Различные физические свойства включают, но не ограничиваются, стабильность (например, по отношению к теплу, свету или влаге), способность к сжатию и плотность (важны в технологии приготовления лекарственных средств и производстве продукции), гигроскопичность, растворимость и скорость растворения и растворимость (которые могут влиять на биодоступность). Различия в стабильности могут быть следствием изменений химической реакционной способности (например, различного окисления, такого,что лекарственная форма обесцвечивается быстрее, когда содержит один полиморф, чем когда содержит другой полиморф) или механических характеристик (например, таблетки крошатся при хранении, так как кинетически благоприятный полиморф превращается в термодинамически более стабильный полиморф),или обоих (например, таблетки одного полиморфа являются более чувствительны к разложению при высокой влажности). Различные физические свойства полиморфов могут влиять на их обработку. Например, один полиморф может вероятнее всего образовывать сольваты или его будет сложно отфильтровать или отмыть от примесей, в отличие от другого, благодаря, например, распределению его частиц по форме и размеру.-9 014432 Соединения настоящего изобретения содержат один или более асимметрических атомов углерода. Как таковое, соединение данного изобретения может существовать в виде индивидуальных стереоизомеров (энантиомеры или диастереомеры), также как и смесь стереоизомеров. Таким образом, соединение настоящего изобретения будет включать не только смесь стереоизомеров, но также индивидуальные соответствующие стереоизомеры, по существу, свободные от стереоизомеров друг друга. Понятие "по существу свободные", как используется здесь, означает, что присутствует менее чем 25% других стереоизомеров, предпочтительно менее чем 10% других стереоизомеров, более предпочтительно менее чем 5% других стереоизомеров и наиболее предпочтительно менее чем 2% других стереоизомеров. Способы получения или синтеза диастереомеров хорошо известны специалисту и могут быть применены на практике для конечных соединений или для исходного материала или интермедиатов. Другие варианты осуществления изобретения являются вариантами, где соединение представляет собой выделенное соединение. Соединения данного изобретения могут быть синтезированы хорошо известными способами. Исходные материалы и определенные интермедиаты, используемые в синтезе соединений данного изобретения, доступны из коммерческих источников или могут быть синтезированы с использованием реагентов и способов, известных специалисту, включая схемы синтеза, которые приведены здесь. См., например, Christensen J.A. and Squires R.F., патент США US 4007196, to Ferrosan; Ward N., патент США US 6172233, to SmithKline Beecham; Liu L.T. et al., патент США US 6833458 to Development Center for Biotechnology; Jacewicz V.W. et al., патент США US 6716985 to SmithKline Beecham; Hoorn H.J. et al., патент США US 6703408 to Synthon BCT Technologies; Rossi R. et al., патент США US 6583287 to Recordati;al., J. Am. Chem. Soc. 2003 125: 11253; Johnson Т.А. et al., J. Am. Chem. Soc. 2001 123: 1004; и заявки на патент США US 20030004352, 20030220370, 20040073038, 20030018048 и 20040215020; причем каждый из документов приведен здесь в качестве ссылки. Схема II Подходящий способ получения соединения формулы (I) показан графически на схеме II, где D представляет собой дейтерий, каждый Y выделен независимо от водорода или дейтерия и W является защитной группой для азота. Защитные группы для азота хорошо известны специалисту и включают, но не ограничиваются, метил, этилбензил, замещенный бензил, аллил; и С 1-6 алкиленкарбаматы, такие как фенилкарбамат, замещенный фенилкарбамат, бензилкарбамат, замещенный бензилкарбамат, винилкарбамат или аллилкарбамат. Предпочтительными защитными группами для азота являются метил, этилбензил, 4-замещенный бензил, трет-бутилкарбамат, бензилкарбамат, метилкарбамат, этилкарбамат, пропилкарбамат, винилкарбамат и аллилкарбамат. Более предпочтительные W-группы включают метил, этил- 10014432 бензил, метилкарбамат, этилкарбамат, винилкарбамат, аллилкарбамат, фенилкарбамат, бензилкарбамат и трет-бутилкарбамат. Подходящие бензиловые заместители включают, например, C1-4 алкил, С 1-4 алкил-О-,фтор-, хлор-, и нитро-. Каждое из соединений формулы (II), (III) и (VI) может быть необязательно далее замещено дейтерием в положении водорода и 13 С в положении 12 С. В каждой формуле (II) и (III), Y1 является предпочтительно дейтерием. Реакция соединений формулы (VI) с соединениями формулы (II) может быть проведена в одну стадию, например, с помощью реакции Мицунобу (см., например, Mitsunobu О., Synthesis 1981, 1) с использованием подходящего фосфина, такого как трифенилфосфин или трибутилфосфин и других, и азодикарбоксилатов, таких как, например, диэтилазодикарбоксилат, диизопропилазодикарбоксилат или дибензилазодикарбоксилат. В качестве альтернативы, спирт может быть превращен в замещаемый электрофил,например, с помощью получения сульфатного эфира или с помощью замещения кислорода на галоген,такой как хлорид, бромид или иодид. Подходящие сульфатные эфиры включают, но не ограничиваются,тозилат, мезилат, брозилат, нозилат и трифлат. Предпочтительным способом для соединений формулы(III) является реакция соединений формулы (VI), где W представляет собой метил, с тионилхлоридом с образованием первичного хлорида, и замещение на соединение формулы (II) при основных условиях,используя основания щелочного металла, такого как натрий или калий, например, в виде метоксида натрия или этоксида натрия. Соединения формулы (III), где W представляет собой метил или этил, могут быть лишены Nзащитной группы в два этапа, с использованием сначала хлорформиат (например, фенилхлорформиат,метилхлорформиат, этилхлорформиат или винилхлорформиат и другие) для одновременного Nдеалкилирования пиперидинового кольца и образования карбамата, соответствующего используемому хлорформиату. В случае простых алкил или арилхлорформиатов, получаемый карбамат затем гидролизуют сильным основанием, таким как водный KOH для получения соединения формулы (I). Винилкарбаматы, полученные реакцией соединений формулы (III) с винилхлорформиатом, могут разлагаться кислотой, такой как HCl, для получения продукта формулы (I). Если W представляет собой бензил или замещенный бензил, то соединение формулы (III) может быть лишено N-защитной группы с помощью гидрогенизации, например, с использованием палладиевого катализатора, такого как металлический палладий или Pd(OH)2 на угле совместно или с газообразным водородом, или с другим донором водорода,таким как муравьиная кислота или формиат аммония. Если W представляет собой бензилкарбамат, то он может быть лишен защиты тем же образом, что и бензиловая группа, или удален ацидолизом, например,с использованием бромоводорода. Если W представляет собой трет-бутилкарбамат, то соединение формулы (III) может быть лишено N-защитной группы путем обработки кислотой (например, соляной кислотой, бромоводородной, трифторуксусной кислотой или п-толуолсульфокислотой). Использование и удаление защитных групп атома азота хорошо известно из уровня техники и многие дополнительные способы защиты и снятия защиты азота пиперидинового кольца будут очевидны для специалиста в органическом синтезе. Соединения формулы (II) могут быть легко синтезированы с помощью гидролиза сложных эфиров,полученных путем окисления 5-формил- или 5-кето-1,3-бензодиоксолов соответственно; с помощью металл-галогенового обмена 5-гало-1,3-бензодиоксола и охлаждения водой; или с помощью окислительного декарбоксилирования 5-бензодиоксольных кислот. См., например, Borzatta V. et al., международная заявка РСТ WO 2004092106; Kuo L-H et al., заявка на патент США US 2002123655, заявитель Sinon Corporation; Pansegrau P.D. и Munson B.P., патент США US 5840997 Dakota Gasification; и Zambrano J.L. иDorta R., Synlett 2003 10: 1545. Дейтерированные бензодиоксолы-предшественники формулы (V) легко доступны с помощью средств органического синтеза, известных из уровня техники. Например, реакция дейтерированного реагента метиленирования с подходящим катехином формулы (VI), таким как 3,4 дигидроксибромбензол, 3,4-дигидроксибензальдегид, 1-(3,4-дигидроксифенил)оксоалканы или 1-(3,4 дигидроксифенил)оксоарены, будет приводить к закрытию кольца и образованию соответствующего бензодиоксола. Примеры подходящих дейтерированных реагентов метиленирования включают, например, моно- и дидейтерированные формы дигалометанов, таких как дихлорметан, бромхлорметан или дииодметан. Синтез бензодиоксолов из предшественников катехина (о-дигидроксифенила) хорошо известен из уровня техники и описывается, например, Cabedo N. et al., J. Med. Chem. 2001, 44: 1794; Walzal., Helv. Chim. Acta, 2003, 86: 2239; Moreau A. et al., Tetrahedron, 2004, 60: 6169; и Panseri P et al., патент США US 5936103 Borregaard Italia. Каждая из вышеназванных публикаций приведена здесь в качестве ссылки. В патенте США US 5936103 предлагается эффективный способ, который может быть применен к легко доступному дихлордидейтерометану для получения предпочтительных соединений формул (I) и(III), где Y является дейтерием, как показано на схеме III ниже. На схеме III R представляет собой галоид, такой как бромо, хлоро или иодо; или оксогруппу, такую как формил, метилкетон, этилкетон или фенилкетон; D является дейтерием; Y представляет собой водород или дейтерий; X и X' являются независимо галоидами, такими как бромо, хлоро или иодо; и Z является водородом, более низшим алкилом, таким как С 1-4 алкил, или арилом, таким как фенил или замещенный фенил. Дальнейшее замещение дейтерием может быть осуществлено в соединениях формулы (II). Например, галогенирование ортогидроксильной группы, например, с использованием N-бромсукцинимида в ионной жидкости, с последующей О-защитой (например, силильной группой, такой как триэтилсилил или трет-бутилдиметилсилил, среди прочих), обмен галоген-металл и гашение дейтерием, таким какCatal. 2004 346: 77; Kirefu T. et al., J. Label. Compd. Radiopharm. 2001 44: 329). Начиная с 1,4-дибром-2,3 диметоксибензола, галоген-дейтериевый обмен похожими средствами приводит к получению 1,2 диметокси-3,6-дидейтеробензола (см., например, Albrecht M., Synthesis 1996: 230). Отщепление метоксигрупп, например, с помощью трибромида бора, с последующим дейтерометиленированием, как описано выше, приводит к получению 2-дейтерийзамещенного 4,7-дидейтеро-1,3-бензодиоксола, который может быть превращен в 4,7-дидейтеропроизводные формулы (II) известными способами (см., например,DePriest R.N., патент США 4940807 to Ethyl Corporation; Feugeas C., Bull. Chim. Soc. Fr. 1964: 1982). Другие способы ароматического замещения, подходящие для включения дейтерия, известны специалистам по органическому синтезу. Изотопное замещение в любом в другом месте в соединениях формулы (II) также может быть осуществлено способами, известными из уровня техники. Например, 1,3-пропандиол является промышленно доступным в многочисленных изотопных формах, например, 1,3-пропандиол-13 С 3 (Sigma Aldrich(ISOTEC), St. Louis, MO); 1,3-пропандиол-2-13 С (Sigma Aldrich (ISOTEC), St. Louis, МО); 1,3 пропандиол-d8 (C/D/N Isotopes, Pointe-Claire, Quebec, Canada) и 1,3-пропан-2,2-d2-диол (C/D/N Isotopes,Pointe-Claire, Quebec, Canada). Эти исходные вещества легко превращаются в известное соединение 4,как показано ниже на схеме IV. Например, монодепротонирование диола и монозащита (например, с помощью трет-бутилдиметилсилильной группы), с последующим окислением свободного спирта в альдегид (например, окисление по Сверну), и реакцией с 4-металлированным фторбензолом (например, 4 бромфторбензол депротонирован н-бутиллитием) приводит к образованию промежуточного соединения 3. Снятие защиты вторичного спирта (например, как эфир тетрагидропирана, с помощью реакции с дигидропираном), О-снятие защиты первичного спирта (например, источника фтора, такого как KF в диметилформамиде, если используется силильная защита), активация получающегося первичного спирта(например, хлорида с использованием трифенилфосфин/тетрахлорид углерода) и реакция с панизидином, с последующим окислением защищенного вторичного спирта в кетон (например, прямое окисление эфира ТГП с использованием кислотного окисляющего агента, или гидролитическое удаление эфира ТГП с последующим окислением), могут быть выполнены для получения соединения 4. Превращение соединения 4 в соединение 7 (эквивалентно формуле (VI), где W является третбутоксикарбонилом) описывается Hughes G. et al., J. Am. Chem. Soc. 2003 125: 11253. Реакция соединения 7 с соединениями формулы (I) могут быть осуществлены аналогично последовательности, показанной на схеме II, хотя, как будет известно, без необходимости превращения N-метильной группы в карбамат, как показано на схеме II. На схеме IV Р представляет собой подходящую защитную группу для кислорода, известную в области органического синтеза. Используемые защитные группы для кислорода включают, но не ограничиваются, C1-4 алкилен, бензил, C1-2 оксиметил или триС 1-6 силил. РМР представляет собой 4-метоксифенил.Boc представляет собой трет-бутилоксикарбонил. Различные молекулярные позиции отмечены для обозначения источников потенциального изотопного замещения: показывает 13 С замещение, обусловленное меченым 1,3-пропандиолом. Позиции 5 и 6 в пиперидине могут быть мечены дейтерием также благодаря 1,3-пропандиолу. "" показывает замещение дейтерием с помощью меченого 4-бром фторбензола (например, C/D/N изотопы). " " показывает 13 С метки, обусловленные меченым диэтилмалонатом (например, Aldrich); показывает 13 С или дейтериевые метки, обусловленные соответственно введением гидроксиметильной группы с использованием 13 С-меченой ацилирующей группы, такой как диметил карбонат-13 С (легко получаемая из 13 С-фосгена (например, Isotec) и метанола), или путем восстановления получаемой сложноэфирной группы подходящим дейтерированным донором "гидрида",таким как дейтероборан (см., например, Kinugawa Y. и Kawashima E., Nucleic Acids Res. Suppl. 2002: 19;Turecek F. и Hanus V., Org. Mass Spec. 1980, 15: 8). Будет определено, что любая одиночная стадия или комбинация стадий мечения, показанная на схеме IV, является возможной. Последовательность синтеза и реагенты на схеме IV иллюстрируют потенциальную возможность для широкого спектра включения стабильных изотопных меток посредством соединений формулы (I) известными способами, но, не предполагает ограничить объем изобретения. Другие способы включения изотопных меток в соединения формулы (I) будут очевидны для специалиста в органической химии, и различные подходы к соединениям формулы (I) будут давать возможность или облегчать мечение различных атомов. Таким образом, замещение углеродов и водородов в соединениях данного изобретения на 13 С и дейтерий, соответственно, осуществимо способами, известными обычному квалифицированному специалисту в органическом синтезе. Особые подходы и соединения, показанные выше, этим не ограничиваются. Дополнительные методы синтеза соединений формулы (I) и их синтетических предшественников, включая предшественников в пределах способов, явным образом не показанных здесь на схемах, известны обычному специалистухимику. Вдобавок к ссылкам по синтезу, изложенным здесь, схемы реакций и правила, могут быть определены квалифицированным специалистом путем использования коммерчески доступного программного обеспечения с базами данных с поиском по структуре, например, SciFinder (CAS подразделение Американского химического общества), STN (CAS подразделение Американского химического общества),CrossFire Beilstein (Elsevier MDL), или поисковой системой Интернета, такой как Google или баз данных по ключевому слову, таких как US Patent или текстовая база данных Trademark Office. Способы оптимизации условий реакции, при необходимости минимизирующие конкурирующие побочные продукты, известны из уровня техники. Для оптимизации реакции и увеличения масштабов- 13014432 можно преимущественно использовать высокоскоростное оборудование с параллельным синтезом и управляемые с помощью компьютера микрореакторы (например, Design And Optimization in Organic Synthesis, 2nd Edition, Carlson R., Ed, 2005; Elsevier Science Ltd., Jhnisch, K. et al., Angew. Chem. Int. Ed. Engl. 2004, 43: 406; и приведенные там ссылки). Способы синтеза, описанные здесь, могут также дополнительно включать стадии как до, так и после любых стадий, описанных на схемах II или III, для добавления или удаления подходящих защитных групп для того, чтобы в итоге обеспечить проведение синтеза соединения с формулой, описанной здесь. Способы, описанные здесь, предполагают превращение соединений одной формулы в соединения другой формулы. Процесс превращения относится к одному или более химическим превращениям, которые могут быть осуществлены in situ, или с отделением промежуточных соединений. Превращения могут включать реакцию исходных соединений или интермедиатов с добавочными реагентами с использованием методов и правил, известных из уровня техники, включая методы и правила, содержащиеся в ссылках,изложенных здесь. Интермедиаты могут быть использованы с или без очищения (например, фильтрации,перегонки, возгонки, кристаллизации, ресуспендирования, твердофазной экстракции, хроматографии). Согласно другому аспекту осуществления изобретение представляет промежуточное соединение формулы (II) или (III), в которых любой водородный и углеродный атом необязательно замещен дейтерием и 13 С соответственно. Комбинации заместителей и переменных, рассмотренные в данном изобретении, представляют собой только те комбинации заместителей и переменных, которые приводят к образованию устойчивых соединений. Понятие "устойчивый", используемое здесь, относится к соединениям, которые обладают устойчивостью, достаточной для осуществления производства, и которые поддерживают целостность соединения в течение достаточного периода времени для того, чтобы их можно было использовать в целях, описанных здесь (например, для разработки терапевтических продуктов, интермедиатов для использования при получении терапевтических соединений, отделяемых или способных хорошо храниться промежуточных соединений, лечения заболевания или состояния, ответственных за повышенную нейротрансмиссию серотонина). Понятие "изотополог" относится к разновидностям, которые отличаются от определенного соединения данного изобретения только по изотопному составу их молекул или ионов. Термины "более легкий изотополог" и "изотополог с более легким атомом", используемые здесь, относятся к разновидности, которая отличается от соединения данного изобретения тем, что она включает один или более легких изотопных атомов 1 Н или 12 С в позициях, занятых дейтерием или 13 С, в определенном соединении данного изобретения. Для целей данного изобретения 11 С не называется легким изотопом углерода. Конкретное соединение данного изобретения также может быть названо "соединением с тяжелым изотопным атомом" для отличия его от более легких изотопологов при обсуждении смесей изотопологов. Причина состоит в том, что конкретное соединение и все его более легкие изотопологи, кроме соединения 1, являются соединениями формулы (I). Терминология химических названий может быть сложной, и различные химические названия часто могут быть применены по различным причинам к одной и той же структуре. Во избежание путаницы,"соединение 1" относится к свободной основной форме агента, ингибирующего активный обратный захват серотонина, который содержится в лекарственном средстве, одобренном US FDA в NDA020710 и 020936. Будет установлено, что многие обыкновенно встречающиеся атомы в биологических системах существуют в природе в качестве смесей изотопов. Так, соединение 1, по существу, включает небольшие количества дейтерированных и/или 13 С-содержащих изотопологов. Настоящее изобретение различает такие формы, имеющие незначительные количества таких изотопологов в том плане, что понятие "соединение", используемое в данном изобретении, относится к композиции вещества, которое является преимущественно определенным изотопологом. Соединение, так как определено здесь в примерах осуществления изобретения, содержит меньше чем 10%, предпочтительно меньше чем 6% и более предпочтительно меньше чем 3% всех других изотопологов, включая соединение 1. Композиции вещества, которые могут содержать более чем 10% всех других специфических изотопологов вместе, здесь называются смесями и должны соответствовать параметрам, которые приведены ниже. Эти ограничения изотопной композиции и все ссылки, приведенные здесь на изотопные композиции, относятся исключительно к активной, свободной основной форме соединения формулы (I) и не включают изотопную композицию гидролизуемых частей пролекарства или противоионов, некоторые из которых, такие как хлорид и бромид, существуют в природе в виде смесей, включающих существенный процент многочисленных изотопов. Понятие "тяжелый атом" относится к изотопам с более высоким атомным весом, чем у преобладающего встречающегося в природе изотопа. Понятие "устойчивый тяжелый атом" относится к нерадиоактивным тяжелым атомам. Оба "2 Н" и "D" относятся к дейтерию."Алкилен" относится к линейной, разветвленной или частично или целиком циклической алкильной группе, которая может содержать одну или более степеней непредельности в форме цис-, транс- или смеси цис-, транс-двойных связей или тройных связей."brine" относится к насыщенному водному хлориду натрия."FDA" относится к Управлению по контролю за продуктами и лекарствами."AUC" относится к площади под концентрационной кривой плазма-время."ЕТА" относится к рецепторам эндотелина подтипа А."ЕТВ" относится к рецепторам эндотелина подтипа В."SSRI" относится к селективному ингибитору повторного поглощения серотонина."PPAR" относится к рецептору активатора пролиферации пероксисом."Ed." относится к редактору. Изобретение, кроме того, представляет композиции, включающие смесь соединения данного изобретения и его более легких изотопологов. Эти смеси могут иметь место, например, просто как результат неэффективности включения изотопа в данную позицию; намеренного или случайного обмена протонов на дейтерий, например, обмен большого количества сольвента на гетероатом-присоединенный дейтерий; или намеренно полученных смесей чистых соединений. В одном из осуществлений изобретения такие смеси включают по крайней мере около 50% соединения с тяжелым изотопным атомом (т.е. менее чем около 50% более легких изотопологов). Более предпочтительной является смесь, включающая по крайней мере 80% соединения с тяжелым изотопным атомом. Наиболее предпочтительной является смесь, включающая 90% соединения с тяжелым изотопным атомом. В альтернативном осуществлении изобретения смесь включает соединение формулы (I) и его более легкие изотопологи в относительных пропорциях, таких, в которых по крайней мере около 50%, предпочтительно по крайней мере 80%, более предпочтительно по крайней мере 90% и даже более предпочтительно по крайней мере 95%, наиболее предпочтительно по крайней мере 98% соединений в названной смеси включают тяжелый изотоп в каждой позиции, содержащей устойчивый тяжелый атомный изотоп в изотопном соединении с тяжелым атомом. Нижеследующее служит примером этому определению. Гипотетическое соединение данного изобретения содержит дейтерий в позициях Y1, Y2 и Y3. Смесь, включающая это соединение и все его потенциальные более легкие изотопологи и относительную долю каждого, отражена в таблице ниже. Из таблицы можно видеть, что соединение и более легкие изотопологи 1, 2 и 4 включают изотопный дейтерий в позиции Y1. Эти соединения присутствуют в смеси в относительных количествах 40, 15,14 и 6%. Таким образом, 75% смеси включает изотоп, который присутствует в соединении, в позиции Y1. Соединение плюс более легкие изотопологи 1, 3 и 5 включают изотопный дейтерий в позиции Y2. Эти соединения присутствуют в смеси в относительных количествах 40, 15, 13 и 5%. Таким образом, 73% смеси включает изотоп, который присутствует в соединении, в позиции Y2. Соединение и более легкие изотопологи 2, 3 и 6 включают изотопный дейтерий в позиции Y3. Эти соединения присутствуют в смеси в относительных количествах 40, 14, 13 и 4%. Таким образом, 71% смеси включает изотоп, который присутствует в соединении, в позиции Y3. Соответственно, эта смесь включает соединение, и его более легкие изотопологи в относительном количестве, так что 71% соединений в названной смеси включают изотоп в каждой позиции, содержащей устойчивый тяжелый изотопный атом в целом изотопном соединении. Изобретение также представляет композиции, включающие эффективное количество соединения любой из формул (I), (II) или (III) или его соль; или пролекарство или соль его пролекарства; или сольват, гидрат или его полиморф, если является применимым; приемлемый носитель. Носитель(и) должен быть "приемлемым" в смысле быть совместимым с другими ингредиентами композиции. В предпочтительном варианте осуществления, изобретение представляет композицию, включающую соединение формулы (I), или фармацевтически приемлемую соль, пролекарство или фармацевтически приемлемую соль его пролекарства; или сольват, гидрат или полиморф любого вышеупомянутого и фармацевтически приемлемого носителя, где упомянутая композиция разработана для фармацевтического использования ("фармацевтическая композиция"). "Фармацевтически приемлемый носитель" представляет собой носитель, совместимый с другими ингредиентами композиции и не являющийся вредным для пациента в количествах, обычно используемых в лекарственных препаратах. Фармацевтически приемлемые носители, адъюванты и переносчики, которые могут быть использованы в фармацевтических композициях данного изобретения, включают, но не ограничиваются, ионные обменники, оксид алюминия, стеарат алюминия, лецитин, протеины сыворотки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, смеси неполных глицеридов насыщенных жирных кислот растительного происхождения, вода,соли или электролиты, такие как протамин сульфат, двузамещенный фосфорно-кислый натрий, вторичный кислый фосфат калия, хлорид натрия, соли цинка, коллоидный кремний, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрий карбоксиметилцеллюлоза, полиакрилаты, воски, полиэтилен-полипропилен-блок-сополимеры, полиэтиленгликоль и ланолин. Фармацевтические композиции данного изобретения включают композиции, подходящие для перорального, ректального, назального, местного (включая трансбуккальное и сублингвальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное и внутрикожное) введения. В определенных вариантах осуществления изобретения соединение данной формулы вводится через кожу(например, с использованием трансдермального пластыря или электрофоретические методы). Другие препараты для удобства могут быть представлены в стандартной лекарственной форме, например, таблетках и капсулах с замедленным высвобождением, и в липосомах, и могут быть получены любыми способами, известными из области фармацевтики. См., например, Remington's Pharmaceutical Sciences, MackPublishing Company, Philadelphia, PA (17th ed. 1985). Такие препаративные методы включают стадию ассоциирования с молекулой, которая должна быть введена, ингредиентов, таких как носитель, который содержит один или более дополнительные ингредиенты. В общем, композиции получают одинаково и приводят в ассоциацию активные ингредиенты с жидкими носителями, липосомами или тонко разделенными твердыми носителями или всеми вместе, и затем при необходимости придают продукту форму. В некоторых предпочтительных осуществлениях изобретения соединение вводится перорально. Композиции настоящего изобретения, подходящие для перорального введения, могут быть представлены в качестве дискретных единиц, таких как капсулы, саше или таблетки, каждая из которых содержит заранее установленное количество активного ингредиента; такие как порошок или гранулы; такие как раствор или суспензия в водном растворе или неводном растворе; или такие как жидкая эмульсия масло-вводе или вода-в-масле, или упакованные в липосомы, или такие как болюсы, и т.д. Мягкие желатиновые капсулы могут быть полезны для включения таких суспензий, что может благоприятно увеличить скорость абсорбции соединения. Таблетка может быть получена с помощью прессования или литья, при желании с одним или более дополнительными ингредиентами. Прессованные таблетки могут быть получены на подходящей машине путем прессования активного ингредиента в легкосыпучей форме, такой как порошок или гранулы, необязательно смешанной со связующим, смазкой, инертным растворителем, консервантом, поверхностноактивным и диспергирующим агентом. Отлитые таблетки могут быть получены с помощью литья на подходящей машине смеси порошкообразного соединения, смоченного инертным жидким растворителем. Таблетки по выбору могут быть покрыты или сделаны шероховатыми и могут быть созданы так,чтобы обеспечивать низкое или контролируемое высвобождение активного ингредиента. Методы создания таких композиций с низким или контролируемым высвобождением фармацевтически активных ингредиентов, таких как ингредиенты, описанные здесь, и других соединений, известных из уровня техники, известны специалистам и описаны в нескольких выданных патентах США, некоторые из которых включают, но не ограничиваются, патенты США US 4369172; 4842866; 5807574; и ссылки, приведенные там. Покрытия могут быть использованы для доставки соединений в кишечник (см., например, патенты США US 6548084, 6638534, 5217720 и 6569457, 6461631, 6528080, 6800663, и ссылки, приведенные там),или они могут быть неразрушающимися и рассчитаны так, чтобы давать возможность выделения активного ингредиента путем экструзии (см., например, патент США US 6706283). Каждый из этих патентов упомянут здесь в качестве ссылки. В случае таблеток для перорального применения, носители, которые обычно используются, включают лактозу и кукурузный крахмал. Также обычно добавляются смазывающие агенты, такие как стеарат магния. Для перорального введения в форме капсул, приемлемые разбавители включают лактозу и высушенный кукурузный крахмал. Когда водные суспензии вводятся перорально, активный ингредиент соединяют с эмульгирующими и суспендирующими агентами. При желании могут быть добавлены определенные подслащивающие, и/или ароматизирующие, и/или красящие агенты. Поверхностно-активные вещества, такие как натрий лаурилсульфат, могут быть полезны для повышения растворимости и абсорбции. Композиции, подходящие для местного применения, включают таблетки для рассасывания, содержащие ингредиенты на ароматизированной основе, обычно сахарозе и камеди или трагаканте; и пастилки, включающие активный ингредиент на инертной основе, такой как желатин и глицерин, или сахароза и камедь. Композиции, подходящие для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, антимикробные добавки и растворенные вещества, которые делают композицию изотонической с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Композиции могут быть представлены в единичных или многодозовых контейнерах, например, запаянных ампулах и пузырьках, и могут храниться в заморожено-высушенном (лиофилизованном) состоянии, требующем только добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед использованием. Растворы и суспензии для инъекций для немедленного приема могут быть приготовлены из стерильных порошков, гранул и таблеток. Такие инъекционные растворы могут быть в форме, например, стерильной водной или масляной суспензии для инъекций. Такая суспензия может быть получена согласно методам, известным из уровня техники, с использованием подходящих диспергирующих или смачивающих агентов (таких как, например, Твин 80) и суспендирующих агентов. Стерильный препарат для инъекций может также представлять собой стерильный раствор для инъекций или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, как раствор в 1,3-бутандиоле. Среди приемлемых носителей и- 17014432 растворителей, которые могут быть использованы: маннитол, вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды традиционно используются стерильные, нелетучие масла. Для этой цели может быть использовано успокаивающее нелетучее масло, включая синтетические моно- и диглицериды. В приготовлении инъекций используются жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, такие как природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных формах. Эти масляные растворы или суспензии могут также содержать длинноцепочечный спиртовой растворитель или диспергирующее вещество, такие как Ph. Helv или похожий спирт. Фармацевтические композиции данного изобретения могут быть введены в форме суппозиториев для ректального или вагинального введения. Эти композиции могут быть получены путем смешивания соединения формулы (I) с подходящим нераздражающим носителем, который является твердым при комнатной температуре, но жидким при ректальной температуре и по этой причине будет расплавляться в прямой кишке с выделением активных компонентов. Такие материалы включают, но не ограничиваются,какао масло, пчелиный воск и полиэтиленгликоли. Местное введение фармацевтических композиций данного изобретения является особенно полезным, когда желаемое лечение включает области или органы, легко доступные для местного применения. Для местного применения на кожу, фармацевтическая композиция будет изготовлена с подходящей мазью, содержащей активные компоненты, суспендированные или растворенные в носителе. Носители для местного применения соединений данного изобретения включают, но не ограничиваются, минеральное масло, жидкие углеводороды, белый вазелин, пропиленгликоль, полиоксиэтиленполиоксипропиленовое соединение, эмульгирующий воск и воду. В качестве альтернативы фармацевтическая композиция может быть получена с подходящим лосьоном или кремом, содержащим активное соединение, суспендированное или растворенное в носителе. Подходящие носители включают, но не ограничиваются, минеральное масло, сорбитан моностеарат, полисорбат 60, воск на основе цетилэфиров, цетиариловый спирт, 2 октилдодеканол, бензиловый спирт и воду. Фармацевтические композиции данного изобретения могут также применяться местно в нижнем желудочно-кишечном тракте в виде ректальной композиции суппозиторий или в подходящей композиции для клизмы. Местно-трансдермальные пластыри и электрофоретическое введение также включены в данное изобретение. Фармацевтические композиции данного изобретения могут быть введены с помощью назального аэрозоля или ингаляции. Такие композиции получают согласно методам, хорошо известным в области создания лекарственных препаратов, и могут быть приготовлены в виде растворов в физиологическом растворе, с использованием бензилового спирта или других подходящих консервантов, стимуляторов всасывания для увеличения биодоступности, фторуглеродов, и/или других солюбилизирующих или диспергирующих агентов, известных из уровня техники. Такое введение, как известно, является эффективным в отношении лекарственных препаратов для лечения эректильной дисфункции: Rabinowitz J.D. иZaffaroni A.C., патент США US 6803031, принадлежащий Alexza Molecular Delivery Corporation. Применение рассматриваемых лекарственных средств может быть местным для введения их в нужную область. Для доставки рассматриваемых лекарственных средств в нужную область могут быть использованы, различные способы, такие как инъекция, использование катетеров, троакаров, спреев, плюронилового геля, стентов, полимеров для медленного высвобождения лекарственного средства или другого устройства, которое обеспечивает внутренний доступ. Также, согласно другому варианту осуществления изобретения соединение формулы (I) может быть введено в фармацевтическую композицию для покрытия имплантируемого медицинского устройства,такого как протез, искусственные клапаны, сосудистые трансплантаты, стенты или катетеры. Подходящие покрытия и общее получение покрытых имплантируемых устройств описаны в патентах США US 6099562; 5886026 и 5304121. Покрытиями являются типично биосовместимые полимерные материалы,такие как гидрогелевый полимер, полиметилдисилоксан, поликапролактон, полиэтиленгликоль, полимолочная кислота, этиленвинилацетат и их смеси. Эти покрытия, кроме того, необязательно покрывают подходящим верхним слоем фторсиликона, полисахаридов, полиэтиленгликоля, фосфолипидов или их комбинаций для придания композиции характеристик контролируемого выделения. Покрытия для инвазивных устройств должны быть включены в определение фармацевтически приемлемого носителя, адъюванта или переносчика, так как эти термины используются здесь. Согласно другому варианту осуществления изобретение представляет способ покрытия имплантируемого медицинского устройства, включающий стадию контактирования указанного устройства с композицией покрытия, описанной выше. Будет очевидным для специалистов в данной области, что покрытие устройства будет производиться до имплантации в организм млекопитающего. Согласно другому варианту осуществления изобретение представляет способ импрегнирования или заполнения имплантируемого медицинского устройства с выделением лекарственного средства, включающий стадию контактирования указанного устройства, выделяющего лекарственное средство, с соединением формулы (I) или фармацевтической композицией данного изобретения. Имплантируемое устройство с выделением лекарственного средства включает, но не ограничивается, биоразрушающиеся- 18014432 полимерные капсулы или шарики, неразрушающиеся, диффундирующие полимерные капсулы и биоразрушающиеся полимерные пластинки. Согласно другому варианту осуществления изобретение представляет имплантируемое медицинское устройство, покрытое соединением формулы (I) или фармацевтической композицией данного изобретения, такой, что указанное соединение является терапевтически активным. Согласно другому варианту осуществления изобретение представляет имплантируемое медицинское устройство с выделением лекарственного средства, импрегнированное или содержащее соединение формулы (I) или фармацевтическую композицию данного изобретения, такую, что указанное соединение выделяется из упомянутого устройства и является терапевтически активным. Когда орган или ткань является доступной вследствие удаления ее из организма пациента, такой орган или ткань может быть погружена в среду, содержащую фармацевтическую композицию данного изобретения, фармацевтическая композиция данного изобретения может быть нанесена на орган, или фармацевтическая композиция данного изобретения может быть применена любым другим подходящим способом. Настоящее изобретение также включает фармацевтические композиции, содержащие эффективное количество одного или более соединений формулы (I), в комбинации с эффективным количеством одного или более других терапевтических агентов, используемых для лечения или предотвращения состояния, выбранного из депрессии, гипертензии, генерализованного тревожного расстройства, посттравматического стрессового синдрома, болезненной замкнутости, сексуальной дисфункции; пищеварительных расстройств, включая булемию, нервно-психическую анорексию и компульсивное переедание; ожирения, химической зависимости, гистаминовой головной боли, мигрени; боли, включая нефропатическую боль, диабетическую нефропатическую боль, постоперационную боль, психогенные болевые расстройства и хронический болевой синдром; болезни Альцгеймера, обсессивно-компульсивного расстройства,панического расстройства с или без агарофобии, расстройств памяти, болезни Паркинсона, расстройств эндокринной системы, вазоспазма, мозжечковой атаксии, расстройств пищеварительного тракта, негативных симптомов шизофрении, предменструального синдрома, синдрома Фибромиалгии; недержания мочи, включая стрессовое недержание; синдрома Туретта, трихотилломании, клептомании, мужской импотенции, рака, хронической пароксизмальной мигрени и болезни молочной железы, расстройства дыхания во сне, когнитивных дефицитов в результате старения, инсульта, травмы головы, нейрогенеративных болезней, шизофрении, страха, агрессии и стрессового состояния, расстройства терморегуляции, респираторной болезни, биполярного расстройства, психоза, расстройства сна, мании, острой мании, болезни мочевого пузыря, мочеполового расстройства, кашля, рвоты, тошноты, и психических расстройств, таких как паранойя и маниакально-депрессивные болезни, тика, диабетической кардиомиопатии, диабетической ретинопатии, катаракты, инфаркта миокарда, продолжительной усталости, хронической усталости,синдрома хронической усталости, преждевременной эякуляции, подавленного настроения, послеродовой депрессии, социофобии, агрессивного поведения, расстройства мотивации, пограничного личностного расстройства, дефицита внимания без гиперактивности, синдрома Шая-Дрейджера, церебральной ишемии, травмы позвоночника, хореи Гентингтона, латерального амиотрофического склероза, ВИЧиндуцированного слабоумия, спазмов мускулатуры, конвульсий, пеританальной гипоксии, гипоксии,остановки сердца, гипогликемического невронального повреждениия, повреждения зрения и дегенерации сетчатки, отека мозга, поздней дискинезии и церебральных дефицитов, сопровождающих операции на сердце и пересадку тканей в условиях искусственного кровообращения, аффективных расстройств,расстройств психики, агорафобии без истории панического расстройства, острых стрессовых расстройств, аутизма, дискинезии, ожирения, обусловленного генетикой или условиями окружающей среды,поликистоза яичников, краниофарингеомы, синдрома Прадера-Вилли, синдрома Фрелиха, диабетов типаII, дефицита роста гормонов, синдрома Тернера; избыточной или нежелательной секреции или образования провосполительного цитокина, десинхроноза, бессонницы, повышенной сонливости, ночного энуреза, синдрома беспокойных ног, вазоокклюзивных осложнений, гипергликемии, гиперинсулинемии, гипертриглицеридемии, диабетов, невосприимчивости к инсулину, нарушенного метаболизма глюкозы,заболеваний с нарушенной переносимостью глюкозы (IGT), заболеваний с нарушенным уровнем глюкозы в плазме натощак, гломерулосклероза, синдрома X, ишемической болезни сердца, бронхиальной астмы, сосудистых рестенозов, эндотелиальной дисфункции, нарушенной адаптационной способности сосудов или острой сердечной недостаточности; и фармацевтически приемлемым носителем. Также в рамках настоящего изобретения находятся фармацевтические композиции, включающие эффективное количество соединения формулы (I) или фармацевтически приемлемую его соль; или пролекарство или фармацевтически приемлемую соль его пролекарства; или его сольват, гидрат или полиморф; в сочетании с эффективным количеством второго терапевтического агента, используемого для уменьшения побочных эффектов соединения 1, для повышения или усиления действия соединения 1, или для увеличения продолжительности фармакологического действия соединения 1; и фармацевтически приемлемый носитель. Дополнительные терапевтические агенты, используемые в сочетании с соединениями данного изобретения, включают, но не ограничиваются: антагонист или лиганд рецептора 5-HT1A; антагонист NK1- 19014432 рецептора; антагонист рецептора серотонина; 2-амино-4,5,6,7-тетрагидро-6-пропиламино-бензотиазол(прамипексол), его (+)- или (-)-энантиомер; сульфаматный антиконвульсивный агент; предшественник или пролекарство серотонина, или интермедиат в биосинтезе серотонина; селективные агонисты и антагонисты одного или обоих рецепторов 5-HT1A и 5-HT1D; композицию, содержащую диметиламиноэтанол(ДМАЭ), омега 3-жирные кислоты, бетаин, олигомерные проантоцианидины, фолиевую кислоту, витамины С, Е, В 12, В 6, B5 и бета-каротин и минералы (кальций, магний, цинк и селен); налтрексон; циклобензаприн или его метаболиты; оланзапин; оланзапин-N-оксид; 2-гидроксиметилоланзапин; или атипичное антипсихотическое средство; трамадол; ингибитор альдозоредуктазы или его пролекарство; 1-треометилфенидат; ингибитор фосфодиэстеразы III типа, IV типа, смеси тип III-тип IV или V типа или сложный эфир, амид, пролекарство, активный метаболит или их комбинации; замещенный индольный эстрогенный агент; (+)-1-(3,4-дихлорфенил)-3-азабицикло[3.1.0]гексан; фолиевую кислоту; метилтетрагидрофолат; WAY 100635; бетаксолол; (R)-3-N,N-дициклобутиламино-8-фторо-3,4-дигидро-2 Н-1-бензопиран 5-карбоксамид водород (2R,3R)-тартрат моногидрат; R-тофизопам; N-ацетилсеротонин; DRD2 специфичный агонист дофамина; антагонист 5 НТ 4-рецептора; налмефен; моксонидин; миртазапин; хром; селективный ингибитор циклооксигеназы-2; селективный антагонист 5 НТ 2 А-рецептора; антагонист CB1 рецептора; антагонист MCH-1R-рецептора; тетразамещенный пиримидопиримидин; селективный лиганд дофамин D4-рецептора; тримебутин; федотозин и его смеси; частичный агонист NMDA-рецептора; антагонист NMDA-рецептора; ингибитор холинэстеразы; ингибитор GSK-3; альфа-2-дельта лиганд или его пролекарство; экстракт кавы; ингибитор обратного захвата норэпинэфрина; кортикостероид; нестероидный иммунофилин-зависимый иммуносупрессор; N-десметилклозапин; (R)-2,3-бензодиазепин, как описано в заявке на патент США US 20040224943; селективный ингибитор неврональной синтазы окислов азота; модафинил; селективный антагонист окситоцина; антагонист никотинового рецептора; антагонист рецептора А 2 а аденозина; антагонист рецептора 5-HT2C; усилитель рецептора AMPA; частичный агонист никотина; ириндалон; лиганд дельта-опиоидного рецептора; стимулятор секреции гормона роста; пхлоро-N-(2-морфолиноэтил)бензамид и его метаболиты; фармацевтически приемлемую соль любого из указанных дополнительных терапевтических агентов; или комбинации двух или более упомянутых выше. Примеры 5-HT1A антагонистов и лигандов включают, но не ограничиваются, альпренолол, WAY 100135, WAY 100635, спиперон, пиндолол, (S)-UH-301, пенбутолол, пропранодол, тертатолол; (R)-5 карбамоил-8-фторо-3-N,N-дизамещенный-амино-3,4-дигидро-2 Н-1-бензопиран и другие, описанные в патентах США US 5776969; 5958429; 6136861; 6656951; 6780860; 6815448; 6821981; 6861427; 6894053; и заявке на патент США US 20050085475. Примеры антагонистов NK1-рецептора включают, но не ограничиваются, примерами, описанными в патентах США US 6162805; 6878732; заявке на патент США US 20050137208; также как CNSпроникающие агенты, способные ингибировать индуцированное агонистом NK1-рецептора движения лапок у песчанок или уменьшение голосовых сигналов, вызванных разлучением детенышей морских свинок. Примеры сульфаматных антиконвульсивных агентов включают, но не ограничиваются, топирамат и другие, описанные и приведенные в качестве ссылки в патенте США US 5384327. Примеры предшественников или пролекарств серотонина и интермедиатов в биосинтезе серотонина включают, но не ограничиваются, L-триптофан, L-5-гидрокситриптофан, диэтил Nбензилоксикарбонил-5-бензилоксикарбонилокси-L-триптофил-L-аспартат,дибензил(DL) 5-гидрокситриптофана и их комбинации. Примеры атипичных антипсихотических агентов включают, но не ограничиваются, рисперидон,клозапин, серокел, сертиндол, зипразидон, зотепин, оланзапин, илоперидон, Org 5222, мелперон, амперозид, SM-9018, JL-13 и их фармацевтически приемлемые соли. Примеры ингибиторов альдозо-редуктазы включают, но не ограничиваются, фидарестат, эпалре- 20014432 стат, миналрестат, SPR-210, зенарестат или зополрестат либо их пролекарство. Примеры селективных агонистов и антагонистов одного или обоих 5-HT1A и 5-HT1D рецепторов включают, но не ограничиваются, примеры, описанные в патенте США US 6562813. Примеры ингибиторов фосфодиэстеразы типа III включают, но не ограничиваются, бипиридины,такие как амринон, милринон и олпринон; анагрелид, беморадан, ибудиласт, изомазол, ликсазинон, мотапизон, олпринон, фталазинол, пимобендан, квазинон, сигвазодан и треквинзин. Примеры блокаторов кальциевых каналов включают, но не ограничиваются, амлодипин, дилтриазем, фелодипин, исрадипин, никардипин, нифедипин и верапамил. Примеры ингибиторов фосфодиэстеразы смешанного типа III-типа IV включают, но не ограничиваются, анагрелид, беморадан, ибудиласт, изомазол, ликсазинон, мотапизон, олпринон, фталазинол, пимобендан, квазинон, сигвазодан и треквинзин. Примеры ингибиторов фосфодиэстеразы типа IV включают, но не ограничиваются, пирролидиноны, в частности ролипрам; квиназолиндионы, производные ксантина, фенилэтилпиридины, тетрагидропиримидоны, производные диазепина, карбаматы оксимов, нафтиридиноны, бензофураны, производные нафталина, производные пурина, имидазолидиноны, циклогексанкарбоновые кислоты, бензамиды, пиридопиридазиноны, бензотиофены, этазолат, S-(+)-глауцин, замещенные фенильные соединения и замещенные бифенильные соединения, как описано далее в патенте США US 6403597. Примеры ингибиторов фосфодиэстеразы типа V включают, но не ограничиваются, силденафил,варденафил, тадалафил, запринаст, дипиридамол, 3-изобутил-8-(6-метокси-изохинолин-4-илметил)-1 метил-3,7-дигидро-пурин-2,6-дион; и примеры, раскрытые в заявках на патент США US 20030055070; 20040044005; 20030139429. Примеры замещенных индольных эстрогенных агентов включают, но не ограничиваются, примеры,описанные и приведенные в качестве ссылки в патенте США US 6369051. Пример DRD2-специфичного агониста дофамина включает, но не ограничивается, бромокриптин. Примеры антагонистов рецептора 5 НТ 4 включают, но не ограничиваются, А-85380, SB 204070, SB 207226, SB 207058, SB 207710, SB 205800, SB 203186, SDZ 205557, N 3389, FK 1052, SC 56184, SC 53606,DAU 6285, GR 125487, GR 113808, RS 23597, RS 39604, LY-353433 и R 50595. Примеры селективных ингибиторов циклооксигеназы-2 включают, но не ограничиваются, целекоксиб, валдекоксиб, деракоксиб, рофекоксиб, эторикоксиб, тилмакоксиб, цимикоксиб, и примеры, описанные и приведенные в качестве ссылки в заявках на патент США US 20050080084 и 20050085477. Примеры антагонистов 5-HT2a рецептора включают, но не ограничиваются, примеры, описанные и приведенные в качестве ссылки в заявке на патент США US 20050070577. Примеры антагонистов CB1 рецептора включают, но не ограничиваются, риминабант и примеры,описанные и приведенные в качестве ссылки в заявках на патент США US 20040248956, 20050009870,20050014786, 20050054659, 20050080087 и 20050143381. Примеры селективных антагонистов MCH-IR рецептора включают, но не ограничиваются, примеры, описанные и приведенные в качестве ссылки в заявках на патент США US 20050009815 и 20050026915. Примеры тетразамещенных пиримидопиримидинов включают, но не ограничиваются, дипиридамол, мопидамол, дипиридамол моноацетат,2,6-ди(2,2-диметил-1,3-диоксолан-4-ил)метокси-4,8-дипиперидинопиримидопиримидин; 2,6-бис-(2,3-диметиоксипропокси)-4,8-дипиперидинопиримидопиримидин; 2,6-бис-[N,N-ди(2-метокси)этил]-4,6-дипиперидинопиримидопиримидин- и 2,6-бис-(диэтаноламино)-4,8-ди-4-метоксибензиламинопиримидопиримидин-. Примеры селективных лигандов рецепторов дофамина D4 включают, но не ограничиваются, пипамперон, фанансерин, L-745,870, PNU-101387G и U-101387. Пример частичного агониста рецептора NMDA включает, но не ограничивается, D-циклосерин. Примеры антагонистов рецептора NMDA включают, но не ограничиваются, декстрометорфан, декстрорфан, амантадин и мемантин. Примеры ингибиторов холинэстеразы включают, но не ограничиваются, такрин, донепезил, эдрофоний, галантамин, физостигмин, эптастигмин, пиридостигмин, неостигмин, ганстигмин, ривастигмин,демекарий, амбеноний, сарин, метрифонат, зоман, табун и диизопропилфторфосфаты. Примеры ингибиторов GSK-3 включают, но не ограничиваются, примеры, описанные и приведенные в качестве ссылки в заявке на патент США US 20050026946. Примеры альфа-2-дельта лигандов включают, но не ограничиваются, габапентин, прегабалин,[(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусная кислота,3-(1-аминометилциклогексилметил)-4 Н-[1,2,4]-оксадиазол-5-один,С-[1-(1 Н-тетразол-5-илметил)циклогептил]метиламин,(3S,4S)-(1-аминометил-3,4-диметилциклопентил)уксусную кислоту,(1,3,5)(3-аминометилбицикло[3.2.0]гепт-3-ил)уксусную кислоту,(3S,5R)-3-аминометил-5-метилкаприловую кислоту,(3S,5R)-3-амино-5-метилэнантовую кислоту,- 21014432(3S,5R)-3-амино-5-метилкаприловую кислоту. Примеры ингибиторов обратного захвата норэпинэфрина включают, но не ограничиваются, дезипрамин, имипрамин, амоксапин, нортриптилин, протриптилин, атомоксетин, оксапротилин, мапротилин,ребоксетин, 1-[1-(3-хлорфенил)-2-(4-метил-1-пиперазинил)этил]циклогексанол; и примеры, описанные в заявке на патент США US 20050014848. Примеры кортикостероидов включают, но не ограничиваются, преднизолон, будезонид, кортизон,дексаметазон, гидрокортизон, метилпреднизолон, флутиказон, преднизон, триамцинолон и дифлоразон. Примеры нестероидных иммунофилин-зависимых иммуносупрессоров включают, но не ограничиваются, циклоспорин, такролимус, ISAtx247, аскомицин, пимекролимус, рапамицин и эверолимус. Примеры селективных ингибиторов неврональной синтазы окислов азота включают, но не ограничиваются, примеры, описанные в заявке на патент США US 20040229911. Пример селективного антагониста окситоцина включает, но не ограничивается, L-368,899. Примеры антагонистов никотинового рецептора включают, но не ограничиваются, мекамиламин,амантадин, пемпидин, дигидро-бета-эритроидин, гексаметоний, эризодин, хлоризондамин, триметафан камзилат, тубокурарин хлорид, d-тубокурарин и их оптические изомеры. Примеры антагонистов А 2 а рецептора аденозина включают, но не ограничиваются, примеры, описанные в заявке на патент США US 20030139395. Примеры антагонистов рецептора 5-НТ 2 С, обратных агонистов и частичных агонистов включают,но не ограничиваются, кетансерин, SB 242084, SB 206553, SB 243213, SB 228356, ритансерин, дерамциклан, миртазепин, миансерин, сертиндол, YM 35 992, Ro 60-0795, Org 38457, Org 12962, EGIS 8465 и RS 102221. Примеры усилителей рецептора АМРА включают, но не ограничиваются,[(метилэтил)сульфонил]2-[4-(4-2-[(метилсульфонил)амино]этилфенил)фенил]пропиламин,(2R)-2-[4-(4-2-[(метилсульфонил)амино]этилфенил)фенил]пропил[(метилэтил)сульфонил]амин,N-2-(4-(3-тиенил)фенилпропил)-2-пропансульфонамид,[2-фтор-2-(4-3-[(метилсульфонил)амино]фенилфенил)пропил][(метилэтил)сульфонил]амин и, отдельно,каждый энантиомер [2-фтор-2-(4-3-[(метилсульфонил)амино]фенилфенил)пропил][(метилэтил) сульфонил]амина. Примеры частичных агонистов никотинового рецептора включают, но не ограничиваются, примеры, описанные в заявках на патент США US 20010036943 и 20030109544. Примеры лигандов дельта опиоидных рецепторов включают, но не ограничиваются, примеры, описанные и приведенные в качестве ссылки в заявке на патент США US 20020077323. Примеры стимуляторов секреции гормона роста включают, но не ограничиваются, примеры, описанные в заявках на патент США US 20020002137 и 20020086865. В другом выполнении изобретение представляет отдельные лекарственные формы соединения формулы (I) и второго терапевтического агента, в которых названное соединение и названный второй терапевтический агент соединены друг с другом. Выражение "соединены друг с другом", использованное здесь, означает, что отдельные лекарственные формы находятся вместе в одной и той же упаковке (например, в отдельных блистерах, скрепленных друг с другом, в отдельных ячейках одного ячеистого контейнера, в отдельных емкостях, находящихся в одной коробке, и т.д.), или иначе соединенных друг с другом так, что сразу видно, что эти лекарственные формы должны быть проданы и применены вместе (с интервалом между ними менее чем 24 ч, последовательно или одновременно. В фармацевтической композиции изобретения соединение формулы (I) представлено в эффективном количестве. Использованное здесь выражение "эффективное количество" относится к количеству,которое при введении в режиме надлежащей дозировки, является достаточным, чтобы снизить или смягчить тяжесть, продолжительность или прогрессирование болезни или повысить функции, поставленные под угрозу расстройством, связанным с недостаточной нейротрансмиссией серотонина, предотвратить развитие расстройства, характеризующегося недостаточной нейротрансмиссией серотонина, вызвать регрессию расстройства, характеризующегося недостаточной нейротрансмиссией серотонина, или усилить или улучшить профилактику или терапевтический эффект(ы) другой терапии. В некоторых предпочтительных исполнениях лечение согласно изобретению приводит к уменьшению или предотвращению по крайней мере одного симптома или проявления болезни, которая связана с недостаточной нейротрансмиссией серотонина, как установило in vivo или in vitro ингибирование по крайней мере около 10%, предпочтительно 20, 30, 40, 50, 60, 70, 80, 90, 95, 98 или 99% клеточного захвата серотонина. В отношении подавления активности обратного захвата серотонина выражение "эффективное количество" означает количество, которое приводит к заметному увеличению количества или концентрации серотонина у пациента или в биологическом образце, коррекции или облегчению реакции,дефицита, симптома, синдрома или расстройства, связанного с пониженной или недостаточной нейротрансмисиией серотонина, самостоятельно или в комбинации с другим агентом или агентами; или возбуждению, активности или ответной реакции, которые связаны с нормализованной или увеличенной- 22014432 нейротрансмиссией серотонина. Соотношение дозировок для животных и людей (выраженных в миллиграммах на квадратный метр поверхности тела) описано в Freireich et al., (1966) Cancer Chemother Rep 50: 219. Площадь поверхности тела может быть приблизительно определена по росту и весу пациента. См., например, Scientific Tables,Geigy Pharmaceuticals, Ardley, N.Y., 1970, 537. Эффективное количество соединения формулы (I) может варьироваться от около 0,001 до около 500 мг/кг, более предпочтительно от 0,01 до около 50 мг/кг, еще более предпочтительно от 0,025 до около 1,5 мг/кг. Эффективные дозы также будут варьироваться, как установлено специалистами, в зависимости от болезни, ее тяжести, способа введения, пола, возраста и общего состояния здоровья пациента, использования наполнителя, возможности совместного использования с другими терапевтическими методами, такими как использование других агентов, и реакции пациента. Для фармацевтической композиции, которая включает второй терапевтический агент, эффективное количество этого второго терапевтического агента варьируется между около 20 и 100% дозировки, стандартно используемой в режиме монотерапии, использующей только этот добавочный агент. Предпочтительно эффективное количество составляет между около 70 и 100% стандартной монотерапевтической дозы. Стандартные монотерапевтические дозировки этих вторых терапевтических агентов хорошо известны специалистам. См., например, Wells et al., eds., Pharmacotherapy Handbook, 2nd Edition, Appletonand Lange, Stamford, Conn. (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, Deluxe Edition, Tarascon Publishing, Loma Linda, Calif. (2000), каждый из которых полностью приведен здесь в качестве ссылки. Ожидается, что некоторые из вторых терапевтических агентов, перечисленных выше, будут синергически взаимодействовать с соединениями этого изобретения. Если это произойдет, то позволит снизить эффективную дозировку второго терапевтического агента и/или соединения формулы (I) по сравнению с требованиями монотерапии. Это дает преимущество в минимизации токсических побочных эффектов либо второго терапевтического агента, либо соединения формулы (I), синергического улучшения эффективности, облегчения введения или использования и/или снижения общих расходов на приготовление соединения или лекарственного средства. Методы лечения В одном осуществлении настоящее изобретение представляет метод ингибирования захвата серотонина у субъекта, включающий этап введения названному субъекту эффективного количества соединения формулы (I), предпочтительно, как часть композиции, дополнительно включающей фармацевтически приемлемый носитель. Предпочтительно этот метод используется для лечения субъекта, страдающего от или склонного к одной или более болезням или расстройствам, таким как депрессия, обсессивнокомпульсивное расстройство, генерализованная тревожность, посттравматический стресс, глубокая депрессия, паническое расстройство, социофобия, предменструальный синдром, сердечные расстройства,несердечная грудная боль; пристрастие к курению (вызвать прекращение или предотвратить рецидив); снижение состояний активации тромбоцитов, алкоголизм и алкогольная зависимость; психические синдромы, включая гнев, отклонение сенситивности и недостаточность ментальной и физической энергии; поздняя лютеиновая фаза дисфорического расстройства, преждевременная эякуляция, старческое слабоумие, ожирение, болезнь Паркинсона или аффективная агрессия. Метод может быть также использован для лечения субъекта, страдающего от или чувствительного к ингибированию роста раковых клеток, методам стимуляции костеобразования путем стимуляции остеобластов, лечению дерматитов или таких расстройств, как гиперпролиферативные или воспалительные кожные заболевания, и лечению преждевременного женского оргазма. Другие осуществления включают некоторые из методов, приведенных здесь, когда субъект нуждается в предписанном лечении. Более предпочтительно, этот метод используется для лечения субъекта, страдающего от или восприимчивого к одной или более болезням или расстройствам, таким как глубокая депрессия, обсессивнокомпульсивное расстройство, социальное тревожное расстройство, генерализованное тревожное расстройство, посттравматический стресс и предменструальное дисфорическое расстройство. Другим аспектом изобретения является соединение формулы (I) для использования в ингибировании захвата серотонина у субъекта. Такое использование предпочтительно для субъектов при лечении или предотвращении болезни, расстройства или симптомов, изложенных выше. Другим аспектом изобретения является использование соединения формулы (I) в производстве лекарственного средства для ингибирования захвата серотонина у субъекта. Предпочтительно это лекарственное средство используется для пациентов при лечении или предупреждении болезни, расстройства или симптомов, изложенных выше. В другом осуществлении метод лечения, кроме того, включает этап введения названному пациенту одного или более терапевтических агентов, которые самостоятельно или в комбинации с соединением 1 являются эффективными при лечении депрессии, гипертензии, генерализованного тревожного расстройства, посттравматического стрессового синдрома, болезненной замкнутости, сексуальной дисфункции; пищеварительных расстройств, включая булемию, нервно-психическую анорексию и компульсивное переедание; ожирения, химической зависимости, гистаминовой головной боли, мигрени; боли, включая- 23014432 нефропатическую боль, диабетическую нефропатическую боль, постоперационную боль, психогенные болевые расстройства и хронический болевой синдром; болезни Альцгеймера, обсессивнокомпульсивного расстройства, панического расстройства с или без агарофобии, расстройств памяти, болезни Паркинсона, расстройств эндокринной системы, вазоспазма, мозжечковой атаксии, расстройств пищеварительного тракта, негативных симптомов шизофрении, предменструального синдрома, синдрома Фибромиалгии; недержания мочи, включая стрессовое недержание; синдрома Туретта, трихотилломании, клептомании, мужской импотенции, рака, хронической пароксизмальной, мигрени и болезни молочной железы, расстройства дыхания во сне, когнитивных дефицитов в результате старения, инсульта,травмы головы, нейрогенеративных болезней, шизофрении, страха, агрессии и стрессового состояния,расстройства терморегуляции, респираторной болезни, биполярного расстройства, психоза, расстройства сна; мании, включая острую манию; болезни мочевого пузыря, мочеполового расстройства, кашля, рвоты, тошноты, психических расстройств, таких как паранойя и маниакально-депрессивные болезни, тика,диабетической кардиомиопатии, диабетической ретинопатии, катаракты, инфаркта миокарда, продолжительной усталости, хронической усталости, синдрома хронической усталости, преждевременной эякуляции, подавленного настроения, послеродовой депрессии, социофобии, агрессивного поведения, расстройства мотивации, пограничного личностного расстройства, дефицита внимания без гиперактивности,синдрома Шая-Драйджера, церебральной ишемии, травмы позвоночника, хореи Гентингтона, латерального амиотрофического склероза, ВИЧ-индуцированного слабоумия, спазмов мускулатуры, конвульсий,пеританальной гипоксии, гипоксии, остановки сердца, гипогликемического невронального повреждения,повреждения зрения и дегенерации сетчатки, отека мозга, поздней дискинезии, церебральных дефицитов,сопровождающих операции на сердце и пересадку тканей в условиях искусственного кровообращения,аффективных расстройств, расстройств психики, агорафобии без истории панического расстройства,острых стрессовых расстройств; и для снижения побочных эффектов соединения 1, увеличения или усиления активности соединения 1 или для увеличения длительности фармакологического действия соединения 1. В другом осуществлении метод лечения также включает дополнительный этап введения названному пациенту одного или более терапевтических агентов, которые самостоятельно или в комбинации с соединением 1 являются эффективными для лечения одного или более состояний аутизма, дискинезии,ожирения, обусловленного генетикой или условиями окружающей среды, поликистоза яичников, краниофарингеомы, синдрома Прадера-Вилли, синдрома Фрелиха, диабетов типа II, дефицита роста гормонов, синдрома Тернера; секреции или образования провосполительного цитокина, десинхроноза, бессонницы, повышенной сонливости, ночного энуреза, синдрома беспокойных ног, вазо-окклюзивных осложнений, гипергликемии, гиперинсулинемии, гипертриглицеридемии, диабетов, невосприимчивости к инсулину, нарушенного метаболизма глюкозы, заболеваний с нарушенной переносимостью глюкозы (IGT),заболеваний с нарушенным уровнем глюкозы в плазме натощак, гломерулосклероза, синдрома X, ишемической болезни сердца, бронхиальной астмы, сосудистых рестенозов, эндотелиальной дисфункции,нарушенной адаптационной способности сосудов или острой сердечной недостаточности; или для того,чтобы усилить действие соединения 1. В каждом из вышеупомянутых осуществлений второй терапевтический агент или агенты могут быть введены вместе с соединением формулы (I) как часть единой дозы или как раздельные дозы. Выборочно, второй терапевтический агент или агенты могут быть введены до, последовательно или после введения соединения формулы (I). В такой комбинированной терапии, как соединения данного изобретения, так и второй терапевтический агент(ы) вводятся обычными методами. Введение второго терапевтического агента(ов) может происходить до, одновременно и/или после введения соединения формулы(I). Когда введение второго терапевтического агента происходит одновременно с соединением формулы(I), то эти два (или более) агента могут быть введены единой дозой (такой, как композиция этого изобретения, включающая соединение формулы (I), второй терапевтический агент или агенты, как описано выше, и фармацевтически допустимый носитель), или как отдельные лекарственные дозы. Введение композиции данного изобретения, включающей как соединение формулы (I), так и второй терапевтический агент(ы) субъекту, не препятствует отдельному введению названного второго терапевтического агента(ов), какого-либо другого терапевтического агента или какого-либо соединения данного изобретения указанному субъекту в другое время в течение курса лечения. Эффективные количества второго терапевтического агента или агентов, используемые в методах данного изобретения, хорошо известны специалистам, и руководство по дозированию может быть найдено в патентах, приведенных здесь в качестве ссылок, а также в Wells et al., eds.:, Pharmacotherapy Handbook, 2nd Edition, Appleton and Lange, Stamford, Conn. (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, Deluxe Edition, Tarascon Publishing, Loma Linda, Calif. (2000), и других медицинских источниках. Однако, хорошо в рамках компетенции специалистов определить оптимальную область значений эффективного количества дополнительного агента(ов). В одном осуществлении данного изобретения, если один или более вторых терапевтических агентов вводятся животному, эффективное количество соединения формулы (I) меньше, чем было бы его эффективное количество в случае, когда второй терапевтический агент(ы) не вводится. В другом исполнении- 24014432 эффективное количество второго терапевтического агента меньше, чем было бы его эффективное количество в случае, когда соединение формулы (I) не вводится (т.е. количество каждого второго терапевтического агента(ов), вводимого при монотерапии). В этом случае, нежелательные побочные эффекты, связанные с высокими дозами любого агента, могут быть минимизированы. Другие возможные преимущества (включая неограниченное улучшение дозировочных режимов и/или снижение цены препарата) будут видны специалистам. Вторые терапевтические агенты, используемые в методе лечения, являются такими же, как терапевтические агенты, описанные выше, как часть составных композиций. Согласно другому аспекту, изобретение представляет соединение формулы (I) и один или более вышеописанных вторых терапевтических агентов, либо в единой композиции, либо как отдельные дозы для использования в лечении или предупреждении у субъекта болезни, расстройства или симптомов,изложенных выше. Еще в другом аспекте изобретение представляет использование соединения формулы (I) и одного или более вышеописанных вторых терапевтических агентов в производстве лекарственного средства,либо как единой композиции, либо в форме отдельных лекарственных доз для лечения или предупреждения у субъекта болезни, расстройства или симптомов, изложенных выше. Соединения этого изобретения могут быть легко исследованы на биологическую активность известными методами. Например, существуют методы in vitro для определения присоединения к серотонину транспортера, использующие рекомбинантные клеточные линии, например, см. Poss M.A. et al., патент США US 6225324 to Bristol-Myers Squibb; и ex vivo ткани мозга, например, см. Young J.W. et al., патент США US 5648396 to Sepracor; и Habert E. et al., Eur. J. Pharmacol, 1985, 118: 107. Модели депрессии на животных представляют воспроизводимые результаты, которые коррелируют с клиническим ответом человека на антидепрессанты, включая ингибиторы обратного захвата серотонина и, в частности, соединения 1. Например, см. Porsolt R.D. et al., Eur. J. Pharmacol. 1979, 57: 201; Detke(eds.), p. 304, 1997, Springer-Verlag, New York; и El Yacoubi M et al., Proc. Natl. Acad. Sci. USA 2003 100: 6227; для описания хорошо известного теста принудительного плавания и теста подвешивания за хвост. Каждое из соединений данного изобретения может быть испытано на таких животных моделях. Скорость метаболизма соединений этого изобретения может быть определена и сравнена со скоростью метаболизма соединения 1 в присутствии, например гетерологически экспрессирующегосяCYP2D6, или микросом печени человека (оба доступны в BD Gentest, Woburn, MA). Соединения также могут быть испытаны на живых животных, например, после перорального или парентерального ведения,с измерением исчезновения введенного соединения и, при желании, выхода метаболитов. Средства для таких измерений хорошо известны, например, см. Segura M. et al., Rapid Commun. Mass Spectrom., 2003,17: 1455; и Hartter S. et al., Ther. Drug Monit. 1994, 16: 400. Инактивация CYP2D6 соединениями данного изобретения также может быть измерена с помощью известного способа определения соответствующих ферментативных параметров, таких как kINACT. См., например, Bertelsen KM et al., Drug Metab. Dispos. 2003, 31: 289. Воздействие соединения формулы (I) на другие средства, о которых известно, что их метаболизм происходит в присутствии ферментов цитохрома семейства 2D, также может быть оценено и сравнено с соответствующими действиями, обусловленными соединением 1; например, см. Hashimoto K.et al., Eur. J. Pharmacol. 1993, 228: 247. Это взаимодействие может быть измерено либо после единичных доз соединения 1 и соединения формулы (I), либо после повторных доз, чтобы оценить инактивацию накопленного цитохрома. Методы диагностики и устройства Согласно другому осуществлению изобретение представляет метод определения концентрации соединения 1 в биологическом образце, при этом названный метод включает этапы: а) добавление второго соединения известной концентрации к названному биологическому образцу,при этом названное второе соединение имеет формулу (I)D является дейтерием; каждый Y независимо выбран из дейтерия или водорода; каждый водородный атом необязательно замещен дейтерием и- 25014432 каждый углеродный атом выборочно замещен 13 С;b) анализ названного биологического образца на измерительном устройстве, который отличает соединение 1 от названного второго соединения;c) калибрование названного измерительного устройства, чтобы скоррелировать найденное количество соединения 1 с названным вторым соединением известной концентрации, добавленным к названному биологическому образцу; иd) определение концентрации названного соединения в названном биологическом образце путем сравнения найденного количества соединения 1 с найденным количеством и известной концентрацией названного второго соединения. Измерительные устройства, которые могут отличить соединение 1 от второго соединения, включают любое измерительное устройство, которое может различать два соединения, обладающие идентичной структурой, но одно из них содержит один или более тяжелых атомов изотопа в отличие от другого. Предпочтительно таким измерительным устройством является масс-спектрометр. В предпочтительном осуществлении по крайней мере три связанных атома водорода и углерода в названном втором соединении соответственно являются дейтерием и 13 С; т.е. (общее количествоD)+(число 13 С)3. В другом предпочтительном осуществлении метод включает дополнительный этап выделения как соединения 1, так и названного второго соединения из названного биологического образца путем органической или твердофазной экстракции перед этапом b). Соединение 1 и второе соединение будут иметь подобные растворимости, экстракционные и хроматографические свойства, но значительно различаться по молекулярной массе. Так, второе соединение используется как внутренний стандарт в методе, который включает этап органической или твердофазной экстракции, для измерения эффективности этой экстракции и гарантии точности определения истинной концентрации соединения 1 (см. Tuchman M. и McCann М.Т., Clin. Chem. 1999, 45: 571; Leis H.J. et al., J.Mass Spectrom. 2001, 36: 923; Taylor R.L. et al., Clin. Chem. 2002, 48: 1511). Соединения настоящего изобретения (второе соединение) особенно полезны в этом методе, так как они не радиоактивны и не являются опасными для персонала, работающего с этими соединениями. Таким образом, эти методы не требуют предосторожностей, кроме тех, что обычно используются при клинических анализах образцов. Более того, меченые изотопы уже давно целенаправленно используются как помощники при исследовании ферментативного механизма ферментов цитохрома Р 450 (например, Korzekwa K.R. et al., DragMetab. Rev. 1995, 27: 45 и упомянутые там ссылки; Kraus J.A. и Guenderich F.P., J. Biol. Chem. 2005, 280: 19496; Mitchell K.H. et al., Proc. Natl. Acad. Sci. USA, 2003, 109: 3784). В другом осуществлении изобретение представляет диагностическое устройство, включающее: а) одно или более диагностических соединений, имеющих формулу (I)D является дейтерием; каждый Y независимо необязательно выбран из водорода или дейтерия; каждый водородный атом необязательно замещен дейтерием и каждый углеродный атом выборочно замещен 13 С; иb) инструкции по использованию названного соединения, чтобы определить концентрацию испытуемого соединения в биологическом образце. В другом осуществлении изобретение представляет способ оценки метаболической стабильности соединения формулы (I), включающий этапы контактирования соединения формулы (I) или его соли присоединения кислоты с источником метаболизирующего фермента в течение некоторого периода времени; и сравнение количества названного соединения и продуктов метаболизма названных соединений после названного периода времени. В одном предпочтительном осуществлении способ включает дополнительный этап сравнения количества названного соединения и названных продуктов метаболизма названных соединений с интервалом в течение названного периода времени. Этот способ позволяет определить скорость метаболизма названного соединения.- 26014432 В другом предпочтительном осуществлении способ включает дополнительные этапы контактирования соединения формулы (I) с названным источником метаболизирующего фермента; сравнение количества названного соединения формулы (I) и продуктов метаболизма названного соединения формулы (I) после названного периода времени определения скорости метаболизма названного соединения формулы(I); и сравнение метаболической стабильности соединения 1 и названного соединения формулы (I). Этот способ используется при определении того, вызывает ли увеличение метаболической стабильности дополнительное замещение атомов соединения формулы (I) дейтерием или 13 С и на каком сайте. Это так же используется при сравнении метаболической стабильности соединения формулы (I) с метаболической стабильностью соединения 1. Источником метаболизирующего фермента может быть очищенный, выделенный или частично очищенный метаболический белок, такой как цитохром Р 450; биологическая фракция, такая как микросомы печени человека; или фрагмент метаболизирующего органа, такой как клетка или срез печени. Определение количества соединения и продуктов его метаболизма хорошо известны специалистам. Это обычно достигается удалением аликвотной пробы из реакционной смеси, которая подвергается анализу, дающему возможность установить различие между соединением и его метаболитами, такому как реверсивно-фазовая ВЭЖХ с УФ-поглощением или масс-спектроскопическое определение. Концентрации как метаболизирующего фермента, так и соединения могут изменяться с целью определения кинетических параметров, например, путем использования надлежащей программы криволинейной регрессии,известной специалистам. Из сравнения кинетических параметров как соединения формулы (I), так и соединения 1, видимое устойчивое влияние изотопа дейтерия (D(V/K можно определить как отношение продуктов, образованных при реакциях водородной формы к дейтериевой. Определение скорости метаболизма соединения формулы (I) может быть достигнуто в реакции отдельно от реакции определения скорости метаболизма соединения 1. Как вариант, соединение 1 может быть смешано с соединением формулы (I) в конкурентном эксперименте определения скоростей исчезновения этих двух соединений, используя аналитические технические средства, способные дифференцировать эти два соединения, основываясь на различии их масс. Еще в одном осуществлении предстационарное состояние кинетики, такое как V0, может быть определено известными специалистам средствами, например, используя устройство блокировки незанятых сайтов связывания, контролируя реакции блокирования в разное время после смешивания соединения или изотополога с источником метаболизирующего фермента. В соотнесенном осуществлении изобретение представляет устройство, включающее в отдельных емкостях: а) соединение 1 и b) источник метаболизирующего фермента. Устройство используется для сравнения метаболической стабильности соединения формулы (I) с соединением 1, а также оценки влияния замены дейтерия и 13 С в разных позициях на соединение формулы (I). В предпочтительном исполнении, устройство так же включает инструкции по использованию соединения 1 и названного источника метаболизирующего фермента для оценки метаболической стабильности соединения формулы (I). Для полного понимания настоящего изобретения далее представлены примеры. Они не предназначены для ограничения масштаба изобретения, и следующие примеры будут ясны обычному специалисту. В каждом представленном далее примере углерод будет 12 С, и водород - 1H, широко распространенные в природе, кроме иначе оговоренных случаев. Пример 1. Дейтеродибромметан. Раствор 1,1 моль дейтерооксида натрия в 140 мл оксида дейтерия обрабатывали в среде аргона 116 ммоль оксида мышьяка до образования раствора арсенита натрия. Бромоформ (190 ммоль) обрабатывали в среде аргона 6,5 мл этанола-d (CH3CH2OD) и 1 мл раствора арсенита натрия и быстро нагревали(струей теплого воздуха) для инициации реакции. Остаток раствора арсенита натрия добавляли по каплям с такой скоростью, чтобы поддержать небольшой возврат жидкости, затем смесь нагревали при 100 С на водяной бане в течение еще 4,5 ч. Смесь азеотропно перегоняли, затем отделяли дистиллят и водные слои экстрагировали 15 мл пентана. Органические слои соединяли, высушивали над хлоридом кальция (CaCl2) и перегоняли, чтобы приготовить названное соединение. Пример 2. 2-Дейтеробензо[d][1,3]диоксол-5-карбальдегид (формула V, где Y=H и R=формил). Раствор 3,4-дигидроксибензальдегида (20 ммоль) в 60 мл диметилформамида (ДМФ) обрабатывали в атмосфере аргона 60 ммоль продукта из примера 1 и 70 ммоль CsF. Смесь нагревали при 140 С на водяной бане в течение 3 ч при сильном перемешивании. Затем смесь фильтровали, концентрировали в вакууме и остаток очищали силикагельной флэш-хроматографией (растворитель для элюирования простой эфир/гексаны), чтобы приготовить названный продукт. Пример 3. 2-Дейтеробензо[d][1,3]диоксол-5-ил формиат. Порцию в 13,4 мл уксусного ангидрида нагревали в атмосфере аргона при 40 С на бане и обрабатывали в течение 6 ч в виде трех равных порций, 10 ммоль 50% перекиси водорода. Раствор обрабатывали 10 ммоль продукта из примера 2, и реакция продолжалась в течение 2 ч при около 40 С. Растворители удаляли в вакууме и осадок очищали перегонкой в трубке с шаровым расширением при давлении около 2 мм рт.ст., чтобы приготовить названное соединение. Пример 4. 2-Дейтеробензо[d][1,3]диоксол-5-ол (формула (II), где Y=H).- 27014432 Порцию в 6,4 ммоль продукта из примера 3 растворяли в 2 мл метанола и смесь обрабатывали 21 мкл уксусной кислоты, затем нагревали с обратным холодильником в течение 15 ч. Раствор концентрировали в вакууме и осадок перегоняли в трубке с шаровым расширением (приблизительно 2 мм Hg),чтобы приготовить названное соединение. Пример 5. 2,2-Дейтеробензо[d][1,3]диоксол-5-карбальдегид (формула V, где Y=D и R=формил). В перегонную колбу простого перегонного устройства с холодильником, наполненным сухим льдом, загружали 50 мл 1-метил-2-пирролидинона и 125 ммоль K2CO3. Смесь нагревали при 130 С и добавляли к ней при сильном перемешивании раствор 100 ммоль 3,4-дигидроксибензальдегида в 15 мл 1 метил-2-пирролидинона. Одновременно, в течение 3 ч, подавали 25 г дидейтеродихлорметана через шприц под высоким давлением с подающей иглой, находящейся непосредственно в перемешиваемом растворителе. К 3 ч перегнанный избыток дидейтеродихлорметана удаляли из приемной колбы и снова инжектировали в реакцию так же, как указано выше, в течение 1,5 ч. Эту рециркулирующую процедуру повторяли еще дважды с интервалами в 1 ч (общее время реакции 6,5 ч). Смесь охлаждали, фильтровали и перегоняли сначала при атмосферном давлении для удаления оставшегося растворенного дидейтеродихлорметана, затем приблизительно при 12 мм рт.ст., чтобы получить названное соединение. Пример 6. 2,2-Дидейтеробензо[d][1,3]диоксол-5-ил формиат. Порцию продукта из примера 5 в количестве 68 ммоль окисляли перуксусной кислотой согласно обычной процедуре, изложенной выше в примере 3, чтобы получить названное соединение после вакуумной перегонки. Пример 7. 2,2-Дидейтеробензо[d][1,3]диоксол-5-ол (формула (II), где Y=D). Порцию продукта из примера 6 в количестве 52,5 ммоль подвергали реакции с метанолом и уксусной кислотой согласно обычной процедуре, изложенной выше в примере 4, чтобы получить названное соединение после вакуумной перегонки. Пример 8.(3S,4R)-бензил 3-2-дейтеробензо[d][1,3]диоксол-5-илокси)метил)-4-(4 фторфенил)пиперидин-1-карбоксилат (формула (III), где Y=H и W=бензилоксикарбонил). Раствор 2,7 ммоль продукта из примера 4 в 10 мл ацетона обрабатывали 4 ммоль тонко измельченного карбоната цезия, затем 2,7 ммоль (3S,4R)-бензил 4-(4-фторфенил)-3-метилсульфонилоксим)метил)пиперидин-1-карбоксилат (Sugi K. et al., патент США US 6476227 to Sumika). Смесь нагревали с обратным холодильником в течение 8 ч, затем охлаждали, фильтровали и концентрировали в вакууме. Остаток разделяли между этилацетатом и водой, органический слой промывали насыщенным водным раствором NaCl, сушили и концентрировали в вакууме. Этот остаток использовали в последующих реакциях без дальнейшей очистки. Пример 9. (3S,4R)-3-2-дейтеробензо[d][1,3]диоксол-5-илокси)метил)-4-(4-фторфенил)пиперидин гидрохлорид (формула (I), где Y=H). Все, полученное в примере 8, за исключением приблизительно 2 мг оставленного образца, растворяли в 8 мл этанола, обрабатывали каталитическим количеством 10% палладия (Pd) на угле (на кончике шпателя) и перемешивали в атмосфере водорода (баллонного) в течение около 16 ч. Смесь фильтровали и концентрировали, и остаток помещали в толуол: и снова концентрировали. Остаток растворяли в около 2.5 мл сухого изопропанола и обрабатывали газообразным хлоридом водорода, чтобы получить белый осадок. Избыток HCl выдували барботированием струи аргона в растворе около 3 мин, затем смесь фильтровали, промывали небольшим количеством изопропанола для получения названного продукта. Пример 10.(3S,4R)-бензил 3-2,2-дидейтеробензо[d][1,3]диоксол-5-илокси)метил)-4-(4 фторфенил)пиперидин-1-карбоксилат (формула (III), где Y=H и W=бензилоксикарбонил). Порцию 11,1 ммоль продукта из примера 7 обрабатывали (3S,4R)-бензил 4-(4-флюорофенил)-3 метилсульфонилокси)метил)пиперидин-1-карбоксилата согласно обычной процедуре, изложенной выше в примере 8, чтобы получить сырой продукт, который после очищения посредством силикагельной хроматографии с использованием этилацетата/гексана для элюирования давал названное соединение. Пример 11. (3S,4R)-3-2-дейтеробензо[d][1,3]диоксол-5-илокси)метил)-4-(4-фторфенил)пиперидин гидрохлорид (формула (I), где Y=D). Гидрогенизация порции продукта 6,8 ммоль из примера 10 и образование соли гидрохлорида согласно обычной процедуре, изложенной выше в примере 9, дает названное соединение. Пример 12. (3S,4R)-трет-бутил 4-(4-фторфенил)-3-(гидроксиметил)пиперидин-1-карбоксилат. Порцию 6,7 ммоль (3S,4R)-бензил 4-(4-фторфенил)-3-(гидроксиметил)пиперидин-1-карбоксилата(патент США US 6476227) растворяли в 25 мл диоксана и обрабатывали в среде аргона с 7,1 ммоль дитрет-бутилдикарбоната и 200 мг 10% Pd/C. Смесь гидрировали в атмосфере водорода (баллонного) в течение около 17 ч, затем фильтровали и концентрировали в вакууме. Остаток очищали хроматографией с силикагелем (растворитель для элюирования метанол/метиленхлорид), чтобы получить названный продукт. Пример 13. (3S,4R)-трет-бутил 4-(4-фторфенил)-3-формилпиперидин-1-карбоксилат. Раствор 6,5 ммоль оксалилхлорида в 15 мл метиленхлорида охлаждали в среде аргона на бане с СО 2/ацетоном и обрабатывали 13 ммоль диметилсульфоксида, добовляя его по каплям. К этой смеси добавляли в течение около 10 мин раствор 5,8 ммоль продукта из примера 12 в виде раствора в 6 мл мети- 28014432 ленхлорида. Полученный раствор перемешивали в течение 1,5 ч, затем обрабатывали 15 ммоль триэтиламина. После дополнительных 15 мин холодную баню удаляли и перемешивание продолжали еще 45 мин. Реакционную смесь разделяли между простым эфиром и насыщенным NH4Cl (40 мл каждого) и органический слой промывали водой и насыщенным раствором NaCl, сушили над сульфатом магния(MgSO4) и концентрировали в вакууме, чтобы получить названный продукт, который использовали без последующего очищения. Пример 14. (3S,4R)-1-(трет-бутоксикарбонил)-4-(4-фторфенил)пиперидин-3-карбоновая кислота. Половину продукта из примера 13 растворяли в 12 мл третичного бутилового спирта и 4 мл воды и добавляли 3,3 ммоль KMnO4. Смесь перемешивали в течение 4 ч при комнатной температуре, затем фильтровали, промывая твердое вещество водой. Смесь концентрировали до около 5 мл в вакууме и разделяли между 40 мл простого эфира и 3 х 10 мл 1H NaOH. Водные слои соединяли, охлаждали на ледяной бане, подкисляли насыщенным KHSO4 и экстрагировали метиленхлоридом (3 х). Эти органические слои соединяли, промывали 50% раствором NaCl, сушили над MgSO4 и концентрировали в вакууме, получая названное соединение. Пример 15. (3S,4R)-трет-бутил 3-(дидейтеро(гидрокси)метил)-4-(4-фторфенил)пиперидин-1 карбоксилат (формула VI, где W=трет-бутоксикарбонил и гидроксиметил углерод замещен дейтерием). Раствор 3,7 ммоль продукта из примера 13 растворяли в 25 мл метиленхлорида, охлаждали на водяной бане и обрабатывали 3,9 ммоль оксалилхлорида и 2 каплями диметилформамида. Ледяную баню удаляли и смесь перемешивали в течение около 2,5 ч, затем концентрировали в вакууме. Сырой хлорангидрид растворяли в 20 мл этилацетата и обрабатывали 7,4 ммоль бородейтеридом натрия (Aldrich). Смесь перемешивали 4 ч, затем охлаждали на ледяной бане и обрабатывали 1 мл 5% раствором KHSO4,добавляя его по каплям. Еще добавляли этилацетат и раствор экстрагировали с 5% KHSO4, насыщеннымNaHCO3 и насыщенным раствором NaCl, затем сушили над MgSO4 и концентрировали в вакууме. Хроматография с силикагелем (растворитель для элюирования метанол/метиленхлорид) дает названный продукт. Пример 16. (3S,4R)-трет-бутил 3-2,2-дидейтеробензо[d][1,3]диоксол-5-илокси)дидейтерометил)-4(4-фторфенил)пиперидин-1-карбоксилат (формула (III), где Y=D, W=трет-бутоксикарбонил и оба водорода на пиперидин-3-метилен углероде замещены дейтерием). 1,2 ммоль образца продукта из примера 7 подвергали реакции с продуктом из примера 15 согласно обычной процедуре, изложенной в примере 8, чтобы получить сырой продукт, который очищали хроматографией с силикагелем, используя в качестве растворителя простой эфирацетат/гексан для элюирования, чтобы получить названное соединение. Пример 17.(3S,4R)-3-2,2-дидейтеробензо[d][1,3]диоксол-5-илокси)дидейтерометил)-4-(4 фторфенил)пиперидин гидрохлорид (формула (I), где Y=D и оба водорода на пиперидин-3 метиленуглероде замещены дейтерием). Порцию продукта 0,87 ммоль из примера 16 растворяли в 3 мл изопропанола, охлаждали на ледяной/водяной бане в атмосфере аргона и обрабатывали струей газообразного хлорида водорода около 2 мин. Смесь выдерживали в закрытом состоянии в течение 1 ч и затем для выдувания избытка HCl через раствор пропускали аргон в течение 2 мин. Смесь фильтровали, промывая фильтрат небольшим количеством холодного изопропанола, получая названное соединение. Пример 18. (3R,4R)-4-(4-фтор-2,3,5,6-тетрадейтерофенил)-1-метилпиреридин-3-карбоновая кислота,(2,10)-камфорсультамил амид. Смесь 9,4 ммоль магниевой стружки в 2 мл ТГФ обрабатывали каталитическим количеством йода(мелкие кристаллы) и нагревали в атмосфере аргона с обратным холодильником в течение 30 мин. Полученную смесь обрабатывали в течение 20 мин раствором 8,5 ммоль 4-фтор-2,3,5,6 тетрадейтеробромбензола (C/D/N изотопы) в 1,5 мл ТГФ. Смесь перемешивали еще 2 ч с обратным холодильником, затем охлаждали до комнатной температуры. Порцию 7,6 ммоль 1-метил-1,2,5,6 тетрагидропиридин-3-карбоновой кислоты, (2,10)-камфорсультамил амида (патент США US 5962689) в 30 мл толуола охлаждали на ледяной/соляной бане в атмосфере аргона и обрабатывали в течение 20 мин реагентом Гриньяра, приготовленным выше. Смесь перемешивали на холоде в течение 17 ч, затем гасили насыщенным хлоридом аммония. Водный слой промывали этилацетатом и соединенные органические слои промывали водой, затем насыщенным раствором NaCl, сушили над MgSO4 и концентрировали в вакууме. Силикагельная хроматография с использованием этилацетата для элюирования обеспечивала получение названного соединения. Пример 19. (3S,4R)-метил 4-(4-фтор-2,3,5,6-тетрадейтерофенил)-1-метилпиперидин-3-карбоксилат. Образец 1,7 ммоль продукта из примера 18 растворяли в 5 мл толуола и обрабатывали 2,5 ммоль тонко растертого трет-бутоксида калия и перемешивали в атмосфере аргона при комнатной температуре в течение 1 ч. Добавляли 1 мл метанола и продолжали перемешивание 5 ч, затем смесь разбавляли толуолом, промывали водой и насыщенным раствором NaCl, высушивали и концентрировали в вакууме. Остаток очищали силикагельной хроматографией, используя ацетон/хлороформ для элюирования, чтобы получить названный продукт. Пример 20. (3S,4R)-4-4-фтор-2,3,5,6-тетрадейтерофенил)-1-метилпиперидин-3-ил)метанол (фор- 29
МПК / Метки
МПК: C07D 295/00
Метки: 1,3-бензодиоксола, производные, дейтерированные
Код ссылки
<a href="https://eas.patents.su/30-14432-dejjterirovannye-proizvodnye-13-benzodioksola.html" rel="bookmark" title="База патентов Евразийского Союза">Дейтерированные производные 1,3-бензодиоксола</a>
Предыдущий патент: Производные хинолина в качестве антибактериальных агентов
Следующий патент: Egfr-зависимая модуляция экспрессии хемокинов, влияние на терапию и диагностику опухолей и её побочные эффекты
Случайный патент: Способ изостатического прессования порошка в окончательную или близкую к окончательной форму












