Соединения (липопептиды на основе цистеина) и композиции в качестве агонистов tlr2, применяемые для лечения инфекционных, воспалительных, респираторных и других заболеваний
Номер патента: 23725
Опубликовано: 29.07.2016
Авторы: У Том Яо-Сянь, Хоффман Тимоти З., Цзоу Ефэн, Пань Цзяньфэн
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
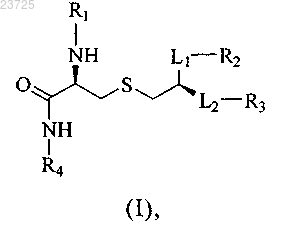
в которой R1 обозначает Н, -С(О)-С7-С18алкил или -С(О)-С1-С6алкил;
R2 обозначает С7-С18алкил;
R3 обозначает С7-С18алкил;
L1 обозначает -CH2OC(O)NR7-;
L2 обозначает -OC(O)NR7-;
R4 обозначает -L4R5;
R5 обозначает -P(O)(OR7)2 или -C(O)OR7;
L4 обозначает -((CR7R7)pO)q(CR10R10)p-;
каждый R7 обозначает Н;
каждый R10 обозначает Н;
каждый р независимо друг от друга выбран из 1, 2, 3, 4, 5 и 6 и
q обозначает 1, 2, 3 или 4.
2. Соединение по п.1, в котором
R1 обозначает Н, -С(О)-С10-С18алкил;
R2 обозначает С10-С18алкил;
R3 обозначает С10-С18алкил;
R4 обозначает -L4R5;
R5 обозначает -P(O)(OR7)2 или -C(O)OR7;
L4 обозначает -((CR7R7)pO)q(CR10R10)p-;
каждый R7 обозначает Н;
каждый R10 обозначает Н;
каждый р независимо друг от друга выбран из 1, 2, 3, 4, 5 и 6 и
q обозначает 1, 2, 3 или 4.
3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, в котором R1 обозначает Н.
4. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, в котором R1 обозначает -С(О)-С15алкил.
5. Соединение по одному из пп.1-4 или его фармацевтически приемлемая соль, в котором
R2 обозначает -С8алкил и R3 обозначает -С8алкил
или R2 обозначает -С10алкил и R3 обозначает -С10алкил.
6. Соединение по одному из пп.1-4 или его фармацевтически приемлемая соль, в котором R2 обозначает -С10алкил и R3 обозначает -С10алкил.
7. Соединение по одному из пп.1-6 или его фармацевтически приемлемая соль, в котором R5 обозначает -С(О)ОН.
8. Соединение по одному из пп.1-6 или его фармацевтически приемлемая соль, в котором R5 обозначает -Р(О)(ОН)2.
9. Соединение по одному из пп.1-8, в котором L4 обозначает -((CR7R7)pO)q(CR10R10)p-; каждый р независимо друг от друга выбран из 2, 3 и 4 и q обозначает 1, 2, 3 или 4.
10. Соединение по п.1, где соединение выбрано из группы, включающей
((14R,18R)-14-амино-18-((децилкарбамоил)окси)-13,21-диоксо-3,6,9,20-тетраокса-16-тиа-12,22-диазадотриаконтил)фосфоновую кислоту;
(15R,19R)-15-амино-19-((децилкарбамоил)окси)-14,22-диоксо-4,7,10,21-тетраокса-17-тиа-13,23-диазатритриаконтан-1-овую кислоту;
((14R,18R)-14-амино-18-((октилкарбамоил)окси)-13,21-диоксо-3,6,9,20-тетраокса-16-тиа-12,22-диазатриаконтил)фосфоновую кислоту;
((14R,18R)-18-((децилкарбамоил)окси)-13,21-диоксо-14-пальмитамидо-3,6,9,20-тетраокса-16-тиа-12,22-диазадотриаконтил)фосфоновую кислоту;
((14R,18R)-14-ацетамидо-18-((децилкарбамоил)окси)-13,21-диоксо-3,6,9,20-тетраокса-16-тиа-12,22-диазадотриаконтил)фосфоновую кислоту;
((14R,18R)-18-((децилкарбамоил)окси)-14-гептанамидо-13,21-диоксо-3,6,9,20-тетраокса-16-тиа-12,22-диазадотриаконтил)фосфоновую кислоту и
((14R,18R)-18-((децилкарбамоил)окси)-14-гексанамидо-13,21-диоксо-3,6,9,20-тетраокса-16-тиа-12,22-диазадотриаконтил)фосфоновую кислоту.
11. Фармацевтическая композиция, обладающая активностью агонистов Толл-подобного рецептора 2 (TLR2), содержащая в терапевтически эффективном количестве соединение по одному из пп.1-10 и фармацевтически приемлемый носитель.
12. Применение соединения по одному из пп.1-10 для приготовления лекарственного средства для лечения у пациента заболевания, связанного с модуляцией Толл-подобного рецептора 2 (TLR2), где заболевание выбирают из инфекционного заболевания, воспалительного заболевания, респираторного заболевания, дерматологического заболевания и аутоиммунного заболевания.
13. Применение по п.12, в котором заболевание представляет собой астму, хроническое обструктивное заболевание легких (ХОЗЛ), респираторный дистресс-синдром взрослых (РДСВ), неспецифический язвенный колит, болезнь Крона, бронхит, дерматит, старческий кератоз, аллергический ринит, псориаз, склеродерму, крапивницу, ревматоидный артрит, рассеянный склероз, рак, ВИЧ-инфекцию или обыкновенную волчанку.
14. Способ лечения заболевания, связанного с модуляцией Толл-подобного рецептора 2 (TLR2), выбранного из инфекционного заболевания, воспалительного заболевания, респираторного заболевания, дерматологического заболевания и аутоиммунного заболевания, заключающийся в том, что вводят пациенту, нуждающемуся в таком лечении, в эффективном количестве соединение по одному из пп.1-10.
15. Способ по п.14, в котором заболевание представляет собой астму, хроническое обструктивное заболевание легких (ХОЗЛ), респираторный дистресс-синдром взрослых (РДСВ), неспецифический язвенный колит, болезнь Крона, бронхит, дерматит, старческий кератоз, аллергический ринит, псориаз, склеродерму, крапивницу, ревматоидный артрит, рассеянный склероз, рак, ВИЧ-инфекцию или обыкновенную волчанку.
16. Применение соединения по одному из пп.1-10 в лечении заболевания, ассоциированного с активностью Толл-подобного рецептора 2 (TLR2), где заболевание представляет собой инфекционное заболевание, воспалительное заболевание, респираторное заболевание, дерматологическое заболевание или аутоиммунное заболевание.
17. Применение по п.16, в котором заболевание представляет собой астму, хроническое обструктивное заболевание легких (ХОЗЛ), респираторный дистресс-синдром взрослых (РДСВ), неспецифический язвенный колит, болезнь Крона, бронхит, дерматит, старческий кератоз, аллергический ринит, псориаз, склеродерму, крапивницу, ревматоидный артрит, рассеянный склероз, рак, ВИЧ-инфекцию или обыкновенную волчанку.
Текст
СОЕДИНЕНИЯ (ЛИПОПЕПТИДЫ НА ОСНОВЕ ЦИСТЕИНА) И КОМПОЗИЦИИ В КАЧЕСТВЕ АГОНИСТОВ TLR2, ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ, ВОСПАЛИТЕЛЬНЫХ, РЕСПИРАТОРНЫХ И ДРУГИХ ЗАБОЛЕВАНИЙ В изобретении описан новый класс соединений формулы (I) иммуногенные композиции и фармацевтические композиции, содержащие такие соединения,и способы применения таких соединений для лечения или предупреждения заболеваний или нарушений, ассоциированных с Толл-подобными рецепторами типа 2. Согласно одному из объектов изобретения соединения можно применять в качестве адъювантов для повышения эффективности вакцины. Перекрестная ссылка на родственные заявки Настоящая заявка притязает согласно 35 U.S.C. 119(е) на приоритет предварительной заявки на патент США 61/316551, зарегистрированной 23 марта 2010 г., которая полностью и для всех целей включена в настоящее описание в качестве ссылки. Сведения о правительственной поддержке Настоящее изобретение выполнено в частности при правительственной поддержке в рамках гранта Агентства по сокращению угроз (DTRA)HDTRA1-07-9-0001, присужденного Министерством обороны. Правительству принадлежат определенные права на изобретение. Область техники, к которой относится изобретение Настоящее изобретение относится к модуляторам Толл-подобных рецепторов (TLR) и способам применения указанных соединений. Предпосылки создания изобретения Раннее выявление конкретных классов патогенов осуществляется врожденной иммунной системой с помощью паттерн-распознающих рецепторов (PRR). К выявляемым патогенам относятся вирусы, бактерии, простейшие и грибы, и каждый из них конститутивно экспрессирует набор специфических для класса устойчивых к мутациям молекул, называемых патоген-ассоциированными молекулярными паттернами (структурами) (РАМР). Эти молекулярные маркеры могут состоять из белков, углеводов, липидов, нуклеиновых кислот или их комбинаций, и они могут иметь внутреннюю или внешнюю локализацию. Примерами РАМР являются бактериальные углеводы (липополисахарид или LPS, манноза), нуклеиновые кислоты (бактериальная или вирусная ДНК или РНК), пептидогликаны и липотейхоевые кислоты (из грамположительных бактерий), N-формилметионин, липопротеины и грибные глюканы. В результате эволюции паттерн-распознающие рецепторы приобрели преимущество, основанное на трех особенностях РАМР. Во-первых, конститутивная экспрессия позволяет хозяину выявлять патогены вне зависимости от стадии их жизненного цикла. Во-вторых, РАМР являются специфическими для класса, что позволяет хозяину различать патогены и, тем самым, специально приспосабливать свой ответ. Втретьих, устойчивость к мутациям позволяет хозяину распознавать патоген вне зависимости от его конкретного штамма. Паттерн-распознающие рецепторы принимают участие не только в распознавании патогенов на основе их РАМР. Будучи связанными, паттерн-распознающие рецепторы имеют тенденцию к образованию кластеров, обеспечивают рекрутмент других внеклеточных и внутриклеточных белков в комплекс и инициируют каскады передачи сигналов, которые в конце концов оказывают воздействие на транскрипцию. Кроме того, паттерн-распознающие рецепторы участвуют в активации функций комплемента, коагуляции, фагоцитоза, воспаления и апоптоза при ответе на выявление патогена. Паттерн-распознающие рецепторы (PRR) можно разделять на эндоцитозные PRR и сигнальныеPRR. Сигнальные PRR включают крупные семейства связанных с мембраной Толл-подобных рецепторов(TLR) и цитоплазматических NOD (домен олигомеризации нуклеотидов)-подобных рецепторов, а эндоцитозные PRR, которые усиливают присоединение, поглощение и деструкцию микроорганизмов фагоцитами без передачи внутриклеточного сигнала, обнаружены у всех фагоцитов и опосредуют удаление апоптозных клеток. Кроме того, эндоцитозные PRR распознают углеводы и включают маннозные рецепторы макрофагов, глюкановые рецепторы, которые имеются у всех фагоцитов, и рецепторы-мусорщики,которые распознают заряженные лиганды. Краткое изложение сущности изобретения В настоящем изобретении предложены соединения и фармацевтические композиции, которые являются агонистами Толл-подобного рецептора 2 (TLR2). Согласно конкретным вариантам осуществления изобретения указанные агонисты TLR2 являются потенциаторами иммунной системы (иммунными потенциаторами), которые связываются с содержащими алюминий адъювантами, такими, например, как(но не ограничиваясь только ими) гидроксид алюминия, оксигидроксид алюминия и гидроксифосфат алюминия. Таким образом, настоящее изобретение относится также к иммуногенным композициям, которые содержат антиген и агонист TLR2, которые связываются с содержащими алюминий адъювантами. Когда указанные иммуногенные композиции вводят индивидууму, который нуждается в этом, то агонисты TLR2 усиливают иммунный ответ на иммуногенную композицию. Одним из объектов изобретения являются указанные соединения и их фармацевтически приемлемые соли, которые имеют структуру, представленную в формуле (I)L4 обозначает -CR7R7)pO)q(CR10R10)p-; каждый R7 обозначает Н; каждый R10 обозначает Н; каждый р независимо друг от друга выбран из 1, 2, 3, 4, 5 и 6, иq обозначает 1, 2, 3 или 4. В конкретных вариантах указанных соединений и их фармацевтически приемлемых солей:L4 обозначает -CR7R7)pO)q(CR10R10)p-; каждый R7 обозначает Н; каждый R10 обозначает Н; каждый р независимо друг от друга выбран из 1, 2, 3, 4, 5 и 6, иq обозначает 1, 2, 3 или 4. В конкретных вариантах указанных соединений и их фармацевтически приемлемых солей R1 обозначает Н. В других вариантах указанных соединений и их фармацевтически приемлемых солей R1 обозначает -С(О)-С 15 алкил. В других вариантах указанных соединений и их фармацевтически приемлемых солей R1 обозначает-С(О)-С 10-С 18 алкил. В конкретных вариантах вышеуказанных соединений и их фармацевтически приемлемых солей R2 обозначает С 10-С 18 алкил. В конкретных вариантах вышеуказанных соединении и их фармацевтически приемлемых солеи R3 обозначает С 10-С 18 алкил. В конкретных вариантах вышеуказанных соединений и их фармацевтически приемлемых солей R2 обозначает -С 11 алкил и R3 обозначает -С 11 алкил; или R2 обозначает -С 16 алкил и R3 обозначает -С 16 алкил; или R2 обозначает -С 16 алкил и R3 обозначает -С 11 алкил; или R2 обозначает -С 12 алкил и R3 обозначаетС 12 алкил; или R2 обозначает-С 7 алкил и R3 обозначает-С 7 алкил; или R2 обозначает -С 9 алкил и R3 обозначает -С 9 алкил; или R2 обозначает -С 8 алкил и R3 обозначает -С 8 алкил; или R2 обозначает -С 13 алкил и R3 обозначает -С 13 алкил; или R2 обозначает-С 12 алкил и R3 обозначает-С 11 алкил; или R2 обозначает -С 12 алкил и R3 обозначает -С 12 алкил; или R2 обозначает -С 10 алкил и R3 обозначает -С 10 алкил; или R2 обозначает С 15 алкил и R3 обозначает -С 15 алкил. В конкретных вариантах вышеуказанных соединений и их фармацевтически приемлемых солей R2 обозначает-С 11 алкил и R3 обозначает-С 11 алкил. В конкретных вариантах вышеуказанных соединений и их фармацевтически приемлемых солей R5 обозначает -Р(О)(ОН)2 или -С(О)ОН. В конкретных вариантах вышеуказанных соединений и их фармацевтически приемлемых солей L4 обозначает -CR7R7)pO)q(CR10R10)р-, где R10 каждый выбран из Н; р каждый независимо друг от друга выбран из 2, 3 и 4 и q обозначает 1, 2, 3 или 4. В конкретных вариантах осуществления изобретения вышеуказанные соединения и их фармацевтически приемлемые соли выбраны из группы, включающей 14R,18R)-14-амино-18-децилкарбамоил)окси)-13,21-диоксо-3,6,9,20-тетраокса-16-тиа-12,22 диазадотриаконтил)фосфоновую кислоту;(15R,19R)-15-амино-19-децилкарбамоил)окси)-14,22-диоксо-4,7,10,21-тетраокса-17-тиа-13,23 диазатритриаконтан-1-овую кислоту; 14R,18R)-14-амино-18-октилкарбамоил)окси)-13,21-диоксо-3,6,9,20-тетраокса-16-тиа-12,22 диазатриаконтил)фосфоновую кислоту; 14R,18R)-18-децилкарбамоил)окси)-13,21-диоксо-14-пальмитамидо-3,6,9,20-тетраокса-16-тиа 12,22-диазадотриаконтил)фосфоновую кислоту; 14R,18R)-14-ацетамидо-18-децилкарбамоил)окси)-13,21-диоксо-3,6,9,20-тетраокса-16-тиа-12,22 диазадотриаконтил)фосфоновую кислоту; 14R,18R)-18-децилкарбамоил)окси)-14-гептанамидо-13,21-диоксо-3.6,9,20-тетраокса-16-тиа 12,22-диазадотриаконтил)фосфоновую кислоту; и 14R,18R)-18-децилкарбамоил)окси)-14-гексанамидо-13,21-диоксо-3,6,9,20-тетраокса-16-тиа 12,22-диазадотриаконтил)фосфоновую кислоту. Каждое из указанных соединений индивидуально относится к предпочтительному варианту соединений, композиций и способов, представленных в настоящем описании.-2 023725 Следующим объектом изобретения являются фармацевтические композиции, которые содержат в терапевтически эффективном количестве соединение, представляющее собой одно из вышеуказанных соединений и их фармацевтически приемлемых солей, а также фармацевтически приемлемый носитель. Конкретными вариантами указанных фармацевтических композиций являются фармацевтические композиции, приготовленные для внутривенного введения, введения в стекловидное тело, внутримышечного введения, орального введения, ректального введения, введения путем ингаляции, введения в нос, местного применения, введения в глаз или введения в ухо. Другими вариантами указанных фармацевтических композиций являются фармацевтические композиции в форме таблетки, пилюли, капсулы, жидкости,ингалянта, раствора назального спрея, суппозитория, раствора, эмульсии, мази, глазных капель или ушных капель. Другим объектом изобретения является применение соединения формулы (I) по п.1 для приготовления лекарственного средства, предназначенного для лечения у пациента заболевания или нарушения,связанного с модуляцией рецептора TLR2. В конкретных вариантах осуществления этого объекта изобретения указанное заболевание или состояние представляет собой инфекционное заболевание, воспалительное заболевание, респираторное заболевание, дерматологическое заболевание или аутоиммунное заболевание. В конкретных вариантах осуществления этого объекта изобретения заболевание или состояние представляет собой астму, хроническое обструктивное заболевание легких (ХОЗЛ), респираторный дистресс-синдром взрослых (РДСВ), неспецифический язвенный колит, болезнь Крона, бронхит,дерматит, старческий кератоз, базально-клеточную карциному, аллергический ринит, псориаз, склеродерму, крапивницу, ревматоидный артрит, рассеянный склероз, рак, рак молочной железы, ВИЧинфекцию и обыкновенную волчанку. Соединения по изобретению могут использоваться в способах активации рецептора TLR2, где способ заключается в том, что вводят в систему или индивидууму, нуждающемуся в этом, в терапевтически эффективном количестве соединение формулы (I) или его фармацевтически приемлемые соли, или фармацевтические композиции, активируя тем самым рецептор TLR. В указанных способах соединение формулы (I) представляет собой агонист рецептора TLR2. В конкретных вариантах способов способы заключаются в том, что вводят соединение в клеточную или тканевую систему или человеку, или животному. Следующим объектом изобретения является способ лечения заболевания или нарушения, связанного с модуляцией рецептора TLR2, где способ заключается в том, что вводят в систему или индивидууму,нуждающемуся в таком лечении, в эффективном количестве соединение формулы (I) по п.1, где соединение формулы (I) представляет собой агонист рецептора TLR2. В конкретных вариантах осуществления этого объекта изобретения указанное заболевание или состояние представляет собой инфекционное заболевание, воспалительное заболевание, респираторное заболевание, дерматологическое заболевание или аутоиммунное заболевание. В конкретных вариантах осуществления этого объекта изобретения заболевание или состояние представляет собой астму, хроническое обструктивное заболевание легких(ХОЗЛ), респираторный дистресс-синдром взрослых (РДСВ), неспецифический язвенный колит, болезнь Крона, бронхит, дерматит, старческий кератоз, базально-клеточную карциному, аллергический ринит,псориаз, склеродерму, крапивницу, ревматоидный артрит, рассеянный склероз, рак, рак молочной железы, ВИЧ-инфекцию или обыкновенную волчанку. Другим объектом изобретения является соединение, предназначенное для лечения заболевания, ассоциированного с активностью рецептора TLR2, где заболевание представляет собой инфекционное заболевание, воспалительное заболевание, респираторное заболевание, дерматологическое заболевание или аутоиммунное заболевание. В конкретных вариантах осуществления этого объекта изобретения заболевание или состояние представляет собой астму, хроническое обструктивное заболевание легких(ХОЗЛ), респираторный дистресс-синдром взрослых (РДСВ), неспецифический язвенный колит, болезнь Крона, бронхит, дерматит, старческий кератоз, базально-клеточную карциному, аллергический ринит,псориаз, склеродерму, крапивницу, ревматоидный артрит, рассеянный склероз, рак, рак молочной железы, ВИЧ или обыкновенную волчанку. Другим объектом изобретения являются фармацевтические композиции, которые включают в терапевтически эффективном количестве соединение формулы (I), содержащий алюминий адъювант, антиген и фармацевтически приемлемый носитель. В указанных фармацевтических композициях соединение формулы (I) присутствует в количестве, достаточном для оказания при его введении иммуностимулирующего действия. Конкретными вариантами указанных фармацевтических композиций является фармацевтическая композиция, приготовленная для внутривенного введения, введения в стекловидное тело или внутримышечного введения. В указанных композициях содержащий алюминий адъюван выбран из гидроксида алюминия, оксигидроксида алюминия и гидроксифосфата алюминия. В конкретных вариантах указанных композиций содержащий алюминий адъювант представляет собой оксигидроксид алюминия или гидроксид алюминия. Другим объектом изобретения является фармацевтическая композиция, которая содержит в терапевтически эффективном количестве соединение формулы (I), связанное с содержащим алюминий адъювантом и фармацевтически приемлемый носитель. В конкретных вариантах осуществления изобретения-3 023725 указанная композиция представляет собой высушенное твердое вещество. В конкретных вариантах осуществления изобретения указанная композиция представляет собой твердое лиофилизированное вещество. В указанных композициях содержащий алюминий адъювант выбран из гидроксида алюминия, оксигидроксида алюминия и гидроксифосфата алюминия. В конкретных враиантах указанных композиция содержащий алюминий адъювант представляет собой оксигидроксид алюминия или гидроксид алюминия. Соединения по изобретению могут использоваться в иммуногенных композициях, включающих соединение формулы (I), содержащий алюминий адъювант и антиген. В конкретных вариантах осуществления изобретения соединение формулы (I) присутствует в количестве, эффективном в отношении вызывания, индукции или усиления иммунного ответа на антиген у индивидуума, которому вводят композицию. В указанных иммуногенных композициях соединение формулы (I) присутствует в количестве, достаточном для осуществления при его введении иммуностимулирующего действия. В указанных иммуногенных композициях содержащий алюминий адъюван выбран из гидроксида алюминия, оксигидроксида алюминия и гидроксифосфата алюминия. В конкретных вариантах указанных иммуногенных композиций содержащий алюминий адъювант представляет собой оксигидроксид алюминия или гидроксид алюминия. В конкретных вариантах указанных иммуногенных композиций антиген представляет собой бактериальный антиген. В других вариантах указанных иммуногенных композиций антиген представляет собой вирусный антиген или грибковый антиген. В конкретных вариантах указанных иммуногенных композиций антиген представляет собой полипептид. В конкретных вариантах осуществления изобретения указанные иммуногенные композиции содержат также дополнительный адъювант. В конкретных вариантах осуществления изобретения указанные иммуногенные композиции представляет собой высушенное твердое вещество. В конкретных вариантах осуществления изобретения указанные иммуногенные композиции представляет собой лиофилизированное твердое вещество. Соединения по изобретению могут использоваться в способе повышения эффективности иммуногенной композиции, в котором иммуногенная композиция включает содержащий алюминий адъювант, и способ заключается в том, что добавляют в эффективном количестве соединение формулы (I) в иммуногенную композицию. В указанных способах содержащий алюминий адъювант выбирают из гидроксида алюминия, оксигидроксида алюминия и гидроксифосфата алюминия. В конкретных вариантах способов содержащий алюминий адъювант представляет собой оксигидроксид алюминия или гидроксид алюминия. Соединения по изобретению могут использоваться в способах вызывания или индукция иммунного ответа у позвоночного животного, заключающихся в том, что вводят позвоночному животному в эффективном количестве иммуногенную композицию, предлагаемую в изобретении. Некоторыми вариантами осуществления настоящего изобретения являются способы вызывания или индукции ответа цитотоксических Т-лимфоцитов (ЦТЛ) у позвоночного животного, заключающиеся в том, что вводят позвоночному животному в эффективном количестве иммуногенную композицию, предлагаемую в изобретении. Другими вариантами осуществления настоящего изобретения являются способы вызывания или индукции опосредованного антителами (гуморального) иммунного ответа у позвоночного животного, заключающиеся в том, что вводят позвоночному животному в эффективном количестве иммуногенную композицию, предлагаемую в изобретении. Соединения по изобретению могут использоваться в способах получения иммуногенных композиций, представленных в настоящем описании. Соединения по изобретению могут использоваться в композициях вакцин, которые содержат иммуногенную композицию, предлагаемую в изобретении. Соединения по изобретению могут использоваться в лекарственных средствах, предназначенных для лечения пациента, имеющего заболевание или нарушение, ассоциированное с активностью рецептора TLR2, и указанные лекарственные средства включают в терапевтически эффективном количестве соединение формулы (I), где соединение формулы (I) представляет собой агонист рецептора TLR2. Другим объектом изобретения являются способы лечения связанного с пролиферацией клеток заболевания, заключающиеся в том, что вводят в систему или индивидууму, который нуждается в таком лечении, в эффективном количестве соединение формулы (I), или его фармацевтически приемлемые соли,или фармацевтические композиции; где связанное с пролиферацией клеток заболевание представляет собой лимфому, остеосаркому, меланому или опухоль молочной железы, почки, предстательной железы,колоректальную опухоль, опухоль щитовидной железы, яичника, поджелудочной железы, нейронную опухоль, опухоль легкого, матки или опухоль желудочно-кишечного тракта. Следующим объектом изобретения является фармацевтическая композиция, которая включает соединение формулы (I), антиген и фармацевтически приемлемый носитель, где указанные фармацевтические композиции представляют собой иммуногенные композиции, а соединение представляет собой потенциатор иммунной системы и присутствует в количестве, эффективном в отношении усиления иммунного ответа на антиген у индивидуума, которому вводят композицию. В конкретных вариантах осуществления изобретения указанные фармацевтические композиции содержат также один или несколько иммунорегуляторов. В конкретных вариантах осуществления изобретения один или несколько иммуноре-4 023725 гуляторов включает(ют) один или несколько адъювантов. В конкретных вариантах осуществления изобретения указанные адъюванты выбирают из адъювантов, которые представляют собой содержащую минерал композицию, масляную эмульсию, препарат сапонина, виросому, вирусоподобную частицу,бактериальное производное, микробное производное, человеческий иммуномодулятор, биоадгезив, мукоадгезив, микрочастицу, липосому, форму простого полиоксиэтиленового эфира, форму сложного полиоксиэтиленового эфира, полифосфазен, мурамиловый пептид или имидазохинолоновое производное. В конкретных вариантах осуществления изобретения адъювант представляет собой масляную эмульсию. В конкретных вариантах осуществления изобретения иммуногенные композиции можно применять в качестве вакцин, и соединение присутствует в количестве, достаточном для осуществления при его введении иммуностимулирующего действия. Подробное описание изобретения Определения. В контексте настоящего описания понятие "алкил" относится к насыщенному разветвленному или прямоцепочечному углеводороду. В конкретных вариантах осуществления изобретения указанные алкильные группы необязательно являются замещенными. В контексте настоящего описания понятия "С 1 С 3 алкил", "С 1-С 4 алкил", "С 1-С 5 алкил", "С 1-С 6 алкил", "С 1-С 7 алкил" и "С 1-С 8 алкил" относятся к алкильной группе, содержащей по меньшей мере 1 и максимум 3, 4, 5, 6, 7 или 8 атомов углерода соответственно. Если специально не указано иное, алкильная группа, как правило, представляет собой С 1-С 6 алкил. В контексте настоящего описания примерами алкильных групп являются (но не ограничиваясь только ими) метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, гексил, гептил, октил, нонил, децил и т.п. В контексте настоящего описания понятие "алкилен" относится к насыщенному разветвленному или прямоцепочечному двухвалентному углеводородному радикалу, полученному из алкильной группы. В конкретных вариантах осуществления изобретения указанные алкиленовые группы необязательно являются замещенными. В контексте настоящего описания понятия "С 1-С 3 алкилен", "С 1-С 4 алкилен", "С 1 С 5 алкилен", "С 1-С 6 алкилен", "С 1-С 7 алкилен" и "С 1-С 8 алкилен" относятся к алкиленовой группе, содержащей по меньшей мере 1 и максимум 3, 4, 5, 6, 7 или 8 атомов углерода соответственно. Если специально не указано иное, алкиленовая группа, как правило, представляет собой C1-С 6 алкилен. В контексте настоящего описания примерами алкиленовых групп являются (но не ограничиваясь только ими) метилен,этилен, н-пропилен, изопропилен, н-бутилен, изобутилен, втор-бутилен, трет-бутилен, н-пентилен, изопентилен, гексилен и т.п. В контексте настоящего описания понятие "алкоксигруппа" относится к группе -ORa, в которой Ra обозначает указанную выше алкильную группу. Алкоксигруппа необязательно может быть замещенной. В контексте настоящего описания понятия "С 1-С 3 алкоксигруппа", "С 1-С 4 алкоксигруппа", "C1 С 5 алкоксигруппа", "C1-С 6 алкоксигруппа", "C1-С 7 алкоксигруппа" и "С 1-С 8 алкоксигруппа" относятся в алкоксигруппе, в которой алкильный фрагмент содержит по меньшей мере один и максимум 3, 4, 5, 6, 7 или 8 атомов углерода. В контексте настоящего описания примерами алкоксигрупп являются (но не ограничиваясь только ими) метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, нбутилоксигруппа, трет-бутилоксигруппа, пентилоксигруппа, гексилоксигруппа, гептилоксигруппа, октилоксигруппа, нонилоксигруппа, децилоксигруппа и т.п. В контексте настоящего описания понятие "арил" относится к моноциклической, бициклической и трициклической кольцевым системам, содержащими в целом от 5 до 14 кольцевых членов, в которых по меньшей мере одно кольцо в системе является ароматическим и в которых каждое кольцо в системе содержит 3-7 кольцевых членов. В конкретных вариантах осуществления изобретения указанные арильные группы необязательно являются замещенными. В контексте настоящего описания примерами арильной группы являются (но не ограничиваясь только ими) фенил, нафтил, флуоренил, инденил, азуленил, антраценил и т.п. В контексте настоящего описания понятие "арилен" означает двухвалентный радикал, полученный из арильной группы. В конкретных вариантах осуществления изобретения указанные ариленовые группы необязательно являются замещенными. В контексте настоящего описания понятие "циклоалкил" относится к насыщенным или частично ненасыщенным, моноциклическим, слитым бициклическим, слитым трициклическим или связанным мостиком полициклическим кольцевым системам. В контексте настоящего описания понятия "С 3 С 5 циклоалкил", "С 3-С 6 циклоалкил", "С 3-С 7 циклоалкил", "С 3-С 8 циклоалкил", "С 3-С 9 циклоалкил" и "С 3 С 10 циклоалкил" относятся к циклоалкильной группе, которая является насыщенной или частично ненасыщенной, моноциклической, слитой бициклической или связанной мостиком полициклической кольцевой системой, которая содержит по меньшей мере 3 и максимум 5, 6, 7, 8, 9 или 10 атомов углерода. В конкретных вариантах осуществления изобретения циклоалкильная группа необязательно является замещенной. В контексте настоящего описания примерами циклоалкильных групп являются (но не ограничиваясь только ими) циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил,циклононил, циклодецил, циклопентенил, циклогексенил, декагидронафталенил, 2,3,4,5,6,7-гексагидро 1 Н-инденил и т.п.-5 023725 В контексте настоящего описания понятие "галоген" относится к фтору (F), хлору (Cl), брому (Br) или йоду (I). В контексте настоящего описания понятие "гало" относится к следующим галогеновым радикалам: фтор (-F), хлор (-Cl), бром (-Br) и йод (-I). В контексте настоящего описания понятия "галоалкил" или "замещенный галогеном алкил" относятся к алкильной группе, как она определена в контексте настоящего описания, замещенной одной или несколькими галогеновыми группами, где галогеновые группы могут быть одинаковыми или различными. Галоалкильная группа необязательно может быть замещенной. В контексте настоящего описания примерами разветвленных или прямоцепочечных галоалкильных групп являются (но не ограничиваясь только ими) метил, этил, пропил, изопропил, изобутил и н-бутил, замещенный одной или несколькими галогеновыми группами, где галогеновые группы могут быть одинаковыми или различными, включая(но не ограничиваясь только ими) трифторметил, пентафторэтил и т.п. В контексте настоящего описания понятие "гетероарил" относится к моноциклическим, бициклическим и трициклическим кольцевым системам, которые содержат в целом от 5 до 14 кольцевых членов, в которых по меньшей мере одно кольцо в системе является ароматическим, по меньшей мере одно кольцо в системе содержит один или несколько гетероатомов, выбранных из азота, кислорода и серы, и в которых каждое кольцо в системе содержит 3-7 кольцевых атомов. В конкретных вариантах осуществления изобретения гстероарильные группы необязательно являются замещенными. В контексте настоящего описания примерами гетероарильных групп являются (но не ограничиваясь только ими) бензофуранил,бензофуразанил, бензоксазолил, бензопиранил, бензтиазолил, бензотиенил, бензазепинил, бензимидазолил, бензотиопиранил, бензо[1,3]диоксол, бензо[b]фурил, бензо[b]тиенил, циннолинил, фуразанил, фурил, фуропиридинил, имидазолил, индолил, индолизинил, индолин-2-он, индазолил, изоиндолил, изохинолинил, изоксазолил, изотиазолил, 1,8-нафтиридинил, оксазолил, оксаиндолил, оксадиазолил, пиразолил, пирролил, фталазинил, птеридинил, пуринил, пиридил, пиридазинил, пиразинил, пиримидинил, хиноксалинил, хинолинил, хиназолинил, 4 Н-хинолизинил, тиазолил, тиадиазолил, тиенил, триазинил, триазолил и тетразолил. В контексте настоящего описания понятие "гетероарилен" означает двухвалентный радикал, полученный из гетероарильной группы. В конкретных вариантах осуществления изобретения гетероариленовые группы необязательно являются замещенными. В контексте настоящего описания понятие "гетероатом" относится к одному или нескольким атомам кислорода, серы, азота, фосфора или кремния. В контексте настоящего описания понятие "гетероциклоалкил" относится к циклоалкилу, как он определен в настоящем описании, в котором один или несколько кольцевых атомов углерода заменены фрагментом, выбранным из -О-, -N=, -NR-, -С(О)-, -S-, -S(O) - или -S(O)2-, где R обозначает водород, С 1 С 4 алкил или защитную группу азота, при условии, что кольцо указанной группы не содержит два примыкающих друг к другу атома О или S. В конкретных вариантах осуществления изобретения гетероциклоалкильная группа необязательно является замещенной. В контексте настоящего описания примерами гетероциклоалкильных групп являются (но не ограничиваясь только ими) морфолиногруппа, пирролидинил, пирролидинил-2-он, пиперазинил, пиперидинил, пиперидинил-2-он, пиперидинил-3-он, пиперидинил-4-он, 1,4-диокса-8-азаспиро[4.5]дец-8-ил, 2 Н-пирролил, 2-пирролинил, 3-пирролинил, 1,3 диоксоланил, 2-имидазолинил, имидазолидинил. 2-пиразолинил, пиразолидинил, 1,4-диоксанил, 1,4 дитианил, тиоморфолинил, азепанил, гексагидро-1,4-диазепинил, тетрагидрофуранил, дигидрофуранил,тетрагидротиенил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, тиоксанил, азетидинил,оксетанил, тиетанил, оксепанил, тиепанил, 1,2,3,6-тетрагидропиридинил, 2 Н-пиранил, 4 Нпиранилдиоксанил, 1,3-диоксоланил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, имидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил и 3-азабицикло[4.1.0]гептанил. В контексте настоящего описания понятие "гидроксил" относится к группе -ОН. В контексте настоящего описания понятие "гидроксиалкил" относится к алкильной группе, как она определена в настоящем описании, замещенной одной или несколькими гидроксильными группами. В контексте настоящего описания примерами разветвленных или прямоцепочечных "С 1 С 6 гидроксиалкильных групп" являются (но не ограничиваясь только ими) метальные, этильные, пропильные, изопропильные, изобутильные и н-бутильные группы, замещенные одной или несколькими гидроксильными группами. В контексте настоящего описания понятие "необязательно замещенный" означает, что указанная группа может быть не замещена или может быть замещена одной или несколькими дополнительной(ыми) группой(ами), индивидуально и независимо друг от друга выбранными из алкила, алкенила,алкинила, циклоалкила, арила, гетероарила, гетероциклоалкила, гидроксила, алкоксигруппы, меркаптила,цианогруппы, галогена, карбонила, тиокарбонила, изоцианатогруппы, тиоцианатогруппы, изотиоцианатогруппы, нитрогруппы, пергалоалкила, перфторалкила и аминогруппы, включая моно- и дизамещенные аминогруппы и их защищенные производные. Примерами необязательных заместителей являются (но не ограничиваясь только ими), галоген, -CN, =O, =N-ОН, =N-OR, =N-R, -OR, -C(O)R, -C(O)OR, -OC(O)R, OC(O)OR, -C(O)NHR, -C(O)NR2, -OC(O)NHR, -OC(O)NR2, -SR-, -S(O)R, -S(O)2R, -NHR, -N(R)2, -6 023725NHC(O)R, -NRC(O)R, -NHC(O)OR, -NRC(O)OR, S(O)2NHR, -S(O)2N(R)2, -NHS(O)2NR2, -NRS(O)2NR2, NHS(O)2R, -NRS(O)2R, С 1-С 8 алкил, С 1-С 8 алкоксигруппа, арил, гетероарил, циклоалкил, гетероциклоалкил, замещенный галогеном C1-С 8 алкил и замещенная галогеном C1-С 8 алкоксигруппа, где R каждый независимо друг от друга выбран из Н, галогена, С 1-С 8 алкила, С 1-С 8 алкоксигруппы, арила, гетероарила,циклоалкила, гетероциклоалкила, замещенного галогеном С 1-С 8 алкила и замещенной галогеном С 1 С 8 алкоксигруппы. Размещение и количество указанных групп заместителей определяется хорошо известными ограничениями, связанными с валентностью каждой группы, например =O можно применять в качестве заместителя алкильной группы, но не арильной группы. В контексте настоящего описания понятие "сольват" относится к комплексу с различной стехиометрией, включающему растворенное вещество (например, соединения формулы (I) или его соли, представленные в настоящем описании) и растворитель. Примерами растворителей являются (но неограничиваясь только ими) вода, ацетон, метанол, этанол и уксусная кислота. В контексте настоящего описания понятие "приемлемый" касательно препаративной формы, композиции или ингредиента означает отсутствие персистентных вредных воздействий на общее состояние здоровья пациента, подлежащего лечению. Понятие "введение" или "вводить" индивидууму соединение означает обработку соединением формулы (I), его фармацевтически приемлемой солью, фармацевтически приемлемым сольватом или пролекарством индивидуума, который нуждается в лечении. Понятие "антиген" относится к молекуле, содержащей один или несколько эпитопов (например, линейных, конформационных или относящихся к обоим типам), которая вызывает иммунологический ответ. Понятие можно применять взаимозаменяемо с понятием "иммуноген". "Вызывать" означает индуцировать, ускорять, усиливать или модулировать иммунный ответ или иммунную реакцию. В некоторых случаях иммунный ответ или иммунная реакция представляет собой гуморальный и/или клеточный ответ. Антиген может индуцировать, ускорять, усиливать или модулировать иммунный ответ или иммунную реакцию в клетках in vitro и/или in vivo у индивидуума и/или ex vivo в клетках или тканях индивидуума. Иммунный ответ или иммунная реакция может вызывать (но не ограничиваясь только ими) образование антител у индивидуума или создание специфических популяций лимфоцитов, вступающих в реакцию с антигеном. Антигены, как правило, представляют собой макромолекулы (например, белки,полисахариды, полинуклеотиды), которые являются чужеродными для хозяина. В контексте настоящего описания понятие "антиген" относится также к субъединичным антигенам(т.е. антигенам, которые выделены и отделены от целого организма, с которым антиген ассоциирован в природе), а также убитые, ослабленные или инактивированные бактерии, вирусы, паразиты или другие патогены или опухолевые клетки, включая внеклеточные домены рецепторов, расположенных на клеточной поверхности, и внутриклеточные участки, содержащие Т-клеточные эпитопы. Антитела, такие как антиидиотипические антитела или их фрагменты и синтетические пептидные мимотопы, которые могут имитировать антиген или антигенную детерминанту, также подпадают под понятие "антиген", которое применяется в настоящем описании. Аналогично этому олигонуклеотид или полинуклеотид, который экспрессирует иммуногенный белок, антиген или антигенную детерминантну in vivo, такой как применяемый в генной терапии или при иммунизации нуклеиновыми кислотами, также подпадают под понятие антигена, которое применяется в настоящем описании. Понятие "эпитоп" относится к области конкретных субстанций (например, антигенной молекулы или антигенного комплекса), которая определяет их иммунологическую специфичность. Эпитоп подпадает под представленное в настоящем описании понятие "антиген". Как правило, эпитоп представляет собой полипептид или полисахарид, который в естественных условиях присутствует в антигене. В искусственных антигенах он может представлять собой низкомолекулярную субстанцию, такую как производное арсаниловой кислоты. В-клеточный эпитоп, как правило, должен включать по меньшей мере примерно 5 аминокислот, но может состоять лишь из 3-4 аминокислот. Т-клеточный эпитоп, такой как эпитоп, распознаваемый ЦТЛ (цитотоксические Т-лимфоциты), как правило, должен включать по меньшей мере примерно 7-9 аминокислот, а эпитоп, распознаваемый Т-клетками-хелперами, как правило, должен включать по меньшей мере примерно 12-20 аминокислот. В контексте настоящего описания понятие "рак" относится к аномальному росту клеток, которые имеют тенденцию к неконтролируемой пролиферации и в некоторых случаях к метастазированию (распространение). Типы рака включают (но не ограничиваясь только ими) плотные (солидные) опухоли (например, мочевого пузыря, кишечника, головного мозга, молочной железы, эндометрия, сердца, почки,легкого, лимфатической ткани (лимфома), яичника, поджелудочной железы или другого органа эндокринной системы (щитовидная железа), предстательной железы, кожи (меланома или гематологические опухоли (например, лейкозы). В контексте настоящего описания понятие "носитель" относится к химическим соединениям или агентам, которые облегчают включение соединения, представленного в настоящем описании, в клетки или ткани. В контексте настоящего описания понятия "совместное введение" или "комбинированное введение" или т.п. относятся к введению выбранных терапевтических средств индивидуальному пациенту и подра-7 023725 зумевается, что они включают схемы лечения, при которых агенты необязательно вводить, используя один и тот же путь введения или введение в одно и то же время. В контексте настоящего описания понятие "дерматологическое нарушение" относится к кожному нарушению. Такие дерматологические нарушения включают (но не ограничиваясь только ими) пролиферативные или воспалительные кожные нарушения, такие как атопический дерматит, буллезные нарушения, коллагенозы, контактный дерматит (экзема), болезнь Кавасаки, розовые угри, синдром ШегренаЛарссона, старческий кератоз, базально-клеточная карцинома и крапивница. В контексте настоящего описания понятие "разбавитель" относится к химическим соединениям, которые применяют для разведения соединения, представленного в настоящем описании, перед его введением. Разбавители можно применять также для стабилизации соединений, представленных в настоящем описании. В контексте настоящего описания понятия "эффективное количество" или "терапевтически эффективное количество" относятся к количеству соединения, представленного в настоящем описании, которое при введении является достаточным для облегчения в некоторой степени одного или нескольких симптомов заболевания или состояния, подлежащего лечению. Результатом может являться снижение и/или облегчение признаков, симптомов или причин заболевания или другое требуемое изменение биологической системы. Например, для терапевтического применения "эффективное количество" представляет собой количество композиции, которая содержит соединение, представленное в настоящем описании, требуемое для клинически значимого снижения симптомов заболевания. Соответствующее "эффективное" количество для любого индивидуума можно определять с помощью таких методик, как опыт с использованием возрастающих доз. В контексте настоящего описания понятия "усиление" или "усиливать" означает повышение или удлинение либо эффективности, либо продолжительности требуемого действия. Так, в контексте усиления действия терапевтических средств понятие "усиление" относится к способности повышать или пролонгировать либо эффективность, либо продолжительность действия других терапевтических средств на систему. В контексте настоящего описания понятие "усиливающее эффективное количество" относится к количеству, требуемому для усиления действия другого терапевтического средства на требуемую систему. Понятие "эксципиент" относится к любой, в сущности, вспомогательной субстанции, которая может присутствовать в конечной лекарственной форме. Например, под понятие "эксципиент" подпадают носители, связующие агенты, разрыхлители, наполнители (разбавители), замасливатели, суспендирующие/диспергирующие агенты и т.п. В контексте настоящего описания понятия "фиброз" или "фиброзирующее нарушение" относятся к состояниям, которые являются следствием острого или хронического воспаления и ассоциированы с аномальным накоплением клеток и/или коллагена, и включают (но не ограничиваясь только ими) фиброз индивидуальных органов или тканей, таких как сердце, почка, суставы, легкое или кожа, а также включают такие нарушения как идиопатический легочный фиброз и криптогенный фиброзирующий альвеолит. В контексте настоящего описания понятие "ятрогенный" относится к состоянию, нарушению или заболевания, возникшему или ухудшенному в результате лекарственного или хирургического лечения. В контексте настоящего описания понятие "иммунологически эффективное количество" означает,что индивидууму вводят достаточное количество либо в виде одной дозы или части серий доз, которое обладает эффективностью в отношении лечения или предупреждения иммунологического заболевания или нарушения. Это количество варьируется в зависимости от состояния здоровья и физического состояния индивидуума, подлежащего лечению, возраста, таксономической группы, к которой относится индивидуум, подлежащий лечению (например, примат кроме человека, примат и т.д.), способности иммунной системы индивидуума синтезировать антитела, требуемой степени защиты, состава вакцины, оценки лечащим врачом медицинской ситуации и других соответствующих факторов. Ожидается, что количество,находящееся в относительно широком диапазоне, можно определять с помощью рутинных экспериментов. В контексте настоящего описания понятия "иммунологический ответ" или "иммунный ответ" на антиген или композицию относятся к развитию у индивидуума гуморального и/или клеточного иммунного ответа на антиген или композицию. Иммунные ответы включают врожденные и адаптивные (приобретенные) иммунные ответы. Врожденные иммунные ответы представляют собой быстродействующие ответы, которые обеспечивают первую линию защиты, обусловленную иммунной системой. В противоположность этому адаптивный иммунитет основан на отборе и клональной экспансии клеток иммунной системы, которые имеют гены соматически преобразованных рецепторов (например, Т- и В-клеточных рецепторов), которые распознают антигены конкретного патогена или нарушения (например, опухоли), обеспечивая тем самым специфичность и иммунологическую память. Врожденные иммунные ответы, вместе с их многочисленными действиями, приводят к быстрому выбросу воспалительных цитокинов и активации антигенпрезентирующих клеток (АПК), таких как макрофаги и дендритные клетки. Для того чтобы отличать патогены от-8 023725 своих компонентов, врожденная иммунная система использует широкий спектр относительно неизменяемых рецепторов, которые выявляют отличительные черты патогенов, известные как ассоциированные с патогенами молекулярные паттерны или РАМР. Известно, что введение микробных компонентов в экспериментальные вакцины приводит к развитию сильных и продолжительных адаптивных иммунных ответов. Установлено, что помимо указанного потенциирования иммунных ответов механизм включает паттерн-распознающие рецепторы (PRR), которые по разному экспрессируются на различных клетках иммунной системы, включая нейтрофилы, макрофаги, дендритные клетки, естественные клеткикиллеры, В-клетки и некоторые неиммунные клетки, такие как эпителиальные и эндотелиальные клетки. Взаимодействие с PRR приводит к активации некоторых из таких клеток и секреции ими цитокинов и хемокинов, а также к созреванию и миграции других клеток. В сочетании это создает воспалительное окружение, что приводит к развитию адаптивного иммунного ответа. PRR включают нефагоцитарные рецепторы, такие как Толл-подобные рецепторы (TLR) и белки связывающего нуклеотиды домена олигомеризации (NOD) и рецепторы, которые индуцируют фагоцитоз, такие как рецепторы-мусорщики,маннозные рецепторы и рецепторы -глюкана. Дендритные клетки относятся к одному из наиболее важных типов клеток касательно инициации примирования нестимулированных CD4+-Т-клеток-хелперовTLR играет важную роль в определении качества ответов этих Т-клеток-хелперов, например, с учетом установленной способности TLR-сигнала определять специфический тип TH-ответа (например, TH1-ответ или TH2-ответ). Комбинация антителозависимого (гуморального) и клеточного иммунитета продуцируется в качестве части ответа TH1-типа, в то время как ответ TH2-типа главным образом представляет собой антителозависимый ответ."клеточный иммунный ответ" означает иммунный ответ, опосредуемый Т-лимфоцитами и/или другими лейкоцитами. Одним из важных аспектов клеточного иммунитета является антигенспецифический ответ цитолитических Т-клеток ("ЦТЛ"). ЦТЛ обладают специфичностью в отношении пептиных антигенов,которые презентуются в ассоциации с белками, кодируемыми главным комплексом гистосовместимости(ГКГ) и экспрессируются на поверхности клеток. ЦТЛ способствуют индукции и ускорению внутриклеточной деструкции внутриклеточных микробов или лизису клеток, инфицированных указанными микробами. Другой аспект клеточного иммунитета включает антигенспецифический ответ Т-клеток-хелперов. Действие Т-клеток-хелперов основано на их свойстве способствовать стимуляции функции и фокусированию активности неспецифических эффекторных клеток в отношении клеток, презентирующих пептидные антигены в сочетании с молекулами ГКГ на их поверхности. Понятие "клеточный иммунный ответ" относится также к производству цитокинов, хемокинов и других подобных молекул, которые продуцируются активированными Т-клетками и/или другими лейкоцитами, включая полученные из CD4+- иCD8+-Т-клетки. Таким образом, композиция, такая как иммуногенная композиция или вакцина, которая вызывает клеточный иммунный ответ, может служить для сенсибилизации позвоночного животного путем презентации антигена в сочетании с молекулами ГКГ на клеточной поверхности. Клеточно-опосредованный иммунный ответ направлен на клетки, которые презентируют антиген на своей поверхности, или на область вблизи этих клеток. Кроме того, могут образовываться антигенспецифические Т-лимфоциты, позволяющие осуществлять дополнительную защиту иммунизированного хозяина. Способность конкретного антигена или композиции стимулировать клеточно-опосредованный иммунологический ответ можно определять с помощью ряда анализов, известных в данной области, таких как анализы лимфопролиферации (активация лимфоцитов), анализы цитотоксических клеток ЦТЛ, анализируя Тлимфоциты, специфические в отношении антигена у сенсибилизированного индивидуума, или путем измерения производства цитокинов Т-клетками в ответ на повторную стимуляцию антигеном. Указанные анализы хорошо известны в данной области (см., например, Erickson и др., J. Immunol. 151, 1993, cc. 4189-4199; Doe и др., Eur. J. Immunol. 24, 1994, c. 2369-2376). Таким образом, в контексте настоящего описания иммунологический ответ может представлять собой ответ, который стимулирует производство ЦТЛ и/или производство или активацию Т-клеток-хелперов. Представляющий интерес антиген может вызывать также антитело-обусловленный иммунный ответ. Таким образом, иммунологический ответ может включать, например, среди прочего одно или несколько следующих действий: производство антител, например, В-клетками; и/или активация Т-клеток-супрессоров и/или -Т-клеток, специфически направленных против антигена или антигенов, присутствующего(их) в представляющей интерес композиции или вакцине. Эти ответы могут служить для нейтрализации инфективности и/или опосредовать связанную с антителом комплемент- или антитело-обусловленную клеточноопосредованную цитотоксичность (ADCC), обеспечивая защиту иммунизированного хозяина. Указанные ответы можно определять с помощью стандартных иммуноанализов и анализов нейтрализации, которые хорошо известны в данной области. Иммуногенные композиции, предлагаемые в изобретении, отличаются "повышенной иммуногенностью" для данного антигена, когда они обладают более высокой способностью вызывать иммунный ответ по сравнению с иммунным ответом, вызываемым эквивалентным количеством антигена в другой-9 023725 композиции (например, когда антиген вводят в виде растворимого белка). Так, композиция может отличаться "повышенной иммуногенностью", например, если композиция генерирует более сильный иммунный ответ или если более низкая доза или меньшее количество доз антигена необходимо для получения иммунного ответа у индивидуума, которому ее вводят. Повышенную иммуногенность можно определять, например, осуществляя введение композиций, предлагаемых в изобретении, и контрольных антигенов животным и осуществляя сравнительный анализ обоих вариантов. В контексте настоящего описания понятие "воспалительные нарушения" относится к заболеваниям или состояниям, которые отличаются одним или несколькими признаками, такими как боль (боль (воспаление) из-за образования вредных токсических веществ и стимуляции нервов), температура (жар в результате вазодилатации), покраснение (краснота в результате вазодилатации и усиленного притока крови), опухание (опухоль в результате избыточного притока или ограниченного оттока жидкости) и снижение функции (functio laesa, которое может быть частичным или полным, временным или перманентным). Воспаление имеет множество форм и включает (но не ограничиваясь только ими) воспаление, которое имеет один или несколько следующих видов: острое, адгезивное, атрофическое, катаральное, хроническое, цирротическое, диффузное, диссеминированное, эксудативное, фибринозное, фиброзное, очаговое,грануломатозное, гиперпластическое, гипертрофическое, интерстициальное, метастатическое, некротическое, облитерирующее, паренхиматозное, пластическое, продуктивное, пролиферативное, псевдомемранозное, гнойное, склерозирующее, серопластическое, серозное, простое, специфическое, подострое,гноеродное, токсическое, травматическое и/или язвенное. К воспалительным нарушениям относятся также (но не ограничиваясь ими) воспаления, повреждающие кровеносные сосуды (полиартериит, преходящий артрит); суставы (артрит: кристаллический, остеоартрит, псориатический, реактивный, ревматоидный, Рейтера); желудочно-кишечный тракт (болезнь,); кожу (дерматит) или множество органов и тканей (системная красная волчанка). В контексте настоящего описания понятие "модулирует" означает такое взаимодействие с мишенью, либо прямое, либо косвенное, которое изменяет активность мишени, включая (но не ограничиваясь только ими) повышение активности мишени, ингибирование активности мишени, ограничение активности мишени или удлинение продолжительности активности мишени. В контексте настоящего описания понятие "модулятор" относится к молекуле, которая взаимодействует с мишенью либо прямо, либо косвенно. Взаимодействия включают (но не ограничиваясь только ими) агонистическое или антагонистическое взаимодействие. В контексте настоящего описания понятия "глазная болезнь" или "офтальмологическое заболевание" относятся к заболеваниям, поражающим глаз или глаза, а также могут поражать окружающие ткани. Глазные или офтальмологические заболевания включают (но не ограничиваясь только ими) конъюнктивит, ретинит, склерит, увеит, аллергический конъюнктивит, вернальный конъюнктивит, папиллярный конъюнктивит и вызываемый цитомегаловирусом (CMV) ретинит. В контексте настоящего описания понятие "олигонуклеотид" относится к полинуклеотиду, состоящему из 5-100 нуклеотидов, как правило, 5-30 нуклеотидов. В контексте настоящего описания понятие "фармацевтически приемлемый" относится к материалу,такому как носитель или разбавитель, который не влияет на биологическую активность или свойства соединений, представленных в настоящем описании. Указанные материалы при введении индивидууму не обладают нежелательными биологическими действиями или не взаимодействуют нежелательным образом с любым из компонентов композиции, в которую они входят. В контексте настоящего описания понятие "фармацевтически приемлемая соль" относится к форме соединения, которая не вызывает выраженного раздражения организма, в который ее вводят, и не влияет на биологическую активность и свойства соединений, представленных в настоящем описании. В контексте настоящего описания понятия "комбинация" или "фармацевтическая комбинация" означает продукт,полученный в результате смешения или объединения более одного действующего вещества, и они включают как фиксированные, так и нефиксированные комбинации действующих веществ. Понятие "фиксированная комбинация" означает, что действующие вещества, например соединение формулы (I) и дополнительное терапевтическое средство, оба вводят пациенту одновременно в виде одной целой формы или дозы. Понятие "нефиксированная комбинация" означает, что действующие вещества, например соединение формулы (I) и дополнительное терапевтическое средство, оба вводят пациенту в виде отдельных форм одновременно, совместно или последовательно, не ограничиваясь конкретными временными пределами, при этом такое введение обеспечивает уровни терапевтической эффективности двух соединений в организме пациента. Последнее относится также к основанной на применении смесей терапии, например к введению 3 или большего количества действующих веществ. В контексте настоящего описания понятия "композиция" или "фармацевтическая композиция" относятся к смеси по меньшей мере одного соединения, например соединений формулы (I), представленных в настоящем описании, по меньшей мере с одним и необязательно несколькими другими фармацевтически приемлемыми химическими компонентами, такими как носители, стабилизаторы, разбавители,диспергирующие агенты, суспендирующие агенты, загустители и/или эксципиенты."Физиологическое значение рН" или "рН в физиологическом диапазоне" означает значение рН в- 10023725 диапазоне примерно от 7,2 до 8,0 включительно, более предпочтительно в диапазоне примерно от 7,2 до 7,6 включительно. В контексте настоящего описания понятие "пролекарство" относится к агенту, который превращается в родительское лекарственное средство in vivo. Примерами пролекарств соединений, представленных в настоящем описании, являются (но не ограничиваясь только ими) соединение, представленное в настоящем описании, вводимое в виде сложного эфира, который затем подвергается метаболическому гидролизу с образованием карбоновой кислоты, т.е. активной субстанции, внутри клетки. Другим примером пролекарства является короткий пептид, связанный с кислотной группой, причем пептид метаболизируется с образованием требуемого активного фрагмента. В контексте настоящего описания понятия "полинуклеотид" и "нуклеиновая кислота" применяют взаимозаменяемо, и они относятся к одно- или двухцепочечному полимеру дезоксирибонуклеотидных или рибонуклеотидных оснований. Одноцепочечные полинуклеотиды включают кодирующие цепи и антисмысловые цепи. Полинуклеотиды включают РНК и ДНК и их можно выделять из природных источников, синтезировать in vitro или получать из комбинации встречающихся в естественных условиях и синтетических молекул. Примерами полинуклеотидов являются (но не ограничиваясь только ими) гены,кДНК, мРНК, самореплицирующиеся молекулы РНК, самореплицирующиеся молекулы ДНК, последовательности геномной ДНК, последовательности геномной РНК, олигонуклеотиды. Самореплицирующиеся молекулы РНК и самореплицирующиеся молекулы ДНК обладают способностью к самоамплификации при интродукции их в клетку-хозяина. Полинуклеотид может быть линейным или нелинейным (например, содержать кольцевые, разветвленные и др. элементы). Под понятия "полинуклеотид" и "нуклеиновая кислота" подпадают модифицированные варианты (например, последовательности с делецией, добавлением и/или заменой). Модифицированные варианты могут быть получены преднамеренно, например с помощью сайтнаправленного мутагенеза, или могут быть получены случайно, например посредством встречающихся в естественных условиях мутаций. Полинуклеотид может состоять из мономеров, которые представляют собой встречающиеся в естественных условиях нуклеотиды (такие как ДНК и РНК) или аналогов встречающихся в естественных условиях нуклеотидов или их комбинации. Модифицированные нуклеотиды могут иметь изменения в сахарных фрагментах и/или фрагментах, представляющих собой пиримидиновое или пуриновое основание. Модификации сахара включают, например, замену одной или нескольких гидроксильных групп на галогены, алкильные группы, амины и азидогруппы, или сахара могут быть функционализированы в виде простых или сложных эфиров. Кроме того, весь сахарный фрагмент может быть замещен структурами, аналогичными с позиций стеричности и электронной структуры, такими как азасахара и карбоциклические аналоги сахаров. Примерами модификаций в фрагменте, представляющем собой основание, являются алкилированные пурины и пиримидины, ацилированные пурины или пиримидины или другие хорошо известные замены на гетероциклы. Мономеры полинуклеотида могут быть сцеплены с помощью фосфодиэфирных связей или аналогов таких связей. Аналогами фосфодиэфирных связей являются фосфоротиоат, фосфородитиоат, фосфороселеноат, фосфородиселеноат, фосфороанилотиоат, фосфорнилидат, фосфорамидат и т.п. Понятие "полинуклеотид" и "нуклеиновая кислота" относится также к так называемым "пептидным нуклеиновым кислотам", которые содержат встречающиеся в естественных условиях или модифицированные основания нуклеиновых кислот, присоединенные в полиамидному каркасу. В контексте настоящего описания понятие "содержащие полинуклеотид субстанции" относится к молекуле, по меньшей часть которой представляет собой полинуклеотид. В контексте настоящего описания понятия "полипептид", "белок" и "пептид" относятся к любому полимеру, состоящему из нескольких аминокислот, вне зависимости от длины или посттрансляционной модификации (например, фосфорилирование или гликозилирование), соединенных, по меньшей мере,частично с помощью ковалентной связи (например, "белок" в контексте настоящего описания относится как к линейным полимерам (цепи) аминокислот, соединенных пептидными связями, так и к белкам,имеющим вторичную, третичную или четвертичную структуру, которые могут включать другие формы внутримолекулярной и межмолекулярной ассоциации, такие как водородные и ван-дер-ваальсовы связи,внутри или между пептидной(ыми) цепью(ями. Примерами полипептидов являются (но не ограничиваясь только ими) белки, пептиды, олигопептиды, димеры, мультимеры, варианты и т.п. В некоторых вариантах осуществления изобретения полипептид может быть немодифицирован, т. е. в нем могут отсутствовать модификации, такие как фосфорилирование и гликозилирование. Полипептид может содержать полный индивидуальный встречающийся в естественных условиях полипептид или его часть или может представлять собой слитый или химерный полипептид, который содержит аминокислотные последовательности из двух или большего количества встречающихся в естественных условиях полипептидов. В контексте настоящего описания понятие "содержащие полипептид субстанции" относится к молекуле, по меньшей мере часть которой представляет собой полипептид. Примерами являются полипептиды, гликопротеины, металлопротеины, липопротеины, представляющие собой сахарид антигены,конъюгированные с белками-носителями, и т. д. В контексте настоящего описания понятие "респираторное заболевание" относится к заболеваниям,- 11023725 которые поражают органы, участвующие в дыхании, такие как нос, глотка, гортань, трахея, бронхи и легкие. Респираторные заболевания включают (но не ограничиваясь только ими) астму, респираторный дистресс-синдром взрослых и аллергическую (приобретенную) астму, неаллергическую (наследственную) астму, острую серьезную астму, хроническую астму, клиническую астму, ночную астму, индуцированную аллергеном астму, аллерген-индуцированную астму, чувствительную к аспирину астму, индуцированную физической нагрузкой астму, изокапническую гипервентиляцию, начинающуюся в детском возрасте астму, начинающуюся во взрослом возрасте астму, кашлевой вариант астмы, профессиональную астму, устойчивую к стероидам астму, сезонную астму, сезонный аллергический ринит, перениальный (круглогодичный) аллергический ринит, хроническое обструктивное заболевание легких, включая хронический бронхит или эмфизему, легочную гипертензию, интерстициальный легочный фиброз и/или воспаление дыхательных путей, муковисцидоз и гипоксию. В контексте настоящего описания понятие "индивидуум" или "пациент" относится к млекопитающим и немлекопитающим. Примерами млекопитающих являются (но не ограничиваясь только ими) люди, шимпанзе, человекообразные обезьяны, крупный рогатый скот, лошади, овцы, козы, свиньи; кролики,собаки, кошки, крысы, мыши, морские свинки и т. п. Примерами немлекопитающих являются (но не ограничиваясь только ими) птицы, рыбы и т. п. Предпочтительно индивидуум представляет собой человека и может представлять собой человека, у которого диагностировано подлежащее лечению заболевание или нарушение, указанное в настоящем описании. В контексте настоящего описания понятие "модулятор TLR2" относится к соединению, которое модулирует рецептор TLR2. В контексте настоящего описания понятие "TLR2-заболевание" или "заболевание или нарушение,ассоциированное с активностью TLR2" относится к любому болезненному состоянию, ассоциированному с Толл-подобным рецептором. Указанные заболевания или нарушения включают (но не ограничиваясь только ими) инфекционные заболевания, воспалительные заболевания, респираторные заболевания и аутоиммунные заболевания, такие, например, как астма, хроническое обструктивное заболевание легких(ХОЗЛ), респираторный дистресс-синдром взрослых (РДСВ), болезнь Крона, бронхит, дерматит, аллергический ринит, псориаз, склеродерма, крапивница, ревматоидный артрит, рассеянный склероз, рак,ВИЧ-инфекция и обыкновенная волчанка. В контексте настоящего описания понятие "терапевтически эффективное количество" относится к любому количеству соединения, приводит к улучшенному по сравнению с соответствующим индивидуум, которому не вводят указанное количество, лечению, заживлению, предупреждению или облегчению заболевания, нарушения или побочного действия или снижает скорость прогрессирования заболевания или нарушения. Под понятие подпадают также количества, эффективные в отношении улучшения обычной физиологической функции. В контексте настоящего описания понятия "лечить", "процесс лечения" и "лечение" относятся к методам облегчения, аннулирования или ослабления симптомов заболевания или состояния, предупреждения возникновения дополнительных симптомов, облегчения или предупреждения лежащих в основе симптомов метаболических нарушений, ингибирования заболевания или состояния, прекращения развития заболевания или состояния, ослабления заболевания или состояния, вызывания регресса заболевания или состояния, ослабления состояния, вызываемого заболеванием или состоянием, или прекращения симптомов заболевания или состояния или профилактически и/или терапевтически. Понятие "векторная конструкция", как правило, относится к любой конструкции, которая обладает способностью обеспечивать экспрессию представляющей(их) интерес нуклеотидной(ых) последовательности(ей) или представляющего(их) интерес гена(ов). "Конструкция ДНК-вектора" относится к молекуле ДНК, которая обладает способностью обеспечивать экспрессию представляющей(их) интерес нуклеотидной(ых) последовательности(ей) или представляющего(их) интерес гена(ов). Одним из конкретных типов конструкции ДНК-вектора является плазмида, которая представляет собой кольцевую эписомальную молекулу ДНК, которая обладает способностью к автономной репликации в клетке-хозяине. Как правило, плазмида представляет собой кольцевую двухцепочечную ДНК-петлю, в которую можно встраивать путем лигирования дополнительные ДНК-сегменты. pCMV представляет собой конкретную плазмиду, хорошо известную в данной области. Известны другие конструкции ДНК-вектора, основой которых являются вирусные РНК. Указанные конструкции ДНК-вектора, как правило, содержат промотор, который функционирует в эукариотической клетке, расположенный на 5'-конце относительно последовательности кДНК, для которой продуктом транскрипции является конструкция РНК-вектора (например, репликон вектора альфавирусной РНК ), и 3'-концевую область терминации. Другими примерами векторных конструкций являются конструкции РНК-вектора (например, конструкции альфавирусных векторов) и т. п. В контексте настоящего описания "конструкция РНК-вектора", "репликон РНК-вектора" и "репликон" относятся к молекуле РНК, которая обладает способностью обеспечивать свою собственную амплификацию или саморепликацию in vivo, как правило, в клетке-мишени. Конструкцию РНКвектора применяют непосредственно без интродукции ДНК в клетку и транспорта в ядро, где должна происходить транскрипция. При использовании РНК-вектора для непосредственного введения в цитоплазму клетки-хозяина имеет место эффективная автономная репликация и трансляция гетерологичнойChemDraw Ultra 10.0 (CambridgeSoft) или Jchem, версия 5.0.3 (фирма ChemAxon). Другие объекты, отличительные признаки и преимущества способов, композиций и комбинацией,представленных в настоящем описании, должны стать очевидными из приведенного ниже подробного описания изобретения. Однако, как должно быть очевидно, подробное описание и конкретные примеры,характеризующие конкретные варианты осуществления изобретения, даны только с целью иллюстрации. Описание предпочтительных вариантов осуществления изобретения Настоящее изобретение относится к соединениям и содержащим их фармацевтическим композициям, которые являются агонистами Толл-подобного рецептора-2 (TLR2). Изобретение относится также к соединениям, фармацевтическим композициям и способам, предназначенным для лечения заболеваний и/или нарушений, ассоциированных с активностью TLR2. Указанные в настоящем описании агонисты TLR2 представляют собой соединения, которые имеют структуру, которая описывается формулой (I), и их фармацевтически приемлемые солиL4 обозначает -CR7R7)pO)q(CR10R10)p-; каждый R7 обозначает Н; каждый R10 обозначает Н; каждый р независимо друг от друга выбран из 1, 2, 3, 4, 5 и 6, иq обозначает 1, 2, 3 или 4. В конкретных вариантах осуществления изобретения соединения формулы (I) представляют собой соединения, которые имеют структуру, представленную в формуле (VI) В конкретных вариантах указанных соединений, которые имеют структуру, представленную в формуле (I) и формуле (VI), R1 обозначает Н. В других вариантах указанных соединений, которые имеют структуру, представленную в формуле (I) и формуле (VI), R1 обозначает -С(О)-С 15 алкил. В других вариантах указанных соединений, которые имеют структуру, представленную в формуле (I) и формуле (VI),R1 обозначает -С(О)-С 10-С 18 алкил. В конкретных вариантах указанных соединений, которые имеют структуру, представленную в формуле (I) и формуле (VI), R2 обозначает С 10-С 18 алкил. В конкретных вариантах указанных соединений, которые имеют структуру, представленную в формуле (I) и формуле (VI), R3 обозначает С 10-С 18 алкил. В конкретных вариантах указанных соединений, которые имеют структуру, представленную в формуле (I) и формуле (VI), R2 обозначает -С 11 алкил и R3 обозначает -С 11 алкил; илиR2 обозначает -С 15 алкил и R3 обозначает -С 15 алкил. В конкретных вариантах указанных соединений, которые имеют структуру, представленную в формуле (I) и формуле (VI), R2 обозначает -С 11 алкил и R3 обозначает -С 11 алкил. В конкретных вариантах указанных соединений, которые имеют структуру, представленную в формуле (I) и формуле (VI), R5 обозначает -Р(О)(ОН)2 или -С(О)ОН. В конкретных вариантах указанных соединений, которые имеют структуру, представленную в формуле (I) и формуле (VI), L4 обозначает -CR7R7)pO)q(CR10R10)p-, R10 каждый независимо друг от друга выбран из Н; р каждый независимо друг от друга выбран из 2, 3 и 4 и q обозначает 1, 2, 3 или 4. В указанных вариантах соединений, которые имеют структуру, представленную в формуле (VI)L4 обозначает -CR7R7)pO)q(CR10R10)p-; каждый R7 обозначает Н; каждый R10 обозначает Н; каждый р независимо друг от друга выбран из 1, 2, 3, 4, 5 и 6, иq обозначает 1, 2, 3 или 4. В конкретных вариантах соединений формул (I) и (VI) R5 обозначает -Р(О)(О-Х+ )2 или -Р(О)(О 2+)2 Х ; где X+ и X2+ обозначают фармацевтически приемлемые катионы. В конкретных вариантах осуществления изобретения указанные фармацевтически приемлемые катионы выбраны из натрия, калия,кальция, цинка и магния. В конкретных вариантах соединений формулы (I) R5 обозначает -РО 3-X3+; где X3+ обозначает Al3+. Содержащие алюминий адъюванты, такие как гидроксид алюминия, оксигидроксид алюминия и гидроксифосфат алюминия, применяют в вакцинах для связывания антигенов. Обсуждение содержащих алюминий адъювантов и их применения в вакцинах представлено в Expert Rev. Vaccines, 46(5), 2007, c. 685-698 и Vaccines, 25, 2007, c. 6618-6624, описание которых полностью включено в настоящее описание в качестве ссылки. В конкретном варианте осуществления изобретения соединения формулы (I), представленные в настоящем описании, являются агонистами TLR2, которые связаны с содержащими алюминий адъювантами, такими как (но не ограничиваясь только ими) гидроксид алюминия, оксигидроксид алюминия и гидроксифосфат алюминия. В конкретных вариантах осуществления изобретения указанные соединения формулы (I) содержат фосфат, фосфоновую кислоту, фосфонат, фторированную фосфоновую или фторированную фосфонатную группу. В других вариантах осуществления изобретения указанные соединения формулы (I) содержат фосфат, фосфоновую кислоту, фосфонат, фторированную фосфоновую кислоту или фторированную фосфонатную группу и одну или несколько дополнительных ионизируемых групп из карбоновой кислоты и сульфата. В конкретных вариантах осуществления изобретения соединения формулы (I), представленные в настоящем описании, объединяют с антигеном, содержащим алюминий адъювантом и необязательно с носителем, фармацевтически приемлемым эксципиентом с получением иммуногенной композиции. В других вариантах осуществления изобретения указанная иммуногенная композиция содержит соединение формулы (I) и антиген, где антиген представляет собой (но не ограничиваясь только ими) бактериальный антиген, вирусный антиген, грибной антиген, опухолевый антиген или антиген, ассоциированный с ЗППП (заболевание, передающееся половым путем), болезнью Альцгеймера, респираторными нарушениями, аутоиммунными нарушениями, такими, например, как (но не ограничиваясь только ими) ревматоидный артрит или обыкновенная волчанка, педиатрическими нарушениями и ожирением, и где количество соединения представляет собой количество, эффективное в отношении усиления иммунного ответа на антиген у индивидуума, которому вводят композицию. Приемлемые для применения в указанных иммуногенных композициях антигены представлены в настоящем описании. В конкретных вариантах осуществления изобретения указанные иммуногенные композиции содержат бактериальный антиген из штамма Neisseria meningitides, например серогруппы А, С, W135, Y и/или В. Конкретные антигены, предназначенные для применения в указанных композициях, представлены в настоящем описании. В других вариантах осуществления изобретения указанные иммуногенные композиции и другие представленные в настоящем описании композиции применяют в качестве вакцин; их применение для лечения нарушений, ассоциированных с входящим в композицию антигеном, представлено в настоящем описании. Соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры и фармацевтические композиции, представленные в настоящем описании, включают все приемлемые изотопные вариации указанных соединений и их фармацевтически приемлемых солей, сольватов, N-оксидов, пролекарств и изомеров и фармацевтических композиций. Под изотопной вариацией со- 14023725 единения, представленного в настоящем описании, или его фармацевтически приемлемой соли подразумевают соединение, в котором по меньшей мере один атом заменен на атом, который имеет такое же атомное число, но атомная масса которого отличается от атомной массы, обычно встречающейся в естественных условиях. Примерами изотопов, которые можно включать в соединения, представленные в настоящем описании, и их фармацевтически приемлемые соли, являются (но не ограничиваясь только ими) изотопы водорода, углерода, азота и кислорода, такие как 2 Н, 3 Н, 11 С, 13 С, 14 С, 15N, 17 О, 18 О, 35S, 18F, 36Cl и 123I. Определенные изотопные вариации соединений, представленных в настоящем описании, и их фармацевтически приемлемых солей, например, в которые включен радиоактивный изотоп, такой как 3 Н или 14 С, можно применять в качестве лекарственного средств и/или субстрата в опытах по изучению распределения в тканях. В конкретных примерах можно применять изотопы 3 Н и 14 С благодаря легкости их получения и простоты выявления. В других примерах замена на изотопы, такие как 2 Н, может обеспечивать определенные терапевтические преимущества в результате более высокой метаболической стабильности,например удлиненное время полужизни in vivo или пониженные требуемые дозы. Изотопные вариации соединений и их фармацевтически приемлемых солей, сольватов, N-оксидов, пролекарств и изомеров и фармацетических композиций, представленных в настоящем описании, получают общепринятыми методами с использованием соответствующих изотопных вариаций приемлемых реагентов. Способы получения соединений формулы (I). Общие процедуры получения соединений формулы (I) описаны ниже в примерах. В описанных реакциях реактивные функциональные группы, например гидроксигруппу, аминогруппу, иминогруппу,тиогруппу или карбоксигруппу, если они должны присутствовать в конечном продукте, можно защищать, препятствуя тем самым их нежелательному участию в реакциях. Можно использовать общепринятые защитные группы согласно стандартной практике (см., например, T.W. Greene и P. G. M. Wuts в:"Protective Groups in Organic Chemistry", изд-во John Wiley and Sons, 1991). В конкретных вариантах осуществления изобретения соединения формулы (I), представленные в настоящем описании, получают в виде фармацевтически приемлемой кислотно-аддитивной соли путем взаимодействия соединения формулы (I) в форме свободного основания с фармацевтически приемлемой органической кислотой или неорганической кислотой. В других вариантах осуществления изобретения получают фармацевтически приемлемую соль присоединения основания соединений формулы (I), представленных в настоящем описании, путем взаимодействия соединения формулы (I) в форме свободной кислоты с фармацевтически приемлемым органическим основанием или неорганическим основанием. В альтернативном варианте соединения формулы (I), представленные в настоящем описании, в форме солей получают, используя соли исходных продуктов или промежуточных продуктов. В конкретных вариантах осуществления изобретения соединения формулы (I), представленные в настоящем описании, находятся в форме других солей, включая (но не ограничиваясь только ими) оксалаты и трифторацетаты. В конкретных вариантах осуществления изобретения образуются полусоли кислот и оснований, например полусульфат и полукальциевые соли. Указанные фармацевтически приемлемые кислотно-аддитивные соли соединений формулы (I) включают (но не ограничиваясь только ими) такие соли как гидробромид, гидрохлорид, сульфат, нитрат,сукцинат, малеат, формиат, ацетат, адипат, безилат, бикарбонат/карбонат, пропионат, фумарат, цитрат,тартрат, лактат, бензоат, салицилат, глутамат, аспартат, пара-толуолсульфонат, бензолсульфонат, метансульфонат, этансульфонат, нафталинсульфонат (например, 2-нафталинсульфонат), соль гексаноат, бисульфат/сульфат, борат, камсилат, цикламат, эдизилат, эзилат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодит/йодит, изетионат, лактат, малаг, малонат, мезилат, метилсульфат, нафтилат, 2-напзилат, никотинат, оротат, оксалат, пальмитат, памоат, фосфат/вторичный кислый фосфат/первичный кислый фосфат, пироглутамат, сахарат, стеарат, таннат, тозизилат, трифторацетат и ксинафоат. Органические или неорганические соли, которые можно применять для получения определенных фармацевтически приемлемых солей соединений формулы (I), включают (но не ограничиваясь только ими) бромисто-водородную, соляную, серную, азотную, фосфорную, янтарную, малеиновую, муравьиную, уксусную, пропионовую, фумаровую, лимонную, винную, молочную, бензойную, салициловую,глутаминовую, аспарагиновую, паратолуолсульфоновую, бензолсульфоновую, метансульфоновую, этансульфоновую, нафталинсульфоновую, например 2-нафталинсульфоновую, или капроновую кислоту. Указанные фармацевтически приемлемые соли присоединения оснований соединений формулы (I) включают (но не ограничиваясь только ими) соли алюминия, аргинана, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. В конкретных вариантах осуществления изобретения соединения формулы (I), представленные в настоящем описании, в форме свободной кислоты или свободного основания получают из соответствующей соли присоединения основания или кислотно-аддитивной соли соответственно. Например, соединение формулы (I) в форме кислотно-аддитивной соли превращают в соответствующее свободное основание путем обработки приемлемым основанием (например (но не ограничиваясь только ими), раствором гидроксида аммония, гидроксида натрия и т. п.). Например, соединение формулы (I) в форме со- 15023725 ли присоединения основания превращают в соответствующую свободную кислоту путем обработки приемлемой кислотой (например (но не ограничиваясь только ею) соляной кислотой). В конкретных вариантах осуществления изобретения соединения формулы (I) в неокисленной форме получают из N-оксидов соединений формулы (I) путем обработки восстановителем (например (но не ограничиваясь только ими), серой, диоксидом серы, трифенилфосфином, борогидридом лития, борогидридом натрия, трихлоридом фосфора, трибромидом фосфора или т. п.) в приемлемом инертном органическом растворителе (например (но не ограничиваясь только ими), в ацетонитриле, этаноле, водном диоксане или т. п.) при температуре от 0 до 80 С. В конкретных вариантах осуществления изобретения производные соединений формулы (I) в виде пролекарств получают с помощью методов, хорошо известных обычным специалистам в данной области(например, см. более подробное описание у Saulnier и др., Bioorganic and Medicinal Chemistry Letters, т. 4,1994, с. 1985). Например, приемлемые пролекарства получают путем взаимодействия недериватизированного соединения формулы (I) с приемлемым карбамилирующим агентом (например (но не ограничиваясь только ими), 1,1-ацилоксиалкилкарбанохлоридатом, паранитрофенилкарбонатом или т.п.). В конкретных вариантах осуществления изобретения соединения формулы (I) получают в виде защищенных производных с помощью методов, известных обычным специалистам в данной области. Подробное описания методик, пригодных для создания защитных групп и их удаления, представлено у Т.W.Greene, "Protecting Groups in Organic Chemistry", 3-е изд., изд-во John Wiley и Sons, Inc., 1999 г. В конкретных вариантах осуществления изобретения соединения формулы (I) получают или они образуются в виде сольватов (например, гидратов). В конкретных вариантах осуществления изобретения гидраты соединений формулы (I) получают путем перекристаллизации из смеси водных/органических растворителей, используя такие органические растворители, как диоксин, тетрагидрофуран или метанол. В конкретных вариантах осуществления изобретения соединения формулы (I) получают в виде их индивидуальных стереоизомеров. В других вариантах осуществления изобретения соединения формулы(I), представленные в настоящем описании, получают в виде индивидуальных стереоизомеров путем взаимодействия рацемической смеси соединения с оптически активным разделяющим агентом с получением пары диастереоизомерных соединений, разделения диастереомеров и выделения оптически чистых энантиомеров. В конкретных вариантах осуществления изобретения разделение энантиомеров осуществляют с помощью ковалентных диастереомерных производных соединений формулы (I) или с использованием диссоциируемых комплексов (например, кристаллических диастереомерных солей). Диастереомеры обладают различными физическими свойствами (например, температурой плавления, температурой кипения, растворимостью, реактивностью и т. д.) и их легко разделять на основе указанных различий. В конкретных вариантах осуществления изобретения диастереомеры разделяют с помощью хроматографии или методов разделения/обратного растворения на основе различий в растворимости. Затем оптически чистый энантиомер выделяют вместе с разделяющим агентом с помощью любых применяемых на практике средств, которые не приводят к рацемизации. Более подробное описание методик, которые можно применять для разделения стереоизомеров соединений из их рацемической смеси, см. у JeanSons, Inc., 1981 г. Соединения формулы (I) получают с помощью процессов, представленных в настоящем описании и проиллюстрированных в примерах. В конкретных вариантах осуществления изобретения соединения формулы (I) получают следующим образом:(а) необязательно превращают соединение формулы (I) в фармацевтически приемлемую соль;(б) необязательно превращают соль соединения формулы (I) в несолевую форму;(в) необязательно превращают неокисленную форму соединения формулы (I) в фармацевтически приемлемый N-оксид;(д) необязательно разделяют и выделяют индивидуальный изомер соединения формулы (I) из смеси изомеров;(е) необязательно превращают недериватизированное соединение формулы (I) в производное в виде фармацевтически приемлемого пролекарства; и(ж) необязательно превращают производное в виде пролекарства соединения формулы (I) в его недериватизированную форму. Примеры (но не ограничиваясь только ими) схем синтеза, применяемых для получения соединений формулы (I), представленных в настоящем описании, проиллюстрированы на реакционных схемах (I)(II). На схеме (I) проиллюстрирован синтез соединений формулы (I), согласно которому получают липопептид I-4 путем сочетания замещенного N-защищенного-(R)-цистеина (I-1) с различными аминами (I2) в присутствии связывающего реагента и последующего удаления защитных групп. Дополнительное взаимодействие первичного амина липопептида I-4 приводит к получению липопептида I-5. ЗаместителиL1, L2, R1, R2, R3 и R4 имеют значения, указанные в настоящем описании. "Prot." обозначает аминозащитную группу, такую, например, как (но не ограничиваясь только ими) Fmoc, Boc и Cbz. На схеме (II) проиллюстрирован синтез соединений формулы (I), в которой L1 обозначает СН 2 ОС(О)- и L2 обозначает -ОС(О)-. При этом путем восстановления (N-Fmoc-OtBu-Cys)2 (II-1) получали N-Fmoc-OtBu-цистеин (II-2) и тиол -N-Fmoc-OtBu-цистеина (II-2) алкилировали с помощью эпоксида сложного эфира с получением N-Fmoc-OtBu-[2(R),3-дигидроксилпропил]-(R)-цистеина (II-3). Путем ацилирования соединения (II-3) получали соединение (II-4) и последующий гидролиз сложного третбутилового эфира позволял получать замещенный N-Fmoc-(R)-цистеин (II-5). Липопептид (II-7) получали путем сочетания замещенного N-Fmoc-(R)-цистеина (II-5) с различными аминами (II-6) в присутствии связывающего реагента. После удаления защитной группы Fmoc получали липопептид (II-8), а после дополнительного взаимодействия первичного амина липопептида (II-8) получали липопептид (II-9). Заместители R1, R2, R3 и R4 имеют значения, указанные в настоящем описании. Схема (II) На схеме (III) проиллюстрирован синтез соединений формулы (I), в которой L1 обозначает -СН 2 О- иL2 обозначает -О-. При этом путем взаимодействия с трифлиновой (трифторметансульфоновой) кислотой 1,2-диалкоксилглицерина (III-1) получали трифлат (III-2), который применяли для алкилирования тиола(III-3) с получением (III-4). Путем последующего гидролиза сложного трет-бутилового эфира получали замещенную карбоновую кислоту (III-5). Липопептид (III-7) получали путем сочетания замещенный карбоновой кислоты (III-5) с различными аминами (III-6) в присутствии связывающего реагента. Затем после удаления защитной группы Fmoc получали липопептид (III-8), а после дополнительного взаимодействия первичного амина липопептида (III-8) получали липопептид (III-9). Заместители R1, R2, R3 и R4 имеют значения, указанные в настоящем описании. Схема (III) На схеме (IV) проиллюстрирован синтез соединений формулы (I), в которой L1 обозначает -СН 2 О- иL2 обозначает -NR7C(O)-. При этом путем избирательного удаления защитных групп первичного спирта в 3-алкоксилглицерине (IV-1) получали соединение (IV-2). Путем мезилирования вторичного спирта глицерина (IV-2) получали соединение (IV-3), а после обработки NaN3 получали азид (IV-4). После удаления защитной силильной группы соединения (IV-4) с последующей обработкой трифлиновой кислотой образовавшего спирта (IV-5) получали трифлированный глицерин (IV-6). Тиол (IV-7) алкилировали трифлатом (IV-6) с получением азида (IV-8). Азид (IV-8) восстанавливали до соответствующего амина, который ацилировали с получением амида (IV-9). Путем гидролиза сложного трет-бутилового эфира (IV-9) получали замещенную карбоновую кислоту (IV-10). Липопептид (IV-12) получали путем сочетания замещенной карбоновой кислоты (IV-10) с различными аминами (IV-11) в присутствии связывающего реагента. Затем после удаления защитной группы Fmoc получали липопептид (IV-13), а после дополнительного взаимодействия первичного амина липопептида (IV-13) получали липопептид (IV-14). Заместители R1,R2, R3, R4 и R7 имеют значения, указанные в настоящем описании. Схема (IV) На схеме (V) проиллюстрирован синтез соединений формулы (I), в которой L1 обозначает -CH2NR7 С(О)- и L2 обозначает -NR7C(O)-. При этом путем восстановления дисульфида (V-2) получали тиол (V-3),который алкилировали с помощью R-эпоксида сложного эфира с получением диола (V-4). Путем мезилирования диола (V-4) получали соединение (V-5), которое обрабатывали NaN3 с получением диазида(V-6). Диазид (V-6) восстанавливали с получением диамина (V-7) с помощью Pd(OH)2, а затем ацилировали с получением диамида (V-8). После гидролиза сложного трет-бутилового эфира (V-8) получали замещенную карбоновую кислоту (V-9). Липопептид (V-11) получали путем сочетания замещенной карбоновой кислоты (V-9) с различными аминами (V-10) в присутствии связывающего реагента. После удаления защитной группы Cbz получали липопетид (V-12), а после дополнительного взаимодействия первичного амина липопептида (V-12) получали липопептид (V-13). Заместители R1, R2, R3 и R4 имеют значения, указанные в настоящем описании. Схема (V) На схеме (VI) проиллюстрирован синтез соединений формулы (I), в которой L1 обозначает -СН 2 О- иL2 обозначает -ОС(О)-. При этом путем циклизации диола (VI-1) получали эпоксид (VI-2), который алкилировали тиолом с получением спирта (VI-3). После ацилирования спирта (VI-3) получали соединение(VI-4). Путем гидролиза сложного трет-бутилового эфира (VI-4) получали замещенную карбоновую кислоту (VI-5). Липопептид (VI-7) получали путем сочетания замещенной карбоновой кислоты (VI-5) с различными аминами (VI-6) в присутствии связывающего реагента. Затем после удаления защитных групп липопептида (VI-7) получали липопептид (VI-8), а после дополнительного взаимодействия первичного амина липопептида (VI-8) получали липопептид (VI-9). Заместители R1, R2, R3 и R4 имеют значения, указанные в настоящем описании. Схема (VI) На схеме (VII) проиллюстрирован синтез соединений формулы (I), в которой R1 обозначает -H-, L1 обозначает -CH2OC(O)NH- и L2 обозначает -OC(O)NH-. При этом путем алкилирования тиола (VII-1) с помощью эпоксида получали диол (VII-2), который ацилировали с помощью изоцианата (VII-3) с полученим бискарбамата (VII-4). Путем гидролиза сложного трет-бутилового эфира (VII-4) получали замещенную карбоновую кислоту (VII-5). Липопептид (VII-7) получали путем сочетания замещенной карбоновой кислоты (VII-5) с различными аминами (VII-6) в присутствии связывающего реагента. Затем после удаления защитных групп липопептида (VII-7) получали липопептид (VII-8). Заместители R1, R2, R3 и R4 имеют значения, указанные в настоящем описании. Схема (VII) На схеме (VIII) проиллюстрирован синтез соединений формулы (I), в которой R1 обозначает -С(О)С 8-С 18 алкил -, L1 обозначает -CH2OC(O)NH- и L2 обозначает - OC(O)NH-. При этом путем восстановления соединения VIII-1 получали свободный амин (VIII-2), который подвергали взаимодействию с RX1(VIII-3) с получением соединения VIII-4. Путем гидролиза сложного трет-бутилового эфира VIII-4 получали замещенную карбоновую кислоту (VIII-5). Липопептид (VIII-7) получали путем сочетания замещенной карбоновой кислоты (VIII-5) с различными аминами (VIII-6) в присутствии связывающего реагента. Заместители R1, R2, R3 и R4 имеют значения, указанные в настоящем описании. Представленные в настоящем описании примеры служат для иллюстрации соединений формулы (I),представленных в настоящем описании (но не ограничены только ими), и путей получения указанных соединений. Фармакология и полезность. Когда чужеродный антиген опознается иммунной системой, она реагирует, запуская иммунный ответ, который характеризуется скоординированным взаимодействием систем как врожденного, так и приобретенного иммунитета. Эти две независимые системы удовлетворяют двум взаимно исключающим требованиям: быстрота (определяемая врожденной системой) и специфичность (определяемая адаптивной системой). Врожденная иммунная система служит в качестве первой линии защиты от внедряющихся патогенов, осуществляя контроль патогена, в это время происходит подготовка (созревание) адаптивных ответов. Она запускается в течение нескольких минут после заражения независимым от антигена образом,реагируя на широкое разнообразие консервативных паттернов у патогенов (хотя они не являются неспецифическими и могут отличать свои патогены от чужих). Важно, что она создает также воспалительную и костимулирующую окружающую среду (иногда это обозначают как сигнал опасности), которая потенциирует адаптивную иммунную систему и направляет (или поляризирует ее) в сторону клеточных или гуморальных ответов, наиболее пригодных для уничтожения инфицирующего агента. Данные о разработке модуляторов TLR, предназначенных для терапевтического направленного воздействия врожденного иммунитета, обобщены в литературе (см. Nature Medicine, 13, 2007, c. 552-559; Drug Discovery Today:Therapeutic Stategies, 3, 2006, c. 343-352 и Journal of Immunology, 174, 2005, c. 1259-1268). Адаптивный ответ становится эффективным через несколько дней или недель, но в конце концов приобретает тонкую антигенную специфичность, необходимую для полной элиминации патогена, и создает иммунологическую память. Он опосредуется в основном Т- и В-клетками, которые подвергнуты реаранжировке зародышевого гена и отличаются специфичностью и длительной памятью. Однако, он включает также рекрутмент элементов врожденной иммунной системы, включая "профессиональные" фагоциты (макрофаги, нейтрофилы и т.д.) и гранулоциты (базофилы, эозинофилы и т.д.), которые поглощают бактерии и даже относительно крупных паразитов из числа простейших. После созревания адаптивного иммунного ответа последующее воздействие патогенов приводит к их быстрой элиминации благодаря созданным высокоспецифическим клеткам памяти, которые быстро активируются при последующем воздействии родственного антигена. Аутоиммунные заболевания зависят от (I) гуморального ответа или образования аутоантител на свой антиген (например, как в случае (но не ограничиваясь только им) первичного гипертиреоза Грейвса,при котором образуются антитела к TSH-рецептору) или (II) клеточного ответа, при котором иммунные клетки разрушают неиммунные клетки, из которых образуется аутоантиген, такие, например, как (но не ограничиваясь только ими) тироциты (тиреоидит Хашимото) или поджелудочные островковые бетаклетки (диабет типа 1). Многие аутоиммунные заболевания связаны с комбинацией обоих явлений, например при тиреоидите Хашимото и диабете типа 1 также присутствуют аутоантитела, антитела к пероксидазе щитовидной железы (ТРО) или антитела к декарбоксилазе глутаминовой кислоты(GAD)/островковой клетке. Аутоиммунные заболевания часто имеют воспалительный компонент, включая (но не ограничиваясь только ими) увеличение количества адгезионных молекул, таких, например, как(но не ограничиваясь только ими), молекулы клеточной адгезии-1 (VCAM-1), и изменение адгезии лейкоцитов к сосудистой сети, примерами таких заболеваний являются (но не ограничиваясь только ими) колит, системная волчанка, систмный склероз и сосудистые осложнения при диабете. Толл-подобные рецепторы (TLR) представляют собой трансмембранные белки типа-I, характеризующиеся наличием внеклеточного N-концевого домена, богатого лейцином повтора (LRR), за которым расположена богатая цистеином область, ТМ-домен, и внутриклеточный (цитоплазматический) "хвост",который содержит консервативную область, обозначенную как домен рецептора Толл/IL-1 (TIR). TLR представляют собой паттерн-распознающие рецепторы (PRR), которые экспрессируются главным образом на иммунных клетках, таких как (но не ограничиваясь только ими) дендритные клетки, Тлимфоциты, макрофаги, моноциты и естественные клетки-киллеры. LLR-домен является важным для- 20023725 связывания лиганда и ассоциированной передачи сигналов и имеет общую структуру, характерную дляPRR. TIR-домен является важным для белок-белковых взаимодействий и ассоциирован с врожденным иммунитетом. TIR-домен объединяет также более крупное суперсемейство IL-1R/TLR, которое состоит из трех подгрупп. Представители первой группы несут иммуноглобулиновые домены в их внеклеточных областях и включают рецепторы IL-1 и IL-18 и вспомогательные белки, такие как ST2. Вторая группа включает TLR. Третья группа включает внутриклеточные белки-адапторы, важные для передачи сигналов.TLR представляют собой группу паттерн-распознающих рецепторов, которые связываются с ассоциированными с патогенами молекулярными паттернами (РАМР) из бактерий, грибов, простейших и вирусов, и действуют в качестве первой линии защиты от внедряющихся патогенов. TLR играют важную роль для индукции экспрессии генов, участвующих в воспалительных ответах, и TLR, и врожденная иммунная система представляют собой имеющую решающее значение стадию в развитии антигенспецифического приобретенного иммунитета. Адаптивный (гуморальный или клеточно-опосредованный) иммунитет ассоциирован с механизмом передачи сигналов TLR врожденного иммунитета. Врожденный иммунитет представляет собой защитный ответ иммунных клеток, который функционирует быстро, борясь со связанным с окружающей средой вмешательством, включающем (но не ограничиваясь только ими) бактериальные и вирусные агенты. Адаптивный иммунитет является более медленным ответом, который включает дифференцировку и активацию нестимулированных Т-лимфоцитов в такие типы клеток, как Т-клетки-хелперы 1 (Th1) или Т-клетки-хелперы 2 (Th2). Th1-клетки главным образом усиливают клеточный иммунитет, а Th2-клетки главным образом усиливают гуморальный иммунитет. Хотя они представляют собой прежде всего защитную систему хозяина, патологическое усиление сигналов врожденного иммунитета, связанных с TLR-путем, участвует в инициации аутоиммунныхвоспалительных заболеваний. Все TLR, вероятно, функционируют либо в виде гомодимера, либо в виде гетеродимера при распознавании специфических молекулярных детерминант или набора специфических молекулярных детерминант, присутствующих на патогенных организмах, таких как бактериальные расположенные на клеточной поверхности липополисахариды, липопротеины, бактериальный флагеллин, ДНК как из бактерий, так и из вирусов, и вирусная РНК. Клеточный ответ на активацию TLR включает активацию одного или несколько факторов транскрипции, что приводит к производству и секреции цитокинов и костимулирующих молекул, таких как интерфероны, TNF, интерлейкины, MIP-1 и МСР-1, которые участвуют в уничтожении и клиренсе патогенной инвазии. Пространственная экспрессия TLR совпадет с поверхностью раздела хозяина и окружающей среды. В то время как в Drosophila клонировали лишь несколько Толл-подобных белков, семейство человеческих TLR состоит по меньшей мере из 11 членов, а именно TLR1-TLR11, которые вызывают перекрывающиеся, но тем не менее различные биологические ответы из-за различий в клеточной экспрессии и в путях передачи сигналов, которые они инициируют. Каждый из TLR экспрессируется на различной субпопуляции лейкоцитов и каждый из TLR является специфическим касательно его схем экспрессии и чувствительности к РАМР и выявляет различные субпопуляции патогенов, обеспечивая "бдительный надзор" иммунной системой. Пути передачи сигналов TLR.TLR распределены по всей клетке. TLR1, TLR2, TLR3 и TLR4 экспрессируются на клеточной поверхности, a TLR3, TLR2, TLR8 и TLR9 экспрессируются во внутриклеточных компартментах, таких как эндосомы. Для опосредуемого TLR3, TLR2 или TLR9 распознавания их лигандов требуется созревание и процессинг эндосом. Когда макрофаги, моноциты, дендритные клетки или неиммунные клетки, которые становятя антигенпрезентирующими клетками, поглощают бактерии путем фагоцитоза, бактерии расщепляются и содержащие CpG ДНК (CpG-ДНК) высвобождаются в фагосомы-лизосомы или в эндосомылизосомы, где они могут взаимодействовать с TLR9, который рекрутирован из эндоплазматического ретикулума при неспецифическом поглощении CpG-ДНК. Кроме того, когда вирусы внедряются в клетки с помощью опосредуемого рецептором эндоцитоза, то содержимое вирусов презентуется цитоплазме путем слияния вирусной мембраны с эндосомальной мембраной. Это приводит к презентации TLR9 TLRлигандов, таких как dsPHK, ssPHK и CpG-ДНК, в фагосомальных/лизосомальный или эндосомальных/лизосомальных компартментах. В путях передачи сигналов в прямом направлении относительно TIR-домена содержащий TIRдомен адаптор, т.е. MyD88, играет важную роль для индукции воспалительных цитокинов, таких какTNF- и IL-12, посредством всех TLR. Хотя содержащие TIR-домен адапторные молекулы (MyD88) являются общими для всех TLR, индивидуальные пути передачи сигналов TLR являются дивергентными, и активация специфических TLR приводит к слегка различающимся схемам профилей генной экспрессии. Например (но не ограничиваясь только этим) активация путей передачи сигналов TLR3 и TLR4 приводит к индукции интерферонов типа I (IFN), в то время как активация опосредуемых TLR2 и TLR5 путей не приводит к такому действию. Однако активация путей передачи сигналов TLR2, TLR8 и TLR9 приводит также к индукции IFN типа I, хотя это происходит посредством механизма, отличного от опосредуемойTLR3/4 индукции. Будучи задействованным, TLR инициируют каскад трансдукции сигналов, приводящий к активацииNFB посредством гена 88 (MyD88) адаптерного белка первичного ответа миелоидной дифференцировки, и к рекрутменту ассоциированной с рецептором IL-1 киназы (IRAK). MyD88-зависимый путь является аналогом пути передачи сигналов рецепторами IL-1 и считается, что MyD88, несущий С-концевойTIR-домен и N-концевой домен смерти, ассоциирован с TIR-доменом TLR. При стимуляции MyD88 осуществляет рекрутмент IRAK-4 в TLR посредством взаимодействия доменов смерти обеих молекул и облегчает опосредуемое IRAK-4 фосфорилированием IRAK-1. Затем фосфорилирование IRAK-1 приводит к рекрутменту ассоциированного с TNF-рецептором фактора 6 (TRAF6), что приводят к активации двух различных путей передачи сигналов. Один путь приводит к активации факторов транскрипции АР-1 посредством активации МАР-киназ. Другой путь активирует комплекс TAK1/ТАВ, что повышает активность комплекса IВ-киназы (IKK). После активации IKK-комплекс индуцирует фосфорилирование и последующее расщепление ингибитора NFB IB, ЧТО приводит к ядерной транслокации фактора транскрипции NFB И инициирует транскрипцию генов, промоторы которых содержат сайты связыванияNFB, например цитокинов. MyD88-зависимый путь играет решающую роль и имеет большое значение для производства воспалительных цитокинов посредством всех TLR. Стимуляция экспрессирующих TLR8 клеток, таких как РВМС, приводит к производству высоких уровней IL-12, IFN-, IL-1, TNF-, IL-6 и других воспалительных цитокинов. Аналогично этому, стимуляция экспрессирующих TLR2 клеток, таких как плазмацитоидные дендритные клетки, приводит к производству высоких уровней интерферона- (IFN) и низких уровней воспалительных цитокинов. Таким образом, следует ожидать, что в результате активации дендритных клеток и других антигенпрезентирующих клеток вовлечение TLR2, TLR8 или TLR9 и производство цитокинов будет активировать разнообразные механизмы врожденных и приобретенных ответов, приводящих к деструкции патогенов, зараженных клеток или опухолевых клеток. Толл-подобный рецептор 2 (TLR2). Для TLR2 характерен высокий уровень экспрессии на мембране дендритных клеток, которые считаются наиболее эффективным типом клеток для презентации антигена (Wetzler L.M., "The role of Tolllike receptor 2 in microbial disease and immunity", Vaccine, 21, 2003, c. 55-60; Iwasaki A., Medzhitov R.,"Toll-like receptor control of the adaptive immune Responses", Nat. Immunol., 5, 2004, c. 987-995; Schmitt A.,Li L., Giannopoulos K., Greiner J., Reinhardt P., Wiesneth M., Schmitt M., "Quantitative expression of Toll-likereceptor-2, -4, and -9 in dendriticcells generated fromblasts of patients with acutemyeloid leukemia", Transfusion, 48, 2008, c. 861-870). TLR2 картирован на хромосоме 4q31-32 и кодирует предполагаемый состоящий из 784 (ак) белок, содержащий 19N-концевых LLR и имеющий рассчитанную молекулярную массу 84 кДа. TLR2 является наиболее родственным TLR6, при этом обнаружена идентичность последовательностей (31% по всей длине аминокислотной последовательности). Экспрессия мРНК TLR2 обнаружена в тканях головного мозга, сердца, легкого и селезенки и наиболее высокий ее уровень обнаружен в PBL(лимфоциты периферической крови), прежде всего миеломоноцитного происхождения. In vivo обнаружены два имеющих различный размер транскрипта TLR2, что позволяет предположить наличие альтернативного спайсинга мРНК. In vitro обнаружена повышающая регуляция экспрессии мРНК TLR2 и белка в клетках моноцитарного лейкоза (ТНР-1) при индуцированной РМА дифференцировке. Повышающая регуляция TLR2 обеспечивается аутокринным IL-6 и TNF-, IL-1 и IL-10. Экспрессия мРНК TLR2 повышается после контакта как с грамположительными, так и с грамотрицательными бактериями.TLR2 распознает свои лиганды в виде гетеродимера в комбинации либо с TLR-1, либо с TLR-6.TLR2 образует гетеродимеры с TLR1, TLR6 и возможно с TLR10, при этом каждый комплекс является особенно чувствительным к субпопуляциям ассоциированных с TLR2 РАМР. Основное различие между двумя типами гетеродимеров состоит в том, что димер TLR-1/TLR2 обладает способностью распознавать триацилированные липопротеины, а TLR2/TLR-6 выявляет диацилированные липопротеины и пептидогликаны (Wetzler L.M., "The role of Toll-like receptor 2 in microbial disease and immunity", Vaccine, 21, 2003,c. 55-60). Из всех TLR TLR2 распознает наиболее широкий спектр ассоциированных с патогеном молекулярных паттернов (РАМР) из большого разнообразия патогенов, прежде всего бактерий. Они включают (но не ограничиваясь только ими) липоарабиноманнан (LAM), липополисахарид (LPS), липотейхоевую кислоту (LTA), пептидогликан (PGN) и другие гликолипиды, гликопротеины и липопротеины. Включающие TLR2 комплексы обладают также способностью выявлять вирусы, включая (но не ограничиваясь только ими) вирус кори (MV), человеческий цитомегаловирус (HCMV) и вирус гепатита С (HCV), и грибковые РАМР, включая (но не ограничиваясь только им) зимозан. TLR2 распознает широкое разнообразие липопротеинов/липопетидов различных патогенов, таких как (но не ограничиваясь только ими) грамположительные бактерии, микобактерии, Trypanosoma cruzi, грибы и трепонемы. Кроме того, TLR2 распознает препараты LPS из не относящихся к энтеробактериям видов, таких, например, как (но не ограничиваясь только ими) Leptospira interrogans, Porphyromonas gingivalis и Helicobacter pylori. Включающие TLR2 комплексы обладают способностью как выявлять "чужие" паттерны, так и выявлять изменен- 22023725 ные "свои" паттерны, например экспонируемые некротическими клетками. TLR2 рекрутируется в фагосомы и участвует в интернализации микробных продуктов клетками. Соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации, представленные в настоящем описании,являются агонистами активности Толл-подобного рецептора 2 и их применяют для лечения заболеваний и/или нарушений, ассоциированных с указанными рецепторами TLR2. В конкретных вариантах осуществления изобретения соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации, представленные в настоящем описании, применяют для лечения респираторных заболеваний и/или нарушений, включающих (но не ограничиваясь только ими) астму, бронхиальную астму, аллергическую астму, наследственную астму, приобретенную астму, индуцированную физической нагрузкой астму, индуцированную лекарственными средствами астму (например, иднуцированную аспирином и НСПВС) и индуцированную пылью астму, хроническое обструктивное заболевание легких (ХОЗЛ); бронхит, включая инфекционный и эозинофильный бронхит; эмфизему; бронхоэктаз; муковисцидоз; саркоидоз; "легкие фермера" (экзогенный аллергический альвеолит) и родственные заболевания; гиперчувствительный пневмонит; фиброз легких, включая криптогенный фиброзирующий альвеолит, идиопатический интерстициальный пневмонит, фиброз, представляющий собой осложнение, связанное с антинеопластической терапией, и хроническую инфекцию, включая туберкулез и аспергиллез и другие грибковые инфекции; осложения после трансплантации легкого; васкулит и тромботические нарушения сосудистой сети легкого и легочную гипертензию; противокашлевое действие, включая лечение хронического кашля, ассоциированного с воспалительными секреторными состояниями дыхательных путей, и иатрогенный кашель; острый и хронический ринит, включая медикаментозный ринит и вазомоторный ринит; перениальный и сезонный аллергический ринит, включая ринит nervosa (сенная лихорадка); носовой полипоз; острую вирусную инфекцию, включая насморк и инфекцию, связанную с респираторносинцитиальным вирусом, вирусом гриппа, коронавирусом (включая SARS) и аденовирусом. В конкретных вариантах осуществления изобретения соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации, представленные в настоящем описании, применяют для лечения дерматологических нарушений, включая (но не ограничиваясь только ими) псориаз, атопический дерматит, контактный дерматит или другие экзематозные дерматозы и реакции гиперчувствительности замедленного типа; фито-, фотодерматит; себоррейный дерматит, дерматит герпетиформный, красный плоский лишай, склеротический и атрофический лишай, гангренозную пиодермию, кожный саркоидоз, базальноклеточную карциному,старческий кератоз, дискоидную красную волчанку, пемфигус, пемфигоид, врожденный буллезный эпидермолиз, крапивницу, ангионевротический отек, васкулитид, токсические эритемы, кожные эозинофилии, гнездую алопецию, мужскую алопецию, синдром Свита, синдром Вебера-Кристиана, мулиформную эритему; целлюлит как инфекционный, так и неинфекционный; панникулит; кожные лимфомы, немеланомный рак кожи и другие диспластические повреждения кожи; индуцированные лекарственными средствами нарушения, включая фиксированную лекарственную сыпь. В конкретных вариантах осуществления изобретения соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации, представленные в настоящем описании, применяют для лечения глазных болезней и/или нарушений, включая (но не ограничиваясь только ими) блефарит; конъюнктивит, включая перениальный и весенний аллергический конъюнктивит; ирит; передний и задний увеит; хороидит; аутоиммунные, дегенеративные или воспалительные нарушения, поражающие сетчатку; офтальмит, включая симпатический офтальмит; саркоидоз, инфекции, включая вирусные, грибковые и бактериальные. В конкретных вариантах осуществления изобретения соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации, представленные в настоящем описании, применяют для лечения заболеваний и/или нарушений мочеполовой системы, включая (но не ограничиваясь только ими) нефрит, включая интерстициальный и гломерулонефрит; нефротический синдром; цистит, включая острый и хронический (интерстициальный) цистит и язву Гуннера; острый и хронический уретрит, простатит, эпидидимит, оофорит и сальпингит; вульво-вагинит; болезнь Пейрони; эректильную дисфункцию (как мужскую, так и женскую). В конкретных вариантах осуществления изобретения соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации, представленные в настоящем описании, применяют для лечения отторжения трансплантата,включая (но не ограничиваясь только ими) острое и хроническое отторжение, например, после трансплантации почки, сердца, печени, легкого, костного мозга, кожи или роговицы, или после трансфузии крови; или хроническую реакцию "трансплантат против хозяина". В конкретных вариантах осуществления изобретения соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации, представленные в настоящем описании, применяют для лечения других аутоиммунных и аллергических нарушений, включая (но не ограничиваясь только ими) ревматоидный артрит, синдром- 23023725 разраженной толстой кишки, системную красную волчанку, рассеянный склероз, тиреоидит Хашимото,болезнь Крона, воспалительное заболевание кишечника (IBD), болезнь Грейвса, болезнь Аддисона, сахарный диабет, идиопатическую тромбоцитопеническую пурпуру, эозинофильный фасцит, гипер-IgEсиндром, антифосфолипидный синдром и синдром Сезари. В конкретных вариантах осуществления изобретения соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры и фармацевтические композиции, представленные в настоящем описании, применяют для лечения рака, включая (но не ограничиваясь только ими) опухоли предстательной железы, молочной железы, легкого, яичника, поджелудочной железы, пищеварительного тракта и ободочной кишки, желудка, кожи и головного мозга и злокачественные заболевания, поражающие головной мозг (включая лейкозы), и лимфопролиферативные системы, такие как болезнь Ходжкина и не-ходжкинская лимфома; включая предупреждение и лечение метастатического заболевания и рецидивов опухолей, и паранеопластичекие синдромы. В конкретных вариантах осуществления изобретения соединения формулы (I), их фармацевтически приемлемые соли, сольваты, Nоксиды, пролекарства и изомеры и фармацевтические композиции, представленные в настоящем описании, можно применять в качестве модуляторов активности Толл-подобного рецептора и их применяют для лечения неоплазм, включая (но не ограничиваясь только ими) базально-клеточную карциному, плоскоклеточную карциному, старческий кератоз, меланому, карциномы, саркомы, лейкозы, почечноклеточную карциному, саркому Капоши, миелогенный лейкоз, хронический лимфолейкоз и множественную миелому. В конкретных вариантах осуществления изобретения соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации, представленные в настоящем описании, применяют для лечения инфекционных болезней,включая (но не ограничиваясь только ими) вирусные заболевания, такие как генитальные бородавки,обычные бородавки, подошвенные бородавки, заболевания, вызываемые респираторным синцитиальным вирусом (RSV), вирусом гепатита В, гепатита С, вирусом Денге, вирусом герпеса простого (например (но не ограничиваясь только ими) HSV-I, HSV-II, CMV или VZV), контагиозным моллюском, вирусом коровьей оспы, натуральной оспы, лентивирусом, вирусом иммунодефицита человека (ВИЧ), вирусом человеческой папилломы (HPV), цитомегаловирусом (CMV), вирусом ветряной оспы (VZV), риновирусом,энтеровирусом, аденовирусом, коронавирусом (например, SARS), вирусом гриппа, пара-гриппа, вирусом эпидемического паротита, вирусом кори, паповавирусом, гепаднавирусом, флавивирусом, ретровирусом,аренавирусом (таким, например, как (но не ограничиваясь только ими) LCM (вирус лимфоцитарного хориоменингита), вирус Хунин, вирус Мачупо, вирус Гуанарито и вирус лихорадки Ласса) и филовирусом(таким, например, как (но не ограничиваясь только ими) вирус Эбола или вирус Марбург). В конкретных вариантах осуществления изобретения соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации, представленные в настоящем описании, применяют для лечения бактериальных, грибковых и протозойных инфекций, включая (но не ограничиваясь только ими ) туберкулез и болезни, вызываемыеMycobacterium avium, проказу; пневмоцистоз, криптоспоридиоз, гистоплазмоз, токсоплазмоз, инфекцию,вызываемую трипаносомой, лейшманиоз, инфекции, вызываемые бациллами из рода Escherichia, Enterobacter, Salmonella, Staphylococcus, Klebsiella, Proteus, Pseudomonas, Streptococcus и Chlamydia, и грибковые инфекции, такие как кандидоз, аспергиллез, гистоплазмоз, криптококковый менингит. В конкретных вариантах осуществления изобретения соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры применяют в качестве потенциаторов иммунной системы. В конкретных вариантах осуществления изобретения соединения, представленные в настоящем описании, включают в иммуногенные композиции или их применяют в сочетании с иммуногенными композициями. В конкретных вариантах осуществления изобретения иммуногенные композиции можно применять в виде вакцин, и соединение присутствует в них в количестве, достаточном для усиления иммунного ответа на вакцину или на антиген, применяемый в смеси с соединением. Вакцина содержит по меньшей мере один антиген, который может представлять собой бактериальный антиген,или ассоциированный с раком антиген, или вирусный антиген. В конкретных вариантах осуществления изобретения соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры и фармацевтические композиции, представленные в настоящем описании, включают в терапевтические вакцины или их применяют в сочетании с терапевтическими вакцинами. В конкретных вариантах осуществления изобретения соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры и фармацевтические композиции, представленные в настоящем описании, включают в профилактические вакцины или применяют в сочетании с профилактическими вакцинами. В конкретных вариантах осуществления изобретения соединения формулы(I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры и фармацевтические композиции, представленные в настоящем описании, включают или применяют в сочетании с терапевтическими вирусными вакцинами. В конкретных вариантах осуществления изобретения соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры и фармацевтические композиции, представленные в настоящем описании, включают или применяют в со- 24023725 четании с противораковыми вакцинами. В других вариантах осуществления изобретения соединения формулы (I) или их фармацевтически приемлемые соли или сольваты, представленные в настоящем описании, можно применять для лечения поврежденной или старения кожи, например рубцов и морщин. Введение и фармацевтические композиции Для терапевтического применения соединений формулы (I), их фармацевтически приемлемых солей, сольватов, N-оксидов, пролекарств и изомеров, представленных в настоящем описании, указанные соединения вводят в терапевтически эффективных количествах либо индивидуально, либо в виде части фармацевтической композиции. Таким образом, в настоящем изобретении предложены фармацевтические композиции, которые содержат по меньшей мере одно соединение формулы (I), представленное в настоящем описании, его фармацевтически приемлемые соли и/или сольваты и один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов. Кроме того, указанные соединения и композиции вводят индивидуально или в сочетании с одним или несколькими дополнительными терапевтическими средствами. Метод введения указанных соединений и композиций включает (но не ограничиваясь только ими) оральное введение, ректальное введение,парентеральное введегние, внутривенное введение, введение в стекловидное тело, внутримышечное введение, введение путем ингаляции, введение в нос, местное применение, введение в глаз или введение в ухо. Терапевтически эффективное количество может варьироваться в зависимости среди прочего от заболевания, для лечения которого оно показано, серьезности заболевания, возраста и относительного состояния здоровья индивидуума, эффективности вводимого соединения, пути введения и требуемого лечения. В конкретных вариантах осуществления изобретения суточная доза соединения формулы (I),обеспечивающая удовлетворительные результаты, может представлять собой системные суточные дозы,составляющие от примерно 0,03 до 2,5 мг/кг веса тела. В конкретных вариантах осуществления изобретения суточная доза соединения формулы (I), которую вводят путем ингаляции, составляет от 0,05 микрограмма на килограмм веса тела (мкг/кг) до 100 микрограммов на килограмм веса тела (мкг/кг). В других вариантах осуществления изобретения суточная доза соединения формулы (I), вводимая оральным путем, составляет от 0,01 микрограмма на килограмм веса тела (мкг/кг) до 100 микрограммов на килограмм веса тела (мкг/кг). Для более крупных млекопитающих, например людей, показанная суточная доза составляет от примерно 0,5 до примерно 100 мг соединения формулы (I), которую удобно вводить,например в виде разделенных доз вплоть до 4 раз в день, или в форме с контролируемым высвобождением. В конкретных вариантах осуществления изобретения стандартные лекарственные дозы, предназначенные для орального введения, составляют примерно от 1 до 50 мг соединения формулы (I). Другими объектами изобретения являются способы получения фармацевтической композиции, которая содержит по меньшей мере одно соединение формулы (I), представленное в настоящем описании,или его фармацевтически приемлемые соли и/или сольваты. В конкретных вариантах осуществления изобретения способы предусматривают смешение соединения формулы (I), представленного в настоящем описании, или его фармацевтически приемлемых солей и/или сольватов с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или эксципиентами. В конкретных вариантах осуществления изобретения фармацевтические композиции, которые содержат соединение формулы(I) в свободной форме или в форме фармацевтически приемлемой соли или сольвата в сочетании по меньшей мере с одним фармацевтически приемлемым носителем, разбавителем или эксципиентом, приготавливают с использованием методов смешения, гранулирования и/или нанесения покрытия. В других вариантах осуществления изобретения указанные композиции необязательно содержат эксципиенты,такие как консерванты, стабилизаторы, смачивающие или эмульгирующие агенты, вещества, повышающие растворимость, соли для регулирования осмотического давления и/или буферы. В других вариантах осуществления изобретения указанные композиции являются стерильными. Оральные лекарственные формы. В конкретных вариантах осуществления изобретения фармацевтические композиции, которые содержат по меньшей мере одно соединение формулы (I), вводят орально в виде отдельных лекарственных форм, при этом указанные лекарственные формы представляют собой (но не ограничиваясь только ими) капсулы, желатиновые капсулы, каплетки, таблетки, жевательные таблетки, порошки, гранулы, сиропы,ароматизированные сиропы, растворы или суспензии в водных или неводных жидкостях, съедобные пены или взбитые продукты и жидкие эмульсии типа масло-в-воде или жидкие эмульсии типа вода-вмасле. Капсулы, желатиновые капсулы, каплетки, таблетки, жевательные таблеки, порошки или гранулы,применяемые для орального введения по меньшей мере одного соединения формулы (I), приготавливают путем смешения по меньшей мере одного соединения формулы (I) (действующее вещество) по меньшей мере с одним эксципиентом, используя общепринятые фармацевтические методы приготовления препаративных форм. Примерами эксципиентов, которые применяют в оральных лекарственных формах,представленных в настоящем описании, являются (но не ограничиваясь только ими) связующие вещества, наполнители, разрыхлители, замасливатели, абсорбенты, красители, корригенты, консервативы и- 25023725 подслащивающие вещества. Примерами связующих веществ являются (но не ограничиваясь только ими) кукурузный крахмал,картофельный крахмал, крахмальная паста, предварительно желированный крахмал или другие крахмалы, сахара, желатин, встречающиеся в естественных условиях или синтетические камеди, такие как гуммиарабик, альгинат натрия, альгиновая кислота и другие альгинаты, трагакант, гуаровая камедь, целлюлоза и ее производные (например (но не ограничиваясь только ими), этилцеллюлоза, ацетат целлюлозы,кальциевая соль карбокиметилцеллюлозы, натриевая соль карбоксиметилцеллюлозы, метилцеллюлоза,гидроксипропилметилцеллюлоза и микрокристаллическая целлюлоза), алюмосиликат магния, поливинилпирролидон и их комбинации. Примерами наполнителей являются (но не ограничиваясь только ими) тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическая целлюлоза, порошкообразная целлюлоза, декстраны, каолин, маннит, кремневая кислота, сорбит, крахмал, предварительно желированный крахмал и их смеси. В конкретных вариантах осуществления изобретения связующее вещество или наполнитель в фармацевтических композициях, представленных в настоящем описании, присутствует в количестве от примерно 50 до примерно 99 мас.% в пересчете на фармацевтическую композицию или лекарственную форму. Примерами разрыхлителей являются (но не ограничиваясь только ими) агар-агар, альгиновая кислота, альгинат натрия, карбонат кальция, карбонат натрия, микрокристаллическая целлюлоза, натриевая соль кармелозы, кросповидон, полакрилин калия, натрийгликолят крахмала, картофельный крахмал или крахмал из тапиоки, предварительно желированный крахмал, другие крахмалы, глины, другие альгинаты, другие производные целлюлозы, камеди и их комбинации. В конкретных вариантах осуществления изобретения разрыхлитель, применяемый в фармацевтических композициях, представленных в настоящем описании, присутствует в количестве от примерно 0,5 до примерно 15 мас.%, а в других вариантах осуществления изобретения в количестве от примерно 1 до примерно 5 мас.%. Примерами замасливателей являются (но не ограничиваясь только ими) стеарат натрия, стеарат кальция, стеарат магния, стеариновая кислота, минеральное масло, жидкое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли, лаурилсульфат натрия, тальк, гидрогенизированное растительное масло (например (но не ограничиваясь только ими), арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло), стеарат цинка, олеат натрия, этилолеат, этиллаурат, агар, кремнезем, силодный силикагель (AEROSIL 200,производимый фирмой W.R. Grace Co., Балтимор, шт. Мэриленд), коагулированный аэросил синтетического кремнезема (поступает в продажу от фирмы Degussa Co., Планто, шт. Техас), CAB-O-SIL (пирогенный диоксид кремния, который поступает в продажу от фирмы Cabot Co., Бостон, шт. Массачусетс) и их комбинации. В конкретных вариантах осуществления изобретения замасливатели, применяемые в фармацевтических композициях, представленных в настоящем описании, присутствуют в количестве,составляющем менее примерно 1 мас.% в пересчете на фармацевтические композиции или лекарственные формы. Примерами разбавителей являются (но не ограничиваясь только ими) лактоза, декстроза, сахароза,маннит, сорбит, целлюлоза, глицин или их комбинации. В конкретных вариантах осуществления таблетки и капсулы приготавливают путем однородного смешения по меньшей мере одного соединения формулы (I) (действующее вещество) с жидкими носителями, тонкоизмельченными твердыми носителями или/и обоими этими типами носителей и затем при необходимости придают продукту требуемую форму. В конкретных вариантах осуществления таблетки получают прессованием. В других вариантах осуществления таблетки получают формованием. В конкретных вариантах осуществления по меньшей мере одно соединение формулы (I) вводят орально в лекарственной форме с контролируемым высвобождением. Указанные лекарственные формы применяют для замедленного или контролируемого высвобождения одного или нескольких соединений формулы (I). Для обеспечения контролируемого высвобождения применяют, например, гидроксипропилметилцеллюлозу, другие полимерные матрицы, гели, проницаемые мембраны, осмотические системы, многослойные покрытия, микрочастицы, липосомы, микросферы или их комбинацию. В конкретных вариантах осуществления лекарственные формы с контролируемым высвобождением применяют для удлинения активности соединения формулы (I), снижения частоты приема доз и повышения удобства для пациента. Для введения соединений формулы (I) в виде предназначенных для орального применения жидкостей, таких как раствор, сиропы и эликсиры, их приготавливают в виде стандартных доз лекарственного средства, в которых в данном количестве раствора, сиропов или эликсиров находится предварительно определенное количество соединения формулы (I). Сиропы приготавливают путем растворения соединения в приемлемом содержащем корригенты водном растворе, а эликсиры приготавливают с использованием нетоксичного спиртового носителя. Суспензии приготавливают путем диспергирования соединения в нетоксичном наполнителе. Примерами эксципиентов, применяемых в предназначенными для орального введения жидкостей, являются (но не ограничиваясь только им) солюбилизаторы, эмульгаторы, корригенты, консерванты и красители. Примерами солюбилизаторов являются (но не ограничиваясь только- 26023725 ими) вода, гликоли, масла, спирты, этоксилированные изостеариловые спирты и простые эфиры полиоксиэтилена и сорбита. Примерами консервантов являются (но не ограничиваясь только ими) бензоат натрия. Примерами корригентов являются (но не ограничиваясь только ими) масло мяты перечной или встречающиеся в естественных условиях подслащивающие вещества, или сахарин, или другие искусственные подслащивающие вещества. Парентеральные лекарственные формы. В конкретных вариантах осуществления изобретения фармацевтические композиции, которые содержат по меньшей мере одно соединение формулы (I), вводят парентерально различными путями,включая (но не ограничиваясь только ими) подкожно, внутривенно (включая болюсную инъекцию),внутримышечно и внутриартериально. Указанные парентеральные лекарственные формы вводят в виде стерильных или подлежащих стерилизации инъецируемых растворов, суспензий, сухих и/или лиофилизированных продуктов, которые легко растворять или суспендировать в фармацевтически приемлемом наполнителе, предназначенном для инъекции (восстанавливаемый порошки), и в виде эмульсий. Наполнители, применяемые в указанных лекарственных формах, представляют собой (но неограничиваясь только ими) воду для инъекцийUSP; водные наполнители, такие как (но не ограничиваясь только ими) хлорид натрия для инъекций,раствор Рингера для инъекций, декстроза для инъекций, декстроза и хлорид натрия для инъекций и лактированный раствор Рингера для инъекций; смешивающиеся с водой наполнители, такие как (но не ограничиваясь только ими) этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные наполнители, такие как (но не ограничиваясь только ими) кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат. Трансдермальные лекарственные формы. В конкретных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), вводят трансдермально. Указанные трансдермальные лекарственные формы могут представлять собой пластыри "резервуарного типа" или "матриксного типа", которые наносят на кожу и носят в течение определенного периода времени, обеспечивающего проникновение требуемого количества соединения формулы (I). Например (но не ограничиваясь только ими) указанные трансдермальные устройства имеют форму повязки, содержащей элемент, служащий подкладкой, резервуар, содержащий соединение необязательно в сочетании с носителями, необязательно контролирующий скорость высвобождения барьер для поступления соединения на кожу хозяина с контролируемой и заранее определенной скоростью в течение продолжительного периода времени, и средства для закрепления устройства на коже. В других вариантах осуществления изобретения применяют также трансдермальные матриксные препаративные формы. Препаративные формы, предназначенные для трансдермального введения соединения формулы (I),включают в эффективном количестве соединение формулы (I), носитель и необязательно разбавитель. Носитель представляет собой (но не ограничиваясь только ими) абсорбируемые фармакологически приемлемые растворители, способствующие проникновению через кожу хозяина, такие как вода, ацетон,этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их комбинации. В конкретных вариантах осуществления изобретения указанные трансдермальные системы введения включают вещества, усиливающие проникновение, которые способствуют введению одного или нескольких соединений формулы (I) в ткань. Указанные вещества, усиливающие проникновение, включают (но не ограничиваясь только ими) ацетон; различные спирты, такие как этанол, олеил и тетрагидрофурил; алкилсульфоксиды, такие как диметилсульфоксид; диметилацетамид; диметилформамид; полиэтиленгликоль; пирролидоны, такие как поливинилпирролидон; различные виды коллидонов (повидон,поливидон); мочевину; и различные водорастворимые или нерастворимые сложные сахарные эфиры,такие как Твин 80 (полисорбат 80) и Спан 60 (сорбитанмоностеарат). В других вариантах осуществления изобретения значение рН указанной трансдермальной фармацевтической композиции или лекарственной формы или ткани, на которую наносят фармацевтическую композицию или лекарственную форму, регулируют для улучшения введения одного или нескольких соединений формулы (I). В других вариантах осуществления изобретения полярность растворителяносителя, его ионную силу или тоничность регулируют для улучшения введения. В других вариантах осуществления изобретения добавляют соединения, такие как стеараты, для требуемого изменения гидрофильности или липофильности одного или нескольких соединений формулы (I) с целью улучшения введения. В других вариантах осуществления изобретения указанные стеараты служат в качестве липидного наполнителя для препаративной формы, такого как эмульгирующий агент или поверхностноактивное вещество, и в качестве усиливающего введение или усиливающего проникновения агента. В других вариантах осуществления изобретения используют различные соли, гидраты или сольваты соединений формулы (I) для дополнительного регулирования свойств образовавшейся композиции. Лекарственные формы для местного применения. В конкретных вариантах осуществления изобретения по меньшей мере одно соединение формулы(I) применяют с помощью местного нанесения фармацевтической композиции, которая содержит по- 27023725 меньшей мере одно соединение формулы (I), в форме лосьонов, гелей, мазей, растворов, эмульсий, суспензий или кремов. Приемлемыми препаративными формами для местного применения на кожу являются водные растворы, мази, кремы или гели, а препаративными формами для офтальмологического применения являются водные растворы. Указанные препаративные формы необязательно содержат солюбилизаторы, стабилизаторы, агенты, повышающие тоничность, буферы и консерванты. Указанные препарпативные формы для местного применения содержат по меньшей мере один носитель и необязательно по меньшей мере один разбавитель. Такие носители и разбавители представляют собой (но не ограничиваясь только ими) воду, ацетон, этанол, этиленгликоль, пропиленгликоль, бутан 1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их комбинации. В конкретных вариантах осуществления изобретения указанные препаративные формы для местного применения включают вещества, усиливающие проникновение, которые способствуют введению одного или нескольких соединений формулы (I) в ткань. Указанные вещества, усиливающие проникновение, включают (но не ограничиваясь только ими) ацетон; различные спирты, такие как этанол, олеил и тетрагидрофурил; алкилсульфоксиды, такие как диметилсульфоксид; диметилацетамид; диметилформамид; полиэтиленгликоль; пирролидоны, такие как поливинилпирролидон; различные виды коллидонов(повидон, поливидон); мочевину; и различные водорастворимые или нерастворимые сложные сахарные эфиры, такие как Твин 80 (полисорбат 80) и Спан 60 (сорбитанмоностеарат). В конкретных вариантах осуществления изобретения фармацевтические композиции, которые содержат по меньшей мере одно соединение формулы (I), вводят путем ингаляции. Лекарственные формы для ингаляционного введения приготавливают в виде аэрозолей или сухих порошков. Аэрозольные препаративные формы для ингаляционного введения содержат раствор или тонкую суспензию по меньшей мере одного соединения формулы (I) в фармацевтически приемлемом водном или неводном растворителе. Кроме того, указанные фармацевтические композиции необязательно содержат порошкообразное основание, такое как лактоза, глюкоза, трегалоза, маннит или крахмал, и необязательно модификатор свойств, такой как L-лейцин или другую аминокислоту, и/или соли металлов и стеариновой кислоты,такие как стеарат магния или кальция. В конкретных вариантах осуществления изобретения соединения формулы (I) вводят непосредственно в легкое путем ингаляции с помощью ингалятора с дозировочной шкалой ("MDI"), который представляет собой баллоны, содержащие приемлемый имеющий низкую температуру кипения пропеллент,например дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой пригодный газ, или устройство в виде ингалятора для сухого порошка (DPI), в котором применяют выброс газа для создания облака сухого порошка внутри контейнера, которое затем вдыхает пациент. В конкретных вариантах осуществления изобретения изготавливают капсулы и картриджы из желатина,предназначенные для применения в ингаляторе или инсуффляторе, которые содержат порошкообразную смесь соединения формулы (I) и порошкообразного основания, такого как лактоза или крахмал. В конкретных вариантах осуществления изобретения соединения формулы (I) вводят в легкое с помощью устройства для распыления жидкостей, такое устройство включает насадку с очень малыми отверстиями для создания аэрозоля жидких препаративных форм лекарственного средства, которые затем непосредственно вводят путем ингаляции в легкое. В других вариантах осуществления изобретения соединения формулы (I) вводят в легкое с помощью распылительного устройства, при этом распылители создают аэрозоль жидких препаративных форм лекарственного средства на основе ультразвуковой энергии с получением тонкоизмельченных частиц, которые легко можно вдыхать. В других вариантах осуществления изобретения соединения формулы (I) вводят в легкое с помощью электрогидродинамического ("EHD") аэрозольного устройства, при этом в указанных аэрозольных EHD-устройствах используется электрическая энергия для создания аэрозоля растворов или суспензий жидких лекарственных средств. В конкретных вариантах осуществления изобретения фармацевтическая композиция, содержащая по меньшей мере одно соединение формулы (I) или его фармацевтически приемлемые соли или сольваты, представленные в настоящем описании, включает также один или несколько усилителей абсорбции. В конкретных вариантах осуществления изобретения указанные усилители абсорбции представляют собой (но не ограничиваясь только ими) гликохолат натрия, капрат натрия, N-лаурилDмальтопиранозид, ЭДТК и смешенные мицеллы. В конкретных вариантах осуществления изобретения фармацевтическую композицию, содержащую по меньшей мере одно соединение формулы (I), вводят в нос. Лекарственные формы для начального введения приготавливают в виде аэрозолей, растворов, капель, гелей или сухих порошков. В конкретных вариантах осуществления изобретения фармацевтическую композицию, содержащую по меньшей мере одно соединение формулы (I), вводят ректально в форме суппозиториев, клизм, мазей,кремов, ректальных пен или ректальных гелей. В конкретных вариантах осуществления изобретения суппозитории приготавливают из жирных эмульсий или суспензий, масла какао или других глицеридов. В конкретных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), применяют в виде офтальмологического средства, такого как глазные капли. Указанные препаративные формы представляют собой водные растворы, которые необязательно содержат солюбилизаторы, стабилизаторы, агенты, повышающие тоничность, буферы и- 28023725 консерванты. В конкретных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), применяют для введение в ухо в виде ушных капель. Указанные препаративные формы представляют собой водные растворы, которые необязательно содержат солюбилизаторы, стабилизаторы, агенты, повышающие тоничность, буферы и консерванты. В конкретных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), приготавливают в виде препаратов в форме депо. Указанные препаративные формы вводят путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. В конкретных вариантах осуществления изобретения указанные препаративные формы включают полимерные или гидрофобные материалы (такие, например, как эмульсию в приемлемом масле) или ионообменные смолы, или слабо растворимые производные, например,слабо растворимую соль. В дополнительных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), адаптированы для орального введения для лечения вирусных заболеваний и/или нарушений, ассоциированных с активностью TLR2. В дополнительных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), адаптированы для орального введения для лечения инфекционных заболеваний и/или нарушений, ассоциированных с TLR2. В дополнительных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), адаптированы для орального введения для лечения бактериальных заболеваний и/или нарушений, ассоциированных с TLR2. В дополнительных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), адаптированы для орального введения для лечения грибковых заболеваний и/или нарушений, ассоциированных с TLR2. В дополнительных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), адаптированы для орального введения для лечения рака, ассоциированного с TLR2. В дополнительных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), адаптированы для внутривенного введения для лечения рака, ассоциированного с TLR2. В дополнительных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), адаптированы для орального введения для лечения связанных с отторжением трансплантата заболеваний и/или нарушений, ассоциированных с TLR2. В дополнительных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), адаптированы для орального введения для лечения заболеваний и/или нарушений мочеполовой системы, ассоциированных с TLR2. В дополнительных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), адаптированы для введения в виде глазных капель для лечения офтальмологических заболеваний и/или нарушений, ассоциированных с TLR2. В дополнительных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), адаптированы для местного применения для лечения дерматологических заболеваний и/или нарушений, ассоциированных с TLR2. В дополнительных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), адаптированы для местного применения для лечения старческого кератоза. В дополнительных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), адаптированы для местного применения в виде крема для лечения старческого кератоза. В дополнительных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), адаптированы для местного применения для лечения базально-клеточной карциномы. В дополнительных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), адаптированы для местного применения в виде крема для лечения базально-клеточной карциномы. В дополнительных вариантах осуществления изобретения фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I), адаптированы для местного применения путем ингаляции для лечения респираторных заболеваний и/или нарушений, ассоциированных с TLR2. В конкретных вариантах осуществления изобретения респираторное заболевание представляет собой аллергическую астму. В настоящем изобретении предложены соединения формулы (I), их фармацевтически приемлемые соли и сольваты и фармацевтические композиции, которые содержат по меньшей мере одно соединение формулы (I) и/или его фармацевтически приемлемые соли или сольваты, предназначенные для применения с целью активации активности TLR2, и которые в результате применяют для предупреждения или
МПК / Метки
МПК: C07K 5/04, C07C 323/60, A61P 17/00, A61P 31/00, A61K 31/17, A61P 29/00, A61K 31/198, A61K 31/661, A61P 35/00, A61P 11/00, A61K 38/10
Метки: воспалительных, цистеина, композиции, агонистов, соединения, инфекционных, других, респираторных, лечения, заболеваний, липопептиды, применяемые, tlr2, качестве, основе
Код ссылки
<a href="https://eas.patents.su/30-23725-soedineniya-lipopeptidy-na-osnove-cisteina-i-kompozicii-v-kachestve-agonistov-tlr2-primenyaemye-dlya-lecheniya-infekcionnyh-vospalitelnyh-respiratornyh-i-drugih-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения (липопептиды на основе цистеина) и композиции в качестве агонистов tlr2, применяемые для лечения инфекционных, воспалительных, респираторных и других заболеваний</a>












