Три(цикло)замещённые амидные соединения
Формула / Реферат
1. Соединение формулы (I)
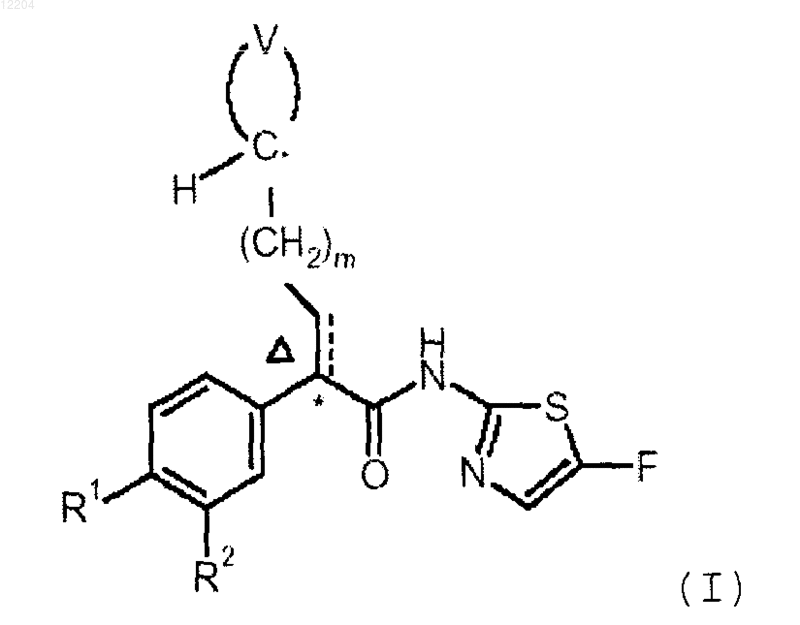
или его фармацевтически приемлемая соль, где
группа, образованная -НС< и >V, представляет собой 3-оксоциклопентил, 4-оксоциклогексил или 3-гидроксициклопентил;
R1 представляет собой SOR3 или SO2R3;
R2 представляет собой водород, хлор, фтор или трифторметил;
R3 представляет собой С1-4алкильную группу, С3-7циклоалкильную группу или арильную группу;
m равно 0 или 1; и
пунктирная линия вместе со сплошной линией обозначает возможную двойную связь, и D показывает, что эта двойная связь имеет (E)-конфигурацию.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где пунктирная линия вместе со сплошной линией обозначает двойную связь.
3. Соединение по п.1 или его фармацевтически приемлемая соль, где пунктирная линия вместе со сплошной линией обозначает простую связь.
4. Соединение по п.3 или его фармацевтически приемлемая соль, где пунктирная линия вместе со сплошной линией обозначает простую связь и абсолютная конфигурация у ассиметрического центра a относительно карбонильного углерода амида представляет собой (R)-конфигурацию.
5. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, где m равно 0.
6. Соединение по любому из пп.1-5 или его фармацевтически приемлемая соль, где R3 представляет собой С1-4алкил или С3-7циклоалкил.
7. Соединение по любому из пп.1-6 или его фармацевтически приемлемая соль, где R1 представляет собой SO2C3-4циклоалкил.
8. Соединение, выбранное из
2(R)-2-(3-хлор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-((R)-3-оксоциклопентил)пропионамида;
2(R)-2-(3-хлор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(4-оксоциклогексил)пропионамида;
2(R)-2-(3-хлор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(3-гидроксициклопентил)пропионамида;
(E)-N-(5-фтортиазол-2-ил)-2-(4-метансульфонилфенил)-3-((S)-3-оксоциклопентил)акриламида;
(E)-N-(5-фтортиазол-2-ил)-2-(4-метансульфонилфенил)-3-(4-оксоциклогексил)акриламида;
(E)-N-(5-фтортиазол-2-ил)-3-(3-гидроксициклопентил)-2-(4-метансульфонилфенил)акриламида;
2(R)-2-(4-циклопропансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-((R)-3-оксоциклопентил)пропионамида;
2(R)-2-(4-циклопропансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(4-оксоциклогексил)пропионамида;
2(R)-2-(4-циклопропансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(3-гидроксициклопентил)пропионамида;
2(R)-2-(4-циклобутансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(3-оксоциклопентил)пропионамида;
2(R)-2-(4-циклобутансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(4-оксоциклогексил)пропионамида;
2(R)-2-(4-циклобутансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(3-гидроксициклопентил)пропионамида;
2(R)-2-(3-фтор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-((R)-3-оксоциклопентил)пропионамида;
2(R)-2-(3-фтор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(4-оксоциклогексил)пропионамида и
2(R)-2-(3-фтор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(3-гидроксициклопентил)пропионамида,
или фармацевтически приемлемая соль любого из них.
9. Фармацевтическая композиция, содержащая соединение по любому из пп.1-8 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
10. Способ профилактического или терапевтического лечения состояния, где требуется активация GK, включающий стадию введения эффективного количества соединения по любому из пп.1-8 или его фармацевтически приемлемой соли.
11. Способ профилактического или терапевтического лечения гипергликемии или диабета, включающий стадию введения эффективного количества соединения по любому из пп.1-8 или его фармацевтически приемлемой соли.
12. Способ по п.11, где соединение по любому из пп.1-8 вводят в комбинации с одним или более другими антигипергликемическими агентами или противодиабетическими агентами.
13. Способ предупреждения диабета у человека, у которого наблюдается преддиабетическая гипергликемия или нарушение толерантности к глюкозе, включающий стадию введения эффективного профилактического количества соединения по любому из пп.1-8 или его фармацевтически приемлемой соли.
14. Способ получения соединения формулы (Ia)
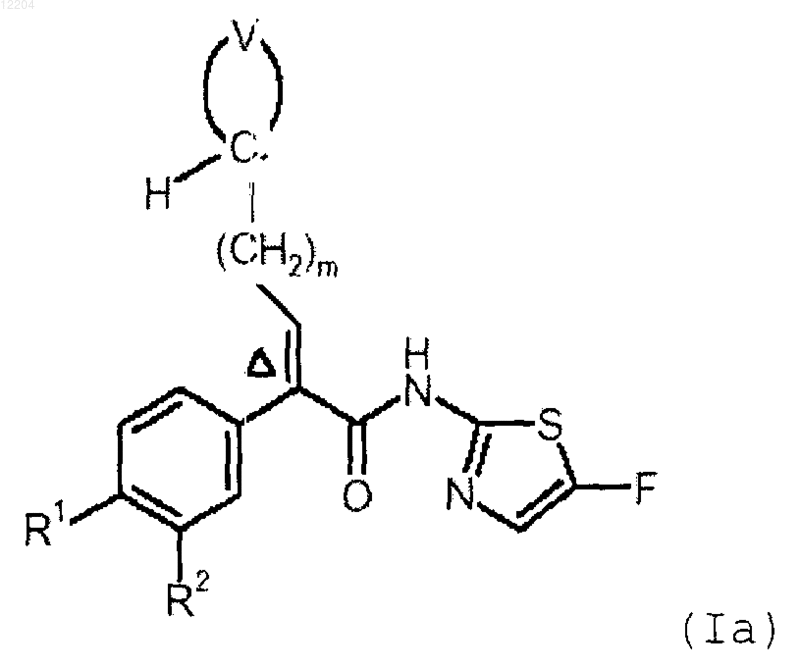
или его фармацевтически приемлемой соли, включающий конденсацию соединения формулы (IV)
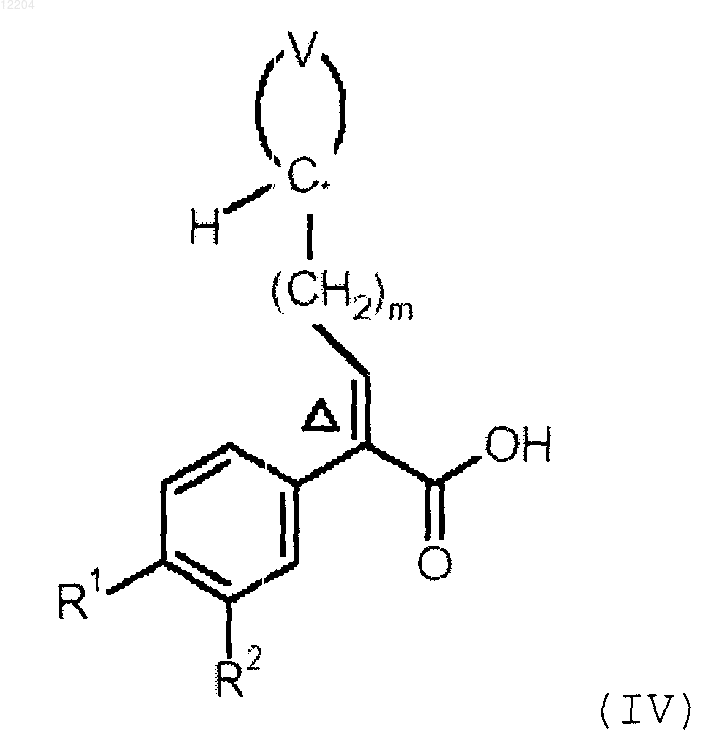
с соединением формулы (V)
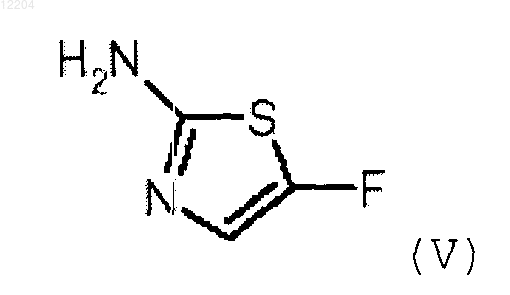
или его солью,где V, R1, R2, m и D такие, как определено в п.1.
15. Способ получения соединения формулы (Ib)

включающий конденсацию соединения формулы (VIII)
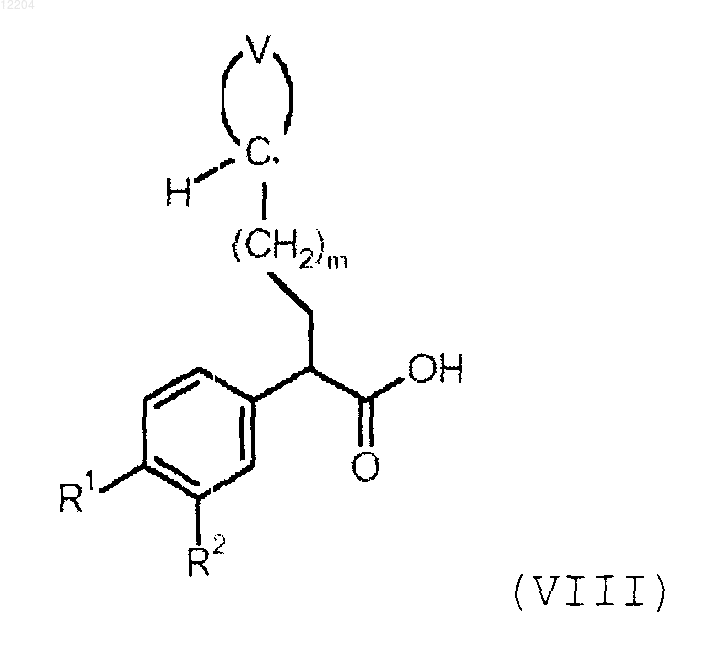
с соединением формулы (V)
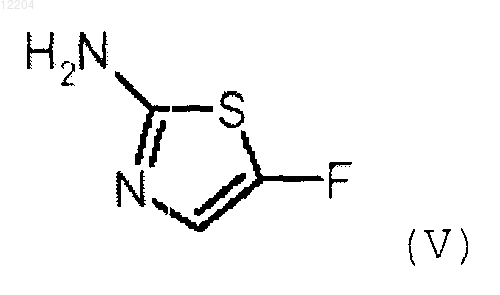
или его солью, где V, R1, R2 и m такие, как определено в п.1.
16. Соединение формулы IV, как оно определено в п.14, где группа, образованная -НС< и >V, представляет собой оксоциклоалкил или гидроксициклоалкил;
R1 представляет собой SO2R3 или SO2NR4R5;
R2 представляет собой водород;
R3 представляет собой C1-3алкильную группу, С3-7циклоалкильную группу или 4-6-членную гетероциклическую группу;
m равно 0; и
D показывает, что двойная связь имеет (E)-конфигурацию.
17. Соединение формулы VIII, как оно определено в п.15, где группа, образованная -НС< и >V, представляет собой оксоциклоалкил или гидроксициклоалкил;
R1 представляет собой SO2R3;
R2 представляет собой водород;
R3 представляет собой С3-7циклоалкильную группу и
m равно 0.
Текст
012204 Предшествующий уровень техники Настоящее изобретение направлено на три(цикло)замещенные амидные соединения. Конкретно, настоящее изобретение направлено на амидные соединения, замещенные (1) по карбонильному углероду этилом/этенилом, присоединенным к фенильному кольцу и карбоциклическому кольцу, и (2) по аминогруппе фторзамещенным триазольным кольцом, которые представляют собой модуляторы глюкокиназы и являются полезными в профилактическом или терапевтическом лечении гипергликемии и диабета, в частности диабета типа II. Считают, что глюкокиназа ("GK") играет важную роль в регуляции организмом уровня глюкозы в плазме. GK, обнаруживаемая главным образом в печени и поджелудочной железе, представляет собой одну из четырех гексокиназ, которые катализируют начальный метаболизм глюкозы. GK-путь насыщается при более высоких уровнях глюкозы, чем другие гексокиназные пути (см. R.L. Printz et al., Annu. Rev.Nutr., 13: 463-496 (1993. GK является необходимым ферментом для поддержания баланса глюкозы у млекопитающих. Животные, которые не экспрессируют GK, умирают от диабета вскоре после рождения,тогда как животные с повышенной экспрессией GK обладают улучшенной толерантностью к глюкозе. Активация GK может приводить к гиперинсулинемической гипогликемии (см. например, H.В.Т. Christesen et al., Diabetes, 51; 1240-1246 (2002. Кроме того, диабет зрелого возраста типа II у молодых людей вызывается мутациями в гене GK, приводящими к потере функции GK, что предполагает, что у людейGK функционирует в качестве сенсора глюкозы (Y. Liang et al., Biochem. J. 309: 167-173 (1995. Таким образом, соединения, которые активируют GK, увеличивают чувствительность GK-сенсорной системы и могли бы быть полезными в лечении гипергликемии, в частности гипергликемии, ассоциированной с диабетом типа II. Поэтому для лечения диабета желательно предложить новые соединения, которые активируют GK. В международной патентной публикацииWO2001/044216 и патенте США 6353111 в качестве активаторов GK описаны (E)-2,3-дизамещенные-N-гетероарилакриламиды. В международной патентной публикацииWO2002/014312 и патентах США 6369232,6388088 и 6441180 описаны тетразолилфенилацетамидные активаторы GK. В международной патентной публикацииWO2000/058293,заявке на европейский патентEP 1169312 и патенте США 6320050 описаны арилциклоалкилпропионамидные активаторы GK. В международной патентной публикацииWO2002/008209 и патенте США 6486184 описаны альфа-ацил и альфа-гетероатомзамещенные бензолацетамидные активаторыGK в качестве противодиабетических агентов. В международной патентной публикацииWO2001/ 083478 описаны гидантоинсодержащие активаторы GK. В международной патентной публикацииWO2002/046173 и патентах США 6433188,6441184 и 6448399 описаны конденсированные гетероароматические активаторы GK. В международной патентной публикацииWO2002/048106 и патенте США 6482951 описаны изоиндолин-1-оновые активаторы GK. В международной патентной публикацииWO2001/085706 описаны замещенные фенилацетамидные активаторы GK для лечения диабета типа II. В патенте США 6384220 описаны параарил- или гетероарилзамещенные фенильные активаторы GK. В патенте Франции 2834295 описаны способы очистки и кристаллическая структура GK человека. В международной патентной публикацииWO2003/095438 описаны N-гетероарилфенилацетамиды и родственные соединения в качестве активаторов GK для лечения диабета типа II. В патенте США 6610846 описано получение циклоалкилгетероарилпропионамидов в качестве активаторов GK. В международной патентной публикацииWO2003/000262 описаны винилфенильные активаторы GK. В международной патентной публикацииWO2003/000267 описаны производные аминоникотината в качестве модуляторов GK. В международной патентной публикацииWO2003/015774 описаны соединения в качестве модуляторов GK. В международной патентной публикацииWO2003/047626 описано применение активатора GK в комбинации с глюкагоновым антагонистом для лечения диабета типа II. В международной патентной публикацииWO2003/055482 описаны амидные производные в качестве активаторов GK. В международной патентной публикацииWO2003/080585 описаны аминобензамидные производные с GK-активностью для лечения диабета и ожирения. В международной патентной публикацииWO2003/097824 описаны GK-кристаллы из печени человека и создание лекарств на основе их структуры. В международной патентной публикацииWO2004/002481 раскрыты арилкарбонильные производные в качестве активаторов GK. В международных патентных публикацияхWO2004/072031 иWO2004/072066 (опубликованных после даты приоритета настоящей заявки) раскрыты различные три(цикло)замещенные амидные соединения, которые являются модуляторами глюкокиназы.-1 012204 Краткое изложение сущности изобретения Соединения, представленные формулой (I) или их фармацевтически приемлемые соли являются полезными в профилактическом или терапевтическом лечении гипергликемии и диабета, в частности диабета типа II. Подробное описание изобретения Настоящее изобретение направлено на соединение формулы (I) или его фармацевтически приемлемую соль, гдеV представляет собой (СН 2)k, где одна группа CH2 может быть возможно заменена CH(OH), C=O,C=NOH, C=NOCH3, CHX, CXX1, CH(OCH3), CH(OCOCH3), СН(С 1-4 алкил) или С(ОН)(С 1-4 алкил);X и X1 независимо выбраны из фторо и хлоро;R1 и R2 независимо выбраны из водорода, галогена, гидрокси, амино, циано, нитро, SR3, SOR3,SO2R3, SO2NR4R5, NHSO2R3 или С 1-4 алкила, С 2-4 алкенила, С 2-4 алкинила, С 1-4 алкокси или гетероарильной группы, где любая группа возможно замещена 1-5 заместителями, независимо выбранными из галогена,циано, нитро, гидрокси, С 1-2 алкокси, -N(С 0-2 алкил)(С 0-2 алкил), С 1-2 алкила, CFnH3-n, арила, гетероарила,-CON(С 0-2 алкил)(С 0-2 алкил), SCH3, SOCH3, SO2CH3 и -SO2N(С 0-2 алкил)(С 0-2 алкил);R3 представляет собой С 1-4 алкильную группу, С 3-7 циклоалкильную группу, арильную группу, гетероарильную группу или 4-7-членную гетероциклическую группу, где любая группа возможно замещена 1-5 заместителями, независимо выбранными из галогена, циано, нитро, гидрокси, С 1-2 алкокси, -N(С 0-2 алкил)(С 0-2 алкил), С 1-2 алкила, С 3-7 циклоалкила, 4-7-членного гетероциклического кольца, CFnH3-n, арила,гетероарила, СОС 1-2 алкил, -CON(С 0-2 алкил)(С 0-2 алкил), SOCH3, SO2CH3 и -SO2N(С 0-2 алкил)(С 0-2 алкил);R4 и R5 независимо представляют собой водород или С 1-4 алкильную группу, С 3-7 циклоалкильную группу, арильную группу, гетероарильную группу или 4-7-членную гетероциклическую группу, где любая группа возможно замещена 1-5 заместителями, независимо выбранными из галогена, циано, нитро,гидрокси, С 1-2 алкокси, -N(С 0-2 алкил)(С 0-2 алкил), С 1-2 алкила, С 3-7 циклоалкила, 4-7-членного гетероциклического кольца, CFnH3-n, арила, гетероарила, -CON(С 0-2 алкил)(С 0-2 алкил), SOCH3, SO2CH3 и -SO2N(С 0-2 алкил)(С 0-2 алкил); или R4 и R5 вместе образуют 4-8-членное гетероциклическое кольцо, которое возможно замещено 1 или 2 заместителями, независимо выбранными из С 1-2 алкила и гидрокси;k означает целое число от 2 до 7;n равно 1, 2 или 3; и пунктирная линия вместе со сплошной линией обозначает возможную двойную связь, ипоказывает, что эта двойная связь имеет (Е)-конфигурацию. Если пунктирная линия вместе со сплошной линией обозначает простую связь, атом углерода, связывающий арильное кольцо и -HC V-содержащую боковую цепь с карбонильным углеродом амида,т.е. атом углерода, отмеченный , является хиральным центром. Соответственно, относительно данного центра, соединение может быть представлено либо в виде рацемата, либо в виде одного энантиомера в, также может быть хиральным. Соответственно, относительно данного центра, соединение может-2 012204 быть представлено либо в виде рацемата, либо в виде одного энантиомера в (R)- или (S)-конфигурации.(R)-энантиомеры являются предпочтительными, когда пунктирная линия вместе со сплошной линией представляет собой простую связь. Когда пунктирная линия вместе со сплошной линией обозначает двойную связь, предпочтительными являются (S)-энантиомеры. В другом аспекте настоящее изобретение направлено на соединение, представленное формулой (Ia): или его фармацевтически приемлемую соль, где V, R1, R2, m итакие, как определено выше в формуле (I). В другом аспекте настоящее изобретение направлено на соединение, представленное формулой (Ia),или его фармацевтически приемлемую соль, где группа, образованная -НС и V, представляет собой оксоциклоалкил или гидроксициклоалкил, например 3-оксоциклопентил, конкретно (R)-3-оксоциклопентил, 4-оксоциклогексил или 3-гидроксициклопентил, особенно (R)-3-оксоциклопентил. В другом и предпочтительном аспекте настоящее изобретение направлено на соединение, представленное формулой (Iб): или его фармацевтически приемлемую соль, где V, R1, R2 и m такие, как определено выше в формуле (I). В воплощении данного предпочтительного аспекта изобретение направлено на соединение, представленное формулой (Iб), или его фармацевтически приемлемую соль, где группа, образованная -НС иV, представляет собой оксоциклоалкил или гидроксициклоалкил, например 3-оксоциклопентил, конкретно (R)-3-оксоциклопентил, 4-оксоциклогексил или 3-гидроксициклопентил, особенно (R)-3 оксоциклопентил. Предпочтительно молекулярная масса соединений формулы (I) составляет менее 800, более предпочтительно - менее 600, наиболее предпочтительно - менее 500. Согласно настоящему изобретению оба R1 и R2 предпочтительно не являются водородом. Согласно настоящему изобретению R1 предпочтительно представляет собой CF3, SOR3, SO2R3,SO2NR4R5, NHSO2R3 или триазолил, более предпочтительно SOR3, SO2R3 или SO2NR4R5, наиболее предпочтительно SO2R3 или SO2NR4R5, особенно SO2R3. Конкретно, R1 представляет собой SO2C3-4 циклоалкил, особенно SO2 циклопропил. Согласно настоящему изобретению R2 предпочтительно представляет собой водород, хлоро, фторо или трифторметил, более предпочтительно водород или хлор. Согласно настоящему изобретению R3 предпочтительно представляет собой C1-3 алкил или С 3-4 циклоалкил, более предпочтительно С 3-4 циклоалкил, особенно циклопропил. Согласно настоящему изобретению R4 и R5 предпочтительно независимо представляют собой водород или С 1-4 алкил, например один из R4 и R5 представляет собой водород, а другой представляет собой этил, или объединены с образованием 4-8-членного гетероциклического кольца. R4 и R5 предпочтительно оба не являются водородом. Согласно настоящему изобретению m предпочтительно равно 0. Согласно настоящему изобретению V предпочтительно представляет собой (СН 2)k, где одна группаCH2 заменена CH(OH) или C=O. Согласно настоящему изобретению k предпочтительно равно 4 или 5. Конкретные соединения по изобретению, которые могут быть упомянуты, представляют собой: 2(R)-2-(3-хлор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-R)-3-оксоциклопентил)пропионамид; 2(R)-2-(3-хлор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(4-оксоциклогексил)пропио-3 012204 намид; 2(R)-2-(3-хлор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(3-гидроксициклопентил)пропионамид;(Е)-N-(5-фтортиазол-2-ил)-3-(3-гидроксициклопентил)-2-(4-метансульфонилфенил)акриламид; 2(R)-2-(4-циклопропансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-R)-3-оксоциклопентил)пропионамид; 2(R)-2-(4-циклопропансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(4-оксоциклогексил)пропионамид; 2(R)-2-(4-циклопропансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(3-гидроксициклопентил)пропионамид; 2(R)-2-(4-циклобутансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(3-оксоциклопентил)пропионамид; 2(R)-2-(4-циклобутансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(4-оксоциклогексил)пропионамид; 2(R)-2-(4-циклобутансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(3-гидроксициклопентил)пропионамид; 2(R)-2-(3-фтор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-R)-3-оксоциклопентил)пропионамид; 2(R)-2-(3-фтор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(4-оксоциклогексил)пропионамид и 2(R)-2-(3-фтор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(3-гидроксициклопентил)пропионамид; или фармацевтически приемлемую соль любого из них. Несмотря на то что предпочтительные группы для каждой переменной в целом перечислены выше отдельно для каждой переменной, предпочтительные соединения по данному изобретению включают те соединения, в которых несколько или каждая переменная в формуле (I) выбраны из предпочтительных,более предпочтительных, наиболее предпочтительных, особенно или конкретно перечисленных групп для каждой переменной. Поэтому подразумевается, что данное изобретение включает все комбинации из предпочтительных, более предпочтительных, наиболее предпочтительных, особенно и конкретно перечисленных групп. Если не указано иначе, то используемый в данном описании термин "алкил", а также другие группы, имеющие префикс "алк", такие как, например, алкокси, алкенил, алкинил и тому подобные, означает углеродные цепи, которые могут являться линейными или разветвленными, или их комбинации. Примеры алкильных групп включают метил, этил, пропил, изопропил, бутил, втор- и трет-бутил, пентил, гексил, гептил и тому подобное. "Алкенил", "алкинил" и другие подобные термины включают углеродные цепи, имеющие по меньшей мере одну ненасыщенную углерод-углеродную связь. В контексте данного описания, например, "С 0-4 алкил" используют для обозначения алкила, имеющего 0-4 атома углерода, т.е. 0, 1, 2, 3, или 4 атома углерода в прямой или разветвленной конфигурации. Алкил, не содержащий углерод, представляет собой водород, если данный алкил является конечной группой. Алкил, не содержащий углерод, представляет собой прямую связь, когда данный алкил является мостиковой (соединительной) группой. Термины "циклоалкил" и "карбоциклическое кольцо" обозначают карбоциклы, не содержащие гетероатомов, и включают моноциклические насыщенные С 3-7 карбоциклы. Примеры циклоалкила и карбоциклических колец включают циклопропил, циклобутил, циклопентил, и циклогексил и тому подобное. Термин "галоген" включает атомы фтора, хлора, брома и йода. Термин "арил" включает, например, фенил и нафтил, предпочтительно фенил. Если не указано иначе, термин "гетероциклическое кольцо" включает 4-8-членные насыщенные кольца, содержащие один или два гетероатома, выбранных из кислорода, серы и азота. Данные гетероатомы не соединяются непосредственно друг с другом. Примеры гетероциклических колец включают оксетан, тетрагидрофуран, тетрагидрапиран, оксепан, оксокан, тиетан, тетрагидротиофен, тетрагидротиопиран, тиепан, тиокан, азетидин, пирролидин, пиперидин, азепан, азокан, [1,3]диоксан, оксазолидин, пиперазин и тому подобное. Другие примеры гетероциклических колец включают окисленные формы серосодержащих колец. Таким образом, считают, что тетрагидротиофен-1-оксид, тетрагидротиофен-1,1 диоксид, тетрагидротиопиран-1-оксид и тетрагидротиопиран-1,1-диоксид также являются гетероциклическими кольцами. Если не указано иначе, термин "гетероарил" включает 5- или 6-членные гетероарильные кольца, содержащие 1-4 гетероатома, выбранные из кислорода, серы и азота. Примерами таких гетероарильных колец являются фурил, тиенил, пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил,изотиазолил, триазолил, оксадиазолил, тиадиазолил, тетразолил, пиридинил, пиридазинил, пиримидинил,пиразинил и триазинил. Вышеприведенные формулы показаны без указания стереохимии в определенных положениях. Настоящее изобретение включает все стереоизомеры (например, геометрические изомеры, оптические изо-4 012204 меры, диастереоизомеры и т.д.) и их фармацевтически приемлемые соли, за исключением тех случаев,когда конкретно показано или указано обратное. Дополнительно также включены смеси стереоизомеров,а также выделенные конкретные стереоизомеры, за исключением тех случаев, когда конкретно показано или указано обратное. В процессе синтеза для получения таких соединений или при использовании способов рацемизации или эпимеризации, известных специалистам в данной области, продукты таких способов могут представлять собой смесь стереоизомеров. Когда существует таутомер соединения вышеприведенных формул, настоящее изобретение включает любые возможные таутомеры и их фармацевтически приемлемые соли и их смеси, за исключением тех случаев, когда конкретно показано или указано обратное. Когда соединение вышеприведенных формул и его фармацевтически приемлемые соли существуют в форме сольватов или полиморфных форм, настоящее изобретение включает любые возможные сольваты и полиморфные формы. Тип растворителя, который образует сольват, конкретно ничем не ограничен, при условии, что растворитель является фармацевтически приемлемым. Например, могут быть использованы вода, этанол, пропанол, ацетон и тому подобное. Так как соединения формулы (I) предназначены для фармацевтического применения, они предложены предпочтительно в по существу чистой форме, например по меньшей мере 60% чистоты, более подходящей является по меньшей мере 75% чистоты, по меньшей мере 95% чистоты и особенно по меньшей мере 98% чистоты (% представляет собой процент по массе). Изобретение также включает фармацевтическую композицию, которая содержит соединение формулы (I) или его фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым носителем. Предпочтительно композиция содержит фармацевтически приемлемый носитель и нетоксичное терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли. Кроме того, данное воплощение изобретения включает фармацевтическую композицию для профилактики или лечения гипергликемии и диабета, в частности диабета типа II, путем активации GK, содержащую фармацевтически приемлемый носитель и нетоксичное терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли. В изобретении также предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в качестве фармацевтического препарата. Соединения и композиции по настоящему изобретению являются эффективными в лечении гипергликемии и диабета, в частности диабета типа II, у млекопитающих, таких как, например, люди. В изобретении также предложен способ профилактического или терапевтического лечения состояния, где требуется активация GK, включающий стадию введения эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В изобретении также предложен способ профилактического или терапевтического лечения гипергликемии или диабета, в частности диабета типа II, включающий стадию введения эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В изобретении также предложен способ предупреждения диабета, в частности диабета типа II, у человека, у которого наблюдается преддиабетическая гипергликемия или нарушение толерантности к глюкозе, включающий стадию введения эффективного профилактического количества соединения формулы(I) или его фармацевтически приемлемой соли. В изобретении также предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в качестве активатора GK. В изобретении также предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в профилактическом или терапевтическом лечении гипергликемии или диабета, в частности диабета типа II. В изобретении также предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в предупреждении диабета, в частности диабета типа II, у человека, у которого наблюдается преддиабетическая гипергликемия или нарушение толерантности к глюкозе. В изобретении также предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в приготовлении лекарства для активации GK. В изобретении также предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в приготовлении лекарства для профилактического или терапевтического лечения гипергликемии или диабета, в частности диабета типа II. В изобретении также предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в приготовлении лекарства для предупреждения диабета, в частности диабета типа II, у человека, у которого наблюдается преддиабетическая гипергликемия или нарушение толерантности к глюкозе. Соединения и композиции по настоящему изобретению могут быть возможно использованы в комбинации с одним или более другими противодиабетическими агентами или антигипергликемическими агентами, которые включают, например, сульфонилмочевины (например, глибурид, глимепирид, глипирид, глипизид, хлорпропамид, гликлазид, глизоксепид, ацетогексамид, глиборнурид, толбутамид, тола-5 012204 замид, карбутамид, гликвидон, глигексамид, фенбутамид, толцикламид и т.д.), бигуаниды (например метформин, фенформин, буформин и т.д.), глюкагоновые антагонисты (например, пептидные или непептидные глюкагоновые антагонисты), ингибиторы глюкозидазы (например, акарбозу, миглитол и т.д.),средства, повышающие секрецию инсулина, сенсибилизаторы инсулина (например, троглитазон, розиглитазон, пиоглитазон и т.д.) и тому подобное; или агентами против ожирения (например, сибутрамином,орлистатом и т.д.) и тому подобным. Соединения и композиции по настоящему изобретению и другие противодиабетические агенты или антигипергликемические агенты могут быть введены одновременно,последовательно или раздельно. Термин "фармацевтически приемлемые соли" относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований или кислот. Когда соединение по настоящему изобретению является кислым, тогда соответствующая его соль может быть легко получена из фармацевтически приемлемых нетоксичных оснований, включая неорганические основания и органические основания. Соли, полученные из таких неорганических оснований, включают соли алюминия, аммония, кальция, двухвалентной меди, одновалентной меди, трехвалентного железа, двухвалентного железа, лития, магния, трехвалентного марганца, двухвалентного марганца, калия, натрия, цинка и тому подобное. Особенно предпочтительными являются соли аммония, кальция, магния, калия и натрия. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, а также циклических аминов и замещенных аминов, таких как природные и синтетические амины. Другие фармацевтически приемлемые органические нетоксичные основания, из которых могут быть образованы соли, включают, например, аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин,N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и тому подобное. Когда соединение по настоящему изобретению является основным, тогда соответствующие его соли могут быть легко получены из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Такие кислоты включают, например, уксусную, бензолсульфоновую,бензойную, камфорсульфоновую, лимонную, этансульфоновую, фумаровую, глюконовую, глутаминовую, бромисто-водородную, соляную, изэтионовую, молочную, малеиновую, яблочную, миндальную,метансульфоновую, слизевую, азотную, памовую, пантотеновую, фосфорную, янтарную, серную, винную, паратолуолсульфоновую кислоту и тому подобные. Особенно предпочтительными являются лимонная, бромисто-водородная, соляная, малеиновая, фосфорная, серная, метансульфоновая и винная кислоты. Фармацевтические композиции по настоящему изобретению содержат соединение формулы (I) или его фармацевтически приемлемую соль в качестве активного ингредиента, фармацевтически приемлемый носитель и, возможно, другие терапевтические ингредиенты или адъюванты. Данные композиции включают композиции, подходящие для перорального, ректального, местного и парентерального (включая подкожное, внутримышечное и внутривенное) введения, а также для введения путем ингаляции, хотя наиболее подходящий путь в любом данном случае будет зависеть от конкретного хозяина и природы тяжести состояний, при которых вводят данный активный ингредиент. Фармацевтические композиции обычно представлены в стандартной лекарственной форме и приготовлены с использованием любого из способов, хорошо известных в области фармации. Фармацевтические композиции по настоящему изобретению предпочтительно адаптированы для перорального введения. На практике соединения формулы (I) или их фармацевтически приемлемые соли в качестве активного ингредиента могут быть объединены в однородной смеси с фармацевтическим носителем в соответствии со стандартными фармацевтическими способами приготовления композиций. Носитель может принимать разнообразные формы в зависимости от формы препарата, желательного для введения, например перорального или парентерального (включая внутривенное). Таким образом, фармацевтические композиции по настоящему изобретению могут быть представлены в виде дискретных единиц, подходящих для перорального введения, таких как капсулы, облатки или таблетки, каждая из которых содержит заданное количество активного ингредиента. Дополнительно композиции могут быть представлены в виде порошка, в виде гранул, в виде раствора, в виде суспензии в водной жидкости, в виде неводной жидкости, в виде эмульсии типа масло-в-воде или в виде жидкой эмульсии типа вода-в-масле. Помимо обычных лекарственных форм, описанных выше, соединение формулы (I) или его фармацевтически приемлемая соль могут быть введены также с помощью средств с контролируемым высвобождением и/или устройств для доставки. Композиции могут быть приготовлены с использованием любого из фармацевтических способов. Обычно такие способы включают стадию объединения активного ингредиента с носителем, который представлен одним или более необходимыми ингредиентами. Обычно композиции приготавливают путем равномерного и тщательного перемешивания активного ингредиента с жидкими носителями или тонкоизмельченными твердыми носителями, или и с теми и с другими. Затем данному продукту можно-6 012204 легко придать желательную форму. Таким образом, фармацевтические композиции по данному изобретению могут содержать фармацевтически приемлемый носитель и соединение формулы (I) или его фармацевтически приемлемую соль. Соединения формулы (I) или их фармацевтически приемлемые соли также могут быть включены в фармацевтические композиции с одним или более другими терапевтически активными соединениями. Фармацевтические композиции по данному изобретению включают фармацевтически приемлемый липосомальный препарат, содержащий соединение формулы (I) или его фармацевтически приемлемую соль. Используемый фармацевтический носитель может представлять собой, например, твердое вещество, жидкость и газ. Примеры твердых носителей включают лактозу, сульфат кальция, сахарозу, тальк,желатин, агар, пектин, гуммиарабик, стеарат магния и стеариновую кислоту. Примерами жидких носителей могут быть сахарный сироп, арахисовое масло, оливковое масло и вода. Примеры газообразных носителей включают диоксид углерода и азот. При приготовлении композиций в пероральной лекарственной форме может быть использована любая удобная фармацевтическая среда. Например, вода, гликоли, масла, спирты, корригенты, консерванты, красители и тому подобное могут быть использованы для образования жидких пероральных препаратов, таких как суспензии, эликсиры и растворы, тогда как такие носители, как крахмалы, сахара,микрокристаллическая целлюлоза, разбавители, гранулирующие агенты, смазывающие вещества, связующие вещества, разрыхлители и тому подобное, могут быть использованы для образования твердых пероральных препаратов, таких как порошки, капсулы и таблетки. Из-за того, что их легко вводить, таблетки и капсулы являются предпочтительными пероральными лекарственными формами, в соответствии с чем используют твердые фармацевтические носители. Возможно, на таблетки может быть нанесено покрытие с помощью стандартных способов с использованием воды и без нее. Таблетка, содержащая композицию по данному изобретению, может быть приготовлена путем прессования или формовки (штамповки), возможно с одним или более вспомогательными ингредиентами или адъювантами. Прессованные таблетки могут быть приготовлены путем прессования в подходящей машине активного ингредиента в свободнотекучей форме, такой как порошок или гранулы, возможно смешанного со связующим веществом, смазывающим веществом, инертным разбавителем, поверхностно-активным или диспергирующим агентом или другим таким эксципиентом. Данные эксципиенты могут представлять собой, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие агенты и разрыхлители, например кукурузный крахмал или альгиновая кислота; связующие агенты, например крахмал, желатин или гуммиарабик; и смазывающие агенты, например стеарат магния, стеариновая кислота или тальк. Таблетки могут не иметь покрытия или могут быть покрыты с использованием известных способов с целью замедления распадаемости и всасывания в желудочно-кишечном тракте и тем самым обеспечения непрерывного действия в течение продолжительного времени. Например, может быть использовано такое вещество с пролонгирующим действием, как глицерилмоностеарат или глицерилдистеарат. В твердых желатиновых капсулах активный ингредиент смешивают с твердым инертным разбавителем, например карбонатом кальция, фосфатом кальция или каолином. В мягких желатиновых капсулах активный ингредиент смешивают с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом. Формованные таблетки могут быть приготовлены путем формования(штамповки) в подходящей машине смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. Каждая таблетка предпочтительно содержит от приблизительно 0,05 мг до приблизительно 5 г активного ингредиента, и каждая облатка или капсула содержит предпочтительно от приблизительно 0,05 мг до приблизительно 5 г активного ингредиента. Например, препарат, предназначенный для перорального введения людям, может содержать от приблизительно 0,05 мг до приблизительно 5 г активного агента, смешанного с подходящим или стандартным количеством вещества-носителя, которое может варьировать от приблизительно 5% до приблизительно 95% от всей композиции. Стандартные лекарственные формы обычно содержат от приблизительно 1 мг до приблизительно 2 г активного ингредиента, типично 25, 50, 100, 200, 300, 400, 500, 600,800 или 1000 мг. Фармацевтические композиции по настоящему изобретению, подходящие для парентерального введения, могут быть приготовлены в виде растворов или суспензий активных соединений в воде. Подходящее поверхностно-активное вещество может включать, например, гидроксипропилцеллюлозу. Дисперсии могут быть приготовлены также в глицерине, жидких полиэтиленгликолях и их смесях в маслах. Дополнительно для предупреждения вредного размножения микроорганизмов могут быть включены консерванты. Фармацевтические композиции по настоящему изобретению, подходящие для использования путем инъекции, включают стерильные водные растворы или дисперсии. Кроме того, данные композиции могут находиться в форме стерильных порошков для немедленного приготовления таких стерильных инъецируемых растворов или дисперсий. Во всех случаях конечная инъецируемая форма должна быть стерильной и должна быть эффективно текучей для легкого впрыскивания. Фармацевтические композиции должны быть стабильными в условиях изготовления и хранения; соответственно, предпочтительно-7 012204 должны быть защищены от контаминирующего действия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой растворяющую или дисперсионную среду, содержащую, например,воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), растительные масла и их подходящие смеси. Фармацевтические композиции по настоящему изобретению могут находиться в форме, подходящей для местного применения, такой как, например, аэрозоль, крем, мазь, лосьон, присыпка и тому подобное. Дополнительно, данные композиции могут находиться в форме, подходящей для применения в трансдермальных устройствах. Данные препараты могут быть приготовлены с использованием соединения формулы (I) или его фармацевтически приемлемой соли стандартными технологическими способами. Например, крем или мазь приготавливают путем смешивания гидрофильного вещества и воды вместе с соединением в количестве от приблизительно 5 мас.% до приблизительно 10 мас.% с получением крема или мази, имеющих желаемую консистенцию. Фармацевтические композиции по данному изобретению могут находиться в форме, подходящей для ректального введения, где носитель представляет собой твердое вещество. Предпочтительно, чтобы из данной смеси можно было приготавливать суппозитории, содержащие однократную дозу. Подходящие носители включают масло какао и другие вещества, обычно используемые в данной области. Суппозитории могут быть легко образованы путем смешивания композиции с размягченным(и) или расплавленным(и) носителем(ями) с последующим охлаждением и формованием в пресс-формах. Фармацевтические композиции по данному изобретению могут находиться в форме, подходящей для ингаляционного введения. Такое введение может быть выполнено в формах и с использованием носителей, описанных, например, в Particulate Interactions in Dry Powder Formulations for Inhalation, XianZeng et al, 2000, Taylor and Francis; Pharmaceutical Inhalation Aerosol Technology, Anthony Hickey, 1992,Marcel Dekker; и Respiratory Drug Delivery, 1990, Editor: P.R. Byron, CRC Press. Дополнительно к вышеупомянутым ингредиентам-носителям описанные выше фармацевтические композиции могут содержать, когда это целесообразно, один или более дополнительных ингредиентовносителей, таких как разбавители, буферы, корригенты, связующие вещества, поверхностно-активные агенты, загустители, смазывающие вещества, консерванты (включая антиоксиданты) и тому подобное. Кроме того, могут быть включены другие адъюванты, чтобы сделать препарат изотоническим по отношению к крови предполагаемого реципиента. Композиции, содержащие соединение формулы (I) или его фармацевтически приемлемую соль, могут быть приготовлены также в форме порошковых или жидких концентратов. Обычно в лечении вышеуказанных состояний полезными являются дозовые уровни порядка от приблизительно 0,01 мг/кг до приблизительно 150 мг/кг массы тела в сутки или, альтернативно, от приблизительно 0,5 мг до приблизительно 10 мг на пациента в сутки. Например, диабет можно эффективно лечить путем введения от приблизительно 0,01 до 100 мг соединения на килограмм массы тела в сутки или, альтернативно, от приблизительно 0,5 мг до приблизительно 7 г на пациента в сутки. Однако понятно, что конкретный уровень доз для любого конкретного пациента будет зависеть от множества факторов, включая возраст, массу тела, общее состояние здоровья, пол, питание, время введения, путь введения, скорость выведения, комбинацию лекарств и тяжесть заболевания у конкретного диабетического пациента, которого лечат. Понятно, что с профилактической целью в случае ожидания гипергликемического состояния дополнительно могут быть введены субтерапевтические уровни соединения и его соли по данному изобретению. Соединения формулы (I) могут проявлять предпочтительные свойства по сравнению с известными активаторами глюкокиназы, например такие, как проиллюстрировано в анализах, приведенных в данном описании. Конкретно, соединения по изобретению могут проявлять улучшенные значения Km, Vmax, ЕС 50,максимальной активации (концентрация глюкозы = 5 мМ), и/или максимальное уменьшение уровня глюкозы в крови до базовых уровней глюкозы в крови (например, у мышей C57BL/6J), или другие предпочтительные фармакологические свойства по сравнению с известными активаторами GK. В соответствии с данным изобретением соединения формулы (I) могут быть получены согласно протоколу, проиллюстрированному ниже на cхеме 1. Схема 1-8 012204 где V, R1, R2, m итакие, как описано выше, и R11 представляет собой С 1-4 алкил. Альдегиды II и эфиры фенилуксусной кислоты III имеются в продаже или могут быть легко получены с использованием известных способов. -Карбанион эфира фенилуксусной кислоты III (R11 = С 1-4 алкил), образованный при -78 С, например, в тетрагидрофуране, при действии сильного основания, например диизопропиламида лития, может быть конденсирован с II с получением ,-ненасыщенного сложного эфира (T. Severin et al. Chem. Ber. 1985, 118, 4760-4773), который может омыляться при использовании, например, гидроксида натрия (W.L. Corbett et al., WO2001/44216) с получением IV. При необходимости, любые функциональные группы в данных промежуточных соединениях, например оксоили гидроксигруппы в соединениях формулы II, могут быть защищены, и защитные группы могут быть удалены с использованием стандартных способов. Например, оксогруппы могут быть защищены в виде кеталей, а гидроксигруппы - в виде эфиров, например метоксиметиловых (MOM) эфиров.,-Ненасыщенные карбоновые кислоты IV могут быть конденсированы с 2-амино-5-фтортиазоломV или его солью, например гидрохлоридной солью, которая может быть получена, как описано в примерах, с использованием различных условий сочетания, например карбодиимид-1-гидроксибензотриазола на полимерной подложке в N,N-диметилформамиде при 20C (типичные способы, смотри http://www.argotech.com/PDF/resins/ps carbodiimide.pdf и доступные от Argonaut Technologies, Inc., Foster City, Калифорния), с получением (Ia). В соответствии с данным изобретением соединения формулы (Iб) могут быть получены огласно протоколу, проиллюстрированному ниже на схеме 2. Схема 2 где V1 R1, R2 и m такие, как описано выше, Y представляет собой CO2R12, где R12 представляет собой водород, С 1-4 алкил или бензил; и X представляет собой хлоро, бромо, йодо или -OSO2R13, где R13 представляет собой С 1-4 алкил, возможно замещенный одним или более атомами фтора, или возможно замещенный арил. Галогениды и эфиры сульфокислот VI и фенилуксусные кислоты и эфиры VII имеются в продаже или могут быть легко получены с использованием известных способов, описанных, например, в международных патентных публикацияхWO2000/058293,WO2001/044216 иWO2003/095438. Эти алкилирующие агенты могут взаимодействовать с дианионами фенилуксусных кислот VII, образованных при -78 С в тетрагидрофуране при действии 2 эквивалентов сильного основания, такого как диизопропиламид лития, с образованием непосредственно VIII (F. T. Bizzarro et al., WO2000/58293). Альтернативно, -карбанион эфира фенилуксусной кислоты VII, образованный при -78 С в тетрагидрофуране при действии сильного основания, такого как бис(триметилсилил)амид лития (L. Snyder et al., J. Org. Chem. 1994, 59, 7033-7037), может быть алкилирован с помощью VI с получением -замещенных сложных эфиров. Омыление этих эфиров с использованием, например, гидроксида натрия в водном метаноле при температуре в диапазоне от 20C до температуры дефлегмации дает карбоновые кислоты VIII. При необходимости, любые функциональные группы в промежуточных соединениях, например оксо- или гидроксигруппы в соединениях формулы VI, могут быть защищены и защитные группы могут быть удалены с использованием стандартных способов. Например, оксогруппы могут быть защищены в виде кеталей, а гидроксигруппы - в виде эфиров, например метоксиметиловых (MOM) эфиров. Карбоновые кислоты VIII могут быть конденсированы с 2-амино-5-фтортиазолом V или его солью,например гидрохлоридной солью, которая может быть получена, как описано в примерах, с использованием различных условий сочетания, например карбодиимид-1-гидроксибензотриазола на полимерной подложке в N,N-диметилформамиде при 20C (типичные способы, смотри http://www.argotech.com/PDF/resins/pscarbodiimide.pdf и доступные от Argonaut Technologies, Inc., Foster City, Калифорния),с получением амидов (Iб). Соединение формулы (Iб) имеет ассиметрический атом углерода, который связывает карбонильный углерод амида, арильное кольцо и боковую цепь, содержащую -HC V. B соответствии с данным изобретением предпочтительной стереоконфигурацией у ассиметрического центра является (R)-конфигурация. Если желательно выделить чистые (R)- или (S)-стереоизомеры соединения формулы (Iб), то можно разделить рацемическую смесь хирального предшественника VIII, представляющего собой карбоновую кислоту, любыми удобными химическими способами и затем конденсировать чистые энантиомеры этих карбоновых кислот с 2-амино-5-фтортиазолом V или его солью с использованием реагента, который вы-9 012204 зывает незначительную рацемизацию: в качестве примера рацемическая смесь VIII может быть конденсирована с хиральным производным оксазолидинона (см., например, F. T. Bizzarro и др., WO2000/58293) с образованием смеси диастереоизомерных имидов, которые могут быть разделены любым удобным способом, например колоночной хроматографией. Гидролиз чистых имидов дает чистые (R)- и (S)стереоизомеры карбоновых кислот, которые затем могут быть конденсированы с 2-амино-5 фтортиазолом V или его солью с использованием реагента, который минимизирует рацемизацию хирального центра, например гексафторфосфата бензотриазол-1-илокситрис(пирролидино)фосфония (J.Coste et al. Tetrahedron Lett. 1990, 31, 205-208), с получением чистых (R)- или (S)-энантиомеров амидов формулы (Iб). Альтернативно, рацемическая смесь амидов формулы (Iб) может быть разделена с помощью хиральной высокоэффективной жидкостной хроматографии с хиральной неподвижной фазой, которая может быть приобретена, например, в Daicel Chemical Industries, Ltd, Токио, Япония. Различные функциональные группы, присутствующие в соединениях формулы (I) и промежуточных соединений, используемых для их получения, могут быть получены путем известных специалистам в данной области превращений функциональных групп. Например, сульфонильные группы в соединениях формулы VIII могут быть получены путем окисления соответствующей сульфанильной группы с использованием, например, mCPBA (мета-хлорпероксибензойной кислоты). Дополнительные детали получения соединений формулы (I) можно найти в примерах. Соединения формулы (I) могут быть получены раздельно или в виде библиотек соединений, включающих по меньшей мере 2, например от 5 до 1000 соединений, и более предпочтительно от 10 до 100 соединений формулы (I). Библиотеки соединений могут быть получены путем комбинаторного подхода"разделение и смешение" или путем множественного параллельного синтеза с использованием жидкофазной или твердофазной химии с помощью способов, известных специалистам в данной области. Во время синтеза соединений формулы (I) подвижные функциональные группы в промежуточных соединениях, например гидрокси-, оксо-, карбокси- и аминогруппы, могут быть защищены. Защитные группы могут быть удалены на любой стадии синтеза соединений формулы (I) или могут присутствовать в конечном соединении формулы (I). Исчерпывающее обсуждение способов, которыми могут быть защищены различные подвижные функциональные группы, и способы расщепления полученных защищенных производных приведены, например, в Protective Groups in Organic Chemistry, T.W. Greene andP.G.M. Wuts, (1991) Wiley-lnterscience, New York, 2nd edition. Любые новые промежуточные соединения, такие, как определено выше, также включены в объем изобретения. Таким образом, в изобретении также предложены: а) соединение формулы IV, как оно определено выше, где R1 представляет собой SO2R3 илиR3 представляет собой C1-3 алкильную группу, С 3-7 циклоалкильную группу или 4-6-членную гетероциклическую группу;R4 и R5 независимо представляют собой водород или С 1-4 алкил, при условии, что R4 и R5 оба не являются водородом;m означает 0; ипоказывает, что двойная связь имеет (E)-конфигурацию; и б) соединение формулы VIII, как оно определено выше, где R1 представляет собой SO2R3 илиR3 представляет собой С 3-7 циклоалкильную группу или 4-6-членную гетероциклическую группу;R4 и R5 независимо представляют собой водород или С 1-4 алкил, при условии, что R4 и R5 оба не являются водородом; иm означает 0. Все публикации, включая, но не ограничиваясь этим, патенты и заявку на патент, процитированные в данном описании, включены в данное описание посредством ссылки, как если бы каждая индивидуальная публикация была конкретно и индивидуально указана с целью включения в данное описание посредством ссылки во всей своей полноте. Примеры Материалы и способы. Колоночную хроматографию можно проводить на SiO2 (40-63 меш), если не оговорено особо. Данные ЖХ/МС могут быть получены с использованием одного из двух способов. Способ А: колонка WatersH2O)-MeCN, содержащим 0,1% HCO2H, в течение 6 минут и УФ-детекция при 220 нм. Параметры градиента: 0,0-1,2 мин: 100% (5% MeCN в H2O); 1,2-3,8 мин: увеличение градиента до 10% (5% MeCN в Н 2 О)90% MeCN; 3,8-4,4 мин: удерживание на уровне 10% (5% MeCN в Н 2 О)-90% MeCN; 4,4-5,5 мин: увеличение градиента до 100% MeCN; 5,5-6,0 мин: возвращение к 100% (5% MeCN в H2O). Способ Б: колонкаMeCN в H2O)-MeCN (от 4:1 до 1:4), содержащим 0,1% HCO2H, в течение 2,95 мин с использованием детектора на основе диодной матрицы. Масс-спектры в способах А и Б могут быть получены с использованием источника ионизации электрораспылением в режиме получения либо положительных ионов (ES+),либо отрицательных ионов (ES-). Спектры химической ионизации при атмосферном давлении (APCI) могут быть получены на приборе FinniganMat SSQ 7000 С. Данные о синтезе следующего соединения опубликованы ранее: 7(S)-йодметил-2(S),3(S)-дифенил 1,4-диоксаспиро[4,4]нонан: WO2003/095438. Аббревиатуры и акронимы: Ac: ацетил; ATP: аденозин-5'-фосфат; n-Bu: н-бутил; DMF: N,Nдиметилформамид; DMPU: 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидинон; DMSO: диметилсульфоксид; EDCI: 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид; Et: этил; FA: кратность активации; GK: глюкокиназа; Glc: глюкоза; G6P: глюкозо-6-фосфат; G6PDH: глюкозо-6-фосфатдегидрогеназа; GST-GK: слитый белок глутатион-S-трансфераза-глюкокиназа; IH: изогексан; LHMDS: бис(триметилсипил)амид лития; Me: метил; NADP(H): (3-никотинамидадениндинуклеотид-фосфат (восстановленный); NBS: N-бромсукцинимид; Ph: фенил; rt: комнатная температура; RT: время удерживания;TFAA: трифторуксусный ангидрид; THF: тетрагидрофуран. Промежуточные соединения Подготовительный пример 1. Гидрохлорид 5-фтортиазол-2-иламинаNEt3 (63,4 мл, 455 ммоль) добавляли к перемешиваемой суспензии гидробромида 5-бромтиазол-2 иламина (102,7 г, 379 ммоль) в CH2Cl2 (1,5 л). Через 1 ч по каплям добавляли TFAA (64,2 мл, 455 ммоль) при 0C в течение 15 мин. Смеси позволяли нагреться до 20C в течение 1 ч, затем перемешивали в течение еще 2 ч. Добавляли H2O (600 мл) и полученный осадок собирали. Водный слой фильтрата отделяли и экстрагировали CHCl3 (3300 мл). Объединенные органические экстракты промывали рассолом, сушили(Na2SO4), фильтровали и концентрировали. Собранный осадок и оставшееся твердое вещество объединяли и растирали с EtOAc-H-C6H14 с получением N-(5-бромтиазол-2-ил)-2,2,2-трифторацетамида: Н(CDCl3): 7,45 (1 Н, s), 13,05 (1 Н, br). n-BuLi (253 мл 1,58 M раствора в гексанах, 403 ммоль) добавляли по каплям в течение 50 минут к перемешиваемому раствору вышеуказанного амида (50,0 г, 183 ммоль) в безводном THF (1,3 л) при -78C. Через 1,5 ч раствор N-фторбензолсульфонимида (86,0 г, 275 ммоль) в безводном THF (250 мл) добавляли по каплям в течение 30 мин. Данную смесь перемешивали в течение 3 ч, затем нагревали до -30C. Добавляли H2O (300 мл) и смесь фильтровали через слой целита. Собранное твердое вещество и целит промывали Et2O (400 мл) и H2O (400 мл). Органический слой фильтрата отделяли и экстрагировали водой (2400 мл). Объединенные водные слои промывали Et2O (400 мл), затем подкисляли 2 M HCl до рН 6,5 и экстрагировали EtOAc (2400 мл). Объединенные органические экстракты промывали H2O (2400 мл) и рассолом, затем сушили (MgSO4), фильтровали и концентрировали. Колоночная хроматография (EtOAc-H-C6H14, от 1:3 до 1:2) давала N-(5-фтортиазол-2-ил)-2,2,2 трифторацетамид: H (CDCl3): 7,13 (1 Н, d). AcCl (12,6 мл, 175 ммоль) добавляли по каплям к перемешиваемому раствору данного амида (15,7 г, 73 ммоль) в MeOH (300 мл) при 0C. Данную смесь перемешивали при 20C в течение 30 мин, нагревали при температуре дефлегмации в течение 1 ч и в конце концентрировали под вакуумом. Оставшееся твердое вещество растирали с THF с получением указанного в заголовке соединения:H (D2O): 7,00 (1 Н, d). Свободное основание указанного в заголовке соединения получали путем суспендирования его HCl соли в диэтиловом эфире, промывки насыщенным водным NaHCO3, сушки эфирного слоя и упаривания с получением свободного основания, которое непосредственно использовали. Подготовительный пример 2: Этил-(4-метансульфонилфенил)ацетатSOCl2 (8,2 мл, 112,0 ммоль) добавляли к перемешиваемой суспензии (4-метансульфонилфенил)уксусной кислоты (20,00 г, 93,3 ммоль) в EtOH (80 мл) при -10C. Смеси позволяли нагреться до 20C в течение 16 ч, затем растворители удаляли при пониженном давлении. Остаток растворяли в EtOAc и полученный раствор промывали H2O до тех пор, пока значение рН водной фазы не становилось нейтральным. EtOAc раствор дополнительно промывали насыщенным водным Na2CO3, затем сушили (MgSO4). Фильтрация и выпаривание растворителя давали указанное в заголовке соединение: m/z (ES+) = 284,1- 11012204 могут быть получены таким образом, как описано в WO2003/095438. Промежуточные соединения карбоновых кислот формулы VIII, необходимые для синтеза в примерах 7-15, могут быть получены с использованием того же общего способа, включающего алкилирование соответствующего сложного эфира 4 йодметил-НС V с последующим гидролизом данного продукта. Промежуточное соединение карбоновой кислоты формулы VIII, необходимое для синтеза в примере 7, получали следующим образом. Подготовительный пример 6 а. (4-Циклопропилсульфанилфенил)оксоуксусная кислота. 2 M водный NaOH (163 мл) добавляли к раствору этил-(4-циклопропилсульфанилфенил)оксоацетата (40,62 г, 162,5 ммоль) в EtOH (200 мл) и данную смесь при перемешивании нагревали при 60C в течение 2 ч. После охлаждения смесь концентрировали до 150 мл и промывали диэтиловым эфиром(2100 мл). Затем добавляли концентрированную HCl в количестве, достаточном для доведения рН до 1,и полученный осадок экстрагировали в EtOAc (2300 мл). Объединенные органические фазы промывали водой (3100 мл), рассолом (200 мл) и сушили (MgSO4). После удаления растворителя получали указанное в заголовке соединение: m/z (ES-) = 221,0 [M- H+]-. Подготовительный пример 6 б. (4-Циклопропилсульфанилфенил)уксусная кислота. Гидрат гидразина (14,19 г, 283,5 ммоль) охлаждали до -50C и в один прием добавляли (4 циклопропилсульфанилфенил)оксоуксусную кислоту (подготовительный пример 6 а, 12,6 г, 56,7 ммоль). Данную суспензию при интенсивном перемешивании нагревали сначала до комнатной температуры и затем при 80C в течение 5 мин. Твердый KOH (8,76 г, 156,5 ммоль) добавляли равными частями в четыре приема и полученный раствор нагревали при 100C в течение 20 ч. После охлаждения до комнатной температуры добавляли воду (25 мл), водную фазу промывали Et2O (20 мл). Саму эфирную фазу промывали водой (215 мл) и добавляли концентрированную HCl в количестве, достаточном для доведения рН объединенных водных фаз до 1. Затем полученный осадок экстрагировали в EtOAc (2300 мл) и объединенные органические фазы промывали водой (3100 мл), рассолом (200 мл), затем сушили (MgSO4). После выпаривания растворителя получали указанное в заголовке соединение: m/z (ES-) = 207,1 [M-H+]-. Подготовительный пример 6 в. 2-(4-Циклопропилсульфанилфенил)-N-(2(R)-гидрокси-1(R)-метил-2 фенилэтил)-N-метилацетамид Безводный ацетон (148 мл) добавляли к (4-циклопропилсульфанилфенил)уксусной кислоте (подготовительный пример 6 б, 16,41 г, 78,8 ммоль) и K2CO3 (32,67 г, 236,4 ммоль) с образованием суспензии,которую охлаждали до -10C при перемешивании. Чистый триметилацетилхлорид (10,2 мл, 82,74 ммоль) вводили по каплям, контролируя, чтобы во время добавления температура не превышала -10C. Данную реакционную смесь перемешивали при -10C в течение 20 мин, нагревали до 0 С в течение 20 мин, затем охлаждали до -15 С и в один прием добавляли твердый (1(R),2(R-(-)-псевдоэфедрин (19,53 г, 118,2 ммоль). Через 10 мин реакционную смесь доводили до комнатной температуры и продолжали перемешивать при данной температуре в течение 1,5 ч. Добавляли воду (100 мл) и смесь экстрагировали EtOAc(500 мл). Органическую фазу промывали водой (2100 мл) и объединенные водные слои подвергали обратной экстракции EtOAc (2250 мл). Затем объединенные органические слои промывали рассолом (100 мл) и сушили (MgSO4). Растворитель удаляли и твердый желтый остаток перекристаллизовывали изLHMDS (162 мл 1 M раствора в THF, 162 ммоль) разбавляли безводным THF (161 мл) и охлаждали до -20C при перемешивании. Раствор 2-(4-циклопропилсульфанилфенил)-N-(2(R)-гидрокси-1(R)-метил 2-фенилэтил)-N-метилацетамида (Подготовительный пример 6 в, 30 г, 84,4 ммоль) в безводном THF (245 мл) добавляли через канюлю в течение 10 минут, контролируя, чтобы температура реакции оставалась- 12012204 ниже -15 С в течение всего добавления. Реакции позволяли нагреться до -7C в течение 30 мин, затем охлаждали до -12C и раствор 7(S)-йодметил-2(S),3(S)-дифенил-1,4-диоксаспиро[4,4]нонана (27 г, 64,2 ммоль) в смеси с безводным THF (111 мл) и DMPU (18,9 мл) добавляли через канюлю в течение 10 мин,контролируя, чтобы температура реакции все время оставалась ниже -7C. Реакцию нагревали до 2 С и перемешивали в течение 4,5 ч, затем вливали в смесь толуола (770 мл) и 20%-ного водного NH4Cl (550 мл). После интенсивного перемешивания органический слой отделяли и промывали 20%-ным воднымNH4Cl (550 мл) и рассолом (100 мл). Водные фазы объединяли и экстрагировали EtOAc (500 мл), который после отделения промывали рассолом (100 мл). Объединенные органические фазы сушили (MgSO4),фильтровали, упаривали и полученное масло очищали с помощью флэш-хроматографии (изменяя соотношение IH-EtOAc с 9:1 до 1:1) с получением 2(R)-(4-циклопропилсульфанилфенил)-3-(2(S),3(S)дифенил-1,4-диоксаспиро[4.4]нон-7(R)-ил)-N-(2(R)-гидрокси-1(R)-метил-2-фенилэтил)-N-метилпропионамида: m/z (ES+) = 648,3 [M + H]+. Перемешиваемый раствор этого амида (30,7 г, 47,38 ммоль) в 1,4 диоксане (62 мл) разбавляли 4,5 M водной H2SO4 (61,5 мл) и полученную смесь нагревали при слабой дефлегмации в течение 18 ч. После охлаждения на льду добавляли воду (162 мл) и смесь экстрагировалиEtOAc (250 мл). Водный слой отделяли и дополнительно экстрагировали EtOAc (2150 мл) и объединенные органические фазы промывали водой (3200 мл), контролируя, чтобы значение рН конечной промывки было нейтральным, и рассолом (100 мл). После сушки (MgSO4) и фильтрации растворитель удаляли и остаток очищали с помощью флэш-хроматографии (CH2Cl2, затем CH2Cl2-THF, изменяя соотношение с 5:1 до 3:1) с получением указанного в заголовке соединения: m/z (ES+) = 305,1 [M + H]+. Подготовительный пример 6 д. 2(R)-(4-Циклопропансульфонилфенил)-3-(3(R)-оксоциклопентил) пропионовая кислота. Перемешиваемый раствор 2(R)-(4-циклопропилсульфанилфенил)-3-(3(S)-оксоциклопентил)пропионовой кислоты (подготовительный пример 6 г, 5,0 г, 16,43 ммоль) в CH2Cl2 (250 мл) охлаждали до 1 С на льду и порциями добавляли 70% mCPBA (8,099 г, 32,85 ммоль), поддерживая температуру ниже 3C. Через 6 ч растворитель удаляли и остаток очищали с помощью флэш-хроматографии (1% AcOH вCH2Cl2, затем THF) с получением указанного в заголовке соединения: m/z (ES+) = 337,1 [M + H]+. Подготовительные примеры 15-17. Промежуточные соединения формулы IV, необходимые для синтеза в примерах 4-6, могут быть получены с использованием следующих общепринятых способов. При необходимости любые функциональные группы в промежуточных соединениях, например оксо- или гидроксигруппы в соединениях формулы II, могут быть защищены и защитные группы могут быть удалены с использованием обычных способов. Способ A. LDA (24 мл 1,8 M раствора в h-C7H16-THF-PhEt, 43,3 ммоль) добавляют по каплям к перемешиваемому раствору DMPU (19 мл, 153,0 ммоль) в безводном THF (100 мл) при -78 С. Через 30 мин добавляют по каплям раствор подходящего эфира фенилуксусной кислоты III (20,6 ммоль) в безводномTHF (42 мл). Данную смесь дополнительно перемешивают в течение 1 ч, затем обрабатывают путем введения по каплям раствора альдегида II или его защищенного производного (20,6 ммоль) в безводномTHF (25 мл). После того, как реакции позволили нагреться до 20C в течение 16 ч, ее гасят насыщенным водным NH4Cl (210 мл). THF удаляют при пониженном давлении, остаток затем экстрагируют EtOAc(3250 мл). Объединенные EtOAc экстракты сушат (MgSO4), фильтруют и концентрируют. После колоночной хроматографии получают акрилатэтиловый эфир. Этот эфир омыляют, например, путем нагревания раствора этого эфира (19,1 ммоль) в MeOH (30 мл) и 1 M NaOH (40 мл, 40,0 ммоль) при температуре дефлегмации в течение 1 ч. После охлаждения смесь промывают EtOAc. Водную фазу подкисляют 1 MHCl, затем экстрагируют EtOAc. Объединенные органические экстракты сушат (MgSO4). В результате фильтрации и выпаривания растворителя получают желаемую (E)-акриловую кислоту. Способ Б. NaOEt (0,63 мл 0,5 M раствора в EtOH, 0,32 ммоль) по каплям добавляют к перемешиваемому раствору эфира фенилуксусной кислоты III (3,16 ммоль) и альдегида Il или его защищенного производного (3,47 ммоль) в безводном DMSO (3 мл). Смесь нагревают при 80C в течение 16 ч перед обработкой AcOH с целью доведения рН до 7. Добавляют EtOAc (30 мл), затем раствор промывают Н 2 О(210 мл) и рассолом (10 мл) перед тем, как сушить (MgSO4). В результате фильтрации, выпаривания растворителя и колоночной хроматографии получают акрилатэтиловый эфир. Данный эфир омыляют,как описано выше в Способе А, с получением (Е)-акриловой кислоты.- 13012204 Примеры Следующие соединения могут быть получены с использованием описанных ниже общепринятых способов.(882 мг, 10,6 ммоль) при 0C. Через 10 минут добавляют подходящее соединение формулы IV или VIII(9,0 ммоль), затем данную смесь перемешивают при 0C в течение 20 мин и затем при 20C в течение 30 мин. Гидрохлорид 5-фтортиазол-2-иламина (933 мг, 9,3 ммоль) и пиридин (2,2 мл, 18,8 ммоль) добавляют при 0C, затем данную смесь перемешивают при 20C в течение 20 ч. После выпаривания растворителя остаток разделяют между 5%-ной водной лимонной кислотой (100 мл) и EtOAc (500 мл). Водный слой дополнительно экстрагируют EtOAc (200 мл), затем объединенные органические слои промываютH2O и рассолом, затем сушат (Na2SO4), фильтруют и концентрируют под вакуумом. В результате хроматографической очистки (CHCl3-MeOH, 99:1) остатка на Chromatorex NH-DM1020 (Fuji Silysia Chemical,Ltd., Aichi-ken, Япония; см. также http://www.fuji-silysia.co.jp/e-fl100dx.htm) получают желаемое соединение. Способ Г. EDCI (80 мг, 420 мкмоль) и HOBt (56 мг, 420 мкмоль) добавляют к перемешиваемому раствору подходящего соединения формулы IV или VIII (320 мкмоль) в безводном DMF (6 мл). Через 15 мин раствор обрабатывают гидрохлоридом 5-фтортиазол-2-иламина (38 мг, 380 мкмоль) и пиридином(61 мкл, 760 мкмоль). Данную смесь перемешивают при 20C в течение 16 ч, затем концентрируют при пониженном давлении. Остаток разделяют между CH2Cl2 и насыщенным водным Na2CO3. Органический- 15012204 слой промывают 1 M HCl и сушат (MgSO4). В результате фильтрации и выпаривания растворителя получают желаемое соединение, которое в том случае, если оно представляет собой рацемат, может быть разделено с помощью HPLC с хиральной стационарной фазой. Способ: CHIRAL CEL OJ (Daicel ChemicalIndustries, Ltd., Токио, Япония), 10 см 25 см, MeOH (100%), 189 мл/мин, УФ 285 нм, 25 С. Способ Д. Оксалилхлорид (0,23 мл, 0,47 ммоль) добавляют к перемешиваемому раствору подходящего соединения формулы IV или VIII (0,42 ммоль) в безводном CH2Cl2 (6 мл) при 0C. Добавляют безводный DMF (50 мкл), затем смесь перемешивают при 0C в течение 2 ч. Добавляют 5-фтортиазол-2 иламин (151 мг, 1,28 ммоль; полученный путем распределения гидрохлоридной соли между Et2O и насыщенным водным Na2CO3, отделения Et2O слоя, сушки (MgSO4) и выпаривания растворителя) и пиридин (69 мкл, 0,85 ммоль), затем данную смесь перемешивают при 0-5C в течение 16 ч, затем в конце концов позволяют ей нагреться до 20 С и разбавляют EtOAc (45 мл). Данный раствор промывают 1 MHCl (220 мл) и насыщенным водным Na2CO3 (220 мл), затем сушат (MgSO4), фильтруют и концентрируют. В результате очистки с помощью хроматографии получают желаемое соединение. Соединение из примера 7, 2(R)-2-(4-циклопропансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-R)-3 оксоциклопентил)пропионамид, получали следующим образом. Раствор 2(R)-(4-циклопропансульфонилфенил)-3-(3(R)-оксоциклопентил)пропионовой кислоты(подготовительный пример 6 д, 893 мг, 2,65 ммоль) в безводном CH2Cl2 (38 мл) охлаждали до 0C и раствор оксалилхлорида (0,408 г, 3,21 ммоль) в безводном CH2Cl2 (2 мл) добавляли по каплям, поддерживая во время добавления температуру 0C. Добавляли сухой DMF (0,08 мл) и реакционную смесь перемешивали в течение 2,5 ч. Медленно вводили раствор 2-амино-5-фтортиазола (подготовительный пример 1,345 мг, 2,92 ммоль) в безводном CH2Cl2 (6 мл), после чего следовало введение пиридина (0,53 мл, 5,31 ммоль), и данную смесь перемешивали при 0C в течение 2 ч, затем при комнатной температуре в течение ночи. Данный раствор разбавляли CH2Cl2 (150 мл) и промывали водной 5% мас./об. лимонной кислотой (230 мл), насыщенным водным NaHCO3 (230 мл), водой (50 мл) и рассолом (50 мл). Органическую фазу сушили (MgSO4), упаривали и остаток очищали с помощью флэш-хроматографии (IH-EtOAc, 3:2) с получением указанного в заголовке соединения: RT = 3,47 мин; m/z (ES+) = 437,1 [M + H]+. Анализы Активность GK in vitro. Используя протокол, аналогичный протоколу, описанному в WO2000/58293, активность GK может быть проанализирована путем сопряжения продукции G6P при действии GST-GK с образованиемNADPH при действии G6PDH в качестве фермента, обеспечивающего данное сопряжение. Анализ GK осуществляют при 30C в плоскодонном 96-луночном планшете для анализа от Costar в конечном инкубационном объеме 100 мкл. Буфер для анализа содержит: 25 мМ Hepes (гидроксиэтилпиперазин-N-2-этансульфоновая кислота)-буфер (рН 7,4), 12,5 мМ KCl, 5 мМ D-Glc, 5 мМ ATP, 6,25 мМNADP, 25 мМ MgCl2, 1 мМ дитиотреитол, тестируемое соединение или 5% DMSO, 3,0 единицы/млG6PDH и 0,4 мкл/мл GST-GK, полученного из GK печени человека. ATP, G6PDH и NADP могут быть приобретены в Roche Diagnostics. Другие реагенты имеют чистоту 98% и могут быть приобретены вKanto Chemicals. Тестируемые соединения растворяют в DMSO перед их добавлением к буферу для анализа без ATP. Данную смесь предварительно инкубируют в камере с регулируемой температурой спектрофотометра для микропланшетов SPECTRAmax 250 (Molecular Devices Corporation, Sunnyvale, CA) в течение 10 минут, затем реакцию запускают путем добавления 10 мкл раствора ATP. После начала реакции в качестве критерия активности GK контролируют увеличение оптической плотности (OD) при 340 нм в течение 10 мин периода инкубации. GST-GK добавляют в количестве, достаточном для того, чтобы вызывать увеличение OD340 в течение 10 мин периода инкубации в лунках, содержащих 5% DMSO, но не тестируемое соединение. В предварительных экспериментах было установлено, что реакция с GK является линейной в течение данного периода времени, даже в присутствии активаторов, которые вызывают 8-кратное увеличение активности GK. Активность GK в контрольных лунках сравнивают с активностью в лунках, содержащих тестируемые активаторы GK. Рассчитывают концентрации соединения, которые вызывают 50%-ное увеличение активности GK (т.е. FA 1,5). Активаторы GK достигают FA 1,5 при 30 мкМ. Используя ряд разведений тестируемого соединения наряду с концентрацией тестируемого соединения, которая вызывает 50%-ную активацию (ЕС 50) можно рассчитать максимальное увеличение активности GK. Соединение из примера 7 вызывало более чем 4-кратную максимальную активацию GK и имело ЕС 500,5 мкМ. Активность GK in vivo. После 18 ч периода голодания мышам C57BL/6J перорально через желудочный зонд вводят активатор GK в количестве 50 мг/кг массы тела. Измерения уровня глюкозы в крови осуществляют 5 раз в течение 6 ч периода исследований после введения дозы. Мышей (n = 5) взвешивают и выдерживают без пищи в течение 18 ч перед пероральной обработкой. Активаторы GK растворяют в носителе Gelucire, описанном в WO 00/58293 (EtOH:Gelucire, 44/14:- 16012204 7,5 мл препарата на кг массы тела, что соответствует дозе 50 мг/кг. Непосредственно перед введением дозы осуществляют преддозовое (нулевой момент времени) измерение уровня Glc в крови путем отрезания у животных небольшой части хвостов (1 мм) и отбора 15 мкл крови для анализа. После обработки активаторами GK осуществляют дополнительные измерения уровня Glc в крови через 1, 2, 4, и 6 ч после введения дозы из той же самой раны в хвосте. Результаты интерпретируют путем сравнения средних значений уровней Glc в крови у 5 мышей, обработанных носителем, и 5 мышей, обработанных активатором GK, в течение 6 ч исследования. Соединения считаются активными, если они проявляют статистически достоверное уменьшение уровня Glc в крови по сравнению с носителем в 2 последующих момента времени, в которые осуществляют анализ. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его фармацевтически приемлемая соль, где группа, образованная -НС и V, представляет собой 3-оксоциклопентил, 4-оксоциклогексил или 3 гидроксициклопентил;R3 представляет собой С 1-4 алкильную группу, С 3-7 циклоалкильную группу или арильную группу;m равно 0 или 1; и пунктирная линия вместе со сплошной линией обозначает возможную двойную связь, ипоказывает, что эта двойная связь имеет (E)-конфигурацию. 2. Соединение по п.1 или его фармацевтически приемлемая соль, где пунктирная линия вместе со сплошной линией обозначает двойную связь. 3. Соединение по п.1 или его фармацевтически приемлемая соль, где пунктирная линия вместе со сплошной линией обозначает простую связь. 4. Соединение по п.3 или его фармацевтически приемлемая соль, где пунктирная линия вместе со сплошной линией обозначает простую связь и абсолютная конфигурация у ассиметрического центраотносительно карбонильного углерода амида представляет собой (R)-конфигурацию. 5. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, где m равно 0. 6. Соединение по любому из пп.1-5 или его фармацевтически приемлемая соль, где R3 представляет собой С 1-4 алкил или С 3-7 циклоалкил. 7. Соединение по любому из пп.1-6 или его фармацевтически приемлемая соль, где R1 представляет собой SO2C3-4 циклоалкил. 8. Соединение, выбранное из 2(R)-2-(3-хлор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-R)-3 оксоциклопентил)пропионамида; 2(R)-2-(3-хлор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(4 оксоциклогексил)пропионамида; 2(R)-2-(3-хлор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(3 гидроксициклопентил)пропионамида;- 17012204 2(R)-2-(4-циклобутансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(4 оксоциклогексил)пропионамида; 2(R)-2-(4-циклобутансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(3 гидроксициклопентил)пропионамида; 2(R)-2-(3-фтор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-R)-3 оксоциклопентил)пропионамида; 2(R)-2-(3-фтор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(4 оксоциклогексил)пропионамида и 2(R)-2-(3-фтор-4-метансульфонилфенил)-N-(5-фтортиазол-2-ил)-3-(3 гидроксициклопентил)пропионамида,или фармацевтически приемлемая соль любого из них. 9. Фармацевтическая композиция, содержащая соединение по любому из пп.1-8 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. 10. Способ профилактического или терапевтического лечения состояния, где требуется активацияGK, включающий стадию введения эффективного количества соединения по любому из пп.1-8 или его фармацевтически приемлемой соли. 11. Способ профилактического или терапевтического лечения гипергликемии или диабета, включающий стадию введения эффективного количества соединения по любому из пп.1-8 или его фармацевтически приемлемой соли. 12. Способ по п.11, где соединение по любому из пп.1-8 вводят в комбинации с одним или более другими антигипергликемическими агентами или противодиабетическими агентами. 13. Способ предупреждения диабета у человека, у которого наблюдается преддиабетическая гипергликемия или нарушение толерантности к глюкозе, включающий стадию введения эффективного профилактического количества соединения по любому из пп.1-8 или его фармацевтически приемлемой соли. 14. Способ получения соединения формулы (Ia) или его фармацевтически приемлемой соли, включающий конденсацию соединения формулы (IV) или его солью, где V, R1, R2, m итакие, как определено в п.1. 15. Способ получения соединения формулы (Ib) включающий конденсацию соединения формулы (VIII) или его солью, где V, R1, R2 и m такие, как определено в п.1. 16. Соединение формулы IV, как оно определено в п.14, где группа, образованная -НС и V, представляет собой оксоциклоалкил или гидроксициклоалкил;R3 представляет собой C1-3 алкильную группу, С 3-7 циклоалкильную группу или 4-6-членную гетероциклическую группу;m равно 0; ипоказывает, что двойная связь имеет (E)-конфигурацию. 17. Соединение формулы VIII, как оно определено в п.15, где группа, образованная -НС и V,представляет собой оксоциклоалкил или гидроксициклоалкил;
МПК / Метки
МПК: A61K 31/427, C07D 277/46, A61P 3/10
Метки: соединения, амидные, три(цикло)замещённые
Код ссылки
<a href="https://eas.patents.su/20-12204-triciklozameshhyonnye-amidnye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Три(цикло)замещённые амидные соединения</a>
Предыдущий патент: Замещенные производные тетрациклина, фармацевтическая композиция и способ лечения субъекта с их использованием
Следующий патент: Гидрогелевые препараты интерферона
Случайный патент: Крышка












