Ингибиторы 17α-гидроксилазы/c17,20-лиазы
Номер патента: 23064
Опубликовано: 29.04.2016
Авторы: Гуммади Венкатешвар Рао, Сенгупта Саумитра, Бок Марк Гари, Гауль Кристоф
Формула / Реферат
1. Соединение формулы (I)
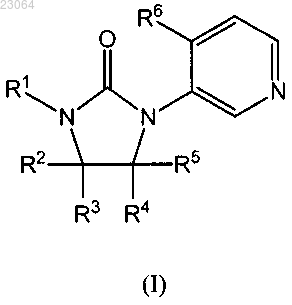
в которой R1 представляет собой фенил, 4-хлор-3-фторфенил, м-толил, 3-метоксифенил, 3-хлор-4-фторфенил, 4-фтор-3-метилфенил, 3-трифторметилфенил, 3-хлорфенил, 4-фтор-3-трифторметилфенил, 3-дифторметил-4-фторфенил, 3-циано-4-фторфенил, 3-цианофенил, 3-хлор-4-цианофенил, 3,4-дифторфенил, 4-трифторметилфенил, нафталин-2-ил, бензо[b]тиофен-5-ил, 3-метилбензо[b]тиофен-5-ил, 2-фтор-3-метилбензо[b]тиофен-5-ил, 3-трифторметилбензо[b]тиофен-5-ил, 2-фторбензо[b]тиофен-5-ил, 2-хлорбензо[b]тиофен-5-ил, бензо[b]тиофен-6-ил, 2-фторбензо[b]тиофен-6-ил, 3-метилбензо[b]тиофен-6-ил, 4-фторбензо[b]тиофен-6-ил, 5-фтор-3-метилбензо[b]тиофен-6-ил, 3-метилбензо[b]изоксазол-5-ил, 1H-индазол-5-ил, 1-метил-1H-индазол-5-ил, 3-амино-1H-индазол-5-ил, 1H-индазол-6-ил, 3-амино-1H-индазол-6-ил, 3-метил-1H-индазол-6-ил, 3-трифторметил-1H-индазол-6-ил, бензотиазол-6-ил, 1,2-дигидро-3-оксоиндазол-6-ил, индан-5-ил, 1H-бензотриазол-5-ил, 3-метилбензофуран-5-ил, 2,3-дигидробензо[1,4]диоксин-6-ил, 2,3-дигидробензофуран-5-ил, 2,2-дифторбензо[1,3]диоксол-5-ил, 5-метилтиофен-2-ил, 5-хлортиофен-2-ил, 5-фторбензо[b]тиофен-2-ил, 5-трифторметилтиофен-2-ил, 5-дифторметилтиофен-3-ил, 5-метилтиофен-3-ил, 2-метилпиридин-4-ил, 2-трифторметилпиридин-4-ил, 4-трифторметилпиридин-2-ил, 2-хлорпиридин-4-ил, 2-метоксипиридин-4-ил, 6-хлорпиримидин-4-ил, 6-хлор-2-метилпиримидин-4-ил, 2-трифторметилпиримидин-4-ил, 4-трифторметилпиримидин-2-ил, 2-хлор-6-(трифторметил)пиридин-4-ил, 6-циклопропилпиримидин-4-ил, 2-циклопропилпиридин-4-ил, 5-фтор-4-метилпиридин-2-ил, 2-циклопропилпиримидин-4-ил, 6-хлор-2-(трифторметил)пиримидин-4-ил, 2,6-дихлорпиридин-4-ил, 2-хлор-6-циклопропилпиридин-4-ил, 2-циклопропил-6-(трифторметил)пиридин-4-ил или 2,6-бис(трифторметил)пиридин-4-ил;
R2 и R5 представляют собой, каждый независимо, CH3 или H;
R3 и R4 представляют собой, каждый независимо, CH3 или H, или R3 и R4, взятые вместе с атомами углерода, к которым они присоединены, образуют циклопропил; и
R6 представляет собой циклопропил;
или их фармацевтически приемлемые соли.
2. Соединение по п.1, где соединением формулы (I) является соединение формулы (III)
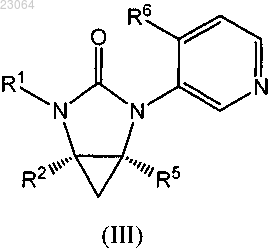
в которой R1, R2, R5 и R6 имеют значения, указанные в п.1;
или его фармацевтически приемлемая соль.
3. Соединение, выбранное из группы, включающей в себя
1-(2-хлорпиридин-4-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(2-(трифторметил)пиридин-4-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(нафталин-2-ил)имидазолидин-2-он;
1-(бензо[b]тиофен-5-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2 -он;
1-(4-циклопропилпиридин-3-ил)-3-(3-(трифторметил)фенил)имидазолидин-2-он;
1-(бензо[b]тиофен-2-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-он;
1-(6-хлор-2-метилпиримидин-4-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(4-(трифторметил)пиридин-2-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(2-метоксипиридин-4-ил)имидазолидин-2-он;
1-(6-хлорпиримидин-4-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(4-(трифторметил)пиримидин-2-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(2-(трифторметил)пиримидин-4-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(3-(трифторметил)бензо[b]тиофен-5-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(2-фторбензо[b]тиофен-5-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(3-метилбензо[b]тиофен-5-ил)имидазолидин-2-он;
1-(бензо[b]тиофен-6-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(2,2-дифторбензо[d][1,3]диоксол-5-ил)имидазолидин-2-он,
1-(4-циклопропилпиридин-3-ил)-3-(3-метилбензо[b]тиофен-6-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(3-метилбензофуран-5-ил)имидазолидин-2-он;
1-(2-хлорбензо[b]тиофен-5-ил)-3-(4-циклопропилпиридин-3-ил) имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(2,3-дигидро-1H-инден-5-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(5-фторбензо[b]тиофен-2-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(3-(трифторметил)бензо[b]тиофен-6-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(2-фтор-3-метилбензо[b]тиофен-5-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3 -(2-фторбензо[b]тиофен-6-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(4-фторбензо[b]тиофен-6-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(5-фторбензо[b]тиофен-6-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(6-фторбензо[b]тиофен-5-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(5-фтор-3-метилбензо[b]тиофен-6-ил)имидазолидин-2-он;
1-(2-хлорпиридин-4-ил)-3-[4-(1-гидроксициклобутил)пиридин-3-ил]имидазолидин-2-он;
1-(2-хлорпиридин-4-ил)-3-(4-циклопентилпиридин-3-ил)имидазолидин-2-он;
1-(2-хлорпиридин-4-ил)-3-[4-(1-гидроксициклопентил)пиридин-3-ил]имидазолидин-2-он;
1-[4-(1-гидроксициклопропил)пиридин-3-ил]-3-(3-трифторметилфенил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(6-циклопропилпиримидин-4-ил)имидазолидин-2 -он;
1-(4-циклопропилпиридин-3-ил)-3-(2-циклопропилпиридин-4-ил)имидазолидин-2 -он;
1-(4-циклопропилпиридин-3-ил)-3-(5-фтор-4-метилпиридин-2-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(2-циклопропилпиримидин-4-ил)имидазолидин-2-он;
1-(6-хлор-2-(трифторметил)пиримидин-4-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2 -он;
1-(4-циклопропилпиридин-3-ил)-3-(2,6-дихлорпиридин-4-ил)имидазолидин-2-он;
1-(2-хлор-6-циклопропилпиридин-4-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-он;
1-(2-циклопропил-6-(трифторметил)пиридин-4-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-он и
1-(2,6-бис(трифторметил)пиридин-4-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-он;
или его фармацевтически приемлемая соль.
4. Соединение, выбранное из группы, включающей в себя
1-(2-хлорпиридин-4-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(2-(трифторметил)пиридин-4-ил)имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(3-(трифторметил)фенил)имидазолидин-2-он;
1-(2-хлорпиридин-4-ил)-3-[4-(1-гидроксициклобутил)пиридин-3-ил]имидазолидин-2-он;
1-(6-хлор-2-метилпиримидин-4-ил)-3-(4-циклопропилпиридин-3-ил) имидазолидин-2-он;
1-(4-циклопропилпиридин-3-ил)-3-(2-метоксипиридин-4-ил)имидазолидин-2-он;
(1R,5S)-2-(4-циклопропилпиридин-3-ил)-4-(2-(трифторметил)пиридин-4-ил)-2,4-диазабицикло[3.1.0]гексан-3-он;
(1S,5R)-2-(2-хлорпиридин-4-ил)-4-(4-циклопропилпиридин-3-ил)-2,4-диазабицикло[3.1.0]гексан-3-он;
(1R,5S)-2-(4-циклопропилпиридин-3-ил)-4-(2-метоксипиридин-4-ил)-2,4-диазабицикло[3.1.0]гексан-3-он;
1-(2-хлор-6-(трифторметил)пиридин-4-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-он;
1-(6-хлор-2-(трифторметил)пиримидин-4-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2 -он;
1-(4-циклопропилпиридин-3-ил)-3-(2,6-дихлорпиридин-4-ил)имидазолидин-2-он;
1-(2-хлор-6-циклопропилпиридин-4-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-он;
1-(2-циклопропил-6-(трифторметил)пиридин-4-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-он и
1-(2,6-бис(трифторметил)пиридин-4-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-он;
или его фармацевтически приемлемая соль.
5. Соединение, выбранное из группы, включающей в себя
(1S,5R)-2-(4-циклопропилпиридин-3-ил)-4-(2-(трифторметил)пиридин-4-ил)-2,4-диазабицикло[3.1.0]гексан-3-он;
(1R,5S)-2-(4-циклопропилпиридин-3-ил)-4-(2-(трифторметил)пиридин-4-ил)-2,4-диазабицикло[3.1.0]гексан-3-он;
(1S,5R)-2-(2-хлорпиридин-4-ил)-4-(4-циклопропилпиридин-3-ил)-2,4-диазабицикло[3.1.0]гексан-3-он;
(1R,5S)-2-(2-хлорпиридин-4-ил)-4-(4-циклопропилпиридин-3-ил)-2,4-диазабицикло[3.1.0]гексан-3-он;
(1S,5R)-2-(4-циклопропилпиридин-3-ил)-4-(2-метоксипиридин-4-ил)-2,4-диазабицикло[3.1.0]гексан-3-он и
(1R,5S)-2-(4-циклопропилпиридин-3-ил)-4-(2-метоксипиридин-4-ил)-2,4-диазабицикло[3.1.0]гексан-3-он,
или его фармацевтически приемлемая соль.
6. Фармацевтическая композиция для лечения рака простаты, содержащая соединение по пп.3-5 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или наполнитель.
7. Способ лечения рака простаты, включающий стадию введения соединения по пп. 3-5 субъекту, нуждающемуся в таком лечении.
Текст
Изобретение относится к соединениям формулы (I) или их фармацевтически приемлемым солям,у которых R1, R2, R3, R4, R5 и R6 имеют значения, указанные в контексте описания. Обнаружено,что соединения настоящего изобретения являются применимыми в качестве ингибиторов 17 гидроксилазы/C17,20-лиазы. Бок Марк Гари (US), Гауль Кристоф Область техники, к которой относится изобретения Изобретение относится к циклическим производным мочевины и их применению для лечения рака простаты посредством регуляции 17-гидроксилазы/С 17,20-лиазы. Уровень техники Число людей, у которых диагностирован рак, во всем мире значительно увеличивалось и продолжает увеличиваться с тревожной скоростью. Рак характеризуется увеличением числа аномальных клеток,происходящих из данной нормальной ткани, инвазией соседних тканей этими аномальными клетками или лимфатическим или гематогенным распространением злокачественных клеток к региональным лимфатическим узлам и отдаленным местам (т.е. метастазом). Особый интерес представляют индивидуумы, у которых диагностированы андрогензависимые нарушения, такие как рак простаты, эстрогензависимые нарушения (такие как рак молочной железы, матки и яичников), синдром Кушинга, синдром поликистоза яичников (PCOS) и альдопродуцирующая аденома(АРА). Рак простаты в настоящее время является наиболее обычным некожным раком и второй основной причиной связанной с раком смерти у людей после рака легких. Основным курсом лечения пациентов, у которых диагностирован ограниченный органом рак простаты, обычно является простатэктомия или радиотерапия. Эти лечения рака простаты и молочной железы являются очень инвазивными и характеризуются нежелательными и серьезными побочными действиями. Кроме того, большой процент индивидуумов, которые получают локализованные лечения, такие как хирургия или радиотерапия, могут страдать рецидивирующим раком и широко распространенными метастазами. Как и в случае хирургии и радиационных терапий, у химиотерапии имеется несколько недостатков, включающих в себя тот факт, что почти все химиотерапевтические агенты являются токсичными и химиотерапия вызывает значительные и часто опасные побочные действия, такие как выраженная тошнота, подавление деятельности костного мозга и иммуносупрессия. Кроме того, многие опухолевые клетки являются резистентными или становятся резистентными к химиотерапевтическим агентам вследствие резистентности ко многим лекарственным средствам. Такое лечение, как гормональная терапия, является другим вариантом для индивидуумов, у которых диагностированы гормонзависимые, гормонвосприимчивые или гормончувствительные раковые заболевания, такие как рак простаты или молочной железы. Однако некоторые индивидуумы, которым проводили лечения современной гормональной терапией, могут не проявлять значительную восприимчивость к таким лечениям и некоторые могут страдать рецидивом рака. В настоящее время пациенты с химиорезистентным и гормонорезистентным раком остаются с очень малыми возможностями выбора лечения и поэтому сохраняется неудовлетворенная потребность в более эффективных путях лечения рака, такого как, но без ограничения указанным, рак простаты и рак молочной железы. Открытие, сделанное Huggins и Hodges C.V. (Cancer Res., 1941, 1, 293) и Huggins et al in Arch. Surg.,1941, 43, 209, привело к тому, что удаление андрогена считают как возможный подход к лечению. Было показано, что уровни тестостерона снижаются орхиэктомией или введением аналогов GnRH (гонадотропинвысвобождающих гормонов гипоталмуса). Аналоги GnRH могут иметь побочные действия, такие как сердечно-сосудистая дегенерация и остеопороз, которые являются двумя наиболее потенциально серьезными состояниями, индуцированными постоянным присутствием GnRH. Кроме того, эти варианты лечения только устраняют продуцирование тестостерона из яичек и не устраняют тестостерон, продуцированный надпочечниками. В надпочечниках биосинтетический путь также приводит к образованию глюко- и минералокортикоидов. Поскольку андроген и эстроген являются гормонами, имеющими различные физиологические активности, такие как дифференциация и пролиферация клеток и тому подобное, полагали, что сильнодействующие и специфические соединения, которые ингибируют синтез андрогена в яичках, надпочечниках и другой ткани, могут быть более эффективными для лечения PCa (Njar, V. С. О.; Brodie, A. M. H., "Inhibitors of 17-hydroxylase-C17,20-lyase (CYP17): Potential agents for the treatment of prostate cancer", CurrentPharm. Design, 1999, 5: 163-180). Для устранения нежелательных побочных действий, ингибиторы биосинтеза андрогена должны быть достаточно специфическими, чтобы не влиять на биосинтез кортикостероидов. Перспективной новой стратегией для лечения рака простаты является разработка сильнодействующих и селективных ингибиторов CYP 17, поскольку это может привести к полному и особому устранению биосинтеза андрогена,предполагаемому в Current Medicinal Chemistry, 2005,72, 1623-1629. Соединения типа стероидов и соединения нестероидного типа уже известны в качестве ингибиторов стероид-C17,20-лиазы. Соединения типа стероидов описаны, например, в WO 92/15404, WO 93/20097,ЕР-А 288053, ЕР-А 413270 и подобных публикациях. Соединения нестероидного типа списаны, например, в WO 94/27989, WO96/14090 и WO97/00257, производные азола описаны в WO95/09157, производные 1 Н-бензимидазола описаны в патенте США 5491161, производные дигидронафталина описаны вWO99/18075 и производные нафталина описаны в WO99/54309. Описаны различные сильнодействующие стероидные и нестероидные ингибиторы CYP17 и показано, что некоторые являются сильнодействующими ингибиторами продуцирования тестостерона в моделях грызунов (Njar and Brodie, см. выше). Jarman и его коллеги описали гормональное действие их наиболее сильнодействующего ингибитора CYP17, абиратерона, у пациентов с раком простаты (O'Donnell etwith prostate cancer", Br. J. Cancer, 2004, 90: 2317-2325). Действие абиратерона на пациентов обсуждалось,например, в WO 200900132, WO 2008024485, WO 2006021776, WO 09509178, WO 09320097. Нестероидные ингибиторы в виде малых молекул описаны, например, в ВМС 2004,12,(4313),YM116, 2-(1 Н-имидазол-4-илметил)-9 Н-карбазол, и его действия по снижении синтеза андрогена надпочечников ингибированием активности С 17-20-лиазы в клетках адренокортикальной карциномы NCI-H295 человека описаны Ideyama Y, Kudoh M, Tanimoto K, Susaki Y, Nanya T, Nakahara T, Ishikawa H, FujikuraT, Akaza H, Shikama H в "Jpn. J. Pharmacol., 1999, 79:No. 2(213-20)". Новый нестероидный ингибитор цитохрома Р 450 (17-гидроксилазы/С 17-20-лиазы), YMl16, и его роль в уменьшении простатических масс снижением концентрации тестостерона и андрогенов надпочечников в сыворотке крови крыс описалиT, Shikama H в Proc. Am. Assoc. Cancer Res., 1998, 39:89 Meet. (384). Синтез и биологическую оценку новых нестероидных ингибиторов стероид-17,20-лиазы описаныYoden T, Okada M, Kawaminami E, Kinoyama I, Ideyama Y, Isomura Y в Abstr. Pap. Am. Chem. Soc., 1997,213 Meet.:Pt. 2 (MEDI206). Дополнительной иллюстрацией предпосылки создания изобретения являются заявки на патенты,такие как US 20080280864A1 или WO 28154382A1. Сущность изобретения Было показано, что соединения, описанные в контексте, являются ингибиторами 17 гидроксилазы/17C17,20-лиазы. Один вариант осуществления настоящего изобретения относится к соединениям формулы (I)R6 представляет собой циклопропил, или их фармацевтически приемлемые соли. В другом конкретном варианте осуществления каждый из R2, R3, R4 и R5 представляет собой H. Еше в одном варианте осуществления предложены соединения формулы (III) в которой R1, R2, R5 и R6 имеют значения, указанные выше; или их фармацевтически приемлемые соли. В одном конкретном варианте осуществления (для любого из соединений или вариантов осуществления, описанных выше) R1 представляет собой фенил, 4-хлор-3-фторфенил, м-толил, 3-метоксифенил, 3 хлор-4-фторфенил, 4-фтор-3-метилфенил, 3-трифторметилфенил, 3-хлорфенил, 4-фтор-3-трифторметилфенил, 3-дифторметил-4-фторфенил, 3-циано-4-фторфенил, 3-цианофенил, 3-хлор-4-цианофенил,3,4-дифторфенил, 4-трифторметилфенил; или их фармацевтически приемлемые соли. В другом конкретном варианте осуществления (для любого из соединений или вариантов осуществления, описанных выше), R1 представляет собой нафталин-2-ил, бензо[b]тиофен-5-ил, 3-метилбензо[d]изоксазол-5-ил, 1H-индазол-5-ил, 1-метил-1H-индазол-5-ил, 3-амино-1H-индазол-5-ил, 1H-индазол-6 ил, 3-амино-1H-индазол-6-ил, 3-метил-1H-индазол-6-ил, 3-трифторметил-1H-индазол-6-ил, бензотиазол 6-ил, 1,2-дигидро-3-оксоиндазол-6-ил, индан-5-ил, 1H-бензотриазсл-5-ил, 3-метилбензофуран-5-ил, 2,3 дигидробензо[1,4]диоксин-6-ил, 2,3-дигидробензофуран-5-ил или 2,2-дифторбензо[1,3]диоксол-5-ил; или его фармацевтически приемлемая соль. В еще одном конкретном варианте осуществления (для любого из соединений или вариантов осуществления, описанных выше) R1 представляет собой бензотиазол-6-ил, 3-метилбензофуран-5-ил, 1Hиндазол-6-ил, 3-метил-1H-индазол-6-ил или 3-трифторметил-1H-индазол-6-ил; или его фармацевтически приемлемая соль. В еще одном конкретном варианте осуществления (для любого из соединений или вариантов осуществления, описанных выше) R1 представляет собой 5-метилтиофен-2-ил, 5-хлортиофен-2-ил, 5 фторбензо[b]тиофен-2-ил, 5-трифторметилтиофен-2-ил, 5-дифторметилтиофен-3-ил, 5-метилтиофен-3 ил, 2-метилпиридин-4-ил, 2-трифторметилпиридин-4-ил, 4-трифторметилпиридин-2-ил, 2-хлорпиридин 4-ил, 2-метоксипиридин-4-ил, 6-хлорпиримидин-4-ил, 6-хлор-2-метилпиримидин-4-ил, 2-трифторметилпиримидин-4-ил, 4-трифторметилпиримидин-2-ил, 2-хлор-6-(трифторметил)пиридин-4-ил, 6 циклопропилпиримидин-4-ил, 2-циклопропилпиридин-4-ил, 5-фтор-4-метилпиридин-2-ил, 2-циклопропилпиримидин-4-ил, 6-хлор-2-(трифторметил)пиримидин-4-ил, 2,6-дихлорпиридин-4-ил, 2-хлор-6 циклопропилпиридин-4-ил, 2-циклопропил-6-(трифторметил)пиридин-4-ил или 2,6-бис(трифторметил) пиридин-4-ил. В еще одном конкретном варианте осуществления (для любого из соединений или вариантов осуществления, описанных выше) R1 представляет собой 5-метилтиофен-2-ил, 5-хлортиофен-2-ил, 5 фторбензо[b]тиофен-2-ил, 5-трифторметилтиофен-2-ил, 5-дифторметилтиофен-3-ил, 5-метилтиофен-3 ил, 2-метилпиридин-4-ил, 2-трифторметилпиридин-4-ил, 4-трифторметилпиридин-2-ил, 2-хлорпиридин 4-ил, 2-метоксипиридин-4-ил, 6-хлорпиримидин-4-ил, 6-хлор-2-метилпиримидин-4-ил, 2-трифторметилпиримидин-4-ил, 4-трифторметилпиримидин-2-ил или 2-хлор-6-(трифторметил)пиридин-4-ил; или его фармацевтически приемлемая соль. Репрезентативные соединения формулы (I), у которых каждый из R2, R3, R4 и R5 представляет собой или их фармацевтически приемлемые соли. Репрезентативные соединения формулы (II) или (III) включают в себя или их фармацевтически приемлемые соли. Соединения, представляющие особый интерес, включают в себя или их фармацевтически приемлемые соли. Другие соединения включают в себя соединения, описанные ниже в разделе примеров, в частности,такие соединения, имеющие IC50 меньше 1 мкМ (или 1000 нМ), предпочтительно меньше 500 нМ, более предпочтительно меньше 100 нМ. В другом аспекте настоящего изобретения предложена фармацевтическая композиция, которая содержит соединение формулы (I) или (III) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или наполнитель. В еще одном аспекте настоящего изобретения предложен способ лечения рака простаты, где способ содержит введение соединения согласно формуле (I) или (III) или фармацевтической композиции, содержащей соединение формулы (I) или (III) и фармацевтически приемлемые наполнители, субъекту, нуждающемуся в таком лечении. Определения Применяемый в контексте термин "алкил" относится к углеводородному радикалу общей формулыCnH2n+1. Радикал алкана может быть неразветвленным или разветвленным. Например, термин "(C1-C6) алкил" относится к одновалентной, неразветвленной или разветвленной алифатической группе, содержащей 1-6 атомов углерода (например, метилу, этилу, н-пропилу, изопропилу, н-бутилу, изобутилу,втор-бутилу, трет-бутилу, н-пентилу, 1-метилбутилу, 2-метилбутилу, 3-метилбутилу, неопентилу, 3,3 диметилпропилу, гексилу, 2-метилпентилу и тому подобному). Аналогично этому, алкильная часть (т.е. алкильный остаток) алкоксигруппы, ацила (например, алканоила), алкиламино-, диалкиламино- и алкилтиогруппы имеет такое же определение, как указано выше."Галогензамещенный алкил" относится к алкильной группе, которая имеет значение, указанное выше, замещенной по меньшей мере одним атомом галогена. Например, когда атомом галогена является фтор, обычно галогеналкильные группы включают в себя фторметил, дифторметил, трифторметил, 2,2,2 трифторэтил, 2,2,2,1,1-пентафторэтил и тому подобное. Включены также замещения алкила с разными атомами галогена (например, хлорфторметил). Термин "алкенил" относится к одновалентной группе, образованной из углеводорода, имеющего по меньшей мере одну углерод-углеродную двойную связь. Термин "C2-C6-алкенил" относится к одновалентной группе, образованной из углеводорода, имеющего от двух до шести атомов углерода и содержащего по меньшей мере одну углерод-углеродную двойную связь. Алкенильная группа могут быть неразветвленной или разветвленной. Репрезентативные примеры алкенила включают в себя винил, 1 пропенил, 2-пропенил, 1-метил-1-пропенил, 1-метил-2-пропенил, 2-метил-1-пропенил, 2-метил-2-7 023064 пропенил, 1-бутенил, 2-бутенил, 3-бутенил и так далее. Термин "алкинил" относится к одновалентной группе, образованной из углеводорода, имеющего по меньшей мере одну углерод-углеродную тройную связь. Термин "С 2-C6-алкинил" относится к одновалентной группе, образованной из углеводорода, имеющего от двух до шести атомов углерода и содержащего по меньшей мере одну углерод-углеродную тройную связь. Алкинильная группа может быть неразветвленной или разветвленной. Репрезентативные примеры включают в себя этинил, пропинил,бутин-1-ил, бутин-2-ил и так далее. Термин "гидроксизамещенный алкил" относится к алкильной группе, которая имеет значение, указанное выше, замещенной одной или несколькими гидроксильными (-OH) группами (например, -CH2OH,-CH(OH)2, -CH(OH)-CH2OH, -CH(OH)-CH3 и так далее). Алкильная группа предпочтительно замещена 1 или 2 гидроксильными группами, оолее предпочтительно одной гидроксильной группой. Термином "галоген" или "гало" может быть фтор, хлор, бром или иод (предпочтительными атомами галогена в качестве заместителей являются атомы фтора и хлора). Термин "оксо" или -С(O)- относится к карбонильной группе. Такую группу содержит, например,кетон, альдегид или она является частью кислотной, сложной эфирной, амидной, лактонной или лактамной группы. Термин "частично или полностью насыщенное карбоциклическое кольцо" (называемое также "частично или полностью насыщенным циклоалкилом") относится к неароматическим кольцам, которые являются либо полностью, либо частично гидрированными и могут существовать в виде одного копьца,бициклического кольца или спирокольца. Если не указано иначе, карбоциклическое кольцо обычно является 3-8-членным кольцом. Например, частично или полностью насыщенные карбоциклические кольца(или циклоалкилы) включают в себя такие группы, как циклопропил, циклопропенил, циклобутил, циклобутенил, циклопентил, циклопентенил, циклопентадиенил, циклогексил, циклогексенил, циклогексадиенил, норборнил (бицикло[2.2.1]гептил), норборненил, бицикло[2.2.2]октил и тому подобное. Когда группа является необязательно замещенной, она присоединена через карбоциклическое кольцо, а не через заместитель. Термин "частично насыщенное или полностью насыщенное гетероциклическое кольцо" (называемое также "частично насыщенным или полностью насыщенным гетероциклом") относится к неароматическим кольцам, которые являются либо частично, либо полностью гидрированными и могут существовать в виде одного кольца, бициклического кольцо или спирокольца. Если не указано иначе, гетероциклическое кольцо обычно является 3-6-членным кольцом, содержащим 1-3 гетероатома (предпочтительно 1 или 2 гетероатома), каждый из которых независимо выбран из атома серы, кислорода и/или азота. Частично насыщенные или полностью насыщенные гетероциклические кольца включают в себя такие группы, как эпоксигруппа, азиридинил, тетрагидрофуранил, дигидрофуранил, дигидропиридинил, пирролидинил, N-метилпирролидинил, имидазолидинил, имидазолинил, пиперидинил, пиперазинил, пиразолидинил, 2 Н-пиранил, 4 Н-пиранил, 2 Н-хроменил, оксазинил, морфолино, тиоморфолино, тетрагидротиенил, 1,1-диоксид тетрагидротиенила и тому подобное. Когда группа является необязательно замещенной,она присоединена через гетероциклическое кольцо, а не через заместитель. Если не указано иначе, гетероциклическое кольцо может быть присоединено посредством любого члена кольца с доступной валентностью (например, заменой H, присоединенного к гетероциклическому кольцу). Термин "конденсированный фенил" относится к фенильной группе, конденсированной с другим кольцом, таким как другой фенил (т.е. нафталину (например, нафталин-2-илу, нафталин-1-илу), частично или полностью насыщенный циклоалкил (например, индан-5-илу, 2,3-дигидро-1H-инденилу или тетрагидронафталинилу и т.д.), гетероарил (например, 1H-индол-5-илу, 1H-индол-6-илу, бензотиазол-5-илу,бензотиазол-6-илу, бензо[b]тиофен-5-илу, хинолин-6-илу, хинолин-7-иду, изохинолин-5-илу, изохинолин-6-илу, изохинолин-7-илу, изохинолин-8-илу, индазол-4-илу, индазол-5-илу, индазол-6-илу, лндазол 7-илу, бензофуран-4-илу, бензофуран-5-илу, бензофуран-6-илу, бензофуран-7-илу, бензимидазол-4-илу или хиноксалин-6-илу, бензооксазол-5-илу, бензо[d]изоксазол-5-илу, бензо[d]изоксазол-6-илу, 1Hбензоимидазол-4-илу, 1H-бензоимидазол-5-илу, 1H-бензоимидазол-6-илу, 1H-бензимидазол-7-илу, 1Hбензотриазол-5-илу и т.д.) или частично насыщенный или полностью насыщенный гетероцикл (например, индолин-4-илу, индолин-5-илу, индолин-6-илу, индолин-7-илу, 1,2-дигидрохинолин-6-илу, 1,2,3,4 тетрагидрохинолин-6-илу, 1,2,3,4-тетрагидрохинолин-7-илу, 2,3-дигидро-1H-бензо[d]имидазолилу, 2,3 дигидро-1H-индазолилу, 2,3-дигидробензо[d]оксазолилу, 2,3-дигидробензо[1,4]диоксин-6-илу, 2,3 дигидробензофуран-5-илу, бензо[1,3]диоксол-5-илу, 2,3-дигидро-1H-индазол-5-илу, 2,3-дигидро-1Hиндазол-6-илу и т.д.), где группа присоединена через один из атомов углерода фенила. Когда конденсированная фенильная группа является замещенной, она присоединена через фенил, а не через заместитель. Когда конденсированный фенил является замещенным, он может быть замещен у любого атома кольца с доступной валентностью (например, заменой атома H, присоединенного к конденсированному фенилу) в конденсированной системе. Например, бензофуранильная группа может быть замещена в фенильной или фуранильной части бензофуранильной группы. Термин "гетероарил" или "гетероароматическое кольцо" относится к ароматическим остаткам, содержащим по меньшей мере один гетероатом (например, атом кислорода, серы, азота или их комбина-8 023064 цию) в 5- или 6-членной ароматической циклической системе (например, пирролилу, пиридилу, пиразолилу, тиенилу, фуранилу, оксазолилу, имидазолилу, тетразолилу, триазинилу, пиримидилу, пиразинилу,тиазолилу, изотиазолилу и т.д.). Типичным одинарным гетероарильным кольцом обычно является 5-или 6-членное кольцо, содержащее от одного до трех гетероатомов, каждый из которых независимо выбран из атомов кислорода, серы и азота. Когда группа является необязательно замещенной, она присоединена через гетероарильное кольцо, а не через заместитель. Термин "конденсированный гетероарил" относится к гетероарильной группе, конденсированной с другим кольцом, таким как другой гетероарил (например, пуринилу, тиено[3,2-с]пиридинилу (например тиено[3,2-c]пиридин-2-илу и тиено[3,2-с]пиридин-3-илу), имидазо[1,2-а]пиридинилу (например имидазо[1,2-а]пиридин-3-илу, имидазо[1,2-а]пиридин-6-илу, имидазо[1,2-а]пиридин-7-илу и 3H-имидазо[4,5b]пиридин-6-илу) или бензо[b]тиофенилу и т.д.), фенил (например, бензо[b]тиофен-2-илу, бензо[b]тиофен-3-илу, хинолин-2-илу, хинолин-3-илу, бензоксазол-2-илу, бензотиазол-2-илу, 1H-индол-2 илу, 1H-индол-3-илу, изохинолин-1-илу, изохинолин-3-илу, изохинолин-4-илу, бензофуран-2-илу, бензофуран-3-илу, индазол-3-илу, бензимидазол-2-илу и т.д.), частично или полностью насыщенный циклоалкил (например, 4,5,6,7-тетрагидробензо[d]оксазолилу, 4,5,6,7-тетрагидро-1H-индолилу, 5,6,7,8 тетрагидрохинолинилу, 5,6,7,8-тетрагидроизохинолинилу, 4,5,6,7-тетрагидробензо[b]тиофенилу, 4,5,6,7 тетрагидробензофуранилу, 4,5,6,7-тетрагидро-1H-индазолилу, 4,5,6,7-тетрагидро-1H-бензо[d]имидазолилу или 4,5,6,7-тетрагидробензо[d]оксазолилу и т.д.), или частично насыщенный или полностью насыщенный гетероцикл (например, 8,9-дигидро-7 Н-пуринилу, 2,3-дигидротиено[3,2-c]пиридинилу, 4,5,6,7 тетрагидротиено[2,3-с]пиридин-2-илу,4,5,6,7-тетрапидротиено[3,2-c]пиридинилу или 5,6,7,8 тетрагидроимидазо[1,2-a]пиридинилу и т.д.), гдегетероарильная группа присоединена через один из атомов кольца с доступной валентность. Когда гетероарильная группа замещена, она присоединена через конденсированный гетероарил, а не через заместитель. Когда конденсированный гетероарил замещен, он может быть замещен у любого атома кольца с доступной валентностью (например, заменой атома H,присоединенного к конденсированному гетероарилу) в конденсированной циклической системе. Например, имидазо[1,2-а]пиридинильная группа может быть замещена в имидазольной или пиридинильной части конденсированной системы. Фраза "терапевтически эффективное количество" означает количество соединения настоящего изобретения, которое (i) лечит или предотвращает конкретное заболевание, состояние или нарушение, (ii) ослабляет, уменьшает интенсивность или устраняет один или несколько симптомов конкретного заболевания, состояния или нарушения или (iii) предотвращает или задерживает начало появления одного или нескольких симптомов конкретного заболевания, состояния или нарушения, описанного в контексте. Термин "животное" относится к человеку (мужчине или женщине), животным-компаньонам (например,собакам, кошкам и лошадям), зооживотным, морским животным, птицам и другим подобным видам животных. Предпочтительными животными являются млекопитающие, в частности человек. Фраза "фармацевтически приемлемый" означает, что вещество или композиция должна быть совместима химически и/или токсикологически с другими ингредиентами, составляющими композицию,и/или с млекопитающим, подвергаемым лечению ими. Термин "соединения настоящего изобретения" (если конкретно не указано иначе) относится к соединениям формулы (I) или (III) или фармацевтически приемлемым солям таких соединений, а также всем стереоизомерам (включающим диастереоизомеры и энантиомеры), таутомерам и меченным изотопами соединениям. Подробное описание Настоящее изобретение относится к соединениям и их фармацевтическим препаратам, которые являются применимыми при лечении рака простаты. Соединения настоящего изобретения можно синтезировать синтетическими путями, которые включают в себя способы, аналогичные способам, хорошо известным в области химии, особенно в свете содержащегося в контексте описания. Исходные вещества обычно являются доступными из коммерческих источников, таких как Aldrich Chemicals (Milwaukee, Wis.) или их можно легко получить с применением способов, хорошо известных специалистам в данной области (например, полученные способами, в общем описанными в публикации Louis F. Fieser and Mary Fieser, Reagents for Organic Synthesis, v. 1-19,Wiley, New York (1967-1999 ed.) или Beilsteins Handbuch der organischen Chemie, 4, Aufl. ed. SpringerVerlag, Berlin, включая добавки (доступные также посредством интерактивной базы данных Бейльштейна. Для иллюстративных целей схемы реакций, изображенные ниже, обеспечивают возможные пути синтеза соединений настоящего изобретения, а также ключевых промежуточных продуктов. Более подробное описание отдельных стадий реакций см. ниже в разделе примеров. Специалистам в данной области техники должно быть понятно, что можно применять другие синтетические пути для синтеза соединений изобретения. Хотя на схемах изображены и обсуждаются ниже конкретные исходные вещества и реагенты, их можно легко заменить другими исходными веществами и реагентами для получения различных производных и/или изменения условий реакции. Кроме того, многие из соединений, полученных способами, описанными ниже, можно дополнительно модифицировать в свете данного описания с при-9 023064 менением обычных химических способов, хорошо известных специалистам в данной области. Ниже, на схеме I представлен возможный путь синтеза соединений формулы (I), в которой каждый из R2, R3, R4 и R5 независимо представляет собой CH3 или Н (указываемых ниже как соединения формулы (I-а). Общие схемы Схема 1 На схеме 1, приведенной выше, R представляет собой следующую группу (в которой R6 имеет указанные выше значения). Стадии 1 и 2. Промежуточные продукты стадий 1 и 2 можно синтезировать с применением способов, аналогичных способам, описанными Kak-Shan Shia, et al., in J Med. Chem., 2002, 45, 1644-1655, с применением необходимых исходных веществ, которые являются коммерчески доступными или которые синтезируют с использованием известных процедур, описанных в данной области техники. Например, различные 2 хлоралкилизоцианаты можно получить с применением методов, описанных С. K. Johnson in J. Org. Chem.(1967), 32(5), 1508-10. Время реакции в некоторых случаях продлевали для повышения выхода в % по сравнению с выходами, указанными в упомянутой выше ссылке J. Med. Chem. Стадия 3. Продукты стадии 2, полученные как описано выше, можно превратить в нужные продукты реакцией с подходящими алкил- или арилгалогенидами, предпочтительно хлор/бромалкил- или арилпроизводными, с применением условий, хорошо известных специалистам в данной области, например, условий CN-сочетания Бухвальд-Хартвига или NaH/ДМФА и тому подобное. Предпочтительными условиями являются условия, которые известны как реакция "БухвальдХартвига", например, в присутствии (а) катализатора, такого как иодид меди, (b) основания, такого как фосфат калия или карбонат цезия, и (с) лиганда, такого как транс-2-диаминоциклогексан, в присутствии подходящих растворителей (например, 1,4-диоксана) при температуре от приблизительно комнатной температуры до температуры флегмы растворителя. Когда применяют защитную группу, то защитную группу затем удаляют, применяя условия, подходящие для конкретной применяемой защитной группы,получая при этом соединения настоящего изобретения. Более подробное описание см. в приведенном ниже разделе примеров. Альтернативно, заместители R1 и R можно ввести в обратном порядке. Например, вместо R-NH2,применяемого в качестве исходного соединения, применяют R1-NH2. Группу R затем вводят на стадии 3,используя R-X вместо R1-X. На схеме 2 описывается, как можно получить указанное выше исходное соединение (SM-1), у которого R2, R3, R4 и/или R5 не являются водородом. Схема 2 Подходящую хлоркарбоновую кислоту сначала превращают в хлорангидридное производное такой кислоты с применением процедур, хорошо известных специалистам в данной области техники. Например, производное карбоновой кислоты можно обработать тионилхлоридом в присутствии диметилформамида (DMF, ДМФА) и растворителя (например, дихлорметана (DCM. Можно применять другие хлорирующие агенты, например трихлорид фосфора или пентахлорид фосфора. Хлорангицрид кислоты затем можно превратить в ее соответствующий азид обработкой азидом натрия. Затем азид превращают в требуемый изоцианат (SM-1) перегруппировкой Куртиуса, например, нагреванием азида при повышенных температурах. На схеме 3 описывается возможный путь получения SM-2, где R6 представляет собой (С 3 С 5)циклоалкил. Схема 3R6 можно ввести в SM-2 при помощи соответствующей (С 3-С 5)циклоалкилбороновой кислоты в присутствии тетракис(трифенилфосфин)палладия(0) с последующим восстановлением нитрогруппы с применением стандартных процедур восстановления, хорошо известных специалистам в данной области(например, обработкой хлоридом аммония в присутствии порошка цинка). На схеме 4 представлен альтернативный путь синтеза для получения соединений формулы (I), (II) или (III). Схема 4 Необходимую группу R1 можно присоединить к соответствующему аминокарбоксилатному соединению посредством условий C-N-сочетания Бухвальда-Хартвига или NaH/ДМФА и тому подобного. Циклическую мочевину затем получают с применением способов, аналогичных способам, описаннымKak-Shan Shia, et al., in J Med. Chem., 2002, 45, 1644-1655. Производное пиридина можно затем сочетать с имидазолином с помощью описанной ранее реакции C-N-сочетания Бухвальда-Хартвига. Альтернативно, несимметричные дизамещенные 1H-имидазолин-2(3H)оны можно получить другими способами, обсуждаемыми Т. Hafner, et al., in Synthesis (2007) 9, 1403-1411 (например, Brazier, S.A, etal., J Chem Soc (1912), 101, 2352 and Schonherr, H.J., et al., Chem Ber (1970), 103, 1037). На схеме 5 представлен другой альтернативный синтез получения соединений формулы (I), у которых R2 (или R3) и R4 (или R5) представляют собой Н (указывается ниже как формула (I-b. Схема 5 На приведенной выше схеме 5 R представляет собой следующую группу: Промежуточное соединение (5 а) можно получить посредством реакции присоединения Михаэля требуемого амина (R1-NH2) к нужной акриловой кислоте с применением процедур, хорошо известных специалистам в данной области техники. Например, амин и акриловую кислоту в подходящем растворителе (например толуоле) нагревают при повышенной температуре (например при температуре от приблизительно 70C до приблизительно 100C) в инертной атмосфере. Промежуточную аминокислоту (5 а) затем циклизуют, получая при этом промежуточную циклическую мочевину (5b). Например, промежуточную циклическую мочевину (I-4b) можно получить обработкой промежуточной аминокислоты (5 а) активирующим агентом (например, дифенилфосфорилазидом (DPPA в присутствии амина (например,триэтиламина) и подходящего растворителя (например, толуола) при повышенной температуре. Необходимую группу А можно присоединить к промежуточной циклической мочевине (5b) с применением стандартных условий сочетания, описанных выше, чтобы получить при этом соединение формулы (I-b). На схеме 6 представлен возможный путь синтеза соединений формулы (II) или (III). Схема 6 Аминозащищенный 3-оксо-2,4-диазабицикло[3.1.0]гексан обычно доступен из коммерческих источников (например, бензил-3-оксо-2,4-диазабицикло[3.1.0]гексан-2-карбоксилат доступен из RareWitiak, D.T., in J. Med Chem, 1978, 21(12) 1194-1197). Группу R1 можно ввести при помощи реакции Бухвальда-Хартвига. Например, обработкой бензил-3-оксо-2,4-диазабицикло[3.1.0]гексан-2-карбоксилата требуемой галогензамещенной арильной или гетероарильной группой (R1-X, где X представляет собойBr или I) в присутствии ксантфоса, палладиевого катализатора (например, трис (дибензилиденацетон(палладия(0 при повышенной температуре (например, приблизительно при 100C). Аминозащитную группу (Pg) затем удаляют с применением условий, подходящих для удаления конкретной защитной группы. После удаления защитной группы нужную R6-замещенную 3-пиридинильную группу можно затем присоединить к производному 3-оксо-2,4-диазабицикло[3.1.0]гексана (6b) с помощью ранее описанной реакции C-N-сочетания Бухвальда-Хартвига. Выше на схеме 6 R представляет собой следующую группу Ниже в разделе примеров приводится более подробное описание синтетических схем, а также других альтернативных способов получения соединений настоящего изобретения, которые может легко модифицировать (например, замещением различных исходных веществ) специалист в данной области. Соединения и промежуточные соединения, описанные в контексте, можно выделить и применять в виде соединения самого по себе или его соли. Многие из соединений, представленных формулами (I),(II), (III), (I-а) и (I-b) способны образовывать кислотно-аддитивные соли, особенно фармацевтически приемлемые кислотно-аддитивные соли. Фармацевтически приемлемые кислотно-аддитивные соли соединений формул (I), (II), (III), (I-а) и (I-b) включают в себя соли неорганических кислот, например галогеноводородных кислот, таких как хлористо-водородная кислота, бромисто-водородная кислота или иодисто-водородная кислота, азотная кислота, серная кислота, фосфорная кислота, и органических кислот,например алифатических монокарбоновых кислот, таких как муравьиная кислота, уксусная кислота,пропионовая кислота и масляная кислота, алифатических гидроксикислот, таких как молочная кислота,лимонная кислота, винная кислота или яблочная кислота, дикарбоновых кислот, таких как малеиновая кислота или янтарная кислота, ароматических карбоновых кислот, таких как бензойная кислота, пхлорбензойная кислота, дифенилуксусная кислота или трифенилуксусная кислота, ароматических гидроксикислот, таких как о-гидроксибензойная кислота, п-гидроксибензойная кислота, 1-гидроксинафталин 2-карбоновач кислота или 3-гидроксинафталин-2-карбоновая кислота, и сульфоновых кислот, таких как метансульфоновая кислота или бензолсульфоновая кислота. Эти соли можно получить из соединений формулы (I), (II), (III), (I-а) или (I-b) известными солеобразующими процедурами. Соединения настоящего изобретения, которые содержат кислотные, например карбоксильные,группы, также способны образовывать соли с основаниями, особенно фармацевтически приемлемыми основаниями, такими как основания, хорошо известные в данной области; такие подходящие соли включают в себя соли металлов, особенно соли щелочных металлов или щелочно-земельных металлов, такие как соли натрия, калия, магния или кальция, или соли с аммиаком или фармацевтически приемлемыми органическими аминами или гетероциклическими основаниями, такими как этаноламины, бензиламины или пиридин. Эти соли можно получить из соединений формул (I), (II), (III), (I-а) и (I-b) известными солеобразующими процедурами. Те соединения, у которых имеется асимметричный атом углерода, существуют в виде индивидуальных оптически активных изомерных форм или в виде их смесей, например в виде рацемических или диастереомерных смесей. Настоящее изобретение включает в себя как индивидуальные оптически активные R- и S-изомеры, так и их смеси, например рацемические или диастереомерные смеси. Соединения настоящего изобретения являются применимыми для лечения рака простаты. Следовательно, другим вариантом осуществления настоящего изобретения является фармацевтическая композиция, содержащая терапевтически эффективное количество соединения настоящего изобретения и фармацевтически приемлемый наполнитель, разбавитель или носитель. Типичный препарат получают смешиванием соединения настоящего изобретения и носителя, разбавителя или наполнителя. Подходящие носители, разбавители и наполнители хорошо известны специалистам в данной области техники и включают в себя такие вещества, как углеводы, воски, растворимые и/или набухаемые в воде полимеры, гидрофильные или гидрофобные вещества, желатин, масла, растворители, воду и тому подобное. Конкретный применяемый носитель, разбавитель или наполнитель будет зависеть от способа и цели, для которых применяют соединение настоящего изобретения. Растворители обычно выбирают на основе растворителей, признанных специалистами в данной области техники в качестве безопасных (GRAS), когда их вводят млекопитающему. В общем, безопасные растворители являются нетоксичными водными растворителями, такими как вода и другие нетоксичные растворители, которые способны растворяться или смешиваться с водой. Подходящие водные растворители включают в себя воду, этанол, пропленгликоль, полиэтиленгликоль (например, ПЭГ 400, ПЭГ 300) и т.д. и их смеси. Препараты могут также включать в себя один или несколько буферов, стабилизирующих агентов, поверхностно-активных вещества, смачивающих агентов, смазывающих агентов, эмульгаторов, суспендирующих агентов, консервантов, антиоксидантов, агентов, придающих препарату непрозрачность, вещества, способствующие скольжению, технологические добавки, красители, подсластители, отдушки, ароматизаторы и другие известные добавки, которые обеспечивают предоставление лекарственного средства в лучшем виде (то есть соединения настоящего изобретения или его фармацевтической композиции) или помогают при изготовлении фармацевтического продукта (т.е лекарственного средства). Препараты можно изготовить с применением общепринятых процедур растворения и смешивания. Например, лекарственное вещество в массе (т.е. соединение настоящего изобретения или стабилизированную форму соединения (например, комплекс с производным циклодекстрина или другим известным комплексообразующим агентом растворяют в подходящем растворителе в присутствии одного или нескольких наполнителей. Соединение настоящего изобретения обычно изготавливают в виде фармацевтических дозированных форм, чтобы легко обеспечить регулируемую дозировку лекарственного средства и дать пациенту продукт в приятной по виду и легко применяемой форме. Фармацевтическую композицию (или препарат) для применения можно упаковать различными способами, в зависимости от способа, применяемого для введения лекарственного средства. Обычно фармацевтическое изделие для продажи включает в себя контейнер, имеющий размещенный в нем фармацевтический препарат в подходящей форме. Подходящие контейнеры хорошо известны специалистам в данной области техники и включают в себя такие контейнеры, как пузырьки (пластиковые и стеклянные), саше, ампулы, пластиковые пакеты, металлические цилиндры и тому подобное. Контейнер может также включать в себя защищенный уплотнителем блок для предотвращения неосторожного доступа к содержимому упаковок. Кроме того, контейнер имеет помещенную на него этикетку, которая описывает содержимое контейнера. Этикетка может также включать в себя соответствующие предостережения. Примеры Следующие аббревиатуры, применяемые в приведенных ниже примерах, имеют следующие значения: Получение промежуточного соединения 4-циклопропил-3-нитропиридина (I-1 а) 4-Хлор-3-нитропиридин (100 мг, 0,630 ммоль и циклопропилбороновую кислоту (10,0 мг, 0,091 ммоль) добавляли к раствору ксилола (3 мл), предварительно продутого аргоном (10 мин). Реакционную смесь продували аргоном в течение еще 15 мин с последующим добавлением карбоната калия (174,35 мг,1,26 ммоль) и Pd(PPh3)4 (34,5 мг, 0,063 ммоль). Полученную смесь нагревали для кипячения с обратным холодильником при 130C в течение ночи. Ход реакции контролировали ТСХ (30% раствор этилацетата в гексане). Реакционную смесь охлаждали и концентрировали, получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (15% раствор этилацетата в гексане) давала 110 мг продукта (выход 100%). Чистота по данным ЖХ-МС 99%, M/Z=165 (M+1). Получение промежуточного соединения 4-циклопропилпиридин-3-амина (I-1b) Порошок цинка (223,2 мг, 3,41 ммоль) и раствор хлорида аммония (365 мг, 6,8 ммоль) добавляли к перемешиваемому раствору 4-циклопропил-3-нитропиридина (I-1 а: 70 мг, 0,426 ммоль) в сухом ТГФ (2 мл) при 0C и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Ход реакции контролировали ТСХ (10% раствор метанола в CHCl3). Реакционную смесь фильтровали через слой целита и промывали ТГФ и фильтрат концентрировали. Остаток растворяли в этилацетате и промывали водой и насыщенным раствором соли и сушили над сульфатом натрия и концентрировали, получая при этом 450 мг продукта (выход 100%). 1H ЯМР (CDCl3, 300 МГц):8,10 (с, 1H), 7,95 (д, 1H), 6,90 (д, 1H), 4,1 (шир. с, 2 Н), 1,75-1,60 (м,1H), 1,10-0,95 (кв., 2 Н), 0,70-0,60 (кв., 2 Н). Чистота по ЖХ-МС 85%, M/Z=135,1 (М+1). Получение промежуточного соединения 1-(2-хлорэтил)-3-(4-циклопропилпиридин-3-ил)мочевины 1-Хлор-2-изоцианатоэтан (472 мг, 4,477 ммоль) добавляли по каплям к перемешиваемой смеси 4 циклопропилпиридин-3-амина (I-1b: 400 мг, 2,78 ммоль) в толуоле (10 мл) при 0C. Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Ход реакции контролировали ТСХ (10% раствор метанола в CHCl3). Неочищенный продукт концентрировали и очищали колоночной хроматографией на сипикагеле (2% раствор метанол в CHCl3), получая при этом 200 мг продукта (выход 28%).H-ЯМР (ДМСО-D6, 400 МГц):8,84 (с, 1H), 8,14 (с, 1H), 8,08-8,07 (д, 1H), 6,97-6,94 (т, 1H), 6,886,87 (д, 1H), 3,69-3,66 (т, 2 Н), 3,46-3,42 (дд, 2 Н), 1,92-1,86 (м, 1H), 1,06-1,01 (кв., 2 Н), 0,73-0,69 (кв.,2 Н). Чистота по ЖХ-МС 97%, m/z=240,l (М+Н). Получение промежуточного соединения 1-(4-циклопропилпиридин-3-ил)имидазолидин-2-она (I-1d) 1-(2-Хлорэтил)-3-(4-циклопропилпиридин-3-ил)мочевину (I-1 с: 200 мг, 0,836 ммоль) в сухом ТТФ добавляли по каплям к перемешиваемой смеси NaH (40,16 мг, 1,67 ммоль) в сухом ТГФ (5 мл) при 0C на протяжении периода 10 мин. Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Ход реакции контролировали ТСХ (10% раствор метанола в CHCl3). Реакционную смесь гасили метанолом и концентрировали, получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (2% раствор метанола в CHCl3) давала 140 мг продукта (выход 94%). 1H-ЯМР (ДМСО-D6, 300 МГц):8,31-8,27 (м, 2 Н), 6,88-6,83 (м, 2 Н), 3,81-3,76 (т, 2 Н), 3,48-3,46 (т,2 Н), 2,10-1,95 (м, 1H), 1,07-1,04 (кв., 2 Н), 0,79-0,76 (кв., 2 Н). Чистота по ЖХ-МС 97%, m/z=204,1 (M+1). Получение указанного в заголовке соединения 1-(2-хлорпиридин-4-ил)-3-(4-циклопропилпиридин 3-ил)имидазолидин-2-она (1 А). Иодид меди (6,5 мг, 0,034 ммоль), Транс-N,N'-диметилциклогексан-1,2-диамин (4,8 мг, 0,034 ммоль) и фосфат калия (219,3 мг, 1,034 ммоль) добавляли к раствору 1,4-диоксана (5 мл), предварительно продутого азотом (10 мин). Реакционную смесь продували аргоном в течение 10 мин с последующим добавлением 1-(4-циклопропилпиридин-3-ил)имидазолидин-2-она (I-1d: 70 мг, 0,344 ммоль) и 2-хлор-4 иодпиридина (99,09 мг, 0,413 ммоль). Реакционную смесь нагревали для кипячения с обратным холодильником при 120C в течение ночи. Ход реакции контролировали ТСХ (10% раствор метанол в хлороформе). Реакционную смесь охлаждали и распределяли между этилацетатом и водой. Органический слой концентрировали, получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (2% раствор метанол в CHCl3) давала 42 мг продукта (выход 41%). 1(шир.с, 1H), 4,09-4,02 (м, 4 Н), 2,0-1,96 (м, 1H), 1,17-1,12 (м, 2 Н), 0,87-0,83 (м, 2 Н). Чистота по ЖХ-МС 99%, m/z=315 (М+1). Чистота по ВЭЖХ 95%. Пример 2. Синтез 1-(4-циклопропилпиридин-3-ил)-3-(2-(трифторметил)пиридин-4-ил)имидазолидин-2-она (2 А) С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил) имидазолидин-2-он (I-1d: 70 мг, 0,344 ммоль) подвергали взаимодействию с 4-бром-2-(трифторметил)пиридином (93,5 мг, 0,413 ммоль) 1,4-диоксаном (5 мл), иодидом меди (6,5 мг,0,034 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (4,8 мг, 0,034 ммоль) и фосфатом калия (219 мг, 1,034 ммоль), получая при этом неочищенный продукт. Очистка препаративной ВЭЖХ давала 40 мг продукта (выход 33%). 1(шир.с, 1H), 4,16-4,04 (м, 4H), 2,2-1,95 (м, 1H), 1,17-1,12 (м, 2 Н), 0,90-0,84 (м, 2 Н). Чистота по ЖХ-МС 97%, m/z = 349,1 (М+1). Чистота по ВЭЖХ 94%. Пример 3. Получение 1-(4-циклопропилпиридин-3-ил)-3-(нафталин-2-ил)имидазолидин-2-она (3 А) С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил) имидазолидин-2-он (I-1d: 7C мг, 0,344 ммоль) подвергали взаимодействию с 2-бромнафталином (85,68 мг, 0,413 ммоль), 1,4-диоксаном (5 мл), иодидом меди (6,5 мг, 0,034 ммоль),транс-N,N'-диметилциклогексан-1,2-диамином (4,8 мг, 0,034 ммоль) и фосфатом калия (219 мг, 1,034 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле(2% раствор метанола в CHCl3) с последующей очисткой препаративной ВЭЖХ давала 13 мг продукта(м, 1H), 1,15-1,13 (м, 2 Н), 0,85-0,84 (м, 2 Н). Чистота по ЖХ-МС 100%, m/z=330,2 (M+1). Чистота по ВЭЖХ 98%. Пример 4. Получение 1-(бензо[b]тиофен-5-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-она С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил)имидазолидин-2-он (I-1d: 70 мг, 0,344 ммоль) подвергали взаимодействию с 5-бромоензо[b]тиофеном (88,1 мг, 0,413 ммоль), 1,4-диоксаном (5 мл), иодидом меди (6,5 мг, 0,034 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (4,8 мг, 0,034 ммоль) и фосфатом калия (219 мг,1,034 ммоль), получая при этом неочищенный продукт. Очистка поепаративной ВЭЖХ давала 15 мг продукта (выход 13%). 1(м, 1H), 1,15-1,11 (м, 2 Н), 0,86-0,82 (м, 2 Н). Чистота по ЖХ-МС 95%, m/z=336,1 (M+1). Чистота по ВЭЖХ 98%. Пример 5. Получение 1-(4-циклопропилпиридин-3-ил)-3-(3-(трифторметил)фенил)имидазолидин-2 она (5 А) С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил) имидазолидин-2-он (I-1d: 150 мг, 0,738 ммоль) подвергали взаимодействию с 1-бром-3-(трифторметил)бензолом (831 мг, 3,69 ммоль), 1,4-диоксаном (10 мл), иодидом меди (14,0 мг,0,073 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (8,4 мг, 0,073 ммоль) и фосфатом калия(469,9 мг, 2,21 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (1,5% раствор метанола в CHCl3) давала 205 мг продукта (выход 8 0%). 1H-ЯМР (CDCl3, 400 МГц):8,70-8,40 (м, 2 Н), 7,90-7,84 (т, 2 Н), 7,51-7,47 (т, 1H), 7,35-7,27 (т, 1H),6,85 (шир.с, 1H), 4,13-4,08 (т, 2 Н), 4,03-3,99 (т, 2 Н), 2,07-2,03 (м, 1H), 1,16-1,11 (м, 2 Н), 0,86-0,82 (м, 2 Н). Чистота по ЖХ-МС 94%, m/z=348,1 (М+1). Чистота по ВЭЖХ 96%. Пример 6. Получение 1-(бензо[b]тиофен-2-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-она С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил) имидазолидин-2-он (I-1d: 150 мг, 0,738 ммоль) подвергали взаимодействию с 2-бромбензо[b]тиофеном (188 мг, 0,886 ммоль), 1,4-диоксаном (6 мл), иодидом меди (14,0 мг, 0,0739 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (10,5 мг, 0,0739 ммоль) и фосфатом калия (470 мг, 2,21 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (0,5% раствор метанола в CHCl3) давала 85 мг продукта (выход 34%). 1 Н-ЯМР (CDCl3, 400 МГц):8,60-8,30 (м, 2 Н), 7,74-7,72 (д, 1H), 7,63-7,60 (д, 1H), 7,33-7,19 (м, 2 Н),6,82 (с, 1H), 6,56 (с, 1H), 4,20-4,04 (м, 4 Н), 2,10-2,0 (м, 1H), 1,16-1,10 (м, 2 Н), 0,85-0,80 (м, 2 Н). Чистота по ЖХ-МС 90%, m/z=336,1 (M+1). Чистота по ВЭЖХ 95%. Пример 7. Получение 1-(6-хлор-2-метилпиримидин-4-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-она (7 А) С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил)имидазолидин-2-он (I-1d: 100 мг, 0,492 ммоль) подвергали взаимодействию с 4,6-дихлор-2-метилпиримидином (80,2 мг, 0,492 ммоль), 1,4-диоксаном (5 мл), иодидом меди (9,3 мг,0,049 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (6,9 мг, 0,049 ммоль) и фосфатом калия (313 мг, 1,47 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (1% раствор метанола в CHCl3) давала 25 мг продукта (выход 15%). 1 Н-ЯМР (CDCl3, 400 МГц):3,55-8,40 (м, 2 Н), 8,16 (с, 1H), 6,84 (с, 1H), 4,30-4,26 (кв., 2 Н), 3,99-3,95= 330,1 (М+1). Чистота по ВЭЖХ 98%. Пример 8. Получение 1-(4-циклопропилпиридин-3-ил)-3-(4-(трифторметил)пиридин-2-ил)имидазолидин-2-она (8 А) С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил) имидазолидин-2-она (I-1d: 150 мг, 0,738 ммоль) подвергали взаимодействию с 2-бром-4-(трифторметил)пиридином (200,3 мг, 0,88 ммоль), 1,4-диоксаном (5 мл), иодидом меди (14,03 мг, 0,073 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (10,49 мг, 0,073 ммоль) и фосфатом калия (469,9 мг, 2,21 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (1% раствор метанола в CHCl3) давала 182,5 мг продукта (выход 71%). 1H-ЯМР (CDCl3, 300 МГц):8,64 (с, 1H), 8,48-8,46 (д, 2 Н), 7,17-7,15 (д, 2 Н), 6,95-6,75 (шир.с, 1H),4,34-4,29 (т, 2 Н), 4,01-3,96 (т, 2 Н), 2,04-1,99 (м, 1H), 1,17-1,10 (м, 2 Н), 0,86-0,81 (м, 2 Н). Чистота по ЖХМС 98%, m/z=349,0 (M+1). Чистота по ВЭЖХ 98%. Пример 9. Получение 1-(4-циклопропилпиридин-3-ил)-3-(2-метоксипиридин-4-ил)имидазолидин-2 она (9 А) С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил) имидазолидин-2-он (I-1d: 100 мг, 0,492 ммоль) подвергали взаимодействию с 4-бром-2-метоксипиридином (111,1 мг, 0,591 ммоль), 1,4-диоксаном (5 мл), иодидом меди (9,39 мг, 0,049 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (6,98 мг, 0,049 ммоль) и фосфатом калия (312,9 мг, 1,47 6 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (1% раствор метанол в CHCl3) давала 80 мг продукта (выход 52%). 1 Н-ЯМР (CDCl3,300 МГц):8,70-8,25 (м, 2 Н), 8,08-8,06 (д, 1H), 7,46-7,44 (дд, 1H), 6,90-6,80 (шир.с,1H), 6,73 (д, 1H), 4,03-4,0 (м, 4 Н), 3,93 (с, 3H), 2,05-1,95 (м, 1H), 1,14-1,10 (м, 2 Н), 0,85-0,81 (м, 2 Н). Чистота по ЖХ-МС 100%, m/z = 311,3 (М+1). Чистота по ВЭЖХ 96%. Пример 10. Получение 1-(6-хлорпиримидин-4-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2 она (10 А) С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил)имидазолидин-2-он (I-1d: 120 мг, 0,591 ммоль) подвергали взаимодействию с 4,6-дихлорпиримидином (88,07 мг, 0,591 ммоль), 1,4-диоксаном (5 мл), иодидом меди (11,21 мг, 0,059 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (8,39 мг, 0,059 ммоль) и фосфатом калия (375,96 мг, 1,77 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (0,5% раствор метанола в CHCl3) давала 15,3 мг продукта (выход 9%). 1 Н-ЯМР (CDCl3, 300 МГц):8,67 (с, 1H), 8,60-8,40 (м, 2 Н), 8,35 (с, 1H), 6,84 (с, 1H), 4,32-4,26 (т,2 Н), 4,0-3,97 (т, 2 Н), 1,98-1,93 (м, 1H), 1,17-1,11 (м, 2 Н), 0,87-0,81 (м, 2 Н). Чистота по ЖХ-МС 100%,m/z=316,1 (M+1). Чистота по ВЭЖХ 95%. Пример 11. Получение 1-(4-циклопропилпиридин-3-ил)-3-(4-(трифторметил)пиримидин-2-ил)имидазолидин-2-она (11 А) Ксантфос (23 мг, 0,049 ммоль) и Pd2(dba)3 (22,5 мг, 0,024 ммоль) добавляли к раствору карбоната цезия (400 мг, 1,23 ммоль) в толуоле (5 мл), предварительно продутому азотом (20 мин). Реакционную смесь продували аргоном в течение 10 мин с последующим добавлением 1-(4-циклопропилпиридин-3 ил) имидазолидин-2-она (I-1d: 100 мг, 0,492 ммоль) и 2-хлор-4-(трифторметил)пиримидина (0,06 мл, 0,54 ммоль). Реакционную смесь нагревали в запаянной трубке при 110C в течение 16 ч. Ход реакции контролировали ТСХ (10% раствор метанола в хлороформе). Реакционную смесь охлаждали, фильтровали и фильтрат распределяли между этилацетатом и водой. Органический слой концентрировали, получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (1,5% раствор метанола в хлороформе) давала 60 мг продукта (выход 35%). 1 Н-ЯМР (CDCl3, 400 МГц):8,95-8,93 (д, 1H), 8,51 (с, 1H), 8,44-8,43 (д, 1H), 7,29-7,28 (д, 1H), 6,836,82 (д, 1H), 4,36-4,32 (т, 2 Н), 4,0-3,96 (т, 2 Н), 2,10-2,0 (м, 1H), 1,15-1,11 (м, 2 Н), 0,84-0,82 (м, 2 Н). Чистота по ЖХ-МС 100%, m/z=350,1 (M+1). Чистота по ВЭЖХ 97%. Пример 12. Получение 1-(4-циклопропилпиридин-3-ил)-3-(2-(трифторметил)пиримидин-4-ил)имидазолидин-2-она (12 А) С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил)имидазолидин-2-он (I-1d: 100 мг, 0,492 ммоль) подвергали взаимодействию с 4-хлор-2-(трифторметил)пиримидином (108 мг, 0,591 ммоль), 1,4-диоксаном (5 мл), иодидом меди (9,3 мг, 0,049 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (6,9 мг, 0,049 ммоль) и фосфатом калия(313 мг, 1,47 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (1% раствор метанола в CHCl3) с последующей очисткой препаративной ВЭЖХ давала 20 мг продукта (выход 12%). 1 Н-ЯМР (CDCl3, 400 МГц):8,64-8,63 (д, 1H), 8,48-8,44 (м, 3H), 6,84-6,83 (д, 1H), 4,38-4,34 (т, 2 Н),4,04-4,00 (т, 2 Н), 2,01-1,95 (м, 1H), 1,17-1,13 (м, 2 Н), 0,87-0,84 (м, 2 Н). Чистота по ЖХ-МС 98%,ra/z=350,1 (M+1). Чистота по ВЭЖХ 99%. Пример 13. Получение 1-(4-циклопропилпиридин-3-ил)-3-(3-(трифторметил)бензо[b]тиофен-5-ил) имидазолидин-2-она (13 А) С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил)имидазолидин-2-он (I-1d: 100 мг, 0,492 ммоль) подвергали взаимодействию с 5-бром-3-(трифторметил)бензо[b]тиофеном (151 мг, 0,54 ммоль), 1,4-диоксаном (5 мл), иодидом меди(9,3 мг, 0,049 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (6,9 мг, 0,049 ммоль) и фосфатом калия (313 мг, 1,47 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (0,5% раствор метанола в CHCl3) с последующей очисткой препаративной ВЭЖХ давала 15,4 мг продукта (выход 8%). 1(д, 1H), 7,81(с, 1H), 6,81-6,79 (д, 1H), 4,18-4,15 (м, 2 Н), 4,05-4,02 (м, 2 Н), 2,15-2,05 (м, 1H), 1,15-1,11 (м,2 Н), 0,84-0,82 (м, 2 Н). Чистота по ЖХ-МС 98%, m/z=404,1 (M+1). Чистота по ВЭЖХ 97%. Пример 14. Получение 1-(4-циклопропилпиридин-3-ил)-3-(2-фторбензо[b]тиофен-5-ил)имидазолидин-2-она (14 А) С применением аналогичных реагентов и условий реакции, как описано на стадии 5 примера 1, 1(4-циклопропилпиридин-3-ил) имидазолидин-2-он (I-1d: 145 мг, 0,714 ммоль) подвергали взаимодейст- 18023064(454 мг, 2,14 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (0,5-1% раствор метанола в CHCl3) с последующей очисткой препаративной ВЭЖХ давала 53 мг продукта (выход 21%). 1H-ЯМР (CDCl3, 300 МГц):8,50 (с, 1H), 8,42-8,40 (д, 1H), 7,86 (с, 1H), 7,63 (с, 2 Н), 6,81-6,79 (д,1H), 6,69-6,68 (д, 1H), 4,14-4,09 (т, 2 Н), 4,02-3,96 (т, 2 Н), 2,11-2,03 (м, 1H), 1,16-1,09 (м, 2 Н), 0,88-0,82 (м,2 Н). Чистота по ЖХ-МС 100%, m/z=354,3 (M+1). Чистота по ВЭЖХ 98%. Пример 15. Получение 1-(4-циклопропилпиридин-3-ил)-3-(3-метилбензо[b]тиофен-5-ил)имидазолидин-2-она (15 А) С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил) имидазолидин-2-он (I-1d: 100 мг, 0,492 ммоль) подвергали взаимодействию с 5-бром-3-метилбензо[b]тиофеном (122,4 мг, 0,541 ммоль), 1,4-диоксаном (5 мл), иодидом меди (9,3 мг,0,049 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (5,6 мг, 0,049 ммоль) и фосфатом калия (313 мг, 1,477 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (2% раствор метанола в CHCl3) давала 100 мг продукта (выход 58%). 1H-ЯМР (CDCl3, 400 МГц):8,70-8,30 (м, 2 Н), 7,94-7,93 (д, 1H), 7,83-7,81 (д, 1H), 7,66-7,64 (дд, 1H),7,09(с, 1H), 6,81(с, 1H), 4,19-4,15 (м, 2H), 4,03-3,99 (м, 2 Н), 2,43 (с, 3H), 2,12-2,08 (м, 1H), 1,15-1,10 (м,2 Н), 0,85-0,81 (м, 2 Н). Чистота по ЖХ-МС 93%, m/z=458,1 (М+1). Чистота по ВЭЖХ 95%. Пример 16. Получение 1-(бензо[b]тиофен-6-ил)-3-(4-циклопропилпиридин-3-ил) имидазолидин-2 она (16 А) С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил)имидазолидин-2-он (I-1d: 100 мг, 0,492 ммоль) подвергали взаимодействию с 6-бромбензо[b]тиофеном (195 мг, 0,541 ммоль), 1,4-диоксаном (6 мл), иодидом меди (9,3 мг, 0,049 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (6,9 мг, 0,049 ммоль) и фосфатом калия (260 мг,1,23 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (0,5% раствор метанола в CHCl3) давала 120 мг продукта (выход 73%). 1 Н-ЯМР (CDCl3,400 МГц):9,20-8,20 (м, 2 Н), 8,11 (д, 1H), 7,81-7,79 (д, 1H), 7,72-7,69 (дд, 1H), 7,357,34 (д, 1H), 7,29-7,27 (д, 1H), 7,15-6,55 (шир.с, 1H), 4,17-4,13 (м, 2 Н), 4,03-3,99 (м, 2 Н), 2,10-2,05 (м, 1H),1,14-1,10 (м, 2 Н), 0,88-0,81 (м, 2 Н). Чистота по ЖХ-МС 95%, m/z=336,1 (М+1). Чистота по ВЭЖХ 97%. Пример 17. Получение 1-(4-циклопропилпиридин-3-ил)-3-(2,2-дифторбензо[d][1,3]диоксол-5-ил) имидазолидин-2-она (17 А) С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил) имидазолидин-2-он (I-1d: 100 мг, 0,492 ммоль) подвергали взаимодействию с 5-бром-2,2-дифторбензо[d][1,3]диоксолом (128,4 мг, 0,541 ммоль), 1,4-диоксаном (5 мл), иодидом меди(9,3 мг, 0,049 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (5,6 мг, 0,049 ммоль) и фосфатом калия (313,6 мг, 1,447 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (2,0% раствор метанола в CHCl3) давала 105 мг продукта (выход 60%). 1(м, 4 Н), 2,05-2,01 (м, 1H), 1,14-1,09 (м, 2 Н), 0,84-0,80 (м, 2 Н). Чистота по ЖХ-МС 95%, m/z=360,1 (М+1). Чистота по ВЭЖХ 98%. Пример 18. Получение 1-(4-циклопропилпиридин-3-ил)-3-(3-метилбензо[b]тиофен-6-ил)имидазолидин-2-она (18 А) С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил) имидазолидин-2-он (I-1d: 100 мг, 0,492 ммоль) подвергали взаимодействию с 6-бром-3-метилбензо[b]тиофеном (112 мг, 0,492 ммоль), 1,4-диоксаном (5 мл), иодидом меди (9,3 мг,0,049 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (7,0 мг, 0,049 ммоль) и фосфатом калия(313,6 мг, 1,447 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (2,0% раствор метанола в CHCl3) давала 45 мг продукта (выход 26%). 1 Н-ЯМР (CDCl3, 400 МГц):3,60-8,40 (м, 2 Н), 8,05 (д, 1H), 7,76-7,74 (м, 1H), 7,69-7,67 (д, 1H), 6,97(д, 1H), 6,82 (шир.с, 1H), 4,20-4,10 (м, 2 Н), 4,05-3,95 (м, 2 Н), 2,43 (с, 3H), 2,15-2,05 (м, 1H), 1,15-1,10 (м,2 Н), 0,85-0,82 (м, 2 Н). Чистота по ЖХ-МС 100%, m/z=350,1 (M+1). Чистота по ВЭЖХ 98%. Пример 19. Получение 1-(4-циклопропилпиридин-3-ил)-3-(3-метилбензофуран-5-ил)имидазолидин 2-она (19 А) С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил) имидазолидин-2-он (I-1d: 100 мг, 0,492 ммоль) подвергали взаимодействию с 5-бром-3-метилбензофураном (125 мг, 0,5904 ммоль), 1,4-диоксаном (4 мл), иодидом меди (10 мг, 0,0492 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (7,0 мг, 0,0492 ммоль) и фосфатом калия (313 мг,1,476 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (1,0% раствор метанола в CHCl3) давала 69 мг продукта (выход 42%). 1H-ЯМР (CDCl3, 300 МГц):8,80-8,30 (м, 2 Н), 7,76 (с, 1H), 7,55-7,30 (м, 2 Н), 6,90-6,70 (шир.с, 1H),4,13-4,10 (т, 2 Н), 4,01-3,96 (т, 2 Н), 2,22 (с, 3H), 2,15-2,05 (м, 1H), 1,20-1,10 (м, 2 Н), 0,92-0,80 (м, 2 Н). Чистота по ЖХ-МС 91%, m/z = 334,1 (М+1). Чистота по ВЭЖХ 95%. Пример 20. Получение 1-(2-хлорбензо[b]тиофен-5-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-она (20 А) Получение промежуточного соединения 5-бром-2-хлорбензо[b]тиофена (I-20 а). н-Бутиллитий (0,64 мл, 1,2 ммоль) добавляли по каплям к раствору диизопропиламина (0,25 мл, 1,5 ммоль) в сухом ТГФ при -78C в атмосфере азота на протяжении периода 5 мин. Реакционную смесь перемешивали при -20C в течение 30 мин. К этой смеси добавляли 5-бром-бензо[b]тиофен (200 мг, 0,938 ммоль) в сухом ТГФ при -78C, продолжали перемешивание в течение еще 30 мин при -78C с последующим добавлением N-хлорсукцинамида (225 мг, 1,68 ммоль) в сухом ТГФ при -78C. Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Ход реакции контролировали ТСХ (100% гексан). Реакционную смесь распределяли между этилацетатом и насыщенным раствором хлорида аммония. Органический слой сушили над сульфатом натрия и концентрировали, получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (100% гексан) давала 70 мг продукта(выход 30%). 1 Н-ЯМР (CDCl3, 300 МГц):7,815-7,811 (д, 1H), 7,57-7,55 (д, 1H), 7,44-7,41 (дд, 1H), 7,12 (с, 1H). Получение указанного в заголовке соединения 1-(2-хлорбензо[b]тиофен-5-ил)-3-(4-циклопропилпиридин-3-ил)имидазолидин-2-она (20 А). С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил)имидазолидин-2-он (I-1d: 100 мг, 0,491 ммоль) подвергают взаимодействию с 5-бром-2-хлорбензо[b]тиофеном (134,6 мг, 0,541 ммоль), иодидом меди (9,3 мг, 0,049 ммоль), транс-N,N'диметилциклогексан-1,2-диамином (7,0 мг, 0,0491 ммоль), фосфатом калия (260,9 мг, 1,23 ммоль) и 1,4 диоксаном (5 мл), получая при этом сырой продукт. Очистка колоночной хроматографией на силикагелеH-ЯМР (CDCl3, 400 МГц):3,90 (с, 1H), 8,52-8,51 (д, 1H), 7,82-7,81 (д, 1H), 7,71-7,68 (д 1H), 7,617,58 (дд, 1H), 7,17-7,15 (т, 2 Н), 4,19-4,08 (м, 4 Н), 2,34-2,29 (м, 1H), 1,50-1,45 (м, 2 Н), 1,11-1,06 (м, 2 Н). Чистота по ЖХ-МС 92%, m/z = 370,0 (М+1). Чистота по ВЭЖХ 94%. С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил) имидазолидин-2-он (I-1d: 100 мг, 0,492 ммоль) подвергали взаимодействию с 5-бром-2,3-дигидро-1H-инденом (132 мг, 0,5418 ммоль), 1,4-диоксаном (4 мл), иодидом меди (9,5 мг,0,0492 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (7,0 мг, 0,0492 ммоль) и фосфатом калия(261 мг, 1,231 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (1,5% раствор метанола в CHCl3) давала 12 мг продукта (выход 8%). 1H-ЯМР (CDCl3, 300 МГц):8,01-7,97 (д, 1H), 7,54 (с, 1H), 7,34-6,90 (м, 3H), 6,83-6,81 (д, 1H), 4,103,85 (м, 4 Н), 3,0-2,8 (м, 4 Н), 2,15-1,95 (м, 3H), 1,15-1,05 (м, 2 Н), 0,85-0,75 (м, 2 Н). Чистота по ЖХ-МС 95%, m/z=320,1 (М+1). Чистота по ВЭЖХ 97%. Пример 22. Получение 1-(4-циклопропилпиридин-3-ил)-3-(5-фторбензо[b]тиофен-2-ил)имидазолидин-2-она (22 А) С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил) имидазолидин-2-он (I-1d: 100 мг, 0,4926 ммоль) подвергали взаимодействию с 2-бром-5-фторбензо[b]тиофеном (125 мг, 0,5418 ммоль), 1,4-диоксаном (4 мл), иодидом меди (9,3 мг,0,0492 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (7,0 мг, 0,0492 ммоль) и фосфатом калия(261 мг, 1,231 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (0,5% раствор метанола в CHCl3) давала 85 мг продукта (выход 49%). 1H-ЯМР (CDCl3, 300 МГц):8,55-8,40 (м, 2 Н), 7,70-7,60 (м, 1H), 7,30-7,20 (м, 1H), 7,0-6,90 (м, 1H),6,85-6,75 (д, 1H), 6,50 (с, 1H), 4,20-4,0 (м, 4 Н), 2,10-1,95 (м, 1H), 1,20-1,10 (м, 2 Н), 0,90-0,82 (м, 2 Н). Чистота по ЖХ-МС 98%, m/z = 354,1 (М+1). Чистота по ВЭЖХ 93%. Пример 23. Получение 1-(4-циклопропилпиридин-3-ил)-3-(3-(трифторметил)бензо[b]тиофен-6-ил) имидазолидин-2-она (23 А) С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил)имидазолидин-2-он (I-1d: 170 мг, 0,837 ммоль) подвергали взаимодействию с 6-бром-3-(трифторметил)бензо[b]тиофеном (259 мг, 0,921 ммоль), 1,4-диоксаном (8 мл), иодидом меди(15,9 мг, 0,083 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (11,9 мг, 0,083 ммоль) и фосфатом калия (533 мг, 2,51 ммоль), получая при этом сырой продукт. Очистка колоночной хроматографией на силикагеле (0,4% раствор метанола в CHCl3) давала 15 мг продукта (выход 4%). 1 Н-ЯМР (CDCl3, 300 МГц):8,70-8,40 (м, 2 Н), 8,29-8,28 (д, 1H), 7,9-7,89 (д, 1H), 7,79 (с, 1H), 7,707,66 (дд, 1H), 6,84-6,80 (шир.с, 1H), 4,2-4,13 (м, 2 Н), 4,04-3,99 (м, 2 Н), 2,10-2,05 (м, 1H), 1,16-1,09 (м, 2 Н),0,86-0,82 (м, 2 Н). Чистота по ЖХ-МС 95%, m/z=404,1 (M+1). Чистота по ВЭЖХ 95%. Пример 24. Получение 1-(4-циклопропилпиридин-3-ил)-3-(2-фтор-3-метилбензо[b]тиофен-5-ил) имидазолидин-2-она (24 А) Получение промежуточного продукта 1-(4-бромфенилсульфанил)пропан-2-она (I-24 а) 1-Хлорпропан-2-он (1,0 г, 11,63 ммоль) и карбонат калия (2,9 г, 21,15 ммоль) добавлялл к раствору 4-бромбензолтиола (2,0 г, 10,58 ммоль) в ДМФА (5,0 мл) при 0C. Полученную смесь перемешивали при комнатной температуре на протяжении ночи. Ход реакции контролировали ТСХ (100% гексан). Реакционную смесь гасили льдом и экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и концентрировали, получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (2% раствор метанола в хлороформе) давала 2,0 г продукта (выход 80%). 1H-ЯМР (CDCl3, 300 МГц):7,44-7,4 (д, 2 Н), 7,22-7,16 (д, 2 Н), 3,6 (с, 2 Н), 2,25 (с, 3H). Получение промежуточного соединения 5-бром-3-метилбензо[b]тиофена (I-24b) Полифосфорную кислоту (7 г) добавляли к раствору 1-(4-бромфенилсульфанил)пропан-2-она (I-24 а: 2,0 г, 8,163 ммоль) в толуоле (10 мл) и полученную смесь нагревали до 100C в течение 5 ч. Ход реакции контролировали ТСХ (100% гексан). Реакционную смесь охлаждали до комнатной температуры, гасили льдом, подщелачивали карбонатом калия (рН 8) и экстрагировали этилацетатом. Органический слой концентрировали, получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (100% гексан) давала 1,2 г продукта (выход 66%). 1(с, 3H). Получение промежуточного соединения 5-бром-2-фтор-3-метилбензо[b]тиофена (I-24 с): С применением аналогичного условия реакции и обработки, как описано выше в примере 20 для получения I-20 а, 5-бром-3-метилбензо[b]тиофен (I-24b: 500 мг, 2,192 ммоль) в сухом ТГФ подвергали реакции с N-фторбензолсульфонимидом (1,2 г, 3,94 ммоль), диизопропиламином (266,2 мг, 2,6315 ммоль), н-бутиллитием (1,3 мл, 2,6315 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (гексан) давала 120 мг продукта (выход 22%). 1H-ЯМР (CDCl3, 300 МГц):7,72-7,68 (д, 1H), 7,54-7,5 (д, 1H), 7,44-7,39 (дд, 1H), 2,11 (с, 3H). Получение указанного в заголовке соединения 1-(4-циклопропилпиридин-3-ил)-3-(2-фтор-3 метилбензо[b]тиофен-5-ил)имидазолидин-2-она(24 А). С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил)имидазолидин-2-он (I-1d: 100 мг, 0,4926 ммоль) подвергали взаимодействию с 5-бром-2-фтор-3-метилбензо[b]тиофеном (I-24 с: 120 мг, 0,4926 ммоль), иодидом меди (9,3 мг, 0,04926 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (7,0 мг, 0,04926 ммоль), фосфатом калия (313 мг,1,4778 ммоль) и 1,4-диоксаном (5 мл), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (2% раствор метанола в хлороформе), получая при этом 120 мг продукта(м, 2 Н). Чистота по ЖХ-МС 96%, m/z=368,1 (M+1). Чистота по ВЭЖХ 97%. Пример 25. Получение 1-(4-циклопропилпиридин-3-ил)-3-(2-фторбензо(b)тиофен-6-ил)имидазолидин-2-она (25 А) Получение промежуточного соединения метилового эфира 6-бромбензо[b]тиофен-2-карбоновой кислоты (I-25 а)TEA (1,29 г, 12,85 ммоль) и метиловый эфир меркаптоуксусной кислоты (1,14 г, 10,83 ммоль) добавляли к ацетонитрилу (50 мл), предварительно продутому аргоном (10 мин). После добавления 4-бром 2-фторбензальдегида (2 г, 9,852 ммоль) полученную смесь нагревали для кипячения с обратным холодильником при 85C на протяжении ночи. Ход реакции контролировали ТСХ (20% раствор этилацетата в гексане). Реакционную смесь охлаждали, концентрировали, подщелачивали 10% раствором NaOH и экс- 22023064 трагировали этилацетатом, получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (5% раствор этилацетата в гексане) давала 2,4 г продукта (выход 90%). 1H-ЯМР (CDCl3, 300 МГц):8,18-8,0 (дд, 2 Н), 7,8-7,7 (д, 1H), 7,65-7,59 (дд, 1H), 4,1-4,0 (с, 3H). Получение промежуточного соединения 6-бромбензо[b]тиофен-2-карбоновой кислоты (I-25b):LiOHH2O (1,85 г, 44 ммоль) и воду (20 мл) добавляли к перемешиваемому раствору метилового эфира 6-бромбензо[b]тиофен-2-карбоновой кислоты (I-25 а: 2,4 г, 8,85 ммоль) в ТГФ (25 мл) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Ход реакции контролировали ТСХ (100% этилацетат). Реакционную смесь концентрировали, подкисляли 2 н. HCl,фильтровали и остаток промывали н-гексаном, получая при этом 1,9 г продукта (выход 84%). 1H-ЯМР (ДМСО-D6, 300 МГц):14,0-14,03 (шир., 1H), 8,4-8,39 (д, 1H), 8,28-8,1 (д, 1H), 8,18-8,0 (д,1H), 7,78-7,62 (дд, 1H). Чистота по ЖХ-МС 99%, m/z=255,9 (M+1). Получение промежуточного соединения 6-бромбензо[b]тиофена (I-25C)DBU (1,21 г, 8,00 ммоль) добавляли к перемешиваемому раствору 6-бромбензо[b]тиофен-2 карбоновой кислоты (I-25b: 2,4 г, 8,85 ммоль) в DMA (4 мл) при комнатной температуре и полученную смесь нагревали в микроволновой печи при 200C в течение 1 ч. Ход реакции контролировали ТСХ (50% раствор этилацетата в гексане). Реакционную смесь подкисляли 1 н. HCl и экстрагировали этилацетатом. Органический слой концентрировали и очищали колоночной хроматографией на силикагеле (100% гексан), получая при этом 320 мг продукта (выход 78%). 1H-ЯМР (CDCl3, 300 МГц):8,18-8,0 (д, 1H), 7,7-7,6 (д, 1H), 7,5-7,59 (д, 1H), 7,59-7,42 (д, 1H), 7,37,29 (д, 1H). Получение промежуточного соединения 6-бром-2-фторбензо[b]тиофена (I-25d) С применением аналогичных условий реакции и реагентов, как описано в примере 20 для получения I-20 а, 6-бромбензо[b]тиофен (I-25 с: 0,5 г, 2,347 ммоль) в сухом ТГФ подвергали реакции с N-фторбензолсульфонимидом (1,33 г, 4,22 ммоль), н-бутиллитием (1,76 мл, 3,52 ммоль), диизопропиламином(0,57 мл, 3,99 ммоль), получая при этом сырой продукт. Очистка колоночной хроматографией на силикагеле (100% гексан) давала 176 мг продукта (выход 33%). 1H-ЯМР (CDCl3, 300 МГц): 6 7,97-7,82 (д, 1H), 7,56-7,52 (дд, 2 Н), 6,5-6,3 (д, 1H). Получение указанного в заголовке соединения 1-(4-циклопропилпиридин-3-ил)-3-(2-фторбензо(b) тиофен-6-ил)имидазолидин-2-она (25 А). С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил) имидазолидин-2-он (I-1d: 150 мг, 0,738 ммоль) подвергали взаимодействию с 6-бром-2-фторбензо[b]тиофеном (I-25d; 170,6 мг, 0,738 ммоль), иодидом меди (14,2, 0,071 ммоль), трансN,N'-диметилциклогексан-1,2-диамином (10,2 мг, 0,071 ммоль), фосфатом калия (469,9 мг, 2,21 ммоль) и 1,4-диоксаном (5 мл), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (1% раствор метанола в CHCl3) с последующей очисткой препаративной ВЭЖХ давала 11,6 мг продукта (выход 4%). 1H-ЯМР (CDCl3, 400 МГц):8,51 (с, 1H), 8,42-8,41 (д, 1H), 8,04-8,03 (д, 1H), 7,61-7,54 (м, 2 Н), 6,816,80 (д, 1H), 6,66-6,65 (д, 1H), 4,14-4,10 (м, 2 Н), 4,02-3,97 (м, 2 Н), 2,11-2,04 (м, 1H), 1,21-1,10 (м, 2 Н),0,88-0,81 (м, 2 Н). Чистота по ЖХ-МС 99%, m/z=354,1 (M+1). Чистота по ВЭЖХ 91%. Пример 26. Получение 1-(4-циклопропилпиридин-3-ил)-3-(4-фторбензо[b]тиофен-6-ил)имидазолидин-2-она (26 А) Получение промежуточно го продукта 4-бром-2,6-дифторбензальдегида (I-26 а) С применением аналогичных условий реакции и реагентов, как описано в примере 20 для получения указанного выше соединения I-20 а, 1-бром-3,5-дифторбензол (2 г, 2,1036 ммоль) в ТГФ подвергали реакции с ДМФА (1,43 г, 19,68 ммоль) н-бутиллитием (1,56 мл, 12,4 ммоль) и диизопропиламином (0,57 мл, 15,5 ммоль), получая при этом сырой продукт. Очистка колоночной хроматографией на силикагелеH-ЯМР (CDCl3, 300 МГц):11,5-11,0 (с, 1H), 7,4-7,2 (дд, 2 Н). Получение промежуточного продукта метилового эфира 6-бром-4-фторбензо[b]тиофен-2-карбоновой кислоты (I-26b) С применением аналогичных условий реакции и реагентов, как описано в примере 25 для получения I-25 а, 4-бром-2,6-дифторбензальдегид (I-26 а: 2,8 г, 12,8 ммоль) подвергали взаимодействию с TEA(1,66 г, 16,47 ммоль), метиловым эфиром меркаптоуксусной кислоты (1,47 г, 13,83 ммоль) и ацетонитрилом (50 мл), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (2% этилацетата в гексане) давала 2,3 г продукта (выход 64%). 1 Н-ЯМР (CDCl3, 400 МГц):8,098 (д, 1H), 7,80 (с, 1H), 7,26-7,23 (м, 1H), 3,96 (с, 3H). Получение промежуточного продукта 6-бром-4-фторбензо[b]тиофен-2-карбоновой кислоты (I-26 с) С применением аналогичных реагентов и условий реакции, как описано в примере 25 для получения указанного выше соединения I-25b, метиловый эфир 6-бром-4-фторбензо[b]тиофен-2-карбоновой кислоты (I-26b: 2,3 г, 7,85 ммоль) в ТГФ (25 мл) гидролизовали посредством LiOH (1,65 г, 39,38 ммоль) и воды (20 мл), получая при этом 1,9 г продукта (выход 83%). 1H-ЯМР (ДМСО-D6, 300 МГц):14,0-14,03 (шир., 1H), 8,38-8,32 (д, 1H), 8,18-8,0 (с, 1H), 7,7-7,6 (дд,1H). Получение промежуточного продукта 6-бром-4-фтор-бензо[b]тиофена (I-26d) С применением аналогичных условий реакции и реагентов, как описано в примере 25 для получения указанного выше соединения I-25 с, 6-бром-4-фторбензо[b]тиофен-2-карбоновую кислоту (I-26 с: 1,8 г, 6,47 ммоль) в DMA (4 мл) и DBU (4,0 г, 26,54 ммоль) нагревали в микроволновой печи, получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (100% гексан) давала 1,45 г продукта (выход 97%). 1 Н-ЯМР (CDCl3, 300 МГц):7,9-7,8 (д, 1H), 7,5-7,48 (дд, 2 Н), 7,3-7,22 (д, 1H). Получение указанного в заголовке соединения 1-(4-циклопропилпиридин-3-ил)-3-(4-фторбензо[b]тиофен-6-ил)имидазолидин-2-она (26 А). С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил)имидазолидин-2-он (I-1d: 120 мг, 0,591 ммоль) подвергали взаимодействию с 6-бром-4-фтор-бензо[b]тиофеном (I-26d: 163,6 мг, 0,738 ммоль), иодидом меди (11,2 мг, 0,059 ммоль),транс-N,N'-диметилциклогексан-1,2-диамином (8,9 мг, 0,0591 ммоль), фосфатом калия (375,9 мг, 1,7 ммоль) и 1,4-диоксаном (5 мл). Очистка колоночной хроматографией на силикагеле (0,3% метанола вCHCl3), получая при этом 51,2 мг продукта (выход 26%). 1H-ЯМР (CDCl3, 400 МГц):9,20-8,20 (м, 2 Н), 7,80 (с, 1H), 7,61-7,57 (дд, 1H), 7,40-7,37 (д, 1H), 7,357,32 (д, 1H), 6,83-6,81 (д, 1H), 4,15-4,10 (м, 2 Н), 4,03-4,00 (м, 2 Н), 2,08-2,04 (м, 1H), 1,15-1,10 (м, 2 Н),0,88-0,82 (м, 2 Н). Чистота по ЖХ-МС 93%, m/z=354,1 (M+1). Чистота по ВЭЖХ 94%. Получение промежуточного соединения 4-бром-2,5-дифторбензальдегида (I-27 а) н-Бутиллитий (3,6 мл, 7,7 ммоль) добавляли по каплям к раствору 1,4-дибром-2,5-дифторбензола (2 г, 7,35 ммоль) в сухом простом эфире при -78C в атмосфере азота и полученную смесь перемешивали при -78 С в течение 30 мин. За этим следовало добавление ДМФА (0,85 мл, 11,03 ммоль) в сухом ТГФ. Полученную смесь перемешивали при комнатной температуре в течение 1 ч. Ход реакции контролировали ТСХ (5% раствор этилацетата в гексане). Реакционную смесь распределяли между этилацетатом и насыщенным раствором хлорида аммония. Органический слой концентрировали и очищали колоночной хроматографией на силикагеле (2% раствор этилацетата в гексане), получая при этом 600 мг продуктаH-ЯМР (CDCl3, 300 МГц):10,27-10,26 (д, 1H), 7,61-7,57 (т, 1H), 7,49-7,44 (кв., 1H). Получение промежуточного продукта метилового эфира 6-бром-5-фторбензо[b]тиофен-2 карбоновой кислоты (I-27b) С применением аналогичных условий реакции и реагентов, как описано в примере 25 для получения указанного выше соединения I-25 а, 4-бром-2,5-дифторбензальдегид (I-27 а: 1,71 г, 7,73 ммоль) подвергали взаимодействию с TEA (1,4 мл, 10,05 ммоль), метиловым эфиром меркаптоуксусной кислоты(920 мг, 8,51 ммоль) и ацетонитрилом (50 мл), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (5% раствор этилацетата в гексане) давала 2,3 г продукта (выход 64%). 1H-ЯМР (CDCl3, 300 МГц):8,1-7,95 (м, 2 Н), 7,65-7,55 (д, 1H), 3,95 (с, 3H). Получение промежуточного продукта 6-бром-5-фторбензо[b]тиофен-2-карбоновой кислоты (I-27 с) С применением аналогичных реагентов и условий реакции, как описано в примере 25 для получения указанного выше соединения I-25b, метиловый эфир 6-бром-5-фтор-бензо[b]тиофен-2-карбоновой кислоты (I-27b: 0,3 г, 1,0 ммоль) в ТГФ (10 мл) гидролизовали посредством LiOH (87 мг, 2,04 ммоль) и воды (2 мл), получая при этом 250 мг продукта (выход 88%). 1 Н-ЯМР (ДМСО-D6, 300 МГц):8,54-8,48 (д, 1H), 8,06-7,94 (м, 2 Н). Получение промежуточного продукта 6-бром-5-фтор-бензо[b]тиофена (I-27d) С применением аналогичных условий реакции и реагентов, как описано в примере 25 для получения указанного выше соединения I-25 с, 6-бром-5-фторбензо[b]тиофен-2-карбоновую кислоту (I-27 с: 250 мг, 0,89 ммоль) в DMA (4 мл) и DBU (550 мл, 3,6 ммоль) нагревали в микроволновой печи, получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (100% гексан) давала 180 мг продукта (выход 86%). 1H-ЯМР (CDCl3, 300 МГц):8,06-8,0 (д, 1H), 7,58-7,48 (т, 2 Н), 7,28-7,24 (д, 1H). Получение указанного в заголовке соединения 1-(4-циклопропилпиридин-3-ил)-3-(5-фторбензо[b] тиофен-6-ил)имидазолидин-2-она (27 А). С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4 циклопропилпиридин-3-ил)имидазолидин-2-он (I-1d: 100 мг, 0,491 ммоль) подвергали взаимодействию с 6-бром-5-фтор-бензо[b]тиофеном (I-27d: 136 мг, 0,5901 ммоль), иодидом меди (28 мг, 0,147 ммоль),транс-N,N'-диметилциклогексан-1,2-диамином (21 мг, 0,147 ммоль), фосфатом калия (313,9 мг, 1,7 ммоль) и 1,4-диоксаном (5 мл), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (1% раствор метанола в CHCl3) давала 80 мг продукта (выход 46%). 1H-ЯМР (CDCl3, 300 МГц):8,85-8,20 (м, 2 Н), 8,10-8,0 (д, 1H), 7,60-7,48 (м, 2 Н), 7,32-7,20 (с, 1H),7,0-6,8 (шир.с, 1H), 4,20-4,10 (м, 4 Н), 2,20-2,05 (м, 1H), 1,20-1,10 (м, 2 Н), 0,88-0,82 (м, 2 Н). Чистота по ЖХ-МС 99%, m/z=354,0 (M+1). Чистота по ВЭЖХ 96%. Пример 28. Получение 1-(4-циклопропилпиридин-3-ил)-3-(6-фторбензо[b]тиофен-5-ил)имидазолидин-2-она (28 А) Получение промежуточного продукта 5-бром-2,4-дифторбензальдегида (I-28 а) С применением аналогичных реагентов и условий реакции, как описано в примере 27 для получения указанного выше соединения I-27 а, 1,5-дибром-2,4-дифторбензол (3 г, 11,07 ммоль) в сухом простом эфире подвергали реакции с ДМФА (1,05 мл, 14,39 ммоль) и н-бутиллитием (6,08 мл, 11,56 ммоль), получая при этом сырой продукт. Очистка колоночной хроматографией на силикагеле (2% раствор этилацетата в гексане) давала 1,5 г продукта (выход 61%). 1 С помощью аналогичных условий реакции и реагентов, как описано в примере 25 для получения указанного выше соединения I-25 а, 5-бром-2,4-дифторбензальдегид (I-28 а: 475 мг, 2,149 ммоль) подвергали взаимодействию с TEA (0,748 мл, 5,372 ммоль), метиловым эфиром меркаптоуксусной кислоты(0,211 мл, 2,36 ммоль) и ДМСО (4 мл), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (1,5% раствор этилацетата в гексане) давала 30 мг продукта (выход 5%). 1 С применением аналогичных реагентов и условий реакции, как описано в примере 25 для получения указанного выше соединения I-25b, метил-5-бром-6-фторбензо[b]тиофен-2-карбоксилат (I-28b: 0,3 г,1,038 ммоль) в ТГФ (10 мл) гидролизовали в посредством LiOH (300 мг, 1,038 ммоль) и воды (2 мл), получая при этом 240 мг продукта (выход 85). 1 Н-ЯМР (ДМСО-D6, 300 МГц):8,40-8,38 (д, 1H), 8,19-8,16 (м, 1H), 8, 09-8, 05 (м, 1H). Получение промежуточного продукта 5-бром-6-фторбензо[b]тиофена (I-28d) С применением аналогичных условий реакции и реагентов, как описано в примере 25 для получения указанного выше соединения I-25 с, 5-бром-6-фторбензо[b]тиофен-2-карбоновую кислоту (I-28 с: 240 мг, 0,875 ммоль) в DMA (4 мл) и DBU (0,523 мл, 3,503 ммоль) нагревали в микроволновой печи, получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (100% гексан) давала 110 мг продукта (выход 55%). 1[b]тиофен-5-ил)имидазолидин-2-она (28 А). С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 1-(4- 26023064 циклопропилпиридин-3-ил)имидазолидин-2-он (I-1d: 90 г, 0,443 ммоль) подвергали взаимодействию с 5 бром-6-фторбензо[b]тиофеном (I-28d: 102 мг, 0,443 ммоль), 1,4-диоксаном (4 мл), иодидом меди (9 мг,0,044 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (19 мг, 0,132 ммоль) и фосфатом калия (282 мг, 1,329 ммоль), получая при этом неочищенный продукт. Очистка препаративной ВЭЖХ давала 9 мг продукта (выход 6%). 1H-ЯМР (CDCl3, 300 МГц):8,55 (с, 1H), 8,43-8,41 (д, 1H), 8,0-7,97 (д, 1H), 7,66-7,62 (д, 1H), 7,437,41 (д, 1H), 7,29-7,26 (д, 1H), 6,83-6,81 (д, 1H), 4,10-4,01 (м, 4 Н), 2,13-2,10 (м, 1H), 1,18-1,15 (м, 2 Н), 0,840,82 (м, 2 Н). Чистота по ЖХ-МС 98%, m/z=354,1 (M+1). Чистота по ВЭЖХ 96%. Пример 29. Получение 1-(4-циклопропилпиридин-3-ил)-3-(5-фтор-3-метилбензо[b]тиофен-6-ил) имидазолидин-2-она (29 А) С применением аналогичных реагентов и условий реакции, как описано в примере 24 для получения указанного выше соединения I-24 а, 3-бром-4-фтор-бензолтиол (2,0 г, 9,756 ммоль) подвергали взаимодействию с 1-хлорпропан-2-оном (0,86 мл, 10,73 ммоль), ДМФА (6,0 мл) и карбонатом калия (2,69 г,19,51 ммоль), получая при этом неочищенный продукт, который очищали на колонке с силикагелем (5% раствор этилацетата в гексане) и получали 2,1 г продукта (выход 82%). 1 С применением аналогичных реагентов и условий реакции, как описано в примере 24 для получения указанного выше соединения I-24b, 1-(3-бром-4-фторфенилсульфанил)пропан-2-он (I-29 а; 2,1 г, 8,015 ммоль) в толуоле (10 мл) подвергали циклизации под действием полифосфорной кислоты (8 г), получая при этом неочищенный продукт, который очищали колоночной хроматографией на силикагеле (100% гексан) и получали 1,4 г продукта (выход 72%). 1H-ЯМР (CDCl3, 300 МГц):8,02-7,96 (д, 1H), 7,72-7,64 (кв., 1H), 7,44-7,38 (д, 1H), 2,4 (с, 3H). Получение указанного в заголовке соединения, 1-(4-циклопропилпиридин-3-ил)-3-(5-фтор-3 метилбензо[b]тиофен-6-ил)имидазолидин-2-она (29 А). С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 4 циклопропилпиридин-3-ил)имидазолидин-2-он (I-1d: 150 мг, 0,7389 ммоль) подвергали взаимодействию с 6-бром-5-фтор-3-метилбензо[b]тиофеном (I-29b: 216 мг, 0,8866 ммоль), 1,4-диоксаном (5 мл), иодидом меди (14,07 мг, 0,0738 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (10,4 мг, 0,0738 ммоль) и фосфатом калия (469,9 мг, 2,2167 ммоль), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (1% раствор метанола в хлороформе) с последующей очисткой препаративной ВЭЖХ давала 62 мг продукта (выход 22%). 1(с, 1H), 6,81-6,80 (д, 1H), 4,20-4,10 (м, 2 Н), 4,05-3,99 (м, 2 Н), 2,40 (с, 3H) 2,2-2,1 (м, 1H), 1,17-1,14 (м, 2 Н),0,83-0,82 (м, 2 Н). Чистота по ЖХ-МС 100%, m/z=368,1 (M+1). Чистота по ВЭЖХ 97%. Пример 30. Получение (1R,5S)-2-(2-хлорпиридин-4-ил)-4-(4-циклопропилпиридин-3-ил)-2,4 диазабицикло[3.1.0]гексан-3-она (энантиомер I: 30A-I) и (1S,5R)-2-(2-хлорпиридин-4-ил)-4-(4 циклопропилпиридин-3-ил)-2,4-диазабицикло[3.1.0]гексан-3-она (энантиомер II: 30A-II) Получение промежуточного продукта 4-циклопропил-3-иодпиридина (I-30 а) Изоамилнитрит (2,62 мг, 22,38 ммоль) добавляли к перемешиваемому раствору 4 циклопропилпиридин-3-амина (1,0 г, 7,46 ммоль) в сухом ТГФ (15 мл) в атмосфере аргона. Затем к смеси добавляли дииодметан (3,0 мл, 22,38 ммоль) и иодид меди (1,42 г, 7,46 ммоль). Полученную смесь кипятили с обратным холодильником при 80C в течение 1 ч. Реакционную смесь охлаждали, фильтровали и фильтрат распределяли между этилацетатом и водой. Органический слой концентрировали, получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (15% раствор этилацетата в гексане) давала 600 мг продукта (выход 34%). 1H-ЯМР (CDCl3, 400 МГц):8,84 (с, 1H), 8,35-8,34 (д, 1H), 6,73-6,71 (д, 1H) 2,10-2,04 (м, 1H), 1,171,12 (м, 2 Н), 0,78-0,74 (м, 2 Н). Получение промежуточного продукта бензил-4-(2-хлорпиридин-4-ил)-3-оксо-2,4-диазабицикло С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, бензил 3-оксо-2,4-диазабицикло[3.1.0]гексан-2-карбоксилат (200 мг, 0,861 моль) подвергали взаимодействию с 2-хлор-4-иодпиридином (227 мг, 0,947 ммоль), ксантфосом (45 мг, 0,077 ммоль), Pd2(dba)3 (24 мг, 0,025 ммоль), карбонатом цезия (421 мг, 1,29 ммоль) и 1,4-диоксаном (12 мл) при 100C в течение 3 ч. Очистка колоночной хроматографией на силикагеле (50% раствор этилацетата в гексане) давала 220 мг продукта(выход 75%). Чистота по ЖХ-МС: 96%, M/Z==344,0 (M+1). Получение промежуточного соединения 2-(2-хлорлиридин-4-ил)-2,4-диазабицикло[3.0,1]гексан-3 она (I-30 с) Раствор бензил-4-(2-хлорпиридин-4-ил)-3-оксо-2,4-диазабицикло[3.1.0]гексан-2-карбоксилата (I30b: 20,0 мг, 0,058 ммоль) в 3,0 мл 6 н HCl нагревали до 100C в течение 1 ч. Полученную смесь подщелачивали 1 н. раствором NaOH. Реакционную смесь охлаждали и распределяли между этилацетатом и водой. Органический слой концентрировали и промывали гексаном, получая при этом 10 мг продукта(м, 1H), 1,05-1,02 (кв., 1H), 0,62-0,59 (кв., 1H). Чистота по ЖХ-МС 90%, m/z = 210,0 (М+1). Получение указанного в заголовке соединения 2-(2-хлорпиридин-4-ил)-4-(4-циклопропилпиридин 3-ил)-2,4-диазабицикло[3.1.0]гексан-3-она (рацемической смеси) (30 А). С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 2-(2 хлорпиридин-4-ил)-2,4-диазабицикло[3.1.0]гексан-3-он (I-30 с: 90 мг, 0,43 ммоль) подвергали взаимодействию с 4-циклопропил-3-иодпиридином (I-30 а: 116 мг, 0,47 ммоль), иодидом меди (8 мг, 0,043 ммоль),транс-N,N'-диметилциклогексан-1,2-диамином (6,1 мг, 0,043 ммоль), фосфатом калия (228 мг, 1,07 ммоль) и 1,4-диоксаном (5 мл), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (1,5% раствор метанола в CHCl3) давала 15 мг продукта (выход 11%). 1H-ЯМР (CDCl3, 400 МГц):8,51 (с, 1H), 8,45-8,44 (д, 1H), 8,32-8,31 (д, 1H), 7,71-7,67 (м, 2 Н), 6,856,84 (д, 1H), 3,72-3,61 (м, 2 Н), 2,07-2,03 (м, 1H), 1,28-1,10 (м, 3H), 0,93-0,78 (м, 3H). Чистота по ЖХ-МС 97%, m/z=327,1 (М+1). Чистота по ВЭЖХ 96%. Рацемическую смесь 2-(2-хлорпиридин-4-ил)-4-(4-циклопропилпиридин-3-ил)-2,4-диазабицикло[3.1.0]гексан-3-она (30 А) дополнительно разделяли хиральной препаративной ВЭЖХ (подвижные фазы А: н-гексан; В: IPA, колонка: CHIRALPAK AD-H (25010 мм, 5 мк), скорость потока: 7 мл/мин, элюирование: изократическое (80% А:20% В), разбавитель: IPA, приблизительные времена удерживания пиков: 15,0 мин (пик I) и 24,0 мин (пик II, получая при этом два чистых изомера: энантиомер I (30A-I) и энантиомер II (30A-II). Энантиомер I (30A-I). Н-ЯМР (CDCl3, 400 МГц):8,60-8,38 (м, 2 Н), 8,31-8,29 (д, 1H), 7,69-7,66 (м, 2 Н), 6,86 (с, 1H), 3,713,66 (м, 1H), 3,64-3,60 (м, 1H), 2,09-2,01 (м, 1H), 1,35-1,10 (м, 3H), 0,95-0,75 (м, 3H). Чистота по ЖХ-МС 100%, m/z = 327,1 (М+1). Чистота по ВЭЖХ 99%. Энантиомер II (30A-II). 1(М+1). Чистота по ВЭЖХ 100%. Пример 31. Получение (1S,5R)-2-(4-циклопролилпиридин-3-ил)-4-(2-метоксипиридин-4-ил)-2,4 диазабицикло[3.1.0]гексан-3-она (энантиомера I: 31A-I) и (1R,5S)-2-(4-циклопропилпиридин-3-ил)-4-(2 метоксипиридин-4-ил)-2,4-диазабицикло[3.1.0]гексан-3-она (энантиомера II: 31A-II): 1 Получение промежуточного соединения диазабицикло[3.1.0]гексан-2-карбоксилата (I-31 а): бензил-4-(2-метоксипиридин-4-ил)-3-оксо-2,4 С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, бензил 3-оксо-2,4-диазабицикло[3.1.0]гексан-2-карбоксилат (50 мг, 0,215 ммоль) подвергают взаимодействию с 4-бром-2-метоксипиридином (44,5 мг, 0,237 ммоль), ксантфосом (11 мг, 0,019 ммоль), Pd2(dba)3 (6,0 мг,0,006 ммоль), карбонатом цезия (105 мг, 0,32 ммоль) и 1,4-диоксаном (3,0 мл) в запаянной трубке при 100C в течение 2,5 ч. Очистка колоночной хроматографией на силикагеле (50% раствор этилацетата в гексане) давала (35% раствор этилацетата в гексане) 30 мг продукта (выход 41%). 1H-ЯМР (CDCl3, 300 МГц):8,12-8,10 (д, 1H), 7,47-7,34 (м, 6 Н), 6,95-6,94 (д, 1H), 5,4-5,3 (кв., 2 Н),3,95 (с, 3H), 3,94-3,82 (м, 1H), 3,48-3,43 (м, 1H), 1,2-1,14 (кв., 1H), 0,75-0,70 (м, 1H). Получение промежуточного соединения 2-(2-метоксипиридин-4-ил)-2,4-диазабицикло[3.1.0]гексан 3-она (I-31b) С применением аналогичных реагентов и условий реакции, как описано в примере 30 для получения указанного выше соединения I-30 с, бензил-4-(2-метоксипиридин-4-ил)-3-оксо-2,4-диазабицикло[3.1.0]гексан-2-карбоксилат (150,0 мг, 0,442 ммоль) обрабатывали 10,0 мл 6 н. HCl, получая при этом сырой продукт. Очистка колоночной хроматографией на силикагеле (1,5% раствор метанола в хлороформе) давала 60 мг продукта (выход 67%). 1H-ЯМР (ДМСО-D6, 300 МГц):8,18 (с, 1H), 8,02-8,00 (д, 1H), 7,38-7,32 (дд, 1H), 6,957-6,951 (д,1H). Получение указанного в заголовке соединения 2-(4-циклопропилпиридин-3-ил)-4-(2-метоксипиридин-4-ил)-2,4-диазабицикло[3.1.0]гексан-3-она (31 А). С применением аналогичных реагентов и условий реакции, как описано выше в примере 1, 2-(2 метоксипиридин-4-ил)-2,4-диазабицикло[3.1.0]гексан-3-он (I-31b: 140 мг, 0,682 ммоль) подвергали взаимодействию с 4-циклопропил-3-иодпиридином (I-30 а: 200 мг, 0,819 ммоль), иодидом меди (13 мг, 0,0682 ммоль), транс-N,N'-диметилциклогексан-1,2-диамином (10 мг, 0,0682 ммоль), фосфатом калия (435 мг,2,05 ммоль) и 1,4-диоксаном (10 мл), получая при этом неочищенный продукт. Очистка колоночной хроматографией на силикагеле (1,5% раствор метанола в хлороформе) давала 120 мг продукта (выход 57%). 1(д, 1H), 6,83-6,82 (д, 1H), 3,95 (с, 3H), 3,68-3,55 (м, 2 Н), 2,09-2,04 (м, 1H), 1,20-0,9 (м, 3H), 0,91-0,79 (м,3H). Чистота по ЖХ-МС 98%, m/z=323,1 (M+1). Чистота по ВЭЖХ 99%. Рацемическую смесь 2-(4-циклопропилпиридин-3-ил)-4-(2-метоксипиридин-4-ил)-2,4-диазабицикло[3.1.0]гексан-3-она (31 А) дополнительно разделяли хиральной препаративной ВЭЖХ (подвижные фазы А: н-гексан, В: IPA, колонка: CHIRALPAK AD-H (25010 мм, 5 мк), скорость потока: 5 мл/мин, элюирование: изократическое (75% А:25% В), разбавитель: этанол, приблизительные времена удерживания пиков: 18,8 мин (пик I) и 26,5 мин (пик II, получая при этом два чистых изомера: энантиомер I (31A-I) и знантиомер II (31A-II).
МПК / Метки
МПК: C07D 401/14, C07D 401/04, A61K 31/444, A61K 31/4439, C07D 405/04, C07D 409/14, A61K 31/506, A61K 31/4436, A61P 35/00
Метки: ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-23064-ingibitory-17alpha-gidroksilazy-c1720-liazy.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы 17α-гидроксилазы/c17,20-лиазы</a>
Предыдущий патент: Способ определения содержания сероводорода в сырой нефти и кубовых остатках
Следующий патент: Способ изготовления бумажной продукции
Случайный патент: Способ противоточной регенерации ионитов


































