Пиперидиноновые производные как ингибиторы mdm2, фармацевтическая композиция, содержащая их, и способ лечения рака
Номер патента: 23004
Опубликовано: 29.04.2016
Авторы: Ровето Филип Марли, Макминн Дастин, Чэнь Сяоци, Хит Джули Энн, Макги Лоуренс, Ли Чжихун, Михалик Джеффри Томас, Ли Ихун, Дейгнан Джеффри, Фу Цзяшэн, Чжу Цзян, Юй Мин, Бартбергер Майкл Дэвид, Хуан Синь, Джонсон Майкл, Гастин Дарин Джеймс, Лай Суцзен, Дукветт Джейсон, Сунь Дацин, Ван Сяодун, Фишер Бенджамин, Медина Хулио Сезар, Лю Цзивень, Ван Инцай, Гонсалес Буэнростро Ана, Рью Йосуп, Копески Дэвид Джон, Экстерович Джон, Лукас Брайан Стюарт, Олсон Стивен Ховард, Кайзер Франк, Ма Чжихуа, Янь Сюэлэй, Фокс Брайан Мэттью, Цзяо Сяньюнь, Лоу Джонатан Данте, Фу Цзыцэ, Гонсалес Лопес Де Турисо Феликс, Гриббл Майкл Уилльям, Макинтош Джоэл, Коннорс Ричард Виктор, Бек Хилари Плэйк
Формула / Реферат
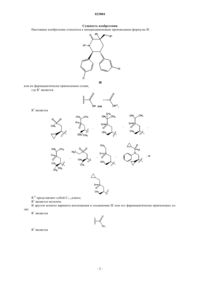
1. Соединение формулы IE
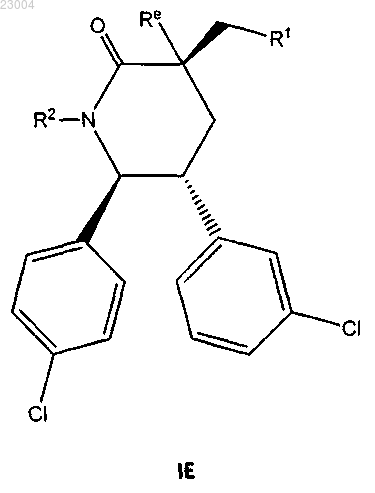
или его фармацевтически приемлемая соль,
где R1 является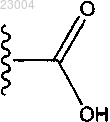 или
или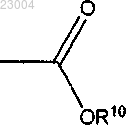 ;
;
R2 является

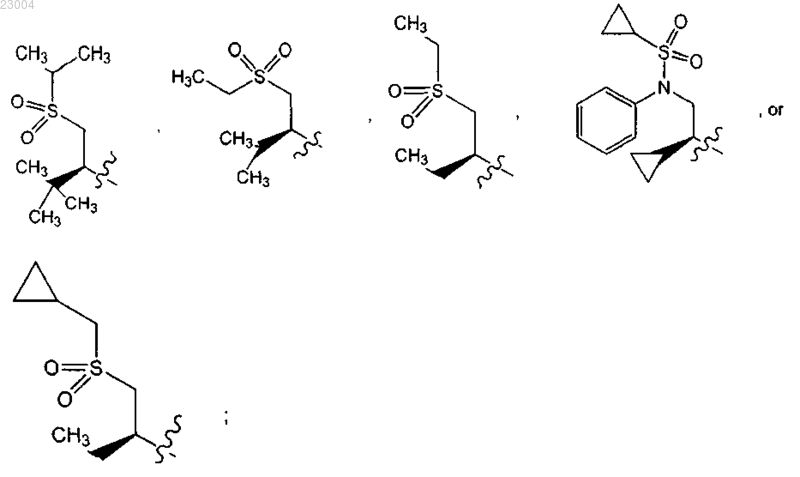
R10 представляет собой С1-12алкил;
Re является метилом.
2. Соединение по п.1 или его фармацевтически приемлемая соль, отличающееся тем, что
R1 является ;
;
R2 является
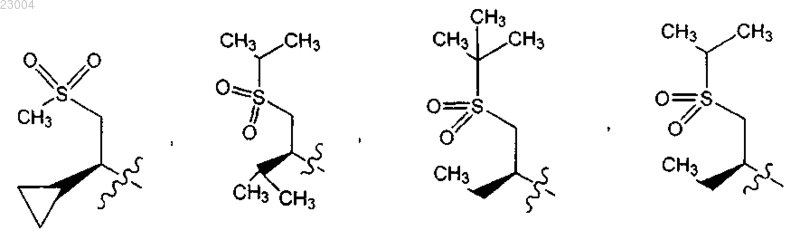
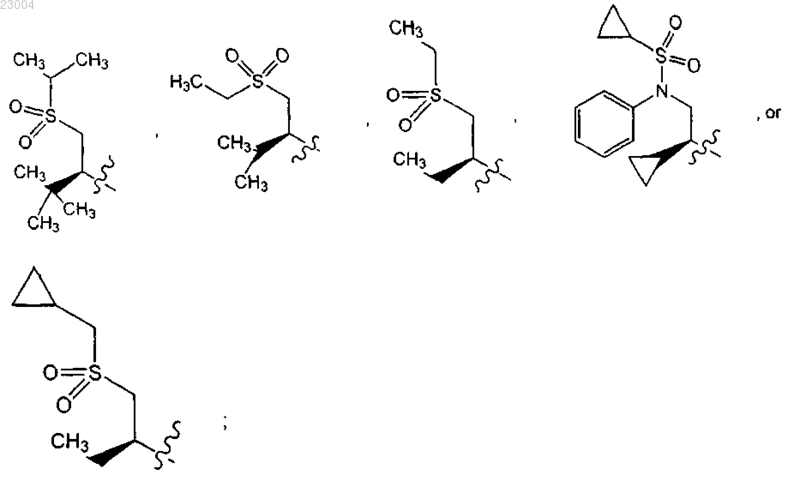
Re является метилом.
3. Соединение, выбранное из
2-((3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-((S)-1-циклопропил-2-(N-фенилциклопропансульфонамидо)этил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-((3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-((S)-1-циклопропил-2-(метилсульфонамидо)этил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-((3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-((S)-1-((циклопропилметил)сульфонил)бутан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-((3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-((S)-1-(этилсульфонил)бутан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-((3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-((S)-1-(изопропилсульфонил)бутан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-((3R,5R,6S)-1-((S)-1-(трет-бутилсульфонил)бутан-2-ил)-5-(3-хлорфенил)-6-(4-хлорфенил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-((3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-((S)-1-циклопропил-2-(метилсульфонил)этил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-((3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-((S)-1-(этилсульфонил)-3-метил6утан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-((3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-((S)-1-(изопропилсульфонил)-3-метилбутан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-((3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-((S)-1-(этилсульфонил)-3,3-диметилбутан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-((3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-((S)-1-(изопропилсульфонил)-3,3-диметилбутан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-циклопропил-2-(N-фенилциклопропансульфонамидо)этил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-((циклопропилметил)сульфонил)бутан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-(этилсульфонил)бутан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-(изопропилсульфонил)бутан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-(1-(1-(трет-бутилсульфонил)бутан-2-ил)-5-(3-хлорфенил)-6-(4-хлорфенил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-циклопропил-2-(метилсульфонил)этил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-(этилсульфонил)-3-метилбутан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-(изопропилсульфонил)-3-метилбутан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-(изопропилсульфонил)-3,3-диметилбутан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты;
2-((3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-((S)-1-циклопропил-2-(N-фенилциклопропансульфонамидо)этил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты или
2-((3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-((S)-1-((циклопропилметил)сульфонил)бутан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты,
или его фармацевтически приемлемой соли.
4. Соединение 2-((3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-((S)-1-(изопропилсульфонил)-3-метилбутан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты или ее фармацевтически приемлемая соль.
5. Соединение 2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-(изопропилсульфонил)-3-метилбутан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты.
6. Фармацевтическая композиция для лечения рака, включающая соединение по любому из пп.1-5, вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем.
7. Способ лечения рака у пациента, нуждающегося в таком лечении, включающий введение этому пациенту эффективного количества дозы соединения по любому из пп.1-5.
Текст
ПИПЕРИДИНОНОВЫЕ ПРОИЗВОДНЫЕ КАК ИНГИБИТОРЫ MDM2,ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИХ, И СПОСОБ ЛЕЧЕНИЯ РАКА Бартбергер Майкл Дэвид, Гонсалес Буэнростро Ана, Бек Хилари Плэйк, Чэнь Сяоци, Коннорс Ричард Виктор, Дейгнан Джеффри, Дукветт Джейсон, Экстерович Джон, Фишер Бенджамин,Фокс Брайан Мэттью, Фу Цзяшэн, Фу Цзыцэ,Гонсалес Лопес де Турисо Феликс, Гриббл Майкл Уилльям, мл., Гастин Дарин Джеймс, Хит Джули Энн, Хуан Синь, Цзяо Сяньюнь, Джонсон Майкл,Кайзер Франк, Копески Дэвид Джон, Лай Суцзен,Ли Ихун, Ли Чжихун, Лю Цзивэнь, Лоу Джонатан Данте, Лукас Брайан Стюарт, Ма Чжихуа, Макги Лоуренс, Макинтош Джоэл, Макминн Дастин,Медина Хулио Сезар, Михалик Джеффри Томас,Олсон Стивен Ховард, Рью Йосуп, Ровето Филип Марли, Сунь Дацин, Ван Сяодун, Ван Инцай, Янь Сюэлэй, Юй Мин, Чжу Цзян (US) В изобретении представлены производные пиперидинона как ингибиторы MDM2 формулы (IE) или его фармацевтически приемлемая соль, где R1 являетсяR10 представляет собой С 1-12 алкил и Re является метилом. Эти соединения являются полезными в качестве терапевтических средств, в частности для лечения раковых заболеваний. Изобретение также относится к фармацевтическим композициям, содержащим указанные соединения (ингибитор MDM2). Область техники Настоящее изобретение относится к соединениям, которые являются ингибиторами MDM2, которые являются полезными в качестве терапевтических средств, в частности для лечения рака. Настоящее изобретение также относится к фармацевтическим композициям, содержащим ингибитор MDM2. Уровень техники р 53 является супрессором опухолей и фактором транскрипции, реагирующим на клеточный стресс путем активации транскрипции различных генов, участвующих в остановке клеточного цикла, апоптозе,старении клеток и восстановлении ДНК. В отличие от нормальных клеток, в которых не часто возникают причины для активации р 53, клетки опухоли постоянно находятся под воздействием клеточного стресса из-за различных повреждений, включая гипоксию и проапоптическую онкогенную активацию. Поэтому существует мощное селективное преимущество для инактивации пути р 53 в опухолях и предполагается,что исключение функции р 53 может быть предпосылкой для выживания опухоли. В подтверждение этого замечания три группы исследователей использовали модели на мышах, чтобы показать, что отсутствие функции р 53 является неразрывным требованием для сохранения устоявшихся опухолей. Когда исследователи восстановили функцию р 53 в опухолях с инактивированным р 53, эти опухоли регрессировали. р 53 инактивируется мутацией и/или потерей 50% солидных опухолей и 10% жидких опухолей. При раке генетически или эпигенетически изменяются также другие важные члены пути р 53. Описано, что онкобелок MDM2 ингибирует функцию р 53 и активируется генной амплификацией в целых 10% случаев заболеваемости. MDM2, в свою очередь, ингибируется другим супрессором опухоли, p14ARF. Предполагается, что нисходящие изменения после р 53 могут отвечать, по меньшей мере, за частичную инактивацию пути р 53 в опухолях р 53WT (р 53 дикого типа). В подтверждение этой концепции некоторые опухоли p53WT демонстрируют пониженную апоптическую способность, несмотря на то, что их способность подвергаться остановке клеточного цикла остается незатронутой. Одна из стратегий лечения рака включает использование низкомолекулярных веществ, связывающих MDM2 и нейтрализующих его взаимодействие с р 53. MDM2 ингибирует активность р 53 по трем механизмам: 1) действуя в качестве Е 3 убиквитин лигазы для промотирования разрушения р 53; 2) связываясь с транскрипционный доменом активации р 53 и блокируя его; и 3) экспортируя р 53 из ядер в цитоплазму. Все три этих механизма блокируются нейтрализацией взаимодействия MDM2-p53. В частности, эта терапевтическая стратегия может применяться в случае опухолей, которые являются р 53WT, а исследования с низкомолекулярными ингибиторами MDM2 дают многообещающее снижение роста опухоли как in vitro, так и in vivo. Далее, у пациентов с р 53-инактивированными опухолями стабилизация р 53 дикого типа в нормальных тканях за счет ингибирования MDM2 может обеспечить селективную защиту нормальных тканей от митотических ядов. Настоящее изобретение относится к соединениям, способным ингибировать взаимодействие между р 53 и MDM2 и активировать р 53 нисходящие эффекторные гены. Следовательно, соединения настоящего изобретения являются полезными при лечении рака, бактериальных инфекций, вирусных инфекций,язв и воспаления. В частности, соединения настоящего изобретения являются полезными для лечения солидных опухолей, таких как рак молочной железы, ободочной кишки, легких и простаты; а также жидких опухолей, таких как лимфомы и лейкозы. При использовании в настоящем документе MDM2 обозначает белок MDM2 человека, а р 53 обозначает белок р 53 человека. Следует отметить, что MDM2 человека может также упоминаться как HDM2 или hMDM2. Сущность изобретения Настоящее изобретение относится к пиперидиноновым производным формулы IE или их фармацевтически приемлемым солям,где R1 являетсяRe является метилом. В другом аспекте варианта воплощения в соединении IE или его фармацевтически приемлемых соляхRe является метилом. В другом аспекте настоящего изобретения представлено соединение или его фармацевтически приемлемая соль, выбранное из 2-3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-циклопропил-2-(Nфенилциклопропансульфонамидо)этил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты; 2-3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-циклопропил-2-(метилсульфонамидо)этил)3-метил-2-оксопиперидин-3-ил)уксусной кислоты; 2-3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-циклопропилметил)сульфонил)бутан-2 ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты; 2-3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-(этилсульфонил)бутан-2-ил)-3-метил-2 оксопиперидин-3-ил)уксусной кислоты; 2-3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-(изопропилсульфонил)бутан-2-ил)-3 метил-2-оксопиперидин-3-ил)уксусной кислоты; 2-3R,5R,6S)-1-S)-1-(трет-бутилсульфонил)бутан-2-ил)-5-(3-хлорфенил)-6-(4-хлорфенил)-3 метил-2-оксопиперидин-3-ил)уксусной кислоты; 2-3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-циклопропил-2-(метилсульфонил)этил)-3 метил-2-оксопиперидин-3-ил)уксусной кислоты; 2-3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-(этилсульфонил)-3-метилбутан-2-ил)-3 метил-2-оксопиперидин-3-ил)уксусной кислоты; 2-3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-(изопропилсульфонил)-3-метилбутан-2 ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты; 2-3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-(этилсульфонил)-3,3-диметилбутан-2-ил)-3 метил-2-оксопиперидин-3-ил)уксусной кислоты; 2-3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-(изопропилсульфонил)-3,3-диметилбутан 2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты; 2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-циклопропил-2-(Nфенилциклопропансульфонамидо)этил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты; 2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-циклопропилметил)сульфонил)бутан-2-ил)-3-метил-2 оксопиперидин-3-ил)уксусной кислоты; 2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-(этилсульфонил)бутан-2-ил)-3-метил-2-оксопиперидин-3 ил)уксусной кислоты; 2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-(изопропилсульфонил)бутан-2-ил)-3-метил-2 оксопиперидин-3-ил)уксусной кислоты; 2-(1-(1-(трет-бутилсульфонил)бутан-2-ил)-5-(3-хлорфенил)-6-(4-хлорфенил)-3-метил-2 оксопиперидин-3-ил)уксусной кислоты; 2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-циклопропил-2-(метилсульфонил)этил)-3-метил-2 оксопиперидин-3-ил)уксусной кислоты; 2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-(этилсульфонил)-3-метилбутан-2-ил)-3-метил-2-3 023004 оксопиперидин-3-ил)уксусной кислоты; 2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-(изопропилсульфонил)-3-метилбутан-2-ил)-3-метил-2 оксопиперидин-3-ил)уксусной кислоты; 2-(5-(3-хлорфенил)-6-(4-хлорфенил)-1-(1-(изопропилсульфонил)-3,3-диметилбутан-2-ил)-3-метил-2 оксопиперидин-3-ил)уксусной кислоты; 2-3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-циклопропил-2-(Nфенилциклопропансульфонамидо)этил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты или 2-3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-циклопропилметил)сульфонил)бутан-2 ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты. или их фармацевтически приемлемых солей. В другом аспекте настоящего изобретения представлено соединение 2-3R,5R,6S)-5-(3-хлорфенил)6-(4-хлорфенил)-1-S)-1-(изопропилсульфонил)-3-метилбутан-2-ил)-3-метил-2-оксопиперидин-3 ил)уксусной кислоты или ее фармацевтически приемлемая соль. В другом аспекте настоящего изобретения представлено соединение 2-(5-(3-хлорфенил)-6-(4 хлорфенил)-1-(1-(изопропилсульфонил)-3-метилбутан-2-ил)-3-метил-2-оксопиперидин-3-ил)уксусной кислоты. В настоящем изобретении представлены фармацевтические композиции, включающие соединение любого из представленных выше аспектов или вариантов или его фармацевтически приемлемую соль,вместе с фармацевтически приемлемым инертным наполнителем, разбавителем или носителем. В настоящем изобретении представлен также способ лечения рака у пациента, нуждающегося в таком лечении, способ, включающий введение этому пациенту эффективного количества дозы соединения в соответствии с любым из представленных выше аспектов или вариантов воплощения или его фармацевтически приемлемой соли. Подробное описание изобретения Термин "Н" обозначает один атом водорода. Этот радикал может быть присоединен, например, к атому кислорода с образованием гидроксильного радикала. При использовании термина "алкил", отдельно или в составе других терминов, таких как "галоалкил" или "алкиламино", он включает линейные или разветвленные радикалы, имеющие от 1 до около 12 атомов углерода. Более предпочтительными алкиловыми радикалами являются "низшие алкиловые" радикалы, имеющие от 1 до около 6 атомов углерода. Примеры таких радикалов включают метил, этил, нпропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил, гексил и т.п. Еще более предпочтительными являются низшие алкиловые радикалы, имеющие один или два атома углерода. Термин "алкиленил" или "алкилен" включают мостиковые двухвалентные алкиловые радикалы, такие как метиленил или этиленил. Термин "низший алкил, замещенный R2" не включает ацетальную группу. Термин "алкил" дополнительно включает алкиловые радикалы, где один или несколько атомов углерода в цепи замещены гетероатомом, выбранным из кислорода, азота или серы. Термин "включает" не является ограничением, включая указанный компонент, но не исключая другие элементы. Группа или атом, замещающий атом водорода, также называются заместителем. Любая конкретная молекула или группа может содержать один или несколько заместителей в зависимости от количества атомов водорода, которые могут быть замещены. Символ "-" представляет ковалентную связь и может также использоваться в радикальной группе для указания точки присоединения к другой группе. В химических структурах этот символ обычно используется для представления метиловой группы в молекуле. Термин "терапевтически эффективное количество" означает количество соединения, которое улучшает, ослабляет или исключает один или несколько симптомов определенного заболевания или состояния, или предотвращает или задерживает возникновение одного или нескольких симптомов определенного заболевания или состояния. Термины "пациент" и "субъект" могут использоваться взаимозаменяемо и означают животных, таких как собаки, кошки, коровы, лошади, овцы и люди. В частности, пациентами являются млекопитающие. Термин "пациент" включает самцов и самок. Термин "фармацевтически приемлемое" означает, что упомянутое вещество, такое как соединение формулы IE или соль соединения формулы IE, или композиция, содержащая соединение формулы IE,или определенный инертный наполнитель являются пригодными для введения пациенту. Термин "лечение", "лечить" и им подобные термины включают превентивное (например, профилактическое) и паллиативное лечение. Термин "инертный наполнитель" означает фармацевтически приемлемую добавку, носитель, разбавитель, адъювант или другой компонент, отличный от активного фармацевтического компонента (API),который обычно включается в композицию и/или вводится пациенту.-4 023004 Соединения настоящего изобретения вводятся пациенту в терапевтически эффективном количестве. Эти соединения могут вводиться по отдельности или как часть фармацевтически приемлемой композиции или состава. Кроме того, соединения или композиции могут вводиться полностью за один раз, как,например, при инъекции ударной дозы, многократно, как при серийном приеме таблеток, или доставляться в основном равномерно в течение какого-либо периода времени, например, как при использовании трансдермальной доставки. Следует также отметить, что дозировка соединения настоящего изобретения может изменяться с течением времени. Кроме того, соединения настоящего изобретения могут вводиться по отдельности, в сочетании с другими соединениями настоящего изобретения или с другими фармацевтически активными соединениями. Другие фармацевтически активные соединения могут предназначаться для лечения того же заболевания или состояния, что и соединения настоящего изобретения, или для лечения другого заболевания или состояния. Если пациенту будет вводиться или вводится несколько фармацевтически активных соединений, то эти соединения могут вводиться одновременно или последовательно. Например, в случае таблеток активные соединения могут находиться в одной таблетке или в разных таблетках, которые могут вводиться одновременно или последовательно в любом порядке. Кроме того, следует понимать, что эти композиции могут быть в разных формах. Например, одно или несколько соединений может доставляться в виде таблеток, тогда как другие вводятся инъекциями или перорально в виде сиропа. Подразумеваются все комбинации, способы доставки и последовательности введения. Термин "рак" означает физиологическое состояние млекопитающих, характеризующееся неконтролируемым клеточным ростом. Основные классы раковых заболеваний включают карциномы, лимфомы,саркомы и бластомы. Соединения настоящего изобретения могут использоваться для лечения рака. Способы лечения рака включают введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы IE или его фармацевтически приемлемой соли. Соединения настоящего изобретения могут использоваться для лечения опухолей. Способы лечения опухоли включают введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы IE или его фармацевтически приемлемой соли. Соединения настоящего изобретения могут использоваться в производстве лекарственных средств для лечения такого состояния, как рак. Раковые заболевания, которые могут лечиться соединениями настоящего изобретения, включают,без ограничений, такие карциномы, как рак мочевого пузыря, молочной железы, ободочной кишки, прямой кишки, почек, печени, легких (мелкоклеточный рак легких и немелкоклеточный рак легких), пищевода, желчного пузыря, яичников, поджелудочной железы, желудка, шейки матки, щитовидной железы,простаты и кожи (в том числе карциному сквамозных клеток); гемопоэтических опухолей лимфоидного происхождения (в том числе лейкоз, острый лимфоцитарный лейкоз, хронический миелогенный лейкоз,острый лимфобластный лейкоз, В-клеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина,неходжкинскую лимфому, лимфому клеток волос и лимфому Буркетта); гемопоэтические опухоли миелоидного происхождения (в том числе острый и хронический миелобластный лейкозы, миелодиспластический синдром и промиелоцитарный лейкоз); опухоли мезенхимального происхождения (в том числе фибросаркому и рабдомиосаркому и другие саркомы, например саркому мягких тканей и костей); опухоли центральной и периферической нервной системы (в том числе астроцитому, нейробластому, глиому и шванному), а также другие опухоли (включая меланому, семиному, тератокарциному, остеосаркому,пигментую ксенодерому, кератоктантому, фолликулярный рак щитовидной железы и саркому Калоши). Другие раковые заболевания, которые могут лечиться соединениями настоящего изобретения, включают рак эндометрия, рак головы и шеи, глиобластому, злокачественные асциты и гемопоэтические раковые заболевания. Конкретные виды рака, которые могут лечиться соединениями настоящего изобретения, включают саркомы мягких тканей, рак костей, такой как остеосаркома, опухоли молочной железы, рак мочевого пузыря, синдром Ли-Фраумени, опухоли мозга, рабдомиосаркому, адренокортикальную карциному, рак ободочной и прямой кишки, немелкоклеточный рак легких и острый миелогенный лейкоз (AML). В отдельном варианте воплощения настоящего изобретения, связанном с лечением рака, рак идентифицируется как р 53 дикого типа (p53WT). В другом отдельном варианте воплощения рак идентифицируется как p53WT и мутант CDKN2A. В другом аспекте настоящего изобретения представлен диагностический способ для определения того, каким пациентам следует вводить соединение настоящего изобретения. Например, может быть взят и проанализирован образец раковых клеток пациента для определения статуса раковых клеток в отношении р 53 и/или CDKN2A. В одном аспекте пациент, страдающий раком,являющимся p53WT, выбирается для лечения среди пациентов, страдающих раком, являющимся мутированным в отношении р 53. В другом аспекте пациент, страдающий раком, являющимся р 53WT и имеющим мутантный белок CDNK2A, выбирается среди пациентов, не имеющих этих характеристик. Взятие раковых клеток для анализов хорошо известно специалистам в данной области. Термин "p53WT" обозначает белок, кодированный геномной ДНК последовательностьюNC 000017 версии 9 (7512445, , 7531642) (GenBank); белок, кодированный кДНК последовательно-5 023004 стьюNM 000546 (GenBank); или белок, имеющий последовательность GenBankNP 000537.3. Термин "мутант CDNK2A" обозначает белок CDNK2A, не являющийся белком дикого типа. Термин "CDNK2A дикого типа" обозначает белок, кодированный геномной ДНК последовательностью 9:21957751-21984490 (Ensembl ID); белок, кодированный кДНК последовательностьюNM 000077 (GenBank) или NM 058195 9GenBank); или белок, имеющий последовательность GenBankNP 000068 или NP 478102. Соединения настоящего изобретения могут также использоваться для лечения некоторых заболеваний, которые не относятся к настоящему изобретению, перечисленных ниже, а именно для лечения гиперпролиферативных нарушений, таких как тироидная гиперплазия (особенно Базедова болезнь), и кисты (такие как гиперваскулярность рака яичников, характерная для синдрома поликистозных яичников(синдром Штейна-Левенталя. Соединения настоящего изобретения могут также использоваться для лечения следующих заболеваний или состояний: астмы, хронической обструктивной болезни легких (COPD), эмфиземы, псориаза,контактного дерматита, конъюнктивита, аллергического ринита, системной красной волчанки (SLE), неспецифического язвенного колита, болезни Крона, рассеянного склероза, ревматоидного артрита, воспалительных заболеваний кишечника, болезни Альцгеймера, атеросклероза и болезни Хантингтона. Соединения настоящего изобретения также могут использоваться для лечения воспалительных заболеваний, гипоксии, язв, вирусных инфекций, бактериальных инфекций и бактериального сепсиса. Соединения формулы IE или их фармацевтически приемлемые соли могут вводиться в комбинации с одним или несколькими дополнительными фармацевтически активными соединениями/средствами. Дополнительное фармацевтически активное средство является средством, которое может использоваться для лечения рака. Например, дополнительное фармацевтически активное средство может быть выбрано из противоопухолевых средств, антиангиогенных средств, химиотерапевтических средств и средств пептидной терапии рака. В другом варианте воплощения противоопухолевые средства выбраны из средств антибиотического типа, алкилирующих средств, антиметаболитных средств, гормональных средств, иммунологических средств, средств типа интерферона, ингибиторов киназы, смешанных средств и их комбинаций. Следует отметить, что дополнительные фармацевтически активные соединения/средства могут быть обычными небольшими органическими химическими молекулами или быть макромолекулами, такими как белки, антитела, пептидные антитела, ДНК, РНК или фрагментами этих макромолекул. Примеры отдельных фармацевтически активных средств, которые могут использоваться для лечения раковых заболеваний и которые могут использоваться в комбинации с одним или несколькими соединениями настоящего изобретения, включают метотрексат; тамоксифен; фторурацил; 5-фторурацил; гидроксимочевину; меркаптопурин; цисплатин; карбоплатин; даунорубицин; доксорубицин; этопозид; винбластин; винкристин; паклитаксель; тиогуанин; идарубицин; дактиномицин; иматиниб; гемцитабин; алтретамин; аспарагиназу; блеомицин; капецитабин; кармустин; кладрибин, насыщенный раствор NaCl; циклофосфамин; цитарабин; декаразин; доцетаксел; идарубицин, ифосфамид; иринотекан; флударабин; митосмицин; митоксан; митоксантрон; топотекан; винорелбин; адриамицин; митрам; имихимод; алемтузмаб; экземестан; бевацизумаб; цетуксимаб; азацитидин; клофарабин; децитабин; дезатиниб; дексразоксан; доцетаксел; эпирубицин; оксалиплатин; эрлотиниб; ралоксифен; фулвестрант; летрозол; гефитиниб; гемтузумаб; трастузумаб; гефитиниб; иксабепилон; лапатиниб; леналидомид; аминолевулиновую кислоту; темозоломид; неларабин; сорафениб; нилотиниб; пэгаспаргазу; пеметрексед; ритуксимаб; дазатиниб; талидомид; бексаротен; темзиролимус; бортезомиб; вориностат; капецитабин; золедроновую кислоту; анастрозол; сунитиниб; апрепитант и неларабин или их фармацевтически приемлемые соли. Дополнительные фармацевтически активные средства, которые могут использоваться для лечения раковых заболеваний и которые могут использоваться в комбинации с одним или несколькими соединениями настоящего изобретения, включают ингибиторы фактора роста эндотелия сосудов (VEGF), ингибиторы фактора роста гепатоцитов/рассеивающего фактора (HGF/SF), ингибиторы ангиопоэтина 1 и/или 2, агонисты индуцирующего апоптоз лиганда, связанного с фактором некроза опухоли (TRAIL), рекомбинантный апо 2 лиганд человека (TRAIL), ингибиторы рецептора инсулин-подобного фактора роста 1(IGFR-1), ингибиторы cFMS, ингибиторы HER 2, ингибиторы c-met, ингибиторы киназы Aurora, ингибиторы CDK 4 и/или 6 и ингибиторы B-raf. Другие дополнительные фармацевтически активные средства, которые могут использоваться при лечении раковых заболеваний и которые могут использоваться в комбинации с одним или несколькими соединениями настоящего изобретения, включают конъюгаты антитело-лекарство (ADC), посредством которых антитело, связывающееся с белком, предпочтительно на раковой клетке, соединяется при помощи линкера с химическим соединением, которое является пагубным для раковой клетки. Примеры химических соединений, которые являются пагубными для раковых клеток, включают производные майтанзиноида и производные ауристатина. Другие дополнительные фармацевтически активные средства, которые могут использоваться для лечения раковых заболеваний и которые могут использоваться в комбинации с одним или несколькими соединениями настоящего изобретения, включают эпоэтин альфа, дарбепоэтин альфа; панитумумаб; пегфилграстим; палифермин; филграстим; деносумаб; анцестим; AMG 102; AMG 319; AMG 386;(Мотесаниб) или их фармацевтически приемлемые соли. В другом аспекте настоящее изобретение относится к применению соединений настоящего изобретения в комбинации с одним или несколькими фармацевтическими средствами, которые являются ингибиторами белка в пути фосфатидилинозитол 3-киназы (PI3K). Комбинации соединений настоящего изобретения вместе с ингибиторами белков в пути PI3K показали синергию в анализах роста раковых клетках, включая усиленный апоптоз и киллинг клеток. Примеры белков в пути PI3K включают PI3K, mTOR и PKB (известный также как Akt). Белок PI3K существует в нескольких изоформах, включая , ,или . Предполагается, что ингибитор PI3K, который может использоваться в комбинации с соединением настоящего изобретения, может быть селективным для одной или нескольких изоформ. Под селективностью понимается, что эти соединения ингибируют одну или несколько изоформ сильнее, чем другие изоформы. Селективность является концепцией, хорошо известной специалистам в данной области, и она может быть измерена хорошо известными анализами активности in vitro или клеточными анализами. Предпочтительная селективность включает более чем в 2 раза, предпочтительно в 10 раз или более предпочтительно в 100 раз больше для одной или нескольких изоформ по сравнению с другими изоформами. В одном аспекте ингибиторы PI3K, которые могут использоваться в комбинации с соединениями настоящего изобретения, являются селективными ингибиторами PI3K . В другом аспекте соединение является селективным ингибитором PI3K . Примеры ингибиторов PI3K, которые могут использоваться в комбинации с одним или несколькими соединениями настоящего изобретения, включают ингибиторы, описанные в следующих публикациях: опубликованная заявка РСТWO 2010/151791; опубликованная заявка РСТWO 2010/151737; опубликованная заявка РСТWO 2010/151735; опубликованная заявка РСТWO 2010151740; опубликованная заявка РСТWO 2008/118455; опубликованная заявка РСТWO 2008/118454; опубликованная заявка РСТWO 2008/118468; опубликованная заявка СШАUS 20100331293; опубликованная заявка СШАUS 20100331306; опубликованная заявка СШАUS 20090023761; опубликованная заявка СШАUS 20090030002; опубликованная заявка СШАUS 20090137581; опубликованная заявка СШАUS 2009/0054405; опубликованная заявка СШАUS 2009/0163489; опубликованная заявка СШАUS 2010/0273764; опубликованная заявка СШАUS 2011/0092504 или опубликованная заявка РСТWO 2010/108074. или их фармацевтически приемлемые соли.-8 023004 Также предпочтительным является соединение формулы IIa или его фармацевтически приемлемая соль где X1 является фтором или водородом;Y1 является водородом или метилом;Z1 является водородом или метилом. Известны соединения, ингибирующие одновременно PI3K и mTOR (двойные ингибиторы). Двойные ингибиторы PI3K и mTOR могут использоваться в комбинации с соединением настоящего изобретения.mTOR является белком в пути PI3K. Ингибитор mTOR может использоваться в комбинации с одним или несколькими соединениями настоящего изобретения. Ингибиторы mTOR, которые могут использоваться в комбинации с соединениями настоящего изобретения, включают ингибиторы, описанные в следующих документах: опубликованная заявка РСТWO 2010/132598 или опубликованная заявка РСТWO 2010/096314.PKB (Akt) также является белком в пути PI3K. Ингибитор mTOR также может использоваться в комбинации с одним или несколькими соединениями настоящего изобретения. Ингибиторы PKB, которые могут использоваться в комбинации с соединениями настоящего изобретения, включают ингибиторы, описанные в следующих документах: патент США 7354944; патент США 7700636; патент США 7919514; патент США 7514566; публикация патентной заявки СШАUS 2009/0270445 А 1; патент США 7919504; патент США 7897619 или опубликованная заявка РСТWO 2010/083246 А 1. Соединения настоящего изобретения могут использоваться в комбинации с ингибиторами CDK4 и/или CDK6. Ингибиторы CDK4 и/или CDK6, которые могут использоваться в комбинации с соединениями настоящего изобретения, включают ингибиторы, описанные в следующих документах: опубликованная заявка РСТWO 2009/085185 или опубликованная патентная заявка СШАUS 2011/0097305. Соединения настоящего изобретения могут также использоваться в комбинации с фармацевтически активными средствами, предназначенными для лечения тошноты. Примеры средств, которые могут применяться для лечения тошноты, включают дронабинол; гранисетрон; метоклопрамид; ондансетрон и прохлорперазин или их фармацевтически приемлемые соли. Кроме того, соединения настоящего изобретения могут использоваться в комбинации с другими средствами, которые могут применяться для лечения рака, такими как ацеманнан; акларубицин; алдеслейкин; алитретиноин; амифостин; амрубицин; амсакрин; анагрелид; арглабин, триоксид мышьяка; ВАМ 002 (Novelos); бикалутамид; броксуридин; целмолейкин; цетрореликс; кладрибин, клотримазол, DA 3030(Dong-A); даклизумаб; денилейкин дифтитокс; деслорелин; дилазеп; докозанол; доксеркалциферол; доксифлуридин; бромокриптин; цитарабин; HIT диклофенак; интерферон альфа; третиноин; эделфозин; эдреколомаб; эфлорнитин; эмитефур; эпирубицин; эпоэтин бета; этопозида фосфат; эксисулинд; фадрозол,финастерид, флударабина фосфат; форместан; фотемустин, галлия нитрат; гемтузумаб зогамицин; комбинации гимерацил/отерацил/тегафур; гликопин; гозерелин; гептаплатин; хорионический гонадотропин человека, фетальный альфа-фетопротеин человека; ибандроновая кислота; интерферон альфа, природный интерферон альфа; интерферон альфа-2, интерферон альфа-2 а; интерферон альфа-2b, интерферон альфаN1, интерферон альфа-n3; интерферон альфакон-1, природный интерферон альфа; интерферон бета, интерферон бета-1 а; интерферон бета-1b, природный интерферон гамма; интерферон гамма-1 а; интерферон гамма-1b, интерлейкин-1 бета; иобенгуан; ирзогладин; ланреотид; LC 9018 (Yakult); лефлуномид; ленограстим; лентинан сульфат; летрозол; лейкоцитарный альфа-интерферон; лейпрорелин; левамизол + фторурацил; лиарозол; лобаплатин; лонидамин; ловастатин; мазопрокол; меларсопрол; метоклопрамид; мифепристон; милтефозин; миримостим; несопряженная двухцепочечная РНК; митогуазон; митолактол; митоксантрон; молграбостим; нафарелин; налоксон + пентазоцин; нартограстим; недаплатин; нилутамид; носкапин, новый эритропоэз-стимулирующий белок; HCK 631570 октреотид; опрелвекин; осатерон; пак-9 023004 литаксел; памидроновая кислота; пегинтерферон альфа-2b; пентозанполисульфат натрия; пентостатин; пицибанил; пирарубицин; антитимоцитарные поликлональные антитела кролика; полиэтиленгликоль интерферон альфа-2 а; порфимер натрия; ралтитрексед; расбуриказа; рения Re 186 этидронат; RII ретинамид; ромуртид; самария (153 Sm) лексидронам; сарграмостим; сизофиран; собузоксан; сонермин, стронция-89 хлорид; сурамин; тазонермин; тазаротен; тегафур; темопорфин; тенипозид; тетрахлордекаоксид; тимальфазин; тиротропин альфа; торемифен; тозитумомаб-йод-131; треосульфан; третиноин; трилостан; триметрексат; трипторелин; природный альфа-фактор некроза опухоли; убенимекс; вакцина рака мочевого пузыря; вакцина Маруяма; лизат-вакцина меланомы; валрубицин; вертепорфин; вирулизин; зиностатина стималамер; абареликс; АЕ 941 (Aeterna); амбамустин; антисмысловый олигонуклеотид; bcl-2EL 532 (Elan); EM 800 (Endorecherche); энилурацил; этанидазол; фенретинид; филграстим SD01 (Amgen); галоцитабин; гастрина 17 иммуноген, генная терапия HLA-B7 (Vical); колониестимулирующий фактор макрофагов гранулоцитов; гистамина дигидрохлорид; ибритумомаб тиуксетан; иломастат, IM 862LYM-1-йод-131 (Techniclone); MAb полиморфного эпителиального муцин-иттрия 90 (Antisoma); маримастат; меногарил; митумомаб; мотексафин гадолиния, MX 6 (Galderma); нолатрексед; белок Р 30; пегвизомант; порфиромицин; приномастат; RL 0903 (Shire); рубитекан; сатраплатин; натрия фенилацетат; спарфозовая кислота; SRL 172 (SR Pharma); SU 5416 (Pfizer), ТА 077 (Tanabe); тетратиомолибдат; талибластин; тромбопоэтин; олова этилэтиопурпурин; тирапазамин; противоопухолевая вакцина (Biomira); вакцина меланомы (Нью-Йоркский университет); вакцина меланомы (Институт Слоан Кеттеринг); вакцина онколизата меланомы (Медицинский институт Нью-Йорка); вакцина лизатов клеток вирусной меланомы (Королевская больница Ньюкасла) или валсподар. Следует отметить, что перечисленные выше средства могут также вводиться в виде фармацевтически приемлемых солей, если это уместно. Соединения настоящего изобретения могут использоваться также в комбинации с лучевой терапией, гормональной терапией, хирургической и иммунотерапией, которые хорошо известны специалистам в данной области. Поскольку использование соединений настоящего изобретения рассматривается в комбинации с фармацевтически активными соединениями, которые могут вводиться по отдельности, то они могут комбинироваться в виде отдельных фармацевтических композиций в форме набора. Набор включает две отдельные фармацевтические композиции: соединение настоящего изобретения и второе фармацевтическое соединение. В набор входит упаковка для хранения отдельных композиций, такая как градуированная бутылка или градуированный пленочный пакет. Дополнительные примеры емкостей включают шприцы, коробки и упаковочные пакеты. Обычно набор включает руководство по использованию отдельных компонентов. Форма набора имеет особое преимущество в случае, если отдельные компоненты предпочтительно вводятся в различных лекарственных формах (например, перорально и парентерально),вводятся с различными интервалами дозировок или если капельное введение индивидуальных компонентов композиции предусмотрено предписанием врача или ветеринара. Примером такого набора является так называемая блистерная упаковка. Блистерные упаковки хорошо известны в упаковочной промышленности и широко используются для упаковки фармацевтических форм разовых доз (таблетки, капсулы и т.п.). Блистерные упаковки обычно состоят из листа относительно жесткого материала, покрытого пленкой, предпочтительно из прозрачного пластика. В процессе упаковки в пластиковой пленке образуются углубления. Углубления имеют размер и форму упаковываемых таблеток или капсул. Затем таблетки или капсулы помещают в эти углубления и приваривают лист относительно жесткого материала к пластиковой пленке с лицевой стороны пленки, находящейся с противоположной стороны относительно направления формования углублений. В результате таблетки или капсулы являются герметизированными в углублениях между пластиковой пленкой и листом. Предпочтительно жесткость листа является такой, чтобы таблетки или капсулы можно было вынуть из блистерной упаковки вручную, надавив на углубление, в результате чего в листе возникает отверстие на месте углубления. Затем таблетку или капсулу можно вынуть через указанное отверстие. Может быть желательным предоставить в наборе памятку, например, в форме номеров последующих таблеток или капсул, где номера соответствуют дням определенного режима приема таблеток или капсул. Другим примером такой памятки является распечатанный на карточке календарь, например, с обозначением "Первая неделя, понедельник, вторник,и т.д. Вторая неделя, понедельник, вторник,и т.д.". Очевидными являются другие варианты памяток. "Дневная доза" может быть одной таблеткой или капсулой или несколькими пилюлями или капсулами для приема за один день. Также дневная доза одного соединения настоящего изобретения может состоять из одной таблетки или капсулы, тогда как дневная доза другого соединения может состоять из нескольких таблеток или капсул, и наоборот. Памятка должна отражать это и способствовать правильному введению активных соединений. Соединение настоящего изобретения может быть помещено в дозатор для дозировки дневных доз на один прием, для обеспечения их применения по назначению. Предпочтительно дозатор оснащен па- 10023004 мяткой для дополнительного облегчения соблюдения режима. Примером такой памятки является механический счетчик, показывающий количество дозированных дневных доз. Другим примером такой памятки является микрочиповая память, работающая от батарейки, соединенная с жидкокристаллическим счетчиком или звуковым напоминающим сигналом, который, например, считывает дату последнего приема суточной дозы и/или напоминает о времени следующего приема дозы. Соединения настоящего изобретения и другие фармацевтически активные соединения, при необходимости, могут вводиться пациенту перорально, ректально, парентерально (например, внутривенно,внутримышечно или подкожно), интрацистернально, интравагинально, внутрибрюшинно, интравезикально, локально (например, порошки, мази или капли) или в виде трансбуккального или назального спрея. Рассматриваются все способы введения фармацевтически активного агента, известные специалисту в данной области. Соединения, пригодные для парентерального введения, могут включать физиологически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для восстановления в стерильных инъецируемых растворах или дисперсиях. Примеры пригодных водных и неводных носителей, разбавителей, растворителей или сред включают воду, этанол,полиолы (пропиленгликоль, полиэтиленгликоль, глицерин и т.п.), их соответствующие смеси, растительные масла (такие как оливковое масло) или инъецируемые органические сложные эфиры, такие как этилолеат. Необходимая текучесть может обеспечиваться, например, за счет использования покрытий,таких как лецитин, сохраняющих нужный размер частиц в случае дисперсий, а также при помощи поверхностно-активных веществ. Эти композиции могут содержать также адъюванты, такие как консервирующие, увлажняющие,эмульгирующие и диспергирующие агенты. Заражение микроорганизмами можно предотвратить добавлением различных антибактериальных и противогрибковых средств, например парабенов, хлорбутанола,фенола, сорбиновой кислоты и т.п. Может быть желательным включить изотонические агенты, например сахара, хлорид натрия и т.п. Пролонгированное поглощение инъецируемых фармацевтических композиций может быть осуществлено за счет использования агентов замедленной абсорбции, например, моностеарата алюминия и желатина. Твердые лекарственные формы для перорального введения включают капсулы, таблетки, порошки и гранулы. В таких твердых лекарственных формах активное соединение вводится по меньшей мере с одним обычным инертным формообразующим средством (или носителем), таким как цитрат натрия или фосфат дикальция или (а) наполнителями или сухими разбавителями, такими как, например, крахмалы,лактоза, сахароза, маннит и кремниевая кислота; (b) связующими, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и гуммиарабик; (b) увлажнителями,такими как, например, глицерин; (d) расщепляющими агентами, такими как, например, агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые сложные силикаты и карбонат натрия; (е) ингибиторами растворения, как, например, парафин; (f) ускорителями абсорбции,как, например, четвертичные аммониевые соединения; (g) смачивающими агентами, как, например, цетиловый спирт и глицерина моностеарат; (h) адсорбентами, как, например, каолин и бентонит; и (i) смазочными агентами, как, например, тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли,натрия лаурилсульфат или их смеси. В случае капсул и таблеток лекарственные формы могут также включать буферные агенты. Твердые композиции такого же типа могут также использоваться в качестве наполнителей в мягких и твердых желатиновых капсулах, где используются такие формообразующие вещества как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п. Твердые лекарственные формы, такие как таблетки, драже, капсулы, пилюли и гранулы, могут быть приготовлены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие известные в данной области. Они могут также содержать контрастные агенты и могут иметь такой состав, что активное соединение или соединения высвобождаются в определенной части кишечника замедленным способом. Примерами встраиваемых композиций, которые могут быть использованы, являются полимерные вещества и воски. Активные соединения могут также быть в микроинкапсулированной форме,если это уместно, с одним или несколькими вышеупомянутыми инертными наполнителями. Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, суспензии, сиропы и эликсиры. Помимо активных соединений, жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в этой области, такие как вода или другие растворители, солюбилизирующие агенты и эмульгаторы, например этиловый спирт, изопропиловый спирт,этилкарбонат,этилацетат,бензиловый спирт,бензилбензоат,пропиленгликоль,1,3-бутиленгликоль, диметилформамид, масла, в частности хлопковое масло, арахисовое масло, масло зародышей кукурузы, оливковое масло, касторовое масло и масло семян кунжута, глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбита или смеси этих соединений, и т.п. Кроме таких инертных разбавителей, композиция может также включать адъюванты, такие как смачивающие агенты, эмульгаторы и суспендирующие агенты, подсластители, ароматизаторы и отдуш- 11023004 ки. Суспензии, помимо активного соединения, могут содержать суспендирующие агенты, как, например,этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбита, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагакант или смеси этих соединений и т.п. Композиции для ректального введения являются преимущественно суппозиториями, которые могут быть получены смешиванием соединений настоящего изобретения с соответствующими не раздражающими инертными наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при обычной комнатной температуре, но жидкими при температуре тела и поэтому плавятся в прямой кишке или полости влагалища и высвобождают активный компонент. Лекарственные формы для локального введения соединения настоящего изобретения включают мази, порошки, спреи и средства для ингаляции. Активное соединение или соответствующие соединения смешиваются в стерильных условиях с физиологически приемлемым носителем и любыми консервантами, буферами или газами-вытеснителями, которые могут потребоваться. Предполагается, что глазные композиции, глазные мази, порошки и растворы также входят в настоящее изобретение. Соединения настоящего изобретения могут вводиться пациенту при уровнях дозировки от около 0,1 до около 3000 мг/день. Для нормального взрослого человека с массой тела около 70 кг, дозировка в диапазоне от около 0,01 до около 100 мг на 1 кг массы тела, как правило, является достаточной. Точная доза и уровень дозировки, которые могут быть использованы, зависят от ряда факторов, включая потребность пациента, серьезность состояния или заболевания, подлежащего лечению, и фармакологическую активность вводимого соединения. Определение диапазона дозировки и оптимальных доз для конкретного пациента является обычной для специалиста в данной области. Соединения настоящего изобретения могут вводиться в виде фармацевтически приемлемых солей,сложных эфиров, амидов или пролекарств. Термин "соли" относится к неорганическим и органическим солям соединений настоящего изобретения. Эти соли могут быть получены in situ при окончательном выделении и очистке соединения, или по отдельной реакции очищенного соединения в его свободной основной или кислотной форме с соответствующим органическим или неорганическим основанием или кислотой и выделения образовавшейся соли. Типичные соли включают гидробромид, гидрохлорид,сульфат, бисульфат, нитрат, ацетат, оксалат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат,тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактобионат,лаурилсульфонатные соли и т.п. Соли могут включать катионы на основе щелочных и щелочноземельных металлов, таких как натрий, литий, калий, кальций, магний и т.п., а также нетоксичных катионов аммония, четвертичного аммония и аминных катионов, включая, но не ограничиваясь этим, аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин,этиламин и т.п. См., например, S.M. Berge, et al., "Pharmaceutical Salts", J. Pharm. Sci., 66:1-19 (1977). Примеры фармацевтически приемлемых сложных эфиров соединений настоящего изобретения включают сложные эфиры C1-C8-алкилов. Приемлемые сложные эфиры включают также сложные эфирыC5-C7-циклоалкилов, а также сложные эфиры арилалкилов, таких как бензил. Обычно используются сложные эфиры алкилов C1-C4. Сложные эфиры соединений настоящего изобретения могут быть получены известными в этой области способами. Примеры фармацевтически приемлемых амидов соединений настоящего изобретения включают амиды, полученные из аммиака, первичные алкиламины C1-C8 и вторичные диалкиламины C1-C8. В случае вторичных аминов амин может быть также в форме 5- или 6-членной гетероциклоалкиловой группы,содержащей по меньшей мере один атом азота. Обычно используются амиды, полученные из аммиака,первичные C1-C3-алкиламины и вторичные C1-C2-диалкиламины. Амиды соединений настоящего изобретения могут быть получены известными в этой области способами. Термин "пролекарство" означает соединение, которое in vivo превращается в соединение настоящего изобретения. Превращение может происходить по различным механизмам, таким как гидролиз в крови. Обсуждение использования пролекарств представлено в публикации Т. Higuchi и W. Stella, "ProdrugsPress, 1987. Например, если соединение настоящего изобретения содержит функциональную группу карбоновой кислоты, то пролекарство может включать сложный эфир, полученный замещением атома водорода кислотной группы такой группой как (C1-C8-алкил, (C2-C12)алканоилоксиметил, 1-(алканоилокси)этил,имеющий от 4 до 9 атомов углерода, 1-метил-1-(алканоилокси)этил, имеющий от 5 до 10 атомов углерода, алкоксикарбонилоксиметил, имеющий от 3 до 6 атомов углерода, 1-(алкоксикарбонилокси)этил,имеющий от 4 до 7 атомов углерода, 1-метил-1-(алкоксикарбонилокси)этил, имеющий от 5 до 8 атомов углерода,N-(алкоксикарбонил)аминометил,имеющий от 3 до 9 атомов углерода,1-(N-(алкоксикарбонил)аминометил, имеющий от 4 до 10 атомов углерода, 3-фталидил,4-кротонолактонил, гамма-бутиролактон-4-ил, ди-N,N-(C1-C2)алкиламино(C2-C3)алкил (такой как-диметиламиноэтил), карбамоил(C1-C2)алкил, N,N-ди(C1-C2)алкилкарбамоил(C1-C2)алкил и пипериди- 12023004 но-, пирролидино- или морфолино(С 2-3)алкил. Точно так же, если соединение настоящего изобретения включает спиртовую функциональную группу, пролекарство может быть получено замещением атома водорода спиртовой группы на такую группу,как-аминоациламиноацил, где каждая -аминоациловая группа независимо выбрана из природныхL-аминокислот, -P(O)(OH)2, -P(O)(O(C1-C6)алкил)2, или гликозил (радикал, полученный при отщеплении гидроксильной группы гемиацетальной формы углевода). Соединения настоящего изобретения могут содержать асимметричные или хиральные центры и, таким образом, существовать в различных стереоизомерных формах. Подразумевается, что все стереоизомерные формы соединений, а также их смеси, включая рацемические смеси, являются частью настоящего изобретения. Кроме того, в настоящем изобретении подразумеваются все геометрические и позиционные изомеры. Например, если соединение содержит двойную связь, то подразумеваются обе формы, циси транс-, обозначаемые как S и Е соответственно), а также их смеси. Смеси стереоизомеров, такие как диастереомерные смеси, могут быть разделены на индивидуальные стереохимические компоненты на основании их физико-химических различий такими известными способами, как хроматография и/или фракционная кристаллизация. Энантиомеры также могут быть разделены превращением энантиомерной смеси в диастереомерную смесь по реакции с соответствующим оптически активным соединением (например, спиртом), разделением диастереомеров и превращением(например, гидролизом) индивидуальных диастереомеров в соответствующие чистые энантиомеры. Также некоторые соединения могут быть атропизомерами (например, замещенные биарилы). Соединения настоящего изобретения могут существовать в несольватированных или сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода (гидрат), этанол и т.п. Возможно также, что соединения настоящего изобретения могут существовать в различных таутомерных формах. Рассматриваются все таутомеры соединений настоящего изобретения, например все таутомерные формы тетразоловой группы, а также, например, все кето-енольные или имин-енаминные формы соединений. Специалистам в данной области понятно, что названия соединений и структур, содержащихся в настоящем документе, могут основываться на конкретном таутомере соединения. Хотя может использоваться только одно название или структура конкретного таутомера, подразумевается, что соединения могут находиться во всех таутомерных формах. Подразумевается также, что соединения могут быть синтезированы in vitro при помощи лабораторных методик, которые известны химикам-синтетикам; или синтезированы с использованием методик invivo, таких как метаболизм, ферментация, усвоение и т.п. Предполагается также, что соединения настоящего изобретения могут синтезироваться при помощи комбинации методик in vitro и in vivo. Соединения настоящего изобретения могут быть мечены изотопами, соединения, являющиеся идентичными перечисленным в настоящем документе, за исключением того, что один или несколько атомов замещены атомами, имеющими атомную массу или массовое число, отличное от атомной массы или массового числа, обычно встречающегося в природе. Примеры изотопов, которые могут внедряться в соединения настоящего изобретения, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2 Н, 3 Н, 13 С, 14 С, 15N, 16O, 17O, 18 О, 31 Р, 32 Р, 35S, 18F и 36Cl. В частности, в соединениях один или несколько атомов водорода могут быть замещены атомами дейтерия (2 Н). Соединения настоящего изобретения могут содержать вышеупомянутые изотопы и/или другие изотопы других атомов. Некоторые меченные изотопами соединения настоящего изобретения, например, те,в которые внедрены радиоактивные изотопы, такие как 3 Н и 14 С, используются для анализа распределения лекарства и/или субстрата в тканях. Изотопы трития, т.е. 3 Н, и углерода-14, т.е. 14 С, являются наиболее предпочтительными, благодаря простоте получения и обнаружения. Кроме того, замена на более тяжелые изотопы, такие как дейтерий, т.е.2 Н, может давать определенное терапевтическое преимущество за счет более высокой метаболической устойчивости, например увеличенного периода полувыведения invivo или снижения необходимых дозировок, и поэтому это может быть более выгодно в некоторых условиях. Соединения настоящего изобретения, меченные изотопами, могут, как правило, быть получены заменой легкодоступных меченных изотопами реагентов на реагенты, не меченные изотопами. Соединения настоящего изобретения могут существовать в различных твердых состояниях, включая кристаллические состояния, а также аморфное состояние. Различные кристаллические состояния,также известные как полиморфы, и аморфные состояния настоящего изобретения рассматриваются как часть настоящего изобретения. При синтезе соединений настоящего изобретения может быть желательным использовать определенные уходящие группы. Термин "уходящие группы" ("LG") обычно относится к группам, которые могут быть заменены на нуклеофил. Такие уходящие группы известны специалистам в данной области. Примеры уходящих групп включают, но не ограничиваясь этим, галогениды (например, I, Br, F, Cl),- 13023004 сульфонаты (например, мезилат, тозилат), сульфиды (например, SCH3), N-гидроксисукцинимид,N-гидроксибензотриазол и т.п. Примеры нуклеофилов включают, но не ограничиваясь этим, амины, тиолы, спирты, реактивы Гриньяра, анионные частицы (например, алкоксиды, амиды, карбанионы) и т.п. Все патенты, опубликованные патентные заявки и другие публикации, перечисленные в настоящем документе, включены в настоящий документ путем ссылки. Представленные ниже примеры иллюстрируют отдельные варианты воплощения настоящего изобретения. Предполагается, что эти примеры являются типичными и никоим образом не являются ограничивающими объем формулы изобретения. Если не указано иное, то при использовании процента в отношении твердого вещества, этот процент является весовым процентом относительно упомянутой твердой композиции. При использовании в настоящем документе процента в отношении жидкости этот процент является объемным процентом относительно упомянутого раствора. Спектры 1H ЯМР обычно были записаны на спектрометрической системе Bruker Avance III 500(Bruker, Биллерика, штат Массачусетс), эксплуатируемой при частоте 1 Н 500,13 МГц, оснащенной датчиком Bruker 5 мм PABBI с градиентом z-оси; или на спектрометре Bruker Avarice II 400, эксплуатируемом при частоте 1 Н 400,23 МГц, оснащенном датчиком Bruker 5 мм РАВВО с градиентом z-оси. Для ЯМР анализа образцы обычно растворяли в 500 мкл ДМСО-d6 или CD3OD. Химические сдвиги 1 Н соотносили с сигналами остаточного растворителя ДМСО-d6 при 2,50 и CD3OD при 3,30. Существенные пики табулируются и обычно включают количество протонов, мультиплетность (s,синглет; d, дублет; dd, дублет дублетов; t, триплет; q, квартет; m, мультиплет; br. s., широкий синглет) и константа(ы) взаимодействия в герцах. Масс-спектры электронной ионизации (EI) обычно записывали на ЖХ/МС масс-спектрометреAgilent Technologies 6140 Quadrupole. Результаты масс-спектрометрии представлены как отношение массы к заряду, иногда с последующей относительной распространенностью каждого иона (в скобках). Исходные материалы в представленных ниже примерах, как правило, могут быть закуплены из коммерческих источников, таких как Sigma-Aldrich, Сент-Луис, штат Миссури, или могут быть получены по описанным в литературе способам. В настоящем документе могут использоваться следующие аббревиатуры:- около;DBU - 1,8-диазабицикло[5.4.0]ундец-7-ен; ДХЭ - дихлорэтан; ДХМ - дихлорметан; ДЭА - диэтиламин; Периодинан Десс-Мартина; реактив Десс-Мартина - 1,1,1-триацетокси-1,1-дигидро-1,2 бензйодоксол-3-(1 Н)-он; ДИЭА или ДИПЭА - диизопропилэтиламин; ДМАП - 4-диметиламинопиридин; ДМЭ - 1,2-диметоксиэтан; ДМФ - N,N-диметилформамид; ДМСО - диметилсульфоксид; д.о. - диастереомерное отношение;HATU - О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат. Примеры Общие схемы синтеза. Соединения настоящего изобретения в общем могут быть получены, начиная с имеющихся в продаже исходных материалов, с использованием способов синтеза, известных специалистам в данной области. Ниже представлены некоторые схемы реакций, пригодные для получения соединений настоящего изобретения. Дополнительные пояснения примерами содержатся в представленных конкретных примерах. Схема 1 Как показано на схеме 1, соединения настоящего изобретения, где оба Ra и Rb являются Н, могут быть получены взаимодействием соответствующей замещенной арил-уксусной кислоты 1 и арилкарбоновой кислоты 2 в органическом растворителе или смеси растворителей (включая водные смеси) в присутствии основания, такого как LHMDs или KHMDs с образованием, после выделения продукта, соединения формулы 3. Обработка соединения 3 метилакрилатом в присутствии основания, такого какtBuOK, приводит к образованию 4,5-замещенного 5-оксопентаноата, который может быть восстановлен восстанавливающим реагентом, таким как NaBH4 или LiBEt3H, в соответствующем растворителе, таком как ТГФ, диэтиловый эфир или диметоксиэтан, с образованием рацемического соединения 4. Соединение 5, в свою очередь, может быть получено из соединения 4 превращением спирта в толуолсульфонат,метансульфонат или трифторметансульфонат с последующим взаимодействием с азидом натрия в соответствующем растворителе, таком как, например, ДМФ, ДМЭ или ацетон. Азид может быть восстановлен до первичного амина многими восстанавливающими агентами, включая NaBH4, Н 2 и катализатор,трифенилфосфин и триметилфосфин, который, в свою очередь, при обработке основанием, таким какLiOH, K2CO3 или NaHCO3, в водной смеси с соответствующим органическим растворителем, таким как ТГФ, циклизуется до пиперидин-2-она 6. Отдельные энантиомеры рацемического соединения 6 могут быть разделены хиральной ВЭЖХ с использованием, например, колонки Chiralcel OD-H, внутренний диаметр 20250 мм (Daicel Chemical Industries LTD, Форт-Ли, штат Нью-Джерси) с использованием в качестве элюента 40% изопропилового спирта в гексане. Схема 2 Как показано на схеме 2, пиперидин-2-он 6 может быть далее модифицирован, например, арилированием или алкилированием азота способами, хорошо известными специалистам в данной области. Например, это преобразование осуществляется взаимодействием соединения 6 с алкилгалогенидом в присутствии основания, такого как гидрид натрия, в растворителе, таком как ДМЭ, ДМФ или ТГФ. Соединение 7 может быть далее алкилировано обработкой основанием, таким как диизопропиламид лития или гексаметилдисилазид лития, в соответствующем растворителе, таком как ТГФ, с последующим взаимодействием с алкилирующим агентом, таким как алкилгалогенид, алкил метансульфонат, алкил трифторметансульфонат или алкил толуолсульфонат, с образованием промежуточного соединения 8. При необходимости, эта последовательность может быть повторена для получения соединений общей формулы 9.- 15023004 Как показано на схеме 3, группа, присоединенная к азоту, потенциально может быть удалена для получения промежуточного соединения 16. Например, такое преобразование дает обработка 2,4-диметоксибензилового производного трифторуксусной кислотой. Аналогичные преобразования хорошо представлены в документальных источниках (см., например, P.G.M. Wuts и Т.W. Greene, "Greene'sprotective groups in organic synthesis", 4-е изд., John WileySons, Нью-Йорк, (2007. Повторная обработка соединения 16 алкилирующими условиями, аналогичными условиям, описанным выше, дает соединение 17. Схема 3 Как показано далее на схеме 3, если одна из алкиловых групп содержит двойную связь, эта двойная связь может быть превращена в карбоновую кислоту 11 рядом способов, известных специалистам в данной области. Например, это преобразование осуществляется взаимодействием соединения 10 с раствором перйодата, содержащего KMnO4 или RuCl3 (см., например, R.U. Lemieux, E. von Rudloff, Can. J.Chem., 38, 1703, (1955. Карбоновая кислота 11 может быть, в свою очередь, превращена в другие группы, такие как амид или гидразид, способами, хорошо известными специалистам в данной области. Например, карбоновая кислота 11 может быть активирована конденсацией с различными связывающими реагентами, включая гидроксибензотриазол (HOBt) и N-гидроксисукцинимид (HOSu), например, с использованием дициклогексилкарбодиимида (ДЦК) или аналогичного карбодиимидного реагента, или широкого ряда реагентов, таких как реагенты, разработанные для образования пептидных связей. Условия для таких реакций хорошо известны специалистам в данной области. Активированное промежуточное соединение, сложный эфир HOBt или HOSu, например, может затем конденсироваться с широким рядом нуклеофилов, таких как амины или спирты. На схеме 3 показано превращение соединения формулы 11 в амид 12 по этой последовательности. С использованием аммиака в качестве нуклеофила получено соединение 13. Дегидратация амида 13 до нитрила 14 может быть выполнена различными способами. Пентоксид фосфора является распространенным дегидратирующим реагентом для этой реакции, но специалистам в данной области известны и многие другие (см., например, R.С. Larock; Comprehensive Organic Transformations, 2-е изд., John WileySons, Нью-Йорк, p. 1983 (1999. Нитрил, в свою очередь, может быть преобразован в другие группы,такие как тетразол, взаимодействием нитрила с азидом, таким как азид натрия, азид лития или азотоводородная кислота в растворителе, таком как ДМФ или вода. Схема 4- 16023004 Как показано на схеме 4, кислота 11 может также использоваться для получения гетероциклических производных, таких как, например, [1,3,4]оксадиазолы 18, [1,2,4]оксадиазол-5(4 Н)-оны 19 и[1,2,4]оксадиазолы 20 способами, хорошо известными специалистам в данной области. Например, превращение кислоты 11 в диацилгидразид с последующей обработкой основанием при повышенной температуре дает соединение 18. В другом примере соединение 11 превращается в нитрил, как описано на схеме 3, который обрабатывается гидроксиламином. Взаимодействие с 1,1'-карбонилдимидазолом в присутствии основания, такого как DBU, дает соединение 19. В другом примере соединение 11 взаимодействует с N-гидроксикарбоксамидиновым производным в присутствии 1,1'-карбонилдиимидазола с последующей обработкой фторидом тетрабутиламмония с получением соединения 20. Схема 5 Как показано на схеме 5, соединение формулы 16 также может быть дигидроксилировано с получением соединения 21. Такое преобразование осуществляет тетроксид осмия в присутствии второго окислительного агента, такого как 4-метилморфолин-4-оксид, в соответствующем растворителе. Соединение 21 может быть превращено в соединение 22 по реакции с ацетоном или 2,2-диметоксипропаном в присутствии кислоты, такой как метансульфоновая кислота, п-толуолсульфоновая кислота или камфорсульфоновая кислота. Соединение 22 затем может быть N-арилировано или N-алкилировано различными способами, хорошо известными специалистам в данной области, такими как обработка соединения 22 алкилгалогенидом, алкилметансульфонатом или алкилтолуолсульфонатом в присутствии основания, такого как бутиллитий или гидрид натрия, в растворителе, таком как ДМЭ, ДМФ или ТГФ. Обработка соединения 23 кислотой, такой как HCl или H2SO4, в присутствии воды дает диол 24, который может быть расщеплен до альдегида 25 различными окислительными агентами, такими как йодная кислота или тетраацетат свинца (см., например, Haines, A.H. Methods for the Oxidation of Organic Compounds, vol. 2;p. 277, Academic Press, Нью-Йорк, (1988. Альдегид 25 может быть превращен в кислоту 26 сильными окислительными агентами, включая CrO3 или раствор перйодата, содержащий RuCl3. Схема 6- 17023004 На схеме 6 показан альтернативный способ получения промежуточных соединений общей структуры 35. Эти промежуточные соединения могут использоваться для получения дополнительных соединений настоящего изобретения. Здесь (4S,5S)-2-аллил-2-хлор-3,4-диметил-5-фенил-1,3,2-оксазасилолидин общей формулы 28 образуется по реакции соединения 27 (полученного так, как описано в публикации J.Am. Chem. Soc. 124, 7920 (2002) с алкеном в присутствии катализатора Граббса. Взаимодействие с амином 29, полученным по реакции 2-(аминометил)фенола с альдегидом с использованием условий, хорошо известных специалистам в данной области, дает соединение 30 (см. также J. Am. Chem. Soc. 129, 14552(2007. Промежуточное соединение 30 может быть, в свою очередь, превращено в соединение 31 последовательным взаимодействием с уксусным ангидридом в присутствии основания, такого как триэтиламин, толуолсульфоновой кислотой и оксалилхлоридом в присутствии пропиленгликоля, как описано, например, в публикации Letters, 11, 433, (2009). Гомоаллиламин 31 может быть необязательно дополнительно модифицирован, например, арилированием или алкилированием азота способами, хорошо известными специалистам в данной области. Например, это преобразование осуществляется взаимодействием соединения 31 с кетоном или альдегидом в присутствии восстанавливающего агента, такого как боргидрид натрия, цианоборгидрид натрия или триацетоксиборгидрид натрия, в растворителе, таком как ДМЭ, ДМФ или ТГФ. Соединение 32 может быть ацилировано или сульфонилировано в условиях,хорошо известных специалистам в данной области, с получением соединения 33. Соединение 33 может быть циклизовано до соединения 34 по реакции метатезиса замыкания кольца (RCM). Катализаторы,пригодные для таких преобразований, являются известными специалистам в данной области (см., например, (a) Grubbs, R.H. Handbook of Metathesis; Wiley-VCH: Weinheim, (2003); (b) Angew. Chem., Int.Ed., 42, 1900 (2003 и включают 1-е поколение катализаторов Граббса и 2-е поколение катализаторов Граббса. Каталитическое гидрогенирование соединения 34 с использованием, например, палладиевого,платинового или иридиевого катализатора в растворителе, таком как ДХМ, ТГФ, метанол или водная смесь, содержащая спирт или ТГФ в качестве совместного растворителя, например, используется для восстановления двойной связи, с получением соединения 35. Схема 7 Соединения настоящего изобретения могут быть также получены по лактонному пути, показанному на схеме 7. Арилбензилкетоны 3, имеющиеся в продаже или полученные конденсацией Дикмана или свя- 18023004 зыванием арилметилкетона 41 с бромариловым соединением 42, могут конденсироваться с акрилатными сложными эфирами 43, включая метакрилат, этакрилат и т.д., с образованием кетосложного эфира 44. Стереоселективное восстановление происходит с боргидридом натрия в метаноле с образованием рацемического соединения 45 в виде смеси эпимеров в положении Re. Альтернативно, это восстановление может быть выполнено динамическим кинетическим разрешением (см., например, публикацию Chen, etal., Organic Process ResearchDevelopment, 2007, 11, 616-623 и ссылки, содержащиеся в ней) для получения энантиомерно обогащенного соединения 46 также в виде смеси эпимеров в положении R". В этом процессе изопропиловые сложные эфиры получаются трансэстерификацией. Гидролиз до карбоновой кислоты 47 с последующей лактонизацией дает рацемический или энантиомерно обогащенный лактон 48 в виде смеси диастереомеров в положении Re. Диастереомеры в виде смеси могут быть енолизированы сильным основанием, таким как LiHMDS или LDA с получением общего енолята, который алкилируется аллилбромидом с образованием лактона 49 в виде отдельного диастереомера. (см. пример 261, этап Е). Конденсация рацемического лактона 49 с энантиомерно чистыми аминоспиртами 50 дает диастереомерные гидроксиламиды 51, которые могут быть превращены в оксазолины 52, соли оксазолиния 53 или гидроксилактамы 54. Разделение диастереомеров может быть в общем выполнено у любого из этих промежуточных соединений нормально-фазовой хроматографией на диоксиде кремния. Альтернативно,конденсация энантиомерно обогащенного лактона 49 с энантиомерно обогащенными аминоспиртами 50 дает улучшенную энантиомерную чистоту полученных соединений 51, 52, 53 или 54. Например, лактон с э.и. 94% вместе с аминоспиртом с э.и. 98% дает э.и. основного диастереомера 99,94%. Гидроксилактам 54 (R5=Et, cPr) был получен альтернативными способами (см. пример 91, этап В; и пример 252, этап А) и использовался в качестве промежуточного соединения для многих соединений настоящего изобретения (эквивалент лактама 10 на схеме 3). Используя лактонный способ, могут быть получены дополнительные примеры (R5=iPr [пример 261, этап Н], tBu и т.д.). Кроме того, в этот способ могут быть включены аминоспирты, содержащие два соседних стереоцентра (т.е. R6 не является Н). Соль оксазолиния 53 также является универсальным промежуточным соединением. Она может взаимодействовать с различными нуклеофилами, такими как азиды, тиолы или сульфинатные соли, с образованием лактамов 56, приводя к аминам, амидам, сульфонамидам и сульфонам. Аллиловая группа соли оксазолиния 53 может быть окислена до окисленного состояния карбоновой кислоты с минимальным затруднением из-за связанности первичного или вторичного спиртового центра в оксазолиновом кольце. Полученный ортоамид 57 высвобождает лактам-карбоксилат 58 в условиях мягкого гидролиза. Так связываются лактон 49 [R3=pClPh, R4=mClPh, Re=Me] и (2S,3S)-3-аминопентан-2-ол[WO 2007/110649A2]. Соответствующий оксазолин 52 [R3=pClPh, R4=mClPh, Re=Me, R5=Et, R6=Me] образуется дегидратацией в условиях Дина-Старка в толуоле с молибдатом аммония в качестве катализатора. Обработка трифторметансульфоновым ангидридом в дихлорметане с диметилпиридином при -50 С дает соль оксазолиния 53 [R3=pClPh, R4=mClPh, Re=Me, R5=Et, R6=Me]. Окисление при помощи KMnO4 в дихлорметане/воде, облегченное хлоридом тетрабутиламмония, дает после выделения продукта и гидролиза с раствором бикарбоната натрия в изопропилацетате при 70 С соединение 58 [R3=pClPh, R4=mClPh,Re=Me, R5=Et, R6=Me], идентичное материалу, полученному в примере 152. Пример 1. 2-3R,5R,6S)-1-S)-1-трет-Бутокси-1-оксобутан-2-ил)-5-(3-хлорфенил)-6-(4-хлорфенил)-2 оксопиперидин-3-ил)уксусная кислота К раствору 2-(3-хлорфенил)уксусной кислоты (10 г, 58,6 ммоль) в ТГФ (58 мл) медленно добавили 117 мл 1 М раствора натрия бис-(триметилсилил)амида в ТГФ в течение 1 ч при -78 С. После перемешивания при -78 С в течение 40 мин добавили раствор метил 4-хлорбензоата (10 г, 58,6 ммоль) в ТГФ(35 мл) за период 10 мин. Реакционную смесь перемешивали при -78 С в течение 3 ч, затем оставили нагреваться до 25 С и перемешивали еще 2 ч до завершения реакции. Реакцию погасили насыщенным водным раствором NH4Cl и удалили большую часть ТГФ под пониженным давлением. Остаток экстрагировали этилацетатом (2100 мл). Объединенные органические слои промыли насыщенным растворомNaCl, высушили над Na2SO4, отфильтровали, а фильтрат концентрировали. Продукт перекристаллизовали из эфира/пентана для получения указанного в заголовке соединения в виде твердого белого вещества. К раствору 52,1 г (197 ммоль) 2-(3-хлорфенил)-1-(4-хлорфенил)этанона (пример 1, этап А) и метилакрилата (19,5 мл, 216 ммоль) в 360 мл ТГФ медленно добавили 20 мл 1 М раствора трет-бутоксида калия в ТГФ при 0 С за период 20 мин (поддерживали температуру реакционного раствора 10 С). Реакционную смесь оставили нагреваться до комнатной температуры. После перемешивания при комнатной температуре в течение 1 ч реакционную смесь концентрировали под пониженным давлением, разбавили водой и экстрагировали этилацетатом. Объединенные органические слои промыли насыщенным раствором NaCl, высушили над Na2SO4, отфильтровали, а фильтрат концентрировали. В результате очистки остатка флэш-хроматографией на силикагеле (элюент: 15% EtOAc в гексанах) получили указанное в заголовке соединение в виде бесцветной жидкости. R является СН 3. Этап С. К раствору 75,1 г (213 ммоль) метил 4-(3-хлорфенил)-5-(4-хлорфенил)-5-оксопентаноата (пример 1,этап В) в MeOH (0,71 л, с=0,3 М) при 0 С добавили боргидрид натрия (8058 мг, 213 ммоль) несколькими небольшими частями. После перемешивания при 0 С в течение 30 мин реакционную смесь погасили ледяной Н 2 О, концентрировали под пониженным давлением и экстрагировали EtOAc. Объединенные органические слои промыли (насыщенным водным раствором NaCl), высушили над Na2SO4, отфильтровали,а фильтрат концентрировали. В результате очистки остатка флэш-хроматографией на силикагеле (элюент: от 20 до 30% EtOAc в гексанах, градиентное элюирование) получили рацемическую смесь указанных в заголовке соединений в виде бесцветной жидкости. Этап К раствору 63,1 г (179 ммоль) (4S,5S)-метил 4-(3-хлорфенил)-5-(4-хлорфенил)-5 гидроксипентаноата и (4R,5R)-метил 4-(3-хлорфенил)-5-(4-хлорфенил)-5-гидроксипентаноата (пример 1,этап С) и триэтиламина (49,8 мл, 357 ммоль) в ДХМ (600 мл, 0,3 М) по каплям добавили метансульфонилхлорид (18 мл, 232 ммоль) при 0 С за период 10 мин. Реакционную смесь перемешивали при 0 С в течение 40 мин и контролировали завершение по ТСХ. Затем реакцию погасили ледяной водой, экстрагировали (3 ДХМ) и промыли насыщенным водным раствором NaCl. Объединенные органические слои высушили (Na2SO4) и концентрировали под пониженным давлением. Неочищенный мезилат, синтезированный выше, растворили в ДМФ (350 мл, 0,5 М) и несколькими частями добавили азид натрия (58 г, 893 ммоль). Смесь нагрели до 100 С и после перемешивания при 100 С в течение 30 мин реакционную смесь охладили до комнатной температуры, разбавили водой и экстрагировали EtOAc. Объединенные органические слои промыли (насыщенным водным растворомNaCl), высушили над Na2SO4, отфильтровали, а фильтрат концентрировали. В результате очистки остатка флэш-хроматографией на силикагеле (элюент: от 5 до 20% EtOAc в гексанах, градиентное элюирование) получили указанное в заголовке соединение в виде бесцветной жидкости. Этап Е. (5R,6S)-5-(3-Хлорфенил)-6-(4-хлорфенил)пиперидин-2-он К раствору 45,9 г (121 ммоль) метил 5-азидо-4-(3-хлорфенил)-5-(4-хлорфенил)пентаноата (пример 1, этап D) в ТГФ/Н 2 О (4:1, 375 мл) добавили 152 мл 1 М раствора триметилфосфина в ТГФ (152 ммоль). После перемешивания в течение 1 ч при 25 С большую часть ТГФ удалили под пониженным давлением. Остаток подщелочили (ледяным 2 М LiOH), а продукт экстрагировали метиленхлоридом. Объединенные органические слои промыли насыщенным раствором NaCl, высушили над Na2SO4, отфильтровали, а- 20023004 фильтрат концентрировали под пониженным давлением для получения твердого белого вещества. Это твердое вещество растворили в MeOH/насыщенном водном NaHCO3 (4:1, 2,4 л, с=0,05 М) и нагревали реакционную смесь с дефлегматором в течение 3 ч. Избыток органического растворителя удалили под пониженным давлением, остаток разбавили водой и экстрагировали (210% MeOH/ДХМ). Объединенные органические слои промыли насыщенным раствором NaCl, высушили над Na2SO4, отфильтровали,а фильтрат концентрировали под пониженным давлением для получения транс-5-(3-хлорфенил)-6-(4-хлорфенил)пиперидин-2-она в виде смеси стереоизомеров. Отдельные стереоизомеры разделили хиральной ВЭЖХ (скорость потока: 18 мл/мин, на колонке Chiralcel OD-H,внутренний диаметр 20250 мм, 5 мкм (Daicel Inc., Форт-Ли, штат Нью-Джерси), используя 40% изопропиловый спирт в гексане в качестве элюента) для получения указанного в заголовке соединения(tR=8,2 мин) в виде твердого белого вещества.MC (ESI) 320.0 [M+H]+. Также по представленному выше способу был получен энантиомер указанного в заголовке соединения, (5S,6R)-5-(3-хлорфенил)-6-(4-хлорфенил)пиперидин-2-он: tR=12,4 мин; []D=-156 (T=23,4 С,с=1,13, MeOH). Этап К раствору 13,5 г (42,2 ммоль) (5R,6S)-5,6-бис-(4-хлорфенил)пиперидин-2-она (пример 1, этап Е) в 140 мл ДМФ добавили 4,22 г (105 ммоль) дисперсии 60% гидрида натрия в минеральном масле при 0 С. После перемешивания в течение 20 мин добавили трет-бутил 2-бромбутаноат (28,2 г, 126 ммоль) при 0 С и полученный раствор перемешивали при 25 С в течение 1,5 ч до завершения реакции. Затем добавили насыщенный водный раствор NH4Cl и экстрагировали смесь этилацетатом. Объединенные органические слои промыли водой и насыщенным раствором NaCl, высушили над Na2SO4, отфильтровали, а фильтрат концентрировали под пониженным давлением. В результате очистки остатка флэш-хроматографией на силикагеле (элюент: от 20 до 50% EtOAc в гексанах, градиентное элюирование) получили трет-бутил(2S)-2-2S,3R)-3-(3-хлорфенил)-2-(4-хлорфенил)-6-оксо-1-пиперидинил)бутаноат как более быстро элюированный неосновной изомер. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d)ppm 7.22 (2H, d, J=8.2 Гц), 7.20-7.10 (2H, m), 7.08 (2H, t,J=8.2 Гц), 6.99-6.96 (1H, m), 6.77-6.73 (1H, m), 4.48 (1H, d, J=9.4 Гц), 3.24 (1H, t, J=7.0 Гц), 3.04-2.94 (1H,m), 2.72-2.58 (2H, m), 2.25-2.00 (3H, m), 1.93-1.82 (1H, m), 1.45 (9H, s), 0.98 (3H, t, J=7.4 Гц);MC (ESI) 462.1 [M+H]+. В результате дальнейшего элюирования получили трет-бутил (2R)-2-2S,3R)-3-(3-хлорфенил)-2-(4 хлорфенил)-6-оксо-1-пиперидинил)бутаноат как более медленно элюированный основной изомер. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d)ppm 7.24 (2H, d, J=8.2 Гц), 7.18-7.10 (2H, m), 7.01 (2H, d,J=8,2 Гц), 7.02-6.98 (1H, m), 6.82-6.78 (1H, m), 5.83 (1H, s), 4.54 (1H, d, J=9.8 Гц), 3.09 (1H, dd, J=8.2,4.3 Гц), 3.05-2.99 (1H, m), 2.70-2.64 (2H, m), 2.28-2.18 (2H, m), 2.08-2.02 (1H, m), 1.48 (9H, s), 0.57 (3H, t,J=7.4 Гц);-78 С по каплям добавили 3,3 мл 1 М раствора лития бис-(триметилсилил)амида в ТГФ (3,3 ммоль). По- 21023004 сле перемешивания при -78 С в течение 3 ч реакцию погасили насыщенным водным раствором NH4Cl,экстрагировали этилацетатом. Объединенные органические слои промыли насыщенным раствором NaCl,высушили над Na2SO4, отфильтровали, а фильтрат концентрировали под пониженным давлением. В результате очистки остатка флэш-хроматографией на силикагеле (50 г SiO2, элюент: от 5 до 20% EtOAc в гексанах, градиентное элюирование) получили трет-бутил (2S)-2-3R,5R,6S)-3-аллил-5-(3-хлорфенил)-6(4-хлорфенил)-2-оксопиперидин-1-ил)бутаноат как более быстро элюированный основной изомер. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d)ppm 7.27-7.24 (2H, m), 7.21-7.12 (2H, m), 7.11-7.00 (3H, m),6.93-6.87 (1 Н, m), 5.90-5.77 (1 Н, m), 5.19-5.09 (2H, m), 4.64 (1 Н, d, J=8.6 Гц), 3.21-3.10 (2H, m), 2.80-2.71MC (ESI) 446.0 [М+H]+. В результате дальнейшего элюирования получили трет-бутил (2S)-2-3S,5R,6S)-3-аллил-5-(3 хлорфенил)-6-(4-хлорфенил)-2-оксопиперидин-1-ил)бутаноат как более медленно элюированный неосновной изомер. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d)ppm 7.23 (2H, d, J=8.2 Гц), 7.19-7.07 (2H, m), 7.01-6.95 (3H,m), 6.77-6.72 (1H, m), 5.95-5.77 (1H, m), 5.16-4.99 (2H, m), 4.51 (1H, d, J=10.6 Гц), 3.13-3.04 (1H, m), 2.94 К быстро перемешиваемому раствору 842 мг (1,67 ммоль) трет-бутил (2S)-2-3S,5R,6S)-3-аллил-5(3-хлорфенил)-6-(4-хлорфенил)-2-оксопиперидин-1-ил)бутаноата (пример 1, этап G) в смеси 7 мл воды,5 мл ацетонитрила и 5 мл CCl4 добавили перйодат натрия (1,43 г, 6,70 ммоль), а затем рутения(III) хлорид гидрат (37,8 мг, 0,168 ммоль). После энергичного перемешивания в течение 18 ч реакционную смесь подкислили (10% лимонной кислотой) и разбавили EtOAc. Реакционную смесь отфильтровали через целит, а фильтрат экстрагировали EtOAc. Объединенные органические слои промыли насыщенным раствором NaCl, высушили над Na2SO4, отфильтровали, а фильтрат концентрировали под пониженным давлением. Остаток очистили обращенно-фазовой препаративной ВЭЖХ (колонка Gemini Prep C18, 5 мкм,Phenomenex, Торранс, штат Калифорния; элюент: от 60 до 80% ацетонитрила + 0,1% ТФК в воде + 0,1% ТФК, градиентное элюирование) для получения указанного в заголовке соединения в виде твердого белого вещества. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d)ppm 7.35 (2H, d, J=8.6 Гц), 7.27-7.24 (3H, m), 7.22-7.16 (1 Н,m), 7.18 (2H, d, J=8.6 Гц), 4.85 (1 Н, d, J=5.1 Гц), 3.36 (1H, dd, J=8.6, 3.5 Гц), 3.18-3.14 (1H, m), 2.92-2.80 Указанное в заголовке соединение получили из (S)-трет-бутил 2-3R,5R,6S)-3-аллил-5-(3 хлорфенил)-6-(4-хлорфенил)-2-оксопиперидин-1-ил)бутаноата (пример 1, этап G) по способу, описанному в примере 1, этап Н. 1 Н ЯМР (500 МГц, ХЛОРОФОРМ-d)ppm 7.27-7.26 (2H, m), 7.12-7.16 (1 Н, m), 7.13-7.10 (1 Н, m),7.02-6.94 (3H, m), 6.74-6.71 (1 Н, m), 4.51 (1 Н, d, J=10.8 Гц), 3.18-3.08 (2H, m), 3.06-2.96 (2H, m), 2.47 (1H,dd, J=15.4, 3.2 Гц), 2.35-2.25 (1H, m), 2.24-2.12 (2H, m), 1.52-1.57 (1H, m), 1.51 (9H, s), 0.56 (3H, t,- 22023004MC (ESI) 520.2 [M+H]+, 518.0 [M-Н]-. Примеры 3-6 были получены так, как описано в примере 1, с заменой трет-бутил 2-бромбутаноата на этапе F на соответствующие количества этил 2-бромбутаноата, этил 2-бром-3-метилпентаноата, этил 2-бромпентаноата и этил 2-бром-2-циклопропилацетата соответственно. Пример 3. 2-3R,5R,6S)-5-(3-Хлорфенил)-6-(4-хлорфенил)-1-S)-1-этокси-1-оксобутан-2-ил)-2 оксопиперидин-3-ил)уксусная кислота Соединения, описанные в примере 5, были получены из рацемического пиперидинона, который получили в примере 1, этап Е. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d)ppm 7.40-7.37 (3H, m), 7.31-7.27 (3H, m), 7.27-7.24 (2H, m),4.92 (1 Н, d, J=3.5 Гц), 4.20-4.10 (2H, m), 3.60 (1 Н, dd, J=8.6, 3.5 Гц), 3.20-3.15 (1 Н, m), 2.83-2.72 (3H, m),2.40-2.30 (2H, m), 2.03-1.97 (1 Н, m), 1.44-1.37 (1 Н, m), 1.27 (3H, t, J=7.2 Гц), 1.26-1.17 (1 Н, m), 0.92-0.80 К раствору 300 мг (0,61 ммоль) 2-3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-этокси-1 оксобутан-2-ил)-2-оксопиперидин-3-ил)уксусной кислоты (пример 3) в 12 мл Et2O добавили тетрагидроборат лития (39,8 мг, 1,83 ммоль) при 0 С. После перемешивания в течение 20 мин добавили метанол(37,0 мкл, 914 мкмоль) при 0 С и полученный раствор перемешивали при 25 С в течение 2 ч. Реакцию погасили (10% лимонной кислотой), экстрагировали (2 EtOAc) и промыли (1 насыщенным водным раствором NaCl). Объединенные органические слои промыли насыщенным раствором NaCl, высушили над Na2SO4, отфильтровали, а фильтрат концентрировали под пониженным давлением. В результате очистки обращенно-фазовой препаративной ВЭЖХ (колонка Gemini Prep C18, 5 мкм, Phenomenex, Торранс, штат Калифорния; элюент: от 35 до 75% ацетонитрила + 0,1% ТФК в воде + 0,1% ТФК, градиентное элюирование) получили указанное в заголовке соединение в виде пенистого белого вещества. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d)ppm 7.42-7.37 (3H, m), 7.34-7.27 (4H, m), 7.18-7.13 (1 Н, m),4.89 (1 Н, d, J=2.7 Гц), 3.99-3.90 (1H, m), 3.78 (1H, dd, J=11.5, 3.3 Гц), 3.32-3.23 (1H, m), 3.13-3.07 (1H, m),2.88-2.65 (3H, m), 2.35-2.25 (1H, m), 2.12-2.03 (1H, m), 1.95-1.84 (1H, m), 1.58-1.46 (1H, m), 0.71 (3H, t,J=7.4 Гц); Указанное в заголовке соединение получили из 2-3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1S)-1-циклопропил-2-этокси-2-оксоэтил)-2-оксопиперидин-3-ил)уксусной кислоты (пример 6), как описано в примере 7. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d)ppm 0.23 (m, 1H), 0.36 (m, 1H), 0.65-0.69 (m, 2H), 0.95 (m,1H), 1.90 (m, 1H), 2.40 (m, 1H), 2.68 (m, 1H), 2.80 (2H, d, J=5.3 Гц), 3.13 (1 Н, m), 3.48 (m, 1H), 3.60-3.85 (m,2H), 5.32 (s, 1H), 7.20 (m, 1H), 7.27-7.40 (m, 3H), 7.40-7.43 (m, 4H); МС (ESI) 462.1 [М+Н]+. Пример 9. 2-3R,5R,6S)-5-(3-Хлорфенил)-6-(4-хлорфенил)-1-S)-1-(циклопропилметокси)бутан-2-ил)-2 оксопиперидин-3-ил)уксусная кислота К раствору 15 г (46,8 ммоль) 5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)пиперидин-2-она (пример 1,этап Е) в 140 мл ДМФ добавили 3,75 г (94 ммоль) дисперсии 60% гидрида натрия в минеральном масле- 24023004 при 0 С. После перемешивания в течение 20 мин добавили этил 2-бромбутаноат (17,2 мл, 117 ммоль) при 0 С и полученный раствор перемешивали при 25 С в течение 12 ч до завершения реакции. Затем добавили насыщенный водный раствор NH4Cl и экстрагировали смесь этилацетатом. Объединенные органические слои промыли водой и насыщенным раствором NaCl, высушили над Na2SO4, отфильтровали, а фильтрат концентрировали под пониженным давлением. В результате очистки остатка флэшхроматографией на силикагеле (элюент: 30% EtOAc в гексанах, градиентное элюирование) получили указанное в заголовке соединение как более быстро элюированный изомер. Этап В. (S)-Этил 2-3S,5R,6S)-3-аллил-5-(3-хлорфенил)-6-(4-хлорфенил)-2-оксопиперидин-1 ил)бутаноат К раствору 0,62 г (1,4 ммоль) (S)-этил 2-2S,3R)-3-(3-хлорфенил)-2-(4-хлорфенил)-6 оксопиперидин-1-ил)бутаноата (пример 9, этап А) и аллилбромида (0,14 мл, 1,7 ммоль) в ТГФ (6,0 мл,0,25 М) добавили лития бис-(триметилсилил)амид (1 М раствор в ТГФ, 1,5 мл, 1,5 ммоль) при -78 С. Реакционную смесь оставили нагреваться до комнатной температуры, затем погасили (насыщенным водным NH4Cl) и экстрагировали EtOAc. Объединенные органические слои промыли водой и насыщенным раствором NaCl, высушили над Na2SO4, отфильтровали, а фильтрат концентрировали под пониженным давлением. В результате очистки остатка флэш-хроматографией на силикагеле (от 15 до 20% EtOAc в гексанах, градиентное элюирование) получили указанное в заголовке соединение как более медленно элюированный изомер в виде бесцветного маслянистого вещества. Этап С. К раствору 256 мг (0,54 ммоль) (S)-этил 2-3S,5R,6S)-3-аллил-5-(3-хлорфенил)-6-(4-хлорфенил)-2 оксопиперидин-1-ил)бутаноата (пример 9, этап В) в Et2O (5,5 мл) добавили боргидрид лития чистоты 90% (17,6 мг, 0,809 ммоль) при 0 С. После перемешивания при 0 С в течение 10 мин реакцию погасили(ледяной 10% лимонной кислотой), экстрагировали (2 EtOAc) и промыли (насыщенным водным раствором NaCl). Объединенные органические слои промыли насыщенным раствором NaCl, высушили надNa2SO4, отфильтровали, а фильтрат концентрировали под пониженным давлением. В результате очистки хроматографией на силикагеле (элюент от 30 до 50% EtOAc в гексанах, градиентное элюирование) получили указанное в заголовке соединение. Этап D. (3S,5R,6S)-3-Аллил-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-(циклопропилметокси)бутан 2-ил)пиперидин-2-он(3S,5R,6S)-3-аллил-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-гидроксибутан-2 ил)пиперидин-2-она (98 мг, 0,227 ммоль) в ДМФ (1,10 мл) добавили 60% гидрид натрия в минеральном масле (27,2 мг, 0,680 ммоль) при 0 С. После перемешивания при 0 С в течение 2 мин добавили (бромметил)циклопропан (47,3 мкл, 0,680 ммоль). Смесь перемешивали при 0 С в течение 2 ч, а затем нагрели до комнатной температуры. Затем реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакцию погасили (насыщенным водным раствором NH4Cl), экстрагировали (2 EtOAc) и промыли(насыщенным водным раствором NaCl). Объединенные органические слои высушили (Na2SO4) и концентрировали под пониженным давлением. В результате очистки хроматографией на силикагеле (градиент от 10 до 20% EtOAc в гексанах) получили (3S,5R,6S)-3-аллил-5-(3-хлорфенил)-6-(4-хлорфенил)-1-R)-1(циклопропилметокси)бутан-2-ил)пиперидин-2-он как менее полярный изомер и указанное в заголовке соединение как более полярный стереоизомер.(3S,5R,6S)-3-Аллил-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-(циклопропилметокси)бутан-2 ил)пиперидин-2-он преобразовали в карбоновую кислоту по способу, аналогичному способу, описанному в примере 1, этап Н. В результате очистки обращенно-фазовой препаративной ВЭЖХ (колонкаGemini Prep C18, 5 мкм, Phenomenex, Торранс, штат Калифорния; элюент: от 50 до 80% ацетонитрила + 0,1% ТФК в воде + 0,1% ТФК, градиентное элюирование) получили указанное в заголовке соединение в виде твердого белого вещества. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d)ppm 7.39 (2H, d, J=8.2 Гц), 7.38-7.36 (1 Н, m), 7.33-7.28 (3H,m), 7.23 (2H, d, J=8.2 Гц), 5.09 (1 Н, d, J=2.0 Гц), 4.17-4.07 (1H, m), 3.47-3.40 (2H, m), 3.23-3.15 (m, 2H),3.12-3.08 (1H, m), 2.85 (1H, dd, J=15.8, 8.8 Гц), 2.66-2.55 (2H, m), 2.22-2.12 (1H, m), 2.07-1.99 (1H, m), 1.951.85 (1H, m), 1.62-1.54 (1H, m), 1.07-1.00 (1H, m), 0.65 (3H, t, J=7.4 Гц), 0.60-0.52 (2H, m), 0.24-0.18 (2H,m);MC (ESI) 504.1 [M+H]+, 502.1 [M-H]-. Примеры 10-12 получили из (3R,5R,6S)-3-аллил-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1 гидроксибутан-2-ил)пиперидин-2-она (пример 9, этап С) по способам, аналогичным способам, описанным в примере 9, этапы D и Е, заменив (бромметил)циклопропан на этапе D на соответствующее количество метилйодида, 2-метоксиэтилбромида и 1-(бромметил)циклопропанкарбонитрила соответственно. Н ЯМР (400 МГц, ХЛОРОФОРМ-d)ppm 7.43-7.30 (3H, m), 7.28-7.20 (4H, m), 7.18-7.10 (1 Н, m),5.04 (1 Н, d, J=3.9 Гц), 4.13 (1H, t, J=9.4 Гц), 3.52-3.43 (2H, m), 3.42-3.33 (1H, m), 3.32-3.24 (1H, m), 3.133.05 (1H, m), 2.92-2.75 (2H, m), 2.72-2.60 (1H, m), 2.20-2.10 (1H, m), 2.10-1.90 (1 Н, m), 1.64-1.49 (1 Н, m),1.35-1.25 (2H, m), 1.00-0.90 (2H, m), 0.71-0.57 (3H, m); МС (ESI) 529.2 [М+Н]+, 527.0 [М-Н]-. Примеры 13-15 были получены из (3R,5R,6S)-3-аллил-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1 циклопропил-2-гидроксиэтил)пиперидин-2-она по способу, аналогичному способу, описанному для примера 9, этап D и Е. Раствор 10 мг (0,02 ммоль) 2-3R,5R,6S)-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1-1 цианоциклопропил)метокси)бутан-2-ил)-2-оксопиперидин-3-ил)уксусной кислоты (пример 11) и гидроксида калия (3,2 мг, 0,06 ммоль) в t-BuOH (189 мкл) перемешивали при 85 С в течение 24 ч. Реакционную смесь подкислили (10% лимонной кислотой) и экстрагировали (2 EtOAc). Объединенные органические слои промыли насыщенным раствором NaCl, высушили над Na2SO4, отфильтровали, а фильтрат концентрировали под пониженным давлением. В результате очистки обращенно-фазовой препаративной ВЭЖХ (колонка Gemini Prep C18, 5 мкм, Phenomenex, Торранс, штат Калифорния; элюент: от 35 до 75% ацетонитрила + 0,1% ТФК в воде + 0,1% ТФК, градиентное элюирование) получили указанное в заголовке соединение. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d)ppm 0.67 (m, 5 Н), 1.34 (m, 2H), 1.54 (m, 1H), 1.87-2.18 (m,4H), 2.65 (m, 1H), 2.71-2.90 (m, 2H), 3.08 (m, 1H), 3.38-3.64 (m, 4H), 3.94 (m, 1H), 4.84 (m, 1 Н), 6.35 (br.s.,1H), 6.91 (br. s., 1 Н), 7.13 (m, 1 Н), 7.21-7.38 (m, 7 Н); МС (ESI) 547.2 [М+Н]+, 545.0 [М-Н]-. В результате дальнейшего элюирования получили пример 17. Пример 17. 2-3S,5R,6S)-1-S)-1-1-Карбамоилциклопропил)метокси)бутан-2-ил)-5-(3-хлорфенил)-6-(4 хлорфенил)-2-оксопиперидин-3-ил)уксусная кислота К раствору 203 мг (0,47 ммоль) (3S,5R,6S)-3-аллил-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)-1 гидроксибутан-2-ил)пиперидин-2-она (пример 9, этап В) и димера ацетата родия(II) (10,4 мг,0,047 ммоль) в CH2Cl2 (1,90 мл) по каплям добавили этилдиазоацетат (286 мкл, 2,35 ммоль) при 25 С. После перемешивания при 25 С в течение 14 ч реакционную смесь концентрировали под пониженным давлением и очистили хроматографией на силикагеле (от 20 до 30% EtOAc в гексанах, градиентное элюирование) для получения указанного в заголовке соединения в виде бесцветной жидкости. Этап В. К раствору этил 2-S)-2-3S,5R,6S)-3-аллил-5-(3-хлорфенил)-6-(4-хлорфенил)-2-оксопиперидин-1 ил)бутокси)ацетата (69,0 мг, 0,133 ммоль) в ТГФ (2,22 мл) добавили метилмагния бромид, 1,4 М в толуоле/ТГФ (0,38 мл, 0,532 ммоль) при 0 С. После перемешивания при 25 С в течение 3 ч реакцию погасили(насыщенным водным NH4Cl) и экстрагировали EtOAc. Объединенные органические слои промыли насыщенным раствором NaCl, высушили над Na2SO4, отфильтровали, а фильтрат концентрировали под пониженным давлением. В результате очистки хроматографией на силикагеле (от 20 до 50% EtOAc в гексанах, градиентное элюирование) получили указанное в заголовке соединение в виде бесцветной жидкости. Этап С. 2-3R,5R,6S)-5-(3-Хлорфенил)-6-(4-хлорфенил)-1-S)-1-(2-гидрокси-2 метилпропокси)бутан-2-ил)-2-оксопиперидин-3-ил)уксусная кислота. К быстро перемешиваемому раствору (3S,5R,6S)-3-аллил-5-(3-хлорфенил)-6-(4-хлорфенил)-1-S)1-(2-гидрокси-2-метилпропокси)бутан-2-ил)пиперидин-2-она (51,0 мг, 0,101 ммоль) в смеси воды(361 мкл), ацетонитрила (241 мкл) и CCl4 (241 мкл) добавили перйодат натрия (86 мг, 0,404 ммоль), а затем рутения(III) хлорид гидрат (2,28 мг, 10,1 мкмоль). После энергичного перемешивания в течение 18 ч реакционную смесь подкислили (10% лимонной кислотой) и разбавили (EtOAc). Смесь отфильтровали через Целит (J.T. Baker, Филлипсберг, штат Нью-Джерси, J.T. Baker, Филлипсберг, штат НьюДжерси, диатомовая земля), а фильтрат экстрагировали EtOAc. Объединенные органические слои промыли насыщенным раствором NaCl, высушили над Na2SO4, отфильтровали, а фильтрат концентрировали под пониженным давлением. В результате очистки обращенно-фазовой препаративной ВЭЖХ (колонкаGemini Prep C18, 5 мкм, Phenomenex, Торранс, штат Калифорния; элюент: от 50 до 76% ацетонитрила + 0,1% ТФК в воде + 0,1% ТФК, градиентное элюирование) получили указанное в заголовке соединения в виде твердого белого вещества. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d)ppm 0.64-0.74 (t, J=7.6 Гц, 3H), 1.21 (d, J=3.7 Гц, 6H), 1.58
МПК / Метки
МПК: C07D 498/20, C07D 407/04, C07D 407/06, C07D 279/02, C07D 401/06, C07D 409/04, C07D 471/20, A61K 31/4412, C07D 498/08, C07D 417/06, C07D 211/40, C07D 401/04, A61P 35/00, C07D 413/06, C07D 401/12
Метки: фармацевтическая, производные, лечения, их, пиперидиноновые, mdm2, способ, рака, содержащая, композиция, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-23004-piperidinonovye-proizvodnye-kak-ingibitory-mdm2-farmacevticheskaya-kompoziciya-soderzhashhaya-ih-i-sposob-lecheniya-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Пиперидиноновые производные как ингибиторы mdm2, фармацевтическая композиция, содержащая их, и способ лечения рака</a>
Предыдущий патент: Бумага для курительного изделия, имеющая свойства, снижающие возможность воспламенения
Следующий патент: Слитый белок против злокачественных новообразований
Случайный патент: Способ реконструкции распределительной системы газоснабжения