Полициклические производные аминокислот, содержащая их фармацевтическая композиция и способ лечения, использующий эти производные
Номер патента: 19879
Опубликовано: 30.07.2014
Авторы: У Вэньсюэ, Чжан Хаймин, Чжан Чэньминь, Цзинь Хайхун, Лю Цинюнь, Маринелли Бретт, Самала Лакшама, Ван Ин, Туноори Ашок, Ши Чжи-Цай, Девасагаярадж Арокиасами
Формула / Реферат
1. Соединение формулы
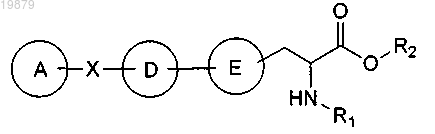
или его фармацевтически приемлемая соль или сольват, где
А представляет собой необязательно замещенный фенил, нафтил или 5-6-членный гетероцикл, включающий 1-3 гетероатома, выбранных из О, N и S, причем необязательное замещение означает замещение одной или более группами С1-6-алкоксила, амино, циано, галогена, гидроксила или фенила, причем фенильная группа необязательно замещена одной или более группами С1-6-алкоксила, амино, циано, галогена или гидроксила;
X представляет собой -O-, -С(R3R4)N(R5)-, -C(R3R4)O- или -OC(R3R4)-;
D представляет собой 1,3,5-триазин, пиримидин или пиразин, необязательно замещенный амино или морфолино;
Е представляет собой фенил или 5-6-членный гетероцикл, включающий 1-3 гетероатома, выбранных из О, N и S;
R1 представляет собой водород или C1-10-алкил;
R2 представляет собой водород или С1-10-алкил, необязательно замещенный морфолино;
R3 представляет собой водород или необязательно замещенный С1-10-алкил;
R4 представляет собой водород и
R5 представляет собой водород или C1-4-алкил.
2. Соединение по п.1, где X представляет собой -C(R3R4)O- или -OC(R3R4)-.
3. Соединение по п.1, где D представляет собой 1,3,5-триазин.
4. Соединение по п.1, где D представляет собой пиримидин.
5. Соединение по п.1, где D представляет собой пиразин.
6. Соединение по п.4, имеющее формулу
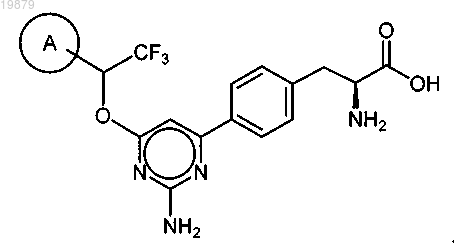
7. Соединение по п.6, где А представляет собой бифенил, необязательно замещенный одним или более
С1-6алкоксилом, амино, галогеном или гидроксилом.
8. Соединение по п.1, где указанным соединением является
(S)-2-амино-3-(4-(2-амино-6-((S)-2,2,2-трифтор-1-(6-метоксинафталин-2-ил)этокси)пиримидин-4-ил)фенил)пропановая кислота;
(2S)-2-амино-3-(4-(2-амино-6-(1-(3,4-дифторфенил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота;
(S)-2-амино-3-(4-(2-амино-6-((R)-2,2,2-трифтор-1-(3'-метоксибифенил-4-ил)этокси)пиримидин-4-ил)фенил)пропановая кислота;
(2S)-2-амино-3-(4-(2-амино-6-(2,2,2-трифтор-1-(3'-фторбифенил-4-ил)этокси)пиримидин-4-ил)фенил)пропановая кислота;
(2S)-2-амино-3-(4-(2-амино-6-(2,2,2-трифтор-1-(4'-фторбифенил-4-ил)этокси)пиримидин-4-ил)фенил)пропановая кислота;
(S)-2-амино-3-(4-(2-амино-6-((R)-2,2,2-трифтор-1-фенилэтокси)пиримидин-4-ил)фенил)пропановая кислота;
(S)-2-амино-3-(4-(2-амино-6-((S)-2,2,2-трифтор-1-(3'-метоксибифенил-4-ил)этокси)пиримидин-4-ил)фенил)пропановая кислота;
(2S)-2-амино-3-(4-(2-амино-6-(2,2,2-трифтор-1-(3-фтор-3'-метоксибифенил-4-ил)этокси)пиримидин-4-ил)фенил)пропановая кислота или
(2S)-2-амино-3-(4-(2-амино-6-(1-(3'-(диметиламино)бифенил-2-ил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота.
9. Соединение по п.1, где указанным соединением является
(2S)-2-амино-3-(4-(2-амино-6-(1-(2-(циклопропилметокси)-4-фторфенил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота;
(2S)-2-амино-3-(4-(2-амино-6-(2,2,2-трифтор-1-(2-(изопентилокси)фенил)этокси)пиримидин-4-ил)фенил)пропановая кислота;
(2S)-2-амино-3-(4-(2-амино-6-(2,2,2-трифтор-1-(4'-метоксибифенил-2-ил)этокси)пиримидин-4-ил)фенил)пропановая кислота;
(2S)-2-амино-3-(4-(2-амино-6-(1-(4-цианофенил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота;
(2S)-2-амино-3-(4-(2-амино-6-(1-(4-(циклопентилокси)фенил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота или
(2S)-2-амино-3-(4-(2-амино-6-(1-(4,5-диметоксибифенил-2-ил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота.
10. Соединение по п.1, где указанным соединением является
(2S)-2-амино-3-(4-(2-амино-6-(1-(2-бромфенил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота;
(2S)-2-амино-3-(4-(2-амино-6-(2,2,2-трифтор-1-(4-метоксибифенил-2-ил)этокси)пиримидин-4-ил)фенил)пропановая кислота;
(2S)-2-амино-3-(4-(2-амино-6-(1-(3'-цианобифенил-2-ил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота;
(2S)-2-амино-3-(4-(2-амино-6-(2,2,2-трифтор-1-(3'-гидроксибифенил-2-ил)этокси)пиримидин-4-ил)фенил)пропановая кислота или
(2S)-2-амино-3-(4-(2-амино-6-(1-(3',5'-дифторбифенил-2-ил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота.
11. Соединение по п.1, где указанным соединением является
(2S)-2-амино-3-(4-(2-амино-6-(2,2,2-трифтор-1-(3'-(трифторметокси)бифенил-2-ил)этокси)пиримидин-4-ил)фенил)пропановая кислота;
(S)-2-амино-3-(4-(2-амино-6-((R)-1-(3'-(диметиламино)бифенил-2-ил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота;
(2S)-2-амино-3-(4-(2-амино-6-(1-(2-(циклопентилокси)-4-фторфенил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота или
(S)-2-амино-3-(4-(2-амино-6-((S)-1-(3'-(диметиламино)бифенил-2-ил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота.
12. Соединение по п.1, где указанным соединением является
(2S)-2-амино-3-(4-(2-амино-6-(1-(2-(циклогексилокси)-4-фторфенил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота;
(S)-2-амино-3-(4-(2-амино-6-((R)-1-(3'-((диметиламино)метил)бифенил-4-ил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота;
(2S)-2-амино-3-(4-(2-амино-6-(1-(4-хлор-2-фторфенил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота;
(2S)-2-амино-3-(4-(2-амино-6-(1-(3,4-дихлорфенил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота;
(2S)-2-амино-3-(4-(2-амино-6-(1-(4-хлор-3-фторфенил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота;
(S)-2-амино-3-(4-(2-амино-6-((R)-1-(3'-(диметиламино)бифенил-4-ил)-2,2,2-трифторэтокси)пиримидин-4-ил)фенил)пропановая кислота или
(2S)-2-амино-3-(4-(2-амино-6-(1-хлор-2,2,2-трифтор-1-(4-метоксибифенил-2-ил)этокси)пиримидин-4-ил)фенил)пропановая кислота.
13. Соединение по п.1, представляющее собой (S)-2-амино-3-(4-(2-амино-6-((R)-2,2,2-трифтор-1-(3'-метоксибифенил-4-ил)этокси)пиримидин-4-ил)фенил)пропановую кислоту.
14. Фармацевтическая композиция, которая содержит соединение по одному из пп.1-13 и фармацевтически приемлемый наполнитель или разбавитель.
15. Способ лечения, профилактики или терапии заболевания или расстройства, опосредованного периферийным серотонином, который включает введение пациенту терапевтически или профилактически эффективного количества соединения по одному из пп.1-13.
16. Способ по п.15, где заболеванием или расстройством является карциноидный синдром.
17. Способ по п.15, где заболеванием или расстройством является желудочно-кишечное заболевание или расстройство.
18. Способ по п.17, где заболеванием или расстройством является синдром раздраженной толстой кишки.
19. Способ по п.15, где заболеванием или расстройством является рвота.
Текст
ПОЛИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ АМИНОКИСЛОТ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ, ИСПОЛЬЗУЮЩИЙ ЭТИ ПРОИЗВОДНЫЕ Описаны соединения формулы, а также содержащие их композиции и способы их применения для лечения, профилактики и терапии серотонин-опосредованных заболеваний и расстройств. Область техники, к которой относится изобретение Настоящее изобретение относится к полициклическим соединениям, к содержащим их композициям и к применению указанных соединений для лечения, профилактики и контроля заболеваний и расстройств. Уровень техники Нейротрансмиттер серотонин [5-гидрокситриптамин (5-НТ)] вовлечен в многочисленные процессы центральной нервной системы, связанные с контролем настроения и регуляцией сна, страхом, алкоголизмом, злоупотреблением лекарственными препаратами, приемом пищи и сексуального поведения. В периферических тканях, серотонин, по имеющимся сведениям, вовлечен в регулирование тонуса сосудов, перистальтики кишечника, первичного гемостаза и иммунных клеточных ответов. Walther D. J., etal., Science 299: 76 (2003). Фермент триптофангидроксилаза (ТРН) катализирует лимитирующую скорость стадию биосинтеза серотонина. Известно о двух изоформах ТРН: ТРН 1, которая экспрессирована в периферии, главным образом, в желудочно-кишечном (GI) тракте; и ТРН 2, которая экспрессирована в головном мозге. Id. Изоформа ТРН 1 кодируется геном tph1; TPH2 кодируется геном tph2. Id. Были описаны мыши с генетическим дефицитом гена tph1 ("нокаут-мышь"). В одном случае, как сообщают, у мыши экспрессируют нормальные количества серотонина в классических серотонинергических областях головного мозга, однако имеется значительный недостаток серотонина в периферии. Id. В другом случае, у нокаут-мыши показана патологическая кардиотоническая активность, которую связывают с недостатком периферического серотонина. Cot, F., et al., PNAS 100(23): 13525-13530 (2003). Так как серотонин вовлечен в большое количество биологических процессов, то действие препаратов, которые воздействуют на уровни серотонина, часто сопровождается неблагоприятными эффектами. Таким образом, существует необходимость в новых способах лечения заболеваний и расстройств, которые связаны с воздействием серотонина. Сущность изобретения Настоящее изобретение относится, в частности, к соединениям формулы или его фармацевтически приемлемая соль или сольват, где А представляет собой необязательно замещенный фенил, нафтил, или 5-6-членный гетероцикл,включающий 1-3 гетероатома, выбранные из О, N и S, причем необязательное замещение означает замещение одной или более группами С 1-6 алкоксила, амино, циано, галогена, гидроксила или фенила, причем фенильная группа необязательно замещена одной или более группами С 1-6 алкоксила, амино, циано, галогена или гидроксила;D представляет собой 1,3,5-триазин, пиримидин или пиразин, необязательно замещенный амино или морфолино; Е представляет собой фенил или 5-6-членный гетероцикл, включающий 1-3 гетероатома, выбранные из О, N и S;R1 представляет собой водород или C1-10-алкил;R2 представляет собой водород или С 1-10-алкил, необязательно замещенный морфолино;R3 представляет собой водород или необязательно замещенный C1-10-алкил;R4 представляет собой водород иR5 представляет собой водород или C1-4-алкил. Также изобретение относится к соединению формулы Определенные соединения ингибируют активность ТРН (например, ТРН 1). Также настоящее изобретение относится к фармацевтическим композициям и способам лечения,профилактики и терапии ряда заболеваний и расстройств. Краткое описание фигур Аспекты изобретения могут быть понятны со ссылкой на прилагаемую фигуру, на которой показано действие эффективного ингибитора ТРН 1 по изобретению в желудочно-кишечном тракте мыши и головном мозге после перорального введения. Все данные представлены как процент значения контрольной(раствор-дозированной) группы. Планки погрешности представляют собой S.E.M. N = 5 на группу. Сим-1 019879 волами являются , р 0,05 по сравнению с контрольной группой. Для данных головного мозга р = 0,5,односторонний ANOVA. Подробное описание изобретения Настоящее изобретение основано, отчасти, на обнаружении того, что нокаут гена tph1 у мыши существенно снижает уровни GI серотонина, при этом вызывая небольшой побочный эффект в отношении центральной нервной системы (ЦНС) или вообще не вызывает. Также настоящее изобретение основано на обнаружении соединений, которые ингибируют ТРН(например, ТРН 1). При введении млекопитающим, предпочтительные соединения по изобретению снижают уровни серотонина, и могут быть использованы в лечении, профилактике и терапии широкого ряда заболеваний и расстройств. Определения Если не указано иное, термин "алкенил" обозначает углеводород с прямой цепью, разветвленный и/или циклический, имеющий от 2 до 20 (например, 2-10 или 2-6) атомов углерода, и содержащий по меньшей мере одну углерод-углерод двойную связь. Приведенные в качестве примеров алкенильные фрагменты включают винил, аллил, 1-бутенил, 2-бутенил, изобутиленил, 1-пентенил, 2-пентенил, 3 метил-1-бутенил, 2-метил-2-бутенил, 2,3-диметил-2-бутенил, 1-гексенил, 2-гексенил, 3-гексенил, 1 гептенил, 2-гептенил, 3-гептенил, 1-октенил, 2-октенил, 3-октенил, 1-ноненил, 2-ноненил, 3-ноненил, 1 деценил, 2-деценил и 3-деценил. Если не указано иное, термин "алкил" обозначает углеводород с прямой цепью, разветвленный и/или циклический ("циклоалкил"), имеющий от 1 до 20 (например, 1-10 или 1-4) атомов углерода. Алкильные фрагменты, имеющие от 1 до 4 атомов углерода, называют "низший алкил." Примеры алкильных групп включают метил, этил, пропил, изопропил, н-бутил, трет-бутил, изобутил, пентил, гексил,изогексил, гептил, 4,4-диметилпентил, октил, 2,2,4-триметилпентил, нонил, децил, ундецил и додецил. Циклоалкильные фрагменты могут быть моноциклическими или полициклическими, и примеры включают циклопропил, циклобутил, циклопентил, циклогексил и адамантил. Другие примеры алкильных фрагментов имеют линейные, разветвленные и/или циклические участки (например, 1-этил-4-метилциклогексил). Термин "алкил" включает насыщенные углеводороды, а также алкенильные и алкинильные фрагменты. Если не указано иное, термин "алкокси" обозначает -O-алкильную группу. Примеры алкоксигрупп включают -ОСН 3, -ОСН 2 СН 3, -О(СН 2)2 СН 3, -О(СН 2)3 СН 3, -О(СН 2)4 СН 3 и -О(СН 2)5 СН 3. Если не указано иное, термин "алкиларил" или "алкил-арил" обозначает алкильный фрагмент, связанный с арильным фрагментом. Если не указано иное, термин "алкилгетероарил" или "алкилгетероарил" обозначает алкильный фрагмент, связанный с гетероарильный фрагментом. Если не указано иное, термин "алкилгетероцикл" или "алкилгетероцикл" обозначает алкильный фрагмент, связанный с гетероциклическим фрагментом. Если не указано иное, термин "алкинил" обозначает углеводород с прямой цепью, разветвленный или циклический, имеющий от 2 до 20 (например, 2-20 или 2-6) атомов углерода, и содержащий по меньшей мере одну углерод-углерод тройную связь. Приведенные в качестве примеров алкинильные фрагменты включают ацетиленил, пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил, 3-метил-1 бутинил, 4-пентинил, 1-гексинил, 2-гексинил, 5-гексинил, 1-гептинил, 2-гептинил, 6-гептинил, 1 октинил, 2-октинил, 7-октинил, 1-нонинил, 2-нонинил, 8-нонинил, 1-децинил, 2-децинил и 9-децинил. Если не указано иное, термин "арил" обозначает ароматическое кольцо или ароматическую или частично ароматическую кольцевую систему, состоящую из атомов углерода и водорода. Арильный фрагмент может содержать несколько колец, связанных или конденсированных вместе. Примеры арильных фрагментов включают антраценил, азуленил, бифенил, флуоренил, индан, инденил, нафтил, фенантренил, фенил, 1,2,3,4-тетрагидронафталин и толил. Если не указано иное, термин "арилалкил" или "арил-алкил" обозначает арильный фрагмент, связанный с алкильным фрагментом. Если не указано иное, термины "биогидролизуемый амид", "биогидролизуемый сложный эфир","биогидролизуемый карбамат", "биогидролизуемый карбонат", "биогидролизуемый уреидо" и "биогидролизуемый фосфат" обозначают амид, сложный эфир, карбамат, карбонат, уреидо или фосфат, соответственно соединения, которое либо: 1) не препятствует биологической активности соединения, но может придавать этому соединению полезные свойства in vivo, такие как поглощение, продолжительность действия или начало действия; либо 2) является биологически неактивным, но преобразуется in vivo в биологически активное соединение. Примеры биогидролизуемых сложных эфиров включают низшие алкильные сложные эфиры, алкоксиацилокси сложные эфиры, алкилациламиноалкил сложные эфиры и холин сложные эфиры. Примеры биогидролизуемых амидов включают низшие алкиламиды, амиды аминокислот, алкоксиацильные амиды и алкиламиноалкил-карбонил амиды. Примеры биогидролизуемых карбаматов включают низшие алкиламины, замещенные этилендиамины, аминокислоты, гидроксиалкиламины, гетероциклические и гетероароматические амины и полиэфирамины. Если не указано иное, выражения "заболевание или расстройство, опосредованное периферическим серотонином" и "заболевание и расстройство, опосредованное периферическим серотонином" обозначают заболевание и/или расстройство, имеющее один или несколько симптомов, тяжесть которых зависит от уровней периферического серотонина. Если не указано иное, термин "галоген" включает фтор, хлор, бром и йод. Если не указано иное, термин "гетероалкил" относится к алкильному фрагменту (например, линейному, разветвленному или циклическому), в котором по меньшей мере один из атомов углерода был заменен на гетероатом (например, N, О или S). Если не указано иное, термин "гетероарил" обозначает арильный фрагмент, где по меньшей мере один из атомов углерода был заменен на гетероатом (например, N, О или S). Примеры включают акридинил, бензимидазолил, бензофуранил, бензоизотиазолил, бензоизоксазолил, бензохиназолинил, бензотиазолил, бензоксазолил, фурил, имидазолил, индолил, изотиазолил, изоксазолил, оксадиазолил, оксазолил, фталазинил, пиразинил, пиразолил, пиридазинил, пиридил, пиримидинил, пиримидил, пирролил,хиназолинил, хинолинил, тетразолил, тиазолил и триазинил. Если не указано иное, термин "гетероарилалкил" или "гетероарилалкил" обозначает гетероарильный фрагмент, связанный с алкильным фрагментом. Если не указано иное, термин "гетероцикл" относится к ароматическому, частично ароматическому или неароматическому моноциклическому или полициклическому кольцу или кольцевой системе, содержащей атом углерода, водорода и по меньшей мере один гетероатом (например, N, О или S). Гетероцикл может содержать несколько (то есть два или более) колец, конденсированных или связанных вместе. Гетероциклы включают гетероарилы. Примеры включают бензо[1,3]диоксолил, 2,3-дигидробензо[1,4]диоксинил, циннолинил, фуранил, гидантоинил, морфолинил, оксетанил, оксиранил, пиперазинил, пиперидинил, пирролидинонил, пирролидинил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил и валеролактамил. Если не указано иное, термин "гетероциклалкил" или "гетероциклалкил" относится к гетероциклильному фрагменту, связанному с алкильным фрагментом. Если не указано иное, термин "гетероциклоалкил" относится к неароматическому гетероциклу. Если не указано иное, термин "гетероциклоалкилалкил" или "гетероциклоалкилалкил" относится к гетероциклоалкильному фрагменту, связанному с алкильным фрагментом. Если не указано иное, термины "лечить", "лечение" и "терапия" включают профилактику рецидива конкретного заболевания или расстройства, или одного или нескольких его симптомов, у пациента, который уже имеет заболевание или расстройство, и/или увеличение времени ремиссии у пациента, который имеет заболевание или расстройство. Термины включают модулирование начала, развития и/или длительности заболевания или расстройства, или изменение реакций пациента на заболевание или расстройство. Если не указано иное, термин "фармацевтически приемлемые соли" относится к солям, полученным из фармацевтически приемлемых нетоксичных кислот или оснований, включая неорганические кислоты и основания и органические кислоты и основания. Подходящие фармацевтически приемлемые соли добавления оснований включают соли металлов, образованные алюминием, кальцием, литием, магнием,калием, натрием и цинком, или органические соли, образованные лизином, N,N'дибензилэтилендиамином, хлорпрокаином, холином, диэтаноламином, этилендиамином, меглумином(N-метилглкжамин) и прокаином. Подходящие нетоксичные кислоты включают неорганические и органические кислоты, такие как уксусная, альгиновая, антраниловая, бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этенсульфоновая, муравьиная, фумаровая, фуранкарбоновая, галактуроновая, глюконовая, глюкуроновая, глутаминовая, гликолевая, бромисто-водородная, хлористо-водородная,изетионовая, молочная, малеиновая, яблочная, миндальная, метансульфоновая, муциновая, азотная, памовая, пантотеновая, фенилуксусная, фосфорная, пропионовая, салициловая, стеариновая, янтарная,сульфаниловая, серная, винная кислота и п-толуолсульфоновая кислота. Конкретные нетоксичные кислоты включают хлористо-водородную, бромисто-водородную, фосфорную, серную и метансульфоновую кислоты. Таким образом, примеры конкретных солей включают гидрохлоридную и мезилатную соли. Другие соли хорошо известны в данной области. Смотри, например, Remington's Pharmaceutical Sciences, 18th ed. (Mack Publishing, Easton PA: 1990) и Remington: The Science and Practice of Pharmacy, 19thed. (Mack Publishing, Easton PA: 1995). Если не указано иное, термин "эффективный ингибитор ТРН 1" относится к соединению, которое имеет ТРН 1IC50 меньше, чем около 10 мкМ. Если не указано иное, термины "предотвращать," "профилактика" и "предохранение" относятся к действию, происходящему до того, как пациент заболевает конкретным заболеванием или расстройством, действию, которое ингибирует или ослабляет тяжесть заболевания или расстройства, или одного или нескольких его симптомов. Термины включают предупреждение. Если не указано иное, "профилактически эффективное количество" соединения равно количеству,достаточному для профилактики заболевания или состояния, или одного или нескольких симптомов,-3 019879 сопутствующих заболеванию или состоянию, или профилактики его рецидива. Профилактически эффективное количество соединения равно количеству терапевтического средства, которое самостоятельно или в сочетании с другими средствами обеспечивает профилактическое действие по предупреждению заболевания. Термин "профилактически эффективное количество" может включать количество, которое улучшает комплексную профилактику или усиливает профилактический эффект другого профилактического средства. Если не указано иное, термин "защитная группа", когда он используется в отношении части молекулы, подвергающейся химической реакции, относится к химическому фрагменту, который не является реакционноспособным в условиях такой химической реакции, и который может быть удален с получением фрагмента, который является реакционно-способным в этих условиях. Защитные группы хорошо известны в данной области. См., например, Greene T.W. and Wuts, P.G.M., Protective Groups in Organic Synthesis (3rd ed., John WileySons: 1999); Larock R.C., Comprehensive Organic Transformations (2nd ed., JohnWileySons: 1999). Некоторые примеры включают бензил, дифенилметил, тритил, Cbz, Boc, Fmoc, метоксикарбонил, этоксикарбонил и фталимидо. Если не указано иное, термин "псевдогалоген" относится к многоатомному аниону, который имеет сходство с ионом галогенида в его кислотно-основных свойствах, способности к замещению и редокс химии, обычно имеет низкую основность, и образует свободный радикал в условиях полимеризации с переносом радикалов. Примеры псевдогалогенов включают ионы азида, цианида, цианата, тиоцианата,тиосульфата, сульфонатов и сульфонилгалогенидов. Если не указано иное, термин "селективный ингибитор ТРН 1" относится к соединению, который имеет ТРН 2IC50, больший по меньшей мере приблизительно в 10 раз, чем его ТРН 1IC50. Если не указано иное, термин "стереоизомерно обогащенная композиция" соединения относится к смеси указанного соединения и его стереоизомера(ов), которая содержит больше указанного соединения,чем его стереоизомера(ов). Например, стереоизомерно дополненная композиция (S)-бутан-2-ола включает смеси (S)-бутан-2-ола и (R)-бутан-2-ола в пропорции, например, около 60/40, 70/30, 80/20, 90/10, 95/5 и 98/2. Если не указано иное, термин "стереоизомерная смесь" включает рацемические смеси, а также стереоизомерно дополненные смеси (например, R/S = 30/70, 35/65, 40/60, 45/55, 55/45, 60/40, 65/35 и 70/30). Если не указано иное, термин "стереоизомерно чистый" обозначает композицию, которая содержит один стереоизомер соединения и является по существу свободной от других стереоизомеров этого соединения. Например, стереоизомерно чистая композиция соединения, имеющая один стерический центр,будет по существу свободна от противоположного стереоизомера соединения. Стереоизомерно чистая композиция соединения, имеющая два стерических центра, будет по существу свободна от других диастереомеров соединения. Типичное стереоизомерно чистое соединение содержит более чем около 8 0% по массе стереоизомера соединения одного вида и меньше чем около 20 мас.% других стереоизомеров соединения, больше чем около 90 мас.% стереоизомера соединения одного вида и меньше чем около 10 мас.% других стереоизомеров соединения, больше чем около 95 мас.% стереоизомера соединения одного вида и меньше чем около 5 мас.% других стереоизомеров соединения, больше чем около 97 мас.% стереоизомера соединения одного вида и меньше чем около 3 мас.% других стереоизомеров соединения,или больше чем около 99 мас.% стереоизомера соединения одного вида и меньше чем около 1 мас.% других стереоизомеров соединения. Если не указано иное, термин "замещенный", когда его используют для описания химической структуры или фрагмента, относится к производному этой структуры или фрагмента, где один или несколькое атомов водорода замещены атомом, химическим фрагментом или функциональной группой,такой как, но ими не ограничиваясь, спирт, альдегид, алкокси, алканоилокси, алкоксикарбонил, алкенил,алкил (например, метил, этил, пропил, трет-бутил), алкинил, алкилкарбонилокси (-ОС(О)алкил), амид(-С(включая алкилсульфонил, арилсульфонил и арилалкилсульфонил), сульфоксид, тиол (например, сульфгидрил, тиоэфир) и мочевина (-NHCONH-алкил-). Если не указано иное, "терапевтически эффективное количество" соединения представляет собой количество, достаточное для обеспечения терапевтического эффекта в лечении или терапии заболевания или состояния, или сдерживания или уменьшения одного или нескольких симптомов, сопутствующих заболеванию или состоянию. Терапевтически эффективное количество соединения представляет собой количество терапевтического средства, которое самостоятельно или в сочетании с другими терапевтическими средствами, обеспечивают терапевтический эффект при лечении или терапии заболевания или состояния. Термин "терапевтически эффективное количество" может включать количество, которое улучшает комплексную терапию, ослабляет или устраняет симптомы или причины заболевания или состояния, или усиливает терапевтический эффект другого терапевтического средства. Если не указано иное, термин "ТРН 1IC50" относится к IC50 соединения для ТРН 1, как определено,используя исследование ингибирования in vitro, описанное в примерах ниже. Если не указано иное, термин "ТРН 2IC50" относится к IC50 соединения для ТРН 2, как определено,используя исследование ингибирования in vitro, описанное в примерах ниже. Если не указано иное, термины "лечить" и "лечение" рассматриваются как действие, которое происходит в то время, когда пациент страдает от конкретного заболевания или расстройства, которое ослабляет тяжесть заболевания или расстройства, или одного или нескольких его симптомов, или сдерживает или замедляет развитие заболевания или расстройства. Если не указано иное, термин "включает" имеет аналогичное термину "содержит" значение, и термин "включает" имеет аналогичное термину "включает, но ими не ограничивается" значение. Аналогичным образом, термин "такие как" имеет аналогичное термину "такие как, но ими не ограничиваясь" значение. Если не указано иное, один или несколько прилагательных, непосредственно предшествующих группе существительных, должны рассматриваться как дополнение к каждому из существительных. Например, выражение "необязательно замещенный алкил, арил или гетероарил" имеет значение, аналогичное "необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный гетероарил." Необходимо отметить, что химический фрагмент, образующий часть большего соединения, может быть описан в настоящем документе, используя название, обычно соответствующее ему, когда он находится в виде отдельной молекулы, или название, обычно соответствующее его радикалу. Например, термины "пиридин" и "пиридил", при описании фрагмента, присоединенного к другим химическим фрагментам, имеют одинаковое значение. Таким образом, два выражения "ХОН, где X представляет собой пиридил" и "ХОН, где X представляет собой пиридин", имеют одинаковое значение, и включают соединения пиридин-2-ол, пиридин-3-ол и пиридин-4-ол. Также необходимо отметить, что, если стереохимия структуры или часть структуры не обозначена,например, сплошной или пунктирной линиями, тогда структуру или часть структуры следует понимать,как включающую все свои стереоизомеры. Аналогично, названия соединений, имеющих один или несколько хиральных центров, которые не определены стереохимией этих центров, включают чистые стереоизомеры и их смеси. Кроме того, предполагается, что любой атом, показанный на рисунке с ненасыщенными валентностями, может быть присоединен к достаточному количеству атомов водорода для насыщения валентностей. Более того, химические связи, обозначенные одной сплошной линией, параллельной пунктирной линии, включают как одинарные, так и двойные (например, ароматические) связи,если позволяет валентность. Соединения Настоящее изобретение включает, среди прочих, соединения формулы или его фармацевтически приемлемая соль или сольват, где А представляет собой необязательно замещенный фенил, нафтил, или 5-6-членный гетероцикл,включающий 1-3 гетероатома, выбранные из О, N и S, причем необязательное замещение означает замещение одной или более группами С 1-6 алкоксила, амино, циано, галогена, гидроксила или фенила, причем фенильная группа необязательно замещена одной или более группами C1-6 алкоксила, амино, циано, галогена или гидроксила;D представляет собой 1,3,5-триазин, пиримидин или пиразин, необязательно замещенный амино или морфолино; Е представляет собой фенил или 5-6-членный гетероцикл, включающий 1-3 гетероатома, выбранные из О, N и S;R1 представляет собой водород или C1-10-алкил;R2 представляет собой водород или C1-10-алкил, необязательно замещенный морфолино;R3 представляет собой водород или необязательно замещенный C1-10-алкил;R4 представляет собой водород иR5 представляет собой водород или C1-4-алкил. Конкретное соединение представлено формулой Некоторые соединения по изобретению являются эффективными ингибиторами ТРН 1. Конкретные соединения имеют значение ТРН 1IC50 меньше чем около 10, 5, 2,5, 1, 0,75, 0,5, 0,4, 0,3, 0,2, 0,1 или 0,05 мкМ. Некоторые соединения являются селективными ингибиторами ТРН 1. Конкретные соединения имеют значение ТРН 1IC50 примерно 10, 25, 50, 100, 250, 500 или 1000 раз меньше, чем их ТРН 2IC50. Некоторые соединения существенно не ингибируют тирозингидроксилазу человека (ТН). Например, конкретные соединения имеют IC50 для ТН больше, чем около 100, 250, 500 или 1000 мкМ. Некоторые соединения существенно не ингибируют фенилаланин-гидроксилазу человека (РАН). Например, конкретные соединения имеют IC50 для РАН больше, чем около 100, 250, 500 или 1000 мкМ. Некоторые соединения по изобретению в основном не связываются (например, ингибируют со значением IC50 больше чем около 10, 25, 50, 100, 250, 500, 750 или 1000 мкМ) с одним или несколькими из следующих веществ: ангиотензин-конвертирующий фермент, эритропоэтиновый (ЕРО) рецептор, факторIX, фактор XI, интегрин (например, 4), изоксазолин или изоксазол фибриногеновый рецептор, металлопротеаза, нейтральная эндопептидаза (NEP), фосфатаза (например, тирозин фосфатаза), фосфодиэстераза(например, PDE-4), полимераза, PPAR, TNF-, молекула адгезии сосудистого эндотелия 1 типа (VCAM1) или витронектиновый рецептор. Способность соединения связываться (например, ингибировать) с любой из этих целей может быть легко определена, используя способы, хорошо известные в данной области, как описано в приведенных выше ссылках. Конкретные соединения по изобретению не ингибируют клеточную адгезию. При введении млекопитающим (например, мыши, крысы, собаки, обезьяны или человек) определенные соединения по изобретению с трудом преодолевают барьер кровь/головной мозг (например,меньше, чем около 5, 2,5, 2, 1,5, 1, 0,5 или 0,01% соединения в крови попадают в головной мозг). Способность или неспособность соединения пересекать барьер кровь/головной мозг может быть определена способами, хорошо известными в данной области. См., например, Riant P. et al., Journal of Neurochemistry 51:421-425 (1988); Kastin A.J., Akerstrom V., J. Pharmacol. Exp. Therapeutics 294: 633-636 (2000); W. A.Banks, W.A., et al., J. Pharmacol. Exp. Therapeutics 302:1062-1069 (2002). Синтез соединений Соединения по изобретению могут быть получены способами, хорошо известными в данной области, и способами, описанными в настоящем документе. Например, со ссылкой на формулу I, соединения, в которых Е представляет собой фенил и D представляет собой необязательно замещенный пиразин, пиридиазин, пиридин или фенил, могут быть получены способами, показанными на схеме 1 Соединения, где X представляет собой -OCR3- обычно могут быть получены, используя способ, показанный на схеме 2, где R3 представляет собой CF3, и D представляет собой пиримидин: Схема 2 где, например, А представляет собой необязательно замещенный фенил, бифенил или нафтил. Соединения по изобретению также могут быть получены, используя способ, показанный ниже на схеме 3: где Р 1 представляет собой R1 или защитную группу; Р 2 представляет собой защитную группу; Р 3 представляет собой OR2 или защитную группу;Y1 и Y3 представляют собой галоген (например, Br, Cl) или подходящий псевдогалогенид (например, трифлат); и каждый R' независимо представляет собой водород или необязательно замещенный алкил, алкиларил, алкилгетероцикл, арил или гетероцикл, или взяты вместе с атомами кислорода, к которым они присоединены с образованием циклического диоксаборолана (например, 4,4,5,5-тетраметил-1,3,2 диоксаборолан). Группы А, R1, R2, R3, R6 и m определены в дугих местах в настоящем документе. Фрагменты Z"l, Z"2, Z"3 и Z"4 также определены в настоящем документе, хотя должно быть понятно, что в отношении показанной выше схемы один из них присоединен к фенильному кольцу. Например, Z"l и Z"4 могут представлять собой независимо CR10 (который определен в настоящем документе), тогда как Z"2 представляет собой N, и Z"3 представляет собой атом углерода, связанный со смежным фенильным кольцом. Отдельные реакции, показанные выше, могут быть выполнены, используя условия, известные в данной области. Например, палладиевые катализаторы и условия, подходящие для реакции конденсации бор и галогенсодержащих фрагментов по Сузуки, хорошо известны, и примеры приведены ниже. Кроме того, хорошо известны типы и подходящие применения защитных групп, а также способы их удаления и замены фрагментами, такими как, но ими не ограничиваясь, водород (например, гидролиз в кислотных или основных средах). Фрагмент А может быть бициклическим (например, необязательно замещенный бифенил). В этих случаях исходное вещество, содержащее А, может быть получено способом, показанным ниже: где Y2 представляет собой галоген или псевдогалоген, и каждый R независимо представляет собой водород или необязательно замещенный алкил, алкил-арил, алкилгетероцикл, арил или гетероцикл, или взяты вместе с атомами кислорода, к которым они присоединены с образованием циклического диоксаборолана (например, 4,4,5,5-тетраметил-1,3,2-диоксаборолан). Другой способ получения соединений, где D представляет собой необязательно замещенный пиримидин или триазин, показан на схеме 4 ниже:FG = В(ОН)2, если Е необязательно представляет замещенный фенил Сложноэфирные производные этих и других соединений по изобретению могут быть легко получены, используя способы, например, показанные на схеме 5 ниже, где Е представляет собой необязательно замещенный фенил: Схема 5 Используя способы, хорошо известные в данной области, способы синтеза, показанные выше, могут быть легко изменены с получением широкого ряда соединений. Например, хиральная хроматография и другие способы, известные в данной области, могут быть использованы для разделения стереоизомеров конечного продукта. См., например, Jacques J., et al., Enantiomers, Racemates и Resolutions (Wiley Interscience, New York, 1981); Wilen S. H., et al., Tetrahedron 33:2725 (1977); Eliel E. L., Stereochemistry of Carbon Compounds (McGraw Hill, NY, 1962) и Wilen S. H., Tables of Resolving Agents and Optical Resolutions,p.268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN, 1972). Кроме того, как показано на некоторых схемах выше, в синтезе могут использоваться хиральные исходные вещества с получением сте-9 019879 реоизомерно обогащенных или чистых продуктов. Способы применения Настоящее изобретение включает способ ингибирования ТРН, который предусматривает контактирование ТРН с соединением по изобретению (то есть соединение, описанное в настоящем документе). В конкретном способе, ТРН представляет собой ТРН 1. В другом, ТРН представляет собой ТРН 2. В конкретном способе, ингибирование происходит in vitro. В другом, ингибирование происходит in vivo. Один из вариантов осуществления включает способ ингибирования ТРН 1 у млекопитающего, который содержит введение млекопитающему соединение по изобретению. В конкретном способе, ТРН 2 ингибируется не существенно. В одном из способов, соединение с трудом преодолевает барьер кровь/головной мозг. В другом, соединение представляет собой селективный ингибитор ТРН 1. Настоящее изобретение включает способы лечения, профилактики и терапии различных заболеваний и расстройств, опосредованных периферическим серотонином, которые содержат ингибирование активности ТРН 1 у пациента, нуждающегося в таком лечении, профилактике или терапии. В конкретном варианте осуществления, ингибирование осуществляется введением пациенту терапевтически или профилактически эффективного количества эффективного ингибитора ТРН 1. Примеры эффективных ингибиторов ТРН 1 описаны в настоящем документе. Конкретные заболевания и расстройства включают карциноидный синдром и желудочно-кишечные заболевания и расстройства. Примеры специфических заболеваний и расстройств включают боль в области живота (например, связанную с медуллярным раком щитовидной железы), страх, карциноидный синдром, глютеиновое заболевание, констипация (например, констипация, имеющая ятрогенную причину, и идиопатическая констипация), болезнь Крона, депрессивный синдром, диабет, диарея (например,желчная кислота диарея, вызванная энтеротоксином секреторная диарея, диарея, имеющая ятрогенную причину, идиопатическая диарея (например, идиопатическая секреторная диарея) и диарея путешественников), рвота, функциональная боль в области живота, функциональная диспепсия, синдром раздражения толстой кишки (IBS), непереносимость лактозы, МЭН типа I и II (множественный эндокринный аденоматоз), синдром Огилви, синдромом панкреатической холеры, недостаточность поджелудочной железы, феохромоцитома, склеродермия, соматическое нарушение и синдром Золлингера-Эллисона. В конкретных способах по изобретению, лечение, терапия и/или профилактика заболевания или расстройства достигается при устранении неблагоприятных эффектов, связанных с изменением уровней серотонина в центральной нервной системе (ЦНС). Примеры таких неблагоприятных эффектов включают тревожное возбуждение, тревожные расстройства, депрессивный синдром и расстройство сна (например, бессонница и нарушение сна). Фармацевтические композиции Настоящее изобретение включает фармацевтические композиции, содержащие одно или несколько соединений по изобретению. Определенные фармацевтические композиции представляют собой стандартные лекарственные формы, подходящие для перорального, слизистого (например, назального, сублингвального, вагинального, трансбуккального или ректального), парентеральный (например, подкожный, внутривенный, болюсное вливание, внутримышечный или внутриартериальный) или трансдермальное введение пациенту. Примеры лекарственных форм включают, но ими не ограничиваются: таблетки; таблетки в форме капсулы; капсулы, такие как мягкие эластичные желатиновые капсулы; крахмальные капсулы; пастилки; леденцы; дисперсии; суппозитории; мази; припарки(примочки); пасты; порошки; повязки; крема; пластыри; растворы; пластыри; аэрозоли (например, назальные спреи или ингаляторы); гели; жидкие лекарственные формы, подходящие перорального или слизистого введения пациенту, включая суспензии (например, водные или неводные жидкие суспензии, эмульсии "масло в воде",или "вода в масле" жидкие эмульсии), растворы и эликсиры; жидкие лекарственные формы, подходящие для парентерального введения пациенту; и стерильные твердые вещества (например, кристаллические или аморфные твердые вещества), которые могут быть восстановлены с получением жидких лекарственных форм, подходящих для парентерального введения пациенту. Композиция должна соответствовать способу введения. Например, пероральное введение соединения, подвергаемого расщеплению в желудке, может быть выполнено путем использования энтеросолюбильного покрытия. Аналогично, композиция может содержать ингредиенты, которые способствуют доставке активного(ых) ингредиента(ов) к месту приложения действия. Например, соединения, для их защиты от разлагающих ферментов, облегчения транспортировки в кровеносную систему и осуществления их доставки через клеточные мембраны, могут быть введены в липосомальных композициях. Аналогично, слаборастворимые соединения могут быть включены в жидкие лекарственные формы(и лекарственные формы, подходящие для восстановления) с помощью солюбилизирующих веществ,эмульгаторов и поверхностно-активных веществ, таких как, но ими не ограничиваясь, циклодекстрины(например, -циклодекстрин, -циклодекстрин, каптизол и энкапсин (см., например, Davis and Brewster, Nat. Rev. Drug Disc. 3:1023-1034 (2004, лабразол, лабрафил, лабрафак, кремафор и неводные растворители, такие как, но ими не ограничиваясь, этиловый спирт, изопропиловый спирт, этилкарбонат,этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид,- 10019879 диметилсульфоксид (ДМСО), биологически совместимые масла (например, хлопковое, арахисовое, кукурузное, пшеничное, оливковое, касторовое и сезамовое масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли, сложные эфиры жирных кислот и сорбита, и их смеси (например,ДМСО:кукурузное масло). Слабо растворимые соединения могут также быть переведены в суспензии, используя другие способы, известные в данной области. Например, наночастицы соединения могут быть суспендированы в жидкости с получением наносуспензии (см., например, Rabinow, Nature Rev. Drug Disc. 3:785-796 (2004. Формы наночастиц соединений, описанных в настоящем документе, могут быть получены способами,описанными в патенте США публикация 2004-0164194, 2004-0195413, 2004-0251332, 2005-0042177 А 1, 2005-0031691 А 1, и патенте США 5145684, 5510118, 5518187, 5534270, 5543133, 5662883,5665331, 5718388, 5718919, 5834025, 5862999, 6431478, 6742734, 6745962, содержания каждого из которых включено в настоящий документ в качестве ссылки. В одном из вариантов осуществления, форма наночастицы содержит частицы, имеющие средний размер частицы, равный меньше чем около 2000 нм,меньше, чем около 1000 нм или меньше чем около 500 нм. Состав, форма и тип лекарственной формы будет обычно изменяться в зависимости от применения. Например, лекарственная форма, применяемая при лечении острого заболевания, может содержать большие количества одного или нескольких активных ингредиентов, чем лекарственная форма, применяемая в лечении хронической формы того же самого заболевания. Аналогичным образом, лекарственная форма для парентерального введения может содержать меньшие количества одного или нескольких активных ингредиентов, чем лекарственная форма перорального введения для применения в лечении того же самого заболевания. Для специалиста в данной области будет очевиден способ определения такой разницы. См., например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA(1990). Лекарственные формы для перорального применения Фармацевтические композиции по изобретению, подходящие для перорального введения, могут быть представлены в виде дискретных лекарственных форм, таких как, но ими не ограничиваются, таблетки (например, разжевываемые таблетки), таблетки в форме капсулы, капсулы и жидкости (например,ароматизированные сиропы). Такие лекарственные формы содержат заранее определенные количества активных ингредиентов, и могут быть получены способами, применяемыми в фармацевтике, хорошо известными специалистам в данной области. Смотри, например, Remington's Pharmaceutical Sciences, 18thed., Mack Publishing, Easton PA (1990). Типичные лекарственные формы для перорального введения получают сочетанием активного(ых) ингредиента(ов) в однородной смеси с по меньшей мере одним наполнителем, в соответствии с обычными способами получения фармацевтических соединений. Наполнители могут принимать широкий ряд форм, в зависимости от желаемой формы введения препарата. Вследствие легкости их введения, таблетки и капсулы представляют собой наиболее предпочтительные стандартные лекарственные формы для перорального введения. Если желательно, таблетки могут быть покрыты оболочкой стандартными водными или неводными способами. Такие лекарственные формы могут быть получены обычными способами, применяемыми в фармацевтике. Обычно фармацевтические композиции и лекарственные формы получают путем непрерывного и непосредственно смешивания активных ингредиентов с жидкими носителями, тонко измельченными твердых носителями, или их обоими, и затем, если необходимо, продукту придают желаемую форму. Для увеличения скорости растворения, в твердые лекарственные формы могут быть введены разрыхляющие вещества. Также для облегчения получения лекарственных форм (например, таблетки) могут быть введены смазывающие вещества. Лекарственные формы для парентерального введения Лекарственные формы для парентерального способа введения могут быть введены пациентам различными способами, включая подкожный, внутривенный (включая болюсное вливание), внутримышечный и внутриартериальный. Поскольку их введение обычно обходит природные защитные механизмы против загрязнителей пациента, лекарственные формы для парентерального способа введения специально стерилизуют или допускают стерилизацию перед введением пациенту. Примеры лекарственных форм для парентерального способа введения включают растворы, готовые для инъекции, сухие продукты, готовые для растворения или суспендирования в фармацевтически приемлемом носителе для инъекции,суспензии, готовые для инъекции, и эмульсии. Подходящие носители, которые могут быть использованы для получения лекарственных форм для парентерального способа введения по изобретению, хорошо известны специалистам в данной области. Примеры включают: воду для инъекции USP; жидкие носители, такие как физиологический раствор для инъекции, раствор Рингера для инъекции, раствор декстрозы для инъекции, раствор декстрозы и физиологического раствора для инъекции, раствор лактата Рингера для инъекции; водорастворимые носители,такие как этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие как кукурузное масло, хлопковое масло, арахисовое масло, сезамовое масло, этилолеат, изопропилмеристат и бензилбензоат. Примеры Создание мышей с поврежденным геном tph1 Экзон 3 гена ТРН 1 мыши удаляли путем нацеливания на ген, главным образом, как описано Wattleret al., Biotechniques 26(6):1150-6 (1999). Полученные нокаут-животные обладали нормальной активностью TPH в мозге, но значительно сниженной экспрессией TPH в кишечнике. Физиологические эффекты поврежденного гена tph1 Гомозиготную мышь (-/-), используемую для повреждения гена tph1, исследовали вместе с гетерозиготной мышью (+/-), используемой для повреждения гена tph1, наряду с пометом мышей дикого типа(+/+). В процессе этого анализа мышь подвергали медицинскому обследованию, используя интегрированный набор медицинских диагностических процедур для оценки функциональности основных систем организма млекопитающего. При исследовании описанных гомозиготных нокаут мышей (-/-) совместно с гетерозиготными мышами (+/-) и помета мышей дикого типа (+/+) были получены более достоверные и воспроизводимые даны. Нарушение гена tph1 прежде всего влияло на желудочно-кишечную изоформу GI фермента TPH(ТРН 1), и не влияло или влияло не значительно на мозговую изоформу фермента ТРН (ТРН 2). Нарушение гена не давало измеримых побочных эффектов на центральную нервную систему. Это подтверждалось иммунохимимическими анализами серотонина, которые указывали, что количество серотонина значительно снижалось или отсутствовало в желудке, двенадцатиперстной, тощей, подвздошной, слепой и тонкой кишке, при чем уровни серотонина в нейронах ядер шва были не были затронуты. Гомозиготные мыши (-/-), используемые для повреждения гена tph1, имели сниженный тромбоз без значительного усиления кровотечения или других побочных эффектов. Характеристики ВЭЖХ В некоторых следующих далее синтетических примерах, представлено время удерживания по данным высокоэффективной жидкостной хроматографии (ВЭЖХ). Если не указано иное, различные условия, используемые для получения этих данных по времени удерживания, описаны далее: Способ A: YMC-PACK ODS-A 3,050 мм; растворитель А = 90% воды, 10% МеОН, 0,1% ТФУ; растворитель В = 90% МеОН, 10% воды, 0,1% ТФУ; В% от 0 до 100% в течение 4 мин; скорость потока = 2 мл/мин; наблюдаемая длина волны = 220 нМ. Способ В: YMC-PACK ODS-A 3,050 мм; растворитель А = 90% воды, 10% МеОН, 0,1% ТФУ; растворитель В = 90% МеОН, 10% воды, 0,1% ТФУ; % В от 10 до 100% в течение 4 мин; скорость потока = 3 мл/мин; наблюдаемая длина волны = 220 нМ. Способ С: УМС-РАСК ODS-A 3,050 мм; растворитель А = 90% воды, 10% МеОН, 0,1% ТФУ; растворитель В = 90% МеОН, 10% воды, 0,1% ТФУ; В% от 0 до 100% в течение 5 мин; скорость потока = 2 мл/мин; наблюдаемая длина волны = 220 нМ. Способ D: Shim VP ODS 4,650 мм; растворитель А = 90% воды, 10% МеОН, 0,1% ТФУ; растворитель В = 90% МеОН, 10% воды, 0,1% ТФУ; В% от 0 до 100% в течение 4 мин; скорость потока = 3 мл/мин; наблюдаемая длина волны = 220 нМ. Способ Е: Shim VP ODS 4,650 мм; растворитель А = 90% воды, 10% МеОН, 0,1% ТФУ; растворитель В = 90% МеОН, 10% воды, 0,1% ТФУ; В% от 0 до 100% в течение 4 мин; скорость потока = 3 мл/мин; наблюдаемая длина волны = 254 нМ. Способ F: YMC-PACK ODS-A 4,633 мм; растворитель А = 90% воды, 10% МеОН, 0,1% ТФУ; растворитель В = 90% МеОН, 10% воды, 0,1% ТФУ; В% от 0 до 100% в течение 4 мин; скорость потока = 3 мл/мин; наблюдаемая длина волны = 220 нМ. Способ G: YMC-PACK ODS-A 4,650 мм; растворитель А = 90% воды, 10% МеОН, 0,1% ТФУ; растворитель В = 90% МеОН, 10% воды, 0,1% ТФУ; В% от 0 до 100% в течение 2 мин; скорость потока = 2,5 мл/мин; наблюдаемая длина волны = 220 нМ. Способ Н: С 18 4,620 мм; растворитель А = 90% воды, 10% МеОН, 0,1% ТФУ; растворитель В = 90% МеОН, 10% воды, 0,1% ТФУ; В% от 0 до 100% в течение 2 мин, скорость потока = 2 мл/мин; наблюдаемая длина волны = 220 нМ. Способ I: YMC PACK ODS-A 3,050 мм; растворитель А = 90% воды, 10% МеОН, 0,1% ТФУ; растворитель В = 90% МеОН, 10% воды, 0,1% ТФУ; В% от 10 до 100% в течение 4 мин; скорость потока = 2 мл/мин; наблюдаемая длина волны = 220 нМ. Способ J: YMC Pack ODS-A 3,050 мм; растворитель А = Н 2 О, 0,1% ТФУ; растворитель В = МеОН,0,1% ТФУ; % В от около 10 до около 90% в течение 4 мин; скорость потока = 2 мл/мин; наблюдаемая длина волны = 220 нМ. Способ K: Sunfire C18 50 мм 4,6 мм 3,5 мкм; растворитель А = 10 мм NH4OAc в воды; растворитель В = MeCN; B% от 10 до 95% в течение 2 мин; скорость потока =4,5 мл/мин; наблюдаемая длина волны = 220 нМ. Способ L: Sunfire C18 50 мм 4,6 мм 3,5 мкм; растворитель А = 10 мм NH4OAc; растворитель В =MeCN; B% от 2 до 20% в течение 0.8 мин, затем до 95% В в течение 2 мин; скорость потока =4,5 мл/мин; наблюдаемая длина волны = 220 нМ. Способ М: YMC-PACK ODS-A 4,633 мм; растворитель А = 90% воды, 10% МеОН, 0,1% ТФУ; растворитель В = 90% МеОН, 10% воды, 0,1% ТФУ; В% от 0 до 100% в течение 5 мин; скорость потока = 2,5 мл/мин; наблюдаемая длина волны = 254 нМ. Способ N: YMC-PACK ODS-A 3,050 мм; растворитель А = Н 2 О, 0,1% ТФУ; растворитель В = МеОН, 0,1% ТФУ; В% от 10 до 90% в течение 4 мин; скорость потока = 2 мл/мин; наблюдаемая длина волны = 220 и 254 нМ. Способ О: YMC-PACK ODS-A 3,050 мм; растворитель А = 90% воды, 10% МеОН с 0,1% ТФУ; растворитель В = 90% МеОН, 10% воды с 0,1% ТФУ; В% от 0 до 100% в течение 4 мин; скорость потока= 2 мл/мин; наблюдаемая длина волны = 220 и 254 нМ. Способ Р: ShimPack VP ODS 4,650 мм; растворитель А = 90% Н 2 О, 10% МеОН, 1% ТФУ; растворитель В = 10% Н 2 О, 90% МеОН, 1%ТФУ; В% от 0 до 100% в течение 2 мин; скорость потока = 3,5 мл/мин; наблюдаемая длина волны = 220 и 254 нМ. Способ Q: Shim VP ODS 4,605 мм; растворитель А = Н 2 О с 0,1% ТФУ; растворитель В = МеОН с 0,1% ТФУ; В% от 0 до 100% в течение 4 мин; скорость потока = 3 мл/мин; наблюдаемая длина волны = 254 нМ. Способ R: YMC Pack ODS-A 4,633 мм; растворитель А = Н 2 О, 0,1% ТФУ; растворитель В = МеОН с 0,1% ТФУ; В% от 10 до 90% в течение 3 мин; скорость потока 2 мл/мин; наблюдаемая длина волны 220 и 254 нМ. Способ S: YMC-Pack ODS-A 3,050 мм; растворитель А = 90% H2O, 10% МеОН, 1% ТФУ; растворитель В = 10% Н 2 О, 90% МеОН, 1% ТФУ; В% от 10 до 90% в течение 4 мин; скорость потока = 2 мл/мин; наблюдаемая длина волны = 220 и 254 нМ. Синтез Смесь 2-амино-4,6-дихлор-[1,3,5]триазина (200 мг, 1,21 ммоль), (R)-(+)-1-(2-нафтил)этиламина (207 мг, 1,21 ммоль) и диизопропилэтиламина (3,63 ммоль) растворяли в 150 мл 1,4-диоксана. Раствор кипятили с обратным холодильником при температуре 90 С в течение 3 ч. После завершения реакции (отслеживали с помощью ВЭЖХ), растворитель удаляли и реакционную смесь экстрагировали CH2Cl2 (100 мл) и Н 2 О (100 мл). Органический слой отделяли и промывали Н 2 О (2100 мл), сушили над Na2SO4 и концентрировали в вакууме с получением сырого промежуточного продукта. Сырой продукт растворяли в 5 мл MeCN и 5 мл Н 2 О в 20 мл-овой пробирке для проведения реакции под воздействием микроволнового излучения. К этому раствору добавляли L-п-борфенилаланин (253 мг, 1,21 ммоль), карбонат натрия (256 мг, 2,42 ммоль) и каталитическое количество дихлорбис(трифенилфосфин)палладия(II) (42,1 мг, 0,06 ммоль). Смесь герметично закрывали и перемешивали в реакторе с микроволновым излучением при температуре 150 С в течение 5 мин, затем фильтровали через целит. Фильтрат концентрировали и растворяли в МеОН и H2O (1:1) и очищали с помощью препаративной ВЭЖХ, используя систему растворителей МеОН/Н 2 О/ТФУ. Объединенные чистые фракции упаривали в вакууме и далее сушили на лиофилизаторе с получением 238 мг 2-амино-3-4-[4-амино-6-(1-нафталин-2-ил)этиламино)-[1,3,5]триазин-2 ил]-фенилпропионовой кислоты (выход: 46%, ЖХ: колонка: YMC Pack ODS-A 3,050 мм, % В = 0100%, градиентное время = 4 мин, скорость потока = 2 мл/мин, длина волны = 220, растворитель А = 90:10 вода: МеОН w/0,1% ТФУ, растворитель В = 90:10 МеОН: вода w/0,1% ТФУ, время удерживания = 2,785 мин, MS: М+1 = 429). ЯМР: 1H-ЯМР (400 МГц, CD3OD):1,65 (д, 3 Н), 3,22-3,42 (м, 2 Н), 4,3 (м, 1 Н), 5,45 (м, 1 Н), 7,4 (м,1 Н), 7,6 (м, 4 Н), 7,8(м, 4 Н), 8,2 (м, 2 Н). Синтез(1,5 мл) в 5 мл-ой пробирке для проведения реакции под воздействием микроволнового излучения. Смесь перемешивали в микроволновом реакторе при температуре 100 С в течение 15 мин. Растворитель удаляли и остаток растворяли в CH2Cl2 (20 мл) и промывали Н 2 О (220 мл), сушили над Na2SO4 и затем удаляли в вакууме. Сырой промежуточный продукт затем растворяли в 1,5 мл MeCN и 1,5 мл Н 2 О в 5 мловой пробирке для проведения реакции под воздействием микроволнового излучения. К этому раствору добавляли L-п-борфенилаланин (126 мг, 0,606 ммоль), карбонат натрия (128 мг, 1,21 ммоль) и каталитическое количество дихлорбис(трифенилфосфин)палладия(II) (21,1 мг, 0,03 ммоль). Смесь герметично закрывали и перемешивали в реакторе с микроволновым излучением при температуре 150 С в течение 5 мин, затем фильтровали через целит. Фильтрат концентрировали и растворяли в МеОН и Н 2 О (1:1) и очищали с помощью препаративной ВЭЖХ, используя систему растворителей МеОН/Н 2 О/ТФУ. Объединенные чистые фракции упаривали в вакууме и далее сушили на лиофилизаторе с получением 21,6 мг 2-амино-3-(4-4-амино-6-[(4'-метилбифенил-4-илметил)амино]-[1,3,5]триазин-2-илфенил)пропионовой кислоты Смесь 2,4-дихлор-6-морфолин-4-ил-[1,3,5]триазина (121 мг, 0,516 ммоль), С-нафталин-2-илметиламин гидрохлорида(100 мг, 0,516 ммоль), карбоната цезия (336 мг, 1,03 ммоль) растворяли в 1,4 диоксане (1,5 мл) и H2O (1,5 мл) в 5 мл-овой пробирке для проведения реакции под воздействием микроволнового излучения. Смесь перемешивали в микроволновом реакторе при температуре 180 С в течение 600 с. Растворитель удаляли, и остаток растворяли в CH2Cl2 (10 мл) и промывали Н 2 О (210 мл), сушили над Na2SO4 и затем в вакууме. Остаток очищали с помощью препаративной ВЭЖХ с получением 20 мг промежуточного продукта (выход 11%, М+1=356). Промежуточный продукт затем растворяли в 0,5 млMeCN и 0,5 мл Н 2 О в 2 мл-овой пробирке для проведения реакции под воздействием микроволнового излучения. К этому раствору добавляли L-п-борфенилаланин (11,7 мг, 0,0562 ммоль), карбонат натрия(11,9 мг, 0,112 ммоль) и каталитическое количество дихлорбис(трифенилфосфин)палладия(II) (2,0 мг,5%). Смесь герметично закрывали и перемешивали в реакторе с микроволновым излучением при температуре 150 С в течение 5 мин, затем фильтровали через целит. Фильтрат концентрировали и растворяли в МеОН и Н 2 О (1:1) и очищали с помощью препаративной ВЭЖХ, используя систему растворителей МеОН/Н 2 О/ТФУ. Объединенные чистые фракции упаривали в вакууме и далее сушили на лиофилизаторе с получением 17 мг 2-амино-3-(4-4-морфолин-4-ил-6-[(нафталин-2-илметил)амино]-[1,3,5]триазин-2 илфенил)пропионовой кислоты (выход: 63%, ЖХ: способ В, время удерживания = 3,108 мин, MS: M+1 = 486). Синтез (2S)-2-амино-3-(4-(2-амино-6-(2,2,2-трифтор-1-(2-(трифторметил)фенил)этокси)пиримидин 4-ил)фенил)пропановой кислоты(TMSCF3) (1,8 мл, 12 ммоль) в 10 мл ТГФ при температуре 0 С добавляли тетрабутиламмоний фторид(0,1 мл; 1,0 М раствор в тетрагидрофуране). Образующуюся смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Реакционную смесь затем обрабатывали 12 мл 1 н HCl и перемешивали в течение ночи. Продукт экстрагировали этилацетатом (320 мл). Органический слой отделяли и сушили над сульфатом натрия. Органический растворитель упаривали с получением 2,2 г 1-(2 трифторметилфенил)-2,2,2-трифторэтанола, выход 90%. К раствору 1-(2-трифторметилфенил)-2,2,2-трифторэтанола (244 мг, 1 ммоль) в 10 мл безводного ТГФ добавляли NaH (80 мг, 60%, 3,0 ммоль). Смесь перемешивали в течение 20 мин, добавляли 2-амино- 14019879 4,6-дихлорпиримидин (164 мг, 1 ммоль) и затем реакционную смесь нагревали при температуре 70 С в течение 1 ч. После охлаждения добавляли 5 мл воды и для экстрагирования продукта использовали этилацетат (20 мл). Органический слой сушили над сульфатом натрия. Растворитель удаляли с помощью роторного испарителя с получением 267 мг 4-хлор-6-[2,2,2-трифтор-1-(2-трифторметилфенил)этокси]пиримидин-2-иламина, выход 71%. В сосуд для проведения реакции под воздействием микроволнового излучения помещали 4-хлор-2 амино-6-[1-(2-трифторметилфенил)-2,2,2-трифторэтокси]пиримидин (33 мг, 0,1 ммоль), 4-бор-Lфенилаланин (31 мг, 0,15 ммоль) и 1 мл ацетонитрила, 0,7 мл воды. К вышеуказанному раствору добавляли 0,3 мл 1 н водного карбоната натрия и затем 5 мол.% дихлорбис(трифенилфосфин)палладия(II). Реакционный сосуд герметично закрывали и нагревали при температуре 150 С в течение 5 мин под воздействием микроволнового излучения. После охлаждения реакционную смесь упаривали досуха. Остаток растворяли в 2,5 мл метанола и затем очищали с помощью преп-ЖХ с получением 5,6 мг 2-амино-3-(42-амино-6-[2,2,2-трифтор-1-(2-трифторметилфенил)этокси]пиримидин-4-илфенил)пропионовой кислоты. 1H ЯМР (400 МГц, CD3OD)7,96 (м, 3 Н), 7,80 (д, J=8,06 Гц, 1 Н), 7,74 (т, J=7,91 Гц 1 Н), 7,63 (т,J=8,06 Гц, 1 Н), 7,41 (д, 3=8,3 Гц, 2 Н), 7,21 (м, 1 Н), 6,69 (с, 1 Н), 3,87 (м, 1 Н), 3,34 (м, 1 Н), 3,08 (м, 1 Н). Синтез (2S)-2-амино-3-(4-(2-амино-6-(2,2,2-трифтор-1-п-толилэтокси)пиримидин-4-ил)фенил)пропановой кислоты Тетрабутиламмоний фторид (0,1 мл; 1,0 М раствор в тетрагидрофуране) добавляли к раствору 4 метилбензальдегида (1,2 г, 10 ммоль) и TMSCF3 (1,8 мл, 12 ммоль) в 10 мл ТГФ при температуре 0 С. Образующуюся смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Реакционную смесь затем обрабатывали 12 мл 1 н HCl и перемешивали в течение ночи. Продукт экстрагировали этилацетатом (320 мл). Органический слой отделяли и сушили над сульфатом натрия. Органический растворитель упаривали с получением 1,6 г 1-(4-метилфенил)-2,2,2-трифторэтанола, выход 86%. К раствору 1-(4-метилфенил)-2,2,2-трифторэтанола (190 мг, 1 ммоль) в 10 мл безводного ТГФ добавляли NaH (80 мг, 60%, 3,0 ммоль). Смесь перемешивали в течение 20 мин, добавляли 2-амино-4,6 дихлорпиримидин (164 мг, 1 ммоль) и затем реакционную смесь нагревали при температуре 70 С в течение 1 ч. После охлаждения добавляли 5 мл воды и для экстрагирования продукта использовали этилацетат (20 мл). Органический слой сушили над сульфатом натрия. Растворитель удаляли с помощью роторного испарителя с получением 209 мг 4-хлор-6-[1-(4-метилфенил)-2,2,2-трифторэтокси]пиримидин-2 иламина, выход 66%. В сосуд для проведения реакции под воздействием микроволнового излучения помещали 4-хлор-2 амино-6-[1-(4-метилфенил)-2,2,2-трифторэтокси]пиримидин (33 мг, 0,1 ммоль), 4-бор-L-фенилаланин (31 мг, 0,15 ммоль) и 1 мл ацетонитрила, 0,7 мл воды. К вышеуказанному раствору добавляли водный карбонат натрия (0,3 мл, 1 н), затем 5 мол.% дихлорбис(трифенилфосфин)палладия(II). Реакционный сосуд герметично закрывали и нагревали до 150 С в течение 5 мин под воздействием микроволнового излучения. После охлаждения реакционную смесь упаривали досуха. Остаток растворяли в 2,5 мл метанола,затем очищали с помощью преп-ЖХ с получением 14,6 мг 2-амино-3-(4-2-амино-6-[2,2,2-трифтор-1-(4 метилфенил)этокси]пиримидин-4-илфенил)пропионовой кислоты. 1 Н ЯМР (300 МГц, CD3OD)7,94 (д, J=8,20 Гц, 2 Н), 7,47 (д, J=7,24 Гц, 4 Н), 7,27 (д, J=8,01 Гц, 2 Н),6,80 (с, 1 Н), 6,75 (м, 1 Н), 4,30 (т, 1 Н), 3,21-3,44 (м, 2 Н), 2,37 (с, 3 Н). Синтез (S)-2-амино-3-(4-(6-(2-фторфенокси)пиримидин-4-ил)фенил)пропановой кислоты К раствору 2-фторфенола (112 мг, 1 ммоль) в 10 мл безводного ТГФ добавляли NaH (80 мг, 60%, 3,0 ммоль), смесь перемешивали в течение 20 мин, добавляли 4,6-дихлорпиримидин (149 мг, 1 ммоль) и затем реакционную смесь нагревали при температуре 70 С в течение 1 ч. После охлаждения добавляли 5 мл воды и для экстрагирования продукта использовали этилацетат (20 мл). Органический слой сушили над сульфатом натрия. Растворитель удаляли с помощью роторного испарителя с получением 146 мг 4 хлор-6-(2-фторфенокси)пиримидина, выход 65%. В сосуд для проведения реакции под воздействием микроволнового излучения (2мл) помещали 4 хлор-6-[2-фторфенокси]пиримидин (33 мг, 0,1 ммоль), 4-бор-L-фенилаланин (31 мг, 0,15 ммоль) и 1 мл ацетонитрила, 0,7 мл воды, к вышеуказанному раствору добавляли 0,3 мл водного карбоната натрия(1 М), затем 5 мол.% дихлорбис(трифенилфосфин)палладия(II). Реакционный сосуд герметично закрыва- 15019879 ли и нагревали до 150 С в течение 5 мин под воздействием микроволнового излучения. После охлаждения реакционную смесь упаривали досуха, остаток растворяли в 2,5 мл метанола, и продукт очищали с помощью преп-ЖХ с получением 4,9 мг 2-амино-3-4-[2-амино-6-(1-2-фторфенил-2,2,2-трифторэтокси)пиримидин-4-ил]фенилпропионовой кислоты. 1 К раствору 2,2,2-трифтор-1-фенилэтанола (176 мг, 1 ммоль) в 10 мл безводного 1,4-диоксана добавляли NaH (80 мг, 60%, 3,0 ммоль). Смесь перемешивали в течение 20 мин, затем добавляли в раствор 2 амино-4,6-дихлортриазина (164 мг, 1 ммоль) в 30 мл 1,4-диоксана при температуре 0 С в течение 1 ч. Реакционную смесь затем нагревали до комнатной температуры. После охлаждения добавляли 5 мл воды и для экстрагирования продукта использовали этилацетат (20 мл). Органический слой сушили над сульфатом натрия. Растворитель удаляли с помощью роторного испарителя с получением 198 мг 4-хлор-6[2,2,2-трифтор-1-фенилэтокси]-[1,3,5]триазин-2-иламина, выход 65%. В сосуд для проведения реакции под воздействием микроволнового излучения помещали 4-хлор-6[2,2,2-трифтор-1-фенилэтокси]-[1,3,5]триазин-2-иламин (33 мг, 0,1 ммоль), 4-бор-L-фенилаланин (31 мг,0,15 ммоль), 1 мл ацетонитрила и 0,7 мл воды. К вышеуказанному раствору добавляли водный карбонат натрия (0,3 мл, 1 М), затем 5 мол.% дихлорбис(трифенилфосфин)палладия(II). Реакционный сосуд герметично закрывали и нагревали до 150 С в течение 5 мин под воздействием микроволнового излучения. После охлаждения реакционную смесь упаривали досуха. Остаток растворяли в 2,5 мл метанола, затем очищали с помощью преп-ЖХ с получением 3,2 мг 2-амино-3-4-[4-амино-6-(1-фенил-2,2,2 трифторэтокси)-[1,3,5]триазин-2-ил]фенилпропионовой кислоты. 1 Н ЯМР (300 МГц, CD3OD)8,22 (д, J=8,20 Гц, 2 Н), 7,52 (м, 2 Н), 7,33 (м, 5 Н) 6,62 (м, 1 Н), 4,19 (т,1 Н), 3,1-3,33 (м, 2 Н). Синтез (2S)-2-амино-3-(4-(6-(2,2,2-трифтор-1-фенилэтокси)пиримидин-4-ил)фенил)пропановой кислоты К раствору 2,2,2-трифтор-1-фенилэтанола (350 мг, 2,03 ммоль) в 5 мл ТГФ добавляли NaH (60%,120 мг, 3,0 ммоль). Смесь перемешивали в течение 20 мин при комнатной температуре. Добавляли 4,6 дихлорпиримидин (300 мг, 2,03 ммоль) и затем реакционную смесь нагревали при температуре 70 С в течение 1 ч. После охлаждения ТГФ упаривали с получением остатка, который растворяли в 15 млEtOAc, и затем промывали водой и сушили над сульфатом натрия. Растворитель удаляли с помощью роторного испарителя с получением 550 мг 4-хлор-6-(2,2,2-трифтор-1-фенилэтокси)пиримидина, выход 95%. В пробирку процесса Emrys (2-5 мл) для проведения реакции при микроволновом облучении помещали 4-хлор-6-(2,2,2-трифтор-1-фенилэтокси)пиримидин (30 мг, 0,11 ммоль), 4-бор-L-фенилаланин (32 мг, 0,16 ммоль), 1 мл ацетонитрила и 0,6 мл воды. К вышеуказанному раствору добавляли водный карбонат натрия (0,42 мл, 1 М), затем 10 мольных процентов POPd2 (дигидро дихлордихлорбис(ди-третбутилфосфинито-P)дипалладат. Реакционный сосуд герметично закрывали и нагревали до 120 С в течение 30 мин под воздействием микроволнового излучения. После охлаждения реакционную смесь упаривали досуха. Остаток растворяли в 2,5 мл метанола, и продукт очищали с помощью преп-ЖХ с получением 4,8 мг 2-амино-3-4-[6-(2,2,2-трифтор-1-фенилэтокси)пиримидин-4-ил]фенилпропионовой кислоты, выход 11%. 1 Н-ЯМР (400 МГц, CD3OD):3,20 (м, 1 Н), 3,40(м, 1 Н), 4,25(t, 1H), 6,82(dd, 1 Н), 7,43(м, 5 Н), 7,57 (s,1H), 7,60 (м, 2 Н), 8,10(д, 2 Н), 8,75 (s, 1H). Синтез Тетрабутиламоний фторид (TBAF: 0,1 мл, 1 М) в ТГФ добавляли к раствору 3,4 дифторбензальдегида(1, 42 г, 10 ммоль) и (трифторметил)триметилсилана (1,70 г, 12 ммоль) в 10 мл ТГФ при температуре 0 С. Смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Реакционную смесь обрабатывали 12 мл 1 М HCl и перемешивали в течение ночи. Продукт экстрагировали дихлорметаном (320 мл), органические слои объединяли и пропускали через слой силикагеля. Органический растворитель упаривали с получением 1,9 г 1-(3,4-дифторфенил)-2,2,2-трифторэтанола, выход 90%. К раствору 1-(3,4-дифторфенил)-2,2,2-трифторэтанола (212 мг, 1 ммоль) в 5 мл ТГФ добавляли NaH(80 мг, 60%, 3,0 ммоль), смесь перемешивали в течение 20 мин при комнатной температуре, добавляли 4,6-дихлорпиримидин (149 мг, 1 ммоль) и затем реакционную смесь нагревали при температуре 70 С в течение 1 ч. После охлаждения ТГФ упаривали. Остаток растворяли в 15 мл EtOAc и затем промывали водой, сушили над сульфатом натрия. Растворитель удаляли с помощью роторного испарителя с получением 230 мг 4-хлор-6-[1-(3,4-дифторфенил)-2,2,2-трифторэтокси]пиримидина, выход 70%. В пробирку процесса Emrys (2-5 мл) для проведения реакции при микроволновом облучении помещали 4-хлор-6-[1-(3,4-дифторфенил)-2,2,2-трифторэтокси]пиримидин (33 мг, 0,1 ммоль), 4-бор-Lфенилаланин (31 мг, 0,15 ммоль), 1 мл ацетонитрила и 0,7 мл воды. К вышеуказанному раствору добавляли водный карбонат натрия (0,3 мл, 1 М), затем 5 мол.% дихлорбис(трифенилфосфин)палладия(II). Реакционный сосуд герметично закрывали и нагревали до 150 С в течение 5 мин под воздействием микроволнового излучения. После охлаждения реакционную смесь упаривали досуха. Остаток растворяли в 2,5 мл метанола, затем очищали с помощью преп-ЖХ с получением 10 мг 2-амино-3-(4-6-[1-(3,4-дифторфенил)-2,2,2-трифторэтокси]пиридин-4-илфенил)пропионовой кислоты, выход 21%. 1 Смесь 1-бифенил-2-ил-2,2,2-трифторэтанона (300 мг, 1,2 ммоль), комплексов борантетрагидрофуран (1,2 мл, 1 М в ТГФ, 1,2 ммоль) и S-2-метил-CBS-оксазаборолидин (0,24 мл, 1 М в толуоле, 0,24 ммоль) в ТГФ (8 мл) перемешивали при комнатной температуре в течение ночи, добавляли несколько капель концентрированной HCl и смесь перемешивали в течение 30 мин. Продукт очищали путем хроматографии на SiO2 (гексан/этилацетат = от 100/0 до 3/1) с получением 290 мг 1-бифенил-2-ил 2,2,2-трифторэтанола (96% выход). Вышеуказанный спирт (290 мг, 1,151 ммоль) растворяли в безводном ТГФ (10 мл). Добавляли сразу весь гидрид натрия (55 мг, 1,375 ммоль) и смесь перемешивали при комнатной температуре в течение 30 мин. Раствор затем переносили в колбу, которая содержала суспензию 2-амино-4,6-дихлортриазина (190 мг, 1,152 ммоль) в ТГФ (20 мл). Смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду и смесь затем разбавляли этилацетатом. Органический слой промывали водой, сушили надMgSO4 и затем концентрировали с получением 400 мг сырого продукта 2-амино-4-(1-бифенил-2-ил-2,2,2 трифторэтокси)-6-хлортриазина. 2-амино-4-(1-бифенил-2-ил-2,2,2-трифторэтокси)-6-хлортриазин (40 мг, 0,105 ммоль) подвергали такой же реакции конденсации Сузуки, как описано выше, с получением 5 мг указанного в заголовке соединения. Выход: 9,4%. 1 Н ЯМР (CD3OD)8,18 (д, 2 Н), 7,86 (м, 1 Н), 7,40-7,52 (м, 9 Н), 7,32 (м, 1 Н), 7,07 (м, 1 Н), 4,32 (м,1 Н), 3,22-3,41 (м, 2 Н). М+1 = 510. Синтез(435 мг, 3,061 ммоль) в ТГФ (3 мл) добавляли тетрабутиламмоний фторид (13 мг, 0,05 ммоль) при температуре 0 С. Температуре давали подняться до комнатной температуры. Смесь перемешивали в течение 5 ч при комнатной температуре, затем разбавляли этилацетатом, промывали водой и насыщенным солевым раствором и сушили с помощью MgSO4. Растворитель удаляли при пониженном давлении с получением 660 мг (97%-ный выход сырого продукта) 2,2,2-трифтор-1-(3'-метилбифенил-2-ил)этанола в виде сырого продукта, который использовали на следующей стадии без дополнительной очистки. Полученный выше спирт (660 мг, 2,481 ммоль) растворяли в безводном 1,4-диоксане (10 мл). Добавляли сразу весь гидрид натрия (119 мг, 60% в минеральном масле, 2,975 ммоль) и смесь перемешивали при комнатной температуре в течение 30 мин. Раствор переносили в колбу, содержащую суспензию 2 амино-4,6-дихлортриазина (491 мг, 2,976 ммоль) в 1,4-диоксане (70 мл). Смесь перемешивали при комнатной температуре в течение 6 ч. Растворитель удаляли и остаток суспендировали в этилацетате, который промывали водой, сушили над MgSO4 и затем концентрировали с получением 790 мг сырого продукта, который содержал около 57% желаемого продукта 2-амино-4-(1-(3'-метилбифенил-2-ил)-2,2,2 трифторэтокси)-6-хлортриазина и около 43% побочного продукта (бизамещенный продукт). Сырой продукт использовали без дополнительной очистки. 2-Амино-4-(1-(3'-метилбифенил-2-ил)-2,2,2-трифторэтокси)-6-хлортриазин (98 мг, 57%-ной чистоты, 0,142 ммоль) использовали для проведения такой же реакции конденсации Сузуки, как описано выше, с получением 9 мг указанного в заголовке соединения. Выход: 12,0%. 1H ЯМР (CD3OD)8,09 (м, 2 Н), 7,85 (м, 1 Н), 7,50 (м, 2 Н), 7,28-7,43 (м, 5 Н), 7,17-7,26 2-Амино-4,6-дихлор пиримидин (0,096 г, 0,6 ммоль), 2,2,2-трифтор-1-(6-метоксинафталин-2-ил)этанол (0,140 г, 0,55 ммоль) и NaH (96 мг, 0,60 ммоль) добавляли в безводный диоксан (20 мл) в атмосфере азота. Реакционную смесь перемешивали при температуре 80 С в течение 12 ч, охлаждали до комнатной температуры и гасили водой (0,2 мл). Реакционную смесь концентрировали и остаток растворяли в CH2Cl2 (50 мл), промывали водой (20 мл), насыщенным солевым раствором (20 мл), сушили (Na2SO4) и концентрировали с получением сырого промежуточного продукта, 4-хлор-6-[2,2,2-трифтор-1-(6-метоксинафталин-2-ил)этокси]пиримидин-2-иламина (0,22 г), который использовали напрямую на следующей стадии. Сырой промежуточный продукт (0,22 г), L-п-борфенилаланин (0,126 г, 0,6 ммоль), карбонат натрияMeCN (2,0 мл) и Н 20 (2,0 мл) в сосуде для проведения реакции под воздействием микроволнового излучения. Сосуд герметично закрывали и перемешивали в реакторе с микроволновым излучением при температуре 150 С в течение 6 мин. Смесь фильтровали и фильтрат концентрировали. Остаток растворяли в МеОН и H2O (1:1) и очищали с помощью препаративной ВЭЖХ, используя МеОН/Н 2 О/ТФУ в качестве системы растворителей, с получением 2-амино-3-(4-2-амино-6-[2,2,2-трифтор-1-(6-метоксинафталин-2 ил)этокси]пиримидин-4-илфенил)пропионовой кислоты в виде соли ТФУ (ВЭЖХ: способ С, время удерживания = 3,190 мин. ВЭЖХ М+1 513. 1 Н ЯМР (400 МГц, CD3OD)3,22-3,42 (м, 2 Н), 3,86 (с, 3 Н), 4,32 (1 Н), 6,88 (м, 1 Н), 6,92 (1 Н), 7,20 К 4'-бром-2,2,2-трифторацетофенону (5,0 г, 19,76 ммоль) в ТГФ (50 мл) при температуре 0 С добавляли NaBH4 (1,5 г, 39,52 ммоль). Смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Реакция протекала полностью по данным ТСЖХ (CH2Cl2). Смесь гасили Н 2 О, упаривали на роторном испарителе для удаления большей части ТГФ, и экстрагировали 2 раза CH2Cl2. Органические продукты объединяли, промывали насыщенным солевым раствором, концентрировали до небольшого объема и фильтровали через слой силикагеля. Силикагель промывали CH2Cl2 для элюирования продукта, и полученный раствор концентрировали с получением 4,65 г 1-(4-бромфенил)-2,2,2-трифторэтанола. Выход 92%. К Pd(PPh3)4 (2,1 г, 1,823 ммоль) добавляли 3-фторфенилмагний бромид (55 мл, 1,0 М в ТГФ, 55 ммоль) при температуре 0 С в течение 15 мин. Ледяную баню удаляли и смесь перемешивали в течение 30 мин. В течение 10 мин добавляли 1-(4-бромфенил)-2,2,2-трифторэтанол (4,65 г, 18,23 ммоль) в ТГФ(50 мл). Смесь нагревали до кипения с обратным холодильником в течение 3 ч и данные ЖХ показывали завершение реакции (колонка Sunfire, ТФУ). Смесь охлаждали, гасили Н 2 О, упаривали на роторном испарителе для удаления большей части ТГФ и экстрагировали 3 раза CH2Cl2. Органические продукты объединяли, промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали. Хроматографирование (SiO2, CH2Cl2) давало 4,64 г 2,2,2-трифтор-1-(3'-фторбифенил-4-ил)этанола. Выход 94%. К 2,2,2-трифтор-1-(3'-фторбифенил-4-ил)этанолу (1,4 г, 5,18 ммоль) в ТГФ (50 мл) при температуре 0 С добавляли NaH (60% в минеральном масле, 0,31 г, 7,77 ммоль). Ледяную баню удаляли, и смесь перемешивали в течение 30 мин. Одной порцией добавляли 2-амино-4,6-дихлорпиримидин (1,0 г, 6,22 ммоль) в ТГФ (25 мл). Смесь нагревали до 50 С в течение 5 ч. Реакция протекала полностью согласно данным ВЭЖХ (Sunfire, ТФУ). Смесь охлаждали, гасили насыщенным солевым раствором и экстрагировали 3 раза CH2Cl2. Органические продукты объединяли, промывали насыщенным солевым раствором,сушили над MgSO4 и концентрировали. Хроматографирование (SiO2, CH2Cl2) давало 1,48 г 4-хлор-6(2,2,2-трифтор-1-(3'-фторбифенил-4-ил)этокси)пиримидин-2-амина. Выход 73%. 4-Хлор-6-(2,2,2-трифтор-1-(3'-фторбифенил-4-ил)этокси)пиримидин-2-амин (0,75 г, 1,89 ммоль), Lп-борфенилаланин (0,47 г, 2,26 ммоль), Pd(PPh3)2Cl2 (79 мг, 0,113 ммоль), Na2CO3 (0,44 г, 4,15 ммоль),ацетонитрил (10 мл) и Н 2 О (10 мл) объединяли в 20 мл микроволновом реакторе и нагревали в микроволновом реакторе при температуре 150 С в течение 7 мин. Реакция протекала полностью согласно данным ВЭЖХ (Sunfire, нейтральный). Смесь концентрировали, растворяли в NaOH (20 мл, 0,5 н), фильтровали, экстрагировали эфиром три раза и охлаждали до 0 С. При температуре 0 С медленно добавляли 1,0 н HCl до установления рН 6,5. Смесь перемешивали при температуре 0 С в течение 30 мин и продукт фильтровали, сушили на воздухе, обрабатывали избытком 2,0 н HCl в эфире, концентрировали, затем растирали в CH2Cl2 с получением 1,12 г, 99% (95,5%-ная чистота). 385 мг очищали с помощью препВЭЖХ (Sunfire, ТФУ), концентрировали, обрабатывали избытком 1,0 н HCl (водн.), концентрировали до небольшого объема и лиофилизовали с получением 240 мг указанного в заголовке соединения. М+1 = 527; 1 Н ЯМР (CD3OD)7,86 (д, 2 Н), 7,64 (с, 4 Н), 7,49 (д, 2 Н), 7,36 (м, 2 Н), 7,28 (м,1 Н), 7,02 (м, 1 Н), 6,95 3,5-Дифторфенилтрифторметил кетон обрабатывали NaBH4 (0,18 г, 4,76 ммоль) в ТГФ (5 мл) в течение 2 ч. Смесь гасили водой, экстрагировали метиленхлоридом (2). Органические продукты объединяли, фильтровали через силикагель и концентрировали с получением 0,46 г 1-(3,4-дифторфенил)-2,2,2 трифторэтанола. 1-(3,4-Дифторфенил)-2,2,2-трифторэтанол (0,1 г, 0,471 ммоль) обрабатывали NaH (60% в минеральном масле, 38 мг, 0,943 ммоль) в сухом ТГФ (3 мл) в течение 30 мин. Добавляли 2-амино-4,6 дихлорпиримидин (77 мг, 0,471 ммоль) и смесь перемешивали при температуре 50 С в течение 6 ч. Смесь гасили водой и экстрагировали метиленхлоридом (2). Органические продукты объединяли, про- 19019879 мывали водой, затем насыщенным солевым раствором, сушили над MgSO4 и концентрировали с получением 0,14 г 4-хлор-6-(1-(3,4-дифторфенил)-2,2,2-трифторэтокси)пиримидин-2-амина. 4-Хлор-6-(1-(3,4-дифторфенил)-2,2,2-трифторэтокси)пиримидин-2-амин (0,14 г, 0,421 ммоль), L-пборфенилаланин (110 мг, 0,505 ммоль), Pd(PPh3)2Cl2 (18 мг, 0,025 ммоль), Na2CO3 (98 мг, 0,926 ммоль),MeCN (2,5 мл) и воду (2,5 мл) нагревали при температуре 150 С в течение 5 мин в микроволновом реакторе. Смесь концентрировали и очищали с помощью преп-ВЭЖХ с получением 74 мг указанного в заголовке соединения. М+1 = 469; 1 Н ЯМР (CD3OD)7,83 (д, 2 Н), 7,47 (м, 1 Н), 7,38 (м, 4 Н), 7,28 (м, 1 Н), 4,21 (т, 1 Н), 3,29 (м, 1 Н), 3,15 К 4'-бром-2,2,2-трифторацетофенону (5,0 г, 19,76 ммоль) в ТГФ (50 мл) при температуре 0 С добавляли NaBH4 (1,5 г, 39,52 ммоль). Смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Реакция протекала полностью по данным ТСХ (CH2Cl2). Смесь гасили H2O, упаривали на роторном испарителе для удаления большей части ТГФ и экстрагировали 2 раза CH2Cl2. Органические продукты объединяли, промывали насыщенным солевым раствором, концентрировали до небольшого объема и фильтровали через слой силикагеля. Силикагель промывали CH2Cl2 для элюирования продукта, и полученный раствор концентрировали с получением 4,65 г 1-(4-бромфенил)-2,2,2-трифторэтанола. Выход: 92%. 1-(4-Бромфенил)-2,2,2-трифторэтанол (0,13 г, 0,525 ммоль), м-толилборную кислоту (0,1 г, 0,736 ммоль), Fibercat (4,28% Pd, 47 мг, 0,0157 ммоль Pd), K2CO3 (0,22 г, 1,576 ммоль), EtOH (3 мл) и Н 2 О (0,5 мл) объединяли и нагревали при температуре 80 С в течение 4 ч. Реакция протекала полностью по данным ТСЖХ (CH2Cl2). Смесь охлаждали, фильтровали, концентрировали, переводили во взвесь в CH2Cl2,и подвергали хроматографии на силикагеле (CH2Cl2) с получением 0,1 г 2,2,2-трифтор-1-(3'метилбифенил-2-ил)этанола. Выход: 72%. Альтернативно, 1-(4-бромфенил)-2,2,2-трифторэтанол (0,98 г, 3,86 ммоль), м-толилборную кислоту(0,63 г, 4,63 ммоль), Pd(PPh3)2Cl2 (0,16 г, 0,232 ммоль Pd), Na2CO3 (0,90 г, 8,49 ммоль), AcCN (10 мл) и Н 2O (10 мл) объединяли и нагревали в микроволновом реакторе при температуре 150 С в течение 10 мин. Реакция протекала полностью по данным ТСЖХ (CH2Cl2). Смесь охлаждали, концентрировали, переводили во взвесь в CH2Cl2, фильтровали подвергали хроматографии на силикагеле (CH2Cl2) с получением 0,80 г 2,2,2-трифтор-1-(3'-метилбифенил-2-ил)этанола. Выход: 79%. Альтернативно, тетрабутиламмонийфторид (TBAF 1,0 н в ТГФ 13 мкл, 3,3 мг, 0,013 ммоль) добавляли к смеси 3-метилбифенил-2-карбоксальдегида (0,25 г, 1,27 ммоль) и трифторметилтриметилсилана(0,25 г, 1,53 ммоль) в ТГФ (1,5 мл) при температуре 0 С. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Добавляли HCl (3,0 н, 2,0 мл) и смесь перемешивали в течение 3 ч. Смесь концентрировали, растворяли в метиленхлориде, фильтровали через силикагель и концентрировали с получением 0,15 г 2,2,2-трифтор-1-(3'-метилбифенил-2-ил)этанола. 2,2,2-Трифтор-1-(3'-метилбифенил-2-ил)этанол (0,15 г, 0,563 ммоль) обрабатывали NaH (60% в минеральном масле, 45 мг, 1,12 ммоль) в сухом ТГФ (5 мл) в течение 30 мин. Добавляли 2-амино-4,6 дихлорпиримидин (92 мг, 0,5633 ммоль) и смесь перемешивали при температуре 50 С в течение 6 ч. Смесь гасили водой и экстрагировали метиленхлоридом (2). Органические продукты объединяли, промывали водой, затем насыщенным солевым раствором, сушили над MgSO4 и концентрировали с получением 0,16 г 4-хлор-6-(2,2,2-трифтор-1-(3'-метилбифенил-2-ил)этокси)пиримидин-2-амина. 4-Хлор-6-(2,2,2-трифтор-1-(3'-метилбифенил-2-ил)этокси)пиримидин-2-амин (0,16 г, 0,406 ммоль),L-п-борфенилаланин (10 мг, 0,487 ммоль), Pd(PPh3)2Cl2 (17 мг, 0,024 ммоль), Na2CO3 (95 мг, 0,894 ммоль), MeCN (2,5 мл) и воду (2,5 мл) нагревали при температуре 150 С в течение 5 мин в микроволновом реакторе. Смесь концентрировали и очищали с помощью преп-ВЭЖХ с получением 105 мг указанного в заголовке соединения. М+1 = 523; 1 Н ЯМР (CD3OD)7,85 (д, 2 Н), 7,70 (д, 1 Н), 7,44 (м, 4 Н), 7,31 (т, 1 Н), 7,21 (м, 2 Н), 7,10 (м, 2 Н), 6,87(кв., 1 Н), 6,84 (с, 1 Н), 4,25 (т, 1 Н), 3,30 (м, 1 Н), 3,18 (м, 1 Н). Дополнительные соединения Дополнительные соединения, полученные используя способы, известные в данной области и/или описанные в настоящем документе, перечислены ниже: Анализ ингибирования in vitro ТРН 1, TPH2, тирозингидроксилаза (ТН) и фенилаланингидроксилаза (РН) человека были получены,используя гены, имеющие следующие номера доступа, соответственно: Х 52836, AY098914, Х 05290 иU49897. Полноразмерную кодирующую последовательность ТРН 1 человека клонировали в бактериальный вектор экспрессии рЕТ 24 (Novagen, Madison, WI, USA). Одну колонию клеток BL21(DE3), несущую вектор экспрессии, инокулировали в 50 мл бульона L (LB)-канамицин и культивировали при температуре 37 С в течение ночи при встряхивании. Затем половину культуры (25 мл) переносили в 3 л среды, содержащей 1,5% дрожжевого экстракта, 2% бактериального пептона, 0,1 мм триптофана, 0,1 мм железистого сульфата аммония и 50 мм фосфатного буфера (рН 7,0), и выращивали до OD600=6 при температуре 37 С с добавлением кислорода при 40%, рН поддерживали равным 7,0, и добавляли глюкозу. Экспрессию ТРН 1 индуцировали с помощью 15% D-лактозы в течение 10 ч при температуре 25 С. Клетки осаждали и промывали один раз физиологическим раствором с фосфатным буфером (PBS). ТРН 1 очищали с помощью аффинной хроматографии, основанной на связывании с птерином. Клеточный осадок повторно суспендировали в лизирующем буфере (100 мл/20 г), содержащем 50 мм трисCl, рН 7,6, 0,5 М NaCl, 0,1% Tween-20, 2 мм EDTA, 5 мм DTT, протеазную ингибиторную смесь (RocheApplied Science, Indianapolis, IN, USA) и 1 мм фторид фенилметансульфонила (PMSF), и клетки лизировали с помощью микрофлюидизатора. Лизат центрифугировали, и супернатант загружали на колонку с птерин-связанной сефарозой 4 В, которую уравновешивали буфером, содержащим 50 мМ трис, рН 8,0, 2 М NaCl, 0,1% Твин-20, 0,5 мМ EDTA и 2 мм DTT. Колонку промывали 50 мл этого буфера и элюировали ТРН 1 буфером, содержащим 30 мм NaHCO3, рН 10,5, 0,5 М NaCl, 0,1% Твин-20, 0,5 мМ EDTA, 2 мМDTT и 10% глицерина. Элюированный фермент немедленно нейтрализовали 200 мм КН 2 РО 4, рН 7,0, 0,5 М NaCl, 20 мм DTT, 0,5 мм EDTA и 10% глицерина, и хранили при температуре -80 С. Триптофангидроксилазу человека типа II (ТРН 2), тирозингидроксилазу (ТН) и фенилаланингидроксилазу (РАН) экспрессировали и очищали по существу аналогичным способом, за исключением того, что в процессе роста к клеткам добавляли тирозин для ТН и фенилаланин для РАН. Активность ТРН 1 и ТРН 2 измеряли в реакционной смеси, содержащей 50 мм 4 морфолинпропанесульфоновой кислоты (MOPS), рН 7,0, 60 мкМ триптофана, 100 мм сульфата аммония,100 мкМ железистого сульфата аммония, 0,5 мм трис(2-карбоксиэтил)фосфина (ТСЕР), 0,3 мм бметилтетрагидроптерина, 0,05 мг/мл каталазы и 0,9 мМ DTT. Реакцию инициировали добавлением ТРН 1 до конечной концентрации 7,5 нМ. Начальную скорость реакций определяли отслеживанием изменения флуоресценции при 360 нм (длинноволновое возбуждение = 300 нм). Ингибирование ТРН 1 и ТРН 2 определяли измерением активности при различных концентрациях соединения, и эффективность соединения подсчитывали, используя уравнение: гдеравно начальной скорости при данной концентрации соединения С, 0 равно , когда С=0, b равно фоновому сигналу, D равно (наклон Хилла) пику кривой, который приблизительно равен 1, и IC50 равно концентрации соединения, которая ингибирует половину максимальной ферментной активности. Активность ТН и РАН человека определяли измерением количества 3 Н 2 О образованного, используяMOPS, pH 7,2, 100 мМ сульфата аммония, 0,05% Tween-20, 1,5 мМ ТСЕР, 100 мкМ железистого сульфата аммония, 0,1 мМ тирозина или фенилаланина, 0,2 мм 6-метил тетрагидроптерина, 0,05 мг/мл каталазы,и 2 мМ DTT. Реакцию оставляли на 10-15 минут и останавливали, добавляя 2 М HCl. Затем смесь фильтровали через активированный уголь, и радиоактивность в фильтрате определяли путем сцинтилляционных измерений. Определяли активности соединений с отношение ТН и РАН, используя это исследование, и подсчитывали способом, аналогичным для ТРН 1 и ТРН 2. Анализ клеточного ингибирования Для скрининга использовали два вида клеточных линий: RBL2H3 представляет собой клеточную линию мастоцитомы крыс, которая содержит ТРН 1 и спонтанно продуцирует 5-гидрокситрипотамин(5 НТ); BON представляет собой клеточную линию карциномы человека, которая содержит ТРН 1 и продуцирует 5-гидрокситриптофан (5 НТР). СВА проводили в формате 96-луночного планшета. Подвижная фаза, используемая в ВЭЖХ, содержала 97% 100 мМ ацетата натрия, рН 3,5 и 3% ацетонитрила. Использовали колонку Waters C18 (4,650 мм) с Waters HPLC (модель 2795). Для мониторинга потока при установке 280 нм в качестве длины волны возбуждения и 360 нм в качестве длины волны излучения использовали многоканальный флуорометр (модель 2475).RBL СВА: Клетки выращивали в полной среде (содержащей 5% бычьей сыворотки) в течение 3-4 ч,позволяя клеткам присоединиться к стенкам планшета (7 К клетка/лунка). Затем в каждую лунку добавляли соединения в пределах концентрации 0,016-11,36 мкМ. Контролем были клетки в полной среде без присутствия какого-либо соединения. Клетки собирали через 3 дня инкубации при температуре 37 С. Клетки были 95% конфлюентны без присутствия соединение. Среду удаляли из планшета и клетки лизировали с равным объемом 0,1 н NaOH. Большую часть клеточного лизата обрабатывали смешиванием с равным объемом 1 М ТСА и затем фильтровали через стекловолокно. Фильтраты помещали в ВЭЖХ с обращенной фазой для анализа концентраций 5 НТ. Небольшую часть клеточного лизата также отбирали для измерения концентрации белка клетки, которая указывает на токсичность соединений при используемой концентрации. Концентрацию белка измеряли, используя метод ВСА. Среднее значение уровня 5 НТ в клетках без обработки соединением использовали как максимальное значение производного IC50, в соответствии с равенством, приведенным выше. Минимальное значение 5 НТ устанавливали либо как 0, либо число клеток, обрабатываемые наибольшей концентрацией соединения, если соединение не является цитотоксичным при этой концентрации.BON СВА: Клетки выращивали в равном объеме DMEM и F12K с 5% бычьей сыворотки в течение 3-4 ч (20 К клетка/лунка) и добавляли соединение при концентрации в пределах 0,07-50 мкМ. Клетки инкубировали при температуре 37 С в течение ночи. Затем, для измерения 5 НТР, брали 50 мкМ супернатанта культуры. Супернатант смешивали с равным объемом 1 М ТСА, затем фильтровали через стекловолокно. Фильтрат загружали на колонку ВЭЖХ с обращенной фазой для измерения концентрации 5 НТР. Жизнеспособность клетки определяли, подвергая оставшиеся клетки анализу на выживание клеток "Promega Celltiter-Glo Luminescent Cell Viability Assay". Затем эффективность соединения вычисляли способом, аналогичным в RBL СВА. Эффекты in vivo Эффекты in vivo эффективного ингибитора ТРН 1 по изобретению оценивали в нескольких исследованиях путем определения уровней 5-НТ в желудочно-кишечном тракте и мозге самцов мышей после перорального введения соединения. Соединение смешивали с различными наполнителями с получением либо суспензии, либо раствора. Обычно 14-недельным самцам мышей альбиносов С 57 вводили 5 мл/кг один раз в день перорально в течение четырех дней без перерыва. Спустя 5 ч после введения последней дозы животных забивали. Отбирали различные области желудочно-кишечного тракта и весь мозг и сразу замораживали. 5-НТ экстрагировали из тканей и измеряли с помощью ВЭЖХ. Собирали образцы крови для демонстрационного анализа. Было обнаружено, что эффективный ингибитор ТРН 1 снижает уровни 5-НТ как в тонком, так и толстом кишечнике, но не снижает в головном мозге. В одном исследовании, соединение находилось в H2O и вводилось мыши при четырех различных уровнях дозы: 15, 50, 150 и 500 мг/кг, один раз в день перорально. Как показано на фиг. 1, соединение вызывало существенное уменьшение 5-НТ в тонкой кишке и подвздошной кишке в дозозависимой манере. В толстой кишке, статистически значимое снижение 5-НТ наблюдалось при уровнях доз 50, 150 и 500 мг/кг/день. Существенного изменения уровней 5-НТ в головном мозге не наблюдали при любых уровнях дозы. или его фармацевтически приемлемая соль или сольват, где А представляет собой необязательно замещенный фенил, нафтил или 5-6-членный гетероцикл,включающий 1-3 гетероатома, выбранных из О, N и S, причем необязательное замещение означает замещение одной или более группами С 1-6 алкоксила, амино, циано, галогена, гидроксила или фенила, причем фенильная группа необязательно замещена одной или более группами С 1-6 алкоксила, амино, циано,галогена или гидроксила;D представляет собой 1,3,5-триазин, пиримидин или пиразин, необязательно замещенный амино или морфолино; Е представляет собой фенил или 5-6-членный гетероцикл, включающий 1-3 гетероатома, выбранных из О, N и S;R1 представляет собой водород или C1-10 алкил;R2 представляет собой водород или С 1-10 алкил, необязательно замещенный морфолино;R3 представляет собой водород или необязательно замещенный С 1-10 алкил;R4 представляет собой водород иR5 представляет собой водород или C1-4 алкил. 2. Соединение по п.1, где X представляет собой -C(R3R4)O- или -OC(R3R4)-. 3. Соединение по п.1, где D представляет собой 1,3,5-триазин. 4. Соединение по п.1, где D представляет собой пиримидин. 5. Соединение по п.1, где D представляет собой пиразин. 6. Соединение по п.4, имеющее формулу 7. Соединение по п.6, где А представляет собой бифенил, необязательно замещенный одним или более С 1-6 алкоксилом, амино, галогеном или гидроксилом. 8. Соединение по п.1, где указанным соединением является(2S)-2-амино-3-(4-(2-амино-6-(1-(3'-(диметиламино)бифенил-2-ил)-2,2,2-трифторэтокси)пиримидин 4-ил)фенил)пропановая кислота. 9. Соединение по п.1, где указанным соединением является
МПК / Метки
МПК: C07D 241/24, A61K 31/4965, A61K 31/53, A61P 25/00, C07D 239/36, A61K 31/4192, C07D 239/46, C07D 251/22
Метки: композиция, полициклические, содержащая, использующий, эти, производные, способ, лечения, аминокислот, фармацевтическая
Код ссылки
<a href="https://eas.patents.su/30-19879-policiklicheskie-proizvodnye-aminokislot-soderzhashhaya-ih-farmacevticheskaya-kompoziciya-i-sposob-lecheniya-ispolzuyushhijj-eti-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Полициклические производные аминокислот, содержащая их фармацевтическая композиция и способ лечения, использующий эти производные</a>
Предыдущий патент: Элемент отопительного радиатора и способ и устройство для закрывания концевой части элемента отопительного радиатора
Следующий патент: Способ и устройство для опреснения
Случайный патент: Сжижение природного газа