Соединения, ингибирующие ферменты гистондеацетилазы, и фармацевтическая композиция, содержащая данные соединения
Номер патента: 22964
Опубликовано: 31.03.2016
Авторы: Лобера Мерседес, Балоглу Эркан, Шмидт Дарби, Гхош Шомир
Формула / Реферат
1. Соединение формулы (I-а)
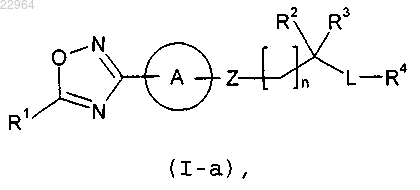
где R1 представляет собой галоген(C1-C2)алкил, где указанный галоген(C1-C2)алкил содержит по меньшей мере 2 атома фтора;
А представляет собой необязательно замещенный (С3-С6)циклоалкил, фенил или 5-6-членный гетероарил, где указанный циклоалкил, фенил или гетероарил необязательно замещен 1-3 группами, независимо выбранными из (C1-C4)алкила, галогена, циано и (C1-C4)алкокси;
Z представляет собой -C(=O)NRX-; -NRXC(=O)-, -SO2NRX-, -NRXSO2-, -NHCH(CF3)-, -CH(CF3)NH-, -(C1-C4)алкил- , -NRX- или -(C1-C3)алкил-NRX-, где RX представляет собой водород или необязательно замещенный (С2-С6)алкил, где указанный (С2-С6)алкил необязательно замещен цианогруппой;
n равно 0-3;
когда n равно 0, оба R2 и R3 представляют собой Н,
когда n равно 1-3, R2 и R3 независимо выбирают из Н и (С1-С4)алкила, или R2 представляет собой -(С1-С4)алкил-NRARB, гидроксил или (C1-С3)алкокси, и R3 представляет собой Н или (C1-С4)алкил, где RA и RB независимо выбирают из (C1-C4)алкила;
или R2 и R3, взятые вместе с атомом, с которым они связаны, образуют необязательно замещенную 4-, 5-, 6- или 7-членную циклоалкильную или гетероциклоалкильную группу, где указанная гетероциклоалкильная группа содержит 1 или 2 гетероатома, независимо выбранные из N, О и S, и указанная циклоалкильная или гетероциклоалкильная группа необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из (C1-C4)алкила; и
L представляет собой 5-6-членный гетероарил или фенил, который замещен R4 и необязательно дополнительно замещен, где, когда L дополнительно замещен, L замещен 1 или 2 заместителями, независимо выбранными из (C1-C4)алкила;
R4 представляет собой Н, галоген, ((C1-C4)алкил) ((C1-С4)алкил)N(С1-С4)алкокси, необязательно замещенный (С3-C6)циклоалкил, необязательно замещенный фенил или необязательно замещенный 5-6-членный гетероарил, где указанный циклоалкил, фенил или гетероарил необязательно замещен 1, 2 или 3 группами, независимо выбранными из галогена, циано, галоген(C1-C4)алкила и (С1-С4)алкокси;
или L-R4, взятые вместе, образуют тетрагидроизохинолильную группу,
где любой указанный 5-6-членный гетероарил представляет собой 5-членную гетероарильную группу, содержащую один кольцевой гетероатом азота, кислорода или серы, и необязательно содержит 1, 2 или 3 дополнительных кольцевых атомов азота или 6-членную гетероарильную группу, содержащую 1, 2, 3 или 4 кольцевых гетероатомов азота;
при условии, что соединение не представляет собой
N-(фенилметил)-4-[5-(трифторметил)-1,2,4-оксадиазол-3-ил]-1,2,5-оксадиазол-3-амин;
или его соль.
2. Соединение или соль по п.1, где R1 представляет собой CHF2 или CF3.
3. Соединение или соль по п.1, где R1 представляет собой CF3.
4. Соединение или соль по любому из пп.1-3, где А представляет собой фенильную группу, необязательно замещенную 1-2 группами, независимо выбранными из (C1-C4)алкила, галогена, циано и (C1-C4)алкокси.
5. Соединение или соль по любому из пп.1-3, где А представляет собой незамещенную фенильную группу или фенильную группу, замещенную этилом, фтором, циано или метоксигруппой.
6. Соединение или соль по любому из пп.1-3,
где А представляет собой циклопропильную, циклопентильную или циклогексильную группу; или
А представляет собой оксазолил, пиразолил или тиенил, необязательно замещенный метильной группой, или
А представляет собой пиридил, необязательно замещенный 1 группой, выбранной из метила и этила.
7. Соединение или соль по любому из пп.1-6, где Z представляет собой -C(=O)NH- или CH2NH-.
8. Соединение или соль по любому из пп.1-7, где n равно 0 или 1.
9. Соединение или соль по любому из пп.1-8, где оба R2 и R3 представляют собой Н или оба R2 и R3 представляют собой метил или n равно 1, R2 представляет собой гидроксил и R3 представляет собой Н или метил.
10. Соединение или соль по любому из пп.1-8, где R2 и R3, взятые вместе с атомом, с которым они связаны, образуют необязательно замещенную 4-, 5- или 6-членную циклоалкильную или гетероциклоалкильную группу, где указанная гетероциклоалкильная группа содержит 1 гетероатом, выбранный из N и О, и указанная необязательно замещенная циклоалкильная или гетероциклоалкильная группа необязательно замещена (C1-С4)алкильным заместителем.
11. Соединение или соль по любому из пп.1-8, где R2 и R3, взятые вместе с атомом, с которым они связаны, образуют тетрагидропиранильную, 2,2-диметилтетрагидропиранильную, циклопентильную или 1-метилпиперидинильную группу.
12. Соединение или соль по любому из пп.1-11, где L представляет собой тиазолил, тиенил, триазолил, пиридил, фенил или оксазолил, который необязательно замещен метильной группой.
13. Соединение или соль по любому из пп.1-12, где R4 представляет собой Н, трифторметил, диметиламиноэтокси-, диметиламинопропил- и необязательно замещенный пиридил, циклогексил, пиперидинил, пиперазинил, имидазолил, тиенил или фенил, где пиридил, циклогексил, пиперидинил, пиперазинил, имидазолил, тиенил или фенил необязательно замещены 1-2 заместителями, независимо выбранными из хлора, брома, фтора, трифторметила, метокси и циано.
14. Соединение или соль формулы (I-а) по п.1,
где А представляет собой незамещенную фенильную группу или фенильную группу, замещенную этилом, фтором, циано или метоксигруппой, или тиенильную, пиридильную или циклопропильную группу;
Z представляет собой -C(=O)NH- или CH2NH-;
n равно 0 или 1, и оба R2 и R3 представляют собой Н или оба R2 и R3 представляют собой метил, или
n равно 1, и R2 представляет собой гидроксил и R3 представляет собой Н или метил, или
n равно 0 или 1, и R2 и R3, взятые вместе с атомом, с которым они связаны, образуют тетрагидропиранильную, 2,2-диметилтетрагидропиранильную, циклопентильную, 1-метилпиперидинильную группу;
L представляет собой тиазолил, тиенил, триазолил, пиридил, фенил или оксазолил, любой из которых необязательно замещен метильной группой;
R4 представляет собой Н, метил, бром, трифторметил, диметиламиноэтокси-, фенил, 4-хлорфенил, 2-бромфенил, 4-фторфенил, 4-цианофенил, 3-трифторметилфенил, 4-метоксифенил, циклогексил, имидазолил, тиенил, пирид-2-ил, пирид-3-ил или пирид-4-ил; или
L-R4, взятые вместе, образуют тетрагидроизохинолильную группу.
15. Соединение или соль по п.1,
где R1 представляет собой CHF2 или CF3;
А представляет собой незамещенную фенильную или пиридильную группу;
Z представляет собой -С(=О)NH- или CH2NH-;
n равно 1;
R2 и R3 оба представляют собой метил, или
R2 представляет собой гидроксил и R3 представляет собой метил, или
R2 и R3 оба представляют собой водород, или
R2 представляет собой метил и R3 представляет собой водород, или
R2 представляет собой гидроксил и R3 представляет собой водород, или
R2 представляет собой диметиламино и R3 представляет собой Н, или
R2 представляет собой N,N-диметиламиноэтил и R3 представляет собой Н, или
R2 и R3, взятые вместе с атомом, с которым они связаны, образуют тетрагидропиранильную, 2,2-диметилтетрагидропиранильную или 1-метилпиперидинильную группу;
L представляет собой тиазолил, тиенил, триазолил, пиридил, фенил или оксазолил, любой из которых необязательно замещен метильной группой;
R4 представляет собой фенил, необязательно замещенный галогеном, циано, галоген(C1-C2)алкил или (C1-С2)алкокси.
16. Соединение, представляющее собой
N-(4-(2-(диметиламино)этокси)бензил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-(диметиламино)этокси)бензил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(4-(1Н-имидазол-1-ил)бензил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-цианоэтил)-N-(пиридин-3-илметил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)-N-((4-(4-(трифторметил)фенил)тетрагидро-2H-пиран-4-ил)метил)бензамид,
1-(4-(4-фенилтиазол-2-ил)тетрагидро-2H-пиран-4-ил)-N-(3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензил)метанамин,
N-((4-(4-фенилтиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-((4-(4-фенилтиофен-2-ил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((1-(4-фенилтиазол-2-ил)циклопентил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(3-фенил-1H-1,2,4-триазол-5-ил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(2-фенилтиазол-4-ил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(4-(4-метоксифенил)тиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(4-(4-хлорфенил)тиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-метил-2-(4-фенилтиазол-2-ил)пропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((1-метил-4-(4-фенилтиазол-2-ил)пиперидин-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(4-(4-фторфенил)тиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(5-метил-4-фенилтиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(4-циклогексилтиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(4-(пиридин-2-ил)тиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(4-(пиридин-4-ил)тиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(4-фенилтиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)тиофен-2-карбоксамид,
N-((4-(4-(тиофен-2-ил)тиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(4-(4-фторфенил)тиазол-2-ил)-2-метилпропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(4-(4-хлорфенил)тиазол-2-ил)-2-метилпропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
3-фтор-N-(2-(4-(4-фторфенил)тиазол-2-ил)-2-метилпропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
3-циано-N-((4-(4-фенилтиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
3-метокси-N-((4-(4-фенилтиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(4-(4-фторфенил)тиазол-2-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(4-(4-цианофенил)тиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(4-(4-фторфенил)тиазол-2-ил)-2,2-диметилтетрагидро-2Н-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(4-фенилтиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензолсульфонамид,
3-этил-N-((4-(4-фенилтиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(3-бромфенил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)-N-((4-(4-(4-(трифторметил)фенил)тиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)бензамид,
N-(2-метил-2-(4-(4-(трифторметил)фенил)тиазол-2-ил)пропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(4-фенилтиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-2-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)циклопропанкарбоксамид,
N-((1-метил-4-(2-фенилтиазол-4-ил)пиперидин-4-ил)метил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(2-(4-хлорфенил)тиазол-4-ил)-2-метилпропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-((4-(2-(4-хлорфенил)тиазол-4-ил)-1-метилпиперидин-4-ил)метил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(2-(4-хлорфенил)тиазол-4-ил)-2-метилпропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-(4-хлорфенил)тиазол-4-ил)этил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(4-(4-хлорфенил)тиазол-2-ил)-2-метилпропил)-2-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)изоникотинамид,
N-(2-(2-(4-фторфенил)тиазол-4-ил)-2-метилпропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-(4-фторфенил)тиазол-4-ил)-2-метилпропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(4-(4-хлорфенил)тиазол-2-ил)-2-метилпропил)-6-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)пиколинамид,
N-(2-(диметиламино)-2-(4-фенилтиазол-2-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(3-фенил-1H-1,2,4-триазол-5-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((1-(4-фенилтиазол-2-ил)циклопропил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
3-(4-(4-фторфенил)тиазол-2-ил)-N-(3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)фенил)пропанамид,
N-(2-(2-(4-хлорфенил)тиазол-4-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-фенилтиазол-2-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(4-(4-фторфенил)тиазол-2-ил)этил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(4-(4-хлорфенил)тиазол-2-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(4-(4-хлорфенил)тиазол-2-ил)этил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-((4-(3,4-дигидроизохинолин-2(1H)-ил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-метил-N-((4-(4-фенилтиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-(4-фторфенил)тиазол-4-ил)этил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(2-(4-фторфенил)тиазол-4-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(4-(4-фторфенил)тиазол-2-ил)-2-метилпропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
2,2,2-трифтор-N-((4-(4-фенилтиазол-2-ил)тетрагидро-2H-пиран-4-ил)метил)-1-(3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)фенил)этанамин,
N-(2-(3-(4-фторфенил)-1H-1,2,4-триазол-5-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(3-(4-хлорфенил)-1H-1,2,4-триазол-5-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-метил-2-(3-фенил-1H-1,2,4-триазол-5-ил)пропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-метил-2-(3-фенил-1H-1,2,4-триазол-5-ил)пропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(3-(4-фторфенил)-1H-1,2,4-триазол-5-ил)-2-метилпропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(3-(4-фторфенил)-1H-1,2,4-триазол-5-ил)-2-метилпропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(3-(4-хлорфенил)-1H-1,2,4-триазол-5-ил)-2-метилпропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(4-(4-хлорфенил)тиазол-2-ил)-2-метилпропил)-6-метил-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(3-(4-фенилтиазол-2-ил)пропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-(4-фторфенил)оксазол-4-ил)этил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(5-фенилтиазол-2-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-(4-фторфенил)оксазол-4-ил)пропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-(3-фторфенил)оксазол-4-ил)этил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(4-(4-хлорфенил)тиазол-2-ил)-2-метилпропил)-2-метил-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-метил-2-(5-фенилтиазол-2-ил)пропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-([1,1'-бифенил]-3-ил)тетрагидро-2H-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-([1,1'-бифенил]-3-ил)тетрагидро-2H-пиран-4-ил)метил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-((2-(4-фторфенил)оксазол-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(2-(4-фторфенил)оксазол-4-ил)-1-метилпиперидин-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-метил-2-(2-фенилоксазол-4-ил)пропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
2-(2-(4-фторфенил)оксазол-4-ил)-2-метил-N-(3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензил)пропан-1-амин,
3-(3-(4-(4-фенилтиазол-2-ил)бутил)фенил)-5-(трифторметил)-1,2,4-оксадиазол,
N-(2-метил-2-(5-фенилоксазол-2-ил)пропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-фенилтиазол-5-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-метил-2-(2-фенилтиазол-5-ил)пропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(2-(4-хлорфенил)тиазол-4-ил)-1-метилпиперидин-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(2-(4-хлорфенил)тиазол-4-ил)-1-метилпиперидин-4-ил)метил)-3-(5-(2,2,2-трифторацетил)тиофен-2-ил)бензамид,
2-фтор-N-(2-(2-(4-фторфенил)оксазол-4-ил)-2-метилпропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-(4-фторфенил)оксазол-4-ил)-2-метилпропил)-2-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)оксазол-4-карбоксамид,
N-(2-(1-метил-2-фенил-1Н-имидазол-5-ил)пропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(2-(4-фторфенил)оксазол-4-ил)-2-гидроксиэтил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
5-(5-(дифторметил)-1,2,4-оксадиазол-3-ил)-N-(2-(2-(4-фторфенил)оксазол-4-ил)-2-метилпропил)никотинамид,
гидрохлорид N-(2-(диметиламино)-2-(2-(4-фторфенил)оксазол-4-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамида,
N-(2-(2-(4-фторфенил)оксазол-4-ил)-2-метилпропил)-2-метокси-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-(4-фторфенил)оксазол-5-ил)-2-метилпропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(4-(диметиламино)-2-(2-(4-фторфенил)оксазол-4-ил)бутил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(4-(диметиламино)-2-(2-(4-фторфенил)оксазол-4-ил)бутил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(2-(4-фторфенил)оксазол-4-ил)-2-гидроксиэтил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-((4-(2-(4-хлорфенил)оксазол-4-ил)-1-метилпиперидин-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
2-(2-(4-хлорфенил)оксазол-4-ил)-2-метил-N-(3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензил)пропан-1-амин,
N-(2-(2-(4-фторфенил)оксазол-5-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-([1,1'-бифенил]-3-ил)-1-метилпиперидин-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-(4-метоксифенил)оксазол-4-ил)этил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
2-хлор-N-(2-(2-(4-фторфенил)оксазол-4-ил)-2-метилпропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-(4-фторфенил)оксазол-4-ил)-2-метилпропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(3-(2-(4-фторфенил)оксазол-4-ил)-3-гидроксипропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-(4-цианофенил)оксазол-4-ил)этил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(2-(2-фторфенил)оксазол-4-ил)этил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(1-метил-2-фенил-1H-имидазол-4-ил)пропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(2-(4-фторфенил)оксазол-4-ил)-2-метоксиэтил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(4-(4-фторфенил)тиазол-2-ил)пропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-(4-фторфенил)оксазол-4-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-(4-фторфенил)оксазол-4-ил)-2-метилпропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-([1,1'-бифенил]-3-ил)-2-метилпропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(4'-фтор[1,1'-бифенил]-3-ил)-2-метилпропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-((4-(4-(3,5-дифторфенил)тиазол-2-ил)тетрагидро-2Н-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(4-(3,5-дифторфенил)тиазол-2-ил)-2-метилпропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-фенилоксазол-4-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-фенилоксазол-4-ил)этил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(2-(4-хлорфенил)оксазол-4-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-(4-хлорфенил)оксазол-4-ил)этил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-метил-2-(2-фенилоксазол-4-ил)пропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(2-(4-хлорфенил)оксазол-4-ил)-2-метилпропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(3-фенил-1,2,4-оксадиазол-5-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-метил-2-(3-фенил-1Н-пиразол-5-ил)пропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
N-(2-(2-(4-фторфенил)оксазол-4-ил)пропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(4-(4-хлорфенил)тиазол-2-ил)-2-метилпропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-((4-([1,1'-бифенил]-3-ил)-1-метилпиперидин-4-ил)метил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,
N-(2-(2-(4-фторфенил)оксазол-4-ил)-2-гидроксипропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,
или его фармацевтически приемлемая соль.
17. Соединение, представляющее собой N-(2-метил-2-(2-фенилоксазол-4-ил)пропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид, или его фармацевтически приемлемая соль.
18. Соединение, представляющее собой N-(2-(2-(4-фторфенил)оксазол-4-ил)-2-метилпропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид, или его фармацевтически приемлемая соль.
19. Фармацевтическая композиция для лечения опосредованных HDAC заболеваний или расстройств, содержащая терапевтически эффективное количество соединения или соли по любому из пп.1-18 и один или более фармацевтически приемлемых эксципиентов.
Текст
в которой R1, R2, R3, R4, A, Z, L и n определены в настоящем описании, способы получения данных соединений и их применение в фармацевтических композициях для лечения опосредованных Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, которые ингибируют ферменты гистондеацетилазы (HDAC), и фармацевтическим композициям, содержащим данные соединения. Предпосылки к созданию изобретения Организация хроматина включает ДНК, закрученную вокруг октамеров гистона, образующих нуклеосомы. Коровые гистоны с N-терминальными хвостами, вытянутыми из компактных нуклеосомных коровых частиц, можно ацетилировать или деацетилировать по эпсилон-лизиновым остаткам, влияя на белковые взаимодействия гистон-ДНК и гистон-не гистон. Гистондеацетилазы (HDAC) катализируют деацетилирование гистоновых и негистоновых белков и играют важную роль в эпигенетической регуляции. В настоящее время известно 18 HDAC, которые организованы в три класса: HDAC I классаII класса (HDAC4, HDAC5, HDAC6, HDAC7, HDAC9 и HDAC10), которые перемещаются между ядром и цитоплазмой, и HDAC III класса (SIRT1-7), клеточная организация которых включает различные органеллы.HDAC II класса дополнительно характеризуются как HDAC IIa класса и HDAC IIb класса.HDAC9 представляют собой гистондеацетилазы IIa класса, высокоэкспрессируемые в Трегуляторных клетках (Treg) человека. Дефицит HDAC9: 1) увеличивает экспрессию Foxp3 (и других маркеров Т-регуляторных клеток), 2) повышает ацетилирование Foxp3 и гистона 3, 3) усиливает связывание Foxp3 ДНК, 4) увеличивает число Т-регуляторных клеток, 5) повышает супрессорную активностьin vitro и in vivo и 6) облегчает колит у крыс. Т-регуляторные клетки, которые являются дефицитными вHDAC9, вызывают постоянную переносимость полностью несовместимых сердечных аллотрансплантатов. Кроме того, ингибиторы HDAC9 могут быть применимы для лечения заболеваний и нарушений,связанных с аномальной клеточной пролиферацией, дифференциацией и выживанием, например опухолей молочной железы и предстательной железы. Из предварительных данных видно, что направленное воздействие на HDAC7, гистондеацетилазуFoxp3+ Т-регуляторных клеток и приводит к долговременному существованию аллотрансплантата. Было показано, что ингибирование HDAC6, HDAC IIb класса повышает супрессорную функцию Трегуляторных клеток in vitro наряду с повышенной экспрессией генов, ассоциированных с белком Foxp3 и Т-регуляторными клетками, включая CTLA, IL-10, TNR18. Ингибирование HDAC6 in vivo уменьшало тяжесть колита в модели колита, вызванного декстраном сульфата натрия, и модели адаптивного переноса колита CD4+CD62Lhigh. Кроме того, ингибирование HDAC6 субтерапевтической дозой рапамицина приводило к продолжительному существованию сердечного аллотрансплантата. Исходя из упомянутых выше данных, ожидается, что перорально доступный селективный низкомолекулярный ингибитор активности HDAC II класса (более конкретно, HDAC9, или HDAC7, или HDAC6) будет модулировать аутоиммунные заболевания за счет расширения и повышения активности Трегуляторных клеток. Ингибирование других HDAC II класса, например HDAC4 и 5, уменьшает миогенез за счет модулирования стабильности и активности комплексов HDAC-MeF2, и потенциально может оказаться применимым для лечения заболеваний мышц и сердца, включая гипертрофию сердца и сердечную недостаточность. Кроме того, ингибирование активности HDAC II класса представляет собой новый подход к прерыванию клеточного цикла или вмешательству в его регуляцию. Ингибиторы HDAC II класса имеют терапевтический потенциал для изучения и/или лечения заболеваний или состояний, улучшаемых посредством модулирования активности HDAC (в частности, клеточно-пролиферативных заболеваний (таких как рак), диабета (диабет I и/или II типа), воспаления, сердечных заболеваний, ожирения, инсульта, эпилепсии, депрессии, иммунологического заболевания или вирусной или грибковой инфекции. Однако многие ингибиторы HDAC ингибируют все изоформы HDAC. Было бы предпочтительно идентифицировать ингибиторы HDAC, которые ингибируют одну или более, но не все изоформы HDAC. Сущность изобретения Настоящее изобретение относится к соединению формулы I-аR1 представляет собой галоген(C1-C2)алкил, где указанный галоген(C1-C2)алкил содержит по меньшей мере 2 атома фтора; А представляет собой необязательно замещенный (С 3-С 6)циклоалкил, фенил или 5-6-членный гетероарил,-1 022964 где необязательно замещенный циклоалкил, фенил или гетероарил необязательно замещен 1-3 группами, независимо выбранными из (C1-C4)алкила, галогена, циано и (C1-C4)алкокси;Z представляет собой -C(=O)NRX-, -NRXC(=O)-, -SO2NRX-, -NRXSO2-, -NHCH(CF3)-, -CH(CF3)NH-,-(C1-C4)алкил, -NRX- или -(C1-C3)алкил-NRX-, где RX представляет собой водород или необязательно замещенный (С 2-С 6)алкил, где указанный необязательно замещенный (С 2-С 6)алкил необязательно замещен цианогруппой;n равно 0-3; когда n равно 0, оба R2 и R3 представляют собой Н,когда n равно 1-3, R2 и R3 независимо выбраны из Н и (C1-С 4)алкила, или R2 представляет собой-(С 1-С 4)алкил-NRARB, гидроксил, или (C1-С 3)алкокси, и R3 представляет собой Н или (C1-С 4)алкил, где RA и RB независимо выбирают из (C1-C4) алкила; или R2 и R3, взятые вместе с атомом, с которым они связаны, образуют необязательно замещенную 4-, 5-, 6- или 7-членную циклоалкильную или гетероциклоалкильную группу, где указанная гетероциклоалкильная группа содержит 1 или 2 гетероатома, независимо выбранные из N, О и S, и указанная необязательно замещенная циклоалкильная или гетероциклоалкильная группа необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из (C1-C4)алкила; иR4 представляет собой Н, галоген, C1-C4)алкил)C1-С 4)алкил)N(C1-C4)алкокси, необязательно замещенный (С 3-С 6)циклоалкил, необязательно замещенный фенил или необязательно замещенный 5-6 членный гетероарил,где указанный необязательно замещенный циклоалкил, фенил или гетероарил необязательно замещен 1, 2 или 3 группами, независимо выбранными из галогена, циано, галоген(C1-C4)алкила и (C1C4)алкокси; или L-R4, взятые вместе, образуют тетрагидроизохинолильную группу, где указанный 5-6-членный гетероарил представляет собой 5-членную гетероарильную группу, содержащую один кольцевой гетероатом азота, кислорода или серы, и необязательно содержит 1, 2 или 3 дополнительных кольцевых атомов азота, или 6-членную гетероарильную группу, содержащую 1, 2, 3 или 4 кольцевых гетероатомов азота; при условии, что соединение не представляет собой N-(фенилметил)-4-[5-(трифторметил)-1,2,4 оксадиазол-3-ил]-1,2,5-оксадиазол-3-амин; или его соли, в частности фармацевтически приемлемой соли, и дополнительно относится к фармацевтической композиции, содержащей соединение формулы I-а или его соль. Подробное описание изобретения Подразумевается, что альтернативные определения различных групп и замещающих групп формулы I-а, приведенных в данном описании, предназначены, в частности, для описания каждого варианта соединений, раскрытых в настоящем изобретении, отдельно, а также группы одного или более вариантов соединений. Объем настоящего изобретения включает любую комбинацию определений данных групп и замещающих групп. В одном из вариантов осуществления R1 собой галоген(C1-С 2)алкильную группу, содержащую по меньшей мере 2 фторидные группы. В конкретном варианте осуществления R1 представляет собой CF3. В другом варианте осуществления А представляет собой фенильную группу, необязательно замещенную 1-2 группами, независимо выбранными из (C1-C4)алкила, галогена, циано и (C1-С 4)алкокси. В следующих вариантах осуществления А представляет собой фенильную группу, необязательно замещенную 1 группой, выбранной из метила, этила, фтора, хлора, метокси, этокси и циано. В конкретных вариантах осуществления А представляет собой незамещенную фенильную группу или фенильную группу,замещенную этильной, фторной, циано- или метоксигруппой. В еще одном варианте осуществления А представляет собой циклопропильную, циклопентильную или циклогексильную группу, необязательно замещенную 1-2 группами, независимо выбранными из (C1C4)алкила и (C1-C4)алкокси. В следующих вариантах осуществления А представляет собой циклопропильную, циклопентильную или циклогексильную группу, необязательно замещенную 1-2 группами,независимо выбранными из метила, этила, трет-бутила, метокси и этокси. В выбранных вариантах осуществления А представляет собой циклопропильную, циклопентильную или циклогексильную группу. В следующих вариантах осуществления А представляет собой 5-6-членный гетероарил, необязательно замещенный 1-2 группами, независимо выбранными из (C1-C4)алкила, галогена, циано и (C1 С 4)алкокси. В других вариантах осуществления А представляет собой 5-6-членный гетероарил, необязательно замещенный 1 группой, выбранной из метила, этила и фтора, и 5-6-членный гетероарил содержит 1 гетероатом в цикле, выбранный из N, О и S, и необязательно содержит 1 дополнительный циклический атом азота. В выбранных вариантах осуществления А представляет собой оксазолил, пиразолил или тие-2 022964 нил, необязательно замещенный метильной группой. В других выбранных вариантах осуществления А представляет собой пиразолил или тиенил, необязательно замещенный метильной группой. В конкретных вариантах осуществления А представляет собой тиенил. В других конкретных вариантах осуществления А представляет собой оксазолил. В других вариантах осуществления А представляет собой пиридильную или пиридил-N-оксидную группу, необязательно замещенную 1-2 группами, независимо выбранными из (C1-C4)алкила, галогена,циано и (C1-C4)алкокси. В следующих вариантах осуществления А представляет собой пиридильную или пиридил-N-оксидную группу, необязательно замещенную 1 группой, выбранной из метила, этила, фтора,хлора, метокси, этокси, циано. В выбранных вариантах осуществления А представляет собой пиридил или пиридил-N-оксид. В конкретных вариантах осуществления А представляет собой пиридил. В другом варианте осуществления настоящего изобретения Z представляет собой -C(=O)NRX- или-NR C(=O)-. В другом варианте осуществления настоящего изобретения Z представляет собой SO2NRXили -NRXSO2-. В другом варианте осуществления Z представляет собой -NHCH(CF3)- или -CH(CF3)NH-. В другом варианте осуществления настоящего изобретения Z представляет собой -(C1-C4)алкил-. В другом варианте осуществления настоящего изобретения Z представляет собой -NRX- или -(C1-C3)алкилNRX- . Для каждого из упомянутых выше вариантов осуществления Z каждый RX может быть независимо выбран из Н, (C1-C4)алкила и необязательно замещенного (С 2-С 4)алкила, где указанный необязательно замещенный (С 2-С 4)алкил необязательно замещен цианогруппой. Для каждого из упомянутых выше вариантов осуществления Z, RX каждый RX может быть независимо выбран из Н, метила, этила, третбутила и цианоэтила-. В конкретных вариантах осуществления каждый RX независимо представляет собой Н, метил или цианоэтил, более конкретно, RX представляет собой Н или метил. В конкретных вариантах осуществления Z представляет собой -C(=O)NRX-, -SO2NRX-,-CH(CF3)NH-, метил (метиленил), этил (этиленил), -NRX- или (С 1-С 3)алкил-NRX-, где каждый RX независимо представляет собой Н, метил или этил. В конкретных вариантах осуществления каждый RX независимо представляет собой Н. В выбранных вариантах осуществления Z представляет собой -C(=O)NH-,-SO2NH-, -CH(CF3)NH-, этил (этиленил), -CH2NH-, -CH2N(CH2CH3)-, -CH(CH3)N(CH2CH3)- или-CH(CH3)NH-. В конкретных вариантах осуществления Z представляет собой -C(=O)NH- или -CH2NH-. В другом варианте осуществления n равно 0-3. В конкретных вариантах осуществления n равно 1 или n равно 0. В другом варианте осуществления один из R2 и R3 отличается от водорода. В еще одном варианте осуществления оба R2 и R3 представляют собой (C1-C4)алкил (например, метил). В еще одном варианте осуществления один из R2 и R3 представляет собой Н, и другой из R2 и R3 представляет собой С 1-4 алкил(например, метил). В следующем варианте осуществления R2 и R3, взятые вместе с атомом, с которым они связаны, образуют необязательно замещенную 4-, 5- или 6-членную циклоалкильную или гетероциклоалкильную группу, где указанная гетероциклоалкильная группа содержит 1 гетероатом, выбранный изN, О и S, и указанная необязательно замещенная циклоалкильная или гетероциклоалкильная группа необязательно замещена заместителем, выбранным из (C1-C4)алкила. В другом варианте осуществления, когда n равно 2-3, R2 и R3 независимо выбраны из Н и (C1C4)алкила. В другом варианте осуществления настоящего изобретения, когда n равно 1-3, R2 выбирают из (C1C3)алкиламино(C1-С 4)алкила, гидроксила и (C1-C4)алкокси, и R3 представляет собой Н. В другом варианте осуществления настоящего изобретения, когда n равно 1-3, R2 выбирают из гидроксила и (C1-C4)алкокси, и R3 выбирают из Н. В другом варианте осуществления настоящего изобретения (для любого значения n) R2 и R3 независимо выбраны из Н и необязательно замещенного (C1C4)алкила. В другом варианте осуществления настоящего изобретения (для любого значения n) R2 выбирают из Н и необязательно замещенного (C1-C4)алкила, и R3 выбирают из Н и метила. В конкретных вариантах осуществления настоящего изобретения (для любого значения n) R2 и R3 независимо выбраны из Н и метила. В более конкретных вариантах осуществления настоящего изобретения оба R2 и R3 представляют собой Н, или оба R2 и R3 представляют собой метил. В другом варианте осуществления настоящего изобретения R2 и R3, взятые вместе с атомом, с которым они связаны, образуют необязательно замещенную 4-, 5- или 6-членную циклоалкильную или гетероциклоалкильную группу, где указанная гетероциклоалкильная группа содержит 1 гетероатом, выбранный из N, О и S, и указанная необязательно замещенная циклоалкильная или гетероциклоалкильная группа необязательно замещена заместителем, выбранным из (C1-C4)алкила. В конкретных вариантах осуществления настоящего изобретения R2 и R3, взятые вместе с атомом, с которым они связаны, образуют необязательно замещенную 4-, 5- или 6-членную циклоалкильную или гетероциклоалкильную группу, где указанная гетероциклоалкильная группа содержит 1 гетероатом, выбранный из N и О, и указанная необязательно замещенная циклоалкильная или гетероциклоалкильная группа необязательно замещена заместителем, выбранным из (C1-C4)алкила,В выбранных вариантах осуществления настоящего изобретения R2 и R3, взятые вместе с атомом, с которым они связаны, образуют тетрагидропиранильную, 2,2-диметилтетрагидропиранильную, циклопентильную, 1-метилпиперидинильную, циклопропильную, циклогексильную, 1-этилпиперидинильную,тетрагидрофуранильную, пиперидинильную, 1-метилпирролидинильную, 1-бензилпирролидинильную,1-циклопропилметилпирролидинильную, оксетанильную, азетидинильную, 1-метилазетидинильную, 1 бензилазетидинильную или 1-циклопропилметилазетидинильную группу. В конкретных вариантах осуществления настоящего изобретения R2 и R3, взятые вместе с атомом, с которым они связаны, образуют тетрагидропиранильную, 2,2-диметилтетрагидропиранильную, циклопентильную, 1-метилпиперидинильную группу. В другом варианте осуществления настоящего изобретения L представляет собой 5-6-членный гетероарил или фенил, который замещен R4 и необязательно дополнительно замещен, где в случае, когда L дополнительно замещен, L замещен 1 или 2 заместителями, независимо выбранными из метила. В другом варианте осуществления настоящего изобретения L представляет собой 5-членный гетероарил, пиридил или фенил, который замещен R4 и необязательно дополнительно замещен, где в случае,когда L дополнительно замещен, L замещен 1 заместителем, выбранным из метила. В выбранных вариантах осуществления L представляет собой пиразолил, оксадиазолил, 1 метилимидазолил, тиазолил, тиенил, триазолил, пиридил, фенил, оксазолил или изоксазолил, любой из которых дополнительно замещен метильной группой. В конкретных вариантах осуществления L представляет собой тиазолил, тиенил, триазолил, пиридил, фенил или оксазолил, который замещен метильной группой. В другом варианте осуществления настоящего изобретения R4 представляет собой Н, галоген, C1C2)алкил)C1-C2)алкил)N(C1-С 3)алкокси-, необязательно замещенный (С 3-С 6)циклоалкил, необязательно замещенный фенил или необязательно замещенный 5-6-членный гетероарил, где указанный необязательно замещенный циклоалкил, фенил или гетероарил необязательно замещен 1 или 2 группами, независимо выбранными из галогена, циано, галоген(C1-С 2)алкила и (C1-C2)алкокси. В выбранных вариантах осуществления R4 представляет собой Н, бром, диметиламиноэтокси- и необязательно замещенный пиридил, циклогексил, имидазолил, тиенил или фенил, где пиридил, циклогексил, имидазолил, тиенил или фенил необязательно замещены 1-2 заместителями, независимо выбранными из хлора, брома, фтора, трифторметила, метокси и циано. В выбранных вариантах осуществления R4 представляет собой Н, бром, трифторметил, диметиламиноэтокси-, фенил, 4-хлорфенил, 2-бромфенил, 4-фторфенил, 4-цианофенил, 3-трифторметилфенил, 4 метоксифенил, циклогексил, имидазолил, тиенил, пирид-2-ил, пирид-3-ил или пирид-4-ил. В выбранных вариантах осуществления настоящего изобретения L-R4, взятые вместе, образуют тетрагидроизохинолильную группу. Использованный в настоящем описании термин "алкил" представляет собой насыщенную, линейную или разветвленную углеводородную группу, которая может быть не замещена или замещена одним или более заместителями, определенными в настоящем описании. Примеры алкилов включают без ограничения метил (Me), этил (Et), н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, нпентил, изопентил (3-метилбутил), неопентил (2,2-диметилпропил) и т.п. Термин "C1-C4" относится к алкилу, содержащему от 1 до 4 атомов углерода. Когда используется термин "алкил" в комбинации с другими замещающими группами, такой как"галогеналкил", или "циклоалкилалкил", или "арилалкил", подразумевается, что термин "алкил" включает двухвалентный линейный или разветвленный углеводородный радикал. Например, подразумевается,что "арилалкил" обозначает радикал-арилалкил, в котором алкильная группа представляет собой двухвалентный линейный или разветвленный углеродный радикал, и арильная группа определена в настоящем описании и представлена структурой связывания, имеющей место в бензильной группе (-СН 2-фенил). Кроме того, термин "алкил" можно использовать для определения двухвалетного заместителя, такого как группа, связанная с двумя другими группами. В этом случае подразумевается, что термин "алкил" включает двухвалентный линейный или разветвленный углеродный радикал. Например, подразумевается, что "пентил" представляет собой пентиленовый дирадикал, в котором пентильная группа представляет собой любой двухвалентный линейный(-СН 2 СН(СН 3)СН 2 СН 2-, СН 2 СН 2 СН(СН 2 СН 3)-, -СН 2 СН 2 С(СН 3)2-) радикал из 5 атомов углерода. Использованный в настоящем описании термин "циклоалкил" представляет собой неароматический, насыщенный, циклический углеводородный цикл. Термин "(С 3-С 8)циклоалкил" относится к неароматическому циклическому углеводородному циклу, содержащему от трех до восьми атомов углерода в цикле. Примеры "(С 3-С 8)циклоалкильных" групп, используемых в настоящем изобретении, включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил."Алкокси" относится к группе, содержащей алкильный радикал, присоединенный через связывающий атом кислорода. Термин "(C1-C4)алкокси" относится к линейному или разветвленному углеводородному радикалу, содержащему по меньшей мере от 1 до 4 атомов углерода, присоединенных через связывающий атом кислорода. Примеры "(C1-C4)алкокси" групп, используемых в настоящем изобретении,включают без ограничения метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси и третбутокси."Арил" представляет собой группу или фрагмент, содержащий ароматический, одновалентный моноциклический или бициклический углеводородный радикал, содержащий от 6 от 10 атомов углерода цикла, которые могут быть не замещены или замещены одним или более заместителями, определенными в настоящем описании, и с которым может быть конденсировано одно или более циклоалкильных колец,которые могут быть не замещены или замещены одним или более заместителями, определенными в настоящем описании. Как правило, в соединениях настоящего изобретения арил представляет собой фенил. Гетероциклические группы могут представлять собой гетероарильные или гетероциклоалкильные группы."Гетероциклоалкил" представляет собой группу или фрагмент, включающий стабильный, неароматический моновалентный моноциклический или бициклический радикал, который является насыщенным или частично ненасыщенным, содержащий от 3 до 10 атомов в цикле, которые включают от 1 до 4 гетероатомов, выбранных из азота, кислорода и серы, и который может быть не замещен или замещен одним или более заместителями, определенными в настоящем описании. Гетероциклоалкил может быть связан через любой атом моноциклического или бициклического радикала, что приводит к образованию устойчивой структуры. Данный термин включает бициклические гетероциклоалкильные группы, в которых циклы соединены через два атома каждого цикла, примером чего является структура связывания в 2,5 диазабицикло[2.2.1]гептильной, 2-азабицикло[2.2.1]гептильной, 2-окса-5-азабицикло[2.2.1]гептильной,7-окса-2-азабицикло[2.2.1]гептильной, 2-тиа-5-азабицикло[2.2.1]гептильной, 7-азабицикло[2.2.1]гептильной, 2,6-диазатрицикло[3.3.1.13,7]децильной, 2-азатрицикло[3.3.1.13,7]децильной, 2,4,9-триазатрицикло[3.3.1.13,7]децильной, 8-азабицикло[3.2.1]октильной, 2,5-диазабицикло[2.2.2]октильной, 2-азабицикло[2.2.2]октильной, 3-азабицикло[3.2.1]октильной, 8-азабицикло[3.2.1]октильной, октагидро-1 Н-пиррол[3,2-b]пиридильной группе. Более точно, данный термин исключает бициклические гетероциклоалкильные группы, в которых циклы объединены через один атом каждого цикла (спиро), примером чего является структура связывания в 1-окса-2-азаспиро[4.5]дец-2-ен-3-ильной группе. Иллюстративные примеры гетероциклоалкилов включают без ограничения азетидинил, пирролидил (или пирролидинил), пиперидинил, пиперазинил, морфолинил, тетрагидро-2 Н-1,4-тиазинил, тетрагидрофурил (или тетрагидрофуранил), дигидрофурил, оксазолинил, тиазолинил, пиразолинил, тетрагидропиранил, дигидропиранил,1,3-диоксоланил, 1,3-диоксанил, 1,4-диоксанил, 1,3-оксатиоланил, 1,3-оксатианил, 1,3-дитианил, азабицикло[3.2.1]октил, азабицикло[3.3.1]нонил, азабицикло[4.3.0]нонил, оксабицикло[2.2.1]гептил и 1,5,9 триазациклододецил. Как правило, в соединениях настоящего изобретения гетероциклоалкильные группы представляют собой 5-членные и/или 6-членные гетероциклоалкильные группы, такие как пирролидил (или пирролидинил), тетрагидрофурил (или тетрагидрофуранил), тетрагидротиенил, дигидрофурил, оксазолинил, тиазолинил или пиразолинил, пиперидил (или пиперидинил), пиперазинил, морфолинил, тетрагидропиранил, дигидропиранил, 1,3-диоксанил, тетрагидро-2 Н-1,4-тиазинил, 1,4-диоксанил, 1,3-оксатианил и 1,3 дитианил."Гетероарил" представляет собой группу или фрагмент, включающий ароматический моновалентный моноциклический или бициклический радикал, содержащий от 5 до 10 атомов в цикле, включающих от 1 до 4 гетероатомов, выбранных из азота, кислорода и серы, который может быть не замещен или замещен одним или более заместителями, определенными в настоящем описании. Данный термин также включает бициклические гетероциклические арильные соединения, содержащие арильный циклический фрагмент, конденсированный с гетероциклоалкильным циклическим фрагментом, содержащим от 5 до 10 атомов в цикле, включая от 1 до 4 гетероатомов, выбранных из азота, кислорода и серы, которые могут быть не замещены или замещены одним или более заместителями, определенными в настоящем описании. Кроме того, данный термин включает гетероциклические группы, содержащие азот и/или серу,где гетероатомы азота или серы необязательно окислены. Иллюстративные примеры гетероарилов включают без ограничения тиенил, пирролил, имидазолил, пиразолил, фурил (или фуранил), изотиазолил,фуразанил, изоксазолил, оксазолил, оксадиазолил, тиазолил, пиридил (или пиридинил), пиридил-Nоксид, пиразинил, пиримидинил, пиридазинил, триазинил, тетразинил, триазолил, тетразолил, бензо[b]тиенил, изобензофурил, 2,3-дигидробензофурил, хроменил, хроманил, индолизинил, изоиндолил,индолил, индазолил, пуринил, изохинолил, хинолил, фталазинил, нафтридинил, хиназолинил, бензотиазолил, бензимидазолил, тетрагидрохинолинил, тетрагидроизохинолинил, изоиндолинил, индолинил,циннолинил, птеридинил, изотиазолил. Некоторые из гетероарильных групп, присутствующих в соединениях настоящего изобретения,представляют собой 5-6-членные моноциклические гетероарильные группы. Выбранные 5-членные гетероарильные группы содержат один циклический гетероатом азота, кислорода или серы и необязательно содержат 1, 2 или 3 дополнительных циклических атома азота. Выбранные 6-членные гетероарильные группы содержат 1, 2, 3 или 4 циклических гетероатома азота. Выбранные 5- или 6-членные гетероарильные группы включают тиенил, пирролил, имидазолил, пиразолил, фурил, изотиазолил, фуразанил,изоксазолил, оксазолил, оксадиазолил, тиазолил, триазолил и тетразолил или пиридил, пиразинил, пиримидинил, пиридазинил, триазинил и тиадиазолил. Некоторые из гетероарильных групп, присутствующих в соединениях настоящего изобретения,представляют собой 9-10-членные бициклические гетероарильные группы. Выбранные 9-членные гетероарильные группы содержат один циклический гетероатом азота, кислорода или серы и необязательно содержат 1, 2 или 3 дополнительных циклических атома азота. Выбранные 10-членные гетероарильные группы содержат один циклический гетероатом азота, кислорода или серы и необязательно содержат 1,2, 3 или 4 дополнительных циклических атома азота. Выбранные 9-10-членные гетероарильные группы включают бензо[b]тиенил, изобензофурил, 2,3-дигидробензофурил, хроменил, хроманил, индолизинил,изоиндолил, индолил, индазолил, пуринил, изохинолил, хинолил, фталазинил, нафтиридинил, хиназолинил, бензотиазолил, бензимидазолил, тетрагидрохинолинил, циннолинил, птеридинил. Термины "галоген" и "гало" представляют собой хлор, фтор, бром или йод-заместители. Подразумевается, что "гидрокси" или "гидроксил" обозначает радикал -ОН. Подразумевается, что термин "оксо" обозначает кето-дирадикал (=O), такой, как присутствующий в пирролидин-2-оновом цикле. Как будет понятно специалистам в данной области, соединениями настоящего изобретения являются только те соединения, для которых предполагается "химическая стабильность". Конкретно, настоящее изобретение относится к соединению формулы (I-а)R1 представляет собой -CF3; А представляет собой необязательно замещенный (С 3-С 6)циклоалкил, фенил или 5-6-членный гетероарил,где любой необязательно замещенный циклоалкил, фенил или гетероарил необязательно замещен 1-3 группами, независимо выбранными из (C1-C4)алкила, галогена, циано и (C1-C4)алкокси;Z представляет собой -C(=O)NRX-, -NRXC(=O)-, -SO2NRX-, -NRXSO2-, -NHCH(CF3)-, -CH(CF3)NH-,-(C1-C4)алкил-, -NRX- или -(C1-C3)алкил-NRX-, где RX представляет собой водород или необязательно замещенный (С 2-С 6)алкил, где указанный необязательно замещенный (С 2-С 6)алкил необязательно замещен цианогруппой;n равно 0-3; когда n равно 0, оба R2 и R3 представляют собой Н,когда n равно 1-3, R2 и R3 независимо выбраны из Н и (C1-С 4)алкила, или R2 выбирают из гидроксила и (C1-C4)алкокси, и R3 представляет собой Н или (C1-C4)алкил,или R2 и R3, взятые вместе с атомом, с которым они связаны, образуют необязательно замещенную 4-, 5-, 6- или 7-членную циклоалкильную или гетероциклоалкильную группу, где указанная гетероциклоалкильная группа содержит 1 или 2 гетероатома, независимо выбранных из N, О и S, и указанная необязательно замещенная циклоалкильная или гетероциклоалкильная группа необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из (C1-C4)алкила; иR4 представляет собой Н, галоген, C1-C4)алкил)С 1-С 4)алкил)N(С 1-С 4)алкокси, необязательно замещенный (С 3-С 6)циклоалкил, необязательно замещенный фенил или необязательно замещенный 5-6 членный гетероарил,где указанные необязательно замещенные циклоалкил, фенил или гетероарил необязательно замещены 1, 2 или 3 группами, независимо выбранными из галогена, циано, галоген(C1-C4)алкила и (С 1 С 4)алкокси; или L-R4, взятые вместе, образуют тетрагидроизохинолильную группу, где любой указанный 5-6 членный гетероарил представляет собой 5-членную гетероарильную группу, содержащую один кольцевой гетероатом азота, кислорода или серы, и необязательно содержит 1, 2 или 3 дополнительных кольцевых атомов азота или 6-членную гетероарильную группу, содержащую 1, 2, 3 или 4 кольцевых гетероатомов азота; и при условии, что данное соединение не представляет собой N-(фенилметил)-4-[5-(трифторметил)1,2,4-оксадиазол-3-ил]-1,2,5-оксадиазол-3-амин; или к его соли, в частности фармацевтически приемлемой соли. Соответственно, изобретение также относится к соединению формулы I-а, гдеR1 представляет собой CHF2 или CF3; А представляет собой фенильную группу, необязательно замещенную 1 группой, выбранной из метила, этила, фтора, хлора, метокси, этокси и циано; или А представляет собой циклопропильную, циклопентильную или циклогексильную группу, необяза-6 022964 тельно замещенную 1-2 группами, независимо выбранными из метила, этила, трет-бутила, метокси или этокси; или А представляет собой 5-6-членный гетероарил, необязательно замещенный 1 группой, выбранной из метила, этила и фтора, где 5-6-членный гетероарил содержит 1 гетероатом в цикле, выбранный из N, О и S, и необязательно содержит 1 дополнительный атом азота в цикле,Z представляет собой -C(=O)NRX-, -NRXC(=O)-, -NHCH(CF3)-, -CH(CF3)NH-, -(C1-C4)алкил- или (C1-C3)алкил-NRX-, где RX представляет собой Н, (C1-C4)алкил- или необязательно замещенный (С 2 С 4)алкил, где указанный необязательно замещенный (С 2-С 4)алкил необязательно замещен цианогруппой;n равно 0-3, и R2 и R3 независимо выбраны из Н и необязательно замещенного (C1-C4)алкила, илиn равно 0-3, и R2 и R3, взятые вместе с атомом, с которым они связаны, образуют необязательно замещенную 4-, 5- или 6-членную циклоалкильную или гетероциклоалкильную группу, где указанная гетероциклоалкильная группа содержит 1 гетероатом, выбранный из N, О и S, и указанная необязательно замещенная циклоалкильная или гетероциклоалкильная группа необязательно замещена заместителем,выбранным из (C1-C4)алкила;R4 представляет собой Н, галоген, C1-C2)алкил)C1-С 2)алкил)N(C1-С 3)алкокси, необязательно замещенный (С 3-С 6)циклоалкил, необязательно замещенный фенил или необязательно замещенный 5-6 членный гетероарил, где указанные необязательно замещенные циклоалкил, фенил или гетероарил необязательно замещены 1 или 2 группами, независимо выбранными из галогена, циано, галоген (C1-C2)алкила, (С 1-С 2)алкокси; или к его соли, в частности фармацевтически приемлемой соли. Кроме того, изобретение также относится к соединению, которое определено в настоящем описании, гдеn равно 0-3, и R2 и R3 независимо выбраны из Н и необязательно замещенного (C1-C4)алкила, илиn равно 0-3, и R2 и R3, взятые вместе с атомом, с которым они связаны, образуют необязательно замещенную 4-, 5- или 6-членную циклоалкильную или гетероциклоалкильную группу, где указанная гетероциклоалкильная группа содержит 1 гетероатом, выбранный из N и О, и указанная необязательно замещенная циклоалкильная или гетероциклоалкильная группа необязательно замещена заместителем, независимо выбранным из (C1-C4)алкила;R4 представляет собой Н, бром, диметиламиноэтокси- и необязательно замещенный пиридил, циклогексил, имидазолил, тиенил или фенил, где пиридил, циклогексил, пиперидинил, пиперазинил, имидазолил, тиенил или фенил необязательно замещены 1-2 заместителями, независимо выбранными из хлора,брома, фтора, трифторметила, метокси и циано; или к его соли, в частности фармацевтически приемлемой соли. Более конкретно, настоящее изобретение относится к соединению согласно формуле I-а, гдеR1 представляет собой CHF2 или CF3; А представляет собой незамещенную фенильную группу или фенильную группу, замещенную этильной, фторидной, циано или метоксигруппой, или тиенильную, пиридильную, циклопропильную,циклопентильную или циклогексильную группу;L представляет собой тиазолил, тиенил, триазолил, пиридил, фенил или оксазолил, любой из которых необязательно замещен метильной группой;L-R4, взятые вместе, образуют тетрагидроизохинолильную группу; или к его соли, в частности фармацевтически приемлемой соли. Более конкретно, настоящее изобретение относится к соединению согласно формуле I-а, гдеR1 представляет собой CHF2 или CF3; А представляет собой незамещенную фенильную или пиридильную группу;L представляет собой тиазолил, тиенил, триазолил, пиридил, фенил или оксазолил, любой из которых необязательно замещен метильной группой;R4 представляет собой фенил, необязательно замещенный галогеном (хлором или фтором), циано,галоген(C1-C2)алкилом или (C1-C2)алкокси; или к его соли, в частности фармацевтически приемлемой соли. Использованный в настоящем описании термин "соединение(ия) настоящего изобретения" обозначает соединение формулы (I-а) (определенное выше) в любой форме, то есть любую солевую или несолевую форму (например, форму свободной кислоты или основания или в виде его фармацевтически приемлемой соли) и любую его физическую форму (например, включая нетвердые формы (например, жидкие или полужидкие формы) и твердые формы (например, аморфные или кристаллические формы, конкретные полиморфные формы, сольваты, включая гидраты (например, моно-, ди- и полугидраты, и смеси различных форм. Использованный в настоящем описании термин "необязательно замещенный" обозначает незамещенные группы или циклы (например, циклоалкильный, гетероциклический и гетероарильный циклы) и группы или циклы, замещенные одним или более конкретными заместителями. Соединения формулы I-а могут иметь один или более асимметрических центров (называемых также хиральными центрами) и могут, следовательно, существовать в виде индивидуальных энантиомеров,диастереомеров или других стереоизомерных форм, или их смесей. Хиральные центры, такие как хиральные атомы углерода, могут также находиться в заместителе, таком как алкильная группа. Когда стереохимия хирального центра, присутствующего в формуле I-а или в любой приведенной в настоящем описании химической структуре, не определена, подразумевается, что данная структура включает все индивидуальные стереоизомеры и все смеси. Таким образом, соединения формулы I-а, содержащие один или более хиральных центров, можно использовать в виде рацемических смесей, скалемических смесей или в виде диастереомерно или энантиомерно чистых веществ. Индивидуальные стереоизомеры соединения формулы I-а, содержащие один или более асимметрических центров, можно разделить способами, которые известны специалистам в данной области. Например, такое разделение можно осуществить (1) путем образования диастереомерных солей, комплексов или других производных; (2) путем селективной реакции со стереоизомер-специфическим реагентом,например, при помощи ферментативного окисления или восстановления; или (3) при помощи газожидкостной или жидкостной хроматографии в хиральном окружении, например на хиральном носителе, таком как силикагель со связанным хиральным лигандом, или в присутствии хирального растворителя. Опытному специалисту будет понятно, что, когда требуемый стереоизомер превращают в другой химический объект при помощи одной из описанных выше методик разделения, необходима дополнительная стадия для высвобождения требуемой формы. Альтернативным образом, можно синтезировать конкретные стереоизомеры при помощи асимметрического синтеза с использованием оптически активных реагентов,веществ, катализаторов или растворителей или превращением одного энантиомера в другой путем асимметрического превращения. Когда раскрытое соединение или его соль названо или изображено при помощи структуры, понятно, что данное соединение или его соль, включая сольваты (в частности, гидраты), может существовать в виде кристаллических форм, некристаллических форм или их смесей. Соединение, или его соль, или сольваты (в частности, гидраты), может также проявлять полиморфизм (то есть способность существовать в виде различных кристаллических форм). Такие различные кристаллические формы обычно известны как "полиморфы". Следует понимать, что описанное соединение или его сольваты (в частности,гидраты), будучи названным или изображенным при помощи структуры, включает также все полиморфы. Полиморфы имеют одинаковый химический состав, но различаются упаковкой, геометрическим окружением и другими описательными свойствами кристаллического твердого состояния. Следовательно,полиморфы могут иметь разные физические свойства, такие как форма, плотность, твердость, деформируемость, устойчивость и растворимость. Как правило, полиморфы имеют разные температуры плавления, ИК-спектры и порошковые рентгенограммы, которые можно использовать для идентификации. Специалист в данной области поймет, что можно получить различные полиморфы, например, изменяя или регулируя условия, используемые при кристаллизации/перекристаллизации соединения. Вследствие своего потенциального применения в медицине соли соединений формулы I-а предпоч-8 022964 тительно являются фармацевтически приемлемыми солями. Подходящие фармацевтически приемлемые соли включают соли, описанные Berge, Bighley и Monkhouse, J. Pharm. Sci (1977) 66, p. 1-19. Соли, подпадающие под термин "фармацевтически приемлемые соли", относятся к нетоксичным солям соединений настоящего изобретения. Обычно соль можно легко получить при использовании требуемой кислоты или основания, при необходимости. Соль может быть выделена осаждением из раствора и собрана фильтрованием или может быть получена выпариванием растворителя. Когда соединение настоящего изобретения представляет собой основание (содержит основную группу), требуемую солевую форму можно получить любым подходящим способом, известным в данной области, включая обработку данного свободного основания неорганической кислотой, такой как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., или органической кислотой, такой как уксусная кислота, трифторуксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота и т.п., или пиранозидильной кислотой, такой как глюкуроновая кислота или галактуроновая кислота, или альфа-гидроксикислотой, такой как лимонная кислота или винная кислота, или аминокислотой, такой как аспарагиновая кислота или глутаминовая кислота, или ароматической кислотой, такой как бензойная кислота или коричная кислота, или сульфоновой кислотой, такой как п-толуосульфокислота, метансульфокислота,этансульфокислота или т.п. Подходящие аддитивные соли получаются из кислот, образующих нетоксичные соли, и примеры включают ацетат, п-аминобензоат, аскорбат, аспартат, бензолсульфонат, бензоат, бикарбонат, бисметиленсалицилат, бисульфат, битартрат, борат, эдетат кальция, камсилат, карбонат, клавуланат, цитрат, циклогексилсульфамат, эдетат, эдизилат, эстолат, эзилат, этандисульфонат, этансульфонат, формиат, фумарат, глуцептат, глюконат, глутамат, гликолят, гликолиларсанилат, гексилсорцинат, гидрабамин, гидробромид, гидрохлорид, дигидрохлорид, гидрофумарат, гидрофосфат, гидройодид, гидромалеат, гидросукцинат, гидроксинафтоат, изетионат, итаконат, лактат, лактобионат, лаурат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, малеат монокальция, мукат, напсилат, нитрат, Nметилглюкамин, оксалат, оксалоацетат, памоат (эмбонат), палмат, пальмитат, пантотенат, фосфат/дифосфат, пируват, полигалактуронат, пропионат, сахарат, салицилат, стеарат, субацетат, сукцинат,сульфат, таннат, тартрат, теоклат, тозилат, триэтийодид, трифторацетат и валерат. Другие примеры кислотно-аддитивных солей включают пиросульфат, сульфит, бисульфит, деканоат, каприлат, акрилат, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, суберат, себацат,бутин-1,4-диоат, гексин-1,6-диоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, фенилацетат, фенилпропионат, фенилбутират, лактат, -гидроксибутират, манделат и сульфонаты, такие как ксилолсульфонат, пропансульфонат, нафталин-1-сульфонат и нафталин-2-сульфонат. Если основное соединение изобретения выделяют в виде соли, соответствующую форму свободного основания данного соединения можно получить любым подходящим способом, известным в данной области, включая обработку соли неорганическим или органическим основанием, подходящим неорганическим или органическим основанием, pKa которого выше, чем у формы свободного основания данного соединения. Если соединение изобретения представляет собой кислоту (содержит кислотную группу), требуемую соль можно получить любым подходящим способом, известным в данной области, включая обработку свободной кислоты неорганическим или органическим основанием, таким как амин (первичный,вторичный или третичный), гидроксид щелочного или щелочно-земельного металла или т.п. Иллюстративные примеры подходящих солей включают органические соли, полученные из аминокислот, таких как глицин и аргинин, аммиака, первичных, вторичных и третичных аминов и циклических аминов, таких как N-метил-D-глюкамин, диэтиламин, изопропиламин, триметиламин, этилендиамин, дициклогексиламин, этаноламин, пиперидин, морфолин и пиперазин, и также неорганические соли, полученные из натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития. Некоторые из соединений настоящего изобретения могут образовывать соли с одним или более эквивалентами кислоты (если соединение содержит основную группу) или основания (если соединение содержит кислотную группу). В объем настоящего изобретения включены все возможные стехиометрические и нестехиометрические солевые формы. Соединения настоящего изобретения, содержащие и основную, и кислотную группу, могут быть в виде цвиттерионов, кислотно-аддитивной соли основной группы или основных солей кислотной группы. В изобретении также предоставлено превращение одной фармацевтически приемлемой соли соединения настоящего изобретения, например гидрохлоридной соли, в другую фармацевтически приемлемую соль соединения настоящего изобретения, например соль натрия. В отношении сольватов соединений формулы I-а или их солей, находящихся в кристаллической форме, квалифицированному специалисту будет понятно, что можно получить фармацевтически приемлемые сольваты, в которых молекулы растворителя внедряются в кристаллическую решетку в процессе кристаллизации. Сольваты могут включать неводные растворители, такие как этанол, изопропанол,ДМСО, уксусную кислоту, этаноламин и этилацетат, или они могут включать воду в качестве растворителя, который включается в кристаллическую решетку. Сольваты, в которых растворителем, включенным в кристаллическую решетку, является вода, обычно называют "гидратами". Гидраты включают стехиометрические гидраты, и также составы, содержащие переменные количества воды. Настоящее изобретение включает все подобные сольваты. Представленное изобретение включает также меченные радиоактивными изотопами соединения,идентичные соединениям, перечисленным в формуле (I-а), за исключением того факта, что один или более атомов замещены атомом, атомная масса или массовое число которого отличается от атомной массы или массового числа, наиболее распространенного в природе. Примеры изотопов, которые можно ввести в соединения настоящего изобретения, включают изотопы водорода, углерода, азота, кислорода, фтора,йода и хлора, такие как 3 Н, 11 С, 14 С, 18F, 123I или 125I. Соединения настоящего изобретения и фармацевтически приемлемые соли указанных соединений,содержащие упомянутые выше изотопы и/или другие изотопы других атомов, находятся в пределах объема настоящего изобретения. Меченные радиоактивными изотопами соединения настоящего изобретения, например соединения, в которые ввели радиоактивные изотопы, такие как 3 Н или 14 С, применимы в анализе распределения лекарственного средства и/или субстрата в тканях. Меченные тритием, то есть 3 Н,и углеродом-14, то есть 14 С, изотопы, особенно предпочтительны вследствие простоты их получения и детектируемости. Изотопы 11 С и 18F особенно применимы для ПЭТ (позитронно-эмиссионной томографии). Поскольку соединения формулы (I-а) предназначены для применения в фармацевтических композициях, легко понять, что каждое из них предпочтительно предоставлено, по существу, в чистом виде,например, с чистотой по меньшей мере 60%, более подходящим образом с чистотой по меньшей мере 75% и предпочтительно по меньшей мере 85%, в особенности с чистотой по меньшей мере 98% (% приведены по массе исходя из массы основного вещества). Препараты соединений с примесями можно использовать для получения более чистых форм, используемых в фармацевтических композициях. Соединения формулы I-а можно получить с использованием методик синтеза, показанных на приведенных далее схемах, или пользуясь знаниями квалифицированного химика-органика. Способы синтеза, представленные на данных схемах, применимы для получения соединений изобретения, имеющих множество различных групп R1 и R2, с использованием соответствующих предшественников, которые защищены подходящим образом в случае необходимости для достижения совместимости с описанными здесь реакциями. В результате последующего снятия защиты, где это необходимо, получают соединения описанной в общем виде природы. Несмотря на то что приведены схемы только с соединениями формулы I-а, они являются иллюстрацией способов, которые можно применять для получения соединений согласно изобретению. Промежуточные соединения (соединения, применяемые для получения соединений настоящего изобретения) могут также присутствовать в виде солей. Так, в отношении промежуточных соединений фраза "соединение(ия) формулы (номер)" обозначает соединение, имеющее данную структурную формулу или его фармацевтически приемлемую соль. Конкретные соединения настоящего изобретения включают соединения примеров 1-138. Репрезентативные соединения настоящего изобретения включаютN-(2-(2-(4-хлорфенил)оксазол-4-ил)-2-метилпропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,N-(2-(3-фенил-1,2,4-оксадиазол-5-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,N-(2-метил-2-(3-фенил-1 Н-пиразол-5-ил)пропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,N-(2-(2-(4-фторфенил)оксазол-4-ил)пропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,N-(2-(4-(4-хлорфенил)тиазол-2-ил)-2-метилпропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,N-4-([1,1'-бифенил]-3-ил)-1-метилпиперидин-4-ил)метил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3 ил)никотинамид,N-(2-(2-(4-фторфенил)оксазол-4-ил)-2-гидроксипропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3 ил)бензамид,и их соли, в частности фармацевтически приемлемые соли. Конкретные соединения настоящего изобретения включаютN-4-(4-фенилтиазол-2-ил)тетрагидро-2 Н-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,N-(2-метил-2-(2-фенилоксазол-4-ил)пропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,N-(2-(3-(4-фторфенил)-1 Н-1,2,4-триазол-5-ил)-2-метилпропил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамид,N-(2-(2-(4-фторфенил)оксазол-4-ил)-2-метилпропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,N-(2-(диметиламино)-2-(2-(4-фторфенил)оксазол-4-ил)этил)-3-(5-(трифторметил)-1,2,4-оксадиазол 3-ил)бензамид,N-(2-(2-(4-фторфенил)оксазол-4-ил)-2-гидроксиэтил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3 ил)бензамид,N-(4-(диметиламино)-(2-(2-(4-фторфенил)оксазол-4-ил)бутил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид,N-(2-(2-(4-фторфенил)оксазол-4-ил)-2-гидроксипропил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3 ил)бензамид,3-(5-(4-фторфенил)оксазол-2-ил)пиперидин-1-ил)(3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)фенил)метанон,и их соли, в частности фармацевтически приемлемые соли. Названия соединений получали при помощи компьютерной программы ChemDraw 11.0, доступной от CambridgeSoft Corporation, 100 CambridgePark Drive, Cambridge, MA 02140, США Настоящее изобретение включает также различные дейтерированные формы соединений формулыI-а. Каждый подходящий атом водорода, связанный с атомом углерода, можно независимо заменить на атом дейтерия. Специалисту стандартной квалификации известно, как синтезировать дейтерированные формы соединений формулы I-а. Например, дейтерированные алкильные группы (например, N(дейтерометил)амины) можно получить согласно стандартным методикам (см., например, метил-d3-амин,доступный от Aldrich Chemical Co., Milwaukee, WI, Cat. No. 489, 689-2). Использование таких соедине- 14022964 ний позволяет получать соединения формулы I-а, в которых различные атомы водорода в N-метильных группах замещены атомом дейтерия. Подразумевается, что терапевтически "эффективное количество" означает такое количество соединения, которое при введении пациенту, нуждающемуся в подобном лечении, является достаточным для оказания лечебного эффекта, определенного в настоящем описании. Так, например, терапевтически эффективное количество соединения формулы I-а или его фармацевтически приемлемой соли представляет собой такое количество агента изобретения, которое при введении нуждающемуся в этом человеку является достаточным для ингибирования активности HDAC таким образом, что болезненное состояние, которое опосредуется этой активностью, уменьшается, облегчается или предупреждается. Количество данного соединения, которое будет соответствовать данному количеству, будет изменяться в зависимости от таких факторов, как конкретное соединение (например, активность (pXC50), эффективность (ЕС 50) и биологический период полураспада конкретного соединения), болезненное состояние и его тяжесть, индивидуальные особенности (например, возраст, размер и вес тела) пациента, нуждающегося в лечении, но,тем не менее, может быть просто определено специалистом в данной области. Аналогичным образом,продолжительность лечения и период времени введения (промежуток времени между дозами и выбор времени введения, например, до/во время/после приема пищи) соединения будет изменяться в соответствии с индивидуальными особенностями нуждающегося в лечении млекопитающего (например, весом),конкретным соединением и его свойствами (например, фармацевтическими характеристиками), заболеванием или состоянием и его тяжестью, и конкретной композицией и используемым способом, но, тем не менее, может быть просто определена специалистом в данной области. Подразумевается, что "лечить" или "лечение" обозначает, по меньшей мере, ослабление болезненного состояния у пациента, где болезненное состояние вызвано или опосредовано HDAC. Способ лечения для ослабления болезненного состояния включает использование соединений настоящего изобретения любым общепринятым приемлемым способом, например, для предупреждения, замедления, профилактики, терапии или лечения заболевания. В одном варианте осуществления настоящее изобретение относится к способу лечения, облегчения или предупреждения аутоиммунного нарушения, иммунологического заболевания, воспалительного нарушения, реакции отторжения трансплантата/аллотрансплантата, лимфопении или заболевания трансплантат-против-хозяина (GvHD) у пациента, в особенности у человека, включающему введение пациенту соединения настоящего изобретения, в количестве, достаточном для повышения концентрации и/или активности Т-регуляторных клеток или популяции Т-регуляторных клеток у пациента, таким образом,проводя лечение, облегчая или предупреждая аутоиммунное нарушение, воспалительное нарушение,реакцию отторжения трансплантата/аллотрансплантата, лимфопению или GvHD у пациента. Дополнительные примеры заболеваний и состояний, которые можно лечить при помощи соединений настоящего изобретения, включают без ограничения сахарный диабет II типа, ишемическую болезнь сердца, аллергии и аллергические реакции и септический/токсический шок. Примеры аутоиммунных заболеваний включают без ограничения рассеянный склероз, юношеский идиопатический артрит, псориатический артрит, смешанную криоглобулинемию, связанную с вирусом гепатита С, полимиозит, дерматомиозит, плюригландулярный синдром II типа, аутоиммунное заболевание печени, болезнь Кавасаки, миастению гравис, Х-сцепленный синдром иммунной дисрегуляции, полиэндокринопатии и энтеропатии (IPEX (синдром, диабет I типа, псориаз, гипотиреоз, гемолитическую анемию, аутоиммунную полиэндокринопатию-кандидоз-эктодермальную дистрофию (APECED), тромбоцитопению, спондилоартрит, синдром Съегрена, ревматоидный артрит, воспалительное заболевание кишечника (IBD), болезнь Крона, неспецифический язвенный колит, экзему, гастрит или тиреоидит. Как часть неограничивающего перечня, воспалительное нарушение может представлять собой контактную гиперчувствительность, атопический дерматит или болезнь Стилла. Дополнительные примеры аутоиммунных заболеваний включают без ограничения аутоиммунные заболевания, включая остеоартрит, системный склероз, саркоидоз, инсулинозависимый сахарный диабет(IDDM, диабет I типа), реактивный артрит, склеродермию, васкулит, гранулематоз Вегенера, болезнь Хашимото, оофорит, системную красную волчанку (SLE), болезнь Грейвса, астму, криоглобулинемию,первичный билиарный склероз, вульгарную пузырчатку, гемолитическую анемию и злокачественную анемию. Примерами реакций отторжения трансплантата/имплантата (например, аллотрансплантата), лимфопении или заболевания трансплантат-против-хозяина (GvHD) являются реакции отторжения, происходящие в результате процедур трансплантации клеток, тканей и органов, такие как трансплантаты терапевтических клеток, например стволовых клеток, мышечных клеток, таких как клетки сердца, островковые клетки, клетки печени, трансплантаты костного мозга, трансплантаты кожи, костные трансплантаты,легочные трансплантаты, трансплантаты почек, трансплантаты печени и трансплантаты сердца. Другие примеры заболеваний и состояний, которые можно лечить при помощи соединений настоящего изобретения, включают без ограничения муковисцидоз, остеопороз, ожирение, эпилепсию, депрессию, талассемию, серповидно-клеточную анемию, боковой амиотрофический склероз (ALS) и гиперальгезию, заболевание сердца (например, инсульт, гипертензию, атеротромботические заболевания, атеро- 15022964 склероз или ограничение области инфаркта при остром коронарном синдроме), заболевания или нарушения, включающие мышечную атрофию, вызванную гентамицином потерю слуха, резистентность к лекарственному средству (например, резистентность к лекарственному средству у клеток остеосаркомы и рака ободочной кишки), инфекционные заболевания и иммунодефицит/ослабленный иммунодефицит у пациентов. Примеры инфекционных заболеваний относятся к различным патогенным инфекциям, таким как вирусные, грибковые, бактериальные, микоплазматические, и инфекциям моноклеточных и многоклеточных эукариотических организмов. Обычные патогены человека включают, но не ограничиваются ими, вирусы HIV, HSV, HPV, гепатита А, В и С, вирус гриппа, вирус денге, zostrella, вирус краснухи,RSV, ротавирус, грамположительные, грамотрицательные бактерии, стрептококки, стафилококки и патогены, вызывающие столбняк, туберкулез, листерию и малярию. В другом варианте осуществления настоящее изобретение относится к ингибиторам HDAC и к их применению для прекращения или снижения роста неопластических клеток, например раковых клеток и опухолевых клеток. Посредством лечения при помощи соединения настоящего изобретения может быть снижен рост раковых клеток и/или опухолевых клеток, обнаруженный при следующих видах рака: карциноме (например, аденокарциноме), гепатоклеточной карциноме, саркоме, миеломе (например, множественной миеломе), лечения костных заболеваний при множественной миеломе, лейкозе, остром детском лимфобластическом лейкозе и лимфоме (например, лимфоме клеток кожи), и смешанных видах рака, таких как аденосквамозная карцинома, смешанная мезодермальная опухоль, карциносаркома и тератокарцинома. В одном из аспектов изобретения рак или опухоль молочной железы или предстательной железы лечат при помощи ингибиторов HDAC по настоящему изобретению. Другие виды рака, которые можно лечить, используя соединения настоящего изобретения, включают, но не ограничиваясь этим, рак мочевого пузыря, рак молочной железы, рак предстательной железы,рак желудка, рак легких, рак ободочной кишки, рак прямой кишки, колоректальный рак, рак печени, рак эндометрия, рак поджелудочной железы, рак шейки матки, рак яичника, рак головы и шеи и меланому. Ингибиторы по настоящему изобретению можно применять отдельно или в комбинации со стандартными противораковыми режимами для лечения неопластических клеток, например опухоли и рака. Соединения по настоящему изобретению можно вводить любым подходящим способом введения,включая как системное введение, так и местное введение. Системное введение включает пероральное введение, парентеральное введение, чрескожное введение, ректальное введение и введение при помощи ингаляции. Парентеральное введение относится к способам введения, отличающимся от энтерального,чрескожного, или путем ингаляции и обычно представляет собой инъекцию или инфузию. Парентеральное введение включает внутривенную, внутримышечную и подкожную инъекцию или инфузию. Ингаляция относится к введению в легкие пациента при вдыхании либо через рот или через носовые ходы. Местное введение включает нанесение на кожу. Соединения настоящего изобретения можно вводить однократно или в соответствии с режимом дозировки, при котором ряд доз вводят при переменных промежутках времени в течение заданного периода времени. Например, дозы можно вводить один, два, три или четыре раза в день. Дозы можно вводить до достижения желаемого терапевтического эффекта или в течение неопределенного времени для поддержания желаемого терапевтического эффекта. Подходящие режимы дозирования для соединения настоящего изобретения зависят от фармакокинетических свойств данного соединения, таких как абсорбция, распределение и период полувыведения, которые может определить опытный специалист. Кроме того, подходящие режимы дозирования, включая продолжительность введения таких режимов, для соединения настоящего изобретения зависят от подлежащего лечению состояния, тяжести подлежащего лечению состояния, возраста и физического состояния проходящего лечение пациента, истории болезни подлежащего лечению пациента, природы сопутствующей терапии, ожидаемого терапевтического эффекта и подобных факторов, находящихся в пределах знаний и компетенции опытного специалиста. Кроме того, опытным специалистам будет ясно, что для подходящих режимов дозирования может потребоваться корректировка в зависимости от для индивидуальной реакции пациента на режим дозирования, или по прошествии времени, когда отдельному пациенту потребуется изменение. Лечение опосредуемых HDAC болезненных состояний можно проводить при использовании соединений настоящего изобретения в виде монотерапии или двойной или множественной комбинированной терапии, такой как комбинация с другими агентами, например, в комбинации с одним или более из числа следующих агентов: ингибиторов ДНК-метилтрансфераз, усилителей ацетилтрансферазы, ингибиторов протеасом или HSP90 и одного или более иммуносупрессантов, которые не активируют Т-супрессорные клетки, включая, но не ограничиваясь ими, кортикостероиды, рапамицин, азатиоприн, микофенолят,циклоспорин, меркаптопурин (6-МР), базиликсимаб, даклизумаб, сиролимус, такролимус, муромонабCD3 циклофосфамид и метотрексат, которые вводят в эффективных количествах, известных в данной области. Перед введением пациенту из соединений настоящего изобретения обычно, но не обязательно, составляют фармацевтические композиции. Соответственно, в следующем аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим соединение настоящего изобретения и фар- 16022964 мацевтически приемлемый эксципиент. Фармацевтические композиции настоящего изобретения могут быть получены и расфасованы в насыпную форму, из которой можно выделить эффективное количество соединения настоящего изобретения и затем дать пациенту, например, с порошками, сиропами и растворами для инъекции. Альтернативным образом,фармацевтические композиции настоящего изобретения можно получить и упаковать в виде стандартной дозированной формы. В случае перорального применения, например, можно вводить одну или более таблеток или капсул. Доза фармацевтической композиции включает, по меньшей мере, терапевтически эффективное количество соединения настоящего изобретения (то есть соединения формулы I или его соли, в частности фармацевтически приемлемой соли). При получении в виде стандартной дозированной формы фармацевтическая композиция может содержать от 1 до 1000 мг соединения настоящего изобретения. Обычно фармацевтические композиции настоящего изобретения включают одно соединение настоящего изобретения. Однако в некоторых вариантах осуществления фармацевтические композиции настоящего изобретения включают более одного соединения настоящего изобретения. Кроме того, фармацевтические композиции настоящего изобретения могут необязательно включать одно или более дополнительных фармацевтически активных соединений. Как использовано в настоящем описании, "фармацевтически приемлемый эксципиент" означает вещество, композицию или носитель, принимающий участие в придании формы или консистенции данной композиции. Каждый эксципиент должен быть совместим с другими ингредиентами фармацевтической композиции при смешивании, чтобы избежать взаимодействий, которые бы существенно снизили эффективность соединения настоящего изобретения при введении пациенту, и взаимодействий, которые привели бы к фармацевтическим композициям, которые не являются фармацевтически приемлемыми. Помимо этого, каждый эксципиент, безусловно, должен иметь достаточно высокую чистоту, придающую ему фармацевтическую приемлемость. Соединения настоящего изобретения и фармацевтически приемлемый эксципиент или эксципиенты обычно составляют в дозированную форму, адаптированную для введения пациенту путем желательного способа введения. Традиционные дозированные формы включают дозированные формы, адаптированные для (1) перорального введения, такие как таблетки, капсулы, каплеты, пилюли, пастилки, порошки, сиропы, эликсиры, суспензии, растворы, эмульсии, пакетики и облатки, (2) парентерального введения, такие как стерильные растворы, суспензии и порошки для восстановления, (3) чрескожного введения, такие как чрескожные пластыри, (4) ректального введения, такие как суппозитории, (5) ингаляции, такие как аэрозоли и растворы, и (6) местного введения, такие как кремы, мази, лосьоны, растворы, пасты, спреи, пены и гели. Подходящие фармацевтически приемлемые эксципиенты будут изменяться в зависимости от конкретно выбранной дозированной формы. Кроме того, подходящие фармацевтически приемлемые эксципиенты можно выбрать для конкретной функции, которую они должны выполнять в данной композиции. Например, некоторые фармацевтически приемлемые эксципиенты можно выбрать по причине их способности облегчать получение однородных дозированных форм. Некоторые фармацевтически приемлемые эксципиенты можно выбрать по причине облегчать получение устойчивых дозированных форм. Некоторые фармацевтически приемлемые эксципиенты можно выбрать по причине облегчать перенос или транспортировку соединения или соединений настоящего изобретения при введении пациенту, от одного органа или части тела к другому органу или части тела. Некоторые фармацевтически приемлемые эксципиенты можно выбрать по причине их способности улучшать соблюдение больным режима и схемы лечения. Подходящие фармацевтически приемлемые эксципиенты включают следующие типы эксципиентов: разбавители, наполнители, связывающие вещества, разрыхлители смазывающие вещества, глиданты, гранулирующие агенты, агенты для нанесения покрытия, смачивающие средства, растворители, вспомогательные растворители, суспендирующие агенты, эмульгаторы, подсластители, вкусо-ароматические агенты, агенты для маскировки вкуса, красители, агенты против спекания, увлажняющие агенты, хелатирующие агенты, пластификаторы, агенты для повышения вязкости, антиоксиданты, консерванты, стабилизаторы, поверхностноактивные вещества и буферные вещества. Опытный специалист поймет, что некоторые фармацевтические эксципиенты могут выполнять более одной функции и могут выполнять альтернативные функции в зависимости от того, в каком количестве данный эксципиент присутствует в препарате и какой другой ингредиент присутствует в препарате. Опытные специалисты, обладающие знаниями и умениями в данной области, способны выбрать подходящие фармацевтически приемлемые эксципиенты в соответствующем количестве для использования в данном изобретении. Кроме того, имеется ряд источников, доступных опытным специалистам, в которых описаны фармацевтически приемлемые эксципиенты и которые могут быть полезны при выборе подходящих фармацевтически приемлемых эксципиентов. Примеры включают Remington's Pharmaceutical Sciences (Mack Publishing Company), The Handbook of Pharmaceutical Additives (Gower Publishing Limited) и The Handbook ofPharmaceutical Excipients (the American Pharmaceutical Association and the Pharmaceutical Press). Фармацевтические композиции настоящего изобретения получают с использованием методик и способов, которые известны специалистам в данной области. Некоторые способы, обычно используемые в данной области, описаны в Remington's Pharmaceutical Sciences (Mack Publishing Company). В одном из аспектов настоящее изобретение относится к твердой пероральной дозированной форме, та- 17022964 кой как таблетка или капсула, содержащая эффективное количество соединения изобретения и разбавитель или наполнитель. Подходящие разбавители или наполнители включают лактозу, сахарозу, декстрозу, маннит,сорбит, крахмал (например, кукурузный крахмал, картофельный крахмал и прежелатинизированный крахмал), целлюлозу и ее производные (например, микрокристаллическую целлюлозу), сульфат кальция и двухосновный фосфат кальция. Кроме того, пероральная твердая дозированная форма может содержать связывающее вещество. Подходящие связывающие вещества включают крахмал (например, кукурузный крахмал,картофельный крахмал и прежелатинизированный крахмал), желатин, аравийскую камедь, альгинат натрия,альгиновую кислоту, трагакант, гуаровую смолу, повидон и целлюлозу и ее производные (например, микрокристаллическую целлюлозу). Пероральная твердая дозированная форма может также содержать разрыхлитель. Подходящие разрыхлители включают кросповидон, натрий гликолят крахмал, кроскармеллозу, альгиновую кислоту и карбоксиметилцеллюлозу натрия. Пероральная твердая дозированная форма может также содержать смазывающее средство. Подходящие смазывающие средства включают стеариновую кислоту, стеарат магния, стеарат кальция и тальк. Примеры Изобретение проиллюстрировано следующими примерами. Данные примеры не предназначены для ограничения объема настоящего изобретения, а предназначены для предоставления руководства специалисту в получении и применении данных соединений, композиций и способов настоящего изобретения. Несмотря на то что описаны конкретные варианты осуществления настоящего изобретения, опытному специалисту будет понятно, что можно осуществить различные изменения и модификации, не выходя за рамки объема и сущности настоящего изобретения. В следующих экспериментальных описаниях могут быть использованы следующие сокращения: Смесь 2-бромацетофенона (2 г, 10 ммоль) и 2-цианотиоацетамида (1 г, 10 ммоль) в EtOH (25 мл) нагревали до 80 С в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и выливали в водный раствор аммиака (конечный рН составлял 7). Затем смесь экстрагировали EtOAc и органический слой промывали Н 2 О и насыщенным раствором соли. Растворитель удаляли при пониженном давлении и сырой продукт очищали колоночной флэш-хроматографией (силикагель 230-400 меш, элюент 8% EtOAc в петролейном эфире), получая 2-(4-фенилтиазол-2-ил)ацетонитрил (1,5 г, выход 75%) в виде твердого вещества желтого цвета. 1 Н ЯМР (300 МГц, CDCl3)7,88-7,91 (м, 2 Н), 7,49 (с, 1 Н), 7,27-7,48 (м, 3 Н), 4,19 (с, 2 Н). МС (ESI) m/z: вычислено для C11H8N2S: 200,04, найдено: 201,2 (М+Н)+. Стадия 2. 4-(4-Фенилтиазол-2-ил)тетрагидро-2 Н-пиран-4-карбонитрил Раствор 2-(4-фенилтиазол-2-ил)ацетонитрила (0,84 г, 4,19 ммоль) в ТГФ (25 мл) охлаждали до 0 С. Добавляли NaH (0,5 г, 60% суспензия в масле) порциями в течение 10 мин. Полученную смесь оставляли нагреваться для комнатной температуры и перемешивали в течение 20 мин. Добавляли по каплям 2 бромэтиловый эфир (1,58 мл, 12,5 ммоль). Реакционную смесь дополнительно перемешивали при комнатной температуре в течение 1 ч и затем гасили насыщенным раствором NH4Cl. Реакционную смесь разбавляли EtOAc и органический слой промывали Н 2 О и насыщенным раствором соли. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (силикагель 60-120 меш, элюент 4-8% EtOAc в петролейном эфире), получая 4-(4-фенилтиазол-2-ил)тетрагидро-2 Н-пиран-4-карбонитрил (0,97 г, выход 85%) в виде твердого вещества желтого цвета. 1 Н ЯМР (300 МГц, CDCl3)7,91-7,94 (м, 2 Н), 7,51 (с, 1 Н), 7,37-7,48 (м, 3 Н), 4,07-4,14 (м, 2 Н), 3,873,96 (м, 2 Н), 2,32-2, 43 (м, 4 Н). МС (ESI) m/z: вычислено для C15H14N2OS: 270,08, найдено: 271,2 (М+Н)+. Стадия 3. (4-(4-Фенилтиазол-2-ил)тетрагидро-2 Н-пиран-4-ил)метанамин К суспензии LiAlH4 (220 мг, 5,9 ммоль) в сухом ТГФ (10 мл) добавляли раствор 4-(4-фенилтиазол 2-ил)тетрагидро-2 Н-пиран-4-карбонитрила (400 мг, 1,47 ммоль) в сухом ТГФ (10 мл) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и затем осторожно гасили водой и разбавляли EtOAc. Органический слой промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (нейтральная окись алюминия, элюент 5% МеОН в CHCl3), получая (4-(4-фенилтиазол-2 ил)тетрагидро-2 Н-пиран-4-ил)метанамин (150 мг, выход 37%). 1 Н ЯМР (400 МГц, CDCl3)7,89-7,91 (м, 2 Н), 7,48 (с, 1 Н), 7,33-7,46 (м, 3 Н), 3,89-3,93 (м, 2 Н), 3,633,69 (м, 2 Н), 3,03 (с, 2 Н), 2,30-2,33 (м, 2 Н), 1,90-1,97 (м, 2 Н). МС (ESI) m/z: вычислено для C15H18N2OS: 274,11, найдено: 275,2 (М+Н)+. Стадия 4. 3-(N'-Гидроксикарбамимидоил)бензойная кислота К раствору 3-цианобензойной кислоты (1 г, 6,8 ммоль) в 50 мл этанола добавляли 8-гидроксихинолин (5 мг, 0,03 ммоль). К реакционной смеси добавляли сначала гидрохлорид гидроксиламина(950 мг, 13,6 ммоль) в воде (8 мл), затем карбонат натрия (1,2 г, 10,9 ммоль) в воде (12 мл). Смесь кипя- 19022964 тили с обратным холодильником в течение 4 ч. После удаления этанола при пониженном давлении остаток разбавляли водой и подкисляли водный раствор 10%-ной HCl до рН 3. Белый осадок отфильтровывали, промывали водой и ацетоном и затем сушили при пониженном давлении, получая соединение 3(N'-гидроксикарбамимидоил)бензойной кислоты (1 г, выход 82%). 1 Н ЯМР (400 МГц, CDCl3)13,03 (ушир.с, 1 Н), 9,76 (с, 1 Н), 8,27-8,26 (м, 1 Н), 7,95-7,89 (м, 2 Н), 7,53 Раствор соединения 3-(N'-гидроксикарбамимидоил)бензойной кислоты (1 г, 5,6 ммоль) в безводном пиридине (15 мл) охлаждали до 0 С и добавляли по каплям ангидрид трифторуксусной кислоты (2,3 мл, 16,7 ммоль). Реакционную смесь медленно нагревали до комнатной температуры и затем нагревали до 50 С в течение 3 ч. Реакционную смесь выливали в ледяную воду и доводили до рН 4 добавлением 1,5 N HCl. Продукт экстрагировали EtOAc и растворитель удаляли при пониженном давлении. Сырой продукт очищали колоночной хроматографией (силикагель 60-120 меш, элюент 10% EtOAc в петролейном эфире), получая 3-(5(трифторметил)-1,2,4-оксадиазол-3-ил)бензойную кислоту (400 мг, выход 28%). 1 Н ЯМР (400 МГц, CDCl3)13,44 (ушир.с, 1 Н), 8,56 (с, 1 Н), 8,30 (д, J=7,9 Гц, 1 Н), 8,21 (д, J=1,9 Гц, 1 Н),7,78 (т, J=1,8 Гц, 1 Н).CH2Cl2 (2 мл) перемешивали при комнатной температуре в течение 8 ч. Затем реакционную смесь разбавляли метиленхлоридом (10 мл), промывали водой (5 мл), сушили над MgSO4 и концентрировали при пониженном давлении. Остаток очищали ISCO (силикагель, элюент 2% метанола в CH2Cl2), получая N-4-(4-фенилтиазол 2-ил)тетрагидро-2 Н-пиран-4-ил)метил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензамид в виде твердого продукта белого цвета (59 мг, выход 62%). 1 Н ЯМР (CDCl3, 500 МГц): 8,49 (с, 1 Н), 8,22 (д, J=7,5 Гц, 1 Н), 7,98 (д, J=8,5 Гц, 1 Н), 7,88 (д, J=8 Гц, 2 Н),7,56-7,53 (м, 2 Н), 7,52 (с, 1 Н), 7,369-7,31 (м, 3 Н), 3,97-3,93 (м, 2 Н), 3,91 (д, J=5,5 Гц, 2 Н), 3,77-3,74 (м, 2 Н),2,36-2,28 (м, 2 Н), 2,06-2,04 (м, 2 Н).MC (ESI) m/z: вычислено для C25H21F3N4O3S: 514,13, найдено: 515,1 (М+Н)+. Примеры 2-6 получали из 3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензойной кислоты и легкодоступных аминов аналогичным образом как часть скрининговой коллекции и охарактеризовывали посредством ЖХМС и 1 Н ЯМР. К перемешиваемому раствору 3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензойной кислоты (0,5 г,1,9 ммоль) в сухом ТГФ (10 мл) добавляли при 0 С комплекс борана с диметилсульфидом (0,3 мл, 2,9 ммоль). Реакционную смесь медленно нагревали до комнатной температуры и дополнительно нагревали при 50 С в течение 4 ч. Затем реакционную смесь осторожно гасили сухим МеОН и концентрировали при пониженном давлении. Сырой продукт очищали колоночной хроматографией (силикагель 60-120 меш, элюент 10-15% EtOAc в петролейном эфире), получая соединение чистого спирта (3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)фенил)метанол (190 мг, выход 41%). 1 Н ЯМР (400 МГц, CDCl3)8,14 (м, 1 Н), 8,06 (д, J=7,5 Гц, 1 Н), 7,61-7,51 (м, 2 Н), 4,81 (с, 2 Н). Раствор соединения (3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)фенил)метанола (150 мг, 0,6 ммоль) в сухом CH2Cl2 (10 мл) продували аргоном в течение 10 мин и добавляли к данному раствору перйодинан Десс-Мартина (0,39 г, 0,9 ммоль) при 0 С. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 5 ч. Затем реакционную смесь осторожно гасили насыщенным раствором тиосульфата натрия и экстрагировали CH2Cl2. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении, получая (3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензальдегид (140 мг,сырой), который использовали без дополнительной очистки. 1 К раствору 3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензальдегида (140 мг, 0,6 ммоль) и (4-(4 фенилтиазол-2-ил)тетрагидро-2 Н-пиран-4-ил)метанамина (170 мг, 0,6 ммоль) в сухом дихлорэтане (20 мл) добавляли триацетоксиборгидрид натрия (200 мг, 0,9 ммоль) при 0 С в атмосфере азота и перемешивали при комнатной температуре в течение 8 ч. Реакционную смесь осторожно гасили 10% растворомNaHCO3 и экстрагировали EtOAc. Органический слой промывали насыщенным раствором соли, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали колоночной хроматографией (силикагель 60-120 меш, элюент 20-25% EtOAc в петролейном эфире), получая 1-(4-(4-фенилтиазол-2-ил)тетрагидро-2 Н-пиран-4-ил)-N-(3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензил)метанамин (65 мг, выход 22%). 1 Н ЯМР (400 МГц, CDCl3)7,98 (м, 2 Н), 7,89 (д, J=7,6 Гц, 2 Н), 7,48 (с, 1 Н), 7,46-7,27 (м, 5 Н), 3,863,81 (м, 4 Н), 3,69-3,64 (м, 2 Н), 2,91 (с, 2 Н), 2,36 (м, 2 Н), 2,03-1,97 (ддд, J=13,7, 9,7, 4 Гц, 2 Н). МС (ESI) m/z: вычислено для C25H23F3N4O2S: 500,15, найдено: 501,0 (М-Н)+. Пример 8 Метил-5-бромникотинат Раствор 5-бромникотиновой кислоты (10 г, 49,5 ммоль) в МеОН (2 00 мл) охлаждали до 0 С и добавляли по каплям конц. H2SO4 (5 мл). Реакционную смесь кипятили с обратным холодильником в течение 12 ч. По завершении реакционную смесь концентрировали при пониженном давлении, разбавляли водой и водный слой промывали EtOAc. Полученную смесь выливали в насыщенный водный растворNaHCO3 для доведения рН до 7-8, затем экстрагировали EtOAc и органический слой сушили над безводным Na2SO4. Растворитель выпаривали при пониженном давлении, получая твердый продукт метил 5- 21022964 бромникотинат в виде твердого вещества не совсем белого цвета (7 г, выход 66%). 1 Н ЯМР (400 МГц, CDCl3)9,14 (с, 1 Н), 8,86 (с, 1 Н), 8,45 (с, 1 Н), 3,98 (с, 3 Н). Метил 5-цианоникотинат(5,22 г, 58,3 ммоль). Раствор продували аргоном и нагревали при 160 С в течение 12 ч в атмосфере аргона. Реакционную смесь охлаждали до комнатной температуры и затем гасили насыщенным растворомNH4Cl. Добавляли дополнительно EtOAc и реакционную смесь перемешивали в течение 10 мин. Реакционную смесь фильтровали через слой целита, органический слой отделяли, промывали водой и насыщенным раствором соли и сушили над безводным Na2SO4. Растворитель выпаривали при пониженном давлении, получая метил 5-цианоникотинат в виде твердого вещества зеленовато-белого цвета (2,7 г,выход 60%). 1 Н ЯМР (300 МГц, ДМСО-d6)9,29-9,27 (м, 2 Н), 8,77 (с, 1 Н), 3,91 (с, 3 Н). 3-Цианоникотиновая кислота К раствору метил 5-цианоникотината (1 г, 6,17 ммоль) в смеси ТГФ-Н 2 О (7:3 об./об., 50 мл) добавляли LiOH (150 мг, 6,2 ммоль) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Затем ТГФ удаляли при пониженном давлении и реакционную смесь разбавляли водой и промывали EtOAc. Полученную реакционную смесь подкисляли 1,5 N HCl до рН 3-4. Смесь экстрагировали EtOAc и органический слой сушили над безводным Na2SO4. Растворитель выпаривали при пониженном давлении, получая 3-цианоникотиновую кислоту в виде твердого вещества не совсем белого цвета (0,7 г, выход 78%). 1 Н ЯМР (300 МГц, ДМСО-d6)13,9 (ушир.с, 1 Н), 9,27 (с, 1 Н), 9,23 (с, 2 Н), 8,71 (с, 1 Н). МС (ESI) m/z: Вычислено для C7H4N2O2: 148,03, найдено: 147,0 (М-Н)-. 5-(N'-Гидроксикарбамимидоил)никотиновая кислота Данное соединение синтезировали из 5-цианоникотиновой кислоты, как описано на стадии 4 примера 1 (330 мг, выход 54%). 1 Н ЯМР (400 МГц, ДМСО-d6)13,54 (ушир.с, 1 Н), 9,98 (с, 1 Н), 9,16 (м, 2 Н), 8,49 (с, 1 Н), 6,11 Данное соединение синтезировали из 5-(N'-гидроксикарбамимидоил)никотиновой кислоты, как описано на стадии 5 примера 1 (260 мг, выход 63%). 1 Н ЯМР (400 МГц, ДМСО-d6)13,93 (ушир.с, 1 Н), 9,43 (д, J=2,1 Гц, 1 Н), 9,31 (д, J=2,1 Гц, 1 Н), 8,77 К перемешиваемому раствору соединения 5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотиновой кислоты (100 мг, 0,4 ммоль) в сухом ДМФА (5 мл) добавляли HATU (180 мг, 0,46 ммоль), затем гидрохлоридную соль (4-(4-фенилтиазол-2-ил)тетрагидро-2 Н-пиран-4-ил)метанамина (120 мг, 0,4 ммоль) иNMM (0,12 мл, 1,1 ммоль) при 0 С. Реакционную смесь медленно нагревали до комнатной температуры и перемешивали дополнительно в течение 10 ч. Реакционную смесь разбавляли EtOAc. Органический слой промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Сырой продукт очищали колоночной хроматографией (сили- 22022964 кагель 60-120 меш, элюент 50-60% EtOAc в петролейном эфире), получая чистый продукт N-4-(4 фенилтиазол-2-ил)тетрагидро-2 Н-пиран-4-ил)метил)-5-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)никотинамида (70 мг, выход 37%). 1 Н ЯМР (400 МГц, CDCl3)9,43 (д, J=2 Гц, 1 Н), 9,21 (ушир.с, 1 Н), 8,76 (ушир.с, 1 Н), 7,87 (д, J=7 Гц, 2 Н), 7,75 (ушир.с, 1 Н), 7,53 (с, 1 Н), 7,41-7,32 (м, 3 Н), 3,99-3,95 (м, 2 Н), 3,79-3,74 (м, 2 Н), 2,35-2,32 (м,2 Н), 2,07-2,03 (м, 2 Н). МС (ESI) m/z: вычислено для C24H20F3N5O3S: 515,12, найдено: 516,0 (М+Н)+. Пример 9 5-4-Фенилтиофен-2-ил)метилен)-2-тиоксотиазолидин-4-он Раствор 4-фенилтиофен-2-карбоксальдегида (1 г, 5,3 ммоль) и роданина (700 мг, 5,3 ммоль) в 10 мл ледяной уксусной кислоты нагревали с безводным ацетатом натрия (1,22 г, 14,8 ммоль) в течение 2 ч. После этого реакционную смесь выливали в холодную воду. Осадок фильтровали, промывали водой и сушили при пониженном давлении, получая 5-4-фенилтиофен-2-ил)метилен)-2-тиоксотиазолидин-4-он(1,4 г, выход 87%). МС (ESI) m/z: вычислено для C14H9NOS3: 302,98, найдено: 302,0 (М-Н)-. Сырой продукт использовали без дополнительной очистки. 3-(4-Фенилтиофен-2-ил)-2-тиоксопропановая кислота Суспензию продукта 5-4-фенилтиофен-2-ил)метилен)-2-тиоксотиазолидин-4-она (1,4 г, 4,6 ммоль) в 12 мл 10% водного NaOH нагревали при 95 С в течение 1 ч. Раствор охлаждали до комнатной температуры и разбавляли водой. Водную фазу промывали EtOAc и подкисляли 10% HCl. Образовавшийся осадок отфильтровывали, промывали водой и сушили при пониженном давлении, получая продукт 3-(4 фенилтиофен-2-ил)-2-тиоксопропановой кислоты (0,9 г, выход 74%). МС (ESI) m/z: вычислено для C13H10O2S2: 262,01, найдено: 261,0 (М-Н)-. Сырой продукт использовали без дополнительной очистки. 2-(Гидроксиимино)-3-(4-фенилтиофен-2-ил)пропановая кислота 3-(4-Фенилтиофен-2-ил)-2-тиоксопропановую кислоту (0,9 г, 3,4 ммоль), гидрохлорид гидроксиламина (740 мг, 10,6 ммоль) и раствор этилата натрия в этаноле (полученный из 0,4 г натрия и 30 мл абсолютного этанола) кипятили с обратным холодильником в течение 1,5 ч. Растворитель удаляли при пониженном давлении и остаток разбавляли водой и подкисляли 1,5 N HCl для доведения рН до 3. Твердый продукт экстрагировали EtOAc. Органический слой сушили над безводным Na2SO4, затем в результате удаления растворителя при пониженном давлении получали 2-(гидроксиимино)-3-(4-фенилтиофен-2 ил)пропанкарбоновую кислоту (0,8 г, выход 89%) в виде твердого вещества не совсем белого цвета. 1 Н ЯМР (400 МГц, MeOD)7,59-7,57 (м, 2 Н), 7,37-7,33 (м, 3 Н), 7,24-7,23 (м, 2 Н), 3,31 (с, 2 Н). МС (ESI) m/z: вычислено для C13H11NO3S: 262,05, найдено: 262,0 (М+Н)+. 2-(4-Фенилтиофен-2-ил)ацетонитрил 2-(Гидроксиимино)-3-(4-фенилтиофен-2-ил)пропановую кислоту (0,8 г, 3,1 ммоль) нагревали в уксусном ангидриде (5 мл) в течение 1,5 ч. Реакционную смесь охлаждали до комнатной температуры и обрабатывали водой. Продукт экстрагировали EtOAc и органический слой промывали Н 2 О и насыщенным раствором соли, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (силикагель 60-120 меш, элюент 10-15% EtOAc в петролейном эфире), получая 2-(4-фенилтиофен-2-ил)ацетонитрил (0,45 мг, выход 73%) в виде твердого вещества бледно-желтого цвета. 1 Н ЯМР (400 МГц, CDCl3)7,57-7,53 (м, 2 Н), 7,43-7,39 (м, 2 Н), 7,37-7,36 (м, 2 Н), 7,34-7,30 (м, 1 Н),3,96 (с, 2 Н). Данное соединение синтезировали из 2-(4-фенилтиофен-2-ил)ацетонитрила, как описано на стадии 2 примера 1 (0,32 г, выход 68%), в виде твердого вещества желтого цвета. 1 Н ЯМР (400 МГц, CDCl3)7,59-7,57 (дд, J=8,2, 1,1 Гц, 2 Н), 7,45-7,40 (м, 4 Н), 7,35-7,31 (м, 1 Н),4,11-4,07 (м, 2 Н), 3,93-3,86 (тд, J=12, 2,4 Гц, 2 Н), 2,29-2,15 (м, 4 Н). Данное соединение синтезировали из 4-(4-фенилтиофен-2-ил)тетрагидро-2 Н-пиран-4-карбонитрила,как описано на стадии 3 примера 1 (210 мг, выход 65%), в виде твердого вещества желтого цвета. 1 Н ЯМР (400 МГц, CDCl3)7,61-7,59 (д, J=7,3 Гц, 2 Н), 7,43-7,30 (м, 4 Н), 7,19-7,18 (д, J=1 Гц, 1 Н),3,86-3,82 (м, 2 Н), 3,62-3,57 (м, 2 Н), 2,69 (ушир.с, 2 Н), 2,11-1,96 (м, 2 Н), 1,81-1,74 (м, 2 Н). МС (ESI) m/z: вычислено для C16H19NOS: 273,12, найдено: 274,2 (М+Н)+. Данное соединение синтезировали из(4-(4-фенилтиофен-2-ил)тетрагидро-2 Н-пиран-4 ил)метанамина и 3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензойной кислоты, как описано на стадии 6 примера 8 (80 мг, выход 20%). 1 Н ЯМР (400 МГц, CDCl3)8,43 (м, 1 Н), 8,25 (д, J=7,8 Гц, 1 Н), 7,96 (д, J=7,8 Гц, 1 Н), 7,62-7,58 (м,3 Н), 7,45 (д, J=1,2 Гц, 1 Н), 7,40 (т, J=7,7 Гц, 2 Н), 7,31 (м, 1 Н), 7,23 (д, J=1,5 Гц, 1 Н), 6,15 (т, J=6,5 Гц, 1 Н),3,96-3,91 (дт, J=11,9, 4,2 Гц, 2 Н), 3,74 (д, J=6,4 Гц, 2 Н), 3,71-3,66 (м, 2 Н), 2,18-2,14 (м, 2 Н), 2,08-2,03 (м,2 Н). МС (ESI) m/z: вычислено для C26H22F3N3O3S: 513,13, найдено: 514,2 (М+Н)+. Пример 10 1-(4-Фенилтиазол-2-ил)циклопентанкарбонитрил Данное соединение синтезировали из 2-(4-фенилтиазол-2-ил)ацетонитрила, как описано на стадии 2 примера 1, с использованием 1,4-дибромбутана (580 мг, выход 91%). 1 Н ЯМР (300 МГц, CDCl3)7,93-7,92 (м, 2 Н), 7,90-7,33 (м, 4 Н), 2,58-2,49 (м, 4 Н), 2,06-2,00 (м, 4 Н). МС (ESI) m/z: вычислено для C15H14N2S: 254,09, найдено: 255,2 (М+Н)+. Данное соединение синтезировали из 1-(4-фенилтиазол-2-ил)циклопентанкарбонитрила, как описано на стадии 3 примера 1 (250 мг, выход 42%). 1 Н ЯМР (400 МГц, ДМСО-d6)7,96-7,93 (м, 3 Н), 7,44-7,40 (м, 2 Н), 7,33-7,29 (м, 1 Н), 2,85 (с, 2 Н),2,06-3,01 (м, 2 Н), 1,94-1,87 (м, 2 Н), 1,73-1,66 (м, 6 Н). Данное соединение синтезировали из (1-(4-фенилтиазол-2-ил)циклопентил)метанамина и 3-(5(трифторметил)-1,2,4-оксадиазол-3-ил)бензойной кислоты, как описано на стадии 6 примера 8 (65 мг,выход 34%). 1 Н ЯМР (400 МГц, ДМСО-d6)8,78 (м, 1 Н), 8,44 (с, 1 Н), 8,19 (д, J=7,6 Гц, 1 Н), 8,06 (д, J=7,9 Гц,1 Н), 7,98 (с, 1 Н), 7,93 (д, J=7,3 Гц, 2 Н), 7,71 (т, J=7,9 Гц, 1 Н), 7,39 (м, 2 Н), 7,30 (м, 1 Н), 3,69 (д, J=6,2 Гц,2 Н), 2,19 (м, 2 Н), 2,07 (м, 2 Н), 1,76 (м, 2 Н), 1,64 (м, 2 Н). МС (ESI) m/z: вычислено для C25H21F3N4O2S: 498,13, найдено: 499,2 (М+Н)+. Пример 11 4-(3-Фенил-1 Н-1,2,4-триазол-5-ил)тетрагидро-2 Н-пиран-4-карбонитрил Данное соединение синтезировали из (5-фенил-2 Н-[1,2,4]триазол-3-ил)ацетонитрила, как описано на стадии 2 примера 1 (0,22 г, выход 16%). 1 Н ЯМР (300 МГц, CDCl3)7,96-7,92 (дд, J=6,6, 3,1 Гц, 2 Н), 7,54-7,49 (м, 3 Н), 4,09-4,03 (дт, J=12,1,3,7 Гц, 2 Н), 3,95-3,87 (м, 2 Н), 2,44-2,38 (м, 2 Н), 2,29-2,25 (м, 2 Н). МС (ESI) m/z: вычислено для C14H14N4O: 254,12, найдено: 255,2 (М+Н)+. 4-(3-Фенил-1 Н-1,2,4-триазол-5-ил)театрагидро-2 Н-пиран-4-ил)метанамин Данное соединение синтезировали из 4-(3-фенил-1 Н-1,2,4-триазол-5-ил)тетрагидро-2 Н-пиран-4 карбонитрила, как описано на стадии 3 примера 1 (170 мг, сырой). 1 Н ЯМР (300 МГц, ДМСО-d6)8,05-8,02 (дд, J=8,0, 1,4 Гц, 2 Н), 7,51-7,40 (м, 3 Н), 3,76-3,72 (м, 2 Н),3,42-3,38 (м, 2 Н), 2,97 (ушир.с, 2 Н), 2,23-2,18 (д, J=11,8 Гц, 2 Н), 1,76-1,68 (м, 2 Н). МС (ESI) m/z: вычислено для C14H18N4O: 258,15, найдено: 259,2 (М+Н)+. Данное соединение синтезировали из (4-(3-фенил-1 Н-1,2,4-триазол-5-ил)тетрагидро-2 Н-пиран-4 ил)метанамина и 3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензойной кислоты, как описано на стадии 6 примера 8 (80 мг, выход 24%). 1 Данное соединение синтезировали из (2-фенилтиазол-4-ил)ацетонитрила, как описано на стадии 2 примера 1 (0,53 г, выход 7 9%), в виде твердого вещества желтого цвета. 1 Н ЯМР (300 МГц, CDCl3)7,98-7,94 (дд, J=6,5, 3,2 Гц, 2 Н), 7,47-7,43 (м, 3 Н), 7,33 (с, 1 Н), 4,12-4,08 Данное соединение синтезировали из 4-(2-фенилтиазол-4-ил)тетрагидро-2 Н-пиран-4-карбонитрила,как описано на стадии 3 примера 1 (380 мг, выход 72%). 1 Н ЯМР (400 МГц, CDCl3)7,96-7,94 (дд, J=7,5, 2,0 Гц, 2 Н), 7,47-7,41 (м, 3 Н), 6,99 (с, 1 Н), 3,89-3,84 Данное соединение синтезировали из (4-(2-фенилтиазол-4-ил)тетрагидро-2 Н-пиран-4-ил)метанамина и 3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензойной кислоты, как описано на стадии 6 примера 8 (85 мг, выход 4 5%). 1 Н ЯМР (400 МГц, ДМСО-d6)8,56 (т, J=6,2 Гц, 1 Н), 8,41 (м, 1 Н), 8,18 (д, J=7,8 Гц, 1 Н), 8,05 (д,J=7,6 Гц, 1 Н), 7,91-7,89 (м, 2 Н), 7,69-7,65 (т, J=7,8 Гц, 1 Н), 7,53 (с, 1 Н), 7,46-7,43 (дд, J=4,8, 1,9 Гц, 3 Н),3,79-3,76 (м, 2 Н), 3,54-3,52 (д, J=6,2 Гц, 2 Н), 3,37 (м, 2 Н), 2,26-2,22 (д, J=13,8 Гц, 2 Н), 1,89-1,84 (м, 2 Н). МС (ESI) m/z: вычислено для C24H21F3N4O3S: 514,13, найдено: 515,0 (М+Н)+. Пример 13 2-(4-(4-Метоксифенил)тиазол-2-ил)ацетонитрил Данное соединение синтезировали из 2-бром-(1-(4-метоксифенил)этанона и 2-цианотиоацетамида,как описано на стадии 1 примера 1 (1,5 г, выход 75%). 1 Н ЯМР (300 МГц, CDCl3)7,83 (д, J=8,9 Гц, 2 Н), 7,35 (с, 1 Н), 6,98 (д, J=8,9 Гц, 2 Н), 4,17 (с, 2 Н),3,86 (с, 3 Н). МС (ESI) m/z: вычислено для C12H10N2OS: 230,05, найдено: 231,2 (М+Н)+. 4-(4-(4-Метоксифенил)тиазол-2-ил)тетрагидро-2 Н-пиран-4-карбонитрил Данное соединение синтезировали из 2-(4-(4-метоксифенил)тиазол-2-ил)ацетонитрила, как описано Данное соединение синтезировали из 4-(4-(4-метоксифенил)тиазол-2-ил)тетрагидро-2 Н-пиран-4 карбонитрила, как описано на стадии 3 примера 1 (200 мг, выход 40%). 1 Н ЯМР (300 МГц, CDCl3)7,86 (д, J=8,8 Гц, 2 Н), 7,33 (с, 1 Н), 6,97 (д, J=8,8 Гц, 2 Н), 3,93-3,88 (м,5 Н), 3,68-3,59 (м, 2 Н), 2,97 (с, 2 Н), 2,33 (м, 2 Н), 1,94-1,86 (м, 2 Н). МС (ESI) m/z: вычислено для C16H20N2O2S: 304,12, найдено: 305,2 (М+Н)+. Данное соединение синтезировали из (4-(4-(4-метоксифенил)тиазол-2-ил)тетрагидро-2 Н-пиран-4 ил)метанамина и 3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензойной кислоты, как описано на стадии 6 примера 8 (80 мг, выход 38%). 1 Н ЯМР (400 МГц, ДМСО-d6)8,78 (т, J=6,3 Гц, 1 Н), 8,43 (с, 1 Н), 8,20 (д, J=7,9 Гц, 1 Н), 8,07 (д,J=7,9 Гц, 1 Н), 7,91 (с, 1 Н), 7,86 (д, J=8,9 Гц, 2 Н), 7,71 (т, J=7,8 Гц, 1 Н), 6,95 (д, J=8,5 Гц, 2 Н), 3,86 (м, 2 Н),3,77 (с, 3 Н), 3,58 (д, J=6,4 Гц, 2 Н), 3,43 (т, J=10,5 Гц, 2 Н), 3,33 (с, 2 Н), 2,25 (д, J=14 Гц, 2 Н), 2,02 (м, 2 Н). МС (ESI) m/z: вычислено для C26H23F3N4O4S: 544,14, найдено: 545,0 (М+Н)+. Пример 14 2-(4-(4-Хлорфенил)тиазол-2-ил)ацетонитрил Данное соединение синтезировали из 2-бром-(1-(4-хлорфенил)этанона и 2-цианотиоацетамида, как описано на стадии 1 примера 1 (1,51 г, выход 75%). 1 Н ЯМР (300 МГц, CDCl3)7,84 (д, J=8,8 Гц, 2 Н), 7,49 (с, 1 Н), 7,43 (д, J=8,8 Гц, 2 Н), 4,18 (с, 2 Н). МС (ESI) m/z: вычислено для C11H7ClN2S: 234,00, найдено: 235,0 (М+Н)+. 4-(4-(4-Хлорфенил)тиазол-2-ил)тетрагидро-2 Н-пиран-4-карбонитрил Данное соединение синтезировали из 2-(4-(4-хлорфенил)тиазол-2-ил)ацетонитрила, как описано на стадии 2 примера 1 (1,15 г, выход 86%). 1 Н ЯМР (300 МГц, CDCl3)7,88 (д, J=8,6 Гц, 2 Н), 7,50 (с, 1 Н), 7,43 (д, J=8,6 Гц, 2 Н), 4,14-4,07 (дт,J=12,3, 3,4 Гц, 2 Н), 3,95-3,86 (м, 2 Н), 2,45-2,30 (м, 4 Н). МС (ESI) m/z: вычислено для C15H13ClN2OS: 304,04, найдено: 305,0 (М+Н)+. Данное соединение синтезировали из 4-(4-(4-хлорфенил)тиазол-2-ил)тетрагидро-2 Н-пиран-4-карбо- 27022964 нитрила, как описано на стадии 3 примера 1 (250 мг, выход 50%). 1 Данное соединение синтезировали из (4-(4-(4-хлорфенил)тиазол-2-ил)тетрагидро-2 Н-пиран-4 ил)метанамина и 3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензойной кислоты, как описано на стадии 6 примера 8 (75 мг, выход 42%). 1 Н ЯМР (400 МГц, CDCl3)8,47 (с, 1 Н), 8,26 (д, J=7,8 Гц, 1 Н), 7,99 (д, J=9 Гц, 1 Н), 7,83 (м, 2 Н), 7,59 Данное соединение синтезировали из 2-(4-фенилтиазол-2-ил)ацетонитрила, как описано на стадии 2 примера 1, при использовании йодметана (250 мг, сырой). 1 Данное соединение синтезировали из 2-метил-2-(4-фенилтиазол-2-ил)пропаннитрила, как описано на стадии 3 примера 1 (100 мг, выход 45%). 1 Н ЯМР (400 МГц, ДМСО-d6)7,95-7,93 (м, 3 Н), 7,44-7,40 (т, J=7,3 Гц, 2 Н), 7,33-7,31 (м, 1 Н), 2,81 Данное соединение синтезировали из 2-метил-2-(4-фенилтиазол-2-ил)пропан-1-амина и 3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензойной кислоты, как описано на стадии 6 примера 8 (75 мг, выход 38%). 1 Н ЯМР (400 МГц, MeOD)8,52 (т, J=1,8 Гц, 1 Н), 8,27 (д, J=7,8 Гц, 1 Н), 8,03 (д, J=8,0 Гц, 1 Н), 7,927,90 (м, 2 Н), 7,69 (с, 1 Н), 7,67-7,63 (т, J=7,8 Гц, 1 Н), 7,36-7,29 (м, 2 Н), 7,28-7,26 (м, 1 Н), 3,79 (д, J=6,3 Гц,2 Н), 1,58 (с, 6 Н). МС (ESI) m/z: вычислено для C23H19F3N4O2S: 472,12, найдено: 473,0 (М+Н)+. Пример 16 1-Метил-4-(4-фенилтиазол-2-ил)пиперидин-4-карбонитрил Данное соединение синтезировали из 2-(4-фенилтиазол-2-ил)ацетонитрила, как описано на стадии 2 примера 1, при использовании гидрохлорида 2-хлор-N-(2-хлорэтил)-N-метилэтанамина и нагревании реакционной смеси при 60 С в течение ночи (200 мг, выход 40%). МС (ESI) m/z: вычислено для C16H17N3S: 283,11, найдено: 284,1 (М+Н)+. Стадия 1b. Альтернативный синтез 1-метил-4-(4-фенилтиазол-2-ил)пиперидин-4-карбонитрила Амид натрия (878 мг, 22,4 ммоль) суспендировали в толуоле (15 мл) и охлаждали до 0 С. К данной суспензии добавляли по каплям раствор (4-фенилтиазол-2-ил)ацетонитрила (1,5 г, 7,4 ммоль) в толуоле(10 мл), поддерживая температуру при 0 С. Реакционную смесь перемешивали в течение 20 мин. Отдельно, гидрохлорид бис-(2-хлорэтил)метиламина (1,45 г, 7,4 ммоль) растворяли в воде (8 мл), охлаждали до 0 С и подщелачивали водным раствором аммиака (доводили рН раствора до 8). Маслянистый слой отделяли от водного слоя и органический продукт экстрагировали толуолом. Слой толуола сушили над гранулами гидроксида натрия. Сухой толуольный раствор бис-(2-хлорэтил)метиламина добавляли к реакционной смеси при 0 С. Реакционную смесь оставляли нагреваться до комнатной температуры и дополнительно нагревали при 110 С в течение 3 ч. После этого реакционную смесь охлаждали до комнатной температуры, разбавляли EtOAc и экстрагировали EtOAc. Объединенные экстракты промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Сырой продукт очищали колоночной хроматографией (силикагель 60-120 меш,элюент 5% МеОН в CH2Cl2), получая 1-метил-4-(4-фенилтиазол-2-ил)пиперидин-4-карбонитрил (350 мг,выход 17%). 1 Н ЯМР (400 МГц, ДМСО-d6)8,22 (с, 1 Н), 7,99-7,97 (м, 2 Н), 7,49-7,44 (м, 2 Н), 7,40-7,36 (м, 1 Н),2,92-2,90 (м, 2 Н), 2,40-2,37 (м, 2 Н), 2,31-2,16 (м, 7 Н). МС (ESI) m/z: вычислено для C16H17N3S: 283,11, найдено: 284,2 (М+Н)+. Данное соединение синтезировали из 1-метил-4-(4-фенилтиазол-2-ил)пиперидин-4-карбонитрила,как описано на стадии 3 примера 1 (200 мг, сырое). МС (ESI) m/z: вычислено для C16H21N3S: 287,15, найдено: 288,1 (М+Н)+. Данное соединение синтезировали из (1-метил-4-(4-фенилтиазол-2-ил)пиперидин-4-ил)метанамина и 3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)бензойной кислоты, как описано на стадии 6 примера 8 (9 мг, выход 23%). 1 Н ЯМР (300 МГц, CDCl3)8,51 (с, 1 Н), 8,21 (д, J=7,5 Гц, 1 Н), 7,98 (д, J=7,5 Гц, 1 Н), 7,86 (д, J=6,3 Гц, 1 Н), 7,78 (м, 1 Н), 7,54 (т, J=6,2 Гц, 2 Н), 7,48 (с, 1 Н), 7,34-7,25 (м, 2 Н), 3,86 (с, 2 Н), 2,69 (м, 2 Н), 2,57 Данное соединение синтезировали из 2-бром-1-(4-фторфенил)этанона и 2-цианотиоацетамида, как описано на стадии 1 примера 1 (3,2 г, выход 72%).
МПК / Метки
МПК: A61K 31/497
Метки: ферменты, композиция, содержащая, гистондеацетилазы, соединения, данные, ингибирующие, фармацевтическая
Код ссылки
<a href="https://eas.patents.su/30-22964-soedineniya-ingibiruyushhie-fermenty-gistondeacetilazy-i-farmacevticheskaya-kompoziciya-soderzhashhaya-dannye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, ингибирующие ферменты гистондеацетилазы, и фармацевтическая композиция, содержащая данные соединения</a>
Предыдущий патент: Устройство для выдачи напитков с устройством для охлаждения воды и устройством для добавления концентрата
Следующий патент: Способ нагревания листов стекла с покрытием в печи
Случайный патент: Турбина для преобразования энергии потока текучей среды в электроэнергию