Комбинация
Формула / Реферат
1. Комбинация, содержащая:
(i) соединение (N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид) структуры (I)
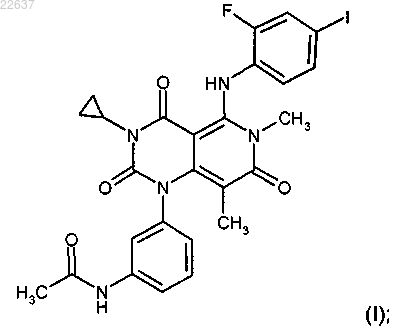
или его фармацевтически приемлемую(ый) соль или сольват; и
(ii) эверолимус или рапамицин в качестве ингибитора mTOR.
2. Комбинация по п.1, где соединение структуры (I) находится в форме диметилсульфоксидного сольвата.
3. Комбинированный набор, содержащий эверолимус или рапамицин в сочетании с фармацевтически приемлемым носителем и соединение структуры (I) или его фармацевтически приемлемую соль или сольват в сочетании с фармацевтически приемлемым носителем, где компоненты представлены в форме, которая пригодна для последовательного, раздельного и/или одновременного введения, где набор снабжен инструкциями по дозировкам и введению.
4. Применение комбинации по п.1 или 2 при изготовлении лекарственного средства или лекарственных средств для лечения ракового заболевания.
5. Применение по п.4, где раковое заболевание имеет дикий тип либо мутантную форму Ras/Raf и дикий тип либо мутантную форму PI3K/PTEN.
6. Применение по п.4, где раковое заболевание выбирают из глиом головного мозга, глиобластом, астроцитом, мультиформной глиобластомы, синдрома Банаяна-Зонана, болезни Коудена, болезни Лермитт-Дуклос, рака молочных желез, отечно-инфильтративного рака молочных желез, опухоли Вильмса, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, рака толстой кишки, рака головы и шеи, рака почек, рака легкого, рака печени, меланомы, саркомы яичников, рака поджелудочной железы, рака предстательной железы, остеосаркомы, гигантоклеточной опухоли кости, рака щитовидной железы, лимфобластной Т-клеточной лейкемии, хронической гранулоцитной лейкемии, хронического лимфоцитарного лейкоза, волосатоклеточного лейкоза, острой лимфобластной лейкемии, острой гранулоцитарной лейкемии, хронической нейтрофильной лейкемии, острой лимфобластной Т-клеточной лейкемии, плазмоцитомы, иммунобластной крупноклеточной лейкемии, лейкемии клеток мантийной ткани, мегакариобластного лейкоза, сопутствующего миеломной болезни, множественной миеломы, острого мегакариобластного лейкоза, промиелоцитарного лейкоза, эритролейкемии, злокачественной лимфомы, ходжкинской лимфомы, неходжкинской лимфомы, лимфобластной Т-клеточной лимфомы, лимфомы Беркитта, фолликулярной лимфомы, нейробластомы, рака мочевого пузыря, рака уротелия, рака легких, рака вульвы, рака шейки матки, рака эндометрия, рака почек, мезотелиомы, рака пищевода, рака слюнных желез, гепатоцеллюлярного рака, рака желудка, рака носоглотки, рака щеки, рака ротовой полости, желудочно-кишечной стромальной опухоли (GIST) и рака яичек.
7. Применение комбинированного набора по п.3 при изготовлении лекарственного средства или лекарственных средств для лечения ракового заболевания.
8. Применение по п.7, где раковое заболевание имеет дикий тип либо мутантную форму Ras/Raf и дикий тип либо мутантную форму PI3K/PTEN.
9. Применение по п.7, где раковое заболевание выбирают из глиом головного мозга, глиобластом, астроцитом, мультиформной глиобластомы, синдрома Банаяна-Зонана, болезни Коудена, болезни Лермитт-Дуклос, рака молочных желез, отечно-инфильтративного рака молочных желез, опухоли Вильмса, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, рака толстой кишки, рака головы и шеи, рака почек, рака легкого, рака печени, меланомы, саркомы яичников, рака поджелудочной железы, рака предстательной железы, остеосаркомы, гигантоклеточной опухоли кости, рака щитовидной железы, лимфобластной Т-клеточной лейкемии, хронической гранулоцитной лейкемии, хронического лимфоцитарного лейкоза, волосатоклеточного лейкоза, острой лимфобластной лейкемии, острой гранулоцитарной лейкемии, хронической нейтрофильной лейкемии, острой лимфобластной Т-клеточной лейкемии, плазмоцитомы, иммунобластной крупноклеточной лейкемии, лейкемии клеток мантийной ткани, мегакариобластного лейкоза, сопутствующего миеломной болезни, множественной миеломы, острого мегакариобластного лейкоза, промиелоцитарного лейкоза, эритролейкемии, злокачественной лимфомы, ходжкинской лимфомы, неходжкинской лимфомы, лимфобластной Т-клеточной лимфомы, лимфомы Беркитта, фолликулярной лимфомы, нейробластомы, рака мочевого пузыря, рака уротелия, рака легких, рака вульвы, рака шейки матки, рака эндометрия, рака почек, мезотелиомы, рака пищевода, рака слюнных желез, гепатоцеллюлярного рака, рака желудка, рака носоглотки, рака щеки, рака ротовой полости, желудочно-кишечной стромальной опухоли (GIST) и рака яичек.
10. Применение комбинации по п.1 или 2 в лечении ракового заболевания.
11. Применение комбинированного набора по п.3 в лечении ракового заболевания.
12. Способ лечения ракового заболевания у человека, нуждающегося в таком лечении, который включает введение терапевтически эффективного количества комбинации N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид диметилсульфоксида и эверолимуса такому человеку.
13. Способ по п.12, где количество N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид диметилсульфоксида выбирают приблизительно из 0,25-9 мг и это количество вводят один раз в день и количество эверолимуса выбирают приблизительно из 3-15 мг и это количество вводят один раз в день.
14. Способ по п.13, где N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид диметилсульфоксид и эверолимус вводят один за другим с промежутком в 12 ч в течение от 1 до 3 последовательных дней с последующим введением N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид диметилсульфоксида в течение 3-7 последующих дней, необязательно с последующим(ими) одним или более циклами повторного введения доз.
15. Способ по п.12, где N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид диметилсульфоксид и эверолимус вводят один за другим с промежутком в 12 ч в течение от 1 до 3 последовательных дней с последующим введением эверолимуса в течение 4-6 последовательных дней, необязательно с последующим(ими) одним или более циклами повторного введения доз.
16. Способ по п.12, где N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид диметилсульфоксид и эверолимус вводят один за другим с промежутком в 12 ч в течение 2 дней из 7-дневного периода и в течение остальных дней из 7-дневного периода вводят либо N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид диметилсульфоксид, либо эверолимус, необязательно с последующим(ими) одним или более циклами повторного введения доз.
17. Способ по п.12, где N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид диметилсульфоксид и эверолимус вводят один за другим с промежутком в 12 ч в течение по меньшей мере 5 последовательных дней.
18. Способ по п.12, где N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид диметилсульфоксид и эверолимус вводят один за другим с промежутком в 12 ч в течение 5 дней из 14-дневного периода и в течение остальных дней 14-дневного периода вводят либо N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид диметилсульфоксид, необязательно с последующим(ими) одним или более циклами повторного введения доз, либо эверолимус, необязательно с последующим(ими) одним или более циклами повторного введения доз.
19. Способ по любому из пп.12-18, где раковое заболевание имеет дикий тип либо мутантную форму Ras/Raf и дикий тип либо мутантную форму PI3K/PTEN.
20. Способ по любому из пп.12-18, где раковое заболевание выбирают из глиом головного мозга, глиобластом, астроцитом, мультиформной глиобластомы, синдрома Банаяна-Зонана, болезни Коудена, болезни Лермитт-Дуклос, рака молочных желез, отечно-инфильтративного рака молочных желез, опухоли Вильмса, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, рака толстой кишки, рака головы и шеи, рака почек, рака легкого, рака печени, меланомы, саркомы яичников, рака поджелудочной железы, рака предстательной железы, остеосаркомы, гигантоклеточной опухоли кости, рака щитовидной железы, лимфобластной Т-клеточной лейкемии, хронической гранулоцитной лейкемии, хронического лимфоцитарного лейкоза, волосатоклеточного лейкоза, острой лимфобластной лейкемии, острой гранулоцитарной лейкемии, хронической нейтрофильной лейкемии, острой лимфобластной Т-клеточной лейкемии, плазмоцитомы, иммунобластной крупноклеточной лейкемии, лейкемии клеток мантийной ткани, мегакариобластного лейкоза, сопутствующего миеломной болезни, множественной миеломы, острого мегакариобластного лейкоза, промиелоцитарного лейкоза, эритролейкемии, злокачественной лимфомы, ходжкинской лимфомы, неходжкинской лимфомы, лимфобластной Т-клеточной лимфомы, лимфомы Беркитта, фолликулярной лимфомы, нейробластомы, рака мочевого пузыря, рака уротелия, рака легких, рака вульвы, рака шейки матки, рака эндометрия, рака почек, мезотелиомы, рака пищевода, рака слюнных желез, гепатоцеллюлярного рака, рака желудка, рака носоглотки, рака щеки, рака ротовой полости, желудочно-кишечной стромальной опухоли (GIST) и рака яичек.
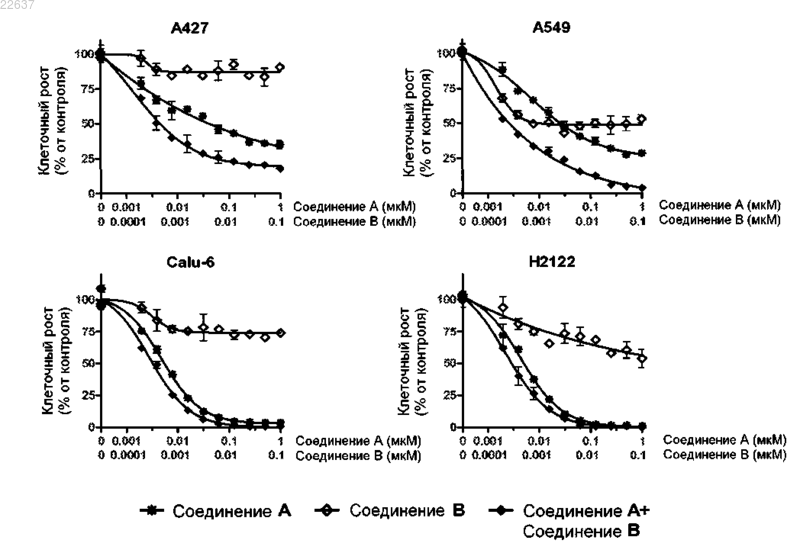
Текст
Настоящее изобретение относится к комбинации, содержащей ингибитор MEK N-3-[3 циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Нпиридо[4,3-d]пиримидин-1-ил]фенилацетамид, или его фармацевтически приемлемую соль, или фармацевтически приемлемый сольват, с эверолимусом или рапамицином в качестве ингибитораmTOR, комбинированному набору, содержащему компоненты указанной комбинации в сочетании с фармацевтически приемлемым носителем, применению таких комбинаций и наборов в лечении раковых заболеваний и к способу лечения раковых заболеваний введением указанной комбинации. Область техники, к которой относится изобретение Настоящее изобретение относится к способу лечения ракового заболевания у млекопитающего и к комбинациям, полезным в таком лечении. В частности, способ относится к новой комбинации, содержащей ингибитор MEK N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо 3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамид, или его фармацевтически приемлемую соль, или сольват с ингибитором mTOR, к фармацевтическим композициям, содержащим то же самое, и к способам применения таких комбинаций в лечении ракового заболевания. Предпосылки создания изобретения Эффективное лечение гиперпролиферативных нарушений, включая раковое заболевание, является постоянной целью в области онкологии. Как правило, раковое заболевание является результатом дерегуляции нормальных процессов, которые контролируют деление клетки, дифференциацию и апоптотическую гибель клетки. Апоптоз (запрограммированная гибель клетки) играет важнейшую роль в эмбриональном развитии и в патогенезе различных заболеваний, таких как дегенеративные нейрональные заболевания, сердечно-сосудистые заболевания и раковые заболевания. Один из наиболее широко изученных путей, который включает в себя киназную регуляцию апоптоза, представляет собой клеточную сигнализацию от рецепторов фактора роста на поверхности клетки к ядрам (Crews and Erikson, Cell, 74:215-17,1993). Киназа митоген-активируемая протеин (MAP)-киназа/регулируемая внеклеточными сигналами киназа (ERK) (в дальнейшем в этом документе называемая MEK), как известно, вовлечена в регуляцию клеточной пролиферации в качестве киназы, которая опосредует Raf-MEK-ERK-путь сигнальной трансдукции, и семейство Raf (B-Raf, C-Raf) активирует семейство MEK (MEK-1, MEK-2 и так далее), а семейство MEK активирует семейство ERK (ERK-1 и ERK-2). Активацию Raf-MEK-ERK-пути сигнальной трансдукции часто фиксировали в раковом заболевании, в особенности, при наличии колоректального ракового заболевания, панкреатического ракового заболевания, рака легких, рака молочной железы и тому подобного. Кроме того, поскольку сигналы, вырабатываемые сигнальными молекулами, такими как фактор роста, цитокин и тому подобное, приводят к активации MEK-ERK, ингибиторы этих функций, как полагают, более эффективно подавляют сигнальную трансдукцию Raf-MEK-ERK по сравнению с подавлением функции вышележащих киназ, таких как RTK, Ras и Raf. Более того, также известно, что соединение, обладающее ингибирующей активностью в отношенииMEK, эффективно индуцирует ингибирование активности ERK1/2 и подавление клеточной пролиферации (The Journal of Biological Chemistry, vol. 276, No. 4, pp. 2686-2692, 2001), и это соединение, как ожидают, показывает действие на заболевания, вызванные нежелательной клеточной пролиферацией, такие как онкогенез и/или раковое заболевание. Мишень рапамицина в клетках млекопитающих (mTOR), также называемая FK506-связывающий белок 12-рапамицин-ассоциированный белок q (FRAP1), представляет собой белок, который у людей кодируется геном FRAP1. mTOR представляет собой серинтреониновую протеинкиназу, которая регулирует клеточный рост, клеточную пролиферацию, подвижность клеток, выживание клеток, синтез белка и транскрипцию. Текущее исследование показывает, что mTOR интегрирует вхождение из разнообразных вышележащих путей, включающих инсулин, факторы роста (такие как IGF-1 и IGF-2) и митогены. mTOR также действует в качестве сенсора уровней питательных веществ и энергии в клетке и окислительновосстановительного состояния. Разрегулирование пути mTOR заключает в себе фактор, способствующий различным процессам, вызывающим у людей заболевания, особенно различные виды раковых заболеваний. Рапамицин представляет собой бактериальный природный препарат, который может ингибироватьmTOR с помощью ассоциации с его внутриклеточным рецептором FKBP12. Комплекс FKBP12-рапамицин связывается непосредственно с FKBP12-рапамицин-связывающим (FRB) доменом mTOR. Было показано, что mTOR действует как каталитическая субъединица двух различающихся молекулярных комплексов в клетках, mTORC1 и mTORC2. Ингибиторы mTOR уже применяются в лечении отторжения трансплантата. Также их начинают применять в лечении рака. Ингибиторы mTOR также могут быть полезными в лечении нескольких возрастных болезней. Было бы полезно предоставить новую терапию, которая обеспечит более эффективное и/или улучшенное лечение индивидуума, страдающего от воздействий ракового заболевания. Краткое изложение сущности изобретения Авторы настоящего изобретения обнаружили комбинации химиотерапевтических средств, которые обеспечивают повышенную активность по сравнению с монотерапией. В частности, комбинации лекарственных средств, которые включают ингибитор MEK N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамид,или его фармацевтически приемлемую(ый) соль, или сольват, соединение структуры (I) в комбинации с ингибитором mTOR. В первом аспекте настоящего изобретения обеспечивают комбинацию, содержащую: или его фармацевтически приемлемую(ый) соль, или сольват, подходяще диметилсульфоксидный сольват (в дальнейшем в этом документе диметилсульфоксидный сольват соединения структуры (I) также называют соединением А, а свободную или несольватированную форму соединения структуры (I) также называют соединением С);(ii) и ингибитор mTOR. Во втором аспекте настоящего изобретения обеспечивают комбинацию, содержащую: или его фармацевтически приемлемую(ый) соль, или сольват, подходяще диметилсульфоксидный сольват;(ii) и ингибитор mTOR, для применения в терапии. В третьем аспекте настоящего изобретения обеспечивают комбинацию, содержащую: или его фармацевтически приемлемую(ый) соль, или сольват, подходяще диметилсульфоксидный сольват;(ii) и ингибитор mTOR, для применения в лечении ракового заболевания. В четвертом аспекте настоящего изобретения обеспечивают фармацевтическую композицию, содержащую: или его фармацевтически приемлемую(ый) соль, или сольват, подходяще диметилсульфоксидный сольват;(ii) и ингибитор mTOR вместе с фармацевтически приемлемым разбавителем или носителем. В пятом аспекте настоящего изобретения обеспечивают применение комбинации, содержащей: или его фармацевтически приемлемую(ый) соль, или сольват, подходяще диметилсульфоксидный сольват;(ii) и ингибитор mTOR, при изготовлении лекарственного средства для лечения ракового заболевания. В шестом аспекте настоящего изобретения обеспечивают способ лечения ракового заболевания у млекопитающего, включающий введение упомянутому млекопитающему:(i) терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, или сольвата, подходяще диметилсульфоксидного сольвата;(ii) и ингибитора mTOR. В дополнительном аспекте этого изобретения обеспечивают способ лечения ракового заболевания у млекопитающего, нуждающегося в таком лечении, который включает введение терапевтически эффективного количества комбинации изобретения, где соединения комбинации вводят в определенный промежуток времени и в течение некоторого периода времени. В дополнительном аспекте этого изобретения предоставляют способ лечения ракового заболевания у млекопитающего, нуждающегося в таком лечении, который включает введение терапевтически эффективного количества комбинации изобретения, где соединения комбинации вводят последовательно. Краткое описание чертежей Фиг. 1 отражает кривые зависимости доза-эффект в отношении ингибирования клеточного роста для клеточных линий А 427, А 549, Calu6 и Н 2122. Фиг. 2 отражает кривые активности каспаз 3/7 для клеточных линий А 427, А 549, Calu6 и Н 2122. Фиг. 3 отражает IC50 (концентрации 50%-ного ингибирования) клеточного роста (gIC50) для ингибиторов MEK и mTOR как таковых и в комбинации в отношении клеточных линий рака. Фиг. 4 отражает логарифмическое значение комбинационного индекса ингибиторов MEK и mTOR в отношении клеточных линий рака. Фиг. 5 отражает эффект действия ингибитора MEK, ингибитора mTOR и их комбинации на рост раковой клеточной линии легких А 549. Фиг. 6 отражает клеточную реакцию на ингибитор MEK, ингибитор mTOR и их комбинацию при рассмотрении раковых клеточных линий. Подробное описание изобретения Настоящее изобретение относится к комбинациям, которые проявляют антипролиферативную активность. Подходящим образом, способ относится к способам лечения ракового заболевания посредством совместного введения ингибитора mTOR иN-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро 2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамида, или его фармацевтически приемлемой(ого) соли,или сольвата, подходяще диметилсульфоксидного сольвата,где соединение представлено структурой I Соединение С раскрывается и заявляют наряду с его фармацевтически приемлемыми солями и сольватами как являющееся полезным в качестве ингибитора активности MEK, в частности в лечении ракового заболевания, в международной заявкеРСТ/JP 2005/011082, имеющей дату международной подачи 10 июня 2005 г.; номер международной публикации WO 2005/121142 и дату международной публикации 22 декабря 2005 г., полное раскрытие которой включено таким образом в этот документ путем ссылки, соединение В представляет собой соединение примера 4-1. Соединение С получают так, как описано в международной заявкеРСТ/JP 2005/011082. Соединение С может быть получено так, как описано в публикации патентной заявки Соединенных ШтатовUS 2006/0014768, опубликованной 19 января 2006 г., полное раскрытие которой включено таким образом в этот документ путем ссылки. Подходящим образом, соединение С находится в форме диметилсульфоксидного сольвата, который представляет собой соединение А. Подходящим образом, соединение С находится в форме натриевой соли. Подходяще соединение С находится в форме гидрата или сольвата, выбранного из уксусной кислоты, этанола, нитрометана, хлорбензола, 1-пентанола, изопропилового спирта, этиленгликоля и 3-метил-1 бутанола. Эти сольваты и солевые формы могут быть получены специалистом в данной области с использованием описания в международной заявкеРСТ/JP 2005/011082 или в публикации заявки Соединенных ШтатовUS 2006/0014768. Для использования в этом документе термины ингибитор mTOR, mTORi и его производные, если не определено иначе, включают рапамицин и его аналоги, RAD001 или эверолимус (Afinitor), CCI-779 или темсиролимус, АР 23573, AZD8055, WYE-354, WYE-600, WYE-687 и Рр 121, но не ограничиваются этим. Подходяще ингибитор mTOR выбирают из рапамицина, эверолимуса (Afinitor) и темсиролимуса. Подходяще ингибитор mTOR выбирают из рапамицина и эверолимуса (Afinitor). Подходяще ингибиторmTOR представляет собой эверолимус. Введение терапевтически эффективного количества комбинаций изобретения является преимущественным в сравнении с отдельно взятыми составляющими комбинации соединениями тем, что комбинации будут обеспечивать одно или более из следующих улучшенных свойств при сравнении с раздельным введением терапевтически эффективного количества составляющего комбинацию соединения: i) более сильный противораковый эффект, чем наиболее активное отдельно взятое средство, ii) синергическая или высокосинергическая противораковая активность, iii) протокол введения дозы, который обеспечивает усиленную противораковую активность со сниженным профилем побочных эффектов, iv) снижение профиля токсических эффектов, v) расширение терапевтического окна, vi) увеличение биодоступности одного или обоих составляющих комбинацию соединений или vii) увеличение апоптоза по сравнению с отдельно взятыми составляющими комбинацию соединениями. Соединения изобретения могут содержать один или более хиральных атомов или иначе могут существовать в виде двух энантиомеров. В соответствии с этим соединения этого изобретения включают смеси энантиомеров, а также очищенные энантиомеры или энантиомерно обогащенные смеси. Также понятно, что все таутомеры и смеси таутомеров включены в диапазон охвата терминов: соединение А и его фармацевтически приемлемые сольваты и/или соли и mTOR-ингибирующее соединение и его фармацевтически приемлемые соли. Соединения изобретения могут образовывать сольват, который, как понимают, представляет собой комплекс с переменной стехиометрией, образованный растворенным веществом (в этом изобретении,соединением А, или его солью, или сольватом, и/или ингибитором mTOR, или его солью) и растворителем. Такие растворители для цели изобретения не могут ухудшать биологическую активность растворенного вещества. Примеры подходящих растворителей включают воду, метанол, диметилсульфоксид,этанол и уксусную кислоту, но не ограничиваются этим. Подходяще используемый растворитель представляет собой фармацевтически приемлемый растворитель. Подходяще используемый растворитель не является водой. Фармацевтически приемлемые соли соединений изобретения специалисты в данной области получают легко. Также в этом документе предусмотрен способ лечения ракового заболевания с использованием комбинации изобретения, где в качестве пролекарств вводят mTORi соединение, или его фармацевтически приемлемую соль, и/или соединение С, или его фармацевтически приемлемую соль, или сольват. Фармацевтически приемлемые пролекарства соединений изобретения специалисты в данной области получают легко. При упоминании протокола введения дозы термин день/сутки, в день и тому подобное относится к промежутку времени в пределах одного календарного дня, который начинается в полночь и заканчивается в следующую полночь. Под термином лечение и его производными, которые используют в этом документе, подразумевают лечебную терапию. Что касается конкретного состояния, лечение означает: (1) улучшение или предупреждение состояния с одним или более из биологических проявлений состояния, (2) вмешательство в(а) одну или более точек биологического каскада, который приводит к этому состоянию или ответственен за это состояние, или в (b) одно или более из биологических проявлений состояния, (3) частичное снятие одного или более из симптомов, эффектов или побочных эффектов, связанных с состоянием или его лечением, или (4) замедление прогрессирования состояния или одного или более из биологических проявлений состояния. Профилактическая терапия также предусмотрена при этом. Специалисту в данной области будет ясно, что предупреждение не является абсолютным термином. В медицине предупреждение, как полагают, относится к профилактическому введению лекарственного средства для существенного уменьшения вероятности или тяжести состояния или его биологического проявления, или для отсрочивания начала проявления такого состояния, или его биологического проявления. Профилактическая терапия приемлема, например, в том случае, когда считают, что субъект имеет большой риск развития ракового заболевания, например, как в том случае, когда субъект имеет вполне определенный семейный анамнез ракового заболевания или, в том случае, когда субъект был подвергнут воздействию канцерогенного вещества. Как используют в этом документе, термин эффективное количество означает то количество лекарственного средства или фармацевтического средства, которое будет вызывать биологическую или медицинскую (соматическую) реакцию ткани, системы, животного или человека, которая является искомой, например, у исследователя или врача-консультанта. Кроме того, термин терапевтически эффективное количество означает любое количество, которое в сравнении с соответственным субъектом, который не принял такое количество, приводит к улучшенному лечению, излечиванию/заживлению, предупреждению, или уменьшению интенсивности симптомов заболевания, нарушения, или побочного эффекта, или к снижению скорости развития заболевания или нарушения. Термин также включает в пределах его диапазона охвата количества, эффективные в улучшении нормальной физиологической функции. Под термином комбинация и его производными, как используют в этом документе, понимают либо одновременное введение или любой способ раздельного последовательного введения терапевтически эффективного количества mTOR-ингибирующего соединения и соединения С, или его фармацевтически приемлемой соли, или сольвата. Предпочтительно, если введение не является одновременным, соединения вводят в тесной временной близости друг к другу. Кроме того, не имеет значения, вводят ли соединения в одной и той же дозированной форме или нет, например одно соединение может быть введено местно, а другое соединение может быть введено перорально. Подходяще оба соединения вводят перорально. Под термином комбинированный набор, который используют в этом документе, понимают фармацевтическую композицию или композиции, которые используют для введения mTOR-ингибирующего соединения и соединения С, или его фармацевтически приемлемой соли, или сольвата, в соответствии с изобретением. В том случае, когда соединения вводят одновременно, комбинированный набор может содержать mTOR-ингибирующее соединение и соединение С, или его фармацевтически приемлемую соль, или сольват, в одной фармацевтической композиции, такой как таблетка, или в раздельных фарацевтических композициях. В том случае, когда соединения не вводят одновременно, комбинированный набор будет содержать mTOR-ингибирующее соединение и соединение С, или его фармацевтически приемлемую соль или сольват, в раздельных фармацевтических композициях. Комбинированный набор может содержать mTOR-ингибирующее соединение и соединение С, или его фармацевтически приемлемую соль, или сольват, в раздельных фармацевтических композициях в одной упаковке или в раздельных фармацевтических композициях в отдельно взятых упаковках. В одном аспекте обеспечивают комбинированный набор, включающий компонентыmTOR-ингибирующее соединение в сочетании с фармацевтически приемлемым носителем и соединение С, или его фармацевтически приемлемую соль, или сольват, в сочетании с фармацевтически приемлемым носителем. В одном варианте осуществления изобретения комбинированный набор содержит следующие компоненты:mTOR-ингибирующее соединение в сочетании с фармацевтически приемлемым носителем и соединение С, или его фармацевтически приемлемую соль, или сольват, в сочетании с фармацевтически приемлемым носителем,где компоненты представлены в форме, которая пригодна для последовательного, раздельного и/или одновременного введения. В одном варианте осуществления комбинированный набор содержит первый контейнер, содержащий mTOR-ингибирующее соединение в сочетании с фармацевтически приемлемым носителем; и второй контейнер, содержащий соединение С, или его фармацевтически приемлемую соль, или сольват, в сочетании с фармацевтически приемлемым носителем, и контейнерное средство для вмещения упомянутых первого и второго контейнеров. Комбинированный набор также может быть снабжен инструкцией, например инструкциями по дозировкам и введению. Такие инструкции по дозировке и введению могут быть такого типа, который представляется для доктора, например, в виде листка-вкладыша/этикетки, или они могут быть такого типа, который представляется доктором, например, в виде инструкций для пациента. Как используют в этом документе, термин неоплазия (новообразование) относится к аномальному росту клеток или ткани и, как полагают, включает доброкачественную опухоль, то есть доброкачественные разрастания, и злокачественную опухоль, то есть злокачественные разрастания. Термин неопластический (новообразовательный) означает относящийся к неоплазии или относится к неоплазии. Как используют в этом документе, термин средство/агент, как полагают, означает вещество, которое вырабатывает желательный эффект в ткани, системе, животном, млекопитающем, человеке или в другом субъекте. В связи с этим термин антинеопластическое средство, как полагают, означает вещество, вырабатывающее антинеопластический эффект в ткани, системе, животном, млекопитающем, человеке или в другом субъекте. Также следует понимать, что средство/агент может представлять собой одно соединение, или комбинацию, или композицию из двух или более соединений. Соединения в комбинациях настоящего изобретения могут иметь способность кристаллизоваться в двух и более формах, то есть характеристическое свойство, которое называют полиморфизм, и полагают,что такие полиморфные формы (полиморфные образования) находятся в пределах диапазона охвата термина соединения комбинаций настоящего изобретения. Полиморфизм, как правило, может возникать как реакция на изменения температуры или давления или обоих параметров и также может быть результатом вариаций в кристаллизационном процессе. Полиморфные образования могут отличаться разными физическими свойствами, известными в данной области, например дифракционными рентгенограммами, растворимостью и температурой плавления. Если не определено иное, во всех протоколах введения дозы, описанных в этом документе, схема приема вводимых соединений не должна стартовать с началом лечения и прекращаться с завершением лечения, единственно требуется, чтобы некоторое количество последовательных дней, когда вводят оба соединения, и некоторое необязательное количество последовательных дней, когда вводят только одно из составляющих комбинацию соединений, или указанный протокол введения дозы - включающий некоторое количество вводимого соединения, имели место в определенный момент времени в ходе лечения. Как используют в этом документе, термин соединение С 2 означает соединение С, или его фармацевтически приемлемую соль, или сольват. Термин ударная доза, который используют в этом документе, как полагают, означает разовую дозу или кратковременную схему приема mTOR-ингибирующего соединения или соединения С 2, имеющего дозировку, большую, чем поддерживающая доза, вводимую субъекту для быстрого увеличения уровня концентрации лекарственного средства в крови. Подходяще кратковременная схема приема для использования в этом изобретении будет включать от 1 до 14 дней; подходяще от 1 до 7 дней; подходяще от 1 до 3 дней; подходяще три дня; подходяще два дня; подходяще один день. В некоторых вариантах осуществления ударная доза может повышать концентрацию лекарственного средства в крови до терапевтически эффективного уровня. В некоторых вариантах осуществления ударная доза может повышать концентрацию лекарственного средства в крови до терапевтически эффективного уровня совместно с поддерживающей дозой лекарственного средства. Ударная доза может быть введена однократно в день или более одного раза в день (например, вплоть до 4 раз в день). Подходяще ударная доза будет вводиться один раз в день. Подходяще ударная доза будет составлять 2-100-кратное количество относительно поддерживающей дозы; подходяще 2-10-кратное количество; подходяще 2-5-кратное количество; подходяще 2-кратное количество; подходяще 3-кратное количество; подходяще 4-кратное количество; подходяще 5-кратное количество. Подходяще ударная доза будет вводиться в течение 1-7 дней; подходяще в течение 1-5 дней; подходяще в течение 1-3 дней; подходяще в течение 1 дня; подходяще в течение 2 дней; подходяще в течение 3 дней, с последующим протоколом введения поддерживающей дозы. Термин поддерживающая доза, который используют в этом документе, как полагают, означает дозу, которую периодически вводят (например, по меньшей мере, дважды) и которая предназначена либо для медленного повышения уровней концентрации соединения в крови до терапевтически эффективного уровня, или для поддержания такого терапевтически эффективного уровня. Поддерживающую дозу, как правило, вводят однократно в день и суточная доза поддерживающей дозы ниже, чем общая суточная доза ударной дозы. Подходяще комбинации этого изобретения вводят через заданный промежуток времени. Под термином заданный промежуток времени и его производными, которые используют в этом документе, понимают интервал времени между введением одного соединения из комбинации mTORингибирующего соединения или соединения С 2 и другого соединения из комбинации mTOR-инги-6 022637 бирующего соединения или соединения С 2. Если не определено иное, заданный промежуток может включать одновременное введение. В том случае, когда оба соединения изобретения вводят однократно в день, заданный промежуток времени относится к интервалу введения mTOR-ингибирующего соединения и соединения С 2 в течение одного дня. В том случае, когда одно соединение или оба соединения изобретения вводят более одного раза в день, заданный промежуток времени вычисляют с учетом первого введения каждого соединения в конкретный день. Все введения соединения изобретения, которые делают после первого введения в течение конкретного дня, не учитываются при вычислении заданного промежутка времени. Подходяще, если соединения не вводят одновременно, их будут вводить одно за другим с интервалом в 24 ч - в этом случае заданный промежуток времени будет составлять 24 ч; подходяще их будут вводить одно за другим с интервалами в 12 ч - в этом случае заданный промежуток времени будет составлять 12 ч; подходяще их будут вводить одно за другим с интервалами в 11 ч - в этом случае заданный промежуток времени будет составлять 11 ч; подходяще их будут вводить одно за другим с интервалами в 10 ч - в этом случае заданный промежуток времени будет составлять 10 ч; подходяще их будут вводить одно за другим с интервалами в 9 ч - в этом случае заданный промежуток времени будет составлять 9 ч; подходяще их будут вводить одно за другим с интервалами в 8 ч - в этом случае заданный промежуток времени будет составлять 8 ч; подходяще их будут вводить одно за другим с интервалами в 7 ч в этом случае заданный промежуток времени будет составлять 7 ч; подходяще их будут вводить одно за другим с интервалами в 6 ч - в этом случае заданный промежуток времени будет составлять 6 ч; подходяще их будут вводить одно за другим с интервалами в 5 ч - в этом случае заданный промежуток времени будет составлять 5 ч; подходяще их будут вводить одно за другим с интервалами в 4 ч - в этом случае заданный промежуток времени будет составлять 4 ч; подходяще их будут вводить одно за другим с интервалами в 3 ч - в этом случае заданный промежуток времени будет составлять 3 ч; подходяще их будут вводить одно за другим с интервалами в 2 ч - в этом случае заданный промежуток времени будет составлять 2 ч; подходяще их будут вводить одно за другим с интервалами в 1 ч - в этом случае заданный промежуток времени будет составлять 1 ч. Как используют в этом документе, введение mTOR-ингибирующего соединения и соединения С 2 с интервалом менее чем приблизительно 45 мин считают одновременным введением. Подходяще, в том случае, когда комбинацию изобретения вводят в течение заданного периода времени, соединения будут совместно вводиться в течение некоторого периода времени. Под термином период времени и его производными, которые используют в этом документе, понимают, что оба соединения изобретения вводят через заданный промежуток времени в течение указанного числа последовательных дней, необязательно с последующим введением в течение ряда последующих дней, когда вводят только одно из составляющих комбинацию соединений. Что касается введения через заданный промежуток времени/в течение заданного периода времени подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 1 дня с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 1 дня - в этом случае период времени будет составлять по меньшей мере 2 дня; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 1 дня с последующим введением mTORингибирующего соединения как такового в течение по меньшей мере 2 дней - в этом случае период времени будет составлять по меньшей мере 3 дня; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 1 дня с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 3 дней - в этом случае период времени будет составлять по меньшей мере 4 дня; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 1 дня с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 4 дней - в этом случае период времени будет составлять по меньшей мере 5 дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 1 дня с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 5 дней - в этом случае период времени будет составлять по меньшей мере 6 дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 1 дня с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 6 дней - в этом случае период времени будет составлять по меньшей мере 7 дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 1 дня с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 7 дней - в этом случае период времени будет составлять по меньшей мере 8 дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 2 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 1 дня - в этом случае период времени будет составлять по меньшей мере 3 дня; подходяще во время прове-7 022637 дения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 2 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 2 последующих дней - в этом случае период времени будет составлять по меньшей мере 4 дня; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 2 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 3 последующих дней - в этом случае период времени будет составлять по меньшей мере 5 дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 2 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 4 последующих дней - в этом случае период времени будет составлять по меньшей мере 6 дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 2 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 5 последующих дней - в этом случае период времени будет составлять по меньшей мере 7 дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 2 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 6 последующих дней - в этом случае период времени будет составлять по меньшей мере 8 дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 2 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 7 последующих дней - в этом случае период времени будет составлять по меньшей мере 9 дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 3 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 1 дня - в этом случае период времени будет составлять по меньшей мере 4 дня; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 3 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 2 последующих дней - в этом случае период времени будет составлять по меньшей мере 5 дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 3 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 3 последующих дней - в этом случае период времени будет составлять по меньшей мере 6 дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 3 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 4 последующих дней - в этом случае период времени будет составлять по меньшей мере 7 дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 3 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 5 последующих дней - в этом случае период времени будет составлять по меньшей мере 8 дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 3 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 6 последующих дней - в этом случае период времени будет составлять по меньшей мере 9 дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 3 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 7 последующих дней - в этом случае период времени будет составлять по меньшей мере 10 дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 4 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 1 дня - в этом случае период времени будет составлять по меньшей мере 5 последовательных дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 4 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 2 последующих дней - в этом случае период времени будет составлять по меньшей мере 6 последовательных дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 4 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 3 последующих дней - в этом случае период времени будет составлять по меньшей мере 7 последовательных дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 4 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 4 последующих дней - в этом случае период времени будет составлять по меньшей мере 8 последовательных дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 4 последовательных дней с последующим введениемmTOR-ингибирующего соединения как такового в течение по меньшей мере 7 последующих дней - в этом случае период времени будет составлять по меньшей мере 11 последовательных дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 5 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 1 дня - в этом случае период времени будет составлять по меньшей мере 6 последовательных дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 5 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 2 последующих дней - в этом случае период времени будет составлять по меньшей мере 7 последовательных дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 5 последовательных дней с последующим введениемmTOR-ингибирующего соединения как такового в течение по меньшей мере 3 последующих дней - в этом случае период времени будет составлять по меньшей мере 8 последовательных дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 5 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 4 последующих дней - в этом случае период времени будет составлять по меньшей мере 9 последовательных дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 5 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 5 последующих дней - в этом случае период времени будет составлять по меньшей мере 10 последовательных дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 7 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 2 последующих дней - в этом случае период времени будет составлять по меньшей мере 9 последовательных дней; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 14 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 7 последующих дней - в этом случае период времени будет составлять по меньшей мере 21 последовательный день; подходяще во время проведения лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 30 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение по меньшей мере 7 последующих дней - в этом случае период времени будет составлять по меньшей мере 37 последовательных дней. Подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение 1-3 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение 3-7 последующих дней. Подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение 3-6 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение 1-4 последующих дней. Подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение 5 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение 2 последующих дней. Подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение 2 последовательных дней с последующим введением mTOR-ингибирующего соединения как такового в течение 3-7 последующих дней. Кроме того, что касается введения через заданный промежуток времени/в течение заданного периода времени подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 1 дня с последующим введением соединения С 2 как такового в течение по меньшей мере 1 дня - в этом случае период времени будет составлять по меньшей мере 2 дня; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 1 дня с последующим введением соединения С 2 как такового в течение по меньшей мере 2 дней - в этом случае период времени будет составлять по меньшей мере 3 дня; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 1 дня с последующим введением соединения С 2 как такового в течение по меньшей мере 3 дней - в этом случае период времени будет составлять по меньшей мере 4 дня; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 1 дня с последующим введением соединения С 2 как такового в течение по меньшей мере 4 дней - в этом случае период времени будет составлять по меньшей мере 5 дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 1 дня с последующим введением соединения С 2 как такового в течение по меньшей мере 5 дней - в этом случае период времени будет составлять по меньшей мере 6 дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 1 дня с последующим введением соединения С 2 как такового в течение по меньшей мере 6 дней - в этом случае пери-9 022637 од времени будет составлять по меньшей мере 7 дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 1 дня с последующим введением соединения С 2 как такового в течение по меньшей мере 7 дней - в этом случае период времени будет составлять по меньшей мере 8 дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 2 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 1 дня - в этом случае период времени будет составлять по меньшей мере 3 дня; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 2 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 2 последующих дней - в этом случае период времени будет составлять по меньшей мере 4 дня; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 2 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 3 последующих дней - в этом случае период времени будет составлять по меньшей мере 5 дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 2 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 4 последующих дней - в этом случае период времени будет составлять по меньшей мере 6 дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 2 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 5 последующих дней - в этом случае период времени будет составлять по меньшей мере 7 дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 2 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 6 последующих дней - в этом случае период времени будет составлять по меньшей мере 8 дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 2 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 7 последующих дней - в этом случае период времени будет составлять по меньшей мере 9 дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 3 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 1 дня - в этом случае период времени будет составлять по меньшей мере 4 дня; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 3 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 2 последующих дней - в этом случае период времени будет составлять по меньшей мере 5 дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 3 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 3 последующих дней в этом случае период времени будет составлять по меньшей мере 6 дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 3 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 4 последующих дней - в этом случае период времени будет составлять по меньшей мере 7 дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 3 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 5 последующих дней - в этом случае период времени будет составлять по меньшей мере 8 дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 3 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 6 последующих дней - в этом случае период времени будет составлять по меньшей мере 9 дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 3 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 7 последующих дней- в этом случае период времени будет составлять по меньшей мере 10 дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 4 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 1 дня - в этом случае период времени будет составлять по меньшей мере 5 последовательных дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 4 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 2 последующих дней - в этом случае период времени будет составлять по меньшей мере 6 последовательных дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 4 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 3 последующих дней в этом случае период времени будет составлять по меньшей мере 7 последовательных дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 4 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 4 последующих дней - в этом случае период времени будет составлять по меньшей мере 8 последовательных дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 4 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 7 последующих дней - в этом случае период времени будет составлять по меньшей мере 11 последовательных дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 5 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 1 дня - в этом случае период времени будет составлять по меньшей мере 6 последовательных дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 5 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 2 последующих дней - в этом случае период времени будет составлять по меньшей мере 7 последовательных дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 5 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 3 последующих дней- в этом случае период времени будет составлять по меньшей мере 8 последовательных дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 5 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 4 последующих дней - в этом случае период времени будет составлять по меньшей мере 9 последовательных дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 5 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 5 последующих дней - в этом случае период времени будет составлять по меньшей мере 10 последовательных дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 7 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 2 последующих дней - в этом случае период времени будет составлять по меньшей мере 9 последовательных дней; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 14 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 7 последующих дней - в этом случае период времени будет составлять по меньшей мере 21 последовательный день; подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение по меньшей мере 30 последовательных дней с последующим введением соединения С 2 как такового в течение по меньшей мере 7 последующих дней - в этом случае период времени будет составлять по меньшей мере 37 последовательных дней. Подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение 1-3 последовательных дней с последующим введением соединения С 2 как такового в течение 3-7 последующих дней. Подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение 3-6 последовательных дней с последующим введением соединения С 2 как такового в течение 1-4 последующих дней. Подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение 5 последовательных дней с последующим введением соединения С 2 как такового в течение 2 последующих дней. Подходяще во время курса лечения оба соединения будут вводить через заданный промежуток времени в течение 2 последовательных дней с последующим введением соединения С 2 как такового в течение 3-7 последующих дней. Кроме того, что касается введения через заданный промежуток времени/в течение заданного периода времени подходяще во время курса лечения mTOR-ингибирующее соединение и соединение С 2 будут вводить через заданный промежуток времени в течение 1-3 дней на протяжении 7-дневного периода и на протяжении остальных дней 7-дневного периода будут вводить mTOR-ингибирующее соединение как таковое. Подходяще этот 7-дневный протокол повторяют в виде 2 циклов или выполняют 14 дней; подходяще в виде 4 циклов или 28 дней; подходяще непрерывным введением. Подходяще во время курса лечения mTOR-ингибирующее соединение и соединение С 2 будут вводить через заданный промежуток времени в течение 1-3 дней на протяжении 7-дневного периода и на протяжении остальных дней 7-дневного периода будут вводить соединение С 2 как таковое. Подходяще этот 7-дневный протокол повторяют в виде 2 циклов или выполняют 14 дней; подходяще в виде 4 циклов или 28 дней; подходяще непрерывным введением. Подходяще во время курса лечения mTOR-ингибирующее соединение и соединение С 2 будут вводить через заданный промежуток времени в течение 3 дней на протяжении 7-дневного периода и на протяжении остальных дней 7-дневного периода будут вводить mTOR-ингибирующее соединение как таковое. Подходяще этот 7-дневный протокол повторяют в виде 2 циклов или выполняют 14 дней; подходяще в виде 4 циклов или 28 дней; подходяще непрерывным введением. Подходяще во время курса лечения mTOR-ингибирующее соединение и соединение С 2 будут вводить через заданный промежуток времени в течение 3 дней на протяжении 7-дневного периода и на протяжении остальных дней 7-дневного периода будут вводить соединение С 2 как таковое. Подходяще этот 7-дневный протокол повторяют в виде 2 циклов или выполняют 14 дней; подходяще в виде 4 циклов или 28 дней; подходяще непрерывным введением. Подходяще во время курса лечения mTOR-ингибирующее соединение и соединение С 2 будут вводить через заданный промежуток времени в течение 2 дней на протяжении 7-дневного периода и на протяжении остальных дней 7-дневного периода будут вводить mTOR-ингибирующее соединение как таковое. Подходяще этот 7-дневный протокол повторяют в виде 2 циклов или выполняют 14 дней; подходяще в виде 4 циклов или 28 дней; подходяще непрерывным введением. Подходяще во время курса лечения mTOR-ингибирующее соединение и соединение С 2 будут вводить через заданный промежуток времени в течение 2 дней на протяжении 7-дневного периода и на протяжении остальных дней 7-дневного периода будут вводить соединение С 2 как таковое. Подходяще этот 7-дневный протокол повторяют в виде 2 циклов или выполняют 14 дней; подходяще в виде 4 циклов или 28 дней; подходяще непрерывным введением. Подходяще во время курса лечения mTOR-ингибирующее соединение и соединение С 2 будут вводить через заданный промежуток времени в течение 1 дня на протяжении 7-дневного периода и на протяжении остальных дней 7-дневного периода будут вводить mTOR-ингибирующее соединение как таковое. Подходяще этот 7-дневный протокол повторяют в виде 2 циклов или выполняют 14 дней; подходяще в виде 4 циклов или 28 дней; подходяще непрерывным введением. Подходяще во время курса лечения mTOR-ингибирующее соединение и соединение С 2 будут вводить через заданный промежуток времени в течение 1 дня на протяжении 7-дневного периода и на протяжении остальных дней 7-дневного периода будут вводить соединение С 2 как таковое. Подходяще этот 7-дневный протокол повторяют в виде 2 циклов или выполняют 14 дней; подходяще в виде 4 циклов или 28 дней; подходяще непрерывным введением. Подходяще во время курса лечения mTOR-ингибирующее соединение и соединение С 2 будут вводить через заданный промежуток времени в течение 1-5 дней на протяжении 14-дневного периода и на протяжении остальных дней 14-дневного периода будут вводить mTOR-ингибирующее соединение как таковое. Подходяще этот 14-дневный протокол повторяют в виде 2 циклов или выполняют 28 дней; подходяще непрерывным введением. Подходяще во время курса лечения mTOR-ингибирующее соединение и соединение С 2 будут вводить через заданный промежуток времени в течение 1-5 дней на протяжении 14-дневного периода и на протяжении остальных дней 14-дневного периода будут вводить соединение С 2 как таковое. Подходяще этот 14-дневный протокол повторяют в виде 2 циклов или выполняют 28 дней; подходяще непрерывным введением. Подходяще во время курса лечения mTOR-ингибирующее соединение и соединение С 2 будут вводить один за другим с промежутком в 12 ч в течение от 1 до 3 последовательных дней с последующим введением mTOR-ингибирующего соединения в течение 4-6 последовательных дней, необязательно с последующим(ими) одним или более циклами повторного введения доз. Подходяще во время курса лечения mTOR-ингибирующее соединение и соединение С 2 будут вводить один за другим с промежутком в 12 ч в течение 2 дней из 7-дневного периода и в течение остальных дней из 7-дневного периода будут вводить либо соединение С 2; либо mTOR-ингибирующее соединение,необязательно с последующим(ими) одним или более циклами повторного введения доз. Подходяще, если соединения не вводят в течение заданного промежутка времени, их вводят последовательно. Под термином последовательное введение и его производными, которые используют в этом документе, понимают, что одно соединение из комбинации mTOR-ингибирующее соединение или соединение С 2 вводят в течение одного или более идущих подряд дней и другое соединение из комбинации mTOR-ингибирующее соединение или соединение С 2 последовательно вводят в течение одного или более последующих дней. Также здесь предусмотрены лекарственные каникулы, используемые между последовательным введением одного соединения из комбинации mTOR-ингибирующего соединения или соединения С 2 и другого соединения из комбинации mTOR-ингибирующего соединения или соединения С 2. Как используют в этом документе, лекарственные каникулы представляют собой период-перерыв в днях после последовательного введения одного соединения из комбинации mTOR-ингибирующего соединения или соединения С 2 и перед введением другого соединения из комбинации mTORингибирующего соединения или соединения С 2, когда не вводят ни mTOR-ингибирующее соединение,ни соединение С 2. Подходящим образом лекарственные каникулы будут представлять собой периодперерыв в днях, выбранный из 1 дня, 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 7 дней, 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней и 14 дней. Что касается последовательного введения подходящим образом одно из соединений комбинации mTOR-ингибирующее соединение или соединение С 2 вводят в течение 1-30 идущих подряд дней с последующими необязательными лекарственными каникулами, с последующим введением другого соединения из комбинации mTOR-ингибирующего соединения или соединения С 2 в течение 1-30 последующих дней. Подходящим образом одно из соединений комбинации mTOR-ингибирующее соединение или соединение С 2 вводят в течение 1- 12022637 21 идущих подряд дней с последующими необязательными лекарственными каникулами и с последующим введением другого соединения из комбинации mTOR-ингибирующего соединения или соединения С 2 в течение 1-21 последующих дней. Подходящим образом одно из соединений комбинации mTORингибирующее соединение или соединение С 2 вводят в течение 1-14 идущих подряд дней с последующими необязательными лекарственными каникулами от 1 до 14 дней и с последующим введением другого соединения из комбинации mTOR-ингибирующего соединения или соединения С 2 в течение 1-14 последующих дней. Подходящим образом одно из соединений комбинации mTOR-ингибирующее соединение или соединение С 2 вводят в течение 2-7 идущих подряд дней с последующими необязательными лекарственными каникулами от 1 до 10 дней и с последующим введением другого соединения из комбинации mTOR-ингибирующего соединения или соединения С 2 в течение 2-7 последующих дней. Подходящим образом соединение С 2 будут вводить первым в последовательности с последующими необязательными лекарственными каникулами и с последующим введением mTOR-ингибирующего соединения. Подходяще соединение С 2 вводят в течение 1-21 идущих подряд дней с последующими необязательными лекарственными каникулами и с последующим введением mTOR-ингибирующего соединения в течение 1-21 последующих дней. Подходящим образом соединение С 2 вводят в течение 3-21 идущих подряд дней с последующими лекарственными каникулами от 1 до 14 дней и с последующим введением mTOR-ингибирующего соединения в течение 3-21 последующих дней. Подходящим образом соединение С 2 вводят в течение 3-21 идущих подряд дней с последующими лекарственными каникулами от 3 до 14 дней и с последующим введением mTOR-ингибирующего соединения в течение 3-21 последующих дней. Подходящим образом соединение С 2 вводят в течение 21 идущих подряд дней с последующими необязательными лекарственными каникулами и с последующим введением mTOR-ингибирующего соединения в течение 14 последующих дней. Подходящим образом соединение С 2 вводят в течение 14 идущих подряд дней с последующими лекарственными каникулами от 1 до 14 дней и с последующим введением mTOR-ингибирующего соединения в течение 14 последующих дней. Подходящим образом соединение С 2 вводят в течение 7 идущих подряд дней с последующими лекарственными каникулами от 3 до 10 дней и с последующим введением mTOR-ингибирующего соединения в течение 7 последующих дней. Подходящим образом соединение С 2 вводят в течение 3 идущих подряд дней с последующими лекарственными каникулами от 3 до 14 дней и с последующим введением mTOR-ингибирующего соединения в течение 7 последующих дней. Подходящим образом соединение С 2 вводят в течение 3 идущих подряд дней с последующими лекарственными каникулами от 3 до 10 дней и с последующим введениемmTOR-ингибирующего соединения в течение 3 последующих дней. Подходящим образом соединение С 2 вводят в течение 7 идущих подряд дней с последующим введением mTOR-ингибирующего соединения в течение 1 дня. Подходящим образом соединение С 2 вводят в течение 6 идущих подряд дней с последующим введением mTOR-ингибирующего соединения в течение 1 дня. Подходящим образом mTOR-ингибирующее соединение вводят в течение 2 идущих подряд дней с последующим введением соединения С 2 в течение 3-7 последующих дней. Подходящим образом mTORингибирующее соединение вводят в течение 2 идущих подряд дней с последующим введением соединения С 2 в течение 5 последующих дней. Подходящим образом mTOR-ингибирующее соединение будут вводить первым в последовательности с последующими необязательными лекарственными каникулами и с последующим введением соединения С 2. Подходящим образом mTOR-ингибирующее соединение вводят в течение 1-21 идущих подряд дней с последующими необязательными лекарственными каникулами и с последующим введением соединения С 2 в течение 1-21 последующих дней. Подходящим образом mTOR-ингибирующее соединение вводят в течение 3-21 идущих подряд дней с последующими необязательными лекарственными каникулами от 1 до 14 дней и с последующим введением соединения С 2 в течение 3-21 последующих дней. Подходящим образом mTOR-ингибирующее соединение вводят в течение 3-21 идущих подряд дней с последующими необязательными лекарственными каникулами от 3 до 14 дней и с последующим введением соединения С 2 в течение 3-21 последующих дней. Подходящим образом mTOR-ингибирующее соединение вводят в течение 21 идущих подряд дней с последующими необязательными лекарственными каникулами и с последующим введением соединения С 2 в течение 14 последующих дней. Подходящим образом mTOR-ингибирующее соединение вводят в течение 14 идущих подряд дней с последующими необязательными лекарственными каникулами от 1 до 14 дней и с последующим введением соединения С 2 в течение 14 последующих дней. Подходящим образом mTOR-ингибирующее соединение вводят в течение 7 идущих подряд дней с последующими необязательными лекарственными каникулами от 3 до 10 дней и с последующим введением соединения С 2 в течение 7 последующих дней. Подходящим образом mTOR-ингибирующее соединение вводят в течение 3 идущих подряд дней с последующими необязательными лекарственными каникулами от 3 до 14 дней и с последующим введением соединения С 2 в течение 7 последующих дней. Подходящим образом mTOR-ингибирующее соединение вводят в течение 3 идущих подряд дней с последующими необязательными лекарственными каникулами от 3 до 10 дней и с последующим введением соединения С 2 в течение 3 последующих дней. Подходящим образом mTORингибирующее соединение вводят в течение 7 идущих подряд дней с последующим введением соединения С 2 в течение 1 дня. Подходящим образом, mTOR-ингибирующее соединение вводят в течение 6- 13022637 идущих подряд дней с последующим введением соединения С 2 в течение 1 дня. Подходящим образом, соединение С 2 вводят в течение 2 идущих подряд дней с последующим введением mTOR-ингибирующего соединения в течение 3-7 последующих дней. Подходящим образом, соединение С 2 вводят в течение 2 идущих подряд дней с последующим введением mTOR-ингибирующего соединения в течение 5 последующих дней. Понятно, что введение с заданным промежутком времени и последовательное введение могут сопровождаться повторным введением доз или могут сопровождаться альтернативным протоколом введения доз и лекарственные каникулы могут предшествовать повторному введению доз или альтернативному протоколу введения доз. Подходяще количество соединения С 2, вводимое как часть комбинации в соответствии с настоящим изобретением, будет представлять собой количество, выбираемое из приблизительно 0,125 мг-приблизительно 10 мг; подходяще количество будет выбрано из приблизительно 0,25 мг-приблизительно 9 мг; подходяще количество будет выбрано из приблизительно 0,25 мг-приблизительно 8 мг; подходяще количество будет выбрано из приблизительно 0,5 мг-приблизительно 8 мг; подходяще количество будет выбрано из приблизительно 0,5 мг-приблизительно 7 мг; подходяще количество будет выбрано из приблизительно 1 мг-приблизительно 7 мг; подходяще количество будет составлять приблизительно 5 мг. В соответствии с этим количество соединения С 2, вводимое как часть комбинации в соответствии с настоящим изобретением, будет представлять собой количество, выбираемое из приблизительно 0,125 мгприблизительно 10 мг. Например, количество соединения С 2, вводимое как часть комбинации в соответствии с настоящим изобретением, будет составлять 0,125, 0,25, 0,5, 0,75, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5,6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5, 10 мг. Подходяще выбранное количество соединения С 2 вводят дважды в день. Подходяще выбранное количество соединения С 2 вводят однократно в день. Подходяще введение соединения С 2 будет начинаться с ударной дозы. Подходяще ударная доза будет составлять 2-100-кратное количество поддерживающей дозы; соответственно 2-5-кратное количество; соответственно 2-кратное количество; соответственно 3-кратное количество; соответственно 4-кратное количество; соответственно 5 кратное количество. Подходящим образом ударную дозу будут вводить 1-7 дней; соответственно 1-5 дней; соответственно 1-3 дня; соответственно в течение 1 дня; соответственно в течение 2 дней; соответственно в течение 3 дней с последующим протоколом введения поддерживающей дозы. Количество ингибитора mTOR будет зависеть в конечном итоге от конкретного используемого средства. Подходяще количество эверолимуса, вводимое как часть комбинации в соответствии с настоящим изобретением, будет представлять собой количество, выбираемое из приблизительно 1,25 мгприблизительно 20 мг; подходяще количество будет выбрано из приблизительно 2 мг-приблизительно 15 мг; подходяще количество будет выбрано из приблизительно 2,5 мг-приблизительно 10 мг. В соответствии с этим количество эверолимуса, вводимое как часть комбинации в соответствии с настоящим изобретением, будет представлять собой количество, выбираемое из приблизительно 1,25 мг-приблизительно 20 мг. Например, количество эверолимуса, вводимое как часть комбинации в соответствии с настоящим изобретением, будет составлять 1,25, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5,10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20. Подходящим образом выбранное количество эверолимуса вводят дважды в день. Подходящим образом выбранное количество эверолимуса вводят однократно в день. Подходящим образом введение эверолимуса будет начинаться с ударной дозы. Подходящим образом ударная доза будет составлять 2-100-кратное количество поддерживающей дозы; соответственно 2-10 кратное количество; соответственно 2-5-кратное количество; соответственно 2-кратное количество; соответственно 3-кратное количество; соответственно 4-кратное количество; соответственно 5-кратное количество. Подходящим образом ударную дозу будут вводить 1-7 дней; соответственно 1-5 дней; соответственно 1-3 дня; соответственно в течение 1 дня; соответственно в течение 2 дней; соответственно в течение 3 дней с последующим протоколом введения поддерживающей дозы. Подходяще количество темсиролимуса, вводимое как часть комбинации в соответствии с настоящим изобретением, будет представлять собой количество, вводимое путем инфузии в течение 30-60 минутного периода, где количество выбирают из приблизительно 5 мг-приблизительно 50 мг; подходяще количество будет выбрано из приблизительно 10 мг-приблизительно 40 мг; подходяще количество будет выбрано из приблизительно 15 мг-приблизительно 35 мг. В соответствии с этим количество темсиролимуса, вводимое как часть комбинации в соответствии с настоящим изобретением, будет представлять собой количество, выбираемое из приблизительно 5 мг-приблизительно 50 мг. Например, количество темсиролимуса, вводимое как часть комбинации в соответствии с настоящим изобретением, будет составлять 5, 10, 15, 20, 25, 30, 35, 40, 45, 50 мг. Подходящим образом выбранное количество темсиролимуса вводят дважды в день. Подходящим образом выбранное количество темсиролимуса вводят однократно в день. Подходящим образом введение темсиролимуса будет начинаться с ударной дозы. Подходящим образом ударная доза будет составлять 2-100-кратное количество поддерживающей дозы; соответственно 2-10-кратное количество; соответственно 2-5-кратное количество; соответственно 2-кратное количество; соответственно 3-кратное количество; соответственно 4-кратное количество; соответственно 5 кратное количество. Подходящим образом ударную дозу будут вводить 1-7 дней; соответственно 1-5 дней; соответственно 1-3 дня; соответственно в течение 1 дня; соответственно в течение 2 дней; соответственно в течение 3 дней с последующим протоколом введения поддерживающей дозы. Как используют в этом документе, все количества, точно описанные для соединения комбинаций настоящего изобретения, соответственно для соединения С 2, указаны в виде количества соединения в свободной или в несолевой, несольватированной форме. Способ лечения Комбинации изобретения, как полагают, имеют полезность в лечении расстройств, где ингибирование MEK и/или mTOR является благотворным. Способ настоящего изобретения также может быть применен с другими терапевтическими способами лечения ракового заболевания. Комбинация изобретения может быть применена как таковая или в комбинации с одним или более другими терапевтическими средствами. Изобретение таким образом обеспечивает в дополнительном аспекте дополнительные комбинацию, содержащую комбинацию изобретения с дополнительным(ыми) терапевтическим(ими) средством или средствами, композиции и лекарственные препараты, содержащие комбинацию, и применение дополнительных комбинаций, композиций и лекарственных препаратов в терапии, в частности в лечении заболеваний, чувствительных к ингибированию MEK- и/или mTORкиназ. В варианте осуществления комбинация изобретения может быть применена с другими терапевтическими способами лечения ракового заболевания. В частности, в антинеопластической терапии предусмотрена комбинированная терапия с другими химиотерапевтическими средствами, гормональными средствами, средствами-антителами, а также с хирургическими и/или радиационными методами лечения,помимо методов лечения, упомянутых выше. Комбинированные методы терапии в соответствии с настоящим изобретением таким образом включают введение соединения С 2 и mTOR-ингибирующего соединения, а также необязательное применение других терапевтических средств, включающих другие антинеопластические средства. Такая комбинация средств может быть введена совместно или раздельно,и при раздельном введении таковое может происходить одновременно или последовательно в любом порядке как близко, так и удаленно по времени. В одном варианте осуществления фармацевтическая комбинация включает соединение С 2 и mTOR-ингибирующее соединение и, необязательно, по меньшей мере одно дополнительное антинеопластическое средство. Как упомянуто, терапевтически эффективные количества соединения С 2 и mTOR-ингибирующего соединения рассмотрены выше. Терапевтически эффективное количество дополнительных терапевтических средств настоящего изобретения будут зависеть от ряда факторов, включающих, например, возраст и вес млекопитающего, точное состояние, требующее лечения, тяжесть состояния, природу состава и путь введения. В конечном итоге терапевтически эффективное количество будет назначаться по усмотрению лечащего врача или ветеринара. Для того чтобы добиться желательного терапевтического эффекта комбинированной терапии, будут выбраны относительные интервалы введения доз. В одном варианте осуществления дополнительной противораковой терапией является хирургическое вмешательство и/или радиотерапия. В одном варианте осуществления дополнительная противораковая терапия представляет собой по меньшей мере одно дополнительное антинеопластическое средство. Любое антинеопластическое средство, которое имеет активность в отношении чувствительной опухоли, подлежащей вылечиванию, может быть применено в комбинации. Обычные полезные антинеопластические средства включают антимикротубулиновые средства, такие как дитерпеноиды и алкалоиды барвинка розового; координационные комплексы платины; алкилирующие агенты, такие как мустаргены,оксазафосфорины, алкилсульфонаты, нитрозомочевины и триазены; антибиотические средства, такие как антрациклины, актиномицины и блеомицины; ингибиторы топоизомеразы II, такие как эпиподофиллотоксины; антиметаболиты, такие как аналоги пурина и пиримидина и антифолатные соединения; ингибиторы топоизомеразы I, такие как камптотецины; гормоны и гормональные аналоги; ингибиторы сигнальной трансдукции; ингибиторы ангиогенеза на основе нерецепторной тирозинкиназы; иммунотерапевтические средства; средства с проапоптозным действием; ингибиторы передачи сигналов (сигнализации) клеточного цикла, но не ограничиваются этим. Антимикротубулиновые или антимитотические средства Антимикротубулиновые или антимитотические средства представляют собой фазоспецифические агенты, активные в отношении микротрубочек клеток опухоли во время фазы М или митоза клеточного цикла. Примеры антимикротубулиновых средств включают дитерпеноиды и алкалоиды барвинка розового, но не ограничиваются этим. Дитерпеноиды, которые получают из природных источников, представляют собой фазоспецифические противораковые агенты, которые управляют фазами G2/M клеточного цикла. Полагают, что дитерпеноиды стабилизируют субъединицу -тубулин микротрубочек путем связывания с этим белком. Затем возникает разборка белка, которая должна быть ингибирована подавляемым митозом с протеканием гибели клетки. Примеры дитерпеноидов включают паклитаксел и его аналог доцетаксел, но не ограничиваются этим. Паклитаксел, 5,20-эпокси-1,2,4,7,10,13-гексагидрокситакс-11-ен-9-он 4,10-диацетат 2-бензоата 13-сложный эфир (2R,3S)-N-бензоил-3-фенилизосерина, представляет собой природный дитерпеновый продукт, выделенный из тиса тихого (Taxus brevifolia), и является коммерчески доступным в форме инъекционного раствора TAXOL. Он является членом таксанового семейства терпенов. Паклитаксел был одобрен для клинического применения в лечении резистентного рака яичников в Соединенных Штатах (Markman et al. Yale Journal of Biology and Medicine, 64:583, 1991; McGuire et al. Ann. Intem, Med.,111:273, 1989) и для лечения рака молочной железы (Holmes et al. J. Nat. Cancer Inst., 83:1797, 1991). Он является потенциальным кандидатом для лечения неоплазий кожи (Einzig et al. Proc. Am. Soc. Clin.Oncol., 20:46) и карцином головы и шеи (Forastire et al. Sem. Oncol., 20:56, 1990). Это соединение также показывает потенциал для лечения поликистозной болезни почек (Woo et al. Nature, 368:750, 1994), рака легких и малярии. Лечение пациентов паклитакселом приводит к подавлению деятельности костного мозга (multiple cell lineages, Ignoff R.J. et al. Cancer Chemotherapy Pocket Guide, 1998), связанному с длительностью введения дозы, превышающей пороговую концентрацию (50 нМ) (Kearns C.M. et al. Seminarsin Oncology, 3(6) p. 16-23, 1995). Доцетаксел, тригидрат 13-сложного эфира (2R,3S)-N-трет-бутил-N-карбокси-3-фенилизосерина и 5-20-эпокси-1,2,4,7,10,13-гексагидрокситакс-11-ен-9-он 4-ацетат 2-бензоата, является коммерчески доступным в форме инъекционного раствора как TAXOTERE. Доцетаксел показан для лечения рака молочной железы. Доцетаксел представляет собой полусинтетическое производное паклитаксела(q.v.), получаемое с использованием природного вещества-предшественника, 10-деацетилбаккатина III,извлекаемого из иголки тиса европейского. Алкалоиды барвинка розового представляют собой фазоспецифические антинеопластические средства, получаемые из растения семейства барвинковых. Алкалоиды барвинка розового действуют в фазе М (митоз) клеточного цикла путем специфического связывания с тубулином. Как следствие, связанная молекула тубулина не способна полимеризоваться с образованием микротрубочек. Митоз, как полагают,подавляется в метафазе в результате протекания гибели клетки. Примеры алкалоидов барвинка розового включают винбластин, винкристин и винорелбин, но не ограничиваются этим. Винбластин, сульфат винкалейкобластина, является коммерчески доступным как VELBAN в форме инъекционного раствора. Хотя он имеет возможное назначение как терапия второй линии для различных солидных опухолей, его в основном назначают в лечении рака яичка и различных лимфом,включая болезнь Ходжкина; и лимфоцитарных и гистиоцитарных лимфом. Миелосупрессия представляет собой побочный эффект винбластина, ограничивающий его дозу. Винкристин, винкалейкобластин, 22-оксо-, сульфат, является коммерчески доступным как ONCOVIN в форме инъекционного раствора. Винкристин назначают для лечения острых форм лейкемии и также обнаружено применение в схемах лечения ходжкинских и неходжкинских злокачественных лимфом. Алопеция и неврологические эффекты являются наиболее распространенными побочными эффектами винкристина и в меньшей степени возникают эффекты миелосупрессии и мукозита желудочнокишечного тракта. Винорелбин, 3',4'-дидегидро-4'-дезокси-C'-норвинкалейкобластин [R-(R,R)-2,3-дигидроксибутандиоат (1:2)(соль)], коммерчески доступный в форме инъекционного раствора винорелбинтартрата (NAVELBINE), представляет собой полусинтетический алкалоид барвинка розового. Винорелбин назначают в виде взятого в отдельности средства или в комбинации с другими химиотерапевтическими средствами, такими как цисплатин, в лечении различных солидных опухолей, в особенности немелкоклеточного рака легких, распространенного рака молочной железы и гормональнорезистентного рака предстательной железы. Миелосупрессия представляет собой наиболее распространенный побочный эффект винорелбина, ограничивающий его дозу. Координационные комплексы платины Координационные комплексы платины представляют собой фазонеспецифические противораковые средства, которые являются взаимно активными с ДНК. Комплексы платины проникают в клетки опухоли, подвергаются гидратации и образуют внутри- и межнитевые поперечные сшивки с ДНК, вызывая неблагоприятные биологические эффекты в опухоли. Примеры координационных комплексов платины включают оксалиплатин, цисплатин и карбоплатин, но не ограничиваются этим. Цисплатин, цис-диаминдихлорплатина, является коммерчески доступной как PLATINOL в форме инъекционного раствора. Цисплатин в первую очередь назначают при лечении метастатического рака яичек и яичников и распространенного рака мочевого пузыря. Карбоплатин, диамино[1,1-циклобутандикарбоксилат(2-)-O,O']платины, является коммерчески доступным как PARAPLATIN в форме инъекционного раствора. Карбоплатин в основном назначают в лечении первой и второй линии распространенного рака яичников. Алкилирующие средства Алкилирующие средства представляют собой фазонеспецифические противораковые средства и сильные электрофилы. Обычно, алкилирующие средства образуют ковалентные связи путем алкилирования с ДНК посредством нуклеофильных фрагментов молекулы ДНК, таких как фосфатные, амино-,- 16022637 сульфгидрильные, гидроксильные, карбоксильные и имидазольные группы. Такое алкилирование нарушает функцию нуклеиновой кислоты, что приводит к гибели клетки. Примеры алкилирующих средств включают мустаргены, такие как циклофосфамид, мелфалан и хлорамбуцил; алкилсульфонаты, такие как бусульфан; нитрозомочевины, такие как кармустин; и триазены, такие как дакарбазин, но не ограничиваются этим. Циклофосфамид, 2-[бис-(2-хлорэтил)амино]тетрагидро-2 Н-1,3,2-оксазафосфорин 2-оксид моногидрат, является коммерчески доступным в форме инъекционного раствора или таблеток как CYTOXAN. Циклофосфамид назначают в виде отдельно взятого средства или в комбинации с другими химиотерапевтическими средствами при лечении злокачественных форм лимфомы, множественной миеломы и форм лейкемии. Мелфалан, 4-[бис(2-хлорэтил)амино]-L-фенилаланин, является коммерчески доступным в форме инъекционного раствора или таблеток как ALKERAN. Мелфалан назначают для паллиативного лечения множественной миеломы и неоперабельного эпителиального рака яичников. Подавление деятельности костного мозга является наиболее распространенным ограничивающим его дозу побочным эффектом мелфалана. Хлорамбуцил, 4-[бис-(2-хлорэтил)амино]бензолбутановая кислота, является коммерчески доступным в форме таблеток LEUKERAN. Хлорамбуцил назначают для паллиативного лечения хронической лимфатической лейкемии и злокачественных форм лимфом, таких как лимфосаркома, гигантофолликулярная лимфома и болезнь Ходжкина. Бусульфан, 1,4-бутандиол диметансульфонат, является коммерчески доступным в форме таблетокMYLERAN. Бусульфан назначают для паллиативного лечения хронической гранулоцитной лейкемии. Кармустин, 1,3-[бис-(2-хлорэтил)-1-нитрозомочевина], является коммерчески доступным в виде отдельно взятых ампул с лиофилизованным веществом BiCNU. Кармустин назначают для паллиативного лечения в виде отдельно взятого средства или в комбинации с другими средствами, опухолей мозга,множественной миеломы, болезни Ходжкина и неходжкинских форм лимфомы. Дакарбазин, 5-(3,3-диметил-1-триазено)имидазол-4-карбоксамид, является коммерчески доступным в отдельно взятых ампулах с веществом DTIC-Dome. Дакарбазин назначают для лечения метастатической злокачественной меланомы, а в комбинации с другими средствами для лечения второй линии болезни Ходжкина. Антибиотические антинеопластические средства Антибиотические антинеопластические средства представляют собой фазонеспецифические средства, которые связываются с ДНК или интеркалируют в ДНК. Обычно, такое действие приводит к разрыву стабильных комплексов или нитей ДНК, который нарушает обычную функцию нуклеиновых кислот,что приводит к гибели клетки. Примеры антибиотических антинеопластических средств включают актиномицины, такие как дактиномицин, антроциклины, такие как даунорубицин и доксорубицин; и блеомицины, но не ограничиваются этим. Дактиномицин, также называемый Актиномицин D, является коммерчески доступным в инъекционной форме как COSMEGEN. Дактиномицин назначают для лечения опухоли Вильмса и рабдомиосаркомы. Даунорубицин, (8S-цис-)-8-ацетил-10-[(3-амино-2,3,6-тридеоксиL-ликсогексопиранозил)окси]7,8,9,10-тетрагидро-6,8,11-тригидрокси-1-метокси-5,12 нафтацендион гидрохлорид, является коммерчески доступным в липосомальной инъекционной форме как DAUNOXOME или в виде инъекционного препарата CERUBIDINE. Даунорубицин назначают для инициирования ремиссии в лечении острой нелимфоцитарной лейкемии и распространенной ВИЧ-ассоциированной саркомы Капоши. Доксорубицин, (8S,10S)-10-[(3-амино-2,3,6-тридеоксиL-ликсогексопиранозил)окси]-8-гликолоил, 7,8,9,10-тетрагидро-6,8,11-тригидрокси-1-метокси-5,12 нафтацендион гидрохлорид, является коммерчески доступным в инъекционной форме как RUBEX или ADRIAMYCIN RDF. Доксорубицин в основном назначают для лечения острой лимфобластной лейкемии и острой миелобластной лейкемии, но также является полезным компонентом в лечении некоторых солидных опухолей и форм лимфомы. Блеомицин, смесь цитотоксичных гликопептидных антибиотиков, выделенных из штамма Streptomyces verticillus, является коммерчески доступным как BLENOXANE. Блеомицин назначают в качестве паллиативного лечения, в виде отдельно взятого средства или в комбинации с другими средствами, плоскоклеточного рака, форм лимфомы и форм рака яичек. Ингибиторы топоизомеразы II Ингибиторы топоизомеразы II включают эпиподофиллотоксины, но не ограничиваются этим. Эпиподофиллотоксины представляют собой фазоспецифические антинеопластические средства,полученные из растения мандрагора. Эпиподофиллотоксины обычно действуют на клетки в фазах S и G2 клеточного цикла путем образования тройного комплекса с топоизомеразой II и путем вызывания разрывов нитей ДНК. Разрывы нитей аккумулируются и протекает гибель клеток. Примеры эпиподофиллотоксины включают этопозид и тенопозид, но не ограничиваются этим. Этопозид, 4'-деметилэпиподофиллотоксин 9[4,6-0-(R)-этилиденD-глюкопиранозид], является ко- 17022637 ммерчески доступным в форме инъекционного раствора или капсул VePESID и общеизвестен как VP16. Этопозид назначают в форме отдельно взятого средства или в комбинации с другими химиотерапевтическими средствами в лечении рака яичка и немелкоклеточного рака легких. Тенипозид, 4'-деметилэпиподофиллотоксин 9[4,6-0-(R)-тенилиденD-глюкопиранозид], является коммерчески доступным в форме инъекционного раствора VUMON и общеизвестен как VM-26. Тенипозид назначают в форме отдельно взятого средства или в комбинации с другими химиотерапевтическими средствами в лечении острой лейкемии у детей. Антиметаболитные неопластические средства Антиметаболитные неопластические средства представляют собой фазоспецифические антинеопластические средства, которые действуют в фазе S (синтез ДНК) клеточного цикла с ингибированием синтеза ДНК или с ингибированием синтеза пуринового или пиримидинового основания и посредством этого с ограничением синтеза ДНК. Как следствие, фаза S не протекает, и происходит гибель клетки. Примеры антиметаболитных антинеопластических средств включают флуороурацил, метотрексат, цитарабин, меркаптопурин, тиогуанин и гемцитабин, но не ограничиваются этим. 5-Флуороурацил, 5-фтор-2,4-(1 Н,3 Н)пиримидиндион, является коммерчески доступным как флуороурацил. Введение 5-флуороурацила приводит к ингибированию синтеза тимидилата и также к внедрению как в РНК, так и в ДНК. Обычно результатом этого является гибель клетки. 5-Флуороурацил назначают в форме отдельно взятого средства или в комбинации с другими химиотерапевтическими средствами в лечении карцином молочной железы, толстой кишки, прямой кишки, желудка и поджелудочной железы. Другие аналоги фторпиримидина включают 5-фтордезоксиуридин (флоксуридин) и 5 фтордезоксиуридинмонофосфат. Цитарабин, 4-амино-1D-арабинофуранозил-2 (1 Н)-пиримидинон, является коммерчески доступным как CYTOSAR-U и общеизвестен как Ara-С. Полагают, что цитарабин проявляет клеточнофазовую специфичность в S-фазе путем ингибирования удлинения цепи ДНК посредством терминального встраивания цитарабина в растущую цепь ДНК. Цитарабин назначают в форме отдельно взятого средства или в комбинации с другими химиотерапевтическими средствами при лечении острой лейкемии. Другие цитидиновые аналоги включают 5-азацитидин и 2',2'-дифтордезоксицитидин (гемцитабин). Меркаптопурин, 1,7-дигидро-6 Н-пурин-6-тион моногидрат, является коммерчески доступным какPURINETHOL. Меркаптопурин проявляет клеточнофазовую специфичность в S-фазе путем ингибирования синтеза ДНК по не установленному точно механизму. Меркаптопурин назначают в форме отдельно взятого средства или в комбинации с другими химиотерапевтическими средствами при лечении острой лейкемии. Полезным аналогом меркаптопурина является азатиоприн. Тиогуанин, 2-амино-1,7-дигидро-6 Н-пурин-6-тион, является коммерчески доступным как TABLOID. Тиогуанин проявляет клеточнофазовую специфичность в S-фазе путем ингибирования синтеза ДНК по не установленному точно механизму. Тиогуанин назначают в форме отдельно взятого средства или в комбинации с другими химиотерапевтическими средствами при лечении острой лейкемии. Другие пуриновые аналоги включают пентостатин, эритрогидроксинониладенин, флударабинфосфат и кладрибин. Гемцитабин, 2'-дезокси-2',2'-дифторцитидинмоногидрохлорид (-изомер), является коммерчески доступным как GEMZAR. Гемцитабин проявляет клеточнофазовую специфичность в S-фазе и в результате блокировки развития клеток на границе фаз G1/S. Гемцитабин назначают в комбинации с цисплатином при лечении локально распространенного немелкоклеточного рака легких и как таковой при лечении локально распространенного рака поджелудочной железы. Метотрексат, N-[4(2,4-диамино-6-птеридинил)метил]метиламино]бензоил]-L-глутаминовая кислота, является коммерчески доступным как метотрексат натрий. Метотрексат проявляет клеточнофазовые эффекты специфично в S-фазе путем ингибирования синтеза, репарации и/или репликации ДНК посредством ингибирования редуктазы дигидрофолиевой кислоты, которая требуется для синтеза пуриновых нуклеотидов и тимидилата. Метотрексат назначают в форме отдельно взятого средства или в комбинации с другими химиотерапевтическими средствами при лечении хориокарциномы, менингеального лейкоза, неходжкинской лимфомы и карцином молочных желез, органов головы, органов шеи, яичников и мочевого пузыря. Ингибиторы топоизомеразы I Камптотецины, включающие камптотецин и производные камптотецина, коммерчески доступны или находятся в стадии разработки в качестве ингибиторов топоизомеразы I. Цитотоксическая активность камптотецинов, как полагают, связана с его ингибирующей активностью в отношении топоизомеразы I. Примеры камптотецинов включают иринотекан, топотекан и различные оптические формы 7-(4 метилпиперазинометилен)-10,11-этилендиокси-20-камптотецина, описанные ниже, но не ограничиваются этим. ИринотеканHCl, (4S)-4,11-диэтил-4-гидрокси-9-[(4-пиперидинопиперидино)карбонилокси]-1 Н-пирано[3',4',6,7]индолизино[1,2-b]хинолин-3,14(4 Н,12 Н)-дион гидрохлорид, является коммерчески доступным в форме инъекционного раствора CAMPTOSAR. Иринотекан является производным камптотеци- 18022637 на, которое связывается, наряду с его активным метаболитом SN-38, с комплексом топоизомераза I-ДНК. Полагают, что цитотоксичность возникает как результат невосстанавливаемых разрывов двойных нитей,вызванных взаимодействием комплекса топоизомераза I:ДНК:иринотекан или тройного комплекса SN-38 с ферментами репликации. Иринотекан назначают для лечения метастатического рака толстой кишки или прямой кишки. ТопотеканHCl, (S)-10-[(диметиламино)метил]-4-этил-4,9-дигидрокси-1 Н-пирано[3',4',6,7]индолизино[1,2-b]хинолин-3,14-(4 Н,12 Н)-дион моногидрохлорид, является коммерчески доступным в форме инъекционного раствора HYCAMTIN. Топотекан представляет собой производное камптотецина, которое связывается с комплексом топоизомераза I-ДНК и предотвращает повторное лигирование однонитевых разрывов, вызванных топоизомеразой I в условиях деформации скручивания молекулы ДНК. Топотекан назначают для лечения второй линии метастатической карциномы яичника и мелкоклеточного рака легких. Гормоны и гормональные аналоги Гормоны и гормональные аналоги являются полезными соединениями для лечения раковых заболеваний, в которых существует взаимозависимость между гормоном(ами) и ростом и/или отсутствием роста рака. Примеры гормонов и гормональные аналоги, полезные в лечении рака, включают адренокортикостероиды, такие как преднизон и преднизолон, которые являются полезными в лечении злокачественной лимфомы и острой лейкемии у детей; аминоглютетимид и другие ингибиторы ароматазы, такие как анастрозол, летразол, воразол и экземестан, полезные в лечении адренокортикальной карциномы и гормонозависимой карциномы молочных желез, содержащих рецепторы эстрогена, прогестины, такие как мегестролацетат, полезные в лечении гормонозависимого рака молочных желез и эндометриальной карциномы; эстрогены, андрогены и антиандрогены, такие как флутамид, нилутамид, бикалутамид, ципротерон ацетат и 5-редуктазы, такие как финастерид и дутастерид, полезные в лечении карциномы предстательной железы и доброкачественной гипертрофии предстательной железы; антиэстрогены, такие как тамоксифен, торемифен, ралоксифен, дролоксифен, йодоксифен, а также селективные модуляторы эстрогеновых рецепторов (SERMS), такие как селективные модуляторы эстрогеновых рецепторов, описанные в патентах США 5681835, 5877219 и 6207716, полезные в лечении гормонозависимой карциномы молочных желез и других чувствительных к действию гормонов раковых заболеваний; и гонадотропинвысвобождающий гормон (GnRH) и его аналоги, которые стимулируют высвобождение лютеинизирующего гормона (LH), и/или фолликулостимулирующий гормон (FSH) для лечения карциномы предстательной железы, например агонисты и антагонисты LHRH, такие как гезерелинацетат и леупролид, но не ограничиваются этим. Ингибиторы путей сигнальной трансдукции Ингибиторы путей сигнальной трансдукции представляют собой те ингибиторы, которые блокируют или ингибируют химический процесс, который вызывает (индуцирует) внутриклеточное изменение. Как используют в этом документе, это изменение представляет собой пролиферацию или дифференциацию. Ингибиторы сигнальной трансдукции, полезные в настоящем изобретении, включают ингибиторы рецепторных тирозинкиназ, нерецепторных тирозинкиназ, блокаторов доменов SH2/SH3, сериновых/треониновых киназ, фосфотидилинозитол-3-киназ, миоинозитольной передачи сигнала и Rasонкогенов. Несколько протеинтирозинкиназ катализируют фосфорилирование специфических тирозильных остатков в различных белках, вовлеченных в регуляцию клеточного роста. Такие протеинтирозинкиназы могут быть грубо классифицированы как рецепторные или нерецепторные киназы. Рецепторные тирозинкиназы представляют собой трансмембранные белки, имеющие межклеточный лигандсвязывающий домен, трансмембранный домен и тирозинкиназный домен. Рецепторные тирозинкиназы участвуют в регуляции клеточного роста и, как правило, называются рецепторами факторов роста. Неприемлемая или нерегулируемая активация многих из этих киназ, то есть аберрантная активность рецепторов факторов роста, например, посредством сверхэкспрессии или мутации, как было показано, приводит к неконтролируемому росту клетки. В соответствии с этим аберрантная активность таких киназ связана с злокачественным ростом ткани. Следовательно, ингибиторы таких киназ могли бы обеспечить способы лечения рака. Рецепторы фактора роста включают, например, рецептор эпидермального фактора роста (EGFr), рецептор тромбоцитарного фактора роста (PDGFr), рецептор erbB2, рецепторerbB4, рецептор ret, рецептор сосудистого эндотелиального фактора роста (VEGFr), тирозинкиназу с иммуноглобулинподобными доменами и с гомологичными эпидермальному фактору роста доменами (TIE2), рецептор инсулиноподобного фактора роста-I (IGFI), макрофагальный колониестимулирующий фактор (cfms), BTK, ckit, cmet, рецепторы фибробластного фактора роста (FGF), рецепторы Trk (TrkA, TrkB и TrkC), эфриновые (eph) рецепторы и протоонкоген RET. Несколько ингибиторов рецепторов роста находятся в стадии разработки и включают антагонисты лигандов, антитела, ингибиторы тирозинкиназы и антисмысловые олигонуклеотиды. Рецепторы факторов роста и агенты, которые ингибируют функцию рецепторов факторов роста, описаны (см., например, публикации Kath, John C., Exp. Opin. Ther. Patentpress 1994, London). Тирозинкиназы, которые не являются киназами рецептора фактора роста, называют нерецепторными тирозинкиназами. Нерецепторные тирозинкиназы, полезные в настоящем изображении, которые являются мишенями или потенциальными мишенями противораковых лекарственных средств, включаютcSrc, Lck, Fyn, Yes, Jak, cAbl, FAK (киназа фокальной адгезии), тирозинкиназу Брутона и Bcr-Abl. Такие нерецепторные киназы и средства, которые ингибируют функцию нерецепторной тирозинкиназы, описаны (см. Sinh S. and Corey S.J. (1999) Journal of Hematotherapy and Stem Cell Research 8 (5):465-80; и BolenJ.B., Brugge J.S. (1997) Annual review of Immunology, 15:371-404). Блокаторы доменов SH2/SH3 представляют собой средства, которые нарушают связывание доменовSH2 или SH3 у ряда ферментов или адапторных белков, включая субъединицу р 85 PI3-K, киназы Srcсемейства, адапторные молекулы (She, Crk, Nek, Grb2) и Ras-GAP. Домены SH2/SH3 в качестве мишеней для противораковых лекарственных средств обсуждаются в публикации Smithgall Т.Е. (1995), Journal ofPharmacological and Toxicological Methods, 34(3) 125-32. Ингибиторы сериновых/треониновых киназ, включая блокаторы МАР-киназного каскада, которые включают блокаторы Raf-киназ (Rafk), митоген- или внеклеточно регулируемой киназы (MEK) и экстраклеточно регулируемых киназ (ERK); и блокаторы членов семейства протеинкиназы С (PKC), включая блокаторы подтипов PKC (альфа, бета, гамма, эпсилон, мю, лямбда, йота, зета), семейства киназ lkB(IKKa, IKKb), киназ семейства PKB, членов семейства киназ Akt и рецепторных киназ TGF-бета. Такие сериновые/треониновые киназы и их ингибиторы описаны (см. Yamamoto Т., Taya S., Kaibuchi K. (1999),Journal of Biochemistry. 126 (5) 799-803; Brodt P, Samani A., and Navab R. (2000), Biochemical Pharmacology, 60. 1101-1107; Massague, J., Weis-Garcia, F. (1996) Cancer Surveys. 27:41-64; Philip P.A., and HarrisLetters, (10), 2000, 223-226; патенте США 6268391; и Martinez-Lacaci L. et al. Int. J. Cancer (2000), 88(1),44-52). Ингибиторы членов семейства фосфатидилинозитол-3-киназы, включающие блокаторы PI3-киназы,ATM, DNA-PK и Ku, также являются полезными в настоящем изобретении (такие киназы обсуждаются в публикациях Abraham R.T. (1996), Current Opinion in Immunology. 8(3) 412-8; Canman C.E., Lim D.S.(1998), Oncogene 17 (25) 3301-3308; Jackson S.P. (1997), International Journal of Biochemistry and Cell Biology. 29 (7):935-8; и Zhong H. et al. Cancer Res, (2000) 60(6), 1541-1545). Также полезными в комбинации с настоящим изобретением являются ингибиторы миоинозитольной передачи сигналов, такие как блокаторы фосфолипазы С и аналоги миоинозитола. Такие ингибиторы передачи сигналов описаны (см. Powis G. and Kozikowski A. (1994) New Molecular Targets forCancer Chemotherapy ed., Paul Workman and David Kerr, CRC Press 1994, London). Другой группой ингибиторов путей сигнальной трансдукции являются ингибиторы онкогена Ras. Такие ингибиторы включают ингибиторы фарнезилтрансферазы, геранилгеранилтрансферазы и СААХпротеаз, а также антисмысловые олигонуклеотиды, рибозимы и иммунотерапию. Было показано, что такие ингибиторы блокируют активацию Ras в клетках, содержащих мутант Ras дикого типа, действуя,таким образом, как антипролиферативные средства. Ингибирование онкогена Ras обсуждается (см. вAshby M.N. (1998), Current Opinion in Lipidology, 9(2)99-102; и BioChim. Biophys. Acta, (1989) 1423(3):1930). Как упомянуто выше, антитела-антагонисты в отношении связывания лиганда рецепторной киназы также могут служить в качестве ингибиторов сигнальной трансдукции. Эта группа ингибиторов пути сигнальной трансдукции включает применение гуманизированных антител к внеклеточному лигандсвязывающему домену рецепторных тирозинкиназ. Например, EGFR-специфичное антитело ImcloneTumor Growth in Mice, Cancer Res. (2000) 60, 5117-5124). Антиангиогенные средства Антиангиогенные средства, включающие ингибиторы ангиогенезе нерецепторных MEK-киназ,также могут быть полезными. Антиангиогенные средства, такие как те, которые ингибируют эффекты сосудистого эндотелиального фактора роста (например, моноклональное антитело бевацизумаб (Avastin) к сосудистому эндотелиально-клеточному фактору роста, и соединения, которые работают по другим механизмам, например линомид, ингибиторы функции интегрина v3, эндостатин и ангиостатин). Иммунотерапевтические средства Средства, используемые в иммунотерапевтических схемах, также могут быть полезными в комбинации с соединениями формулы (I). Иммунотерапевтические подходы, включая, например, подходы exvivo и in-vivo к повышению иммуногенности клеток опухоли пациента, например трансфекция цитоки- 20022637 нами, такими как интерлейкин 2, интерлейкин 4 или гранулоцитарно-макрофагальный колониестимулирующий фактор, подходы к снижению Т-клеточной толерантности, подходы с использованием трансфицированных иммунных клеток, таких как цитокинтрансфицированные опухолевые клеточные линии, и подходы с использованием антиидиотипических антител. Проапоптозные средства Средства, используемые в проапоптозных схемах (например, антисмысловые олигонуклеотиды bcl2), также могут быть полезными в комбинации настоящего изобретения. Ингибиторы сигнализации клеточного цикла Ингибиторы сигнализации в клеточном цикле ингибируют молекулы, вовлеченные в контроль клеточного цикла. Взаимодействие семейства протеинкиназ, называемого циклинзависимые киназы (CDK),с семейством белков, называемым циклины, контролирует продвижение по клеточному циклу у эукариот. Скоординированная активация и инактивация разных комплексов циклин/CDK необходима для нормального продвижения по клеточному циклу. Несколько ингибиторов сигнализации в клеточном цикле находятся в разработке. Например, примеры циклинзависимых киназ, включая CDK2, CDK4 и CDK6, и их ингибиторы описаны (см., например, публикации Rosania et al. Exp. Opin. Ther. Patents (2000), 10(2):215-230). В одном варианте осуществления комбинация настоящего изобретения содержит соединение формулы I, или его соль, или сольват и по меньшей мере одно антинеопластическое средство, выбранное из антимикротубулиновых средств, координационных комплексов платины, алкилирующих агентов, антибиотических средств, ингибиторов топоизомеразы II, антиметаболитов, ингибиторов топоизомеразы I,гормонов и гормональных аналогов, ингибиторов пути сигнальной трансдукции, ингибиторов ангиогенеза на основе нерецепторной тирозинкиназы MEK, иммунотерапевтических средств, проапоптозных средств и ингибиторов сигнализации в клеточном цикле. В одном варианте осуществления комбинация настоящего изобретения содержит соединение формулы I, или его соль, или сольват и по меньшей мере одно антинеопластическое средство, которое представляет собой антимикротубулиновое средство, выбранное из дитерпеноидов и алкалоидов барвинка розового. В дополнительном варианте осуществления по меньшей мере одно антинеопластическое средство представляет собой дитерпеноид. В дополнительном варианте осуществления по меньшей мере одно антинеопластическое средство представляет собой алкалоид барвинка розового. В одном варианте осуществления комбинация настоящего изобретения содержит соединение формулы I, или его соль, или сольват и по меньшей мере одно антинеопластическое средство, которое представляет собой координационный комплекс платины. В дополнительном варианте осуществления по меньшей мере одно антинеопластическое средство представляет собой паклитаксел, карбоплатин или винорелбин. В дополнительном варианте осуществления по меньшей мере одно антинеопластическое средство представляет собой карбоплатин. В дополнительном варианте осуществления по меньшей мере одно антинеопластическое средство представляет собой винорелбин. В дополнительном варианте осуществления по меньшей мере одно антинеопластическое средство представляет собой паклитаксел. В одном варианте осуществления комбинация настоящего изобретения содержит соединение формулы I, или его соли, или сольваты и по меньшей мере одно антинеопластическое средство, которое представляет собой ингибитор пути сигнальной трансдукции. В дополнительном варианте осуществления ингибитор пути сигнальной трансдукции представляет собой ингибитор киназы рецепторов фактора роста VEGFR2 (рецептор 2 сосудистого эндотелиального фактора роста), TIE2 (тирозинкиназа с иммуноглобулином и повторами 2 эпидермальногофактора роста),PDGFR (рецептор тромбоцитарного фактора роста), ВТС, erbB2, EGFr (рецептор эпидермального фактора роста), IGFR-1 (рецептор инсулинподобного фактора роста 1), TrkA, TrkB, TrkC или c-fms. В дополнительном варианте осуществления ингибитор пути сигнальной трансдукции представляет собой ингибитор сериновой/треониновой киназы rafk, akt или PKC-zeta. В дополнительном варианте осуществления ингибитор пути сигнальной трансдукции представляет собой ингибитор нерецепторной тирозинкиназы, выбранной из семейства киназ src. В дополнительном варианте осуществления ингибитор пути сигнальной трансдукции представляет собой ингибитор c-src. В дополнительном варианте осуществления ингибитор пути сигнальной трансдукции представляет собой ингибитор онкогена Ras, выбранный из ингибиторов фарнезилтрансферазы и геранилгеранилтрансферазы. В дополнительном варианте осуществления ингибитор пути сигнальной трансдукции представляет собой ингибитор сериновой/треониновой киназы, выбранной из группы, состоящей из PI3K-киназы. В дополнительном варианте осуществления ингибитор пути сигнальной трансдукции представляет собой двойной ингибитор EGFr/erbB2, например N-3-хлор-4-[(3-фторбензил)окси]фенил-6-[5-([2-(метансульфонил)этил]аминометил)-2-фурил]-4-хиназолинамин (структура ниже) В одном варианте осуществления комбинация настоящего изобретения содержит соединение формулы I, или его соль, или сольват и по меньшей мере одно антинеопластическое средство, которое представляет собой ингибитор сигнализации в клеточном цикле. В дополнительном варианте осуществления ингибитор сигнализации в клеточном цикле представляет собой ингибитор CDK2, CDK4 или CDK6. В одном варианте осуществления млекопитающее в способах и применениях настоящего изобретения представляет собой человека. Хотя возможно то, что для применения в терапии терапевтически эффективные количества комбинаций настоящего изобретения могут быть введены в форме исходно взятых комбинаций, предпочтительно, чтобы комбинации присутствовали в форме фармацевтической композиции или фармацевтических композиций. В соответствии с этим изобретение дополнительно обеспечивает фармацевтические композиции, которые включают соединение С 2 и/или mTOR-ингибирующее соединение и один или более фармацевтически приемлемых носителей. Комбинации настоящего изобретения являются такими,как они описаны выше. Носитель(и) должен(ны) быть приемлемым(ыми) в смысле наличия совместимости с другими ингредиентами препарата, должен(ны) быть в состоянии обеспечивать фармацевтический препарат и должен(ны) быть безвредным(ыми) для его(их) реципиента. В соответствии с другим аспектом изобретения также обеспечивают способ получения фармацевтического препарата, включающий смешение соединения С 2 и/или mTOR-ингибирующего соединения с одним или более фармацевтически приемлемыми носителями. Как упомянуто выше, такие элементы используемой фармацевтической комбинации могут присутствовать в отдельно взятых фармацевтических композициях или могут быть смешаны вместе в один фармацевтический препарат. Фармацевтические препараты могут быть представлены в единичных дозированных формах, содержащих заданное количество активного ингредиента на единичную дозу. Как известно специалистам в данной области, количество активного ингредиента на дозу будет зависеть от состояния, подлежащего лечению, пути введения и возраста, веса и состояния пациента. Предпочтительными единичными дозированными препаратами являются препараты, содержащие суточную дозу или субдозу активного ингредиента, или ее подходящую долю. Кроме того, такие фармацевтические препараты могут быть получены любым способом, хорошо известным в фармацевтической области. Соединение С 2 и mTOR-ингибирующее соединение могут быть введены любым приемлемым путем. Подходящие пути включают пероральный, ректальный, назальный, местный (включая буккальный и сублингвальный), вагинальный и парентеральный (включая подкожный, внутримышечный, внутривенный, интрадермальный, интратекальный и эпидуральный) пути. Будет ясно, что предпочтительный путь может варьироваться, например, в зависимости от состояния реципиента, комбинации и от ракового заболевания, которое должно быть вылечено. Также будет ясно, что каждое из вводимых средств может быть введено одинаковыми или различными путями и что соединение С 2 и mTOR-ингибирующее соединение могут быть смешаны вместе в фармацевтическую композицию/фармацевтический препарат. Подходяще соединение С 2 и mTOR-ингибирующее соединение вводят перорально отдельными фармацевтическими композициями. Соединения или комбинации данного изобретения включают в удобные дозированные формы, такие как капсулы, таблетки или инъекционные препараты. Применяют твердые или жидкие фармацевтические носители. Твердые носители включают крахмал, лактозу, дигидрат сульфата кальция, фарфоровую глину (сульфат кальция), сахарозу, тальк, желатин, агар, пектин, гуммиарабик, стеарат магния и стеариновую кислоту. Жидкие носители включают сироп, арахисовое масло, оливковое масло, раствор хлорида натрия и воду. Подобно тому, носитель может включать вещество с пролонгированным высвобождением, такое как глицерилмоностеарат или глицериодистеарат, как таковое или с воском. Количество твердого носителя варьируется в широких пределах, но предпочтительно будет составлять от приблизительно 25 мг до приблизительно 1 г на единицу дозирования. В том случае, когда используют жидкий носитель, препарат будет подходящим образом находиться в форме сиропа, эликсира, эмульсии, мягкой желатиновой капсулы, стерильной инъецируемой жидкости, например в ампуле или в водной или неводной жидкой суспензии. Например, для перорального введения в форме таблетки или капсулы компонент активного лекар- 22022637 ственного средства может быть соединен с перорально вводимым, нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и тому подобное. Порошки приготавливают растиранием соединения в порошок до подходящего размера мелких частиц и смешением с подобно измельченным фармацевтическим носителем, таким как съедобный (пищевой) углевод, такой как,например, крахмал или маннит. Также могут присутствовать ароматизирующие, консервирующие, диспергирующие и окрашивающие средства. Следует понимать, что в дополнение к ингредиентам, упомянутым выше, препараты могут включать другие средства, обычно применяемые в данной области при обращении к рассматриваемому типу препарата, например ингредиенты, подходящие для перорального введения, могут включать ароматизирующие средства. Как упомянуто, терапевтически эффективные количества комбинаций изобретения (соединение С 2 в комбинации с mTOR-ингибирующим соединением) вводят человеку. Обычно терапевтически эффективное количество вводимых средств настоящего изобретения будет зависеть от ряда факторов, включающих, например, возраст и вес субъекта, точное состояние, требующее лечение, тяжесть состояния,природа препарата и путь введения. В конечном итоге, терапевтически эффективное количество будет отводиться на усмотрение лечащего врача. Комбинации изобретения испытывают на эффективность, преимущественные и синергические свойства известными процедурами. Подходяще комбинации изобретения испытывают на эффективность, преимущественные и синергические свойства, как правило, в соответствии со следующими комбинированными методами анализа клеточной пролиферации. Клетки высевают на 384-луночные планшеты по 500 клеток/лунку в культуральной среде, приемлемой для каждого типа клеток, дополненной 10% FBS (фетальная бычья сыворотка) и 1% пенициллина/стрептомицина, и инкубируют в течение ночи при 37 С, 5% СО 2. Клетки обрабатывают сетчатым способом разбавленным раствором соединения А 2 (20 разбавленных растворов, в том числе без соединения, полученных методом двукратных разведений, начиная с 1-20 мкМ в зависимости от соединения) слева направо на 384-луночном планшете и также обрабатывают соединением В 2 (20 разбавленных растворов, в том числе без соединения, полученных методом двукратных разведений, начиная с 1-20 мкМ в зависимости от соединения) сверху вниз на 384-луночном планшете, и инкубируют так же,как упомянуто выше, в течение дополнительных 72 ч. В некоторых случаях соединения добавляют ступенчатым способом, и время инкубирования может составлять вплоть до 7 дней. Клеточный рост измеряют с использованием реагента Cell Titer Glo в соответствии с протоколом изготовителя и сигналы считывают на ридере PerkinElmer Envision, настроенный на люминесцентный режим с 0,5-секундным считыванием. Данные анализируют так, как описано ниже. Результаты выражают в процентах величины в момент времени t=0 и наносят на график в зависимости от концентрации соединения(ний). Значение в момент времени t=0 нормализовано к 100% и представляет собой число клеток, присутствующих в момент введения соединения. Клеточную реакцию определяют для каждого соединения и/или для каждой комбинации соединения с использованием 4- или 6 параметрового подбора кривой жизнеспособности клеток в зависимости от концентрации с использованием подключаемого блока IDBS XLfit для программного обеспечения Micrisoft Excel и с определением концентрации, которая требуется для 50%-ного ингибирования клеточного роста (gIC50). Поправку на фон делают путем вычитания значений для лунок, не содержащих клетки. Для каждой комбинации лекарственных средств вычисляют Комбинационный Индекс (CI), Превышение над действием одного наиболее сильнодействующего лекарственного средства (EOHSA) и Превышение над действием, оцененным методом анализа межлекарственных взаимодействий по Блиссу (EOBliss) в соответствии с известными способами, такими как, например, описаны в публикациях (см. Chou and Talalay (1984) Advances in Enzyme Regulation, 22, 37-55; и Berenbaum, MC (1981) Adv. Cancer Research, 35, 269-335). Анализ 1 В анализе 1 и на соответствующих фиг. 1 и 2 используемое MEK-ингибирующее соединение представляет собой соединение А, которое определено в этом документе, и используемое mTOR-ингибирующее соединение представляет собой эверолимус, который имеет структуру, указанную ниже, и который представляет собой соединение В в анализе 1. Эверолимус Ингибирование клеточного роста и индукция апоптоза in vitro с помощью соединения А и соединения В (эверолимус) на панели опухолевых клеточных линий легкого Способы Клеточные линии и условия роста Опухолевые клеточные линии человека в случае рака легких, А 427, А 549, Calu1, Calu3, Calu6, CORL23, НОР 62, MV522, NCl-H1155, NCl-H1299, NCl-H1355, NCl-H1395, NCl-H157, NCl-H1573, NCl-H1666,NCl-1755, NCl-H1792, NCl-2009, NCl-H2030, NCl-H2122, NCl-H2291, NCl-H23, NCl-H2347, NCl-H358,NCl-H441, NCl-H460, NCl-H650, NCl-H727, SW1573 и SW900, выращивают в среде RPMI 1640, содержащей 10% FBS (фетальная бычья сыворотка). Данные мутации клеточной линии сопоставляют на предмет статуса генов RAS и RAF. Источником данных являются данные по скринингу, направленному на мутацию в клеточных линиях рака, опубликованные в виде части Catalog of Somatic Mutations in Cancer database (COSMIC) (Bamford S. Et al. Br. J. Cancer. 2004. 91:355-58) и/или полученные при секвенировании ДНК в лабораторных условиях. Анализ ингибирования клеточного роста и анализ данных по комбинациям Клетки высевают в 96-луночный планшет для тканевой культуры (NUNC 136102) со средой RPMI,содержащей 10% FBS, по 500-2000 клеток на лунку. Через приблизительно 24 ч после высевания клетки подвергают воздействию десяти разбавленных растворов, полученных двукратным или трехкратным последовательным разведением либо соединения А или В, либо комбинации двух средств в молярном соотношении 10:1 (соединения А и В соответственно). Диапазон конечных концентраций дозировок для соединения А составляет 2-1000 нМ и для соединения В составляет 0,2-100 нМ. Клетки инкубируют в присутствии соединений в течение 3 дней. Уровни АТР (аденозинтрифосфат) определяют путем добавления набора реагентов Cell Titer Glo (Promega) в соответствии с протоколом изготовителя. Кратко,набор реагентов Cell Titer Glo добавляют в каждый планшет, инкубированный в течение 20 мин, затем считывают люминесцентный сигнал на планшет-ридере SpectraMax L со временем интегрирования 0,5 с. Все анализы проводят по меньшей мере в двух повторностях. Ингибирование клеточного роста оценивают после обработки соединением или комбинацией соединений в течение трех дней и сравнивают сигнал с клетками, обработанными средой для лекарства(DMSO). Клеточный рост вычисляют относительно контрольных лунок, обработанных средой для лекарства (DMSO). Концентрацию соединения, которая ингибирует 50% клеточного роста, получаемого в контрольных лунках, (IC50) подвергают обратной интерполяции, где y=50% обработанных DMSO контрольных лунок, с использованием нелинейной регрессии с уравнением где А представляет собой минимальную реакцию (ymin), В отражает максимальную реакцию (ymax),С означает точку перегиба кривой (ЕС 50) и D представляет собой коэффициент Хилла. Эффекты комбинации в отношении эффективности оценивают с использованием Комбинационного Индекса (CI), который вычисляют с помощью полученных обратной интерполяцией значений IC50 и уравнения для взаимно не исключающих изоболограмм двух веществ, полученного Chou and Talalay(Chou Т.С., Talalay P. Adv. Enzyme Regul. 1984; 22:27-55) где IC50(a) представляет собой IC50 для соединения А; IC50(b) представляет собой IC50 для соединения В; Da обозначает концентрацию соединения А в комбинации с соединением В, которая ингибирует 50% клеточного роста; и Db обозначает концентрацию соединения В в комбинации с соединением А,которая ингибирует 50% клеточного роста. В общем и целом, значение CI0,9, от 0,9 до 1,1, или 1,1 указывает на синергию, аддитивность и антагонизм соответственно. В целом, чем меньше число CI, тем больше сила синергии. Эффекты комбинации в отношении шкалы ответных реакций количественно оценивают по EOHSA и по Превышению над действием Одного Наиболее сильнодействующего Лекарственного Средства при Общей Дозе (EOHSATD). Последнее основано на концепции нелинейного смешивания, которая ранее подробно описана (PetersonNovick S.J. J. Recept Signal Transduct Res. 2007, 27:125-46; Peterson J. Frontiers of Bioscience S2, 483-503, 2010). В этом исследовании значения EOHSA и EOHSATD определяют как увеличения улучшения [измерены как разница процентных точек (ppts)], полученные с помощью комбинации в сравнении с наилучшим отдельно взятым лекарственным средством с уровнем дозы его как компонента комбинации и с аналогичной общей дозой как в случае комбинации соответственно. Следовательно, показатель EOHSATD представляет собой меру более сильной синергии, чем показатель EOHSA, который сравнивает комбинацию с дозами ее компонента (лекарственного средства как такового), а не с общей дозой. Точные методы вычисления EOHSA описаны ранее. Для данной комбинации (с общей дозой D) достигается синергия по показателю EOHSATD, если средняя реакция для комбинации с общей дозой D является значительно лучше, чем для лекарственного средства 1 с дозой D или для лекарственного средства 2 с дозой D. Что касается сравнений по показателю EOHSA, сравнения по показателю EOHSATD проводят с использованием аппроксимирующих кривых зависимости дозаэффект при фиксированном соотношении доз и кривых для отдельно взятых соединений. Взаимодействия между соединениями А и В считают синергическими в том случае, когда показатель EOHSATD 0. В этом исследовании совместное введение соединений А и В показывает синергическое взаимодействие в конкретной клеточной линии в отношении эффективности или шкалы ответных реакций, если CI 0,9 или EOHSATD 0 ppt. Анализ клеточного апоптоза - активация каспазы 3/7 Для исследования индукции апоптоза клеточные линии высевают по 5000 клеток на лунку в 96 луночный планшет для тканевой культуры и оставляют прикрепляться в течение приблизительно 24 ч. Затем клетки обрабатывают соединениями так, как описано выше. Через 24 ч после обработки соединением определяют уровни активных каспазы 3 и каспазы 7 с помощью Caspase Glo 3/7 (Promega, cat G8093) в соответствии с инструкциями, предоставленными изготовителем. Результаты Эффекты ингибирования клеточного роста и апоптоза на опухолевые клеточные линии легкого под действием комбинации соединения А и соединения В Эффект ингибирования клеточного роста под действием ингибитора митогенакивированного белка/ERK-киназы (MEK) соединения А, ингибитора mTOR соединения В (эверолимус) и их комбинации определяют на панели из 29 опухолевых клеточных линий легкого человека. Средние значения IC50S (из по меньшей мере двух независимых экспериментов) и эффекты комбинации при IC50S сводят в табл. 1 с мутационным статусом RAS и RAF. Обращаясь к табл. 1, 17 из 29 линий проявляют чувствительность к соединению А с IC50s 100 нМ,тогда как 2 из 29 линий чувствительны к эверолимусу (IC50s 100 нМ). Комбинация соединения А и соединения В является синергической со значениями CI 0,19 и 0,62 в линиях А 549 и Н 2122 соответственно и со значениями EOHSATD между 4 и 25 ppts в 27 из 29 линий. Кроме того, комбинация соединения А и соединения В также показывает усиление ингибирования клеточного роста со значениями EOHSA между 5 и 40 ppts во всех 29 линиях. Следует отметить, значения CI не могут быть вычислены, следовательно,не применимы в том случае, когда значения отдельно взятого средства выходят за пределы испытываемого диапазона. Целевое, комбинированное введение соединения А и соединения В в опухолевые клеточные линии легкого показывает синергический эффект, демонстрируемый значениями CI 0,9 и EOHSATD 0, или приводит к значительно более сниженным значениям IC50 (1-22 нМ для соединения A и 0,1-2 нМ для соединения В в 25 из 29 линий) в сравнении со значениями IC50 для соединения А или соединения В, вводимых по отдельности, где по меньшей мере одно из отдельно взятых средств не приводит к 50%-ному ингибированию в испытуемом диапазоне. Репрезентативные кривые зависимости дозаэффект для ингибирования клеточного роста под действием соединения А и соединения В как таковых и их комбинации показаны для клеточных линий А 427, А 549, Calu6 и Н 2122 на фиг. 1. Эти опухолевые клеточные линии легкого дополнительно оценивают на способность соединения А,соединения В или комбинации соединения А и соединения В индуцировать апоптоз, который определяется по активности каспазы 3/7. Активация каспазы 3 является критерием индукции апоптоза. Клеточные линии А 427, А 549, Calu6, Н 2122, Н 1755, Н 2347, Н 727 и SW900 показывают усиление апоптоза в результате обработки комбинацией соединения А и соединения В относительно обработки отдельно взятым средством: соединением А или соединением В. Репрезентативные кривые активности каспазы 3/7 для клеточных линий А 427, А 549, Calu6 и Н 2122 приведены на фиг. 2. Таблица 1. Ингибирование клеточного роста соединением А, соединением В и их комбинацией в опухолевых клеточных линиях легкого человекаIC50: концентрация соединения(ий), которая снижает клеточный рост на 50%; 3 начения Комбинационного Индекса (CI), CI в Н 2122 = 0,62 + 0,11; CI в А 549 = 0,190,11;EOHSATD: Превышение над действием Одного Наиболее сильнодействующего Лекарственного Средства при Общей Дозе, измеренное в процентах;EOHSA: Превышение над действием Одного Наиболее сильнодействующего Лекарственного Средства, измеренное в процентах Анализ 2 В анализе 2 используемое MEK-ингибирующее соединение представляет собой соединение А, которое определено в этом документе, и используемое mTOR-ингибирующее соединение представляет собой рапамицин, который имеет структуру, указанную ниже Комбинация ингибиторов MEK (соединение А) и mTOR (рапамицин) на клеточных линиях рака 95 Клеточных линий рака обрабатывают ингибитором MEK (соединение А) или ингибиторомmTOR (mTORi, рапамицин) как таковыми или комбинацией обоих средств в соотношении 1:2(MEKi:mTORi), и клеточную пролиферацию/гибель измеряют после 3-дневного воздействия лекарственного средства. Кратко, клетки высевают на 384-луночные планшеты по 500 клеток/лунку в культуральную среду, подходящую для каждого типа клеток, дополненную 10% FBS и 1% пенициллина/стрептомицина, и инкубируют в течение ночи при 37 С в атмосфере 5% СО 2. Клетки обрабатывают ингибитором MEK (полученные последовательными двукратными разведениями разбавленные растворы с концентрацией, находящейся в диапазоне 7,3 мкМ-0,014 нМ) или ингибитором mTOR (полученные последовательными двукратными разведениями разбавленные растворы с концентрацией, находящейся в диапазоне 14,6 мкМ-0,112 нМ), или комбинацией обоих соединений, и инкубируют в течение 72 ч. Клеточный рост измеряют с использованием реагента Cell Titer Glo (CTG) (Promega) в соответствии с протоколом изготовителя. Данные анализируют с использованием средства обработки кривых аппроксимацией XLfit (IDBS Ltd.) для Microsoft Excel. Концентрации полумаксимального ингибирования IC50 роста(gIC50) и значения Ymin получают с использованием четырехпараметрового алгоритма аппроксимации кривой (алгоритм XLFit205). Результаты выражают в процентах для t=0 и откладывают в зависимости от концентрации соединения. Значение Т=0 нормализуют к 100% и составляет число клеток в момент времени введения соединения. Клеточную реакцию определяют для каждого соединения путем аппроксимации реакции в зависимости от концентрации с помощью 4- или 6-параметровой аппроксимации кривой с использованием программного обеспечения XLfit и путем определения концентрации, которая ингибирует 50% клеточного роста (gIC50), а также нижнего значения Y (Ymin) при любой концентрации соединения. Формулу, которая дана ниже, используют для вычисления Комбинационного Индекса (CI) взаимоисключающих лекарственных средств. Данные сообщают в виде logCI в том случае, когда вычисляют логарифмическое значение для CI.CI=IC50 (для а+b)/IC50 (для а)+IC50 (для b+а)/IC50 (для b),где a=MEKi и b=mTORi Определяют синергию, если CI1, аддитивность, если CI = 1, и антагонизм, если CI1. Принимая во внимание вариабельность этих методов анализа пролиферации, произвольно определяют logCI0,1 как антагонизм, между -0,1 и 0,1 как отсутствие значительного эффекта и -0,1 как синергию. Анализ gIC50 показывает, что для большей части клеточных линий комбинация обоих ингибиторов является благотворной, понижающей измеряемое значение gIC50 в сравнении со значением gIC50 для каждого ингибитора как такового. Концентрации 50%-ного ингибирования IC50 роста (gIC50) для MEK- иmTOR-ингибиторов как таковых и в комбинации по отношению к клеточным линиям рака представлены графически на фиг. 3. Для повторного графического представления gIC507,3 мкМ для MEKi и 14,6 мкМ для mTOR наносят на график как 7,3 и 14,6 мкМ соответственно. Комбинационный Индекс (CI) вычисляют так, как описано выше, и его логарифмические значения откладывают и представляют на фиг. 4. Эти данные демонстрируют, что комбинации MEKi и mTORi являются синергическими на большей части испытуемых клеточных линий (74/95 клеточных линий, 77,9%), хотя эта комбинация является антагонистической на нескольких испытуемых клеточных линиях (8/95 клеточных линий, 8,4%). Фиг. 5 демонстрирует, что для некоторых клеточных линий, хотя комбинация ингибиторов MEK иmTOR слегка влияет на gIC50, основное наблюдаемое различие находится в значении Ymin (максимальное наблюдаемое ингибирование), которое определяется как нижнее значение Y при любой концентрации соединения. В этом примере Ymin для ингибитора mTOR как такового, для ингибитора MEK как такового и для комбинации обоих лекарственных средств составляют 487, 257 и -73% соответственно. Подобный анализ проводят для всех клеточных линий и результаты по Ymin отражают на фиг. 6. Эти данные демонстрируют, что комбинация обоих лекарственных средств дает больший процент клеток,находящихся в состоянии гибели (ниже голубая линия, цитотоксичность, 44,2%), чем каждое лекарственное средство как таковое (mTORi=9,5% и MEKi=20%). Проводят подобный анализ при группировании клеток по мутационному статусу на основе KRAS иPI3K. Данные, отраженные в табл. 2, демонстрируют, что mTORi как таковой вызывает клеточную смерть (цитотоксическое действие) только на небольшой субпопуляции в испытуемой популяции клеточной линии рака независимо от мутационного статуса KRAS или PI3K. Однако хотя MEKi вызывает гибель значительного числа клеточных линий независимо от статуса KRAS (20%), он показывает более низкую активность в отношении клеточных линий с мутантной PI3K по сравнению с клеточными линиями с PI3K дикого типа (WT). Комбинация обоих лекарственных средств является активной в большем количестве клеточных линий во всех мутационных подгруппах в сравнении с отдельно взятым средством. Таблица 2. Процентное содержание клеточных линий рака, обработанных комбинацией ингибиторовMEK и mTOR, испытывающих гибель, на основе мутационного статуса KRAS или PI3K Анализ способности каждого соединения как такового или в комбинации вызывать клеточную гибель на основе мутационного статуса KRAS и PI3K одновременно отражен в табл. 3. Хотя ингибиторmTOR как отдельно взятое средство вызывает гибель нескольких клеточных линий (11%), ингибиторMEK как таковой индуцирует клеточную гибель в 30% клеточных линий с генотипом мутантныйKRAS/PI3K дикого типа. Комбинация обоих средств в дополнение к тому, что она является лучшей по общему числу клеточных линий, подвергающихся гибели, является активной в отношении не только по- 27022637 пуляции с генотипом мутантный KRAS/PI3K дикого типа, но на клетках с геном KRAS дикого типа, а также на клетках, кодирующих PI3K мутантной формы. Таблица 3. Процентное содержание клеточных линий рака, обработанных комбинацией ингибиторовMEK и mTOR, испытывающих гибель, на основе мутационного статуса KRAS и PI3K Подводя итог вышесказанному, комбинация ингибиторов MEK и mTOR является преимущественной в снижении концентрации каждого соединения, которая вызывает 50%-ное ингибирование роста, что приводит к синергическому эффекту на 77,9% испытуемых клеточных линий рака. Кроме того, эта комбинация вызывает клеточную гибель, при рассмотрении такой меры, как значение Ymin в сравнении с исходным числом клеток в момент времени Т=0, в большем количестве клеточных линий рака, чем каждое средство как таковое. Комбинация этих средств, как показано, является преимущественной в клеточных линиях с геном KRAS дикого типа независимо от мутационного статуса PI3K и в клеточных линиях с геном KRAS мутантной формы при наличии PI3K дикого типа. Ввиду того, что комбинации настоящего изобретения являются активными в вышеупомянутых анализах, они демонстрируют преимущественную терапевтическую полезность в лечении рака. Подходяще настоящее изобретение относится к способу лечения или снижения тяжести ракового заболевания, выбранного из глиом головного мозга, глиобластом, астроцитом, мультиформной глиобластомы, синдрома Банаяна-Зонана, болезни Коудена, болезни Лермитт-Дуклос, рака молочных желез,отечно-инфильтративного рака молочных желез, опухоли Вильмса, саркомы Юинга, рабдомиосаркомы,эпендимомы, медуллобластомы, рака толстой кишки, рака головы и шеи, рака почек, рака легкого, рака печени, меланомы, саркомы яичников, рака поджелудочной железы, рака предстательной железы, остеосаркомы, гигантоклеточной опухоли кости, рака щитовидной железы, лимфобластной Т-клеточной лейкемии, хронической гранулоцитной лейкемии, хронического лимфоцитарного лейкоза, волосатоклеточного лейкоза, острой лимфобластной лейкемии, острой гранулоцитарной лейкемии, хронической нейтрофильной лейкемии, острой лимфобластной Т-клеточной лейкемии, плазмоцитомы, иммунобластной крупноклеточной лейкемии, лейкемии клеток мантийной ткани, мегакариобластного лейкоза, сопутствующего миеломной болезни, множественной миеломы, острого мегакариобластного лейкоза, промиелоцитарного лейкоза, эритролейкемии, злокачественной лимфомы, ходжкинской лимфомы, неходжкинской лимфомы, лимфобластной Т-клеточной лимфомы, лимфомы Беркитта, фолликулярной лимфомы,нейробластомы, рака мочевого пузыря, рака уротелия, рака легких, рака вульвы, рака шейки матки, рака эндометрия, рака почек, мезотелиомы, рака пищевода, рака слюнных желез, гепатоцеллюлярного рака,рака желудка, рака носоглотки, рака щеки, рака ротовой полости, желудочно-кишечной стромальной опухоли (GIST) и рака яичек. Подходяще настоящее изобретение относится к способу лечения или снижения тяжести ракового заболевания, выбранного из глиом головного мозга, глиобластом, астроцитом, мультиформной глиобластомы, синдрома Банаяна-Зонана, болезни Коудена, болезни Лермитт-Дуклос, рака молочных желез, рака толстой кишки, рака головы и шеи, рака почек, рака легкого, рака печени, меланомы, саркомы яичников, рака поджелудочной железы, рака предстательной железы и рака щитовидной железы. Подходяще настоящее изобретение относится к способу лечения или снижения тяжести ракового заболевания, выбранного из рака яичников, рака молочных желез, рака поджелудочной железы и предстательной железы. Подходящим образом настоящее изобретение относится к способу лечения или снижения тяжести ракового заболевания, которое имеет либо дикий тип или мутантную форму Ras/Raf и либо дикий тип или мутантную форму PI3K/PTEN. Это включает пациентов с диким типом как Ras/Raf, так иPI3K/PTEN, с мутантной формой как Ras/Raf, так и PI3K/PTEN, с мутантной формой Ras/Raf и с диким типом PI3K/PTEN и с диким типом Ras/Raf и мутантной формой PI3K/PTEN. В одном варианте осуществления опухолевая клетка также имеет по меньшей мере одну мутациюBraf. Мутация Braf включает R4621, I463S, G464V, G464E, G466A, G466E, G466V, G469A, G469E,D594V, F595L, G596R, L597V, L597R, T599I, V600E, V600D, V600K, V600R, T119S и K601E. Термин дикий тип, как понимают в данной области, относится к полипептидной или полинуклеотидной последовательности, которая имеет место в природной популяции без генетической модификации. Также как понимают в данной области, мутантная форма включает полипептидную или полинуклеотидную последовательность, имеющую по меньшей мере одну модификацию в аминокислоте или в нуклеиновой кислоте по сравнению с соответствующей аминокислотой или нуклеиновой кислотой, обнаруживаемой в полипептиде или в полинуклеотиде дикого типа соответственно. Включенным в термин мутантная форма является Одиночный Нуклеотидный Полиморфизм (SNP), где в последовательности нити нуклеиновых кислот существует отличие в одной паре оснований по сравнению с наиболее часто обнаруживаемой (дикий тип) последовательностью нити нуклеиновых кислот. Раковые заболевания, которые имеют либо дикий тип или мутантную форму для Ras/Raf, либо дикий тип или мутантную форму для PI3K/PTEN, идентифицируют (диагностируют) известными способами. Например, опухолевые клетки с диким типом или мутантной формой Ras/Raf или PI3K/PTEN могут быть идентифицированы методами амплификации и секвенирования ДНК, методами детектирования ДНК и РНК, включая Нозерн-блоттинг и Саузерн-блоттинг соответственно и/или различные биочиптехнологии и матричные технологии определения генетической информации, но не ограничиваясь этим. Полипептиды дикого типа и мутантной формы могут быть детектированы с помощью ряда технологий,включающих иммунодиагностические методы, такие как ELISA (энзим-связанный иммуносорбентный анализ), Вестерн-блот анализ или иммуноцитохимия, но не ограниченных этим. Генеративная мутация в сериновой/треониновой киназе 11 (STK11, также называемой LKB1) приводит к синдрому Пейтца-Егерса, характеризующемуся гамартомами кишечника и повышенным уровнем заболеваемости эпителиальными раковыми заболеваниями (Hongbin et al. Nature (2007) 448:807-810, иHearle et al. Clin. Cancer Res. (2006) 12:3209-3215). Соматические мутации LKB1, как сообщается, имеют место в некоторых первичных аденокарциномах легкого человека и, как показано, модулируют клеточную дифференциацию и метастаз рака легкого с мутированным типом Kras-гена (Hongbin et al.). Как используют в этом документе, термин LKB1 является синонимичным термину сериновая/треониновая киназа 11 (STK11). Ген LKB человека (официальный символ гена согласно HUGO,STK11) кодирует сериновую/треониновую протеинкиназу, которая имеет дефект у пациентов с синдромом Пейтца-Егерса (PJS). PJS представляет собой наследственный синдром аутосомно-доминантного типа, характеризующийся гамартоматозным полипозом желудочно-кишечного тракта и кожно-слизистой пигментацией. К настоящему времени сделаны сообщения о 145 различных генеративных мутациях вLKB1. Большая часть мутаций приводит к продукту на основе процессированного белка. Наблюдают один мутационный гипервариабельный участок. Делеция 1-bp и вставка 1-bp при мононуклеотидном повторе (повтор С 6, с. 837-842) между кодонами 279-281 обнаружены в шести и в семи неродственных семьях с PJS соответственно. Однако эти мутации составляют только приблизительно 7% всех мутаций,идентифицированных в семьях с PJS (13/193). Обзор литературы предоставляет всего 40 различных соматических мутаций LKB1 в 41 спорадической опухоли и в семи клеточных линиях рака. Мутации происходят в особенности в процессе рака легкого и колоректального рака. Большая часть соматических мутаций LKB1 приводит к процессингу белка. Оказывается, что мутационный гипервариабельный участок представляет собой повтор С 6, составляющий 12,5% всех соматических мутаций (6/48). Эти результаты согласуются со спектром генеративных мутаций. Однако доля миссенс-мутаций, как оказывается,является большей среди соматических мутаций (45%), чем среди генеративных мутаций (21%), и только семь мутаций точно совпадают в обоих мутационных типах (см. Hum Mutat 26(4), 291-297, 2005.Launonen. Human Mutation. 26(4), 291-297, 2005). Термин белок Ras, как используют в этом документе, означает любой белок, который является членом подсемейства ras, которое является подсемейством ГТФаз, вовлеченных в клеточную сигнализацию. Как известно в данной области, активация Ras вызывает клеточные рост, дифференциацию и выживаемость. Белки Ras включают белки H-ras, K-ras и N-ras, но не ограничиваются этим. В одном аспекте опухолевые клетки имеют по меньшей мере одну мутацию по меньшей мере в одном белке Ras или гене, кодирующем по меньшей мере один белок Ras, который находится в K-ras, N-ras или H-ras. Мутация Ras по меньшей мере в одном гене, кодирующем по меньшей мере один белок Ras,может быть в экзоне 2 и/или 3. В некоторых случаях ген, кодирующий по меньшей мере один белок Ras,имеет мутацию по меньшей мере в одном кодоне ras, выбранном из кодона 12, 13, 14, 60, 74 и 76. В некоторых вариантах осуществления мутацию Ras выбирают из G12S, G12V, G12D, G12A, G12C, G12R,G13A, G13D, V14I, G60E, Т 74 Р, E76G, Е 76K и E76Q. Опухолевые клетки могут иметь мутацию, делецию или вставку в LKB1. По меньшей мере одна миссенс-мутация в LKB1 может быть выбрана из 581 АТ, вызывающей замену аминокислоты D194V;
МПК / Метки
МПК: A61K 31/397
Метки: комбинация
Код ссылки
<a href="https://eas.patents.su/30-22637-kombinaciya.html" rel="bookmark" title="База патентов Евразийского Союза">Комбинация</a>
Предыдущий патент: Оппозитный радиальный роторно-поршневой двигатель
Следующий патент: Способ и устройство для укладки трубопровода в дне водоема
Случайный патент: Полиморфные модификации дофетилида












