Оксазольные ингибиторы киназы, содержащие их композиции и их применение
Номер патента: 22188
Опубликовано: 30.11.2015
Авторы: Беньяхад Абделла, Пез Дидье, Шевинье Эммануэль, Сандринелли Франк, Мартен Язон, Мусси Ален, Пикуль Вилли
Формула / Реферат
1. Соединение формулы I
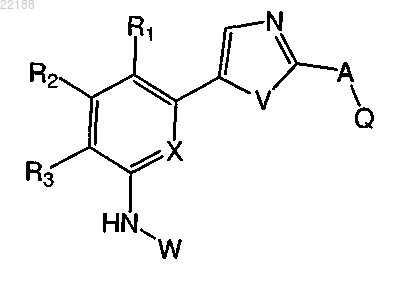
формула I
где заместители A, Q, X, R1, R2, R3, V и W в формуле I являются такими, как описано ниже:
А представляет собой одно из нижеследующего:
i) N(R4)(CH2)n, где 0<n<3;
ii) (CH2)n, где 0≤n<2;
iii) C(R4)=C(R5);
iv) CºC(R5);
R4 и R5, каждый независимо, представляют собой атом водорода, С1-4алкил;
X представляет собой СН или N;
V представляет собой О;
Q выбран из:
i) алкильной1 группы, либо
ii) арильной1 группы, либо
iii) гетероарильной1 группы;
где алкильная1 группа представляет собой нормальную или разветвленную алкильную группу, содержащую от 1 до 10 атомов углерода, или циклоалкильную группу, содержащую от 3 до 10 атомов углерода, необязательно замещенную одним или более гетероатомами, выбранными из атома галогена, атома кислорода и атома азота; трифторметилом, карбоксилом, циано, нитро, формилом; CO-R, COO-R, CONR-R', SO2-R, и SO2NR-R', где R и R' представляют собой нормальную или разветвленную алкильную группу, содержащую от 1 до 10 атомов углерода и необязательно замещенную по меньшей мере одним гетероатомом, выбранным из атома галогена, атома кислорода и атома азота; или циклоалкильной группой;
арильная1 группа - это фенил или его замещенный вариант, несущий любую комбинацию в любом положении кольца одного или более заместителей, выбранных из
атома галогена;
алкильной1 группы;
арильной или гетероарильной группы;
трифторметильной, О-алкильной, карбоксильной, циано, нитро, формильной, гидрокси, NH-алкильной, N(алкил)(алкил) и аминогруппы;
NRCO-R', либо NRCOO-R', либо NRCONR'-R", либо NRSO2-R', либо NRSO2NR"-R", либо CO-R, либо COO-R, либо CONR-R', либо SO2-R, либо SO2NRR', где R, R' и R", каждый независимо, выбран из атома водорода, алкильной, арильной или гетероарильной группы;
гетероарильная1 группа - это пиридильная, пиримидинильная, пиразинильная, пиридазинильная, тиенильная, тиазолильная, имидазолильная, пиразолильная, пирролильная, фуранильная, оксазолильная, изоксазолильная, триазолильная, тетразолильная, индолильная, бензимидазольная, бензоксазольная, бензотиазольная, хинолинильная группа, которая может дополнительно нести любую комбинацию в любом положении кольца одного или более заместителей, выбранных из
атома галогена;
алкильной1 группы;
арильной или гетероарильной группы;
трифторметильной, О-алкильной, карбоксильной, циано, нитро, формильной, гидрокси, NH-алкильной, N(алкил)(алкил) и аминогруппы;
NRCO-R', либо NRCOO-R', либо NRCONR'-R", либо NRSO2-R', либо NRSO2NR'-R", либо CO-R, либо COO-R, либо CONR-R', либо SO2-R, либо SO2NRR', где R, R' и R", каждый независимо, выбран из атома водорода, алкильной, арильной или гетероарильной группы;
R1, R2 и R3 каждый независимо выбран из атома водорода, атома галогена, нормальной или разветвленной алкильной группы, содержащей от 1 до 10 атомов углерода, трифторметила, C1-6алкилокси, С1-6алкиламино, ди(С1-6алкил)амино, циано;
W выбран из фенила, пиридинила, пиразинила, пиримидинила, оксазолила или тиазолила, необязательно замещенных одним или более атомами галогена, нормальной или разветвленной алкильной группой, содержащей от одного до двух атомов углерода, трифторметилом или морфолинилэтокси.
2. Соединение по п.1 формулы II
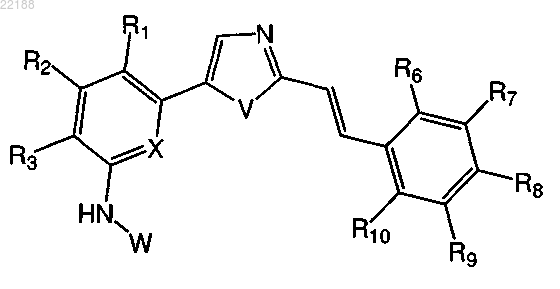
формула II
где R1, R2, R3, X, V и W имеют значение, указанное в п.1, и
где R6, R7, R8, R9 и R10 каждый независимо выбран из атома водорода, атома галогена, нормальной или разветвленной алкильной группы, содержащей от 1 до 10 атомов углерода и необязательно замещенной одним или более гетероатомами, выбранными из атома галогена, атома кислорода и атома азота; трифторметила, С1-6алкилокси, амино, С1-6алкиламино, ди(С1-6алкил)амино, карбоксила, циано, нитро, формила, гидрокси и CO-R, COO-R, CONR-R', SO2-R и SO2NR-R', где R и R', каждый независимо, выбран из атома водорода, алкильной, арильной или гетероарильной группы.
3. Соединение по п.1 формулы III
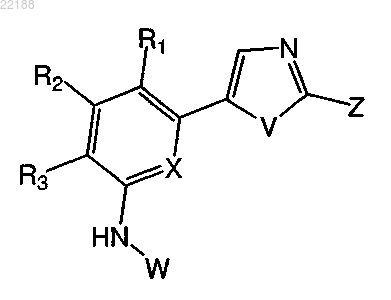
формула III
где Z представляет собой арил1 или гетероарил1, R1, R2, R3, X, V, W, арил1 и гетероарил1 имеют значения, указанные в п.1.
4. Соединение по п.1 формулы Ia

формула Ia
где A, Q, R1, R2, R3 и V являются такими, как определено в любом из пп.1-3, и W1 выбран из одного или более из нижеследующего: атома водорода, атома галогена, нормальной или разветвленной алкильной группы, содержащей от 1 до 2 атомов углерода, трифторметила или морфолинилэтокси.
5. Соединение по п.1 формулы IIa
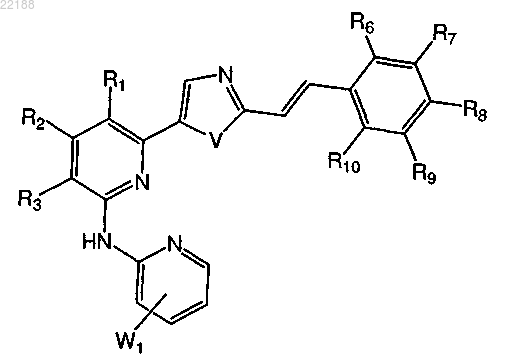
формула IIa
где R1, R2, R3, R6, R7, R8, R9 и R10, V и W1 имеют значение, указанное в любом из пп.1-4.
6. Соединение по п.1 формулы IIIa
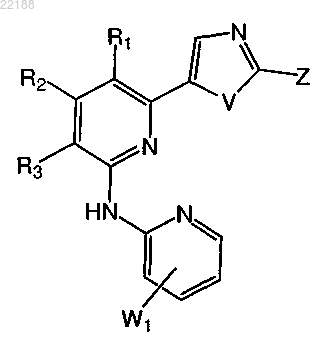
формула IIIa
где R1, R2, R3, V, W1 и Z имеют значение, указанное в любом из пп.1-4.
7. Соединение по любому из пп.1-3, в котором X представляет собой СН.
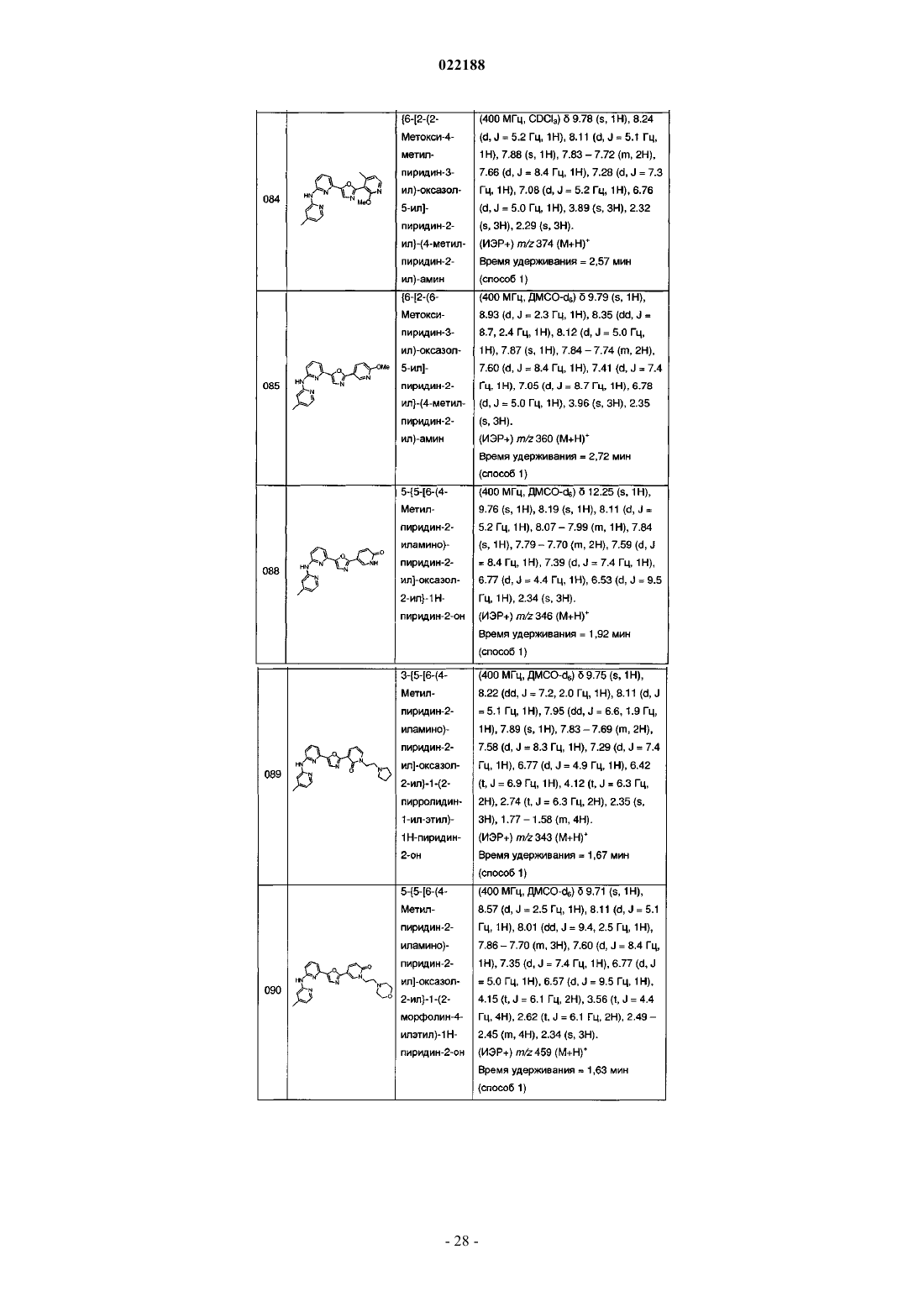
8. Соединение по п.1, выбранное из
(4-метилпиридин-2-ил)-[6-(2-фенетилоксазол-5-ил)пиридин-2-ил]амина;
(4-метилпиридин-2-ил)-[3-(2-фенилсульфанилоксазол-5-ил)фенил]амина;
(3-{2-[2-(4-метоксифенил)винил]оксазол-5-ил}фенил)-(4-метилпиридин-2-ил)амина;
(6-{2-[2-(4-метоксифенил)винил]оксазол-5-ил}пиридин-2-ил)-(4-метилпиридин-2-ил)амина;
(4-метилпиридин-2-ил)-[6-(2-стирилоксазол-5-ил)пиридин-2-ил]амина;
пиридин-2-ил-[6-(2-стирилоксазол-5-ил)пиридин-2-ил]амина;
(6-{2-[2-(4-метоксифенил)винил]оксазол-5-ил}пиридин-2-ил)пиридин-2-иламина;
(6-{2-[2,6-диметил-4-(2-морфолин-4-илэтокси)фенил]оксазол-5-ил}пиридин-2-ил)-(4-метилпиридин-2-ил)амина;
(5-хлорпиридин-2-ил)-[6-(2-фенилоксазол-5-ил)пиридин-2-ил]амина;
(4-метилпиперазин-1-ил)-(3-{5-[3-(4-метилпиридин-2-иламино)фенил]оксазол-2-ил}фенил)метанона;
3-(4-метилпиридин-2-иламино)-5-(2-тиофен-3-илоксазол-5-ил)бензонитрила;
(4-метилпиридин-2-ил)-{3-[2-(3-трифторметилфенил)оксазол-5-ил]фенил}амина;
4-(2-{5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}винил)бензонитрила;
4-(2-{5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}этил)бензонитрила;
(4-метилпиридин-2-ил)-[6-(2-пиридин-3-илоксазол-5-ил)пиридин-2-ил]амина;
N-(2-гидроксиэтил)-N-метил-3-{5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}бензолсульфонамида;
(4-метилпиридин-2-ил)-{6-[2-(3-пирролидин-1-илметилфенил)оксазол-5-ил]пиридин-2-ил}амина гидрохлорида;
(4-метилпиридин-2-ил)-{6-[2-(3-морфолин-4-илметилфенил)оксазол-5-ил]пиридин-2-ил}амина гидрохлорида;
(5-хлорпиридин-2-ил)-[6-(2-тиофен-3-илоксазол-5-ил)пиридин-2-ил]амина;
{6-[2-(1н-индол-5-ил)оксазол-5-ил]пиридин-2-ил}пиразин-2-иламина;
{6-[2-(1н-индол-5-ил)оксазол-5-ил]-5-метилпиридин-2-ил}-(4-метилпиридин-2-ил)амина;
[6-(2-циклогексилсульфанилоксазол-5-ил)пиридин-2-ил]-(4-метилпиридин-2-ил)амина;
5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]-N-(пиридин-4-илметил)оксазол-2-амина;
N-(4-метоксибензил)-5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-амина;
4-{5-[6-(5-метилтиазол-2-иламино)пиридин-2-ил]оксазол-2-ил}пиперазин-2-она;
{6-[2-(4-метилпиперазин-1-ил)оксазол-5-ил]пиридин-2-ил}-{3-трифторметилфенил)амина;
(6-{2-[4-(2-метоксиэтил)пиперазин-1-ил]оксазол-5-ил}пиридин-2-ил)-(4-метилпиридин-2-ил)амина;
1-(2-метоксиэтил)-4-{5-[3-(4-метилпиримидин-2-иламино)фенил]оксазол-2-ил}пиперазин-2-она;
3-{2-[(2-метоксиэтил)метиламино]оксазол-5-ил}-5-(4-метилпиридин-2-иламино)бензонитрила;
(4-метилпиридин-2-ил)-[6-(2-пиридин-2-илоксазол-5-ил)пиридин-2-ил]амина;
(4-метилпиридин-2-ил)-[6-(2-фенилоксазол-5-ил)пиридин-2-ил]амина;
(4-метилпиридин-2-ил)-(3-{2-[2-(3-трифторметилфенил)винил]оксазол-5-ил}фенил)амина;
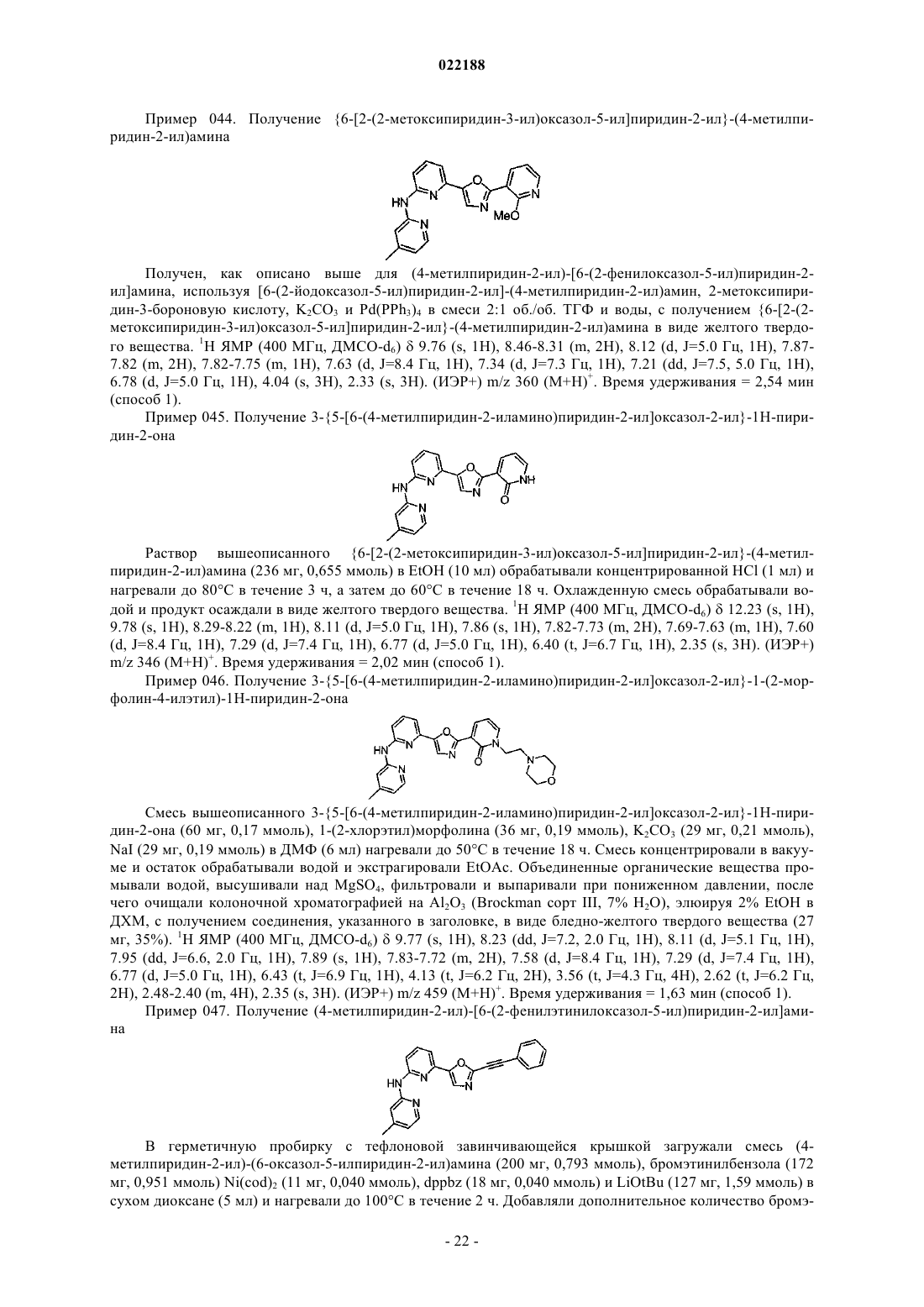
{6-[2-(2-метоксипиридин-3-ил)оксазол-5-ил]пиридин-2-ил}-(4-метилпиридин-2-ил)амина;
3-{5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}-1н-пиридин-2-она;
3-{5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}-1-(2-морфолин-4-илэтил)-1н-пиридин-2-она;
(4-метилпиридин-2-ил)-[6-(2-фенилэтинилоксазол-5-ил)пиридин-2-ил]амина;
[6-(2-бензоксазол-2-илоксазол-5-ил)пиридин-2-ил]-(4-метилпиридин-2-ил)амина;
(4-метилпиридин-2-ил)-[6-{2-[3-(2-морфолин-4-илэтокси)фенил]оксазол-5-ил}пиридин-2-ил]амина;
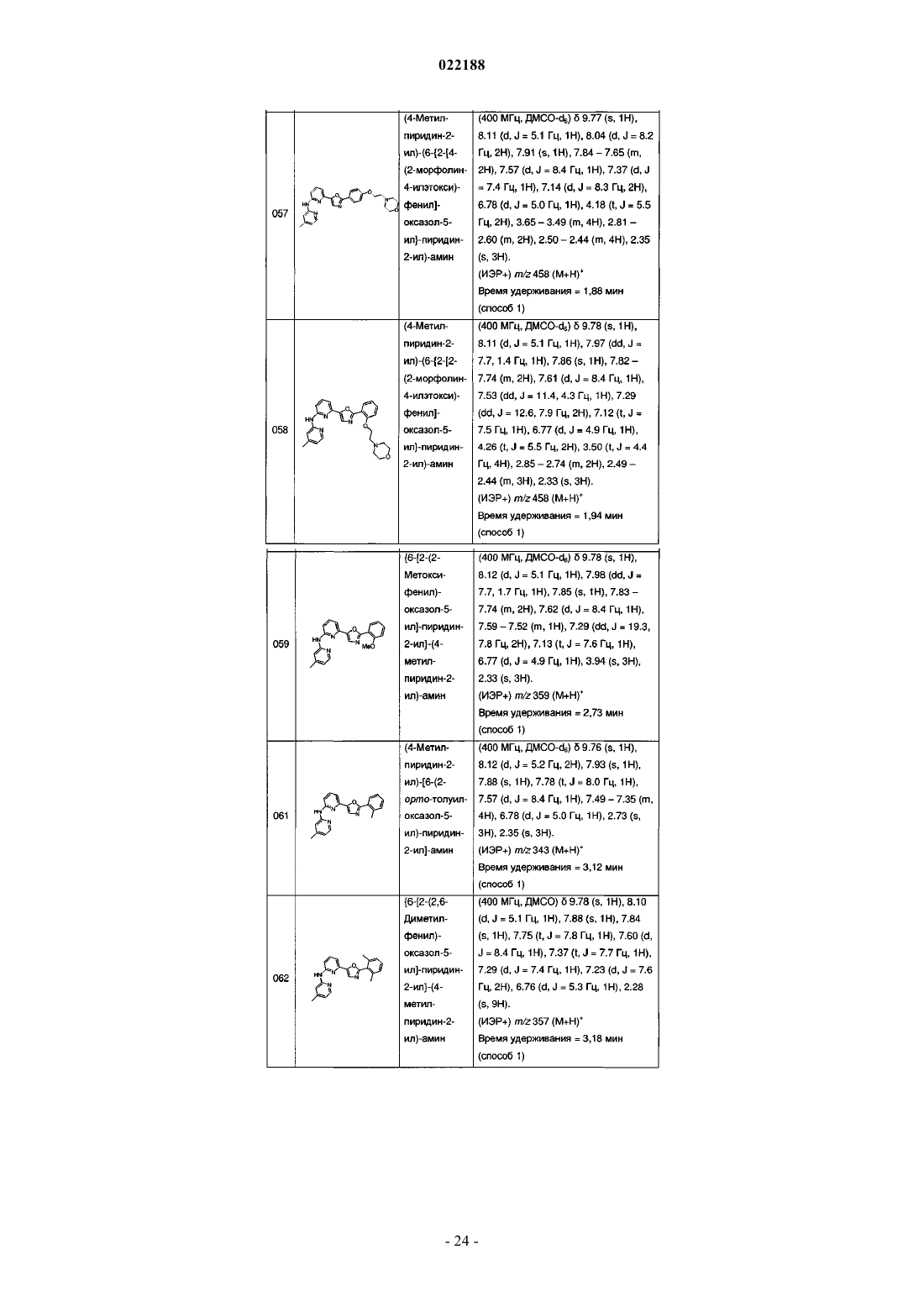
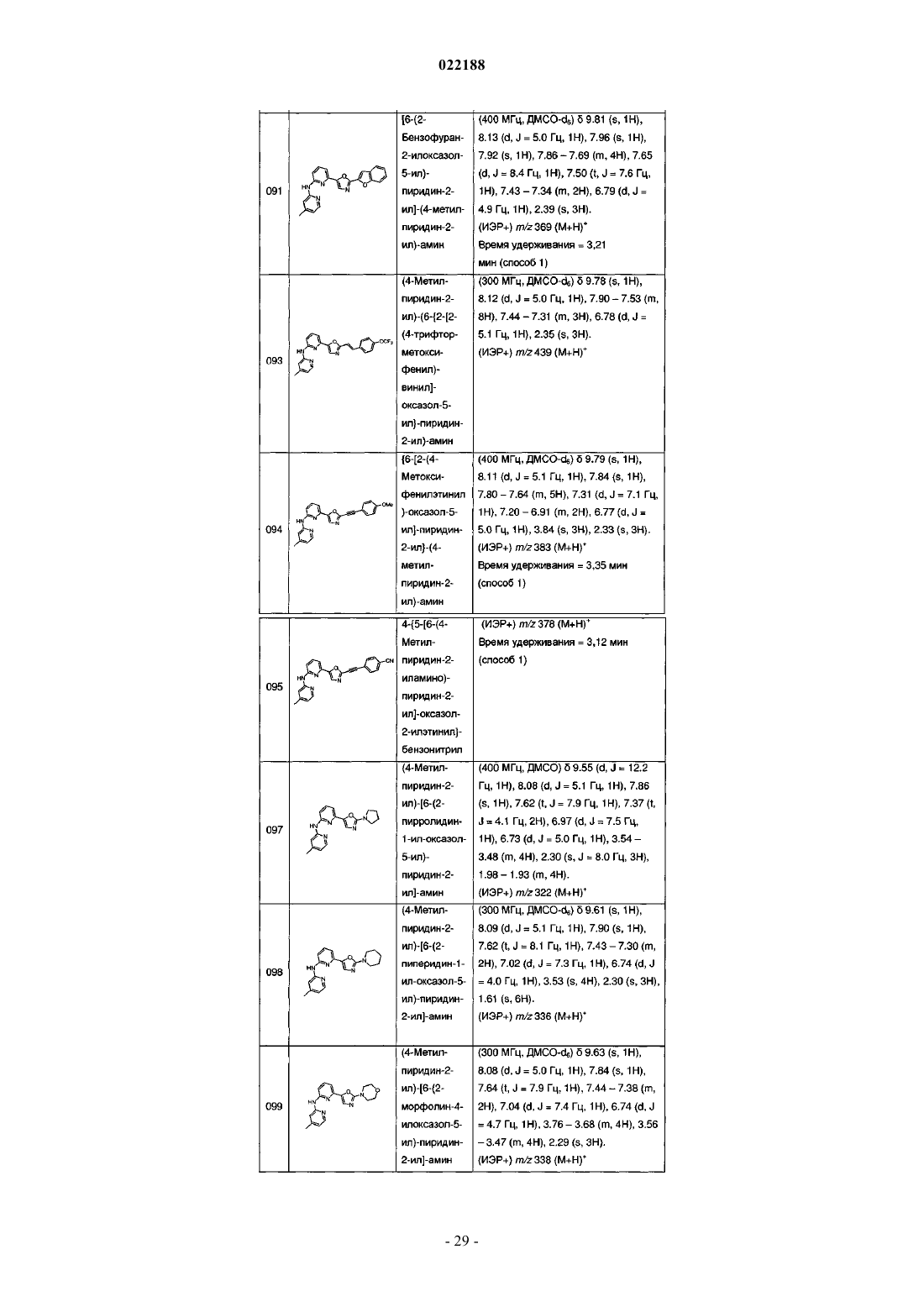
(4-метилпиридин-2-ил)-[6-{2-[4-(2-морфолин-4-илэтокси)фенил]оксазол-5-ил}пиридин-2-ил]амина;
(4-метилпиридин-2-ил)-(6-{2-[2-(2-морфолин-4-илэтокси)фенил]оксазол-5-ил}пиридин-2-ил)амина;
{6-[2-(2-метоксифенил)оксазол-5-ил]пиридин-2-ил}-(4-метилпиридин-2-ил)амина;
(4-метилпиридин-2-ил)-[6-(2-орто-толуилоксазол-5-ил)пиридин-2-ил]амина;
{6-[2-(2,6-диметилфенил)оксазол-5-ил]пиридин-2-ил}-(4-метилпиридин-2-ил)амина;
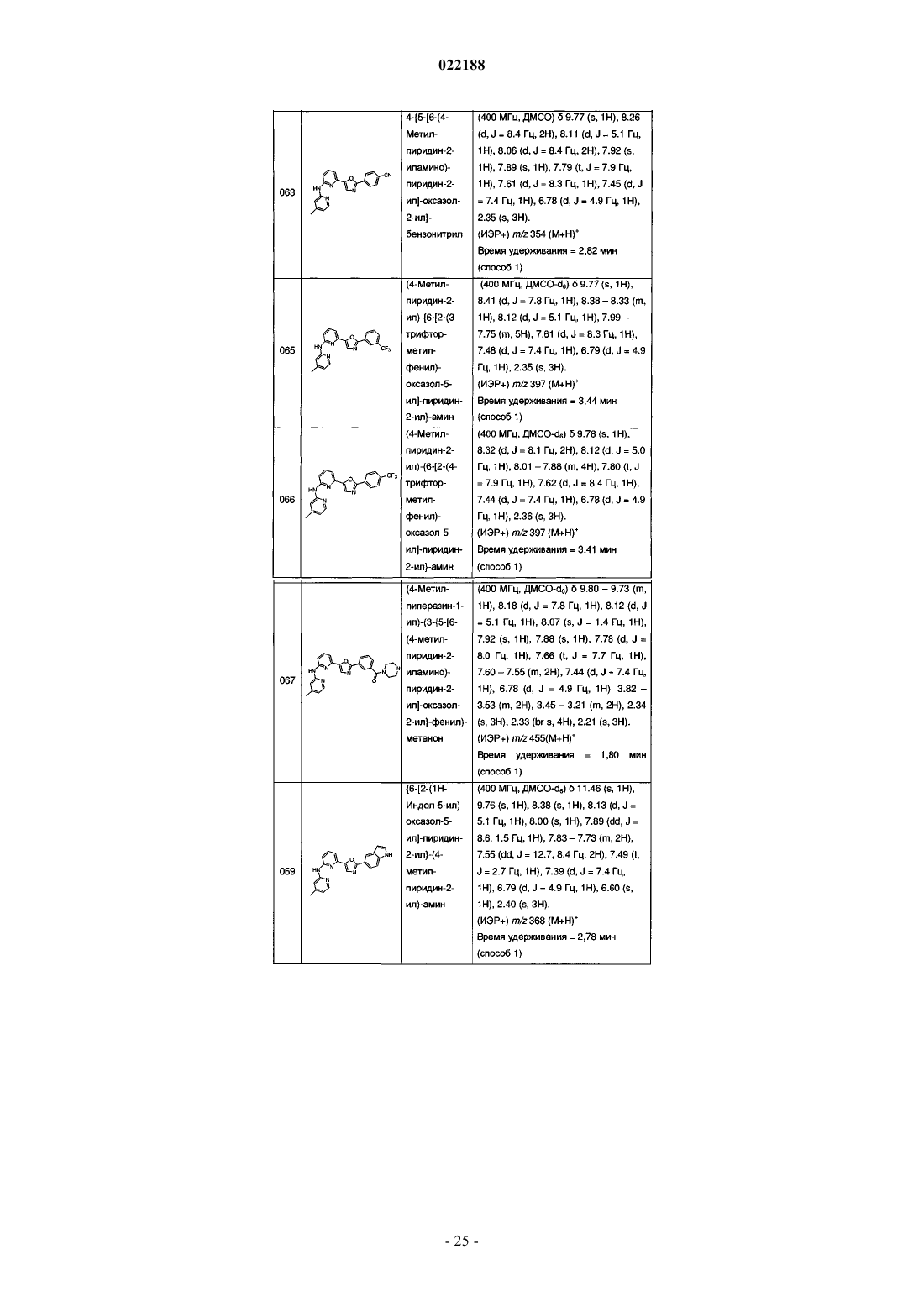
4-{5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}бензонитрила;
(4-метилпиридин-2-ил)-{6-[2-(3-трифторметилфенил)оксазол-5-ил]пиридин-2-ил}амина;
(4-метилпиридин-2-ил)-{6-[2-(4-трифторметилфенил)оксазол-5-ил]пиридин-2-ил}амина;
(4-метилпиперазин-1-ил)-(3-{5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}фенил)метанона;
{6-[2-(1Н-индол-5-ил)оксазол-5-ил]пиридин-2-ил}-(4-метилпиридин-2-ил)амина;
[6-(2-фуран-2-илоксазол-5-ил)пиридин-2-ил]-(4-метилпиридин-2-ил)амина;
4-{5-[6-(3-трифторметилфениламино)пиридин-2-ил]оксазол-2-ил}пиперазин-2-она;
{5-метил-6-[2-(4-метилпиперазин-1-ил)оксазол-5-ил]пиридин-2-ил}-(4-метилпиридин-2-ил)амина;
4-{5-[3-метил-6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}пиперазин-2-она;
(4-метилпиридин-2-ил)-[5-метил-6-(2-тиофен-3-илоксазол-5-ил)пиридин-2-ил]амина;
1-(2-метоксиэтил)-4-{5-[3-метил-6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}пиперазин-2-она;
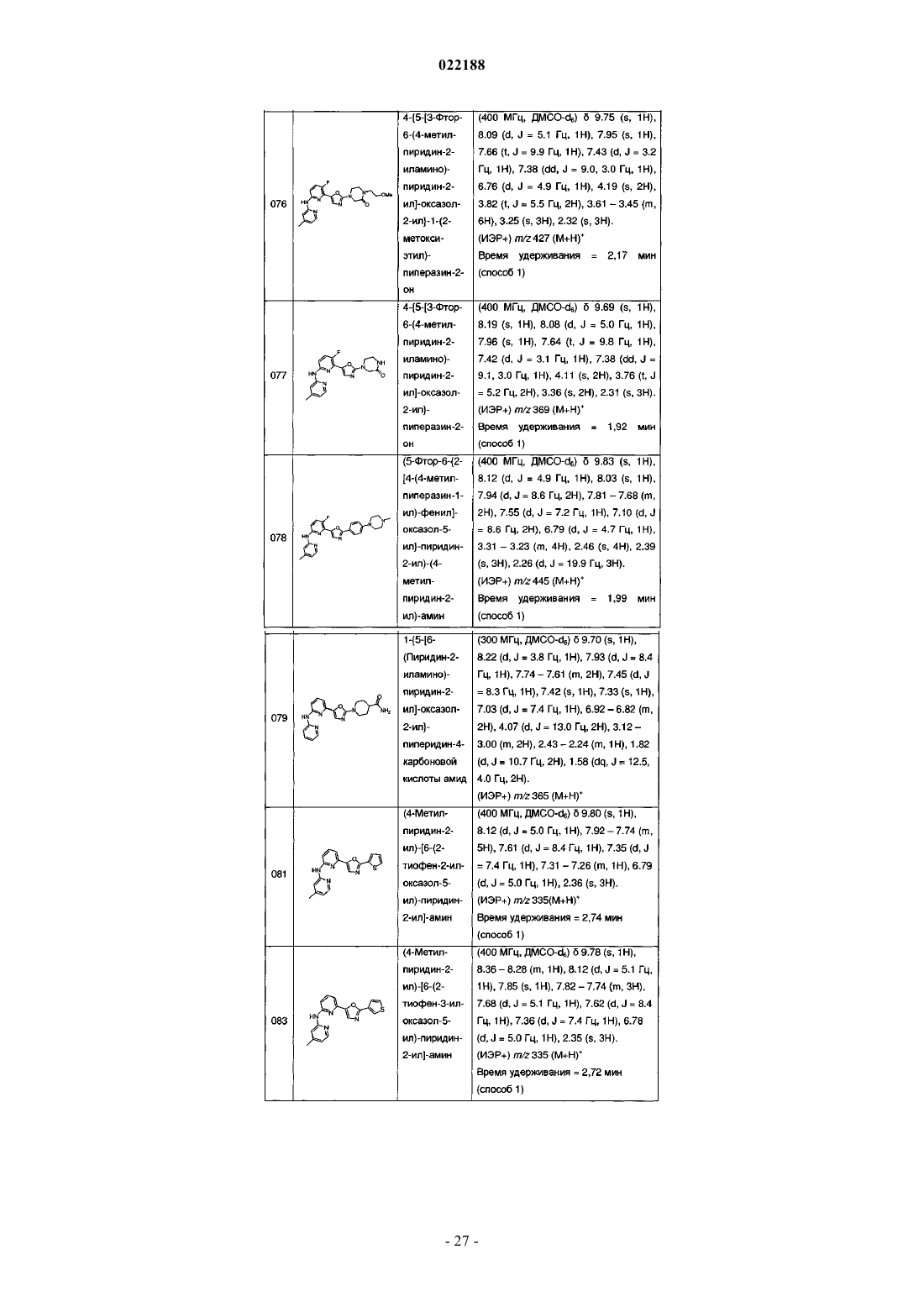
4-{5-[3-фтор-6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}-1-(2-метоксиэтил)пиперазин-2-она;
4-{5-[3-фтор-6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}пиперазин-2-она;
(5-фтор-6-{2-[4-(4-метилпиперазин-1-ил)фенил]оксазол-5-ил}пиридин-2-ил)-(4-метилпиридин-2-ил)амина;
1-{5-[6-(пиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}пиперидин-4-карбоновой кислоты амида;
(4-метилпиридин-2-ил)-[6-(2-тиофен-2-илоксазол-5-ил)пиридин-2-ил]амина;
(4-метилпиридин-2-ил)-[6-(2-тиофен-3-илоксазол-5-ил)пиридин-2-ил]амина;
{6-[2-(2-метокси-4-метилпиридин-3-ил)оксазол-5-ил]пиридин-2-ил}-(4-метилпиридин-2-ил)амина;
{6-[2-(6-метоксипиридин-3-ил)оксазол-5-ил]пиридин-2-ил}-(4-метилпиридин-2-ил)амина;
5-{5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}-1Н-пиридин-2-она;
3-{5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}-1-(2-пирролидин-1-илэтил)-1Н-пиридин-2-она;
5-{5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}-1-(2-морфолин-4-илэтил)-1Н-пиридин-2-она;
[6-(2-бензофуран-2-илоксазол-5-ил)пиридин-2-ил]-(4-метилпиридин-2-ил)амина;
(4-метилпиридин-2-ил)-(6-{2-[2-(4-трифторметоксифенил)винил]оксазол-5-ил}пиридин-2-ил)амина;
{6-[2-(4-метоксифенилэтинил)оксазол-5-ил]пиридин-2-ил}-(4-метилпиридин-2-ил)амина;
4-{5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-илэтинил}бензонитрила;
(4-метилпиридин-2-ил)-[6-(2-пирролидин-1-илоксазол-5-ил)пиридин-2-ил]амина;
(4-метилпиридин-2-ил)-[6-(2-пиперидин-1-илоксазол-5-ил)пиридин-2-ил]амина;
(4-метилпиридин-2-ил)-[6-(2-морфолин-4-илоксазол-5-ил)пиридин-2-ил]амина;
4-{5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}пиперазин-2-она;
(4-метилпиридин-2-ил)-[6-(2-тиоморфолин-4-илоксазол-5-ил)пиридин-2-ил]амина;
{6-[2-(4-метилпиперазин-1-ил)оксазол-5-ил]пиридин-2-ил}-(4-метилпиридин-2-ил)амина;
1-{5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}пиперидин-4-карбоновой кислоты амида;
(4-метилпиридин-2-ил)-{6-[2-(2-метоксиэтиламино)оксазол-5-ил]пиридин-2-ил}амина;
(4-метилпиридин-2-ил)-{6-[2-(2-морфолин-4-илэтил)аминооксазол-5-ил])пиридин-2-ил}амина;
1-(2-метоксиэтил)-4-{5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}пиперазин-2-она;
[6-(2-циклопентилсульфанилоксазол-5-ил)пиридин-2-ил]-(4-метилпиридин-2-ил)амина;
(3-метилпиридин-2-ил)-[6-(2-фенилоксазол-5-ил)пиридин-2-ил]амина;
{6-[2-(1Н-индол-5-ил)оксазол-5-ил]пиридин-2-ил}-(3-метилпиридин-2-ил)амина;
(3-метилпиридин-2-ил)-[6-(2-тиофен-3-илоксазол-5-ил)пиридин-2-ил]амина;
(5-метилпиридин-2-ил)-[6-(2-фенилоксазол-5-ил)пиридин-2-ил]амина;
(5-метилпиридин-2-ил)-[6-(2-тиофен-3-илоксазол-5-ил)пиридин-2-ил]амина;
{6-[2-(1Н-индол-5-ил)оксазол-5-ил]пиридин-2-ил}-(5-метилпиридин-2-ил)амина;
(5-метилпиридин-2-ил)-[6-(2-пирролидин-1-илоксазол-5-ил)пиридин-2-ил]амина;
4-{5-[6-(5-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}пиперазин-2-она;
{6-[2-(4-метилпиперазин-1-ил)оксазол-5-ил]пиридин-2-ил}-(5-метилпиридин-2-ил)амина;
(4-хлорпиридин-2-ил)-[6-(2-тиофен-3-илоксазол-5-ил)пиридин-2-ил]амина;
(4-хлорпиридин-2-ил)-{6-[2-(1Н-индол-5-ил)оксазол-5-ил]пиридин-2-ил}амина;
(4-хлорпиридин-2-ил)-[6-(2-тиофен-2-илоксазол-5-ил)пиридин-2-ил]амина;
(4-хлорпиридин-2-ил)-[6-(2-фуран-2-илоксазол-5-ил)пиридин-2-ил]амина;
(5-хлорпиридин-2-ил)-{6-[2-(1Н-индол-5-ил)оксазол-5-ил]пиридин-2-ил}амина;
(5-хлорпиридин-2-ил)-[6-(2-пирролидин-1-илоксазол-5-ил)пиридин-2-ил]амина;
4-{5-[6-(5-хлорпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}пиперазин-2-она;
(5-хлорпиридин-2-ил)-{6-[2-(4-метилпиперазин-1-ил)оксазол-5-ил]пиридин-2-ил}амина;
(5-хлорпиридин-2-ил)-{6-[2-(2-метоксиэтил)метиламинооксазол-5-ил}пиридин-2-ил}амина;
(4,6-диметилпиридин-2-ил)-[6-(2-фенилоксазол-5-ил)пиридин-2-ил]амина;
(4,6-диметилпиридин-2-ил)-[6-(2-тиофен-3-илоксазол-5-ил)пиридин-2-ил]амина;
(4,6-диметилпиридин-2-ил)-{6-[2-(1Н-индол-5-ил)-оксазол-5-ил]пиридин-2-ил}амина;
(4,6-диметилпиридин-2-ил)-[6-(2-пирролидин-1-илоксазол-5-ил)пиридин-2-ил]амина;
4-{5-[6-(4,6-диметилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}пиперазин-2-она;
4-{5-[6-(4-этилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}пиперазин-2-она;
2-{6-[2-(3-оксопиперазин-1-ил)оксазол-5-ил]пиридин-2-иламино}изоникотинонитрила;
4-{5-[6-(5-трифторметилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}пиперазин-2-она;
4-{5-[6-(5-трифторметилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил}пиперазин-2-она;
(6-{2-[2-(4-метоксифенил)винил]оксазол-5-ил}пиридин-2-ил)-[4-(2-морфолин-4-илэтокси)пиридин-2-ил]амина;
(6-{2-[2-(4-метоксифенил)винил]оксазол-5-ил}пиридин-2-ил)-(4-метилпиримидин-2-ил)амина;
4-{5-[6-(пиразин-2-иламино)пиридин-2-ил]оксазол-2-ил}пиперазин-2-она;
4-{5-[6-(4-метилтиазол-2-иламино)пиридин-2-ил]оксазол-2-ил}пиперазин-2-она;
{6-[2-(4-метилпиперазин-1-ил)оксазол-5-ил]пиридин-2-ил}-(4-метилтиазол-2-ил)амина;
(4-метилпиридин-2-ил)-[3-(2-стирилоксазол-5-ил)фенил]амина;
(3-{2-[2-(2,4-дифторфенил)винил]оксазол-5-ил}фенил)-(4-метилпиридин-2-ил)амина;
(4-метилпиридин-2-ил)-[3-(2-тиофен-3-илоксазол-5-ил)фенил]амина;
{3-[2-(2,4-диметоксифенил)оксазол-5-ил]фенил}-(4-метилпиридин-2-ил)амина;
{3-[2-(1Н-индол-5-ил)оксазол-5-ил]фенил}-(4-метилпиридин-2-ил)амина;
1-{5-[3-(4-метилпиридин-2-иламино)фенил]оксазол-2-ил}пиперидин-4-карбоновой кислоты амида;
(4-метилпиридин-2-ил)-[3-(2-морфолин-4-илоксазол-5-ил)фенил]амина;
(4-метилпиридин-2-ил)-(3-{2-[(пиридин-2-илметил)амино]оксазол-5-ил}фенил)амина;
[3-(2-бензиламинооксазол-5-ил)фенил]-(4-метилпиридин-2-ил)амина;
4-{5-[3-(4-метилпиримидин-2-иламино)фенил]оксазол-2-ил}пиперазин-2-она;
{3-[2-(4-метилпиперазин-1-ил)оксазол-5-ил]фенил}-(4-метилпиримидин-2-ил)амина;
(4,6-диметилпиридин-2-ил)-{3-[2-(1Н-индол-5-ил)оксазол-5-ил]фенил}амина;
3-(4-метилпиридин-2-иламино)-5-[2-(3-оксопиперазин-1-ил)оксазол-5-ил]бензонитрила;
3-[2-(4-метилпиперазин-1-ил)оксазол-5-ил]-5-(4-метилпиридин-2-иламино)бензонитрила;
4-{5-[3-(4-метилпиридин-2-иламино)-5-трифторметоксифенил]оксазол-2-ил}пиперазин-2-она;
{3-[2-(4-метилпиперазин-1-ил)оксазол-5-ил]-5-трифторметоксифенил}-(4-метилпиридин-2-ил)амина;
4-{5-[4-метил-3-(4-метилпиридин-2-иламино)фенил]оксазол-2-ил}пиперазин-2-она;
{5-[2-(1Н-индол-5-ил)оксазол-5-ил]-2-метилфенил}-(4-метилпиридин-2-ил)амина;
4-[5-(6-метатолуиламинопиридин-2-ил)оксазол-2-ил]пиперазин-2-она;
{6-[2-(4-метилпиперазин-1-ил)-оксазол-5-ил]пиридин-2-ил}метатолуиламин;
(6-{2-[(2-метоксиэтил)метиламино]оксазол-5-ил}пиридин-2-ил)метатолуиламин;
(3,5-диметилфенил)-{6-[2-(1Н-индол-5-ил)оксазол-5-ил]пиридин-2-ил}амина;
4-{5-[6-(4-хлорфениламино)пиридин-2-ил]оксазол-2-ил}пиперазин-2-она;
(4-хлорфенил)-{6-[2-(4-метилпиперазин-1-ил)оксазол-5-ил]пиридин-2-ил}амина.
9. Фармацевтическая композиция, содержащая соединение по любому из пп.1-8.
10. Косметическая композиция для местного введения, содержащая соединение по любому из пп.1-8.
11. Применение соединения по любому из пп.1-8 для получения лекарственного средства.
12. Применение соединения по любому из пп.1-8 для получения лекарственного средства для лечения гематологических злокачественных опухолей, миелопролиферативного расстройства, других пролиферативных расстройств, аутоиммунных расстройств, воспалительных заболеваний, аллергических заболеваний и/или неврологических заболеваний.
13. Применение по п.12, где гематологические злокачественные опухоли представляют собой острые миелоидные лейкозы (ОМЛ), миелодиспластические синдромы (МДС), острый лимфобластный лейкоз (ОЛЛ) и/или хронический миелоидный лейкоз (ХМЛ).
14. Применение по п.12, где пролиферативное расстройство представляет собой рак.
15. Применение по п.12, где аутоиммунные расстройства представляют собой рассеянный склероз, псориаз, воспалительное кишечное заболевание, неспецифический язвенный колит, болезнь Крона, ревматоидный артрит и полиартрит, локальную и системную склеродерму, системную красную волчанку, дискоидную красную волчанку, кожную красную волчанку, дерматомиозит, полимиозит, синдром Шегрена, узловой панартериит, аутоиммунную энтеропатию, атопический дерматит и/или пролиферативный гломерулонефрит.
16. Применение по п.12, где аллергические заболевания представляют собой астму, аллергический ринит, аллергический синусит, анафилактический синдром, крапивницу, ангионевротический отек, атопический дерматит, аллергический контактный дерматит, узловую эритему, полиморфную эритему, кожный некротизирующий венулит и воспаление кожи вследствие укусов насекомых и/или инвазии кровососущих паразитов.
17. Применение по п.12, где неврологические заболевания представляют собой болезнь Гентингтона, шизофрению, болезнь Паркинсона и/или болезнь Альцгеймера.
18. Применение соединения по любому из пп.1-8 для получения лекарственного средства, которое действует в качестве ингибитора протеинкиназ.
19. Применение по п.18, где протеинкиназа представляет собой Flt-3 или syk.
20. Фармацевтическая композиция, содержащая эффективное количество комбинации соединения по любому из пп.1-8 и другого агента молекулярной направленности.
21. Применение соединения по любому из пп.1-8 вместе с другим агентом молекулярной направленности для получения лекарственного средства для лечения гематологических злокачественных опухолей, миелопролиферативного расстройства, других пролиферативных расстройств, аутоиммунных расстройств и кожных расстройств.
Текст
ОКСАЗОЛЬНЫЕ ИНГИБИТОРЫ КИНАЗЫ, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ Настоящее изобретение относится к замещенным оксазольным производным, которые селективно модулируют, регулируют и/или ингибируют преобразование сигнала, опосредованное определенными нативными и/или мутантными протеинкиназами, вовлеченными в ряд заболеваний человека и животных, таких как клеточно-пролиферативные, метаболические, аллергические и дегенеративные расстройства. В частности, некоторые из этих соединений являются эффективными и селективными ингибиторами Flt-3 и/или syk. 022188 Настоящее изобретение относится к замещенным оксазольным производным, которые селективно модулируют, регулируют и/или ингибируют преобразование сигнала, опосредованное определенными нативными и/или мутантными протеинкиназами, вовлеченными в ряд заболеваний человека и животных,таких как клеточно-пролиферативные, метаболические, аллергические и дегенеративные расстройства. В частности, некоторые из этих соединений являются эффективными и селективными ингибиторами Flt-3 и/или syk. Предшествующий уровень техники Протеинкиназы представляют собой белки рецепторного типа или нерецепторного типа, которые переносят концевой фосфат АТФ на аминокислотные остатки, такие как остатки тирозина, треонина,серина, белков, активируя или инактивируя посредством этого биохимические пути преобразования сигнала. Известно, что эти белки вовлечены во многие клеточные механизмы, которые в случае прерывания приводят к расстройствам, таким как аномальная клеточная пролиферация и миграция, а также воспаление. На сегодняшний день известно более 500 протеинкиназ. Хорошо известными являются Abl, Akt1,Akt2, Akt3, ALK, Alk5, A-Raf, Axl, B-Raf, Brk, Btk, Cdk2, Cdk4, Cdk5, Cdk6, CHK1, c-Raf-1, Csk, EGFR,EphA1, EphA2, EphB2, EphB4, Erk2, Fak, Fes, Fer, FGFR1, FGFR2, FGFR3, FGFR4, Flt-3, Fms, Frk, Fyn,Gsk3, Gsk3, HCK, Her2/Erbb2, Her4/Erbb4, IGF1R, IKK бета, Irak4, Itk, Jak1, Jak2, Jak3, Jnk1, Jnk2, Jnk3,KDR, Kit, Lck, Lyn, MAP2K1, MAP2K2, MAP4K4, MAPKAPK2, Met, Mer, MNK1, MLK1, mTOR, p38,PDGFR, PDGFR, PDPK1, PI3K, PI3K, PI3K, PI3K, Pim1, Pim2, Pim3, PKC альфа, PKC бета, PKC тета, Plk1, Pyk2, Ret, ROCK1, ROCK2, RON, Src, Stk6, syk, TEC, Tie2, TrkA, TrkB, Tyk2, VEGFR1/Flt-1,VEGFR2/Kdr, VEGFR3/Flt-4, Yes и Zap70. Среди тирозинкиназных рецепторов Flt-3 представляет особый интерес. Действительно, от 60 до 80% бластных клеток острых миелоидных лейкозов (ОМЛ), а также высокий процент острых лимфобластных лейкозов (ОЛЛ) экспрессирует рецептор Flt-3, рецептор к лиганду Flt-3. Как лиганд, так и рецептор непосредственно или в сочетании определены как U119 (Hannum et al., Nature 368, pp. 643-648, 1994;Rosnet et al., Genomics 9, pp. 380-385, 1991). Flt-3 опосредует дифференциацию и пролиферацию нормальных гемопоэтических стволовых клеток и опосредует сигналы пролиферации и выживания в бластных клетках ОМЛ. Хотя Flt-3 чаще всего экспрессируется в форме дикого типа, лейкемический клон от 30 до 35% пациентов с ОМЛ (Nakao et al., Leukemia 12, pp. 1911-1918, 1996) экспрессирует мутантную форму Flt-3, которая содержит внутреннюю тандемную дупликацию (Flt-3 ITD) кодирующей последовательности околомембранного домена. Эта мутация приводит к конститутивной активации рецептора и автономному цитокин-независимому росту. Также сообщили, что когорта пациентов с ОМЛ (примерно 7%) содержит мутации в петле активации Flt-3 около положения аминокислоты Asp835 (Flt-3D835) (Yamamoto et al., Blood 97, pp. 2434-2439, 2001). Мутации Flt-3 также описаны с частотой 15% при вторичном ОМЛ и могут быть ассоциированы с прогрессированием заболевания или с рецидивом ОМЛ. Пациенты с мутациями Flt-3 склонны к плохому прогнозу со сниженными периодами ремиссии и безрецидивной выживаемости. Специфичные ингибиторы нативной и/или мутантной киназы Flt-3 представляют привлекательную мишень для лечения гемопоэтических расстройств и гематологических злокачественных опухолей. Селезеночная тирозинкиназа (syk), внутриклеточная протеинтирозинкиназа, является ключевым медиатором иммунорецепторной передачи сигнала у хозяина воспалительных клеток, включающих В клетки, мастоциты, макрофаги и нейтрофилы (Wong Br. et al. (2004), Expert Opin Investig Drugs, 13, 743762). Syk также широко экспрессируется в не гемопоэтических клетках, таких как фибробласты, клетки рака молочной железы, клетки карциномы ободочной кишки, гепатоциты, нейроны и эндотелиальные клетки кровеносных сосудов (Okamura S. et al. (1999), Oncol. Res. 11, 281-285). Исходно считали, что syk функционирует, прежде всего, при передаче сигнала иммунорецепторов, таких как рецептор Fc (FcR) и В-клеточный рецептор (BCR). Однако недавние исследования продемонстрировали критическую рольsyk в клеточной передаче сигнала различных клеточных стимулов, включающих IL-1, фактор некроза опухоли- (TNF), липополисахарид и 1-интегрин (Yamada T. et al. (2001), J Immunol., 167, 283-288). Например, syk может быть активирована TNF, что приводит в результате к MAPK фосфорилированию и транслокации NF-В в гемопоэтических клеточных линиях (Takada Y. и Aggarwal B.B. (2004), J Immunol., 173, 1066-1077). Индуцированное IL-1 продуцирование хемокинов в фибробластах носовых полипов также опосредовано активацией syk (Yamada T. et al. (2001), J Immunol., 167, 283-288). Syk стала потенциальной терапевтической мишенью для лечения аллергических и аутоиммунных расстройств. Задача изобретения Основная задача, лежащая в основе настоящего изобретения, таким образом, состоит в нахождении эффективных и селективных соединений, способных к ингибированию протеинкиназы дикого типа и/или мутантной, в частности тирозинкиназы дикого типа и/или мутантной, более конкретно Flt-3 и/или syk дикого типа и/или мутантной. Множество различных соединений описано в качестве ингибиторов тирозинкиназы Flt-3, например(Ambit Biosciences Corp. USA). В приведенных ниже международных заявках РСТ и заявках на патенты США раскрыты дополнительные модуляторы киназ, включая модуляторы Flt-3: WO 2002032861, WO 2002092599, WO 2003035009, WO 2003024931, WO 2003037347, WO 2003057690, WO 2003099771, WO 2003024969, WO 2004005281, WO 2004016597, WO 2004018419, WO 2004039782, WO 2004043389, WO 2004046120, WO 2004058749, WO 2004058749, WO 2008016665. Сообщали, что соединение R406 (Rigel Pharmaceuticals) ингибирует syk (Braselmann, Taylor et al. JPharmacol Exp Ther (2006), 319(3), 998-1008). Интересно, и после syk аутофосфорилирование Flt-3 было наиболее эффективно ингибировано R406 с эффективностью, примерно в 5 раз меньшей, чем активностьsyk (Braselmann, Taylor et al. 2006). Хотя точный механизм действия ингибитора Rigel R406 неясен, данные позволяют предположить, что ингибирование киназ, которые опосредуют сигнал выживания в лимфоцитах, является клинически полезным. В частности, задача изобретения состоит в разработке способа и соединений для селективного модулирования, регуляции и/или ингибирования преобразования сигнала, опосредованного определенной нативной и/или мутантной протеинкиназой, в частности тирозинкиназ, вовлеченных в ряд заболеваний человека и животных, таких как клеточно-пролиферативные, метаболические, аллергические и дегенеративные расстройства. Более конкретно эти соединения являются эффективными и селективными ингибиторами Flt-3 и/или syk. Конкретно задачей изобретения является разработка способа лечения ОМЛ или ОЛЛ. Раскрытие изобретения Соединения по настоящему изобретению подвергали скринингу на их способность ингибировать протеинкиназу, в частности тирозинкиназу, более конкретно Flt-3 и/или мутантная Flt-3 (особенно Flt-3ITD) и/или syk. В связи с настоящим изобретением авторы изобретения открыли, что соединения, имеющие определенные замещения в оксазольных производных, являются эффективными и селективными ингибиторами нативной и/или мутантной Flt-3. Эти соединения являются хорошими кандидатами для лечения клеточно-пролиферативного расстройства и/или расстройств, связанных с Flt-3. Такими расстройствами являются аномальная клеточная пролиферация и миграция, а также воспаление, где экспрессия Flt-3 должна быть ингибирована или где необходимо селективно модулировать, регулировать и/или ингибировать преобразование сигнала, опосредованное определенной нативной и/или мутантной Flt-3. В частности, изобретение относится к способу и соединениям для лечения гемопоэтических расстройств и гематологических злокачественных опухолей. Такие расстройства включают острый миелоидный лейкоз и острые лимфоидные лейкозы. В связи с настоящим изобретением авторы изобретения открыли, что соединения, имеющие определенные замещения в оксазольных производных, являются эффективными и селективными ингибиторами syk. Подробное описание изобретения Таким образом, настоящее изобретение относится к соединениям, принадлежащим к замещенным оксазольным производным. Эти соединения способны к селективному ингибированию преобразования сигнала, в которое вовлечена протеинкиназа, в частности тирозинкиназа, более конкретно тирозинфосфокиназа Flt-3 и ее мутантные формы и/или syk. В приведенном выше описании любая ссылка на протеинкиназу, в частности на тирозинкиназу,косвенно относится к Flt-3 и/или syk. В первой форме осуществления целью изобретения являются соединения формулы I, которые могут представлять собой либо формы свободного основания этих веществ, либо их фармацевтически приемлемые соли формула I где заместители A, Q, X, R1, R2, R3, V и W в формуле I являются такими, как описано ниже. А представляет собой одно из нижеследующего:R4 и R5 каждый независимо представляет собой атом водорода, С 1-4 алкил;X представляет собой СН или N;iii) гетероарильной 1 группы; где алкильная 1 группа представляет собой нормальную или разветвленную алкильную группу, содержащую от 1 до 10 атомов углерода, или циклоалкильную группу, содержащую от 3 до 10 атомов углерода, необязательно замещенную одним или более гетероатомами, выбранными из атома галогена,атома кислорода и атома азота; трифторметилом, карбоксилом, циано, нитро, формилом; CO-R, COO-R,CONR-R', SO2-R и SO2NR-R', где R и R' представляют собой нормальную или разветвленную алкильную группу, содержащую от 1 до 10 атомов углерода и необязательно замещенную по меньшей мере одним гетероатомом, выбранным из атома галогена, атома кислорода и атома азота; или циклоалкильной группой; арильная 1 группа - это фенил или его замещенный вариант, несущий любую комбинацию в любом положении кольца одного или более заместителей, выбранных из атома галогена; алкильной 1 группы; арильной или гетероарильной группы; трифторметильной, О-алкильной, карбоксильной, циано, нитро, формильной, гидрокси, NH-алкильной, N(алкил)(алкил) и аминогруппы;NRCO-R', либо NRCOO-R', либо NRCONR'-R", либо NRSO2-R', либо NRSO2NR'-R", либо CO-R, либо COO-R, либо CONR-R', либо SO2-R, либо SO2NRR', где R, R' и R" каждый независимо выбран из атома водорода, алкильной, арильной или гетероарильной группы; гетероарильная 1 группа - это пиридильная, пиримидинильная, пиразинильная, пиридазинильная,тиенильная, тиазолильная, имидазолильная, пиразолильная, пирролильная, фуранильная, оксазолильная,изоксазолильная, триазолильная, тетразолильная, индолильная, бензимидазольная, бензоксазольная, бензотиазольная, хинолинильная группа, которая может дополнительно нести любую комбинацию в любом положении кольца одного или более заместителей, выбранных из атома галогена; алкильной 1 группы; арильной или гетероарильной группы; трифторметильной, О-алкильной, карбоксильной, циано, нитро, формильной, гидрокси, NH-алкильной, N(алкил)(алкил) и аминогруппы;NRCO-R', либо NRCOO-R', либо NRCONR'-R", либо NRSO2-R', либо NRSO2NR'-R", либо CO-R, либо COO-R, либо CONR-R', либо SO2-R, либо SO2NRR', где R, R' и R" каждый независимо выбран из атома водорода, алкильной, арильной или гетероарильной группы;R1, R2 и R3 каждый независимо выбран из атома водорода, атома галогена, нормальной или разветвленной алкильной группы, содержащей от 1 до 10 атомов углерода, трифторметила, C1-6 алкилокси,С 1-6 алкиламино, ди(С 1-6 алкил)амино, циано;W выбран из фенила, пиридинила, пиразинила, пиримидинила, оксазолила или тиазолила, необязательно замещенных одним или более атомами галогена, нормальной или разветвленной алкильной группой, содержащей от одного до двух атомов углерода, трифторметилом или морфолинилэтокси. Если не указано иное (например, под указанием алкил 1, арил 1 или гетероарил 1), для целей настоящего изобретения термин "алкильная группа" означает любую нормальную или разветвленную, замещенную или незамещенную С 1-С 10 алкильную группу, такую как С 1-С 4 или С 1-С 6, в частности метильную, этильную группу, пропильную группу, предпочтительно метил. Термин "циклоалкильная группа" означает насыщенную или частично ненасыщенную, моноциклическую, конденсированную бициклическую или мостиковую полициклическую кольцевую структуру, содержащую указанное число кольцевых атомов. Этот термин включает замещенные или незамещенные циклоалкильные группы. Например, циклоалкильная группа может представлять собой С 3-С 10 алкильную группу, такую как С 5 или С 6, в частности циклопропильную, циклобутильную, циклопентильную, циклогексильную, циклогептильную или циклооктильную группу и т.д. Циклоалкильные группы включают гетероцикл в результате замещения одного или более чем одного атома углерода циклоалкильной группы одним или более чем одним атомом азота, кислорода или серы. Эти группы включают циклогетероалкильные группы, придающие растворимость в воде, как описано в данной заявке ниже. Термин "алкоксигруппа", как используют в данной заявке, отдельно или в комбинации, включает алкильную группу, соединенную с соединительным атомом кислорода. Примеры подходящих алкоксигрупп включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси, трет-бутокси. Термин "арильная группа" означает замещенную или незамещенную моноциклическую или конденсированную бициклическую ароматическую кольцевую структу-3 022188 ру, содержащую от шести до десяти кольцевых атомов углерода. Например, арил может представлять собой фенил или нафтил, предпочтительно фенил. Термин "гетероарильная группа" является таким, как определено выше для арильной группы, где один или более чем один из членов кольца представляет собой гетероатом. Например, гетероарильные группы включают пиридил, индолил, индазолил, хиноксалинил, хинолинил, бензофуранил, бензопиранил, бензотиопиранил, бензо[1,3]диоксол, имидазолил, бензимидазолил, пиримидинил, фуранил, оксазолил, изоксазолил, триазолил, тетразолил, пиразолил, тиенил и т.д. В некоторых формах осуществления группировки Q и W каждая независимо представляет собой замещенную арильную группу или гетероарильную группу, в которой по меньшей мере один из заместителей представляет собой группу, придающую растворимость в воде. Как используют в данной заявке,группа, "придающая растворимость в воде", представляет собой группу, которая обладает гидрофильным характером, достаточным для улучшения или повышения растворимости в воде соединения, в которое она включена, по сравнению с аналогичным соединением, которое не включает эту группу. Гидрофильный характер может быть достигнут любыми средствами, как, например, путем включения групп, которые ионизируются в условиях применения с образованием заряженных группировок (например, карбоновых кислот, сульфоновых кислот, фосфоновых кислот, аминов и т.д.); групп, которые включают постоянные заряды (например, четвертичные аммониевые группы) и/или гетероатомов или гетероатомных групп (например, О, S, N, NH, N-(CH2)zR, N-(CH2)z-C(O)R, N-(CH2)z-C(O)OR, N-(CH2)z-S(O)2R, N-(CH2)zS(O)2OR, N-(CH2)z-C(O)NRR' и т.д., где z представляет собой целое число в интервале от 0 до 6, R и R' каждый независимо выбран из атома водорода, нормальной или разветвленной алкильной группы, содержащей от 1 до 10 атомов углерода и необязательно замещенной одним или более чем одним гетероатомом, таким как атом галогена (выбранный из F, Cl, Br или I), атом кислорода и атом азота; а также С 1-6 алкилокси, С 1-6 алкиламино, C1-6 алкилгидрокси, ди(С 1-6 алкил)амино; а также арильной и гетероарильной группы. В некоторых формах осуществления группа, придающая растворимость в воде, представляет собой циклогетероалкил, который необязательно включает от 1 до 5 заместителей, которые сами могут представлять собой группы, придающие растворимость в воде. В конкретной форме осуществления группы, придающие растворимость в воде, имеют формулу где L выбран из группы, состоящей из СН и N, М выбран из группы, состоящей из -CH(R)-, -СН 2-,-О-, -S-, -NH-, -N(-(CH2)z-R)-, -N(-(CH2)z-C(O)R)-, -N(-(CH2)z-C(O)OR)-, -N(-(CH2)z-S(O)2R)-,-N(-(CH2)z-S(O)2OR)- и -N(-(CH2)z-C(O)NRR')-,где z представляет собой целое число в интервале от 0 до 6, R и R' каждый независимо выбран из атома водорода, нормальной или разветвленной алкильной группы, содержащей от 1 до 10 атомов углерода и необязательно замещенной одним или более чем одним гетероатомом, таким как атом галогена(выбранный из F, Cl, Br или I), атом кислорода и атом азота; а также С 1-6 алкилокси, C1-6 алкиламино,С 1-6 алкилгидрокси, ди(С 1-6 алкил)амино; а также арильной и гетероарильной группы, при условии, что L и М оба одновременно не представляют собой СН и СН 2 соответственно. В другой конкретной форме осуществления придающая растворимость в воде группа выбрана из группы, состоящей из морфолино, пиперидинила, (С 1-С 6)N-алкилпиперидинила, N-метилпиперидинила,N-(4-пиперидинил)пиперидинила, 4-(1-пиперидинил)пиперидинила, 1-пирролидинилпиперидинила, 4 морфолинопиперидинила, 4-(N-метил-1-пиперазинил)пиперидинила, пиперазинила, (С 1-С 6)N-алкилпиперазинила, N-метилпиперазинила, N-этилпиперидинила, N-этилпиперазинила, N-циклоалкилпиперазинила, N-циклогексилпиперазинила, пирролидинила, N-алкилпирролидинила, N-метилпирролидинила, диазепинила, N-этилпирролидинила, N-алкилазепинила, N-метилазепинила, N-этилазепинила, гомопиперазинила, N-метилгомопиперазинила, N-этилгомопиперазинила, имидазолила и тому подобного. Термины "один или более" охватывают любые комбинации предметов, к которым они относятся.-4 022188 Предпочтительными соединениями по изобретению являются соединения формулы Ia формула Ia где A, Q, R1, R2, R3 и V являются такими, как определено выше, и W1 выбран из одного или более из нижеследующего: атома водорода, атома галогена, нормальной или разветвленной алкильной группы,содержащей от 1 до 2 атомов углерода, трифторметила или морфолинилэтокси. В конкретной форме осуществления V представляет собой О. В одной форме осуществления все R1, R2, R3 представляют собой атомы водорода. В формуле I и Ia А предпочтительно выбран из СН 2-СН 2, NH-CH2, CH=CH, СС или отсутствует. В соответствии с одной формой осуществления формулы I и Ia Q представляет собой арильную или гетероарильную группу, необязательно замещенную атомом галогена (выбранным из F, Cl, Br или I),группами циано, трифторметил, амино, алкокси, как определено выше, алкильными группами, как определено выше, или нитрогруппой. В соответствии с одной формой осуществления формулы I и Ia Q представляет собой циклоалкил,такой, как определено выше, и предпочтительно выбранный из циклогексила, циклопентила, циклогептила и циклооктила. В одной форме осуществления W1 представляет собой атом водорода, атом галогена, нормальную или разветвленную алкильную группу, содержащую от 1 до 2 атомов углерода, трифторметил или морфолинилэтокси. Среди конкретных соединений формулы I изобретение направлено на соединения приведенной ниже формулы формула II где R1, R2, R3, X, V и W имеют значения, описанные выше, и где R6, R7, R8, R9 и R10 каждый независимо выбран из атома водорода, атома галогена, нормальной или разветвленной алкильной группы, содержащей от 1 до 10 атомов углерода и необязательно замещенной одним или более гетероатомами, выбранными из атома галогена, атома кислорода и атома азота; трифторметила, C1-6 алкилокси, амино, С 1-6 алкиламино, ди(С 1-6 алкил)амино, карбоксила, циано, нитро,формила, гидрокси и CO-R, COO-R, CONR-R', SO2-R и SO2NR-R' где R и R' каждый независимо выбран из атома водорода, алкильной, арильной или гетероарильной группы. В соответствии с изобретением соединения формулы II могут представлять собой соединения формулы Ia, определенной выше, включая каждую форму осуществления, где A-Q является таким, как показано ниже Такие соединения могут быть представлены формулой IIa ниже-5 022188 Среди конкретных соединений формулы I изобретение направлено на соединения приведенной ниже формулы формула III где Z представляет собой арил 1 или гетероарил 1, R1, R2, R3, X, V, W, арил 1 и гетероарил 1 имеют значение, описанное выше. В соответствии с изобретением соединения формулы III могут представлять собой соединения формулы Ia, определенной выше, включая каждую форму осуществления, где A-Q представляет собой Z,как определено выше. Такие соединения могут быть представлены формулой IIIa ниже формула IIIa где R1, R2, R3, V, W1 и Z имеют значение, описанное выше. Соединения по настоящему изобретению могут быть получены с использованием общего протокола,как описано ниже. Ароматические альдегиды общей формулы (2) подвергали взаимодействию с паратолуолсульфонилметилизоцианидом (TosMIC) с получением соответствующих 5-арилзамещенных оксазолов (3), используя метод Van Leusen et. al. (Tetrahedron Lett., 1972, 23, 2369). Альдегиды, не имеющиеся в продаже, были получены с использованием описанных в литературе методов введения альдегидной группы из соответствующего бромированного ароматического соединения (1), используя металлорганический реагент и ДМФ (Org. Lett.,2004, 6, 1887). Эти соединения общей формулы (3), несущие замещаемый атом, например Br, затем по необходимости подвергали дальнейшей функционализации, используя известные протоколы катализируемого палладием Nарилирования с соответствующим сочетанием лиганда и неорганического основания для каждого субстрата с получением N-связанных аналогов (4). Депротонирование оксазольной группировки подходящим органическим основанием и последующее электрофильное хлорирование или йодирование использовали для получения 2-хлороксазольных или 2-йодоксазольных соединений (5). Это дало возможность получить различные семейства молекул путем замещения атома хлора либо аминными, либо тиольными нуклеофилами с образованием соединений общей формулы (6). Подобным образом, хлорированные или йодированные оксазолы (5) использовали для получения дополнительных С-2 замещенных аналогов (7), используя классические катализируемые палладием реакции сочетания (Diederich F. и Stang P.J. "Metal-catalyzed Cross-coupling Reactions"WILEY-VCH, 1998), например сочетание Стилле или Сузуки в присутствии станнанов или арилбороновых кислот соответственно (схема 1). Соединения (4) использовали для получения дополнительных аналогов (14) путем катализируемого никелем алкинилирования, используя метод Matsuyama et. al. (Org. Lett., 2009, 77,4156).-6 022188 Кроме того, незамещенные оксазолы (4) использовали в катализируемых палладием реакциях С-Н активации (схема 2) с целью региоселективного установления ароматического кольца в С-2 положение в соответствии с методом Besselievre et al. (Synthesis 2009, 20, 3511; Org. Lett., 2008, 10 (18), 4029). Кроме того, эти оксазольные промежуточные соединения (4) подвергали взаимодействию с рядом -бромстиролов с получением соответствующих 2-стирилоксазолов (8) подобным способом. Не имеющиеся в продаже бромстиролы, используемые в данной заявке, получали из соответствующих коричных кислот, используя опубликованный протокол Hunsdieker, или из соответствующих альдегидов путем дебромирования Кори-Фукса с последующим дебромированием путем восстановления Хирау с трифенилфосфином. Альтернативно оксазолы (8) могут быть получены из галогенированных аналогов (5) путем катализируемого палладием кросс-сочетания с подходящей бороновой кислотой или сложным эфиром. Следующее семейство ингибиторов (9) было получено путем восстановления двойной связи стирилоксазолов (8) каталитической гидрогенизацией атмосферного давления (см. в Hudlicky "Reductions in Organic схема 2 При синтезе соединений формулы I R1 и R схематически представляют собой одну или более чем одну группу, выбранную из R1, R2 и R3; X представляет собой атом галогена; R3 представляет собой одну или более чем одну группу, выбранную из R6, R7, R8, R9 и R10. YR2 представляет собой аминную группу или тиольную группу. Ar и Ar1 представляют собой арильную или гетероарильную группу. Hal представляет собой атом галогена. Во второй форме осуществления изобретение относится к фармацевтической композиции, содержащей соединение, изображенное выше. Соответственно, изобретение относится к фармацевтической композиции, содержащей по меньшей мере одно соединение по изобретению и приемлемый фармацевтический эксципиент. Как известно специалистам в данной области техники, можно использовать различные формы эксципиентов соответственно пути введения, и некоторые из них могут способствовать эффективности активной молекулы, например, путем стимуляции профиля высвобождения, делающего данную активную молекулу в целом более эффективной для желаемого лечения. Таким образом, фармацевтические композиции по изобретению могут быть введены в различных формах, более конкретно, например, в инъекционной форме, в аэрозольной форме или в форме для приема внутрь, например, посредством внутримышечного, внутривенного, подкожного, внутрикожного, перорального, местного, ректального, вагинального, глазного, назального, чрескожного или парентерального пути. Настоящее изобретение конкретно охватывает применение соединения в соответствии с настоящим изобретением для получения композиции, в частности фармацевтической композиции. Такое лекарственное средство может иметь форму фармацевтической композиции, приспособленной для перорального введения, которую можно включать в препарат с использованием фармацевтически приемлемых носителей, хорошо известных в данной области техники, в подходящих дозировках. Такие носители обеспечивают включение фармацевтических композиций в препараты в виде таблеток,пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и тому подобного для приема пациентом внутрь. В дополнение к активным ингредиентам эти фармацевтические композиции могут содержать подходящие фармацевтически приемлемые носители, включающие эксципиенты и вспомогательные вещества, которые облегчают обработку активных соединений с получением препаратов, которые можно применять фармацевтически. Дополнительные подробности о методах включения в препарат и введения можно найти в последнем издании Remington's Pharmaceutical Sciences (Maack Publishing Co.,Easton, Pa.). Композиция по изобретению может также иметь форму фармацевтической или косметической композиции для местного введения. Такие композиции могут быть представлены в форме геля, пасты, мази, крема, лосьона, жидкой суспензии в водных, водно-спиртовых или масляных растворах, либо дисперсий типа сыворотки или лосьона, либо безводных или липофильных гелей, либо эмульсий жидкой или полужидкой консистенции типа молочка, полученных путем диспергирования жировой фазы в водной фазе или наоборот, либо сус-7 022188 пензий или эмульсий мягкой, полутвердой консистенции типа крема или геля, либо альтернативно микроэмульсий, микрокапсул или дисперсий микрочастиц или везикул ионного и/или неионного типа. Эти композиции готовят в соответствии со стандартными способами. Композиция в соответствии с изобретением содержит любой ингредиент, обычно используемый в дерматологии и косметике. Он может включать по меньшей мере один ингредиент, выбранный из гидрофильных или липофильных гелеобразующих агентов, гидрофильных или липофильных активных агентов, консервантов, смягчающих средств, полимеров, усиливающих вязкость, увлажнителей, сурфактантов, консервантов, антиоксидантов, растворителей и наполнителей, ароматизирующих веществ, наполнителей, экранирующих агентов, бактерицидных средств, поглотителей запаха и красящего вещества. В качестве масел, которые можно использовать в изобретении, можно упомянуть минеральные масла (жидкий вазелин), растительные масла (жидкую фракцию масла ши, подсолнечное масло), животные масла, синтетические масла, силиконовые масла (циклометикон) и фторированные масла. Жирные спирты, жирные кислоты (стеариновую кислоту) и воски (парафин, карнаубский воск, пчелиный воск) можно также использовать в качестве жировых веществ. В качестве эмульгаторов, которые можно использовать в изобретении, рассматривают глицеринстеарат, полисорбат 60 и смесь ПЭГ-6/ПЭГ-32/гликольстеарат. В качестве гидрофильных гелеобразующих агентов можно упомянуть карбоксивиниловые полимеры (карбомер), акриловые сополимеры, такие как сополимеры акрилата и алкилакрилата, полиакриламиды, полисахариды, такие как гидроксипропилцеллюлоза, глины и натуральные смолы, и в качестве липофильных гелеобразующих агентов можно упомянуть модифицированные глины, такие как бентониты,соли металлов и жирных кислот, такие как стеараты алюминия и гидрофобный кремнезем, или альтернативно этилцеллюлозу и полиэтилен. В качестве гидрофильных активных агентов можно использовать белки или гидролизаты белков,аминокислоты, полиолы, мочевину, аллантоин, сахара и производные сахаров, витамины, крахмальные и растительные экстракты, в частности, экстракты алоэ вера. В качестве липофильных активных агентов можно использовать ретинол (витамин А) и его производные, токоферол (витамин Е) и его производные, незаменимые жирные кислоты, церамиды и эфирные масла. Эти агенты придают дополнительное увлажнение или обладают свойствами смягчения кожи при применении. Кроме того, сурфактант можно включать в композицию, чтобы обеспечить более глубокое проникновение соединения, способного к истощению мастоцитов, такого как ингибитор тирозинкиназы. Среди рассмотренных ингредиентов изобретение включает агенты, усиливающие проницаемость,выбранные, например, из группы, состоящей из минерального масла, воды, этанола, триацетина, глицерина и пропиленгликоля; агенты когезии, выбранные, например, из группы, состоящей из полиизобутилена, поливинилацетата и поливинилового спирта, и загустители. Химические методы усиления местного всасывания лекарственных средств хорошо известны в данной области техники. Например, соединения со свойствами усиления проницаемости включают лаурилсульфат натрия (Dugard, P.H. and Sheuplein, R.J. "Effects of Ionic Surfactants on the Permeability of Human Epidermis: An Electrometric Study", J. Ivest. Dermatol. V. 60, pp. 263-69, 1973), лауриламиноксид(Johnson et. al., US 4411893), азон (Rajadhyaksha, US 4405616 и 3989816) и децилметилсульфоксид (Sekura, D.L. и Scala, J. "The Percutaneous Absorption of Alkyl methyl Sulfides", Pharmacology of the Skin, Advances In Biology of Skin (Appleton-Century Craft). V. 12, pp. 257-69, 1972). Наблюдали, что увеличение полярности концевой группы в амфотерных молекулах увеличивает их свойства, усиливающие проницаемость, но за счет увеличения их свойств раздражения кожи (Cooper, E.R. и Bemer, В. "Interaction ofed. (Marcel Dekker, Inc.), pp. 195-210, 1987). Второй класс химических усилителей обычно относят к сорастворителям. Эти вещества всасываются местно относительно легко и посредством ряда механизмов достигают усиления проницаемости для некоторых лекарственных средств. Этанол (Gale et al., патент США 4615699, и Campbell et al., патенты США 4460372 и 4379454), диметилсульфоксид (US 3740420 и US 3743727, а также US 4575515) и производные глицерина (US 4322433) являются несколькими примерами соединений, которые проявляют способность к усилению всасывания различных соединений. Фармацевтические композиции по изобретению могут быть также предназначены для введения в аэрозольном препарате в целевые области дыхательных путей пациента. Приемы и методологии для доставки аэрозольных впрысков препарата лекарственного средства раскрыты в US 5906202. Эти препараты предпочтительно представляют собой растворы, например водные растворы, этанольные растворы, водно-этанольные растворы, физиологические растворы, коллоидные суспензии и микрокристаллические суспензии. Например, аэрозольные частицы, содержащие вышеупомянутый активный ингредиент и носитель (например, фармацевтически активное легочное лекарственное средство и носитель), образуют при проталкивании препарата через насадку, которая предпочтительно находится в форме гибкой пористой мембраны. Частицы имеют размер, достаточно малый, чтобы при образовании частиц они оставались суспендированными в воздухе в течение достаточного количест-8 022188 ва времени, чтобы пациент мог вдыхать эти частицы в легкие пациента. Изобретение включает системы, описанные в US 5556611 системы жидкость-газ (сжиженный газ используют в качестве газа-пропеллента (например, легкокипящий FCHC или пропан, бутан) в контейнере под давлением),суспензионный аэрозоль (частицы активного вещества суспендированы в твердой форме в фазе жидкого пропеллента),система газа, подаваемого под давлением (используют сжатый газ, такой как азот, диоксид углерода, закись азота, воздух). Таким образом, в соответствии с изобретением фармацевтический препарат готовят таким образом,чтобы активное вещество было растворено или диспергировано в соответствующей нетоксичной среде, и этот раствор или дисперсию измельчают до аэрозоля, то есть крайне тонко распределяют в газеносителе. Это технически возможно, например, в форме аэрозольных упаковок газа-пропеллента, нагнетаемых аэрозолей или других устройств, которые известны как таковые для распыления жидкостей и тонкого измельчения твердых веществ, которые, в частности, дают возможность точного индивидуального дозирования. Таким образом, изобретение также направлено на аэрозольные устройства, содержащие соединение, как определено выше, и такой препарат, предпочтительно с дозирующими клапанами. Фармацевтические композиции по изобретению могут быть также предназначены для интраназального введения. В этом отношении фармацевтически приемлемые носители для введения соединения на поверхности слизистой оболочки носа хорошо известны обычному специалисту в данной области техники (см.Remington's Pharmaceutical Sciences" 16th edition, 1980, ed. by Arthur Osol, содержание которой включено в данную заявку посредством ссылки). Выбор соответствующих носителей зависит от конкретного рассматриваемого типа введения. Для введения через верхние дыхательные пути композицию можно включать в раствор, например, воду или изотонический физиологический раствор, буферный или не буферный, либо в виде суспензии для интраназального введения в виде капель или в виде спрея. Предпочтительно такие растворы или суспензии являются изотоническими относительно секреции носа и имеют примерно такой же рН в интервале, например, от примерно рН 4,0 до примерно рН 7,4 или от рН 6,0 до 7,0. Буферы должны быть физиологически совместимыми и включают, просто для примера, фосфатные буферы. Например, репрезентативный назальный деконгестант описан как забуференный до рН примерно 6,2 (Remington's, Id. на с. 1445). Конечно, обычный специалист в данной области техники может легко определить подходящее содержание солей и рН для нетоксичного водного носителя для назального введения и/или для введения в верхние дыхательные пути. Общепринятые интраназальные носители, включающие назальные гели, кремы, пасты или мази с вязкостью, например, от примерно 10 до примерно 3000 сП или от примерно 2500 до 6500 сП или более,можно использовать для обеспечения более пролонгированного контакта с поверхностями слизистой оболочки носа. Такие препараты вязкого носителя могут быть основаны, просто для примера, на алкилцеллюлозах и/или других биосовместимых носителях высокой вязкости, хорошо известных в данной области техники (см., например, Remington's, цитируется выше). Предпочтительной алкилцеллюлозой является, например, метилцеллюлоза в концентрации в интервале от примерно 5 до примерно 1000 или более мг на 100 мл носителя. Более предпочтительная концентрация метилцеллюлозы составляет, просто для примера, от примерно 25 до примерно 7 мг на 100 мл носителя. Другие ингредиенты, такие как известные в данной области техники консерванты, красители, смазывающие или вязкие минеральные или растительные масла, ароматизирующие вещества, натуральные или синтетические растительные экстракты, такие как ароматические масла, а также увлажняющие агенты и усилители вязкости, такие как, например, глицерин, можно также включать для обеспечения дополнительной вязкости, удерживания влаги и благоприятной текстуры и запаха для препарата. Для назального введения растворов или суспензий в соответствии с изобретением в данной области техники доступны различные устройства для образования капель, капелек и спреев. Дозатор предварительно отмеренной стандартной дозы, включающий капельное или аэрозольное устройство, содержащее раствор или суспензию для доставки в виде капель или в виде спрея, получают таким образом, что оно содержит одну или более чем одну дозу лекарственного средства для введения, и они составляют другой объект изобретения. Изобретение также включает набор, содержащий одну или более чем одну стандартную дозу сухого вещества соединения вместе с любой необходимой солью и/или буферным агентом, консервантом, красителем и тому подобным, готовый к приготовлению раствора или суспензии путем добавления подходящего количества воды. Другой аспект изобретения направлен на применение соединения для получения лекарственного средства. Иными словами, изобретение охватывает способ лечения заболевания, обусловленного нарушенной регуляцией Flt-3 и/или syk, включающий введение эффективного количества по меньшей мере одного соединения, как определено выше, млекопитающему, нуждающемуся в таком лечении. Заболевание, обусловленное нарушенной регуляцией Flt-3 и/или syk, представляет собой заболева-9 022188 ние, которое предупреждают, лечат, либо которое претерпевает обратное развитие в результате модулирования, регулирования и/или ингибирования Flt-3 и/или syk. Предпочтительно соединения в соответствии с изобретением можно применять в эффективном количестве. Эти количества обычно включают от 0,1 мг до 2 г соединения по изобретению в сутки на килограмм массы тела. Изобретение относится к другому аспекту способа или соединения для модулирования, регулирования и/или ингибирования в клетках преобразования сигнала, опосредованного нативной и/или мутантной протеинкиназой, в частности нативной и/или мутантной тирозинкиназой, более конкретно нативной и/или мутантной Flt-3 и/или syk. Этот способ включает введение в клетки по меньшей мере одного соединения по изобретению. В одной форме осуществления клетки представляют собой бластные клетки ОМЛ или гемопоэтические стволовые клетки с мутацией протеинкиназы, в частности с мутацией тирозинкиназы, более конкретно с мутацией Flt-3. Термин "соединение по изобретению" означает азольное производное, как описано выше, включая каждую форму осуществления, взятую отдельно или в комбинациях. Любая комбинация различных вариантов, аспектов и форм осуществления находится в пределах объема изобретения. Изобретение также относится к способу или соединению для лечения заболеваний человека и животных, обусловленных нарушением преобразования сигнала, опосредованного нативной и/или мутантной протеинкиназой, в частности нативной и/или мутантной тирозинкиназой, более конкретно нативной и/или мутантной Flt-3 и/или syk. В частности, такой способ предназначен для лечения пролиферативного, метаболического, аллергического и/или дегенеративного расстройства. Данный способ включает введение субъекту, в частности пациенту-человеку, нуждающемуся в этом, эффективного количества по меньшей мере одного соединения по изобретению. В одной форме осуществления у субъекта или пациента диагностирован ОМЛ или ОЛЛ. Изобретение относится к способу или соединению для лечения ОМЛ или ОЛЛ, где способ включает введение эффективного количества по меньшей мере одного соединения по изобретению субъекту, в частности пациенту-человеку, страдающему ОМЛ или ОЛЛ. Изобретение относится к способу или соединению для лечения гемопоэтических расстройств и гематологических злокачественных опухолей. Более конкретно целью изобретения является способ лечения заболевания, выбранного из аутоиммунных заболеваний, аллергических заболеваний, разрежения кости, раков, таких как лейкоз и стромальная опухоль ЖКТ, опухолевого ангиогенеза, вирусной инфекции, воспалительных заболеваний,воспалительных кишечных заболеваний (ВКЗ), интерстициального цистита, мастоцитоза, инфекционных заболеваний, метаболических расстройств, фиброза, диабета и расстройств ЦНС, включающий введение эффективного количества соединения, изображенного выше, млекопитающему, нуждающемуся в таком лечении. Вышеописанные соединения полезны для получения лекарственного средства для лечения заболеваний, обусловленных нарушенной регуляцией Flt-3 и/или syk, включающих, но не ограниченных ими опухолевые заболевания, такие как мастоцитоз, мастоцитома у собак, солидные опухоли, стромальная опухоль желудочно-кишечного тракта человека ("ЖКСО"), мелкоклеточный рак легкого, немелкоклеточный рак легкого, острый миелоидный лейкоз, острый лимфоцитарный лейкоз, миелодиспластический синдром, хронический миелогенный лейкоз, колоректальные карциномы, желудочные карциномы,желудочно-кишечные стромальные опухоли, тестикулярные раки, глиобластомы, солидные опухоли и астроцитомы; опухолевый ангиогенез; метаболические заболевания, такие как сахарный диабет и его хронические осложнения; ожирение; диабет типа II; гиперлипидемии и дислипидемии; атеросклероз; гипертензия и сердечно-сосудистое заболевание; аллергические заболевания, такие как астма, аллергический ринит, аллергический синусит, анафилактический синдром, крапивница, ангионевротический отек, атопический дерматит, аллергический контактный дерматит, узловая эритема, полиморфная эритема, кожный некротизирующий венулит, а также кожное воспаление вследствие укусов насекомых и инвазии кровососущих паразитов; интерстициальный цистит; разрежение кости (остеопороз); воспалительные заболевания, такие как ревматоидный артрит, конъюнктивит, ревматоидный спондилоартрит, остеоартрит, подагрический артрит и другие артритные состояния; аутоиммунные заболевания, такие как рассеянный склероз, псориаз, кишечное воспалительное заболевание, неспецифический язвенный колит, болезнь Крона, ревматоидный артрит и полиартрит, локальная и системная склеродерма, системная красная волчанка, дискоидная красная волчанка, кожная красная волчанка, дерматомиозит, полимиозит, синдром Шегрена, узловой панартериит, аутоиммунная энтеропатия, а также пролиферативный гломерулонефрит; болезнь трансплантат-против-хозяина или отторжение трансплантата при трансплантации любых органов, включая почку, поджелудочную железу, печень, сердце, легкое и костный мозг;- 10022188 другие аутоиммунные заболевания, включенные в изобретение, активный хронический гепатит и синдром хронической усталости; расстройства, связанные с образованием субэпидермальных пузырей, такие как пузырчатка; васкулит; вирусная инфекция; бактериальная инфекция; заболевания, обусловленные дисфункцией меланоцитов, такие как гипермеланоз, являющиеся результатом дисфункции меланоцитов и включающие лентигиноз, солнечное или сенильное лентиго, предраковый меланоз Дюбрея, невусы, а также злокачественные меланомы. В этом отношении изобретение охватывает применение определенных выше соединений для получения лекарственного средства или косметической композиции для отбеливания кожи человека; расстройства ЦНС, такие как психиатрические расстройства, мигрень, боль, потеря памяти и дегенерация нервных клеток. Более конкретно способ в соответствии с изобретением полезен для лечения приведенных ниже расстройств: депрессии, включая дистимическое расстройство, циклотимическое расстройство, биполярную депрессию, тяжелую или "меланхолическую" депрессию, атипичную депрессию,рефракторную депрессию, сезонную депрессию; анорексии; булимии; предменструального синдрома; постменопаузального синдрома; других синдромов, таких как снижение умственной деятельности и потеря концентрации, пессимистическое беспокойство, возбуждение, самоуничижение, сниженное либидо; боли, включая острую боль, послеоперационную боль, хроническую боль, ноцицептивную боль, раковую боль, невропатическую боль, психогенные болевые синдромы; тревожных расстройств, включая тревогу,обусловленную гипервентиляцией и сердечными аритмиями; фобических расстройств; обсессивнокомпульсивного расстройства; посттравматического стрессового расстройства; острого стрессового расстройства; генерализованного тревожного расстройства; неотложных психиатрических расстройств, таких как панические приступы, включая психоз, бредовые расстройства, конверсионные расстройства,фобии, манию, бред, диссоциативные эпизоды, включая диссоциативную амнезию, диссоциативное бродяжничество и диссоциативное расстройство личности, деперсонализацию, кататонию, судороги; тяжелые неотложные психиатрические расстройства, включающие суицидальное поведение, самоотрицание,буйное или агрессивное поведение, травму, пограничное расстройство личности и острый психоз; шизофрении, включая параноидную шизофрению, гебефрению, кататоническую шизофрению и недифференцированный тип шизофрении; нейродегенеративные заболевания, включая болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, прионные заболевания, мотонейронное заболевание (МНЗ) и боковой амиотрофический склероз (БАС); расстройства, обусловленные злоупотреблением химическими веществами, на которые ссылаются в данной заявке, но не ограниченные ими, наркоманию, злоупотребление лекарственными средствами,привыкание к лекарственным средствам, лекарственную зависимость, синдром отмены и передозировку; церебральную ишемию; фиброз; миодистрофию Дюшенна. Изобретение, таким образом, относится к применению одного или более чем одного соединения по изобретению для получения лекарственного средства для лечения гематологических злокачественных опухолей, миелопролиферативного расстройства, других пролиферативных расстройств, аутоиммунных расстройств, воспалительных заболеваний, аллергических заболеваний и/или неврологических заболеваний. В одной форме осуществления гематологические злокачественные опухоли представляют собой острый миелоидный лейкоз (ОМЛ), миелодиспластические синдромы (МДС), острый лимфобластный лейкоз (ОЛЛ) и/или хронический миелоидный лейкоз (ХМЛ). В форме осуществления пролиферативное расстройство представляет собой рак. В форме осуществления аутоиммунные расстройства представляют собой рассеянный склероз, псориаз, воспалительное кишечное заболевание, неспецифический язвенный колит, болезнь Крона, ревматоидный артрит и полиартрит, локальную и системную склеродерму, системную красную волчанку, дискоидную красную волчанку, кожную красную волчанку, дерматомиозит, полимиозит, синдром Шегрена,узловой панартериит, аутоиммунную энтеропатию, атопический дерматит и/или пролиферативный гломерулонефрит. В форме осуществления аллергические заболевания представляют собой астму, аллергический ринит, аллергический синусит, анафилактический синдром, крапивницу, ангионевротический отек, атопический дерматит, аллергический контактный дерматит, узловую эритему, полиморфную эритему, кожный некротизирующий венулит, а также кожное воспаление вследствие укусов насекомых и инвазии кровососущих паразитов. В форме осуществления неврологическое заболевание представляет собой болезнь Гентингтона,шизофрению, болезнь Паркинсона и/или болезнь Альцгеймера. В форме осуществления соединение(я) по изобретению применяют для получения лекарственного- 11022188 средства, которое действует в качестве ингибитора протеинкиназ. В частности, протеинкиназа представляет собой Flt-3 или syk. Изобретение относится к фармацевтической композиции, содержащей эффективное количество комбинации по меньшей мере одного соединения по изобретению и другого агента молекулярной направленности. Изобретение относится к применению по меньшей мере одного соединения по изобретению вместе с другим агентом молекулярной направленности для получения лекарственного средства для лечения гематологических злокачественных опухолей, миелопролиферативного расстройства, других пролиферативных расстройств, аутоиммунных расстройств и кожных расстройств. Изобретение относится также к применению по меньшей мере одного соединения по изобретению для селективного ингибирования syk. Изобретение относится также к применению по меньшей мере одного соединения по изобретению для лечения аутоиммунных, и/или воспалительных, и/или аллергических заболеваний. Теперь изобретение проиллюстрировано примерами, которые являются предпочтительными в данной заявке формами осуществления, которые составляют часть изобретения, но которые никоим образом не используют для ограничения его объема. Примеры предпочтительных соединений формулы I изображены ниже. Пример 001. (4-Метилпиридин-2-ил)-[6-(2-фенетилоксазол-5-ил)пиридин-2-ил]амин(способ 1). Примеры предпочтительных соединений формулы II изображены ниже. Пример 003. (3-2-[2-(4-Метоксифенил)винил]оксазол-5-илфенил)-(4-метилпиридин-2-ил)амин(ИЭР+) m/z 371 (М+Н)+. Примеры предпочтительных соединений формулы III изображены ниже. Пример 025. (6-2-[2,6-Диметил-4-(2-морфолин-4-илэтокси)фенил]оксазол-5-илпиридин-2-ил)-(4 метилпиридин-2-ил)амин Н ЯМР (400 МГц, ДМСО)9.16 (s, 1 Н), 8.36 (d, J=7.7 Гц, 1 Н), 8.31 (s, 1H), 8.14 (s, 1 Н), 8.07 (d,J=5.2 Гц, 1 Н), 7.94 (d, J=8.0 Гц, 1 Н), 7.89-7.75 (m, 3 Н), 7.45-7.34 (m, 2 Н), 6.69 (s, 1 Н), 6.66 (d, J=5.3 Гц,1 Н), 2.26 (s, 3 Н). (ИЭР+) m/z 396 (М+Н)+. Время удерживания = 3,59 мин (способ 1). Примеры синтеза соединений Изобретение будет понято более полно со ссылкой на приведенные ниже примеры получения, но их не следует истолковывать как ограничивающие объем изобретения. Общее: все используемые химические вещества представляли собой имеющиеся в продаже продукты, чистые для анализа. Растворители представляли собой растворители безводного технического сорта и были использованы без дополнительной очистки. ТГФ был свежеперегнанным в потоке аргона перед применением. За ходом реакций следили с помощью тонкослойной хроматографии, используя предварительно покрытые силикагелем 60F 254 пластины для ТСХ фирмы Merck, которые визуализировали в УФ-свете. Кратности в спектрах 1 Н ЯМР указаны как синглет (s), широкий синглет (br s), дублет (d), триплет (t), квадруплет (q) и мультиплет (m), и спектры ЯМР снимали на спектрометре Bruker 300, 360 или 400 МГц. Масс-спектры снимали с помощью масс-спектрометрии с ионизацией электрораспылением (ИЭР МС) в положительном режиме или с помощью масс-спектрометрии с химической ионизацией атмосферного давления (APCI МС) в положительном режиме. Способы ЖХ-МС Способ 1. Этот способ проводили на приборе для сверхэффективной жидкостной хроматографии(СЭЖХ) ACQUITY Waters, соединенном с масс-спектрометром TQD. Используемый градиент представлял собой: начало при t=0,0 мин с 5% CH3CN+0,1% муравьиной кислоты в воде+0,1% муравьиной кислоты до t=0,5 мин; затем линейный градиент от t=0,5 до t=7,0 мин, достигая 100% CH3CN+0,1% муравьиной кислоты; затем оставляли в этом состоянии от t=7,0 мин до t=10,0 мин. Используемая колонка представляла собой колонку Waters HSS C18 1,8 мкм, 2,150 мм. Используемый прибор для обнаружения представлял собой тройной квадрупольный масс-спектрометр (TQD) с использованием положительного режима ИЭР. Способ 2. Этот способ проводили на приборе для ВЭЖХ 2695 Alliance Waters, соединенном с массспектрометром ZMD. Используемый градиент представлял собой: начало при t=0,0 мин с 0%CH3CN+0,04% муравьиной кислоты в воде (10 мМ); затем линейный градиент от t=3,1 мин, достигая 100% CH3CN + 0,04% муравьиной кислоты; затем оставляли в этом состоянии до t=3,8 мин и снижали доt=4,8 мин до 0% CH3CN + 0,04% муравьиной кислоты в воде. Используемая колонка представляла собой колонку Sunfire 2,150 мм dp:3,5 мкм. Используемый прибор для обнаружения представлял собой тройной квадрупольный масс-спектрометр (TQD) с использованием положительного режима APCI. СокращенияAPCI+ масс-спектрометрии с химической ионизацией атмосферного давления (положительный режим)CDCl3 Дейтериохлороформ ДХМ Дихлорметан ДМФ N,N-Диметилформамид ДМСО-d6 ГексадейтериодиметилсульфоксидTosMIC паратолуолсульфонилметилизоцианид ТГФ Тетрагидрофуран Пример 008. Получение (4-метилпиридин-2-ил)-(6-оксазол-5-илпиридин-2-ил)амина(150 мл) добавляли K2CO3 (5,25 г, 38,0 ммоль) и TosMIC (7,43 г, 38,0 ммоль). После перемешивания при температуре окружающей среды в течение 1,5 ч смесь концентрировали в вакууме и продукт осаждали добавлением воды. Твердое вещество собирали фильтрованием и высушивали в вакуумном эксикаторе при 50 С с получением соединения 2-бром-6-оксазол-5-илпиридина в виде бежевого твердого вещества(6,81 г, 95% выход). 1 Н ЯМР (CDCl3, 300 МГц)7.97 (s, 1 Н), 7.76 (s, 1 Н), 7.65-7.57 (m, 2H), 7.48-7.37 (m,1 Н). В герметичную пробирку с тефлоновой завинчивающейся крышкой загружали 2-бром-6-оксазол-5 илпиридин (4,00 г, 17,8 ммоль), 2-амино-4-метилпиридин (2,30 г, 21,3 ммоль), Pd2(dba)3 (320 мг, 0,349 ммоль), -BINAP (440 мг, 0,707 ммоль), NaOtBu (2,40 г, 25,0 ммоль) и безводный толуол (80 мл) и нагревали до 90 С при перемешивании в течение 1 ч. Охлажденную реакционную смесь обрабатывали водой и экстрагировали ДХМ. Объединенные органические вещества высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, после чего очищали колоночной хроматографией на SiO2,элюируя 30% EtOAc в циклогексане, с получением соединения, указанного в заголовке, в виде желтооранжевого твердого вещества (1,89 г, 42%). 1 Н ЯМР (300 МГц, ДМСО-d6)9.78 (s, 1 Н), 8.53 (s, 1 Н), 8.11 В герметичную пробирку загружали смесь (4-метилпиридин-2-ил)-(6-оксазол-5-илпиридин-2 ил)амина (200 мг, 0,793 ммоль), 4-(2-бромвинил)бензонитрила (330 мг, 1,59 ммоль), Pd(PPh3)4 (46 мг,0,0396 ммоль), LiOtBu (127 мг, 1,59 ммоль) и безводного 1,4-диоксана (5 мл) и нагревали до 100 С при перемешивании в течение 2 ч. Охлажденную реакционную смесь обрабатывали водой и экстрагировали ДХМ. Объединенные органические вещества высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, после чего очищали колоночной хроматографией на SiO2, элюируя 50% EtOAc в циклогексане, с получением соединения, указанного в заголовке, в виде желтого твердого вещества (76 мг, 25%). 1 Н ЯМР (300 МГц, ДМСО-d6) =9.79 (s, 1H), 8.12 (d, J=5.1 Гц, 1 Н), 7.97 (d, J=8.3 Гц, 2 Н), 7.90 Смесь 4-(2-5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-илвинил)бензонитрила (72 мг, 0,189 ммоль) и 10% палладия на активированном угле (27 мг) в МеОН и ДХМ (10 мл каждого) энергично перемешивали в атмосфере водорода при температуре и давлении окружающей среды в течение 24 ч. Добавляли дополнительный катализатор (27 мг) и смесь перемешивали еще в течение 18 ч. Смесь фильтровали и выпаривали при пониженном давлении, после чего растирали из ДХМ/пентана с получением соединения, указанного в заголовке, в виде бледно-желтого твердого вещества (32 мг, 44%). 1 Н ЯМР (300 МГц, ДМСО-d6)9.75(s, 1 Н), 8.10 (d, J=5.0 Гц, 1 Н), 7.89-7.39 (m, 8 Н), 7.17 (d, J=7.2 Гц, 1 Н),6.73 (t, J=13.6 Гц, 1 Н), 3.22 (s, 4 Н), 2.31 (s, 3 Н). (ИЭР+) m/z 382 (М+Н). Пример 011. Получение (4-метилпиридин-2-ил)-[6-(2-пиридин-3-илоксазол-5-ил)пиридин-2-ил] амина Получен, как описано выше для 4-(2-5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2 илвинил)бензонитрила, используя (4-метилпиридин-2-ил)-(6-оксазол-5-илпиридин-2-ил)амин, 3-бромпиридин, Pd(PPh3)4, LiOtBu и безводный 1,4-диоксан, с получением соединения, указанного в заголовке,в виде бледно-желтого твердого вещества (8%). 1 Н ЯМР (300 МГц, ДМСО-d6)9.81 (s, 1 Н), 9.31 (s, 1 Н),8.76 (d, J=4.8 Гц, 1H), 8.46 (d, J=8.1 Гц, 1 Н), 8.12 (d, J=5.0 Гц, 1 Н), 7.91 (s, 2 Н), 7.84-7.76 (m, 1 Н), 7.69-7.52 Получен, как описано выше для 4-(2-5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2 илвинил)бензонитрила, используя (4-метилпиридин-2-ил)-(6-оксазол-5-илпиридин-2-ил)амин, 3-бромN-(2-гидроксиэтил)-N-метилбензолсульфонамид, Pd(PPh3)4, LiOtBu и безводный 1,4-диоксан, с получением соединения, указанного в заголовке, в виде бледно-желтого твердого вещества (24%). 1 Н ЯМР (400 МГц, CDCl3)9.81 (s, 1 Н), 8.45-8.34 (m, 2H), 8.12 (d, J=5.0 Гц, 1 Н), 8.01-7.77 (m, 5 Н), 7.66 (d, J=8.4 Гц,1 Н), 7.46 (d, J=7.4 Гц, 1 Н), 6.79 (d, J=5.0 Гц, 1 Н), 4.83 (t, J=5.5 Гц, 1 Н), 3.55 (q, J=5.8 Гц, 2 Н), 3.11 (t, J=5.9 Гц, 2 Н), 2.81 (d, J=8.0 Гц, 3 Н), 2.36 (s, 3 Н). (ИЭР+) m/z 466 (М+Н)+. Время удерживания = 2,45 мин (способ 1). Пример 033. Получение (4-метилпиридин-2-ил)-6-[2-(3-пирролидин-1-илметилфенил)оксазол-5 ил]пиридин-2-иламина гидрохлорида Раствор 3-йодбензилового спирта (600 мг, 2,56 ммоль) в ДХМ (3 мл) обрабатывали тионилхлоридом (3 мл, 41,3 ммоль) и перемешивали при температуре окружающей среды в течение 18 ч, после чего дополнительно добавляли тионилхлорид (1 мл, 13,7 ммоль) и нагревали до температуры образования флегмы в течение 12 ч. Охлажденный раствор подщелачивали 50% NaOH, разбавляли водой и экстрагировали ДХМ. Объединенные органические вещества высушивали над MgSO4, фильтровали и выпаривали с получением прозрачного сиропа, который кристаллизуется при стоянии с образованием 3-йодбензилхлорида в виде белого твердого вещества (650 мг, количественно). Раствор 3-йодбензилхлорида (100 мг, 0,396 ммоль) в 1,4-диоксане (3 мл) обрабатывали пирролидином (0,5 мл, 6,02 ммоль) и нагревали до температуры образования флегмы в течение 5 ч. Охлажденную смесь выпаривали до сухости и обрабатывали EtOAc и водой. Органические вещества отделяли, высушивали над MgSO4, фильтровали и выпаривали с получением 1-(3-йодбензил)пирролидина в виде про- 16022188 зрачного сиропа (110 мг, 97%). Затем(4-метилпиридин-2-ил)-6-[2-(3-пирролидин-1-илметилфенил)оксазол-5-ил]пиридин-2-ил амин был получен, как описано выше для 4-(2-5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол 2-илвинил)бензонитрила, используя (4-метилпиридин-2-ил)-(6-оксазол-5-ил-пиридин-2-ил)амин (пример 008), 1-(3-йодбензил)пирролидин, Pd(PPh3)4, LiOtBu и безводный 1,4-диоксан. Выделенное вещество растворяли в EtOAc и обрабатывали HCl (2M в эфире) с получением соединения, указанного в заголовке,в виде бежевого твердого вещества (35%) после выпаривания в вакууме. 1 Н ЯМР (400 МГц, ДМСО-d6)12.65 (s, 1 Н), 11.30 (s, 1 Н), 8.53-8.47 (m, 2 Н), 8.33 (s, 1 Н), 8.19 (d, J=7.6 Гц, 1 Н), 8.07 (t, J=7.9 Гц, 1 Н), 7.85 4-(3-Йодбензил)морфолин был получен, как описано выше для 1-(3-йодбензил)пирролидина. Затем(4-метилпиридин-2-ил)-6-[2-(3-морфолин-4-илметилфенил)оксазол-5-ил]пиридин-2-иламин был получен, как описано выше для (4-метилпиридин-2-ил)-6-[2-(3-пирролидин-1-илметилфенил)оксазол-5 ил]пиридин-2-иламина гидрохлорида, используя (4-метилпиридин-2-ил)-(6-оксазол-5-илпиридин-2 ил)амин (пример 008), 4-(3-йодбензил)морфолин, Pd(PPh3)4, LiOtBu и безводный 1,4-диоксан, затем HCl(2M в эфире) с получением соединения, указанного в заголовке, в виде бежевого твердого вещества Перемешанный раствор (4-метилпиридин-2-ил)-(6-оксазол-5-илпиридин-2-ил)амина (пример 008,1,00 г, 3,96 ммоль) в сухом дистиллированном ТГФ (50 мл) в атмосфере аргона охлаждали до -78 С, затем обрабатывали LiHMDS (1M в ТГФ) (5,96 мл, 5,96 ммоль) по каплям. После перемешивания при-78 С в течение 15 мин раствор обрабатывали C2Cl6 (1,41 г, 5,96 ммоль) одной порцией и реакционной смеси давали возможность вернуться к температуре окружающей среды. Затем реакционную смесь охлаждали до -78 С и обрабатывали LiHMDS (1 М в ТГФ) (5,96 мл, 5,96 ммоль) по каплям, затем C2Cl6(1,41 г, 5,96 ммоль) и подогревали до комнатной температуры и перемешивали в течение 1 ч. Смесь обрабатывали водой и экстрагировали ДХМ. Объединенные органические вещества высушивали надMgSO4, фильтровали и выпаривали при пониженном давлении, после чего очищали колоночной хроматографией на SiO2, элюируя 30% EtOAc в циклогексане, с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (836 мг, 74%).1 Н ЯМР (300 МГц, ДМСО-d6)9.82 (s, 1 Н), 8.10[6-(2-Хлороксазол-5-ил)пиридин-2-ил]-(5-хлорпиридин-2-ил)амин был получен путем такой же последовательности реакций, как описано выше для получения [6-(2-хлороксазол-5-ил)пиридин-2-ил]-(4 метилпиридин-2-ил)амина (пример 012), с итоговым хлорированием LiHMDS и C2Cl6 с получением желаемого хлороксазола. Раствор [6-(2-хлороксазол-5-ил)пиридин-2-ил]-(5-хлорпиридин-2-ил)амина (50 мг, 0,162 ммоль) в ТГФ (4 мл) и воде (2 мл) обрабатывали 3-тиофенбороновой кислотой (25 мг, 0,195 ммоль), Pd(PPh3)4 (19- 17022188 мг, 0,0162 ммоль) и K2CO3 (50 мг, 0,358 ммоль), после чего нагревали до 100 С в течение 60 ч. Охлажденную смесь обрабатывали водой и экстрагировали ДХМ. Объединенные органические вещества высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, после чего очищали колоночной хроматографией на SiO2, элюируя 1% EtOH в ДХМ, с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (51 мг, 89%). 1 Н ЯМР (400 МГц, ДМСО-d6)10.05 (s, 1H),8.33-8.31 (m, 1 Н), 8.28 (d, J=2.5 Гц, 1 Н), 8.15 (d, J=9.0 Гц, 1 Н), 7.89 (dd, J=9.0, 2.7 Гц, 1 Н), 7.85 (s, 1 Н),7.83-7.77 (m, 2 Н), 7.69-7.65 (m, 1 Н), 7.49 (d, J=8.3 Гц, 1 Н), 7.40 (d, J=7.4 Гц, 1 Н). (ИЭР+) m/z 355 (М+Н)+. Время удерживания = 4,28 мин (способ 1). Пример 036. Получение 6-[2-(1 Н-индол-5-ил)оксазол-5-ил]пиридин-2-илпиразин-2-ил-амина Получен, как описано выше для (5-хлорпиридин-2-ил)-[6-(2-тиофен-3-илоксазол-5-ил)пиридин-2 ил]амина, из [6-(2-хлороксазол-5-ил)пиридин-2-ил]пиразин-2-иламина, индол-5-бороновой кислоты,Pd(PPh3)4 и K2CO3 в ТГФ/воде с получением соединения, указанного в заголовке, в виде бежевого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)11.37 (s, 1H), 10.08 (s, 1H), 9.28 (s, 1H), 8.38 (s, 1H), 8.308.25 (m, 1H), 8.16 (d, J=2.6 Гц, 1H), 7.93-7.81 (m, 2H), 7.79 (s, 1H), 7.65 (d, J=8.3 Гц, 1H), 7.58 (d, J=8.5 Гц,1H), 7.51-7.42 (m, 2H), 6.62 (s, 1H). (ИЭР+) m/z 338 (M+H)+. Время удерживания = 1,81 мин (способ 1). Пример 037. Получение 6-[2-(1 Н-индол-5-ил)оксазол-5-ил]-5-метилпиридин-2-ил-(4-метилпиридин-2-ил)амина 2-Бром-6-хлор-3-метилпиридин был получен из 2-хлор-5-метилпиридина способом Gros Р. и Fort Y.-78 С в атмосфере аргона обрабатывали по каплям 2-бром-6-хлор-3-метилпиридином (642 мг, 3,10 ммоль) в сухом ТГФ (4 мл) и перемешивали при этой температуре в течение 30 мин. Добавляли по каплям раствор ДМФ (385 мкл, 4,70 ммоль) в сухом ТГФ (1 мл) и перемешивали при -78 С еще в течение 45 мин, после чего подогревали до температуры окружающей среды. Реакционную смесь гасили МеОН (3 мл), обрабатывали водой и экстрагировали EtOAc. Объединенные органические вещества высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, после чего очищали колоночной хроматографией на SiO2, элюируя 2% EtOH в ДХМ, с получением 6-хлор-3-метилпиридин-2 карбальдегида в виде желтого твердого вещества (217 мг, 45%). 1 Н ЯМР (400 МГц, CDCl3)10.09 (s,1 Н), 7.60 (d, J=7.7 Гц, 1 Н), 7.42 (d, J=7.7 Гц, 1 Н), 2.64 (s, 3 Н). Затем [6-(2-хлороксазол-5-ил)-5-метилпиридин-2-ил]-(4-метилпиридин-2-ил)амин был получен путем такой же последовательности реакций, как описано выше для получения [6-(2-хлороксазол-5 ил)пиридин-2-ил]-(4-метилпиридин-2-ил)амина, с итоговым хлорированием LiHMDS и C2Cl6 с получением желаемого хлороксазола, который использовали без дополнительной очистки. Затем 6-[2-(1 Н-индол-5-ил)оксазол-5-ил]-5-метилпиридин-2-ил-(4-метилпиридин-2-ил)амин был получен, как описано выше для (5-хлорпиридин-2-ил)-[6-(2-тиофен-3-илоксазол-5-ил)пиридин-2-ил]амина, используя (5-хлорпиридин-2-ил)-[6-(2-тиофен-3-илоксазол-5-ил)пиридин-2-ил]амин, индол-5-бороновую кислоту, Pd(PPh3)4 и K2CO3 в ТГФ/воде, с получением 6-[2-(1 Н-индол-5-ил)оксазол-5-ил]-5-метилпиридин-2-ил-(4-метилпиридин-2-ил)амина в виде бежевого твердого вещества (32%). 1 Н ЯМР (400 МГц, ДМСО-d6)11.45 (s, 1H), 9.62 (s, 1 Н), 8.36 (s, 1 Н), 8.14 (s, 1 Н), 8.11 (d, J=5.1 Гц, 1 Н), 7.90 (dd, J=8.5,1.5 Гц, 1 Н), 7.72 (s, 1 Н), 7.65-7.54 (m, 2H), 7.51-7.46 (m, 1 Н), 7.40 (d, J=8.4 Гц, 1 Н), 6.77 (d, J=4.9 Гц, 1 Н),6.61 (s, 1 Н), 2.51 (s, 3 Н), 2.39 (s, 3 Н). (ИЭР+) m/z 382 (М+Н)+. Время удерживания = 2,98 мин (способ 1). Пример 013. Получение [6-(2-циклогексилсульфанилоксазол-5-ил)пиридин-2-ил]-(4-метилпиридин 2-ил)амина Смесь [6-(2-хлороксазол-5-ил)пиридин-2-ил]-(4-метилпиридин-2-ил)амина (50 мг, 0,174 ммоль),K2CO3 (72 мг, 0,523 ммоль) и циклогексантиола (64 мкл, 0,523 ммоль) в iPrOH (5 мл) нагревали до обра- 18022188 зования флегмы в течение 18 ч. Охлажденную смесь обрабатывали водой и экстрагировали ДХМ. Объединенные органические вещества высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении до желтой смолы. Эту смолу растворяли в минимальном количестве ДХМ и осаждали нпентаном с получением соединения, указанного в заголовке, в виде бежевого твердого вещества (45 мг,71%). 1 Н ЯМР (300 МГц, ДМСО-d6)9.76 (s, 1 Н), 8.10 (s, 1 Н), 7.56-7.78 (m, 4 Н), 7.17 (d, J=5.9 Гц, 1 Н),6.75 (s, 1 Н), 3.71 (m, 1 Н), 2.31 (s, 3 Н), 2.08 (m, 2 Н), 1.64 (m, 8 Н). (ИЭР+) m/z 367 (М+Н)+. Пример 014. Получение 5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]-N-(пиридин-4-илметил)оксазол-2-аминаiPrOH (5 мл) обрабатывали 4-аминометилпиридином (53 мкл) и нагревали до образования флегмы в течение 40 ч. Охлажденную смесь обрабатывали водой и экстрагировали ДХМ. Объединенные органические вещества высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, после чего очищали колоночной хроматографией на Al2O3 (Brockman сорт III, 7% Н 2 О), элюируя 2% EtOH в ДХМ. В результате осаждения из ДХМ н-пентаном получили соединение, указанное в заголовке, в виде бледно-желтого твердого вещества (34 мг, 55%). 1 Н ЯМР (300 МГц, ДМСО-d6)9.61 (s, 1H), 8.52 (d,J=4.6 Гц, 2 Н), 8.25 (t, J=5.8 Гц, 1 Н), 8.08 (d, J=5.0 Гц, 1 Н), 7.73 (s, 1H), 7.64 (t, J=7.9 Гц, 1 Н), 7.47 (d, J=8.3 Гц, 1 Н), 7.36 (d, J=4.9 Гц, 2 Н), 7.29 (s, 1H), 6.92 (d, J=7.6 Гц, 1 Н), 6.73 (d, J=5.0 Гц, 1 Н), 4.49 (d, J=5.7 Гц,2 Н), 2.29 (s, 3 Н). (ИЭР+) m/z 359 (М+Н)+. Пример 015. Получение N-(4-метоксибензил)-5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-амина Получен, как описано выше для 5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]-N-(пиридин-4 илметил)оксазол-2-амина из хлороксазола и 4-метоксибензиламина в iPrOH. 1H ЯМР (300 МГц, ДМСОd6)9.60 (s, 1H), 8.18-8.00 (m, 2 Н), 7.75 (s, 1 Н), 7.63 (t, J=7.9 Гц, 1 Н), 7.45 (d, J=8.3 Гц, 1 Н), 7.38-7.24 (m,3 Н), 6.95-6.86 (m, 3 Н), 6.73 (d, J=5.0 Гц, 1 Н), 4.37 (d, J=5.9 Гц, 2 Н), 3.72 (s, 3 Н), 2.30 (s, 3 Н). (ИЭР+) m/z 388 (М+Н)+. Пример 038. Получение 4-5-[6-(5-метилтиазол-2-иламино)пиридин-2-ил]оксазол-2-илпиперазин 2-она Получен, как описано выше для 5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]-N-(пиридин-4 илметил)оксазол-2-амина из [6-(2-хлороксазол-5-ил)пиридин-2-ил]-(5-метилтиазол-2-ил)амина и 2 оксопиперазина в iPrOH. 1H ЯМР (400 МГц, ДМСО-d6)11.08 (s, 1 Н), 8.14 (s, 1 Н), 7.68 (t, J=7.9 Гц, 1 Н),7.59 (s, 1H), 7.16-6.97 (m, 2H), 6.83 (d, J=8.2 Гц, 1H), 4.11 (s, 2H), 3.86-3.63 (m, 2H), 3.43-3.32 (m, 2H), 2.37 Получен, как описано выше для 5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]-N-(пиридин-4-илметил)оксазол-2-амина, из [6-(2-хлороксазол-5-ил)пиридин-2-ил]-(3-трифторметилфенил)амина и Nметилпиперазина в iPrOH. 1H ЯМР (400 МГц, ДМСО-d6)9.54 (s, 1 Н), 8.66 (s, 1 Н), 7.72 (d, J=8.0 Гц, 1 Н),7.63 (t, J=7.9 Гц, 1 Н), 7.50 (t, J=7.9 Гц, 1 Н), 7.36 (s, 1 Н), 7.21 (d, J=7.5 Гц, 1 Н), 7.00 (d, J=7.5 Гц, 1 Н), 6.70 Раствор N-Вос-пиперазина (1,00 г, 5,31 ммоль) в ацетонитриле (30 мл) обрабатывали К 2 СО 3 (2,20 г,15,9 ммоль) и (2-бромэтил)метиловым эфиром (812 мкл, 5,84 ммоль) и нагревали до 80 С в течение 18 ч. Охлажденную смесь разбавляли водой и экстрагировали ДХМ. Объединенные органические вещества высушивали над MgSO4, фильтровали и выпаривали, и остаток очищали колоночной хроматографией наSiO2, элюируя 5% EtOH в ДХМ, с получением 1-Вос-4-(2-метоксиэтил)пиперазина в виде прозрачного масла (978 мг, 76%).1 Н ЯМР (400 МГц, ДМСО-d6)3.41 (t, J=5.8 Гц, 2 Н), 3.29-3.25 (m, 4H), 3.21 (s, 3 Н),2.45 (t, J=5.8 Гц, 2 Н), 2.33 (t, J=5.0 Гц, 4 Н), 1.38 (s, 9H). Раствор 1-Вос-4-(2-метоксиэтил)пиперазина (264 мг, 1,08 ммоль) в ДХМ (10 мл) обрабатывали ТФУ(1 мл) и перемешивали при температуре окружающей среды в течение 2 ч. Раствор выпаривали до сухости, и сырую смесь, содержащую соль трифторуксусной кислоты 1-(2-метоксиэтил)пиперазина, использовали без дополнительной очистки. Затем(6-2-[4-(2-метоксиэтил)пиперазин-1-ил]оксазол-5-илпиридин-2-ил)-(4-метилпиридин-2 ил)амин был получен, как описано выше для 5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]-N-(пиридин-4-илметил)оксазол-2-амина, из [6-(2-хлороксазол-5-ил)пиридин-2-ил]-(4-метилпиридин-2-ил)амина и соли трифторуксусной кислоты 1-(2-метоксиэтил)пиперазина в iPrOH. 1H ЯМР (400 МГц, ДМСО-d6)9.59 (s, 1 Н), 8.08 (d, J=5.1 Гц, 1 Н), 7.86 (s, 1 Н), 7.63 (t, J=8.0 Гц, 1 Н), 7.41-7.36 (m, 2H), 7.03 (d, J=7.4 Гц,1 Н), 6.73 (d, J=4.9 Гц, 1 Н), 3.52 (t, J=4.7 Гц, 4 Н), 3.47 (t, J=5.7 Гц, 2 Н), 3.25 (s, 3H), 2.63-2.52 (m, 6H), 2.30 Получен, как описано выше для 5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]-N-(пиридин-4 илметил)оксазол-2-амина, из [3-(2-хлороксазол-5-ил)фенил]-(4-метилпиримидин-2-ил)амина и соли трифторуксусной кислоты 1-(2-метоксиэтил)-2-оксопиперазина в iPrOH. 1H ЯМР (400 МГц, ДМСО-d6)9.56 Получен, как описано выше для 5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]-N-(пиридин-4 илметил)оксазол-2-амина, из 3-(2-хлороксазол-5-ил)-5-(4-метилпиридин-2-иламино)бензонитрила и N-(2 метоксиэтил)метиламина в iPrOH. (400 МГц, ДМСО-d6)9.38 (s, 1 Н), 8.18 (d, J=1.7 Гц, 1 Н), 8.10 (d, J=5.1 Гц, 1 Н), 7.87 (t, J=1.7 Гц, 1 Н), 7.49 (t, J=1.4 Гц, 1 Н), 7.41 (s, 1 Н), 6.70 (d, J=5.3 Гц, 1 Н), 6.68 (s, 1 Н), 3.643.60 (m, 2 Н), 3.60-3.55 (m, 2 Н), 3.29 (s, 3 Н), 3.11 (s, 3 Н), 2.26 (s, 3 Н).(ИЭР+) m/z 364 (М+Н)+. Время удерживания = 2,55 мин (способ 1). Смесь [6-(2-хлороксазол-5-ил)пиридин-2-ил]-(4-метилпиридин-2-ил)амина (44 мг, 0,153 ммоль), 2 три-н-бутилстаннилпиридина (68 мг, 0,184 ммоль) и Pd(PPh3)4 (18 мг, 0,016 ммоль) в толуоле (4 мл) нагревали до образования флегмы в течение 18 ч, а затем концентрировали в вакууме. Остаток очищали колоночной хроматографией на SiO2, элюируя 5% EtOH в ДХМ, с получением соединения, указанного в заголовке, в виде бледно-оранжевого твердого вещества (16 мг, 31%). 1 Н ЯМР (300 МГц, ДМСО-d6)9.85 (s, 1 Н), 8.76 (d, J=5.0 Гц, 1 Н), 8.21 (d, J=7.8 Гц, 1 Н), 8.12 (d, J=5.0 Гц, 1 Н), 8.03 (t, J=7.8 Гц, 1 Н), 7.94 2-Йодоксазольное производное было получено, как описано выше для [6-(2-хлороксазол-5 ил)пиридин-2-ил]-(4-метилпиридин-2-ил)амина, из (4-метилпиридин-2-ил)-(6-оксазол-5-илпиридин-2 ил)амина с LiHMDS (1 М раствор в ТГФ) и дийодоэтаном в безводном ТГФ с получением соединения,указанного в заголовке, в виде желтого твердого вещества (41%) после очистки колоночной хроматографией на SiO2 с элюированием 40% EtOAc в циклогексане. 1 Н ЯМР (300 МГц, ДМСО-d6)9.81 (s, 1 Н),8.10 (d, J=5.0 Гц, 1 Н), 7.84-7.51 (m, 4H), 7.23 (d, J=7.2 Гц, 1 Н), 6.77 (d, J=4.6 Гц, 1 Н), 2.33 (s, 3 Н). Пример 018. Получение (4-метилпиридин-2-ил)-[6-(2-фенилоксазол-5-ил)пиридин-2-ил]амина Раствор [6-(2-йодоксазол-5-ил)пиридин-2-ил]-(4-метилпиридин-2-ил)амина (46 мг, 0,121 ммоль),фенилбороновой кислоты (30 мг, 0,246 ммоль), K2CO3 (37 мг, 0,268 ммоль) и Pd(PPh3)4 (14 мг, 0,012 ммоль) в смеси ТГФ (4 мл) и воды (2 мл) перемешивали при 90 С в течение 18 ч. Охлажденную реакционную смесь обрабатывали водой и экстрагировали EtOAc. Объединенные органические вещества высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, после чего очищали колоночной хроматографией на SiO2, элюируя 30% EtOAc в циклогексане, с получением соединения, указанного в заголовке, в виде бледно-оранжевого твердого вещества (30 мг, 75%). 1 Н ЯМР (ДМСО-d6, 300 МГц):9.79 (s, 1 Н), 8.12 (m, 2 Н), 8.02 (s, 1 Н), 7.93 (s, 1 Н), 7.86 (s, 1 Н), 7.78 (m, 2 Н), 7.58 (m, 2 Н), 7.40 (t,J=7.0 Гц, 1 Н), 7.33 (t, J=7.0 Гц, 1 Н), 6.78 (d, J=5.0 Гц, 1 Н), 2.37 (s, 3 Н). (ИЭР+) m/z 329 (М+Н)+. Время удерживания = 2,84 мин (способ 1). Пример 043. Получение (4-метилпиридин-2-ил)-(3-2-[2-(3-трифторметилфенил)винил]оксазол-5 илфенил)амина Получен, как описано выше для (4-метилпиридин-2-ил)-[6-(2-фенилоксазол-5-ил)пиридин-2 ил]амина, используя [3-(2-йодоксазол-5-ил)фенил]-(4-метилпиридин-2-ил)амин, транс-2-(3-трифторметилфенил)винилбороновую кислоту, K2CO3 и Pd(PPh3)4 в смеси 2:1 об./об. ТГФ и воды, с получением (4 метилпиридин-2-ил)-(3-2-[2-(3-трифторметилфенил)винил]оксазол-5-илфенил)амина в виде бледножелтого твердого вещества (72%). 1 Н ЯМР (400 МГц, ДМСО-d6)9.26-8.94 (m, 1 Н), 8.15 (s, J=8.6 Гц,1 Н), 8.11-8.06 (m, 3 Н), 7.76-7.63 (m, 5 Н), 7.43 (d, J=16.5 Гц, 1 Н), 7.40-7.29 (m, 2 Н), 6.68 (s, 1 Н), 6.64 (d,J=5.2 Гц, 1 Н), 2.25 (s, 3 Н). (ИЭР+) m/z 422 (М+Н)+. Время удерживания = 3,84 мин (способ 1). Получен, как описано выше для (4-метилпиридин-2-ил)-[6-(2-фенилоксазол-5-ил)пиридин-2 ил]амина, используя [6-(2-йодоксазол-5-ил)пиридин-2-ил]-(4-метилпиридин-2-ил)амин, 2-метоксипиридин-3-бороновую кислоту, K2CO3 и Pd(PPh3)4 в смеси 2:1 об./об. ТГФ и воды, с получением 6-[2-(2 метоксипиридин-3-ил)оксазол-5-ил]пиридин-2-ил-(4-метилпиридин-2-ил)амина в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)9.76 (s, 1H), 8.46-8.31 (m, 2H), 8.12 (d, J=5.0 Гц, 1 Н), 7.877.82 (m, 2 Н), 7.82-7.75 (m, 1 Н), 7.63 (d, J=8.4 Гц, 1 Н), 7.34 (d, J=7.3 Гц, 1 Н), 7.21 (dd, J=7.5, 5.0 Гц, 1 Н),6.78 (d, J=5.0 Гц, 1 Н), 4.04 (s, 3 Н), 2.33 (s, 3 Н). (ИЭР+) m/z 360 (М+Н)+. Время удерживания = 2,54 мин Раствор вышеописанного 6-[2-(2-метоксипиридин-3-ил)оксазол-5-ил]пиридин-2-ил-(4-метилпиридин-2-ил)амина (236 мг, 0,655 ммоль) в EtOH (10 мл) обрабатывали концентрированной HCl (1 мл) и нагревали до 80 С в течение 3 ч, а затем до 60 С в течение 18 ч. Охлажденную смесь обрабатывали водой и продукт осаждали в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)12.23 (s, 1 Н),9.78 (s, 1 Н), 8.29-8.22 (m, 1 Н), 8.11 (d, J=5.0 Гц, 1 Н), 7.86 (s, 1 Н), 7.82-7.73 (m, 2 Н), 7.69-7.63 (m, 1 Н), 7.60 Смесь вышеописанного 3-5-[6-(4-метилпиридин-2-иламино)пиридин-2-ил]оксазол-2-ил-1 Н-пиридин-2-она (60 мг, 0,17 ммоль), 1-(2-хлорэтил)морфолина (36 мг, 0,19 ммоль), K2CO3 (29 мг, 0,21 ммоль),NaI (29 мг, 0,19 ммоль) в ДМФ (6 мл) нагревали до 50 С в течение 18 ч. Смесь концентрировали в вакууме и остаток обрабатывали водой и экстрагировали EtOAc. Объединенные органические вещества промывали водой, высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, после чего очищали колоночной хроматографией на Al2O3 (Brockman сорт III, 7% Н 2 О), элюируя 2% EtOH в ДХМ, с получением соединения, указанного в заголовке, в виде бледно-желтого твердого вещества (27 мг, 35%). 1 Н ЯМР (400 МГц, ДМСО-d6)9.77 (s, 1 Н), 8.23 (dd, J=7.2, 2.0 Гц, 1 Н), 8.11 (d, J=5.1 Гц, 1 Н),7.95 (dd, J=6.6, 2.0 Гц, 1 Н), 7.89 (s, 1H), 7.83-7.72 (m, 2H), 7.58 (d, J=8.4 Гц, 1 Н), 7.29 (d, J=7.4 Гц, 1 Н),6.77 (d, J=5.0 Гц, 1 Н), 6.43 (t, J=6.9 Гц, 1 Н), 4.13 (t, J=6.2 Гц, 2 Н), 3.56 (t, J=4.3 Гц, 4 Н), 2.62 (t, J=6.2 Гц,2 Н), 2.48-2.40 (m, 4H), 2.35 (s, 3 Н). (ИЭР+) m/z 459 (М+Н)+. Время удерживания = 1,63 мин (способ 1). Пример 047. Получение (4-метилпиридин-2-ил)-[6-(2-фенилэтинилоксазол-5-ил)пиридин-2-ил]амина В герметичную пробирку с тефлоновой завинчивающейся крышкой загружали смесь (4 метилпиридин-2-ил)-(6-оксазол-5-илпиридин-2-ил)амина (200 мг, 0,793 ммоль), бромэтинилбензола (172 мг, 0,951 ммоль) Ni(cod)2 (11 мг, 0,040 ммоль), dppbz (18 мг, 0,040 ммоль) и LiOtBu (127 мг, 1,59 ммоль) в сухом диоксане (5 мл) и нагревали до 100 С в течение 2 ч. Добавляли дополнительное количество бромэ- 22022188 тинилбензола (172 мг), Ni(cod)2 (11 мг), dppbz (18 мг), LiOtBu (127 мг, 1,59 ммоль) и сухого диоксана (2 мл) и нагревание продолжали в течение 36 ч. Охлажденную смесь обрабатывали водой и экстрагировали ДХМ. Объединенные органические вещества высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, после чего очищали колоночной хроматографией на SiO2, элюируя 30% EtOAc в циклогексане, с получением соединения, указанного в заголовке, в виде беловатого твердого вещества В герметичную пробирку с тефлоновой завинчивающейся крышкой загружали смесь [6-(2 йодоксазол-5-ил)пиридин-2-ил]-(4-метилпиридин-2-ил)амина (100 мг, 0,264 ммоль), бензоксазола (31 мг,0,264 ммоль), Pd(PPh3)4 (15 мг, 0,013 ммоль) и LiOtBu (42 мг, 0,529 ммоль) в сухом диоксане (5 мл) и нагревали до 100 С в течение 24 ч. Охлажденную смесь обрабатывали водой и экстрагировали ДХМ. Объединенные органические вещества высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении, после чего очищали колоночной хроматографией на SiO2, элюируя 30% EtOAc в циклогексане,с получением соединения, указанного в заголовке, в виде бежевого твердого вещества (12 мг, 12%). 1 Н ЯМР (400 МГц, ДМСО-d6)9.88 (s, 1H), 8.14-8.11 (m, 2 Н), 7.99-7.88 (m, 3 Н), 7.83 (t, J=7.9 Гц, 1 Н), 7.73(d, J=8.4 Гц, 1 Н), 7.61-7.51 (m, 2 Н), 7.46 (d, J=7.3 Гц, 1 Н), 6.80 (d, J=5.0 Гц, 1 Н), 2.41 (s, 3H). (ИЭР+) m/z 370 (М+Н)+. Время удерживания = 2,88 мин (способ 1). Путем повторения вышеописанных способов с использованием соответствующих исходных веществ и условий были получены и охарактеризованы приведенные ниже дополнительные аналоги в табл. 1. Таблица 1
МПК / Метки
МПК: A61K 31/444, C07D 417/14, C07D 413/12, C07D 413/14, A61P 35/00, A61K 31/443, A61P 37/00, A61K 31/4436
Метки: ингибиторы, оксазольные, содержащие, применение, киназы, композиции
Код ссылки
<a href="https://eas.patents.su/30-22188-oksazolnye-ingibitory-kinazy-soderzhashhie-ih-kompozicii-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Оксазольные ингибиторы киназы, содержащие их композиции и их применение</a>
Предыдущий патент: Биоразлагаемая смазочная композиция и ее применение в качестве бурового раствора, в особенности для очень глубоких месторождений
Следующий патент: Композиция шампуня
Случайный патент: Типографская краска для глубокой печати, включающая дендримеры