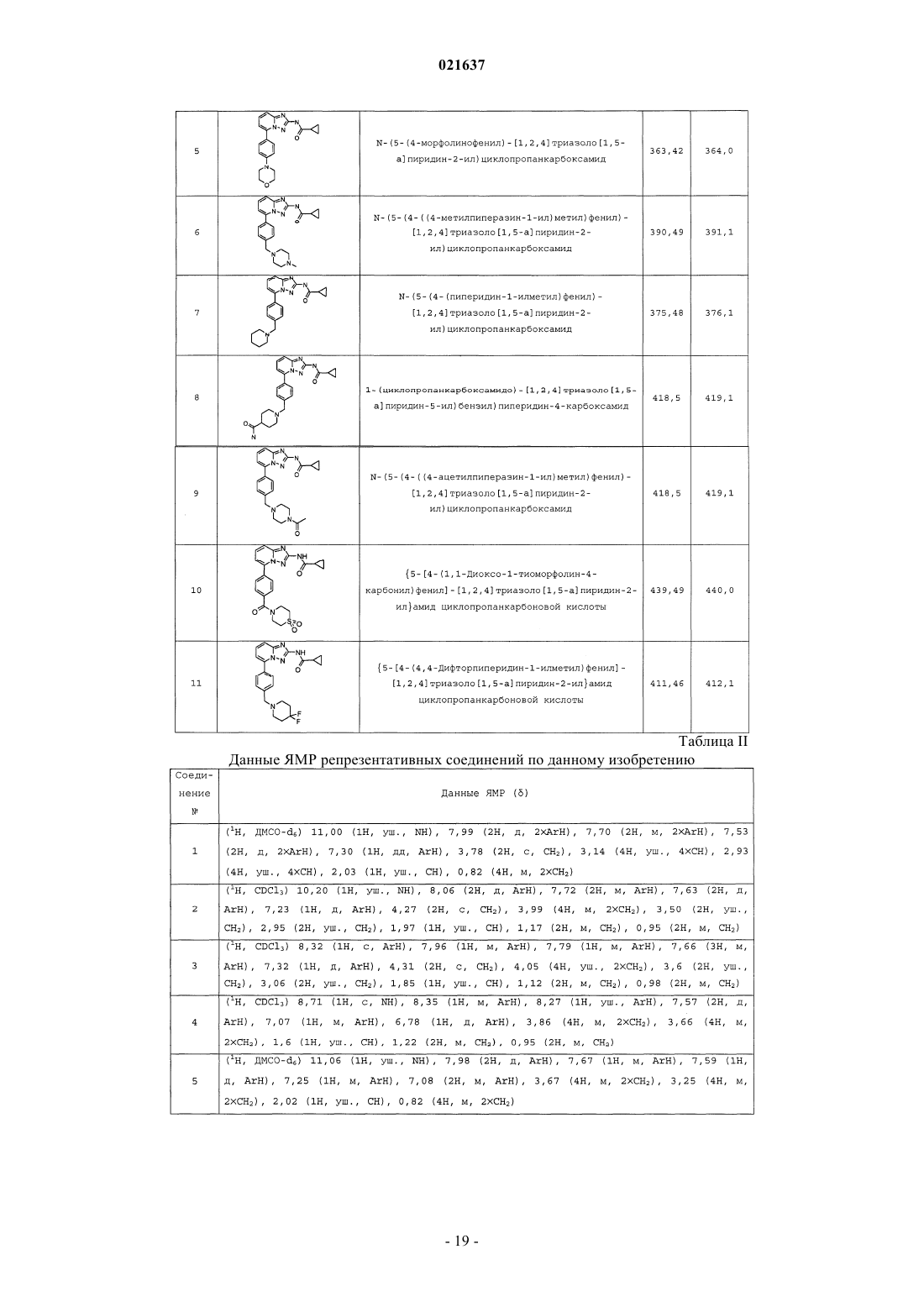
5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-илкарбоксамиды в качестве ингибиторов jak
Формула / Реферат
1. Соединение, имеющее формулу (I)
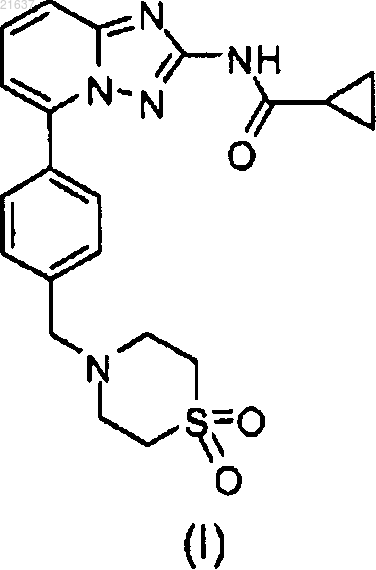
или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция, пригодная для лечения, предотвращения или профилактики воспалительных состояний, аутоиммунных заболеваний, пролиферативных заболеваний, отторжения при трансплантации, заболеваний, связанных с ухудшением обновления хряща, врожденными пороками развития хряща, болезни Кастлемана, множественной миеломы, псориаза, саркомы Капоши и/или мезангиального пролиферативного гломерулонефрита, содержащая фармацевтически приемлемый носитель и фармацевтически эффективное количество соединения по п.1.
3. Применение соединения по п.1 для получения лекарственного средства.
4. Применение соединения по п.1 для получения лекарственного средства для лечения, предотвращения или профилактики воспалительных состояний, аутоиммунных заболеваний, пролиферативных заболеваний, отторжения при трансплантации, заболеваний, связанных с ухудшением обновления хряща, врожденными пороками развития хряща, болезни Кастлемана, множественной миеломы, псориаза, саркомы Капоши и/или мезангиального пролиферативного гломерулонефрита.
5. Применение по п.4, где воспалительное состояние выбирают из остеоартрита, ревматоидного артрита, аллергической болезни дыхательных путей, воспалительных заболеваний кишечника.
6. Применение по п.4, где воспалительное состояние представляет собой ревматоидный артрит.
7. Применение по п.4, где воспалительное состояние представляет собой саркому Капоши и/или неспецифический язвенный колит.
8. Способ лечения, предотвращения или профилактики воспалительных состояний, аутоиммунных заболеваний, пролиферативных заболеваний, отторжения при трансплантации, заболеваний, связанных с ухудшением обновления хряща, врожденными пороками развития хряща, болезни Кастлемана, множественной миеломы, псориаза, саркомы Капоши и/или мезангиального пролиферативного гломерулонефрита, включающий введение количества соединения по п.1, достаточного для воздействия указанного лечения, предотвращения или профилактики.
9. Способ по п.8, где воспалительное состояние выбирают из остеоартрита, ревматоидного артрита, аллергической болезни дыхательных путей, воспалительных заболеваний кишечника.
10. Способ по п.8, где воспалительное состояние представляет собой ревматоидный артрит.
11. Способ по п.8, где воспалительное состояние представляет собой саркому Капоши и/или неспецифический язвенный колит.
12. Способ лечения, предотвращения или профилактики воспалительных состояний, аутоиммунных заболеваний, пролиферативных заболеваний, отторжения при трансплантации, заболеваний, связанных с ухудшением обновления хряща, врожденными пороками развития хряща, болезни Кастлемана, множественной миеломы, псориаза, саркомы Капоши и/или мезангиального пролиферативного гломерулонефрита, включающий введение количества фармацевтической композиции по п.2, достаточного для воздействия указанного лечения, предотвращения или профилактики.
13. Способ по п.12, где воспалительное состояние выбирают из остеоартрита, ревматоидного артрита, аллергической болезни дыхательных путей, воспалительных заболеваний кишечника.
14. Способ по п.12, где воспалительное состояние представляет собой ревматоидный артрит.
15. Способ по п.12, где воспалительное состояние представляет собой саркому Капоши и/или неспецифический язвенный колит.
Текст
В изобретении раскрывается новое соединение, способное ингибировать JAK, это соединение может быть получено в виде фармацевтической композиции и может быть использовано для предотвращения и лечения целого ряда состояний у млекопитающих, в том числе людей,включая в качестве неограничивающего примера воспалительные состояния, аутоиммунные заболевания, пролиферативные заболевания, отторжение при трансплантации, болезни, связанные с ухудшением обновления хряща, врожденными пороками развития хряща; и/или болезни,связанные с гиперсекрецией IL6. Мене Кристель Жанн Мари, Смитс Коэн Курт (BE) Медведев В.Н. (RU) Область техники Настоящее изобретение относится к соединению, которое представляет собой ингибитор JAK, семейства тирозинкиназ, которые вовлечены в патогенез воспалительных состояний, аутоиммунных заболеваний, пролиферативных заболеваний, отторжения при трансплантации, заболеваний, связанных с ухудшением обновления хряща, врожденными пороками развития хряща; и/или заболеваний, связанных с гиперсекрецией IL6. В частности, соединение по данному изобретению ингибирует JAK1 и JAK2. Кроме того, настоящее изобретение предлагает способы получения соединения по данному изобретению,фармацевтические композиции, содержащие соединение по данному изобретению, способы предотвращения и/или лечения заболеваний, включая воспалительные состояния, аутоиммунные болезни, пролиферативные болезни, отторжение при трансплантации, болезни, связанные с ухудшением обновления хряща, врожденными пороками развития хряща, и/или болезни, связанные с гиперсекрецией IL6, путем введения соединения по данному изобретению.Janus киназы (JAK) представляют собой цитоплазматические тирозинкиназы, которые играют ключевую роль в передаче сигналов цитокинов от мембранных рецепторов к факторам транскрипции STAT. Описаны четыре представителя семейства JAK, JAK1, JAK2, JAK3 и TYK2. После связывания цитокина с его рецептором представители семейства JAK ауто- и/или трансфосфорилируют друг друга с последующим фосфорилированием факторов транскрипции (STAT), которые затем мигрируют в ядра клеток,модулируя транскрипцию. Во внутриклеточной сигнальной трансдукции JAK-STAT задействованы интерфероны, большинство интерлейкинов, а также ряд цитокинов и эндокринных факторов, таких как ЕРО, ТРО, GH, OSM, LIF, CNTF, GM-CSF и PRL (Vainchenker W. et al. (2008. Исследование комбинации генетических моделей и ингибитора JAK, имеющего небольшую молекулу, обнаружило терапевтический потенциал некоторых JAK. JAK3 аттестована генетикой мыши и человека как мишень для подавления иммунитета (О'Shea J. et al. (2004. Ингибиторы JAK3 были успешно апробированы в клиническом развитии некоторых заболеваний, вначале в случае отторжения трансплантата органа и позднее также при других иммуновоспалительных показаниях, таких как ревматоидный артрит (RA), псориаз и болезнь Крона (http://clinicaltrials.gov/).TYK2 представляет собой потенциальную мишень для иммуновоспалительных заболеваний, что подтверждено исследованием с учетом генетики человека и исследованием с использованием мышейнокаутов (Levy D. and Loomis С. (2007.JAK1 представляет собой новую мишень в области иммуновоспалительных заболеваний. JAK1 образует гетеродимер с другими JAK, трансдуцируя цитокинстимулируемую провоспалительную передачу сигнала. Поэтому ингибирование JAK1 и/или других JAK, как ожидают, может иметь терапевтическую значимость для целого ряда воспалительных состояний, а также для других заболеваний, стимулируемыхJAK-опосредованной сигнальной трансдукцией. Известный уровень техники Дегенерация хряща - отличительный признак различных заболеваний, среди которых наиболее известны ревматоидный артрит и остеоартрит. Ревматоидный артрит (RA) представляет собой хроническую дегенеративную болезнь суставов, характеризуемую воспалением и разрушением структур суставов. Когда болезнь неконтролируема, она ведет к значительной потере трудоспособности и боли вследствие потери функции сустава и даже преждевременной смерти. Цель лечения RA поэтому состоит не только в замедлении течения болезни, но и в достижении состояния ремиссии для того, чтобы приостановить разрушение суставов. Помимо тяжести последствий заболевания, высокая распространенностьRA (0,8% взрослого населения во всем мире поражено этой болезнью) представляет большую социально-экономическую проблему (относительно получения информации по RA авторы отсылают к Smolenand Steiner (2003); Lee and Weinblatt (2001); Choy and Panayi (2001); O'Dell (2004) and Firestein (2003. Остеоартрит (также называемый ОА, или артрит, обусловленный изнашиванием или старением) представляет собой наиболее распространенную форму артрита и характеризуется потерей суставного хряща, часто связанную с гипертрофией кости и болями (в отношении подробной информации по остеоартриту авторы отсылают к Wieland et al. (2005. Остеоартрит трудно поддается лечению. В настоящее время не существует лечения, которое полностью бы излечило это заболевание, и лечение, как правило, фокусируется на ослаблении боли и предотвращении деформации пораженного сустава. Обычные лечения включают использование нестероидных противовоспалительных лекарственных средств (NSAID). Несмотря на то что добавки к рациону, такие как хондроитин и глюкозамин сульфат, были рекомендованы как безопасные и эффективные возможные варианты для лечения остеоартрита, последнее клиническое испытание обнаружило, что оба лечения не снижают боль, связанную с остеоартритом (Clegg et al., 2006). Стимулирование анаболических процессов, блокирование катаболических процессов или комбинация этих двух путей может привести к стабилизации хряща и, возможно, даже реверсии нарушения и в соответствии с этим предотвратить дальнейшее прогрессирование болезни. Были разработаны терапевтические методы для коррекции патологических изменений суставного хряща, которые появляются во время остеоартритического заболевания, но до настоящего времени ни один из них не смог опосредовать регенерацию суставного хряща in situ и in vivo. Суммируя вышеизложенное, можно утверждать, что на данный момент не существует подходящих болезнь-модифицирующих остеоартритических лекарственных средств.Vandeghinste и др. (WO 2005/124342) раскрыли JAK1 как мишень, ингибирование которой может иметь терапевтическую значимость для некоторых заболеваний, включая ОА. Нокаут гена JAK1 у мышей показал, что JAK1 играет существенную и нерезервированную роль во время развития: JAK1 -/мыши погибали в течение 24 ч после рождения и развитие лимфоцитов серьезно замедлялось. Кроме того, JAK1 -/- клетки оказались нереактивными или менее реактивными в отношении цитокинов, которые используют цитокиновые рецепторы класса II, цитокиновым рецепторам, которые используют гамма-с субъединицу для передачи сигнала и семейству цитокиновых рецепторов, которые используют субъединицу gp 130 для передачи сигнала (Rodig et al., 1998). В биологии хондроцитов различные группы вовлечены в сигнальный путь JAK-STAT. Li et al.(2001) показали, что Онкостатин М индуцирует экспрессию генов ММР и TIMP3 в первичных хондроцитах путем активации JAK/STAT и MAPK сигнальных путей. Osaki et al. (2003) показали, что интерферонгамма-опосредованное ингибирование коллагена II в хондроцитах включает JAK-STAT сигнальный путь.IL1-бета индуцирует катаболизм хряща путем снижения экспрессии компонентов матрикса и путем индуцирования экспрессии коллагенов и индуцируемой синтазы оксида азота (NOS2), которая опосредует продуцирование оксида азота (NO). Otero et al. (2005) показали, что лептин и IL1-бета синергически индуцируют продуцирование NO или экспрессию мРНК NOS2 в хондроцитах и что это блокируется ингибитором JAK. Legendre et al. (2003) показали, что IL6/IL6 рецептор индуцирует понижающую регуляцию генов хрящ-специфического матрикса, коллагена II, появления ядра окостения и белка связи в бычьих суставных хондроцитах, и что это опосредуется JAK/STAT сигнальным путем. Таким образом, эти данные наблюдений свидетельствуют в пользу роли активности JAK киназ в гомеостазе хряща и терапевтических возможностей ингибиторов JAK киназ. Представители семейства оказались вовлеченными в патогенез дополнительных состояний, включая миелопролиферативные нарушения (O'Sullivan et al., 2007, Mol. Immunol., 44(10):2497-506), в которых были идентифицированы мутации в JAK2. Это указывает на то, что ингибиторы JAK, в частностиJAK2, могут также найти применение в лечении миелопролиферативных заболеваний. Кроме того, семейство JAK, в частности JAK1, JAK2 и JAK3, оказалось связанным с видами рака, в частности лейкозами, например острым миелоидным лейкозом (О'Sullivan et al., 2007, Mol. Immunol., 44 (10): 2497-506;First Edition Paper, prepublished online December 26, 2007; DOI 10.1182/blood-2007-05-090308) и острым лимфобластным лейкозом (Mullighan et al., 2009) или солидными злокачественными опухолями, например лейомиосаркомой матки (Constantinescu et al., 2007, Trends in Biochemical Sciences 33(3): 122-131),раком предстательной железы (Tam et al., 2007, British Journal of Cancer, 97, 378-383). Эти результаты свидетельствуют о том, что ингибиторы JAK, в частности JAK1 и/или JAK2, могут также найти применение для лечения злокачественных новообразований (лейкозы и солидные опухоли, например лейомиосаркома матки, рак предстательной железы). Кроме того, болезнь Кастлемана, множественная миелома, мезангиальный пролиферативный гломерулонефрит, псориаз и саркома Капоши, по-видимому, обусловлены гиперсекрецией цитокина IL-6,биологические действия которого опосредованы внутриклеточным JAK-STAT сигнальным путем (TetsujiNaka, Norihiro Nishimoto and Tadamitsu Kishimoto, Arthritis Res 2002, 4 (suppl 3): S233-S242). Этот результат показывает, что ингибиторы JAK могут также найти применение в лечении вышеуказанных заболеваний. Проводимые в настоящее время терапии не являются достаточными, и поэтому остается необходимость в идентифицировании дополнительных соединений, которые можно было использовать для лечения дегенеративных заболеваний суставов, например остеоартрита, ревматоидного артрита и остеопороза, в частности остеоартрита. В соответствии с этим настоящее изобретение предлагает соединение, способы его получения и фармацевтические композиции, содержащие соединение по данному изобретению вместе с подходящим фармацевтическим носителем. Кроме того, настоящее изобретение предусматривает использование соединения по данному изобретению для получения лекарственного средства для лечения дегенеративных заболеваний суставов. В частности, настоящее изобретение предлагает новый ингибитор JAK, который проявляет значительно повышенную in vivo активность. Краткое изложение существа изобретения Настоящее изобретение основано на обнаружении того факта, что соединение по данному изобретению способно действовать как ингибитор JAK и что его можно использовать для лечения воспалительных состояний, аутоиммунных болезней, пролиферативных заболеваний, отторжения при трансплантации, болезней, связанных с ухудшением обновления хряща, врожденными пороками развития хряща; и/или болезней, связанных с гиперсекрецией IL6. В конкретном аспекте соединение представляет собой ингибитор JAK1 и JAK2. Кроме того, настоящее изобретение предлагает способы получения этого соединения, фармацевтической композиции, содержащей это соединение, и способы лечения воспалительных состояний, аутоиммунных болезней, пролиферативных заболеваний, отторжения при трансплантации, болезней, связанных с ухудшением обновления хряща, врожденными пороками развития хряща; и/или заболеваний, связанных с гиперсекрецией IL6, путем введения соединения по данному изобретению. В соответствии с этим в первом аспекте данного изобретения предлагается соединение по данному изобретению, имеющее формулу (I) Соединение по данному изобретению представляет собой новый ингибитор JAK, который, повидимому, обладает значительно улучшенной in vivo активностью по сравнению со структурно аналогичными соединениями. В конкретном варианте соединение по данному изобретению представляет собой ингибитор JAK1 и JAK2. В частности, оно, по-видимому, демонстрирует вышеуказанное повышение в активности при более низких уровнях экспозиции in vivo по сравнению со структурно аналогичными соединениями. Предполагают, что использование соединения с вышеуказанными преимуществами приведет к возможности применения более низких доз (и, следовательно, улучшенной схеме дозировки лекарственного средства). В другом аспекте настоящее изобретение предлагает фармацевтические композиции, содержащие соединение по данному изобретению и фармацевтический носитель, наполнитель или разбавитель. Кроме того, соединение по данному изобретению, используемое в фармацевтических композициях и способах лечения, раскрытых в настоящем описании, является фармацевтически приемлемым в том виде, как его получают и используют. В этом аспекте данного изобретения фармацевтическая композиция может дополнительно содержать другие активные ингредиенты, подходящие для использования в комбинации с соединением по данному изобретению. В другом аспекте данного изобретения настоящее изобретение предлагает способ лечения млекопитающего, восприимчивого к или пораженного состоянием из числа тех, которые перечислены в данном контексте, и, в частности, такого состояния, которое может быть связано с аберрантной активностьюJAK, например воспалительные состояния, аутоиммунные болезни, пролиферативные заболевания, отторжение при трансплантации, болезни, связанные с ухудшением обновления хряща, врожденными пороками развития хряща; и болезни, связанные с гиперсекрецией IL6, и этот способ включает введение эффективного количества фармацевтической композиции или соединения по данному изобретению, описанного в настоящем описании. В конкретном варианте состояние связано с аберрантной активностьюJAK1 и JAK2. В другом аспекте настоящее изобретение предлагает соединение по данному изобретению для использования в лечении или предотвращении состояния, выбранного из состояний, перечисленных в данном контексте, в частности таких состояний, которые могут быть связаны с аберрантной активностьюJAK, например воспалительных состояний, аутоиммунных болезней, пролиферативных заболеваний,отторжения при трансплантации, болезней, связанных с ухудшением обновления хряща, врожденными пороками развития хряща; и заболеваний, связанных с гиперсекрецией IL6. В очередном аспекте способа лечения это изобретение предлагает способ лечения млекопитающего,восприимчивого к или пораженного состоянием, которое причинносвязано с аномальной активностьюJAK, описанной в данном контексте, и включает введение количества фармацевтической композиции или соединения по данному изобретению, эффективного для лечения или предотвращения состояний,перечисленных в настоящем описании. В конкретном аспекте состояние причинносвязано с аномальной активностью JAK1 и JAK2. В другом аспекте настоящее изобретение предлагает соединение по данному изобретению для использования в лечении или профилактике состояния, которое причинносвязано с аномальной активностью JAK. В дополнительных аспектах данное изобретение предлагает способы синтеза соединения по данному изобретению, причем репрезентативные протоколы и пути синтеза указанного соединения раскрываются позднее в настоящем описании. Таким образом, принципиальная цель данного изобретения заключается в разработке нового соединения, которое может модифицировать активность JAK и тем самым предотвратить или лечить любые заболевания, которые могут быть причинносвязаны с этим. В конкретном аспекте соединение по данному изобретению модулирует активность JAK1 и JAK2. Другая цель данного изобретения состоит в разработке соединения, которое может лечить или смягчать течение заболеваний или ослаблять интенсивность проявления их симптомов, таких как воспалительные состояния, аутоиммунные болезни, пролиферативные заболевания, отторжение при трансплантации, болезни, связанные с ухудшением обновления хряща, врожденными пороками развития хря-3 021637 ща; и заболевания, связанные с гиперсекрецией IL6, которые могут быть причинносвязаны с активностью JAK, в частности JAK1 и JAK2. Следующей целью настоящего изобретения является разработка фармацевтической композиции,которая может быть использована для лечения или предотвращения различных патологических состояний, включая заболевания, связанные с активностью JAK, такие как воспалительные состояния, аутоиммунные болезни, пролиферативные заболевания, отторжение при трансплантации, болезни, связанные с ухудшением обновления хряща, врожденными пороками развития хряща; и заболевания, связанные с гиперсекрецией IL6. В конкретном варианте заболевание связано с активностью JAK1 и JAK2. Другие цели и преимущества настоящего изобретения становятся очевидными для специалистов в данной области техники из рассмотрения нижеследующего подробного описания. Подробное описание изобретения Определения. Подразумевается, что нижеследующие термины имеют значения, представленные в данном контексте ниже, и их используют для достижения более полного понимания существа описания и предполагаемого объема настоящего изобретения. При описании изобретения, которое может включать соединения, фармацевтические композиции,содержащие такие соединения, и способы использования вышеуказанных соединений и композиций,нижеприведенные термины, если они присутствуют, имеют следующие значения, если не оговорено иначе. Следует также иметь в виду, что при описании в данном контексте любая из частей, определенных ниже, может быть замещена различными заместителями и что соответствующие определения, как предполагают, включают такие замещенные части в пределах их объема, как представлено ниже. Если не оговорен особо, термин "замещенный" следует определять, как изложено ниже. Кроме того, следует иметь в виду, что термины "группы" и радикалы" при их использовании в настоящем описании могут рассматриваться взаимозаменяемо. Используемый в данном контексте термин "JAK" относится к семейству Janus киназ (JAK), которые представляют собой цитоплазматические тирозинкиназы, которые играют ключевую роль в передаче сигналов цитокинов от мембранных рецепторов к транскриптационным факторам STAT. Описаны четыре представителя семейства JAK, JAK1, JAK2, JAK3 и TYK2, и термин "JAK" может относиться ко всем представителям семейства JAK в собирательном значении или к одному или большему числу представителей семейства JAK в зависимости от того, как указано в контексте."Фармацевтически приемлемый" означает утвержденный или одобренный регулирующим органом Федерального правительства или правительства штата или соответствующего ведомства в странах, помимо США, или который находится в перечне Фармакопеи США или другой общеизвестной фармакопеи для использования для животных и, в частности, для людей."Фармацевтически приемлемая соль" относится к соли соединения по данному изобретению, которая является фармацевтически приемлемой и которая обладает желательной фармакологической активностью исходного соединения. В частности, такие соли являются нетоксичными и могут представлять собой неорганические или органические кислотно-аддитивные соли и основно-аддитивные соли. Конкретно, такие соли включают (1) аддитивные соли кислоты, образованные с неорганическими кислотами,такими как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п.; или образованные с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота,пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота,малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4 гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота,этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4 толуолсульфокислота, камфорсульфокислота, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновая кислота,глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, трет-бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота,салициловая кислота, стеариновя кислота, муконовая кислота и т.п.; или (2) соли, образованные в тех случаях, когда кислый протон присутствует в исходном соединении, либо замещен на ион металла, например ион щелочного металла, ион щелочно-земельного металла или ион алюминия; или координирует с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, N-метиоглюкамин и т.п. Кроме того, соли включают, в качестве примера только, натрий, калий, кальций, магний, аммоний,тетраалкиламмоний и т.п.; и в тех случаях, когда соединение содержит основную функциональность,соли нетоксичных органических или неорганических кислот, такие как гидрохлорид, гидробромид, тартрат, мезилат, ацетат, малеат, оксалат и т.п. Термин "фармацевтически приемлемый катион" относится к приемлемому катионному противоиону кислой функциональной группы. Примерами таких катионов являются катионы натрия, калия, кальция, магния, аммония, тетраалкиламмония и т.п."Фармацевтически приемлемый наполнитель" относится к разбавителю, адъюванту, наполнителю или носителю, с которым вводят соединение по данному изобретению."Сольват" относится к формам соединения, в которых соединение связано с растворителем, обычно посредством реакции сольволиза. Эта физическая связь включает водородную связь. Обычные растворители включают воду, этанол, уксусную кислоту и т.п. Соединение по данному изобретению можно получить, например, в кристаллической форме, и оно может находиться в сольватированной или гидратной форме. Подходящие сольваты включают фармацевтически приемлемые сольваты, такие как гидраты, и,кроме того, включают как стехиометрические сольваты, так и нестехиометрические сольваты. В некоторых случаях сольват может быть выделен в свободном состоянии, например, когда одна или несколько молекул растворителя включены в кристаллическую решетку кристаллического твердого вещества."Сольват" охватывает как сольваты в жидкой фазе, так и поддающиеся выделению сольваты. Репрезентативные сольваты включают гидраты, этанолаты и метанолаты."Терапевтически эффективное количество" подразумевает количество соединения, которое при введении субъекту для лечения заболевания оказывается достаточным для воздействия такого лечения на такое заболевание. "Терапевтически эффективное количество" может варьироваться в зависимости от соединения, заболевания и его степени тяжести, возраста, массы тела и т.д. субъекта, подлежащего лечению."Предотвращение или профилактика" относится к снижению риска приобретения или развития болезни или нарушения (т.е. предотвращение развития по меньшей мере одного из клинических симптомов заболевания у субъекта, который может быть подвергнут воздействию болезнь-вызывающего средства,или предрасположеного к болезни до ее возникновения). Термин "профилактика" относится к "предотвращению" и относится к мероприятию или способу,цель которого состоит в предотвращении, а не лечении или излечении заболевания. Неограничивающие примеры профилактических мер могут включать введение вакцин; введение низкомолекулярного гепарина госпитализированным больным с повышенным риском возникновения тромбоза вследствие, например, обездвиживания; и введение противомалярийного средства, такого как хлорохин, перед визитом в географический регион, для которого малярия эндемична или где высок риск контакта с малярией."Лечение" или "терапия" какого-либо заболевания или нарушения относится в одном варианте к улучшению ameliorating течения болезни или нарушения (т.е. устранения клинических проявлений заболевания или снижения манифестации, степени или тяжести по меньшей мере одного из клинических симптомов болезни). В другом варианте "лечение" или "терапия" относится к улучшению по меньшей мере одного физического параметра, который может быть неявным для субъекта. В очередном варианте"лечение" или "терапия" относится к модулированию заболевания или нарушения, либо физически (например, стабилизация различимого симптома), физиологически (например, стабилизация физического параметра), либо и физически, и физиологически. В другом варианте "лечение" или "терапия" относится к торможению прогрессирования болезни. Используемый в настоящем описании термин "воспалительное состояние(я)" относится к группе состояний, включая ревматоидный артрит, остеоартрит, ювенильный идиопатический артрит, псориаз,аллергическую болезнь дыхательных путей (например, астма, ринит), воспалительные заболевания кишечника (например, болезнь Крона, колит), эндотоксин-стимулируемые патологические состояния (например, осложнения после операции обходного шунтирования или хронические эндотоксиновые состояния, способствующие, например, развитию хронической сердечной недостаточности) и родственные болезни, затрагивающие хрящ, такие как болезнь суставов. В частности, этот термин относится к ревматоидному артриту, остеоартриту, аллергической болезни дыхательных путей (например, астма) и воспалительным болезням кишечника. Используемый в настоящем описании термин "аутоиммунная болезнь(и)" относится к группе заболеваний, включая непроходимость дыхательных путей, включая состояния, такие как COPD (хроническое обструктивное заболевание легких), астма (например, наследственная бронхиальная астма, приобретенная бронхиальная астма, индуцированная пылью астма, инфантильная астма), в частности хроническая или трудноизлечимая [запущенная] астма (например, поздняя астма и гиперчувствительность дыхательных путей), бронхит, включая бронхиальную астму, системная красная волчанка (SLE), рассеянный склероз, сахарный диабет 1 типа и осложнения, связанные с ним, диффузный нейродерматит (атопический дерматит), контактный дерматит и дополнительный экзематозный дерматит, воспалительная болезнь кишечника (например, болезнь Крона и неспецифический язвенный колит), атеросклероз и боковой амиотрофический склероз. В частности, термин относится к COPD, астме, системной красной волчанке, сахарному диабету I типа и воспалительной болезни кишечника. Используемый в настоящем описании термин "пролиферативная болезнь(и)" относится к состояниям, таким как рак (например, лейомиосаркома матки или рак предстательной железы), миелопролиферативные нарушения (например, болезнь Вакеза, эссенциальный тромбоцитоз и миелофиброз), лейкоз (например, острый миелоидный лейкоз и острый лимфобластный лейкоз), множественная миелома, псориаз,рестеноз, склеродерматит или фиброз. В частности, термин относится к раку, лейкозу, множественной миеломе и псориазу. Как использовано в настоящем описании, термин "рак" относится к злокачественному и доброкачественному росту клеток в коже и органах тела, например, но ими не ограничиваясь, молочная железа,предстательная железа, легкое, почка, поджелудочная железа, желудок или кишечник. Рак имеет тенденцию к инфильтрации в соседние ткани и распространению (метастазированию) в отдаленные органы,например в костную ткань, печень, легкое и головной мозг. Используемый в настоящем описании термин "рак" включает как метастатические типы опухолевых клеток, такие как, но не ограничиваясь ими,меланома, лимфома, лейкемия, фибросаркома, рабдомиосаркома и мастоцитома, так и типы тканевой карциномы, такие как, но ими не ограничиваясь, колоректальный рак, рак простаты, мелкоклеточный рак легких и немелкоклеточный рак легких, рак молочной железы, рак поджелудочной железы, рак мочевого пузыря, рак почки, рак желудка, глиобластома, первичный рак печени, рак яичника, рак простаты и лейомиосаркома матки. Используемый в настоящем описании термин "лейкоз" относится к неопластическим заболеваниям крови и кровеобразующим органам. Такие болезни могут вызвать нарушение функции костного мозга и иммунной системы, что приводит хозяина в состояние высокой чувствительности к инфекции и кровотечению. В частности, термин "лейкоз" относится к острому миелоидному лейкозу (AML) и острому лимфобластному лейкозу (ALL). Используемый в настоящем описании термин "отторжение трансплантата" относится к острому или хроническому отторжению клеток, алло- или ксенотрансплантатов ткани или твердых органов, например островков Лангерганса, стволовых клеток, костного мозга, кожи, мышцы, корнеальной ткани, нейронной ткани, сердца, легкого, комбинированного сердца-легкого, почки, печени, кишки, поджелудочной железы, трахеи или пищевода, или реакциям "трансплантат-против-хозяина". Используемый в настоящем описании термин "болезни, включая ухудшение обновления хряща" включает состояния, такие как остеоартрит, псориатический артрит, ювенильный ревматоидный артрит,подагрический артрит, септический или инфекционный неспецифический артрит, реактивный артрит,симпатическая рефлекторная дистрофия, альгодистрофия, синдром Титце или дистрофия ребер, фибромиалгия, остеохондрит, нейрогенный или нейропатический артрит, заболевание суставов, эндемические формы артрита, подобные деформирующему эндемическому остеоартриту, болезнь Mseleni и болезньHandigodu; дегенерацию, являющуюся результатом фибромиалгии, системную красную волчанку, склеродермию и алкилозирующий спондилоартрит. Используемый в настоящем описании термин "врожденный порок(и) развития хряща" включает состояния, такие как наследственный хондролиз, хондродисплазии и псевдохондродисплазии, в частности,но ими не ограничиваясь, микротию, анотию, метафизарную хондродисплазию, и родственные нарушения. Используемый в настоящем описании термин "болезнь(и), связанная с гиперсекрецией IL6" включает состояния, такие как болезнь Кастлемана, множественная миелома, псориаз, саркома Капоши и/или мезангиальный пролиферативный гломерулонефрит."Соединение по данному изобретению" и эквивалентные выражения, как подразумевается, охватывают соединение формулы, описанной выше, и это выражение включает фармацевтически приемлемые соли и сольваты, например гидраты, и сольваты фармацевтически приемлемых солей, где контекст это допускает. Аналогично, ссылка на промежуточные продукты, независимо от того, заявляются они как таковые, или нет, как полагают, охватывает их соли и сольваты, если контекст это допускает. Другие производные соединения по данному изобретению имеют активность как в их кислотной форме, так и форме кислотной производной, однако кислотная форма зачастую имеет преимущества в растворимости, тканевой совместимости или замедленном высвобождении в организме млекопитающего(см. Bundgard, H., Design of Prodrugs, p. 7-9, 21-24, Elsevier, Amsterdam, 1985). Как использовано в настоящем описании, термин "изотопический вариант" относится к соединению, которое содержит неестественные пропорции изотопов при одном или нескольких атомах, которые составляют такое соединение. Например, "изотопический вариант" соединения может содержать один или несколько нерадиоактивных изотопов, таких как, например, дейтерий (2 Н или D), углерод-13 (13 С),азот-15 (15N) или т.п. Должно быть очевидно, что в соединении, в котором сделано такое изотопное замещение, следующие атомы, если присутствуют, могут меняться, так что, например, любой водород может представлять собой 2H/D, любой углерод может быть 13 С или любой азот может быть 15N, и что присутствие и расположение таких атомов может быть определено в рамках знания данной области техники. Аналогично, изобретение может включать получение изотопических вариантов с радиоактивными изотопами, в случае, например, когда полученные соединения могут быть использованы для исследований распределения лекарственного средства и/или субстрата в ткани. Для этой цели, в частности, используют радиоактивные изотопы, тритий, т.е. 3 Н, и углерод-14, т.е. 14 С, принимая во внимание легкость их включения и имеющиеся в распоряжении средства их детектирования. Кроме того, можно получить соединения, которые замещены позитрон-излучающими изотопами, такими как 11 С, 18F, 15O и 13N, и они могут быть использованы в исследованиях методом позитрон-эмиссионной томографии (PET) степени занятости [заполненности] рецепторов субстратом. Все изотопические варианты соединения, представленные в настоящем описании, независимо от того, радиоактивные они или нет, как предполагают, охватываются объемом данного изобретения."Таутомеры" относятся к соединениям, которые представляют собой взаимозаменяемые формы структуры конкретного соединения и которые отличаются расположением водородных атомов и электронов. Таким образом, две структуры могут находиться в равновесии благодаря перемещению-электронов и атома (обычно Н). Например, енолы и кетоны являются таутомерами, поскольку они быстро взаимопревращаются при обработке либо кислотой, либо основанием. Другим примером таутомерии являются аци- и нитроформы фенилнитрометана, которые подобным образом образуются при обработке кислотой или основанием. Таутомерные формы могут быть релевантны в достижении оптимальной химической реакционной способности и биологической активности соединения, представляющего интерес. Соединение. Настоящее изобретение основано на обнаружении того, что соединение по данному изобретению представляет собой ингибитор JAK и что оно является полезным для лечения воспалительных заболеваний, аутоиммунных болезней, пролиферативных заболеваний, отторжения трансплантата, заболеваний,связанных с ухудшением обновления хряща, врожденными пороками развития хряща; и болезней, связанных с гиперсекрецией IL6. Кроме того, настоящее изобретение предлагает способы получения соединения по данному изобретению, фармацевтических композиций, содержащих соединение по данному изобретению, и способы лечения воспалительных состояний, аутоиммунных болезней, пролиферативных заболеваний, отторжения трансплантата, болезней, связанных с ухудшением обновления хряща, врожденными пороками развития хряща; и заболеваний, связанных с гиперсекрецией IL6, путем введения соединения по данному изобретению. В конкретном варианте соединение по данному изобретению представляет собой ингибитор JAK1 и JAK2. Таким образом, в первом аспекте данного изобретения раскрывают соединение по данному изобретению, имеющее формулу (I) В одном варианте соединение по данному изобретению представляет собой неизотопический вариант. Соединение по данному изобретению представляет собой новый ингибитор JAK. В частности, соединение представляет собой сильнодействующий ингибитор JAK1 и JAK2, однако это соединение все же также ингибирует TYK2 и JAK3, но с более низкой активностью. Соединение по данному изобретению проявляет значительно улучшенную активность in vivo. Эти улучшения реально и неожиданно обнаруживаются даже в сравнении со структурно аналогичными соединениями. Использование соединения с такими преимуществами может привести к возможности применения более низких доз (и, следовательно, улучшенной схеме дозировки лекарственного средства). Фармацевтические композиции. При использовании в качестве фармацевтического препарата соединение по данному изобретению обычно вводят в форме фармацевтической композиции. Такие композиции могут быть получены способом, хорошо известным в фармацевтической области, и они содержат по меньшей мере одно активное соединение. Как правило, соединение по данному изобретению вводят в фармацевтически эффективном количестве. Количество в действительности вводимого соединения обычно определяется врачом с учетом соответствующих обстоятельств, включая состояние, подлежащее лечению, выбранный путь введения, реально вводимое соединение, возраст, массу тела и реакцию конкретного пациента, степень тяжести симптомов болезни у пациента и т.п. Фармацевтические композиции по данному изобретению могут вводиться различными путями,включая пероральный, ректальный, трансдермальный, подкожный, внутрисуставный, внутривенный,внутримышечный и интраназальный. В зависимости от предполагаемого пути доставки соединение по данному изобретению предпочтительно получают в виде либо инъецируемых композиций, либо в виде композиций, предназначенных для перорального введения, или в виде целебных мазей, в виде лосьонов,или в виде пластырей, все, в случае трансдермального применения. Композиции для перорального введения могут иметь форму растворов или суспензий жидкого продукта, хранимых в сосудах, или сыпучих порошков. В большинстве случаев, однако, композиции представлены в стандартных лекарственных формах для облегчения точности дозирования. Термин "стандартные лекарственные формы" относится к физически дискретным единицам, подходящим для введения в виде стандартных доз для людей и других млекопитающих, при этом каждая единица содержит заранее установленное количество активного соединения, согласно расчету обеспечивающее проявление желательного терапевтического действия, в сочетании с подходящим фармацевтическим носителем. Типичные стандартные лекарственные формы включают ампулы или шприцы, заранее заполненные предварительно измеренным количеством жидких композиций, или пилюли, таблетки, капсулы или т.п. в случае твердых композиций. В таких композициях соединение по данному изобретению представляет собой второстепенный компонент (от около 0,1 до около 50 мас.% или предпочтительно от около 1 до около 40 мас.%), при этом оставшуюся часть представляют различные наполнители или носители и вспомогательные добавки, полезные для формообразования желательных лекарственных форм. Жидкие формы, подходящие для перорального введения, могут содержать подходящий водный или неводный наполнитель наряду с буферами, суспендирующими и диспергирующими средствами, красителями, корригентами и т.п. Твердые формы могут содержать, например, любой из нижеследующих ингредиентов или соединения подобной природы: связующее, такое как микрокристаллическая целлюлоза,трагакантовая камедь или желатин; наполнитель, такой как крахмал или лактоза, дезинтегрирующее средство, такое как альгиновая кислота, примогель, или кукурузный крахмал; смазку, такую как стеарат магния; глидант, такой коллоидный диоксид кремния; подслащивающее вещество, такое как сахароза или сахарин; или ароматизирующее вещество, такое как мята перечная, метилсалицилат или отдушка апельсина. Композиции, предназначенные для инъекции, обычно основаны на подходящем для инъецирования стерильном физиологическом растворе или фосфат-забуференном физиологическом растворе или других подходящих для инъекции носителях, известных в данной области. Как и раньше, активное соединение в таких композициях является обычно второстепенным компонентом, который зачастую находится в количестве в диапазоне от около 0,05 до 10 мас.%, при этом оставшаяся часть представляет собой подходящий для инъецирования носитель и т.п. Трансдермальные композиции обычно получают в виде мази или крема для местного нанесения,содержащего активный ингредиент(ы), обычно в количестве, начиная от около 0,01 и кончая около 20 мас.%, предпочтительно от около 0,1 до около 20 мас.%, предпочтительно от около 0,1 до около 10 мас.% и более предпочтительно от около 0,5 до около 15 мас.%. При приготовлении в виде мази активные ингредиенты обычно смешивают с либо парафиновой мазевой основой, либо водорастворимой мазевой основой. Альтернативно, активные ингредиенты могут быть введены в состав крема вместе, например, с кремовой основой типа "масло-в-воде". Такие трансдермальные фармацевтические композиции хорошо известны в данной области и обычно включают дополнительные ингредиенты, обеспечивающие повышенную проницаемость чрез кожу активных ингредиентов и стабильность активных ингредиентов или фармацевтической композиции. Все вышеуказанные известные трансдермальные фармацевтические композиции и ингредиенты не выходят за рамки объема данного изобретения. Соединение по данному изобретению может также вводиться посредством трансдермального устройства. В соответствии с этим трансдермальное введение может быть осуществлено, используя пластырь либо резервуарного типа, либо типа пористой мембраны, либо разновидности твердого матрикса. Вышеописанные компоненты для перорально вводимых, инъецируемых или местно вводимых композиций носят только репрезентативный характер. Другие материалы, а также технологии приготовления и т.п. приведены в Part 8 of Remington's Pharmaceutical Sciences, 17th edition, 1985, Mack Publishing Company, Easton, Pennsylvania, содержание которой включено в настоящее описание в виде ссылке. Кроме того, соединение по данному изобретению может вводиться в формах замедленного высвобождения лекарственного средства или используя системы доставки лекарственного средства пролонгированного действия. Описание репрезентативных материалов, обеспечивающих пролонгированное высвобождение лекарственного средства, можно найти в Remington's Pharmaceutical Sciences. Нижеследующие примеры фармацевтических композиций иллюстрируют репрезентативные фармацевтические композиции, которые можно получить в соответствии с данным изобретением. Настоящее изобретение, однако, не ограничивается приведенными ниже фармацевтическими композициями. Фармацевтическая композиция 1. Таблетки. Соединение по данному изобретению может быть смешано в виде сухого порошка со связующим,сухим желатином при массовом соотношении приблизительно 1:2. В качестве смазки может быть добавлено незначительное количество стеарата магния. Можно придать смеси форму таблетки массой 240-270 мг (80-90 мг активного амидного соединения на таблетку) в таблетировочном прессе. Фармацевтическая композиция 2. Капсулы. Соединение по данному изобретению может быть смешано в виде сухого порошка с разбавителем,крахмалом при массовом соотношении приблизительно 1:1. Смесь может быть заполнена в 250-мг капсулы (125 мг активного амидного соединения на капсулу). Фармацевтическая композиция 3. Жидкость. Соединение по данному изобретению (125 мг) может быть смешано с сахарозой (1,75 г) и ксантановой камедью (4 мг) и полученная смесь может быть подвергнута смешиванию, пропусканию через сито с размером отверстий 10 меш США и затем смешана с заранее приготовленным раствором микрокристаллической целлюлозы и натрий-карбоксиметилцеллюлозы (11:89, 50 мг) в воде. Бензоат натрия (10 мг),ароматизатор и краситель могут быть разбавлены водой и добавлены в смесь при перемешивании. Затем для получения общего объема 5 мл при перемешивании может быть добавлено необходимое для этого количество воды. Фармацевтичекая композиция 4. Таблетки. Соединение по данному изобретению может быть смешано в виде сухого порошка со связующим,сухим желатином при массовом соотношении приблизительно 1:2. В качестве смазки может быть добавлено незначительное количество стеарата магния. Можно придать смеси форму таблетки массой 490-900 мг (150-300 мг активного амидного соединения) в таблетировочном прессе. Фармацевтическая композиция 5. Инъекция. Соединение по данному изобретению может быть растворено или суспендировано в инъецируемой водной среде, забуференном стерильном физиологическом растворе с получением концентрации приблизительно 5 мг/мл. Фармацевтическая композиция 6. Для местного нанесения. Стеариловый спирт (250 г) и медицинский вазелин (250 г) могут быть расплавлены при температуре около 75 С и затем в полученный расплав может быть добавлена смесь соединения по данному изобретению (50 г), метилпарабена (0,25 г), пропилпарабена (0,15 г), лаурилсульфата натрия (10 г) и пропиленгликоля (120 г), растворенная в воде (около 370 г), и полученная смесь может быть подвергнута перемешиванию до ее полного застывания. Способы лечения. Соединение по данному изобретению может быть использовано в качестве терапевтического средства для лечения состояний у млекопитающих, которые причинносвязаны с или могут быть приписаны аберрантной активности JAK, в частности, состояния, связанные с отклоненной от нормы активностьюJAK1 и/или JAK2. В соответствии с этим соединение и фармацевтические композиции по данному изобретению находят применение в качестве терапевтических средств для предотвращения и/или лечения воспалительных состояний, аутоиммунных болезней, пролиферативных заболеваний, отторжения трансплантата, заболеваний, связанных с ухудшением обновления хряща, врожденными пороками развития хряща; и болезней, связанных с гиперсекрецией 1L6 у млекопитающих, включая людей. В дополнительном способе аспектов лечения это изобретение предлагает способы лечения млекопитающего, восприимчивого к или пораженного воспалительным заболеванием. Способы включают введение эффективного количества одной или нескольких из фармацевтических композиций или соединения по данному изобретению для лечения или предотвращения состояний, описанных в данном контексте. В конкретном варианте воспалительное состояние выбрано из ревматоидного артрита, остеоартрита,аллергического заболевания дыхательных путей (например, астма) и воспалительных заболеваний кишечника. В другом аспекте настоящее изобретение предлагает соединение по данному изобретению для использования в лечении, предотвращении или профилактике воспалительного состояния. В конкретном варианте воспалительное состояние выбрано из ревматоидного артрита, остеоартрита, аллергической болезни дыхательных путей (например, астма) и воспалительных заболеваний кишечника. В дополнительном способе аспектов лечения данное изобретение предлагает способы лечения млекопитающего, восприимчивого к или пораженного аутоиммунной болезнью. Способы включают введение эффективного количества одной или нескольких из фармацевтических композиций или соединения по данному изобретению для лечения или предотвращения состояний, описанных в данном контексте. В конкретном варианте аутоиммунная болезнь выбрана из COPD (хроническое обструктивное заболевание легких), астмы, системной красной волчанки, сахарного диабета I типа и воспалительной болезни кишечника. В другом аспекте настоящее изобретение предлагает соединение по данному изобретению для использования в лечении, предотвращении или профилактике аутоиммунной болезни. В конкретном варианте аутоиммунное заболевание выбрано из COPD, астмы, системной красной волчанки, сахарного диабета I типа и воспалительного заболевания кишечника. В другом способе аспектов лечения данное изобретение предлагает способы лечения млекопитающего, восприимчивого к или пораженного пролиферативным заболеванием, в частности раком (например, солидные опухоли, такие как лейомиосаркома матки или рак предстательной железы), лейкозом(например, AML или ALL), множественной миеломой и/или псориазом. В другом аспекте настоящее изобретение предлагает соединение по данному изобретению для использования в лечении, предотвращении и профилактике пролиферативной болезни, в частности рака(например, солидные опухоли, такие как лейомиосаркома матки или рак предстательной железы), лейкоза (например, AML или ALL), множественной миеломы и/или псориаза. В другом способе аспектов лечения данное изобретение предлагает способы лечения млекопитающего, восприимчивого к или пораженного болезнью отторжения трансплантата. В конкретном варианте данное изобретение предлагает способы лечения отторжения трансплантата. В другом аспекте настоящее изобретение предлагает соединение по данному изобретению для использования в лечении, предотвращении или профилактике отторжения трансплантата. В конкретном варианте данное изобретение предлагает способы лечения отторжения трансплантата органа. В способе аспекта лечения данное изобретение предлагает способ лечения, предотвращения или профилактики у млекопитающего, восприимчивого к или пораженного болезнями, связанными с ухудшением обновления хряща, и этот способ включает введение терапевтически эффективного количества соединения по данному изобретению, или одной или нескольких из фармацевтических композиций, описанных в настоящем описании. В другом аспекте настоящее изобретение предлагает соединение по данному изобретению для использования в лечении, предотвращении и профилактике заболеваний, связанных с ухудшением обновления хряща. Кроме того, настоящее изобретение предлагает способ лечения врожденных пороков развития хряща, и этот способ включает введение эффективного количества одной или нескольких из фармацевтических композиций или соединения по данному изобретению, описанных в настоящем описании. В другом аспекте настоящее изобретение предлагает соединение по данному изобретению для использования в лечении, предотвращении или профилактике врожденных пороков развития хряща. В другом способе аспектов лечения данное изобретение предлагает способы лечения млекопитающего, восприимчивого к или пораженного заболеваниями, связанными с гиперсекрецией IL6, в частности болезни Кастлемана или мезангиального пролиферативного гломерулонефрита. В другом аспекте настоящее изобретение предлагает соединение по данному изобретению для использования в лечении, предотвращении или профилактике заболеваний, связанных с гиперсекрециейIL6, в частности болезни Кастлемана или мезангиального пролиферативного гломерулонефрита. В качестве дополнительного аспекта данного изобретения предлагается соединение по данному изобретению для использования в качестве фармацевтического препарата, главным образом, для лечения или предотвращения вышеупомянутых состояний и болезней. Кроме того, в настоящем описании предлагается применение соединений по данному изобретению для получения лекарственного средства для лечения или предотвращения одного из вышеупомянутых состояний и болезней. Конкретная схема осуществления способа по данному изобретению включает введение субъекту,страдающему заболеванием, связанным с воспалением, эффективного количества соединения по данному изобретению на протяжении периода времени, достаточного для снижения уровня воспаления у субъекта, и предпочтительно устранения процессов, ответственных за указанное воспаление. Отдельный вариант способа включает введение эффективного количества соединения по данному изобретению пациенту, страдающему или восприимчивому к развитию ревматоидного артрита, на протяжении периода времени, достаточного для снижения или предотвращения соответственно воспаления на суставах указанного пациента, и предпочтительно устранения процессов, ответственных за указанное воспаление. Дополнительная конкретная схема осуществления настоящего способа включает введение субъекту, страдающему патологическим состоянием, характеризуемым деградацией хряща или суставов (например, ревматоидный артрит и/или остеоартрит), эффективного количества соединения по данному изобретению на протяжении периода времени, достаточного для снижения или предпочтительно купирования самовоспроизводящихся процессов, ответственных за указанную деградацию. Конкретный вариант способа включает введение эффективного количества соединения по данному изобретению пациенту, страдающему или восприимчивому к развитию остеоартрита, на протяжении периода времени, достаточного для снижения или предотвращения соответственно деградации хряща в суставах указанного пациента, и предпочтительно купирования самовоспроизводящихся процессов, ответственных за указанную деградацию. В конкретном варианте указанное соединение может проявлять анаболические и/или противокатаболические свойства в отношении хряща. Уровни инъекционных доз колеблются от около 0,1 до по меньшей мере 10 мг/кг/ч, все на протяжении от около 1 до около 120 ч и предпочтительно от 24 до 96 ч. Для достижения адекватных уровней устойчивого состояния может быть также введен болюс с предварительной нагрузкой от около 0,1 до около 10 мг/кг или больше. Максимальная суммарная доза, как предполагают, не превышает около 2 г/день для пациента-человека с массой тела от 40 до 80 кг. Для предотвращения и/или лечения длительно существующих состояний, таких как дегенеративные состояния, схема лечения обычно растягивается до нескольких месяцев или лет, и поэтому для удобства и толерантности пациента в этом случае предпочтительно пероральное дозирование. При пероральном дозировании репрезентативные схемы приема лекарственного средства включают ежедневный прием внутрь от одной до пяти, предпочтительно от двух до четырех и типично трех доз. Используя эти схемы дозирования, каждая доза обеспечивает от около 0,01 до около 20 мг/кг соединения по данному изобретению, при этом отдельные дозы, каждая, обеспечивает от около 0,1 до около 10 мг/кг и предпочтительно от около 1 до около 5 мг/кг. Трансдермальные дозы обычно выбирают таким образом, чтобы они обеспечивали уровни в крови,которые аналогичны или ниже уровней, достигаемых при использовании инъекционных доз. При использовании для предотвращения возникновения воспалительного состояния соединение по данному изобретению вводят пациенту с повышенным риском развития такого состояния, как правило,по совету и под наблюдением врача при уровнях доз, описанных выше. Пациенты с повышенным риском развития конкретного состояния обычно включают пациентов, которые имеют семейный анамнез со- 10021637 стояния, или пациентов, которые были идентифицированы согласно генетическому тестированию и скринингу как обладающие восприимчивостью к развитию указанного состояния. Соединение по данному изобретению можно вводить в виде единственного активного средства или его можно вводить в комбинации с другими терапевтическими средствами, включая другие соединения,которые проявляют такую же или аналогичную терапевтическую активность и которые определены как безопасные и эффективные для такого комбинированного введения. В конкретном варианте совместное введение двух (или большего числа) средств предусматривает использование значительно более низких доз каждого из средств, тем самым снижая проявление побочных действий. В одном варианте соединение по данному изобретению вводят совместно с другим терапевтическим средством для лечения и/или предотвращения болезни, связанной с воспалением; конкретные средства включают, но не ограничивясь ими, иммунорегуляторы, например азатиоприн, кортикостероиды(например, преднизолон или дексаметазон), циклофосфамид, циклоспорин А, такролимус, Микофенолят Мофетил, муромонаб-CD3 (ОКТ 3, например, Orthocolone), ATG, аспирин, ацетаминофен, ибупрофен,напроксен и пироксикам. В одном варианте соединение по данному изобретению вводят совместно с другим терапевтическим средством для лечения и/или предотвращения артрита (например, ревматоидный артрит); конкретные средства включают, но не ограничиваясь ими, анальгетики, нестероидные противовоспалительные средства (NSAIDS), стероиды, синтетические DMARDS (например, но без ограничения, метотрексат,лефлуномид, сульфасалазин, ауранофин, натрий ауротиомалат, пеницилламин, хлорохин, гидроксихлорохин, азатиоприн, и циклоспорин), и биологические DMARDS (например, но без ограничения, Инфликсимаб, Этанерцепт, Адалимумаб, Ритуксимаб и Абатацепт). В одном варианте соединение по данному изобретению вводят совместно с другим терапевтическим средством для лечения и/или предотвращения пролиферативных расстройств; конкретные средства включают, но без ограничения, метотрексат, лейковорин, адриамицин, пренизон, блеомицин, циклофосфамид, 5-фторурацил, паклитаксел, доцетаксел, винкристин, винбластин, винорелбин, доксорубицин,тамоксифен, торемифен, мегестрол ацетат, анастрозол, госерелин, моноклональное антитело противHER2 (например, Herceptin), капецитабин, ралоксифен гидрохлорид, ингибиторы EGFR (например,Iressa, Tarceva, Erbitux), ингибиторы VEGF (например, Avastin), ингибиторы протеасомы (например, Velcade), Glivec и ингибиторы hsp90 (например, 17-AAG). Кроме того, соединение по данному изобретению можно вводить в комбинации с другими лечениями, включая, но без ограничения, лучевую терапию или хирургическое вмешательство. В конкретном варианте пролиферативное нарушение выбрано из злокачественного новообразования, миелопролиферативного заболевания или лейкоза. В одном варианте соединение по данному изобретению вводят совместно с другим терапевтическим средством для лечения и/или предотвращения аутоиммунных заболеваний, конкретные средства включают, но без ограничения, глюкокортикоиды, цитостатические средства (например, аналоги пурина), алкилирующие средства, (например, азотистые производные иприта (циклофосфамид), нитрозомочевины, соединения платины, и другие), антиметаболиты (например, метотрексат, азатиоприн и меркаптопурин), цитотоксические антибиотики (например, дактиномицин, антрациклины, митомицин С, блеомицин и митрамицин), антитела (например, моноклональные антитела против CD20, против CD25 или против CD3 (ОТК 3), Atgam и Thymoglobuline), циклоспорин, такролимус, рапамицин (сиролимус),интерфероны (например, IFN-), TNF-связывающие белки (например, инфликсимаб (Remicade), зтанерцепт (Enbrel), или адалимумаб (Humira, микофенолят, Финголимод и Мириоцин. В одном варианте соединение по данному изобретению вводят совместно с другим терапевтическим средством для лечения и/или предотвращения отторжения трансплантации, конкретные средства включают, но без ограничения, ингибиторы кальциневрина (например, циклоспорин или такролимус(например, азатиоприн, микофенольная кислота), кортикостероиды (например, преднизолон, гидрокортизон), антитела (например, моноклональные антитела против рецептора IL-2R, басиликсимаб, даклизумаб), поликлональные антитела против Т-клеток (например, антитела против тимоцитного глобулина(ATG), антитела против лимфоцитного глобулина (ALG. В одном варианте соединение по данному изобретению вводят совместно с другим терапевтическим средством для лечения и/или предотвращения астмы, и/или ринита, и/или COPD, конкретные средства включают, но без ограничения, агонисты бета 2-адренорецептора (например, сальбутамол, левалбутерол, тербуталин и битолтерол), эпинефрин (ингаляционный или таблетки), антихолинергические средства (например, бромид ипратропия), глюкокортикоиды (пероральные или ингаляционные), 2-агонисты пролонгирующего действия (например, салметерол, формотерол, бамбутерол и пероральный албутерол пролонгированного действия), комбинации ингаляционных стероидов и бронхолитических средств пролонгированного действия (например, флутиказон/салметерол, будесонид/формотерол), антагонисты лейкотриенов и ингибиторы синтеза лейкотриенов (например, монтелукаст, зафирлукаст и зилеутон), ингибиторы высвобождения медиаторов (например, кромогликат и кетотифен), биологические регуляторы сосудосуживающие средства (например, оксиметазолин, ксилометазолин, нафазолин и трамазолин). Кроме того, соединение по данному изобретению может вводиться в комбинации с экстренной терапией при астме и/или COPD, такие терапии включают введение кислорода или кислородно-гелиевой смеси, ингаляцию аэрозоля сальбутамола или тербуталина (необязательно в комбинации с антихолинергическим средством (например, ипратропий), системные стероиды (пероральное или внутривенное введение, например, преднизона, преднизолона, метилпреднизолона, дексаметазона или гидрокортизона),внутривенный сальбутамол, неспецифические beta-агонисты, инъекционные или ингаляционные (например, эпинефрин, изоэтарин, изопротеренол, метапротеренол), противохолинергические средства (внутривенно или ингаляция аэрозолем, например, гликопирролат, атропин, ипратропий), метилксантины(теофиллин, аминофиллин, бамифиллин), ингаляционные анестетики которые оказывают бронхолитическое действие (например, изофлуран, галотан, энфлуран), кетамин и внутривенный сульфат магния. В одном варианте соединение по данному изобретению вводят совместно с другим терапевтическим средством для лечения и/или предотвращения IBD, конкретные средства включают, но без ограничения, глюкокортикоиды (например, преднизон, будесонид), синтетические модифицирующие болезнь иммуномодуляторы (например, метотрексат, лефлуномид, сульфасалазин, месалазин, азатиоприн, 6 меркаптопурин и циклоспорин) и биологические модифицирующие болезнь иммуномодуляторы (инфликсимаб, адалимумаб, ритуксимаб и абатацепт). В одном варианте соединение по данному изобретению вводят совместно с другим терапевтическим средством для лечения и/или предотвращения SLE, конкретные средства включают, но без ограничения, болезнь-модифицирующие противоревматические лекарственные средства (DMARD), такие как противомалярийные средства (например, плаквенил, гидроксихлорохин), иммунодепрессивные средства(например, метотрексат и азатиоприн), циклофосфамид и микофенольная кислота; иммунодепрессивные лекарственные средства и аналгетики, такие как нестероидные противовоспалительные лекарственные средства, опиаты (например, декстропропоксифен и ко-кодамол), синтетические наркотические препараты (например, гидрокодон, оксикодон, MS Contin, или метадон) и трансдермальный duragesic патч [пластырь] с высоким соедержанием фентанила. В одном варианте соединение по данному изобретению вводят совместно с другим терапевтическим средством для лечения и/или предотвращения псориаза, конкретные средства включают, но без ограничения, местные терапии, такие как растворы для ванн, увлажнители, лечебные кремы и мази, содержащие каменно-угольную смолу, дитранол (антралин), кортикостероиды, подобные дезоксиметазону(этретинат, ацитретин, тазаротен), системные терапии, такие как метотрексат, циклоспорин, ретиноиды,тиогуанин, гидроксимочевина, сульфасалазин, микофенолят мофетил, азатиоприн, такролимус, сложные эфиры фумаровой кислоты или биопрепараты, такие как Amevive, Enbrel, Humira, Remicade,Raptiva и устекинумаб (блокатор IL-12 и IL-23). Кроме того, соединение по данному изобретению можно вводить в комбинации с другими терапиями, включая, но без ограничения, светолечение или фотохимиотерапию (например, сочетание светочувствительного псоралена с облучением УФ-лучами большой длины волн (А) (PUVA. Как очевидно специалистам в данной области техники, при совместном введении возможно использование любого способа доставки двух или нескольких терапевтических средств пациенту, как часть одной и той же схемы лечения. Пока два или несколько вышеуказанных средств могут вводиться пациенту одновременно в составе одного препарата, это не существенно. Указанные средства могут вводиться в составе различных препаратов и в разное время. Общие способы синтеза Общие сведения. Соединение по данному изобретению и сравнительные примеры, раскрытые в WO2010010190, могут быть получены исходя из легкодоступных исходных продуктов, используя нижеприведенные общие методы и способы. Следует иметь в виду, что там, где представлены типичные или предпочтительные условия проведения способа (т.е. температуры реакции, времена, мольные отношения реагирующих веществ, растворители, давления и т.д.), могут быть также использованы и другие условия осуществления способа, если не оговорено иначе. Оптимальные условия проведения реакции могут варьироваться в зависимости от использования конкретных реагирующих веществ и растворителей, тем не менее, вышеуказанные условия могут быть определены специалистом в данной области техники, пользуясь обычными методами оптимизации. Кроме того, как очевидно специалистам в данной области техники, для предотвращения протекания нежелательных реакций с участием некоторых функциональных групп возможно использование обычных защитных групп. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящих условий для защиты и снятия защиты хорошо известны в данной области техники. Например, многочисленные защитные группы и их введение и удаление описаны в T.W. Greene and Нижеследующие способы подробно представляют способы получения как для соединения по данному изобретению, определенного в данном контексте выше, так и сравнительных примеров. Специалист в области органического синтеза может получить соединение по данному изобретению и сравнительные примеры, исходя из известных или коммерчески доступных исходных продуктов и реагентов. Все реагенты представляют собой продукты торгового качества и их использовали без дополнительной очистки, если не оговорено особо. Для реакций, проводимых в инертной атмосфере, использовали коммерчески доступные безводные растворители. Если не оговорено иначе, во всех других случаях использовали растворители реактивной чистоты. Колоночную хроматографию осуществляли на силикагеле 60 (35-70 мкм). Тонкослойную хроматографию осуществляли, используя пластины, предварительно покрытые силикагелем F-254 (толщина 0,25 мм). Спектры 1 Н ЯМР регистрируют на ЯМР-спектрометреBruker DPX 400 (400 МГц). Химические сдвигидля спектров 1 Н-ЯМР приводятся в ч./млн (м.д.) относительно тетраметилсилана (50,00) или соответствующей линии остаточного растворителя, т.е. CHCl3 ( 7,27), в качестве внутреннего стандарта. Типы расщепления [мультиплетность] представлены в виде синглета (с), дублета (д), триплета (т), квартета (кв), мультиплета (м) и широкого сигнала (ушир). Константы спин-спинового взаимодействия (J) представлены в Гц. Спектры МС с электрораспылительной ионизацией получали на комбинированной системе ЖХ/масс-спектрометр Micromass. Для всех анализов посредством ЖХ-МС использовали колонку Waters Acquity UPLC ВЕН С 18 1,7 мкм, 2,1 мм, в.д.,50 мм,длина, (Part No. 186002350. Препаративная ВЭЖХ: колонка Waters XBridge Prep C18 5 мкм ODB 19 мм в.д.100 мм длина (Part No. 186002978). Во всех методах используют градиенты MeCN/H2O. H2O содержит либо 0,1% TFA, либо 0,1% NH3. Перечень аббревиатур, используемых в экспериментальном разделе: Синтетическое получение соединения по данному изобретению и сравнительных примеров Соединение по данному изобретению и сравнительные примеры могут быть получены согласно нижеследующей схеме. Общий способ синтеза-СО- и гетероциклоалкильная группа является необязательно замещенной. Общая методика. 1.1.1. 1-(6-Бромпиридин-2-ил)-3-карбоэтокситиомочевина (2) К раствору 2-амино-6-бромпиридина (1) (253,8 г, 1,467 моль) в DCM (2,5 л), охлажденному до 5 С,добавляют по каплям этоксикарбонилизотиоцианат (173,0 мл, 1,467 моль) на протяжении 15 мин. Затем реакционной смеси дают возможность нагреться до комнатной температуры (20 С) и перемешивают в течение 16 ч. Упаривание в вакууме дает твердое вещество, которое может быть собрано фильтрацией,тщательно промыто бензином (3600 мл) и высушено на воздухе, с получением (2). Тиомочевина может быть использована как таковая на следующей стадии без какой-либо очистки. 1 Н (400 МГц, CDCl3)12,03 (1 Н, уш. с, NH), 8,81 (1 Н, д, J=7,8 Гц, Н-3), 8,15 (1 Н, уш. с, NH), 7,60 (1 Н, т, J=8,0 Гц, Н-4), 7,32 К суспензии гидрохлорида гидроксиламина (101,8 г, 1,465 моль) в смеси EtOH/MeOH (1:1, 900 мл) добавляют N,N-диизопропилэтиламин (145,3 мл, 0,879 моль) и смесь перемешивают при комнатной температуре (20 С) в течение 1 ч. Затем добавляют 1-(6-бромпиридин-2-ил)-3-карбоэтокситиомочевину (2)(89,0 г, 0,293 моль) и смесь медленно нагревают до кипения (замечание: скруббер требуется для гашения выделяемого H2S). Через 3 ч при кипячении смеси дают возможность охладиться и фильтруют, собирая осажденное твердое вещество. Дополнительный продукт собирают упариванием в вакууме фильтрата,добавлением H2O (250 мл) и фильтрацией. Объединенные твердые вещества промывают последовательно H2O (250 мл), смесью EtOH/MeOH (1:1, 250 мл) и Et2O (250 мл), затем сушат в вакууме, получая производное триазолопиридина (3) в виде твердого вещества. Соединение может быть использовано как таковое на следующей стадии без какой-либо очистки. 1 Н (400 МГц, ДМСО-d6)7,43-7,34 (2 Н, м,2 ароматический-Н), 7,24 (1 Н, дд, J=6,8 и 1,8 Гц, ароматический-Н), 6,30 (2 Н, ушир., NH2); m/z 213/215(1:1, М+Н+, 100%). Общая методика моноацилирования для получения промежуточного продукта (4) К раствору 2-аминотриазолопиридина (3) (7,10 г, 33,3 ммоль) в сухом CH3CN (150 мл) при 5 С добавляют Et3N (11,6 мл, 83,3 ммоль), за которым следует добавление циклопропанкарбонилхлорида (83,3 ммоль). Затем реакционной смеси дают возможность нагреться до температуры окружающей среды и перемешивают до полного израсходования исходного продукта (3). Если требуется, для обеспечения полного протекания реакции добавляют дополнительное количество Et3N (4,64 мл, 33,3 ммоль) и циклопропанкарбонилхлорида (33,3 ммоль). После выпаривания растворителя в вакууме полученный остаток обрабатывают 7 N метанольным раствором аммиака (50 мл) и перемешивают при температуре окружающей среды (в течение 1-16 ч) для гидролиза какого-либо бис-ацилированного продукта. Выделение продукта проводят путем удаления летучих веществ в вакууме с последующим растиранием в Et2O (50 мл). Твердые вещества собирают фильтрацией, промывают H2O (250 мл), ацетоном (50 мл) и Et2O (50 мл), затем сушат в вакууме, получая требуемый бромсодержащий промежуточный продукт (4). Способ А. Получение соединений по данному изобретению посредством связывания по Suzuki (5). Подходящую бороновую кислоту (2 экв.) добавляют к раствору бромсодержащего промежуточного продукта (4) в смеси 1,4-диоксан/вода (5:1). К раствору добавляют K2CO3 (2 экв.) и PdCl2dppf (5%). Затем полученную смесь нагревают в микроволновой печи при 140 С в течение 30 мин (эту реакцию можно также осуществить обычным нагреванием на масляной бане при 90 С в течение 16 ч в атмосфере N2). Добавляют воду и раствор экстрагируют этилацетатом. Органические слои сушат над безводным MgSO4 и упаривают в вакууме. Получают конечное соединение после очистки флэш-хроматографией или препаративной ВЭЖХ. ВЭЖХ: Waters XBridge Prep C18 5 мкм ODB 19 мм (вн.д, ID)100 мм (длина) (PartNo. 186002978). Все эти методы используют градиенты MeCN/H2O. H2O содержит либо 0,1% TFA, либо 0,1% NH3. Способ В 2 капли DMF добавляют к раствору 4-[2-(циклопропанкарбониламино)-[1,2,4]триазоло[1,5 а]пиридин-5-ил]бензойной кислоты (1 экв.), полученной по способу А, используя 4-карбоксифенилбороновую кислоту в DCM в атмосфере N2. Затем к этому полученному раствору по каплям добавляют оксалилхлорид (2 экв.) (выделение газа). Смесь перемешивают при комнатной температуре в течение 2 ч. После завершения реакции согласно ЖХМС удаляют растворитель. Неочищенный хлорангидрид кислоты используют на следующей стадии без очистки. В 2. Образование амида (общий способ) Подходящий амин (1,1 экв.) и Et3N (5 экв.) растворяют в DCM в атмосфере N2 и охлаждают при 0 С. К этому раствору добавляют по каплям хлорангидрид кислоты (В 1, 1 экв.), растворенный в DCM. Реакционную смесь перемешивают при комнатной температуре в течение 16 ч. По окончании этого времени реакцию завершают. Соединение экстрагируют EtOAc и водой, промывают насыщенным раствором соли и сушат над безводным MgSO4. Органические слои фильтруют и упаривают. Конечное соединение выделяют препаративной ВЭЖХ. Препаративная ВЭЖХ: Waters XBridge Prep C18 5 мкм ODB 19 мм (вн.д.)100 мм (длина) (Part No. 186002978). Все эти методы используют градиенты MeCN/H2O. H2O содержит либо 0,1% TFA, либо 0,1% NH3. Способ С Гидроалкилирование (общий способ). Подходящий амин (2 экв.), циклопропанкарбоновую кислоту (например, [5-(4-формилфенил)[1,2,4]триазоло[1,5-а]пиридин-2-ил]амид циклопропанкарбоновой кислоты), полученную по спсобу А (1 экв.) и Ti(OPr)4 смешивают и перемешивают при комнатной температуре в течение 3 ч. Смесь разбавляют в этаноле и добавляют Na(CN)BH3 (1 экв.). Полученный раствор перемешивают при комнатной температуре в течение 16 ч. Смесь разбавляют в воде и фильтруют. Фильтрат промывают этанолом. Объединенные органические фазы упаривают в вакууме. Конечное соединение выделяют посредством препаративной ВЭЖХ. Способ D 2-(4-Бромметилфенил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолан (1 экв.) и Et3N (2 экв.) (или AgCO3) растворяют в смеси DCM/MeOH (4:1 об.:об.) в атмосфере N2 и добавляют по каплям амин (2 экв.). Полученный раствор перемешивают при комнатной температуре в течение 16 ч. По истечении этого времени реакцию завершают. Растворительь выпаривают. Соединение экстрагируют EtOAc и водой, промывают насыщенным раствором соли и сушат над безводным MgSO4. Органические слои фильтруют и упаривают. Конечное соединение выделяют флэш-хроматографией. Связывание по Suzuki Полученную бороновую кислоту (2 экв.) добавляют к раствору (5-бром-[1,2,4]триазоло[1,5 а]пиридин-2-иламида циклопропанкарбоновой кислоты (4) в смеси 1,4-диоксан/вода (5:1). К раствору добавляют K2CO3 (2 экв.) и PdCl2dppf (5%). Затем полученный раствор нагревают в микроволновой печи при 140 С в течение 30 мин (эту реакцию можно также осуществить путем обычного нагревания на масляной бане при 90 С в течение 16 ч в атмосфере N2). Добавляют воду и раствор экстрагируют этилацетатом. Органические слои сушат над безводным MgSO4 и упаривают в вакууме. Конечное соединение получают после очистки посредством флэш-хроматорафии или препаративной ВЭЖХ. ВЭЖХ: WatersXBridge Prep C18 5 мкм ODB 19 мм (вн.д.)100 мм (длина) (Part No. 186002978). Все эти методы используют градиенты MeCN/H2O. H2O содержит либо 0,1% TFA, либо 0,1% NH3. Синтез соединения по данному изобретению и сравнительных примеров. Соединение 1 (соединение по данному изобретению). Стадия 1 2-(4-Бромметилфенил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолан (1 экв.) и DIPEA (2 экв.) растворяют в смеси DCM/MeOH (5:1 об.:об.) в атмосфере N2 и порциями добавляют 1,1-диоксид тиоморфолина (2 экв.). Полученный раствор перемешивают при комнатной температуре в течение 16 ч. По окончании этого времени реакцию завершают. Растворитель выпаривают. Соединение экстрагируют EtOAc и водой,промывают насыщенным раствором соли и сушат над безводным MgSO4. Органические слои фильтруют и упаривают. Конечное соединение выделяют без дополнительной очистки. 4-[4-(4,4,5,5-Тетраметил-[1,3,2]диоксаборолан-2-ил)бензил]тиоморфолин-1,1-диоксид (1/1 экв.) добавляют к раствору (5-бром- [1,2,4]триазоло[1,5-а]пиридин-2-ил)амида циклопропанкарбоновой кислоты в смеси 1,4-диоксан/вода (4:1). К раствору добавляют K2CO3 (2 экв.) и PdCl2dppf (0,03 экв.). Затем полученную смесь нагревают на масляной бане при 90 С в течение 16 ч в атмосфере N2. Добавляют воду и раствор экстрагируют этилацетатом. Органические слои сушат над безводным MgSO4 и упаривают в вакууме. Конечное соединение получают после очистки посредством флэш-хроматографии. Альтернативно, после завершения реакции добавляют акцептор палладия, такой как 1,2-бис(дифенилфосфино)этан, реакционной смеси дают возможность охладиться и осуществляют фильтрацию. Осадок на фильтре ресуспендируют в подходящем растворителе (например, ацетон), твердое вещество отделяют фильтрацией, промывают дополнительным количеством ацетона и сушат. Полученное твердое вещество ресуспендируют в воде, добавляют водный HCl и после перемешивания при КТ полученный раствор фильтруют на целите (Celpure P300). Затем к фильтрату добавляют водный NaOH и полученную суспензию перемешивают при КТ, твердое вещество отделяют фильтрацией, промывают водой и сушат отсасыванием. Наконец, осадок на фильтре повторно подвергают солюбилизации в смеси THF/H2O, обрабатывают акцептором палладия (например, SMOPEX 234) при 50 С, суспензию фильтруют, органические растворители удаляют выпариванием и полученную взвесь промывают водой и метанолом, сушат и просеивают, получая указанное в заголовке соединение в виде свободного основания. Альтернативный путь к соединению 1 (соединение по данному изобретению). Стадия 1(4:1). К раствору добавляют K2CO3 (2 экв.) и PdCl2dppf (0,03 экв.). Затем полученную смесь нагревают на масляной бане при 90 С в течение 16 ч в атмосфере N2. Добавляют воду и раствор экстрагируют этилацетатом. Органические слои сушат над безводным MgSO4 и упаривают в вакууме. Полученную смесь используют без дополнительной очистки. Стадия 2 К раствору [5-(4-гидроксиметилфенил)-[1,2,4]триазоло[1,5-а]пиридин-2-ил]амида циклопропанкарбоновой кислоты (1,0 экв.) в хлороформе медленно добавляют трибромид фосфора (1,0 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 20 ч, гасят льдом и водой (20 мл) и экстрагируют дихлорметаном. Органический слой сушат над безводным MgSO4, фильтруют и концентрируют досуха. Полученный белый остаток растирают в смеси дихлорметан/диэтиловый эфир 2:1, получая ожидаемый продукт в виде белого твердого вещества. Стадия 3(1 экв.) и DIPEA (2 экв.) растворяют в смеси DCM/MeOH (5:1 об.:об.) в атмосфере N2 и по каплям добавляют 1,1-диоксид тиоморфолина (1,1 экв.). Полученный раствор перемешивают при комнатной температуре в течение 16 ч. По окончании этого времени реакцию завершают. Растворитель выпаривают. Соединение растворяют в DCM, промывают водой и сушат над безводным MgSO4. Органические слои фильтруют и упаривают. Конечное соединение выделяют колоночной хроматографией, используя EtOAc, с получением желаемого продукта. Сравнительные примеры. Соединение 2. Это соединение получают, используя общий способ А и 4-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензил]морфолин. Соединение 3. Это соединение получают, используя общий способ А и гидрохлорид пинаколового эфира 3-(4 морфолинометил)фенилбороновой кислоты. Соединение 4. Это соединение получают, используя общий способ А и пинаколовый эфир 2-(4 морфолино)пиридин-5-бороновой кислоты. Соединение 5. Это соединение получают, используя общий способ А и 4-[4-(4,4,5,5-тетраметил-1,3,2 диоксаборолан-2-ил)фенил]морфолин. Соединение 6. Это соединение получают, используя общий способ С и N-метилпиперазин. Соединение 7. Это соединение получают, используя общий способ С и пиперидин. Соединение 8. Это соединение получают, используя общий способ С и амид пиперидин-4-карбоновой кислоты. Соединение 9. Это соединение получают, используя общий способ С и 1-пиперазин-1-илэтанон. Соединение 10. Это соединение получают, используя общий способ В и 1,1-диоксид тиоморфолина. Соединение 11. Это соединение получают, используя общий способ D и 4,4-дифторпиперидин. Соединение по данному изобретению и сравнительные примеры, которые были получены согласно способам синтеза, описанным в настоящем описании, представлены в табл. I ниже. Данные спектров ЯМР соединения по данному изобретению и некоторых сравнительных примеров приводятся в табл. II. Таблица I Таблица II Данные ЯМР репрезентативных соединений по данному изобретению Биологические примеры. Пример 1. Анализы in vitro. 1.1. Анализ ингибирования JAK1. Каталитический домен рекомбинантной человеческой JAK1 (аминокислоты 850-1154; номер по каталогу 08-144) закупают у Carna Biosciences. 10 нг JAK1 инкубируют с 12,5 мкг субстратом поли-GT(номер по каталогу Sigma P0275) в киназном реакционном буфере (при конечных концентрациях: 15 мМ Трис-HCl рН 7,5, 1 мМ DTT, 0,01% Твин-20, 10 мМ MgCl2, 2 мкМ нерадиоактивного АТФ, 0,25 мкКи 33 Ргамма-АТФ (GE Healthcare, номер по каталогу АН 9968) с или без 5 мкл, содержащими испытуемое соединение или наполнитель (ДМСО, конечная концентрация 1%), в суммарном объеме 25 мкл, в полипропиленовом 96-луночном планшете (Greiner, V-образные лунки). Через 45 мин при 30 С реакции останавливают добавлением 25 мкл/лунка 150 мМ фосфорной кислоты. Все реакционные смеси после окончания реакции переносят в предварительно промытые (75 мМ фосфорная кислота) 96-луночные фильтрационные планшеты (номер по каталогу Perkin Elmer 6005177), используя харвестер клеток (PerkinElmer). Планшеты промывают 6 раз 300 мкл на лунку 75 мМ раствора фосфорной кислоты и дно планшетов герметизируют. Добавляют 40 мкл/лунка Microscint-20 и верх планшетов герметизируют и осуществляют считывание, используя сцинтилляционный счетчик Topcount (Perkin Elmer). Вычисляют киназную активность путем вычитания числа импульсов в 1 мин (cpm), полученных в присутствии положительного контрольного ингибитора (10 мкМ стауроспорина) из числа импульсов/мин (cpm), полученных в присутствии наполнителя. Способность испытуемого соединения ингибировать эту активность определяют как ингибирование, %, = cpm, определенное для образца с испытуемым соединением, cpm, определенное для образца с положительным контрольным ингибитором), деленное на (cpm, определенное в присутствии наполнителя, cpm, определенное для образца с положительным контрольным ингибитором 100. Получают серию дозовых разведений для соединений, что дает возможность исследовать зависимость доза-ответ в анализе ингибирования JAK1 и вычислить IC50 для каждого соединения. Каждое соединение обычно тестируют при концентрации 20 мкМ с последующим 1/3 серийным разведением, 8 точек (20 мкМ - 6,67 мкМ - 2,22 мкМ - 740 нМ - 247 нМ - 82 нМ - 27 нМ - 9 нМ) при конечной концентрации ДМСО 1%. Когда активность ряда соединений увеличивается, получают больше разведений и/или верхнюю концентрацию понижают (например, 5, 1 мкМ). Нижеследующие соединения были испытаны на их активность в отношении JAK1, и значения IC50,определенные, используя анализы, описанные в настоящем описании, представлены ниже в табл. IIIA. Таблица IIIA Активность соединений в отношении JAK1 1.2. Определение Ki JAK1. Для определения Ki различные количества соединения смешивают с ферментом и ферментативную реакцию прослеживают как функцию концентрации ATP. Ki, константу связывания ингибитора, определяют посредством графического построения функции Km от концентрации соединения, где Km определяют, используя линеаризацию уравнения Михаэлиса-Ментен по Лайнуверу-Берка, методу двойных обратных величин. В анализе используют 1 нг JAK1 (Invitrogen, PV4774). Субстрат представляет собой 50 нМ Ulight-JAK-1 (Tyr1023) пептид (Perkin Elmer, TRF0121). Реакцию осуществляют в 25 мМ MOPS pH 6,8, 0,01%, 2 мМ DTT, 5 мМ MgCl2 Brij-35 при изменении концентраций АТР и соединения. Фосфорилированный субстрат измеряют, используя Eu-меченное антитело РТ 66 против фосфотирозина (PerkinElmer, AD0068). Считывание осуществляют на приборе Envision (Perkin Elmer) при возбуждении при 320 нм и последующем испускании при 615 и 665 нм. Например, когда в этом анализе испытывают соединение 1, измеряют значение Ki, равное 39 нМ. 1.3. Анализ ингибирования JAK2. Каталитический домен рекомбинантной человеческой JAK2 (аминокислоты 808-1132; номер по каталогу PV4210) закупают у Invitrogen. 0,025 мЕ JAK2 инкубируют с 2,5 мкг субстрата поли-GT (номер по каталогу Sigma P0275) в киназном реакционном буфере (конечные концентрации: 5 мМ MOPS pH 7,5, 9 мМ MgAc, 0,3 мМ EDTA, 0,06% Brij и 0,6 мМ DTT, 1 мкМ нерадиоактивного АТР, 0,25 мкКи 33 Р-гаммаАТР (GE Healthcare, номер по каталогу АН 9968) с или без 5 мкл, содержащими(их) испытуемое соединение или наполнитель (ДМСО, конечная концентрация 1%, в суммарном объеме 25 мкл, в полипропиленовом 96-луночном планшете (Greiner, V-образные лунки). Через 90 мин при 30 С реакции останавливают добавлением 25 мкл/лунка 150 мМ фосфорной кислоты. Все реакционные смеси после окончания реакции переносят в предварительно промытые (75 мМ фосфорная кислота) 96-луночные фильтрационные планшеты (номер по каталогу Perkin Elmer 6005177), используя харвестер клеток (Perkin Elmer). Планшеты промывают 6 раз 300 мкл на лунку 75 мМ раствора фосфорной кислоты и дно планшетов герметизируют. Добавляют 40 мкл/лунка Microscint-20, верх планшетов герметизируют и осуществляют считывание, используя сцинтилляционный счетчик Topcount (Perkin Elmer). Вычисляют киназную активность путем вычитания числа импульсов в 1 мин (cpm), полученных в присутствии положительного контрольного ингибитора (10 мкМ стауроспорина) из числа импульсов/мин (cpm), полученных в присутствии наполнителя. Способность испытуемого соединения ингибировать эту активность определяют как ингибирование, %, = cpm, определенное для образца с испытуемым соединением, cpm, определенное для образца с положительным контрольным ингибитором), деленное на (cpm, определенное в присутствии наполнителя, cpm, определенное для образца с положительным контрольным ингибитором 100. Получают серию дозовых разведений для соединений, что дает возможность исследовать зависимость доза-ответ в анализе ингибирования JAK2 и вычислить IC50 для каждого соединения. Каждое соединение обычно тестируют при концентрации 20 мкМ с последующим 1/3 серийным разведением, 8 точек (20 мкМ - 6,67 мкМ - 2,22 мкМ - 740 нМ - 247 нМ - 82 нМ - 27 нМ - 9 нМ) при конечной концентрации ДМСО 1%. Когда активность ряда соединений увеличивается, получают больше разведений и/или понижают верхнюю концентрацию (например, 5, 1 мкМ). Нижеследующие соединения были испытаны на их активность в отношении JAK2, и значения IC50,определенные, используя анализы, описанные в настоящем описании, представлены ниже в табл. IIIB. Таблица IIIB Активность соединений в отношении JAK2JAK2 (Invitrogen, PV4210) используют при конечной концентрации 5 нМ. Опыт по связыванию осуществляют в 50 нМ Hepes pH 7,5, 0,01% Brij-35, 10 мМ MgCl2, 1 мМ EGTA, используя 25 нМ киназного индикатора 236 (Invitrogen, PV5592) и 2 нМ Eu-анти-GST (Invitrogen, PV5594) при изменении концентраций соединений. Детектирование индикатора осуществляют согласно методике от производителей. Например, когда в этом анализе испытывают соединение 1, получают значение Kd, равное 205 нМ. 1.5. Анализ ингибирования JAK3. Каталитический домен рекомбинантной человеческой JAK3 (аминокислоты 781-1124; номер по каталогу PV3855) закупают у Invitrogen. 0,025 мЕ JAK3 инкубируют с 2,5 мкг субстрата поли-GT (номер по каталогу Sigma P0275) в киназном реакционном буфере (конечные концентрации: 25 мМ Трис рН 7,5, 0,5 мМ EGTA, 0,5 мМ Na3VO4, 5 мМ b-глицеролфосфат, 0,01% Тритон X-100, 1 мкМ нерадиоактивного АТР,0,25 мкКи 33 Р-гамма-АТР (GE Healthcare, номер по каталогу АН 9968) с или без 5 мкл, содержащими(их) испытуемое соединение или наполнитель (ДМСО, конечная концентрация 1%, в суммарном объеме 25 мкл, в полипропиленовом 96-луночном планшете (Greiner, V-образные лунки). Через 105 мин при 30 С реакции останавливают добавлением 25 мкл/лунка 150 мМ фосфорной кислоты. Все реакционные смеси после окончания реакции переносят в предварительно промытые (75 мМ фосфорная кислота) 96 луночные фильтрационные планшеты (номер по каталогу Perkin Elmer 6005177), используя харвестер клеток (Perkin Elmer). Планшеты промывают 6 раз 300 мкл на лунку 75 мМ раствора фосфорной кислоты и дно планшетов герметизируют. Добавляют 40 мкл/лунка Microscint-20, верх планшетов герметизируют и осуществляют считывание, используя сцинтилляционный счетчик Topcount (Perkin Elmer). Вычисляют киназную активность путем вычитания числа импульсов в 1 мин (cpm), полученных в присутствии положительного контрольного ингибитора (10 мкМ стауроспорин) из cpm, полученных в присутствии наполнителя. Способность испытуемого соединения ингибировать эту активность определяют как ингибирование, %, = cpm, определенное для образца с испытуемым соединением, cpm, определенное для образца с положительным контрольным ингибитором), деленное на (cpm, определенное в присутствии наполнителя, cpm, определенное для образца с положительным контрольным ингибитором 100. Получают серию дозовых разведений для соединений, что дает возможность исследовать зависимость доза-ответ в анализе ингибирования JAK3 и вычислить IC50 для каждого соединения. Каждое соединение обычно тестируют при концентрации 20 мкМ с последующим 1/3 серийным разведением, 8 точек (20 мкМ - 6,67 мкМ - 2,22 мкМ - 740 нМ - 247 нМ - 82 нМ - 27 нМ - 9 нМ) при конечной концентрации ДМСО 1%. Когда активность ряда соединений увеличивается, приготавливают большее число разведений и/или снижают верхнюю концентрацию (например, 5, 1 мкМ). Нижеследующие соединения были испытаны на их активность в отношении JAK3 и значения IC50,определенные, используя анализы, описанные в настоящем описании, представлены ниже в табл. IIIC. Таблица IIIC Активность соединений в отношении JAK3 1.6. Определения Ki JAK3. Для определения Ki различные количества соединения смешивают с ферментом и прослеживают ферментативную реакцию как функцию концентрации ATP. Ki, константу связывания ингибитора, определяют посредством графического построения функции Km от концентрации соединения, где Km определяют, используя линеаризацию уравнения Михаэлиса-Ментен по Лайнуверу-Берка, методу двойных обратных величин. JAK3 (Carna Biosciences, 09CBS-0625 В) используют при конечной концентрации 10 нг/мл. Субстрат представлял собой Поли(Glu,Tyr)натриевую соль (4:1), ММ 20000-50000 (Sigma, P0275). Реакцию осуществляют в 25 мМ Трис рН 7,5, 0,01% Тритон Х-100, 0,5 мМ EGTA, 2, 5 мМ DTT, 0,5 мМNa3VO4, 5 мМ b-глицеролфосфат, 10 мМ MgCl2 при изменении концентраций АТР и соединения и реакцию останавливают путем добавления 150 мМ фосфорной кислоты. Измерение включенного фосфата в субстрат, polyGT, проводят путем загрузки образцов на фильтрационный планшет (используя харвестер,Perkin Elmer) и последующей промывки. Включенный в polyGT 33P измеряют в сцинтилляционном счетчике Topcount после добавления сцинтилляционной жидкости в фильтрационные планшеты (PerkinElmer). Например, когда в этом анализе тестируют соединение 1, то получают значение Ki, равное 353 нМ. 1.7. Анализ ингибирования TYK2. Каталитический домен рекомбинантной человеческой TYK2 (аминокислоты 871-1187; номер по каталогу 08-147) закупают у Carna biosciences. 0,5 нг TYK2 инкубируют с 12,5 мкг субстрата поли-GT (номер по каталогу Sigma P0275) в киназном реакционном буфере (конечные концентрации: 25 мМ Hepes рН 7,5, 100 мМ NaCl, 0,2 мМ Na3VO4, 0,1% NP-40, 0,1 мкМ нерадиоактивного АТР, 0,125 мкКи 33 Ргамма-АТР (GE Healthcare, номер по каталогу АН 9968) с или без 5 мкл, содержащими(их) испытуемое соединение или наполнитель (ДМСО, конечная концентрация 1%, в суммарном объеме 25 мкл, в полипропиленовом 96-луночном планшете (Greiner, V-образные лунки). Через 90 мин при 30 С реакции останавливают добавлением 25 мкл/лунка 150 мМ фосфорной кислоты. Все реакционные смеси после окончания реакции переносят в предварительно промытые (75 мМ фосфорная кислота) 96-луночные фильтрационные планшеты (номер по каталогу Perkin Elmer 6005177), используя харвестер клеток (PerkinElmer). Планшеты промывают 6 раз 300 мкл на лунку 75 мМ раствора фосфорной кислоты и дно планшетов герметизируют. Добавляют 40 мкл/лунка Microscint-20, и верх планшетов герметизируют и осуществляют считывание, используя сцинтилляционный счетчик Topcount (Perkin Elmer). Вычисляют киназную активность путем вычитания числа импульсов в 1 мин (cpm), полученных в присутствии положительного контрольного ингибитора (10 мкМ стауроспорина) из cpm, полученных в присутствии наполнителя. Способность испытуемого соединения ингибировать эту активность определяют как ингибирование, %, = cpm, определенное для образца с испытуемым соединением, cpm, определенное для образца с положительным контрольным ингибитором), деленное на (cpm, определенное в присутствии наполнителя, cpm, определенное для образца с положительным контрольным ингибитором 100. Получают серию дозовых разведений для соединений, что дает возможность исследовать зависимость доза-ответ в анализе ингибирования TYK2 и вычислить IC50 для каждого соединения. Каждое соединение обычно тестируют при концентрации 20 мкМ с последующим 1/3 серийным разведением, 8 точек (20 мкМ - 6,67 мкМ - 2,22 мкМ - 740 нМ - 247 нМ - 82 нМ - 27 нМ - 9 нМ) при конечной концентрации ДМСО 1%. Когда активность ряда соединений увеличивается, приготавливают большее число разведений и/или снижают верхнюю концентрацию (например, 5, 1 мкМ). Нижеследующие соединения были испытаны на их активность в отношении TYK2 и значения IC50,определенные, используя анализы, описанные в настоящем описании, представлены ниже в табл. IIID. Таблица IIID Активность соединений в отношении TYK2TYK2 (Carna Biosciences, 09CBS-0983D) используют при конечной концентрации 5 нМ. Опыт по связыванию осуществляют в 50 мМ Hepes pH 7,5, 0,01% Brij-35, 10 мМ MgCl2, 1 мМ EGTA, используя 50 нМ киназной метки 236 (Invitrogen, PV5592) и 2 нМ Eu-анти-GST (Invitrogen, PV5594) при изменении концентраций соединения. Детектирование метки осуществляют согласно методике производителей. Например, когда в этом анализе испытывают соединение 1, получают значение Kd, равное 376 нМ. Пример 2. Анализы с использованием клеток. 2.1. JAK-STAT сигнальный путь. Клетки HeLa выдерживают в модифицированной по способу Дульбекко среде Игла (DMEM), содержащей 10% нагретой инактивированной фетальной телячьей сыворотки, 100 Е/мл пенициллина и 100 мкг/мл стрептомиина. Клетки HeLa используют при 70% слиянии для трансфекции. 20000 клеток в 87 мкл клеточной культуральной среды кратковременно трансфицируют с 40 нг репортера pSTAT1(2)люцефераза (Panomics), 8 нг репортера LacZ в качестве внутреннего контрольного репортера и 52 нгpBSK, используя 0,32 мкл Jet-PEI (Polyplus) в качестве трансфицирующего реагента на лунку в формате 96-луночного планшета. После инкубации на протяжении ночи при 37 С 10% CO2, трансфекционную среду удаляют. Добавляют 75 мкл DMEM+1,5% нагретой инактивированной фетальной телячьей сыворотки. 15 мкл соединения при 6,7 концентрации добавляют на протяжении 60 мин и затем 10 мкл человеческого OSM (Peprotech) при конечной концентрации 33 нг/мл. Все соединения тестируют в двух экземплярах, исходя из 20 мкМ с последующим 1/3 серийным разведением, 8 доз, в целом (20 мкМ - 6,6 мкМ - 2,2 мкМ - 740 нМ - 250 нМ - 82 нМ - 27 нМ - 9 нМ) при конечной концентрации ДМСО 0,2%. После инкубации на протяжении ночи при 37 С, 10% CO2, клетки подвергают лизису в 100 мкл буфера для лизиса/лунка (PBS, 0,9 мМ CaCl2, 0,5 мМ MgCl2, 5% Трегалозы, 0,025% Тергитола NP9, 0,15%BSA). 40 мкл клеточного лизата используют для считывания активности -галактозидазы путем добавления 180 мкл раствора -Gal (30 мкл ONPG 4 мг/мл + 150 мкл буфера -галактозидазы (0,06 М Na2HPO4,0,04 M NaH2PO4, 1 мМ MgCl2 в течение 20 мин. Реакцию останавливают путем добавления 50 мкл 1 МNa2CO3. Оптическую плотность считывают при 405 нм. Люцеферазную активность измеряют, используя 40 мкл клеточного лизата плюс 40 мкл Steadylite,описанного производителем (Perkin Elmer), на приборе Envision (Perkin Elmer). 10 мкМ ингибитора pan-JAK используют в качестве положительного контроля (100% ингибирование). В качестве отрицательного контроля используют 0,5% ДМСО (0% ингибирование). Положительные и отрицательные контроли используют для вычисления значений z и ингибирования, выраженного в процентах (PIN). Ингибирование, %, = флуоресценция, определенная в присутствии наполнителя, флуоресценция,определенная для образца с испытуемым соединением), деленная на (флуоресценция, определенная в присутствии наполнителя, флуоресценция, определенная для образца без триггера)100. Значения PIN наносят на график зависимости доза-ответ против концентрации испытуемых соединений и получают значения ЕС 50. Пример 2.2. OSM/IL-I сигнальный путь. Было показано, что OSM и IL-I синергически повышают уровни ММР 13 в клеточной линииSW1353 хондросаркомы человека. Клетки высевают в 96-луночные планшеты при 15000 клеток/лунка в объеме 120 мкл DMEM (Invitrogen), содержащей 10% (об./об.) FBS и 1% пенициллин/стрептомицин (Invitrogen), инкубированной при 37 С 5% CO2. Клетки предварительно инкубируют с 15 мкл соединения в среде М 199 с 2% ДМСО 1 ч до стимуляции посредством 15 мкл OSM и IL-1, достигая 25 нг/мл OSM и 1 нг/мл IL-1, и через 48 ч после стимуляции измеряют уровни ММР 13 в кондиционированной среде. Активность ММР 13 измеряют, используя метод определения активности с захватом антитела. Для этой цели 384-луночные планшеты (NUNC, 460518, MaxiSorb черные лунки) покрывают 35 мкл 1,5 мкг/мл раствора антитела против человеческого ММР 13 (RD Systems, MAB511) в течение 24 ч при 4 С. После промывания лунок 2 раза смесью PBS+0,05% Твин оставшиеся сайты связывания блокируют 100 мкл 5% нежирного сухого молока (Santa Cruz, sc-2325, Blotto) в PBS в течение 24 ч при 4 С. Затем лунки промывают дважды PBS+0,05% Твин и добавляют 3 5 мкл 1/10 разведения культурального супернатанта, содержащего ММР 13 в 100-кратно разбавленном буфере для блокирования и инкубируют в течение 4 ч при комнатной температуре. Затем лунки промывают дважды смесью PBS+0,05% Твина с последующей активацией ММР 13 добавлением 35 мкл 1,5 мМ раствора 4-аминофенилртутьацетата (АРМА) (Sigma,A9563) и инкубированием при 37 С в течение 1 ч. Клетки промывают снова смесью PBS+0,05% Твин и добавляют 35 мкл субстрата ММР 13 (Biomol, Р-126, OmniMMP флуоресцирующий субстрат). После инкубации в течение 24 ч при 37 С флуоресценцию превращенного субстрата измеряют в Perkin Elmer Wallac Envision 2102 Multilabel планшет-ридере (длина волны возбуждения: 320 нм, длина волны испускания: 405 нм). Процентное ингибирование = флуоресценция, определенная в присутствии наполнителя, флуоресценция, определенная для образца с испытуемым соединением), деленное на (флуоресценция, определенная в присутствии наполнителя, флуоресценция, определенная для образца без триггера 100. Например, когда в этом анализе тестируют соединение 1, получают значение ЕС 50, равное 2242,5(1098,5) нМ. Пример 2.3. Анализ пролиферации PBL. Лимфоциты периферической крови (PBL) человека стимулируют посредством IL-2 и измеряют пролиферацию, используя метод включения BrdU. PBL сначала стимулируют в течение 72 ч посредством РНА, индуцируя рецептор IL-2, затем их подвергают голоданию на протяжении 24 ч, приостанавливая тем самым пролиферацию клеток с последующей стимуляцией посредством IL-2 на протяжении еще 72 ч(включая 24-часовое BrdU мечение). Клетки предварительно инкубируют с испытуемыми соединениями за 1 ч до введения IL-2. Клетки культивируют в среде RPMI 1640, содержащей 10% (об./об.) FBS. Пример 2.4. Анализ цельной крови (WBA). 2.4.1. Протокол стимуляции IFN. Для предсказания активности испытуемых соединений в ингибировании JAK1- или JAK2 зависимых сигнальных путей in vivo была разработана физиологически релевантная модель in vitro, используя цельную кровь человека. В WBA анализе кровь, изъятую у волонтеров, которые дали информированное согласие, обрабатывают ex vivo соединением (1h) и затем стимулируют либо в течение 30 мин интерфероном(IFN, JAK1-зависимый путь) или в течение 2 ч гранулоцитарным макрофагальным колониестимулирующим фактором (GM-CSF, JAK2-зависимый путь). 2.4.1.1. Анализ фосфо - STAT1. В случае стимуляции IFN увеличение в фосфорилировании трансдукторов сигнала и активаторов транскрипции 1 (pSTAT1) посредством IFN в экстрактах лейкоцитов измеряют, используя анализpSTAT1 методом ELISA. Фосфорилирование сигнального белка-трансдуктора и активатора транскрипции 1 (STAT1) после стимуляции интерфероном альфа (IFN) представляет собой JAK1-опосредованное событие. Анализ фосфо-STAT1, который используют для измерения уровней фосфо-STAT1 в клеточных экстрактах, был разработан для оценки способности соединения ингибировать JAK1-зависимые сигнальные пути. Цельную кровь человека, изъятую у волонтеров, которые дали информированное согласие, обрабатывают ex vivo соединением (1h) и затем стимулируют в течение 30 мин посредством IFN. Увеличение в фосфорилировании STAT1 посредством INF в экстрактах лейкоцитов измеряют, используя фосфоSTAT1 ELISA. Буфер для лизиса АСК состоял из 0,15 М NH4Cl, 10 мМ KHCO3, 0,1 мМ EDTA. рН буфера состав- 24021637 лял 7,3. 10 концентрат для лизиса клеток (часть PathScan диагностического набора для фосфо-STAT1(Tyr701) ELISA-анализа "сэндвич"-типа от Cell Signaling) разводят в 100 раз H2O. Ингибиторы протеиназы добавляют к буферу до использования. 20 мкг IFN растворяют в 40 мкл H2O с получением исходного раствора с концентрацией 500 мкг/мл. Исходный раствор хранят при -20 С. Получают серию 3-кратного разведения соединения в ДМСО (максимальная концентрация 10 мМ). Впоследствии соединение дополнительно разводят в среде (фактор разведения зависит от требуемой концентрации соединения). 2.4.1.1.1. Инкубация крови с соединением и стимуляция интерфероном IFN. Кровь человека собирают в обработанных гепарином пробирках. Кровь делят на аликвоты 392 мкл. Затем 4 мкл разведения соединения добавляют к каждой аликвоте и образцы крови инкубируют в течение 1 ч при 37 С. Исходный раствор IFN разводят в 100 раз в среде RPMI, получая рабочий раствор с концентрацией 500 нг/мл. 4 мкл 500 нг/мл рабочего раствора добавляют в образцы крови (конечная концентрация IFN: 5 нг/мл). Образцы инкубируют при 37 С в течение 30 мин. 2.4.1.1.2. Получение клеточных экстрактов. В конце стимуляционного периода для лизиса эритроцитов к образцам крови добавляют 7,6 мл буфера АСК. Образцы перемешивают путем переворачивания пробирок пять раз и реакционную смесь инкубируют, выдерживая их на льду, в течение 5 мин. Лизис эритроцитов (RBC) должен быть очевиден во время этой инкубации. Клетки осаждают центрифугированием при 300 g, 4 С в течение 7 мин и супернатант удаляют. 10 мл 1PBS добавляют в каждую пробирку и дебрис клеток ресуспендируют. Образцы снова центрифугируют в течение 7 мин при 300 g, 4 С. Супернатант отбрасывают и дебрис ресуспендируют в 500 мкл 1PBS. Затем суспензию клеток переносят в чистую 1,5 мл микроцентрифужную пробирку. Клетки осаждают центрифугированием при 700 g в течение 5 мин при 4 С. Супернатант удаляют и дебрис растворяют в 150 мкл буфера для лизиса клеток. Образцы инкубируют, выдерживая на льду, в течение 15 мин. После этого образцы хранят при -80 С до следующей обработки. 2.4.1.1.3. Измерение фосфорилирования STAT1 методом ELISA. Для определения уровней фосфо-STAT1 используют Pathscan набор для ELISA-анализа сэндвичтипа фосфо-STAT1 (Tyr701) от Cell Signaling (номер по каталогу 7234). Клеточные экстракты размораживают на льду. Пробирки центрифугируют в течение 5 мин при 16000 g, 4 С и получают просветленные лизаты. Между тем, микролуночные полоски из набора уравновешивают при комнатной температуре и буфер для промывки получают разведением 20 буфера для промывки в H2O. Образцы разбавляют в 100 раз в разбавителе для образца и 100 мкл добавляют к полоскам микролунок. Полоски инкубируют на протяжении ночи при 4 С. На следующий день лунки промывают 3 раза буфером для промывки. В лунки добавляют 100 мкл антитела детектирования. Полоски инкубируют при 37 С в течение 1 ч. Затем лунки снова промывают 3 раза буфером для промывки. В каждую лунку добавляют 100 мкл HRP-связанного вторичного антитела и образцы инкубируют при 37 С. Через 30 мин лунки снова промывают 3 раза и во все лунки добавляют 100 мкл субстрата. После того как образцы посинеют, для приостановления реакции добавляют 100 мклSTOP раствора. Оптическую плотность измеряют при 450 нм. 2.4.1.2. Анализ данных. Ингибирование индукции фосфо STAT1 IFN в клеточных экстрактах наносят на график в зависимости от концентрации соединения и получают значения IC50, используя программное обеспечениеGraphpad. Данные аккумулируют, если R2 больше, чем 0,8, и наклон кривой меньше чем 3. 2.4.1.2. Анализ IL-8 методом ELISA. В случае стимуляции посредством GM-CSF увеличение уровней интерлейкина-8 (IL-8) в плазме измеряют, используя анализ IL-8 методом ELISA. Индуцируемая гранулоцитарным макрофагальным колониестимулирующим фактором экспрессия интерлейкина 8 (IL-8) представляет собой JAK2 опосредованное событие. Анализ IL-8 методом ELISA, который может быть использован для измерения уровней IL-8 в образцах плазмы, был разработан с целью оценки способности соединения ингибироватьJAK2-зависимые сигнальные пути. Цельную кровь человека, изъятую у волонтеров, которые дали информированное согласие, обрабатывают ex vivo соединением (1 ч) и затем стимулируют в течение 2 ч посредством GM-CSF. Увеличение уровней IL-8 в плазме измеряют, используя анализ IL-8 методом ELISA. 10 мкг GM-CSF растворяют в 100 мкл H2O, получая исходный раствор с концентрацией 100 мкг/мл. Исходный раствор хранят при -20 С. Получают серию 3-кратного разведения испытуемого соединения в ДМСО (максимальная концентрация 10 мМ). Впоследствии соединение подвергают дополнительному разведению в среде (фактор разведения зависит от требуемой конечной концентрации соединения). 2.4.1.2.1. Инкубация крови с соединением и стимуляция посредством GM-CSF. Кровь человека собирают в обработанных гепарином пробирках. Кровь делят на аликвоты 245 мкл. Затем 2,5 мкл разведения испытуемого соединения добавляют к каждой аликвоте и образцы крови инкубируют в течение 1 ч при 37 С. Исходный раствор GM-CSF разводят в 100 раз в среде RPMI, получая рабочий раствор с концентрацией 1 мкг/мл. 2,5 мкл 1 мкг/мл рабочего раствора добавляют в образцы крови (конечная концентрация GM-CSF: 10 нг/мл). Образцы инкубируют при 37 С в течение 2 ч. 2.4.1.2.2. Получение плазменных образцов. Образцы центрифугируют в течение 15 мин при 1000 g, 4 С. 100 мкл плазмы собирают и хранят при -80 С до дальнейшего использования. 2.4.1.2.3. Измерение уровней IL-8 методом ELISA. Для определения уровней IL-8 используют набор для хемилюминесцентного иммуноанализа IL-8 человека от RD Systems (номер по каталогу Q8000B). Буфер для промывки получают разведением 10 буфера для промывки в H2O. Рабочий glo реагент получают добавлением 1 ч. Glo реагента 1 к 2 ч. Glo реагента В за 15 мин-4 ч до использования. В каждую лунку добавляют 100 мкл разбавителя для анализа RD1-86. После этого добавляют 50 мкл образца (плазма). Планшет для ELISA инкубируют в течение 2 ч при комнатной температуре,500 об/мин. Все лунки промывают 4 раза буфером для промывки и в каждую лунку добавляют 200 мкл конъюгата IL-8. После инкубации в течение 3 ч при комнатной температуре лунки промывают 4 раза буфером для промывки и в каждую лунку добавляют 100 мкл рабочего glo реагента. Планшет ELISA инкубируют в течение 5 мин при комнатной температуре (защищенный от света). Измеряют люминесценцию (время считывания 0,5 с/лунка). 2.4.1.3. Результаты. Например, при соблюдении вышеприведенного протокола pIC50 соединения 1 для ингибирования индуцируемого INF увеличения уровней pSTAT1 составляла 6,230,15 (ССО, SEM). Этот результат показывает, что соединение 1 достаточно убедительно ингибирует JAK1 сигнальный путь в физиологической обстановке. 2.4.2. Протокол стимуляции посредством IL-6. Кроме того, осуществляют проточный цитометрический анализ для установления селективности exvivo соединения в отношении JAK1 в сравнении с JAK2, используя цельную кровь человека. Поэтому у волонтеров, которые дали информированное согласие, отбирают кровь. Затем кровь уравновешивают в течение 30 мин при 37 С при слабом покачивании, затем распределяют в виде аликвотных проб в пробирки Эппендорфа. Соединение добавляют при различных концентрациях и инкубируют при 37 С в течение 30 мин при слабом покачивании и затем стимулируют в течение 20 мин при 37 С пи слабом покачивании интерлейкином 6 (IL-6) для стимуляции JAK1-зависимого сигнального пути или посредствомGM-CSF для стимуляции JAK2-зависимого сигнального пути. Затем оценивают фосфо-STAT1 и фосфоSTATS, используя FACS анализ. 2.4.2.1. Анализы фосфо-STAT1. В случае IL-6-стимулируемого увеличения фосфорилирования трансдукторов сигнала и активаторов транскрипции 1 (pSTAT1) в лейкоците цельную кровь человека, изъятую у волонтеров, которые дали информированное согласие, обрабатывают ex vivo соединением в течение 30 мин и затем стимулируют в течение 20 мин IL-6. Увеличение в фосфорилировании STAT1 посредством IL-6 в лимфоцитах измеряют,используя антитело против фосфо-STAT1 согласно анализу FACS. 5 буфер Lyse/Fix (BD PhosFlow, номер по каталогу 558049) разводят в 5 раз дистиллированной водой и предварительно нагревают при 37 С. Оставшийся разведенный буфер для лизиса/фиксации(Lyse/Fix) отбрасывают. 10 мкг rhIL-6 (RD Systems, номер по каталогу 206-IL) растворяют в 1 мл PBS 0,1% BSA, получая исходный раствор с концентрацией 10 мкг/мл. Исходный раствор делят на аликвоты и хранят при -80 С. Получают серию 3-кратного разведения соединения в ДМСО (10 мМ исходный раствор). Контрольобработанные образцы содержали ДМСО вместо соединения. Все образцы инкубируют при конечной концентрации ДМСО 1%. 2.4.2.1.1. Инкубация крови с соединением и стимуляция IL-6. Кровь человека собирают в обработанных гепарином пробирках. Кровь делят на аликвоты 148,5 мкл. Затем к каждой аликвоте крови добавляют 1,5 мкл разведения испытуемого соединения и инкубируют в течение 30 мин при 37 С при слабом покачивании. К образцам крови добавляют исходный раствор IL-6 (1,5 мкл) (конечная концентрация 10 нг/мл) и образцы инкубируют при 37 С в течение 20 мин при слабом покачивании. 2.4.2.1.2. Получение лейкоцитов и мечение CD4. В конце стимуляционного периода к образцам крови незамедлительно добавляют 3 мл 1 предварительно нагретого буфера лизис/фиксация, встряхивают кратковременно и инкубируют в течение 15 мин при 37 С на водяной бане для осуществения лизиса эритроцитов и фиксации лейкоцитов, затем замораживают при -80 С до дальнейшего использования. Для следующих стадий пробирки размораживают при 37 С на протяжении приблизительно 20 мин и центрифугируют в течение 5 мин при 400g при 4 С. Дебрис клеток промывают 3 мл холодного 1PBS и после центрифугирования дебрис клеток снова ресуспендируют в 100 мкл PBS, содержащем 3%BSA. Добавляют конъюгированное с FITC антитело против CD4 или контрольное FITCконъюгированное изотипное антитело и инкубируют в течение 20 мин при комнатной температуре, в темноте. 2.4.2.1.3. Получение клеток с повышенной проницаемостью мембраны и мечение антителом против фосфо-STAT1. После промывания клеток 1PBS дебрис клеток ресуспендируют в 100 мкл охлажденного на льду 1PBS и добавляют 900 мкл охлажденного на льду 100% метанола. Затем клетки инкубируют при 4 С в течение 30 мин для достижения их повышенной проницаемости. Затем клетки с искусственно увеличенной проницаемостью мембраны промывают 1PBS, содержащим 3% BSA и, наконец, ресуспендируют в 80 мкл 1 РВХ, содержащего 3% BSA. 20 мкл РЕ мышиного антитела против STAT1 (pY701) или РЕ мышиного IgG2 ак-изотипа контрольного антитела (BD Biosciences, номер по каталогу 612564 и 559319 соответственно) добавляют и смешивают, затем инкубируют в течение 30 мин при 4 С, в темноте. Затем клетки промывают один раз 1PBS и анализируют на проточном цитометре FACSCanto II(BD Biosciences). 2.4.2.1.4. Флуоресцентный анализ на FACSCanto II. 50000 суммарных событий считывают и Phospho-STAT1 положительные клетки измеряют после клеточной сортировки относительно CD4+ клеток, в лимфоцитарном окне. Данные анализируют, используя программное обеспечение FACSDiva, и вычисляют процентное ингибирование IL-6 стимуляции по процентному содержанию фосфо-STAT1 положительных клеток относительно CD4+ клеток. 2.4.2.2. Анализ фосфо-STAT5. В случае GM-CSF-стимулируемого увеличения фосфорилирования сигнального белка-трансдуктора и активатора транскрипции 5 (pSTAT5) в лейкоците цельную кровь человека, изъятую у волонтеров, которые дали информированное согласие, обрабатывают ex vivo соединением в течение 30 мин и затем стимулируют в течение 20 мин посредством GM-CSF. Увеличение в фосфорилировании STAT5 посредством GM-CSF в моноцитах измеряют, используя антитело против фосфо-STAT5 согласно анализуFACS. 5 буфер для лизиса/фиксации (BD PhosFlow, номер по каталогу 558049) разводят в 5 раз дистиллированной водой и предварительно нагревают при 37 С. Оставшийся разведенный буфер для лизиса/фиксации отбрасывают. 10 мкг rhGM-CSF (AbCys S.A., номер по каталогу Р 300-03) растворяют в 1 мл PBS 0,1% BSA, получая исходный раствор с концентрацией 100 мкг/мл. Исходный раствор хранят в виде аликвот -80 С. Получают серию 3-кратного разведения соединения в ДМСО (10 мМ исходный раствор). Контрольобработанные образцы содержали ДМСО без испытуемого соединения. Все образцы инкубируют при конечной концентрации ДМСО 1%. 2.4.2.2.1. Инкубация крови с соединением и стимуляция посредством GM-CSF. Кровь человека собирают в обработанных гепарином пробирках. Кровь делят на аликвоты 148,5 мкл. Затем к каждой аликвоте крови добавляют 1,5 мкл разведения испытуемого соединения и образцы крови инкубируют в течение 30 мин при 37 С при слабом покачивании. К образцам крови добавляют исходный раствор GM-CSF (1,5 мкл) (конечная концентрация 20 пг/мл) и образцы инкубируют при 37 С в течение 20 мин при слабом покачивании. 2.4.2.2.2. Получение лейкоцитов и мечение CD4. В конце стимуляционного периода к образцам крови незамедлительно добавляют 3 мл 1 предварительно нагретого буфера для лизиса/фиксации, встряхивают кратковременно и инкубируют в течение 15 мин при 37 С на водяной бане для осуществления лизиса эритроцитов и фиксации лейкоцитов, затем замораживают при -80 С до дальнейшего использования. Для следующих стадий пробирки размораживают при 37 С на протяжении приблизительно 20 мин и центрифугируют в течение 5 мин при 400g при 4 С. Дебрис клеток промывают 3 мл холодного 1PBS и после центрифугирования дебрис снова ресуспендируют в 100 мкл PBS, содержащем 3% BSA. Добавляют FITC мышиное антитело против CD4 (BD Biosciences, номер по каталогу 345784) или контрольноеFITC мышиное IgG2bk-изотипа антитело (BD Biosciences, номер по каталогу 555057) и инкубируют в течение 20 мин при комнатной температуре, в темноте. 2.4.2.2.3. Получение клеток с повышенной проницаемостью мембраны и мечение антителом против фосфо-STAT5. После промывания клеток 1PBS дебрис клеток ресуспендируют в 100 мкл охлажденного на льду 1PBS и добавляют 900 мкл охлажденного на льду 100% метанола. Затем клетки инкубируют при 4 С в течение 30 мин для достижения их повышенной проницаемости. Затем клетки с искусственно увеличенной проницаемостью мембраны промывают 1PBS, содер- 27021637 жащим 3% BSA и, наконец, ресуспендируют в 80 мкл 1PBX, содержащего 3% BSA. 20 мкл РЕ мышиное антитело против STAT5 (pY694) или РЕ мышиное IgG1k-изотипа контрольное антитело (BD Biosciences, номер по каталогу 612567 и 554680 соответственно) добавляют, смешивают,затем инкубируют в течение 30 мин при 4 С, в темноте. Затем клетки промывают один раз 1PBS и анализируют на проточном цитометре FACSCanto II(BD Biosciences). 2.4.2.2.4. Флуоресцентный анализ на FACSCanto II. 50000 суммарных событий считывают и фосфо-STAT5 положительные клетки измеряют после клеточного сортинга относительно CD4+ клеток. Данные анализируют, используя программное обеспечениеFACSDiva, и они соответствуют проценту ингибирования GM-CSF стимуляции, рассчитанному по процентному содержанию фосфо-STAT5 положительных клеток относительно CD4+ клеток. 2.4.2.2. Результаты. При соблюдении вышеприведенного протокола для каждого из испытуемых соединений был определен процент ингибирования (PIN), который представляет собой среднее значение для трех здоровых волонтеров. Например, при испытании соединение 1 для ингибирования фосфорилирования STAT1 получают pIC50=6,08. Пример 3. Модели in vivo. Пример 3.1. Модель CIA. 3.1.1. Материалы. Полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA) закупают у Difco. Бычий коллаген типа II (CII), липополисахарид (LPS) и Enbrel получают от Chondrex (Isle d'Abeau, France); Sigma (P4252, L'Isle d'Abeau, France), Whyett (25 мг шприц для инъекции, France) Acros Organics (Palo Alto,CA) соответственно. Все другие используемые реагенты отвечали реактивной чистоте и все растворители имели аналитическую чистоту. 3.1.2. Животные. Темных крыс Agouti (самцы, возраст 7-8 недель) получали из Harlan Laboratories (Maison-Alfort,France). Крыс выдерживали при 12 ч свет/темнота цикле (0700-1900). Температуру поддерживали при 22 С и пищу и воду предоставляли по желанию. 3.1.3. Индуцируемый коллагеном артрит (CIA). За один день до опыта получают раствор CII (2 мг/мл) с 0,05 М уксусной кислоты и хранят при 4 С. Непосредственно перед иммунизацией равные объемы адъюванта (IFA) и CII смешивают при помощи гомогенизатора в предварительно охлажденном стеклянном сосуде на бане со смесью воды и льда. Если не образуется эмульсия, то может потребоваться экстраадъювант и продолжительная гомогенизация. На день 1 0,2 мл эмульсии инъецируют внутрикожно в основание хвоста каждой крысы, вторую ревакцинирующую внутрикожную инъекцию (раствор CII при 2 мг/мл в CFA 0,1 мл физиологического раствора) проводят на день 9. Этот метод иммунизации скорректирован, исходя из опубликованных методов (Simset al., 2004; Jou et al., 2005). 3.1.4. План исследования. Терапевтические действия соединений испытывают на модели CIA у крыс. Крыс случайным образом делят на равные группы, и каждая группа содержит по 10 крыс. Все крысы подвергаются иммунизации на день 1 и ревакцинизации на день 9. Терпевтическое дозирование осуществляют на протяжении периода времени, начиная с дня 16 по день 30. Отрицательную контрольную группу обрабатывают наполнителем (МС 0,5%) и положительную контрольную группу обрабатывают Enbrel (10 мг/кг, 3 неделя,подкожно). Соединение, представляющее интерес, обычно испытывают при 3 дозах, например 3, 10, 30 мг/кг, перорально (р.о.) 3.1.5. Клиническая оценка артрита. Артрит оценивают согласно методу Khachigian, 2006, Lin et al., 2007 and Nishida et al., 2004). Припухлость каждой из четырех лап оценивают в соответствии со шкалой оценки артрита, которая выглядит следующим образом: 0 - нет симптомов; 1 - слабо выраженная, но определяемая краснота и припухлость одного типа сустава, такого как голеностопный сустав или запястье, или очевидное покраснение и припухлость, ограниченное отдельными пальцами, независимо от числа пораженных пальцев; 2 - умеренная краснота и припухлость двух или большего числа типов суставов; 3 - серьезная краснота и припухлость всей лапы, включая пальцы; 4 - максимально воспаленная конечность с вовлечением в патологический процесс множественных суставов (максимальная кумулятивная клиническая оценка артрита 16 на одного животного) (Nishida et al., 2004). Для того чтобы сделать возможным мета-анализ многочисленных исследований, значения клинической оценки нормализуют следующим образом.AUC клинической оценки (AUC оценка). Площадь под кривой (AUC), начиная с дня 1 и кончая днем 14, вычисляют для каждой индивидуальной крысы. AUC каждого животного делят на среднюю AUC, полученную для наполнителя в исследовании, из которого получают данные по животному, и умножают на 100 (т.е. AUC выражают как процент средней AUC с наполнителем на исследование). Увеличение клинической оценки со дня 1 до дня 14 (конечная точечная оценка). Различие клинической оценки для каждого животного делят на среднее различие клинической оценки, полученное для наполнителя в исследовании, из которого получают данные по животному, и умножают на 100 (т.е. различие выражают в виде процента среднего различия клинической оценки для наполнителя на исследование). 3.1.6. Изменение массы тела (%) после возникновения артрита. Клинически потерю массы тела ассоциируют с артритом (Shelton et al., 2005; Argiles et al., 1998;Rail, 2004; Walsmith et al., 2004). Отсюда, изменения массы тела после возникновения артрита могут быть использованы в качестве неспецифической конечной точки для оценки действия лечения на модели болезни у крыс. Изменение массы тела (%) после возникновения артрита вычисляют следующим образом: 3.1.7. Рентгенология. Получают рентгеновские снимки задних лап каждого отдельного животного. Случайный слепой идентификационный номер присваивают каждому из снимков, и степень тяжести костного поражения оценивается двумя независимыми оценщиками, исходя из радиологической системы оценки по Ларсену,которая выглядит следующим образом: 0 - нормальное состояние, отсутствие поврежденных костных очертаний и обычное состояние занимаемого суставом пространства; 1 - незначительная аномалия, касающаяся любой одной или двух из наружных плюсневых костей, демонстрирующая незначительное поражение [эрозию] кости; 2 - определяемая начальная аномалия, касающаяся любой из трех-пяти плюсневых костей любой из трех-пяти наружных плюсневых костей, демонстрирующая поражение [эрозию] кости; 3 - средняя деструктивная аномалия, касающаяся всех наружных плюсневых костей, а также любой одной или двух из внутренних плюсневых костей, демонстрирующая определенное поражение [эрозию] кости; 4 - серьезная деструктивная аномалия, касающаяся всех плюсневых костей, демонстрирующая определенное поражение [эрозию] кости и по меньшей мере одного из внутренних плюсневых суставов, находящегося в состоянии полного истончения, оставляя лишь некоторые очертания костного сустава частично сохраненными; 5 - калечащая аномалия состояния кости без каких-либо костных очертаний. Эта система оценки представляет собой модификацию системы, представленной в Salvemini et al.,2001; Bush et al., 2002; Sims et al., 2004; Jou et al., 2005. 3.1.8. Гистология. После радиологического анализа задние лапы мышей фиксируют в 10% забуференном фосфатом формалине (рН 7,4), декальцинируют с помощью средства, быстро удаляющего соли кальция с поверхности кости, для последующего тонкого гистологического исследования (Laboratories Eurobio) и погружают в парафин. Для обеспечения экстенсивной оценки суставов, пораженных артритом, делают по меньшей мере четыре серийных среза (толщиной 5 мкм), при этом каждая серия срезов отстоит друг от друга на 100 мкм. Среды окрашивают гематоксилином и козином (НЕ). Гистологические исследования с целью выявления синовиального воспаления и поражения кости и хряща осуществляют, используя двойной слепой метод изучения. Для каждой лапы проводят оценку по четырем параметрам, используя четырехточечную шкалу оценок, выраженную в баллах. Параметры представляли собой клеточную инфильтрацию, тяжесть симптомов паннуса, эрозию [истончение] хряща и эрозии кости. Оценку проводят согласно нижеследующему: 1 - нормальная, 2 - выраженность легкой степени, 3 - средней степени, 4 - заметная. Эти четыре оценки суммируют вместе и представляют в виде дополнительной оценки, т.е. общая оценка RA. 3.1.9. Анализ пяточной кости с помощью микрокомпьютерной томографии (мкСТ). Деградация кости, наблюдаемая при RA, проявляется, главным образом, на кортикальном слое кости, и ее можно обнаружить с помощью СТ анализа (Sims NA et al., Arthritis Rheum. 50 (2004) 2338-2346:model by micro-CT morphometry). После сканирования и трехмерной реконструкции пяточной кости костную деградацию измеряют в виде некоторого числа дискретных объектов предметов на предметном
МПК / Метки
МПК: A61K 31/437, A61P 19/02, C07D 471/04
Метки: 5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-илкарбоксамиды, ингибиторов, качестве
Код ссылки
<a href="https://eas.patents.su/30-21637-5-fenil-124triazolo15-apiridin-2-ilkarboksamidy-v-kachestve-ingibitorov-jak.html" rel="bookmark" title="База патентов Евразийского Союза">5-фенил-[1,2,4]триазоло[1,5-a]пиридин-2-илкарбоксамиды в качестве ингибиторов jak</a>
Предыдущий патент: Трансформанты talaromyces
Следующий патент: Натриево-известковое стекло с разделенными фазами
Случайный патент: Высоковязкие диутановые камеди и способы их получения