Гидроксильные, кето и глюкуронидные производные 3-(4-(7н-пирроло[2,3-d]пиримидин-4-ил)-1н-пиразол-1-ил)-3-циклопентилпропаннитрила
Номер патента: 21478
Опубликовано: 30.06.2015
Авторы: Галя Лорин Дж., Роджерс Джеймс Д., Недза Фрэнк М., Шепард Стейси, Арванитис Аргириос Г., Ли Мей, Шиллинг Адам
Формула / Реферат
1. Соединение формулы I
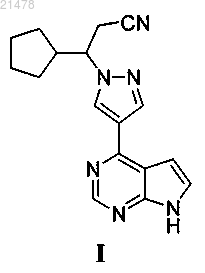
или его фармацевтически приемлемая соль, где каждая из n групп С-Н независимо замещена на С-ОН; или одна группа СН2 независимо замещена на С=О; или одна группа С-Н замещена на
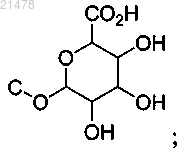
или две группы С-Н, каждая независимо, замещены на С-ОН, и одна С-Н группа замещена на
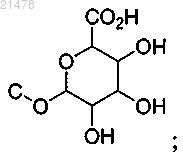
и
n равен 1, 2, 3 или 4;
при условии, что соединение не является выбранным из
3-(4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил)-3-(3-гидроксициклопентил)пропаннитрила;
3-(4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил)-3-(2-гидроксициклопентил)пропаннитрила;
3-(4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил)-3-(3-оксоциклопентил)пропаннитрила;
и его фармацевтически приемлемые соли.
2. Соединение по п.1 или его фармацевтически приемлемая соль, отличающееся тем, что группа СН в положении α к цианогруппе не замещена на группу С-ОН;
группа СН2 в положении α к цианогруппе не замещена на группу С=О и
группа СН в положении β к цианогруппе не замещена на группу С-ОН.
3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что n групп С-Н, каждая независимо, являются замещенными на С-ОН.
4. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что n равен 1.
5. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что n равен 2.
6. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что n равен 3.
7. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что n равен 4.
8. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что одна группа СН2 независимо замещена на С=О.
9. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что одна группа С-Н независимо замещена на

10. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что одна насыщенная группа С-Н замещена на
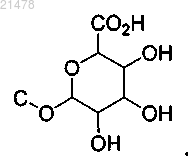
11. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что две группы С-Н, каждая независимо, являются замещенными на С-ОН и одна группа С-Н замещена на
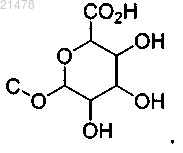
12. Соединение по п.1, отличающееся тем, что выбрано из
6-(3-(1-(4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил)-2-цианоэтил)циклопентилокси)-3,4,5-тригидрокситетрагидро-2Н-пиран-2-карбоновой кислоты;
3-(4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил)-3-(1,2-дигидроксициклопентил)пропаннитрила и
3-(4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил)-3-(1-гидроксициклопентил)пропаннитрила
или фармацевтически приемлемой соли любого из вышеупомянутых соединений.
13. Соединение по п.1, отличающееся тем, что выбрано из





или фармацевтически приемлемая соль любого из вышеупомянутых соединений.
14. Соединение, выбранное из


или фармацевтически приемлемая соль любого из вышеупомянутых соединений.
15. Соединение, выбранное из

или фармацевтически приемлемая соль любого из вышеупомянутых соединений.
16. Фармацевтическая композиция, включающая соединение по любому из пп.1-15 или его фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый носитель для лечения заболевания, ассоциированного с активностью JAK.
17. Композиция по п.16, отличающаяся тем, что она является пригодной для перорального введения.
18. Фармацевтическая композиция, включающая соединение по любому из пп.1-15 или его фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый носитель, для лечения миелоидной метаплазии с миелофиброзом (МММ), истинной полицитемией (PV) или эссенциальной тромбоцитемии (ЕТ).
Текст
В настоящем изобретении представлены гидроксильные, кето и глюкуронидные производные 3-(4(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-циклопентилпропаннитрила. Родственные заявки Настоящая заявка заявляет о приоритете предварительной заявки на патент США 61/250387, поданной 9 октября 2009 г., предварительной заявки на патент США 61/316218, подданной 22 марта 2010 г. Описание этих документов включено в настоящую заявку путем ссылки в полном объеме. Область техники В настоящем изобретении представлены гидроксильные, кето и глюкуронидные производные 3-(4(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-циклопентилпропаннитрила. Уровень техники Протеинкиназы (PK) являются группой ферментов, которые регулируют разнообразные важные биологические процессы, включая, помимо прочего, рост, выживание и дифференцировку клеток, формирование органов и морфогенез, неоваскуляризацию, восстановление и регенерацию тканей. Протеинкиназы проявляют свои физиологические функции путем катализирования фосфорилирования белков(или субстратов), модулируя таким образом клеточную активность субстратов в различных биологических контекстах. Помимо функции в нормальных тканях/органах многие протеинкиназы также играют более специализированные роли в носителе заболеваний человека, включая рак. Подмножество протеинкиназ (также упоминаемых как онкогенные протеинкиназы) при дисрегуляции могут вызывать образование и рост опухоли, а затем вносить вклад в сохранение и прогрессию опухоли (Blume-Jensen P. et al.,Nature 2001, 411(6835):355-365). Поэтому онкогенные протеинкиназы представляют собой одну из крупнейших и наиболее привлекательных групп белков-мишеней для вмешательства в раковое заболевание и разработки лекарств. Семейство Янус-киназ (JAK) играет роль в цитокинзависимой регуляции пролиферации и функции клеток, участвующих в иммунной реакции. В настоящее время известно четыре члена семейства JAK млекопитающих: JAK1 (известная также как Янус-киназа-1), JAK2 (известная также как Янус-киназа-2),JAK3 (известная также как Янус-киназа, лейкоцит; JAKL; L-JAK и Янус-киназа-3) и TYK2 (известная также как протеин-тирозинкиназа 2). Белки JAK имеют размер от 120 до 140 кДа и включают семь консервативных доменов гомологии JAK (JH); один из этих функциональных каталитических доменов киназы, а также другой, являющийся доменом псевдокиназы, потенциально выполняют регуляторную функцию и/или служат в качестве центра присоединения STAT (Scott, Godshall et al. 2002, supra). Блокирующая сигнальная трансдукция на уровне киназ JAK является многообещающей для разработки средств лечения рака у людей. Предполагается также, что ингибирование киназ JAK обладает терапевтическим преимуществом у пациентов, страдающих кожными иммунными нарушениями, такими как псориаз и чувствительность кожи. Соответственно, ингибиторы Янус-киназ или родственных киназ являются предметом обширных изысканий и нескольких публикаций, в которых описываются эффективные классы соединений. Например, некоторые ингибиторы JAK, включая (R)-3-(4-(7 Н-пирроло[2,3d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-циклопентилпропаннитрил, представленный ниже, описаны в публикации США сер.11/637545 (US 2007/0135461), зарегистрированной 12 декабря 2006 г.; публикации США сер.12/138082 (US 2009/0181959), зарегистрированной 16 июля 2009 г.; и некоторые метаболиты соединения I описаны в публикации США сер.12/137883 (US 2008/0312258), зарегистрированной 12 июня 2008 г., каждая из которых включена в настоящую заявку путем ссылки в полном объеме. Поэтому постоянно необходимы новые или улучшенные агенты, ингибирующие киназы, такие как Янус-киназы, для разработки новых и более эффективных фармацевтических средств лечения рака и других заболеваний. Метаболиты, композиции и способы, описанные в настоящем документе, нацелены на удовлетворение этих потребностей и других конечных целей. Сущность изобретения В настоящем изобретении представлены, inter alia, гидроксильные, кето и глюкуронидные производные соединения формулы I или их фармацевтически приемлемые соли. Так, в одном варианте изобретения представлено соединение формулы I или его фармацевтически приемлемая соль, где каждая из n групп С-Н независимо замещена на С-ОН; или одна группа СН 2 независимо замещена на С=О; или одна группа С-Н замещена на или две группы С-Н, каждая независимо, замещены на С-ОН и одна группа С-Н замещена наn равен 1, 2, 3 или 4; при условии, что соединение не является выбранным из 3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1H-пиразол-1-ил)-3-(3-гидроксициклопентил)пропаннитрила; 3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-(2-гидроксициклопентил)пропаннитрила; 3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-(3-оксоциклопентил)пропаннитрила; и его фармацевтически приемлемые соли. В одном варианте формулы I атом углерода в положениик цианогруппе не является замещенным группой С-ОН или С=О; и атом углерода в положениик цианогруппе не является замещенным группой С-ОН. В другом варианте этого соединения n групп С-Н, каждая независимо, являются замещенными на С-ОН. В другом варианте n равен 1. В другом варианте n равен 2. В другом варианте n равен 3. В другом варианте n равен 4. В другом варианте формулы I одна группа СН 2 независимо замещена на С=О. В другом варианте одна группа С-Н замещена на В другом варианте одна насыщенная группа С-Н замещена на-2 021478 В другом варианте две группы С-Н, каждая независимо, замещены на С-ОН и одна группа С-Н замещена на В настоящем изобретении дополнительно представлены композиции, включающие соединения,описанные в настоящем документе, или их фармацевтически приемлемые соли и по меньшей мере один фармацевтически приемлемый носитель. В настоящем изобретении дополнительно представлены способы модулирования активности JAK,включающие взаимодействие JAK с некоторыми соединениями, описанными в настоящем документе,или их фармацевтически приемлемыми солями. В настоящем изобретении дополнительно представлены способы лечения заболеваний у пациента, включающие введение пациенту терапевтически эффективного количества некоторых соединений, описанных в настоящем документе, или их фармацевтически приемлемых солей. В определенном варианте заболевание является связанным с активностью JAK. Такие заболевания включают, например, отторжение аллотрансплантата или заболевание "трансплантат против хозяина". Это заболевание может быть также аутоиммунным заболеванием, включая, но не ограничиваясь этим, кожные нарушения, рассеянный склероз, ревматоидный артрит, ювенильный артрит, диабет I типа, волчанку, воспалительное заболевание кишечника, болезнь Крона, миастению, иммуноглобулиннефропатию, миокардит или аутоиммунные тироидные нарушения. Аутоиммунные нарушения также могут быть нарушением буллезной кожы, например обыкновенной пузырчаткой (PV) или буллезным пемфигоидом (ВР). Кожные нарушения могут быть атопическим дерматитом, псориазом, чувствительностью кожи, раздражением кожи, сыпью на коже, контактным дерматитом или аллергической контактной сенсибилизацией. В другом варианте заболевание является вирусным заболеванием. Примеры вирусных заболеваний,которые могут лечиться соединениями, описанными в настоящем документе, включают вирус Эпштейна-Барра (EBV), гепатит В, гепатит С, ВИЧ, лимфотропный вирус человека типа 1 (HTLV 1), вирус ветряной оспы (VZV) или вирус папилломы человека (HPV). В другом варианте заболевание является раком, например твердой опухолью. Рак, подлежащий лечению, может быть раком простаты, раком почек, раком печени, раком груди, раком легких, раком щитовидной железы, саркомой Капоши, болезнью Каслмана или раком поджелудочной железы. В определенном варианте рак является раком простаты. Рак может быть гематологическим. Рак может быть также лимфомой, лейкемией или множественной миеломой. В другом варианте рак является раком кожи, например лимфомой Т-клеток кожи или лимфомой В-клеток кожи. В другом варианте рак является множественной миеломой. Заболевание, подлежащее лечению, может быть также истощением, вызванным или связанным с раком, или анорексией, или кахексией, вызванной или связанной с раком. В другом варианте заболевание, подлежащее лечению, является миелопролиферативным нарушением, например истинной полицитемией (PV), эссенциальной тромбоцитемией (ЕТ), миелоидной метаплазией с миелофиброзом (МММ), хроническим миелолейкозом (CML), хроническим миеломоноцитарным лейкозом (CMML), гиперэозинофильным синдромом (HES) или системным мастоцитозом (SMCD). В другом варианте заболевание, подлежащее лечению, является воспалительным заболеванием. Воспалительное заболевание может быть воспалительным заболеванием глаз, например иритом, увеитом, склеритом или конъюнктивитом. Воспалительное заболевание может быть воспалительным заболеванием дыхательных путей, например верхних дыхательных путей или нижних дыхательных путей. Воспалительное заболевание может быть воспалительной миопатией или миокардитом. В другом варианте заболевание является реперфузией ишемии или заболеваниями, связанными с ишемией. Подробное описание изобретения В настоящем изобретении представлены, inter alia, гидроксильные, кето и глюкуронидные производные 3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-циклопентилпропаннитрила. В некоторых вариантах соединение является метаболитом соединения I. В некоторых вариантах соединение является активным метаболитом, который может модулировать активность одной или более JAK и может быть полезным, например, при лечении заболеваний, связанных с экспрессией или активностьюJAK. В некоторых вариантах уровень метаболитного соединения, описанного в настоящем документе,измеряется и профилируется для того, чтобы помочь лечащему врачу подобрать уровень дозировки соединения формулы I. Соответственно, в настоящем изобретении представлено соединение формулы I или его фармацевтически приемлемая соль, где каждая из n групп С-Н независимо замещена С-ОН; или одна группа СН 2 независимо замещена на С=О; или одна группа С-Н замещена на или две группы С-Н, каждая независимо, замещены на С-ОН и одна С-Н группа замещена наn равен 1, 2, 3 или 4; при условии, что соединение не является выбранным из 3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-(3-гидроксициклопентил)пропаннитрила; 3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-(2-гидроксициклопентил)пропаннитрила; 3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-(3-оксоциклопентил)пропаннитрила; и его фармацевтически приемлемые соли. В некоторых вариантах n групп С-Н, каждая независимо, являются замещенными на С-ОН. В некоторых вариантах n равен 1. В некоторых вариантах n равен 2. В некоторых вариантах n равен 3. В некоторых вариантах n равен 4. В некоторых вариантах одна группа СН 2 независимо замещена на С=О. В некоторых вариантах одна группа С-Н замещена на В некоторых вариантах одна насыщенная группа С-Н замещена на В некоторых вариантах две группы С-Н, каждая независимо, замещены на С-ОН и одна группа С-Н замещена на В некоторых вариантах атом углерода в положениик цианогруппе не является замещенным группой С-ОН, С=О или и атом углерода в положениик цианогруппе не является замещенным группой С-ОН или В некоторых вариантах атом углерода в положениик цианогруппе не является замещенным группой С-ОН или С=О; и атом углерода в положениик цианогруппе не является замещенным группой С-ОН. В другом варианте настоящего изобретения представлено соединение формулы II или его фармацевтически приемлемая соль, где 1, 2, 3 или 4 углерода а, b, с, d, e, f, g, h, i, j, k или m, каждый независимо, являются замещенными на ОН; или один из углеродов h, i, j, k или m независимо является замещенным на =O; или один из углеродов а, b, с, d, e, f, g, h, i, j, k или m является замещенным на или два углерода а, b, с, d, e, f, g, h, i, j, k или m являются независимо замещенными на ОН и при условии, что соединение не является выбранным из 3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-(3-гидроксициклопентил)пропаннитрила; 3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-(2-гидроксициклопентил)пропаннитрила; 3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-(3-оксоциклопентил)пропаннитрила; и его фармацевтически приемлемые соли. В некоторых вариантах формулы II 1, 2, 3 или 4 углерода а, b, с, d, e, f, g, h, i, j, k или m, каждый независимо, являются замещенными на ОН. В некоторых вариантах один из углеродов а, b, с, d, e, f, g, h, i,j, k или m является замещенным на ОН. В некоторых вариантах 2 углерода из а, b, с, d, e, f, g, h, i, j, k илиm, каждый независимо, являются замещенными на ОН. В некоторых вариантах 3 углерода из а, b, с, d, e,f, g, h, i, j, k или m, каждый независимо, являются замещенными на ОН. В некоторых вариантах 4 углерода из а, b, с, d, e, f, g, h, i, j, k или m, каждый независимо, являются замещенными на ОН. В некоторых вариантах один из углеродов h, i, j, k или m является замещенным на =О. В некоторых вариантах один из углеродов а, b, с, d, e, f, g, h, i, j, k или m является замещенным на В некоторых вариантах один из углеродов f, g, h, i, j, k или m является замещенным на В некоторых вариантах два углерода из а, b, с, d, e, f, g, h, i, j, k или m, каждый независимо, являются замещенными на ОН и один из углеродов а, b, с, d, е, f, g, h, i, j, k или m является замещенным на В некоторых вариантах углерод m не замещен на группу ОН, =O или и углерод f не замещен на группу ОН или В некоторых вариантах углерод m не замещен на группу ОН или =O и углерод f не замещен на группу ОН. Каждый из вышеупомянутых вариантов предполагает, что соблюдаются правила надлежащей валентности. В некоторых вариантах соединение выбрано из 6-(3-(1-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-2-цианоэтил)циклопентилокси)3,4,5-тригидрокситетрагидро-2 Н-пиран-2-карбоновой кислоты; 3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-(1,2-дигидроксициклопентил)пропаннитрила и 3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-(1-гидроксициклопентил)пропаннитрила или фармацевтически приемлемой соли любого из вышеупомянутых соединений. В некоторых вариантах соединение выбрано из 3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-(1-гидроксициклопентил)пропаннитрила; 3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-циклопентил-3-гидроксипропаннитрила; 3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-циклопентил-2-гидроксипропаннитрила; 3-циклопентил-3-(5-гидрокси-4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)пропаннитрила; 3-циклопентил-3-(3-гидрокси-4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)пропаннитрила; 3-циклопентил-3-(4-(5-гидрокси-7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)пропаннитрила; 3-циклопентил-3-(4-(6-гидрокси-7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)пропаннитрила; 3-циклопентил-3-(4-(2-гидрокси-7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)пропан-6 021478 нитрила; 3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-(1,2-дигидроксициклопентил)пропаннитрила; 3-циклопентил-3-(4-(5,6-дигидрокси-6,7-дигидро-5 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1 ил)пропаннитрила и 6-(4-(1-(2-циано-1-циклопентилэтил)-1 Н-пиразол-4-ил)-7 Н-пирроло[2,3-d]пиримидин-7-ил)-3,4,5 тригидрокситетрагидро-2 Н-пиран-2-карбоновой кислоты или фармацевтически приемлемой соли любого из вышеупомянутых соединений. В некоторых вариантах соединения, описанные в настоящем документе, могут включать соединения, показанные ниже на схемах 1-7, а также их энантиомеры, диастереомеры и рацематы. Схема 1 Некоторые метаболиты представлены ниже в табл. 1. Предполагается, что структуры охватывают все возможные стереоизомеры. Таблица 1 Номера в круглых скобках означают номера соединений в табл. 2 (infra) Соединения, описанные в настоящем документе, являются метаболитами (R)-3-(4-(7 Н-пирроло[2,3d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3-циклопентилпропаннитрила. Метаболиты настоящего изобретения были выделены из образцов мочи человека, крысы или собак, собранных в фармакокинетических и токсикокинетических исследованиях ингибитора JAK (R)-3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Нпиразол-1-ил)-3-циклопентилпропаннитрила (соединение I). Некоторые метаболиты могут быть ингибиторами JAK и могут обладать полезными свойствами, связанными со значительно более высокими свободными фракциями и более высокой метаболической стабильностью в микросомах человека по сравнению с соединением I. Метаболиты настоящего изобретения могут предпочтительно иметь более продолжительный период полувыведения из организма человека по сравнению с соединением I. В некоторых вариантах метаболиты настоящего изобретения являются, в основном, выделенными. Термин "в основном, выделенные" означает, что соединение является, по меньшей мере, частично или по большей части отделенным от окружающей среды, в которой оно было образовано или обнаружено. Частичное разделение может включать, например, композицию, обогащенную соединением настоящего изобретения. Существенное разделение может включать композиции, содержащие по меньшей мере около 50%, по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 90%, по меньшей мере около 95%, по меньшей мере около 97% или по меньшей мере около 99 вес.% метаболита. В настоящее изобретение включены также фармацевтически приемлемые соли соединений, опи- 10021478 санных в настоящем документе. Используемый в настоящем документе термин "фармацевтически приемлемые соли" относится к производным описанных соединений, где исходное соединение модифицировано превращением существующей кислотной или основной группы в ее солевую форму. Примеры фармацевтически приемлемых солей включают, не ограничиваясь этим, соли минеральных или органических кислот и основных остатков, таких как амины; щелочные или органические соли кислотных остатков, таких как карбоновые кислоты; и т.п. Фармацевтически приемлемые соли настоящего изобретения включают традиционные нетоксичные соли исходного соединения, образованные, например, из нетоксичных неорганических или органических кислот. Фармацевтически приемлемые соли настоящего изобретения могут быть синтезированы из исходного соединения, содержащего основную или кислотную группу, обычными химическими способами. Обычно такие соли могут быть получены при взаимодействии свободной кислотной или основной формы этих соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или органическом растворителе или в смеси их обоих; как правило, предпочтительными являются такие неводные среды, как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Списки пригодных солей представлены в публикациях Remington's Pharmaceutical Sciences, 17-е изд., Mack Publishing Company, Easton, Пенсильвания, 1985, с. 1418 и в Journal of Pharmaceutical Science, 66, 2 (1977), каждая из которых включена в настоящую заявку путем ссылки в полном объеме. Выражение "фармацевтически приемлемый", употребляемое в настоящем документе, относится к таким соединениям, материалам, композициям и/или лекарственным формам, которые являются по результатам тщательной медицинской клинической оценки пригодными для использования в контакте с тканями организма человека и животных, без избыточной токсичности, раздражения, аллергических реакций или других проблем или осложнений, соразмерно с отношением приемлемой пользы и риска. Соединения, описанные в настоящем документе, являются асимметричными (например, имеющими один или более стереоцентров). Подразумеваются все стереоизомеры, такие как энантиомеры и диастереомеры, если не указано иное. Способы получения оптически активных форм из оптически активных исходных материалов известны в данной области, например разделение рацемических смесей или стереоселективный синтез. Соединения, описанные в настоящем документе, включают также все изотопы атомов, встречающиеся в метаболитах. Изотопы включают те атомы, которые имеют такой же атомный номер, но другое массовое число. Например, изотопы водорода включают тритий и дейтерий. Соединения могут также включать сольваты и гидраты соединений или солевых форм. Термин "соединение", используемый в настоящем документе, включает все стереоизомеры, геометрические изомеры, таутомеры и изотопы изображенных структур. Синтез. Соединения, описанные в настоящем документе, включая их соли, могут быть получены по известным методикам органического синтеза и могут быть синтезированы одним из многочисленных возможных путей синтеза. Реакции получения соединений, описанных в настоящем документе, могут быть выполнены в подходящих растворителях, которые специалист в области органического синтеза может легко подобрать. Подходящими растворителями могут быть растворители, по большей части не реагирующие с исходными материалами (реагентами), промежуточными соединениями или продуктами при температурах выполнения реакции, например при температурах, которые могут изменяться от температуры замерзания растворителя до температуры кипения растворителя. Данную реакцию можно выполнить в одном растворителе или в смеси из более одного растворителя. В зависимости от конкретного этапа реакции пригодные растворители для конкретного этапа реакции могут быть подобраны специалистом в данной области. Получение соединений, описанных в настоящем документе, может включать защиту и снятие защиты с различных химических групп. Необходимость защиты или снятия защиты, а также выбор соответствующих защитных групп может быть легко установлена специалистом в данной области. Химия защитных групп представлена, например, в публикации T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 3-е изд., WileySons, Inc., Нью-Йорк (1999), которая включена в настоящую заявку путем ссылки в полном объеме. Реакции могут контролироваться в соответствии с любым пригодным способом, известным в данной области. Например, образование продукта можно контролировать спектроскопическими способами,такими как спектроскопия ядерного магнитного резонанса (например, 1 Н или 13 С), инфракрасная спектроскопия, спектрофотометрия (например, УФ-видимая), масс-спектрометрия или хроматография, такая как высокоэффективная жидкостная хроматография (ВЭЖХ) или тонкослойная хроматография. Соединения, описанные в настоящем документе, могут быть получены в соответствии с многочисленными способами получения, представленными в литературе. Например, соединения, описанные в настоящем документе, могут быть получены по способам, аналогичным способам, которые описаны в публикации США сер.11/637545 (US 2007/0135461), зарегистрированной 12 декабря 2006 г.; публикации США сер.12/138082 (US 2009/0181959), зарегистрированной 16 июля 2009 г.; и публикации- 11021478 США сер.12/137883 (US 2008/0312258), зарегистрированной 12 июня 2008 г., каждая из которых включена в настоящую заявку путем ссылки в полном объеме. Примеры способов синтеза для получения соединений, описанных в настоящем документе, представлены ниже на схемах. Как показано на схеме 1, синтез соединения 32 начинается с 4-хлорпирролопиримидина S1. Связывание Сузуки соединения S1 с пиразолборонатом S2 в щелочных условиях в присутствии катализатораPd(0) может дать трициклическое соединение S3, которое затем селективно превращается в йодсодержащее соединение S4 с использованием N-йодсукцинимида. Йодсодержащее соединение S4 преобразуется в соответствующий ацетат S5. Обработка S5 4 М раствором бромоводорода в уксусной кислоте даетS6 с заданным окислением в пирроловом кольце одновременно со снятием защиты метоксигруппы до свободного гидроксила. Цианогруппа, которая гидролизовалась до амида в этих условиях, восстанавливается до соединения 32 обработкой S6 трихлорацетилхлоридом и триэтиламином для достижения дегидратации. Схема 1 Моногидроксилированное соединение 42 (метаболит 8) описано в публикации США сер.12/137883, зарегистрированной 12 июня 2008 г. Дополнительно соединения, имеющие гидроксильную группу в циклопентиловом кольце, могут быть также синтезированы по схеме 2. Например, из имеющегося в продаже рацемического соединения S14, в котором спиртовая группа является защищенной, с последующим восстановлением карбоксильного сложного эфира до альдегида с последующей олефинизацией альдегида с получением S17. Добавление конъюгата S9 к S17 в щелочных условиях дает S18, в котором последовательно снимаются защитные группы у спирта и пирролового кольца с получением смеси диастереомеров, которая затем разделяется с использованием нескольких колонок хиральной ВЭЖХ с получением четырех диастереомеров S19. В некоторых вариантах настоящего изобретения представлен способ получения соединения 42 или его фармацевтически приемлемой соли, включающий один или более этапов схемы 2. Схема 2- 12021478 Другой пример моногидроксилированного соединения 36 получен по последовательности, представленной на схеме 3. Защищенный цианогидрин S31 может быть восстановлен при помощи DIBAL до соответствующего альдегида с последующей олефинизацией с фосфонатом, таким как S7, с получением кротонитрила S33. Добавление конъюгата S9 к S33 в щелочных условиях дает S34, в котором снимается защитная группа у пирролового кольца с получением смеси диастереомеров, которая затем разделяется с использованием нескольких колонок хиральной ВЭЖХ с получением индивидуальных стереоизомеров 36. Схема 3 Дигидроксилированные метаболиты могут быть получены таким же способом, как показано на схеме 4: циклопентен карбоксальдегид S6A может быть обработан напрямую илидом S7 с получением производного кротонитрила S8. Нитрил S8 затем может реагировать с пиразолом S9 в присутствии основания, такого как DBU, с получением S10 в виде смеси диастереомеров, которые могут дигидроксилироваться тетроксидом осмия с получением цис-спиртов цис-S12A, после удаления группы SEM. Индивидуальные стереоизомеры этой смеси (цис-S12A) могут быть разделены хиральной хроматографией с получением энантиомерно чистых спиртов. транс-S12A могут быть получены первоначальной эпоксидизацией олефина с м-СРВА с последующим раскрытием эпоксида в кислых условиях. Индивидуальные стереоизомеры этой смеси (транс-S12 А) могут быть разделены хиральной хроматографией с получением энантиомерно чистых спиртов. Такие же пути синтеза могут использоваться для получения изомерныхS12B и S12C при замене исходного альдегида S6A на S6B и S6C. Схема 4 Комбинация способов, описанных выше, со способами, описанными в заявке на патент США сер.11/637545, поданной 12 декабря 2006 г.; и в заявке на патент США сер.12/137883, поданной 12 ию- 13021478 ня 2008 г., которые включены в настоящий документ в полном объеме, могут использоваться для получения тригидроксисоединений настоящего изобретения. Например, гидрокси- и дигидроксисоединения,описанные в настоящем документе, могут быть окислены по реакции окисления Сверна, описанной в заявке на патент США сер.12/137883, поданной 12 июня 2008 г. Глюкурониды метаболитов, содержащие гидроксильные группы, могут быть синтезированы по способу, описанному в публикации Suzukiet al. (Bioorg. Med. Chem. Lett. (1999), 9(5), 659-662, которая включена в настоящий документ в полном объеме). Способы. Некоторые соединения, описанные в настоящем документе, могут модулировать активность одной или более Янус-киназ (JAK). Термин "модулировать" относится к способности увеличивать или уменьшать активность одного или более членов семейства киназ JAK. Соответственно, некоторые соединения,описанные в настоящем документе, могут использоваться в способах модулирования JAK путем взаимодействия JAK с одним или более соединений или композиций, описанных в настоящем документе. В некоторых вариантах определенные соединения могут действовать как ингибиторы одной или более JAK. В некоторых вариантах определенные соединения, описанные в настоящем документе, могут дейстовать для стимуляции активности одной или более JAK. В дополнительных вариантах определенные соединения могут использоваться для модулирования активности JAK у пациентов, нуждающихся в модулировании рецептора, путем введения модулирующего количества соединения настоящего изобретения. Киназы JAK, с которыми связываются и/или которые модулируются соединениями настоящего изобретения, могут включать любые члены семейства JAK. В некоторых вариантах JAK является JAK1,JAK2, JAK3 или TYK2. В некоторых вариантах JAK является JAK1 или JAK2. В некоторых вариантахJAK является JAK2. В некоторых вариантах JAK является JAK3. В некоторых вариантах активные соединения могут быть селективными. Под "селективными" подразумевается, что соединения связываются с JAK или ингибируют JAK с большей аффинностью или силой, соответственно, по сравнению по меньшей мере с одной другой JAK (например, селективные ингибиторы JAK1 или JAK2 по сравнению JAK3 и/или TYK2). В некоторых вариантах селективность означает селективное ингибирование JAK2 (например, по сравнению с JAK1, JAK3 и TYK2). Не ограничиваясь теорией, поскольку ингибиторы JAK3 могут приводить к иммуноподавляющим эффектам, соединение,которое является селективным в отношении JAK2 по сравнению с JAK3 и которое является полезным при лечении рака (такого как множественная миелома, например), может обеспечивать дополнительное преимущество, заключающееся в меньшем количестве побочных иммуноподавляющих эффектов. Селективность может быть по меньшей мере примерно 5-кратной, по меньшей мере примерно 10-кратной, по меньшей мере примерно 20-кратной, по меньшей мере примерно 50-кратной, по меньшей мере примерно 100-кратной, по меньшей мере примерно 200-кратной, по меньшей мере примерно 500-кратной или по меньшей мере примерно 1000-кратной. Селективность может быть измерена обычными в данной области способами. В некоторых вариантах селективность может быть испытана при Km каждого фермента. В некоторых вариантах селективность JAK2 по сравнению с JAK3 может быть определена по клеточной концентрации АТФ. Другой аспект настоящего изобретения относится к способам лечения JAK-связанного заболевания или нарушения у субъекта (например, пациента) путем введения субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества или дозы определенного соединения, описанного в настоящем документе, или его фармацевтической композиции. Заболевания, связанные с JAK, могут включать любые заболевания, нарушения или состояния, прямо или косвенно связанные с экспрессией или активностью JAK, включая сверхэкспрессию и/или аномальный уровень активности. Заболевания, связанные с JAK, также могут включать любые заболевания, нарушения или состояния, которые можно предотвратить, улучшить или вылечить модулированием активности JAK. Примеры JAK-связанных заболеваний включают заболевания, затрагивающие иммунную систему,включая, например, отторжение трансплантата органа (например, отторжение аллотрансплантата и заболевания "трансплантат против хозяина"). Дополнительные примеры JAK-связанных заболеваний включают аутоиммунные заболевания, такие как рассеянный склероз, ревматоидный артрит, ювенильный артрит, диабет I типа, волчанку, псориаз, воспалительное заболевание кишечника, неспецифический язвенный колит, болезнь Крона, миастению, иммуноглобулин-нефропатию, аутоиммунное нарушение щитовидной железы и т.п. В некоторых вариантах аутоиммунное заболевание является аутоиммунным буллезным нарушением кожи, таким как обыкновенная пузырчатка (PV) или буллезный пемфигоид (ВР). Дополнительные примеры JAK-связанных заболеваний включают аллергические состояния, такие как астма, пищевые аллергии, атопические дерматиты и риниты. Дополнительные примеры JAKсвязанных заболеваний включают вирус Эпштейна-Барра (EBV), гепатит В, гепатит С, ВИЧ, лимфотропный вирус человека типа 1 (HTLV 1), вирус ветряной оспы (VZV) и вирус папилломы человека (HPV). Дополнительные примеры JAK-связанных заболеваний или состояний включают кожные нарушения, такие как псориаз (например, обыкновенный псориаз), атопические дерматиты, кожные высыпания,раздражение кожи, чувствительность кожи (например, контактный дерматит, аллергический контактный- 14021478 дерматит или аллергическая контактная сенсибилизация). Например, некоторые вещества, включая некоторые фармацевтические средства, при локальном нанесении могут вызывать сенсибилизацию кожи. В некоторых вариантах совместное введение или последовательное введение по меньшей мере одного ингибитора JAK вместе с агентом, вызывающим нежелательную сенсибилизацию, может быть полезным для лечения таких нежелательных сенсибилизации или дерматитов. В некоторых вариантах кожное нарушение лечится местным введением по меньшей мере одного ингибитора JAK. В дополнительных вариантах JAK-связанное заболевание является раком, включая рак, характеризующийся твердыми опухолями (например, рак простаты, рак почек, рак печени, рак поджелудочной железы, рак желудка, рак груди, рак легких, рак головы и шеи, рак щитовидной железы, глиобластома,саркома Капоши, болезнь Каслмана, меланома и т.п.), гематологические виды рака (например, лимфома,лейкоз, такой как острый лимфобластный лейкоз, острый миелогенный лейкоз (AML) или множественная миелома) и рак кожи, такой как лимфома Т-клеток кожи (CTCL) и лимфома В-клеток кожи. Примеры лимфом Т-клеток кожи включают синдром Сезари и грибовидный микоз.JAK-связанные заболевания могут дополнительно включать заболевания, которые характеризуются экспрессией: мутантов JAK2, таких как мутанты, имеющие по меньшей мере одну мутацию в домене псевдокиназы (например, JAK2V617F); мутанты JAK2, имеющие по меньшей мере одну мутацию за пределами домена псевдокиназы; мутанты JAK1; мутанты JAK3; мутанты рецептора эритропоэтина (EPOR); или разрегулированной экспрессией CRLF2.JAK-связанные заболевания могут дополнительно включать миелопролиферативные нарушения(MPD), такие как истинная полицитемия (PV), эссенциальная тромбоцитемия (ЕТ), миелоидная метаплазия с миелофиброзом (МММ), хронический миелолейкоз (CML), хронический миеломоноцитарный лейкоз (CMML), гиперэозинофильный синдром (HES), системный мастоцитоз (SMCD) и т.п. Дополнительно JAK-связанные заболевания включают воспаление и воспалительные заболевания. Примеры воспалительных заболеваний включают саркоидоз, воспалительные заболевания глаз (например, сухость глаз, ирит, увеит, склерит, конъюктивит или родственные заболевания), воспалительные заболевания дыхательных путей (например, верхних дыхательных путей, включая нос и пазухи, такие как синусит, или нижних дыхательных путей, включая бронхит, хроническое обструктивное заболевание легких и т.п.), воспалительную миопатию, такую как миокардит, и другие воспалительные заболевания. Другие воспалительные заболевания, которые могут лечиться ингибиторами JAK, включают синдром системной воспалительной реакции (SIRS) и септический шок. При использовании в настоящем документе термин "сухость глаз" охватывает болезненные состояния, обобщенные в недавно опубликованном официальном отчете Dry Eye Workshop (DEWS), где сухость глаз определяется как "многофакторное заболевание выделения слез и поверхности глаз, которое приводит к симптомам дискомфорта, нарушения зрения и нестабильности слезной пленки с потенциальным повреждением поверхности глаз. Оно сопровождается увеличенной осмотической концентрацией слезной пленки и воспалением поверхности глаз". Публикация Lemp, "The Definition and Classification ofDry Eye Disease: Report of the Definition and Classification Subcommittee of the International Dry Eye Workshop", The Ocular Surface, 5(2), 75-92 April 2007, которая включена в настоящий документ путем ссылки в полном объеме. В некоторых вариантах сухость глаз выбрана из сухости глаз, связанной с дефицитом водянистых слез (ADDE), или сухости глаз в результате испарения, или их комбинации. В некоторых вариантах сухость глаз является синдромом сухости глаз Сьогрена (SSDE). В некоторых вариантах сухость глаз является синдромом сухости глаз не-Сьогрена (NSSDE). В дополнительном аспекте настоящего изобретения представлен способ лечения конъюнктивита,увеита (в том числе хронического увеита), хориодита, ретинита, циклита, склерита, эписклерита или ирита; лечения воспаления или боли, связанной с пересадкой роговицы, LASIK (кератомилез с помощью лазера in situ), фоторефракционной кератэктомией или LASEK (суб-эпителиальный кератомилез с помощью лазера); замедления потери остроты зрения, связанного с пересадкой роговицы, LASIK, фоторефракционной кератэктомией или LASEK; или ингибирования отторжения трансплантата у больных, нуждающихся в этом, включающий введение пациенту терапевтически эффективного количества соединения настоящего изобретения или его фармацевтически приемлемой соли. Ингибиторы JAK могут дополнительно использоваться для лечения повреждений реперфузии ишемии или заболевания или состояния, связанного с воспалительной ишемией, такой как приступ или остановка сердца. Ингибиторы JAK могут дополнительно использоваться для лечения анорексии, кахексии или истощения, такого как истощение, связанное с раком. Ингибиторы JAK могут дополнительно использоваться для лечения рестеноза, склеродермита или фиброза. Ингибиторы JAK могут дополнительно использоваться для лечения состояний, связанных с гипоксией или астроглиозом, таких как, например,диабетическая ретинопатия, рак или нейродегенерация. См., например, Dudley, A.C. et al. Biochem. J. 2005, 390 (Pt 2):427-36 и Sriram, K. et al. J. Biol. Chem. 2004, 279(19): 19936-47. Epub 2004 Mar 2. Ингибиторы JAK могут дополнительно использоваться для лечения подагры и увеличенного размера простаты, например, из-за доброкачественой гипертрофии простаты или доброкачественной гиперплазии простаты. Дополнительно JAK-связанные заболевания включают заболевания резорбции костей, такие как ос- 15021478 теопороз, остеоартрит. Резорбция костей может быть также связана с другими состояниями, такими как гормональный дисбаланс и/или гормональная терапия, аутоиммунное заболевание (например, костный саркоидоз) или рак (например, миелома). Снижение костной резорбции благодаря ингибиторам JAK может составлять около 10%, около 20, около 30, около 40, около 50, около 60, около 70, около 80 или около 90%. Используемый в настоящем документе термин "взаимодействие" относится к соединению указанных групп в системах in vitro или системах in vivo. Например, "взаимодействие" JAK с соединением включает введение соединения настоящего изобретения субъекту или пациенту, такому как человек,имеющему JAK, а также, например, введение соединения в образец, содержащий клеточный или очищенный препарат, содержащий JAK. Используемые в настоящем документе термины "субъект" или "пациент", которые используются взаимозаменяемо, относятся к любому животному, включая млекопитающих, предпочтительно мышей,крыс, других грызунов, кроликов, собак, кошек, свиней, крупный рогатый скот, овец, лошадей или приматов и наиболее предпочтительно людей. Используемое в настоящем документе выражение "терапевтически эффективное количество" относится к такому количеству активного соединения или фармацевтического средства, которое вызывает биологическую или медицинскую реакцию, которая ожидается исследователем, ветеринаром, лечащим врачом или другим клиницистом, в ткани, системе, организме животного, субъекта или человека. Используемый в настоящем документе термин "лечение" относится к одному или более из пунктов:(1) предотвращение заболевания; например предотвращение заболевания, состояния или нарушения у субъекта, который, возможно, является предрасположенным к этому заболеванию, состоянию или нарушению, но еще не болеет или не проявляет патологии или симптоматологии этого заболевания; (2) ингибирование заболевания; например ингибирование заболевания, состояния или нарушения у субъекта,который уже болеет или проявляет патологию или симптоматологию этого заболевания, состояния или нарушения; и (3) улучшение заболевания; например улучшение заболевания, состояния или нарушения у субъекта, который уже болеет или проявляет патологию или симптоматологию заболевания, состояния или нарушения (т.е. реверсирование патологии и/или симптоматологии), такое как уменьшение степени заболевания. Содержание метаболитов в организме пациента после введения соединения I у пациента может быть измерено и профилировано. Такой профиль метаболита затем можно использовать для регулировки режима дозирования (например, для введения соединения I) этому пациенту. Например, более быстрое очищение организма от соединения I, что показано содержанием различных метаболитов через определенный промежуток времени, может означать, что исходные дозировки могут быть скорректированы в сторону увеличения. Комплексные терапии. Одно или более дополнительных фармацевтических средств, таких как, например, химиотерапевтические, противовоспалительные средства, стероиды, иммунодепрессанты, а также ингибиторы киназ BcrAb1, Flt-3, RAF и FAK, такие как, например, описаны в публикации WO 2006/056399, или другие средства могут использоваться в комбинации с некоторыми соединениями, описанными в настоящем документе, для лечения связанных с JAK заболеваний, нарушений или состояний. Один или более дополнительных фармацевтических агентов может вводиться пациенту одновременно или последовательно. Примеры химиотерапевтических средств включают ингибиторы протеосом (например, бортезомиб), талидомид, ревлимид и ДНК-повреждающие агенты, такие как мелфалан, доксорубицин, циклофосфамид, винкристин, этопозид, кармустин и т.п. Примеры стероидов включают кортикостероиды, такие как дексаметазон или преднизон. Примеры ингибиторов Bcr-Ab1 включают соединения настоящего изобретения и их фармацевтически приемлемые соли, родов и видов, описанных в патенте США 5521184, WO 04/005281 и публикации США сер.60/578491. Примеры пригодных ингибиторов Flt-3 включают соединения и их фармацевтически приемлемые соли, как описано в публикациях WO 03/037347, WO 03/099771 и WO 04/046120. Примеры пригодных ингибиторов RAF включают соединения и их фармацевтически приемлемые соли, как описано в публикациях WO 00/09495 и WO 05/028444. Примеры пригодных ингибиторов FAK включают соединения и их фармацевтически приемлемые соли, как описано в публикациях WO 04/080980, WO 04/056786, WO 03/024967, WO 01/064655, WO 00/053595 и WO 01/014402. В некоторых вариантах одно или более соединений, описанных в настоящем документе, могут использоваться в комбинации с одним или более других ингибиторов киназ, включая иматиниб, в частности, для лечения пациентов, резистентных к иматинибу или другим ингибиторам киназ. В некоторых вариантах одно или более соединений могут использоваться в комбинации с химиотерапевтическими средствами лечения рака, таких как множественная миелома, и могут улучшать реакцию на лечение по сравнению с реакцией на лечение только химиотерапевтическим средством, без усиления его токсического эффекта. Примеры дополнительных фармацевтических средств, используемых для ле- 16021478 чения множественной миеломы, например, могут включать, не ограничиваясь, мелфалан, мелфалан плюс преднизон (МП), доксорубицин, дексаметазон и Велкад (бортезомиб). Другие дополнительные агенты,используемые для лечения множественной миеломы, включают ингибиторы киназ Bcr-Ab1, Flt-3, RAF иFAK. Аддитивные или синергетические эффекты являются желательными результатами комбинирования соединения настоящего изобретения с дополнительным агентом. Более того, устойчивость клеток множественной миеломы к таким агентам, как дексаметазон, может быть обратимой при лечении с соединением настоящего изобретения. Эти агенты могут комбинироваться с ингибитором JAK в составе одной или сплошной лекарственной формы, или эти агенты могут вводиться одновременно или последовательно в виде различных лекарственных форм. В некоторых вариантах кортикостероиды, такие как дексаметазон, вводятся пациенту в комбинации по меньшей мере с одним ингибитором JAK, где дексаметазон вводится периодически, в противоположность непрерывному. В некоторых дополнительных вариантах комбинации одного или более соединений с другими терапевтическими средствами могут вводиться пацинту до, во время и/или после трансплантата костного мозга или трансплантата стволовых клеток. Фармацевтические композиции и лекарственные формы. При использовании в качестве лекарственных средств соединения, описанные в настоящем документе, могут вводиться в форме фармацевтических композиций. Эти композиции могут быть получены хорошо известными в фармацевтике способами и могут вводиться различными путями в зависимости от того, требуется ли локальное или системное лечение, а также от области, подлежащей лечению. Введение может быть местным (включая трансдермальное, эпидермальное, офтальмическое и в слизистые оболочки, включая интраназальную, вагинальную и ректальную доставку), пульмональным (например,при ингаляции или инсуфляции порошков или аэрозолей, включая распылитель; внутритрахеально или интраназально), пероральным или парентеральным. В некоторых вариантах композиция настоящего изобретения пригодна для перорального применения. Парентеральное введение включает внутривенные,внутриартериальные, подкожные, внутрибрюшинные, внутримышечные инъекции или инфузии; или внутричерепное, например интратекальное или внутрижелудочковое введение. Парентеральное введение может осуществляться в форме единого болюсного введения или, например, через непрерывный перфузионный дозатор. Фармацевтические композиции и рецептуры для локального применения могут включать трансдермальные пластыри, мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки. Могут быть необходимы или желательны стандартные фармацевтические носители, водные,порошковые или масляные основы, загустители и т.п. Могут быть полезны также презервативы с покрытиями, перчатки и т.п. Настоящее изобретение включает также фармацевтические композиции, которые содержат в качестве активного компонента одно или более соединений, описанных в настоящем документе, в комбинации с одним или более фармацевтически приемлемым носителем (наполнителем). При приготовлении композиций настоящего изобретения активный ингредиент обычно смешивается с носителем, разбавляется носителем или внедряется в такой носитель в форме, например, капсулы, саше, бумажной или другой упаковки. Если носитель служит разбавителем, это может быть твердый, полутвердый или жидкий материал, который действует как наполнитель, носитель или среда для активного ингредиента. Так, композиции настоящего изобретения могут быть в форме таблеток, пилюль, порошков, лепешек, саше, капсул, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (в виде твердого вещества или в жидкой среде), мазей, содержащих, например, до 10 вес.% активного соединения, мягких или твердых желатиновых капсул, суппозиториев, стерильных растворов для инъекций или стерильных фасованных порошков. При приготовлении композиции активное соединение перед смешиванием с другими ингредиентами может быть измельчено для получения соответствующего размера частиц. Если активное соединение является практически нерастворимым, оно может быть измельчено до размеров частиц менее 200 меш. Если активное соединение, в основном, растворимо в воде, то размер частиц может быть подобран измельчением для получения практически однородного распределения в композиции, например, около 40 меш. Активный компонент может измельчаться известными способами измельчения, такими как влажное измельчение для получения соответствующего размера частиц для формования таблеток и для составления других типов композиций. Тонкоизмельченные (наноразмерные) композиции активного компонента могут быть получены известными в данной области способами, см., например, заявку на международный патентWO 2002/000196. Некоторые примеры пригодных носителей включают лактозу, декстрозу, сахарозу, сорбит, маннит,крахмалы, гуммиарабик, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп и метилцеллюлозу. Композиции могут дополнительно включать смазывающие агенты, такие как тальк, стеарат магния и минеральное масло; увлажняющие агенты, эмульгаторы и суспендирующие агенты; консервирующие агенты, такие как метил- и пропилгидроксибензоаты, подсластители и ароматизаторы. Композиции настоящего- 17021478 изобретения могут составляться таким образом, чтобы обеспечивать быстрое, непрерывное или замедленное высвобождение активного ингредиента после введения пациенту путем использования известных в данной области способов. Композиции могут составляться в виде единичных лекарственных форм, каждая форма содержит от около 5 до около 1000 мг (1 г), более часто от около 100 до около 500 мг активного ингредиента. Термин"единичная лекарственная форма" относится к физически отдельной единице, пригодной в качестве однократной дозировки для организма человека или других млекопитающих, каждая единица содержит предварительно установленное количество активного материала, рассчитанное для обеспечения желаемого терапевтического эффекта, в сочетании с пригодным фармацевтическим носителем. В некоторых вариантах композиции настоящего изобретения содержат от около 5 до около 50 мг активного ингредиента. Специалисту в данной области понятно, что соединения или композиции этих вариантов содержат от около 5 до около 10 мг, от около 10 до около 15 мг, от около 15 до около 20 мг, от около 20 до около 25 мг, от около 25 до около 30 мг, от около 30 до около 35 мг, от около 35 до около 40 мг, от около 40 до около 45 мг или от около 45 до около 50 мг активного ингредиента. В некоторых вариантах композиции настоящего изобретения содержат от около 50 до около 500 мг активного ингредиента. Специалисту в данной области понятно, что соединения или композиции этих вариантов содержат от около 50 до около 100 мг, от около 100 до около 150 мг, от около 150 до около 200 мг, от около 200 до около 250 мг, от около 250 до около 300 мг, от около 350 до около 400 мг или от около 450 до около 500 мг активного ингредиента. В некоторых вариантах композиции настоящего изобретения содержат от около 500 до около 1000 мг активного ингредиента. Специалисту в данной области понятно, что соединения или композиции этих вариантов содержат от около 500 до около 550 мг, от около 550 до около 600 мг, от около 600 до около 650 мг, от около 650 до около 700 мг, от около 700 до около 750 мг, от около 750 до около 800 мг, от около 800 до около 850 мг, от около 850 до около 900 мг или от около 900 до около 950 мг или от около 950 до около 1000 мг активного ингредиента. Активное соединение может быть эффективным в широком диапазоне дозировок и обычно вводится в фармацевтически эффективном количестве. Однако следует понимать, что фактическое количество вводимого соединения обычно определяется врачом в соответствии с существующими обстоятельствами, включая состояние, подлежащее лечению, выбранный способ введения, фактически вводимое соединение, возраст, вес и реакцию конкретного пациента, серьезность симптомов пациента и т.п. Для получения твердых композиций, таких как таблетки, основной активный ингредиент смешивается с фармацевтическим носителем для получения предварительно составленной твердой композиции,содержащей гомогенную смесь соединения настоящего изобретения. При упоминании таких предварительно составленных гомогенных композиций активный ингредиент обычно равномерно диспергируется по всей композиции, так что эту композицию можно легко разделить на равные эффективные единичные лекарственные формы, такие как таблетки, пилюли и капсулы. Такие твердые предварительно составленные композиции затем делятся на единичные лекарственные формы описанных выше типов, содержащие, например, от около 0,1 до около 1000 мг активного ингредиента настоящего изобретения. Таблетки или пилюли настоящего изобретения могут быть покрыты или компаундированы другим способом для получения лекарственной формы, дающей возможность получать пролонгированное действие. Например, таблетки или пилюли могут включать внутренний или внешний лекарственный компонент, при этом последний в форме оболочки вокруг формообразующего агента. Эти два компонента могут быть разделены энтеральным слоем, который служит для предотвращения разрушения в желудке и прохождения неповрежденного внутреннего компонента в двенадцатиперстную кишку или для замедления его высвобождения. Для таких энтеральных слоев или покрытий могут использоваться различные материалы, включая ряд полимерных кислот и смесей полимерных кислот с такими материалами, как шеллак, цетиловый спирт и ацетат целлюлозы. Жидкие формы, в которых соединения и композиции могут использоваться для перорального или инъекционного введения, включают водные растворы, пригодные ароматизированные сиропы, водные или масляные суспензии и ароматизированные эмульсии со съедобными маслами, такими как хлопоковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и аналогичные фармацевтические среды. Композиции для ингаляции или инсуффляции включают растворы и суспензии в фармацевтически приемлемых водных или органических растворителях или их смесях и порошки. Жидкие или твердые композиции могут содержать подходящие фармацевтически приемлемые носители, как описано ранее. В некоторых вариантах композиции вводятся пероральным или назальным респираторным путем для местного или системного эффекта. Композиции могут распыляться при помощи инертных газов. Распыленные растворы могут вдыхаться непосредственно из распыляющего устройства, или распылительное устройство может подключаться к маске для лица, тенту или дыхательному аппарату избыточного давления периодического действия. Композиции в растворах, суспензиях или порошках могут вводиться перорально или назально через устройства, которые обеспечивают доставку композиции соответствующим образом.- 18021478 Количество соединения или композиции, вводимое пациенту, варьируется в зависимости от того,что именно вводится, цели введения, такой как профилактика или терапия, состояния пациента, способа введения и т.п. В терапевтических применениях соединения могут вводиться пациенту, страдающему заболеванием, в количестве, эффективном для лечения или, по меньшей мере, частичного прекращения симптомов заболевания и его осложнений. Эффективные дозы зависят от состояния заболевания, подлежащего лечению, а также от решения лечащего врача в зависимости от таких факторов, как серьезность заболевания, возраст, вес, общее состояние пациента и т.п. Вводимые пациенту композиции могут быть в форме фармацевтических композиций, описанных выше. Эти композиции могут быть стерилизованы обычными способами стерилизации или могут быть стерилизованы фильтрованием. Водные растворы могут быть упакованы для использования в исходном или лиофилизованном виде, лиофилизованный препарат объединяется со стерильным водным носителем перед введением. рН препаратов соединений настоящего изобретения составляет обычно от 3 до 11, более предпочтительно от 5 до 9 и более предпочтительно от 7 до 8. Следует понимать, что использование определенных вышеупомянутых носителей, наполнителей или стабилизаторов приведет к образованию фармацевтических солей. Терапевтическая дозировка соединений может варьироваться в соответствии, например, с использованием для лечения определенного заболевания, способом введения соединения, здоровьем и состоянием пациента и решением лечащего врача. Пропорция или концентрация соединения в фармацевтической композиции может варьировать в зависимости от ряда факторов, включая дозировку, химические свойства (например, гидрофобность) и способ введения. Например, соединения могут быть представлены в виде водного физиологического буферного раствора, содержащего от около 0,1 до около 10 вес./об.% соединения для парентерального введения. Некоторые стандартные уровни дозировок составляют от около 1 мкг/кг до около 1 г/кг веса тела в день. В некоторых вариантах уровень дозировки составляет от около 0,01 до около 100 мг/кг веса тела в день. Дозировка, вероятно, зависит от таких переменных, как тип и степень прогрессии заболевания или нарушения, общее состояние здоровья конкретного пациента, относительная биологическая эффективность выбранного соединения, состав носителя и способ введения. Эффективные дозировки могут экстраполироваться по кривым зависимости реакции от дозировки, полученных из испытательных систем in vitro или моделей на животных. Композиции настоящего изобретения могут дополнительно включать один или более дополнительных фармацевтических агентов, таких как химиотерапевтические, стероидные, противовоспалительные соединения или иммунодепрессанты, примеры которых перечислены выше в настоящем документе. В некоторых вариантах соединение или его фармацевтически приемлемая соль вводится в виде офтальмической композиции. Соответственно, в некоторых вариантах способы включают введение соединения или его фармацевтически приемлемой соли и офтальмически приемлемого носителя. В некоторых вариантах офтальмическая композиция является жидкой композицией, полутвердой композицией, вставкой, пленкой, микрочастицами или наночастицами. В некоторых вариантах офтальмическая композиция является жидкой композицией. В некоторых вариантах офтальмическая композиция является полутвердой композицией. В некоторых вариантах офтальмическая композиция является композицией местного применения. Композиции местного применения включают, но не ограничиваясь этим, жидкие и полутвердые композиции. В некоторых вариантах офтальмическая композиция является композицией местного применения. В некоторых вариантах композиции местного применения включают водный раствор, водную суспензию, мазь или гель. В некоторых вариантах офтальмическая композиция наносится локально на переднюю часть глаза, под верхнее веко, на нижнее веко и в слепой мешок. В некоторых вариантах офтальмическая композиция является стерилизованной. Стерилизация может быть осуществлена известными способами, такими как стерилизующая фильтрация раствора или путем нагревания раствора в ампуле, готовой к применению. Офтальмические композиции настоящего изобретения могут дополнительно включать фармацевтические формообразующие средства, пригодные для составления офтальмических композиций. Примерами таких формообразующих средств являются консервирующие средства, буферные агенты, хелатирующие агенты, антиокислители и соли для регулирования осмотического давления. При использовании в настоящем документе термин "офтальмически приемлемый носитель" относится к любому материалу, который может содержать и высвобождать соединение настоящего изобретения или его фармацевтически приемлемую соль и который совместим с глазами. В некоторых вариантах офтальмически приемлемый носитель является водой или водным раствором или суспензией, но также включает масла, такие как масла, используемые для получения мазей, и полимерные матрицы, такие как матрицы, используемые в глазных вставках. В некоторых вариантах композиция может быть водной суспензией, включающей соединение настоящего изобретения или его фармацевтически приемлемую соль. Жидкие офтальмические композиции, включая мази и суспензии, могут иметь соответствующую вязкость для выбранного способа введения. В некоторых вариантах офтальмическая композиция имеет вязкость в диапазоне от около 1000 до около 30000 сП. В некоторых вариантах офтальмическая композиция может дополнительно включать одно или более из поверхностно-активных веществ, адъювантов, буферов, антиоксидантов, регуляторов тонуса, кон- 19021478 сервантов (например, ЭДТА, БАХ (бензалкония хлорид), хлорит натрия, перборат натрия, поликватериум-1), загустителей или модификаторов вязкости (например, карбоксиметилцеллюлоза, гидроксиметилцеллюлоза, поливиниловый спирт, полиэтиленгликоль, гликоль 400, пропиленгликоль гидроксиметилцеллюлоза, гидроксипропил-гуар, гиалуроновая кислота и гидроксипропилцеллюлоза) и т.п. Добавки в композиции могут включать, но не ограничиваясь этим, хлорид натрия, бикарбонат натрия, сорбиновую кислоту, метилпарабен, пропилпарабен, хлоргексидин, касторовое масло и перборат натрия. Водные офтальмические композиции (растворы или суспензии) обычно не содержат физиологически или офтальмически вредных компонентов. В некоторых вариантах в композиции используется очищенная или деионизированная вода. рН может быть отрегулирован добавлением любых физиологически и офтальмически приемлемых регулирующих рН кислот, оснований или буферов в диапазоне от около 5,0 до 8,5. Офтальмически приемлемые примеры кислот включают уксусную, борную, лимонную, молочную, фосфорную, хлороводородную и т.п., а примеры оснований включают гидроксид натрия, фосфат натрия, борат натрия, цитрат натрия, ацетат натрия, лактат натрия, трометамин, трисгидроксиметиламинометан и т.п. Соли и буферы включают цитрат/декстрозу, бикарбонат натрия, хлорид аммония и смеси вышеупомянутых кислот и оснований. В некоторых вариантах способы включают образование или доставку депо терапевтического средства в контакте с внешней поверхностью глаза. Депо означает источник терапевтического средства, которое медленно выводится со слезами или другим механизмом очистки глаз. Это обеспечивает присутствие непрерывной, устойчивой концентрации терапевтического средства в жидкости на внешней поверхности глаза при однократном применении. Не ограничиваясь пределами какой-либо теории, предполагается, что абсорбция и проникновение может зависить как от концентрации растворенного лекарства, так и от продолжительности контакта внешней ткани с жидкостью, содержащей лекарство. По мере удаления лекарства при очистке глазной жидкости и/или абсорбции внутрь глазной ткани из депо в пополненное количество глазной жидкости выделяется дополнительное количество лекарства, например растворенного. Соответственно, использование депо может проще способствовать пополнению глазной ткани более нерастворимыми терапевтическими средствами. В некоторых вариантах депо может сохраняться до восьми часов или более. В некоторых вариантах офтальмическое депо образует, включая и не ограничиваясь этим, водные полимерные суспензиии, мази и твердые вставки. В некоторых вариантах офтальмическая композиция является мазью или гелем. В некоторых вариантах офтальмическая композиция является средством доставки на основе масла. В некоторых вариантах композиция включает нефтяную или ланолиновую основу, к которой добавлен активный компонент,обычно в количестве 0,1-2%, и формообразующие средства. Обычные основы могут включать, но не ограничиваясь этим, минеральное масло, петролатум и их комбинации. В некоторых вариантах мазь наносится в виде ленты на нижнее веко. В некоторых вариантах офтальмическая композиция является офтальмической вставкой. В некоторых вариантах офтальмическая вставка является биологически инертной, мягкой, биоразлагаемой, вязкоэластичной, устойчивой к стерилизации после воздействия терапевтических средств, устойчивой к инфекциям от находящихся в воздухе бактерий, биоразлагаемой, биосовместимой и/или вязкоэластичной. В некоторых вариантах вставка включает офтальмически приемлемую матрицу, например полимерную матрицу. Матрица обычно является полимером, а терапевтическое средство обычно диспергировано в нем или связано с полимерной матрицей. В некоторых вариантах терапевтическое средство может медленно высвобождаться из матрицы путем растворения или гидролиза ковалентной связи. В некоторых вариантах полимер является биоразлагаемым (растворимым), и скорость его растворения может регулировать скорость высвобождения терапевтического средства, диспергированного в нем. В другой форме полимерная матрица является биоразлагаемым полимером, который разрушается, например, гидролизом,высвобождая, таким образом, терапевтическое средство, связанное с ним, или диспергированное в нем. В дополнительных вариантах матрица и терапевтическое средство могут быть заключены в дополнительную полимерную оболочку для дополнительного регулирования высвобождения. В некоторых вариантах вставка включает биоразлагаемый полимер, такой как поликапролактон (PCL), этилен/винилацетатный сополимер (EVA), полиалкил цианоакрилат, полиуретан, нейлон или поли(dl-лактид-со-гликолид)(PLGA) или их сополимеры. В некоторых вариантах терапевтическое средство диспергировано в материале матрицы или диспергировано в композиции мономеров, используемых для получения материала матрицы перед полимеризацией. В некоторых вариантах количество терапевтического средства составляет от около 0,1 до около 50%, или от около 2 до около 20%. В дополнительных вариантах используется биоразлагаемая или биоразрушаемая полимерная матрица, чтобы отработавшую вставку не нужно было удалять. По мере разрушения или растворения биоразлагаемого или биоразрушаемого полимера высвобождается терапевтическое средство. В дополнительных вариантах офтальмическая вставка включает, но не ограничиваясь этим, полимеры, описанные в публикации Wagh, et al., "Polymers used in ocular dosage form and drug deliverysystems", Asian J. Pharm., стр. 12-17 (январь 2008 г.), которая включена в настоящую заявку путем ссылки в полном объеме. В некоторых вариантах вставка включает полимер, выбранный из поливинилпирролидона (ПВП), полимера или сополимера акрилата или метакрилата (например, семейство полимеров Eu- 20021478dragit компании Rohm или Degussa), гидроксиметилцеллюлозы, полиакриловой кислоты, поли(амидоамин) дендримеров, полидиметилсилоксана, полиэтиленоксида, поли(лактид-со-гликолида),поли(2-гидроксиэтилметакрилата), поливинилового спирта или поли(пропиленфумарата). В некоторых вариантах вставка включает Gelfoam R. В некоторых вариантах вставка является полиакриловой кислотой конъюгата цистеина 450 кДа. В некоторых вариантах офтальмическая композиция является офтальмической пленкой. Полимеры,пригодные для таких пленок, включают, но не ограничиваясь этим, полимеры, описанные в публикацииWagh, et al. (ibid). В некоторых вариантах пленка является мягкой контактной линзой, такой как линзы,сделанные из сополимеров N,N-диэтилакриламида и метакриловой кислоты, сшитой с диметилакрилатом этиленгликоля. В некоторых вариантах офтальмическая композиция включает микросферы или наночастицы. В некоторых вариантах микросферы включают желатин. В некоторых вариантах эти микросферы введены инъекцией в задний сегмент глаза, в хороидальное пространство, в склеру, в стекловидное тело или под сетчатку. В некоторых вариантах микросферы или наночастицы включают полимер, включая, но не ограничиваясь этим, полимеры, описанные в публикации Wagh, et al. (ibid), которая включена в настоящую заявку путем ссылки в полном объеме. В некоторых вариантах полимер является хитозаном, поликарбоновой кислотой, такой как полиакриловая кислота, частицами альбумина, сложными эфирами гиалуроновой кислоты, полиитаконовой кислотой, поли(бутил)цианоакрилатом, поликарпролактоном, поли(изобутил)капролактоном, полимолочной кислотой, сополимеризованной с гликолевой кислотой или полимолочной кислотой. В некоторых вариантах микросферы или наночастицы включают твердые липидные частицы. В некоторых вариантах офтальмическая композиция включает ионообменную смолу. В некоторых вариантах ионообменная смола является неорганическим цеолитом или синтетической органической смолой. В некоторых вариантах ионообменные смолы включают, но не ограничиваясь этим, смолы, описанные в публикации Wagh, et al. (ibid), которая включена в настоящую заявку путем ссылки в полном объеме. В некоторых вариантах ионообменная смола является частично нейтрализованной полиакриловой кислотой. В некоторых вариантах офтальмическая композиция является водной полимерной суспензией. В некоторых вариантах терапевтическое средство или полимерный суспендирующий агент является суспендированным в водной среде. В некоторых вариантах водная полимерная суспензия может быть составлена так, чтобы сохранять такую же или преимущественно такую же вязкость в глазу, которую она имела до введения в глаз. В некоторых вариантах они могут быть составлены так, чтобы при контакте со слезной жидкостью увеличивалось гелеобразование. Меченные соединения и способы анализа. Другой аспект настоящего изобретения относится к меченым вариантам некоторых соединений,описанных в настоящем документе (с радиоактивной меткой, с флуоресцентной меткой и т.п.), которые могут быть полезны не только для средств формирования изображения, но также и в анализах как invitro, так и in vivo, для локализации и количественной оценки JAK в образцах тканей, включая ткани человека, а также для определения лигандов JAK путем ингибирования связывания меченых соединений. Соответственно, настоящее изобретение включает образцы JAK, которые содержат такие меченые соединения. Настоящее изобретение дополнительно включает меченные изотопами соединения. "Меченное изотопом" или соединение "с радиоактивной меткой" является соединением, описанным в настоящем документе, где один или более атомов замещены или заменены атомом, имеющим атомную массу или массовое число, отличное от атомной массы или массового числа, обычно встречающегося в природе (например, природного). Пригодные радионуклиды, которые могут встраиваться в соединения, описанные в настоящем документе, включают, не ограничиваясь этим, 2 Н (также записывается как D для дейтерия),3 Н (также записывается как Т для трития), 11 С, 13 С, 14 С, 13N, 15N, 15O, 17O,18O,18F, 35S, 36Cl, 82Br, 75Br, 76Br,77Br, 123I, 124I, 125I и 131I. Радионуклиды, которые встраиваются в соединения с радиоактивной меткой, зависят от конкретного применения этого соединения с радиоактивной меткой. Например, для меченых и конкурирующих анализов металлопротеазы in vitro обычно более пригодны соединения, содержащие 3 Н,14 С, 82Br, 125I, 131I,35S. Для получения радиоизображения обычно более пригодны 11 С, 18F, l25I, 123I, 124I,l31 75I, Br, 76Br или 77Br. Следует понимать, что "меченое соединение" или соединение "с радиоактивной меткой" является соединением, содержащим по меньшей мере один радионуклид. В некоторых вариантах радионуклид выбран из группы, состоящей из 3 Н, 14 С, 125I,35S и 82Br. Настоящее изобретение может дополнительно включать способы синтеза для внедрения радиоизотопов в соединения, описанные в настоящем документе. Способы синтеза для внедрения радиоизотопов в органические соединения хорошо известны в данной области, и специалист в данной области легко установит способы, применимые для соединений, описанных в настоящем документе. Меченые соединения настоящего изобретения могут использоваться в скрининговых исследовани- 21021478 ях для идентификации/оценки соединений. Например, недавно синтезированное или идентифицированное меченое соединение (например, тестовое соединение), может быть оценено на его способность связывать JAK путем мониторинга изменения его концентрации при взаимодействии с JAK за счет отслеживания метки. Например, тестовое соединение (меченое) может быть оценено на его способность снижать связывание другого соединения, связывающего JAK (например, обычное соединение). Соответственно, способность тестового соединения конкурировать с обычным соединением за связывание с JAK прямо коррелирует с его связывающей способностью. И наоборот, в некоторых других скрининговых исследованиях стандартное соединение является меченым, а тестовое соединение не имеет метки. Соответственно, контролируется концентрация меченого стандартного соединения для оценки конкуренции между стандартным соединением и тестовым соединением, таким образом устанавливается относительная связывающая способность тестового соединения. Наборы. Настоящее изобретение включает также фармацевтические наборы, пригодные, например, для лечения или предотвращения заболеваний или нарушений, связанных с JAK, таких как рак, которые включают одну или более упаковок, содержащих фармацевтическую композицию, включающую терапевтически эффективное количество активного соединения. Такие наборы могут дополнительно включать, при необходимости, один или более различных компонентов обычных фармацевтических наборов, таких как,например, контейнеры для одного или более фармацевтически приемлемого носителя, дополнительные емкости и т.п., что очевидно для специалиста в данной области. Также в состав набора могут входить инструкции как в виде вкладышей, так и в виде этикеток, показывающие количество компонентов, подлежащих введению, инструкции по введению и/или инструкции по смешиванию компонентов. Настоящее изобретение будет более подробно описано на конкретных примерах. Следующие примеры служат для целей наглядности и никоим образом не ограничивают настоящее изобретение. Специалисту в данной области понятны различные некритичные параметры, которые могут быть изменены или модифицированы для получения практически таких же результатов. Примеры Пример 1. (R)-3-циклопентил-3-[4-(2-гидрокси-5-оксо-6,7-дигидро-5 Н-пирроло[2,3-d]пиримидин-4 ил)-1H-пиразол-1-ил]пропаннитрил(0,824 г, 2,61 ммоль, полученный так, как описано в публикации Org. Lett., 2009, 11(9), 1999-2002), растворили в 1,4-диоксане (4 мл) и добавили карбонат калия (0,903 г, 6,54 ммоль) в воде (2 мл). Смесь дегазировали и добавили тетракис(трифенилфосфин)палладий(0) (0,126 г, 0,109 ммоль). Реакционную смесь нагревали до 100 С в течение 16 ч. Реакционную смесь разделили между водой и этилацетатом. Водный слой экстрагировали этилацетатом три раза. Объединенные экстракты высушили над сульфатом натрия,декантировали и концентрировали. Использовали колоночную флэш-хроматографию, элюируя градиентом от 0-10% МеОН в метиленхлориде для очистки продукта (670 мг, 91%). 1 Н ЯМР (300 МГц, CD3OD):8.59 (s, 1 Н), 8.35 (s, 1H), 7.24 (d, 1H), 6.81 (d, 1H), 4.47 (dt, 1H), 4.04 (s,3H), 3.21 (dd, 1H), 3.10 (dd, 1H), 2.62-2.44 (m, 1H), 2.02-1.86 (m, 1H), 1.81-1.20 (m, 7H); LCMS (M+H)+: 337.0. К раствору 3-циклопентил-3-[4-(2-метокси-7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1 ил]пропаннитрила (0,532 г, 1,58 ммоль) в тетрагидрофуране (20 мл) добавили N-йодсукцинимид (0,36 г,1,6 ммоль). Реакционную смесь перемешивали в течение 30 мин и удалили растворитель in vacuo. Остаток очистили колоночной флэш-хроматографией, элюируя градиентом от 0-65% этилацетата в гексанах для получения твердого желтого вещества (250 мг, 34%). 1 Н ЯМР (300 МГц, CDCl3):10.31 (br s, 1H), 8.27 (s, 1H), 8.23 (s, 1H), 7.29 (s, 1H), 4.34-4.21 (m, 1H),4.06 (s, 3H), 3.14 (dd, 1H), 3.03-2.90 (m, 1H), 2.66-2.49 (m, 1H), 2.02-1.17 (m, 8H); LCMS (M+H)+: 463.0. Этап 3. (R)-4-[1-(2-циано-1-циклопентилэтил)-1 Н-пиразол-4-ил]-2-метокси-7 Н-пирроло[2,3-d]пиримидин-5-ил ацетат Раствор 3-циклопентил-3-[4-(5-йодо-2-метокси-7 Н-пирроло[2,3-d]пиримидин-4-ил)-1H-пиразол-1 ил]пропаннитрила (0,25 г, 0,54 ммоль) в уксусной кислоте (3 мл) обработали ацетатом серебра (0,27 г, 1,6 ммоль) и нагревали до 70 С в течение 16 ч. Смесь отфильтровали, промыли MeCN, к фильтрату добавили воду и перемешивали эту смесь в течение 20 мин. К этому раствору добавили твердый хлорид натрия. Продукт получили экстрацией этой водной смеси тремя порциями этилацетата. Объединенные экстракты высушили над сульфатом натрия, декантировали и концентрировали. Часть продукта использовали на этапе гидролиза (этап 4) без дополнительной очистки. 1 Н ЯМР (300 МГц, CDCl3):9.87 (br s, 1H), 8.39 (s,1H), 8.37 (s, 1H), 7.33 (s, 1H), 4.22 (dt, 1H), 4.06 4 М раствор HBr в уксусной кислоте (2 мл, 8 ммоль) добавили к 4-[1-(2-циано-1-циклопентилэтил)1 Н-пиразол-4-ил]-2-метокси-7 Н-пирроло[2,3-d]пиримидин-5-ил ацетату (0,050 г, 0,13 ммоль), и перемешивали реакционную смесь в течение 1 ч. Летучие вещества удалили in vacuo. Остаток восстановили и использовали препаративную ВЭЖХ-МС (элюируя градиентом MeCN/Н 2 О, содержащим 0,15% NH4OH) для получения очищенного продукта (12 мг, 26%). 1 Н ЯМР (500 МГц, d6-DMSO):9.20 (s, 1 Н), 8.69 (s, 1H), 7.34 (s, 1H), 6.75 (s, 1H), 4.49 (dt, 1H), 3.89(s, 2H), 2.80 (dd, 1H), 2.64 (dd, 1H), 2.36-2.26 (m, 1H), 1.83-1.74 (m, 1H), 1.63-1.36 (m, 4H), 1.32-1.20 (m,2H), 1.15-1.05 (m, 1H); LCMS (M+H)+: 357.0. Этап 5. (R)-3-циклопентил-3-[4-(2-гидрокси-5-оксо-6,7-дигидро-5 Н-пирроло[2,3-d]пиримидин-4- 23021478 ил)-1 Н-пиразол-1-ил]пропаннитрил. К раствору 3-циклопентил-3-[4-(2-гидрокси-5-оксо-6,7-дигидро-5 Н-пирроло[2,3-d]пиримидин-4 ил)-1 Н-пиразол-1-ил]пропанамида (0,006 г, 0,02 ммоль) в метиленхлориде (0,5 мл), содержащему триэтиламин (20 мкл, 0,2 ммоль), добавили трихлорацетилхлорид (20 мкл, 0,2 ммоль). После завершения реакции использовали препаративную ВЭЖХ-МС (MeCN/Н 2 О, содержащий 0,15% NH4OH) для получения очищенного продукта (3 мг, 52%). 1 Н ЯМР (400 МГц, d6-DMSO):11.39 (br s, 1H), 9.37 (s, 1H), 8.77 (s, 1H), 8.63 (s, 1H), 4.68-4.59 (m,1H), 3.94 (s, 2H), 3.19-3.15 (m, 2H), 2.42-2.30 (m, 1H), 1.86-1.75 (m, 1H), 1.69-1.20 (m, 6H), 1.18-1.05 (m,1H); LCMS (M+H)+: 339.1. Пример 2. (3R)- и (3S)-3-[(1R,2R)-2-гидроксициклопентил]-3-[4-(7 Н-пирроло[2,3-d]пиримидин-4 ил)-1H-пиразол-1-ил]пропаннитрил и (3R)- и (3S)-3-[(1S,2S)-2-гидроксициклопентил]-3-[4-(7 Нпирроло[2,3-d]пиримидин-4-ил)-1H-пиразол-1-ил]пропаннитрил К раствору трет-бутилдиметилсилил хлорида (0,524 г, 3,48 ммоль) и 1 Н-имидазола (0,473 г, 6,95 ммоль) в N,N-диметилформамиде (15 мл) добавили этил цис-2-гидрокси-1-циклопентанкарбоксилат (рацемический, Acros) (0,50 г, 0,0032 моль). Реакционную смесь перемешивали в течение 16 ч. Дополнительно добавили частями имидазол (0,40 г, 5,8 ммоль) и трет-бутилдиметилсилил хлорид (0,50 г, 3,3 ммоль) и перемешивали реакционную смесь еще 24 ч. Продукт экстрагировали гексаном. Экстракты промыли водой, высушили над сульфатом натрия, отфильтровали и выпарили для получения рацемического TBS-защищенного гидроксиэфира (0,9 г), который использовали без дополнительной очистки. 1 Н ЯМР (400 МГц, CDCl3):4.46 (ddd, 1 Н), 4.19 (dq, 1H), 4.01 (dq, 1H), 2.72 (dt, 1H), 2.22-2.11 (m,1H), 1.96-1.49 (m, 5H), 1.26 (t, 3H), 0.84 (s, 9H), 0.03 (s, 3H), 0.01 (s, 3H). Этап 2. (1S,2R-2-(трет-бутилдиметилсилилокси)циклопентанкарбальдегид и (1R,2S)-2-(третбутилдиметилсилилокси)циклопентанкарбальдегид К раствору (1S,2R)-этил 2-(трет-бутилдиметилсилилокси)циклопентанкарбоксилата и (1R,2S)-этил 2-(трет-бутилдиметилсилилокси)циклопентанкарбоксилата из этапа 1 (0,86 г, 3,2 ммоль) в гексанах (40 мл) при -78 С по каплям добавили раствор 1,0 М диизобутилалюминия гидрида в толуоле (3,5 мл, 3,5 ммоль). Реакционную смесь перемешивали в течение 1 ч при -78 С и погасили при этой температуре покапельным добавлением метанола (2 мл). Охлаждение прервали, а смесь оставили нагреваться до ком- 24021478 натной температуры. Добавили водный раствор соли Рошель. Двухфазную смесь энергично перемешивали в течение 2 ч и разделили полученные слои. Водный слой экстрагировали один раз дополнительным количеством гексанов, затем тремя порциями этилацетата. Объединенные экстракты промыли насыщенным солевым раствором, высушили над сульфатом натрия, декантировали и концентрировали для получения рацемического альдегидного продукта, который использовали без дополнительной очистки (0,7 г,97%). 1 Н ЯМР (400 МГц, CDCl3):9.74 (d, 1H), 4.62 (ddd, 1H), 2.68-2.61 (m, 1H), 2.22-2.11 (m,1H), 1.951.83 (m, 1H), 1.80-1.57 (m, 4H), 0.85 (s, 9H), 0.05 (s, 3H), 0.04 (s, 3H). Этап 3. (E)- и (Z)-3-1R,2R)-2-(трет-бутилдиметилсилилокси)циклопентил)акрилонитрил и (E)- и К раствору (1S,2R)-2-(трет-бутилдиметилсилилокси)циклопентанкарбальдегида и (1R,2S)-2-(третбутилдиметилсилилокси)циклопентанкарбальдегида (0,36 г, 1,6 ммоль, из этапа 2) в толуоле (9 мл) добавили (трифенилфосфоранилиден)ацетонитрил (0,475 г, 1,58 ммоль) и нагревали реакционную смесь до 80 С в течение 2 ч. Реакционную смесь охладили до комнатной температуры и добавили воду. Продукт экстрагировали тремя порциями этилового эфира. Экстракты промыли насыщенным солевым раствором,высушили над сульфатом натрия, декантировали и концентрировали для получения рацемической смеси Е- и Z-олефиновых изомеров, которую использовали без дополнительной очистки. 1 Н ЯМР (400 МГц, CDCl3):6.82 (dd, 1 Н, trans olefin), 6.63 (dd, 1H, cis olefin), 5.307 (dd, 1H, trans(E)- и (Z)-3-1S,2S)-2-(трет-бутилдиметилсилилокси)циклопентил)акрилонитрила (0,40 г, 1,6 ммоль, неочищенный продукт из этапа 3) в ацетонитриле (20 мл) добавили 4-(1 Н-пиразол-4-ил)-7-[2(триметилсилил)этокси]метил-7 Н-пирроло[2,3-d]пиримидин (0,50 г, 1,6 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU, 0,24 мл, 1,6 ммоль). Реакционную смесь перемешивали в течение 2 ч при комнатной температуре и добавили дополнительное количество DBU (0,24 мл, 1,6 ммоль). Реакционную смесь перемешивали в течение 3 дней и концентрировали. Использовали колоночную флэшхроматографию (элюируя градиентом от 10-40% этилацетат/гексаны) для очистки продукта, который затем обработали 20% ТФК в ДХМ в течение 3 ч, выпарили и обработали избытком раствора этилендиамина в метаноле в течение ночи. После завершения удаления защитной группы SEM оставшиеся TBSзащищенные группы удалили перемешиванием с EtOH/Н 2 О/к.HCl в течение 3 ч (объемное отношение 10:4:3). Продукт с полностью снятой защитой очистили препаративной ВЭЖХ-МС (0,15% NH4OH в градиенте MeCN/Н 2 О). Все фракции М+Н=323 объединили и выпарили (около 80 мг). Продукты подвергли серии хиральных хроматографических очисток следующим образом: колонка Chiralcel компании ChiralTechnologies OJ-H (325 см, 5 мкм), элюируя 20% EtOH/80% гексаны при скорости потока 25 мл/мин,для получения пика 1 (19 мг), следующий неосновной пик не собирали; пик 2 (60 мг), пик 3 (6 мг). Пик 2 являлся смесью, которую затем дополнительно разделили, используя колонку Chiralpak Chiral Technologies IA (225 см, 5 мкм), элюируя градиентом 70% EtOH/30% гексаны при скорости потока 8 мл/мин, на три компонента. Их обозначили пик 2-1 (прогон 2, пик 1, 32 мг), который являлся смесью продуктов, пик 22 (6,5 мг) и пик 2-3 (13,7 мг). Пик 2-1 дополнительно разделили на три компонента, используя колонку Chiralpak IA Chiral Technologies (225 см, 5 мкм), элюируя градиентом 25% EtOH/75% гексаны при скорости потока 12 мл/мин. Выделенные продукты обозначили пик 2-1-1 (10,5 мг); 2-1-2 (13 мг) и 2-1-3 (2,3 мг). Реакцию выполнили по такому же способу, как описано в публикации Tetrahedron, 50(9), 2821-30; 1994. К раствору 1-[(триметилсилил)окси]циклопентанкарбонитрила (2,25 г, 12,3 ммоль, полученному так, как описано в публикации Organometallics, 3(11), 1660-5; 1984) в толуоле (18 мл) при -45 С добавили по каплям 1,0 М раствор диизобутилалюминия гидрида в гексане (17,2 мл, 17,2 ммоль). Раствор затем оставили нагреваться до 0 С и перемешивали в течение 1 ч при этой температуре. Реакционную смесь вылили в смесь диэтилового эфира (25 мл) и хлорида аммония (25 мл, насыщенный). К полученной смеси при 15 С добавили разбавленный раствор серной кислоты (полученный разбавлением 1,53 мл концентрированной H2SO4 в 50 мл воды). Затем раствор перемешивали при температуре 5 С в течение ночи. Смесь экстрагировали тремя частями диэтилового эфира, объединенные экстракты промыли насыщенным солевым раствором, высушили над сульфатом натрия, декантировали и концентрировали для получения продукта (0,84 г, 36%), который использовали без дополнительной очистки на этапе 2. 1 Н ЯМР (300 МГц, CDCl3):9.47 (s, 1 Н), 1.88-1.46 (m, 8H), 0.00 (s, 9H). Этап 2. (2 Е)- и (2Z)-3-1-[(триметилсилил)окси]циклопентилакрилонитрил Диэтил цианометилфосфонат (0,912 мл, 5,64 ммоль) добавили по каплям к суспензии гидрида натрия (0,198 г, 4,96 ммоль) в тетрагидрофуране (10 мл) при 0 С. После добавления реакционную смесь нагрели до комнатной температуры и перемешивали в течение 45 мин. Смесь повторно охладили до 0 С и ввели 1-[(триметилсилил)окси]циклопентанкарбальдегид (0,84 г, 4,5 ммоль) в тетрагидрофуране (20 мл). Реакционную смесь оставили нагреваться до комнатной температуры и перемешивали в течение 2 ч. В реакционную смесь добавили этилацетат и воду и разделили слои. Водный слой экстрагировали двумя- 26021478 порциями этилацетата. Объединенные органические экстракты промыли насыщенным солевым раствором, высушили над сульфатом натрия, декантировали и концентрировали для получения продукта в виде смеси олефиновых изомеров, которую использовали без дополнительной очистки на этапе 3. 1 Н ЯМР (300 МГц, CDCl3):6.80 (d, 1H, транс/основной продукт), 6.53 (d, 1H, цис/неосновной продукт), 5.52 (d, 1H, транс), 5.28 (d, 1H, цис), 2.06-0.76 (m, 16H общий для обоих изомеров), 0.18 (s, 9H, неосновной продукт), 0.13 (s, 9H, основной продукт). Этап 3. Рацемический 3-(1-гидроксициклопентил)-3-(4-(7-2-(триметилсилил)этокси)метил)-7 Нпирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)пропаннитрил К суспензии (2 Е)- и (2Z)-3-1-[(триметилсилил)окси]циклопентилакрилонитрила (0,94 г, 4,5 ммоль) и 4-(1 Н-пиразол-4-ил)-7-[2-(триметилсилил)этокси]метил-7 Н-пирроло[2,3-d]пиримидина (1,4 г,4,5 ммоль) в ацетонитриле (20 мл) добавили 1,8-диазабицикло[5.4.0]ундец-7-ен (0,67 мл, 4,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 6 дней. Ацетонитрил выпарили. Заданный незащищенный спиртовый продукт выделили из смеси незащищенного спирта и TMSзащищенного спиртового продукта, используя колоночную флэш-хроматографию, элюируя градиентом от 0-80% этилацетата в гексанах (890 мг, 44%). 1 Н ЯМР (300 МГц, CDCl3):8.87 (s, 1 Н), 8.56 (br s, 1H), 8.35 (s, 1H), 7.46 (d, 1H), 6.84 (d, 1H), 5.69(s, 2H), 4.40 (dd, 1H), 4.03 (s, 1H), 3.55 (dd, 2H), 3.46 (dd, 1H), 2.97 (dd, 1H), 2.04-1.27 (m, 8H), 0.93 (dd,2H), -0.05 (s, 9H); LCMS (M+H)+: 453.1. Этап 4. Рацемическая 3-(1-гидроксициклопентил)-3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Нпиразол-1-ил]пропаннитрила трифторуксусная соль. Раствор рацемического 3-(1-гидроксициклопентил)-3-[4-(7-[2-(триметилсилил)этокси]метил-7 Нпирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]пропаннитрила (0,100 г, 0,221 ммоль) в метиленхлориде (4 мл) и трифторуксусной кислоте (1 мл) перемешивали в течение 2 ч и выпарили растворители. Остаток перемешивали с этилендиамином (0,1 мл, 2 ммоль) в метаноле (4,5 мл) в течение 1 ч и выпарили. Неочищенный продукт восстановили в метаноле и очистили двумя последовательными хроматографическими этапами, используя препаративную ВЭЖХ-МС (элюируя градиентом ацетонитрил/Н 2 О, содержащим 0,15% NH4OH для первого прогона, а затем градиентом ацетонитрил/Н 2 О, содержащим 0,1% ТФК для второго прогона) для получения рацемического продукта в виде соли трифторуксусной кислоты. 1 Н ЯМР (400 МГц, d6-DMSO):12.72 (br s, 1H), 8.94 (s, 1H), 8.86 (s, 1H), 8.49 (s, 1H), 7.82 (s, 1H),7.21 (s, 1H), 4.80 (dd, 1H), 3.51 (dd, 1H), 3.22 (dd, 1H), 1.79-1.42 (m, 7H), 1.25-1.15 (m, 1H); LCMS (M+H)+: 323.1. Пример А. Метаболиты 1-39 выделили из мочи, плазмы или фекалий человека, крыс или собак после введения соединения I в связи с фармакокинетическими и токсикокинетическими исследованиями. Идентичность метаболитов была установлена после выделения метаболита с использованием методов ВЭЖХ. Использованные способы и соответствущее время удержания метаболитов представлены в табл. 2. Совокупность анализов МС/МС и экспериментов MSn более высоких порядков была выполнена так, как это необходимо для толкования структурной информации. Соединение I демонстрирует протонированный молекулярный ион при m/z 307, и спектр иона продукта показывает сигналы при m/z 266, 186 и 159. Ион фрагмента при m/z 266 согласуется с потерей карбонитрильной группы. Диагностический ион фрагмента при m/z 186 является показателем потери целой циклопентилпропаннитрильной группы. Ион фрагмента при m/z 159 показывает потерю циклопентилпропаннитрила в сочетании с расщеплением пиразольного кольца соединения I. Метаболитные соединения 1, 2, 27 и 29 наблюдались преимущественно в моче пациентов, являющихся людьми, со следовыми количествами соединений 27 и 29, наблюдаемых в плазме. Массспектроскопия полного сканирования показала протонированный молекулярный ион при m/z 399, что согласуется с бис-гидроксилированием соединения I. Фрагментация иона продукта этих m/z 399 дает практически идентичный спектр для этих метаболитов с ионами, наблюдаемыми при m/z 321, 186, 159 и 154. Ион при m/z 321 согласуется с потерей воды, и предполагается, что в циклопентиловом кольце может быть по меньшей мере одно гидроксилирование. Ионы при m/z 186 и m/z 159 согласуются с целым пиразол-пирролопиримидином. Ион при m/z 154 согласуется с нейтральной потерей целой немодифици- 27021478 рованной пиразол/пирролпиримидиновой группы. Ионы неосновных фрагментов при m/z 298 и m/z 280 предполагают потерю элементов ацетонитрила с легкой потерей воды или без такой потери, дополнительно ограничивая положение гидроксилирования в циклопентиловой группе. Это дополнительно подтверждается ионом при m/z 237, который согласуется с потерей модифицированного циклопентила, оставляя остальную часть молекулы немодифицированной. Соединение 31 было обнаружено в моче пациентов, являющихся людьми. Масс-спектроскопия полного сканирования показала протонированный молекулярный ион при m/z 399, что согласуется с добавлением 32 а.е.м. к соединению I. Ионная фрагментация продукта иона m/z 399 дает ионы фрагментов при m/z 311, 218 и 191. Первичный фрагмент при m/z 218 согласуется с добавлением 32 а.е.м. к пиразоло-пирролопиримидиновой группе. Ион фрагмента при m/z 191 согласуется с потерей CHN из пиразоловой группы предполагаемого бис-гидроксилированного пиразол-пирролопиримидина, ограничивая положение модификации(ий) у пирролопиримидина. Ион фрагмента при m/z 311 вероятно возникает из первоначального расщепления амидной связи с последующей потерей СО из пирролидинона. Структурное распределение соединения 31 с использованием только масс-спектроскопии привело к неоднозначному результату, поэтому соединение 31 выделили из мочи человека и проанализировали при помощи ЯМР 1 Н и 13 С. Структура 31 идентифицирована как амид-спиртовый метаболит насыщенной пирролопиримидиновой группой соединения I. Протонный спектр ЯМР соединения 31 имеет синглет при 3,56 с интенсивностью 2 Н. Этот синглет имеет большой диапазон корреляции к углероду при 177,9, согласующийся с амидом. Кроме того, между Н 3 и Н 9 наблюдается ядерное усиление Оверхаузера (nOe). Соединение 32 было обнаружено в плазме и моче пациентов, являющихся людьми. Массспектроскопия полного сканирования показала протонированный молекулярный ион при m/z 399, что согласуется с добавлением 32 а.е.м. к соединению I. Ионная фрагментация продукта иона m/z 399 дает ионы фрагментов при m/z 218 и 191. Первичный фрагмент при m/z 218 согласуется с добавлением 32 а.е.м. к пиразоло-пирролопиримидиновой группе. Ион фрагмента при m/z 191 согласуется с потерейCHN из пиразоловой группы предполагаемого бис-гидроксилированного пиразол-пирролопиримидина,ограничивая положение модификации(ий) у пирролопиримидина. Структурное распределение соединения 32 с использованием только масс-спектроскопии привело к неоднозначному результату, поэтому соединение 32 выделили из мочи человека и проанализировали при помощи ЯМР 1 Н и 13 С. Структура соединения 32 идентифицирована как кето-спиртовый метаболит насыщенной пирролопиримидиновой группы соединения I. Протонный ЯМР-спектр соединения 32 имеет синглет при 3,82, который имеет интенсивность 2 Н и показывает большой диапазон корреляции к углероду при 191,5, что согласуется с кетоном. У Н 2 не наблюдалось ядерного усиления Оверхаузера (nOe) ни с одним другим протоном. Соединение 40 наблюдалось в плазме и моче пациентов, являющихся людьми. Масс-спектроскопия полного сканирования показала протонированный молекулярный ион при m/z 341, что согласуется с добавлением 34 а.е.м. к соединению I. Ионная фрагментация продукта иона m/z 341 дает ионы фрагментов при m/z 323, 220, 202 и 175. Ион фрагмента при m/z 323 возникает из-за потери воды из пирролидин диола. Ионы фрагментов при m/z 220 и 202 согласуются с дважды гидроксилированным насыщенным пирролопиримидином, с наблюдаемой легкой потерей воды или без такой потери. Ион, наблюдаемый приm/z 175, согласуется с потерей CNH из пиразоловой группы дважды гидроксилированного насыщенного пиразол-пирролопиримидина с последующей легкой потерей воды. Соединение 40 идентифицировано как 3-циклопентил-3-(4-(5,6-дигидрокси-6,7-дигидро-5 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1 ил)пропаннитрил. Конъюгаты однократно гидроксилированных метаболитов соединения I, имеющие наблюдаемыйm/z 499, наблюдались в моче человека с двумя из семи конъюгатов, наблюдаемых также в следовых количествах в плазме человека. Ионная фрагментация исходного продукта дает практически идентичный спектр для шести из этих метаболитов с наблюдаемым ионом при m/z 323, согласующимся с потерей глюкуронидного конъюгата. Ионная фрагментация продукта (MS3) этих ионов фрагментов m/z 323 снова показала практически идентичный масс-спектр с ионами фрагментов при m/z 305, 186 и 159. Ион фрагмента, обнаруженный при m/z 305, согласуется с потерей воды (18 а.е.м.), что предполагает гидроксилирование и последующую фрагментацию в результате столкновения в насыщенной части молекулы, ограничивая положение модификации у циклопентиловой группы. Ионы фрагментов при m/z 186 и m/z 159 согласуются с немодифицированным пиразол-пирролопиримидином. Дополнительные неосновные ионы фрагментов были слишком слабыми, чтобы рассматривать их с определенной уверенностью. Идентичность этих предположительных метаболитов была подтверждена гидролизом выделенных глюкуронидных конъюгатов с -глюкуронидазой для обнаружения агликона, который затем подвергли анализу ВЭЖХ-МС, где время удержания и масс-спектр выделенных агликонов соответствовали времени удержания и масс-спектрам однократно гидроксилированных метаболитных образцов. Агликоны этих метаболитов глюкуронидного конъюгата соответствуют 2-гидроксильным метаболитам (метаболит 9, табл. 1) и 3-гидроксильным метаболитам (метаболит 8, табл. 1). Агликон из седьмого метаболита глюкуронидного конъюгата, соединение 42, соответствует однократно гидроксилированному метаболиту пиразолпирролопиримидиновой группы соединения I, который не наблюдался самостоятельно в плазме или мо- 28021478 че пациентов, являющихся людьми. Масс-спектроскопия полного сканирования показала протонированный молекулярный ион при m/z 323, что согласуется с добавлением 16 а.е.м. к соединению I. Ионная фрагментация продукта иона m/z 323 дает ионы фрагментов при m/z 202, который согласуется с добавлением 16 а.е.м. к пиразол-пирролопиримидиновой группе. Ион фрагмента при m/z 175 согласуется с потерей CHN из пиразоловой группы предполагаемого гидроксилированного пиразолпирролопиримидина, ограничивая положение модификации у пирролопиримидина. Структура метаболита соединения 42 идентифицирована как глюкуронидный конъюгат однократно гидроксилированной пирролопиримидиновой группы соединения I. Метаболитное соединение 41 было обнаружено в моче пациентов, являющихся людьми. Массспектроскопия полного сканирования показала протонированный молекулярный ион при m/z 583, что согласуется с глюкуронидной конъюгацией немодифицированного соединения I. Ионная фрагментация продукта иона m/z 583 дает первичный фрагмент при m/z 307, который согласуется с потерей целого глюкуронида. Ионы неосновных фрагментов при m/z 186 и m/z 159 согласуются с ионами, наблюдаемыми для соединения I. Фрагментация MS3 иона фрагмента m/z 307 также раскрывает ионы фрагментов приm/z 186 и m/z 159. Соединение 41 идентифицировано как N-связанный глюкуронидный конъюгат соединения I. Таблица 2
МПК / Метки
МПК: C07D 487/04, A61K 31/519
Метки: глюкуронидные, гидроксильные, кето, 3-(4-(7н-пирроло[2,3-d]пиримидин-4-ил)-1н-пиразол-1-ил)-3-циклопентилпропаннитрила, производные
Код ссылки
<a href="https://eas.patents.su/30-21478-gidroksilnye-keto-i-glyukuronidnye-proizvodnye-3-4-7n-pirrolo23-dpirimidin-4-il-1n-pirazol-1-il-3-ciklopentilpropannitrila.html" rel="bookmark" title="База патентов Евразийского Союза">Гидроксильные, кето и глюкуронидные производные 3-(4-(7н-пирроло[2,3-d]пиримидин-4-ил)-1н-пиразол-1-ил)-3-циклопентилпропаннитрила</a>
Предыдущий патент: Система определения местоположения поезда
Следующий патент: Замещенные производные карбамоилметиламиноуксусной кислоты в качестве новых ингибиторов nep
Случайный патент: Система и способ распределения данных












