3-[4-(7h-пирроло[2,3-d]пиримидин-4-ил)-1h-пиразол-1-ил]октан- или гептаннитрил как jak-ингибиторы
Формула / Реферат
1. Соединение, выбранное из группы
3-[4-(7Н-пиролло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]октаннитрил и
3-[4-(7Н-пирролло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]гептаннитрил
или их фармацевтически приемлемая соль.
2. Соединение по п.1, отличающееся тем, что является 3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]октаннитрилом или его фармацевтически приемлемой солью.
3. Соединение по п.1, отличающееся тем, что является (3R)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]октаннитрилом или его фармацевтически приемлемой солью.
4. Соединение по п.1, отличающееся тем, что является (3S)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]октаннитрилом или его фармацевтически приемлемой солью.
5. Соединение по п.1, отличающееся тем, что является фосфатом 3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]октаннитрила.
6. Соединение по п.1, отличающееся тем, что является фосфатом (3R)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]октаннитрила.
7. Соединение по п.1, отличающееся тем, что является фосфатом (3S)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]октаннитрила.
8. Соединение по п.1, отличающееся тем, что является 3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]гептаннитрилом или его фармацевтически приемлемой солью.
9. Соединение по п.1, отличающееся тем, что является (3R)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]гептаннитрилом или его фармацевтически приемлемой солью.
10. Соединение по п.1, отличающееся тем, что является (3S)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]гептаннитрилом или его фармацевтически приемлемой солью.
11. Соединение по п.1, отличающееся тем, что является фосфатом 3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]гептаннитрила.
12. Соединение по п.1, отличающееся тем, что является фосфатом (3R)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]гептаннитрила.
13. Соединение по п.1, отличающееся тем, что является фосфатом (3S)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]гептаннитрила.
14. Композиция, обладающая JAK ингибирующей активностью, включающая соединение или соль по любому из пп.1-4 и 8-10 или соль любого из пп.5-7 и 11-13, а также по меньшей мере один фармацевтически приемлемый носитель.
15. Композиция по п.14, отличающаяся тем, что является пригодной для местного введения.
16. Композиция по п.14, отличающаяся тем, что является пригодной для трансдермального введения.
17. Композиция по п.16 в форме трансдермального пластыря, мази, лосьона, крема или геля.
18. Способ лечения поражения кожи у пациента, включающий введение указанному пациенту терапевтически эффективного количества соединения или соли по любому из пп.1-4 и 8-10 или соли по любому из пп.5-7 и 11-13.
19. Способ по п.18, отличающийся тем, что упомянутое поражение кожи является атопическим дерматитом или псориазом.
20. Способ по п.18, отличающийся тем, что упомянутое кожное поражение является повышенной чувствительностью кожи, раздражением кожи, кожной сыпью, контактным дерматитом или аллергическим контактным дерматитом.
21. Способ по п.18, где поражение кожи является псориазом.
22. Способ получения соли фосфорной кислоты соединения формулы III
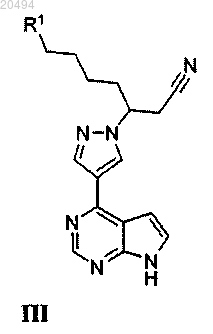
где R1 обозначает Н или метил, включающий объединение соединения формулы III с фосфорной кислотой в растворителе при температуре выше чем приблизительно 20°С.
23. Способ по п.22, отличающийся тем, что он является способом получения фосфата 3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]октаннитрила.
24. Способ по п.22, отличающийся тем, что он является способом получения фосфата 3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]гептаннитрила.
25. Способ по любому из пп. 22-24, отличающийся тем, что растворитель является органическим растворителем.
26. Способ по п.25, отличающийся тем, что указанным органическим растворителем является спирт.
27. Способ по п.26, отличающийся тем, что спирт выбирают из группы, включающей метанол, этанол, изопропанол и бутанол.
28. Способ по любому из пп.22-24, отличающийся тем, что объединение проводят при температуре выше приблизительно 60°С.
Текст
3-[4-(7H-ПИРРОЛО[2,3-d]ПИРИМИДИН-4-ИЛ)-1H-ПИРАЗОЛ-1-ИЛ]ОКТАН- ИЛИ ГЕПТАННИТРИЛ КАК JAK-ИНГИБИТОРЫ Настоящее изобретение относится к ингибиторам янус-киназы (JAK-ингибиторам) 3-[4(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрилу или 3-[4-(7 Н-пирроло[2,3d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрилу, а также их композициям и способам их получения и использования при лечении заболеваний, связанных с активностью янус-киназ,включая, например, воспалительные и аутоиммунные заболевания, кожные воспаления. Настоящая заявка заявляет о приоритете предварительной заявки на патент США, серийный номер 61/180582, поданной 22 мая 2009 г., включенной путем ссылки в полном объеме. Область техники Настоящее изобретение относится к ингибиторам янус-киназы (JAK-ингибиторам) 3-[4-(7 Нпирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрилу или 3-[4-(7 Н-пирроло[2,3-d]пиримидин 4-ил)-1 Н-пиразол-1-ил]гептаннитрилу, а также их композициям и способам их использования при лечении заболеваний, связанных с активностью янус-киназ, включая, например, воспалительные и аутоиммунные заболевания, кожные воспаления. Уровень техники Протеинкиназы (ПК) регулируют разнообразные биологические процессы, включая рост клеток, их выживаемость, дифференцировку клеток, образование органов, морфогенез, неоваскуляризацию, восстановление тканей и регенерацию, среди всего прочего. Протеинкиназы также играют особые роли во множестве заболеваний человека, включая рак. Цитокины, низкомолекулярные полипептиды или гликопротеины регулируют многие процессы, участвующие в реакциях организма на сепсис, например воспалительных. Цитокины влияют на дифференцировку клеток, пролиферацию и активацию и могут модулировать как провоспалительные, так и антивоспалительные реакции, что позволяет организму адекватно реагировать на патогены. Широкий спектр цитокинов, передающих сигналы, включает семейство янускиназ из протеиновых тирозинкиназ и сигнальные трансдукторы и активаторы транскрипции (СТАТ). Известно четыре янус-киназы в клетках млекопитающих: JAK1 (янус-киназа-1), JAK2, JAK3 (также известная как янус-киназа, лейкоцит; JAKL и L-JAK) и TYK2 (протеин-тирозинкиназа-2). Стимулируемые цитокинами иммунные и воспалительные ответы вызывают патогенез болезней: патологии, например тяжелый комбинированный иммунодефицит (SCID) возникает из-за подавления иммунной системы, в то время как гиперактивный или неадекватный иммунный/воспалительный ответ вызывает патологию аутоиммунных заболеваний (например, астмы, системной красной волчанки, тиреоидита, миокардита) и таких заболеваний, как склеродермия и остеоартрит (Ortmann R. А., Т. Cheng et al.(2000) Arthritis Res 2(1): 16-32). Многие патологии связаны с дефицитом в организме янус-киназ. Например, Jak1-/- мыши рождаются карликовыми, они не могут сосать грудное молоко и умирают практически сразу же (Rodig, S. J., M.A. Meraz et al. (1998) Cell 93(3): 373-83). JAK2-/-мыши эмбрионов страдают анемией и умирают приблизительно через 12,5 дней после зачатия из-за отсутствия окончательного эритропоэза. Полагают, что сигнальная система JAK/STAT, и в частности, все четыре янус-киназы, играют роль в патогенезе астматической реакции, хронического обструктивного заболевания легких, бронхитов и других родственных воспалительных заболеваний нижнего респираторного тракта. Многочисленные цитокины, которые передают сигналы через янус-киназы, связаны с воспалительными заболеваниями/состоянием верхних дыхательных путей, которые затрагивают нос и придаточные пазухи (например,ринит и синусит), независимо от того, являются ли они классическими аллергическими реакциями или нет. Сигнальная система JAK/STAT также влечет за собой воспалительные заболевания/состояния глаз и хронические аллергические реакции. Активация сигнальной системы JAK/STAT при раке может иметь место посредством стимуляции цитокинов (например, IL-6 или GM-CSF) или путем снижения эндогенных супрессоров JAK-сигналов,таких как SOCS (супрессор цитокиновой сигнализации) или PIAS (протеиновый ингибитор активированного STAT) (Boudny V. and Kovarik J., Neoplasm. 49:349-355, 2002). Активация сигнальной системыSTAT, a также других систем, нижележащих от янус-киназ (например, Akt-киназа), коррелировала со слабым прогнозированием многих типов раковых заболеваний (Bowman Т. et al. Oncogene 19:2474-2488,2000). Повышенные уровни циркулирующих цитокинов, которые передают сигнал через системуJAK/STAT, играют причинную роль в кахексии и/или хронической усталости. Поэтому JAKингибирование может быть полезным для пациентов, больных раком, по причинам, которые выходят за пределы потенциальной противоопухолевой активности. Тирозинкиназа JAK2 может быть полезной для пациентов с миелопролиферативными нарушениями, например истинная полицитемия (ИП), эссенциальная тромбоцитемия (ЭТ), миелоидная метаплазия с миелофиброзом (МММ) (Levin et al, Cancer С ell, vol. 7, 2005: 387-397). Ингибирование JAK2V617Fкиназы снижает пролиферацию гемопоэтических клеток, предполагая, что JAK2 является потенциальной мишенью для фармакологического ингибирования у пациентов с ИП, ЭТ и МММ. Ингибирование янус-киназ может оказаться полезным пациентам, страдающим от кожных заболеваний, связанных с нарушением иммунной системы, таких как псориаз и повышенная чувствительность кожи. Полагают, что псориаз зависит от ряда цитокинов, оказывающих влияние на воспалительные процессы, а также от различных хемокинов и факторов роста (JCI, 113:1664-1675), многие из которых передают сигнал через янус-киназы (Adv Pharmacol. 2000; 47:113-74). Таким образом, ингибиторы янус-киназ или родственных им киназ широко распространены. Например, некоторые ингибиторы янус-киназ, в том числе и пирролопиридины и пирролопиримидины, как сообщается в заявке на патент США, серийный номер 11/637,545, поданной 12 декабря 2006 г. Поэтому новые или усовершенствованные средства, которые ингибируют киназы, такие как янус-1 020494 киназы, постоянно необходимы для разработки новых и более эффективных фармацевтических препаратов, направленных на увеличение или подавление иммунного и воспалительного процессов (например,иммуносупрессивные препараты для пересадки органов), а также в качестве препаратов для профилактики и лечения аутоиммунных заболеваний, болезней, включающих гиперактивную воспалительную реакцию (например, экзему), аллергий, рака (например, рака предстательной железы, лейкемии, множественной миеломы), и некоторых иммунных реакций (например, сыпь на коже или контактный дерматит или диарея), вызванных другими способами лечения. Соединения согласно настоящему изобретению, а также их композиции и способы их использования, описанные здесь, предназначены для удовлетворения этих потребностей, а также для других целей. Сущность изобретения Настоящее изобретение относится, среди прочего, к ингибитору янус-киназы 3-[4-(7 Н-пирроло[2,3d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрилу или его фармацевтически приемлемой соли. Настоящее изобретение также относится к 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1 ил]гептаннитрилу или его фармацевтически приемлемой соли. Настоящее изобретение также относится к фармацевтическим композициям, включающим 3-[4-(7 Нпирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрил или 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4 ил)-1 Н-пиразол-1-ил]гептаннитрил или их фармацевтически приемлемые соли и по меньшей мере один фармацевтически приемлемый носитель. Настоящее изобретение также относится к способам лечения любого из различных связанных с активностью янус-киназ заболеваний и расстройств, указанных в этом изобретении, путем введения пациенту терапевтически эффективного количества 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1 ил]октаннитрила или 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрила или их фармацевтически приемлемой соли. Настоящее изобретение также относится к 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1 ил]октаннитрилу или 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрилу или их фармацевтически приемлемой соли для использования в лечебных целях. Настоящее изобретение также относится к 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1 ил]октаннитрилу или 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрилу или их фармацевтически приемлемой соли для производства лекарственного средства для использования в лечебных целях. Настоящее изобретение также относится к композициям для местного или трансдермального введения, где композиции включают 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрил или 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрил или их фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый носитель. Настоящее изобретение также относится к способам лечения аутоиммунных заболеваний, воспалительных заболеваний и кожных расстройств путем местного введения пациенту терапевтически эффективного количества 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрила или 3-[4(7 Н-пирроло [2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрила или их фармацевтически приемлемой соли. Настоящее изобретение также относится к способу получения солей фосфорной кислоты: фосфата 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрила и фосфата 3-[4-(7 Нпирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрила. Подробное описание изобретения Настоящее изобретение относится, среди прочего, к ингибитору янус-киназы 3-[4-(7 Н-пирроло[2,3d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрилу (формула I): или его фармацевтически приемлемой соли. Настоящее изобретение относится, среди прочего, к ингибитору янус-киназы 3-[4-(7 Н-пирроло[2,3d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрилу (формула II): или его фармацевтически приемлемой соли. Соединения, описанные в настоящем изобретении, могут быть асимметричными (например, иметь один или более стереоцентров). Подразумевают оба R/S энантиомера, если не указано особо. Соединения настоящего изобретения можно выделить в оптически активной или рацемической формах. Способы получения оптически активных форм из оптически неактивных исходных материалов известны в данной области химии и включают, например, разделение рацемических смесей или стереоселективный синтез. В некоторых вариантах воплощения соединение формулы I или II является R-энантиомером, который при желании можно до высокой степени чистоты отделить от S-энантиомера. В некоторых вариантах воплощения соединение формулы I или II является S-энантиомером, который при желании можно до высокой степени чистоты отделить от R-энантиомера. Разделение рацемических смесей соединений можно выполнить одним из многочисленных способов, известных в этой области химии. Например, один из способов включает фракционную рекристаллизацию с использованием хиральной селективной кислоты, которая является оптически активной, солеобразующей органической кислотой. Подходящие селективные агенты для способов фракционной рекристаллизации включают, например, такие оптические активные кислоты, как D и L формы винной кислоты, диацетилвинную кислоту, дибензоилвинную кислоту, миндальную кислоту, яблочную кислоту, молочную кислоту или различные оптически активные камфоросульфоновые кислоты, такие как камфоросульфоновая кислота. Разделение рацемических смесей также можно проводить путем элюирования колонки, заполненной оптически активным селективным агентом (например, динитробензоилфенилглицином). Специалист в данной области может найти подходящий состав элюирующего раствора. Термин "соединение", используемый в документе, включает, если не указано иное, все стереоизомеры и изотопы изображенных структур. Все соединения и их фармацевтически приемлемые соли можно получить вместе с другими веществами, такими как вода и растворители (например, гидраты и сольваты), или можно получить отдельно. В некоторых вариантах воплощения соединения настоящего изобретения или их соли являются, в основном, выделенными. Под термином "в основном, выделенные" понимают, что соединение, по крайней мере, частично или, в основном, выделено из среды, которую использовали для его получения или обнаружения. Частично выделенный продукт может включать, например, композицию, обогащенную соединением, предлагаемым настоящим изобретением. В основном выделенный продукт может включать композиции, содержащие по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 99 вес.% соединения, предлагаемого настоящим изобретением или его соли. Способы выделения соединений и их солей являются обычными для данной области. Выражение "фармацевтически приемлемый", используемое в настоящем изобретении, относится к тем соединениям, материалам, композициям и/или лекарственным формам, которые в пределах области действия официального медицинского заключения подходят для использования в контакте с тканями человека и животных без чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений, соизмеримых с разумным соотношением польза/риск. Выражения "температура окружающей среды" и "комнатная температура", используемые в настоящем документе и в данной области, относятся, в основном, к температуре, например температуре проведения реакции, равной приблизительно температуре окружающей среды, в которой проходит реакция,например, температуре от приблизительно 20 до приблизительно 30 С. Соединения настоящего изобретения, можно получить согласно синтетическим процедурам, описанным ниже в разделе Примеры. В другом аспекте настоящее изобретение относится к способу получения соли фосфорной кислоты соединения формулы III: где R1 обозначает Н или метил, включая объединение соединения формулы III с фосфорной кислотой. В некоторых вариантах воплощения объединение осуществляют в присутствии органического растворителя (такого, как спирт) при температуре выше чем приблизительно 20 С (например, выше чем приблизительно 40 С, выше чем приблизительно 60 С, выше чем приблизительно 80 С, или выше чем приблизительно 100 С). В некоторых вариантах воплощения объединение можно проводить при температуре приблизительно 60 С. В некоторых вариантах воплощения спиртом может быть метанол, этанол,изопропанол или бутанол. В некоторых вариантах воплощения спиртом является изопропанол. В некоторых вариантах воплощения настоящее изобретение относится к способу получения фосфата 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрила, который включает объединение 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрила с фосфорной кислотой,при желании, в присутствии органического растворителя (такого, как спирт) при температуре значительно выше чем приблизительно 20 С (например, выше чем приблизительно 40 С, выше чем приблизительно 60 С, выше чем приблизительно 80 С, или выше чем приблизительно 100 С). В некоторых вариантах воплощения объединение можно проводить при температуре приблизительно 60 С. В некоторых вариантах воплощения спиртом может быть метанол, этанол, изопропанол или бутанол. В некоторых вариантах воплощения настоящее изобретение относится к способу получения фосфата 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрила, который включает объединение 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрила с фосфорной кислотой,при желании, в присутствии органического растворителя (такого, как спирт) при температуре значительно выше чем приблизительно 20 С (например, выше, чем приблизительно 40 С, выше чем приблизительно 60 С, выше чем приблизительно 80 С, или выше чем приблизительно 100 С). В некоторых вариантах воплощения объединение можно проводить при температуре приблизительно 60 С. В некоторых вариантах воплощения спиртом может быть метанол, этанол, изопропанол или бутанол. Настоящее изобретение также относится к фармацевтически приемлемым солям соединений, описанных в настоящем документе. К "фармацевтически приемлемым солям" в настоящем документе относятся производные открытых соединений, в которых исходное соединение модифицировано путем превращения существующей кислотной или основной структуры в его солевую форму. Примеры фармацевтически приемлемых солей включают, не ограничиваясь, минеральные или органические соли остатков оснований, таких как амины; основные или органические соли остатков кислот, таких как карбоновые кислоты; и тому подобное. Фармацевтически приемлемые соли настоящего изобретения включают обычные нетоксичные соли исходных соединений, образованных, например, из нетоксичных неорганических или органических кислот. Фармацевтически приемлемые соли настоящего изобретения можно синтезировать из исходного соединения, содержащего основную или кислотную группу, обычными химическими способами. Как правило, такие соли можно получить путем взаимодействия свободных кислотных или основных форм этих соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или органическом растворителе, или в смеси воды и растворителя; как правило, предпочтительнее использовать неводную среду, например эфир, этилацетат, спирты (например, метанол, этанол, изопропанол или бутанол) или ацетонитрил (ACN). Перечень подходящих солей приведен в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Co mpany, Easton, Pa., 1985, p. 1418 и в Journal of Pharmaceutical Science, 66, 2 (1977), каждый из которых включен в настоящую заявку путем ссылки в полном объеме. Способы Соединения настоящего изобретения могут модулировать активность одной или более янус-киназ. Термин "модулировать" означает способность увеличивать или уменьшать активность одного или более членов семейства янус-киназ. Таким образом, соединения изобретения можно использовать в способах модуляции янус-киназ путем контактирования янус-киназ с любым одним или более из соединений или композиций, описанных выше. В некоторых вариантах воплощения соединения настоящего изобретения могут действовать как ингибиторы одной или более янус-киназ. В других вариантах воплощения соединения изобретения можно использовать для модуляции активности янус-киназ в отдельном, нуждающемся в модуляции рецепторе, путем введения модулирующего количества соединения настоящего изобретения или его фармацевтически приемлемой соли. Еще один аспект настоящего изобретения относится к способам лечения болезней или расстройств,-4 020494 связанных с активностью янус-киназ у индивидуума (например, у пациента) путем введения индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества или лекарственной формы соединения настоящего изобретения или фармацевтической композиции из него. Заболевания, связанные с активностью янус-киназ, могут включать любое заболевание, расстройство или состояние, которое прямо или косвенно связано с экспрессией или активностью янус-киназ, включая гиперэкспрессию и/или ненормальные уровни активности. Заболевания, связанные с активностью янус-киназ, могут также включать любое заболевание, расстройство или состояние, которое можно предотвратить, улучшить или вылечить путем модуляции активности янус-киназ. Примеры заболеваний, связанных с активностью янус-киназ, включают болезни, связанные с иммунной системой, например отторжение органа трансплантата (например, отторжение аллотрансплантата и болезнь "трансплантат против хозяина"). Другие примеры заболеваний, связанных с активностью янус-киназ, включают аутоиммунные заболевания, такие как рассеянный склероз, ревматоидный артрит,ювенильный артрит, псориатический артрит, диабет I типа, волчанка, псориаз, воспалительное заболевание кишечника, неспецифический язвенный колит, болезнь Крона, миастения гравис, иммуноглобулиннефропатия, аутоиммунные расстройства щитовидной железы, и тому подобное. В некоторых вариантах воплощения аутоиммунное заболевание представляет собой аутоиммунные буллезные кожные высыпания, например пузырчатка обыкновенная (ПО) или буллезной пемфигоид (БП). Другие примеры заболеваний, связанных с активностью янус-киназ, включают аллергические состояния, такие как астма, пищевая аллергия, атопический дерматит и ринит. Другие примеры заболеваний, связанных с активностью янус-киназ, включают вирусные заболевания, такие как вирус ЭпштейнаБарр (EBV), гепатит В, гепатит С , вирус иммунодефицита человека (ВИЧ), Т-лимфотропный вирус человека I типа (HTLV 1), вирус Варицелла-Зостер (VZV) и вирус папилломы человека (HPV). Другие примеры заболеваний или состояний, связанных с активностью янус-киназ, включают кожные расстройства, такие как псориаз (например, псориаз обыкновенный), атопический дерматит, кожная сыпь, раздражение кожи, повышенная чувствительность кожи (например, контактный дерматит, или аллергический контактный дерматит). Например, некоторые вещества, в том числе и некоторые фармацевтические препараты, при местном применении могут вызвать повышенную чувствительность кожи. В некоторых вариантах воплощения одновременное или последовательное введение по меньшей мере одного ингибитора янус-киназы настоящего изобретения вместе с агентом, вызывающим нежелательную сенсибилизацию кожи, может быть полезным в лечении такой нежелательной чувствительности кожи или дерматита. В некоторых вариантах воплощения заболевание кожи лечится путем местного применения, по меньшей мере, одного ингибитора янус-киназы настоящего изобретения. В других вариантах воплощения заболеванием, связанным с активностью янус-киназ, является рак,в том числе типы рака, которые характеризуются твердыми опухолями (например, рак предстательной железы, рак почки, рак печени, рак поджелудочной железы, рак желудка, рак молочной железы, рак легкого, рак головы и шеи, рак щитовидной железы, глиобластома, саркома Капоши, болезнь Кастельмана,меланома и т.д.), рак крови (например, лимфома, лейкемии, такие как острый лимфобластный лейкоз,острый миелобластный лейкоз (ОМЛ) или множественная миелома) и рак кожи, например, Т-клеточная лимфома кожи и В-клеточная лимфома кожи. Примеры Т-клеточной лимфомы кожи включают синдром Сезари и грибовидный микоз. В некоторых вариантах воплощения JAK-ингибиторы, описанные в настоящем документе, а также другие ингибиторы янус-киназ, о которых сообщалось в патенте США, серийный номер 11/637545, могут быть использованы для лечения рака, связанного с воспалительными процессами. В некоторых вариантах воплощения заболевание раком связано с воспалительным заболеванием кишечника. В некоторых вариантах воплощения воспалительным заболеванием кишечника является язвенный колит. В некоторых вариантах воплощения воспалительным заболеванием кишечника является болезнь Крона. В некоторых вариантах воплощения раком, связанным с воспалительными способами, является рак на фоне язвенного колита. В некоторых вариантах воплощения раком, связанным с воспалительными процессами, является рак толстой кишки или колоректальный рак. В некоторых вариантах воплощения раком является рак желудка, карциноидные опухоли желудочно-кишечного тракта, стромальные опухоли желудочнокишечного тракта (GIST), аденокарцинома, мелкоклеточный рак кишечника или рак прямой кишки. Заболевания, связанные с активностью янус-киназ, могут дополнительно включать заболевания, которые характеризуются экспрессией мутанта JAK2, например, те, что имеют по меньшей мере одну мутацию в псевдокиназном домене (например, JAK2V617F). Заболевания, связанные с активностью янус-киназ, могут дополнительно включать миелопролиферативные заболевания (МПЗ), такие как истинная полицитемия (ИП), эссенциальная тромбоцитемия(ЭТ), миелофиброз с миелоидной метаплазией (МММ), первичный миелофиброз (ПМФ), хронический миелолейкоз (ХМЛ), хронический миеломоноцитарный лейкоз (ХММЛ), гиперэозинофильный синдром(ГЭС), системный мастоцитоз (СМ) и тому подобное. В некоторых вариантах воплощения миелопролиферативным расстройством является первичный миелофиброз (ПМФ) или пост-полицитемия истинная/эссенциальная тромбоцитемия и миелофиброз (пост-ПИ/ЭТ МФ). Настоящее изобретение также относится к способам лечения псориаза или других кожных заболе-5 020494 ваний путем введения фармацевтической композиции местного применения, содержащей соединение настоящего изобретения. Настоящее изобретение также относится к способу лечения дерматологических побочных эффектов от применения других лекарственных средств путем введения соединения настоящего изобретения. Например, многочисленные фармацевтические средства приводят к нежелательным аллергическим реакциям, которые могут проявляться как угревая сыпь или схожие дерматиты. Примеры фармацевтических средств, которые имеют такие нежелательные побочные эффекты, включают противораковые препараты,например, гефитиниб, цетуксимаб, эрлотиниб и тому подобное. Соединения настоящего изобретения могут быть введены системно или местно (например, могут быть локализованы в окрестности дерматита) в сочетании с (например, одновременно или последовательно) лекарственным средством, которое имеет нежелательный, дерматологический побочный эффект. В некоторых вариантах воплощения соединения настоящего изобретения могут применяться местно вместе с одним или несколькими другими лекарственными средствами там, где другие лекарственные средства при местном применении в отсутствие соединения настоящего изобретения вызывают контактный дерматит, аллергическую контактную чувствительность кожи или аналогичные расстройства кожи. Таким образом, композиции настоящего изобретения, включают композиции местного применения, содержащие соединение настоящего изобретения, а также лекарственное средство, которое может вызвать дерматит, кожные расстройства или связанные с ним побочные эффекты. В другом аспекте настоящее изобретение относится к соединению или соли соединения для использования в одном из способов лечения, как описано в настоящем документе, в другом аспекте настоящее изобретение относится к использованию соединения или соли соединения для получения лекарственного препарата с целью использования в одном из способов лечения, как описано в настоящем документе. Термин "контактирование", используемый в документе, относится к сведению вместе указанных структур в системе in vitro или в системе in vivo. Например, "контактирование" янус-киназы с соединением настоящего изобретения включает введение соединения настоящего изобретения индивидууму или пациенту, например человеку, организм которого имеет янус-киназы, а также, например, введение соединения настоящего изобретения в образец, содержащий клеточный или очищенный препарат, содержащий янус-киназы. Термины "индивидуум" или "пациент" используются взаимозаменяемо и относятся к любому животному, включая млекопитающих, предпочтительно мышам, крысам, другим грызунам, кроликам, собакам, котам, свиньям, представителям крупного рогатого скота, овцам, лошадям или приматам и, предпочтительнее всего, человекообразным приматам. Термин "терапевтически эффективное количество", используемый в настоящем документе, означает такое количество действующего соединения или фармацевтического средства, которое вызывает биологическую или медицинскую реакцию, которую исследователь, ветеринар, врач или другой медицинский работник стремится обнаружить в тканях, системе, животном, индивидууме или человеке. Термин "лечить" или "лечение", используемый в настоящем документе, означает один или более (1) способов предотвращения заболевания; например предотвращение заболевания, состояния или расстройства у индивидуума, который может быть предрасположен к болезни, состоянию или расстройству, но еще не испытал или не проявил патологию или симптомы заболевания; (2) ингибирование заболевания; например ингибирование болезни, состояния или расстройства у индивидуума, который испытывает или проявляет патологию или симптомы болезни, состояния или расстройства (то есть остановку дальнейшего развития патологии и/или симптомов); и (3) улучшение течения болезни; например улучшения в течении болезни, улучшение состояния или улучшения в расстройстве у индивидуума, который испытывает или проявляет патологию или симптомы болезни, состояния или расстройства (то есть изменение патологии и/или симптомов в обратную сторону), например, снижение серьезности заболевания. Комбинированные фармацевтические средства Одно или несколько дополнительных фармацевтических средств, таких как химиотерапевтические средства, противовоспалительные средства, стероиды, иммунодепрессанты, а также ингибиторы киназыBcr-Abl, Flt-3, RAF и FAK, например, описанные в WO 2006/056399, или другие средства можно использовать в комбинации с соединением настоящего изобретения для лечения заболеваний, расстройств или состояний, связанных с активностью янус-киназы. Один или несколько дополнительных фармацевтических средств можно ввести пациенту одновременно или последовательно. Химиотерапевтические средства включают ингибиторы протеазы (например, бортезомиб), талидомид, ревлимид и ДНК-повреждающие агенты, такие как мелфалан, доксорубицин, циклофосфамид, винкристин, этопозид, кармустин и тому подобное. Стероиды включают кортикостероиды, такие как дексаметазон или преднизон. Соответствующие Bcr-Ab1-ингибиторы включают соединения и их фармацевтически приемлемые соли, соединения аналогичного рода и вида, раскрытые в патенте США, серийный номер 5521184, WO 04/005281, ЕР 2005/009967, ЕР 2005/010408, патенте США, серийный номер 60/578491. Соответствующие Flt-ингибиторы включают соединения и их фармацевтически приемлемые соли,раскрытые в публикациях WO 03/037347, WO 03/099771 и WO 04/046120. Соответствующие RAF-ингибиторы включают соединения и их фармацевтически приемлемые соли, раскрытые в публикациях WO 00/09495 и WO 05/028444, Соответствующие FAK-ингибиторы включают соединения и их фармацевтически приемлемые соли, раскрытые в публикациях WO 04/080980, WO 04/056786, WO 03/024967, WO 01/064655, WO 00/053595 и WO 01/014402. В некоторых вариантах воплощения соединение настоящего изобретения можно использовать в комбинации с одним или несколькими другими ингибиторами киназ, включая иматиниб, особенно для лечения больных, резистентных к иматинибу или другим ингибиторам киназы. В некоторых вариантах воплощения соединение настоящего изобретения можно использовать в комбинации с химиотерапевтическими средствами для лечения рака, такого как множественная миелома,и можно улучшить реакцию на лечение по сравнению с реакцией на применяемое отдельно химиотерапевтическое средство без обострения его токсического действия. Примеры дополнительных фармацевтических средств, используемых для лечения множественной миеломы, могут включать, не ограничиваясь,мелфалан, мелфалан с преднизоном [МП], доксорубицин, дексаметазон и Велкейд (бортезомиб). Дополнительные средства, используемые в лечении множественной миеломы, включают ингибиторов киназы Bcr-Abl, Flt-3, RAF и FAK. Аддитивный или синергический эффект является желаемым результатом совместного использования JAK-ингибитора настоящего изобретения и дополнительного средства. Кроме того, при множественной миеломе сопротивление клеток таким лекарственным средствам, как дексаметазон может быть обратимым при лечении JAK-ингибитором настоящего изобретения. Лекарственные средства можно комбинировать с соединением настоящего изобретения при разовом или постоянном введении лекарственной формы, или лекарственные средства можно вводить одновременно или последовательно в виде отдельных лекарственных форм. В некоторых вариантах воплощения, кортикостероид, например дексаметазон, вводят пациенту в комбинации с соединением настоящего изобретения, где дексаметазон назначают с перерывами, а не постоянно. В некоторых других вариантах воплощения комбинации соединения настоящего изобретения с другими терапевтическими средствами можно вводить пациенту до, во время и/или после трансплантации костного мозга или пересадки стволовых клеток. Фармацевтические композиции и лекарственные формы Если соединения настоящего изобретения используются в качестве лекарственных средств, то они могут быть введены в виде фармацевтических композиций. Эти композиции можно приготовить способами, хорошо известными в фармацевтике, и вводить различными способами, в зависимости от того,местное или системное лечение предпочтительнее и какая область подлежит лечению. Введение может быть местным (в том числе, трансдермальным, эпидермальным, офтальмологическим и через слизистые оболочки, включая интраназальную, вагинальную и ректальную доставку лекарственного средства), ингаляционным (например, путем ингаляции или инсуффляции порошков или аэрозолей, в том числе посредством распылителя; внутритрахеально или интраназально), оральным или парентеральным. Парентеральное введение включает внутривенную, внутриартериальную, подкожную,внутрибрюшинную, внутримышечную или инъекцию, или инфузию; или внутричерепное, например интратекальное или внутрижелудочковое введение. Парентеральное введение может быть в форме разовой болюсной дозы или может осуществляться непрерывно с помощью перфузионного насоса. Фармацевтические композиции и препараты для местного введения могут включать трансдермальные пластыри, мази, лосьоны, кремы, гели, капли, суппозитории, аэрозоли, жидкости и порошки. Обычные фармацевтические носители на водной, порошковой или масляной основе, загустители и тому подобные вещества могут быть необходимыми или желательными. Кондомы с покрытием, перчатки и аналогичные изделия также могут применяться. Это изобретение также включает фармацевтические композиции, содержащие в качестве активного ингредиента соединение настоящего изобретения или его фармацевтически приемлемую соль в комбинации с одним или несколькими фармацевтически приемлемыми носителями (наполнителями). В некоторых вариантах воплощения композиция пригодна для местного введения. При изготовлении композиций настоящего изобретения активный ингредиент обычно смешивают с наполнителем, разбавляют наполнителем или заключают в таком наполнителе в форму, например, в капсулу, пакетик, бумажный или другой контейнер. Если наполнитель служит разбавителем, то он может быть твердым, полутвердым или жидким материалом, которое действует как проводник, носитель или среда для активного ингредиента. Таким образом, композиции могут быть в форме таблеток, пилюль, порошков, драже, сашэ, облаток,суспензий, эмульсий, растворов, сиропов, аэрозолей (как в твердой, так и в жидкой среде), мазей, содержащих, например, до 10 вес.% активного соединения, мягких и твердых желатиновых капсул, суппозиториев, стерильных растворов для инъекций и стерильных упакованных порошков. При приготовлении композиции активное соединение может быть измельчено до надлежащего размера частиц до смешения с другими ингредиентами. Если активное соединение является практически нерастворимым, то его можно измельчить до размера частиц менее 200 меш. Если активное вещество хорошо растворяется в воде, то размер частиц можно отрегулировать путем измельчения, чтобы обеспечить равномерное распределение активного вещества в фармацевтической композиции, например, до размера частиц приблизительно 40 меш. Соединение настоящего изобретения можно измельчить с помощью известных процедур, таких как мокрый размол с целью получения частиц размером, пригодным для формирования таблетки и для других типов фармацевтических композиций. Тонко измельченные (до наночастиц) препараты соединения настоящего изобретения можно получить с помощью известных способов, описанных, например, в Международной заявке, номер публикации WO 2002/000196. Соответствующие наполнители включают лактозу, декстрозу, сахарозу, сорбит, маннит, крахмал,камедь акации, фосфат кальция, альгинат, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп и метилцеллюлозу. Композиции могут дополнительно включать смазывающие агенты, такие как тальк, стеарат магния и минеральное масло; увлажняющие агенты; эмульгаторы и суспендирующие агенты; консерванты, такие как метил- и пропилгидроксибензоаты; подсластители; и ароматизаторы. Композиции настоящего изобретения можно приготовить так, чтобы обеспечить быстрое, продолжительное или замедленное высвобождение активного ингредиента после введения композиции пациенту, используя процедуры, известные в данной области. Композиции могут быть приготовлены в единичной лекарственной форме, каждая доза содержит от приблизительно 5 до приблизительно 1000 мг (1 г), чаще всего от приблизительно 100 до приблизительно 500 мг активного ингредиента. Термин "единичная лекарственная форма" относится к физически дискретным единицам, пригодным в качестве единичных доз для человека и других млекопитающих, каждая единица содержит заранее установленное количество активного материала, рассчитанное для получения желаемого терапевтического эффекта, в комбинации с подходящим фармацевтическим наполнителем. Активное соединение может быть эффективным в широком диапазоне доз и, как правило, вводится в фармацевтически эффективном количестве. Однако следует иметь в виду, что количество фактически вводимого соединения, как правило, определяется врачом в зависимости от обстоятельств, в том числе от состояния пациента, выбранного пути введения, конкретного соединения, возраста, веса и реакции пациента, тяжести симптомов пациента и тому подобное. Для приготовления твердых композиций, таких как таблетки, основной активный ингредиент смешивают с фармацевтическим наполнителем для образования твердой предварительной фармацевтической композиции, содержащей однородную смесь соединения настоящего изобретения. Однородная фармацевтическая композиция означает, что активный ингредиент, как правило, равномерно распределен по всей композиции, так что композицию легко можно разделить с получением эффективных единичных лекарственных форм, таких как таблетки, пилюли и капсулы. Эту твердую предварительную фармацевтическую композицию разделяют с получением единичной лекарственной формы вышеописанного типа, содержащей, например, от приблизительно 0,1 до приблизительно 1000 мг активного ингредиента настоящего изобретения. Таблетки или пилюли настоящего изобретения могут быть покрыты или иным образом сформованы, чтобы получить лекарственную форму, обеспечивающую преимущество пролонгированного действия. Например, таблетка или пилюля может содержать дозу внутреннего компонента и дозу внешнего компонента, причем последний в форме оболочки над первым. Два компонента могут быть отделены друг от друга энтеросолюбильным слоем, который противостоит распаду компонента в желудке и позволяет внутреннему компоненту перейти нетронутым в двенадцатиперстную кишку или задерживает его действие на некоторое время. Различные материалы можно использовать для таких энтеросолюбильных слоев или покрытий, включая ряд полимерных кислот и смесей полимерных кислот с такими материалами, как шеллак, цетиловый спирт и ацетат целлюлозы. Жидкие формы, в которых соединение и композиции настоящего изобретения можно соединить вместе для перорального введения или в виде инъекций, включают водные растворы, соответствующие ароматизированные сиропы, водные или масляные суспензии, ароматизированные эмульсии со съедобными маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и аналогичные проводники лекарственных средств. Композиции для ингаляции или инсуффляции включают растворы и суспензии в фармацевтически приемлемых, водных или органических растворителях или их смесях и порошки. Жидкие или твердые композиции могут содержать соответствующие фармацевтически приемлемые наполнители, как описано выше. В некоторых вариантах воплощения композиции вводят орально или через носовые дыхательные пути для местного или системного эффекта. Композиции могут быть распылены с использованием инертных газов. Распыленные растворы могут вдыхаться прямо с распылителя или устройство для распыления можно прикрепить к лицевой маске для ингаляций или к дыхательному аппарату с перемежающимся положительным давлением. Раствор, суспензию или порошковую композицию можно вводить перорально или в нос с устройства, которое доставляет лекарственное средство адекватным способом. Фармацевтические композиции для местного применения могут содержать один или несколько обычных носителей. В некоторых вариантах воплощения мази могут содержать воду и один или более гидрофобных носителей, выбранных из таких соединений, как жидкий парафин, полиоксиэтиленалкиловый эфир, пропиленгликоль, белый вазелин и тому подобное. Носители для фармацевтических композиций в форме кремов могут быть основаны на воде в комбинации с глицерином и одним или несколькими другими компонентами, например глицеринмоностеаратом, ПЭГ-глицеринмоностеаратом и цетилстеариловым спиртом. Гели можно получать с использованием изопропилового спирта и воды в комбинации с другими компонентами, такими как глицерин, гидроксиэтилцеллюлоза и тому подобное. В некоторых вариантах воплощения лекарственные препараты для местного применения содержат по меньшей мере приблизительно 0,1, по меньшей мере приблизительно 0,25, по меньшей мере приблизительно 0,5, по меньшей мере приблизительно 1, по меньшей мере приблизительно 2 или по меньшей мере приблизительно 5 вес.% соединения настоящего изобретения. Лекарственные препараты для местного применения должны быть соответствующим образом упакованы в тюбики вместимостью, например, 100 г, которые желательно сопроводить инструкциями по лечению для конкретного заболевания, например,псориаза или другого расстройства кожи. Изобретение также относится к фармацевтической композиции для местного кожного применения,содержащей терапевтически эффективное количество соединения настоящего изобретения, или его фармацевтически приемлемой соли. В некоторых вариантах воплощения фармацевтическая композиция содержит эмульсии масло в воде и терапевтически эффективное количество соединения настоящего изобретения или его фармацевтически приемлемойсоли. В некоторых вариантах воплощения эмульсия содержит воду, масляный компонент и компонент эмульгатора. Термин "компонент эмульгатора", используемый в настоящем изобретении, означает в одном аспекте вещество или смесь веществ, которые поддерживают элемент или частицу в суспензионном состоянии в жидкой среде. В некоторых вариантах воплощения компонент эмульгатора служит для получения и стабилизации эмульсии при смешении масла и воды. В некоторых вариантах воплощения компонент эмульгатора означает одно или более неионогенных поверхностно-активных веществ. В некоторых вариантах воплощения масляный компонент присутствует в количестве от приблизительно 10 до приблизительно 40% (вес./вес.) композиции. В некоторых вариантах воплощения масляный компонент включает одно или более веществ, независимо выбранных из таких веществ, как петролатум, жирные спирты, минеральные масла, триглицериды и силиконовые масла. В некоторых вариантах воплощения масляный компонент включает одно или более веществ, независимо выбранных из таких веществ, как белый вазелин, цетиловый спирт, стеариловый спирт, легкое минеральное масло, триглицериды со средней длиной цепи и диметикон. В некоторых вариантах воплощения масляный компонент включает компонент окклюзивного агента. В некоторых вариантах воплощения компонент окклюзивного агента присутствует в количестве от приблизительно 2 до приблизительно 15% (вес./вес.) композиции. Термин "компонент окклюзивного агента", используемый в настоящем изобретении, означает гидрофобный агент или смесь гидрофобных агентов, образующих окклюзивную пленку на коже, которая снижает трансэпидермальную потерю воды (ТЭВП) путем предотвращения испарения воды из рогового слоя. В некоторых вариантах воплощения компонент окклюзивного агента включает одно или более веществ, выбранных из таких веществ, как жирные кислоты (например, ланолиновая кислота), жирные спирты (например, ланолиновый спирт), углеводородные масла и воски (например, петролатум), полигидроспирты (например, пропиленгликоль), силиконы (например, диметикон), стеролы (например, холестерин), растительные или животные жиры (например, кокосовое масло), растительные воски (например,карнаубский воск) и сложные эфиры воска (например, пчелиный воск). В некоторых вариантах воплощения компонент окклюзивного агента включает одно или более веществ, выбранных из таких веществ, как ланолиновая кислота, жирные спирты, ланолиновый спирт, петролатум, пропиленгликоль, диметикон, холестерин, кокосовое масло, карнаубский воск и пчелиный воск. В некоторых вариантах воплощения компонент окклюзивного агента включает петролатум. В некоторых вариантах воплощения компонент окклюзивного агент включает белый вазелин. В некоторых вариантах воплощения масляный компонент включает компонент загустителя. В некоторых вариантах воплощения компонент загустителя присутствует в количестве от приблизительно 2 до приблизительно 8% (вес./вес.) композиции. Термин "компонент загустителя", используемый в настоящем изобретении, означает вещество или смесь веществ, которые увеличивают вязкость и/или консистенцию композиции или улучшают ее реологию. В некоторых вариантах воплощения компонент загустителя включает одно или более веществ, независимо выбранных из жирных спиртов. В некоторых вариантах воплощения компонент загустителя включает одно или более веществ, независимо выбранных из жирных спиртов с длиной цепи С 12-20. В некоторых вариантах воплощения компонент загустителя включает одно или более веществ, независимо выбранных из жирных спиртов с длиной цепи С 16-18. В некоторых вариантах воплощения компонент загустителя включает одно или более веществ, независимо выбранных из цетилового спирта и стеарилового спирта. В некоторых вариантах воплощения масляный компонент включает смягчающий компонент. В некоторых вариантах воплощения смягчающий компонент присутствует в количестве от приблизительно 5 до приблизительно 15% (вес./вес.) композиции. Термин "смягчающий компонент", используемый в настоящем изобретении, относится к агенту, который смягчает или успокаивает кожу, или успокаивает раздраженную внутреннюю поверхность. В некоторых вариантах воплощения смягчающий компонент включает одно или более веществ, независимо выбранных из минеральных масел и триглицеридов,В некоторых вариантах воплощения смягчающий компонент включает одно или более веществ, независимо выбранных из таких веществ, как легкое минеральное масло и триглицериды со средней длиной цепи. В некоторых вариантах воплощения смягчающий компонент включает одно или более веществ, независимо выбранных из таких веществ, как легкое минеральное масло, триглицериды со средней длиной цепи и диметикон. В некоторых вариантах воплощения вода присутствует в количестве от приблизительно 35 до приблизительно 65% (вес./вес.) композиции. В некоторых вариантах воплощения компонент эмульгатора присутствует в количестве от приблизительно 1 до приблизительно 9% (вес./вес.) композиции. В некоторых вариантах воплощения компонент эмульгатора включает одно или более веществ, независимо выбранных из таких веществ, как глицериновые эфиры жирных кислот и сорбитовые эфиры жирных кислот. В некоторых вариантах воплощения компонент эмульгатора включает одно или более веществ, независимо выбранных из глицерилстеарата и полисорбата 20. В некоторых вариантах воплощения фармацевтическая композиция также включает компонент стабилизатора. В некоторых вариантах воплощения компонент стабилизатора присутствует в количестве от приблизительно 0,05 до приблизительно 5% (вес./вес.) композиции. Термин "компонент стабилизатора", используемый в настоящем изобретении, означает вещество или смесь веществ, которые улучшают стабильность фармацевтической композиции и/или совместимость компонентов в ней. В некоторых вариантах воплощения компонент стабилизатора предотвращает агломерацию эмульсии и стабилизирует капли в эмульсии типа масло в воде. В некоторых вариантах воплощения компонент стабилизатора включает одно или более веществ,независимо выбранных из полисахаридов. В некоторых вариантах воплощения компонент стабилизатора включает ксантановую смолу. В некоторых вариантах воплощения фармацевтическая композиция также включает компонент растворителя. В некоторых вариантах воплощения стабилизатор присутствует в количестве от приблизительно 10 до приблизительно 35% (вес./вес.) композиции. Термин "компонент растворителя", используемый в настоящем изобретении, означает жидкое вещество или смесь жидких веществ, которые способны растворять соединение настоящего изобретения или другие вещества в фармацевтической композиции. В некоторых вариантах воплощения компонентом растворителя является жидкое вещество или смесь жидких веществ, в которых соединение настоящего изобретения или его фармацевтически приемлемая соль имеет достаточную растворимость. В некоторых вариантах воплощения компонент растворителя включает одно или более веществ, независимо выбранных из алкиленгликолей и полиалкиленгликолей. В некоторых вариантах воплощения компонент растворителя включает одно или более веществ, независимо выбранных из пропиленгликоля и полиэтиленгликоля. В некоторых вариантах воплощения соединение настоящего изобретения присутствует в количестве от приблизительно 0,5 до приблизительно 2,0% вес./вес. композиции, считая на свободное основание. В некоторых вариантах воплощения соединение настоящего изобретения присутствует в количестве приблизительно 0,5% вес./вес. композиции, считая на свободное основание. В некоторых вариантах воплощения соединение настоящего изобретения присутствует в количестве приблизительно 1% вес./вес. композиции, считая на свободное основание. В некоторых вариантах воплощения соединение настоящего изобретения присутствует в количестве приблизительно 1,5% вес./вес. композиции, считая на свободное основание. В некоторых вариантах воплощения соединение настоящего изобретения присутствует в количестве, выбранном из таких количеств: приблизительно 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7,1,8, 1,9 и 2,0% вес./вес. композиции, считая на свободное основание. В некоторых вариантах воплощения фармацевтическая композиция включает воду; масляный ком- 10020494 понент; компонент эмульгатора; компонент растворителя; компонент стабилизатора и от приблизительно 0,5 до приблизительно 2,0% соединения настоящего изобретения или его фармацевтически приемлемой соли по весу от веса композиции, считая на свободное основание. В некоторых вариантах воплощения фармацевтическая композиция включает от приблизительно 35 до приблизительно 65% воды по весу от веса композиции; от приблизительно 10 до приблизительно 40% масляного компонента по весу от веса композиции; от приблизительно 1 до приблизительно 9% компонента эмульгатора по весу от веса композиции; от приблизительно 10 до приблизительно 35% компонента растворителя по весу от веса композиции; от приблизительно 0,05 до приблизительно 5% компонента стабилизатора по весу от веса композиции и от приблизительно 0,5 до приблизительно 2,0% соединения настоящего изобретения или его фармацевтически приемлемой соли по весу от веса композиции, считая на свободное основание. В некоторых вариантах воплощения масляный компонент включает одно или более веществ, независимо выбранных из петролатумов,жирных спиртов, минеральных масел, триглицеридов и диметиконов; компонент эмульгатора включает одно или более веществ, независимо выбранных из глицериновых эфиров жирных кислот и сорбитовых эфиров жирных кислот; компонент растворителя включает одно или более веществ, независимо выбранных из алкиленгликолей и полиалкиленгликолей; и компонент стабилизатора включает одно или более веществ, независимо выбранных из полисахаридов. В некоторых вариантах воплощения масляный компонент включает одно или более веществ, независимо выбранных из таких веществ,как белый вазелин, цетиловый спирт, стеариловый спирт, легкое минеральное масло, триглицериды со средней длиной цепи и диметикон; компонент эмульгатора включает одно или более веществ, независимо выбранных из глицерилстеарата и полисорбата 20; компонент растворителя включает одно или более веществ, независимо выбранных из пропиленгликоля и полиэтиленгликоля; и компонент стабилизатора включает ксантановую смолу. В некоторых вариантах воплощения фармацевтическая композиция включает от приблизительно 35 до приблизительно 65% воды по весу от веса композиции; от приблизительно 2 до приблизительно 15% компонента окклюзивного агента по весу от веса композиции; от приблизительно 2 до приблизительно 8% компонента загустителя по весу от веса композиции; от приблизительно 5 до приблизительно 15% компонента смягчающего агента по весу от веса композиции; от приблизительно 1 до приблизительно 9% компонента эмульгатора по весу от веса композиции; от приблизительно 0,05 до приблизительно 5% компонента стабилизатора по весу от веса композиции; от приблизительно 10 до приблизительно 35% компонента растворителя по весу от веса композиции; и от приблизительно 0,5 до приблизительно 2,0% соединения настоящего изобретения или его фармацевтически приемлемой соли по весу от веса композиции, считая на свободное основание. В некоторых вариантах воплощения компонент окклюзивного агента включает петролатум; компонент загустителя включает одно или более веществ, независимо выбранных из одного или более жирных спиртов; смягчающий компонент включает одно или более веществ, независимо выбранных из минеральных масел и триглицеридов; компонент эмульгатора включает одно или более веществ, независимо выбранных из глицериновых эфиров жирных кислот и сорбитовых эфиров жирных кислот; компонент стабилизатора включает одно или более веществ, независимо выбранных из полисахаридов; и компонент растворителя включает одно или более веществ, независимо выбранных из алкиленгликолей и полиалкиленгликолей. В некоторых вариантах воплощения компонент окклюзивного агента включает белый вазелин; компонент загустителя включает одно или более веществ, независимо выбранных из цетилового спирта и стеарилового спирта; смягчающий компонент включает одно или более веществ, независимо выбранных из легкого ми- 11020494 нерального масла, триглицеридов со средней длиной цепи и диметикона; компонент эмульгатора включает одно или более веществ, независимо выбранных из глицерилстеарата и полисорбата 20; компонент стабилизатора включает ксантановую смолу и компонент растворителя одно или более веществ, независимо выбранных из пропиленгликоля и полиэтиленгликоля. В некоторых вариантах воплощения фармацевтическая композиция дополнительно включает компонент антимикробного консерванта. В некоторых вариантах воплощения компонент антимикробного консерванта присутствует в количестве от приблизительно 0,05% до приблизительно 3% по весу от веса композиции. Выражение "компонент антимикробного консерванта", используемое в настоящем изобретении, означает вещество или смесь веществ, которые ингибируют рост микробов в композиции. В некоторых вариантах воплощения компонент антимикробного консерванта включает одно или более веществ, независимо выбранных из алкилпарабенов и феноксиэтанола. В некоторых вариантах воплощения компонент антимикробного консерванта включает одно или более веществ, независимо выбранных из метилпарабена, пропилпарабена и феноксиэтанола. В некоторых вариантах воплощения фармацевтический препарат дополнительно содержит компонент хелатного агента. Выражение "компонент хелатного агента", используемое в настоящем изобретении, означает вещество или смесь веществ, которые способны образовывать сильные связи с ионами металлов. В некоторых вариантах воплощения компонент хелатного агента включает динатрия эдетат. Выражение "% по весу от веса композиции", используемое в настоящем изобретении, означает концентрацию компонента в композиции, рассчитанную в весовых процентах, то есть % (вес компонента)/(вес композиции). Например, 1% компонента А по весу от веса композиции = [(масса компонента А)/(общая масса композиции)] 100. Используемое в настоящем изобретении выражение "% по весу от веса композиции, считая на свободное основание" для соединения настоящего изобретения или его фармацевтически приемлемой соли означает, что концентрацию в весовых процентах рассчитывают, исходя из веса чистого, то есть свободного основания соединения настоящего изобретения по отношению ко всей композиции,В некоторых вариантах воплощения компоненты присутствуют в точно указанных диапазонах (например, термин "приблизительно" не употребляется). В некоторых вариантах воплощения термин "приблизительно" означает плюс или минус 10% от указанного значения. Как было показано, некоторые компоненты фармацевтических композиций, описанные здесь, могут обладать разными функциями. Например, данное вещество может действовать как компонент эмульгатора и стабилизатор. В некоторых таких случаях функцию данного компонента можно считать единственной, даже, если его свойства позволяют использовать этот компонент, как многофункциональный. В некоторых вариантах воплощения каждый компонент композиции включает в себя разные вещества или смесь веществ. Термин "компонент", используемый в настоящем изобретении, означает одно вещество или смесь веществ. Термин "жирная кислота", используемый в настоящем изобретении, относится к алифатической кислоте - насыщенной и ненасыщенной. В некоторых вариантах воплощения под жирной кислотой понимают смесь различных жирных кислот. В некоторых вариантах воплощения жирная кислота содержит в среднем от приблизительно восьми до приблизительно тридцати атомов углерода. В некоторых вариантах воплощения жирная кислота имеет, в среднем, от приблизительно 12 до 20, 14-20 или 16-18 атомов углерода. Соответствующие жирные кислоты включают, но, не ограничиваясь, цетиловую кислоту, стеариновую кислоту, лауриновую кислоту, миристиновую кислоту, эруковую кислоту, пальмитиновую кислоту, пальмитолеиновую кислоту, капроновую кислоту, каприловую кислоту, олеиновую кислоту, линолевую кислоту, линолеиновую кислоту, гидроксистеариновую кислоту, 12-гидроксистеариновую кислоту, цетостеариновую кислоту, изостеариновую кислоту, сесквиолеиновую кислоту, сескви-9 октадекановую кислоту, сесквиизооктадекановую кислоту, бегеновую кислоту, изобегеновую кислоту и арахидоновую кислоту или смеси этих кислот. Термин "жирный спирт", используемый в настоящем изобретении, относится к алифатическому спирту - насыщенному или ненасыщенному. В некоторых вариантах воплощения жирным спиртом является смесь различных жирных спиртов. В некоторых вариантах воплощения жирный спирт имеет в среднем от приблизительно 12 до приблизительно 20, от приблизительно 14 до приблизительно 20 или от приблизительно 16 до приблизительно 18 атомов углерода. Соответствующие жирные спирты включают,но, не ограничиваясь, стеариловый спирт, лауриловый спирт, пальмитиловый спирт, цетиловый спирт,каприловый спирт, каприлиловый спирт, олеиловый спирт, линолениловый, арахидоновый спирт, бегениловый спирт, изобегениловый спирт, селахиловый спир, химиловый и линолеиловый спирт или смеси этих спиртов. Термин "полиалкиленгликоль", который используется здесь один или в сочетании с другими тер- 12020494 минами, относится к полимеру, содержащему оксиалкиленовые мономерные единицы, или сополимеру,содержащему разные оксиалкиленовые мономерные единицы, где алкиленовая группа имеет от 2 до 6, от 2 до 4 или от 2 до 3 атомов углерода. Термин "оксиалкилен", который используется здесь один или в сочетании с другими терминами, относится к группе формулы - О-алкилен-. В некоторых вариантах воплощения полиалкиленгликоль является полиэтиленгликолем. Термин "сорбитовый эфир жирной кислоты", используемый в настоящем изобретении, включает продукты, полученные взаимодействием жирных кислот и сорбита или сорбитола и, как вариант, полимер на основе этиленгликоля, содержащий сорбитовые эфиры, и полиэтоксилированные сорбитовые эфиры. В некоторых вариантах воплощения сорбитовым эфиром жирной кислоты является полиэтоксилированный сорбитовый эфир. Термин "сорбитовый эфир", используемый в настоящем изобретении,относится к соединению или смеси соединений, полученных по реакции этерификации сорбитола и, по меньшей мере, одной жирной кислоты. Жирные кислоты, используемые для получения сорбитовых эфиров, включают, но, не ограничиваясь, кислоты, описанные в настоящем документе. Соответствующие сорбитовые эфиры включают, но, не ограничиваясь, эфиры марки Span (компании Uniqema), которые включают Span 20 (сорбитан монолаурат), 40 (сорбитан монопальмитат), 60 (сорбитан моностеарат), 65(сорбитан тристеарат), 80 (сорбитан моноолеат), и 85 (сорбитан триолеат). Другие подходящие сорбитовые эфиры включают эфиры, перечисленные в публикации R. С. Rowe and P. J. Shesky, Handbook ofpharmaceutical excipients, (2006), 5th ed., включенной путем ссылки в полном объеме. Используемый здесь термин "полиэтоксилированный сорбитовый эфир жирной кислоты" относится к соединению или смеси соединений, полученных путем этоксилирования сорбитового эфира жирной кислоты. Полиоксиэтиленовая часть в соединении может находиться между сложноэфирной группой и группой, принадлежащей сорбиту. В некоторых вариантах воплощения полиоксиэтиленовая часть соединения или смеси имеет от приблизительно 2 до приблизительно 200 оксиэтиленовых единиц. В некоторых вариантах воплощения полиоксиэтиленовая часть соединения или смеси имеет от приблизительно 2 до приблизительно 100 оксиэтиленовых единиц. В некоторых вариантах воплощения полиоксиэтиленовая часть соединения или смеси имеет от приблизительно 4 до приблизительно 80 оксиэтиленовых единиц. В некоторых вариантах воплощения полиоксиэтиленовая часть соединения или смеси имеет от приблизительно 4 до приблизительно 40 оксиэтиленовых единиц. В некоторых вариантах воплощения полиоксиэтиленовая часть соединения или смеси имеет от приблизительно 4 до приблизительно 20 оксиэтиленовых единиц. Соответствующие поли этоксилированные сорбитовые эфиры жирных кислот включают, но, не ограничиваясь, соединения марки Tween (компании Uniqema), которые включают Tween 20 (РОЕ(20) сорбитан монолаурат), 21 (РОЕ(4) сорбитан монолаурат), 40 (РОЕ(20) сорбитан монопальмитат), 60 (РОЕ(20) сорбитан моностеарат), 60K (РОЕ(20) сорбитан моностеарат), 61 (РОЕ(4) сорбитан моностеарат), 65 (РОЕ(20) сорбитан тристеарат), 80 (РОЕ(20) сорбитан моноолеат), 80K (РОЕ(20) сорбитан моноолеат), 81 (РОЕ(5) сорбитан моноолеат) и 85 (РОЕ(20) сорбитан триолеат). Аббревиатура "РОЕ" относится к полиоксиэтилену. Число после аббревиатуры РОЕ относится к числу оксиэтиленовых повторяющихся единиц в соединении. Другие подходящие полиэтоксилированные сорбитовые эфиры жирных кислот перечислены в публикации R. С. Rowe and P. J. Shesky, Handbook of pharmaceutical excipients,(2006), 5th ed., включенной путем ссылки в полном объеме. В некоторых вариантах воплощения полиэтоксилированным сорбитовым эфиром жирной кислоты является полисорбат. В некоторых вариантах воплощения полиэтоксилированным сорбитовым эфиром жирной кислоты является полисорбат 20. Используемый здесь термин "глицериновые эфиры жирных кислот" относится к моно-, ди- или триглицеридам жирных кислот. Глицериновые эфиры жирных кислот могут быть, как вариант, замещены сульфоновыми кислотными группами или их фармацевтически приемлемыми солями. Соответствующие жирные кислоты для получения глицеридов жирных кислот включают, но, не ограничиваясь,вышеописанные кислоты. В некоторых вариантах воплощения глицериновым эфиром жирной кислоты является моноглицерид жирной кислоты, содержащей 12-18 атомов углерода. В некоторых вариантах воплощения глицериновым эфиром жирной кислоты является стеарат глицерина. Используемый здесь термин "триглицериды" относится к триглицериду жирной кислоты. В некоторых вариантах воплощения триглицеридом являются триглицериды со средней длиной цепи. Используемый здесь термин "алкиленгликоль" относится к группе формулы -О-алкилен-, где алкиленовая группа имеет от 2 до 6, от 2 до 4 или 2-3 атома углерода. В некоторых вариантах воплощения алкиленгликолем является пропиленгликоль (1,2-пропандиол). Используемый здесь термин "полиэтиленгликоль" относится к полимеру, содержащему этиленгликольные мономерные единицы формулы -О-СН 2-СН 2-. Соответствующие полиэтиленгликоли могут иметь свободную гидроксильную группу на каждом конце полимерной молекулы или могут иметь одну или более гидроксильных групп, этерифицированных низшим алкилом, метильной группой. Также используются производные полиэтиленгликолей, которые имеют этерифицированные карбоксильные группы. Полиэтиленгликоли, используемые в настоящем изобретении, могут быть полимерами с цепью любой длины или полимерами любого молекулярного веса и могут включать разветвление цепи. В некоторых вариантах воплощения средний молекулярный вес полиэтиленгликоля находится в диапазоне от приблизительно 200 до приблизительно 9000. В некоторых вариантах воплощения средний молекуляр- 13020494 ный вес полиэтиленгликоля находится в диапазоне от приблизительно 200 до приблизительно 5000. В некоторых вариантах воплощения средний молекулярный вес полиэтиленгликоля находится в диапазоне от приблизительно 200 до приблизительно 900. В некоторых вариантах воплощения средний молекулярный вес полиэтиленгликоля равен приблизительно 400. Соответствующие полиэтиленгликоли включают,но, не ограничиваясь, полиэтиленгликоль-200, полиэтиленгликоль-300, полиэтиленгликоль-400, полиэтиленгликоль-600 и полиэтиленгликоль-900. Число после дефиса означает средний молекулярный вес полимера. Фармацевтические композиции, представляющие собой эмульсию (крем) типа масло-в-воде можно получить путем использования верхнеприводной мешалки с лопастями с высоким и низким сдвигом. Например, в некоторых вариантах воплощения композиции можно синтезировать по следующей процедуре. 1. Фазу, содержащую часть антимикробного консерванта, можно приготовить путем смешения части компонента антимикробного консерванта с частью компонента растворителя. 2. Далее фазу, содержащую стабилизатор, готовят путем смешения компонента стабилизатора с частью компонента растворителя. 3. Масляную фазу готовят путем смешения смягчающего компонента, компонента эмульгатора,компонента окклюзивного агента и компонента загустителя. Масляную фазу нагревают при температуре 70-80 С до расплавления и образования однородной смеси. 4. Затем водную фазу готовят путем смешения очищенной воды, оставшегося количества компонента растворителя и компонента хелатного агента. Фазу нагревают до температуры 70-80 С. 5. Водную фазу, полученную на стадии 4, антимикробный консервант, полученный на стадии 1, и соединение настоящего изобретения или его фармацевтически приемлемую соль соединяют вместе с образованием смеси. 6. Затем фазу, содержащую стабилизатор из стадии 2, добавляют к смеси, полученной на стадии 5. 7. Затем масляную фазу из стадии 3 соединяют со смесью, полученной на стадии 6, и перемешивают мешалкой с лопастью с высоким сдвигом с образованием эмульсии. 8. И, наконец, в эмульсию, полученную на стадии 7, можно добавить дополнительный компонент антимикробного консерванта. Перемешивание продолжают, а затем продукт охлаждают при перемешивании мешалкой с низким сдвигом. Количество соединения или композиции, вводимое пациенту, будет меняться в зависимости от того, что вводят, для чего вводят, то есть с целью профилактики или лечения, а также в зависимости от состояния пациента, способа введения и тому подобное. В терапевтических целях, композиции могут вводиться уже заболевшему пациенту в количестве, достаточном для лечения или, по крайней мере, частично для задержки в развитии симптомов болезни и ее осложнений. Эффективные дозы будут зависеть от состояния пациента, подлежащего лечению, а также от решения, принимаемого лечащим врачом в зависимости от таких факторов, как тяжесть заболевания, возраст, вес, общее состояние больного, и тому подобное. Композиции, вводимые пациенту, могут быть в виде фармацевтической композиции, описанной выше. Эти композиции можно стерилизовать обычными способами стерилизации или путем стерилизующей фильтрации. Водные растворы могут быть упакованы для дальнейшего использования, так как они есть или лиофилизованы, и лиофилизованный препарат соединяют со стерильным водным носителем перед введением пациенту. рН приготовленной композиции обычно находится в диапазоне от 3 до 11, более предпочтительно от 5 до 9 и наиболее предпочтительно от 7 до 8. Следует иметь в виду, что использование некоторых из вышеизложенных наполнителей, носителей или стабилизаторов приводит к образованию фармацевтических солей. Терапевтическая доза соединения настоящего изобретения может варьировать в зависимости от,например, конкретного заболевания, способа введения соединения, здоровья и состояния пациента, и решения врача. Доля или концентрация соединения настоящего изобретения в фармацевтической композиции может варьировать в зависимости от ряда факторов, включая дозировку, химические свойства (например, гидрофобность) и способ введения. Например, соединение настоящего изобретения можно получить в водном физиологическом буферном растворе, содержащем от приблизительно 0,1 до приблизительно 10% (вес./об.) соединения для парентерального введения. Некоторые типичные диапазоны дозы находятся в пределах от приблизительно 1 мг/кг до приблизительно 1 г/кг массы тела в день. В некоторых вариантах воплощения диапазон доз составляет от приблизительно 0,01 до приблизительно 100 мг/кг массы тела в день. Дозировка, вероятно, зависит от таких переменных, как тип и степень прогрессирования заболевания или нарушения, общее состояние здоровья конкретного пациента, относительная биологическая эффективность выбранного соединения, состав наполнителя и способ введения. Эффективные дозы можно экстраполировать, исходя из кривых доза-реакция, полученных при изучении in vitro или при анализе тест-систем экспериментальных моделей на животных. Композиции настоящего изобретения могут также включать один или несколько дополнительных фармацевтических агентов, таких как химиотерапевтические, стероидные, противовоспалительные со- 14020494 единения или иммунодепрессанты, примеры которых приведены выше. Меченые соединения и способы анализа Другой аспект настоящего изобретения относится к меченым соединениям данного изобретения (с радиоактивной меткой, флуоресцентной меткой и т.д.), которые м огут быть полезны не только в рентгеновских исследованиях, но также при анализах как in vitro, так и in vivo, для локализации и количественного определения янус-киназы в образцах тканей, включая ткани человека, и для выявления лиганд янускиназы путем ингибирования связывания меченого соединения. Таким образом, настоящее изобретение включает анализы янус-киназ, которые содержат такие меченые соединения. Настоящее изобретение также включает изотопно-меченые соединения данного изобретения. "Изотопно-" или "радиомеченое" соединение - это соединение настоящего изобретения, в котором один или более атомов заменены атомом с атомной массой или массовым числом, которые отличаются от атомной массы или массового числа атома, распространенного в природе. Подходящие радионуклиды, которые могут входить в соединения настоящего изобретения, включают, но, не ограничиваясь, следующие: 2 Н (D для дейтерия), 3 Н (Т для трития), 11 С, 13 С, 14 С, 13N, 15N, 15O,17O,18 О, I8F, 35S, 36Cl,82Br, 75Br, 76Br, 77Br, 123I, 124I, 125I и 131I. Тип радионуклида, который включают в радиомеченые соединения, зависит от конкретного применения радиомеченого соединения. Например, если метят янус-киназу in vitro и проводят конкурентный анализ, то обычно используют соединения, включающие 3 Н, 14 С, 82Br, 125I, 131I, 35S. Для использования в радиовизиографии, как правило, используют 11 С, 18F, 125I,123I,124I,131I, 75Br, 76Br или 77Br. Понятно, что "радиомеченое" или "меченое соединение" - это соединение, которое включает в себя хотя бы один радионуклид. В некоторых вариантах воплощения радионуклид выбирают из группы, состоящей из 3 Н, 14 С, 125I,35S и 82Br. Настоящее изобретение может также включать синтетические способы включения радиоизотопов в соединения данного изобретения. Синтетические способы для включения радиоизотопов в органические соединения хорошо известны в данной области, и специалисты легко выберут способы, применимые для соединений настоящего изобретения. Меченое соединение настоящего изобретения можно использовать при скрининговом анализе для идентификации/оценки соединений. Например, новое синтезированное или идентифицируемое соединение (например, тестируемое соединение) с меткой можно оценить в отношении его способности связывать янус-киназу путем мониторинга изменения концентрации меченого соединения при контактировании с янус-киназой через отслеживание метки. Например, тестируемое (меченое) соединение можно оценить по его способности уменьшать связывание другого соединения, которое связывает янус-киназу известным образом (например, стандартное соединение). Соответственно способность тестируемого соединения конкурировать со стандартным соединением за связывание янус-киназы непосредственно коррелирует с его связывающей способностью. И, наоборот, при некоторых других скрининговых исследованиях в стандартное соединение включают метку, а в тестируемые соединения - нет. Соответственно проводят мониторинг концентрации меченого стандартного соединения с целью оценивания конкуренции между стандартным и тестируемым соединениями и, таким образом, устанавливают относительную связывающую способность исследуемого соединения. Наборы Настоящее изобретение также включает в себя наборы фармацевтических препаратов, которые пригодны, например, при лечении или профилактике заболеваний или расстройств, связанных с янускиназой, таких как рак, которые включают в себя один или несколько контейнеров с фармацевтическими композициями, содержащими терапевтически эффективное количество соединения настоящего изобретения. Такие наборы могут дополнительно включать как вариант один или несколько различных, обычных фармацевтических компонентов, например контейнеры с одним или несколькими фармацевтически приемлемыми носителями, дополнительные контейнеры и т.д., что хорошо понятно специалистам в данной области. В такие наборы также включают инструкции - либо в виде вставок, либо в виде наклеек, с указанием количества компонентов для введения, руководства по назначению и/или руководства для смешения компонентов. Изобретение будет описано подробнее на конкретных примерах. Следующие примеры приводятся для иллюстрации и не предназначены для ограничения настоящего изобретения в любой форме. Специалисты в данной области легко определят несущественные параметры, которые можно изменять или модифицировать без изменения результата. Примеры Пример 1. Соль фосфорной кислоты Фосфат 3-[4-(7 Н-пирроло[2,3-d]пирамидин-4-ил)-1 Н-пиразол-1-ил]октаннитрила Стадия 1: Окт-2-еннитрил К 1,0 М раствору трет-бутоксида калия в тетрагидрофуране (165 мл, 0,165 моль) при температуре 0 С добавляли по каплям раствор диэтилцианометилфосфоната (27 мл, 0,17 моль) в тетрагидрофуране(100 мл). Реакционную массу нагрели до комнатной температуры, а затем снова охладили до 0 С после перемешивания в течение 30 мин. К реакционной смеси добавили раствор гексаналя (18 мл, 0,15 моль) в тетрагидрофуране (150 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Затем смесь охладили водой и экстрагировали этилацетатом (EtOAc). Объединенные органические слои промыли соленым раствором, осушили MgSO4, концентрировали и очищали хроматографией на силикагеле (элюируя 0-15% ЕtOАс в гексане) для получения желаемого продукта (17 г, 92%) в виде смеси циси транс-изомеров. МС (масс-спектрометрия) для CgH14N(M+H)+: рассчитано масса/заряд (m/z) = 124,113; найдено: 124,3. Стадия 2: 3-[4-(7-[2-(триметилсилил)этокси]метил-7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Нпиразол-1-ил]октаннитрил Смесь 4-(1 Н-пиразол-4-ил)-7-[2-(триметилсилил)этокси]метил-7 Н-пирроло[2,3-d]пиримидина,полученного, по сути, как описано в примере 65 в заявке США, номер публикации 2007/0135461 или в международной заявке, номер PCT/US2006/047369 (номер публикации WO 2007/070514); 12 г, 0,038 моль), окт-2-еннитрила (6,0 г, 0,049 моль) и 1,8-диазобицикло[5.4.0]ундец-7-ена (ДБУ, 4,6 мл, 0,030 моль) в ацетонитриле (120 мл, 2,3 моль) перемешивали при комнатной температуре всю ночь. После концентрирования в вакууме полученный остаток очищали хроматографией на силикагеле (элюируя 040% EtOAc в гексане), чтобы получить желаемый продукт (15 г, 89,89%). Энантиомеры (время удержания первого пика 11,02 мин, время удержания второго пика 14,10 мин) разделяли на колонке ChiralCelOD-H (30250 мм, 5 мкм), элюируя подвижной фазой, содержащей 15% этанола и 85% гексана при скорости 25 мл/мин. МС для C23H35N6OSi(M+H)+: рассчитано m/z = 439,264; найдено: 439,4. 1 Н NMR (300 MHz, CDCl3)8.91 (1 Н, s), 8.38 (1 Н, s), 8.37 (1H, s), 7.46 (1H, d, J = 3.8 Hz), 6.86 (1 Н,d, J = 3.8 Hz), 5.73 (2H, s), 4.59 (1H, m), 3.60 (2H, t, J = 8.3 Hz), 3.06 (2H, td, J = 16.8 и 7.5 Hz), 2.21 (1H, m),2.01 (1H, m), 1.40-1.21 (6H, m), 0.98 (2H, t, J = 8.3 Hz), 0.91 (3H, t, J = 6.3 Hz), 0.00 (9H, s) ppm. Стадия 3. 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрил К раствору 3-[4-(7-[2-(триметилсилил)этокси]метил-7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Нпиразол-1-ил]октаннитрила (13 г, 0,030 моль) (пик 2 из хирального разделения на стадии 2) в ацетонитриле (200,0 мл, 3,829 моль) и воде (16,0 мл, 0,888 моль, 8% ацетонитрил/вода) добавили тетрафторборат лития (28,4 г, 0,297 моль). Реакционную смесь нагревали с обратным холодильником при 100 С в течение ночи. Смесь охладили и при комнатной температуре добавили 7,2 М раствор гидроксида аммония в воде (17 мл, 0,12 моль) порциями в течение 5 мин, регулируя рН до 9-10 при перемешивании в течение 2 ч. Твердое вещество удалили фильтрацией, фильтрат разбавили ацетонитрилом, водой и МеОН и очищали на препаративной колонке LCMS (XBridge C18 Column, элюируя градиентом ацетонитрил/вода, содержащим 0,15% NH4OH), чтобы получить желаемый продукт (5,9 г, 64%). МС для C17H21N6(M+H)+: рассчитано m/z = 309,183; найдено: 309,3. 1 Н NMR (300 MHz, DMSO-D6)12.10 (1 Н, s), 8.78 (1H, s), 8.66 Стадия 4. Фосфат 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1H-пиразол-1-ил]октаннитрила К раствору 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрила (из стадии 3,4,50 г, 0,0146 моль) в изопропиловом спирте (80 мл, 1 моль) добавили фосфорную кислоту (1,43 г, 0,0146 моль) в изопропиловом спирте (5,0 мл), поддерживая температуру раствора 60 С. Соль фосфорной кислоты выпала в осадок. Дальнейшее нагревание не оказало влияние на растворение. После охлаждения до комнатной температуры соль фосфорной кислоты отфильтровали, высушили на воздухе, затем промыли небольшим количеством диэтилового эфира и снова высушили на воздухе. МС для основания(1H, m), 0.78 (3H, t, J = 6.8 Hz). 99,9% чистоты продукта было достигнуто за счет трехразовой прогонки через обращенно-фазовую колонку ВЭЖХ (HPLC) и 99,7% энантиомерной чистоты продукта получено путем шести разных прогонов через хиральную колонку ВЭЖХ. Пример 2. Фосфат 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрила Стадия 1. Гепт-2-еннитрил К 1,00 М раствору трет-бутоксида калия в тетрагидрофуране (49,3 мл, 49,3 ммоль) при 0 С добавляли по каплям раствор диэтилцианометилфосфоната (8,37 мл, 51,7 ммоль) в тетрагидрофуране (63 мл). Реакционную смесь нагрели до комнатной температуры, а затем снова охладили до 0 С. К реакционной смеси добавили раствор пентаналя (5,0 мл, 47 ммоль) в тетрагидрофуране (12,6 мл). Реакционную смесь нагрели до комнатной температуры и перемешивали всю ночь. После охлаждения водой смесь экстрагировали эфиром. Объединенные органические слои промыли соленым раствором, осушили и выпарили досуха. Эту сырьевую смесь использовали непосредственно на следующей стадии. ЖХМС (жидкостная хроматомасс-спектрометрия) для C7H12N(M+H)+: рассчитано m/z = 110,1; найдено: 110,3. Стадия 2. 3-[4-(7-[2-(триметилсилил)этокси]метил-7 Н-пирроло[2,3-d]пиримидин-4-ил)-1Hпиразол-1-ил]гептаннитрил К раствору 4-(1 Н-пиразол-4-ил)-7-[2-(триметилсилил)этокси]метил-7 Н-пирроло[2,3d]пиримидина (6,1 г, 19 ммоль) в ацетонитриле (58 мл) добавили неочищенный гепт-2-еннитрил (2,6 г, 23 ммоль), а затем 1,8-диазабицикло[5.4.0]ундец-7-ен (3,49 мл, 23,4 ммоль). Полученную смесь перемешивали при комнатной температуре в течение выходных, а затем выпарили досуха. Остаток очищали хроматографией на силикагеле, элюируя 0-50% этилацетатом в гексане с получением целевого продукта(6,90 г, 84%). ЖХМС для C22H33N6OSi(M+H)+: рассчитано m/z = 425,2; найдено: 425,4. Рацемическую смесь разделяли на колонке OD-H (325 см, 5 мкм), элюируя смесью из 15% этанола и 85% гексана при скорости потока 28 мл/мин, чтобы получить два желаемых энантиомера. Время удержания первого пика составило 9,46 мин; время удержания второго пика - 12,35 мин. Стадия 3. 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрил В 500-мл круглодонную колбу, снабженную мешалкой, обратным холодильником и входом для подачи азота добавили ацетонитрил (58 мл), воду (5,0 мл), 3-[4-(7-[2-(триметилсилил)эпокси]метил-7 Нпирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрил (2-ой пик из хирального разделения в стадии 2; 3,50 г, 8,24 ммоль) и тетрафторборат лития (7,88 г, 82,4 ммоль). Смесь нагревали с обратным холодильником в течение ночи. К реакционной смеси добавили порциями 7,2 М раствор гидроксида ам- 17020494 мония (4,3 мл, 31 ммоль) в воде в течение 5 мин при комнатной температуре, доводя рН до 9-10. Полученную реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Твердое вещество удалили фильтрацией, а фильтрат очищали на колонке RP-HPLC (колонка XBridge С 18; 30100 мм 5 мкм); с объемом введенной пробы 5 мл и скоростью потока 60 мл/мин; при градиенте вода - ацетонитрил и 0,15% NH4OH), чтобы получить желаемый продукт (1,79 г, 74%). ЖХМС для C16H19N6(M+H)+: рассчитано m/z = 295.2; найдено: 295,2. Стадия 4. Фосфат 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрила К раствору 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрила (0,363 г, 1,23 ммоль) в изопропиловом спирте (8,0 мл) добавили фосфорную кислоту (0,133 г, 1,36 ммоль) в 1,0 мл изопропилового спирта при 60 С. Смесь нагревали при 60 С в течение 1 ч, затем охладили до комнатной температуры. Осадок отфильтровали и высушили на воздухе, промыли этиловым эфиром, а затем высушили на воздухе для получения желаемой соли фосфорной кислоты (418 мг, 86,5%). 1 Н NMR (DMSO-d6, 400 MHz)12.10 (1 Н, s), 8.78 (1H, s), 8.66 (1H, s), 8.36 (1H, s), 7.58 (1H, m), 6.97(3H, t, J = 7.2 Hz) ppm. Пример А: Анализ янус-киназы in vitro Соединения настоящего изобретения испытывали на ингибирующую активность в отношении мишеней янус-киназы в соответствии со следующим анализом in vitro, описанным в публикации Park et. al,"Analytical Biochemistry", 1999, 269, 94-104. Каталитические домены человеческой His-меченой янускиназы JAK-1 (а.а. 837-1142), JAK-2 (а.а. 828-1132) и JAK-3 (а.а. 781-1124) с N-терминалом экспрессировали в системе бакуловирус и очищали. Каталитическую активность JAK-1, JAK-2 и JAK-3 оценивали путем измерения фосфорилирования биотинилированного пептида. Фосфорилированный пептид обнаруживали с помощью гомогенной флуоресценции с разрешением по времени (HTRF). Величину IC50 измеряли для каждой киназы в реакциях объемом 40 мкл, содержащих энзим, АТФ и 500 нМ пептид в 50 мМ Трис-буфере (рН 7,8) с 100 мМ NaCl, 5 мМ ДТТ (дитиотреитол) и 0,1 мг/мл (0,01%) BSA (бычий сывороточный альбумин). Концентрация АТФ в реакциях составляла 90 мкМ для Jakl, 30 мкМ для Jak2 и 3 мкМ для Jak3. Реакции проводили при комнатной температуре в течение одного часа, затем обрывали добавлением 20 мкл 45 мМ ЭДТК (этилендиаминтетрауксусной кислоты), 300 нМ стрептавидинааллофикоцианина (SA-APC), 6 нМ Eu-Ру 20 в аналитическом буферном растворе (Perkin Elmer, Boston,MA). Привязывание к меченому европием антителу происходило в течение 40 мин, а сигнал HTRF замеряли на сканирующем спектрофотометре для прочтения планшетов Fusion (Perkin Elmer, Boston, MA). Соединения предлагаемого изобретения оказались мощными ингибиторами янус-киназы. В примере 1 установлено, что энантиомер, полученный из пика 2 стадии хирального разделения, обладает величиной IC50 меньшей, чем 10 нМ для JAK2. Соль фосфорной кислоты (фосфат) того же энантимера оказалась такой же активной. Также для примера 1 было установлено, что энантиомер, полученный из пика 1 стадии хирального разделения, обладает величиной IC50 меньшей, чем 10 нМ для JAK2, хотя он не был таким же мощным, как другой энантиомер. Таблица Пример В. Клеточный анализ Линии раковых клеток, зависимые от цитокинов и, следовательно, от сигнальной трансдукцииJAK/STAT, для роста (например, INA-6), высевают при плотности 6000 клеток в каждую ячейку (96 ячейчной пластины) в среде RPMI 1640, содержащей 10% ФБС (фетальная бычья сыворотка) и 1 нг/мл соответствующего цитокина. Соединения добавляют к клеткам в ДМСО/среде (конечная концентрация ДМСО 0,2%) и инкубируют в течение 72 ч при температуре 37 С, 5% СО 2. Действие соединения на жизнеспособность клеток оценивают с помощью люминесцентного анализа жизнеспособности клетокCellTiter-Glo (Promega) с последующим количественным анализом TopCount (Perkin Elmer, Boston, MA). Потенциальные неспецифичные эффекты соединений измеряют параллельно, используя линию клеток необработанных янус-киназ с аналогичным считыванием показаний анализа. Все эксперименты, как правило, выполняли дважды. Вышеуказанные линии клеток используют для анализа влияния соединений на фосфорилирование янус-киназ или таких потенциально нижележащих субстратов, как белки STAT, Akt, Shp2 или Erk. Эти эксперименты выполняют после голодания цитокинов в течение целой ночи после краткой предварительной инкубации с соединением (2 ч или менее) и стимуляции цитокинов в течение примерно 1 ч или меньше. Затем белки извлекают из клеток и анализируют с помощью способов, известных в данной области, включая вестерн-блоттинг или иммуноферментный анализ (ИФА или ELISA), используя антитела,которые могут различать фосфорилированный и общий белок. В этих экспериментах нормальные или раковые клетки используют для исследования активности соединений в отношении биологии выживания опухолевых клеток или медиаторов воспалительных заболеваний. Например, что касается последних, то такие цитокины, как IL-6, IL-12, IL-23 или IFN используют, чтобы стимулировать активацию янускиназы, что в результате приводит к фосфорилированию белка(-ов) STAT и потенциально к транскрипционным факторам (оцениваемым технологией массивов или технологией qPCR) или получению и/или выделению таких белков, как IL-17. Способность соединений ингибировать эти промежуточные эффекты цитокинов измеряют с помощью способов, известных в данной области. Соединения настоящего изобретения можно проверить на клеточных моделях, предназначенных для оценивания их эффективности и активности против мутантных янус-киназ, например мутацииJAK2V617F, обнаруженной при миелопролиферативных заболеваниях. В этих экспериментах часто используют цитокинзависимые клетки гематологических линий (например, BaF/3), в которых янус-киназы дикого типа или мутантные янус-киназы эктопически экспрессированы (публикация James С. et al. Nature 434:1144-1148; публикация Staerk J. et al. JBC 280:41893-41899). Конечные показатели включают влияния соединений на выживаемость клеток, пролиферацию и фосфорилированные янус-киназы, белки STAT,Akt или Erk. Соединения настоящего изобретения можно оценить по их активности ингибировать пролиферации Т-клеток. Такой анализ можно считать дополнительным анализом пролиферации, активированной цитокином (то есть янус-киназой), а также упрощенным анализом подавления иммунитета или ингибирования иммунной активности. Ниже кратко приводится пример выполнения таких экспериментов. Моноядерные клетки периферической крови (МКПК) получают из образцов цельной крови человека, используя способ разделения Ficoll Hypaque, а Т-клетки (фракцию 2000) получают из МКПК путем отстаивания. Свежевыделенные Т-клетки человека сохраняют в культивируемой среде (RPMI-растворе 1640 с 10% ФБС, 100% ед./мл пенициллина, 100 мкг/мл стрептомицина) при плотности 2106 клеток/мл при 37 С в течение двух дней. Для анализа пролиферации клеток, стимулированных IL-2, Т-клетки вначале обрабатывают фитогемагглютином (ФГЛ) при конечной концентрации 10 мкг/мл в течение 72 ч. После промывки фосфатно-солевым буферным раствором (ФСБ), 6000 клеток/ячейка высеивают на 96 ячеечный планшет и обрабатывают соединениями при различных концентрациях в культивируемой среде в присутствии 100 ед/мл. IL-2 человека (ProSpec-Tany TechnoGene; Rehovot, Israel). Планшеты инкубируют при температуре 37 С в течение 72 ч, а индекс пролиферации оценивают с помощью люминесцентных реагентов CellTiter-Glo, придерживаясь предложенного протокола производителя (Promega;Madison, WI). Пример С. Противоопухолевая эффективность in vivo Соединения настоящего изобретения можно оценивать с помощью ксенотрансплантантных моделей, в которых опухолевые клетки человека пересаживают иммунодефицитным мышам. Например, онкогенный вариант клеточной линии плазмоцитома INA-6 можно использовать для введения мышам с серьезным комбинированным иммунодефицитом (ТКИД) подкожно (Burger R. et al. Hematol J. 2:42-53,2001). Животные-опухоленосители случайным образом разделяли на две группы - на группу лекарственной терапии и терапии плацебо, а различные дозы соединений можно было вводить обычными способами, включая оральное, внутрибрюшинное введение или непрерывное вливание, используя вживляемые насосы для вливаний. Рост опухоли можно отслеживать с помощью акушерского циркуля. Кроме того,образцы опухоли можно собирать в любое время после начала лечения для проведения анализа, как описано выше (Пример В), чтобы оценить сложные влияния соединений на активность янус-киназы и нижележащих белков сигнальных путей. Кроме того, избирательность соединения можно оценить, используя опухолевые ксенотрансплантантные модели, которые активируются другими известными киназами (например, Bcr-Ab1) такими, как модель опухоли K562. Пример D: Реакция кожной гиперчувствительности замедленного типа у мышей Соединения настоящего изобретения также можно проверить на эффективность (ингибирования мишеней янус-киназы) на тестовой модели реакции кожной гиперчувствительности замедленного типа у мышей, индуцируемой Т-клетками. Реакция кожной гиперчувствительности замедленного типа (ГЗТ) у мышей считается надежной моделью клинических проявлений контактных дерматитов и других Тлимфоцитзависимых иммунологических нарушений кожи, таких как псориаз (Immunol Today. 1998 Jan; 19(l):37-44). У мышиной ГЗТ много общих характеристик с псориазом, в том числе иммунный инфильтрат, сопровождающийся увеличением воспалительных цитокинов и гиперпролиферацией кератиноцитов. Кроме того, многие классы веществ, которые являются эффективными при лечении псориаза в клинике,являются также эффективными ингибиторами реакции ГЗТ у мышей (Agents Actions. 1993 Jan;38(l2):116-21). В первые два дня у лабораторных белых мышей (популяции Balb/c) повышали чувствительность путем местного действия на их бритые брюшки антигена 2,4-динитрофторбензола (ДНФБ). На пятый день толщину ушей измерили обычным микрометром. Результаты этих измерений записали и использовали в качестве исходных. Затем оба уха животных подвергли контрольному заражению путем местного введения ДНФБ в количестве 20 мкл раствора (10 мкл на внутренней ушной раковине и 10 мкл - на внешней) при концентрации 0,2%. Через 24 и 72 ч после заражения толщину ушей измеряли снова. Лечение с помощью тестируемого соединения проводилось в течение фаз повышения чувствительности и проверки иммунной реакции (после заражения) (с первого по седьмой день) или перед и во время фазы проверки иммунной реакции (обычно во второй половине дня с четвертого по седьмой день). Лечение с помощью тестируемого соединения (при различных концентрациях) проводилось либо системно, либо локально (местное применение лечения ушей). На эффективность тестируемого соединения указывает снижение опухоли на ухе по сравнению с ситуацией без лечения. Если соединение вызывает уменьшение опухоли на 20% и более, то оно считается эффективным. В некоторых экспериментах мышей подвергали заражению, но не повышали чувствительность (отрицательный контроль). Ингибирующий эффект (ингибирование активации сигнальной системы JAK-STAT) тестируемого соединения можно подтвердить с помощью иммунно-химического анализа. Активация сигнальных путейJAK-STAT приводит к образованию и транслокации функциональных транскрипционных факторов. Кроме того, приток иммунноцитов и повышенная пролиферация кератиноцитов также должны обеспечить уникальные изменения профиля экспрессии в ухе, которые можно исследовать и оценить количественно. Зафиксированные формалином и запарафиненные образцы уха (собранные после фазы проверки на иммунную реакцию) в модели ГЗТ подвергли иммунногистохимическому исследованию, используя антитела, которые специфически взаимодействуют с фосфорилированными STAT3 (клон 58 Е 12, CellSignaling Technologies). Мышиные уши обрабатывали тестируемым соединением, плацебо или дексаметазоном (клинически эффективным для лечения псориаза) или оставляли без лечения в модели ГЗТ для сравнения. Тестируемое соединение и дексаметазон могут привести к аналогичным транскрипционным изменениям - качественным и количественным, также и тестируемое соединение, и дексаметазон могут уменьшить число инфильтрующих клеток. Как системное применение, так и местное применение тестируемого соединения может давать ингибирующие эффекты, то есть уменьшать число инфильтрующих клеток и ингибировать транскрипционные изменения. Пример Е: Противовоспалительное действие in vivo Соединения настоящего изобретения можно оценивать на моделях с грызунами или моделях без грызунов, предназначенных для воспроизведения реакции на отдельную или сложную опухоль. Например, модели артрита грызунов можно использовать для оценивания терапевтического потенциала соединений, вводимых с профилактической или лечебной целью. Такие модели включают, но, не ограничиваясь, коллаген-индуцированный артрит мышей или крыс, адъювант-индуцированный артрит крыс и коллаген/антитело-индуцированный артрит. Аутоиммунные заболевания включают, но, не ограничиваясь,рассеянный склероз, сахарный диабет I типа, увеоретинит, тиреодит, миастению гравис, иммуноглобулин-нефропатию, миокардит, чувствительность дыхательных путей (астму), туберкулез кожи или колит,которые можно также использовать для оценивания терапевтического потенциала данных соединений. Эти модели положительно зарекомендовали себя в научно-исследовательском сообществе и хорошо знакомы специалистам в данной области (публикация Coligan J.E. et al., Current Protocols in Immunology, vol. 3., Wiley Press.; публикация Winyard, P.G. and Willoughby D.A., Methods in Molecular Biology: vol. 225,Inflammation Protocols., Humana Press, 2003.). Пример F: Животные модели для лечения синдрома сухости глаз, увеита и конъюнктивита Лекарственные средства могут оцениваться с помощью одной или нескольких доклинических моделей синдрома сухости глаз, хорошо знакомым специалистам в этой области, включая, но, не ограничиваясь, модели конканавалина А (ConA) слезной железы кролика, модели скополамина, вводимого мышам(подкожно или трансдермально), модели ботулизма слезной железы мыши или любой из множества аутоиммунных спонтанных моделей грызунов, которые приводят к дисфункции глазных желез (например,NOD-SCID, MRL/lpr или NZB/NZW) (Barabino et al., Experimental Eye Research 2004, 79, 613-621 иSchrader et al., Developmental Opthalmology, Karger 2008, 41, 298-312). Конечные критерии оценки в этих моделях могут включать гистопатологию глазных желез или глаза (роговицы и т.д.) и, возможно, классический тест Ширмера (Schirmer) или его модифицированную версию (Barabino et al.), где измеряют количество выделенных слез. Действие средства можно оценить путем введения средств разными способа- 20020494 ми (например, системное или местное введение), которое можно начать до или после измеримого заболевания. Средства могут оцениваться с помощью одной или нескольких доклинических моделей увеита, хорошо знакомым специалистам в этой области. Они включают, но, не ограничиваясь, экспериментальные модели аутоиммунного увеита и модели увеита, индуцированного эндотоксином. Экспериментальные модели аутоиммунного увеита можно выполнять на кроликах, крысах или мышах, и они могут включать пассивную или активную иммунизацию. Например, любой из антигенов сетчатки можно использовать для повышения чувствительности животных к соответствующему иммуногену, после чего животных можно наглядно стимулировать аналогичным антигеном. Модель увеита, индуцированного эндотоксином, является более острой и включает местное или системное введение липополисахарида в сублетальных дозах. Конечные критерии оценки для обеих моделей могут включать осмотр глазного дна, гистопатологию, помимо всего прочего. Эти модели рассматривает Смит (Smith) с сотрудниками (Immunologyand Cell Biology 1998, 76, 497-512). Действие средства оценивают путем введения средств разными способами (например, системное или местное введение), которое можно начать до или после измеримого заболевания. Некоторые модели,приведенные выше, могут также вызывать склерит/эписклерит, хориоидит, циклит или воспаление радужной оболочки и поэтому используются при исследовании потенциального действия соединений для терапевтического лечения этих заболеваний. Средства также можно оценивать с помощью одной или нескольких доклинических моделей конъюнктивита, хорошо знакомым специалистам в этой области. Они включают, но, не ограничиваясь, модели грызунов, где используют морских свинок, крыс или мышей. Модели с морскими свинками включают модели, в которых используется активная или пассивная иммунизация и/или протоколы иммунной стимуляции антигенами, такими как яичный альбумин или амброзии (представленных в Groneberg D.A., etal., Allergy 2003, 58, 1101-1113). Модели с крысами и мышами аналогичны по общей схеме с моделями с морскими свинками (также рассмотренные Groneberg). Действие средства можно оценивать путем введения средства разными способами (например, системное или местное введение), которое можно начать до или после измеримого заболевания. Конечные к ритерии о ценки таких исследований могут включать,например, гистологический, иммунологический, биохимический или молекулярный анализ глазных тканей, таких как конъюнктивы. Различные модификации настоящего изобретения в дополнение к описанным здесь будут понятны специалистам в данной области из вышеизложенного описания. Такие модификации также попадают в пределы настоящей формулы изобретения. Каждая ссылка, в том числе ссылки на все патенты, патентные заявки и публикации, которые указаны в настоящем документе, включены в настоящую путем ссылки в полном объеме. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, выбранное из группы 3-[4-(7 Н-пиролло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрил и 3-[4-(7 Н-пирролло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрил или их фармацевтически приемлемая соль. 2. Соединение по п.1, отличающееся тем, что является 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Нпиразол-1-ил]октаннитрилом или его фармацевтически приемлемой солью. 3. Соединение по п.1, отличающееся тем, что является (3R)-3-[4-(7 Н-пирроло[2,3-d]пиримидин-4 ил)-1 Н-пиразол-1-ил]октаннитрилом или его фармацевтически приемлемой солью. 4. Соединение по п.1, отличающееся тем, что является (3S)-3-[4-(7 Н-пирроло[2,3-d]пиримидин-4 ил)-1 Н-пиразол-1-ил]октаннитрилом или его фармацевтически приемлемой солью. 5. Соединение по п.1, отличающееся тем, что является фосфатом 3-[4-(7 Н-пирроло[2,3d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрила. 6. Соединение по п.1, отличающееся тем, что является фосфатом (3R)-3-[4-(7 Н-пирроло[2,3d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрила. 7. Соединение по п.1, отличающееся тем, что является фосфатом (3S)-3-[4-(7 Н-пирроло[2,3d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрила. 8. Соединение по п.1, отличающееся тем, что является 3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Нпиразол-1-ил]гептаннитрилом или его фармацевтически приемлемой солью. 9. Соединение по п.1, отличающееся тем, что является (3R)-3-[4-(7 Н-пирроло[2,3-d]пиримидин-4 ил)-1 Н-пиразол-1-ил]гептаннитрилом или его фармацевтически приемлемой солью. 10. Соединение по п.1, отличающееся тем, что является (3S)-3-[4-(7 Н-пирроло[2,3-d]пиримидин-4 ил)-1 Н-пиразол-1-ил]гептаннитрилом или его фармацевтически приемлемой солью. 11. Соединение по п.1, отличающееся тем, что является фосфатом 3-[4-(7 Н-пирроло[2,3d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрила. 12. Соединение по п.1, отличающееся тем, что является фосфатом (3R)-3-[4-(7 Н-пирроло[2,3- 21020494d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрила. 13. Соединение по п.1, отличающееся тем, что является фосфатом (3S)-3-[4-(7 Н-пирроло[2,3d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрила. 14. Композиция, обладающая JAK ингибирующей активностью, включающая соединение или соль по любому из пп.1-4 и 8-10 или соль любого из пп.5-7 и 11-13, а также по меньшей мере один фармацевтически приемлемый носитель. 15. Композиция по п.14, отличающаяся тем, что является пригодной для местного введения. 16. Композиция по п.14, отличающаяся тем, что является пригодной для трансдермального введения. 17. Композиция по п.16 в форме трансдермального пластыря, мази, лосьона, крема или геля. 18. Способ лечения поражения кожи у пациента, включающий введение указанному пациенту терапевтически эффективного количества соединения или соли по любому из пп.1-4 и 8-10 или соли по любому из пп.5-7 и 11-13. 19. Способ по п.18, отличающийся тем, что упомянутое поражение кожи является атопическим дерматитом или псориазом. 20. Способ по п.18, отличающийся тем, что упомянутое кожное поражение является повышенной чувствительностью кожи, раздражением кожи, кожной сыпью, контактным дерматитом или аллергическим контактным дерматитом. 21. Способ по п.18, где поражение кожи является псориазом. 22. Способ получения соли фосфорной кислоты соединения формулы III где R1 обозначает Н или метил, включающий объединение соединения формулы III с фосфорной кислотой в растворителе при температуре выше чем приблизительно 20 С. 23. Способ по п.22, отличающийся тем, что он является способом получения фосфата 3-[4-(7 Нпирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]октаннитрила. 24. Способ по п.22, отличающийся тем, что он является способом получения фосфата 3-[4-(7 Нпирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]гептаннитрила. 25. Способ по любому из пп. 22-24, отличающийся тем, что растворитель является органическим растворителем. 26. Способ по п.25, отличающийся тем, что указанным органическим растворителем является спирт. 27. Способ по п.26, отличающийся тем, что спирт выбирают из группы, включающей метанол, этанол, изопропанол и бутанол. 28. Способ по любому из пп.22-24, отличающийся тем, что объединение проводят при температуре выше приблизительно 60 С.
МПК / Метки
МПК: A61P 29/00, A61P 35/00, A61K 31/519, C07D 487/04, A61P 27/02, A61P 17/00
Метки: 3-[4-(7h-пирроло[2,3-d]пиримидин-4-ил)-1h-пиразол-1-ил]октан, jak-ингибиторы, гептаннитрил
Код ссылки
<a href="https://eas.patents.su/23-20494-3-4-7h-pirrolo23-dpirimidin-4-il-1h-pirazol-1-iloktan-ili-geptannitril-kak-jak-ingibitory.html" rel="bookmark" title="База патентов Евразийского Союза">3-[4-(7h-пирроло[2,3-d]пиримидин-4-ил)-1h-пиразол-1-ил]октан- или гептаннитрил как jak-ингибиторы</a>
Предыдущий патент: Сернистый цементный продукт
Следующий патент: Расточная головка
Случайный патент: Укрытие перевозимого груза












