Производные индол-пиридона, обладающие ингибиторной активностью в отношении киназы 1, содержащая их фармацевтическая композиция и их применение
Номер патента: 21464
Опубликовано: 30.06.2015
Авторы: Уэбб Пол, Драйсдейл Мартин, Бедфорд Саймон, Фолопп Николас, Фиумана Андреа, Стоукс Стивен
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль

где R1, R2, R5 и R6, каждый, представляют собой водород;
R3 и R4 независимо выбирают из водорода, гидрокси, C1-C3 алкила, фтор-(C1-C3)-алкила, гидрокси-(C1-C3)-алкила, C1-C3 алкокси, фтор-(C1-C3)-алкокси, гидрокси-(C1-C3)-алкокси, -N(R11)-R12, -Alk-N(R11)-R12, -O-Alk-N(R11)-R12, -C(=O)OH, карбокси-(C1-C3)-алкила или -C(=O)-NH-R13;
Alk представляет собой прямую или разветвленную цепь двухвалентного C1-C6 алкиленового радикала;
R7 и R8, оба, представляют собой водород;
X представляет собой прямую цепь двухвалентного C1-C3 алкиленового радикала, необязательно замещенного по одному или большему количеству атомов углерода с помощью R9 и/или R10;
R9 и R10 независимо выбирают из метила, гидрокси или фтора;
R11 представляет собой водород, C1-C3 алкил или фтор-(C1-C3)-алкил и
R12 представляет собой C1-C3 алкил или гидрокси-(C1-C6)-алкил, любой из которых может быть необязательно замещен в алкильной части с помощью фенила, C1-C3 алкокси-(C1-C3)-алкила-, галоген-(С1-С4)-алкила, C3-C6 циклоалкила, метилсульфонил-(C1-C3)-алкила или -N(R18)-R19;
R13 представляет собой водород, C1-C3 алкил, фтор-(C1-C3)-алкил или радикал формулы -Alk-N(R14)-R15;
R14 и R15 независимо выбирают из водорода, C1-C3 алкила или фтор-(C1-C3)-алкила;
или R11 и R12 или R14 и R15, вместе с атомом азота, к которому они соответственно присоединены, образуют необязательно замещенное от 4- до 6-членное моноциклическое неароматическое гетероциклическое кольцо, имеющее не более чем один дополнительный гетероатом, независимо выбранный из кислорода и азота;
W выбирают из -C(=O)-N(-R16)- или -N(-R17)-C(=O)-;
R16 или R17 выбирают из водорода;
R18 и R19 выбирают из водорода, C1-C3 алкила или фтор-(C1-C3)-алкила или R18 и R19 вместе с атомом азота, к которому они соответственно присоединены, образуют необязательно замещенное, от 4- до 6-членное, моноциклическое гетероциклическое кольцо, имеющее не более чем один дополнительный гетероатом, независимо выбранный из кислорода и азота;
Y представляет собой водород, C1-C3 алкил, C1-C3 алкокси или галоген; и
Q выбирают из необязательно замещенного фенила, необязательно замещенного циклогексила или необязательно замещенного 6-членного моноциклического гетероарильного кольца, содержащего по меньшей мере один атом азота в качестве гертероатома, где необязательный заместитель выбран из (C1-C6)алкила, (C1-C6)алкокси, гидрокси, гидрокси(C1-C6)алкила, меркапто, меркапто(C1-C6)алкила, (C1-C6)алкилтио, галогена (включая фтор и хлор), трифторметила, трифторометокси, нитро, нитрила (-CN), оксо, фенила, -СООН, -COORA, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB,
-SO2NRARB, -NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB, -NHCORA, -NHCOORA,
-NRBCOORA, -NHSO2ORA, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB, -NRACONHRB,
-NHCONRARB или -NRACONRARB, где RA и RB независимо представляют собой (C1-C6)алкильную группу или RA и RB, когда присоединены к одному и тому же атому азота, могут образовывать циклическое аминовое кольцо, такое как морфолиниловое, пиперидиниловое или пиперазиниловое кольцо.
2. Соединение по п.1, где R3 или R4 выбирают из -N(R11)-R12, -Alk-N(R11)-R12 или -O-Alk-N(R11)-R12, где R11 и R12 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное от 5- до 6-членное моноциклическое гетероциклическое кольцо, имеющее не более чем одним дополнительный гетероатом, независимо выбранный из кислорода и азота:
3. Соединение по п.2, где R11 и R12 вместе с атомом азота, к которому они присоединены, образуют пиперидиновое, морфолиновое или пиперазиновое кольцо, необязательно замещенное с помощью C1-C3 алкила, гидрокси-(C1-C3 алкила)- или фтора.
4. Соединение по п.3, где R11 и R12 вместе с атомом азота, к которому они присоединены, образуют пиперидин-1-ил, морфолин-4-ил, пиперазин-1-ил, 1-метилпиперидин-4-ил, 1-метилпиперазин-4-ил или 1-фторпиперидин-4-ил.
5. Соединение по п.1, где R3 или R4 выбирают из -N(R11)-R12, -Alk-N(R11)-R12 или -O-Alk-N(R11)-R12, где R11 и R12 независимо выбирают из метила и этила или R11 представляет собой метил или этил и R12 представляет собой -N(R18)-R19, где R18 и R19 независимо выбирают из метила и этила.
6. Соединение по любому из предыдущих пунктов, где Alk представляет собой -CH2-, -CH2CH2-, -CH2CH2CH2-, -CH2C(CH3)2CH2- или представляет собой двухвалентный радикал формулы (II)
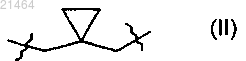
7. Соединение по любому из предыдущих пунктов, где R1, R2, R4, R5 и R6, каждый, представляют собой водород.
8. Соединение по любому из предыдущих пунктов, где Y представляет собой водород или метил.
9. Соединение по любому из предыдущих пунктов, где W представляет собой -NH-C(=O)-, где карбонильная группа связана с пиразольным кольцом.
10. Соединение по любому из предыдущих пунктов, где X представляет собой -CH2-, -CH(CH3)- или -С(CH3)2-.
11. Соединение по любому из предыдущих пунктов, где Q представляет собой необязательно замещенный фенил.
12. Соединение по п.11, где заместитель или заместители на фенильном кольце выбран/выбирают из метила, трифторметила, метокси, фтора, хлора или циано.
13. Соединение по п.11, где Q представляет собой 2-метилфенил, 3-метилфенил, 4-метилфенил, 3-трифторметилфенил, 4-трифторметилфенил, 4-метоксифенил, 2-фторфенил, 3-фторфенил, 4-фторфенил, 3-хлорфенил, 4-хлорфенил, 3-цианофенил, 4-цианофенил, 3,4-дифторфенил, 3,5-дифторфенил или 3-фтор-4-метилфенил.
14. Соединение по любому из пп.1-10, где Q представляет собой циклогексил или пирид-3-ил.
15. Соединение по п.1, где
R1, R2, R4, R5, R6, R7 и R8, каждый, представляют собой водород;
Y представляет собой водород или метил;
W представляет собой -NH-C(=O)-, где карбонильная группа связана с пиразольным кольцом;
R3 представляет собой -N(R11)-R12, -Alk-N(R11)-R12 или -O-Alk-N(R11)-R12;
R11 и R12 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное от 5- до 6-членное моноциклическое гетероциклическое кольцо, имеющее не более чем один дополнительный гетероатом, независимо выбранный из кислорода и азота; или R11 и R12 независимо выбирают из метила и этила; или R11 представляет собой метил или этил и R12 представляет собой -N(R18)-R19, где R18 и R19 независимо выбирают из метила и этила;
Alk представляет собой -CH2-, -CH2CH2-, -CH2CH2CH2-, -CH2C(CH3)2CH2- или представляет собой двухвалентный радикал формулы (II):

X представляет собой -CH2-, -CH(CH3)- или -С(CH3)2-; и
Q представляет собой фенил, необязательно замещенный с помощью одного или двух заместителей, выбранных из C1-C3 алкила, фтор-(C1-C3)алкила, C1-C3 алкокси, фтор-(C1-C3)алкокси, галогена и циано.
16. Соединение по п.15, где R11 и R12 вместе с атомом азота, к которому они присоединены, образуют пиперидиновое, морфолиновое или пиперазиновое кольцо, необязательно замещенное с помощью C1-C3 алкила или фтора.
17. Соединение, выбранное из группы, состоящей из следующих соединений:
1-бензил-1H-пиразол-4-карбоновой кислоты [5-(1H-индол-2-ил)-6-оксо-1,6-дигидропиридин-3-ил]амид,
1-(4-метилбензил)-1H-пиразол-4-карбоновой кислоты [6-оксо-5-(5-пиперидин-1-илметил-1H-индол-2-ил)-1,6-дигидропиридин-3-ил]амид,
1-бензил-1H-пиразол-4-карбоновой кислоты {5-[5-(4-фторпиперидин-1-илметил)-1H-индол-2-ил]-6-оксо-1,6-дигидропиридин-3-ил}амид,
1-бензил-1H-пиразол-4-карбоновой кислоты [6-оксо-5-(5-пиперидин-1-илметил-1H-индол-2-ил)-1,6-дигидропиридин-3-ил]амид,
1-бензил-1H-пиразол-4-карбоновой кислоты {5-[5-(цис-2,6-диметилморфолин-4-илметил)-1H-индол-2-ил]-6-оксо-1,6-дигидропиридин-3-ил}амид,
1-бензил-1H-пиразол-4-карбоновой кислоты {5-[5-(4-метилпиперидин-1-илметил)-1H-индол-2-ил]-6-оксо-1,6-дигидропиридин-3-ил}амид,
1-(1-фенилэтил)-1H-пиразол-4-карбоновой кислоты {5-[5-(4-фторпиперидин-1-илметил)-1H-индол-2-ил]-6-оксо-1,6-дигидропиридин-3-ил}амид,
1-бензил-1H-пиразол-4-карбоновой кислоты {5-[5-(3-диметиламино-2,2-диметилпропокси)-1H-индол-2-ил]-6-оксо-1,6-дигидропиридин-3-ил}амид,
1-((R)-1-фенилэтил)-1H-пиразол-4-карбоновой кислоты {5-[5-(цис-2,6-диметилморфолин-4-илметил)-1H-индол-2-ил]-6-оксо-1,6-дигидропиридин-3-ил}амид,
1-бензил-1H-пиразол-4-карбоновой кислоты {5-[5-((S)-2-метилпиперидин-1-илметил)-1H-индол-2-ил]-6-оксо-1,6-дигидропиридин-3-ил}амид,
1-бензил-1H-пиразол-4-карбоновой кислоты {5-[5-((R)-2-метилпиперидин-1-илметил)-1H-индол-2-ил]-6-оксо-1,6-дигидропиридин-3-ил}амид,
1-бензил-1H-пиразол-4-карбоновой кислоты [5-(5-{[(3-диметиламино-2,2-диметилпропил)этил-амино]метил}-1Н-индол-2-ил)-6-оксо-1,6-дигидропиридин-3-ил]амид,
1-бензил-1H-пиразол-4-карбоновой кислоты {5-[5-(цис-2,6-диметилпиперидин-1-илметил)-1H-индол-2-ил]-6-оксо-1,6-дигидропиридин-3-ил}амид,
1-бензил-1Н-пиразол-4-карбоновой кислоты {5-[5-(3-диэтиламино-2,2-диметилпропокси)-1H-индол-2-ил]-6-оксо-1,6-дигидропиридин-3-ил}амид,
1-бензил-1H-пиразол-4-карбоновой кислоты {5-[5-(2-диметиламино-1,1-диметилэтокси)-1H-индол-2-ил]-6-оксо-1,6-дигидропиридин-3-ил}амид,
1-бензил-1H-пиразол-4-карбоновой кислоты {5-[5-(2,2-диметил-3-пирролидин-1-илпропокси)-1H-индол-2-ил]-6-оксо-1,6-дигидропиридин-3-ил}амид,
1-бензил-1H-пиразол-4-карбоновой кислоты {5-[5-(2,2-диметил-3-пиперидин-1-илпропокси)-1H-индол-2-ил]-6-оксо-1,6-дигидропиридин-3-ил}амид,
1-бензил-1H-пиразол-4-карбоновой кислоты {5-[5-(1-диэтиламинометилциклопропилметокси)-1H-индол-2-ил]-6-оксо-1,6-дигидропиридин-3-ил}амид,
и их фармацевтически приемлемых солей.
18. Фармацевтическая композиция, обладающая ингибиторной активностью в отношении киназы CHK1, содержащая соединение по любому из предыдущих пунктов и один или большее число фармацевтически приемлемых носителей и/или наполнителей.
19. Композиция по п.18, которая дополнительно содержит цитотоксический или цитостатический агент.
20. Применение соединения по любому из пп.1-17 для лечения состояний, чувствительных к ингибированию активности белка киназы.
21. Применение по п.20, отличающееся тем, что белок киназы представляет собой CHK1.
22. Применение по п.20 или 21, отличающееся тем, что состояние, чувствительное к ингибированию активности белка киназы или CHK1, выбирают из рака и аутоиммунных заболеваний.
23. Применение по п.22, отличающееся тем, что указанное аутоиммунное заболевание представляет собой отторжение трансплантата органа, волчанку, рассеянный склероз, ревматоидный артрит и остеоартрит.
24. Применение по п.22, при котором состояние представляет собой рак.
25. Применение по п.22, предназначенное для лечения рака путем введения в комбинации с радиотерапией или химиотерапией.
26. Способ лечения млекопитающих, страдающих от состояния, чувствительного к ингибированию активности белка киназы, включающий введение млекопитающему соединения по любому из пп.1-17, в количестве, эффективном для ингибирования активности белка киназы у млекопитающего.
27. Способ по п.26, отличающийся тем, что белок киназы представляет собой CHK1.
28. Способ по п.26 или 27, отличающийся тем, что состояние, чувствительное к ингибированию активности белка киназы или CHK1, выбирают из рака и аутоиммунных заболеваний.
29. Способ по п.28, отличающийся тем, что указанное аутоиммунное заболевание представляет собой отторжение трансплантата органа, волчанку, рассеянный склероз, ревматоидный артрит и остеоартрит.
30. Способ по п.28, в котором состояние представляет собой рак.
31. Способ по п.28 для лечения рака путем введения в комбинации с радиотерапией или химиотерапией.
Текст
ПРОИЗВОДНЫЕ ИНДОЛ-ПИРИДОНА, ОБЛАДАЮЩИЕ ИНГИБИТОРНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ КИНАЗЫ 1, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ Описываются соединения формулы (I), имеющее ингибиторную активность киназы 1 (CHK1) контрольной точки: где R1, R2, R5 и R6 каждый представляет собой водород; R3 и R4 независимо выбирают из водорода, гидрокси, C1-C3 алкила, фтор-(C1-C3)-алкила, гидрокси-(C1-C3)-алкила, C1-C3 алкокси,фтор-(C1-C3)-алкокси, гидрокси-(C1-C3)-алкокси, -N(R11)-R12, -Alk-N(R11)-R12, -O-Alk-N(R11)-R12,-C(=O)OH, карбокси-(C1-C3)-алкила или -C(=O)-NH-R13; Alk представляет собой прямую или разветвленную цепь двухвалентного C1-C6 алкиленового радикала; R7 и R8 оба представляют собой водород; X представляет собой прямую цепь двухвалентного C1-C3 алкиленового радикала,необязательно замещенного по одому или большему количеству атомов углерода с помощьюR9 и/или R10; W выбирают из -С(=О)-N(-R16)- или -N(-R17)-C(=O)-; Y представляет собой водород, C1-C3 алкил, C1-C3 алкокси или галоген; и Q выбирают из необязательно замещенного фенила, необязательно замещенного циклогексила или необязательно замещенного 6-членного моноциклического гетероарильного кольца. Изобретение относится к индолилпиридоновым производным, обладающим ингибиторной активностью касательно киназы 1 (CHK1), для использования указанных соединений в медицине, особенно в отношении лечения рака, через ингибирование аберрантного размножения клетки и к фармацевтическим композициям, содержащим такие соединения. Уровень техники Многие стандартные противоопухолевые агенты действуют в основном через их способность индуцировать повреждение ДНК, вызывая ингибирование роста опухоли. Тем не менее, эти агенты вызывают угнетение клеточного цикла посредством индукциии контрольных точек либо в S-фазе, либо в переходе G2-M. Угнетение G2 обеспечивает клетке время на репарацию поврежденной ДНК перед вступлением в митоз.CHK1 и несвязанная серин/треониновая киназа CHK2 играют ключевую роль в угнетении клеточного цикла в переходе G2-M (O'Connell et al EMBO J (1997) vol 16 p545-554).CHK1/2 индуцируют эту контрольную точку посредством фосфорилирования серина в 216 позицииCDC25 фосфатазы, ингибируя удаление двух инактивирующих фосфатов циклин-зависимых киназ(CDKs) (Zheng et al Nature (1998) vol 395 p507-510). Еще один перекрывающийся путь, опосредованный р 53, также вызывает угнетение клеточного цикла в ответ на повреждение ДНК. Однако р 53 мутационным образом инактивируется во многих типах рака, результатом чего является частичный дефицит их способности инициировать реакцию ДНК-репарации. Если активность CHK1 также ингибирована в р 53-негативных раках, вся способность к угнетению и репарации ДНК в ответ на повреждение ДНК теряется, приводя к прекращению митоза и усиливая действие ДНК-повреждающих агентов. (Konarias et al Oncogene (2001) vol 20 p7453-7463, Bunch and Eastman Clin. Can. Res. (1996) vol 2p791-797, Tenzer and Pruschy Curr. Med Chem (2003) vol 3 p35-46). Напротив, нормальные клетки будут относительно интактны из-за задержки компетентного р 53 опосредованного пути угнетения клеточного цикла. Ингибирование контрольных точек повреждения ДНК, таким образом, сенсибилизирует патологически пролиферирующие клетки к ДНК-повреждающим агентам. Такая сенсибилизация, в свою очередь,как ожидается, увеличит терапевтический индекс таких химиотерапевтических агентов или ионизирующего излучения. (Clary, D.O. Inhibition of Chk kinases in a leukemia model abrogates DNA damage checkpoints and promotes mitotic catastrophe. Proc Am Assoc Cancer Res (AACR) 2007, 48: Abst 5385). В связи с этим ожидается, что эффективные ингибиторы CHK1 приведут к соответствующему существенному улучшению эффективности текущих химиотерапевтических режимов, вызывающих повреждение ДНК (Sausville et al, J. Clinical Oncology (2001) vol19 p2319-2333). Многие из предполагаемых ингибиторов CHK1 в настоящее время находятся в I фазе клинических испытаний, включая XL-844 (двойной CHK1/CHK2 ингибитор для лечения лимфомы и солидных опухолей), PF 00477736 (Фаза I Исследование PF-00477736 с гемцитабином у больных с распространенными солидными злокачественными опухолями)AZD7762 (Фаза I открытое многоцентровое исследование увеличения дозы, для оценки безопасности переносимости и фармакокинетики AZD7762, примененного как единственное внутривенное средство и в комбинации с еженедельной стандартной дозой гемцитабина у больных с распространенными солидными злокачественными опухолями). Таким образом, остается актуальной медицинская потребность в низкомолекулярных ингибиторахCHK1 с фармакокинетическими и фармакодинамическими свойствами, делающими их подходящими для использования в качестве фармацевтических агентов. Объектом настоящего изобретения является обеспечение таких фармацевтических агентов и способов лечения. Как было показано, определенные производные индолил-пиридона проявляют эффективность как ингибиторы CHK1. Сущность изобретения Изобретение относится к классу замещенных индолилпиридоновых соединений, полезных в качестве CHK1 ингибиторов, например, для лечения рака. Ядро индолилпиридоновой модели, с замещением по пиридоновой части с помощью замещенной пиразолиламидо-связанной группы, представляет собой принцип, характеризующий особенности соединений, с которыми связано изобретение. Подробное описание изобретения В соответствии с настоящим изобретением предлагается соединение формулы (I) или его фармацевтически приемлемая соль: где R1, R2, R5 и R6, независимо выбирают из водорода, гидрокси, метила, трифторметила, гидроксиметила, метокси, трифторометокси, метиламино и диметиламино;R3 и R4, независимо выбирают из водорода, гидрокси, C1-C3 алкила, фтор-(C1-C3)-алкила, гидрокси(C1-C3)-алкила, C1-C3 алкокси, фтор-(C1-C3)-алкокси, гидрокси-(C1-C3)-алкокси, -N(R11)-R12, -Alk-N(R11)R12, -O-Alk-N(R11)-R12, -C(=O)OH, карбокси-(C1-C3)-алкила или -C(=O)-NH-R13;Alk представляет собой прямую или разветвленную цепь двухвалентного C1-C6 алкиленового радикала;R7 и R8 независимо выбирают из водорода, гидрокси или C1-C3 алкокси;X представляет собой прямую цепь двухвалентного C1-C3 алкиленового радикала, необязательно замещенного по одому или большему количеству атомов углерода с помощью R9 и/или R10;R9 и R10 независимо выбирают из метила, гидрокси или фтора;R12 представляет собой C1-C3 алкил или гидрокси-(C1-C6)-алкил, любой из которых может быть необязательно замещен на алкильную часть с помощью фенила, C1-C3 алкокси-(C1-C3)-алкила, галоген-(C1C4)-алкила, C3-C6 циклоалкила, метилсульфонил-(С 1-C3)-алкила или -N(R18)-R19;R13 представляет собой водород, C1-C3 алкил, фтор-(C1-C3)-алкил или радикал формулы -Alk-N(R14)R15;R14 и R15 независимо выбирают из водорода, C1-C3 алкила или фтор-(C1-C3)-алкила; илиR11 и R12 или R14 и R15, вместе с атомом азота, к которому они соответственно присоединены, образуют необязательно замещенное, от 4- до 6-членное, моноциклическое гетероциклическое кольцо, имеющее не более, чем три дополнительных гетероатома, независимо выбранных из кислорода, серы и азота;R18 и R19 выбирают из водорода, C1-C3 алкила или фтор-(C1-C3)-алкила или R18 и R19 вместе с атомом азота, к которому они соответственно присоединены, образуют необязательно замещенное, от 4- до 6 членное, моноциклическое гетероциклическое кольцо, имеющее не более, чем три дополнительных гетероатома, независимо выбранных из кислорода, серы и азота;Q выбирают из необязательно замещенного фенила, необязательно замещенного циклогексила или необязательно замещенного 6-членного моноциклического гетероарильного кольца. Активные соединения формулы (I) представляют собой ингибиторы CHK1 и являются полезными для лечения, предупреждения и подавления пролиферативного заболевания, такого как рак в комбинации с радиотерапией или химиотерапией. В соответствии с дальнейшим воплощением настоящее изобретение обеспечивает применение соединения формулы (I) или его фармацевтически приемлемой соли при получении лекарственного препарата для увеличения терапевтического эффекта от радиоционной или химиотерапии при лечения рака. В соответствии с дальнейшим воплощением настоящее изобретение обеспечивает способ лечения рака, включающий введение субъекту, нуждающемуся в таком лечении, эффективной дозы соединения формулы (I) или его фармацевтически приемлемой соли. В соответствии с дальнейшим воплощением настоящее изобретение обеспечивает фармацевтическую композицию, содержащую соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Терминология Как используют в настоящем описании, термин "(Ca-Cb)алкил", где а и b являются целыми числами,относится к прямой или разветвленной цепи алкильного радикала, имеющего от а до b атомов углерода. Таким образом, когда а равен 1 и b равен 6, например, термин включает метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор.-бутил, трет-бутил, н-пентил и н-гексил. Как используют в настоящем описании, термин "двухвалентный (Ca-Cb)алкиленовый радикал", где а и b являются целыми числами, относится к насыщенной углеводородной цепи, имеющей от а до b атомов углерода и две ненасыщенные валентности, такие как -CH2-, -CH2CH2-, -CH2CH2CH2-, CH2CH(CH3)CH2-и -CH2C(CH3)2CH2-. Во избежании неясности, должно быть понятно, что двухвалентная разветвленная цепь (Ca-Cb)алкиленового радикала включает те, в которых один из атомов углерода углеводородной цепи представляет собой углеродное кольцо циклоалкильного кольца (то есть представляет Как используют в настоящем описании, термин "фтор-(Ca-Cb)-алкил", где а и b являются целыми числами, относится к прямой или разветвленной цепи алкильного радикала, имеющего от а до b атомов углерода, замещенных с помощью одного или большего числа атомов фтора. Термин включает, например, фторметил, дифторметил и трифторметил. Как используют в настоящем описании, термин "циклоалкил" относится к насыщенному карбоциклическому радикалу, имеющему от 3-8 атомов углерода и включает, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Как используют в настоящем описании, термин "карбоциклический" относится к моно- или бициклическому радикалу, в котором все атомы кольца предсталяют собой атом углерода и включает моноциклические арильные, циклоалкильные и циклоалкенильные радикалы, при условии, что ни одно присутствующее кольцо не имеет более чем 8 кольцевых членов. "Карбоциклическая" группа включает моно-мостиковую или мультимостиковую циклическую алкильную группу. Как используют в настоящем описании, термин "арил" относится к моно-, би- или трициклическому карбоциклическому ароматическому радикалу. Иллюстрацией таких радикалов являются фенил, бифенил и нафтил. Как используют в настоящем описании, термин "гетероарил" относится к моно-, би-или трициклическому ароматическому радикалу, содержащему один или большее число гетероатомов, выбранных изS, N и О. Иллюстрацией таких радикалов являются тиенил, бензтиенил, фурил, бензфурил, пирролил,имидазолил, бензимидазолил, тиазолил, бензтиазолил, изотиазолил, бензизотиазолил, пиразолил, оксазолил, бензоксазолил, изоксазолил, бензизоксазолил, изотиазолил, триазолил, бензтриазолил, тиадиазолил,оксадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, триазинил, индолил и индазолил. Как используют в настоящем описании, неограниченный термин "гетероциклил" или "гетероциклический" включает термин "гетероарил", как определено выше, и, в частности, относится к моно-, би- или три-циклическому неароматическому радикалу, содержащему один или большее число гетероатомов,выбранных из S, N и О, в группе, состоящей из моноциклического неароматического радикала, содержащего один или большее число таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом и с моно-, би- или трициклическим неароматическим радикалом, содержащим один или большее число гетероатомов, выбранных из S, N и О, который является мономостиковым или мультимостиковым. Иллюстрацией таких радикалов являются пирролил, фуранил, тиенил, пиперидинил, имидазолил, оксазолил, изоксазолил, тиазолил, тиадиазолил,пиразолил, пиридинил, пирролидинил, пиримидинил, морфолинил, пиперазинил, индолил, морфолинил,бензфуранил, пиранил, изоксазолил, бензимидазолил, метилендиоксифенил, этилендиоксифенил, малеимидо и сукцинимидо группы. Если иное не определено в контексте, в котором он встречается, термин "замещенный", как используют в любой части настоящего описания, означает замещенный с помощью по крайней мере одного заместителя, например, выбранного из (C1-C6)алкила, (C1-C6)алкокси, гидрокси, гидрокси(C1-C6)алкила,меркапто, меркапто(C1-C6)алкила, (C1-C6)алкилтио, галогена (включая фтор и хлор), трифторметила,трифторометокси, нитро, нитрила (-CN), оксо, фенила, -СООН, -COORA, -CORA, -SO2RA, -CONH2,-SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB, -NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA ,-OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA, -NHSO2ORA, -NRBSO2ORA, -NHCONH2, -NRACONH2,-NHCONHRB, -NRACONHRB, -NHCONRARB или -NRACONRARB, где RA и RB независимо представляют собой (C1-C6)алкильную группу или RA и RB, когда присоединены к одному и тому же атому азота, могут образовывать циклическое аминовое кольцо, такое как морфолиниловое, пиперидиниловое или пиперазиниловое кольцо. "Необязательный заместитель" или "заместитель" может быть одним из вышеупомянутого заместителя группы. Как используют в настоящем описании, термин "соль" включает основно-аддитивные, кислотноаддитивные и четвертичные соли. Соединения по изобретению, которые являются кислотными, могут образовывать соли, включая фармацевтически или ветеринарно-приемлемые соли, с основаниями, такими как гидроксиды щелочных металлов, например гидроксиды натрия и калия, гидроксиды щелочноземельных металлов, например гидроксиды кальция, бария и магния, с органическими основаниями, например N-этилпиперидином, дибензиламином и им подобными. Эти соединения (I), которые являются основными, могут образовывать соли, включая фармацевтически или ветеринарно-приемлемые соли с неорганическими кислотами, например с гидрогалоидными кислотами, такими как соляная или бромистоводородная кислоты, серная кислота, азотная кислота или фосфорная кислота и им подобные и с органическими кислотами, например с уксусной, винной, янтарной, фумаровой, малеиновой, оксиянтарной,салициловой, лимонной, метансульфоновой и п-толуолсульфоновой кислотами и им подобные. Для просмотра подходящих солей, см. Handbook of Pharmaceutical Salts: Properties, Selection, and ват", как используют в настоящем описании, описывает молекулярный комплекс, включающий соединение по изобретению и стехиометрическое количество одного или большего числа фармацевтически приемлемых молекул растворителя, например этанол. Термин "гидрат" применяют, когда указанный растворитель является водой. Любую ссылку в настоящем описании на соединение формулы(I) понимают как включающую такие гидраты и сольваты. Соединения, с которыми изобретение связано, могут существовать в одной или большем количестве стереоизомерных форм, поскольку присутствие асиммеричных атомов или ратационных ограничений может существовать как ряд стереоизомеров с R или S стереохимией по каждому хиральному центру или как атропизомеры с R или S стереохимией на каждой хиральной оси. Изобретение включает все такие энантиомеры и диастереомеры и их смеси. Так называемые "пролекарства" соединений формулы (I) находятся также в границах изобретения. Таким образом, определенные производные соединений формулы (I), которые могут иметь небольшую или не иметь фармакологическую активность, сами, когда их вводят в организм или на местно, могут быть превращены в соединения формулы (I), имеющие требуемую активность, например, с помощью гидролизного расщепления. Такие производные относятся к "пролекарствам". Дальнейшая информация на применение пролекарств может быть найдена в Pro-drugs as Novel Delivery Systems, Vol. 14, ACS(ed. E. B. Roche, American Pharmaceutical Association). Пролекарства в соответствии с изобретением могут, например, быть произведены с помощью замещения подходящих функциональностей, присутствующих в соединениях формулы (I) с определенными остатками, известными среднему специалисту как "прочасти" как описано, например, в Design of Prodrugs by H. Bundgaard (Elsevier, 1985). Также включенными в границы изобретения являются метаболиты соединений формулы (I), которые представляют собой соединения, образованные in vivo при введении лекарства. Некоторые примеры метаболитов включают:(-NHR1-NH2),(v) соединение формулы (I) содержит фенильный остаток, его фенольное производное (-Ph(-CONH2COOH). Переменные заместители, присутствующие в соединениях (I), будут описаны в дальнейшем. Из последующего описания понятно, что любой раскрытый заместитель или класс заместителей может присутствовать в любой комбинации с любым другим раскрытым классом заместителей. Конкретные примеры переменных заместителей включают те, которые присутствуют в соединениях по примерам в настоящем описании. Группы R1 R2, R5 и R6.R1, R2, R5 и R6 независимо выбирают из водорода или небольших заместителей, таких как гидрокси,метил, трифторметил, гидроксиметил, метокси, трифторометокси, метиламино и диметиламино. В настоящее время предпочтительно каждый R1, R2, R5 и R6 представляет собой водород. Группы R3 и R4.R3 и R4 представляют собой водород, гидрокси, C1-C3 алкил, фтор-(C1-C3)-алкил, гидрокси-(С 1-С 3)алкил, C1-C3 алкокси, фтор-(C1-C3)-алкокси, гидрокси-(C1-C3)-алкокси, -N(R11)-R12, -Alk-N(R11)-R12, -OAlk-N(R11)-R12, -C(=O)OH, карбокси-(C1-C3)-алкил или -C(=O)-NH-R13. В некоторых воплощениях изобретения, один из R3 и R4 представляет собой водород и другой выбирают из -N(R11)-R12, -Alk-N(R11)-R12 и -O-Alk-N(R11)-R12, в особенности последние два. В настоящее время предпочтительно то, что R4 является водородом. R11 и R12 вместе с атомом азота, к которому они присоединены, могут образовать необязательно замещенное, от 4- до 6-членное, моноциклическое гетероциклическое кольцо, имеющее не более чем три дополнительных гетероатома, независимо выбранных из кислорода, серы и азота. Предпочтительные структуры включают те, где R11 и R12 вместе с атомом азота, к которому они присоединены, образуют азетидиновое, пирролидиновое, пиперидиновое, морфолиновое или пиперазиновое кольцо, необязательно замещенное с помощью C1-C3 алкила, гидрокси-(C1C3)-алкила, фтора или гидрокси. Особенно предпочтительными являются те соединения, где R11 и R12 вместе с атомом азота, к которому они присоединены, образуют 1-гидроксиазетидин-3-ил, пирролидин 1-ил, пиперидин-1-ил, морфолин-4-ил, пиперазин-1-ил, 1-метилпиперидин-4-ил, 1-фторпиперидин-4-ил,1-гидроксипиперидин-4-ил, 1-(гидроксиметил)пиперидин-4-ил или 1-метилпиперазин-4-ил. В этих под-4 021464 классах Alk может быть, например C1-C6 алкиленом, предпочтительно метиленом или этиленом. В этих подклассах Alk может быть, например -CH2-, -CH2CH2-, -CH2CH2CH2- или -CH2CH(CH3)CH2- или двухвалентной разветвленной цепью алкиленового радикала -CH2C(CH3)2CH2- или формулы (II) В других воплощениях изобретения, один из R3 и R4 представляет собой водород и другой выбирают из -N(R11)-R12, -Alk-N(R11)-R12 и -O-Alk-N(R11)-R12, в особенности последние два, где R11 и R12 независимо выбирают из C1-C3 алкила, например метила и этила или R11 представляет собой C1-C3 алкил, например метил или этил и R12 представляет собой -N(R18)-R19, где R18 и R19 независимо выбирают из C1-C3 алкила, например метила и этила. В этих подклассах также Alk может быть, например -CH2-, -CH2CH2-, CH2CH2CH2- или -CH2CH(CH3)CH2- или предпочтительно двухвалентной разветвленной цепью алкиленового радикала -CH2C(CH3)2CH2- или формулы (II) В других воплощениях изобретения, один из R3 и R4 представляет собой водород и другой выбирают из -N(R11)-R12, -Alk-N(R11)-R12 или -O-Alk-N(R11)-R12, где R11 представляет собой водород или C1-C3 алкил, особенно метил или этил и R12 представляет собой гидрокси-(C1-C6)-алкил, такие как 2 гидроксиэтил. В этих подклассах также Alk может быть, например -CH2-, -CH2CH2-, -CH2CH2CH2- или-CH2CH(CH3)CH2- или предпочтительно двухвалентной разветвленной цепью алкиленового радикалаY представляет собой водород, C1-C3 алкил, C1-C3 алкокси или галоген. Настоящее время предпочтительно то, что Y представляет собой водород, метил, метокси или галоген. Особенно предпочтительными являются те соединения, где Y представляет собой водород или метил. Группа W.W выбирают из -C(=O)-N(-R16)- или -N(-R17)-C(=O)-. R16 и R17 выбирают из водорода C1-C3 алкила,такие как метил и фтор-(C1-C3)-алкил, такие как трифторметил. Предпочтительные структуры включают те, где W представляет собой -C(=O)-NH- (то есть где атом азота связан с пиразольным кольцом или NH-C(=O) то есть, где карбонильная группа связана с пиразольным кольцом), особенно последним. Радикалы R7 и R8.R7 и R8 независимо выбирают из водорода, гидрокси или C1-C3 алкокси. Предпочтительные структуры включают те, где R7 и R8 независимо выбирают из водорода, гидрокси или метокси. Особенно предпочтительными случаями являются те, где один или оба R7 и R8 является/являются водородом. Двухвалентный радикал X.X представляет собой прямую цепь двухвалентного C1-C3 алкиленового радикала, необязательно замещенного одним или большим количеством атомов углерода с помощью R9 и/или R10. R9 и R10 независимо выбирают из метила, гидрокси или фтора. В настоящее время предпочтительным является то, что оба R9 и R10, когда присутсвуют, представляют собой метил. Например, X может быть -CH2-, -CH(CH3)или -С(CH3)2-. Группа Q.Q выбирают из необязательно замещенного фенила, необязательно замещенного циклогексила или необязательно замещенного 6-членного моноциклического гетероарильного кольца. В подклассе соединений, с которыми изобретение связано, Q представляет собой незамещенный или замещенный фенил. Незамещенный фенил в настоящее время является предпочтительным, но когда присутствуют заместители, фенильное кольцо может быть замещено на не более чем два заместетеля,независимо выбранных из C1-C3 алкила, галоген-(C1-C3)алкила, C1-C3 алкокси, галогена или циано. Предпочтительными заместителями являются метил, трифторметил, метокси, фтор, хлор или циано. Предпочтительные структуры включают те, где Q представляет собой 2-метилфенил, 3-метилфенил, 4 метилфенил, 3-трифторметилфенил, 4-трифторметилфенил, 4-метоксифенил, 2-фторфенил, 3-фторфенил,4-фторфенил, 3-хлорфенил, 4-хлорфенил, 3-циано-фенил, 4-цианофенил, 3,4-дифторфенил, 3,5 дифторфенил или 3-фтор-4-метилфенил. В другом подклассе соединений, с которыми изобретение связано, Q представляет собой необязательно замещенный циклогексил. В еще другом подклассе соединений, с которыми изобретение связано, Q представляет собой необязательно замещенное 6-членное моноциклическое гетероарильное кольцо, предпочтительно пиридил,особенно пирид-3-ил или пирид-4-ил. В настоящее время предпочтительным является то, что Q представляет собой фенил, 3-метилфенил,4-метилфенил, 3-трифторметилфенил, 3-фторфенил, 4-фторфенил, 3-хлорфенил, 4-хлорфенил, 3,4 дифторфенил или 3,5-дифторфенил, особенно фенил, 4-метилфенил или 4-хлорфенил. В настоящее время в предпочтительном подклассе соединений формулы (I) изобретения каждый R1,R2, R4, R5, R6, R7 и R8 представляет собой водород; Y представляет собой водород или метил; W представляет собой -NH-C(=O)- где карбонильная группа связана с пиразольным кольцом; R3 представляет собой -N(R11)-R12, -Alk-N(R11)-R12 или -O-Alk-N(R11)-R12; R11 и R12 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное, от 5- до 6-членное, моноциклическое гетероциклическое кольцо, имеющее не более чем три дополнительных гетероатома, независимо выбранных из кислорода, серы и азота. Или R11 и R12 независимо выбирают из метила и этила; Alk представляет собой-С(CH3)2-; и Q представляет собой фенил, необязательно замещенный с помощью одного или двух заместителей, выбранных из C1-C3 алкила, фтор-(C1-C3)алкила, C1-C3 алкокси, фтор-(C1-C3)алкокси, галогена и циано. В этом предпочтительном подклассе, R11 и R12 вместе с атомом азота, к которому они присоединены, могут образовывать пиперидиновое, морфолиновое или пиперазиновое кольцо, необязательно замещенное с помощью C1-C3 алкила или фтора. Кроме того, в этом предпочтительном подклассе Q может быть незамещенным фенилом. Конкретные соединения по изобретению включают соединения по примерам в настоящем описании и их фармацевтически приемлемые соли. Применение Настоящее изобретение может быть использовано в отношении человека или подопытного животного, предпочтительнее млекопитающего, более предпочтительно человека. Используемый здесь термин "лечение" включает профилактическое лечение. Соединения по настоящему изобретению могут применяться в виде монотерапии в лечении рака и аутоиммунных расстройств, таких как отторжение пересаженного органа, волчанка, рассеянный склероз,ревматоидный артрит и остеоартроз. Тем не менее, как объяснялось выше в разделе "уровень техники", главная ценность ингибиторовCHK1, заключается в их способности улучшать эффективность современных химиотерапевтических режимов и лучевой терапии, вызывающих повреждение ДНК, при лечении рака. Соединение формулы (I), таким образом, предпочтительно используется в комбинации для лечения рака с лучевой терапией или одним или более цитотоксическими или цитостатическими препаратами,или препаратами, которые вызывают цитотоксичность или цитостаз. Соединение по изобретению и этот другой компонент могут быть в одном и том же фармацевтическом препарате или в отдельных препаратах для введения одновременно или последовательно. Неограничивающие примеры химиотерапевтических средств, радиотерапевтических агентов и других активных и вспомогательных средств приведены ниже.(v) Алкил-сульфонаты, такие как бусульфан. (vi) Триазины, такие как дакарбазин (DTIC).(vii) Антиметаболиты, такие как аналоги фолиевой кислоты, такие как(xii) Дифференцирующие вещества, такие как производные ретиноевой кислоты.(xxiv) Эпиподофилотоксины, такие как этопозид или тенипозид.(xxxi) Адренокортикальный супрессор митокан (o,p'-DDD) аминоглутетимид.(xxxii) Цитокины, такие как интерферон (, , ) и интерлейкин-2. Следует понимать, что конкретный уровень дозирования для каждого отдельно взятого пациента будет зависеть от множества факторов, включающих активность конкретного используемого соединения, возраст, массу тела, общее состояние здоровья, пол, диету, время введения, путь введения, скорость выведения, лекарственное взаимодействие, а также этиологию и тяжесть конкретного заболевания, подверженного терапии. Как правило, достаточная доза соединений для перорального приема обычно будет в диапазоне от 0,1 до 3000 мг, один, два или три раза в день или эквивалентное суточное количество, введенное посредством инфузии или других путей введения. Тем не менее, оптимальные уровни дозирования и частота дозирования будут определены клиническими испытаниями, как принято в данной специальности. Соединения по изобретению могут быть приготовлены для введения любым путем, соответствующим их фармакокинетическим свойствам. Препараты, назначаемые перорально, могут быть в форме таблеток, капсул, порошков, гранул, пастилок, жидких и гелевых препаратов, таких как пероральные, предназначенные для местного применения или стерильные парентеральные растворы или суспензии. Таблетки и капсулы для перорального приема могут быть в форме однократной дозы и могут содержать обычные наполнители, такие как вяжущие агенты, например сироп, гуммиарабик, желатин, сорбитол, трагакант или поливинил-пирролидон, наполнители, например, лактоза, сахар, кукурузный крахмал, фосфат кальция, сорбитол или глицин, смазывающее вещество для изготовления таблеток, например стеарат магния, тальк, полиэтиленгликоль или силикагель, разрыхлитель, например картофельный крахмал или приемлемые увлажняющие агенты, такие как лаурил сульфат натрия. Таблетки могут быть покрыты в соответствии с методами, которые хорошо известны в обычной фармацевтической практике. Пероральные жидкие препараты могут быть в форме, например, водных или масляных суспензий,растворов, эмульсий, сиропов или эликсиров или могут быть представлены в виде сухого продукта для разведения водой или другим подходящим носителем перед приготовлением. Такие жидкие препараты могут содержать обычные вспомогательные вещества, такие как суспендирующие агенты, например сорбитол, сироп, метилцеллюлоза, сироп глюкозы, пищевые жиры гидрогенизированные желатином, эмульгирующие агенты, например, лецитин, сорбитан моноолеат или гуммиарабик, неводные носители (которые могут включать пищевые жиры), например миндальное масло,фракционированное кокосовое масло, сложные эфиры, такие как глицерин, пропиленгликоль или этанол,консерванты, например, метил или пропил р-гидроксибензоат или сорбиновая кислота, и по необходимости обычные ароматизаторы и красители. Для местного назначения на кожу лекарственный препарат может быть в виде крема, лосьона или мази. Препараты в виде крема или мази, которые могут быть использованы для лекарственного средства,являются обычными препаратами, известными в специальности, например, как описанные в стандартных книгах по фармацевтике, таких как Британская Фармакопея. Активное вещество также может быть назначено парентерально в стерильной среде. В зависимости от носителя и используемой концентрации, лекарство может быть или суспендировано или растворено в этом носителе. Предпочтительно, вспомогательные лекарственные вещества, такие как местный анестетик, стабилизатор или буферные агенты могут быть растворены в этом носителе. Существуют разнообразные синтетические методы для производства соединений (I) по настоящему изобретению, но все они основаны на известных химических принципах, знакомых специалисту в области синтетической органической химии. Таким образом, соединения по формуле (I) могут быть синтезированы согласно методикам, описанным в обычной литературе и хорошо известны среднему специалисту в данной области. Типичными литературными источниками являются "Advanced organic chemistry", 4th Edition (Wiley),J March, "Comprehensive Organic Transformation", 2nd Edition (Wiley), R.C. Larock, "Handbook of Heterocyclic Chemistry", 2nd Edition (Pergamon), A.R. Katritzky), обзоры статей, такие как в "Synthesis", "Acc. Chem.Res.", "Chem. Rev", или первичные литературные источники, обнаруживаемые стандартным поиском литературы в компьютерных сетях или из вторичных источников, таких как "Chemical Abstracts" или"Beilstein". Такие литературные способы включают приведенные здесь подготовительные примеры и методы,аналогичные им. Примеры способов, известных в области органической химии в общем, посредством которых соединения по настоящему изобретению могут быть получены, включены в следующие схемы реакций и методики. Схема 1 Примеры Следующие примеры иллюстрируют получение конкретных соединений по изобретению и не предназначены для ограничения объема изобретения. Пример 1. 5-(1 Н-Индол-2-ил)-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты (1-бензил-1Hпиразол-4-ил)амид Указанное в заголовке соединение получают в соответствии с направлением, обозначенным на схеме 1. Стадия 1. Получение 5-иод-6-(2-триметилсиланилэтокси)никотиновой кислоты метилового эфира(1 а). 6-Гидрокси-5-иодоникотиновой кислоты метиловый эфир (2.0 г, 7.17 ммоль) перемешивают в безводном 1,2-диметоксиэтане (60 мл), при температуре окружающей среды, с фторидом калия (4.17 г, 71.7 ммоль). 2-(Триметилсилил)этоксиметилхлорид (1.20 г, 1.27 мл, 7.17 ммоль) добавляют по каплям и реакционную смесь перемешивают при температуре окружающей среды в течение 3 ч. Реакционную смесь фильтруют через целит и фильтровальную лепешку промывают метанолом (225 мл). Фильтрат и промывки объединяют и концентрируют в вакууме. Остаток распределяют между водой и дихлорметаном и органический слой отделяют. Водный слой экстрагируют дополнительной порцией дихлорметана и объединенные дихлорметановые слои сушат (Na2SO4) и концентрируют в вакууме. Полученный сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя вначале смесью 20% этилацетат/гексан и затем 66% этилацетат / гексан, чтобы вначале получить нежелательное замещенное кислородом соединение и затем требуемое соединение, указанное в заголовке в виде твердого вещества грязно-белого цвета, 2.28 г, 78%. Стадия 2. Получение 2-[5-метоксикарбонил-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-индол-1-карбоновой кислоты трет-бутилового эфира (1b). Промежуточное соединение (1 а), 5-иод-6-(2-триметилсиланилэтокси)-никотиновой кислоты метиловый эфир (1.14 г, 2.79 ммоль), 1-(трет-бутоксикарбонил) индол-2-бороновую кислоту (1.09 г, 4.18 ммоль), дихлорид бис(трифенилфосфин) палладия(II) (0.1 г, 0.143 ммоль), ацетат калия (0.82 г, 8.37 ммоль) и безводный N,N-диметилформамид (15 мл) объединяют в пробирку для микроволнового облучения объемом 20 мл. Содержимое пробирки дегазируют и затем нагревают при температуре 60C в течение 20 мин при микроволновом облучении. Реакционную смесь концентрируют в вакууме. Остаток распределяют между водой и дихлорметаном и органический слой отделяют. Водный слой экстрагируют дополнительной порцией дихлорметана и объединенные дихлорметановые слои сушат (Na2SO4) и концентрируют в вакууме. Полученный сырой продукт очищают с помощью флеш хроматографии на SiO2,элюируя смесью 20% этилацетат/гексан, чтобы получить требуемое соединение, указанное в заголовке в виде масла 1.39 г, 100%. Стадия 3. Получение 2-[5-карбокси-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]индол-1-карбоновой кислоты трет-бутилового эфира (1 с). Промежуточное соединение (1b), 2-[5-метоксикарбонил-2-оксо-1-(2-триметилсиланилэтоксиметил)1,2-дигидропиридин-3-ил]индол-1-карбоновой кислоты трет-бутиловый эфир (2.88 г, 5.78 ммоль) перемешивают в смеси терагидрофурана (40 мл) и воды (20 мл). Добавляют гидроксид лития (0.469 г, 11.2 ммоль) и полученную реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение 2 ч. После охлаждения реакционную смесь концентрируют в вакууме и остаток помещают в воду и значение pH доводят до 5 путем осторожного добавления 2 М водного раствора соляной кислоты. Указанный водный раствор экстрагируют дихлорметаном (3) и объединенные экстракты промывают рассолом, сушат (Na2SO4) и концентрируют в вакууме, чтобы получить требуемое соединение, указанное в заголовке в виде твердого вещества желтого цвета 2.30 г, 85%. Стадия 4. Получение 2-[5-(1-бензил-1H-пиразол-4-илкарбамоил)-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]индол-1-карбоновой кислоты трет-бутилового эфира (1d). Промежуточное соединение (1 с), 2-[5-карбокси-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2 дигидропиридин-3-ил]индол-1-карбоновой кислоты трет-бутиловый эфир (300 мг, 0.62 ммоль), гидрохлорид N-(3-диметиламинопропил)-N-этилкарбодиимида (357 мг, 1.86 ммоль), гидрат 1-гидроксибензотриазола (251 мг, 1.86 ммоль), N,N-диизопропилэтиламин (320 мг, 0.431 мл, 2.48 ммоль), 1-бензил-1Hпиразол-4-иламин (322 мг, 1.86 ммоль) и тетрагидрофуран (12 мл) объединяют в пробирку для микроволнового облучения объемом 20 мл. Содержимое пробирки нагревают при температуре 90C в течение 30 мин при микроволновом облучении. Реакционную смесь концентрируют в вакууме. Остаток распределяют между водой и дихлорметаном и органический слой отделяют. Водный слой экстрагируют до- 15021464 полнительной порцией дихлорметана и объединенные дихлорметановые слои сушат (Na2SO4) и концентрируют в вакууме. Полученный сырой продукт очищают с помощью флеш хроматографии на SiO2,элюируя смесью 20% этилацетат/гексан и затем 2% метанол/дихлорметан, чтобы получить требуемое соединение, указанное в заголовке в виде твердого вещества, 315 мг, 80%. Стадия 5. Получение указанного в заголовке соединения: 5-(1 Н-индол-2-ил)-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты (1-бензил-1H-пиразол-4-ил)амида. Промежуточное соединение (1d), 2-[5-(1-бензил-1H-пиразол-4-илкарбамоил)-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]индол-1-карбоновой кислоты трет-бутиловый эфир(315 мг, 0.492 ммоль) перемешивают в тетрагидрофуране (15 мл) и добавляют 1,2-диаминоэтан (89 мг, 98 мкл, 1.48 ммоль), а затем 1.0 М раствор фторида тетрабутиламмония в тетрагидрофуране (2.46 мл, 2.46 ммоль). Реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 18 ч и охлаждают до температуры окружающей среды. Реакционную смесь концентрируют в вакууме. Остаток распределяют между водой и дихлорметаном и органический слой отделяют. Водный слой экстрагируют дополнительной порцией дихлорметана и объединенные дихлорметановые слои промывают водой (3) сушат (Na2SO4) и концентрируют в вакууме. Полученный сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью дихлорметан - 8% метанол/дихлорметан (градиент), чтобы получить твердое вещество. Указанное твердое вещество растирают в порошок с диэтиловым эфиром, чтобы получить требуемое соединение, указанное в заголовке в виде твердого вещества желтого цвета, 41 мг, 20%.LC/MS: RT = 2.33 мин (270 нм), м/е = 410, 411 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1 Указанное в заголовке соединение получают в соответствии с направлением, обозначенным на схеме 1. Стадия 1. Получение 4-нитро-1H-пиразола (1 е). Пиразол (16 г, 235 ммоль) добавляют порциями к серной кислоте 98%, (100 мл), поддерживая температуру ниже 40C. К указанному раствору добавляют азотную кислоту 70%, (16 мл), поддерживая температуру ниже 55C. После завершения добавления реакционную смесь нагревают при температуре 55C в течение 3 ч и затем охлаждают до температуры 0C, перед осторожным добавлением к смеси воды со льдом (400 мл) при перемешивании. Указанную смесь нейтрализуют путем осторожного добавления 50% водного раствора гидроксида натрия, используя внешнее охлаждение и эффективное перемешивание. Полученный раствор экстрагируют этилацетатом (3300 мл) и объединенные экстракты промывают рассолом (2250 мл), сушат (Na2SO4) и концентрируют в вакууме, чтобы получить на выходе твердое вещество белого цвета, которое используют на следующей стадии без дополнительной очистки,24.74 г, 93%. Стадия 2. Получение 1-(4-метоксибензил)-4-нитро-1H-пиразола. 4-Нитро-1H-пиразол (565 мг, 5 ммоль) перемешивают в ацетонитриле (15 мл) с карбонатом калия(829 мг, 6 ммоль) в течение 5 мин и затем добавляют 4-метоксибензилхлорид (861 мг, 0.746 мл, 5.5 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 18 ч и затем распределяют между этилацетатом и 2 М водным раствором соляной кислоты. Органический слой отделяют и водный раствор экстрагируют дополнительной порцией этилацетата. Объединенные этилацетатные слои сушат (Na2SO4) и концентрируют в вакууме. Полученный сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью 20% этилацетат/гексан и затем 50% этилацетат/дихлорметан, чтобы получить требуемое соединение, указанное в заголовке в виде масла, 1.08 г, 93%. Стадия 3. Получение 1-(4-метоксибензил)-1H-пиразол-4-иламина. 1-(4-Метоксибензил)-4-нитро-1H-пиразол (240 мг, 1.03 ммоль) перемешивают в этаноле (10 мл) и колбу вакуумируют и затем продувают азотом. Добавляют платину, сульфидированную, 5 вес.% на угле,восстановленным, сухим (10 мг, каталитическое количество) и после двух циклов вакуум/Н 2 для замещения азота внутри колбы водородом, смесь встряхивают в течение 18 ч при обычном давлении водорода(1 атм). Реакционную смесь фильтруют и фильтрат концентрируют в вакууме, чтобы получить на выходе масло красного цвета, которое используют на следующей стадии без дополнительной очистки, 168 мг,- 16021464 81%. Стадия 4. Получение 2-[5-[1-(4-метоксибензил)-1H-пиразол-4-илкарбамоил]-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-индол-1-карбоновой кислоты трет-бутилового эфира. Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 1, стадия 4, используя промежуточное соединение (1 с) и 1-(4-метоксибензил)-1Hпиразол-4-иламин. После обычной обработки водного раствора полученный сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью гексан - 50% этилацетат/гексан. Это дает указанное в заголовке соединение в виде твердого вещества виде розового цвета 180 мг, 50%. Стадия 5. Получение указанного в заголовке соединения: 5-(1 Н-индол-2-ил)-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты [1-(4-метоксибензил)-1H-пиразол-4-ил]амид. Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 1, стадия 5 с 2-[5-[1-(4-метоксибензил)-1H-пиразол-4-илкарбамоил]-2-оксо-1-(2 триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]индол-1-карбоновой кислоты трет-бутиловым эфиром. После обычной обработки водного раствора, полученный сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью 50% этилацетат/дихлорметан и затем 5% метанол/дихлорметан, чтобы получить твердое вещество, которое затем очищают с помощью препаративной HPLC при значении pH 9, чтобы получить указанное в заголовке твердое вещество желтого цвета 40 мг, 36%.LC/MS: RT = 2.29 мин (270 нм), м/е = 440 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):3.75 (с, 3H), 5.25 (с, 2H), 6.91-6.95 (м, 2H), 6.98-7.03 (м, 1H), 7.09-7.13 (м,1H), 7.23-7.28 (м, 3H), 7.51 (д, 1H), 7.56 (д, 1H), 7.6 (д, 1H), 8.06 (с, 1H), 8.12 (д, 1H), 8.57 (д, 1H), 10.3 (с,1H), 11.51 (широкий с, 1H), 12.5 (широкий с, 1H). Пример 3. 5-(1 Н-Индол-2-ил)-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты [1-(2-метилбензил)-1H-пиразол-4-ил]амид Указанное в заголовке соединение получают в соответствии с направлением, обозначенным на схеме 2. Стадия 1. Получение 1 Н-пиразол-4-иламина (2f). Промежуточное соединение (1 е), 4-нитро-1H-пиразол (2.8 г, 24.8 ммоль), перемешивают в этаноле(200 мл) и колбу вакуумируют и затем продувают азотом. Добавляют палладий, 10 вес.% на активированном угле (300 мг, каталитическое количество) и после двух циклов вакуум / H2 для замещения азота внутри колбы водородом, смесь встряхивают в течение 18 ч при обычном давлении водорода (1 атм). Добавляют палладий, 10 вес.% на активированном угле (300 мг) и после следующих двух циклов вакуум/H2 для замещения азота внутри колбы водородом, смесь встряхивают в течение еще 4 ч. Реакционную смесь фильтруют через целит и фильтровальную лепешку промывают этанолом (250 мл). Объединенные промывки и фильтрат концентрируют в вакууме. Полученный остаток растирают в порошок с этилацетатом, чтобы получить на выходе твердое вещество светло-розового цвета, 1.48 г, 72%, позже полученный фильтрат концентрируют в вакууме, чтобы получить на выходе другую партию достаточно чистого продукта, 0.54 г, 26%, в виде твердого вещества темно-розового цвета. Стадия 2. Получение 2-[2-оксо-5-(1H-пиразол-4-илкарбамоил)-1-(2-триметилсиланилэтоксиметил)1,2-дигидропиридин-3-ил]индол-1-карбоновой кислоты трет-бутилового эфира (2d). К раствору промежуточного соединения (1 с), 2-[5-карбокси-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]индол-1-карбоновой кислоты трет-бутиловому эфиру, (3 г, 6.2 ммоль) в тетрагидрофуране (100 мл) добавляют промежуточное соединение (2f), 1 Н-пиразол-4-иламин(0.62 г, 7.46 ммоль), гидрат 1-гидроксибензотриазола (1.09 г, 8.07 ммоль), N,N-диизопропилэтиламин (2.4 г, 3.24 мл, 18.6 ммоль) и гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (1.55 г, 8.07 ммоль). Реакционную смесь нагревают при температуре 40C в течение 2 ч. Затем ее охлаждают и распределяют между этилацетатом и насыщенным водным раствором гидрокарбонатом натрия. Этилацетатный слой отделяют и промывают рассолом, сушат (Na2SO4) и концентрируют в вакууме. Полученный сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью гексан - 66% этилацетат / гексан (градиент), чтобы получить требуемое соединение, указанное в заголовке в виде твердого вещества желтого цвета, 1.36 г, 40%. Стадия 3. 2-[5-[1-(2-Метилбензил)-1H-пиразол-4-илкарбамоил]-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-индол-1-карбоновой кислоты трет-бутиловый эфир (2 е). Промежуточное соединение (2d), 2-[2-оксо-5-(1 Н-пиразол-4-илкарбамоил)-1-(2-триметилсиланил- 17021464 этоксиметил)-1,2-дигидропиридин-3-ил]-индол-1-карбоновой кислоты трет-бутиловый эфир (50 мг, 0.091 ммоль), Cs2CO3 (45 мг, 0.136 ммоль) и бромид 2-метилбензила (21 мг, 15 мкл, 0.11 ммоль) перемешивают в N,N-диметилформамиде (5 мл) при температуре окружающей среды в течение 48 ч. Неорганику отделяют путем фильтрования и фильтрат концентрируют в вакууме. Полученный сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью гексан - 50% этилацетат/гексан (градиент), чтобы получить требуемое соединение, указанное в заголовке в виде твердого вещества, 55 мг, 93%. Стадия 4. Получение указанного в заголовке соединения. 5-(1 Н-Индол-2-ил)-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты[1-(2-метилбензил)-1Hпиразол-4-ил]амид. Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 1, стадия 5, используя промежуточное соединение (2 е), 2-[5-[1-(2-метилбензил)-1Hпиразол-4-илкарбамоил]-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]индол-1 карбоновой кислоты трет-бутиловый эфир. После обычной обработки водного раствора, полученный сырой продукт очищают путем растирания в порошок с ацетонитрилом. Это дает указанное в заголовке соединение в виде твердого вещества желтого цвета, 30 мг, 84%.LC/MS: RT = 2.41 мин (270 нм), м/е = 424 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):2.29 (с, 3H), 5.33 (с, 2H), 6.98 (широкий т, 2H), 7.08 (широкий т, 1H), 7.17 Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 2, следуя методикам, аналогичным методикам получения соединений, представленным в примере 3.LC/MS: RT = 2.41 мин (270 нм), м/е = 424 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d4 MeOD):2.30 (с, 3H), 5.28 (с, 2H), 7.05 (м, 5H), 7.15 (с, 1H), 7.22 (т, 1H), 7.42 (д, 1H),7.54 (т, 1H), 7.68 (с, 1H), 8.07 (м, 2H), 8.61 (д, 1H), NHs не отмечен. Пример 5. 5-(1 Н-Индол-2-ил)-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты [1-(4-метилбензил)-1H-пиразол-4-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 2, следуя методикам, аналогичным методикам получения соединений, представленным в примере 3.LC/MS: RT =2.31 мин (270 нм), м/е = 424 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):3.31 (с, 3H), 5.26 (с, 2H), 6.98 (тд, 1H), 7.09 (тд, 1H), 7.15 (широкий с, 4H),7.24 (д, 1H), 7.48 (дд, 1H), 7.54 (д, 1H), 7.58 (д, 1H), 8.05 (с, 1H), 8.01 (широкий с, 1H), 8.55 (д, 1H)10.27 (с,1H), 11.49 (широкий с, 1H), 12.46 (широкий с, 1H). Пример 6. 5-(1 Н-Индол-2-ил)-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты [1-(3-цианобензил)-1H-пиразол-4-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 2, следуя методикам, аналогичным методикам получения соединений, представленным в примере 3.LC/MS: RT = 2.12 мин (270 нм), м/е = 435 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):5.41 (с, 2H), 6.98 (т, 1H), 7.08 (т, 1H), 7.24 (с, 1H), 7.49 (д, 1H), 7.55 (м, 3H),7.63 (с, 1H), 7.69 (с, 1H), 7.78 (дт, 1H), 8.11 (д,1H), 8.19 (с, 1H), 8.55 (д, 1H), 10.35 (с, 1H), 11.52 (с, 1H),- 18021464 Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 2, следуя методикам, аналогичным методикам получения соединений, представленным в примере 3.LC/MS: RT = 2.15 мин (270 нм), м/е = 435 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):5.41 (с, 2H), 6.99 (т, 1H), 7.09 (т, 1H), 7.25 (с, 1H), 7.36 (д, 2H), 7.49 (д, 1H),7.54 (д, 1H), 7.64 (с, 1H), 7.83 (д, 2H), 8.12 широкий м, 1H), 8.19 (с, 1H), 8.55 (д, 1H), 10.33 (с, 1H), 11.50 Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 2, следуя методикам, аналогичным методикам получения соединений, представленным в примере 3.LC/MS: RT = 2.24 мин (270 нм), м/е = 428 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):5.39 (с, 2H), 6.98 (тд, 1H), 7.11 (тд, 1H), 7.21 (м, 4H), 7.37 (м, 1H), 7.48 (д,1H), 7.54 (д, 1H), 7.61 (д, 1H), 8.11 (м, 2H), 8.55 (д, 1H), 10.30 (с, 1H), 11.49 (широкий с, 1H), 12.47 (широкий с, 1H). Пример 9. 5-(1H-Индол-2-ил)-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты [1-(3-фторбензил)1H-пиразол-4-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 2, следуя методикам, аналогичным методикам получения соединений, представленным в примере 3.LC/MS: RT = 2.24 мин (270 нм), м/е = 428 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):5.35 (с, 2H), 6.98 (т, 1H), 7.04 (м, 5H), 7.24 (широкий с, 1H), 7.40 (qd, 1H),7.48 (д, 1H), 7.54 (д, 1H), 7.62 (с, 1H), 8.11 (д, 1H), 8.14 (с, 1H), 8.55 (д, 1H), 10.30 (широкий с, 1H), 11.53 Указанное в заголовке соединение получают простых изменений способов, представленных в примере 3, но тем не менее используя направление, представленное на схеме 2. Проводят модификацию для стадии 3, и она описана ниже. 2-[2-Оксо-5-(1 Н-пиразол-4-илкарбамоил)-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин 3-ил]индол-1-карбоновой кислоты трет-бутиловый эфир, (2d), (100 мг, 0.182 ммоль) перемешивают в ацетоне (5 мл) с карбонатом калия (126 мг, 0.91 ммоль) и добавляют 4-фторбензилбромид (41 мг, 27 мкл,- 19021464 0.218 ммоль). Реакционную смесь нагревают при температуре 50C в течение 8 ч и затем охлаждают до температуры окружающей среды. Неорганику отделяют путем фильтрования и фильтровальную лепешку промывают этилацетатом (25 мл). Объединенные промывки и фильтрат концентрируют в вакууме и полученный остаток очищают с помощью флеш хроматографии на SiO2, элюируя смесью 20% этилацетат / гексан, чтобы получить требуемое соединение в виде масла, 87 мг, 72%. Указанное в заголовке соединение выделяют в виде твердого вещества желтого цвета.LC/MS: RT = 2.29 мин (270 нм), м/е = 428 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):5.35 (с, 2H), 6.98-7.03 (м, 1H), 7.09-7.14 (м, 1H), 7.18-7.24 (м, 2H), 7.27 (д,1H), 7.31-7.36 (м, 2H), 7.51 (д, 1H), 7.57 (д, 1H), 7.63 (д, 1H), 8.12-8.15 (м, 2H), 8.58 (д, 1H), 10.34 (с, 1H),11.54 (широкий с, 1H), 12.1 (широкий с, 1H). Пример 11. 5-(1 Н-Индол-2-ил)-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты [1-(3,4 дифторбензил)-1H-пиразол-4-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 2, следуя методикам, аналогичным методикам получения соединений, представленным в примере 10.LC/MS: RT =1.21 мин (270 нм), м/е = 446 [M+H]. Общее время выполнения 1.9 мин (супер короткая позиция). 1H ЯМР (d6 DMSO):5.35 (с, 2H), 7.00 (т, 1H), 7.10 (т, 1H), 7.30 (широкий с,1H), 7.35 (м, 1H),7.45 (кв., 1H), 7.55 (д, 1H), 7.60 (д, 1H), 7.70 (с, 1H) 8.15 (д, 1H), 8.20 (с, 1H), 8.60 (д, 1H), 10.35 (с, 1H),NH(3) не отмечен. Пример 12. 5-(1 Н-Индол-2-ил)-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 2, следуя методикам, аналогичным методикам получения соединений, представленным в примере 10.LC/MS: RT = 1.24 мин (270 нм), м/е = 444 [M+H]. Общее время выполнения 1.9 мин (супер короткая позиция). 1H ЯМР (d6 DMSO):5.40 (д, 2H), 7.05 (т, 1H), 7.15 (т, 1H), 7.35 (д, 2H), 7.50 (д, 2H), 7.55 (д,1H), 7.65 (д, 1H), 7.70 (с, 1H) 8.20 (д, 1H), 8.25 (с, 1H), 8.65 (д, 1H), 10.45 (с, 1H), NH (3) не отмечен. Пример 13. 5-(1 Н-Индол-2-ил)-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты [1-(3,5 дифторбензил)-1H-пиразол-4-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 2, следуя методикам, аналогичным методикам получения соединений, представленным в примере 10.LC/MS: RT = 1.22 мин (270 нм), м/е = 446 [M+H]. Общее время выполнения 1.9 мин (супер короткая позиция). 1H ЯМР (d6 DMSO): 5.40 (с, 2H), 7.00 (м, 2H), 7.05 (т, 1H), 7.15 (т, 1H), 7.25 (м, 1H), 7.30 (д, 1H),7.55 (д, 1H), 7.60 (д, 1H), 7.70 (с, 1H) 8.15 (д, 1H), 8.25 (с, 1H), 8.60 (д, 1H), 10.40 (с, 1H), NH (2) не отмечен. Пример 14. 5-(1 Н-Индол-2-ил)-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты [1-(3-фтор-4 метилбензил)-1H-пиразол-4-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 2, следуя методикам, аналогичным методикам получения соединений, представленным в примере 10.LC/MS: RT = 1.25 мин (270 нм), м/е = 442 [M+H]. Общее время выполнения 1.9 мин (супер короткая позиция). 1H ЯМР (d6 DMSO): 2.25 (с, 3H), 5.30 (с, 2H), 7.00 (м, 3H), 7.10 (т, 1H), 7.30 (м, 2H), 7.50 (д, 1H),7.60 (д, 1H), 7.70 (с, 1H) 8.15 (м, 2H), 8.55 (д, 1H), 10.35 (с, 1H), NHs не отмечен. Пример 15. 5-[5-(4-Метилпиперазин-1-карбонил)-1H-индол-2-ил]-6-оксо-1,6-дигидропиридин-3 карбоновой кислоты (1-бензил-1H-пиразол-4-ил)амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 3. Стадия 1. Получение 1 Н-Индол-5-карбоновой кислоты бензилового эфира (3 а). К раствору индол-5-карбоновой кислоты (2.63 г, 16.34 ммоль) в N,N-диметилформамиде (50 мл) добавляют гидрокарбонат натрия (8.24 г, 98.04 ммоль) и бензилбромид (11.66 мл, 98.04 ммоль). Реакционную смесь перемешивают в течение 48 ч при температуре окружающей среды в атмосфере азота. Реакционную смесь затем распределяют между этилацетатом и водой. Органический слой отделяют и водный раствор экстрагируют дополнительной порцией этилацетата. Объединенные органические слои сушат(MgSO4) и упаривают в вакууме. Полученный сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью 20% этилацетат/гексан, а затем 50% этилацетат/гексан, чтобы получить указанное в заголовке соединение в виде масла, 4.82 г, выход количественный. Стадия 2. Получение индол-1,5-дикарбоновой кислоты 5-бензилового эфира, 1-трет-бутилового эфира (3b). К раствору промежуточного соединения (3 а), 1 Н-индол-5-карбоновой кислоты бензиловому эфиру,(4.8 г, 16.34 ммоль) в ацетонитриле (100 мл) добавляют ди-трет-бутилдикарбонат (3.92 г, 17.97 ммоль) и 4-диметиламинопиридин (0.2 г, 1.63 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в атмосфере азота в течение 12 ч. Затем ее концентрируют в вакууме и полученный сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью 20% этилацетат / гексан, чтобы получить указанное в заголовке соединение в виде грязно-белого цвета твердого вещества,5.04 г, 88%. Стадия 3. Получение индол-2-бороновой кислоты-1,5-дикарбоновой кислоты, 5-бензилового эфира,1-трет-бутилового эфира (3c). К раствору промежуточного соединения (3b), индол-1,5-дикарбоновой кислоты 5-бензилового эфира, 1-трет-бутилового эфира, (5.04 г, 14.36 ммоль) в тетрагидрофуране (50 мл) при температуре 0C добавляют триизопропилборат (5 мл, 21.54 ммоль). Затем добавляют по каплям свежеприготовленный раствор диизопропиламида лития (18.67 ммоль) в тетрагидрофуране (10 мл) при температуре 0C и полученную реакционную смесь перемешивают при температуре 0C в течение 2 ч в атмосфере азота. Значение pH реакционной смеси доводят до pH 7 путем осторожного добавления 2 М водного раствора соляной кислоты и перемешивают при температуре окружающей среды в течение еще 30 мин. Органику отделяют, сушат (Na2SO4) и концентрируют в вакууме. Это дает указанное в заголовке соединение, которое используют на следующей стадии без дополнительной очистки, 5.05 г, выход количественный. Стадия 4. Получение 2-[5-метоксикарбонил-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-индол-1,5-дикарбоновой кислоты 5-бензилового эфира, 1-трет-бутилового эфира (3d). К раствору промежуточного соединения (1 а), 5-иод-6-оксо-1-(2-триметилсиланилэтоксиметил)-1,6 дигидропиридин-3-карбоновой кислоты метиловому эфиру, (2.94 г, 7.18 ммоль) в N,N-диметилформамиде (16 мл) добавляют промежуточное соединение (3 с), индол-2-бороновую кислоту-1,5 дикарбоновой кислоты 5-бензилового эфира, 1-трет-бутилового эфира, (5.05 г, 14.36 ммоль) и ацетат калия (2.11 г, 21.54 ммоль). Реакционную смесь дегазируют в течение 10 мин, после чего добавляют дихлорид бис(трифенилфосфин)палладия(II) (0.25 г, 0.359 ммоль) добавляют и полученную реакционную смесь дегазируют в течение еще 10 мин. Реакционную смесь затем нагревают до температуры 60C при микроволновом облучениие в течение 20 мин. Реакционную смесь концентрируют в вакууме и остаток распределяют между дихлорметаном и водой. Органический слой отделяют и водный раствор экстрагируют дополнительной порцией дихлорметана. Объединенные органику сушат (MgSO4) и упаривают в вакууме. Полученный сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью 20% этилацетат/гексан, чтобы получить указанное в заголовке соединение в виде масла желтого цвета, 2.07 г, 46%. Стадия 5. Получение 2-[5-метоксикарбонил-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]индол-1,5-дикарбоновой кислоты 1-трет-бутилового эфира (3 е). К дегазируемому раствору промежуточного соединения (3d), 2-[5-метоксикарбонил-2-оксо-1-(2- 21021464 триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]индол-1,5-дикарбоновой кислоты 5-бензилового эфира, 1-трет-бутилового эфира, (2.07 г, 3.27 ммоль) в метаноле (30 мл) добавляют палладий, 10 вес.% на активированном угле (50 мг) и полученную реакционную смесь затем дегазируют. Реакционную смесь нагревают до температуры 30C в течение 72 ч в атмосфере водорода. Реакционную смесь затем фильтруют через плотный слой из целита и плотный слой промывают горячим метанолом (20 мл). Объединенный фильтрат и промывки концентрируют в вакууме и переносят на 410g РЕ-AX колонки. Колонки затем промывают метанолом и элюируют смесью 20% уксусная кислота/метанол. Объединенную органику концентрируют в вакууме. К остатку добавляют эфир и его концентрируют в вакууме. Указанный процесс повторяют более двух раз, что обеспечивает требуемое соединение, указанное в заголовке в виде твердого вещества коричневого цвета, 627 мг, 35%. Стадия 6. Получение 2-[5-метоксикарбонил-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-5-(4-метилпиперазин-1-карбонил)индол-1-карбоновой кислоты трет-бутилового эфира(3f). Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 3, стадия 2, используя промежуточное соединение (3 е), 2-[5-метоксикарбонил-2 оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]индол-1,5-дикарбоновой кислоты 1 трет-бутиловый эфир. После обычной обработки водным раствором, сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью 6% метанол/дихлорметан, чтобы получить указанное в заголовке соединение в виде смолы желтого цвета, 219 мг, 95%. Стадия 7. Получение 2-[5-карбокси-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-5-(4-метилпиперазин-1-карбонил)индол-1-карбоновой кислоты трет-бутилового эфира (3g). Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 1, стадия 3, используя промежуточное соединение (3f), 2-[5-метоксикарбонил-2 оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-5-(4-метилпиперазин-1-карбонил)индол-1-карбоновой кислоты трет-бутиловый эфир. После обычной обработки, требуемое соединение,указанное в заголовке выделяют в виде твердого вещества желтого цвета, 142 мг, 66%. Стадия 8. Получение 2-[5-(1-бензил-1H-пиразол-4-илкарбамоил)-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-5-(4-метилпиперазин-1-карбонил)индол-1-карбоновой кислоты трет-бутилового эфира (3h). Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 1, стадия 4, используя промежуточное соединение (3g), 2-[5-карбокси-2-оксо-1-(2 триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-5-(4-метилпиперазин-1-карбонил)индол-1 карбоновой кислоты трет-бутиловый эфир. После обычной обработки сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью 5% метанол / дихлорметан, чтобы получить указанное в заголовке соединение в виде пены коричневого цвета, 178 мг, выход количественный. Стадия 9. Получение указанного в заголовке соединения 5-[5-(4-метилпиперазин-1-карбонил)-1Hиндол-2-ил]-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты (1-бензил-1 Н-пиразол-4-ил)амид. Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 1, стадия 5, используя промежуточное соединение (3h), 2-[5-(1-бензил-1H-пиразол 4-илкарбамоил)-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-5-(4-метилпиперазин-1-карбонил)-индол-1-карбоновой кислоты трет-бутиловый эфир. После обычной обработки сырой продукт помещают в метанол (1 мл) и загружают на 5 г SCX колонку. Колонку промывают метанолом и затем элюируют 7N раствором аммиака в метаноле. Элюент концентрируют в вакууме и остаток затем очищают с помощью препаративной HPLC при значении pH 4, чтобы получить указанное в заголовке соединение в виде твердого вещества коричневого цвета, 13 мг, 10%.LC/MS RT = 1.52 мин (270 нм), м/е = 536 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):2.21 (с, 3H), 2.33, широкий м, 4H), 3.53-3.56, широкий м, 4H) .33 (с, 2H),7.13 (дд, 1H), 7.31 (м, 6H), 7.53 (д, 1H), 7.61 (с, 2H), 8.10 (с, 1H), 8.14 (д, 1H), 8.58 (д, 1H), 10.31 (с, 1H),11.72 (с, 1H), 12.5 (с, 1H). Пример 16. 6-Оксо-5-(5-пиперазин-1-илметил-1H-индол-2-ил)-1,6-дигидропиридин-3-карбоновой кислоты (1-бензил-1H-пиразол-4-ил)амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 4. Стадия 1. Получение индол-2-бороновой кислоты-5-(4-трет-бутоксикарбонилпиперазин-1-илметил) индол-1-карбоновой кислоты трет-бутилового эфира (4 а). К перемешиваемому раствору индол-5-карбоксальдегида (2 г, 13.8 ммоль) в толуоле (10 мл) добав- 22021464 ляют 4-диметиламинопиридин (1 мол.%, 10 мг) и ди-трет-бутилдикарбонат (3.14 г, 14.5 ммоль) и полученную смесь перемешивают при температуре окружающей среды в течение 30 мин. После указанного времени добавляют порциями трет-бутил-пиперазин-1-карбоксилат (2.56 г, 13.8 ммоль), а затем триацетоксиборогидрид натрия (4.44 г, 20.7 ммоль). После перемешивание в течение 90 мин добавляют 2.5% об./об. раствор уксусной кислоты в воде (10 мл), быстро перемешивают и органический слой отделяют. Указанный слой промывают водой (50 мл) и концентрируют почти досуха. Добавляют метанол (50 мл) и полученную реакционную смесь концентрируют досуха. Остаток растирают в порошок с толуолом и жидкость концентрируют досуха, чтобы получить на выходе защищенный индол. Указанный остаток растворяют в безводном тетрагидрофуране (6 мл). Указанный раствор добавляют через шприц в заполненную азотом колбу и охлаждают до температуры 5C. Добавляют триизопропилборат (4.77 мл, 20.7 ммоль), а затем медленно добавляют 2 М раствор диизопропиламида лития в тетрагидрофуране (8.95 мл, 17.9 ммоль), обеспечивая интервал температур,остающийся между 0 и 5C. Смесь перемешивают при температуре 5C в течение 1 ч, затем гасят путем добавления 2 М водного раствора соляной кислоты (2 мл). Значение pH доводят до 7 с помощью водного раствора аммиака, баню со льдом удаляют и полученную двухфазную смесь перемешивают при температуре окружающей среды в течение 30 мин. Органический слой отделяют, сушат (MgSO4) и концентрируют в вакууме, чтобы получить указанное в заголовке соединение, 6.34 г, выход количественный. Стадия 2. Получение 5-(4-трет-бутоксикарбонилпиперазин-1-илметил)-2-[5-метоксикарбонил-2 оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-индол-1-карбоновой кислоты третбутилового эфира (4b). Промежуточное соединение (4 а), индол-2-бороновую кислоту-5-(4-трет-бутоксикарбонилпиперазин-1-илметил)индол-1-карбоновой кислоты трет-бутиловый эфир (6.34 г, 13.8 ммоль), ацетат калия(2.59 г, 26.4 ммоль) и промежуточное соединение (1 а), 5-иод-6-(2-триметилсиланилэтокси)-никотиновой кислоты метиловый эфир (3.51 г, 8.6 ммоль) растворяют в N,N-диметилформамиде (70 мл). Реакционную смесь дегазируют трижды, используя альтернативные циклы вакуума и сухого азота и затем добавляют дихлорид бис(трифенилфосфин)палладия(II) (0.45 г, 0.64 ммоль). Смесь снова дегазируют затем нагревают в атмосфере азота при температуре 60C в течение 1 ч. Смесь охлаждают, концентрируют досуха и остаток распределяют между водой и этилацетатом. Органический слой отделяют и водный раствор экстрагируют дополнительной порцией этилацетата. Объединенные этилацетатные слои сушат (Na2SO4) и концентрируют в вакууме. Полученный сырой продукт очищают с помощью флеш хроматографии наSiO2, элюируя смесью гексан - 20% этилацетат/гексан (градиент), чтобы получить требуемое соединение,указанное в заголовке в виде окрашенного в медный цвет твердого вещества, 2.4 г, 40%. Стадия 3. Получение 5-(4-трет-бутоксикарбонилпиперазин-1-илметил)-2-[5-карбокси-2-оксо-1-(2 триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-индол-1-карбоновой кислоты трет-бутилового эфира (4 с). Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 1, стадия 3, используя промежуточное соединение (4b), 5-(4-трет-бутоксикарбонилпиперазин-1-илметил)-2-[5-метоксикарбонил-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-индол-1-карбоновой кислоты трет-бутиловый эфир. После обычной обработки, указанное в заголовке соединение выделяют в виде пены коричневого цвета, 2.35 г, выход количественный. Стадия 4. Получение 2-[5-(1-бензил-1H-пиразол-4-илкарбамоил)-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-5-(4-трет-бутоксикарбонилпиперазин-1-илметил)индол-1 карбоновой кислоты трет-бутилового эфира (4d). Промежуточное соединение (4 с), 5-(4-трет-бутоксикарбонилпиперазин-1-илметил)-2-[5-карбокси-2 оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]индол-1-карбоновой кислоты третбутиловый эфир, (1 г, 1.46 ммоль), бензил-1H-пиразол-4-иламин (0.75 г, 4.39 ммоль), гидрат 1 гидроксибензотриазола (0.59 г, 4.39 ммоль) и тетрагидрофуран (15 мл) помещают в пробирку для микроволнового облучения. К указанному раствору добавляют N,N-диизопропилэтиламин (0.58 г, 0.78 мл, 4.49 ммоль) и гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (0.84 г, 4.39 ммоль), пробирку закрывают и нагревают при микроволновом облучение при температуре 90C в течение 30 мин. После охлаждения, смесь концентрируют в вакууме и остаток распределяют между водой и дихлорметаном. Органический слой отделяют и водный раствор экстрагируют дополнительной порцией дихлорметана. Объединенные дихлорметановые слои сушат (Na2SO4) и концентрируют в вакууме. Полученный сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью дихлорметан- 15% метанол/дихлорметан (градиент), чтобы получить требуемое соединение, указанное в заголовке в виде пены желтого цвета, 1.0 г, 82%. Стадия 5. Получение указанного в заголовке соединения 6-оксо-5-(5-пиперазин-1-илметил-1Hиндол-2-ил)-1,6-дигидропиридин-3-карбоновой кислоты (1-бензил-1H-пиразол-4-ил)амид. К раствору промежуточного соединения (4d), 2-[5-(1-бензил-1H-пиразол-4-илкарбамоил)-2-оксо-1(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-5-(4-трет-бутоксикарбонилпиперазин-1 илметил)индол-1-карбоновой кислоты трет-бутилового эфира, 120 мг, 0.14 ммоль) в метаноле (4 мл) добавляют соляную кислоту, 37% (0.75 мл). Смесь нагревают при температуре 90 С в течение 3 ч. Реакци- 23021464 онной смеси дают возможность достичь температуры окружающей среды и значение pH доводят до 7 путем осторожного добавления 7N раствора аммиака в метаноле. Смесь концентрируют в вакууме и полученный сырой остаток очищают через препаративную HPLC при значении pH 9, чтобы получить указанное в заголовке соединение в виде твердого вещества желтого цвета, 1.83 мг, 3%.LC/MS: RT = 1.59 мин (270 нм), м/е = 508 [M+H]+. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d4 MeOD):2.71 (широкий т, 4H), 3.18 (т, 4H), 3.70 (с, 2H), 5.32 (с, 2H), 7.13 (м, 2H),7.29 (м, 5H), 7.41 (д, 1H), 7.50 (широкий с, 1H), 7.68 (с, 1H), 8.07 (с, 2H), 8.45 (с, 1H), 8.57 (д, 1H), NHs не отмечен. Пример 17. 5-(1 Н-Индол-2-ил)-2-метил-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты (1-бензил-1H-пиразол-4-ил)амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 5. Стадия 1. Получение (Е)-4-[1-амино-эт-(Z)-илден]-пент-2-ендиовой кислоты диэтилового эфира(5 а). Этилпропиолат (39.2 г, 41 мл, 400 ммоль) добавляют к этил-3-аминокротонату (51.75 г, 400 ммоль) и полученную смесь нагревают при температуре 90C в течение 90 мин, что дает масло темно-красного цвета. Смеси дают возможность остыть, что дает продукт в виде твердого вещества темно-оранжевого цвета, 87.0 г (96%). Стадия 2. Получение 2-метил-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты этилового эфира(5b). Раствор промежуточного соединения (5 а), (Е)-4-[1-амино-эт-(Z)-илден]-пент-2-ендиовой кислоты диэтиловый эфир (51 г, 225 ммоль) в N,N-диметилформамиде (250 мл) нагревают при температуре 175C в течение 24 ч, что дает раствор темно-коричневого цвета. Полученному раствору дают возможность остыть, при этом медленно образуется осадок бледно-коричневого цвета. Осадок удаляют фильтрованием и твердые вещества промывают дихлорметаном (75 мл) и гексаном (100 мл), что дает порошок бледно-желтого цвета. Твердые вещества сушат в вакууме (60C), что дает указанное в заголовке соединение в виде порошка бледно-желтого цвета, 14.45 г (36%). Стадия 3. Получение 5-иод-2-метил-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты этиловый эфир (5 с).N-Иодосукцинимид (40 г, 180 ммоль) добавляют к суспензии промежуточного соединения (5b), 2 метил-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты этиловому эфиру (18.1 г, 100 ммоль) в ацетонитриле (400 мл), в атмосфере азота. Полученную суспензию нагревают при температуре 95C в течение 5 ч, что дает исходный раствор оранжевого цвета. Медленно образуется осадок грязно-белого цвета. Полученной суспензии дают возможность остыть и выливают в воду (1200 мл), что дает осадок грязнобелого цвета. Его отделяют фильтрованием и твердые вещества промывают водой (500 мл), что дает порошок грязно-белого цвета. Твердое вещество сушат в вакууме (60C), что дает продукт в виде порошка грязно-белого цвета, 28.3 г (92%). Стадия 4. Получение 5-иод-2-метил-6-оксо-1-(2-триметилсиланилэтоксиметил)-1,6-дигидропиридин-3-карбоновой кислоты этилового эфира (5d). Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 1, стадия 1, используя промежуточное соединение (5 с), 5-иод-2-метил-6-оксо-1,6 дигидропиридин-3-карбоновой кислоты этиловый эфир. После обычной обработки, полученный сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью 20% этилацетат/гексан, что дает продукт в виде масла желтого цвета/зеленого цвета, 30.5 г (76%). Стадия 5. Получение 2-метил-5-(1-метил-1H-индол-2-ил)-6-оксо-1-(2-триметилсиланилэтоксиметил)-1,6-дигидропиридин-3-карбоновой кислоты этилового эфира (5 е). Пробирку для микроволнового облучения объемом (20 мл) загружают промежуточным соединением (5d), 5-иодометил-6-оксо-1-(2-триметилсиланилэтоксиметил)-1,6-дигидропиридин-3-карбоновой кислоты этиловым эфиром (0.87 г, 1.99 ммоль), карбонатом калия (0.825 г, 5.97 ммоль), 1-(трет-бутоксикарбонил) индол-2-бороновой кислотой (0.624 г, 2.39 ммоль), дихлорметановым комплексом [1,1'бис(дифенилфосфино)ферроцен)]дихлорпалладия(II), (0.082 г, 5 моль%), тетрагидрофураном (14 мл) и водой (2.3 мл). Содержимое пробирки дегазируют и затем нагревают при температуре 60C в течение 1 ч при микроволновом облучении. После охлаждения реакционную смесь распределяют между рассолом(50 мл) и этилацетатом (50 мл). Органический слой отделяют, сушат (Na2SO4) и концентрируют в вакууме. Полученный сырой продукт очищают с помощью флеш хроматографии на SiO2 со смесью гексан 15% этилацетат/гексан (градиент), чтобы получить указанное в заголовке соединение в виде пены желто- 24021464 го цвета, 1.02 г, 97%. Стадия 6. Получение 2-метил-5-(1-метил-1H-индол-2-ил)-6-оксо-1-(2-триметилсиланилэтоксиметил)-1,6-дигидропиридин-3-карбоновой кислоты (5f). Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 1, стадия 3, используя промежуточное соединение (5 е), 2-метил-5-(1-метил-1Hиндол-2-ил)-6-оксо-1-(2-триметилсиланилэтоксиметил)-1,6-дигидропиридин-3-карбоновой кислоты этиловый эфир. После обычной обработки указанное в заголовке соединение выделяют в виде твердого вещества желтого цвета, 419 мг, 92%. Стадия 7. Получение 2-Метил-5-(1-метил-1H-индол-2-ил)-6-оксо-1-(2-триметилсиланилэтоксиметил)-1,6-дигидропиридин-3-карбоновой кислоты (1-бензил-1H-пиразол-4-ил)амида (5g). Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 16, стадия 4, используя промежуточное соединение (5f), 2-метил-5-(1-метил-1Hиндол-2-ил)-6-оксо-1-(2-триметилсиланилэтоксиметил)-1,6-дигидропиридин-3-карбоновой кислоты. После обычной обработки сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью гексан - 33% этилацетат/гексан (градиент), чтобы получить требуемое соединение, указанное в заголовке в виде твердого вещества желтого цвета, 110 мг, 84%. Стадия 8. Получение указанного в заголовке соединения 5-(1 Н-индол-2-ил)-2-метил-6-оксо-1,6 дигидропиридин-3-карбоновой кислоты (1-бензил-1H-пиразол-4-ил)амида. Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 1, стадия 5, используя промежуточное соединение (5g), 2-метил-5-(1-метил-1Hиндол-2-ил)-6-оксо-1-(2-триметилсиланилэтоксиметил)-1,6-дигидропиридин-3-карбоновой кислоты (1 бензил-1H-пиразол-4-ил)амид. Очистку сырого продукта осуществляют, используя растирание в порошок с ацетонитрилом. Указанное в заголовке соединение выделяют в виде твердого вещества желтого цвета, 14 мг, 20%.LC/MS: RT = 2.29 мин (270 нм), м/е = 424 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):2.46 (с, 3H), 5.32 (с, 2H), 6.97 (т, 1H), 7.07 (т, 1H), 7.22-7.38 (м, 6H), 7.47 (д,1H), 7.52 (д, 1H), 7.57 (с, 1H), 8.10 (с, 1H), 8.26 (с, 1H), 10.31 (с, 1H), 11.39 (с, 1H), 12.28 (широкий с, 1H). Пример 18. 5-(1H-Индол-2-ил)-2-метил-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты [1-(3 фторбензил)-1H-пиразол-4-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 5, следуя методикам, аналогичным методикам получения соединений, представленным в примере 17.LC/MS: RT = 2.28 мин (270 нм), м/е = 442 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):2.47 (с, 3H), 5.35 (с, 2H), 6.97-7.16 (м, 5H), 7.21 (с, 1H), 7.40 (м, 1H), 7.47 (д,1H), 7.52 (д, 1H), 7.59 (с, 1H), 8.16 (с, 1H), 8.27 (с, 1H), 10.33 (с, 1H), 11.39 (с, 1H), 12.28 (широкий с, 1H). Пример 19. 5-(1 Н-Индол-2-ил)-2-метил-6-оксо-1,6-дигидропиридин-3-карбоновой кислоты [1-(3,4 дифторбензил)-1H-пиразол-4-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 5, следуя методикам, аналогичным методикам получения соединений, представленным в примере 17.LC/MS: RT = 2.32 мин (270 нм), м/е = 460 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):2.47 (с, 3H), 5.32 (с, 2H), 6.98-7.59 (м, 9H), 8.17 (с, 1H), 8.26 (с, 1H), 10.33 (с,1H), 11.39 (с, 1H), 12.28 (широкий с, 1H). Пример 20. 1-Бензил-1H-пиразол-4-карбоновой кислоты [5-(1 Н-индол-2-ил)-6-оксо-1,6-дигидропиридин-3-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 6. Стадия 1. Получение 3-иод-5-нитро-1-(2-триметилсиланилэтоксиметил)-1H-пиридин-2-она (6 а). Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 1, стадия 1, используя 2-гидрокси-3-иод-5-нитропиридин. После обычной обработки, полученный сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя вначале гексаном и затем смесью 20% этилацетат/гексан, чтобы вначале получить нежелательное замещенное кислородом соединение и затем требуемое соединение, указанное в заголовке в виде масла желтого цвета,4.36 г, 59%. Стадия 2. Получение 2-[5-нитро-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3 ил]индол-1-карбоновой кислоты трет-бутилового эфира (6b). Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 17, стадия 5, используя промежуточное соединение (6 а), 3-иод-5-нитро-1-(2 триметилсиланилэтоксиметил)-1H-пиридин-2-он. После обычной обработки сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью гексан - 20% этилацетат/гексан (градиент), чтобы получить требуемое соединение, указанное в заголовке в виде масла 0.523 г, 64%. Стадия 3. Получение 2-[5-амино-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3 ил]-индол-1-карбоновой кислоты трет-бутилового эфира (6 с). Круглодонную колбу загружают промежуточным соединением (6b), 2-[5-нитро-2-оксо-1-(2 триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-индол-1-карбоновой кислоты трет-бутиловым эфиром (0.485 г, 1 ммоль), тетрагидрофураном (5 мл) и ацетатом палладия (11 мг, 5 моль%). Колбу герметизируют и продувают азотом. Пока колбу продувают азотом, добавляют через шприц раствор фторида калия (116 мг, 2 ммоль) в воде (2 мл), который тщательно дегазируют. Подвод азота удаляют и заменяют азотом из баллона. Добавляют по каплям поли(метилгидросилоксан) (0.44 мл) и полученную реакционную смесь перемешивают при температуре окружающей среды в течение 18 ч. Реакционную смесь разбавляют дихлорметаном (20 мл) и насыщенным водным раствором гидрокарбоната натрия (20 мл). Органический слой отделяют, фильтруют через плотный слой из целита и концентрируют в вакууме. Полученный сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью гексан 50% этилацетат/гексан (градиент), чтобы получить требуемое соединение, указанное в заголовке в виде твердого вещества коричневого цвета 0.308 г, 67%. Стадия 4. Получение 2-[5-[(1-бензил-1H-пиразол-4-карбонил)амино]-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-индол-1-карбоновой кислоты трет-бутилового эфира (6d). К раствору соединения (6 с), 2-[5-амино-2-оксо-1-(2-триметилсиланилэтоксиметил)-1.2-дигидропиридин-3-ил]-индол-1-карбоновой кислоты трет-бутилового эфира (0.3 г, 0.659 ммоль) в ацетонитриле (10 мл) добавляют 1-бензил-1H-пиразол-4-карбоновую кислоту (0.111 г, 0.549 ммоль) и триэтиламин (0.133 г, 0.184 мл, 1.32 ммоль). Последним добавляют О-бензотриазол-N,N,N',N'-тетраметилуронийгексафторфосфат (0.312 г, 0.823 ммоль) и полученную реакционную смесь перемешивают при температуре окружающей среды в течение 18 ч. Реакционную смесь концентрируют в вакууме и остаток распределяют между этилацетатом (25 мл) и насыщенным водным раствором гидрокарбоната натрия (20 мл). Органический слой отделяют и водный раствор экстрагируют дополнительной порцией этилацетата (25 мл). Объединенные этилацетатные слои промывают рассолом, сушат (Na2SO4) и концентрируют в вакууме. Полученный сырой продукт очищают с помощью флеш хроматографии на SiO2, элюируя смесью гексан 35% этилацетат/гексан - 50% этилацетат/гексан (градиент), чтобы получить требуемое соединение, указанное в заголовке в виде твердого вещества светло-коричневого цвета, 0.246 г, 70%. Стадия 5. Получение указанного в заголовке соединения 1-бензил-1H-пиразол-4-карбоновой кислоты [5-(1 Н-индол-2-ил)-6-оксо-1,6-дигидропиридин-3-ил]амида. Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 1, стадия 5, используя промежуточное соединение (6d), 2-[5-[(1-бензил-1H-пиразол 4-карбонил)амино]-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]индол-1 карбоновой кислоты трет-бутиловый эфир. Полученный сырой продукт очищают путем растирания в порошок с ацетонитрилом, чтобы получить указанное в заголовке соединение в виде твердого вещества желтого цвета, 64 мг, 42%.LC/MS: RT = 2.16 мин (270 нм), м/е = 410 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):5.41 (с, 2H), 6.99 (т, 1H), 7.06-7.10 (м, 2H), 7.29-7.41 (м, 5H), 7.52 (т, 2H),7.81 (д, 1H), 8.03 (с, 1H), 8.18 (д, 1H), 8.40 (с, 1H), 9.77 (с, 1H), 11.54 (с, 1H), 11.98 (широкий с, 1H). Пример 21. 1-(4-Фторбензил)-1H-пиразол-4-карбоновой кислоты [5-(1 Н-индол-2-ил)-6-оксо-1,6 дигидропиридин-3-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 6, следуя методикам, аналогичным методикам получения соединений, представленным в примере 20, но используя промежуточное соединение (6 е) на стадии 4. Получение 1-(4-фторбензил)-1H-пиразол-4-карбоновой кислоты (6 е). 1 Н-Пиразол-4-карбоновую кислоту этиловый эфир (1 г, 7.14 ммоль) перемешивают в ацетоне (15 мл) с карбонатом калия (4.93 г, 35.7 ммоль) и добавляют 4-фторбензилбромид (1.62 г, 0.746 мл, 8.56 ммоль). Реакционную смесь нагревают при температуре 50C в течение 4 ч. Затем ее охлаждают и неорганику отделяют путем фильтрования. Фильтровальную лепешку промывают этилацетатом (210 мл) и объединенные промывки и фильтрат концентрируют в вакууме. Остаток нагревают при температуре кипения с обратным холодильником в метаноле (10 мл), содержащим гидроксид калия (0.8 г, 14.28 ммоль) в течение 18 ч. Реакционную смесь охлаждают и концентрируют в вакууме. Остаток растворяют в H2O и промывают дихлорметаном. Водный слой отделяют и осторожно подкисляют, используя 6N водный раствор соляной кислоты. Полученный осадок фильтруют,промывают обильным количеством воды и сушат в вакууме, чтобы получить указанное в заголовке соединение, 1.05 г, 67%. Указанное в заголовке соединение по примеру 21 очищают путем растирания в порошок с ацетонитрилом и выделяют в виде твердого вещества зеленого цвета, 80 мг, 51%.LC/MS: RT = 1.14 мин (270 нм), м/е = 428 [M+H]. Общее время выполнения 1.9 мин (супер короткая позиция). 1H ЯМР (d6 DMSO):5.44 (с, 2H), 6.96-7.01 (м, 1H), 7.05-7.20 (м, 5H), 7.40-7.47 (м, 1H), 7.497.55 (м, 2H), 7.80-7.84 (м, 1H), 8.06 (с, 1H), 8.18 (д, 1H), 8.44 (с, 1H), 9.80 (с, 1H), 11.56 (широкий с, 1H),12.01 (широкий с, 1H). Пример 22. 1-(3-Фторбензил)-1H-пиразол-4-карбоновой кислоты [5-(1 Н-индол-2-ил)-6-оксо-1,6 дигидропиридин-3-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 6, следуя экспериментальным методикам, аналогичным тем, которые представлены в примерах 20 и 21.LC/MS: RT = 1.14 мин (270 нм), м/е = 428 [M+H]. Общее время выполнения 1.9 мин (супер короткая позиция). 1H ЯМР (d6 DMSO):5.44 (с, 2H), 6.96-7.01 (м, 1H), 7.05-7.22 (м, 5H), 7.40-7.47 (м, 1H), 7.507.55 (м, 2H), 7.82 (м, 1H), 8.06 (с, 1H), 8.19 (д, 1H), 8.45 (с, 1H), 9.81 (с, 1H), 11.56 (широкий с, 1H), 12.02 Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 6, следуя экспериментальным методикам, аналогичным тем, которые представлены в примерах 20 и 21.LC/MS: RT = 1.21 мин (270 нм), м/е = 478 [M+H]. Общее время выполнения 1.9 мин (супер короткая позиция). 1H ЯМР (d6 DMSO):5.53 (с, 2H), 6.96-7.01 (м, 1H), 7.05-7.10 (м, 2H), 7.49-7.72 (м, 6H), 7.807.84 (м, 1H), 8.07 (с, 1H), 8.18 (д, 1H), 8.48 (с, 1H), 9.80 (с, 1H), 11.56 (широкий с, 1H), 12.02 (широкий с,1H). Пример 24. 1-(3,4-Дифторбензил)-1H-пиразол-4-карбоновой кислоты [5-(1 Н-индол-2-ил)-6-оксо-1,6 дигидропиридин-3-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 6, следуя экспериментальным методикам, аналогичным тем, которые представлены в примерах 20 и 21.LC/MS: RT = 1.16 мин (270 нм), м/е = 446 [M+H]. Общее время выполнения 1.9 мин (супер короткая Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 6, следуя экспериментальным методикам, аналогичным тем, которые представлены в примерах 20 и 21.LC/MS: RT = 1.21 мин (270 нм), м/е = 478 [M+H]. Общее время выполнения 1.9 мин (супер короткая позиция). 1H ЯМР (d6 DMSO):5.54 (с, 2H), 6.95-7.01 (м, 1H), 7.05-7.10 (м, 2H), 7.44-7.56 (м, 4H), 7.76 (д,2H), 8.08 (с, 1H), 8.19 (д, 1H), 8.48 (с, 1H), 9.82 (с, 1H), 11.56 (широкий с, 1H), 11.91 (широкий с, 1H), NH не отмечен. Пример 26. 1-(3-Метилбензил)-1H-пиразол-4-карбоновой кислоты [5-(1 Н-индол-2-ил)-6-оксо-1,6 дигидропиридин-3-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 6, следуя экспериментальным методикам, аналогичным тем, которые представлены в примерах 20 и 21.LC/MS: RT = 2.29 мин (270 нм), м/е = 424 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):2.30 (с, 3H), 5.36 (с, 2H), 6.95-7.01 (м, 1H), 7.04-7.17 (м, 5H), 7.24-7.29 (м,1H), 7.48-7.56 (м, 2H), 7.81 (с, 1H), 8.04 (с, 1H), 8.18 (д, 1H), 8.39 (с, 1H), 9.78 (с, 1H), 11.55 (широкий с,1H), 12.01 (широкий с, 1H). Пример 27. 1-(3-Хлорбензил)-1H-пиразол-4-карбоновой кислоты [5-(1 Н-индол-2-ил)-6-оксо-1,6 дигидропиридин-3-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 6, следуя экспериментальным методикам, аналогичным тем, которые представлены в примерах 20 и 21.LC/MS: RT = 2.31 мин (270 нм), м/е = 444, 446 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):5.43 (с, 2H), 6.95-7.11 (м, 3H), 7.22-7.28 (м, 1H), 7.34-7.57 (м, 5H), 7.81 (д,1H), 8.06 (с, 1H), 8.19 (д, 1H), 8.45 (с, 1H), 9.81 (с, 1H), 11.56 (широкий с, 1H), 12.02 (широкий с, 1H). Пример 28. 1-(4-Хлорбензил)-1H-пиразол-4-карбоновой кислоты [5-(1 Н-индол-2-ил)-6-оксо-1,6 дигидропиридин-3-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 6, следуя экспериментальным методикам, аналогичным тем, которые представлены в примерах 20 и 21.LC/MS: RT = 2.31 мин (270 нм), м/е = 444, 446 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):5.41 (с, 2H), 6.96-7.11 (м, 3H), 7.29-7.34 (м, 2H), 7.43-7.56 (м, 4H), 7.81 (д,1H), 8.05 (с, 1H), 8.18 (д, 1H), 8.42 (с, 1H), 9.80 (с, 1H), 11.56 (широкий с, 1H), 12.02 (широкий с, 1H). Пример 29. 1-(4-Метилбензил)-1H-пиразол-4-карбоновой кислоты [5-(1H-индол-2-ил)-6-оксо-1,6 дигидропиридин-3-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 6, следуя экспериментальным методикам, аналогичным тем, которые представлены в примерах 20 и 21.LC/MS: RT = 2.28 мин (270 нм), м/е = 424 [M+H]. Общее время выполнения 3.75 мин (короткая позиция). 1H ЯМР (d6 DMSO):2.29 (с, 3H), 5.35 (с, 2H), 6.94-7.11 (м, 3H), 7.19 (м, 4H), 7.48-7.56 (м, 2H),7.81 (д, 1H), 8.02 (с, 1H), 8.18 (д, 1H), 8.37 (с, 1H), 9.77 (с, 1H), 11.56 (широкий с, 1H), 12.01 (широкий с,1H). Пример 30. 1-(3-Фторбензил)-1H-пиразол-4-карбоновой кислоты [5-(1 Н-индол-2-ил)-2-метил-6 оксо-1,6-дигидропиридин-3-ил]амид Указанное в заголовке соединение получают с помощью способа, обозначенного на схеме 7. Стадия 1. Получение 3-иод-6-метил-5-нитро-1H-пиридин-2-она (7 а). Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 17, стадия 3, используя 2-гидрокси-6-метил-5-нитропиридин. Обычная обработка дает указанное в заголовке соединение в виде твердого вещества бледно-желтого цвета, 4.95 г, 81%. Стадия 2. Получение 3-иод-6-метил-5-нитро-1-(2-триметилсиланилэтоксиметил)-1 Н-пиридин-2-она(7b). Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 1, стадия 1, используя промежуточное соединение (7 а), 3-иод-6-метил-5-нитро-1Hпиридин-2-он. После обычной обработки сырой продукт очищают с помощью флеш хроматографии наSiO2, элюируя вначале гексаном и затем смесью 10% этилацетат/гексан, чтобы вначале получить нежелательное с замещением кислородом соединение и затем требуемое соединение, указанное в заголовке в виде масла желтого цвета, 3.6 г, 42%. Стадия 3. Получение 2-[6-метил-5-нитро-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]индол-1-карбоновой кислоты трет-бутилового эфира (7 с). Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 17, стадия 5, используя промежуточное соединение 7(b), 3-иод-6-метил-5-нитро-1(2-триметилсиланилэтоксиметил)-1H-пиридин-2-он. После обычной обработки сырой продукт очищают с помощью флеш хроматографии на SiO2 со смесью гексан - 10% этилацетат/гексан (градиент), чтобы получить указанное в заголовке соединение в виде cream окрашенного твердого вещества, 3.46 г, 72%. Стадия 4. Получение 2-[5-амино-6-метил-2-оксо-1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-индол-1-карбоновой кислоты трет-бутилового эфира (7d). Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 20, стадия 3, используя промежуточное соединение (7 с), 2-[6-метил-5-нитро-2-оксо 1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-индол-1-карбоновой кислоты трет-бутиловый эфир. После обычной обработки сырой продукт очищают с помощью флеш хроматографии наSiO2 со смесью гексан - 65% этилацетат/гексан (градиент), чтобы получить указанное в заголовке соединение в виде пены желтого цвета, 2.21 г, 83%. Стадия 5. Получение 2-[5-[1-(3-фторбензил)-1H-пиразол-4-карбонил]амино-6-метил-2-оксо-1-(2 триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]-индол-1-карбоновой кислоты трет-бутилового эфира (7 е). Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, применяемой в примере 20, стадия 4, используя промежуточное соединение (7d), 2-[5-амино-6-метил-2-оксо 1-(2-триметилсиланилэтоксиметил)-1,2-дигидропиридин-3-ил]индол-1-карбоновой кислоты трет-бутиловый эфир и 1-(3-фторбензил)-1H-пиразол-4-карбоновой кислоты, которые синтезируют в соответствии со способом, описанным для получения промежуточного соединения (6 е) в примере 21. Полученный сырой продукт очищают с помощью флеш хроматографии на SiO2 со смесью гексан - 50% этилацетат/гексан(градиент), чтобы получить указанное в заголовке соединение в виде масла желтого цвета, 80 мг, 70%. Стадия 6. Получение указанного в заголовке соединения: 1-(3-фторбензил)-1H-пиразол-4 карбоновой кислоты [5-(1 Н-индол-2-ил)-2-метил-6-оксо-1,6-дигидропиридин-3-ил]амида. Указанное в заголовке соединение получают в соответствии с экспериментальной методикой, опи- 29
МПК / Метки
МПК: C07D 401/14, A61K 31/4412, A61P 35/00
Метки: композиция, киназы, отношении, применение, производные, индол-пиридона, обладающие, содержащая, фармацевтическая, активностью, ингибиторной
Код ссылки
<a href="https://eas.patents.su/30-21464-proizvodnye-indol-piridona-obladayushhie-ingibitornojj-aktivnostyu-v-otnoshenii-kinazy-1-soderzhashhaya-ih-farmacevticheskaya-kompoziciya-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные индол-пиридона, обладающие ингибиторной активностью в отношении киназы 1, содержащая их фармацевтическая композиция и их применение</a>
Предыдущий патент: Пуриновые производные и их применение в качестве модуляторов толл-подобного рецептора 7
Следующий патент: Способ получения декагидрата карбоната натрия
Случайный патент: Комбинированное устройство для кулинарной обработки и отрезания мяса " донер" в системе быстрого питания и способ для этого












