Тиазолопиридиновые соединения, регулирующие сиртуин
Номер патента: 21424
Опубликовано: 30.06.2015
Авторы: Диш Джереми С., Перни Роберт Б., Нг Пуи Йее, Оулманн Кристофер
Формула / Реферат
1. Соединение структурной формулы (III)
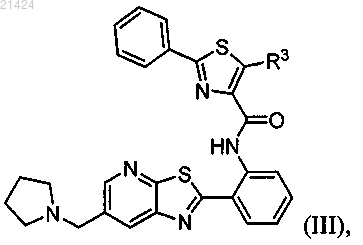
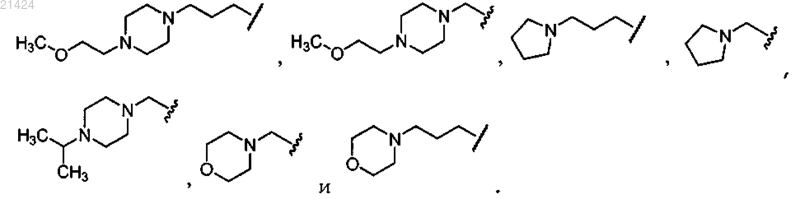
где R3 выбирается из водорода, метоксипропила, метоксипроп-1-инила,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R3 выбирается из водорода,
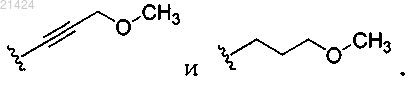
или его фармацевтически приемлемая соль.
3. Соединение по п.1, где соединение представляет собой 5-(3-метоксипропил)-2-фенил-N-(2-(6-(пирролидин-1-илметил)тиазоло[5,4-b]пиридин-2-ил)фенил)тиазол-4-карбоксамид
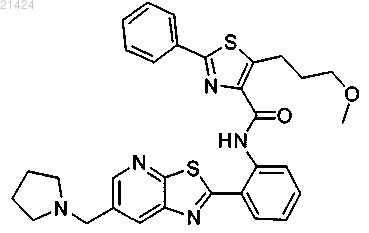
или его фармацевтически приемлемая соль.
4. Соединение по п.1, где соединение представляет собой 2-фенил-N-(2-(6-(пирролидин-1-илметил)тиазоло[5,4-b]пиридин-2-ил)фенил)тиазол-4-карбоксамида
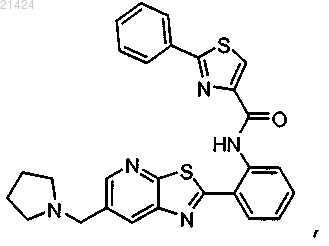
или его фармацевтически приемлемая соль.
5. Соединение по п.1, где соединение представляет собой 5-(3-метоксипроп-1-инил)-2-фенил-N-(2-(6-(пирролидин-1-илметил)тиазоло[5,4-b]пиридин-2-ил)фенил)тиазол-4-карбоксамида
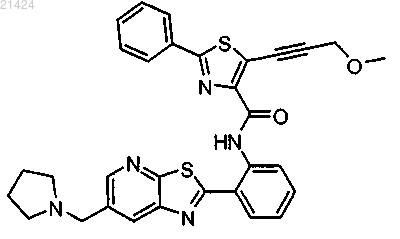
или его фармацевтически приемлемая соль.
6. Фармацевтическая композиция, регулирующая сиртуин, содержащая эффективное количество соединения по любому из пп.1-5 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
7. Композиция по п.6, содержащая дополнительный активный агент, выбранный из группы, состоящей из ресвератрола, бутеина, фисетина, пицеатаннола, кверцетина, никотиновой кислоты, никотинамида (NAM); сурамина; NF023 (антагонист G-белков); NF279 (антагонист пуринергических рецепторов); тролокса (6-гидрокси-2,5,7,8-третраметилхроман-2-карбоксикислота); (-)-эпигаллокатехина (гидроксильные группы в положениях 3,5,7,3',4',5'); (-)-эпигаллокатехин галлата (гидроксильные группы в положениях 5,7,3',4',5' и сложный эфир галловой кислоты в положении 3); цианидина хлорида (3,5,7,3',4'-пентагидроксифлавилиум хлорид); дельфинидина хлорида (3,5,7,3',4',5'-гексагидроксифлавилиум хлорид); мирицетина (каннабисцетин; 3,5,7,3',4',5'-гексагидроксифлавон); 3,7,3',4',5'-пентагидроксифлавон; госсипетина (3,5,7,8,3',4'-гексагидроксифлавон), сиртинола и сплитомицина.
8. Способ лечения субъекта, страдающего от или восприимчивого к устойчивости к инсулину, метаболическому синдрому, диабету или их осложнениям, или для повышения чувствительности к инсулину у субъекта, включающий введение нуждающемуся субъекту эффективного количества композиции по п.6.
9. Способ по п.8, включающий введение дополнительного активного агента, который выбран из группы, состоящей из ресвератрола, бутеина, фисетина, пицеатаннола, кверцетина, никотиновой кислоты, никотинамида (NAM); сурамина; NF023 (антагонист G-белков); NF279 (антагонист пуринергических рецепторов); тролокса (6-гидрокси-2,5,7,8-третраметилхроман-2-карбоксикислота); (-)-эпигаллокатехина (гидроксильные группы в положениях 3,5,7,3',4',5'); (-)-эпигаллокатехин галлата (гидроксильные группы в положениях 5,7,3',4',5' и сложный эфир галловой кислоты в положении 3); цианидина хлорида (3,5,7,3',4',-пентагидроксифлавилиум хлорид); дельфинидина хлорида (3,5,7,3',4',5'-гексагидроксифлавилиум хлорид); мирицетина (каннабисцетин; 3,5,7,3',4',5'-гексагидроксифлавон); 3,7,3',4',5'-пентагидроксифлавон; госсипетина (3,5,7,8,3',4'-гексагидроксифлавон), сиртинола и сплитомицина.
Текст
В изобретении представлены новые соединения, регулирующие сиртуин формулы (III) где значения радикалов раскрыты в формуле изобретения, и способы их применения. Соединения,регулирующие сиртуин могут использоваться для увеличения продолжительности жизни клетки и лечения и/или профилактики множества различных заболеваний и нарушений, включая,например, диабет, ожирение, метаболический синдром, а также заболевания или нарушения,течение которых может улучшиться при повышении митохондриальной активности. Также представлены композиции, содержащие соединение, регулирующее сиртуин, в комбинации с другим терапевтическим агентом. Ссылка на родственные заявки Заявка устанавливает приоритет предварительной заявки на патент США 61/203156, поданной 19 декабря 2008 г., содержание которой полностью включено в настоящий документ в качестве ссылки. Предпосылки изобретения Семейство генов SIR (Silent Information Regulator) представляет собой группу высококонсервативных генов, присутствующих в организмах от архебактерий до высших эукариот. Белки SIR, кодируемые этими генами, задействованы в различных процессах - от регуляции сайленсинга генов до репарации ДНК. Белки, кодируемые генами семейства SIR, имеют высококонсервативный кислый коровый домен,содержащий 250 аминокислот. К этому семейству принадлежит хорошо охарактеризованный ген S. cerevisiae SIR2, участвующий в сайленсинге локусов НМ, которые содержат информацию, определяющую тип спаривания дрожжей, теломерный эффект положения и старение клеток. Белок дрожжей Sir2 принадлежит к семейству гистон-деацетилаз. Гомолог Sir2 у Salmonella tiphimurium, CobB, представляет собой НАД (никотинамид аденин динуклеотид)-зависимую АДФ-рибозилтрансферазу. Белок Sir2 представляет собой деацетилазу класса III, использующую НАД в качестве косубстрата. В отличие от других деацетилаз, многие из которых вовлечены в сайленсинг генов, Sir2 нечувствительна к ингибиторам деацетилаз I и II классов, таким как трихостатин A (TSA). В результате деацетилирования Sir2 ацетиллизина, тесно связанного с гидролизом НАД, получается никотинамид и новое соединение ацетил-АДФ-рибозы. НАД-зависимая деацетилазная активность Sir2 необходима для его функций, связывающих его биологическую роль с клеточным метаболизмом у дрожжей. Гомологи Sir2 у млекопитающих обладают активностью НАД-зависимой гистон-деацетилазы. Большинство информации, проливающей свет на функции, опосредованные Sir2, было получено в исследованиях, проведенных на дрожжах. Биохимические исследования показали, что Sir2 способен деацетилировать N-концы гистонов Н 3 и Н 4, что приводит к образованию 1-O-ацетил-АДФ-рибозы и никотинамида. Для штаммов дрожжей, содержащих дополнительные копии SIR2, характерны повышенный сайленсинг рДНК и увеличенная на 30% продолжительность жизни. Недавно было показано, что дополнительные копии гомолога SIR2 у С.elegans, sir-2.1, и у D. melanogaster, dSir2, намного увеличивают продолжительность жизни этих организмов. Это подразумевает, что SIR2-зависимый путь передачи регуляторных сигналов, связанных со старением, появился на ранних стадиях эволюции и является эволюционно консервативным. На сегодняшний день считается, что гены Sir2 эволюционировали для улучшения здоровья организма и ответа на стресс с целью увеличения шансов на выживание в неблагоприятных обстоятельствах. У человека имеется семь Sir2-подобных генов (SIRT1-SIRT7), включающих консервативный каталитический домен Sir2. SIRT1 представляет собой ядерный белок, чья последовательность наиболее близка к последовательности Sir2. SIRT1 воздействует путем деацетилирования на множественные мишени в клетке, включая опухолевый супрессор р 53, фактор клеточного сигналинга NF-кВ и транскрипционный фактор FOXO.SIRT3 представляет собой гомолог SIRT1, консервативный среди прокариот и эукариот. БелокSIRT3 направляется в митохондриальные кристы с помощью уникального домена, расположенного на Nконце. SIRT3 обладает НАД+-зависимой протеин-деацетилазной активностью и экспрессируется повсеместно, в особенности в метаболически активных тканях. После переноса в митохондрии SIRT3, вероятно, расщепляется до меньшей активной формы с помощью пептидазы, процессирующей митохондриальный матрикс (МРР). Уже в течение 70 лет известно, что ограничение калорий улучшает состояние здоровья и продляет жизнь млекопитающих. Продолжительность жизни дрожжей, так же, как и многоклеточных организмов,увеличивается от вмешательств, сходных с ограничением калорий, таких как низкая глюкоза. Тот факт,что продолжительность жизни дрожжей и мух, у которых отсутствует ген SIR2, не увеличивается в условиях ограничения калорий, доказывает, что гены SIR2 опосредуют благоприятное влияние диеты с ограничением калорий на состояние здоровья. Кроме того, мутации, ослабляющие активность глюкозореспонсивного цАМФ (аденозин-3',5'-монофосфата)-зависимого пути (РКА) увеличивают продолжительность жизни клеток дикого типа, но не клеток мутантных по sir2 штаммов, что указывает на вероятную ключевую роль SIR2 в передаче сигналов от ограничения калорий. Сущность изобретения В настоящем изобретении представлены новые соединения, регулирующие сиртуин, и способы их использования. В одном аспекте в настоящем изобретении представлены соединения, регулирующие сиртуин, со структурной формулой (III), подробно описанные ниже. В другом аспекте в настоящем изобретении представлены способы использования соединений, регулирующих сиртуин, или композиций, содержащих соединения, регулирующие сиртуин. В некоторых воплощениях соединения, регулирующие сиртуин, которые повышают уровень и/или активность белка сиртуина, могут использоваться в различных терапевтических целях, включая, например, увеличение продолжительности жизни клетки и лечение и/или профилактику множества различных заболеваний и нарушений, включая, например, заболевания или нарушения, связанные со старением или стрессом, диа-1 021424 бет, ожирение, нейродегенеративные заболевания, нейропатию, индуцированную химиотерапией, нейропатию, ассоциированную с ишемическим событием, болезни и/или нарушения глаз, сердечнососудистое заболевание, нарушения свертываемости крови, воспаление и/или покраснение лица и т.д. Соединения, регулирующие сиртуин, которые повышают уровень и/или активность белка сиртуина, могут также использоваться для лечения заболевания или нарушения у субъекта, течение может улучшиться при повышении митохондриальной активности, для улучшения работы мыщц, для повышения уровня мышечного АТФ или для лечения или профилактики повреждений мышечной ткани, ассоциированных с гипоксией или ишемией. В других воплощениях соединения, регулирующие сиртуин, которые понижают уровень и/или активность белка сиртуина, могут использоваться в различных терапевтических целях,например, повышения чувствительности клеток к стрессу, стимуляции апоптоза, терапии рака, стимуляции аппетита и/или стимуляции набора веса и т.д. Как подробно описано ниже, способы включают введение субъекту, нуждающемуся в подобном лечении, фармацевтически эффективного количества соединения, регулирующего сиртуин. В некоторых аспектах соединения, регулирующие сиртуин, могут вводиться по отдельности или в комбинации с другими соединениями, включая другие соединения, регулирующие сиртуин, или другие терапевтические агенты. Подробное описание изобретения 1. Определения. При использовании в настоящем документе следующие термины и выражения имеют значения,приведенные ниже. Если не указано иначе, все технические и научные термины, использованные в настоящем документе, имеют общепринятые значения, очевидные для специалиста в области техники. Термин "агент" используется в настоящем документе для обозначения химического соединения,смеси химических соединений, биологической макромолекулы (такой как нуклеиновая кислота, антитело, белок или его часть, например, пептид) или экстракта, полученного из биологических материалов,таких как клетки или ткани бактерий, растений, грибков или животных (в особенности млекопитающих). Активность таких агентов может делать их пригодными в качестве "терапевтического агента", представляющего собой биологически, физиологически или фармакологически активное вещество (вещества),воздействующее на субъекта локально или системно. Термин "биодоступный" в отношении соединения известен из уровня техники и означает форму соединения, которая позволяет ему, или части введенного количества вещества, адсорбироваться, поглощаться или становиться физиологически доступным другим способом для субъекта или пациента, подвергавшегося введению."Биологически активная часть сиртуина" означает часть белка сиртуина, обладающую биологической активностью, такой как способность к деацетилированию. Биологически активные части сиртуина могут включать коровые домены сиртуинов. Биологические активные части SIRT1 с номером доступа вGenBank NP036370, включающие НАД+-связывающий домен и субстратсвязывающий домен, например,могут включать без ограничений аминокислоты 62-293 номера доступа в GenBank NP036370, кодируемые нуклеотидами 237-932 номера доступа в GenBank NM012238. Этот регион иногда называется коровым домном. Другие биологические активные части SIRT1, также иногда называемые коровыми доменами, включают аминокислоты примерно 261-447 номера доступа в GenBank NP036370, кодируемые нуклеотидами 834-1394 номера доступа в GenBank NM012238; аминокислоты примерно 242-493 номера доступа в GenBank NP036370, кодируемые нуклеотидами 777-1532 номера доступа в GenBankNM012238; или аминокислоты примерно 254-495 номера доступа в GenBank NP036370, кодируемые нуклеотидами 813-1538 номера доступа в GenBank NM012238. Термин "животные-компаньоны" относится к кошкам и собакам. Термин "собака" ("собаки") используемый в настоящем документе, означает любого представителя вида Canis familiaris, включающего множество различных пород. Термин "кошка" ("кошки") означает кошек, включая домашних кошек и других членов семейства кошачьих рода Felis."Диабет" означает высокое содержание сахара в крови или кетоацидоз, а также хронические, системные нарушения обмена веществ, обусловленные длительным высоким содержанием сахара в крови или понижением толерантности к глюкозе. "Диабет" включает как I, так и II (неинсулинозависимый сахарный диабет, NIDDM) типы заболевания. Факторы риска для диабета включают следующие факторы: обхват талии более 40 дюймов для мужчин или 35 дюймов для женщин, кровяное давление 130/85 мм рт. ст. или выше, триглицериды более 150 мг/дл, глюкоза в крови натощак более 100 мг/дл или липопротеины высокой плотности ниже 40 мг/дл у мужчин или 50 мг/дл у женщин. Термин "ED50" означает меру эффективности дозы, принятую в уровне техники. В некоторых воплощениях ED50 означает дозу препарата, дающую 50% максимального результата или эффекта, или альтернативно, доза, дающая заданный результат у 50% субъектов или препаратов. Термин "LD50" означает меру смертельной дозы, принятую в уровне техники. В некоторых воплощениях LD50 означает дозу, приводящую к гибели 50% субъектов. Термин "терапевтический индекс" принят в уровне техники и означает терапевтический индекс лекарственного препарата, определяемый как LD50/ED50. Термин "гиперинсулинемия" означает состояние индивидуума, при котором уровень инсулина в крови превышает норму. Термин "устойчивость к инсулину" означает состояние, при котором нормальное количество инсулина вызывает пониженный биологический ответ по сравнению с биологическим ответом у субъекта, не имеющего устойчивости к инсулину."Нарушение устойчивости к инсулину" при обсуждении в настоящем документе означает любое заболевание или состояние, которое вызывается или которому способствует устойчивость к инсулину. Примеры включают: диабет, ожирение, метаболический синдром, синдромы устойчивости к инсулину,синдром X, устойчивость к инсулину, высокое кровяное давление, гипертонию, высокий уровень холестерина в крови, дислипидемию, гиперлипидемию, атеросклеротические заболевания, включая инсульт,заболевание коронарных артерий или инфаркт миокарда, гиперглицемию, гиперинсулинемию и/или гиперпроинсулинемию, ослабленную толерантность к глюкозе, замедленное высвобождение инсулина,диабетические осложнения, включая ишемическую болезнь сердца, грудную жабу, застойную сердечную недостаточность, инсульт, когнитивные функции при деменции, ретинопатию, периферическую нейропатию, нефропатию, гломерулонефрит, гломерулосклероз, нефротический синдром, гипертонический нефросклероз, некоторые типы рака (такие как рак матки, груди, простаты и кишечника), осложнения беременности, нарушения женского репродуктивного здоровья (такие как нерегулярные менструации,бесплодие, нерегулярные овуляции, поликистоз яичников (PCOS, липодистрофию, нарушения, относящиеся к холестерину, такие как желчные камни, холецистит и холелитиаз, подагру, апноэ и дыхательные проблемы, остеоартрит и потеря костной массы, например, в особенности остеопороз. Термин "сельскохозяйственные животные" означает одомашненных четвероногих животных,включающих животных, выращиваемых на мясо и другие побочные продукты, например крупный рогатый скот, включая коров и других представителей рода Bos, свиней, включая домашнюю свинью и других представителей рода Sus, овец, включая овец и других представителей рода Ovis, домашних коз и других представителей рода Capra; одомашненных четвероногих животных, разводимых для особых целей, например для использования в качестве вьючных животных, например лошадей, включая домашних лошадей и других представителей семейства лошадиных рода Equus. Термин "млекопитающее" известен из уровня техники, типичные млекопитающие включают человека, приматов, сельскохозяйственных животных (включая коров, свиней и т.д.), животных-компаньонов"Тучные" индивидуумы или индивидуумы, страдающие ожирением, обычно имеют индекс массы тела (BMI) по меньшей мере 25 или выше. Ожирение может быть или не быть ассоциировано с устойчивостью к инсулину. Термины "парэнтеральное введение" и "вводить парэнтерально" известны из уровня техники и означают способы введения, отличные от энтерального введения и местного нанесения, обычно путем инъекции, и включающие без ограничения внутривенную, внутримышечную, внутриартериальную, интратекальную, интракапсулярную, интраорбитальную, внутрисердечную, внутрикожную, внутрибрюшинную,чрестрахеальную, подкожную, подкутикулярную, внутрисуставную, субкапсулярную, субарахноидальную, интраспинальную и интрастернальную инъекцию и инфузию."Пациент", "субъект", "индивидуум" или "реципиент" означает человека или животное, отличное от человека. Термин "фармацевтически приемлемый носитель" известен из уровня техники и означает фармацевтически приемлемый материал, композицию или наполнитель, такой как жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующий материал, участвующий в переносе или транспорте любой обсуждаемой композиции или ее компонента. Каждый носитель должен быть"приемлемым" в том смысле, что он должен быть совместимым с обсуждаемой композицией и ее компонентами и не являться вредным для пациента. Примеры материалов, могущих служить фармацевтически приемлемыми носителями, включают: (1) сахара, такие как лактоза, глюкоза, и сахароза; (2) крахмалы,такие как кукурузный крахмал и картофельный крахмал; (3) целлюлоза и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; (4) порошок трагаканта; (5) солод;(6) желатин; (7) тальк; (8) эксципиенты, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные агенты, такие как гидроксид магния и гидроксид алюминия; (15) альгиновая кислота;(16) вода, не содержащая пирогенов; (17) изотонический раствор соли; (18) раствор Рингера; (19) этиловый спирт; (20) растворы фосфатного буфера и (21) другие нетоксичные совместимые субстанции, используемые в фармацевтических препаратах. Термин "профилактика" принят в уровне техники и при использовании по отношению к состоянию,такому как локальный рецидив (например, боли), заболевание, такое как рак, комплекс синдромов, такой как паралич сердца или любое другое заболевание, свободно понимается специалистами в уровне техники и включает введение композиции, снижающей частоту или отдаляющей возникновение симптомов заболевания у субъекта относительно субъекта, не получающего композиции. Таким образом, профилак-3 021424 тика рака включает, например, уменьшение числа обнаруживаемых раковых опухолей у популяции пациентов, получающих профилактическое лечение, по сравнению с контрольной популяцией, не получающей лечения, и/или отсрочку появления обнаруживаемых раковых опухолей в популяции, получающей лечение, по сравнению с контрольной популяцией, например, на статистически и/или клинически значимую величину. Профилактика инфекции включает, например, уменьшение числа диагнозов инфекции в популяции, получающей лечение, по сравнению с контрольной популяцией и/или отсрочку появления симптомов инфекции у популяции, получающей лечение, по сравнению с контрольной популяцией. Профилактика боли включает, например, ослабление или, альтернативно, отсрочку болевых ощущений, испытываемых субъектами в популяции, получающей лечение, по сравнению с контрольной популяцией. Термин "профилактическое" или "терапевтическое" лечение известен из уровня техники и означает введение лекарственного препарата реципиенту. Если препарат вводят до клинического проявления нежелательного состояния (например, заболевания или другого нежелательно состояния животногореципиента), лечение является профилактическим, т.е. защищает реципиента от развития нежелательного состояния, в то время как, если препарат вводят после проявления нежелательного состояния, лечение является терапевтическим (т.е. направлено на уменьшение, улучшение или поддержание существующего нежелательного состояния или его побочных эффектов). Термин "не содержащий пирогенов", относящийся к композиции, означает композицию, не содержащую пирогенов в количестве, достаточном для проявления побочных эффектов (например, раздражение, лихорадка, воспаление, диарея, дыхательная недостаточность, эндотоксический шок и т.д.) у субъекта, которому вводят композицию. Например, в термин включаются композиции, не содержащие или практически не содержащие эндотоксина, такого как, например, липополисахарид (LPS)."Репликативная продолжительность жизни" клетки означает количество дочерних клеток, происходящих от одной и той же "материнской клетки". "Хронологическое старение" или "хронологическая продолжительность жизни" означают время, в течение которого остается жизнеспособной популяция неделящихся клеток, лишенных питательных веществ. "Увеличение продолжительности жизни клетки" или"удлинение продолжительности жизни клетки" при употреблении в отношении клеток или организмов означает увеличение количества дочерних клеток, происходящих от одной клетки; повышение способности клеток или организмов сопротивляться стрессу и ликвидировать повреждения, например, ДНК или белков; и/или повышения способности клеток или организмов выживать и существовать в живом состоянии дольше в определенных условиях, например при стрессе (например, тепловой шок, осмотический стресс, высокоэнергетическое облучение, химический стресс, повреждения ДНК, недостаточный уровень соли, недостаточный уровень азота или недостаточный уровень питательных веществ). Продолжительность жизни может быть увеличена на примерно 10, 20, 30, 40, 50 или 60% или между 20 и 70, 30 и 60, 40 и 60% или более, используя способы, описанные в настоящем документе."Соединение, активирующее сиртуин" означает соединение, повышающее уровень белка сиртуина и/или повышающее по меньшей мере одну активность белка сиртуина. В типичном воплощении соединение, активирующее сиртуин, может повышать по меньшей мере одну биологическую активность белка сиртуина, по меньшей мере, примерно на 10, 25, 50, 75, 100% или больше. Типичные биологические активности белка сиртуина включают деацетилирование, например, гистонов и р 53; увеличение продолжительности жизни; повышение стабильности генома; сайленсинг транскрипции и регуляцию сегрегации окисленных белков между материнской и дочерней клетками."Белок сиртуин" означает член белкового семейства сиртуиновых деацетилаз или предпочтительно семейства sir2, включающий белок дрожжей Sir2 (номер доступа в GenBank Р 53685), белок C.elegans Sir2.1 (номер доступа в GenBank NP501912) и белки человека SIRT1 (номер доступа в GenBankNM012238 и NP036370 (или AF083106 и SIRT2 (номер доступа в GenBank NM012237, NM030593,NP036369, NP085096 и AF083107). Другие члены семейства включают четыре дополнительных Sir2 подобных гена дрожжей, называемых "генами HST" (homologues of Sir two) HST1, HST2, HST3 и HST4, И пять других человеческих гомологов, hSIRT3, hSIRT4, hSIRT5, hSIRT6 и hSIRT7 (Brachmann et al. (1995)Genes Dev. 9:2888 и Frye at al. (1999) BBRC 260:273). Предпочтительные сиртуины включают те, которые более близки к SIRT1, т.е. hSIRTl и/или Sir2, чем к SIRT2, например, включающие по меньшей мере часть N-концевой последовательности, присутствующей в SIRT1 и не присутствующей в SIRT2, как например, SIRT3."Белок SIRT1" означает член семейства sir2 сиртуиновых деацетилаз. В одном воплощении белокSIRT1 включает белок дрожжей sir2 (номер доступа в GenBank P53685), белок C.elegans Sir-2.1 (номер доступа в GenBank NP501912), белок человека SIRT1 (номер доступа в GenBank NM012238 илиNP036370 (или AF083106 и их эквиваленты и фрагменты. В другом воплощении белок SIRT1 включает полипептид, содержащий последовательность, состоящую из или состоящую практически из аминокислотной последовательности, приведенной в GenBank за номерами доступа NP036370, NP501912,NP085096, NP036369 или Р 53685. Белки SIRT1 включают полипептиды, содержащие полностью или частично аминокислотную последовательность, приведенную в GenBank за номерами NP036370,NP501912, NP085096, NP036369 или Р 53685; аминокислотную последовательность, приведенную вGenBank за номерами NP036370, NP501912, NP085096, NP036369 или Р 53685 с 1 до примерно 2, 3,5, 7, 10, 15, 20, 30, 50, 75 или более замен консервативных аминокислот; последовательность, идентичную по меньшей мере на 60, 70, 80, 90, 95, 96, 97, 98 или 99% номерам доступа в GenBank NP036370,NP501912, NP085096, NP036369 или Р 53685 и их функциональные фрагменты. Полипептиды согласно настоящему изобретению также включают гомологи (например, ортологи и паралоги), варианты или фрагменты номеров доступа в GenBank NP036370, NP501912, NP085096, NP036369 или Р 53685. При употреблении в настоящем документе термины "белок SIRT2", "белок SIRT3", "белок SIRT4","белок SIRT5", "белок SIRT6" и "белок SIRT7" означают другие сиртуиновые деацетилазы млекопитающих, например человека, гомологичные белку SIRT1, в особенности в области консервативного каталитического домена длиной примерно 275 аминокислот. Например, "белок SIRT3" означает члена семейства сиртуиновых деацетилаз, гомологичного белку SIRT1. В одном воплощении белок SIRT3 включает человеческий белок SIRT3 (номер доступа в GenBank AAH01042, NP036371 или NP001017524) и мышиный белок SIRT3 (номер доступа в GenBank NP071878), а также их эквиваленты и фрагменты. В другом воплощении белок SIRT3 включает полипептид, содержащий последовательность, состоящую или практически состоящую из последовательности, приведенной в GenBank за номерами ААН 01042,NP036371, NP001017524, NP071878. Белки SIRT3 включают полипептиды, содержащие всю или часть аминокислотной последовательности, приведенной в GenBank за номерами ААН 01042, NP036371,NP001017524, NP071878; аминокислотную последовательность, приведенную в GenBank за номерами ААН 01042, NP036371, NP001017524, NP071878, содержащую от 1 до примерно 2, 3, 5, 7, 10, 15, 20,30, 50, 75 или более замен консервативных аминокислот; аминокислотную последовательность, идентичную по меньшей мере на 60, 70, 80, 90, 95, 96, 97, 98 или 99% номерам доступа в GenBank ААН 01042,NP036371, NP001017524 или NP071878; и ее функциональные фрагменты. Полипептиды согласно настоящему изобретению также включают гомологи (например, ортологи и паралоги), варианты или фрагменты номеров доступа в GenBank ААН 01042, NP036371, NP001017524 или NP071878. В одном воплощении белок SIRT3 включает фрагмент белка SIRT3, получающийся в результате его расщепления пептидазой, процессирующей митохондриальный матрикс (МРР) и/или митохондриальной промежуточной пептидазой (MIP). Термины "системное введение", "вводимый системно", "периферическое введение" и "вводимый периферически" известны из уровня техники и означают введение обсуждаемой композиции, терапевтического или иного материала не напрямую в центральную нервную систему таким образом, что он попадает в систему пациента и таким образом подвергается обмену веществ и другим сходным процессам. Используемый в настоящем документе термин "таутомер" хорошо известен из уровня техники и означает формальную миграцию атома водорода, т.е. протона, и переключение конфигураций одинарной связи и соседней двойной связи. При использовании в настоящем документе для описания соединения или рода соединений таутомер включает любую часть соединения или целое соединение, такие как единственная замещающая группа соединения, множественные замещающие группы соединения или, например, целое соединение. Например, таутомер соединения, включающего гидроксилзамещенное пиридиновое кольцо (А), представляет собой соединение, включающее кето-енольное замещенное кольцо (В): Термин "терапевтический агент" известен из уровня техники и означает любое химическое вещество, представляющее собой биологически, физиологически или фармакологически активную субстанцию,воздействующую на субъект системно или локально. Термин также означает любую субстанцию, используемую для диагностирования, излечения, облегчения, лечения или профилактики заболевания или для усиления желаемого физического или умственного развития и/или состояний у животного или человека. Термин "терапевтический эффект" известен из уровня техники и означает локальный или системный эффект у животных, в особенности у млекопитающих, и особенно у человека, обусловленный фармакологически активной субстанцией. Выражение "терапевтически эффективное количество" означает количество такой субстанции, производящее некий желаемый местный или системный эффект при разумном соотношении риска и выгоды, уместном при любом лечении. Терапевтически эффективное количество такой субстанции варьирует в зависимости от субъекта и заболевания, подвергающегося лечению, веса и возраста субъекта, степени выраженности заболевания, способа введения и т.п., что очевидно для специалиста в области техники. Например, некоторые композиции, описанные в настоящем документе, могут вводиться в достаточном количестве для достижения желаемого эффекта при разумном соотношении риска и выгоды, уместном при таком лечении."Лечение" состояния или заболевания означает как излечение, так и улучшение по меньшей мере одного симптома состояния или заболевания. Термин "ослабление зрения" относится к ухудшенному зрению, которое зачастую в результате лечения (например, хирургической операции) поддается только частичному улучшению или не поддается улучшению вообще. Особенно сильно ослабленное зрение называется "слепотой" или "потерей зрения",которая означает полную потерю зрения, зрение хуже 20/200, не поддающееся коррекции с помощью линз, или поле зрение диаметром менее 20 (радиусом менее 10). 2. Регуляторы сиртуина. В одном аспекте в настоящем изобретении представлены новые соединения, регулирующие сиртуин, для лечения и/или профилактики множества различных заболеваний и нарушений, включая, например, заболевания или нарушения, связанные со старением или стрессом, диабет, ожирение, нейродегенеративные заболевания, болезни и/или нарушения глаз, сердечно-сосудистое заболевание, нарушения свертываемости крови, воспаление, рак и/или покраснение лица и т.д. Соединения, регулирующие сиртуин, которые повышают уровень и/или активность белка сиртуина, могут также использоваться при лечении заболевания или нарушения у субъекта, течение которых может улучшиться при повышении митохондриальной активности, для улучшения работы мыщц, для повышения уровня мышечного АТФ или для лечения или профилактики повреждений мышечной ткани, ассоциированных с гипоксией или ишемией. Другие соединения, описанные в настоящем документе, могут быть пригодными для использования в составе фармацевтической композиции и/или в одном или более способов, описанных в настоящем документе. В одном воплощении соединения, регулирующие сиртуин, согласно настоящему изобретению описываются структурной (III): или его фармацевтически приемлемая соль, где R3 выбирается из водорода, метоксипропила, метоксипроп-1-инила, В частном варианте, где R3 выбирается из водорода, В предпочтительном варианте соединение представляет собой 5-(3-метоксипропил)-2-фенил-N-(2(6-(пирролидин-1-илметил)тиазоло[5,4-b]пиридин-2-ил)фенил)тиазол-4-карбоксамид или его фармацевтически приемлемую соль. В более предпочтительном варианте соединение представляет собой 2-фенил-N-(2-(6-(пирролидин 1-илметил)тиазоло[5,4-b]пиридин-2-ил)фенил)тиазол-4-карбоксамида: или его фармацевтически приемлемую соль. В наиболее предпочтительном варианте соединение представляет собой 5-(3-метоксипроп-1-инил)2-фенил-N-(2-(6-(пирролидин-1-илметил)тиазоло[5,4-b]пиридин-2-ил)фенил)тиазол-4-карбоксамида: или его фармацевтически приемлемую соль. Изобретение также включает соли, в особенности фармацевтически приемлемые соли соединений,регулирующих сиртуин, описанных в настоящем документе. Соединения согласно настоящему изобретению, имеющие достаточно кислую, достаточно щелочную или обе функциональные группы, могут реагировать с определенными неорганическими основаниями и неорганическими и органическими кислотами с образованием солей. Альтернативно, несущие заряд соединения, такие как содержащие четвертичный азот, могут образовывать соль с подходящим ионом противоположного заряда (например,галид, такой как бромид, хлорид или фторид, в особенности бромид). Кислоты, обычно используемые для образования солей с кислотами, представляют собой неорганические кислоты, такие как соляная кислота, бромисто-водородная кислота, йодисто-водородная кислота,серная кислота, фосфорная кислота и т.д., и органические кислоты, такие как п-толуенсульфоновая кислота, метансульфоновая кислота, щавелевая кислота, п-бромфенилсульфоновая кислота, угольная кислота, янтарная кислота, лимонная кислота, бензоевая кислота, уксусная кислота и т.д. Примеры таких солей включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, однозамещенный фосфат, двузамещенный фосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, ацетат, пропионат, деканоат, каприлат, акрилат, формат, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат,суберат, себакат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, ксиленсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, гамма-гидроксибутират, гликолат, тартрат, метансульфонат, пропансульфонат, нафтален-1-сульфонат, нафтален-2-сульфонат, манделат и т.д. Соли, образующиеся при добавлении оснований, включают соли, образующиеся при добавлении неорганических оснований, таких как аммоний, или щелочи, или гидроксиды, карбонаты, бикарбонаты щелочно-земельных металлов и т.д. Таким образом, основания, пригодные для получения солей согласно настоящему изобретению, включают гидроксид натрия, гидроксид калия, гидроксид аммония, гидроксид кальция и т.д. Согласно другому воплощению в настоящем изобретении представлены способы получения вышеупомянутых соединений, регулирующих сиртуин. Эти соединения могут быть синтезированы с помощью общепринятых техник. Кроме того, такие соединения можно легко синтезировать из доступных исходных материалов. Трансформации и методологии химии синтеза, используемые для синтеза соединений, регулирующих сиртуин, описанные в настоящем документе, известны из уровня техники и включают, например,описанные в R. Larock, Comprehensive Organic Transformations (1989); Т. W. Greene и P. G. M. Wuts, Protective Groups in Organic Synthesis, 2-е изд. (1991); L. Fieser и М. Fieser, Fieser and Fieser's Reagents for Organic Synthesis (1994); и Encyclopedia of Reagents for Organic Synthesis под ред. L. Paquette (1995). В типичном воплощении соединение, регулирующее сиртуин, может проходить через цитоплазматическую мембрану клетки. Например, соединение может иметь проницаемость для клетки по меньшей мере 20, 50, 75, 80, 90 или 95%. Соединения, регулирующие сиртуин, описанные в настоящем документе, могут также иметь одно или более следующих свойств: соединение может быть практически не токсично для клетки или субъекта; соединение, влияющее на сиртуин, может представлять собой органическую молекулу или малую молекулу массой не более 2000 а.м.е., не более 1000 а.м.е.; соединение может иметь время полужизни в нормальных атмосферных условиях по меньшей мере примерно 30 дней, 60 дней, 120 дней, 6 месяцев или 1 год; соединение, влияющее на сиртуин, может быть стабильнее в растворе, чем ресвератрол, по меньшей мере на 50%, в 2 раза, 5 раз, 10 раз, 30 раз, 50 раз или 100 раз; соединение, влияющее на сиртуин, может вызывать деацетилирование фактора репарации ДНК Ku70; соединение, влияющее на сиртуин, может вызывать деацетилирование RelA/p65; соединение может повышать скорость обмена веществ в клетке и повышать чувствительность клеток к апоптозу, индуцированному TNF. В некоторых воплощениях соединение, регулирующее сиртуин, практически не имеет активности,ингибирующей гистон деацетилазу (HDACs) класса I, HDAC класса II или HDAC I и II в концентрациях(например, in vivo), эффективно регулирующих деацетилазную активность сиртуина. Например, в предпочтительных воплощениях соединение, влияющее на сиртуин, представляет собой соединение, активирующее сиртуин, и выбирается так, чтобы ЕС 50 для активации деацетилазной активности сиртуина была по меньшей мере в 5 раз меньше, чем ЕС 50 для ингибирования HDAC I и/или HDAC II, более предпочтительно по меньшей мере в 10 раз, 100 раз или даже в 1000 раз меньше. Способы оценки активностиHDAC I и/или HDAC II хорошо известны из уровня техники, а наборы для проведения таких тестов имеются в продаже. См., например, BioVision, Inc (адрес в Интернете biovision.com) и Thomas Scientific(Swedesboro, NJ; адрес в Интернете tomassci.com). В некоторых воплощениях соединение, влияющее на сиртуин, практически не способно регулировать гомологи сиртуина. В одном воплощении, активатор человеческого белка сиртуина практически не способен активировать белок сиртуин низших эукариот, в особенности дрожжей или человеческих патогенов, в концентрациях (например, in vivo), эффективных для активирования деацетилазной активности человеческого сиртуина. Например, соединение, влияющее на сиртуин, может выбираться так, чтобы ЕС 50 для активации деацетилазной активности человеческого сиртуина, такого как SIRT1 и/или SIRT3,была по меньшей мере в 5 раз меньше, чем ЕС 50 для активации сиртуина дрожжей, такого как Sir2 (таких как Candida, S. Cerevisiae и.т.д.), более предпочтительно по меньшей мере в 10 раз, 100 раз или даже в 1000 раз меньше. В другом воплощении ингибитор белка сиртуина низших эукариот, в особенности дрожжей или человеческих патогенов, практически не способен ингибировать человеческий белок сиртуин в концентрациях (например, in vivo), эффективных для ингибирования деацетилазной активности сиртуина низших эукариот. Например, соединение, ингибирующее сиртуин, может выбираться так, чтобы IC50 для ингибирования деацетилазной активности человеческого сиртуина, такого как SIRT1 и/илиSIRT3, была по меньшей мере в 5 раз меньше, чем IC50 для ингибирования сиртуина дрожжей, такого какSir2 (таких как Candida, S. Cerevisiae и.т.д.), более предпочтительно по меньшей мере в 10 раз, 100 раз или даже в 1000 раз меньше. В некоторых воплощениях соединение, влияющее на сиртуин, может быть способным регулировать один или более гомологов белка сиртуина, таких как, например, один или более человеческих SIRT1,SIRT2, SIRT3, SIRT4, SIRT5, SIRT6 или SIRT7. В одном воплощении соединение, регулирующее сиртуин, способно регулировать как белок SIRT1, так и белок SIRT3. В других воплощениях регулятор SIRT1 практически не способен регулировать другие гомологи белка сиртуина, такие как, например, один или более человеческих SIRT2, SIRT3, SIRT4, SIRT5, SIRT6 или SIRT7, в концентрациях (например, in vivo), эффективных для регулирования деацетилазной активности человеческого SIRT1. Например, соединение, регулирующее сиртуин, может выбираться так, чтобы ED50 для регулирования деацетилазной активности человеческого SIRT1 была по меньшей мере в 5 раз меньше, чем ED50 для регулирования одного или более человеческих SIRT2, SIRT3, SIRT4, SIRT5,SIRT6 или SIRT7, более предпочтительно по меньшей мере в 10 раз, 100 раз или даже в 1000 раз меньше. В одном воплощении регулятор SIRT1 практически не способен регулировать белок SIRT3. В других воплощениях регулятор SIRT3 практически не способен регулировать другие гомологи белка сиртуина, такие как, например, один или более человеческих SIRT1, SIRT2, SIRT4, SIRT5, SIRT6 или SIRT7, в концентрациях (например, in vivo), эффективных для регулирования деацетилазной активности человеческого SIRT3. Например, соединение, регулирующее сиртуин, может выбираться так, чтобы ED50 для регулирования деацетилазной активности человеческого SIRT3 была по меньшей мере в 5 раз меньше, чем ED50 для регулирования одного или более человеческих SIRT1, SIRT2, SIRT4, SIRT5,SIRT6 или SIRT7, более предпочтительно по меньшей мере в 10 раз, 100 раз или даже в 1000 раз меньше. В одном воплощении регулятор SIRT3 практически не способен регулировать белок SIRT1. В некоторых воплощениях соединение, регулирующее сиртуин, может иметь сродство связывания с белком сиртуином, равное примерно 10-9 М, 10-10 М, 10-11M, 10-12 М или ниже. Соединение, регулирующее сиртуин, может понижать (активатор) или повышать (ингибитор) исходную Km белка сиртуина к его субстрату или НАД+ (или другому кофактору) по меньше мере в 2, 3, 4, 5, 10, 20, 30, 50 или 100 раз. В некоторых воплощениях значения Km определяют с помощью масс-спектрометрического анализа, описанного в настоящем документе. Предпочтительные активирующие соединения уменьшают Km сиртуина к его субстрату или кофактору в большей степени, чем ресвератрол в близкой концентрации, или уменьшают Km сиртуина к его субстрату или кофактору сравнимо с ресвератролом в более низкой концентрации. Соединение, регулирующее сиртуин, может повышать Vmax белка сиртуина по меньшей мере в 2, 3, 4, 5, 10, 20, 30, 50 или 100 раз. Соединение, регулирующее сиртуин, может иметь ED50 регуляции деацетилазной активности белка SIRT1 и/или SIRT3 менее примерно 1 нМ, менее примерно 10 нМ,менее примерно 100 нМ, менее примерно 1 мкМ, менее примерно 10 мкМ, менее примерно 100 мкМ, или примерно 1-10 нм, примерно 10-100 нм, примерно 0,1-1 мкМ, примерно 1-10 мкМ, или примерно 10-100 мкМ. Соединение, регулирующее сиртуин, может изменять деацетилазную активность белка SIRT1 и/или SIRT3 по меньшей мере в 5, 10, 20, 30, 50 или 100 раз по данным клеточного теста или теста, основанного на клетках. Соединение, активирующее сиртуин, может индуцировать деацетилазную активность белка сиртуина по меньшей мере на примерно 10, 30, 50, 80% в 2 раза, в 5 раз, в 10 раз, в 50 раз или в 100 раз по сравнению с такой же концентрацией ресвератрола. Соединение, регулирующее сиртуин,может иметь ED50 регуляции SIRT5 по меньшей мере в 10 раз, 20 раз, 30 раз или 50 раз выше, чем ED50 регуляции SIRT1 и/или SIRT3. 3. Примеры использования. В некоторых аспектах в настоящем изобретении представлены способы регуляции уровня и/или активности белка сиртуина и способы их использования. В некоторых воплощениях в настоящем изобретении представлены способы использования соединений, регулирующих сиртуин, где соединения, регулирующие сиртуин, активируют белок сиртуин, т.е. повышают уровень и/или активность белка сиртуина. Соединения, регулирующие сиртуин, которые повышают уровень и/или активность белка сиртуина, могут использоваться в различных терапевтических целях, включая, например, увеличение продолжительности жизни клетки и лечение и/или профилактику множества различных заболеваний и нарушений, включая, например, заболевания или нарушения, связанные со старением или стрессом, диабет, ожирение, нейродегенеративные заболевания, сердечнососудистое заболевание, нарушения свертываемости крови, воспаление, рак и/или покраснение лица и т.д. Способы включают введение субъекту, нуждающемуся во введении, фармацевтически эффективного количества вещества, регулирующего сиртуин, например вещества, активирующего сиртуин. Не желая ограничиваться какой-либо одной теорией, считается, что активаторы согласно настоящему изобретению могут взаимодействовать с сиртуином в одном и том же месте белка сиртуина (на-8 021424 пример, активный центр или положение, влияющее на Km или Vmax активного центра). Считается, что поэтому некоторые классы активаторов и ингибиторов сиртуина могут обладать значительным структурным сходством. В некоторых воплощениях соединения, регулирующие сиртуин, описанные в настоящем документе,могут приниматься по отдельности или в комбинации с другими соединениями. В одном воплощении субъекту, нуждающемуся во введении, может вводиться смесь двух или более соединений, регулирующих сиртуин. В другом воплощении соединение, регулирующее сиртуин, которое повышает уровень и/или активность белка сиртуина, может вводиться с одним или более следующих соединений: ресвератрол, бутеин, фисетин, пицеатаннол или кверцетин. В типичном воплощении соединение, регулирующее сиртуин, которое повышает уровень и/или активность белка сиртуина, может вводиться в комбинации с никотиновой кислотой. В другом воплощении соединение, регулирующее сиртуин, которое понижает уровень и/или активность белка сиртуина, может вводиться с одним или более следующих соединений: никотинамид (NAM); сурамин; NF023 (антагонист G-белков); NF279 (антагонист пуринергических рецепторов); тролокс (6-гидрокси-2,5,7,8-третраметилхроман-2-карбоксикислота); (-)-эпигаллокатехин(гидроксильные группы в положениях 3,5,7,3',4',5'); (-)-эпигаллокатехин галлат (гидроксильные группы в положениях 5,7,3',4',5' и сложный эфир галловой кислоты в положении 3); цианидин хлорид (3,5,7,3',4'пентагидроксифлавилиум хлорид); дельфинидин хлорид (3,5,7,3',4',5'-гексагидроксифлавилиум хлорид); мирицетин (каннабисцетин; 3,5,7,3',4',5'-гексагидроксифлавон); 3,7,3',4',5'-пентагидроксифлавон; госсипетин (3,5,7,8,3',4'-гексагидроксифлавон), сиртинол и сплитомицин. Еще в одном воплощении одно или более соединений, регулирующих сиртуин, могут вводиться с одним или более терапевтическими агентами для лечения или профилактики различных заболеваний, включая, например, рак диабет, нейродегенеративные заболевания, сердечно-сосудистое заболевание, свертываемость крови, лихорадка, ожирение,старение, стресс и т.д. В различных воплощениях комбинированная терапия, включающая соединение,регулирующее сиртуин, может означать (1) фармацевтические композиции, содержащие одно или более соединений, регулирующих сиртуин, в сочетании с одним или более терапевтических агентов (например,одним или более терапевтических агентов, описанных в настоящем документе); и (2) совместное введение одного или более соединения, регулирующего сиртуин и одного или более терапевтического агента,где соединение, регулирующее сиртуин и терапевтический агент не находятся в составе одних и тех же композиций (но могут быть в составе одного и того же набора или упаковки, такой как блистерная упаковка или другая упаковка с несколькими отделениями; соединенные, запаянные по отдельности контейнеры (например, кармашки из фольги), которые могут разделяться пользователем; или набор, где соединение (соединения), регулирующее сиртуин, и другой терапевтически агент (агенты) находятся в разных сосудах. При использовании раздельных рецептур соединение, регулирующее сиртуин, может вводиться одновременно, попеременно, смещенно, перед, после или в комбинациях вариантов введения с другим терапевтическим агентом. В некоторых воплощениях способы ослабления, предотвращения или лечения заболеваний с использованием соединения, регулирующего сиртуин, могут также включать повышение уровня сиртуина,такого как человеческий SIRT1, SIRT2 и/или SIRT3, или их гомологов. Повышение уровня белка может достигаться путем введения в клетки одной или более копий нуклеиновой кислоты, кодирующей сиртуин. Например, можно повысить уровень белка сиртуина в клетке млекопитающего путем введения в клетку млекопитающего нуклеиновой кислоты, кодирующей сиртуин, например, повысить уровеньSIRT1 путем введения нуклеиновой кислоты, кодирующей аминокислотную последовательность, приведенную в GenBank за номером NP036370, и/или повысить уровень SIRT3 путем введения нуклеиновой кислоты, кодирующей аминокислотную последовательность, приведенную в GenBank за номером ААН 01042. Нуклеиновая кислота, вводимая в клетку для повышения уровня белка сиртуина, может кодировать белок по меньшей мере примерно на 80, 85, 90, 95 или 99%, идентичный последовательности сиртуина,например белка SIRT1 и/или SIRT3. Например, нуклеиновая кислота, кодирующая белок, может быть по меньшей мере примерно на 80, 85, 90, 95, 98 или 99% идентичной нуклеиновой кислоте, кодирующей белок SIRT1 (например, номер доступа в GenBank NM012238) и/или SIRT3 (например, номер доступа вGenBank BC001042). Нуклеиновая кислота может также представлять собой нуклеиновую кислоту, гибридизующуюся предпочтительно в строгих условиях гибридизации с нуклеиновой кислотой, кодирующей сиртуин дикого типа, например, белок SIRT1 и/или SIRT3. Строгие условия гибридизации могут включать гибридизацию и отмывку в 0,2 SSC при 65 С. При использовании нуклеиновой кислоты, кодирующей белок, отличающийся от белка сиртуина дикого типа, такой как белок, представляющий собой фрагмент сиртуина дикого типа, предпочтительно чтобы белок обладал биологической активностью, т.е. был способен к деацетилированию. Необходимо экспрессировать в клетке только биологически активную часть сиртуина. Например, белок, отличающийся от SIRT1 дикого типа, имеющего номер доступа вGenBank NP036370, предпочтительно включает его коровую структуру. Коровой структурой называют аминокислоты 62-293 номера доступа в GenBank NP036370, кодируемые нуклеотидами 237-932 номера доступа в GenBank NM012238; в эту структуру входят НАД-связывающий и субстрат-связывающий домены. Коровым доменом SIRT1 могут также называться аминокислоты примерно 261-447 номера дос-9 021424 тупа в GenBank NP036370, кодируемые нуклеотидами 834-1394 номера доступа в GenBank NM012238; аминокислоты примерно 242-493 номера доступа в GenBank NP036370, кодируемые нуклеотидами 7771532 номера доступа в GenBank NM012238; аминокислоты примерно 254-495 номера доступа в GenBank NP036370, кодируемые нуклеотидами 813-1538 номера доступа в GenBank NM012238. Способы,известные из уровня техники, позволяют определить, сохраняет ли белок биологические функции, например способность к деацетилированию. В некоторых воплощениях способы ослабления, предотвращения или лечения заболеваний или нарушений с использованием соединений, регулирующих сиртуин, могут также включать понижение уровня белка сиртуина, такого как человеческий SIRT1, SIRT2 и/или SIRT3, или их гомологов. Понижение уровня белка сиртуина может достигаться согласно способам, известным из уровня техники. Например, в клетке можно экспрессировать миРНК, антисмысловую нуклеиновую кислоту или рибозим, направленные на сиртуин. Также может использоваться доминантно-негативный мутант сиртуина, например мутант, не способный к деацетилированию. Например, может использоваться мутант H363Y SIRT1,описанный, например, в Luo et al. (2001) Cell 107:137. Альтернативно могут использоваться агенты, ингибирующие транскрипцию. Способы регуляции уровня белка сиртуина также включают способы регуляции транскрипции генов, кодирующих сиртуины, способы стабилизации/дестабилизации соответствующих мРНК и другие способы, известные из уровня техники. Соединения, регулирующие сиртуин, могут вводиться субъекту местно или системно. В одном воплощении соединение, регулирующее сиртуин, вводится местно к ткани или органу путем инъекции,композиции для местного нанесения и т.д. Еще в одном воплощении соединение, регулирующее сиртуин, которое повышает уровень и/или активность белка сиртуина, может вводиться субъекту для общего увеличения продолжительности жизни его клеток и для защиты его клеток от стресса и/или апоптоза. Считается, что воздействие на субъекта соединением, описанным в настоящем документе, сродни гормезису, то есть мягкому стрессу, который благотворно действует на организмы и может увеличивать их продолжительность жизни. Диабетические нейропатии представляют собой нейропатические заболевания, ассоциированные с сахарным диабетом. Относительно часто встречающиеся состояния, которые могут ассоциироваться с диабетической нейропатией, включают паралич глазодвигательного нерва; мононейропатию; множественный мононеврит; диабетическую амиотрофию; болезненную полинейропатию; автономную нейропатию и торакоабдоминальную нейропатию. Периферическая нейропатия - медицинский термин, обозначающий повреждения нервов периферической нервной системы, которое может быть обусловлено заболеваниями нервов или побочными эффектами системных заболеваний. Основные причины периферической нейропатии включают судороги,недостаточность питательных веществ и СПИД, хотя наиболее вероятной причиной является диабет. В другом аспекте соединения, регулирующие сиртуин, которые повышают уровень и/или активность белка сиртуина, могут использоваться для профилактики набора веса или ожирения у субъекта. Например, соединения, регулирующие сиртуин, которые повышают уровень и/или активность белка сиртуина, могут использоваться для лечения или профилактики наследственного ожирения, диетического ожирения, гормонального ожирения, ожирения, связанного с введением лекарственных препаратов, для уменьшения веса субъекта или для уменьшения или предотвращения набора веса субъектом. Субъектом,нуждающимся в подобном лечении, может быть тучный субъект, субъект, могущий стать тучным, субъект, имеющий лишний вес, или субъект, могущий набрать лишний вес. Субъектов, могущих стать тучными или набрать лишний вес, можно идентифицировать, например, на основании семейной истории,генетики, диеты, уровня активности, принимаемых лекарств или различных комбинаций вышеперечисленного. В другом аспекте соединения, регулирующие сиртуин, которые повышают уровень и/или активность белка сиртуина, могут использоваться для лечения или профилактики метаболического заболевания, такого как устойчивость к инсулину, преддиабетическое состояние, диабет II типа и/или их осложнений. Введение соединения, регулирующего сиртуин, которое повышает уровень и/или активность белка сиртуина, может повышать чувствительность к инсулину и/или снижать уровень инсулина у субъекта. Субъектом, нуждающимся в подобном лечении, может быть субъект с устойчивостью к инсулину или другим симптомом-предшественником диабета II типа, субъект, страдающий диабетом II типа, или субъект, у которого может развиться любое из этих состояний. Например, субъект может быть субъектом с устойчивостью к инсулину, например, иметь высокий уровень инсулина в крови и/или ассоциированные состояния, такие как гиперлипидемия, нарушение липогенеза, гиперхолестеринемия, пониженная толерантность к глюкозе, высокое содержание глюкозы в крови, другие проявления синдрома X, гипертония,атеросклероз и липодистрофия. В типичном воплощении соединения, регулирующие сиртуин, которые повышают уровень и/или активность белка сиртуина, могут вводиться в составе комбинированной терапии для лечения или профилактики метаболического заболевания. Например, одно или более соединений, регулирующих сиртуин, которые повышают уровень и/или активность белка сиртуина, может вводиться с одним или более противодиабетических агентов. 4. Тесты. Описаны различные типы тестов для определения активности сиртуина. Например, активность сиртуина можно измерить с помощью флуоресцентного анализа, например, с помощью коммерческого теста производства Biomol, например, SIRT1 Fluorimetric Drug Discovery Kit (AK-555), SIRT2 Fluorimetric DrugDiscovery Kit (AK-556) или SIRT3 Fluorimetric Drug Discovery Kit (AK-557) (Biomol International, Plymouth Meeting, PA). Другие пригодные тесты на сиртуин включают анализ высвобождения никотинамида (Kaeberlein et al., J. Biol. Chem. 280(17): 17038 (2005, FRET-анализ (Marcotte et al, Anal. Biochem. 332:90 (2004 и анализ связывания С 14 НАД с бороновой смолой (McDonagh et al., Methods 36:346(2005. Другие пригодные тесты на сиртуин включают радиоиммунный анализ (RIA), анализ сцинцилляционной близости, анализ, основанный на HPLC, и репортерный анализ (например, для мишеней транскрипционных факторов). Типичный тест на определение активности сиртуина представляет собой анализ поляризации флуоресценции. Анализ поляризации флуоресценции описан в настоящем документе и также описан в публикации РСТWO 2006/094239. В других воплощениях активность сиртуина может определяться способом масс-спектрометрии. Примеры тестов, основанных на масс-спектрометрии, описаны в настоящем документе и также описаны в публикации РСТ WO 2007/064902. Также для определения активности сиртуина могут использоваться клеточные тесты. Примеры клеточных тестов для определения активности сиртуина описаны в публикациях РСТWO 2007/064902 и WO 2008/060400. Другие способы, предусматриваемые настоящим документом, представляют собой способы скрининга для обнаружения соединений или агентов, регулирующих сиртуины. Агент может представлять собой нуклеиновую кислоту, такую как аптамер. Тесты можно проводить в клеточной или бесклеточной системе. Например, тест может включать инкубацию (или приведение в контакт) сиртуина с тестируемым агентом в условиях, при которых сиртуин может регулироваться известным агентом, регулирующим сиртуин, и наблюдение или определение уровня регуляции сиртуина в присутствии тестируемого агента относительно отсутствия тестируемого агента. Уровень регуляции сиртуина можно определять путем определения его способности деацетилировать субстрат. Типичные субстраты представляют собой ацетилированные белки, например, приобретенные у BIOMOL (Plymouth Meeting, PA). Предпочтительные субстраты включают пептиды р 53, такие как пептиды, включающие ацетилированный К 382. В особенности предпочтителен субстрат Fluor de Lys-SIRTl (BIOMOL), т.е. ацетилированный пептид Arg-HisLys-Lys. Другие субстраты представляют собой пептиды из человеческих гистонов Н 3 и Н 4 или ацетилированную аминокислоту. Субстраты могут быть флуорогенны. Сиртуин может представлять собойSIRT1, Sir2, SIRT2, SIRT3 или их часть. Например, рекомбинантный SIRT1 можно приобрести у BIOMOL. Реакцию можно проводить в течение примерно 30 мин, а затем остановить ее, например, с помощью никотинамида. Для определения уровня ацетилирования может использоваться набор реагентовHDAC fluorescent activity assay/drug discovery kit (AK-500, BIOMOL Research Laboratories). Похожие тесты описаны в Bitterman et al. (2002) J. Biol. Chem. 277:45099. Уровень регуляции сиртуина в тесте можно сравнить с уровнем регуляции сиртуина в присутствии одного или более (по отдельности или одновременно) соединений, описанных в настоящем документе, которые могут служить положительным или отрицательным контролем. Сиртуины для использования в тестах могут представлять собой полноразмерные белки сиртуины или их части. Поскольку в настоящем документе было показано, что активирующие соединения взаимодействуют с N-концом SIRT1, белки для использования в тестах включаютN-концевую область сиртуинов, например, аминокислоты примерно 1-176 или 1-255 SIRT1; аминокислоты примерно 1-174 или 1-252 Sir2. В одном воплощении скрининговый тест включает (i) приведение в контакт сиртуина с тестируемым агентом и ацетилированным субстратом в условиях, благоприятных для деацетилирования сиртуином субстрата в отсутствие тестируемого агента; (ii) и определение уровня ацетилирования субстрата,где пониженный уровень ацетилирования субстрата в присутствии тестируемого агента относительно отсутствия тестируемого агента указывает на то, что тестируемый агент стимулирует деацетилирование сиртуином, в от время как повышенный уровень ацетилирования субстрата в присутствии тестируемого агента относительно отсутствия тестируемого агента указывает на то, что тестируемый агент ингибирует деацетилирование сиртуином. Способы обнаружения агента, который регулирует, например стимулирует сиртуины in vivo, может включать: (i) приведение клетки в контакт с тестируемым агентом и субстратом, который может проникнуть в клетку в присутствии ингибитора HDAC I и II классов, в условиях, благоприятных для деацетилирования сиртуином субстрата в отсутствие тестируемого агента; (ii) и определение уровня ацетилирования субстрата, где пониженный уровень ацетилирования субстрата в присутствии тестируемого агента относительно отсутствия тестируемого агента указывает на то, что тестируемый агент стимулирует деацетилирование сиртуином, в то время как повышенный уровень ацетилирования субстрата в присутствии тестируемого агента относительно отсутствия тестируемого агента указывает на то, что тестируемый агент ингибирует деацетилирование сиртуином. Предпочтительный субстрат представляет собой ацетилированный пептид, который также предпочтительно является флуорогенным, как подробно описано ниже. Метод может далее включать лизис клеток для определения уровня ацетилирования субстрата. Субстраты можно добавлять к клеткам в концентрациях примерно 1 мкМ-10 мМ, предпочтительно примерно 10 мкМ-1 мМ, еще более предпочтительно примерно 100 мкМ-1 мМ, такой как 200 мкМ. Предпочтительный субстрат представляет собой ацетилированный лизин, например, -ацетиллизин (Fluor deLys, FdL) или FLuor de Lys-SIRT1. Предпочтительный ингибитор HDAC I и II классов представляет собой трихостатин A (TSA), который может использоваться в концентрациях примерно 0,01-100 мкМ,предпочтительно примерно 0,1-10 мкМ, такой как 1 мкМ. Инкубацию клеток с тестируемым соединением и субстратом можно проводить в течение примерно от 10 мин до 5 ч, предпочтительно примерно 1-3 ч. Поскольку TSA ингибирует все HDAC I и II классов и некоторые субстраты, например, Fluor de Lys,плохо подходят для SIRT2 и еще хуже для SIRT3-7, такой тест может использоваться для обнаружения регуляторов SIRT1 in vivo. 5. Фармацевтические композиции. Соединения, регулирующие сиртуин, описанные в настоящем документе, могут быть составлены в композицию общепринятым способом с использованием одного или более фармацевтически приемлемых носителей или наполнителей. Например, соединения, регулирующие сиртуин, и их фармацевтически приемлемые соли и сольваты могут быть составлены в композицию для введения, например, путем инъекции (например, подкожной, внутримышечной, внутрибрюшинной), ингаляции или инсуффляции(через рот или через нос) или путем перорального, буккального, подъязычного, чрескожного, назального,парэнтерального или ректального введения. В одном воплощении соединение, регулирующее сиртуин,может вводиться местно, в место присутствия клеток-мишеней, т.е. в определенную ткань, орган или жидкость (например, кровь, спинномозговую жидкость и т.д.). Соединения, регулирующие сиртуин, могут быть составлены в композицию для различных способов введения, включая системное, или топическое, или местное введение. Техники и композиции в общем описаны в Remington's Pharmaceutical Sciences, Meade Publishing Co., Easton, PA. Для парентерального введения предпочтительна инъекция, включая внутримышечную, внутривенную, внутрибрюшинную и подкожную. Соединения для инъекции могут составляться в жидкие растворы, предпочтительно в физиологически совместимых буферных растворах, таких как раствор Хэнка или раствор Рингера. Кроме того, соединения могут составляться в твердые формы для растворения или суспендирования непосредственно перед употреблением. Также включаются лиофилизированные формы. Для перорального введения фармацевтические композиции могут быть в форме таблеток, пастилок или капсул, изготовленных общепринятыми способами с фармацевтически приемлемыми наполнителями, такими как связующие агенты (например, прежелатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза), наполнители (например, лактоза, микрокристаллическая целлюлоза или вторичный фосфат кальция); смазки (например, стеарат магния, тальк или окись кремния); дезинтегрирующие средства (например, картофельный крахмал или натрия крахмал гликолат) или смачивающие агенты (например, натрия лаурилсульфат). Таблетки могут покрываться способом,известным из уровня техники. Жидкие препараты для перорального введения могут быть в форме, например, растворов, сиропов или суспензий или могут быть представлены в виде сухого продукта для восстановления водой или другим подходящим носителем перед употреблением. Такие жидкие препараты могут быть изготовлены общепринятыми способами с фармацевтически приемлемыми добавками,такими как суспендирующие агенты (например, сорбитовый сироп, производные целлюлозы или гидрогенизированные пищевые жиры); эмульгаторы (например, лецитин или акация); неводные носители (например, миндальное масло, эфиры масел, этиловый спирт или фракционированные растительные масла); и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Препараты также могут при необходимости содержать буферные соли, вкусовые добавки, красители и подсластители. Препараты для перорального введения могут быть составлены для контролируемого высвобождения активного вещества. Для введения путем ингаляции (например, доставка в легкие) соединения, регулирующие сиртуин,могут быть легко доставлены в форме аэрозоля из баллонов под давлением или небулайзера, с использованием пригодного пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением доза может определяться предоставленным клапаном для высвобождения отмеренного количества. В составе капсул и ампул, например желатиновых, для использования в ингаляторе или инсуффляторе может быть порошковая смесь соединения и подходящей порошковой базы, такой как лактоза или крахмал. Соединения, регулирующие сиртуин, могут быть составлены в композиции для парентерального введения путем инъекции, например, путем болюсной инъекции или постоянной инфузии. Композиции для инъекций могут быть представлены в виде стандартной дозы, например, в ампулах или многодозовых контейнерах, с добавлением консерванта. Композиции могут быть в форме суспензий, растворов или эмульсий в масляных или водных растворителях и могут содержать композиционные агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в форме порошка для восстановления подходящим растворителем, например стерильной водой, не содержащей пирогенов, перед употреблением. Соединения, регулирующие сиртуин, могут также быть составлены в ректальные композиции, такие как суппозитории или удерживающие клизмы, например, содержащие общепринятые основы для суппозиториев, такие как какао-масло или другие глицериды. В дополнение к вышеописанным композициям соединения, регулирующие сиртуин, могут быть составлены в форме препарата депо. Такие композиции длительного действия могут вводиться путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Так, например, соединения, регулирующие сиртуин, могут быть составлены в композицию с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле), или ионообменными смолами, или в виде слаборастворимых производных, например, слаборастворимой соли. Формула контролируемого высвобождения также включает пластыри. В некоторых воплощениях соединения, описанные в настоящем документе, могут быть составлены в композиции для доставки в центральную нервную систему (ЦНС) (см. обзор Begley, PharmacologyTherapeutics 104: 29-45 (2004. Стандартные подходы доставки лекарств в ЦНС включают: нейрохирургические подходы (например, внутримозговую инъекцию или внутримозговую инфузию в область желудочков); изменение молекулярного состава агента (например, получение слитого химерного белка,включающего транспортный пептид, обладающий сродством к молекуле на поверхности эндотелиальных клеток, в комбинации с агентом, способным проникать через гематоэнцефалический барьер) для использования одного из эндогенных путей транспорта через гематоэнцефалический барьер; фармакологические стратегии, направленные на повышение растворимости агента в липидах (например, конъюгация водорастворимых агентов с липидными или холестериновыми носителями); и временное нарушение целостности гематоэнцефалического барьера путем гиперосмотического разрыва (в результате инфузии раствора маннита в сонную артерию или использования биологически активного агента, такого как пептид ангиотензина). Липосомы представляют собой легко инъецируемую форму доставки лекарств. Соответственно в способе согласно изобретению активные компоненты могут также вводиться в форме липосомной доставки. Липосомы хорошо известны специалисту в области техники. Липосомы могут образовываться различными фосфолипидами, такими как холестерин, стеариламин или фосфатидилхолины. Липосомы,подходящие для способа согласно изобретению, включают все типы липосом, включая, но не ограничиваясь малыми однослойными липосомами, большими однослойными липосомами и многослойными липосомами. Еще одним способом получения композиции, в особенности регулятора сиртуина, такого как ресвератрол или его производное, является использование циклодекстрина. Под циклодекстрином понимается-, - или -циклодекстрин. Циклодекстрины подробно описаны в Pitha et al., патент США 4 727 064,полностью включенный в настоящий документ в качестве ссылки. Циклодекстрины представляют собой циклические олигомеры глюкозы; эти соединения образуют комплексы включения с любым препаратом,чья молекула помещается в липофильные карманы молекулы циклодекстрина. Быстро разлагающиеся или растворяющиеся лекарственные формы пригодны для быстрой абсорбции, в особенности буккальной и сублингвальной абсорбции, фармацевтически активных агентов. Быстрорастворимые лекарственные формы подходят пациентам, таким как пожилым и педиатрическим пациентам, испытывающим трудности при проглатывании типичных твердых лекарственных форм, таких как каплеты и таблетки. Кроме того, быстрорастворимые лекарственные формы позволяют избавиться от недостатков, например, жевательных лекарственных форм, для которых время, в течение которого активный агент находится во рту пациента, играет большую роль в определении вкуса или сухости в гортани, вызываемым активным агентом. Фармацевтические композиции (включая косметические препараты) могут содержать примерно от 0,00001 до 10%, например от 0,001 до 10% или от 0,1 до 5% по массе одного или более соединений, регулирующих сиртуин, описанных в настоящем документе. В других воплощениях фармацевтическая композиция содержит: (i) 0,05-1000 мг соединений согласно изобретению или их фармацевтически приемлемых солей, и (ii) 0,1-2 г одного или более фармацевтически приемлемых наполнителей. В одном воплощении соединение, регулирующее сиртуин, описанное в настоящем документе,включено в композицию для местного нанесения, содержащую носитель для местного нанесения, который, в общем, пригоден для местного нанесения и включает любые подобные материалы, известные из уровня техники. Носитель для местного нанесения может выбираться с тем, чтобы композиция имела желаемую форму, например мази, лосьона, крема, микроэмульсии, геля, масла, раствора и т.д., и может состоять из натуральных или синтетических материалов. Предпочтительно, если выбранный носитель не оказывает неблагоприятного влияния на активный агент или другие компоненты композиции для местного нанесения. Примеры подходящих носителей для местного нанесения для использования в настоящем изобретении включают воду, спирты и другие нетоксичные органические растворители, глицерин,минеральное масло, силикон, вазелин, ланолин, жирные кислоты, растительные масла, парабены, воски и т.п. Композиция может представлять собой мази, лосьоны, кремы, микроэмульсии и гели без цвета и запаха. Соединения, регулирующие сиртуин, могут быть включены в мази, которые в общем случае представляют собой полутвердые препараты, в основе которых обычно лежит вазелин или другие производные нефти. Для специалиста в области техники очевидно, что конкретная основа мази должна обеспечивать оптимальную доставку лекарства и предпочтительно также другие желательные характеристики,например, смягчающие и т.п. Как и другие носители или разбавители, основа мази должна быть инертной, стабильной, не должна раздражать и сенсибилизировать. Соединения, регулирующие сиртуин, могут быть включены в лосьоны, которые в общем случае представляют собой препараты, наносимые на поверхность кожи без трения, и обычно представляют собой жидкие или полужидкие препараты, в которых твердые частицы, включая активный агент, находятся в водной или спиртовой основе. Лосьоны обычно представляют собой суспензии твердых веществ и могут включать жидкую масляную эмульсию типа "масло в воде". Соединения, регулирующие сиртуин, могут быть включены в кремы, которые в общем случае представляют собой вязкие жидкости или полутвердые эмульсии типов "масло в воде" или "вода в масле". Основы кремов смываются водой и содержат масляную фазу, эмульгатор и водную фазу. Масляная фаза обычно содержит вазелин и жирный спирт, такой как цетиловый или стеариловый спирт; водная фаза обычно, хотя не обязательно, превосходит в объеме масляную фазу и обычно содержит увлажнитель. Как описано в Remington (см. выше), эмульгатор обычно представляет собой неионное, анионное, катионное или амфотерное поверхностно-активное вещество. Соединения, регулирующие сиртуин, могут быть включены в микроэмульсии, которые в общем случае представляют собой термодинамические стабильные прозрачные во всех направлениях дисперсии двух несмешивающихся жидкостей, таких как масло и вода, стабилизированные межфазной пленкой из молекул поверхностно-активного вещества (Encyclopedia of Pharmaceutical Technology (New York: MarcelDekker, 1992), том 9). Соединения, регулирующие сиртуин, могут быть включены в гелевые композиции, которые в общем случае представляют собой полутвердые системы, состоящие из суспензий мелких неорганических частиц (двухфазная система) или больших органических молекул, распределенных практически равномерно по жидкости-носителю (однофазные гели). Обычно в роли жидкости-носителя в геле используется вода, но также могут использоваться спирты и масла. В композиции могут включаться другие активные агенты, например, другие противовоспалительные агенты, обезболивающие, противомикробные агенты, противогрибковые агенты, антибиотики, витамины, антиоксиданты и солнцезащитные агенты, обычно содержащиеся в солнцезащитных композициях,включая, но не ограничиваясь антранилатами, бензофенонами (в особенности бензофеноном-5), производными камфоры, циннаматами (например, октилметоксициннамат), дибензоилметанами (например,бутилметоксидибензоилметан), п-аминобензоевой кислотой (РАВА) и ее производными и салицилатами(например, октилсалицилат). В некоторых композициях для местного нанесения массовая доля активного агента может составлять примерно 0,25-75% композиции, предпочтительно примерно 0,25-30% композиции, более предпочтительно примерно 0,5-15% композиции и наиболее предпочтительно примерно 1,0-10% композиции. Для лечения или профилактики состояний глаз можно использовать, например, системную, местную, внутриглазную инъекцию соединения, регулирующего сиртуин, или введение устройства для замедленного высвобождения соединения, регулирующего сиртуин. Соединение, регулирующее сиртуин,которое повышает уровень и/или активность белка сиртуина, может доставляться в фармацевтически приемлемом офтальмологическом разбавителе, так чтобы соединение находилось в контакте с поверхностью глаза в течение времени, достаточного для проникновения соединения в роговицу и внутренние области глаза, например, в переднюю камеру, заднюю камеру, стекловидное тело, внутриглазную жидкость, роговицу, радужную оболочку/область ресниц, хрусталик, сосудистую оболочку глаза/сетчатку и склеру. Фармацевтически приемлемый офтальмологический разбавитель может представлять собой, например, мазь, растительное масло или инкапсулирующее вещество. Альтернативно, соединения согласно изобретению могут инъецироваться напрямую в стекловидное тело и внутриглазную жидкость. Еще в одном аспекте для лечения глаз соединения можно вводить системно, например, путем внутривенной инфузии или инъекции. Соединения, регулирующие сиртуин, описанные в настоящем документе, могут храниться в бескислородной среде. Например, ресвератрол или его аналог могут заключаться в герметичную капсулу для перорального приема, такую как Capsugel производства Pfizer, Inc. Клетки, например, обработанные ex vivo соединением, регулирующим сиртуин, могут вводиться согласно способам введения трансплантата субъекту, которые могут сопровождаться, например, введением иммуносупрессирующего препарата, например, циклоспорина А. Общие принципы медицинских композиций описаны в (Cell Therapy: Stem Cell Transplantation, Gene Therapy, and Cellular Immunotherapy,под ред. G. Morstyn и W. Sheridan, Cambridge University Press, 1996; и Hematopoietic Stem Cell Therapy, E.D. Ball, J. Lister и Р. Law, Churchill Livingstone, 2000). Токсичность и терапевтическую эффективность соединений, регулирующих сиртуин, можно определить с помощью стандартных фармацевтических процедур на клеточных культурах или эксперимен- 14021424 тальных животных. Доза, смертельная для 50% популяции, называется LD50. Доза, терапевтически эффективная для 50% популяции, называется ED50. Соотношение токсического и терапевтического эффекта(LD50/ED50) называется терапевтическим индексом. Предпочтительны соединения, регулирующие сиртуин, обладающие высокими терапевтическими индексами. При использовании соединений, регулирующих сиртуин, обладающих токсическими побочными эффектами, необходима тщательная разработка системы доставки, направляющей такие соединения к поврежденной ткани для уменьшения возможных повреждений неинфицированных клеток и соответственно ослабления побочных эффектов. Данные, полученные в ходе исследований на клеточных культурах и животных, могут использоваться для определения пределов дозировок для людей. Дозировка таких соединений может находиться в пределах нетоксичных или слаботоксичных концентраций в кровотоке, включающих ED50. Дозировка может варьировать в этих пределах в зависимости от используемой лекарственной формы и используемого пути введения. Для любого соединения терапевтически эффективная доза вначале может быть вычислена на основании данных исследований на клеточных культурах. Для экспериментальных моделей на животных может рассчитываться доза, необходимая для достижения пределов концентрации в плазме крови, включающих величину IC50 (то есть концентрацию тестируемого вещества, наполовину ингибирующую симптомы), рассчитанную на клеточной культуре. Эта информация может использоваться для более точного расчета дозы для человека. Уровни в плазме могут измеряться, например, с помощью высокоскоростной жидкостной хроматографии (HPLC). 6. Наборы реагентов. Также в настоящем изобретении представлены наборы реагентов, например наборы реагентов для терапевтических целей или наборы реагентов для регуляции продолжительности жизни клеток или регуляции апоптоза. Набор реагентов может содержать одно или более соединений, регулирующих сиртуин,например, в заранее отмеренных дозах. Набор реагентов может необязательно включать устройства для приведения клеток в контакт с соединениями и инструкции по употреблению. Устройства включают шприцы, стенты и другие устройства для введения субъекту (например, в кровеносный сосуд субъекта) или нанесения на кожу субъекта соединения, регулирующего сиртуин. Еще в одном воплощении в изобретении представлена смесь веществ, включающая регулятор сиртуина согласно настоящему изобретению и другой терапевтический агент (те же, что используются для комбинированной терапии и комбинированных композиций), в составе раздельных лекарственных форм,ассоциированных друг с другом. Употребляемый в настоящем документе термин "ассоциированные друг с другом" означает, что раздельные лекарственные формы упакованы вместе или связаны друг с другом каким-либо другим способом, из которого очевидно, что раздельные лекарственные формы продаются и вводятся как части одной и той же терапии. Агент и регулятор сиртуина предпочтительно упакованы вместе в блистерную упаковку или другую упаковку с несколькими отделениями или в соединенные,запаянные по отдельности контейнеры (например, кармашки из фольги и т.п.), которые могут разделяться пользователем (например, разделяться по линии разрыва между двумя контейнерами). Еще в одном воплощении в изобретении представлен набор реагентов, включающий в отдельных емкостях: а) регулятор сиртуина согласно настоящему изобретению; и b) другой терапевтический агент,такой, как описанный в настоящей заявке. При применении настоящих способов используются, если не указано иначе, стандартные техники клеточной биологии, культивирования клеток, молекулярной биологии, трансгенной биологии, микробиологии, работы с рекомбинантной ДНК и иммунологии, находящиеся в компетенции специалиста в области техники. Такие техники полностью описаны в литературе. См. например, Molecular Cloning AMouse Embryo, (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y., 1986). Примеры Помимо общего описания изобретения для более ясного понимания приводятся следующие примеры, включенные в настоящий документ с целью иллюстрации частных воплощений настоящего изобретения, но не являются ограничивающими. Пример 1. Получение соединений, регулирующих сиртуин, и их предшественников. Получение 2-(тиазоло[5,4-b]пиридин-2-ил)анилина: Смесь 3-амино-2-хлорпиридина (3,85 г, 29,95 ммоль) и 2-нитробензоилхлорида (5,56 г, 29,95 ммоль) в пиридине (50 мл) перемешивали в течение 1 ч при 0 С и далее в течение ночи при комнатной температуре. После добавления воды образовавшийся осадок собирали путем фильтрации и высушивания для получения N-(2-хлопиридин-3-ил)-2-нитробензамид в виде твердого вещества белого цвета (8,52 г, выход неочищенного продукта: 100%). Смесь N-(2-хлопиридин-3-ил)-2-нитробензамида (12,98 г, 46,75 ммоль), P2S5 (31,17 г, 140,24 ммоль) и пиридина (80 мл) в п-ксилене (310 мл) нагревали до 120 С в течение 18 ч. Перемешивание прекращали на 30 мин и охлаждали смесь до 100 С. Верхний прозрачный раствор переносили и концентрировали в вакууме, после чего добавляли этанол (50 мл). Суспензию нагревали до 75 С в течение 30 мин для растворения продукта, фильтровали горячим, охлаждали до комнатной температуры и оставляли на 18 ч. Твердый продукт собирали фильтрацией, промывали холодным этанолом и высушивали в вакууме для получения неочищенной смеси N-(2-хлопиридин-3-ил)-2-нитробензамида и 2-(2-нитрофенил)тиазоло[5,4-b]пиридина в виде твердого вещества желтого цвета (10,60 г). Вышеописанную неочищенную смесь (10,60 г), железо (11,50 г, 206,01 ммоль) и NH4Cl (17,63 г,329,61 ммоль) в МеОН/Н 2 О (80/20 мл) нагревали в колбе с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и экстрагировали этилацетатом. Органический слой концентрировали в вакууме и очищали хроматографией на силикагеле для получения 2(тиазоло[5,4-b]пиридин-2-ил)анилина в виде твердого вещества желтого цвета (3 г, выход по двум стадиям 28%). (MS, MН=228). Получение 2-(6-(пирролидин-1-илметил)тиазоло[5,4-b]пиридин-2-ил)анилина: К раствору 6-гидрокси-5-нитроникотиновой кислоты (1 экв) в SOCl2 (4,7 экв) добавляли DMF (0,15 экв). Смесь нагревали в колбе с обратным холодильником в течение 8 ч, затем концентрировали в вакууме. Осадок размешивали в CH2Cl2, охлаждали до -40 С и добавляли МеОН (1,4 экв), поддерживая внутреннюю температуру ниже -30 С. К смеси добавляли водный NaHCO3 (1 экв) и оставляли нагреваться до комнатной температуры. Органическую фазу отделяли и концентрировали в вакууме. Неочищенную смесь кристаллизовали из EtOH для получения метил 6-хлор-5-нитроникотината (выход 90%). Суспензию метил 6-хлор-5-нитроникотината (1 экв), порошка железа (5,2 экв) и NH4Cl3 (5,3 экв) в МеОН нагревали до 75 С в течение 2 ч. Смесь пропускали через раскаленный добела целит и концентрировали в вакууме для получения метил 5-амино-6-хлорникотината (выход 56%). К раствору метил 5-амино-6-хлорникотината (1 экв) и 2-нитробензоилхлорида (1,2 экв) в CH2Cl2 добавляли пиридин (1,1 экв). Смесь перемешивали при комнатной температуре в течение 10 ч и концентрировали в вакууме. Добавляли Н 2 О, и образовавшийся осадок собирали путем фильтрации, промывалиCH2Cl2 и высушивали для получения метил 6-хлор-5-(2-нитробензамидо)никотината (выход 73%). Смесь метил 6-хлор-5-(2-нитробензамидо)никотината (1 экв), P2S5 (2,1 экв) и пиридина (7,6 экв) в пксилене нагревали до 130 С в течение 2 ч. Прозрачную жидкость сливали и оставляли остывать до комнатной температуры. Полученный осадок собирали фильтрацией и высушивали для получения метил 2(2-нитрофенил)тиазоло[5,4-b]пиридин-6-карбоксилата (выход 57%). Раствор метил 2-(2-нитрофенил)тиазоло[5,4-b]пиридин-6-карбоксилата (1 экв) в THF добавляли в течение 8 ч к смеси алюмогидрида лития (LAH) (4,4 экв) в THF, поддерживая внутреннюю температуру-55 С. Реакционную смесь перемешивали еще 4 ч при -60 С. Добавляли ацетон (18 экв) и далее насыщенный водный раствор Na2CO3. Образовавшийся осадок удаляли фильтрацией и промывали THF. Объединенные органические вещества концентрировали в вакууме и кристаллизовали неочищенный осадок из CH2Cl2 для получения (2-(2-нитрофенил)тиазоло[5,4-b]пиридин-6-ил)метанола (выход 50%). К суспензии (2-(2-нитрофенил)тиазоло[5,4-b]пиридин-6-ил) метанола (0,62 моль, 180 г) в CH2Cl2(1,8 л) медленно добавляли тионил хлорид (3,1 моль, 227 мл) при комнатной температуре. После того,как добавляли DMF (5 мл), реакция становилась гомогенной. Реакцию перемешивали в течение 1 ч, далее концентрировали при пониженном давлении. Неочищенный продукт растворяли в CH2Cl2 (150 мл) и концентрировали при пониженном давлении. Неочищенный продукт промывали гексаном (200 мл 3) и высушивали под вакуумом в течение 16 ч для получения 6-(хлорметил)-2-(2-нитрофенил)тиазоло[5,4-b] пиридина в виде твердого вещества желто-коричневого цвета (180 г, выход 94%). К суспензии 6-(хлорметил)-2-(2-нитрофенил)тиазоло[5,4-b]пиридина (0,52 моль, 175 г) в CH3CN(1,7 л) добавляли пирролидин (2,8 моль, 203 г) и K2CO3 (2,8 моль, 395 г). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Добавляли Н 2 О (1 л) и перемешивали смесь в течение 30 мин. CH3CN удаляли под вакуумом и получившуюся смесь экстрагировали CH2Cl2 (31,5 л). Объединенные органические вещества промывали солевым раствором, высушивали (Na2SO4) и концентрировали под вакуумом для получения 2-(2-нитрофенил)-6-(пирролидин-1-илметил)тиазоло[5,4-b]пиридина в виде темного масла (150 г, выход 76%). К раствору 2-(2-нитрофенил)-6-(пирролидин-1-илметил)тиазоло[5,4-b]пиридина (11,1 моль, 3,8 г) вCH2Cl2 (100 мл) добавляли железный порошок (55 ммоль, 3,1 г) и далее уксусную кислоту (10 мл). Реакционную смесь нагревали в колбе с обратным холодильником в течение 3 ч, затем охлаждали до комнатной температуры. Na2CO3 (14 г) добавляли по частям. Смесь пропускали через целит и промывалиCH2Cl2. Объединенные фильтраты промывали Na2CO3 (320 мл), высушивали (MgSO4) и концентрировали при пониженном давлении для получения 2-(6-(пирролидин-1-илметил)тиазоло[5,4-b]пиридин-2 ил)анилина (3,4 г, выход 98%) в виде твердого вещества желтого цвета. Получение 2-(6-морфолинометил)тиазоло[5,4-b]пиридин-2-ил)анилина: Указанное соединение получали в результате процедуры, описанной для 2-(6-(пирролидин-1 илметил)тиазоло[5,4-b]пиридин-2-ил) анилина, с заменой пирролидина на морфолин. Получение 2-(6-4-(2-метоксиэтил)пиперазин-1-ил)метил)тиазоло[5,4-b]пиридин-2-ил)анилина: Указанное соединение получали в результате процедуры, описанной для 2-(6-(пирролидин-1-илметил)тиазоло[5,4-b]пиридин-2-ил) анилина, с заменой пирролидина на 4-(2-метоксиэтил)пиперазин. Получение 2-фенил-5-(пирролидин-1-илметил)тиазол-4-карбоновой кислоты гидрохлорида: 4-Ацетамидобензолсульфонил азид (1,5 мл) добавляли к раствору трет-бутил 3-оксобутаноата (1,86 г, 10,12 ммоль) и TEA (3,85 мл) в CH3CN (60 мл). Смесь перемешивали в течение ночи при комнатной температуре, концентрировали и очищали флэш-хроматографией для получения трет-бутил 2-диазо-3 оксобутаноата в виде жидкости желтого цвета (1,3 г, выход 77%). Раствор трет-бутил 2-диазо-3-оксобутаноата (13,1 г, 71,7 ммоль) в 1,2-дихлорэтане добавляли в течение 12 ч к кипящему в колбе с обратным холодильником раствору бензамида (6,16 г, 50,8 ммоль) и диродия тетраацетата (786 мг, 1,78 ммоль) в 1,2-дихлорэтане (75 мл). Смесь выпаривали в вакууме и очищали флэш-хроматографией для получения трет-бутил 2-бензамидо-3-оксобутаноата в виде твердого вещества белого цвета (6,97 г, выход 51%). Раствор трет-бутил 2-бензамидо-3-оксобутаноата (842 мл, 3,04 ммоль) и 2,4-бис(4-метоксифенил)1,2,3,4-дитиадифосфэтана 2,4-дисульфида (реагента Лоуссона) (1,88 г, 6,07 ммоль) в THF (20 мл) нагревали в колбе с обратным холодильником в течение 6 ч. Смесь выпаривали в вакууме и очищали флэшхроматографией для получения трет-бутил 5-метил-2-фенилтиазол-4-карбоксилата в виде твердого вещества желтого цвета (520 мг, выход 62%). Раствор трет-бутил 5-метил-2-фенилтиазол-4-карбоксилата (1,0 г, 3,64 ммоль), N-бромсукцинимида(NBS) (0,65 г, 3,64 ммоль) и бензоилпероксида (ВРО) (5,5 мг, 0,023 ммоль) в CCl4 (30 мл) нагревали в колбе с обратным холодильником в течение 16 ч. Реакционную смесь концентрировали в вакууме и очищали флэш-хроматографией для получения трет-бутил 5-(бромметил)-2-фенилтиазол-4-карбоксилата в виде твердого вещества светло-желтого цвета (0,96 г, выход 75%). Пирролидин (0,5 мл) добавляли к раствору трет-бутил 5-(бромметил)-2-фенилтиазол-4-карбоксилата (1,029 г, 2,90 ммоль) и диизопропилэтиламина (DIPEA) (1,5 мл) в CH2Cl2 (10 мл). Смесь перемешивали в течение 30 мин при комнатной температуре, концентрировали в вакууме и очищали флэшхроматографией для получения трет-бутил 2-фенил-5-(пирролидин-1-илметил)тиазол-4-карбоксилата в виде твердого вещества желтого цвета (920 мг, выход 98%). Концентрированную HCl (2,8 мл, 33,9 ммоль) добавляли к раствору трет-бутил 2-фенил-5(пирролидин-1-илметил)тиазол-4-карбоксилата (2,1 г, 6,1 ммоль) в THF (30 мл). Смесь перемешивали в течение ночи и концентрировали в вакууме для получения 2-фенил-5-(пирролидин-1-илметил)тиазол-4 карбоксилата гидрохлорида (1,5 г, выход 82%). Получение 5-(морфолинометил)-2-фенилтиазол-4-карбоновой кислоты гидрохлорида: Указанное соединение получали в результате процедуры, описанной для 2-фенил-5-(пирролидин-1 илметил)тиазол-4-карбоновой кислоты, с заменой пирролидина на морфолин с выходом 52%. Получение 5-4-изопропилпиперазин-1-ил)метил)-2-фенилтиазол-4-карбоновой кислоты гидрохлорида: Указанное соединение получали в результате процедуры, описанной для 2-фенил-5-(пирролидин-1 илметил)тиазол-4-карбоновой кислоты, с заменой пирролидина на 4-(и-пропил)пиперазин с выходом 80%. Получение 5-4-(2-метоксиэтил)пиперазин-1-ил)метил)-2-фенилтиазол-4-карбоновой кислоты гидрохлорида: Указанное соединение получали в результате процедуры, описанной для 2-фенил-5-(пирролидин-1 илметил)тиазол-4-карбоновой кислоты, с заменой пирролидина на морфолин с выходом 49%. Получение 5-4-(трет-бутоксикарбонил)пиперазин-1-ил)метил)-2-фенилтиазол-4-карбоновой кислоты: Раствор этил 2-диазо-3-оксобутаноата (20 г, 128 ммоль) в 1,2-дихлорэтане (100 мл) добавляли в течение 16 ч к раствору бензамида (13 г, 107 ммоль) и диродия тетраацетата (1,4 г, 3 ммоль) в 1,2 дихлорэтане (200 мл), кипящему в колбе с обратным холодильником. Смесь выпаривали в вакууме и очищали флэш-хроматографией для получения этил 2-бензамидо-3-оксобутаноата в виде масла желтого цвета (20 г, выход 50%). Раствор этил 2-бензамидо-3-оксобутаноата (13,0 г, 0,052 моль) в оксихлориде фосфора (100 мл) нагревали в колбе с обратным холодильником в течение 1,5 ч, затем охлаждали и концентрировали при пониженном давлении до получения коричневого сиропа, который растворяли в дихлорметане (250 мл). Раствор последовательно промывали водой, насыщенным раствором Na2CO3 и солевым раствором, затем высушивали над безводным Na2SO4 и концентрировали для получения этил 5-метил-2-фенилоксазол-4 карбоксилата в виде масла коричневого цвета (11,0 г, выход 91%). Раствор этил 5-метил-2-фенилоксазол-4-карбоксилата (11,0 г, 48 ммоль), NBS (8,5 г, 48 ммоль) и ВРО (100 мг) в CCl4 (200 мл) нагревали в колбе с обратным холодильником в течение 16 ч. Реакционную смесь концентрировали в вакууме и очищали флэш-хроматографией для получения этил 5-(бромметил)2-фенилоксазол-4-карбоксилата в виде твердого вещества желто-коричневого цвета (5,2 г, выход 35%). Т-бутил пиперазин-1-карбоксилат (3,2 г, 17,3 ммоль) добавляли к раствору этил 5-(бромметил)-2 фенилоксазол-4-карбоксилата (2,7 г, 8,7 ммоль) и DIPEA (2,9 мл) в CH2Cl2 (20 мл). Смесь перемешивали при комнатной температуре в течение 16 ч, промывали водой и солевым раствором, высушивали над безводным Na2SO4, концентрировали и очищали флэш-хроматографией для получения этил 5-4-(третбутоксикарбонил)пиперазин-1-ил)метил)-2-фенилтиазол-4-карбоксилата в виде твердого вещества желтого цвета (3,0 г, выход 83%). 1N NaOH (5,4 мл) добавляли к раствору этил 5-4-(трет-бутоксикарбонил) пиперазин-1-ил)метил)2-фенилтиазол-4-карбоксилата (1,50 г, 3,6 ммоль) в метаноле (10 мл) и тетрагидрофуране (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч, затем концентрировали в вакууме. Добавляли H2O и промывали смесь EtOAc. pH водного слоя доводили до 5, добавляя IN HCl, и образовавшийся осадок собирали путем фильтрации, промывали Н 2 О и высушивали для получения 5-4(трет-бутоксикарбонил)пиперазин-1-ил)метил)-2-фенилтиазол-4-карбоновой кислоты в виде твердого вещества белого цвета (0,9 г, выход 64%). Получение 5-(морфолинометил)-2-фенилоксазол-4-карбоновой кислоты: Указанное соединение получали в результате процедуры, описанной для 5-4-(трет-бутоксикарбонил)пиперазин-1-ил)метил)-2-фенилтиазол-4-карбоновой кислоты, с заменой т-бутил пиперазин-1 карбоксилата на морфолин с выходом 28%. Получение 5-4-(2-метоксиэтил)пиперазин-1-ил)метил)-2-фенилоксазол-4-карбоновой кислоты: Указанное соединение получали в результате процедуры, описанной для 5-4-(трет-бутоксикарбонил)пиперазин-1-ил)метил)-2-фенилтиазол-4-карбоновой кислоты, с заменой т-бутил пиперазин-1 карбоксилата на 4-(2-метоксиэтил)пиперазин с выходом 51%. Получение 2-фенил-5-(пирролидин-1-илметил)оксазол-4-карбоновой кислоты: Указанное соединение получали в результате процедуры, описанной для 5-4-(третбутоксикарбонил)пиперазин-1-ил)метил)-2-фенилтиазол-4-карбоновой кислоты, с заменой т-бутил пиперазин-1-карбоксилата на пирролидин с выходом 38%. Получение 5-(3-метоксипропил)-2-фенилтиазол-4-карбонилхлорида: Азот пропускали через раствор этил 5-бром-2-фенилтиазол-4-карбоксилат (13,1 г, 41,9 ммоль) и метил пропаргиловый эфир (7,1 мл, 83,9 ммоль) в диметоксиэтане (DME) (200 мл). Далее добавляли дихлорбис(трифенилфосфин)палладий (II) (1,47 г, 2,2 ммоль), йодид меди (I) (0,2 г, 1,1 ммоль) и TEA (29 мл, 210 ммоль) и нагревали реакционную смесь до кипения в колбе с обратным холодильником в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, вливали в Н 2 О (200 мл) и экстрагировали EtOAc (2200 мл). Объединенные органические вещества промывали солевым раствором, высушивали (MgSO4) и концентрировали. Неочищенный продукт очищали MPLC-элюцией пентаном/EtOAc (050% градиент) для получения этил 5-(3-метоксипроп-1-инил)-2-фенилтиазол-4-карбоксилата в виде твердого вещества желто-коричневого цвета (11 г, выход 88%). Этил 5-(3-метоксипроп-1-инил)-2-фенилтиазол-4-карбоксилат (26,1 г, 86,6 ммоль) растворяли вEtOAc (350 мл) и гидрогенизировали под баллоном газообразного водорода в течение 4 дней, пока LCMS не показывала полное насыщение. На 3 день катализатор удаляли путем фильтрации, добавляли свежий катализатор, и смесь снова подвергали гидрогенизации под баллоном газообразного водорода. Катализатор удаляли фильтрацией через целит. Фильтр промывали EtOAc и фильтрат концентрировали до высу- 19021424 шивания. Неочищенный продукт очищали MPLC-элюцией пентаном/EtOAc для получения этил 5-(3 метоксипропил)-2-фенилтиазол-4-карбоксилата (23,2 г, выход 88%). Этил 5-(3-метоксипропил)-2-фенилтиазол-4-карбоксилат (26,3 г, 76,1 ммоль) растворяли в THF/MeOH (1:1,300 мл) и добавляли раствор LiOH (3,6 г, 152 ммоль) в Н 2 О (75 мл). Реакцию перемешивали в течение 5 ч, и рН доводили до 3, добавляя 3N HCl. Смесь вливали в солевой раствор и экстрагировалиEtOAc. Объединенные органические вещества промывали солевым раствором, высушивали (MgSO4) и концентрировали для получения 5-(3-метоксипропил)-2-фенилтиазол-4-карбоновой кислоты (21 г, выход 99%) в виде твердого вещества желто-коричневого цвета. Оксалил хлорид (67,2 ммоль, 5,9 мл) медленно добавляли к раствору 5-(3-метоксипропил)-2 фенилтиазол-4-карбоксилата (22,4 ммоль, 6,2 г) в CH2Cl2 (100 мл) при комнатной температуре. После добавления 3 капель DMF через 20 мин реакция стала гомогенной. Реакцию перемешивали в течение 3 ч, затем концентрировали при пониженном давлении. Неочищенный продукт растворяли в CH2Cl2 (150 мл) и концентрировали при пониженном давлении. Неочищенный продукт растворяли в EtOAc (150 мл),промывали солевым раствором (2100 мл), высушивали (MgSO4) и концентрировали при пониженном давлении для получения 5-(3-метоксипроп)-2-фенилтиазол-4-карбонил хлорида в виде твердого вещества желто-коричневого цвета (6,6 г, выход 99%). Получение 5-(3-метоксипроп-1-инил)-2-фенилтиазол-4-карбоновой кислоты:THF/MeOH (1:1, 40 мл) и добавляли раствор LiOH (167 мг, 7,0 ммоль) в Н 2 О (10 мл). Реакцию перемешивали в течение 16 ч и доводили рН до 3, добавляя 3N HCl. Смесь вливали в солевой раствор и экстрагировали EtOAc. Объединенные органические вещества промывали солевым раствором, высушивали(MgSO4) и концентрировали для получения 5-(3-метоксипроп-1-инил)-2-фенилтиазол-4-карбоновой кислоты (636 мг, выход 99%) в виде твердого вещества желто-коричневого цвета. Получение 4-фенилтиазол-2-карбоновой кислоты:(1 мл) в течение 18 ч. THF удаляли при пониженном давлении, и водный раствор закисляли 4N HCl, экстрагировали CH2Cl2, высушивали над Na2SO4 и концентрировали для получения 4-фенилтиазол-2 карбоновой кислоты, используемой, как есть, в следующей стадии. Получение 5-(3-хлорпропил)-2-фенил-N-(2-(тиазоло[5,4-b]пиридин-2-ил)фенил)тиазол-4-карбоксамида: Азот пропускали через раствор этил 5-бром-2-фенилтиазол-4-карбоксилата (3,6 г, 11,5 ммоль) и 2(проп-2-инилокси)тетрагидро-2 Н-пирана (3,3 мл, 23,1 ммоль) в THF (30 мл). Далее добавляли дихлорбис(трифенилфосфин)палладий (II) (405 мг, 0,6 ммоль), йодид меди (I) (55 мг, 0,3 ммоль) и триэтиламин(TEA) (8 мл, 57,7 ммоль) и нагревали реакционную смесь при 100 С в течение 30 мин в микроволновом реакторе. Реакционную смесь вливали в Н 2 О и экстрагировали EtOAc (2200 мл). Объединенные органические вещества промывали солевым раствором, высушивали (MgSO4) и концентрировали. Неочищенный продукт очищали MPLC-элюцией пентаном/EtOAc (0-50% градиент) для получения этил 2-фенил-5(3-(тетрагидро-2 Н-пиран-2-илокси)проп-1-инил)тиазол-4-карбоксилата (3,8 г, выход 88%). Этил 2-фенил-5-(3-(тетрагидро-2 Н-пиран-2-илокси)проп-1-инил)тиазол-4-карбоксилат (3,8 г, 10,1 ммоль) растворяли в MeOH/THF (1:1,60 мл) и гидрогенизировали под баллоном газообразного водорода в течение 4 дней, пока LCMS не показывала полное насыщение. На 3 день катализатор удаляли путем фильтрации, добавляли свежий катализатор, и смесь снова подвергали гидрогенизации под баллоном газообразного водорода. Катализатор удаляли фильтрацией через целит. Фильтр промывали EtOAc и фильтрат концентрировали до высушивания. Неочищенный продукт растворяли в MeOH. Добавляли п-толуенсульфоновую кислоту (p-TsOH) (0,15 экв) и перемешивали реакционную смесь в течение 16 ч, затем концентрировали до высушивания. Неочищенный осадок размешивали в EtOAc, промывали насыщенным водным раствором NaHCO3, солевым раствором, высушивали и концентрировали. Неочищенный продукт очищалиMPLC-элюцией пентаном/EtOAc (0-100% градиент) для получения смеси метилового и этилового сложных эфиров ожидаемого продукта (1,9 г). Указанную смесь продуктов (1,9 г) растворяли в THF/MeOH (1:1,30 мл) и добавляли раствор LiOH(313 мг, 13 ммоль) в Н 2 О (15 мл). Реакцию перемешивали в течение 5 ч и доводили рН до 3, добавляя 3N HCl. Смесь вливали в солевой раствор и экстрагировали EtOAc. Объединенные органические вещества промывали солевым раствором, высушивали (MgSO4) и концентрировали для получения 5-(3 гидроксипропил)-2-фенилтиазол-4-карбоновой кислоты (1,7 г). Смесь 5-(3-гидроксипропил)-2-фенилтиазол-4-карбоновой кислоты (850 мг, 3,2 ммоль) и LiCl (3,2 ммоль) в тионил хлориде (10 мл) нагревали в колбе с обратным холодильником в течение 16 ч и далее концентрировали до высушивания. Неочищенный продукт растворяли в EtOAc, промывали солевым раствором, высушивали (MgSO4) и концентрировали при пониженном давлении для получения 5-(3-хлорпропил)-2-фенилтиазол-4-карбонилхлорида (906 мг, выход 99%). Суспензию 5-(3-хлорпропил)-2-фенилтиазол-4-карбонилхлорида (906 мг, 3,2 ммоль), DIPEA (1,1 мл, 6,4 ммоль) и 2-(тиазоло[5,4-b]пиридин-2-ил)анилина (585 мг, 2,6 ммоль) в CH3CN (12 мл) перемешивали в течение 16 ч. Образовавшийся осадок собирали путем фильтрации, промывали CH3CN и высушивали. Неочищенный продукт очищали MPLC-элюцией DCM/MeOH (0-5% градиент) для получения 5-(3 хлорпропил)-2-фенил-N-(2-(тиазоло[5,4-b]пиридин-2-ил)фенил)тиазол-4-карбоксамида (316 мг, выход 26%). Получение 5-(3-оксопропил)-2-фенил-N-(2-(тиазоло[5,4-b]пиридин-2-ил)фенил)тиазол-4-карбоксамида: Раствор (2-(1,3-диоксолан-2-ил)этил)цинк(II) бромида (35 мл, 17,3 ммоль) в THF добавляли в дегазированный раствор этил 5-бром-2-фенилтиазол-4-карбоксилата (3,6 г, 11,5 ммоль) и тетракис (трифенилфосфин) палладия (666 мг, 0, 58 ммоль) в THF (20 мл). Реакционную смесь нагревали в колбе с обратным холодильником в течение 16 ч, далее вливали в насыщенный водный раствор NaHCO3. Смесь экстрагировали EtOAc, промывали солевым раствором, высушивали (MgSO4) и концентрировали. Неочищенный продукт очищали MPLC-элюцией пентаном/EtOAc (0-100% градиент) для получения этил 5(2-(1,3-диоксолан-2-ил)этил)-2-фенилтиазол-4-карбоксилата (2,0 г, выход 52%). Этил 5-(2-(1,3-диоксолан-2-ил)этил)-2-фенилтиазол-4-карбоксилат (2,6 г, 7,9 ммоль) растворяли вMeOH/THF (1:1,60 мл) и добавляли раствор LiOH (378 мг, 15,7 ммоль) в Н 2 О (15 мл). Реакцию перемешивали в течение 5 ч и доводили рН до 3, добавляя 3N HCl. Смесь вливали в солевой раствор и экстрагировали EtOAc. Объединенные органические вещества промывали солевым раствором, высушивали(MgSO4) и концентрировали. Неочищенный продукт кристаллизовали из EtOAc для получения 5-(2-(1,3 диоксолан-2-ил)этил)-2-фенилтиазол-4-карбоновой кислоты (1,8 г, выход 75%). 2-(1 Н-7-азабензотриазол-1-ил)-1,1,3,3 тетраметил уроний гексафторфосфат метанаминий (HATU)(669 мг, 1,8 ммоль) добавляли к раствору 5-(2-(1,3-диоксолан-2-ил)этил)-2-фенилтиазол-4-карбоновой кислоты (504 мг, 1,7 ммоль), DIPEA (613 мкл, 3,5 ммоль) и 2-(тиазоло[5,4-b]пиридин-2-ил)анилина b (250 мг, 1,1 ммоль) в DMF (7 мл). Реакционную смесь перемешивали в течение 16 ч, вливали в насыщенный водный раствор NaHCO3 и экстрагировали EtOAc. Органические фракции промывали солевым раствором, высушивали и концентрировали. Неочищенный продукт кристаллизовали из EtOH для получения 5(2-(1,3-диоксолан-2-ил)этил)-2-фенил-N-(2-(тиазоло[5,4-b]пиридин-2-ил) фенил) тиазол-4-карбоксамида(372 мг, выход 66%). 5-(2-(1,3-диоксолан-2-ил)этил)-2-фенил-N-(2-(тиазоло[5,4-b]пиридин-2-ил)фенил)тиазол-4-карбоксамид (250 мг, 0,5 ммоль) растворяли в смеси THF (4 мл), АсОН (8 мл) и Н 2 О (0,5 мл), нагревали в колбе с обратным холодильником в течение 16 ч, далее концентрировали до сухости. Осадок растворяли вEtOAc, промывали насыщенным водным раствором NaHCO3, высушивали (MgSO4) и концентрировали при пониженном давлении. Неочищенный продукт очищали путем MPLC-элюции CH2Cl2/МеОН (0-5% Общий способ синтеза амидов А: Смесь анилина (1 экв), карбоновой кислоты (1-1,5 экв) HATU (1,5 экв) и DIPEA (2,0 экв) перемешивали при комнатной температуре в подходящем растворителе (например, DMF) в течение 18 ч. К реакционной смеси добавляли воду для осаждения продукта. Протокол 1. Если продукт выпадал в осадок, его собирали путем фильтрации, промывали водой,растирали в порошок с горячим метанолом или этанолом и высушивали под вакуумом для получения желаемого амида. Продукты далее очищали хроматографией для повышения чистоты до необходимой. Протокол 2. Если полученный раствор не был гомогенен, продукт экстрагировали органическим растворителем (CH2Cl2 или EtOAc), промывали насыщенным раствором NaHCO3, солевым раствором,высушивали с Na2SO4 и концентрировали. Неочищенный продукт затем очищали хроматографией по необходимости. Общий способ синтеза амидов В: Желаемую карбоновую кислоту (1,2-1,5 экв) суспендировали в CH2Cl2 и обрабатывали оксалил хлоридом (6 экв) и DMF (катализатор) в течение 1,5-18 ч до получения прозрачного раствора. Раствор далее концентрировали до высушивания и к реакционной смеси добавляли пиридиновую суспензию желаемого анилина (1,0 экв) и перемешивали при комнатной температуре в течение до 18 ч или нагревали в микроволновой печи (160 С, 10 мин). Если продукт выпадал в осадок из раствора, его собирали фильтрацией, выпаривали вместе с метанолом и очищали хроматографией. Если он не выпадал в осадок, раствор концентрировали до высушивания, растирали в порошок и очищали хроматографией. Кислые хлориды также получали суспендированием соответствующей кислоты в SOCl2 и нагреванием в колбе с обратным холодильником в течение нескольких часов. Избыточный SOCl2 удаляли при пониженном давлении, и осадок промывали толуеном. Полученный кислый хлорид высушивали под вакуумом и использовали без дальнейшей очистки. Получение N-(2-(6-(морфолинометил)тиазоло[5,4-b]пиридин-2-ил)фенил)-4-фенилтиазол-2-карбоксамида Указанное соединение получали согласно общему способу синтеза амидов А, с использованием 2(6-(морфолинометил)тиазоло[5,4-b]пиридин-2-ил)анилина и 4-фенилтиазол-2-карбоновой кислоты. Продукт выделяли осаждением во время добавления воды, растирали в порошок с горячим метанолом и очищали хроматографией на силикагеле (0-10% градиент метанола в CH2Cl2). MS, рассчитанная для Указанное соединение получали согласно общему способу синтеза амидов А, с использованием 2(6-(пирролидин-1-илметил)тиазоло[5,4-b]пиридин-2-ил)анилина и 4-фенилтиазол-2-карбоновой кислоты. Продукт выделяли осаждением путем добавления воды, растирали в порошок с горячим метанолом и очищали хроматографией на силикагеле (0-10% градиент метанола в CH2Cl2). MS, рассчитанная для Указанное соединение получали согласно общему способу синтеза амидов В, с использованием 2(6-4-(2-метоксиэтил)пиперазин-1-ил)метил)тиазоло[5,4-b]пиридин-2-ил)анилина и 4-фенилтиазол-2- 23021424 карбоновой кислоты (1,5 экв). При добавлении воды к неочищенной реакции продукт не выпадал в осадок, соответственно его концентрировали, растирали в порошок последовательно с горячим MeCN, смесью MeCN/EtOAc/MeOH и EtOAc/MeOH. Полученное твердое вещество бледно-желтого цвета лиофилизировали со смесью MeCN/вода/HCl и далее очищали препаративной HPLC. MS, рассчитанная для Указанное соединение получали согласно общему способу синтеза амидов А, с использованием 2(6-(морфолинометил)тиазоло[5,4-b]пиридин-2-ил)анилина и 5-метил-2-фенилоксазол-4-карбоновой кислоты. Продукт осаждали путем добавления воды, растирали в порошок с горячим метанолом и очищали путем хроматографии на силикагеле (градиент 0-10% метанола в CH2Cl2). MS, рассчитанная для Указанное соединение получали согласно общему способу синтеза амидов А, с использованием 2(6-(пирролидин-1-илметил)тиазоло[5,4-b]пиридин-2-ил)анилина и 5-метил-2-фенилоксазол-4-карбоновой кислоты. Продукт выделяли осаждением путем добавления воды, растирали в порошок с горячим метанолом и очищали путем хроматографии на силикагеле (градиент 0-10% метанол в CH2Cl2). MS, рассчитанная для C28H25N5O2S: 495,17. Обнаруженная (М+Н) + m/z=496. Получение N-(2-(6-4-(2-метоксиэтил)пиперазин-1-ил)метил)тиазоло[5,4-b]пиридин-2-ил)фенил)-5 метил-2-фенилоксазол-4-карбоксамида: Указанное соединение получали согласно общему способу синтеза амидов В, с использованием 2(6-4-(2-метоксиэтил)пиперазин-1-ил)метил)тиазоло[5,4-b]пиридин-2-ил)анилина и 5-метил-2-фенилоксазол-4-карбоновой кислоты (1,5 экв). Продукт выпадал в осадок из реакционной смеси, его фильтровалии промывали метанолом. Продукт очищали препаративной HPLC. MS, рассчитанная для Указанное соединение получали согласно общему способу синтеза амидов А, с использованием 2(6-(морфолинометил)тиазоло[5,4-b]пиридин-2-ил)анилина и 2-фенилтиазол-4-карбоновой кислоты. Продукт выделяли осаждением путем добавления воды, растирали в порошок с горячим метанолом, растворяли в CH2Cl2, промывали разбавленным NaHCO3, концентрировали и очищали хроматографией на силикагеле (градиент 0-10% метанола в CH2Cl2) . MS, рассчитанная для C27H23N5O2S: 513,13. Обнаруженная (М+Н)+ m/z=514. Получение 2-фенил-N-(2-(6-(пирролидин-1-илметил)тиазоло[5,4-b]пиридин-2-ил)фенил)тиазол-4 карбоксамида: Указанное соединение получали согласно общему способу синтеза амидов А, с использованием 2(6-(пирролидин-1-илметил) тиазоло [5,4-b] пиридин-2-ил) анилина и 2-фенилтиазол-4-карбоновой кисло- 24021424 ты. Продукт выделяли осаждением путем добавления воды, растирали в порошок с горячим метанолом,растворяли в CH2Cl2, промывали разбавленным NaHCO3, концентрировали и очищали хроматографией на силикагеле (градиент 0-10% метанола в CH2Cl2) . MS, рассчитанная для C27H23N5OS2: 497,13. Обнаруженная (М+Н)+ m/z=498. Получение N-(2-(6-4-(2-метоксиэтил)пиперазин-1-ил)метил)тиазоло[5,4-b]пиридин-2-ил)фенил)-2 фенилтиазол-4-карбоксамида: Указанное соединение получали согласно общему способу синтеза амидов А, с использованием 2(6-4-(2-метоксиэтил)пиперазин-1-ил)метил)тиазоло[5,4-b]пиридин-2-ил)анилина и 2-фенилтиазол-4 карбоновой кислоты (3 экв), HATU (3 экв) и DIPEA (5 экв). Продукт выделяли осаждением путем добавления воды, растирали в порошок с горячим метанолом и очищали хроматографией на силикагеле (градиент 0-10% метанола в CH2Cl2). MS, рассчитанная для C30H30N6O2S2: 570,19. Обнаруженная (М+Н)+ Указанное соединение получали согласно общему способу синтеза амидов В, с использованием 2(6-4-(2-метоксиэтил)пиперазин-1-ил)метил)тиазоло[5,4-b]пиридин-2-ил)анилина и 2-фенил-5-(трифторметил)оксазол-4-карбоновой кислоты (1,5 экв). Продукт фильтровали из неочищенной реакционной смеси, выпаривали с метанолом и очищали хроматографией на силикагеле (градиент 0-10% метанола в(300 мл). К реакционной смеси добавляли DIPEA (24 мл, 136,3 ммоль) и перемешивали при комнатной температуре в течение 16 ч. Образовавшийся осадок собирали фильтрацией и промывали ацетонитрилом. Неочищенный продукт растворяли в CH2Cl2 (200 мл), пропускали через фарфоровый фильтр и высушивали под вакуумом для получения продукта в виде твердого вещества желто-коричневого цвета (27 г). В результате перекристаллизации из EtOAc (300 мл) получали указанное соединение в виде твердого вещества белого цвета (25 г, выход 72%). MS, рассчитанная для C31H31N5O2S2: 569,19. Обнаруженная Указанное соединение получали согласно общему способу синтеза амидов А, с использованием 2(6-(пирролидин-1-илметил)тиазоло[5,4-b]пиридин-2-ил)анилина и 5-(3-метоксипроп-1-инил)-2-фенилтиазол-4-карбоновой кислоты. Продукт выделяли согласно протоколу 2 и очищали хроматографией на силикагеле (градиент 0-10% метанола в CH2Cl2) и последующей перекристаллизации из МеОН для получения указанного соединения (111 мг, выход 30%). MS, рассчитанная для C31H27N5O2S2: 565,16. Обнаруженная (М+Н)+ m/z=566. Получение 5-(3-метоксипропил)-2-фенил-N-(2-(тиазоло[5,4-b]пиридин-2-ил)фенил)тиазол-4-карбоксамида: 5-(3-метоксипропил)-2-фенилтиазол-4-карбонилхлорид (229 мг, 0,774 ммоль) добавляли к суспензии 2-(тиазоло[5,4-b]пиридин-2-ил)анилина (141 мг, 0,619 ммоль) в ацетонитриле (15 мл). К реакционной смеси добавляли DIPEA (162 мкл, 0,929 ммоль) и перемешивали при комнатной температуре в течение 16 ч. Образовавшийся осадок собирали фильтрацией и промывали ацетонитрилом для получения указанного соединения в виде твердого вещества белого цвета (260 мг, выход 86%). MS, рассчитанная для Указанное соединение получали согласно общему способу синтеза амидов В, с использованием 2 тиазоло[5,4-b]пиридин-2-ил)анилина и 5-(морфолинометил)-2-фенилтиазол-4-карбоновой кислоты гидрохлорида (390 мг, выход 92%). MS, рассчитанная для C27H23N5O2S2: 513,13. Обнаруженная (М+Н)+ Указанное соединение получали согласно общему способу синтеза амидов В, с использованием 2 тиазоло[5,4-b]пиридин-2-ил)анилина и 5-4-изопропилпиперазин-1-ил)метил)-2-фенилтиазол-4-карбоновой кислоты гидрохлорида (140 мг, выход 56%). MS, рассчитанная для C30H30N6OS2: 554,19. Обнаруженная (М+Н)+ m/z=555. Получение 2-фенил-5-(пирролидин-1-илметил)-N-(2-тиазоло[5,4-b]пиридин-2-ил)фенил)тиазол-4 карбоксамида Указанное соединение получали согласно общему способу синтеза амидов В, с использованием 2 тиазоло[5,4-b]пиридин-2-ил)анилина и 2-фенил-5-(пирролидин-1-илметил)тиазол-4-карбоксилата гидрохлорида (270 мг, выход 76%). MS, рассчитанная для C27H23N5OS2: 497,13. Обнаруженная (М+Н)+ Указанное соединение получали согласно общему способу синтеза амидов В, с использованием 2 тиазоло[5,4-b]пиридин-2-ил)анилина и 5-4-(2-метоксиэтил)пиперазин-1-ил)метил)-2-фенилтиазол-4 карбоновой кислоты гидрохлорида (140 мг, выход 35%). MS, рассчитанная для C30H30N6O2S2: 570,19. Обнаруженная (М+Н)+ m/z=571. Получение 5-(морфолинометил)-2-фенил-N-(2-(тиазоло[5,4-b]пиридин-2-ил)фенил)оксазол-4-карбоксамида: Указанное соединение получали согласно общему способу синтеза амидов А, с использованием 2 тиазоло[5,4-b]пиридин-2-ил)анилина и 5-(морфолинометил)-2-фенилоксазол-4-карбоновой кислоты (115 мг, выход 55%). MS, рассчитанная для C27H23N5O3S: 497,15. Обнаруженная (М+Н)+ m/z=498. Получение 5-4-(2-метоксиэтил)пиперазин-1-ил)метил)-2-фенил-N-(2-тиазоло[5,4-b]пиридин-2 ил)фенил)оксазол-4-карбоксамида: Указанное соединение получали согласно общему способу синтеза амидов А, с использованием 2 тиазоло[5,4-b]пиридин-2-ил)анилина и 5-4-(2-метоксиэтил)пиперазин-1-ил)метил)-2-фенилоксазол-4 карбоновой кислоты (140 мг, выход 25%). MS, рассчитанная для C30H30N6O3S: 554,21. Обнаруженная Указанное соединение получали согласно общему способу синтеза амидов А, с использованием 2 тиазоло[5,4-b]пиридин-2-ил)анилина и 2-фенил-5-(пирролидин-1-илметил)тиазол-4-карбоксилата (400 мг, выход 83%). MS, рассчитанная для C27H23N5O2S: 481,16. Обнаруженная (М+Н)+ m/z=482. Получение трет-бутил 4-2-фенил-4-(2-(тиазоло[5,4-b]пиридин-2-ил)фенилкарбамоил)оксазол-5 ил)метил)пиперазин-1-карбоксилата: Указанное соединение получали согласно общему способу синтеза амидов А, с использованием 2 тиазоло[5,4-b]пиридин-2-ил)анилина и 5-4-(трет-бутоксикарбонил)пиперазин-1-ил)метил)-2-фенилтиазол-4-карбоновой кислоты (270 мг, выход 45%). MS, рассчитанная для C32H32N6O4S: 596,22. Обнаруженная (М+Н)+ m/z=597. Получение 5-(3-(4-(2-метоксиэтил)пиперазин-1-ил)пропил)-2-фенил-N-(2-(тиазоло[5,4-b]пиридин-2 ил)фенил)тиазол-4-карбоксамида:(316 мг, 0,67 ммоль) и 1-(2-метоксиэтил)пиперазина (964 мг, 6,7 ммоль) в DMSO (12 мл) нагревали до 70 С в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры и вливали в Н 2 О. Образовавшийся осадок собирали фильтрацией и промывали Н 2 О. Неочищенный продукт очищали MPLCэлюцией DCM/MeOH+1% TEA (0-10% градиент) для получения указанного соединения (374 мг, выход 96%). MS, рассчитанная для C32H34N6O2S2: 598,22. Обнаруженная (М+Н)+ m/z=599. Получение 2-фенил-5-(3-(пирролидин-1-ил)пропил)-N-(2-(тиазоло[5,4-b]пиридин-2-ил)фенил) тиазол-4-карбоксамида:[5,4-b]пиридин-2-ил)фенил)тиазол-4-карбоксамида (250 мг, 0,53 ммоль) и АсОН (127 мг, 2,1 ммоль) в дихлорэтане (DCE) (10 мл). Реакционную смесь перемешивали в течение 1 ч. Добавляли триацетоксиборгидрид натрия (449 мг, 2,1 ммоль) и продолжали перемешивать в течение 16 ч. Реакционную смесь вливали в насыщенный водный раствор NaHCO3 и экстрагировали DCM. Объединенные органические вещества промывали солевым раствором, высушивали (MgSO4) и концентрировали. Неочищенный продукт очищали MPLC-элюцией CH2Cl2/MeOH+1% TEA (0-10% градиент) для получения указанного соединения (87 мг, выход 31%). MS, рассчитанная для C29H27N5OS2: 525,17. Обнаруженная (M+Н)+ Указанное соединение получали согласно процедуре, описанной для 2-фенил-5-(3-(пирролидин-1 ил)пропил)-N-(2-(тиазоло[5,4-b]пиридин-2-ил)фенил)тиазол-4-карбоксамида, с заменой пирролидина на морфолин (128 мг, выход 45%). MS, рассчитанная для C29H27N5O2S2: 541,16. Обнаруженная (М+Н)+m/z=542. Пример 2. Биологическая активность. Для идентификации регуляторов активности SIRT1 использовался тест, основанный на массспектрометрии. Для теста, основанного на масс-спектрометрии, использовался следующий пептид длиной 20 аминокислотных остатков: Ас-ЕЕ-K(биотин)-GQSTSSHSK(Ac)NleSTEG-K(5TMR)-EE-NH2 (SEQID NO: 1) 1) где K(Ас) означает ацетилированный остаток лизина, a Nle означает норлейцин. Пептид помечен флуорохромом 5TMR (возбуждение 540 нм/испускание 580 нм) на С-конце. Последовательность пептида основана на р 53 с несколькими модификациями. Кроме того, присутствующий в натуральной последовательности остаток метионина заменяли на норлейцин, поскольку метионин может окисляться во время синтеза и очистки. Масс-спектрометрический тест проводили следующим образом: 0,5 мкМ пептидного субстрата и 120 мкМ НАД+ инкубировали с 10 нМ SIRT1 в течение 25 мин при 25 С в реакционном буфере (50 мМ трис-ацетат рН 8, 137 мМ NaCl, 2,7 мМ KCl, 1 мМ MgCl2, 5 мМ DTT, 0,05% BSA). Тестируемые соединения могут добавляться к реакции, как описано выше. Ген SirT1 клонировали в вектор, содержащий промотор Т 7, и трансформировали в BL2(DE3). После инкубации с SIRT1 в течение 25 мин, добавляли 10 мкл 10% муравьиной кислоты для остановки реакции. Реакции запечатывали и замораживали для дальнейшего масс-спектрометрического анализа. Определение массы пептидного субстрата позволяет точно определить степень ацетилирования (т.е. исходного материала) по сравнению с деацетилированным пептидом (продукт). Контрольное ингибирование активности сиртуина ставили путем добавления 1 мкл 500 мМ никотинамида в качестве отрицательного контроля в начале реакции (т.е. максимальное ингибирование сиртуина). Контроль повышения активности сиртуина ставили с использованием 10 нМ белка сиртуина с 1 мкл DMSO вместо соединения для определения степени деацетилирования субстрата в данный момент времени на линейном участке теста. Тот же момент времени использовали для тестируемых соединений,и на линейном участке конечная точка указывает на изменение скорости. Белок SIRT1 для вышеописанного теста экспрессировали и очищали следующим образом. Ген SirT1 клонировали в вектор, содержащий промотор Т 7, и трансформировали в BL2(DE3). Белок экспрессировали путем индукции 1 мМ IPTG в виде белка, слитого с гистидиновой меткой на N-конце, в течение ночи при 18 С и собирали при 30000 g. Клетки лизировали лизозимом в лизисном буфере (50 мМ трисHCl, 2 мМ трис[2-карбоксиэтил]фосфин (ТСЕР), 10 мкМ ZnCl2, 200 мМ NaCl) и далее подвергали соникации в течение 10 мин для полного лизиса. Белок очищали на колонке Ni-NTA (Amerhsam), и фракции,содержащие очищенный белок, объединяли, концентрировали и пропускали через гель-фильтрационную колонку (Sephadex S200 26/60 global). Собирали пик, содержащий растворимый белок, и прогоняли через ионообменную колонку (MonoQ). В результате градиентной элюции (200 мМ-500 мМ NaCl) получали очищенный белок. Этот белок концентрировали и диализовали против диализного буфера (20 мМ трисHCl, 2 мМ ТСЕР) в течение ночи. Белок делили на аликвоты и замораживали при -80 С до дальнейшего использования. Соединения, регулирующие сиртуин, которые активировали SIRT1, идентифицировали с помощью вышеописанного теста, результаты которого приведены в табл. 1. Величины EC1,5 для активирующих соединений обозначены A (EC1,51 мкМ), В (EC1,51 и 10 мкМ), или С (EC1,510 мкМ). Максимальный процент активации обозначен А (активация 300%), В (активация 150% и 300%) или С (активация 150%).
МПК / Метки
МПК: A61K 31/5377, A61P 9/00, A61K 31/496, A61P 37/00, A61K 31/437, A61P 5/50, A61P 3/00, A61P 25/00, C07D 513/04, A61P 19/00, A61P 31/00
Метки: тиазолопиридиновые, сиртуин, регулирующие, соединения
Код ссылки
<a href="https://eas.patents.su/30-21424-tiazolopiridinovye-soedineniya-reguliruyushhie-sirtuin.html" rel="bookmark" title="База патентов Евразийского Союза">Тиазолопиридиновые соединения, регулирующие сиртуин</a>
Предыдущий патент: Способ синтеза жидкого топлива и устройство для синтеза жидкого топлива
Следующий патент: Мутанты fgf21 и их применение
Случайный патент: Переходный элемент для многоуровневых потолков












