Соединения, эффективные в качестве ингибиторов ксантиноксидазы, способ их получения и содержащая их фармацевтическая композиция
Номер патента: 21025
Опубликовано: 31.03.2015
Авторы: Артемов Василий, Ким Тае Хун, Сонг Дзеонг Юк, Коо Ки Чул, Чои Еун Сил, Парк Ван Су, Парк Хиун Дзунг, Чои Сунг Пил, Парк Хеуи Сул, Дзунг Чеол Киу, Ким Геун Тае, Парк Деок Сеонг
Формула / Реферат
1. Соединение следующей формулы (1):
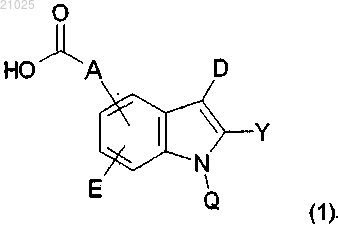
в которой А выбран из следующих заместителей (A-i), (A-iv), (A-v), (A-vi) и (A-vii):
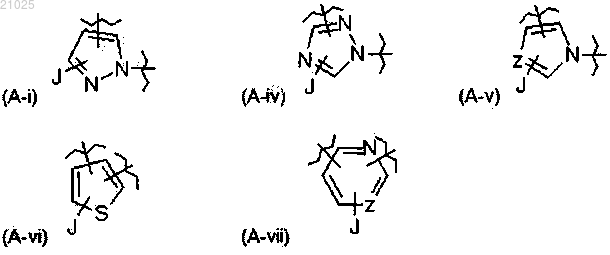
в которых J обозначает водород или галогензамещенный или незамещенный C1-С6-алкил;
Z обозначает С или N;
Е обозначает водород или циано;
D обозначает циано или нитро;
Q выбран из следующих заместителей (Q-i), (Q-ii) и (Q-iii-1):
(Q-i) водород;
(Q-ii) С1-С8-алкил, который является незамещенным или замещенным группой, выбранной из галогена, C3-С7-циклоалкила и O-R6, где R6 обозначает С1-С4-алкил; или С3-С7-циклоалкил;
(Q-iii-1)
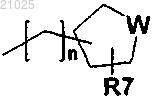
где W обозначает О или S, R7 обозначает водород или C1-С7-алкил, n обозначает целое число 0-3;
Y обозначает водород, С1-С4-алкил, С1-С4-алкокси-С1-С4-алкил или фенил,
или его фармацевтически приемлемая соль.
2. Соединение, выбранное из следующей группы:
1) 1-(3-циано-1-изопропилиндол-5-ил)пиразол-4-карбоновая кислота;
2) 1-[3-циано-1-(циклопропилметил)индол-5-ил]пиразол-4-карбоновая кислота;
3) 1-[3-циано-1-циклопропилиндол-5-ил]пиразол-4-карбоновая кислота;
4) 1-(3-циано-1-изобутилиндол-5-ил)пиразол-4-карбоновая кислота;
5) 1-[3-циано-1-(2,2-диметилпропил)индол-5-ил]пиразол-4-карбоновая кислота;
6) 1-[3-циано-1-(2-метоксиэтил)индол-5-ил]пиразол-4-карбоновая кислота;
7) 1-(3-циано-1-втор-бутилиндол-5-ил)пиразол-4-карбоновая кислота;
8) 1-[3-циано-1-циклобутилиндол-5-ил]пиразол-4-карбоновая кислота;
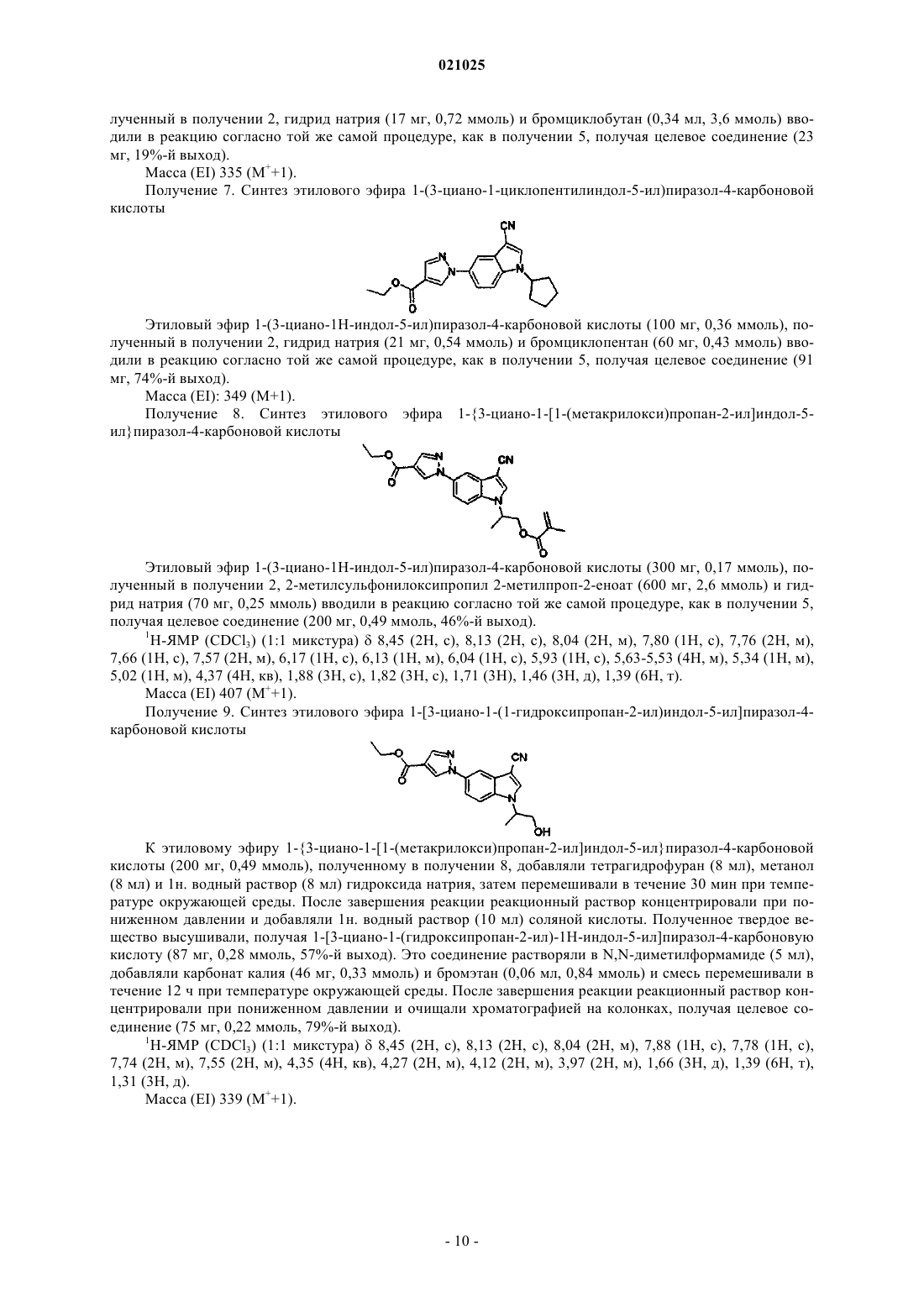
9) 1-(3-циано-1-циклопентилиндол-5-ил)пиразол-4-карбоновая кислота;
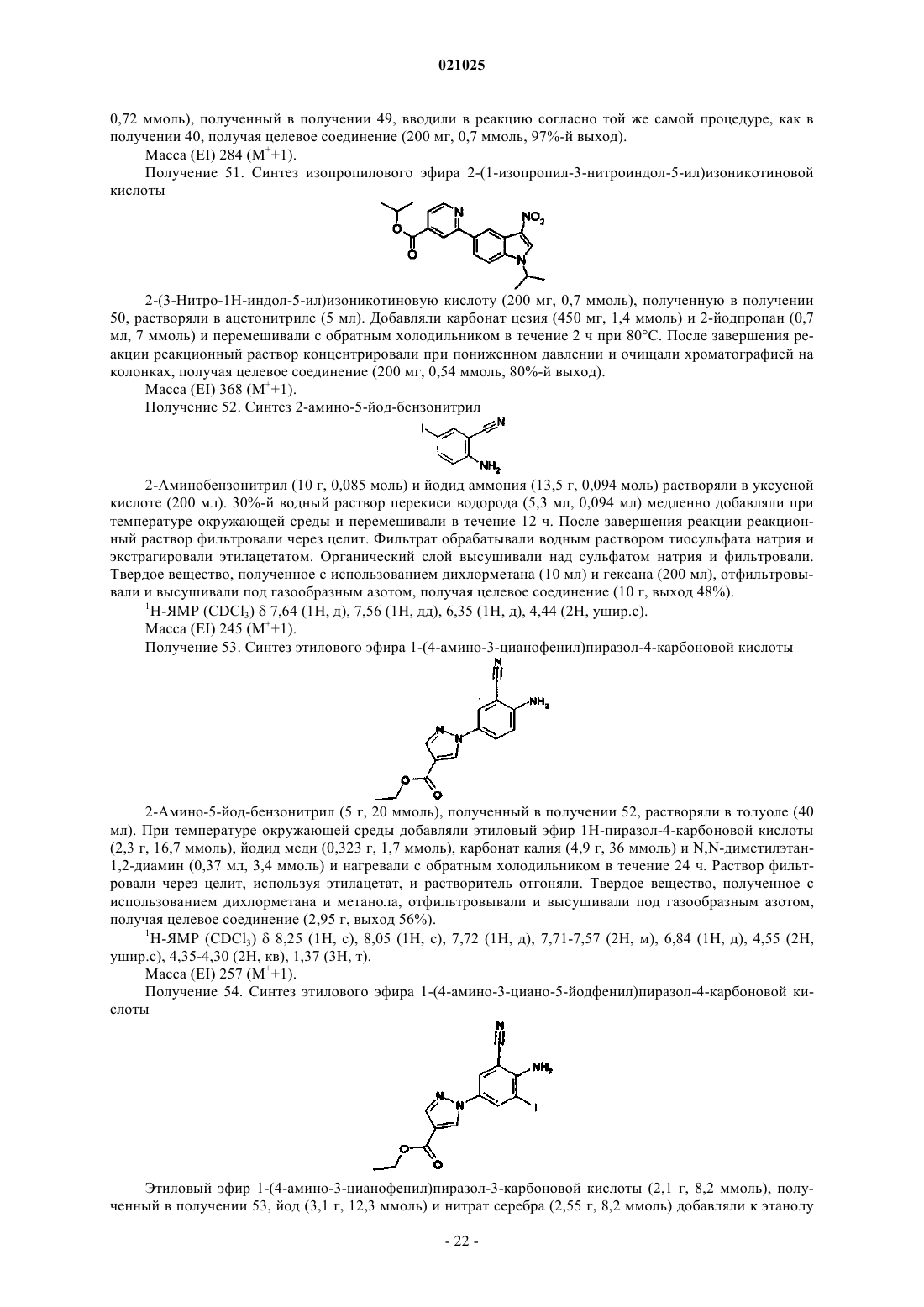
10) 1-[3-циано-1-(1-фторпропан-2-ил)индол-5-ил]пиразол-4-карбоновая кислота;
11) 1-[3-циано-1-(тетрагидрофуран-3-ил)индол-5-ил]пиразол-4-карбоновая кислота;
12) 1-[3-циано-1-изопропилиндол-5-ил]-3-метилпиразол-4-карбоновая кислота;
13) 1-[3-циано-1-(циклопропилметил)индол-5-ил]-3-метилпиразол-4-карбоновая кислота;
14) 1-[3-циано-1-(2-метоксиэтил)индол-5-ил]-3-метилпиразол-4-карбоновая кислота;
15) 1-[3-циано-1-изопропилиндол-5-ил]-3-(трифторметил)пиразол-4-карбоновая кислота;
16) 1-[3-циано-1-(циклопропилметил)индол-5-ил]-3-(трифторметил)пиразол-4-карбоновая кислота;
17) 1-(1-изопропил-3-нитроиндол-5-ил)пиразол-4-карбоновая кислота;
18) 1-(3-циано-1-изопропилиндол-5-ил)-1,2,4-триазол-3-карбоновая кислота;
19) 1-(3-циано-1-изопропилиндол-5-ил)имидазол-4-карбоновая кислота;
20) 5-(3-циано-1-изопропилиндол-5-ил)тиофен-2-карбоновая кислота;
21) 2-(3-циано-1-изопропилиндол-5-ил)изоникотиновая кислота;
22) 2-[3-циано-1-(циклопропилметил)индол-5-ил]изоникотиновая кислота;
23) 2-[3-циано-1-(тетрагидрофуран-3-ил)индол-5-ил] изоникотиновая кислота;
24) 2-[3-циано-1-(1-фторпропан-2-ил)индол-5-ил] изоникотиновая кислота;
25) 2-[3-циано-1-(2-метоксиэтил)индол-5-ил]изоникотиновая кислота;
26) 2-(3-циано-1-изопропилиндол-5-ил)-6-метилизоникотиновая кислота;
27) 2-(1-изопропил-3-нитроиндол-5-ил)изоникотиновая кислота;
28) 1-(7-циано-2-фенил-1Н-индол-5-ил)пиразол-4-карбоновая кислота;
29) 1-(7-циано-2-изопропил-1Н-индол-5-ил)пиразол-4-карбоновая кислота;
30) 1-(7-циано-2-метоксиметил-1Н-индол-5-ил)пиразол-4-карбоновая кислота и
31) 1-(7-циано-1Н-индол-5-ил)пиразол-4-карбоновая кислота,
или его фармацевтически приемлемая соль.
3. Способ получения соединения формулы (1) или его фармацевтически приемлемой соли по п.1, характеризующийся следующей реакционной схемой (1):
Реакционная схема 1
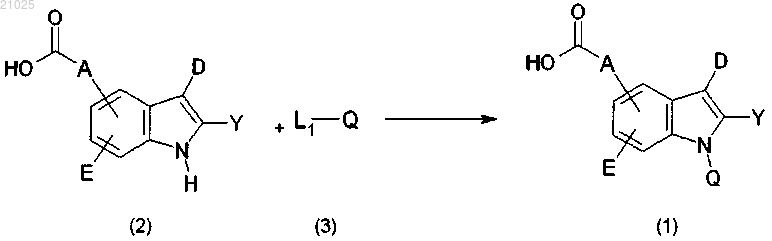
где A, D, E, Y и Q имеют значения, определенные в п.1, при условии, что Q не обозначает водород;
L1 обозначает уходящую группу.
4. Способ получения соединения формулы (1) или его фармацевтически приемлемой соли по п.1, характеризующийся следующей реакционной схемой (2):
Реакционная схема 2
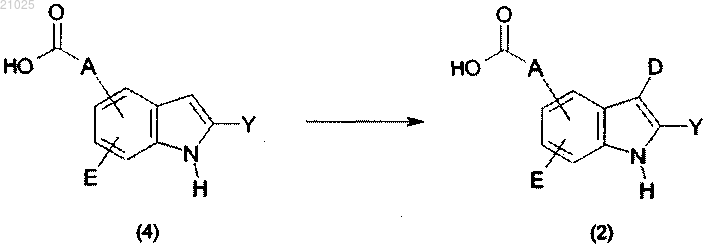
где A, D, Е и Y имеют значения, определенные в п.1, при условии, что D не обозначает водород,
причем соединение формулы (2) получают путем реакции соединения формулы (4) с нитратом серебра и бензоилхлоридом в органическом растворителе; или соединение формулы (2) получают путем реакции соединения формулы (4) с оксалилхлоридом в дихлорметане, добавлением тетрагидрофурана и ацетата аммония, нагреванием смеси с получением альдегидного соединения, реакцией альдегидного соединения с гидроксиламином в пиридиновом растворителе с получением соединения оксима и реакцией соединения оксима с 2-хлор-1-метилпиридиниййодидом или ди(имидазол-1-ил)метантионом и триэтиламином в тетрагидрофуране.
5. Способ по п.4, в котором соединение формулы (4), используемое как исходный материал, получено согласно следующей реакционной схеме (3):
Реакционная схема 3
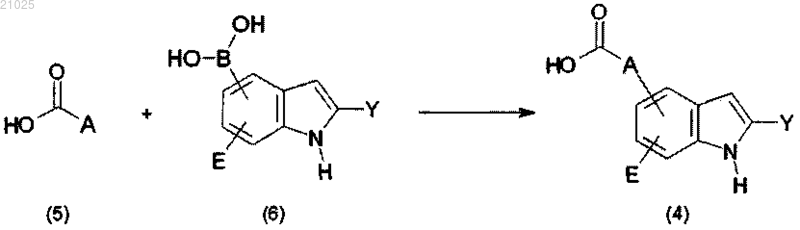
где А, Е и Y имеют значения, определенные в п.1.
6. Фармацевтическая композиция для ингибирования ксантиноксидазы, которая включает (а) терапевтически эффективное количество соединения формулы (1) или его фармацевтически приемлемой соли по п.1; (b) фармацевтически приемлемый носитель, разбавитель, эксципиент или их комбинацию.
7. Композиция по п.6, которая используется для профилактики или лечения заболевания, связанного с человеческой ксантиноксидазой.
8. Композиция по п.7 для лечения заболевания, связанного с человеческой ксантиноксидазой, выбранного из группы, состоящей из гиперурикемии, подагры, сердечной недостаточности, сердечно-сосудистого заболевания, артериальной гипертензии, диабета, осложнения диабета, заболевания почек, воспаления, заболевания суставов и воспалительного заболевания кишечника.
9. Композиция по п.8 для лечения осложнения диабета, выбранного из группы, состоящей из гиперлипидемии, атеросклероза, ожирения, артериальной гипертензии, ретиноза и отказа почек.
Текст
СОЕДИНЕНИЯ, ЭФФЕКТИВНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КСАНТИНОКСИДАЗЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ Настоящее изобретение относится к новым соединениям следующей формулы (1): которые являются эффективными в качестве ингибиторов ксантиноксидазы, к способу их получения и к фармацевтической композиции, включающей терапевтически эффективное количество этих соединений.(71)(73) Заявитель и патентовладелец: Эл Джи ЛАЙФ САЙЕНСИЗ ЛТД. Область техники Настоящее изобретение относится к новым соединениям формулы (1) в которой A, D, E, Y и Q имеют значения, определенные ниже,которые являются эффективными как ингибиторы ксантиноксидазы, к способу их получения и к фармацевтической композиции, включающей терапевтически эффективное количество этих соединений. Уровень техники Ксантиноксидаза известна как фермент, который преобразует гипозантин в ксантин и далее преобразует таким образом сформированный зантин в мочевую кислоту. Хотя большинство млекопитающих имеет уриказу, она отсутствует у человека и шимпанзе, таким образом мочевая кислота, как известно,является конечным продуктом метаболизма пурина (S.P. Bruce, Ann. Pharm., 2006, 40, 2187-2194). Стойкое повышение концентрации в крови мочевой кислоты вызывает различные заболевания, включая, в первую очередь, подагру. Как описано выше, подагра вызывается повышенным уровнем мочевой кислоты в организме, указывая состояние, при котором кристаллы мочевой кислоты, аккумулированные в хрящах, связках и окружающей ткани, вызывают тяжелое воспаление и боль. Подагра представляет собой своего рода воспалительное заболевание суставов, и заболеваемость ей стабильно росла в течение последних 40 лет (N.L.Edwards, ArthritisRheumatism, 2008, 58, 2587-2590). С 1960-х до середины 1990-х пациенты, страдающие подагрой, в странах Запада показывали удивительное увеличение на приблизительно 200-300%, главным образом у мужчин. Увеличение числа пациентов с подагрой может быть связано с ожирением, старением, снижением функции почек, артериальной гипертензией и т.д. Заболеваемость подагрой, по-видимому, находится на уровне приблизительно 1,4/1000 человек, но она также зависит от уровня мочевой кислоты. Таким образом, в то время как заболеваемость подагрой составляет 0,5% в группе пациентов с уровнем мочевой кислоты в крови 7,0 мг/дл или более, заболеваемость подагрой составляет 5,5% в группе пациентов с уровнем мочевой кислоты 9,0 мг/дл или более (G. Nuki, Medicine, 2006, 34, 417-423). Относительно заболеваемости, как описано выше,было обнаружено, что уровень мочевой кислоты в крови является важным причинным фактором подагры. Кроме того, особенности питания, потребление алкоголя, липидов и ожирение могут служить важными факторами, стимулирующими подагру. В последнее время многими исследователями интенсивно изучалась корреляция мочевой кислоты с сердечной недостаточностью, артериальной гипертензией,диабетом, почечными заболеваниями и сердечно-сосудистыми заболеваниями, и была выявлена важность контроля мочевой кислоты (D.I. Feig et al., N. Eng. J. Med, 2008, 23, 1811-1821). Кроме того, известно, что, как ингибитор ксантиноксидазы, аллопуринол имеет эффект в отношении неспецифического язвенного колита (Aliment. Pharmacol. Ther. 2000, 14, 1159-1162; WO 2007/043457). Аллопуринол был уникальным лекарственным средством для лечения подагры в течение 40 лет,пока фебуксостат не был апробирован в качестве средства для лечения подагры в США в 2009 (BrainTomlinson, Current Opin. Invest. Drugs, 2005, 6, 1168-1178). Аллопуринол, как известно, является неспецифичным ингибитором различных ферментов, которые участвуют в метаболизме пурина и пиримидина,и он имеет Ki 700 нМ в отношении ксантиноксидазы (Y. Takano et al., Life Sciences, 2005, 76, 1835-1847). Аллопуринол немедленно окисляется ксантиноксидазой до оксипуринола, и этот метаболит известен по своему действию как мощный ингибитор ксантиноксидазы. Однако известно, что аллопуринол вызывает побочные эффекты на уровне желудочно-кишечного тракта и высыпания на коже и приводит к недостаточному комплаенсу в случае долговременного введения. Особенно среди пациентов, получающих аллопуринол, сообщалось о побочном эффекте синдрома Стивенса-Джонсона, с низкой частотой, но этот синдром непредсказуем и летален (Felix Arellano et al.,Ann. Pharm., 1993, 27, 337-43). Известно, что этот серьезный побочный эффект сопровождает некроцитоз в коже и слизистой оболочке рта, и без надлежащего лечения приблизительно 25% пациентов могут в результате умереть. Таким образом, чтобы разработать новые ингибиторы ксантиноксидазы, проводили различные исследования, описанные в многочисленных патентных публикациях (например, WO 1992/009279,WO 1998/018765, WO 2007/004688, WO 2007/043457, WO 2008/126770, WO 2008/126898,WO 2008/126899). Из них в WO 1998/018765 описано ингибирующее действие пиразолов и производных фенила против ксантиноксидазы, и в WO 2008/126898 сообщается, что соединения индола показывают ингибирующее действие против ксантиноксидазы. Раскрытие изобретения Техническая задача Одной целью настоящего изобретения является получение новых соединений формулы (1), которые показывают превосходное ингибирующее действие против ксантиноксидазы. Другой целью настоящего изобретения является разработка нового способа получения соединений формулы (1). Другой целью настоящего изобретения является получение фармацевтической композиции для ингибирования ксантиноксидазы, которая включает терапевтически эффективное количество соединений формулы (1) в качестве активного ингредиента. Другой целью настоящего изобретения является разработка способа лечения и/или профилактики заболеваний, связанных с ксантиноксидазой, таких как гиперурикемия, подагра, сердечная недостаточность, сердечно-сосудистое заболевание, артериальная гипертензия, диабет, заболевание почек, воспаление и заболевание суставов и воспалительное заболевание кишечника, который включает применение соединений формулы (1) в качестве активного ингредиента. Решение задачи В рамках решения вышеупомянутой технической задачи настоящее изобретение относится к соединениям следующей формулы (1): где А выбран из следующих заместителей (A-i), (A-iv), (A-v), (A-vi) и (A-vii): в которых J обозначает водород или галогензамещенный или незамещенный C1-С 6-алкил;Z обозначает С или N; Е обозначает водород или циано;D обозначает циано или нитро;Q выбран из следующих заместителей (Q-i), (Q-ii) и (Q-iii-1):(Q-ii) C1-C8-алкил, который является незамещенным или замещенным группой, выбранной из галогена, С 3-С 7-циклоалкила и O-R6, где R6 обозначает C1-С 4-алкил; или С 3-С 7-циклоалкил; где W обозначает О или S, R7 обозначает водород или C1-С 7-алкил, n обозначает целое число 0-3;Y обозначает водород, C1-C4-алкил, C1-C4-алкокси-C1-C4-алкил или фенил. В дальнейшем, если специально не ограничено, соединения формулы (1) в качестве активного ингредиента терапевтического средства включают все их фармацевтически приемлемые соли, и эти формы подпадают в объем настоящего изобретения. Только для удобства объяснения они упоминаются в настоящем описании просто как соединения формулы (1)'. Вышеописанные соединения формулы (1) согласно настоящему изобретению имеют химическую структуру, весьма отличную от ранее известных ингибиторов ксантиноксидазы. Как показано в следующих экспериментах, они демонстрируют превосходное ингибирующее действие против ксантиноксидазы, связанной с подагрой. Таким образом, они могут использоваться для профилактики и лечения заболеваний, связанных с ксантиноксидазой, таких как, например, гиперурикемия, сердечная недостаточность, сердечно-сосудистое заболевание, артериальная гипертензия, диабет, заболевание почек, воспаление, заболевание суставов и т.д. Термины, используемые здесь, будут кратко объяснены ниже. Если нет никакого специального упоминания в настоящем описании, термин "замещенный или незамещенный" означает включающий оба случая, когда радикал является замещенным и незамещенным. В случае "замещенного" радикал может быть замещен индивидуально и независимо одной или более группами, выбранными из алкила, циклоалкила, гидрокси, алкокси, меркапто, алкилтио, циано, галогена,карбонила, тиокарбонила, нитро и их защитных производных. Если возможно, эти группы могут быть дополнительно замещены. В рамках изобретения "фармацевтически приемлемые соли" означают формы соли соединения, которые не оказывают никакого серьезного раздражающего действия на организм, в который соединение вводят, и не ухудшают биологическую активность и свойства соединения. Такая "фармацевтически приемлемая соль" включает нетоксичную соль присоединения с кислотой, содержащую фармацевтически приемлемый анион, например соль с неорганическими кислотами, такими как соляная кислота, серная кислота, азотная кислота, фосфорная кислота, бромисто-водородная кислота, йодисто-водородная кислота и т.д.; соль с органическими карбоновыми кислотами, такими как винная кислота, муравьиная кислота, лимонная кислота, уксусная кислота, трихлоруксусная кислота, трифторуксусная кислота, глюконовая кислота, бензойная кислота, молочная кислота, фумаровая кислота, малеиновая кислота, салициловая кислота и т.д.; или соль с сульфоновыми кислотами, такими как метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота и т.д. Соединения формулы (1) могут также образовывать фармацевтически приемлемую соль, например соль со щелочными металлами или щелочно-земельными металлами, такими как литий, натрий, калий, кальций, магний и т.д.; соль с аминокислотами, такими как лизин, аргинин, гуанидин и т.д.; или органическую соль со следующим: дициклогексиламин, N-метил-D-глюкамин, трис-(гидроксиметил)метиламин, диэтаноламин, холин, триэтиламин и т.д. Соединения формулы (1) согласно настоящему изобретению могут быть превращены в их соли согласно любому из обычных способов. В рамках изобретения "алкил" означает алифатическую углеводородную группу. Алкильная группа может быть "насыщенным алкилом", вообще не содержащим алкеновую или алкиновую группу, или"ненасыщенным алкилом", содержащим по меньшей мере одну алкеновую или алкиновую группу. Термин "алкен" означает группу, имеющую по меньшей мере одну углерод-углеродную двойную связь, и"алкин" означает группу, имеющую по меньшей мере одну углерод-углеродную тройную связь. Независимо от того, является ли она насыщенной или ненасыщенной, алкильная группа может быть разветвленной, прямой или циклической. Если не указано иное, алкильная группа может содержать от 1 до 20 атомов углерода, и низшая алкильная группа может содержать от 1 до 7 атомов углерода. В качестве типичных примеров этого могут быть названы метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, этенил, пропенил, бутенил, этинил, пропинил, бутинил, циклопропил, циклобутил, циклопентил, циклогексил и т.д. Алкильная группа может быть замещенной или незамещенной. В случае "замещенного" радикал может быть замещен индивидуально и независимо одной или более группами, выбранными из циклоалкила,гидрокси, алкокси, меркапто, алкилтио, циано, галогена, карбонила, тиокарбонила, нитро и их защитных производных. В рамках изобретения "галоген" означает F (или -F), Cl (или -Cl), Br (или -Br) и I (или -I). Другие термины в настоящем описании имеют значения, обычно понимаемые специалистом в этой области. Особенно предпочтительными соединениями формулы (I) являются такие, в которых А выбран из следующих заместителей (A-i), (A-iv), (A-v), (A-vi) и (A-vii): в которых J обозначает галогензамещенный или незамещенный С 1-С 4-алкил;Z обозначает С или N; Е обозначает водород или циано;D обозначает циано или нитро;Q выбран из следующих заместителей (Q-i), (Q-ii) и (Q-iii-1):(Q-ii) C1-C8-алкил, который является незамещенным или замещенным группой, выбранной из галогена, C3-С 7-циклоалкила и O-R6, причем R6 обозначает С 1-С 4-алкил; где W обозначает О или S, R7 обозначает водород или C1-C4-алкил, n обозначает целое число 0-3;Y обозначает водород, C1-C4-алкил, C1-C4-алкокси-C1-C4-алкил или фенил. Репрезентативные соединения формулы (1) согласно настоящему изобретению включают следующие перечисленные соединения: 1) 1-(3-циано-1-изопропилиндол-5-ил)пиразол-4-карбоновая кислота; 2) 1-[3-циано-1-(циклопропилметил)индол-5-ил]пиразол-4-карбоновая кислота; 3) 1-[3-циано-1-циклопропилиндол-5-ил]пиразол-4-карбоновая кислота; 4) 1-(3-циано-1-изобутилиндол-5-ил)пиразол-4-карбоновая кислота; 5) 1-[3-циано-1-(2,2-диметилпропил)индол-5-ил]пиразол-4-карбоновая кислота; 6) 1-[3-циано-1-(2-метоксиэтил)индол-5-ил]пиразол-4-карбоновая кислота; 7) 1-(3-циано-1-втор-бутилиндол-5-ил)пиразол-4-карбоновая кислота; 8) 1-[3-циано-1-циклобутилиндол-5-ил]пиразол-4-карбоновая кислота; 9) 1-(3-циано-1-циклопентилиндол-5-ил)пиразол-4-карбоновая кислота; 10) 1-[3-циано-1-(1-фторпропан-2-ил)индол-5-ил]пиразол-4-карбоновая кислота; 11) 1-[3-циано-1-(тетрагидрофуран-3-ил)индол-5-ил]пиразол-4-карбоновая кислота; 12) 1-[3-циано-1-изопропилиндол-5-ил]-3-метилпиразол-4-карбоновая кислота; 13) 1-[3-циано-1-(циклопропилметил)индол-5-ил]-3-метилпиразол-4-карбоновая кислота; 14) 1-[3-циано-1-(2-метоксиэтил)индол-5-ил]-3-метилпиразол-4-карбоновая кислота; 15) 1-[3-циано-1-изопропилиндол-5-ил]-3-(трифторметил)пиразол-4-карбоновая кислота; 16) 1-[3-циано-1-(циклопропилметил)индол-5-ил]-3-(трифторметил)пиразол-4-карбоновая кислота; 17) 1-(1-изопропил-3-нитроиндол-5-ил)пиразол-4-карбоновая кислота; 18) 1-(3-циано-1-изопропилиндол-5-ил)-1,2,4-триазол-3-карбоновая кислота; 19) 1-(3-циано-1-изопропилиндол-5-ил)имидазол-4-карбоновая кислота; 20) 5-(3-циано-1-изопропилиндол-5-ил)тиофен-2-карбоновая кислота; 21) 2-(3-циано-1-изопропилиндол-5-ил)изоникотиновая кислота; 22) 2-[3-циано-1-(циклопропилметил)индол-5-ил]изоникотиновая кислота; 23) 2-[3-циано-1-(тетрагидрофуран-3-ил)индол-5-ил]изоникотиновая кислота; 24) 2-[3-циано-1-(1-фторпропан-2-ил)индол-5-ил]изоникотиновая кислота; 25) 2-[3-циано-1-(2-метоксиэтил)индол-5-ил]изоникотиновая кислота; 26) 2-(3-циано-1-изопропилиндол-5-ил)-6-метилизоникотиновая кислота; 27) 2-(1-изопропил-3-нитроиндол-5-ил)изоникотиновая кислота; 28) 1-(7-циано-2-фенил-1 Н-индол-5-ил)пиразол-4-карбоновая кислота; 29) 1-(7-циано-2-изопропил-1 Н-индол-5-ил)пиразол-4-карбоновая кислота; 30) 1-(7-циано-2-метоксиметил-1 Н-индол-5-ил)пиразол-4-карбоновая кислота и 31) 1-(7-циано-1 Н-индол-5-ил)пиразол-4-карбоновая кислота. Настоящее изобретение также относится к способам получения соединений формулы (1). Специалист в области техники, к которой относится настоящее изобретение, может получить соединения формулы (1) различными путями в зависимости от их структур, и такие способы входят в объем настоящего изобретения. Другими словами, соединения формулы (1) можно получать, в случае необходимости объединяя различные способы синтеза, которые описаны в настоящем описании или раскрыты в документах предшествующего уровня техники. Способы получения соединений формулы (1) охватывают и такие процессы и не ограничены объясненными ниже. В качестве одного типичного способа соединения формулы (1), в которой Q не обозначает водород,могут быть получены реакцией соединений формулы (2) с соединениями формулы (3) в присутствии основания, как изображено на следующей реакционной схеме (1). Реакционная схема 1 где A, D, E, Y и Q имеют значения, определенные для формулы (1), при условии, что Q не обозначает водород;L1 обозначает уходящую группу в реакции замещения, такую как, например, галоген, метансульфонилокси, п-толуолсульфонилокси, трифторметансульфонилокси и т.д. Вышеописанная реакция может быть осуществлена в органическом растворителе, таком как диметилформамид, диметилацетамид, ацетонитрил и т.д., и в некоторых случаях может использоваться смесь двух или более органических растворителей. Типичные примеры основания, используемого в реакции,включают гидрид натрия, гидроксид натрия, трет-бутоксид калия, карбонат цезия, карбонат калия, карбонат натрия, бис-(триметилсилил)амид калия и т.д., и в некоторых случаях может использоваться смесь двух или более оснований. В случае необходимости, когда G не обозначает водород, соединения, полученные в соответствии с вышеописанной реакционной схемой (1), могут быть гидролизованы с получением соединений формулы(1), в которой G обозначает водород. Как другой типичный способ, соединения формулы (1), в которой D не обозначает водород и Q обозначает водород, могут быть получены введением заместителя D согласно следующей реакционной схеме (2). Реакционная схема 2 где A, D, Е и Y имеют значения, определенные в формуле (1), при условии, что D не обозначает водород. В вышеописанной реакционной схеме (2) случай, в котором D обозначает нитро, объясняется сначала следующим образом. Соединение (4), нитрат серебра и бензоилхлорид могут быть введены в реакцию в органическом растворителе, таком как ацетонитрил и т.д., с получением конечного соединения (2), в котором D обозначает нитро. Или соединение (2), в котором D обозначает нитро, может также быть получено при использовании азотной кислоты и уксусного ангидрида, причем, в случае необходимости, используется смесь двух или более органических растворителей (Tetrahedron, 2000, 56, 10133). Если возможно, сначала в соединение (4) вводят группу Q согласно реакционной схеме (1), и затем нитрогруппа может быть введена, как объяснено выше. В вышеописанной реакционной схеме (2) случай, в котором D обозначает циано, объясняется следующим образом. Соединение индола (4) вводят в реакцию с оксалилхлоридом в дихлорметане, добавляют по каплям тетрагидрофуран и ацетат аммония, и смесь нагревают, получая соединение альдегида [соединение (2), в котором D обозначает -СНО]. Соединение альдегида вводят в реакцию с гидроксиламином в пиридиновом растворителе, получая соединение оксима. Соединение оксима вводят в реакцию с 2-хлор-1-метилпиридиний йодидом или ди(имидазол-1-ил)метантионом и триэтиламином в тетрагидрофуране, получая соединение (2), в котором D обозначает -CN. Эта реакция может быть осуществлена согласно J. Ludwiget al., J. Med. Chem., 2006, 49, 2611. В случае необходимости, заместитель Q может быть сначала введен в соединение (4) тем же самым образом, как на вышеописанной реакционной схеме (1), и цианогруппа может быть введена позже, как объяснено выше. Соединение (4), используемое в качестве исходного материала в вышеописанной реакционной схеме (2), может быть получено согласно следующей реакционной схеме (3). Реакционная схема 3 где А, Е и Y имеют значения, определенные в формуле (1). Способ получения соединения (4) согласно вышеописанной реакционной схеме (3) объясняется подробно ниже. Соединение (5) и соединение (6) растворяют вместе с ацетатом меди(II) и пиридином в(4). Альтернативно, соединение (5) и соединение (6) растворяют вместе с карбонатом натрия и тетракис(трифенилфосфин)палладием в толуоле или диоксане, и они вступают в реакцию с получением соединения (4). Специалист может также получить вышеуказанные используемые в реакции соединения различными способами в зависимости от их химических структур в объеме настоящего изобретения. Специалист может подтвердить специфические реакционные условия и т.д. для получения соединений согласно настоящему изобретению через примеры получения и примеры, приведенные ниже, и таким образом их подробные объяснения здесь опущены. Настоящее изобретение также относится к фармацевтической композиции для ингибирования ксан-5 021025 тиноксидазы, которая включает (а) терапевтически эффективное количество соединений формулы (1), их фармацевтически приемлемых солей или изомеров и (b) фармацевтически приемлемые носители, разбавители, эксципиенты или их комбинации. В рамках изобретения "фармацевтическая композиция" означает композиции, включающие соединения согласно настоящему изобретению и другие химические компоненты, такие как носители, разбавители, эксципиенты и т.д. Фармацевтическая композиция облегчает введение соединения в живой организм. Существует множество методик введения соединения, и они включают, но не ограничены ими,пероральное, инъекционное, аэрозольное, парентеральное и топическое введение. Терапевтически активные ингредиенты, которые содержатся в фармацевтической композиции, могут быть превращены в их соли реакцией кислотного соединения, такого как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота,салициловая кислота и т.д. с соединениями формулы (1). В рамках изобретения "терапевтически эффективное количество" означает количество активного ингредиента, эффективного для облегчения или устранения одного или более симптомов нарушения,подвергаемого лечению, или задержки клинических маркеров или инициации симптомов заболевания,которое требуется предотвратить. Таким образом, терапевтически эффективное количество означает количество, имеющее эффект (1) обращения скорости развития заболевания, (2) препятствования дальнейшему развитию заболевания и/или (3) облегчения (предпочтительно устранения) одного или более симптомов, связанных с заболеванием. Терапевтически эффективное количество может быть определено на основании эксперимента путем тестирования соединений в системах модели in vivo и in vitro, известных для заболевания, которое подвергают лечению. В рамках изобретения "носитель" означает вещество, которое облегчает включение соединения в клетки или ткани. Например, диметилсульфоксид (ДМСО) представляет собой типичный носитель, который облегчает введение различных органических соединений в клетки или ткани живых организмов. В рамках изобретения "разбавитель" определяют как вещество, которое разбавлено в воде, которое растворяет рассматриваемое соединение, а также стабилизирует биологически активную форму соединения. Соли, растворенные в буферном растворе, используются как разбавители в данной области техники. Обычно используемый буферный раствор представляет собой буферизованный фосфатом солевой раствор, который имитирует солевую форму человеческого раствора. Буферные разбавители редко изменяют биологические активности соединения, поскольку буферные соли могут контролировать рН раствора в низкой концентрации. Соединение, используемое здесь, может вводиться как соединение per se или как фармацевтическая композиция, включающая соединение с другими активными ингредиентами в комбинированной терапии или с другими подходящими носителями или эксципиентами, пациенту-человеку. Методики для составления и введения соединения могут быть найдены в "Remington's Pharmaceutical Sciences" (Mack Publishing Co., Easton, PA, 18th edition, 1990). Фармацевтическая композиция согласно настоящему изобретению может быть получена известными способами, такими как, например, обычное смешивание, растворение, гранулирование, дражирование, измельчение в порошок, эмульгирование, инкапсулирование, улавливание, сушка сублимацией и т.д. Таким образом, фармацевтическая композиция согласно настоящему изобретению может быть получена обычными способами использования одного или более фармацевтически приемлемых носителей. Носители включают эксципиенты или адъюванты, которыми активное соединение может быть легко превращено в фармацевтически приемлемые составы. Подходящие составы могут зависеть от выбранного пути введения. Могут быть выбраны методики, носители и эксципиенты, и средства, известные в данной области техники, например, в "Remington's Pharmaceutical Sciences", как объяснено выше. Например, соединения формулы (1) согласно настоящему изобретению могут быть составлены в форме препарата для инъекций, перорального препарата и т.д., в зависимости от предназначенной цели. Что касается препарата для инъекций, активные соединения согласно настоящему изобретению могут быть составлены в жидкий препарат при использовании фармацевтически подходящих буферов,предпочтительно раствора Хэнка, раствора Рингера, физиологического солевого раствора и т.д. Для введения через слизистые оболочки, усилители проникновения, подходящие для барьера, через который требуется проникнуть, используются для состава. Такие усилители проникновения традиционно известны в данной области техники. Активные соединения согласно настоящему изобретению могут быть легко составлены как лекарственные формы для перорального введения путем комбинации соединений с фармацевтически приемлемыми носителями, известными в данной области техники. С использованием таких носителей, соединения согласно настоящему изобретению могут быть составлены в таблетки, пилюли, порошки, гранулы,драже, капсулы, жидкости, гели, сиропы, кашицы, суспензии и т.д. Капсулы, таблетки, пилюли, порошки и гранулы являются предпочтительными, и капсулы и таблетки являются особенно предпочтительными. Предпочтительно, таблетки и пилюли получают как формы, имеющие энтеросолюбильное покрытые. Например, твердые лекарственные формы для перорального введения могут быть получены следующим образом. Одно или более соединений согласно настоящему изобретению смешивают с одним или более эксципиентами и смесь измельчают в порошок, если необходимо. Подходящие адъюванты добавляют в случае необходимости, и таблетки или сердцевины драже могут быть получены из смесей гранул. В качестве подходящих эксципиентов могут быть названы наполнители, такие как лактоза, сахароза, маннит или сорбит; целлюлозные вещества, такие как кукурузный крахмал, пшеничный крахмал, рисовый крахмал,картофельный крахмал, желатин, трагакант, метилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и/или поливинилпирролидон (PVP); и т.д. В случае необходимости,дезинтеграторы, такие как поперечно сшитый поливинилпирролидон, агар-агар, альгиновая кислота или ее соли, такие как альгинат натрия, лубриканты, такие как стеарат магния, и связующие агенты могут быть добавлены в качестве носителя. Пероральные препараты могут включать герметизированные мягкие капсулы, изготовленные из желатина и пластичных агентов, таких как гликоль или сорбит, и твердые желатиновые капсулы, изготовленные из желатина. Твердые желатиновые капсулы могут содержать активное соединение в форме смеси с наполнителями, такими как лактоза, связующими, такими как крахмал, и/или лубрикантами, такими как тальк или стеарат магния. В мягкой капсуле активное соединение может быть растворено или диспергировано в подходящей среде, такой как жирная кислота, жидкий парафин или жидкий полиэтиленгликоль. Кроме того, может быть включен стабилизатор. Все составы для перорального введения могут содержать подходящее количество активного соединения для такого введения. Активное соединение может также быть составлено как препарат для инъекций, такой как, например, большая инъекция типа пилюли или инъекция непрерывного типа, для парентерального введения. Препарат для инъекций можно получить в форме ампулы, имеющей консервант, или стандартной лекарственной форме, которую заряжают в многодозовый контейнер. Композиции могут принимать такие формы, как суспензии в масляных или сжиженных носителях, растворы или эмульсии и могут содержать такие компоненты для составов как суспендирующие агенты, стабилизаторы и/или диспергирующие агенты. Кроме того, активный ингредиент может быть в форме сухого порошка, который предназначен для восстановления путем растворения в подходящем носителе, таком как стерилизованная апирогенная вода, перед использованием. Соединения согласно настоящему изобретению могут также быть составлены в композиции для ректального введения, такие как суппозиторий или клизма, с использованием обычной основы для суппозитория, такой как масло какао или другие глицериды. Фармацевтические композиции согласно настоящему изобретению содержат активный ингредиент в количестве, эффективном для достижения намеченной цели. Более конкретно, терапевтически эффективное количество означает количество активного соединения, эффективного для продления жизни пациента, получающего лечение, или предотвращения, облегчения или уменьшения симптомов заболевания. Специалист может определить терапевтически эффективное количество, особенно в свете приведенного здесь подробного описания. Когда соединение составлено в стандартную лекарственную форму, активные соединения формулы(1) предпочтительно содержатся в количестве приблизительно от 0,1 до 1000 мг на стандартную лекарственную форму. Дозировка соединений формулы (1) зависит от предписания врача, принимая во внимание такие факторы, как масса тела или возраст пациента, конкретная природа заболевания, серьезность заболевания и т.д. Однако дозировка, необходимая для лечения взрослого, обычно составляет приблизительно от 1 до 1000 мг в сутки, в зависимости от интенсивности и частоты введения. При введении взрослому внутримышечным или внутривенным путем полная дозировка обычно приблизительно от 1 до 500 мг в сутки будет достаточна при отдельном введении в единственной дозе, но для некоторых пациентов более может быть желательной высокая суточная доза. Настоящее изобретение также относится к способу профилактики или лечения заболеваний, обязанных с человеческой ксантиноксидазой, с использованием терапевтически эффективного количества соединений формулы (1), их фармацевтически приемлемых солей или изомеров. "Заболевания, связанные с человеческой ксантиноксидазой" означают такие заболевания, которые могут быть обработаны или предотвращены путем ингибирования человеческой ксантиноксидазы, и они включают, но не ограничены ими, гиперурикемию, подагру, сердечную недостаточность, сердечно-сосудистое заболевание, артериальную гипертензию, диабет, осложнения диабета, заболевание почек, воспаление и заболевание суставов, воспалительное заболевание кишечника и т.д. Как примеры указанных осложнений диабета могут быть названы гиперлипидемия, атеросклероз, ожирение, артериальная гипертензия, ретиноз, отказ почек и т.д. В рамках изобретения "лечение" означает прерывание или задержку развития заболевания при введении пациенту, демонстрирующему начало проявления симптомов заболевания, и "профилактика" означает прерывание или задержку признака начала заболевания при введении пациенту, который не демонстрирует, но имеет риск начала проявления симптомов заболевания. Краткое описание чертежей Фиг. 1 представляет собой график, показывающий результат измерения концентрации мочевой кислоты (мг/дл) в плазме согласно процедуре эксперимента 2 (Р 0,001, t-тест, Р 0,05, Р 0,01 тест множественного сравнения Даннетта). Фиг. 2 представляет собой график, показывающий результат измерения степени ингибирования (%) в отношении мочевой кислоты в плазме согласно процедуре эксперимента 2 (Р 0,001, t-тест, Р 0,05,Р 0,01 тест множественного сравнения Даннетта). Лучший способ осуществления изобретения В дальнейшем настоящее изобретение будет более специфично объяснено примерами получения,примерами и экспериментами. Однако следует понимать, что объем настоящего изобретения не ограничен этими примерами. Получение 1. Синтез этилового эфира 1-(1 Н-индол-5-ил)пиразол-4-карбоновой кислоты(0,972 г, 5,35 ммоль) и пиридин (1,2 мл, 14,8 ммоль) и смесь перемешивали в течение 3 дней при температуре окружающей среды. Растворитель отгоняли при пониженном давлении и остаток очищали хроматографией на колонках, получая целевое соединение (1,40 г, 5,47 ммоль, 77%-й выход). 1 Н-ЯМР (CDCl3)8,39 (1 Н, с), 8,30 (1 Н, ушир), 8,11 (1 Н, с), 7,92 (1 Н, д), 7,54 (1 Н, дд), 7,47 (1 Н, д),7,31(1 Н, т), 6,64-6,62 (1 Н, м), 4,35 (2 Н, кв), 1,39 (1 Н, т). Масса (EI) 256 (М 1). Получение 2. Синтез этилового эфира 1-(3-циано-1 Н-индол-5-ил)пиразол-4-карбоновой кислоты. Целевое соединение получали следующими способами (1)-(3).(1) Синтез этилового эфира 1-(3-формил-1 Н-индол-5-ил)пиразол-4-карбоновой кислоты Оксалилхлорид (0,56 мл, 6,6 ммоль) добавляли к безводному дихлорметану (50 мл), N,Nдиметилформамид (0,51 мл, 6,6 ммоль) добавляли при 0 С и смесь перемешивали в течение 30 мин при 0 С. К этому реакционному раствору добавляли смесь этилового эфира 1-(1 Н-индол-5-ил)пиразол-4 карбоновой кислоты (1,40 г, 5,47 ммоль), полученного в получении 1, и дихлорметана (50 мл). Смесь перемешивали с обратным холодильником в течение 1 ч при температуре окружающей среды и растворитель удаляли. Добавляли тетрагидрофуран (100 мл) и 20%-й водный раствор (100 мл) ацетата аммония,который затем нагревали в течение 30 мин при перемешивании с обратным холодильником. После завершения реакции реакционный раствор охлаждали. Добавляли этилацетат и смесь промывали водным раствором гидрокарбоната натрия. Органический слой высушивали над безводным сульфатом магния и концентрировали при пониженном давлении, получая целевое соединение. Масса (EI) 284 (М 1).(2) Синтез этилового эфира 1-[3-[(E,Z)-гидроксииминометил]-1 Н-индол-5-ил]пиразол-4-карбоновой кислоты(1), растворяли в пиридине (150 мл) и добавляли гидроксиаммонийхлорид (499 мг, 7,18 ммоль). Смесь нагревали в течение 5 ч при перемешивании с обратным холодильником. После завершения реакции растворитель удаляли при пониженном давлении. Остаток фильтровали через силикагель, используя ацетон в качестве растворителя, получая целевое соединение. Масса (EI) 299 (М 1).(3) Синтез этилового эфира 1-(3-циано-1 Н-индол-5-ил)пиразол-4-карбоновой кислоты полученный в способе (2), растворяли в безводном тетрагидрофуране (94 мл), добавляли ди(имидазол-1 ил)метантион (90%, 2,79 г, 14,1 ммоль) и смесь перемешивали в течение 2 ч при температуре окружающей среды. После завершения реакции реакционный раствор концентрировали при пониженном давлении и полученное твердое вещество очищали хроматографией на колонках, получая целевое соединение(1,32 г, 4,71 ммоль, 86%-й выход). 1 Н-ЯМР (ДМСО-d6)12,40 (1 Н, ушир), 9,20 (1 Н, с), 8,37 (1 Н, с), 8,21 (1 Н, д), 8,14 (1 Н, с), 7,89 (1 Н,дд), 7,68 (1 Н, д), 4,29 (2 Н, кв), 1,32 (3 Н, т). Масса (EI) 281 (М 1). Получение 3. Синтез этилового эфира 1-(3-циано-1-изопропилиндол-5-ил)пиразол-4-карбоновой кислоты Этиловый эфир 1-(3-циано-1 Н-индол-5-ил)пиразол-4-карбоновой кислоты (13,84 г, 49,38 ммоль),полученный в получении 2, растворяли в ацетонитриле (200 мл). Добавляли карбонат цезия (32,17 г,98,74 ммоль) и 2-йодпропан (19,7 мл, 198 ммоль), затем нагревали в течение 5 ч при перемешивании с обратным холодильником. После завершения реакции реакционный раствор концентрировали при пониженном давлении и полученное твердое вещество очищали хроматографией на колонках, получая целевое соединение (13,87 г, 43,03 ммоль, 87%-й выход). 1 Н-ЯМР (CDCl3)8,48 (1 Н, с), 8,16 (1 Н, с), 8,06 (1 Н, д), 7,82 (1 Н, с), 7,78 (1 Н, дд), 7,57 (1 Н, д), 4,804,73 (1 Н, м), 4,38 (2 Н, кв), 1,64 (6 Н, д), 1,42 (3 Н, т). Масса (EI) 323 (М 1). Получение 4. Синтез этилового эфира 1-[3-циано-1-циклопропилиндол-5-ил]пиразол-4-карбоновой кислоты Этиловый эфир 1-(3-циано-1 Н-индол-5-ил)пиразол-4-карбоновой кислоты (200 мг, 0,71 ммоль), полученный в получении 2, циклопропил бороновую кислоту (129 мг, 1,42 ммоль), ацетат меди(II) (136 мг,0,71 ммоль), гексаметилдисилазид калия (150 мг, 0,71 ммоль) и N,N-диметил-4-аминопиридин (275 г,2,13 ммоль) растворяли в толуоле (50 мл) и перемешивали в течение 15 ч при 95 С. Добавляли этилацетат (50 мл) и смесь промывали раствором бикарбоната натрия. Органический слой отделяли, высушивали над сульфатом магния, фильтровали и очищали хроматографией на колонках, получая целевое соединение (120 мг, 52%-й выход). Масса (EI) 321 (М 1). Получение 5. Синтез этилового эфира 1-(3-циано-1-втор-бутилиндол-5-ил)пиразол-4-карбоновой кислоты Этиловый эфир 1-(3-циано-1 Н-индол-5-ил)пиразол-4-карбоновой кислоты (100 мг, 0,36 ммоль), полученный в получении 2, растворяли в N,N-диметилформамиде, и гидрид натрия (21 мг, 0,54 ммоль) добавляли при 0 С. После перемешивания в течение 10 мин добавляли 2-йодбутан (78 мг, 0,43 ммоль), затем перемешивали в течение 2 ч. Добавляли этилацетат (50 мл) и смесь промывали водным раствором хлорида аммония. Органический слой отделяли, высушивали над безводным сульфатом магния и фильтровали. Растворитель удаляли, получая целевое соединение (102 мг, 85%-й выход). Масса (EI): 337 (М+1). Получение 6. Синтез этилового эфира 1-[3-циано-1-циклобутилиндол-5-ил]пиразол-4-карбоновой кислоты лученный в получении 2, гидрид натрия (17 мг, 0,72 ммоль) и бромциклобутан (0,34 мл, 3,6 ммоль) вводили в реакцию согласно той же самой процедуре, как в получении 5, получая целевое соединение (23 мг, 19%-й выход). Масса (EI) 335 (M1). Получение 7. Синтез этилового эфира 1-(3-циано-1-циклопентилиндол-5-ил)пиразол-4-карбоновой кислоты Этиловый эфир 1-(3-циано-1 Н-индол-5-ил)пиразол-4-карбоновой кислоты (100 мг, 0,36 ммоль), полученный в получении 2, гидрид натрия (21 мг, 0,54 ммоль) и бромциклопентан (60 мг, 0,43 ммоль) вводили в реакцию согласно той же самой процедуре, как в получении 5, получая целевое соединение (91 мг, 74%-й выход). Масса (EI): 349 (М+1). Получение 8. Синтез этилового эфира 1-3-циано-1-[1-(метакрилокси)пропан-2-ил]индол-5 илпиразол-4-карбоновой кислоты Этиловый эфир 1-(3-циано-1 Н-индол-5-ил)пиразол-4-карбоновой кислоты (300 мг, 0,17 ммоль), полученный в получении 2, 2-метилсульфонилоксипропил 2-метилпроп-2-еноат (600 мг, 2,6 ммоль) и гидрид натрия (70 мг, 0,25 ммоль) вводили в реакцию согласно той же самой процедуре, как в получении 5,получая целевое соединение (200 мг, 0,49 ммоль, 46%-й выход). 1H-ЯМР (CDCl3) (1:1 микстура)8,45 (2 Н, с), 8,13 (2 Н, с), 8,04 (2 Н, м), 7,80 (1 Н, с), 7,76 (2 Н, м),7,66 (1 Н, с), 7,57 (2 Н, м), 6,17 (1 Н, с), 6,13 (1 Н, м), 6,04 (1 Н, с), 5,93 (1 Н, с), 5,63-5,53 (4 Н, м), 5,34 (1 Н, м),5,02 (1 Н, м), 4,37 (4 Н, кв), 1,88 (3 Н, с), 1,82 (3 Н, с), 1,71 (3 Н), 1,46 (3 Н, д), 1,39 (6 Н, т). Масса (EI) 407 (М 1). Получение 9. Синтез этилового эфира 1-[3-циано-1-(1-гидроксипропан-2-ил)индол-5-ил]пиразол-4 карбоновой кислоты(8 мл) и 1 н. водный раствор (8 мл) гидроксида натрия, затем перемешивали в течение 30 мин при температуре окружающей среды. После завершения реакции реакционный раствор концентрировали при пониженном давлении и добавляли 1 н. водный раствор (10 мл) соляной кислоты. Полученное твердое вещество высушивали, получая 1-[3-циано-1-(гидроксипропан-2-ил)-1 Н-индол-5-ил]пиразол-4-карбоновую кислоту (87 мг, 0,28 ммоль, 57%-й выход). Это соединение растворяли в N,N-диметилформамиде (5 мл),добавляли карбонат калия (46 мг, 0,33 ммоль) и бромэтан (0,06 мл, 0,84 ммоль) и смесь перемешивали в течение 12 ч при температуре окружающей среды. После завершения реакции реакционный раствор концентрировали при пониженном давлении и очищали хроматографией на колонках, получая целевое соединение (75 мг, 0,22 ммоль, 79%-й выход). 1 Получение 10. Синтез этилового эфира 1-[3-циано-1-(1-фторпропан-2-ил)индол-5-ил]пиразол-4 карбоновой кислоты К этиловому эфиру 1-[3-циано-1-(1-гидроксипропан-2-ил)индол-5-ил]пиразол-4-карбоновой кислоты (75 мг, 0,22 ммоль), полученному в получении 9, добавляли дихлорметан (4 мл) и трифторид(диметиламино)серы (0,04 мл, 0,3 ммоль) в указанном порядке. Смесь перемешивали в течение 1 ч при температуре окружающей среды, добавляли этилацетат (20 мл) и смесь промывали водным раствором хлорида натрия. Органический слой отделяли, высушивали над безводным сульфатом магния, фильтровали и очищали хроматографией на колонках, получая целевое соединение (56 мг, 0,16 ммоль, 74%-й выход). 1 Н-ЯМР (CDCl3) (1:1 микстура)8,45 (2 Н, с), 8,12 (2 Н, с), 8,04 (1 Н, с), 8,03 (1 Н, с), 7,85 (1 Н, с), 7,75(2 Н, м), 7,73 (1 Н, с), 7,51 (2 Н, м), 5,01-4,62 (4 Н, м), 4,35 (4 Н, кв), 4,46-4,26 (2 Н, м), 1,70 (3 Н, дд), 1,45 (3 Н,д), 1,39 (6 Н, т). Масса (EI) 341 (М 1). Получение 11. Синтез этилового эфира 1-(3-циано-1-тетрагидрофуран-3-ил-индол-5-ил)пиразол-4 карбоновой кислоты Этиловый эфир 1-(3-циано-1 Н-индол-5-ил)пиразол-4-карбоновой кислоты (150 мг, 0,53 ммоль), полученный в получении 2, и тетрагидрофуран-3-ил-метансульфонат (270 мг, 1,59 ммоль) вводили в реакцию согласно той же самой процедуре, как в получении 5, получая целевое соединение (150 мг, 0,43 ммоль, 80%-й выход). 1(1 Н, м), 4,36 (2 Н, кв), 4,21 (2 Н, м), 4,24-4,18 (1 Н, м), 4,10-3,95 (1 Н, м), 2,63 (1 Н, м), 2,20 (1 Н, м), 1,39 (1 Н,т). Масса (EI) 351 (М 1). Получение 12. Синтез этилового эфира 1-(1 Н-индол-5-ил)-3-метилпиразол-4-карбоновой кислоты Этиловый эфир 3-метил-1 Н-пиразол-4-карбоновой кислоты (1,43 г, 9,27 ммоль) и 1 Н-индол-5 илбороновую кислоту (1,50 г, 9,29 ммоль) растворяли в N,N-диметилформамиде (93 мл). Добавляли ацетат меди(II) (1,27 г, 6,98 ммоль) и пиридин (1,50 мл, 18,5 ммоль) и смесь перемешивали в течение 3 дней при температуре окружающей среды. Растворитель отгоняли при пониженном давлении и остаток очищали хроматографией на колонках, получая целевое соединение (1,2433 г, 4,62 ммоль, 50%-й выход). 1H-ЯМР (CDCl3)8,35 (1 Н, с), 8,30 (1 Н, ушир), 7,91 (1 Н, д), 7,53 (1 Н, дд), 7,47 (1 Н, д), 7,32 (1 Н, т),6,63 (1 Н, с), 4,35 (2 Н, кв), 2,61 (3 Н, с), 1,41 (3 Н, т). Масса (EI) 270 (М 1). Получение 13. Синтез этилового эфира 1-(3-циано-1 Н-индол-5-ил)-3-метилпиразол-4-карбоновой кислоты. Целевое соединение получали следующими способами (1)-(3).(1) Синтез этилового эфира 1-(3-формил-1 Н-индол-5-ил)-3-метилпиразол-4-карбоновой кислоты Этиловый эфир 1-(1 Н-индол-5-ил)-3-метилпиразол-4-карбоновой кислоты (540 мг, 2,01 ммоль), полученный в получении 12, оксалилхлорид (0,20 мл, 2,36 ммоль), N,N-диметилформамид (0,19 мл, 2,45 ммоль) и дихлорметан вводили в реакцию согласно той же самой процедуре, как в способе (1) из получения 2, получая целевое соединение. Масса (EI) 298 (М 1).(2) Синтез этилового эфира 1-[3-[(E,Z)-гидроксииминометил]-1 Н-индол-5-ил]-3-метилпиразол-4 карбоновой кислоты Этиловый эфир 1-(3-формил-1 Н-индол-5-ил)-3-метилпиразол-4-карбоновой кислоты, полученный в способе (1), гидроксиаммоний хлорид (172 мг, 2,47 ммоль) и пиридин вводили в реакцию согласно той же самой процедуре, как в способе (2) из получения 2, получая целевое соединение. Масса (EI) 313 (М 1).(3) Синтез этилового эфира 1-(3-циано-1 Н-индол-5-ил)-3-метилпиразол-4-карбоновой кислоты Этиловый эфир 1-[3-[(Е,Z)-гидроксииминометил]-1 Н-индол-5-ил]-3-метилпиразол-4-карбоновой кислоты, полученный в способе (2), ди(имидазол-1-ил)метантион (90%, 1,05 г, 5,31 ммоль) и безводный тетрагидрофуран вводили в реакцию согласно той же самой процедуре, как в способе (3) из получения 2,получая целевое соединение (420,1 мг, 1,43 ммоль, 71%-й выход). 1 Н-ЯМР (CDCl3)12,40 (1 Н, ушир), 9,06 (1 Н, с), 8,35 (1 Н, с), 8,16 (1 Н, д), 7,86 (1 Н, дд), 7,65 (1 Н, д),4,27 (2 Н, кв), 2,47 (3 Н, с), 1,32 (3 Н, т). Масса (EI) 295 (М 1). Получение 14. Синтез этилового эфира 1-[3-циано-1-изопропилиндол-5-ил]-3-метилпиразол-4 карбоновой кислоты Этиловый эфир 1-(3-циано-1 Н-индол-5-ил)-3-метилпиразол-4-карбоновой кислоты (140 мг, 0,48 ммоль), полученный в получении 13, гидрид натрия (17 мг, 0,71 ммоль) и 2-йодпропан (0,10 мл, 0,96 ммоль) вводили в реакцию согласно той же самой процедуре, как в получении 5, получая целевое соединение (150 мг, 93%-й выход). Получение 15. Синтез этилового эфира 1-(1 Н-индол-5-ил)-3-(трифторметил)пиразол-4-карбоновой кислоты 1 Н-индол-5-илбороновую кислоту (1,000 мг, 6,21 ммоль) и этиловый эфир 3-трифторметил-1 Нпиразол-4-карбоновой кислоты (646 мг, 3,10 ммоль) вводили в реакцию согласно той же самой процедуре, как в получении 1, получая целевое соединение (723 мг, 72%-й выход). 1 Н-ЯМР (CDCl3)8,46 (1 Н, с), 7,93 (1 Н, с), 7,53 (1 Н, д), 7,51 (1 Н, д), 7,33 (1 Н, д), 6,64 (1 Н, д), 4,36(2 Н, кв), 1,37 (3 Н, т). Масса (EI) 324 (М 1). Получение 16. Синтез этилового эфира 1-(3-формил-1 Н-индол-5-ил)-3-(трифторметил)пиразол-4 карбоновой кислоты Этиловый эфир 1-(1 Н-индол-5-ил)-3-(трифторметил)пиразол-4-карбоновой кислоты (720 мг, 2,23 ммоль), полученный в получении 15, вводили в реакцию согласно той же самой процедуре, как в способе(1) из получения 2, получая целевое соединение (750 мг, 96%-й выход). Масса (EI) 352 (М 1). Получение 17. Синтез этилового эфира 1-3-[(E,Z)-гидроксииминометил]-1 Н-индол-5-ил-3(трифторметил)пиразол-4-карбоновой кислоты Этиловый эфир 1-(3-формил-1 Н-индол-5-ил)-3-(трифторметил)пиразол-4-карбоновой кислоты (750 мг, 2,13 ммоль), полученный в получении 16, вводили в реакцию согласно той же самой процедуре, как в способе (2) из получения 2, получая целевое соединение (680 мг, 87%-й выход). Масса (EI) 367 (М 1). Получение 18. Синтез этилового эфира 1-(3-циано-1 Н-индол-5-ил)-3-(трифторметил)пиразол-4 карбоновой кислоты Этиловый эфир 1-3-[(Е,Z)-гидроксииминометил]-1 Н-индол-5-ил-3-(трифторметил)пиразол-4 карбоновой кислоты (680 мг, 1,86 ммоль), полученный в получении 17, вводили в реакцию согласно той же самой процедуре, как в способе (3) из получения 2, получая целевое соединение (562 мг, 87%-й выход). Масса (EI) 349 (М 1). Получение 19. Синтез этилового эфира 1-[3-циано-1-изопропилиндол-5-ил]-3(трифторметил)пиразол-4-карбоновой кислоты Этиловый эфир 1-(3-циано-1 Н-индол-5-ил)-3-(трифторметил)пиразол-4-карбоновой кислоты (130 мг, 0,37 ммоль), полученный в получении 18, гидрид натрия (13 мг, 0,56 ммоль) и 2-йодпропан (0,07 мл,0,74 ммоль) вводили в реакцию согласно той же самой процедуре, как в получении 5, получая целевое соединение (130 мг, 90%-й выход). Масса (EI) 391 (М 1). Получение 20. Синтез этилового эфира 1-[3-циано-1-(циклопропилметил)индол-5-ил]-3(трифторметил)пиразол-4-карбоновой кислоты Этиловый эфир 1-(3-циано-1 Н-индол-5-ил)-3-(трифторметил)пиразол-4-карбоновой кислоты (110 мг, 0,32 ммоль), полученный в получении 18, гидрид натрия (11 мг, 0,47 ммоль) и бромметилциклопропан (0,06 мл, 0,64 ммоль) вводили в реакцию согласно той же самой процедуре, как в получении 5, получая целевое соединение (110 мг, 85%-й выход). Масса (EI) 403 (М 1). Получение 21. Синтез этилового эфира 1-(3-нитро-1 Н-индол-5-ил)пиразол-4-карбоновой кислоты Этиловый эфир 1-(1 Н-индол-5-ил)пиразол-4-карбоновой кислоты (293,6 мг, 1,15 ммоль), полученный в получении 1, растворяли в ацетонитриле (2,3 мл). Нитрат серебра (214,9 мг, 1,27 ммоль) добавляли при 0 С, и бензоилхлорид медленно добавляли по каплям под атмосферой азота. После завершения реакции реакционный раствор охлаждали, добавляли этилацетат, затем промывали водным раствором гидрокарбоната натрия. Органический слой высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Полученное твердое вещество очищали хроматографией на колонках,получая целевое соединение (119,1 мг, 0,397 ммоль, 34%-й выход). Масса (EI) 301 (М 1). Получение 22. Синтез этилового эфира 1-(1-изопропил-3-нитроиндол-5-ил)пиразол-4-карбоновой кислоты Этиловый эфир 1-(3-нитро-1 Н-индол-5-ил)пиразол-4-карбоновой кислоты (119,1 мг, 0,397 ммоль),полученный в получении 21, растворяли в N,N-диметилформамиде (4,0 мл). Гидрид натрия (55%, 26,0 мг, 0,60 ммоль) добавляли при 0 С, и смесь перемешивали в течение 10 мин при температуре окружающей среды. Добавляли 2-йодпропан (19,7 мл, 198 ммоль) и перемешивали в течение 15 ч при температуре окружающей среды. Растворитель отгоняли, к остатку добавляли этилацетат и смесь промывали водным раствором хлорида аммония. Органический слой отделяли, высушивали над безводным сульфатом магния, фильтровали и очищали хроматографией на колонках, получая целевое соединение (60,8 мг,0,178 ммоль, 45%-й выход). Масса (EI) 343 (М 1). Получение 23. Синтез метилового эфира 1-(1 Н-индол-5-ил)-1,2,4-триазол-3-карбоновой кислоты Метиловый эфир 1 Н-1,2,4-триазол-3-карбоновой кислоты (1,12 г, 8,79 ммоль), 1 Н-индол-5 илбороновую кислоту (1,42 г, 8,79 ммоль), N,N-диметилформамид (90 мл), ацетат меди(II) (1,20 г, 6,60 ммоль) и пиридин (1,40 мл, 17,3 ммоль) вводили в реакцию согласно той же самой процедуре, как в получении 1, получая целевое соединение (519,7 мг, 2,15 ммоль, 24%-й выход). 1H-ЯМР (CDCl3)8,52 (1 Н, с), 8,33 (1 Н, ушир), 7,88 (1 Н, с), 7,47-7,42 (2 Н, м), 7,28 (1 Н, т), 6,58 (1 Н,т), 3,98 (3 Н, с). Масса (EI) 243 (М 1). Получение 24. Синтез метилового эфира 1-(1-изопропилиндол-5-ил)-1,2,4-триазол-3-карбоновой кислоты Метиловый эфир 1-(1 Н-индол-5-ил)-1,2,4-триазол-3-карбоновой кислоты (139,5 мг, 0,58 ммоль),полученный в получении 23, гидрид натрия (55%, 38 мг, 0,87 ммоль), 2-йодпропан (0,09 мл, 0,90 ммоль) и N,N-диметилформамид (5,8 мл) вводили в реакцию согласно той же самой процедуре, как в получении 5, получая целевое соединение (83,4 мг, 0,29 ммоль, 51%-й выход). Масса (EI) 285 (М 1). Получение 25. Синтез метилового эфира 1-(3-циано-1-изопропилиндол-5-ил)-1,2,4-триазол-3 карбоновой кислоты. Целевое соединение получали следующими способами (1)-(3).(1) Синтез метилового эфира 1-(3-формил-1-изопропилиндол-5-ил)-1,2,4-триазол-3-карбоновой кислоты Метиловый эфир 1-(1-изопропилиндол-5-ил)-1,2,4-триазол-3-карбоновой кислоты (83,4 мг, 0,29 ммоль), полученный в получении 24, оксалилхлорид (0,03 мл, 0,35 ммоль), N,N-диметилформамид (0,03 мл, 0,39 ммоль) и дихлорметан вводили в реакцию согласно той же самой процедуре, как в способе (1) из получения 2, получая целевое соединение. Масса (EI) 313 (М 1).(2) Синтез метилового эфира 1-[3-[(E,Z)-гидроксииминометил]-1-изопропилиндол-5-ил]-1,2,4 триазол-3-карбоновой кислоты Метиловый эфир 1-(3-формил-1-изопропилиндол-5-ил)-1,2,4-триазол-3-карбоновой кислоты, полученный в процессе (1), гидроксиаммоний хлорид (24 мг, 0,35 ммоль) и пиридин вводили в реакцию согласно той же самой процедуре, как в способе (2) из получения 2, получая целевое соединение. Масса (EI) 328 (М 1).(3) Синтез метилового эфира 1-(3-циано-1-изопропилиндол-5-ил)-1,2,4-триазол-3-карбоновой кислоты Метиловый эфир 1-[3-[(Е,Z)-гидроксииминометил]-1-изопропилиндол-5-ил]-1,2,4-триазол-3 карбоновой кислоты, полученный в способе (2), ди(имидазол-1-ил)метантион (90%, 148 мг, 0,75 ммоль) и безводный тетрагидрофуран вводили в реакцию согласно той же самой процедуре, как в способе (3) из получения 2, получая целевое соединение. Масса (EI) 310 (М 1). Получение 26. Синтез этилового эфира 1-(1 Н-индол-5-ил)имидазол-4-карбоновой кислоты Смесь этилцианоацетата (1,0 г, 7,75 ммоль) и трет-бутокси-бис-(диметиламино)метана (2,7 г, 15,5 ммоль) перемешивали в течение 18 ч при температуре окружающей среды. После дистилляции при пониженном давлении добавляли 5-аминоиндол (1,3 г, 7,75 ммоль). Смесь растворяли в н-бутаноле и нагревали с обратным холодильником в течение 15 ч. Реакционный раствор охлаждали, добавляли этилацетат и промывали водным раствором бикарбоната натрия. Органический слой высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Полученное твердое вещество отфильтровывали, промывали этилацетатом и высушивали, получая целевое соединение (0,33 г, 17%-й выход). 1(1 Н, д), 6,67 (1 Н, с), 4,48 (2 Н, кв), 1,46 (3 Н, т). Масса (EI): 256 (М+1). Получение 27. Синтез этилового эфира 1-(1-изопропилиндол-5-ил)имидазол-4-карбоновой кислоты Этиловый эфир 1-(1 Н-индол-5-ил)имидазол-4-карбоновой кислоты (0,33 г, 1,29 ммоль), полученный в получении 26, карбонат цезия (0,63 г, 1,94 ммоль) и 2-йодпропан (0,26 г, 1,55 ммоль) растворяли в ацетонитриле (30 мл) и нагревали с обратным холодильником в течение 5 ч. Добавляли этилацетат (50 мл) и смесь промывали водным раствором бикарбоната натрия. Органический слой отделяли, высушивали над безводным сульфатом магния, фильтровали и очищали хроматографией на колонках, получая целевое соединение (90 мг, 24%-й выход). 1(1 Н, с), 4,78 (1 Н, м), 4,48 (2 Н, кв), 1,62 (6 Н, д), 1,46 (3 Н, т). Масса (EI): 298 (М+1). Получение 28. Синтез этилового эфира 1-(3-формил-1-изопропилиндол-5-ил)имидазол-4 карбоновой кислоты К безводному дихлорметану (30 мл) добавляли оксалилхлорид (0,03 мл, 0,36 ммоль). N,Nдиметилформамид (0,03 мл, 0,36 ммоль) добавляли при 0 С, затем перемешивали в течение 30 мин при 0 С. К этому раствору добавляли этиловый эфир 1-(1-изопропилиндол-5-ил)имидазол-4-карбоновой кислоты (0,09 г, 0,3 ммоль), полученный в получении 27, и смесь перемешивали в течение 1 ч при температуре окружающей среды. Растворитель удаляли, к остатку добавляли тетрагидрофуран (30 мл) и 20% водный раствор ацетата аммония (30 мл) и смесь нагревали в течение 30 мин при перемешивании при нагревании с обратным холодильником. Реакционный раствор охлаждали, добавляли этилацетат и промывали водным раствором бикарбоната натрия. Органический слой высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Полученное твердое вещество отфильтровывали, промывали этилацетатом и высушивали, получая целевое соединение (0,09 г, выход 92%). 1 Н-ЯМР (CDCl3)10,08 (1 Н, с), 8,45 (1 Н, с), 8,06 (1 Н, с), 8,00 (1 Н, с), 7,96 (1 Н, д), 7,59 (1 Н, д), 7,42(1 Н, д), 4,80 (1 Н, м), 4,48 (2 Н, кв), 1,66 (6 Н, д), 1,46 (3 Н, т). Масса (EI): 326 (М+1). Получение 29. Синтез этилового эфира 1-[3-[(E,Z)-гидроксииминометил]-1-изопропилиндол-5 ил]имидазол-4-карбоновой кислоты Этиловый эфир 1-(3-формил-1-изопропилиндол-5-ил)имидазол-4-карбоновой кислоты (0,09 г, 0,27 ммоль), полученный в получении 28, растворяли в пиридине (30 мл). После добавления гидроксиаммоний хлорида (23 мг, 0,33 ммоль), смесь нагревали в течение 5 ч при перемешивании с обратным холодильником. После завершения реакции растворитель концентрировали при пониженном давлении, к остатку добавляли этилацетат и смесь промывали 1 н. водный раствором соляной кислоты. Органический слой высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Полученное твердое вещество промывали этилацетатом и высушивали, получая целевое соединение (0,08 г,98%-й выход). Масса (EI): 341 (М+1). Получение 30. Синтез этилового эфира 1-(3-циано-1-изопропилиндол-5-ил)имидазол-4-карбоновой кислоты Этиловый эфир 1-[3-[(Е,Z)-гидроксииминометил]-1-изопропилиндол-5-ил]имидазол-4-карбоновой кислоты (0,68 г, 0,27 ммоль), полученный в получении 29, растворяли в безводном тетрагидрофуране (30 мл). Добавляли ди(имидазол-1-ил)метантион (0,12 г, 0,67 ммоль) и перемешивали в течение 13 ч при температуре окружающей среды. После завершения реакции реакционный раствор концентрировали при пониженном давлении, добавляли этилацетат и промывали 0,5 н. водным раствором соляной кислоты. Органический слой высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Полученное твердое вещество промывали этилацетатом и высушивали, получая целевое соединение (86 мг, 78%-й выход). 1 Н-ЯМР (CDCl3)8,04 (2 Н, д), 7,88 (1 Н, с), 7,82 (1 Н, с), 7,63 (1 Н, д), 7,42 (1 Н, д), 4,80 (1 Н, м), 4,43(2 Н, кв), 1,63 (6 Н, д), 1,28 (3 Н, т). Масса (EI): 323 (М+1). Получение 31. Синтез метилового эфира 5-(1 Н-индол-5-ил)тиофен-2-карбоновой кислоты Метиловый эфир 5-бромтиофен-2-карбоновой кислоты (0,5 г, 2,26 ммоль), 1 Н-индол-5 илбороновую кислоту (0,36 г, 2,26 ммоль), тетракис-(трифенилфосфин)палладий(0) (0,13 г, 0,11 ммоль) и карбонат натрия (0,48 г, 4,52 ммоль) растворяли в диоксане (30 мл) и нагревали с обратным холодильником в течение 5 ч. Добавляли этилацетат (30 мл) и смесь промывали раствором бикарбоната натрия. Органический слой отделяли, высушивали над безводным сульфатом магния, фильтровали и очищали хроматографией на колонках, получая целевое соединение (0,36 г, 62%-й выход). 1 Н-ЯМР (CDCl3)8,29 (1 Н, с), 7,98 (1 Н, с), 7,81 (1 Н, с), 7,54 (1 Н, д), 7,47 (1 Н, д), 7,31 (2 Н, с), 6,65 Получение 32. Синтез метилового эфира 5-(1-изопропилиндол-5-ил)тиофен-2-карбоновой кислоты Метиловый эфир 5-(1 Н-индол-5-ил)тиофен-2-карбоновой кислоты (0,26 г, 1,01 ммоль), полученный в получении 31, карбонат цезия (0,32 г, 2,02 ммоль) и 2-йодпропан (0,25 г, 0,59 ммоль) растворяли в ацетонитриле (30 мл) и нагревали с обратным холодильником в течение 5 ч. Добавляли этилацетат (50 мл) и смесь промывали раствором бикарбоната натрия. Органический слой отделяли, высушивали над безводным сульфатом магния, фильтровали и очищали хроматографией на колонках, получая целевое соединение (0,3 г, 99%-й выход). 1 Н-ЯМР (CDCl3)7,96 (1 Н, с), 7,81 (1 Н, с), 7,54 (1 Н, д), 7,42 (1 Н, д), 7,30 (2 Н, с), 6,60 (1 Н, с), 3,94(3 Н, с). Масса (EI): 300 (М+1). Получение 33. Синтез метилового эфира 5-(3-формил-1-изопропилиндол-5-ил)тиофен-2-карбоновой кислоты К безводному дихлорметану (30 мл) добавляли оксалилхлорид (0,1 мл, 1,2 ммоль). N,Nдиметилформамид (0,1 мл, 1,2 ммоль) добавляли при 0 С и перемешивали в течение 30 мин при 0 С. К этому реакционному раствору добавляли метиловый эфир 5-(1-изопропилиндол-5-ил)тиофен-2 карбоновой кислоты (0,3 г, 1,0 ммоль), полученный в получении 32, затем перемешивали в течение 1 ч при температуре окружающей среды. Растворитель удаляли, к остатку добавляли тетрагидрофуран (30 мл) и 20% водный раствор ацетата аммония (30 мл) и смесь нагревали в течение 30 мин при перемешивании при нагревании с обратным холодильником. Реакционный раствор охлаждали, добавляли этилацетат и смесь промывали водным раствором бикарбоната натрия. Органический слой высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Полученное твердое вещество фильтровали, промывали этилацетатом и высушивали, получая целевое соединение (0,32 г, выход 99%). 1 Н-ЯМР (CDCl3)10,08 (1 Н, с), 8,67 (1 Н, с), 7,92 (1 Н, с), 7,84 (1 Н, д), 7,67 (1 Н, д), 7,50 (1 Н, д), 7,42(1 Н, д), 4,77 (1 Н, м), 3,96 (3 Н, с), 1,68 (6 Н, д). Масса (EI): 328 (М+1). Получение 34. Синтез метилового эфира 5-[3-[(E,Z)-гидроксииминометил]-1-изопропилиндол-5 ил]тиофен-2-карбоновой кислоты Метиловый эфир 5-(3-формил-1-изопропилиндол-5-ил)тиофен-2-карбоновой кислоты (0,32 г, 0,97 ммоль), полученный в получении 33, растворяли в пиридине (30 мл), добавляли гидроксиаммоний хлорид (81 мг, 1,17 ммоль) и смесь нагревали в течение 5 ч при перемешивании с обратным холодильником. После завершения реакции растворитель концентрировали при пониженном давлении, добавляли этилацетат и смесь промывали 1 н. водным раствором соляной кислоты. Органический слой высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Полученное твердое вещество промывали этилацетатом и высушивали, получая целевое соединение (0,29 г, 89%-й выход). Масса (EI): 343 (М+1). Получение 35. Синтез метилового эфира 5-(3-циано-1-изопропилиндол-5-ил)тиофен-2-карбоновой кислоты кислоты (0,29 г, 0,85 ммоль), полученный в получении 34, растворяли в безводном тетрагидрофуране (30 мл). Добавляли 2-хлор-1-метилпиридиний йодид (0,25 г, 1,02 ммоль) и перемешивали в течение 10 мин при температуре окружающей среды. К этому реакционному раствору медленно добавляли по каплям в течение 15 мин триэтиламин (0,47 мл, 3,4 ммоль), затем перемешивали в течение 20 ч при температуре окружающей среды. После завершения реакции реакционный раствор концентрировали при пониженном давлении и добавляли этилацетат. Смесь промывали 0,5 н. водным раствором соляной кислоты. Органический слой высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Полученное твердое вещество промывали этилацетатом и высушивали, получая целевое соединение(3 Н, с), 1,61 (6 Н, д). Масса (EI): 325 (М+1). Получение 36. Синтез метилового эфира 2-(1 Н-индол-5-ил)изоникотиновой кислоты Метиловый эфир 2-хлоризоникотиновой кислоты (1,22 г, 7,11 ммоль), 1 Н-индол-5-бороновую кислоту (1,15 г, 7,13 ммоль), 2 М водный раствор карбоната натрия (10 мл, 20 ммоль) и тетракис(трифенилфосфин)палладий (0,41 г, 0,35 ммоль) растворяли в толуоле (140 мл) и перемешивали в течение 12 ч с обратным холодильником. После завершения реакции добавляли этилацетат (200 мл) и промывали водным раствором хлорида натрия. Органический слой отделяли, высушивали над безводным сульфатом магния, концентрировали при пониженном давлении и очищали хроматографией на колонках,получая целевое соединение (440 мг, 1,74 ммоль, 25%-й выход). 1H-ЯМР (CDCl3)8,82 (1 Н, дд), 8,36 (2 Н, с), 8,24 (1 Н, ушир), 7,95 (1 Н, дд), 7,71 (1 Н, дд), 7,5 (1 Н, д),7,27 (1 Н, м), 6,66 (1 Н, м), 4,00 (3 Н, с). Масса (EI) 253 (M1). Получение 37. Синтез метилового эфира 2-(3-циано-1 Н-индол-5-ил)изоникотиновой кислоты К безводному дихлорметану (35 мл) добавляли оксалилхлорид (0,23 мл, 2,71 ммоль). N,Nдиметилформамид (0,27 мл, 3,48 ммоль) добавляли при 0 С и смесь перемешивали в течение 30 мин при 0 С. К этому реакционному раствору добавляли метиловый эфир 2-(1 Н-индол-5-ил)изоникотиновой кислоты (0,44 г, 1,74 ммоль), полученный в получении 36, затем перемешивали в течение 1 ч при температуре окружающей среды. Растворитель удаляли, добавляли тетрагидрофуран (40 мл) и 20% водный раствор ацетата аммония (30 мл) и смесь нагревали в течение 30 мин при перемешивании при нагревании с обратным холодильником. Реакционный раствор охлаждали, добавляли этилацетат и промывали водным раствором бикарбоната натрия. Органический слой отделяли, высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Полученное твердое вещество отфильтровывали,промывали этилацетатом и высушивали, получая метиловый эфир 2-(3-формил-1 Н-индол-5 ил)изоникотиновой кислоты. Метиловый эфир 2-(3-формил-1 Н-индол-5-ил)изоникотиновой кислоты, полученный выше, растворяли в пиридине (16 мл), добавляли гидроксиаммоний хлорид (134 мг, 1,93 ммоль) и смесь нагревали в течение 2 ч при перемешивании с обратным холодильником. После завершения реакции растворитель концентрировали при пониженном давлении, к остатку добавляли этилацетат, затем промывали водным раствором хлорида натрия. Органический слой высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Полученное твердое вещество промывали этилацетатом и высушивали, получая метиловый эфир 2-3-[(Е,Z)-гидроксииминометил]-1 Н-индол-5-илизоникотиновой кислоты. Метиловый эфир 2-3-[(Е,Z)-гидроксииминометил]-1 Н-индол-5-илизоникотиновой кислоты, полученный выше, ди(имидазол-1-ил)метантион (0,8 г, 4,48 ммоль) растворяли в тетрагидрофуране (30 мл) и перемешивали в течение 2 ч при температуре окружающей среды. После завершения реакции к реакционному раствору добавляли этилацетат, затем промывали водным раствором хлорида натрия. Органический слой отделяли, высушивали над безводным сульфатом магния, фильтровали и очищали хроматографией на колонках, получая целевое соединение (0,36 г, 1,30 ммоль, 76%-й выход). 1 Н-ЯМР (CDCl3)8,98 (1 Н, ушир), 8,90 (1 Н, д), 8,50 (1 Н, с), 8,42 (1 Н, с), 8,17 (1 Н, дд), 7,83 (2 Н, м),7,62 (1 Н, д), 4,07 (3 Н, с). Масса (EI) 278 (М 1). Получение 38. Синтез изопропилового эфира 2-(3-циано-1-изопропилиндол-5-ил)изоникотиновой кислоты Метиловый эфир 2-(3-циано-1 Н-индол-5-ил)изоникотиновой кислоты (13 мг, 0,047 ммоль), полученный в получении 37, растворяли в N,N-диметилформамиде (0,5 мл). Гидрид натрия (3 мг, 0,068 ммоль) добавляли при 0 С и перемешивали в течение 10 мин при температуре окружающей среды. Добавляли 2-йодпропан (0,02 мл, 0,23 ммоль) и перемешивали в течение 2 ч при температуре окружающей среды. После завершения реакции раствор концентрировали при пониженном давлении, добавляли этилацетат (50 мл) и промывали водным раствором хлорида аммония. Органический слой отделяли, высушивали над безводным сульфатом магния, фильтровали и очищали хроматографией на колонках, получая целевое соединение (13 мг, 0,037 ммоль, 80%-й выход). 1H-ЯМР (CDCl3)8,84 (1 Н, д), 8,43 (1 Н, д), 8,34 (1 Н, м), 8,11 (1 Н, дд), 7,79 (1 Н, дд), 7,77 (1 Н, с),7,56 (1 Н, д), 5,34 (1 Н, м), 4,75 (1 Н, м), 1,58 (6 Н, д), 1,44 (6 Н, д). Масса (EI) 348 (М 1). Получение 39. Синтез метилового эфира 2-3-циано-1-[1-(метакрилокси)пропан-2-ил]индол-5 илизоникотиновой кислоты Метиловый эфир 2-(3-циано-1 Н-индол-5-ил)изоникотиновой кислоты (250 мг, 0,90 ммоль), полученный в получении 37, 2-метилсульфонилоксипропил 2-метилпроп-2-еноат (500 мг, 2,25 ммоль) и гидрид натрия (78 мг, 1,8 ммоль) вводили в реакцию согласно той же самой процедуре, как в получении 5,получая целевое соединение (140 мг, 0,34 ммоль, 40%-й выход). 1 Н-ЯМР (CDCl3)(1:1 микстура)8,86 (2 Н, м), 8,44 (2 Н, м), 8,38 (2 Н, м), 8,14 (2 Н, м), 7,78 (2 Н, м),7,77 (1 Н, с), 7,64 (1 Н, с), 7,58 (1 Н, с), 7,56 (1 Н, с), 6,05 (1 Н, с), 5,93 (1 Н, с), 5,59 (1 Н, м), 5,52 (1 Н, м), 5,35 К метиловому эфиру 2-3-циано-1-[1-(метакрилокси)пропан-2-ил]индол-5-илизоникотиновой кислоты (140 мг, 0,34 ммоль), полученному в получении 39, добавляли тетрагидрофуран (5,0 мл), воду (5,0 мл) и метанол (5,0 мл) и растворяли. Добавляли гидроксид натрия (280 мг, 6,8 ммоль) и перемешивали в течение 1 ч при температуре окружающей среды. Добавляли 1 н. водный раствор соляной кислоты, получая твердое вещество, которое затем отфильтровывали, получая целевое соединение (96 мг, 0,29 ммоль,86%-й выход). Масса (EI) 322 (М 1). Получение 41. Синтез этилового эфира 2-[3-циано-1-(1-фторпропан-2-ил)индол-5 ил]изоникотиновой кислоты 2-[3-Циано-1-(гидроксипропан-2-ил-индол-5-ил)изоникотиновую кислоту, (96 мг, 0,29 ммоль) полученную в получении 40, растворяли в N,N-диметилформамиде (6 мл) и добавляли карбонат калия (62 мг, 0,43 ммоль) и бромэтан (0,07 мл, 0,86 ммоль). Раствор перемешивали в течение 12 ч при температуре окружающей среды и концентрировали при пониженном давлении. Добавляли насыщенный раствор (5 мл) хлорида аммония и добавляли этилацетат (20 мл). Органический слой отделяли, высушивали над безводным сульфатом магния и фильтровали. Растворитель удаляли и остаток очищали хроматографией на колонках, получая этиловый эфир 2-[3-циано-1-(гидроксипропан-2-ил)индол-5-ил]изоникотиновой кислоты (70 мг, 0,20 ммоль, 67%-й выход). Добавляли дихлорметан (4 мл), добавляли трифторид (диме- 19021025 тиламино)серы (0,04 мл, 0,30 ммоль) и смесь перемешивали в течение 2 ч при температуре окружающей среды. После завершения реакции добавляли этилацетат. Смесь промывали водным раствором хлорида натрия, высушивали над безводным сульфатом магния и фильтровали. Растворитель удаляли и остаток очищали хроматографией на колонках, получая целевое соединение (39 мг, 0,11 ммоль, 55%-й выход). 1H-ЯМР (CDCl3)(1:1 микстура)8,84 (2 Н, м), 8,43 (2 Н, м), 8,36 (2 Н, с), 8,14 (1 Н, м), 8,12 (1 Н, м),7,79 (2 Н, м), 7,71 (1 Н, м), 7,49 (1 Н, м), 5,09-4,28 (6 Н, м), 4,47 (4 Н, кв), 1,70 (3 Н, д), 1,46 (6 Н, т), 1,38 (3 Н,д). Масса (EI) 352 (М 1). Получение 42. Синтез метилового эфира 2-[3-циано-1-(2-метоксиэтил)индол-5-ил]изоникотиновой кислоты Метиловый эфир 2-(3-циано-1 Н-индол-5-ил)изоникотиновой кислоты (65 мг, 0,023 ммоль), полученный в получении 37, вводили в реакцию согласно той же самой процедуре, как в получении 5, получая целевое соединение (44 мг, 0,13 ммоль, 57%-й выход). 1 Н ЯМР (CDCl3)8,85 (1 Н, дд), 8,43 (1 Н, м), 8,37 (1 Н, м), 8,12 (1 Н, дд), 7,78 (1 Н, дд), 7,75 (1 Н, с),7,52 (1 Н, д), 4,35 (2 Н, т), 4,02 (3 Н, с), 3,74 (2 Н, т), 3,35 (3 Н, с). Масса (EI) 336 (М 1). Получение 43. Синтез метилового эфира 2-(1 Н-индол-5-ил)-6-метилизоникотиновой кислоты Метиловый эфир 2-хлор-6-метилизоникотиновой кислоты (1 г, 5,38 ммоль) вводили в реакцию согласно той же самой процедуре, как в получении 36, получая целевое соединение (420 мг, 1,57 ммоль,29%-й выход). 1 Н ЯМР (CDCl3)8,35 (1 Н, м), 8,22 (1 Н, ушир), 7,94 (1 Н, дд), 7,59 (1 Н, м), 7,48 (2 Н, м), 6,65 (1 Н, м),3,98 (3 Н, с), 2,70 (3 Н, с). Масса (EI) 267 (М 1). Получение 44. Синтез метилового эфира 2-(3-формил-1 Н-индол-5-ил)-6-метилизоникотиновой кислоты Метиловый эфир 2-(1 Н-индол-5-ил)-6-метилизоникотиновой кислоты (420 мг, 1,57 ммоль), полученный в получении 43, вводили в реакцию согласно той же самой процедуре, как в способе (1) из получения 2, получая целевое соединение (350 мг, 1,18 ммоль, 75%-й выход). 1 Н-ЯМР (CDCl3)10,12 (1 Н, с), 8,93 (1 Н, с), 8,89 (1 Н, ушир), 8,20 (1 Н, д), 8,13 (1 Н, дд), 7,89 (1 Н, д),7,65 (1 Н, с), 7,53 (1 Н, д), 4,00 (3 Н, с), 2,71 (3 Н, с). Масса (EI) 295 (М 1). Получение 45. Синтез метилового эфира 2-(3-циано-1 Н-индол-5-ил)-6-метилизоникотиновой кислоты Метиловый эфир 2-(3-формил-1 Н-индол-5-ил)-6-метилизоникотиновой кислоты (350 мг, 1,18 ммоль), полученный в получении 44, вводили в реакцию согласно той же самой процедуре, как в способе(2) из получения 2, получая метиловый эфир 2-3-[(Е,Z)-гидроксииминометил]-1 Н-индол-5-ил-6 метилизоникотиновой кислоты. Это соединение вводили в реакцию согласно той же самой процедуре,как в способе (3) из получения 2, получая целевое соединение (220 мг, 0,76 ммоль, 64%-й выход). 1 2-(3-циано-1-изопропилиндол-5-ил)-6 Метиловый эфир 2-(3-цианоиндол-5-ил)-6-метилизоникотиновой кислоты (100 мг, 0,34 ммоль), полученный в получении 45, вводили в реакцию согласно той же самой процедуре, как в получении 5, получая целевое соединение (80 мг, 0,22 ммоль, 64%-й выход). 1(1 Н, м), 4,60 (1 Н, м), 2,82 (3 Н, с), 1,60 (6 Н, д), 1,37 (6 Н, д). Масса (EI) 362 (М 1). Получение 47. Синтез этилового эфира 2-(1 Н-индол-5-ил)изоникотиновой кислоты Этиловый эфир 2-бромизоникотиновой кислоты (2 г, 8,66 ммоль) вводили в реакцию согласно той же самой процедуре, как в получении 1, получая целевое соединение (1,4 г, 5,25 ммоль, 60%-й выход). 1H-ЯМР (CDCl3)8,81 (1 Н, д), 8,35 (3 Н, ушир), 7,94 (1 Н, дд), 7,72 (1 Н, дд), 7,49 (1 Н, д), 7,25 (1 Н,м), 6,65 (1 Н, м), 4,45 (2 Н, кв), 1,44 (3 Н, т). Масса (EI) 267 (М 1). Получение 48. Синтез этилового эфира 2-[1-(фенилсульфонил)индол-5-ил]изоникотиновой кислоты Этиловый эфир 2-(1 Н-индол-5-ил)изоникотиновой кислоты (1,4 г, 5,25 ммоль), полученный в получении 47, растворяли в N,N-диметилформамид (25 мл) и охлаждали до 0 С. Гидрид натрия (460 мг, 10,5 ммоль) и фенилсульфонилхлорид (0,8 мл, 6,3 ммоль) добавляли и перемешивали в течение 12 ч при температуре окружающей среды. После завершения реакции реакционный раствор концентрировали при пониженном давлении, добавляли этилацетат (100 мл) и промывали водным раствором хлорида аммония. Органический слой отделяли, высушивали над безводным сульфатом магния, фильтровали, высушивали при пониженном давлении и очищали хроматографией на колонках, получая целевое соединение (1,2 г,2,95 ммоль, 56%-й выход). 1 Н-ЯМР (CDCl3)8,81 (1 Н, дд), 8,29 (1H, м), 8,22 (1H, м), 8,11 (1H, д), 8,02 (1H, дд), 7,89 (2H, м),7,76 (1 Н, дд), 7,61 (1 Н, д), 7,54 (1 Н, м), 7,44 (2 Н, т), 6,76 (1 Н, д), 4,45 (2 Н, кв), 1,44 (3 Н, т). Масса (EI) 407 (М 1). Получение 49. Синтез этилового эфира 2-[3-нитро-1-(фенилсульфонил)индол-5-ил]изоникотиновой кислоты Этиловый эфир 2-[1-(фенилсульфонил)индол-6-ил]изоникотиновой кислоты (300 мг, 0,73 ммоль),полученный в получении 48, растворяли в уксусном ангидриде (4 мл) и медленно добавляли азотную кислоту (90%, дымящая, 0,1 мл, 2,2 ммоль). Смесь перемешивали в течение 12 ч при температуре окружающей среды и вливали в воду со льдом (100 мл). Добавляли этилацетат (100 мл), чтобы отделить органический слой, который затем высушивали над безводным сульфатом магния. Полученное твердое вещество отфильтровывали, получая целевое соединение (330 мг, 0,72 ммоль, 99%-й выход). 1 Н-ЯМР (CDCl3)9,12 (1 Н, д), 8,76 (1 Н, д), 8,67 (1 Н, с), 8,57 (1 Н, д), 8,26 (1 Н, д), 8,22 (1 Н, дд), 8,11 0,72 ммоль), полученный в получении 49, вводили в реакцию согласно той же самой процедуре, как в получении 40, получая целевое соединение (200 мг, 0,7 ммоль, 97%-й выход). Масса (EI) 284 (M1). Получение 51. Синтез изопропилового эфира 2-(1-изопропил-3-нитроиндол-5-ил)изоникотиновой кислоты 2-(3-Нитро-1 Н-индол-5-ил)изоникотиновую кислоту (200 мг, 0,7 ммоль), полученную в получении 50, растворяли в ацетонитриле (5 мл). Добавляли карбонат цезия (450 мг, 1,4 ммоль) и 2-йодпропан (0,7 мл, 7 ммоль) и перемешивали с обратным холодильником в течение 2 ч при 80 С. После завершения реакции реакционный раствор концентрировали при пониженном давлении и очищали хроматографией на колонках, получая целевое соединение (200 мг, 0,54 ммоль, 80%-й выход). Масса (EI) 368 (М 1). Получение 52. Синтез 2-амино-5-йод-бензонитрил 2-Аминобензонитрил (10 г, 0,085 моль) и йодид аммония (13,5 г, 0,094 моль) растворяли в уксусной кислоте (200 мл). 30%-й водный раствор перекиси водорода (5,3 мл, 0,094 мл) медленно добавляли при температуре окружающей среды и перемешивали в течение 12 ч. После завершения реакции реакционный раствор фильтровали через целит. Фильтрат обрабатывали водным раствором тиосульфата натрия и экстрагировали этилацетатом. Органический слой высушивали над сульфатом натрия и фильтровали. Твердое вещество, полученное с использованием дихлорметана (10 мл) и гексана (200 мл), отфильтровывали и высушивали под газообразным азотом, получая целевое соединение (10 г, выход 48%). 1 Н-ЯМР (CDCl3)7,64 (1 Н, д), 7,56 (1 Н, дд), 6,35 (1 Н, д), 4,44 (2 Н, ушир.с). Масса (EI) 245 (М 1). Получение 53. Синтез этилового эфира 1-(4-амино-3-цианофенил)пиразол-4-карбоновой кислоты 2-Амино-5-йод-бензонитрил (5 г, 20 ммоль), полученный в получении 52, растворяли в толуоле (40 мл). При температуре окружающей среды добавляли этиловый эфир 1 Н-пиразол-4-карбоновой кислоты(2,3 г, 16,7 ммоль), йодид меди (0,323 г, 1,7 ммоль), карбонат калия (4,9 г, 36 ммоль) и N,N-диметилэтан 1,2-диамин (0,37 мл, 3,4 ммоль) и нагревали с обратным холодильником в течение 24 ч. Раствор фильтровали через целит, используя этилацетат, и растворитель отгоняли. Твердое вещество, полученное с использованием дихлорметана и метанола, отфильтровывали и высушивали под газообразным азотом,получая целевое соединение (2,95 г, выход 56%). 1 Н-ЯМР (CDCl3)8,25 (1 Н, с), 8,05 (1 Н, с), 7,72 (1 Н, д), 7,71-7,57 (2 Н, м), 6,84 (1 Н, д), 4,55 (2 Н,ушир.с), 4,35-4,30 (2 Н, кв), 1,37 (3 Н, т). Масса (EI) 257 (М 1). Получение 54. Синтез этилового эфира 1-(4-амино-3-циано-5-йодфенил)пиразол-4-карбоновой кислоты(50 мл) и вводили в реакцию в течение 12 ч при температуре окружающей среды. После реакции раствор фильтровали через целит, используя этанол. После фильтрации добавляли тиосульфат натрия (20 мл) и добавляли этилацетат (100 мл). Органический слой отделяли и высушивали над безводным сульфатом магния. Весь растворитель удаляли. Твердое вещество получали, используя гексан и дихлорметан, фильтровали и высушивали под газообразным азотом, получая целевое соединение (1,5 г, 49%-й выход). 1 Н-ЯМР (CDCl3)8,29 (1 Н, с), 8,26 (1 Н, д), 8,10 (1 Н, с), 7,78 (1 Н, д), 5,05 (2 Н, ушир.с), 4,41-4,55(2 Н, кв), 1,42 (3 Н, т). Масса (EI) 383 (М 1). Получение 55. Синтез этилового эфира 1-(4-амино-3-циано-5-фенилэтинил)пиразол-4-карбоновой кислоты Этиловый эфир 1-(4-амино-3-циано-5-йодфенил)пиразол-4-карбоновой кислоты (0,038 г, 0,1 ммоль), полученный в получении 54, дихлорбис(трифенилфосфин)палладий (0,035 г, 0,05 ммоль), йодид меди (2 мг, 0,01 ммоль), этинилбензол (0,055 мл, 0,5 ммоль) и триэтиламин (0,07 мл, 0,5 ммоль) добавляли к тетрагидрофурану (5 мл) и проводили реакцию в течение 3 ч при температуре окружающей среды. После реакции раствор фильтровали через целит, используя этилацетат. После фильтрации добавляли 1 н. водный раствор (10 мл) соляной кислоты и добавляли этилацетат (10 мл). Органический слой отделяли,высушивали над безводным сульфатом магния, фильтровали и очищали хроматографией на колонках,получая целевое соединение (0,03 г, выход 82%). 1 Н-ЯМР (CDCl3)8,29 (1 Н, с), 8,26 (1 Н, д), 8,10 (1 Н, с), 7,78 (1 Н, д), 5,05 (2 Н, ушир.с), 4,41-4,35(2 Н, кв), 1,42 (3 Н, т). Масса (EI) 357 (М 1). Получение 56. Синтез этилового эфира 1-(7-циано-2-фенил-1 Н-индол-5-ил)пиразол-4-карбоновой кислоты Этиловый эфир 1-(4-амино-3-циано-5-фенилэтинил)пиразол-4-карбоновой кислоты (0,03 г, 0,084 ммоль), полученный в получении 55, растворяли в 1-метил-2-пирролидиноне (NMP) (3 мл). При температуре окружающей среды добавляли трет-бутоксид калия (0,014 г, 0,13 ммоль) и перемешивали в течение 1 ч. После реакции добавляли этилацетат (20 мл) и промывали водой. Органический слой отделяли,высушивали над сульфатом магния, фильтровали и очищали хроматографией на колонках, получая целевое соединение (0,02 г, 67%-й выход). 1H-ЯМР (CDCl3)9,60 (1 Н, д), 8,41 (1 Н, с), 8,11 (1 Н, с), 8,10 (1 Н, с), 7,85 (1 Н, с), 7,71-7,41 (5 Н, м),6,94 (1 Н, д), 4,36-4,32 (2 Н, кв), 1,38 (3 Н, т). Масса (EI) 357 (М 1). Получение 57. Синтез этилового эфира 1-[4-амино-3-циано-5-(3-метил-1-бутинил)фенил]пиразол-4 карбоновой кислоты полученный в получении 54, и 3-метил-1-бутин (0,057 мл, 0,23 ммоль) вводили в реакцию согласно той же самой процедуре, как в получении 55, получая целевое соединение (0,06 г, 69%-й выход). 1(2 Н, кв), 2,87-2,84 (1 Н, м), 1,36 (3 Н, т), 1,31 (6 Н, д). Масса (EI) 323 (M1). Получение 58. Синтез этилового эфира 1-[4-амино-3-циано-5-(3-метокси-1 пропинил)фенил]пиразол-4-карбоновой кислоты Этиловый эфир 1-(4-амино-3-циано-5-йодфенил)пиразол-4-карбоновой кислоты (0,2 г, 0,54 ммоль),полученный в получении 54, и 3-метоксиметилацетилен (0,068 мл, 0,81 ммоль) вводили в реакцию согласно той же самой процедуре, как в получении 55, получая целевое соединение (0,16 г, 91%-й выход). 1H-ЯМР (CDCl3)8,24 (1 Н, с), 8,02 (1 Н, с), 7,78 (1 Н, д), 7,69 (1 Н, д), 4,36 (2 Н, с), 4,32-4,28 (2 Н, кв),3,44 (3 Н, с), 3,37 (2 Н, с), 1,33 (3 Н, т). Масса (EI) 325 (М 1). Получение 59. Синтез этилового эфира 1-(4-амино-3-циано-5 триметилсиланилэтинилфенил)пиразол-4-карбоновой кислоты Этиловый эфир 1-(4-амино-3-циано-5-йодфенил)пиразол-4-карбоновой кислоты (0,1 г, 0,27 ммоль),полученный в получении 54, и этинилтриметилсилан (0,057 мл, 0,41 ммоль) вводили в реакцию согласно той же самой процедуре, как в получении 55, получая целевое соединение (0,16 г, 91%-й выход). 1 Н-ЯМР (CDCl3)8,25 (1 Н, с), 8,05 (1 Н, с), 7,81 (1 Н, д), 7,71 (1 Н, д), 5,09 (2 Н, ушир.с), 4,34-4,30(2 Н, кв), 1,36 (3 Н, т), 0,27 (9 Н, с). Масса (EI) 353 (М 1). Получение 60. Синтез этилового эфира 1-(4-амино-3-циано-5-этинилфенил)пиразол-4-карбоновой кислоты Этиловый эфир 1-(4-амино-3-циано-5-триметилсиланилэтинилфенил)пиразол-4-карбоновой кислоты (0,06 г, 0,18 ммоль), полученный в получении 59, растворяли в метаноле (10 мл). Карбонат калия (2,5 мг, 0,018 ммоль) добавляли при температуре окружающей среды и перемешивали в течение 3 ч. Полученное твердое вещество промывали водой, фильтровали и высушивали под газообразным азотом, получая целевое соединение (40 мг, 81%-й выход). 1 Н-ЯМР (CDCl3)8,25 (1 Н, с), 8,06 (1 Н, с), 7,84 (1 Н, д), 7,75 (1 Н, д), 5,12 (2 Н, ушир.с), 4,34-4,30 Этиловый эфир 1-(3-циано-1-изопропилиндол-5-ил)пиразол-4-карбоновой кислоты (13,87 г, 43,03 ммоль), полученный в получении 3, добавляли к тетрагидрофурану (140 мл), метанолу (140 мл) и 6 н. раствору (70 мл) гидроксида натрия, которые затем вводили в реакцию в течение 1 ч при температуре окружающей среды. После реакции органический растворитель удаляли при пониженном давлении, и оставшийся водный слой промывали этилацетатом. Добавляли концентрированную соляную кислоту,чтобы подкислить водный раствор до рН 1. Осажденное твердое вещество отфильтровывали, промывали дистиллированной водой и высушивали, получая целевое соединение (12,09 г, 41,08 ммоль, 95%-й выход). 1 Н-ЯМР (ДМСО-d6)12,55 (1 Н, ушир), 9,10 (1 Н, с), 8,53 (1 Н, с), 8,16 (1 Н, д), 8,06 (1 Н, с), 7,90 (1 Н,дд), 7,86 (1 Н, д), 4,92-4,86 (1 Н, м), 1,48 (6 Н, д). Масса (-EI) 295 (М 1). Пример 2. Синтез 1-[3-циано-1-(циклопропилметил)индол-5-ил]пиразол-4-карбоновой кислоты Этиловый эфир 1-(3-циано-1 Н-индол-5-ил)пиразол-4-карбоновой кислоты (94,3 мг, 0,36 ммоль), полученный в получении 2, растворяли в N,N-диметилформамиде (3,3 мл). Гидрид натрия (55%, 22 мг, 0,50 ммоль) добавляли при 0 С и перемешивали в течение 10 мин при температуре окружающей среды. Добавляли бромметилциклопропан (0,04 мл, 0,41 ммоль) и перемешивали в течение 15 ч при температуре окружающей среды. К раствору добавляли 6 н. раствор (2 мл) гидроксида натрия, затем осуществляли реакцию в течение 1 ч при температуре окружающей среды. Растворитель отгоняли при пониженном давлении и остаток очищали хроматографией на колонках, получая целевое соединение (23,1 мг, 0,075 ммоль, 22%-й выход). 1 Н-ЯМР (ДМСО-d6)9,05 (1 Н, с), 8,40 (1 Н, с), 8,11 (1 Н, д), 8,01 (1 Н, с), 7,85 (1 Н, дд), 7,82 (1 Н, д),4,10 (2 Н, д), 1,26-1,22 (1 Н, м), 0,50-0,46 (2 Н, м), 0,39-0,35 (2 Н, м). Масса (EI) 307 (М 1). Пример 3. Синтез 1-[3-циано-1-циклопропилиндол-5-ил]пиразол-4-карбоновой кислоты Этиловый эфир 1-(3-циано-1-циклопропилиндол-5-ил)пиразол-4-карбоновой кислоты (120 мг, 0,37 ммоль), полученный в получении 4, вводили в реакцию согласно той же самой процедуре, как в примере 1, получая целевое соединение (95 мг, 88%-й выход). 1 Н-ЯМР (ДМСО-d6)12,56 (1 Н, ушир.), 9,13 (1 Н, с), 8,40 (1 Н, с), 8,18 (1 Н, д), 8,08 (1 Н, с), 7,97 (1 Н,дд), 7,74 (1 Н, д), 3,68-3,63 (1 Н, м), 1,15-1,11 (2 Н, м), 1,10-1,08 (2 Н, м). Масса (EI) 293 (М 1). Пример 4. Синтез 1-(3-циано-1-изобутилиндол-5-ил)пиразол-4-карбоновой кислоты Этиловый эфир 1-(3-циано-1 Н-индол-5-ил)пиразол-4-карбоновой кислоты (92,3 мг, 0,33 ммоль), полученный в получении 2, гидрид натрия (55%, 22,0 мг, 0,50 ммоль) и 1-бром-2-метилпропан (0,04 мл,0,37 ммоль) вводили в реакцию согласно той же самой процедуре, как в примере 2, получая целевое со- 25021025 Этиловый эфир 1-(3-циано-1 Н-индол-5-ил)пиразол-4-карбоновой кислоты (79,5 мг, 0,28 ммоль), полученный в получении 2, гидрид натрия (55%, 20,0 мг, 0,46 ммоль) и 1-бром-2,2-диметилпропан (0,04 мл,0,32 ммоль) вводили в реакцию согласно той же самой процедуре, как в примере 2, получая целевое соединение (25,5 мг, 0,079 ммоль, 28%-й выход). 1 Н-ЯМР (ДМСО-d6)9,09 (1 Н, с), 8,31 (1 Н, с), 8,14 (1 Н, с), 8,05 (1 Н, с), 7,91-7,86 (2 Н, м), 4,11 (2 Н,с), 0,92 (9 Н, с). Масса (EI) 323 (М 1). Пример 6. Синтез 1-[3-циано-1-(2-метоксиэтил)индол-5-ил]пиразол-4-карбоновой кислоты Этиловый эфир 1-(3-циано-1 Н-индол-5-ил)пиразол-4-карбоновой кислоты (96,7 мг, 0,34 ммоль), полученный в получении 2, гидрид натрия (55%, 22,6 мг, 0,52 ммоль) и простой 2-бромэтилметиловый эфир (0,05 мл, 0,53 ммоль) вводили в реакцию согласно той же самой процедуре, как в примере 2, получая целевое соединение (48,0 мг, 0,155 ммоль, 45%-й выход). 1 Н-ЯМР (ДМСО-d6)9,09 (1 Н, с), 8,37 (1 Н, с), 8,18 (1 Н, д), 8,08 (1 Н, с), 7,93 (1 Н, дд), 7,87 (1 Н, д),4,49 (2 Н, т), 3,72 (2 Н, т), 3,24 (3 Н, с). Масса (EI) 311 (М 1). Пример 7. Синтез 1-(3-циано-1-втор-бутилиндол-5-ил)пиразол-4-карбоновой кислоты Этиловый эфир 1-(3-циано-1-втор-бутилиндол-5-ил)пиразол-4-карбоновой кислоты (102 мг, 0,3 ммоль), полученный в получении 5, вводили в реакцию согласно той же самой процедуре, как в примере 1, получая целевое соединение (75 мг, 80%-й выход). 1 Н-ЯМР (CD3OD)8,76 (1 Н, с), 8,25 (1 Н, с), 8,11 (1 Н, с), 8,08 (1 Н, с), 7,80 (2 Н, с), 4,66 (1 Н, м), 2,01 Этиловый эфир 1-(3-циано-1-циклобутилиндол-5-ил)пиразол-4-карбоновой кислоты (23 мг, 0,07 ммоль), полученный в получении 6, вводили в реакцию согласно той же самой процедуре, как в примере 1, получая целевое соединение (10 мг, 48%-й выход). 1 Н-ЯМР (MeOD-d4)8,76 (1 Н, д), 8,21 (1 Н, с), 8,12-8,07 (2 Н, м), 7,81-7,72 (2 Н, м), 4,18 (1 Н, д), 2,672,52 (1 Н, м), 1,42-1,26 (3 Н, м), 0,71-0,67 (1 Н, м), 0,52-0,48 (1 Н, м). Масса (EI) 307 (М 1). Этиловый эфир 1-(3-циано-1-циклопентилиндол-5-ил)пиразол-4-карбоновой кислоты (91 мг, 0,3 ммоль), полученный в получении 7, вводили в реакцию согласно той же самой процедуре, как в примере 1, получая целевое соединение (68 мг, 81%-й выход). 1 Этиловый эфир 1-[3-циано-1-(1-фторпропан-2-ил)индол-5-ил]пиразол-4-карбоновой кислоты (56 мг, 0,16 ммоль), полученный в получении 10, вводили в реакцию согласно той же самой процедуре, как в примере 1, получая целевое соединение (48 мг, 0,15 ммоль, 93%-й выход). 1 Н-ЯМР (ДМСО-d6)(1:1 микстура)9,11 (2 Н, с), 8,58 (1 Н, с), 8,36 (1 Н, с), 8,19 (1 Н, с), 8,18 (1 Н,с), 8,07 (2 Н, с), 7,91 (4 Н, м), 5,20-4,50 (6 Н, м), 1,55 (3 Н, д), 1,35 (3 Н, м). Масса (EI) 313 (М 1). Пример 11. Синтез 1-[3-циано-1-(тетрагидрофуран-3-ил)индол-5-ил]пиразол-4-карбоновой кислоты(150 мг, 0,53 ммоль), полученный в получении 11, вводили в реакцию согласно той же самой процедуре,как в примере 1, получая целевое соединение (100 мг, 0,31 ммоль, 72%-й выход). 1 Н-ЯМР (ДМСО-d6)9,15 (1 Н, с), 8,42 (1 Н, с), 8,20 (1 Н, с), 8,09 (1 Н, с), 7,94 (2 Н, м), 5,40 (1 Н, м),4,11 (1 Н, кв), 3,97 (2 Н, д), 3,85 (1 Н, кв), 2,60 (1 Н, м), 2,09 (1 Н, м). Масса (EI) 323 (М 1). Пример 12. Синтез 1-[3-циано-1-изопропилиндол-5-ил]-3-метилпиразол-4-карбоновой кислоты Этиловый эфир 1-(3-циано-1-изопропилиндол-5-ил)-3-метилпиразол-4-карбоновой кислоты (150 мг,0,45 ммоль), полученный в получении 14, вводили в реакцию согласно той же самой процедуре, как в примере 1, получая целевое соединение (122 мг, 88%-й выход). 1 Н-ЯМР (ДМСО-d6)9,04 (1 Н, с), 8,53 (1 Н, с), 8,13 (1 Н, с), 7,87 (2 Н, дд), 4,92-4,89 (1 Н, м), 2,46 (3 Н,с), 1,50 (6 Н, д). Масса (EI) 309 (М 1). Пример 13. Синтез 1-[3-циано-1-(циклопропилметил)индол-5-ил]-3-метилпиразол-4-карбоновая кислота(0,04 мл, 0,41 ммоль) вводили в реакцию согласно той же самой процедуре, как в примере 2, получая целевое соединение (30,4 мг, 0,095 ммоль, 33%-й выход). 1 Н-ЯМР (ДМСО-d6)9,01 (1 Н, с), 8,47 (1 Н, с), 8,15 (1 Н, д), 7,91 (1 Н, дд), 7,88 (1 Н, д), 4,18 (2 Н, д),2,47 (3 Н, с), 1,36-1,30 (1 Н, м), 0,59-0,55 (2 Н, м), 0,48-0,44 (2 Н, м). Масса (EI) 321 (М 1). Пример 14. Синтез 1-[3-циано-1-(2-метоксиэтил)индол-5-ил]-3-метилпиразол-4-карбоновой кислоты Этиловый эфир 1-(3-циано-1 Н-индол-5-ил)-3-метилпиразол-4-карбоновой кислоты (88,8 мг, 0,30 ммоль), полученный в получении 13, гидрид натрия (55%, 20 мг, 0,46 ммоль) и простой 2 бромэтилметиловый эфир (0,04 мл, 0,43 ммоль) вводили в реакцию согласно той же самой процедуре,как в примере 2, получая целевое соединение (63,9 мг, 0,197 ммоль, 65%-й выход). 1 Н-ЯМР (ДМСО-d6)9,01 (1 Н, с), 8,35 (1 Н, с), 8,14 (1 Н, д), 7,90 (1 Н, дд), 7,84 (1 Н, д), 4,48 (2 Н, т),3,71 (2 Н, т), 3,24 (3 Н, с), 2,47 (3 Н, с). Масса (EI) 325 (М 1). Пример 15. Синтез 1-[3-циано-1-изопропилиндол-5-ил]-3-(трифторметил)пиразол-4-карбоновой кислоты Этиловый эфир 1-(3-циано-1-изопропилиндол-5-ил)-3-(трифторметил)пиразол-4-карбоновой кислоты (130 мг, 0,33 ммоль), полученный в получении 19, вводили в реакцию согласно той же самой процедуре, как в примере 1, получая целевое соединение (100 мг, 84%-й выход). 1 Н-ЯМР (ДМСО-d6)9,34 (1 Н, с), 8,60 (1 Н, с), 8,24 (1 Н, с), 7,94 (2 Н, дд), 4,95-4,92 (1 Н, м), 1,51 (6 Н,д). Масса (EI) 363 (М 1). Пример 16. Синтез 1-[3-циано-1-(циклопропилметил)индол-5-ил]-3-(трифторметил)пиразол-4-карбоновой кислоты Этиловый эфир 1-[3-циано-1-(циклопропилметил)индол-5-ил]-3-(трифторметил)пиразол-4 карбоновой кислоты (130 мг, 0,33 ммоль), полученный в получении 20, вводили в реакцию согласно той же самой процедуре, как в примере 1, получая целевое соединение (91 мг, 90%-й выход). 1 Н-ЯМР (ДМСО-d6)9,34 (1 Н, с), 8,51 (1 Н, с), 8,24 (1 Н, с), 7,92 (2 Н, дд), 4,19 (2 Н, д), 1,32-1,23 (1 Н,м), 0,56 (2 Н, д), 0,45 (2 Н, д). Масса (EI) 375 (М 1). Пример 17. Синтез 1-(1-изопропил-3-нитроиндол-5-ил)пиразол-4-карбоновой кислоты Этиловый эфир 1-(1-изопропил-3-нитроиндол-5-ил)пиразол-4-карбоновой кислоты (60,8 мг, 0,178 ммоль), полученный в получении 22, тетрагидрофуран (2 мл), метанол (2 мл) и 6 н. раствор (1 мл) гидроксида натрия вводили в реакцию согласно той же самой процедуре, как в примере 1, получая целевое соединение (35,8 мг, 0,114 ммоль, 56%-й выход). 1 Н-ЯМР (ДМСО-d6)9,05 (1 Н, с), 8,89 (1 Н, с), 8,55 (1 Н, м), 8,08 (1 Н, с), 7,95 (1 Н, д), 7,95 (1 Н, с),4,99-4,92 (1 Н, м), 1,53 (6 Н, д). Масса (EI) 315 (М 1). Метиловый эфир 1-(3-циано-1-изопропилиндол-5-ил)-1,2,4-триазол-3-карбоновой кислоты, полученный в получении 25, тетрагидрофуран (2 мл), метанол (2 мл) и 6 н. раствор (1 мл) гидроксида натрия вводили в реакцию согласно той же самой процедуре, как в примере 1, получая целевое соединение (40,0 мг, 0,135 ммоль, 46%-й выход). 1 Н-ЯМР (ДМСО-d6)9,44 (1 Н, с), 8,59 (1 Н, с), 8,16 (1 Н, д), 7,95 (1 Н, д,), 7,84 (1 Н, дд), 4,93-4,90 (1 Н,м), 1,49 (6 Н, д). Масса (EI) 296 (М 1). Пример 19. Синтез 1-(3-циано-1-изопропилиндол-5-ил)имидазол-4-карбоновой кислоты Этиловый эфир 1-(3-циано-1-изопропилиндол-5-ил)имидазол-4-карбоновой кислоты (86 мг, 0,26 ммоль), полученный в получении 30, вводили в реакцию согласно той же самой процедуре, как в примере 1, получая целевое соединение (45 мг, 57%-й выход). 1 Н-ЯМР (CD3OD)9,06 (1 Н, с), 8,53 (1 Н, с), 8,35 (1 Н, с), 8,05 (1 Н, д), 7,92 (1 Н, д), 7,67 (1 Н, д), 4,96 Метиловый эфир 5-(3-циано-1-изопропилиндол-5-ил)тиофен-2-карбоновой кислоты (183 мг, 0,56 ммоль), полученный в получении 35, вводили в реакцию согласно той же самой процедуре, как в примере 1, получая целевое соединение (130 мг, 74%-й выход). 1 Н-ЯМР (CD3OD)8,20 (1 Н, с), 7,96 (1 Н, с), 7,78 (1 Н, д), 7,71 (2 Н, с), 7,48 (1 Н, д), 4,91 (1 Н, м), 1,61 Изопропиловый эфир 2-(3-циано-1-изопропилиндол-5-ил)изоникотиновой кислоты (13 мг, 0,037 ммоль), полученный в получении 38, добавляли к тетрагидрофурану (1,0 мл), метанолу (1,0 мл) и 1 н. водному раствору (1 мл) гидроксида натрия, которые затем вводили в реакцию в течение 1 ч при температуре окружающей среды. После реакции добавляли насыщенный водный раствор (3 мл) хлорида аммония и добавляли этилацетат (10 мл). Органический слой отделяли, высушивали над безводным сульфатом магния и фильтровали. Растворитель удаляли и остаток очищали хроматографией на колонках,получая целевое соединение (6 мг, 0,02 ммоль, 54%-й выход). 1 Н-ЯМР (CD3OD)8,78 (1 Н, д), 8,42 (1 Н, с), 8,35 (1 Н, с), 8,23 (1 Н, с), 8,04 (1 Н, д), 7,85 (1 Н, д), 7,79
МПК / Метки
МПК: A61K 31/40, C07D 403/02, C07D 209/04, A61P 3/10
Метки: ингибиторов, качестве, получения, фармацевтическая, способ, эффективные, содержащая, композиция, соединения, ксантиноксидазы
Код ссылки
<a href="https://eas.patents.su/30-21025-soedineniya-effektivnye-v-kachestve-ingibitorov-ksantinoksidazy-sposob-ih-polucheniya-i-soderzhashhaya-ih-farmacevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, эффективные в качестве ингибиторов ксантиноксидазы, способ их получения и содержащая их фармацевтическая композиция</a>
Предыдущий патент: Косметическая пена
Следующий патент: 8-гидроксихинолиновые производные
Случайный патент: Способ подавления шума серий цифровых рентгенограмм