8-гидроксихинолиновые производные
Номер патента: 21026
Опубликовано: 31.03.2015
Авторы: Тамаш Габор, Ожвари Бела, Канижаи Иван, Фехер Лилиана, Сабо Чаба, Пускас Ласло, Мадачи Рамона, Дьюриш Марио
Формула / Реферат
1. Соединения общей формулы I и их фармацевтически приемлемые соли
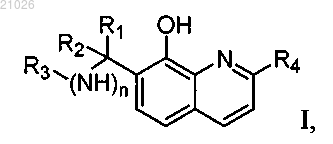
где R1 представляет фенильную группу, необязательно замещенную в орто-, мета- и/или пара-положении гидроксигруппой, трифторметильной группой, нитрогруппой, или пиридиновую группу, необязательно замещенную в орто-, мета- и/или пара-положении атомами галогена, гидроксигруппой, трифторметильной группой, нитрогруппой или низшей алкильной группой;
R2 представляет атом водорода;
R3 представляет пиримидиновую группу, необязательно замещенную в орто-, мета- или пара-положении атомами галогена, трифторметильной группой, нитрогруппой или низшей алкильной группой;
R4 представляет атом водорода или метильную группу;
n равно 1.
2. Соединения общей формулы I по п.1, где указанные соединения выбраны из следующего:
7-((4-метилпиримидин-2-иламино)(4-нитрофенил)метил)хинолин-8-ол;
7-((4-метилпиримидин-2-иламино)(4-(трифторметил)фенил)метил)хинолин-8-ол;
7-[(2-гидроксифенил)-(4-метилпиримидин-2-иламино)метил]хинолин-8-ол;
7-[(4,6-диметилпиримидин-2-иламино)-(4-трифторметилфенил)метил]хинолин-8-ол.
3. Способ получения соединений общей формулы I
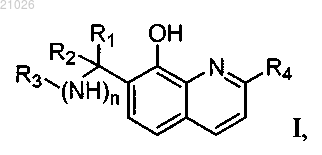
где R1 представляет фенильную группу, необязательно замещенную в орто-, мета- и/или пара-положении гидроксигруппой, трифторметильной группой, нитрогруппой, или пиридиновую группу, необязательно замещенную в орто-, мета- и/или пара-положении атомами галогена, гидроксигруппой, трифторметильной группой, нитрогруппой или низшей алкильной группой;
R2 представляет атом водорода;
R3 представляет пиримидиновую группу, необязательно замещенную в орто-, мета- или пара-положении атомами галогена, трифторметильной группой, нитрогруппой или низшей алкильной группой;
R4 представляет атом водорода или метильную группу;
n равно 1,
отличающийся тем, что 8-гидроксихинолиновое производное общей формулы II
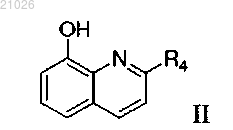
реагирует с оксосоединением общей формулы III
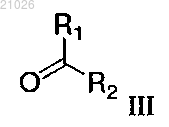
и амином общей формулы IV
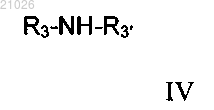
где заместители являются таковыми, как определено выше;
R3' независимо выбирают из значений R3 и R3' может также быть атомом водорода; а также R3 и R3' могут быть соединены друг с другом, образуя циклический вторичный амин,
и полученное соединение общей формулы I необязательно преобразуют в фармацевтически приемлемую кислотно-аддитивную соль или высвобождают из его соли.
4. Фармацевтическая композиция для лечения заболеваний, ассоциированных с неврологическим и/или окислительным стрессом, содержащая соединение по п.1 или 2 и фармацевтически приемлемый твердый или жидкий носитель и/или наполнитель.
5. Способ получения фармацевтической композиции по п.4, отличающийся тем, что соединение по п.1 или 2 смешивают с фармацевтически приемлемым инертным твердым или жидким носителем и/или наполнителем.
6. Способ лечения заболеваний, ассоциированных с неврологическим и/или окислительным стрессом, отличающийся тем, что терапевтически эффективное количество соединения по п.1 или 2 вводят пациенту, нуждающемуся в лечении.
7. Способ по п.6, где заболевания, ассоциированные с неврологическим и/или окислительным стрессом, выбирают из ишемии, реперфузионного повреждения, сердечно-сосудистых расстройств, нейродегенеративных расстройств (в том числе, в частности, болезни Альцгеймера и болезни Хантингтона), травмы, психоневрологических заболеваний (в том числе, в частности, депрессии и тревожных расстройств) и повреждений печени, почек и легких.
Текст
Настоящее изобретение относится к соединениям общей формулы I и их терапевтически приемлемым солям (при этом в формуле R1 представляет атом водорода, низшую алкильную группу, низшую алкенильную группу, низшую циклоалкильную группу, арильную группу, аралкильную группу или гетероциклическую группу, где вышеупомянутые группы необязательно замещены в орто-, мета- и/или пара-положении 1, 2, 3 или 4 электроноакцепторными группами или электронодонорными группами; R2 представляет атом водорода, низшую алкильную группу, арильную группу,аралкильную группу или гетероциклическую группу, где вышеупомянутые группы необязательно замещены одним или несколькими атомами галогена; R3 представляет низшую алкильную группу, арильную группу, аралкильную группу или гетероциклическую группу, где вышеупомянутые группы необязательно замещены в орто-, мета- или пара-положении 1,2, 3 или 4 электроноакцепторными группами или электронодонорными группами; R4 представляет атом водорода,низшую алкильную группу или любую кислотную функциональную группу; n равно 1 или 2). Соединения по настоящему изобретению можно применять в медицине, главным образом, для лечения заболеваний, ассоциированных с неврологическим и/или окислительным стрессом."АВИДИН" КУТАТО, ФЕЙЛЕСТО ЕШ КЕРЕШКЕДЕЛМИ КОРЛАТОЛТ ФЕЛЕЛШШГУ ТАРСАСАГ; УБИЦХЕМ КУТАТО КОРЛАТОЛТ ФЕЛЕЛОШШЕГУ ТАРСАСАГ (HU) Настоящее изобретение относится к новым хинолиновым производным, синтезу этих соединений,фармацевтическим композициям, содержащим эти соединения, получению этих фармацевтических композиций, а также оно относится к применению новых 8-гидроксихинолиновых производных по настоящему изобретению в лечении и профилактике различных заболеваний, в первую очередь, таких заболеваний, которые ассоциированы с неврологическим и/или окислительным стрессом. Настоящее изобретение раскрывает цитопротекторные средства и средства образования хелатов металлов, а также их медицинское применение. Кроме того, целью настоящего изобретения является лечение ишемии, реперфузионного повреждения, сердечно-сосудистых расстройств, нейродегенеративных расстройств (в том числе болезни Альцгеймера и болезни Хантингтона) и травм. Кроме того, целью настоящего изобретения является лечение депрессии и других психоневрологических расстройств, в том числе тревожных расстройств. Другой целью настоящего изобретения является лечение повреждений печени, почек или легких. Соединения по настоящему изобретению можно применять в качестве нейропротекторных и кардиопротекторных средств, а также для лечения психоневрологических расстройств. Публикации и цитируемые патенты, упомянутые в настоящем описании патента, включены в настоящее описание в качестве ссылок. Клеточные повреждения и формы клеточной гибели различной этиологии являются главными характерными чертами многих сердечно-сосудистых, неврологических и воспалительных расстройств. Клеточные повреждения могут происходить в результате клеточной гипоксии или ишемии, образования различных видов оксидантов или свободных радикалов и/или избыточной продукции различных биологических медиаторов (цитокины, хемокины, липидные медиаторы). Эти процессы часто независимы; так что они происходят как части самоусиливающихся ("суицидальных") внутриклеточных циклов и образуют определяющую основу многих заболеваний человека. Хотя клеточную гибель обычно квалифицируют как апоптоз или некроз, эти две формы представляют только два конца спектра форм клеточных повреждений. Внутриклеточные механизмы, участвующие в вышеупомянутых процессах клеточной гибели, являются сложными, но часто активируют семейство эффекторов клеточной гибели, называемых каспазами, а также митохондриальную дисфункцию, митохондриальную деполяризацию, образование активных форм кислорода и высвобождение митохондриальных компонентов в цитозоль (исчерпывающая литература: Szab, 2005; Duprez et al., 2009; Degterev s Yuan, 2008; Wang et al., 2009). Путь клеточной гибели включает активацию поли(АДФ-рибоза)-полимеразы (PARP). Последний фермент экспрессируется в ядре (исчерпывающая литература: Jagtap и Szab, 2005). Соединения, предотвращающие клеточные повреждения и клеточную гибель, как правило, называют "цитопротекторными" соединениями. Цитопротекция может достигаться многими фармакологическими и биохимическими способами. Следующие примеры таковых упоминаются здесь: акцепторы оксидантов и свободных радикалов, ингибиторы определенных "эффекторных путей гибели", стабилизация клеточных мембран и т.д. В ходе процессов ишемии или некоторых связанных заболеваний катионы железа и меди высвобождаются из тканей, что катализирует образование гидроксильных свободных радикалов по пути Габера-Вейса, известным образом вызывающих клеточные повреждения. Инактивация или образование хелатов этих катионов металлов может приводить в результате к цитопротекторному эффекту. При этом проводили эксперименты для ослабления каталитической эффективности катионов железа и меди таким образом, что вводили образующие хелаты железа сидерофоры (например, дефероксамин) (Lewen et al., 2000; Britton et al., 2002). Известно, что глутамат высвобождается вместе с катионами цинка из синаптосом клеток нервной системы, использующих глутамат в качестве химического мессенджера. Как правило, цинк, высвобожденный в нервных синапсах, быстро встраивается вновь в синаптосомы. Вследствие ишемии, длительных кризов и церебрального поражения цинк, высвобожденный из синаптосом, скапливается во внеклеточной жидкости, окружающей нейроны. Когда избыточные количества цинка проникают в тело клетки,цинк может запускать клеточную гибель посредством апоптоза и некроза. Ввиду этого механизма образование хелатов цинка может приводить в результате к нейропротекции и влиять на исходразличных психоневрологических заболеваний (Regland et al., 2001; Koh et al., 1996). Следовательно, хелатообразующие средства для цинка могут также применяться в лечении болезни Альцгеймера связыванием цинка, встречающегося в бляшках, таким образом, ослабляя структуру бляшек (Frederickson et al., 2005; Schafer et al., 2007). Хелатообразующие средства для цинка могут также применяться в лечении болезни Хантингтона (Nguyen et al., 2005). Согласно другому способу цитопротекции индуцируются внутриклеточные пути, опосредующие защитные эффекты. Прототипом данного подхода является так называемое "ишемическое прекондиционирование", когда клетки или органы подвергают ишемии в течение короткого времени для индуцирования сверхрегуляции цитопротекторных генов (например, гены антиоксидантных ферментов, белков теплового шока и др.). В некоторых экспериментальных системах была показана цитопротекция при экспрессии фермента гемоксигеназы (НО-1) (например, Li et al., 2007; Idris et al., 2008). Предыдущие патентные заявки, относящиеся к цитопротекторному подходу, имеют отношение к следующему: ингибиторы различных путей или эффекторов апоптоза (например, US 6949516; митохондриальной функции во время клеточного повреждения (например, US 6552076; US 6511966;US 7550439; US 7528174); прямое ингибирование каталитической активности фермента PARP (например, US 6476048; US 6531464; US 7601719; US 7595406; US 7550603; US 7449464; US 7217709;US 6956053; US 6534651); сверхрегуляция цитопротекторных генов (в том числе гена гемоксигеназы)(например, US 7524819; US 7364757). Соединения, применяемые для ингибирования стресса эндоплазматического ретикулума, были описаны в публикации американской патентной заявки 2008/293699. В последнее время были выполнены скрининговые тесты на основе клеток для систематической идентификации цитопротекторных соединений. В этом тесте моделировали определенную форму клеточного повреждения и подвергали скринингу химическую библиотеку для идентификации соединений,предотвращающих или замедляющих клеточное повреждение (например, Gero et al., 2007). Скрининговые тесты не идентифицируют механизм эффекта, однако его можно идентифицировать с помощью вторичных тестов. Посредством скринингового способа на основе клеток были обнаружены и идентифицированы новые гидроксихинолиновые производные. Эти соединения защищают клетки от повреждений, индуцированных окислительным стрессом, следовательно, они могут потенциально применяться в лечении многих заболеваний. Соединения по настоящему изобретению вызывают различные клеточные эффекты,например образование хелатов железа, ингибирование активации PARP, ингибирование митохондриальной дисфункции, активация гемоксигеназы и хелатообразование с ионами железа. В ходе исполнения настоящего изобретения хелаторы добавляют в форме, не содержащей катионы железа, цинка и меди,следовательно, эти соединения образуют комплексы с вышеупомянутыми катионами при контакте с физиологической системой. Фармацевтические композиции по настоящему изобретению содержат хелаторы в качестве активного средства, которые не находятся в комплексной связи с катионами железа, меди или цинка. Дополнительной целью настоящего изобретения является нейропротекторная и/или кардиопротекторная процедура для пациентов, страдающих от состояний, ассоциированных с клеточной гибелью. Нейропротекция и/или кардиопротекция достигается в соответствии с настоящим изобретением таким образом, что соединение по настоящему изобретению, способное к защите клеток от цитотоксических воздействий, вводят пациенту, нуждающемуся в лечении. Объектом настоящего изобретения, с одной стороны, являются соединения с общей формулой I и их терапевтически приемлемые соли где R1 представляет атом водорода, низшую алкильную группу, низшую алкенильную группу, низшую циклоалкильную группу, арильную группу, аралкильную группу или гетероциклическую группу,где вышеупомянутые группы необязательно замещены 1, 2, 3 или 4 электроноакцепторными группами или электронодонорными группами в орто-, мета- и/или пара-положении;R2 представляет атом водорода, низшую алкильную группу, арильную группу, аралкильную группу,гетероциклическую группу, где вышеупомянутые группы необязательно замещены одним или несколькими атомами галогена;R3 представляет низшую алкильную группу, арильную группу, аралкильную группу или гетероциклическую группу, где вышеупомянутые группы необязательно замещены 1, 2, 3 или 4 электроноакцепторными группами или электронодонорными группами в орто-, мета- или пара-положении;R4 представляет атом водорода, низшую алкильную группу или любую кислотную функциональную группу;n равно 1 или 2. Предпочтительная группа соединений с общей формулой I представляет собой производные, в которыхR1 представляет группу, замещенную электроноакцепторной группой в пара-положении, или группу, замещенную электроноакцепторной группой в мета-положении, или вышеупомянутую группу, замещенную электронодонорной группой в орто-, мета- или пара-положении; или R1 представляет группу,дизамещенную электроноакцепторными группами в мета- и пара-положениях; или R1 представляет группу, дизамещенную электроноакцепторными группами в орто- и пара-положениях; или R1 представляет замещенную или незамещенную гетероциклическую группу;R3 представляет ароматическую группу, замещенную электроноакцепторной группой в параположении; или R3 представляет гетероароматическую или алициклическую группу, незамещенную или замещенную алкильной группой и/или электроноакцепторными группами в орто-, мета- или параположении; В особенно предпочтительных производных соединений настоящего изобретения с общей формулой IR1 представляет фенильную группу, необязательно моно- или дизамещенную нитрогруппой, трифторметильной группой, гидроксигруппой, атомом фтора или изопропоксигруппой, или пиридильную группу;R3 представляет фенильную группу, необязательно моно- или дизамещенную трифторметильной группой или метоксикарбонильной группой, или пиридильную группу, необязательно моно- или дизамещенную метильной группой, атомом фтора, нитрогруппой, или пиримидильную, пирролидинильную,оксазолидинильную группу или пиразолильную группу;n равно 1. Особенно предпочтительными являются 8-гидроксихинолиновые производные, упоминаемые как титульные соединения примеров. Краткое описание графических материалов На фиг. 1a, 1b и 1 с иллюстрируется ослабляющий эффект на реперфузионное повреждение соединения по примеру 1 после пересадки сердца. На фиг. 2 иллюстрируется эффект некоторых соединений по настоящему изобретению на клеточную гибель, вызванную пероксидом водорода in vitro в клетках печени. На фиг. 3 иллюстрируется эффект некоторых соединений по настоящему изобретению на клеточную гибель, вызванную пероксидом водорода in vitro в смешанных нейронах и астроцитах. На фиг. 4 иллюстрируется эффект соединения по примеру 1 в тестах с приподнятым крестообразным лабиринтом. На фиг. 5 иллюстрируется эффект соединения по примеру 1 в тестах принудительного плавания. Выражения, применяемые в описании, следует толковать, как указано далее."Низшая алкильная группа" означает разветвленную или неразветвленную алкильную группу с 1-4 атомами углерода (например, метильная, этильная, изопропильная группа и т.д.). Выражение "низшая алкенильная группа" означает разветвленную или неразветвленную алкенильную группу с 2-4 атомами углерода (например, аллильная или пропенильная группа). Выражение "циклоалкильная группа" означает циклические группы, содержащие 3-8 атомов углерода (например, циклопропильная, циклобутильная, циклогексильная группа и т.д.). Выражение "арильная группа" означает моноциклические или бициклические ароматические углеводородные группы (например, фенильная, нафтильная группа и т.д.). Выражение "аралкильная группа" означает алкильные группы, моно- или дизамещенные вышеупомянутыми арильными группами, удовлетворяющими вышеупомянутому определению (например, бензильная, бета-фенилэтильная группа и т.д.). Выражение "гетероциклическая группа" означает ароматические группы с от 3 до 7, предпочтительно 5 или 6 членами, содержащими один или несколько атомов кислорода, азота и/или серы (например, пиридильная, пиримидильная, пирролильная, оксазолильная группа и т.д.). Выражение "атом галогена" означает атом брома, фтора, хлора или йода; атомы фтора и хлора являются предпочтительными. Заместители с "электроноакцепторной группой" предпочтительно являются атомами галогена, трифторметильными или нитрогруппами. Из "электронодонорных" заместителей упоминаются низшие алкильные группы (например, метильная группа)."Кислотной функциональной группой" может быть любая сложноэфирная группа (низшая алкоксикарбонильная группа, предпочтительно метоксикарбонильная группа), или нитрильная, или кислотноамидная группа. Соединения, имеющие общую формулу I, образуют соли с основаниями на гидроксильных группах или с кислотами на атоме азота. Для образования соли можно применять фармацевтически приемлемые основания (например, гидроксиды щелочных металлов, подобные, например, гидроксиду натрия или калия) или фармацевтически приемлемые неорганические или органические кислоты (например, соляную кислоту, бромид водорода, уксусную кислоту, фумаровую кислоту, малеиновую кислоту, яблочную кислоту, янтарную кислоту, винную кислоту, бензолсульфоновую кислоту, п-толуолсульфоновую кислоту, метансульфоновую кислоту и т.д.). Также объектом настоящего изобретения является способ получения соединений с общей формулой I и их фармацевтически приемлемых солей, отличающийся тем, что 8-гидроксихинолиновое производное с общей формулой II(при этом в формулах заместители являются таковыми, как определено выше, и R3' может независимо выбираться из возможных значений R3, и R3 может также быть атомом водорода; а также R3 и R3' могут быть соединены друг с другом, образуя циклический вторичный амин), затем полученное соединение с формулой I необязательно преобразуют в его фармацевтически приемлемую соль или высвобождают из его соли. Реакцию осуществляют с использованием модифицированной реакции Бетти, что является известным способом (Betti, 1900; Betti, 1903; Phillips et al., 1954; Phillips et al., 1956; Phillips, 1956). Реакцию осуществляют в растворителе. В качестве реакционной среды можно применять воду или органические растворители (например, ацетонитрил). Необязательно реакцию проводят в присутствии кислотного катализатора (например, муравьиной кислоты). Для получения соединений по настоящему изобретению - в зависимости от исходных материалов применяли следующие способы А или В. Способ А. Суспендировать или растворить 1 ммоль альдегида в 2 объеме воды и добавить к реакционной смеси 1,1 экв. первичного амина. Выдержать при 600C в течение 1 ч и к горячей смеси добавить по каплям раствор 0,6 экв. 8-гидроксихинолина, растворенного в объеме ацетонитрила или ацетона, вдвое превышающем объем воды. Далее охладить реакционную смесь до комнатной температуры и перемешивать до того, как выпадет осадок. Контролировать реакцию посредством ВЭЖХ и TLC. Отфильтровать осадок, промыть ацетонитрилом и высушить. Способ В. Растворить 1 ммоль альдегида в 3 объеме ацетонитрила и добавить к реакционной смеси 1 экв. амина, 0,6 экв. 8-гидроксихинолина и 1 об./об. % муравьиной кислоты. Перемешивать смесь до того, как выпадет осадок или начнут исчезать хинолиновые пятна. Обработать смесь путем фильтрации, промывания ацетонитрилом, осуществить хроматографию со смесью гексана (смесь изомеров)/этилацетата и подвергнуть перекристаллизации из спирта или ацетонитрила. По завершении реакции выделить требуемый продукт из реакционной смеси с применением обычных способов (например, фильтрации или центрифугирования) и, при необходимости, очистить известными способами (перекристаллизацией или хроматографией). Также объектом настоящего изобретения является фармацевтическая композиция, содержащая соединение общей формулы I или его фармацевтически приемлемую соль в качестве активного средства, а также инертный твердый или жидкий фармацевтический носитель и/или наполнитель. Фармацевтические композиции по настоящему изобретению могут представлять собой твердые(например, таблетка, капсула), полутвердые (например, суппозиторий) или жидкие (например, инъекционный раствор) препараты. Препараты могут вводиться перорально, ректально или парентерально. Композиции по настоящему изобретению могут содержать обычные терапевтически подходящие носители и/или наполнители (например, крахмал, целлюлозу или производные целлюлозы, лактозу, маннит, хлорид натрия, карбонат натрия, сахарозу, мальтозу, карбонат кальция и т.д.). Фармацевтические композиции по настоящему изобретению можно применять для лечения заболеваний, связанных с неврологическим и/или окислительным стрессом, во время которого пациенту, нуждающемуся в лечении, вводят терапевтически эффективное количество соединения с общей формулой I или его фармацевтически приемлемую соль. Согласно предпочтительному варианту осуществления настоящего изобретения заболевания, связанные с неврологическим и/или окислительным стрессом, выбирают из следующих заболеваний: ишемии, реперфузионного повреждения, сердечно-сосудистых расстройств, нейродегенеративных расстройств (в том числе, в частности, болезни Альцгеймера и болезни Хантингтона), травмы, психоневрологических заболеваний (в том числе, в частности, депрессии и тревожных расстройств) и повреждений печени, почек и легких. В соответствии с вышеупомянутым фармацевтическую композицию по настоящему изобретению можно применять в качестве нейропротекторного и кардиопротекторного средства в случае повреждений печени, почек и легких, а также для лечения или профилактики депрессии, тревожных расстройств, болезни Альцгеймера и болезни Хантингтона. Дополнительные детали настоящего изобретения описываются ниже в примерах без ограничения объема защиты примерами. Химические примеры Пример 1: 7-6-метилпиридин-2-иламино)(4-нитрофенил)метил)хинолин-8-ол Способ А. К 10,1 г (18,5 ммоль, Sigma) 4-нитробензальдегида добавили по каплям воду (20 мл), затем к лимонно-желтой суспензии добавили при интенсивном перемешивании 2-амино-6-пиколин (7,95 г, 1,1 экв.,Aldrich). После изменения цвета (с лимонно-желтого на оранжево-желтый) к суспензии добавили раствор 5,82 г 8-гидроксихинолина (0,6 экв., Sigma) в 20 мл ацетона (Molar) и реакционный сосуд нагревали при 60C в течение 4 ч, затем раствор охладили до комнатной температуры. Осажденный желтый порошок отфильтровали (7,87 г, 50,8%), промыли небольшим количеством ацетона; его чистоту проверили посредством ВЭЖХ (99,5%). Способ В. 4-Нитробензальдегид (2,8 г, 18,5 ммоль, Sigma) растворили в абсолютном ацетонитриле (15 мл, Molar) и к лимонно-желтому раствору добавили при перемешивании 2-амино-6-пиколин (2 г, 1 экв.,Aldrich). К смеси добавили 1,61 г 8-гидроксихинолина (0,6 экв., Sigma) и ее перемешивали при комнатной температуре в течение 4 суток. Осажденный продукт (4,2 г, 27,1%) отфильтровали, молекулярный вес продукта верифицировали посредством масс-спектроскопии, его структуру продемонстрировали посредством ЯМР (MB: 386,1), а чистоту проверили посредством ВЭЖХ (99,6%). Титульное соединение получали как способом А, так и способом В, представленными для соединения из примера 1, с таким изменением, что в качестве исходных материалов применяли бензокаин(Sigma), 4-нитробензальдегид (Sigma) и 8-гидроксихинолин. Продукт, очищенный посредством колоночной хроматографии: C25H21N3O5; (MB: 443,2); выход: 50 мг (30,9%, способ А). ВЭЖХ (CH3CN/H2O 70:30Phenomenex C-18 254 нм): Tr = 8,82 мин. Пример 3: 4-[(8-гидроксихинолин-7-ил)фенилметил]аминобензойной кислоты этиловый сложный эфирC25H22N2O3; (MB: 398,1). Его получали способом А из примера 1.C21H17N3O; (MB: 327,1). Его получали способом А из примера 1. Пример 5: 7-[пиридин-2-ил-(4-трифторметилфениламино)метил]хинолин-8-ол Титульное соединение по примеру 5 получали как способом А, так и способом В, представленными для соединения из примера 1, с таким изменением, что в качестве исходного альдегида применяли пиридин-2-карбоксальдегид (Molar), а в качестве первичного амина применяли 4-трифторметиланилин(Sigma). Продукт, очищенный посредством колоночной хроматографии: C22H16F3N3O (MB: 395,1); выход: 151 мг, (42,1%, способ В); т.пл.: 158-161C; ВЭЖХ (CH3CN/H2O 70:30 Phenomenex С 18 254 нм): Tr = 10,39 мин. 1 Титульное соединение получали как способом А, так и способом В, представленными для соединения из примера 1, с таким изменением, что в качестве исходных материалов применяли 4 трифторметилбензальдегид (Sigma), 2-амино-6-пиколин и 8-гидроксихинолин. Полученный продукт Титульное соединение получали способом В, представленным для соединения из примера 1, с таким изменением, что в качестве исходных материалов применяли 2-амино-4-метилпиридин (Molar), 4 трифторметилбензальдегид (Sigma) и 8-гидроксихинолин (Sigma). Полученный продукт: C23H18F3N3O; Титульное соединение получали способом В, представленным для соединения из примера 1, с таким изменением, что в качестве исходных материалов применяли 2-амино-4-метилпиримидин (Sigma), 4 нитробензальдегид и 8-гидроксихинолин. Полученный продукт: C21H17N5O3, (MB: 387,1); выход: 344 мг,(49,6%); т.пл.: 136-145C; ВЭЖХ (CH3CN/H2O 70:30 Phenomenex C18 282 нм): Tr = 5,21 мин. 1 Титульное соединение получали как способом А, так и способом В, представленными для соединения из примера 1, с таким изменением, что в качестве источников альдегида и амина применяли 4 трифторметилбензальдегид и 2-амино-4-метилпиримидин (Molar). Полученный продукт (способ В), выход: 1,7 г (34,8%); C22H17F3N4O; (MB: 410,1), т.пл.: 144-147C; ВЭЖХ (CH,CN/H2O 70:30 Phenomenex C18 254 нм): Tr = 7,75 мин. 1 Титульное соединение получали способом В, представленным для соединения из примера 1, с таким изменением, что в качестве исходных материалов применяли 2-гидроксибензальдегид (Molar) и 2 амино-4-метилпиримидин (Sigma). Осажденный продукт, выход: 45 мг; C21H18N4O2; (MB: 358,1). Титульное соединение получали способом В, представленным для соединения из примера 1, с таким изменением, что в качестве альдегидного компонента применяли 4-изопропилоксибензальдегид(Molar). Продукт, очищенный путем колоночной хроматографии, C25H25N3O2; (МВ+1: 399,2), выход 135 мг (63,1%); т.пл.: 132-134C; ВЭЖХ (CH3CN/H2O 70:30 Phenomenex C18 282 нм): Tr = 9,23 мин. Пример 13: 7-[(2-гидроксифенил)-(6-метилпиридин-2-иламино)метил]хинолин-8-ол Титульное соединение получали способом В, представленным для соединения из примера 1, с таким изменением, что реакцию проводили с салицилальдегидом (Molar), 2-амино-6-пиколином (1 экв.) и 8-гидроксихинолином (0,6 экв.) в качестве исходных материалов. Осажденный продукт; C22H19N3O2; (MB: 357,1), выход 1,6 г, (50,9%); т.пл.: 189-191C; ВЭЖХC20H19FN2O; (MB: 322,2). Титульное соединение получали способом А из примера 1. Пример 15: 7-[(5-метил-1,2-оксазол-3-ил)амино](3-нитрофенил)метилхинолин-8-олC20H16N4O4; (MB: 376,1). Титульное соединение получали способом А из примера 1. Титульное соединение получали способом В, представленным для соединения из примера 1, с таким изменением, что 3,4-дифторбензальдегид вводили в реакцию с 2-амино-6-пиколином и 8 гидроксихинолином. Осажденный белый порошок, C22H17F2N3O, (MB: 377,1); выход: 275 мг (53,3%); т.пл.: 162-165C; ВЭЖХ (CH3CN/H2O 70:30 Phenomenex C18 282 нм): 7,97 мин. Пример 17: 7-(6-метилпиридин-2-иламино)(3-(трифторметилфенил)метил)хинолин-8-ол Титульное соединение получали способом В, представленным для соединения из примера 1, с более высоким выходом. Осажденный белый порошок, C23H18F3N3O (MB: 409,1); выход: 356 мг, 57,3%; т.пл.: 140-143C, ВЭЖХ (MeOH/Н 2 О 80:20 Phenomenex C18 254 нм): 10,21 мин. Пример 18: 7-[(4,6-диметилпиримидин-2-иламино)-(4-трифторметилфенил)метил]хинолин-8-ол Титульное соединение получали способом В, представленным для соединения из примера 1, с более высоким выходом. Осажденный белый порошок; C23H19F3N4O; (MB: 424,2); выход: 255 мг (54,6%). Пример 19: 7-[(6-метилпиридин-2-иламино)пиридин-2-илметил]хинолин-8-ол Титульное соединение получали способом В, представленным для соединения из примера 1. Осажденный желтовато-белый порошок, C21H18N4O (MB: 342,2); выход: 1,2 г (70,5%); т.пл.: 155-157C. Пример 20: 7-[(5-фторпиридин-2-иламино)пиридин-2-илметил]хинолин-8-ол Титульное соединение получали способом В, представленным для соединения из примера 1. Порошок цвета кости, очищенный посредством колоночной хроматографии. C20H15FN4O; (MB: 346,1), выход 45 мг (18,4%); т.пл.: 165-168C, ВЭЖХ (CH3CN/H2O 70:30 Phenomenex C18 282 нм): 4,44 мин. Титульное соединение получали способом В, представленным для соединения из примера 1; в реакции применяли 2-амино-5-хлорпиридин, 2-пиридинкарбоксальдегид и 8-гидроксихинолин; реакционную смесь нагревали при 60C в течение 3 суток. Серовато-белый порошок, продукт, очищенный посредством колоночной хроматографии. C20H15ClN4O; (MB: 362,1); выход: 55 мг (23,7%); т.пл.: 160-162C,ВЭЖХ (CH3CN/H2O 70:30 Phenomenex C18 282 нм): 5,69 мин. Пример 22: 7-[(5-метил-6-нитропиридин-2-иламино)-(4-трифторметилфенил)метил]хинолин-8-ол Титульное соединение получали способом В, представленным для соединения из примера 1, с таким изменением, что применяли 2-амино-5-метил-6-нитропиридин, 4-трифторметилбензальдегид и 8 гидроксихинолин, а также реакционную смесь нагревали при 60C в течение 7 суток. Желтовато-белый порошок. C23H17F3N4O3; (MB: 454,1), выход: 26 мг (10%); т.пл.300C, ВЭЖХ (CH3CN/H2O 70:30 Phenomenex С 18 282 нм): Tr = 5,60 мин. Пример 23: 7-[(3-гидроксифенил)-(6-метилпиридин-2-иламино)метил]хинолин-8-ол Титульное соединение получали способом В, представленным для соединения из примера 1, с таким изменением, что 3-гидроксибензальдегид вводили в реакцию с 2-метил-6-пиколином и 8 гидроксихинолином. Белый порошок, очищенный посредством колоночной хроматографии. C22H19N3O2;Tr = 3,97 мин. Биологические примеры. Пример 24: ингибирование активностей матричной металлопротеиназы 2 (MMP-2, 72 кДа желатиназа) и матричной металлопротеиназы 9 (MMP-9, 92 кДа желатиназа) с помощью 7-6-метилпиридин-2 иламино)(4-нитрофенил)метил)хинолин-8-ола. Эмбриональные клетки миокарда крысы Н 9 с 2 (от АТСС, Роквилл, Мэриленд, США) выращивали на среде Игла в модификации Дульбекко, содержащей 10% сыворотки крупного рогатого скота, 4 мМ Lглутамина (Sigma-Aldrich, Венгрия), 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина. Перед электрофорезом к образцу надосадочной жидкости от Н 9 с 2 добавили 30 мкМ соединения по примеру 1 (76-метилпиридин-2-иламино)(4-нитрофенил)метил)хинолин-8-ол) из маточного раствора, содержащего 30 мМ DMSO (1000-кратное разбавление). К контролю добавили DMSO, не содержащий соединение по примеру 1. После электрофореза вслед за ренатурацией гель разрезали на две половины; одну половину инкубировали таким образом, что к ней добавили 30 мкМ в конечной концентрации соединения по примеру 1, тогда как вторую половину (контроль) инкубировали без него. Соединение по примеру 1 полностью ингибировало 72 кДа желатиназу (MMP-2), если вещество присутствовало во время инкубации. Оно также ингибировало 92 кДа желатиназу (MMP-9), но в меньшей степени, чем 72 кДа желатиназу.MMP-9 и MMP-2 участвуют в опосредованной каспазами гибели клеток эндотелия, реоксигенации после гипоксии путем разрушения клеточно-матриксных взаимодействий и гомеостатического интегринового сигнала. Ингибиторы MMP-2 и MMP-9 существенно ослабляют активность каспазы-3 и снижают гибель эндотелиальных клеток (Lee et al., 2004). Пример 25: соединение по примеру 1(7-6-метилпиридин-2-иламино)(4 нитрофенил)метил)хинолин-8-ол) ослабляет реперфузионное повреждение после пересадки сердца. Экспериментальную модель гетеротропного сердечного трансплантата выполняли описанным ранее образом (поли(АДФ-рибоза); ингибирование полимеразы ослабляет реперфузионное повреждение,происходящее после пересадки сердца (Szab et al. 2002). Вкратце: донорские сердца пересаживали от крыс линии Льюис. После ишемической защиты, выполняемой при 4C в течение 1 ч, сердца имплантировали внутрь брюшной полости путем анастомозирования аорты и легочной артерии донорского сердца с брюшной аортой или полой веной крысы-реципиента. Содержание всех животных выполняли люди в соответствии с требованиями "Принципов ухода за лабораторными животными"; Национального общества медицинских исследований и Руководства по содержанию и использованию лабораторных животных, подготовленного Национальной академией наук; издатель: Национальные институты здоровья(публикация NIH86-23, редакция 1996 г.). Функциональные измерения трансплантата проводили, как указано ниже: систолическое давление в левом желудочке (LVSP), конечное диастолическое давление в левом желудочке (LVEDP), скорость изменения давления крови (dP/dt) и постоянную времени релаксации (ТЕ) измеряли посредством микроманометра Millar (Millar Instruments, Inc.), с различными LV, с применением внутрижелудочкового баллона. Общий коронарный кровоток (CBF) измеряли на донорской аорте периваскулярным ультразвуковым замером потока. После определения исходного состояния непосредственно в коронарные артерии трансплантата через донорскую аорту добавили эндотелий-зависимый сосудорасширяющий фактор ацетилхолин (ACH, 1 нмоль/л, 0,2 мл) и брадикинин (ВК 0,1 нмоль/л, 0,2 мл), а также эндотелий-независимый сосудорасширяющий фактор нитропруссид натрия (SNP, 10 нмоль/л, 0,2 мл). Между инфузиями CBF давали возможность возвратиться на уровень исходного состояния. Сосудорасширяющую реакцию выражали как максимальное относительное изменение CBF от исходного состояния. Исследовали две группы трансплантатов (n=6/в каждой группе). Непосредственно перед ослаблением зажима аорты начинали медленную инъекцию раствора хлорида натрия (контрольная группа) или соединения по примеру 1 (3 мг/кг), и ее продолжали в течение первых 5 мин периода реперфузии. Измерение систолической и диастолической функций и CBF в группе А (контроль) и группе В (соединение по примеру 1) выполняли через час после реперфузии. Гемодинамические параметры и миокардиальный кровоток определяли через 60 мин после реперфузии. Частота сердечных сокращений и давление в аорте реципиента были одинаковыми в каждой группе. Восстановление систолической функции было существенно лучшим в группе, обработанной соединением по примеру 1, чем контрольные значения. LVSP и пиковое положительное значение dP/dt были существенно (P=0,05) выше в группе, обработанной соединением по примеру 1. На кривых систолической сердечной функции в группе, обработанной соединением по примеру 1,показано существенное отклонение влево по сравнению с группой, обработанной носителем (фиг. 1 а и 1b). LVEDP не показал изменение значений между группами. Диастолические кривые взаимодействия(отношение конечное диастолическое давление-объем) сходны в каждой группе (фиг. 1 с). Пример 26: обработка соединениями, имеющими общую формулу I, предотвращала клеточную гибель, вызванную пероксидом водорода in vitro в клетках сердца, нейронах и клетках печени. Эмбриональные клетки миокарда крысы Н 9 с 2 (от АТСС, Роквилл, Мэриленд, США) выращивали на среде Игла в модификации Дульбекко, содержащей 10% сыворотки крупного рогатого скота, 4 мМ Lглутамина (Sigma-Aldrich, Венгрия), 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина. Клетки поместили на 96-луночные планшеты для микротитрования (10000 клеток/лунка) и спустя 24 ч обработали 1% раствором Н 2 О 2 (Sigma) (конечная концентрация 0,2 мМ). Через 30 мин после обработки на них внесли различные соединения с общей формулой I в различных концентрациях, и через 3 и 24 ч определяли жизнеспособность клеток посредством МТТ-теста (3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2Hтетразолия бромид). 3-(4,5-Диметил-2-тиазолил)-2,5-дифенил-2H-тетразолия бромид (МТТ, Serva) добавляли к клеткам в конечной концентрации 0,5 мг/мл и инкубировали при 37C в течение 1 ч. Клетки промывали PBS и формазановый краситель растворяли в изопропаноле. Количество преобразованного формазанового красителя измеряли посредством ридера Powerwave (Biotek, Уинуски, Вермонт) при 570 нм; фоновое измерение 690 нм. Градуировочную кривую получили следующим образом, измеряли способность серийных разведений клеток преобразовывать МТТ, и подсчитывали количество жизнеспособных клеток с применением программного обеспечения Gen5. Измерения осуществляли через 3 и через 24 ч после подвергания каждой серии экспериментов воздействию Н 2 О 2. Пример 27: обработка различными соединениями с общей формулой I предотвращала клеточную гибель, вызванную пероксидом водорода in vitro в клетках печени. Клетки гепатомы человека Hep3B (АТСС, Роквилл, Мэриленд, США) 10% выращивали на среде Игла в модификации Дульбекко, содержащей 10% сыворотки крупного рогатого скота, 4 мМ Lглутамина (Sigma-Aldrich, Венгрия), 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина. Клетки поддерживали в 100-мм ТС-чашках (Orange Scientific, Бельгия) в инкубаторе в зоне с 37C, содержащей увлажненный воздух и 5% СО 2. Клетки поместили на 96-луночные Е-планшеты (Roche) для микротитрования, предварительно обработанные желатиной (10000 клеток/лунка), и выращивали в течение 16 ч. Через 30 мин после обработки на них внесли различные соединения с общей формулой I в различных концентрациях и непрерывно измеряли жизнеспособность клеток прибором Excelligence способом RT-CES (Roche) посредством определения клеточного индекса, измеряемого каждые 2 мин. Результаты показаны на фиг. 2. Кривая "А" представляет необработанный контроль, кривая "I" представляет соединение PJ34, известный ингибиторPARP, тогда как кривая "J" представляет контроль, обработанный пероксидом. В этом эксперименте тестировали следующие соединения согласно общей формуле (1) (указывают какая кривая на фиг. 2 представляет эффект данного соединения на нормированный клеточный индекс): 7-4-нитрофениламино)(фенил)метил)хинолин-8-ол (кривая "В"),4-[(8-гидроксихинолин-7-ил)-фенилметил]аминобензойной кислоты этиловый сложный эфир(кривая "С", пример 3),7-4-фенилпиперазин-1-ил)(тиофен-2-ил)метил)хинолин-8-ол (кривая "D"),7-6-метилпиридин-2-иламино)(4-(трифторметил)фенил)метил)хинолин-8-ол (кривая "Е"),7-4-фторфенил)(тиазол-2-иламино)метил)хинолин-8-ол (кривая "F"),7-(фениламинопиридин-2-илметил)хинолин-8-ол (кривая "G", пример 4) и 7-[(4-фторфенил)-(пирролидин-1-ил)метил]хинолин-8-ол (кривая "Н", 14). Тесты осуществляли для определения цитопротекторного эффекта на клетки гепатомы человекаHep3B через 30 мин после обработки Н 2 О 2. На этих клетках применяли 250 мкМ пероксид водорода. Во время нанесения пероксида водорода клеточный рост является линейным. Через 30 мин после обработки различными соединениями с общей формулой I по настоящему изобретению наклоны кривых клеточного индекса существенно менялись, на основании чего можно установить различные цитопротекторные эффекты соединений по настоящему изобретению. Пример 28: обработка различными соединениями с общей формулой I предотвращала клеточную гибель, вызванную пероксидом водорода in vitro в смешанных первичных нейронах и астроцитах. Клетки поддерживали в 100-мм ТС-чашках (Orange Scientific, Бельгия) в инкубаторе в зоне с 37C,содержащей увлажненный воздух и 5% диоксид углерода. Смешанную культуру черепно-мозговых нейронов и астроцитов получали, следуя способу Griffin S. и соавт. (Griffin et al., 2005). Клеточные культуры поддерживали на минимальной среде Игла, содержащей 10% эмбриональной сыворотки крупного рогатого скота и 1% раствор заменимых аминокислот (Sigma-Aldrich, Венгрия). Результаты показаны на фиг. 3. Кривая "K" представляет необработанный контроль, кривая "Р" представляет контроль, обработанныйPJ34, и кривая "Q" представляет контроль, обработанный пероксидом водорода. Клетки поместили на 96-луночные Е-планшеты (Roche) для микротитрования, предварительно обработанные желатиной (10000 клеток/лунка), и выращивали в течение 16 ч. За 5 мин до обработки на них вносили следующие соединения с общей формулой I по настоящему изобретению в концентрации 5 мкМ: 7-6-метилпиридин-2-иламино)(4-нитрофенил)метил)хинолин-8-ол (кривая "L", пример 1),7-[(6-метилпиридин-2-иламино)-(4-трифторметилфенил)метил]хинолин-8-ол (кривая "М", пример 7),этил-4-8-гидроксихинолин-7-ил)(4-нитрофенил)метиламино)бензоат (кривая "N", пример 2) и 7-4-метилпиримидин-2-иламино)(4-(трифторметил)фенил)метил)хинолин-8-ол (кривая "О", пример 10). Затем жизнеспособность клеток измеряли непрерывно прибором Excelligence способом RT-CES(Roche) посредством определения клеточного индекса, измеряемого каждые 2 мин. Обработку начали с добавления 100 мкМ Н 2 О 2, вызывающего разрушение 90% общего числа клеток в контрольной лунке, не содержащей соединения с общей формулой I. Пример 29: эффект соединения по примеру 1 (7-6-метилпиридин-2-иламино)(4 нитрофенил)метил)хинолин-8-ол) на поведение крыс. Подопытные животные. В качестве подопытных животных применялись крысы линии Вистар, полученных из Charles RiverLaboratories (Будапешт, Венгрия). Применялись крысы в возрасте приблизительно 2 месяца (вес тела 200-300 г). Животных адаптировали в течение приблизительно 1 недели. Животные получали стандартную лабораторную пищу (Charles River Laboratories, Будапешт, Венгрия) и водопроводную воду ad libitum. Температуру и влажность поддерживали 222C и 6010% соответственно. Крыс содержали в группах по 5 в клетках Makrolon 453525 см. Применялись 12-часовые циклы день/ночь; свет отключали в 19:00. Эксперименты проводили в светлое время суток. Эксперименты проводили в соответствии с директивой Совета Европейского сообщества от 24 ноября 1986 (86/609/ЕЕС, согласно контролю и одобрению Комитета по защите животных Института экспериментальной медицины). Пример 29.1: верификация подавляющего тревожность эффекта соединения по примеру 1 посредством теста с приподнятым крестообразным лабиринтом. Тест с приподнятым крестообразным лабиринтом. Для теста с приподнятым крестообразным лабиринтом применяли черный металлический ящик. Размеры оборудования следующие: длина рукавов: 40 см, ширина рукавов: 12 см, высота стенки: 30 см и высота платформы: 70 см. Открытые рукава окружены бортами 0,5 см. Тест проводили согласно следующей публикации: Pellow et al., 1985. В ранние часы световой фазы крыс обрабатывали носителем, соединением по примеру 1 (2 мг/кг),соединением по примеру 1 (8 мг/кг) и хлордиазепоксидом (8 мг/кг) (n=10 в каждой группе). Эта доза хлордиазепоксида достоверно ослабляла тревожность в данном тесте ранее. Через 2 ч после обработки животных помещали в центр устройства головами, направленными в сторону закрытого рукава. Продолжительность воздействия составляла 5 мин. Вхождения в закрытые рукава являются показателями двигательной активности, тогда как использование открытых рукавов является показателем степени тревожности. Использование открытого рукава характеризовали двумя параметрами: процентная доля времени, проведенного в открытых рукавах, и процентная частота вхождений в открытые рукава(100 вхождения в открытые рукава/общее число вхождений в рукава) (Pellow et al., 1985; Hogg, 1996). Результаты показаны на фиг. 4. На фигуре "пример 1" относится к соединению по примеру 1, CDP относится к хлордиазепоксиду. Пример 29.2: воздействие соединения по примеру 1 на депрессию. Тест принудительного плавания. Крыс принуждали к плаванию дважды, как описано в следующей публикации: Porsolt et al., 1978. В первый день каждую крысу помещали в стеклянный цилиндр шириной 15 см, высотой 35 см, наполненный водой до 30 см. При этой толщине слоя воды хвосты крыс не касались дна цилиндра. Температура воды составляла 240,5C. На следующий день животных обработали носителем, 2 мг/кг соединения по примеру 1, 8 мг/кг соединения по примеру 1 и 30 мг/кг имипрамина. Эта доза имипрамина достоверно ослабляла плавание на поверхности в предыдущих экспериментах; в данном тесте это является главной характеристикой поведения, подобного депрессии. После периода отдыха 2 ч крыс вновь принуждали к плаванию в течение 5 мин. Поведение животных регистрировали с помощью видеокамеры, расположенной в 2 м от цилиндров. Регистрировали следующие поведенческие факторы: борьба (животное пытается покинуть цилиндр путем влезания на стенки); плавание (плавание в цилиндре по кругу) и плавание на поверхности (животное совершает только движения, необходимые для удержания головы над водой). Время плавания на поверхности показывает степень поведения, подобного депрессии, в этом тесте. Результаты показаны на фиг. 5. На этой фигуре "пример 1" относится к соединению по примеру 1. Пример 30: цитотоксический эффект соединений по настоящему изобретению на различные опухолевые клеточные линии. В настоящем эксперименте применяли клеточные культуры HepG2 и Hep3B (гепатоцеллюлярная карцинома человека), SUM149PT (опухоль молочной железы человека), К 562 (эритробластный лейкоз человека), U87 (глиома человека), CCRF-CEM (лейкоз человека); их выращивали на следующей среде:BRL, Карлсбад, Калифорния, США), пенициллин (50 МЕ/мл), стрептомицин (50 мг/мл), 10% эмбриональной сыворотки крупного рогатого скота; 1:1 смесь HepG2, Hep3B, SUM149PT: среда Игла в модификации Дульбекко (D-MEM) (высокое содержание глюкозы) (Gibco BRL, Карлсбад, Калифорния, США) и питательная смесь F-12 Ham (Sigma, Сент-Луис, Миссури, США), пенициллин (50 МЕ/мл), стрептомицин (50 мг/мл), 10% эмбриональной сыворотки крупного рогатого скота. CCRF-CEM: RPMI среды 1640(Gibco BRL, Карлсбад, Калифорния, США), пенициллин (50 МЕ/мл), стрептомицин (50 мг/мл), 10% эмбриональная сыворотка крупного рогатого скота. Клетки поместили на 96-луночные планшеты для микротитрования (10000 клеток/лунка) и спустя 24 ч клетки инкубировали с различными веществами. После инкубации провели MTS-тест (3-(4,5 диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2H-тетразолий) (Promega, Мэдисон, Висконсин, США), добавляя его в конечной концентрации 0,5 мг/мл к клеткам, которые затем инкубировали при 37C в течение 1 ч. Клетки промывали PBS и растворяли формазановый краситель в изопропаноле. Количество преобразованного формазанового красителя измеряли посредством ридера Powerwave(Biotek, Уинуски, Вермонт) при 570 нм; фоновое измерение 690 нм. Градуировочную кривую получили следующим образом: измеряли способность серийных разведений клеток к преобразованию MTS, и подсчитывали количество жизнеспособных клеток с использованием программного обеспечения Gen5. Результаты эксперимента с различными клетками показаны в таблице, где представлены значения ЕС 50 каждого вещества (концентрация, при которой погибла половина клеток, на основании результатов теста с MTS). Хорошо видно, что соединения по настоящему изобретению проявляют цитотоксический эффект на различные опухолевые клеточные линии. Цитостатический эффект различных хинолиновых производных на различные опухолевые клеточные линии человека ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы I и их фармацевтически приемлемые соли где R1 представляет фенильную группу, необязательно замещенную в орто-, мета- и/или параположении гидроксигруппой, трифторметильной группой, нитрогруппой, или пиридиновую группу, необязательно замещенную в орто-, мета- и/или пара-положении атомами галогена, гидроксигруппой, трифторметильной группой, нитрогруппой или низшей алкильной группой;R3 представляет пиримидиновую группу, необязательно замещенную в орто-, мета- или параположении атомами галогена, трифторметильной группой, нитрогруппой или низшей алкильной группой;R4 представляет атом водорода или метильную группу;n равно 1. 2. Соединения общей формулы I по п.1, где указанные соединения выбраны из следующего: 7-4-метилпиримидин-2-иламино)(4-нитрофенил)метил)хинолин-8-ол; 7-4-метилпиримидин-2-иламино)(4-(трифторметил)фенил)метил)хинолин-8-ол; 7-[(2-гидроксифенил)-(4-метилпиримидин-2-иламино)метил]хинолин-8-ол; 7-[(4,6-диметилпиримидин-2-иламино)-(4-трифторметилфенил)метил]хинолин-8-ол. 3. Способ получения соединений общей формулы I где R1 представляет фенильную группу, необязательно замещенную в орто-, мета- и/или параположении гидроксигруппой, трифторметильной группой, нитрогруппой, или пиридиновую группу, необязательно замещенную в орто-, мета- и/или пара-положении атомами галогена, гидроксигруппой, трифторметильной группой, нитрогруппой или низшей алкильной группой;R3 представляет пиримидиновую группу, необязательно замещенную в орто-, мета- или параположении атомами галогена, трифторметильной группой, нитрогруппой или низшей алкильной группой;R4 представляет атом водорода или метильную группу;n равно 1,отличающийся тем, что 8-гидроксихинолиновое производное общей формулы II реагирует с оксосоединением общей формулы III и амином общей формулы IV где заместители являются таковыми, как определено выше;R3' независимо выбирают из значений R3 и R3' может также быть атомом водорода; а также R3 и R3' могут быть соединены друг с другом, образуя циклический вторичный амин,и полученное соединение общей формулы I необязательно преобразуют в фармацевтически приемлемую кислотно-аддитивную соль или высвобождают из его соли. 4. Фармацевтическая композиция для лечения заболеваний, ассоциированных с неврологическим и/или окислительным стрессом, содержащая соединение по п.1 или 2 и фармацевтически приемлемый твердый или жидкий носитель и/или наполнитель. 5. Способ получения фармацевтической композиции по п.4, отличающийся тем, что соединение по п.1 или 2 смешивают с фармацевтически приемлемым инертным твердым или жидким носителем и/или наполнителем. 6. Способ лечения заболеваний, ассоциированных с неврологическим и/или окислительным стрессом, отличающийся тем, что терапевтически эффективное количество соединения по п.1 или 2 вводят пациенту, нуждающемуся в лечении. 7. Способ по п.6, где заболевания, ассоциированные с неврологическим и/или окислительным стрессом, выбирают из ишемии, реперфузионного повреждения, сердечно-сосудистых расстройств, нейродегенеративных расстройств (в том числе, в частности, болезни Альцгеймера и болезни Хантингтона),травмы, психоневрологических заболеваний (в том числе, в частности, депрессии и тревожных расстройств) и повреждений печени, почек и легких.
МПК / Метки
МПК: A61P 9/10, A61P 25/28, C07D 401/14, C07D 401/06, A61K 31/4709, C07D 215/26, C07D 401/12, A61K 31/47, C07D 413/12
Метки: 8-гидроксихинолиновые, производные
Код ссылки
<a href="https://eas.patents.su/20-21026-8-gidroksihinolinovye-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">8-гидроксихинолиновые производные</a>
Предыдущий патент: Соединения, эффективные в качестве ингибиторов ксантиноксидазы, способ их получения и содержащая их фармацевтическая композиция
Следующий патент: Способы и устройства для перекачивания частиц
Случайный патент: Антагонисты trpv4












