Соединения пиридина
Номер патента: 20807
Опубликовано: 30.01.2015
Авторы: Фут Кевин Майкл, Джонс Клиффорд Дейвид, Пле Патрик, Барлам Бернар Кристоф
Формула / Реферат
1. Соединение формулы I
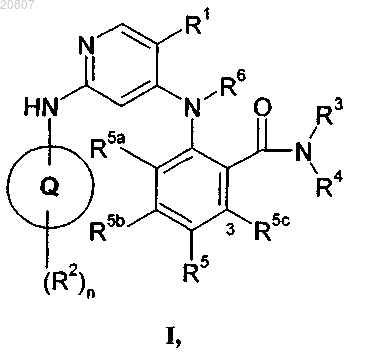
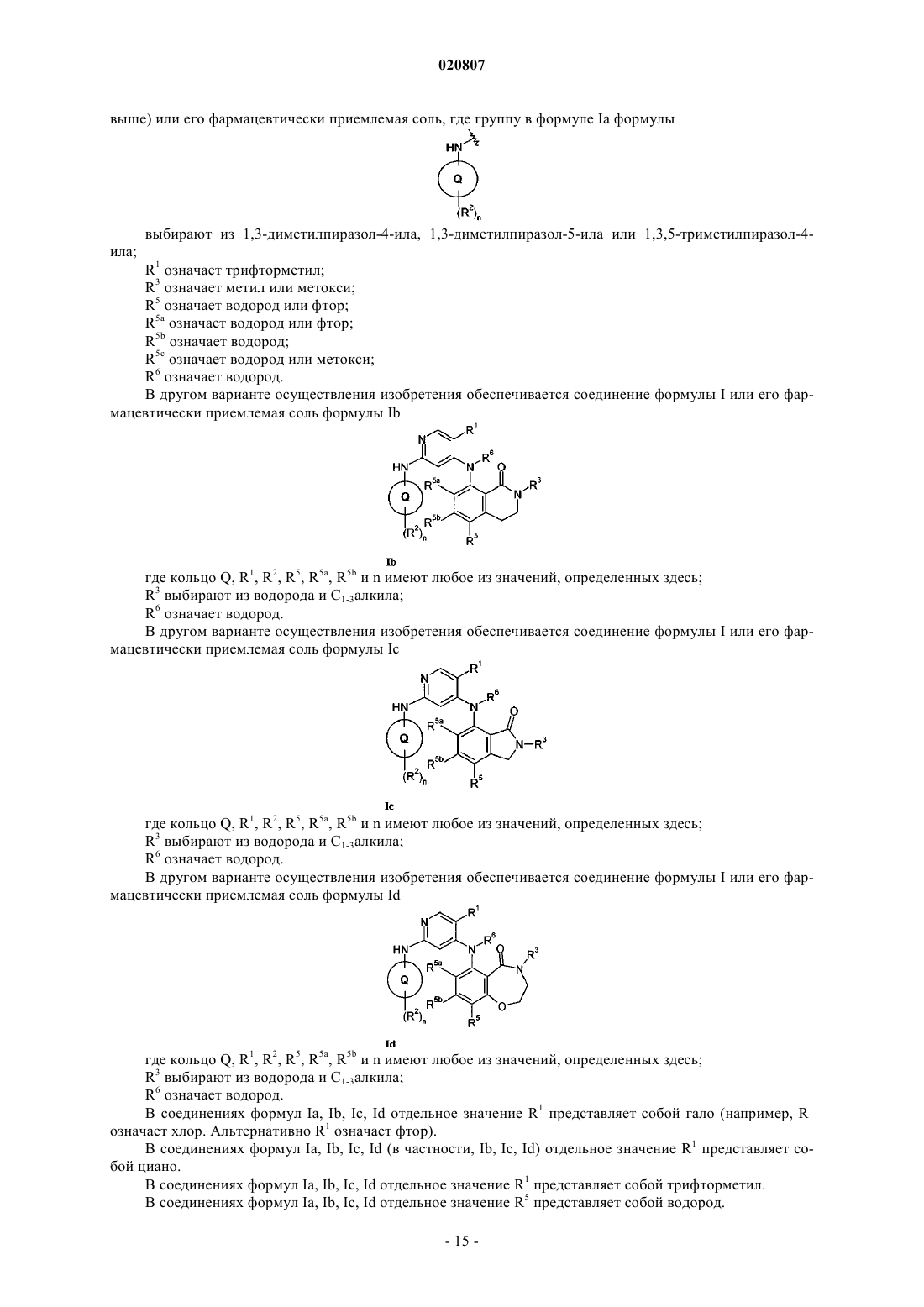
где кольцо Q означает пиразолил;
R1 выбирают из гало, трифторметила и циано;
n означает 1 или 2;
R2 выбирают из циано, C1-6алкила и C1-6алкокси, где C1-6алкил и C1-6алкокси могут быть необязательно замещены по углероду одним или несколькими R7;
или R2 выбирают из:
(1) С3-7циклоалкил-Х1-, где X1 выбирают из прямой связи, -О-, -N(R14)C(O)- и -C(O)N(R14)-;
(2) гетероциклил-Х2-, где X2 означает прямую связь, где гетероциклил присоединен через углерод к X2, и его выбирают из азетидинила, тетрагидрофуранила, тетрагидропиранила, пирролидинила, морфолинила, тиоморфолинила, тиоморфолинил 1,1-диоксида, пиперидинила, пиперазинила, тетрагидротиенила, тетрагидротиенил 1,1-диоксида, гомопиперидинила, гомопиперазинила, хинуклидинила и тетрагидропиридазинила;
указанные циклоалкил или гетероциклил могут быть необязательно замещены по углероду одним или несколькими R7;
если гетероциклил в рамках R2 содержит -NH- фрагмент, то азот может быть необязательно замещен группой, выбранной из R8;
любой гетероциклил в рамках R2 необязательно несет 1 или 2 оксозаместителя;
R3 выбирают из водорода, C1-3алкила и C1-3алкокси;
R4 выбирают из водорода и C1-3алкила;
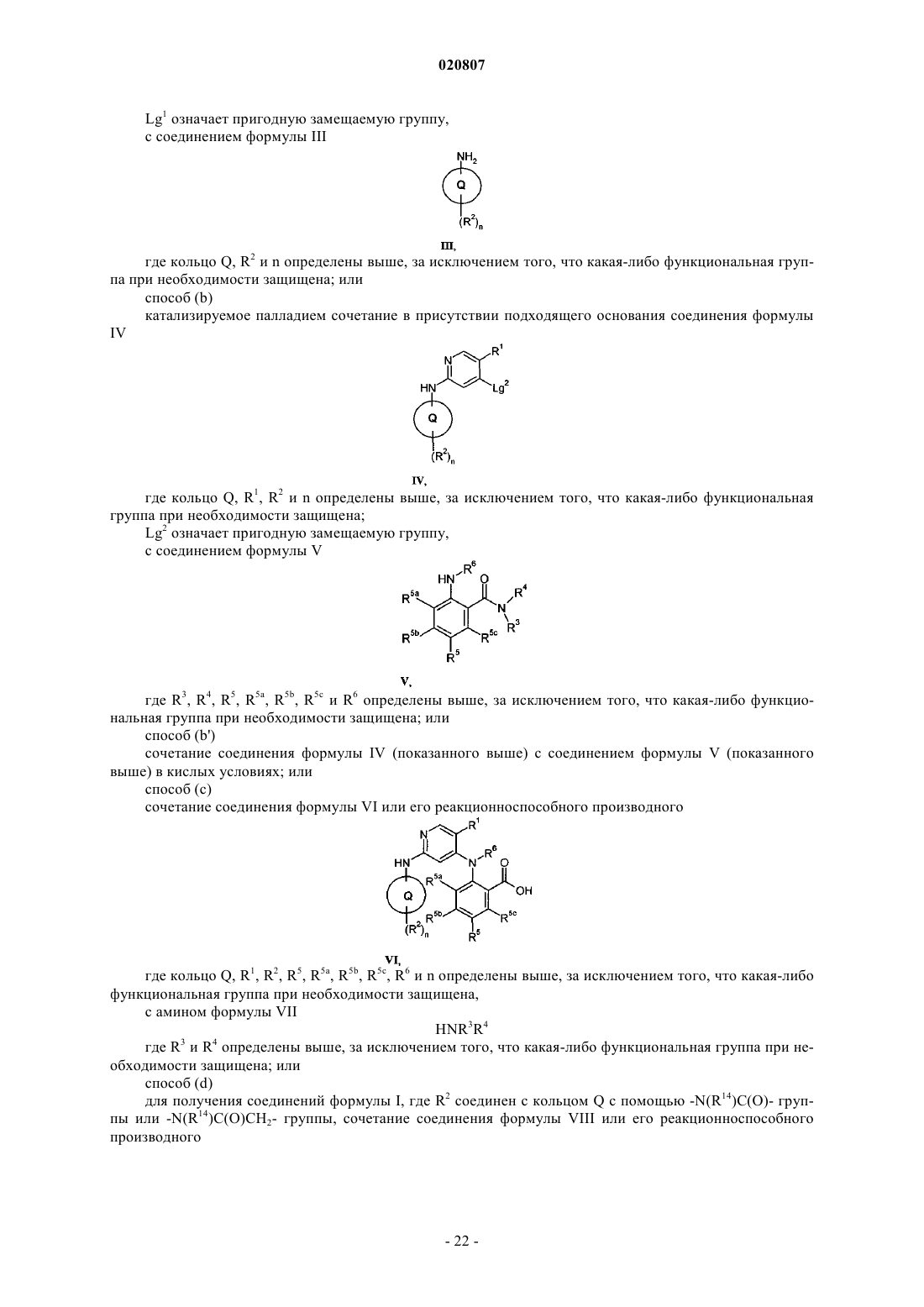
или группа C(O)NR3R4 вместе с атомом углерода, к которому она присоединена, и группа R5c вместе с атомом углерода, к которому она присоединена по положению 3 фенильного кольца, образуют гетероциклическое кольцо, конденсированное с фенильным кольцом так, что анилин в положении 4 на пиридиновом кольце в формуле I выбирают из:
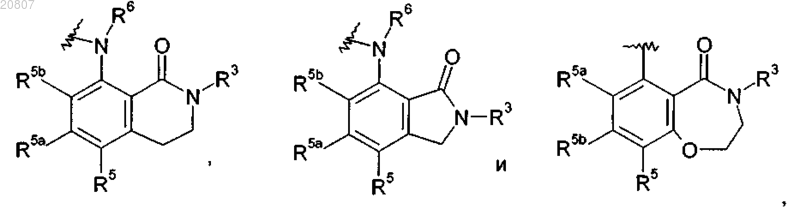
где гетероциклическое кольцо, таким образом образованное с помощью C(O)NR3R4 члена кольца, может быть необязательно замещено по углероду одним или несколькими R3a, выбранным из C1-4алкила, C1-4алкокси, гало, циано, гидрокси и оксо;
R5 выбирают из водорода, фторо, 4-метилпиперазинила и 4-изопропилпиперазинила;
R5a выбирают из водорода и фторо;
R5b означает водород;
R5c выбирают из водорода, гало и C1-4алкокси;
R6 означает водород;
R7 выбирают из гало, гидрокси, амино, карбамоила, C1-6алкила, С3-7циклоалкила, C1-6алкокси, C1-6алканоила, N-(C1-6алкил)амино, N,N-(C1-6алкил)2амино, N-(C1-6алкил)карбамоила, N,N-(C1-6алкил)2карбамоила и гетероциклила, где гетероциклил выбирают из азетидинила, тетрагидрофуранила, тетрагидропиранила, пирролидинила, морфолинила, пиперидинила, пиперазинила, гомопиперидинила, гомопиперазинила и диазепанила;
R7 может быть независимо необязательно замещен по углероду одним или несколькими R11, выбранными из гало, амино, гидрокси, метила, этила, циклопропила, циклобутила, метокси, этокси, метиламино, этиламино, диметиламино, диэтиламино и N-метил-N-этиламино; и если какой-либо гетероциклил в R7 содержит -NH- фрагмент, то азот может быть необязательно замещен группой, выбранной из R12;
любой гетероциклил или циклоалкил в рамках R7 необязательно несет 1 или 2 оксозаместителя;
R8 и R12 независимо выбирают из C1-6алкила, C1-6алканоила, C1-6алкилсульфонила, C1-6алкоксикарбонила, карбамоила, N-(C1-6алкил)карбамоила и N,N-(C1-6алкил)2карбамоила,
R8 и R12 могут быть необязательно замещены по углероду одним или несколькими R13;
R13 выбирают из гало, гидрокси, циклопропила, циклобутила, метокси и этокси;
R14 выбирают из водорода или C1-4алкила,
или его фармацевтически приемлемая соль.
2. Соединение формулы I по п.1 или его фармацевтически приемлемая соль, где R1 означает трифторметил.
3. Соединение формулы I по п.1 или его фармацевтически приемлемая соль, где R1 означает хлоро.
4. Соединение формулы I по любому из пп.1-3 или его фармацевтически приемлемая соль, где R3 означает метокси.
5. Соединение формулы I по любому из пп.1-4 или его фармацевтически приемлемая соль, где R5 означает водород.
6. Соединение формулы I по любому из пп.1-5 или его фармацевтически приемлемая соль, где R5a означает водород.
7. Соединение формулы I по любому из пп.1-6 или его фармацевтически приемлемая соль, где R5c означает водород.
8. Фармацевтическая композиция, которая включает соединение формулы I или его фармацевтически приемлемую соль по любому из пп.1-7 совместно с фармацевтически приемлемым разбавителем или носителем.
9. Применение соединения формулы I или его фармацевтически приемлемой соли по любому из пп.1-7 для приготовления лекарственного средства для лечения или профилактики рака.
10. Применение по п.9, где рак выбирают из рака легкого, рака желудка и рака яичника.
Текст
Изобретение относится к соединениям формулы I, которые ингибируют функцию киназы фокальной адгезии, способам их получения, фармацевтическим композициям, содержащим их в качестве активного ингредиента, к их применению в качестве лекарственных средств и к их применению для приготовления лекарственных средств для применения при лечении у теплокровных животных, таких как люди, заболеваний, таких как рак. Барлам Бернар Кристоф (FR), Фут Кевин Майкл (GB), Пле Патрик (FR),Джонс Клиффорд Дейвид (GB) Поликарпов А.В., Борисова Е.Н.,Соколова М.В. (RU) Область техники, к которой относится изобретение Настоящее изобретение относится к новым производным пиридина, к способам их получения и к композициям, содержащим их. Кроме того, настоящее изобретение относится к применению производных пиридина в терапии, в частности к способам лечения и предотвращения разных типов рака. Предпосылки создания изобретения Киназа фокальной адгезии (FAK) является членом подсемейства нерецепторных протеиновых тирозинкиназ и экспрессируется в различных типах тканей и клеток. FAK действует в качестве раннего модулятора в интегриновом каскаде передачи сигналов, так что кластеризация интегрина в ответ на различные стимулы приводит к FAK аутофосфорилированию по Tyr397. Это порождает мотив, который распознается различными белками, содержащими SH2 домен, такими как src. FAK-src комплекс связывает и фосфорилирует многие нижерасположенные в каскаде молекулы, такие как p130Cas, связанный с рецептором фактора роста белок-2 (Grb2) и фосфоинозитид-3 киназа (PI3K), таким образом трансдуцируя сигналы посредством многих различных комплексных путей, которые взаимодействуют друг с другом 1. В нормальных клетках FAK регулирует различные основные клеточные функции, такие как пролиферация и рост, защита от апоптоза, адгезия и распластывание клеток, инвазия и миграция. Повышенную экспрессию, активность или сигнализирование FAK связывают со злокачественностью множества раковых клеток, приводящей к стимулированию пролиферации раковых клеток, увеличению инвазии in vitro и увеличению метастазов in vivo 4. Кроме того, FAK, по-видимому, является ключевой молекулой в активации некоторых путей передачи сигналов, инициируемых ангиогенными факторами, включая пролиферацию, миграцию и дифференциацию. Показанная специфическая эндотелиально-клеточная делеция FAK является ключевой для стабильности сосудов во время развития сосудов 3. Вследствие этого, FAK может быть пригодна для лечения патологического ангиогенеза, например,в качестве антиангиогенной терапии при заболеваниях, таких как рак и ретинопатия. Ингибиторы FAK также могут оказывать благоприятные воздействия на пролиферацию или инвазивную способность опухолевых клеток 2. Появляются доказательства потенциальной корреляции между экспрессией FAK и злокачественным превращением, и поэтому ингибирование FAK могло бы замедлить прогрессирование заболевания. Международные заявки на патент WO 2008/115369, WO 2008/073687, WO 2007/072158,WO 2007/0633848, WO 2006/074057, WO 2006/021457, WO 2006/021454, WO 2005/123191,WO 2005/016894, WO 2004/080980 и WO 2001/64655 раскрывают соединения, которые, как установлено,проявляют ингибирующие FAK свойства. Соединение PF-00562271 находится на начальной стадии разработки в качестве FAK ингибитора для применения при лечении рака. Тем не менее, остается необходимость в поиске дополнительных соединений, которые являются ингибиторами FAK, в частности соединений, обеспечивающих соответствующие фармакокинетические и фармакодинамические свойства лекарственных средств, а также соединений, которые демонстрируют соответствующий(е) профиль(и) селективности по отношению к другим киназам и рецепторам. 1. Chatzizacharias, N.A. et al. Expert Opin. Ther. Targets. 2007; 11(10):1315-1328. 2. Angelucci, А et al. Current Pharmaceutical Design. 2007; 13:2129-2145. 3. Braren, R. et al. JCB 2006; 1:151-162. 4. Mitra, S.K. Current opinion in Cell Biology 2006; 18:516-523. 5. Chatzizacharias, N.A. et al. Histology Histopathol. 2008; 23:629-650. Краткое изложение сущности изобретения Согласно настоящему изобретению предложены соединения формулы IR2 выбирают из циано, С 1-6 алкила и C1-6 алкокси, где C1-6 алкил и C1-6 алкокси могут быть необязательно замещены по углероду одним или несколькими R7; или R2 выбирают из:(1) C3-7 циклоалкил-Х 1-, где X1 выбирают из прямой связи, -О-, -N(R14)C(O)- и -C(O)N(R14)-;(2) гетероциклил-Х 2-, где X2 означает прямую связь, где гетероциклил присоединен через углерод кX2, и его выбирают из азетидинила, тетрагидрофуранила, тетрагидропиранила, пирролидинила, морфолинила, тиоморфолинила, тиоморфолинил 1,1-диоксида, пиперидинила, пиперазинила, тетрагидротиенила, тетрагидротиенил 1,1-диоксида, гомопиперидинила, гомопиперазинила, хинуклидинила и тетрагидропиридазинила; указанные циклоалкил или гетероциклил могут быть необязательно замещены по углероду одним или несколькими R7; если гетероциклил в рамках R2 содержит -NH- фрагмент, то азот может быть необязательно замещен группой, выбранной из R8; любой гетероциклил в рамках R2 необязательно несет 1 или 2 оксозаместителя;R4 выбирают из водорода и C1-3 алкила; или группа C(O)NR3R4 вместе с атомом углерода, к которому она присоединена, и группа R5c вместе с атомом углерода, к которому она присоединена по положению 3 фенильного кольца, образуют гетероциклическое кольцо, конденсированное с фенильным кольцом так, что анилин в положении 4 на пиридиновом кольце в формуле I выбирают из: где гетероциклическое кольцо, таким образом образованное с помощью C(O)NR3R4 члена кольца,может быть необязательно замещено по углероду одним или несколькими R3a, выбранным из C1-4 алкила,C1-4 алкокси, гало, циано, гидрокси и оксо;R5a выбирают из водорода и фторо;R7 выбирают из гало, гидрокси, амино, карбамоила, C1-6 алкила, С 3-7 циклоалкила, C1-6 алкокси,C1-6 алканоила,N-(С 1-6 алкил)амино,N,N-(C1-6 алкил)2 амино,N-(C1-6 алкил)карбамоила,N,N-(C1-6 алкил)2 карбамоила и гетероциклила, где гетероциклил выбирают из азетидинила, тетрагидрофуранила, тетрагидропиранила, пирролидинила, морфолинила, пиперидинила, пиперазинила, гомопиперидинила, гомопиперазинила и диазепанила;R7 может быть независимо необязательно замещен по углероду одним или несколькими R11, выбранными из гало, амино, гидрокси, метила, этила, циклопропила, циклобутила, метокси, этокси, метиламино, этиламино, диметиламино, диэтиламино и N-метил-N-этиламино; и если какой-либо гетероциклил в R7 содержит -NH- фрагмент, то азот может быть необязательно замещен группой, выбранной изR12; любой гетероциклил или циклоалкил в рамках R7 необязательно несет 1 или 2 оксозаместителя;R8 и R12 независимо выбирают из C1-6 алкила, C1-6 алканоила, C1-6 алкилсульфонила,C1-6 алкоксикарбонила, карбамоила, N-(C1-6 алкил)карбамоила и N,N-(C1-6 алкил)2 карбамоила;R8 и R12 могут быть необязательно замещены по углероду одним или несколькими R13;R14 выбирают из водорода или C1-4 алкила,или их фармацевтически приемлемые соли. Предпочтительными являются соединения формулы I или их фармацевтически приемлемые соли,где R1 означает трифторметил. Также предпочтительными являются соединения формулы I или их фармацевтически приемлемые соли, где R1 означает хлоро. Также предпочтительными являются соединения формулы I или их фармацевтически приемлемые соли, где R3 означает метокси. Также предпочтительными являются соединения формулы I или их фармацевтически приемлемые соли, где R5 означает водород. Также предпочтительными являются соединения формулы I или их фармацевтически приемлемые соли, где R5a означает водород. Также предпочтительными являются соединения формулы I или их фармацевтически приемлемые соли, где R5c означает водород. Согласно настоящему изобретению также предложена фармацевтическая композиция, которая включает соединение формулы I или его фармацевтически приемлемую соль совместно с фармацевтиче-2 020807 ски приемлемым разбавителем или носителем. Согласно настоящему изобретению также предложено применение соединения формулы I или его фармацевтически приемлемой соли для приготовления лекарственного средства для лечения или профилактики рака, предпочтительно выбранного из рака легкого, рака желудка и рака яичника. Подробное описание изобретения В соответствии с настоящим изобретением заявители выявили новые соединения пиридина или их фармацевтически приемлемые соли, которые обладают ингибирующим действием по отношению к FAK и, следовательно, должны проявлять пролиферативное и/или проапоптическое и/или антиинвазивное и/или подавляющее подвижность клеток и/или антиангиогенное действие и быть пригодными для применения в способах лечения организма человека или животного, например при замедлении роста опухоли и метастазирования разных типов рака. Изобретение также относится к способам получения вышеуказанных соединений пиридина или их фармацевтически приемлемых солей, к фармацевтическим композициям, содержащим их, и к их применению для приготовления лекарственных средств для применения для выработки антипролиферативного и/или проапоптического и/или антиинвазивного и/или подавляющего подвижность клеток и/или антиангиогенного действия у теплокровных животных, таких как человек. Также в соответствии с настоящим изобретением заявители обеспечивают способы применения таких соединений пиридина или их фармацевтически приемлемых солей при лечении рака. Свойства заявленных в этом изобретении соединений, как ожидают, будут иметь ценность при лечении болезненных состояний, связанных с клеточной пролиферацией и патологическим ангиогенезом. Под "патологическим ангиогенезом" подразумевают нежелательный ангиогенез, который приводит к нежелательному медицинскому состоянию или заболеванию, такому как глазные болезни с пролиферацией сосудов сетчатки, например возрастная макулярная дегенерация (AMD). Патологический ангиогенез также происходит во многих солидных опухолях, таких как упомянутые в данном описании, и соединения в соответствии с изобретением могут быть пригодны при подавлении такого ангиогенеза. В частности, соединения в соответствии с изобретением или их фармацевтически приемлемые соли, как ожидают, являются пригодными при лечении разных типов рака (солидных опухолей и лейкемии), например при лечении или профилактики разных типов рака, выбранных из рака пищевода, миеломы, гепатоцеллюлярного рака, рака поджелудочной железы, рака шейки матки, опухоли Юинга, нейробластомы, саркомы Капоши, рака яичников, рака молочной железы, колоректального рака, рака предстательной железы, рака мочевого пузыря, меланомы, рака легкого - немелкоклеточного рака легкого (NSCLC), и мелкоклеточного рака легкого (SCLC), рака желудка, рака головы и шеи, рака почки, лимфомы и лейкемии; в частности, рака яичников, рака молочной железы, колоректального рака, рака предстательной железы, рака поджелудочной железы и рака легкого - NSCLC и SCLC. В настоящем описании изобретения термин "алкил" включает алкильные группы как с прямой цепью, так и с разветвленной цепью. Ссылки на конкретные алкильные группы, такие как "пропил" являются специфическими только для вариантов с прямой цепью, а ссылки на конкретные алкильные группы с разветвленной цепью, такие как "изопропил", являются специфическими только для вариантов с разветвленной цепью. Например, "C1-6 алкил" включает C1-4 алкил, C1-3 алкил, пропил, изопропил и т-бутил. Подобное правило применяется и к другим радикалам, например "фенил-C1-6 алкил" включает фенил-C1-4 алкил, бензил, 1-фенилэтил и 2-фенилэтил. Термин "Cm-n" или "Cm-n группа", используемый отдельно или в качестве приставки, относится к любой группе, имеющей от m до n атомов углерода."Алкиленовая" группа означает алкильную группу, которая расположена между и служит для соединения двух других химических групп. Таким образом, "C1-6 алкилен" означает линейный насыщенный двухвалентный углеводородный радикал, состоящий из одного-шести атомов углерода или разветвленный насыщенный двухвалентный углеводородный радикал, состоящий из трех-шести атомов углерода,например метилен, этилен, пропилен, 2-метилпропилен, пентилен и подобные.C1-6 алкиленовой группе, обе из которых определены здесь. Термин "гало" относится к фтору, хлору, брому и йоду."Галоалкил" означает алкил, замещенный одним или несколькими одинаковыми или разными атомами галогенов, например -CH2Cl, -CF3, -CH2CF3, -CH2CCl3 и подобные. Термин "гетероциклил", "гетероциклический" или "гетероцикл" означает неароматическую насыщенную или частично насыщенную моноциклическую, конденсированную, соединенную мостиком, или спиробициклическую гетероциклическую кольцевую систему(ы). Термин гетероциклил включает как моновалентные, так и двухвалентные радикалы. Моноциклические гетероциклические кольца содержат от около 3 до 12 (подходяще от 3 до 7) атомов в кольце, вместе с от 1 до 5 (подходяще 1, 2 или 3) гетероатомами в кольце, выбранными из азота, кислорода или серы. Бициклические гетероциклы содержат в кольце от 7 до 17 атомов-членов, подходяще от 7 до 12 атомов-членов. Бициклические гетероцикличе-3 020807 ские кольца могут быть конденсированными, спиро или соединенными мостиками кольцевыми системами. Примеры гетероциклических групп включают циклические простые эфиры, такие как оксиранил,оксетанил, тетрагидрофуранил, диоксанил и замещенные циклические простые эфиры. Гетероциклы,содержащие азот, включают, например, азетидинил, пирролидинил, пиперидинил, пиперазинил, тетрагидротиазинил, тетрагидропиразолил и подобные. Типичные серосодержащие гетероциклы включают тетрагидротиенил, дигидро-1,3-дитиол, тетрагидро-2H-тиопиран и гексагидротиепин. Другие гетероциклы включают дигидрооксатиолил, тетрагидрооксазолил, тетрагидрооксадиазолил, тетрагидродиоксазолил, тетрагидрооксатиазолил, гексагидротиазинил, тетрагидрооксазинил, морфолинил, тиоморфолинил,тетрагидропиримидинил, диоксолинил, октагидробензофуранил, октагидробензимидазолил и октагидробензотиазолил. В случае гетероциклов, содержащих серу, гетероциклы с окисленной серой, содержащие группы SO или SO2, также включены. Примеры включают сульфоксидную и сульфоновую форму тетрагидротиенила и тиоморфолинила, например тетрагидротиен 1,1-диоксид и тиоморфолинил 1,1-диоксид. Подходящим значением для гетероциклильной группы, которая несет 1 или 2 оксо (=O) или тиоксо (=S) заместителя, является, например, 2-оксопирролидинил, 2-тиоксопирролидинил, 2-оксоимидазолидинил,2-тиоксоимидазолидинил, 2-оксопиперидинил, 2,5-диоксопирролидинил, 2,5-диоксоимидазолидинил или 2,6-диоксопиперидинил. Отдельные гетероциклильные группы являются насыщенными моноциклическими 3-7-членными гетероциклилами, содержащими 1, 2 или 3 гетероатома, выбранных из азота, кислорода или серы, например азетидинил, тетрагидрофуранил, тетрагидропиранил, пирролидинил, морфолинил, тетрагидротиенил, тетрагидротиенил 1,1-диоксид, тиоморфолинил, тиоморфолинил 1,1-диоксид,пиперидинил, гомопиперидинил, пиперазинил или гомопиперазинил. Специалист в данной области техники поймет, что любой гетероцикл может быть присоединен к другой группе с помощью любого пригодного атома, как, например, через атом углерода или азота. Тем не менее, ссылка здесь на пиперидино или морфолино относится к пиперидин-1-ильному или морфолин-4-ильному кольцу, которое присоединено через азот кольца. Под "соединенными мостиком кольцевыми системами" понимают кольцевые системы, в которых два кольца делят более чем два атома, см., например, Advanced Organic Chemistry, авт. Jerry March, 4-е изд., Wiley Interscience, c. 131-133, 1992. Примеры соединенных мостиком гетероциклильных кольцевых систем включают азабицикло[2.2.1]гептан, 2-окса-5-азабицикло[2.2.1]гептан, азабицикло[2.2.2]октан,азабицикло[3.2.1]октан и хинуклидин.C1-6 алкиленовой группе, обе из которых определены здесь. Данное описание изобретения также использует некоторые составные термины для описания групп,которые содержат более чем одну функциональность. Такие термины должны интерпретироваться, как установлено в данной области техники. Например, гетероциклил-Cm-n-алкил включает Cm-n-алкил, замещенный с помощью гетероциклила,аN-(C1-6 алкил)амино, замещенный с помощью карбонильной группы, где карбонил замещен с помощьюC1-6 алкоксигруппы т.е. C1-6 алкокси присоединен к амино через карбонильную группу, т.е. означает-N(C1-6 алкил)-С(О)-OC1-6 алкил. Примеры заместителей в рамках соединения формулы I перечислены ниже. Многие из этих примеров также будут применяться для других Cm-n значений, например примеры для C1-4 алкила также включают метил, этил, пропил, изопропил и трет-бутил. Примеры включают (но не обязательно ограничены перечисленным): Термин "необязательно замещенный" относится как к замещенным, так и к незамещенным группам,структурам или молекулам. Следует понимать, что определение "необязательные заместители выбирают из "одной или нескольких" групп" включает все заместители, выбранные из одной из указанных групп, или заместители,выбранные из двух или большего числа указанных групп. "Один или несколько" включает (но не ограничивается) "1, 2 или 3", "1 или 2" и "1". Когда, как определено здесь, например, R2 означает С 3-7 циклоалкил-Х 1- и, например, X1 означает 14-N(R )C(O)- связывающую группу, к циклоалкильной группе присоединен атом азота, а не атом углерода -N(R14)C(O)- связывающей группы. Такой же принцип применяется к другой группе формулы "гетероциклил-Х", определенной здесь. В случае если указано, что C(O)NR3R4 группа вместе с атомом углерода, к которому она присоединена, и группа R5c вместе с атомом углерода, к которому она присоединена (в положении 3 на фенильном кольце), образуют гетероциклическое кольцо, где гетероциклическое кольцо содержит -C(O)N(R3)- группу в качестве члена кольца, таким образом образованное кольцо является конденсированным с фенильным кольцом так, что таким образом образованное соединение формулы I описывается формулой I' где кольцо Q, n, R1, R2, R5, R5a, R5b и R6 определены выше; кольцо А означает гетероциклическое кольцо, содержащее группу C(O)N(R3) в качестве члена кольца; где R3 имеет определенное выше значение; или N(R3) член кольца вместе с расположенным рядом членом кольца образуют гетероциклическое кольцо; кольцо А или любое гетероциклическое кольцо, образованное с помощью NR3 члена кольца, может быть необязательно замещено по углероду одним или несколькими R3a, выбранными из C1-4 алкила,C1-4 алкокси, гало, циано, гидрокси и оксо. Кольцо А соответственно является 5-, 6- или 7-членным моноциклическим гетероциклическим кольцом, конденсированным с фенильным кольцом, где гетероциклическое кольцо необязательно замещено, как определено выше. Например, в соединениях формулы I' группа формулы может представлять собой, например, где в каждом случае кольцо А необязательно замещено, как определено выше;R3 имеет определенное выше значение или N(R3) член кольца вместе с расположенным рядом членом кольца образуют гетероциклическое кольцо, где гетероциклическое кольцо необязательно замещено,как определено выше. Различные функциональные группы и заместители, составляющие соединения формулы I, типично выбирают таким образом, чтобы молекулярная масса соединения формулы I не превышала 1000. Более предпочтительно молекулярная масса соединения должна быть менее чем 750, например менее чем 700,или менее чем 650, или менее чем 600, или менее чем 550. Более предпочтительно молекулярная масса соединения составляет менее чем 525 и, например, равняется 500 или менее. Пригодной фармацевтически приемлемой солью соединения изобретения является, например, соль присоединения кислоты к соединению изобретения, которое является в достаточной мере основным, например, соль присоединения кислоты с, например, неорганической или органической кислотой, например соляной, бромисто-водородной, серной, фосфорной, трифторуксусной, муравьиной, лимонной или малеиновой кислотой. Кроме того, пригодной фармацевтически приемлемой солью соединения изобретения, которое является в достаточной мере кислым, является соль щелочного металла, например соль натрия или калия, соль щелочно-земельного металла, например соль кальция или магния, соль аммония или соль с органическим основанием, которое дает физиологически приемлемый катион, например соль с метиламином, диметиламином, триметиламином, пиперидином, морфолином или трис-(2 гидроксиэтил)амином. Соединения, которые имеют такую же молекулярную формулу, но отличаются природой или последовательностью соединения своих атомов, или расположением своих атомов в пространстве, объединены термином "изомеры". Изомеры, которые различаются расположением своих атомов в пространстве,объединены термином "стереоизомеры". Стереоизомеры, которые не являются зеркальными изображениями друг друга, объединены термином "диастереоизомеры", а те, которые являются ненакладываемыми зеркальными изображениями друг друга, объединены термином "энантиомеры". Когда соединение имеет асимметричный центр, например атом, присоединенный к четырем разным группам, возможно существование пары энантиомеров. Энантиомеры могут характеризоваться абсолютной конфигурацией их асимметричных центров и описываться правилами R- и S-последовательности Кана и Прелога, или методом, основанным на способности молекулы вращать плоскость поляризованного света и определяемой как правовращающая или левовращающая (т.е. как (+) или (-)-изомеры соответственно). Хиральное соединение может существовать в виде или индивидуального энантиомера, или в виде их смеси. Смесь,содержащая одинаковые части энантиомеров, называется "рацемическая смесь". Соединения настоящего изобретения могут иметь один или несколько асимметричных центров; вследствие этого такие соединения могут получаться или в виде индивидуальных (R)- или (S)стереоизомеров, или в виде их смесей. Если не указано иное, описание или присваивание названия отдельному соединению в описании изобретения и формуле предназначено для включения и индивидуальных энантиомеров и их смесей, рацемических или других. Способы определения стереохимии и разделения стереоизомеров хорошо известны в уровне техники (см. обсуждение в главе 4 "Advanced OrganicChemistry", 4-е изд. J. March, John Wiley and Sons, New York, 2001), например, стереоизомеры могут быть получены путем синтеза из оптически активных исходных веществ или путем разделения рацемической формы. Некоторые соединения согласно изобретению могут иметь геометрические изомерные центры(Е- и Z-изомеры). Следует понимать, что настоящее изобретение охватывает все оптические изомеры,диастереоизомеры и геометрические изомеры и их смеси, которые обладают ингибирующим действием по отношению к FAK. Также следует понимать, что определенные соединения формулы I могут существовать в сольватированной так же, как и в несольватированной формах, таких как, например, гидратированные формы. Следует понимать, что изобретение охватывает все такие сольватированные формы, которые обладают ингибирующим действием по отношению к FAK. Также следует понимать, что определенные соединения формулы I могут демонстрировать поли-6 020807 морфизм и что изобретение охватывает все такие формы, которые обладают ингибирующим действием по отношению к FAK. Соединения формулы I могут существовать в нескольких разных таутомерных формах и ссылка на соединения формулы I включает все такие формы. Во избежание недоразумений следует отметить, что в случае, когда соединение может существовать в любой одной из нескольких таутомерных форм, но только одна из них специально описана или показана, то все другие такие формы все же также охватываются формулой I. Примеры таутомерных форм включают кето-, енол- и енолят-формы, как, например, в следующих таутомерных парах: кето/енол (проиллюстрирована ниже), имин/енамин, амид/имино-спирт,амидин/амидин, нитрозо/оксим, тиокетон/ентиол и нитро/ацинитро. Соединения формулы I, содержащие аминную функцию, также могут образовывать N-оксиды. Ссылка при этом на соединение формулы I, которое содержит аминную функцию, также включает Nоксид. В случае, когда соединение содержит несколько аминных функций, один или более чем один атом азота может быть окислен с образованием N-оксида. Отдельными примерами N-оксидов являются Nоксиды третичного амина или атома азота азотсодержащего гетероцикла. N-оксиды можно получить путем обработки соответствующего амина окислителем, таким как пероксид водорода или перкислотойL.W. Deady (Syn. Comm. 1977, 7, 509-514), в которой соединение амина вводят в реакцию с мхлорпероксибензойной кислотой (МСРВА), например, в инертном растворителе, таком как дихлорметан. Соединения формулы I могут быть введены в виде пролекарства, которое разлагается в организме человека или животного с высвобождением соединения согласно изобретению. Пролекарство может применяться для изменения физических свойств и/или фармакокинетических свойств соединения согласно изобретению. Пролекарство может быть образовано в случае, когда соединение согласно изобретению содержит пригодную группу или заместитель, к которому может быть присоединена группа, модифицирующая свойства. Примеры пролекарств включают расщепляемые in vivo производные сложного эфира, которые могут быть образованы при помощи карбоксильной или гидроксильной группы в соединении формулы I и расщепляемые in-vivo амидные производные, которые могут быть образованы при помощи карбоксильной или аминогруппы в соединении формулы I. Соответственно, настоящее изобретение включает те соединения формулы I, как определено выше,которые доступны путем органического синтеза и которые доступны в организме человека или животного путем расщепления их пролекарства. Соответственно, настоящее изобретение включает те соединения формулы I, которые получаются с помощью органических синтетических методов, и также соединения,которые продуцируются в организме человека или животного путем метаболизма соединенияпредшественника, т.е. соединение формулы I может быть синтетически полученным соединением или метаболически продуцированным соединением. Пригодным фармацевтически приемлемым пролекарством соединения формулы I является таковое,которое, исходя из обоснованной медицинской оценки, является пригодным для введения в организм человека или животного без нежелательной фармакологической активности и без чрезмерной токсичности. Различные формы пролекарств описаны, например, в следующих документах:h) E. Roche (редактор), "Bioreversible Carriers in Drug Design", Pergamon Press, 1987. Пригодным фармацевтически приемлемым пролекарством соединения формулы I, которое имеет карбоксильную группу, является, например, его сложный эфир, расщепляемый in vivo. Расщепляемым invivo сложным эфиром соединения формулы I, содержащим карбоксильную группу, является, например,фармацевтически приемлемый сложный эфир, который расщепляется в организме человека или животного с получением исходной кислоты. Пригодные фармацевтически приемлемые сложные эфиры в случае присутствия карбоксильной группы, включают C1-6 алкиловые сложные эфиры, такие как метиловые,этиловые и трет-бутиловые, C1-6 алкоксиметиловые сложные эфиры, такие как метоксиметиловые сложные эфиры, C1-6 алканоилоксиметиловые сложные эфиры, такие как пивалоилоксиметиловые сложные эфиры, 3-фталидиловые сложные эфиры, С 3-8 циклоалкилкарбонилокси-С 1-6 алкиловые сложные эфиры,-7 020807 такие как циклопентилкарбонилоксиметиловые и 1-циклогексилкарбонилоксиэтиловые сложные эфиры,2-оксо-1,3-диоксоленилметиловые сложные эфиры, такие как 5-метил-2-оксо-1,3-диоксолен-4-илметиловые сложные эфиры и С 1-6 алкоксикарбонилокси-C1-6 алкиловые сложные эфиры, такие как метоксикарбонилоксиметиловые и 1-метоксикарбонилоксиэтиловые сложные эфиры. Пригодным фармацевтически приемлемым пролекарством соединения формулы I, которое имеет гидроксильную группу, является, например, его сложный или простой эфир, расщепляемый in vivo. Расщепляемым in vivo сложным или простым эфиром соединения формулы I, содержащего гидроксильную группу, является, например, фармацевтически приемлемый сложный или простой эфир, который расщепляется в организме человека или животного с получением исходного гидроксильного соединения. Пригодные фармацевтически приемлемые группы для образования сложного эфира с гидроксильной группой включают неорганические сложные эфиры, такие как фосфатные сложные эфиры (включая фосфорамидные циклические сложные эфиры). Дальнейшие пригодные фармацевтически приемлемые группы для образования сложного эфира с гидроксильной группой включают C1-10 алканоильные группы, такие как ацетильная, бензоильная, фенилацетильная и замещенная бензоильная и фенилацетильная группы,С 1-10 алкоксикарбонильные группы, такие как этоксикарбонильные, N,N-(C1-6)2 карбамоильные, 2 диалкиламиноацетильные и 2-карбоксиацетильные группы. Примеры заместителей кольца в фенилацетильной и бензоильной группах включают аминометил, N-алкиламинометил, N,N-диалкиламинометил,морфолинометил, пиперазин-1-илметил и 4-(С 1-4 алкил)пиперазин-1-илметил. Пригодные фармацевтически приемлемые группы для образования простого эфира с гидроксильной группой включают аацилоксиалкильные группы, такие как ацетоксиметильная и пивалоилоксиметильная группы. Пригодным фармацевтически приемлемым пролекарством соединения формулы I, которое имеет карбоксильную группу, является, например, его амид, расщепляемый in vivo, например амид, образованный с амином, таким как аммиак, С 1-4 алкиламин, такой как метиламин, (C1-4 алкил)2 амин, такой как диметиламин, N-этил-N-метиламин или диэтиламин, C1-4 алкокси-C2-4 алкиламин, такой как 2 метоксиэтиламин, фенил-С 1-4 алкиламин, такой как бензиламин, и аминокислотами, такими как глицин,или их сложными эфирами. Пригодным фармацевтически приемлемым пролекарством соединения формулы I, которое имеет аминогруппу, является, например, его амидное производное, расщепляемое in vivo. Пригодные фармацевтически приемлемые амиды, полученные исходя из аминогрупп, включают, например, амид, полученный с C1-10 алканоильными группами, такими как ацетильная, бензоильная, фенилацетильная и замещенная бензоильная и фенилацетильная группы. Примеры заместителей кольца в фенилацетильной и бензоильной группах включают аминометил, N-алкиламинометил, N,N-диалкиламинометил, морфолинометил, пиперазин-1-илметил и 4-(С 1-4 алкил)пиперазин-1-илметил. Действие in vivo соединения формулы I может частично осуществляться посредством одного или нескольких метаболитов, которые образуются в организме человека или животного после введения соединения формулы I. Как указано выше, действие in vivo соединения формулы I может также осуществляться путем метаболизма предшествующего соединения (пролекарства)."Проведение лечения" или "лечение" заболевания включает: 1) предотвращение заболевания, т.е. предупреждение развития клинических симптомов заболевания у млекопитающего, которое может быть незащищенным или предрасположенным к заболеванию, но все еще не испытывает или не проявляет симптомы заболевания; 2) подавление заболевания, т.е. остановку или уменьшение развития заболевания или его клинических симптомов; или 3) облегчение заболевания, т.е. обеспечение обратного развития заболевания или его клинических симптомов."Терапевтически эффективное количество" означает количество соединения, которое при введении млекопитающему для проведения лечения заболевания является достаточным для осуществления такого лечения заболевания. "Терапевтически эффективный количество" будет варьироваться в зависимости от соединения, заболевания и его серьезности, возраста, веса и т.д. млекопитающего, получающего лечение. Фраза "соединение изобретения" означает соединения, которые раскрыты здесь, и в общем, и более точно. Отдельные новые соединения изобретения включают, например, соединения формулы I или их фармацевтически приемлемые соли, где, если не указано иное, каждая из переменных - кольцо Q, R1, R2,R3, R4, R5, R5a, R5b, R6 и n - имеет любое из значений, определенных выше или в любом из абзацев (1)-(62) ниже:(5) R1 выбирают из фтора и хлора.(10) R2 выбирают из циано, C1-6 алкила, C1-6 алкокси, С 3-7 циклоалкил-Х 1- и гетероциклил-Х 2-; где C1-6 алкил, C1-6 алкокси, С 3-7 циклоалкил и гетероциклил могут быть необязательно замещены по углероду одним или несколькими R7, и если гетероциклил в рамках R2 содержит -NH- фрагмент, то азот может быть необязательно замещен группой, выбранной из R8; и где любой гетероциклил в рамках R2 необязательно несет 1 или 2 оксозаместителей;R7 может быть необязательно замещен по углероду одним или несколькими R11, выбранными из гало, амино, гидрокси, метила, этила, циклопропила, циклобутила, метокси, этокси, метиламино, этиламино, диметиламино, диэтиламино и N-метил-N-этиламино; и если какой-либо гетероциклил в R7 содержит-NH- фрагмент, то азот может быть необязательно замещен группой, выбранной из R12; любой гетероциклил или циклоалкил в рамках R7 необязательно несет 1 или 2 оксозаместителя;R8 и R12 независимо выбирают из C1-6 алкила, C1-6 алканоила, C1-6 алкилсульфонила,С 1-6 алкоксикарбонила, карбамоила, N-(C1-6 алкил)карбамоила и N,N-(C1-6 алкил)2 карбамоила,R8 и R12 могут быть необязательно замещены по углероду одним или несколькими R13;R14 выбирают из водорода или C1-4 алкила.(11) R2 выбирают из циано, C1-6 алкила и C1-6 алкокси, где C1-6 алкил и C1-6 алкокси могут быть необязательно замещены по углероду одним или несколькими R7; или R2 выбирают из:(1) C3-7 циклоалкил-Х 1-, где X1 выбирают из прямой связи, -О-, -N(R14)C(O)- и -C(O)N(R14)-;(2) гетероциклил-Х 2-, где X2 означает прямую связь, где гетероциклил присоединен через углерод к 2X , и его выбирают из азетидинила, тетрагидрофуранила, тетрагидропиранила, пирролидинила, морфолинила, тиоморфолинила, тиоморфолинил 1,1-диоксида, пиперидинила, пиперазинила, тетрагидротиенила, тетрагидротиенил 1,1-диоксида, гомопиперидинила, гомопиперазинила, хинуклидинила и тетрагидропиридазинила; указанные циклоалкил или гетероциклил могут быть необязательно замещены по углероду одним или несколькими R7; если гетероциклил в рамках R2 содержит -NH- фрагмент, то азот может быть необязательно замещен группой, выбранной из R8; любой гетероциклил в рамках R2 необязательно несет 1 или 2 оксозаместителя;(b) гетероциклила, где гетероциклил выбирают из азетидинила, тетрагидрофуранила, тетрагидропиранила, пирролидинила, морфолинила, пиперидинила, пиперазинила, гомопиперидинила, гомопиперазинила и диазепанила; где R7 может быть независимо необязательно замещен по углероду одним или несколькими R11,выбранными из гало, амино, гидрокси, метила, этила, циклопропила, циклобутила, метокси, этокси, метиламино, этиламино, диметиламино, диэтиламино и N-метил-N-этиламино; и если какой-либо гетероциклил в R7 содержит -NH- фрагмент, то азот может быть необязательно замещен группой, выбранной изR12; любой гетероциклил или циклоалкил в рамках R7 необязательно несет 1 или 2 оксозаместителя;R8 и R12 независимо выбирают из C1-6 алкила, C1-6 алканоила, C1-6 алкилсульфонила,C1-6 алкоксикарбонила, карбамоила, N-(C1-6 алкил)карбамоила и N,N-(C1-6 алкил)2 карбамоила,R8 и R12 могут быть необязательно замещены по углероду одним или несколькими R13;R14 выбирают из водорода или C1-4 алкила.(12) R2 выбирают из циано, метила, метокси, циклопропила, где метил может быть необязательно замещен по углероду одним или несколькими R7a; илиC1-4 алкил может быть необязательно замещен 1, 2 или 3 гало, гидрокси или метоксигруппами; илиR2 означает гетероциклил-Х 2-, где X2 означает прямую связь, где гетероциклил присоединен через углерод к X2 и выбран из тетрагидропиранила, пиперидинила и пиперазинила, где гетероциклил может быть необязательно замещен по углероду одним или несколькими R7, и если гетероциклил в рамках R2 содержит -NH- фрагмент, то азот может быть необязательно замещен группой, выбранной из R8; и где любой гетероциклил в рамках R2 необязательно несет оксозаместители;R7a выбирают из N-(C1-6 алкил)карбамоила или N,N-(C1-6 алкил)2 карбамоила или R7a означает гетеро-9 020807 циклил, где гетероциклил выбирают из пирролидинила, морфолинила, пиперидинила, пиперазинила и диазепанила;R7a может быть необязательно замещен по углероду одним или несколькими R11, выбранными из метила, метокси, метиламино, диметиламино, диэтиламино и R7a может быть необязательно замещен по азоту метилом;R7b означает метил или ацетил;(13) R2 выбирают из циано, метила, метокси, циклопропила, где метил может быть необязательно замещен по углероду одним или несколькими R7a; илиR2 означает гетероциклил-Х 2-, где X2 означает прямую связь, где гетероциклил присоединен через углерод к X2 и выбран из тетрагидропиранила, пиперидинила и пиперазинила, где гетероциклил может быть необязательно замещен по углероду одним или несколькими R7b, и если гетероциклил в рамках R2 содержит -NH- фрагмент, то азот может быть необязательно замещен группой, выбранной из R8; и где любой гетероциклил в рамках R2 необязательно несет оксозаместители;R7a выбирают из N-(C1-6 алкил)карбамоила или N,N-(C1-6 алкил)2 карбамоила, или R7a означает гетероциклил, где гетероциклил выбирают из пирролидинила, морфолинила, пиперидинила, пиперазинила и диазепанила;R7a может быть необязательно замещен по углероду одним или несколькими R11, выбранными из метила, метокси, метиламино, диметиламино, диэтиламино; и R7a может быть необязательно замещен по азоту метилом;R2 означает гетероциклическое кольцо, выбранное из пиперидинила, пиперазинила и тетрагидропиранила, где кольцо само необязательно замещено метилом или ацетилом и необязательно несет оксозаместитель; илиR2 означает гетероциклическое кольцо, выбранное из пиперидина, пиперазинила и тетрагидропиранила, где кольцо само необязательно замещено метилом или ацетилом и необязательно несет оксозаместитель; или показывает место присоединения кольца Q к NH группе в формуле I. где показывает место присоединения кольца Q к NH группе в формуле I. где показывает место присоединения кольца Q к NH группе в формуле I. где показывает место присоединения кольца Q к NH группе в формуле I. Как будет ясно, кольцо Q в (22)-(26) выше необязательно замещено с помощью n R2 групп, как определено выше, например n и R2 принимают значения, определенные в любом из (10)-(21) выше. дополнительно выбирают из 1,5-диметилпиразол-4-ила, 1-этил-3-метилпиразол-4-ила, 1 изобутилпиразол-4-ила, 1-этилпиразол-4-ила, 1,3,5-триметилпиразол-4-ила, 1-изопропилпиразол-4-ила,1-метил-3-трифторметилпиразол-4-ила, 1,3-диметилпиразол-5-ила, 1-метилпиразол-5-ила, 1-метил-3 циклопропилпиразол-5-ила,1-этилпиразол-5-ила,1-трет-бутил-3-этил-4-метилпиразол-5-ила,1 пиперидин-4-илпиразол-3-ила, 4-циано-5-(4-метилпиперазидин-1-ил)пиразол-3-ила, 1-метилпиразол-3 ила,1-этилпиразол-3-ила,1-метил-3-метоксипиразол-5-ила,3-метилпиразол-4-ила,1-метил-3 метоксипиразол-4-ила, 1-метил-3-цианопиразол-4-ила, 1-метил-3-(метоксиметил)пиразол-4-ила, 1-метил 3-(метиламинокарбонил)пиразол-4-ила,1-метил-3-(диметиламинокарбонил)пиразол-4-ила,1-(2 гидроксиэтил)пиразол-4-ила, 1-дифторметил-3-метилпиразол-4-ила и 1-изопропил-3-метилпиразол-4 ила.(30) R3 выбирают из водорода и C1-3 алкила.(42) R3 выбирают из C1-3 алкокси (в частности, R3 означает C1-3 алкокси, такой как метокси) и R4 выбирают из водорода и C1-3 алкила.(48) Группа C(O)NR3R4 вместе с атомом углерода, к которому она присоединена, и группа R5c вместе с атомом углерода, к которому она присоединена (в положении 3 на фенильном кольце), образуют гетероциклическое кольцо, конденсированное с фенильным кольцом так, что анилин в положении 4 на пиридиновом кольце в формуле I изображается формулой где гетероциклическое кольцо, таким образом образованное с помощью C(O)NR3R4 члена кольца,может быть необязательно замещено по углероду одним или несколькими R3a, выбранными изC1-4 алкила, C1-4 алкокси, гало, циано, гидрокси и оксо; и R3, R5, R5a, R5 и R6 имеют любое из значений,определенных здесь.(49) C(O)NR3R4 группа вместе с атомом углерода, к которому она присоединена, и группа R5c вместе с атомом углерода, к которому она присоединена (в положении 3 на фенильном кольце), образуют гетероциклическое кольцо, конденсированное с фенильным кольцом так, что анилин в положении 4 на пиридиновом кольце в формуле I изображается формулой где гетероциклическое кольцо, таким образом образованное с помощью C(O)NR3R4 члена кольца,может быть необязательно замещено по углероду одним или несколькими R3a, как определено здесь, иR3, R5, R5a, R5b и R6 имеют любое из значений, определенных здесь.(50) Группа C(O)NR3R4 вместе с атомом углерода, к которому она присоединена, и группа R5c вместе с атомом углерода, к которому она присоединена (в положении 3 на фенильном кольце), образуют гетероциклическое кольцо, конденсированное с фенильным кольцом так, что анилин в положении 4 на пиридиновом кольце в формуле I изображается формулой где гетероциклическое кольцо, таким образом образованное с помощью C(O)NR3R4 члена кольца,может быть необязательно замещено по углероду одним или несколькими R3a, как определено здесь, иR3, R5, R5a, R5b и R6 имеют любое из значений, определенных здесь.(51) Группа C(O)NR3R4 вместе с атомом углерода, к которому она присоединена, и группа R5c вместе с атомом углерода, к которому она присоединена (в положении 3 на фенильном кольце), образуют гетероциклическое кольцо, конденсированное с фенильным кольцом так, что анилин в положении 4 на пиридиновом кольце в формуле I изображается формулой где гетероциклическое кольцо, таким образом образованное с помощью C(O)NR3R4 члена кольца,может быть необязательно замещено по углероду одним или несколькими R3a, как определено здесь, иR3, R5, R5a, R5b и R6 имеют любое из значений, определенных здесь.(53) R5 означает водород или фтор.(55) R5a означает водород или фтор.(60) R5c означает водород или фтор (в частности, водород).(61) R5c означает водород или метокси.(62) R6 означает водород. В одном варианте осуществления изобретения обеспечивается соединение формулы I или его фармацевтически приемлемая соль, где кольцо Q означает пиразолил;R1 выбирают из фтора и хлора (в частности, R1 означает хлор, более предпочтительно R1 означает фтор);R2 принимает определенные выше значения, например определенные в любом одном из пунктовR4 выбирают из водорода и C1-3 алкила (например, R3 означает C1-3 алкил, такой как метил, и R4 означает водород); или группа C(O)NR3R4 вместе с атомом углерода, к которому она присоединена, и группа R5c вместе с атомом углерода, к которому она присоединена (в положении 3 на фенильном кольце), образуют гетероциклическое кольцо, конденсированное с фенильным кольцом так, что анилин в положении 4 на пиридиновом кольце в формуле I выбирают из где гетероциклическое кольцо, таким образом образованное с помощью C(O)NR3R4 члена кольца,может быть необязательно замещено по углероду одним или несколькими R3a, выбранными изR6 означает водород. В другом варианте осуществления изобретения обеспечивается соединение формулы I или его фармацевтически приемлемая соль, где кольцо Q означает пиразолил;R2 принимает определенные выше значения, например определенные в любом одном из (10)-(18) выше;R4 выбирают из водорода и C1-3 алкила (например, R3 означает C1-3 алкил, такой как метил, и R4 означает водород); или группа C(O)NR3R4 вместе с атомом углерода, к которому она присоединена, и группа R5c вместе с атомом углерода, к которому она присоединена (в положении 3 на фенильном кольце), образуют гетероциклическое кольцо, конденсированное с фенильным кольцом так, что анилин в положении 4 на пиридиновом кольце в формуле I выбирают из где гетероциклическое кольцо, таким образом образованное с помощью C(O)NR3R4 члена кольца,может быть необязательно замещено по углероду одним или несколькими R3a, выбранными изR6 означает водород. В другом варианте осуществления изобретения обеспечивается соединение формулы I или его фармацевтически приемлемая соль формулы Ia где кольцо Q, R1, R2, R5, R5a, R5b, R5c и n имеют любое из значений, определенных здесь;R3 выбирают из водорода, С 1-3 алкила и С 1-3 алкокси (в частности, R3 выбирают из водорода иR6 означает водород. В отдельном варианте осуществления в соединении формулы Ia R3 означает C1-3 алкил, такой как метил, и R4 означает водород. В другом варианте осуществления изобретения обеспечивается соединение формулы Ia (показанной выше) или его фармацевтически приемлемая соль, где кольцо Q выбирают изR2 принимает значение, определенное в пункте (14) выше и более предпочтительно определенное в пункте (16) выше;R3 выбирают из водорода, C1-3 алкила и C1-3 алкокси (в частности, R3 выбирают из C1-3 алкила, такого как метил и C1-3 алкокси, такого как метокси);R5a означает водород или фторо;R6 означает водород. В другом варианте осуществления изобретения обеспечивается соединение формулы Ia (показанного выше) или его фармацевтически приемлемая соль, где кольцо Q выбирают изR3 означает метил или метокси;R5 означает водород или фтор;R5a означает водород или фтор;R5c означает водород или метокси;R6 означает водород. В другом варианте осуществления изобретения обеспечивается соединение формулы Ia (показанной- 14020807 выше) или его фармацевтически приемлемая соль, где группу в формуле Ia формулыR3 означает метил или метокси;R5 означает водород или фтор;R5a означает водород или фтор;R5c означает водород или метокси;R6 означает водород. В другом варианте осуществления изобретения обеспечивается соединение формулы I или его фармацевтически приемлемая соль формулы Ib где кольцо Q, R1, R2, R5, R5a, R5b и n имеют любое из значений, определенных здесь;R3 выбирают из водорода и C1-3 алкила;R6 означает водород. В другом варианте осуществления изобретения обеспечивается соединение формулы I или его фармацевтически приемлемая соль формулы Ic где кольцо Q, R1, R2, R5, R5a, R5b и n имеют любое из значений, определенных здесь;R3 выбирают из водорода и C1-3 алкила;R6 означает водород. В другом варианте осуществления изобретения обеспечивается соединение формулы I или его фармацевтически приемлемая соль формулы Id где кольцо Q, R1, R2, R5, R5a, R5b и n имеют любое из значений, определенных здесь;R3 выбирают из водорода и С 1-3 алкила;R6 означает водород. В соединениях формул Ia, Ib, Ic, Id отдельное значение R1 представляет собой гало (например, R1 означает хлор. Альтернативно R1 означает фтор). В соединениях формул Ia, Ib, Ic, Id (в частности, Ib, Ic, Id) отдельное значение R1 представляет собой циано. В соединениях формул Ia, Ib, Ic, Id отдельное значение R1 представляет собой трифторметил. В соединениях формул Ia, Ib, Ic, Id отдельное значение R5 представляет собой водород.- 15020807 В соединениях формул Ia, Ib, Ic, Id отдельное значение R5 представляет собой фтор. В соединениях формул Ia, Ib, Ic, Id отдельное значение R5 представляет собой 4-метилпиперазинил или 4-изопропилпиперазинил. В соединениях формул Ia, Ib, Ic, Id отдельное значение R5a представляет собой водород или фтор. В соединениях формул Ia, Ib, Ic, Id отдельное значение R5a представляет собой водород. В соединениях формул Ia, Ib, Ic, Id отдельное значение R5b представляет собой водород. В соединениях формул Ia, Ib, Ic, Id отдельное значение R5c представляет собой водород или фтор. В соединениях формул Ia, Ib, Ic, Id отдельное значение R5c представляет собой водород. В соединениях формул Ia, Ib, Ic, Id отдельное значение R5c представляет собой метокси. В соединениях формул Ia, Ib, Ic, Id отдельное значение R3 представляет собой водород илиC1-3 алкил. В частности, R3 означает C1-3 алкил, такой как метил или этил (в частности, R3 означает метил). В частности, R3 означает C1-3 алкокси, такой как метокси. В дополнительном варианте осуществления в соединениях формул Ia, Ib, Ic, Id отдельное значениеn означает 1 или 2 и R2 имеет любое из значений, определенных здесь ранее. Например, радикал R2 определен в любом одном из (10)-(18) выше. В другом варианте осуществления в соединениях формул Ia, Ib, Ic, Id отдельное значение n означает 1 и R2 имеет любое из значений, определенных здесь ранее. Например, радикал R2 определен в любом одном из пунктов (10)-(18) выше. В другом варианте осуществления в соединениях формул Ia, Ib, Ic кольцо Q означает где показывает место присоединения кольца Q к NH группе в формулах Ia, Ib, Ic и Id, и кольцо Q необязательно замещено с помощью n R2 групп, как определено здесь, так как n означает 2, и R2 принимает любое из значений, указанных в пункте (14) или (16). Таким образом, в дополнительном варианте осуществления обеспечивается соединение формулы I формулы Ia, Ib, Ic или Id, как определено выше, или его фармацевтически приемлемая соль, где кольцо Q выбирают из где показывает место присоединения кольца Q к NH группе в формулах Ia, Ib, Ic и Id, и кольцо Q необязательно замещено с помощью n R2 групп;R1 выбирают из хлора и фтора (в частности, R1 означает хлор; более предпочтительно R1 означает фтор);R2 имеет любое из значений, определенных здесь, например определенных в любом одном из пунктов (10)-(18). В частности, в этом варианте группа в формуле Ia, Ib, Ic и Id формулы принимает значение, определенное в (27) или (28) выше. Таким образом, в дополнительном варианте осуществления обеспечивается соединение формулы I формулы Ia, Ib, Ic или Id, как определено выше, или его фармацевтически приемлемая соль, где кольцо Q выбирают из где показывает место присоединения кольца Q к NH группе в формулах Ia, Ib и Ic; кольцо Q необязательно замещено с помощью n R2 групп, как определено здесь;R2 имеет любое из значений, определенных здесь, например определенных в любом одном из пунктов (10)-(18). В частности, в этом варианте группа в формуле Ia, Ib, Ic и Id формулы принимает значение, определенное в пункте (27) или (28) выше. Таким образом, в дополнительном варианте осуществления обеспечивается соединение формулы I,формулы Ia, Ib, Ic или Id, как определено выше, или его фармацевтически приемлемая соль, где кольцо Q выбирают из где показывает место присоединения кольца Q к NH группе в формулах Ia, Ib и Ic; и кольцо Q необязательно замещено с помощью n R2 групп, как определено здесь;R3 означает C1-3 алкил, такой как метил или C1-3 алкокси, такой как метокси;R5a означает водород или фтор;R2 имеет любое из значений, определенных здесь, например определенных в любом одном из (10)(18). В частности, в этом варианте группа в формуле Ia, Ib, Ic и Id формулы принимает значение, определенное в (27) или (28) выше. В другом варианте осуществления изобретения обеспечивается соединение формулы I, выбранное из: 2-5-циано-2-[(1,3-диметилпиразол-4-ил)амино]-4-пиридил]амино]-N-метилбензамида; 2-5-циано-2-[(5-метокси-2-метилпиразол-3-ил)амино]пиридин-4-ил]амино]-N-метилбензамида; 2-5-циано-2-[(1,3-диметилпиразол-4-ил)амино]-4-пиридил]амино]-N-метокси-N-метилбензамида; 4-[(2-метил-1-оксо-3,4-дигидроизохинолин-8-ил)амино]-6-[(1-метилпиразол-4-ил)амино]пиридин-3 карбонитрила; 6-[(1,5-диметилпиразол-3-ил)амино]-4-[(2-метил-1-оксо-3,4-дигидроизохинолин-8 ил)амино]пиридин-3-карбонитрила; 6-[(5-метокси-2-метилпиразол-3-ил)амино]-4-[(2-метил-1-оксо-3,4-дигидроизохинолин-8 ил)амино]пиридин-3-карбонитрила; 4-[(2-метил-1-оксо-3,4-дигидроизохинолин-8-ил)амино]-6-1-(1-метил-4-пиперидил)пиразол-4 ил]амино]пиридин-3-карбонитрила; 6-[(1,3-диметилпиразол-4-ил)амино]-4-[(2-метил-1-оксо-3,4-дигидроизохинолин-8 ил)амино]пиридин-3-карбонитрила; 6-[(1,3-диметилпиразол-4-ил)амино]-4-7-(4-изопропилпиперазин-1-ил)-2-метил-3-оксоизоиндолин-4-ил]амино]пиридин-3-карбонитрила; 2-2-[(1,5-диметилпиразол-3-ил)амино]-5-(трифторметил)-4-пиридил]амино]-N-метилбензамида; 2-2-[(1,3-диметилпиразол-4-ил)амино]-5-(трифторметил)-4-пиридил]амино]-N-метилбензамида; 2-5-хлор-2-[(1,3-диметилпиразол-4-ил)амино]-4-пиридил]амино]-N-метоксибензамида; 2-5-хлор-2-[(1,5-диметилпиразол-3-ил)амино]-4-пиридил]амино]-N-метоксибензамида;N-(2-диметиламиноэтил)-2-[4-5-фтор-4-[(2-метил-1-оксо-3,4-дигидроизохинолин-8-ил)амино]-2 пиридил]амино]пиразол-1-ил]ацетамида; 2-[4-5-фтор-4-[(2-метил-1-оксо-3,4-дигидроизохинолин-8-ил)амино]-2-пиридил]амино]пиразол-1 ил]-N-(2-метоксиэтил)ацетамида; 2-[4-5-фтор-4-[(2-метил-1-оксо-3,4-дигидроизохинолин-8-ил)амино]-2-пиридил]амино]пиразол-1 ил]-N-(2-метоксиэтил)-N-метилацетамида; 7-2-[(1,3-диметилпиразол-4-ил)амино]-5-фтор-4-пиридил]амино]-4-(4-изопропилпиперазин-1-ил)2-метилизоиндолин-1-она; 3-5-фтор-4-[(2-метил-1-оксо-3,4-дигидроизохинолин-8-ил)амино]-2-пиридил]амино]-5-(4 метилпиперазин-1-ил)-1H-пиразол-4-карбонитрила; или его фармацевтически приемлемую соль. Кроме того, изобретение также обеспечивает соединение формулы (I), выбранное из любого одного из: 2-5-хлор-2-[(1,3-диметилпиразол-4-ил)амино]-4-пиридил]амино]-5-фтор-N-метилбензамида; 8-2-[(1,3-диметилпиразол-4-ил)амино]-5-(трифторметил)-4-пиридил]амино]-2-метил-3,4 дигидроизохинолин-1-она; 2-2-[(1,3-диметилпиразол-4-ил)амино]-5-(трифторметил)-4-пиридил]амино]-6-метокси-Nметилбензамида; 6-2-[(1,3-диметилпиразол-4-ил)амино]-5-(трифторметил)-4-пиридил]амино]-4-метил-2,3-дигидро 1,4-бензоксазепин-5-она; 8-5-хлор-2-[(2-метилпиразол-3-ил)амино]-4-пиридил]амино]-2-метил-3,4-дигидроизохинолин-1 она; 8-5-хлор-2-[(2,5-диметилпиразол-3-ил)амино]-4-пиридил]амино]-2-метил-3,4-дигидроизохинолин 1-она; 8-5-хлор-2-[(1,5-диметилпиразол-4-ил)амино]-4-пиридил]амино]-2-метил-3,4-дигидроизохинолин 1-она; 8-5-хлор-2-[(1-этил-3-метилпиразол-4-ил)амино]-4-пиридил]амино]-2-метил-3,4 дигидроизохинолин-1-она; 8-5-хлор-2-[(5-циклопропил-2-метилпиразол-3-ил)амино]-4-пиридил]амино]-2-метил-3,4 дигидроизохинолин-1-она; 8-5-хлор-2-[(2-этилпиразол-3-ил)амино]-4-пиридил]амино]-2-метил-3,4-дигидроизохинолин-1-она; 8-5-хлор-2-[(1-метилпиразол-3-ил)амино]-4-пиридил]амино]-2-метил-3,4-дигидроизохинолин-1 она; 8-5-хлор-2-[(1-изобутилпиразол-4-ил)амино]-4-пиридил]амино]-2-метил-3,4-дигидроизохинолин 1-она;N-метил-2-2-[(3-метил-1H-пиразол-4-ил)амино]-5-(трифторметил)-4-пиридил]амино]бензамида; 2-2-3-(метоксиметил)-1-метилпиразол-4-ил]амино]-5-(трифторметил)-4-пиридил]амино]-Nметилбензамида; 2-2-[(3-циано-1-метилпиразол-4-ил)амино]-5-(трифторметил)-4-пиридил]амино]-Nметилбензамида; 2-2-[(3-метокси-1-метилпиразол-4-ил)амино]-5-(трифторметил)-4-пиридил]амино]-Nметилбензамида; 8-5-хлор-2-[(1-изопропил-3-метилпиразол-4-ил)амино]-4-пиридил]амино]-2-метил-3,4 дигидроизохинолин-1-она; 2-2-[(1-изопропил-3-метилпиразол-4-ил)амино]-5-(трифторметил)-4-пиридил]амино]-Nметилбензамида; 2-2-1-(дифторметил)-3-метилпиразол-4-ил]амино]-5-(трифторметил)-4-пиридил]амино]-Nметилбензамида; 8-5-хлор-2-1-(дифторметил)-3-метилпиразол-4-ил]амино]-4-пиридил]амино]-2-метил-3,4 дигидроизохинолин-1-она; 8-5-хлор-2-1-(2-гидроксиэтил)-3-метилпиразол-4-ил]амино]-4-пиридил]амино]-2-метил-3,4 дигидроизохинолин-1-она; 2-2-1-(2-гидроксиэтил)-3-метилпиразол-4-ил]амино]-5-(трифторметил)-4-пиридил]амино]-Nметилбензамида; 2-2-[(1,3-диметилпиразол-4-ил)амино]-5-(трифторметил)-4-пиридил]амино]-N,6 диметоксибензамида; 2-2-[(2,5-диметилпиразол-3-ил)амино]-5-(трифторметил)-4-пиридил]амино]-N-метоксибензамида; 2-2-[(2,5-диметилпиразол-3-ил)амино]-5-(трифторметил)-4-пиридил]амино]-N,6 диметоксибензамида; 2-2-[(2,5-диметилпиразол-3-ил)амино]-5-(трифторметил)-4-пиридил]амино]-N-этоксибензамида; 2-2-[(2,5-диметилпиразол-3-ил)амино]-5-(трифторметил)-4-пиридил]амино]-5-фтор-Nметоксибензамида и 2-2-[(1,3-диметилпиразол-4-ил)амино]-5-(трифторметил)-4-пиридил]амино]-5-фтор-Nметоксибензамида; или его фармацевтически приемлемую соль. Синтез. Соединения согласно настоящему изобретению могут быть получены множеством путей, используя способы, аналогичные хорошо известным способам органического синтеза. Более конкретно, новые соединения настоящего изобретения могут быть получены, используя реакции и методики, описанные здесь. Следует понимать, что все условия реакций, включая выбор растворителя, реакционную атмосферу, температуру реакции, продолжительность эксперимента и методики обработки продуктов, предложенные ниже в описании синтетических способов, выбраны в качестве стандарта для рассматриваемой реакции. Специалисту в области органического синтеза ясно, что функциональности, присутствующие на различных частях молекулы, должны быть совместимыми с реагентами и предложенными реакциями. Такие ограничения касательно заместителей, которые не являются совместимыми с условиями реакций,будут очевидными для специалиста в данной области техники и, в таком случае, должны использоваться альтернативные способа. Будет ясно, что во время осуществления определенных нижеупомянутых способов определенные заместители могут требовать защиты для предотвращения их нежелательного взаимодействия. Квалифицированный химик поймет, в каких случаях требуется такая защита, и каким образом такие защитные группы могут быть введены в нужное место, и позже удалены. Примеры защитных групп можно найти в одном из многих общих руководств по данной теме, например в "Protective Groups in Organic Synthesis", под ред. Theodora Green (издательство: John WileySons). Защитные группы могут быть удалены с помощью любого подходящего способа, описанного в литературе или известного квалифицированному химику, подходящего для удаления данной защитной группы, причем такой способ выбирают с учетом того, чтобы удаление такой защитной группы оказывало минимальное влияние на группы, расположенные в другом месте молекулы. Таким образом, если реагенты содержат группы, например, такие как амино, карбокси или гидро- 20020807 кси, может потребоваться проведение защиты этих групп в некоторых из реакций, упомянутых здесь. Подходящей защитной группой для амино или алкиламиногруппы является, например, ацильная группа, например алканоильная группа, такая как ацетильная, алкоксикарбонильная группа, например метоксикарбонильная, этоксикарбонильная или трет-бутоксикарбонильная группа, арилметоксикарбонильная группа, например бензилоксикарбонильная, или ароильная группа, например бензоильная. Условия снятия защиты для вышеуказанных защитных групп непременно варьируются с выбором защитной группы. Таким образом, например, ацильная группа, такая как алканоильная или алкоксикарбонильная группа или ароильная группа, может быть удалена, например, путем гидролиза подходящим основанием, таким как гидроксид щелочного металла, например гидроксид лития или натрия. Альтернативно,ацильная группа, такая как трет-бутоксикарбонильная группа, может быть удалена, например, путем обработки подходящей кислотой, такой как хлористо-водородная, серная или фосфорная кислота или трифторуксусная кислота, и арилметоксикарбонильная группа, такая как бензилоксикарбонильная группа, может быть удалена, например, путем гидрирования над катализатором, таким как палладий на угле,или путем обработки кислотой Льюиса, например трис-(трифторацетатом) бора. Подходящей альтернативной защитной группой для первичной аминогруппы является, например, фталоильная группа, которая может быть удалена путем обработки алкиламином, например диметиламинопропиламином, или гидразином. Подходящей защитной группой для гидроксильной группы является, например, ацильная группа,например алканоильная группа, такая как ацетил, ароильная группа, например бензоил, или арилметильная группа, например бензил. Условия снятия защиты для вышеуказанных защитных групп будут непременно варьироваться с выбором защитной группы. Таким образом, например, ацильная группа, такая как алканоильная или ароильная группа, может быть удалена, например, путем гидролиза подходящим основанием, таким как гидроксид щелочного металла, например, гидроксид лития, натрия или аммиак. Альтернативно, арилметильная группа, такая как бензильная группа, может быть удалена, например, путем гидрирования над катализатором, таким как палладий на угле. Подходящей защитной группой для карбоксильной группы является, например, группа, образующая сложный эфир, например, метальная или этильная группа, которая может быть удалена, например,путем гидролиза основанием, таким как гидроксид натрия, или, например, трет-бутильная группа, которая может быть удалена, например, путем обработки кислотой, например, органической кислотой, такой как трифторуксусная кислота, или, например, бензильная группа, которая может быть удалена, например, путем гидрирования над катализатором, таким как палладий на угле. В качестве защитной группы также могут использоваться смолы. Защитные группы могут быть удалены на любой подходящей стадии синтеза, используя обычные методики, хорошо известные в области химии. Соединения формулы I или их фармацевтически приемлемые соли или пролекарства могут быть получены с помощью любого способа, известного в качестве подходящего для получения химически родственных соединений. Такие способы при использовании для получения соединения формулы I или его фармацевтически приемлемой соли или пролекарства обеспечены в качестве дальнейшей характерной черты изобретения и проиллюстрированы с помощью следующих характерных примеров. Необходимые исходные вещества могут быть получены с помощью стандартных методик органической химии(см., например, Advanced Organic Chemistry (Wiley-Interscience), Jerry March). Получение таких исходных веществ описано в сопроводительных неограничивающих примерах. Альтернативно, необходимые исходные вещества доступны по методикам, которые аналогичны проиллюстрированным и находятся в пределах квалификации химика-органика. Настоящее изобретение также обеспечивает получение соединений формулы I и родственных соединений или их фармацевтически приемлемых солей или пролекарств с помощью способа (а)-(d), как изложено ниже (где переменные принимают значения, определенные выше, если не оговорено иное): способ (а) катализируемое палладием сочетание в присутствии подходящего основания соединения формулы где R1, R3, R4, R5, R5a, R5b, R5c и R6 определены выше, за исключением того, что какая-либо функциональная группа при необходимости защищена;Lg1 означает пригодную замещаемую группу,с соединением формулы III где кольцо Q, R2 и n определены выше, за исключением того, что какая-либо функциональная группа при необходимости защищена; или способ (b) катализируемое палладием сочетание в присутствии подходящего основания соединения формулы где кольцо Q, R1, R2 и n определены выше, за исключением того, что какая-либо функциональная группа при необходимости защищена;Lg2 означает пригодную замещаемую группу,с соединением формулы V где R3, R4, R5, R5a, R5b, R5c и R6 определены выше, за исключением того, что какая-либо функциональная группа при необходимости защищена; или способ (b') сочетание соединения формулы IV (показанного выше) с соединением формулы V (показанного выше) в кислых условиях; или способ (с) сочетание соединения формулы VI или его реакционноспособного производного где кольцо Q, R1, R2, R5, R5a, R5b, R5c, R6 и n определены выше, за исключением того, что какая-либо функциональная группа при необходимости защищена,с амином формулы VIIHNR3R4 3 4 где R и R определены выше, за исключением того, что какая-либо функциональная группа при необходимости защищена; или способ (d) для получения соединений формулы I, где R2 соединен с кольцом Q с помощью -N(R14)C(O)- группы или -N(R14)C(O)CH2- группы, сочетание соединения формулы VIII или его реакционноспособного производного где кольцо Q, R1, R2, R3, R4, R5, R5a, R5b, R5c и R6 определены выше, за исключением того, что какаялибо функциональная группа при необходимости защищена,с соответствующим амином так, что сочетание с соединением формулы VIII дает амидсвязанный R2 заместитель, определенный выше; и затем, при необходимости (в любом порядке):(i) превращение соединение формулы I в другое соединение формулы I;(iii) образование фармацевтически приемлемой соли соединения формулы I. Условия реакции для способа (а). Удобной замещаемой группой Lg1 является, например, гало, алкансульфонилокси или арилсульфонилоксигруппа, например хлор, бром, метансульфонилокси, трифторметансульфонилокси, 4 нитробензолсульфонилокси или толуол-4-сульфонилоксигруппа. Группу Lg1 выбирают с условием, чтобы она была более подвижной, чем группа R1. Например, когда R1 означает фтор, пригодная группа Lg1 означает хлор. Реакцию преимущественно проводят в присутствии основания. Пригодным основанием является,например, органическое аминное основание, такое как, например, карбонат или гидроксид щелочного или щелочно-земельного металла, например карбонат натрия, карбонат калия, карбонат цезия или карбонат кальция. Альтернативно, таким основанием является, например, трет-бутилат щелочного металла,такой как трет-бутилат натрия или калия. Отдельным основанием является карбонат цезия. Реакцию сочетания выполняют в присутствии пригодного палладиевого катализатора. Соответственно, катализатор образуют in situ путем реакции источника палладия, такого как ацетат палладия(II), с пригодным лигандом, в частности фосфоросодержащим лигандом, таким как 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (Xantphos). Реакцию соответственно осуществляют в присутствии инертного растворителя или разбавителя,например биполярного апротонного растворителя, такого как N,N-диметилформамид, N,Nдиметилацетамид, N-метилпирролидин-2-он или диметилсульфоксид; углеводород, такой как толуол; или эфир, такой как диоксан. Реакцию без труда осуществляют при повышенной температуре, например в интервале, например, от 50 до 180 С (или температуры кипения растворителя), соответственно при около 150 С. Соединения формулы II можно получить, используя способы, хорошо известные специалисту в области органической химии. Типичные способы проиллюстрированы в примерах, описанных здесь. Например, соединения формулы II можно получить в соответствии с реакционной схемой 1. Реакционная схема 1 где Lg3 означает пригодную замещаемую группу, такую как йод или хлор. Реакцию выполняют в условиях, аналогичных описанных для способа (а) выше, или в сильно основных условиях (например, используя гидрид натрия в ТГФ при типично 60 С). Выбранные условия должны допускать образование аниона анилина. Соединения формулы III доступны для приобретения, известны из литературы, или могут быть получены с помощью общепринятых способов, известных в уровне техники. Условия реакции для способа (b).Lg2 означает пригодную замещаемую группу, такую как йод или хлор. Реакцию выполняют в условиях, аналогичных описанных для способа (а) выше. Соединения формулы IV можно получить, используя способы, хорошо известные специалисту в области органической химии. Типичные способы проиллюстрированы в примерах, описанных здесь. Например, соединения формулы IV можно получить в соответствии с реакционной схемой 2. где Lg1 имеет определенное выше значение, например фтор или хлор. Реакцию соответственно выполняют при повышенной температуре, например при около 80 С. Соединения формулы IV также можно получить в соответствии с реакционной схемой 3. Реакционная схема 3 Соединения формулы V доступны для приобретения, или они известны из литературы, или они могут быть получены с помощью общепринятых способов, известных в уровне техники. Условия реакции для способа (b'). Сочетание соединения формулы IV с соединением формулы V в кислых условиях может требовать,например, присутствия п-толуолсульфоновой кислоты в растворителях, таких как циклогексанол. Такую реакцию, соответственно, выполняют при повышенной температуре, такой как 160 С. Для реакций такого типа, Lg2 типично означает хлор и R1 типично означает циано. Условия реакции для способа (с). Реакцию сочетания можно проводить с использованием общепринятых способов сочетание кислот и аминов. Реакцию сочетания без труда проводят в присутствии пригодного реагента сочетания. В качестве пригодных реагентов сочетания можно использовать обычные реагенты пептидного сочетания, известные в уровне техники, например тетрафторборат О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония(TBTU) или гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU) или, например, карбонилдиимидазол или карбодиимид, такой как дициклогексилкарбодиимид или N-этил-N'-(3 диметиламинопропил)карбодиимид (EDCI), необязательно в присутствии катализатора, такого как диметиламинопиридин, 4-пирролидинопиридин или 2-гидроксипиридин-N-оксид, необязательно в присутствии основания, например триалкиламина, такого как триэтиламин или N-этилдиизопропиламин, Nметилморфолина, пиридина, или 2,6-диалкилпиридинов, таких как 2,6-лутидин или 2,6-ди-третбутилпиридин. Реакцию без труда выполняют в присутствии пригодного инертного растворителя. Пригодные растворители включают, например биполярный апротонный растворитель, такой как N,Nдиметилформамид, N,N-диметилацетамид, N-метилпирролидин-2-он или диметилсульфоксид; дихлорметан; бензол или тетрагидрофуран. Реакцию сочетания без труда выполняют при температуре в интервале от -40 до 40 С соответственно при приблизительно комнатной температуре."Реакционноспособным производным" кислоты формулы VI является производное карбоновой кислоты, которое будет реагировать с амином формулы VII с получением соответствующего амида. Пригодным реакционноспособным производным карбоновой кислоты формулы VI является, например,ацилгалогенид, например ацилхлорид, образованный по реакции кислоты и хлорангидрида неорганической кислоты, например тионилхлорида; смешанный ангидрид, например ангидрид, образованный по реакции кислоты и хлорформиата, такого как изобутилхлорформиат; активный сложный эфир, например сложный эфир, образованный по реакции кислоты и фенола, такого как пентафторфенол, сложного эфира, такого как пентафторфенилтрифторацетат или спирта, такого как метанол, этанол, изопропанол, бутанол или N-гидроксибензотриазол; или ацилазид, например азид, образованный по реакции кислоты и азида, такого как дифенилфосфорилазид; ацилцианид, например цианид, образованный по реакции кислоты и цианида, такого как диэтилфосфорилцианид. Реакция таких реакционноспособных производных- 24020807 карбоновой кислоты с аминами хорошо известна в уровне техники, например они могут быть введены в реакцию в присутствии основания, такого как описанное выше, и в пригодном растворителе, таком как описанный выше. Реакцию с реакционноспособным производным можно без труда выполнить при температуре, описанной выше. Соединения формулы VI можно получить, используя способы, хорошо известные специалисту в области органической химии. Типичные способы проиллюстрированы в примерах, описанных здесь. Соединения формулы VII доступны для приобретения, известны из литературы, или они могут быть получены с помощью общепринятых способов, известных в уровне техники. Условия реакции для способа (d). Реакцию сочетания можно проводить с использованием условий, аналогичных описанным в способе (с) выше. Способ (d) является пригодным для получения соединения формулы I, где заместитель R2 соединен с кольцом Q с помощью амидного звена (-N(R14)C(O)- или -N(R14)C(O)CH2). Таким образом,способ (с) является пригодным для получения соединения формулы I, где R2 является, например, карбамоилом, N-(C1-6 алкил)карбамоилом, N,N-(C1-6 алкил)2 карбамоилом, C3-7 циклоалкил-Х 1-, гетероциклил-Х 2 и гетероарил-Х 3-, где X1, X2 и X3 означают -N(R14)C(O)-; причем указанные группы могут быть необязательно замещены описанным здесь образом. Очевидно, соответствующий амин вводят в реакцию с соединением формулы VIII с получением требуемого амида. Например, когда R2 означает гетероциклилN(R14)С(О)-, соединение формулы VIII вводят в реакцию с амином формулы гетероциклил-NH(R14) с получением необходимого амид-связанного R2. Предполагается, что аналогичные способы можно было бы использовать для получения заместителей R2, которые связанны с кольцом В с помощью звена -C(O)N(R14)-, путем реакции соединения формулы VIII, где карбоксильная группа замещена аминогруппой, с соответствующей карбоновой кислотой. Соединения формулы VIII можно получить, используя способы, хорошо известные специалисту в области органической химии. Типичные способы проиллюстрированы в примерах. Соединения формулы I или родственные соединения также можно получить путем модифицирования заместителя или введения заместителя в другое соединение формулы I или его фармацевтически приемлемую соль или пролекарство. Пригодные химические превращения хорошо известны специалистам в области органической химии. Следует понимать, что определенные различные заместители кольца соединения согласно настоящему изобретению могут быть введены с помощью стандартных реакций ароматического замещения,или образованы с помощью обычных модификаций функциональных групп, либо до или непосредственно после проведения упомянутых выше способов, что также включено в аспект способа изобретения. Такие реакции и модификации включают, например, введение заместителя посредством реакции ароматического замещения, восстановление заместителей, алкилирование заместителей и окисление заместителей. Реагенты и условия реакций для таких методик хорошо известны в области химии. Отдельные примеры реакций ароматического замещения включают введение нитрогруппы с использованием концентрированной азотной кислоты, введение ацильной группы с использованием, например, ацилгалогенида и кислоты Льюиса (такой, как трихлорид алюминия) в условиях Фриделя Крафтса; введение алкильной группы с использованием алкилгалогенида и кислоты Льюиса (такой, как трихлорид алюминия) в условиях Фриделя Крафтса; и введение галогенной группы. Отдельные примеры модификаций включают восстановление нитрогруппы до аминогруппы с помощью, например, каталитического гидрирования с никелевым катализатором, или обработки железом в присутствии соляной кислоты с нагреванием; окисление алкилтио до алкилсульфинила или алкилсульфонила. В случае, если необходима фармацевтически приемлемая соль соединения формулы I или родственного соединения, например, соль присоединения кислоты или основания, она может быть получена путем, например, реакции соединения формулы I или родственного соединения с подходящей кислотой или основанием с использованием обычной методики. Способы получения фармацевтически приемлемых солей хорошо известны в уровне техники. Например, после реакции соединения формулы I с кислотой или основанием, требуемая соль может быть осаждена из раствора с помощью перенасыщения раствора, содержащего соединение формулы I. Перенасыщения можно достичь с использованием широко известных методик, например, путем охлаждения раствора, путем удаления растворителя с помощью упаривания или путем добавления подходящего антирастворителя до осаждения соли. Для содействия выделению соединения формулы I или родственного соединения во время его получения, соединение может быть получено в виде соли, которая не является фармацевтически приемлемой солью. Получающаяся соль затем может быть модифицирована с помощью обычных методик с получением фармацевтически приемлемой соли соединения. Такие методики модификации соли хорошо известны и включают, например, методики на основе ионного обмена или повторного осаждения соединения из раствора в присутствии фармацевтически приемлемого противоиона, как описано выше, например, путем повторного осаждения в присутствии подходящей фармацевтически приемлемой кислоты с получением требуемой фармацевтически приемлемой соли присоединения кислоты соединения формулы I или родственного соединения. Стереоизомеры соединений формулы I или родственных соединений могут быть разделены с ис- 25020807 пользованием обычных методик, например хроматографией или фракционной кристаллизацией. Энантиомеры могут быть выделены путем разделения рацемата например, с помощью фракционной кристаллизации, повторного растворения или ЖХВД. Диастереоизомеры могут быть выделены путем разделения, осуществление которого возможно из-за их разных физических свойств, например, путем фракционной кристаллизации, ЖХВД или флэш-хроматографии. Альтернативно, отдельные стереоизомеры могут быть получены путем хирального синтеза из хиральных исходных веществ при условиях, которые не допускают рацемизации или эпимеризации, или путем дериватизации хиральными реагентами. Выделение отдельного стереоизомера подразумевает выделение в форме, по существу свободной от других стереоизомеров, например, с содержащим менее чем 20%, в частности, менее чем 10%, и более особо менее чем 5 мас.% других стереоизомеров. В разделе синтеза выше и ниже выражение "инертный растворитель" относится к растворителю, который не вступает во взаимодействие с исходными веществами, реагентами, промежуточными соединениями или продуктами способом, который неблагоприятно влияет на выход желаемого продукта. Специалист в данной области техники поймет, что для того, чтобы получить соединения согласно изобретению или родственные соединения, альтернативным и, в некоторых случаях, более подходящим образом, отдельные стадии способа, упомянутые выше, могут быть осуществлены в разном порядке,и/или отдельные реакции могут быть осуществлены на разных стадиях в общем пути синтеза (т.е., химические превращения могут быть осуществлены на разных промежуточных соединениях, связанных выше с конкретной реакцией). Определенные промежуточные соединения, используемые в описанных выше способах получения соединений формулы I, образуют дополнительный аспект изобретения. Биологическая активность. Следующие анализы можно использовать для измерения действия соединений настоящего изобретения и родственных соединений в качестве ингибиторов FAK.(а) Ферментный анализ in vitro. Принцип анализа. С целью определения уровня действия выбранного соединения на ингибирование ферментной активности протеиновой тирозинкиназы FAK использовали сэндвич-метод ELISA с колориметрическим исследованием по конечной точке с применением 3,3',5,5'-тетраметилбензидина (ТМВ). Синтетическим тирозинсодержащим пептидом покрывают пластмассовую поверхность, уровень фосфорилирования этих остатков тирозина посредством киназного фермента в присутствии ингибиторов измеряют с использованием антитела, которое специфически присоединяется к фосфорилированным остаткам тирозина. Количество антитела, присоединенного к подложке, является пропорциональным уровню ферментативного катализа. Протокол анализа на идентифицирование ингибиторов киназы фокальной адгезии (FAK). Автоматизированный жидкостный манипулятор PlateMate Plus 384 с 100 мкл одноразовым наконечником использовали для осуществления добавлений всех реагентов, за исключением соединения, а машину для мойки планшетов Tecan 384PW с 384 головками использовали для всех стадий промывки. Сначала Matrix 384-луночные полистирольные планшеты (Кат.4311) покрывали 40 мкл/лунку 0.0375 мг/мл раствором синтетического полипептида (polyGAT, Sigma, Кат.Р 3899), растворенного в забуференном фосфатом физиологическом растворе (PBS). Планшеты выдерживали в течение ночи при 4 С. Непосредственно перед использованием покрывающий раствор отсасывали и каждую лунку промывали 2100 мкл PBS + 0.05% Tween 20. Для удаления остатка фосфата лунки затем промывали 2100 мкл 50 мМ HEPES буфера, рН 7.4. Планшеты перед добавлением соединений промокали бумагой насухо. Соединения тестировали на 12 точечном диапазоне доз, прибор Labcyte Echo 550 использовали для распределения соединений в нл объемах и заполнения ДМСО. Конечная концентрация соединения в анализе зависела от начальной концентрации соединения. Для 10 мМ исходного соединения, конечная анализируемая доза находилась в пределах от 100 мкМ вплоть до 0.1 нМ с 1/2 логарифмическим единичным шагом, конечная точка дозы соответствовала соединению в концентрации 0.01 нМ. Контрольные лунки,содержащие 120 нл ДМСО (макс.) или 120 нл 10 мМ стауроспорина (LC Laboratories, Бостон, США, Кат.S-9300) (мин.), включали в каждый планшет. Добавляли 10 мкл 5% диметилсульфоксида об./об.(ДМСО, Fisher Scientific) к каждой лунке непосредственно перед добавлением 10 мкл раствора кофактора, содержащего 80 мМ MgCl2 (Sigma, Кат.M1028); 80 мМ MnCl2 (Sigma, Кат.M1787); АТФ в концентрации, вычисленной для возможности достижения начальной скорости половинной максимальная скорости реакции (Km для АТФ) (Sigma, Кат.А 7699). Для начала хода анализа к каждой лунке осуществляли конечное добавление 20 мкл раствора фермента, содержащего 100 мМ HEPES рН 7.4; 0.2 мМ ванадата натрия (Sigma, Кат.S6508); 0.2 г/л альбумина бычьей сыворотки (BSA, Sigma, Кат.А 7888); 0.2 мМ дитиореитола (Sigma, Кат.5545); 0.1% Тритона Х 100 (Sigma, Кат.Х 100); FAK фермента (2 мкл/мл). FAK фермент вырабатывали из культуры насекомых, инфицированных бакуловирусом,содержащим последовательность ДНК, кодирующую 6 His меченый домен киназы (GenBank- 26020807 Планшеты оставляли стоять при комнатной температуре в течение 25 мин перед добавлением 10 мкл 500 мМ этилендиаминтетрауксусной кислоты (EDTA) для остановки анализа и лунки непосредственно промывали 3100 мкл PBS + 0.05% Tween 20. 4G10 антитело (Millipore, Кат.16-105; 16-184) с непосредственно конъюгированной пероксидазой хрена (HRP) использовали для детектирования фосфорилирования подложки посредством FAK. 40 мкл раствора PBS + 0.05% Tween 20, содержащего 0.5%BSA и 0.1 мкл/мл антитела, добавляли к каждой лунке и оставляли стоять в течение 1 ч при комнатной температуре с целью обеспечения возможности связывания антитела. По истечении этого периода лунки вновь промывали 3100 мкл PBS + 0.05% Tween 20. В качестве подложки для HRP использовали ТМВSigma (Кат.Р 4922), следуя рекомендациям производителя. ТМВ растворяли в концентрации 1 мг/мл в ДМСО и разбавляли вплоть до конечной концентрации 0.05 мг/мл с помощью фосфор-цитратного буфера. К каждой анализируемой лунке добавляли 40 мкл раствора ТМВ и оставляли стоять в течение 30 мин для развития голубого окрашивания. С целью фиксирования окрашивания к каждой лунке добавляли 20 мкл 2 М серной кислоты, цвет изменялся от голубого до желтого. Планшеты считывали в приборе PerkinElmer Envision с использованием оптических фильтров с длиной волны 450 нм. Автоматизированный анализ данных проводили путем импортирования файлов необработанных данных из ридера в Origin. С использованием среднего макс. и среднего мин. сигнала на каждом планшете для привязки вершины и дна кривой, наносили оптическую плотность против концентрации соединения. Значение IC50 затем экстраполировали из формы кривой.(b) Клеточный анализ in vitro. Принцип анализа. В этом анализе используют HEK293, которые временно трансфектируют плазмидой, кодирующей сМус меченую полноразмерную человеческую FAK, с использованием липофектамина 2000. Клетки трансфектируют в течение ночи перед обработкой соединением в течение 1 ч. Клетки затем лизируют и вводят в следующую фазу анализа, которая представляет собой твердофазный сэндвич-метод фермент связанного иммуносорбентного анализа. Для анализа используют планшеты, предварительно покрытые анти-сМус антителом для осаждения сМус меченой киназы, и затем детектируют анти-pY397 FAK антитело. После дополнительного инкубирования с антикроличьим IgG-HRP, и последующего инкубирования с QuantaBlu, образуется флюоресцирующий продукт, параметры которого можно измерять на оптическом считывающем устройстве. Интенсивность этого флюоресцирующего продукта прямо пропорциональна концентрации FAK [pY397], присутствующего в начальном лизате. Протокол анализа на идентифицирование ингибиторов киназы фокальной адгезии (FAK). Моечную машину Tecan Power использовали для всех стадий промывки и использовали либо Wellmate или Multidrop для осуществления добавлений всех реагентов, за исключением соединения.HEK293 клетки как положено культивировали в 10% FCS (Sigma F7524) плюс 1% L-глутамин (Gibco 25030) в MEM Эрла (Gibco 21090). Клетки высевали при плотности 3-4106 клеток на Т 175 колбу, с получением через 2-3 дня конфлюентности культуры около 85%. На первый день анализа клетки отделяли от их культуральной подложки путем промывания клеток в колбах один раз с помощью 12 мл HBSS(Gibco 14170) перед отслаиванием с помощью 2 мл аккутазы/колбу (Innovative Cell Technologies Inc, Кат.AT104). Предварительно нагретую пластинчатую среду (1% FCS (Sigma F7524) плюс 1% L-глутамин(Gibco 25030) в MEM Эрла (Gibco 21090 добавляли к каждой колбе (13 мл на колбу) и клетки объединяли. Клетки подсчитывали с использованием счетчика Культера и разбавляли пластинчатой средой до 3.6105 клеток/мл. Клетки трансфектировали в суспензии путем добавления трансфекционной смеси в соотношении 5:1 об./об. (для 96-луночного планшета 10 мл суспензии клеток + 2 мл трансфекционной смеси) и осторожно вращали до перемешивания. Трансфекционную смесь приготовляли путем инкубирования при комнатной температуре в течение 5 мин 24 мкл липофектамина 2000 (Invitrogen, Кат.11668019) с 809 мкл OptiMEM (Gibco 31985) на планшет. Тем временем ДНК смесь приготовляли путем добавления 20 мкг рсДНК 3.2 Fakcmyc плазмиды (GenBank NP722560) к 816 мкл OptiMEM (Gibco 31985) на планшет. Равное количество (об./об.) липофектамина 2000/OptiMEM добавляли к ДНК/OptiMEM растворам с образованием трансфекционной смеси, которую инубировали при комнатной температуре в течение 20 мин перед добавлением к клеткам. Стерильную головку использовали для высевания клеток/трансфекционной смеси при 100 мкл/лунку при конечной концентрации клеток 3105 клеток/мл в покрытые поли-D-лизин BD Biocoat планшеты (Becton Dickinson, Кат.356461). Клетки оставляли осесть в планшетах в течение около 2 мин перед помещением в инкубатор. Планшеты инкубировали при 37 С в атмосфере 5% СО 2 в течение ночи.ELISA планшеты приготовляли путем разбавления c-myc 9E10 мышиного моноклонального антитела (собственного производства) в забуференном фосфатом физиологическом растворе (PBS) до конечной концентрации 5 мкг/мл, добавляли 50 мкл на лунку к черным сильно связанным 96-луночным планшетам (Greiner 655077). Планшеты запечатывали и инкубировали в течение ночи при 4 С. На следующий день ELISA планшеты промывали 2400 мкл PBS-Tween для удаления несвязанного антитела. Планшеты блокировали при комнатной температуре в течение 1 ч путем добавления 50 мкл/лунку 3% BSA (SigmaA8022) в PBS-Tween. Соединения дозировали к клеткам в 6- или 8-точечном диапазоне доз, прибор Labcyte Echo 500 использовали для распределения соединения в нл объемах и заполнения ДМСО. Верхняя концентрация составляла 3 мкМ и уменьшалась с 1/2 логарифмическим шагом. Контрольные лунки, содержащие ДМСО или соединение включали в каждый планшет. Вслед за дозированием клеточные планшеты возвращали в инкубатор на 1 час. Среду/раствор соединения отсасывали из лунки и клетки лизировали путем добавления 70 мкл/лунку лизирующего буфера (конечная концентрация 25 мМ Трис/HCl (собственного производства), 3 мМ EDTA (собственного производства), 3 мМ EGTA (Sigma E4378), 50 мМ NaF (Sigma(Sigma G6251), 5 мМ пирофосфата натрия (Sigma S6422), 0.5% Тритона Х-100 (Sigma X100), таблеткиComplete Protease Inhibitor Cocktail (Roche1697498 или 1836153. Планшеты инкубировали при комнатной температуре в течение 10-30 мин. 50 мкл клеточного лизата переносили в предварительно промытые ELISA планшеты (2400 мкл PBS-Tween) с использованием PlateMate PlusPlus. Планшеты запечатывали и инкубировали при 4 С в течение ночи. На следующий день ELISA планшеты промывали 2400 мкл PBS-Tween. добавляли 50 мкл раствора первичного антитела (pY397 FAK (Biosource 44-624G (поликлональное) или 44-625G (моноклональное, разбавленного 1/2000 в 3% BSA (Sigma A8022) в PBS-0.05%) на лунку, и инкубировали при комнатной температуре в течение 1 ч. Несвязанного антитело удаляли путем промывания с помощью 2400 мкл PBS-Tween. Добавляли 50 мкл раствора вторичного антитела (козлиное антикроличье HRP (Cell Signalling CS7074), разбавленного 1/5000 в 3% BSA (Sigma А 8022) в PBS-0.05%) на лунку, и инкубировали при комнатной температуре в течение 1 ч. Несвязанного антитело удаляли путем промывания с помощью 2400 мкл PBS-Tween. QuantaBlu флуорогенпероксидазный набор подложки (Pierce15169) использовали в качестве подложки для HRP. Пероксидный раствор разбавляли 1/10 раствором для подложки. Добавляли 35 мкл/лунку рабочего раствора и инкубировали при комнатной температуре в течение 90 мин. Реакцию останавливали путем добавления 35 мкл останавливающего раствора (обеспечен в наборе). Флуоресценцию считывали на приборе Tecan Ultra с использованием фильтра возбуждения 340 нм и эмиссионного фильтра 465 нм. Вариант клеточного анализа in vitro (b) приведен далее. Принцип анализа. В этом анализе используют HEK293, которые временно трансфектируют плазмидой, кодирующей сМус меченую полноразмерную человеческую FAK, с использованием липофектамина 2000. Криоконсервированые клетки, которые трансфектировались в течение 5 ч, культивируют в течение ночи перед обработкой соединением в течение 11/2-2 ч. Клетки затем лизируют и вводят в следующую фазу анализа,которая представляет собой твердофазный сэндвич-метод фермент связанного иммуносорбентного анализа. Для анализа используют планшеты, предварительно покрытые анти-сМус антителом для осаждения сМус меченой киназы и затем детектируют анти-pY397 FAK антитело. После дополнительного инкубирования с антикроличьим IgG-HRP, и последующего инкубирования с QuantaBlu, образуется флюоресцирующий продукт, параметры которого можно измерять на оптическом считывающем устройстве. Интенсивность этого флюоресцирующего продукта прямо пропорциональна концентрации FAK [pY397], присутствующего в начальном лизате. Протокол анализа на идентифицирование ингибиторов киназы фокальной адгезии (FAK). Моечную машину Tecan Power использовали для всех стадий промывки и использовали либо Wellmate или Multidrop для осуществления добавлений всех реагентов, за исключением соединения.HEK293 клетки, выращенные в 10-слойных "клеточных фабриках" временно трансфектировали плазмидой, кодирующей 3' сМус-меченую полноразмерную FAK (GenBank NP722560), с использованием липофектамина 2000 (Invitrogen, Кат.11668019). Спустя 5 ч после трансфектирования клетки отделяли от их культуральной подложки и криоконсервировали. Для каждого анализа необходимое число пробирок оттаивали, ресуспендировали в среде для клеточного анализа (DMEM (Gibco,41966), содержащей 1% FCS (Sigma F7524) и HEPES (Gibco15630 и центрифугировали для удаления ДМСО из криоконсервированной среды. Клетки ресуспендировали в среде для клеточного анализа и число клеток устанавливали на 1.25105/мл. Клетки высевали с использованием Wellmate в покрытые поли-D-лизином 384 луночные планшеты BD Biocoat (Becton Dickinson, Кат.356461), и оставляли прилипать в течение ночи при 37 С в инкубатор с 5% СО 2.ELISA планшеты получали путем разбавления c-myc 9B11 (Cell Signalingcs2276) мышиного моноклонального антитела в забуференном фосфатом физиологическом растворе (PBS/A) до конечной концентрации 1 мкг/мл, добавляли 20 мкл на лунку к черным сильно связанным 384-луночным планшетам(Greiner 781077). Планшеты запечатывали и инкубировали в течение ночи при 4 С. На следующий деньELISA планшеты промывали 3400 мкл PBS-Tween для удаления несвязанного антитело. Планшеты блокировали при комнатной температуре в течение 1 ч путем добавления 40 мкл/лунка 3% BSA (SigmaA8022) в PBS-Tween. Соединения дозировали к клеткам в 8-точечном диапазоне доз, прибор Labcyte Echo 500 использо- 28020807 вали для распределения соединения в нл объемах и заполнения ДМСО. Верхняя концентрация составляла 3.125 мкМ и уменьшалась с 1/2 логарифмическим шагом. Контрольные лунки, содержащие ДМСО или соединение, включали в каждый планшет. Вслед за дозированием клеточные планшеты возвращали в инкубатор на 11/2-2 ч. Среду/раствор соединения отсасывали из лунки и клетки лизировали путем добавления 40 мкл/лунку лизирующего буфера (конечная концентрация 25 мМ Трис/HCl (собственного производства), 3 мМ EDTA (собственного производства), 3 мМ EGTA (Sigma E4378), 50 мМ NaF (Sigma(Sigma G6251), 5 мМ пирофосфата натрия (Sigma S6422), 0.5% Тритона Х-100 (Sigma Х 100), таблеткиComplete Protease Inhibitor Cocktail (Roche1697498 или 1836153. Планшеты инкубировали при комнатной температуре в течение 10-30 мин. 15 мкл клеточного лизата переносили в предварительно промытые ELISA планшеты (3400 мкл PBS-Tween) с использованием PlateMate PlusPlus. Планшеты запечатывали и инкубировали при 4 С в течение ночи. На следующий день ELISA планшеты промывали 3400 мкл PBS-Tween. Добавляли 20 мкл раствора первичного антитела (pY397 FAK (Biosource 44-624G (поликлональное, разбавленного 1/2000 в 3%BSA (Sigma A8022) в PBS-Tween) на лунку, и инкубировали при комнатной температуре в течение 1 ч. Несвязанное антитело удаляли путем промывания с помощью 3400 мкл PBS-Tween. Добавляли 20 мкл раствора вторичного антитела (козлиное антикроличье HRP (Cell Signalling, CS7074), разбавленного 1/5000 в 3% BSA (Sigma A8022) в PBS-Tween) на лунку, и инкубировали при комнатной температуре в течение 1 ч. Несвязанного антитело удаляли путем промывания с помощью 3400 мкл PBS-Tween.QuantaBlu флуорогенпероксидазный набор подложки (Pierce15169) использовали в качестве подложки для HRP. Пероксидный раствор разбавляли 1/10 раствором для подложки. Добавляли 20 мкл/лунку рабочего раствора и инкубировали при комнатной температуре в течение 90 мин. Реакцию останавливали путем добавления 20 мкл останавливающего раствора (обеспечен в наборе). Флуоресценцию считывали на приборе Tecan SafireExcitation, длина волны 325 нм и длина волны эмиссии 425 нм. Несмотря на то что фармакологические свойства соединений формулы I изменяются с изменением структуры, как и следовало ожидать, было обнаружено, что соединения формулы I, являются активными в вышеупомянутых исследованиях. В общем, активность, которой обладают соединения формулы I,можно продемонстрировать на следующих концентрациях или дозах в одном или нескольких из приведенных выше тестов (а) и (b): Тест (a): IC50 менее чем 25 мкМ (предпочтительные соединения обладают значением IC50 менее чем 5 мкМ, более предпочтительно менее чем 1 мкМ). Тест (b): максимальная концентрация соединений, используемых в тесте (b) составляла 3 мкМ. Соответственно, предпочтительные соединения обладают значением IC50 менее чем 3 мкМ. Определенные тестируемые соединения для нахождения IC50 требовали концентраций более чем 3 мкМ. Для таких соединений значение IC50 не определяли. В качестве примера, в анализе, по существу, аналогичному описанному выше в отношении ферментного анализа in vitro, тест (а), была определена активность следующих соединений.
МПК / Метки
МПК: A61P 35/00, C07D 401/14, C07D 401/12, A61K 31/4439, C07D 413/14, C07D 405/14
Метки: пиридина, соединения
Код ссылки
<a href="https://eas.patents.su/30-20807-soedineniya-piridina.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения пиридина</a>
Следующий патент: Деградация лигноцеллюлозного материала
Случайный патент: Многослойный стеклопакет и способ его получения