N-ацилированные октасахариды, активирующие рецепторы fgf, их получение и применение в терапии
Номер патента: 20485
Опубликовано: 28.11.2014
Авторы: Фон Пьер, Эрбер Корантен, Дюшоссуа Филипп, Дриге Пьер Александр, Лассалль Жильбер
Формула / Реферат
1. Октасахаридные соединения формулы (I)
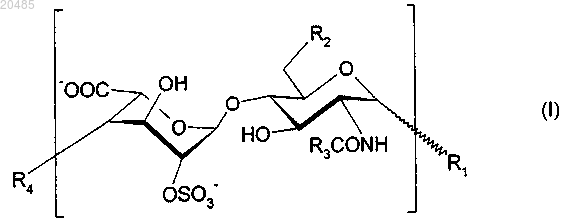
где зигзагообразная линия обозначает связь, расположенную под плоскостью или над плоскостью пиранозного цикла глюкозаминового звена;
R1 представляет собой О-алкил, в котором алкил содержит от 1 до 16 атомов углерода и при необходимости имеет один или несколько заместителей, которые являются одинаковыми или различными и выбраны из C5-C10-арилов и С3-С6-циклоалкилов;
R2 представляет собой OSO3- или гидроксигруппу;
R3 представляет собой С1-С6-алкил, С3-С6-циклоалкил или С1-С6-алкил(С3-С6-циклоалкил);
R4 представляет собой дисахарид формулы (II)
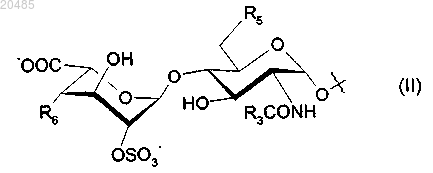
где R3 имеет определенные ранее значения;
R5 представляет собой OSO3- или гидроксигруппу;
R6 представляет собой дисахарид формулы (III)
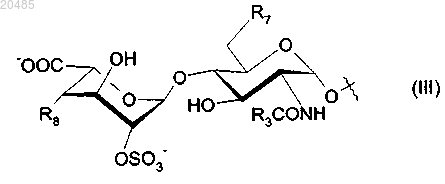
где R3 имеет определенные ранее значения;
R7 представляет собой OSO3- или гидроксигруппу;
R8 представляет собой дисахарид формулы (IV)
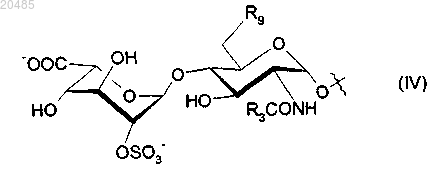
где R3 имеет определенные ранее значения;
R9 представляет собой OSO3- или гидроксигруппу;
в виде кислоты или в виде любой из их фармацевтически приемлемых солей.
2. Соединения по п.1, в которых R1 представляет собой
или О-алкил, в котором алкил содержит от 5 до 16 атомов углерода;
или О-алкил, в котором алкил содержит от 1 до 8 атомов углерода и имеет 1 или 2 заместителя, являющихся одинаковыми или различающимися и выбранных из С5-С10-арилов и С3-С6-циклоалкилов.
3. Соединения по п.1 или 2, в которых R1 представляет собой О-алкил, в котором алкил содержит от 5 до 12 атомов углерода.
4. Соединения по любому из пп.1-3, в которых R1 представляет собой О-алкил, в котором алкил содержит от 3 до 6 атомов углерода и имеет 1 или 2 заместителя, которые являются одинаковыми или различными и выбраны из фенила и С3-С6-циклоалкилов.
5. Соединения по любому из пп.1-4, в которых R3 представляет собой алкил, содержащий от 2 до 6 атомов углерода, или С3-С6-циклоалкил.
6. Соединения по любому из пп.1-5, в которых по меньшей мере один из радикалов R2, R5, R7 и R9 представляет собой гидроксигруппу.
7. Соединения по любому из пп.1-6, в которых по меньшей мере один из радикалов R2, R5, R7 и R9 представляет собой гидроксигруппу и по меньшей мере один из радикалов R2, R5, R7 и R9 представляет собой OSO3-.
8. Соединения по любому из пп.1-7, отличающиеся тем, что они соответствуют формуле (I'), в которой R1, R2, R3, R5, R7 и R9 имеют значения, определенные в любом из пп.1-7:
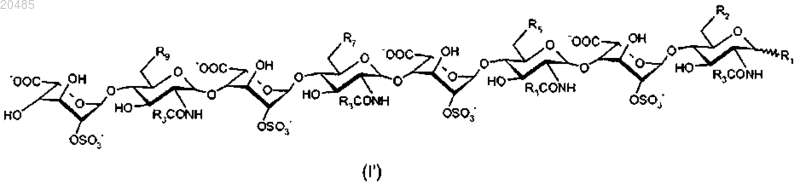
9. Соединения по любому из пп.1-8, выбранные из следующих соединений:
пентил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-ацетамидо-2-дезокси-6-O-натрийсульфонато-β-D-глюкопиранозид (№ 1);
пентил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксобутил)амино-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксобутил)амино-6-О-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксобутил)амино-6-О-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-дезокси-2-(1-оксобутил)амино-6-O-натрийсульфонато-β-D-глюкопиранозид (№ 2);
пентил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксогексил)амино-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксогексил)амино-6-О-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксогексил)амино-6-О-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-дезокси-2-(1-оксогексил)амино-6-O-натрийсульфонато-β-D-глюкопиранозид (№ 3);
пентил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-[(циклопентилкарбонил)амино]-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-[(циклопентилкарбонил)амино]-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-[(циклопентилкарбонил)амино]-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-[(циклопентилкарбонил)амино]-2-дезокси-6-O-натрийсульфонато-β-D-глюкопиранозид (№ 4);
ундецил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-ацетамидо-2-дезокси-6-O-натрийсульфонато-β-D-глюкопиранозид (№ 5);
5-фенилпентил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-О-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-ацетамидо-2-дезокси-6-O-натрийсульфонато-β-D-глюкопиранозид (№ 6);
метил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-[(1®4)-(2-О-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)]2-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозид (№ 7);
метил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозид (№ 8);
метил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозид (№ 9);
метил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-О-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-ацетамидо-2-дезокси-α-D-глюкопиранозид (№ 10);
метил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозид (№ 11);
метил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-О-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-α-D-глюкопиранозил)-(1®4)-(2-О-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-ацетамидо-2-дезокси-α-D-глюкопиранозид (№ 12);
метил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-О-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-α-D-глюкопиранозил)-(1®4)-(2-О-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-ацетамидо-2-дезокси-6-O-натрийсульфонато-α-D-глюкопиранозид (№ 13);
5-фенилпентил(2-О-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксобутил)амино-6-О-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксобутил)амино-6-О-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксобутил)амино-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-дезокси-2-(1-оксобутил)амино-β-D-глюкопиранозид (№ 14);
2-пропилпентил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксобутил)амино-6-O-натрийсульфонато-α-O-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксобутил)амино-6-О-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксобутил)амино-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-дезокси-2-(1-оксобутил)амино-β-D-глюкопиранозид (№ 15);
3-циклогексилпропил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-ацетамидо-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-ацетамидо-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-ацетамидо-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-дезокси-2-ацетамидо-β-D-глюкопиранозид (№ 16);
3-циклогексилпропил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксобутил)амино-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксобутил)амино-6-О-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксобутил)амино-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-дезокси-2-(1-оксобутил) амино-β-D-глюкопиранозид (№ 17);
3,3-дифенилпропил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксобутил)амино-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксобутил)амино-6-О-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(1-оксобутил)амино-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-дезокси-2-(1-оксобутил)амино-β-D-глюкопиранозид (№ 18) и
5-фенилпентил(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(3-метил-1-оксобутил)амино-6-O-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(3-метил-1-оксобутил)амино-6-О-натрийсульфонато-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-(2-дезокси-2-(3-метил-1-оксобутил)амино-α-D-глюкопиранозил)-(1®4)-(2-O-натрийсульфонато-α-L-идопиранозилуронат натрия)-(1®4)-2-дезокси-2-(3-метил-1-оксобутил)амино-β-D-глюкопиранозид (№ 19).
10. Лекарственное средство, обладающее агонистическим действием в отношении рецепторов FGF, отличающееся тем, что оно включает соединение по любому из пп.1-9 или фармацевтически приемлемую соль данного соединения.
11. Фармацевтическая композиция, обладающая агонистическим действием в отношении рецепторов FGF, отличающаяся тем, что она включает соединение по любому из пп.1-9 или фармацевтически приемлемую соль данного соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент.
12. Применение соединения по любому из пп.1-9 для лечения патологий, требующих активации рецепторов FGF.
13. Применение по п.12 для лечения патологий, требующих активации ангиогенеза и постишемической реваскуляризации.
14. Применение по п.12 или 13 для лечения ишемии, при лечении заболеваний, связанных со стенозом или обструкцией артерий, или артериитов, при лечении стенокардии, облитерирующего тромбангиита, атеросклероза, для подавления рестеноза после ангиопластики или эндартерэктомии, для заживления ран, при регенерации мышц, для выживания миобластов, при лечении периферической нейропатии, послеоперационных повреждений нервов, нейрогенной недостаточности, при лечении деменции, для улучшения выживания биоинженерных трансплантатов поджелудочной железы у больных диабетом, для улучшения реваскуляризации крупных имплантатов и выживания трансплантатов, при лечении дегенерации сетчатки, пигментного ретинита, остеоартрита, преэклампсии или повреждений сосудов и острого респираторного дистресс-синдрома, при восстановлении хрящей, при восстановлении и защите костей, при восстановлении и защите волосяных фолликулов и для защиты и регулирования роста капилляров.
15. Применение по п.14 для лечения ишемии, где ишемия выбрана из ишемии сердца и артериальной ишемии нижних конечностей.
16. Применение по п.14 для лечения нейрогенной недостаточности, выбранной из болезни Паркинсона, болезни Альцгеймера, прионной болезни и дегенерации нейронов у алкоголиков.
17. Соединение формулы (V), в которой Alk представляет собой C1-С6-алкил, R1 имеет значения, определенные в любом из пп.1-4, Pg, Pg' и Pg", являющиеся одинаковыми или отличающимися друг от друга, представляют собой защитные группы:
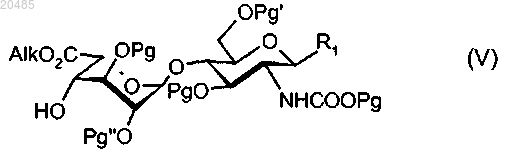
18. Соединение по п.17, в котором Pg, Pg' и Pg" представляют собой бензил, tBDPS (трет-бутилдифенилсилил) и ацетил соответственно, Alk представляет собой метил, a R1 имеет значения, определенные по любому из пп.1-4.
19. Соединение по п.17 или 18, в котором Pg, Pg' и Pg" представляют собой бензил, tBDPS и ацетил соответственно, Alk представляет собой метил, a R1 выбран из таких групп, как -О-метил, -О-(СН2)5-фенил, -О-СН2-СН(С3Н7)2, -O-(СН2)3-C6H11 и -O-(СН2)2-СН(фенил)2.
20. Соединение формулы (VI), в котором Alk представляет собой C1-C6-алкил, а Pg, Pg' и Pg", являющиеся одинаковыми или отличающимися друг от друга, представляют собой защитные группы:
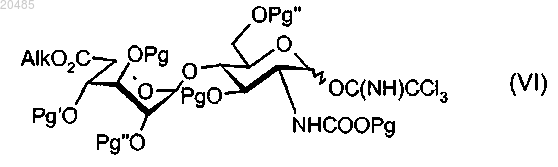
21. Соединение по п.20, в котором Alk представляет собой метил, а Pg, Pg' и Pg" представляют собой бензил, левулинил и ацетил соответственно.
Текст
N-Ацилированные октасахариды, активирующие рецепторы FGF и соответствующие формуле (I),в которой R1 представляет собой О-алкил, имеющий при необходимости в качестве заместителей один или несколько арилов или циклоалкилов; R2 представляет собой OSO3- или гидроксигруппу;R3 представляет собой алкил, циклоалкил или алкилциклоалкил; R4 представляет собой дисахарид формулы (II); R6 представляет собой дисахарид формулы (III); R8 представляет собой дисахарид формулы (IV), в которой R5, R7 и R9 представляют собой группы OSO3 или гидроксигруппы. Их получение и применение в терапии. Изобретение относится к N-ацилированным октасахаридам-агонистам системы FGF/FGFR, к их получению и применению в терапии. Ангиогенез представляет собой процесс образования новых капиллярных сосудов. При закупорке кровеносного сосуда ангиогенез, сочетающийся с артериогенезом (укрупнением капилляров), улучшает реваскуляризацию зоны закупорки. In vitro и in vivo показано, что многие факторы роста, такие как Fibroblast Growth Factors (FGF, факторы роста фибробластов), стимулируют процесс неоваскуляризации.FGF представляют собой группу из 23 белков. FGF2 (или базовый FGF) представляет собой белок массой 18 кДа. FGF2 на уровне эндотелиальных клеток индуцирует в культуре их пролиферацию, миграцию и продуцирование протеаз. In vivo FGF2 благоприятствует явлениям неоваскуляризации. FGF2 взаимодействует с эндотелиальными клетками посредством двух классов рецепторов: рецепторов с высоким сродством к активности тирозинкиназы (FGFR) и рецепторов с низким сродством типа гепарансульфатпротеогликана (HSPG). Известно, что рецепторы, отвечающие за активность тирозинкиназы, находящиеся на поверхности клеток, ассоциируются в виде димера с комплексом, образованным двумя молекулами лиганда, и с молекулой гепарансульфата. Образование данного комплекса позволяет запустить каскад внутриклеточных сигналов, ведущих к активации пролиферации и клеточной миграции, представляющих собой два ключевых процесса, вовлеченных в ангиогенез. Таким образом, FGF2 и его рецепторы представляют собой очень подходящие мишени для терапии,направленной на активацию или ингибирование процессов ангиогенеза. Синтетические олигосахариды также были объектом исследований взаимодействий с рецепторамиFGF (С. Tabeur et al., Bioorg.Med. Chem. , 1999, 7, 2003-2012; C. Noti et al., Chem. Eur. J., 2006, 12,8664-8686). В настоящее время заявителями найдены новые синтетические олигосахаридные соединения, способные облегчать образование комплекса FGF/FGFR, благоприятствовать, таким образом, выживанию эндотелиальных клеток in vitro и способствовать образованию новых сосудов in vitro и in vivo. Настоящее изобретение относится к новым октасахаридным соединениям, соответствующим формуле (I) где зигзагообразная линия обозначает связь, расположенную под плоскостью или над плоскостью пиранозного цикла глюкозаминового звена;R1 представляет собой O-алкил, в котором алкил содержит от 1 до 16 атомов углерода и при необходимости имеет один или несколько заместителей (например, 1 или 2), которые являются одинаковыми или различными и выбраны из арилов и циклоалкилов;R4 представляет собой дисахарид формулы (II)R6 представляет собой дисахарид формулы (III)R8 представляет собой дисахарид формулы (IV):R9 представляет собой OSO3- или гидроксигруппу. В рамках настоящего изобретения, если в тексте не упомянуто иное, принято, что алкил обозначает линейную или разветвленную алифатическую насыщенную группу. Если в тексте не указано иное, такой алкил содержит преимущественно от 1 до 6 атомов углерода. В качестве примеров можно упомянуть метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил и т.д.; циклоалкил обозначает циклический алкильный радикал, содержащий от 3 до 6 атомов углерода,например, циклопентил или циклогексил; алкилциклоалкил обозначает алкил, имеющий в качестве заместителя циклоалкил, причем упомянутые алкил и циклоалкил имеют значения, определенные ранее; арил обозначает ароматический цикл, содержащий от 5 до 10 атомов углерода, например фенил. Такой арил при необходимости имеет один или несколько заместителей, таких как атомы галогенов, алкилы, алкоксигруппы, тиоалкилы, трифторметил и фенил. Октасахариды по настоящему изобретению представляют собой синтетические олигосахариды, то есть соединения, полученные исключительно путем синтеза из промежуточных синтонов соответственно приведенному далее подробному описанию. В этом качестве они отличаются от олигосахаридов, полученных деполимеризацией или выделением из сложных смесей полисахаридов типа гепаринов или гепаринов с низкой молекулярной массой. В частности, соединения по настоящему изобретению обладают четко определенной структурой, образующейся при их химическом синтезе, и представляют собой чистые октасахариды, то есть свободные от других олигосахаридных соединений. Настоящее изобретение относится в целом к соединениям формулы (I) в виде кислоты или в виде любой из их фармацевтически приемлемых солей. Функциональные группы -COO- и -SO3- в виде кислоты представляют собой -СООН и -SO3H, соответственно. Под фармацевтически приемлемой солью соединения по настоящему изобретению понимают соединение, в котором одна или несколько функциональных групп -COO- или/и -SO3- связаны ионной связью с фармацевтически приемлемым катионом. Предпочтительными по настоящему изобретению солями являются соли, в которых катион выбран из катионов щелочных металлов и предпочтительно представляет собой катион Na+. Соединения формулы (I) по настоящему изобретению включают в себя также соединения, в которых один или несколько атомов водорода или углерода замещены их радиоактивными изотопами, например, тритием или углеродом 14 С. Такие меченые соединения являются полезными при исследовании метаболизма или фармакокинетики в качестве лигандов в биохимических испытаниях. В формуле (I) соединений по настоящему изобретению понимают, что дисахарид формулы (II) связан с дисахаридным звеном, соответствующим формуле (I), через атом кислорода, находящийся в положении 1 его глюкозаминового звена; аналогичным образом дисахарид формулы (III) связан с дисахаридом формулы (II) через атом кислорода, находящийся в положении 1 его глюкозаминового звена; аналогичным образом дисахарид формулы (IV) связан с дисахаридом формулы (III) через атом кислорода, находящийся в положении 1 его глюкозаминового звена. Под термином "глюкозаминовое звено" понимают моносахаридное звено следующей формулы: Представителем другого типа сахаридных звеньев, содержащихся в соединениях по настоящему изобретению, является уроновая кислота и более точно идуроновая кислота, соответствующая следующей формуле: Таким образом, соединения формулы (I) по настоящему изобретению, представляющие собой октасахариды, также могут быть представлены приведенной далее формулой (I'), в которой чередуются идуроновые и глюкозаминовые звенья, a R1, R2, R3, R5, R7 и R9 имеют определенные ранее значения: Среди соединений формулы (I)/(I'), являющихся объектами настоящего изобретения, можно упомянуть подгруппу соединений, в которых R1 представляет собой или О-алкил, в котором алкил содержит от 5 до 16 атомов углерода и преимущественно от 5 до 12 атомов углерода (например, -О-пентил, -O-ундецил или 2-пропилпентил); или О-алкил, в котором алкил содержит от 1 до 8 атомов углерода и преимущественно от 3 до 6 атомов углерода (например, -O-пропил или -О-пентил) и имеет 1 или 2 заместителя, которые являются одинаковыми или различными и выбраны из арилов и циклоалкилов (например, фенилов и циклоалкилов, таких как циклогексил). Среди соединений формулы (I)/(I'), являющихся объектами настоящего изобретения, можно упомянуть другую подгруппу соединений, в которых R3 представляет собой алкил, содержащий от 2 до 6 атомов углерода (например, пропил или пентил), или циклоалкил (например, циклопентил). Среди соединений формулы (I)/(I'), являющихся объектами настоящего изобретения, можно упомянуть другую подгруппу соединений, в которых по меньшей мере один из радикалов R2, R5, R7 и R9 представляет собой гидроксигруппу. Другую подгруппу соединений, являющихся объектами настоящего изобретения, образуют соединения, в которых по меньшей мере один из радикалов R2, R5, R7 и R9 представляет собой гидроксигруппу и по меньшей мере один из радикалов R2, R5, R7 и R9 представляет собой OSO3-. Другие подгруппы октасахаридов по настоящему изобретению могут иметь несколько характеристик, указанных ранее для каждой из определенных ранее подгрупп. Предпочтительно можно упомянуть подгруппу соединений формулы (I), в которойR1 представляет собой или О-алкил, в котором алкил содержит от 5 до 16 атомов углерода и преимущественно от 5 до 12 атомов углерода (например, -О-пентил, -О-ундецил или 2-пропилпентил); или О-алкил, в котором алкил содержит от 1 до 8 атомов углерода и преимущественно от 3 до 6 атомов углерода (например, -О-пропил или -О-пентил) и имеет 1 или 2 заместителя, которые являются одинаковыми или различными и выбраны из арилов и циклоалкилов (например, фенилов и циклоалкилов, таких как циклогексил);R3 представляет собой алкил, содержащий от 2 до 6 атомов углерода (например, пропил или пентил), или циклоалкил (например, циклопентил); по меньшей мере один из радикалов R2, R5, R7 и R9 представляет собой гидроксигруппу. Среди соединений по настоящему изобретению можно предпочтительно упомянуть следующие октасахариды: пентил(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-ацетамидо-2-дезокси-6 О-натрийсульфонатоD-глюкопиранозил)-(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонатоD-глюкопиранозил)-(14)-(2-OнатрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-ацетамидо-2-дезокси-6-О-натрийсульфонатоD-глюкопиранозил)-(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-2 ацетамидо-2-дезокси-6-O-натрийсульфонатоD-глюкопиранозид ( 1); пентил(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-дезокси-2-(1-оксобутил) амино-6-O-натрийсульфонатоD-глюкопиранозил)-(14)-(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-дезокси-2-(1-оксобутил)амино-6-O-натрийсульфонатоD-глюкопиранозил)(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-дезокси-2-(1-оксобутил)амино-6-О-натрийсульфонатоD-глюкопиранозил)-(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-2-дезокси-2-(1-оксобутил)амино-6-O-натрийсульфонатоD-глюкопиранозид ( 2); пентил(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-дезокси-2-(1-оксогексил) амино-6-O-натрийсульфонатоD-глюкопиранозил)-(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-дезокси-2-(1-оксогексил)амино-6-O-натрийсульфонатоD-глюкопиранозил)(14)-(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-дезокси-2-(1-оксогексил)амино-6-О-натрийсульфонатоD-глюкопиранозил)-(14)-(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-2-дезокси-2-(1-оксогексил)амино-6-О-натрийсульфонатоD-глюкопиранозид ( 3); пентил(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-[(циклопентилкарбонил) амино]-2-дезокси-6-О-натрийсульфонатоD-глюкопиранозил)-(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-[(циклопентилкарбонил)амино]-2-дезокси-6-О-натрийсульфонато-D-глюкопиранозил)-(14)-(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-[(циклопентилкарбонил)амино]-2-дезокси-6-О-натрийсульфонатоD-глюкопиранозил)-(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-2-[(циклопентилкарбонил)амино]-2-дезокси-6-ОнатрийсульфонатоD-глюкопиранозид ( 4); ундецил(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-ацетамидо-2-дезокси-6O-натрийсульфонатоD-глюкопиранозил)-(14)-(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-ацетамидо-2-дезокси-6-O-натрийсульфонатоD-глюкопиранозил)-(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-ацетамидо-2-дезокси-6-О-натрийсульфонато-D-глюкопиранозил)-(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-2-ацетамидо-2-дезокси-6-O-натрийсульфонатоD-глюкопиранозид ( 5);(14)-2-дезокси-2- (1-оксобутил) аминоD-глюкопиранозид ( 15); 3-циклогексилпропил(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-дезокси 2-ацетамидо-6-O-натрийсульфонатоD-глюкопиранозил)-(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-дезокси-2-ацетамидо-6-О-натрийсульфонатоD-глюкопиранозил)(14)-(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-дезокси-2-ацетамидоDглюкопиранозил)-(14)-(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-2-дезокси-2 ацетамидоD-глюкопиранозид ( 16); 3-циклогексилпропил(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-дезокси 2-(1-оксобутил)амино-6-О-натрийсульфонатоD-глюкопиранозил)-(14)-(2-O-натрийсульфонатоLидопиранозилуронат натрия)-(14)-(2-дезокси-2-(1-оксобутил)амино-6-О-натрийсульфонатоDглюкопиранозил)-(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-дезокси-2(1-оксобутил)аминоD-глюкопиранозил)-(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-2-дезокси-2-(1-оксобутил) аминоD-глюкопиранозид ( 17); 3,3-дифенилпропил(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-дезокси-2(1-оксобутил)амино-6-О-натрийсульфонатоD-глюкопиранозил)-(14)-(2-O-натрийсульфонатоLидопиранозилуронат натрия)-(14)-(2-дезокси-2-(1-оксобутил)амино-6-О-натрийсульфонатоDглюкопиранозил)-(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-дезокси-2(1-оксобутил) аминоD-глюкопиранозил)-(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-2-дезокси-2-(1-оксобутил)амино 6-глюкопиранозид ( 18); 5-фенилпентил(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-дезокси-2-(3 метил-1-оксобутил)амино-6-О-натрийсульфонатоD-глюкопиранозил)-(14) -(2-О-натрийсульфонато-L-идопиранозилуронат натрия)-(14)-(2-дезокси-2-(3-метил-1-оксобутил)амино-6-О-натрийсульфонатоD-глюкопиранозил)-(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2 дезокси-2-(3-метил-1-оксобутил)аминоD-глюкопиранозил)-(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-2-дезокси-2-(3-метил-1-оксобутил)аминоD-глюкопиранозид ( 19). Принципиально в способе получения соединений по настоящему изобретению используют основные синтоны ди- или олигосахаридов, полученные соответственно приведенным ранее литературным источникам. В частности, можно сослаться на патенты или заявки ЕР 0300099, ЕР 0529715, ЕР 0621282 и ЕР 0649854, а также на публикацию С. Van Boeckel и М. Petitou в Angew. Chem. Int. Ed. Engl., 1993, 32,1671-1690. Затем такие синтоны сочетают друг с другом таким образом, чтобы получить полностью защищенный эквивалент октасахарида по настоящему изобретению. Далее данный защищенный эквивалент превращают в соединение по настоящему изобретению. В упомянутых реакциях сочетания ди- или олигосахарид-"донор", активированный по своему аномерному углероду, взаимодействует с ди- или олигосахаридом-"акцептором", обладающим свободной гидроксигруппой. Специфицированные схемы синтезов описаны в подробных примерах, приведенных далее. Таким образом, настоящее изобретение относится к способу получения октасахаридов формулы(I)/(I'), отличающемуся тем, что на первой стадии синтезируют полностью защищенный эквивалент требуемого октасахарида (I); на второй стадии в положениях, в которые надлежит вводить сульфатные группы конечной молекулы, снимают защиту и затем осуществляют О-сульфатирование; на третьей стадии снимают защиту со всего соединения; на четвертой стадии вводят N-ацильные группы (введение групп R3-CO-). Синтез полностью защищенного эквивалента требуемого октасахарида (I) осуществляют по реакциям, хорошо известным специалистам в данной области техники, используя способы синтеза олигосахаридов (см., например, G.J. Boons, Tetrahedron (1996), 52, 1095-1121 и заявки WO 98/03554 и WO 99/36443), в которых олигосахарид-донор гликозидной связи сочетают с олигосахаридом-акцептором гликозидной связи для получения другого олигосахарида, представляющего собой совокупность двух реагентов. Данную последовательность повторяют до получения соединения формулы (I), при необходимости, в защищенном виде. Природу и профиль заряда требуемого конечного соединения определяет природа химических звеньев, использованных на различных стадиях синтеза, согласно правилам, хорошо известных специалистам в данной области техники. Можно сослаться, например, на С. Van Boeckel и М. Petitou, Angew. Chem. Int. Ed. Engl. (1993), 32, 1671-1690 или также на Н. Paulsen, "Advances in selective chemical syntheses of complex oligosaccharides", Angew. Chem. Int. Ed. Engl. (1982), 21, 155-173. Соединения по настоящему изобретению, разумеется, могут быть получены с использованием различных стратегий, известных специалистам в области синтеза олигосахаридов. Способ, описанный ранее, представляет собой предпочтительный способ по настоящему изобретению. Тем не менее, соединения формулы (I)/(I') могут быть получены другими способами, хорошо известными в химии сахаров и описанными, например, в "Monosaccharides, their chemistry and their roles in natural products", P.M. Collinset R.J. Ferrier, J. WileySons (1995) и G.J. Boons в Tetrahedron (1996), 52, 1095-1121. Защитные группы, используемые в способе получения соединений формулы (I)/(I'), представляют собой группы, которые позволяют, с одной стороны, защищать реакционноспособную функциональную группу, такую как гидрокси- или аминогруппа, в ходе синтеза, а с другой стороны, восстанавливать реакционноспособную функциональную группу в исходном виде в конце синтеза. Для осуществления способа по настоящему изобретению используют защитные группы, традиционно используемые в химии сахаров, такие как описанные, например, в "Protective Groups in Organic Synthesis", Green et al., 3rd Edition(John WileySons, Inc., New York). Защитные группы выбирают, например, из таких групп, как ацетил,метил, пентенил, бензоил, левулинил, бензил, замещенный бензил, азиды, бензилкарбамат, третбутилдиметилсилил (tBDMS) или трет-бутилдифенилсилил (tBDPS). Также могут быть использованы активирующие группы; речь идет о группах, традиционно используемых в химии сахаров, например, согласно G.J. Boons, Tetrahedron (1996), 52, 1095-1121. Такие активирующие группы выбирают, например, из имидатов или тиогликозидов. Способ, описанный ранее, позволяет получать соединения по настоящему изобретению в виде солей и предпочтительно в виде солей натрия. Для получения соответствующих кислот соединения по настоящему изобретению в виде солей могут быть приведены в контакт с катионообменными смолами в кислой форме. Затем соединения по настоящему изобретению в виде кислот могут быть нейтрализованы основанием для получения требуемой соли. Для получения солей соединений формулы (I)/(I') можно использовать любое неорганическое или органическое основание, образующее с соединениями формулы(I)/(I') фармацевтически приемлемые соли. Настоящее изобретение относится также к соединениям приведенной далее формулы (V), в которойAlk представляет собой алкил, R1 имеет значения, определенные ранее в отношении соединений формулы (I)/(I'), а Pg, Pg' и Pg", являющиеся одинаковыми или отличающимися друг от друга, представляют собой защитные группы: Такие соединения являются приемлемыми в качестве промежуточных соединений в синтезе соединений формулы (I)/(I'). Предпочтительно объектами настоящего изобретения являются соединения (V), в которых Alk представляет собой метил, а Pg, Pg' и Pg" представляют собой бензил, tBDPS и ацетил, соответственно. Более предпочтительно, настоящее изобретение относится к соединениям формулы (V), в которых R1 выбран из таких групп, как -О-метил, -О-(СН 2)5-фенил, -О-СН 2-СН(С 3 Н 7)2, -O-(CH2)3-C6H11 и -О-(СН 2)2 СН(фенил)2. Такие соединения соответствуют дисахаридам 58, 131, 132, 133 и 134, поясненным на приведенных далее схемах синтеза и являющимся приемлемыми для синтеза соединений 10, 11 и 14-19 по настоящему изобретению соответственно приведенному далее подробному описанию. Настоящее изобретение относится также к соединениям приведенной далее формулы (VI), в которой Alk представляет собой алкил, а Pg, Pg' и Pg", являющиеся одинаковыми или отличающимися друг от друга, представляют собой защитные группы: Такие соединения являются приемлемыми в качестве промежуточных соединений в синтезе соединений формулы (I)/(I'). Настоящее изобретение предпочтительно относится к соединению (VI), в котором Alk представляет собой метил, а Pg, Pg' и Pg" представляют собой бензил, левулинил и ацетил, соответственно. Данное соединение соответствует дисахариду 24, поясненному на приведенных далее схемах синтеза и являющемуся приемлемым для синтеза соединений 1-4 по настоящему изобретению соответственно приведенному далее подробному описанию. В приведенных далее примерах описано получение некоторых соединений по настоящему изобретению. Данные примеры не являются ограничительными и приведены только для пояснения настоящего изобретения. Исходные вещества и реагенты, способы получения которых не описаны конкретно, имеются в продаже или описаны в литературе, или могут быть получены способами, описанными в данном тексте или известными специалистам в данной области техники. Приняты следующие сокращения:Rf - фактор замедления (время удерживания, определенное при ТСХ по отношению к фронту продвижения растворителя);Z - бензилоксикарбонил.ЖХ-МС осуществляют на приборе ZQ4000 марки Waters. Используемая колонка представляет собой колонку Symetry C18, 3,5 мкм (2,150 мм). Элюент А представляет собой смесь H2O + 0,005% ТФУ с рН=3,15. Элюент В представляет собой смесь ацетонитрил + 0,005% ТФУ. Градиент варьируют в интервале от 0 до 90% элюента В в течение 10 (или 30) мин и в течение 5 мин при 90% элюента В. Расход составляет 0,4 мл/мин. Получение промежуточных соединений, используемых в синтезе(1985), 293-321) в N/N-диметилформамиде (155 мл) прибавляют триэтиламин (Et3N) (65 мл, 15 мол. экв.) и затем 1,3-пропандитиол (47 мл, 15 мол. экв.). После перемешивания в течение 17 ч магнитной мешалкой реакционную смесь разбавляют этилацетатом, промывают водой, сушат (над Na2SO4), фильтруют,концентрируют и затем очищают на силикагеле (ацетон-циклогексан) с получением соединения 21 (15,8 г, 76%). ЖХ-МС: m/z 672,2 [(М+Н)+]. TR=0,94 мин. Получение(метил-2-О-ацетил-3-O-бензил-4-O-левулиноилL-идопиранозилуронат)-(14)-1,6 ангидро-3-О-бензил-2-дезокси-2-[(бензилокси)карбонил] аминоD-глюкопиранозы ( 22). К раствору соединения 21 (128,12 г, 190,7 ммоль) в дихлорметане (240 мл) прибавляют насыщенный водный раствор гидрокарбоната натрия (240 мл) и затем при 0 С бензилоксикарбонилхлорид (35,5 мл, 1,3 молярного эквивалента). После интенсивного перемешивания в течение 15 мин магнитной мешалкой при 0C реакционную смесь разбавляют дихлорметаном, промывают водой до нейтральной реакции, сушат (над Na2SO4), фильтруют и концентрируют. Неочищенный продукт реакции используют на следующей стадии без очистки. ЖХ-МС: m/z 806,2 [(М+Н)+]. TR=1,55 мин. Получение(метил-2-О-ацетил-3-О-бензил-4-О-левулиноилL-идопиранозилуронат)-(14)-1,6 ди-О-ацетил-3-О-бензил-2-дезокси-2-[(бензилокси)карбонил]амино-,-D-глюкопиранозы ( 23). Остаток, полученный на предыдущей стадии, растворяют в уксусном ангидриде (1,05 л) и затем при 0 С в течение 15 мин прибавляют трифторуксусную кислоту (ТФУ) (105 мл). Реакционную смесь перемешивают в течение 10 мин при 0 С и далее в течение 18 ч при комнатной температуре, затем концентрируют, упаривают совместно с толуолом и очищают на силикагеле (циклогексан-ацетон) с получением соединения 23 (138,9 г, 80%, 2 стадии). ЖХ-МС: m/z 930,3 [(M+Na)+]. TR=21,68/21,84 мин. Получение трихлорацетимидата (метил-2-О-ацетил-3-О-бензил-4-O-левулиноилL-идопиранозилуронат)-(14)-6-О-ацетил-3-О-бензил-2-дезокси-2-[(бензилокси)карбонил]амино-,-D-глюкопира-7 020485 нозы ( 24). К раствору соединения 23 (25 г, 27,5 ммоль) в диэтиловом эфире (1,1 л) при 0 С прибавляют бензиламин (BnNH2) (109 мл, 36 мол. экв.). После перемешивания в течение 1 ч при 0 С и далее в течение 4,5 ч при комнатной температуре реакционную смесь разбавляют этилацетатом, затем нейтрализуют холодным 1 н. раствором HCl (0-4 С), промывают водой, сушат (над Na2SO4), фильтруют, концентрируют и очищают на силикагеле (ацетон-циклогексан) с получением (метил-2-О-ацетил-3-O-бензил-4-О-левулиноилL-идопиранозилуронат)-(14)-6-О-ацетил-3-О-бензил-2-дезокси-2-[(бензилокси)карбонил]амино-,-D-глюкопиранозы (18,5 г, 78%). ЖХ-МС: m/z 888,3 [(M+Na)+]. TR=19,95/20,60 мин. К раствору полученного таким образом соединения (18,5 г, 21,4 ммоль) в дихлорметане (405 мл) в атмосфере аргона при 0 С прибавляют карбонат цезия (Cs2CO3) (11,1 г, 1,6 мол. экв.) и трихлорацетонитрил (CCl3CN) (14,8 мл, 5,0 мол. экв.). После перемешивания в течение 1 ч при комнатной температуре реакционную смесь фильтруют и затем концентрируют. Остаток очищают на силикагеле (ацетонциклогексан + 0,1% триэтиламина) с получением соединения 24 (17,2 г, 80%).Rf=0,47 (этилацетат-циклогексан, 7/3). Химические сдвиги аномерных протонов (500 МГц, CDCl3)5,17 IdoUAII, 6,28 GlcI. ЖХ-МС: m/z 866,3 [(M+Na)+]. TR1=19,91 мин. Получение 4-пентенил (метил-2-О-ацетил-3-О-бензил-4-О-левулиноилL-идопиранозилуронат)(14)-6-О-ацетил-3-О-бензил-2-дезокси-2-[(бензилокси)карбонил]аминоD-глюкопиранозида ( 25). Раствор трет-бутилдиметилсилилтрифлата в дихлорметане (1 М, 0,2 моль на моль имидата) в атмосфере аргона при -20 С прибавляют к раствору имидата 24 (13,7 г, 13,56 ммоль) и аллилового спирта (6,8 мл, 5 мол. экв.) в дихлорметане (590 мл) в присутствии молекулярного сита 4 (17,6 г). После перемешивания в течение 20 мин (по анализу ТСХ) прибавляют насыщенный водный раствор гидрокарбоната натрия. После фильтрования, промывки водой, высушивания (над Na2SO4), фильтрования и упаривания досуха смесь очищают на силикагеле с получением соединения 25 (10,7 г, 85%). ЖХ-МС: m/z 934,5 [(М+Н)+]. TR=24,00 мин. Получение 4-пентенил (метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-6-О-ацетил 3-О-бензил-2-дезокси-2-[(бензилокси)карбонил]аминоD-глюкопиранозида ( 26). К раствору соединения 25 (10,6 г, 11,35 ммоль) в смеси толуол/этанол, 1:2 (1,2 л), прибавляют гидразинацетат (5,2 г, 5 мол. экв.). После перемешивания в течение 2,5 ч магнитной мешалкой смесь концентрируют в вакууме и затем очищают на силикагеле с получением соединения 26 (6,98 г, 74%).-8 020485 ЖХ-МС: m/z 858,4 [(M+Na)+]. TR=22,62 мин. Получение 4-пентенил (метил-2-О-ацетил-3-О-бензил-4-О-левулиноилL-идопиранозилуронат)(14)-(6-О-ацетил-2-азидо-3-O-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-ОбензилL-идопиранозилуронат)-(14)-6-О-ацетил-3-О-бензил-2-дезокси-2-[(бензилокси)карбонил] аминоD-глюкопиранозида ( 28). Раствор трет-бутилдиметилсилилтрифлата в дихлорметане (1 M, 0,15 моль на моль имидата) в атмосфере аргона при -20 С прибавляют к раствору имидата 27 (9,0 г, 9,98 ммоль) (С. Tabeur et coll., BioOrg. Med. Chem. (1999) 7, 2003-2012) и акцептор глюкозила 26 (6,95 г, 8,32 ммоль) в дихлорметане (350 мл) в присутствии молекулярного сита 4 (7,5 г). После выдерживания в течение 18 ч при -20 С (по анализу ТСХ) прибавляют гидрокарбонат натрия в твердом состоянии. После фильтрования, промывки 2%м водным раствором гидрокарбоната натрия и водой, высушивания (над Na2SO4), фильтрования и упаривания досуха остаток очищают на силикагеле с получением соединения 28 (9,04 г, 69%).Rf=0,38 (ацетон-толуол, 1/4). Получение 4-пентенил(метил-2-O-ацетил-3-O-бензилL-идопиранозилуронат)-(14)-(6-О-ацетил-2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-О-бензилLидопиранозилуронат)-(14)-6-О-ацетил-3-О-бензил-2-дезокси-2-[(бензилокси)карбонил]аминоDглюкопиранозида ( 29). К раствору соединения 28 (9,0 г, 5,7 ммоль) в смеси толуол/этанол, 1:2 (570 мл), прибавляют гидразинацетат (2,6 г, 5 мол. экв.). После перемешивания в течение 1 ч магнитной мешалкой смесь концентрируют в вакууме и затем очищают на силикагеле с получением соединения 29 (7,15 г, 85%).Rf=0,29 (ацетон-толуол, 1/4). Получение 4-пентенил(метил-2-О-ацетил-3-О-бензил-4-О-левулиноилL-идопиранозилуронат)(14)-(6-О-ацетил-2-азидо-3-O-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-OбензилL-идопиранозилуронат)-(14)-(6-О-ацетил-2-азидо-3-O-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-O-бензилL-идопиранозилуронат)-(14)-6-О-ацетил-3-О-бензил-2 дезокси-2-[(бензилокси)карбонил]аминоD-глюкопиранозида ( 30). Раствор (трет-бутилдиметилсилилтрифлата в дихлорметане (1 М, 0,15 моль на моль имидата) в атмосфере аргона при -20 С прибавляют к раствору имидата 27 (4,80 г, 5,32 ммоль) и акцептора глюкозила 29 (7,15 г, 4,84 ммоль) в дихлорметане (180 мл) в присутствии молекулярного сита 4 (3,99 г). После выдерживания в течение 18 ч при -20 С (по анализу ТСХ) прибавляют гидрокарбонат натрия в твердом состоянии. После перемешивания магнитной мешалкой при комнатной температуре (в течение 30 мин),фильтрования, промывки 2%-м водным раствором гидрокарбоната натрия и затем водой, высушивания(над Na2SO4) и упаривания досуха остаток очищают на силикагеле с получением соединения 30 (5,23 г,49%).(метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-(6-Оацетил-2-азидо-3-О-бензил-2-дезоксиР-глюкопиранозил)-(14)-(метил-2-О-ацетил-З-О-бензилLидопиранозилуронат)-(14)-(6-O-ацетил-2-азидо-3-O-бензил-2-дезоксиD-глюкопиранозил)-(14)(метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-6-О-ацетил-3-О-бензил-2-дезокси-2[(бензилокси)карбонил]аминоD-глюкопиранозида ( 31). К раствору соединения 30 (5,21 г, 2,35 ммоль) в смеси толуол/этанол, 1:2 (180 мл), прибавляют гидразинацетат (1,08 г, 5 мол. экв.). После перемешивания в течение 1 ч 10 мин магнитной мешалкой смесь концентрируют в вакууме и затем очищают на силикагеле с получением соединения 31 (4,78 г, 96%). Получение (3,4-ди-О-бензил-2-О-(4-метокси)бензил-6-О-трет-бутилдиметилсилилL-идопиранозил)-(14)-1,6-ангидро-2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозы ( 33). К раствору соединения 32 (32,3 г, 42,2 ммоль) (WO 2006/021653) в N,N-диметилформамиде (210 мл) при 0 С в атмосфере аргона прибавляют бензилбромид (25 мл, 5 мол. экв.) и затем 55%-й NaH (3 г, 1,5 молярного эквивалента). После перемешивания в течение 20 мин магнитной мешалкой прибавляют метанол (30 мл) и реакционную смесь концентрируют в вакууме, неочищенный продукт реакции разбавляют этилацетатом, промывают водой и затем насыщенным водным раствором хлорида натрия, сушат (надNa2SO4), фильтруют и концентрируют. Полученный остаток используют на следующей стадии без очистки. ЖХ-МС: m/z 871,7 [(M+NH4)+]. TR=13,86 мин. Получение (2-О-ацетил-3,4-ди-O-бензил-6-O-трет-бутилдиметилсилилL-идопиранозил)-(14)1,6-ангидро-2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозы ( 34). К раствору неочищенного соединения 33 (38,6 г) в дихлорметане (1,6 л) прибавляют воду (80 мл) и затем при 0 С прибавляют DDQ (14,2 г, 1,5 мол. экв.). После перемешивания в течение 4 ч 45 мин при 0 С смесь разбавляют дихлорметаном и прибавляют раствор гидрокарбоната натрия. Затем органическую фракцию промывают водой, сушат (над Na2SO4), фильтруют и концентрируют. Полученное соединение используют на следующей стадии без очистки. Полученный остаток растворяют в дихлорметане (350 мл) и затем прибавляют триэтиламин (13 мл),4-диметиламинопиридин (2 г) и уксусный ангидрид (60 мл). После перемешивания в течение 10 мин магнитной мешалкой при 0 С и далее в течение 1 ч 45 мин при комнатной температуре реакционную смесь разбавляют дихлорметаном, затем последовательно промывают 10%-м водным раствором гидросульфата калия и водой и далее органическую фракцию сушат (над Na2SO4), фильтруют и концентрируют. Полученный остаток очищают на диоксиде кремния (этилацетат-циклогексан) с получением соединения 34 (26,8 г, 83%, 3 стадии). ЖХ-МС: m/z 798,3 [(M+Na)+]. TR=12,97 мин. Получение(10,5 г, 3,1 мол. экв.) в 3,5 М водном растворе H2SO4 (47 мл). После перемешивания в течение 4 ч механической мешалкой при 0 С реакционную смесь разбавляют дихлорметаном, промывают водой до нейтральной реакции и затем органическую фракцию сушат (над Na2SO4), фильтруют и концентрируют. Полученное соединение используют на следующей стадии без очистки. Полученный остаток растворяют в N,N-диметилформамиде (210 мл) и прибавляют гидрокарбонат калия (17 г, 5 мол. экв.) и метилиодид (21 мл, 10 мол. экв.). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч и затем концентрируют в вакууме. Остаток разбавляют этилацетатом,затем промывают водой, насыщенным водным раствором тиосульфата натрия и насыщенным водным раствором хлорида натрия и далее сушат (над Na2SO4), фильтруют и концентрируют. Полученное соединение используют на следующей стадии без очистки. ЖХ-МС: m/z 707,3 [(M+NH4)+]. TR=10,37 мин. Получение (метил-2-О-ацетил-3,4-ди-О-бензилL-идопиранозилуронат)-(14)-1,6-ди-О-ацетил 2-азидо-3-О-бензил-2-дезокси-,-D-глюкопиранозы ( 36). Неочищенный остаток, полученный на предыдущей стадии, растворяют в уксусном ангидриде (177 мл) и затем прибавляют трифторуксусную кислоту (ТФУ) (17,7 мл). Реакционную смесь перемешивают в течение 16 ч, затем концентрируют, упаривают совместно с толуолом и очищают на силикагеле (циклогексан-этилацетат) с получением соединения 36 (17,4 г, 65%, 3 стадии). ЖХ-МС: m/z 809,3 [(M+NH4)+]. TR=10,81 мин. Получение(метил-2-О-ацетил-3,4-ди-О-бензилL-идопиранозилуронат)-(14)-6-O-ацетил-2 азидо-3-О-бензил-2-дезокси-,-D-глюкопиранозы ( 37). К раствору соединения 36 (7 г, 8,84 ммоль) в диэтиловом эфире (303 мл) при 0 С в атмосфере аргона прибавляют бензиламин (BnNH2) (29,7 мл, 36 мол. экв.). После перемешивания в течение 1 ч магнитной мешалкой при 0 С и затем в течение 6 ч при комнатной температуре реакционную смесь нейтрализуют холодным 1 н. раствором HCl (0-4 С), промывают водой, сушат (над Na2SO4), фильтруют, концентрируют и очищают на силикагеле (этилацетат-циклогексан) с получением соединения 37 (5,95 г, 90%). ЖХ-МС: m/z 767,7 [(M+NH4)+]. TR=1,64 мин. Получение трихлорацетимидата (метил-2-О-ацетил-3,4-ди-О-бензилL-идопиранозилуронат)(14)-6-О-ацетил-2-азидо-3-О-бензил-2-дезокси-,-D-глюкопиранозы ( 38). К раствору соединения 37 (5,94 г, 7,9 ммоль) в дихлорметане (150 мл) в атмосфере аргона прибавляют карбонат цезия (Cs2CO3) (4,1 г, 1,6 молярного эквивалента) и трихлорацетонитрил (CCl3CN) (3,9 мл,5,0 мол. экв.). После перемешивания в течение 45 мин при комнатной температуре реакционную смесь фильтруют и затем концентрируют. Остаток очищают на силикагеле (этилацетат-циклогексан + 0,1% триэтиламина) с получением соединения 38 (5,7 г, 81%). ЖХ-МС: m/z 912,0 [(M+NH4)+]. TR=1,81 мин. Получение 4-пентенил (метил-2-О-ацетил-3,4-ди-О-бензилL-идопиранозилуронат)-(14)-(6-Oацетил-2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-О-бензилLидопиранозилуронат)-(14)-(6-O-ацетил-2-азидо-3-O-бензил-2-дезоксиD-глюкопиранозил)-(14)(метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-(6-O-ацетил-2-азидо-3-O-бензил-2 дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-6 О-ацетил-3-О-бензил-2-дезокси-2-[(бензилокси)карбонил]аминоD-глюкопиранозида ( 39). Раствор трет-бутилдиметилсилилтрифлата в дихлорметане (1 М, 0,1 моль на моль имидата) в атмосфере аргона при -15 С прибавляют к раствору имидата 38 (2,61 г, 2,92 ммоль) и акцептора глюкозила 31(4,78 г, 2,25 ммоль) в дихлорметане (146 мл) в присутствии молекулярного сита 4 (1,99 г). После перемешивания в течение 2 ч магнитной мешалкой при -15 С (по анализу ТСХ) дополнительно прибавляют имидат 38 с интервалами от 15 до 30 мин до максимального расходования акцептора 31. В конце реакции(по анализу ТСХ) прибавляют гидрокарбонат натрия в твердом состоянии до нейтральной реакции и после перемешивания магнитной мешалкой при комнатной температуре (в течение 15 мин), фильтрования,промывки 2%-м водным раствором гидрокарбоната натрия и затем водой, высушивания (над Na2SO4) и упаривания досуха остаток очищают на силикагеле с получением соединения 39 (3,71 г, 58%). Получение 4-пентенил(метил-3,4-ди-O-бензилL-идопиранозилуронат)-(14)-(2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-3-О-бензилL-идопиранозилуронат)-(14)-(2-азидо-3-O-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-3-О-бензилL-идопиранозилуронат)(14)-(2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-3-О-бензилL-идопиранозилуронат)-(14)-3-О-бензил-2-дезокси-2-[(бензилокси)карбонил]аминоD-глюкопиранозида ( 40). К раствору соединения 39 (300 мг, 0,105 ммоль) в смеси метанол/дихлорметан, 3/2 (31 мл), при 0 С прибавляют 1 М метанольный раствор метилата натрия (0,31 мл) в присутствии молекулярного сита 3. После перемешивания при 0 С в течение 1 ч и далее при комнатной температуре в течение 15 ч смесь нейтрализуют смолой Powex 50WX4 в Н+-форме. После фильтрования и частичного концентрирования реакционную смесь очищают на колонке для эксклюзионной хроматографии LH-20, используя смесь метанол/дихлорметан, 1:1, в качестве элюента, затем после объединения фракций, содержащих требуемое вещество, и концентрирования в вакууме остаток очищают на силикагеле, элюируя смесью дихлорметан/этилацетат/этанол с получением соединения 40 (185 мг, 69%).Rf=0,22 (CH2Cl2-AcOEt-EtOH, 9/1/0,3). Получение 4-пентенил (метил-3,4-ди-O-бензил-2-O-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-(2-азидо-3-О-бензил-2-дезокси-6-О-триэтиламмонийсульфонатоD-глюкопиранозил)-(14)-(метил-3-О-бензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-(2 азидо-3-О-бензил-2-дезокси-6-О-триэтиламмонийсульфонатоD-глюкопиранозил)-(14)-(метил-3-Обензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-(2-азидо-3-O-бензил-2-дезокси-6-О-триэтиламмонийсульфонатоD-глюкопиранозил)-(14)-(метил-3-О-бензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-3-О-бензил-2-дезокси-2-[(бензилокси)карбонил]амино 6-О-триэтиламмонийсульфонатоD-глюкопиранозида ( 41). Комплекс триэтиламин/триоксид серы (513 мг, 5 моль на гидроксигруппу) прибавляют к раствору соединения 40 (178 мг, 70,8 мкмоль) в N,N-диметилформамиде (6,3 мл, 90 л/моль). После перемешивания в течение 17 ч магнитной мешалкой при 55 дС без доступа света прибавляют при 0 С метанол и после перемешивания в течение 0,5 ч при 0 С и затем в течение 0,5 ч при комнатной температуре реакционную смесь очищают на колонке LH-20, используя смесь метанол/N,N-диметилформамид, 9:1, в качестве элюента. Далее фракции, содержащие требуемое вещество, концентрируют в глубоком вакууме с получением требуемого соединения 41 (241 мг, 87%). Получение 4-пентенил(3,4-ди-O-бензил-2-O-литийсульфонатоL-идопиранозилуронат лития)(14)-(2-азидо-3-O-бензил-2-дезокси-6-О-литийсульфонатоD-глюкопиранозил)-(14)-(3-O-бензил-2O-литийсульфонатоL-идопиранозилуронат лития)-(14)-(2-азидо-3-O-бензил-2-дезокси-6-O-литийсульфонатоD-глюкопиранозил)-(14)-(3-O-бензил-2-O-литийсульфонатоL-идопиранозилуронат лития)-(14)-(2-азидо-3-О-бензил-2-дезокси-6-О-литийсульфонатоD-глюкопиранозил)-(14)-(3-Обензил-2-О-литийсульфонатоL-идопиранозилуронат лития)-(14)-3-О-бензил-2-дезокси-2-[(бензилокси)карбонил]амино-6-О-литийсульфонатоD-глюкопиранозида ( 42). К раствору соединения 41 (238 мг, 60 мкмоль) в смеси метанол/тетрагидрофуран, 1:1 (9,6 мл), при 0 С прибавляют молярный водный раствор LiOH. После перемешивания в течение 1 ч при 0 С и затем в течение 16 ч при комнатной температуре реакционную смесь очищают на колонке LH-20, используя смесь метанол/N,N-диметилформамид, 9:1, в качестве элюента. Далее фракции, содержащие требуемое вещество, концентрируют в глубоком вакууме с получением требуемого соединения 42.Rf=0,42 (AcOEt-пиридин-АсОН-Н 2 О, 11/7/1,6/4). Получение пентил (2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-амино-2 дезокси-6-O-натрийсульфонатоD-глюкопиранозил)-(14)-(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-амино-2-дезокси-6-O-натрийсульфонатоD-глюкопиранозил)-(14)-(2-ОнатрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-амино-2-дезокси-6-O-натрийсульфонато-D-глюкопиранозил)-(14)-(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-2-амино 2-дезокси-6-O-натрийсульфонатоD-глюкопиранозида ( 43). К раствору ранее полученного соединения 42 в смеси трет-бутанол/вода, 1:1 (14 мл), последовательно прибавляют формиат аммония (617 мг, 9,8 ммоль) и Pd/C, 10% (1,55 г). После интенсивного перемешивания в течение 4 ч при комнатной температуре реакционную смесь фильтруют, частично концентрируют в вакууме, затем раствор вносят в верх колонки Sephadex G-25 и элюируют 0,2 М раствором хлорида натрия. Фракции, содержащие требуемое вещество, концентрируют и освобождают от соли,используя ту же самую колонку и элюируя водой. Затем фракции, содержащие требуемое вещество, концентрируют в глубоком вакууме с получением требуемого соединения 43 (123 мг, 61% (2 стадии. Химические сдвиги аномерных протонов (600 МГц, D2O)5,11 IdoUAVIII, 5,38 GlcVII, 5,19 IdoUAVI,5,38 GlcV, 5,19 IdoUAIV, 5,38 GlcIII, 5,21 IdoUAII, 4,70 GlcI.( 44). К раствору соединения 39 (610 мг, 214 мкмоль) в дихлорметане (10,7 мл) прибавляют 1-октен (67 мкл, 2 мол. экв.) и катализатор Граббса первого поколения (C44H74Cl2P2Ru) (18 мг, 0,1 мол. экв.). После нагревания с обратным холодильником в течение 6 ч и последующего перемешивания в течение ночи при комнатной температуре смесь концентрируют в глубоком вакууме, после чего она может быть снова введена в реакцию в тех же самых условиях в случае неполного протекания реакции. Неочищенный продукт реакции очищают хроматографией на силикагеле (толуол-ацетон) с получением требуемого соединения 44 (131 мг, 20%).( 45). К раствору соединения 39 (100 мг, 35 мкмоль) в дихлорметане (1 мл) прибавляют стирол (16 мкл, 4 мол. экв.) и катализатор Граббса второго поколения (C46H65Cl2N2PRu) (1,8 мг, 0,06 мол. экв.). После нагревания с обратным холодильником в течение 8 ч и последующего перемешивания в течение ночи при 35 С реактивы, в случае необходимости, прибавляют дополнительно. Затем смесь концентрируют в глубоком вакууме и очищают хроматографией на силикагеле (толуол-этилацетат) с получением требуемого соединения 45 (38 мг, 37%).( 46). К раствору соединения 44 (152 мг, 0,052 ммоль) в смеси метанол/дихлорметан, 3/2 (15 мл), при 0 С прибавляют 1 М метанольный раствор метилата натрия (154 мкл) в присутствии молекулярного сита 3. После перемешивания при 0C в течение 1 ч и далее при комнатной температуре в течение 15 ч смесь нейтрализуют смолой Powex 50WX4 в Н+-форме. После фильтрования и частичного концентрирования реакционную смесь очищают на колонке для эксклюзионной хроматографии LH-20, используя смесь метанол/дихлорметан, 1:1, в качестве элюента, затем после объединения фракций, содержащих требуемое вещество, и концентрирования в вакууме остаток очищают на силикагеле, элюируя смесью толуол/ацетон/этилацетат/этанол с получением соединения 46 (83 мг, 61%).Rf=0,25 (толуол-ацетон-EtOH, 7/3/0,1). Получение (Z/E) 5-фенил-4-пентенил(метил-3,4-ди-O-бензилL-идопиранозилуронат)-(14)-(2 азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-3-О-бензилL-идопиранозилуронат)(14)-(2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-3-O-бензилL-идопиранозилуронат)-(14)-(2-азидо-3-O-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-3-О-бензилLидопиранозилуронат)-(14)-3-О-бензил-2-дезокси-2-[(бензилокси)карбонил]аминоD-глюкопиранозида ( 47). К раствору соединения 45 (229 мг, 0,078 ммоль) в смеси метанол/дихлорметан, 3/2 (23 мл), при 0 С прибавляют 1 М метанольный раствор метилата натрия (232 мкл) в присутствии молекулярного сита 3. После перемешивания при 0 С в течение 1 ч и далее при комнатной температуре в течение 15 ч смесь нейтрализуют смолой Powex 50WX4 в Н+-форме. После фильтрования и частичного концентрирования реакционную смесь очищают на колонке для эксклюзионной хроматографии LH-20, используя смесь метанол/дихлорметан, 1:1, в качестве элюента, затем после объединения фракций, содержащих требуемое вещество, и концентрирования в вакууме остаток очищают на силикагеле, элюируя смесью дихлорметан/этилацетат/этанол с получением соединения 47 (141 мг, 69%). глюкопиранозил)-(14)-(метил-3-О-бензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)(14)-(2-азидо-3-О-бензил-2-дезокси-6-О-триэтиламмонийсульфонатоD-глюкопиранозил)-(14)(метил-3-О-бензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-(2-азидо-3-Обензил-2-дезокси-6-О-триэтиламмонийсульфонатоD-глюкопиранозил)-(14)-(метил-3-О-бензил-2-ОтриэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-3-O-бензил-2-дезокси-2-[(бензилокси) карбонил]амино-6-О-триэтиламмонийсульфонатоD-глюкопиранозида ( 48). Комплекс триэтиламин/триоксид серы (225 мг, 5 моль на гидроксигруппу) прибавляют к раствору соединения 46 (81 мг, 31 мкмоль) в N,N-диметилформамиде (2,8 мл, 90 л/моль). После перемешивания в течение 16 ч магнитной мешалкой при 50 С без доступа света прибавляют при 0 С метанол (0,2 мл) и после перемешивания в течение 35 мин при 0 С и затем в течение 2,5 ч при комнатной температуре реакционную смесь очищают на колонке LH-20, используя смесь метанол/дихлорметан/N,N-диметилформамид, 1:1:0,1, в качестве элюента. Далее фракции, содержащие требуемое вещество, концентрируют в глубоком вакууме с получением требуемого соединения 48 (122 мг, 99%).Rf=0,36 (АсОЕ-пиридин-АсОН-Н 2 О, 11/7/1,6/4). Получение (Z/E) 5-фенил-4-пентенил(метил-3,4-ди-О-бензил-2-O-триэтиламмонийсульфонатоLидопиранозилуронат)-(14)-(2-азидо-3-O-бензил-2-дезокси-6-O-триэтиламмонийсульфонатоDглюкопиранозил)-(14)-(метил-3-О-бензил-2-O-триэтиламмонийсульфонатоL-идопиранозилуронат)(14)-(2-азидо-3-О-бензил-2-дезокси-6-О-триэтиламмонийсульфонатоD-глюкопиранозил)-(14)(метил-3-О-бензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-(2-азидо-3-Обензил-2-дезокси-6-О-триэтиламмонийсульфонатоD-глюкопиранозил)-(14)-(метил-3-O-бензил-2-OтриэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-3-O-бензил-2-дезокси-2-[(бензилокси) карбонил]амино-6-О-триэтиламмонийсульфонатоD-глюкопиранозида ( 49). Комплекс триэтиламин/триоксид серы (385 мг, 5 моль на гидроксигруппу) прибавляют к раствору соединения 47 (138 мг, 53 мкмоль) в N,N-диметилформамиде (4,7 мл, 90 л/моль). После перемешивания в течение 16 часов магнитной мешалкой при 50 С без доступа света прибавляют при 0 С метанол (0,35 мл) и после перемешивания в течение 30 мин при 0 С и затем в течение 1 ч при комнатной температуре реакционную смесь очищают на колонке LH-20, используя смесь метанол/дихлорметан/N,Nдиметилформамид, 1:1:0,1, в качестве элюента. Далее фракции, содержащие требуемое вещество, концентрируют в глубоком вакууме с получением требуемого соединения 49 (194 мг, 92%).Rf=0,35 (AcOEt-пиридин-AcOH-H2O, 11/7/1,6/4). Получение (Z/E) ундец-4-енил (3,4-ди-O-бензил-2-O-литийсульфонатоL-идопиранозилуронат лития)-(14)-(2-азидо-3-O-бензил-2-дезокси-6-O-литийсульфонатоD-глюкопиранозил)-(14)-(3-Oбензил-2-O-литийсульфонатоL-идопиранозилуронат лития)-(14)-(2-азидо-3-O-бензил-2-дезокси-6O-литийсульфонатоD-глюкопиранозил)-(14)-(3-O-бензил-2-O-литийсульфонатоL-идопиранозилуронат лития)-(14)-(2-азидо-3-О-бензил-2-дезокси-6-O-литийсульфонатоD-глюкопиранозил)(14)-(3-О-бензил-2-О-литийсульфонатоL-идопиранозилуронат лития)-(14)-3-О-бензил-2-дезокси 2-[(бензилокси)карбонил]амино-6-О-литийсульфонатоD-глюкопиранозида ( 50). К раствору соединения 48 (119 мг, 29 мкмоль) в смеси метанол/тетрагидрофуран, 1:1 (4,7 мл), при 0 С прибавляют молярный водный раствор LiOH (1,18 мл). После перемешивания в течение 1 ч при 0 С и затем в течение 19,5 ч при комнатной температуре реакционную смесь очищают на колонке LH-20,используя смесь метанол/N,N-диметилформамид, 4:1, в качестве элюента. Далее фракции, содержащие требуемое вещество, концентрируют в глубоком вакууме с получением требуемого соединения 50.Rf=0,40 (АсОЕ-пиридин-АсОН-Н 2 О, 11/7/1,6/4). Получение (Z/E) 5-фенил-4-пентенил(3,4-ди-О-бензил-2-О-литийсульфонатоL-идопиранозилуронат лития)-(14)-(2-азидо-3-O-бензил-2-дезокси-6-O-литийсульфонатоD-глюкопиранозил)(14)-(3-O-бензил-2-O-литийсульфонатоL-идопиранозилуронат лития)-(14)-(2-азидо-3-O-бензил-2 дезокси-6-O-литийсульфонатоD-глюкопиранозил)-(14)-(3-O-бензил-2-O-литийсульфонатоLидопиранозилуронат лития)-(14)-(2-азидо-3-O-бензил-2-дезокси-6-О-литийсульфонатоD-глюкопиранозил)-(14)-(3-О-бензил-2-O-литийсульфонатоL-идопиранозилуронат лития)-(14)-3-О-бензил 2-дезокси-2-[(бензилокси)карбонил]амино-6-O-литийсульфонатоD-глюкопиранозида ( 51). К раствору соединения 49 (190 мг, 47 мкмоль) в смеси метанол/тетрагидрофуран, 1:1 (7,4 мл), при 0C прибавляют молярный водный раствор LiOH (1,88 мл). После перемешивания в течение 1 ч при 0 С и затем в течение 16 ч при комнатной температуре реакционную смесь очищают на колонке LH-20, используя смесь метанол/N,N-диметилформамид, 9:1, в качестве элюента. Далее фракции, содержащие требуемое вещество, концентрируют в глубоком вакууме с получением требуемого соединения 51.-D-глюкопиранозил)-(14)-(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-2-амино 2-дезокси-6-О-натрийсульфонатоD-глюкопиранозида ( 52). К раствору ранее полученного соединения 50 в смеси трет-бутанол/вода, 1:1 (6 мл), последовательно прибавляют формиат аммония (260 мг, 4,1 ммоль) и Pd/C, 10% (672 мг). После интенсивного перемешивания в течение 4 ч 5 мин при комнатной температуре реакционную смесь фильтруют, частично концентрируют в вакууме, затем раствор вносят в верх колонки Sephadex G-25 и элюируют 0,2 М раствором хлорида натрия. Фракции, содержащие требуемое вещество, концентрируют и освобождают от соли,используя ту же самую колонку и элюируя водой. Затем фракции, содержащие требуемое вещество, концентрируют в глубоком вакууме с получением требуемого соединения 52 (34 мг, 49% (2 стадии. Масса: способ ИЭР, электроотрицательный режим: теоретическая масса - 2337,81; экспериментальная масса: 2337,270,06 а.е.м. [M-4Na+4H]. Получение 5-фенилпентил (2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2 амино-2-дезокси-6-О-натрийсульфонатоD-глюкопиранозил)-(14)-(2-O-натрийсульфонатоLидопиранозилуронат натрия)-(14)-(2-амино-2-дезокси-6-О-натрийсульфонатоD-глюкопиранозил)(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-амино-2-дезокси-6-O-натрийсульфонатоD-глюкопиранозил)-(14)-(2-О-натрийсульфонатоL-идопиранозилуронат натрия)(14)-2-амино-2-дезокси-6-O-натрийсульфонато-[3-D-глюкопиранозида ( 53). К раствору ранее полученного соединения 51 в смеси трет-бутанол/вода, 1:1 (9,2 мл), последовательно прибавляют формиат аммония (407 мг, 6,47 ммоль) и Pd/C, 10% (1,05 г). После интенсивного перемешивания в течение 4 ч 5 мин при комнатной температуре реакционную смесь фильтруют, частично концентрируют в вакууме, затем раствор вносят в верх колонки Sephadex G-25 и элюируют 0,2 М раствором хлорида натрия. Фракции, содержащие требуемое вещество, концентрируют и освобождают от соли, используя ту же самую колонку и элюируя водой. Затем фракции, содержащие требуемое вещество, концентрируют в глубоком вакууме с получением требуемого соединения 53 (79 мг, 72% (2 стадии. Способ ИЭР, электроотрицательный режим: детектирован многозарядный ион m/z 537,0713 [М 4 Н]4- (форма кислоты). Получение метил (метил-2-О-ацетил-3-О-бензил-4-О-левулиноилL-идопиранозилуронат)-(14)6-О-ацетил-3-О-бензил-2-бензилоксикарбониламино-2-дезоксиD-глюкопиранозида ( 55). К раствору соединения 54 (23,5 г, 30 ммоль; Carbohydrate Research (1987), 167, 67-75) в дихлорметане (600 мл) при 0 С в инертной атмосфере прибавляют 4-диметиламинопиридин (733 мг, 6 ммоль),гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (11,5 г, 60 ммоль) и левулиновую кислоту(6,2 мл, 60 ммоль). После перемешивания в течение 16 ч при комнатной температуре смесь разбавляют дихлорметаном (1,5 л). Органическую фракцию последовательно промывают 10%-м водным раствором гидросульфата калия, водой, насыщенным раствором гидрокарбоната натрия и еще раз водой, сушат над сульфатом натрия, фильтруют и затем упаривают досуха. Остаток очищают флэш-хроматографией на колонке с силикагелем (циклогексан/этилацетат, 1/3) с получением соединения 55 (22,6 г).Rf=0,37, силикагель, циклогексан/этилацетат, 1/3. Получение метил(метил-2-О-ацетил-3-О-бензил-4-О-левулиноилL-идопиранозилуронат)-(14)3-О-бензил-2-бензилоксикарбониламино-2-дезоксиD-глюкопиранозида ( 56). К раствору соединения 55 (20,2 г, 23 ммоль) в смеси тетрагидрофуран/метанол, 1/1 (140 мл), в инертной атмосфере прибавляют [tBu2SnCl(ОН)]2 (226 мг, 0,79 ммоль), полученный согласно A. Orita etal., Chem. Eur. J. (2001) 7, 3321. Реакционную смесь перемешивают в течение 38 ч при 35 С. Полученный после концентрирования остаток (20,8 г) используют без очистки на следующей стадии.( 57). К раствору неочищенного соединения 56 (23 ммоль) в дихлорметане (190 мл) при 0C в инертной атмосфере прибавляют триэтиламин (8 мл, 57,5 ммоль), 4-диметиламинопиридин (1,4 г, 11,5 ммоль) и трет-бутилдифенилсилилхлорид (12 мл, 46,0 ммоль). Реакционную смесь перемешивают в течение 16 ч при комнатной температуре. Реакционную смесь разбавляют дихлорметаном. Органическую фракцию последовательно промывают насыщенным раствором хлорида натрия и водой, сушат над сульфатом натрия, фильтруют и затем упаривают. Остаток очищают флэш-хроматографией на колонке с силикагелемRf=0,42, силикагель, циклогексан/этилацетат, 2/1. Получение метил (метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-3-O-бензил-2 бензилоксикарбониламино-6-O-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозида ( 58). К раствору соединения 57 (22,6 г, 20,0 ммоль) в смеси толуол/этанол, 1/2 (2,5 л), прибавляют гидразинацетат (9,21 г, 100,0 ммоль). Реакционную смесь перемешивают в течение 30 мин при комнатной температуре. Полученный после концентрирования остаток очищают флэш-хроматографией на колонке с силикагелем (циклогексан/этилацетат, 2/1) с получением 17,6 г соединения 58.Rf=0,40, силикагель, циклогексан/этилацетат, 2/1. Химические сдвиги аномерных протонов (500 МГц, CDCl3)5,19 IdoUAII, 4,63 GlcI. ЖХ-МС: m/z 978,5 [(М+Н)+]. TR=12,29 мин. Получение (метил-2-O-ацетил-3-O-бензил-4-O-левулиноилL-идопиранозилуронат)-(14)-1-Оацетил-2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозы ( 60). К раствору соединения 59 (11 г, 13,7 ммоль) (С. Tabeur, et coll., Carbohydr. Res., 281 (1996) 253-276) в смеси метанол/тетрагидрофуран, 1/1 (80 мл), прибавляют [tBu2SnCl(ОН)]2 (0,55 г, 0,14 мол. экв.), полученный согласно А. Orita et al., Chem. Eur. J. (2001) 7, 3321. После перемешивания при 35 С в течение 5,5 ч, далее при комнатной температуре в течение 16 ч и затем снова при 35 С в течение 4 ч реакционную смесь концентрируют в вакууме и затем очищают хроматографией с получением соединения 60 (5,97 г,57%). ЖХ-МС: m/z 780,2 [(M+Na)+]. TR=9,14 мин. Получение (метил-2-O-ацетил-3-O-бензил-4-O-левулиноилL-идопиранозилуронат)-(14) -1-Oацетил-2-азидо-3-O-бензил-6-O-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозы ( 61). Соединение 60 (5,97 г, 7,88 ммоль) растворяют в дихлорметане (63 мл). При 0 С в атмосфере аргона последовательно прибавляют 4-диметиламинопиридин (0,481 г, 0,5 мол. экв.), триэтиламин (2,7 мл, 2,5 молярного эквивалента) и трет-бутилдифенилсилилхлорид (4 мл, 2 молярных эквивалента). После перемешивания в течение 4 ч магнитной мешалкой реакционную смесь разбавляют дихлорметаном, промывают 10%-м водным раствором гидросульфата калия и водой, сушат (над Na2SO4), фильтруют и концентрируют. Полученный остаток очищают на диоксиде кремния (этилацетат-гептан) с получением соединения 61 (7 г, 90%). ЖХ-МС: m/z 1018,3 [(M+Na)+]. TR=12,33 мин. Получение(метил-2-O-ацетил-3-O-бензил-4-O-левулиноилL-идопиранозилуронат)-(14)-2 азидо-3-О-бензил-6-О-трет-бутилдифенилсилил-2-дезокси-,-D-глюкопиранозы ( 62). К раствору соединения 61 (7 г, 7,03 ммоль) в диэтиловом эфире (70 мл) при 0 С прибавляют бензиламин (BnNH2) (29 мл, 38 мол. экв.). После перемешивания в течение 15 минут при 0 С и далее в течение 6 ч при комнатной температуре реакционную смесь разбавляют этилацетатом, затем нейтрализуют холодным 1 н. раствором HCl (0-4 С), промывают водой, сушат (над Na2SO4), фильтруют, концентрируют и очищают на силикагеле (этилацетат-толуол) с получением соединения 62 (5,86 г, 87%). ЖХ-МС: m/z 976,3 [(M+Na)+]. TR=27,6/27,8 мин. Получение трихлорацетимидата (метил-2-О-ацетил-3-О-бензил-4-O-левулиноилL-идопиранозилуронат)-(14)-2-азидо-3-О-бензил-6-О-трет-бутилдифенилсилил-2-дезокси-,-D-глюкопиранозы ( 63). К раствору соединения 62 (6,5 г, 6,81 ммоль) в дихлорметане (140 мл) в присутствии порошка молекулярного сита 4 (7 г) в атмосфере аргона прибавляют карбонат цезия (Cs2CO3) (3,5 г, 1,6 молярного эквивалента) и затем при 0 С прибавляют трихлорацетонитрил (CCl3CN) (3,4 мл, 5,0 молярного эквивалента). После перемешивания в течение 15 мин при 0 С и далее в течение 5 ч при комнатной температуре реакционную смесь фильтруют и затем концентрируют. Остаток очищают на силикагеле (этилацетат- 17020485 Получение метил (метил-2-О-ацетил-3-О-бензил-4-О-левулиноилL-идопиранозилуронат)-(14)(2-азидо-3-О-бензил-6-О-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-Oацетил-3-O-бензилL-идопиранозилуронат)-(14)-3-O-бензил-2-бензилоксикарбониламино-6-O-третбутилдифенилсилил-2-дезоксиD-глюкопиранозида ( 64). Смесь акцептора глюкозила 58 (8,80 мг, 9,00 ммоль), имидата 63 (6,58 г, 6,00 ммоль) и порошка молекулярного сита 4 (4,50 г) в дихлорметане (210 мл) перемешивают в атмосфере аргона в течение 1 ч при 25 С. Реакционную смесь охлаждают до -20 С и прибавляют 1 М раствор трет-бутилдиметилсилилтрифлата в дихлорметане (900 мкл). Через 1 ч 20 мин реакционную смесь нейтрализуют прибавлением гидрокарбоната натрия в твердом состоянии. Полученный после фильтрования через Celite и концентрирования остаток хроматографируют на колонке Sephadex LH20 (1903,2 см, дихлорметан/этанол,1/1) с получением 8,26 г соединения 64.Rf=0,30, силикагель, циклогексан/этилацетат, 2/1. Получение метил (метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-(2-азидо-3-Обензил-6-О-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-O-ацетил-3-OбензилL-идопиранозилуронат)-(14)-3-О-бензил-2-бензилоксикарбониламино-6-О-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозида ( 65). Соединение 64 (8,26 г, 4,31 ммоль) превращают в соединение 65 (6,41 г) аналогично методике, описанной для синтеза соединения 58.( 66). Смесь акцептора глюкозила 65 (7,42 г, 4,09 ммоль), имидата 63 (6,73 г, 6,1 ммоль) и порошка молекулярного сита 4 (4,60 г) в дихлорметане (215 мл) перемешивают в атмосфере аргона в течение 1 ч при 25 С. Реакционную смесь охлаждают до -20 С и прибавляют 1 М раствор трет-бутилдиметилсилилтрифлата в дихлорметане (920 мкл). Через 1 ч 30 мин реакционную смесь нейтрализуют прибавлением гидрокарбоната натрия в твердом состоянии. После фильтрования через Celite реакционную смесь разбавляют дихлорметаном (800 мл). Органическую фракцию последовательно промывают 2%-м раствором гидрокарбоната натрия и водой, затем сушат над сульфатом натрия, фильтруют и далее упаривают досуха. Полученный остаток очищают хроматографией на колонке Sephadex LH20 (1903,2 см, дихлорметан/этанол, 1/1) с последующим хроматографированием на колонке с силикагелем (толуол/этилацетат,6/1) с получением 6,13 г соединения 66.Rf=0,46, силикагель, толуол/этилацетат, 4/1. Получение метил (метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-(2-азидо-3-Обензил-6-О-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-O-ацетил-3-OбензилL-идопиранозилуронат)-(14)-(2-азидо-3-О-бензил-6-O-трет-бутилдифенилсилил-2-дезокси-D-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-3-О-бензил 2-бензилоксикарбониламино-6-O-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозида ( 67). Соединение 66 (7,14 г, 2,59 ммоль) превращают в соединение 67 (6,07 г) аналогично методике, описанной для получения соединения 58.[tBu2SnCl(ОН)]2 (0,25 г, 0,14 молярного эквивалента), полученный согласно А. Orita et al., Chem. Eur. J. (2001) 7, 3321. После перемешивания при комнатной температуре в течение 72 ч реакционную смесь концентрируют в вакууме и затем очищают хроматографией с получением соединения 68 (2,89 г, 64%). ЖХ-МС: m/z 772,4 [(M+Na)+]. TR=10,23 мин. Получение (метил-2-О-ацетил-3,4-ди-O-бензилL-идопиранозилуронат)-(14)-1-O-ацетил-2-азидо-3-O-бензил-6-O-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозы ( 69). Соединение 68 (2,89 г, 3,86 ммоль) растворяют в дихлорметане (31 мл). При 0 С в атмосфере аргона последовательно прибавляют триэтиламин (1,3 мл, 2,5 мол. экв.), 4-диметиламинопиридин (0,235 г, 0,5 молярного эквивалента) и трет-бутилдифенилсилилхлорид (2 мл, 2 молярных эквивалента). После перемешивания в течение 3 ч магнитной мешалкой реакционную смесь разбавляют дихлорметаном, промывают 10%-м водным раствором гидросульфата калия и водой, сушат (над Na2SO4), фильтруют и концентрируют. Полученный остаток очищают на диоксиде кремния (этилацетат-циклогексан) с получением соединения 69 (3,4 г, 90%). ЖХ-МС: m/z 1010,6 [(M+Na)+] . TR=13,10 мин. Получение(метил-2-О-ацетил-3,4-ди-О-бензилL-идопиранозилуронат)-(14)-2-азидо-3-Обензил-6-О-трет-бутилдифенилсилил-2-дезокси-,-D-глюкопиранозы ( 70). К раствору соединения 69 (3,44 г, 3,48 ммоль) в диэтиловом эфире (35 мл) при 0C прибавляют бензиламин (BnNH2) (14,5 мл, 38 мол. экв.). После перемешивания в течение 8 ч при комнатной температуре реакционную смесь выдерживают при -18 С в течение 16 ч и затем в течение 2,5 ч снова при комнатной температуре. Далее смесь разбавляют этилацетатом, нейтрализуют холодным 1 н. раствором HCl (0-4 С),промывают водой, сушат (над Na2SO4), фильтруют, концентрируют и очищают на силикагеле (этилацетат-циклогексан, 15/85) с получением соединения 70 (3,83 г, 91%). ЖХ-МС: m/z 963,6 [(M+NH4)+]. TR=12,37, 12,47 мин. Получение трихлорацетимидата (метил-2-О-ацетил-3,4-ди-О-бензилL-идопиранозилуронат)(14)-2-азидо-3-О-бензил-6-О-трет-бутилдифенилсилил-2-дезокси-,-D-глюкопиранозы ( 71). К раствору соединения 70 (2,99 г, 3,16 ммоль) в дихлорметане (60 мл) в присутствии порошка молекулярного сита 4 (3 г) при 0 С в атмосфере аргона прибавляют карбонат цезия (Cs2CO3) (1,6 г, 1,6 молярного эквивалента) и трихлорацетонитрил (CCl3CN) (1,6 мл, 5,0 мол. экв.). После перемешивания в течение 20 мин при 0 С и далее в течение 7 ч при комнатной температуре, выдерживания при -18 С в течение 16 ч, затем после перемешивания магнитной мешалкой в течение 8 ч при комнатной температу- 19020485 ре, выдерживания при -18C в течение 16 ч и заключительного перемешивания магнитной мешалкой в течение 1 ч при комнатной температуре реакционную смесь фильтруют и далее концентрируют. Остаток очищают на силикагеле (этилацетат-циклогексан, 15:85 + 0,1% триэтиламина) с получением соединения 71 (2,69 г, 78%). ЖХ-МС: m/z 1113,4 [(M+Na)+]. TR=14,58 мин. Получение метил (метил-2-О-ацетил-3,4-ди-О-бензилL-идопиранозилуронат)-(14)-(2-азидо-3 О-бензил-6-О-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозил)-(14)-[(метил-2-О-ацетил-3-ОбензилL-идопиранозилуронат)-(14)-(2-азидо-3-О-бензил-6-О-трет-бутилдифенилсилил-2-дезокси-D-глюкопиранозил)-(14)]2-(метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-3-О-бензил-2 бензилоксикарбониламино-6-O-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозида ( 72). Смесь акцептора глюкозила 67 (3,50 г, 1,32 ммоль), имидата 71 (2,16 г, 1,98 ммоль) и порошка молекулярного сита 4 (1,48 г) в дихлорметане (69 мл) перемешивают в атмосфере аргона в течение 1 ч при комнатной температуре. Реакционную смесь охлаждают до -20 С и прибавляют 1 М раствор третбутилдиметилсилилтрифлата в дихлорметане (297 мкл). Через 2 ч 30 мин реакционную смесь нейтрализуют прибавлением гидрокарбоната натрия в твердом состоянии. После фильтрования через Celite реакционную смесь разбавляют дихлорметаном (400 мл). Органическую фракцию последовательно промывают 2%-м раствором гидрокарбоната натрия и водой, затем сушат над сульфатом натрия, фильтруют и далее упаривают досуха. Полученный остаток очищают хроматографией на колонке Sephadex LH20(1903,2 см, дихлорметан/этанол, 1/1) с последующим хроматографированием на колонке с силикагелем жащей молекулярное сито 3 (78 мг), в атмосфере аргона при 0 С прибавляют 1 М раствор метилата натрия в метаноле (99,7 мкл). После выдерживания в течение 24 ч при комнатной температуре реакционную смесь нейтрализуют смолой Dowex AG 50 WX4 в Н+-форме. Полученный после фильтрования и концентрирования остаток хроматографируют на колонке Sephadex LH20 (1203 см, дихлорметан/этанол, 1/1) с последующей флэш-хроматографией на колонке с силикагелем (циклогексан/этилацетат, 1/066/34) с получением 1,80 г соединения 73.(38,0 мг, 1,03 ммоль). После перемешивания в течение 140 часов при комнатной температуре реакционную смесь вносят в колонку Sephadex LH20 (952 см, дихлорметан/этанол, 1/1) с последующей флэшхроматографией на колонке с силикагелем (толуол/ацетон, 3/2) с получением соединения 74 (24,2 мг).Rf=0,46, силикагель, толуол/ацетон, 3/2. Получение метил (метил-3,4-ди-О-бензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-(2-азидо-3-О-бензил-2-дезокси-6-О-триэтиламмонийсульфонатоD-глюкопиранозил)[(14)-(метил-3-О-бензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-(2-азидо-3 О-бензил-2-дезокси-6-О-триэтиламмонийсульфонатоD-глюкопиранозил)]2-(14)-(метил-3-О-бензил 2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-3-O-бензил-2-бензилоксикарбониламино-2-дезокси-6-O-триэтиламмонийсульфонатоD-глюкопиранозида ( 75). Соединение 74 (24,2 мг, 9,96 мкмоль) сушат совместной отгонкой с NN-диметилформамидом (31,0 мл) и затем растворяют в N,N-диметилформамиде (1,0 мл). К данному раствору прибавляют комплекс триэтиламин-триоксид серы (72,2 мг, 0,4 ммоль). Смесь перемешивают в течение 16 ч при 55 С без доступа света и затем избыток реактива нейтрализуют метанолом (16,2 мкл). Реакционную смесь вносят в колонку Sephadex LH20 (1203 см) и элюируют смесью дихлорметан/этанол, 1/1, с получением соединения 75 (29,0 мг).Rf=0,26, силикагель, этилацетат/пиридин/уксусная кислота/вода, 28/16/3,8/9. Получение метил(3,4-ди-О-бензил-2-О-литийсульфонатоL-идопиранозилуронат лития)-(14)(2-азидо-3-О-бензил-2-дезокси-6-O-литийсульфонатоD-глюкопиранозил)-[(14)-(3-О-бензил-2-ОлитийсульфонатоL-идопиранозилуронат лития)-(14)-(2-азидо-3-О-бензил-2-дезокси-6-О-литийсульфонатоD-глюкопиранозил)]2-(14)-(3-О-бензил-2-О-литийсульфонатоL-идопиранозилуронат лития)-(14)-3-О-бензил-2-бензилоксикарбониламино-2-дезокси-6-О-литийсульфонатоD-глюкопиранозида ( 76). К раствору соединения 75 (78,5 мг, 30,1 мкмоль) в смеси тетрагидрофуран/метанол, 1/1 (3,2 мл), при 0 С прибавляют 0,7 М раствор гидроксида лития в воде (440 мкл). После выдерживания в течение 1 ч при 0C и затем в течение 16 ч при комнатной температуре раствор вносят в колонку Sephadex LH20[]D=13,1 (c=1,0; МеОН). Получение метил (2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-амино-2 дезокси-6-O-натрийсульфонатоD-глюкопиранозил)-[(14)-(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-амино-2-дезокси-6-О-натрийсульфонатоD-глюкопиранозил) ]2-(14)-(2 О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-2-амино-2-дезокси-6-О-натрийсульфонатоD-глюкопиранозида ( 77). К раствору соединения 76 (19,3 мг, 6,16 мкмоль) в смеси трет-бутанол/вода 1/1 (1,2 мл) последовательно прибавляют формиат аммония (50,8 мг) и палладий/С, 10% (125 мг). После выдерживания в течение 4 ч при комнатной температуре реакционную смесь фильтруют (фильтр Millipore LSWP, 5 мкм),затем вносят в колонку с гелем Sephadex G-25 fine (952 см) и элюируют 0,2 М водным раствором NaCl. Фракции, содержащие требуемое соединение, объединяют, вносят в колонку Sephadex G-25 fine (952 см), элюируют водой и получают 11,2 мг соединения 77. Масса: способ ИЭР, электроотрицательный режим: теоретическая масса = 2285,47; экспериментальная масса: 2197,200,34 а.е.м. (идуроновые кислоты, наблюдаемые в СООН-форме) Получение метил (метил-2-О-ацетил-3-О-бензил-4-О-левулиноилL-идопиранозилуронат)-(14)(6-О-ацетил-2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-О-бензил-L-идопиранозилуронат)-(14)-(2-азидо-3-О-бензил-6-О-трет-бутилдифенилсилил-2-дезоксиDглюкопиранозил)-(14)-(метил-2-О-ацетил-3-O-бензилL-идопиранозилуронат)-(14)-3-O-бензил-2 бензилоксикарбониламино-6-O-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозида ( 78). Смесь акцептора глюкозила 65 (1,82 г, 1,00 ммоль), имидата 27 (1,35 г, 1,50 ммоль) и порошка молекулярного сита 4 (1,12 г) в дихлорметане (52 мл) перемешивают в атмосфере аргона в течение 1 ч при 25 С. Реакционную смесь охлаждают до -20 С и затем прибавляют 1 М раствор третбутилдиметилсилилтрифлата в дихлорметане (224 мкл). Через 50 мин реакционную смесь нейтрализуют прибавлением гидрокарбоната натрия в твердом состоянии. После фильтрования через Celite реакционную смесь разбавляют дихлорметаном (500 мл). Органическую фракцию последовательно промывают 2%-м водным раствором гидрокарбоната натрия и водой, затем сушат над сульфатом натрия, фильтруют и далее упаривают досуха. Полученный остаток хроматографируют на колонке Sephadex LH20Rf=0,47, силикагель, толуол/ацетон, 3/1. Получение метил (метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-(6-О-ацетил-2 азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-(2-азидо-3-О-бензил-6-О-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-3-О-бензил-2-бензилоксикарбониламино-6-О-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозида ( 79). Соединение 78 (1,56 г, 0,61 ммоль) превращают в соединение 79 (1,44 г) аналогично методике, описанной для получения соединения 58.(метил-2-О-ацетил-3,4-ди-О-бензилL-идопиранозилуронат)-(14)-(6-Oацетил-2-азидо-3-O-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-О-бензилLидопиранозилуронат)-(14)-(6-О-ацетил-2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)(метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-(2-азидо-3-О-бензил-6-О-третбутилдифенилсилил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-O-ацетил-3-O-бензилLидопиранозилуронат)-(14)-3-О-бензил-2-бензилоксикарбониламино-6-О-трет-бутилдифенилсилил-2 дезоксиD-глюкопиранозида ( 80). Смесь акцептора глюкозила 79 (1,0 г, 0,41 ммоль), имидата 38 (543 мг, 0,61 ммоль) и порошка молекулярного сита 4 (455 мг) в дихлорметане (21 мл) перемешивают в атмосфере аргона в течение 1 ч при комнатной температуре. Реакционную смесь охлаждают до -20 С и прибавляют 1 М раствор третбутилдиметилсилилтрифлата в дихлорметане (91,0 мкл). Через 1 ч 10 мин реакционную смесь нейтрализуют прибавлением гидрокарбоната натрия в твердом состоянии. После фильтрования через Celite реакционную смесь разбавляют дихлорметаном (250 мл). Органическую фракцию последовательно промывают 2%-м водным раствором гидрокарбоната натрия и водой, затем сушат над сульфатом натрия, фильтруют и далее упаривают досуха. Полученный остаток очищают хроматографией на колонке Sephadex бензилL-идопиранозилуронат)-(14)-3-О-бензил-2-бензилоксикарбониламино-6-O-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозида ( 81). Соединение 80 (820 мг, 0,257 ммоль) омыляют по методике, использованной для синтеза соединения 73, с получением октасахарида 81 (593,8 мг) после флэш-хроматографии на колонке с силикагелемRf=0,57, силикагель, толуол/ацетон, 2/1. Получение метил (метил-3,4-ди-О-бензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-(2-азидо-3-О-бензил-2-дезокси-6-О-триэтиламмонийсульфонатоD-глюкопиранозил)(14)-(метил-3-О-бензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-(2-азидо-3 О-бензил-2-дезокси-6-О-триэтиламмонийсульфонатоD-глюкопиранозил)-(14)-(метил-3-О-бензил-2 О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-(2-азидо-3-О-бензил-6-О-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозил)-(14)-(метил-3-О-бензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-3-O-бензил-2-бензилоксикарбониламино-6-O-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозида ( 82). Соединение 81 (130 мг, 44,3 мкмоль) превращают в соединение 82 (164,1 мг) аналогично методике,описанной для получения соединения 75. Масса: способ ИЭР, электроотрицательный режим: теоретическая масса = 4024,90; экспериментальная масса: 4024. Получение метил (метил-2-О-аммонийсульфонато-3,4-ди-О-бензилL-идопиранозилуронат)(14)-(6-О-аммонийсульфонато-2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2 О-аммонийсульфонато-3-О-бензилL-идопиранозилуронат)-(14)-(6-О-аммонийсульфонато 2 азидо-3-О-бензил-2-дезокси-D-глюкопиранозил)-(14)-(метил-2-О-аммонийсульфонато-3-О-бензил-L-идопиранозилуронат)-(14)-(2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-Оаммонийсульфонато-3-О-бензилL-идопиранозилуронат)-(14)-3-О-бензил-2-бензилоксикарбониламино-2-дезоксиD-глюкопиранозида ( 83). К раствору соединения 82 (91,8 мг, 22,8 мкмоль) в метаноле (3,0 мл) прибавляют фторид аммония(67,6 мг, 1,82 ммоль). После перемешивания в течение 48 ч при 55 С реакционную смесь вносят в колонку Sephadex LH20 (1203 см, дихлорметан/этанол, 1/1) с последующей флэш-хроматографией на колонке с силикагелем (метанол/вода, 95/5) с получением соединения 83 (62,7 мг).Rf=0,32, силикагель, этилацетат/пиридин/уксусная кислота/вода, 17/9/2,2/5. Получение метил(3,4-ди-O-бензил-2-O-литийсульфонатоL-идопиранозилуронат лития)-(14)(2-азидо-3-О-бензил-2-дезокси-6-О-литийсульфонатоD-глюкопиранозил)-(14)-(3-О-бензил-2-ОлитийсульфонатоL-идопиранозилуронат лития)-(14)-(2-азидо-3-O-бензил-2-дезокси-6-O-литийсульфонатоD-глюкопиранозил)-(14)-(3-O-бензил-2-O-литийсульфонатоL-идопиранозилуронат лития)-(14)-(2-азидо-3-O-бензил-2-дезоксиD-глюкопиранозил)-(14)-(3-О-бензил-2-О-литийсульфонатоL-идопиранозилуронат лития)-(14)-3-O-бензил-2-бензилоксикарбониламино-2-дезоксиDглюкопиранозида ( 84). К раствору соединения 83 (86 мг, 24,2 мкмоль) в смеси тетрагидрофуран/метанол, 1/1 (3,9 мл), при 0 С прибавляют 1 М раствор гидроксида лития в воде (780 мкл). После выдерживания в течение 1 ч при 0 С и затем в течение 16 ч при комнатной температуре раствор вносят в колонку Sephadex LH20 (952 см) и элюируют смесью метанол/вода, 95/5, с получением соединения 84 (65,3 мг).Rf=0,27, силикагель, этилацетат/пиридин/уксусная кислота/вода, 17/9/2,2/5. Получение метил (2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-амино-2 дезокси-6-О-натрийсульфонатоD-глюкопиранозил)-(14)-(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-амино-2-дезокси-6-О-натрийсульфонатоD-глюкопиранозил)-(14)-(2-ОнатрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-амино-2-дезоксиD-глюкопиранозил)(14)-(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-2-амино-2-дезоксиD-глюкопиранозида ( 85). Соединение 84 (95,0 мг, 32,3 мкмоль) обрабатывают аналогично методике, описанной для синтеза соединения 77, с получением соединения 85 (47,3 мг). Масса: способ ИЭР, электроотрицательный режим: теоретическая масса = 2081,38; экспериментальная масса: 1993,150,11 а.е.м. (идуроновые кислоты, наблюдаемые в СООН-форме). Получение метил (метил-3,4-ди-О-бензилL-идопиранозилуронат)-(14)-(2-азидо-3-O-бензил-2 дезоксиD-глюкопиранозил)-(14)-(метил-3-О-бензилL-идопиранозилуронат)-(14)-(2-азидо-3-Обензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-3-О-бензилL-идопиранозилуронат)-(14)-(2 азидо-3-О-бензил-6-О-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозил)-(14)-(метил-3-ОбензилL-идопиранозилуронат)-(14)-3-О-бензил-2-бензилоксикарбониламино-2-дезоксиDглюкопиранозида ( 86). К раствору соединения 81 (50 мг, 0,017 ммоль) в метаноле (2,2 мл) прибавляют фторид аммония (25 мг, 0,68 ммоль). После перемешивания в течение 7 часов при комнатной температуре и затем в течение 16 ч при 20C реакционную смесь разбавляют дихлорметаном. Органическую фракцию промывают водой, сушат над сульфатом натрия, фильтруют и затем упаривают досуха. Остаток очищают флэшхроматографией на колонке с силикагелем (толуол/метанол, 100/082/18) с получением 27,7 мг соединения 86.Rf=0,16, силикагель, толуол/метанол, 85/15. Получение метил (метил-3,4-ди-О-бензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-(2-азидо-3-О-бензил-2-дезокси-6-О-триэтиламмонийсульфонатоD-глюкопиранозил)(14)-(метил-3-О-бензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-(2-азидо-3 О-бензил-2-дезокси-6-О-триэтиламмонийсульфонатоD-глюкопиранозил)-(14)-(метил-3-О-бензил-2 О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-(2-азидо-3-О-бензил-6-О-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозил)-(14)-(метил-3-О-бензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-3-О-бензил-2-бензилоксикарбониламино-2-дезокси-6-O-триэтиламмонийсульфонатоD-глюкопиранозида ( 87). Соединение 86 (94 мг, 34,8 мкмоль) обрабатывают аналогично методике, описанной для синтеза соединения 75, с получением соединения 87 (131,9 мг).Rf=0,37, силикагель, этилацетат/пиридин/уксусная кислота/вода, 17/9/2,2/5. Получение метил (метил-2-О-аммонийсульфонато-3,4-ди-О-бензилL-идопиранозилуронат)(14)-(6-О-аммонийсульфонато-2-азидо-3-O-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2O-аммонийсульфонато-3-O-бензилL-идопиранозилуронат)-(14)-(2-азидо-3-О-бензил-2-дезоксиDглюкопиранозил)-(14)-(метил-2-O-аммонийсульфонато-3-O-бензилL-идопиранозилуронат)-(14)(2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-3-О-бензилL-идопиранозилуронат)-(14)-6-О-аммонийсульфонато-3-О-бензил-2-бензилоксикарбониламино-2-дезоксиDглюкопиранозида ( 88). Соединение 87 (130 мг, 32,8 мкмоль) обрабатывают аналогично методике, описанной для синтеза соединения 74, с получением соединения 88 (102,0 мг). литийсульфонатоL-идопиранозилуронат лития)-(14)-(2-азидо-3-О-бензил-2-дезокси-6-О-литийсульфонатоD-глюкопиранозил)-(14)-(3-О-бензил-2-О-литийсульфонатоL-идопиранозилуронат лития)-(14)-(2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(3-О-бензил-2-О-литийсульфонатоL-идопиранозилуронат лития)-(14)-3-O-бензил-2-бензилоксикарбониламино-2-дезокси-6-OлитийсульфонатоD-глюкопиранозида ( 89). Соединение 88 (100 мг, 26,8 мкмоль) обрабатывают аналогично методике, описанной для синтеза соединения 76 с получением неочищенного соединения 89, используемого в таком виде на следующей стадии.Rf=0,25, силикагель, этилацетат/пиридин/уксусная кислота/вода, 17/9/2,2/5. Получение метил (2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-амино-2 дезокси-6-О-натрийсульфонатоD-глюкопиранозил)-(14)-(2-О-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-амино-2-дезокси-6-O-натрийсульфонатоD-глюкопиранозил)-(14)-(2-ОнатрийсульфонатоL-идопиранозилуронат натрия)-(14)-(2-амино-2-дезоксиD-глюкопиранозил)(14)-(2-O-натрийсульфонатоL-идопиранозилуронат натрия)-(14)-2-амино-2-дезокси-6-О-натрийсульфонатоD-глюкопиранозида ( 90). Неочищенное соединение 89 (75 мг, 24,8 мкмоль) обрабатывают аналогично методике, описанной для синтеза соединения 77, с получением соединения 90 (48,2 мг). Масса: способ ИЭР, электроотрицательный режим: теоретическая масса = 2183,42; экспериментальная масса: 2095,070,24 а.е.м. (идуроновые кислоты, наблюдаемые в СООН-форме). Получение метил (метил-2-О-ацетил-3-О-бензил-4-О-левулиноилL-идопиранозилуронат)-(14)(6-O-ацетил-2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-О-бензил-L-идопиранозилуронат)-(14)-3-О-бензил-6-O-трет-бутилдифенилсилил-2-дезокси-2-[(бензилокси) карбонил]аминоD-глюкопиранозида ( 91). Раствор трет-бутилдиметилсилилтрифлата в дихлорметане (1 М, 0,15 моль на моль имидата) в атмосфере аргона при -20 С прибавляют к раствору имидата 27 (3,26 г, 3,62 ммоль) и акцептора глюкозила 58(3,22 г, 3,29 ммоль) в дихлорметане (115 мл) в присутствии молекулярного сита 4 (2,5 г). После выдерживания в течение 1 ч 40 мин при -20 С (по анализу ТСХ) прибавляют гидрокарбонат натрия в твердом состоянии. После фильтрования, промывки 2%-и водным раствором гидрокарбоната натрия и водным раствором хлорида натрия, затем после высушивания (над Na2SO4) и упаривания досуха остаток очищают на силикагеле (толуол-ацетон) с получением соединения 91 (4,66 г, 83%).Rf=0,49 (толуол-ацетон, 7/3). Получение метил (метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-(6-О-ацетил-2 азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-3-О-бензил-6-О-трет-бутилдифенилсилил-2-дезокси-2-[(бензилокси)карбонил] аминоD-глюкопиранозида ( 92). К раствору соединения 91 (4,66 г, 2,71 ммоль) в смеси толуол/этанол, 1:2 (542 мл), прибавляют гидразинацетат (1,2 г, 5 мол. экв.). После перемешивания в течение 2 ч магнитной мешалкой дополнительно прибавляют такое же количество реактива и через 2 ч смесь концентрируют в вакууме и затем очищают на силикагеле (толуол-ацетон) с получением соединения 92 (3,83 г, 87%).Rf=0,42 (толуол-ацетон, 3/1). Получение метил (метил-2-О-ацетил-3-О-бензил-4-О-левулиноилL-идопиранозилуронат)-(14)(6-О-ацетил-2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-О-бензил-L-идопиранозилуронат)-(14)-(6-О-ацетил-2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)(14)-(метил-2-О-ацетил-3-О-бензилL-идолиранозилуронат)-(14)-3-О-бензил-6-О-трет-бутилдифенилсилил-2-дезокси-2-[(бензилокси)карбонил]аминоD-глюкопиранозида ( 93). Раствор трет-бутилдиметилсилилтрифлата в дихлорметане (1 М, 0,15 моль на моль имидата) в атмосфере аргона при -20C прибавляют к раствору имидата 27 (3,2 г, 3,55 ммоль) и акцептора глюкозила 92(3,83 г, 2,36 ммоль) в дихлорметане (106 мл) в присутствии молекулярного сита 4 (1,8 г). После выдерживания в течение 2,5 ч при -20 С (по анализу ТСХ) прибавляют гидрокарбонат натрия в твердом состоянии. После фильтрования, промывки 2%-м водным раствором гидрокарбоната натрия и водным раствором хлорида натрия, высушивания (над Na2SO4) и упаривания досуха остаток очищают на силикагелеRf=0,47 (толуол-этилацетат, 1/1). Получение метил (метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-(6-О-ацетил-2 азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-(6-O-ацетил-2-азидо-3-O-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил 2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-3-О-бензил-6-О-трет-бутилдифенилсилил-2 дезокси-2-[(бензилокси)карбонил]аминоD-глюкопиранозида ( 94). К раствору соединения 93 (3,36 г, 1,42 ммоль) в смеси толуол/этанол, 1:2 (280 мл), прибавляют гидразинацетат (0,645 г, 4,93 молярного эквивалента). После перемешивания в течение 2,5 ч магнитной мешалкой смесь концентрируют в вакууме и затем очищают на силикагеле с получением соединения 94Rf=0,43 (толуол-ацетон, 4/1). Получение метил (метил-2-О-ацетил-3,4-ди-О-бензилL-идопиранозилуронат)-(14)-(2-азидо-3 О-бензил-6-О-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-ОбензилL-идопиранозилуронат)-(14)-(6-О-ацетил-2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-(6-О-ацетил-2-азидо-3-Обензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-ацетил-3-О-бензилL-идопиранозилуронат)-(14)-3-O-бензил-6-О-трет-бутилдифенилсилил-2-дезокси-2-[(бензилокси)карбонил]аминоDглюкопиранозида ( 95). 0,1 М раствор трет-бутилдиметилсилилтрифлата в дихлорметане (1 мл) в атмосфере аргона при 20 С прибавляют к раствору имидата 71 (0,29 г, 0,3 ммоль) и акцептора глюкозила 94 (3,01 г, 1,33 ммоль) в дихлорметане (60 мл) в присутствии молекулярного сита 4 (0,93 г). После перемешивания в течение 10 мин магнитной мешалкой при -20 С (по анализу ТСХ) дополнительно прибавляют имидат 71 с интервалом от 10 мин до 2,5 ч до общего количества 3,19 г. После выдерживания в течение 20 ч при -20 С (по анализу ТСХ) прибавляют гидрокарбонат натрия в твердом состоянии до нейтральной реакции и после фильтрования, промывки 2%-м водным раствором гидрокарбоната натрия и водным раствором хлорида натрия, высушивания (над Na2SO4) и упаривания досуха остаток очищают на силикагеле с получением соединения 95 (2,58 г, 61%). зилокси)карбонил]аминоD-глюкопиранозида ( 96). К раствору соединения 95 (1,18 г, 0,37 ммоль) в смеси метанол/дихлорметан, 3/2 (111 мл), прибавляют 1 М метанольный раствор метилата натрия (1,1 мл) в присутствии молекулярного сита 3 (463 мг). После перемешивания в течение 20 ч при комнатной температуре смесь нейтрализуют смолой Powex 50WX4 в Н+-форме. После фильтрования и концентрирования остаток очищают на силикагеле смесью толуол/ацетон с получением соединения 96 (773 мг, 77%). Получение метил (метил-3,4-ди-О-бензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-(2-азидо-3-О-бензил-6-О-трет-бутилдифенилсилил-2-дезоксиD-глюкопиранозил)(14)-(метил-3-О-бензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-(2-азидо-3O-бензил-2-дезокси-6-O-триэтиламмонийсульфонатоD-глюкопиранозил)-(14)-(метил-3-О-бензил-2 О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-(2-азидо-3-O-бензил-2-дезокси-6-OтриэтиламмонийсульфонатоD-глюкопиранозил)-(14)-(метил-3-О-бензил-2-О-триэтиламмонийсульфонатоL-идопиранозилуронат)-(14)-3-O-бензил-6-О-трет-бутилдифенилсилил-2-дезокси-2[(бензилокси)карбонил]аминоD-глюкопиранозида ( 97). Комплекс триэтиламин/триоксид серы (761 мг, 5 моль на гидроксигруппу) прибавляют к раствору соединения 96 (324 мг, 120 мкмоль) в N,N-диметилформамиде (11 мл, 90 л/моль). После перемешивания в течение 17 ч магнитной мешалкой при 55 С без доступа света прибавляют при 0 С метанол и после перемешивания в течение 0,5 ч при 0C и затем в течение 0,5 ч при комнатной температуре реакционную смесь разбавляют метанолом и далее очищают на колонке LH-20, используя смесь метанол/дихлорметан,1:1, в качестве элюента. Затем фракции, содержащие требуемое вещество, концентрируют в глубоком вакууме и, в случае необходимости, снова вводят в реакцию в тех же самых условиях. Полученное соединение 97 используют непосредственно на следующей стадии.Rf=0,5 (AcOEt-пиридин-АсОН-Н 2 О, 11/7/1,6/4). Получение метил (метил-2-О-аммонийсульфонато-3,4-ди-О-бензилL-идопиранозилуронат)(14)-(2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-аммонийсульфонато-3 О-бензилL-идопиранозилуронат)-(14)-(6-О-аммонийсульфонато-2-азидо-3-О-бензил-2-дезоксиDглюкопиранозил)-(14)-(метил-2-О-аммонийсульфонато-3-О-бензилL-идопиранозилуронат)-(14)(6-О-аммонийсульфонато-2-азидо-3-О-бензил-2-дезоксиD-глюкопиранозил)-(14)-(метил-2-О-аммонийсульфонато-3-О-бензилL-идопиранозилуронат)-(14)-3-О-бензил-2-дезокси-2-[(бензилокси)карбонил]аминоD-глюкопиранозида ( 98). К раствору ранее полученного соединения 97 в метаноле (16 мл) прибавляют фторид аммония (361 мг, 80 мол. экв.). После перемешивания магнитной мешалкой при 55C в течение 48 ч реакционную смесь очищают на колонке LH-20, используя смесь метанол/N,N-диметилформамид/вода, 75/20/5, в качестве элюента. Затем фракции, содержащие требуемое вещество, концентрируют в глубоком вакууме с получением соединения 98 (410 мг, 95%, 2 стадии). Получение метил(3,4-ди-O-бензил-2-O-литийсульфонатоL-идопиранозилуронат лития)-(14)(2-азидо-3-O-бензил-2-дезоксиD-глюкопиранозил)-(14)-(3-O-бензил-2-O-литийсульфонатоLидопиранозилуронат лития)-(14)-(2-азидо-3-О-бензил-2-дезокси-6-O-литийсульфонатоD-глюкопиранозил)-(14)-(3-О-бензил-2-О-литийсульфонатоL-идопиранозилуронат лития)-(14)-(2-азидо-3-Oбензил-2-дезокси-6-O-литийсульфонатоD-глюкопиранозил)-(14)-(3-O-бензил-2-O-литийсульфонатоL-идопиранозилуронат лития)-(14)-3-О-бензил-2-дезокси-2-[(бензилокси)карбонил]аминоDглюкопиранозида ( 99). К раствору соединения 98 (202 мг, 57 мкмоль) в смеси метанол/тетрагидрофуран, 1:1 (9 мл), при 0 С по каплям прибавляют 1 н. водный раствор LiOH (1,8 мл, 7,9 эквивалента на функциональную группу сложного метилового эфира). После перемешивания в течение 1 ч при 0 С и затем в течение 16 ч при комнатной температуре реакционную смесь очищают на колонке LH-20, используя смесь метанол/N,Nдиметилформамид/вода, 75/20/5, в качестве элюента. Далее фракции, содержащие требуемое вещество,концентрируют в глубоком вакууме с получением требуемого соединения 99, которое используют непосредственно на следующей стадии.Rf=0,41 (AcOEt-пиридин-АсОН-Н 2 О, 57/29/7,2/16). Получение метил(2-O-литийсульфонатоL-идопиранозилуронат лития)-(14)-(2-амино-2-дезокси-D-глюкопиранозил)-(14)-(2-О-литийсульфонатоL-идопиранозилуронат лития)-(14)-(2-амино-2 дезокси-6-О-литийсульфонатоD-глюкопиранозил)-(14)-(2-О-литийсульфонатоL-идопиранозилуронат лития)-(14)-(2-амино-2-дезокси-6-О-литийсульфонатоD-глюкопиранозил)-(14)-(2-O-литийсульфонатоL-идопиранозилуронат лития)-(14)-2-амино-2-дезоксиD-глюкопиранозида ( 100). К раствору ранее полученного соединения 99 в смеси трет-бутанол/вода, 1:1 (13 мл), последовательно прибавляют формиат аммония (529 мг, 8,4 ммоль) и Pd/C, 10% (1,24 г). После интенсивного перемешивания в течение 4 ч 15 мин при комнатной температуре реакционную смесь фильтруют, частично концентрируют в вакууме, затем раствор вносят в верх колонки Sephadex G-25 и элюируют 0,2 М раствором хлорида натрия. Фракции, содержащие требуемое вещество, концентрируют и освобождают от соли, используя ту же самую колонку и элюируя водой. Затем фракции, содержащие требуемое вещество, концентрируют в глубоком вакууме с получением требуемого соединения 100 (78 мг, 66%, 2 стадии). Масса: способ ИЭР, электроотрицательный режим: теоретическая масса = 1992,8; экспериментальная масса [M-Na-H]: 1971,030,10 а.е.м. (идуроновые кислоты, наблюдаемые в СООН-форме).
МПК / Метки
МПК: A61K 31/737, C07H 13/04, C07H 13/12, C08B 37/00, C07H 15/203
Метки: активирующие, октасахариды, терапии, получение, рецепторы, n-ацилированные, применение
Код ссылки
<a href="https://eas.patents.su/30-20485-n-acilirovannye-oktasaharidy-aktiviruyushhie-receptory-fgf-ih-poluchenie-i-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">N-ацилированные октасахариды, активирующие рецепторы fgf, их получение и применение в терапии</a>


































