N-((1r,2s,5r)-5-(трет-бутиламино)-2-((s)-3-(7-трет-бутилпиразоло[1,5-a][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамид в качестве двойного модулятора активности хемокиновых рецепторов, его кристаллические формы и способ получения
Номер патента: 20486
Опубликовано: 28.11.2014
Авторы: Картер Перси Х., Черни Роберт Дж., Россо Виктор В., Ли Хун
Формула / Реферат
1. Соединение формулы

или его соль.
2. Кристаллическая форма N-1 соединения по п.1, характеризующаяся параметрами элементарной ячейки, имеющими, по существу, следующие значения:
размеры ячейки:
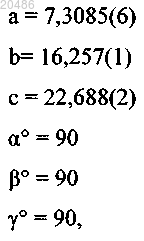
пространственная группа: P212121;
количество молекул на элементарную ячейку (Z): 1;
плотность (рассчитанная, г×см-3): 1,194,
когда указанный кристалл находится при температуре приблизительно -70°C.
3. Кристаллическая форма по п.2, отличающаяся тем, что указанная форма N-1 находится, по существу, в чистой форме.
4. Кристаллическая форма по п.2, характеризующаяся порошковой рентгеновской дифрактограммой, по существу, соответствующей дифрактограмме, приведенной на фиг. 1.
5. Кристаллическая форма по п.2, которая характеризуется термограммой, полученной с использованием методики дифференциальной сканирующей калориметрии, по существу, соответствующей термограмме, приведенной на фиг. 2, согласно которой температура эндотермического перехода выше приблизительно 205°C.
6. Кристаллическая форма по п.2, которая характеризуется кривой термического гравиметрического анализа, соответствующей кривой, приведенной на фиг. 3.
7. Фармацевтическая композиция для модулирования активности рецепторов хемокинов, содержащая терапевтически эффективное количество соединения по п.1 или кристаллической формы по любому из пп.2-6 и фармацевтически приемлемый носитель.
8. Фармацевтическая композиция по п.7, дополнительно содержащая по меньшей мере один дополнительный терапевтический агент.
9. Способ модулирования активности рецепторов CCR-2 и CCR-5, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения по п.1 или кристаллической формы по любому из пп.2-6.
10. Способ лечения расстройства, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1 или кристаллической формы по любому из пп.2-6, где указанное расстройство выбрано из диабета, ожирения, метаболического синдрома, инсульта, невропатической боли, ишемической кардиомиопатии, псориаза, гипертензии, склеродермии, остеоартрита, аневризмы, лихорадки, сердечно-сосудистого заболевания, болезни Крона, застойной сердечной недостаточности, аутоиммунных заболеваний, ВИЧ-инфекции, ВИЧ-ассоциированной деменции, псориаза, идиопатического легочного фиброза, артериосклероза трансплантата, физически или химически индуцированной травмы головного мозга, воспалительного заболевания кишечника, альвеолита, колита, системной эритематозной волчанки, нефрита, вызванного введением нефротоксической сыворотки, гломерулонефрита, астмы, рассеянного склероза, атеросклероза, васкулита, атероматозных бляшек, заболевания почек, ревматоидного артрита, рестеноза, венозной неоинтимальной гиперплазии, неоинтимальной гиперплазии диализного трансплантата, интимальной гиперплазии артериовенозного шунта, последствий трансплантации органов, хронической нефропатии аллотрансплантата, рака, венозной неоинтимальной гиперплазии, неоинтимальной гиперплазии диализного трансплантата и неоинтимальной гиперплазии артериовенозного шунта.
11. Способ получения N-((1R,2S,5R)-5-(трет-бутиламино)-2-((S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамида, включающий:
1) взаимодействие
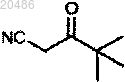 с
с
при условиях AcONa, 50°C с получением
 ;
;
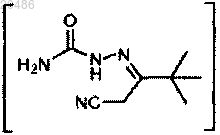
2) взаимодействие
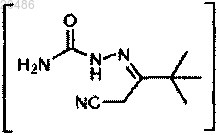
с (MeO)3CH при условиях AcOH, 70°C с получением
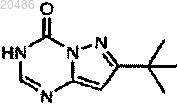 ;
;
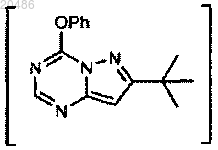
3) превращение
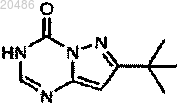
при условиях
 ;
;
4) взаимодействие
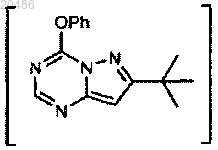 с
с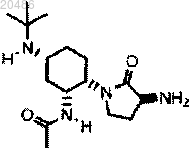
при кислотной обработке и затем 7,5% K2HPO4 с получением

.
Текст
N-1R,2S,5R)-5-(ТРЕТ-БУТИЛАМИНО)-2-S)-3-(7-ТРЕТ-БУТИЛПИРАЗОЛО[1,5-a][1,3,5] ТРИАЗИН-4-ИЛАМИНО)-2-ОКСОПИРРОЛИДИН-1-ИЛ)ЦИКЛОГЕКСИЛ)АЦЕТАМИД В КАЧЕСТВЕ ДВОЙНОГО МОДУЛЯТОРА АКТИВНОСТИ ХЕМОКИНОВЫХ РЕЦЕПТОРОВ, ЕГО КРИСТАЛЛИЧЕСКИЕ ФОРМЫ И СПОСОБ ПОЛУЧЕНИЯ и его кристаллическая форма N1, обладающие двойной ингибирующей активностью в отношении рецепторов CCR-2 и CCR-5. Раскрыты композиции на основе указанных соединений и использование соединений и композиций для модулирования активности рецепторов CCR-2 иCCR-5 и лечения воспалительных, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний. В изобретении также предложен способ получения N1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)2-оксопирролидин-1-ил)циклогексил)ацетамида. Область техники В настоящем изобретении предложен N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-третбутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамид или его кристаллическая форма, обладающие неожиданной желаемой двойной активностью. Объектами настоящего изобретения также являются фармацевтические композиции, содержащие указанные соединения, и способы применения этих соединений в качестве агентов для лечения воспалительных заболеваний, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний. В настоящем изобретении также предложен способ получения N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7 трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамида формулы В данном изобретении также предложены кристаллическая форма соединений, фармацевтические композиции, содержащие е, и их применение. Уровень техники Хемокины представляют собой хемотаксические цитокины с молекулярной массой 6-15 кДа, которые высвобождаются многими типами клеток и контролируют миграцию и активацию макрофагов, Т- и В-лимфоцитов, эозинофилов, базофилов, нейтрофилов и других клеток (см. обзоры Charo et al., New Eng.(1997. Существует два основных класса хемокинов, СХС и СС, в СХС-хемокинах первые два цистеина в аминокислотой последовательности разделены одной аминокислотой, в СС-хемокинах указанные два цистеина не разделены другими аминокислотами. СХС-хемокины, такие как интерлейкин-8 (IL-8), нейтрофил-активирующий белок-2 (NAP-2) и белок, обладающий активностью, стимулирующей рост меланомы (MGSA), являются хемоаттрактантами, главным образом, для нейтрофилов и Т-лимфоцитов, тогда как СС-хемокины, такие как RANTES, MIP-1, MIP-1, моноцитарные хемотаксические протеины(MCP-1, MCP-2, MCP-3, MCP-4 и MCP-5) и эотаксины (-1 и -2), являются хемоаттрактантами для макрофагов, Т-лимфоцитов. эозинофилов, дендритных клеток, базофилов и других типов клеток. Существуют также хемокины, которые не относятся ни к одному из основных подсемейств хемокинов: лимфотактин 1, лимфотактин-2 (С-хемокины) и фракталин (СХ 3 С-хемокин). Хемокины связываются со специфическими рецепторами на поверхности клеток, принадлежащими семейству G-белок-сопряженных семиспиральных белков (см. обзор Horuk, Trends Pharm. Sci., 15:159165 (1994, которые называются "рецепторами хемокинов". При связывании со своими лигандами рецепторы хемокинов передают внутриклеточный сигнал через тримерные G-белки, связанные с данными рецепторами, что приводит к быстрому увеличению внутриклеточной концентрации кальция, изменению формы клеток, повышенной экспрессии молекул клеточной адгезии, дегрануляции, стимулированию миграции клеток и другим типам клеточного ответа. У человека имеется по меньшей мере десять хемокиновых рецепторов, которые связываются с СС-хемокинами или отвечают на них, данные рецепторы имеют следующий хемокиновый профиль Показано, что в клетках млекопитающих, инфицированных цитомегаловирусами, вирусами герпеса и поксвирусами млекопитающих, кроме хемокиновых рецепторов млекопитающих, присутствуют белки,экспрессируемые указанными вирусами, имеющие профиль связывания, характерный для рецепторов хемокинов (см. обзор Wells et al., Curr. Opin. Biotech., 8:741-748 (1997. CC-хемокины человека, такие как RANTES и MCP-3, могут вызывать быструю мобилизацию кальция, опосредованную рецепторами,кодируемыми указанными вирусами. Экспрессия рецепторов вируса до непатогенного уровня может быть вполне допустима, учитывая роль нормальной системы иммунного надзора и ответ иммунной системы на инфекцию. Кроме того, хемокиновые рецепторы человека, такие как CXCR4, CCR-2, CCR-3,CCR-5 и CCR-8, могут являться корецепторами при инфицировании клеток млекопитающих микроорганизмами, например вирусами иммунодефицита человека (ВИЧ). Подразумевается, что хемокины и их рецепторы являются важными медиаторами воспалительных,инфекционных и иммунорегуляторных расстройств и заболеваний, включая астму и аллергические заболевания; а также аутоиммунных патологий, таких как ревматоидный артрит и рассеянный склероз, и метаболических заболеваний, таких как атеросклероз и диабет (см. обзор Charo et al., New Eng. J. Med.,354:610-621 (2006); Gao, Z. et al., Chem. Rev., 103:3733 (2003); Carter, P.H., Curr. Opin. Chem. Biol., 6:510Premack et al., Nature Medicine, 2:1174 (1996. Например, моноцитарный хемотаксический протеин 1(MCP-1) и его рецептор, СС-хемокиновый рецептор 2 (CCR-2), играют главную роль в миграции лейкоцитов в очаг воспаления и в последующей активации данных клеток. Связывание хемокина MCP-1 сCCR-2 индуцирует быстрое увеличение внутриклеточной концентрации кальция, повышение экспрессии молекул клеточной адгезии и стимулирование миграции лейкоцитов. Важность взаимодействияMCP-1/CCR-2 была продемонстрирована в экспериментах на генетически модифицированных мышах. Показано, что мыши MCP-1-/- не способны рекрутировать моноциты в очаг воспаления в ответ на различные типы иммунной провокации (Lu, В. et al., J. Exp. Med., 187:601 (1998. Аналогично мыши CCR-2/не способны рекрутировать моноциты или продуцировать интерферон- в ответ на провокацию различными экзогенными агентами, более того, лейкоциты мышей с нулевой мутацией в гене CCR-2 не мигрировали в ответ на MCP-1 (Boring, L. et al., J. Clin. Invest., 100:2552 (1997, что указывает на специфичность взаимодействия MCP-1/CCR-2. Аналогичные результаты были получены в двух других независимых исследованиях с использованием разных линий мышей CCR-2-/- (Kuziel, W.A. et al., Proc. Natl. Acad.Sci. USA, 94:12053 (1997) и Kurihara, T. et al., J. Exp. Med., 186:1757 (1997. Поскольку животные MCP-1/и CCR-2-/- являются жизнеспособными и обычно имеют нормальное состояние здоровья, нарушение взаимодействия MCP-1/CCR-2 не вызывает физиологического кризиса. Взятые в совокупности, эти данные позволяют сделать вывод, что молекулы, которые блокируют действие MCP-1/CCR-2, могут быть использованы при лечении различных воспалительных и аутоиммунных расстройств (см. обзор Feria, M.et al., Exp. Opin. Ther. Patents, 16:49 (2006) и Dawson, J. et al., Exp. Opin. Ther. Targets, 7:35 (2003. В настоящее время достоверность данной гипотезы подтверждена на нескольких экспериментальных моделях заболеваний на животных, описанных ниже. Известно, что у пациентов с ревматоидным артритом повышен уровень экспрессии MCP-1(Koch, A. et al., J. Clin. Invest., 90:772-779 (1992. Кроме того, в нескольких преклинических исследованиях было показано, что антагонистическое действие на связывание MCP-1 с рецептором CCR-2 может иметь терапевтический эффект при лечении ревматоидного артрита. Недавно показано, что ДНКвакцина, кодирующая MCP-1, уменьшает интенсивность хронического артрита, вызванного введением полиадъюванта, у крыс (Youssef, S. et al., J. Clin. Invest., 106:361 (2000. Аналогично симптомы данного заболевания можно контролировать путем прямого введения антител против MCP-1 у крыс с артритом,вызванным введением коллагена (Ogata, H. et al., J. Pathol., 182:106 (1997, или у крыс с артритом, вызванным введением клеточных стенок стрептококков (Schimmer, R.C. et al., J. Immunol., 160:1466 (1998. Возможно, наиболее значительные результаты получены на экспериментальной модели артрита с использованием линии мышей MRL-lpr; показано, что пептидный антагонист MCP-1, MCP-1 (9-76), способен как предотвращать начало развития данного заболевания, так и уменьшать симптомы заболевания (в зависимости от времени введения) (Gong, J.-H. et al., J. Exp. Med., 186:131 (1997. Кроме того, показано,что введение малых молекул-антагонистов репрессора CCR-2 снижает клинические показатели в экспериментальных моделях артрита у грызунов (Brodmerkel, C.M. et al., J. Immunol., 175:5370 (2005) и Xia, M.et al., публикация заявки на патент США 2006/0069123). Введение антитела против CCR-2 мышам с CIA(артритом, вызванным введением коллагена) оказывает разное действие, в зависимости от времени введения (Bruhl, H. et al., J. Immunol., 172:890 (2004. Недавние исследования с использованием мышейCCR-2-/- позволяют предположить, что делеция гена CCR-2 может приводить к обострению экспериментального артрита у грызунов в определенных экспериментальных условиях (Quinones, M.P. et al., J. Clin.Invest., 113:856 (2004); Quinones, M.P. et al., J. Mol. Med., 84:503 (2006. Известно, что при атеросклеротических повреждениях повышен уровень экспрессии MCP-1, и показано, что уровень циркулирующего в крови MCP-1 уменьшается при лечении терапевтическими агентами (Rezaie-Majd, A. et al., Arterioscler. Thromb. Vase. Biol., 22:1194-1199 (2002. В нескольких ключевых исследованиях показано, что антагонистическое действие на связывание MCP-1 с рецептором CCR-2 может иметь терапевтический эффект при лечении атеросклероза. Например, скрещивание мышейMCP-1-/- с мышами, дефицитными по рецептору ЛПНП (липопротеинов низкой плотности), приводит к снижению депонирования липидов в аорте на 83% (Gu, L. et al., Mol. Cell., 2:275 (1998. Аналогично мыши, полученные путем удаления гена, кодирующего MCP-1, у мышей с повышенной экспрессией аполипопротеина В человека, лучше защищены от атеросклеротического повреждения по сравнению с контрольными мышами MCP-1+/+ apoB (Gosling, J. et al., J. Clin. Invest., 103:773 (1999. Аналогично скрещивание мышей CCR-2-/- с мышами аполипопротеин Е-/- приводит к значительному снижению вероятности атеросклеротических повреждений (Boring, L. et al., Nature, 394:894 (1998); Dawson, T.C. et al.,Atherosclerosis, 143:205 (1999. И, наконец, у мышей аполипопротеин Е-/- после введения гена, кодирующего пептидный антагонист рецептора CCR-2, уменьшается размер повреждений и повышается стабильность бляшек (Ni, W. et al., Circulation, 103:2096-2101 (2001. Трансплантация костного мозга мышей CCR-2-/- мышам АроЕ 3-Leiden вызывает ингибирование раннего атерогенеза (Guo, J. et al.,Arterioscler. Thromb. Vase. Biol., 23:447 (2003, но оказывает минимальное действие на запущенные повреждения (Guo, J. et al., Arterioscler. Thromb. Vase. Biol., 25:1014 (2005. У пациентов с сахарным диабетом типа 2 обычно наблюдается резистентность к инсулину, что является одним из отличительных признаков данного заболевания. Резистентность к инсулину также ассоциируется с комбинацией расстройств, известной как "метаболический синдром" или "X-синдром", которые включают ожирение, атеросклероз, гипертензию и дислипидемию (см. обзор Eckel et al., Lancet,365:1415 (2005. Хорошо известно, что воспаление играет роль в обострении патологического процесса при диабете типа 2 и расстройствах, относящихся к "Х-синдрому" (см. обзор Chen, H., PharmacologicalResearch, 53:469 (2006); Neels et al., J. Clin. Invest., 116:33 (2006); Danadona et al., Am. J. Cardiol., 90:27G33G (2002); Pickup et al., Diabetologia, 41:1241 (1998. Показано, что MCP-1 играет роль в резистентности к инсулину, вызванной ожирением. В клеточной культуре преадипоциты человека конститутивно экспрессируют MCP-1 (Gerhardt, Mol. Cell. Endocrinology, 175:81 (2001. CCR-2 экспрессируется на адипоцитах; добавление MCP-1 к дифференцированным адипоцитам in vitro уменьшает стимулированное инсулином поглощение глюкозы и экспрессию нескольких генов, ответственных за липогенез (генов, кодирующих LpL, адипсин, GLU-4, аР 2, 3-адренергический рецептор и PPAR) (Sartipy, P. et al., Proc. Natl.Acad. Sci. USA, 96:6902 (1999. Пациенты с диабетом типа 2 имеют более высокий уровень циркулирующего в крови MCP-1 по сравнению с контрольной группой недиабетических пациентов (Nomura, S. etal., Clin. Exp. Immunol., 121:437 (2000, лечение таких пациентов противодиабетическими препаратами,такими как метформин или тиазолидиндион, может уменьшить высвобождение MCP-1 из жировой ткани(Bruun, J.M. et al., J. Clin. Endocrinol. Metab., 90:2282 (2005. Аналогично повышенная экспрессия MCP-1 также наблюдается у мышей с экспериментальными моделями ожирения, MCP-1 главным образом продуцируется жировой тканью (Sartipy et al., Proc. Natl. Acad. Sci. USA, 100:7265 (2003. У мышей с экспериментальным ожирением экспрессия MCP-1 предшествует возникновению резистентности к инсулину или появляется одновременно с началом данного заболевания (Xu, H. et al., J. Clin. Invest., 112:1821(2003. В другом исследовании показано, что экспрессия MCP-1 позитивно коррелирует с массой жировой ткани, окружающей половые железы (Weisberg et al., J. Clin. Invest., 112:1796 (2003. С этими данными согласуются результаты другого исследования, в котором показано, что развитие резистентности к инсулину у мышей db/db может быть ослаблено в результате генетической делеции MCP-1 или путем экспрессии трансгена, кодирующего доминантный негативный пептид (Kanda, H. et al., J. Clin. Invest.,116:1494 (2006. Показано, что является верным и обратное утверждение, а именно повышенная экс-3 020486 прессия MCP-1 в жировой ткани стимулирует развитие резистентности к инсулину (Kamei, N. et al., J.Biol. Chem., 281:26602 (2006. Описан также факт, находящийся в противоречии с описанными выше данными, а именно у мышей db/db генетическая делеция MCP-1 не влияет на резистентность к инсулину(Chow, F.Y. et al., Diabetologia, 50:471 (2007. С данными, полученными на MCP-1, согласуются результаты исследований, выполненных с использованием CCR-2 (MCP-1-рецептора), согласно которым данный рецептор участвует в развитии ожирения и резистентности к инсулину, вызванной ожирением. Диета с высоким содержанием жира повышает количество циркулирующих в крови CCR-2+ воспалительных моноцитов как у мышей дикого типа (Tsou, C.L. et al., J. Clin. Invest., 117:902 (2007, так и у мышей АроЕ-/- (Таске, F. et al., J. Clin. Invest., 117:185 (2007. Генетическая делеция CCR-2 уменьшает количество активированных макрофагов в жировой ткани мышей (Lumeng, C.N. et al., Diabetes, 56:16 (2007, но не оказывает влияния на популяцию макрофагов М 2 жировой ткани, которые, как полагают, поддерживают "тощее" состояние (Lumeng, С.N. et al., J. Clin. Invest., 117:175 (2007. Генетическая делеция CCR-2 уменьшает ожирение, вызванное диетой, и увеличивает чувствительность к инсулину у животных с экспериментальным ожирением, вызванным диетой (Weisberg, S.P. et al., J. Clin. Invest., 116:115 (2006);Cornelius, P. et al., РСТ-публикации WO 2006/013427 A2), в зависимости от экспериментальных условий(Chen, A. et al., Obes. Res. 13:1311 (2005. Введение малой молекулы-антагониста репрессора CCR-2 также увеличивает чувствительность к инсулину у животных с экспериментальным ожирением, вызванным диетой (Weisberg, S.P. et al., J. Clin. Invest., 116:115 (2006. В двух исследованиях показано, что CCR-2 играет важную роль в сосудистом воспалении, вызванном гипертензией, ремоделировании и гипертрофии (Bush, E. et al., Hypertension, 36:360 (2000); Ishibashi,M. et al., Circ. Res., 94:1203 (2004. Известно, что у пациентов с рассеянным склерозом повышен уровень экспрессии MCP-1, и показано, что эффективная терапия интерфероном -1b уменьшает экспрессию MCP-1 в мононуклеарных клетках периферической крови; это дает возможность предположить, что MCP-1 играет роль в прогрессировании заболевания (Iarlori, С. et al., J. Neuroimmunol., 123:170-179 (2002. В других исследованиях показано, что антагонистическое действие на связывание MCP-1 с рецептором CCR-2 может иметь терапевтический эффект при лечении рассеянного склероза; все исследования были выполнены с использованием экспериментальной модели аутоиммунного энцефаломиелита (ЕАЕ), стандартной модели рассеянного склероза у животных. Введение антител против MCP-1 животным с ЕАЕ значительно снижает вероятность рецидива заболевания (Kennedy, K.J. et al., J. Neuroimmunol., 92:98 (1998. Кроме того, в двух исследованиях показано, что мыши CCR-2-/- устойчивы к ЕАЕ (Fife, B.T. et al., J. Exp. Med., 192:899 (2000);Izikson, L. et al., J. Exp. Med., 192:1075 (2000. В дальнейшем эти исследования были продолжены, и было изучено влияние делеции CCR-2 с использованием различных линий мышей (Gaupp, S. et al., Am. J.Pathol., 162:139 (2003. Интересно, что введение малой молекулы-антагониста рецептора CCR-2 также тормозит прогрессирование заболевания у мышей C57BL/6 (Brodmerkel, C.M. et al., J. Immunol., 175:5370(2005. Известно, что у пациентов с синдромом облитерирующего бронхиолита, развившимся после трансплантации легкого, повышен уровень экспрессии MCP-1 (Reynaud-Gaubert, M. et al., J. Heart LungTransplant, 21:721-730 (2002); Belperio, J. et al., J. Clin. Invest., 108:547-556 (2001. В исследовании с использованием мышиной модели синдрома облитерирующего бронхиолита показано, что введение антитела против MCP-1 приводит к уменьшению облитерации дыхательных путей; аналогично мышиCCR-2-/- с экспериментальным синдромом облитерирующего бронхиолита резистентны к облитерации дыхательных путей (Belperio, J. et al., J. Clin. Invest., 108:547-556 (2001. Эти данные дают возможность предположить, что антагонистическое действие на связывание MCP-1 с рецептором CCR-2 может иметь терапевтический эффект при лечении отторжения трансплантированных органов. Кроме того, исследования показали, что нарушение системы MCP-1/CCR-2 способно повышать выживаемость трансплантированных островковых клеток (Lee, I. et al., J. Immunol., 171:6929 (2003); Abdi, R. et al., J. Immunol.,172:767 (2004. В исследовании с использованием крысиных моделей экспериментальных трансплантатов показано, что у животных с развившейся васкулопатией трансплантата в трансплантатах повышен уровень экспрессии CCR-2 и MCP-1 (Horiguchi, K. et al., J. Heart Lung Transplant, 21:1090 (2002. В другом исследовании показано, что генная анти-MCP-1-терапия ослабляет васкулопатию трансплантата(Saiura, A. et al., Arterioscler. Thromb. Vase. Biol., 24:1886 (2004. В одном исследовали описано ингибирование экспериментального неоинтимального образования в венозном трансплантате путем блокадыMCP-1 (Tatewaki, H. et al., J. Vasc. Surg., 45:1236 (2007. В других исследованиях показано, что антагонистическое действие на связывание MCP-1 с рецептором CCR-2 может иметь терапевтический эффект при лечении астмы. Секвестрация MCP-1 нейтрализующим антителом у мышей, сенсибилизированных овальбумином, приводит к значительному уменьшению гиперчувствительности и воспаления бронхов (Gonzalo, J.-A. et al., J. Exp. Med., 188:157 (1998. Доказано, что можно уменьшить аллергическое воспаление дыхательных путей у мышей, сенсибилизированных яйцами Schistosoma mansoni, путем введения антител против MCP-1 (Lukacs, N.W. et al., J.Immunol., 158:4398 (1997. С этими данными согласуются результаты другого исследования, в котором показано, что у мышей MCP-1-/- уменьшена ответная реакция на провокацию яйцами Schistosomamansoni (Lu, В. et al., J. Exp. Med., 187:601 (1998. В других исследованиях было показано, что антагонистическое действие на связывание MCP-1 с рецептором CCR-2 может иметь терапевтический эффект при лечении заболевания почек. Введение антител против MCP-1 мышам с экспериментальным гломерулярным нефритом приводит к заметному уменьшению гломерулярных серповидных образований и отложений коллагена типа I (Lloyd, С.М. et al.,J. Exp. Med., 185:1371 (1997. Кроме того, у мышей MCP-1-/- с нефритом, вызванным введением нефротоксической сыворотки, тубулярное повреждение выражено в значительно меньшей степени, чем у мышей MCP-1+/+ (Tesch, G.H. et al., J. Clin. Invest., 103:73 (1999. В нескольких исследованиях было показано, что антагонистическое действие на связывание MCP-1 с рецептором CCR-2 может иметь терапевтический эффект при лечении системной эритематозной волчанки. В исследовании с использованием мышиной модели системной эритематозной волчанки показано, что у мышей CCR-2-/- повышена выживаемость и уменьшено поражение почек по сравнению с мышами дикого типа (WT) (Perez de Lema, G. et al., J. Am. Soc. Neph., 16:3592 (2005. Эти данные согласуются с результатами недавних исследований, в которых показано, что генетическая делеция MCP-1(Shimizu, S. et al., Rheumatology (Oxford), 43:1121 (2004); Tesch, G.H. et al., J. Exp. Med., 190:1813 (1999 или введение пептидного антагониста CCR-2 (Hasegawa, H. et al., Arthritis Rheum., 48:2555 (2003 в экспериментальных моделях обыкновенной волчанки у грызунов оказывают модифицирующее действие на заболевание. В собственной пластинке слизистой оболочки тонкой кишки пациентов с болезнью Крона наблюдается значительное (30-кратное) увеличение количества CCR-2+ лимфоцитов по сравнению со здоровой подвздошной кишкой (Connor, S.J. et al., Gut, 53:1287 (2004. Также следует отметить, что наблюдается расширение субпопуляции циркулирующих в крови CCR-2+/CD14+/CD56+ моноцитов у пациентов с активной формой болезни Крона по сравнению с контрольной группой. В нескольких исследованиях, выполненных на грызунах, показано, что антагонистическое действие на связывание MCP-1 с рецепторомCCR-2 может иметь терапевтический эффект при лечении болезни Крона/колита. Так, мыши CCR-2-/- не подвержены колиту, вызываемому введением декстрана сульфата натрия (Andres, P.G. et al., J. Immunol.,164:6303 (2000. Введение малой молекулы-антагониста рецепторов CCR-2, CCR-5 и CXCR3 (аффинность связывания с рецепторами мыши = 24, 236 и 369 нМ соответственно) также предупреждает развитие колита, вызываемого введением декстрана сульфата натрия (Tokuyama, H. et al., Int. Immunol.,17:1023 (2005. И, наконец, у мышей MCP-1-/- с экспериментальным колитом, вызванным введением гаптена, заметно уменьшено поражение толстой кишки (как при макроскопическом, так и при гистологическом исследовании) (Khan, W.I. et al., Am. J. Physiol. Gastrointest. Liver Physiol., 291:G803 (2006. В двух статьях описано, что у пациентов с воспалительным заболеванием кишечника повышена экспрессия MCP-1 в клетках интестинального эпителия и в слизистой кишечника (Reinecker, H.C. et al.,Gastroenterology, 108:40 (1995) и Grimm, M.C. et al., J. Leukoc. Biol., 59:804 (1996. В одном исследовании показана связь полиморфизма промотора гена MCP-1 со склеродермией (системным склерозом) (Karrer, S. et al., J. Invest. Dermatol., 124:92 (2005. В исследованиях с использованием родственных экспериментальных моделей фиброза ткани показано, что ингибирование взаимодействия CCR-2/MCP-1 уменьшает фиброз кожи (Yamamoto, Т. et al., J. Invest. Dermatol., 121:510 (2003);(2004); Gharaee-Kermani, M. et al., Cytokine, 24:266 (2003, почки (Kitagawa, K. et al., Am. J. Pathol.,165:237 (2004); Wada, T. et al., J. Am. Soc. Nephrol., 15:940 (2004, сердца (Hayashidani, S. et al., Circulation, 108:2134 (2003 и печени (Tsuruta, S. et al., Int. J. Mol. Med, 14:837 (2004. В одном исследовании показано, что антагонистическое действие на связывание MCP-1 с рецептором CCR-2 может иметь терапевтический эффект при лечении альвеолита. Показано, что у крыс с поражением легкого, вызванным IgA-содержащим иммунным комплексом, после внутривенного введения антител против MCP-1 (JE) крысы симптомы альвеолита частично смягчаются (Jones, M.L. et al., J.Immunol., 149:2147 (1992. В нескольких исследованиях показано, что антагонистическое действие на связывание MCP-1 с рецептором CCR-2 может иметь терапевтический эффект при лечении рака (см. обзоры Craig, M.J. et al.,Cancer Metastasis Rev., 25:611 (2006); Conti, I. et al., Seminars in Cancer Biology, 14:149 (2004); Giles, R. etal., Curr. Cancer Drug Targets, 6:659 (2006. У иммунодефицитных мышей с пересаженными клетками карциномы молочной железы человека после введения антитела против MCP-1 наблюдается ингибирование микрометастазов в легких и повышение выживаемости (Salcedo, R. et al., Blood, 96:34-40 (2000. В исследовании с использованием клинических проб опухолей человека показано, что экспрессия CCR-2 ассоциирована с прогрессированием рака предстательной железы (Lu, Y. et al., J. Cell. Biochem., 101:676(2007. Показано, что in vitro экспрессия MCP-1 опосредует рост и инвазию клеток рака предстательной железы (Lu, Y. et al., Prostate, 66:1311 (2006; кроме того, MCP-1, экспрессированный клетками рака предстательной железы, индуцирует клетки-предшественники костного мозга человека, участвующие в резорбции костной ткани (Lu, Y. et al., Cancer Res., 67:3646 (2007. В нескольких исследованиях показано, что антагонистическое действие на связывание MCP-1 с рецептором CCR-2 может иметь терапевтический эффект при лечении рестеноза. У человека уровеньMCP-1 прямо коррелируют с риском возникновения рестеноза (Cipollone, F. et al., Arterioscler. Thromb.Vase. Biol., 21:327 (2001. У мышей, дефицитных по CCR-2 или MCP-1, уменьшена площадь интимы и соотношение интима/среда (по сравнению с однопометными животными дикого типа) после повреждения артерии (Roque, M. et al., Arterioscler. Thromb. Vase. Biol., 22:554 (2002); Schober, A. et al., Circ. Res.,95:1125 (2004); Kim, W.J. et al., Biochem. Biophys. Res. Commun., 310:936 (2003. У мышей трансфекция доминантного негативного ингибитора MCP-1 в скелетные мышцы (Egashira, K. et al., Circ. Res., 90:1167(2002 также уменьшает гиперплазию интимы после повреждения артерии. У приматов блокада CCR-2 с использованием нейтрализующего антитела уменьшает неоинтимальную гиперплазию после стентирования (Horvath, С. et al., Circ. Res., 90:488 (2002. В двух статьях описано, что у крыс с экспериментальной травмой головного мозга повышена экспрессия MCP-1 (King, J.S. et al., J. Neuroimmunol., 56:127 (1994) и Berman, J.W. et al., J. Immunol.,156:3017 (1996. Кроме того, результаты исследований показывают, что мыши CCR-2-/- (Dimitrijevic,O.B. et al., Stroke, 38:1345 (2007 и мыши MCP-1-/- (Hughes, P.M. et al., J. Cereb. Blood Flow Metab., 22:308(2002 частично защищены от ишемического/реперфузионного повреждения. Известно, что моноциты/макрофаги играют важную роль в развитии невропатической боли (Liu, Т.et al., Pain, 86:25 (2000. Недавно описана потенциальная роль CCR-2 в лечении воспалительной и невропатической боли, что согласуется с этими данными. Показано, что у мышей CCR-2-/- изменена реакция на воспалительную боль по сравнению с мышами дикого типа (WT), включая снижение степени проявления составляющих болевого поведения после интраплантарной инъекции формалина и незначительное уменьшение механической аллодинии после интраплантарной инъекции CFA (полного адъюванта Фрейнда) (Abbadie, C. et al., Proc. Natl. Acad. Sci. USA, 100:7947 (2003. Кроме того, у мышей CCR-2-/отсутствуют значительные проявления механической аллодинии после повреждения седалищного нерва. Аналогично пероральное введение малой молекулы-антагониста рецептора CCR-2 уменьшает механическую аллодинию до 80% от уровня, предшествующего травме (Abbadie, С. et al., PCT публикацияWO 2004/110376). В одном исследовании показана ключевая роль MCP-1 в ишемической кардиомиопатии(Frangogiannis, N.G. et al., Circulation, 115:584 (2007. В другом исследовании показано, что ингибирование MCP-1 ослабляет экспериментальную сердечную недостаточность (Hayashidani, S. et al., Circulation,108:2134 (2003. В других исследованиях получены доказательства того, что экспрессия MCP-1 повышена также при других болезненных состояниях, не указанных выше. Эти данные позволяют предположить, что антагонисты MCP-1 могут быть использованы в качестве лекарств для лечения таких заболеваний. В другом исследовании показано, что у грызунов с сердечным аллотрансплантатом в трансплантате повышена экспрессия MCP-1, что позволяет предположить, что MCP-1 участвует в патогенезе артериосклероза трансплантата (Russell, M.E. et al., Proc. Natl. Acad. Sci. USA, 90:6086 (1993. Показано, что у пациентов с идиопатическим легочным фиброзом повышена экспрессия MCP-1 в эндотелиальных клетках легкого(Antoniades, H.N. et al., Proc. Natl. Acad. Sci. USA, 89:5371 (1992. Аналогично повышенный уровень экспрессии MCP-1 наблюдается в коже пациентов с псориазом (Deleuran, M. et al., J. Dermatol. Sci.,13:228 (1996) и Gillitzer, R. et al., J. Invest. Dermatol., 101:127 (1993; эти данные коррелируют с результатами другого исследования, в котором показано, что для псориаза характерно преобладание CCR-2+клеток (Vestergaard, С. et al., Acta Derm. Venerol., 84:353 (2004. Наконец, в недавно опубликованном исследовании показано, что у пациентов с ВИЧ-1-ассоциированной деменцией повышена экспрессияMCP-1 в головном мозге и спинномозговой жидкости (Garzino-Demo, A., PCT публикация WO 99/46991). Кроме того, показано, что полиморфизм CCR-2 ассоциирован с саркоидозом по меньшей мере в одной субпопуляции пациентов (Spagnolo, P. et al., Am. J. Respir. Crit. CareMed, 168:1162 (2003. Следует также отметить, что CCR-2 является корецептором для некоторых штаммов ВИЧ (вируса иммунодефицита человека) (Doranz, B.J. et al., Cell, 85:1149 (1996. Также установлено, что использование CCR-2 в качестве корецептора для ВИЧ может коррелировать с прогрессированием заболевания(Connor, R.I. et al., J. Exp. Med., 185:621 (1997. Это наблюдение согласуется с результатами недавно опубликованного исследования, в котором показано, что присутствие мутантного CCR-2 (CCR-2-64I) позитивно коррелирует с задержкой развития ВИЧ в человеческой популяции (Smith, M.W. et al., Science,277:959 (1997. И хотя MCP-1 не вовлечен в эти процессы, возможно, антагонисты MCP-1, действие которых опосредовано связыванием с рецептором CCR-2, могут оказывать благоприятное терапевтическое действие на замедление развития СПИДа у ВИЧ-инфицированных пациентов. Следует отметить, что CCR-2 также является рецептором хемокинов человека MCP-2, MCP-3 иMCP-4 (Luster, New Eng. J. Med., 338:436-445 (1998. Так как новые соединения формулы (I), описанные в данном документе, являются антагонистами MCP-1, действие которых опосредовано связыванием с рецептором CCR-2, возможно, данные соединения формулы (I) также являются эффективными антагонистами MCP-2, MCP-3 и MCP-4 в отношении тех эффектов, которые опосредованы связыванием указанных лигандов с рецептором CCR-2. Соответственно, в контексте данного описания предполагается,что выражение "антагонизм MCP-1" эквивалентно выражению "антагонизм стимуляции CCR-2 хемокинами". Соответственно, соединения, которые модулируют активность хемокинов, могут иметь широкую область применения при лечении воспалительных, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний. В РСТ публикациях WO 2005/021500 A1 (включенной в данное описание посредством ссылки и принадлежащей заявителю данного изобретения),WO 2008/014381 A1, WO 2008/014360 А 1 и WO 2008/014361 А 1 описаны соединения, которые модулируют активность MCP-1, MCP-2, MCP-3 и MCP-4 через CCR-2. В данных публикациях также описаны различные способы получения указанных соединений, в том числе многоступенчатый синтез, который включает введение и последующее удаление защитных групп. Желательно найти новые соединения с фармакологическими характеристиками, улучшенными по сравнению с фармакологическими характеристиками известных модуляторов хемокинов. Например, желательно найти новые соединения, обладающие равномощной двойной ингибирующей активностью в отношении CCR-2 и CCR-5 по сравнению с соединениями, обладающими избирательностью в отношении только CCR-2, избирательностью преимущественно в отношении CCR-2 по сравнению с CCR-5, избирательностью преимущественно в отношении CCR-5 по сравнению с CCR-2 или избирательностью в отношении других G-белок-сопряженных рецепторов (т.е. 5 НТ 2 А-рецептора). Желательно также найти соединения, обладающие равномощной двойной ингибирующей активностью в отношении CCR-2 иCCR-5 и полезными характеристиками, относящимися к одной или более чем одной из следующих категорий: а) фармацевтические свойства (т.е. растворимость, проницаемость, возможность получения препаратов с замедленным высвобождением); б) требования, предъявляемые к дозированию (например, уменьшение дозы и/или введение препарата один раз в сутки); в) факторы, которые уменьшают колебания между максимальной и минимальной концентрациями препарата в крови (т.е. клиренс и/или объем распределения); г) факторы, которые увеличивают концентрацию активного лекарства у рецептора (т.е. связывание с белками, объем распределения); д) факторы, которые уменьшают предрасположенность к клинически значимым взаимодействиям лекарство-лекарство (например, таким как ингибирование или индукция ферментов семейства цитохром Р 450, например ингибирование CYP 2D6, см. публикацию Dresser, G.K. et al., Clin. Pharmacokinet., 38:4157 (2000), которая включена в данное описание посредством ссылки); и е) факторы, которые уменьшают возможность неблагоприятных побочных эффектов (например,фармакологической избирательности в отношении рецепторов, отличных от G-белок-сопряженных рецепторов, потенциальной химической или метаболической реактивности, ограниченного проникновения в ЦНС (центральную нервную систему), избирательности в отношении ионных каналов). Особенно желательно найти соединения с нужной комбинацией вышеупомянутых фармакологических характеристик. Также желательно в данной области предложить новые и/или улучшенные способы получения таких соединений. Данные способы могут иметь, без ограничения, следующие отличительные признаки: а) простая адаптация к крупномасштабному производству, например на пилотном заводе или в промышленном масштабе; б) стадии синтеза и/или методики, позволяющие повысить чистоту (включая хиральную чистоту), стабильность и/или легкость обращения с промежуточными соединениями и/или конечными соединениями; и/или в) меньшее количество стадий синтеза. Сущность изобретения В настоящем изобретении предложен новый антагонист N-1R,2S,5R)-5-(трет-бутиламино)-2-S)3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамид,обладающий неожиданной равномощной двойной ингибирующей активностью в отношении рецепторовCCR-2 и CCR-5 Кроме того, в настоящем изобретении предложена новая и неожиданная комбинация равномощной двойной активности в отношении рецепторов CCR-2 и CCR-5 и желательных фармакологических характеристик. Также предложены кристаллические формы соединений согласно настоящему изобретению. Объектами настоящего изобретения также являются фармацевтические композиции, содержащие указанные соединения, и способы применения этих соединений в качестве агентов для лечения воспалительных заболеваний, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний. В настоящем изобретении также предложено применение N-1R,2S,5R)-5-(трет-бутиламино)-2S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1 ил)циклогексил)ацетамида для лечения воспалительных заболеваний, аллергических, аутоиммунных,метаболических, раковых и/или сердечно-сосудистых заболеваний. Соответственно, в данном изобретении описаны новые модуляторы активности хемокинов, обладающие неожиданным сочетанием желаемых фармакологических характеристик. В настоящем изобретении предложены фармацевтические композиции, содержащие фармацевтически приемлемый носитель и терапевтически эффективное количество по меньшей мере одного из соединений согласно настоящему изобретению или его кристаллической формы. В настоящем изобретении также предложены способы лечения воспалительных, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний, в особенности диабета,рассеянного склероза, болезни Крона и/или атеросклероза, включающие введение объекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения или его кристаллической формы согласно настоящему изобретению. В настоящем изобретении предложен способ получения соединений, раскрытых в данном описании, и соединений, которые могут быть использованы в качестве промежуточных соединений при их получении. В настоящем изобретении предложено применение соединений согласно настоящему изобретению в терапии для лечения воспалительных, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний. Краткое описание чертежей На фиг. 1 представлены экспериментальная и симулированная порошковые дифрактограммыN-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2 оксопирролидин-1-ил)циклогексил)ацетамида. На фиг. 2 представлены данные анализа формы N-1 N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7 трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамида свободного основания, полученные с использованием дифференциальной сканирующей калориметрии. На фиг. 3 представлены данные термогравиметрического анализа формы N-1 N-1R,2S,5R)-5-(третбутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1 ил)циклогексил)ацетамида свободного основания. Подробное описание изобретения В настоящем изобретении предложен новый антагонист N-1R,2S,5R)-5-(трет-бутиламино)-2-S)3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамид или его кристаллическая форма, обладающие неожиданной равномощной двойной активностью в отношении рецепторов CCR-2 и CCR-5. Кроме того, в настоящем изобретении предложена новая комбинация желательных фармакологических характеристик. Также предложены кристаллические формы соединений согласно настоящему изобретению. Объектами настоящего изобретения также являются фармацевтические композиции, содержащие указанные соединения, и способы применения этих соединений в качестве агентов для лечения воспалительных заболеваний, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний. В настоящем изобретении также предложен способ получения N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4 иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамида. В данном изобретении также предложены соединения, которые могут быть использованы в качестве промежуточных соединений в способе получения соединений согласно настоящему изобретению.N-1R,2S,5R)-5-(трет-Бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)2-оксопирролидин-1-ил)циклогексил)ацетамид обладает неожиданной равномощной двойной ингибирующей активностью в отношении рецепторов CCR-2 и CCR-5. Кроме того, N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин 4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамид обладает желательной комбинацией равномощной двойной ингибирующей активности в отношении рецепторов CCR-2 и CCR-5 и фармакологических характеристик, включая неожиданно высокую степень биодоступности при пероральном введении в сочетании с показаниями к применению, благодаря чему данное соединение является высокоэффективным и имеет прекрасные критерии безопасности. Известные модуляторы рецепторов хемокинов, такие как модуляторы, раскрытые в РСТ публикациях WO 2004/071460 А 1 и WO 2005/021500 А 1 (патент США 7163937, выданный 16 января 2007 г.,принадлежащий заявителю данного изобретения), недостаточно эффективны, как показывают измерения их способности связываться с CCR-2 или CCR-5 (измерения эффективности связывания), и/или не отвечают подходящим критериям безопасности, на что указывает их избирательность в отношении ионных каналов, определенная в исследованиях с использованием hERG и Na+-ионных каналов. Другие известные модуляторы рецепторов хемокинов, такие как модуляторы, раскрытые в РСТ публикациях WO 2008/014381 A1, WO 2008/014360 А 1 и WO 2008/014361 А 1, являются избирательными антагонистами или избирательными частичными агонистами/антагонистами в отношении активности рецептора CCR-2. Однако данные известные модуляторы обладают активностью преимущественно в отношении рецептора CCR-2, но не являются равномощными двойными антагонистами, что показано путем измерения их способности связываться с рецепторами CCR-2 и CCR-5. Другие известные модуляторы рецепторов хемокинов, такие как модуляторы, описанные в Carter etal. American Chemical Society, August 17, 2008, являются двойными модуляторами рецепторов CCR-2 иCCR-5, но не отвечают подходящим критериям безопасности, на что указывает их избирательность в отношении ионных каналов, определенная в исследованиях с использованием hERG и Na+-ионных каналов. В отличие от указанных модуляторов, N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-третбутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамид обладает неожиданной равномощной способностью связываться с рецепторами CCR-5 и CCR-2 (соответствующие иллюстративные данные приведены ниже в разделе данного описания "Сравнительные фармакологические характеристики". Кроме того,N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-третбутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамид имеет неожиданно высокую степень проницаемости через мембраны и к тому же сочетает равномощную способность связываться с рецепторами CCR-2 и CCR-5 с прекрасной избирательностью в отношении ионных каналов. Соответственно, в настоящем изобретении предложены новые модуляторы хемокинов, обладающие равномощной способностью связываться с рецепторами CCR-2 и CCR-5 и улучшенными фармакологическими характеристиками, что, как ожидается, может иметь благоприятный терапевтический эффект при лечении воспалительных, аллергических, аутоиммунных, метаболических, раковых и/или сердечнососудистых заболеваний. Варианты осуществления изобретения Один из вариантов осуществления изобретения относится к N-1R,2S,5R)-5-(трет-бутиламино)-2S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1 ил)циклогексил)ацетамиду Другой вариант осуществления изобретения относится к кристаллической форме N-1N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2 оксопирролидин-1-ил)циклогексил)ацетамида, характеризующейся параметрами элементарной ячейки,имеющими, по существу, следующие значения: размеры ячейки: пространственная группа: P212121; количество молекул на элементарную ячейку (Z): 1; плотность (рассчитанная, гсм-3): 1,194,когда указанный кристалл находится при температуре приблизительно -70 С. Другой вариант осуществления изобретения относится к кристаллической форме N-1R,2S,5R)-5(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1 ил)циклогексил)ацетамида, причем указанная кристаллическая форма включает форму N-1, по существу,. в чистой форме. Другой вариант осуществления изобретения относится к форме N-2, которая характеризуется порошковой рентгеновской дифрактограммой, по существу, соответствующей дифрактограмме, приведенной на фиг. 1 (или имеет такую дифрактограмму). Другой вариант осуществления изобретения относится к форме N-2, которая характеризуется термограммой, полученной с использованием методики дифференциальной сканирующей калориметрии, по существу, соответствующей термограмме, приведенной на фиг. 2, согласно которой температура эндотермического перехода выше приблизительно 205C (или имеет такую термограмму). Другой вариант осуществления изобретения относится к форме, которая характеризуется кривой термического гравиметрического анализа, соответствующей кривой, приведенной на фиг. 3 (или имеет такую кривую). Другой вариант осуществления изобретения относится к фармацевтической композиции, состоящей из N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2 оксопирролидин-1-ил)циклогексил)ацетамида или его кристаллической формы и фармацевтически приемлемого носителя. Другой вариант осуществления изобретения относится к фармацевтической композиции, состоящей из N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-a][1,3,5]триазин-4-иламино)-2 оксопирролидин-1-ил)циклогексил)ацетамида, его кристаллической формы и по меньшей мере одного дополнительного терапевтического агента. Другой вариант осуществления изобретения относится к способу модулирования активности хемокинов или рецепторов хемокинов, включающему введение нуждающемуся в этом пациенту терапевтически эффективного количества N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5 а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамида и его кристаллической формы. Другой вариант осуществления изобретения относится к способу модулирования активности рецепторов CCR-2 и CCR-5, включающему введение нуждающемуся в этом пациенту терапевтически эффективного количества N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-трет-бутиламино[1,5-а][1,3,5]триазин 4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамида или его кристаллической формы. Изобретение также рассматривает способ модулирования активности MCP-1, MCP-2, MCP-3,MCP-4, MCP-5, MIP-1a, MIP-1b и RANTES, опосредованной рецепторами CCR-2 и CCR-5, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества N-1R,2S,5R)-5(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1 ил)циклогексил)ацетамида и его кристаллической формы. Другой вариант осуществления изобретения относится к способу лечения расстройства, включающему введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количестваN-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2 оксопирролидин-1-ил)циклогексил)ацетамида и его кристаллической формы, где указанное расстройство выбрано из диабета, ожирения, метаболического синдрома, инсульта, невропатической боли, ишемической кардиомиопатии, псориаза, гипертензии, склеродермии, остеоартрита, аневризмы, лихорадки, сердечно-сосудистого заболевания, болезни Крона, застойной сердечной недостаточности, аутоиммунных заболеваний, ВИЧ-инфекции, ВИЧ-ассоциированной деменции, идиопатического легочного фиброза,артериосклероза трансплантата, физически или химически индуцированной травмы головного мозга,воспалительного заболевания кишечника, альвеолита, колита, системной эритематозной волчанки, нефрита, вызванного введением нефротоксической сыворотки, гломерулонефрита, астмы, рассеянного склероза, атеросклероза, васкулита, атероматозных бляшек, ревматоидного артрита, рестеноза, венозной неоинтимальной гиперплазии, неоинтимальной гиперплазии диализного трансплантата, интимальной гиперплазии артериовенозного шунта, последствий трансплантации органов, хронической нефропатии аллотрансплантата, рака, неоинтимальной гиперплазии диализного трансплантата и неоинтимальной гиперплазии артериовенозного шунта. Другой вариант осуществления изобретения относится к способу лечения рака, например рака молочной железы, рака печени, рака предстательной железы и меланомы, включающему введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества N-1R,2S,5R)-5-(третбутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-a][1,3,5]триазин-4-иламино)-2-оксопирролидин-1 ил)циклогексил)ацетамида и его кристаллической формы. Другой вариант осуществления изобретения относится к способу лечения заболевания, которое, по меньшей мере частично, опосредовано рецепторами CCR-2 и CCR-5, включающему введение пациенту,нуждающемуся в таком лечении, терапевтически эффективного количества N-1R,2S,5R)-5-(третбутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1 ил)циклогексил)ацетамида и его кристаллической формы. Варианты осуществления способов изобретения Согласно первому варианту осуществления изобретения предложен способ полученияN-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2 оксопирролидин-1-ил)циклогексил)ацетамида, включающий способ, приведенный на следующей схеме. Могут быть предложены другие конкретные варианты осуществления настоящего изобретения без отступления от сущности или основных признаков изобретения. Кроме того, подразумевается, что любой элемент варианта осуществления изобретения может быть комбинирован со всеми без исключения другими элементами любого варианта осуществления изобретения, данные комбинации образуют дополнительные варианты осуществления изобретения. Кроме того, настоящее изобретение включает комбинации различных вариантов осуществления изобретения, частей вариантов осуществления изобретения,определений, описаний и примеров изобретения, отмеченных в данном описании. Определения Далее приведены определения терминов, используемых в данном описании и прилагаемой формуле изобретения. Если не указано иное, начальное определение, приведенное для группы или термина, относится к данной группе или термину, независимо от того, в какой части описания и прилагаемой формулы изобретения данная группа или термин упоминаются, самостоятельно или как часть другой группы. Подразумевается, что термин "терапевтически эффективное количество" включает количество одного соединения согласно настоящему изобретению, или количество комбинации соединений согласно настоящему изобретению, или количество соединения согласно настоящему изобретению в комбинации с другими активными ингредиентами, эффективное для ингибирования CCR-2 и CCR-5 или эффективное для лечения или предупреждения расстройств, указанных в данном описании. В контексте данного описания термины "лечить" или "лечение" относятся к лечению болезненного состояния у млекопитающего, в особенности у человека, и включают (а) предупреждение болезненного состояния у млекопитающего, в частности, когда такое млекопитающее предрасположено к развитию болезненного состояния, но диагноз еще не поставлен; (б) ингибирование болезненного состояния, т.е. остановку его развития; и/или (в) облегчение болезненного состояния, т.е. регрессию болезненного состояния. Названия, используемые в данном описании для обозначения конкретной формы, например "N-1" или "Р-1", не должны рассматриваться как ограничение в отношении любого другого вещества, имеющего сходные или идентичные физические и химические характеристики, скорее, данные обозначения следует рассматривать только как идентификаторы, которые следует интерпретировать в соответствии с информацией, содержащей характеристики вещества, которая также приписывается данным идентификаторам. В настоящем изобретении предложены кристаллические формы свободного основанияN-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2 оксопирролидин-1-ил)циклогексил)ацетамида в качестве нового вещества, в частности, в фармацевтически приемлемой форме. Согласно некоторым предпочтительным вариантам осуществления изобретения кристаллические формы данного свободного основания находятся, по существу, в чистой форме. Предпочтительные варианты данного свободного основания описаны в примерах и относятся к форме N-1. Подразумевается, что настоящее изобретение включает все изотопы атомов, присутствующих в соединениях согласно настоящему изобретению. Изотопы включают атомы, имеющие одинаковый атомный номер, но разные массовые числа. В качестве типичного неограничивающего примера можно привести изотопы водорода, которые включают дейтерий и тритий. Изотопы углерода включают 13 С и 14 С. Соединения согласно изобретению, меченные изотопами, обычно могут быть получены с помощью стандартных методик, известных специалистам в данной области техники, или с помощью методик, аналогичных методикам, приведенным в данном описании, с использованием подходящего меченного изо- 11020486 топом реагента вместо немеченного реагента, используемого в другом случае. В контексте данного описания термин "аморфный" относится к твердой форме вещества, молекулы,атомы и/или ионы которого не образуют кристаллическую структуру. Аморфное твердое вещество не имеет характерную рентгеновскую дифрактограмму. В контексте данного описания термин "по существу, чистый" по отношению к кристаллической форме означает, что соединение имеет степень чистоты более 90% (по массе), включая степень чистоты более 90, 91, 92, 93, 94, 95, 96, 97, 98 и 99% (по массе), а также степень чистоты, равную приблизительно 100% (по массе), рассчитанную на основе массы соединения. Оставшаяся часть вещества содержит другую форму (другие формы) соединения, и/или примеси компонентов реакционной смеси, и/или примеси,добавленные в процессе получения соединения. Например, кристаллическую форму N-1R,2S,5R)-5 бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1 ил)циклогексил)ацетамида, свободного основания или соли можно считать, по существу, чистой в том случае, когда степень чистоты данной формы составляет более 90 мас.% согласно измерению с помощью средств, известных и обычно используемых в данной области техники в настоящее время, и остаток, составляющий менее 10 мас.%, содержит другую форму (другие формы) N-1R,2S,5R)-5-(третбутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1 ил)циклогексил)ацетамида, свободного основания или соли, и/или примеси компонентов реакционной смеси, и/или примеси, добавленные в процессе получения соединения. Могут быть получены образцы кристаллических форм, по существу, чистые в смысле фазовой гомогенности, что указывает на присутствие доминирующего количества одной кристаллической формы и необязательно минорного количества одной или более чем одной другой кристаллической формы. Присутствие в образце более одной кристаллической формы может быть определено с помощью таких методик, как рентгеновская порошковая дифрактометрия (PXRD) или твердотельная ядерная магнитнорезонансная спектроскопия (SSNMR). Например, присутствие дополнительных пиков на экспериментально полученной PXRD-дифрактограмме по сравнению с симулированной PXRD-дифрактограммой может указывать на наличие в образце более одной кристаллической формы. Симулированная PXRDдифрактограмма может быть рассчитана, исходя из рентгеноструктурных данных для монокристалла. См. Smith, D.K., "A FORTRAN Program for Calculating X-Ray Powder Diffraction Patterns", Lawrence Radiation Laboratory, Livermore, California, UCRL-7196 (April 1963). Предпочтительно, когда кристаллическая форма является, по существу, чистой в смысле фазовой гомогенности, т.е. менее 10%, предпочтительно менее 5% и более предпочтительно менее 2% общей площади пиков на экспериментально полученной PXRD-дифрактограмме занимают дополнительные пики, которые отсутствуют на симулированной PXRD-дифрактограмме. Наиболее предпочтительно, когда кристаллическая форма является, по существу, чистой в смысле фазовой гомогенности, и на ее экспериментально полученной PXRD-дифрактограмме менее 1% общей площади пиков занимают дополнительные пики, которые отсутствуют на симулированной PXRD-дифрактограмме. Методики получения кристаллических форм известны в данной области техники. Кристаллические формы могут быть получены с помощью различных методик, включая, например, кристаллизацию или перекристаллизацию из подходящего растворителя, сублимацию, выращивание из расплава, полиморфное превращение из другой фазы, кристаллизацию из сверхкритической жидкости и струйное распыление. Методики кристаллизации или перекристаллизации кристаллических форм из смеси с растворителем включают, например, выпаривание растворителя, уменьшение температуры указанной смеси, затравливание кристалла соединения и/или его соли в пересыщенную смесь, лиофилизацию указанной смеси и добавление антирастворителей (противорастворителей) к указанной смеси. Указанные формы могут быть характеризованы и идентифицированы с использованием рентгеновской дифракции на монокристаллах, которая основана на измерении параметров элементарной ячейки монокристалла исследуемой формы при фиксированной температуре. Подробное описание элементарных ячеек приведено в Stout et al., Chapter 3, X-Ray Structure Determination: A Practical Guide, MacmillanCo., New York (1968). Альтернативно, уникальное пространственное расположение атомов внутри кристаллической решетки может быть характеризовано экспериментально определенными фракционными координатами атомов. Другой способ характеризации кристаллической структуры, основанный на анализе данных рентгеновской порошковой дифрактометрии, заключается в сравнении экспериментального(или наблюдаемого) профиля дифракции с симулированным профилем, соответствующим чистому порошку, при одной и той же температуре, где измерения, характеризующие исследуемую форму, представлены в виде ряда значений 2. Для характеризации формы могут быть использованы другие методики, такие как твердотельный ядерный магнитный резонанс (SSNMR), дифференциальная сканирующая калориметрия и термогравиметрический анализ. Для характеризации исследуемой формы также может быть использована комбинация данных методик. Термин "незначительная потеря массы", используемый в данном описании при характеризации формы с использованием TGA, указывает на присутствие чистой (несольватированной) кристаллической формы. Согласно одному из вариантов осуществления изобретения кристаллическая форма N-1R,2S,5R)5-(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин 1-ил)циклогексил)ацетамида, свободного основания присутствует, по существу, в чистой форме. Данная кристаллическая форма может быть использована в фармацевтических композициях, которые необязательно могут включать один или более чем один другой компонент, выбранный, например, из группы,состоящей из эксципиентов, носителей, и один компонент, выбранный из других активных фармацевтических ингредиентов или активных химических соединений с другими молекулярными структурами. Предпочтительно, когда кристаллическая форма является, по существу, чистой в смысле фазовой гомогенности, т.е. менее 10%, предпочтительно менее 5% и более предпочтительно менее 2% общей площади пиков на экспериментально полученной PXRD-дифрактограмме занимают дополнительные пики, которые отсутствуют на симулированной PXRD-дифрактограмме. Наиболее предпочтительно, когда кристаллическая форма является, по существу, чистой в смысле фазовой гомогенности, и на ее экспериментально полученной PXRD-дифрактограмме менее 1% общей площади пиков занимают дополнительные пики, которые отсутствуют на симулированной PXRD-дифрактограмме. Согласно другому варианту осуществления изобретения предложена композиция, состоящая, по существу,из кристаллических формN-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-третбутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамида, свободного основания или соли. Композиция согласно данному варианту осуществления изобретения может содержать по меньшей мере 90% (по массе) указанной формы исходя из массы композиции. Присутствие примесей компонентов реакционной смеси и/или примесей, добавленных в процессе получения соединения, может быть определено с помощью аналитических методик, известных в данной области техники, таких как, например, хроматография, ядерный магнитный резонанс, спектроскопия,масс-спектрометрия или инфракрасная спектроскопия. Кристаллические формы могут быть получены с помощью различных методик, включая, например,кристаллизацию или перекристаллизацию из подходящего растворителя, сублимацию, выращивание из расплава, полиморфное превращение из другой фазы, кристаллизацию из сверхкритической жидкости и струйное распыление. Методики кристаллизации или перекристаллизации кристаллических форм из смеси с растворителем включают, например, выпаривание растворителя, уменьшение температуры указанной смеси, затравливание кристалла соединения и/или его соли в пересыщенную смесь, лиофилизацию указанной смеси и добавление антирастворителей (противорастворителей) к указанной смеси. Для получения кристаллических форм, включая полиморфы, могут быть использованы методики высокопроизводительной кристаллизации. Кристаллы лекарств, включая полиморфы, методики их получения и характеризация кристаллов лекарств обсуждаются в Byrn, S.R. et al., Solid-State Chemistry of Drugs, 2nd Edition, SSCI, West Lafayette,Indiana (1999). В методиках кристаллизации с использованием растворителя выбор растворителя или растворителей обычно зависит от одного или более чем одного фактора, такого как растворимость соединения, методика кристаллизации и давление паров растворителя. Могут быть использованы комбинации растворителей; например, соединение можно растворить в первом растворителе с получением раствора и затем добавить антирастворитель для уменьшения растворимости соединения в растворителе и образования кристаллов. "Антирастворитель" представляет собой растворитель, в котором соединение имеет низкую растворимость. Растворители, подходящие для получения кристаллов, включают полярные и неполярные растворители. В одной из методик получения кристаллов N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-третбутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамид, свободное основание или соль суспендируют и/или перемешивают в подходящем растворителе с получением суспензии, которую для ускорения растворения можно нагреть. Термин "суспензия" в контексте данного описания означает насыщенный раствор, который при определенной температуре также может содержать дополнительное количество твердого вещества, т.е. может представлять собой гетерогенную смесь. Подходящие в этом случае растворители включают, например, полярные апротонные растворители и полярные протонные растворители, а также смеси двух и более указанных растворителей, таких как описано в данном изобретении. В любую кристаллизационную смесь для ускорения кристаллизации могут быть добавлены затравочные кристаллы. Специалистам в данной области техники известно, что внесение затравки дает возможность контролировать рост конкретной кристаллической формы или дает возможность контролировать распределение размера частиц кристаллического продукта Соответственно, при расчете количества необходимой затравки принимается во внимание размер имеющихся в распоряжении затравочных кристаллов и желаемый средний размер частиц продукта, как описано, например, в Mullin, J.W. et al.,"Programmed cooling of batch crystallizers", Chemical Engineering Science, 26:369-377 (1971). В общем случае для эффективного контроля роста кристаллов в кристаллизаторе необходимо использовать мелкие затравочные кристаллы. Мелкие затравочные кристаллы могут быть получены путем просеивания, дробления или микронизации больших кристаллов или путем микрокристаллизации из растворов. Следует обращать внимание на то, чтобы дробление или микронизация кристаллов не приводили к каким-либо отклонениям кристаллического состояния от желаемой кристаллической формы (т.е. к превращению в аморфное вещество или в другой полиморф). Охлажденная смесь может быть отфильтрована под вакуумом, и выделенное твердое вещество может быть промыто подходящим растворителем, таким как растворитель для холодной перекристаллизации, и высушено в потоке азота с получением желаемой кристаллической формы. Выделенное твердое вещество может быть проанализировано с использованием подходящих спектроскопических или аналитических методик, таких как SSNMR, DSC, PXRD и т.п., чтобы подтвердить образование предпочтительной кристаллической формы продукта. Фактический выход полученной кристаллической формы обычно составляет более приблизительно 70% (по массе), предпочтительно более 90% (по массе) относительно исходной массы N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5 а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамида, свободного основания или соли, используемой в методике кристаллизации. При необходимости полученный продукт может быть подвергнут дроблению или продавлен через сито, чтобы разбить комки. Кристаллические формы могут быть получены прямо из реакционной смеси после окончания последней стадии синтезаN-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5 а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамида, свободного основания или соли. Это может быть достигнуто, например, путем использования на последней стадии синтеза растворителя или смеси растворителей, из которых может быть кристаллизовано данное соединение. Альтернативно, кристаллические формы могут быть получены путем дистилляции или добавления растворителя. Растворители, пригодные для этой цели, включают любой из растворителей, описанных в данном документе, включая протонные полярные растворители, такие как спирты, и апротонные полярные растворители, такие как кетоны. В соответствии с общими правилами в данной области техники реакционная смесь может быть отфильтрована с целью удаления любых нежелательных примесей, неорганических солей и т.п. с последующим промыванием растворителем, использованным в реакции, или растворителем для кристаллизации. Полученный раствор может быть сконцентрирован с целью удаления избытка растворителя или газообразных компонентов. Если используется дистилляция, максимальное количество собранного дистиллята может изменяться в зависимости от технологических факторов, включая, например, размер реактора, интенсивность перемешивания и т.п. В соответствии с общими правилами в данной области техники перед заменой растворителя объем реакционной смеси в процессе дистилляции может быть уменьшен приблизительно до 1/10 от исходного объема. В ходе реакции из реакционной смеси могут быть отобраны пробы, которые анализируют с использованием стандартных методик с целью определения степени завершения реакции и выхода продукта (мас.%). При желании, для оптимизации концентрации реакционной смеси может быть добавлено дополнительное количество растворителя, использованного в реакции, или, наоборот, удалено некоторое количество данного растворителя. Предпочтительно, когда конечная концентрация составляет приблизительно 50% (по массе); при такой концентрации обычно образуется суспензия. В некоторых случаях предпочтительно добавлять растворители прямо в химический реактор без дистилляции реакционной смеси. Для этой цели предпочтительно выбрать растворитель, который может быть максимально включен в кристаллическую решетку, как это уже обсуждалось выше в связи с заменой растворителя. Хотя конечная концентрация может меняться в зависимости от желаемой чистоты,выхода и т.п., конечная концентрация свободного основания в растворе предпочтительно составляет от приблизительно 4 до приблизительно 7%. После добавления растворителя реакционную смесь можно перемешивать и одновременно нагревать. Например, реакционную смесь можно перемешивать в течение приблизительно 1 ч с нагреванием до приблизительно 70C. Реакционную смесь фильтруют предпочтительно в горячем виде и промывают либо растворителем, использованным в реакции, либо дополнительно добавленным растворителем, либо смесью этих растворителей. Для инициации кристаллизации в любой раствор для кристаллизации могут быть добавлены затравочные кристаллы. Различные формы, описанные в данном документе, могут быть идентифицированы с помощью различных аналитических методик, известных среднему специалисту в данной области техники. Такие методики включают рентгеновскую порошковую дифрактометрию (PXRD), дифференциальную сканирующую калориметрию (DSC) и/или термогравиметрический анализ (TGA), но не ограничены ими. Альтернативно, формы могут быть характеризованы и идентифицированы с использованием рентгеновской дифракции на монокристаллах, которая основана на измерении параметров элементарной ячейки монокристалла исследуемой формы при фиксированной температуре. Подробное описание элементарных ячеек приведено в Stout et al., Chapter 3, X-Ray Structure Determination: A Practical Guide, Macmillan Co.,New York (1968). Например, уникальное пространственное расположение атомов внутри кристаллической решетки может быть характеризовано экспериментально определенными фракционными координатами атомов. Другой способ характеризации кристаллической структуры, основанный на анализе данных рентгеновской порошковой дифрактометрии, заключается в сравнении наблюдаемого профиля дифракции с симулированным профилем, рассчитанным по данным структуры монокристалла. Результаты рентгеновской дифракции на порошке для исследуемой формы представлены в виде серии значений 2(обычно четырех или более). Для характеризации формы могут быть использованы другие методики, такие как твердотельный ядерный магнитный резонанс (SSNMR) спектроскопия, дифференциальная сканирующая калориметрия(DSC), термография и макроскопическое исследование кристаллической или аморфной морфологии. Для характеризации исследуемой формы также может быть использована комбинация данных методик. Среднему специалисту в данной области техники понятно, что рентгеновская дифрактограмма может быть получена с ошибкой измерения, которая зависит от используемых условий измерения. В частности, общеизвестно, что значения интенсивности на рентгеновской дифрактограмме могут меняться в зависимости от используемых условий измерения и от формы или морфологии кристалла. Кроме того,следует понимать, что относительные интенсивности также могут меняться в зависимости от условий проведения эксперимента, и, соответственно, не следует принимать во внимание точное значение интенсивности. Кроме того, ошибка измерения угла дифракции 2 на стандартной рентгеновской дифрактограмме обычно составляет приблизительно 0,2 или менее, предпочтительно приблизительно 0,1 (см. в данном описании ниже), и такую ошибку измерения следует принимать во внимание при рассмотрении указанных выше углов дифракции. Соответственно, должно быть понятно, что кристаллические формы согласно настоящему изобретению не ограничены кристаллическими формами, рентгеновские дифрактограммы которых полностью идентичны рентгеновским дифрактограммам, изображенным на фигурах,прилагаемых к данному описанию. Любые кристаллические формы, рентгеновские дифрактограммы которых, по существу, идентичны дифрактограммам, изображенным на прилагаемых фигурах, включены в объем настоящего изобретения. Выявление, по существу, идентичных рентгеновских дифрактограмм находится в компетенции среднего специалиста в данной области техники. СинтезN-1R,2S,5R)-5-(трет-Бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)2-оксопирролидин-1-ил)циклогексил)ацетамид может быть получен в соответствии со следующей схемой: Исходные вещества, используемые в способе согласно настоящему изобретению, имеются в продаже или могут быть легко получены средним специалистом в данной области техники. Подходящие растворители, температура, давление, исходные вещества, содержащие желаемые группы, и другие условия реакции могут быть легко выбраны средним специалистом в данной области техники. Данный способ может быть осуществлен в промышленном масштабе для получения больших количеств соединения,например, на промышленном оборудовании. Следующие примеры иллюстрируют варианты осуществления изобретения, относящиеся к предложенным в изобретении соединениям и исходным веществам, и не ограничивают объем данного изобретения. При необходимости реакции проводили в атмосфере сухого азота (или аргона). Для проведения безводных реакций использовали растворители DRISOLV (ЕМ). Для других реакций использовали химически чистые растворители или растворители стандарта "для ЖХВД". Если не указано иное, все реагенты, имеющиеся в продаже, использовали в том виде, в котором они были получены. ЖХ-МС-анализ проводили с использованием одноквадрупольной масс-спектрометрической гибридной системы Shimadzu HPLC/Waters ZQ. Данные для представляющих интерес пиков получали с использованием ионизации электрораспылением в режиме положительных ионов. Спектры ЯМР (ядерного магнитного резонанса) обычно получали на аппарате Bruker или JEOL при 400 и 600 МГц в указанных растворителях. Все химические сдвиги приведены в м.д. относительно тетраметилсилана, резонансная линия которого используется в качестве внутреннего стандарта. 1 Н ЯМР-спектры обычно приведены в следующем формате: химический сдвиг, мультиплетность (s = синглет, br s = уширенный синглет,- 15020486d = дублет, dd = дублет дублетов, t = триплет, q = квартет, sep = септет, m = мультиплет, арр = кажущийся), константы взаимодействия (Гц) и интегральная интенсивность. Стандартные аббревиатуры, используемые в данном описании, должны быть понятны специалисту в данной области техники. Краткая справка аббревиатур включает, без ограничения: Hg = давление в мм рт.ст.; нас. = насыщенный; ЖХВД = жидкостная хроматография высокого давления; АР = относительная площадь; KF = Karl-Fischer; RT = комнатная температура (если не указано иное, RT соответствует приблизительно 22C); ммоль = миллимоль; HRMS = масс-спектрометрия высокого разрешения; C = градусы Цельсия; кг = килограмм или килограммы; г = грамм или граммы; мг = миллиграмм или миллиграммы; л = литр или литры; мл = миллилитр или миллилитры; ч = час или часы; М = молярный; н. = нормальный; мин = минута или минуты; МГц = мегагерц; об./об. = отношение объем/объем;, , "R" и "S" представляют собой стереохимические обозначения, хорошо известные специалистам в данной области техники. Пример 1. Стадия 1. В круглодонную колбу объемом 3 л вносили семикарбазида гидрохлорид (100,0 г, 0,89 моль), пивалоилацетонитрил (112,2 г, 0,89 моль) и этанол (1 л) при 22-25C. После завершения добавления реакционную смесь охлаждали до 12-15C и добавляли безводный ацетат натрия (73,5 г, 0,89 моль). Добавление безводного ацетата натрия сопровождалось выделением тепла, температура смеси повышалась до 2225C. Реакционную смесь поддерживали при 22-25C и перемешивали в течение 60-90 мин. Затем реакционную смесь анализировали с использованием ЖХВД; полученные результаты указывали на то, что образование гидразонового промежуточного соединения было завершено. Стадия 2. Затем реакционную смесь нагревали до 68-72C и в течение 5-10 мин добавляли триметилортоформиат (475,7 г, 4,48 моль). Данную реакционную смесь оставляли охлаждаться до 40-45C и затем в течение 15-20 мин добавляли уксусную кислоту (53,8 г, 0,89 моль). После завершения добавления температуру смеси повышали до 702C в течение 20-25 мин. Когда температура установилась на заданном уровне, реакционную смесь перемешивали в течение 18-20 ч. По истечении данного периода реакционную смесь анализировали с использованием ЖХВД; полученные результаты указывали на то, что образование пиразоло[1,5-а][1,3,5]триазина было завершено. Стадия 3. Пиразоло[1,5-а][1,3,5]триазин, полученный на стадии 2 (пример 1), концентрировали при 50-55C при пониженном давлении (5-10 мм рт.ст. (666,5-1333 Па. К полученному остатку добавляли тетрагидрофуран (ТГФ, 2 л) и ацетон (2 л) и данную смесь перемешивали в течение 90 мин при 50-55C. Затем реакционную смесь фильтровали через воронку Бюхнера для удаления выпавшего в осадок хлорида натрия (NaCl) и ацетата натрия (NaOAc). Полученный фильтрат концентрировали досуха при 50-55C при пониженном давлении (400-450 мм рт.ст. (53320-59985 Па. Полученный остаток переносили в 2-метилортоформиат (2-метил-ТГФ, 450 мл) и данную смесь перемешивали при 22-25C в течение 2 ч. По истечении данного периода реакционную смесь фильтровали и затем промывали струей 2-метил-ТГФ(100 мл) и затем трет-бутилметиловым эфиром (МТВЕ, 200 мл). Полученный продукт сушили при 45-50C при пониженном давлении (400-450 мм рт.ст. (53320-59985 Па с выходом 7-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4(3H)-она (107,0 г, 62,1% (мас./мас.), чистота согласно ЖХВД: 99,2 АР при 220 нм). Стадии 1-3 повторяли в большем масштабе для получения 1 кг количества 1-трет-бутилпиразоло[1,5-а][1,3,5]триазин-4(3H)-она. Стадия 4. В футерованный стеклом химический реактор добавляли 7-трет-бутилпиразоло[1,5 а][1,3,5]триазин-4(3H)-он (1,0 кг, 5,2 моль), диметил 4-аминопиридин (1,27 кг, 10,4 моль), ацетонитрил(10 л) и диизопропилэтиламин (0,672 кг, 5,2 моль). Полученную суспензию перемешивали при температуре окружающей среды в атмосфере азота до образования прозрачного раствора в течение по меньшей мере 15 мин. Данный прозрачный раствор медленно добавляли во второй футерованный стеклом химический реактор, содержащий ацетонитрил (6 л) и оксихлорид фосфора (POCl3, 0,822 кг, 5,3 моль). После завершения добавления полученную смесь перемешивали при температуре ниже 35C в течение 2 ч. По истечении данного периода реакционную смесь анализировали с использованием ЖХВД; полученные результаты указывали на то, что реакция была завершена. Добавляли фенол (0,64 кг, 6,8 моль) и диизопропилэтиламин (0,87 кг) и полученную реакционную смесь перемешивали при температуре окружающей среды в течение по меньшей мере 1 ч. Затем реакционную смесь анализировали с использованием ЖХВД; полученные результаты указывали на то, что реакция была завершена. К реакционной смеси добавляли 2-метил-ТГФ (20 л) и затем воду (10 л). Органическую и водную фазы разделяли и водную фазу удаляли. Органическую фазу промывали раствором лимонной кислоты в солевом растворе (5 мас.%,10 л), полученные органическую и водную фазы разделяли и водную фазу снова удаляли. Промывку указанным раствором лимонной кислоты в солевом растворе повторяли еще два раза. После завершения промывки раствором лимонной кислоты в солевом растворе добавляли раствор гидроортофосфата калия(K2HPO4, 7,5 мас.%, 10 л). Органическую и водную фазы разделяли и водную фазу удаляли. Промывку указанным раствором K2HPO4 повторяли еще два раза до рН 8. Стадия 5. В щелочную органическую фазу, полученную на стадии 4 (пример 1), добавляли N-[2-(3-амино-2 оксопирролидин-1-ил)-5-трет-бутиламиноциклогексил]ацетамид (полученный в соответствии с методикой, аналогичной методике, описанной в публикации заявки на патент США 2008/0027083 А 1; 1,05 кг). После завершения добавления реакционную смесь перемешивали в течение 16 ч при температуре окружающей среды. По истечении данного периода реакционную смесь анализировали с использованием ЖХВД; полученные результаты указывали на то, что реакция была завершена. К реакционной смеси добавляли воду (20 л) и затем уксусную кислоту (НОАс, 0,406 кг) и полученные органический и водный слои разделяли. Водный слой экстрагировали 2-метил-ТГФ (10 л). Органические слои объединяли и добавляли НОАс (0,406 кг). Полученную смесь промывали водой (10 л) и полученные органический и водный слои разделяли. Водный слой снова экстрагировали 2-метил-ТГФ (10 л). Водные слои снова объединяли и добавляли дихлорметан (ДХМ, 15 л). рН смеси доводили до 13,0 путем добавления гидроксида натрия (NaOH, 10 н., 1,04 л). После завершения добавления органический и водный слои снова разделяли и оставляли обогащенный продуктом дихлорметановый слой. Водный слой дополнительно экстрагировали дихлорметаном (10 л). Дихлорметановые органические слои, содержащие продукт, объединяли и промывали водой (10 л). Полученный обогащенный продуктом дихлорметановый раствор концентрировали под вакуумом до минимального объема. Добавляли этилацетат (EtOAc), оставшийся ДХМ и воду отгоняли в течение длительного времени с получением суспензии (конечный объем 5 л). Добавляли МТВЕ (15 л) и полученную суспензию перемешивали в течение по меньшей мере 1 ч. Затем суспензию фильтровали и полученный влажный осадок на фильтре дополнительно промывали МТВЕ (5 л). Фильтрационный осадок сушили при 55C под вакуумом до LOD0,5% (по массе) с получением свободного основания указанного в заголовке соединения в виде аморфного вещества (0,9 кг, выход: 55 М%,чистота согласно ЖХВД: 99,5 АР). 1 Н ЯМР (600.13 МГц, ДМСО-d6):1.04 (s, 9H), 1.34 (s, 9H), 1.58 (m, 3H), 1.64 (m, 2H), 1.81 (s, 3 Н),2.05 (m, 1H), 2.12 (m, 1 Н), 2.36 (m, 1H), 2.93 (br s, 1H), 3.48 (m, 2 Н), 3.84 (m, 1 Н), 4.26 (br s, 1H), 4.86 (t,J=8.9 Гц, 1 Н), 6.39 (s, 1 Н), 8.07 (s, 1H), 8.94 (br s, 1H); 13 С ЯМР (125.8 МГц, ДМСО-d6):21.3, 23.3, 25.9, 29.3, 30.0, 32.2, 32.6, 35.5, 43.1, 46.5, 47.7, 50.7,51.7, 52.5, 92.3, 148.7, 148.8, 152.9, 167.3, 168.5, 171.2; Пример 5. Кристаллическая форма N-1 N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5 а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамида. Кристаллическую форму свободного основания N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-третбутилпиразоло[1,5-а][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамида, включая его соли и сольваты, получали и характеризовали, как описано ниже. Методики характеризации форм. Исследование монокристаллов. Исследования проводили на дифрактометре Bruker-Nonius серии CAD4 (Bruker AXS, Inc., 5465 EastCheryl Parkway Madison, WI 53711 USA). Параметры элементарной ячейки определяли путем обработки методом наименьших квадратов экспериментальных данных для 25 рефлексов, соответствующих большим углам, которые регистрировали, задавая необходимые установочные параметры дифрактометра. Интенсивность рефлексов измеряли, используя радиацию с длиной волны =1.5418(CuK) при постоянной температуре образца и методику вариабельного сканирования -2; и корректировали только на поляризационные факторы Лоренца. Фоновые импульсы подсчитывали при предельных углах сканирования в течение периода времени, равного половине времени сканирования. Альтернативно, исследование монокристаллов проводили с использованием системы Bruker-Nonius Kappa CCD 2000, используя радиацию с длиной волны =1.5418(CuK). Индексирование и процесс измерения интенсивности рефлексов проводили под управлением пакета программ HKL2000 (Otwinowski, Z. et al. in Macromolecularprogram suite (Collect Data collection and processing user interface: Collect: Data collection software, R. Hooft,Nonius B.V., 1998). Альтернативно, исследование монокристаллов проводили с использованием системыBruker AXS АРЕХ 2 CCD, используя радиацию с длиной волны =1.5418(CuK). Индексирование и процесс измерения интенсивности рефлексов проводили под управлением пакета программ АРЕХ 2 из коллекции программ (АРЕХ 2 Data collection and processing user interface: APEX2 User Manual, vol. 27;(Oxford Cryosystems Cryostream cooler: Cosier, J. et al., J. Appl. Cryst., 19:105 (1986. Для решения структур использовали прямые методы, структуры уточняли с учетом наблюдаемых рефлексов, используя для этого либо незначительно модифицированный пакет программ SDP (SDP,Structure Determination Package, Enraf-Nonius, Bohemia NY 11716; используемые в программе SDP коэффициенты рассеяния, включая f' и f, взяты из International Tables for Crystallography, Kynoch Press,Birmingham, England, Vol. IV, Tables 2.2A и 2.3.1 (1974, либо кристаллографический пакет MAXUS(координаты и температурные факторы) уточняли путем минимизации суммы квадратов элементов полной матрицы. Функция, значение которой подвергается минимизации в итерациях, имеет следующий вид: где w представляет собой подходящую весовую функцию ошибки наблюдаемых интенсивностей. В итерационных циклах использовали алгоритм разностного отображения. Атомам водорода приписывали идеальные координаты и изотропные температурные факторы, параметры атомов водорода не варьировали. Исследование дифракции рентгеновских лучей на порошке (PXRD). Данные PXRD получали с использованием Bruker C2 GADDS. Параметры рентгеновской радиации:CuK (40 кВ, 50 мА). Расстояние от образца до детектора составляло 15 см. Образцы порошков в запаянных стеклянных капиллярах диаметром 1 мм или менее вращали в течение всего периода регистрации дифракции. Дифракцию регистрировали в интервале значений угла 2 от 3 до 35, время экспозиции образца составляло по меньшей мере 2000 с. Полученные двумерные дифракционные линии интегрировали с получением традиционных одномерных PXRD-дифрактограмм с шагом угла 2, равным 0,02, в диапазоне значений 2 от 3 до 35. В держатель образца для регистрации дифракции рентгеновских лучей на порошке (PXRD) (Philips) помещали приблизительно 200 мг образца. Образец переносили в Philips MPD(многоцелевой дифрактометр) (45 кВ, 40 мА, CuK). Дифракцию регистрировали при комнатной температуре в интервале значений угла 2 от 2 до 32 (режим непрерывного сканирования, скорость сканирования: 0,03/с, автоматические щели расходимости и автоматические антирассеивающие щели, приемная щель: 0,2 мм, вращение образца: включено). Дифференциальная сканирующая калориметрия (DSC).DSC-эксперименты проводили с использованием ТА INSTRUMENTS (модель Q1000 или 2920). Образец (приблизительно 2-6 мг) взвешивали на алюминиевой чашке с точностью до сотой доли миллиграмма и переносили в DSC. Калориметр продували газообразным азотом (50 мл/мин). Данные регистрировали в интервале от комнатной температуры до 300C (скорость повышения температуры составляла 10C/мин). Полученный график содержал эндотермические пики, направленные вниз. Термогравиметрический анализ (TGA). Термогравиметрический анализ выполняли с использованием ТА INSTRUMENTS (модель Q500 или 2950). Образец (приблизительно 10-30 мг) помещали на предварительно тарированную платиновую чашку. Массу образца определяли с точностью до тысячной доли миллиграмма. Печь продували газообразным азотом (100 мл/мин). Данные регистрировали в интервале от комнатной температуры до 300C(скорость повышения температуры составляла 10C/мин). Получение и анализ кристаллических форм. Параметры элементарной ячейки и другие характеристики соединения, описанного в примере,представлены в табл. 1. Параметры элементарной ячейки получены путем кристаллографического рентгеновского анализа монокристалла. Подробное описание расчета параметров элементарной ячейки можно найти в Stout et al. X-Ray Structure Determination: a Practical Guide, Chapter 3, Macmillan (1968). В заключение на фиг. 1 представлена PXRD-дифрактограмма соединения, описанного в примере 5. На фиг. 2 и 3 представлены результаты DSC- и TGA-анализа соответственно соединения, описанного в примере 5. Получение кристаллической формы, XRD-, DSC- и TGA-анализ. Соединение, описанное в примере 5, форма N-1, свободное основание. Форму N-1 N-1R,2S,5R)-5-(трет-бутиламино)-2-S)-3-(7-трет-бутилпиразоло[1,5-а][1,3,5]триазин 4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамида получали путем кристаллизации из этилацетата и метил-трет-бутилового эфира (МТВЕ). Форма N-1 представляет собой чистую форму (отсутствуют молекулы воды или растворителя)N-1 характеризуется XRD-дифрактограммой, которая совпадает с симулированной дифрактограммой,рассчитанной по данным структуры монокристалла. Форма N-1 характеризуется DSC-термограммой,согласно которой температура эндотермического перехода (плавления/разложения) равна приблизительно 205C. Форма N-1 характеризуется кривой термогравиметрического анализа (TGA), согласно которой уменьшение массы происходит при температуре приблизительно 210C. Переменные, использованные в табл. 1, определены следующим образом: Т = температура по 100-градусной шкале для кристаллографических данных (RT - комнатная температура, равная приблизительно 22C).Z' = количество молекул лекарства на асимметрическую ячейку.Vm = V (объем элементарной ячейки)/Z (количество молекул лекарства на ячейку).dcalc = рассчитанная плотность кристалла. Сравнительные фармакологические характеристики Ниже приведен анализ фармакологических характеристик соединения, описанного в примере 1, и сравнение фармакологических характеристик соединения, описанного в примере 1, и соединений, раскрытых в WO 2005/021500 A1, WO 2008/014381 А 1 и WO 2008/014360 А 1. Связывание с мононуклеарными клетками периферической крови человека. См. также Yoshimura et al., J. Immunol., 145:292 (1990). Анализ связывания рецептора CCR-2 мононуклеарных клеток периферической крови человека (hPBMC) выполняли с использованием в качестве меченого лиганда 125I-MCP-1 человека. hPBMC выделяли из Leukopak, полученного из крови человека(Biological Specialty Inc.), с использованием стандартного протокола с фиколл-гипаком (MediatechCELLGRO). Выделенные hPBMC промывали и разбавляли буфером для связывания (RPMI-1640, 0,1% БСА (бычий сывороточный альбумин), 20 мМ HEPES (N-2-гидроксиэтилпиперазин-N'-2 этансульфоновая кислота), рН 7,4) до концентрации 1107 /мл. 125I-MCP-1 (NEN/Perkin Elmer) разбавляли в буфере для связывания до концентрации 0,45 нМ. Исследуемое соединение разбавляли в буфере для связывания до концентрации, в три раза превышающей концентрацию, используемую для анализа связывания. Анализ связывания выполняли с использованием 96-луночного планшет-фильтра (Millipore). Общее количество связанного 125I-MCP-1 оценивали следующим образом. В каждую реакционную смесь(конечный объем смеси составлял 150 мкл) добавляли 5105 клеток, 0,15 нМ 125I-MCP-1 и соединение до конечной концентрации 0-100 нМ. Планшет инкубировали при комнатной температуре в течение 30 мин,затем три раза промывали буфером (RPMI-1640, 0,1% БСА, 0,4 М NaCl, 20 мМ HEPES, рН 7,4), используя для фильтрации вакуумный коллектор (Millipore). Затем планшет промывали и сушили на воздухе в течение 60 мин при комнатной температуре. Затем в каждую лунку добавляли 25 мкл Microscint 20. Планшет запечатывали и в течение 1 мин подсчитали радиоактивность на счетчике Trilux. Неспецифическое связывание определяли в присутствии 300 нМ немеченного MCP-1 (PeproTech Inc.). Специфическое связывание 125I-MCP-1 вычисляли как разницу между общим и неспецифическим связыванием. Все измерения выполняли с двукратным повторением. Значение ИК 50 определяли как концентрацию конкурирующего соединения, требуемую для уменьшения специфического связывания на 50%. Анализ связывания рецептора CCR-5 Т-клеток выполняли в соответствии с методикой, аналогичной методике для анализа связывания рецептора CCR-2 клеток hPBMC, за исключением того, что использовали Т-клетки периферической крови человека в качестве источника рецепторов CCR-5 (см. ниже) и 125 Выделение Т-клеток периферической крови человека. В недавно опубликованном исследовании показано, что уровень экспрессии рецепторов CCR-5 на Т-клетках у разных индивидуумов значительно отличается (Desmetz, С. et al., "The strength of the chemotactic response to a CCR-5 binding chemokine is determined by the level of cell surface CCR-5 density",Immunology, 119(4):551-561 (2006. Поэтому среди доноров крови предварительно отбирали индивидуумов с высоким уровнем экспрессии рецептора CCR-5 на Т-клетках. Сначала из цельной крови выделяли клетки hPBMC с использованием стандартного протокола с фиколл-гипаком. Для измерения уровня экспрессии CCR-5 Т-клетки окрашивали с использованием антитела против CCR-5 плюс антитела противCD4 или антитела против CD8 и затем проводили проточный цитометрический анализ. У доноров, в крови которых 5% Т-клеток периферической крови (CD4+ и CD8+) экспрессировали CCR-5, были взяты повторные пробы крови, из которых выделяли РВМС и затем Т-клетки, используя стандартную методику Е-розеткообразования, которая основана на уникальной способности Т-клеток связываться с эритроцитами (RBC) барана.CCR-2-хемотаксис. Анализ хемотаксиса, обусловленного рецептором CCR-2 человека, выполняли с использованием линии моноцитов человека ТНР-1. Сначала клетки ТНР-1 метили флуоресцентным красителемCalcein-AM в среде RPMI-1640 (рН 7,4), не содержащей феноловый красный и БСА, при 37C в течение 30 мин, осторожно перемешивая через каждые 15 мин. Полученные меченые клетки промывали и ресуспендировали до концентрации 1105/мл в буфере для анализа хемотаксиса (не содержащая феноловый красный среда RPMI-1640, 0,1% БСА, рН 7,4). Исследуемое соединение разбавляли в буфере для анализа хемотаксиса до конечной концентрации в диапазоне от 0,01 нМ до 1 мкМ. Лиганд MCP-1 (PeproTechInc.) разбавляли до концентрации 20 нМ в буфере для анализа хемотаксиса. Для выполнения анализа смешивали равные объемы исследуемого соединения из приготовленных разбавлений и меченых клеток ТНР-1 (смесь 1) и равные объемы исследуемого соединения из приготовленных разбавлений и разбавленного лиганда MCP-1 (смесь 2). Обе смеси независимо инкубировали при 37C в течение 10 мин и затем осторожно перемешивали. MCP-1-индуцированный хемотаксис анализировали в планшете для анализа хемотаксиса (Becton Dickinson), для этого добавляли 50 мкл смеси 1 в верхнюю камеру лунки и 225 мкл смеси 2 в нижнюю камеру лунки. Планшет закрывали крышкой и инкубировали при 37C в течение 30 мин. Через 30 мин планшет сканировали с помощью CYTOFLUOR. Все измерения выполняли с двукратным повторением. Для определения соотношения сигнал/фон в верхнюю камеру лунки добавляли только меченые клетки ТНР-1 (50 мкл, 5104/лунку), а в нижнюю камеру добавляли только лигандMCP-1 (225 мкл, конечная концентрация 10 нМ). Определяли зависимость величины ингибирования от концентрации исследуемого соединения, где величину ингибирования выражали в процентах относительно MCP-1-контроля, не содержащего исследуемое соединение. Значение ИК 50 определяли как концентрацию исследуемого соединения, требуемую для 50%-ного ингибирования клеточного хемотаксиса.CCR-5-хемотаксис. Анализ хемотаксиса выполняли в соответствии с методикой, аналогичной методике, описанной выше, за исключением того, что использовали Т-клетки периферической крови в качестве клеток, экспрессирующих CCR-5, и MIP-1 в качестве лиганда (50 нМ, PeproTech Inc.). Поток через hERG-канал. Клетки HEK-293, стабильно экспрессирующие hERG-каналы, выращивали в инкубаторе (37C, 5% СО 2) в модифицированной по способу Дульбекко среде Игла, содержащей в качестве добавок 10% эмбриональной телячьей сыворотки (Sigma), заменимые аминокислоты, L-глутамин (2 мМ) и G418(500 мкг/мл). Для извлечения клеток из колбы использовали буфер для диссоциации клеток, полученные клетки засевали в темные прозрачные 384-луночные планшеты CORNING, покрытые поли-D-лизином,по 2104 клеток на лунку (20 мкл) в 10% сывороточную среду и инкубировали при 37C в атмосфере СО 2(5%) до образования монослоя клеток (15-24 ч). Готовили исходный 2 мМ раствор красителя ВТС-АМ (Molecular Probes, Eugene, OR) в 100% ДМСО, в день анализа данный раствор смешивали в соотношении 1:1 с 10% (мас./об.) раствором плюроника (Pluronic F-127, pluronic acid) в ДМСО. Затем краситель разбавляли во внешнем буфере ЕР для анализа hERG (140 мМ NaCl, 4,0 мМ KCl, 1,8 мМ CaCl2, 1,0 мМ MgCl2, 10 мМ HEPES, рН 7,3 и 10 мМ глюкоза; все компоненты буфера получены от Sigma Chemical). Данную смесь (30 мкл), содержащую краситель ВТС, добавляли к клеткам (конечная концентрация красителя: 2,5 мкМ). Клетки инкубировали при 21C в течение 45 мин. Исследуемое соединение разбавляли в 60 мкл ДМСО до концентрации 10 мМ. Затем данный исходный раствор соединения последовательно разбавляли с помощью ДМСО в соотношении 1:2, используя для этого колонки 1-10 и 11-20 384-луночного планшета. С помощью системы Velocity 11 BioCel в планшеты для анализа вносили пробы объемом 2,5 мкл из планшета, содержащего последовательные разбавления соединения в ДМСО. Перед сканированием на FLIPR (флуориметрическом планшетном анализаторе) в планшеты добавляли водную среду (48 мкл буфера ЕР) и оставляли на 30-45 мин. Разведенное в водном буфере соединение (10 мкл) добавляли к клеткам, нагруженным красителем, таким об- 21020486 разом, получали десять проб с концентрацией соединения в диапазоне от 80 мкМ до 0,156 нМ; каждую пробу повторяли на трех планшетах. Конечная концентрация ДМСО в пробах составляла 1%. Пробы для данных планшетов готовили и разбавляли с помощью манипулятора для жидкостей CyBio. Клетки, нагруженные красителем, анализировали на флуориметре FLIPR 384 (Molecular Devices,Sunnyvale, СА), в котором для возбуждения флуоресценции красителя используется аргоновый лазерhERG-каналов стимулировали путем добавления буфера ЕР (20 мкл/лунку), содержащего 66 мМ K2SO4 и 1,3 мМ TI2SO4 (Sigma/Aldrich). Данные с каждого планшета регистрировали каждую секунду в течение первых 12 с и затем добавляли Tl+-содержащий стимулирующий буфер. Данные продолжали регистрировать каждую секунду в течение следующих 48 с, а затем каждые 3 с в течение 2 мин. Динамический интервал анализа определяли, используя лунки с негативным контролем и лунки с позитивным контролем. В анализируемом планшете лунки с позитивным контролем (колонки 21 и 22) определяли максимальную активацию hERG-канала (отсутствовало тестируемое соединение), а лунки с негативным контролем (колонки 23 и 24) определяли 100%-ное ингибирование. Лунки с негативным контролем содержали стандартный ингибитор hERG, дофетилид (Ficker et al., 1998) или Е-4031, в концентрации 400 нМ. Исходные данные для каждой пробы сначала корректировали по соотношению клетка/сигнал, негативному контролю (фону) и затем нормализовали по позитивному контролю (максимальной активации), используя онлайн-версию программного обеспечения для FLIPR. Затем строили кривые зависимости hERG Tl+-потока от концентрации исследуемого соединения методом подгонки с помощью программы Excel Fit (ID Business Solutions Limited, Surrey, UK), используя логистическое уравнение Y=A+B-A)/1+C/X)D для маносайтовой модели связывания, где А=максимальное ингибирование. Данные, полученные для исследуемого соединения, анализировали путем вычисления максимальной амплитуды изменения флуоресценции, обусловленного Tl+-потоком, при заданных условиях. Активность соединения (значения ИК 50) вычисляли как среднее значение, полученное на основе данных анализа трех лунок. Анализ связывания натриевого канала по сайту 2. См. также Catterall, W.A. et al. J. Biol. Chem., 256:8922 (1981). Стандартный буфер для связывания содержал 50 мМ HEPES, 50 мМ Трис-HCl, рН 7,4, 130 мМ хлорид холина, 5,4 мМ KCl, 0,8 мМ MgCl2,5,5 мМ глюкозу, 40 нг/мл LqT. Реакцию связывания инициировали путем добавления к реакционной смеси, содержащей 5 нМ [3 Н]-батрахотоксин в стандартном буфере для связывания и исследуемое соединение в заданной концентрации, синаптосом (полученных из головного мозга крыс Wistar). Затем пробы перемешивали и инкубировали при 37C в течение 60 мин. Реакцию останавливали путем добавления охлажденного до 0C буфера для промывания, содержащего 50 мМ HEPES, 50 мМ Трис-HCl, рН 7,4, 1,8 мМ CaCl2, 0,8 мМ MgCl2 и бычий сывороточный альбумин (1 мг/мл). Затем синаптосомы сразу собирали на стекловолоконные фильтры и 3 раза промывали буфером для промывания. Радиоактивность задержанного на фильтрах [3 Н]-батрахотоксина измеряли с использованием жидкостных сцинтилляционных спектрометров. Параллельный анализ проницаемости через искусственную мембрану. Параллельный анализ проницаемости через искусственную мембрану (РАМРА) выполняли с использованием специально приготовленной комбинации липидов на основе лецитина, называемой липидом желудочно-кишечного тракта (ЖКТ). Данный ЖКТ-липид используют для формирования мембраны в сэндвич-планшете, конструкция которого аналогична конструкции планшета, используемого для Caco2-анализа. Исследования с использованием известных стандартных соединений с пассивным всасыванием в организме человека показали, что ЖКТ-липид по своему составу и характеристикам очень похож наin vivo-мембраны. РАМРА широко используется в качестве in vitro модели для скрининга проницаемости разрабатываемых соединений. Скорость прохождения соединений через РАМРА-мембрану используют для определения коэффициента проницаемости (Pc), который относится к пассивной проницаемости соединения in vivo. Коэффициент проницаемости (Pc) соединения определяли в рН-зависимых условиях при апикальном и базолатеральном рН, равным 7,4. Все эксперименты выполняли с тройным повторением. Исходный раствор исследуемого соединения (10 мМ, в 100% ДМСО) разбавляли в соотношении 1:100 буфером для донорных лунок (рН 7,4, pION кат.110151) с получением 100 мкМ раствора в 1% ДМСО, который использовали для дальнейшего анализа. Раствор соединения в буфере для донорных лунок переносили в планшет Whatman UNIFILTER, фильтровали и затем 200 мкл соединения вносили в донорную лунку планшета для анализа (pION кат.110163). РАМРА-мембрану формировали путем нанесения пипеткой 4 мкл раствора липида (pION кат.110169) на фильтр-планшет (VWR кат.13503). Затем мембрану покрывали буфером для акцепторных лунок (200 мкл, рН 7,4, pION кат.110139). Донорную и акцепторную половины планшета для РАМРА-анализа объединяли и инкубировали при комнатной температуре в течение 4 ч. Затем данный планшет разбирали и пробы переносили в спектрофотометрические планшеты (VWR кат.655801) (150 мкл/лунку). Донорные, акцепторные, эталонные и контрольные планшеты считывали на планшет-ридере SPECTRAMAX UV. Данные автоматически вводились в программу pION, с помощью которой анализировали спектры и вычисляли значения Pc. Пэтч-кламп hERG-канала. Для прямого измерения тока через hERG-каналы клеток HEK-293, стабильно экспрессирующих клонированную -субъединицу калиевого канала hERG, использовали метод фиксации потенциала в конфигурации "целая клетка" (whole-cell patch-clamp). Соединение анализировали в водном буфере (рН 7,4) при комнатной температуре. Прикладывали циклические тестовые импульсы с частотой 0,05 Гц, в которых за 2 с напряжение изменялось от -80 мВ (исходный потенциал) до 20 мВ, и после тестовых импульсов генерировали хвостовые токи путем ступенчатого понижения напряжения до -65 мВ. Эффекты соединений рассчитывали, измеряя ингибирование пикового значения хвостового тока. Пэтч-кламп натриевого канала. Для прямого измерения тока, обусловленного поступлением ионов натрия внутрь клеток HEK-293,экспрессирующих ген SCN5A, кодирующий натриевый канал сердечной мышцы человека, использовали метод фиксации потенциала в конфигурации "целая клетка". Соединение тестировали в водном буфере,не содержащем белка. Для определения равновесного ингибирования каждые 5 с генерировали ток через натриевые каналы, используя следующий протокол изменения напряжения: клетки выдерживали при напряжении -90 мВ и затем в течение 60 мс напряжение ступенчато повышали до -20 мВ. Эффекты рассчитывали, измеряя ингибирование пикового значения тока во время тестового импульса, напряжение которого соответствовало -20 мВ. Скорость ингибирования оценивали путем стимуляции импульсами с частотой 1 и 4 Гц. Фармакокинетика одноразовой дозы у крыс. Для фармакокинетического анализа использовали самцов крыс Sprague-Dawley массой 250-300 г. Крысам не давали корм в течение ночи перед пероральным (PO) введением дозы и предоставляли доступ к корму через 4 ч после введения дозы. Из яремной вены отбирали пробы крови (0,3 мл) в пробирки,содержащие K2 ЭДТА, и путем центрифугирования при 4C (1500-2000g) получали образцы плазмы. В исследовании биодоступности при пероральном введении 2 группы животных (N=2-3 в группе) получали тестируемое соединение либо путем внутривенной (в/в) инфузии в яремную вену в течение 10 мин, либо с помощью зонда, введенного через рот. Через 0,17 (только для в/в введения), 0,25, 0,5, 0,75, 1, 2, 4, 6, 8 и 24 ч после введения дозы отбирали пробы крови. Образцы плазмы, полученные путем центрифугирования при 4C (1500-2000g), хранили при -20C до проведения ЖХ-МС/МС-анализа. Фармакокинетика одноразовой дозы у обезьян. Для фармакокинетического анализа исследуемых соединений использовали самцов яванской макаки в перекрестном исследовании. Обезьянам не давали корм в течение ночи перед пероральным (РО) введением дозы и предоставляли доступ к корму через 4 ч после введения дозы. Группа из 1-3 животных(3-5 кг) получала исследуемое соединение либо путем внутривенной (в/в) инфузии в бедренную вену в течение 10 мин, либо с помощью зонда, введенного через рот, каждому следующему анализу предшествовал однонедельный период выведения. Через 0,17 (только для в/в введения), 0,25, 0,5, 0,75, 1, 2, 4, 6, 8 и 24 ч после введения дозы из бедренной артерии отбирали пробы крови (0,3 мл) и путем центрифугирования при 4C (1500-2000g) получали образцы плазмы. Образцы плазму хранили при -20C до проведения ЖХ-МС/МС-анализа. Анализ результатов фармакокинетических исследований. Фармакокинетические характеристики соединений получали с использованием некомпартментного анализа зависимости концентрации в плазме от времени (программа KINETICA, Версия 4.2, InnaPhaseCorporation, Philadelphia, PA). Пиковую концентрацию (Cmax) и время, соответствующее Cmax, регистрировали непосредственно в ходе экспериментальных наблюдений. Вычисляли площадь под кривой в диапазоне от начала отсчета до времени отбора последней пробы (AUC(0-Т, используя комбинацию линейного и log (логарифмического) трапецеидального суммирования. Полный клиренс плазмы (CLTp),равновесный объем распределения (Vss), кажущийся период полувыведения (T1/2) и среднее время удержания (MRT) определяли после в/в введения. Определение T1/2 проводили с использованием минимум 3 временных точек с количественно измеримыми концентрациями. Абсолютную пероральную биодоступность (F) определяли как отношение нормализованных по дозе значений AUC для пероральной и внутривенной доз.CCR-2-опосредованная мобилизация кальция. Анализ опосредованного рецептором CCR-2 человека потока кальция в клетку проводили с использованием клеточной линии моноцитов человека ТНР-1. Сначала клетки ТНР-1 нагружали флуорофором,для этого клетки ресуспендировали в PBS (фосфатно-солевом буфере), забуференном глюкозой и HEPES(рН 7,4), содержащем Fluo-3 (4 мкМ, Molecular Probes) и пробенецид (1,25 мМ), и затем инкубировали в течение 60 мин при 37C. Затем клетки один раз промывали для удаления избытка Fluo-3, ресуспендировали в буфере для промывания (содержащем среду RPMI без фенолового красного) с пробенецидомFLIPR-1 (Molecular Devices), оснащенный аргон-ионным лазером для возбуждения в клетках флуорес- 23020486 ценции и роботом, с помощью которого добавляли исследуемые соединения и человеческий MCP-1 в процессе мониторинга изменения флуоресценции. В лунки добавляли растворы исследуемого соединения с концентрацией соединения в диапазоне от 0 до 100 нМ или чистый буфер, планшеты центрифугировали и инкубировали в течение 10 мин. Затем добавляли рекомбинантный человеческий MCP-1(PeproTech Inc.) до конечной концентрации, равной 10 нМ. Осуществляли мониторинг изменения флуоресценции и автоматически вычисляли пиковое отклонение от исходного уровня. Все измерения выполняли с двукратным повторением. Определяли зависимость величины ингибирования от концентрации исследуемого соединения, где величину ингибирования выражали в процентах относительно MCP-1 контроля, не содержащего исследуемое соединение.CCR-5-опосредованная мобилизация кальция. Анализ мобилизации кальция выполняли в соответствии с методикой, аналогичной описанной выше методике анализа CCR-2-опосредованной мобилизации кальция, за исключением того, что использовали MIP-1 (50 нМ), в качестве лиганда и линию клеток HT1080/CCR-5, у которых экспрессия эндогенного CCR-5 увеличена путем использования технологии случайной активации экспрессии гена (RAGE).MCP-1-зависимое связывание [35S]-GTP-S с рецептором CCR-2 определяли с использованием мембран, полученных из клеток человека линии HT1080, у которых экспрессия эндогенного CCR-2 увеличена путем RAGE (Athersys). Каждая реакционная смесь (200 мкл) содержала 20 мМ Na-HEPES, 10 мМMgCl2, 50 мМ NaCl, 0,1% БСА (Sigma), 1% ДМСО и 10 мМ GTP (рН 7,4). Значение ЕС 50 для MCP-1 зависимого связывания [35S]-GTP-S определяли путем изменения концентрации MCP-1 в диапазоне от 1 пМ до 1 мкМ. Реакционные смеси инкубировали в течение 90 мин при комнатной температуре и комплексы [35S]-GTP-S/Gi собирали на 96-луночном фильтр-планшете Millipore MAFC. Ингибирование исследуемыми соединениями MCP-1-зависимого связывания [35S]-GTP-S с CCR-2-мембранами определяли в одинаковых условиях при концентрации MCP-1, равной 1 нМ. Данные анализировали с использованием программы ligand binding из пакета программ Graphpad Prism 4.CCR-5-опосредованный обмен GTP-S. Анализ обмена GTP-S выполняли в соответствии с методикой, аналогичной описанной выше методике анализа CCR-2-опосредованного обмена GTP-S, за исключением того, что использовалиMIP-1/LD78, в качестве лиганда и линию клеток CCR-5/HT1080. Использование MIP-1/LD78 в качестве лиганда рецептора CCR-5 вызвано тем, что данный лиганд обеспечивает большее соотношение сигнал/фон, чем MIP-1.CCR-2-опосредованноеповышение уровня экспрессии интегрина (CD11b) в цельной крови. Анализ CCR-2-опосредованного повышения уровня экспрессии CD11b проводили с использованием цельной крови человека. Цельную кровь (100 мкл) предварительно инкубировали с различными концентрациями соединения, описанного в примере 1, при 37C в течение 10 мин. Затем в каждую реакционную смесь, за исключением нестимулированного контроля, добавляли рекомбинантный человеческийMCP-1 (10 мкл из 100 нМ раствора) до конечной концентрации 10 нМ. Данные реакционные смеси инкубировали в течение 30 мин при 37C. После инкубации добавляли 1 мл охлажденного до 0C буфера дляFACS (PBS с 10% FBS), пробы центрифугировали при 1500 об/мин в течение 5 мин и ресуспендировали в 50 мкл FACS-буфера. Затем клетки инкубировали на льду в темноте в течение 20 мин с 20 мкл раствора антител против CD14-FITC и против CD11b-PE и затем в каждую реакционную смесь добавляли 1 мл 1xFACS-лизирующего раствора (Becton Dickinson). Затем данные пробы инкубировали на льду в темноте в течение 30 мин. После фиксации и лизиса эритроцитов отставшие клетки центрифугировали и ресуспендировали в 200 мкл FACS-лизирующего раствора. Данные пробы анализировали методом проточной цитометрии (проточный цитометр FACSCalibur) в течение 1 ч после окрашивания. Сбор данных и их анализ проводили с использованием программы CellQuestPro. Для анализа популяции моноцитовCD14high CD11b+ использовали стратегию последовательного гейтирования. В процессе цитометрииCD11b-клетки определяли как объекты, имеющие среднюю интенсивность флуоресценции (MFI).CCR-5-опосредованное повышение уровня экспрессии CD11b в цельной крови. Анализ цельной крови выполняли в соответствии с методикой, аналогичной описанной выше методике анализа CCR-2-опосредованного повышения уровня экспрессии CD11b, за исключением того, что в качестве лиганда использовали MIP-1 (50 нМ). Ниже приведены результаты сравнения соединений (см. WO 2008/014381 A1, WO 2008/014360 A1 иWO 2008/014361 A1). В результате сравнения найдена неожиданная комбинация равномощной двойной ингибирующей активности в отношении рецепторов CCR-2 и CCR-5 и желательных фармакологических характеристик. Неожиданно было найдено, что соединение, описанное в примере 1 настоящего изобретения, не обладает преимущественной ингибирующей активностью в отношении рецептора CCR-2 или CCR-5, а является равномощным двойным антагонистом, согласно данным анализа связывания с рецепторамиCCR-2 и CCR-5, и имеет благоприятные фармакологические характеристики. См. данные, представленные в табл. 2-5. Например, в табл. 5 представлены данные, свидетельствующие о том, что соединение,описанное в примере 1, обладает равномощной ингибирующей активностью в отношении рецепторовCCR-2 и CCR-5, тогда как соединения, описанные в примерах 1 WO 2008/014381 и WO 2008/014360, обладают ингибирующей активностью преимущественно в отношении CCR-2. Полезность С использованием экспериментальных подходов, известных специалистам в данной области техники, показано, что соединения, описанные в примерах, являются модуляторами активности хемокиновых рецепторов. В данном разделе описаны такие экспериментальные подходы и указаны ссылки на соответствующую литературу. Дополнительные экспериментальные подходы описаны выше в разделе "Сравнительные фармакологические характеристики". Результаты данных исследований показывают, что соединения, описанные в примерах, обладают антагонистической активностью в отношении функции MCP-1,поэтому можно ожидать, что данные соединения могут быть использованы для лечения заболеваний человека, ассоциированных с хемокинами и их рецепторами. В качестве критерия активности в данных исследованиях использовано значение ИК 50, соединение считается активным, если данное значение 30 мкМ, конкретное значение ИК 50 зависит от условий конкретного анализа. Антагонистическая активность в отношении MCP-1-индуцированного притока кальция (Sullivan etal., Methods Mol. Biol., 114:125-133 (1999. Согласно результатам анализа, представленного в данном описании, по меньшей мере одно из соединений, описанных в примерах, обладает антагонистической активностью в отношенииMCP-1-индуцированного притока кальция. Мобилизацию кальция измеряли с использованием флуоресцентного Са 2+-индикаторного красителя содержащем 0,1% бычьего сывороточного альбумина, 20 мМ буфер HEPES, 5 мМ глюкозу, 1% эмбриональной телячьей сыворотки, 4 мкМ Fluo-3 AM и 2,5 мМ пробенецид. Для анализа притока кальция могут быть использованы моноциты человека, выделенные в соответствии с методикой, описанной вWeiner et al., J. Immunol. Methods, 36:89-97 (1980), или клеточные линии, экспрессирующие эндогенный рецептор CCR-2, такие как THP-1 и MonoMac-6. Затем клетки промывали три раза фосфатно-солевым буфером, содержащим 0,1% бычьего сывороточного альбумина, 20 мМ HEPES, 5 мМ глюкозу и 2,5 мМ пробенецид. Клетки ресуспендировали в фосфатно-солевом буфере, содержащем 0,5% бычьего сывороточного альбумина, 20 мМ HEPES и 2,5 мМ пробенецид, до конечной концентрации 2-4106 клеток/мл. Клетки высевали в 96-луночные микропланшеты с черными стенками (100 мкл/лунку) и данные планшеты центрифугировали при 200g в течение 5 мин. В лунки добавляли соединение в различных концентрациях (50 мкл/лунку) и через 5 мин добавляли MCP-1 (50 мкл/лунку) до конечной концентрации 10 нМ. Для регистрации мобилизации кальция использовали флуориметрический планшетный анализатор. В клеточном монослое возбуждали флуоресценцию с использованием аргонового лазера (488 нМ) и в течение 3 мин измеряли ассоциированную с клетками флуоресценцию (с интервалом 1 с в течение первых 90 с и с интервалом 10 с в течение следующих 90 с). Данные получали в условных единицах флуоресценции и изменение флуоресценции в каждой лунке определяли как разницу максимальной и минимальной флуоресценции. Ингибирование, вызываемое соединением, вычисляли относительно флуоресценции в лунках, содержащих только MCP-1. Рецепторы хемокинов млекопитающих являются мишенью для подавления или стимулирования функции иммунных клеток у млекопитающих, например у человека. Соединения, которые ингибируют или стимулируют функцию хемокиновых рецепторов могут быть использованы, в частности, для модулирования функции иммунных клеток с терапевтической целью. Соответственно, настоящее изобретение относится к соединениям, которые можно применять для предупреждения и/или лечения различных воспалительных, инфекционных и иммунорегуляторных расстройств и заболеваний, включая астму и аллергические заболевания, инфекции, вызванные патогенными микроорганизмами (которые, по определению, включают вирусные инфекции), а также аутоиммунные патологии, такие как ревматоидный артрит и атеросклероз. Например, соединение согласно настоящему изобретению, которое ингибирует одну или более чем одну функцию хемокинового рецептора млекопитающих (например, хемокинового рецептора человека),может быть введено с целью ингибирования (т.е. ослабления или предупреждения) воспалительного или инфекционного заболевания. В результате происходит ингибирование одного или более чем одного воспалительного процесса, такого как эмиграция лейкоцитов, адгезия, хемотаксис, экзоцитоз (например,ферментов, гистамина) или высвобождение медиатора воспаления. Аналогично соединение согласно настоящему изобретению, которое стимулирует одну или более чем одну функцию хемокинового рецептора млекопитающих (например, хемокинового рецептора человека), может быть введено с целью стимуляции (индицирования или усиления) иммунной или воспалительной реакции, такой как эмиграция лейкоцитов, адгезия, хемотаксис, экзоцитоз (например, ферментов, гистамина) или высвобождение медиаторов воспаления, приводящей к стимуляции воспалительных процессов, имеющих положительный эффект. Например, эозинофилы могут быть рекрутированы на борьбу с паразитарными заболеваниями. Кроме того, можно рассматривать возможность лечения вышеупомянутых воспалительных, аллергических и аутоиммунных заболеваний с использованием соединения согласно настоящему изобретению, которое стимулирует одну или более чем одну функцию хемокинового рецептора млекопитающих, если предположить возможность доставки такого соединения в количестве, достаточном для того, чтобы вызвать уменьшение экспрессии рецептора на клетках путем индукции интернализации хемокиновых рецепторов, или возможность доставки соединения способом, который приводит к неправильной миграции клеток. Кроме приматов, таких как человек, способ согласно настоящему изобретению можно применять для лечения других млекопитающих. Например, млекопитающие, для лечения которых можно применять способ согласно настоящему изобретению, включают, без ограничения, коров, овец, коз, лошадей,собак, кошек, морских свинок, крыс или других представителей видов крупного рогатого скота, баранов,лошадиных, собачьих, кошачьих, грызунов или мышиных. Однако данный способ также можно применять для лечения других видов, например видов птиц. Субъектом лечения в описанных выше способах является млекопитающее, особь мужского или женского пола, на состояние здоровья которого модуляция активности хемокиновых рецепторов может оказать благоприятное действие. Термин "модуляция" в контексте данного описания включает антагонизм, агонизм, частичный антагонизм и/или частичный агонизм. Функциональный анализ с использованием флуориметрического планшетного анализатора(FLIPR). В 384-луночные планшеты (черные с прозрачным дном, BIOCOAT PDL, Beckton Dickinson) высевали клетки HT1080 (клон 3559.1.6) (10000 клеток/лунку, 30 мкл) и затем добавляли флуоресцентный краситель Fluo-4 AM (30 мкл/лунку), приготовленный путем растворения 1 мг Fluo-4 AM в 440 мкл
МПК / Метки
МПК: A61K 31/53, C07D 487/04, A61P 37/00
Метки: качестве, способ, кристаллические, двойного, хемокиновых, активности, получения, рецепторов, формы, модулятора, n-((1r,2s,5r)-5-(трет-бутиламино)-2-((s)-3-(7-трет-бутилпиразоло[1,5-a][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамид
Код ссылки
<a href="https://eas.patents.su/30-20486-n-1r2s5r-5-tret-butilamino-2-s-3-7-tret-butilpirazolo15-a135triazin-4-ilamino-2-oksopirrolidin-1-ilciklogeksilacetamid-v-kachestve-dvojjnogo-modulyatora-aktivnosti-hemokinovyh-rece.html" rel="bookmark" title="База патентов Евразийского Союза">N-((1r,2s,5r)-5-(трет-бутиламино)-2-((s)-3-(7-трет-бутилпиразоло[1,5-a][1,3,5]триазин-4-иламино)-2-оксопирролидин-1-ил)циклогексил)ацетамид в качестве двойного модулятора активности хемокиновых рецепторов, его кристаллические формы и способ получения</a>
Предыдущий патент: N-ацилированные октасахариды, активирующие рецепторы fgf, их получение и применение в терапии
Следующий патент: Новые вторичные производные 8-оксихинолин-7-карбоксамида
Случайный патент: Способ получения низших олефинов с использованием катализатора на основе zsm-5












