Стимуляторы секреции инсулина – производные пиридопиразинонов, способы их получения и их применение для лечения диабета
Номер патента: 20372
Опубликовано: 30.10.2014
Авторы: Шарон Кристине, Кергоат Мишлине, Валёр Эрик, Боттон Жерар, Эльбаваб Самер
Формула / Реферат
1. Соединение общей формулы (I)
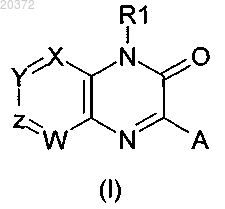
где один атом из X, Y, Z, W означает атом азота, а другие означают атом углерода, замещенный заместителем, выбранным из водорода, Т;
А означает фенил, гетероарил, выбранный из фуранила, тиенила, пиридила; каждая из этих групп может быть необязательно замещена одним или несколькими заместителями, выбранными из Т;
R1 означает алкил, алкилоксиалкил, циклоалкил, циклоалкилалкил, R3P4N-алкил; каждая из этих групп может быть необязательно замещена одним или несколькими заместителями, выбранными из Т;
Т означает гидрокси, галоген, трифторметил, карбокси, алкил;
где алкил содержит от 1 до 20 атомов углерода, циклоалкил означает насыщенное карбоциклическое кольцо, включающее от 3 до 10 атомов углерода;
R3 и R4 независимо выбраны из низшего алкила, включающего от 1 до 4 атомов углерода;
а также его фармацевтически приемлемые соли.
2. Соединение по п.1, где R1 означает этил, изопропил, бутил, 2,2-дифторэтил, 2-метоксиэтил, циклопропил, циклопропилметил, циклобутил.
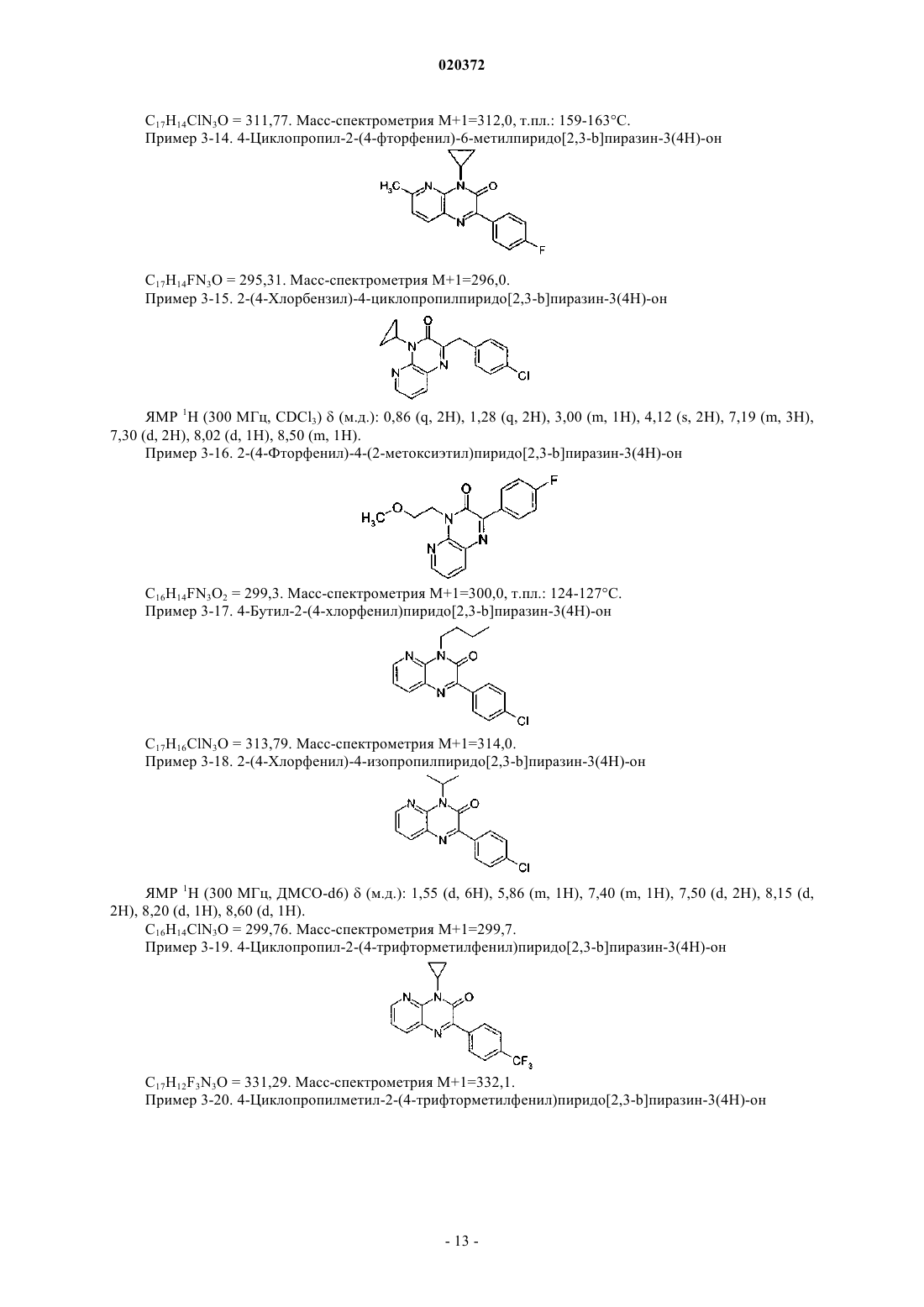
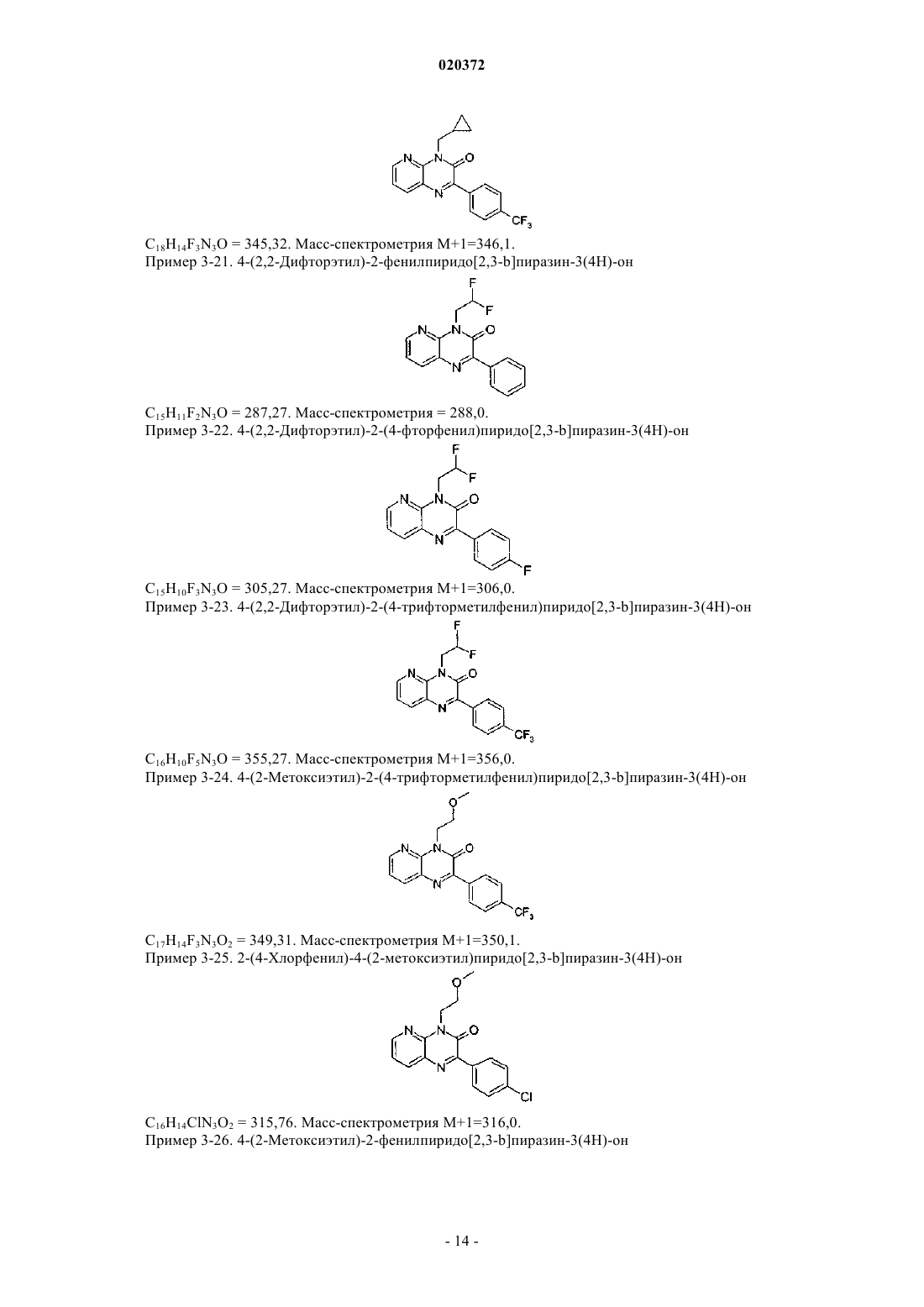
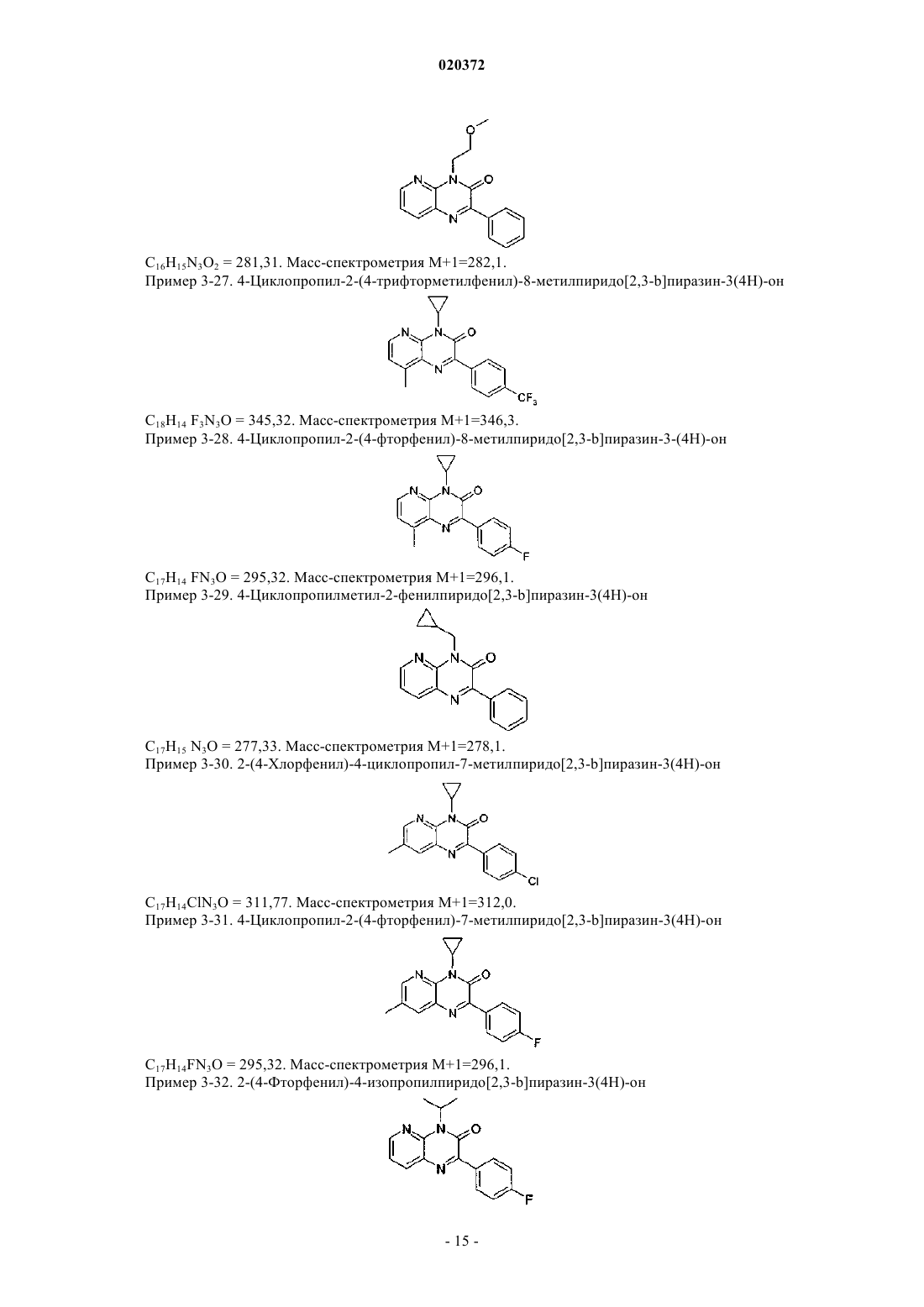
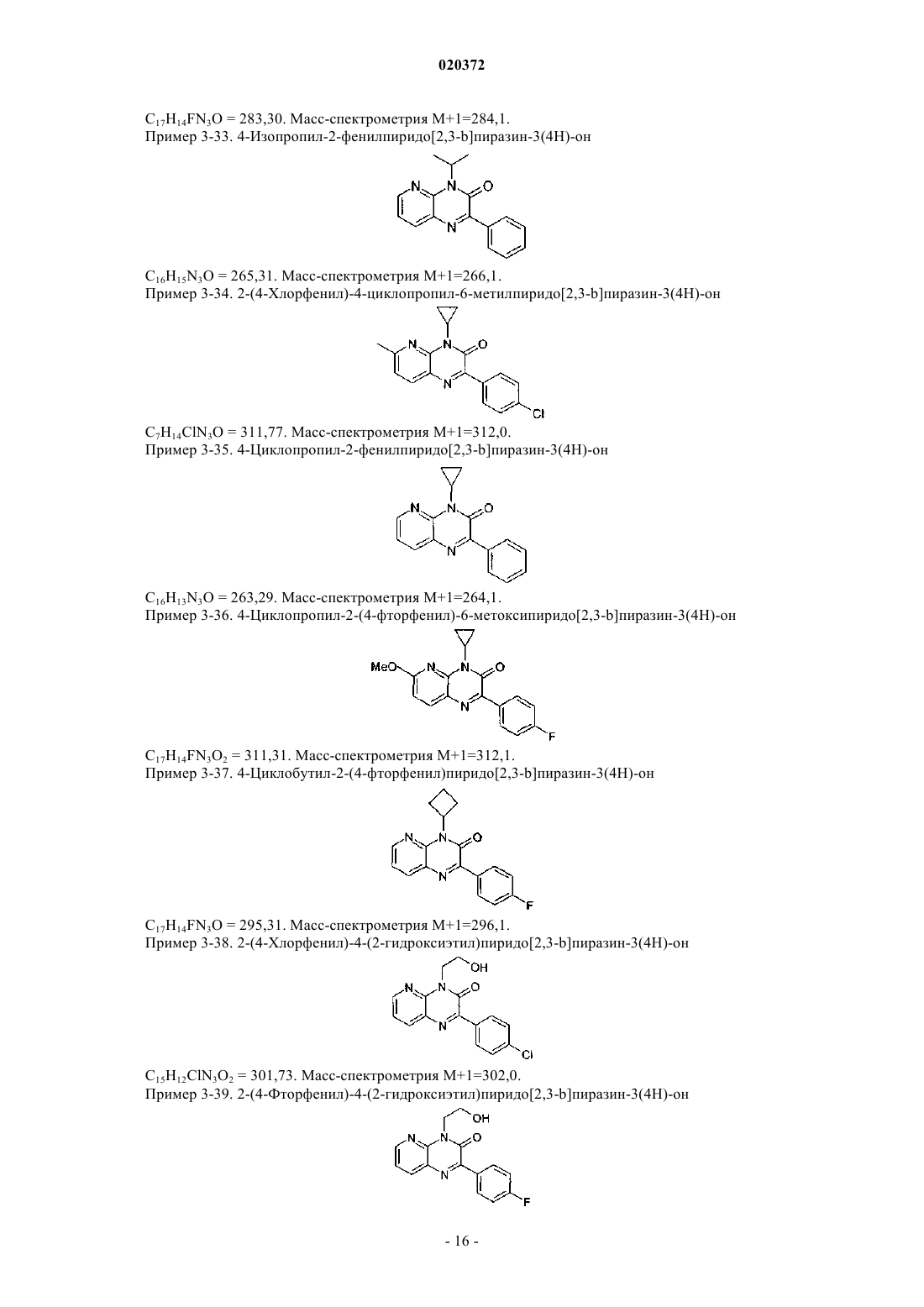
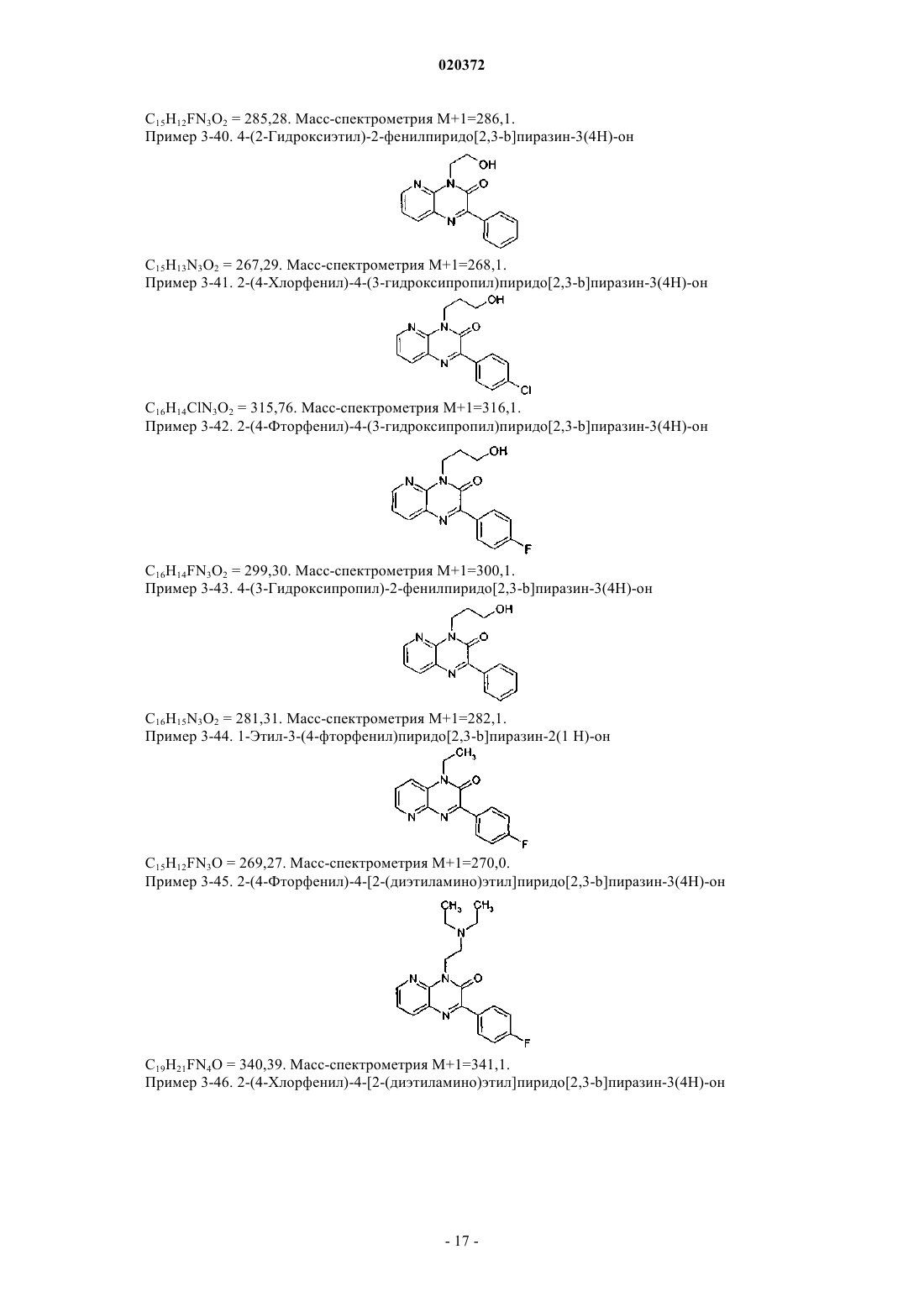
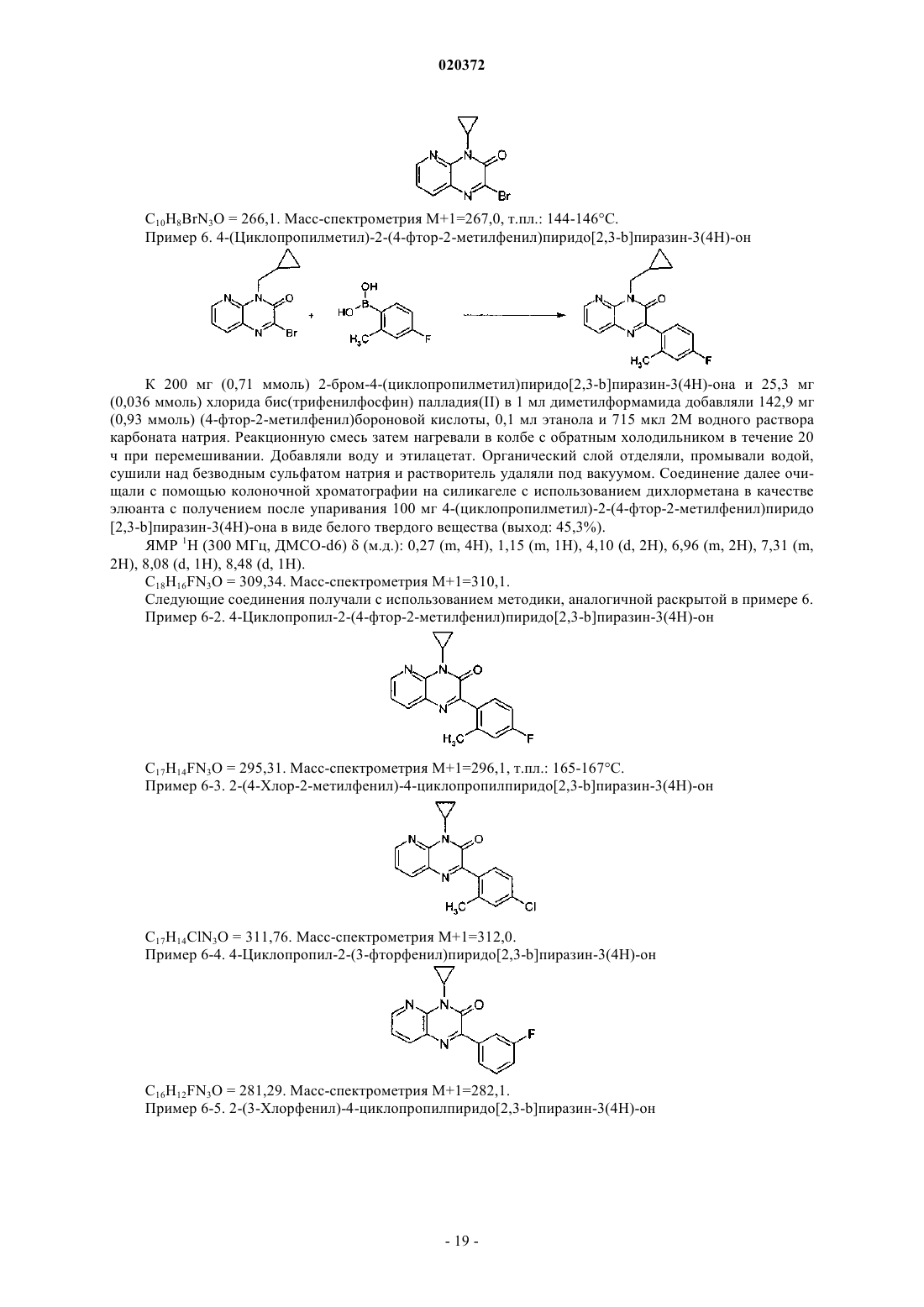
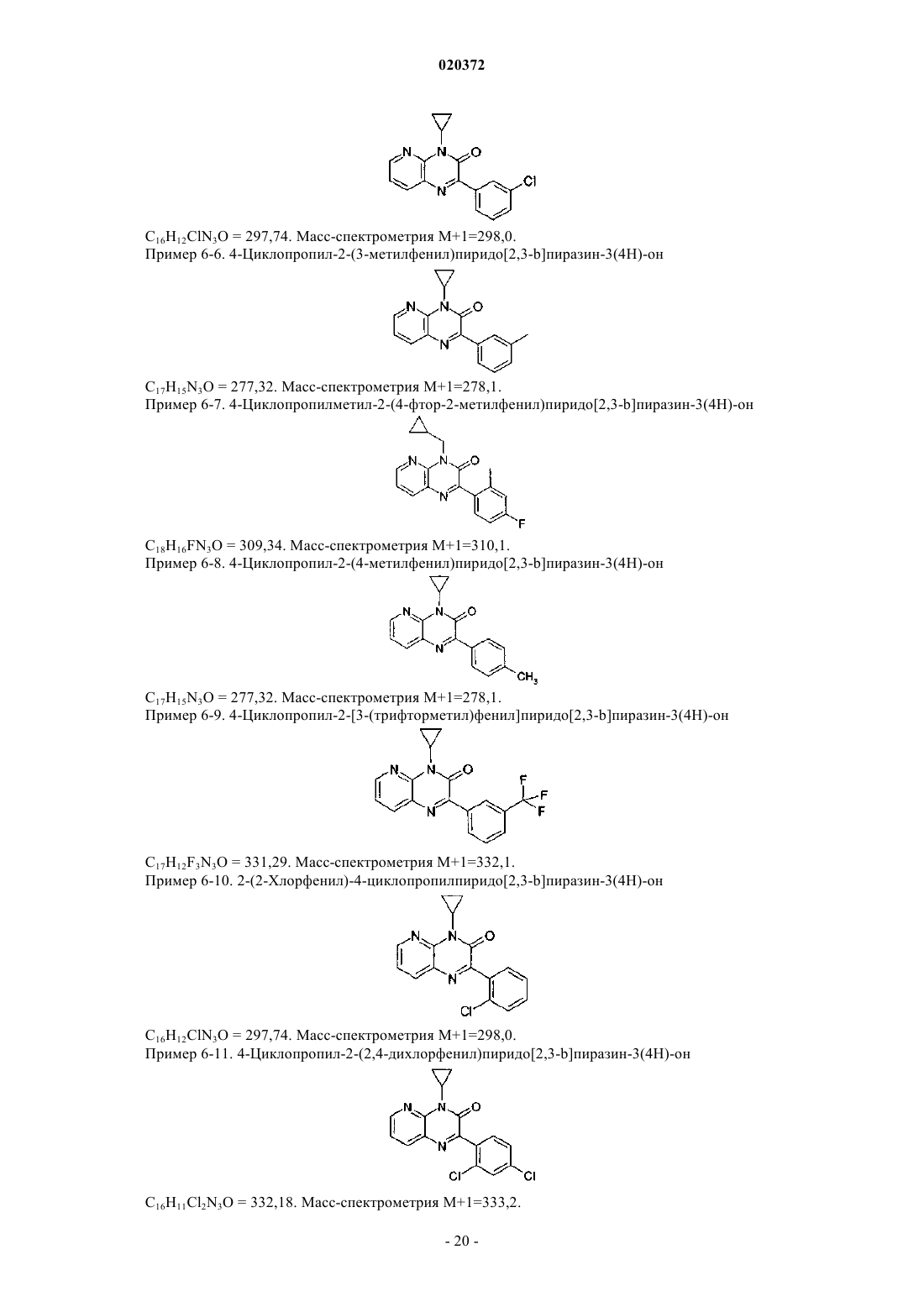
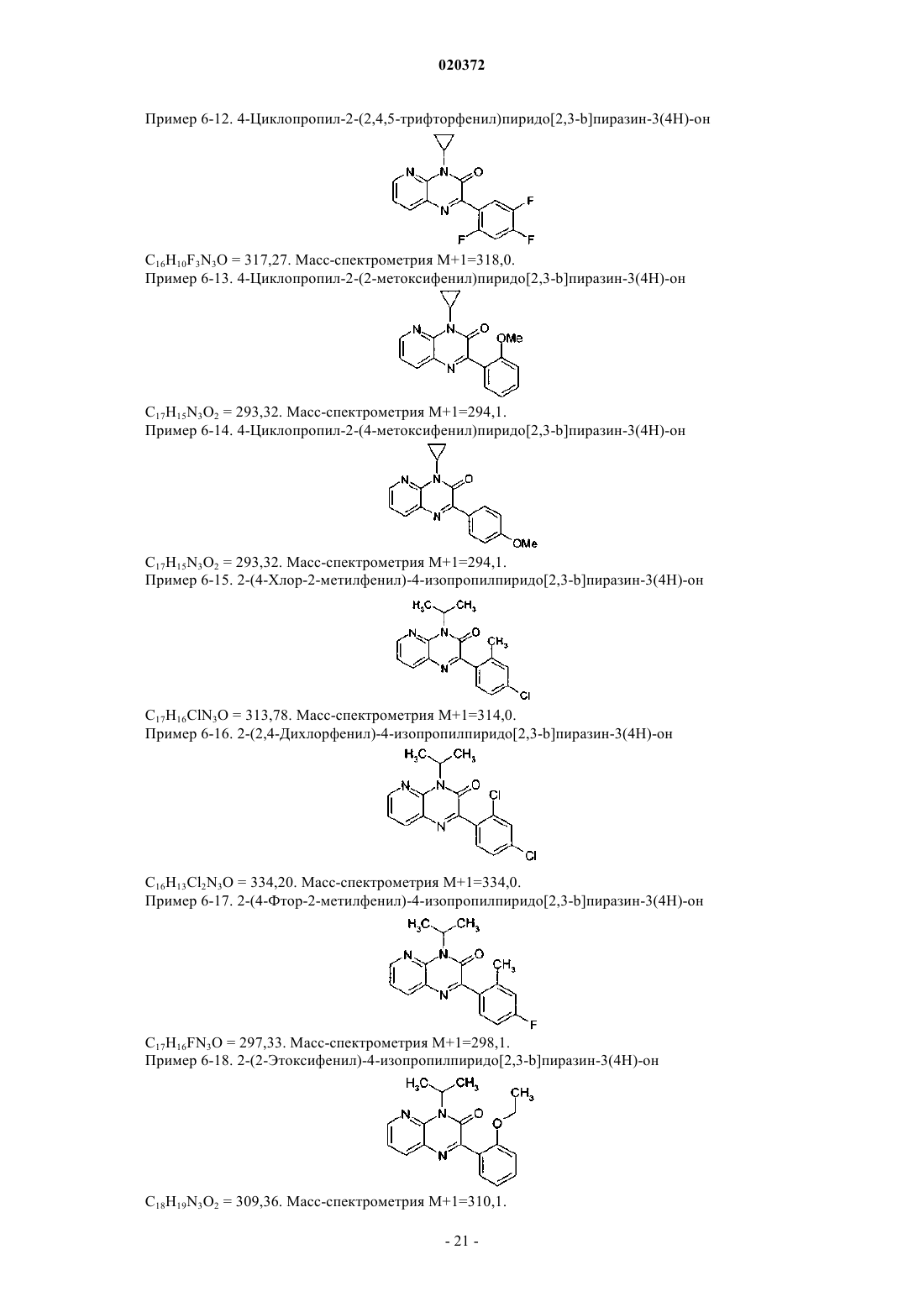
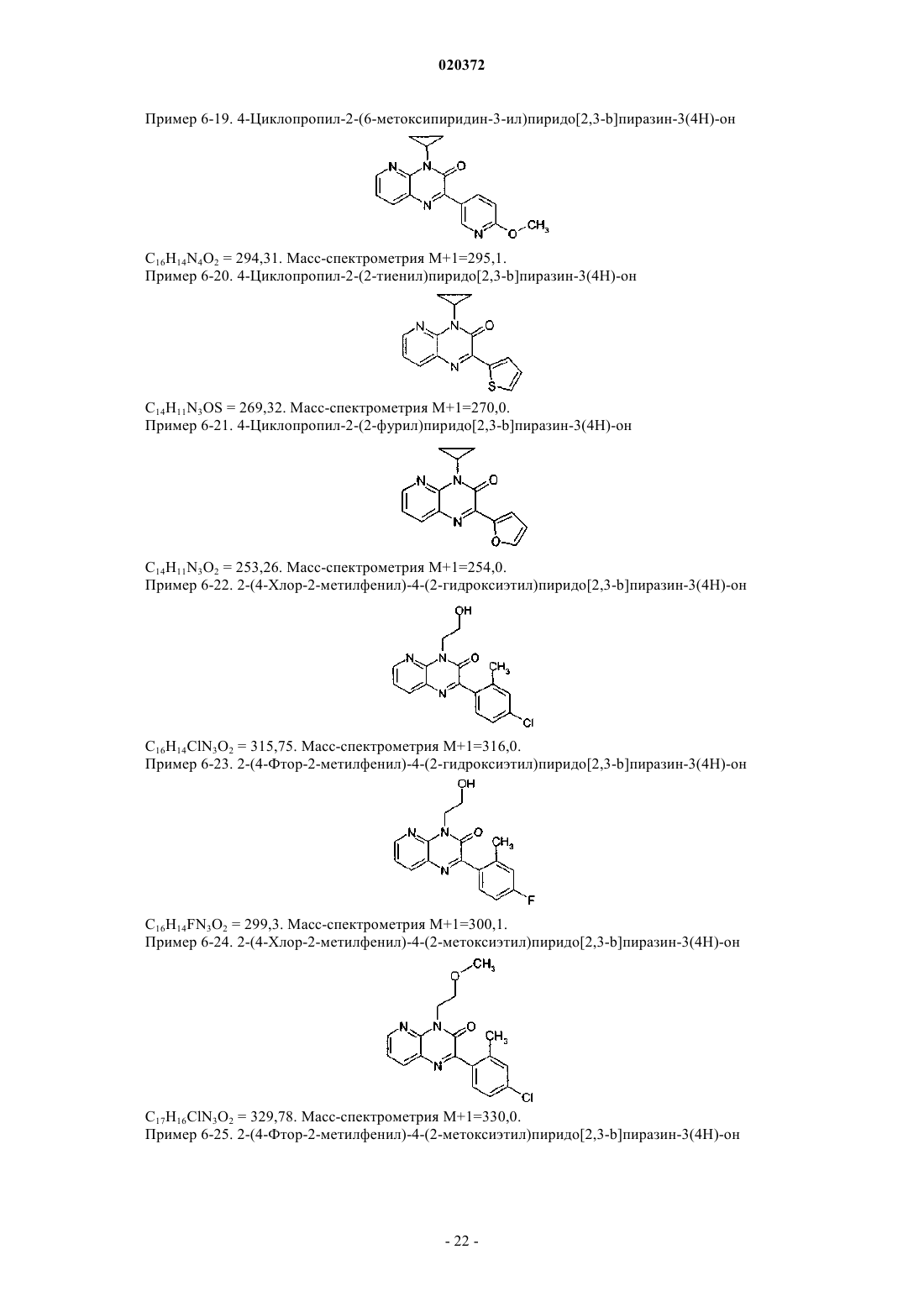
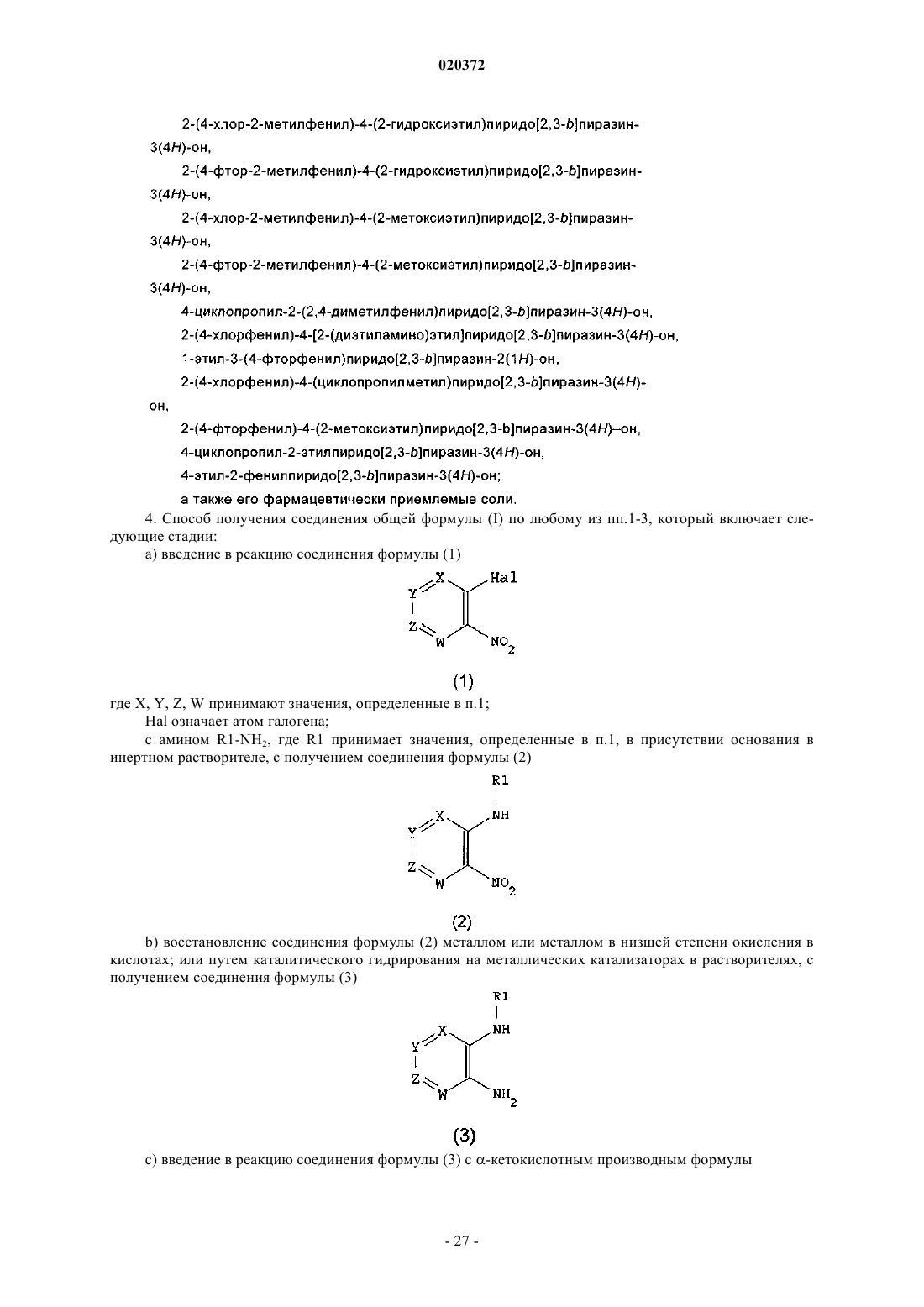
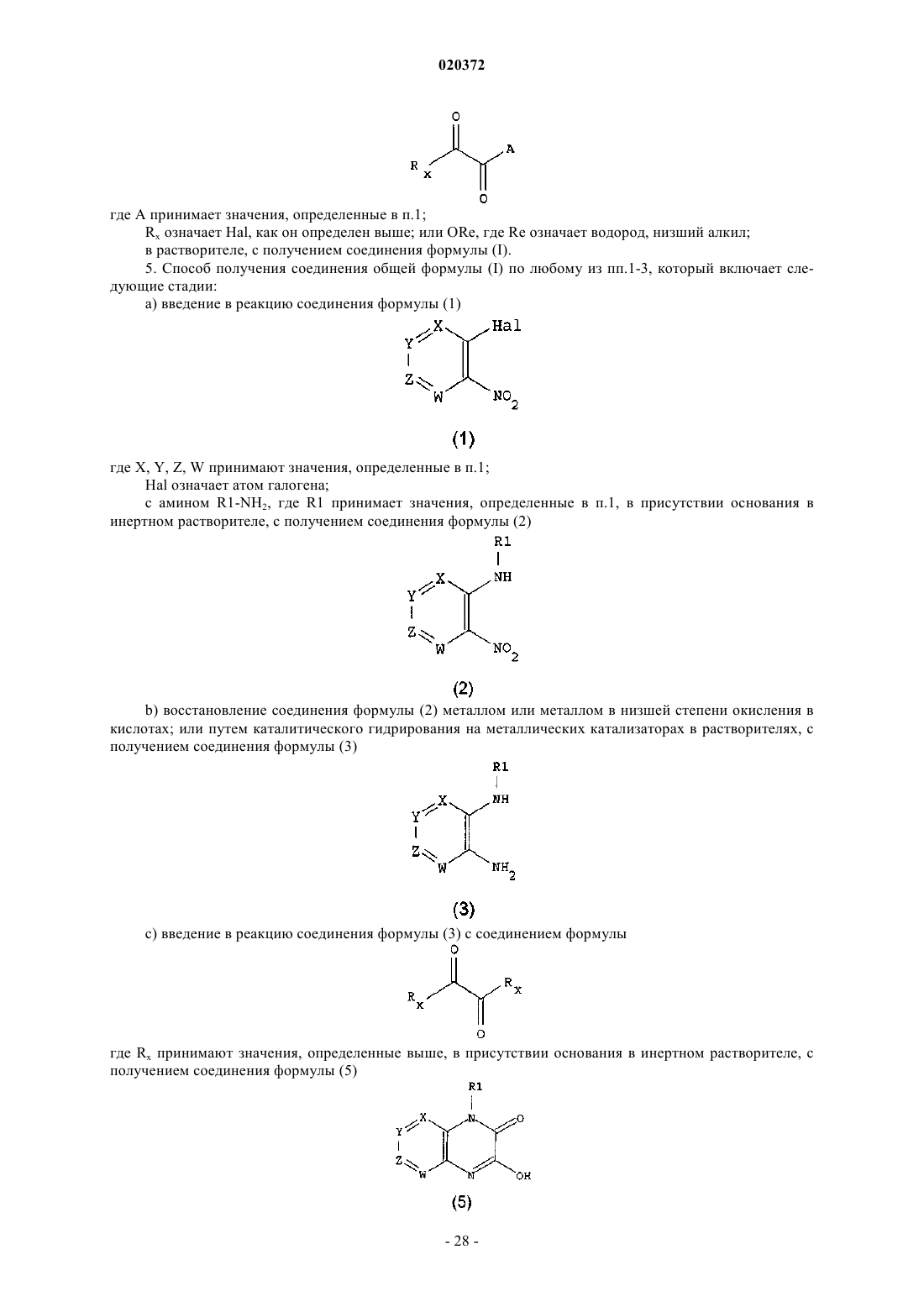
3. Соединение по любому из предыдущих пунктов, выбранное из следующих соединений:




4. Способ получения соединения общей формулы (I) по любому из пп.1-3, который включает следующие стадии:
а) введение в реакцию соединения формулы (1)
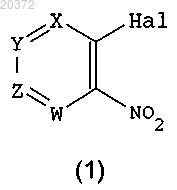
где X, Y, Z, W принимают значения, определенные в п.1;
Hal означает атом галогена;
с амином R1-NH2, где R1 принимает значения, определенные в п.1, в присутствии основания в инертном растворителе, с получением соединения формулы (2)
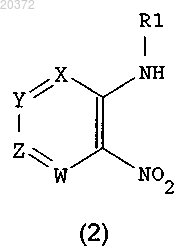
b) восстановление соединения формулы (2) металлом или металлом в низшей степени окисления в кислотах; или путем каталитического гидрирования на металлических катализаторах в растворителях, с получением соединения формулы (3)
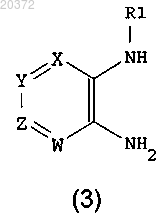
с) введение в реакцию соединения формулы (3) с α-кетокислотным производным формулы
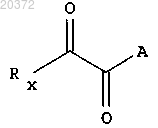
где А принимает значения, определенные в п.1;
Rx означает Hal, как он определен выше; или ORe, где Re означает водород, низший алкил;
в растворителе, с получением соединения формулы (I).
5. Способ получения соединения общей формулы (I) по любому из пп.1-3, который включает следующие стадии:
а) введение в реакцию соединения формулы (1)
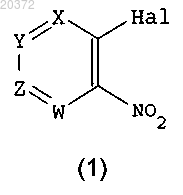
где X, Y, Z, W принимают значения, определенные в п.1;
Hal означает атом галогена;
с амином R1-NH2, где R1 принимает значения, определенные в п.1, в присутствии основания в инертном растворителе, с получением соединения формулы (2)
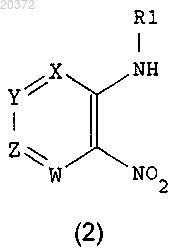
b) восстановление соединения формулы (2) металлом или металлом в низшей степени окисления в кислотах; или путем каталитического гидрирования на металлических катализаторах в растворителях, с получением соединения формулы (3)
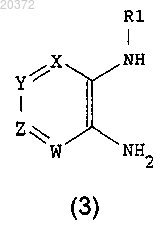
с) введение в реакцию соединения формулы (3) с соединением формулы
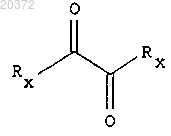
где Rx принимают значения, определенные выше, в присутствии основания в инертном растворителе, с получением соединения формулы (5)
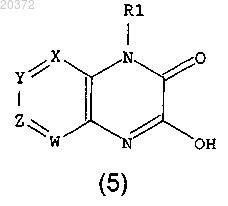
d) введение в реакцию соединения формулы (5) с бромирующим агентом в инертном растворителе, с получением соединения формулы (6)
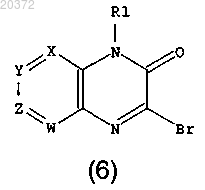
е) введение в реакцию соединения формулы (6) с производными бороновой кислоты или их сложными эфирами, в присутствии основания и катализатора в инертном растворителе, с получением соединения формулы (I).
6. Применение соединения общей формулы (I), где X, Y, Z, W, А и R1 принимают значения, определенные в любом из пп.1-3, а также его фармацевтически приемлемых солей для предупреждения и/или лечения патологий, связанных с гипергликемией.
7. Применение по п.6 для индуцирования секреции инсулина в ответ на концентрацию глюкозы.
8. Применение по п.6 или 7 для предупреждения и/или лечения диабета, диабета II типа, патологий, связанных с нарушениями обмена веществ, гиперхолестеринемии, гиперлипидемии, которые усиливаются гиперинсулинемией и гипергликемией; дислипидемии, ожирения, сердечно-сосудистых заболеваний, включая атеросклероз, ишемию миокарда, и заболеваний, выбранных из связанных с диабетом микро- и макрососудистых осложнений, где осложнения включают артериальную гипертензию, атеросклероз, воспалительные процессы, микроангиопатию, макроангиопатию, ретинопатию и невропатию; а также для снижения гипергликемии.
9. Фармацевтическая композиция, содержащая соединение общей формулы (I) по пп.1-3 и/или его фармацевтически приемлемую соль и один или несколько фармацевтически приемлемых носителей, адъювантов, разбавителей или эксципиентов.
Текст
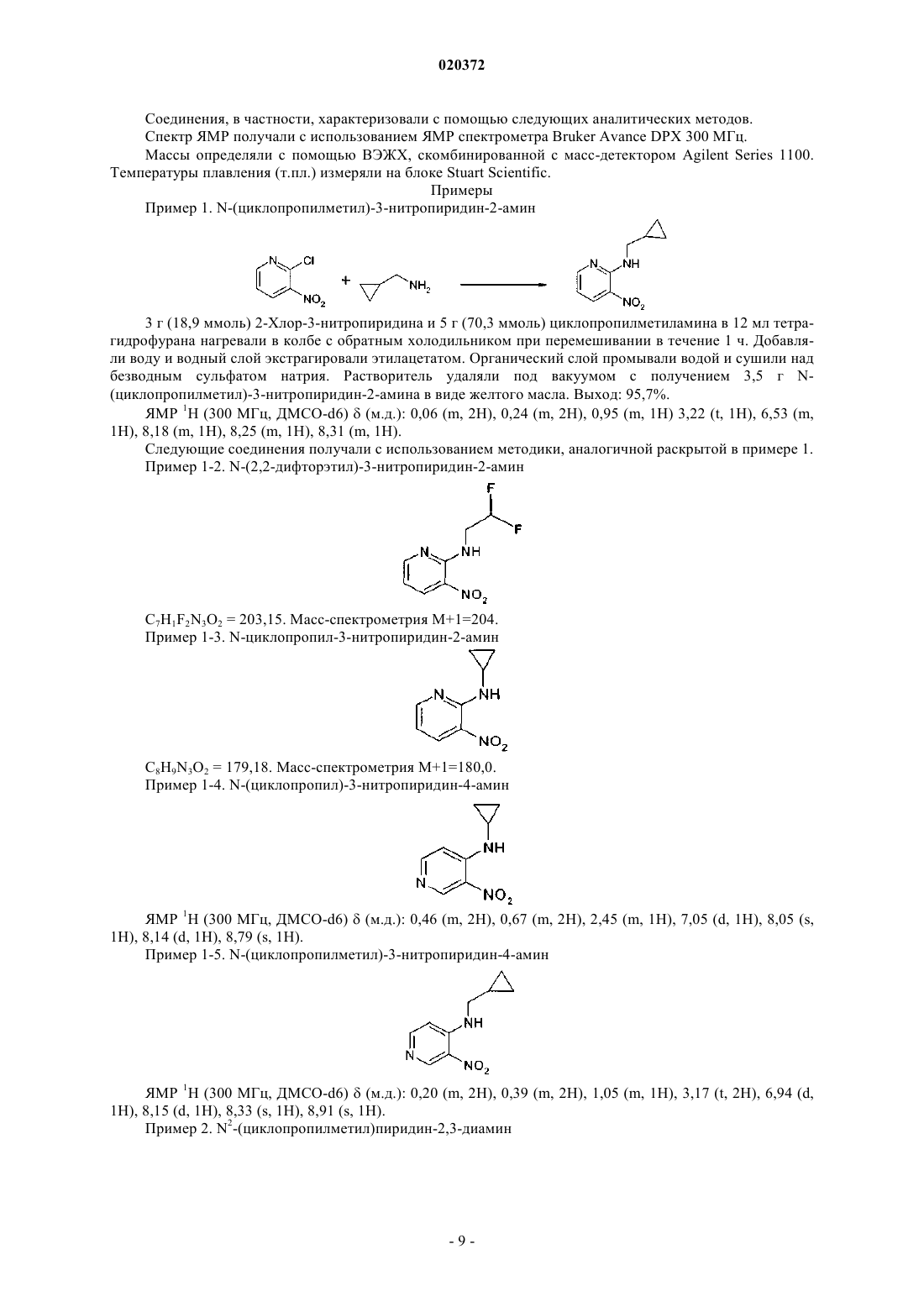
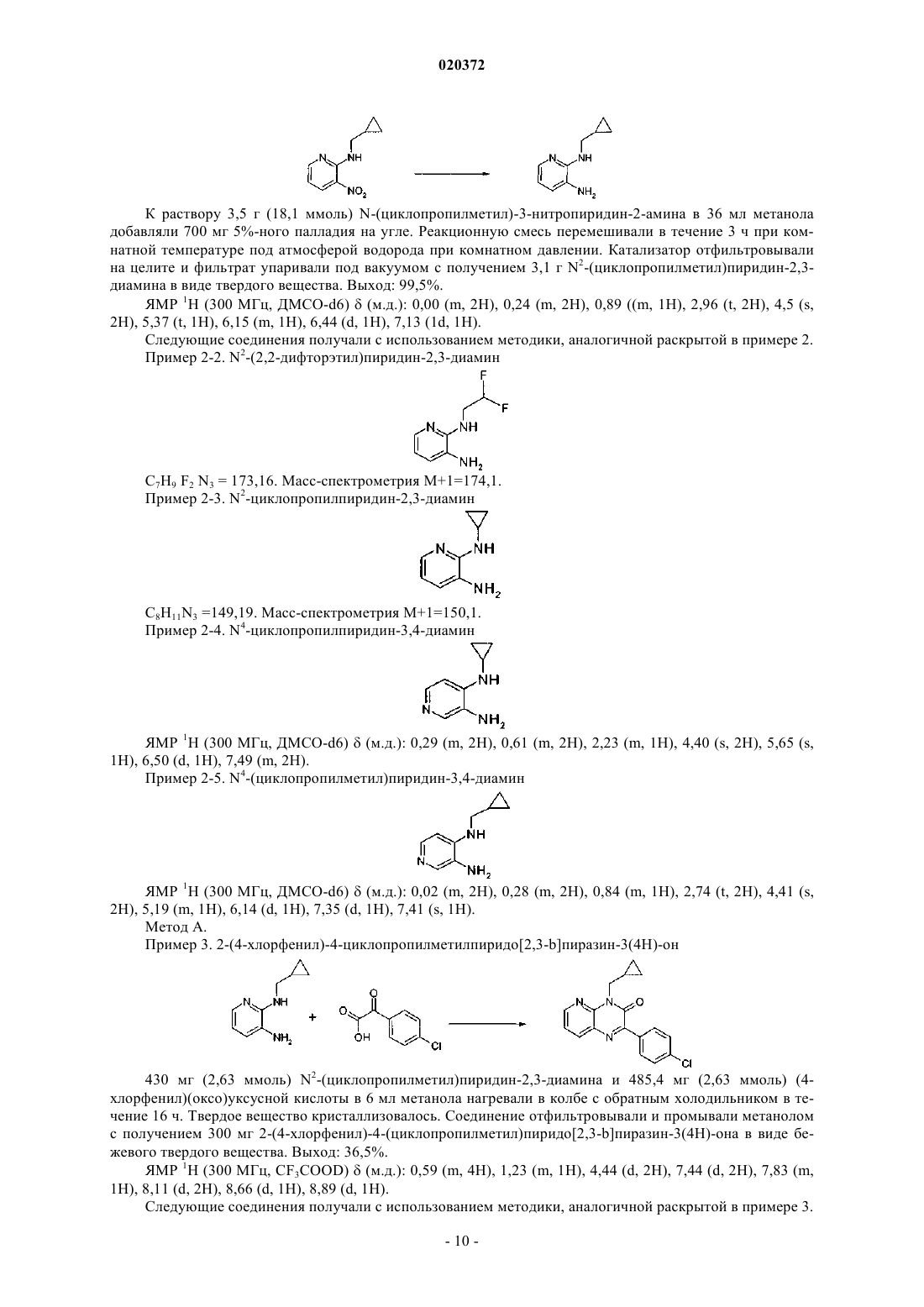
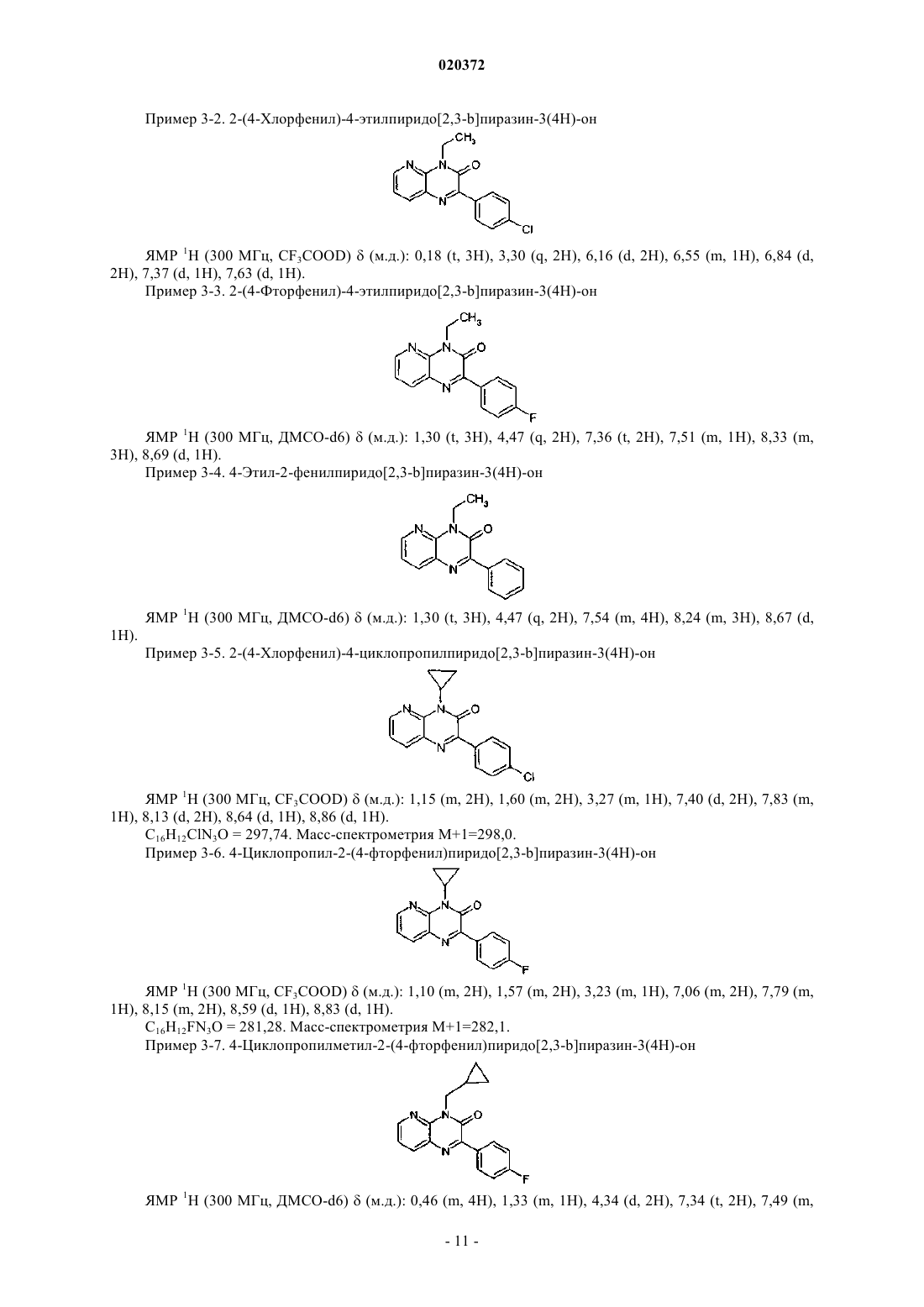
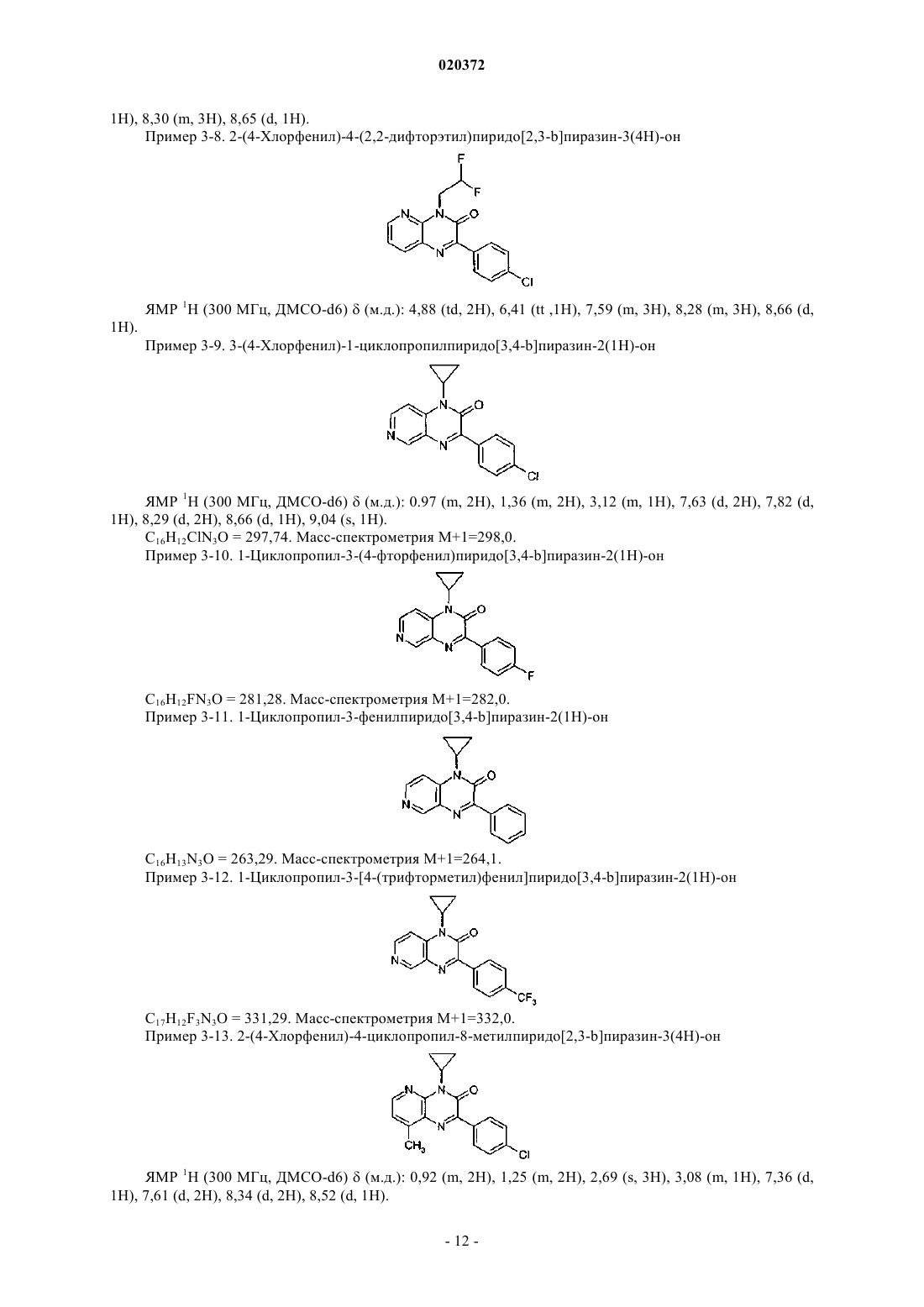
СТИМУЛЯТОРЫ СЕКРЕЦИИ ИНСУЛИНА - ПРОИЗВОДНЫЕ ПИРИДОПИРАЗИНОНОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ДИАБЕТА(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE)(57) Настоящее изобретение относится к производным пиридопиразинона формулы (I) где X, Y, Z, W, А и R1 принимают значения, определенные в п.1, в качестве стимуляторов секреции инсулина. Изобретение также относится к получению и применению этих производных пиридопиразинона для профилактики и/или лечения диабета и связанных с ним патологий. Область техники, к которой относится изобретение Настоящее изобретение относится к производным пиридопиразинона формулы (I) в качестве стимуляторов секреции инсулина. Изобретение также относится к получению и применению этих производных пиридопиразинона для профилактики и/или лечения диабета и связанных с ним патологий. Предпосылки создания изобретения Сахарный диабет 2 типа является одним из самых распространнных в мире заболеваний. В 2007 г. его уровень распространения оценивался в 5,9% (246 млн человек) взрослого населения и находится в непрерывном росте. Это заболевание является более серьезным, так как оно может привести к тяжелым микро- и макроосложнениям, которые могут привести к потере трудоспособности или смертельным случаям, поскольку диабет является главным фактором риска сердечно-сосудистого заболевания и удара. Диабет 2 типа характеризуется гипергликемией и натощак, и после приема пищи вследствие двух главных дефектов: резистентности к инсулину на уровне целевых тканей и изменения секреции инсулина-клетками поджелудочной железы. Это последнее отклонение от нормы, вероятно, проявляется очень рано, поскольку оно присутствует на стадии нарушения толерантности к глюкозе (IGT) (Mitrakou и др.,N. Engl. J. Med. 326: 22-29, 1992). В британском проспективном исследовании сахарного диабета (UKProspective Diabetes Study, UKPDS) зарегистрировано, что 50% функционирования -клеток потеряно уже на момент диагностирования диабета, что указывает на то, что ухудшение функционирования клеток может начинаться за 10-12 лет до диагностирования диабета (Holman, Diabetes Res. Clin. Pract. 40:S21, 1998 или UKPDS Group, Diabetes 44: 1249-58, 1995). Неполноценная секреция инсулина является следствием количественного и качественного повреждения -клеток, то есть уменьшения массы -клеток и специфического дефекта секреции инсулина в ответ на глюкозу, особенно первой фазы секреции, так как ответ на неглюкозные стимуляторы секреции на данной фазе сохранен (Pfeifer и др., Am. J. Med. 70: 579-88, 1981). Важность восстановления нормального профиля секреции инсулина в ответ на глюкозу с целью сохранения гликемического контроля в нормальном диапазоне подтверждена исследованиями на добровольцах, не страдающих диабетом, показывающими, что задержка первой фазы секреции инсулина в ответ на глюкозу приводит к непереносимости глюкозы (Calles-Escandon и др., Diabetes 36: 1167-72,1987). Пероральные антидиабетические средства для лечения пациентов с диабетом 2 типа, такие как сульфонилмочевины или глиниды, известны тем, что индуцируют секрецию инсулина путем связывания с сульфонилмочевинным рецептором на К-АТФ каналах -клеток, что приводит к увеличению внутриклеточного кальция и экзоцитоза инсулина. Таким образом, эта секреция инсулина полностью независима от уровня глюкозы в плазме и лечение этими молекулами обычно индуцирует пролонгированную гиперинсулинемию, что может привести к некоторым побочным эффектам, таким как тяжелая гипогликемия, увеличение массы тела и увеличение сердечно-сосудистого риска. Кроме того, пролонгированная гиперинсулинемия, наблюдаемая при лечении сульфонилмочевиной, без защитного действия на массу клеток, должна привести к вторичному повреждению через истощение -клеток, еще одному опасному побочному эффекту этих соединений. Новое лечение диабета 2 типа должно восстановить нормальный профиль секреции инсулина именно в ответ на глюкозу, наряду с сохранением или увеличением массы -клеток. Это наблюдается сGLP-1 аналогами, такими как эксенатид или лираглутид, но эти молекулы являются пептидами и должны быть введены парентеральным путем. Такие характеристики для новых соединений с небольшими молекулами для перорального введения были бы большим преимуществом перед другими противодиабетическими препаратами. В соответствии с настоящим изобретением соединения формулы (I) являются стимуляторами секреции инсулина, полезными для лечения диабета и связанных с ним патологий. Они снижают уровни глюкозы в крови путем восстановления нарушенной стимулируемой глюкозой секреции инсулина при диабете 2-го типа. Заявка на патент WO 2007020521 раскрывает производные пиридопиразинона в качестве ингибиторов PDE V. ЕР 770079 раскрывает производные пиридопиразинона в качестве ингибиторов PDE IV и TNF. Заявка на патент WO 2004031189 раскрывает производные пиридопиразинона в качестве антагонистов рецепторов рилизинг фактора кортикотропина для лечения тревоги и депрессии.US 4296114 описывает производные пиридопиразинона в качестве противовоспалительных средств. Ни один из документов уровня техники не раскрывает производные пиридопиразинона с антидиабетической активностью. Краткое изложение сущности изобретения Настоящее изобретение направлено на производные пиридопиразинона формулы (I). Указанные производные полезны для лечения диабета и связанных с ним патологий. Производные пиридопиразинона в соответствии с изобретением имеют следующую формулу (I): где один атом из X, Y, Z, W означает атом азота, а другие означают атом углерода, замещенный заместителем, выбранным из водорода, Т; А означает фенил, гетероарил, выбранный из фуранила, тиенила, пиридила; каждая из этих групп может быть необязательно замещена одним или несколькими заместителями, выбранными из Т;R1 означает алкил, алкилоксиалкил, циклоалкил, циклоалкилалкил, R3R4N-алкил; каждая из этих групп может быть необязательно замещена одним или несколькими заместителями, выбранными из Т; предпочтительно R1 означает этил; изопропил; бутил; 2,2-дифторэтил; 2-метоксиэтил; циклопропил; циклопропилметил, циклобутил; Т означает гидрокси, галоген, трифторметил, карбокси, алкил;R3 и R4 независимо выбраны из низшего алкила; а также их фармацевтически приемлемые соли. Соединения согласно изобретению формулы (I) согласно вышеприведенному определению содержащие достаточно кислотную функцию, или достаточно основную функцию, или обе, могут включать соответствующие фармацевтически приемлемые соли органической или минеральной кислоты или орга-3 020372 нического или минерального основания. Выражение "фармацевтически приемлемые соли" относится к относительно нетоксичным минеральным и органическим солям присоединения кислоты и солям присоединения основания соединений настоящего изобретения. Эти соли могут быть получены in situ во время заключительного выделения и очистки соединений. В частности, соли присоединения кислоты могут быть получены с помощью отдельной реакции очищенного соединения в его очищенной форме с органический или минеральной кислотой и выделения таким образом образованной соли. Получающиеся соли представляют собой, например, гидрохлориды,гидробромиды, сульфаты, гидросульфаты, дигидрофосфаты, цитраты, малеаты, фумараты, трифторацетаты, 2-нафталинсульфонаты, паратолуолсульфонаты. Изобретение также относится к фармацевтически приемлемым солям с органическими или неорганическими основаниями. В частности, соли присоединения основания могут быть получены с помощью отдельной реакции очищенного соединения в его очищенной форме с органическим или неорганическим основанием и выделения таким образом образованной соли. Получающиеся соли представляют собой,например, соли металлов, особенно соли щелочных металлов, соли щелочно-земельных металлов и соли переходных металлов (таких как натрий, калий, кальций, магний, алюминий), или соли, полученные с основаниями, такими как аммиак или вторичные или третичные амины (такие как диэтиламин, триэтиламин, пиперидин, пиперазин, морфолин), или с основными аминокислотами, или с аминосахарами (такими как меглюмин), или с аминоспиртами (такими как 3-аминобутанол и 2-аминоэтанол). Изобретение также относится к солям, используемым для хирального разделения рацематов. В качестве примеров можно использовать следующие хиральные кислоты:(+)-D-ди-О-бензоилвинная кислота, (-)-L-ди-О-бензоилвинная кислота, (-)-L-ди-О,О'-п-толуил-Lвинная кислота, (+)-D-ди-О,О'-п-толуил-L-винная кислота, (R)-(+)-яблочная кислота, (S)-(-)-яблочная кислота, (+)-камфорная кислота, (-)-камфорная кислота, R-(-)1,1'-бинафталин-2,2'-диилгидрофосфоновая кислота, (+)-камфановая кислота, (-)-камфановая кислота, (S)-(+)-2-фенилпропионовая кислота, (R)-(+)-2 фенилпропионовая кислота, О-(-)-миндальная кислота, L-(+)-миндальная кислота, D-винная кислота, Lвинная кислота или любые их смеси. В качестве примеров можно использовать следующие хиральные амины: хинин, бруцин, (S)-1-(бензилоксиметил)пропиламин(III), (-)-эфедрин, (4S,5R)-(+)-1,2,2,3,4 тетраметил-5-фенил-1,3-оксазолидин, (R)-1-фенил-2-п-толилэтиламин, (S)-фенилглицинол, (-)-Nметилэфедрин, (+)-(2S,3R)-4-диметиламино-3-метил-1,2-дифенил-2-бутанол, (S)-фенилглицинол, (S)-метилбензиламин или любые их смеси. Использованный здесь термин "пролекарство" относится к любому соединению, которое после введения биологической системе образовывает "лекарственное" вещество (биологически активное соединение) в результате самопроизвольной(ых) химической(их) реакции(й), катализируемой(ых) ферментами химической(их) реакции(й) и/или метаболической(их) химической(их) реакции(й). В соответствии с настоящим изобретением и как используется в этом документе, следующим терминам дают определение со следующими значениями, если явно не определено иначе. Термин "арил" относится к ароматическим группам, которые имеют 5-14 атомов кольца и по меньшей мере одно кольцо, имеющее конъюгированную пи (тг) электронную систему, и включает биарильные группы, все из которых могут быть необязательно замещенными. Пригодные арильные группы включают фенил, нафтил, бифенил, антрил, фенантрил, инденил и т.п. Термин "гетероарил" относится к ароматическим гетероциклам из 5-14 атомов кольца, содержащим от 1 до 4 гетероатомов в качестве атомов кольца в ароматическом кольце, а оставшиеся атомы кольца представляют собой атомы углерода. Пригодные гетероатомы включают О, S, N. Пригодные гетероарильные группы включают фуранил, бензофуранил, тиенил, пиридил, пиридил-N-оксид, пиримидинил,пиразинил, оксазолил, тиазолил, изоксазолил, хинолинил, триазолил, пиридазинил, пирролил, имидазолил, индазолил, изотиазолил, индолил, оксадиазолил и т.п. Термин "циклоалкил" означает насыщенные карбоциклические кольца, необязательно замещенные,и включает моно-, би- и трициклические соединения, включающие от 3 до 10 атомов углерода. Пригодными циклоалкильными группами являются: циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил, адамантил и т.п. Термин "гетероциклоалкил" относится к необязательно замещенным моноциклическим, бициклическим или трициклическим радикалам, включающим один или несколько гетероатомов, предпочтительно выбранных из числа О, S и N, необязательно в окисленном состоянии (в случае S и N), и необязательно одну или несколько двойных связей. По меньшей мере одно из колец предпочтительно включает от 1 до 4 внутрикольцевых гетероатомов, более предпочтительно от 1 до 3 гетероатомов. Наиболее предпочтительно, гетероциклоалкильный (или просто "гетероциклический") радикал включает одно или несколько колец, каждое из которых имеет от 5 до 8 узлов. Примерами гетероциклических радикалов являются: морфолинил, пиперидинил, пиперазинил, тиазолидинил, оксазолидинил, тетрагидротиенил, дигидрофуранил, тетрагидрофуранил, пиразолидинил, 1,3-диоксоланил, пирролидинил, пиранил, дигидропиранил, изоксазолидинил, имидазолил, имидазолидинил и т.п. Термин "алкил" относится к насыщенным алифатическим группам, в том числе к группам с нераз-4 020372 ветвленной и разветвленной цепью. Пригодные алкильные группы, имеющие от 1 до 20 атомов углерода,включают метильную, этильную,пропильную, изопропильную, бутильную, втор-бутильную, трет-бутильную, пентильную, гексильную, октильную, деканоильную, додеканоильную, гексадецильную, октадецильную группы и т.п. Термин "алкилен" относится к двухвалентному радикалу, полученному из алкильного радикала после удаления одного атома водорода. Термин "алкенил" относится к ненасыщенным группам, включающим по меньшей мере одну углерод-углеродную двойную связь, и включает группы с неразветвленной, разветвленной цепью и циклические группы. Пригодные алкенильные группы, имеющие от 2 до 20 атомов углерода, включают этенил,2-пропенил, 2-бутенил, 3-бутенил, 2-пентенил, 3-пентенил, 4-пентенил и т.п. Термин "алкинил" относится к ненасыщенным группам, включающим по меньшей мере одну углерод-углеродную тройную связь, и включает группы с неразветвленной, разветвленной цепью и циклические группы; и необязательно включает по меньшей мере одну углерод-углеродную двойную связь. Пригодные алкинильные группы, имеющие от 2 до 20 атомов углерода, включают этинил, 2-пропинил, 2 бутинил, 3-бутинил, 2-пентинил, 3-пентинил, 4-пентинил и т.п. Термин "арилалкил" относится к алкильной группе, предпочтительно алкильной группе, имеющей от 1 до 20 атомов углерода, замещенной арильной группой. Пригодные арилалкильные группы включают бензил, пиколил и т.п. Термин "алкокси" относится к группе алк-О-, где "алк" означает алкильную группу. Термин "арилокси" относится к группе арил-О-. Термин "арилоксиалкил" относится к алкильной группе, замещенной арилоксигруппой. Термин "арилалкоксиалкил" относится к алкильной группе, замещенной арилалкоксигруппой. Термин "арилалкокси" относится к группе арил-алк-О-, где "алк" означает алкильную группу. Термин "арилтиоалкил" относится к алкильной группе, замещенной арилтиогруппой. Термин "арилалкилтиоалкил" относится к алкильной группе, замещенной арилалкилтио. Термин "гетероарилалкил" относится к алкильной группе, замещенной гетероарильной группой. Термин "гетероарилоксиалкил" относится к алкильной группе, замещенной гетероарилоксигруппой. Термин "гетероарилалкоксиалкил" относится к алкильной группе, замещенной гетероарилалкоксигруппой. Термин "гетероарилтиоалкил" относится к алкильной группе, замещенной гетероарилтиогруппой. Термин "гетероарилалкилтиоалкил" относится к алкильной группе, замещенной гетероарилалкилтиогруппой. Термин "гетероциклоалкилалкил" относится к алкильной группе, замещенной гетероциклоалкильной группой. Термин "гетероциклоалкилоксиалкил" относится к алкильной группе, замещенной гетероциклоалкилоксигруппой. Термин "гетероциклоалкилалкоксиалкил" относится к алкильной группе, замещенной гетероциклоалкилалкоксигруппой. Термин "гетероциклоалкилтиоалкил" относится к алкильной группе, замещенной гетероциклоалкилтиогруппой. Термин "гетероциклоалкилалкилтиоалкил" относится к алкильной группе, замещенной гетероциклоалкилалкилтиогруппой. Термин "арилалкенил" относится к алкенильной группе, замещенной арильной группой. Термин "арилалкинил" относится к алкинильной группе, замещенной арильной группой. Термин "алкилоксиалкил" относится к алкильной группе, замещенной алкилоксигруппой. Термин "циклоалкилалкил" относится к алкильной группе, замещенной циклоалкильной группой. Термин "гетероциклоалкилоксиалкил" относится к алкильной группе, замещенной гетероциклоалкилоксигруппой. Термин "гетероциклоалкилалкоксиалкил" относится к алкильной группе, замещенной гетероциклоалкилалкоксигруппой. Термин "гетероциклоалкилтиоалкил" относится к алкильной группе, замещенной гетероциклоалкилтиогруппой. Термин "гетероциклоалкилалкилтиоалкил" относится к алкильной группе, замещенной гетероциклоалкилалкилтиогруппой. Термин "низший", упомянутый здесь применительно к органическим радикалам или соединениям соответственно, означает, например, вплоть до 10, предпочтительно вплоть до 6 и преимущественно от одного до четырех атомов углерода. Такие группы могут иметь неразветвленную, разветвленную или циклическую цепь. Термин "арилсульфонилалкил" относится к группе арил-SO2-алк, где "алк" означает алкильную группу. Термин "алкилтио" относится к группе алк-S-, где "алк" означает алкильную группу. Термин "галоген" относится к атому фтора, брома или хлора. Термин "амидино" относится к группе -C(NR3)-NR3R4, где R3R4 принимает значения, определенные выше, и все радикалы, за исключением водорода, необязательно замещены. Соединения изобретения в соответствии с формулой (I) проявляют гипогликемическое действие и являются полезными при лечении патологий, связанных с синдромом резистентности к инсулину. Резистентность к инсулину характеризуется снижением действия инсулина (cp."Presse Medicale",(1997), 26(14), 671-677) и вовлекается во многие патологические состояния, такие как диабет и, в частности, инсулиннезависимый диабет (диабет II типа или NIDDM), дислипидемия, ожирение, артериальная гипертензия и также определенные сердечные, микро- и макрососудистые осложнения, например атеросклероз, ретинопатию и невропатию. В этом отношении ссылка должна быть сделана, например, на Diabetes, 37, (1988), 1595-1607; Journal of Diabetes and its complications, 12, (1998), 110-119; Horm. Res., 38,(1992), 28-32. Изобретение также относится к фармацевтической композиции, содержащей в качестве активного ингредиента по меньшей мере одно соединение формулы (I) согласно вышеприведенному определению и/или его фармацевтически приемлемую соль, в комбинации с одним или несколькими фармацевтически приемлемыми носителями, адъювантами, разбавителями или эксципиентами. Специалист в данной области техники осведомлен о всем многообразии таких соединений - носителей, адъювантов, разбавителей или эксципиентов, пригодных для составления фармацевтической композиции. Фармацевтические композиции настоящего изобретения могут вводиться различными путями, включая пероральный, парентеральный, внутривенный, внутримышечный, ректальный, внутрислизистый или подкожный. Они таким образом будут представлены в форме инъецируемых растворов или суспензий или в форме мультидозовых флаконов, в форме обыкновенных или покрытых таблеток, таблеток с сахарным покрытием,слоистых капсул, желатиновых капсул, пилюль, саше, порошков, суппозиториев или ректальных капсул,растворов или суспензий для подкожного применения в полярном растворителе или для внутрислизистого применения. Эксципиентами, которые пригодны для таких путей введения, являются фармацевтически приемлемые эксципиенты, такие как производные целлюлозы или микрокристаллической целлюлозы, карбонаты щелочно-земельных металлов, фосфат магния, крахмалы, модифицированные крахмалы,лактоза и т.п. эксципиенты для твердых форм. Для ректального применения предпочтительными эксципиентами являются масло какао или стеараты полиэтиленгликоля. Для парентерального введения наиболее подходящими для применения разбавителями являются вода, водные растворы, физиологические и изотонические растворы. Например, в случае перорального введения, например в форме гранул, таблеток или покрытых таблеток, пилюль, капсул, желатиновых капсул, гелей, облаток или порошков, пригодная дозировка соединений составляет между около 0,1 и около 100 мг/кг, предпочтительно между около 0,5 и около 50 мг/кг,более предпочтительно между около 1 и около 10 мг/кг и наиболее предпочтительно между около 2 и около 5 мг/кг массы тела в сутки. Если типичные массы тела принимают равными 10 и 100 кг, с целью иллюстрации суточного диапазона доз для перорального введения, который можно использовать и как описано выше, пригодные дозировки соединений формулы (I) будут находиться между около 1-10 и 1000-10000 мг/в сутки, предпочтительно между около 5-50 и 500-5000 мг/в сутки, более предпочтительно между 10-100 и 100-1000 мг/в сутки и наиболее предпочтительно между 20-200 и 50-500 мг/в сутки. Следует понимать, однако, что индивидуальный уровень дозы для какого-либо отдельного пациента будет зависеть от ряда факторов, в том числе активности отдельного используемого соединения; возраста, массы тела, общего состояния здоровья, пола и режима питания пациента, подлежащего лечению; времени и пути введения; скорости экскреции; других лекарственных препаратов, которые были введены ранее; и серьезности отдельного заболевания, подвергающегося лечению, что хорошо понятно специалисту в данной области. Как отмечалось ранее, составы настоящего изобретения, пригодные для перорального введения, могут быть представлены в виде отдельных единиц, таких как капсулы, облатки или таблетки, каждая из которых содержит заранее заданное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной или неводной жидкости; или в виде жидкой эмульсии масло-вводе или вода-в-масле. Активный ингредиент также может быть введен в виде болюса, электуария или пасты. Настоящее изобретение также относится к соединению общей формулы (I), a также его рацемическим формам, таутомерам, энантиомерам, диастереоизомерам, эпимерам и полиморфам, и их смесям и их фармацевтически приемлемым солям для приготовления лекарственного средства для предупреждения и/или лечения патологий, связанных с гипергликемией; для приготовления лекарственного средства,которое вызывает секрецию инсулина в ответ на концентрацию глюкозы, предпочтительно для лечения диабета, более предпочтительно для предупреждения и/или лечения диабета II типа и патологий, связанных с нарушениями обмена веществ, гиперхолестеринемией, гиперлипидемией, которые усиливаются гиперинсулинемией и гипергликемией; для лечения заболеваний, выбранных из связанных с диабетом микро- и макрососудистых осложнений, таких как артериальная гипертензия, воспалительные процессы,микроангиопатия, макроангиопатия, ретинопатия и невропатия; для снижения гипергликемии, для лече-6 020372 ния дислипидемии и ожирения; или для лечения заболеваний, таких как сердечно-сосудистые заболевания, включая атеросклероз, ишемию миокарда. Настоящее изобретение также относится к применению по меньшей мере соединения общей формулы (I), а также его рацемических форм, таутомеров, энантиомеров, диастереоизомеров, эпимеров и полиморфов и их смесей и их фармацевтически приемлемых солей и пролекарств, для предупреждения и/или лечения патологий, связанных с гипергликемией, предпочтительно для лечения диабета, более предпочтительно для предупреждения и/или лечения диабета II типа и патологий, связанных с нарушениями обмена веществ, гиперхолестеринемией, гиперлипидемией, которые усиливаются гиперинсулинемией и гипергликемией; для лечения заболеваний, выбранных из связанных с диабетом микро- и макрососудистых осложнений, таких как артериальная гипертензия, воспалительные процессы, микроангиопатия, макроангиопатия, ретинопатия и невропатия; для снижения гипергликемии, для лечения дислипидемии и ожирения; или для лечения заболеваний, таких как сердечно-сосудистые заболевания, включая атеросклероз, ишемию миокарда. Настоящее изобретение также относится к способу получения соединений формулы (I) согласно вышеприведенному определению, в соответствии со следующими образцовыми методами, показанными на схеме 1 (получение промежуточных соединений - диаминопиридиновых производных); схеме 2 (метод А) или схеме 3 (метод В), на которых X, Y, Z, W, R1, А принимают значения, определенные выше для формулы (I) и Hal означает атом галогена, предпочтительно Cl или Br. Следующие схемы приведены для репрезентативных целей и исключительно для цели облегчения репрезентации. Излишне говорить, что, в зависимости от природы соединений формулы (I), подлежащих получению, представленные методики могут быть приспособлены специалистом в данной области техники путем выбора соответствующих исходных веществ, в которых природа заместителей R1 и А может быть изменена, особенно в виде функции природы и длины заданной цепи. Соединения, полезные в соответствии с изобретением, можно получить, если не указано более точно, путем применения или приспособления известных методов, которые подразумевают методы, используемые ранее или описанные в литературе, патентах или заявках на патент, источнике "Chemical Abstracts" и в Интернете. Получение промежуточных соединений - диаминопиридиновых производных Схема 1R1 принимает значения, определенные выше для формулы (I);X, Y, Z и W принимают значения, определенные выше для формулы (I). Аминонитропиридиновые производные формулы (2) получают с помощью реакции галонитропиридинового производного формулы (1) с амином в присутствии по меньшей мере 1 экв. основания, такого как карбонат натрия или калия, карбонат цезия, или в присутствии по меньшей мере 2 экв. рассматриваемого амина, в инертном растворителе, таком как тетрагидрофуран, ацетонитрил или толуол, при температуре между 20 С и температурой в колбе при нагревании с обратным холодильником в течение 1-24 ч. Диаминопиридиновые производные формулы (3) могут быть получены из соединений формулы (2) путем восстановления нитрогруппы до соответствующего первичного ароматического амина. В предпочтительные методах используют металл, такой как Zn, Sn или Fe, в кислотах, таких как водная HCl. В других предпочтительных методах используют металл в низшей степени окисления, например хлорид Sn(II) в HCl. Особенно предпочтительным является восстановление с помощью каталитического гидрирования,при котором используется металлический катализатор, выбранный из металлов, таких как Pd, Pt или Ni,предпочтительно Pd на угле или никель Ренея, в растворителях, таких как метанол, этанол, тетрагидрофуран. Получение производных пиридопиразинона Схема 2 - метод А Этот метод является особенно пригодным для соединений формулы (I),где Rx означает Hal, ORe (где Re означает водород, низший алкил);R1 принимает значения, определенные выше для формулы (I); А принимают значения, определенные выше для формулы (I);X, Y, Z и W принимают значения, определенные выше для формулы (I). Пиридопиразиноны формулы (I) получают с помощью циклизации соединений формулы (3) с кетокислотным производным в растворителе, таком как, например, метанол, ацетонитрил, диметилформамид (ДМФА) или толуол, при температуре между 20 С и температурой в колбе при нагревании с обратным холодильником, более предпочтительно при температуре в колбе при нагревании с обратным холодильником в течение от 1 до 36 ч. Схема 3 - метод В Этот метод является особенно пригодным для соединений формулы (I),где Rx означает Hal, ORe (где Re означает водород, низший алкил);R1 принимает значения, определенные выше для формулы (I); А принимают значения, определенные выше для формулы (I);X, Y, Z и W принимают значения, определенные выше для формулы (I). Гидроксипиридопиразиноны формулы (5) получают путем циклизации соединений формулы (3),например, с хлор(оксо)ацетатными производными в присутствии по меньшей мере одного эквивалента основания, неорганического основания, такого как карбонат натрия или калия, карбонат цезия, или органического основания, такого как триэтиламин или диизопропилэтиламин, в инертном растворителе, таком как, например, дихлорметан, ацетонитрил, ДМФА, при температуре между 20 С и температурой в колбе при нагревании с обратным холодильником в течение 1-24 ч. Бромпроизводные формулы (6) получают с помощью бромирования соединений формулы (5) с использованием бромирующего агента, такого как POBr3, в инертном растворителе, таком как 1,2 дихлорэтан, при температуре между 20 С и температурой в колбе при нагревании с обратным холодильником, более предпочтительно при температуре в колбе при нагревании с обратным холодильником в течение 1-24 ч. Пиридопиразиноны формулы (I) получают с помощью реакции бромсодержащих соединений формулы (6) с производными бороновой кислоты или их сложными эфирами, в присутствии основания, такого как карбонат натрия или карбонат калия, и катализатора, такого как хлорид бис(трифенилфосфин) палладия(II), в инертном растворителе, таком как диметилформамид или толуол, при температуре между 20 С и температурой в колбе при нагревании с обратным холодильником, более предпочтительно при температуре в колбе при нагревании с обратным холодильником в течение 1-24 ч. Примеры, которые следуют ниже, иллюстрируют изобретение, однако, без его ограничения. Используемые сходные вещества являются известными продуктами или продуктами, полученными в соответствии с известными методиками. Процентные значения, если не указано особо, выражены на основе массы. Соединения, в частности, характеризовали с помощью следующих аналитических методов. Спектр ЯМР получали с использованием ЯМР спектрометра Bruker Avance DPX 300 МГц. Массы определяли с помощью ВЭЖХ, скомбинированной с масс-детектором Agilent Series 1100. Температуры плавления (т.пл.) измеряли на блоке Stuart Scientific. Примеры Пример 1. N-(циклопропилметил)-3-нитропиридин-2-амин 3 г (18,9 ммоль) 2-Хлор-3-нитропиридина и 5 г (70,3 ммоль) циклопропилметиламина в 12 мл тетрагидрофурана нагревали в колбе с обратным холодильником при перемешивании в течение 1 ч. Добавляли воду и водный слой экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом натрия. Растворитель удаляли под вакуумом с получением 3,5 г N(циклопропилметил)-3-нитропиридин-2-амина в виде желтого масла. Выход: 95,7%. ЯМР 1 Н (300 МГц, ДМСО-d6)(м.д.): 0,06 (m, 2 Н), 0,24 (m, 2 Н), 0,95 (m, 1 Н) 3,22 (t, 1H), 6,53 (m,1 Н), 8,18 (m, 1 Н), 8,25 (m, 1 Н), 8,31 (m, 1 Н). Следующие соединения получали с использованием методики, аналогичной раскрытой в примере 1. Пример 1-2. N-(2,2-дифторэтил)-3-нитропиридин-2-амин К раствору 3,5 г (18,1 ммоль) N-(циклопропилметил)-3-нитропиридин-2-амина в 36 мл метанола добавляли 700 мг 5%-ного палладия на угле. Реакционную смесь перемешивали в течение 3 ч при комнатной температуре под атмосферой водорода при комнатном давлении. Катализатор отфильтровывали на целите и фильтрат упаривали под вакуумом с получением 3,1 г N2-(циклопропилметил)пиридин-2,3 диамина в виде твердого вещества. Выход: 99,5%. ЯМР 1 Н (300 МГц, ДМСО-d6)(м.д.): 0,00 (m, 2 Н), 0,24 (m, 2H), 0,89 m, 1H), 2,96 (t, 2H), 4,5 (s,2H), 5,37 (t, 1H), 6,15 (m, 1H), 6,44 (d, 1H), 7,13 (1d, 1H). Следующие соединения получали с использованием методики, аналогичной раскрытой в примере 2. Пример 2-2. N2-(2,2-дифторэтил)пиридин-2,3-диамин 430 мг (2,63 ммоль) N2-(циклопропилметил)пиридин-2,3-диамина и 485,4 мг (2,63 ммоль) (4 хлорфенил)(оксо)уксусной кислоты в 6 мл метанола нагревали в колбе с обратным холодильником в течение 16 ч. Твердое вещество кристаллизовалось. Соединение отфильтровывали и промывали метанолом с получением 300 мг 2-(4-хлорфенил)-4-(циклопропилметил)пиридо[2,3-b]пиразин-3(4 Н)-она в виде бежевого твердого вещества. Выход: 36,5%. ЯМР 1 Н (300 МГц, CF3COOD)(м.д.): 0,59 (m, 4 Н), 1,23 (m, 1 Н), 4,44 (d, 2H), 7,44 (d, 2H), 7,83 (m,1H), 8,11 (d, 2H), 8,66 (d, 1H), 8,89 (d, 1H). Следующие соединения получали с использованием методики, аналогичной раскрытой в примере 3. К 1,6 г (9,8 ммоль) N2-(циклопропилметил)пиридин-2,3-диамина и 1,7 мл (9,8 ммоль) диизопропиламина в 20 мл дихлорметана при комнатной температуре прикапывали при перемешивании 1,1 мл (9,8 ммоль) этилхлор(оксо)ацетата. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч и добавляли воду. Органический слой отделяли, а водный слой дважды экстрагировали дихлорметаном. Объединенный органический слой промывали водой, сушили над безводным сульфатом натрия и растворитель удаляли под вакуумом. Соединение далее очищали с помощью колоночной хроматографии на силикагеле с использованием в качестве элюанта смеси дихлорметан/метанол (95/5), что приносило после упаривания 700 мг 4-(циклопропилметил)-2-гидроксипиридо[2,3-b]пиразин-3(4 Н)-она в виде твердого вещества. Выход: 33%. ЯМР 1 Н (300 МГц, ДМСО-d6)(м.д.): 0,19 (m, 4H), 1,03 (m, 1H), 3,90 (d, 2H), 6,98 (m, 1 Н), 7,29 (d,1H), 7,96 (d, 1H), 11,94 (s, 1H). Следующие соединения получали с использованием методики, аналогичной раскрытой в примере 4. Пример 4-2. 4-(Циклопропил)-2-гидроксипиридо[2,3-b]пиразин-3(4 Н)-он(3,22 ммоль) 95%-ного оксибромида фосфора в 10 мл дихлорэтане нагревали в колбе с обратным холодильником в течение 16 ч при перемешивании. Реакционную смесь затем подщелачивали водным раствором карбоната натрия и водный слой экстрагировали дихлорметаном. Органический слой отделяли, промывали водой, сушили над безводным сульфатом натрия и растворитель удаляли под вакуумом. Соединение далее очищали с помощью колоночной хроматографии на силикагеле с использованием дихлорметана в качестве элюанта с получением, после упаривания, 650 мг 2-бром-4-(циклопропилметил)пиридо[2,3-b]пиразин-3(4H)-она в виде белого твердого вещества. Выход: 66,5%. ЯМР 1 Н (300 МГц, ДМСО-d6)(м.д.): 0.46 (m, 4 Н), 1,31 (m, 1 Н), 4,26 (d, 2H), 7,49 (m, 1H), 8,22 (d,1H), 8,68 (d, 1H). Следующие соединения получали с использованием методики, аналогичной раскрытой в примере 5. Пример 5-2. 2-Бром-4-(циклопропил)пиридо[2,3-b]пиразин-3(4H)-он(0,036 ммоль) хлорида бис(трифенилфосфин) палладия(II) в 1 мл диметилформамида добавляли 142,9 мг(0,93 ммоль) (4-фтор-2-метилфенил)бороновой кислоты, 0,1 мл этанола и 715 мкл 2 М водного раствора карбоната натрия. Реакционную смесь затем нагревали в колбе с обратным холодильником в течение 20 ч при перемешивании. Добавляли воду и этилацетат. Органический слой отделяли, промывали водой,сушили над безводным сульфатом натрия и растворитель удаляли под вакуумом. Соединение далее очищали с помощью колоночной хроматографии на силикагеле с использованием дихлорметана в качестве элюанта с получением после упаривания 100 мг 4-(циклопропилметил)-2-(4-фтор-2-метилфенил)пиридо[2,3-b]пиразин-3(4 Н)-она в виде белого твердого вещества (выход: 45,3%). ЯМР 1 Н (300 МГц, ДМСО-d6)(м.д.): 0,27 (m, 4H), 1,15 (m, 1H), 4,10 (d, 2H), 6,96 (m, 2 Н), 7,31 (m,2 Н), 8,08 (d, 1H), 8,48 (d, 1H).C18H16FN3O = 309,34. Масс-спектрометрия М+1=310,1. Следующие соединения получали с использованием методики, аналогичной раскрытой в примере 6. Пример 6-2. 4-Циклопропил-2-(4-фтор-2-метилфенил)пиридо[2,3-b]пиразин-3(4 Н)-онC18H17N3O = 291,35. Масс-спектрометрия М+1=292,1. Биологические анализы Клетки INS-1 были выбраны для оценки соединений настоящего изобретения относительно их превосходного ответа на глюкозу и другие физиологические и фармакологические стимуляторы секреции инсулина. Культура панкреатических клеток INS-1. Клетки INS-1 культивировали в полной среде RPMI1640, содержащей 1 мМ пируват натрия, 50 мМ 2-меркаптоэтанол, 2 мМ глутамин, 10 мМ HEPES, 100 МЕ/мл пенициллин и 100 мг/мл стрептомицина(СМ), дополненной 10 мМ глюкозой, и 10% (об./об.) термоинактивированной фетальной телячьей сывороткой (ФТС), как описано Asfari и др. (Endocrinology 130: 167-178, 1992). Анализ на секрецию инсулина. Клетки INS-1 вносили в 48-луночные планшеты и культивировали. Через 2 дня культивирования среду удаляли и клетки культивировали в течение 24 ч со средой, замененной на 5 мМ глюкозу, 1% ФТС. Клетки затем промывали бикарбонатным HEPES буфером Кребса-Рингера (KRBH; 135 мМ NaCl; 3,6 мМKCl; 5 мМ NaHCO3; 0,5 мМ NaH2PO4; 0,5 мМ MgCl2; 1,5 мМ CaCl2 и 10 мМ HEPES; pH 7,4) - 0,1% BSA,содержащим 2,8 мМ глюкозу, и предварительно инкубировали в течение 30 мин при 37 С в том же самом буфере. Клетки затем промывали дважды и инкубировали в течение 1 ч в KRBH 0,1% BSA, содержащем 4,2 мМ глюкозу и разные концентрации испытываемых молекул. Концентрацию инсулина в собранных супернатантах измеряли с помощью ELISA, используя крысиное антиинсулиновое антитело (Insulin Rat Elit PLUS, кат. реф. 10-1145-01). Результаты секреции инсулина выражены в % от контроля Секреция инсулина в диабетических островках N0STZ крысы. Материалы и методы. Выделение и обработка островков. 143-недельных сытых N0STZ (PORTHA и др., 1974) самцов крыс (Charles Rivers-Domaine des Oncins, Л'Арбрель, Франция) анестезировали пентобарбиталом натрия (Nembutal: 45 мг/кг в 5 мл/кг, вводимых внутрибрюшинно), и температуру тела поддерживали лампой для обогрева. Крысиные панкреатические островки Лангерганса выделяли из поджелудочных желез 8 крыс с помощью обработки коллагеназой Р (Boehringer, Мейлан, Франция). Островки очищали путем седиментации в сбалансированном солевом растворе Хенкса [NaCl (137 мМ); KCl (5,36 мМ); MgSO4, 7 Н 2 О (0,81 мМ); Na2HPO4, 12 Н 2 О (0,34 мМ); KH2PO4 (0,44 мМ); CaCl2, 2 Н 2 О (1,26 мМ); NaHCO3(4,17 мМ)] с последующим градиентным разделением на фиколле. Островки затем сортировали вручную под стереоскопическим микроскопом и группу из 3 островков инкубировали в течение 90 мин при 37 С при непрерывном встряхивании в увлажненном состоянии (95% О 2, 5% СО 2) в 1 мл раствора Кребсф/Hepes с рН 7[NaCl (115 мМ), NaHCO3 (24 мМ), KCl (5 мМ), MgCl2 (1 мМ), CaCl2, 2 Н 2 О (1 мМ), 0.2% альбумина бычьей сыворотки (фракция V, свободная от жирных кислот, Boehringer, Мангейм), 10 мМ Hepes], содержащем требуемую концентрацию глюкозы или соединения. Соединения растворяли в ДМСО, получая исходные растворы с концентрацией 2,10-2 М. Затем указанные растворы разбавляли до требуемой концентрации буфером Кребса/Hepes, содержащим требуемую концентрацию глюкозы. В конце инкубирования среду собирали и уровни инсулина измеряли с использованием ELISA(EUROBIO, Коуртабоеуф (Courtaboeuf), Франция). Дозозависимое действие соединений на секрецию инсулина в диабетических островках N0STZ крысы Островки отсортировывали вручную и инкубировали в присутствии возрастающих концентраций соединений в присутствии глюкозы концентрацией 2,8 или 8 мМ. В конце инкубирования среду собирали и уровни инсулина измеряли с использованием метода ELISA. Результаты выражены в виде % от контроля глюкозы (2,8 или 8 мМ) и представляют собой среднееСОС. В островках, выделенных из диабетических N0STZ крыс, соединения не показывали действия в присутствии низкой, нестимулирующей,концентрации глюкозы (2,8 мМ), даже при высокой концентрации (10-4 М), в то время как они усиливали секрецию инсулина в ответ на 8 мМ, стимулирующую концентрацию глюкозы. Эти результаты показывают, что действие соединений на секрецию инсулина зависит от уровня глюкозы и указывают на то, что лечение этими соединениями позволит избежать риска развития гипогликемии. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I) где один атом из X, Y, Z, W означает атом азота, а другие означают атом углерода, замещенный заместителем, выбранным из водорода, Т; А означает фенил, гетероарил, выбранный из фуранила, тиенила, пиридила; каждая из этих групп может быть необязательно замещена одним или несколькими заместителями, выбранными из Т;R1 означает алкил, алкилоксиалкил, циклоалкил, циклоалкилалкил, R3P4N-алкил; каждая из этих групп может быть необязательно замещена одним или несколькими заместителями, выбранными из Т; Т означает гидрокси, галоген, трифторметил, карбокси, алкил; где алкил содержит от 1 до 20 атомов углерода, циклоалкил означает насыщенное карбоциклическое кольцо, включающее от 3 до 10 атомов углерода;R3 и R4 независимо выбраны из низшего алкила, включающего от 1 до 4 атомов углерода; а также его фармацевтически приемлемые соли. 2. Соединение по п.1, где R1 означает этил, изопропил, бутил, 2,2-дифторэтил, 2-метоксиэтил, циклопропил, циклопропилметил, циклобутил. 3. Соединение по любому из предыдущих пунктов, выбранное из следующих соединений: 4. Способ получения соединения общей формулы (I) по любому из пп.1-3, который включает следующие стадии: а) введение в реакцию соединения формулы (1)Hal означает атом галогена; с амином R1-NH2, где R1 принимает значения, определенные в п.1, в присутствии основания в инертном растворителе, с получением соединения формулы (2)b) восстановление соединения формулы (2) металлом или металлом в низшей степени окисления в кислотах; или путем каталитического гидрирования на металлических катализаторах в растворителях, с получением соединения формулы (3) с) введение в реакцию соединения формулы (3) с -кетокислотным производным формулыRx означает Hal, как он определен выше; или ORe, где Re означает водород, низший алкил; в растворителе, с получением соединения формулы (I). 5. Способ получения соединения общей формулы (I) по любому из пп.1-3, который включает следующие стадии: а) введение в реакцию соединения формулы (1)Hal означает атом галогена; с амином R1-NH2, где R1 принимает значения, определенные в п.1, в присутствии основания в инертном растворителе, с получением соединения формулы (2)b) восстановление соединения формулы (2) металлом или металлом в низшей степени окисления в кислотах; или путем каталитического гидрирования на металлических катализаторах в растворителях, с получением соединения формулы (3) с) введение в реакцию соединения формулы (3) с соединением формулы где Rx принимают значения, определенные выше, в присутствии основания в инертном растворителе, с получением соединения формулы (5)
МПК / Метки
МПК: A61K 31/4985, C07D 471/04
Метки: диабета, стимуляторы, производные, пиридопиразинонов, применение, секреции, инсулина, способы, получения, лечения
Код ссылки
<a href="https://eas.patents.su/30-20372-stimulyatory-sekrecii-insulina-proizvodnye-piridopirazinonov-sposoby-ih-polucheniya-i-ih-primenenie-dlya-lecheniya-diabeta.html" rel="bookmark" title="База патентов Евразийского Союза">Стимуляторы секреции инсулина – производные пиридопиразинонов, способы их получения и их применение для лечения диабета</a>
Предыдущий патент: Алкилзамещенные 3-гидроксипиридины для лечения депрессии
Следующий патент: (аза)индольное производное, замещенное по положению 5, содержащая его фармацевтическая композиция, промежуточные соединения и способ их получения
Случайный патент: Кристаллическая форма мононатрия ризедроната