Стимуляторы секреции гормона роста
Номер патента: 2746
Опубликовано: 29.08.2002
Авторы: Шеферд Тимоти Алан, Джонс Скотт Алан, Хаузер Кеннет Ли, Альт Чарльз Артур, Трэнкл Уилльям Джордж, Брайант Генри Ульман, Хейман Марк Луис, Лугар Чарльз Уиллис III, Кохен Джеффри Дэниел, Джангхейм Луис Николаус, Гриттон Уилльям Харлан, Додж Джеффри Алан, Ратц Эндрю Майкл, Мюэль Брайан Стефен, Трэшер Кеннет Джефф, Палковитц Алан Дэвид, Роби Роберт Льюис, Родес Гари Энтони, Копп Джеймс Денсмор
Формула / Реферат
1. Соединение формулы I
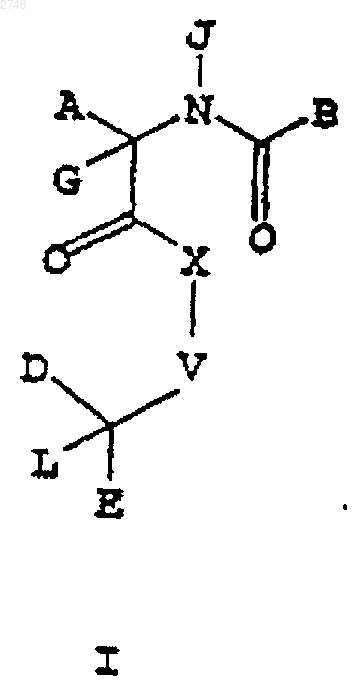
где А представляет собой C1-C6алкил, арил, C1-С6алкиларил, C1-С6алкил(О)C1-С6алкиларил, C1-C6алкил(S)C1-С6алкиларил, индолил, индолинил, тиенил, (C1-C6алкил)тиенил, бензотиенил, бензофуранил, нафтил, циклогексил, (C1-С6алкил)индолил, (C1-C6алкил) бензотиенил, (C1-C6)алкилнафтил, (C1-C6 алкил)бензофуранил и (C1-C6алкил)циклогексил;
В представляет собой NH2, NHR1, С1-C6алкилNН2, C1-C6алкилNHR1, С1-C6алкиларилNH2, C1-C6алкиларилNHR1, C1-C6алкилциклогексилNH2, С1-C6алкилциклогексилNНR1, R1-пиперидин-3-ил(C1-C6алкил), R1-пиперидин-2-ил(C1-С6алкил), R1-пиперидин-4-ил(C1-С6алкил), R1-хинолин-2-ил(C1-C6алкил), R1-2,4-дигидрохинолин-2-ил(C1-С6алкил), R1-изохинолин-2-ил(C1-С6алкил) и R1-2,4-дигидроизохинолин-2-ил(C1-C6алкил);
R1 представляет собой водород, C1-С6алкил, C1-С6алкил(ОН) или C1-C6алкилиденил (ОН)R2;
R2 представляет собой C1-С6алкил, C1-С6алкенил, C1-C6алкил(O)С1-C6алкил, С(О)O-C1-C6алкил, арил или C1-C6алкиларил;
Х представляет собой C1-С6алкилиденил, О, S, NH или N(C1-С6алкил);
V выбран из группы, включающей
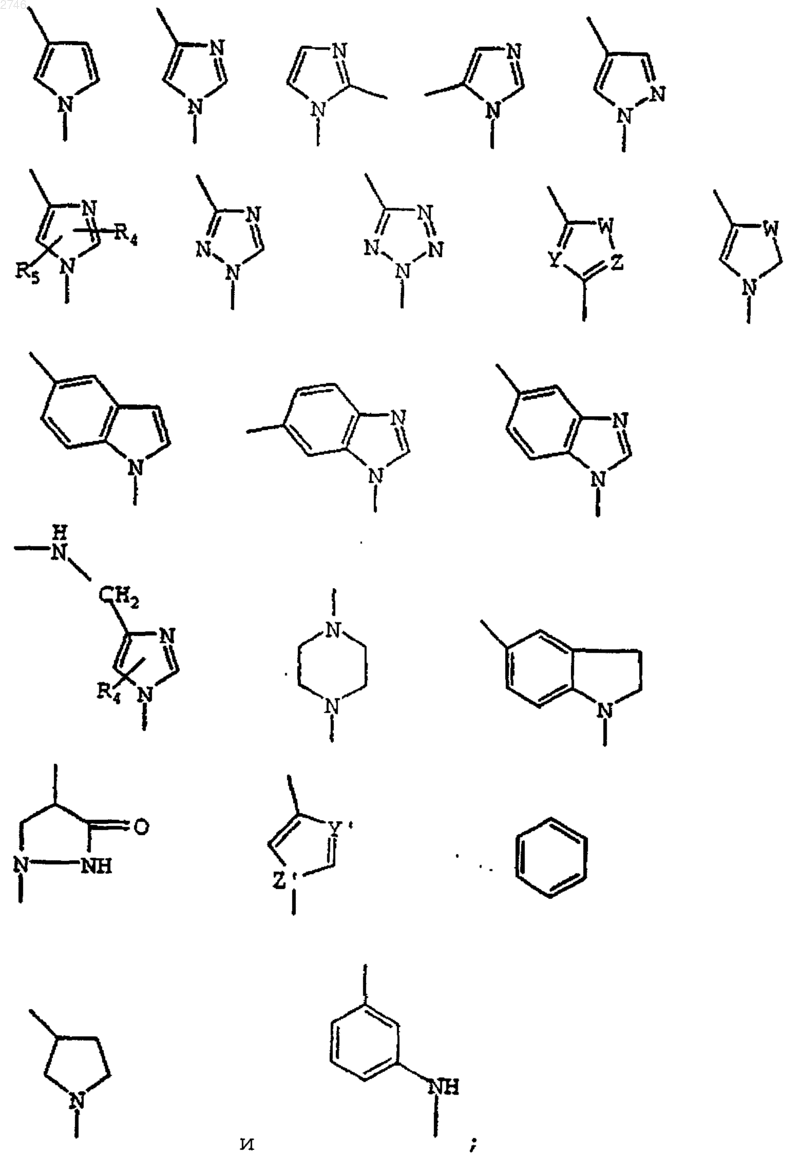
W представляет собой S, О, NH или СН2;
Y представляет собой N или СН;
Z представляет собой N или СН;
Y' представляет собой N или СН;
Z' представляет собой N или СН;
R4 и R5 независимо представляют водород, C1-C6алкил, арил, C1-C6алкиларил, С(О)О(C1-C6алкил), С(O)N(C1-С6алкил)2 или С1-C6алкилСОR7;
R7 представляет собой водород, C1-C6алкил, пирролидинил, пиперидинил, гомопролин или пролин;
D представляет собой водород, C1-C6алкил, C1-C6алкил(О)(СО)С1-C6алкил, С1-C6алкил(O)(СО)N(C1-C6алкил)2, C1-С6алкиларил, С(O)R6, С1-С6алкил(О)R6, C1-C6алкил(ОН), C1-C6алкилС(О)R6, С1-C6алкилR6, арил, (C1-С6алкил)NHSO2(C1-C6алкил), (C1-C6алкил)NHSO2(арил);
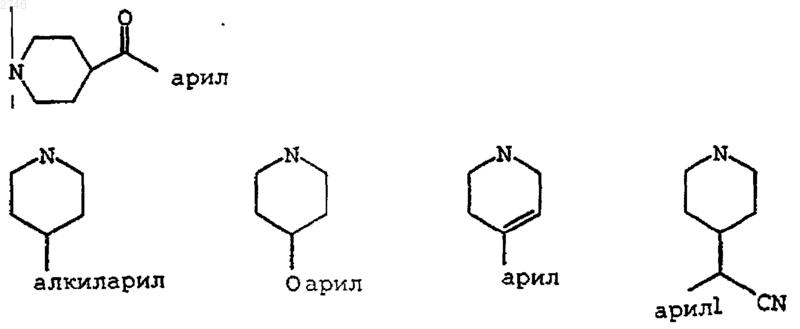
R6 представляет собой Н, C1-C6алкил, арил, нафтил, C1-C6алкиларил, ацетил, NH2, NH(C1-C6алкил), NH (C1-C6алкил)О(C1-C6алкил), NH(C1-С6алкил)S(C1-C6алкил), NH(C1-C6алкилиденил)ОСН3, NH(C1-C6алкил)арил, NH(С3-C6циклоалкил), NH(C1-C6алкил)С(О)(C1-C6алкил), NH(C1-C6алкил)NH(C1-C6алкил), NH(C1-C6алкил)NH(C1-C6алкиларил), NHSO2(C1-С6алкиларил), NH(C1-C6алкил)С(О)О(C1-C6алкил), NH(нафтил), N(C1-C6алкил)2, N(C1-C6алкил)(арил), N(C1-С6алкил)(C1-С6алкиларил), O(C1-C6алкил), О(арил), О(C1-C6алкиларил), пиперидинил, пиперидинил-С(О)NH(C1-C6алкил), пиперидинил-С(О)NH(C1-C6алкиларил), пиперидинил-С(О)N(C1-C6алкил)2, пиперидинил-С(О)N(C1-C6алкил)(арил), пирролидинил, пирролидинилС(О)NH(арил), пирролидинилС(О)NH(C1-C6алкил), пирролидинилС(О)N(C1-С6алкил)2, пирролидинилС(О)NH(C1-С6алкиларил), пирролидинилС(О)NH(C1-C6алкил)арил, пирролинил, морфолино, гексаметиленимино, гептаметиленимино, хинолинил, 2,4-дигидрохинолинил, 1,2,3,4-тетрагидрохинолинил, 2,4-дигидроизохинолинил, 1,2,3,4-тетрагидроизохинолинил, индолинил, аминокислоту, выбранную из группы, включающей пролин, гомопролин, глицин, аланин, валин, лейцин, изолейцин, тирозин, триптофан, фенилаланин, серин, треонин, аспарагин, глутаминовую кислоту, аспарагинововую кислоту, лизин, аргинин, глутамин, гистидин, цистеин и метионин, или азотсодержащий гетероцикл, выбранный из группы, включающей

Е представляет собой водород, C1-C6алкил, C(O)C1-C6алкил, арил, (арил)С(О)R6, (арил)(C1-C6алкил)С(О)R6, C1-C6алкиларил, С(О)арил, C1-С6алкилС(О)арил, нафтил, C1-C6алкилнафтил, С(О)нафтил, C1-C6алкилС(О)нафтил, гетероарил, C1-C6алкилгетероарил, С(О)гетероарил, C1-C6алкилС(О)гетероарил, инданил, C1-С6алкилинданил, С(O)инданил, C1-С6алкилС(О)инданил, циклоалкил;
или D и Е объединены с образованием инданила, флуоренила или циклоалкила;
G представляет собой водород, C1-C6алкил, арил, C1-C6алкиларил и C1-C6алкенил;
J представляет собой водород, C1-C6алкил, арил и C1-C6алкиларил;
L представляет собой водород, C1-С6алкил, C(O)OC1-C6алкил, арил, C1-C6алкиларил, С(О)OC1-C6алкиларил, C1-C6алкенил, -F и -CN, C1-C6алкил-ОН, С1-C6алкил-О-С1-C6алкил, C1-C6алкил-С(О)R6;
или его фармацевтически приемлемая соль или сольват.
2. Соединение по п.1, где А выбран из группы, включающей
3. Соединение по п.1, где В представляет собой

4. Соединение по п.1, где Х представляет собой NH.
5. Соединение по п.1, где V выбран из группы
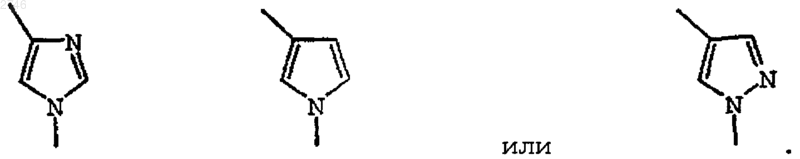
6. Соединение по п.1, где D представляет собой-С(О)R6 и R6 представляет собой 1-пирролидинил, 1-пиперидинил, 4-метил-1-пиперидинил,
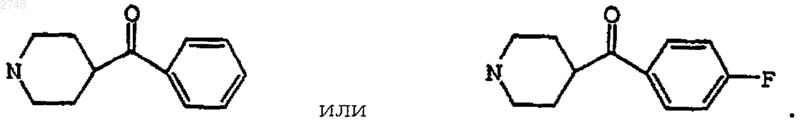
7. Соединение по п.1, где Е представляет собой
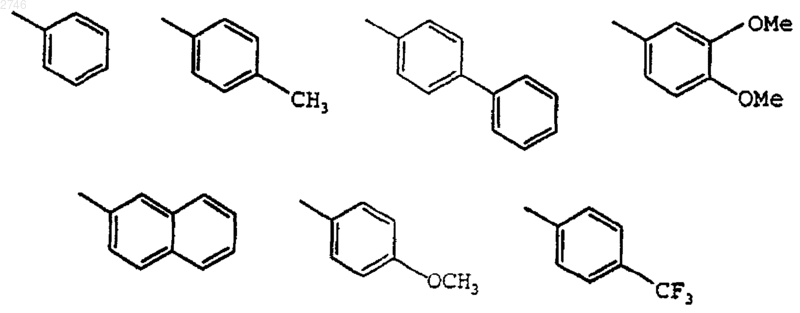
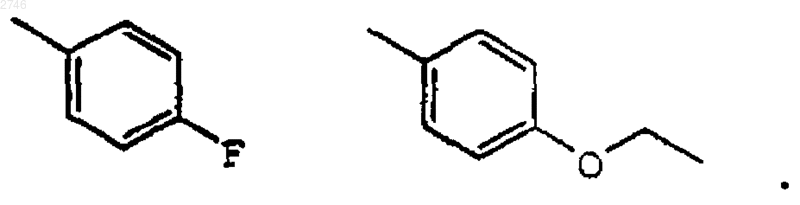
8. Соединение по п.1, где G представляет собой Н.
9. Соединение по п.1, где J представляет собой Н.
10. Соединение по п.1, где L представляет собой Н или СН3.
11. Соединение формулы IA
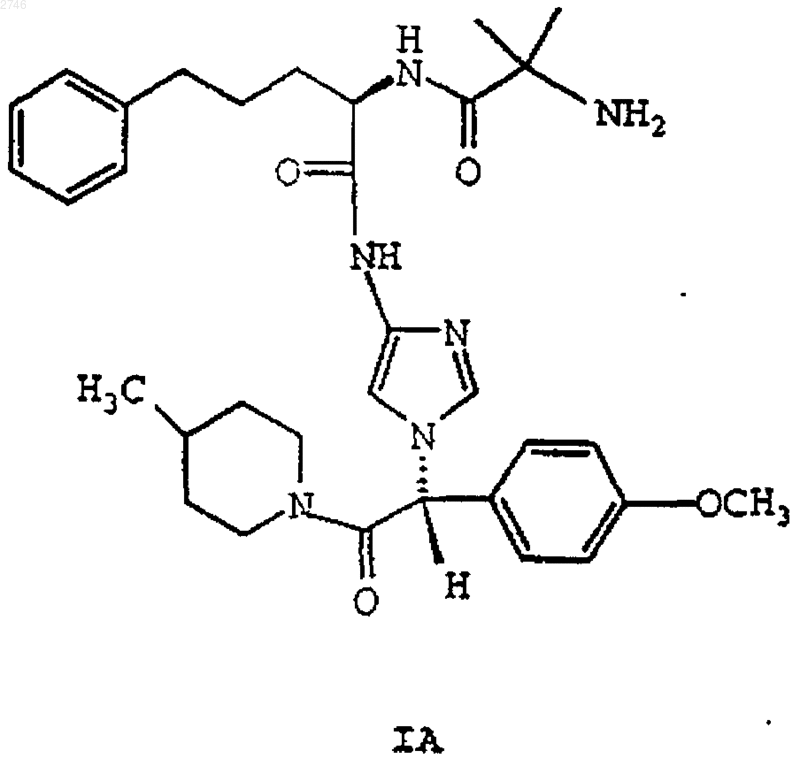
или его фармацевтически приемлемая соль или сольват.
12. Соединение формулы IB
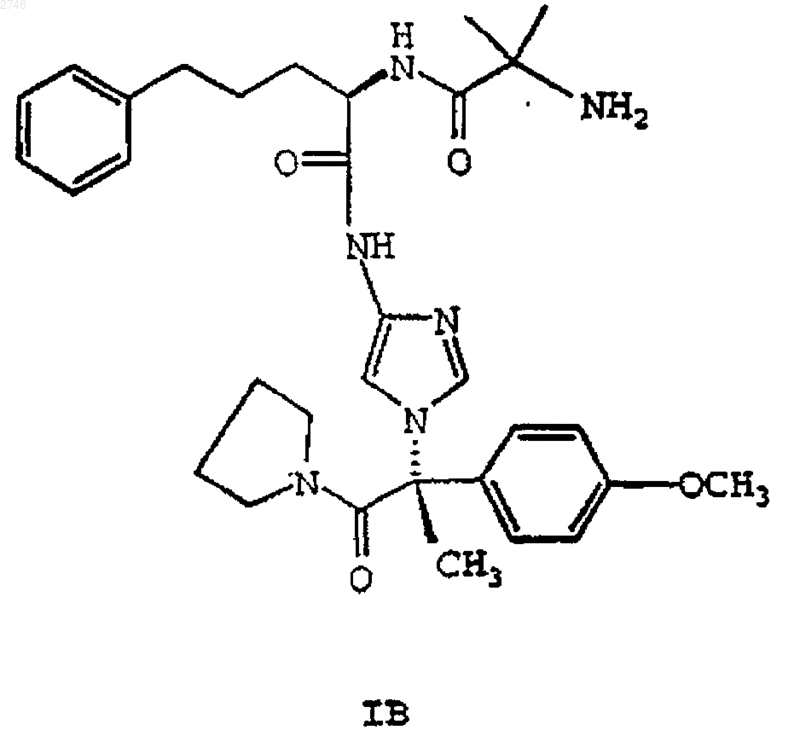
или его фармацевтически приемлемая соль или сольват.
13. Соединение формулы Iа'
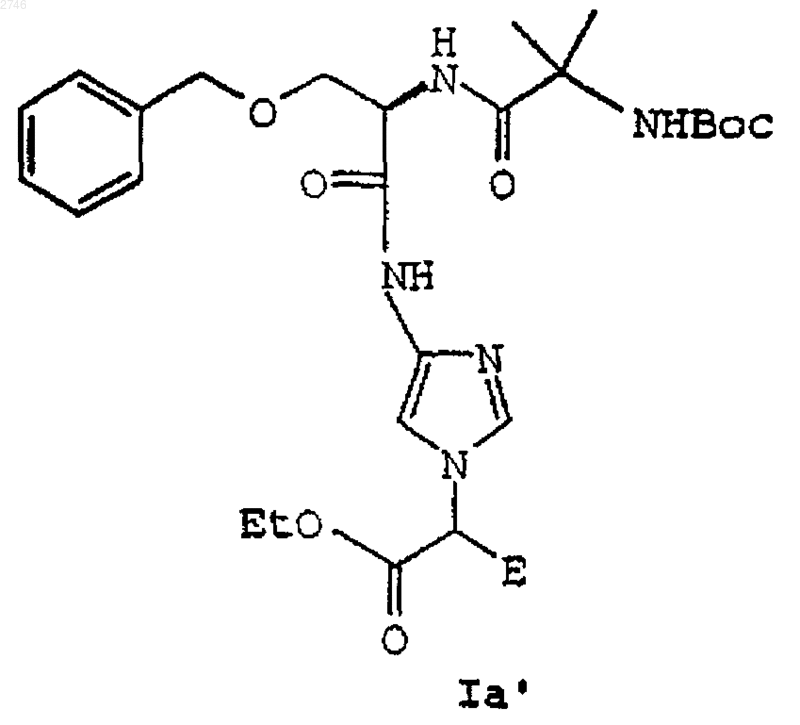
где Е выбран из группы, включающей водород, C1-C6алкил, С(О)C1-С6алкил, арил, (арил)С(О)NR6, (арил)(C1-C6алкил)С(О)R6, C1-C6алкиларил, С(О)арил, C1-С6алкилС(О)арил, нафтил, C1-C6алкилнафтил, С(О)нафтил, C1-С6алкилС(О)нафтил, гетероарил, C1-C6алкилгетероарил, С(О)гетероарил, C1-C6алкилС(О)гетероарил, инданил, C1-С6алкилинданил, С(O)инданил, C1-С6алкилС(О)инданил, циклоалкил;
или его фармацевтически приемлемая соль или сольват.
14. Соединение формулы ZZ

где Е выбран из группы, включающей водород, C1-C6алкил, С(О)C1-C6алкил, арил, C1-C6алкиларил, С(О)арил, C1-C6алкилС(О)арил, нафтил, C1-C6алкилнафтил, С(О)нафтил,C1-C6алкилС(О)нафтил, гетероарил, C1-C6алкилгетероарил, С(О)гетероарил, C1-C6алкилС(О)гетероарил, инданил, C1-C6алкилинданил, С(О)инданил, C1-C6алкилС(О)инданил, циклопропил, циклобутил, циклопентил и циклогексил.
15. Соединение формулы ZZZ
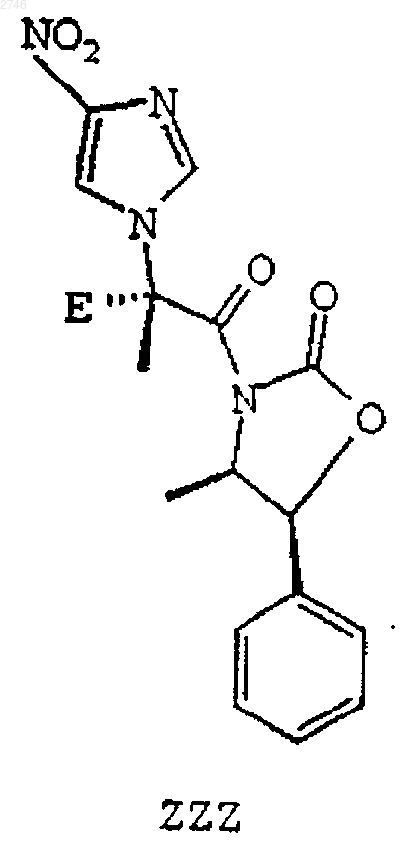
где Е выбран из группы, включающей водород, C1-C6алкил, С(О)C1-C6алкил, арил, C1-C6алкиларил, С(O)арил, C1-C6алкилС(О)арил, нафтил, C1-C6алкилнафтил, С(О)нафтил, C1-C6алкилС(О)нафтил, гетероарил, C1-C6алкилгетероарил, С(О)гетероарил, C1-C6алкилС(О)гетероарил, инданил, C1-C6алкилинданил, С(О)инданил, C1-C6алкилС(О)инданил, циклопропил, циклобутил, циклопентил и циклогексил.
16. Способ повышения уровня секреторного гормона роста у человека и животного, который заключается во введении указанному человеку или животному эффективного количества соединения формулы Id
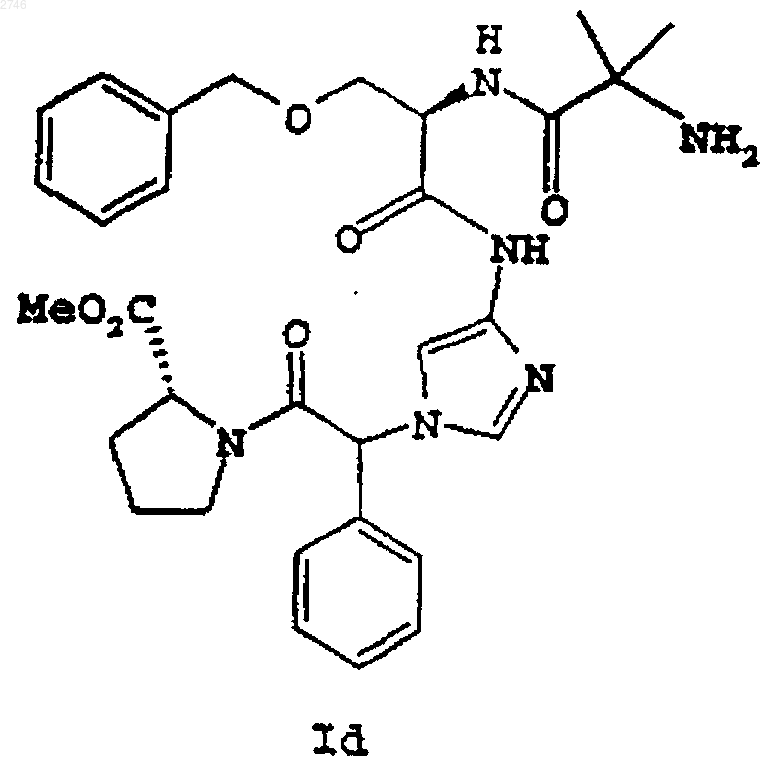
или его фармацевтически приемлемой соли или сольвата.
17. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение по п.1 или его фармацевтически приемлемую соль или сольват в сочетании с одним или несколькими фармацевтически приемлемыми носителями, растворителями или эксципиентами.
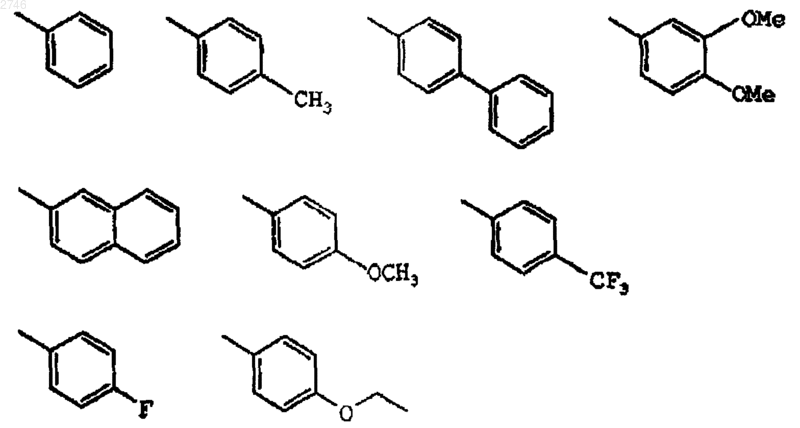
18. Соединение по п.1, где А выбран из группы, включающей
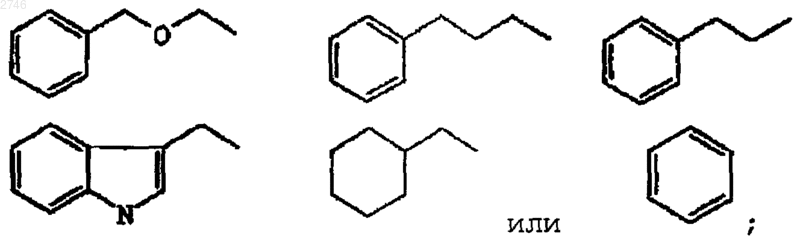
В представляет собой
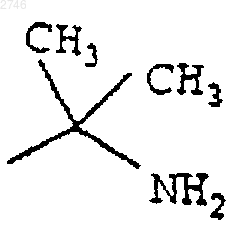
J представляет собой Н;
G представляет собой Н;
Х представляет собой NH;
V представляет собой
Е представляет собой
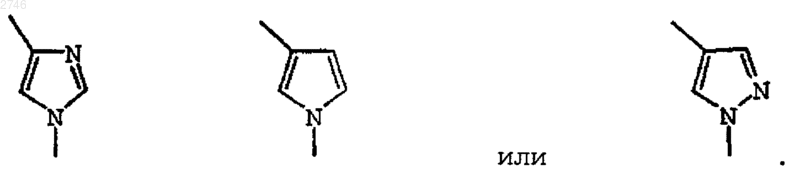
D представляет собой -C(O)R6 и R6 представляет собой 1-пирролидин, 1-пиперидинил, 4-метил-1-пиперидинил,
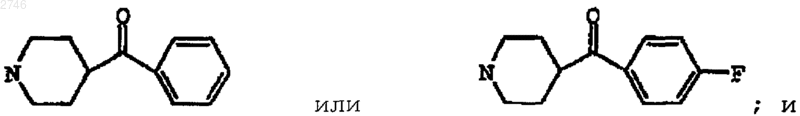
L представляет Н или СН3;
или его фармацевтически приемлемая соль или сольват.
19. Соединение по п.1, представляющее собой соединение формулы
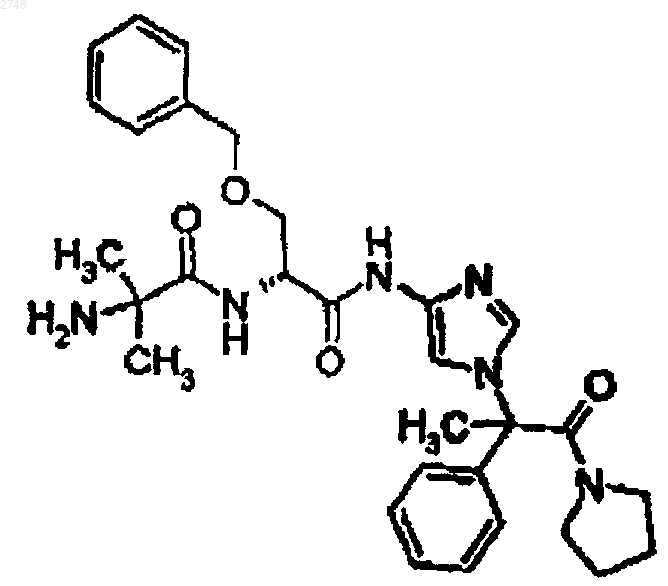
или его фармацевтически приемлемая соль.
20. Соединение по п.1, представляющее собой соединение формулы
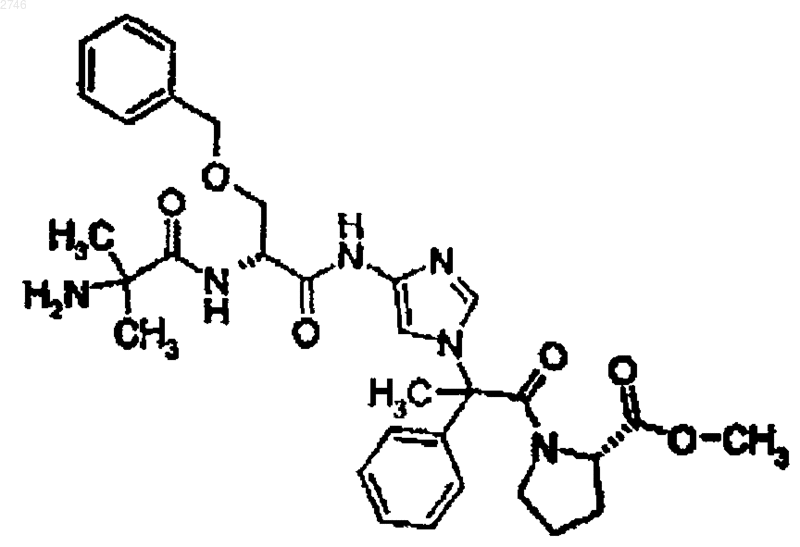
или его фармацевтически приемлемая соль.
21. Соединение по п.1, представляющее собой соединение формулы
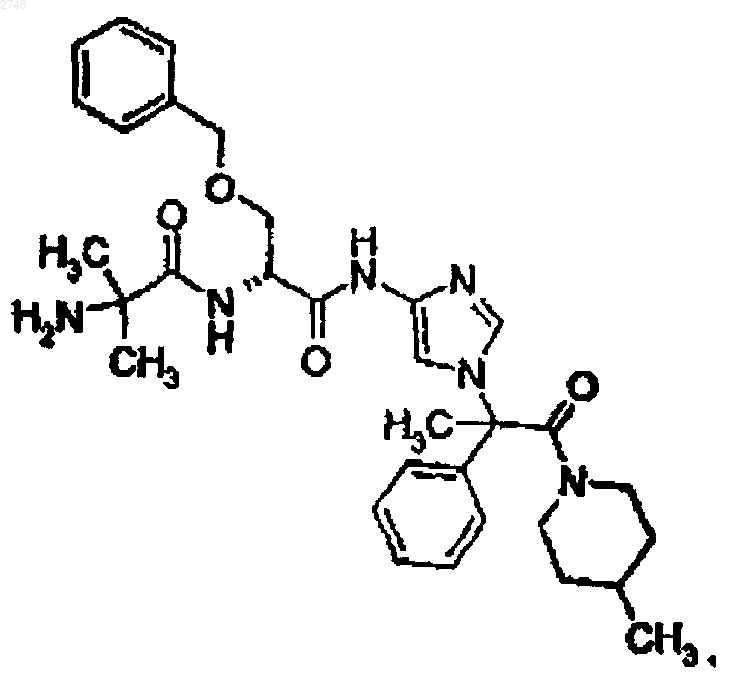
или его фармацевтически приемлемая соль.
22. Соединение по п.1, представляющее собой соединение формулы
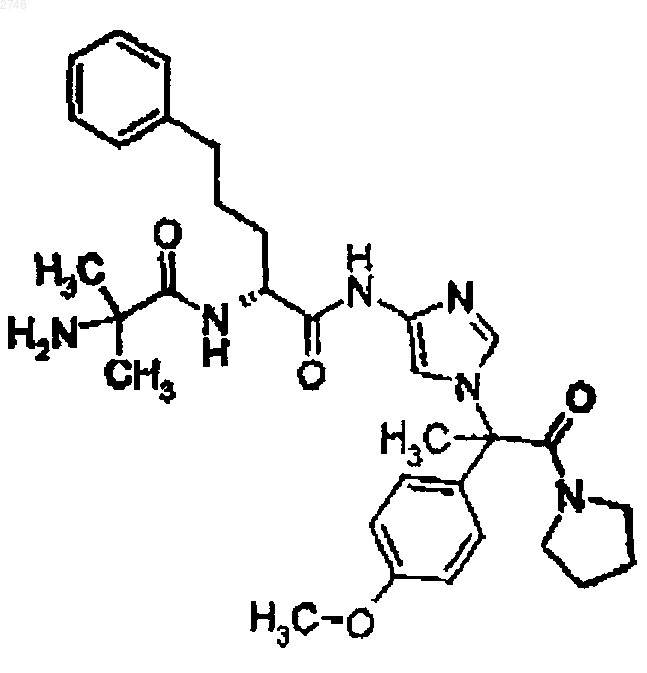
или его фармацевтически приемлемая соль.
23. Соединение по п.1, представляющее собой соединение формулы
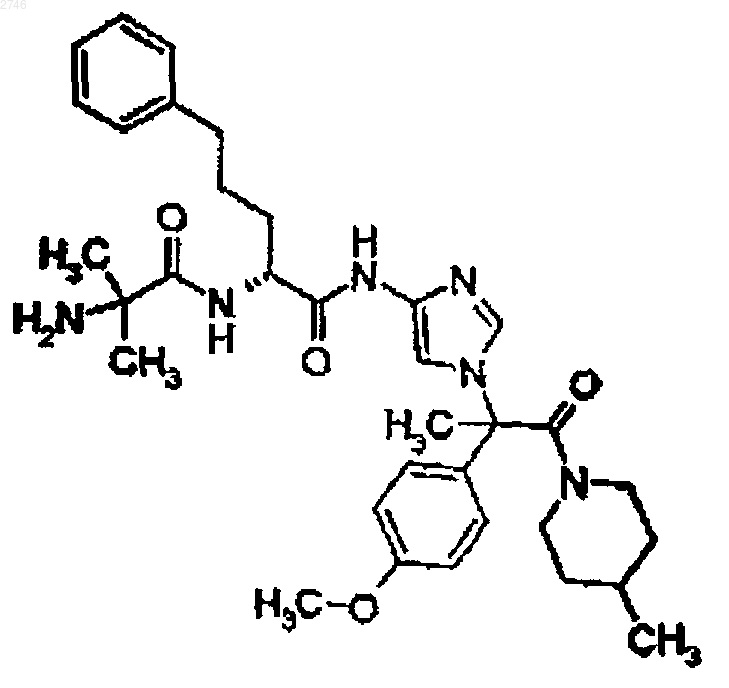
или его фармацевтически приемлемая соль.
24. Соединение по п.1, представляющее собой соединение формулы
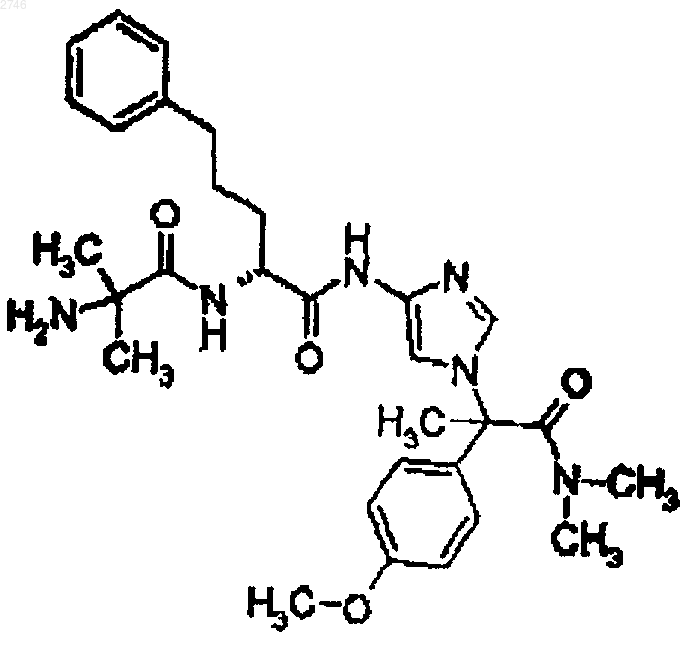
или его фармацевтически приемлемая соль.
25. Соединение по п.1, представляющее собой соединение формулы
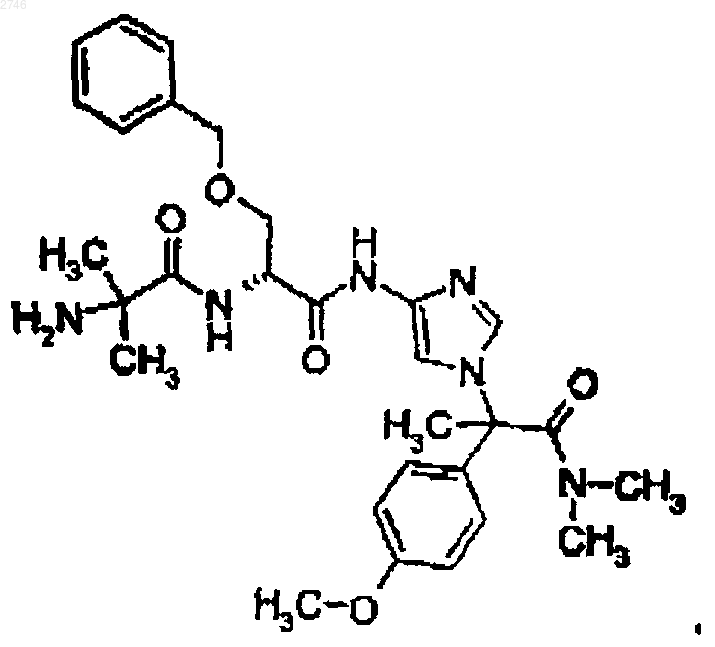
или его фармацевтически приемлемая соль.
26. Соединение по п.1, представляющее собой соединение формулы
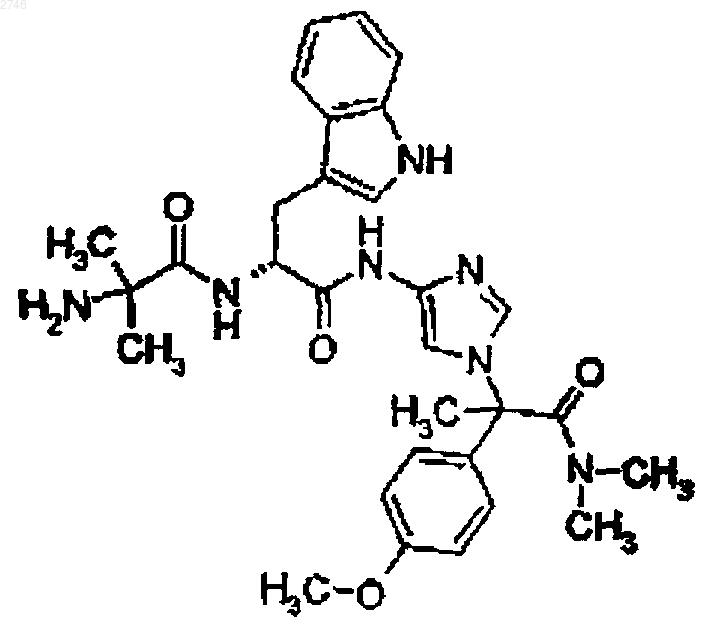
или его фармацевтически приемлемая соль.
27. Соединение по п.1, представляющее собой соединение формулы

или его фармацевтически приемлемая соль.
28. Соединение по п.1, представляющее собой соединение формулы
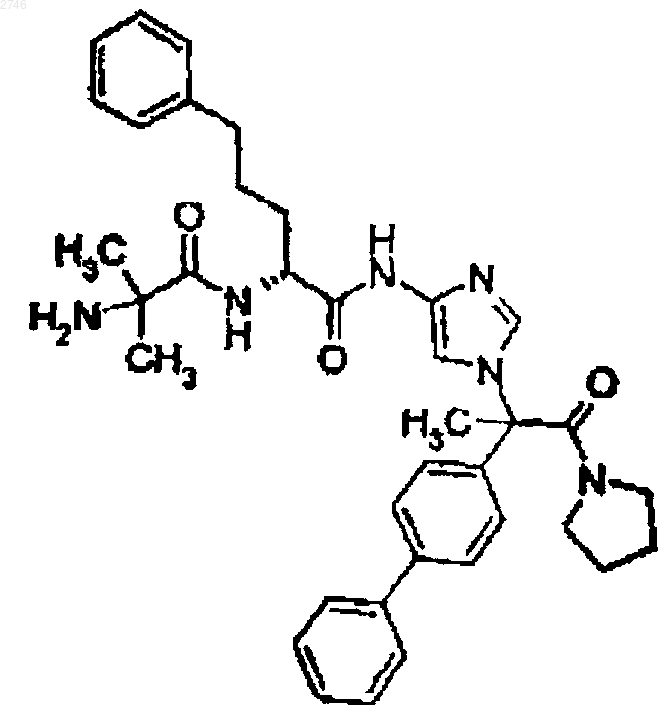
или его фармацевтически приемлемая соль.
29. Соединение по п.1, представляющее собой соединение формулы
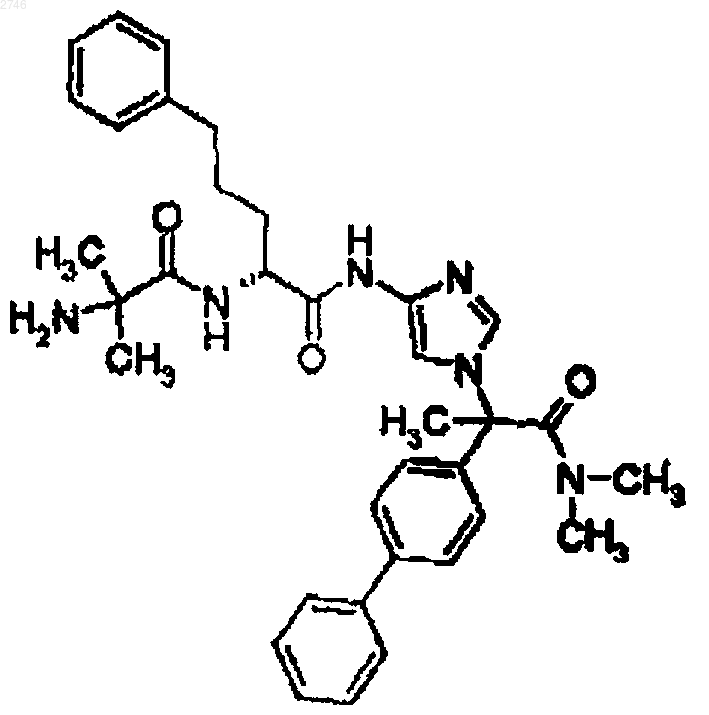
или его фармацевтически приемлемая соль.
30. Соединение по п.1, представляющее собой соединение формулы
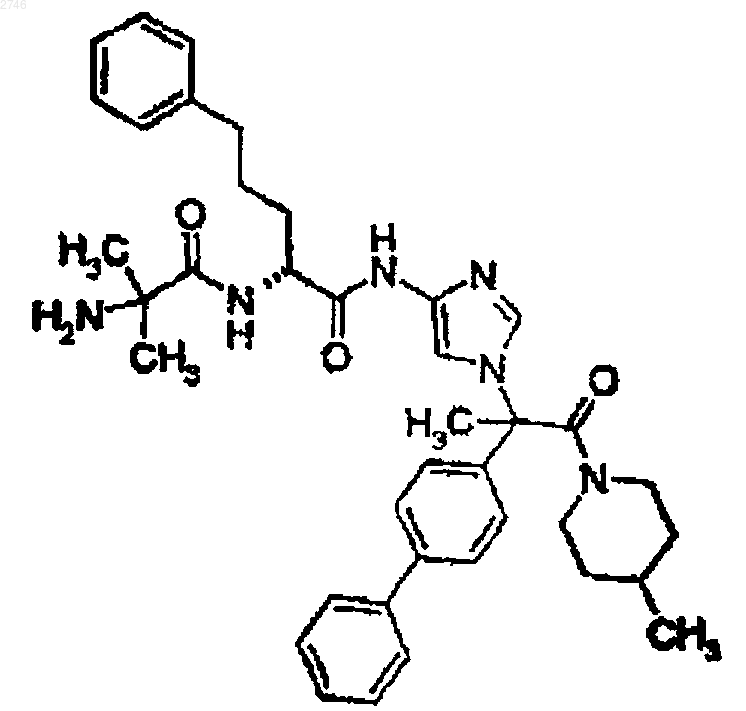
или его фармацевтически приемлемая соль.
31. Соединение по п.1, представляющее собой соединение формулы
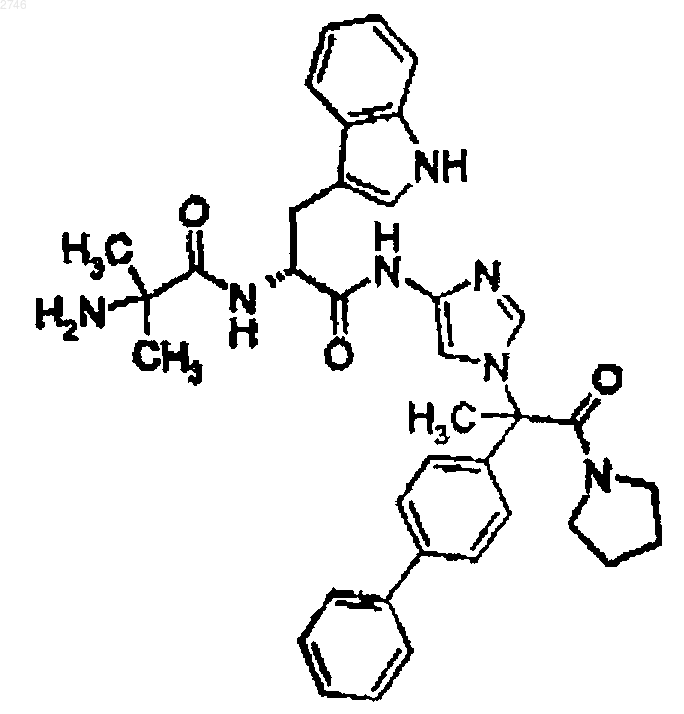
или его фармацевтически приемлемая соль.
32. Соединение по п.1, представляющее собой соединение формулы
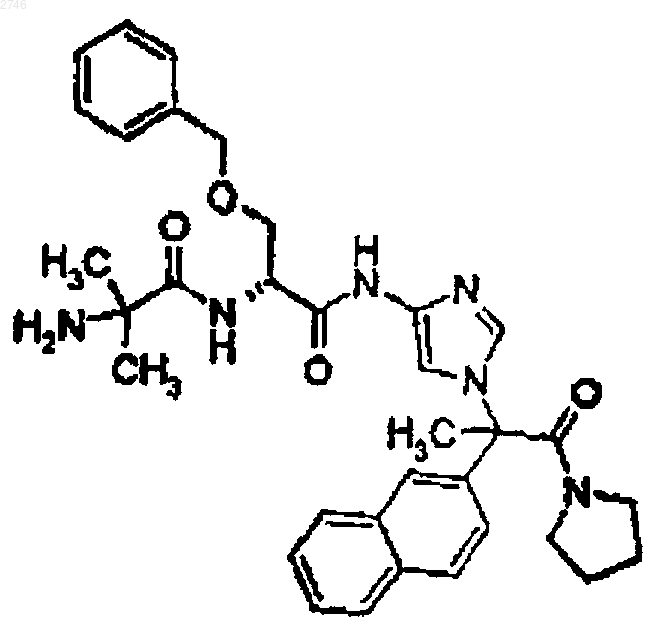
или его фармацевтически приемлемая соль.
Текст
1 Предпосылки изобретения Гормон роста представляет собой секреторный белок гипофиза животных, имеющий широкий спектр эффектов, связанных с развитием организма. Было показано, что искусственное управление содержанием гормона роста имеет значительную терапевтическую применимость. Было показано, что введение человеческого гормона роста является эффективным лечением при недостаточности гормона роста и связанных с ней болезненных состояний человека. Безотносительно к данному применению исследования позволили обнаружить новые и важные свойства гормона роста, которые придают большее значение способности управлять содержанием гормона роста. Например, недавние клинические исследования показали, что добавление гормона роста может быть использовано для борьбы с заболеваниями, связанными со старением человека. Было показано, что повышенное содержание гормона роста у животных приводит к росту постной мышечной массы. Применение этого последнего наблюдения может приводить к увеличению производства постных мясопродуктов или к получению более крупных и/или сильных животных. В то время, как гормон роста в норме продуцируется гипофизом, секреция гормона роста в кровяное русло контролируется другим белком, рилизинг-фактором гормона роста (GRF). Этот гормон также широко известен в данной области как соматокринин, рилизинг гормон гормона роста (GHRH) и рилизинг-гормон роста(GRH). Существует два пути решения проблемы повышения содержания гормона роста в циркуляторном русле: (1) повышение содержания гормона роста в организме непосредственно; (2) повышение природной способности организма к продуцированию гормона роста. Последний путь может быть осуществлен посредством введения GRF. Было показано, что GRF увеличивает содержание гормона роста в циркуляторном русле in vivo (Rivier, et al., Nature (London),300:276 (1982. Действие GRF, включая его структурные аналоги, на продукцию гормона роста было широко изучено. Главным препятствием для использования GRF для непосредственного введения является короткое время жизни in vivo. L.A. Frohman, et al. Journal of ClinicalInvestigation, 78:906 (1986). Таким образом, более сильные и/или более долгоживущие GRF молекулы являются желательными для разработки эффективных терапевтических или животноводческих средств. Структуру GRF всячески изменяли в целях получения более сильных и/или более долгоживущих GRF аналогов. Было показано, что первые 29 аминокислот N-конца являются достаточными для сохранения полной активностиGRF. Speiss, et al., Biochemistry, 21:6037 (1982). Одним направлением являлось присоединение 2 новых D-аминокислотных остатков к различным областям молекулы GRF. V.A. Lance, et al.,Biochemical and Biophysical Research Communications, 119:265 (1984); D.H. Coy, et al., Peptides,8 (suppl. 1):49 (1986). Другое направление состояло в изменении пептидного скелета GRF путем включения изостереомерных пептидных связей в N-концевую область. D. Tourwe, Janssen. Chim. Acta, 3:3 (1985); S.J. Hocart, et al.,Journal of Medicinal Chemistry, 33:1954-58(1990). Ряд весьма активных аналогов GHRH описан в европейской патентной публикации 511003, опубликованной 28 октября 1992 г. Помимо воздействия GHRH существуют различные известные способы высвобождения гормона роста. Например, химические вещества,такие как аргинин, L-3,4-дигидроксифенилаланин (L-ДОФА), глюкагон, вазопрессин и гипогликемия, вызванная инсулином, так же как формы активности, такие как сон и нагрузка,косвенно вызывают высвобождение гормона роста из гипофиза путем некоторого воздействия на гипоталамус, возможно либо с уменьшением секреции соматостатина, либо с увеличением секреции GHRH. В случаях, когда желательно увеличение содержания гормона роста, проблему обычно решают путем введения экзогенного гормона роста или путем введения GHRH, или родственных пептидильных соединений, которые стимулируют продукцию или секрецию гормона роста. В любом случае, пептидильная природа такого соединения требует введения путем инъекции. Были разработаны другие соединения, которые стимулируют высвобождение эндогенного гормона роста, такие как аналоги пептидильных соединений, родственные GHRH. Эти пептиды, несмотря на то, что они значительно меньше гормона роста, являются метаболически неустойчивыми. Введение гексапептида рилизинг-пептида гормона 6 (GHRP-6) приводит к секреции гормона роста у многих видов, включая человека. Этот пептид является одним из ряда синтетических пептидов, структура которых основывалась на пентапептиде Met-энкефалине. Было показано, что GHRP связывается специфично с гипофизом, хотя связывание не включает опиоидные, GHRH или соматостатиновые рецепторы. В последние годы значительные усилия были направлены на разработку непептидильных аналогов данного ряда соединений. Такие соединения, названные стимуляторами секреции гормона роста, должны быть биологически доступными при пероральном применении, индуцировать продукцию или секрецию гормона роста и действовать совместно, или синергически, с GHRH. Типичные стимуляторы секреции гормона роста описаны в патентах США 3239345; 4036979; 4411890; 5206235; 5248841; 5310737; 5310017; европейских патентных публикациях 144230; 513974; патентной публикации по договору о патентной кооперации WO 94/07486; патентной публикации по договору о патентной кооперации WO 94/08583; патентной публикации по договору о патентной кооперации WO 94/13696; заявке на патент США серии 08/704,494, поданной 20 августа 1996 г., заявке на патент США серии 08/700,206, поданной 20 августа 1996 г., и Science, 260:1640-1643(1993). В патенте США 5206235, выданном 27 апреля 1993 года, описан ряд бензолактамных соединений, объединенных следующей структурной формулой. Эти соединения продемонстрировали клиническую активность на людях в повышении уровней секреции гормона роста. B.J. Gertz,Journal of Clinical Endocrinology and Metabolism. 77:1393-1397 (1993). Другая группа средств, усиливающих секрецию гормона роста, описана в патентной публикации по Договору о патентной кооперацииWO 94/13696, опубликована 23 июня 1994 г. Типичные представители этих соединений представлены следующими структурами. Настоящее изобретение относится к ряду соединений, которые обладают активностью в качестве стимуляторов секреции гормона роста. Эти соединения являются не пептидными по природе и являются, следовательно, более метаболически стабильными, чем гормон роста, рилизинг гормон гормона роста, или аналоги любых этих белков. Соединения, используемые в настоящем изобретении, являются предпочтительными для фармацевтического применения на человеке, а также для применения в ветеринарии, в частности на крупном рогатом скоте,свиньях, овцах, домашних птицах и рыбах. Настоящее изобретение относится к соединениям формулы IOC1-C6 алкиларил, C1-C6 алкенил, -F и -CN, C1-C6 алкил-ОН, С 1-C6 алкил-О-С 1-C6 алкил, C1-C6 алкил-С(О)R6; или их фармацевтически приемлемым солям или сольватам. Настоящее изобретение относится также к фармацевтическим препаратам, содержащим соединения формулы I, отдельно или в сочетании с другими соединениями стимуляторами секреции гормона роста и/или в сочетании с приемлемыми костно-антирезорбционными средствами, и к применению указанных соединений и/или препаратов, по меньшей мере, для повышения эндогенных уровней гормона роста у млекопитающего. Настоящее изобретение, кроме того, относится к способам лечения или профилактики физиологического состояния, которое может быть вызвано повышением эндогенного гормона роста, при этом способ включает введение Настоящее изобретение еще далее относится к соединениям формулы IB где Е такой, как определен выше. Также предложены соединения формул ZZ и ZZZ, используемые в качестве хиральных промежуточных соединений при получении соединений формулы I где Е такой, как определено выше. Настоящее изобретение далее относится к способу получения соединений формулы I. Термины и аббревиатуры, используемые в текущих примерах, имеют свое обычное значение, если не указано другое. Например, С относится к градусам Цельсия; н относится к нормальности; ммоль относится к миллимолю или миллимолям; г относится к грамму или граммам; мл означает миллилитр или миллилитры; М относится к мольности или моляр 002746FDMC относится к авто десорбционной массспектроскопии; УФ относится к ультрафиолетовой спектроскопии; ИК относится к инфракрасной спектроскопии; и ЯМР относится к ядерно-магнитной спектроскопии. Как здесь используется, термин C1C6 алкил относится к прямым или разветвленным, моновалентным, насыщенным алифатическим цепям с от 1 до 6 углеродными атомами и включает, но не ограничивается ими, метил,этил, пропил, изопропил, бутил, изобутил, третбутил, пентил, изопентил и гексил. Термин C1-C6 алкил включает в свое определение термин C1-C4 алкил. Как здесь используется, термин циклоалкил относится к циклическим цепям с 1-6 углеродными атомами и включает, но не ограничивается ими, циклопропил, циклобутил, циклопентил и циклогексил. Галоген представляет собой хлор, фтор,бром или йод.C1-C6 алкокси представляет собой прямую или разветвленную алкильную цепь, содержащую от одного до шести атомов углерода,присоединенных к атому кислорода. ОбычныеC1-C6 алкокси группы включают метокси,этокси, пропокси, изопропокси, бутокси, третбутокси, пентокси и тому подобное. ТерминC1-C6 алкокси включает в свое определение термин C1-С 4 алкокси. С 2-C6 алканоил представляет собой прямую или разветвленную алкильную цепь, содержащую от одного до пяти атомов углерода,присоединенных через карбонильную группу. Обычная С 2-C6 алканоильная группа включает этаноил (также называемая как ацетил), пропаноил, изопропаноил, бутаноил, трет-бутаноил,пентаноил, гексаноил и тому подобное.C1-C6 алкилиденил относится к прямой или разветвленной, дивалентной, насыщенной алифатической цепи с от одного до шести углеродными атомами и включает, но не ограничивается ими, метиленил, этиленил, пропиленил,изопропиленил, бутиленил, изобутиленил, третбутиленил, пентиленил, изопентиленил, гексиленил и тому подобное. Термин арил представляет собой ароматическое кольцо или кольца, включая фенил,нафтил, бифенил и ароматические остатки 5-7 членных колец с 1-4 гетероатомами (гетероарил), все из которых могут быть необязательно замещены одним или несколькими заместителями, включая C1-С 6 алкил, -ОС 1-С 6 алкил,-ОСF3, амид, NНамид, карбоксамид, сульфонамид, NНсульфонамид, имид, гидрокси, карбокси, нитро, хлор, фтор, три(хлор или фтор)метил,циано и тому подобное. Ароматические кольца могут быть присоединены к любому атому углерода или гетероатому, при условии образования стабильной структуры. Сюда включен 3,4 метилендиоксифенил. 9 Термин гетероцикл представляет собой стабильное 5-7-членное моноциклическое или 7-10-членное бициклическое гетероциклическое кольцо, которое является насыщенным или ненасыщенным, и которое содержит углеродные атомы и 1-4 гетероатома, выбранных из группы,включающей азот, кислород или серу, и где гетероатомы азота и серы могут быть необязательно окислены, и гетероатом азота может быть необязательно кватернизирован, и включая бициклическую группу, в которой любое из вышеуказанных гетероциклических колец является конденсированным с бензольным кольцом. Гетероциклическое кольцо может быть присоединено к любому гетероатому или углеродному атому, при условии образования стабильной структуры, и может быть необязательно замещено одним или несколькими заместителями,выбранными из группы, включающей C1-C6 алкил, -ОС 1-С 6 алкил, гидрокси, нитро, хлор,фтор или три(хлор или фтор)метил и тому подобное. Термин карбоксизащитная группа, как здесь используется, относится к заместителям карбоксигруппы, обычно используемым для блокирования или защиты функциональной карбоксигруппы в процессе взаимодействия других функциональных групп соединения. Примеры таких защитных групп включают метил, этил, п-нитробензил, п-метилбензил, пметоксибензил,3,4-диметоксибензил,2,4 диметоксибензил, 2,4,6-триметоксибензил, 2,4,6-триметилбензил, пентаметилбензил, 3,4-метилендиоксибензил, бензгидрил, 4,4'-диметоксибензгидрил, 2,2',4,4'-тетраметоксибензгидрил,трет-бутил, трет-амил, тритил, 4-метокситритил,4,4'-диметокситритил, 4,4',4-триметокситритил,2-фенилпроп-2-ил, триметилсилил, трет-бутилдиметилсилил, фенацил, 2,2,2-трихлорэтил, 2(ди(н-бутил)метилсилил)этил, п-толуолсульфонилэтил, 4-нитробензилсульфонилэтил, аллил,циннамил, 1-(триметилсилилметил)проп-1-ен-3 ил и тому подобное. Предпочтительными карбоксизащитными группами при практическом осуществлении настоящего изобретения являются метил или этил. Другие примеры этих групп могут быть найдены в Е. Haslam, supra, в главе 5, и T.W. Greene, et al., supra, в главе 5. Термин аминозащитная группа, как здесь используется, относится к заместителям аминогруппы, обычно используемым для блокирования или защиты функциональной аминогруппы в процессе взаимодействия других функциональных групп соединения. Примеры таких аминозащитных групп включают формил,тритил, фталимидо, трихлорацетил, хлорацетил,бромацетил, йодацетил и защитные группы уретанового типа, такие как бензилоксикарбонил,4-фенилбензилоксикарбонил, 2-метилбензилоксикарбонил, 4-метоксибензилоксикарбонил, 4 фторбензилоксикарбонил,4-хлорбензилоксикарбонил, 3-хлорбензилоксикарбонил, 2-хлор 002746(ФМОК),2-(триметилсилил)этоксикарбонил,аллилоксикарбонил,1-(триметилсилилметил) проп-1-енилоксикарбонил, 5-бензизоксалилметоксикарбонил, 4-ацетоксибензилоксикарбонил,2,2,2-трихлорэтоксикарбонил, 2-этинил-2-пропоксикарбонил, циклопропилметоксикарбонил,4-(децилокси)бензилоксикарбонил, изоборнилоксикарбонил, 1-пиперидилоксикарбонил и тому подобное; бензоилметилсульфонильная группа, 2-нитрофенилсульфенил, дифенилфосфиноксид и тому подобные аминозащитные группы. Используемая аминозащитная группа обычно не является определяющей до тех пор,пока производные аминогруппы стабильны в среде последовательных реакций, протекающих на других положениях промежуточной молекулы, и может быть избирательно удалена в соответствующей точке без разрушения остатка молекулы, включая любые другие аминозащитные группы. Предпочтительной аминозащитной группой в практическом осуществлении настоящего изобретения является трет-бутоксикарбонил (NBoc). Другие примеры групп, относящиеся к вышеуказанным терминам, описаны Е. Haslam, Protective Groups in OrganicGroups in Organic Synthesis (1991), в главе 7. Термин удаляемая группа (Q) относится к группе атомов, которые удаляются от углеродного атома путем атаки нуклеофила в реакции нуклеофильного замещения. Подходящие удаляемые группы включают бром, хлор и йод,бензолсульфонилокси, метансульфонилокси и толуолсульфонилокси. Термин удаляемая группа (Q) включает активирующие группы. Термин активирующие группы, как здесь используется, относится к удаляемой группе, которая, когда взята с карбонильной(-С=O) группой, к которой она присоединена,более вероятно, принимает участие в реакции ацилирования, чем в том случае, если группа не присутствует, как в свободной кислоте. Такие активирующие группы хорошо известны специалистам в данной области и могут представлять собой, например, сукцинимидокси, фтали 11 мидокси, бензотриазолилокси, азидо или -O-СО(С 4-С 7 алкил). Соединения, используемые в способе по настоящему изобретению, могут иметь один или несколько асимметричных центров. В результате наличия этих хиральных центров, соединения по данному изобретению могут быть в виде рацематов, смесей энантиомеров и отдельных энантиомеров, а также в виде диастереомеров и смесей диастереомеров. Все асимметричные формы, отдельные изомеры и их сочетания входят в объем притязаний по настоящему изобретению. Термины R и S используются здесь как они обычно используются в органической химии для обозначения конкретных конфигураций хирального центра. Термин R (rectus) относится к такой конфигурации хирального центра, где старшинство групп, от наивысшей до второй наинизшей, соответствует расположению по часовой стрелке, если смотреть вдоль связи, направленной к самой младшей по старшинству группе. Термин S (sinister) относится к такой конфигурации хирального центра, где группы по старшинству, от наивысшей до второй наинизшей, расположены против часовой стрелке, если смотреть вдоль связи по направлению к младшей по старшинству группе. Старшинство групп основано на их атомном числе (в порядке уменьшения атомного числа). Частичный список старшинств и обсуждение стереохимии содержится в Nomenclature of Organic Compounds: Principles and Practice, (J.H.Fletcher, et al., eds. 1974) на страницах 103-120. В добавление к (R) - (S) системам, более старая D-L система также используется в данном документе для обозначения абсолютной конфигурации, особенно при отсылке к аминокислотам. В этой системе проекционная формула Фишера ориентируется так, чтобы углерод номер 1 главной цепи был бы на вершине. Префикс D используется для представления абсолютной конфигурации изомера, в котором функциональная (определяющая) группа находится на правой стороне углеродного атома при хиральном центре, и L указывает на то, что это изомер, в котором она находится слева. В целях преимущественного получения одного оптического изомера из его энантиомеров, возможно множество путей. В виде примера, может быть получена смесь энантиомеров, и затем два энантиомера могут быть разделены. Обычно используемый способ для разделения рацемической смеси (или смеси энантиомеров) на отдельные энантиомеры заключается в том,что сначала преобразуют энантиомеры в диастереомеры путем образования соли с оптически активной кислотой или основанием. Эти диастереомеры могут быть затем разделены,используя различие в растворимости, путем фракционной кристаллизации, хроматографии или тому подобное. Дальнейшие подробности, 002746 12 касающиеся разделения энантиомерных смесей могут быть найдены в J. Jacques, et al., Enantiomers, Racemates, and Resolutions, (1991). Предпочтительными соединениями по настоящему изобретению являются соединения формулы I, где А представляет собойL представляет собой Н или СН 3; или их фармацевтически приемлемые соли или сольваты. Предпочтительные соединения включают соединение формулы Id представленной ниже: 13 Также предпочтительными являются соединения формулы IA и IB, представленные выше. В течение любой из следующих последовательностей синтеза может быть необходимо или желательно защитить чувствительную или реакционноспособную группу на любой участвующей молекуле. Это может быть достигнуто использованием обычных защитных групп, как описано выше. Соединения по настоящему изобретению могут быть получены многочисленными путями, многие из которых известны специалистам в данной области. Конкретный порядок стадий,используемых в синтезах соединений формулыI, зависит от того, какое соединение должно быть синтезировано, используемых исходных соединений и от относительной неустойчивости замещенных групп. Примеры таких синтетических путей могут быть найдены на схемах I-IV,представленных ниже, а также в примерах. Один из путей синтеза соединений по настоящему изобретению представлен на схеме I ниже. Соединения формул IV' и IV являются коммерчески доступными или могут быть получены с помощью способов, известных в данной области. Соединение формулы IV может быть получено из соединения формулы IV' через промежуточный хлорангидрид кислоты, полученный обычными способами, используя тионилхлорид или оксалилхлорид. Обработка полученного хлорангидрида кислоты источником брома, таким как N-бромсукцинимид, с последующим гашением хлорангидрида кислоты этанолом дает соединение формулы IV. Следует учесть, что вместо брома на соединении формулы IV может быть фактически любая удаляемая группа (Q), как здесь описано. Это получение представлено ниже на схеме IA. Схема IA где R является представителем Е, как определено для соединения формулы I, выше. Исходный продукт затем включает соединения формулы V, которые являются коммерчески доступными или могут быть получены обычными способами синтеза, известными специалисту в данной области. Соединения формулы IV могут связываться с соединением формулы V (4-нитроимидазол) способами, известными в данной области с получением соединения формулы IIb'. Подходящие средства, которые могут быть использованы для связывания этих соединений, включают обработку соединения формулы IV органическим или неорганическим основанием с последующим взаимодействием с бромсодержащим соединением формулы IV. Обычные органические основания включают 14 триалкиламины, гексаметилдисилазид калия,гексаметилдисилазид лития, диизопропиламид лития, карбонат калия и тому подобное. Предпочтительными при практическом осуществлении настоящего изобретения являются гидрид натрия или карбонат калия в диметилформамиде. У соединения формулы IIb' затем удаляют защиту с получением соединения формулы IIb,используя гидроксид лития, хотя в этой реакции могут быть использованы другие реагенты, удаляющие защитные группы. Такие реагенты,удаляющие защитные группы, включают обычные реагенты омыления, такие как гидроксид натрия, гидроксид калия и гидроксид лития. По существу чистые (R) энантиомеры соединения формулы IIb могут быть также синтезированы с помощью способов, представленных в патентах США 5344937 и 5380866, описание которых включено здесь в качестве ссылки. Соединение формулы IIb затем преобразуют в соответствующий амид в соответствующих условиях с соединением формулы VI с получением соединения формулы IIа. Обычно амидирование первичных или вторичных аминов формулы VI может быть осуществлено различными способами, известными в данной области, в которых активация кислоты с образованием более легко удаляемой группы является начальной стадией. Подходящие активирующие агенты для этого также известны в данной области и включают дициклогексикарбодиимид(ДЦК), 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (EDC) с гидроксибензотриазолом (НОВТ), оксалилхлорид, тионилхлорид, РуВОР (бензотриазол-1-ил-окситрипирролидинфосфоний гексафторфосфат) и тому подобное. Предпочтительным при практическом осуществлении настоящего изобретения является гидроксибензотриазол (НОВТ). Нитрогруппа полученного соединения формулы IIа может быть затем восстановлена до аминогруппы с помощью любых подходящих средств, используя подходящий восстанавливающий агент. Предпочтительным при осуществлении настоящего изобретения является каталитическое восстановление с использованием водорода и 5% палладия на угле. Соединение формулы II получают путем этой реакции восстановления. Предпочтительная реакционный температурный интервал, используемый в этих реакциях, находится в области -40 и 150 С, и наиболее предпочтительная область находится между 10 и 40 С. Эти реакции могут быть удобным образом проведены in situ, без выделения конкретного соединения после его получения. Примеры этих реакций представлены на схеме I. где R является представителем Е, как определено ранее, и R2R1N представляет собой R6 как определено ранее. Вторая часть полного синтеза соединений формулы I представлена на схеме II ниже. Представителем исходного продукта для этого синтеза является соединение формулы IIIb', которое является химически защищенной формой аминокислоты 0-серин. Химически-защищенные подразумевает, что обе функциональные группы амино- и карбокси- соответствующим образом защищены с целью облегчения дальнейших взаимодействий с этой молекулой. Такие реакции по введению защитных групп известны в данной области, и могут быть применены к другим другим подходящим исходным продуктам. Промежуточные соединения формулы IIIb' являются коммерчески доступными или могут быть получены обычными методами синтеза аминокислот. Такие синтезы широко известны специалистам в данной области и описаны, например, в Chemistry and Biochemistry ofAmino Acids, (G.C. Chapman ed., 1985). У защищенных аминогрупп могут быть специфически удалены защитные группы с помощью трифторуксусной кислоты и метиленхлорида для дальнейших реакций с этими функциональными аминогруппами. Эта реакция удаления защитных групп приводит к соединению формулыIIIb. Соединение формулы IIIb может затем быть N-ацилировано амино-защищенным соединением формулы Х с получением соединения формулы IIIa'. Подходящие активирующие 16 агенты для этой реакции N-ацилирования известны в данной области и включают ДЦК,НОВТ, EDC и оксалилхлорид. Предпочтительным в практическом осуществлении настоящего изобретения является НОВТ. Соединения формулы Х являются коммерчески доступными или их легко получают из подходящих доступных исходных продуктов. Защищенные карбоксигруппы соединения формулы IIIa' подвергают затем селективному удалению защитных групп,обычно с помощью гидроксида лития с получением соединения формулы III. Соединения формулы III, для которых исходным продуктомIIIb' является метиловый эфир 2-Nbосаминопентановой кислоты, могут быть также получены путем, описанным на схеме II. Соединение формулы III затем связывают с соединением, полученным при восстановлении IIb' водородом и палладиевым катализатором, используя реакцию связывания с получением соединения формулы Iа. Опять, обычные реагенты для этой реакции N-ацилирования известны в данной области, и включают ДЦК и НОВТ, и это является предпочтительным методом связывания, используемым при практическом осуществлении настоящего изобретения. Соединения формулы Iа затем подвергают селективному удалению защитных групп на карбоксильной группе, связывают на этом участке с соединением формулы VI и затем далее удаляют защитные группы на аминогруппе с получением соединения формулы Iа. Подходящие агенты для этих реакций удаления защитных групп и присоединения обсуждаются, ниже, и широко известны в данной области. Соединения формулы Iа охватываются формулой I и являются фармацевтически активными. Предпочтительный реакционный температурный интервал, используемый в этих реакциях, находится в области -40 и 150 С, и наиболее предпочтительная область находится между 10 и 40 С. Эти реакции могут быть удобным образом проведены in situ, без выделения конкретного соединения после его получения. Альтернативно, соединения формулы IIа могут быть связаны с соединениями формулыIII с получением промежуточных продуктов,которые могут быть подвергнуты удалению защитных групп с получением соединений формулы Ia. Представительные реакции показаны ниже на схеме II. 18 удаляют, как обсуждено ранее, обычно с помощью гидроксида лития, с последующим связыванием с соединением формулы XII. Нитрогруппу на полученном соединении формулыVIII затем восстанавливают с последующим связыванием с соединением формулы III. Затем удаляют защитные группы у полученного соединения формулы Ib' с получением соединения формулы Ib. Соединения формулы Ib охватываются формулой I и являются фармацевтически активными. Эти реакции представлены ниже на схеме III. Схема III где R является Е, как определено ранее, и R2R1N являются R6, как определено ранее. Альтернативная схема синтеза представлена на схеме III ниже. Соединение формулыVII (5-нитробензимидазол) является коммерчески доступным или может быть получено обычными методами, известными в данной области. Соединение формулы VII связывают с соединением формулы IV по реакции алкилирования, с помощью связывающего агента, как обсуждается ниже. Получают соединение формулы VIII', в котором функциональная карбоксигруппа является защищенной. Эту защитную группу затем Еще один способ синтеза соединений формулы I представлен ниже на схеме IV. Исходные продукты формулы IX (3-аминонитробензол) являются коммерчески доступными. Сначала соединение формулы IX связывают с соединением формулы IV обсуждаемым ранее способом. Затем удаляют защитные группы у полученного соединения формулы XI' с последующим связыванием с соединением формулыXII с получением соединения формулы XI. Соединение формулы XI затем восстанавливают и проводят дальнейшее связывание по реакции Nацилирования с соединением формулы III. Затем удаляют защитные группы у полученного соединения формулы Iс' с получением соединения формулы Iс. Условия для этих реакций были обсуждены ранее. Соединения формулы Iс охватываются формулой I и являются фармацевтически активными. В дополнение к схемам, обсуждаемым выше, может быть использован энантиоспецифический протокол для получения соединений формулы I. Обычно, выбирают такой путь реакции синтеза, при котором поддерживают желаемую ориентацию хирального центра, имеющегося в исходном продукте. Предпочтительными реакциями синтеза являются те, где обычно получают соединения в которых больше чем 95 процентов продукта является желаемым энантиомером. В схеме V ниже, R-замещенный фенил представляет собой Е заместители, как описано в соединениях формулы I выше. Схема V Следующие объяснения относятся к реакциям, описанным на схеме V. Конкретно, взаи 002746 20 модействия соединений формул I, II и III являются такими, как представлено при обсуждении схемы I выше. Соединение формулы IV может быть получено путем алкилиривания соединения формулы III с помощью обычных методов используя основания, такие как гидрид натрия, затем обработкой электрофилом, таком как метилйодид. Предпочтительные основния для этой реакции включают гексаметилдисилазид натрия,лития или калия, литий диизопропиламид и гидрид натрия. Предпочтительно метилирующие агенты включают метил галогениды или любую метильную группу с подходящей уходящей группой в качестве заместителя, такой как тозилат, мезилат и тому подобное. Соединение формулы V может быть получено путем гидролиза соединения формулы IV,используя обычные омыляющие условия, известные в данной области. Подходящие реагенты для этого преобразования включают гидроксид натрия или гидроксид лития. Полученная карбоновая кислота может быть преобразована в хлорангидрид кислоты с помощью обычных методов, используя тионилхлорид или, предпочтительно, оксалилхлорид. Хлорангидрид кислоты может затем реагировать с литиевой солью с вспомогательным хиральным центром,такой как (4R, 5S)-(+)-4-метил-5-фенил-2 оксазолидинон, с получением соединений формулы V и VI, которые легко разделимы с помощью хроматографии на силикагеле. Соединение формулы VII может быть получено путем удаления вспомогательного хирального центра в щелочных условиях, таких как гидроксид лития. Другие реагенты, известные в данной области для удаления вспомогательного хирального центра, могут использоваться для этого преобразования. Они включают такие условия, как гидроксид лития/перекись водорода, восстановление/окисление, замещение алкилсерой и трансаминирование. Соединение формулы VIII может быть получено из соединения формулы VII способами,известными специалистами. Образование хлорангидрида кислоты с помощью оксалил- или тионилхлорида, затем реакция с подходящим замещенным амином (NR2) дают соединения формулы VIII. Соединение формулы IX может быть получено восстановлением соединения формулыVIII с использованием водорода и палладия на угле. Другие способы, известные в данной области, которые могут быть использованы для восстановления нитрогруппы, включают применение хлорида олова (II), железа в растворе кислоты, сульфата железа и водной щелочи, активированного оксида алюминия и сульфита натрия. Полученное производное 4-аминоимидазола формулы VIIIa затем подвергают прямому взаимодействию с соответствующей дипептидной кислотой (соединение формулыIIХ) в обычных условиях пептидного связывания, включая образование активного сложного эфира дипептида, с последующим взаимодействием с амином VIIa. Условия, подходящие для образования амида, включают ДЦК, EDC с НОВТ. Соединение формулы IIХ может быть получено из метилового эфира неприродных Dаминокислот, таких как D-бензилоксисерин, Dтриптофан и D-2-амино-5-фенилпентановая кислота и тому подобное, которые являются известными в данной области. Обычные методики связывания, включая образование активного сложного эфира аминокислоты с использованием ДЦК/НОВТ, с последующим взаимодействием с N-Вос-аминоизомасляной кислотой дают дипептидные кислоты формулы IIХ. Воc защитная группа соединения формулыIX может быть удалена в обычных кислых средах, таких как соляная кислота в уксусной кислоте или этилацетате, трифторуксусная кислота, хлорид алюминия, серная кислота в диоксане и метансульфоновая кислота. Дополнительный способ получения диастереомерных соединений формулы I включает использование хроматографической колонки с применением хиральной фазы. Пример такого получения может быть найден в примерах части 6, как показано далее. При практическом осуществлении настоящего изобретения предпочтительны такие соединения формулы I, где указанной стерической конфигурацией является (R,R) в двух хиральных центрах. Примером такой предпочтительной конфигурации являются соединения формул IA и IB, как показано выше. Две дополнительные схемы для получения хиральных промежуточных продуктов показаны ниже в виде схем VA и VB. Как описано на схеме VA, оптически чистые арилглицинаминокислоты могут быть защищены в амино положении путем взаимодействия с подходящий защитной группой, такой как Воc. Взаимодействие Воc защищенных промежуточных продуктов с обычным метилирующим агентом, таким как метилйодид, может давать соответствующий фенольный метиловый эфир. Карбоксамид может быть получен связыванием с амином, таким как диметиламин, пирролидин или 4 метилпиперидин, с использованием обычных методик связывания. Предпочтительными агентами связывания по изобретению являются диэтилцианофосфоран (DECP), триэтиламин и амин при 0 С. Воc защитная группа может быть удалена в обычных кислых средах, предпочтительно с трифторуксусной кислотой. Желаемые производные 4-нитроимидазола могут быть получены путем взаимодействия свободного амина с 1,4-динитроимидазолом с получением оптически чистого соединения, как определено хиральной ВЭЖХ. Такие хиральные промежуточные продукты могут быть подвергнуты обработке, как описано на схемах I и II, с получе 002746 22 нием диастереомерных чистых продуктов. Например, хиральные нитроимидазолы, описанные на схемах VA и VB, могут быть восстановлены в обычных условиях, таких как гидрирование на палладиевом катализаторе, с получением соответствующего хирального аминного промежуточного соединения II. Такие промежуточные соединения могут быть последовательно связаны с соединениями типа III, как описано ранее,с получением хирального промежуточного продукта, у которого может быть удалена защита с получением диастереомерно чистых соединений формулы Iа. Схема VA Хиральный синтез подъединицы Dфенилглицинимидазола Дополнительный подход и соответствующая схема синтеза получения соединений по настоящему изобретению представлены ниже на схеме VI: Схема VI Фармацевтически активные соединения формулы I включают, по меньшей мере, соединения IA, IB, Id и Iа', как здесь описано. Соединения формулы I может быть удобным образом подвергнуто скринингу на активность по усилению секреции гормона роста. В 23 типичном анализе могут использоваться клетки гипофиза, находящиеся в культуре, с последующей обработкой различными соединениями формулы I и соответствующего определения уровней гормона роста. Уровни гормона роста могут быть рассчитаны с помощью различных радиоиммунных методов, известных специалистам в данной области. Скрининг соединений на активность по усилению секреции гормона роста может быть удобным образом соотнесен со шкалой высокоскоростного скрининга. Изобретение далее включает способы, использующие фармацевтически приемлемые соли соединений, определенных формулой I. Хотя оно обычно нейтральное, соединение по данному изобретению может содержать достаточно кислотную, достаточно основную, или обе функциональные группы, и соответственно взаимодействовать с любым из множества неорганических оснований, и неорганических и органических кислот с образованием фармацевтически приемлемой соли. Термин фармацевтически приемлемая соль, как здесь используется относится к солям соединений формулы I, которые являются по существу нетоксичными по отношению к живым организмам. Типичные фармацевтически приемлемые соли включают соли, полученные путем взаимодействия соединений по настоящему изобретению с фармацевтически приемлемыми минеральной или органической кислотой, или неорганическим основанием. Такие соли известны как соли добавления кислот и соли добавления оснований. Кислоты, обычно используемые для получения солей добавления кислот, являются неорганическими кислотами, такими как хлористоводородная кислота, бромисто-водородная кислота, йодисто-водородная кислота, серная кислота, фосфорная кислота, и тому подобное, и органическими кислотами, такими как п-толуолсульфоновая, метансульфоновая кислота, щавелевая кислота, п-бромфенилсульфоновая кислота, угольная кислота, янтарная кислота, лимонная кислота, бензойная кислота, уксусная кислота и тому подобное. Примерами таких фармацевтически приемлемых солей является сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат,суберат, себакат, фумарат, малеат, бутин-1,4 диоат, гексин-1,6-диоат, бензоат, хлорбензоат,метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, -гидроксибутират,гликолят, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2 сульфонат, манделат, мезилат и тому подобное. 24 Предпочтительными фармацевтически приемлемыми солями добавления кислот являются образованные с минеральными кислотами, такими как хлористо-водородистая кислота и бромисто-водородная кислота, и образованные с органическими кислотами, такими как малеиновая кислота и метансульфоновая кислота. Соли по аминогруппам могут также представлять кватернизованные соли аммония, в которых амино азот несет подходящую органическую группу, такую как группа алкил, алкенил, алкинил или аралкил. Соли добавления оснований включают соли, полученные из неорганических оснований,такие как гидроксиды аммония или щелочных или щелочно-земельных металлов, карбонаты,бикарбонаты и тому подобное. Такие основания, используемые при получении солей по данному изобретению, включают гидроксид натрия, гидроксид калия, гидроксид аммония,карбонат калия, карбоната натрия, бикарбонат натрия, бикарбонат калия, гидроксид кальция,карбонат кальция и тому подобное. Соли калия и натрия особенно предпочтительны. Следует учесть, что природа конкретного противоиона, составляющего часть любой соли по данному изобретению, не является определяющей в той степени, пока соль является в целом фармацевтически приемлемой и пока противоион не вносит нежелаемых свойств в соль в целом. Данное изобретение далее охватывает способы использования фармацевтически приемлемых сольватов соединений формулы I. Многие соединения формулы I могут объединяться с растворителями, такими как вода, метанол, этанол и ацетонитрил с образованием фармацевтически приемлемых сольватов, таких как соответствующий гидрат, метанолят, этанолят и ацетонитрилат. Данное изобретение также охватывает способы использования фармацевтически приемлемых пролекарств соединения формулы I. Пролекарство представляет собой лекарственное средство, которое химически изменено и может быть биологически неактивным на участке его действия, но которое может быть разложено, или преобразовано одним или несколькими ферментативными или другим in vivo способами в исходную биологически активную форму. Это пролекарство должно иметь иной фармакокинетический профиль, чем исходное,что позволяет более легко абсорбироваться через слизистую оболочку эпителия, легче образовывать соль или лучше растворяться, или обладать улучшенной системной стабильностью(увеличения полупериода жизни в плазме, например). Обычно такие химические модификации включают: 25 1) сложноэфирные или амидные производные, которые могут быть расщеплены эстеразами или липазами; 2) пептиды, которые могут быть распознаны с помощью специфичных или неспецифичных протеаз; или 3) производные, которые накапливаются на участке действия через мембранный отбор пролекарственной формы или модифицированной пролекарственной формы; или любое сочетание 1-3, выше. Обычные способы отбора и получения подходящих пролекарственных производных описаны, например, Н. Bundgaard,Design of Prodrugs, (1985). Как здесь используется, термин эффективное количество означает количество соединения по настоящему изобретению, которое способно ингибировать, облегчать, улучшать,лечить или предотвращать дальнейшие симптомы у млекопитающих, включая человека, которые возникать из-за понижения уровней эндогенного гормона роста. Под фармацевтически приемлемым препаратом подразумевается носитель, разбавитель, эксципиенты и соль, которые должны быть совместимы с активным ингредиентом (соединение формулы I) препарата, и не быть вредными по отношению к реципиенту. Фармацевтические препараты могут быть получены способами, известными в данной области. Например,соединения по данному изобретению могут входить в состав препарата вместе с обычными эксципиентами, разбавителями или носителями и сформованы в таблетки, капсулы и тому подобное. Примеры эксципиентов, разбавителей или наполнителей и носителей, которые являются подходящими для таких препаратов,включают следующее: волокна и наполнители,такие как крахмал, сахара, маннит и кремниевые производные; связующие агенты, такие как карбоксиметилцеллюлоза и другие производные целлюлозы, альгинаты, желатин и поливининилпирролидон; увлажняющие агенты, такие как глицерин; разрыхляющие агенты, такие как агар-агар, карбонат кальция и бикарбонат натрия; агенты для замедления растворения, такие как парафин; ускорители поглощения, такие как четвертичные аммонийные соединения; поверхностно-активные агенты, такие как цетиловый спирт, моностеарат глицерина; адсорбционные носители, такие как каолин и бентонит; и смазывающие агенты, такие как тальк, кальций и стеарат магния и твердые полиэтиленгликоли. Конечными фармацевтическими формами могут быть: пилюли, таблетки, порошки, лепешки,сиропы, аэрозоли, саше, каше, эликсиры, суспензии, эмульсии, мази, суппозитории, стерильные инъекционные растворы или стерильные пакетированные порошки и тому подобное, в зависимости от типа используемого эксципиента. 26 Кроме того, соединения по данному изобретению хорошо подходят для препаратов в виде дозированных форм с замедленным высвобождением. Препараты могут также быть так составлены, что они высвобождают активный ингредиент только или предпочтительно в конкретную часть тонкого кишечника, возможно в течение определенного периода времени. Такие препараты могли бы включать покрытия, оболочки или защитные матрицы, которые могут быть изготовлены из полимерных веществ или восков. Конкретная доза соединения, требуемая для лечения, ингибирования или профилактики симптомов и/или заболеваний хронической сердечной недостаточности у млекопитающего,включая людей, в соответствии с данным изобретением будет зависеть от конкретного заболевания, симптомов и серьезности. Дозировка,пути введения и частота дозирования лучше всего решается лечащим врачом. Обычно, принятыми и эффективными дозами будут от 15 до 1000 мг, и более обычно от 15 до 80 мг. Такие дозы будут вводиться пациенту при необходимости лечения от одного до трех раз в день или так часто, как необходимо для эффективности. Кроме того, соединения, усиливающие секрецию гормона роста, описанные здесь, могут быть введены пациенту при необходимости лечения в сочетании с другими средствами,усиливающими секрецию гормона роста, известными в данной области, и/или с подходящим костным антирезорбтивным средством или средством для профилактики или лечения остеопороза и/или потери силы мышц. Указанные подходящие костные антирезорбтивные средства включают селективные модуляторы эстрогенного рецептора, бифосфонаты, кальцитонин и заменяющие гормон терапевтические средства. Дополнительно РТН может быть введен в сочетании с указанными средствами, усиливающими секрецию гормона роста. Эта комбинационная терапия может быть назначена сопутствующе или последовательно. Подходящие области доз соединений формулы I включают от 0,01 (мкг/кг/день) до 60(мг/кг/день). Представительные фармацевтические препараты, содержащие соединения формулы I, представлены ниже. Препараты, которые даны в целях иллюстрации, не предназначены для ограничения каким либо способом. Общее содержание активных ингредиентов в таких препаратах составляет от 0,1 до 99,9% по массе препарата. Термин активный ингредиент означает соединение формулы I. Препарат 1. Получают твердые желатиновые капсулы,содержащие следующие ингредиенты: 27 Ингредиент Активный ингредиент Крахмал Стеарат магния Вышеуказанные ингредиенты смешивают и помещают в твердые желатиновые капсулы в количестве по 340 мг. Препарат 2. Состав для таблеток получают, используя ингредиенты, указанные ниже: Ингредиент Количество(мг/таблетка) Активный ингредиент 25,0 Целлюлоза, микроцеллюлоза 200,0 Коллоидный диоксид кремния 10,0 Стеариновая кислота 5,0 Компоненты гомогенизируют и прессуют с получением таблеток, каждая весом 240 мг. Препарат 3. Получают препарат сухого порошка для ингаляции, содержащий следующие компоненты: Ингредиент Масса, % Активный ингредиент 5 Лактоза 95 Активную смесь смешивают с лактозой и смесь добавляют в прибор для ингаляции сухим порошком. Препарат 4. Таблетки, каждая из которых содержит 30 мг активного ингредиента, получают следующим образом: Ингредиент Количество(мг/таблетка) Активный ингредиент 30,0 мг Крахмал 45,0 мг Микрокристаллическая целлюлоза 35,0 мг Поливинилпирролидон (в виде 10% раствора в воде) 4, 0 мг Натрий карбоксиметилкрахмал 4, 5 мг Стеарат магния 0, 5 мг Тальк 1,0 мг Всего 120 мг Активный ингредиент, крахмал и целлюлозу пропускают через сито 20 меш U.S. и тщательно смешивают. Раствор поливинилпирролидона смешивают с полученными порошками и затем пропускают через сито 16 меш U.S. Полученные таким образом гранулы сушат при 50-60 С и пропускают через сито 16 меш U.S. Натрий карбоксиметил крахмал, стеарат магния и тальк, предварительно пропущенные через сито No. 30 меш U.S., затем добавляют к гранулам, которые после перемешивания прессуют в машине для получения таблеток, каждая весом 120 мг.(мг/капсула) Активный ингредиент 40,0 мг Крахмал 109,0 мг Стеарат магния 1,0 мг Всего 150,0 мг Активный ингредиент, целлюлозу, крахмал, стеарат магния гомогенизируют, пропускают через сито No. 20 меш U.S. и помещают в твердые желатиновые капсулы в количестве по 150 мг. Препарат 6. Суппозитории, каждый содержащий 25 мг активного вещества, получают следующим образом: Ингредиенты Количество Активный ингредиент 25 мг Глицериды насыщенных жирных кислот до 2,000 мг Активный ингредиент пропускают через сито 60 меш U.S. и суспендируют в глицеридах насыщенных жирных кислот, расплавленных путем минимального необходимого нагревания. Смесь затем выливают в форму для суппозитория номинальной емкостью 2,0 г и дают остыть. Препарат 7. Суспензии, каждая содержащая 50 мг лекарственного средства на 5,0 мл дозу, получают следующим образом: Ингредиенты Количество Активный ингредиент 50,0 мг Ксантановая смола 4,0 мг Натрий карбоксиметилцеллюлоза(11%) 50,0 мг Микрокристаллическая целлюлоза (89%) Сахароза 1,75 г Бензоат натрия 10,0 мг Ароматизирующий и окрашивающий агентыq.v. Очищенная вода до 5,0 мл Активный ингредиент, сахарозу и ксантановую смолу гомогенизируют, пропускают через сито 10 меш U.S. и затем смешивали с предварительно приготовленным раствором микрокристаллической целлюлозы и натрий карбоксиметил-целлюлозы в воде. Бензоат натрия, ароматизирующий и окрашивающий агенты разбавляют небольшим количеством воды и добавляют при перемешивании. Затем добавляют достаточное количество воды для достижения требуемого объема.(мг/капсула) Активный ингредиент 15,0 мг Крахмал 407,0 мг Стеарат магния 3,0 мг Всего 425,0 мг Активный ингредиент, целлюлозу, крахмал и стеарат магния гомогенизируют, пропускают через сито 20 меш U.S. и помещают в твердые желатиновые капсулы в количестве по 425 мг. Препарат 9. Препарат для внутривенного введения может быть получен следующим образом: Ингредиенты Количество Активный ингредиент 250,0 мг Изотонический солевой раствор 1000 мл Препарат 10. Препарат для наружного применения может быть получен следующим образом: Ингредиенты Количество Активный ингредиент 1-10 г Эмульгирующий воск 30 г Жидкий парафин 20 г Белый мягкий парафин До 100 г Белый мягкий парафин нагревают до плавления, добавляют жидкий парафин и эмульгирующий воск и перемешивали до растворения. Добавляют активный ингредиент и перемешивание продолжают до образования дисперсии. Затем смесь охлаждают до затвердевания. Препарат 11. Подъязычные и защечные таблетки, каждая содержащая 10 мг активного ингредиента,могут быть получены следующим образом: Ингредиенты Количество в таблетке Активный ингредиент 10,0 мг Глицерин 210,5 мг Вода 143,0 мг Цитрат натрия 4,5 мг Поливиниловый спирт 26,5 мг Поливинилпирролидон 15,5 мг Всего 410,0 мг Глицерин, воду, цитрат натрия, поливиниловый спирт и поливинилпирролидон смешивают при непрерывном перемешивании и поддержании температуры при около 90 С. Когда полимеры переходят в раствор, раствор охлаждают до около 50-55 С и медленно подмешивают лекарственное средство. Гомогенную смесь выливают в формы, сделанные из инертного материала с получением содержащей лекарственное средство диффузной матрицы, имеющей толщину около 2-4 мм. Эту диффузную матрицу 30 затем нарезают с получением отдельных таблеток, имеющих подходящий размер. Другой препарат, используемый в методах по настоящему изобретению, использует чрескожные средства доставки или пластыри. Такие чрескожные пластыри могут использоваться для обеспечения непрерывного или прерывного вливания соединений по настоящему изобретению в контролируемом количестве. Строение и использование трансдермальных пластырей для доставки фармацевтических агентов хорошо известно в данной области. См., например, патент США 5023252, который здесь включен в качестве ссылки. Такие пластыри могут быть составлены для непрерывной, пульсирующей или какой необходимо доставки фармацевтических агентов. Часто бывает желательно или необходимо ввести фармацевтическую композицию в мозг,либо прямо, либо опосредованно. Прямые методики обычно включают введение катетера для доставки лекарственного средства в сосудистую систему хозяина, для того, чтобы обойти гематоэнцефалический барьер. Одна такая имплантируемая система доставки, используемая для переноса биологических факторов в конкретные анатомические области тела, описаны в патенте США 5011472, описание которого включено здесь в качестве ссылки. Непрямые методики, которые обычно предпочтительны, обычно включают составлений композиций для обеспечения продолжительного действия путем преобразования гидрофильных лекарств в липидрастворимые лекарства или пролекарства. Продолжительность действия достигается путем блокирования гидрокси, карбонильных, сульфатных и первичных аминогрупп, представленных на лекарственном средстве, для того, чтобы лекарственное средство стало более растворимым в липидах и податливым для транспортировки через гематоэнцефалический барьер. Альтернативно, доставка гидрофильных лекарственных средств может быть расширена путем внутриартериального вливания гипертонических растворов, который могут временно открыть гематоэнцефалический барьер. Следующие примеры и приготовления являются иллюстративными для способов, используемых в синтезе соединений по настоящему изобретению. Как понятно специалистам в данной области, могут быть использованы другие схемы синтеза для получения соединений по настоящему изобретению. Примеры, часть 1 Приготовление 1(14,2 г, 169 ммоль), затем метилйодид (26,4 мл,424 ммоль). Через 18 ч реакционную смесь концентрировали до приблизительно 100 мл. Добавляли этилацетат, смесь промывали водным бикарбонатом натрия и насыщенным солевым раствором. Органический экстракт сушили и концентрировали с получением желаемого соединения (25 г, 96%) в виде светло-желтого масла. 1 К раствору соединения по приготовлению 1 (5,0 г, 16 ммоль), перемешиваемому в дихлорметане (25 мл) и анизоле (1 мл) при 0 С, добавляли трифторуксусную кислоту. Через 4 ч при комнатной температуре добавляли насыщенный раствор бикарбоната натрия и смесь экстрагировали этилацетатом. Объединенные органические экстракты промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали. Сырой продукт использовали в последующих стадиях без дополнительной очистки. Приготовление 3 К раствору соединения по приготовлению 2 (65,4 ммоль), bocаминоизомасляной кислоты (13,2 г, 65,4 ммоль), 1-гидроксибензотриазола (8,8 г, 65,4 ммоль) и N,Nдиизопропилэтиламина (22,8 мл, 130,7 ммоль),перемешиваемому в дихлорметане (500 мл) при 0 С, добавляли 1-(3-диметиламинопропил)-3 этилкарбодиимид (12,3 г, 71,9 ммоль). Через 18 ч добавляли этилацетат и насыщенный хлорид аммония, и смесь экстрагировали хлоридом аммония, бикарбонатом натрия и насыщенным солевым раствором. Органические экстракты сушили над сульфатом натрия и концентрировали. Очистка хроматографией на силикагеле(25% этилацетат/гексан) дает желаемое соединение (21,6 г, 83%) в виде белого твердого продукта. 1 К раствору соединения по приготовлению 3 (5,30 г, 13,4), перемешиваемому в диоксане(100 мл)/вода (50 мл) при комнатной температуре, добавляли гидроксид лития (2,80 г, 67,3 ммоль). Через 18 ч добавляли воду и раствор концентрировали. Полученную смесь экстрагировали диэтиловым эфиром. К водному слою добавляли хлорид натрия и доводили рН 1 н. НСl до 3,5. Полученную смесь экстрагировали этилацетатом, и объединенные органические экстракты сушили над сульфатом натрия, затем концентрировали с получением соединения,указанного в заголовке (4,40 г, 86%) в виде белой пены. 1 Н-ЯМР (300 МГц, СDСl3) d 1,39 (с, 9 Н),1,45 (с, 3 Н), 1,47 (с, 3 Н), 3,68 (м, 1H), 3,95 (м,1H), 4,54 (с, 2 Н), 4,70 (м, 1 Н), 5,51 (ушир. с, 1H),7,18 (д, J=9,1 Гц, 1H), 7,25 (м, 5 Н), 9,90 (ушир. с,1H); МС (FD) m/e 381. Для C19H28N2O6: Вычислено: С 59,99; Н 7,42; N 7,36. Найдено: С 59,74; Н 7,26; N 7,30. Приготовление 5(100 г, 466 ммоль), перемешиваемому в абсолютном этаноле (500 мл) при комнатной температуре, добавляли моногидрат п-толуолсульфоновой кислоты (10 г, 53 ммоль). Этот раствор кипятили с обратным холодильником и через 8 ч досуха концентрировали. Полученный остаток растворяли в этилацетате, промывали насыщенным водным бикарбонатом натрия, насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали с получением 77 г (68 %) желаемого продукта в виде оранжевого масла. Данные 1H-ЯMP подтверждают структуру. МС (FD) 241,9, 243,9. Приготовление 6 К суспензии гидрида натрия (13,6 г 60% дисперсии в минеральном масле, 341 ммоль),перемешиваемой в N,N-диметилформамиде (240 мл), осторожно добавляли 4-нитроимидазол(38,6 г, 341 ммоль) таким образом, чтобы температура в процессе добавления оставалась ниже 40 С. Эту полученную суспензию перемешивали в течение 1 ч и затем охлаждали до 5 С. В эту смесь медленно добавляли BX8-MEZ-148(76 г, 310 ммоль) с такой скоростью, чтобы реакционная температура поддерживалась ниже 20 С. Через 4 ч реакционную смесь концентрировали и затем экстрагировали этилацетатом. 33 Объединенные органические экстракты фильтровали, промывали водой, насыщенным солевым раствором, сушили над сульфатом натрия,фильтровали и концентрировали. Полученный остаток очищали с помощью хроматографии на силикагеле (градиент метанол/хлороформ) с получением 60,1 г (70%) желаемого продукта в виде белого твердого вещества. Данные 1 Н-ЯМР подтверждают структуру. МС (FD) 275 (М+). Вычислено: С 56,73; Н 4,73; N 15,27. Найдено: С 56,48; Н 4,78; N 15,08. Приготовление 7 К суспензии 5% Pd/C (0,85 г) и соединения по приготовлению 6 (2,13 г, 7,21 ммоль), перемешиваемой в диоксане (50 мл) при комнатной температуре, добавляли водород (g) (241,316 кПа (35 фунт-сила на квадратный дюйм в аппарате Парра. Через 4 ч смесь продували азотом, добавляли целит и раствор фильтровали через пад из целита. В атмосфере азота к полученному фильтрату добавляли соединение по приготовлению 4 (2,74 г, 7,21 ммоль), 1 гидроксибензотриазол (0,97 г, 7,21 ммоль), N,Nдиизопропилэтиламин (2,5 мл, 14,4 ммоль) и 1(3-диметиламинопропил)-3-этилкарбодиимид(1,36 г, 7,93 ммоль). Через 18 ч добавляли этилацетат и смесь промывали насыщенным водным хлоридом аммония, насыщенным водным бикарбонатом натрия и насыщенным солевым раствором. Органический экстракт сушили над сульфатом натрия и концентрировали. Очистка хроматографией на силикагеле (5% метанол/дихлорметан) дает соединение, указанное в заголовке (1,25 г, 29 %) в виде желтой пены. 1 К раствору соединения по приготовлению 7 (5,3 г, 8,75), перемешиваемому в диоксане (50 мл)/воде (25 мл) при комнатной температуре,добавляли гидроксид лития (0,73 г, 17,50 ммоль). Через 20 мин добавляли воду и реакционную смесь концентрировали до приблизительно 30 мл. Полученную смесь экстрагировали диэтиловым эфиром и водный слой насыща 002746 34 ли хлоридом натрия, затем доводили 1 н. НСl до рН 3,5. Смесь экстрагировали этилацетатом,объединенные органические экстракты сушили над сульфатом натрия и концентрировали с получением соединения, указанного в заголовке К раствору соединения по приготовлению 8 (2,09 г, 3,61 ммоль), пирролидина (0,30 мл,3,61 ммоль) и 1-гидроксибензотриазола (0,54 г,3,97 ммоль), перемешиваемому в безводном ДМФ (50 мл) при 0 С, добавляли 1,3 дициклогексилкарбодиимид (0,82 г, 3,97 ммоль). Через 18 ч при комнатной температуре,реакционную смесь концентрировали, растворяли в дихлорметане, фильтровали и концентрировали. Очистка хроматографией на силикагеле К раствору соединения по приготовлению 9 (1,00 г, 1,58 ммоль) и анизола (0,3 мл), перемешиваемому в безводном дихлорметане (12 мл) при 0 С, добавляли трифторуксусную кислоту (3 мл) и реакционную смесь нагревали до комнатной температуры. Через 4 ч дихлорметан удаляли в вакууме и добавляли в избытке диэтиловый эфир. Через 20 мин реакционную смесь фильтровали с получением соединения,указанного в заголовке (1,02 г, 85%) в виде белого твердого продукта. 1 К суспензии d, 1 амино-4-фенилмасляной кислоты (20,0 г, 111 ммоль), перемешиваемой в 3 н. серной кислоты (200 мл) при 0 С,добавляли тонко измельченный бромид калия(48 г, 403 ммоль). Эту суспензию охлаждали до-10 С, затем по каплям добавляли раствор нитрита натрия (11,0 г, 160 ммоль в воде (75 мл. Медленно нагревая до температуры окружающей среды, полученный раствор перемешивали в течение 4 ч. Полученный преципитат фильтровали с получением 20,0 г желтого твердого продукта. К раствору желтого твердого продукта (18,8 г, 80 ммоль) в абсолютном этаноле (400 мл) добавляли моногидрат п-толуолсульфоновой кислоты (4,6 г, 24 ммоль). Этот раствор кипятили с обратным холодильником в течение 4 ч, фильтровали и концентрировали. Полученный остаток очищали с помощью хроматографии на силикагеле (градиент этилацетат/гексан) с получением 7,2 г (24%) желаемого продукта в виде прозрачного масла. Данные 1H-ЯМР подтверждают структуру. МС (FD) 269, 27. Приготовление 11 К суспензии гидрида натрия (1,0 г 60% дисперсия в минеральном масле, 24 ммоль), перемешиваемой в N,N-диметилформамиде (200 мл) при температуре окружающей среды, осторожно добавляли раствор 4-нитроимидазола (5,7 г, 20 ммоль). Эту смесь охлаждали до 0 С и добавляли раствор соединения по приготовлению 10 (15,2 г, 60 ммоль) в N,N-диметилформамиде(10 мл). Через 16 ч смесь медленно нагревали до температуры окружающей среды, концентрировали и полученный остаток экстрагировали хлороформом. Объединенные органические экстракты промывали водой, насыщенным солевым раствором, сушили над сульфатом натрия,фильтровали и концентрировали. Полученный остаток очищали с помощью хроматографии на силикагеле (хлороформ) с получением 5,0 г К раствору соединения по приготовлению 11 (4,24 г, 14 ммоль) перемешиваемому в тетрагидрофуране (30 мл) и этаноле (30 мл) при комнатной температуре, добавляли 2 н. NaOH (35 мл, 70 ммоль). Через 1 ч эту смесь обрабатывали 5 н. НСl до рН 2,5. Добавляли этилацетат (30 мл) и воду (30 мл), и полученный раствор экстрагировали этилацетатом. Объединенные органические экстракты промывали насыщенным солевым раствором, сушили над сульфатом натрия,фильтровали и концентрировали с получением 3,8 г (98%) желаемого продукта в виде желтого масла. Данные 1H-ЯМР подтверждают структуру. МС (FD) 276 (М+). Приготовление 13 К раствору соединения по приготовлению 12 (3,8 г, 14 ммоль), метилового эфира 1-пролина (1,8 г, 14 ммоль) и 1-гидроксибензотриазолгидрата (2,1 г, 15 ммоль), перемешиваемому в N,N-диметилформамиде (150 мл) при комнатной температуре, добавляли 1,3-дициклогексилкарбодиимид (3,2 г, 15,4 ммоль). Через 16 ч смесь концентрировали и полученный остаток распределяли между этилацетатом и водой. Объединенные органические экстракты промывали водой, насыщенным солевым раствором,сушили над сульфатом натрия и концентрировали. Полученное оранжевое масло очищали с помощью хроматографии на силикагеле (градиенты метанол/хлороформ) с получением 3,8 г К суспензии 10% Pd/C в диоксане (10 мл) добавляли раствор соединения по приготовлению 13 (2,4 г, 6,2 ммоль) в диоксане (100 мл). Смесь затем обрабатывали газообразным водородом (275,79 кПа (40 фунт-сила на квадратный дюйм в аппарате Парра. Через 5 ч добавляли 10% Pd/C (0,5 г) в диоксане (10 мл). Смесь гид 37 рировали в течение 4 ч, затем осторожно фильтровали через целит. К полученному фильтрату добавляли соединение по приготовлению 4 (2,4 г, 6,2 ммоль), 1-гидроксибензотриазолгидрат(0,92 г, 6,8 ммоль), затем 1,3-дициклогексилкарбодиимид (1,4 г, 6,8 ммоль). Через 16 ч реакционную смесь концентрировали, и полученный остаток экстрагировали этилацетатом. Объединенные органические экстракты промывали насыщенным водным бикарбонатом натрия, насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Очистка хроматографией на силикагеле К раствору соединения по приготовлению 14 (2,1 г, 3,0 ммоль), перемешиваемому в дихлорметане (25 мл), добавляли трифторуксусную кислоту (8 мл, 104 ммоль). Через один час добавляли воду (25 мл) и раствор осторожно гасили натрий карбонатом, затем экстрагировали хлороформом. Объединенные органические экстракты промывали насыщенным солевым раствором, сушили над сульфатом натрия,фильтровали и концентрировали. К раствору полученного остатка в диэтиловом эфире (40 мл) добавляли насыщенный раствор НСl в диэтиловом эфире (40 мл). Полученную суспензию концентрировали досуха с получением 1,6 г Взаимодействие соединения по приготовлению 15 (15,22 г, 60 ммоль), гидрида натрия Взаимодействие соединения по приготовлению 16 (3,3 г, 12,0 ммоль), 2 н. NaOH (30 мл,60 ммоль) в этилацетате (30 мл)/этаноле (30 мл) в соответствии с приготовлением 12 дает 2,85 г,(90%) желаемого продукта в виде белого твердого вещества. Данные 1H-ЯМР подтверждают структуру. МС (FD) 262 (М+). Вычислено: С 55,17; Н 4,24; N 16,09. Найдено: С 55,14; Н 4,24; N 15,94. Приготовление 18 Взаимодействие соединения по приготовлению 17 (2,8 г, 11,0 ммоль), метилового эфира 1-пролина (1,4 г, 11,0 ммоль), 1-гидроксибензотриазолгидрата (1,63 г, 12,1 ммоль) и 1,3 дициклогексилкарбодиимида (2,5 г, 12,1 ммоль) в N,N-диметилформамиде (150 мл) в соответствии с приготовлением 13 дает 3,2 г (70,4%) желаемого продукта в виде белого твердого вещества. Данные 1H-ЯМР подтверждают структуру. МС (FD) 372 (М+). Приготовление 19 Взаимодействие соединения по приготовлению 18 (0,6 г, 1,6 ммоль), 5% Pd/C (0,66 г) в 39 этилацетате (50 мл), этаноле (50 мл) и дихлорметане (4 мл), соединения по приготовлению 4 Взаимодействие соединения по приготовлению 19 (0,23 г, 0,33 ммоль), трифторуксусной кислоты (4,0 мл, 24 ммоль) в дихлорметане (12 мл), затем обработка раствором HCl/этилацетата Взаимодействие этилбромацетата (4,9 мл,44 ммоль), 4-нитроимидазола (5,00 г, 44 ммоль) и карбоната калия (12,2 г, 88 ммоль) при температуре окружающей среды в N,N-диметилформамиде (50 мл) в соответствии с приготовлением 3 из раздела примеры, часть 2 А, дает 7,77 г (88%) желаемого продукта в виде оранжевого твердого вещества. Данные 1 Н-ЯМР подтверждают структуру. МС (FD) 199 (М+). Вычислено: С 42,21; Н 4,55; N 21,10. Найдено: С 42,51; Н 4,66; N 21,24. Приготовление 21 Взаимодействие соединения по приготовлению 20 (2,00 г, 10,0 ммоль) и 2 н. NaOH (30 мл, 60 ммоль) в тетрагидрофуране (5 мл) и этаноле (5 мл) в соответствии с приготовлением 12 дает 1,3 г (76%) желаемого продукта в виде желтовато-коричневого твердого продукта, ко 002746 40 торое использовали без дополнительной очистки. Приготовление 22 Взаимодействие соединения по приготовлению 21 (1,20 г, 7,0 ммоль), гидрохлорида метилового эфира 1-пролина (1,27 г, 8,4 ммоль), 1 гидроксибензотриазолгидрата (1,04 г, 8,4 ммоль), триэтиламина (1,95 мл, 14,0 ммоль) и 1,3-дициклогексилкарбодиимида (1,6 г, 8,4 ммоль) в N,N-диметилформамиде в соответствии с приготовлением 13 дает 0,6 г, (30%) желаемого соединения в виде желтоватокоричневого полутвердого продукта. Данные 1H-ЯМР подтверждают структуру. МС (FD) 282 (М+). Приготовление 23 Гидрирование соединения по приготовлению 22 (0,47 мг, 1,1 ммоль) и 5% Pd-C (0,15 г) в этилацетате (20 мл)/этаноле (20 мл), затем обработка 1-гидроксибензотриазолгидратом (225 мг,1,7 ммоль), 1,3-дициклогексилкарбодиимидом Взаимодействие соединения по приготовлению 23 (0,40 г, 0,65 ммоль) и трифторуксусной кислоты (5 мл, 64 ммоль) в дихлорметане(20 мл) в соответствии с примером 2 дает 0,22 г,(67%) желаемого продукта в виде не совсем белого твердого вещества. Данные 1H-ЯМР подтверждают структуру. МС (FD) 514 (М+). Вычислено: С 58,35; Н 6,66; N 16,33. Найдено: С 58,25; Н 6,40; N 16,16. Приготовление 24 Взаимодействие соединения по приготовлению 24 (2,0 г, 6,2 ммоль) и 2 н. NaOH (50 мл,100 ммоль) в тетрагидрофуране (10 мл)/этаноле(8 мл) в соответствии с приготовлением 12 дает 1,4 г, (76%) желаемого продукта в виде желтого твердого вещества. Данные 1H-ЯМР подтверждают структуру. МС (FD) 296 (М+). Вычислено: С 64,86; Н 4,08; N 9,45. Найдено: С 64,60; Н 4,14; N 9,29. Приготовление 26 Взаимодействие соединения по приготовлению 27 (0,38 г, 0,51 ммоль) и трифторуксусной кислоты (2 мл, 26 ммоль) в дихлорметане Взаимодействие соединения по приготовлению 25 (1,0 г, 5,7 ммоль), 1-гидроксибензотриазолгидрата (0,85 г, 6,3 ммоль), гидрохлорида метилового эфира 1-пролина (1,03 г, 6,3 ммоль), триэтиламина (1,6 мл, 11,4 ммоль) и 1,3-дициклогексилкарбодиимида (1,3 г, 6,3 ммоль) в N,N-диметилформамиде (25 мл) в соответствии с приготовлением 13 дает 1,35 г(58%) желаемого продукта в виде желтого твердого вещества. Данные 1H-ЯМР подтверждают структуру. МС (FD) 407 (М+). Вычислено: С 64,86; Н 5,20; N 10,31. Найдено: С 65,20; Н 5,50; N 10,10. Приготовление 27 К раствору соединения по приготовлению 6 (27 г, 98 ммоль) перемешиваемому в тетрагидрофуране (60 мл) и абсолютном этаноле (60 мл) при температуре окружающей среды добавляли 2 н. NaOH (250 мл, 500 ммоль). Через 3,5 ч смесь промывали диэтиловым эфиром, и органический экстракт затем промывали водой. Объединенные водные экстракты подкисляли и полученную смесь экстрагировали этилацетатом. Объединенные органические экстракты промывали один раз насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали с получением 24,2 г(75%) желаемого продукта в виде желтоватокоричневого твердого вещества. Данные 1H-ЯMP подтверждают структуру. МС (FD) 246,9 (М+). Т.пл. = 218-221 С. Вычислено: С 53,44; Н 3,67; N 17,00. Найдено: С 53,71; Н 3,67; N 16,83. Приготовление 29 Гидрирование соединения по приготовлению 26 (0,41 г, 1,0 ммоль) с 5% Pd-C (0,08 г) в этаноле (25 мл)/этилацетате (25 мл), затем обработка 1-гидроксибензотриазолгидратом (0,15 г,1,1 ммоль), 1,3-дициклогексилкарбодиимидом К суспензии соединения по приготовлению 28 (8,15 г, 33 ммоль), перемешиваемому в дихлорметане (100 мл), добавляли оксалилхлорид (11,5 мл, 130 ммоль) и N,N-диметилформамид (2 капли). Через 90 мин при температуре окружающей среды, смесь концентрировали, и остаток растворяли в дихлорметане (40 мл). В полученный раствор добавлялиN,N 43 диизопропилэтиламин (6,5 мл, 360 ммоль) и 1 пролинметиловый эфир (3,9 г, 20 ммоль) в дихлорметане (4 мл). Через 2 ч при температуре окружающей среды, смесь экстрагировали этилацетатом и объединенные органические экстракты промывали водой, насыщенным солевым раствором, сушили над сульфатом натрия,фильтровали и концентрировали. Полученный остаток очищали с помощью хроматографии на силикагеле (этилацетат/гексан) с получением 10,7 г (71%) желаемого продукта в виде желтовато-коричневой пены. Данные 1H-ЯМР подтверждают структуру. Т.пл. = 103-111 С. Вычислено: С 56,98; Н 5,06; N 15,63. Найдено: С 56,75; Н, 5,14; N 15,44. Приготовление 30(30 мл) добавляли раствор соединения по приготовлению 29 (1,0 г, 2,8 ммоль) в этаноле (100 мл). Смесь гидрировали при 275,79 кПа (40 фунт-сила на квадратный дюйм) в аппарате Парра. Через 25 мин добавляли дополнительные 5% Pd/C (0,5 г) и смесь последовательно гидрировали в течение 45 мин, затем фильтровали через целит и концентрировали. К суспензии полученного остатка в N,N-диметилформамиде(0,31 г, 2,3 ммоль), затем 1,3-дициклогексилкарбодиимид (0,48 г, 2,3 ммоль). Через 48 ч смесь фильтровали и концентрировали, и остаток очищали с помощью радиальной хроматографии (силикагель, градиент метанол/хлороформа). Полученный продукт растворяли в этилацетате и промывали водой, сушили над сульфатом натрия, фильтровали и концентрировали с получением 0,5 г (30%) желаемого продукта в виде желтовато-коричневой пены. Данные 1H-ЯМР подтверждают структуру. МС (FD) 605 (М+). Приготовление 31 К раствору соединения по приготовлению 30 (3,1 г, 5,1 ммоль) перемешиваемому в метаноле (200 мл) при комнатной температуре добавляли 5 н. НСl (51,0 ммоль). Через 16 ч, остаток распределяли между этилацетатом и водой, 002746 44 экстрагировали этилацетатом. Объединенные органические экстракты промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали с получением 2,1 г (81%) желаемого соединения в виде желтовато-коричневой пены. Данные 1H-ЯМР подтверждают структуру. МС (FD) 506 (М+). Вычислено: С 64,14; Н 6,18; N 13,85. Найдено: С 63,92; Н 6,18; N 13,56. Приготовление 32 К раствору соединения по приготовлению 31 (2,1 г, 4,2 ммоль) перемешиваемому в N,Nдиметилформамиде (200 мл) добавляли Вос-аминоизомасляную кислоту (0,85 г, 4,2 ммоль),1-гидроксибензотриазолгидрат (0,62 г, 4,6 ммоль). Через 16 ч смесь концентрировали досуха, и полученный остаток экстрагировали этилацетатом. Объединенные органические экстракты промывали водой, насыщенным солевым раствором, сушили над сульфатом натрия,фильтровали и концентрировали. Очистка хроматографией на силикагеле (метанол/хлороформ) давало 2,3 г (80%) желаемого продукта в виде желтовато-коричневой пены. Данные 1H-ЯMP подтверждают структуру. МС (FD) 690 (М+). Пример 6 К раствору соединения по приготовлению 32 (1,75 г, 2,5 ммоль) перемешиваемому в дихлорметане (190 мл) добавляли трифторуксусную кислоту (63 мл, 780 ммоль). Через 1 ч смесь осторожно выливали в насыщенный водный бикарбонат натрия и экстрагировали этилацетатом. Объединенные органические экстракты промывали насыщенным солевым раствором,сушили над сульфатом натрия, фильтровали и концентрировали. Остаток растворяли в этилацетате (250 мл) и затем обрабатывали насыщенным раствором НСl в этилацетате (100 мл). Полученную смесь концентрировали досуха,растирали с диэтиловым эфиром и фильтровали с получением 0,6 г (38%) желаемого продукта в виде желтовато-коричневого твердого вещества. Данные 1H-ЯMP подтверждают структуру. МС (FD) 590 (М+). ИК (КВr) 3164, 3030, 2978, 45(этилацетат/гексан) соединения по приготовлению 29 с получением 1,3 г желаемого изомера. Данные 1H-ЯМР подтверждают структуру. МС (FD) 358 (М+). Т.пл. = 114-118 С. Вычислено: С 56,98; Н 5,06; N 15,63. Найдено: С 57,22; Н 4,87; N 15,34. Приготовление 34 Гидрирование соединения по приготовлению 29 (1,0 г, 2,8 ммоль) и 5% Pd/C (0,756 г) в абсолютном этаноле (20 мл)/этилацетате (20 мл), затем обработка полученной смеси boc-dбензилоксисерином (0,83 г, 2,8 ммоль), 1-гидроксибензотриазолгидратом (0,42 г, 3,4 ммоль) и 1,3-дициклогексилкарбодиимидом (0,64 г, 3,1 ммоль) в соответствии с приготовлением 1 дает 0,69 г (41%) желаемого продукта в виде кристаллического твердого вещества. Очистка хроматографией на силикагеле (метанол/хлороформ), затем перекристаллизация из этилацетата. Данные 1H-ЯМР подтверждают структуру. МС (FD) 605 (М+). Т.пл. = 184-186 С. Вычислено: С 63,46; Н 6,49; N 11,56. Найдено: С 63,61; Н 6,31; N 11,38. Приготовление 35 Взаимодействие соединения по приготовлению 34 (0,61 г, 1,0 ммоль) и трифторуксусной кислоты (1,7 мл, 22 ммоль) в дихлорметане (40 мл) в соответствии с приготовлением 1 дает 0,5 г (100%) желаемого продукта в виде пены. Данные 1H-ЯМР подтверждают структуру. МС (FD) 506 (М+). Т.пл. = 55-60 С. Взаимодействие соединения по приготовлению 35 (0,5 г, 1 ммоль), 1-гидроксибензотриазолгидрата (0,15 г, 1,1 ммоль) и 1,3-дициклогексилкарбодиимида (0,23 г, 1,1 ммоль) в Взаимодействие соединения по приготовлению 36 (0,595 г, 0,95 ммоль) и трифторуксусной кислоты (0,7 мл, 9,0 ммоль) в дихлорметане Взаимодействие соединения по приготовлению 29 (2,63 г, 8,0 ммоль), boc-1-бензилоксисерина (2,4 г, 8,0 ммоль), 1-гидроксибензотриазолгидрата (1,2 г, 8,8 ммоль), 1,3-дициклогексилкарбодиимида (1,8 г, 8,8 ммоль) в N,Nдиметилформамиде (250 мл) дает 2,4 г (50%) желаемого продукта в виде желтоватокоричневой пены. Данные 1H-ЯMP подтверждают структуру. МС (FD) 605 (М+). Приготовление 38 47 Взаимодействие соединения по приготовлению 37 (2,3 г, 3,8 ммоль), трифторуксусной кислоты (35 мл, 45 ммоль) в дихлорметане (90 мл) дает 1,4 г (74%) желаемого продукта в виде желтовато-коричневой пены. Данные 1 Н-ЯМР подтверждают структуру. МС (FD) 506 (М+). Приготовление 39 Взаимодействие соединения по приготовлению 38 (1,1 г, 2,2 ммоль), bocаминоизомасляной кислоты (0,45 г, 2,2 ммоль), 1 гидроксибензотриазолгидрата (0,33 г, 2,4 ммоль) и 1,3-дициклогексилкарбодиимида (0,5 г, 2,4 ммоль) в N,N-диметилформамиде (100 мл) дает 0,84 г (55%) желаемого продукта в виде желтовато-коричневой пены. Данные 1 Н-ЯМР подтверждают структуру. МС (FD) 690 (М+). Пример 8 48 центрировали и остаток экстрагировали этилацетатом. Объединенные органические экстракты фильтровали, промывали насыщенным водным бикарбонатом натрия, водой, насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Полученный остаток очищали с помощью хроматографии на силикагеле (метанол/хлороформ) с получением 0,75 г, (60%) желаемого продукта в виде белой пены. Данные 1H-ЯМР подтверждают структуру. МС (FD) 316 (М+). Приготовление 41 Взаимодействие соединения по приготовлению 39 (0,7 г, 1,0 ммоль), трифторуксусной кислоты (25 мл, 320 ммоль) в дихлорметане,затем растворение в этилацетате (100 мл) и обработка этилацетатом, насыщенным НСl (100 мл) давало 0,29 г (44%) желаемого соединения в виде белого твердого продукта. Данные 1H-ЯМР подтверждают структуру. МС (FD) 590 (М+). ИК (КВr) 3163,75, 3031,15,2952,46, 2876,38, 1745,07, 1664,94, 1530,69,1497,79, 1453,37, 1435,81, 1197,21, 1177,62,1094,93, 747,95, 701,04 см-1. Вычислено: С 56,11; Н 6,08; N 12,66. Найдено: С 56,16; Н 5,92; N 12,56. Приготовление 40(5 мл) осторожно добавляли раствор соединения по приготовлению 40 (0,67 г, 2,0 ммоль) в этилацетате (25 мл)/этаноле (25 мл). Полученную суспензию обрабатывали газообразным водородом при 275,79 кПа (40 фунт-сила на квадратный дюйм) в аппарате Парра. Через 1 ч в эту смесь добавляли суспензию 5% Pd/C (0,18 г) в этилацетате (10 мл), затем гидрировали при 275,79 кПа (40 фунт-сила на квадратный дюйм). Через 1 ч смесь фильтровали через целит и концентрировали. К остатку, перемешиваемому вN,N-диметилформамиде (100 мл), добавляли соединение по приготовлению 4 (0,53 г, 1,4) и 1 гидроксибензотриазолгидрат (0,21 г, 1,54 ммоль), затем 1,3-дициклогексилкарбодиимид(0,32 г, 1,54 ммоль). Через 16 ч при комнатной температуре раствор концентрировали и экстрагировали этилацетатом. Объединенные органические экстракты промывали водой, насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Полученный остаток очищали с помощью хроматографии на силикагеле (метанол/хлороформ) с получением 0,27 г (30%) желаемого продукта в виде желтовато-коричневой пены. Данные 1 НЯМР подтверждают структуру. МС (FD) 448 К раствору соединения по приготовлению 28 (1,0 г, 4,0 ммоль), морфолина (0,35 мл, 4,0 ммоль), 1-гидроксибензотриазолгидрата (0,6 г,4,4 ммоль), перемешиваемому в N,Nдиметилформамиде (50 мл) при комнатной температуре добавляли 1,3-дициклогексилкарбодиимид (0,9 г, 4,4 ммоль). Через 16 ч смесь кон К раствору соединения по приготовлению 41 (0,27 г, 0,42 ммоль) перемешиваемому в дихлорметане (12 мл) при комнатной температуре добавляли трифторуксусную кислоту (4 мл, 51 ммоль). Через 1,5 ч добавляли воду (40 мл) и 49 реакционную смесь осторожно гасили твердым бикарбонатом натрия. Полученную смесь экстрагировали этилацетатом и объединенные органические экстракты промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Концентрат растворяли в этилацетате (40 мл) и затем обрабатывали насыщенным раствором НСl в этилацетате (40 мл). Через 15 мин смесь концентрировали с получением 0,14 г (54%) желаемого продукта в виде белого твердого вещества. Данные 1H-ЯMP подтверждают структуру. МС (FD) 548 (М+). ИК (КВr) 2927, 2858,9,1659,3, 1542,2, 1114,4 см-1. Вычислено: С 56,04; Н 6,16; N 13,52. Найдено: С 55,78; Н 6,11; N 13,27. Приготовление 42 Взаимодействие соединения по приготовлению 28 (1,0 г, 4,0 ммоль), пиперидина (0,4 мл,4,0 ммоль), 1-гидроксибензотриазолгидрата (0,6 г, 4,4 ммоль) и 1,3-дициклогексилкарбодиимида Гидрирование соединения по приготовлению 42 (0,91 г, 2,9 ммоль) в этилацетате (50 мл)/этаноле (50 мл), 5% Pd/C (0,36 г) в этилацетате (5 мл), затем реакция с соединением получения 4 (0,95 г, 2,5 ммоль), 1-гидроксибензотриазолгидратом (0,37 г, 2,75 ммоль) и 1,3 дициклогексилкарбодиимидом (0,57 г, 2,75 ммоль) дает 0,43 г (25%) желаемого продукта в виде желтовато-коричневой пены. Данные 1HЯMP подтверждают структуру. МС (FD) 646 Взаимодействие соединения по приготовлению 43 (0,38 г, 0,59 ммоль) и трифторуксус 002746(25 мл) добавляли раствор соединения по приготовлению 6 (8,25 г, 30 ммоль) в этилацетате(25 мл)/абсолютном этаноле (25 мл). Суспензию гидрировали при 275,79 кПа (40 фунт-сила на квадратный дюйм) в аппарате Парра. Через 75 мин суспензию 5% Pd/C (0,7 г) в этилацетате (25 мл) добавляли в реакционную смесь. После гидрирования при 275,79 кПа (40 фунт-сила на квадратный дюйм) в течение 1,5 ч смесь фильтровали через целит и концентрировали. Концентрат растворяли в N,N-диметилформамиде (500 мл) и boc-d-бензилоксисерине (9,0 г, 30,8 ммоль),добавляли 1-гидроксибензотриазолгидрат (4,5 г, 33 ммоль) и 1,3 дициклогексилкарбодиимид (6,8 г, 33 ммоль). Через 16 ч при температуре окружающей среды смесь концентрировали и остаток экстрагировали этилацетатом. Объединенные органические экстракты промывали водой, насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Очистка хроматографией на силикагеле (метанол/хлороформ) давало 8,33 г (53%) желаемого продукта в виде желтовато-коричневого твердого вещества. Данные 1H-ЯМР подтверждают структуру. МС (FD) 522 (М+). Вычислено: С 64,35; Н 6,56; N 10,72. Найдено: С 64,59; Н 6,83; N 10,77. Приготовление 45 К раствору соединения по приготовлению 44 (8,1 г, 15,5 ммоль), перемешиваемому при комнатной температуре в дихлорметане (75 мл),добавляли трифторуксусную кислоту (25 мл,320 ммоль). Через 50 мин смесь осторожно выливали в насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом. Объединенные органические экстракты промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концен 51 трировали с получением 6,5 г (99%) желаемого продукта в виде желтовато-коричневого твердого вещества. Данные 1H-ЯMP подтверждают структуру. МС (FD) 422 (М+). Приготовление 46 К раствору соединения по приготовлению 45 (6,5 г, 15,0 ммоль), bocаминоизомасляной кислоты (3,05 г, 15,0 ммоль), 1-гидроксибензотриазолгидрата (2,23 г, 16,5 ммоль), перемешиваемому в N,N-диметилформамиде (400 мл) при комнатной температуре, добавляли 1,3 дициклогексилкарбодиимид (3,4 г, 16,5 ммоль). Через 16 ч смесь концентрировали, и полученный остаток экстрагировали этилацетатом. Объединенные органические экстракты промывали водой, насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Очистка хроматографией на силикагеле (метанол/хлороформ) дает 6,39 г (70%) желаемого продукта в виде желтоватокоричневой пены. Данные 1H-ЯМР подтверждают структуру. МС (FD) 607 (М+). Вычислено: С 63,25; Н 6,80; N 11,52. Найдено: С 63,36; Н 6,92; N 11,59. Приготовление 47 К раствору соединения по приготовлению 46 (6,04 г, 9,9 ммоль), перемешиваемому в абсолютном этаноле (50 мл)/тетрагидрофуране (50 мл) при комнатной температуре, добавляли 1 н.NaOH (50 мл, 49,5 ммоль). Через 30 мин, смесь подкисляли 1 н. НСl и экстрагировали этилацетатом. Объединенные органические экстракты промывали насыщенным солевым раствором,сушили над сульфатом натрия, фильтровали и концентрировали с получением 5,4 г (94%) желаемого продукта в виде желтовато-коричневой пены. Данные 1H-ЯМР подтверждают структуру. МС (FD) 580 (М+). Вычислено: С 62,16; Н 6,43; N 12,08. Найдено: С 61,86; Н 6,29; N 12,06. К раствору соединения по приготовлению 47 (0,7 г, 1,2 ммоль), гидрохлорида N-метиламина (0,08 г, 1,2 ммоль), триэтиламина (0,5 мл,3,6 ммоль) и 1-гидроксибензотриазолгидрата(0,18 г, 1,32 ммоль), перемешиваемому в N,Nдиметилформамиде (50 мл) при комнатной температуре, добавляли 1,3-дициклогексилкарбодиимид (0,27 г, 1,32 ммоль). Через 16 ч смесь концентрировали, и полученный остаток экстрагировали этилацетатом. Объединенные органические экстракты промывали водой, насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Очистка хроматографией на силикагеле (метанол/ хлороформ) дает 0,25 г (35%) желаемого продукта в виде белого твердого вещества. Данные 1H-ЯМР подтверждают структуру. МС (FD) 592,4 (М+). Для 0,32 моль гидрата: Вычислено: С 62,21; Н 6,76; N 14,04. Найдено: С 62,17; Н 6,74; N 14,19. Пример 11 К суспензии соединения по приготовлению 48 (0,2 г, 0,34 ммоль), перемешиваемому в дихлорметане (12 мл) при комнатной температуре, добавляли трифторуксусную кислоту (4 мл, 52 ммоль). Через 2 ч добавляли дополнительно трифторуксусную кислоту (4 мл, 52 ммоль) и реакционную смесь кипятили с обратным холодильником. Через 7 ч смесь охлаждали до комнатной температуры, добавляли воду (40 мл), затем избыток твердого бикарбоната натрия. Смесь экстрагировали этилацетатом и объединенные органические экстракты промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Полученный сырой продукт растворяли в этилацетате (40 мл) и добавляли насыщенный раствор НСl в диэтиловом эфире (40 мл). Через 15 мин эту суспензию концентрировали с получением 0,13 г (68%) желаемого продукта в виде белого твердого вещества. Данные 1H-ЯМР подтверждают структуру. МС (FD) 492 (М+). ИК (КВr) 3224, 3061, 3032,2962, 2936, 2873, 1678, 1636, 1538, 1498, 1454,1101 см-1. Вычислено: С 55,22; Н 6,06; N 14,86. Взаимодействие соединения по приготовлению 47 (1,00 г, 580 ммоль), гексаметиленимина (0,2 мл, 1,7 ммоль), 1-гидроксибензотриазолгидрата (0,25 г, 1,9 ммоль) и 1,3 дициклогексилкарбодиимида (0,4 г, 1,9 ммоль) в Взаимодействие соединения по приготовлению 49 (0,67 г, 1,0 ммоль) и трифторуксусной кислоты (4 мл, 52 ммоль) в дихлорметане (12 мл) в течение 1 ч при температуре окружающей среды с последующим подкислением НСl в этилацетате в соответствии с приготовлением 4 дает 0,3 г (48%) желаемого продукта в виде белого твердого вещества. Данные 1H-ЯМР подтверждают структуру. К раствору м-нитроанилина (1,0 г, 7,24 ммоль), перемешиваемому в безводном N,Nдиметилформамиде (40 мл) при комнатной температуре добавляли раствор соединения по приготовлению 5 (2,11 г, 8,69 ммоль) в безводномN,N-диметилформамиде (10 мл). Через 2,5 ч реакционную смесь разбавляли Н 2 О (70 мл) и экстрагировали этилацетатом. Объединенные органические экстракты промывали насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением желтого масла. Очистка радиальной хроматографией (силикагель, 10-75% этилацетат/гексан) давала 1,65 г(76%) продукта (1:1 смесь диастереомеров) в виде оранжевого твердого вещества. К суспензии гидрида натрия (0,15 г 60% дисперсия в минеральном масле, 3,86 ммоль),перемешиваемой в N,N-диметилформамиде (30 мл) при комнатной температуре, добавляли раствор 6-нитробензимидазола (0,60 г, 3,68 ммоль) в N,N-диметилформамиде (10 мл). Через 10 мин добавляли раствор этилового эфира -бромфенилуксусной кислоты в N,N-диметилформамиде(10 мл) и раствор перемешивали в течение 4 ч при комнатной температуре, гасили водой и экстрагировали этилацетатом. Объединенные органические экстракты промывали водой, насыщенным солевым раствором,сушили(Na2SO4) и концентрировали. Очистка хроматографией на силикагеле (25-75% этилацетат/гексан) дает 0,580 г (50%) продукта (смесь диастереомеров) в виде желтого масла. 1 К раствору соединения по приготовлению 50 (0,81 г, 2,73 ммоль), перемешиваемому в диоксане (30 мл) при комнатной температуре, добавляли LiOHH2O (0,57 г, 13,6 ммоль) и Н 2 О(15 мл). Через 45 мин смесь концентрировали до объема приблизительно 20 мл. Полученный водный раствор разбавляли Н 2 О (75 мл) и экстрагировали диэтиловым эфиром. Водный слой подкисляли 1 н. НСl и экстрагировали этилацетатом. Объединенные органические экстракты промывали насыщенным солевым раствором,сушили (Na2SO4) и концентрировали с получением 0,71 г (95%) продукта (1:1 смесь диастереомеров) в виде желтого твердого вещества. К раствору соединения по приготовлению 51 (0,48 г, 1,48 ммоль), перемешиваемому в диоксане (20 мл) при комнатной температуре, добавляли LiOHH2O (0,31 г, 7,38 ммоль) и Н 2 О(10 мл). Через 45 мин реакционную смесь концентрировали до объема приблизительно 15 мл. Полученный водный раствор разбавляли Н 2 О(75 мл) и экстрагировали диэтиловым эфиром. Водный слой подкисляли 1 н. НСl и экстрагировали этилацетатом. Объединенные органические экстракты промывали насыщенным солевым раствором, сушили (Na2SO4) и концентрировали с получением 0,450 г (95%) продукта(1:1 смесь диастереомеров) в виде светложелтого твердого продукта. 1 Н ЯМР (300 МГц, ДМСО)8,63 (с, 1 Н),8,56-8,57 (д, 1 Н, J=2,1 Гц), 8,14-8,20 (дд, 1 Н,J=9,2 Гц; 2,1 Гц), 7,82-7,86 (д, 1 Н, J=9,2 Гц),7,52-7,58 (м, 2 Н), 7,38-7,49 (м, 3 Н), 6,88 (с, 1 Н); К раствору соединения по приготовлению 52 (0,75 г, 2,78 ммоль), гидрохлорида метилового эфира L-пролина (0,46 г, 2,78 ммоль), 1 гидроксибензотриазолгидрата (0,38 г, 2,78 ммоль) и N,N-диизопропилэтиламина (1,26 г,9,72 ммоль) в безводном 1,2-дихлорметане (30 мл), перемешиваемому при комнатной температуре, добавляли 1-(3-диметиламинопропил)-3 этилкарбодиимид (0,585 г, 3,05 ммоль). Через 18 ч реакционную смесь разбавляли Н 2 О (50 мл) экстрагировали этилацетатом. Объединенные органические экстракты промывали 10% лимонной кислотой, насыщенным водным бикарбонатом натрия, водой, насыщенным солевым раствором, сушили (Na2SO4) и концентрировали. Очистка радиальной хроматографией (силикагель, 40-75% этилацетат/гексан) давало 0,56 г(53%) продукта (1:1 смесь диастереомеров) в виде желтого твердого продукта. К раствору соединения по приготовлению 53 (0,43 г, 1,46 ммоль), гидрохлорида метилового эфира L-пролина (0,24 г, 1,46 ммоль), 1 гидроксибензотриазолгидрата (0,20 г, 1,46 ммоль) и N,N-диизопропилэтиламина (0,66 г,5,10 ммоль), перемешиваемому в безводном 1,2 дихлорметане (30 мл) при комнатной температуре, добавляли 1-(3-диметиламинопропил)-3 этилкарбодиимид (0,31 г, 1,60 ммоль). Через 18 ч реакционную смесь гасили Н 2 О (50 мл) и экстрагировали этилацетатом. Объединенные органические экстракты промывали 10% лимонной кислотой, насыщенный водным бикарбонатом натрия, Н 2 О, насыщенным солевым раствором,сушили (Na2SO4) и концентрировали. Очистка радиальной хроматографией (силикагель, градиент 50% этилацетат/гексан к 100% этилацетата) дает 0,25 г (42%) индивидуального диастереомера в виде белого твердого продукта в виде пены. 1H ЯМР (300 МГц, СDСl3) d 8,75-8,76 (д,1 Н, J=2,1 Гц), 8,28-8,32 (дд, 1 Н, J=8,9 Гц; 2,1 Гц), 7,91 (с, 1 Н), 7,45-7,58 (м, 6 Н), 6,26 (с, 1 Н),4,65-4,70 (м, 1 Н), 3,83-3,92 (м, 1 Н), 3,78 (с, 3 Н),3,30-3,39 (м, 1 Н), 1,95-2,30 (м, 5 Н); FD+ МС для К суспензии 5% Pd/C (0,07 г) в этаноле (30 мл) добавляли раствор соединения по приготовлению 54 (0,15 г, 0,39 ммоль) в этилацетате (30 мл). Смесь обрабатывали газообразным водоро 57 дом (220,632 кПа (32 фунт-сила на квадратный дюйм при комнатной температуре в течение 4 ч в аппарате Парра, затем осторожно фильтровали через целит. Полученный фильтрат упаривали с получением не совсем белого твердого продукта в виде пены, которую растворяли вN,N-диметилформамиде (30 мл). В этот раствор добавляли соединение по приготовлению 4 (0,16 г, 0,41 ммоль), 1-гидроксибензотриазолгидрат(0,06 г, 0,41 ммоль) и 1,3-дициклогексилкарбодиимид (0,09 г, 0,45 ммоль). Этот раствор перемешивали в течение ночи при комнатной температуре и затем разбавляли водой (50 мл),затем экстрагировали этилацетатом. Объединенные органические экстракты промывали водой, насыщенным солевым раствором, сушили(Na2SO4) и упаривали с получением желтоватокоричневой пены. Очистка радиальной хроматографией (силикагель, градиент- 50% этилацетата/гексан к 100% этилацетата) давала 0,23 г(82%) продукта (смесь диастереомеров) в виде не совсем белого твердого вещества в виде пены. 1(Na2SO4) и концентрировали. Очистка радиальной хроматографией (силикагель, градиент 75% этилацетата/гексан к 100% этилацетата) давала 0,10 г (66%) продукта (один диастереомер) в виде не совсем белого твердого вещества в виде пены. Данные 1H ЯМР подтверждали структуру.(30 мл) добавляли раствор соединения по приготовлению 55 (0,08 г, 0,20 ммоль) в этилацетате (30 мл). Смесь обрабатывали газообразным водородом 220,632 кПа (32 фунт-сила на квадратный дюйм) при комнатной температуре в течение 4 ч в аппарате Парра, затем осторожно фильтровали через целит. Полученный фильтрат упаривали с получением белого твердого продукта в виде пены, которую растворяли вN,N-диметилформамиде (20 мл). В этот раствор добавляли соединение по приготовлению 4 (0,08 г, 0,20 ммоль), 1-гидроксибензотриазолгидрат(0,03 г, 0,22 ммоль) и 1,3-дициклогексилкарбодиимид (0,05 г, 0,22 ммоль). Этот раствор перемешивали в течение ночи при комнатной температуре и затем разбавляли водой (50 мл),затем экстрагировали этилацетатом. Объединенные органические экстракты промывали во К раствору соединения по приготовлению 57 (0,080 г, 0,11 ммоль) и анизоле (0,0123 г,0,114 ммоль), перемешиваемому в безводном дихлорметане (5 мл) при 0 С, добавляли трифторуксусную кислоту (1 мл). Через 4 ч смесь осторожно гасили насыщенным бикарбонатом натрия и экстрагировали этилацетатом. Объединенные органические экстракты промывали насыщенным водным бикарбонатом натрия, водой, насыщенным солевым раствором, сушили(Nа 2SO4) и концентрировали с получением 0,09 г (95%) пены желаемого продукта (один диастереомер) в виде не совсем белого твердого вещества. Данные 1H ЯМР подтверждают структуру; К раствору соединения по приготовлению 56 (0,17 г, 0,24 ммоль) и анизоле (0,03 г, 0,26 ммоль), перемешиваемому в безводном дихлорметане (5 мл) при 0 С, добавляли трифторуксусную кислоту (1 мл). Через 4 ч реакционную смесь осторожно гасили насыщенным водным бикарбонатом натрия, экстрагировали этилацетатом. Объединенные органические экстракты промывали насыщенным водным бикарбонатом натрия, водой, насыщенным солевым раствором, сушили (Nа 2SO4) и упаривали с получением желаемого продукта (смесь 1:1 диастереомеров) в виде не совсем белой пены, 0,100 г (67%). Данные 1H-ЯMP подтверждают структуру. 59 Найдено: С 51,86; Н 4,74; N 9,54. Примеры, часть 2 А Приготовление 1 а Метиловый эфир трет-бутилоксикарбонилО-бензил-D-серина. К раствору трет-бутилоксикарбонил-Обензил-D-серина (25,0 г, 84,7 ммоль), перемешиваемому в диметилформамиде (500 мл) при комнатной температуре, добавляли бикарбонат натрия (14,2 г, 169 ммоль), затем метилйодид(26,4 мл, 424 ммоль). Через 18 ч реакционную смесь концентрировали до приблизительно 100 мл. Добавляли этилацетат и смесь промывали водным бикарбонатом натрия и насыщенным солевым раствором. Органический экстракт сушили и концентрировали с получением желаемого соединения (25 г, 96%) в виде светложелтого масла. 1 Метиловый эфир О-бензил-D-серина. К раствору метилового эфира трет-бутилоксикарбонил-O-бензил-D-серина(BF8-EZO275) (5,0 г, 16 ммоль), перемешиваемому в дихлорметане (40 мл) и анизоле (1 мл) при 0 С,добавляли трифторуксусную кислоту (10 мл). Через 4 ч при комнатной температуре добавляли насыщенный водный раствор бикарбоната натрия и полученную смесь экстрагировали этилацетатом. Объединенные органические экстракты промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали. Сырой продукт использовали в последующих стадиях без дополнительной очистки. Приготовление 1 с К раствору метилового эфира О-бензил-Dсерина (продукт по приготовлению 1b) (65,4 ммоль), boc-а-аминоизомасляной кислоты (13,2 г, 65,4 ммоль), 1-гидроксибензотриазола (8,8 г,65,4 ммоль) и N,N-диизопропилэтиламина (22,8 мл, 130,7 ммоль), перемешиваемому в дихлорметане (500 мл) при 0 С, добавляли 1-(3 диметиламинопропил)-3-этилкарбодиимид (12,3 г, 71,9 ммоль). Через 18 ч добавляли этилацетат и хлорид аммония (насыщенный водный раствор) и полученную смесь экстрагировали водным хлоридом аммония, водным бикарбонатом натрия и насыщенным солевым раствором. Органические экстракты сушили над сульфатом натрия и концентрировали. Очистка флэш 002746 60 хроматографией (25% этилацетат/гексан) давало желаемое соединение (21,6 г, 83%) в виде белого твердого продукта. 1 К раствору продукта по приготовлению 1 с(5,30 г, 13,4), перемешиваемому в диоксане (100 мл)/воде (50 мл) при комнатной температуре,добавляли гидроксид лития (2,80 г, 67,3 ммоль). Через 18 ч добавляли воду и раствор концентрировали. Полученную смесь экстрагировали диэтиловым эфиром. Добавляли насыщенный солевой раствор к водному слою и рН доводили 1 н. НСl до 3,5. Полученную смесь экстрагировали этилацетатом, и объединенные органические экстракты сушили над сульфатом натрия,затем концентрировали с получением соединения, указанного в заголовке (4,40 г, 86%) в виде белой пены. 1 Раствор этоксида натрия получали добавлением металлического натрия (52,89 г, 2,3007 моль) в течение 3 ч к этанолу (1500 мл). К раствору этоксида натрия при температуре окружающей среды добавляли раствор диэтилацетамидомалоната (499,75 г, 2,3007 моль), растворенного в этаноле (225 мл). Реакционную смесь перемешивали в течение 1,5 ч при температуре окружающей среды, добавляли в течение 15 мин 1-бром-3-фенилпропан (458,07 г, 2,3007 моль) и реакционную смесь кипятили с обратным холодильником до завершения реакции по данным ВЭЖХ (16 ч). Реакционную смесь концентрировали досуха и остаток распределяли между этилацетатом (1 х 1500 мл и 2 х 500 мл) и водой(1500 мл). Этилацетатные слои объединяли,промывали насыщенным раствором хлорида натрия (4 х 500 мл), сушили с помощью сульфата натрия и концентрировали с получением 752,1 г (98%) желаемого соединения в виде светло-желтого твердого продукта. 1,0 г образца
МПК / Метки
МПК: C07D 233/88, A61P 43/00, A61K 31/415
Метки: стимуляторы, секреции, роста, гормона
Код ссылки
<a href="https://eas.patents.su/30-2746-stimulyatory-sekrecii-gormona-rosta.html" rel="bookmark" title="База патентов Евразийского Союза">Стимуляторы секреции гормона роста</a>
Предыдущий патент: Конъюгаты, которые можно использовать при лечении рака предстательной железы
Следующий патент: Система электроснабжения
Случайный патент: Способ ионной обработки поверхности диэлектрика и устройство для осуществления способа












