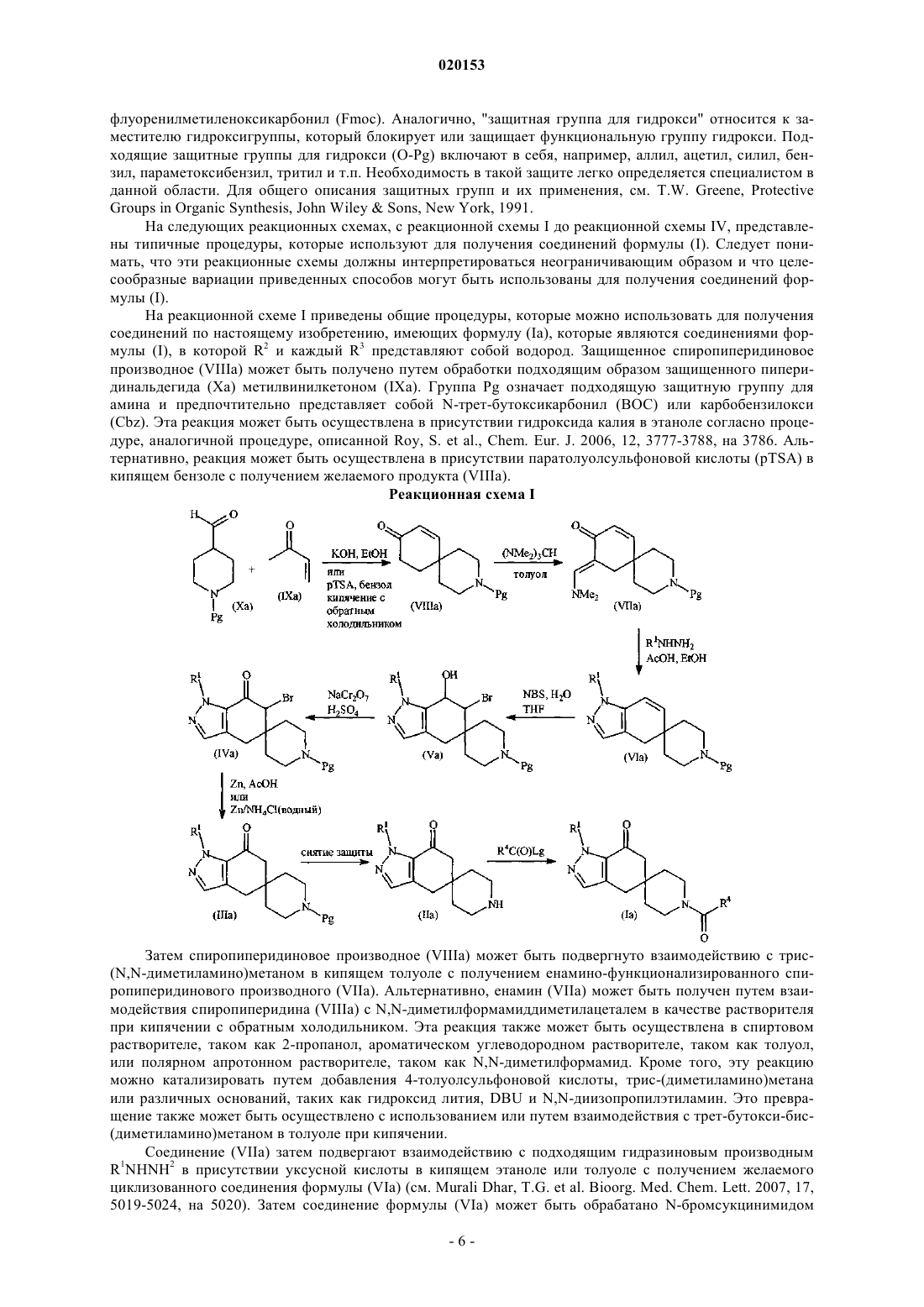
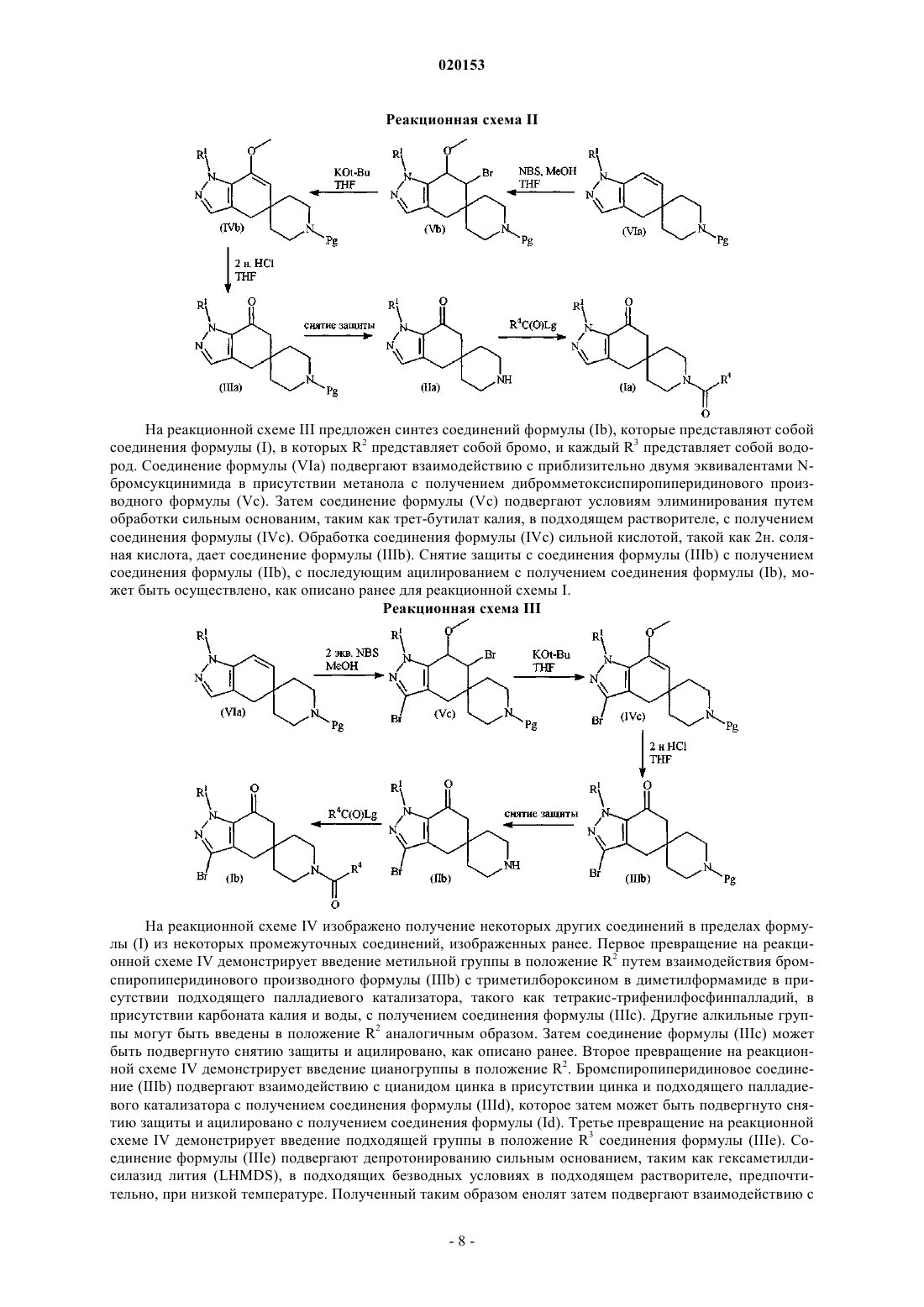
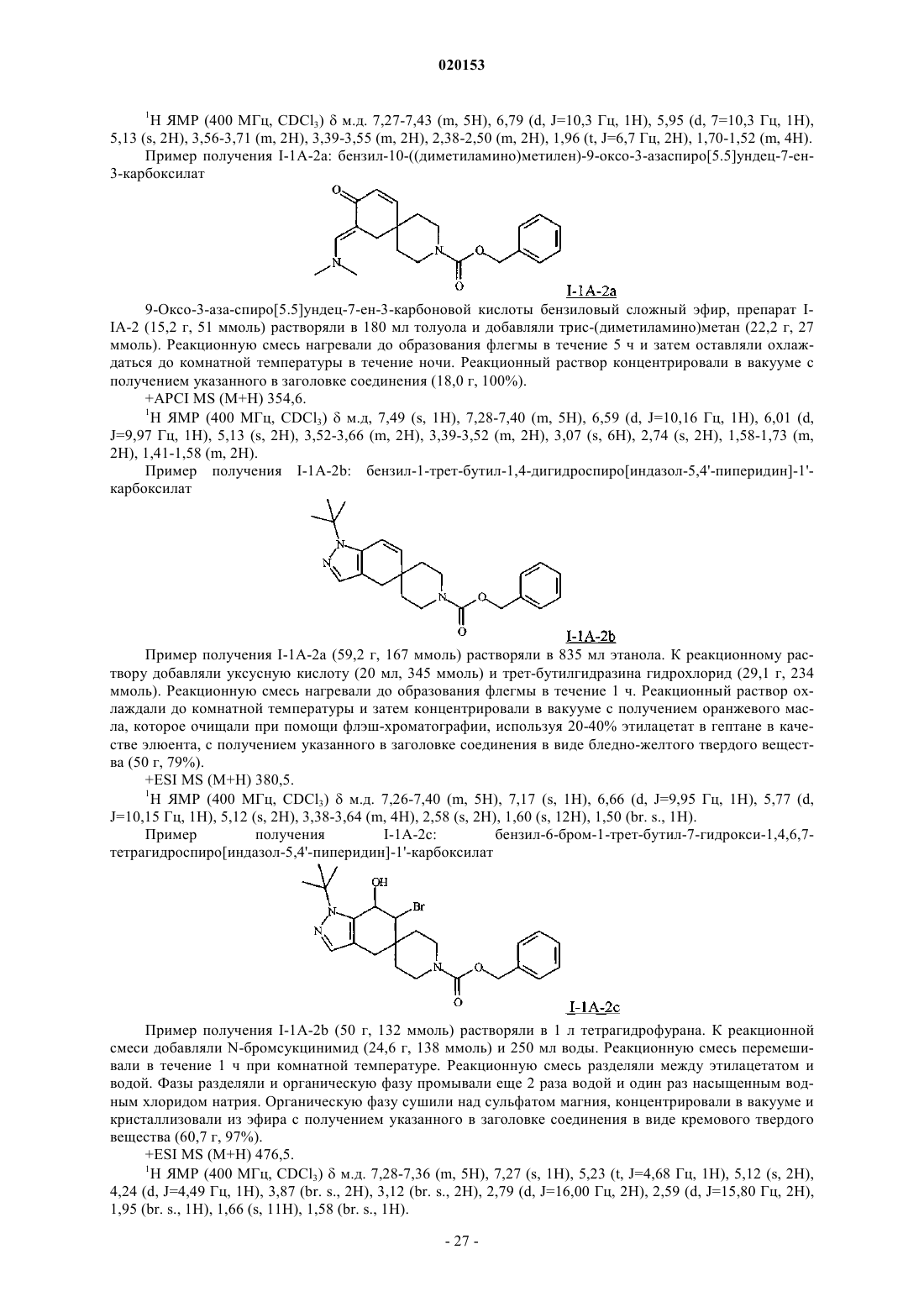
N1-пиразолоспирокетоновые ингибиторы ацетил-koa-карбоксилазы
Номер патента: 20153
Опубликовано: 30.09.2014
Авторы: Гриффит Дэвид Эндрю, Кунг Дэниел Вэй-Шун, Бэгли Скотт Уильям
Формула / Реферат
1. Соединение формулы (I)
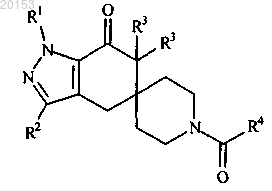
где R1 представляет собой (C1-C6)алкил, (C3-C7)циклоалкил, тетрагидрофуранил или оксетанил, где указанный (C1-C6)алкил возможно замещен 1-2 заместителями, независимо выбранными из (C1-C3)алкокси, гидрокси, фторо, фенила, тетрагидрофуранила или оксетанила;
R2 представляет собой водород, галогено, (C1-C3)алкил или циано;
каждый R3 представляет собой независимо водород или (C1-C3)алкил;
R4 представляет собой (C6-C10)арил, 5-12-членный гетероарил, содержащий по меньшей мере один гетероатом, выбранный из азота, кислорода и серы, или 8-12-членный конденсированный гетероциклический арил; где каждый из указанных (C6-C10)арила, 5-12-членного гетероарила или 8-12-членного конденсированного гетероциклического арила возможно замещен заместителями в количестве от одного до трех, независимо выбранными из (C1-C3)алкила, (C1-C3)алкокси, галогено, амино, (C1-C3)алкиламино, ди(C1-C3)алкиламино, гидрокси, циано, амидо, фенила, 5-6-членного гетероарила, содержащего по меньшей мере один гетероатом, выбранный из азота, кислорода и серы, или 5-6-членного гетероциклила, представляющего собой морфолинил,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R1 представляет собой (C1-C6)алкил, (C3-C7)циклоалкил или тетрагидрофуранил и R2 представляет собой водород или метил, или его фармацевтически приемлемая соль.
3. Соединение по п.2, где R1 представляет собой этил, изопропил или трет-бутил; каждый R3 представляет собой водород; R4 представляет собой фенил, пиразолил, имидазолил, триазолил, пиридинил, пиримидинил, индолил, бензопиразинил, бензоимидазолил, бензоимидазолонил, пирролопиридинил, пирролопиримидинил, пиразолопиридинил, пиразолопиримидинил, индазолил, индолинонил, нафтиридинил, хинолинил, хинолинонил, дигидрохинолинонил, оксодигидрохинолинонил, изохинолинил, изохинолинонил, дигидроизохинонил или оксодигидроизохинонил, где каждый возможно замещен заместителями в количестве от одного до трех, независимо выбранными из фторо, хлоро, метила, метокси, амино, метиламино, диметиламино, амидо, циано, фенила, имидазолила, пиразолила, триазолила, пиридинила или морфолинила, или его фармацевтически приемлемая соль.
4. Соединение по п.3, где R1 представляет собой изопропил или трет-бутил и R2 представляет собой водород, или его фармацевтически приемлемая соль.
5. Соединение по п.4, где R4 представляет собой индазолил, бензоимидазолил, 1-оксо-1,2-дигидроизохинолинил, 1H-пирроло[3,2-b]пиридинил, 2-оксо-2,3-дигидро-1H-бензо[d]имидазолил, 1H-пиразолилфенил, 1H-пиразолилпиридинил или 1H-имидазолилфенил, где каждый возможно замещен метилом, хлоро или фторо в количестве от одного до двух, или его фармацевтически приемлемая соль.
6. 1-Изопропил-1'-(1H-пирроло[3,2-b]пиридин-6-карбонил)-4,6-дигидроспиро[индазол-5,4'-пиперидин]-7(1H)-он или его фармацевтически приемлемая соль.
7. Соединение формулы
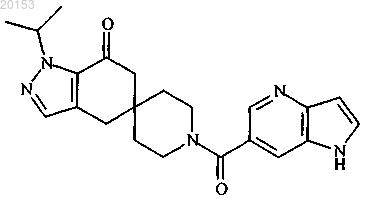
8. 1-Изопропил-1'-(2-метил-1H-бензо[d]имидазол-6-карбонил)-4,6-дигидроспиро[индазол-5,4'-пиперидин]-7(1H)-он или его фармацевтически приемлемая соль.
9. Соединение формулы
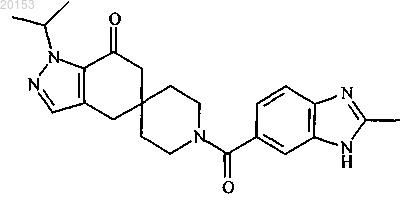
10. Соединение формулы
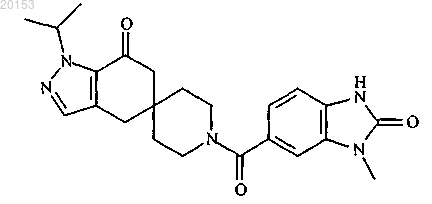
или его фармацевтически приемлемая соль.
11. Соединение по п.1 формулы

или его фармацевтически приемлемая соль.
12. Соединение по п.1 формулы
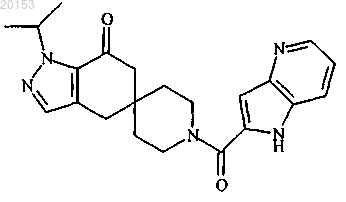
или его фармацевтически приемлемая соль.
13. Фармацевтическая композиция, обладающая активностью ингибитора ацетил-КоА-карбоксилазы, содержащая терапевтически эффективное количество соединения по любому из пп.1-10 или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент, разбавитель или носитель.
14. Применение соединения по любому из пп.1-10 для изготовления лекарственного средства для лечения или замедления развития или начала диабета 2.
15. Применение соединения по любому из пп.1-10 для изготовления лекарственного средства для лечения неалкогольной жировой дистрофии печени (NAFLD) или печеночной инсулинорезистентности.
16. Применение фармацевтической композиции по п.13 для изготовления лекарственного средства для лечения или замедления развития или начала диабета 2.
17. Применение фармацевтической композиции по п.13 для изготовления лекарственного средства для лечения неалкогольной жировой дистрофии печени (NAFLD) или печеночной инсулинорезистентности.
Текст
В изобретении предложено соединение формулы (I) или фармацевтически приемлемая соль соединения, где R1, R2, R3 и R4 являются такими, как описано в данном патенте; его фармацевтические композиции и его применение в лечении заболеваний, состояний или расстройств, модулируемых путем ингибирования фермента(ов) ацетил-КоА-карбоксилазы у животных. Область изобретения Данное изобретение относится к замещенным пиразолоспирокетоновым соединениям, которые действуют в качестве ингибиторов ацетил-КоА-карбоксилаз(ы), и к их применению в лечении заболеваний, состояний или расстройств, модулируемых путем ингибирования ацетил-КоА-карбоксилазного(ых) фермента(ов). Предпосылки изобретения Ацетил-КоА-карбоксилазы (АСС) представляют собой семейство ферментов, обнаруженных у большинства видов, и связаны с синтезом и метаболизмом жирных кислот через катализ продукции малонил-КоА из ацетил-КоА. У млекопитающих были идентифицированы две изоформы фермента АСС. АСС 1, которая экспрессируется на высоких уровнях в липогенных тканях, таких как жировая ткань, и печени, контролирует первую стадию, задействованную в биосинтезе длинноцепочечных жирных кислот. Если ацетил-КоА не карбоксилируется с образованием малонил-КоА, то он метаболизируется через цикл Кребса. АСС 2, минорный компонент печеночной АСС, но преобладающая изоформа в сердечной и скелетной мышце, катализирует продукцию малонил-КоА на цитоплазматической поверхности митохондрий и регулирует, в какой степени жирные кислоты утилизируются при -окислении путем ингибирования карнитинпальмитоилтрансферазы. Таким образом, путем увеличения утилизации жирных кислот и предотвращения увеличения синтеза жирных кислот de novo, постоянное введение ингибитора АСС (ACC-I) также может истощать запасы триглицеридов (TG) в печени и жировой ткани у субъектов,страдающих ожирением, придерживающихся высоко- или низкожирной диеты, что приводит к избирательной потере телесного жира. Исследования, проведенные Abu-Etheiga с соавт., указывают на то, что АСС 2 играет существенную роль в контролировании окисления жирных кислот и как таковая представляет собой мишень в терапии против ожирения и заболеваний, связанных с ожирением, таких как диабет 2 типа. См. Abu-Etheiga, L., etal. "Acetyl-CoA carboxylase 2 mutant mice are protected against obesity and diabetes induced by high-fat/highcarbohydrate diets", PNAS, 100 (18), 10207-10212 (2003); см. также Choi, C.S., et al. "Continuous fat oxidation in acetyl-CoA carboxylase 2 knockout mice increases total energy expenditure, reduces fat mass, and improves insulin sensitivity", PNAS, 104 (42), 16480-16485 (2007). Становится все более ясно, что накопление печеночного жира вызывает печеночную инсулинорезистентность и вносит вклад в патогенез диабета 2 типа. Salvage с соавт. продемонстрировал, что АСС 1 и АСС 2 участвуют в регуляции окисления жира в гепатоцитах, в то время как АСС 1, преобладающая изоформа в печени крыс, является единственным регулятором синтеза жирных кислот. Более того, в их модели совместное уменьшение обеих изоформ является необходимым для значительного снижения уровней малонил-КоА в печени, увеличения окисления жира в сытом состоянии, уменьшения накопления липидов и улучшения действия инсулина in vivo. Таким образом, показано, что ингибиторы печеночных АСС 1 и АСС 2 могут быть полезными в лечении неалкогольной жировой дистрофии печени (NAFLD) и печеночной инсулинорезистентности. См. Savage, D.B., et al. "Reversal of diet-induced hepatic steatosis andInvest doi: 10.1172/JCI27300; см. также Oh W., et al. "Glucose and fat metabolism in adipose tissue of acetylCoA carboxylase 2 knockout mice", PNAS, 102 (5), 1384-1389 (2005). Следовательно, существует потребность в лекарственных средствах, содержащих ингибиторы АСС 1 и/или АСС 2, для лечения ожирения и заболеваний, связанных с ожирением (таких как NAFLD и диабет 2 типа), путем ингибирования синтеза жирных кислот и путем усиления окисления жирных кислот. Краткое изложение сущности изобретения Настоящее изобретение относится к соединениям, имеющим структуру формулы (I) где R1 представляет собой (C1-C6)алкил, (C3-C7)циклоалкил, тетрагидрофуранил или оксетанил; где указанный (C1-C6)алкил возможно замещен 1-2 заместителями, независимо выбранными из (C1C3)алкокси; гидрокси, фторо, фенила, тетрагидрофуранила или оксетанила;R2 представляет собой водород, галогено, (C1-C3)алкил или циано; каждый R3 независимо представляет собой водород или (C1-C3)алкил;R4 представляет собой (C6-C10)арил, 5-12-членный гетероарил или 8-12-членный конденсированный гетероциклический арил; где каждый из указанных (C6-C10)арила, 5-12-членного гетероарила или 8-12 членного конденсированного гетероциклического арила возможно замещен заместителями в количестве от одного до трех, независимо выбранными из (C1-C3)алкила, (C1-C3)алкокси, галогено, амино, (C1C3)алкиламино, ди(C1-C3)алкиламино, гидрокси, циано, амидо, фенила, 5-6-членного гетероарила или 56-членного гетероциклила,или их фармацевтически приемлемой соли. Предпочтительным воплощением настоящего изобретения являются соединения формулы (I), гдеR4 представляет собой (C6-C10)арил, выбранный из фенила или нафтила; 5-12-членный гетероарил, выбранный из пиридинила, пиразолила, пиримидинила, триазолила, индолизинила, индазолила, пирроло[2,3-b]пиридинила, пирроло[3,2-b]пиридинила, пирроло[1,2-a]пиразинила, имидазо[1,2-a]пиридинила,имидазо[1,5-a]пиридинила,бензо[d]имидазолила,пиразоло[3,4-b]пиридинила,пиразоло[4,3b]пиридинила, пиразоло[1,5-а]пиримидинила, бензо[d]имидазол-2-онила, 1,6-нафтиридинила, хиноксалинила, хинолин-4-онила или изохинолин-1-онила; или 8-12-членный конденсированный гетероциклический арил, выбранный из 3,4-дигидрохинолин-2-онила или индолин-2-онила; где каждая группа R4 возможно замещена заместителями в количестве от одного до трех, независимо выбранными из (C1C3)алкила, (C1-C3)алкокси, галогено, амино, (C1-C3)алкиламино, ди(С 1-С 3)алкиламино, гидрокси, циано,амидо, фенила, 5-6-членного гетероарила или 5-6-членного гетероциклила, или их фармацевтически приемлемая соль. Другое предпочтительное воплощение настоящего изобретения представляет собой соединение формулы (I), где R1 представляет собой (C1-C6)алкил, (С 3-С 7)циклоалкил или тетрагидрофуранил; и R2 представляет собой водород или метил, или его фармацевтически приемлемую соль. Другое предпочтительное воплощение настоящего изобретения представляет собой соединение формулы (I), где R1 представляет собой этил, изопропил или трет-бутил; R4 представляет собой фенил, пиразолил, имидазолил,триазолил, пиридинил, пиримидинил, индолил, бензопиразинил, бензоимидазолил, бензоимидазолонил,пирролопиридинил, пирролопиримидинил, пиразолопиридинил, пиразолопиримидинил, индазолил, индолинонил, нафтиридинил, хинолинил, хинолинонил, дигидрохинолинонил, оксодигидрохинолинонил,изохинолинил, изохинолинонил, дигидроизохинонил или оксодигидроизохинонил, каждый из которых возможно замещен заместителями в количестве от одного до трех, независимо выбранными из фторо,хлоро, метила, амино, метиламино, диметиламино, амидо, циано, фенила, имидазолила, пиразолила, триазолила, пиридинила или морфолинила, или его фармацевтически приемлемую соль. Другое предпочтительное воплощение настоящего изобретения представляет собой соединение формулы (I), где R1 представляет собой изопропил или трет-бутил; R2 представляет собой водород; каждый R3 представляет собой водород, или его фармацевтически приемлемую соль. Другое предпочтительное воплощение настоящего изобретения представляет собой соединение формулы (I), где R4 представляет собой индазолил, бензоимидазолил, 1-оксо-1,2-дигидроизохинолинил, 1H-пирроло[3,2-b]пиридинил, 2-оксо-2,3 дигидро-1H-бензо[d]имидазолил,1H-пиразолилфенил,1H-пиразолилпиридинил или 1Hимидазолилфенил; каждый из которых возможно замещен метилом, хлоро или фторо в количестве от одного до двух, или его фармацевтически приемлемую соль. Другое предпочтительное воплощение настоящего изобретения представляет собой соединение,выбранное из 1-изопропил-1'-(1-оксо-1,2-дигидроизохинолин-6-карбонил)-4,6-дигидроспиро[индазол-5,4'пиперидин]-7(1H)-она; 1-изопропил-1'-(1H-пирроло[3,2-b]пиридин-6-карбонил)-4,6-дигидроспиро[индазол-5,4'пиперидин]-7(1H)-она; 1-(трет-бутил)-1'-(2-метил-3H-бензо[d]имидазол-5-карбонил)-4,6-дигидроспиро[индазол-5,4'пиперидин]-7(1H)-она; 1-(трет-бутил)-1'-(1H-пирроло[3,2-b]пиридин-6-карбонил)-4,6-дигидроспиро[индазол-5,4'пиперидин]-7(1H)-она; 1-(трет-бутил)-1'-(1H-индазол-5-карбонил)-4,6-дигидроспиро[индазол-5,4'-пиперидин]-7(1H)-она; 1-(трет-бутил)-1'-(2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-карбонил)-4,6-дигидроспиро[индазол 5,4'-пиперидин]-7(1H)-она; 1-изопропил-1'-(2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-карбонил)-4,6-дигидроспиро[индазол 5,4'-пиперидин]-7(1H)-она; 1'-(7-фтор-1H-индазол-5-карбонил)-1-изопропил-4,6-дигидроспиро[индазол-5,4'-пиперидин]-7(1H)она; 1-изопропил-1'-(1-метил-2-оксо-2,3-дигидро-1 Н-бензо[d]имидазол-5-карбонил)-4,6 дигидроспиро[индазол-5,4'-пиперидин]-7(1H)-она; 1'-(7-хлор-2-метил-3H-бензо[d]имидазол-5-карбонил)-1-изопропил-4,6-дигидроспиро[индазол-5,4'пиперидин]-7(1H)-она; 1'-(1H-индазол-6-карбонил)-1-изопропил-4,6-дигидроспиро[индазол-5,4'-пиперидин]-7(1H)-она; 1-изопропил-1'-(3-(1H-пиразол-4-ил)бензоил)-4,6-дигидроспиро[индазол-5,4'-пиперидин]-7(1H)-она; 1-изопропил-1'-(2-метил-1H-бензо[d]имидазол-5-карбонил)-4,6-дигидроспиро[индазол-5,4'пиперидин]-7(1H)-она; 1'-(1H-индазол-5-карбонил)-1-изопропил-4,6-дигидроспиро[индазол-5,4'-пиперидин]-7(1H)-она; 1'-(1H-индазол-5-карбонил)-1-изопропил-3-метил-4,6-дигидроспиро[индазол-5,4'-пиперидин]-7(1H)она; 1-(трет-бутил)-1'-(2-(1H-пиразол-3-ил)пиридин-4-карбонил)-4,6-дигидроспиро[индазол-5,4'пиперидин]-7(1H)-она; 1-(трет-бутил)-1'-(3-(1H-пиразол-3-ил)бензоил)-4,6-дигидроспиро[индазол-5,4'-пиперидин]-7(1H)она; 1-изопропил-1'-(1H-пирроло[3,2-b]пиридин-2-карбонил)-4,6-дигидроспиро[индазол-5,4'пиперидин]-7(1H)-она; 1-(трет-бутил)-1'-(4-(1H-имидазол-2-ил)бензоил)-4,6-дигидроспиро[индазол-5,4'-пиперидин]-7(1H)она; 1-(трет-бутил)-1'-(3-(1H-имидазол-2-ил)бензоил)-4,6-дигидроспиро[индазол-5,4'-пиперидин]-7(1H)она или 1-(трет-бутил)-1'-(1H-индазол-6-карбонил)-4,6-дигидроспиро[индазол-5,4'-пиперидин]-7(1H)-она,или его фармацевтически приемлемую соль. Другой аспект настоящего изобретения представляет собой фармацевтическую композицию, содержащую количество соединения формулы (I), как описано в любом из воплощений, или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент, разбавитель или носитель. Предпочтительно композиция содержит терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли. Композиция также может содержать по меньшей мере один дополнительный фармацевтический агент. Предпочтительные агенты включают в себя противодиабетические агенты и/или агенты против ожирения (описанные ниже в данном изобретении). В другом аспекте настоящего изобретения предложен способ лечения заболевания, состояния или расстройства, опосредованного ингибированием ацетил-КоА-карбоксилазного(ых) фермента(ов) у млекопитающего, который включает стадию введения млекопитающему, предпочтительно человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по настоящему изобретению, или его фармацевтически приемлемой соли, или его фармацевтической композиции. Заболевания, расстройства или состояния, опосредованные ингибиторами ацетил-КоАкарбоксилазы, включают в себя диабет II типа и заболевания, связанные с диабетом, такие как неалкогольная жировая дистрофия печени (NAFLD), печеночная инсулинорезистентность, гипергликемия, метаболический синдром, нарушенная толерантность к глюкозе, диабетическая нейропатия, диабетическая нефропатия, диабетическая ретинопатия, ожирение, дислипидемия, гипертензия, гиперинсулинемия и синдром инсулинорезистентности. Предпочтительные заболевания, расстройства или состояния включают в себя диабет II типа, неалкогольную жировую дистрофию печени (NAFLD), печеночную инсулинорезистентность, гипергликемию, нарушенную толерантность к глюкозе, ожирение и синдром инсулинорезистентности. Более предпочтительными являются диабет II типа, неалкогольная жировая дистрофия печени (NAFLD), печеночная инсулинорезистентность, гипергликемия и ожирение. Наиболее предпочтительным является диабет II типа. Предпочтительное воплощение представляет собой способ лечения (например, замедления развития или начала) диабета 2 типа и связанных с диабетом расстройств у животных, включающий стадию введения животному, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по настоящему изобретению, или его фармацевтически приемлемой соли, или его композиции. Другое предпочтительное воплощение представляет собой способ лечения ожирения и расстройств,связанных с ожирением, у животных, включающий стадию введения животному, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по настоящему изобретению, или его фармацевтически приемлемой соли, или его композиции. Другое предпочтительное воплощение представляет собой способ лечения неалкогольной жировой дистрофии печени (NAFLD) или печеночной инсулинорезистентности у животных, включающий стадию введения животному, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по настоящему изобретению, или его фармацевтически приемлемой соли, или его композиции. Соединения по настоящему изобретению могут быть введены в комбинации с другими фармацевтическими агентами (в частности, агентами против ожирения и противодиабетическими агентами, описанными ниже в данном изобретении). Комбинированную терапию можно вводить в виде (а) единой фармацевтической композиции, которая содержит соединение по настоящему изобретению или его фармацевтически приемлемую соль, по меньшей мере один дополнительный фармацевтический агент, описанный в данном изобретении, и фармацевтически приемлемый эксципиент, разбавитель или носитель; или (б) двух раздельных фармацевтических композиций, содержащих (1) первую композицию, содержащую соединение по настоящему изобретению или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент, разбавитель или носитель, и (2) вторую композицию, содержащую по меньшей мере один дополнительный фармацевтический агент, описанный в данном изобретении, и фармацевтически приемлемый эксципиент, разбавитель или носитель. Фармацевтические композиции можно вводить одновременно или последовательно в любом порядке. В SEQ ID NO: 1 предложена последовательность рекомбинантной АСС 1 человека (SEQ ID NO: 1),которая может быть использована в анализе Transcreener in vitro. В SEQ ID NO: 2 предложена последовательность рекомбинантной АСС 2 человека (SEQ ID NO: 2),которая может быть использована в анализе Transcreener in vitro. Подробное описание изобретения Определения. Фраза "терапевтически эффективное количество" означает количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, которое (1) лечит или предотвращает конкретное заболевание, состояние или расстройство, (2) уменьшает, облегчает или устраняет один или более симптомов конкретного заболевания, состояния или расстройства, или (3) предотвращает или замедляет возникновение одного или более симптомов конкретного заболевания, состояния или расстройства, описанного в данном изобретении. Термин "животное" относится к людям (мужчинам или женщинам), домашним животным (например, собакам, кошкам и лошадям), животным-источникам пищи, животным в неволе, морским животным, птицам и другим сходным видам животных. "Животные, пригодные в пищу" относятся к животным, являющимся источниками пищи, таким как коровы, свиньи, овцы и куры. Фраза "фармацевтически приемлемый" означает, что вещество или композиция должны быть совместимы химически и/или токсикологически с другими ингредиентами, составляющими препарат,и/или с животным, которое лечится ими. Термины "лечащий", "лечить" или "лечение" охватывают как превентивное, т.е. профилактическое,так и паллиативное лечение. Термины "модулированный", или "модулирование", или "модулирует(ют)", как использовано в данном изобретении, если не указано иное, относятся к ингибированию ацетил-КоАкарбоксилазного(ых) (АСС) фермента(ов) с помощью соединений по настоящему изобретению. Термины "опосредованный", или "опосредование", или "опосредует(ют)", как использовано в данном изобретении, если не указано иное, относятся к (1) лечению или предупреждению конкретного заболевания, состояния или расстройства, (2) уменьшению, облегчению или устранению одного или более симптомов конкретного заболевания, состояния или расстройства, или (3) предупреждению или замедлению возникновения одного или более симптомов конкретного заболевания, состояния или расстройства, описанного в данном изобретении, путем ингибирования ацетил-КоА-карбоксилазного(ых) (АСС) фермента(ов). Термин "соединения по настоящему изобретению" (если специально не указано иное) относится к соединениям формулы (I) и любым фармацевтически приемлемым солям соединений, а также ко всем стереоизомерам (включая диастереоизомеры и энантиомеры), таутомерам, конформационным изомерам и меченным изотопами соединениям. Гидраты и сольваты соединений по настоящему изобретению считаются композициями по настоящему изобретению, где соединение находится в ассоциации с водой или растворителем соответственно. Термины "(C1-C6)алкил" и "(C1-C3)алкил" означают алкильные группы с определенным числом атомов углерода, от одного до шести или от одного до трех атомов углерода, соответственно, которые могут быть либо с прямой цепью, либо разветвленными. Например, термин "(C1-C3)алкил" имеет от одного до трех атомов углерода и состоит из метила, этила, н-пропила и изопропила. Термин "(C3-C7)циклоалкил" означает циклоалкильную группу с тремя-семью атомами углерода и состоит из циклопропана, циклобутила, циклопентила, циклогексила и циклогептила. Термин "галогено" означает фторо, хлоро, бромо или йодо. Термин "(C6-C10)арил" означает ароматическую карбоциклическую группу, состоящую из шести-десяти атомов углерода, такую как фенил или нафтил. Термин "5-12-членный гетероарил" означает 5-12-членную ароматическую группу, которая содержит по меньшей мере один гетероатом, выбранный из азота, кислорода и серы. Как использовано в данном изобретении, место присоединения "5-12-членной гетероарильной" группы находится на атоме углерода этой группы. "5-12-членная гетероарильная" группа может быть либо моноциклической, либо бициклической. Предпочтительные воплощения моноциклических гетероарилов включают в себя, но не ограничиваются этим, пиразолил, имидазолил, триазолил, пиридинил и пиримидинил. Предпочтительные воплощения бициклических гетероарилов включают в себя, но не ограничиваются этим, радикалы следующих кольцевых систем: Термин "8-12-членный конденсированный гетероциклический арил" означает 8-12-членную кольцевую систему, в которой неароматическое гетероциклическое кольцо конденсировано с арильным кольцом. Как использовано в данном изобретении, место присоединения "8-12-членной конденсированной гетероциклической арильной" группы находится на атоме углерода этой группы. Предпочтительное воплощение включает в себя радикалы кольцевых систем, таких как Соединения по настоящему изобретению могут быть синтезированы синтетическими путями, которые включают в себя процессы, аналогичные процессам, хорошо известным в области химии, особенно в свете описания, содержащегося в данном изобретении. Исходные материалы обычно доступны из коммерческих источников, таких как Aldrich Chemicals (Milwaukee, WI), или могут быть легко получены с использованием способов, хорошо известных специалистам в данной области (например, получены способами, в общем описанными в Louis F. Fieser and Mary Fieser, Reagents for Organic Synthesis, v. 1-19,Wiley, New York (1967-1999 ed.), или Beilsteins Handbuch der organischen Chemie, 4, Aufl. ed. SpringerVerlag, Berlin, включая приложения (также доступные онлайн в базе данных Beilstein. Для иллюстративных целей в реакционных схемах, приведенных ниже, предложены возможные пути синтеза соединений по настоящему изобретению, а также ключевых промежуточных соединений. Для более подробного описания индивидуальных реакционных стадий см. раздел "Примеры" ниже. Специалистам в данной области будет понятно, что для синтеза соединений по изобретению могут быть использованы другие синтетические пути. Хотя конкретные исходные вещества и реагенты приведены на схемах и обсуждаются ниже, исходные вещества и реагенты могут быть с легкостью заменены на другие с получением различных производных и/или реакционных условий. Кроме того, многие соединения, полученные способами, описанными ниже, могут быть дополнительно модифицированы в свете настоящего описания с использованием традиционной химии, хорошо известной специалистам в данной области. При получении соединений по настоящему изобретению может быть необходима защита удаленной функциональной группы (например, первичного или вторичного амина) промежуточных соединений. Необходимость такой защиты будет варьироваться в зависимости от природы удаленной функциональной группы и условий способов получения. Подходящие защитные группы для амино (NH-Pg) включают в себя ацетил, трифторацетил, трет-бутоксикарбонил (ВОС), бензилоксикарбонил (CBz) и 9-5 020153 флуоренилметиленоксикарбонил (Fmoc). Аналогично, "защитная группа для гидрокси" относится к заместителю гидроксигруппы, который блокирует или защищает функциональную группу гидрокси. Подходящие защитные группы для гидрокси (O-Pg) включают в себя, например, аллил, ацетил, силил, бензил, параметоксибензил, тритил и т.п. Необходимость в такой защите легко определяется специалистом в данной области. Для общего описания защитных групп и их применения, см. Т.W. Greene, ProtectiveGroups in Organic Synthesis, John WileySons, New York, 1991. На следующих реакционных схемах, с реакционной схемы I до реакционной схемы IV, представлены типичные процедуры, которые используют для получения соединений формулы (I). Следует понимать, что эти реакционные схемы должны интерпретироваться неограничивающим образом и что целесообразные вариации приведенных способов могут быть использованы для получения соединений формулы (I). На реакционной схеме I приведены общие процедуры, которые можно использовать для получения соединений по настоящему изобретению, имеющих формулу (Ia), которые являются соединениями формулы (I), в которой R2 и каждый R3 представляют собой водород. Защищенное спиропиперидиновое производное (VIIIa) может быть получено путем обработки подходящим образом защищенного пиперидинальдегида (Ха) метилвинилкетоном (IXa). Группа Pg означает подходящую защитную группу для амина и предпочтительно представляет собой N-трет-бутоксикарбонил (ВОС) или карбобензилокси(Cbz). Эта реакция может быть осуществлена в присутствии гидроксида калия в этаноле согласно процедуре, аналогичной процедуре, описанной Roy, S. et al., Chem. Eur. J. 2006, 12, 3777-3788, на 3786. Альтернативно, реакция может быть осуществлена в присутствии паратолуолсульфоновой кислоты (pTSA) в кипящем бензоле с получением желаемого продукта (VIIIa). Реакционная схема I Затем спиропиперидиновое производное (VIIIa) может быть подвергнуто взаимодействию с трис(N,N-диметиламино)метаном в кипящем толуоле с получением енамино-функционализированного спиропиперидинового производного (VIIa). Альтернативно, енамин (VIIa) может быть получен путем взаимодействия спиропиперидина (VIIIa) с N,N-диметилформамиддиметилацеталем в качестве растворителя при кипячении с обратным холодильником. Эта реакция также может быть осуществлена в спиртовом растворителе, таком как 2-пропанол, ароматическом углеводородном растворителе, таком как толуол,или полярном апротонном растворителе, таком как N,N-диметилформамид. Кроме того, эту реакцию можно катализировать путем добавления 4-толуолсульфоновой кислоты, трис-(диметиламино)метана или различных оснований, таких как гидроксид лития, DBU и N,N-диизопропилэтиламин. Это превращение также может быть осуществлено с использованием или путем взаимодействия с трет-бутокси-бис(диметиламино)метаном в толуоле при кипячении. Соединение (VIIa) затем подвергают взаимодействию с подходящим гидразиновым производнымR1NHNH2 в присутствии уксусной кислоты в кипящем этаноле или толуоле с получением желаемого циклизованного соединения формулы (VIa) (см. Murali Dhar, T.G. et al. Bioorg. Med. Chem. Lett. 2007, 17,5019-5024, на 5020). Затем соединение формулы (VIa) может быть обрабатано N-бромсукцинимидом(Va). Затем бромгидрокси-производное (Va) окисляют реагентом Джонса в способе, аналогичном способу, изложенному в Wolinsky, J. et al., J. Org. Chem. 1978, 43 (5), 875-881, на 876, 879, с получением бромкетопроизводного формулы (IVa). Альтернативно, окисление (Va) может быть осуществлено с помощью каталитического тетрапропиламмония перрутената и N-метилморфолина N-оксида. Затем соединение формулы (IVa) может быть подвергнуто дебромированию с использованием традиционных способов, таких как обработка цинком и уксусной кислотой, или, альтернативно, цинком в присутствии водного хлорида аммония в тетрагидрофуране, с получением соединения формулы (IIIa). Соединение формулы (IIIa) затем может быть подвергнуто снятию защиты с получением свободного спиропиперидинового производного формулы (IIa) с использованием стандартных способов, которые зависят от того, какая защитная группа Pg была использована. Например, когда Pg представляет собой трет-бутилоксикарбонил (ВОС), для удаления ВОС-группы могут быть использованы стандартные условия снятия защиты сильной кислотой, такой как 4 н. соляная кислота в диоксане или трифторуксусная кислота в подходящем растворителе, таком как дихлорметан. Когда Pg представляет собой карбобензилокси (Cbz), для снятия защиты может быть использовано гидрирование над палладием на углероде в этаноле или обработка источником водорода, таким как формиат аммония или 1-метил-1,4 циклогексадиен в присутствии палладия на углероде в этаноле или этилацетате. Затем спиропиперидиновое производное формулы (IIa) может быть ацилировано с использованием стандартных способов с получением соединения формулы (Ia). Например, соединение (Ia) затем может быть образовано с использованием стандартной реакции пептидного сочетания с желаемой карбоновой кислотой (R4CO2H). Например, спиропиперидиновое промежуточное соединение (IIa) и карбоновая кислота (R4CO2H) могут быть подвергнуты сочетанию путем образования активированного сложного эфира карбоновой кислоты, например, путем приведения карбоновой кислоты (R4CO2H) в контакт с реагентом пептидного сочетания, таким как О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU) или 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид (EDCHCl), в присутствии или в отсутствие активирующего агента, такого как гидроксибензотриазол (HOBt), и в присутствии подходящего основания, такого как N,N-диизопропилэтиламин (DIEA), триэтиламин или Nметилморфолин (NMM), в подходящем растворителе, таком как THF и/или DMF, диметилацетамид(DMA) или дихлорметан, и затем приведения активированного сложного эфира карбоновой кислоты в контакт со спиропиперидиновым производным (IIa) с образованием соединения формулы (Ia). Альтернативно, соединения формулы (Ia) могут быть получены сначала путем превращения карбоновой кислоты (R4CO2H) в хлорангидрид (R4COCl), например путем взаимодействия с тионилхлоридом,и затем взаимодействия хлорангидрида со спиропиперидиновым производным (IIa) в присутствии подходящего основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан, с получением соединения формулы (Ia). Еще один альтернативный способ предполагает обработку карбоновой кислоты (R4CO2H) 2-хлор-4,6-диметокситриазином в присутствии подходящего основания, такого как N-метилморфолин, в подходящем растворителе, таком как THF и/или DMF. К активированному сложному эфиру добавляют раствор спиропиперидинового производного (IIa) и основания, такого как Nметилморфолин, в подходящем растворителе, таком как THF и/или DMF, в результате чего образуется соединение формулы (Ia). На реакционной схеме II предложен альтернативный синтез соединений формулы (Ia), начиная с промежуточного соединения формулы (VIa). Соединение формулы (VIa) обрабатывают Nбромсукцинимидом (NBS) в присутствии метанола в THF или предпочтительно в метаноле (Nishimura, T.et al. Org. Lett. 2008, 10 (18), 4057-4060, на 4059) с получением метоксибромспиропиперидинового производного формулы (Vb). Индуцированное основанием элиминирование соединения формулы (Vb) путем обработки сильным основанием, таким как трет-бутилат калия в THF, дает соединение формулы(IVb), которое затем обрабатывают сильной кислотой, такой как 2 н. соляная кислота в THF, с получением соединения формулы (IIIa). Затем соединение формулы (IIIa) может быть подвергнуто снятию защиты и ацилировано, как описано ранее на реакционной схеме I, с получением соединений формулы (Ia). На реакционной схеме III предложен синтез соединений формулы (Ib), которые представляют собой соединения формулы (I), в которых R2 представляет собой бромо, и каждый R3 представляет собой водород. Соединение формулы (VIa) подвергают взаимодействию с приблизительно двумя эквивалентами Nбромсукцинимида в присутствии метанола с получением дибромметоксиспиропиперидинового производного формулы (Vc). Затем соединение формулы (Vc) подвергают условиям элиминирования путем обработки сильным основаним, таким как трет-бутилат калия, в подходящем растворителе, с получением соединения формулы (IVc). Обработка соединения формулы (IVc) сильной кислотой, такой как 2 н. соляная кислота, дает соединение формулы (IIIb). Снятие защиты с соединения формулы (IIIb) с получением соединения формулы (IIb), с последующим ацилированием с получением соединения формулы (Ib), может быть осуществлено, как описано ранее для реакционной схемы I. Реакционная схема III На реакционной схеме IV изображено получение некоторых других соединений в пределах формулы (I) из некоторых промежуточных соединений, изображенных ранее. Первое превращение на реакционной схеме IV демонстрирует введение метильной группы в положение R2 путем взаимодействия бромспиропиперидинового производного формулы (IIIb) с триметилбороксином в диметилформамиде в присутствии подходящего палладиевого катализатора, такого как тетракис-трифенилфосфинпалладий, в присутствии карбоната калия и воды, с получением соединения формулы (IIIc). Другие алкильные группы могут быть введены в положение R2 аналогичным образом. Затем соединение формулы (IIIc) может быть подвергнуто снятию защиты и ацилировано, как описано ранее. Второе превращение на реакционной схеме IV демонстрирует введение цианогруппы в положение R2. Бромспиропиперидиновое соединение (IIIb) подвергают взаимодействию с цианидом цинка в присутствии цинка и подходящего палладиевого катализатора с получением соединения формулы (IIId), которое затем может быть подвергнуто снятию защиты и ацилировано с получением соединения формулы (Id). Третье превращение на реакционной схеме IV демонстрирует введение подходящей группы в положение R3 соединения формулы (IIIe). Соединение формулы (IIIe) подвергают депротонированию сильным основанием, таким как гексаметилдисилазид лития (LHMDS), в подходящих безводных условиях в подходящем растворителе, предпочтительно, при низкой температуре. Полученный таким образом енолят затем подвергают взаимодействию с-8 020153 подходящим электрофилом R3Lg, где Lg означает подходящую уходящую группу (такую как галогенид,когда R3Lg представляет собой алкилгалогенид), с получением соединения формулы (IIIf), где R3 представляет собой подходящую группу, такую как алкильная группа. Депротонирование соединения формулы (IIIf) и взаимодействие с другим R3Lg затем могут быть осуществлены снова, при необходимости. Соединение формулы (IIIf) затем может быть подвергнуто снятию защиты и ацилировано, как описано ранее, с получением соединения формулы (Ie). Реакционная схема IV Соединения по настоящему изобретению могут быть выделены и использованы per se или в форме их фармацевтически приемлемых солей. В соответствии с настоящим изобретением, соединения с несколькими основными атомами азота могут образовывать соли в варьирующим числом эквивалентов(экв.) кислоты. Практикующим специалистам будет понятно, что все такие соли находятся в пределах настоящего изобретения. Фармацевтически приемлемые соли, как использовано в данном изобретении в отношении соединений по настоящему изобретению, включают в себя фармацевтически приемлемые неорганические и органические соли соединения. Эти соли могут быть получены in situ во время конечного выделения и очистки соединения или путем отдельного взаимодействия соединения с подходящей органической или неорганической кислотой и выделения соли, образованной таким образом. Типичные соли включают в себя, но не ограничиваются этим, соли гидробромид, гидрохлорид, йодгидрат, сульфат, бисульфат, нитрат, ацетат, трифторацетат, оксалат, безилат, пальмитат, памоат, малонат, стеарат, лаурат, малат, борат,бензоат, лактат, фосфате, гексафторфосфат, бензолсульфонат, тозилат, формиат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактобионат и лаурилсульфонат и т.п. Они также могут включать катионы, основанные на щелочных и щелочно-земельных металлах, таких как натрий, литий, калий, кальций, магний и т.п., а также нетоксичные аммониевые, четвертичные аммониевые и аминные катионы, включающие, но не ограничивающиеся этим, аммоний, тетраметиламмоний, тетраэтиламмоний, метиламмоний, диметиламмоний, триметиламмоний, триэтиламмоний, этиламмоний и т.п. Для дополнительных примеров см., например, Berge, et al., J. Pharm. Sci., 66, 1-19 (1977). Соединения по настоящему изобретению могут существовать в более чем одной кристаллической форме. Полиморфы соединений формулы (I) и их солей (включая сольваты и гидраты) образуют часть данного изобретения и могут быть получены посредством кристаллизации соединения по настоящему изобретению в различных условиях. Например, используя различные растворители или различные смеси растворителей для перекристаллизации; кристаллизацию при различных температурах; различные режимы охлаждения, варьирующиеся от очень быстрого до очень медленного охлаждения во время кристаллизации. Полиморфы также могут быть получены путем нагревания или плавления соединения по настоящему изобретению с последующим постепенным или быстрым охлаждением. Присутствие полиморфов может быть определено посредством твердотельной ядерной магнитной резонансной (ЯМР) спектроскопии, инфракрасной (ИК) спектроскопии, дифференциальной сканирующей калориметрии,рентгеновской дифракции на порошке или других таких методов. Данное изобретение также включает в себя меченные изотопами соединения, которые идентичны соединениям, описанным формулой (I), за исключением того, что один или более атомов заменены атомом, имеющим атомную массу или массовое число, отличное от атомной массы или массового числа,обычно встречающегося в природе. Примеры изотопов, которые могут быть введены в соединения по изобретению, включают в себя изотопы водорода, углерода, азота, кислорода, серы и фтора, такие как 2 Н, 3 Н, 13 С, 14 С, 15N, 18O, 17O, 35S, 36Cl, 125I, 129I и 18F соответственно. Некоторые меченные изотопами соединения по настоящему изобретению, например соединения, в которые введены радиоактивные изотопы, такие как 3 Н и 14 С, являются полезными в анализах распределения в тканях лекарственного средства и/или субстрата. Меченные изотопом тритием (т.е. 3 Н) и углеродом-14 (т.е. 14 С) соединения являются особенно предпочтительными вследствие легкости их получения и детектирования. Кроме того, замена более тяжелыми изотопами, такими как дейтерий (т.е. 2 Н), может давать некоторые терапевтические преимущества, являющиеся результатом их большей метаболической стабильности, например увеличенный период полувыведения in vivo или уменьшенные требования к дозировкам, и, следовательно, могут быть предпочтительными в некоторых обстоятельствах. Меченные изотопами соединения по настоящему изобретению обычно могут быть получены путем осуществления процедур, изложенных на схемах и/или в примерах ниже, путем замены не меченного изотопом реагента на легко доступный меченный изотопом реагент. Соединения по настоящему изобретению могут содержать стереогенные центры. Эти соединения могут существовать в виде смеси энантиомеров или в виде чистых энантиомеров. Когда соединение включает стереогенный центр, тогда соединение может быть разделено на чистые энантиомеры способами, известными специалистам в данной области, например путем образования диастереоизомерных солей, которые могут быть разделены, например, посредством кристаллизации; образования стереоизомерных производных или комплексов, которые могут быть разделены, например, посредством кристаллизации, газожидкостной или жидкостной хроматографии; селективной реакции одного энантиомера с энантиомер-специфическим реагентом, например, ферментативной этерификации; или газожидкостной, или жидкостной хроматографии в хиральной среде, например на хиральном носителе, например силикагеле со связанным хиральным лигандом, или в присутствии хирального растворителя. Следует понимать, что,когда желаемый стереоизомер превращают в другую химическую сущность с помощью одной из процедур разделения, описанных выше, требуется дополнительная стадия высвобождения желаемой энантиомерной формы. Альтернативно, конкретные стереоизомеры могут быть синтезированы с использованием оптически активного исходного материала, посредством асимметрического синтеза с использованием оптически активных реагентов, субстратов, катализаторов или растворителей, или путем превращения одного стереоизомера в другой посредством асимметрического превращения. Соединения по настоящему изобретению могут существовать в различных стабильных конформационных формах, которые могут быть разделены. Торсионная асимметрия вследствие ограниченного вращения вокруг асимметричной одинарной связи, например, вследствие стерического затруднения или напряжения кольца, может обеспечить разделение различных конформеров. Соединения по настоящему изобретению также включают каждый конформационный изомер соединений формулы (I) и их смеси. Соединения по настоящему изобретению являются полезными для лечения заболеваний, состояний и/или расстройств, модулируемых путем ингибирования ацетил-КоА-карбоксилазного(ых) фермента(ов)(в частности, АСС 1 и АСС 2). Другое воплощение настоящего изобретения представляет собой фармацевтическую композицию, содержащую терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли и фармацевтически приемлемый эксципиент, разбавитель или носитель. Соединения по настоящему изобретению (включая композиции и способы, используемые в данном изобретении) также могут быть использованы в изготовлении лекарственного средства для терапевтических применений, описанных в данном изобретении. Типичный препарат получают путем смешивания соединения по настоящему изобретению и носителя, разбавителя или эксципиента. Подходящие носители, разбавители и эксципиенты хорошо известны специалистам в данной области и включают в себя материалы, такие как углеводы, воски, водорастворимые и/или набухаемые полимеры, гидрофильные или гидрофобные материалы, желатин, масла, растворители, вода и т.п. Конкретный используемый носитель, разбавитель или эксципиент будет зависеть от способа и цели, для которых используют соединение по настоящему изобретению. Растворители обычно выбирают, основываясь на растворителях, признанных специалистами в данной области в качестве безопасных (GRAS) для введения млекопитающему. В общем, безопасные растворители представляют собой нетоксичные водные растворители, такие как вода, и другие нетоксичные растворители, которые растворимы в воде или смешиваются с водой. Подходящие водные растворители включают в себя воду, этанол,пропиленгликоль, полиэтиленгликоли (например, PEG400, PEG300) и т.д. и их смеси. Препараты также могут включать один или более буферов, стабилизирующих агентов, поверхностно-активных веществ,увлажняющих агентов, смазывающих агентов, эмульгаторов, суспендирующих агентов, консервантов,антиоксидантов, замутняющих агентов, скользящих агентов, технологических добавок, красителей, подсластителей, ароматизирующих агентов, вкусовых агентов и других известных добавок с получением прекрасного представления лекарственного средства (т.е. соединения по настоящему изобретению или его фармацевтически приемлемой соли или его фармацевтической композиции) или для изготовления фармацевтического продукта (т.е. для применения в медицине, такого как изготовление лекарственного средства). Препараты могут быть получены с использованием стандартных процедур растворения и смешивания. Например, нефасованную лекарственную субстанцию (т.е. соединение по настоящему изобретению или стабилизированную форму соединения (например, комплекс с циклодекстриновым производным или другим известным агентом комплексообразования растворяют в подходящем растворителе в присутствии одного или более эксципиентов, описанных выше. Скорость растворения малорастворимых в воде соединений можно увеличить путем применения высушенной распылением дисперсии, такой как описано Takeuchi, H. с соавт. в "Enhancement of the dissolution rate of a poorly water-soluble drug (tolbutamide) by a spray-drying solvent deposition method and disintegrants", J. Pharm. Pharmacol., 39, 769-773(1987); и EP0901786 B1 (US2002/009494), включенных в данное изобретение посредством ссылки. Соединение по настоящему изобретению обычно готовят в фармацевтических лекарственных формах для обеспечения легко контролируемой дозировки лекарственного средства и для обеспечения пациента прекрасным и легко управляемым продуктом. Фармацевтические композиции также включают сольваты и гидраты соединений по настоящему изобретению. Термин "сольват" относится к молекулярному комплексу соединения, представленного формулой (I) (включая его фармацевтически приемлемые соли), с одной или более молекулами растворителя. Такие молекулы растворителя являются такими, которые обычно используются в фармацевтической области, которые, как известно, являются безопасными для реципиента, например вода, этанол,этиленгликоль и т.п. Термин "гидрат" относится к комплексу, где молекула растворителя представляет собой воду. Сольваты и/или гидраты предпочтительно существуют в кристаллической форме. Другие растворители могут быть использованы в виде промежуточных сольватов при получении более желательных сольватов, таких как метанол, метил-трет-бутиловый эфир, этилацетат, метилацетат, (S)пропиленгликоль, (R)-пропиленгликоль, 1,4-бутин-диол и т.п. Фармацевтическая композиция (или препарат) для применения может быть упакована различными способами, зависящими от способа, используемого для введения лекарственного средства. Обычно изделие для распределения включает контейнер с размещенным в нем фармацевтическим препаратом в подходящей форме. Подходящие контейнеры хорошо известны специалистам в данной области и включают материалы, такие как бутылки (пластмассовые и стеклянные), саше, ампулы, пластмассовые пакеты, металлические цилиндры и т.п. Контейнер также может включать защищенную от неумелого обращения систему для предупреждения неосторожного доступа к содержимому упаковки. В дополнение к этому,на контейнере размещена этикетка, которая описывает содержимое контейнера. Этикетка также может включать соответствующие предупреждения. Кроме того, в настоящем изобретении предложен способ лечения заболеваний, состояний и/или расстройств, модулируемых путем ингибирования ацетил-КоА-карбоксилазного(ых) фермента(ов) у животного, который включает введение животному, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по настоящему изобретению или фармацевтической композиции,содержащей эффективное количество соединения по настоящему изобретению и фармацевтически приемлемый эксципиент, разбавитель или носитель. Способ особенно полезен для лечения заболеваний, состояний и/или расстройств, которые извлекают пользу из ингибирования ацетил-КоАкарбоксилазного(ых) фермента(ов). Один аспект настоящего изобретения представляет собой лечение ожирения и связанных с ожирением расстройств (например, избыточной массы тела, увеличения массы или поддержания массы). Ожирение и избыточную массу тела обычно определяют с помощью индекса массы тела (BMI), который коррелирует с общим жиром в организме и оценивает относительный риск заболевания. BMI вычисляют по массе в килограммах, деленной на рост в метрах квадратных (кг/м 2). Избыточную массу тела обычно определяют как BMI 25-29,9 кг/м 2, и ожирение обычно определяют как BMI 30 кг/м 2. См., например, National Heart, Lung, and Blood Institute, Clinical Guidelines on the Identification, Evaluation, and Treatment ofOverweight and Obesity in Adults, The Evidence Report, Washington, DC: U.S. Department of Health and Human Services, NIH publication no. 98-4083 (1998). Другой аспект настоящего изобретения состоит в лечении или замедлении развития или начала диабета или связанных с диабетом расстройств, включающих диабет типа 1 (инсулинзависимый сахарный диабет, также называемый "IDDM") и типа 2 (инсулиннезависимый сахарный диабет, также называемый "NIDDM"), нарушенную толерантность к глюкозе, инсулинорезистентность, гипергликемию и диабетические осложнения (такие как атеросклероз, коронарную болезнь сердца, инсульт, периферическое сосудистое заболевание, нефропатию, гипертензию, невропатию и ретинопатию). Еще один другой аспект настоящего изобретения состоит в лечении сопутствующих ожирению заболеваний, таких как метаболический синдром. Метаболический синдром включает заболевания, состояния или расстройства, такие как дислипидемия, гипертензия, инсулинорезистентность, диабет (например,диабет 2 типа), болезнь коронарной артерии и сердечную недостаточность. Для более подробной информации о метаболическом синдроме см., например, Zimmet, P.Z., et al. "The Metabolic Syndrome: Perhaps anEndocrinology. 7 (2) (2005); и Alberti, K.G., et al. "The Metabolic Syndrome - A New Worldwide Definition",Lancet, 366, 1059-62 (2005). Предпочтительно введение соединений по настоящему изобретению обеспечивает статистически значимое (р 0,05) снижение по меньшей мере одного фактора риска сердечнососудистого заболевания, такого как снижение лептина в плазме, С-реактивного белка (CRP) и/или холестерина, по сравнению с контролем-носителем, не содержащим лекарственного средства. Введение соединений по настоящему изобретению также может обеспечить статистически значимое (р 0,05) снижение уровней глюкозы в сыворотке. Еще один другой аспект изобретения состоит в лечении неалкогольной жировой дистрофии печени(NAFLD) и печеночной инсулинорезистентности. Для нормального взрослого человека, имеющего массу тела примерно 100 кг, достаточной обычно является дозировка в диапазоне от примерно 0,001 до примерно 10 мг на 1 кг массы тела, предпочтительно от примерно 0,01 до примерно 5,0 мг/кг, более предпочтительно от примерно 0,01 до примерно 1 мг/кг. Однако может потребоваться некоторая вариабельность в общем диапазоне дозировок, зависящая от возраста и массы субъекта, которого лечат, предполагаемого пути введения, конкретного вводимого соединения и т.п. Определение диапазонов дозировок и оптимальных дозировок для конкретного пациента находится в пределах способности среднего специалиста в данной области, имеющего пользу от настоящего описания изобретения. Следует также отметить, что соединения по настоящему изобретению могут быть использованы в препаратах с замедленным высвобождением, контролируемым высвобождением и отсроченным высвобождением, и эти формы также хорошо известны среднему специалисту в данной области. Соединения по настоящему изобретению также могут быть использованы в сочетании с другим(и) фармацевтическим(и) агентом(ами) для лечения заболеваний, состояний и/или расстройств, описанных в данном изобретении. Поэтому также предложены способы лечения, которые включают введение соединений по настоящему изобретению в комбинации с другими фармацевтическими агентами. Подходящие фармацевтические агенты, которые могут быть использованы в комбинации с соединениями по настоящему изобретению, включают в себя агенты против ожирения (включая агенты для подавления аппетита), противодиабетические агенты, антигипергликемические агенты, агенты, снижающие уровень липидов, и антигипертензивные агенты. Подходящие агенты против ожирения включают в себя ингибиторы 11 гидроксистероиддегидрогеназы-1 (11-HSD типа 1), ингибитор стеароил-КоА-десатуразы-1 (SCD-1),агонисты MCR-4, агонисты холецистокинина-А (CCK-A), ингибиторы обратного захвата моноаминов(такие как сибутрамин), симпатомиметические агенты, 3-адренергические агонисты, агонисты дофамина (такие как бромкриптин), аналоги меланоцит-стимулирующего гормона, агонисты 5 НТ 2 с, антагонисты меланин-концентрирующего гормона, лептин (белок ОВ), аналоги лептина, агонисты лептина, антагонисты галанина, ингибиторы липазы (такие как тетрагидролипстатин, т.е. орлистат), анорексигенные агенты (такие как агонист бомбезина), антагонисты нейропептида-Y (например, антагонисты NPY Y5),PYY3-36 (включая его аналоги), тиреомиметические агенты, дегидроэпиандростерон или его аналог, глюкокортикоидные агонисты или антагонисты, антагонисты орексина, агонисты глюкагоноподобного пептида-1, цилиарные нейротрофические факторы (такие как Axokine, доступный от Regeneron Pharmaceuticals, Inc., Tarrytown, NY и ProcterGamble Company, Cincinnati, ОН), ингибиторы агути-родственного белка человека (AGRP), антагонисты грелина, антагонисты или обратные агонисты гистамина 3, агонисты нейромедина U, ингибиторы МТР/АроВ (например, кишечные ингибиторы МТР, такие как дирлотапид), опиоидный антагонист, орексиновый антагонист и т.п. Предпочтительные агенты против ожирения для применения в комбинированных аспектах настоящего изобретения включают в себя кишечные ингибиторы МТР (например, дирлотапид, митратапид и имплитапид, R56918 (CAS403987) и CAS913541-47-6), агонисты ССКа (например, N-бензил-2-[4(1 Н-индол-3-илметил)-5-оксо-1-фенил-4,5-дигидро-2,3,6,10b-тетрааза-бензо[е]азулен-6-ил]-N-изопропилацетамид, описанный в публикации РСТWO 2005/116034 или публикации США 2005-0267100 А 1),агонисты 5 НТ 2 с (например, лоркасерин), агонист MCR4 (например, соединение, описанное в US 6818658), ингибитор липазы (например, цетилистат), PYY3-36 (используемый в данном изобретении"PYY3-36" включает аналоги, такие как пэгилированный PYY3-36, например, аналоги, описанные в публикации США 2006/0178501), опиоидные антагонисты (например, налтрексон), олеоил-эстрон (CAS180003-17-2), обинепитид (ТМ 30338), прамлинтид (Symlin), тесофенсин (NS2330), лептин, лираглутид,бромкриптин, орлистат, эксенатид (Byetta), AOD-9604 (CAS221231-10-3) и сибутрамин. Предпочтительно соединения по настоящему изобретению и комбинированные терапии вводят в сочетании с тренировками и целесообразной диетой. Подходящие противодиабетические агенты включают в себя ингибитор натрий-глюкозного котранспортера (SGLT), ингибитор фосфодиэстеразы (PDE)-10, ингибитор диацилглицеринацилтрансферазы (DGAT) 1 или 2, сульфонилмочевину (например, ацетогексамид, хлорпропамид, диабинезе, глибенкламид, глипизид, глибурид, глимепирид, гликлазид, глипентид, гликвидон, глизоламид, толазамид и толбутамид), меглитинид, ингибитор -амилазы (например, тендамистат, трестатин и AL-3688), ингибитор гидролазы -глюкозидазы (например, акарбозу), ингибитор -глюкозидазы (например, адипозин, камиглибозу, эмиглитат, миглитол, воглибозу, прадимицин-Q и салбостатин), агонист PPAR (например, балаглитазон, циглитазон, дарглитазон, энглитазон, исаглитазон, пиоглитазон, росиглитазон и троглитазон), агонист PPAR / (например, CLX-0940, GW-1536, GW-1929, GW-2433, KRP-297, L-796449, LR-90,MK-0767 и SB-219994), бигуанид (например, метформин), агонист глюкагоноподобного пептида 1 (GLP1) (например, Byetta, эксендин-3 и эксендин-4), ингибитор протеинтирозинфосфатазы-1 В (РТР-1B)(например, тродусквемин, гиртиосаловый экстракт и соединения, описанные в Zhang, S., et al., Drug Discovery Today, 12 (9/10), 373-381 (2007, ингибитор SIRT-1 (например, ресерватрол), ингибитор дипептидилпептидазы IV (DPP-IV) (например, ситаглиптин, вилдаглиптин, алоглиптин и саксаглиптин), усилитель секреции инсулина, ингибитор окисления жирных кислот, А 2 антагонист, ингибитор аминоконцевой киназы c-jun (JNK), инсулин, миметик инсулина, ингибитор гликогенфосфорилазы, агонист рецептора VPAC2 и активатор глюкокиназы. Предпочтительные противодиабетические агенты представляют собой метформин, агонист глюкагоноподобного пептида 1 (GLP-1) (например, Byetta) и ингибиторыDPP-IV (например, ситаглиптин, вилдаглиптин, алоглиптин и саксаглиптин). Все перечисленные патенты и публикации США, включая все технические бюллетени, упомянутые в примерах, включены в данное изобретение посредством ссылки во всей своей полноте. Примеры, представленные в данном изобретении ниже, предназначены лишь для иллюстративных целей. Композиции, способы и различные параметры, отраженные в данном изобретении, предназначены только для пояснения различных аспектов и воплощений изобретения и не предназначены для ограничения объема заявленного изобретения каким-либо образом. Примеры Соединения и промежуточные соединения, описанные ниже, обычно названы согласно рекомендациям IUPAC (Международный союз теоретической и прикладной химии) по номенклатуре органической химии и правилам CAS Index. Если не указано иное, все реагенты получали из коммерческих источников. Флэш-хроматографию осуществляли согласно способу, описанному в Still et al., J. Org. Chem., 1978,43, 2923. Все очистки Biotage, обсуждавшиеся в данном изобретении, осуществляли с использованием колонки либо 40 М, либо 40S Biotage, содержащей диоксид кремния KP-SIL (40-63 мкМ, 60 ангстрем)(Biotage AB; Uppsala, Швеция). Все очистки CombiFlash, обсуждавшиеся в данном изобретении, осуществляли с использованием системы CombiFlash Companion (Teledyne Isco; Lincoln, Nebraska), применяя упакованные колонки с диоксидом кремния RediSep. Масс-спектры регистрировали на спектрометре Waters (Waters Corp.; Milford, MA) Micromass Platform II. Если не указано иное, масс-спектры регистрировали на спектрометре Waters (Milford, MA) Micromass Platform II. Протонные ЯМР химические сдвиги даны в частях на миллион в сторону от тетраметилсилана и регистрировали на спектрометре Varian Unity 400 или 500 МГц (Varian Inc.; Palo Alto, СА). Химические сдвиги ЯМР даны в частях на миллион в сторону от тетраметилсилана (для протона) или фтортрихлорметана (для фтора). Примеры получения, описанные ниже, использовали в синтезе соединений, приведенных в следующих примерах. Получение исходных материалов и промежуточных соединений. Карбоново-кислотные исходные материалы. Следующие имеющиеся в продаже карбоновые кислоты использовали для получения приведенных в примерах соединений по настоящему изобретению: 4-хлор-3-метилбензойная кислота (Alfa Aesar, WardList). Следующие карбоновые кислоты (которые использовали для получения соединений, описанных в примерах ниже) получали согласно ранее опубликованным сведениям: 3-гидрокси-6-метилпиколиновая кислота (P. Korovchenko et al., Catalysis Today 2007, 121, 13-21); 4-гидрокси-1,3-диметил-1H-пиразол-5 карбоновая кислота (Tet. Let. 1971, 19, 1591); 3-амино-2,6-диметилизоникотиновая кислота (Gulland, J.M.,Robinson, R.J. Chem. Soc., Trans. 1925, 127, 1493-503); 5-гидроксихинолин-6-карбоновая кислота (Bogert,М.Т.; Fisher, Harry L. Orig. Com. 8th Intern. Cangr. Appl. Chem. 1912, 6, 37-44); 5-гидроксиизохинолин-6 карбоновая кислота (может быть получена посредством гидролиза соответствующего метилового сложного эфира: Dyke, S.F.; White, A.W.С.; Hartley, D. Tempahedron 1973, 29, 857-62); 3-метил-1-(пиридин-3 ил)-1 Н-пиразол-5-карбоновая кислота (может быть получена посредством аналогичного химического способа в J. Het. Chem. 1999, 36, 217). Следующие карбоново-кислотные исходные материалы (которые использовали для получения соединений, описанных в примерах ниже) получали, как описано ниже. Получение кислоты 1: 4-хлор-1H-бензимидазол-6-карбоновая кислота К смеси 4-амино-3-нитробензойной кислоты (10 г, 56 ммоль) в уксусной кислоте (100 мл) при 0 С добавляли сульфурилхлорид (8,98 г, 66 ммоль). Реакционную смесь оставляли нагреваться до температуры окружающей среды и перемешивали в течение ночи. Смесь вливали в ледяную воду, фильтровали и сушили на воздухе с получением 4-амино-5-хлор-3-нитробензойной кислоты (7,35 г, 62%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6)м.д. 8,24 (s, 2 Н), 8,19 (s, 1H), 7,86 (s, 1H). Суспензию 4-амино-5-хлор-3-нитробензойной кислоты (7,35 г, 34 ммоль) в метаноле (150 мл) обрабатывали концентрированной серной кислотой (40 мл). Суспензию нагревали до образования флегмы в течение ночи. Реакционный раствор концентрировали в вакууме с получением желтого твердого вещества, которое переносили в этилацетат (200 мл) и воду (30 мл). Раствор охлаждали до 0 С и добавляли карбонат калия (12,4 г) в воде (30 мл). Слои разделяли и водный слой экстрагировали этилацетатом (200 мл). Объединенные органические слои сушили над сульфатом магния и концентрировали в вакууме с полу- 14020153 чением метил-4-амино-5-хлор-3-нитробензоата в виде желтого твердого вещества (7,25 г, 93%). 1H ЯМР (400 МГц, ДМСО-d6)м.д. 8,50 (d, J=2,15 Гц, 1 Н), 8,02 (d, J=1,95 Гц, 1 Н), 7,84 (br. s., 2 Н),3,80 (s, 3H). К раствору метил-4-амино-5-хлор-3-нитробензоата (4,29 г, 18,6 ммоль) в этаноле (115 мл), воде (250 мл) и тетрагидрофуране (200 мл) добавляли гидросульфит натрия (80 г, 391 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 2 ч. К реакционной смеси добавляли воду(55 мл). После перемешивания в течение дополнительного часа к реакционной смеси добавляли насыщенный водный бикарбонат натрия (140 мл). Реакционную смесь фильтровали и фильтрат экстрагировали дважды этилацетатом (200 мл каждый раз). Органические экстракты объединяли и промывали насыщенным водным бикарбонатом натрия (100 мл), затем насыщенным водным хлоридом натрия (100 мл). Органический слой концентрировали в вакууме до конечного объема 100 мл и затем оставляли осаждаться при температуре окружающей среды в течение ночи с получением осадка. Смесь фильтровали и сушили в токе азота с получением метил-3,4-диамино-5-хлорбензоата (973 мг, 26%). Фильтрат концентрировали в вакууме с получением метил-3,4-диамино-5-хлорбензоата (2,45 г, 66%). 1(s, 2 Н), 3,70 (s, 3 Н). 3,4-Диамино-5-хлорбензоат (1,2 г, 6 ммоль) добавляли к воде (10 мл) и муравьиной кислоте (826 мг,18 ммоль) и кипятили с обратным холодильником в течение 4 ч. Реакционную смесь охлаждали до температуры окружающей среды и добавляли водный гидроксид калия (21 мл, 1 М). Реакционный раствор промывали этилацетатом (225 мл каждый раз). Водный слой подкисляли до рН 5 водной соляной кислотой (1 н.) с получением осадка, который фильтровали, промывали водой и сушили в токе азота с получением указанного в заголовке соединения (439 мг, 37%). 1 3,4-Диамино-5-хлорбензоат (из примера получения кислоты 1, 100 мг, 0,50 ммоль) и карбонилдиимидазол (89 мг, 0,55 ммоль) объединяли в тетрагидрофуране (2 мл) и перемешивали в течение 16 ч. Реакционный раствор нагревали до 60 С в течение 3 ч. К реакционной смеси добавляли карбонилдиимидазол (81 мг, 0,50 ммоль) и реакцию продолжали при 60 С в течение 2 ч. Реакционную смесь оставляли охлаждаться до комнатной температуры и перемешивали в течение 16 ч. Образовывался осадок. Смесь фильтровали. Фильтрат концентрировали в вакууме и остаток суспендировали в этилацетате. Суспензию фильтровали на том же фильтре, что и для первоначальной фильтрации. Собранные твердые вещества промывали порцией этилацетата и затем сушили в токе азота с получением метил-7-хлор-2-оксо-2,3 дигидро-1 Н-бензо[d]имидазол-5-карбоксилата в виде белого твердого вещества (93 мг, 82%). 1H ЯМР (400 МГц, ДМСО-d6)м.д. 11,60 (br. s., 1H), 11,16 (s, 1H), 7,55 (d, J=1,37 Гц, 1 Н), 7,38 (d,J=1,56 Гц, 1 Н), 3,80 (s, 3 Н). Метил-7-хлор-2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-карбоксилат (351 мг, 1,55 ммоль), 1 М водный гидроксид лития (0,774 мл, 1,55 ммоль) и тетрагидрофуран (5 мл) объединяли и нагревали до 50 С в течение 2 ч. К реакционной смеси добавляли 1 М водный гидроксид лития (0,774 мл, 1,55 ммоль) и метанол (10 мл), реакционную смесь нагревали до образования флегмы в течение 6 ч и затем оставляли охлаждаться до температуры окружающей среды в течение ночи. Реакционный раствор концентрировали в вакууме для удаления тетрагидрофурана и метанола. Остаточный водный слой экстрагировали этилацетатом (2 мл). К водному слою добавляли воду (2 мл), этилацетат (2 мл) и 3 М водную соляную кислоту. Образовывался осадок. Смесь фильтровали и твердые вещества промывали водой и этилацетатом. Твердые вещества сушили в токе азота с получением указанного в заголовке соединения (296 мг, 90%). 1 В 2,5-5-мл пробирку для микроволновой обработки добавляли 6-бром-4-фтор-1H-бензо[d]имидазол транс-ди(u-ацетато)-бис-[о-(ди-о-толилфосфино)бензил]дипалладий(II) (26 мг, 0,043 ммоль) и гексакарбонил молибдена (100 мг, 0,38 ммоль), наряду с карбонатом натрия (237 мг, 2,23 ммоль), растворенным в дегазированной воде (2 мл). Смесь перемешивали в течение 20 с и затем нагревали при 155 С в микроволновой печи в течение 10 мин, поддерживая давление ниже 16 бар (1,6 МПа). Сосуд продували перед обработкой и выдерживали в течение ночи при комнатной температуре. К реакционной смеси добавляли воду (2 мл) и этилацетат (3 мл) и смесь затем фильтровали через Celite. Фильтрат распределяли с этилацетатом и разделяли. Водную фракцию промывали этилацетатом еще раз и объединенные органические слои отбрасывали. К водному слою добавляли другую порцию воды (5 мл) и подкисляли с помощью 0,5 М HCl до рН 3; образовывался коричневый осадок. Смесь выдерживали в холодильнике при 4 С в течение 1 ч. Смесь фильтровали и промывали водой с получением 4-фтор-1H-бензо[d]имидазол-6 карбоновой кислоты в виде серого твердого вещества (63%-ный выход). 1 К смеси (Е)-3-(3-бромфенил)акриловой кислоты (100 г, 0,44 моль) и триэтиламина (0,48 моль) в толуоле (1000 мл) добавляли по каплям дифенилфосфорилазид (127,4 г, 0,45 моль) при 0-10 С. Смесь перемешивали при комнатной температуре в течение ночи. Тонкослойная хроматография (петролейный эфир/этилацетат=8:1) показала завершение реакции. Полученную смесь промывали 1 н. гидроксидом натрия (500 мл) и экстрагировали этилацетатом (2000 мл 3). Органический слой концентрировали с получением неочищенного (Е)-1-азидо-3-(3-бромфенил)проп-2-ен-1-оны, который использовали непосредственно на следующей стадии. Смесь неочищенного (Е)-1-азидо-3-(3-бромфенил)проп-2-ен-1-она (неочищенного примерно 120 г) и толуола (200 мл) кипятили с обратным холодильником в течение 2 ч. Тонкослойная хроматография(петролейный эфир/этилацетат=8:1) показала, что большая часть исходного материала была израсходована. Смесь концентрировали с получением неочищенного (Е)-1-бром-3-(2-изоцианатовинил)бензола(100 г, 94%), который использовали непосредственно на следующей стадии. Раствор (Е)-1-бром-3-(2-изоцианатовинил)бензола (100 г, 0,44 моль) в толуоле (200 мл) добавляли по каплям к смеси трибутиламина (100 мл) и оксидибензола (500 мл) при 190 С. После добавления смесь нагревали при 210 С в течение еще 2 ч. Тонкослойная хроматография (петролейный эфир/этилацетат=1:1) показала, что реакция завершилась. Смесь охлаждали до комнатной температуры,фильтровали и твердое вещество промывали этилацетатом (50 мл 3). Твердое вещество сушили под вакуумом с получением неочищенного 6-бромизохинолин-1(2 Н)-она (30 г, 30%) в виде бледно-желтого твердого вещества, которое использовали непосредственно на следующей стадии. Смесь 6-бромизохинолин-1(2 Н)-она (30 г, 134 ммоль), триэтиламина (17,6 г, 174 ммоль), хлорида палладия(II) (0,24 г, 1,34 ммоль) и (S)-(-)-2,2'-бис-(дифенилфосфино)-1,1'-бинафтила (0,84 г, 1,34 ммоль) в метане (300 мл) нагревали при 100 С при 2 МПа монооксида углерода и перемешивали в течение 12 ч. Тонкослойная хроматография (петролейный эфир/этилацетат=1:1) показала, что реакция завершилась. Реакционную смесь концентрировали, остаток промывали водой и твердое вещество фильтровали и сушили в вакууме с получением неочищенного метил-1-оксо-1,2-дигидроизохинолин-6-карбоксилата (23,8 г, 95%) в виде желтого твердого вещества, которое использовали непосредственно на следующей стадии. К смеси метил-1-оксо-1,2-дигидроизохинолин-6-карбоксилата (25 г, 0,133 моль), тетрагидрофурана(200 мл) и воды (200 мл) добавляли гидроксид лития (16,8 г, 0,40 моль) при комнатной температуре и смесь перемешивали в течение 4 ч. Тонкослойная хроматография (петролейный эфир/этилацетат=1:1) показала, что реакция завершилась. Реакционную смесь экстрагировали этилацетатом (100 мл 3) для удаления примесей. Водный слой подкисляли 4 н. водной HCl до рН 5 и фильтровали. Твердое вещество сушили в вакууме с получением 1-оксо-1,2-дигидроизохинолин-6-карбоновой кислоты (11,3 г, 48%) в виде бледно-желтого твердого вещества. 1 1-Оксо-1,2-дигидроизохинолин-7-карбоновую кислоту получали по аналогии с 1-оксо-1,2 дигидроизохинолин-6-карбоновой кислотой (получение кислоты 4). 5-Бромпиколинонитрил (2,0 г, 10,9 ммоль), имидазол (818 мг, 12 ммоль) карбонат калия (1,66 г, 12 ммоль) и диметилформамид (40 мл) объединяли и нагревали до 130 С в течение 20 ч. Реакционный раствор упаривали и остаток распределяли между дихлорметаном (150 мл) и водой (100 мл). Фазы разделяли и органическую фазу промывали водой (50 мл), сушили над сульфатом магния и упаривали с получением остатка, который очищали посредством флэш-хроматографии, элюируя 2-3%-ным метанолом в дихлорметановом градиенте, с получением 5-(1H-имидазол-1-ил)пиколинонитрила (1,23 г, 66%). 5-(1 Н-Имидазол-1-ил)пиколинонитрил (136 мг, 0,80 ммоль) нагревали до образования флегмы в 6 н. водной соляной кислоте (10 мл) в течение 2 ч. Реакционную смесь упаривали и остаток подвергали азеотропной перегонке с тремя порциями толуола с получением остатка, который очищали на ионообменной колонке (AG-50 Biorad), элюируя 0-10%-ным пиридином в водном градиенте, с получением указанного в заголовке соединения в виде белого твердого вещества (128 мг, 84%). 1 К смеси 4-амино-3-хлор-5-метилбензонитрила (3,0 г, 18,0 ммоль) в хлороформе (50 мл) добавляли уксусный ангидрид (3,92 мл, 41,4 ммоль). Смесь кипятили с обратным холодильником в течение 5 ч и затем охлаждали до комнатной температуры. К смеси добавляли ацетат калия (530 мг, 5,4 ммоль) и изоамилнитрит (5,28 мл, 39,6 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, экстрагировали насыщенным водным бикарбонатом натрия, органические вещества сушили над сульфатом натрия и концентрировали в вакууме с получением коричневого масла. Масло растворяли в метаноле (25 мл) и добавляли концентрированную соляную кислоту (25 мл). Реакционную смесь перемешивали при комнатной температуре в течение 22 ч и метанол концентрировали в вакууме. Остаточный водный слой корректировали до рН 7 и полученный осадок фильтровали с получением коричневого твердого вещества, которое очищали посредством флэшхроматографии, используя 50%-ный дихлорметан в гептане в качестве элюента, с получением 7-хлор-1Hиндазол-5-карбонитрила в виде твердого вещества (585 мг, 18%).(17,5 мл) и гидроксид калия (6,44 г, 115 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, дважды экстрагировали этиловым эфиром, подкисляли водный слой 1 н. соляной кислотой и полученный осадок фильтровали с получением 7-хлор-1 Н-индазол-5-карбоновой кислоты в виде коричневого твердого вещества (900 мг,60%). Диэтилмалонат (151 г, 0,944 моль) добавляли по каплям при перемешивании к 60%-ному гидриду натрия в минеральном масле (37,8 г, 0,944 моль) в сухом тетрагидрофуране (1 л). После того как водород прекращал выделяться, добавляли 2-хлор-5-нитропиридин (125 г, 0,787 моль). Реакционную смесь кипятили с обратным холодильником в течение 2 ч и тетрагидрофуран затем выпаривали в вакууме с получением неочищенного диэтил(5-нитропиридин-2-ил)малоната, который использовали на следующей стадии без очистки. Неочищенный диэтил(5-нитропиридин-2-ил)малонат добавляли к кипящей 65%-ной азотной кислоте (1,5 л) при перемешивании. Реакционную смесь кипятили с обратным холодильником при перемешивании в течение 15 ч. Реакционную смесь концентрировали в вакууме и полученное твердое вещество промывали хлороформом с получением 5-нитропиридин-2-карбоновой кислоты (выход 65%, 85,9 г). 5-Нитропиридин-2-карбоновую кислоту (100 г, 0,60 моль) кипятили с обратным холодильником в метаноле (1 л) и серной кислоте (57 мл) в течение 5 ч. Реакционную смесь охлаждали, уменьшали до половины объема в вакууме и остаток нейтрализовали раствором карбоната натрия. Полученный осадок фильтровали с получением метил-5-нитропиридин-2-карбоксилата (выход 89%, 98 г). Метил-5-нитропиридин-2-карбоксилат (182 г, 1 моль) кипятили с обратным холодильником в пиперидине (250 мл) в течение 1 ч. Реакционную смесь концентрировали в вакууме с получением неочищенного 5-нитро-2-(пиперидин-1-илкарбонил)пиридина, который использовали для следующей стадии без дополнительной очистки. Неочищенный 5-нитро-2-(пиперидин-1-илкарбонил)пиридин восстанавливали водородом при атмосферном давлении в присутствии 10% палладия на углероде (4 г) в уксусной кислоте (500 мл). Катализатор отделяли путем фильтрации и растворитель выпаривали в вакууме с получением неочищенного 6(пиперидин-1-илкарбонил)пиридин-3-амина, который использовали на следующей стадии без дополнительной очистки. Раствор нитрита натрия (69 г) в концентрированной соляной кислоте (1,5 л) добавляли к неочищенному 6-(пиперидин-1-илкарбонил)пиридин-3-амину при 0 С и смесь перемешивали в течение 10 мин. Добавляли мочевину (20 г) и смесь перемешивали в течение 15 мин. Добавляли йодид натрия (150 г),продукт выделяли путем фильтрации и перекристаллизовывали из этанола с получением 5-йод-2(пиперидин-1-илкарбонил)пиридина (выход 23%, вычисленный для метил-5-нитропиридин-2 карбоксилата, 71 г). Смесь 5-йод-2-(пиперидин-1-илкарбонил)пиридина (71 г, 0,23 моль), ацетата палладия(II) (1,03 г, 46 ммоль), 2-(ди-трет-бутилфосфино)бифенила (2,76 г, 92 ммоль), морфолина (23,7 г, 0,28 моль) и третбутилата натрия (27,8 г, 0,28 моль) в толуоле (400 мл) перемешивали в атмосфере аргона при 95 С в течение 2 ч. Продукт выделяли посредством хроматографии (силикагель, этилацетат) и перекристаллизовывали из этанола с получением 4-[6-(пиперидин-1-илкарбонил)пиридин-3-ил]морфолина (выход 37%,22 г). 25% KOH (100 мл) добавляли к 4-[6-(пиперидин-1-илкарбонил)пиридин-3-ил]морфолину (18,3 г),смесь кипятили с обратным холодильником и затем нейтрализовали HCl. Раствор упаривали в вакууме и продукт экстрагировали горячим изопропанолом с получением указанного в заголовке соединения (выход 71%, 11,5 г). 2 н. соляную кислоту (8 мл) добавляли к раствору 3,4-диамино-5-хлорбензоата (из примера получения кислоты 1, 435 мг, 2,17 ммоль) в этаноле (20 мл). Смесь нагревали до образования флегмы, затем к желтому раствору добавляли ацетилацетон (437 мг, 4,37 ммоль). При добавлении желтый раствор становился пурпурным. Перемешивали при кипячении с обратным холодильником в течение 1 ч и раствор снова становился желтым. Перемешивали при кипячении с обратным холодильником в течение еще 1 ч. Растворитель концентрировали до бесцветного остатка. Добавляли воду (20 мл). Суспензию экстрагировали этилацетатом (20 мл). Водный слой подщелачивали 2 н. гидроксидом натрия (примерно 8 мл) до рН примерно 10. Экстрагировали этилацетатом (315 мл). Объединенные органические вещества из щелочной экстракции промывали рассолом (5 мл). Сушили над сульфатом магния, фильтровали, концентрировали и сушили под высоким вакуумом с получением метил-7-хлор-2-метил-1 Н-бензо[d]имидазол-5 карбоксилата (290 мг, 59%) в виде бесцветного твердого вещества. 1H ЯМР (400 МГц, CDCl3)м.д. 2,68 (s, 3 Н), 3,93 (s, 3 Н), 7,25 (s, 1H), 7,96 (s, 1H). К раствору метил-7-хлор-2-метил-1H-бензо[d]имидазол-5-карбоксилата (280 мг, 1,25 ммоль) в метаноле (7,5 мл) добавляли 2 н. гидроксид натрия (5 мл, 5 ммоль). Перемешивали при 65 С в течение 16 ч. Метанол концентрировали в вакууме и оставшийся водный слой экстрагировали этилацетатом (10 мл). Водный слой подкисляли до рН примерно 4 с помощью 1 н. соляной кислоты (примерно 5 мл). Бесцветный осадок фильтровали и сушили под высоким вакуумом с получением указанного в заголовке соединения (189 мг, 72%). В круглодонную колбу загружали 5-бром-3-фторбензол-1,2-диамин (400 мг, 2 ммоль) и 30 мл этанола. Затем добавляли 5 н. соляную кислоту (8 мл, 40 ммоль). Эту смесь нагревали до образования флегмы и добавляли 2,4-пентандион. Реакционная смесь становилась темно-пурпурной по цвету, затем обратно медленно становилась желтого цвета. Реакцию оставляли протекать в течение 3 ч и затем охлаждали и нейтрализовали насыщенным раствором бикарбоната натрия. Затем реакционную смесь трижды экстрагировали дихлорметаном. Объединенные органические слои промывали рассолом, сушили сульфатом магния, фильтровали и концентрировали в вакууме. Неочищенную смесь растирали в диэтиловом эфире, затем фильтровали с получением 6-бром-4-фтор-2-метил-1H-бензо[d]имидазола (375 мг, 82%) в виде желто-коричневого твердого вещества. 1H ЯМР (400 МГц, CDCl3)м.д, 7,44 (br. s., 1H), 7,10 (d, J=11,22 Гц, 1 Н), 2,63 (s, 3 Н). В 5-мл флакон для микроволновой обработки загружали 6-бром-4-фтор-2-метил-1Hбензо[d]имидазол (187 мг, 0,815 ммоль) и суспендировали в дегазированном диоксане (2 мл), транс-ди-ацетатобис[2-(ди-О-толилфосфино)бензил]дипалладии(II) (28 мг, 0,048 ммоль) и гексакарбониле молибдена (110 мг, 0,417 ммоль). Затем добавляли дегазированный 10%-ный водный карбонат натрия (2,45 мл,2,45 ммоль). Затем реакционную смесь перемешивали в течение 20 с перед проведением реакции в микроволновой печи при 155 С при очень высоком поглощении в течение 10 мин. Затем сосуд вентилировали и выдерживали в течение ночи при комнатной температуре. Затем добавляли воду (2 мл) и этилацетат(3 мл) и смесь фильтровали через Celite. Слои разделяли и водный слой промывали этилацетатом (2). Объединенные этилацетатные слои отбрасывали. Воду добавляли к водному слою (5 мл), который затем подкисляли 0,5 М соляной кислотой до рН 3, затем охлаждали до 4 С. Образовывалось твердое вещество, которое фильтровали и промывали водой с получением указанного в заголовке соединения (61 мг,37%) в виде желтого твердого вещества. Образовывалась вторая партия, которую затем фильтровали с получением указанного в заголовке соединения (100 мг, 63%). 1 К суспензии гидрида натрия (5,08 г, 127 ммоль) в диметилформамиде (75 мл) добавляли диэтилмалонат (19,26 мл, 127 ммоль) при 0 С. Затем раствор перемешивали при температуре окружающей среды в течение 30 мин и добавляли по каплям раствор 5-бром-2-хлор-3-нитропиридина (30 г, 127 ммоль) в диметилформамиде (75 мл). Затем темно-коричневую смесь перемешивали при 100 С в течение 2 ч, после чего охлаждали до температуры окружающей среды и гасили насыщенным раствором хлорида аммония (500 мл) при 0 С. Смесь экстрагировали этилацетатом (3500 мл) и объединенные органические вещества сушили над сульфатом магния. Растворитель удаляли в вакууме с получением темнокоричневого масла, которое очищали посредством колоночной флэш-хроматографии (10% этилацетат/гексан) с получением диэтил-2-(5-бром-3-нитропиридин-2-ил)малоната в виде коричневого твердого вещества (31,8 г, 88 ммоль, 69%). 1H ЯМР (400 МГц, CDCl3)м.д. 8,86 (s, 1H), 8,61 (s, 1 Н), 5,44 (1H, s), 4,29 (q, 4H), 1,27 (t, 6H). Смесь диэтил-2-(5-бром-3-нитропиридин-2-ил)малоната (31,8 г, 88 ммоль) в водной соляной кислоте (6 М, 1,4 л) перемешивали при кипячении с обратным холодильником в течение 18 ч. Реакционную смесь охлаждали до температуры окружающей среды и очень медленно добавляли к насыщенному водному раствору бикарбоната натрия (4 л) при 0 С. Затем смесь экстрагировали дихлорметаном (7 л), сушили над сульфатом магния и растворитель удаляли в вакууме с получением 5-бром-2-метил-3 нитропиридина в виде оранжевого масла (13,8 г, 63,9 ммоль, 72%), которое отверждалось при стоянии. 1H ЯМР (300 МГц, CDCl3)м.д. 8,78 (s, 1H), 8,43 (s, 1H), 2,79 (s, 3 Н). К раствору 5-бром-2-метил-3-нитропиридина (13,8 г, 63,9 ммоль) в промышленном метилированном спирте (330 мл) при 40 С добавляли железный порошок (20 г) (порциями во избежание комкования),затем концентрированную водную соляную кислоту (5 мл). Темно-коричневую смесь интенсивно перемешивали при кипячении с обратным холодильником в течение 2 ч и затем охлаждали и фильтровали через Celite (который промывали 1 л промышленного метилированного спирта). Затем растворитель удаляли в вакууме и остаток переносили в этилацетат (200 мл) и промывали насыщенным водным рас- 19020153 твором бикарбоната натрия (200 мл), сушили над сульфатом магния и растворитель удаляли в вакууме с получением 5-бром-2-метилпиридин-3-амина в виде оранжевого твердого вещества (10,7 г, 57,5 ммоль,89,9%). 1H ЯМР (400 МГц, CDCl3)м.д. 7,91 (s, 1H), 7,00 (s, 1H), 3,75 (br,s, 2H), 2,25 (s, 3 Н). К раствору 5-бром-2-метилпиридин-3-амина (10,7 г, 57,5 ммоль) в дихлорметане (575 мл) добавляли уксусный ангидрид (12 мл, 126,5 ммоль) при 0 С, затем добавляли триэтиламин (22 мл, 158 ммоль). Смесь оставляли нагреваться до температуры окружающей среды и перемешивали в течение 18 ч, после чего добавляли дополнительный эквивалент уксусного ангидрида (6 мл, 63 ммоль). Смесь перемешивали при температуре окружающей среды в течение еще 72 ч. Реакционную смесь гасили насыщенным водным раствором бикарбоната натрия (500 мл) и органическую фазу промывали насыщенным водным хлоридом натрия (500 мл), сушили над сульфатом магния и концентрировали в вакууме с получением коричневого твердого вещества. Это твердое вещество растирали с 30%-ным этилацетатом в гексанах с получением N-(5-бром-2-метилпиридин-3-ил)ацетамида в виде не совсем белого твердого вещества (8,28 г, 36 ммоль, 63%). 1H ЯМР (400 МГц, CD3OD)м.д. 8,31 (s, 1H), 8,18 (s, 1H), 2,43 (s, 3 Н), 2,18 (s, 3 Н). К раствору N-(5-бром-2-метилпиридин-3-ил)ацетамида (8,28 г, 36 ммоль) в хлороформе (550 мл) при температуре окружающей среды добавляли ацетат калия (4,32 г, 43,6 ммоль), уксусную кислоту (2,5 мл, 43,6 ммоль) и затем уксусный ангидрид (6,86 мл, 72,6 ммоль). Смесь перемешивали при температуре окружающей среды в течение 15 мин, после чего нагревали до 40 С. Затем по каплям добавляли изоамилнитрит. Затем реакционную смесь перемешивали при 60 С в течение 48 ч. Реакционную смесь медленно вливали в насыщенный раствор бикарбоната натрия (500 мл) при 0 С. Органическую фазу сохраняли, а водную фазу экстрагировали дихлорметаном (500 мл). Затем объединенные органические вещества концентрировали до коричневого масла, которое растворяли в метаноле (500 мл). Добавляли водный гидроксид натрия (2 М, 500 мл) при 0 С и смесь перемешивали при температуре окружающей среды в течение 1 ч, после чего метанол удаляли в вакууме. Затем водную смесь экстрагировали этилацетатом(3500 мл). Объединенные органические вещества сушили над сульфатом магния и растворитель удаляли в вакууме с получением 6-бром-1H-пиразоло[4,3-b]пиридина в виде светло-коричневого твердого вещества (5,5 г, 27,9 ммоль, 77%). 1H ЯМР (400, CD3OD)м.д. 8,55 (s, 1H), 8,24 (s, 1H), 8,21 (s, 1H). К раствору 6-бром-1 Н-пиразоло[4,3-b]пиридина (5,5 г, 27,9 ммоль) в метаноле (125 мл) и ацетонитриле (75 мл) добавляли триэтиламин (22 мл, 156 ммоль), 2,2'-бис-(дифенилфосфино)-1,1'-бинафтил (1,98 г, 3,07 ммоль), дихлорид палладия (1,23 г, 6,98 ммоль). Смесь помещали под давление монооксида углерода 20 бар (2 МПа), нагревали до 100 С и интенсивно перемешивали в течение 18 ч. Реакционную смесь охлаждали до температуры окружающей среды и фильтровали через Celite, после чего растворитель удаляли в вакууме с получением коричневого масла. Затем это неочищенное масло очищали посредством колоночной флэш-хроматографии (1:1, этилацетат:гексан) с получением метил-1H-пиразоло[4,3b]пиридин-6-карбоксилата в виде бледно-желтого твердого вещества (4,52 г, 92%-ный выход). 1H ЯМР (400, CDCl3)м.д. 10,56 (s, 1H), 9,23 (s, 1H), 8,35 (s, 1H), 8,40 (s, 1H), 4,01 (s, 3 Н). К раствору метил-1 Н-пиразоло[4,3-b]пиридин-6-карбоксилата (3,52 г, 20 ммоль) в метаноле (250 мл) и воде (190 мл) при 0 С по каплям добавляли водный гидроксид натрия (2 М, 64 мл, 128 ммоль). Затем суспензию оставляли нагреваться до температуры окружающей среды и перемешивали в течение 18 ч. Затем метанол удаляли в вакууме и водную смесь экстрагировали этилацетатом (250 мл), после чего подкисляли (до рН 5-6) водной соляной кислотой (2 М, 70 мл). Выпавшее в осадок твердое вещество кремового цвета затем отфильтровывали и сушили в эксикаторе с получением указанного в заголовке соединения (0,675 г, 4,16 ммоль, 21%-ный выход). 1 Суспензию (2-нитрофенил)ацетонитрила (30 г, 185 ммоль) и 10%-ного палладия на углероде (2 г) в уксусной кислоте (450 мл) гидрировали в аппарате Парра под давлением 30 футов на кв.дюйм (206,8 кПа) при температуре окружающей среды в течение 2 ч. Смесь фильтровали через набивку Celite и фильтрат концентрировали в вакууме. Полученный остаток растворяли в этилацетате (250 мл). Полученный раствор промывали водой (2100 мл) и насыщенным хлоридом натрия (50 мл), затем сушили над безводным сульфатом натрия и концентрировали в вакууме с получением продукта. Неочищенное вещество очищали посредством колоночной хроматографии (силикагель, 100-200 меш), используя 8%-ный этилацетат в петролейном эфире в качестве элюента, с получением (2-аминофенил)ацетонитрила (13,5 г,55%) в виде твердого вещества. 1 К охлажденному раствору (2-аминофенил)ацетонитрила (13 г, 98 ммоль) в диметилформамиде (150 мл) при 0 С порциями добавляли N-бромсукцинимид (19,3 г, 108 ммоль) в течение 30 мин и поддерживали при 0 С в течение 1 ч. Смесь разбавляли этилацетатом (300 мл) и промывали водой (3100 мл) и насыщенным хлоридом натрия (50 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Полученный неочищенный продукт очищали посредством колоночной хроматографии (силикагель, 100-200 меш), используя 10%-ный этилацетат в петролейном эфире в качестве элюента, с получением (2-амино-5-бромфенил)ацетонитрила (11 г, 53%) в виде твердого вещества. 1H ЯМР (CDCl3)7,35 (s, 1H), 7,25 (d, 1H), 6,65 (d, 1H), 3,7 (br, 2H), 3,52 (s, 2H). К охлажденному раствору (2-амино-5-бромфенил)ацетонитрила (11 г, 52 ммоль) в концентрированной соляной кислоте (110 мл) при -50 С медленно добавляли раствор нитрита натрия (3,9 г, 57 ммоль) в воде (20 мл). После добавления смесь перемешивали при -50 С в течение 2 ч. Смесь нейтрализовали 33%-ным гидроксидом аммония при 0 С и экстрагировали этилацетатом (3100 мл). Объединенные органические слои промывали насыщенным хлоридом натрия (100 мл), сушили над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт очищали посредством колоночной хроматографии (силикагель, 100-200 меш), используя 10%-ный этилацетат в петролейном эфире в качестве элюента, с получением 5-бром-3-цианоиндазола (7 г, 60%) в виде твердого вещества. 1(3 г,13,51 ммоль),дихлорида 1,1'-бис(дифенилфосфино)ферроцен-палладия (1,76 г, 2,16 ммоль), ацетата натрия (3,32 г, 40,5 ммоль), диметилформамида (1 мл) в метаноле (100 мл) дегазировали и выдерживали под давлением монооксида углерода(80 фунтов на кв.дюйм (551,6 кПа в автоклаве при 80 С в течение 16 ч. Смесь разбавляли водой (50 мл),фильтровали через набивку Celite и фильтрат концентрировали. Полученный остаток подкисляли 10%ным раствором лимонной кислоты и экстрагировали этилацетатом (2100 мл). Объединенные органические слои промывали рассолом (50 мл), сушили над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт очищали посредством колоночной хроматографии (силикагель, 100200 меш), используя 10%-ный этилацетат в хлороформе в качестве элюента, с получением метил-3 циано-1 Н-индазол-5-карбоксилата (1,8 г, 68%) в виде твердого вещества. 1H ЯМР (CDCl3)м.д. 10,8 (s, 1H), 8,7 (s, 1H), 8,22 (d, 1H), 7,64 (d, 1H), 4,0 (s, 3 Н). К раствору метил-3-циано-1 Н-индазол-5-карбоксилата (2,5 г, 12 ммоль) в этаноле (40 мл) добавляли раствор гидроксида лития (1,04 г, 24,9 ммоль) в воде (15 мл) и перемешивали при температуре окружающей среды в течение 16 ч. Смесь концентрировали и полученный остаток растворяли в воде (25 мл) и промывали этилацетатом (20 мл). Водный слой подкисляли 10%-ным раствором лимонной кислоты,полученный осадок фильтровали, промывали 50%-ным этилацетатом в петролейном эфире (210 мл) и сушили с получением указанного в заголовке соединения (1,9 г, 82%) в виде коричневого твердого вещества. 1 К перемешиваемому раствору 29,0 г (69 ммоль) 2-бром-4-метилпиридина в 150 мл концентрированной серной кислоты порциями добавляли 67,9 г (231 ммоль) дихромата калия. Реакционную смесь охлаждали на ледяной бане так, чтобы температура оставалась между 20 и 50 С. После завершения добавления перемешивание продолжали при комнатной температуре в течение еще 2 ч. Затем реакционную смесь медленно вливали в 2 л смеси льда с водой и смесь перемешивали в течение 1 ч при комнатной температуре. Полученные кристаллы собирали путем фильтрации, промывали водой до тех пор, пока промывки не становился бесцветными, и сушили в вакууме с получением 30,0 г (88%) 2 бромизоникотиновой кислоты. К охлажденному на льду раствору 2-бромизоникотиновой кислоты (73 г, 0,361 моль) в дихлорметане(35 г,1,08 моль) порциями добавляли 1-этил-3-[3(диметиламино)пропил]карбодиимида гидрохлорид (67 г, 0,434 моль). Смесь перемешивали при температуре окружающей среды в течение ночи. Затем добавляли 120 г силикагеля и растворитель выпаривали. Остаток очищали посредством флэш-хроматографии, элюируя 5%-ным этилацетатом в петролейном эфире, с получением 58 г (75%) метил-2-бромизоникотината в виде белого твердого вещества. Метил-2-бромизоникотинат (216 г, 1 моль), сухой ацетонитрил (1,7 л), этинил(триметил)силан (117 г, 1,2 моль), диизопропиламин (122 г, 1,2 моль) и дихлор-бис-(трифенилфосфин)палладий (36 г, 0,05 моль) помещали в хорошо высушенную трехгорлую колбу, которую дважды продували током азота. Реакционную смесь перемешивали в течение 0,5 ч, охлаждали до 10 С и добавляли йодид меди (19 г, 0,1 моль) в токе азота. При 20 С реакционная смесь становилась вязкой и черной и наблюдалась экзотермическая реакция, после чего образовывался осадок. После добавления йодида меди реакционную смесь перемешивали в течение еще 2 ч при температуре окружающей среды. Осажденный остаток выделяли путем фильтрации и дважды промывали диэтиловым эфиром (800 мл). Фильтрат промывали насыщенным хлоридом аммония (2300 мл) и рассолом (2300 мл). После сушки над сульфатом натрия растворитель выпаривали. Остаток очищали с использованием колонки с силикагелем, элюируя гексаном, затем 5%-ным этилацетатом в петролейном эфире, с получением 191 г (82%) метил-2 триметилсилил)этинил)изоникотината. Концентрированную серную кислоту (60 мл, 1,1 моль) добавляли к суспензии метил-2 триметилсилил)этинил)изоникотината (127 г, 0,54 моль) в тетрагидрофуране (600 мл) и ацетате ртути(51,5 г, 0,16 моль). Суспензию перемешивали в течение 3 ч при 50 С и оставляли на ночь. Реакционную смесь разбавляли диэтиловым эфиром (1,5 л) и серную кислоту нейтрализовали насыщенным бикарбонатом натрия (150 г, 1,7 моль). Остаток солей ртути выделяли путем фильтрации. Эфирный раствор промывали водой и сушили над сульфатом натрия. Растворитель удаляли с получением метил-2 ацетилизоникотината в виде масла, которое использовали непосредственно на следующей стадии. В 2-л трехгорлую колбу добавляли метил-2-ацетилизоникотинат (160 г, 0,894 моль), диметилформамид-диметилацетамид (350 мл) и толуол (350 мл). Смесь кипятили с обратным холодильником в течение примерно 5 ч с насадкой Дина-Старка для удаления образующегося метанола. Добавляли дополнительное количество диметилформамида-диметилацетамида и толуола для поддержания реакционного объема на уровне примерно 800-900 мл. Когда жидкостная хроматография-масс-спектрометрия показала,что реакция завершилась, растворитель удаляли с получением неочищенного (Z)-метил-2-(3(диметиламино)акрилоил)изоникотината в виде темного твердого вещества. Неочищенное твердое вещество использовали непосредственно на следующей стадии. В 2-л трехгорлую колбу добавляли (Z)-метил-2-(3-(диметиламино)акрилоил)изоникотинат (0,894 моль), гидразин-гидрат (48,8 г), безводный этанол (1 л). Суспензию перемешивали при 20 С в течение ночи. Растворитель удаляли в вакууме. Остаток переносили в концентрированную соляную кислоту (600 мл) и нагревали до образования флегмы в течение 2 ч. Смесь охлаждали до температуры окружающей среды. Полученный осадок фильтровали, промывали водой, этанолом и ацетоном и сушили с получением 78,6 г указанного в заголовке соединения в виде коричневого твердого вещества. 1 Водный раствор гидросульфита натрия (17,4 г, 100 ммоль в 80 мл воды) добавляли к метил-3(метиламино)-4-нитробензолкарбоксилату (855 мг, 4,75 ммоль) в тетрагидрофуране (70 мл) и этаноле (30 мл) при 0 С. При добавлении оранжевый раствор превращался в оранжевую суспензию. Смесь перемешивали при комнатной температуре в течение 2 ч. В течение этого времени оранжевая суспензия превращалась в желтую суспензию. Добавляли насыщенный бикарбонат натрия (100 мл), затем желтая суспензия становилась бесцветной. Смесь экстрагировали этилацетатом (2100 мл). Объединенные органические вещества промывали рассолом (30 мл). Сушили над сульфатом магния, фильтровали, концентрировали и сушили под высоким вакуумом с получением метил-4-амино-3-(метиламино)бензоата (586 мг,68%) в виде желтого масла. Полученное масло начинало кристаллизоваться при стоянии через 10 мин. 1H ЯМР (400 МГц, CDCl3)м.д. 2,89 (s, 3 Н), 3,37-3,81 (m, 2 Н), 3,85 (s, 3 Н), 6,67 (d, J=8,01 Гц, 1 Н),7,33 (d, J=1,37 Гц, 1 Н), 7,44 (dd, J=8,11, 1,66 Гц, 1 Н). К раствору метил-4-амино-3-(метиламино)бензоата (586 мг, 3,19 ммоль) в тетрагидрофуране (20 мл) добавляли карбонилдиимидазол (567 мг, 3,50 ммоль) при комнатной температуре. Желтый раствор перемешивали при комнатной температуре в течение 16 ч. Добавляли карбонилдиимидазол (500 мг, 0,96). Перемешивали при комнатной температуре в течение 4 ч. Добавляли этилацетат (75 мл). Промывали 10%-ной лимонной кислотой (5 мл), 1 н. гидроксидом натрия (5 мл) и рассолом (5 мл). Органические вещества сушили над сульфатом магния, фильтровали, концентрировали и сушили под высоким вакуумом с получением неочищенного желтого твердого вещества (690 мг, 100%). Это неочищенное твердое вещество растирали с этилацетатом (10 мл). Осадок фильтровали и сушили под высоким вакуумом с получением метил-3-метил-2-оксо-2,3-дигидро-1 Н-бензо[d]имидазол-5-карбоксилата (422 мг, 64%). 1 1 Н-бензо[d]имидазол-5-карбоксилата (420 мг, 2,04 ммоль) в метаноле (10 мл). Суспензия становилась раствором при добавлении 1 н. гидроксида натрия. Перемешивали при 65 С в течение 16 ч. Охлаждали до комнатной температуры, затем концентрировали для удаления метанола. Водную фазу экстрагировали этилацетатом (5 мл). Водную фазу подкисляли 2 н. хлористым водородом (3 мл) до рН примерно 2. Водный слой концентрировали до твердого вещества. Твердое вещество растирали с водой (3 мл). Осадок фильтровали и сушили под высоким вакуумом с получением указанного в заголовке соединения (234 мг,59%) в виде бледно-коричневого твердого вещества. 1 Суспензию метил-4-амино-3-бром-5-нитробензоата (10 г, 36,3 ммоль) и хлорида олова(II) (33 г, 14,5 ммоль) в метаноле (100 мл) нагревали до 60 С и выдерживали в течение 4 ч. Реакционную массу охлаждали до температуры окружающей среды и концентрировали с получением остатка; остаток подщелачивали, используя насыщенный водный бикарбонат натрия, до тех пор, пока рН не достигал 11, и водный слой экстрагировали дихлорметаном (3200 мл). Объединенные органические слои промывали водным насыщенным хлоридом натрия (200 мл), сушили над безводным сульфатом натрия и концентрировали с получением метил-3,4-диамино-5-бромбензоата в виде не совсем белого твердого вещества (5 г, 58%). 1(уширенный s, 2H). Раствор 3,4-диамино-5-бромбензоата (1 г, 4,0 ммоль) и триэтиламина (0,4 г, 4,0 ммоль) в дихлорметане (6 мл) охлаждали до 0 С. К этому раствору добавляли раствор трифосгена (1,2 г, 4,08 ммоль) в дихлорметане (15 мл). Реакционную смесь оставляли нагреваться до температуры окружающей среды и поддерживали в течение 18 ч. Реакционную массу гасили водой (3 мл) и экстрагировали этилацетатом(310 мл). Объединенные органические слои промывали водным насыщенным хлоридом натрия (50 мл),сушили над безводным сульфатом натрия и концентрировали с получением метил-7-бром-2-оксо-2,3 дигидро-1H-бензо[d]имидазол-5-карбоксилата в виде не совсем белого твердого вещества (500 мг, 45%). 1H ЯМР (CDCl3+ДМСО-d6)11,35 (s, 1H), 11,05 (s, 1H), 7,75 (s, 1 Н), 7,52 (s, 1H) и 3,85 (s, 3 Н). Метил-7-бром-2-оксо-2,3-дигидро-1 Н-бензо[d]имидазол-5-карбоксилат (238 мг, 0,878 ммоль) и 2 н. водный гидроксид натрия (1,50 мл, 3,0 ммоль) объединяли в метаноле (5 мл) и нагревали до 50 С в течение 90 мин. Реакционный раствор концентрировали для удаления метанола. К реакционному остатку добавляли этилацетат (5 мл). Полученный раствор подкисляли 1 н. водной соляной кислотой (1,5 мл) с получением конечного рН 4. Образовывался осадок, который фильтровали и сушили под вакуумом с получением указанного в заголовке соединения (226 мг, 100%) в виде твердого вещества. 1 Смесь ацетонитрила (2 моль), гидроксиламина гидрохлорида (2 моль) и метилата натрия (2 моль) перемешивали при комнатной температуре в течение 3 суток, затем фильтровали и фильтрат концентрировали при температуре ниже 20 С с получением (Z)-N'-гидроксиацетимидамида (150 г) в виде белого твердого вещества, которое непосредственно использовали на следующей стадии. Смесь метанола (800 мл), гидроксида калия (44 г, 0,95 моль) и диметил-пиридин-2,4 дикарбоксилата (ChemPacific) (156 г, 0,79 моль) кипятили с обратным холодильником в течение 0,5 ч и затем упаривали в вакууме с получением 4-(метоксикарбонил)пиколиновой кислоты (144 г) в виде желтого твердого вещества. К 4-(метоксикарбонил)пиколиновой кислоте (150 г, 1,62 моль) в дихлорметане (500 мл) добавляли оксалилхлорид (400 мл), поддерживая температуру 25-30 С в течение 3 суток. Реакционную смесь упаривали в вакууме с получением метил-2-(хлоркарбонил)изоникотината в виде желтого масла. К раствору метил-2-(хлоркарбонил)изоникотината в дихлорметане (500 мл) добавляли (Z)-N'гидроксиацетимидамид и триэтиламин, поддерживая температуру 25-30 С в течение 1 суток. Реакционную смесь концентрировали в вакууме с получением аминоэтилиденаминоокси)карбонил)изоникотината в виде желтого твердого вещества. Раствор (Z)-метил-2-1-аминоэтилиденаминоокси)карбонил)изоникотината в толуоле (1 л) нагревали с обратным холодильником в течение ночи. Полученную смесь упаривали и очищали посредством колоночной хроматографии на силикагеле с получением метил-2-(3-метил-1,2,4-оксадиазол-5 ил)изоникотината в виде белого твердого вещества. Смесь гидроксида лития (15 г, 0,35 моль), этанола (500 мл) и метил-2-(3-метил-1,2,4-оксадиазол-5 ил)изоникотината (52 г, 0,23 моль) перемешивали при комнатной температуре в течение 5 ч, затем смесь концентрировали в вакууме. Добавляли воду, затем экстрагировали этилацетатом. Водный слой доводили до рН 1,5 водной 1 н. соляной кислотой и экстрагировали этилацетатом. Органический слой концентрировали в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества(375 г) в тетрагидрофуране (18 л). Реакционную смесь охлаждали до -5 С и раствор гидроксида калия в этаноле (3 н., 0,243 л) добавляли по каплям в течение 10 мин. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 16 ч. Добавляли циклогексан (10 л) и раствор промывали насыщенным хлоридом натрия (310 л). Органический слой концентрировали с получением масла. Данное масло растворяли в 2 л смеси 80:20 циклогексан/этилацетат и фильтровали через Celite для удаления нерастворимого вещества. Фильтрат очищали при помощи колоночной флэшхроматографии (70:30 гексан/этилацетат) с получением продукта в виде масла. Это масло растирали в гексанах с получением целевого продукта в виде белого твердого вещества (131 г, 28%). Пример получения Пример получения I-1 А-1 а (101 г) и трис-(диметиламинометан) (133 мл) растворяли в толуоле (800 мл) и нагревали до образования флегмы в течение 17 ч. Реакционную смесь концентрировали до минимального перемешиваемого объема и добавляли этилацетат (600 мл). Данную смесь нагревали до образования флегмы и добавляли гептан (1,2 л) в течение 20 мин. Горячий раствор охлаждали до комнатной температуры в течение 3 ч. Твердые вещества отфильтровали через крупнозернистый стеклоцемент и промывали гептаном (300 мл). Полученное твердое вещество сушили в вакуумной печи при 40 С в течение 3 ч с получением целевого продукта в виде желтого твердого вещества (107 г). 1(44,4 г). Реакционную смесь перемешивали при кипении с обратным холодильником в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат (500 мл). Реакционный раствор промывали лимонной кислотой (2300 мл, 10% водная) и водой (400 мл). Органический слой концентрировали в вакууме с получением I-1 А-1 с в виде желтого твердого вещества (109 г). 1 К раствору примера получения I-1 А-1 с (109 г) в метаноле (1 л) добавляли N-бром-сукцинимид (61,4 г). Реакционную смесь перемешивали в течение 1 ч. Реакцию гасили тиосульфатом натрия (10 г в 300 мл воды) и затем перегоняли до конечного объема 500 мл. Раствор охлаждали до температуры окружающей среды и добавляли 2-метилтетрагидрофуран (1 л) и воду (100 мл). Органический слой удаляли и водный слой экстрагировали 2-метилтетрагидрофураном. Органические слои объединяли, промывали водным гидроксидом натрия (1 н., 250 мл), водой и насыщенным водным хлоридом натрия. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали до оранжевого масла. Это масло растворяли в тетрагидрофуране (500 мл) и добавляли трет-бутилат калия (76,8 г) в тетрагидрофуране (500 мл). Раствор нагревали до 60 С и перемешивали в течение 1 ч. Добавляли водную соляную кислоту (1 н., 1 л) и раствор перемешивали в течение 30 мин. Фазы разделяли и водный слой экстрагировали этилацетатом(700 мл). Органические слои объединяли, промывали водой (400 мл) и насыщенным водным хлоридом натрия (100 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением остатка. Этот остаток сушили в вакуумной печи при 40 С в течение 16 ч с получением указанного в заголовке соединения в виде оранжевого воска (117 г). 1 Пример получения I-1A-1d (23,5 г) суспендировали в этилацетате (260 мл) и метаноле (70 мл). Реакционный раствор охлаждали до 2 С и ацетилхлорид (33,6 мл) добавляли по каплям в течение 20 мин. Реакционную смесь оставляли медленно нагреваться до комнатной температуры и перемешивали в течение 4 ч. Реакционный раствор охлаждали до 0 С и осадок отфильтровывали. Осадок промывали этилацетатом (200 мл) и сушили в вакуумной печи (40 С, 10 мм рт.ст. (1,33 кПа в течение 16 ч с получением указанного в заголовке соединения в виде светло-желтого твердого вещества.+ESI MS (M+H)=248,4. Альтернативное получение препарата (I-1 А-1 е) 1-изопропил-4,6-дигидроспиро[индазол-5,4'пиперидин]-7(1 Н)-она(325 мл) растворяли в толуоле (1,9 л) и нагревали с обратным холодильником в течение 4 ч. Смесь перегоняли и концентрировали до минимального перемешиваемого объема (110 С) и затем добавляли толуол(1,9 л). Реакционную смесь снова перегоняли до минимального перемешиваемого объема и охлаждали до комнатной температуры. Добавляли толуол (1,8 л) и изопропилгидразина гидрохлорид (135 г) и раствор нагревали до образования флегмы в течение 5 ч. Реакционную смесь охлаждали до комнатной температуры и затем промывали лимонной кислотой (10% водная, 2150 мл) и водой (200 мл), затем органический слой перегоняли до минимального перемешиваемого объема. Добавляли метанол (2 л) и перегоняли до минимального перемешиваемого объема. Это повторяли с метанолом (2 л). Раствор снова растворяли в метаноле (2,5 л) и добавляли одной порцией N-бромсукцинимид (176 г). Раствор перемешивали при 23 С в течение 2 ч. Добавляли водный раствор тиосульфата натрия (5 мас.%, 0,5 л) и смесь перемешивали в течение 15 мин. Реакционную смесь концентрировали при помощи перегонки (45 С, 210 мм рт.ст.(27,93 кПа до примерно 0,5 л и затем добавляли 2-метилтетрагидрофуран (2,5 л). После перемешивания в течение 15 мин водный слой отбрасывали. Органический слой концентрировали до примерно 0,2 л и добавляли тетрагидрофуран (0,5 л). К смеси добавляли раствор трет-бутилата калия в тетрагидрофуране(1,9 л, 1 М раствор). Раствор нагревали до 60 С и перемешивали в течение 1 ч. После охлаждения до комнатной температуры добавляли водную соляную кислоту (1 н., 2,2 л) в течение 20 мин. Смесь перемешивали при комнатной температуре в течение 20 мин и затем слои оставляли разделяться. Водный слой удаляли и обратно экстрагировали этилацетатом (1,75 л). Объединенные органические слои промывали водой (1 л) и органический слой концентрировали посредством перегонки (удаляли 4 л растворителя). Добавляли этилацетат (1,8 л) и раствор концентрировали до минимального перемешиваемого объема. Добавляли этилацетат (3 л) и метанол (0,8 л) и раствор охлаждали до 0 С. Ацетилхлорид (401 мл) добавляли по каплям в течение 20 мин и раствор перемешивали при 0 С в течение 4 ч. Осадок собирали посредством фильтрации в атмосфере азота. Фильтрат промывали этилацетатом (0,5 л) и сушили в вакуумной печи при 40 С с получением I-1 А-1 е в виде не совсем белого твердого вещества (241 г). 1 К бензольному (700 мл) раствору бензил-4-формилпиперидин-1-карбоксилата (90,0 г, 363,9 ммоль),перемешиваемому в 2 л 3-горлой колбе, снабженной ловушкой Дина-Старка, добавляли паратолуолсульфоновую кислоту (6,92 г, 36,4 ммоль). Реакционную смесь нагревали до 70 С, добавляли 3-бутен-2 он (61,8 мл, 753 ммоль) и смесь нагревали с обратным холодильником в течение 24 ч, собирая вытесненную воду в ловушку. Реакционную смесь охлаждали до комнатной температуры и промывали 500 мл насыщенного водного бикарбоната натрия. Органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали. Полученное темно-коричневое масло переносили в 200 мл дихлорметана и фильтровали через подушку диоксида кремния (600 мл диоксида кремния), элюируя 2 л гептана, затем 3 л 50% смеси этилацетат/гептан и затем 3 л этилацетата, собирая 1 л фракции. Фракции, содержащие чистый продукт, объединяли и концентрировали с получением 68,1 г указанное в заголовке соединения в виде густого коричневого масла. Фракции, содержащие неочищенный продукт, объединяли и концентрировали и очищали посредством флэш-хроматографии (10-80% этилацетат/гептан, 340 г силикагеля) с получением еще 23,6 г указанного в заголовке соединения в виде густого коричневого масла. Общий выход составлял 91,7 г (94,1%). 9-Оксо-3-аза-спиро[5.5]ундец-7-ен-3-карбоновой кислоты бензиловый сложный эфир, препарат IIA-2 (15,2 г, 51 ммоль) растворяли в 180 мл толуола и добавляли трис-(диметиламино)метан (22,2 г, 27 ммоль). Реакционную смесь нагревали до образования флегмы в течение 5 ч и затем оставляли охлаждаться до комнатной температуры в течение ночи. Реакционный раствор концентрировали в вакууме с получением указанного в заголовке соединения (18,0 г, 100%). Пример получения I-1A-2 а (59,2 г, 167 ммоль) растворяли в 835 мл этанола. К реакционному раствору добавляли уксусную кислоту (20 мл, 345 ммоль) и трет-бутилгидразина гидрохлорид (29,1 г, 234 ммоль). Реакционную смесь нагревали до образования флегмы в течение 1 ч. Реакционный раствор охлаждали до комнатной температуры и затем концентрировали в вакууме с получением оранжевого масла, которое очищали при помощи флэш-хроматографии, используя 20-40% этилацетат в гептане в качестве элюента, с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (50 г, 79%). Пример получения I-1A-2b (50 г, 132 ммоль) растворяли в 1 л тетрагидрофурана. К реакционной смеси добавляли N-бромсукцинимид (24,6 г, 138 ммоль) и 250 мл воды. Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь разделяли между этилацетатом и водой. Фазы разделяли и органическую фазу промывали еще 2 раза водой и один раз насыщенным водным хлоридом натрия. Органическую фазу сушили над сульфатом магния, концентрировали в вакууме и кристаллизовали из эфира с получением указанного в заголовке соединения в виде кремового твердого вещества (60,7 г, 97%). Пример получения I-1A-2 с (57,9 г, 122 ммоль) растворяли в 1 л ацетона и затем охлаждали до 0 С в ледяной бане. К раствору добавляли 122 мл реагента Джонса (Fillion, E. Tetrahedron Letters 2004, 46,1091-1094). Ледяную баню удаляли и реакционную смесь оставляли нагреваться до комнатной температуры, затем ее перемешивали в течение 45 мин. Добавляли насыщенный водный бикарбонат натрия, пока не наблюдалось отсутствие выделения газа и значение рН не достигало 7. Полученную смесь фильтровали через подушку Celite, промывая этилацетатом. Слои фильтрата разделяли и водный слой обратно экстрагировали этилацетатом. Органические экстракты объединяли, промывали два раза водой, один раз насыщенным водным хлоридом натрия, сушили над сульфатом магния и концентрировали в вакууме. Остаток кристаллизовали из смеси этилацетат/гептан с получением указанного в заголовке соединения Пример получения I-1A-2d (50,4 г, 106 ммоль) растворяли в 600 мл тетрагидрофурана, к нему добавляли насыщенный водный хлорид аммония (600 мл) и цинковый порошок (20,8 г, 319 ммоль). Реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Реакционную смесь фильтровали через Celite, фазы разделяли и органическую фазу промывали водой и насыщенным водным хлоридом натрия, сушили над сульфатом магния и концентрировали в вакууме с получением пены. Пену растирали один раз в смеси этилацетат/гептан и один раз в эфире и фильтровали с получением указанного в заголовке соединения в виде белого твердого вещества (40,4 г, 96%). Пример получения I-1A-2 е (46,6 г, 118 ммоль) растворяли в 730 мл этанола и раствор добавляли к 10% палладию на углероде (9,4 г). К нему добавляли 1-метил-1,4-циклогексадиен (90 мл, 769 ммоль). Реакционную смесь перемешивали при кипении с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и фильтровали через Celite. Фильтрат концентрировали в вакууме с получением серого твердого вещества. Это твердое вещество растворяли в 150 мл этилацетата,к нему добавляли 35 мл 4 М соляной кислоты в диоксане. Образовался осадок и его собирали фильтрацией с получением указанного в заголовке соединения в виде белого твердого вещества (34 г, 97%). Этилгидразиноацетата гидрохлорид (0,92 г, 5,95 ммоль) добавляли к раствору примера получения I1 А-2 а (1,25 г, 3,90 ммоль) в этаноле (30 мл). Смесь перемешивали при кипении с обратным холодильником в течение 1 ч. Аликвота показала посредством 1 Н ЯМР, что взаимодействие было закончено. Реакционную смесь охлаждали до комнатной температуры и концентрировали в глубоком вакууме до коричневого масла. Масло растирали с диэтиловым эфиром (50 мл). Осадок фильтровали и фильтрат концентрировали и сушили в глубоком вакууме с получением указанного в заголовке соединения (1,50 г, 100%) в виде коричневого масла. Пример получения I-2 А-42 а (1,45 г, 3,86 ммоль) в толуоле (5 мл) добавляли к суспензии гидрида натрия (0,148 г, 60% дисперсия в минеральном масле) в диэтилкарбонате (30 мл) по каплям при 80 С в течение 30 мин. Реакционную смесь перемешивали при кипении с обратным холодильником в течение 1,5 ч. 1H ЯМР показала, что исходное вещество было израсходовано и что образовался целевой продукт. Реакционную смесь охлаждали до комнатной температуры. Добавляли метанол (1 мл) и раствор перемешивали при комнатной температуре в течение 5 мин. Добавляли воду (5 мл). Раствор подкисляли до рН примерно 32 н. водной соляной кислотой (3 мл), затем экстрагировали дихлорметаном (315 мл). Объединенные органические вещества сушили над сульфатом магния, фильтровали, концентрировали и сушили в глубоком вакууме с получением коричневой смолы (1,59 г, 92%). Неочищенное вещество растирали со смесью 1:1 диэтиловый эфир:гептаны (50 мл). Осадок отфильтровывали. Фильтрат концентрировали и сушили в глубоком вакууме с получением указанного в заголовке соединения (1,25 г, 72%).
МПК / Метки
МПК: A61K 31/438, C07D 471/10
Метки: ацетил-koa-карбоксилазы, ингибиторы, n1-пиразолоспирокетоновые
Код ссылки
<a href="https://eas.patents.su/30-20153-n1-pirazolospiroketonovye-ingibitory-acetil-koa-karboksilazy.html" rel="bookmark" title="База патентов Евразийского Союза">N1-пиразолоспирокетоновые ингибиторы ацетил-koa-карбоксилазы</a>
Предыдущий патент: Синергетическая фунгицидная комбинация производного дитиинотетракарбоксимида, композиция, ее содержащая, для контроля нежелательных фитопатогенных грибов и их применение
Следующий патент: Способ измельчения твердых веществ в мокром состоянии и устройство для его осуществления
Случайный патент: Транспортная тележка, в основном предназначаемая для использования в хлеве