Модуляторы tgr5 и способы их применения
Формула / Реферат
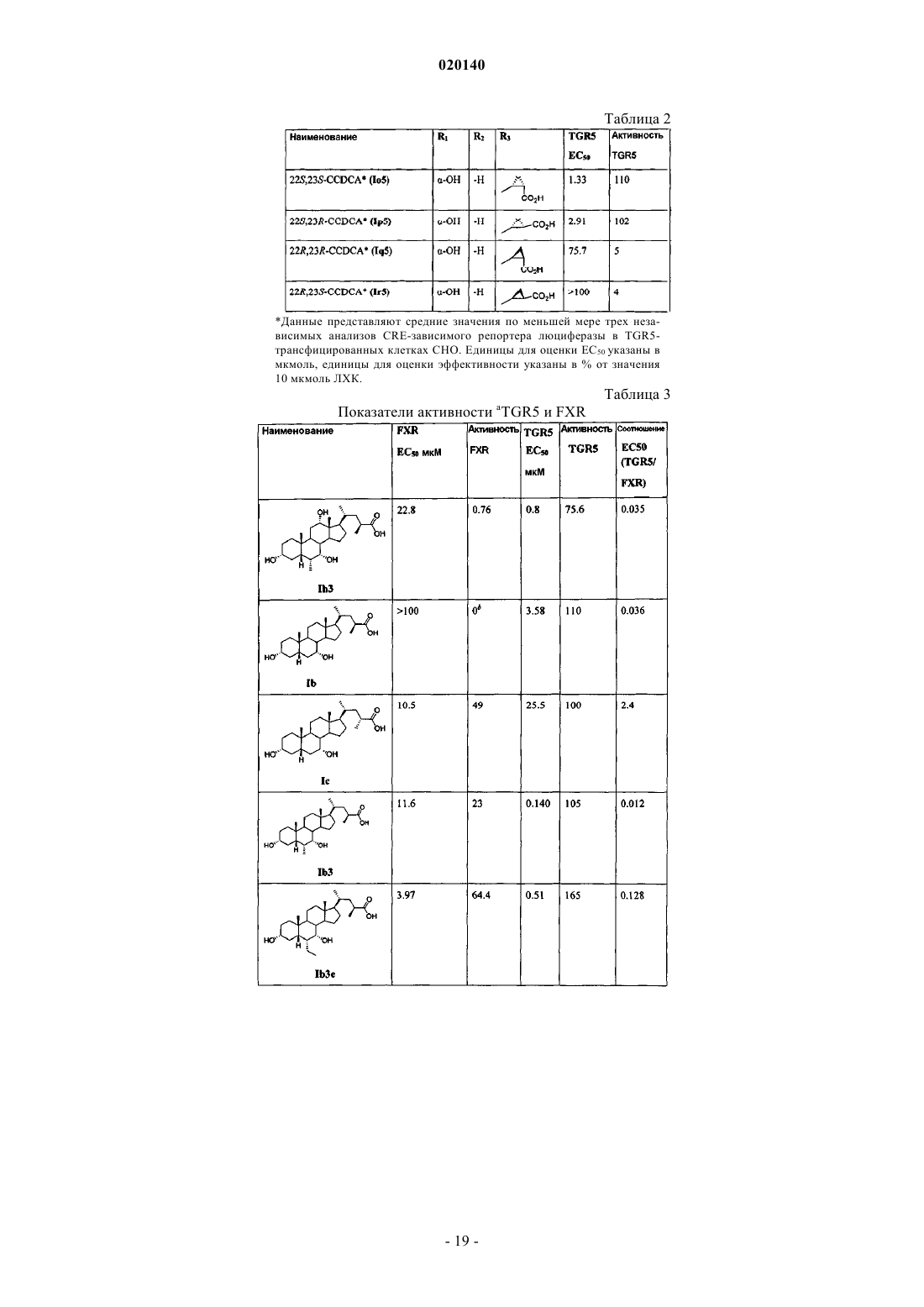
1. Соединение Ih3e, имеющее формулу

или его соль, гидрат или конъюгат глициновой или тауриновой аминокислоты.
2. Соединение по п.1, где соединение является конъюгатом глициновой аминокислоты.
3. Соединение по п.1, где соединение является конъюгатом тауриновой аминокислоты.
4. Соединение по п.1, где соединение является фармацевтически приемлемой солью.
5. Фармацевтически приемлемая композиция, содержащая соединение по любому из пп.1-4 и по меньшей мере один фармацевтически приемлемый наполнитель.
6. Применение соединения по любому из пп.1-4 в способе лечения или профилактики болезни, выбранной из метаболического заболевания, воспалительного заболевания, болезни печени, аутоиммунного заболевания, болезни сердца, болезни почек, рака и болезни желудочно-кишечного тракта.
7. Набор для лечения или профилактики болезни у субъекта, содержащий соединение по любому из пп.1-4 и информационный материал, содержащий инструкции по применению соединения.
8. Применение по п.6, где метаболическое заболевание выбирают из группы, состоящей из ожирения, диабета, диажирения, метаболического синдрома, резистентности к инсулину, предиабетической резистентности к инсулину, гипертонии, дислипидемии.
9. Применение по п.8, где метаболическое заболевание представляет собой ожирение.
10. Применение по п.8, где метаболическое заболевание представляет собой диабет.
11. Применение по п.8, где метаболическое заболевание представляет собой диажирение.
Текст
Изобретение относится к соединению Ih3e или его соли, гидрату или конъюгату глициновой или тауриновой аминокислоты, которое представляет собой модулятор TGR5 и имеет структуру,представленную ниже, фармацевтической композиции, содержащей указанное соединение, набору,включающему указанное соединение, и к применению соединения Ih3e для лечения или профилактики болезни, выбранной из метаболического заболевания, воспалительного заболевания,болезни печени, аутоиммунного заболевания, болезни сердца, болезни почек, рака и болезни желудочно-кишечного тракта. Родственная заявка Настоящий патент заявляет приоритет европейской заявки 08169462.2, зарегистрированной 19 ноября 2008 года, содержание которой включено в настоящее изобретение. Область изобретения Изобретение относится к соединениям, которые модулируют TGR5, и к композициям, полезным для способов лечения и/или профилактики различных заболеваний. Уровень изобретения Рецептор TGR5 представляет собой связанный с G-белком рецептор, идентифицированный как рецептор клеточной поверхности, который восприимчив к желчным кислотам (ЖК). У человеческого, бычьего, кроличьего, крысиного и мышиного TGR5 выявлена высокая консервативность первичной структуры TGR5 и его чувствительность к желчным кислотам, и в этой связи предполагается, что TGR5 имеет важные физиологические функции. Выявлено, что TGR5 широко распространен не только в лимфатических тканях, но также и в других тканях. Высокий уровень содержания мРНК TGR5 был обнаружен в плаценте, селезенке и моноцитах/макрофагах. Показано, что желчные кислоты индуцируют интернализацию слитого белка TGR5 от клеточной мембраны до цитоплазмы. Kawamata et al. 2003, J. Bio. Chem.,278, 9435. Выявлена идентичность TGR5 и hGPCR19, о чем опубликовано авторами Takeda et al. 2002,FEBS Lett. 520, 97-101. Существует связь TGR5 с внутриклеточным накоплением цАМФ, что широко проявляется в клетках разных типов. Активация мембранного рецептора TGR5 в макрофагах уменьшает продукцию провоспалительных цитокинов (Kawamata, Y., et al. J. Biol. Chem., 2003, 278, 9435-9440), при этом стимуляция этого рецептора посредством ЖК в адипоцитах и миоцитах увеличивает потребление энергии (Watanabe, M. et al. Nature., 2006, 439, 484-489). Указанный эффект охватывает цАМФ-зависимую индукцию 2 типа йодотирониндейодиназы (D2), которая с помощью локального превращения Т 4 в Т 3 вызывает повышение активности гормона щитовидной железы. Роль TGR5 в контроле энергетического обмена согласуется с тем, что у нокаутных по TGR5 самок мышей выявлено значительное накопление жира с увеличением веса при провокации высокожирной диетой, что указывает на уменьшение потребления энергии и возникновение ожирения при недостатке TGR5 (Maruyama, Т., et al. J. Endocrinol., 2006, 191, 197205). Дополнительно, и в связи с вовлечением TGR5 в энергетический гомеостаз известно, что активация мембранного рецептора посредством желчных кислот способствует продукции глюкагон-подобного пептида 1 (GLP-1) в мышиных энтероэндокринных клеточных линиях (Katsuma, S., Biochem. Biophys. Res.Comraun., 2005, 329, 386-390). Ha основании всех вышеупомянутых наблюдений утверждается, что TGR5 представляет собой привлекательную цель для лечения заболевания, например ожирения, диабета и метаболического синдрома. В дополнение к применению агонистов TGR5 для лечения и профилактики метаболических заболеваний соединения, которые модулируют модуляторы TGR5, также полезны для лечения других заболеваний, например болезней центральной нервной системы, а также воспалительных заболеваний (WO 01/77325 и WO 02/84286). Модуляторы TGR5 также обеспечивают способы регуляции гомеостаза желчных кислот и холестерина, абсорбции жирных кислот и переваривания углеводов и белков. В литературе описано относительно мало примеров агонистов TGR5. В недавних публикациях отмечено, что 23-алкил-замещенные и 6,23-алкил-дизамещенные производные хенодезоксихолевой кислоты (ХДХК), такие как соединение 6-этил-23(S)-метил-хенодезоксихолевая кислота, показанная ниже,представляют собой мощные и селективные агонисты TGR5 (Pellicciari, R.; et al. J. Med. Chem., 2007, 50,4265-4268). В частности, метилирование (S-конфигурация) в С 23-положении желчных кислот (ЖК) природного происхождения придает выраженную селективность к TGR5 после активации FXR (фарнезоидных Xрецепторов), тогда как 6-алкильное замещение увеличивает потенциал обоих рецепторов. Некоторые примеры других агонистов TGR5 включают сложный бензиловый эфир 6-метил-2-оксо-4-тиофен-2-ил 1,2,3,4-тетрагидро-пиримидин-5-карбоновой кислоты (WO 004067008, Takeda Chemical Industries LTD,Япония, 2004) и олеанолевая кислота (Sato, H. et al. Biochem. and Biophys. Res. Commun., 2007, 362, 793798; Ito, F. et al. WO 02004067008, 2004). Позднее первый синтез энантиомерической хенодезоксихолевой кислоты (ХДХК) и литохолевой кислоты (ЛХК) позволил подойти к изучению специфичности взаимодействия ЖК природного происхождения с TGR5 (Katona, В.W. et al. J. Med. Chem., 2007, 50, 6048-6058). Разработанные в последнее время агонисты TGR5 также впервые позволили дифференцировать с фармакологической точки зрения геномные эффекты, отличая их от негеномных эффектов ЖК, и также сделали возможными информативные исследования взаимоотношений структуры и действия, например,-1 020140 выявлено, что присутствие дополнительного связывающего кармана в TGR5 играет основную роль в определении селективности лиганда (см. Pellicciari, et al. Med. Chem., 2007, 50, 4265-4268). В этой связи наличие более мощных и селективных модуляторов TGR5 необходимо для дальнейшего определения дополнительных признаков, влияющих на активацию рецептора и определения параметров физиологического и фармакологического действия указанного рецептора, с целью лучшего понимания его отношения к профилактике и лечению заболевания. Наконец, особый интерес представляют биологические и физико-химические свойства соединения холевой кислоты (ХК), структура которой показана ниже Холевая кислота, представляющая собой первичную желчную кислоту у человека и многих видов животных, также известна как один из основных компонентов, наряду с билирубином Calculus Bovis,который высоко ценится в традиционной китайской медицине (Chen, X., Biochem. Pharmacol., 2002, 63,533-541). Холевая кислота (ХК) отличается от хенодезоксихолевой кислоты (ХДХК) и ее производных,описанных выше, наличием в С-12 положении дополнительной -гидроксильной группы, ориентированной на полярную сторону молекулы. Это "незначительное" структурное различие обусловливает заметно различающиеся физико-химические и биологические характеристики двух упомянутых желчных кислот. По сравнению с ХДХК, протонированная ХК обладает в 4 раза большей растворимостью и относительно меньшей детергентностью благодаря своему балансу гидрофобности/гидрофильности и полярности. Кроме того, ХК не имеет активности по отношению к рецептору FXR (EC50100 мкМ) и при этом проявляет умеренное агонистическое действие к TGR5 (ЕС 50=13,6 мкМ). Еще более важное соображение по предыдущим публикациям состоит в том, что фармакологическое введение ХК в количестве 0,5% об./об. мышам с ожирением, индуцированным диетой, является эффективным для профилактики и лечения метаболического синдрома (Katsuma, S., Biochem. Biophys. Res. Commun., 2005, 329, 386). В настоящем исследовании получены интересные результаты, связанные с эндокринными функциями желчных кислот, тем не менее, необходимость высокой дозы (0,5% об./об.) ограничивает доказательство концепции в отношении терапевтической значимости TGR5 в контексте метаболических заболеваний, поскольку при указанной дозе нельзя исключать модуляцию других и неизвестных мишеней. Также дополнительной проблемой был риск, связанный с тестированием высокой дозы ХК в клинических испытаниях, по причине продукции токсичного вторичного метаболита ЖК дезоксихолевой кислоты ДХК путем обширного и эффективного 7-дегидроксилирования с помощью кишечных бактерий (Nagengast, F.М., Eur. J.Cancer, 1995, 31 А, 1067). Таким образом, существует потребность в разработке модуляторов TGR5 для лечения и/или профилактики различных заболеваний. В настоящем изобретении определены соединения, которые модулируют TGR5, а также способы применения указанных соединений для лечения или профилактики заболевания. Сущность изобретения Настоящее изобретение относится к модуляторам TGR5 и их применению для лечения и/или профилактики различных заболеваний. Изобретение рассматривает соединение Ih3e, имеющее формулу или его соль, гидрат или конъюгат глициновой или тауриновой аминокислоты. Настоящее изобретение включает композицию, содержащую соединение по изобретению и по меньшей мере один фармацевтически приемлемый наполнитель. Изобретение включает соединения для использования в способе лечения или профилактики болезни у субъекта. Изобретение также включает использование композиции или соединения по изобретению для получения лекарства для лечения или профилактики болезни у субъекта. В одном аспекте болезнь выбирают из метаболического заболевания,воспалительного заболевания, болезни печени, аутоиммунного заболевания, болезни сердца, болезни почек, рака и болезни желудочно-кишечного тракта. Вышеупомянутое описание достаточно широко формулирует наиболее важные признаки настоящего изобретения для понимания его дальнейшего подробного описания, с тем, чтобы лучше оценить вклад настоящего изобретения в данную область. Другие цели и признаки настоящего изобретения станут очевидными из следующего подробного описания, которое рассматривается вместе с примерами. Краткое описание чертежей Фиг. 1 представляет собой график, на котором показано влияние соединения Ih3e на прибавление веса у мышей, получающих обычный рацион и высокожирный корм. Фиг. 2 представляет собой ряд из девяти графиков ("А-I"), на которых показаны изменения профиля метаболизма у мышей, получавших высокожирный корм, леченных соединением Ih3e. Анализ плазмы мышей с индуцированным диетой ожирением, леченных соединением Ih3e. Фиг. 2A-D относятся к ферментам печени. Фиг. 2F-I относятся к липидам плазмы. Фиг. 3 представляет собой ряд графиков (А-В), на которых показаны результаты анализа плазмы на инсулин и пероральный тест на толерантность к глюкозе у мышей, получавших обычный рацион и высокожирный корм, леченных соединением Ih3e. Фиг. 4 представляет собой график, который показывает изменения содержания глюкозы у мышей,получавших обычный рацион, леченных соединением Ih3e. Фиг. 5 представляет собой ряд графиков (A-D), которые показывают высвобождение инсулина invivo после тестовой еды у мышей, получавших обычный рацион и высокожирный корм, леченных соединением Ih3e. Фиг. 6 представляет собой ряд графиков (A-D), которые показывают потребление кислорода и продукцию CO2, измеренные путем непрямой калориметрии у мышей, получавших обычный рацион и высокожирный корм, леченных соединением Ih3e. Фиг. 7 представляет собой три графика (А-С), которые показывают значение коэффициента дыхательного обмена (RER), вычисляемое путем непрямой калориметрии у мышей, получавших обычный рацион и высокожирный корм, леченных соединением Ih3e. Фиг. 8 представляет собой ряд графиков (А-В), которые показывают двигательную активность и поглощение корма и воды мышами, получавшими обычный рацион и высокожирный корм, леченных соединением Ih3e. Фиг. 9 представляет собой ряд графиков (А-С), которые показывают изменения веса органов у мышей, получавших обычный рацион и высокожирный корм, леченных соединением Ih3e. Фиг. 10 является графиком, отображающим поверхностное натяжение в зависимости от логарифма концентрации соединения Ih3e (мМ) в 0,15 М NaCl. Фиг. 11 показывает схему эксперимента дуоденального вливания, проводимого с применением соединения Ih3e. Фиг. 12 показывает схему эксперимента феморального вливания, проводимого с применением соединения Ih3e. Фиг. 13 представляет график, отображающий скорости выделения в зависимости от времени, в экспериментах феморального и дуоденального вливания, проводимых с применением соединения Ih3e. Фиг. 14 представляет собой серию графиков (A-D), относящихся к соединению Ih3e и его метаболитам. Фиг. 14 А показывает соединение Ih3e и его основные метаболиты, определяемые в желчи путем масс-спектрометрии в эксперименте в/в вливания. Данные представлены как абсолютные значения областей. Фиг. 14B представляет собой увеличенное изображение фиг. 14 А. Фиг. 14 С показывает соединение Ih3e и его основные метаболиты, определяемые в желчи путем масс-спектрометрии. Фиг. 14D представляет собой увеличенное изображение фиг. 14 С. Фиг. 15 представляет собой график, который показывает стабильность соединения Ih3e (треугольник) и ХК (квадрат) в культуре человеческого кала. Фиг. 16 представляет собой гистограмму, показывающую дозозависимое высвобождение GLP-1 exvivo, индуцированное соединением Ih3e. Фиг. 17 А показывает графики корреляции экспрессии мРНК в печени у TGR5 и Cox-VII в генетической эталонной популяции мышей BxD (n=41). Фиг. 17 В представляет гистограмму, показывающую активность Сох в клетках STC-1, которые в течение 1 ч обрабатывали соединением Ih3e при определенной концентрации. За 15 мин до обработки добавляли носитель или ингибитор аденилатциклазы MDL-12330-A (MDL) (1 мкмоль) (n=3). Фиг. 17 С представляет график потребления кислорода в клетках STC-1, измеряемого с помощью анализатора внеклеточного потока XF24 (Seahorse Bioscience). Первая вертикальная пунктирная линия показывает добавление в культуральную среду носителя или MDL-12330-A (MDL) и вторая пунктирная линия указывает на обработку соединением Ih3e в дозе 1 мкмоль (n=10). Фиг. 17D представляет гистограмму, показывающую соотношение АТФ/ДЦФ в клетках STC-1, обработанных, как показано для фиг. 17 В (n=3). Фиг. 17 Е показывает графики корреляции экспрессии мРНК в печени для TGR5 и Kir6.2 в генетической эталонной популяции мышей BxD согласно методике, сходной с описанием для фиг. 17 А. Фиг. 17F представляет собой гистограмму, которая показывает уровни экспрессии мРНК, измеряемой путем количественной ПЦР в реальном времени, для TGR5, Сох-IV и Kir6.2 в клетках STC-1, трансфицированных в течение 36 ч контролем или mTGR5 из короткой шпилечной РНК (shPHK). Уровень мРНК-мишени стандартизировали по уровню 36 В 4 мРНК (n=3). Данные представлены как среднее значение SE; непарный t-тест Стьюдента; р 0,05. Фиг. 18 А показывает графики корреляции экспрессии мРНК в печени для TGR5 и Cav2.2 в генетической эталонной популяции мышей BxD (n=41) по данным веб-сайта GeneNetwork Университета Теннесси. Фиг. 18 В и 18C представляют собой графики, показывающие внутриклеточное содержание кальция в клетках NCI-H716, трансфицированных пустым вектором, вектором экспрессии hTGR5 или hTGR5siPHK в течение 36 ч, и обработанных соединением Ih3e в дозе 1 (В) или 10 мкмоль (С). Стрелка показывает обработку соединением Ih3e (n=3). Фиг. 18D представляет собой график внутриклеточного содержания кальция в клетках NCI-H716,обработанных соединением Ih3e (обозначено стрелкой) в дозе 3 мкмоль в присутствии носителя или ингибитора аденилатциклазы MDL-12330-A (MDL) (10 мкмоль). MDL или носитель добавляли за 15 мин до обработки соединением Ih3e (n=3). Фиг. 18 Е представляет собой график, показывающий внутриклеточное содержание кальция в клетках NCI-H716, обработанных 1% глюкозой и затем соединением Ih3e в дозе 1 мкмоль (n=3). Фиг. 18F является гистограммой, показывающей высвобождение GLP-1 в клетках NCI-H716 после обработки 1% глюкозой, или соединением Ih3e в дозе в дозе 1 мкмоль, или комбинацией обоих агентов(n=3). Фиг. 18G представляет собой гистограмму, которая показывает высвобождение GLP-1 в клеткахSTC-1, трансфицированных в течение 36 ч контролем, вектором экспрессии mTGR5 или mTGR5 shPHK,и на которые затем воздействовали соединением Ih3e в течение 30 мин при определенной концентрации. В культуральную среду добавляли ингибитор DPP4 0,1% (Millipore) (n=3). Фиг. 18 Н представляет гистограмму, показывающую эффект обработки соединением Ih3e в течение 30 мин на высвобождение GLP-1 в клетках STC-1, трансфицированных вектором экспрессии mTGR5 в присутствии носителя или ингибитора аденилатциклазы 2330-А MDL-1 (10 мкмоль). MDL или носитель добавляли за 15 мин до обработки соединением Ih3e. В культуральную среду добавляли ингибитор DPP4 0,1% (Millipore) (n=3). Данные представлены как среднее значение SE. Непарный t-тест Стьюдента; р 0,05 обработка носителем по сравнению с соединение Ih3e; р 0,05 обработка носителем по сравнению с обработкой MDL-1 2330-А. Фиг. 19 А представляет собой график, который показывает результаты перорального теста толерантности к глюкозе (ПТТГ) у самцов мышей TGR5-Tg, которые в течение 10 недель получали высокожирный (ВЖ) корм, и у подобранных по возрасту однопометных самцов, получавших обычный рацион(ОР) и ВЖ корм в течение того же периода. На момент начала кормления ВЖ пищей возраст всех мышей составлял 8 недель. Масса тела мышей TGR5-Tg и контрольных однопометников составляла 37,91,7 г и 37,01,8 г соответственно (n=8; без статистической разницы). Соседняя гистограмма показывает среднюю область под кривой (AUC) (n=8). Фиг. 19 В и 19 С показывают содержание инсулина в плазме (верхние графики) и GLP-1 (нижние графики) во время ПТТГ (19 В) или перед тестовой пищевой провокации и после нее (19 С) (n=8). Фиг. 19D показывает гистограмму высвобождения GLP-1 из подвздошных эксплантов, выделенных от самцов контрольных мышей и мышей TGR5-Tg, получавших в течение 18 недель ВЖ корм, на которые воздействовали в течение 1 ч определенными концентрациям ЛХК (n=4). Фиг. 19 Е показывает ряд снимков, представляющих меченные иммунофлуоресцентным инсулином срезы поджелудочной железы от самцов мышей TGR5-Tg, получавших в течение 20 недель ВЖ корм,или от подобранных по возрасту самцов-однопометников, получавших ОР и ВЖ корм в течение того же периода. Фиг. 19F является гистограммой, показывающей профиль распределения панкреатических островков у самцов мышей TGR5-Tg и контрольных однопометников, получавших ОР и ВЖ корм, как описано для фиг. 19 Е. Подсчет и измерение островков проводили с помощью программного обеспечения ImageJanalysis на четырех окрашенных ГЭ (гематоксилин+эозин) послойных панкреатических срезах, расположенных через каждые 150 мкМ (n=5). Фиг. 19G показывает гистограмму содержания инсулина в выделенных с помощью коллагеназы панкреатических островках у самцов мышей TGR5-Tg и контрольных однопометников, получавших ОР и ВЖ корм, как описано выше (фиг. 19 Е). Фиг. 19 Н представляет собой график, показывающий результаты ПТТГ у самцов мышей TGR5-/- иTGR5+/+, получавших в течение 8 недель ВЖ корм. На вставке показана средняя область AUC. Масса тела самцов мышей TGR5-/- и TGR5+/+ во время анализа составляла 46,33,9 и 51,92,0 г соответственно(n=8; без статистической разницы). Фиг. 19I и 19J представляют собой графики, показывающие содержание в плазме GLP-1 у получавших ОР мышей TGR5+/+ (фиг. 19I) и у мышей TGR5-/- (фиг. 19J) после пероральной провокации глюкозой, которую проводили за 30 мин перед пероральным введением солевого раствора или соединения Ih3e(n=6). Данные представлены как среднее значение SE. Непарный t-тест Стьюдента; р 0,05, ВЖ диета по сравнению с ВЖ диетой у мышей, леченных соединением Ih3e; и р 0,05, ВЖ диета по сравнению с ОР у мышей за исключением (I) и (J), где обозначены показатели от мышей после введения солевого раствора или DPP4i по сравнению с мышами, леченными соединением Ih3e или Ih3e+DPP4i, и показано введение мышам солевого раствора по сравнению с DPP4i. Фиг. 20 А представляет собой график, который показывает результаты измерения содержания в плазме соединения Ih3e с помощью ВЭЖХ у самцов мышей C57BL6/J, получавших ОР, ВЖ корм и ВЖ корм на фоне лечения соединением Ih3e. Фиг. 20 В представляет собой график, который показывает результат воздействия диеты с соединением Ih3e (30 мг/кг/в день), начатого после 14-недельного периода кормления ВЖ пищей, время начала воздействия обозначено стрелкой. Во время исследования наблюдали увеличение массы тела во всех группах (n=8). Фиг. 20 С представляет гистограмму, показывающую конституцию тела, которую оценивали с помощью ЯМР (ядерно-магнитного резонанса) через 8 недель воздействия диеты (n=8). Фиг. 20D представляет гистограмму массы органов, выраженной как процент веса контрольных мышей, получавших ОР. Фиг. 20 Е представляет собой гистограмму, которая показывает поглощение пищи (n=8). Фиг. 20F представляет собой ряд гистограмм, показывающих спонтанную горизонтальную активность и расход энергии, которые оценивали с помощью измерения потребления кислорода (VO2) и высвобождения углекислого газа (VCO2), указанные измерения проводили в течение 18 ч через 6 недель после начала воздействия диеты. Дыхательный коэффициент (ДК) вычисляли как отношение VCO2/VO2. Гистограммы представляют среднее значение AUC. В отношении ДК гистограммы показывают среднее значение (n=8). Фиг. 20G является гистограммой, показывающей генную экспрессию в бурой жировой ткани (БЖТ) с помощью количественной ПЦР в реальном времени через 18 недель воздействия диеты. Содержание мРНК мишени было стандартизировано по уровню 36 В 4 мРНК (n=8). Фиг. 20 Н представляет собой график, показывающий первичные коричневые адипоциты, выделенные у самцов мышей C57BL/6J, получавших ОР, которые культивировали в течение 12 ч с носителем или 3 мкмоль соединения Ih3e, затем измеряли потребление O2 с использованием анализатора внеклеточного потока XF24 (Seahorse Bioscience) (n=5). Пунктирные линии показывают добавление разобщающего агента FCCP в последовательных дозах 250 и 500 нМ. Фиг. 20I представляет собой ряд фотографий, которые отображают окрашивание криосрезов печениoil redO (ORO) (верхний ряд) и окрашивание парафиновых срезов печени Сириус красным (нижний ряд) в конце воздействия диеты. Фиброз обозначен стрелкой. Фиг. 20J представляет собой ряд гистограмм, которые показывают содержание липида I в образцах печени, выделенных способом по Folch (n=8). Фиг. 20K и 20L представляет ряд гистограмм, которые показывают содержание в плазме печеночных ферментов (фиг. 20K) и липидов (фиг. 20L) в конце воздействия диеты (n=8). Данные представлены как среднее значение SE. Непарный t-тест Стьюдента; р 0,05, получавшие ВЖ мыши по сравнению с получавшими ВЖ корм и леченными Ih3e мышами; и р 0,05, получавшие ВЖ по сравнению с получавшими ОР мышами. Фиг. 21 А показывает на графике результаты ПТТГ у самцов мышей C57BL6/J, получавших ОР и ВЖ корм с добавлением 30 мг/кг/вдень соединения Ih3e в течение 8 недель после начала ожирения, индуцированного употреблением ВЖ корма в течение 10 недель. На вставке показана средняя областьAUC. Масса тела мышей, леченных носителем и рассматриваемым соединением Ih3e, составляла 38,081,83 г и 32,260,95 г соответственно (n=8; р 0,05). Фиг. 21 В представляет собой график, который показывает гликемию и инсулинемию натощак (4 ч голодания) у мышей с диет-индуцированным ожирением (ДИО) через 3 недели воздействия диеты с соединением Ih3e (верхняя схема). Содержание инсулина в плазме во время ПТТГ у мышей с диетиндуцированным ожирением (ДИО) (нижняя схема). Фиг. 21 С представляет собой график, который показывает результат ПТТГ у 14-недельных самцов мышей db/db, получавших ОР и леченных соединением Ih3e в дозе 30 мг/кг/в день в течение 6 недель. На вставке показана средняя область AUC (n=8). Фиг. 21D представляет собой график, показывающий гликемию и инсулинемию натощак (4 ч) у мышей db/db через 6 недель лечения соединением Ih3e (верхняя схема). Содержание инсулина в плазме во время ПТТГ у мышей ДИО (нижняя схема). Фиг. 21E представляет ряд из двух гистограмм, показывающих чувствительность к инсулину, оценениваемую по средней скорости вливания глюкозы в равновесном состоянии (эугликемия) в гиперинсулинемическом эугликемическом клэмп-тесте (10 mU инсулина/мин/кг) у мышей ДИО (после возникновения ожирения, индуцированного кормлением ВЖ пищей в течение 10 недель) через 10 недель воздействия диетой с соединением Ih3e (30 мг/кг/в день) (n=5). Продукцию глюкозы в печени и ее подавление инсулином, а также скорость исчезновения глюкозы оценивали в равновесном состоянии с использованием 3 Н-глюкозы (n=5). Фиг. 21F представляет собой ряд гистограмм, показывающих инсулин-стимулируемый захват глюкозы в обозначенных тканях, который измеряли с помощью меченой 14 С-2-дезоксиглюкозы (n=5). Фиг. 21G представляет ряд гистограмм, показывающих профиль экспрессии генов в печени, получаемый с помощью количественной ПЦР в реальном времени. Содержание мРНК мишени стандартизировали по уровню 36 В 4 (n=8). Данные представлены как среднее значение SE. Непарный t-тест Стьюдента; р 0,05, получавшие ВЖ мыши по сравнению с мышами, которым давали ВЖ корм и вводилиIh3e; и р 0,05, получавшие ВЖ по сравнению с получавшими ОР мышами. Фиг. 22 А представляет ряд графиков, показывающих результаты исследования, в котором самцы мышей TGR5+/+ и TGR5-/- получали ВЖ диету в течение 9 недель, и первый ПТТГ проводили после указанного периода. Затем к ВЖ корму добавляли соединение Ih3e в дозе 30 мг/кг/в день. Повторный ПТТГ проводили через 4 недели после начала лечения соединением Ih3e. Кривые показывают толерантность к глюкозе у мышей перед лечением и после лечения в течение 4 недель соединением Ih3e у TGR5+/+ (график слева) и TGR5-/- (график справа). На вставке показана средняя область AUC. У мышей TGR5+/+ масса тела перед лечением соединением Ih3e и после лечения составляла 46,863,54 г и 43,503,47 г соответственно (n=8; без статистической разницы). У мышей TGR5 масса тела перед лечением соединением Ih3e и после лечения составляла 54,342,23 г и 52,302,72 г соответственно (n=8; без статистической разницы). Фиг. 22 В представляет собой ряд графиков с показателями содержания инсулина в плазме, которые одновременно измеряли во время ПТТГ у мышей ДИО с TGR5+/+ (левый график) и TGR5-/- (правый график) перед лечением и после лечения в течение 4 недель соединением Ih3e. На вставке показана средняя область AUC (n=8). Данные представлены как среднее значение SE. Непарный t-тест Стьюдента; р 0,05, носитель по сравнению с содинением Ih3e у 7 леченых мышей. Фиг. 23 является графиком, показывающим содержание соединения Ih3e и скорость желчеотделения Ii3e в тесте феморального вливания дозы 1 мкмоль/мин/кг в течение 1 ч и скорость желчеотделения в феморальном тесте в качестве контрольного вливания физиологического раствора с 3% бычьего сывороточного альбумина БСА в течение 1 ч. Фиг. 24 представляет график, который показывает уровень соединения Ih3e и выделения тауро-Ih3 е в зависимости от времени в феморальном тесте при дозе 1 мкмоль/мин/кг в течение 1 ч. Фиг. 25 представляет график, показывающий уровень соединения Ih3e и выделения тауро-Ih3 е в зависимости от времени в феморальном тесте при дозе 1 мкмоль/мин/кг в течение 1 ч. Фиг. 26 представляет график, показывающий уровень соединения Ih3e и его основных метаболитов,обнаруженных в образцах желчи, которые получали в тесте феморального вливания. Данные представлены как абсолютные значения области. Фиг. 27 представляет увеличенное изображение фиг. 26. Описание изобретения Подробности одного или больше вариантов осуществления изобретения сформулированы ниже в прилагаемом описании. При осуществлении или тестировании настоящего изобретения можно использовать любые способы и материалы, подобные или эквивалентные описанным в изобретении, и в настоящем описании приведены указанные способы и материалы. Другие признаки, задачи и преимущества изобретения станут очевидными из настоящего описания. Формы единственного числа в настоящем описании также включают формы множественного числа, если из контекста явно не следует иначе. Если не указано иначе, все технические и научные термины, приведенные в изобретении, имеют значения, аналогичные общепринятым значениям, которые понятны рядовым специалистам в области техники настоящего изобретения. В случае противоречий настоящее описание их будет урегулировать. Определения. Для удобства далее собраны конкретные термины, используемые в описании, примерах и в прилагаемой формуле изобретения. Термин "лечение", используемый в изобретении, означает облегчение, уменьшение, снижение, устранение, модуляцию или улучшение, то есть то, что вызывает регресс болезни или патологического состояния. Термин "профилактика", используемый в изобретении, означает полное или почти полное предотвращение состояния болезни или нарушения, его возникновения у пациента или субъекта, в особенности если пациент или субъект предрасположен к такому состоянию или имеет риск возникновения болезни или патологического состояния. Профилактика также может включать ингибирование, то есть прекращение развития болезни или патологического состояния, и облегчение или улучшение, то есть вызывать регресс болезни или патологического состояния, например, если болезнь или патологическое состояние уже наступили. Альтернативно, соединение Ih3e может также называться 6-этил-(23S)-метил-3,7,12 тригидрокси-5-холан-24-оевой кислотой. Используемое в изобретении сокращение "ЖК" означает желчную кислоту и производные желчной кислоты. Желчные кислоты представляют собой стероидные карбоновые кислоты, происходящие из холестерина. Первичными желчными кислотами являются холевая и хенодезоксихолевая кислоты. В организме указанные кислоты сопрягаются с глицином или таурином перед их выделением в составе желчи. Термин "R-EMCA" относится к соединению 6-этил-23(R)-метилхолевой кислоты, имеющей структуру Она может иметь альтернативное название 6-этил-(23R)метил 3,7,12-тригидрокси-5-холан 24-оевая кислота. Дополнительно, соединения настоящего изобретения, например соли соединений, могут существовать или в гидратированной или в негидратированной (безводной) форме или в виде сольватов с другими сольватными молекулами. Неограничивающие примеры гидратов включают моногидраты, дигидраты и т.д. Неограничивающие примеры сольватов включают этанольные сольваты, ацетоновые сольваты и т.д. Термин "сольваты" означает сольвентные аддитивные формы, которые содержат или стехиометрическое или нестехиометрическое количество растворителя. Некоторые соединения имеют тенденцию захватывать фиксированное молярное соотношение сольватных молекул в твердое кристаллическое состояние, образуя таким путем сольват. Если растворителем является вода, образуемый сольват называют гидратом, когда растворителем является спирт, образуемый сольват называют алкоголятом. Гидраты образованы комбинацией одной или больше молекул воды с одним из веществ, в которых вода сохраняет свое молекулярное состояние как H2O, и такая комбинация обладает способностью образовать один или больше гидратов. Необходимо отметить, что в структуру некоторых из соединений изобретения включены асимметричные атомы углерода. Соответственно подразумевается, что изомеры, являющиеся результатом такой асимметрии (например, все энантиомеры и диастереомеры), включены в объем изобретения, если не указано иначе. Такие изомеры можно получать, по существу, в чистой форме с помощью классических способов разделения и путем стериохимически контролируемого синтеза. Наименование энантиомеров (R- иS-конфигурации) осуществляют согласно системе, разработанной авторами R.S. Cahn, С. Ingold и V. Prelog. Структуры и другие соединения, рассмотренные в настоящем патенте, дополнительно включают все свои атроповые изомеры. Атроповые изомеры представляют собой тип стереоизомера, в котором атомы двух изомеров имеют отличающееся пространственное расположение. Существование атроповых изомеров обусловлено ограниченным вращением, вызванным затруднением вращения больших групп вокруг центральной связи. Такие атроповые изомеры обычно существуют в виде смеси, вместе с тем в результате последних разработок хроматографических методик стало возможным в отдельных случаях разделение смеси двух атроповых изомеров. Понятия "стабильное соединение" и "стабильная структура" предназначается для определения соединения, которое является достаточно устойчивым, чтобы выдерживать выделение из реакционной смеси до полезной степени чистоты и приготовление рецептуры эффективного терапевтического агента. Используемый в изобретении термин "аналог" относится к химическому соединению, обладающему структурным подобием с другим соединением, который при этом немного отличается по составу (например, заменой одного атома на атом другого элемента, или присутствием конкретной функциональной группы, или заменой одной функциональной группы на другую функциональную группу). Таким образом, аналог представляет собой соединение, которое сходно или сопоставимо по функции и внешнему виду с рассматриваемым соединением. Термин "биоизостер" относится к соединению, которое получено в результате обмена атома или группы атомов на другой, в общем подобный, атом или группу атомов. Биоизостерическая замена может иметь физикохимическую или топологическую основу. Примеры биоизостеров карбоксильной кислоты включают ацилсульфонимиды, тетразолы, сульфонаты и фосфонаты; см., например, Patani and LaVoie,-7 020140Chem. Rev., 96, 3147-3176 (1996). Термин "комбинированная терапия" (или "ко-терапия") включает введение соединения по изобретению и, по меньшей мере, второго агента в качестве части конкретной схемы лечения, предназначенной для обеспечения полезного эффекта от совместного действия этих терапевтических агентов (то есть соединения по изобретению и, по меньшей мере, второго агента). Полезный эффект комбинации включает без ограничения фармакокинетическое или фармакодинамическое совместное действие, являющееся результатом комбинации терапевтических агентов. Введение указанных терапевтических агентов в комбинации обычно проводят в определенные периоды времени (обычно минуты, часы, дни или недели, в зависимости от выбранной комбинации). Термин "комбинированная терапия" может быть предназначен,но обычно нет, чтобы подразумевать введение двух или больше из указанных терапевтических агентов в качестве части отдельных схем монотерапии, которые случайным и произвольным образом оказались в комбинациях настоящего изобретения. Термин "комбинированная терапия" охватывает введение указанных терапевтических агентов последовательным образом, то есть когда каждое терапевтическое вещество вводят в разное время, а также введение указанных терапевтических агентов, или по меньшей мере двух из терапевтических агентов, по существу, одновременно. По существу, одновременное введение можно осуществлять, например, путем введения субъекту единственной капсулы, в которой каждый из терапевтических агентов содержится в фиксированном соотношении, или путем многократного введения одиночных капсул для каждого из терапевтических агентов. Последовательное или, по существу, одновременное введение каждого терапевтического агента можно осуществлять любым подходящим путем,включающим без ограничения пероральные пути, внутривенные пути, внутримышечные пути и прямую абсорбцию через ткани слизистых оболочек. Терапевтические агенты можно вводить одинаковыми путями или разными путями. Например, первый терапевтический агент выбранной комбинации можно вводить путем внутривенной инъекции, тогда как другие терапевтические агенты комбинации можно вводить перорально. Альтернативно, все терапевтические агенты можно вводить, например, перорально или все терапевтические агенты можно вводить путем внутривенной инъекции. Последовательность, в которой вводят терапевтические агенты, не имеет строгого значения. Термин "комбинированная терапия" также охватывает введение описанных выше терапевтических агентов в дополнительной комбинации с другими биологически активными компонентами и нелекарственными способами лечения (например, в сочетании с хирургическим или механическим лечением). Если комбинированная терапия дополнительно содержит нелекарственное лечение, можно проводить нелекарственное лечение в любое подходящее время с условием достижения полезного эффекта от совместного действия комбинации терапевтических агентов и нелекарственного лечения. Например, в соответствующих случаях достижение полезного эффекта сохраняется при смещении во времени нелекарственного лечения и введения терапевтических агентов, возможно, на периоды в днях или даже неделях. Термины "парентеральное введение" и "вводимый парентерально", используемые в изобретении,относятся к способам введения, отличным от энтерального и местного введения, и обычно относятся к инъекции и включают без ограничения, внутривенную, внутримышечную, внутриартериальную, интратекальную, внутрикапсульную, внутриорбитальную, внутрисердечную, внутрикожную, внутрибрюшинную, чрезтрахеальную, подкожную, субкутикулярную, внутрисуставную, подкапсульную, субарахноидальную, внутриспинальную и внутригрудинную инъекцию и вливание. Термин "легочный", используемый в изобретении, относится к любой части, ткани или органу, основной функцией которого является газовый обмен с внешней средой, например обмен О 2/СО 2 в организме пациента. Термин "легочный" обычно относится к тканям дыхательных путей. Таким образом,выражение "легочное введение" относится к введению описанных в изобретении рецептур в любую часть, ткань или орган, основной функцией которого является газовый обмен с внешней средой (например, рот, нос, зев, ротоглотка, гортаноглотка, гортань, трахея, киль, бронхи, бронхиолы, альвеолы). Для целей настоящего изобретения термин "легочный" также включает ткань или полость, которая связана с дыхательными путями, в частности пазухи. Понятие "терапевтически эффективное количество" соединения изобретения или комбинации соединений представляет собой количество (количественную величину или концентрацию) соединения или соединений. В одном варианте осуществления при введении субъекту, который нуждается в лечении,терапевтически эффективного количества соединения происходит немедленное улучшение вызванных болезнью симптомов или улучшение после введения соединения один или больше раз. Количество соединения, которое будет введено субъекту, зависит от конкретной патологии, способа введения, совместно вводимых соединений, если таковые имеются, и особенностей субъекта, таких как общее состояние здоровья, наличие других заболеваний, возраст, пол, генотип, масса тела и переносимость лекарственных препаратов. Квалифицированный специалист сможет определить подходящие дозировки в зависимости от указанных и других факторов. Понятие "профилактически эффективное количество" означает количество (количественную величину или концентрацию) соединения настоящего изобретения или комбинации соединений, предназначенных для введения с целью профилактики или уменьшения заболевания, другими словами, количест-8 020140 во, необходимое для обеспечения превентивного или профилактического эффекта. Количество соединения, которое будет введено субъекту, зависит от конкретной патологии, пути введения, совместно вводимых соединений, если таковые имеются, и особенностей субъекта, таких как общее состояние здоровья, наличие других заболеваний, возраст, пол, генотип, масса тела и переносимость лекарственных препаратов. Квалифицированный специалист сможет определить подходящие дозировки в зависимости от указанных и других факторов. Понятие "уменьшение риска", используемое в изобретении, означает снижение возможности или вероятности возникновения у пациента заболевания центральной нервной системы, воспалительного заболевания и/или метаболического заболевания, в особенности если пациент или субъект предрасположены к такому возникновению."Фармацевтически приемлемая соль" или "соль" соединения по изобретению представляет собой продукт соединения, который несет ионную связь и обычно приготовляется путем реакции соединения или с кислотой либо с основанием, подходящими для введения субъекту. Используемый в изобретении термин "фармацевтически приемлемые соли" относятся к производным соединений по изобретению, в которых исходное соединение модифицировано путем получения его кислоты или основных солей. Примеры фармацевтически приемлемых солей включают без ограничения соли минеральных или органических кислот из остатков оснований, например амины; щелочные или органические соли кислотных остатков, например карбоновые кислоты; и т.п. Фармацевтически приемлемые соли включают общепринятые нетоксичные соли исходного соединения или соли четвертичного аммония, которые образованы, например, из нетоксичных неорганических или органических кислот. Например, такие общепринятые нетоксичные соли включают без ограничения соли, полученные из неорганических и органических кислот, выбираемых из 2-ацетоксибензойной, 2-гидроксиэтансульфоновой,уксусной, аскорбиновой, бензолсульфоновой, бензойной, бикарбоновой, карбоновой, лимонной, этилендиаминтетрауксусной, этандисульфоновой, этансульфоновой, фумаровой, глюкогептоновой, глюконовой, глутаминовой, гликолевой, гликольарсаниловой, гексилрезорциновой, гидрабамовой, бромистоводородной, хлористо-водородной, йодисто-водородной, гидроксималеиновой, гидроксинафтойной, изотионовой, молочной, лактобионовой, лаурилсульфоновой, малеиновой, яблочной, миндальной, метансульфоновой, напсиловой, азотной, щавелевой, памовой, пантотеновой, фенилуксусной, фосфорной, полигалактуроновой, пропионовой, салициловой, стеариновой, субацетиловой, янтарной, сульфамовой,сульфаниловой, серной, дубильной, винной и толуолсульфоновой кислот. Фармацевтически приемлемые соли настоящего изобретения можно синтезировать общепринятыми химическими способами из исходного соединения, которое содержит основной или кислый функциональный остаток. В общем, такие соли можно получать путем реакции свободных кислотных или основных форм указанных соединений со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе либо в смеси воды и органического растворителя; в общем, предпочтительными являются неводные среды, такие как эфир, этилацетат, этанол, изопропиловый спирт или ацетонитрил. Перечень подходящих солей опубликован в 18-м издании Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, PA, USA, p. 1445 (1990). Понятие "фармацевтически приемлемое" является общепризнанным в данной области техники. В определенных вариантах осуществления термин включает соединения, полимеры и другие материалы и/или лекарственные формы, которые подходят в рамках по результатам тщательной клинической оценки для применения в контакте с тканями людей и животных без чрезмерной токсичности, раздражения,аллергической реакции или другой проблемы или осложнения, соизмеряемого с разумным соотношением пользы/риска. Понятие "фармацевтически приемлемый носитель" общепризнано в данной области техники и включает в себя, например, фармацевтически приемлемые материалы, композиции или носители, такие как жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующий материал, участвующий в переносе или транспорте какой-либо рассматриваемой композиции от одного органа или части тела, в другой орган или часть тела. Каждый носитель должен быть "приемлемым" в плане совместимости с другими компонентами рассматриваемого соединения и не наносить вред пациенту. В определенных вариантах осуществления фармацевтически приемлемый носитель является неапирогенным. Некоторые примеры материалов, которые могут служить фармацевтически приемлемыми носителями, включают в себя (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетатцеллюлоза; (4) порошок трагаканта; (5) солод; (6) желатин; (7) тальк; (8) эксципиенты, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин,сорбитол, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар;(14) буферные агенты, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) фосфатно-буферные растворы и (21) другие нетоксичные совместимые субстанции, приме-9 020140"Композиция" или "фармацевтически приемлемая композиция" представляет собой рецептуру, содержащую соединение по изобретению или его соль, сольват, гидрат или пролекарство. В одном варианте осуществления фармацевтическая композиция не расфасована или находится в монолитной лекарственной форме. Монолитная лекарственная форма представляет собой какую-либо из множества форм,включающих, например, капсулы, внутривенный (в/в) болюс, таблетки, одиночную помпу на аэрозольном ингаляторе или флакон. Количество активного компонента (например, рецептуры соединения по изобретения или его солей) в монолитной дозе соединения является эффективным количеством и варьирует в соответствии с конкретным применяемым лечением. Специалисту в данной области техники будет очевидно, что иногда необходимо осуществлять обычные изменения дозы в зависимости от возраста и состояния пациента. Доза также будет зависеть от пути введения. Рассматривается ряд путей введения,включающих пероральный, легочный, ректальный, парентеральный, чрескожный, подкожный, внутривенный, внутримышечный, внутрибрюшинный, внутриносовой и т.п. Лекарственные формы для местного или чрескожного введения соединения настоящего изобретения включают порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и ингаляционные формы. В другом варианте осуществления в стерильных условиях действующее соединение смешивают с фармацевтически приемлемым носителем и с любыми необходимыми консервантами, буферами или пропеллентами. Термин "флэш-доза" относится к рецептурам соединения, которые представляют собой быстродиспергируемые лекарственные формы. Термин "немедленное высвобождение" подразумевает высвобождение соединения из лекарственной формы за относительно короткий промежуток времени, обычно до 60 мин. Термин "модифицированное высвобождение" включает отсроченное высвобождение, продолжительное высвобождение и импульсное высвобождение. Термин "импульсное высвобождение" подразумевает высвобождение препарата из лекарственной формы сериями. Термин "длительное высвобождение" или "продолжительное высвобождение" обозначает непрерывное высвобождение соединения из лекарственной формы за длительный период. Понятие "субъект" включает млекопитающих, например людей, домашних животных (например,собаки, кошки, птицы и т.п.), сельскохозяйственных животных (например, коровы, овцы, свиньи, лошади, домашняя птица и т.п.) и лабораторных животных (например, крысы, мыши, морские свинки, птицы и т.п.). Обычно субъектом является человек. Соединения настоящего изобретения также включают пролекарства или физиологически эквивалентные производные. Термины "пролекарство" или "физиологически эквивалентное производное" включают прекурсорную форму препарата, метаболическое превращение которой in vivo приводит к получению активного препарата. Изобретение дополнительно рассматривает применение пролекарств, которые in vivo превращаются в TGR5-модулирующие соединения, используемые в способах изобретенияPress, Chp. 88). Такие пролекарства можно применять для влияния на биораспределение (например, чтобы соединения, которые обычно не проходят через гематоэнцефалический барьер, получили возможность проходить через гематоэнцефалический барьер), или фармакокинетику соединения, модулирующего TGR5. Например, анионную группу, такую как карбоксилат, сульфат или сульфонат, можно этерифицировать, например, с помощью алкильной группы (например, метильной группой) или фенильной группы, для получения сложного эфира. При введении сложного эфира субъекту происходит ферментативное или неферментативное, восстановительное или гидролитическое расщепление сложного эфира для выявления анионной группы. Такой слоэжный эфир может быть циклическим, например циклическим сульфатом или сульфоном, или два или больше анионных остатка могут быть этерифицированы посредством связывающей группы. Анионную группу можно этерифицировать с функциональными остатками (например, ацилоксиметиловыми сложными эфирами), которые расщепляются для выявления промежуточного соединения, модулирующего TGR5, которое впоследствии разлагается для получения активного соединения, модулирующего TGR5. В одном варианте осуществления пролекарство представляет собой восстановленную форму карбоксилата, сульфата или сульфоната, например спирт или тиол,который окисляется in vivo до соединения, модулирующего TGR5. Кроме того, анионная функциональная группа может быть этерифицирована до группы, которая in vivo активно переносится или селективно захватывается в органах-мишенях. Используемый в настоящем изобретении термин "аминокислотные конъюгаты" относится к конъгатам соединений по изобретению с любой подходящей аминокислотой. Примерами аминокислотных конъгатов являются таурин (NH(CH2)2SO3H) и глицин (NHCH2CO2H). Подходящие аминокислотные конъюгаты соединений имеют дополнительное преимущество улучшенной целостности в желчи или жидкостях кишечника. Подходящие аминокислоты не ограничены таурином и глицином. Изобретение охватывает аминокислотные конъюгаты соединений по изобретению. Более конкретно, изобретение включает аминокислотные конъюгаты соединения Ih3e. Еще более конкретно, изобретение включает тауриновый и глициновый конъюгаты соединения Ih3e. Термин "соединения по изобретению" относится к соединениям с формулами, описанными в изо- 10020140TGR5. Взаимодействие не ограничено действием соединения в качестве антагониста, агониста, частичного агониста или обратного агониста рецептора TGR5. В одном аспекте соединения настоящего изобретения действуют как антагонисты рецептора TGR5. В другом аспекте соединения настоящего изобретения действуют как агонисты рецептора TGR5. В другом аспекте соединения настоящего изобретения действуют как частичные агонисты рецептора TGR5. В другом аспекте соединения настоящего изобретения действуют как обратные агонисты рецептора TGR5. Обычно профиль лиганда, эндогенного или синтетического, отличается своей собственной эффективностью "е", описанной впервые автором Furchgott в 1966 году. Это понятие используют для выражения степени выработки варьирующих биологических ответов у разных лигандов, которые задействуют при этом одинаковое количество рецепторов. В общем, термин "агонист" означает соединение, которое повышает активность другой молекулы или рецепторного участка. По классическому определению агонист, который может быть ортостерическим,аллостерическим, обратным или ко-агонистом, обладает свойством связываться с рецептором, изменять состояние рецептора и в результате производить биологическое действие. Следовательно, агонизм определяют как свойство агониста или лиганда производить биологическое действие. В отличие от этого "антагонист" является, по существу, агонистом с высокой аффинностью к той же рецепторной макромолекуле, но с намного меньшей или незначительной собственной эффективностью, и тем самым стерически предотвращает биологические действия агониста. В плане свойств антагонизм может быть функциональным или физиологическим, когда агонист непосредственно конкурирует за рецепторный участок с вышеупомянутыми и противоположными эффектами посредством отличающейся системы рецептормессенджер в последнем случае. Более конкретно, агонист TGR5 представляет собой рецепторный лиганд или соединение, которое связывается с TGR5 и повышает по меньшей мере на 20% концентрацию циклического аденозинмонофосфата (цАМФ) в клетках, экспрессирующих рецептор. Напротив, антагонист TGR5 представляет собой соединение, которое антагонизирует или блокирует действие агониста и таким образом вызывает снижение концентрации цАМФ. Настоящее изобретение относится к соединениям, обладающим действием модуляции рецептораTGR5, и к их применению для лечения и/или профилактики различных болезней, включающих метаболическое заболевание, воспалительное заболевание, болезнь печени, аутоиммунное заболевание, болезнь сердца, болезнь почек, рак и болезнь желудочно-кишечного тракта. Дополнительно, настоящее изобретение относится к соединениями с описанными в нем формулами. Соединения и композиции. В одном аспекте изобретение относится к соединению Ih3e или его соли, гидрату или конъюгату глициновой или тауриновой аминокислоты. В одном аспекте изобретение включает тауриновый конъюгат соединения Ih3e или его соль, гидрат. В одном аспекте изобретение включает конъюгат глицина из соединения Ih3e или его соль, гидрат. В одном аспекте изобретение включает соединение по изобретению, в котором соединение представляет собой фармацевтически приемлемую соль. В одном аспекте изобретение включает композицию, содержащую соединение по изобретению или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство, и по меньшей мере один фармацевтически приемлемый наполнитель. Настоящее изобретение также включает радиомеченые соединения по изобретению. Радиомеченые соединения можно изготавливать с помощью общепринятых способов. Например, радиомеченые соединения изобретения можно изготавливать путем реакции соединения по изобретению с газообразным три- 11020140 тием в присутствии подходящего катализатора с целью получения радиомеченых соединений, имеющих описанные в изобретении формулы. В одном варианте осуществления соединения по изобретению мечены тритием. Применение и способы. Изобретение включает использование соединения или его фармацевтически приемлемой соли,сольвата, гидрата или пролекарства для изготовления лекарства для лечения или профилактики болезни у субъекта. Изобретение также включает способ лечения или профилактики болезни у субъекта путем введения соединения по изобретению или его фармацевтически приемлемой соли, гидрата или пролекарства. В одном аспекте изобретение включает указанное применение или способ, при этом болезнь выбирают из метаболического заболевания, воспалительного заболевания, болезни печени, аутоиммунного заболевания, болезни сердца, болезни почек, рака и болезни желудочно-кишечного тракта. В одном аспекте изобретение включает метаболическое заболевание, выбираемое из ожирения, диабета, диажирения, метаболического синдрома, гипертонии, дислипидемии и резистентности к инсулину, включающей пре-диабетическую резистентность к инсулину. В одном аспекте метаболическим заболеванием является ожирение. В другом аспекте метаболическим заболеванием является диабет. В одном аспекте диабет выбирают из преддиабетического состояния и диабета II типа. В одном аспекте метаболическим заболеванием является метаболический синдром. В одном аспекте метаболическим заболеванием является резистентность к инсулину. В одном аспекте метаболическое заболевание представляет собой дислипидемию. В одном аспекте метаболическим заболеванием является диажирение. Термин "диажирение" относится к состоянию, при котором субъект страдает диабетом и имеет излишний вес. В одном аспекте изобретение включает воспалительное заболевание, выбираемое из аллергии, остеоартрита (ОА), хронической обструктивной болезни легких (ХОБЛ), аппендицита, бронхиальной астмы, панкреатита, аллергической сыпи и псориаза. В одном аспекте изобретение включает аутоиммунное заболевание, выбираемое из ревматоидного артрита, рассеянного склероза и диабета I типа. В одном аспекте изобретение включает болезнь желудочно-кишечного тракта, выбираемую из воспалительной болезни кишечника (болезнь Крона, язвенный колит), синдрома короткой кишки (пострадиационный колит), микроскопический колит, синдром раздраженного кишечника (мальабсорбция) и чрезмерный рост бактерий. В одном аспекте изобретение включает болезнь почек, выбираемую из диабетической нефропатии,хронической почечной недостаточности, гломерулярного нефрита, гипертензивного нефросклероза, хронического гломерулонефрита, хронической трансплантационной гломерулопатии, хронического интерстициального нефрита и поликистозной болезни почек. В одном аспекте изобретение включает рак, выбираемый из колоректального рака, рака печени, гепатоцеллюлярной карциномы, холангиокарциномы, рака почки, рака желудка, рака поджелудочной железы, рака предстательной железы и инсулиномы. В одном аспекте изобретение включает болезнь печени, выбираемую из неалкогольного стеатогепатита, неалкогольной жировой болезни печени, хронического вирусного гепатита, алкогольной болезни печени, лекарственного гепатита, гемохроматоза, первичного билиарного цирроза, первичного склерозирующего холангита, портальной гипертензии, десатурации желчи, болезни Гоше, болезни Вилсона, дефицита 1-антитрипсина, полного парентерального питания (ППП), холелитиаза, ПППассоциированного холестаза и сепсиса. В одном аспекте изобретение включает в себя аутоиммунное заболевание эритематоз. В одном аспекте изобретение включает болезнь сердца, выбираемую из застойной сердечной недостаточности, инфаркта миокарда, атеросклероза, стенокардии, артериосклероза и церебральноваскулярного заболевания (кровоизлияние, инсульт, церебрально-васкулярный инфаркт). В одном аспекте изобретение включает применение или способ, в котором соединение по изобретению представляет собой агонист TGR5. В одном аспекте коэффициент селективности TGR5 ЕС 50 к FXR ЕС 50 составляет меньше 0,05. В одном аспекте изобретение включает применение или способ, в котором соединение или композицию вводят субъекту перорально, парентерально, внутривенно или местно. В одном аспекте субъектом является человек. Один аспект изобретения включает применение или способ, содержащий введение субъекту терапевтически эффективного количества соединения по изобретения. В одном аспекте изобретение включает применение или способ, содержащий введение субъекту, который нуждается в таком введении. Настоящее изобретение включает применение или способ, содержащий введение субъекту профилактически эффективного количества соединения по изобретению. Соединения и композиции настоящего изобретения можно вводить разными путями, например пероральным, подкожным, внутримышечным, внутривенным или внутрибрюшинным путем. Рассматриваемые пути введения фармацевтических композиций представляют собой пероральные, подкожные и внутривенные пути с ежедневными дозами от около 0,01 до около 5000 мг в день, предпочтительно от 5 до 500 мг в день лиганда FXR, которые рассчитаны для взрослого человека весом 70 кг. Подходящую дозу можно вводить как однократную ежедневную дозу или в виде разделенных доз с подходящими интервалами, например две, три, четыре или больше части дозы в день. Для изготовления фармацевтических композиций, содержащих соединения по изобретению, используют инертные и фармацевтически приемлемые носители. Фармацевтический носитель может быть как твердым, так и жидким. Рецептуры твердых форм включают в себя, например, порошки, таблетки,диспергируемые гранулы, капсулы, саше и суппозитории. Твердый носитель может представлять собой одну или больше субстанций, которые могут также действовать как разбавители, ароматизаторы, солюбилизаторы, лубриканты, суспендирующие агенты, связующие агенты или агенты, дезинтегрирующие таблетки; также могут быть инкапсулирующим материалом. Носитель в порошках обычно является тонкоизмельченным твердым веществом, которое находится в смеси с тонкоизмельченным активным компонентом, например соединением по изобретению. В таблетках активный компонент смешивают в подходящих пропорциях с носителем, имеющим необходимые связующие свойства, и прессуют с желательной формой и размером. Для изготовления фармацевтических композиций в форме суппозиториев сначала расплавляют низкоплавкий воск, например смесь глицеридов жирных кислот и масла какао, и диспергируют в нем активный компонент, например, путем взбалтывания. Затем расплавленную гомогенную смесь наливают в формы удобного размера и оставляют для охлаждения и отвердения. Порошки и таблетки предпочтительно содержат активный компонент соединения по изобретению в диапазоне от около 5 до около 70 вес.%. Подходящие носители включают в себя, например, карбонат магния, стеарат магния, тальк, лактозу, сахар, пектин, декстрин, крахмал, трагакант, метилцеллюлозу,натрий-карбоксиметилцеллюлозу, низкоплавкий воск, масло какао и т.п. Фармацевтические композиции могут включать рецептуру активного соединения с инкапсулирующим материалом в качестве носителя для получения капсулы, в которую помещают с помощью носителя соединение по изобретению (с носителями или без других носителей) таким образом, что носитель становится ассоциированным с соединением. Подобным образом в изобретение также могут быть включены саше. Таблетки, порошки, саше и капсулы можно применять как твердые лекарственные формы, подходящие для перорального введения. Жидкие фармацевтические композиции включают в себя, например, растворы, подходящие для перорального или парентерального введения, суспензии и эмульсии, подходящие для перорального введения. Примерами жидких соединений, подходящих для парентерального введения, являются стерильные водные растворы активных компонентов или стерильные растворы активного компонента в растворителях, содержащих воду, буферный водный раствор, солевой раствор, фосфатно-буферный раствор (ФБР),этанол или пропиленгликоль. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, необходимые для приближения к физиологическим условиям, такие как регуляторы уровня рН и буферные агенты, агенты, регулирующие тоничность, увлажняющие агенты, детергенты и т.п. Стерильные растворы можно приготовлять путем растворения активного компонента (например,соединения по изобретению) в желательной растворяющей системе с последующим пропусканием полученного раствора через мембранный фильтр для его стерилизации или, альтернативно, путем растворения в стерильных условиях стерильного соединения в заранее простерилизованном растворителе. Полученные водные растворы можно упаковывать для использования как есть, или лиофилизировать, при этом лиофилизированный препарат перед введением соединяют со стерильным водным носителем. Уровень рН указанных препаратов обычно будет в диапазоне от 3 до 11, более предпочтительно от 5 до 9 и наиболее предпочтительно от 7 и 8. Фармацевтические композиции, содержащие соединения по изобретению, можно вводить в целях профилактического и/или терапевтического лечения. Для терапевтических применений соединения вводят в количестве, достаточном для излечения, обратного развития болезни или, по меньшей мере, частичного замедления или прекращения симптомов болезни и ее осложнений. Количество, адекватное для излечения, обратного развития или, по меньшей мере, частичного замедления или прекращения симптомов болезни и ее осложнений определяют как "терапевтически эффективная доза". Для профилактических применений соединения вводят в количестве, достаточном для предотвращения симптома болезни и ее осложнений. Количество, адекватное для профилактики симптома болезни и ее осложнений, определяют как "профилактически эффективная доза". Количество, эффективное для терапевтического применения, будет зависеть от степени тяжести болезни или нарушения и веса и общего состояния здоровья пациента, но обычно для пациента весом 70 кг будет находиться в диапазоне от около 0,1 до 2000 мг соединения в день, с более общепринятыми дозами для пациента весом 70 кг от около 5 до около 500 мг соединения в день. Для профилактических применений фармацевтические соединения, содержащие соединения по изобретению, вводят пациенту, предрасположенному к развитию болезни или имеющему риск развития болезни, в количестве, достаточном для задержки развития или предотвращения возникновения симптомов болезни. Такое количество определяют как "профилактически эффективная доза." Точное количест- 13020140 во соединения для указанного применения также зависит от состояния здоровья пациента и веса, но обычно для пациента весом 70 кг будет находиться в диапазоне от около 0,1 мг до 2000 мг соединения в день, с более общепринятыми дозами для пациента весом 70 кг от около 5 мг до около 500 мг соединения в день. Выбор дозировок и путей введения соединений при однократных или многократных введениях может осуществлять лечащий врач. В любом случае, фармацевтические рецептуры должны обеспечивать количество соединения по изобретению, достаточное для эффективного лечения или профилактики болезни у пациента. Изобретение также относится к комплектам для профилактики или лечения болезни согласно использованию и способу настоящего изобретения. В одном аспекте изобретение включает комплект для лечения или профилактики болезни у субъекта, при этом комплект содержит соединение по изобретению или его соль, сольват, гидрат или пролекарство. Комплекты обычно включают фармацевтическую композицию, которая содержит эффективное количество соединения по изобретению, а также информационный материал с инструкциями по отпуску фармацевтической композиции, включающими описание типа пациентов для возможного лечения, схему (например, доза и частота введения) и путь введения, и т.п. Ниже представлены некоторые примеры соединения по изобретению. Все цитируемые в настоящем изобретении публикации и патентные документы включены в него путем ссылки, как если бы каждая такая публикация или документ были конкретно и отдельно указаны,как включенные в изобретение со ссылкой. Предполагается, что цитирование публикаций и патентных документов не является признанием отношения чего-либо из цитированного к предшествующему уровню техники и не является каким-либо признанием относительно их содержания или даты. Изобретение описано посредством письменного описания, и специалистам в данной области техники будет очевидна возможность осуществления изобретения с помощью ряда вариантов осуществления и что предшествующее описание и нижеуказанные примеры приведены в иллюстативных целях и не ограничивают объем изложенной далее формулы изобретения. Пример 1. Синтез модуляторов TGR5. Соединения изобретения и родственные производные можно синтезировать способами, известными специалистам в данной области техники. Подобные способы синтеза указанных соединений описаны ниже; см. также патенты WO 02/072598, WO 2004/0007521, ЕР 1568706 и ЕР 135782. Если рассматриваются соединения, в которых R1 представляет собой водород, R2 и R3 представляют собой гидрокси и R4 представляет собой группу низшего алкила, соединение формулы (I) можно получать согласно следующей схеме:(i) 3,4-DHP, р-толуолсульфоновая кислота (ТСК), диоксан, комнатная температура (КТ); (ii) а) диизопропиламид лития LDA, CH3I, -78 С; b) HCl, СН 3 ОН, КТ; iii) NaOH, CH3OH, кипячение с обратным холодильником. Метилхенодеоксихоланоат (1) имел защиту в 3- и в 7-положениях после обработки 3,4-дигидро-2 Нпираном в диоксане в присутствии каталитического количества р-толуолсульфоновой кислоты (р-ТСК),для получения 3,7-тетрагидропиранилокси аналогов (2). Реакция 2 с метилйодидом (или с подходящим алкилгалидом) при температуре -78 С с использованием в качестве основы диизопропиламида лития и тетрагидрофурана (ТГФ) в качестве растворителя с последующей обработкой метанольной HCl приводила к получению соответствующего соединения метил-23-метил-3,7-дигидрокси-5-холан-24 оат (3). Гидролиз 3 с использованием щелочи сложного метилового эфира и очистка флэшхроматографией приводит к получению желаемой 23(S)-метил-3,7-дигидрокси-5-холан-24-оевой кислоты (Ib) и 23(R)-метил-3,7-дигидрокси-5-холан-24-оевой кислоты (Ic). Получение 23(R)- и 23(S)-метил-3,7-дигидрокси-5-холан-24-оевой кислоты (Ib, Ic). а) Метил 3,7-дитетрагидропиранилокси-5-холан-24-оат (2). К раствору метил-3,7-дигидрокси-5-холан-24-оата (1) (2,0 г, 4,9 ммоль) в диоксане (6 мл) добавляли р-толуолсульфоновую кислоту (78 мг, 0,41 ммоль), 3,4-дигидро-2 Н-пиран (20,1 мл, 0,098 моль). Реакционную смесь перемешивали при комнатной температуре в течение 15 мин. Затем добавляли H2O(50 мл), смесь частично выпаривали в вакууме и экстрагировали EtOAc (350 мл). Объединенные орга- 14020140 нические фракции промывали солевым раствором (150 мл), высушивали (Na2SO4) и выпаривали в вакууме. Остаток очищали колоночной хроматографией на силикагеле. Элюирование петролейным эфиром/этилацетатом 80/20 приводило к получению 2,5 г очищенного соединения 2 (выход 90%). 1 Н-ЯМР (CDCl3) : 0,64 (с, 3 Н, СН 3-18), 0,89 (с, 3 Н, СН 3-19), 0,92 (д, 3 Н, СН 3-21), 3,31-3,67 (м, 4 Н,-СН 2 ОСН-), 3,65 (с, 3 Н, СО 2 СН 3), 3,67 (м, 1 Н, СН-3), 3,88 (шир.с, 1 Н, СН-7), 4,67 (шир.с, 1 Н, -О-СН-О-),4,73 (шир.с, 1 Н, -О-СН-О-).N-Бутил-литий (4,3 мл, 2,2 М раствор в гексане) добавляли по капле при -78 С к раствору диизопропиламина (1,4 мл, 10,1 ммоль) в безводном ТГФ (50 мл). Систему сохраняли при -78 С в течение дополнительных 30 мин и затем к смеси по капле добавляли метил-3,7,12-тетрагидропиранилокси-5 холан-24-оат (2) (1,8 г, 3,2 ммоль), растворенный в безводном ТГФ (14 мл). Через 20 мин медленно добавляли метилйодид (1,4 мл, 22,0 ммоль), растворенный в безводном ТГФ (7 мл), и смесь оставляли для нагревания до комнатной температуры в течение ночи. Растворители удаляли в вакууме, подкисляли 10% HCl и экстрагировали EtOAc (550 мл), промывали 5% раствором Na2S2O3 (250 мл), высушивали(над безводным Na2SO4), фильтровали и выпаривали в вакууме. Затем сырой остаток обрабатывали 2 н. раствором HCl в МеОН (50 мл) в течение 12 ч. Остаток выпаривали в вакууме и поглощали EtOAc (100 мл), промывали влажным раствором NaHCO3 (250 мл), высушивали (Na2SO4) и выпаривали в вакууме. Остаток очищали флэш-хроматографией на силикагеле. Элюирование петролейным эфиром/этилацетатом 70/30 приводило к получению 1,1 г (2,7 ммоль) очищенного соединения 3 (выход 84%). 1 Н-ЯМР (CDCl3) : 0,62 (с, 3 Н, СН 3-18), 0,87 (с, 3 Н, СН 3-19), 0,92 (д, 3 Н, СН 3-21), 2,38 (м, 1 Н, СН 23), 3,27-3,40 (м, 1 Н, СН-3), 3,55 (шир.с, 1 Н, СН-7), 3,63 (с, 3 Н, СО 2 СН 3). с) 23(R)-Метил-3,7-дигидрокси-5-холан-24-оевая кислота (Ib) и 23(S)-метил-3,7-дигидрокси 5-холан-24-оевая кислота (Ic). Метил-23-метил-3,7-дигидрокси-5-холан-24-оат 0,97 г (2,3 ммоль) растворяли в МеОН (25 мл) и добавляли 10% NaOH в МеОН (5,7 мл, 14,2 ммоль). Смесь нагревали с обратным холодильником в течение 16 ч. Смесь подкисляли 3 н. HCl и экстрагировали EtOAc (320 мл). Объединенные органические фракции промывали солевым раствором (150 мл), высушивали (Na2SO4) и выпаривали в вакууме. Остаток очищали флэш-хроматографией на силикагеле. Элюирование CHCl3:МеОН (95/5) приводило к получению 1,5 г (65%) 23(S)-метил-3,7-дигидрокси-5-холан-24-оевой кислоты и 330 мг 23(R)-метил 3,7-дигидрокси-5-холан-24-оевой кислоты. 23(S)-Метил-3,7-дигидрокси-5-холан-24-оевая кислота.(Ib3, Ic3). Получали следующие соединения путем алкилирования 6-метил-3,7-дигидрокси-5-холан-24 оевой кислоты согласно методике из примера 1. 23(S)-Метил-6-метил-3,7-дигидрокси-5-холан-24-оевая кислота.(м, 3 Н, СН 3-6), 0,95-0,99 (д, 3 Н, СН 3-21), 1,08-1,14 (д, 3 Н, -СН 3), 2,35 (м, 1 Н, СН-23), 3,29-3,48 (м, 1 Н,СН-3), 3,57 (шир.с, 1 Н, СН-7), 13 С-ЯМР (CDCl3+CD3OD) : 11,70, 15,66, 16,02, 18,00, 20,61, 23,09, 23,60,28,51, 30,39, 32,61, 33,72, 33,92, 35,38, 35,65, 36,33, 39,57, 39,94, 42,77, 47,30, 50,39, 56,53, 72,22, 72,83,180,50. Пример 3. Получение 23(R)- и 23(S)-метил-3,7,12-тригидрокси-5-холан-24-оевой кислоты (Ih,Ii). Получали следующие соединения путем алкилирования 3,7,12-тригидрокси-5-холан-24-оевой кислоты согласно методике из примера 1.(CDCl3) : 0,63 (с, 3 Н, СН 3-18), 0,87 (с, 3 Н, СН 3-19), 0,96-0,98 (м, 3 Н, СН 3-21), 1,07-1,11 (д, 3 Н, -СН 3),2,44-2,73 (м, 1 Н, СН-23), 3,35-3,50 (м, 1 Н, СН-3), 3,82 (шир.с, 1 Н, СН-7) 3,95 (шир.с, 1 Н, СН-12), 13 СЯМР (ДМСО) : 12,76, 16,88, 17,31, 23,04, 23,24, 26,62, 28,12, 28,94, 30,81, 33,97, 34,80, 35,28, 35,71,37,20, 41,85, 46,29, 47,44, 66,67, 70,86, 71,45, 178,77. Пример 4. Получение 23(R)- и 23(S)-метил-6-метил-3,7,12-тригидрокси-5-холан-24-оевой кислоты (Ih3, Ii3). Получали следующие соединения путем алкилирования 6-метил-3,7,12-тригидрокси-5 холан-24-оевой кислоты согласно методике из примера 1. 23(S)-Метил-6-метил-3,7,12-тригидрокси-5-холан-24-оевая кислота (Ih3): т.пл.: 131-134 С,1 Н-ЯМР (CDCl3+CD3OD) : 0,65 (с, 3 Н, СН 3-18), 0,87 (с, 3 Н, СН 3-19), 0,97-1,00 (м, 3 Н, СН 3-21), 1,14-1,18(CD3OD) : 11,61, 15,04, 15,32, 16,15, 22,04, 22,75, 26,27, 27,62, 28,18, 29,61, 32,91, 33,74, 34,31, 35,06,35,18, 36,56, 39,70, 40,25, 41,68, 46,19, 46,31, 71,76, 71,77, 72,62, 180,11. Пример 5. Получение 23(R)- и 23(S)-метил-3-гидрокси-5-холан-24-оевой кислоты (Ip, Iq). Получали следующие соединения путем алкилирования 3-гидрокси-5-холан-24-оевой кислоты согласно методике из примера 1. 1 23(S)-Метил-3-гидрокси-5-холан-24-оевая кислотаLDA, MeI, -78C, d) МеОН, HCl, 45 С, е) МеОН, NaOH, 45C, 41%. Полный выход: 39,7%. Синтез 23(S)-метил-3,7,12-тригидрокси-6-этил-5-холан-24-оата (2). К раствору 1 (2,78 г, 6,37 ммоль) в МеОН (120 мл) добавляли рТСК (0,12 г, 0,63 ммоль) и смесь обрабатывали ультразвуком в течение 90 мин. Зетем смесь выпаривали при пониженном давлении и полученный остаток разводили AcOEt (120 мл), промывали Н 2 О (3100 мл), солевым раствором (100 мл), высушивали над безводным Na2SO4 и выпаривали при пониженном давлении для получения соединения 2(количественный выход), которое использовали для следующего этапа без дополнительной очистки. 1 Метил-3,7,12-тригидрокси-6-этил-5-24-оат (3). К раствору 2 (2,50 г, 5,55 ммоль) в СНС 13 (60 мл) и диметоксиметане (34,10 мл, 166,66 ммоль) порциями добавляли Р 2 О 5 (14,18 г, 99,90 ммоль) и полученную суспензию механически смешивали в течение 45 мин. Затем смесь фильтровали и органический слой обрабатывали 10% NaHCO3 (50 мл) в течение 10 мин. Затем органический слой отделяли и водный слой экстрагировали CHCl3 (350 мл). Собранные органические слои промывали солевым раствором (100 мл), высушивали над безводным Na2SO4 и выпаривали при пониженном давлении для получения соединения 3 (3,14 г, 97%), которое использовали в следующем этапе без дополнительной очистки. 1 Н-ЯМР (CDCl3) : 0,67 (3 Н, с, 18-СН 3), 0,88-1,04 (9 Н, м, 19 СН 3+СН 3 СН 2+21-СН 3), 3,30 (1 Н, м, 3-СН), 3,30-3,40 (7 Н, м, 3-СН+2 СН 3 ОСН 2 О), 3,45 (3 Н, с,СН 3 ОСН 2 О), 3,50 (1 Н, м, 7-СН), 3,66 (3 Н, с, СООСН 3), 3,79 (1 Н, м, 12-СН), 4,57-4,75 (6 Н, м,3 СН 3 ОСН 2 О). 23(S)-Метил-3,7,12-тригидрокси-6-этил-5-холан-24-оевая кислота (Ih3e). К раствору диизопропиламина (0,56 мл, 4,026 ммоль) в свежем дистиллированном ТГФ (15 мл), охлажденном до -78 С, в атмосфере N2 по капле добавляли 11BuLi 2,5 н. в гексане (1,53 мл, 3,840 ммоль). Реакционную смесь перемешивали при -78 С в течение 30 мин и затем по капле добавляли раствор 3(350 мг, 0,601 ммоль), растворенный в свежедистиллированном ТГФ (7 мл). Полученный раствор перемешивали при -78 С в течение 90 мин. Добавляли йодометан (0,56 мл, 9,015 ммоль), реакционную смесь перемешивали при -78 С в течение 60 мин и затем медленно подогревали до комнатной температуры в течение ночи. Затем смесь выпаривали при пониженном давлении, после чего полученный остаток разводили Н 2 О (30 мл) и экстрагировали AcOEt (330 мл). Собранные органические слои промывали солевым раствором (30 мл), высушивали над безводным Na2SO4 и выпаривали при пониженном давлении. Затем остаток обрабатывали раствором 37% МеОН/HCl (20 мл, 20:1 об./об.) при 45 С в течение 8 ч. Смесь выпаривали при пониженном давлении, полученный остаток разводили Н 2 О (30 мл) и экстрагировали AcOEt (330 мл). Объединенные органические слои промывали солевым раствором (100 мл), высушивали над безводным Na2SO4 и выпаривали при пониженном давлении. Полученный остаток обрабатывали 10% раствором NaOH в МеОН (15 мл) при 45 С в течение 24 ч. Затем смесь выпаривали при пониженном давлении и полученный остаток разводили Н 2 О (20 мл), промывали iPr2O (315 мл), подкисляли 3 н. HCl и в завершении экстрагировали CHCl3 (320 мл). Органические слои промывали солевым раствором (100 мл), высушивали над безводным Na2SO4 и выпаривали. Полученный остаток очищали хроматографией среднего давления (колонка: "RP-18 Lobar В, МеОН/H2O от 5:5 до 6:4, 50 фунт/кв.дюйм) для получения соединения 4 (47 мг, 41%). Т.пл.: 195-197 С. 1(i) ЭДА (этилдиазоацетат), Rh2(OAc)4, CH2Cl2, комнатная температура; (ii) (a) NaOH, EtOH, кипячение с обратным холодильником, (b) ЖХСД (жидкостная хроматография среднего давления). 3,7-Дигидрокси-22,23-метилен-5-холан-24-оевые кислоты (Io5, Ip5, Iq5 и Ir5). Этилдиазоацетат (0,478 г, 1,19 ммоль) в сухом CH2Cl2 (15 мл) медленно добавляли по капле к перемешиваемой суспензии 3,7-диацетокси-5-норхолан-22,23-ен (1) (0,6 г, 1,39 ммоль) в присутствии диродий (II) тетраацетата (9 мг, 0,02 ммоль) в сухом CH2Cl2 (15 мл) в атмосфере азота при комнатной температуре. Реакционную смесь фильтровали и промывали Н 2 О (20 мл), высушивали (Na2SO4) и выпарива- 17020140 ли в вакууме и таким образом получали смесь четырех диастереоизомерных сложных эфиров 2. Сложные эфиры 2 последовательно растворяли в EtOH (15 мл) и обрабатывали 10 н. раствором NaOH (10 мл) с кипячением с обратным холодильником в течение 4 ч, охлаждали, вливали в холодную H2O (50 мл), подкисляли 2 н. HCl и экстрагировали EtOAc (315 мл). Органическую фазу промывали солевым раствором(10 мл), высушивали (Na2SO4) и выпаривали в вакууме. Остаток очищали хроматографией на силикагеле. Элюирование CH2Cl2/MeOH 96/4 с 0,1% АсОН приводило к получению 0,087 г (выход 15%) (22S,23R)3,7-дигидрокси-22,23-метилен-5-холан-24-оевой кислоты (Io5) и 0,065 г (выход 11,5%) (22R,23R)3,7-дигидрокси-22,23-метилен-5-холан-24-оевой кислоты (Iq5). Элюирование CH2Cl2/MeOH 95,5/4,5 с 0,1% АсОН давало 0,18 г (выход 32%) (22S,23R)-3,7-дигидрокси-22,23-метилен-5-холан-24-оевой кислоты (Ip5) и 0,15 г (выход 26,7%) (22R, 23S)-3 а,7 а-дигидрокси-22,23-метилен-5-холан-24-оевой кислоты (Ir5) в виде белых твердых веществ.(CDCl3) : 12,00, 13,50, 19,90, 20,90, 22,50, 23,10, 24,00, 28,00, 30,70, 31,60, 33,20, 34,90, 35,40, 35,65,39,70, 39,73, 41,80, 43,10, 50,40, 58,00, 68,80, 72,20, 177,60. Пример 8. Активность in vitro T6R5 и FXR. Потенциал и эффективность действия соединений изобретения на рецептор TGR5 оценивали с помощью тестов in vitro. В табл. 1 указано, что соединения по изобретению представляют собой мощные и селективные модуляторы TGR5. Введение алкильной группы в положении С-23 желчной кислоты придает селективность рецептору TGR5 по сравнению с FXR. Это очевидно из наблюдаемых биологических результатов дляFXR и TGR5, полученных с ХДХК, 6-МеХДХК и 6,23-диМе-ХДХК (смесь изомеров 23-R,S), как указано в табл. 1 6,23-диМе-ХДХК является в 100 раз более мощной на рецепторе TGR5 по сравнению с рецептором FXR. Описание связывания рецептора TGR5 с использованием тестов in vitro см., например, в публикации Kawamata, J. Biol. Chera, 2003, Vol. 278, No. 11, p. 9435-9440). Активность на FXR оценивали с помощью резонансного переноса энергии флуоресценции FRET для рекрутинга пептида SRC-I в человеческий FXR с использованием бесклеточного фермент-связанного иммуносорбентного анализа ELISA; см. Blanchard et al. WO 00/37077. Таблица 1EC50 (мкмоль) соединений из примеров на рецепторах FXR и TGR5 В табл. 2 и 3 показаны дополнительные соединения, оцениваемые на активность TGR5. Активность люциферазы определяли в клетках СНО, устойчиво экспрессирующих hTGR5, или транзиторно котрансфицированных вектором экспрессии hTGR5 и цАМФ чувствительный элемент (CRE) - зависимым геномрепортером люциферазы. Некоторые из соединений дополнительно анализировали в тесте репортера люциферазы для оценки их способности активировать ядерный рецептор желчной кислоты FXR. Данные представляют средние значения по меньшей мере трех независимых анализов CRE-зависимого репортера люциферазы в TGR5 трансфицированных клетках СНО. Единицы для оценки ЕС 50 указаны в мкмоль, единицы для оценки эффективности указаны в % от значения 10 мкмоль ЛХК. а Данные показывают средние значения по меньшей мере трех независимых экспериментов. Значение эффективности выражено как % активности от значения 10 мкмоль ЛХК (TGR5) или 10 мкмоль 6 ХДХК (FXR).b Плато уровня активации не достигнуто; максимальная тестированная концентрация составляла 125 мкмоль для Ib и 100 мМ для Ii. Данные в табл. 2 и 3 можно определить с помощью способов, известных в данной области техники,например, согласно описанию ниже. Плазмиды. Клоны MGC:40597 из Коллекции генов млекопитающих NIH (также именуемыйpCMVSPORT6/hTGR5 или pTGR5) и pcDNA3.1(+) были получены из компании Invitrogen (Carlsbad, CA).pCRE-Luc и pCMV были получены из компании Clontech (Palo Alto, CA). pCMX-hFXR и рСМХmRXR были предоставлены в дар д-ром David J. Mangelsdorf (Howard Hughes Medical Institute, University of Texas Southwestern Medical Center). pEcREx7-Luc были предоствлены в дар д-ром Richard A. Heyman (X-ceptor Therapeutics, CA). Клеточная культура. Клетки яичника китайского хомяка (СНО), клетки NCI-H716, клетки Нер 3 В и клетки COS1 были получены из Американской коллекции типовых культур (Manassas, VA). Культуральные среды для клеток, сыворотки и добавки поставлялись компаниями Invitrogen или Sigma-Aldrich. Все клетки СНО сохранялись в минимальной эссенциальной среде(-МЕМ) с добавлением 10% (об./об.) эмбриональной бычьей сыворотки (ЭБС) и 100 мкмоль неосновных аминокислот (NEAA). Клетки NCI-H716 сохраняли в суспензии в среде RPMI-1640 с добавленем 10% ЭБС (v/v), 10 мМ HEPES и 1 мМ пирувата натрия. Клетки Нер 3 В сохраняли в среде Игла с добавлением 10% ЭБС (об./об.) и 100 мкмоль NEAA. Клетки COS1 сохраняли в модифицированной по Дульбекко среде Игла (DMEM) с добавлением 10% ЭБС (об./об.). Во все культуральные среды для клеток добавляли 100 ед/мл пенициллина и 100 мкг/мл стрептомицина сульфата. Клетки выращивали при 37 С в атмосфере 5% СО 2, пассировали каждые 2-6 дней и для каждого эксперимента высевали заново. Транзиторные трансфекции. Клетки СНО высевали в 96-луночные планшеты с плотностью 3,5104 клеток/на лунку, культивировали в течение 24 ч, и затем трансфицировали 150 нг человеческой (h) плазмидой экспрессии TGR5(pCMVSPORT6/hTGRS) и 100 нг цАМФ-чувствительного элемента (CRE)-зависимой репортерной плазмиды люциферазы (pCRE-Luc) в каждой лунке с использованием реактива Липофектамин 2000 (Invitrogen) согласно инструкциям изготовителя. Через 6 ч инкубации клетки однократно промывали фосфатнобуферным раствором (ФБР) и заменяли среду на среду DMEM, содержащую 0,1% (вес./об.) бычьего сывороточного альбумина (БСА). Через следующие 18 ч инкубации клетки обрабатывали в течение 5 ч каждым из соединений в разных концентрациях в новой DMEM, содержащей 0,1% (вес./об.) БСА. После обработки клетки лизировали с помощью лизирующего буфера 50 мкл (25 мМ Трис-Cl (рН 7,6), 2 мМ ЭДТА, 1 мМ дитиотретиола (ДТТ), 10% (об./об.) глицерина и 1% (об./об.) тритона Х-100) путем цикла замораживания-оттаивания и подвергали анализу с люциферазой, как описано ниже. Клетки COS1 высевали в 96-луночные планшеты с плотностью 2,5104 клеток/на лунку в средеDMEM с добавлением 10% (об./об.) очищенной на активированном угле ЭБС, культивировали в течение 24 ч, и затем трансфицировали 25 нг плазмиды экспрессии hFXR (pCMX-hFXR), 25 нг плазмиды экспрессии мышиного (m) ретиноидного X рецептора a (RXR) (pCMX-mRXRa), 50 нг репортерной плазмиды (pEcREx7-Luc) и 50 нг pCMV в качестве внутреннего контроля в каждой лунке с использованием реактива Липофектамин 2000 (Invitrogen). Через 24 ч клетки дважды промывали ФБР и обрабатывали каждым из соединений в разных концентрациях в свежей DMEM с добавлением 10% (об./об.) очищенной на активированном угле ЭБС в течение 24 ч. После обработки клетки лизировали с помощью лизирую- 20020140 щего буфера 50 мкл путем цикла замораживания-оттаивания и подвергали анализам и с люциферазой, и с -галактозидазой, как описано ниже. Стандартизированные значения люциферазы определяли как отношение активности люциферазы к активности -галактозидазы. Анализы с люциферазой и с -галактозидазой. Для анализов с люциферазой смешивали 20 мкл клеточного лизата со 100 мкл люциферазного реакционного буфера [235 мкмоль люциферина, 265 мкмоль АТФ и 135 мкмоль коэнзима А (КоА)] и определяли люминесценцию на оборудовании CentroXS3 LB960 (Berthold Technologies, Bad Wildbad, Германия). Для анализа с -галактозидазой 10 мкл клеточного лизата смешивали со 100 мкл буфера Z [60 мМNa2HPO4, 10 мМ KCl, 1 мМ MgSO4, 50 мМ -меркаптоэтанола и 0,75 мг/мл о-нитрофенилDгалактопиранозида (ONPG)], и инкубировали при 37 С в течение от 0,5 до 3 ч. Реакции прекращали путем добавления 50 мкл останавливающего буфера (1M Na2CO3), и определяли оптическую плотность при 420 нм. Создание клеток СНО, устойчиво экспрессирующих человеческий TGR5 (клетки CHO-TGR5). Клетки СНО были трансфицированы 3,8 мкг плазмиды экспрессии hTGR5 (pCMVSPORT6/hTGR5),3,8 мкг CRE-зависимой репортерной плазмиды люциферазы (pCRE-Luc) и 0,4 мкг плазмиды экспрессии гена резистентности к неомицину [pcDNA3.1(+)] с использованием липофектамина 2000. Трансфектанты были отобраны с использованием 400 мкг/мл G418 сульфата, и одиночные клоны выращивали по отдельности в 96-луночных планшетах. Проводили скрининг клеточных линий СНО, экспрессирующихTGR5 путем обработки ЛХК с последующими люциферазными анализами. Анализ продукции цАМФ. Клетки NCI-H716 высевали в 96-луночные планшеты с нанесенным 0,75 мг/мл гелем Matrigel (BDBiosciences) согласно инструкциям изготовителя непосредственно перед использованием, с плотностью 6104 клеток/на лунку в среде DMEM с добавлением 10% (об./об.) ЭБС, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина сульфата, и культивировали в течение 24 ч, что приводило к адгезии клеток на дне планшета. Клетки CHO-TGR5 высевали в 96-луночные планшеты с плотностью 3,5104 клеток/на лунку в среде -МЕМ с добавлением 10% (об./об.) ЭБС, 100 мкмоль NEAA, 100 Ед/мл пенициллина и 100 мкг стрептомицина сульфата, и культивировали в течение 24 ч. Клетки дважды промывали ФБР, затем меняли среду на среду для цАМФ-анализа [DMEM, содержащую 0,1% (вес./об.) БСА и 0,5 мМ 3 изобутил-1-метилксантина (IBMX)]. После инкубации в течение 30 мин при 37 С клетки обрабатывали каждым соединением в течение 30 мин в новой среде для цАМФ-анализа. После обработки среду удаляли и определяли количество цАМФ с помощью комплекта для скрининга cAMP-Screen (Applied Biosystems, Foster City, CA) согласно инструкциям изготовителя. Концентрации с 50% эффективности (ЕС 50) и определение эффективности. Анализы проводили три раза или четыре раза для каждого условия. Значения ЕС 50 определяли с помощью пробит-анализа. Эффективность в анализе с агонистом TGR5 определяли вычислением процента от значения для 10 мкмоль ЛХК, и в анализе с агонистом FXR от значения 10 мкмоль 6-Et-ХДХК соответственно. После вычитания среднего значения исходного состояния (при лечении носителем) эти значения использовали для определения ЕС 50 и/или эффективности. Вычисление среднего ЕС 50 и сравнение ЕС 50 разных соединений выполняли после логарифмического преобразования. Статистический анализ. Статистический анализ выполняли с помощью t-теста Стьюдента и значения р 0,05 считали статистически значимыми. Таблица 3 А Данные в табл. 3 А были получены с помощью описанных ниже способов. Анализ FRET (определение внутриклеточного содержания цАМФ). Проводили анализ связывания рецептора путем измерения уровня циклического АМФ (цАМФ) с помощью анализа FRET. Человеческие клеточные линии кишечных клеток (NCI-H716) высевали в 96 луночные планшеты, покрытые непосредственно перед использованием 0,75 мг/мл гелем Matrigel (BDBiosciences) согласно инструкциям изготовителя, с плотностью 12103 клеток/на лунку в среде DMEM с добавлением 10% (об./об.) ЭБС, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина сульфата, и культивировали в течение 24 ч, что приводило к адгезии клеток на дне планшета. Клетки дважды промывали ФБР, затем среду заменяли на среду для анализа цАМФ [OPTIMEM, содержащую 0,1% (вес./об.) БСА и 1 мМ 3-изобутил-1-метилксантин (IBMX)]. После инкубации в течение 60 мин при 37 С клетки в течение 1 ч при комнатной температуре обрабатывали возрастающими концентрациями соединения Ih3 с в стимулирующем буфере (5 мМ HEPES, 0,1% БСА в HBSS (сбалансированном солевом растворе Хенкса) с уровнем рН 7,4) который содержал конъюгированное с хелатом европия - стрептадивином и ALEXA Фтор-647 антитело анти-цАМФ (PerkinElmer). Уровень внутриклеточного цАМФ определяли с помощью комплекта Lance (PerkinElmer). В качестве контрольного лиганда использовали литохолевую кислоту. Z' фактор использовали для подтверждения анализа. Для получения значения ЕС 50 были построены нелинейные кривые регрессии без ограничений с использованием уравнения с четырьмя параметрами и программного обеспечения GraphPad Prism (GraphPad Inc). Альфа-скрининговый анализ. Активность FXR оцененивали по методике альфа-скрининга в анализе рекрутинга коактиватора. Альфа-скрининг представляет собой химическое исследование, основанное на изучении гранул, которое используют для изучения биомолекулярных взаимодействий. Связывание молекул, зафиксированных на гранулах, приводит к передаче энергии от одной гранулы к другой, что в итоге производит люминесцентный сигнал. При взаимодействии партнеров химическая энергия передается от донорных на акцепторные гранулы и возникает сигнал. При стимуляции желчных кислот GST-FXR-LBD взаимодействует с пептидом Src-1. Для фиксации GST-слитого FXR-LBD использовали анти-GST-покрытые акцепторные гранулы, тогда как биотинилированный SRC-1 пептид фиксировали донорными стрептадивиновыми гранулами. После облучения 680 нм происходил перенос химической энергии от донорных гранул к акцепторным гранулам через комплекс стрептадивин-донор/Src-1-биотин/GSTFXR-LBD/анти-GSTакцептор и возникал сигнал. Анализ проводили в белых малообъемных 384-луночных планшетах Optiplates (PerkinElmer) в конечном объеме 25 мкл, содержащем конечные концентрации 10 нМ очищенногоGST-меченого белка FXR-LBD, 30 нМ биотинилированного пептида Src-1, 20 мкг/мл анти-GST акцепторных гранул и 10 мкг/мл стрептавидиновых донорных гранул (PerkinElmer). Тестовый буфер содержал 50 мМ Трис (уровень рН 7,4), 50 мМ KCl, 0,1% БСА и 1 мМ ДТТ. Устанавливали время возбуждения с помощью 1 мкл лигандов (солюбилизированных в 100%-ном ДМСО) в течение 30 мин при комнатной температуре. Поддерживали концентрацию ДМСО в каждой лунке с конечной концентрацией 4%. После добавления смеси обнаружения (донорные и акцепторные гранулы) планшеты икубировали в темноте в течение 4 ч при комнатной температуре, затем данные считывали в анализаторе Envision microplate analyzer (PerkinElmer). Кривые доза-ответ получали трижды и для подтверждения анализа использовали фактор Z'. Для получения значения ЕС 50 были построены нелинейные кривые регрессии без ограничений с использованием уравнения с четырьмя параметрами и программного обеспечения GraphPad Prism(GraphPad Inc). Клеточная культура, трансфекция и люциферазный анализ. Клетки HEPG2 и НЕК 293 Т культивировали в среде Е-МЕМ и DMEM соответственно, и в обе среды добавляли 1% пенициллин/стрептомицин, 1% L-глутамин и 10% эмбриональной бычьей сыворотки (с высоким содержанием глюкозы) (Invitrogen, Carlsbad, CA). Клетки выращивали при 37 С в атмосфере 5% СО 2. Все трансфекции осуществляли с помощью трансфекционного реактива Fugene HD Trasfection(мкл) и ДНК (мкг) 5:2, соответственно (Roche). За 24 ч до трансфекции клетки НЕК 293 Т или HepG2 высевали на 96-луночные планшеты с плотностью 10000 или 15000 клеток/на лунку соответственно. Осуществляли транзиторные трансфекции с использованием 100 нг векторного репортераpGL4.29[luc2P/CRE/Hygro] (Promega), 40 нг pGL4.74 (Renilla), в качестве внутреннего контроля эффективности трансфекции, и 10 нг плазмиды экспрессии pCMV-SPORT6-hTGR5. Коллекция генных клонов млекопитающих NIH MGC:40597 (Invitrogen). Вектор pGEM добавляли для стандартизации количества трансфицированной ДНК в каждом анализе (2 мкг). Через 24 ч после трансфекции клетки в течение 18 ч стимулировались соединением Ih3e с возрастающей концентрацией. В контрольные культуры вводили только носитель (0,1% ДМСО). Затем клетки лизировали с добавлением 75 мкл люциферазного реактиваDual-Glo (Promega) к 75 мкл содержащих среду клеток/лунку. Активность люциферазы Renilla измеряли при добавлении объема реактива Dual-Glo StopGlo и оригинальной культуральной среды. Активность люциферазы выражали как отношение люциферазной единицы к единице люциферазы renilla. Каждая точка данных является средним показателем из трех анализов. Каждый эксперимент повторяли по меньшей мере три раза. Предпочтительными являются соединения, имеющие группу альфа-этила в С-6 положении на кольце желчной кислоты. Более конкретно, наиболее предпочтительны соединения, имеющие группу альфаэтила в С-6 положении 23-метил-холевой кислоты. Как показано в табл. 3 А выше, соединения, имеющие группу альфа-этила в С-6 положении, являлись более мощными, чем соответствующее С-6-альфа-метилпроизводное, что было удивительным и неожиданным. Пример 9. Метаболическая активность олеанолевой кислоты и 6-этил-23-метил-холевой кислоты(Ih3e) в мышиной модели индуцированного диетой ожирения. Цель исследования состояла в определении способности агониста TGR5 (олеанолевой (ОК кислоты или 6-этил-23-метилхолевой кислоты (Ih3e) к коррекции in vivo развития ожирения и связанной резистентности к инсулину. Для проверки этого предположения OK/Ih3e вводили с кормом в течение 16 недель самцам мышей C57BL6J, которых в течение 10 недель перед исследованием подвергали кормлению высокожирной пищей. Протокол II. В предыдущем исследовании наблюдали действие ОК как селективного агониста TGR5, который не вызывал отвращение к пище. Вместе с тем, у животных, получавших ОК в дозе 100 мг/кг/день, были выявлены некоторые признаки токсичности, тогда как более низкие дозы переносились хорошо. Поэтому в этом исследовании ОК вводили в дозе 50 мг/кг/день. В исследованиях in vitro выявлено, что Ih3e является мощным и селективным лигандом TGR5. Не предполагалось каких-либо проблем токсичности при введении Ih3e в концентрациях в 50 раз меньше. В этом исследовании 48 самцов мышей C57BL6J (в возрасте 5 недель) разделяли на две группы: 24 животных одной группы (группы 1, 2 и 3) получали обычный рацион, тогда как другие 24 мыши получали высокожирную диету в течение 10 недель (группа 4, 5 и 6). Затем животных исследовали в течение 16 недель. Пять групп из 10 животных имели следующие назначения: 1: обычный рацион,2: обычный рацион+ОК 50 мг/кг/день,3: обычный рацион+6Et23MeCA (Ih3e) 30 мг/кг/день,4: высокожирная пища,5: высокожирная пища+ОК 50 мг/кг/день,6: высокожирная пища+6Et23MeCA (Ih3e) 30 мг/кг/день. На протяжении всего исследования массу тела и рацион питания контролировали два раза в неделю. Неделя 2. Конституцию тела анализировали для всех групп с помощью двухэнергетической рентгеновской абсорбциометрии (Dexascan). Неделя 1. Сывороточное содержание трансаминаз, глюкозы, триглицеридов, холестерина, липопротеинов высокой плотности ЛВП-С, липопротеинов низкой плотности ЛНВ-С и инсулина измеряли во всех группах после периода голодания в течение 12 ч, затем мышам назначали диету, указанную выше(день 0). Неделя 2. Сывороточное содержание трансаминаз, глюкозы, триглицеридов, холестерина, ЛВП-С,ЛНВ-С и инсулина измеряли во всех группах после периода голодания в течение 12 ч (день 14). Неделя 4. Определяли толерантность к глюкозе у всех животных с помощью внутрибрюшинного теста толерантности к глюкозе (IPGTT). Перед указанным исследованием животные голодали в течение 12 ч. Путем непрямой калориметрии измеряли ночное потребление энергии в группах 1, 4, 5 и 6 (обычный рацион, высокожирная диета и высокожирная диета с OK/6Et23 МеХДХК (Ih3e). Неделя 8. Во всех группах повторно анализировали конституцию веса тела с помощью дексасканирования Dexascan. Сывороточное содержание трансаминаз, глюкозы, триглицеридов, холестерина,ЛВП-С, ЛНВ-С и инсулина измеряли во всех группах после периода голодания в течение 12 ч (день 56). Неделя 9. В течение 30 ч изучали циркадную активность в группах 4, 5 и 6 (мыши, получавшие высокожирную пищу). Неделя 10. В группах 4, 5 и 6 измеряли кровяное давление и сердечный ритм. Неделя 11. Измеряли ректальную температуру у всех животных при комнатной температуре в 10.00. Циркадную активность определяли в группах 1, 2, 3 и 4. Неделя 12. Определяли толерантность к глюкозе у всех животных с помощью внутрибрюшинного теста толерантности к глюкозе (IPGTT). Во время IPGTT также производили забор крови для анализа уровня инсулина. Перед указанным исследованием животные голодали в течение 12 ч. Во всех группах на протяжении 24 ч собирали фекалии для измерения содержания липидов в фекалиях. Неделя 16. Всем животным проводили холодовый тест с измерением температуры тела животных,содержащихся при 4 С. Через три дня животных умерщвляли. При забивании собирали кровь для анализа на липиды плазмы (общий холестерин ОХ, триглицериды ТГ, ЛВП-С, свободные жирные кислоты СЖК); функции печени (АЛТ, ACT, щелочная фосфатаза, гамма-глутаминтрансфераза -ГТ); глюкоза и инсулин; профили липопротеина в плазме у выбранных групп (эксклюзионная хроматография). Осуществляли забор печени, тонкой кишки, жировых тканей (белой жировой ткани БЖТ и коричневой жировой ткани КЖТ), поджелудочной железы, сердца и мышечной ткани, все взвешивали и сохраняли для дальнейших исследований, включающих стандартный гистологический анализ (окрашивание гематоксилин-эозином ГЭ, окрашивание сукцинатдегидрогеназой, окрашивание oil-red-О и морфологический клеточный анализ); содержание липидов в ткани; электронную микроскопию КЖТ и мышц для изучения митохондрий; выделение РНК для исследования путем количественной RT-ПЦР экспрессии отдельных генов, вовлеченных в метаболизм и энергетический гомеостаз; экстракцию белка для исследования пост-трансляционных модификаций, таких как ацетилирование рассматриваемых белков (например, PGC-1).III. Подробные методики. А. Методики и диеты животных. Содержание и работа с животными. Мышей содержали по группам (5 животных на клетку) в специальных беспатогенных условиях с режимом циклов света/темноты 12 ч:12 ч (с 7.00), при температуре (20-22 С) и регулируемой влажности в виварии, согласно инструкциям Европейского Экономического Сообщества. Животные имели свободный доступ к воде и пище. Питьевая вода. Химический состав воды из-под крана регулярно анализировали с целью проверки отсутствия потенциальных токсичных веществ в институте Institut d'Hydrologie, ULP, Страсбург. Питьевую воду обрабатывали HCl и HClO4, чтобы поддерживать уровень рН от 5 и 5,5 и концентрацияю хлорина от 5 до 6 промилле. Диета. Стандартный рацион для грызунов получали из ОАР и высокожирную пищу поставляла фирма Research Diet. Мышам давали или обычный рацион (16% белка, 3% жира, 5% волокна, 5% зола) или высокожирную пищу (20% белка, 20% углеводов, 60% жира). Олеанолевую кислоту и 6Et23 МеХДХК (Ih3e) подмешивали и к порошкообразному обычному корму, и к высокожирной пище в следующих пропорциях: 0,5 г ОК/кг пищи для введения в дозе 50 мг/кг/день и 0,08 г 6Et23MeCA (Ih3e)/кг пищи для введения в дозе 10 мг/кг/день. Затем восстанавливали форму шариков. Контрольные группы получали шарики корма, поставляемые указанной компанией. Учитывая консистенцию высокожирного корма, воду в смесь с ОК совсем не добавляли. В случае обычного корма, который труднее восстанавливал форму, к порошку добавляли минимальное количество воды для воссоздания шариков, которые затем высушивали на воздухе. Новые порции корма приготовляли еженедельно. Забор крови. Кровь собирали из ретроорбитальной пазухи с анестезией или из хвостовой вены. Анестезия. Для экспериментального декса-сканирования животным проводили анестезию смесью кетамина(200 мг/кг)/ксилазина (10 мг/кг), вводимой путем внутрибрюшинной инъекции. Для венепункции животным проводили ингаляционную анестезию смесью изофлурана-O2. В. Биохимия. Анализы проводили на автоматизированной лабораторной рабочей станции Olympus AU-400 с использованием коммерческих реактивов (Olympus). Анализ липидов и липопротеинов. Содержание в сыворотке триглицеридов, общего холестерина и ЛВН-холестерина определяли ферментным анализом. Сывороточное содержание холестерина определяли после преципитации апо-Всодержащих липопротеинов фосфорно-вольфрамовой кислотой/Mg (например, Roche Diagnostics, Mann- 24020140heim, Германия). Уровень свободных жирных кислот определяли с помощью комплекта Wako (например, Neuss, Германия) согласно инструкциям изготовителя. Исследование метаболизма и эндокринного статуса. Концентрацию глюкозы в крови измеряли высокоточным анализатором Precision Q.I.D (например,системой Medisense), используя электроды Medisense Precis (например, Abbot Laboratories, Medisenseproducts, Бедфорд, США). Этот способ подтверждали сравнением данных анализатора Precision Q.I.D со значениями классических измерений глюкозы. Способ Precision Q.I.D был выбран благодаря минимальному количеству требуемой крови и, следовательно, его можно применять для многократных измерений,например, в ходе IPGTT. Содержание инсулина в плазме (например, Mercodia, Uppsala, Швеция) определяли путем ELISA согласно инструкциям изготовителя. С. Метаболическое исследование. Профили липопротеина. Профили липопротеина получали с помощью жидкостной экспресс-хроматографии белка, позволяющей разделение трех основных классов липопротеинов очень низкой плотности ЛПОНП, ЛНП и ЛВП. Внутрибрюшинный тест толерантности к глюкозе (IPGTT) - пероральный тест толерантности к глюкозе. Тест IPGTT проводили у мышей, голодавших в течение ночи (12 ч). Мышам интраперитонеально(IPGTT) вводили раствор 20% глюкозы в стерильном солевом растворе (0,9% NaCl) в дозе 2 г глюкозы/кг массы тела. Кровь для контроля содержания глюкозы и инсулина забирали из хвостовой вены перед введением и через 15, 30, 45, 75, 90, 120, 150, 180 мин после введения раствора глюкозы. Область приращения глюкозной кривой рассчитывали как степень чувствительности к инсулину, при этом соответствующие уровни инсулина указывают на резервы секреции инсулина. Потребление энергии. Потребление энергии оценивали путем непрямой калориметрии, измеряя потребление кислорода с помощью прибора Oxymax (например, Columbus Instruments, Columbus, ОН) в течение 12 ч. Эта система состоит из открытой цепи с входом и выходом воздуха из пластмассовых клеток (с одной мышью в клетке). Животные имели свободный доступ к корму и воде. Высокоточный датчик СО 2 и О 2 измерял разницу концентрации О 2 и СО 2 в обоих объемах воздуха, что давало количество кислорода, потребляемого за промежуток времени, при условии постоянного потока входящего в клетку воздуха. Полученные на приборе данные обрабатывали на соединенном с ним компьютере, анализировали и сохраняли в возможном для переноса файле Excel. Значения выражали в млкг-1 ч-1, общепринято называемое VO2. Определение содержания жира в организме с помощью декса-сканирования. Декса-сканирование выполняли на денситометре с ультравысоким разрешением серии PIXIMUS(0,180,18 мм пикселей, GE Medical Systems, Madison, WI, США). Минеральную плотность костной ткани (МПКТ, г/см 2) и конституцию тела определяли с помощью программного обеспечения PIXIMUS (версия 1,4, GE Medical Systems).D. Неинвазивное измерение кровяного давления и пульса. Система анализа кровяного давления Visitech BP-2000 представляет собой автоматизированную компьютерную систему с хвостовой манжетой, которая используется для проведения многократных измерений одновременно у 4 бодрствующих мышей без вмешательства оператора. Мышей содержали в индивидуальных темных клетках на теплой платформе с зажатыми в манжете хвостами. Система измеряла кровяное давление посредством определения давления в манжете, которая пережимала кровоток в хвосте. Фотоэлектрический датчик определял пульс субъекта. Система дает результаты, показывающие их близкое соответствие значению внутриартериального давления, измеренного одновременно в каротидной артерии. Это позволяет получать воспроизводимые значения систолического кровяного давления и скорости сердечного ритма. Для этого требуется подготовка животных в системе в течение одной недели.E. Циркадная активность. Спонтанную двигательную активность измеряли с помощью индивидуальных боксов, каждый из которых состоял из съемной клетки со скользким полом и был оборудован инфракрасными датчиками,позволяющими измерять двигательную активность передвижений и частоту испражнений. Боксы были связаны с компьютером с помощью электронного интерфейса (например, Imetronic, Pessac, Франция). Мышей тестировали в течение 32 ч, чтобы измерить привыкание к аппарату, а также ночную и дневную активность. Во время теста измеряли количество потребляемой воды, используя автоматизированный ликометр. Результаты исследования представлены на фиг. 1-9. Фиг. 1 показывает влияние соединения Ih3e на прибавление веса у мышей, получавших обычный рацион и высокожирную пищу. Прибавление веса измеряли на протяжении 16 недель. У мышей, потреблявших высокожирную пищу на фоне лечения соединением Ih3e, увеличение веса выявлено в меньшей степени, чем у мышей, получавших высокожирную пищу и леченных носителем. Фиг. 2 показывает, что соединение Ih3e улучшает метаболический профиль у мышей, получавших высокожирную пищу. Результаты анализов плазмы крови и сердечного ритма у мышей с индуцированной диетой ожирением на фоне лечения соединением Ih3e представлены на фиг. 2 и включают уровни глюкозы крови, ферменты печени (лактатдегидрогеназа ЛДГ, ACT и АЛТ) и липиды плазмы (общий холестерин, ЛВП-холестерин, ЛНП-холестерин и триглицериды). У мышей, получавших высокожирную пищу на фоне лечения соединением Ih3e, выявлено более низкое содержание в крови глюкозы, ферментов печени и липидов в плазме, чем у мышей, получавших высокожирную пищу на фоне введения носителя. Скорость сердечного ритма мышей, получавших высокожирную пищу и соединение Ih3e, также была ниже по сравнению с сердечным ритмом у мышей, получавших высокожирную пищу на фоне введения носителя. Фиг. 3 показывает, что соединение Ih3e улучшает толерантность к глюкозе у мышей, получавших высокожирную пищу. Уровни инсулина в плазме были повышенными через 10 недель у мышей с обычным рационом и у мышей, получавших высокожирную пищу, которых лечили соединением Ih3e, по сравнению с мышами, которым вводили носитель, как показано на фиг. 3 А. Выявлено, что через 12 недель уровни глюкозы были ниже у мышей, получавших высокожирную пищу и леченных соединением Ih3e, как показано на фиг. 3 В. Фиг. 4 показывает результаты перорального теста толерантности к глюкозе (ПТТГ) в виде содержания глюкозы на протяжении 200 мин у мышей с обычным рационом, которым вводили соединение Ih3e. Фиг. 5 (графики А-D) показывает высвобождение инсулина in vivo после тестового корма. Фиг. 5 А показывает уровень высвобождения инсулина в течение 30 мин. Фиг. 5 В показывает кратность увеличения высвобождения инсулина по сравнению с исходным уровнем инсулина. Примерно на 12 мин содержание инсулина достигало пикового повышения у мышей,получавших высокожирную пищу и леченных соединением Ih3e по сравнению с мышами, которым вводили носитель. Фиг. 5 С и 5D показывают кратность увеличения высвобождения инсулина по сравнению с исходными уровнями инсулина. Кратность увеличения у мышей, получавших высокожирную пищу и соединение Ih3e, была выше в точках времени 15 и 30 мин, как показано на фиг. 5D. Фиг. 6 (графики A-D) и 7 (графики А-С) показывают увеличение коэффициента дыхательного обмена (RER) у леченных соединением Ih3e мышей на фоне ВЖ диеты (высокожирной диеты), что можно объяснить связью с улучшенной у этих мышей чувствительностью к инсулину, который сохраняет способность к окислению глюкозы. Фиг. 8 (графики А и В) показывает двигательную активность и потребление корма/воды у леченых мышей, получавших высокожирный и обычный рацион по сравнению с введением носителя. Выявлено небольшое увеличение потребления корма/воды у мышей, получавших высокожирную пищу на фоне лечения соединением Ih3e,по сравнению с мышами, которым вводили носитель. Фиг. 9 (графики А-С) показывает изменения веса органов. Фиг. 9 В и 9 С показывают процент изменения массы тела, печени, почек, сердца, окружающей БЖТ, поверхностной БЖТ, подкожной БЖТ и КЖТ по сравнению с весом у мышей, получаших обычный рацион. Во всех органах мышей, получавших высокожирную пищу на фоне лечения соединением Ih3e,выявлено уменьшенное процентное изменение. Пример 10. Физико-химические свойства. Растворимость в воде. Твердые ЖК (в протонированной форме для соединения Ih3e) суспендировали в 5 мл 0,1 М HCl. После инкубации в течение 1 недели насыщенные растворы фильтровали на фильтре Millipore (0,22 мкпм) и измеряли концентрацию ЖК с помощью высокоэффективной жидкостной хроматографии ВЭЖХ-ESI-MS/MS с использованием колонки С 18 (внутр. диаметр 1502 мм, 4 мкмоль) и подвижные водные фазы, содержащие 15 мМ уксусной кислоты с уровнем рН 5 и ацетонитрил. Расход составлял 150 мкл/мин. Получение данных масс-спектрометрии осуществляли по схеме многократного контроля реакции с использованием отрицательного ионизированного источника ESI. Растворимость в воде выражали в мкмоль/л. Значение водной растворимости соединения Ih3e составляло 99 пМ, что превышало соответствующие значения для дигидрокси-ЖК и сопоставимо со значением для ХК (см. табл. 4). Таблица 4Ws: водная растворимость, относится к ЖК как к протонированному типу, поэтому не проводили оценку для ТХДХК (тауро-ХДХК), и ТУДХК (тауроурсоХДК), обладающих высокой расторимостью (в.р.).LogPA-: коэффициент распределения 1-октанол-вода исследуемых ионизированных видов желчных кислот.: значения из литературных данных. Присутствие в соединении Ih3e группы 23-метила не изменяет растворимость в воде. Обнаружено,что значение растворимости соединения Ih3e находится в диапазоне ЖК природного происхождения и ранее изученных синтетических аналогов. Дополнительно, учитывая относительно хорошее связывание соединения Ih3e с альбумином, можно облегчать циркуляцию в крови соединения Ih3e, таким образом способствуя системному нацеливанию TGR5 в периферические ткани, например в мышечную ткань и коричневую жировую ткань. Следующие примеры 9, 16 и 17 поддерживают эту гипотезу. Критическая мицеллярная концентрация (CMC). Детергентность, то есть тенденцию к образованию мицелл, оценивали для всех заряженных молекул, растворимых в воде, например натриевой соли (на 2 единицы pKa). Критическую мицеллярную концентрацию (CMC) определяли измерением поверхностного натяжения (ПН), используя способ максимального давления в пузырьке, который дает значение поверхностного натяжения при незначительном влиянии потенциальных примесей, подобно статической методике. Использовали тензиометр Sensadyne 6000 (Chem-Dyne Research Corp., Milwaukee, WI), снабженный двумя стеклянными зондами диаметром 0,5 и 4,0 мм, связанными с источником азота. Частота пузырьков составляла 1 пузырек/1 с в дистиллированной воде при 26 С (Р=2,7 атм), калибровку проводили с бидистиллированной водой и метанолом. Поверхностное натяжение растворов натриевых солей ЖК в 0,15 М NaCl измеряли в разных концентрациях в диапазоне от 0,13 до 50 мМ. Значения поверхностного натяжения откладывали от логарифма концентрации желчной соли; линии регрессии, соответствующие двум частям кривой (мономерная и мицеллярная фазы), вычисляли по методике наименьших квадратов, и пересечение линий принимали как значение CMC. По кривым ПН в зависимости от концентрации также вычисляли значение поверхностного натяжения в CMC (при равновесии мономерных и полимерных типов), что давало информацию о силе детергентности, которая связана с размером мицелл вместе со способностью уменьшения поверхностного натяжения. Оценку CMC проводили путем измерения поверхностного натяжения в неравновесных условиях, то есть в условиях, когда примеси незначительно влияют на результаты поверхностного натяжения (фиг. 10). Соединение Ih3e показывает низкое значение CMC, при этом умеренную детергентность и способность к уменьшению поверхностного натяжения, о чем свидетельствуют показатели поверхностного натяжения в CMC (низкая детергентность означает низкую токсичность для мембраны или клеток). Коэффициент распределения октанол/вода. Поскольку сульфат и сульфированные аналоги всегда являются ионизированными при всех значениях рН, коэффициент распределения октанол/вода измеряли для всех молекул в ионизированной форме,поэтому карбоксильные аналоги исследовали при высоком уровне рН. Коэффициент распределения 1 октанол/вода (log P) оценивали путем общепринятой методики встряхиваемой колбы. Эксперименты выполняли с 0,1 мМ раствором желчной соли, забуференном 0,1 М фосфатным буфером с уровнем рН 8,для гарантии полной ионизации ЖК; значения log P относятся к ЖК в ионизированной форме, а не к протонированным типам, и начальная концентрация каждой ЖК была ниже ее собственного значенияCMC. Водный буфер заранее предварительно насыщался 1-октанолом, затем добавляли 5 мл 1-октанола,предварительно насыщенного водой, и образцы оставляли для уравновешивания в течение 2 недель при непрерывном встряхивании при комнатной температуре. После центрифугирования тщательно отделяли эти две фазы. Концентрацию ЖК в водной фазе измеряли с помощью ВЭЖХ-ESI-MS/MS с колонкой С 18(внутр. диаметр 1502 мм, 4 мкмоль) и с водой в качестве подвижной фазы, содержащей 15 мМ уксусной кислоты с рН 5 и ацетонитрил. Расход составлял 150 мкл/мин, температуру колонки поддерживали при 45 С. Получение данных масс-спектрометрии осуществляли по схеме многократного контроля реакции с использованием отрицательного ионизированного источника ESI. Карбоксилированное соединение Ih3e с тремя гидроксильными группами в 3,7- и 12- положениях показывает слегка более высокую липофильность 1,4 против 1,1 по сравнению с аналогом ХК природного происхождения, что обусловлено присутствием этила в 6-положении и метила в 23-положении. Связывание альбумина. Степень связывания альбумина оценивали равновесным диализом при фиксированном соотношении альбумин/ЖК. Растворяли ЖК в концентрации 100 мкмоль в 5% растворе бычьего сывороточного альбумина-соляного раствора (уровень рН 7,2) и оставляли для отстаивания в течение 24 ч при 25 С. Два миллилитра указанного раствора подвергали диализу в целлюлозных мешочках с молекулярно-массовым задержанием 12-14000 по сравнению с 25 мл соляного раствора. Систему уравновешивали мягким механическим встряхиванием в течение 72 ч при 25 С. Концентрации ЖК в диализном растворе (соответствующие свободной несвязанной фракции) и в исходном растворе определяли с помощью ВЭЖХ-ESIMS/MS при тех же условиях, как в предшествующем анализе. Процент связывания альбумина рассчитывали от начальной концентрации ЖК и от несвязанной концентрации в диализной фракции. Данные приведены в табл. 4. Процент связывания альбумина у соединения Ih3e немного превышал процент у ХК, что обусловлено присутствием групп 23-метила и 6-этила. Пример 11. Метаболическая устойчивость in vitro в культуре человеческого кала. Устойчивость к кишечным бактериям. Пример 11 а. 7-Дегидроксилирование. Гомогенизированные образцы свежего человеческого кала (500 мг) переносили в стерильные флаконы, в которые добавляли 5 мл стерилизованной среды из мясного фарша и глюкозы (Scott Lab., Fiskville, RI). Затем добавляли ЖК в конечной концентрации 0,05 мМ. Флаконы инкубировали при 37 С; затем после добавления ЖК в точки времени 0, 1, 2, 4, 8 и 24 ч реакцию останавливали посредством 150 мкл 30% KOH. Образцы центрифугировали при 3500 об/мин в течение 10 мин; выделение ЖК из супернатантов осуществляли С-18 твердофазной экстракцией, затем анализировали с помощью тонкослойной хроматографии ТСХ и ВЭЖХ-ES-MS/MS. Тонкослойная хроматография (ТСХ) с силикагелевыми пластинками толщиной 0,25 мм (Merck,Darmstat, Германия) служила первым скрининговым тестом. Растворяющая система, используемая для разделения конъюгированных ЖК, состояла из пропионовой кислоты/изоамилацетата/воды/N-пропанола(3:4: 1:2, об./об./об./об./; растворитель I) и растворяющая система для разделения неконъюгированных ЖК представляла собой уксусную кислоту/четырххлористый углерод/изопропиловый эфир/изоамилацетат/воду/N-пропанол/бензол (1:4:6:8:2:2, об./об./об./об./об./об.; растворитель II). Разделенные ЖК обнаруживали с помощью 5% этанолового раствора фосфомолибденовой кислоты. Соединение Ih3e обладало высокой устойчивостью при инкубации в культуре человеческого кала, и даже через 24 ч более 85% соединения восстанавливались немодифицированными. Напротив, рассматриваемый естественный аналог ХДХК показывал период полувыведения около 1 ч, и через 8 ч инкубации он был почти полностью метаболизирован (7-дегидроксилирован) с образованием литохолевой кислоты. После продолжительной инкубации в соединении Ih3e фактически останавливалось 7 дегидроксилирование и образование промежуточного 7-оксо-производного. Пример 11b. Известно, что кишечные бактерии гидролизуют С 24-амидную связь в тауриновых и глициновых конъюгатах ЖК и удаляют 7-гидроксильную группу ХК, что приводит к образованию токсичных липофильных вторичных ЖК, например деоксихолевой кислоты (ДХК) (Ridlon, J.M., et al., J. Lipid Res., 2006,47, 241-259). Для определения чувствительности соединения Ih3e к 7-дегидроксилированию, обусловленному кишечной флорой, изучали его метаболическую устойчивость в бульонной культуре человеческого кала, как описано авторами Roda, A., et al., J. Lipid Res., 1994, 35, 2268-2279. Обнаружено, что соединение Ih3e невосприимчиво к указанному процессу и проявляет высокую устойчивость, то есть через 12 ч инкубации более 95% соединения остается немодифицированным. Для сравнения, более 50% ХК(холевой кислоты) подвергалось метаболизму через 1 ч и в пределах 8 ч до 90% ХК (фиг. 15). Вероятно,что повышенная устойчивость соединения Ih3e связана с алкилированием в С 6-положении, что обеспечивает стерическое препятствие для осуществления бактериального 7-дегидроксилирования. Стабильность боковой цепи. Исходя из приведенных результатов, боковая цепь соединения Ih3e не подвергалась модификации посредством ферментативной активности кишечных бактерий. По этим данным предполагается, что присутствие группы этила в С-6 положении является стерическим препятствием и защищает 7-гидроксильную группу от окисления или удаления. Дополнительно,соединение Ih3e также является очень стабильным в отношении метаболизма боковой цепи. Не было обнаружено каких-либо минорных метаболитов с помощью ВЭЖХ-ES-MS/MS. Исходя из этих данных предполагается, что указанные аналоги устойчивы в содержимом нижних отделов кишечника в присутствии анаэробных бактерий. Пример 12. Секреция желчи и метаболизм соединения Ih3e у крыс с желчной фистулой после дуоденального (и/д) и феморального (в/в) введения. Пример 12 А. Цели и обоснование. Структурные модификации желчных кислот могут влиять на их захват в печени, печеночный транспорт, секрецию и абсорбцию в кишечнике. Поэтому представление о секреции желчи для соединений и после в/в и после и/д введения, а также об их метаболизме, является ключевым пунктом для отбора соединений в дополнительные исследования. Для оценки способа и эффективности кишечной абсорбции соединения Ih3e указанное соединение вводили двумя путями: внутривенным (феморальное вливание) и оральном (дуоденальное вливание) в одинаковых дозах и оценивали уровень секреции желчи на модели крысы с желчной фистулой. Отличия в области под кривой секреции желчи в зависимости от времени и от способов введения в/в и и/д обусловливают абсорбцию указанного соединения в кишечнике и дают информацию о его био- 28020140 доступности. Кроме того, печеночный и кишечный метаболизм может иметь значительные различия,поэтому определяли секрецию желчи для соединения Ih3e и его основных печеночных метаболитов. Желчегонный эффект. Дуоденальное вливание. Крысиная модель с желчной фистулой была разработана Болонским университетом в лабораторииLab facilities. Соединение Ih3e вводили группе крыс путем дуоденального вливания (и/д) в дозе 1 мкмоль/кг/мин (вливание в течение 1 ч). Крысам создавали желчную фистулу для сбора образцов желчи в разное время перед вливанием, во время и после вливания. В эксперименте дуоденального вливания было 6 крыс (25010 г). Образцы желчи собирали каждые 15 мин в течение 4 ч. Дополнительно, 3 контрольным крысам вводили соляной раствор при тех же условиях в отношении времени и сбора образцов(контрольные крысы с дуоденальным вливанием). Дуоденальное вливание соединения Ih3e значительно увеличивало скорость желчеотделения, которое достигало максимального значения для ХК 120 мкл/мин/кг. Это явление начиналось во время вливания и продолжалось в течение по меньшей мере 3 ч. Соединение Ih3e показывает мощный желчегонный эффект, который, как предполагают, связан с его структурой; метильная группа в положении С-23 частично предотвращает конъюгацию, и эта молекула может проходить холегепатический шунтовый путь. Для сравнения, дуоденальное вливание ХДХК незначительно увеличивает желчеотделение, которое не превышало 80 мкл/мин/кг. Внутривенное вливание. В эксперименте феморального вливания было 6 крыс. Фиг. 12 показывает желчеотделение во время исследования. Феморальное вливание начинали через 75 мин после стабилизации состояния и продолжали в течение 60 мин. Образцы желчи собирали каждые 15 мин в течение 4 ч. Дополнительно, 3 крысам вводили 3% соляной раствор БСА при тех же условиях в отношении времени и сбора образцов (контрольные крысы с феморальным вливанием). В течение всего периода эксперимента во время в/в вливания 3% солевого носителя БСА (контроль, n=1) показатели желчеотделения поддерживались в диапазоне от 40 до 80 мкл/мин/кг. Вливание в/в соединения Ih3e значительно увеличивало скорость желчеотделения, и это явление начиналось через 15 мин от начала вливания и продолжалось в течение по меньшей мере 2 ч. Желчегонный эффект был очень сходным с эффектом, достигнутым в эксперименте и/д вливания. Секреция желчи. Анализировали образцы желчи, собранные в ходе в/в и и/д экспериментов для определения секреции желчи при использовании соединения Ih3e и его метаболитов. Анализ ВЭЖХ-ES-MS/MS. Чистый кристаллический порошок соединения Ih3e был получен из лаборатории R. Pellicciari laboratory of Perugia. Приготовляли стоковые растворы в метаноле 1 ммоль/л и рабочие растворы путем разведения соответствующих объемов первичного раствора. Метанол и ацетонитрил имели чистоту ВЭЖХсорта. Концентрация аммиака составляла 30%, концентрация уксусной кислоты была 99,8 %. Все реактивы были получены из фирмы Carlo Erba Reagents. Вода ВЭЖХ-сорта поставлялась Milli-Q system. Получение образцов. Образцы крысиной желчи доводили до комнатной температуры, недолго перемешивали и разводили 15 мМ буфером ацетата аммония (уровень рН 5,0):ацетонитрил=70:30 (об./об.) в соотношении 1:100 об./об. (дуоденальные или инфузионные образцы желчи) и 1:100 или 1:200 об./об. (образцы желчи при феморальном вливании). Конечный раствор переносили в пробирку для автосэмплера и вносили 10 мкл в хроматографическую колонку. Методика ВЭЖХ-ESI-MS/MS. Образцы крысиной желчи анализировали тандемной жидкостной хроматографией с массспектрометрией (ВЭЖХ-MS/MS) с использованием источника электроспрея (ESI) с отрицательной ионизацией. Для жидкостной хроматографии использовали модуль разделения Waters Alliance 2695, соединенный с автосэмплером. Автосэмплер находился при 7 С. Разделение осуществляли на колонке C18SecurityGuard ODS, оба прибора от компании Phenomenex. Анализируемое вещество элюировали с использованием 15 мМ буфера ацетата аммония (уровень рН 5,00) в качестве подвижной фазы А и ацетонитрилом в качестве подвижной фазы В. Подвижную фазу В увеличивали от 30 до 64% за 10 мин, затем до 100% за 10 мин и поддерживали постоянной в течение 10 мин. Расход составлял 150 мкл/мин, температуру в колонке поддерживали 45 С. Колоночный эффлюент вводили в источник ESI, связанный с тройным квадрупольным масс-спектрометром (Quattro-LC, Micromass), работающим в режиме получения данных Multiple Reaction Monitoring (MRM). В качестве газа распылителя применяли азот со скоростью потока 100 л/ч, скорость потока азота в качестве газа десольватации составляла 930 л/ч. Показатели температур блока источника ионов и десольватации устанавливали соответственно в 80 и 180 С. Капиллярное напряжение составляло 3,0 кВ. Для сбора и обработки
МПК / Метки
МПК: A61K 31/575, C07J 9/00, A61P 1/16, C07J 31/00, C07J 41/00
Метки: применения, модуляторы, способы
Код ссылки
<a href="https://eas.patents.su/30-20140-modulyatory-tgr5-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Модуляторы tgr5 и способы их применения</a>