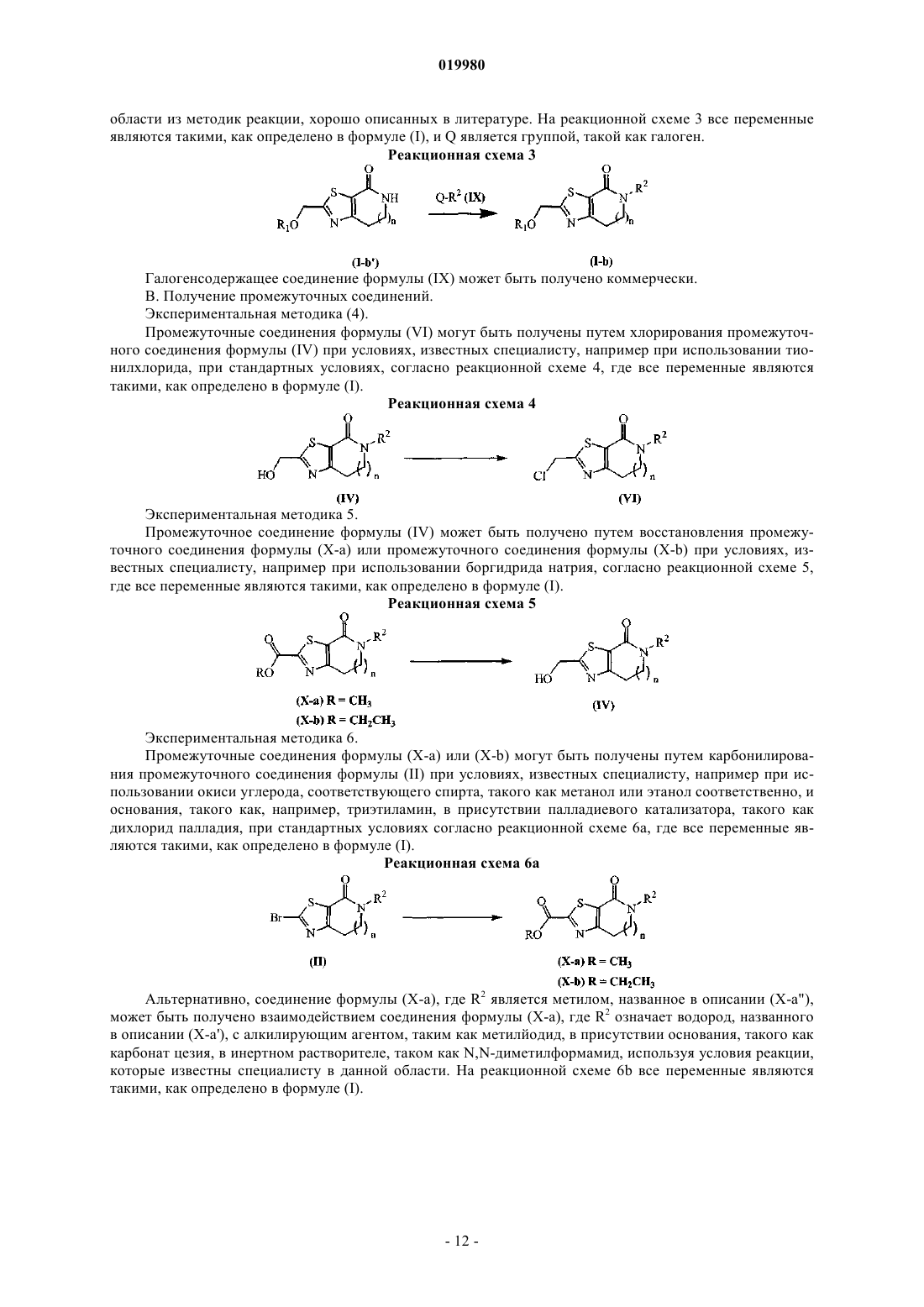
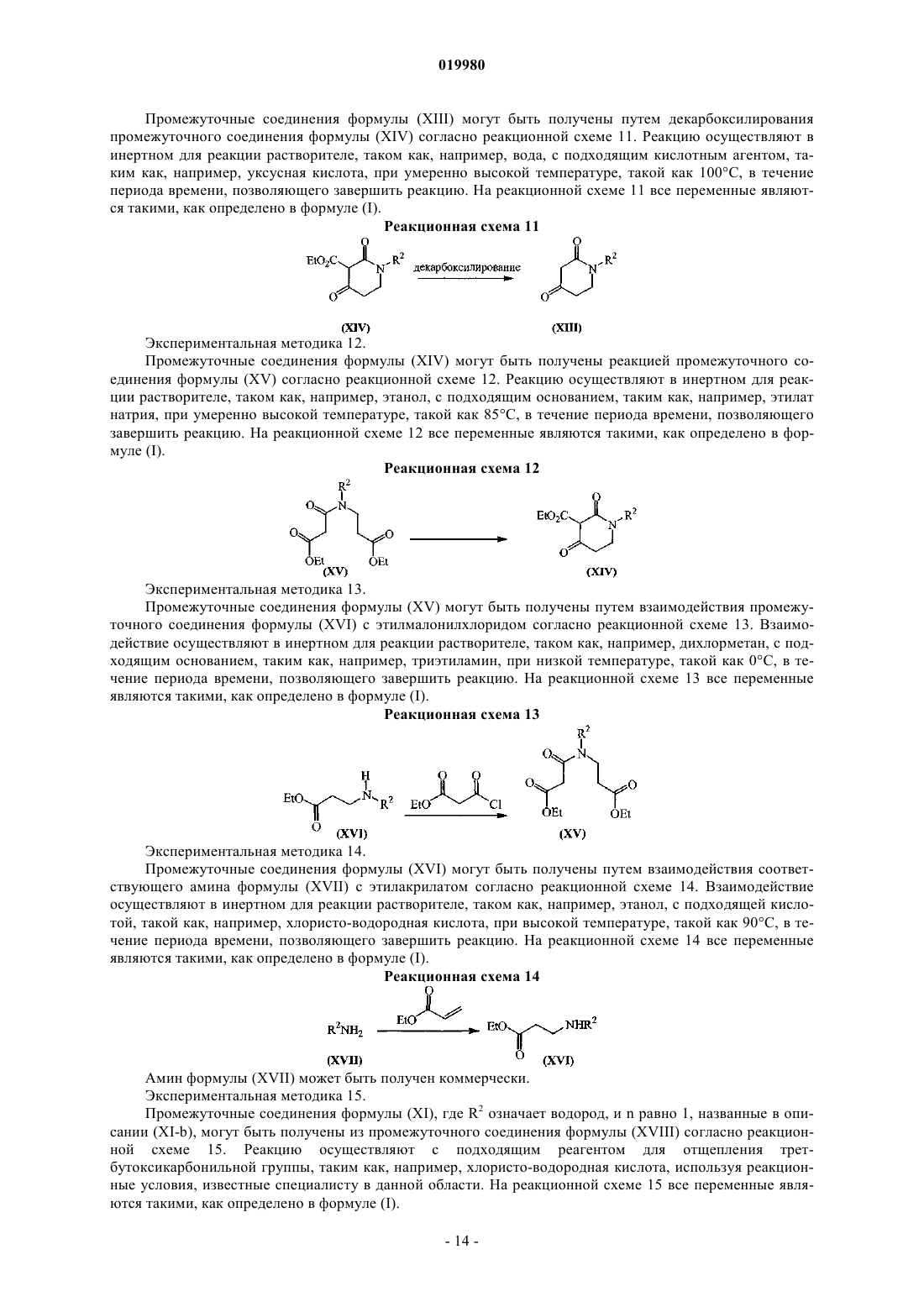
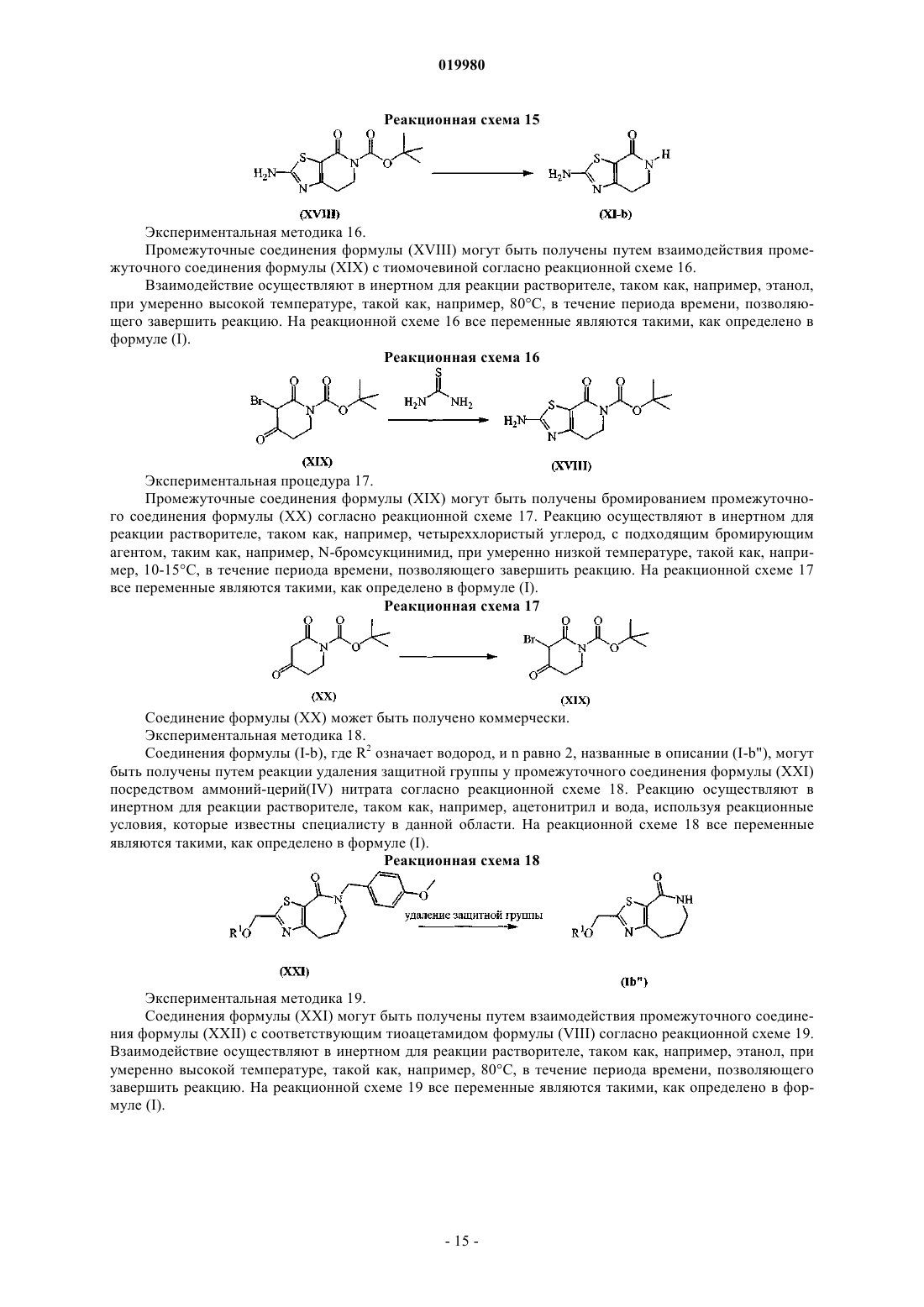
Бициклические тиазолы в качестве аллостерических модуляторов рецепторов mglur5
Номер патента: 19980
Опубликовано: 30.07.2014
Авторы: Бартоломе-Небреда Хосе Мануэль, Трабанко-Суарес Андрес Авелино, Конде-Сейде Сусана, Пастор-Фернандес Хоакин, Тресадерн Гэри Джон, Макдональд Грегор Джеймс
Формула / Реферат
1. Соединение формулы (I)
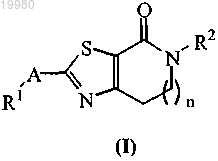
или его стереоизомерная форма,
где n равно 1 или 2;
А выбирают из группы, состоящей из -CH2O- и -O-CH2-;
R1 выбирают из группы, состоящей из фенила и фенила, замещенного 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из С1-6алкила, трифторметила, циано и галогена; и
R2 выбирают из группы, состоящей из водорода; С1-8алкила; (С1-6алкилокси)С1-3алкила; С3-8циклоалкила; (С3-8циклоалкил)С1-3алкила; фенила; фенила, замещенного 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из С1-6алкила, С1-3алкилокси, галогена и С1-3алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; (фенил)С1-3алкила; (фенил)С1-3алкила, где фенильная часть замещена 1, 2 или 3 независимо выбранными галогенными заместителями; пиридинила; пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из С1-6алкила, С1-3алкилокси, галогена и С1-3алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; и (тетрагидро-2Н-пиранил)метила,
или его фармацевтически приемлемая соль и сольват.
2. Соединение формулы (I) по п.1, где
n равно 1 или 2;
А выбирают из группы, состоящей из -CH2O- и -O-CH2-;
R1 выбирают из группы, состоящей из фенила; фенила, замещенного 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из С1-3алкила и фтора; и 3-цианофенила; и
R2 выбирают из группы, состоящей из водорода; С1-6алкила; (С1-6алкилокси)С1-3алкила; С3-8циклоалкила; (С3-8циклоалкил)С1-3алкила; фенила; фенила, замещенного 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из С1-3алкила, С1-3алкилокси, галогена и С1-3алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; (фенил)С1-3алкила; (фенил)С1-3алкила, где фенильная часть замещена 1, 2 или 3 независимо выбранными галогенными заместителями; пиридинила; пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из С1-3алкила, С1-3алкилокси, галогена и С1-3алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; и (тетрагидро-2Н-пиранил)метила,
или его фармацевтически приемлемая соль или сольват.
3. Соединение по п.1 или 2, где
n равно 1 или 2;
A означает -CH2O-;
R1 выбирают из группы, состоящей из фенила и фенила, замещенного 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из С1-3алкила и фтора; и 3-цианофенила; и
R2 выбирают из группы, состоящей из водорода; метила; этила; 1,2,2-триметилпропила; (С1-6алкилокси)С1-3алкила; С3-8циклоалкила; (С3-8циклоалкил)С1-3алкила; фенила; фенила, замещенного 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из С1-3алкила, С1-3алкилокси, галогена и С1-3алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; (фенил)С1-3алкила; (фенил)С1-3алкила, где фенильная часть замещена 1, 2 или 3 независимо выбранными галогенными заместителями; пиридинила; пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из С1-3алкила, С1-3алкилокси, галогена и С1-3алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; и (тетрагидро-2Н-пиранил)метила,
или его фармацевтически приемлемая соль или сольват.
4. Соединение по п.1 или 2, где
n равно 1 или 2;
A означает -CH2O-;
R1 выбирают из группы, состоящей из фенила и фенила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из С1-3алкила и фтора; и
R2 выбирают из группы, состоящей из водорода; метила; этила; 1,2,2-триметилпропила; (С1-6алкилокси)С1-3алкила; (С3-8циклоалкил)С1-3алкила; фенила; фенила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3алкила, С1-3алкилокси, галогена и C1-3алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; (фенил)C1-3алкила; (фенил)C1-3алкила, где фенильная часть замещена 1 или 2 независимо выбранными галогенными заместителями; пиридинила; пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3алкила, C1-3алкилокси, галогена и C1-3алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; и (тетрагидро-2Н-пиранил)метила,
или его фармацевтически приемлемая соль или сольват.
5. Соединение по п.1 или 2, где
n равно 1 или 2;
A означает -O-CH2-;
R1 выбирают из группы, состоящей из фенила; фенила, замещенного 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3алкила и фтора; и 3-цианофенила; и
R2 выбирают из группы, состоящей из C1-3алкила, (C1-6алкилокси)C1-3алкила; С3-8циклоалкила; (С3-8циклоалкил)C1-3алкила; фенила; фенила, замещенного 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3алкила, C1-3алкилокси, галогена и C1-3алкила, замещенного 1, 2 или 3 фторидными заместителями; (фенил)C1-3алкила; (фенил)C1-3алкила, где фенильная часть замещена 1, 2 или 3 независимо выбранными галогенными заместителями; пиридинила; пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3алкила, C1-3алкилокси, галогена и C1-3алкила, замещенного 1, 2 или 3 фторидными заместителями; и (тетрагидро-2Н-пиранил)метила;
или его фармацевтически приемлемая соль или сольват.
6. Соединение по п.1, выбранное из группы, состоящей из
5-(4-фторфенил)-6,7-дигидро-2-(фенилметокси)тиазоло[5,4-с]пиридин-4(5Н)-она,
6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
6,7-дигидро-2-(феноксиметил)-5-[(тетрагидро-2Н-пиран-4-ил)метил]тиазоло[5,4-с]пиридин-4(5Н)-она,
6,7-дигидро-5-(2-метоксиэтил)-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
6,7-дигидро-5-(5-метил-2-пиридинил)-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(4-фторфенокси)метил]-5-(4-фторфенил)-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(3-фторфенокси)метил]-6,7-дигидро-5-[(1R)-1,2,2-триметилпропил]тиазоло[5,4-с]пиридин-4(5Н)-она,
6,7-дигидро-5-метил-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
5-(4-фторфенил)-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
5,6,7,8-тетрагидро-2-(феноксиметил)-4Н-тиазоло[5,4-с]азепин-4-она,
5-(4-фторфенил)-5,6,7,8-тетрагидро-2-(феноксиметил)-4Н-тиазоло[5,4-с]азепин-4-она,
5-(2,4-дифторфенил)-6,7-дигидро-2-(фенилметокси)тиазоло[5,4-с]пиридин-4(5Н)-она,
5-[(2,4-дифторфенил)метил]-6,7-дигидро-2-(фенилметокси)тиазоло[5,4-с]пиридин-4(5Н)-она,
5-[(4-фторфенил)метил]-6,7-дигидро-2-(фенилметокси)тиазоло[5,4-с]пиридин-4(5Н)-она,
5-[(3-фторфенил)метил]-6,7-дигидро-2-(фенилметокси)тиазоло[5,4-с]пиридин-4(5Н)-она,
5-[(2-фторфенил)метил]-6,7-дигидро-2-(фенилметокси)тиазоло[5,4-с]пиридин-4(5Н)-она,
5-(2,4-дифторфенил)-2-[(3-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
5-(2,4-дифторфенил)-2-[(2-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
5-(4-фторфенил)-2-[(3-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
3-[[[5-(2,4-дифторфенил)-4,5,6,7-тетрагидро-4-оксотиазоло[5,4-с]пиридин-2-ил]окси]метил]бензонитрила,
5-(2,4-дифторфенил)-6,7-дигидро-2-[(3-метилфенил)метокси]тиазоло[5,4-с]пиридин-4(5Н)-она,
5-(4-фторфенил)-2-[(2-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
5-(2,4-дифторфенил)-2-[(2,4-дифторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
6,7-дигидро-5-метил-2-(фенилметокси)тиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(3-фторфенокси)метил]-5-(4-фторфенил)-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(3-фторфенил)метокси]-6,7-дигидро-5-[4-(трифторметил)фенил]тиазоло[5,4-с]пиридин-4(5Н)-она,
5-(3-фторфенил)-2-[(3-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
5-(2,4-дифторфенил)-2-[(3-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
5-(2,4-дифторфенил)-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(3-фторфенил)метокси]-6,7-дигидро-5-[3-(трифторметил)фенил]тиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(2-фторфенокси)метил]-5-(4-фторфенил)-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
5-(2,4-дифторфенил)-2-[(4-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(2-фторфенокси)метил]-6,7-дигидро-5-[(1R)-1,2,2-триметилпропил]тиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(4-фторфенокси)метил]-6,7-дигидро-5-[(1R)-1,2,2-триметилпропил]тиазоло[5,4-с]пиридин-4(5Н)-она,
6,7-дигидро-2-(феноксиметил)-5-[(1R)-1,2,2-триметилпропил]тиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(2-фторфенокси)метил]-6,7-дигидро-5-(2-метоксифенил)тиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(3-фторфенокси)метил]-6,7-дигидро-5-(2-метоксифенил)тиазоло[5,4-с]пиридин-4(5Н)-она,
5,6,7,8-тетрагидро-5-метил-2-(феноксиметил)-4Н-тиазоло[5,4-с]азепин-4-она,
5-(циклопропилметил)-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
5-циклопропил-2-[(3-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
5-(циклопропилметил)-2-[(3-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
5-(циклопропилметил)-2-[(2-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
5-(циклопропилметил)-2-[(4-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
5-циклопропил-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
6,7-дигидро-2-(феноксиметил)-5-(2-пиридинил)тиазоло[5,4-с]пиридин-4(5Н)-она,
6,7-дигидро-5-(6-метил-2-пиридинил)-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
5-(5-фтор-2-пиридинил)-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
6,7-дигидро-2-(феноксиметил)-5-(3-пиридинил)тиазоло[5,4-с]пиридин-4(5Н)-она,
6,7-дигидро-2-(феноксиметил)-5-(4-пиридинил)тиазоло[5,4-с]пиридин-4(5Н)-она,
5-(3-фтор-2-пиридинил)-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
6,7-дигидро-5-(4-метил-2-пиридинил)-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
6,7-дигидро-5-(3-метил-2-пиридинил)-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(4-фторфенокси)метил]-5-(5-фтор-2-пиридинил)-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(3-фторфенокси)метил]-5-(5-фтор-2-пиридинил)-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(2-фторфенокси)метил]-5-(5-фтор-2-пиридинил)-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
5-этил-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
5-(5-фтор-3-пиридинил)-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
5-(3-фтор-4-пиридинил)-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
5-(2,4-дифторфенил)-2-[(2-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(4-хлорфенокси)метил]-5-(4-фторфенил)-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
5-циклопропил-2-[(2-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
5-циклопропил-2-[(4-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
6,7-дигидро-5-(1-метилэтил)-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(3-фторфенокси)метил]-6,7-дигидро-5-(1-метилэтил)тиазоло[5,4-с]пиридин-4(5Н)-она,
6,7-дигидро-2-(фенилметокси)тиазоло[5,4-с]пиридин-4(5Н)-она,
2-фтор-5-[[(4,5,6,7-тетрагидро-4-оксотиазоло[5,4-с]пиридин-2-ил)окси]метил]бензонитрила,
6,7-дигидро-2-[(2-метилфенил)метокси]тиазоло[5,4-с]пиридин-4(5Н)-она,
6,7-дигидро-2-[(3-метилфенил)метокси]тиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(2-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(2-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она трифторацетата,
2-[(3-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(3-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она трифторацетата,
2-[(4-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
2-[(4-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она трифторацетата,
6,7-дигидро-2-[(4-метилфенил)метокси]тиазоло[5,4-с]пиридин-4(5Н)-она,
5-(2,4-дифторфенил)-2-[(3,5-дифторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
5-(2,4-дифторфенил)-2-[(3,4-дифторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5Н)-она,
4-[[[5-(2,4-дифторфенил)-4,5,6,7-тетрагидро-4-оксотиазоло[5,4-с]пиридин-2-ил]окси]метил]бензонитрила,
2-[[[5-(2,4-дифторфенил)-4,5,6,7-тетрагидро-4-оксотиазоло[5,4-с]пиридин-2-ил]окси]метил]бензонитрила,
2-[(3-фторфенил)метокси]-6,7-дигидро-5-[(1R)-1,2,2-триметилпропил]тиазоло[5,4-с]пиридин-4(5Н)-она,
5-(2,4-дифторфенил)-6,7-дигидро-2-[[4-(трифторметил)фенил]метокси]тиазоло[5,4-с]пиридин-4(5Н)-она,
5-(2,4-дифторфенил)-6,7-дигидро-2-[(2-метоксифенил)метокси]тиазоло[5,4-с]пиридин-4(5Н)-она,
5-(2,4-дифторфенил)-6,7-дигидро-2-[(3-метоксифенил)метокси]тиазоло[5,4-с]пиридин-4(5Н)-она и
5-(2,4-дифторфенил)-6,7-дигидро-2-[[2-(трифторметил)фенил]метокси]тиазоло[5,4-с]пиридин-4(5Н)-она
и его стереоизомерные формы, фармацевтически приемлемые соли и сольваты.
7. Применение соединения, определенного в любом из пп.1-6, в качестве лекарственного средства для предотвращения, лечения или профилактики неврологических или психических расстройств.
8. Применение соединения, определенного в любом из пп.1-6, для предотвращения, лечения или профилактики неврологических или психических расстройств.
9. Применение по п.8, где неврологические или психические расстройства выбирают из шизофрении, шизофреноформного расстройства, шизоаффективного расстройства, бредового расстройства, кратковременного психотического расстройства, индуцированного психотического расстройства, психотического расстройства, обусловленного общим состоянием здоровья, индуцированного веществом психотического расстройства, неуточненного психотического расстройства; психоза, ассоциированного с деменцией, большого депрессивного расстройства, дистимического расстройства, дисфорического расстройства поздней лютеиновой фазы, неуточненного депрессивного расстройства, биполярного расстройства I типа, биполярного расстройства II типа, циклотимического расстройства, неуточненного биполярного расстройства, расстройства настроения, обусловленного общим состоянием здоровья, индуцированного веществом расстройства настроения, неуточненного расстройства настроения, генерализованного тревожного расстройства, обсессивно-компульсивного расстройства, панического синдрома, острого стрессового расстройства, посттравматического стрессового расстройства, умственной отсталости, первазивного расстройства развития, расстройства дефицита внимания, расстройства дефицита внимания с гиперактивностью, расстройства социального поведения, параноидного расстройства личности, шизоидного расстройства личности, шизотипического расстройства личности, тикового расстройства, синдрома Тауретта, аддиктивного расстройства, химической зависимости, синдрома отмены вещества, трихотилломании и состояний, при которых когнитивная деятельность ухудшается, болезни Альцгеймера, болезни Паркинсона, болезни диффузных телец Леви, деменции вследствие ВИЧ-заболевания, деменции вследствие болезни Крейцфельдта-Якоба, амнестического синдрома, умеренных когнитивных нарушений, связанного с возрастом снижения когнитивных способностей, расстройств питания.
10. Применение по п.9, где расстройство питания представляет собой анорексию, булимию или ожирение.
11. Фармацевтическая композиция для предотвращения, лечения или профилактики неврологических или психических расстройств, содержащая терапевтически эффективное количество соединения, как определено в любом из пп.1-6, и фармацевтически приемлемый носитель.
12. Способ получения фармацевтической композиции, как определено в п.11, отличающийся тем, что фармацевтически приемлемый носитель равномерно смешивают с терапевтически эффективным количеством соединения, как определено в любом одном из пп.1-6.
Текст
БИЦИКЛИЧЕСКИЕ ТИАЗОЛЫ В КАЧЕСТВЕ АЛЛОСТЕРИЧЕСКИХ МОДУЛЯТОРОВ РЕЦЕПТОРОВ mGluR5 Изобретение относится к новым бициклическим тиазолам формулы (I), которые являются позитивными аллостерическими модуляторами метаботропного глутаматного рецептора подтипа 5 ("mGluR5") и которые являются пригодными в лечении или предотвращении расстройств,ассоциированных с дисфункцией глутамата, и заболеваний, в патогенезе которых подтип mGluR5 рецепторов принимает участие. Изобретение также направлено на фармацевтические композиции,содержащие такие соединения, на способы получения таких соединений и композиций и на использование таких соединений и композиций с целью лечения расстройств, в патогенезе которых участвует mGluR5. Макдональд Грегор Джеймс (BE),Трабанко-Суарес Андрес Авелино,Конде-Сейде Сусана, Тресадерн Гэри Джон, Бартоломе-Небреда Хосе Мануэль, Пастор-Фернандес Хоакин(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) Область техники, к которой относится изобретение Настоящее изобретение относится к новым бициклическим тиазолам, которые являются позитивными аллостерическими модуляторами метаботропного глутаматного рецептора подтипа 5 ("mGluR5") и которые являются пригодными для лечения или предотвращения нарушений, ассоциированных с дисфункцией глутамата, и заболеваний, в патогенезе которых участвуют рецепторы подтипа mGluR5. Изобретение также направлено на фармацевтические композиции, содержащие такие соединения, на способы получения таких соединений и композиций и на использование таких соединений и композиций для предотвращения и лечения нарушений, в патогенезе которых участвуют рецепторы mGluR5. Уровень техники Глутамат является одним из главных аминокислотных нейротрансмиттеров в центральной нервной системе млекопитающих. Глутамат играет главную роль в многочисленных физиологических функциях,таких как обучение и память, а также чувственное восприятие, развитие синаптической пластичности,регуляция движения, дыхание и регуляция сердечно-сосудистой функции. Кроме того, глутамат является центральным звеном в некоторых различных неврологических и психических заболеваниях, отличающихся дисбалансом глутаматергической нейротрансмиссии. Глутамат опосредует синаптическую нейротрансмиссию через активацию каналов ионотропных глутаматных рецепторов (mGluR) и NMDA, АМРА и каинатных рецепторов, которые обусловливают быструю передачу возбуждения (Kew and Kemp Psychopharmacol. (2005), 179:4-29). Кроме того, глутамат активирует метаботропные глутаматные рецепторы (mGluR), которые скорее играют роль модуляторов, чем вносят вклад в точное регулирование эффективности синапсов. Глутамат активирует mGluR посредством связывания с большим внеклеточным аминоконцевым доменом рецептора, названным в описании ортостерическим связывающим центром. Указанное связывание вызывает конформационное изменение в молекуле рецептора, которое приводит к активацииG-белка и внутриклеточных путей передачи сигнала. Рецепторы mGluR и NMDA совместно экспрессируются в гиппокампе, коре головного мозга и полосатом теле.mGluR усиливает функцию рецептора NMDA посредством PKC- и Src-зависимого механизма. Блокада рецепторов mGluR или NMDA ослабляет когнитивную функцию, в то время как активация рецепторов mGluR или NMDA приводит к норме нарушенное амфетамином преимпульсное торможение (PPI). Стимуляция рецепторов mGluR5, как предполагают, нормализует гипофункцию рецептора NMDA при шизофрении. Позитивный аллостерический модулятор (РАМ) mGluR5 может оказывать благотворные воздействия на познание, положительные и отрицательные симптомы шизофрении и когнитивные расстройства при различных формах деменции и умеренные когнитивные нарушения. К настоящему времени большинство доступных фармакологических средств, таргетирующихmGluR5, представлены отростерическими лигандами, которые дают перекрестную реакцию с некоторыми членами семейства, поскольку они являются структурными аналогами глутамата и имеют ограниченную биодоступность (Schoepp D.D. et al. Neuropharmacology (1999), 38(10), 1431-1476). Новый подход к развитию селективных соединений, оказывающих воздействие на mGluR, заключается в идентификации молекул, действующих посредством аллостерических механизмов, опосредующих рецептор путем связывания с участком, отличным от высококонсервативного глутаматсвязывающего участка. Позитивные аллостерические модуляторы mGluR появились недавно как новые фармакологические объекты, обеспечивающие это интересное вариантное решение. Такой тип молекулы был описан для некоторых подтипов mGluR (рассмотренных в Mutel (2002), Expert Opin. Ther. Patents, 12:1-8). Международные публикации WO 2005/082856, WO 2007/023242 и WO 2007/023290 (Merz) описывают тетрагидрохинолиноны в качестве модуляторов группы I mGluR. Международная публикацияWO 2008/151184 (Vanderbilt University) описывает бензамиды в качестве позитивных аллостерических модуляторов mGluR5. Конденсированные тиазоловые соединения также известны из других международных публикаций WO 2008/060597 (Vertex), WO 2008/076562 (Lilly), WO 2008/001076 (UCB),WO 2008/066174 (Lilly) и WO 2006/066174 (Eli Lilly). Патент США 2010/0081690 (Addex Pharma, S.A.),опубликованный 1 апреля 2010 г., раскрывает оксазоловые производные в качестве позитивных аллостерических модуляторов mGluR5. Международная публикация WO 2008/012010 (UCB Pharma, S.A.), опубликованная 31 января 2008 г., раскрывает конденсированные оксазолы и тиазолы в качестве лигандов гистаминового Н 3-рецептора с группами у 2-положения тиазолового кольца, которые отличаются от представленных в описании соединений. Международная публикация WO 2010/114971 (Sepracor Inc.),опубликованная 7 октября 2010 г., раскрывает бициклические соединения и предоставляет данные, свидетельствующие об их активности как NAM (негативные аллостерические модуляторы) mGluR5; ни одно из соединений, раскрытых в данной публикации, не содержит заместитель у 2-положения тиазолового кольца, как представлено в настоящем описании, и ни одно из иллюстрированных соединений не содержит карбонильную группу в бициклическом ядре. Целью настоящего изобретения является предоставление новых соединений с улучшенным балансом свойств по сравнению с предыдущими соединениями, в частности с благоприятными свойствами,такими как проникновение в центральную нервную систему, улучшенная in vivo активность при более-1 019980 низкой дозе и/или улучшенные фармакокинетические свойства. Описание изобретения Настоящее изобретение относится к соединениям, проявляющим модуляторную активность по отношению к метаботропному глутаматному рецептору 5, указанным соединениям, имеющим формулу (I)R1 выбирают из группы, состоящей из фенила и фенила, замещенного 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-6 алкила, трифторметила, циано и галогена; иC3-8 циклоалкила; (C3-8 циклоалкил)C1-3 алкила; фенила; фенила, замещенного 1, 2 или 3 заместителями,каждый из которых независимо выбран из группы, состоящей из C1-6 алкила, C1-3 алкилокси, галогена иC1-3 алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями;(фенил)C1-3 алкила; (фенил)C1-3 алкила, где фенильная часть замещена 1, 2 или 3 независимо выбранными галогенными заместителями; пиридинила; пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-6 алкила, C1-3 алкилокси, галогена и C1-3 алкила,замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; и (тетрагидро-2 Нпиранил)метила,и к их фармацевтически приемлемым солям и сольватам. Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель или наполнитель. Кроме того, изобретение относится к соединению формулы (I) для его использования в качестве лекарственного средства и к соединению формулы (I) в качестве лекарственного средства с целью лечения или предотвращения неврологических или психических нарушений, в патогенезе которых рецепторmGluR5 принимает участие. Изобретение также относится к использованию соединения формулы (I) или фармацевтической композиции согласно изобретению для производства лекарственного средства с целью лечения или предотвращения неврологических или психических нарушений, в патогенезе которых рецептор mGluR5 принимает участие. Кроме того, изобретение также относится к использованию соединения формулы (I) в комбинации с дополнительным фармацевтическим средством для производства лекарственного средства с целью лечения или предотвращения неврологических или психических нарушений, в патогенезе которых рецепторmGluR5 принимает участие. Кроме того, изобретение относится к способу приготовления фармацевтической композиции согласно изобретению, отличающейся тем, что фармацевтически приемлемый носитель тщательно смешивают с терапевтически эффективным количеством соединения формулы (I). Изобретение также относится к продукту, содержащему соединение формулы (I) и дополнительное фармацевтическое средство, в качестве комбинированного препарата для одновременного, раздельного или последовательного использования в предотвращении, лечении или профилактике неврологических и психических нарушений и заболеваний. Химические названия соединений согласно настоящему изобретению были даны согласно правилам номенклатуры, принятым Подразделением Американского химического общества (CAS), используя новейшие химические разработки Advanced Chemical Development, Inc., программа (ACD/версия названия продукта 10.01; Build 15494, 1 Dec. 2006). В случае таутомерных форм было дано название изображаемой таутомерной формы структуры. Однако ясно, что другая не изображаемая таутомерная форма также включена в объем настоящего изобретения. Для большей точности А соответствует бивалентному линкеру формулы -CH2-O-, -O-CH2-, где определение следует читать слева направо, переходя от бициклического ядра молекулы к R1. Таким образом, когда A означает -CH2-O-, группа -CH2- связана с бициклом и группа -O- соединена с R1; когда A означает -O-CH2-, группа -O- связана с бициклом и группа -CH2- связана с R1. Краткое описание чертежей На фигуре графически представлены данные дозозависимых обратимых эффектов соединения 8 относительно амфетамин-индуцированной гиперлокомоции, описанной в фармакологических примерах, на которой (1)-(6) имеют следующие значения:(6) растворитель (рН 7) р.о./растворитель (рН 7) s.c. Растворителем для соединения 8 является 20% мас./об. 2-гидроксипропилциклодекстрин, и растворителем для амфетамина является стерилизованная вода. "Способность передвигаться" соответствует"прерыванию общих световых лучей/5-минутные интервалы". Подробное описание изобретения Определения. Термин "галоген" или "гало", употребляемый в описании сам по себе или как часть другой группы,относится к фтору, хлору, брому или йоду, причем фтор или хлор является предпочтительным и фтор является особенно предпочтительным. Термин "C1-3 алкил", "C1-6 алкил" или "C1-8 алкил", употребляемый в описании сам по себе или как часть другой группы, если не указано иное, относится к радикалу насыщенной прямой или разветвленной, необязательно замещенной углеводородной цепи, содержащей от 1 до 3, или от 1 до 6, или от 1 до 8 атомов углерода, если не указано иное, который соединен с остальной частью молекулы простой связью,который включает, но не ограничивается ими, метил, этил, 1-пропил, 1-бутил, 1-пентил, 1-метилэтил,1,1-диметилэтил, 2-метилпропил, 3-метилбутил, 1,2-диметилпропил, 1-гексил, 1,2,2-триметилпропил,1-этил-2,2-диметилпропил, 1,1,2,2-тетраметилпропил, 1-гептил и 1-октил. Термин "С 3-8 циклоалкил", употребляемый в описании сам по себе или как часть другой группы, если не указано иное, относится к циклопропилу, циклобутилу, циклопентилу, циклогексилу, циклогептилу и циклооктилу. Термин "C1-3 алкил, замещенный 1, 2 или 3 независимо выбранными галогенными заместителями",употребляемый в описании, относится к алкильной группе, как определено выше, замещенной 1, 2 или 3 атомами галогена в любом доступном положении, такой как, например, фторметил; дифторметил; трифторметил; 2,2,2-трифторэтил; 1,1-дифторэтил; 3,3,3-трифторпропил. Предпочтительными примерами указанных групп являются трифторметил; 2,2,2-трифторэтил и 1,1-дифторэтил, причем трифторметил является особенно предпочтительным. В отдельном варианте осуществления изобретения изобретение относится к соединениям формулыR1 выбирают из группы, состоящей из фенила; фенила, замещенного 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-6 алкила и фтора; и 3-цианофенила; иC3-8 циклоалкила; (C3-8 циклоалкил)C1-3 алкила; фенила; фенила, замещенного 1, 2 или 3 заместителями,каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, C1-3 алкилокси, галогена иC1-3 алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями;(фенил)C1-3 алкила; (фенил)C1-3 алкила, где фенильная часть замещена 1, 2 или 3 независимо выбранными галогенными заместителями; пиридинила; пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, C1-3 алкилокси, галогена и C1-3 алкила,замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; и (тетрагидро-2 Нпиранил)метила,и к их фармацевтически приемлемым солям и сольватам. В отдельном варианте осуществления изобретения изобретение относится к соединениям формулыR1 выбирают из группы, состоящей из фенила; фенила, замещенного 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила и фтора; и 3-цианофенила; иR2 выбирают из группы, состоящей из водорода; C1-6 алкила; (C1-6 алкилокси)C1-3 алкила; С 3-8 циклоалкила; (C3-8 циклоалкил)C1-3 алкила; фенила; фенила, замещенного 1, 2 или 3 заместителями,каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, C1-3 алкилокси, галогена иC1-3 алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями;(фенил)C1-3 алкила; (фенил)C1-3 алкила, где фенильная часть замещена 1, 2 или 3 независимо выбранными галогенными заместителями; пиридинила; пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, C1-3 алкилокси, галогена и C1-3 алкила,замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; и (тетрагидро-2 Нпиранил)метила,и к их фармацевтически приемлемым солям и сольватам. В варианте осуществления изобретения R2 выбирают из группы, состоящей из C1-6 алкила;(C1-6 алкилокси)C1-3 алкила; (C3-8 циклоалкил)C1-3 алкила; фенила; фенила, замещенного 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, C1-3 алкилокси, галогена и C1-3 алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями;(фенил)C1-3 алкила; (фенил)C1-3 алкила, где фенильная часть замещена 1, 2 или 3 независимо выбранными галогенными заместителями; пиридинила; пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, C1-3 алкилокси, галогена и C1-3 алкила,замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; и (тетрагидро-2 Нпиранил)метила; и n, А и R1 являются такими, как ранее определено. В отдельном варианте осуществления изобретения изобретение относится к соединениям формулыR1 выбирают из группы, состоящей из фенила и фенила, замещенного 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила и фтора; и 3-цианофенила; и(C1-6 алкилокси)C1-3 алкила; C3-8 циклоалкила; (С 3-8 циклоалкил)C1-3 алкила; фенила; фенила, замещенного 1,2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила,C1-3 алкилокси, галогена и C1-3 алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; (фенил)C1-3 алкила; (фенил)C1-3 алкила, где фенильная часть замещена 1, 2 или 3 независимо выбранными галогенными заместителями; пиридинила; пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, C1-3 алкилокси, галогена и C1-3 алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; и (тетрагидро-2 Н-пиранил)метила,и к их фармацевтически приемлемым солям и сольватам. В варианте осуществления изобретения R2 выбирают из группы, состоящей из водорода; метила; этила; 1,2,2-триметилпропила; (C1-6 алкилокси)C1-3 алкила; (С 3-8 циклоалкил)C1-3 алкила; фенила; фенила,замещенного 1, 2 или 3 заместителями, каждый независимо выбирают из группы, состоящей изC1-3 алкила, C1-3 алкилокси, галогена и C1-3 алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; (фенил)C1-3 алкила; (фенил)C1-3 алкила, где фенильная часть замещена 1, 2 или 3 независимо выбранными галогенными заместителями; пиридинила; пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила,C1-3 алкилокси, галогена и C1-3 алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; и (тетрагидро-2 Н-пиранил)метила; и n, А и R1 являются такими, как определено ранее. В отдельном варианте осуществления изобретения изобретение относится к соединениям формулыR1 выбирают из группы, состоящей из фенила и фенила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила и фтора; и(C1-6 алкилокси)C1-3 алкила; (C3-8 циклоалкил)C1-3 алкила; фенила; фенила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, C1-3 алкилокси, галогена и C1-3 алкила, замещенного 1, 2 или 3 независимо выбранными галогенными заместителями; (фенил)C13 алкила; (фенил)C1-3 алкила, где фенильная часть замещена 1 или 2 независимо выбранными галогенными заместителями; пиридинила; пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, C1-3 алкилокси, галогена и C1-3 алкила, замещенного 1,2 или 3 независимо выбранными галогенными заместителями; и (тетрагидро-2 Н-пиранил)метила,и к их фармацевтически приемлемым солям и сольватам. В отдельном варианте осуществления изобретения изобретение относится к соединениям формулыR1 выбирают из группы, состоящей из фенила и фенила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила и фтора; и(C1-6 алкилокси)C1-3 алкила; (C3-8 циклоалкил)C1-3 алкила; фенила; фенила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, C1-3 алкилокси, фтора иC1-3 алкила, замещенного 1, 2 или 3 независимо выбранными фторидными заместителями;(фенил)C1-3 алкила; (фенил)C1-3 алкила, где фенильная часть замещена 1 или 2 независимо выбранными фторидными заместителями; пиридинила; пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, C1-3 алкилокси, фтора и C1-3 алкила, замещенного 1, 2 или 3 независимо выбранными фторидными заместителями; и (тетрагидро-2 Нпиранил)метила,и к их фармацевтически приемлемым солям и сольватам. В отдельном варианте осуществления изобретения изобретение относится к соединениям формулыR1 выбирают из группы, состоящей из фенила и фенила, замещенного 1 или 2 фторидными заместителями; и(С 1-6 алкилокси)C1-3 алкила; (С 3-8 циклоалкил)C1-3 алкила; фенила; фенила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкилокси и фтора; пиридинила; пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила и фтора; и (тетрагидро-2 Н-пиранил)метила,и к их фармацевтически приемлемым солям и сольватам. В отдельном варианте осуществления изобретения изобретение относится к соединениям формулыR1 выбирают из группы, состоящей из фенила и фенила, замещенного 1 или 2 фторидными заместителями; иR2 выбирают из группы, состоящей из метила; фенила; фенила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкилокси и фтора; пиридинила; и пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы,состоящей из C1-3 алкила и фтора,и к их фармацевтически приемлемым солям и сольватам. В отдельном варианте осуществления изобретения изобретение относится к соединениям формулыR1 выбирают из группы, состоящей из фенила и фенила, замещенного 1 или 2 фторидными заместителями; иR2 выбирают из группы, состоящей из метила; фенила; фенила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из метокси и фтора; пиридинила; и пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы,состоящей из метила и фтора,и к их фармацевтически приемлемым солям и сольватам. В отдельном варианте осуществления изобретения изобретение относится к соединениям формулыR1 выбирают из группы, состоящей из фенила и фенила, замещенного 1 или 2 фторидными заместителями; иR2 выбирают из группы, состоящей из фенила; фенила, замещенного 1 или 2 фторидными заместителями; и пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из метила и фтора,и к их фармацевтически приемлемым солям и сольватам. В отдельном варианте осуществления изобретения изобретение относится к соединениям формулыR1 выбирают из группы, состоящей из фенила и фенила, замещенного 1 или 2 фторидными заместителями; иR2 выбирают из группы, состоящей из метила; фенила и фенила, замещенного 1 или 2 фторидными заместителями,и к их фармацевтически приемлемым солям и сольватам.-5 019980 В отдельном варианте осуществления изобретения изобретение относится к соединениям формулыR1 выбирают из группы, состоящей из фенила; фенила, замещенного 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила и фтора; и 3-цианофенила; и(С 3-8 циклоалкил)C1-3 алкила; фенила; фенила, замещенного 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, C1-3 алкилокси, галогена и C1-3 алкила, замещенного 1, 2 или 3 фторидными заместителями; (фенил)C1-3 алкила; (фенил)C1-3 алкила, где фенильная часть замещена 1, 2 или 3 независимо выбранными галогенными заместителями; пиридинила; пиридинила,замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из(тетрагидро-2 Н-пиранил)метила,и к их фармацевтически приемлемым солям и сольватам. В отдельном варианте осуществления изобретения изобретение относится к соединениям формулыR1 выбирают из группы, состоящей из фенила и фенила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила и фтора; и(С 3-8 циклоалкил)C1-3 алкила; фенила; фенила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, C1-3 алкилокси, галогена и C1-3 алкила, замещенного 1, 2 или 3 фторидными заместителями; (фенил)C1-3 алкила; (фенил)C1-3 алкила, где фенильная часть замещена 1 или 2 независимо выбранными галогенными заместителями; пиридинила; пиридинила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из(тетрагидро-2 Н-пиранил)метила,и к их фармацевтически приемлемым солям и сольватам. В варианте осуществления изобретения R2 выбирают из группы, состоящей из C1-3 алкила;(C1-6 алкилокси)C1-3 алкила; (C3-8 циклоалкил)C1-3 алкила; фенила; фенила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, C1-3 алкилокси, галогена и C1-3 алкила, замещенного 1, 2 или 3 фторидными заместителями; (фенил)C1-3 алкила и(фенил)C1-3 алкила, где фенильная часть замещена 1 или 2 независимо выбранными галогенными заместителями; и n, А и R1 являются такими, как определено ранее. В отдельном варианте осуществления изобретения изобретение относится к соединениям формулыR1 выбирают из группы, состоящей из фенила и фенила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила и фтора; иR2 выбирают из группы, состоящей из C1-3 алкила; фенила; фенила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена и C1-3 алкила, замещенного 1, 2 или 3 фторидными заместителями; (фенил)C1-3 алкила и (фенил)C1-3 алкила, где фенильная часть замещена 1 или 2 независимо выбранными галогенными заместителями,и к их фармацевтически приемлемым солям и сольватам. В отдельном варианте осуществления изобретения изобретение относится к соединениям формулыR1 выбирают из группы, состоящей из фенила и фенила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из метила и фтора; иR2 выбирают из группы, состоящей из C1-3 алкила; фенила; фенила, замещенного 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей из фтора и трифторметила; (фенил)метила и (фенил)метила, где фенильная часть замещена 1 или 2 фторидными заместителями,и к их фармацевтически приемлемым солям и сольватам. В отдельном варианте осуществления изобретения изобретение относится к соединениям формулыR2 выбирают из группы, состоящей из метила и 4-фторфенила,и к их фармацевтически приемлемым солям и сольватам. В другом варианте осуществления изобретения R1 выбирают из группы, состоящей из фенила; 2-фторфенила; 3-фторфенила; 4-фторфенила; 2,4-дифторфенила; 3-метилфенила и 3-цианофенила; и n, X и R2 являются такими, как определено ранее. В другом варианте осуществления изобретения R1 выбирают из группы, состоящей из фенила; 2-фторфенила; 3-фторфенила; 4-фторфенила; 2,4-дифторфенила; 3-метилфенила; и n, X и R2 являются такими, как определено ранее. В дополнительном варианте осуществления изобретения R1 означает фенил, необязательно замещенный 1 или 2 заместителями, каждый из которых независимо выбран из группы, состоящей изC1-3 алкила и фтора. В дополнительном варианте осуществления изобретения R1 означает фенил, необязательно замещенный 1 или 2 фторидными заместителями. В другом варианте осуществления изобретения R1 выбирают из группы, состоящей из фенила; 2-фторфенила; 3-фторфенила и 4-фторфенила. В другом варианте осуществления изобретения R2 выбирают из группы, состоящей из водорода; метила; этила; 1,2,2-триметилпропила; 2-метоксиэтила; циклопропила; (циклопропил)метила; фенила; 3-фторфенила; 4-фторфенила; 2,4-дифторфенила;(2,4-дифторфенил)метила; 2-пиридинила; 3-метил-2-пиридинила; 4-метил-2-пиридинила; 5-метил-2-пиридинила; 6-метил-2-пиридинила; 5-фтор-2-пиридинила; 3-пиридинила; 4-пиридинила; 3-фтор-2-пиридинила; 5-фтор-3-пиридинила; 3-фтор-4-пиридинила и (тетрагидро-2 Н-пиран-4-ил)метила. В другом варианте осуществления изобретения R2 выбирают из группы, состоящей из водорода; метила; этила; 1,2,2-триметилпропила; 2-метоксиэтила; (циклопропил)метила; фенила; 3-фторфенила; 4-фторфенила; 2,4-дифторфенила; (фенил)метила; 3-трифторметилфенила; 4-трифторметилфенила; 2-метоксифенила;(2,4-дифторфенил)метила; 2-пиридинила; 3-метил-2-пиридинила; 4-метил-2-пиридинила; 5-метил-2-пиридинила; 6-метил-2-пиридинила; 5-фтор-2-пиридинила; 3-пиридинила; 4-пиридинила; 3-фтор-2-пиридинила; 5-фтор-3-пиридинила; 3-фтор-4-пиридинила и (тетрагидро-2 Н-пиран-4-ил)метила. В дополнительном варианте осуществления изобретения R2 выбирают из группы, состоящей из водорода; метила; этила; 1,2,2-триметилпропила; 2-метоксиэтила; (циклопропил)метила; 4-фторфенила; 2,4-дифторфенила; 2-метоксифенила; 2-пиридинила; 3-метил-2-пиридинила; 4-метил-2-пиридинила; 5-метил-2-пиридинила; 6-метил-2-пиридинила; 5-фтор-2-пиридинила; 3-пиридинила; 4-пиридинила; 3-фтор-2-пиридинила; 5-фтор-3-пиридинила; 3-фтор-4-пиридинила и (тетрагидро-2 Н-пиран-4-ил)метила. В дополнительном варианте осуществления изобретения R2 выбирают из группы, состоящей из водорода; метила; этила; 1,2,2-триметилпропила; 2-метоксиэтила; (циклопропил)метила; 4-фторфенила; 2,4-дифторфенила; 2-метоксифенила; 2-пиридинила; 3-метил-2-пиридинила; 4-метил-2-пиридинила; 5-метил-2-пиридинила; 6-метил-2-пиридинила; 5-фтор-2-пиридинила; 3-пиридинила; 4-пиридинила; 3-фтор-2-пиридинила; 5-фтор-3-пиридинила; 3-фтор-4-пиридинила и (тетрагидро-2 Н-пиран-4-ил)метила; и n, X и R1 являются такими, как определено ранее. В другом варианте осуществления изобретения A означает -CH2O-. В другом варианте осуществления изобретения A означает -OCH2-. В другом варианте осуществления изобретения A означает -OCH2- и n равно 1. В другом варианте осуществления изобретения R2 означает метил. В другом варианте осуществления изобретения R2 означает 4-фторфенил. В варианте осуществления изобретения галоген представляет собой фтор в каждом определении. В еще одном предпочтительном варианте осуществления изобретения R2 выбирают из группы, состоящей из метила; метоксиэтила; 4-фторфенила; 2,4-дифторфенила;(фенил)метила; 2-фторфенилметила; 3-фторфенилметила; 4-фторфенилметила и 2,4-дифторфенилметила. Все возможные комбинации указанных выше представляющих интерес вариантов осуществления изобретения рассматривают как охватывающие объем данного изобретения. Конкретные соединения могут быть выбраны из группы: 5-(4-фторфенил)-6,7-дигидро-2-(фенилметокси)тиазоло[5,4-с]пиридин-4(5 Н)-она,6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,6,7-дигидро-2-(феноксиметил)-5-[(тетрагидро-2 Н-пиран-4-ил)метил]тиазоло[5,4-с]пиридин-4(5 Н)она,6,7-дигидро-5-(2-метоксиэтил)-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,6,7-дигидро-5-(5-метил-2-пиридинил)-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(4-фторфенокси)метил]-5-(4-фторфенил)-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(3-фторфенокси)метил]-6,7-дигидро-5-[(1R)-1,2,2-триметилпропил]тиазоло[5,4-с]пиридин-4(5 Н)она,-7 019980 6,7-дигидро-5-метил-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,5-(4-фторфенил)-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,5,6,7,8-тетрагидро-2-(феноксиметил)-4 Н-тиазоло[5,4-с]азепин-4-она,5-(4-фторфенил)-5,6,7,8-тетрагидро-2-(феноксиметил)-4 Н-тиазоло[5,4-с]азепин-4-она,5-(2,4-дифторфенил)-6,7-дигидро-2-(фенилметокси)тиазоло[5,4-с]пиридин-4(5 Н)-она,5-[(2,4-дифторфенил)метил]-6,7-дигидро-2-(фенилметокси)тиазоло[5,4-с]пиридин-4(5 Н)-она,5-[(4-фторфенил)метил]-6,7-дигидро-2-(фенилметокси)тиазоло[5,4-с]пиридин-4(5 Н)-она,5-[(3-фторфенил)метил]-6,7-дигидро-2-(фенилметокси)тиазоло[5,4-с]пиридин-4(5 Н)-она,5-[(2-фторфенил)метил]-6,7-дигидро-2-(фенилметокси)тиазоло[5,4-с]пиридин-4(5 Н)-она,5-(2,4-дифторфенил)-2-[(3-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,5-(2,4-дифторфенил)-2-[(2-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,5-(4-фторфенил)-2-[(3-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,3-5-(2,4-дифторфенил)-4,5,6,7-тетрагидро-4-оксотиазоло[5,4-с]пиридин-2 ил]окси]метил]бензонитрила,5-(2,4-дифторфенил)-6,7-дигидро-2-[(3-метилфенил)метокси]тиазоло[5,4-с]пиридин-4(5 Н)-она,5-(4-фторфенил)-2-[(2-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,5-(2,4-дифторфенил)-2-[(2,4-дифторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,6,7-дигидро-5-метил-2-(фенилметокси)тиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(3-фторфенокси)метил]-5-(4-фторфенил)-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(3-фторфенил)метокси]-6,7-дигидро-5-[4-(трифторметил)фенил]тиазоло[5,4-с]пиридин-4(5 Н)она,5-(3-фторфенил)-2-[(3-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,5-(2,4-дифторфенил)-2-[(3-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,5-(2,4-дифторфенил)-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(3-фторфенил)метокси]-6,7-дигидро-5-[3-(трифторметил)фенил]тиазоло[5,4-с]пиридин-4(5 Н)она,2-[(2-фторфенокси)метил]-5-(4-фторфенил)-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,5-(2,4-дифторфенил)-2-[(4-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(2-фторфенокси)метил]-6,7-дигидро-5-[(1R)-1,2,2-триметилпропил]тиазоло[5,4-с]пиридин-4(5 Н)она,2-[(4-фторфенокси)метил]-6,7-дигидро-5-[(1R)-1,2,2-триметилпропил]тиазоло[5,4-с]пиридин-4(5 Н)она,6,7-дигидро-2-(феноксиметил)-5-[(1R)-1,2,2-триметилпропил]тиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(2-фторфенокси)метил]-6,7-дигидро-5-(2-метоксифенил)тиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(3-фторфенокси)метил]-6,7-дигидро-5-(2-метоксифенил)тиазоло[5,4-с]пиридин-4(5 Н)-она,5,6,7,8-тетрагидро-5-метил-2-(феноксиметил)-4 Н-тиазоло[5,4-с]азепин-4-она,5-(циклопропилметил)-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,5-циклопропил-2-[(3-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,5-(циклопропилметил)-2-[(3-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,5-(циклопропилметил)-2-[(2-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,5-(циклопропилметил)-2-[(4-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,5-циклопропил-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,6,7-дигидро-2-(феноксиметил)-5-(2-пиридинил)тиазоло[5,4-с]пиридин-4(5 Н)-она,6,7-дигидро-5-(6-метил-2-пиридинил)-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,5-(5-фтор-2-пиридинил)-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,6,7-дигидро-2-(феноксиметил)-5-(3-пиридинил)тиазоло[5,4-с]пиридин-4(5 Н)-она,6,7-дигидро-2-(феноксиметил)-5-(4-пиридинил)тиазоло[5,4-с]пиридин-4(5 Н)-она,5-(3-фтор-2-пиридинил)-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,6,7-дигидро-5-(4-метил-2-пиридинил)-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,6,7-дигидро-5-(3-метил-2-пиридинил)-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(4-фторфенокси)метил]-5-(5-фтор-2-пиридинил)-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(3-фторфенокси)метил]-5-(5-фтор-2-пиридинил)-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(2-фторфенокси)метил]-5-(5-фтор-2-пиридинил)-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,5-этил-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,5-(5-фтор-3-пиридинил)-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,5-(3-фтор-4-пиридинил)-6,7-дигидро-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,5-(2,4-дифторфенил)-2-[(2-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(4-хлорфенокси)метил]-5-(4-фторфенил)-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,5-циклопропил-2-[(2-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,5-циклопропил-2-[(4-фторфенокси)метил]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,6,7-дигидро-5-(1-метилэтил)-2-(феноксиметил)тиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(3-фторфенокси)метил]-6,7-дигидро-5-(1-метилэтил)тиазоло[5,4-с]пиридин-4(5 Н)-она,-8 019980 6,7-дигидро-2-(фенилметокси)тиазоло[5,4-с]пиридин-4(5 Н)-она,2-фтор-5-(4,5,6,7-тетрагидро-4-оксотиазоло[5,4-с]пиридин-2-ил)окси]метил]бензонитрила,6,7-дигидро-2-[(2-метилфенил)метокси]тиазоло[5,4-с]пиридин-4(5 Н)-она,6,7-дигидро-2-[(3-метилфенил)метокси]тиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(2-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(2-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она трифторацетата,2-[(3-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(3-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она трифторацетата,2-[(4-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,2-[(4-фторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она трифторацетата,6,7-дигидро-2-[(4-метилфенил)метокси]тиазоло[5,4-с]пиридин-4(5 Н)-она,5-(2,4-дифторфенил)-2-[(3,5-дифторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,5-(2,4-дифторфенил)-2-[(3,4-дифторфенил)метокси]-6,7-дигидротиазоло[5,4-с]пиридин-4(5 Н)-она,4-5-(2,4-дифторфенил)-4,5,6,7-тетрагидро-4-оксотиазоло[5,4-с]пиридин-2 ил]окси]метил]бензонитрила,2-5-(2,4-дифторфенил)-4,5,6,7-тетрагидро-4-оксотиазоло[5,4-с]пиридин-2 ил]окси]метил]бензонитрила,2-[(3-фторфенил)метокси]-6,7-дигидро-5-[(1R)-1,2,2-триметилпропил]тиазоло[5,4-с]пиридин-4(5 Н)она,5-(2,4-дифторфенил)-6,7-дигидро-2-4-(трифторметил)фенил]метокси]тиазоло[5,4-с]пиридин 4(5 Н)-она,5-(2,4-дифторфенил)-6,7-дигидро-2-[(2-метоксифенил)метокси]тиазоло[5,4-с]пиридин-4(5 Н)-она,5-(2,4-дифторфенил)-6,7-дигидро-2-[(3-метоксифенил)метокси]тиазоло[5,4-с]пиридин-4(5 Н)-она и 5-(2,4-дифторфенил)-6,7-дигидро-2-2-(трифторметил)фенил]метокси]тиазоло[5,4-с]пиридин 4(5 Н)-она,и их стереоизомерных форм, фармацевтически приемлемых солей и сольватов. Для терапевтического использования соли соединений формулы (I) являются солями, у которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут найти использование, например, в приготовлении или очистке фармацевтически приемлемого соединения. Все соли, являются ли они фармацевтически приемлемыми или нет, включены в объем настоящего изобретения. Фармацевтически приемлемые соли предназначены включать терапевтически активные нетоксичные кислотно-аддитивные солевые формы, которые соединения формулы (I) способны образовать. Указанные соли могут быть получены путем обработки основной формы соединений формулы (I) соответствующими кислотами, например неорганическими кислотами, например галогенводородной кислотой, в частности хлористо-водородной, бромисто-водородной, серной, азотной и фосфорной кислотами, органическими кислотами, например уксусной, гидроксиуксусной, пропановой, молочной, пировиноградной,щавелевой, малоновой, янтарной, малеиновой, фумаровой, яблочной, винной, лимонной, метансульфокислотой, этансульфокислотой, бензолсульфокислотой, р-толуолсульфокислотой, цикламовой, салициловой, р-аминосалициловой и памовой кислотами. В свою очередь, указанные солевые формы могут быть превращены в свободную основную форму путем обработки соответствующим основанием. Соединения формулы (I), содержащие кислые протоны, также могут быть превращены в их терапевтически активные нетоксичные основные солевые формы путем обработки соответствующими органическими и неорганическими основаниями. Соответствующие основные солевые формы включают,например, аммониевые соли, соли щелочных и щелочно-земельных металлов, в частности литиевые, натриевые, калиевые, магниевые и кальциевые соли, соли, образованные с органическими основаниями,например, первичными, вторичными и третичными алифатическими и ароматическими аминами, такими как метиламин, этиламин, пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин,морфолин, триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин; бензатин, N-метил-D-глюкамин, соли гидрабамина и соли, образованные с аминокислотами, например аргинином и лизином. В свою очередь, указанные солевые формы могут быть превращены в свободные кислотные формы обработкой соответствующей кислотой. Термин "сольват" включает формы присоединения растворителя, а также их соли, которые соединения формулы (I) способны образовывать. Примерами таких форм присоединения растворителя являются гидраты, алкоголяты и т.п. Термин "стереохимические изомерные формы" или "стереоизомерные формы", как употребляют в описании выше и ниже, определяет все возможные изомерные формы, которыми соединения формулы(I) могут обладать. Если не упомянуто или не указано иное, химическое название соединений указывает на смесь всех возможных стереохимически изомерных форм, указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Изобретение также охватывает каждую из ин-9 019980 дивидуальных изомерных форм соединений формулы (I) и их солей и сольватов, по существу, свободных, т.е. ассоциированных менее чем с 50%, предпочтительно менее чем с 20%, более предпочтительно менее чем с 10%, предпочтительно менее чем с 5%, в частности менее чем с 2% и наиболее предпочтительно менее чем с 1% других изомеров. Таким образом, когда соединение формулы (I) определяется,например, как (R), это означает, что соединение является в основном свободным от (S)-изомера. Стереогенные центры могут иметь R- или S-конфигурацию; заместители в бивалентных циклических (частично) насыщенных радикалах могут иметь либо цис-, либо транс-конфигурацию. Соединения, содержащие двойные связи, могут иметь Е- или Z-стереохимию около упомянутой двойной связи. Стереоизомерные формы соединений формулы (I) входят в объем данного изобретения. Следуя правилам номенклатуры CAS, когда два стереогенных центра известной абсолютной конфигурации присутствуют в соединении, R- или S-дескриптор присваивают (на основании правила последовательности Кана-Ингольда-Прелога) хиральному центру с наименьшим номером базовому центру. Конфигурацию второго стереогенного центра указывают, используя относительные дескрипторы [R,R] или [R,S], где R всегда определяют как базовый центр, и [R,R] указывает на центры с одинаковой хиральностью, и [R,S] указывает на центры с отличающейся хиральностью. Например, если хиральный центр с наименьшим номером в соединении имеет S-конфигурацию и второй центр имеет Rконфигурацию, стереодескриптор должен быть определен как S-[R,S]. Если используют и : положение заместителя с наибольшим приоритетом у асимметричного атома углерода в кольцевой системе,имеющего наименьший номер в кольце, произвольно всегда расположено в -положении средней плоскости, детерминированной кольцевой системой. Положение заместителя с наибольшим приоритетом у другого асимметричного атома углерода в кольцевой системе (атом водорода в соединениях формулы(I относительно положения заместителя с наибольшим приоритетом у базового атома обозначают ,если он расположен с той же стороны средней плоскости, детерминированной кольцевой системой, или, если он расположен с другой стороны средней плоскости, детерминированной кольцевой системой. В рамках данного изобретения элемент, в частности, когда упоминают в отношении соединения формулы (I), включает все изотопы и смеси изотопов указанного элемента либо природного, либо синтетического происхождения, либо с природным изотопным составом, либо в обогащенном изотопом виде. Соединения формулы (I), меченные радиоактивным изотопом, могут включать радиоактивный изотоп,выбранный из группы 3 Н, 11 С, 18F, 122I, 123I, 125I, 131I, 75Br, 76Br, 77Br и 82Br. Предпочтительно радиоактивный изотоп выбирают из группы 3 Н, 11C и 18F. Получение. Соединения согласно изобретению могут быть получены в основном последовательными стадиями,каждая из которых известна специалисту. В частности, соединения могут быть получены следующими способами синтеза. Соединения формулы (I) могут быть синтезированы в виде рацемических смесей энантиомеров, которые можно отделить один от другого, следуя известным в данной области способам разделения. Рацемические соединения формулы (I) могут быть превращены в соответствующие диастереомерные солевые формы путем взаимодействия с подходящей хиральной кислотой. Затем указанные диастереомерные солевые формы разделяют, например, путем избирательной или фракционной кристаллизации, и энантиомеры выделяют обработкой щелочью. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы также могут быть получены из чистых стереохимически изомерных форм соответствующих исходных материалов, при условии, что реакция протекает стереоспецифически. А. Получение конечных соединений. Экспериментальная методика 1. Соединения формулы (I), где A означает -O-CH2-, названные (I-а), могут быть получены путем взаимодействия промежуточного соединения формулы (II) со спиртом формулы (III) согласно схеме реакции 1. Реакцию осуществляют в подходящем инертном для реакции растворителе, таком как, например,ацетонитрил, в присутствии подходящего основания, такого как, например, Cs2CO3, при тепловых условиях, таких как, например, нагревание реакционной смеси при 80 С в течение периода времени, позволяющего завершить реакцию, например в течение ночи. Альтернативные условия реакции могут быть выбраны специалистом в данной области из методик реакции, хорошо описанных в литературе. На реакционной схеме 1 все переменные являются такими, как определено в формуле (I). Реакционная схема 1 Соединение формулы (III) может быть получено коммерчески.- 10019980 Экспериментальная методика 2. Соединения формулы (I), где A означает -CH2-O-, названные (I-b), могут быть получены реакцией типа реакции Мицуноби путем взаимодействия промежуточного соединения формулы (IV) и соответствующего спирта формулы (V), в присутствии триалкилфосфина или триарилфосфина, такого как, например, трифенилфосфин, и реагента диалкилазодикарбоксилата, такого как, например, ди-третбутилазодикарбоксилата (DTBAD), согласно реакционной схеме 2 а. Реакцию осуществляют в подходящем инертном для реакции растворителе, таком как, например, тетрагидрофуран, при тепловых условиях, таких как, например, нагревание реакционной смеси при 120 С, в течение периода времени, позволяющего завершить реакцию, например 20 мин. На реакционной схеме 2 а все переменные являются такими, как определено в формуле (I). Реакционная схема 2 а Альтернативно, соединения формулы (I-b) могут быть получены путем взаимодействия промежуточного соединения формулы (VI) с соответствующим спиртом формулы (V) согласно реакционной схеме 2b. Взаимодействие осуществляют в подходящем инертном для реакции растворителе, таком как, например, ацетонитрил, в присутствии подходящего основания, такого как, например, Cs2CO3, при тепловых условиях, таких как, например, нагревание реакционной смеси при 80C, в течение периода времени,позволяющего завершить реакцию, например в течение ночи. Альтернативные условия реакции могут быть выбраны специалистом в данной области из методик реакции, хорошо описанных в литературе. На реакционной схеме 2b все переменные являются такими, как определено в формуле (I). Реакционная схема 2b Соединение формулы (V) может быть получено коммерчески. Соединения формулы (I-b) также могут быть получены путем взаимодействия промежуточного соединения формулы (VII) с соответствующим тиоацетамидом формулы (VIII) согласно реакционной схеме 2 с. Взаимодействие осуществляют в инертном для реакции растворителе, таком как, например, этанол, при умеренно высокой температуре, такой как, например, 80C, в течение периода времени, позволяющего завершить реакцию. На реакционной схеме 2 с все переменные являются такими, как определено в формуле (I). Реакционная схема 2 с Соединение формулы (VIII) может быть получено согласно методике, описанной в международной публикации WO 2007/056366 A2 (18.05.2007), или альтернативно может быть получено коммерчески. Экспериментальная методика 3. Соединения формулы (I-b) могут быть получены путем реакции сочетания между соединением формулы (I-b), где R2 означает водород, названным (I-b'), и реагентом формулы (IX) согласно реакционной схеме 3. Реакцию осуществляют в подходящем инертном для реакции растворителе, таком как, например, толуол, в присутствии подходящего основания, такого как, например, Na2CO3, в присутствии лиганда, такого как, например, N,N'-диметилэтилендиамин, в присутствии соли меди, такой как, например, йодид меди, при тепловых условиях, таких как, например, нагревание реакционной смеси при 120C, в течение периода времени, позволяющего завершить реакцию, например в течение ночи. Альтернативно, реакцию также можно осуществлять в подходящем инертном для реакции растворителе, таком как, например, ацетонитрил, в присутствии подходящего основания, такого как, например, Cs2CO3,при тепловых условиях, таких как, например, нагревание реакционной смеси при 80C, или реакцию также можно осуществлять в подходящем инертном для реакции растворителе, таком как, например,N,N-диметилформамид, в присутствии подходящего основания, такого как, например, гидрид натрия,при низкой температуре, такой как 0 С, в течение периода времени, позволяющего завершить реакцию,например в течение ночи. Альтернативно, условия реакции могут быть выбраны специалистом в данной- 11019980 области из методик реакции, хорошо описанных в литературе. На реакционной схеме 3 все переменные являются такими, как определено в формуле (I), и Q является группой, такой как галоген. Реакционная схема 3 Галогенсодержащее соединение формулы (IX) может быть получено коммерчески. В. Получение промежуточных соединений. Экспериментальная методика (4). Промежуточные соединения формулы (VI) могут быть получены путем хлорирования промежуточного соединения формулы (IV) при условиях, известных специалисту, например при использовании тионилхлорида, при стандартных условиях, согласно реакционной схеме 4, где все переменные являются такими, как определено в формуле (I). Реакционная схема 4 Экспериментальная методика 5. Промежуточное соединение формулы (IV) может быть получено путем восстановления промежуточного соединения формулы (X-a) или промежуточного соединения формулы (Х-b) при условиях, известных специалисту, например при использовании боргидрида натрия, согласно реакционной схеме 5,где все переменные являются такими, как определено в формуле (I). Реакционная схема 5 Экспериментальная методика 6. Промежуточные соединения формулы (X-a) или (Х-b) могут быть получены путем карбонилирования промежуточного соединения формулы (II) при условиях, известных специалисту, например при использовании окиси углерода, соответствующего спирта, такого как метанол или этанол соответственно, и основания, такого как, например, триэтиламин, в присутствии палладиевого катализатора, такого как дихлорид палладия, при стандартных условиях согласно реакционной схеме 6 а, где все переменные являются такими, как определено в формуле (I). Реакционная схема 6 а Альтернативно, соединение формулы (X-a), где R2 является метилом, названное в описании (X-a"),может быть получено взаимодействием соединения формулы (X-a), где R2 означает водород, названного в описании (X-a'), с алкилирующим агентом, таким как метилйодид, в присутствии основания, такого как карбонат цезия, в инертном растворителе, таком как N,N-диметилформамид, используя условия реакции,которые известны специалисту в данной области. На реакционной схеме 6b все переменные являются такими, как определено в формуле (I). Экспериментальная методика 7. Промежуточные соединения формулы (II) могут быть получены реакцией промежуточного соединения формулы (XI) согласно реакционной схеме 7. Реакцию осуществляют с реагентом или смесью реагентов, подходящей для превращения NH2-группы в атом галогена, такой как, например, смесь бромида меди(II) и 3-метил-1-нитрозооксибутана, используя условия реакции, которые известны специалисту в данной области. На реакционной схеме 7 все переменные являются такими, как определено в формуле Экспериментальная методика 8. Промежуточные соединения формулы (XI), где n равно 1, названные в описании (XI-а), могут быть получены путем взаимодействия промежуточного соединения формулы (XII) с тиомочевиной согласно реакционной схеме 8. Взаимодействие осуществляют в инертном для реакции растворителе, таком как,например, этанол, при умеренно высокой температуре, такой как, например, 80C, в течение периода времени, позволяющего завершить реакцию. На реакционной схеме 8 все переменные являются такими,как определено в (I). Реакционная схема 8 Экспериментальная методика 9. Альтернативно, соединение формулы (Х-b) может быть получено путем бромирования промежуточного соединения формулы (XII) с этилтиооксаматом согласно реакционной схеме 9. Реакцию осуществляют в инертном для реакции растворителе, таком как, например, этанол, с подходящим основанием,таким как, например, бикарбонат натрия, при умеренно высокой температуре, такой как, например, 80 С,в течение периода времени, позволяющего завершить реакцию. На реакционной схеме 9 все переменные являются такими, как определено в формуле (I). Реакционная схема 9 Экспериментальная методика 10. Промежуточные соединения формулы (XII) могут быть получены путем бромирования промежуточного соединения формулы (XIII) согласно реакционной схеме 10. Реакцию осуществляют в инертном для реакции растворителе, таком как, например, четыреххлористый углерод, с подходящим бромирующим агентом, таким как, например, N-бромсукцинимид, при умеренно низкой температуре, такой как,например, 10-15 С, в течение периода времени, позволяющего завершить реакцию. На реакционной схеме 10 все переменные являются такими, как определено в формуле (I). Реакционная схема 10- 13019980 Промежуточные соединения формулы (XIII) могут быть получены путем декарбоксилирования промежуточного соединения формулы (XIV) согласно реакционной схеме 11. Реакцию осуществляют в инертном для реакции растворителе, таком как, например, вода, с подходящим кислотным агентом, таким как, например, уксусная кислота, при умеренно высокой температуре, такой как 100C, в течение периода времени, позволяющего завершить реакцию. На реакционной схеме 11 все переменные являются такими, как определено в формуле (I). Реакционная схема 11 Экспериментальная методика 12. Промежуточные соединения формулы (XIV) могут быть получены реакцией промежуточного соединения формулы (XV) согласно реакционной схеме 12. Реакцию осуществляют в инертном для реакции растворителе, таком как, например, этанол, с подходящим основанием, таким как, например, этилат натрия, при умеренно высокой температуре, такой как 85 С, в течение периода времени, позволяющего завершить реакцию. На реакционной схеме 12 все переменные являются такими, как определено в формуле (I). Реакционная схема 12 Экспериментальная методика 13. Промежуточные соединения формулы (XV) могут быть получены путем взаимодействия промежуточного соединения формулы (XVI) с этилмалонилхлоридом согласно реакционной схеме 13. Взаимодействие осуществляют в инертном для реакции растворителе, таком как, например, дихлорметан, с подходящим основанием, таким как, например, триэтиламин, при низкой температуре, такой как 0C, в течение периода времени, позволяющего завершить реакцию. На реакционной схеме 13 все переменные являются такими, как определено в формуле (I). Реакционная схема 13 Экспериментальная методика 14. Промежуточные соединения формулы (XVI) могут быть получены путем взаимодействия соответствующего амина формулы (XVII) с этилакрилатом согласно реакционной схеме 14. Взаимодействие осуществляют в инертном для реакции растворителе, таком как, например, этанол, с подходящей кислотой, такой как, например, хлористо-водородная кислота, при высокой температуре, такой как 90C, в течение периода времени, позволяющего завершить реакцию. На реакционной схеме 14 все переменные являются такими, как определено в формуле (I). Реакционная схема 14 Амин формулы (XVII) может быть получен коммерчески. Экспериментальная методика 15. Промежуточные соединения формулы (XI), где R2 означает водород, и n равно 1, названные в описании (XI-b), могут быть получены из промежуточного соединения формулы (XVIII) согласно реакционной схеме 15. Реакцию осуществляют с подходящим реагентом для отщепления третбутоксикарбонильной группы, таким как, например, хлористо-водородная кислота, используя реакционные условия, известные специалисту в данной области. На реакционной схеме 15 все переменные являются такими, как определено в формуле (I). Экспериментальная методика 16. Промежуточные соединения формулы (XVIII) могут быть получены путем взаимодействия промежуточного соединения формулы (XIX) с тиомочевиной согласно реакционной схеме 16. Взаимодействие осуществляют в инертном для реакции растворителе, таком как, например, этанол,при умеренно высокой температуре, такой как, например, 80C, в течение периода времени, позволяющего завершить реакцию. На реакционной схеме 16 все переменные являются такими, как определено в формуле (I). Реакционная схема 16 Экспериментальная процедура 17. Промежуточные соединения формулы (XIX) могут быть получены бромированием промежуточного соединения формулы (XX) согласно реакционной схеме 17. Реакцию осуществляют в инертном для реакции растворителе, таком как, например, четыреххлористый углерод, с подходящим бромирующим агентом, таким как, например, N-бромсукцинимид, при умеренно низкой температуре, такой как, например, 10-15C, в течение периода времени, позволяющего завершить реакцию. На реакционной схеме 17 все переменные являются такими, как определено в формуле (I). Реакционная схема 17 Соединение формулы (XX) может быть получено коммерчески. Экспериментальная методика 18. Соединения формулы (I-b), где R2 означает водород, и n равно 2, названные в описании (I-b"), могут быть получены путем реакции удаления защитной группы у промежуточного соединения формулы (XXI) посредством аммоний-церий(IV) нитрата согласно реакционной схеме 18. Реакцию осуществляют в инертном для реакции растворителе, таком как, например, ацетонитрил и вода, используя реакционные условия, которые известны специалисту в данной области. На реакционной схеме 18 все переменные являются такими, как определено в формуле (I). Реакционная схема 18 Экспериментальная методика 19. Соединения формулы (XXI) могут быть получены путем взаимодействия промежуточного соединения формулы (XXII) с соответствующим тиоацетамидом формулы (VIII) согласно реакционной схеме 19. Взаимодействие осуществляют в инертном для реакции растворителе, таком как, например, этанол, при умеренно высокой температуре, такой как, например, 80 С, в течение периода времени, позволяющего завершить реакцию. На реакционной схеме 19 все переменные являются такими, как определено в формуле (I). Соединение формулы (VIII) может быть получено способом, описанным в международной публикации WO 2007/056366 A2 (2007.05.18) или альтернативно может быть получено коммерчески. Экспериментальная методика 20. Промежуточное соединение формулы (XXII) может быть получено путем взаимодействия промежуточного соединения формулы (XXIII) с N-бромсукцинимидом согласно реакционной схеме 20. Взаимодействие осуществляют в инертном растворителе, таком как, например, этанол, в присутствии подходящей кислоты, такой как, например, гидрат бисульфата натрия, при комнатной температуре, в течение периода времени, позволяющего завершить реакцию. Реакционная схема 20 Соединение формулы (XXIII) может быть получено способом, описанным в журнале Synthesis,2006, 14, 2319-2322. Фармакология Соединения, представленные в данном изобретении, являются позитивными аллостерическими модуляторами метаботропных глутаматных рецепторов, в частности, они являются позитивными аллостерическими модуляторами рецептора mGluR5. Соединения согласно настоящему изобретению, повидимому, не связываются с участком распознавания глутамата, ортостерическим лигандным участком,но вместо этого связываются с аллостерическим центром. В присутствии глутамата или агониста рецептора mGluR5 соединения согласно данному изобретению повышают ответ mGluR5. Соединения, представленные в данном изобретении, как ожидалось, проявляют эффект в отношении mGluR5 посредством их способности повышать ответ таких рецепторов на глутамат или агонисты mGluR5, усиливающие ответ рецептора. Как используется в описании, термин "лечение" предназначен охватить все процессы, где может происходить замедление, прерывание, купирование или остановка развития заболевания, но необязательно указывает на общее исключение всех симптомов. В результате, настоящее изобретение относится к соединению согласно настоящему изобретению, к его стереоизомерным формам и фармацевтически приемлемым солям присоединения кислоты или основания и к его сольватам для использования в качестве лекарственного средства. Изобретение также относится к использованию соединения общей формулы (I), его стереоизомерных форм и фармацевтически приемлемых солей присоединения кислоты или основания и их сольватов или фармацевтической композиции согласно изобретению для производства лекарственного средства, а также к использованию соединения согласно изобретению или фармацевтической композиции согласно изобретению для производства лекарственного средства с целью лечения или предотвращения, в частности лечения, состояния у млекопитающего, включающего человека, лечение или предотвращение которого осуществляется или облегчается благодаря нейромодуляторному эффекту аллостерических модуляторов рецептора mGluR5, в частности его позитивных аллостерических модуляторов. Изобретение также относится к соединению общей формулы (I), к его стереоизомерным формам и фармацевтически приемлемым солям присоединения кислоты или основания и их сольватам, или к фармацевтической композиции согласно изобретению для использования в лечении или предотвращении, в частности лечении, состояния у млекопитающего, включая человека, лечение или предотвращение которого осуществляется или облегчается благодаря нейромодуляторному эффекту аллостерических модуляторов mGluR5, в частности его позитивных аллостерических модуляторов. Настоящее изобретение также относится к соединению общей формулы (I), к его стереоизомерным формам и фармацевтически приемлемым солям присоединения кислоты или основания и их сольватам или к фармацевтической композиции согласно изобретению для использования в лечении, предотвращении, уменьшении интенсивности, контроле или снижении риска различных неврологических и психических нарушений, ассоциированных с дисфункцией глутамата у млекопитающего, включая человека, лечение или предотвращение которых осуществляется или облегчается благодаря нейромодуляторному эффекту позитивных аллостерических модуляторов mGluR5. Кроме того, настоящее изобретение относится к использованию соединения общей формулы (I), его стереоизомерных форм и фармацевтически приемлемых солей присоединения кислоты или основания и- 16019980 их сольватов или фармацевтической композиции согласно изобретению для производства лекарственного средства с целью лечения, предотвращения, уменьшения интенсивности, контролирования или снижения риска различных неврологических и психических нарушений, ассоциированных с дисфункцией глутамата у млекопитающего, включая человека, лечение или предотвращение которых осуществляется или облегчается благодаря нейромодуляторному эффекту позитивных аллостерических модуляторовmGluR5. Настоящее изобретение также относится к соединению согласно настоящему изобретению или к его фармацевтической композиции согласно изобретению для использования в производстве лекарственного средства с целью лечения или предотвращения, в частности лечения, состояния у млекопитающего, включая человека, лечение или предотвращение которого осуществляется или облегчается благодаря нейромодуляторному эффекту аллостерических модуляторов mGluR5, в частности его позитивных аллостерических модуляторов. Настоящее изобретение также относится к соединению согласно настоящему изобретению или к его фармацевтической композиции согласно изобретению для лечения или предотвращения, в частности лечения, состояния у млекопитающего, включая человека, лечение или предотвращение которого осуществляется или облегчается благодаря нейромодуляторному эффекту аллостерических модуляторов рецептора mGluR5, в частности его позитивных аллостерических модуляторов. Также настоящее изобретение относится к использованию соединения согласно изобретению или его фармацевтической композиции согласно изобретению для производства лекарственного средства с целью лечения, предотвращения, уменьшения интенсивности, контролирования или снижения риска различных неврологических и психических нарушений, ассоциированных с дисфункцией глутамата у млекопитающего, включая человека, лечение или предотвращение которых осуществляется или облегчается благодаря нейромодуляторному эффекту позитивных аллостерических модуляторов mGluR5. В случаях, где сказано, что изобретение относится к использованию соединения или композиции согласно изобретению для производства лекарственного средства с целью, например, лечения млекопитающего, понятно, что такое использование интерпретируется в некоторых сферах деятельности как способ, например, лечения млекопитающего, включающий введение млекопитающему при необходимости такого лечения, например, эффективного количества соединения композиции согласно изобретению. В частности, неврологические и психические нарушения, ассоциированные с дисфункцией глутамата, включают одно или более из следующих состояний или заболеваний: острые неврологические и психические расстройства, такие как, например, церебральные недостаточности после коронарного шунтирования и имплантации, удар, церебральная ишемия, травма спинного мозга, травма головы, перинатальная гипоксия, остановка сердца, гипогликемическое нейрональное повреждение, деменция (включаяAIDS-индуцированную деменцию), болезнь Альцгеймера, хорея Гентингтона, амиотрофический боковой склероз, поражение зрения, ретинопатия, когнитивные расстройства, идиопатическая и индуцированная лекарственным средством болезнь Паркинсона, мышечные спазмы и нарушения, ассоциированные с мышечной спастичностью, включая треморы, эпилепсию, конвульсии, гемикранию (включая головную боль), недержание мочи, переносимость вещества, отмена вещества (включая вещества, такие как, например, опиаты, никотин, табачные изделия, алкоголь, бензодиазепины, кокаин, седативные средства,снотворные средства и т.д.), психоз, шизофрения (включая ее положительные, отрицательные и когнитивные симптомы), тревога (включая генерализованное тревожное расстройство, панический синдром и обессивно-компульсивное расстройство), расстройства настроения (включая депрессию, маниакальное состояние, биполярные расстройства), невралгия тройничного нерва, тугоухость, шум в ушах, макулярная дистрофия, рвота, отек головного мозга, боль (включая острые и хронические состояния, сильную боль, неукротимую боль, нейропатическую боль и посттравматическую боль), поздняя дискинезия, нарушения сна (включая нарколепсию), синдром дефицита внимания/гиперактивности и расстройство поведения. В частности, состоянием или заболеванием является расстройство центральной нервной системы,выбранное из группы, состоящей из тревожных расстройств, психотических расстройств, расстройств личности, связанных с веществом расстройств, расстройств питания, расстройств настроения, гемикрании, эпилепсии или судорожных расстройств, расстройств детского возраста, когнитивных расстройств,нейродегенерации, нейротоксичности и ишемии. Предпочтительно расстройством центральной нервной системы является тревожное расстройство,выбранное из агорафобии, генерализованного тревожного расстройства (GAD), обессивнокомпульсивного расстройства (OCD), панического синдрома, посттравматического стрессового расстройства (PTSD), социальной фобии и других фобий. Предпочтительно расстройством центральной нервной системы является психотическое расстройство, выбранное из шизофрении, бредового расстройства, шизоаффективного расстройства, шизофреноформного расстройства и индуцированного веществом психотического расстройства. Предпочтительно расстройством центральной нервной системы является расстройство личности,выбранное из обсессивно-компульсивного расстройства личности и шизоидного расстройства личности,шизотипического расстройства. Предпочтительно расстройством центральной нервной системы является связанное с веществом- 17019980 расстройство, выбранное из алкоголизма, алкогольной зависимости, похмельного синдрома, бреда при алкогольной абстиненции, вызванного алкоголем психотического расстройства, амфетаминовой зависимости, синдрома отмены амфетамина, кокаиновой зависимости, синдрома отмены кокаина, никотиновой зависимости, синдрома отмены никотина, опиоидной зависимости и синдрома отмены опиоида. Предпочтительно расстройством центральной нервной системы является расстройство питания,выбранное из нервной анорексии и нейрогенной булимии. Предпочтительно расстройством центральной нервной системы является расстройство настроения,выбранное из биполярных расстройств (III), циклотимического расстройства, депрессии, дистимического расстройства, большого депрессивного расстройства и вызванного веществом расстройства настроения. Предпочтительно расстройством центральной нервной системы является гемикрания. Предпочтительно расстройством центральной нервной системы является эпилепсия или судорожное расстройство, выбранное из бессудорожной генерализованной эпилепсии, генерализованной судорожной эпилепсии, легкой формы эпилептического статуса, тяжелой формы эпилептического статуса,парциальной эпилепсии с и без нарушения сознания, инфантильных спазмов, эпилепсии парциальной непрерывной и других форм эпилепсии. Предпочтительно расстройством центральной нервной системы является синдром дефицита внимания/гиперактивности. Предпочтительно расстройством центральной нервной системы является когнитивное расстройство, выбранное из делирия, вызванного веществом непрекращающегося делирия, деменции, деменции вследствие ВИЧ-заболевания, деменции вследствие болезни Гентингтона, деменции вследствие болезни Паркинсона, деменции типа Альцгеймера, вызванной веществом персистирующей деменции и умеренного когнитивного нарушения. Из описанных выше расстройств лечение шизофрении и деменции представляет собой особую важность. В настоящее время 4-е изд. Диагностического и Статистического руководства по психическим расстройствам (DSM-IV) Американской ассоциации психиатров предоставляет диагностическое средство для идентификации представленных в описании расстройств. Специалист в данной области признает, что существуют альтернативные номенклатуры, нозологии и системы классификации для неврологических и психических расстройств и что они изменяются с развитием медицины и науки. Поэтому изобретение также относится к соединению общей формулы (I), к его стереоизомерным формам и фармацевтически приемлемым солям присоединения кислоты или основания и к его сольватам для использования в лечении любого одного из заболеваний, упомянутых выше. Изобретение также относится к соединению общей формулы (I), к его стереоизомерным формам и фармацевтически приемлемым солям присоединения кислоты или основания и к его сольватам для использования в лечении любого одного из заболеваний, упомянутых выше. Изобретение также относится к соединению общей формулы (I), к его стереоизомерным формам и фармацевтически приемлемым солям присоединения кислоты или основания и к его сольватам для лечения или предотвращения, в частности лечения, любого одного из заболеваний, упомянутых выше. Изобретение также относится к использованию соединения общей формулы (I), к его стереоизомерным формам и фармацевтически приемлемым солям присоединения кислоты или основания и к его сольватам для производства лекарственного средства с целью лечения или предотвращения любого одного из болезненных состояний, упомянутых выше. Изобретение также относится к использованию соединения общей формулы (I), к его стереоизомерным формам и фармацевтически приемлемым солям присоединения кислоты или основания и к его сольватам для производства лекарственного средства с целью лечения любого одного из болезненных состояний, упомянутых выше. Соединения согласно настоящему изобретению могут быть введены млекопитающим, предпочтительно людям, для лечения или предотвращения любого одного из заболеваний, упомянутых выше. Принимая во внимание полезность соединений формулы (I), предоставлен способ лечения теплокровных животных, включая людей, страдающих от любого одного из упомянутых выше заболеваний, и способ предотвращения у теплокровных животных, включая людей, любого одного из упомянутых выше заболеваний. Указанные способы включают введение, т.е. системное или местное введение, предпочтительно пероральное введение, терапевтически эффективного количества соединения формулы (I), его стереоизомерной формы и фармацевтически приемлемой аддитивной соли или сольвата теплокровным животным,включая людей. Поэтому изобретение также относится к способу предотвращения и/или лечения любого одного из упомянутых выше заболеваний, включающему введение пациенту при необходимости терапевтически эффективного количества соединения согласно изобретению.- 18019980 Специалисту в данной области понятно, что терапевтически эффективным количеством РАМ согласно настоящему изобретению является количество, достаточное для модуляции активности mGluR5, и что это количество изменяется inter alia в зависимости от типа заболевания, концентрации соединения в терапевтическом средстве и от состояния больного. В общем, количество РАМ, которое должно быть введено в качестве терапевтического средства для лечения заболеваний, при которых модуляция mGluR5 является эффективной, таких как описанные выше расстройства, будет определяться для каждого случая отдельно лечащим врачом. Вообще, подходящей дозой является доза, которая приводит к концентрации РАМ в месте лечения в диапазоне от 0,5 нМ до 200 мкМ и по большей части от 5 нМ до 50 мкМ. Для того чтобы достичь указанных терапевтических концентраций, пациенту при необходимости лечения, вероятно, будут вводить эффективное ежедневное количество от приблизительно 0,01 до приблизительно 50 мг/кг массы тела,предпочтительно от приблизительно 0,01 до приблизительно 25 мг/кг массы тела, более предпочтительно от приблизительно 0,01 до приблизительно 10 мг/кг массы тела, более предпочтительно от приблизительно 0,01 до приблизительно 2,5 мг/кг массы тела, даже более предпочтительно от приблизительно 0,05 до приблизительно 1 мг/кг массы тела, более предпочтительно от приблизительно 0,1 до приблизительно 0,5 мг/кг массы тела. Количество соединения согласно настоящему изобретению, также названного в описании как активный ингредиент, которое требуется для достижения терапевтически активного количества, будет, конечно, изменяться в каждом конкретном случае, в зависимости от конкретного соединения, способа введения, возраста и состояния реципиента и конкретного расстройства или заболевания, подвергаемого лечению. Способ лечения также может включать введение активного ингредиента в режиме между одним и четырьмя приемами в день. В данных способах лечения соединения согласно изобретению предпочтительно разрабатывают в качестве лекарственного средства до поступления. Как описано ниже, подходящие фармацевтические препараты приготовляют известными способами, используя хорошо известные и легкодоступные ингредиенты. Поскольку такие позитивные аллостерические модуляторы mGluR5, включающие соединения формулы (I), усиливают ответ mGluR5 к глутамату, предпочтительно, когда в настоящих способах используют эндогенный глутамат. Поскольку позитивные аллостерические молуляторы mGluR5, включая соединения формулы (I),усиливают ответ mGluR5 к агонистам, понятно, что настоящее изобретение направлено на лечение неврологических и психических расстройств, ассоциированных с дисфункцией глутамата, таких как, например, расстройства, упомянутые в описании выше, путем введения эффективного количества позитивного аллостерического модулятора mGluR5, включая соединения формулы (I), в комбинации с агонистомmGluR5. Соединения согласно настоящему изобретению могут быть использованы в комбинации с одним или более лекарственными средствами в лечении, предотвращении, контролировании, ослаблении или снижении риска заболеваний или состояний, для которых соединения формулы (I) или другие лекарственные средства могут иметь применение, где комбинация лекарственных средств является более безопасной или более эффективной, чем любое лекарственное средство само по себе. Фармацевтические композиции Настоящее изобретение также предоставляет композиции для предотвращения или лечения заболеваний, при которых модуляция рецептора mGluR5 является благотворной, таких как описанные выше расстройства. Хотя возможно вводить активный ингредиент сам по себе, предпочтительно представить его в виде фармацевтической композиции. Соответственно, изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель или разбавитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения согласно изобретению, в частности соединения формулы (I), его фармацевтически приемлемой соли, сольвата или стереохимически изомерной формы. Носитель или разбавитель должен быть "приемлемым" в смысле его совместимости с другими ингредиентами композиции и не оказывающим вредного воздействия на реципиентов. Соединения согласно изобретению, в частности соединения формулы (I), их фармацевтически приемлемые соли, сольваты и стереохимически изомерные формы или их любая подгруппа или комбинация могут быть составлены с целью их введения в различные фармацевтические формы. В качестве подходящих композиций могут быть приведены все композиции, которые обычно используют для системного введения лекарственных средств. Фармацевтические композиции согласно настоящему изобретению могут быть получены любыми способами, хорошо известными в данной области фармацевтики, например, с использованием способов,таких как способы, описанные в Gennaro et al. Remington's Pharmaceutical Sciences (18th ed., MackPublishing Company, 1990, см., в частности, Part 8: Pharmaceutical preparations and their Manufacture). Для того чтобы приготовить фармацевтические композиции согласно данному изобретению, эффективное количество конкретного соединения, необязательно в виде соли, в качестве активного ингредиента комбинируют в виде однородной смеси с фармацевтически приемлемым носителем или разбавителем, причем носитель или разбавитель может быть различных видов в зависимости от формы препарата, требуемого для введения. Указанные фармацевтические композиции желательно представить в стандартной- 19019980 лекарственной форме, подходящей, в частности, для введения перорально, ректально, чрескожно, путем парентеральной инъекции или ингаляции. Например, для получения композиций в пероральной лекарственной форме может быть использована любая из обычных фармацевтических сред, таких как, например, вода, гликоли, масла, спирты и т.п. в случае пероральных жидких препаратов, таких как, например,суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как, например, крахмалы, сахара, каолин, разбавители, смазывающие средства, связующие вещества, дезинтегрирующие средства и т.п. в случае порошков, пилюль, капсул и таблеток. Ввиду легкости введения пероральное введение является предпочтительным, и таблетки и капсулы представляют собой наиболее эффективные пероральные стандартные лекарственные формы, в случае которых естественно используются твердые фармацевтические носители. Относительно парентеральных композиций носитель обычно должен включать стерилизованную воду, по меньшей мере, в значительной степени, хотя могут быть включены другие ингредиенты, например поверхностно-активные вещества, чтобы способствовать растворимости. Могут быть приготовлены, например, инъецируемые растворы, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также могут быть приготовлены инъецируемые суспензии, в случае которых могут быть использованы подходящие жидкие носители, суспендирующие средства и т.п. Также включенными являются твердые препаративные формы, которые предназначены для их превращения непосредственно перед использованием в жидкие препаративные формы. В композициях, подходящих для чрескожного введения, носитель необязательно включает усиливающее проникновение средство и/или подходящее смачивающее средство, необязательно комбинированный с подходящими добавками любой природы в малых пропорциях, которые не наносят значительного повреждающего действия на кожу. Указанные добавки могут облегчать введение через кожу и/или могут быть пригодными для приготовления желаемых композиций. Указанные композиции могут быть введены различными путями, например в виде трансдермального пластыря, нанесения spot-on, мази. В особенности благоприятным является составление описанных выше фармацевтических композиций в стандартной лекарственной форме для легкости введения и однородности дозировки. Стандартная лекарственная форма, как употребляют в описании, относится к физически дискретным единицам, подходящим в качестве единичных дозировок, каждая единица содержит определенное количество активного ингредиента, рассчитанное на достижение желаемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (с риской или покрытые оболочкой таблетки), капсулы, пилюли, пакеты с порошкообразными продуктами, облатки, суппозитории, инъецируемые растворы или суспензии и т.п. и их отдельные кратные единицы. Поскольку соединения согласно изобретению являются перорально вводимыми соединениями,фармацевтические композиции, содержащие вспомогательные соединения для перорального введения,являются наиболее эффективными. С целью повышения растворимости и/или стабильности соединений формулы (I) в фармацевтических композициях, может оказаться благоприятным использовать -, - или -циклодекстрины или их производные, в частности гидроксиалкилзамещенные циклодекстрины, например 2-гидроксипропил-циклодекстрин или сульфобутилциклодекстрин. Кроме того, сорастворители, такие как спирты, могут улучшить растворимость и/или стабильность соединений согласно изобретению в фармацевтических композициях. Точная дозировка и частота введения зависят от конкретного используемого соединения формулы(I), конкретного состояния, подвергаемого лечению, тяжести состояния, подвергаемого лечению, возраста, массы, пола, степени нарушения и общего физического состояния конкретного пациента, а также от другого лекарственного средства, которое может принимать индивидуум, что хорошо известно специалисту в данной области. Кроме того, понятно, что указанное эффективное ежедневное количество может быть снижено или повышено в зависимости от ответа подвергаемого лечению субъекта и/или в зависимости от оценки врача, предписывающего соединения согласно настоящему изобретению. В зависимости от способа введения фармацевтическая композиция будет содержать от 0,05 до 99 мас.%, предпочтительно от 0,1 до 70 мас.%, более предпочтительно от 0,1 до 50 мас.% активного ингредиента и от 1 до 99,95 мас.%, предпочтительно от 30 до 99,9 мас.%, более предпочтительно от 50 до 99,9 мас.% фармацевтически приемлемого носителя, все проценты основаны на общей массе композиции. Количество соединения формулы (I), которое может быть комбинировано с материалом носителя для получения стандартной лекарственной формы, будет меняться в зависимости от заболевания, подвергаемого лечению, вида млекопитающего и отдельного способа введения. Однако в виде общего указания подходящие одноразовые дозы соединений согласно настоящему изобретению могут, например,предпочтительно включать от 0,1 до приблизительно 1000 мг активного соединения. Предпочтительная одноразовая доза составляет от 1 до приблизительно 500 мг. Более предпочтительная одноразовая доза составляет от 1 до приблизительно 300 мг. Еще более предпочтительная одно- 20019980 разовая доза составляет от 1 до приблизительно 100 мг. Такие одноразовые дозы могут быть введены более одного раза в день, например 2, 3, 4, 5 или 6 раз в день, но предпочтительно 1 или 2 раза в день, так что общая дозировка для взрослого человека массой 70 кг составляет от 0,001 до приблизительно 15 мг на 1 кг массы тела субъекта на одно введение. Предпочтительная дозировка составляет от 0,01 до приблизительно 1,5 мг на 1 кг массы тела субъекта на одно введение, и подобная терапия может продолжаться в течение ряда недель или месяцев и в некоторых случаях в течение нескольких лет. Понятно,однако, что заданный уровень дозы для любого конкретного пациента будет зависеть от ряда факторов,включающих активность конкретного используемого соединения; возраста, массы тела, общего здоровья, пола и питания индивидуума, подвергаемого лечению; времени и способа введения; скорости выведения; других лекарственных средств, которые ранее вводились; и тяжести конкретного заболевания,подвергаемого терапии, что является понятным специалисту в данной области. Стандартной дозировкой может быть одна таблетка, содержащая от 1 до приблизительно 100 мг или от 1 до приблизительно 300 мг, принимаемая один раз в день или много раз в день, или одна капсула или таблетка с медленным высвобождением, принимаемая один раз в день и содержащая пропорционально более высокое количество активного ингредиента. Эффект медленного высвобождения может быть достигнут благодаря материалам капсул, которые растворяются при различных значениях рН, благодаря капсулам, которые высвобождают медленно путем осмотического давления, или благодаря любым другим известным средствам контролируемого высвобождения. В некоторых случаях может оказаться необходимым использовать дозировки вне указанных диапазонов, что понятно специалистам в данной области. Кроме того, следует отметить, что клиницист или лечащий врач будет знать, как и когда начать, прервать, корректировать или завершить терапию в соответствии с реакцией отдельного больного. Как уже упоминалось, изобретение также относится к фармацевтической композиции, содержащей соединения согласно изобретению и одно или несколько других лекарственных средств, для лечения,предотвращения, контроля, уменьшения интенсивности заболеваний или состояний или снижения риска развития заболеваний или состояний, для которых соединения формулы (I) или другие лекарственные средства могут иметь применение, а также к использованию такой композиции для производства лекарственного средства. Использование такой композиции для производства лекарственного средства с целью лечения, предотвращения, контроля, уменьшения интенсивности заболеваний или состояний или снижения риска развития заболеваний или состояний, для которых соединения формулы (I) или другие лекарственные средства могут иметь применение, также предусмотрено изобретением. Настоящее изобретение также относится к комбинации соединения согласно настоящему изобретению и ортостерического агониста mGluR5. Настоящее изобретение также относится к такой комбинации для применения в качестве лекарственного средства. Настоящее изобретение также относится к продукту, содержащему(а) соединение согласно настоящему изобретению, его фармацевтически приемлемую соль или сольват и(b) ортостерический агонист mGluR5 в качестве комбинированного препарата для одновременного, раздельного или последовательного использования в лечении или предотвращении состояния у млекопитающего, включая человека, такого состояния, как, например, состояние, описанное выше, лечение или предотвращение которого осуществляется или облегчается благодаря нейромодуляторному эффекту аллостерических модуляторов mGluR5, в частности позитивных аллостерических модуляторов mGluR5. Различные лекарственные средства такой комбинации или продукта могут быть комбинированы в одном препарате вместе с фармацевтически приемлемыми носителями или разбавителями, или каждый из них может присутствовать в отдельном препарате вместе с фармацевтически приемлемыми носителями или разбавителями. Следующие примеры предназначены иллюстрировать, а не ограничивать объем настоящего изобретения. Экспериментальная часть Некоторые способы получения соединений согласно данному изобретению иллюстрированы в следующих примерах. Если не указано иное, все исходные материалы были получены от частных поставщиков и использованы без дополнительной очистки. В описании термин "THF" означает тетрагидрофуран (ТГФ), "ДМФ" означаетN,N-диметилформамид (ДМФ), "DCM" означает дихлорметан, "ACN" означает ацетонитрил, "AcOEt" означает этилацетат, "АсОН" означает уксусную кислоту, "EtOH" означает этанол, "МеОН" означает метанол, "RP" означает обращенную фазу (ОФ). Реакции под воздействием микроволнового излучения осуществляли в одномодовом реакторе: микроволновый реактор Initiator Sixty EXP (Biotage AB) или в многомодовом реакторе: MicroSYNTHLabstation (Milestone, Inc.). Тонкослойную хроматографию (ТСХ) осуществляли на пластинах с силикагелем 60 F254 (Merck),используя химически чистые растворители. Автоматизированную колоночную флэш-хроматографию осуществляли, используя готовые к подсоединению картриджи от компании Merck, на неодинаковом- 21019980 фазой) на системе SPOT или LAFLASH из Armen Instrument. Isolute SCX2 представляет собой картридж с сорбентом, основанным на силикагеле с химически связанной функциональной группой пропилсульфокислотой. А. Получение промежуточных соединений. Пример А 1. Получение промежуточного соединения 1. К смеси трет-бутилового эфира 2,4-диоксопиперидин-1-карбоновой кислоты (40 г, 187,58 ммоль) в четыреххлористом углероде (500 мл) добавляли N-бромсукцинимид (33,38 г, 187,58 ммоль) порциями,поддерживая температуру реакции в диапазоне 10-15 С. Затем смесь перемешивали при 10-15 С в течение 2 ч. Реакционную смесь оставляли нагреваться до комнатной температуры и растворители упаривали в вакууме. Полученный таким образом остаток растворяли в AcOEt и промывали H2O. Органический слой отделяли, сушили (Na2SO4), фильтровали и растворители упаривали в вакууме с получением 30 г(55%) рацемического промежуточного соединения 1, которое использовали на следующей стадии без дополнительной очистки. Пример А 2. Получение промежуточного соединения 2. Смесь промежуточного соединения 1 (25 г, 85,6 ммоль), тиомочевины (6,5 г, 85,6 ммоль) и NaHCO3(7,2 г, 85,6 ммоль) в EtOH (400 мл) нагревали при 80 С в течение 2,5 ч. Реакционную смесь затем охлаждали до комнатной температуры и твердые частицы отфильтровывали. Фильтрат упаривали в вакууме с получением остатка, который кристаллизовали из EtOH. Полученные таким образом желтые кристаллы отфильтровывали и сушили с получением 15 г (66%) промежуточного соединения 2. Пример A3. Получение промежуточного соединения 3. Раствор промежуточного соединения 2 (15 г, 55,6 ммоль) в 4 М растворе HCl в 1,4-диоксане(100 мл) перемешивали при комнатной температуре в течение 30 мин. Растворитель упаривали в вакууме с получением 10 г (95%) промежуточного соединения 3 в виде желтого порошка, который использовали на следующей стадии без дополнительной очистки. Пример А 4. Получение промежуточного соединения 4. Смесь промежуточного соединения 3 (8 г, 39,8 ммоль), бромида меди(II) (10,43 г, 46,68 ммоль) и 3-метил-1-нитрозооксибутана (6,8 г, 58,35 ммоль) в ACN (100 мл) перемешивали при комнатной температуре в течение 1,5 ч. Растворитель упаривали в вакууме. Полученный таким образом остаток растворяли в AcOEt и промывали Н 2 О. Органический слой отделяли, сушили (Na2SO4), фильтровали и растворители упаривали в вакууме с получением 5 г (55%) промежуточного соединения 4, которое использовали на следующей стадии без дополнительной очистки. Пример А 5. Получение промежуточного соединения 5.(2,0 г, 2,7 ммоль) в ТГФ (300 мл) добавляли к раствору промежуточного соединения 4 (7,5 г, 23,6 ммоль) в МеОН (300 мл). Смесь перемешивали при 50 С в течение ночи в атмосфере СО (2,5 МПа). Реакционную смесь охлаждали, фильтровали и растворитель упаривали в вакууме. Сырой продукт очищали колоночной флэш-хроматографией (силикагель; DCM в МеОН 100/1). Требуемые фракции собирали и растворители упаривали в вакууме с получением желтого твердого вещества, которое кристаллизовали из- 22019980 Пример А 6. Получение промежуточного соединения 6. Йодметан (4,4 мл, 70,68 ммоль) добавляли к суспензии промежуточного соединения 5 (10 г,47,12 ммоль) и Cs2CO3 (23 г, 70,68 ммоль) в ДМФ (118 мл) и смесь перемешивали при комнатной температуре в течение 60 ч в атмосфере азота. Реакционную смесь разбавляли H2O и экстрагировали AcOEt. Органический слой отделяли, сушили (Na2SO4), фильтровали и растворители упаривали в вакууме. Сырой продукт очищали колоночной флэш-хроматографией (силикагель; AcOEt в DCM от 0/100 до 50/50). Требуемые фракции собирали и растворители упаривали в вакууме с получением промежуточного соединения 6 (4,46 г, 42%) в виде светло-коричневого твердого маслянистого вещества. Пример А 7. Получение промежуточного соединения 7. Боргидрид натрия (0,15 г, 4,0 ммоль) добавляли к перемешиваемому раствору промежуточного соединения 6 (0,65 г, 2,87 ммоль) в ТГФ (8,8 мл) и МеОН (8,8 мл). Смесь перемешивали при 0 С в течение 30 мин в запаянной трубке в атмосфере азота и затем разбавляли H2O и экстрагировали DCM. Органический слой отделяли, сушили (Na2SO4), фильтровали и растворители упаривали в вакууме. Водную фазу подкисляли 3 н. раствором HCl и экстрагировали DCM. Два органических слоя объединяли, сушили(Na2SO4), фильтровали и растворители упаривали в вакууме. Сырой продукт очищали колоночной флэшхроматографией (силикагель; МеОН в AcOEt от 0/100 до 20/80). Требуемые фракции собирали и растворители упаривали в вакууме с получением промежуточного соединения 7 (0,59 г, 99%) в виде темного масла. Пример А 8. Получение промежуточного соединения 8. Промежуточное соединение 8 получали согласно методике синтеза, описанной в примере А 7, из промежуточного соединения 5. Пример А 9. Получение промежуточного соединения 9. К раствору 4-фторанилина (11,5 мл, 121,4 ммоль) в АсОН (7 мл) добавляли этилакрилат (15,85 мл,145,68 ммоль). Смесь перемешивали при 90 С в течение 18 ч в запаянной трубке. Реакционную смесь оставляли нагревать до комнатной температуры и затем выливали в охлажденную воду, подщелачивали путем добавления 10%-ного раствора Na2CO3 и экстрагировали DCM. Органический слой отделяли, сушили (Na2SO4), фильтровали и растворители упаривали в вакууме. Остаток очищали колоночной флэшхроматографией (силикагель; AcOEt в гептане от 0/100 до 10/90). Требуемые фракции собирали и растворители упаривали в вакууме с получением 24,6 г (66%) промежуточного соединения 9. Пример А 10. Получение промежуточного соединения 10. К раствору промежуточного соединения 9 (10 г, 47,34 ммоль) в DCM (10 мл) добавляли этилмалонилхлорид (7,88 мл, 61,54 ммоль) и N,N-диизопропилэтиламин (16,49 мл, 94,68 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч и затем разбавляли дополнительным количествомDCM и промывали насыщенным раствором NH4Cl. Органический слой отделяли, сушили (Na2SO4),фильтровали и растворитель упаривали в вакууме. Сырой продукт очищали колоночной флэш- 23019980 хроматографией (силикагель; AcOEt в гептане от 0/100 до 20/80). Требуемые фракции собирали и растворители упаривали в вакууме с получением 11 г (71%) промежуточного соединения 10 в виде оранжевого масла. Пример A11. Получение промежуточного соединения 11. Смесь промежуточного соединения 10 (6,27 г, 19,27 ммоль) в 21%-ном растворе этилата натрия вEtOH (14,39 мл, 38,55 ммоль) перемешивали при 85 С в течение 16 ч. Растворитель упаривали в вакууме и остаток распределяли между AcOEt и Н 2 О. Водный слой отделяли, подкисляли путем добавления 1 н. раствора HCl и экстрагировали DCM. Органический слой отделяли, сушили (Na2SO4), фильтровали и растворитель упаривали в вакууме с получением 5 г (93%) промежуточного соединения 11, используемого на следующей стадии без дополнительной очистки. Пример А 12. Получение промежуточного соединения 12. Раствор промежуточного соединения 11 (7,5 г, 26,86 ммоль) в смеси АсОН (0,6 мл) и Н 2 О (59,4 мл) перемешивали при 90 С в течение 16 ч. Реакционную смесь сушили (MgSO4), фильтровали и растворители упаривали в вакууме с получением 5,5 г (99%) промежуточного соединения 12, которое использовали на следующей стадии без дополнительной очистки. Пример А 13. Получение промежуточного соединения 13. К раствору промежуточного соединения 12 (5,5 г, 26,54 ммоль) в DCM (60 мл) при 0 С добавлялиN-бромсукцинимид (5,2 г, 29,2 ммоль). Смесь перемешивали при 0 С в течение 30 мин и растворитель упаривали в вакууме с получением 7,7 г (100%) промежуточного соединения 13, используемого на следующей стадии без дополнительной очистки. Следующие промежуточные соединения были получены согласно методике синтеза, описанной в примерах А 9-А 13. Пример А 14. Получение промежуточного соединения 14 из (R)-(-)-3,3-диметил-2-бутиламина и этилакрилата. Пример А 15. Получение промежуточного соединения 15 из 2,4-фторанилина и этилакрилата. Пример А 16. Получение промежуточного соединения 16 из 2-метоксианилина и этилакрилата. Пример А 17. Получение промежуточного соединения 17 из циклопропиламина и этилакрилата. Пример А 18. Получение промежуточного соединения 18 из 2-амино-5-фторпиридина и этилакрилата. Пример А 19. Получение промежуточного соединения 19 из циклопропилэтиламина и этилакрилата. Пример А 20. Получение промежуточного соединения 20 из изопропиламина и этилакрилата. Пример А 21. Получение промежуточного соединения 21. Смесь промежуточного соединения 13 (4,14 г, 14,48 ммоль), тиомочевины (1,1 г, 14,48 ммоль) иNaHCO3 (1,22 г, 14,48 ммоль) в EtOH (60 мл) нагревали при 80C в течение 1 ч. Реакционную смесь затем охлаждали до комнатной температуры и твердые частицы отфильтровывали. Фильтрат упаривали в вакууме с получением 3,1 г (81%) промежуточного соединения 21, используемого на следующей стадии без дополнительной очистки. Пример А 22. Получение промежуточного соединения 22. Смесь промежуточного соединения 21 (3 г, 11,39 ммоль), бромида меди(II) (3,05 г, 13,67 ммоль) и 3 метил-1-нитрозооксибутана (2,3 мл, 17,09 ммоль) в ACN (80 мл) перемешивали при комнатной температуре в течение 45 мин. Реакционную смесь затем концентрировали в вакууме. Полученный таким образом остаток распределяли между AcOEt и Н 2 О. Органический слой отделяли, сушили (Na2SO4), фильтровали и растворитель упаривали в вакууме. Остаток очищали колоночной флэш-хроматографией (силикагель; AcOEt в гептане от 0/100 до 30/70). Требуемые фракции собирали и растворители упаривали в вакууме с получением 1,2 г (32%) промежуточного соединения 22 в виде белого твердого вещества. Пример А 23. Получение промежуточного соединения 23. Смесь промежуточного соединения 13 (11,8 г, 41,3 ммоль), этил тиооксамата (5,5 г, 41,3 ммоль) иNaHCO3 (8,7 г, 82 ммоль) в EtOH (400 мл) перемешивали при 80C в течение 2 ч. Реакционную смесь охлаждали, фильтровали и растворитель упаривали в вакууме. Сырой продукт очищали колоночной флэш-хроматографией (силикагель; AcOEt в петролейном эфире от 10/1 до 2/1). Требуемые фракции собирали и растворители упаривали в вакууме с получением 2 г (15%) промежуточного соединения 23. Пример А 24. Получение промежуточного соединения 24. Боргидрид натрия (0,7 г, 18,7 ммоль) добавляли к раствору промежуточного соединения 23 (2 г,6,3 ммоль) в МеОН (50 мл) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, реакцию гасили H2O и смесь экстрагировали AcOEt. Органический слой отделяли, сушили(Na2SO4), фильтровали и растворители упаривали в вакууме. Сырой продукт очищали колоночной флэшхроматографией (силикагель; AcOEt в петролейном эфире от 4/1 до 1/2). Требуемые фракции собирали и растворители упаривали в вакууме с получением 1 г (53%) промежуточного соединения 24 в виде твер- 25019980 дого вещества. Следующее промежуточное соединение было получено согласно методике синтеза, описанной в примере А 21-А 24. Пример А 25. Получение промежуточного соединения 25 из промежуточного соединения 14. Пример А 26. Получение промежуточного соединения 26.(10 мл). Смесь перемешивали при комнатной температуре в течение 2 ч и растворители упаривали в вакууме с получением 1 г (100%) промежуточного соединения 26, которое использовали на следующей стадии без дополнительной очистки. Следующее промежуточное соединение было получено согласно методике синтеза, описанной в примере А 26. Пример А 27. Получение промежуточного соединения 27 из промежуточного соединения А 25. Следующие промежуточные соединения были получены согласно методикам синтеза, описанным в примерах А 21-А 24, А 26. Пример А 28. Получение промежуточного соединения 28 из промежуточного соединения 15. Пример А 29. Получение промежуточного соединения 29 из промежуточного соединения 16. Пример A30. Получение промежуточного соединения 30 из промежуточного соединения 17. Пример А 31. Получение промежуточного соединения 31.N-Бромсукцинимид (2,88 г, 16,17 ммоль) добавляли порциями к перемешиваемому раствору 1-(4-метоксибензил)азепан-2,4-диона (получен согласно методике, описанной в публикации Synthesis,2006, 14, 2319-2322, 4,0 г, 16,17 ммоль) и NaHSO4 Н 2 О (0,67 г, 4,85 ммоль) в безводном ТГФ (80 мл) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч и растворитель упаривали в вакууме с получением 8 г (91%, 60% чистоты) промежуточного соединения 31 в виде вязкого оранжевого масла, которое использовали на следующей стадии без дополнительной очистки.- 26019980 Пример A32. Получение промежуточного соединения 32. Смесь промежуточного соединения 31 (0,78 г, 2,38 ммоль) и 2-фенокситиоацетамида (0,36 г,2,14 ммоль) в ДМФ (12,5 мл) перемешивали при комнатной температуре в течение 15 мин. ЗатемNaHCO3 (0,32 г, 3,81 ммоль) добавляли и реакционную смесь перемешивали при 100 С в течение 30 мин. Реакционную смесь разбавляли H2O и экстрагировали AcOEt. Органический слой отделяли, сушили(Na2SO4), фильтровали и растворители упаривали в вакууме. Сырой продукт очищали колоночной флэшхроматографией (силикагель; DCM в гептане от 0/100 до 100/0). Требуемые фракции собирали и растворители упаривали в вакууме с получением 58 г (62%) промежуточного соединения 32 в виде оранжевого масла. В. Получение конечных соединений. Пример B1. Получение соединения 1. Бензиловый спирт (0,38 мл, 3,67 ммоль) добавляли по каплям к 60%-ной дисперсии гидрида натрия в минеральных маслах (0,183 г, 4,58 ммоль) в ТГФ (12 мл) в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 15 мин и затем добавляли промежуточное соединение 22 (1 г,3,06 ммоль). Смесь перемешивали при 120 С в течение 25 мин в запаянной трубке при воздействии микроволнового излучения. Смесь распределяли между DCM и H2O. Органический слой отделяли, сушили(MgSO4), фильтровали и растворитель упаривали в вакууме. Сырой продукт очищали колоночной флэшхроматографией (силикагель; AcOEt в DCM в гептане от 0/0/100 до 10/10/80). Требуемые фракции собирали и упаривали в вакууме с получением 0,68 г (63%) соединения 1 в виде белого твердого вещества. Ди-трет-бутил азодикарбоксилат (3,0 г, 13,0 ммоль) добавляли к перемешиваемому раствору промежуточного соединения 8 (2,0 г, 10,8 ммоль), фенола (1,20 г, 13,0 ммоль) и трифенилфосфина (3,4 г,13,0 ммоль) в ТГФ (31 мл) в запаянной трубке и в атмосфере азота. Смесь перемешивали при 120C в течение 20 мин при воздействии микроволнового излучения и затем растворитель упаривали в вакууме. Сырой продукт очищали колоночной флэш-хроматографией (силикагель; 7 М раствор аммиака в метаноле в DCM от 0/100 до 5/95). Требуемые фракции собирали и растворители упаривали в вакууме с получением (1,82 г, 64% выход, 69% чистоты). Часть продукта (0,14 г) вновь подвергали очистке ВЭЖХ (градиентное элюирование: 0,1% ТФУ в ACN/0,1% ТФУ в H2O). Требуемые фракции собирали и растворители упаривали в вакууме с получением соединения 2 (51 мг) в виде белого твердого вещества. Дисперсию 60% гидрида натрия в минеральных маслах (0,034 г, 0,86 ммоль) добавляли к раствору соединения 2 (0,15 г, 0,57 ммоль) в ДМФ (2,5 мл) при 0 С и смесь перемешивали при комнатной температуре в течение 1 ч. Затем 4-(бромметил)тетрагидропиран (0,15 г, 0,57 ммоль) добавляли и смесь перемешивали при комнатной температуре в течение 16 ч, разбавляли H2O и экстрагировали AcOEt. Органический слой отделяли, сушили (Na2SO4), фильтровали и растворители упаривали в вакууме. Сырой продукт очищали колоночной флэш-хроматографией (силикагель; 7 М раствор аммиака в МеОН в DCM от 0/100 до 4/96). Требуемые фракции собирали и растворители упаривали в вакууме. Полученный продукт- 27019980 растирали в DIPE и вновь подвергали очистке путем ОФ-ВЭЖХ (80% 0,1% NH4CO3H/NH4OH pH 9 раствор в Н 2 О, от 20% ACN до 0% 0,1% NH4CO3H/NH4OH pH 9 раствор в Н 2 О, 100% ACN) с получением соединения 3 (0,027 г, 13% выход) в виде белого твердого вещества. 2-Бромэтилметиловый эфир (0,081 мл, 0,86 ммоль) добавляли к суспензии соединения 2 (0,15 г,0,57 ммоль) и Cs2CO3 (0,28 г, 0,86 ммоль) в ДМФ (2,5 мл) и затем смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Смесь затем перемешивали при 100 С в течение 1 ч, разбавляли H2O и экстрагировали AcOEt. Органический слой отделяли, промывали насыщенным раствором соли, сушили (Na2SO4), фильтровали и растворители упаривали в вакууме. Сырой продукт очищали колоночной флэш-хроматографией (силикагель; AcOEt в DCM от 0/100 до 50/50). Требуемые фракции собирали и растворители упаривали в вакууме. Продукт растирали в DIPE с получением соединения 4(0,09 г, 49% выход) в виде желтого твердого вещества.K2CO3 (0,16 г, 1,15 ммоль) добавляли к перемешиваемой суспензии соединения 2 (0,15 г,0,57 ммоль), 2-бром-5-метилпиридина (0,10 г, 0,57 ммоль), йодида меди(I) (0,022 г, 0,11 ммоль) иN,N'-диметилэтилендиамина (0,037 мл, 0,34 ммоль) в толуоле (3 мл) в запаянной трубке и в атмосфере азота. Смесь перемешивали при 120 С в течение 16 ч, фильтровали через слой диатомовой земли, промывали AcOEt и фильтрат упаривали в вакууме. Сырой продукт очищали колоночной флэшхроматографией (силикагель; AcOEt в DCM от 0/100 до 100/0). Требуемые фракции собирали и растворители упаривали в вакууме. Продукт вновь подвергали очистке посредством ионообменной хроматографии, используя картридж Isolute SCX2 и элюируя 7 М раствором аммиака в МеОН. Затем продукт вновь подвергали очистке колоночной флэш-хроматографией (силикагель; AcOEt в DCM от 0/100 до 50/50). Требуемые фракции собирали и концентрировали в вакууме. Остаток очищали ОФ-ВЭЖХ (градиент от 80% 0,1% NH4CO3H/NH4OH рН 9 раствор в H2O, от 20% ACN до 0% 0,1% NH4CO3H/NH4OH рН 9 раствор в H2O, 100% ACN) с получением соединения 6 (16 мг, 8% выход) в виде белого твердого вещества. 4-Фторфенол (0,15 г, 1,30 ммоль) добавляли к перемешиваемому раствору промежуточного соединения 26 (0,33 г, 1,34 ммоль) и K2CO3 (0,41 г, 3,0 ммоль) в ДМФ (40 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 дня, фильтровали и растворитель упаривали в вакууме. Остаток очищали ОФ-ВЭЖХ (градиентное элюирование: 0,1% ТФУ в ACN/0,1% ТФУ в Н 2 О). Требуемые фракции собирали, промывали насыщенным раствором NaHCO3 и экстрагировали AcOEt. Объединенные органические слои отделяли, сушили (Na2SO4), фильтровали и растворители упаривали в вакууме с получением соединения 6 (74 мг, 20% выход) в виде твердого вещества. Диэтилазодикарбоксилат (0,4 г, 2,2 ммоль) добавляли к перемешиваемому раствору трифенилфосфина (0,54 г, 2,1 ммоль) в ТГФ (10 мл) в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 10 мин с последующим добавлением промежуточного соединения 25 (0,3 г, 1,1 ммоль) и 3-фторфенила (0,3 г, 2,6 ммоль), затем смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель упаривали в вакууме и сырой продукт очищали колоночной флэш-хроматографией (силикагель; AcOEt в петролейном эфире от 1/15 до 1/10). Требуемые фракции собирали и растворители упаривали в вакууме с получением соединения 7 (0,065 г, 16% выход) в виде белого твердого вещества. Ди-трет-бутилазодикарбоксилат (0,48 г, 2,12 ммоль) добавляли к перемешиваемому раствору трифенилфосфина (0,55 г, 2,12 ммоль), промежуточного соединения 7 (0,35 г, 1,76 ммоль) и фенола (0,2 г,2,12 ммоль) в ТГФ (7,2 мл). Смесь перемешивали при 0C в течение 5 мин и затем при комнатной температуре в течение 2 ч в запаянной трубке в атмосфере азота. Затем ди-трет-бутилазодикарбоксилат (0,20 г,0,42 ммоль), трифенилфосфин (0,23 г, 0,42 ммоль), фенол (0,08 г, 0,42 ммоль) добавляли вновь, и образовавшуюся смесь перемешивали при 0C в течение 5 мин, при комнатной температуре в течение 1 ч. Растворитель упаривали в вакууме и сырой продукт очищали колоночной флэш-хроматографией (силикагель; AcOEt в DCM от 0/100 до 40/60). Требуемые фракции собирали и растворители упаривали в вакууме с получением продукта, который растирали в DIPE с получением соединения 8 (0,26 г, 53% выход) в виде белого твердого вещества. Смесь промежуточного соединения 13 (0,41 г, 1,45 ммоль) и 2-фенокситиоацетамида (0,22 г,1,3 ммоль) в ДМФ (5 мл) перемешивали при комнатной температуре в течение 15 мин до добавленияNaHCO3 (0,19 г, 2,3 ммоль). Смесь перемешивали при 100 С в течение 30 мин, разбавляли AcOEt и промывали Н 2 О. Органический слой отделяли, сушили (MgSO4), фильтровали и фильтрат упаривали в вакууме. Продукт очищали колоночной флэш-хроматографией (силикагель; AcOEt в DCM от 100/0 до 98/2). Требуемые фракции собирали и упаривали в вакууме с получением соединения 9 (0,084 г, 16% выход) в виде белого твердого вещества. Раствор аммоний-церий(IV) нитрата (1,08 г, 1,97 ммоль) в H2O (1,5 мл) добавляли к перемешиваемому раствору промежуточного соединения 32 (0,22 г, 0,56 ммоль) в ACN (5 мл). Смесь перемешивали при комнатной температуре в течение 16 ч и затем разбавляли H2O и экстрагировали AcOEt. Органический слой отделяли, сушили (Na2SO4), фильтровали и растворители упаривали в вакууме. Сырой продукт очищали колоночной флэш-хроматографией (силикагель; AcOEt в DCM от 0/100 до 100/0). Требуемые
МПК / Метки
МПК: A61K 31/428, A61P 25/18, C07D 513/04, A61K 31/429
Метки: mglur5, качестве, аллостерических, модуляторов, тиазолы, рецепторов, бициклические
Код ссылки
<a href="https://eas.patents.su/30-19980-biciklicheskie-tiazoly-v-kachestve-allostericheskih-modulyatorov-receptorov-mglur5.html" rel="bookmark" title="База патентов Евразийского Союза">Бициклические тиазолы в качестве аллостерических модуляторов рецепторов mglur5</a>
Предыдущий патент: Пьезохромный защитный элемент
Следующий патент: Способ удаления соединений серы, содержащихся в жаропрочном бетоне
Случайный патент: Способ и устройство для непрерывного контроля внутренних областей оборудования и трубопроводов бензохранилища