Антагонисты киназы
Формула / Реферат
1. Соединение, выбранное из соединений, имеющих следующую формулу:
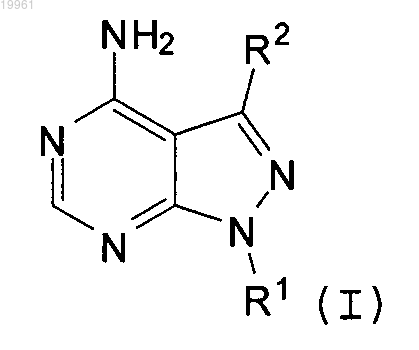
где R1 представляет собой водород, R3-замещенный или незамещенный C1-C8-алкил, незамещенный C5-C7-циклоалкил или незамещенный 5-7-членный гетероциклоалкил;
R2 представляет собой R4-замещенный гетероарил, который имеет 2-3 конденсированных кольца, которые содержат 1-4 гетероатома, выбранных из N, О и S;
R3 представляет собой галоген, -CN, -OR5, -S(O)nR6, -NR7R8, -C(O)R9, -NR10-C(O)R11, -NR12-C(O)-OR13,
-С(O)NR14R15, -NR16S(O)2R17, R19-замещенный или незамещенный C1-C8-алкил, R19-замещенный или незамещенный 2-8-членный гетероалкил, R19-замещенный или незамещенный C5-C7-циклоалкил или R19-замещенный или незамещенный 5-7-членный гетероциклоалкил, где n равен целому числу от 0 до 2;
R4 представляет собой галоген, -OR20 или -NR22R23;
R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16 и R17 представляют собой независимо водород, R35-замещенный или незамещенный C1-C8-алкил, R35-замещенный или незамещенный 2-8-членный гетероалкил, незамещенный C5-C7-циклоалкил, R35-замещенный или незамещенный 5-7-членный гетероциклоалкил;
R19 и R35 независимо представляют собой водород, галоген, незамещенный C1-C8-алкил, незамещенный 2-8-членный гетероалкил, незамещенный C5-C7-циклоалкил, незамещенный 5-7-членный гетероциклоалкил;
R20, R22 и R23 независимо представляют собой водород.
2. Соединение по п.1, в котором R2 представляет собой

где W1, W2, W3 и W4 независимо представляют собой =CH-, =CR4- или =N- и
кольцо А представляет собой частично или полностью ненасыщенное 6- или 7-членное кольцо.
3. Соединение по любому из пп.1, 2, где R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16 и R17 представляют собой независимо водород, незамещенный C1-C8-алкил, незамещенный 2-8-членный гетероалкил, незамещенный C5-C7-циклоалкил или незамещенный 5-7-членный гетероциклоалкил.
4. Соединение по любому из пп.1-3, где R1 представляет собой R3-замещенный или незамещенный C1-C8-алкил или незамещенный 5-7-членный гетероциклоалкил.
5. Соединение по любому из пп.1-4, где R1 представляет собой R3-замещенный или незамещенный C1-C8-алкил.
6. Соединение по любому из пп.1-5, где R1 представляет собой R3-замещенный или незамещенный C1-C4-алкил.
7. Соединение по любому из пп.1-5, где R1 представляет собой метил или незамещенный разветвленный C3-C6-алкил.
8. Соединение по любому из пп.1-7, где R1 представляет собой изопропил.
9. Соединение по любому из пп.1, 2, где R3 представляет собой R19-замещенный или незамещенный C1-C8-алкил или R19-замещенный или незамещенный C5-C7-циклоалкил.
10. Соединение по любому из пп.1-9, где R19 представляет собой незамещенный C1-C8-алкил или незамещенный C5-C7-циклоалкил.
11. Соединение по любому из пп.1-10, где R19 представляет собой незамещенный C1-C4-алкил или незамещенный циклопентил.
12. Соединение по п.1, где R2 представляет собой R4-замещенный или незамещенный индолил, R4-замещенный или незамещенный бензоксадиазолил, R4-замещенный или незамещенный бензодиоксолил, R4-замещенный или незамещенный бензодиоксанил, R4-замещенный или незамещенный тианафтанил, R4-замещенный или незамещенный пирролопиридинил, R4-замещенный или незамещенный индазолил, R4-замещенный или незамещенный тетрагидронафталинил, R4-замещенный или незамещенный хинолинил, R4-замещенный или незамещенный хиноксалинил, R4-замещенный или незамещенный пиридопиразинил, R4-замещенный или незамещенный хиназолинонил, R4-замещенный или незамещенный хроменонил, R4-замещенный или незамещенный бензоизоксазолил, R4-замещенный или незамещенный имидазопиридинил, R4-замещенный или незамещенный бензофуранил или R4-замещенный или незамещенный бензотиофенил.
13. Соединение по п.12, где R2 представляет собой R4-замещенный индолил.
14. Соединение по п.12, где R2 представляет собой 5-гидроксииндол-2-ил и R1 представляет собой изопропил.
15. Фармацевтическая композиция, содержащая соединение по любому из пп.1-14 и фармацевтически приемлемый эксципиент.
16. Применение соединения по любому из пп.1-14 для лечения заболевания, опосредуемого активностью PI3-киназы или активностью PI3-киназы и активностью тирозинкиназы, у человека или животного.
17. Способ лечения заболевания, опосредуемого активностью PI3-киназы или активностью PI3-киназы и активностью тирозинкиназы, у субъекта, нуждающегося в таком лечении, причем указанный способ включает введение указанному субъекту терапевтически эффективного количества соединения по любому из пп.1-14.
18. Способ лечения нарушения резорбции костей, аномального воспаления, аутоиммунного заболевания, тромбоза, астмы или рака у субъекта, нуждающегося в таком лечении, причем указанный способ включает введение указанному субъекту терапевтически эффективного количества соединения по любому из пп.1-14.
19. Способ по п.18, где рак выбирают из группы, включающей метастазы рака; лейкоз; карциномы; саркомы; рак головного мозга, шейки матки, головы и шеи, почек, легких, меланому, мезотелиому, рак желудка или матки; медуллобластому, болезнь Ходжкина, неходжкинскую лимфому, множественную миелому, рак яичников, рабдомиосаркому, первичный тромбоцитоз, первичную макроглобулинемию, первичные опухоли головного мозга, злокачественную панкреатическую инсуланому, злокачественный карциноид, рак мочевого пузыря, предзлокачественные повреждения кожи, тестикулярный рак, лимфомы, рак щитовидной железы, нейробластому, рак пищевода, рак мочеполового тракта, злокачественную гиперкальциемию, внутриматочный рак, адренальный кортикальный рак, новообразования эндокринного и экзокринного отделов поджелудочной железы, рак простаты, рак печени, рак толстой кишки, рак молочной железы, острый миелоидный лейкоз, хронический миелоидный лейкоз или немелкоклеточный рак легких.
20. Применение соединения по любому из пп.1-14 для получения лекарственного средства для лечения заболевания, опосредуемого активностью PI3-киназы, или заболевания, опосредуемого активностью PI3-киназы и активностью тирозинкиназы.
21. Применение соединения по любому из пп.1-14 для получения лекарственного средства для лечения резорбции костей, аномального воспаления, аутоиммунного заболевания, тромбоза, астмы или рака.
22. Применение по п.21, где рак выбирают из группы, включающей метастазы рака; лейкоз; карциномы; саркомы; рак головного мозга, шейки матки, головы и шеи, почек, легких, меланому, мезотелиому, рак желудка или матки; медуллобластому, болезнь Ходжкина, неходжкинскую лимфому, множественную миелому, рак яичников, рабдомиосаркому, первичный тромбоцитоз, первичную макроглобулинемию, первичные опухоли головного мозга, злокачественную панкреатическую инсуланому, злокачественный карциноид, рак мочевого пузыря, предзлокачественные повреждения кожи, тестикулярный рак, лимфомы, рак щитовидной железы, нейробластому, рак пищевода, рак мочеполового тракта, злокачественную гиперкальциемию, внутриматочный рак, адренальный кортикальный рак, новообразования эндокринного и экзокринного отделов поджелудочной железы, рак простаты, рак печени, рак толстой кишки, рак молочной железы, острый миелоидный лейкоз, хронический миелоидный лейкоз или немелкоклеточный рак легких.
Текст
Изобретение относится к новым соединениям формулы (I) где R1 и R2 имеют значения, указанные в формуле изобретения, фармацевтической композиции на их основе. Соединения формулы (I) являются антагонистами РI3-киназы, РI3-киназы и тирозинкиназы и полезны для лечения заболеваний, опосредуемых активностью РI3-киназы или активностью РI3-киназы и активностью тирозинкиназы, таких как нарушение резорбции костей, аномальное воспаление, аутоиммунное заболевание, тромбоз, астма или рак.(71)(73) Заявитель и патентовладелец: ДЗЕ РИДЖЕНТС ОФ ДЗЕ ЮНИВЕРСИТИ ОФ КАЛИФОРНИЯ Уровень техники изобретения Фосфоинозитид-3-киназы (PI3-K) катализируют синтез вторичных мессенджеров фосфатидилинозита (PI): PI(3)Р, PI(3, 4)Р 2 и PI(3, 4, 6)P3 (PIP3) (Fruman et al., 1998). В этой связи указанные три липида регулируют различные физиологические процессы, включая рост, выживание, дифференциацию и хемотаксис клеток (Katso et al., 2001). Семейство PI3-K включает 15 киназ с различными субстратными специфичностями, картинами экспрессии и способами регуляции (Katso et al., 2001). PI3-K (p110, p110,р 110 и p110) класса I активируются тирозинкиназами или связанными с G-белком рецепторами для генерации PIP3, который далее вовлекает в процесс эффекторы, такие как путь Akt/PDK1, киназы семейства Тес и ГТФазы семейства Rho. PI3-K классов II и III играют ключевую роль во внутриклеточной направленной миграции посредством синтеза PI(3)Р и PI(3, 4)P2. PIKK являются протеинкиназами, которые регулируют рост клеток (mTORC1) или проводят мониторинг геномной целостности (ATM, ATR,ДНК-PK и hSmg-1). Важность указанных ферментов в другой патофизиологии сделало семейство PI3-K фокусом большого интереса в качестве нового класса мишеней лекарственных средств (Ward et al., 2003). Данный интерес был подогрет последним открытием, что p110 часто мутирует в первичных опухолях (Samuels etal., 2004), и доказательством, что липидфосфатаза PTEN, ингибитор сигнальной PI3-K, обычно инактивируется супрессором опухоли (Cantley and Neel, 1999). Усилия направлены на разработку ингибиторовPI3-K в виде малых молекул для лечения воспалительных и аутоиммунных заболеваний (р 110, p110 иmTOR), тромбоза (р 110), вирусной инфекции (PIKK) и рака (p110, mTOR и др.). Недавно описаны первые селективные ингибиторы указанных ферментов (Camps et al., 2005; Condliffe et al., 2005; Jacksonet al., 2005; Knight et al., 2004; Lau et al., 2005; Sadhu et al., 2003). Протеинкиназы, протеинсерин/треонинкиназы и липидкиназы являются различными классами белков, которые играют критические роли в регуляции и пролиферации клеточной активности. Малые молекулы, которые ингибируют указанные классы белков, обладают потенциалом для нарушения дисфункциональных/патологических путей в двух разных точках. Известно, что, например, передача сигнала посредством рецепторов тирозинкиназ дезрегулируется в нескольких типах раковых заболеваний. Этот путь передачи сигнала включает белки последующих событий, такие как PI3-киназа. Известно, что передача сигнала посредством серин/треонинпротеинкиназы mTOR (известной также в качестве мишени рапамицина млекопитающих) регулирует рост клеток, пролиферацию клеток, подвижность клеток, выживание клеток, синтез и транскрипцию белков. Нарушение пути mTOR подразумевается как содействующий фактор для различных процессов заболеваний людей, особенно различных типов рака. Ингибитор,который блокирует активность протеинтирозинкиназы и PI3-киназы, mTOR и PI3-киназы или mTOR,протеинтирозинкиназы и PI3-киназы, обладает потенциалом для остановки аберрантной передачи сигнала на двух или трех различных уровнях. Сдвоенное или утроенное ингибирование малой молекулой может повысить активность лекарственного средства, повышая, тем самым, терапевтический потенциал соединения. Настоящее изобретение удовлетворяет эти и другие потребности в данной области предоставлением нового класса антагонистов PI3-киназы, антагонистов PI3-киназы и тирозинкиназы, антагонистов PI3 киназы и mTOR и антагонистов PI3-киназы, mTOR и тирозинкиназы. Краткая сущность изобретения Обнаружено, что соединения, описанные здесь, являются сильнодействующими антагонистами PI3 киназы, PI3-киназы и тирозинкиназы, PI3K-киназы и mTOR или PI3-киназы, mTOR и тирозинкиназы. В одном аспекте настоящее изобретение относится к соединениям формулы (I)-NR -C(O)-OR13, -С(O)NR14R15, -NR16S(O)2R17, R19-замещенный или незамещенный C1-C8-алкил, R19 замещенный или незамещенный 2-8-членный гетероалкил, R19-замещенный или незамещенныйC5-C7-циклоалкил или R19-замещенный или незамещенный 5-7-членный гетероциклоалкил, где n равен целому числу от 0 до 2;R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16 и R17 представляют собой независимо водород,35R19 и R35 независимо представляют собой водород, галоген, незамещенный C1-C8-алкил, незамещенный 2-8-членный гетероалкил, незамещенный C5-C7-циклоалкил, незамещенный 5-7-членный гетероциклоалкил;R20, R22 и R23 независимо представляют собой водород. В следующем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) и фармацевтически приемлемый эксципиент. В другом аспекте настоящее изобретение относится к применению соединения формулы (I) в способе лечения заболевания, опосредуемого активностью PI3-киназы или активностью PI3-киназы и активностью тирозинкиназы, у человека или животного. В другом аспекте настоящее изобретение относится к способу лечения заболевания, опосредуемого активностью PI3-киназы, активностью PI3-киназы и активностью тирозинкиназы, у субъекта, нуждающегося в таком лечении. Способ включает введение субъекту терапевтически эффективного количества соединения настоящего изобретения (т.е. антагонистов, связывающих "карман" аффинности PI3-киназы,или антагониста формулы (I. В следующем аспекте настоящее изобретение относится к способу лечения нарушения резорбции костей, аномального воспаления, аутоиммунного заболевания, тромбоза, астмы или рака у субъекта, нуждающегося в таком лечении, причем указанный способ включает введение указанному субъекту терапевтически эффективного количества соединения формулы (I). В другом аспекте настоящее изобретение относится к применению соединения формулы (I) для получения лекарственного средства для лечения заболевания, опосредуемого активностью PI3-киназы, или заболевания, опосредуемого активностью PI3-киназы и активностью тирозинкиназы. В следующем аспекте настоящее изобретение относится к применению соединения формулы (I) для получения лекарственного средства для лечения резорбции костей, аномального воспаления, аутоиммунного заболевания, тромбоза, астмы или рака. Краткое описание графических материалов На фиг. 1 иллюстрируются структуры репрезентативных соединений из одиннадцати хемотипов ингибиторов PI3-K. На фиг. 2 иллюстрируются структуры изоформ-селективных ингибиторов PI3-K: А - структура АТФ в активном сайте р 110, где выделены различные области АТФ-связывающего"кармана"; В - согласование всех описанных сокристаллических структур PI3-K-ингибитор. Met 804 принимаетup-конформацию во всех структурах, за исключением PIK-39; С - структуры или модели изоформ-селективных ингибиторов PI3-K, связанных с p110;D - структуры или модели полимишеневых ингибиторов PI3-K, связанных с p110. На фиг. 3 иллюстрируется зондирование селективности и "кармана" аффинности PI3-киназы: А - структура PIK-39, связанного с p110, предполагает модель для связывания IC87114. PIK-293 иPIK-294 являются пиразолопиримидиновыми аналогами IC87114. PIK-294 вдвигает м-фенол в карман аффинности, и это соединение является более сильнодействующим против PI3-K класса I; В - (слева) отношение величин IC50 ингибиторов для мутантного р 110 и р 110 дикого типа иp110/многомишеневых ингибиторов; (центр) кривые зависимости от дозы для связывания двух ингибиторов р 110 для дикого типа: M752I и M752V р 110; (справа) модели, предполагающие влияние мутацийM752I и M752V в р 110 на связывание различных классов ингибиторов. Фиг. 4. Структуры дополнительных ингибиторов PI3-K и неактивных аналогов. Фиг. 5. Величины IC50 (мкМ) для выбранных ингибиторов PI3-K против липидкиназ. Фиг. 6. Ингибирование протеинкиназ ингибиторами PI3-K. Величины представляют собой % активности, оставшейся в присутствии 10 мкМ ингибитора. Величины являются средней величиной трех измерений. Величины IC50 указываются (при необходимости) в скобках (мкМ). На фиг. 7 указывается последовательность киназы р 110 человека. На фиг. 8 указывается последовательность киназы p110 человека. На фиг. 9 указывается последовательность киназы p110 человека. На фиг. 10 указывается последовательность киназы p110 человека.I. Определения. Применяемые в контексте аббревиатуры имеют их общепринятые значения в химической и биологической областях. Когда группы-заместители указываются их общепринятыми химическими формулами, написанными слева направо, они в равной степени включают химически идентичные заместители, которые могут быть результатом написания структуры справа налево, например -CH2O- является эквивалентным-OCH2-. Термин "алкил", отдельно или как часть другого заместителя, означает, если не оговорено особо,имеющий прямую (т.е. неразветвленную) или разветвленную цепь углеводородный радикал или циклический углеводородный радикал или их комбинацию, причем радикал или комбинация таких радикалов могут быть полностью насыщенными, моно- или полиненасыщенными, могут включать двух- и поливалентные радикалы и имеет указанное число атомов углерода (т.е. C1-C10 означает от 1 до 10 атомов углерода). Примеры насыщенных углеводородных радикалов включают, но не ограничиваются перечисленным, такие группы, как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил,циклогексил, (циклогексил)метил, циклопропилметил, гомологи и изомеры, например, н-пентила,н-гексила, н-гептила, н-октила и т.п. Ненасыщенной алкильной группой является группа, имеющая одну или несколько двойных или тройных связей. Примеры ненасыщенных алкильных групп включают, но не ограничиваются перечисленным, винил, 2-пропенил, кротил, 2-изопентенил, 2-(бутадиенил),2,4-пентадиенил, 3-(1,4-пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил и высшие гомологи и изомеры. Термин "алкилен", отдельно или как часть другого заместителя, означает двухвалентный радикал,образованный из алкила, примерами которого являются, но без ограничения перечисленным,-CH2CH2CH2CH2-, -CH2CH=CHCH2-, -CH2CCCH2-, -CH2CH2CH(CH2CH2CH3)CH2-. Обычно алкильная(или алкиленовая) группа имеет от 1 до 24 атомов углерода, причем в настоящем изобретении предпочтительными являются такие группы, имеющие 10 или меньше атомов углерода. "Низший алкил" или"низший алкилен" представляет собой алкильную или алкиленовую группу с более короткой цепью,обычно имеющей 8 или меньше атомов углерода. Термин "гетероалкил", отдельно или в комбинации с другим термином, означает, если не оговорено особо, стабильный, имеющий неразветвленную или разветвленную цепь углеводородный радикал или циклический углеводородный радикал (или их комбинацию), состоящий по меньшей мере из одного атома углерода и по меньшей мере одного гетероатома, выбранного из группы, состоящей из О, N, P, Si иS, где атомы азота, фосфора и серы могут быть необязательно окислены и гетероатом азота может быть необязательно кватернизован. Гетероатом(ы) О, N, Р и S и Si может быть расположен в любом внутреннем положении гетероалкильной группы или в положении, в котором алкильная группа присоединена к остальной части молекулы. Примеры его включают, но не ограничиваются перечисленным,-CH2-CH2-O-CH3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2-S(O)-CH3,-CH2-CH2-S(O)2-CH3, -CH=CH-O-CH3, -Si(CH3)3, -CH2-CH=N-OCH3, -CH=CH-N(CH3)-CH3, -O-CH3,-O-CH2-CH3 и -CN. До двух или трех гетероатомов могут быть расположены последовательно, например,как в -CH2-NH-OCH3 и -CH2-O-Si(CH3)3. Аналогично этому, термин "гетероалкилен", отдельно или в качестве части другого заместителя, означает двухвалентный радикал, образованный из гетероалкила, примерами которого являются, но без ограничения указанным, -CH2-CH2-S-CH2-CH2- и-CH2-S-CH2-CH2-NH-CH2-. В гетероалкиленовых группах гетероатомы могут также занимать одно или оба концевых положения цепи (например, алкиленоксо, алкилендиоксо, алкиленамино, алкилендиамино и т.п.). Далее, для алкиленовых и гетероалкиленовых связывающих групп ориентация такой связывающей группы не определяется направлением, в котором написана формула связывающей группы. Например, формула -С(О)OR' представляет собой как -С(О)OR'-, так и R'OC(O)-. Как описано выше, гетероалкильные группы, применяемые здесь, включают такие группы, которые присоединены к остальной части молекулы через гетероатом, такие как C(O)R', -C(O)NR', -NR'R", -OR', -SR' и/или -SO2R'. Когда указывается "гетероалкил" с последующими перечислениями определенных гетероалкильных групп, таких как NR'R" или т.п., должно быть понятно, что термины гетероалкил и -NR'R" не являются излишними или взаимно исключающими. Скорее, определенные гетероалкильные группы перечисляют для внесения ясности. Таким образом, термин "гетероалкил" не следует интерпретировать здесь как исключающий определенные гетероалкильные группы, такие как -NR'R" или т.п. Термины "циклоалкил" и "гетероциклоалкил", отдельно или в комбинации с другим термином,представляют собой, если не оговорено особо, циклические варианты "алкила" и "гетероалкила" соответственно. Кроме того, в гетероциклоалкиле гетероатом может занимать положение, у которого гетероцикл присоединен к остальной части молекулы. Примеры циклоалкила включают, но не ограничиваются перечисленным, циклопентил, циклогексил, 1-циклогексенил, 3-циклогексенил, циклогептил и т.п. Примеры гетероциклоалкила включают, но не ограничиваются перечисленным, 1-(1,2,5,6-тетрагидропиридил),1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-морфолинил, 3-морфолинил, тетрагидрофуран-2-ил,тетрагидрофуран-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил, 1-пиперазинил, 2-пиперазинил и т.п.-3 019961 Термины "циклоалкилен" и "гетероциклоалкилен" относятся к двухвалентным производным циклоалкила и гетероциклоалкила соответственно. Термин "галоген", отдельно или как часть другого заместителя, означает, если не указано особо,атом фтора, хлора, брома или йода. Кроме того, имеется в виду, что такие термины, как "галогеналкил",включают моногалогеналкил и полигалогеналкил. Например, имеется в виду, что термин"галоген(C1-C4)алкил" включает,но не ограничивается перечисленным,трифторметил,2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил и т.п. Термин "арил" означает, если не оговорено особо, полиненасыщенный, ароматический углеводородный заместитель, который может иметь одно или несколько колец (предпочтительно 1-3 кольца), которые конденсированы вместе (например, нафтил) или соединены ковалентно. Термин "гетероарил" относится к арильным группам (или кольцам), которые содержат от 1 до 4 гетероатомов (в каждом отдельном кольце в случае нескольких колец), выбранных из N, О и S, где атомы азота и серы необязательно окислены и атом(ы) азота необязательно кватернизованы. Гетероарильная группа может быть присоединена к остальной части молекулы через атом углерода или гетероатом. Неограничивающие примеры арильных и гетероарильных групп включают фенил, 1-нафтил, 2-нафтил, 4-бифенил, 1-пирролил,2-пирролил, 3-пирролил, 3-пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил,4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил,2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил,4-пиридил, 2-пиримидил, 4-пиримидил, 5-бензотиазолил, пуринил, 2-бензимидазолил, 5-индолил,1-изохинолил, 6-изохинолил, 2-хиноксалинил, 5-хиноксалинил, 3-хинолил и 6-хинолил. Таким образом,термин "гетероарил" включает структуры с конденсированными кольцами, в которых по меньшей мере одно кольцо включает по меньшей мере две двойные связи. Заместители для каждой из указанных выше арильных и гетероарильных циклических систем выбраны из группы приемлемых заместителей, описанных ниже. Термины "арилен" и "гетероарилен" относятся к двухвалентным радикалам арила и гетероарила соответственно. Для краткости, термин "арил" при применении в комбинации с другими терминами (например,арилоксо, арилтиоксо, арилалкил) включает как арильные, так и гетероарильные кольца, которые имеют значения, указанные выше. Таким образом, имеется в виду, что термин "арилалкил" включает такие радикалы, в которых арильная группа присоединена к алкильной группе (например, бензил, фенетил, пиридилметил и т.п.), в том числе таким алкильным группам, у которых атом углерода (например, метиленовой группы) заменен, например, атомом кислорода (например, феноксиметил, 2-пиридилоксиметил,3-(1-нафтилокси)пропил и т.п.). Однако имеется в виду, что термин "галогенарил", применяемый здесь,включает только арилы, замещенные одним или несколькими атомами галогена. Когда гетероалкил, гетероциклоалкил или гетероарил включает определенное число членов (например, "3-7-членный"), термин "член" относится к атому углерода или гетероатому. Применяемый здесь термин "оксо" означает атом кислорода, который связан с атомом углерода двойной связью. Имеется в виду, что каждый из указанных выше терминов (например, "алкил", "гетероалкил", "циклоалкил", "гетероциклоалкил", "арил", "гетероарил", а также их двухвалентные радикальные производные) включает как замещенные, так и незамещенные формы указанного радикала. Предпочтительные заместители для каждого типа радикала представлены ниже. Заместителями для алкильных, гетероалкильных, циклоалкильных, гетероциклоалкильных одновалентных и двухвалентных радикалов (в том числе таких радикалов, часто называемых алкилен, алкенил,гетероалкилен, гетероалкенил, алкинил, циклоалкил, гетероциклоалкил, циклоалкенил и гетероциклоалкенил) могут быть одна или несколько групп, выбранных, но без ограничения перечисленным, из -OR',=O, =NR', =N-OR', -NR'R", -SR', -галогена, -SiR'R"R'", -OC(O)R', -C(O)R', -CO2R', -C(O)NR'R",-ОС(О)NR'R", -NR"C(O)R', -NR'-C(O)NR"R"', -NR"C(O)OR', -NR-C(NR'R")=NR'", -S(O)R', -S(O)2R',-S(O)2NR'R", -NRSO2R', -CN и -NO2, причем число таких заместителей составляет от 0 до (2m'+1), где m' равно общему числу атомов углерода в таком радикале. R', R", R"' и R, каждый предпочтительно независимо, представляют собой водород, замещенную или незамещенную гетероалкильную, замещенную или незамещенную циклоалкильную, замещенную или незамещенную гетероциклоалкильную, замещенную или незамещенную арильную (например, арил, замещенный 1-3 атомами галогена), замещенную или незамещенную алкильную группу, алкокси- или тиоалкоксигруппу или арилалкильную группу. Имеется в виду, что применяемый здесь термин "гетероатом" или "гетероатом кольца" включает атом кислорода (О), азота (N), серы (S), фосфора (Р) и кремния (Si). Соединения настоящего изобретения могут существовать в виде солей. Настоящее изобретение включает такие соли. Примеры приемлемых форм солей включают гидрохлориды, гидробромиды, сульфаты, метансульфонаты, нитраты, малеаты, ацетаты, цитраты, фумараты, тартраты (например,(+)-тартраты, (-)-тартраты или их смеси, включая рацемические смеси), сукцинаты, бензоаты и соли с аминокислотами, такими как глутаминовая кислота. Такие соли можно получить методами, хорошо известными специалисту в данной области. Включены также основно-аддитивные соли, такие как соль натрия, калия, кальция, аммония, органического амина или магния, или аналогичная соль. Когда соедине-4 019961 ния настоящего изобретения содержат относительно основные функциональные группы, кислотноаддитивные соли можно получить контактированием нейтральной формы таких соединений с достаточным количеством требуемой кислоты либо без растворителя, либо в подходящем инертном растворителе. Примеры приемлемых кислотно-аддитивных солей включают соли, полученные из неорганических кислот, подобных хлористо-водородной, бромисто-водородной, азотной, угольной, моногидроугольной,фосфорной, моногидрофосфорной, дигидрофосфорной, серной, моногидросерной, йодисто-водородной или фосфористой кислотам и т.п., а также соли, полученные из органических кислот, подобных уксусной, пропионовой, изомасляной, малеиновой, малоновой, бензойной, янтарной, субериновой, фумаровой,молочной, миндальной, фталевой, бензолсульфоновой, п-толуолсульфоновой, лимонной, винной, метансульфоновой кислотам и т.п. Включены также соли аминокислот, такие как аргинат и т.п., и соли органических кислот, подобных глюкуроновым или галактуроновым кислотам и т.п. Некоторые особые соединения настоящего изобретения содержат как основную, так и кислотную функциональные группы,которые позволяют соединениям превратиться либо в основно-, либо в кислотно-аддитивные соли. Нейтральные формы соединений предпочтительно получают контактированием соли с основанием или кислотой и выделением "родительского" соединения общепринятым способом. Родительская форма соединения отличается от различных форм ее солей некоторыми физическими свойствами, такими как растворимость в полярных растворителях. Некоторые соединения настоящего изобретения могут существовать в несольватированных формах,а также сольватированных формах, в том числе в гидратированных формах. В общем, сольватированные формы являются эквивалентными несольватированным формам и включены в объем настоящего изобретения. Некоторые соединения настоящего изобретения могут существовать во многих кристаллических или аморфных формах. В общем, все физические формы являются эквивалентными для применений,рассматриваемых настоящим изобретением, и предполагается, что они входят в объем настоящего изобретения. Некоторые соединения настоящего изобретения имеют асимметричные атомы углерода (оптические или хиральные центры) или двойные связи; энантиомеры, рацематы, диастереомеры, таутомеры,геометрические изомеры, стереоизомерные формы, которые можно указать в терминах абсолютной стереохимии как (R)- или (S)- или как (D)- или (L)-изомеры для аминокислот, и индивидуальные изомеры включены в объем настоящего изобретения. Соединения настоящего изобретения не включают соединения, которые, как известно в данной области, являются слишком нестабильными для синтеза и/или выделения. Имеется в виду, что настоящее изобретение включает соединения в рацемических и оптически чистых формах. Оптически активные (R)- и (S)- или (D)- и (L)-изомеры можно получить с применением хиральных синтонов или хиральных реагентов или разделением на изомеры с применением общепринятых методик. Когда описанные здесь соединения содержат олефиновые связи или другие центры геометрической асимметрии, и если не оговорено особо, предполагается, что соединения включают Е- иZ-геометрические изомеры. Термин "таутомер", применяемый здесь, относится к одному из двух или более структурных изомеров, которые существуют в равновесии и которые легко превращаются из одной изомерной формы в другую. Специалисту в данной области должно быть очевидно, что некоторые соединения данного изобретения могут существовать в таутомерных формах, причем все такие таутомерные формы соединений входят в объем изобретения. Имеется в виду, если не оговорено особо, что структуры, указанные в данном тексте, включают все стереохимические формы структуры; т.е. R- и S-конфигурации для каждого асимметричного центра. Следовательно, в объем изобретения входят индивидуальные стереохимические изомеры, а также энантиомерные и диастереомерные смеси настоящего изобретения. Имеется в виду, если не оговорено особо, что структуры, указанные в данном тексте, включают соединения, которые отличаются только присутствием одного или нескольких атомов, обогащенных изотопом. Например, соединения, имеющие данные структуры, за исключением замены атома водорода дейтерием или тритием или замены атома углерода 13 С- или 14 С-обогащенным атомом углерода, входят в объем настоящего изобретения. Соединения настоящего изобретения могут также содержать неприродные пропорции атомных изотопов у одного или нескольких атомов, которые составляют такие соединения. Например, соединения могут быть радиомечеными радиоактивными изотопами, такими как, например, тритий (3 Н), йод-125(125I) или углерод-14 (14 С). Все изотопные варианты соединений настоящего изобретения, независимо от того, являются ли они радиоактивными или нет, включены в объем настоящего изобретения. Имеется в виду, что термин "фармацевтически приемлемые соли" включает соли активных соединений, которые получают с относительно нетоксичными кислотами или основаниями, в зависимости от конкретных групп-заместителей, обнаруженных на описанных здесь соединениях. Когда соединения настоящего изобретения содержат относительно кислотные функциональные группы, основно-аддитивные соли можно получить контактированием нейтральной формы таких соединений с достаточным количеством требуемого основания либо без растворителя, либо в подходящем инертном растворителе. Приме-5 019961 ры фармацевтически приемлемых основно-аддитивных солей включают соль натрия, калия, кальция,аммония, органического амина или магния или аналогичную соль. Когда соединения настоящего изобретения содержат относительно основные функциональные группы, кислотно-аддитивные соли можно получить контактированием нейтральной формы таких соединений с достаточным количеством требуемой кислоты либо без растворителя, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых кислотно-аддитивных солей включают соли, полученные из неорганических кислот, подобных хлористо-водородной, бромисто-водородной, азотной, угольной, моногидроугольной, фосфорной,моногидрофосфорной, дигидрофосфорной, серной, моногидросерной, йодисто-водородной или фосфористой кислотам и т.п., а также соли, полученные из относительно нетоксичных органических кислот,подобных уксусной, пропионовой, изомасляной, малеиновой, малоновой, бензойной, янтарной, субериновой, фумаровой, молочной, миндальной, фталевой, бензолсульфоновой, п-толуолсульфоновой, лимонной, винной, метансульфоновой кислотам и т.п. Включены также соли аминокислот, такие как аргинат и т.п., и соли органических кислот, подобных глюкуроновым или галактуроновым кислотам и т.п. (см.,например, Berge et al, "Pharmaceutical Salts", Journal of Pharmaceutical Science, 1977, 66, 1-19). Некоторые особые соединения настоящего изобретения содержат как основные, так и кислотные функциональные группы, которые позволяют соединениям превращаться либо в основно-, либо в кислотно-аддитивные соли. Помимо форм солей, настоящее изобретение предлагает соединения, которые находятся в форме пролекарства. Пролекарствами описанных здесь соединений являются такие соединения, которые легко подвергаются химическим превращениям в физиологических условиях с образованием соединений настоящего изобретения. Кроме того, пролекарства можно превратить в соединения настоящего изобретения химическими или биохимическими методами в ex vivo окружающей среде. Например, пролекарства можно медленно превратить в соединения настоящего изобретения при помещении в резервуар из чрескожного пластыря с подходящим ферментом или химическим реагентом. Описание соединений настоящего изобретения ограничивается принципами химического связывания, известными специалисту в данной области. Соответственно этому, когда группа может быть замещена одним или несколькими из ряда заместителей, такие замещения выбраны так, чтобы подчиняться принципам химического связывания и образовывать соединения, которые по своей природе не являются нестабильными и/или, как должно быть известно среднему специалисту в данной области, возможно,являются нестабильными в условиях окружающей среды, таких как водные, нейтральные условия и различные известные физиологические условия. Например, гетероциклоалкил или гетероарил присоединен к остальной части молекулы через гетероатом кольца согласно принципам химического связывания, известным специалисту в данной области, что тем самым, по существу, предотвращает применение нестабильных соединений. Термин "лечение" относится к любым показателям успеха при лечении или уменьшении интенсивности симптомов повреждения, патологии или состояния, в том числе любому объективному или субъективному параметру такого ослабления; ремиссии; уменьшению симптомов или доведению повреждения, патологии или состояния до степени, более переносимой пациентом; снижению скорости дегенерации или хронического прогрессирующего заболевания; достижению менее изнуряющей конечной точки дегенерации; улучшению физического или психического самочувствия пациента. Лечение или уменьшение симптомов может быть основано на объективных или субъективных параметрах, включающих результаты объективного обследования, нейропсихиатрического освидетельствования и/или психиатрической экспертизы. Например, некоторые способы, представленные здесь, успешно лечат рак снижением заболеваемости раком и/или индуцированием ремиссии рака."Эффективное количество" является количеством, достаточным для содействия лечению, профилактике или уменьшению интенсивности симптома или симптомов заболевания. "Эффективное количество" можно также называть "терапевтически эффективным количеством". "Уменьшение интенсивности" симптома или симптомов (и грамматические эквиваленты данной фразы) означает снижение тяжести или частоты появления симптома(ов) или устранение симптома(ов). "Профилактически эффективным количеством" лекарственного средства является количество лекарственного средства, которое при введении субъекту будет оказывать предполагаемое профилактическое действие, например профилактику или задержку начала (или повторного появления) заболевания или уменьшение вероятности начала (или повторного появления) заболевания или его симптомов. Полное профилактическое действие необязательно достигается введением одной дозы и может иметь место только после введения ряда доз. Таким образом,профилактически эффективное количество можно ввести одним или несколькими введениями. Фраза"снижающее активность количество", применяемая в данном контексте, относится к количеству антагониста, требуемого для снижения активности фермента, по сравнению с отсутствием антагониста. Фраза"количество, нарушающее функцию", применяемая в данном контексте, относится к количеству антагониста, требуемого для нарушения функции остеокласта или лейкоцита, по сравнению с отсутствием антагониста.-6 019961 Применяемый в данном контексте термин "антагонист" или "соединение настоящего изобретения" относится к соединению формулы (I) или антагонисту, связывающему карман аффинности PI3-киназы(например, пиразолопиримидиновому антагонисту, связывающему карман аффинности PI3-киназы, или пирролопиримидиновому антагонисту, связывающему карман аффинности PI3-киназы).II. Антагонисты киназы. В одном аспекте настоящее изобретение относится к новым антагонистам киназы. Антагонистами киназы может быть антагонист, связывающий карман аффинности PI3-киназы (например, пиразолопиримидиновый антагонист, связывающий карман аффинности PI3-киназы, или пирролопиримидиновый антагонист, связывающий карман аффинности PI3-киназы), или соединение формулы (I). Антагонистами, связывающими карман аффинности PI3-киназы настоящего изобретения, являются соединения, содержащие остаток, связывающий карман аффинности PI3-киназы. Пиразолопиримидиновыми антагонистами настоящего изобретения, связывающими карман аффинности PI3-киназы, являются замещенные пиразолопиримидиновые соединения, содержащие остаток,связывающий карман аффинности PI3-киназы. Подобным же образом, пирролопиримидиновыми антагонистами настоящего изобретения, связывающими карман аффинности PI3-киназы, являются замещенные пирролопиримидиновые соединения, содержащие остаток, связывающий карман аффинности PI3 киназы. Остатком, связывающим карман аффинности PI3-киназы, является заместитель, который при контактировании с киназой p110, p110, p110 или р 110 заполняет пространство в кармане аффинности соответствующей PI3-киназы. В некоторых вариантах осуществления остаток, связывающий карман аффинности PI3-киназы, заменяет по меньшей мере одну молекулу воды в кармане аффинности PI3 киназы. Остаток, связывающий карман аффинности PI3-киназы, может также взаимодействовать с одной или несколькими аминокислотами, которые образуют часть кармана аффинности PI3-киназы. Описание кармана аффинности PI3-киназы и способов определения, заполняет ли заместитель пространство в кармане аффинности PI3-киназы, приводится ниже. В одном варианте осуществления изобретения антагонист киназы настоящего изобретения имеет формулуC5-C7-циклоалкил или R19-замещенный или незамещенный 5-7-членный гетероциклоалкил, где n равен целому числу от 0 до 2;R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16 и R17 представляют собой независимо водород,35R19 и R35 независимо представляют собой водород, галоген, незамещенный C1-C8-алкил, незамещенный 2-8-членный гетероалкил, незамещенный C5-C7-циклоалкил, незамещенный 5-7-членный гетероциклоалкил;R20, R22 и R23 независимо представляют собой водород. В некоторых вариантах осуществления R2 представляет собой где W1, W2, W3 и W4 независимо представляют собой =CH-, =CR4- или =N- и кольцо А представляет собой частично или полностью ненасыщенное 6- или 7-членное кольцо. В некоторых вариантах осуществления R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16 и R17 представляют собой независимо водород, незамещенный C1-C8-алкил, незамещенный 2-8-членный гетероалкил, незамещенный C5-C7-циклоалкил или незамещенный 5-7-членный гетероциклоалкил. В некоторых вариантах осуществления R1 представляет собой R3-замещенный или незамещенный-7 019961 В некоторых вариантах осуществления R1 представляет собой R3-замещенный или незамещенныйC1-C8-алкил. В некоторых вариантах осуществления R1 представляет собой R3-замещенный или незамещенныйC1-C4-алкил. В других вариантах осуществления описанных выше соединений R1 представляет собой метил или незамещенный разветвленный C3-C6-алкил. В дополнительных вариантах осуществления описанных выше соединений R1 представляет собой изопропил. В других вариантах осуществления R3 представляет собой R19-замещенный или незамещенныйC1-C8-алкил или R19-замещенный или незамещенный C5-C7-циклоалкил. В одном из вариантов осуществления R19 представляет собой незамещенный C1-C8-алкил или незамещенный C5-C7-циклоалкил. В другом из вариантов осуществления R19 представляет собой незамещенный C1-C4-алкил или незамещенный циклопентил. В других вариантах осуществления описанных выше соединений R2 представляет собой 4R -замещенный или незамещенный индолил, R4-замещенный или незамещенный бензоксадиазолил,R4-замещенный или незамещенный бензодиоксолил, R4-замещенный или незамещенный бензодиоксанил, R4-замещенный или незамещенный тианафтанил, R4-замещенный или незамещенный пирролопиридинил, R4-замещенный или незамещенный индазолил, R4-замещенный или незамещенный тетрагидронафталинил, R4-замещенный или незамещенный хинолинил, R4-замещенный или незамещенный хиноксалинил, R4-замещенный или незамещенный пиридопиразинил, R4-замещенный или незамещенный хиназолинонил, R4-замещенный или незамещенный хроменонил, R4-замещенный или незамещенный бензоизоксазолил, R4-замещенный или незамещенный имидазопиридинил, R4-замещенный или незамещенный бензофуранил или R4-замещенный или незамещенный бензотиофенил. В одном из вариантов осуществления R2 представляет собой R4-замещенный индолил. В другом варианте осуществления R2 представляет собой 5-гидроксииндол-2-ил и R1 представляет собой изопропил. В другом варианте осуществления соединения формулы (I) включают некоторые из соединений,перечисленных в табл. 1.III. Карман аффинности PI3-киназы. Применяемый здесь термин "карман аффинности PI3-киназы" относится к полости в p110, p110,p110 и р 110, соответствующей слегка затемненной области, показанной на фиг. 2 А-2D, названной"карманом аффинности". Фиг. 2 А-2D иллюстрируют компьютерную модель кристаллической структурыp110. В p110 поверхность кармана аффинности PI3-киназы связана, по меньшей мере частично, с боковой цепью K833, D964, I879 и D841 (нумерацию аминокислот p110 см. на фиг. 8). Поверхность соответствующей полости в р 110 связана, по меньшей мере частично, с боковой цепью K779, D911, I825 иD787 (нумерацию аминокислот р 110 см. на фиг. 7). Соответствующая полость в p110 связана, по меньшей мере частично, с боковыми цепями K802, D933, I848 и D810 (нумерацию аминокислот р 110 см. на фиг. 9). Соответствующая полость в р 110 связана, по меньшей мере частично, с боковыми цепями K805, D937, I851 и D813 (нумерацию аминокислот p110 см. на фиг. 10). Карман аффинности PI3 киназы является недоступным для АТФ. Карман аффинности PI3-киназы р 110 может быть назван здесь карманом аффинности р 110. Подобным же образом, карман аффинности PI3-киназы p110 может быть назван здесь карманом аффинности p110. Карман аффинности PI3-киназы включает лизин 779, который согласно компьютерным моделям образует водородную связь с атомом азота пиридина PIK-90 и атомом кислорода фенола PI 103(фиг. 2D), оба из которых являются ингибиторами р 110. На основании указанных результатов компьютерного моделирования был разработан новый антагонист, основанный на химической структуре PIK-39 и IC87114, как подробно указано ниже. Как показано на фиг. 2 С, PIK-39 не содержит остаток, связывающий карман PI3-киназы. И, как показано на фиг. 3 А, IC87114 сохраняет контакты с Е 880 и V882 в АТФ-связывающей области p110, но также обнаруживает отсутствие остатка, связывающего карман PI3-киназы. Встраивание м-фенола (остаток, связывающий карман PI3-киназы) у С 3 пиразолопиримидина IC87114 делает доступным карман аффинности PI3-киназы (фиг. 3 А), что приводит к 60-кратному повышению активности ингибирования р 110. Как описано выше, остаток, связывающий карман PI3-киназы, представляет собой заместитель, который при контактировании с p110, p110, p110 или р 110 заполняет пространство в кармане связывания соответствующей PI3-киназы. Например, остатком, связывающим карман аффинности PI3-киназы,является заместитель, который при контактировании с р 110 заполняет пространство в кармане аффинности p110. Подобным же образом, остатком, связывающим карман аффинности p110, является заместитель, который при контактировании с p110 заполняет пространство в кармане аффинности p110.-8 019961 В некоторых вариантах осуществления остаток, связывающий карман PI3-киназы, дополнительно взаимодействует (например, связывается) с аминокислотой, которая образует часть кармана связыванияPI3-киназы. В некоторых родственных вариантах осуществления взаимодействием является взаимодействие с образованием водородных связей, ван-дер-ваальсовых связей, ионных связей, ковалентных связей (например, дисульфидной связи) или гидрофобное взаимодействие.IV. Определение заполнения пространства в кармане аффинности PI3-киназы. Для определения того, заполняет ли остаток, связывающий карман аффинности PI3-киназ, пространство в кармане аффинности PI3-киназы, применяют методики компьютерного моделирования. Исследуемый антагонист, связывающий карман аффинности PI3-киназ (т.е. испытуемое соединение),вставляют в компьютерное изображение p110. Компьютерное изображение p110 получают из сольватированной сокристаллической структуры киназы p110 человека, связанной с PIK-39. Для получения изображения можно применять PyMOL Molecular Graphics System. Пример представлен на фиг. 3 А, гдеIC87114 и PIK-294 встроены в компьютерное изображение киназы р 110, полученное из сокристалла р 110-PIK-39. См. Knight, et al., Cell. 125: 733-745 (2006). Компьютерные модели обычно анализируют для предотвращения любых больших стерических затруднений и удовлетворения требований в отношении образования ключевых водородных связей между испытуемым антагонистом, связывающим карман аффинности PI3-киназы, и белком p110 (например,V882 и М 804). В некоторых вариантах осуществления проводят вычисления минимизации энергии для оптимизации энергии связывания. С применением таких методик специалист в данной области может легко определить, включает ли испытуемый антагонист, связывающий карман аффинности PI3-киназы,остаток, связывающий карман аффинности PI3-киназы, который заполняет пространство в кармане аффинности PI3-киназы. В некоторых вариантах осуществления испытуемый антагонист, связывающий карман аффинностиPI3-киназы, анализируют для определения, образуется ли по меньшей мере одна связь (например, водородная связь) между испытуемым антагонистом, связывающим карман аффинности PI3-киназы, и аминокислотой, которая образует часть кармана аффинности PI3-киназы. Применением методики компьютерного моделирования, описываемой выше, определяют расстояние между одной или несколькими аминокислотами, которые образуют часть кармана аффинности PI3-киназы, и потенциальной контактной точкой на остатке, связывающем карман аффинности PI3-киназы. На основании этого расстояния специалист в данной области может определить, образуется ли по меньшей мере одна связь между одной или несколькими аминокислотами, которые образуют часть кармана аффинности PI3-киназы, и остатком,связывающим карман аффинности PI3-киназы.V. Общие синтезы. Соединения изобретения синтезируют подходящим сочетанием в общем хорошо известных синтетических способов. Методики, применимые при синтезе соединений изобретения, являются как легко очевидными, так и доступными специалистам в данной области. Ниже предложено обсуждение для иллюстрации некоторых из различных способов, доступных для применения при "сборке" соединений изобретения. Однако предполагается, что обсуждение не определяет пределы реакций или последовательности реакций, которые являются применимыми при получении соединений настоящего изобретения. Схема I По указанной выше схеме I йодирование пиразоло- или пирролопиримидина выполняют с применением подходящего реагента йодирования, такого как N-йодсукцинамид. Введение подходящего заместителя в 1-положение можно выполнить посредством замены галогена бромированным заместителем(например, замещенным или незамещенным алкилбромидом). Катализируемое палладием перекрестное сочетание между органобороновой кислотой и йодгалогенидом (т.е. сочетание Сузуки) затем применяют для введения заместителя в 3-положение. Новые разработки катализатора и способа значительно расширили возможные применения сочетания Сузуки, так что диапазон исходных реагентов реакции не ограничивается арильными реагентами. Вместо бороновых кислот можно применять трифторбораты калия и органобораны или боронатные эфиры. В качестве реагентов сочетания можно также применять некоторые псевдогалогениды (например, трифлаты (трифторметилсульфонаты. Дополнительную информацию относительно сочетания Сузуки можно найти, например, в Kudo et al., Angew. Chem. Int. Ed. 45: 1282-1284 (2006); Kirchhoff et al., J. Am. Chem. Soc., 124: 13662-13663 (2002); Wu et al., J. Org. Chem., 68: 670-673 (2003) and Molander et al., J. Org. Chem., 67: 8424-8429 (2002).VI. Способы. Соединения настоящего изобретения способны уменьшать каталитическую активность PI3-киназы(например, p110-киназы). Способ включает стадию контактирования PI3-киназы с уменьшающим активность количеством соединения настоящего изобретения (т.е. антагониста, связывающего карман аффинности PI3-киназы,или соединения формулы (I. В некоторых вариантах осуществления антагонист способен уменьшить каталитическую активность тирозинкиназы. В некоторых вариантах осуществления антагонистом является связывающий карман аффинности PI3-киназы пиразолопиримидиновый антагонист или связывающий карман аффинности PI3-киназы пирролопиримидиновый антагонист. В некоторых вариантах осуществления антагонист является специфичным для p110 относительно действия антагониста против р 110, p110 и/или р 110. В некоторых вариантах осуществления IC50 дляp110 по меньшей мере в 1,5, 2,0, 3,0, 4,0, 5,0, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 500 или 1000 раз ниже, чем IC50 против р 110, p110 и/или р 110. В других вариантах осуществления IC50 антагониста против p110 меньше чем 100, 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1 мкМ, 50, 10, 1, 0,5, 0,1 нМ, 50, 10 или 1 пМ. В некоторых вариантах осуществления антагонист является специфичным для p110 относительно действия антагониста против рецепторной тирозинкиназы инсулина. В некоторых вариантах осуществления IC50 для p110 по меньшей мере в 1,5, 2,0, 3,0, 4,0, 5,0, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 500 или 1000 раз меньше, чем IC50 против рецепторной тирозинкиназы инсулина. В других вариантах осуществления IC50 антагониста против p110 меньше чем 100, 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1 мкМ, 50, 10, 1,0,5, 0,1 нМ, 50, 10 или 1 пМ. В некоторых вариантах осуществления антагонист снижает или способен снизить каталитическую активность тирозинкиназы. В некоторых вариантах осуществления IC50 антагониста против тирозинкиназы меньше чем 100, 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1 мкМ, 50, 10, 1, 0,5, 0,1 нМ, 50, 10 или 1 пМ. Некоторые тирозинкиназы включают, например, ДНК-зависимую тирозинкиназу, ДНК-зависимую тирозинкиназу (номер доступа в Pubmed-белки) (PPAN) AAA79184), тирозинкиназу Abl (САА 52387), Bcr-Abl, киназу кроветворных клеток (PPAN CAI19695), Src (PPAN САА 24495), рецептор-2 васкулярного эндотелиального фактора роста (PPAN АВВ 82619), рецептор-2 васкулярного эндотелиального фактора роста(PPAN ABB82619), рецептор эпидермального фактора роста (PPAN AG43241), рецептор В 4 ЕРН (PPANEAL23820), рецептор фактора стволовых клеток (PPAN AAF22141), рецептор TIE-2 тирозинпротеинкиназы (PPAN Q02858), относящаяся к fms тирозинкиназа 3 (PPAN NP 004110), рецептор альфа тромбоцитарного фактора роста (PPAN NP 990080), RET (PPAN CAA73131) и их функциональные мутанты. В некоторых вариантах осуществления тирозинкиназой является Abl, Bcr-Abl, EGFR или Flt-3. В некоторых вариантах осуществления антагонист снижает или способен снизить каталитическую активность mTOR (PPAN AAI17167). В некоторых вариантах осуществления IC50 антагониста противmTOR меньше чем 100, 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1 мкМ, 50, 10, 1, 0,5, 0,1 нМ, 50, 10 или 1 пМ. В некоторых вариантах осуществления антагонист снижает или способен снизить каталитическую активность mTOR и р 110 при IC50 меньше чем 100, 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1 мкМ, 50, 10, 1, 0,5,0,1 нМ, 50, 10 или 1 пМ. В других вариантах осуществления антагонист снижает или способен снизить каталитическую активность тирозинкиназы и р 110 при IC50 меньше чем 100, 50, 40, 30, 20, 10, 5, 1, 0,5,0,1 мкМ, 50, 10, 1, 0,5, 0,1 нМ, 50, 10 или 1 пМ. В других вариантах осуществления антагонист снижает или способен снизить каталитическую активность тирозинкиназы, mTOR и р 110 при IC50 меньше чем 100, 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1 мкМ, 50, 10, 1, 0,5, 0,1 нМ, 50, 10 или 1 пМ. В другом аспекте настоящее изобретение относится к способу лечения заболевания, опосредуемого активностью PI3-киназы, активностью PI3-киназы и активностью тирозинкиназы, у субъекта, нуждающегося в таком лечении. Способ включает введение субъекту терапевтически эффективного количества антагониста. Антагонистом является антагонист, связывающий карман аффинности PI3-киназы, соединение формулы (I). Заболеванием может быть также нарушение резорбции костей, аномальное воспаление, аутоиммунное заболевание, тромбоз или астма. Заболевание может быть также типа рака или метастазов рака, в том числе, например, лейкоз, карциномы и саркомы, такие как рак головного мозга, молочной железы, шейки матки, толстой кишки, головы и шеи, печени, почек, легких, немелкоклеточный рак легких, меланома, мезотелиома, рак яичников, саркома, рак желудка, матки и медуллобластома. Дополнительные примеры включают болезнь Ходжкина, неходжкинскую лимфому, множественную миелому, нейробластому, рак яичников, рабдомиосаркому, первичный тромбоцитоз, первичную макроглобулинемию, первичные опухоли головного мозга, рак, злокачественную панкреатическую инсуланому,злокачественный карциноид, рак мочевого пузыря, предзлокачественные повреждения кожи, тестикулярный рак, лимфомы, рак щитовидной железы, нейробластому, рак пищевода, рак мочеполового тракта,злокачественную гиперкальциемию, внутриматочный рак, адренальный кортикальный рак, новообразования эндокринного и экзокринного отделов поджелудочной железы и рак простаты. В некоторых вариантах осуществления заболевание выбрано из рака печени, рака толстой кишки, рака молочной железы,меланомы, острого миелоидного лейкоза, хронического миелоидного лейкоза или немелкоклеточного рака легких.VII. Фармацевтические препараты. В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) в смеси с фармацевтически приемлемым эксципиентом. Специалисту в данной области должно быть понятно, что фармацевтические композиции включают фармацевтически приемлемые соли антагонистов PI3-киназы настоящего изобретения, описанные выше. При терапевтических и/или диагностических применениях соединения изобретения можно вводить в состав фармацевтических препаратов для различных методов введения, включая системное и местное или локализованное введение. Методики и препараты в общем можно найти в публикации Remington:The Science and Practice of Pharmacy (20th ed.) Lippincott, WilliamsWilkins (2000). Соединения согласно изобретению являются эффективными в пределах широкого диапазона доз. Например, при лечении взрослых людей примерами доз, которые можно применять, являются дозы 0,011000, 0,5-100, 1-50 и 5-40 мг/день. Наиболее предпочтительной дозой является 10-30 мг/день. Точная доза будет зависеть от пути введения, формы, в которой соединение вводят, подвергаемого лечению субъекта, массы тела подвергаемого лечению субъекта и предпочтения и опыта штатного врача больницы. Фармацевтически приемлемые соли обычно хорошо известны среднему специалисту в данной области и могут включать в качестве примера, например, но без ограничения перечисленным, ацетат, бензолсульфонат, безилат, бензоат, бикарбонат, битартрат, бромид, эдетат кальция, карнсилат, карбонат,цитрат, эдетат, эдисилат, эстолат, эзилат, фумарат, глюцептат, глюконат, глутамат, гликоллиларсанилат,гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, йодид, изетионат, лактат,лактобионат, малат, малеат, манделат, мезилат, мукат, напсилат, нитрат, памоат (эмбонат), пантотенат,фосфат/дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, сульфат, таннат, тартрат или теоклат. Другие фармацевтически приемлемые соли можно найти, например, в публикацииRemington: The Science and Practice of Pharmacy (20th ed.) Lippincott, WilliamsWilkins (2000). Предпочтительные фармацевтически приемлемые соли включают, например, ацетат, бензоат, бромид, карбонат,цитрат, глюконат, гидробромид, гидрохлорид, малеат, мезилат, напсилат, памоат (эмбонат), фосфат, салицилат, сукцинат, сульфат или тартрат. В зависимости от подвергаемых лечению определенных состояний такие агенты можно изготовить в составе жидких или твердых дозированных форм и вводить системно или локально. Агенты можно доставить, например, в форме с длительным по времени или замедленным высвобождением, которая известна специалисту в данной области. Методики изготовления и введения можно найти в публикацииRemington: The Science and Practice of Pharmacy (20th ed.) Lippincott, WilliamsWilkins (2000). Подходящие пути могут включать оральный, буккальный путь, ингаляцию спрея, сублингвальный, ректальный,чрескожный, вагинальный путь, путь через слизистую оболочку, назальное или кишечное введение; парентеральную доставку, в том числе внутримышечные, подкожные, интрамедуллярные инъекции, а также внутриоболочечные, прямые внутрижелудочковые, внутривенные, внутрисуставные, внутригрудинные, внутрипеченочные инъекции, инъекции внутрь повреждения, внутричерепные, внутрибрюшинные,интраназальные или внутриглазные инъекции или другие методы доставки. Для инъекции агенты изобретения можно изготовить в составе препарата и разбавить в водных растворах, таких как физиологически совместимые буферы, такие как раствор Ханка, раствор Рингера или физиологический солевой буфер. В препарате для такого введения через слизистую оболочку применяют агенты, усиливающие проникновение, подходящие для преодоления барьера. Такие агенты, усиливающие проникновение, в общем известны в данной области. Применение фармацевтически приемлемых инертных носителей для изготовления препаратов соединений, описанных здесь для практического применения изобретения, в виде доз, подходящих для системного введения, входит в объем изобретения. При правильном выборе носителя и подходящей практике изготовления композиции настоящего изобретения, особенно композиции, изготовленные в виде растворов, можно вводить парентерально, например внутривенной инъекцией. Соединения можно легко изготовить в составе фармацевтических препаратов с применением фармацевтически приемлемых носителей, хорошо известных в данной области, и в дозах, подходящих для орального введения. Такие носители позволяют изготовлять соединения изобретения в составе препаратов в виде таблеток, пилюль, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и т.п. для орального приема подвергаемым лечению субъектом (например, пациентом). Для назальной или ингаляционной доставки агенты изобретения можно также изготовлять в составе препаратов методами, известными специалисту в данной области, и такие препараты могут включать,например, но без ограничения перечисленным, растворяющие, разбавляющие или диспергирующие вещества, такие как физиологический раствор, консерванты, такие как бензиловый спирт, промоторы абсорбции и фторуглероды. Фармацевтические композиции, подходящие для применения в настоящем изобретении, включают композиции, в которых активные ингредиенты содержатся в количестве, эффективном для достижения предполагаемой цели. Определение эффективных количеств находится полностью в пределах компетенции специалиста в данной области, особенно в свете предложенного здесь подробного описания.- 11019961 Помимо активных ингредиентов, эти фармацевтические композиции могут содержать подходящие фармацевтически приемлемые носители, включающие эксципиенты и вспомогательные вещества, которые облегчают процесс изготовления препаратов из активных соединений, которые можно применять для фармацевтических целей. Препараты, изготовленные для орального введения, могут быть в форме таблеток, драже, капсул или растворов. Фармацевтические препараты для орального применения можно получить смешиванием активных соединений с твердыми эксципиентами, необязательно размалыванием образовавшейся смеси и обработкой смеси гранул, если нужно, после добавления подходящих вспомогательных веществ с получением сердцевин таблеток или драже. Подходящими эксципиентами в особенности являются наполнители, такие как сахара, в том числе лактоза, сахароза, маннит или сорбит; препараты целлюлозы, например маисовый крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая соль карбоксиметилцеллюлозы(CMC) и/или поливинилпирролидон (PVP: повидон). При необходимости, можно добавить дезинтегрирующие агенты, такие как сшитый поливинилпирролидон, агар или альгиновая кислота или ее соль, такая как альгинат натрия. Сердцевины драже покрывают подходящими оболочками. Для этой цели можно применять концентрированные растворы сахара, которые могут необязательно содержать аравийскую камедь, тальк, поливинилпирролидон, гель карбопола, полиэтиленгликоль (ПЭГ) и/или диоксид титана, растворы лака и подходящие органические растворители или смеси растворителей. Для идентификации или характеризации различных комбинаций доз активного соединения к покрытиям таблеток или драже можно добавлять красители или пигменты. Фармацевтические препараты, которые можно применять орально, включают капсулы "пуш-фит",изготовленные из желатина, а также мягкие, герметизированные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит. Капсулы "пуш-фит" могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связывающими веществами, такими как крахмалы,и/или лубрикантами, такими как тальк или стеарат магния и, необязательно, стабилизаторами. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях,таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли (ПЭГ). Кроме этого, могут быть добавлены стабилизаторы. В зависимости от конкретного состояния или патологического состояния, которое лечат или предотвращают, вместе с ингибиторами данного изобретения можно вводить дополнительные терапевтические агенты, которые обычно вводят для лечения или профилактики такого состояния. Например, с ингибиторами данного изобретения можно комбинировать химиотерапевтические агенты или другие антипролиферативные агенты для лечения пролиферативных заболеваний и рака. Примеры известных химиотерапевтических агентов включают, но не ограничиваются перечисленным, адриамицин, дексаметазон,винкристин, циклофосфамид, фторурацил, топотекан, таксол, интерфероны и производные платины. Другие примеры агентов, которые также можно комбинировать с ингибиторами данного изобретения, включают, без ограничения, противовоспалительные агенты, такие как кортикостероиды, блокаторыTNF, IL-1 RA, азатиоприн, циклофосфамид и сульфазалазин; иммуномодулирующие и иммуносупрессивные агенты, такие как циклоспорин, такролимус, рапамицин, микофенолят мофетил, интерфероны,кортикостероиды, циклофосфамид, азатиоприн и сульфазалазин; нейротрофические факторы, такие как ингибиторы ацетилхолинэстеразы, ингибиторы МАО, интерфероны, противосудорожные средства, блокаторы ионных каналов, рилузол и агенты против паркинсонизма; агенты для лечения сердечнососудистого заболевания, такие как бета-блокаторы, ингибиторы АСЕ, диуретики, нитраты, блокаторы кальциевых каналов и статины; агенты для лечения заболевания печени, такие как кортикостероиды, холестериламин, интерфероны и противовирусные агенты; агенты для лечения болезни крови, такие как кортикостероиды, антилейкемические агенты и факторы роста; агенты для лечения диабета, такие как инсулин, аналоги инсулина, ингибиторы альфа-глюкозидазы, бигуаниды и сенсибилизаторы инсулина, и агенты для лечения иммунологической недостаточности, такие как гамма-глобулин. Указанные дополнительные агенты можно вводить отдельно от композиции изобретения как часть схемы приема нескольких лекарственных средств. В альтернативном случае эти агенты могут быть частью одной дозированной формы, смешанной с ингибитором в одной композиции. Настоящее изобретение не ограничивается в объеме указанными в качестве примеров вариантами осуществления, которые представлены для иллюстрации отдельных аспектов изобретения. В действительности, специалисту в данной области на основании предшествующего описания станут очевидными различные модификации изобретения, помимо описанных здесь модификаций. Предполагается, что такие модификации находятся в пределах изобретения. Кроме того, любой один или несколько других признаков любого варианта осуществления изобретения можно сочетать с любым одним или несколькими другими признаками любого другого варианта осуществления изобретения, не выходя за пределы объема изобретения. Например, описанные выше антагонисты PI3-киназы настоящего изобретения в равной мере являются применимыми для описанных здесь способов лечения и способов ингибирования киназ. Ссылки, цитированные на всем протяжении данного описания, являются примерами уровня знаний в- 12019961 данной области и тем самым включаются здесь посредством ссылки во всей их полноте для всех целей,независимо от того, были ли они ранее, в частности, включены или нет.VIII. Примеры. Имеется в виду, что нижеследующие примеры иллюстрируют некоторые варианты осуществления изобретения, но не ограничивают объем изобретения. Общие способы. Все применяемые химикаты, реагенты и растворители были приобретены коммерческим образом,их применяли как таковые (без дополнительной очистки). dH2O относится к деионизированной воде. Выпаривание растворителей проводили на роторном испарителе при пониженном давлении. Соединения очищали высокоэффективной жидкостной хроматографией (ВЭЖХ), элюируя смесью 50:50:0,1dH2O-MeCN-трифторуксусная кислота, если не указано иначе. Анализ продуктов проводили на приборе жидкостной хроматограф-масс-спектрометр (ЖХ-МС) с применением раствора MeCN-0,1% муравьиная кислота (изменяемые отношения) в качестве элюента. А. Выбранные методики реакций. Синтез 1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA18). Раствор 250 мл формамида и 3-амино-4-пиразолкарбонитрила (25 г, 0,231 моль) нагревают до 180C на протяжении ночи в атмосфере аргона. Реакционную смесь охлаждают и добавляют 400 мл dH2O. Образовавшееся твердое вещество отделяют фильтрованием и промывают холодной dH2O. Белый твердый осадок собирают и сушат в вакууме на протяжении ночи, получая при этом BA18 (39 г, выход 100%).ESI-MC (M+H)+ m/z: вычислено 136,1, найдено 136,1. Синтез 3-йод-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA19). Раствор 3 Н-пиразоло[3,4-d]пиримидин-4-амина (10 г, 0,074 моль) и N-йодсукцинамида (25 г,0,111 моль) в ДМФА (80 мл) нагревают до 80C на протяжении ночи в атмосфере аргона. Образовавшееся твердое вещество отделяют фильтрованием и промывают холодным EtOH. Продукт сушат в вакууме на протяжении ночи, получая при этом BA19 (24 г, выход 100%).ESI-MC (М+Н)+ m/z: вычислено 262,0, найдено 262,0. Синтез 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA12). Раствор 3-йод-1 Н-пиразоло[3,4-d]пиримидин-4-амина (2 г, 0,0077 моль) и K2CO3 (4,2 г, 0,031 моль) в ДМФА (50 мл) нагревают до 80C в атмосфере аргона. Шприцем добавляют изопропилбромид (1,0 г,0,0084 моль). Реакционную смесь кипятят с обратным холодильником в атмосфере аргона в течение 2 ч. Твердый K2CO3 удаляют фильтрованием. Растворитель частично удаляют в вакууме. Добавляют цитрат натрия (50 мл) и реакционную смесь экстрагируют EtOAc. Органические фазы концентрируют в вакууме и очищают с применением колоночной хроматографии на силикагеле [MeOH-CH2Cl2, 5:95], получая при этом BA12 (1,68 г, выход 72%).ESI-MC (M+H)+ m/z: вычислено 304,0, найдено 304,1. Общая методика реакции сочетания Сузуки. Получение конечных продуктов (см. табл. 1 для названий и структур конечных продуктов). 3-Йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амин (40 мг, 0,13 ммоль, 1 экв.) растворяют вDME (12 мл). Бороновую кислоту (1,1 экв.) растворяют в EtOH (3,3 мл) и добавляют к реакционной смеси. К реакционной смеси добавляют Pd(PPh3)4 (30 мг, 0,026 ммоль, 0,2 экв.) и насыщенный Na2CO3(1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона и кипятят с обратным холодильником в течение 8 ч. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют и растворитель удаляют. Образовавшееся твердое вещество (или масло) растворяют в смеси 50:50:0,1 dH2O-MeCN-трифторуксусная кислота и очищают ВЭЖХ. Идентичность очищенного продукта (варьирующиеся выходы) подтверждают ЖХ-МС. Синтез 4-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)бензолсульфонамида (BA14). Раствор пинаконового эфира бензолсульфонамид-4-бороновой кислоты (23 мг, 0,08 ммоль) в EtOH(3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (20 мг,0,07 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA14 (2,2 мг, выход 10%).EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (20 мг,0,07 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA15 (4,3 мг, выход 20%).(12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA15 (4,8 мг, выход 23%).DME (12 мл). Добавляют Pd(PPh3)4 (40 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0, 1% TFA), получая при этом BA20.ESI-MC (M+H)+ m/z: вычислено 399,2, найдено 399,1. Синтез 3-(4-амино-3-метоксифенил)-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA20d). Раствор трет-бутил-4-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)-2 метоксифенилкарбамата (BA20) (20 мг, 0,05 ммоль) в CH2Cl2, TFA, S(CH2)2, H2O (45:45:5:5) (1 мл) перемешивают при комнатной температуре в течение 15 мин. Добавляют NaHCO3 (2 мл) до тех пор, пока реакционная смесь не станет щелочной. Реакционную смесь экстрагируют H2O и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA20d. Синтез 5-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)пиридин-2-карбонитрила(BA21). Раствор пинаконового эфира 2-цианопиридин-5-бороновой кислоты (18 мг, 0,08 ммоль) в EtOH(3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (20 мг,0,07 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA21 (2,5 мг, выход 14%).(12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA22 (15,6 мг, выход 60%).ESI-MC (M+H)+ m/z: вычислено 378,1, найдено 378,0. Синтез 3-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)-5-фторфенола (BA22). Раствор 3-(3-бензилокси-5-фторфенил)-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (15 мг,0,04 ммоль) в MeOH (0,9 мл) промывают струей аргона. Осторожно добавляют Pd на активированном угле (10 мл) при выдерживании реакционной смеси в атмосфере аргона. Реакционную смесь промывают струей газообразного Н 2 и оставляют в атмосфере Н 2 на ночь при комнатной температуре. Реакционную смесь фильтруют через целит и промывают MeOH, получая при этом BA22 (15 мг, выход 100%).ESI-MC (M+H)+ m/z: вычислено 288,1, найдено 288,1. Синтез 1-изопропил-3-(3,4-диметоксифенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA23). Раствор 3,4-диметоксифенилбороновой кислоты (24 мг, 0,13 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (20 мг, 0,07 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA23 (13,1 мг, выход 60%).ESI-MC (M+H)+ m/z: вычислено 314,0, найдено 314,1. Синтез (3-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)фенил)метанола (BA26). Раствор (3-гидроксиметилфенил)бороновой кислоты (24 мг, 0,13 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (20 мг, 0,07 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагрева- 14019961 ют до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA26 (8,4 мг, выход 42%).EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (20 мг,0,07 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA30 (17,8 мг, выход 67%). Синтез 1-(4-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)фенил)этанона (BA31). Раствор 4-ацетилфенилбороновой кислоты (12,7 мг, 0,08 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (20 мг, 0,07 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA31 (12,9 мг, выход 62%). Синтез (3-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)фенил)метанола (BA32). Раствор (4-аминокарбонил-3-хлорфенил)бороновой кислоты (16 мг, 0,08 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (20 мг, 0,07 ммоль) вDME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA32 (9,7 мг, выход 42%).(12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA34 (14,7 мг, выход 38%).ESI-MC (M+H)+ m/z: вычислено 302,1, найдено 302,0. Синтез 5-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)фуран-3-карбальдегида (BA35). Раствор 4-формилфуран-2-бороновой кислоты (20 мг, 0,14 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (40 мг, 0,13 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA35 (13,5 мг, выход 39%).DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA38 (24,3 мг, выход 54%).ESI-MC (M+H)+ m/z: вычислено 347,1, найдено 347,0. Синтез 3-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)бензонитрила (BA39). Раствор 3-цианофенилбороновой кислоты (23 мг, 0,15 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (40 мг, 0,13 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ(MeCN:H2O:0,1% TFA), получая при этом BA39 (14,9 мг, выход 41%).DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA40 (0,9 мг, выход 3%).ESI-MC (M+H)+ m/z: вычислено 347,1, найдено 347,0. Синтез 3-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)бензолсульфонамида (BA41). Раствор пинаконового эфира бензолсульфонамид-3-бороновой кислоты (31 мг, 0,11 ммоль) в EtOH(3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (30 мг,0,10 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA41 (9,2 мг, выход 28%).ESI-MC (M+H)+ m/z: вычислено 333,1, найдено 333,0. Синтез 2-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)бензо[b]тиофен-5 карбальдегида (BA42). Раствор пинаконового эфира 5-формилбензо[b]тиофен-2-бороновой кислоты (31 мг, 0,11 ммоль) вEtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (30 мг,0,10 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA42 (15,2 мг, выход 45%).(BA43). Раствор пинаконового эфира N-Boc-3-формил-5-индолбороновой кислоты (40 мг, 0,11 ммоль) вEtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (30 мг,0,10 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA). После очистки продукт гидролизуют TFA для удаления Boc, получая при этом BA43.(12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA44.(BA45). Раствор (4-цианометилфенил)бороновой кислоты (18 мг, 0,11 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (30 мг, 0,10 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA45.(BA46). Раствор (3-цианометилфенил)бороновой кислоты (18 мг, 0,11 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (30 мг, 0,10 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют- 16019961 насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA46.ESI-MC (M+H)+ m/z: вычислено 293,1, найдено 293,1. Синтез 1-изопропил-3-(4-метоксифенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA48). Раствор (4-метоксифенил)бороновой кислоты (17 мг, 0,11 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (30 мг, 0,10 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA48 (4,5 мг, выход 16%).ESI-MC (M+H)+ m/z: вычислено 284,1, найдено 284,1. Синтез 1-изопропил-3-(3-метоксифенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA49). Раствор 3-метоксифенилбороновой кислоты (17 мг, 0,11 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (30 мг, 0,10 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA49.ESI-MC (M+H)+ m/z: вычислено 284,1, найдено 284,0. Синтез 1-изопропил-3-(пиридин-3-ил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA52). Раствор 3-пиридинилбороновой кислоты (15 мг, 0,14 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (40 мг, 0,13 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (15 мг, 0,015 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O), получая при этом BA52.ESI-MC (М+Н)+ m/z: вычислено 255,1, найдено 255,0. Синтез 1-изопропил-3-(пиримидин-5-ил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA53). Раствор 5-пиримидинилбороновой кислоты (15 мг, 0,14 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (40 мг, 0,13 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (15 мг, 0,015 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O), получая при этом BA53.DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA54 (6 мг, выход 15%).ESI-MC (M+H)+ m/z: вычислено 312,1, найдено 312,0. Синтез 1-(3-4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)фенилэтанона (BA55). Раствор 3-ацетилфенилбороновой кислоты (23 мг, 0,14 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (40 мг, 0,13 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA55 (7 мг, выход 18%).ESI-MC (M+H)+ m/z: вычислено 296,1, найдено 296,1. Синтез 4-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)фенола (BA56). Раствор 4-гидроксифенилбороновой кислоты (30 мг, 0,14 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (40 мг, 0,13 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA56 (12 мг, выход 32%).- 17019961 Синтез двойных ингибиторов PI3-K/тирозинкиназы. Синтез 1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA18). Раствор 250 мл формамида и 3-амино-4-пиразолкарбонитрила (25 г, 0,231 моль) нагревают до 180C на протяжении ночи в атмосфере аргона. Реакционную смесь охлаждают и добавляют 400 мл dH2O. Образовавшееся твердое вещество отделяют фильтрованием и промывают холодной dH2O. Осадок белого твердого вещества собирают и сушат в вакууме на протяжении ночи, получая при этом BA18 (39 г, выход 100%).ESI-MC (M+H)+ m/z: вычислено 136,1, найдено 136,1. Синтез 3-йод-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA19). Раствор 3 Н-пиразоло[3,4-d]пиримидин-4-амина (10 г, 0,074 моль) и N-йодсукцинамида (25 г,0,111 моль) в ДМФА (80 мл) нагревают до 80C на протяжении ночи в атмосфере аргона. Образовавшееся твердое вещество отделяют фильтрованием и промывают холодным EtOH. Продукт сушат в вакууме на протяжении ночи, получая при этом BA19 (24 г, выход 100%).ESI-MC (M+H)+ m/z: вычислено 262,0, найдено 262,0. Синтез 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA12). Раствор 3-йод-1 Н-пиразоло[3,4-d]пиримидин-4-амина (2 г, 0,0077 моль) и K2CO3 (4,2 г, 0,031 моль) в ДМФА (50 мл) нагревают до 80C в атмосфере аргона. Шприцем добавляют изопропилбромид (1,0 г,0,0084 моль). Реакционную смесь кипятят с обратным холодильником в атмосфере аргона в течение 2 ч. Твердый K2CO3 удаляют фильтрованием. Растворитель частично удаляют в вакууме. Добавляют цитрат натрия (50 мл) и реакционную смесь экстрагируют EtOAc. Органические фазы концентрируют в вакууме и очищают с применением колоночной хроматографии на силикагеле [MeOH-CH2Cl2, 5:95], получая при этом BA12 (1,68 г, выход 72%).ESI-MC (M+H)+ m/z: вычислено 304,0, найдено 304,1. Синтез 4-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)бензолсульфонамида (BA14). Раствор пинаконового эфира бензолсульфонамид-4-бороновой кислоты (23 мг, 0,08 ммоль) в EtOH(3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (20 мг,0,07 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA14 (2,2 мг, выход 10%).EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (20 мг,0,07 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA15 (4,3 мг, выход 20%).(12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA15 (4,8 мг, выход 23%).DME (12 мл). Добавляют Pd(PPh3)4 (40 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA20.ESI-MC (M+H)+ m/z: вычислено 399,2, найдено 399,1. Синтез 3-(4-амино-3-метоксифенил)-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA20d). Раствор трет-бутил-4-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)-2 метоксифенилкарбамата (BA20) (20 мг, 0,05 ммоль) в CH2Cl2, TFA, S(CH2)2, H2O (45:45:5:5) (1 мл) перемешивают при комнатной температуре в течение 15 мин. Добавляют NaHCO3 (2 мл) до тех пор, пока ре- 18019961 акционная смесь не станет щелочной. Реакционную смесь экстрагируют H2O и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA20d. Синтез 2-амино-5-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)фенола (BA20dd).(трет-бутил-4-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)-2-метоксифенилкарбамат, 7 мг, 0,018 ммоль) растворяют в CH2Cl2 (2,5 мл) и перемешивают в атмосфере аргона при комнатной температуре. Медленно шприцем добавляют BBr3 (0,500 мл). Реакционную смесь перемешивают на протяжении ночи в атмосфере аргона при комнатной температуре. BBr3 удаляют в вакууме и оставшееся твердое вещество очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA20dd. Синтез 5-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)пиридин-2-карбонитрила(BA21). Раствор пинаконового эфира 2-цианопиридин-5-бороновой кислоты (18 мг, 0,08 ммоль) в EtOH(3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (20 мг,0,07 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA21 (2,5 мг, выход 14%).(12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA22 (15,6 мг, выход 60%).(15 мг, 0,04 ммоль) в MeOH (0,9 мл) промывают струей аргона. Осторожно добавляют Pd на активированном угле (10 мл) при выдерживании реакционной смеси в атмосфере аргона. Реакционную смесь промывают струей газообразного Н 2 и выдерживают в атмосфере Н 2 на протяжении ночи при комнатной температуре. Реакционную смесь фильтруют через целит и промывают MeOH, получая при этом BA22ESI-MC (M+H)+ m/z: вычислено 288,1, найдено 288,1. Синтез 1-изопропил-3-(3,4-диметоксифенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA23). Раствор 3,4-диметоксифенилбороновой кислоты (24 мг, 0,13 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (20 мг, 0,07 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA23 (13,1 мг, выход 60%).DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают колоночной хроматографией на силикагеле [EtOAc-гексаны, 5:95], получая при этомBA24 (3-(4-фтор-3-метоксифенил)-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амин, 30 мг,0,10 ммоль) растворяют в растворе муравьиной кислоты (4,5 мл, 10 экв.) и HCl (0,45 мл, 1 экв.). Реакционную смесь нагревают и перемешивают в течение 1 ч в атмосфере аргона. Реакционную смесь затем концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA24dd.- 19019961 Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA26 (8,4 мг, выход 42%).EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (20 мг,0,07 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA30 (17,8 мг, выход 67%). Синтез 1-(4-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)фенил)этанона (BA31). Раствор 4-ацетилфенилбороновой кислоты (12,7 мг, 0,08 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (20 мг, 0,07 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA31 (12,9 мг, выход 62%). Синтез (3-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)фенил)метанола (BA32). Раствор (4-аминокарбонил-3-хлорфенил)бороновой кислоты (16 мг, 0,08 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (20 мг, 0,07 ммоль) вDME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA32 (9,7 мг, выход 42%).(12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA34 (14,7 мг, выход 38%).ESI-MC (M+H)+ m/z: вычислено 302,1, найдено 302,0. Синтез 5-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)фуран-3-карбальдегида (BA35). Раствор 4-формилфуран-2-бороновой кислоты (20 мг, 0,14 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (40 мг, 0,13 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA35 (13,5 мг, выход 39%).DME (12 мл). Добавляют Pd(PPh3)4 (16 мг, 0,014 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA38 (24,3 мг, выход 54%).ESI-MC (M+H)+ m/z: вычислено 347,1, найдено 347,0. Синтез 3-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)бензонитрила (BA39). Раствор 3-цианофенилбороновой кислоты (23 мг, 0,15 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (40 мг, 0,13 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ(MeCN:H2O:0,1% TFA), получая при этом BA39 (14,9 мг, выход 41%).DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA40 (0,9 мг, выход 3%).ESI-MC (M+H)+ m/z: вычислено 347,1, найдено 347,0. Синтез 3-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)бензолсульфонамида (BA41). Раствор пинаконового эфира бензолсульфонамид-3-бороновой кислоты (31 мг, 0,11 ммоль) в EtOH(3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (30 мг,0,10 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA41 (9,2 мг, выход 28%).ESI-MC (M+H)+ m/z: вычислено 333,1, найдено 333,0. Синтез 2-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)бензо[b]тиофен-5 карбальдегида (BA42). Раствор пинаконового эфира 5-формилбензо[b]тиофен-2-бороновой кислоты (31 мг, 0,11 ммоль) вEtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (30 мг,0,10 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA42 (15,2 мг, выход 45%).(BA43). Раствор пинаконового эфира N-Вос-3-формил-5-индолбороновой кислоты (40 мг, 0,11 ммоль) вEtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (30 мг,0,10 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1/9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA). После очистки продукт гидролизуют TFA для удаления Boc, получая при этом BA43.(12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA44.(BA45). Раствор (4-цианометилфенил)бороновой кислоты (18 мг, 0,11 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (30 мг, 0,10 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA45.- 21019961 до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA46.ESI-MC (M+H)+ m/z: вычислено 293,1, найдено 293,1. Синтез 1-изопропил-3-(4-метоксифенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA48). Раствор (4-метоксифенил)бороновой кислоты (17 мг, 0,11 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (30 мг, 0,10 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA48 (4,5 мг, выход 16%).ESI-MC (M+H)+ m/z: вычислено 284,1, найдено 284,1. Синтез 1-изопропил-3-(3-метоксифенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA49). Раствор 3-метоксифенилбороновой кислоты (17 мг, 0,11 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (30 мг, 0,10 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA49.ESI-MC (M+H)+ m/z: вычислено 284,1, найдено 284,0. Синтез 1-изопропил-3-(пиридин-3-ил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA52). Раствор 3-пиридинилбороновой кислоты (15 мг, 0,14 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (40 мг, 0,13 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (15 мг, 0,015 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O), получая при этом BA52.ESI-MC (М+Н)+ m/z: вычислено 255,1, найдено 255,0. Синтез 1-изопропил-3-(пиримидин-5-ил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA53). Раствор 5-пиримидинилбороновой кислоты (15 мг, 0,14 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (40 мг, 0,13 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (15 мг, 0,015 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O), получая при этом BA53.DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA54 (6 мг, выход 15%).ESI-MC (M+H)+ m/z: вычислено 312,1, найдено 312,0. Синтез 1-(3-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)фенил)этанона (BA55). Раствор 3-ацетилфенилбороновой кислоты (23 мг, 0,14 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (40 мг, 0,13 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA55 (7 мг, выход 18%).ESI-MC (M+H)+ m/z: вычислено 296,1, найдено 296,1. Синтез 4-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)фенола (BA56). Раствор 4-гидроксифенилбороновой кислоты (30 мг, 0,14 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (40 мг, 0,13 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA56 (12 мг, выход 32%).(12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают с применением колоночной хроматографией на силикагеле с обращенной фазой[MeOH-CH2Cl2, 2:98], получая при этом BA59 (26 мг, выход 27%).(12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают колоночной хроматографией на силикагеле [MeOH-CH2Cl2, 2:98], получая при этом BA60ESI-MC (M+H)+ m/z: вычислено 284, найдено 284. Синтез 3-(4-фтор-3-метоксифенил)-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA62). Раствор 4-фтор-3-метоксифенилбороновой кислоты (61 мг, 0,36 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (90 мг, 0,30 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают колоночной хроматографией на силикагеле [MeOH-CH2Cl2, 2:98], получая при этом BA62 (40 мг, выход 44%).ESI-MC (M+H)+ m/z: вычислено 302, найдено 302. Синтез 5-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)-2-фторфенола (BA62d). Раствор BA62 3-(4-фтор-3-метоксифенил)-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина,30 мг, 0,10 ммоль) растворяют в CH2Cl2 (5 мл) и перемешивают в атмосфере аргона. Медленно, при перемешивании, шприцем добавляют BBr3 (500 мкл, 0,5 моль). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч, затем концентрируют в вакууме и очищают с применением колоночной хроматографии на силикагеле [MeOH-CH2Cl2, 2:98], получая при этом BA62d (23 мг, выход 44%).(12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают колоночной хроматографией на силикагеле [MeOH-CH2Cl2, 2:98], получая при этом BA63ESI-MC (M+H)+ m/z: вычислено 320,1, найдено 320,0. Синтез 4-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)-2,5-дифторфенола (BA93). 3-(2,5-Дифтор-4-метоксифенил)-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амин (BA63) (20 мг,0,06 ммоль) растворяют в CH2Cl2 (2 мл) и медленно шприцем при перемешивании добавляют BBr3(0,630 мл, 0,63 моль). Реакционную смесь перемешивают при комнатной температуре на протяжении ночи, затем концентрируют в вакууме и очищают с применением ОФ-ВЭЖХ [MeCN:H2O:0,1% TFA),получая при этом BA93 (6,7 мг, выход 35%).(BA64). Раствор 3,4,5-триметоксифенилбороновой кислоты (123 мг, 0,58 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (70 мг, 0,23 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают колоночной хроматографией на силикагеле [MeOH-CH2Cl2, 2:98], получая при этом BA64 (70 мг, выход 89%).- 23019961 Синтез 1-изопропил-3-(2,3-диметоксифенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA65). Раствор 2,3-диметоксифенилбороновой кислоты (105 мг, 0,58 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (70 мг, 0,23 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают колоночной хроматографией на силикагеле [MeOH-CH2Cl2, 2:98], получая при этом BA65 (63 мг, выход 88%).DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают колоночной хроматографией на силикагеле [MeOH-CH2Cl2, 2:98], получая при этомESI-MC (M+H)+ m/z: вычислено 316,1, найдено 316,0. Синтез 1-циклопентил-3-(3-фтор-5-метоксифенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA79). 3-Фтор-5-метоксибензойную кислоту (5 г, 0,029 моль) перемешивают в CH2Cl2 (50 мл) при 0C в атмосфере аргона. Добавляют ДМФА (9 капель, каталитическое количество) с последующим добавлением оксалилхлорида (12,7 мл, 0,147 моль). Реакционную смесь нагревают до комнатной температуры, затем перемешивают в атмосфере аргона в течение 1 ч. Реакционную смесь концентрируют в вакууме, получая при этом 3-фтор-5-метоксибензоилхлорид (BA67). Раствор малононитрила (2,87 г, 0,044 моль) в сухом ТГФ (50 мл) перемешивают при 0C в атмосфере аргона. К раствору в виде кусочков добавляют NaH в парафиновом масле (4,64 г, 0,116 моль). 3-Фтор 5-метоксибензоилхлорид (BA67, 0,029 моль) растворяют в 50 мл сухого ТГФ и раствор медленно добавляют к реакционной смеси. Реакционную смесь нагревают до комнатной температуры и перемешивают в атмосфере аргона в течение 24 ч. Медленно добавляют 1 н. HCl (200 мл), затем реакционную смесь экстрагируют EtOAc. Органические фазы объединяют, сушат над сульфатом магния, затем концентрируют в вакууме, получая при этом 2-3-фтор-5-метоксифенил)(метокси)метилен)малононитрил (BA69). 2-3-Фтор-5-метоксифенил)(метокси)метилен)малононитрил (BA69, 0,029 моль) перемешивают при EtOH (20 мл) при комнатной температуре в атмосфере аргона. Добавляют гидразин (1,4 мл,29 ммоль) и реакционную смесь оставляют для перемешивания в течение 90 мин. Реакционную смесь концентрируют в вакууме и сушат с применением вакуумного насоса на протяжении ночи, получая при этом промежуточный 5-амино-3-(3-фтор-5-метоксифенил)-1 Н-пиразол-4-карбонитрил (BA73). Добавляют формамид (20 мл) и реакционную смесь нагревают до 180C в атмосфере аргона на протяжении ночи. Реакционную смесь охлаждают и добавляют dH2O (40 мл), вызывая осаждение белого твердого вещества из раствора. Осадок собирают и промывают dH2O. Твердое вещество сушат и очищают колоночной хроматографией на силикагеле [MeOH-CH2Cl2, 10:90], получая при этом 3-(3-фтор-5-метоксифенил)-1 Нпиразоло[3,4-d]пиримидин-4-амин (BA75). 3-(3-Фтор-5-метоксифенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амин (BA75, 100 мг, 0,386 ммоль) растворяют в ДМФА (10 мл). Добавляют K2CO3 (250 мг, 1,54 ммоль) и реакционную смесь перемешивают при комнатной температуре в атмосфере аргона. Шприцем добавляют йодциклопентан (0,134 мл,1,16 ммоль) и реакционную смесь перемешивают в течение 2 ч. Твердый K2CO3 удаляют фильтрованием. Растворитель частично удаляют в вакууме. Добавляют цитрат натрия и реакционную смесь экстрагируютEtOAc. Органические фазы концентрируют в вакууме и очищают с применением ОФ-ВЭЖХ(MeCN:H2O:0,1% TFA), получая при этом BA79. Синтез 1-циклопентил-3-(3-фтор-5-метоксифенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA79d). 1-Циклопентил-3-(3-фтор-5-метоксифенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амин(BA79,0,386 ммоль) растворяют в CH2Cl2 (2 мл). Медленно при перемешивании шприцем добавляют BBr3 (4 мл,4 моль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, затем концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA79 (69 мг, выход 57%). Синтез 1-циклопентил-3-йод-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA80). Раствор 3-йод-1 Н-пиразоло[3,4-d]пиримидин-4-амина (400 мг, 1,53 ммоль) и K2CO3 (1 г, 6 ммоль) в ДМФА (5 мл) перемешивают при комнатной температуре в атмосфере аргона. Шприцем добавляют йодциклопентан (1,0 г, 0,0084 моль). Реакционную смесь кипятят с обратным холодильником в атмосфере аргона в течение 2 ч. Твердый K2CO3 удаляют фильтрованием. Растворитель частично удаляют в вакууме. Добавляют цитрат натрия (50 мл) и реакционную смесь экстрагируют EtOAc. Органические фазы концентрируют в вакууме и очищают с применением колоночной хроматографии на силикагеле[MeOH-CH2Cl2, 5:95], получая при этом BA80 (300 мг, выход 60%).(200 мг, 0,76 ммоль) в EtOH (3,3 мл) добавляют к раствору 1-циклопентил-3-йод-1 Н-пиразоло[3,4d]пиримидин-4-амина (BA80, 100 мг, 0,30 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг,0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают с применением колоночной хроматографии на силикагеле [MeOH-CH2Cl2, 5:95], получая при этом BA81. BA81 растворяют в смеси 50:50CH2Cl2:TFA и перемешивают в течение 1 ч при комнатной температуре. Реакционную смесь концентрируют в вакууме и очищают с применением ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA81d.BA81d растворяют в CH2Cl2 (2 мл) и медленно шприцем при перемешивании добавляют BBr3 (4 мл,4 моль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, затем концентрируют в вакууме и очищают с применением ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этомEtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (65 мг,0,216 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA85 (28 мг, выход 36%).ESI-MC (M+H)+ m/z: вычислено 362,1, найдено 362,0. Синтез 3-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)-5-бромфенола (BA87). 3-(3-Бром-5-метоксифенил)-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амин (BA85, 0,1 ммоль) растворяют в CH2Cl2 (1 мл) и при перемешивании медленно шприцем добавляют BBr3 (1 мл, 1 моль). Реакционную смесь перемешивают при комнатной температуре в течение 35 мин, затем концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA87 (10,7 мг, выход 31%).(212 мг, 0,61 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4d]пиримидин-4-амина (75 мг, 0,25 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN: H2O), получая при этом(BA86, 9 мг, 0,022 ммоль) растворяют в смеси 50:50 CH2Cl2:TFA и перемешивают в течение 1 ч при комнатной температуре. Реакционную смесь концентрируют в вакууме и очищают с применением ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA89 (4,8 мг, выход 75%).(130 мг, 0,38 ммоль) в EtOH (3,3 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4d]пиримидин-4-амина (50 мг, 0,15 ммоль) в DME (12 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (1,9 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O), получая при этомESI-MC (M+H)+ m/z вычислено 419,2, найдено 419,1. Синтез 3-(1 Н-индол-5-ил)-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA94). трет-Бутил-5-(4-амино-1-циклопентил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)-1 Н-индол-1 карбоксилат (BA88) растворяют в смеси 50:50 CH2Cl2:TFA и перемешивают в течение 1 ч при комнатной температуре. Реакционную смесь концентрируют в вакууме и очищают с применением ОФ-ВЭЖХ(MeCN:H2O:0,1% TFA), получая при этом BA89 (6,3 мг).ESI-MC (M+H)+ m/z: вычислено 319,1, найдено 319,2. Синтез 1-циклопентил-3-(3,4-диметоксифенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA90). Раствор 3,4-диметоксифенилбороновой кислоты (41 мг, 0,23 ммоль) в EtOH (1,65 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (30 мг, 0,09 ммоль) в DME (6 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (0,95 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O), получая при этом BA90 (8,4 мг, выход 28%).ESI-MC (М+Н)+ m/z: вычислено 340,2, найдено 340,1. Синтез 3-(1 Н-индол-4-ил)-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA91). Раствор 1 Н-индол-4-ил-4-бороновой кислоты (40 мг, 0,25 ммоль) в EtOH (1,65 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (30 мг, 0,1 ммоль) в DME (6 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (0,95 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA91 (14,6 мг, выход 50%).ESI-MC (M+H)+ m/z: вычислено 293,1, найдено 293,1. Синтез 1-циклопентил-3-(1 Н-индол-4-ил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA92). Раствор 1 Н-индол-4-ил-4-бороновой кислоты (30 мг, 0,19 ммоль) в EtOH (1,65 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (25 мг, 0,076 ммоль) в DME (6 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (0,95 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA92 (23 мг, выход 95%).(6 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (0,95 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA95 (15,7 мг, выход 59%).(1,65 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (30 мг,0,1 ммоль) в DME (6 мл). Добавляют Pd(PPh3)4 (30 мг, 0,03 ммоль) и насыщенный Na2CO3 (0,95 мл) и реакционную смесь нагревают до 80C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA96 (19 мг, выход 72%).ESI-MC (M+H)+ m/z: вычислено 296,1, найдено 296,1. Синтез 5-(4-амино-1-циклопентил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)-2-этоксифенола (BA98). 1-Циклопентил-3-(4-этокси-3-метоксифенил)-1 Н-пиразо[3,4-d]пиримидин-4-амин (ZK359, 25 мг,0,071 ммоль) растворяют в CH2Cl2 (5 мл) и перемешивают при -10C в атмосфере аргона. Спустя 30 мин реакционную смесь нагревают до 0C и перемешивают в течение 2,5 ч. Реакционную смесь перемешивают в течение дополнительных 4 ч при комнатной температуре, затем концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA98 (3 мг, выход 13%).ESI-MC (М+Н)+ m/z: вычислено 340,1, найдено 340,1. Синтез 2-(4-(4-амино-1-изопропил-1 Н-пиразо[3,4-d]пиримидин-3-ил)-2 метоксифениламино)пропан-1-ола (BA99). 3-(4-Амино-3-метоксифенил)-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амин (BA20d) (30 мг,0,10 ммоль) растворяют в ДМФА (0,400 мл). Добавляют K2CO3 (55 мг, 0,4 ммоль) и реакционную смесь перемешивают при 70C. Добавляют 3-бром-1-пропанол (0,050 мл, 0,6 ммоль) и реакционную смесь перемешивают на протяжении ночи. Твердый K2CO3 удаляют фильтрованием. Растворитель частично удаляют в вакууме. Добавляют цитрат натрия (50 мл) и реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA),получая при этом BA99 (8,4 мг, выход 24%).- 26019961 Синтез 3-йод-1-метил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA109). Раствор 3-йод-1 Н-пиразоло[3,4-d]пиримидин-4-амина (2 г, 7,69 ммоль) и K2CO3 (4,25 г, 30,8 ммоль) в ДМФА (5 мл) перемешивают при комнатной температуре в атмосфере аргона. Шприцем добавляют йодметан (1,17 мл, 7,69 ммоль). Реакционную смесь перемешивают в атмосфере аргона при комнатной температуре в течение 2 ч. Твердый K2CO3 удаляют фильтрованием. Растворитель частично удаляют в вакууме. Добавляют цитрат натрия (50 мл) и реакционную смесь экстрагируют EtOAc. Органические фазы концентрируют в вакууме и очищают с применением колоночной хроматографии на силикагеле[MeOH-CH2Cl2, 5:95], получая при этом BA109 (212 мг, выход 10%).ESI-MC (М+Н)+ m/z: вычислено 275,9, найдено 275,9. Общая синтетическая схема для BA102, BA105-108, BA110, BA118, BA128-BA135, BA137, BA139140, BA143, BA147, BA149-BA152, BA156, BA158, BA160-BA162. Раствор бороновой кислоты (2,5 экв.) в EtOH (1,65 мл) добавляют к раствору 3-йод-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина(BA12, 1 экв.) в DME (6 мл). Добавляют Pd(PPh3)4 (15 мг, 0,15 ммоль) и насыщенный Na2CO3 (0,95 мл) и реакционную смесь нагревают до 90C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют, концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом требуемые продукты. Продукты анализируют ЖХ-МС. Общая синтетическая схема для BA112, BA115, BA121, BA122, BA124, BA136, BA138, BA141 иBA144. Раствор бороновой кислоты (2,5 экв.) в EtOH (1,65 мл) добавляют к раствору 1-циклопентил-3 йод-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA80, 1 экв.) в DME (6 мл). Добавляют Pd(PPh3)4 (15 мг,0,15 ммоль) и насыщенный Na2CO3 (0,95 мл) и реакционную смесь нагревают до 90C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и(MeCN:H2O:0,1% TFA), получая при этом требуемые продукты. Продукты анализируют ЖХ-МС. Общая синтетическая схема для BA111, BA114, Ва 116, BA117, BA119 и BA120. Раствор бороновой кислоты (2,5 экв.) в EtOH (1,65 мл) добавляют к раствору 3-йод-1-метил-1 Н-пиразоло[3,4-d]пиримидин 4-амина (BA109, 1 экв.) в DME (6 мл). Добавляют Pd(PPh3)4 (15 мг, 0,15 ммоль) и насыщенный Na2CO3(0,95 мл) и реакционную смесь нагревают до 90C в атмосфере аргона на протяжении ночи. После охлаждения реакционную смесь экстрагируют насыщенным NaCl и CH2Cl2. Органические фазы объединяют,концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN: H2O:0,1% TFA), получая при этом требуемые продукты. Продукты анализируют ЖХ-МС. Синтез 6-(4-амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)хинолин-2-амина (BA146). 3-(2-Хлорхинолин-6-ил)-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амин(MeCN:H2O:0,1% TFA), получая при этом BA146 (22 мг, выход 46%).ESI-MC (M+H)+ m/z: вычислено 320,2, найдено 320,4. Синтез 3-(3-амино-1 Н-индазол-6-ил)-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (BA154). 4-(4-Амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)-2-фторбензонитрил (BA150, 20 мг,0,07 ммоль) растворяют в н-BuOH (2 мл). Добавляют моногидрат гидразина (0,400 мл) и реакционную смесь нагревают до 110C в атмосфере аргона и оставляют для перемешивания на протяжении ночи. Реакционную смесь концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA154 (15 мг, выход 70%).(BA1552). 4-(4-Амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)-2-фторбензонитрил (BA150, 25 мг,0,1 ммоль) растворяют в ДМФА (1 мл). Добавляют t-BuOK (24 мг, 0,21 ммоль) и реакционную смесь перемешивают при комнатной температуре на протяжении ночи. Реакционную смесь затем нагревают до 150C в течение 24 ч. Реакционную смесь затем концентрируют в вакууме и очищают ОФ-ВЭЖХ(MeCN:H2O:0,1% TFA), получая при этом BA1552 (21 мг, выход 89%).(BA1573). 5-(4-Амино-1-изопропил-1 Н-пиразоло[3,4-d]пиримидин-3-ил)-2-фторбензонитрил (BA151, 20 мг,0,07 ммоль) растворяют в ДМФА (1 мл). Добавляют t-BuOK (24 мг, 0,21 ммоль) и реакционную смесь перемешивают при комнатной температуре на протяжении ночи. Реакционную смесь затем нагревают до 150C в течение 24 ч. Реакционную смесь затем концентрируют в вакууме и очищают ОФ-ВЭЖХ(BA149,20 мг, 0,063 ммоль) растворяют в н-BuOH (1 мл). Добавляют моногидрат гидразина (0,400 мл) и реакционную смесь нагревают до 110C в атмосфере аргона и оставляют для перемешивания в течение 2,5 ч. Реакционную смесь концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA), получая при этом BA159 (15 мг, выход 77%).ESI-MC (M+H)+ m/z: вычислено 312,1, найдено 312,4. Синтез 4-хлор-7-метил-5-(нафталин-2-ил)-7 Н-пирроло[2,3-d]пиримидина (ZK102). Раствор 4-хлор-5-йод-7-метил-7 Н-пирроло[2,3-d]пиримидина (19 мг, 0,065 ммоль), нафталин-2-ил 2-бороновой кислоты (12,2 мг, 0,071 ммоль), Na2CO3 (68,9 мг, 0,65 ммоль) и PdCl2 (dppf) (26,5 мг,0,00325 ммоль) в ТГФ (3 мл) нагревают для кипячения с обратным холодильником в атмосфере аргона в течение ночи. Реакционную смесь концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1%TFA), получая при этом ZK102 (2 мг, выход 26%).(10 мг,0,034 ммоль),3-бифенилбороновой кислоты (7,4 мг, 0,038 ммоль), Na2CO3 (36,1 мг, 0,34 ммоль) и PdCl2 (dppf) (1,4 мг,0,0017 ммоль) в ТГФ (10 мл) нагревают для кипячения с обратным холодильником в атмосфере аргона в течение ночи. Реакционную смесь концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1%TFA), получая при этом ZK103 (3 мг, выход 28%).ESI-MC (M+H)+ m/z: вычислено 320,1, найдено 320,0. Синтез 3-(4-трет-бутилфенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (ZK125). 1-трет-Бутил-3-(4-трет-бутилфенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амин растворяют в растворе муравьиной кислоты (1 мл) и концентрированной HCl (0,1 мл) и нагревают для кипячения с обратным холодильником в течение 2 ч. Реакционную смесь концентрируют в вакууме и очищают ОФ-ВЭЖХ(MeCN:H2O:0,1% TFA), получая при этом ZK125 (количественный выход).ESI-MC (M+H)+ m/z: вычислено 268,2, найдено 268,4. Синтез 3-(3-феноксифенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (ZK126). 1-трет-Бутил-3-(3-феноксифенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амин (50 мг, 0,16 ммоль) растворяют в растворе муравьиной кислоты (5 мл) и концентрированной HCl (0,1 мл) и нагревают для кипячения с обратным холодильником в течение 2,5 ч. Реакционную смесь концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA).ESI-MC (M+H)+ m/z: вычислено 304,1, найдено 304,3. Синтез 3-м-толил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (ZK127). 1-трет-Бутил-3-м-толил-1 Н-пиразоло[3,4-d]пиримидин-4-амин (23 мг, 0,1 ммоль) растворяют в растворе муравьиной кислоты (1 мл) и концентрированной HCl (0,3 мл) и нагревают для кипячения с обратным холодильником в течение 2,5 ч. Реакционную смесь концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA).ESI-MC (M+H)+ m/z: вычислено 226,1, найдено 226,3. Синтез 3-(3-нитрофенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (ZK128). 1-трет-Бутил-3-(3-нитрофенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амин (23 мг, 0,055 ммоль) растворяют в растворе муравьиной кислоты (5 мл) и концентрированной HCl (0,1 мл) и нагревают для кипячения с обратным холодильником в течение 2 ч. Реакционную смесь концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA).(21 мг,0,082 ммоль) растворяют в растворе муравьиной кислоты (1 мл) и концентрированной HCl (0,2 мл) и нагревают для кипячения с обратным холодильником в течение 2 ч. Реакционную смесь концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA).ESI-MC (M+H)+ m/z: вычислено 256,1, найдено 256,3. Синтез 3-(4-нитрофенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (ZK130). 1-трет-Бутил-3-(4-нитрофенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амин (21 мг, 0,082 ммоль) растворяют в растворе муравьиной кислоты (2 мл) и концентрированной HCl (0,2 мл) и нагревают для кипячения с обратным холодильником в течение 30 мин. Реакционную смесь концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA).ESI-MC (M+H)+ m/z: вычислено 257,1, найдено 257,3. Синтез 3-(3-(2,6-дихлорбензилокси)фенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (ZK131). 1-трет-Бутил-3-(3-(2,6-дихорбензилокси)фенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амин (19,5 мг,0,05 ммоль) растворяют в растворе муравьиной кислоты (2 мл) и концентрированной HCl (0,2 мл) и нагревают для кипячения с обратным холодильником в течение 30 мин. Реакционную смесь концентриру- 28019961 ют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA).ESI-MC (M+H)+ m/z: вычислено 386,1, найдено 386,2. Синтез 3-(2,3-диметилфенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (ZK132). 1-трет-Бутил-3-(2,3-диметилфенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амин (34 мг, 0,14 ммоль) растворяют в растворе муравьиной кислоты (2 мл) и концентрированной HCl (0,2 мл) и нагревают для кипячения с обратным холодильником в течение 30 мин. Реакционную смесь концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA).ESI-MC (M+H)+ m/z: вычислено 240,1, найдено 240,4. Синтез 2-(4-амино-1 Н-пиразоло[3,4-d]пиримидин-3-ил)фенола (ZK133). 1-трет-Бутил-2-(4-амино-1 Н-пиразоло[3,4-d]пиримидин-3-ил)фенол (5 мг, 0,014 ммоль) растворяют в растворе муравьиной кислоты (2 мл) и концентрированной HCl (0,2 мл) и нагревают для кипячения с обратным холодильником в течение 30 мин. Реакционную смесь концентрируют в вакууме и очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA).ESI-MC (M+H)+ m/z: вычислено 228,1, найдено 228,3. Синтез 3-о-толил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (ZK134). 1-трет-Бутил-3-о-толил-1 Н-пиразоло[3,4-d]пиримидин-4-амин растворяют в растворе муравьиной кислоты (2 мл) и концентрированной HCl (0,2 мл) и нагревают для кипячения с обратным холодильником в течение 30 мин. Реакционную смесь концентрируют в вакууме и очищают ОФ-ВЭЖХESI-MC (M+H)+ m/z: вычислено 226,1, найдено 226,3. Синтез 3-(3-аминофенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (ZK135). 1-трет-Бутил-3-(3-аминофенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амин растворяют в растворе муравьиной кислоты (2 мл) и концентрированной HCl (0,2 мл) и нагревают для кипячения с обратным холодильником в течение 30 мин. Реакционную смесь концентрируют в вакууме и очищают ОФ-ВЭЖХESI-MC (M+H)+ m/z: вычислено 227,1, найдено 227,3. Синтез 3-(3-(бензилокси)фенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (ZK136). 1-трет-Бутил-3-(3-(бензилокси)фенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амин (19 мг, 0,052 ммоль) растворяют в растворе муравьиной кислоты (1 мл) и концентрированной HCl (0,1 мл) и нагревают для кипячения с обратным холодильником в течение 30 мин. Реакция дает смесь ZK136 и 3-(4-амино-1 Нпиразоло[3,4-d]пиримидин-3-ил)фенола (ZK138). Реакционную смесь концентрируют в вакууме и продукты очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA).ZK138: ESI-MC (M+H)+ m/z: вычислено 228,1, найдено 228,3. Синтез 3-(4-аминофенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (ZK137). 1-трет-Бутил-3-(4-аминофенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амин (9 мг, 0,032 ммоль) растворяют в растворе муравьиной кислоты (1 мл) и концентрированной HCl (0,2 мл) и нагревают для кипячения с обратным холодильником. Реакционной смеси дают возможность реагировать 30 мин, затем концентрируют в вакууме и продукты очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA).ESI-MC (М+Н)+ m/z: вычислено 227,1, найдено 227,3. Синтез 3-(1,2,3,4-тетрагидронафталин-2-ил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (ZK139). 1-трет-Бутил-3-(1,2,3,4-тетрагидронафталин-2-ил)-1 Н-пиразоло[3,4-d]пиримидин-4-амин (9 мг,0,029 ммоль) растворяют в растворе муравьиной кислоты (1 мл) и концентрированной HCl (0,1 мл) и нагревают для кипячения с обратным холодильником. Реакционной смеси дают возможность реагировать 30 мин, затем концентрируют в вакууме и продукты очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA).NH3/MeOH и нагревают в герметизированной трубке при 110C на протяжении ночи. Реакционную смесь концентрируют в вакууме, получая при этом коричневое/не совсем белое твердое вещество. Синтез 3-п-толил-1 Н-пиразоло[3,4-d]пиримидин-4-амина (ZK141). 1-трет-Бутил-3-п-толил-1 Н-пиразоло[3,4-d]пиримидин-4-амин растворяют в растворе муравьиной кислоты (1 мл) и концентрированной HCl (0,1 мл) и нагревают для кипячения с обратным холодильником. Реакционной смеси дают возможность реагировать 30 мин, затем концентрируют в вакууме и продукты очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA).ESI-MC (M+H)+ m/z: вычислено 226,1, найдено 226,3. Синтез 3-(4-бифенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амина (ZK142). 1-трет-Бутил-3-(4-бифенил)-1 Н-пиразоло[3,4-d]пиримидин-4-амин (22 мг, 0,066 ммоль) растворяют в растворе муравьиной кислоты (1 мл) и концентрированной HCl (0,1 мл) и нагревают для кипячения с обратным холодильником. Реакционной смеси дают возможность реагировать 30 мин, затем концентрируют в вакууме и продукты очищают ОФ-ВЭЖХ (MeCN:H2O:0,1% TFA).
МПК / Метки
МПК: A61K 31/519, A61P 35/04, C07D 487/04
Метки: киназы, антагонисты
Код ссылки
<a href="https://eas.patents.su/30-19961-antagonisty-kinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонисты киназы</a>
Предыдущий патент: Lxr модуляторы
Следующий патент: Конъюгаты цитотоксинов
Случайный патент: Планарная керамическая мембранная сборка и система реакторов окисления


































